Хр атрофический гастрит: Лечение хронического атрофического гастрита желудка в Екатеринбурге
Хронический гастрит и риск развития рака желудка
Рак желудка является одним из заболеваний, возникающих из-за хронического гастрита – воспаления слизистой оболочки желудка. Наиболее частой причиной хронического гастрита считается инфицирование бактериями Helicobacter pylori (далее, H. pylori). В свою очередь, заболеваемость раком слизистой желудка, который не поражен хеликобактер пилори, составляет всего 1% и менее. Следовательно, если уничтожить эти вредные бактерии, то заболеваемость раком желудка снизится. Именно поэтому с февраля 2013 года в рамках страховой медицинской помощи в Японии началась программа эрадикационной терапии (т.е. лечения, направленного на уничтожение вредных бактерий), которая стала применяться у людей с хроническим гастритом, вызванным инфекцией H. pylori. До введения этой программы эрадикационная терапия в рамках медицинского страхования проводилась только у пациентов с раком желудка, язвой желудка и двенадцатиперстной кишки, а также у людей с заболеванием крови, связанным с инфекцией хэликобактер пилори.
Поэтому тем людям, кто проходил медосмотр или просто ФГДС в прошлом, особенно тем, у кого был диагностирован атрофический или хронический гастрит, рекомендуется провериться на предмет наличия Helicobacter pylori, так как возможно в то время диагностика данной инфекции еще не входила в программу обследования.
Хронический гастрит, вызванный Helicobacter pylori, еще называют атрофическим гастритом. Атрофия (истончение) слизистой желудка может начаться в 20-летнем возрасте и за несколько лет распространится на всю слизистую оболочку. Примерно у 10% людей с атрофией через 10 лет появляется риск развития рака желудка, который с годами увеличивается. Именно поэтому такое обследование как ФГДС является чрезвычайно важным методом диагностики, который позволяет не просто выявить рак, а спрогнозировать риск развития рака исходя из степени атрофии слизистой желудка. При высокой степени атрофии слизистой желудка важно наблюдаться с помощью ФГДС 1 раз в год, чтобы была возможность выявить рак на самой ранней стадии.
К тому же, с помощью эрадикационной терапии H. pylori есть возможность снизить риск развития рака желудка. В докладах сообщается, что «у пациентов, у которых после лечения рака желудка на ранней стадии проводилась эрадикационная терапия, по сравнению с пациентами, у которых данная терапия не проводилась, рецидив рака желудка в течение 3-х лет появился только у 1/3 пациентов». К сожалению, только лишь с помощью уничтожения бактерий пилори невозможно свести риск развития рака желудка до 0%, однако можно предупредить заболевание, поэтому мы призываем активно применять данный вид лечения в качестве профилактической меры.
Источник: Raffles Japanese Clinic
что пишет патологоанатом, что должен понять и сделать клиницист
Владимир Трофимович Ивашкин, академик РАМН, доктор медицинских наук:
– Пришло время для выступления Алексея Владимировича Кононова из Омска.
Алексей Владимирович Кононов, профессор:
– Дорогие коллеги, мы сегодня поговорим с вами о взаимоотношениях специалистов в таком сложном деле, как канцерпревенция и курации пациентов с предраковыми состояниями и предраковыми изменениями. Центральной проблемой канцерпревенции стоит проблема атрофии слизистой оболочки, которая является феноменом, располагающимся между собственно воспалительными изменениями слизистой оболочки желудка и предраковыми изменениями, которые вот Сергей Владимирович Кашин блестяще демонстрировал и называл дисплазией эпителия. Мне больше нравится термин «неоплазия», который подчеркивает необратимость этих процессов даже в виде низкой степени градации неоплазии. Таким образом, и у патологоанатома, и у клинициста встает один вопрос – это идентификация, детекция атрофии слизистой оболочки желудка и интерпретация этого заключения.
Центральной проблемой канцерпревенции стоит проблема атрофии слизистой оболочки, которая является феноменом, располагающимся между собственно воспалительными изменениями слизистой оболочки желудка и предраковыми изменениями, которые вот Сергей Владимирович Кашин блестяще демонстрировал и называл дисплазией эпителия. Мне больше нравится термин «неоплазия», который подчеркивает необратимость этих процессов даже в виде низкой степени градации неоплазии. Таким образом, и у патологоанатома, и у клинициста встает один вопрос – это идентификация, детекция атрофии слизистой оболочки желудка и интерпретация этого заключения.
Что делать, когда термин «атрофия», «атрофический гастрит» появляется в патологоанатомическом заключении? На сегодняшний день как будто бы проблем с этим нет. Существует основной классификационный вариант для оценки атрофии слизистой оболочки – это модифицированная сиднейская система, где в визуально-аналоговой шкале эти состояния ранжированы на уровни: нет атрофии, слабая, умеренная, выраженная, как в теле, так и в антральном отделе желудка. Но проблема состоит вот в чем. Проблема состоит в том, что для точной идентификации атрофии даже по модифицированной сиднейской системе необходим не один фрагмент слизистой оболочки, не два фрагмента, а 5 фрагментов, взятых по протоколу: по большой и малой кривизне тела желудка, в области угла желудка и по большой и малой кривизне в антральном отделе желудка. Больше того, когда в 2008 году мы получили новую классификацию хронического гастрита, где атрофия и воспаления оцениваются как интегральные понятия на уровне целого органа, то это взятие биоптата из 5 точек является просто необходимой процедурой, без которой система, которая получила название OLGIM, просто не работает.
Но проблема состоит вот в чем. Проблема состоит в том, что для точной идентификации атрофии даже по модифицированной сиднейской системе необходим не один фрагмент слизистой оболочки, не два фрагмента, а 5 фрагментов, взятых по протоколу: по большой и малой кривизне тела желудка, в области угла желудка и по большой и малой кривизне в антральном отделе желудка. Больше того, когда в 2008 году мы получили новую классификацию хронического гастрита, где атрофия и воспаления оцениваются как интегральные понятия на уровне целого органа, то это взятие биоптата из 5 точек является просто необходимой процедурой, без которой система, которая получила название OLGIM, просто не работает.
Вот это визуально-аналоговая шкала, отечественный вариант ее. По уровню абсцисс и ординат пиктограммы изменения слизистой оболочки – слабая, выраженная, умеренная атрофия в теле, в антральном отделе, а на перекрестии стадия, выраженность на уровне целого органа атрофических изменений. Точно так же построена шкала для оценки воспалительных изменений, которые называются степенью гастрита, там тоже пиктограммы.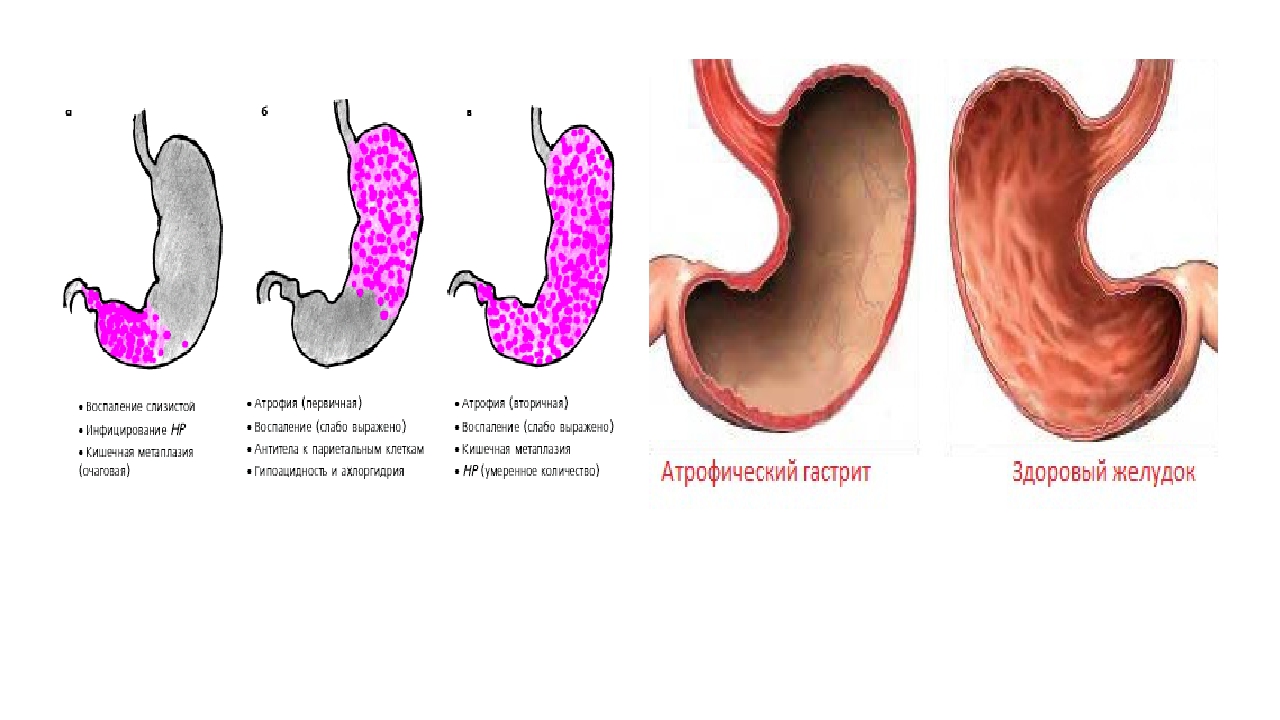 Смотрите, вот это воспалительный инфильтрат, причем здесь интегрально и нейтрофильные лейкоциты, и мононуклеары, которые, по сути, собой представляют воспалительный ответ слизистой оболочки, и мукозальный иммунитет одновременно. Проблема состоит в том, что появилось новое понимание атрофии слизистой оболочки. Это не просто уменьшение объема желез в теле и антральном отделе, но и замена их метаплазированным эпителием. Это так называемая метапластическая атрофия, и вот ее место в каскаде Пелайо Корреа. Причем сам, кстати, Пелайо Корреа очень положительно относится к этому термину и идентификации кишечной метаплазии с оценкой вместе с атрофией слизистой оболочки. Проблема возникает в другом. Иногда воспалительный инфильтрат настолько раздвигает желудочные железы, что возникает феномен так называемой неопределенной атрофии.
Смотрите, вот это воспалительный инфильтрат, причем здесь интегрально и нейтрофильные лейкоциты, и мононуклеары, которые, по сути, собой представляют воспалительный ответ слизистой оболочки, и мукозальный иммунитет одновременно. Проблема состоит в том, что появилось новое понимание атрофии слизистой оболочки. Это не просто уменьшение объема желез в теле и антральном отделе, но и замена их метаплазированным эпителием. Это так называемая метапластическая атрофия, и вот ее место в каскаде Пелайо Корреа. Причем сам, кстати, Пелайо Корреа очень положительно относится к этому термину и идентификации кишечной метаплазии с оценкой вместе с атрофией слизистой оболочки. Проблема возникает в другом. Иногда воспалительный инфильтрат настолько раздвигает желудочные железы, что возникает феномен так называемой неопределенной атрофии.
Вот давайте полечим больного, воспалительный инфильтрат рассосется частично в результате апоптоза воспалительных клеток, частично в результате миграции по лимфатическим сосудам, межтканевым щелям и так далее, а потом мы посмотрим.

Кстати говоря, вот наши прибалтийские коллеги опубликовали в январском номере этого года «Вирховского архива» – уважаемый, авторитетнейший патологоанатомический журнал Европы – такую статью, где они сравнили кишечную метаплазию, взятую в качестве детекции атрофии, и систему OLGIM. Оказалось, что критерий согласия экспертов выше там, где в качестве маркера атрофии применяли кишечную метаплазию. Правда, деликатно замечают наши коллеги, есть стадии атрофического гастрита, когда только кишечной метаплазии для детекции собственно атрофии недостаточно. Что еще пишут про кишечную метаплазию и атрофию? Оказывается, мы можем очень тесно сотрудничать с врачами эндоскопической диагностики. Мы можем говорить об уровне выраженности атрофических изменений, определяя стадию, а врачи эндоскопической диагностики определяют площадь очагов кишечной метаплазии, как это блестяще показал сегодня Сергей Владимирович, и вот это сочетание дает более точный прогноз канцерогенеза у конкретного пациента.
Вот здесь вот слева обозначены изменения, которые находит врач эндоскопической диагностики и патологоанатом в своем заключении, а справа написано, что должен делать клиницист с пациентом. Определены дефиниции, что такое неоплазия, что такое неоплазия низкой степени, что такое неоплазия высокой степени. Мы можем просто посмотреть, пока я говорю, следующие слайды. Пожалуйста, следующий, еще следующий слайд. Неопределенная неоплазия. Вот так же, как неопределенная атрофия, так и неопределенная неоплазия – то ли это изменения регенеративные, то ли это уже действительно опухолевый процесс.
Какие возможны утешения? Только ли наблюдать? Только ли брать биопсии и ставить диагноз? Сегодня мы знаем новые молекулярные клеточные мишени, открывшиеся сравнительно недавно для хорошо известного препарата на основе ионов висмута. Ну, во-первых, антиоксидантное свойство висмута. Свободные радикалы нейтрофильных лейкоцитов, возникающие при кислородном взрыве в них, нарушают ДНК стволовых клеток слизистой оболочки желудка до уровня двунитевых разрывов. Эти двунитевые разрывы подвергаются репарации, но при этом возникают мутации, накопление которых может закончиться канцерогенезом. Таким образом, препараты висмута в условиях воспалительной инфильтрации слизистой оболочки защищают ДНК, предотвращают процесс маргинализации. Это вторичная профилактика. Опять же, ионный эффект висмута великолепно продемонстрирован в попытке создания нового препарата, где висмут будет в составе растворимого соединения, и ионная активность его будет повышаться.
Эти двунитевые разрывы подвергаются репарации, но при этом возникают мутации, накопление которых может закончиться канцерогенезом. Таким образом, препараты висмута в условиях воспалительной инфильтрации слизистой оболочки защищают ДНК, предотвращают процесс маргинализации. Это вторичная профилактика. Опять же, ионный эффект висмута великолепно продемонстрирован в попытке создания нового препарата, где висмут будет в составе растворимого соединения, и ионная активность его будет повышаться.
2 года назад Нобелевскую премию получили молекулярные биологи за изучение серпантинных рецепторов и G-белков, которые являются регуляторными путями клетки. Оказывается, в них вмешивается висмут и запускает в стволовых клетках пролиферативный стимул, и проводя эрадикацию с помощью солей висмута мы попутно решаем и вторую задачу – мы мобилизируем и стимулируем местные стволовые клетки в слизистой оболочке желудка, и если не устраняем атрофию, то по крайней мере препятствуем ее обратному развитию.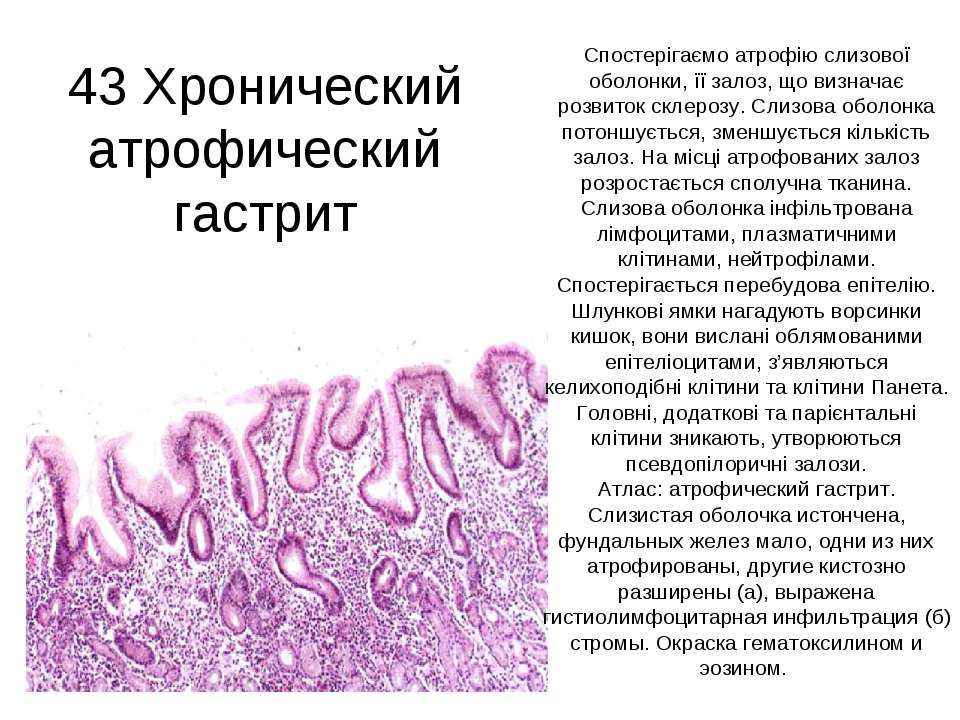 Что еще появилось нового в отношении ионов висмута как фармакопрепаратов? Появились следующие результаты. Это работа, которая известна пока еще только в препринте, январский номер, она еще не вышла. О чем говорит препринт? Культура ткани и ионы висмута. Оказывается, ионы висмута обладают меньшей степенью повреждения бактериальной клетки Helicobacter рylori, нежели висмут металлический, который нанесен в виде монослоя, атомарный висмут, на носители, которые взаимодействуют с бактериальной клеткой. Нанотехнологии и антибактериальный эффект препаратов висмута – это новое.
Что еще появилось нового в отношении ионов висмута как фармакопрепаратов? Появились следующие результаты. Это работа, которая известна пока еще только в препринте, январский номер, она еще не вышла. О чем говорит препринт? Культура ткани и ионы висмута. Оказывается, ионы висмута обладают меньшей степенью повреждения бактериальной клетки Helicobacter рylori, нежели висмут металлический, который нанесен в виде монослоя, атомарный висмут, на носители, которые взаимодействуют с бактериальной клеткой. Нанотехнологии и антибактериальный эффект препаратов висмута – это новое.
Давайте обсудим клинический пример. Пациенту 55 лет, с диспептическими жалобами, выполнена эндоскопическая биопсия слизистой оболочки желудка. Что получил патологоанатом и что он написал? «Два фрагмента слизистой оболочки – тело и антральный отдел». Я хочу обратить ваше внимание – два фрагмента. Дальше патологоанатом по классификационной схеме, модифицированной сиднейской системе описывает ситуацию. Все очень правильно, в каждом кусочке, и он определяет изменения в теле и антральном отделе желудка.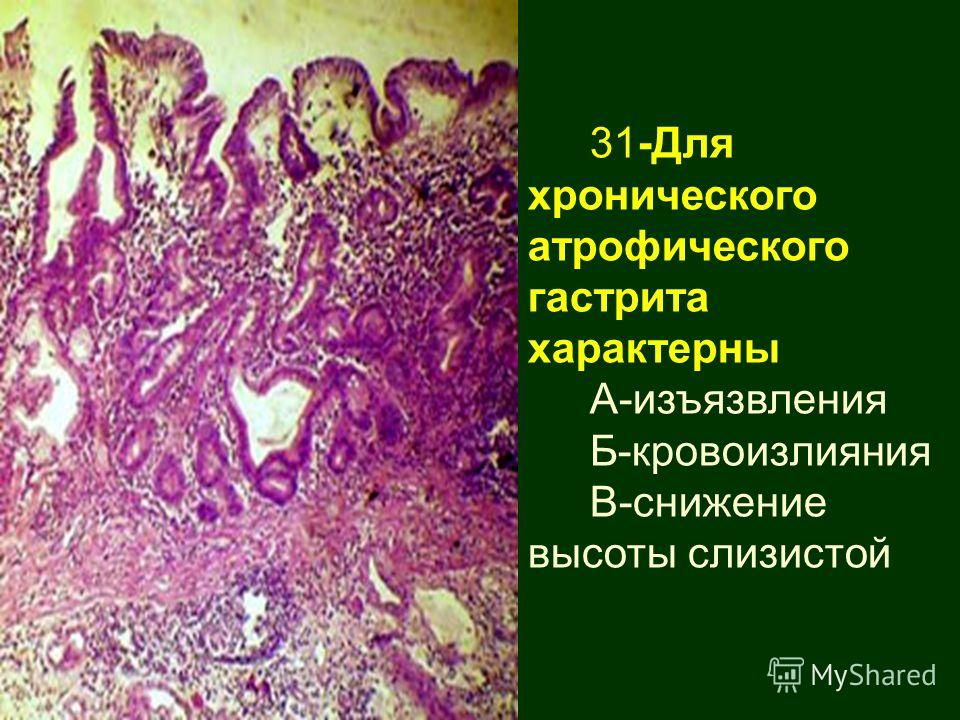
Давайте посмотрим, как это выглядит вообще на популяционном уровне. Вот посмотрите, 20 тысяч гастробиоптатов от 9 тысяч пациентов, и только 4% исследований могут быть оценены с позиции определения риска рака желудка 3-й, 4-й стадии по классификации OLGA. Давайте посмотрим, что в Америке происходит. Роберт Максимилиан Гента, известный патологоанатом-гастроэнтеролог, эксперт ВОЗ по опухолям пищеварительного тракта, проделал точно такое же исследование, что проделали мы, только в 20 раз больше, там было 400 тысяч биоптатов. Но он получил тот же самый процент: только 4% пригодны для оценки риска рака желудка по современной классификации. Второй клинический пример. У пациента 45 лет при эндоскопическом исследовании верифицирован видимый участок изменений в виде площадки 0,5х0,7 см, из которого взят биоптат. Что пишет патологоанатом? Один биоптат. Патологоанатом пишет: «Морфологические признаки очаговой эпителиальной дисплазии/неоплазии, – ну, «дисплазия» и «неплазия», как мы с вами договорились, это термины-синонимы, – низкой степени (тубулярная аденома с неоплазией низкой степени)».
Вот посмотрите, 20 тысяч гастробиоптатов от 9 тысяч пациентов, и только 4% исследований могут быть оценены с позиции определения риска рака желудка 3-й, 4-й стадии по классификации OLGA. Давайте посмотрим, что в Америке происходит. Роберт Максимилиан Гента, известный патологоанатом-гастроэнтеролог, эксперт ВОЗ по опухолям пищеварительного тракта, проделал точно такое же исследование, что проделали мы, только в 20 раз больше, там было 400 тысяч биоптатов. Но он получил тот же самый процент: только 4% пригодны для оценки риска рака желудка по современной классификации. Второй клинический пример. У пациента 45 лет при эндоскопическом исследовании верифицирован видимый участок изменений в виде площадки 0,5х0,7 см, из которого взят биоптат. Что пишет патологоанатом? Один биоптат. Патологоанатом пишет: «Морфологические признаки очаговой эпителиальной дисплазии/неоплазии, – ну, «дисплазия» и «неплазия», как мы с вами договорились, это термины-синонимы, – низкой степени (тубулярная аденома с неоплазией низкой степени)».
О чем должен думать клиницист? Не сговариваясь с Сергеем Владимировичем, мы обсудили эту ситуацию, поэтому я могу только прокомментировать. Ну, прежде всего, принять наличие у пациента предопухолевого состояния или даже предопухолевого заболевания. Затем необходимо отметить, что степень риска развития рака желудка определить невозможно. Во-первых, один фрагмент. Взятый рядышком фрагмент может показать дисплазию/неоплазию высокой степени, а еще третий может показать инвазивную карциному. Значит, весь объем образования должен быть представлен достаточно репрезентативно при повторных биопсиях, если нет возможности выполнить мукозальную резекцию так, как это написано в Европейских рекомендациях по предраковым состояниям. Ну, и, наконец, что делать врачу-гастроэнтерологу или терапевту в данной ситуации? Он должен, по крайней мере, заказать повторное исследование для того, чтобы взять биоптаты из визуально измененного участка, а также обязательно 5 биоптатов по системе OLGA для того, чтобы точно определить риск рака желудка у пациента.
И последний пример. Пациенту 55 лет с хроническим Helicobacter-ассоциированным гастритом, выраженной атрофией (стадия III) – должен отметить, риск рака желудка априори увеличен в 5-6 раз по сравнению с популяцией – выполнена успешная эрадикационная терапия. Эндоскопическое исследование через 4 недели после окончания терапии имеет следующий результат. Взяты 5 фрагментов по схеме. Вот это картинки, которые мы с вами рассматриваем в микроскоп. Это пластическая атрофия в антральном отделе, но что нас особенно взволновало – это то, что спустя месяц после окончания эрадикационной терапии в собственной пластинке слизистой оболочки в инфильтрате сохранились нейтрофильные лейкоциты. А мы с вами уже договорились, чем чреват кислородный взрыв нейтрофильных лейкоцитов, и это атрофический гастрит, кстати говоря.
Что же должен в ответ вот на эти замечания, которые сделал патологоанатом, выполнить клиницист? Как он должен интерпретировать эту ситуацию? Ну, прежде всего, констатировать успешную эрадикацию, но на этом отнюдь не успокоиться. Он должен отметить, что уровень атрофических изменений остался прежним – что, в общем, не удивительно – и это уровень, который говорит о риске рака желудка, в 5-6 раз большем, чем в популяции. Обратить особое внимание на инфильтрацию нейтрофильными лейкоцитами, то есть активность воспаления. Это скрытая угроза повреждения ДНК стволовых клеток, особенно атрофически измененной слизистой оболочки, опасность канцерогенных мутаций. А что же сделать с пациентом? А обратиться к рекомендациям Российской гастроэнтерологической ассоциации. И я хочу закончить теми же рекомендациями, которые уже цитировал глубокоуважаемый Сергей Владимирович. При хроническом гастрите, в том числе атрофическом, после окончания эрадикационной терапии возможно продолжение лечения препаратом висмута от 4 до 8 недель для обеспечения защиты слизистой оболочки желудка. Благодарю вас, уважаемые коллеги!
Он должен отметить, что уровень атрофических изменений остался прежним – что, в общем, не удивительно – и это уровень, который говорит о риске рака желудка, в 5-6 раз большем, чем в популяции. Обратить особое внимание на инфильтрацию нейтрофильными лейкоцитами, то есть активность воспаления. Это скрытая угроза повреждения ДНК стволовых клеток, особенно атрофически измененной слизистой оболочки, опасность канцерогенных мутаций. А что же сделать с пациентом? А обратиться к рекомендациям Российской гастроэнтерологической ассоциации. И я хочу закончить теми же рекомендациями, которые уже цитировал глубокоуважаемый Сергей Владимирович. При хроническом гастрите, в том числе атрофическом, после окончания эрадикационной терапии возможно продолжение лечения препаратом висмута от 4 до 8 недель для обеспечения защиты слизистой оболочки желудка. Благодарю вас, уважаемые коллеги!
Хронический атрофический гастрит у детей
Анализ имеющейся педиатрической литературы и многолетние собственные наблюдения невольно заставляют поставить вопрос: существует ли вообще хронический атрофический гастрит у детей, поскольку морфологическое понятие «атрофия слизистой оболочки» связывается прежде всего с патологией взрослых. Если нет, то это означает, что кроме деструктивных процессов слизистой оболочки желудка (СОЖ) (эрозивно-язвенные поражения) в детском возрасте других форм хронического воспалительного процесса в желудке (поверхностный гастрит) не встречается, т.к. все варианты эритематозной гастропатии (эндоскопическая характеристика состояния СО желудка), соответствующие понятию «хронический поверхностный гастрит», трактуются в настоящее время как проявления функциональной диспепсии. Это привело к практическому вытеснению диагноза «хронический поверхностный гастрит» и подмене его диагнозом «функциональная диспепсия» (ФД) [2, 3]. Нет нужды говорить, что с морфологической точки зрения это является нонсенсом. Чтобы более определенно трактовать сущность функциональной диспепсии, некоторые исследователи [5] предложили даже выделять две основные формы функциональной диспепсии: ФД без морфологических изменений и ФД с морфологическими изменениями.
Если нет, то это означает, что кроме деструктивных процессов слизистой оболочки желудка (СОЖ) (эрозивно-язвенные поражения) в детском возрасте других форм хронического воспалительного процесса в желудке (поверхностный гастрит) не встречается, т.к. все варианты эритематозной гастропатии (эндоскопическая характеристика состояния СО желудка), соответствующие понятию «хронический поверхностный гастрит», трактуются в настоящее время как проявления функциональной диспепсии. Это привело к практическому вытеснению диагноза «хронический поверхностный гастрит» и подмене его диагнозом «функциональная диспепсия» (ФД) [2, 3]. Нет нужды говорить, что с морфологической точки зрения это является нонсенсом. Чтобы более определенно трактовать сущность функциональной диспепсии, некоторые исследователи [5] предложили даже выделять две основные формы функциональной диспепсии: ФД без морфологических изменений и ФД с морфологическими изменениями.
Если принять во внимание, что хронический гастрит с морфологической (и клинической) точки зрения представляет собой стадийный процесс, который развивается от поверхностных до атрофических изменений и соответственно от повышенной до пониженной кислотности, то правомерно считать, что в детском возрасте преобладают начальные (поверхностные) формы заболевания, сопровождающиеся повышенной кислотностью, а у взрослых — атрофические формы с низкой кислотностью. Иными словами, во-первых, для формирования хронического атрофического гастрита (ХАГ) необходимо время, во-вторых — именно ХАГ является завершающей (классической) формой ХГ, тогда как остальные морфологические варианты (поверхностный, с поражением желез без атрофии) — промежуточными стадиями, которые необоснованно относят к ФД.
Иными словами, во-первых, для формирования хронического атрофического гастрита (ХАГ) необходимо время, во-вторых — именно ХАГ является завершающей (классической) формой ХГ, тогда как остальные морфологические варианты (поверхностный, с поражением желез без атрофии) — промежуточными стадиями, которые необоснованно относят к ФД.
Итак, диагноз хронического гастрита в современных условиях можно поставить в двух случаях: при наличии эрозивных изменений слизистой оболочки (что в детском возрасте встречается не так уж редко) или атрофических изменений СО. При этом в первом случае диагноз может основываться на результатах эндоскопического исследования, во-втором — требуется морфологическое исследование биоптата СО желудка. Эндоскопическое исследование в педиатрической практике является рядовым, морфологическое — эксквизитным. Может быть, именно поэтому существует представление об отсутствии или исключительной редкости атрофического гастрита в детском возрасте.
Атрофия СО фундального отдела или тела желудка с позиций классической патоморфологии представляет собой «необратимую утрату желез желудка с замещением их фиброзной тканью или метаплазированным эпителием». Такое состояние формируется «на протяжении десятилетий, когда хронический гастрит переходит в гастрит атрофический» [14]. P. Sipponen [20] определил хронический гастрит как опосредованный возрастом прогрессирующий процесс, в результате которого происходит «постепенная утрата желез, завершающаяся тотальной атрофией слизистой оболочки»: В МКБ-10 атрофия СО желудка представлена всего лишь одной нозологической формой, имеющей название «хронический атрофический гастрит» (К.29.4).
Такое состояние формируется «на протяжении десятилетий, когда хронический гастрит переходит в гастрит атрофический» [14]. P. Sipponen [20] определил хронический гастрит как опосредованный возрастом прогрессирующий процесс, в результате которого происходит «постепенная утрата желез, завершающаяся тотальной атрофией слизистой оболочки»: В МКБ-10 атрофия СО желудка представлена всего лишь одной нозологической формой, имеющей название «хронический атрофический гастрит» (К.29.4).
Чаще всего атрофия является следствием разрушительного действия на слизистую оболочку желудка, париетальные и главные клетки длительного воспалительного процесса под влиянием инфекцииH.pylori, но может развиться в результате аутоиммунного процесса или длительно текущего рефлюкс-гастрита. Железистая ткань постепенно замещается фиброзной [18, 21]. Сопутствующими факторами на фоне Нр-инфекции являются несбалансированное питание (прежде всего избыток поваренной соли), прием нестероидных противовоспалительных препаратов, курение.
Уже простое перечисление этих факторов свидетельствует о том, что они играют свою роль также в детском и подростковом возрасте: H.pylori-инфекция распространена значительно — у детей с 12-летнего возраста инфицированность практически не отличается от инфицированности взрослых, аллергические и аутоаллергические процессы достаточно часты, дуоденогастральный рефлюкс нередко сопровождает гастродуоденальную патологию, да и курение не столь уж редко, особенно в подростковом возрасте.
Трудно предположить, что перечисленные факторы оказывают патогенное влияние и приводят к развитию атрофического гастрита у взрослых и не сказываются на детях. Следовательно, в детском возрасте имеются все условия для развития атрофического процесса СО желудка, и эти изменения необходимо только выявлять.
О.Я. Бабак [1] отмечает, что естественное течение атрофического гастрита может протекать по двум основным вариантам. Первый — длительно существующий ХГ приводит к значительному снижению кислотообразующей функции желудка, требующему заместительной терапии, без которой будут наблюдаться признаки нарушения пищеварительной функции. Второй вариант — в результате длительного хронического персистирующего воспаления в СО желудка, характерного для H.pylori-ассоциированного гастрита, происходит нарушение клеточного обновления в желудке, что способствует появлению клеток-мишеней для влияния на них канцерогенных веществ, в дальнейшем — к клеточным мутациям. В результате нормальный клеточный эпителий желудка замещается метапластическим, диспластическим и неопластическим. Иными словами, атрофический гастрит может по праву считаться предраковым состоянием. Детскому и подростковому возрасту, по-видимому, более присущ первый вариант с постепенным снижением кислотообразующей функции желудка.
Второй вариант — в результате длительного хронического персистирующего воспаления в СО желудка, характерного для H.pylori-ассоциированного гастрита, происходит нарушение клеточного обновления в желудке, что способствует появлению клеток-мишеней для влияния на них канцерогенных веществ, в дальнейшем — к клеточным мутациям. В результате нормальный клеточный эпителий желудка замещается метапластическим, диспластическим и неопластическим. Иными словами, атрофический гастрит может по праву считаться предраковым состоянием. Детскому и подростковому возрасту, по-видимому, более присущ первый вариант с постепенным снижением кислотообразующей функции желудка.
Ю.А. Лысиков, Т.А. Малицына и Е.А. Рославцева [9] считают, что атрофические гастриты у детей являются актуальной клинической проблемой, которая до конца не решена по сей день. Авторы приходят к выводу, что микроатрофию различных отделов СО желудка у детей можно выявить только при морфологическом исследовании.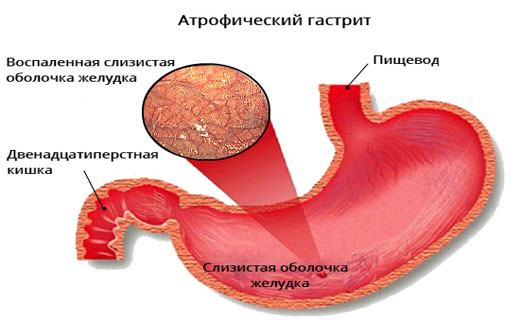 Она выражается в уменьшении толщины СО, толщины зоны слизистого эпителия и глубины желез. Атрофия желез заключается в уменьшении численности клеток, продуцирующих пепсины, и париетальных клеток, выделяющих соляную кислоту. Атрофия может затрагивать одну или обе популяции клеток, что приводит к нарушению или уменьшению секреции пепсинов и соляной кислоты. Л.М. Мосийчук и М.Ю. Зак [11] показали, что использование в клинической практике определения уровня G-17 (гастрин) и РG-1 (пепсиноген-1) в сыворотке крови может способствовать (наряду с гастробиопсией) верификации атрофического процесса в желудке. Методика основывается на том, что гастрин-17 (G-17) синтезируется в G-клетках, расположенных в антральном отделе желудка и снижение его уровня в крови может свидетельствовать об атрофических процессах в антральном отделе желудка, Пепсиноген-1 (PG-1) синтезируется в главных клетках, расположенных в фундальном отделе желудка. Снижение уровня PG-1 может свидетельствовать об атрофических процессах в фундальном отделе желудка.
Она выражается в уменьшении толщины СО, толщины зоны слизистого эпителия и глубины желез. Атрофия желез заключается в уменьшении численности клеток, продуцирующих пепсины, и париетальных клеток, выделяющих соляную кислоту. Атрофия может затрагивать одну или обе популяции клеток, что приводит к нарушению или уменьшению секреции пепсинов и соляной кислоты. Л.М. Мосийчук и М.Ю. Зак [11] показали, что использование в клинической практике определения уровня G-17 (гастрин) и РG-1 (пепсиноген-1) в сыворотке крови может способствовать (наряду с гастробиопсией) верификации атрофического процесса в желудке. Методика основывается на том, что гастрин-17 (G-17) синтезируется в G-клетках, расположенных в антральном отделе желудка и снижение его уровня в крови может свидетельствовать об атрофических процессах в антральном отделе желудка, Пепсиноген-1 (PG-1) синтезируется в главных клетках, расположенных в фундальном отделе желудка. Снижение уровня PG-1 может свидетельствовать об атрофических процессах в фундальном отделе желудка.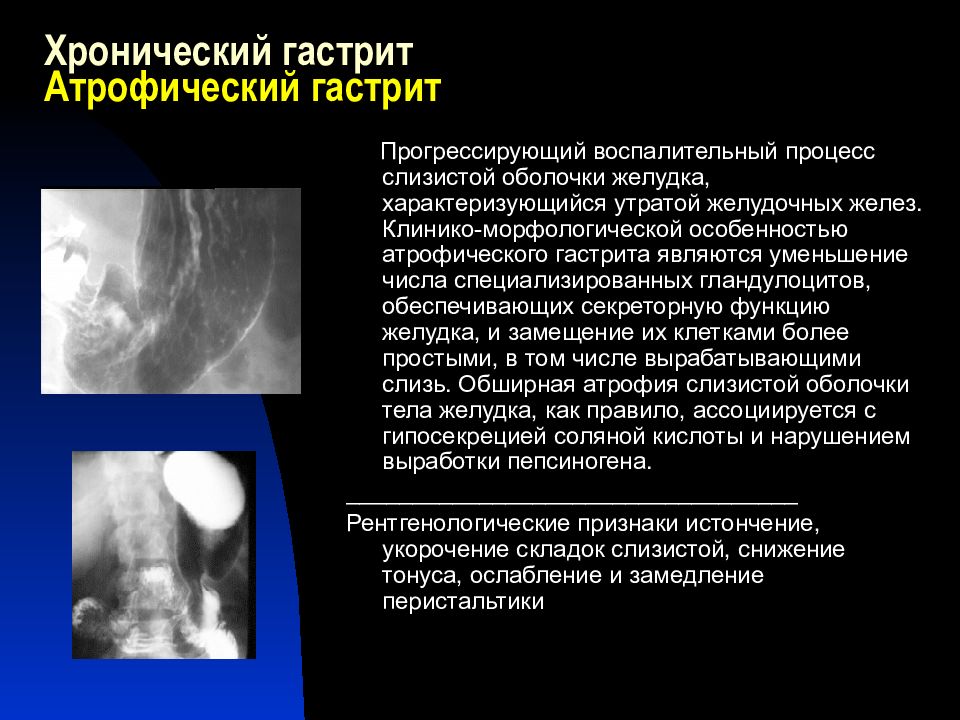 Авторы подтверждают точку зрения F. Di Mario, L.G. Cavallaro [17], что на первом этапе больным с диспептическими жалобами необходимо проводить анализ серологических маркеров, а в случае изменения их содержания — эндоскопическое исследование с гастробиопсией. Последнее положение особенно интересно для педиатрической практики, т.к. позволяет ограничить, а иногда и исключить необходимость эндоскопического исследования.
Авторы подтверждают точку зрения F. Di Mario, L.G. Cavallaro [17], что на первом этапе больным с диспептическими жалобами необходимо проводить анализ серологических маркеров, а в случае изменения их содержания — эндоскопическое исследование с гастробиопсией. Последнее положение особенно интересно для педиатрической практики, т.к. позволяет ограничить, а иногда и исключить необходимость эндоскопического исследования.
Ряд исследователей [16, 17, 19] подтверждают взаимосвязь между снижением уровня в сыворотке крови G-17 и PG-1 и увеличением степени атрофии СО соответственно антрального отдела и тела желудка.
Выше уже подчеркивалось, что непременным условием верификации атрофического процесса является фиброскопия с гастробиопсией; при этом в терапевтической практике современные требования определяют необходимость взятия не менее пяти биоптатов — трех из антрального отдела и двух из тела желудка, хотя это далеко не всегда позволяет выявить атрофию, которая обычно носит очаговый характер и не всегда, даже при условии взятия пяти биоптатов, попадает в поле зрения патоморфолога [11].
Не это ли обстоятельство является ключевым в плане диагностики хронического атрофического гастрита у детей? Морфологическое исследование СО в педиатрической практике вообще является достаточно редким, проводится только в специализированных учреждениях по специальным показаниям. При этом обычно ограничиваются взятием двух (а иногда и одного) биоптатов. Неудивительно, что в таких условиях атрофия выявляется редко и диагноз «хронический атрофический колит» является эксквизитным. Иными словами, чтобы установить частоту развития хронического атрофического гастрита у детей, необходимы более массовые морфологические исследования с большим числом биоптатов в каждом случае, чего трудно ожидать в ближайшее время в силу хоть и минимальной, но все же инвазивности процедуры, с одной стороны, и необходимости достаточно дорогостоящих морфологических исследований — с другой.
Поделиться своими наблюдениями о выявлении ХАГ в детском возрасте могут только специализированные детские гастроэнтерологические отделения, годами наблюдающие детей с гастродуоденальной патологией и накопившие сведения об эндоскопических и (пусть в редких случаях) морфологических исследованиях. Однако таких сведений в педиатрической литературе явно недостаточно.
Однако таких сведений в педиатрической литературе явно недостаточно.
Наиболее полную информацию о состоянии проблемы хронического гастрита у детей, в том числе атрофического гастрита, можно получить при анализе ежегодных конференций «Актуальные вопросы абдоминальной патологии у детей», проводимых в Москве или Санкт-Петербурге, в которых принимают активное участие многие практикующие детские гастроэнтерологи России и стран СНГ и практически все профессора, занимающиеся изучением заболеваний пищеварительной системы у детей. По материалам этих конференций издаются солидные сборники, последний ХVII издан в 2010 году.
Анализ публикуемых сообщений показывает, что проблеме хронического гастрита (гастродуоденита) у детей уделяется значительное внимание. И если говорить о трансформации представлений о хроническом гастрите, то основным положением стал пересмотр трактовки минимальных (поверхностных) изменений слизистой оболочки желудка. Начальные поверхностные изменения, которые эндоскопически характеризовались как эритематозная гастропатия, а морфологически — как поверхностный гастрит, перестали считать доказательством наличия воспалительного процесса, полагая, что, поскольку клинические проявления заболевания определяются не наличием эритематозной гастропатии, последнюю следует расценивать как функциональную диспепсию. С точки зрения классической патоморфологии это нонсенс, и патоморфологи никогда не согласятся с подобной трактовкой, но такой подход привел практически к вытеснению диагноза «хронический поверхностный гастрит» из клинической практики. Однако, как ни относиться к подобной трактовке диагноза, очевидно, что к хроническому атрофическому гастриту это не имеет отношения.
С точки зрения классической патоморфологии это нонсенс, и патоморфологи никогда не согласятся с подобной трактовкой, но такой подход привел практически к вытеснению диагноза «хронический поверхностный гастрит» из клинической практики. Однако, как ни относиться к подобной трактовке диагноза, очевидно, что к хроническому атрофическому гастриту это не имеет отношения.
О функциональной диспепсии (она же морфологически хронический поверхностный гастрит) пишут очень много, в то же время хроническому атрофическому гастриту посвящены лишь отдельные сообщения.
Л.Н. Малямова, А.М. Чередниченко, С.Ю. Медведева из Екатеринбурга [10], подчеркивая, что вопрос о возможности развития атрофических изменений слизистой оболочки желудка как завершающего этапа длительно текущего воспалительного процесса у детей остается дискуссионным, приводят результаты гистологического исследования СО антрального отдела желудка у 106 детей с хроническим гастритом (гастродуоденитом) с эрозиями, 84 детей — без эрозий и 50 больных с язвенной болезнью. Результаты исследования показали, что только у 3,3 % больных при гистологическом исследовании препаратов антрального отдела желудка атрофические изменения не выявлены. У 22,8 % детей атрофические изменения слизистой оболочки были выражены незначительно: склероз базальных отделов СО желудка имел очаговый характер, при этом объем железистого эпителия был сохранен. У большинства же больных (67,6 %) атрофические изменения СО трактовались как умеренно выраженные, при этом имели место так называемые стромальные изменения в виде гиперплазии ретикулиновых волокон, разрастания гладкомышечных клеток и редко — эластических волокон. Наряду с диффузным склерозом базальных отделов СОЖ имел место и интерстициальный (межуточный) склероз собственной пластинки, а также очаговая атрофия желез, сопровождающаяся уменьшением объема железистого эпителия. И наконец, в ряде случаев (6,2 %) гистологические изменения указывали на выраженную атрофию СО антрального отдела. Последнее касалось прежде всего железистого эпителия, объем которого был значительно уменьшен.
Результаты исследования показали, что только у 3,3 % больных при гистологическом исследовании препаратов антрального отдела желудка атрофические изменения не выявлены. У 22,8 % детей атрофические изменения слизистой оболочки были выражены незначительно: склероз базальных отделов СО желудка имел очаговый характер, при этом объем железистого эпителия был сохранен. У большинства же больных (67,6 %) атрофические изменения СО трактовались как умеренно выраженные, при этом имели место так называемые стромальные изменения в виде гиперплазии ретикулиновых волокон, разрастания гладкомышечных клеток и редко — эластических волокон. Наряду с диффузным склерозом базальных отделов СОЖ имел место и интерстициальный (межуточный) склероз собственной пластинки, а также очаговая атрофия желез, сопровождающаяся уменьшением объема железистого эпителия. И наконец, в ряде случаев (6,2 %) гистологические изменения указывали на выраженную атрофию СО антрального отдела. Последнее касалось прежде всего железистого эпителия, объем которого был значительно уменьшен. Атрофические изменения слизистой оболочки желудка характеризовались не только развитием интерстициального склероза базальных отделов СО, но и замещением высокодифференцированного эпителия метапластическим эпителием, свидетельствующим о нарушении клеточной регенерации с развитием тонкокишечной метаплазии.
Атрофические изменения слизистой оболочки желудка характеризовались не только развитием интерстициального склероза базальных отделов СО, но и замещением высокодифференцированного эпителия метапластическим эпителием, свидетельствующим о нарушении клеточной регенерации с развитием тонкокишечной метаплазии.
Авторы приходят к выводу, что многолетнее течение хронического гастрита (без эрозий, с эрозиями) сопровождается не только активным воспалительным процессом, но и атрофическими изменениями СО, которые сохраняются на фоне проводимой базисной терапии, что требует поиска более эффективных мер реабилитации этих больных.
Атрофические изменения СОЖ выявлены у 10 % наблюдаемых больных московскими исследователями И.В. Сичинавой и соавт. [15]. Атрофические изменения в антральном отделе желудка выявлены у 54,8 % больных и в фундальном — у 25 % детей, проживающих в условиях Курской магнитной аномалии [6]. Л.П. Парменова [13] отмечает, что клинические и морфологические проявления ХГ у детей зависят от основного этиологического фактора и длительности заболевания: при гипоацидности, декомпенсации ощелачивания в антральном отделе желудка при активном процессе атрофия СО антрального и фундального отделов желудка встречается у 30 % детей.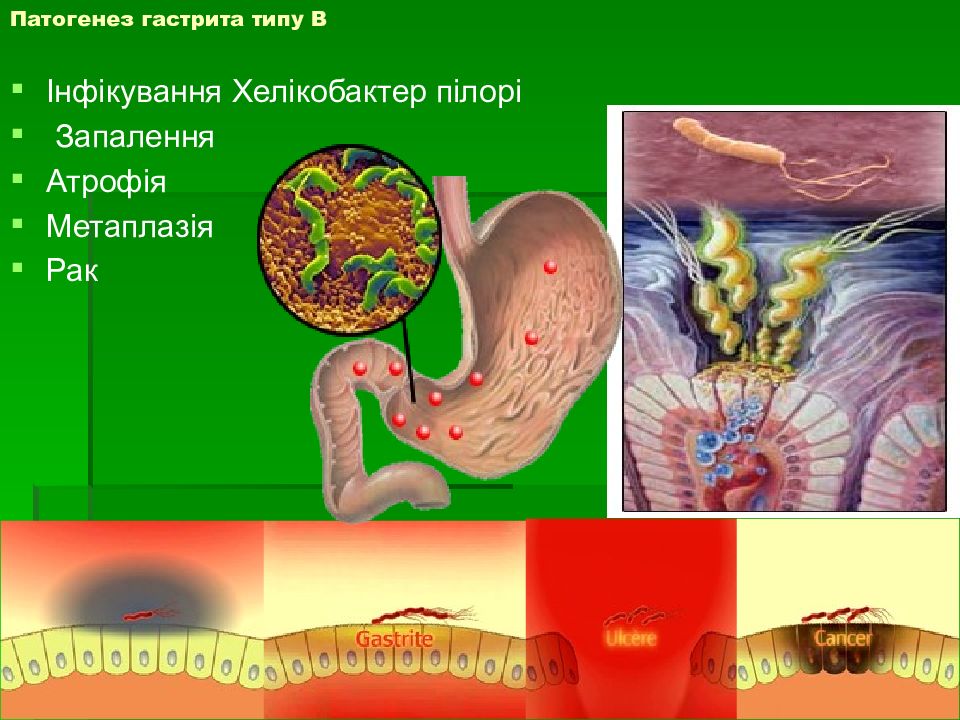
В то же время В.П. Новикова из Санкт-Петербурга [12] лишь у 2 больных из 51 выявила признаки атрофии СОЖ антрального отдела желудка, а белорусские авторы С.Э. Загорский и О.Н. Назаренко [8] из 44 детей с эрозивно-язвенными поражениями желудка и двенадцатиперстной кишки лишь у 1 выявили атрофические изменения СОЖ и у 1 — кишечную метаплазию, что позволило авторам сделать вывод о том, что атрофические и метапластические изменения СОЖ не характерны для детского и подросткового возраста. А.В. Бурлуцкая [4] выявила атрофический гастрит у 17 детей, что составило лишь 2,5 % от общего числа обследованных.
Таким образом, частота ХАГ в детском возрасте, по данным разных авторов, весьма вариабельна, но возможность развития этого заболевания в детском возрасте практически признается всеми авторами.
Имеющиеся в литературе немногочисленные свидетельства о возможности развития ХАГ в детском возрасте подтверждаются исследованиями кафедры педиатрической гастроэнтерологии и нутрициологии Харьковской медицинской академии последипломного образования, проведенными в последние годы [7].
Под наблюдением в детском городском гастроэнтерологическом отделении г. Харькова находились 79 больных, у которых на основании клинического и эндоскопического исследования был установлен диагноз хронического гастрита, в том числе у 2 детей — эрозивный процесс.
Во время проведения фиброгастроскопического исследования у всех детей проводилась прицельная биопсия с наиболее измененных участков антрального отдела желудка (обычно два биоптата).
Гистологическое исследование, проведенное на кафедре патологической анатомии ХМАПО, подтвердило наличие воспалительных изменений СО желудка у 74 из 79 больных (93 ± 3).
Из 74 детей у 25 (34 ± 6 %) отмечался поверхностный гастрит, который характеризовался наличием умеренной лимфоидно-плазматической инфильтрации с небольшим количеством макрофагов, эозинофилов, сегментоядерных лейкоцитов. Толщина СО и структура железистого слоя были сохранены. Активность процесса выявлена у 7 из 28 больных (25,0 ± 8,0 %). Это подтверждалось наличием инфильтрации эпителия и собственного слоя полиморфноядерными лейкоцитами на фоне свойственной хроническому гастриту инфильтрации плазматическими клетками и лимфоцитами, а также повреждением эпителия.
У остальных 49 детей (66 ± 6,0 %) морфологически выявлены различные формы атрофического гастрита, что свидетельствует о частоте этой формы заболевания у детей, даже при анализе биопсийного материала только СО антрального отдела желудка.
Начальный атрофический гастрит отмечался у 32 (65 ± 7 %) детей, у 29 из них (91 ± 5 %) выявлено активное воспаление.
При начальном атрофическом гастрите воспалительный инфильтрат локализовался между железами. В строме определялось значительное количество нейтрофильных лейкоцитов, лимфоцитов, плазмоцитов. Встречались отдельные эозинофильные лейкоциты. В поверхностном эпителии определялось снижение секреции мукоида. Наряду с дистрофическими процессами наблюдалась умеренно выраженная дисплазия, особенно в шеечной части желез. На фоне часто встречающейся фовеолярной гиперплазии у 28,3 % больных наблюдалась наиболее высокая степень обсеменения Нр (+++), которая сопровождалась значительной активностью воспалительного процесса.
Умеренная атрофия слизистой оболочки выявлена у 17 больных (35 ± 7 %), из них у 11 (65 ± 12 %) процесс носил активный характер. У больных отмечались патологические изменения в эпителии пилорических желез со снижением количества ШИК-положительных соединений. При этом уменьшалось и количество пилорических желез. В строме определялась инфильтрация лимфоцитами, плазмоцитами, незначительным количеством сегментоядерных лейкоцитов, выявлялись лимфоидные фолликулы.
У больных отмечались патологические изменения в эпителии пилорических желез со снижением количества ШИК-положительных соединений. При этом уменьшалось и количество пилорических желез. В строме определялась инфильтрация лимфоцитами, плазмоцитами, незначительным количеством сегментоядерных лейкоцитов, выявлялись лимфоидные фолликулы.
Сопоставление возраста детей и длительности заболевания с частотой выявления ХАГ показало, что заболевание чаще отмечается у детей старшего возраста, и его длительность составляет не менее 3 лет.
Выводы
1. Хронический атрофический колит у детей не является исключительно редким заболеванием, во всяком случае, встречается чаще, чем диагностируется. Частота ХАГ у детей увеличивается с возрастом и длительностью заболевания.
2. Частота выявления ХАГ зависит от уровня применяемых исследований. Эндоскопические признаки, которые считаются характерными для хронического атрофического гастрита (сглаженность складок слизистой оболочки, их отсутствие на определенных участках, уменьшение размеров желудка), малоинформативны и не дают достаточных оснований для диагностики этой формы заболевания.
3. ХАГ — диагноз морфологический, причем информативность гистологического исследования прямо коррелирует с наличием биопсионного материала из различных отделов желудка (три из антрального отдела и два из тела желудка), что в педиатрической практике практически не делается; диагноз устанавливается на основании одной, редко — двух биопсий, что, безусловно, снижает информативность заключения.
4. Морфологические изменения при ХАГ неоднородны. Умеренная степень атрофии характеризуется наличием не более одного конечного отдела главных желез, которые открываются в одну желудочную ямку, с увеличенным количеством добавочных клеток в составе главных желез, что приводит к развитию пилорической метаплазии желез. В собственной пластинке слизистой оболочки определяются воспалительные изменения и умеренно выраженный фиброз. В некоторых случаях наблюдается умеренная степень атрофии СО тела желудка одновременно с развитием кишечной метаплазии покровно-ямочного эпителия.
Выраженная атрофия СО тела желудка характеризуется резким снижением количества главных желез и удлинением желудочных ямок, что иногда сопровождается развитием фовеолярной гиперплазии СО. Качественный состав главных желез изменяется в сторону преобладания добавочных клеток с развитием пилоризации желез. В собственной пластинке СО наблюдаются воспалительные изменения и выраженный фиброз.
Качественный состав главных желез изменяется в сторону преобладания добавочных клеток с развитием пилоризации желез. В собственной пластинке СО наблюдаются воспалительные изменения и выраженный фиброз.
5. Перспективным для детской гастроэнтерологии в плане диагностики ХАГ следует считать определение гастрина-1 (G-17) и пепсиногена-1 (PG-1) в сыворотке крови. Информативность этих показателей в плане подтверждения наличия атрофического процесса в СО желудка доказана исследованиями зарубежных и отечественных гастроэнтерологов-терапевтов.
6. Патогенетические особенности ХАГ определяют необходимость дифференцированного подхода к лечению больных, которое должно отличаться от лечения поверхностных и деструктивных форм заболевания и быть направлено прежде всего на стимуляцию репаративных процессов и восстановление желудочной секреции.
Bibliography1. Бабак О.Я. Атрофический гастрит: прогнозы и перспективы // Здоровье Украины. — 2006. — № 21 (1). — С. 1-3.
2. Белоусов Ю.В. Функциональная диспепсия или хронический гастрит // Здоровье Украины. — 2009. — № 6 (1). — С. 44-45.
Белоусов Ю.В. Функциональная диспепсия или хронический гастрит // Здоровье Украины. — 2009. — № 6 (1). — С. 44-45.
3. Белоусов Ю.В., Белоусова О.Ю. Секреторно-моторные взаимосвязи органов гастродуоденальной зоны у детей // Врачебная практика. — 2002. — С. 84-88.
4. Бурлуцкая А.В., Карпенко Л.В., Левицкая Н.В. Структура заболеваемости верхних отделов желудочно-кишечного тракта у детей г. Краснодара по данным детского стационара // Актуальные проблемы абдоминальной патологии у детей. Материалы ХIII Конгресса детских гастроэнтерологов России. — Москва, 2006. — С. 104-105.
5. Волошин К.В. Функціональна диспепсія у дітей: критерії діагностики та диференційної діагностики: Автореф. дис… канд. мед. наук. — Харків, 2010. — 20 с.
6. Гурова М.М., Гусева С.П., Дутлова Е.Д., Ляляева Т.В. Эндоскопические и морфологические особенности хронических гастродуоденитов у детей, проживающих в условиях Курской магнитной аномалии // Актуальные проблемы абдоминальной патологии у детей. Материалы ХI Конгресса детских гастроэнтерологов России. — Москва, 2004. — С. 184-185.
Материалы ХI Конгресса детских гастроэнтерологов России. — Москва, 2004. — С. 184-185.
7. Денисюк Т.А. Секреторно-моторні взаємозв’язки у дітей з хронічною Helicobacter pylory-асоційованою гастродуоденальною патологією та ефективність ерадикаційної терапії з використанням вітчизняних препаратів: Автореф. дис… канд. мед. наук. — Харків, 2010. — 20 с.
8. Загорский С.Э., Назаренко А.Н. Морфологические особенности эрозивно-язвенных поражений желудка и двенадцатиперстной кишки у детей и подростков // Актуальные проблемы абдоминальной патологии у детей. Материалы ХVII Конгресса детских гастроэнтерологов России и стран СНГ. — Москва, 2010. — С. 86-87.
9. Лысиков Ю.А., Малицына Т.А., Рославцева Е.А. Трудности в диагностике атрофических гастритов у детей // Педиатрия. — 2006. — № 6. — С. 1-3.
10. Малямова Л.Н., Чередниченко А.М., Медведева С.Ю. Дискуссионные вопросы прогрессирования морфологических изменений слизистой оболочки желудка у детей с хроническими заболеваниями гастродуоденальной области // Актуальные проблемы абдоминальной патологии у детей. Материалы ХI Конгресса детских гастроэнтерологов России. — Москва, 2004. — С. 132-134.
Материалы ХI Конгресса детских гастроэнтерологов России. — Москва, 2004. — С. 132-134.
11. Мосійчук Л.М., Зак М.Ю. Оптимізація діагностики хронічного атрофічного гастриту сучасними неінвазивними методами // Сучасна гастроентерологія. — 2010. — № 4 (54). — С. 52-56.
12. Новикова В.П., Мельникова И.Ю., Струков Е.Л., Антонов П.В. Морфологическая картина слизистой оболочки желудка у детей с хроническим гастродуоденитом в сочетании с аутоиммунным тиреоидитом // Актуальные проблемы абдоминальной патологии у детей. Материалы 8-й конференции «Детская гастроэнтерология 2001». — Москва, 2001. — С. 72-73.
13. Парменова Л.П. Клинические и морфологические особенности хронического гастрита у детей // Актуальные проблемы абдоминальной патологи у детей. Материалы ХII Конгресса детских гастроэнтерологов России. — Москва, 2005. — С. 208-209.
14. Пюрвеева К.В., Лапина Т.Л., Ивашкин В.Т. Значение сывороточных показателей пепсиногена-1, пепсиногена-2 и гастрина-17 в диагностике атрофического гастрита // Российский журнал гастроэнтерол. , гематолог., колопроктол. — 2005. — № 3. — С. 48-51.
, гематолог., колопроктол. — 2005. — № 3. — С. 48-51.
15. Сичинава И.В., Новикова А.В., Каганов Б.С., Шерешевская А.Я. и соавт. Течение хронического гастрита у детей // Актуальные проблемы абдоминальной патологии у детей. Сборник материалов 7-й конференции «Детская гастроэнтерология-2000». — Москва, 2000. — С. 107-108.
16. Chae H., Lee J.H., Lim J. Clinical utility of serum pepsinogen levels as a screening Test of atrophic gastritis // Korean J. Lab. Med. — 2008. — Vol. 28 (3). — P. 201-206.
17. Di Mario E., Cavallaro L.J. Non-invasive tests in gastric disease // Dig. Liver. Dis. — 2008. — Vol. 40 (7). — P. 523-530.
18. Fox J.G., Wang T.S. Inflamattion, atrophy, and gastric cancer // J. Clin. Invest. — 2007. — Vol. 117. — P. 60-69.
19. Leverin C., Jacobsson S., Lindstedt G. Serum biomarkers for atrophic gastritis and antibodies against Helicobacter pylori in the elderly: Implications for vitamin B12, foliac acid and iron status and response to oral vitamin therapy // Scand. J. Gastroenterol. — 2008. — Vol. 43 (9). — P. 1050-1056.
J. Gastroenterol. — 2008. — Vol. 43 (9). — P. 1050-1056.
20. Sipponen P. Atrophic gastritis as premalignant condition // Ann. Med. — 1989. — Vol. 21. — P. 287-290.
21. Vannelia L., Lahner E., Osborn J. Risk factor for progression to gastric neoplastic lesions in patients with atrophic gastritis // Aliment. Pharmacol. Thier. — 2010. — Vol. 18. — P. 33-37.
Атрофический гастрит – причины, симптомы, диагностика и лечение
Атрофический гастрит – это хронический гастрит типа А, при котором уменьшается количество желудочных желез, снижается кислотообразующая функция. Считается предраковым состоянием. Проявляется тяжестью и тупыми болями в желудке, тошнотой, изжогой, диспепсическими явлениями, анемией. Наиболее значимыми методами диагностики являются: гастроскопия с забором и гистологией биоптатов, различные исследования для определения наличия хеликобактерной инфекции. Менее информативны гастрография, УЗИ органов брюшной полости. Так как 90% атрофий желудка связаны с воздействием хеликобактерий, специфическое лечение включает в себя эрадикацию инфекции.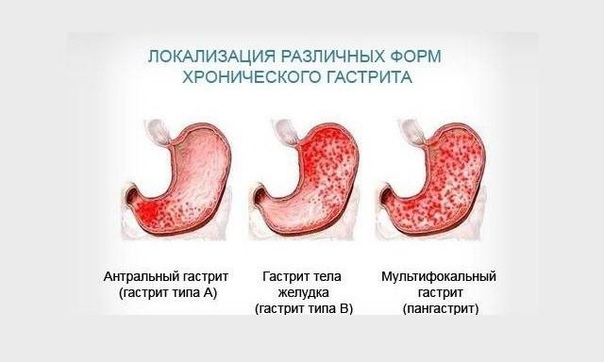 Назначается заместительная и симптоматическая терапия, санаторное лечение и физиотерапия.
Назначается заместительная и симптоматическая терапия, санаторное лечение и физиотерапия.
Общие сведения
Атрофический гастрит – хроническое прогрессирующее воспаление слизистой желудка, в результате которого полностью утрачиваются обкладочные железы желудка, происходит постепенная атрофия с последующей метаплазией участков слизистой. Основным признаком, который указывает на высокую вероятность рака, является не вид перестройки клеток, а площадь процесса – при распространенности метаплазии на 20% площади слизистой желудка и более вероятность развития рака практически 100%.
По наблюдениям специалистов в сфере практической гастроэнтерологии, хронический атрофический гастрит в 13% случаев заканчивается развитием онкологической патологии. По сравнению с неатрофическим процессом вероятность такого осложнения при атрофическом гастрите в пять раз выше. Основной задачей гастроэнтерологов сегодня является разработка новых, простых и неинвазивных методов достоверной диагностики атрофии, а также ранней диагностики рака желудка. Замечено, что своевременная диагностика и полная эрадикация инфекционного процесса уже через пять лет приводят к восстановлению слизистой желудка и значительному уменьшению площади метаплазии.
Замечено, что своевременная диагностика и полная эрадикация инфекционного процесса уже через пять лет приводят к восстановлению слизистой желудка и значительному уменьшению площади метаплазии.
Атрофический гастрит
Причины
Основными причинами развития атрофического гастрита являются длительно текущая хеликобактерная инфекция и аутоиммунный процесс, при котором собственные антитела повреждают G-клетки желудка (они являются основной составляющей обкладочных желез). Атрофии железистого эпителия могут способствовать различные сопутствующие заболевания и состояния: бесконтрольный прием медикаментов, алкоголизм, стрессы и выраженное физическое переутомление, различные профессиональные вредности, наследственные особенности работы ЖКТ, тяжелые фоновые заболевания.
Патогенез
H.pylori вызывает хроническое повреждение клеток, ослабляя местные защитные свойства слизистой желудка, что в результате позволяет токсинам и свободным радикалам беспрепятственно проникать в ткани и повреждать ядра клеток.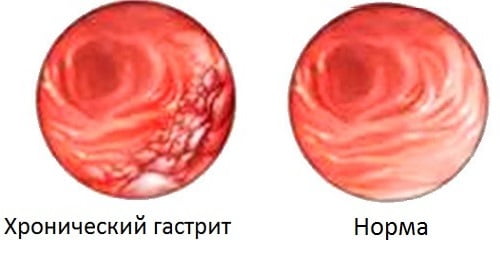 В финале этого процесса клетки приобретают свойства нескольких типов тканей – так называемые гибридные клетки, которые имеют свойства предраковых. Данный процесс называется кишечная метаплазия. Вначале эти участки слизистой приобретают вид тонкокишечного эпителия, затем толстокишечного. Чем дальше зашел процесс метаплазии, тем больше вероятность развития аденокарциномы желудка. На сегодняшний день хеликобактерная инфекция включена в список биологических канцерогенов, ведь без надлежащего лечения она рано или поздно приводит к раку желудка.
В финале этого процесса клетки приобретают свойства нескольких типов тканей – так называемые гибридные клетки, которые имеют свойства предраковых. Данный процесс называется кишечная метаплазия. Вначале эти участки слизистой приобретают вид тонкокишечного эпителия, затем толстокишечного. Чем дальше зашел процесс метаплазии, тем больше вероятность развития аденокарциномы желудка. На сегодняшний день хеликобактерная инфекция включена в список биологических канцерогенов, ведь без надлежащего лечения она рано или поздно приводит к раку желудка.
Механизм развития аутоиммунного процесса несколько иной. При этом в организме из-за нарушения иммунитета начинают образовываться антитела, которые распознают собственные ткани желудка как чужеродные. Чаще всего антитела вырабатываются к G-клеткам и фактору Касла, который отвечает за всасывание витамина В12. Из-за этого постепенно снижается кислотность желудка, клетки перестраиваются и начинают производить слизь вместо соляной кислоты. В желудке перестают всасываться железо и витамины, развивается тяжелая пернициозная анемия. Если же аутоиммунному гастриту сопутствует хеликобактерная инфекция, предраковое состояние разовьется гораздо быстрее.
В желудке перестают всасываться железо и витамины, развивается тяжелая пернициозная анемия. Если же аутоиммунному гастриту сопутствует хеликобактерная инфекция, предраковое состояние разовьется гораздо быстрее.
Симптомы атрофического гастрита
Патология развивается медленно, поражение при этом начинается со дна желудка, переходя на его тело, а затем и на остальную слизистую. В начале заболевания особой симптоматики может и не быть, что затрудняет диагностику и мешает раннему началу лечения. После развития полной клинической картины у пациента могут выявляться несколько симптомокомплексов.
Анемический синдром развивается из-за нарушения всасывания железа и витаминов (особенно В12, фолиевой кислоты) в полости желудка. Проявляется он выраженной слабостью, утомляемостью, сонливостью, постоянной усталостью (порой даже нарушается обычная деятельность пациента). Кожные покровы и слизистые бледнеют. Пациент отмечает постоянные боли в языке, жжение, слизистая языка становится лаковой. Также больной предъявляет жалобы на нарушения чувствительности в конечностях, обычно симметричные. Характерны сухие волосы и ломкие ногти, беспокоит одышка при незначительных нагрузках, колющие боли в сердце.
Также больной предъявляет жалобы на нарушения чувствительности в конечностях, обычно симметричные. Характерны сухие волосы и ломкие ногти, беспокоит одышка при незначительных нагрузках, колющие боли в сердце.
Диспепсический синдром проявляется выраженной тяжестью в эпигастрии, реже тупыми ноющими болями в верхней половине живота. Боли связаны с растяжением стенок желудка пищевыми массами из-за нарушений пищеварения. Также пациента беспокоят изжога (забрасывание кислого содержимого в пищевод), срыгивание (забрасывание пищи из желудка в ротовую полость), отрыжка (непроизвольный выход воздуха из желудка). Сопровождаются эти симптомы тошнотой, иногда рвотой, после которой боль в эпигастрии уменьшается. В рвотных массах – большое количество съеденной пищи, слизь, желчь. Аппетит значительно снижен.
Нарушения пищеварения распространяются на другие отделы ЖКТ – появляется дискомфорт в животе, стул становится неустойчивым – запоры сменяются поносами. По утрам во рту неприятный привкус, беспокоит постоянный запах изо рта. Язык обложен сероватым налетом, на нем видны отпечатки зубов. Нарушенное пищеварение и снижение аппетита могут приводить к потере веса, а при отсутствии лечения – к выраженной алиментарной дистрофии. Развивается полигиповитаминоз, который приводит к значительному снижению иммунитета, присоединению различных инфекций.
По утрам во рту неприятный привкус, беспокоит постоянный запах изо рта. Язык обложен сероватым налетом, на нем видны отпечатки зубов. Нарушенное пищеварение и снижение аппетита могут приводить к потере веса, а при отсутствии лечения – к выраженной алиментарной дистрофии. Развивается полигиповитаминоз, который приводит к значительному снижению иммунитета, присоединению различных инфекций.
Диагностика
Сегодня все больше внимания уделяется ранней неинвазивной диагностике атрофического гастрита. Для этого врачами-гастроэнтерологами разработана специальная панель диагностики. При проведении обычной гастроскопии выявить очаги дисплазии эпителия, а тем более определить их площадь не представляется возможным. Из-за этого зачастую возникают ошибки, связанные как с гипердиагностикой, так и гиподиагностикой: площадь гиперплазии может быть оценена неправильно, а воспалительные изменения могут быть приняты за метаплазию эпителия. Для того, чтобы правильно оценить площадь измененного эпителия, взять биопсию из всех измененных участков, во время гастроскопии производится окрашивание слизистой (чаще всего метиленовым синим) – краситель хорошо воспринимается участками с кишечной метаплазией.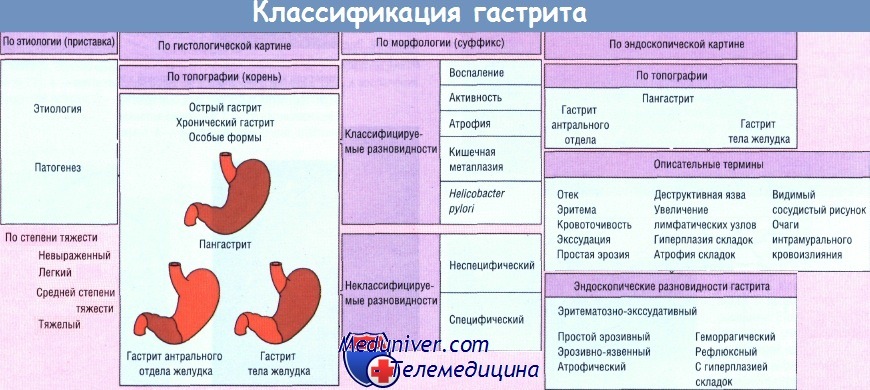
Специальная гематологическая панель Biohit позволяет быстро и эффективно определить степень метаплазии эпителия, атрофии слизистой и обкладочных желез, избежать ошибок диагностики. В этой панели исследуется уровень сывороточного пепсиногена, определяется соотношение пепсиногена 1 к пепсиногену 2, гистамина 17. Снижение этих показателей говорит о выраженной атрофии клеток железистого эпителия, а низкий уровень гастрина 17 говорит о гибели G-клеток желез желудка.
В то же время, повышение уровня гастрина 17 и пепсиногена 1 часто ассоциируется с хеликобактерной инфекцией. Значительное повышение уровня гастрина 17 чаще всего связано с аутоиммунным гастритом, при котором наблюдается ахлоргидрия или гипохлоргидрия, сохранена функция антрального отдела желудка. Если же в антральном отделе также имеются очаги атрофии (мультифокальная атрофия), то уровни всех этих показателей будут низкими. Данная панель имеет не менее 80% достоверности, используется на начальных этапах обследования и позволяет определиться с типом гастрита, его локализацией и причиной, выявить предраковое состояние и определить правильную тактику лечения.
В сравнении с гематологической панелью и эндоскопическим исследованием с забором биопсии, остальные методы диагностики атрофического гастрита менее информативны. Так, при гастрографии отмечается сглаженность складок слизистой и замедление перистальтики желудка, размеры его уменьшены. Такая же картина обнаруживается при проведении УЗИ желудка. Внутрижелудочная рН-метрия обнаруживает снижение кислотности желудочного сока. Для уточнения диагноза желательно проводить суточное измерение кислотности.
При подозрении на малигнизацию необходимо провести МСКТ органов брюшной полости для исключения опухолевого процесса. Также обязательно проводятся все необходимые исследования для выявления инфицированности H.pylori: ПЦР-диагностику хеликобактер, дыхательный тест, выявление в крови антител к хеликобактер.
Лечение атрофического гастрита
Основной задачей гастроэнтеролога является предупреждение дальнейшей кишечной метаплазии, раковой трансформации. При своевременном начале лечения атрофического гастрита уже через пять лет наступает значительное улучшение состояния эпителия. Обязательно назначается лечебная диета, которая на начальном этапе включает в себя химически, термически и механически щадящую пищу.
При своевременном начале лечения атрофического гастрита уже через пять лет наступает значительное улучшение состояния эпителия. Обязательно назначается лечебная диета, которая на начальном этапе включает в себя химически, термически и механически щадящую пищу.
После нормализации состояния допускается употребление химически активных продуктов: разведенных соков (лимонный, капустный, клюквенный). Свежие фрукты из диеты исключаются, можно есть только бананы. К пище предъявляются особые требования – она должна быть теплой (нельзя принимать холодные и горячие продукты), приемы пищи должны быть частыми и дробными. Необходимо исключить спиртные напитки и курение.
При обнаружении хеликобактерной инфекции обязательным условием выздоровления является эрадикация инфекционного агента. Современные протоколы лечения предусматривают назначение двух- или трехкомпонентной схемы, включающей антихеликобактерные антибиотики, ингибиторы протонной помпы, препараты висмута. Только полное излечение от хеликобактерий может привести к восстановлению слизистой и снижению риска малигнизации.
Только полное излечение от хеликобактерий может привести к восстановлению слизистой и снижению риска малигнизации.
Глюкокортикоидные гормоны при атрофическом гастрите назначаются только при развитии В12-фолиеводефицитной анемии. Также назначается симптоматическое лечение: заместительная терапия натуральным желудочным соком, ферментами, недостающими витаминами, препаратами железа. Для стимуляции секреции соляной кислоты необходимо пить минеральные воды с высоким содержанием солей, отвары трав (подорожник, полынь, фенхель), кислые соки, растворы лимонной и янтарной кислот.
Используются гастропротекторы (мизопростол, карбеноксолон), стимуляторы регенерации (облепиховое масло), обволакивающие средства на основе алюминия и висмута, препараты для улучшения перистальтики. Активно применяется физиотерапия: электрофорез с лекарственными препаратами, электро- и магнитотерапия, тепловые процедуры на область эпигастрия. Санаторно-курортное лечение вне периода обострения включает терапию минеральными водами на бальнеологических курортах.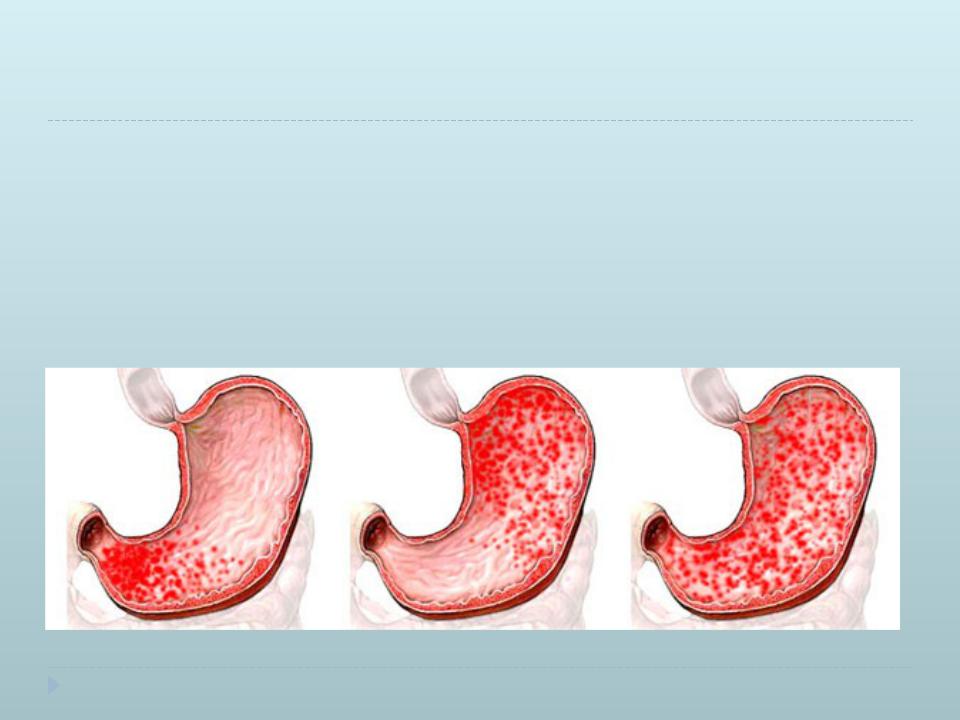
Прогноз и профилактика
Прогноз атрофического гастрита хуже у пациентов возрастной группы старше 50 лет – в этом возрасте метапластические процессы развиваются гораздо быстрее и чаще приводят к малигнизации. Большое значение для полного выздоровления имеет раннее начало лечения, а также степень эрадикации инфекционного агента. Если при повторном обследовании после курса антихеликобактерной терапии в желудочном содержимом определяются микроорганизмы, то курс следует повторить. Профилактикой развития атрофического гастрита является ранняя диагностика и лечение H.pylori, соблюдение режима дня и рационального питания, гигиены рук для предотвращения инфицирования.
Хронический атрофический гастрит – причины, симптомы, диагностика и лечение
Хронический атрофический гастрит – это заболевание, характеризующееся атрофией желудочных желез, перерождением эпителия желудка в кишечный, умеренно выраженным воспалительным процессом. Проявления зависят от локализации и этиологии атрофических процессов: в основном, это тяжесть в желудке после еды, быстрая насыщаемость, отрыжка, тошнота, неприятный вкус во рту, анемия. Золотой стандарт диагностики – ЭГДС с биопсией слизистой, внутрижелудочная рН-метрия, выявление H.pylori; остальные методы являются вспомогательными. Лечение заключается во введении глюкокортикоидных гормонов, натурального желудочного сока, витамина В12, применении антихеликобактерной схемы терапии.
Проявления зависят от локализации и этиологии атрофических процессов: в основном, это тяжесть в желудке после еды, быстрая насыщаемость, отрыжка, тошнота, неприятный вкус во рту, анемия. Золотой стандарт диагностики – ЭГДС с биопсией слизистой, внутрижелудочная рН-метрия, выявление H.pylori; остальные методы являются вспомогательными. Лечение заключается во введении глюкокортикоидных гормонов, натурального желудочного сока, витамина В12, применении антихеликобактерной схемы терапии.
Общие сведения
Хронический атрофический гастрит – диагноз морфологический, для верификации которого обязательны результаты ЭГДС. Клинические проявления данной патологии не всегда соответствуют выявляемым при проведении биопсии изменениям. Хронический атрофический гастрит может развиться как на поздних стадиях хеликобактерного гастрита (из-за длительной персистенции инфекции происходит постепенная гибель значительного количества желудочных желез), так и в результате аутоиммунных нарушений в организме (антитела к эпителиальным клеткам желудка вызывают их гибель, постепенно развивается ахлоргидрия).
H.pylori выявляется более чем у 80% населения России, при этом хроническое воспаление слизистой желудка обнаруживается примерно у 50%. Аутоиммунный гастрит у женщин диагностируется в три раза чаще, чем у мужчин, однако является достаточно редким заболеванием. Исследования в области гастроэнтерологии подтверждают, что заболеваемость хроническим гастритом повышается на 1,5% ежегодно.
Хронический атрофический гастрит
Причины
Наиболее значимыми причинами хронического атрофического гастрита являются инфекция H.pylori и аутоиммунные процессы. Атрофия эпителия желудка развивается на поздних стадиях хронического хеликобактер-ассоциированного гастрита. Бактерии сначала колонизируют слизистую антрального отдела, вызывая хронический воспалительный ответ. По мере прогрессирования инфекции процесс распространяется сначала на тело желудка, а затем и на остальные его отделы, инициируя пангастрит. На этой стадии уже четко визуализируются атрофические изменения слизистой, формируется хронический атрофический гастрит. Обычно на данном этапе хеликобактерии перестают выявляться, так как желудочные железы атрофируются, происходит замена желудочного эпителия на кишечный, к которому H.pylori не имеет тропности.
Обычно на данном этапе хеликобактерии перестают выявляться, так как желудочные железы атрофируются, происходит замена желудочного эпителия на кишечный, к которому H.pylori не имеет тропности.
При аутоиммунном гастрите поражение основных желез желудка наблюдается в начале заболевания. Диффузная атрофия эпителия желудка очень быстро прогрессирует, что связано с выработкой аутоантител к микросомальным антигенам париетальных клеток, гастринсвязывающим белкам, внутреннему фактору. Антитела принимают непосредственное участие в деструкции эпителиальных клеток желудка.
Причина образования аутоантител на сегодняшний день не определена, но гастроэнтерологи не исключают наследственной предрасположенности к хроническому атрофическому гастриту. Известно, что для запуска аутоиммунного процесса в эпителии желудка титр антител должен достичь некой критической цифры, индивидуальной для каждого человека. Повлиять на скорость этого процесса могут различные эндогенные и экзогенные провоцирующие факторы:
- Эндогенные факторы: генетические особенности, дуодено-гастральный рефлюкс, эндоинтоксикация, кислородное голодание, хронические инфекции, обменные и эндокринные нарушения, недостаток витаминов (гиповитаминоз), висцеральные рефлекторные реакции при патологии других органов.

- Экзогенные факторы: нарушения питания, вредные привычки (алкоголь, курение), прием некоторых медикаментов, воздействие ионизирующего излучения, инфекционные агенты (бактерии, грибы, паразиты).
Симптомы
Для хронического атрофического гастрита характерны как местные, так и общие проявления. Некоторые симптомы зависят от этиологии заболевания (HP-ассоциированный или аутоиммунный тип) и локализации воспалительного процесса.
При бактериальном генезе хронического атрофического гастрита с локализацией в антральном отделе пациенты предъявляют жалобы на тяжесть в желудке во время или сразу после еды. Если хронический гастрит длительно протекал как гиперацидный, больного могут беспокоить диспепсические нарушения: диарея или запоры, повышенный метеоризм, урчание в животе.
Аутоиммунный гастрит характеризуется тетрадой признаков: аутоиммунный процесс, наличие в крови антител к обкладочным клеткам желудка, В12-фолиеводефицитная анемия, ахлоргидрия. При любом виде хронического атрофического гастрита беспокоят боли в эпигастрии во время или после еды, тошнота, неприятный запах и привкус во рту, отрыжка и срыгивания, жжение в подложечной области или изжога.
При любом виде хронического атрофического гастрита беспокоят боли в эпигастрии во время или после еды, тошнота, неприятный запах и привкус во рту, отрыжка и срыгивания, жжение в подложечной области или изжога.
Общие проявления выражаются слабостью, раздражительностью, склонностью к артериальной гипотонии, колющими болями в сердце. Для хронического атрофического гастрита характерен демпинг-синдром: после еды возникает резкая слабость, бледность кожи, потливость, сонливость, икота, неустойчивый стул.
Осложнения
При аутоиммунном гастрите антитела поражают не только клетки желудка, но и внутренний фактор Касла, участвующий в метаболизме витамина В12. В результате этого развивается пернициозная анемия, проявляющаяся жжением в языке, симметричными парестезиями в руках и ногах, утомляемостью, сонливостью, депрессией. Помимо В12-дефицитной анемии, хронический аутоиммунный гастрит может осложняться язвенной болезнью желудка и ДПК, ахлоргидрией, раком желудка.
Диагностика
При подозрении на хронический гастрит пациент в обязательном порядке нуждается в консультации гастроэнтеролога и врача-эндоскописта. На первичном приеме назначается ряд анализов и исследований. После получения результатов проводится повторная консультация, на которой обычно и выставляется диагноз хронического атрофического гастрита.
- Лабораторые исследования. Анализ кала на скрытую кровь может быть положительным при наличии изъязвлений в слизистой желудка. В обязательном порядке проводятся исследования с целью обнаружения H.pylori: определение хеликобактер в кале методом ИФА, ПЦР-диагностика, определение антител к хеликобактер в крови, уреазный дыхательный тест.
- Эндоскопия желудка. Эзофагогастродуоденоскопия позволяет выявить атрофию слизистой оболочки желудка. Для подтверждения визуальных изменений проводится эндоскопическая биопсия с морфологическим исследованием биоптатов.
- Дополнительные методы диагностики.
 Чтобы определить уровень секреции желудочного сока, осуществляется внутрижелудочная pH-метрия. УЗИ органов брюшной полости используется только для дифференциальной диагностики и выявления сопутствующей патологии.
Чтобы определить уровень секреции желудочного сока, осуществляется внутрижелудочная pH-метрия. УЗИ органов брюшной полости используется только для дифференциальной диагностики и выявления сопутствующей патологии.
Лечение хронического атрофического гастрита
Перед началом лечения рекомендуется отказаться от вредных привычек (курения, приема алкоголя). Диета не является основным методом терапии хронического атрофического гастрита. Медикаментозное лечение планируется в зависимости от этиологии заболевания (хеликобактерный или аутоиммунный гастрит).
При хроническом атрофическом гастрите, сопровождающемся тяжелыми аутоиммунными нарушениями, показано назначение коротких курсов глюкокортикоидных гормонов в невысоких дозах. После стабилизации процесса и регресса клинических проявлений лечение прекращается. Если секреторная функция желудка не восстановилась, назначают натуральный желудочный сок, прокинетики, ферменты поджелудочной железы. Проводится коррекция В12-дефицитной анемии.
Проводится коррекция В12-дефицитной анемии.
Лечение хеликобактер-ассоциированного хронического атрофического гастрита стандартное: ингибиторы протонной помпы в сочетании с антибактериальными препаратами (кларитромицин, амоксициллин, фуразолидон, метронидазол, тетрациклин), препаратами висмута. Использование препаратов висмута вместо ИПП показано пациентам с пониженной секреторной функцией желудка.
После 1,5-2 месяцев антихеликобактерной терапии необходимо провести повторное исследование на H.pylori. Если эрадикации возбудителя не произошло, то определяется его чувствительность к антибиотикам, и дальнейшее лечение проводится согласно полученным результатам. Симптоматическая терапия включает в себя препараты, препятствующие дуодено-гастральному рефлюксу (уродезоксихолевая кислота), метеоризму, замещающую ферментную терапию.
Прогноз и профилактика
Прогноз при хроническом атрофическом гастрите зависит от многих факторов: степени обсеменения H.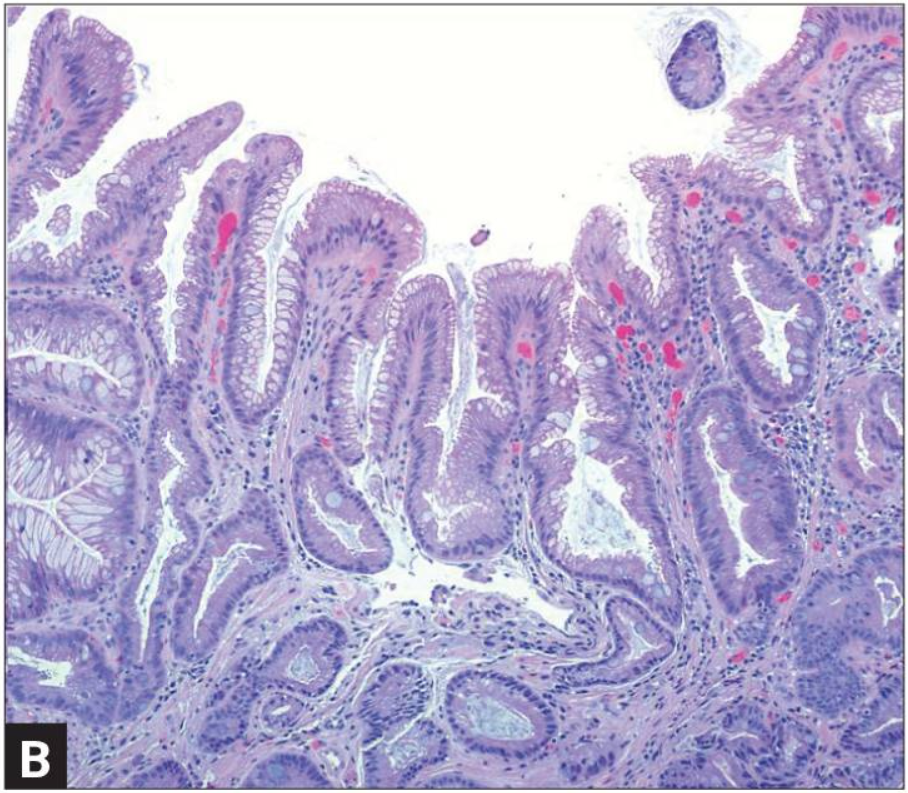 pylori и атрофии слизистой и др. Хеликобактерная инфекция является начальным звеном патологического процесса, который в будущем может привести к раку желудка. На начальных этапах атрофию слизистой можно предотвратить или остановить, именно на этой стадии большинство пациентов обращается за медицинской помощью.
pylori и атрофии слизистой и др. Хеликобактерная инфекция является начальным звеном патологического процесса, который в будущем может привести к раку желудка. На начальных этапах атрофию слизистой можно предотвратить или остановить, именно на этой стадии большинство пациентов обращается за медицинской помощью.
Значительно улучшить прогноз позволяет эрадикация H.pylori до наступления атрофии слизистой желудка, а также своевременное начало лечения пернициозной анемии. На стадии кишечной метаплазии риск малигнизации крайне высокий. Профилактика хронического атрофического гастрита заключается в своевременном выявлении и лечении инфекции H.pylori, устранении других факторов риска этого заболевания.
Атрофический гастрит: симптомы, диагностика, лечение
Симптомы атрофического гастрита
Выявить основные симптомы болезни несложно. В частности, пациенты жалуются на переполненность желудка после еды, ощущение тяжести в нем. Боль практически полностью отсутствует. Прием пищи неизбежно вызывает отрыжку воздухом, которая со временем приобретает довольно неприятный привкус, вслед за которым начинается изжога. Одновременно страдающий атрофическим гастритом теряет аппетит, секреторная функция желудка работает с заметными нарушениями, из-за чего пациент может сильно похудеть. Также среди симптомов атрофического гастрита выделяют бульканье и урчание в животе, походы в туалет оборачиваются запорами и поносом. Иногда после еды пациентов беспокоит излишняя потливость, слабость в теле, головокружение.
Боль практически полностью отсутствует. Прием пищи неизбежно вызывает отрыжку воздухом, которая со временем приобретает довольно неприятный привкус, вслед за которым начинается изжога. Одновременно страдающий атрофическим гастритом теряет аппетит, секреторная функция желудка работает с заметными нарушениями, из-за чего пациент может сильно похудеть. Также среди симптомов атрофического гастрита выделяют бульканье и урчание в животе, походы в туалет оборачиваются запорами и поносом. Иногда после еды пациентов беспокоит излишняя потливость, слабость в теле, головокружение.
Рано или поздно возникают проблемы со всасыванием в кишечнике и желудке важных для организма веществ. Ввиду недостатка витамина A ухудшается зрение, кожа становится сухой, пациент бледнеет. Дефицит витамина C может привести к кровоточивости десен, выпадению волос, ломающимся ногтям.
Диагностика атрофического гастрита
Если пациент заметил у себя хотя бы некоторые из вышеперечисленных симптомов, необходимо пройти диагностику в зарекомендовавшей себя клинике, в которой работают высококвалифицированные специалисты. Главным методом диагностики атрофического гастрита является эндоскопическое исследование. Оно представляет собой внимательный осмотр внутренних органов — желудка, двенадцатиперстной кишки, пищевода. Атрофический гастрит, так или иначе, проявляет себя, и слизистая оболочка является поврежденной, бледно-серой, истонченной. При этом сосудистый рисунок становится более выраженным, а размер складок слизистой оболочки уменьшается. Тем не менее, подводить итоги можно лишь после того, как будут проанализированы кусочки ткани слизистой оболочки желудка, которые врач берет во время эндоскопии.
Главным методом диагностики атрофического гастрита является эндоскопическое исследование. Оно представляет собой внимательный осмотр внутренних органов — желудка, двенадцатиперстной кишки, пищевода. Атрофический гастрит, так или иначе, проявляет себя, и слизистая оболочка является поврежденной, бледно-серой, истонченной. При этом сосудистый рисунок становится более выраженным, а размер складок слизистой оболочки уменьшается. Тем не менее, подводить итоги можно лишь после того, как будут проанализированы кусочки ткани слизистой оболочки желудка, которые врач берет во время эндоскопии.
В медицинском центре «Евромедпрестиж» диагностикой атрофического гастрита занимаются профессиональные врачи, имеющие большой медицинский опыт и, оборудованную согласно всем современным требованиям, лабораторию. Результаты анализов обрабатываются максимально быстро и точно.
Лечение атрофического гастрита
Лечение атрофического гастрита подразумевает комплексный подход. Медикаменты, безусловно, оказывают благотворное влияние, однако, принимать их стоит лишь в период обострения атрофического гастрита. Ни в коем случае нельзя забывать о специальных физиотерапевтических процедурах, лечебно-физкультурном комплексе, отдых на курортах и в санаториях.
Ни в коем случае нельзя забывать о специальных физиотерапевтических процедурах, лечебно-физкультурном комплексе, отдых на курортах и в санаториях.
Для лечения и избавления от боли врачи советуют принимать холинолитики периферического действия. В частности, речь идет о метацине, атропине, платиллине. Помимо этого, очень помогают антациды: гастал, фосфалюгель, алмагель, маалокса.
Нужно вовремя озаботиться поиском ответа на вопрос, как вылечить атрофический гастрит, потому что болезнь в запущенном состоянии создает все предпосылки для возникновения рака желудка. Сейчас, в двадцать первом веке, существует множество эффективных методов лечения атрофического гастрита.
Полноценное и правильное питание поможет снизить риск образования опухоли в желудке. В первую очередь, надо забыть о маринованных, копченых и консервированных продуктов. Обязателен полный отказ от табака и крепкого алкоголя (особенно когда в качестве закуски подаются соленые, жирные, жареные и копченые блюда). Нельзя переедать. Стоит добавить в рацион как можно больше свежих овощей и фруктов, качественных соков, зелени, витаминов A и C, молочных продуктов.
Нельзя переедать. Стоит добавить в рацион как можно больше свежих овощей и фруктов, качественных соков, зелени, витаминов A и C, молочных продуктов.
Также важно следить за своим весом, по возможности делать физические упражнения, избегать стресса, выстроить режим дня, при котором время на отдых и на работу будет сбалансировано.
Зачастую лечение атрофического гастрита занимает достаточно продолжительное время, но под контролем опытного врача этот процесс происходит быстрее.
Профилактика атрофического гастрита
Медики считают основным фактором в успешной профилактике атрофического гастрита своевременное лечение хеликобактерной инфекции. Все, что для этого нужно — пройти специальный курс лечения, который в среднем длится от семи до четырнадцати дней. Обычно пациентам выписываю три препарата, в большинстве своем антибиотики. Категорически запрещается лично заниматься выбором правильных лекарств, так как это может быть чревато осложнениями. Только профессиональный врач является компетентным в подобных вопросах.
Диета при атрофическом гастрите
Для выбора наиболее оптимальной диеты важно определить, с каким именно типом атрофического гастрита столкнулся пациент.
Если гастрит имеет пониженную кислотность, нужно полностью исключить из рациона изделия из сдобы, свежий хлеб, молоко. Гастрит с повышенной кислотностью запрещает употребление творога и других кисломолочных продуктов, томатов, соленых и копченых блюд, мясных и наваристых супов, острой и кислой пищи.
Подходящую диету при атрофическом гастрите поможет подобрать врач, исходя от стадии заболевания, возраста пациента, особенной его организма.
В медицинском центре «Евромедпрестиж» вам помогут выявить атрофический гастрит даже на ранней стадии развития. Вы можете пройти полную диагностику и сдать все необходимые анализы в лаборатории, оснащенной медицинским оборудованием согласно всем современным требованиям. Высококвалифицированные врачи с большим медицинским опытом помогут подобрать подходящую именно вам схему лечения, которая даст положительные результаты и вернет вам здоровье и отличное самочувствие.
Медицинский центр «Евромедпрестиж»: мы знаем, как вылечить атрофический гастрит.
Анализ особенностей течения язвенной болезни желудка на фоне хронического атрофического гастрита
Хронический атрофический гастрит относят к хроническим воспалительно-дистрофическим заболеваниям желудка, которые сопровождаются структурно-морфофункциональной перестройкой его слизистой оболочки с последующей прогрессирующей атрофией железистого эпителия, нарушениями секреторной, моторной и нередко инкреторной функции желудка.
Будучи одним из самых распространенных заболеваний в мире хронический атрофический гастрит чаще диагностируется у людей старших возрастных групп. В возрасте старше 60 лет этим заболеванием страдает более 90 % населения.
В основе патогенеза атрофического гастрита лежат дистрофические и дисрегенераторные изменения клеток поверхностного эпителия, воспалительная инфильтрация слизистой оболочки желудка и атрофия нормальных желез. Почти в половине случаев атрофический гастрит может сочетаться со структурной перестройкой слизистой оболочки желудка в виде метаплазии, дисплазии или неоплазии эпителия — процессов, которые потенциально приводят к развитию рака желудка. Связь между патогенетическими процессами при хроническом гастритом и язвенной болезнью на сегодняшний день остается не постоянной. Теория о гастритической этиологии язвенной болезни рассматривает хронический гастрит как первичное заболевание, предшествующее язвенной болезни (с локализацией язвы в желудке), то есть, вторичному возникновению язв на фоне гастрита. Особенно же реальной угроза возникновения язв желудка, становится в условиях, когда атрофические изменения слизистой оболочки желудка выявляются в комбинации с сохраненной или повышенной секрецией соляной кислоты. Тем не менее, существует множество работ, ставящих под сомнение теорию гастритической этиологии в происхождении язвенной болезни желудка. В особенности, следует обратить внимание на то, что распространенность хронического гастрита среди населения может достигать в настоящее время 80 %, однако заболеваемость язвенной болезнью (в целом хоть и достаточно высокая) все же не превышает 7–10 %.
Почти в половине случаев атрофический гастрит может сочетаться со структурной перестройкой слизистой оболочки желудка в виде метаплазии, дисплазии или неоплазии эпителия — процессов, которые потенциально приводят к развитию рака желудка. Связь между патогенетическими процессами при хроническом гастритом и язвенной болезнью на сегодняшний день остается не постоянной. Теория о гастритической этиологии язвенной болезни рассматривает хронический гастрит как первичное заболевание, предшествующее язвенной болезни (с локализацией язвы в желудке), то есть, вторичному возникновению язв на фоне гастрита. Особенно же реальной угроза возникновения язв желудка, становится в условиях, когда атрофические изменения слизистой оболочки желудка выявляются в комбинации с сохраненной или повышенной секрецией соляной кислоты. Тем не менее, существует множество работ, ставящих под сомнение теорию гастритической этиологии в происхождении язвенной болезни желудка. В особенности, следует обратить внимание на то, что распространенность хронического гастрита среди населения может достигать в настоящее время 80 %, однако заболеваемость язвенной болезнью (в целом хоть и достаточно высокая) все же не превышает 7–10 %. Возможность возникновения язв желудка на фоне интактной слизистой оболочки или же гастрита типа Менетрие (считается нехарактерным для язвенного поражения желудка), также была многократно доказана. Но, факт о снижении регенераторной способности при атрофии слизистой оболочки, способствующему развитию осложнений язвенной болезни (перфорация, пенетрация), остается несомненным. Само наличие атрофии с последующими дисплазией и неоплазией может быть рассмотрено как потенциально предраковое состояние. Таким образом, патогенетическая взаимосвязь между хроническим гастритом и язвенной болезнью желудка все еще остается непостоянной.
Возможность возникновения язв желудка на фоне интактной слизистой оболочки или же гастрита типа Менетрие (считается нехарактерным для язвенного поражения желудка), также была многократно доказана. Но, факт о снижении регенераторной способности при атрофии слизистой оболочки, способствующему развитию осложнений язвенной болезни (перфорация, пенетрация), остается несомненным. Само наличие атрофии с последующими дисплазией и неоплазией может быть рассмотрено как потенциально предраковое состояние. Таким образом, патогенетическая взаимосвязь между хроническим гастритом и язвенной болезнью желудка все еще остается непостоянной.
Цель исследования заключалась в оценке особенностей протекания язвенной болезни желудка на фоне хронического атрофического гастрита.
Материал иметоды. Был проведен анализ 156 историй болезни пациентов с язвенной болезнью желудка в анамнезе. Исследование проводилось на базе гастроэнтерологического отделения РКБ г. Владикавказа. Особое внимание при анализе было направлено на оценку клинических симптомов, состояния слизистой оболочки желудка, инфицированность Helicobacter pylori, размер и локализацию язв, наличие специфических осложнений (перфорация, пенетрация, малигнизация).
Результаты иобсуждение. Результаты данного исследования представлены в виде таблице. Исследование показало, что развитие язвенного дефекта в большинстве случаев (70 %) происходило на фоне атрофии слизистой: 108 случаев. Таким образом, находит свое подтверждение факт о высокой распространенности атрофического гастрита как фонового процесса для болезней желудочно-кишечного тракта. Размеры язвенного дефекта у больных атрофическим гастритом, превышали таковые у пациентов с интактной слизистой оболочкой. Например, средний диаметр язв у больных с атрофическими изменениями составлял 1,7 см, а у пациентов с неизмененной слизистой — 1,1 см. Среди лиц с атрофией в большем количестве случаев наблюдались множественные язвенные дефекты — 24 и 16 случаев соответственно.
Атрофический гастрит характеризуется появлением язвенного дефекта в теле и углу желудка, в местах, где раньше и чаще наблюдаются процессы малигнизации. Известно, что в процессе появления раковой опухоли слизистая оболочка претерпевает изменения, соответствующие стадиям хронического гастрита (каскад Correa): хеликобактерная инфекция — воспалительные изменения — атрофия — метаплазия — дисплазия, неоплазия — рак. В ходе исследования осложнение в виде малигнизации было отмечено в 8 случаях, примечательно, что во всех случаях язва находилась в теле желудка на фоне атрофического гастрита. Этиологическим фактором послужили Helicobacter pylori (HP), что было подтверждено методом Полимеразной цепной реакции.
Стоит отметить, что НР были выявлены у 56 пациентов с атрофическим гастритом (58 % случаев) и у 34 больных с неатрофическим гастритом. У 26 пациентов Нelicobacter Рylori не были обнаружены, к сожалению, у 40 больных диагностика НР не была проведена.
Анализ клинической картины (главным образом диспепсического синдрома) проводился с использованием записей в историях болезни. Было выявлено, что у пациентов с диагностированным атрофическим гастритом болевой синдром присутствовал лишь в 10 % случаев, а доминировали такие симптомы, как чувство распирания в животе, тяжесть, тошнота. В то же время пациенты с неатрофическим гастритом чаще предъявляли жалобы на боли с наиболее частой локализацией в эпигастральной области. Примечательно, что купирование симптомов на фоне лечения было более эффективным у больных с язвенной болезнью на фоне атрофического гастрита.
Морфофункциональные особенности язвенного дефекта упациентов схроническим атрофическим инеатрофическим гастритом.
Признаки | Хр. атрофический гастрит | Хр. неатрофический гастрит |
Всего случаев | 108 (70 %) | 48 (30 %) |
Средний диаметр язв, см | 1,7 | 1,1 |
Множественные язвенные дефекты | 24 (15 %) | 16 (10 %) |
Локализация в теле | 62 (40 %) | 12 (7,6 %) |
Локализация в антруме | 26 (16,6 %) | 30 (19,2 %) |
Локализация в углу, кол. случаев | 20 (12,8 %) | 6 (3,8 %) |
Малигнизация | 8 (5 %) | 0 |
Пенетрация, перфораци | 10 (6,4 %) | 8 (5 %) |
Частота болевого синдрома | 16 (10,2 %) | 40 (25,6 %) |
Частота дискинетического синдрома | 96 (61,5 %) | 12 (7,6 %) |
Выводы. 1. Наличие атрофии слизистой оболочки желудка не всегда способствует развитию язвенной болезни, но часто усугубляет течение: увеличивает размер и число язвенных дефектов.2. Возникновение язвенной болезни желудка на фоне атрофического гастрита всегда ассоциировано с Helicobacter pylori.3. Язвенная болезнь на фоне атрофии слизистой оболочки определяет высокий риск малигнизации.
Литература:
- Кудрявцева Л. В. Helicobacter spp.: виды, штаммы, патогенность для человека с позиций микробиолога. Доклад на 4-ом съезде научного общества гастроэнтерологов России. М. — 5 февраля — 2004
- Ливзан М. А., Кононов А. В., Мозговой С. И. Экс-хеликобактерный гастрит: неологизм или реальность? // Экспериментальная и клиническая гастроэнтерология. — 2004; 5: 55–60.
- Борисов, Д. Н. Эндоскопическая диагностика и лечение больных с синдромом Меллори-Вейса, осложненным кровотечением — М., 2001.
Атрофический гастрит – StatPearls – Книжная полка NCBI
Непрерывное обучение
Атрофия желудка (GA) и кишечная метаплазия слизистой оболочки желудка (GIM) вместе известны как хронический атрофический гастрит (CAG). Эти ранние состояния могут прогрессировать до аденокарциномы желудка. В этом обзоре основное внимание уделяется текущим данным и рекомендациям по диагностике, лечению и надзору за хроническим атрофическим гастритом с целью выявления лиц, подверженных риску прогрессирования аденокарциномы желудка.В нем также подчеркивается роль межпрофессиональной команды в ведении пациентов, страдающих атрофическим гастритом.
Цели:
Описать результаты лабораторных и эндоскопических исследований хронического атрофического гастрита.
Обзор патофизиологии хронического атрофического гастрита.
Объясните важность мониторинга и наблюдения за пациентами с хроническим атрофическим гастритом.
Подчеркните важность межпрофессионального сотрудничества в долгосрочном ведении пациентов с хроническим атрофическим гастритом.
Введение
Атрофия желудка (GA) и кишечная метаплазия слизистой оболочки желудка (GIM) вместе известны как хронический атрофический гастрит (CAG). Эти ранние состояния могут привести к развитию аденокарциномы желудка (ГК). В этом обзоре основное внимание уделяется текущим данным и рекомендациям по диагностике, лечению и надзору за хроническим атрофическим гастритом с целью выявления лиц, подверженных риску прогрессирования аденокарциномы желудка.[1]
Хронический атрофический гастрит считается предшественником рака желудка, который является пятым по распространенности раком в мире и несет третье место в мире по смертности от рака. Этот агрессивный рак проявляется поздно в большинстве стран, где нет программ скрининга, и приводит к многочисленным смертельным исходам из-за поздней диагностики.
Распространенной этиологией этого предракового поражения является Helicobacter pylori (H. pylori) и аутоиммунный гастрит. Хроническое воспаление приводит к потере слизистой оболочки желудка, что приводит к обедненной кислотой среде, которая, как предполагается, является ранним предшественником дистального рака желудка.[2]
H. pylori – это микроаэрофильный грамотрицательный бактериальный патоген. Его роль связана не только с атрофическим гастритом, но и с пептическими язвами, аденокарциномой желудка и лимфомой лимфоидной ткани, ассоциированной со слизистой оболочкой (MALT). Идентификация и искоренение патогена играют важную роль в снижении риска CAG. [3] [4]
Чрезвычайно важно идентифицировать предраковые поражения путем выявления тех, которые находятся в группе риска. Также крайне важно проводить контрольную эндоскопию и, при необходимости, эндоскопическое вмешательство, чтобы избежать обширной хирургической резекции при поздних стадиях рака желудка.
Популярный Correa Cascade предполагает линейное прогрессирование от хронического атрофического гастрита (CAG) с метапластическим кишечным эпителием до дисплазии низкой степени (LGD), дисплазии высокой степени (HGD) и, в конечном итоге, аденокарциномы желудка [2].
Этиология
Хотя этиология атрофического гастрита все еще обсуждается, мы знаем, что бактерий H. pylori и являются основным виновником хронического атрофического гастрита. Со временем это может привести к прогрессирующей потере и разрушению желудочных желез, описываемых как multifoca l atrophic gastritis.Распространенность инфекции составляет почти 50% мирового населения. H. pylori был первоначально обнаружен как причина язвы желудка и двенадцатиперстной кишки в начале 1980-х годов. Сложность возникает при ведении людей, инфицированных патогеном, который затем может отрицательно повлиять на лечение заболевания пищевода. [3] [5]
Аутоиммунный гастрит возникает из-за разрушения оксинтических клеток слизистой оболочки аутоантител против антигенного белка H + / K + АТФазы, что приводит к атрофии слизистой оболочки.Эта аутоиммунная реакция преимущественно атакует тело и дно желудка, где расположены кислородные клетки (париетальные и главные клетки), не затрагивая антральный отдел [6] [7].
Эпидемиология
Хронический атрофический гастрит чаще встречается у пожилых людей, хотя он варьируется в разных регионах мира. Сложность возникает из-за бессимптомного характера заболевания у большинства людей [8].
Возраст
В популяционном когортном исследовании в Германии диагноз поставлен на основании серологической оценки пепсиногена 1 и H.pylori распространенность увеличилась с 4,8% в возрастной группе от 50 до 54 лет до 8,7% в возрастной группе от 70 до 74 лет. Эта разница была выше в Японии, увеличившись с 2,7 до 9,1%. [9] [10]
Аутоиммунный атрофический гастрит распространен среди пожилых женщин североевропейского и скандинавского происхождения, но теперь обнаружено, что он существует во всех этнических группах, регионах и возрастах. [11]
Возраст и Helicobacter Pylori
CAG чаще встречается у пожилых людей с H.pylori и несколько чаще встречается у мужчин. Распространенность наблюдалась при серологическом исследовании пепсиногена и эндоскопической биопсии. В регионах с высокой заболеваемостью, таких как Япония и Китай, этот показатель колеблется от 33% до 84%. [12] [9]
В целом существует широкий разброс в риске развития аденокарциномы желудка у лиц с предраковыми состояниями, такими как CAG (GA / IM) с частотой <1% в год (человеко-год), независимо от того, относится ли человек к группе низкого риска или группа высокого риска.[13]
Существует два различных типа злокачественных новообразований, связанных с CAG: аденокарцинома желудка, связанная с инфекцией H pylori , и нейроэндокринная гастрин-зависимая опухоль (карциноид желудка 1 типа), вторичная по отношению к гиперплазии энтерохромаффиноподобных клеток. [2]
Атрофический гастрит и риск рака
В другом когортном исследовании было проведено эндоскопическое наблюдение пациентов с H. pylori AG для выявления рисков рака желудка.Средняя продолжительность контрольной эндоскопии составила 6,2 +/- 4,8 года. Кумулятивная 5-летняя заболеваемость аденокарциномой желудка колебалась от 0,7% при отсутствии или легкой АГ до 10% при тяжелой АГ. [14] [15]
Патофизиология
Риск рака желудка у людей связан с комбинацией трех различных наборов этиологии: первичная инфекция H. pylori и способность хозяина к иммунному ответу, восприимчивость хозяина к атрофическому гастриту в результате хронического воспаления и факторы окружающей среды, такие как курение сигарет и высокое потребление соли.
H. pylori может первоначально вызвать неатрофический гастрит (NAG), который может быть излечен путем избавления от инфекции; однако тяжелая НАГ может привести к атрофии слизистой оболочки и псевдопилорической метаплазии. На этом этапе прогрессирование до атрофии зависит от вирулентности бактерий, такой как наличие cag -положительных штаммов vacA s1m1 по сравнению с cag-отрицательными штаммами vacA s2m2 при неатрофическом гастрите (NAG). [16]
Мультифокальный атрофический гастрит (МАГ) или гастрит типа B
Длительный воспалительный процесс, в основном вызванный H.pylori, приводит к постепенной потере железистой оксинитической слизистой оболочки. Это начинается в теле и антральном отделе, а затем распространяется по желудку и называется мультифокальным атрофическим гастритом (МАГ). Снижение уровня пепсиногена 1 является показателем степени атрофии кислородных клеток. Уровни пепсиногена 2 повышаются из-за их контрастной стимуляции воспалением H. pylori и гиперплазией фовеолярных клеток. Уровни пепсиногена и соотношение пепсиноген 1 / пепсиноген 2 могут предсказывать обширный атрофический гастрит.[17]
Аутоиммунный метапластический атрофический гастрит (AMAG) или гастрит типа A
Этот неуловимый синдром встречается редко и может также сопровождаться инфекцией H. pylori . На ранних стадиях он протекает бессимптомно. Он включает тяжелую диффузную атрофию оксинтных клеток (париетальных клеток) в теле и глазном дне, но , а не в антральном отделе из-за аутоиммунной реакции антител против париетальных клеток. Это вызывает гипохлоргидрию, повышающую pH в желудке.Внутренний фактор, необходимый для всасывания витамина B12, секретируется париетальными клетками. Отсутствие внутреннего фактора приводит к злокачественной анемии, гематологическому проявлению этого аутоиммунного процесса. [18] [6] [19]
Кишечная метаплазия
Утраченная слизистая оболочка желудочного эпителия в конечном итоге заменяется слизистой оболочкой кишечного типа, которая может быть тонкой или толстой кишки в зависимости от морфологии и иммуногистохимии. Среди энтероцитов могут быть бокаловидные клетки тонкого кишечника и микроворсинки, создающие вид «щеточной каймы».[20]
Кишечная метаплазия толстокишечного типа демонстрирует фенотип толстой кишки и экспрессию муцина. Пищеварительные ферменты не обнаруживаются все время и поэтому называются «неполными». Эта слизистая оболочка не имеет микроворсинок и содержит множество муциновых клеток. Неполная слизистая оболочка и большая площадь поражения этого типа кишечной метаплазии несут более высокий риск предракового развития [10].
Гистопатология
H. pylori – наиболее частая причина гастрита с инфильтрацией полиморфноядерных нейтрофилов и мононуклеарных лейкоцитов в слизистую оболочку и собственную пластинку.Тяжесть воспаления зависит от штамма H. pylori , а выраженное острое воспаление может предрасполагать к микроабсцессам. При хроническом гастрите наблюдается накопление мононуклеарных лейкоцитов в собственной пластинке и наличие лимфоидных агрегатов с зародышевыми центрами [21].
Гистологические признаки включают бледность, потерю желудочных складок, выступающих сосудов и атрофическую границу (демаркация бледной атрофии там, где заканчивается нормальная розовая граница) [22].
Предполагается, что протяженность атрофической границы с нормальной розовой слизистой оболочкой напрямую связана с прогнозированием прогрессирования CAG до риска GC.При определенных обстоятельствах биопсия тела может предоставить ценную информацию, так как длительное использование ингибитора протонной помпы может почти не привести к инфильтрации H. pylori , а пораженная оксинтическая слизистая оболочка расположена проксимальнее антрального отдела желудка [23].
При стандартной эндоскопии в белом свете ИМ выглядит как небольшие серо-белые слегка приподнятые бляшки с окруженными неровными пятнами бледно-розовой слизистой оболочки. [24] Когда ИМ расширяется, прямые железы становятся удлиненными и образуют бороздки, как в антральном отделе.[25]
Метаплазия определяется как замена дифференцированного типа слизистой оболочки другим дифференцированным типом клеток, не нормальным для органа. Кишечная метаплазия включает замену слизистой оболочки желудка слизистой оболочкой кишечника, что характерно для бокаловидных клеток, энтероцитов и колоноцитов [26].
История и физика
Классическая презентация предполагает наличие у людей боли в эпигастрии, тошноты и иногда рвоты; однако это бывает редко.Наиболее частое проявление – анемия. Это может проявляться в виде общей слабости, утомляемости, головных болей и сердцебиения. [27]
Нам известно, что у большинства пациентов с мультифокальным атрофическим гастритом, вызванным H. pylori- , симптомы отсутствуют. Симптомы, если они присутствуют, такие как тошнота и рвота, кратковременны и повторяются. [28]
Точно так же аутоиммунный метапластический атрофический гастрит обычно имеет неспецифические признаки и симптомы у женщин старше 60 лет. [29]
При AMAG может развиться злокачественная анемия с общей распространенностью 0.1%. Он может проявляться усталостью, головокружением, раздражительностью, депрессией, бессонницей и перепадами настроения. Иногда он может присутствовать при нормальном уровне витамина B12. [30]
Большинство людей уже получают лечение от дефицита железа, фолиевой кислоты или витамина B12 без подтвержденного основного диагноза. [11]
Представление может быть различным и может привести к диагностическим трудностям, когда у людей есть ассоциированные аутоиммунные состояния, такие как гипотиреоз, миелодиспластические синдромы, сидеробластная анемия или сосуществующие железодефицитная анемия и талассемия.[30]
Медицинский осмотр имеет ограниченное применение и обычно неспецифический с редкими признаками бледности, анемии и исхудания из-за плохого аппетита, но они встречаются редко.
При AMAG могут быть стигматы ассоциированного аутоиммунного заболевания с желтухой, тахикардией и систолическим шумом. [30]
Оценка
Из всех мировых руководств очевидно, что пациенты с хроническим атрофическим гастритом или кишечной метаплазией подвержены риску развития аденокарциномы желудка.Цель состоит в том, чтобы выявить запущенные стадии гастрита с атрофией и кишечной метаплазией в антральном отделе и слизистой оболочке тела, чтобы предотвратить прогрессирование дисплазии высокой степени и инвазивной карциномы. Эндоскопия высокого качества – золотой стандарт.
Уровни пепсиногена
Низкие уровни пепсиногена 1 и низкое соотношение пепсиноген 1 / пепсиноген 2 могут предсказать прогрессирующий атрофический гастрит и должны сопровождаться эндоскопией. Был сделан вывод, что комбинация пепсиногена H.pylori и уровни гастрина-17 являются хорошим диагностическим тестом для диагностики атрофического гастрита в группах высокого риска РЖ [31].
В метаанализе исследуемой популяции из более чем 32000 человек для выявления лиц с риском GC и CAG, риск развития GC на основании положительного теста на пепсиноген
Значение 0,3+ имело чувствительность 57 % и специфичность 76%. [32]
Эндоскопия
Недавнее обновление руководства по исследованию и лечению предраковых поражений желудка (GPL) связано с публикациями Европейского общества гастроэнтерологической эндоскопии совместно с европейскими обществами (лечение предраковых состояний эпителия и поражений желудка). (MAPS II) и Американской гастроэнтерологической ассоциации (AGA).[17]
Европейские и британские руководства сосредоточены на диагностике, лечении и наблюдении за атрофическим гастритом, IM и дисплазией, тогда как американские рекомендации сосредоточены на ведении людей с IM.
Первичная биопсия должна сопровождаться картированием биопсии в соответствии с Сиднейским протоколом для гастрита, по крайней мере, из двух топографических участков, антрального отдела x2 (меньшая кривая A1 антрального отдела и A2 большая кривая антрального отдела), incisura angularis (A3), переднее и заднее тело x2 и для H.pylori . Это связано с нерегулярным распространением гастрита. Кроме того, любое морфологически аномальное поражение, такое как язва, приподнятая поверхность или полип, прилегающие к атрофическим областям, следует биопсировать отдельно и отправить на гистологическую оценку в отдельном флаконе. [33]
Эндоскопические методы
Обычная хромоэндоскопия (ХЭ) с применением красителей, таких как индигокармин, метиленовый синий, уксусная кислота и гематоксилин, позволяет с высокой точностью обнаруживать предопухолевые поражения желудка.[34]
Хромоэндоскопия высокого разрешения лучше, чем эндоскопия высокого разрешения в белом свете для диагностики и картирования степени предраковых поражений желудка (GPL).
Эндоскопия в белом свете (WLE) недостаточно хороша, но HD WLE показала многообещающие результаты, но недостаточно надежные, чтобы предлагать их в качестве протокола. [35]
Узкополосная визуализация более чувствительна для обнаружения АГ и ИМ по сравнению с эндоскопией в белом свете высокой четкости, а также имеет лучшую визуальную диагностическую способность для раннего выявления рака.Некоторые центры используют комбинированный HD WLE с узкополосной визуализацией для достижения лучшего результата прицельной биопсии. [36] [37]
Обновленный протокол Сиднея показал, что область incisura angularis имеет самую высокую частоту и тяжесть IM. Incisura увеличила количество стадий высокого риска OLGA / OLGIM. Если КЭ недоступен, может быть полезна инцизура и более обширная биопсия. [38] [39]
Дисплазия низкой и высокой степени
Высококачественная хромоэндоскопия рекомендуется, если биопсия показывает дисплазию низкой или высокой степени.Пациенту может потребоваться эндоскопия под интенсивным наблюдением или направление на эндоскопическую резекцию. [17]
Важно отметить, что система OLGA оценивает весь спектр от атрофии желудка, фиброза, псевдопилорической метаплазии и кишечной метаплазии в отличие от системы OLGIM, которая оценивает только IM.
OLGA и OLGIM рекомендуют тестировать и лечить H. pylori у пациентов с GPL. Это также применимо после эндоскопического иссечения GPL. Обе системы оценки также согласны с тем, что IM, будь то обширный / толстый (неполный) тип или IM с семейным анамнезом GC, считаются высоким риском GC.В обоих методах оценки подтип IM также не важен, но может быть полезен для наблюдения.
Европейские руководящие принципы рекомендуют повторную эндоскопию с короткими интервалами с Сиднейским протоколом биопсии у тех, у кого случайно обнаружен КАГ. Напротив, Американская гастроэнтерологическая ассоциация (AGA) не рекомендует эндоскопию с коротким интервалом. Это должны быть высококачественные биопсии, ориентированные на направляющие, и виртуальная хромоэндоскопия. [40]
Рекомендации AGA основаны на совместном принятии решений клиницистом и пациентом при рутинной эндоскопии наблюдения за пациентами с «высоким риском РЖ» и учитывают расу / этническую принадлежность как фактор риска.Обоснование AGA состоит в том, что ни одно из рандомизированных контролируемых испытаний не предполагает, что эндоскопическое наблюдение снижает риск GC у лиц с GPL. Основанием для европейских обществ является то, что данных наблюдательных когортных исследований достаточно, чтобы оправдать более строгий надзор. [41] [42]
Лечение / ведение
Ликвидация Helicobacter Pylori
Было проведено множество исследований, оценивающих роль эрадикационной терапии при хроническом атрофическом и неатрофическом гастрите и раке желудка.В одном метаанализе эрадикационная терапия значительно улучшила гистологическую (OLGA / OLGIM) оценку атрофии желудка в теле и антральном отделе и кишечной метаплазии в антральном отделе (но не в теле) [43].
Может быть значительное снижение риска развития кишечных ГК за счет эрадикации H. pylori . В двух других метаанализах эрадикация H. pylori значительно снизила риск ГК, но не хронического атрофического гастрита и ИМ. [44] [45] H.pylori рекомендуется эрадикационная терапия пациентам, которым проводится эндоскопическое лечение поверхностной неоплазии желудка. Это снижает количество метахронных повторений GC почти вдвое. [4]
Таким образом, эрадикация H. pylori играет важную роль в гистологическом понижении стадии и может играть роль в снижении прогрессирования до GC.
Ингибиторы ЦОГ
Хотя было показано, что ингибиторы циклооксигеназы (ЦОГ-1 или ЦОГ-2) замедляют прогрессирование предраковых состояний желудка и теоретически снижают риск ГК, их недостаточно. статистические данные испытаний, позволяющие рекомендовать их для профилактики.[46]
Нестероидные противовоспалительные препараты
Имеются некоторые свидетельства положительного эффекта НПВП и аспирина в замедлении прогрессирования предраковых поражений желудка после удаления H. pylori из предыдущих исследований. Тем не менее, эффект невелик, чтобы рекомендовать его в качестве ориентира. Для изучения влияния НПВП на GPL необходимы дальнейшие исследования. Аспирин в низких дозах может быть безопаснее для использования и обеспечивать другие системные преимущества, например, при сердечно-сосудистых заболеваниях, но любое преимущество следует рассматривать в сравнении с известными желудочно-кишечными эффектами.[47]
Другие лекарственные препараты
Молуодан, китайский фитотерапевтический препарат, описанный в рандомизированном контролируемом исследовании с участием лиц с дисплазией, пониженной на 24,6% при гистологическом исследовании после шести месяцев лечения. [48] Ребамипид уменьшал воспаление и частоту атрофического гастрита и кишечной метаплазии в рандомизированном контролируемом исследовании, проведенном в Китае [49].
Было показано, что витамины A, C и E снижают риск рака желудка на треть в общей популяции при приеме внутрь в малых дополнительных дозах.[50]
Эндоскопическое лечение
Лечение хронического атрофического гастрита и кишечной метаплазии – это наблюдение, направленное на снижение прогрессирования до более сложных GPL, таких как дисплазия. Частота наблюдения зависит от гистологических данных.
Эндоскопическая резекция рекомендуется при диспластических поражениях и ранней аденокарциноме желудка. Эндоскопическая резекция слизистой оболочки (EMR) требуется для иссечения единым блоком поражений размером менее 10 мм. При поражениях размером более 10 мм может потребоваться эндоскопическая диссекция подслизистого слоя (ESD).[51] [52]
Протоколы для более продвинутых поражений кишечной аденокарциномы желудка выходят за рамки данной статьи и должны следовать протоколам рака желудка, чтобы гарантировать резекцию R0.
Дифференциальный диагноз
На основании клинических проявлений следующие состояния могут проявляться симптомами и признаками со стороны верхних отделов желудочно-кишечного тракта, что делает диагностику зависимой от инвазивных исследований, таких как эндоскопия:
Пищевод
Воспалительный
- 4 Рефлюкс-эзофагит1
Эозинофильный эзофагит
Стриктура пищевода
Инфекционный
Нарушения моторики
Неопластический
Желудок
Воспалительный
- H.pylori , кортикостероиды, стресс, анастомотические язвы)
Острый эрозивный гастрит (НПВП, аспирин)
Химиотоксик
Болезнь Крона
Билиарный гастрит, рефлюкс-гастрит 11
Радиационно-индуцированная
Инородное тело (трихобезоар, проглоченные предметы)
Инфекционное
Новообразование
Аденокарцинома желудка
Стоматологическая опухоль желудка
050005 Грудная лимфома
0005Нейроэндокринная опухоль
Двенадцатиперстная кишка
Воспалительная
Неопластическая
Поджелудочная железа
Желчный пузырь
Стадия
Прогрессивные изменения в развитии слизистой оболочки желудка и аденомы желудка могут приводить к номы.Гистологические изменения от поверхностного гастрита до злокачественной трансформации слизистой оболочки описаны ниже:
Helicobacter pylori гастрит
Неатрофический гастрит (NAG)
Язва двенадцатиперстной кишки или многоочаговый атрофический гастрит (MAG) без метаплазия
MAG с метаплазией (тип тонкого кишечника) или кишечной метаплазией неполного типа толстой кишки
Дисплазия низкой степени
Дисплазия высокой степени
Мукозирующая слизистая оболочка кишечника аденокарцинома
Стадия хронического атрофического гастрита / кишечной метаплазии
Успех определения степени тяжести гепатита побудил группу патологов и гастроэнтерологов организовать аналогичную систему отчетности .Это основано на риске рака от самого низкого (стадия 0) до самого высокого (стадия IV) в зависимости от тяжести атрофии и степени распространения атрофии в желудке. [53]
Аномальные участки слизистой оболочки, идентифицированные с помощью визуальной аналоговой шкалы, сравниваются со стандартизированными образцами биопсии по крайней мере пяти различных топографических областей. Постановка основана на комбинированной оценке тяжести атрофии и локализации и степени CAG в желудке. Степень атрофии слизистой оболочки рассчитывается на гистологических образцах как процентное соотношение атрофической / метапластической слизистой оболочки по сравнению с нормальной слизистой оболочкой антрального отдела и тела.Отдельные «средние» баллы тяжести атрофии рассчитываются для антрального отдела и тела, а затем сравниваются с задействованными топографическими областями, что приводит к этапам 1, 2, 3 и 4 классификации OLGA.
Степень атрофии (антральный отдел и тело)
Местоположение
Оценка антральной атрофии
Оценка атрофии корпуса
9000 A3 Средняя оценка антрального отдела будет рассчитана как A1 + A2 + Corpus С1 + С2. Общий балл OLGA классифицируется между стадиями с 1 по 4 в зависимости от сочетания тяжести атрофии и локализации распространения в антральном отделе и / или теле.Стадии 0, 1 и 2 считаются низким риском, а стадии 3 и 4 – высоким риском. Таким образом, на поздних стадиях 3 и 4 наблюдается более обширная атрофия слизистой оболочки и более широко распространенное топографическое поражение слизистой оболочки антрального отдела и тела желудка, что требует окончательного наблюдения. Следует отметить, что у человека может быть гастрит 3 стадии с тяжелой атрофией 3 балла, которая затрагивает только антральный отдел, но будет стадией 2, если она затрагивает только тело.GA и GIM имеют более высокий риск прогрессирования рака желудка при поражении тела, антрального отдела и инцизуры (3 или 4 стадии пангастрита).
Оперативное звено кишечной метаплазии желудка использует ту же конфигурацию биопсий в пяти регионах у лиц с кишечной метаплазией и классифицирует OLGIM стадии 0, 1, 2 низкого риска и стадии 3, 4 OLGIM высокого риска в зависимости от степени тяжести и степень распространения IM в желудке. Эта система рекомендована Американской гастроэнтерологической ассоциацией (AGA), тогда как европейские и британские центры следуют классификации OLGA для картирования и наблюдения. По степени тяжести метаплазия бывает легкой, средней и тяжелой кишечной метаплазии в антральном отделе и теле.На более поздних стадиях (3/4) наблюдается прогрессирующее распространение кишечной метаплазии от умеренной до тяжелой в теле и антральном отделе [54].
Система гистологической классификации OLGA оценивает все хронические атрофические изменения, включая кишечную метаплазию, тогда как в OLGIM учитывается только кишечная метаплазия. Сторонники OLGIM предполагают более высокую вероятность прогрессирования рака желудка в случаях OLGIM высокой стадии по сравнению с случаями OLGA высокой стадии. [55]
Недавний метаанализ исследований с участием более чем 2700 субъектов показал сильную связь между OLGA / OLGIM стадии 3/4 и аденокарциномой желудка и аденокарциномой желудка.стадия 1/2. Важно, чтобы люди с стадией 3/4 OLGA / OLGIM проходили более интенсивное наблюдение, чтобы снизить риск GC. [56]
Дисплазия желудка является поворотным моментом в развитии канцерогенеза желудка. Несомненно, дисплазию следует лечить как злокачественное новообразование с помощью эндоскопической или хирургической резекции. [57]
Стадия аденокарциномы желудка основана на классификации Лорена на диффузную аденокарциному желудка и аденокарциному желудка кишечного типа [58].
Прогноз
Аденокарцинома желудка является пятым по распространенности раком в мире.[1]
Хронический атрофический гастрит часто диагностируется поздно, так как многие люди годами могут протекать бессимптомно и диагностировать их случайно. Важно исследовать людей с факторами риска, такими как новое начало симптомов со стороны верхних отделов желудочно-кишечного тракта у лиц старше 50 лет, злокачественная анемия или семейный анамнез. [27]
Согласно одному из крупнейших метаанализов многочисленных исследований, проведенных во всем мире, заболеваемость раком желудка у лиц с атрофией желудка колеблется в широких пределах от 0.От 53 процентов до 15,24 на 1000 человеко-лет в зависимости от региона и этнической принадлежности, с самыми высокими показателями в странах Азии. Заболеваемость GC у людей с кишечной метаплазией была еще больше – от 0,38 до 17,08 на 1000 человеко-лет. Самый высокий уровень заболеваемости, который был выше 15 на 1000 человеко-лет, был в Азии и Соединенных Штатах Америки [13].
С точки зрения прогноза, совокупная пятилетняя заболеваемость аденокарциномой желудка увеличивается с 0,7% при легкой форме до 10% при тяжелом атрофическом гастрите у H.pylori – ассоциированный гастрит в более недавнем японском когортном исследовании [14].
Важно выявлять лиц из определенных этнических меньшинств, подвергающихся риску, и расследовать их. В другом исследовании американцы латиноамериканского и азиатского происхождения имели более высокую распространенность инфекции H. pylori и предраковых поражений желудка (GPL). Этническая принадлежность пациента должна рассматриваться как фактор риска при обнаружении GPL. [3] [59]
Осложнения
Осложнения, связанные с атрофией слизистой оболочки желудка, обычно могут быть:
Ахлоргидрия (потеря продукции кислоты приводит к гипергастринемии)
Макроцитарная анемия (внутренний фактор аутоиммунного гастрита)
дефицит железа (из-за потери абсорбции железа)Язва двенадцатиперстной кишки / желудка
Доброкачественные стриктуры привратника
Геморрагический гастрит
Аденокарцинома желудка
- лимфоассоциированная ткань слизистой оболочки желудка
Карциноидная опухоль желудка (гиперплазия энтерохромаффинных клеток)
Сдерживание и обучение пациентов
Выявление лиц из группы риска и регулярное наблюдение необходимы для предотвращения прогрессирования аденокарциномы желудка.
Хотя существуют разногласия в отношении длительного лечения атрофического гастрита и кишечной метаплазии, точный эндоскопический диагноз может помочь прийти к взаимоприемлемому соглашению о наблюдении между клиницистом и пациентом.
Случайное обнаружение анемии (дефицит железа или B12) следует исследовать наряду с лечением, чтобы избежать задержки в постановке диагноза.
Эрадикация Helicobacter pylori при более раннем гастрите и резекция предраковых поражений желудка могут снизить риск первичных и метахронных злокачественных новообразований.
Улучшение результатов медицинской бригады
У большинства людей симптомы отсутствуют или могут иметь место клиническая картина анемии (усталость, головные боли, сердцебиение и т. Д.) Или расплывчатые признаки и симптомы верхних отделов желудочно-кишечного тракта, такие как изжога, боль в эпигастрии, тошнота и, в редких случаях, рвота. Люди с пернициозной анемией могут иметь последствия аутоиммунных состояний, таких как ассоциированное заболевание щитовидной железы, сахарный диабет, дерматологические заболевания или заболевания суставов.
Кишечная метаплазия – самый надежный маркер прогрессирования хронического атрофического гастрита.Специализированная эндоскопия с хромоэндоскопией или эндоскопия в белом свете высокой четкости с узкополосной визуализацией или без нее полезна для картирования и взятия прицельной биопсии. Хотя кишечная метаплазия в очаговой локализации несет более высокий риск рака желудка по сравнению с отсутствием IM или CAG, риск, по-видимому, слишком мал, чтобы оправдать наблюдение за всеми людьми. Следует принять решение по отдельным факторам риска, которые уже обсуждались. [55]
- Одноцентровое IM с неполным IM типа толстой кишки с постоянным H.pylori или с семейным анамнезом потребует высококачественной эндоскопии через 3 года. [33] [60] [61] [Уровень 2, Уровень 1]
- На поздних стадиях атрофического гастрита или ИМ в обоих антральных отделах и корпуса необходимо пройти эндоскопию через 3 года [17].
- Лица с злокачественной анемией имеют семикратный относительный риск развития GC с коэффициентом заболеваемости 0,27% на человеко-год. Лица с аутоиммунным атрофическим гастритом должны пройти эндоскопию через 3-5 лет [19] [62].
- При дисплазии высокой или низкой степени потребуется эндоскопия раз в полгода и 12 раз в месяц, соответственно, с целью резекции диспластических поражений.[10]
Таким образом, хронический атрофический гастрит (атрофия желудка и метаплазия желудочно-кишечного тракта) является предраковым поражением желудка. Имеются данные о том, что на поздних стадиях CAG необходимо наблюдение во всех вышеупомянутых группах повышенного риска для предотвращения прогрессирования до злокачественного новообразования. Высококачественная эндоскопия для первоначального диагноза и мультидисциплинарный подход с участием лечащего врача, медсестры и гастроэнтеролога необходимы для надлежащего обследования, определения стадии и долгосрочного наблюдения за этими людьми.Врачи первичной медико-санитарной помощи могут помочь выявить людей с неясной этиологией анемии или другими желудочно-кишечными симптомами. Коллеги-медсестры могут помочь с получением подробного анамнеза, включая семейный анамнез или анамнез инфекции H. pylori . Гастроэнтеролог может помочь с эндоскопией и направить пациентов обратно к лечащему врачу с планом будущего наблюдения и выявления признаков и симптомов осложнений, включая рак желудка.
Дополнительное образование / Контрольные вопросы
Рисунок
OLGA со ссылкой 34.Предоставлено Mehdi Raza, MBBS, MRCS, MSc, FRCS
Рисунок
OLGIM со ссылкой 35. Предоставлено Mehdi Raza, MBBS, MRCS, MSc, FRCS
Ссылки
- 1.
- Arnold M, Abnet CC, Abnet CC Neale RE, Vignat J, Giovannucci EL, McGlynn KA, Bray F. Глобальное бремя 5 основных типов рака желудочно-кишечного тракта. Гастроэнтерология. 2020 июл; 159 (1): 335-349.e15. [PubMed: 32247694]
- 2.
- Корреа П. Биологическая модель желудочного канцерогенеза.IARC Sci Publ. 2004; (157): 301-10. [PubMed: 15055303]
- 3.
- Kusters JG, van Vliet AH, Kuipers EJ. Патогенез инфекции Helicobacter pylori. Clin Microbiol Rev.2006 июл; 19 (3): 449-90. [Бесплатная статья PMC: PMC1539101] [PubMed: 16847081]
- 4.
- Чой И.Дж., Кук М.С., Ким Й.И., Чо С.Дж., Ли Дж.Й., Ким К.Г., Пак Би, Нам Б. Helicobacter pylori для профилактики метахронного рака желудка. N Engl J Med. 2018 22 марта; 378 (12): 1085-1095. [PubMed: 29562147]
- 5.
- Testerman TL, Morris J. За желудком: обновленный взгляд на патогенез, диагностику и лечение Helicobacter pylori. Мир Дж. Гастроэнтерол. 2014 28 сентября; 20 (36): 12781-808. [Бесплатная статья PMC: PMC4177463] [PubMed: 25278678]
- 6.
- Питтман М.Э., Вольтаджо Л., Бхайджи Ф., Робертсон С.А., Монтгомери Е.А. Аутоиммунный метапластический атрофический гастрит: распознавание предшествующих поражений для соответствующей оценки пациента. Am J Surg Pathol. 2015 декабрь; 39 (12): 1611-20. [PubMed: 262]
- 7.
- Toh BH. Диагностика и классификация аутоиммунного гастрита. Autoimmun Rev.2014 апрель-май; 13 (4-5): 459-62. [PubMed: 24424193]
- 8.
- Аннибале Б., Эспозито Г., Ланер Э. Текущий клинический обзор атрофического гастрита. Эксперт Рев Гастроэнтерол Гепатол. 2020 Февраль; 14 (2): 93-102. [PubMed: 31951768]
- 9.
- Weck MN, Stegmaier C, Rothenbacher D, Brenner H. Эпидемиология хронического атрофического гастрита: популяционное исследование среди 9444 пожилых людей из Германии.Алимент Pharmacol Ther. 2007 15 сентября; 26 (6): 879-87. [PubMed: 17767472]
- 10.
- Бэнкс М., Грэм Д., Янсен М., Готода Т., Кода С., ди Пьетро М., Уэдо Н., Бхандари П., Притчард Д.М., Койперс Э.Д., Родригес-Хусто М., Новелли М.Р., Рагунат К., Шеперд Н., Динис-Рибейро М. Рекомендации Британского общества гастроэнтерологов по диагностике и ведению пациентов с риском аденокарциномы желудка. Кишечник. 2019 сентябрь; 68 (9): 1545-1575. [Бесплатная статья PMC: PMC6709778] [PubMed: 31278206]
- 11.
- Нойманн В.Л., Косс Э, Рагге М, Гента РМ. Аутоиммунный атрофический гастрит – патогенез, патология и лечение. Нат Рев Гастроэнтерол Гепатол. 2013 сентябрь; 10 (9): 529-41. [PubMed: 23774773]
- 12.
- Намеката Т., Мики К., Кимми М., Фриче Т., Хьюз Д., Мур Д., Судзуки К. Хронический атрофический гастрит и инфекция Helicobacter pylori среди американцев японского происхождения в Сиэтле. Am J Epidemiol. 2000 15 апреля; 151 (8): 820-30. [PubMed: 10965979]
- 13.
- Спенс А.Д., Кардвелл С.Р., Макменамин О.К., Хикс Б.М., Джонстон Б.Т., Мюррей Л.Дж., Коулман Х.Г.Риск аденокарциномы при атрофии желудка и кишечной метаплазии: систематический обзор. BMC Gastroenterol. 2017 декабрь 11; 17 (1): 157. [Бесплатная статья PMC: PMC5725642] [PubMed: 29228909]
- 14.
- Shichijo S, Hirata Y, Niikura R, Hayakawa Y, Yamada A, Ushiku T., Fukayama M, Koike K. Прогнозируются гистологическая кишечная метаплазия и эндоскопическая атрофия развития рака желудка после эрадикации Helicobacter pylori. Gastrointest Endosc. 2016 Октябрь; 84 (4): 618-24. [PubMed: 26995689]
- 15.
- Уэмура Н., Окамото С., Ямамото С., Мацумура Н., Ямагути С., Ямакидо М., Танияма К., Сасаки Н., Шлемпер Р.Дж. Инфекция Helicobacter pylori и развитие рака желудка. N Engl J Med. 2001, 13 сентября; 345 (11): 784-9. [PubMed: 11556297]
- 16.
- Wroblewski LE, Peek RM, Wilson KT. Helicobacter pylori и рак желудка: факторы, влияющие на риск заболевания. Clin Microbiol Rev.2010 Октябрь; 23 (4): 713-39. [Бесплатная статья PMC: PMC2952980] [PubMed: 20930071]
- 17.
- Пиментел-Нуньес П., Либаниу Д., Маркос-Пинто Р., Арейя М., Лея М., Эспозито Г., Гарридо М., Кикусте И., Меграуд Ф, Матисиак -Budnik T, Annibale B, Dumonceau JM, Barros R, Fléjou JF, Carneiro F, van Hooft JE, Kuipers EJ, Dinis-Ribeiro M.Ведение предраковых состояний и поражений эпителия желудка (MAPS II): Европейское общество эндоскопии желудочно-кишечного тракта (ESGE), Европейская группа изучения хеликобактерий и микробиоты (EHMSG), Европейское общество патологов (ESP) и Sociedade Portuguesa de Endoscopia Digestiva (SPED). ) обновление рекомендаций 2019. Эндоскопия. 2019 Апрель; 51 (4): 365-388. [PubMed: 30841008]
- 18.
- Cavalcoli F, Zilli A, Conte D, Massironi S. Дефицит микронутриентов у пациентов с хроническим атрофическим аутоиммунным гастритом: обзор.Мир Дж. Гастроэнтерол. 2017 28 января; 23 (4): 563-572. [Бесплатная статья PMC: PMC5292330] [PubMed: 28216963]
- 19.
- Vannella L, Lahner E, Osborn J, Annibale B. Систематический обзор: заболеваемость раком желудка при злокачественной анемии. Алимент Pharmacol Ther. 2013 Февраль; 37 (4): 375-82. [PubMed: 23216458]
- 20.
- Като Ю., Китагава Т., Янагисава А., Кубо К., Утсуде Т., Хирацука Х., Тамаки М., Сугано Х. Сайт-зависимое развитие типов полной и неполной кишечной метаплазии в желудке человека .Jpn J Cancer Res. 1992 Февраль; 83 (2): 178-83. [Бесплатная статья PMC: PMC5918776] [PubMed: 1372886]
- 21.
- Морсон BC, Собин Л.Х., Грундманн Э., Йохансен А., Нагайо Т., Серк-Ханссен А. Предраковые состояния и эпителиальная дисплазия в желудке. J Clin Pathol. 1980 августа; 33 (8): 711-21. [Бесплатная статья PMC: PMC1146204] [PubMed: 7430384]
- 22.
- Уэдо Н., Яо К. Эндолюминальная диагностика раннего рака желудка и его предшественников: устранение разрыва между эндоскопией и патологией.Adv Exp Med Biol. 2016; 908: 293-316. [PubMed: 27573777]
- 23.
- Sugimoto M, Ban H, Ichikawa H, Sahara S, Otsuka T., Inatomi O, Bamba S., Furuta T., Andoh A. Эффективность Киотской классификации гастрита в выявлении пациентов с высокой степенью Риск рака желудка. Intern Med. 2017; 56 (6): 579-586. [Бесплатная статья PMC: PMC5410464] [PubMed: 28321054]
- 24.
- Nagata N, Shimbo T., Akiyama J, Nakashima R, Kim HH, Yoshida T., Hoshimoto K, Uemura N. Эритема при эндоскопии.Gastroenterology Res. 2011 Октябрь; 4 (5): 203-209. [Бесплатная статья PMC: PMC5139844] [PubMed: 27957016]
- 25.
- Уэдо Н., Исихара Р., Ииси Х., Ямамото С., Ямамото С., Ямада Т., Иманака К., Такеучи Ю., Хигасино К., Исигуро С., Тацута М. Новый метод диагностики кишечной метаплазии желудка: узкополосная визуализация с увеличительной эндоскопией. Эндоскопия. 2006 август; 38 (8): 819-24. [PubMed: 17001572]
- 26.
- Crafa P, Russo M, Miraglia C, Barchi A, Moccia F, Nouvenne A, Leandro G, Meschi T., De ‘Angelis GL, Di Mario F.От Сидни до Ольги: обзор атрофического гастрита. Acta Biomed. 2018 17 декабря; 89 (8-S): 93-99. [Бесплатная статья PMC: PMC6502213] [PubMed: 30561425]
- 27.
- Li Y, Xia R, Zhang B, Li C. Хронический атрофический гастрит: обзор. J Environ Pathol Toxicol Oncol. 2018; 37 (3): 241-259. [PubMed: 30317974]
- 28.
- White JR, Winter JA, Robinson K. Дифференциальный воспалительный ответ на инфекцию Helicobacter pylori: этиология и клинические исходы. J Inflamm Res. 2015; 8: 137-47.[Бесплатная статья PMC: PMC4540215] [PubMed: 26316793]
- 29.
- Park JY, Cornish TC, Lam-Himlin D, Shi C., Montgomery E. Поражения желудка у пациентов с аутоиммунным метапластическим атрофическим гастритом (AMAG) в третичном периоде установка по уходу. Am J Surg Pathol. 2010 ноя; 34 (11): 1591-8. [PubMed: 20975338]
- 30.
- Oo TH, Rojas-Hernandez CM. Сложные клинические проявления злокачественной анемии. Discov Med. 2017 сентябрь; 24 (131): 107-115. [PubMed: 28972879]
- 31.
- Загари Р.М., Рабитти С., Гринвуд, округ Колумбия, Эусеби Л.Х., Вестито А., Баццоли Ф.Систематический обзор с метаанализом: диагностическая эффективность комбинации сывороточных тестов на пепсиноген, гастрин-17 и анти-Helicobacter pylori для диагностики атрофического гастрита. Алимент Pharmacol Ther. 2017 Октябрь; 46 (7): 657-667. [PubMed: 28782119]
- 32.
- Терасава Т., Нисида Х., Като К., Мияширо И., Йошикава Т., Такаку Р., Хамашима С. Прогнозирование развития рака желудка с помощью анализа сывороточного пепсиногена и серопозитивности на Helicobacter pylori у жителей Восточной Азии: a систематический обзор и метаанализ.PLoS One. 2014; 9 (10): e109783. [Бесплатная статья PMC: PMC4196955] [PubMed: 25314140]
- 33.
- Хван Й.Дж., Ким Н., Ли Х.С., Ли Дж.Б., Чой Й.Дж., Юн Х., Шин С.М., Пак И.С., Ли Д. Обратимость атрофического гастрита и кишечной метаплазии после эрадикации Helicobacter pylori – проспективное исследование сроком до 10 лет. Алимент Pharmacol Ther. 2018 Февраль; 47 (3): 380-390. [PubMed: 29193217]
- 34.
- Zhao Z, Yin Z, Wang S, Wang J, Bai B, Qiu Z, Zhao Q. Мета-анализ: диагностическая эффективность хромоэндоскопии для раннего рака желудка и предраковых поражений желудка.J Gastroenterol Hepatol. 2016 сентябрь; 31 (9): 1539-45. [PubMed: 26860924]
- 35.
- Anagnostopoulos GK, Yao K, Kaye P, Fogden E, Fortun P, Shonde A, Foley S, Sunil S, Atherton JJ, Hawkey C, Ragunath K. Эндоскопия с увеличением с высоким разрешением достоверно определить нормальную слизистую желудка, гастрит, ассоциированный с Helicobacter pylori, и атрофию желудка. Эндоскопия. 2007 Март; 39 (3): 202-7. [PubMed: 17273960]
- 36.
- Ang TL, Pittayanon R, Lau JY, Rerknimitr R, Ho SH, Singh R, Kwek AB, Ang DS, Chiu PW, Luk S, Goh KL, Ong JP, Tan JY, Тео Э. К., Фок К. М..Многоцентровое рандомизированное сравнение эндоскопии с высоким разрешением в белом свете и узкополосной визуализации для выявления поражений желудка. Eur J Gastroenterol Hepatol. 2015 декабрь; 27 (12): 1473-8. [PubMed: 26426836]
- 37.
- Эзоэ Й., Муто М, Уэдо Н., Дояма Х., Яо К., Ода И, Канеко К., Кавахара Й, Йокои С., Сугиура Й, Исикава Х, Такеучи Й, Канеко Й, Сайто Ю. Увеличивающая узкополосная визуализация более точна, чем обычная визуализация в белом свете при диагностике рака слизистой оболочки желудка. Гастроэнтерология.2011 декабрь; 141 (6): 2017-2025.e3. [PubMed: 21856268]
- 38.
- Исаев С., Лиепниеце-Кареле I, Янчаускас Д., Моисеев Г., Функа К., Кикусте И., Ванагс А., Толманис И., Лея М. Влияние биопсии инцизуры угловатой на оценку стадии гастрита. Eur J Gastroenterol Hepatol. 2014 Май; 26 (5): 510-3. [PubMed: 24625520]
- 39.
- Варбанова М., Векс Т., Йехорек Д., Рель Ф.В., Лангнер С., Селград М., Мальфертхайнер П. Влияние биопсии угла на выявление предопухолевых состояний желудка и оценку риска рака желудка.J Clin Pathol. 2016 Янв; 69 (1): 19-25. [PubMed: 26163538]
- 40.
- Комитет по стандартам практики ASGE. Эванс Дж. А., Чандрасекхара В., Чатади К. В., Декер Г. А., Ранний Д. С., Фишер Д. А., Фоули К., Хван Дж. Х., Джу Т. Л., Лайтдейл Дж. Р., Паша С. Ф., Шараф Р., Шергилл А. К., Кэш Б. Д., ДеВитт Дж. М.. Роль эндоскопии в лечении предраковых и злокачественных состояний желудка. Gastrointest Endosc. 2015 июл; 82 (1): 1-8. [PubMed: 25935705]
- 41.
- Matysiak-Budnik T, Camargo MC, Piazuelo MB, Leja M.Недавние рекомендации по ведению пациентов с атрофией желудка: общие точки и противоречия. Dig Dis Sci. 2020 июл; 65 (7): 1899-1903. [Бесплатная статья PMC: PMC7767582] [PubMed: 32356261]
- 42.
- Исаев С., Лиепниеце-Кареле I, Янчаускас Д., Моисеев Г., Путнинс В., Функа К., Кикусте И., Ванагс А., Толманис И., Лея М. Стадия гастрита: соглашение между наблюдателями с использованием систем OLGA и OLGIM. Арка Вирхова. 2014 Апрель; 464 (4): 403-7. [PubMed: 24477629]
- 43.
- Kong YJ, Yi HG, Dai JC, Wei MX.Гистологические изменения слизистой оболочки желудка после эрадикации Helicobacter pylori: систематический обзор и метаанализ. Мир Дж. Гастроэнтерол. 2014 21 мая; 20 (19): 5903-11. [Бесплатная статья PMC: PMC4024801] [PubMed: 242]
- 44.
- Чен Х.Н., Ван З., Ли Х, Чжоу З. Эрадикация Helicobacter pylori не может снизить риск рака желудка у пациентов с кишечной метаплазией и дисплазией: данные метаанализа. Рак желудка. 2016 Янв; 19 (1): 166-75. [PubMed: 25609452]
- 45.
- Роккас Т., Рокка А., Портинкаса П. Систематический обзор и метаанализ роли эрадикации Helicobacter pylori в предотвращении рака желудка. Энн Гастроэнтерол. 2017; 30 (4): 414-423. [Бесплатная статья PMC: PMC5479993] [PubMed: 28655977]
- 46.
- Wong BC, Zhang L, Ma JL, Pan KF, Li JY, Shen L, Liu WD, Feng GS, Zhang XD, Li J, Lu AP , Xia HH, Lam S, You WC. Влияние селективного ингибитора ЦОГ-2 и эрадикации Helicobacter pylori на предраковые поражения желудка.Кишечник. 2012 июн; 61 (6): 812-8. [PubMed: 21917649]
- 47.
- Хуан XZ, Чен Y, Ву Дж., Чжан Х, Ву С.К., Чжан С.Й., Сунь С.С., Чен В.Дж.. Использование аспирина и нестероидных противовоспалительных препаратов снижает риск рака желудка: метаанализ зависимости реакции от дозы. Oncotarget. 2017 17 января; 8 (3): 4781-4795. [Бесплатная статья PMC: PMC5354871] [PubMed: 274]
- 48.
- Tang XD, Zhou LY, Zhang ST, Xu YQ, Cui QC, Li L, Lu JJ, Li P, Lu F, Wang FY, Wang P , Биан LQ, Биан ZX. Рандомизированное двойное слепое клиническое испытание Молуодана () для лечения хронического атрофического гастрита с дисплазией.Chin J Integr Med. 2016 Янв; 22 (1): 9-18. [PubMed: 26424292]
- 49.
- Хан Х, Цзян К., Ван Б., Чжоу Л., Чен Х, Ли С. Влияние ребамипида на предраковое прогрессирование хронического гастрита: рандомизированное контролируемое исследование. Clin Drug Investigation. 2015 Октябрь; 35 (10): 665-73. [PubMed: 26369655]
- 50.
- Kong P, Cai Q, Geng Q, Wang J, Lan Y, Zhan Y, Xu D. Потребление витаминов снижает риск рака желудка: метаанализ и систематический обзор рандомизированных и наблюдательные исследования.PLoS One. 2014; 9 (12): e116060. [Бесплатная статья PMC: PMC4280145] [PubMed: 25549091]
- 51.
- Японская ассоциация рака желудка. Японское руководство по лечению рака желудка, 2014 г. (вер. 4). Рак желудка. 2017 Янв; 20 (1): 1-19. [Бесплатная статья PMC: PMC5215069] [PubMed: 27342689]
- 52.
- Hirasawa T., Gotoda T, Miyata S, Kato Y, Shimoda T, Taniguchi H, Fujisaki J, Sano T, Yamaguchi T. Частота метастазов в лимфатических узлах и возможность эндоскопической резекции недифференцированного рака желудка на ранней стадии.Рак желудка. 2009; 12 (3): 148-52. [PubMed: 198]
- 53.
- Рагге М., Меггио А, Пеннелли Дж., Пишоли Ф., Джакомелли Л., Де Претис Дж., Грэхем Д. Я. Стадия гастрита в клинической практике: стадия OLGA. Кишечник. 2007 Май; 56 (5): 631-6. [Бесплатная статья PMC: PMC1942143] [PubMed: 17142647]
- 54.
- Capelle LG, de Vries AC, Haringsma J, Ter Borg F, de Vries RA, Bruno MJ, van Dekken H, Meijer J, van Grieken NC, Kuipers EJ. Определение стадии гастрита с помощью системы OLGA с использованием кишечной метаплазии в качестве точной альтернативы атрофическому гастриту.Gastrointest Endosc. 2010 июн; 71 (7): 1150-8. [PubMed: 20381801]
- 55.
- Mera RM, Bravo LE, Camargo MC, Bravo JC, Delgado AG, Romero-Gallo J, Yepez MC, Realpe JL, Schneider BG, Morgan DR, Peek RM, Correa P, Wilson KT, Piazuelo MB. Динамика инфекции Helicobacter pylori как детерминанта прогрессирования предраковых поражений желудка: 16-летнее наблюдение после испытания по ликвидации. Кишечник. 2018 июл; 67 (7): 1239-1246. [Бесплатная статья PMC: PMC5742304] [PubMed: 28647684]
- 56.
- Юэ Х, Шан Л., Бин Л. Значение систем стадирования OLGA и OLGIM в оценке риска рака желудка: систематический обзор и метаанализ. Рак желудка. 2018 июл; 21 (4): 579-587. [PubMed: 29460004]
- 57.
- Корреа П. Клинические последствия последних достижений в патологии и эпидемиологии рака желудка. Семин Онкол. 1985 Март; 12 (1): 2-10. [PubMed: 3975643]
- 58.
- ЛОРЕН П. ДВА ГИСТОЛОГИЧЕСКИХ ОСНОВНЫХ ВИДА КАРЦИНОМЫ ЖЕЛУДКА: ДИФФУЗНЫЙ И ТАК НАЗЫВАЕМЫЙ КИШЕЧНЫЙ ТИП.ПОПЫТКА НА ГИСТОКЛИНИЧЕСКУЮ КЛАССИФИКАЦИЮ. Acta Pathol Microbiol Scand. 1965; 64: 31-49. [PubMed: 14320675]
- 59.
- Choi CE, Sonnenberg A, Turner K, Genta RM. Высокая распространенность предопухолевых поражений желудка у выходцев из Восточной Азии и латиноамериканцев в США. Dig Dis Sci. 2015 июл; 60 (7): 2070-6. [PubMed: 25724165]
- 60.
- González CA, Sanz-Anquela JM, Gisbert JP, Correa P. Полезность субтипирования кишечной метаплазии как маркера риска рака желудка. Обзор доказательств.Int J Cancer. 2013 Сентябрь 01; 133 (5): 1023-32. [Бесплатная статья PMC: PMC3732516] [PubMed: 23280711]
- 61.
- Conchillo JM, Houben G, de Bruïne A, Stockbrügger R. Является ли кишечная метаплазия III типа обязательным предраковым поражением при карциноме желудка кишечного типа? Eur J Cancer Пред. 2001 август; 10 (4): 307-12. [PubMed: 11535872]
- 62.
- Ланер Э., Загари Р.М., Зулло А, Ди Сабатино А, Меггио А, Чезаро П., Ленти М.В., Аннибале Б., Корацца Г.Р. Хронический атрофический гастрит: естественная история, диагностика и лечение.Позиционный документ Итальянского общества больничных гастроэнтерологов и пищеварительных эндоскопистов [AIGO], Итальянского общества пищеварительной эндоскопии [SIED], Итальянского общества гастроэнтерологов [SIGE] и Итальянского общества внутренней медицины [SIMI]. Dig Liver Dis. 2019 декабрь; 51 (12): 1621-1632. [PubMed: 31635944]
Аутоиммунный гастрит, леченный микофенолатом мофетил
ACG Case Rep J. 2020 Dec; 7 (12): e00496.
, MD, 1 , MD, 1 , MD, 2 и, MD, PhD 2, 3Али Х.Харб
1 Отделение гастроэнтерологии Юго-западного медицинского центра Техасского университета, Даллас, Техас
Рупа Вемулапалли
1 Отделение гастроэнтерологии Юго-западного медицинского центра Техасского университета, Даллас, Техас
Пурва
Пурва Пурва 2 Отделение патологии Юго-западного медицинского центра Техасского университета, Даллас, ТехасДжейсон Ю. Парк
2 Отделение патологии Юго-западного медицинского центра Техасского университета, Даллас, Техас
3 Центр Юджина Макдермотта для Человеческий рост и развитие, Юго-западный медицинский центр Техасского университета, Даллас, Техас
1 Отделение гастроэнтерологии, Юго-западный медицинский центр Техасского университета, Даллас, Техас
2 Отделение патологии Юго-западного медицинского центра Техасского университета, Даллас, Техас
3 Юджин Макдермотт Центр человеческого роста и Development, Юго-западный медицинский центр Техасского университета, Даллас, Техас
Автор, ответственный за переписку.Поступило 25.11.2019; Принято 2020 24 июля.
Copyright © 2020 Автор (ы). Опубликовано Wolters Kluwer Health, Inc. от имени Американского колледжа гастроэнтерологии.РЕФЕРАТ
Аутоиммунный гастрит – воспалительное заболевание слизистой оболочки желудка. Мы сообщаем о 64-летней женщине с хронической болью в животе продолжительностью 3 года. Эндоскопическое и гистологическое обследование выявило аутоиммунный пангастрит. Гастрит частично поддавался лечению стероидами, но попытки его ослабить не увенчались успехом, и пациент не почувствовал облегчения от меркаптопурина, адалимумаба, будесонида или гидроксихлорохина.Пациент проходил лечение микофенолятмофетилом, что привело к исчезновению симптомов. Эндоскопическое и гистологическое исследование после терапии микофенолатами показало практически полное исчезновение активного воспаления. Насколько нам известно, это первое сообщение о симптоматическом аутоиммунном гастрите, успешно вылеченном микофенолятмофетилом.
ВВЕДЕНИЕ
Классический аутоиммунный гастрит (AIG) – это воспалительный процесс с преобладанием в организме желудка, опосредованный антителами, которые нацелены на H + , K + -АТФазу париетальных клеток. 1 Пациенты с преобладающим в организме AIG имеют симптомы, включая боль в эпигастрии, потерю веса, изжогу и тошноту. 2 Наиболее серьезными долгосрочными последствиями являются злокачественные новообразования, авитаминоз (например, витамин B12) и злокачественная анемия. Сообщений о пациентах с аутоиммунным пангастритом с диффузным поражением тела и антрального отдела немного. 3,4 В этом отчете мы представляем пациента с сильной болью в животе и пангастритом, который лечился несколькими иммунодепрессантами для облегчения симптомов.
СЛУЧАЙ ИЗЛУЧЕНИЯ
64-летняя белая женщина обратилась в нашу клинику для повторного заключения по поводу ее непрекращающейся боли в животе после приема пищи и тошноты продолжительностью 3 года, связанной с потерей веса на 35 фунтов. В анамнезе у нее была гипертония (лечилась олмесартаном), гипотиреоз и красный плоский лишай. Ее предыдущее обследование показало микроцитарную анемию и низкий нормальный уровень витамина B12. Компьютерная томография брюшной полости в норме. Эндоскопия в стороннем учреждении показала глубоко изъязвленную слизистую желудка (рисунок).Двенадцатиперстная кишка, терминальный отдел подвздошной кишки и толстая кишка эндоскопически и гистологически без особенностей. Биопсия желудка показала гастрит Helicobacter pylori , который лечили четырехкратной терапией, включая максимальную дозу ингибитора протонной помпы. Боли в животе продолжались, и через месяц эндоскопия показала стойкие язвы желудка. Биопсия антрального отдела желудка и тела показала продолжающееся сильное воспаление; однако был уничтожен H. pylori . Исследования периферической крови, включая гастрин, антитела к внутреннему фактору и антитела к париетальным клеткам, были без особенностей.Клинический диагноз болезни Крона рассматривался в связи с предыдущими эндоскопическими данными. Дополнительное обследование, включая эндоскопию видеокапсулы, 24-часовой мониторинг pH-зависимости, манометрию пищевода, компьютерную томографию брыжеечной ангиограммы и исследования опорожнения желудка, не выявили. У нее продолжались сильные и неослабевающие боли в животе. Она продолжила прием максимального ингибитора протонной помпы и начала прием преднизона (40 мг в день в течение 2 недель, постепенное снижение на 10 мг в неделю до 5 мг в день) с умеренным улучшением клинических симптомов и результатов эндоскопии.При приеме 5 мг преднизона эндоскопия показала частичное улучшение язв желудка (рисунок).
Первоначальная эндоскопия показывает сильное воспаление с глубокими изъязвлениями по всему желудку.
Лечение стероидами (преднизон, 5 мг в день) показало некоторое улучшение, но продолжающееся воспаление (тело желудка).
При постепенном снижении доз преднизона у нее были рецидивы боли в эпигастральной области живота и потеря веса, связанные с ранним чувством насыщения, тошнотой и выпадением волос. Клиническое подозрение на болезнь Крона продолжалось на основании отсутствия улучшения желудочно-кишечных симптомов и стойких язв желудка.Ревматологическая экспертиза в стороннем учреждении выявила повышенный уровень С-реактивного белка (55 мг / л), антинуклеарных (1: 320), анти-Смитовых (> 8 ед.) И антихроматиновых антител (> 2 ед.), Которые были связаны с системной волчанкой. красная, а также желудочная болезнь Крона. Пытаясь щадить стероидную терапию, она последовательно лечилась во внешних учреждениях меркаптопурином (6 месяцев), адалимумабом (5 месяцев), будесонидом (4 месяца) и гидроксихлорохином (6 месяцев) без улучшения симптомов, серологических маркеров, эндоскопии, или гистология.Она продолжала принимать различные дозы преднизона, что частично уменьшило ее боль в животе.
Через два года после ее первого обращения она была направлена в наше учреждение для приема преднизона 20 мг в день с продолжающейся болью в животе, потерей веса и тошнотой. Были рассмотрены внешние биопсии из предыдущих эндоскопий, и в качестве дополнительных соображений были добавлены олмесартановый гастрит или аутоиммунный пангастрит. Олмесартан был отменен; однако эндоскопия через 3 месяца показала продолжающееся тяжелое воспаление желудка с поверхностными язвами в антральном отделе.Гистология по-прежнему позволяла предположить аутоиммунный пангастрит (Рисунок A). Доза преднизона была уменьшена, а затем отменена. Последующая оценка показала некоторое эндоскопическое улучшение, но изъязвление продолжалось. Боль в животе уменьшилась, но затем у нее развилась артралгия и мышечная слабость. Ее направили к ревматологу в наше учреждение, и у нее было обнаружено стойкое повышение уровня антинуклеарных, анти-Смит-антител и антицентромерных антител в сыворотке крови. Первичным диагнозом теперь считался аутоиммунный пангастрит, вторичный по отношению к атипичной системной красной волчанке.К этому моменту она не принимала преднизон в течение 4 месяцев. Поскольку гидроксихлорохин ранее был неэффективен, ей начали принимать микофенолятмофетил (ММФ) в дозе 250 мг два раза в день, а затем увеличили дозу до 750 мг два раза в день в течение месяца. У нее исчезли боли в животе и артралгии. Гистология после лечения MMF показала исчезновение активного воспаления, но продолжающееся хроническое воспаление с обширной метаплазией (Рисунок B). Через тридцать два месяца после начала MMF эндоскопия показала полное исчезновение изъязвлений слизистой оболочки (рисунок).Биопсия не показала активного воспаления, но были отмечены неактивный хронический гастрит с атрофией и кишечной метаплазией (рисунок). В настоящее время пациент принимает MMF 500 мг два раза в день, и у него нет симптомов только с минимальным эндоскопическим или гистологическим воспалением.
(A) Биопсия желудка, взятая во время лечения пациента стероидами, показывает активное воспаление, атрофию желез и метаплазию пилорических желез; на вставке – увеличенная пилорическая железа и активное воспаление. (B) Через девять месяцев после лечения микофенолятмофетилом активное воспаление исчезло; однако хроническое воспаление продолжается.Тело желудка показывает пилорическую и кишечную метаплазию; на вставке – кишечные железы с бокаловидными клетками.
Через девять месяцев после лечения микофенолятмофетилом стероиды были снижены, и у пациента не было симптомов без эндоскопических признаков изъязвления или воспаления (тело желудка).
Атрофия желез больше не полная; периодически появляются новые железы, состоящие из париетальных и главных клеток, как показано на вставке.
ОБСУЖДЕНИЕ
AIG – это предраковое состояние, характеризующееся аутоиммунным разрушением париетальных клеток желудка. 1 Заболеваемость AIG оценивается примерно у 4% пациентов клиники гастроэнтерологии, причем непропорционально сильно страдают пожилые женщины. 2 Диагноз может быть сложным с клинической точки зрения, поскольку желудочно-кишечные симптомы неспецифичны, а гематологические проявления основаны на дефиците B12 / железа, присутствующем на поздних стадиях заболевания. 5 Сообщается о средней задержке в 14 месяцев между появлением симптомов и выявлением заболевания. 6 Высокая степень подозрительности, раннее определение внутреннего фактора и антител к париетальным клеткам, а также адекватный эндоскопический забор слизистой оболочки желудка могут ускорить диагностику и помочь предотвратить последствия заболевания. 1,5,7
Волчанка – сложное заболевание с широким спектром желудочно-кишечных проявлений. 8 Другим аспектом истории болезни этой пациентки было ее лечение артериальной гипертензии олмесартаном, антагонистом рецепторов ангиотензина II. Предыдущие сообщения описывали олмесартан, связанный с тяжелой энтеропатией, а также гастритом. 9–11 Первоначально эта пациентка рассматривала гастрит, связанный с олмесартаном, но прекращение приема олмесартана не помогло излечить ее гастрит.
Исторически, лечение AIG было сосредоточено на диетической терапии, включая добавление витаминов и скрининг на рак желудка. Нам неизвестны стратегии лечения, позволяющие изменить течение воспалительного заболевания. MMF является иммунодепрессантом, который ингибирует пролиферацию Т- и В-клеток, что у нашего пациента привело к полному облегчению симптомов боли и ремиссии активности заболевания по данным эндоскопии и гистологии. 12 Пациент перенес более 32 месяцев терапии MMF без побочных эффектов.Насколько нам известно, это первый отчет человека об иммуносупрессивном контроле AIG. Необходимы дальнейшие исследования для подтверждения эффективности и безопасности терапии MMF при AIG.
РАСКРЫТИЯ ИНФОРМАЦИИ
Вклад авторов: Все авторы внесли равный вклад в эту рукопись. JY Park является гарантом статьи.
Раскрытие финансовой информации: авторы заявляют об отсутствии конфликта интересов в отношении авторства или публикации этой статьи. JY Park входит в научно-консультативный совет Miraca Holdings; дочерние компании включают Baylor Genetics, SRL Labs и Fujirebio Inc.
Для этого случая было получено информированное согласие.
ССЫЛКИ
1. Park JY, Lam-Himlin D, Vemulapalli R. Обзор аутоиммунного метапластического атрофического гастрита. Гастроинтест Эндоск 2013; 77: 284–92. [PubMed] [Google Scholar] 2. Мицели Э., Ленти М.В., Падула Д. и др. Общие черты пациентов с аутоиммунным атрофическим гастритом. Клин Гастроэнтерол Гепатол 2012; 10: 812–4. [PubMed] [Google Scholar] 3. Евремович Д., Торбенсон М., Мюррей Дж. А., Бургарт Л. Дж., Абрахам СК. Атрофический аутоиммунный пангастрит: отличительная форма антрального и фундального гастрита, связанная с системным аутоиммунным заболеванием.Am J Surg Pathol 2006; 30: 1412–9. [PubMed] [Google Scholar] 4. Погорилер Дж., Камин Д., Голдсмит Дж. Д. Детский атрофический гастрит, не связанный с Helicobacter pylori: серия случаев. Am J Surg Pathol 2015; 39: 786–92. [PubMed] [Google Scholar] 5. Kulnigg-Dabsch S, Resch M, Oberhuber G, Klinglmueller F, Gasche A, Gasche C. Обследование на дефицит железа показывает высокую частоту аутоиммунного гастрита с использованием антител к париетальным клеткам в качестве надежного скринингового теста. Семин Гематол 2018; 55: 256–61. [PubMed] [Google Scholar] 6. Ленти М.В., Мичели Э., Кокоча С. и др.Детерминанты задержки диагностики аутоиммунного атрофического гастрита. Алимент Фармакол Тер 2019; 50: 167–75. [PubMed] [Google Scholar] 7. Махмуд Н., Сташек К., Катона Б.В. и др. Заболеваемость неоплазией у пациентов с аутоиммунным метапластическим атрофическим гастритом: новый призыв к наблюдению. Энн Гастроэнтерол 2019; 32: 67–72. [Бесплатная статья PMC] [PubMed] [Google Scholar] 8. Тянь XP, Чжан Х. Поражение желудочно-кишечного тракта при системной красной волчанке: понимание патогенеза, диагностики и лечения.Мир Дж Гастроэнтерол 2010; 16: 2971–7. [Бесплатная статья PMC] [PubMed] [Google Scholar] 9. Рубио-Тапиа А., Герман М.Л., Людвигссон Дж. Ф. и др. Тяжелая кишечная энтеропатия, связанная с приемом олмесартана. Mayo Clin Proc 2012; 87: 732–8. [Бесплатная статья PMC] [PubMed] [Google Scholar] 10. Ма С., Пак Дж.Й., Монтгомери Е.А. и др. Сравнительное клинико-патологическое исследование коллагенозного гастрита у детей и взрослых: одно и то же заболевание с ассоциированными иммуноопосредованными заболеваниями. Am J Surg Pathol 2015; 39: 802–12. [PubMed] [Google Scholar] 12.Allison AC. Механизмы действия мофетила микофенолят. Волчанка 2005; 14 (Приложение 1): s2-8. [PubMed] [Google Scholar]Аутоиммунный гастрит | Архив патологии и лабораторной медицины
Диагноз АГ ставится гистологически с помощью эндоскопической биопсии. Серологические тесты на аутоантитела могут использоваться или не использоваться в клинической практике в качестве дополнения к диагностике.
В биопсиях, которые включают слизистые оболочки антрального отдела и тела, гистологический диагноз АГ будет иметь 2 типа слизистой оболочки: нормальную слизистую оболочку антрального отдела и воспаленную, аномальную слизистую оболочку тела.Гистологические данные различаются в зависимости от того, находится ли пациент в ранней фазе, в фазе плода или в конечной фазе, когда они подвергаются биопсии. 1,8 Ранняя фаза характеризуется диффузным воспалением с преобладанием базального слоя в собственной пластинке (рис. 1, А) кислородной слизистой оболочки. Лимфоциты, которые преимущественно представляют собой Т-клетки CD4 + , смешаны с плазматическими клетками, эозинофилами и тучными клетками. Видны пятнистые очаги лимфоцитов, инфильтрирующих железы, и вторичные апоптотические тела (рис. 1, Б).На ранней стадии также можно увидеть различные эпителиальные метаплазии. Это включает слизистую метаплазию (также называемую псевдопилорической метаплазией), ацинарную метаплазию поджелудочной железы (рис. 1, C) и пролиферацию незрелых клеток шеи. Степень атрофии может быть разной, но остаточные париетальные клетки на ранней стадии могут стать гипертрофическими из-за избытка гастрина и образовывать небольшие полиповидные узелки, называемые псевдополипами кислородных желез, которые содержат все клетки этой слизистой оболочки, включая главные клетки. 8
Флоридная фаза имеет выраженную атрофию оксинтной слизистой оболочки с диффузным лимфоплазмоцитарным воспалением. На этой стадии преобладающее базальное место воспаления может быть менее интенсивным. Метаплазия, отмеченная на ранней стадии, сохраняется, но кишечная метаплазия также обычно заметна (рис. 1, D). Клетки ECL начинают размножаться. Слизистая оболочка антрального отдела при биопсии выявляет гиперплазию клеток гастрина.Наконец, конечная стадия похожа на стадию плода, с почти полной потерей кислородных желез, выраженной эпителиальной метаплазией и гиперплазией ECL-клеток, но с уменьшением воспаления.
Гиперплазия ECL-клеток указывает на состояние гипергастринемии и увеличивается параллельно степени атрофии. Это происходит только при диффузной глубокой атрофии желез и, следовательно, может присутствовать или отсутствовать на начальной биопсии или на ранней стадии заболевания.Гиперплазия может быть простой, линейной и узловатой. Клетки ECL маленькие, с прозрачной цитоплазмой, круглыми ядрами и мелкодисперсным хроматином. 8 Их наличие является диагностическим признаком АГ. Кроме того, гиперплазия ECL-клеток является предшественником карциноидной опухоли 1 типа.
Наиболее частыми эндоскопическими поражениями при АГ являются гиперпластические полипы, обнаруживаемые у 10-40% пациентов. 3 Большинство полипов сидячие, менее 2 см в диаметре и часто множественные. 8 Полипы могут быть настолько многочисленными, что имитировать полипоз, и диагноз АГ может быть пропущен, если эндоскописты не проведут биопсию прилегающей слизистой оболочки. Псевдополипы оксинтических желез, упомянутые ранее, также могут быть обнаружены эндоскопически на ранних стадиях АГ.
Идентификация места биопсии желудка может быть затруднена при АГ, если эндоскопист не помещает образцы в отдельно помеченные сосуды для антрального отдела и тела / дна.Полная потеря оксинтической слизистой оболочки в теле у пациента с АГ может отдаленно напоминать слизистую оболочку антрального отдела из-за потери кислородных желез, замененных метапластическими слизистыми железами. В случаях, когда и антральная, и кислородная слизистые оболочки помещаются в одну и ту же банку с образцом, можно использовать окраску гастрина для определения местоположения желудка. G-клетки присутствуют только в слизистой оболочке антрального отдела. Иммуногистохимическое окрашивание гастрина выделяет G-клетки в слизистой оболочке антрального отдела (рис. 2, А) и является отрицательным в оксинитной слизистой оболочке (рис. 2, В).
Подтверждение эффектов Qinghuayin против хронического атрофического гастрита и предварительное наблюдение вовлеченных воспалительных сигнальных путей: исследование in vivo
Предпосылки. Qinghuayin (QHY) – китайская формула, которая широко используется при лечении хронического атрофического гастрита (CAG). Это исследование было запланировано со следующими целями: подтвердить эффективность QHY на модели CAG у крыс и провести предварительное наблюдение за изменениями в нескольких воспалительных сигнальных путях, потенциально участвующих в механизмах QHY. Методы. Всего в этом исследовании было использовано 33 крысы; они были разделены на контрольную (n = 12) и модельную (n = 21) группы. QHY было администрировано в обеих группах. Мы оценили патологические проявления и уровень сывороточного фактора некроза опухоли альфа (TNF- α ) как маркеры эффективности. Мы также выполнили предварительное наблюдение изменений в экспрессии белка и матричной рибонуклеиновой кислоты (мРНК) толл-подобных рецепторов 4 (TLR4), MyD88, NF- κ B и COX-2. Результатов. Патологические изменения, вызванные у крыс созданием моделей CAG, были устранены низкими и высокими дозами QHY. Их сывороточный уровень TNF- α также снижался после лечения QHY низкими и высокими дозами. Экспрессия белков и мРНК TLR4, MyD88, NF- κ B и COX-2 была усилена созданием моделей CAG и подавлена введением низких и высоких доз QHY. Выводы . Наши данные подтверждают эффективность QHY в качестве адъювантной терапии, основанной на теориях традиционной китайской медицины.Предварительные наблюдения показывают, что подавление усиленных воспалительных сигнальных путей может быть критическими механизмами QHY, которые нуждаются в дальнейшей проверке.
1. Введение
Хронический атрофический гастрит (ХАГ) – распространенное хроническое поражение слизистой оболочки желудка, которое играет решающую роль в развитии карциномы желудка, типа рака с высоким уровнем смертности в Китае. Разработка эффективных методов лечения CAG чрезвычайно важна для снижения смертности от рака желудка.Патогенез CAG сложен, и хорошо известно, что инфекция Helicobacter pylori (HP) сильно связана с CAG и последующим развитием рака желудка [1]. Таким образом, лечение против HP является важным методом лечения CAG. Кроме того, при лечении КАГ использовались другие методы лечения, такие как защита слизистой оболочки желудка, симптоматическое облегчение боли, добавление витамина С и введение ингибитора протонной помпы [2]. Однако специфического лечения КАГ не существует.В Китае были рассмотрены многие методы лечения, основанные на теориях традиционной китайской медицины (ТКМ). В недавнем системном обзоре было высказано предположение, что китайская классическая формула, отвар Сиджунзи, может принести пользу пациентам с ХАГ [3]. В дополнение к отвару Сиджунцзи, Qinghuayin (QHY) – это еще одна китайская формула, которая широко используется в лечении CAG на основе теорий TCM об устранении тепла и устранении сырости. QHY состоит из трав, включая semen dolichoris album (Baibiandou) , Poria cocos (Fuling) , семена коикса (Yiyiren) , herba artemisia scoparia (Yinchen) , herba eupatorii (Peilan) , amomum cardamom (Baidoukou) , rhizoma coptidis (Huanglian) , кора магнолии лекарственной (Houpu) и radix paeoniae rubra (Chishao) . В нескольких китайских исследованиях сообщается о хорошей эффективности / безопасности QHY при лечении CAG [4–6]. Однако основные механизмы остаются неясными.
Напротив, инфекция HP может влиять на сигнальные пути [7]. CAG также связан с воспалительными сигнальными путями, такими как сигнальный путь IL-11 / STAT3 [8], сигнальный путь рецептора лептина [9, 10], путь E-кадгерина / β -катенин / tcf-4 [11] и путь PI3k / Akt [12]. Wang et al. сообщили, что Toll-подобные рецепторы 4 (TLR4) и TLR9 регулируются HP и тесно связаны с CAG [11].Мы предположили, что механизмы QHY также связаны с регуляцией воспалительных сигнальных путей. Таким образом, мы наблюдали изменения биомаркеров нескольких сигнальных путей в моделях CAG крыс, получавших QHY. Мы попытались провести предварительное исследование роли, которую играют сигнальные пути в механизмах QHY.
2. Методы и материалы
2.1. Животные
Всего в испытании участвовали 33 крысы-самцы линии Wistar (масса тела 110 г ± 10 г).Со всеми крысами тщательно обращались в соответствии с рекомендациями Национального института здравоохранения по уходу и использованию лабораторных животных. Все эксперименты были одобрены и контролировались Комитетом по уходу и использованию животных Фуцзянского университета традиционной китайской медицины (номер разрешения: 3100101037). Крыс выращивали в помещении при 23 ° C в нормальном ритме (с 8:00 до 20:00, свет был включен).
2.2. QHY Preparation
Состав QHY был приготовлен в соответствии с формулой, утвержденной Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов провинции Фуцзянь (номер разрешения: Z05104030).Ингредиенты раствора QHY перечислены в таблице 1. Мы отфильтровали отвар и довели концентрацию до 2,2 г / мл (сырье) при 60 ° C. Раствор был разлит по бутылкам и стерилизован для экспериментов.
| |||||||||||||||||||||||||||||||||||||||||||||


 Чтобы определить уровень секреции желудочного сока, осуществляется внутрижелудочная pH-метрия. УЗИ органов брюшной полости используется только для дифференциальной диагностики и выявления сопутствующей патологии.
Чтобы определить уровень секреции желудочного сока, осуществляется внутрижелудочная pH-метрия. УЗИ органов брюшной полости используется только для дифференциальной диагностики и выявления сопутствующей патологии.