Хронический антрум гастрит: Антральный гастрит: симптомы, лечение, диета
Антральный гастрит: симптомы, лечение, диета
В зависимости от запущенности заболевания, диета имеет несколько вариаций. Такого питания приходится придерживаться длительное время, пока поврежденные ткани полностью не восстановятся.Время приемов пищи также будет отличаться от привычного. О редких, но плотных порциях, как и о быстрых перекусах придется забыть. Придется питаться часто, но дробно (5-6 раз в день). Это снижает нагрузку на желудок. При гастрите следует тщательно пережевывать пищу, а не заглатывать крупными кусками, так как хорошо измельченная еда лучше переваривается.
Консистенция должна быть максимально мягкой, термически обработанной(запеченной, вареной или пареной). Крупные куски лучше измельчать, чтобы больному желудку было проще с ними справиться. Также считается, что для лечения эрозивного гастрита очень эффективна жидкая диета, то есть супы особенно крупяные.
Необходимо воздерживаться от продуктов, провоцирующих аппетит и повышающих кислотность (специи, закуски, соленья, копчености, жирное, жареное и т. д.).Также придется контролировать потребление соли, ее необходимо минимизировать.
д.).Также придется контролировать потребление соли, ее необходимо минимизировать.
Температура еды должна быть приближенной к температуре тела, не слишком горячей, не слишком холодной, так как большие перепады замедляют процесс восстановления пораженной ткани.
Итак, что же необходимо для качественного восстановления:
- частый прием пищи;
- маленькие порции еды;
- соблюдение температурного режима;
- тщательное пережевывание продуктов;
- соблюдение режима потребления воды;
- включение в рацион измельченной, протертой пищи;
- отказ от продуктов, способных нанести механическое, термическое, химическое повреждение раздраженным стенкам желудка.
Запрещенные продукты:
- цитрусовые фрукты;
- молочные продукты с высоким содержанием жирности;
- свежие овощи и фрукты;
- ягоды;
- жирное мясо, рыбу, морепродукты;
- сыр;
- грибы;
- хлебобулочные изделия из пшеничной муки, слоеное тесто;
- пряности, специи, приправы;
- соусы, кетчуп, майонез;
- сахар;
- алкогольные напитки;
- крепкий чай, кофе, какао;
- соки из цитрусовых фруктов.

Антральный гастрит. Лечение в Москве
Антральный гастрит развивается на фоне не долеченного острого гастрита. При осложнении развивается воспаление пилорического отдела. Это нижний отдел желудка, где измельчается пища, синтезируются бикарбонаты, расщепляющие частички еды, а также врабатывается слизь, защищающая стенки желудка от соляной кислоты. Заболевание развивается на фоне поражения пищеварительной системы инфекцией Хеликобактер пилори. Лечение антрального гастрита на ранних стадиях консервативное. Отсутствие своевременной терапии приводит к тяжелым осложнениям, вплоть до прогрессирования злокачественных процессов.
Симптомы антрального гастрита
На ранних стадиях развития патологическая симптоматика может полностью отсутствовать. Иногда могут беспокоить общие симптомы, указывающие на проблемы в работе системы пищеварения:
- изжога;
- тяжесть в желудке;
- вздутие;
- неустойчивый стул;
- боль в животе до или после приема пищи.

По мере прогрессирования симптоматика становится выраженнее, беспокоит чаще. Нередко острую форму путают с отравлением. Но в отличии от интоксикации, клиническая картина антрального гастрита не исчезает после приема препаратов, купирующих отравление. Это должно насторожить больного и стать поводом как можно скорее посетить врача.
При антральном гастрите нередко беспокоит неспецифическая симптоматика:
- вялость, слабость;
- повышенная раздражительность;
- тяжесть в левом подреберье;
- аритмия, кардиалгия.
Лечение антрального гастрита
Диагностикой и лечением патологии занимается врач-гастроэнтеролог. На первичном приеме врач выслушает жалобы, соберет анамнез, после чего направит на комплексную диагностику для подтверждения диагноза.
Лечение поверхностного антрального гастрита должно быть комплексным, проводиться под врачебным контролем. Самолечение при таком заболевании чревато тяжелыми осложнениями. Группы препаратов, используемых для купирования воспалительного процесса и патологической симптоматики:
- Антибиотики.
 Подбираются врачом индивидуально. Курс терапии составляет в среднем 10 – 14 дней. После уничтожения Helicobacter pylori удастся предотвратить прогрессирование болезни и перетекание ее в хроническую форму.
Подбираются врачом индивидуально. Курс терапии составляет в среднем 10 – 14 дней. После уничтожения Helicobacter pylori удастся предотвратить прогрессирование болезни и перетекание ее в хроническую форму. - Антациды. Нейтрализуют желудочную кислоту, которая еще больше разъедает стенки поврежденного инфекцией желудка. Лечение антацидами поможет избавиться от рези и боли в желудке, ускорить заживление пораженных стенок.
- Ингибиторы протонной помпы. Замедляют синтез соляной кислоты, благодаря чему пораженные ткани быстрее восстанавливаются.
- Спазмолитики. Купируют спазмы, вызывающие боль и дискомфорт в желудке.
- Средства для восстановления микрофлоры. После употребления антибиотиков баланс кишечной микрофлоры нарушается. Восстановить его помогут специальные препараты, содержащие бифидумбактерии.
Диета – неотъемлемая составляющая консервативной терапии при антральном гастрите. Питание должно быть щадящим, сбалансированным, обогащенным витаминами и полезными элементами.
Антральный гастрит: симптомы и лечение
Знакомое многим понятие «гастрит» – очень емкое и подразумевает воспаление слизистой оболочки желудка. А вот разновидностей этого заболевания существует очень много: классификация строится по течению процесса (острый или хронический гастрит), по локализации, по морфологии, по распространенности поражения.
Сегодня Passion.ru рассказывает об антральном гастрите, ведь по статистике именно эта форма заболевания в 80% случаев приводит к возникновению язвы.
Что такое антральный гастрит?
Антральный гастрит локализуется в самой низкорасположенной части желудка, переходящей в двенадцатиперстную кишку. Слизистая оболочка этого отдела продуцирует гормон гастрин, который оказывает мощное стимулирующее действие на продукцию кислоты. Таким образом, это гиперсекреторный гастрит с повышенной кислотностью, который относится к хроническим поверхностным воспалениям слизистой оболочки желудка.
Исторически было принято считать, что антральный гастрит вызывается несбалансированными питанием, злоупотреблением алкоголем, никотином, кофеином, а также острыми и кислыми приправами и специями, нарушением режима питания, регулярными стрессами и прочими внешними факторами.
Но за последние годы многочисленные исследования в области медицины доказали, что истинной причиной развития антрального гастрита являются бактерии Helicobacter pylori. Их внедрение в слизистую оболочку антрального отдела желудка приводит к развитию воспалительного процесса, повышению секреторной функции желудка и повышению кислотности желудочного содержимого.
Однако здесь имеется и свой плюс: повышенные показатели внутрижелудочной рН-метрии (то есть, параметры кислотности желудочного сока) позволяют с легкостью установить правильный диагноз и как можно раньше приступить к лечению.
При отсутствии своевременного и правильного лечения, назначенного специалистом-гастроэнтерологом, антральный гастрит может приобрести дегенеративно-дистрофическую форму и стать причиной возникновения рубцов на слизистой желудка, что приводит, в свою очередь, к затруднению перемещения пищи в кишечник.
Основные симптомы
Клиническая картина характеризуется как общими, так и местными симптомами, проявляющимися, как правило, в период обострения заболевания.
Антральный гастрит – причины, симптомы, диагностика и лечение
Антральный гастрит – это хроническое воспалительное заболевание желудка, поражающее слизистую в выходном отделе (антруме). Относится к хроническому гастриту типа В – бактериально обусловленному. Проявляется болями в эпигастрии (голодными или через пару часов после еды), тошнотой, отрыжкой кислотой, диспепсическими явлениями при сохраненном аппетите. Основным методом диагностики является фиброгастродуоденоскопия, исследование на предмет наличия хеликобактерий. В лечение обязательно включаются антихеликобактерные антибиотики, антациды, регенерирующие и обезболивающие препараты.
Общие сведения
Антральный гастрит – хроническое воспаление слизистой желудка, локализующееся в пилорическом отделе. Данный отдел желудка выполняет функцию ощелачивания пищевого химуса перед переходом в кишечник. Воспаление в антруме вызывает блокировку выработки бикарбонатов, кислотность желудочного сока повышается, а в двенадцатиперстную кишку попадает кислое содержимое, провоцируя образование язв. Антральный гастрит обычно рассматривается как ранняя стадия хронического гастрита, при этой форме воспаления хеликобактерии выявляются в очень большом количестве. При распространении инфекции на другие отделы количество бактерии уменьшается. Антральный гастрит имеет симптоматику, весьма сходную с язвенной болезнью желудка. 85% всех заболеваний желудка приходится на эту патологию, тем не менее, обращаются к гастроэнтерологу лишь 10-15% всех больных хроническим гастритом.
Антральный гастрит обычно рассматривается как ранняя стадия хронического гастрита, при этой форме воспаления хеликобактерии выявляются в очень большом количестве. При распространении инфекции на другие отделы количество бактерии уменьшается. Антральный гастрит имеет симптоматику, весьма сходную с язвенной болезнью желудка. 85% всех заболеваний желудка приходится на эту патологию, тем не менее, обращаются к гастроэнтерологу лишь 10-15% всех больных хроническим гастритом.
Антральный гастрит
Причины
По наблюдениям специалистов в сфере клинической гастроэнтерологии, около 95% всех случаев хронического антрального гастрита связаны с обнаружением в слизистой желудка бактерии под названием Helicobacter pylori. Этот возбудитель может комфортно обитать в желудочной слизи при рН от 4 до 6, хотя и в более кислой среде сохраняет свою активность. Губительной для хеликобактерий является гипохлоргидрия (пониженная кислотность желудочного сока). В неблагоприятных условиях бактерия может принимать специальную форму покоя, а при попадании в комфортную среду – снова становится активной.
Способствуют хеликобактерной инвазии дуодено-гастральный рефлюкс (заброс содержимого кишечника в желудок из-за слабости пилоруса), прием некоторых препаратов (салицилаты, НПВС, противотуберкулезные средства), пищевая аллергия, неправильное питание, употребление спиртного, курение. Также предрасполагают к развитию этой патологии некоторые внутренние факторы: очаги хронической инфекции, эндокринная патология, недостаток железа, сердечная и дыхательная недостаточность, хроническая почечная недостаточность.
Патогенез
Особенностью хеликобактерий является выработка ими ряда ферментов, которые способствую изменению среды вокруг них. Так, уреаза расщепляет находящуюся в желудке мочевину до аммиака, защелачивая среду вокруг микроорганизма. Муциназа способствует снижению вязкости желудочной слизи. В таких условиях подвижные бактерии легко проникают сквозь слой защитной слизи к антральному эпителию желудка, где и начинают активно размножаться, вызывая повреждение слизистой и нарушение работы желудочных желез.
Симптомы антрального гастрита
Обычно воспаление антральной части желудка проходит на начальных стадиях как неатрофический процесс без недостаточности секреции желудочного сока. Клиника этой патологии язвенноподобна: боли в эпигастральной области, голодные или через несколько часов после еды; изжога, отрыжка кислым и воздухом, склонность к запорам. Аппетит при этом не страдает. При осмотре язык чистый, влажный. При пальпации живота болезненность локализуется в эпигастрии справа (пилородуоденальная зона). Потеря веса бывает только при тяжелом течении заболевания.
Диагностика
При гастрографии с контрастированием у больных антральным гастритом отмечается утолщение рельефных складок в пилорическом отделе, спазм пилоруса, сегментирующая перистальтика, беспорядочная эвакуация желудочного содержимого.
Уреазный тест на определение хеликобактерий проводится с помощью специальных экспресс-наборов во время гастроскопии. Для этого биоптат слизистой помещают в специальную среду, которая меняет свою окраску в зависимости от концентрации микроорганизмов на малиновую – от часа до суток. Если окраска не изменилась в течение суток – тест отрицательный. Также существует С-уреазный дыхательный тест. Для его проведения в желудок вводят меченную С13 мочевину, а затем в выдыхаемом воздухе определяют концентрацию С13. Если в желудке есть хеликобактерии, они разрушат мочевину, и концентрация С13 будет выше 1% (3,5% – легкая степень инвазии, 9,5% – крайне тяжелая).
С биоптатов слизистой обязательно делают посевы, инкубация которых происходит при крайне низкой концентрации кислорода (менее 5%) на кровяных средах. Результат посева с чувствительностью к антибиотикам будет получен уже через 3-5 суток. Достаточно чувствительным является ИФА метод выявления антител к хеликобактериям в крови, слюне и желудочном соке. Антитела появляются в крови в течение месяца после инфицирования, сохраняют свою активность также в течение месяца после полного излечения. Для определения кислотности желудочного сока используют внутрижелудочную рН-метрию, фракционное исследование желудочного сока с применением стимуляторов секреции. Заболеване дифференцируют с функциональными расстройствами, язвенной болезнью желудка.
Лечение антрального гастрита
Лечением данной патологии занимаются врачи-гастроэнтерологи, терапевты, эндоскописты; при обострениях больной находится в отделении гастроэнтерологии или терапии. Начинается лечение антрального гастрита с назначения специальной лечебной диеты: в период обострения стол 1б с постепенным расширением до первого стола в течение нескольких недель или месяцев.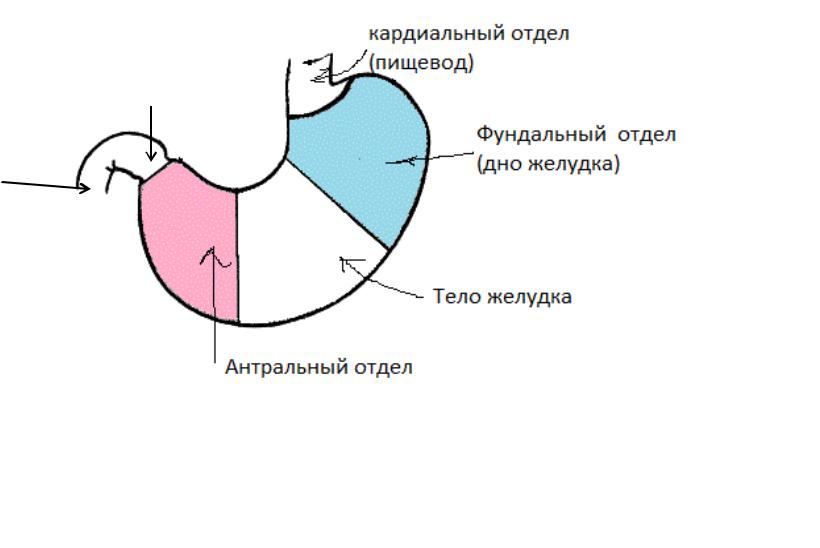
Обязательно назначаются антихеликобактерные препараты. Этиотропная терапия H.pylori достаточно сложна, так как это микроорганизм быстро приспосабливается к популярным антибиотикам. Чаще всего назначают двойную или тройную схему лечения, в которую включают метронидазол, кларитромицин, ампициллин или тетрациклин. В схему рекомендуется добавлять ингибиторы протонной помпы, которые угнетают хеликобактерии, а антибактериальными препаратами проводят их полную эрадикацию.
Противовоспалительная терапия может проводиться как аптечными препаратами, так и травами по рецептам народной медицины. Так, в период обострения рекомендуется употреблять настои ромашки, мяты, зверобоя, семян льна. При появлении эрозий на слизистой антрального отдела желудка, повышенной кислотности желудочного сока назначают антисекреторные средства. При спазме пилоруса успешно применяются миотропные спазмолитики: дротаверин, папаверин. Для нормализации перистальтики и устранения дуоденогастрального рефлюкса используется метоклопрамид.
Условием полного выздоровления является назначение репаративных средств. Это могут быть препараты, стимулирующие синтез белка (инозин, анаболические стероиды), карнитин, масло облепихи. Важное место занимает и физиотерапия: гальванизация желудка с электрофорезом лекарственных средств (при спазме пилорического отдела), УВЧ-терапия, лечение ультразвуком (с обезболивающей целью), диадинамическими токами Бернара, синусоидальными модулированными токами (для устранения боли и диспепсии). После купирования обострения рекомендуют проведение грязе- и парафинотерапии, лечение минеральными водами.
Прогноз и профилактика
Прогноз при антральном гастрите благоприятный только при своевременном начале лечения, соблюдении всех рекомендаций, режима дня и питания. Если вовремя не обратиться к гастроэнтерологу, гастрит переходит в диффузную форму, которая может закончиться образованием язв (при гиперфункции слизистой) или опухолей желудка (при атрофии слизистой). Для того чтобы избежать развития тяжелого воспалительного процесса в желудке, необходимо правильно питаться, отказаться от вредных привычек (курение, спиртное), избегать физического и эмоционального перенапряжения, соблюдать режим дня.
Для того чтобы избежать развития тяжелого воспалительного процесса в желудке, необходимо правильно питаться, отказаться от вредных привычек (курение, спиртное), избегать физического и эмоционального перенапряжения, соблюдать режим дня.
Антральный гастрит (Тип в) – признаки, причины, симптомы, лечение и профилактика
Лечение
Терапия в первую очередь сконцентрирована на уничтожении патогенной микрофлоры Helicobacter pylori. Проводится она с помощью антибиотиков, в основном это метронидазол, ампициллин, тетрациклин.
Назначается лечебный диетический стол. Пищу нужно принимать часто и маленькими порциями, приготовленную на пару. Необходимо уменьшить нагрузку на пораженный орган, исключаются тяжелые продукты, алкоголь, жареное, копченое, кофе, свежие фрукты и овощи, шоколад.
Симптоматическая терапия – это спазмолитики (но-шпа), препараты, нормализирующие кислотный фон (омепразол), ферменты (панкреатин, мезим), медикаменты, при помощи которых восстанавливается слизистая – солкосерил, актовегин.
Длительность и эффективность лечения зависит от соблюдения всех назначенных врачом рекомендаций, в основном затягивается до нескольких месяцев.
Прогноз благоприятный при своевременном лечении, в противном же случае болезнь может осложниться язвой или онкологией.
Профилактика
Чтобы обезопасить себя от заболевания, следует вести здоровый образ жизни, не злоупотреблять вредной едой, спиртным и сигаретами. Периодически проходить профилактические медосмотры.
При наличии хронического гастрита важно соблюдать диету. Полезные продукты: нежирное мясо, сухое печенье, хлеб, крупы (рисовая, гречневая, манная), легкие супы, сладкие фрукты и ягоды в печеном виде.
Народные средства борьбы с недомоганием очень разнообразны.
Натощак утром рекомендуют выпивать стакан свежевыжатого картофельного сока. Это снизит болевые ощущения, травяные чаи со зверобоем, ромашкой, шиповником. Семена льна при варке образуют слизь, данный настой обволакивает слизистую оболочку, чем предохраняет ее от пагубного действия кислоты. Показана умеренная физическая нагрузка, минимум нервных стрессов.
Показана умеренная физическая нагрузка, минимум нервных стрессов.
Литература и источники
Видео по теме:
Хронический гастрит и рак желудка / Блог / Клиника ЭКСПЕРТ
Рак желудка – одно из самых распространенных злокачественных заболеваний в мире, где оно занимает 5 место в структуре онкологических болезней и 2 место в структуре смертности от онкопатологии. В России рак желудка занимает пятое место в структуре заболеваемости злокачественными новообразованиями у мужчин и шестое место – у женщин.
Широкая распространенность этой болезни и низкий процент пятилетней выживаемости (в среднем по миру 10-20%) заставляет специалистов по всему миру активно искать алгоритмы своевременной диагностики не столько рака желудка, сколько предраковых заболеваний.
С учетом локализации поражения принято выделять два основных типа рака желудка: кардиальный (поражение кардиального отдела) и некардиальный рак (тело и/или выходной отдел желудка).
Хронический гастрит – маленький шаг на пути к раку желудка
Такое пугающее название подзаголовка достаточно точно отражает текущее понимание этапов развития рака желудка. Само заболевание «хронический гастрит» обычно не вызывает явных симптомов. А вот наличие типичных проявлений болезни, таких как боли в животе, чувство тяжести, переполнения после еды, тошнота – это симптомы функциональной диспепсии, до сих пор неверно определяемой не только пациентами, но даже врачами-гастроэнтерологами как хронический гастрит.
Итак, хронический гастрит – заболевание, которое не проявляется симптомами, а диагноз подтверждается только на основании гистологического исследования биоптатов желудка. Врач-морфолог, выполняющий исследование, может выявить воспаление в слизистой оболочке различной степени выраженности. Это и есть хронический гастрит.
Врач-морфолог, выполняющий исследование, может выявить воспаление в слизистой оболочке различной степени выраженности. Это и есть хронический гастрит.
У определенной части лиц длительное воспаление в слизистой желудка (хронический неатрофический гастрит) может привести к развитию атрофических изменений, а иногда клетки желудка могут замещаться нетипичными кишечными клетками (так называемая кишечная метаплазия).
Кишечная метаплазия повышает риск развития дисплазии – предракового заболевания, которое со временем может трансформироваться в аденокарциному (рак) желудка.
Эти этапы, сменяющие друг друга, – хронический гастрит без атрофии, атрофический гастрит, кишечная метаплазия, дисплазия, рак желудка – получили название «каскад Корреа» по имени автора, который описал данную последовательность.
Причины хронического гастрита
Поскольку воспалительные изменения в слизистой желудка, т.е. гастрит – начальные этапы развития рака желудка, попробуем разобраться, откуда же возникает это заболевание. Давно уже доказано, что нерегулярное питание, еда всухомятку и другие нарушения режима приема пищи не вызывают гастрит. Скорее, эти факторы могут способствовать обострению функциональной диспепсии. Тогда что же, образно выражаясь, подкидывает дрова в топку воспаления в слизистой оболочке желудка?
Давно уже доказано, что нерегулярное питание, еда всухомятку и другие нарушения режима приема пищи не вызывают гастрит. Скорее, эти факторы могут способствовать обострению функциональной диспепсии. Тогда что же, образно выражаясь, подкидывает дрова в топку воспаления в слизистой оболочке желудка?
На сегодняшний день выделено несколько факторов, которые доказано вызывают развитие воспаления в желудке:
- инфекция, прежде всего инфекция Helicobacter pylori (H.pylori);
- аутоиммунное воспаление;
- воспаление в ответ на химическое повреждение (например, желчью при дуодено-гастральном рефлюксе).
Конечно, существуют и другие причины, но их вклад в развитие воспаления в желудке можно считать незначительным.
Инфекция H.pylori в настоящее время рассматривается как основной фактор, вызывающий развитие хронического гастрита. Около 44% населения земного шара инфицированы этим возбудителем. Известно, что распространенность атрофического гастрита на фоне инфекции H. pylori риска варьирует от 8% в Западных странах до 84% в Японии и Китае. H.pylori считается наиболее значимым фактором риска развития некардиального рака желудка.
pylori риска варьирует от 8% в Западных странах до 84% в Японии и Китае. H.pylori считается наиболее значимым фактором риска развития некардиального рака желудка.
Аутоиммунное воспаление встречается намного реже, однако также приводит к развитию хронического гастрита, нередко с атрофией, и ассоциировано с повышенным риском развития рака желудка.
Факторы риска развития аденокарциномы (рака) желудка
1) Наследственная предрасположенность.
Известно, что риск развития рака желудка у родственников первой степени родства (родители, дети) повышен в 2,3-3,5 раза. При указании на 2 и более случаев рака желудка у ближайших родственников этот риск возрастает в 5-12 раз. Риск выше в тех случаях, когда онкопатология желудка была выявлена у родственников в возрасте менее 50 лет.
2) Аутоиммунное поражение желудка с развитием пернициозной (В12-дефицитной) анемии.
Для аутоиммунного поражения желудка помимо развития атрофии характерно также разрушение внутреннего фактора (фактора Кастла), который обеспечивает нормальное всасывание витамина В12 в тонкой кишке. Установлено, что аутоиммунный гастрит повышает риск развития аденокарциномы (рака) желудка в 2-6,8 раз.
Установлено, что аутоиммунный гастрит повышает риск развития аденокарциномы (рака) желудка в 2-6,8 раз.
3) Этнические факторы.
Установлено, что риск развития рака желудка выше у азиатов по сравнению с белыми (в 2,1 раза) и лицами негроидной расы (в 1,7 раза). Среди лиц азиатской расы наибольший риск отмечен у китайцев (4,77) и корейцев (7,39). Нельзя исключить, что такое различие обусловлено в том числе высокой частотой инфекции H.pylori у этих лиц и генетическими особенностями.
4) Старший возраст.
Существуют доказательства того, что в разных возрастных группах риск развития рака желудка различается. «Пограничным» считается возраст старше 45 лет, после которого риск развития заболевания повышается в 1,92-3,1 раза. Вероятнее всего, такая взаимосвязь обусловлена длительностью инфицирования H.pylori и возникшего на этом фоне хронического воспаления
5) Мужской пол.
По данным исследований мужчины имеют больший риск развития аденокарциномы (рака) желудка по равнению с женщинами, при этом риск повышен в 1,3-3 раза.
6) Табакокурение.
Курильщики имеют повышенный риск развития рака желудка, локализованного в кардиальном отделе. Вероятность развития заболевания увеличивается в 1,45-2 раза по данным разных исследований.
7) Инфекция H.pylori.
По всей видимости, это наиболее «весомый» фактор риска развития рака желудка, учитывая широкую распространенность этой инфекции по всему миру. Исследования показали, что риск развития некардиального рака желудка у инфицированных лиц увеличен в 12 раз. Примерно у 1% из них в течение жизни развивается аденокарцинома желудка. Риск развития рака кардиального отдела желудка не повышается.
8) Полипы желудка.
Полипы желудка делятся на 3 вида: полипы фундальных желез, гиперпластические полипы и аденоматозные полипы. В полипах фундальных желез размерами более 1 см редко, но выявляет дисплазия и рак (с частотой по 1,9%, соответственно). Для гиперпластических полипов больших (>1 см) размеров характерно нередкое выявление дисплазии (1,9-19%) и, реже злокачественное перерождение (0,6-2,1%). Аденоматозные полипы значительно повышают риск развития аденокарциномы желудка, а при размерах полипов >2 см частота выявления в них аденокарцином достигает по некоторым данным 50%.
Аденоматозные полипы значительно повышают риск развития аденокарциномы желудка, а при размерах полипов >2 см частота выявления в них аденокарцином достигает по некоторым данным 50%.
9) Атрофический гастрит.
Поскольку атрофический гастрит является одним из этапов в «каскаде Корреа» (см.выше), проводилась оценка риска его трансформации в рак желудка. Согласно современным данным, ежегодный риск перехода атрофического гастрита в рак желудка составляет 0,1-1,2%. Частота выявления рака желудка у пациентов с атрофией в течение 5 лет варьирует от 0,7% (для слабо выраженной атрофии) до 10% (тяжелая атрофия).
10) Кишечная метаплазия.
Как и атрофический гастрит, кишечная метаплазия является одним из этапов «каскада Корреа» на пути к развитию рака желудка. Ежегодный риск перехода кишечной метаплазии в рак желудка составляет 0,25-0,4%. Частота выявления рака желудка у пациентов с кишечной метаплазией в течение 5 лет составляет 5,3-9,8%.
11) Дисплазия.
Дисплазия (предраковое состояние) делится на два типа: низкой и высокой степени. Дисплазия низкой степени имеет ежегодный риск трансформации в рак желудка 0,6%, в то время как для высокой степени – 6%.
Частота выявления рака желудка у пациентов с дисплазией низкой степени в течение 5 лет составляет 0-23%, высокой степени – 60-85%.
Рекомендации по профилактике развития аденокарциномы (рака) желудка
В течение 2019 года были опубликованы рекомендации по диагностике и лечению пациентов с высоким риском аденокарциномы (рака) желудка сразу двумя группами авторов: Британским обществом гастроэнтерологов и коллегией ученых, представленных членами Европейского общества гастроинтестинальной эндоскопии, Европейской группы по изучению Helicobacter pylori и микробиоты, Европейского общества патологов и Португальского общества гастроинтестинальной эндоскопии (т.н. международные рекомендации по лечению предраковых состояний и изменений желудка второго пересмотра (MAPS II).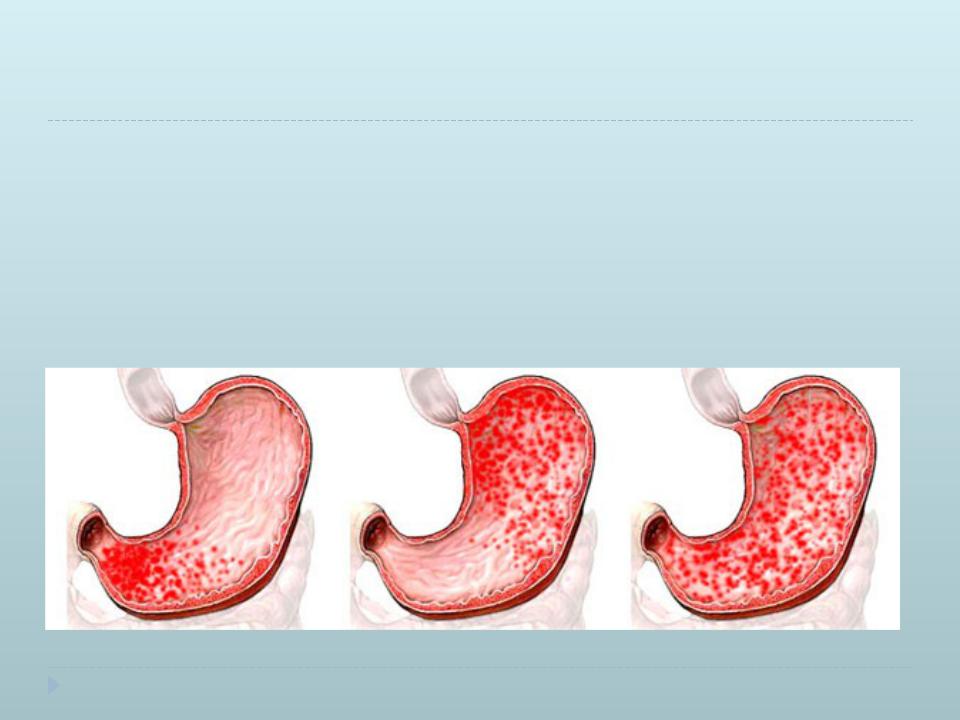 Были даны рекомендации по недопущению развития и своевременному выявлению грозной болезни – рака желудка.
Были даны рекомендации по недопущению развития и своевременному выявлению грозной болезни – рака желудка.
Итак, каковы же рекомендации в отношении профилактики развития рака желудка?
1) Пациенты с хроническим атрофическим гастритом или кишечной метаплазией подвержены риску развития рака желудка.
Комментарий: Наибольший риск отмечается при выявлении атрофии/кишечной метаплазии одновременно в антральном отделе и теле желудка.
2) Лица, проживающие в регионах с высокой частотой рака желудка должны быть тестированы на инфекцию H.pylori.
Комментарий: следует использовать достоверные методы диагностики, включающие дыхательный тест с С13 меченой мочевиной, определение антигена H.pylori в кале или антител к H.pylori класса IgG в крови. Россия относится к регионам с высокой распространенностью рака желудка.
3) Лицам без симптомов в возрасте ≥50 лет с множественными факторами риска (мужской пол, курение табака, наследственность по раку желудка и т. д.) следует проводить скрининговую гастроскопию.
д.) следует проводить скрининговую гастроскопию.
Примечание: скрининг в медицине – это комплекс мероприятий, направленных на выявление заболевания, которое себя никак не проявляет. В данном случае речь идет о проведении гастроскопии лицам без симптомов рака желудка.
Очень важно! Существует несколько видов наследственного рака желудка, для которого характерно более раннее появление (в возрасте до 40 лет).
4) Лицам с высоким риском развития рака желудка (включая гастрит с атрофией и кишечной метаплазией) необходимо проведение регулярной гастроскопии с фотофиксацией и гистологическим исследованием.
Комментарий: согласно данным зарубежных исследований, рак желудка оказывается невыявленным при проведении гастроскопии в 6-11% случаев. Очень важной является медленный осмотр слизистой оболочки желудка и фиксация изображений (фотографии, видеозапись), что позволяет увеличить выявление раннего рака желудка. В клинике «Эксперт» ведется видеозапись всех эндоскопических исследований желудочно-кишечного тракта на обязательной основе.
5) Пациентам с распространенной атрофией и кишечной метаплазией (вовлечение антрального отдела и тела желудка) показана регулярная гастроскопия с биопсией.
Комментарий: частота гастроскопий зависит от многих факторов, включая случаи рака желудка в семье, сохранение инфекции H.pylori, несмотря на адекватное лечение, и т.д.
6) Лицам, имеющим хронический гастрит или гастрит с атрофией на фоне H.pylori, должна быть проведена эрадикационная терапия инфекции.
Комментарий: профилактика развития рака желудка наиболее эффективна в тех случаях, когда пациента начинали лечить от инфекции H.pylori на этапе выявления неатрофического гастрита или гастрита с атрофией.
7) Лечение инфекции H.pylori может быть эффективной мерой в отношении профилактики развития рака желудка у части пациентов, которые уже имеют кишечную метаплазию, дисплазию или рак желудка.
Комментарий: лечение инфекции H. pylori у пациентов с кишечной метаплазией и дисплазией, а также у лиц с удаленной эндоскопическим методом аденокарциномой желудка снижает риск развития/повторного развития рака желудка. Однако профилактический эффект от лечения на этих этапах меньший, чем при хроническом неатрофическом или атрофическом гастрите.
pylori у пациентов с кишечной метаплазией и дисплазией, а также у лиц с удаленной эндоскопическим методом аденокарциномой желудка снижает риск развития/повторного развития рака желудка. Однако профилактический эффект от лечения на этих этапах меньший, чем при хроническом неатрофическом или атрофическом гастрите.
Заключение
Своевременная и адекватная по объему диагностика на этапе «простого гастрита», т.е. до развития атрофии/метаплазии/дисплазии позволяет определиться с рисками развития онкопатологии желудка, подобрать верную тактику, позволяющую избежать развития грозного заболевания.
Диагностика и лечение эрозивного гастрита
Эрозивный гастрит. Что это?
Эрозивный гастрит – заболевание желудка, при котором происходит разрушение слизистой оболочки. На начальной стадии заболевания эрозии имеют небольшой размер и зачастую локализуются только на внешней оболочке желудка. С течением времени болезнь усугубляется и при несвоевременном выявлении и лечении довольно быстро распространяется на все большую площадь слизистой, при этом вызывая болевые ощущения и желудочно-кишечные расстройства.
Бешеный ритм жизни современного человека, особенно в огромном мегаполисе, сопровождаемый частыми стрессами, отсутствием времени, позволяющего правильно и рационально питаться, на фоне печального состояния окружающей среды, – все это и способствует развитию эрозивного гастрита желудка.
Также к факторам, ведущим к развитию эрозии в желудке, относятся: частое употребление лекарств разного рода (особенно кортикостероидов, препаратов дигиталиса, верошпирона, нестероидных противовоспалительных средств и других), алкогольная интоксикация, курение, хронические заболевания (почечная недостаточность, сепсис, гиперпаратиреоз, диабет, заболевания системы кровообращения), наличие бактерий Helicobacter pylori в комбинации с другими патологиями.
Различают первичный и вторичный эрозивный гастрит. Первичный является самостоятельным заболеванием, в то время как вторичный – это последствие других заболеваний.
- Острый эрозивный гастрит – самая редкая, но, в то же время, самая тяжелая форма болезни, вызываемая химическими ожогами, механическими травмами, кровопотерей, а также печеночной или почечной недостаточностью.
- Хронический эрозивный (геморрагический) гастрит – самая распространенная форма заболевания, характеризующаяся наличием больших эрозий (3-7 мм) на слизистой оболочке и воспалением внутренних покровов желудка. Причиной данной разновидности является неправильный образ жизни (вредное питание, курение, злоупотребление алкоголем), прием на протяжении долгого периода времени нестероидных противовоспалительных средств, хирургическое вмешательство на желудке.
- Антральный эрозивный гастрит – форма недуга, которая вызывается бактерией Helicobacter pylori и сопровождается воспалением слизистой с развитием эрозий в месте ее обитания, а именно в нижнем сегменте желудка.
- Эрозивный рефлюкс – патология, при которой постоянно происходит заброс содержимого двенадцатиперстной кишки в желудок, что и приводит к раздражению слизистой оболочки желудка с дальнейшим развитием эрозий.

Развитие острого эрозивного гастрита проявляется наличием таких симптомов:
- тошнота;
- изжога;
- чувство тяжести в желудке после приема пищи;
- рвота, в том числе с кровью;
- стул с примесью крови;
- тупая боль в желудке, усиливающаяся после приема пищи.
Хронический гастрит протекает бессимптомно и может проявится только наличием крови в стуле или рвоте. Однако стоит особое внимание обращать на проявление таких симптомов как:
- тошнота;
- потеря аппетита;
- тяжесть и дискомфорт в желудке;
- метеоризм.
При выявлении пациентом у себя признаков эрозивного гастрита необходимо пройти процедуру эндоскопии, которая выполняется с помощью одноименного аппарата – эндоскопа, представляющего собой трубку с вмонтированной на конце камерой. При выполнении процедуры трубку прибора вводят в полость желудка оральным путем. Камера передает всю визуальную информацию врачу, который оценит состояние и степень поражения слизистой, в случае необходимости также может производится забор образца ткани для проведения биопсии.
При выполнении процедуры трубку прибора вводят в полость желудка оральным путем. Камера передает всю визуальную информацию врачу, который оценит состояние и степень поражения слизистой, в случае необходимости также может производится забор образца ткани для проведения биопсии.
Кроме эндоскопии пациенту назначается ряд лабораторных анализов.
Лечение эрозивного гастритаДокторами израильской клиники Ассута было вылечено тысячи случаев эрозивного гастрита, многолетний опыт борьбы с этой болезнью показывает прекрасные результаты лечения.
Лечение эрозивного гастрита необходимо начинать с определения причины, которая вызвала заболевание. Если болезнь вызвана бактерией Helicobacter pylori, то при лечении необходимо использовать антибиотики. Очень важно не прерывать лечение, в противном случае Helicobacter pylori быстро возобновляют свою колонию. На следующем этапе лечения нужно нормализовать кислотность желудочного сока. И на завершающем этапе происходит восстановление слизистой желудка.
Если Вас интересует, как пройти лечение за рубежом в клинике Ассута, то подробную информацию можно узнать на сайте клиники.
Хронический гастрит – обзор
Активный хронический гастрит
Хронический гастрит означает гистологическое присутствие мононуклеарных клеток (лимфоцитов и плазматических клеток) в слизистой оболочке желудка. Гистологический хронический гастрит очень тесно связан с H. pylori , и есть несколько пациентов с этим обнаружением, у которых нет микроорганизма. 45 Существует также различная нейтрофильная инфильтрация слизистой оболочки, обычно поражающая шейки слизистых желез.Этот последний вид дает название «активный» или «острый» типичному гистологическому виду «активного хронического гастрита». 46 Поскольку причина хронического гастрита была неизвестна до открытия H. pylori, терминология была запутанной и нестандартной. В большей части литературы такие термины, как «атрофический гастрит», «поверхностный гастрит», «простой гастрит», «антральный гастрит» и «гастрит типа 1» относятся к гистологии инфекции H. pylori .Различные классификационные и описательные термины для поражения были хорошо описаны в нескольких статьях. 47–49
pylori .Различные классификационные и описательные термины для поражения были хорошо описаны в нескольких статьях. 47–49
В антральном отделе желудка H. pylori наиболее многочисленны на поверхности эпителия (под слоем слизи), но также обитают в секретирующих слизь железах. В теле желудка (корпусе) почти все организмы находятся на поверхности. Воспаление имеет тенденцию скапливаться рядом с бактериями. Таким образом, в теле возникает «поверхностный гастрит», тогда как в антральном отделе воспаление более глубокое.В любом месте поражение может быть связано с лимфоидными фолликулами. 50
В длительном случае хронического активного поверхностного гастрита поверхностное воспаление включает преобладание ПЯН. Напротив, в глубокой части желез ниже шеи воспаление преимущественно хроническое, с лимфоцитами, окружающими разрушенные остатки глубоких желез желудка; появление, которое было названо поражением адгезии железистых лимфоцитов. По мере того, как это глубокое воспаление становится более обширным, глубокие железы становятся островками, разделенными хроническим воспалением, они менее плотно упакованы, и их глубина уменьшается. Это уменьшение называется хроническим атрофическим гастритом. Другой способ замены глубоких желез – кишечная метаплазия. Степень утраты глубоких желез в результате воспаления или кишечной метаплазии определяет, насколько обширен хронический атрофический гастрит. 51 Хронический атрофический гастрит – это предраковое поражение, которое, вероятно, является следствием длительной гипохлоргидрии и, как следствие, аномальной желудочной флоры. В целом воспаление, как поверхностное, так и глубокое, более выражено в антральном отделе, меньше в теле и меньше всего в кардии. 52 Как в антральном отделе, так и в теле, предшествующие поражения могут быть связаны с лимфоидными фолликулами. Лимфоидные фолликулы редко встречаются на слизистой оболочке желудка, за исключением случаев инфицирования H. pylori . 53
Это уменьшение называется хроническим атрофическим гастритом. Другой способ замены глубоких желез – кишечная метаплазия. Степень утраты глубоких желез в результате воспаления или кишечной метаплазии определяет, насколько обширен хронический атрофический гастрит. 51 Хронический атрофический гастрит – это предраковое поражение, которое, вероятно, является следствием длительной гипохлоргидрии и, как следствие, аномальной желудочной флоры. В целом воспаление, как поверхностное, так и глубокое, более выражено в антральном отделе, меньше в теле и меньше всего в кардии. 52 Как в антральном отделе, так и в теле, предшествующие поражения могут быть связаны с лимфоидными фолликулами. Лимфоидные фолликулы редко встречаются на слизистой оболочке желудка, за исключением случаев инфицирования H. pylori . 53
Прикрепление бактерии вызывает повреждение цитоскелета эпителиальных клеток, так что они выпирают, а не поддерживают ровную поверхность просвета. При периодическом окрашивании кислотой-Шиффом содержание слизи в апикальной части инфицированной слизистой оболочки желудка меньше нормы, а клетки короче.Эти изменения получили название деструктивного муцинового поражения покрывающего эпителия желудка. 49, 54
При периодическом окрашивании кислотой-Шиффом содержание слизи в апикальной части инфицированной слизистой оболочки желудка меньше нормы, а клетки короче.Эти изменения получили название деструктивного муцинового поражения покрывающего эпителия желудка. 49, 54
На протяжении жизни инфицированного человека воспаление может разрушить железистые элементы (атрофия), а кишечные клетки часто замещают эпителий, секретирующий слизь желудка (кишечная метаплазия). Возникающий в результате атрофический гастрит является последней фазой «выгорания» инфекции H. pylori , обычно наблюдаемой у пожилых людей. Однако в тропических странах, где H.pylori , возможно, присутствовал с очень раннего возраста, атрофический гастрит может наблюдаться у молодых людей и считается основным фактором риска рака желудка. 55
Признаки хронического гастрита | Ада
Что такое хронический гастрит?
Хронический гастрит – это хроническое заболевание, при котором слизистый слой желудка , также известный как слизистая оболочка желудка, воспаляется или раздражается в течение длительного периода времени. Симптомы имеют тенденцию проявляться медленно, с течением времени.
Симптомы имеют тенденцию проявляться медленно, с течением времени.
Некоторые из причин хронического гастрита включают:
- Заражение бактериями вида Helicobacter pylori ( H. pylori ). Эта причина является наиболее частой и иногда упоминается как гастрит типа B.
- Повреждение слизистой оболочки желудка, например, вызванное химическим раздражением веществами, включая алкоголь, некоторыми обезболивающими, такими как нестероидные противовоспалительные препараты (НПВП) или попаданием желчи в желудок.
- Нарушение работы иммунной системы, что делает его аутоиммунным заболеванием.Иногда это называют гастритом типа А, и он является наименее частой причиной хронического гастрита
В зависимости от основной причины хронический гастрит, как правило, лечится относительно просто. Хронический гастрит часто быстро проходит после начала лечения.
Без лечения хронический гастрит может прогрессировать в течение нескольких месяцев до лет до такой степени, что слизистая оболочка желудка повреждена настолько, что у больного возникает риск:
- Язвенная болезнь
- Полипы желудка или опухоли, не являющиеся злокачественными
- Анемия, чаще при аутоиммунном гастрите
Несмотря на то, что риск остается низким, люди с нелеченым хроническим гастритом также подвергаются более высокому риску развития раковых опухолей желудка, чем население в целом.
Хронический гастрит в сравнении с острым
Острый гастрит – это также воспаление или раздражение слизистой оболочки желудка, но оно длится более короткий период времени, чем хронический гастрит. Человек, страдающий хроническим гастритом, может иногда не замечать многих или даже не замечать никаких симптомов, а когда появляется боль, она обычно тупая и длительная. Острый гастрит имеет тенденцию возникать быстрее, при этом боль часто ощущается сильнее.
Подробнее об остром гастрите »
Гастрит vs.гастроэнтерит
Острый и хронический гастрит напрямую влияет на желудок и может вызвать тошноту и рвоту. Гастроэнтерит поражает кишечник, и желудок. Хотя тошнота и рвота часто возникают в результате гастроэнтерита, они также очень часто приводят к диарее, которая не является симптомом гастрита.
Подробнее о Гастроэнтерите »
Симптомы хронического гастрита
Многие люди, инфицированные H. Pylori , который является основной причиной хронического гастрита, не проявляют никаких симптомов в течение длительного времени и не испытывают никаких осложнений.
Люди, у которых наблюдаются симптомы, связанные с хроническим гастритом, а не с его различными осложнениями, могут испытывать:
- Боль или ломота в верхней части живота
- Чувство сытости
- Боль при голодании
- Боль после еды
- Тошнота
- Рвота
Беспокоитесь, что у вас может быть это состояние? Начните оценку симптомов в приложении Ada.
Симптомы аутоиммунного хронического гастрита типа А
Боль может не быть на первом плане у людей с аутоиммунным хроническим гастритом, и большинство из них не будет испытывать такой сильной боли, как пациенты с хроническим гастритом, вызванным H.pylori или НПВП.
Некоторые люди с аутоиммунным хроническим гастритом могут испытывать чувство переполнения в верхней части живота после еды, тошноту или рвоту.
Основным результатом аутоиммунного хронического гастрита является злокачественная анемия , вызванная нехваткой витамина B12 из-за проблем с абсорбцией витамина B12 из-за последствий гастрита. Однако это также может привести к железодефицитной анемии или другим состояниям.
Однако это также может привести к железодефицитной анемии или другим состояниям.
Симптомы злокачественной анемии могут включать:
- Диарея
- Чувство головокружения или неуклюжести
- Чувство усталости
- Одышка, особенно при выполнении упражнений
- Хрупкие ногти и сухая кожа
- Онемение или иглы и иглы
- Нарушения походки
- Снижение вкуса и запаха
- Недостаток концентрации
- Психиатрические или когнитивные симптомы
Симптомы железодефицитной анемии могут включать:
- Чувство усталости
- Бледная кожа
- Головные боли
- Хрупкие ногти и сухая кожа
- Одышка
- Учащенное сердцебиение
- Тиннитус
Подробнее об анемии ».
Осложнения хронического гастрита
Хронический гастрит может привести к другим состояниям, если не лечить его должным образом. Поскольку хронический гастрит часто протекает бессимптомно, другое заболевание может быть первым признаком того, что человек страдает хроническим гастритом. Если какой-либо из этих симптомов кажется вам знакомым, попробуйте оценить симптом в приложении Ada. Некоторые из этих осложнений включают:
Если какой-либо из этих симптомов кажется вам знакомым, попробуйте оценить симптом в приложении Ada. Некоторые из этих осложнений включают:
Язва желудка
Язва желудка – это язва в слизистой оболочке желудка , вызванная повреждением слизистой оболочки желудка из-за длительного воздействия желудочной кислоты.Восемь из 10 язв желудка, также известных как пептические язвы, связаны с инфицированием H. pylori . Другая причина – длительный прием обезболивающих НПВП.
Симптомы язвы желудка включают:
- Жгучая боль в животе
- Тошнота и рвота
- Рвота
- Вздутие живота или чувство сытости
- Отрыжка
- Изжога
- Изменения аппетита
- Необъяснимая потеря веса
- Затрудненное дыхание
- Чувство обморока
- Рвота кровью
- Кровь в стуле
- Стул, который кажется черным или смолистым
Обычно эти симптомы:
- Появление на пустой желудок
- Продолжительность минуты или, возможно, часов
- Появляются и выключаются в течение нескольких недель
- Можно на короткое время прекратить прием антацидов
Подробнее о язвенной болезни »
Атрофический гастрит
Если не лечить, тяжелый хронический гастрит, особенно аутоиммунный хронический гастрит типа A, а также тип B H.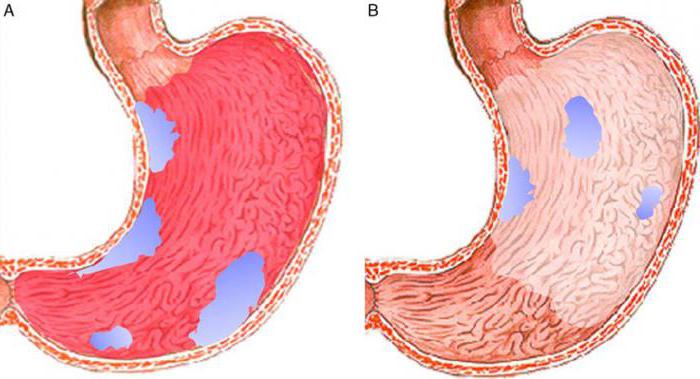 pylori может перерасти в атрофический гастрит. Это место, где защитный слой слизи в желудке повреждается, что приводит к потере железистых клеток желудка, которая компенсируется клетками, обычно обнаруживаемыми в кишечнике. Со временем железистые клетки желудка заменяются кишечной и фиброзной тканью. Этот процесс известен как кишечная метаплазия (IM) желудка, и пострадавшие подвергаются повышенному риску рака желудка по сравнению с населением в целом, хотя общий риск остается относительно низким.
pylori может перерасти в атрофический гастрит. Это место, где защитный слой слизи в желудке повреждается, что приводит к потере железистых клеток желудка, которая компенсируется клетками, обычно обнаруживаемыми в кишечнике. Со временем железистые клетки желудка заменяются кишечной и фиброзной тканью. Этот процесс известен как кишечная метаплазия (IM) желудка, и пострадавшие подвергаются повышенному риску рака желудка по сравнению с населением в целом, хотя общий риск остается относительно низким.
Атрофический гастрит – это развитие хронического гастрита, симптомы которого зависят от конкретной причины состояния. Например, атрофический гастрит, вызванный хроническим гастритом, вызванным бактериями H. pylori, часто может не вызывать многих, а возможно, даже не вызывать никаких симптомов. В то время как у человека с аутоиммунным хроническим гастритом, который перерастает в атрофический гастрит, могут проявляться симптомы пагубной (связанной с витамином B12) или железодефицитной анемии.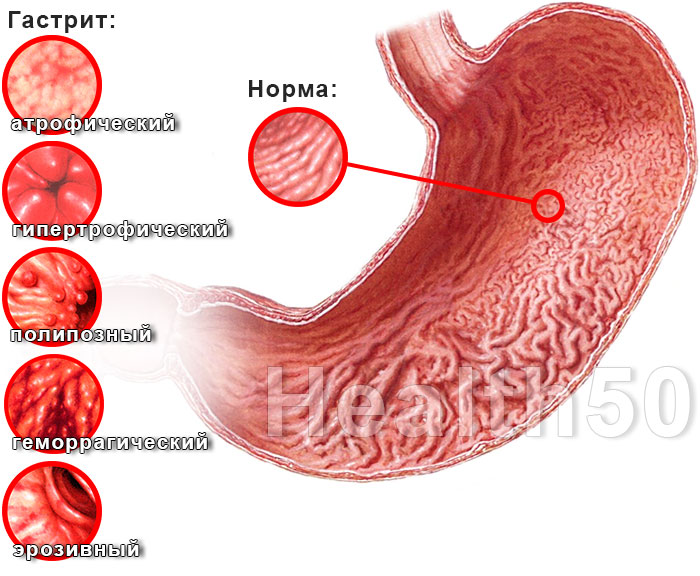 См. Раздел о симптомах выше, чтобы увидеть больше признаков хронического гастрита.
См. Раздел о симптомах выше, чтобы увидеть больше признаков хронического гастрита.
Полипы или опухоли желудка
Полипы желудка – это разрастания, которые образуются в слизистой оболочке желудка . Обычно они не вызывают симптомов, но когда они появляются, они могут включать:
- Анемия
- Болезненность желудка при надавливании
- В более редких случаях кровотечение
Большинство полипов желудка доброкачественные, то есть доброкачественные , но некоторые из них могут перерасти в рак желудка.
При появлении каких-либо симптомов хронического или острого гастрита рекомендуется обратиться к врачу за консультацией.
Полезно знать: Вероятность развития рака в результате гастрита или атрофического гастрита мала. Тем не менее, людям с диагнозом атрофический гастрит рекомендуется регулярно проходить обследование на рак желудка. Эти промежутки между обследованиями, вероятно, будут составлять от одного до трех лет в зависимости от рекомендаций врача.
Другие эффективные способы снижения вероятности рака желудка включают:
- Диета с высоким содержанием свежих фруктов и овощей
- Диета с низким содержанием продуктов высокой степени обработки, содержащих большое количество соли (натрия) и гидрогенизированных жиров
- Избегать красного мяса, особенно обработанного и копченого, с высоким содержанием нитратных солей и / или нитритов
- Образ жизни, свободный от табачного дыма и никотина
- Употребление алкоголя только в умеренных количествах
Причины хронического гастрита
Если защитный слой слизи в желудке поврежден, желудочная кислота может раздражать слизистую оболочку желудка под слизью .
В подавляющем большинстве случаев хронический гастрит вызывается бактериями H. pylori . Эти бактерии вызывают воспаление слизистой оболочки желудка, и постепенно клетки желудка повреждаются. Заражение с _H. pylori_ обычно приобретается в детстве, хотя симптомы очень часто развиваются только в более зрелом возрасте.
Хронический гастрит также может быть вызван несколькими химическими веществами. Эти причины включают:
- Повторное использование высоких доз и / или длительное использование некоторых болеутоляющих, таких как аспирин, который также может быть назначен для обезболивания в более низких дозах, например.г., после сердечного приступа, или НПВП , такие как ибупрофен или напроксен- Чрезмерное употребление алкоголя .
- Желчь , жидкость, которую печень вырабатывает для улучшения пищеварения, попадая в желудок. Это известно как рефлюкс желчи
Небольшое количество случаев хронического гастрита вызвано аутоиммунной реакцией (хронический гастрит типа А).
Причины аутоиммунного хронического гастрита
Аутоиммунная реакция также может вызывать хронический гастрит.Аутоиммунный ответ организма вызывает воспаление слизистой оболочки желудка, покрытой защитной слизью, что в конечном итоге влияет на клетки, продуцирующие слизь, и разрушает их.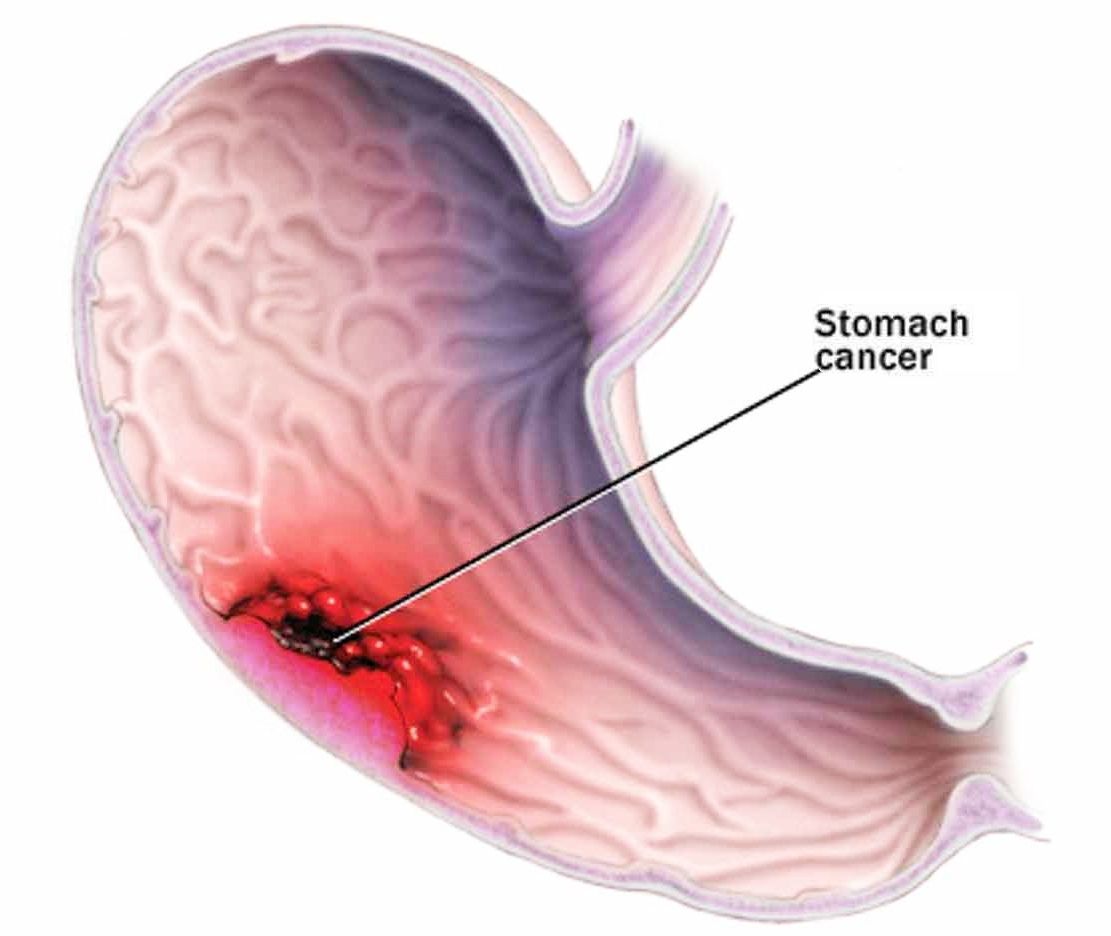 Это приводит к меньшему количеству клеток, продуцирующих слизь, и, следовательно, к меньшей защите желудка. Это сопровождается потерей париетальных клеток в желудке, которые регулируют кислотность желудочного сока. Париетальные клетки также влияют на всасывание витамина B12 и железа в желудке. Таким образом, повреждение или потеря этих клеток может привести к тому, что в организме будет меньше витамина B12 и железа, доступного для различных процессов, что приведет к анемии и другим симптомам дефицита (см. Раздел о симптомах выше).
Это приводит к меньшему количеству клеток, продуцирующих слизь, и, следовательно, к меньшей защите желудка. Это сопровождается потерей париетальных клеток в желудке, которые регулируют кислотность желудочного сока. Париетальные клетки также влияют на всасывание витамина B12 и железа в желудке. Таким образом, повреждение или потеря этих клеток может привести к тому, что в организме будет меньше витамина B12 и железа, доступного для различных процессов, что приведет к анемии и другим симптомам дефицита (см. Раздел о симптомах выше).
Пока не известно, что вызывает аутоиммунную реакцию, но люди с аутоиммунным хроническим гастритом часто также имеют другие аутоиммунные состояния, такие как аутоиммунный тиреоидит, болезнь Аддисона или диабет I типа.
Факторы риска хронического гастрита
Определенные группы населения и люди, злоупотребляющие определенными веществами, подвержены повышенному риску хронического гастрита:
- Привычное использование обезболивающих , таких как аспирин, ибупрофен и напроксен, может изменить состав слизистой оболочки желудка, делая его менее защищенным и вызывая как острый, так и хронический гастрит
- Чрезмерное употребление алкоголя – еще один распространенный фактор риска
- Заражение H.
 pylori (тип B) является большим фактором риска развития острого, а также хронического гастрита. Заболеваемость инфекцией H. pylori снижается в развитых странах с 1960-х годов, вероятно, из-за улучшения гигиены.
pylori (тип B) является большим фактором риска развития острого, а также хронического гастрита. Заболеваемость инфекцией H. pylori снижается в развитых странах с 1960-х годов, вероятно, из-за улучшения гигиены.
Диагностика хронического гастрита
Чтобы помочь в диагностике хронического гастрита, врач изучает историю болезни человека , , включая прием лекарств, таких как аспирин, обезболивающие и антациды НПВП, а также потребление алкоголя и поездки в страны, где инфицировано ЧАС.pylori является обычным явлением. Например, по оценкам, около девяти из каждых 10 человек в Нигерии, Португалии и Эстонии инфицированы H. pylori . . Врач также проведет физический осмотр брюшной полости / живота.
В зависимости от этих факторов для диагностики или оценки потенциальных причин может использоваться ряд тестов:
- Тестирование на H. pylori . Эти анализы могут включать анализы крови, стула или дыхания
- Анализы крови на анемию
- Анализы крови для выявления антител, которые по ошибке вызывают иммунный ответ против клеток в собственном желудке человека
- Анализы крови на функцию печени и почек
- Анализы кала на наличие крови
Другие тесты могут включать:
EGD (эзофагогастродуоденоскопия), также называемая гастроскопией или эндоскопией верхних отделов желудка: EGD – это визуальный осмотр слизистой оболочки желудка, проводимый путем пропускания эндоскопа – длинной, тонкой, гибкой трубки с камерой с подсветкой – вниз по горлу и в полость желудка.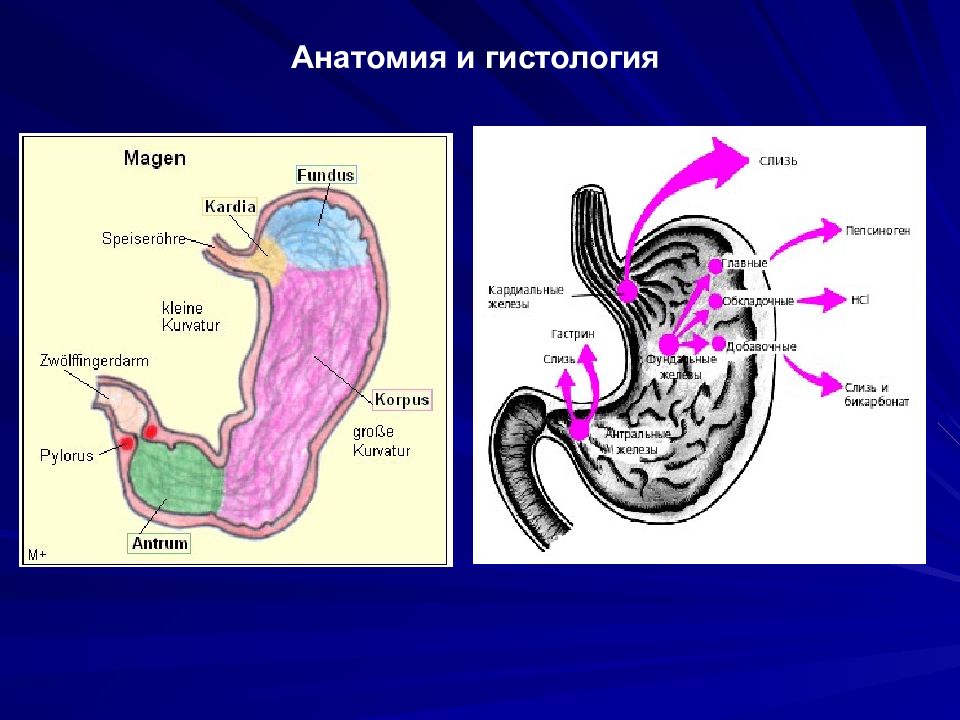 пищевод, желудок и верхний отдел тонкой кишки.Врач может осмотреть слизистую оболочку желудка на наличие признаков воспаления и взять небольшой образец ткани (биопсия) для проверки на H. pylori . EGD – лучший диагностический инструмент для аутоиммунного хронического гастрита.
пищевод, желудок и верхний отдел тонкой кишки.Врач может осмотреть слизистую оболочку желудка на наличие признаков воспаления и взять небольшой образец ткани (биопсия) для проверки на H. pylori . EGD – лучший диагностический инструмент для аутоиммунного хронического гастрита.
Серия для верхних отделов желудочно-кишечного тракта (ЖКТ): Этот тест, также называемый «проглатыванием бария», создает серию рентгеновских снимков желудочно-кишечного тракта. Проглатывание жидкости, содержащей барий (соединение металла), покрывает внутреннюю часть желудка, пищевода и тонкой кишки, делая органы, а также любые возможные язвы, полипы или другие аномалии более заметными на рентгеновском снимке.
Лечение хронического гастрита
Как лечить хронический гастрит, зависит от первопричины . Если состояние вызвано длительным и чрезмерным употреблением НПВП или алкоголя, человеку необходимо прекратить прием этих веществ. Медицинский работник сможет помочь с заменой болеутоляющих или с любыми эффектами отмены, а также перенаправить на другую необходимую поддержку, например, группы поддержки для отказа от алкоголя.
Лечение
H. pyloriАнтибиотики могут лечить H.pylori инфекция. Избавление от этих бактерий часто помогает излечить гастрит. В первом случае для лечения инфекции H. pylori обычно используется комбинация из трех препаратов. Это лечение обычно включает ингибитор протонной помпы (ИПП), лекарство, которое снижает количество кислоты, вырабатываемой желудком, а также два антибиотика. Это называется тройной терапией, и курс лечения длится от 10 до 14 дней.
В большинстве случаев тройная терапия успешно избавит от инфекции.Если требуется дополнительное лечение, врачи часто рекомендуют четырехкратную терапию. Это включает в себя ИПП и три антибиотика и также длится от 10 до 14 дней.
Лечение кишечной метаплазии
Хронический гастрит может привести к изменению слизистой оболочки желудка, известному как кишечная метаплазия (IM). Это когда клетки желудка изменяются и становятся больше похожими на клетки кишечника.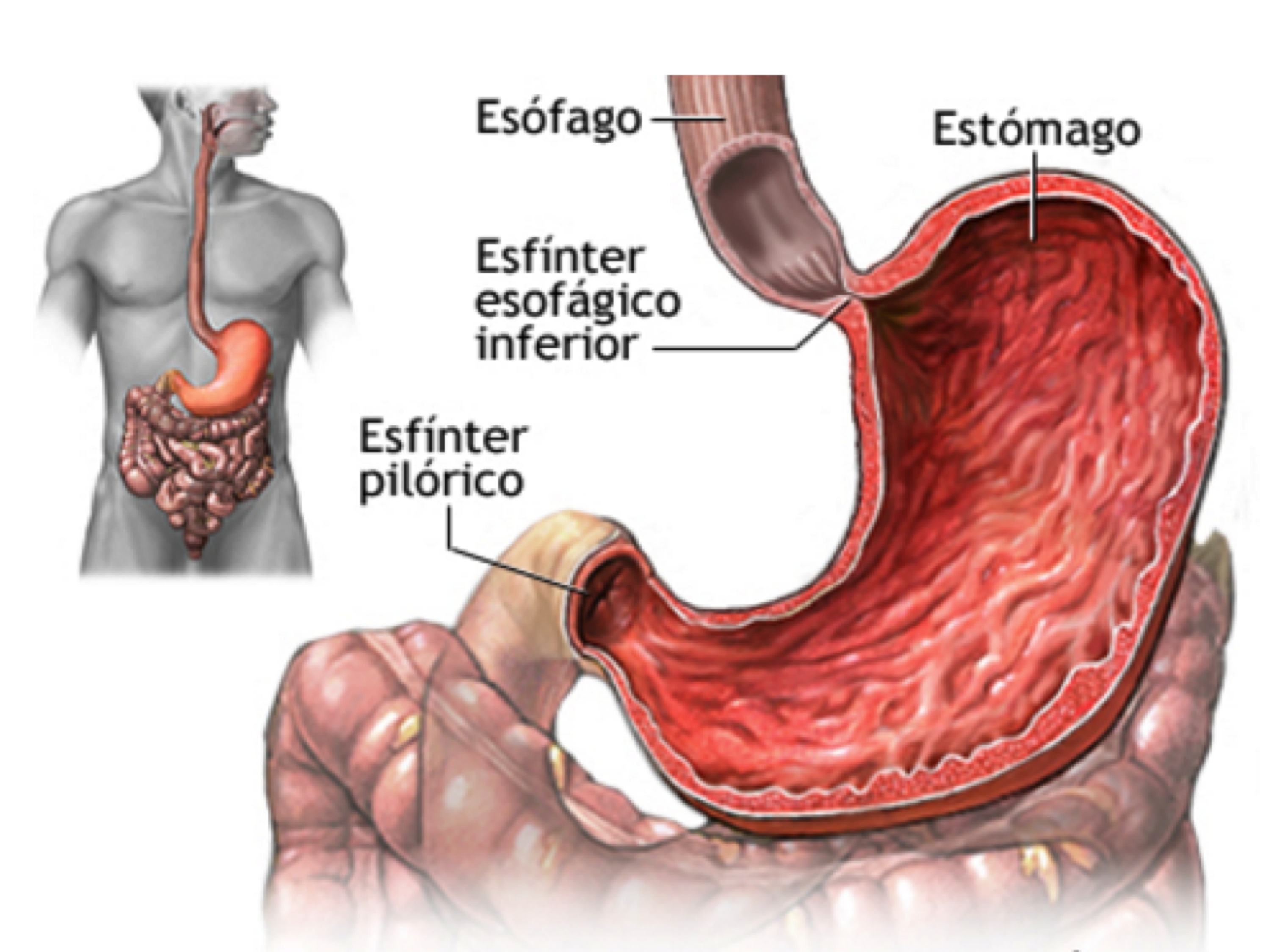 IM ассоциируется с повышенным риском рака, но риск по-прежнему остается низким.
IM ассоциируется с повышенным риском рака, но риск по-прежнему остается низким.
Хотя лечение инфекции H. pylori устраняет хронический гастрит, остается неясным, окажется ли это лечение эффективным в обращении кишечной метаплазии. Данные свидетельствуют о том, что удаление H. pylori может, по крайней мере, замедлить IM.
Лечение аутоиммунного хронического гастрита
В настоящее время не существует лечения, которое вылечило бы аутоиммунный хронический гастрит. Однако дефицит витамина B12 и железа, который он часто вызывает , можно лечить с помощью добавок в виде таблеток, инъекций или внутривенных инфузий.
Несмотря на то, что аутоиммунный хронический гастрит не может быть устранен лечением, риск развития рака желудка как осложнения этого состояния по-прежнему от умеренного до низкого. Тем не менее, врач может порекомендовать повторную эндоскопию для выявления любых ранних признаков рака желудка. Лечение рака желудка обычно тем эффективнее, чем раньше выявляется и лечится заболевание.
Лечение рака желудка обычно тем эффективнее, чем раньше выявляется и лечится заболевание.
Последующее наблюдение Эндоскопия может быть рекомендована для наблюдения за развитием атрофического гастрита и выявления любых ранних признаков рака желудка, что позволит затем вылечить его как можно скорее с наилучшим возможным результатом.
Диета и домашние средства при хроническом гастрите
Диета не играет роли в возникновении хронического гастрита , хотя для облегчения симптомов люди могут посчитать целесообразным прекратить есть продукты, которые раздражают желудок, например жирную, острую или очень кислую пищу. Некоторые люди предпочитают сокращать количество продуктов, содержащих лактозу или глютен.
Другие изменения в образе жизни, которые могут помочь, включают в себя более частое меньшее употребление пищи, а не обильное, снижение веса и управление стрессом.
Лекарства, отпускаемые без рецепта, такие как антациды, могут облегчить желудочные и пищеварительные симптомы, но не решат основную проблему. Лекарства, отпускаемые без рецепта, не следует принимать часто и полагаться на них. Если симптомы сохраняются более недели или являются серьезными, следует проконсультироваться с врачом.
Лекарства, отпускаемые без рецепта, не следует принимать часто и полагаться на них. Если симптомы сохраняются более недели или являются серьезными, следует проконсультироваться с врачом.
Часто задаваемые вопросы о хроническом гастрите
В: Есть ли лекарство от хронического гастрита?
A: Хронический гастрит, вызванный бактериями H. pylori или приемом НПВП или алкоголя, можно вылечить, либо уничтожив бактерии, либо прекратив употребление вещества.Однако, если человек страдает хроническим гастритом в течение длительного времени, некоторые повреждения внутренней оболочки желудка могут быть необратимыми.
В: Опасен ли хронический гастрит?
A: Хронический гастрит сам по себе не опасен, но может, как и острый гастрит, привести к развитию других проблем, таких как язвы. Кроме того, это может перерасти в более серьезную стадию. Если хронический гастрит прогрессирует до атрофического гастрита, это может дополнительно увеличить риск развития язв, анемии, полипов или доброкачественных опухолей, а также рака желудка.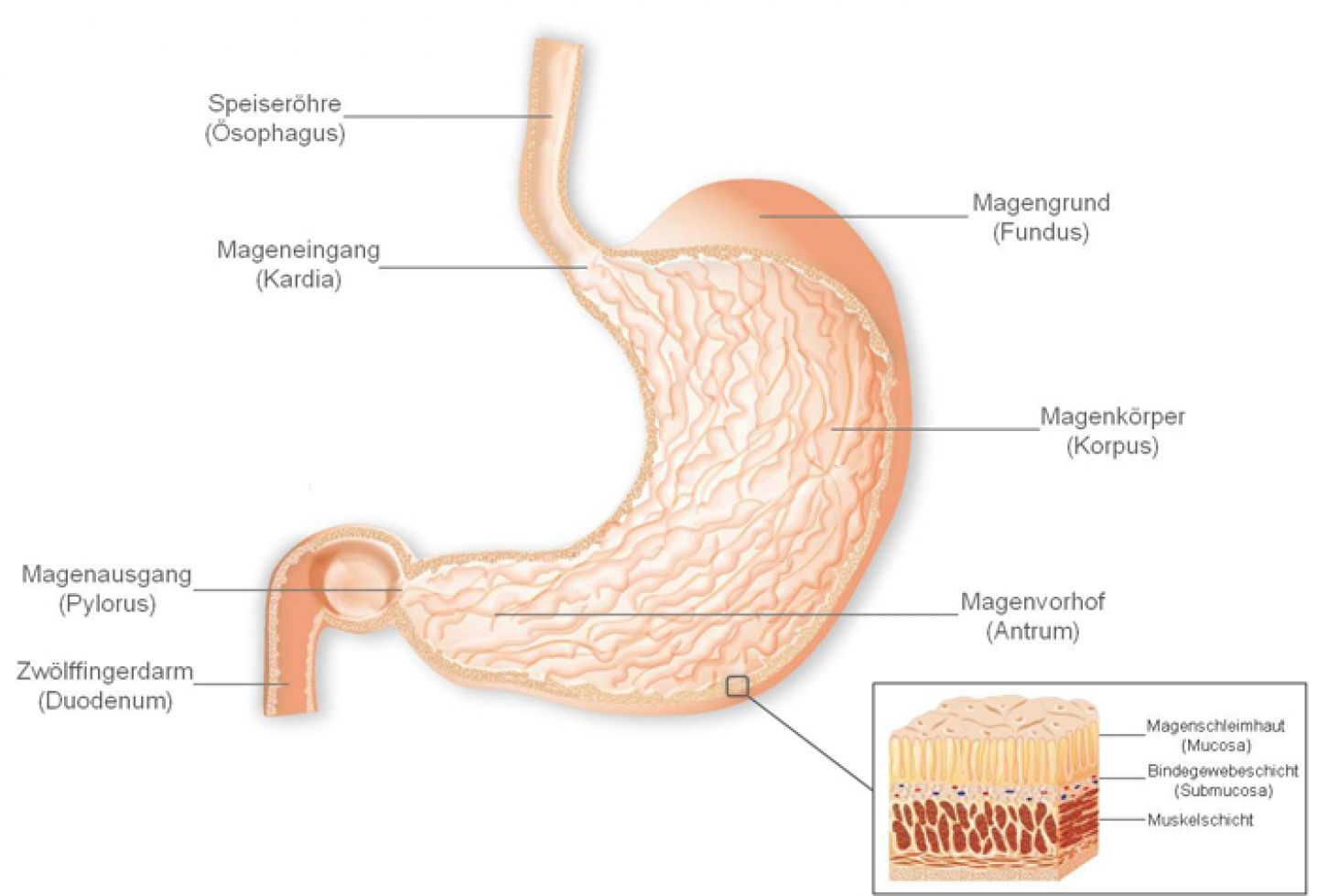
В: Что такое хронический антральный гастрит?
A: Антральный гастрит поражает только нижнюю часть желудка, называемую антральным отделом, а не весь орган. Как и гастрит, поражающий весь желудок, антральный гастрит может быть хроническим или острым. Гастрит, вызванный H. pylori , часто фокусируется в антральном отделе, прежде чем распространиться на остальную часть желудка.
В: Что такое слизистая оболочка желудка?
A: Слизистая оболочка желудка – это внутренняя оболочка или слизистая оболочка желудка.Он покрыт толстым слоем слизи и не только производит кислоту для расщепления пищи, попадающей в желудок, но и защищает желудок от кислоты, которую он создает. Гастрит возникает при воспалении слизистой оболочки желудка.
В: Как долго длится хронический гастрит?
A: Хронический гастрит, особенно распространенный из-за H. pylori или раздражителей, таких как алкоголь или обезболивающие, обычно быстро проходит после начала надлежащего лечения. Однако, если заболевание не лечить, хронический гастрит может поражать человека в течение многих месяцев или даже лет.Потенциально, как и при более редком аутоиммунном гастрите, он может сохраняться, даже несмотря на поддерживающее лечение, всю оставшуюся жизнь человека.
Однако, если заболевание не лечить, хронический гастрит может поражать человека в течение многих месяцев или даже лет.Потенциально, как и при более редком аутоиммунном гастрите, он может сохраняться, даже несмотря на поддерживающее лечение, всю оставшуюся жизнь человека.
Хронический гастрит
Scand J Gastroenterol. 2015 июн 3; 50 (6): 657–667.
Pentti Sipponen
a Patolab Oy, Эспоо, Финляндия и Тартуский государственный университет, Тарту, Эстония
Heidi-Ingrid Maaroos
a Patolab Oy, Espoo, Финляндия и Тартуский государственный университет
, Эстонский государственный университет
, Тартуский государственный университет
a Patolab Oy, Эспоо, Финляндия, и Тартуский государственный университет, Тарту, ЭстонияПоступила 28 января 2015 г .; Пересмотрено 11 февраля 2015 г .; Принята в печать 12 февраля 2015 г.
Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License (http://creativecommons. org/licenses/by/4.0/), которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии, что оригинал эта статья цитируется в других статьях в PMC.
org/licenses/by/4.0/), которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии, что оригинал эта статья цитируется в других статьях в PMC.Abstract
Распространенность хронического гастрита заметно снизилась в развитых популяциях за последние десятилетия. Однако хронический гастрит по-прежнему остается одной из наиболее распространенных серьезных пандемических инфекций с такими серьезными смертельными последствиями, как язвенная болезнь желудка или рак желудка.В настоящее время в мире в среднем более половины людей могут иметь хронический гастрит. Хеликобактер pylori Инфекция в детстве является основной причиной хронического гастрита, микробное происхождение которого является ключом к пониманию причудливой эпидемиологии и течения болезни. Продолжительное и агрессивное воспаление при гастрите со временем (годы и десятилетия) приводит к разрушению (атрофическому гастриту) слизистой оболочки желудка.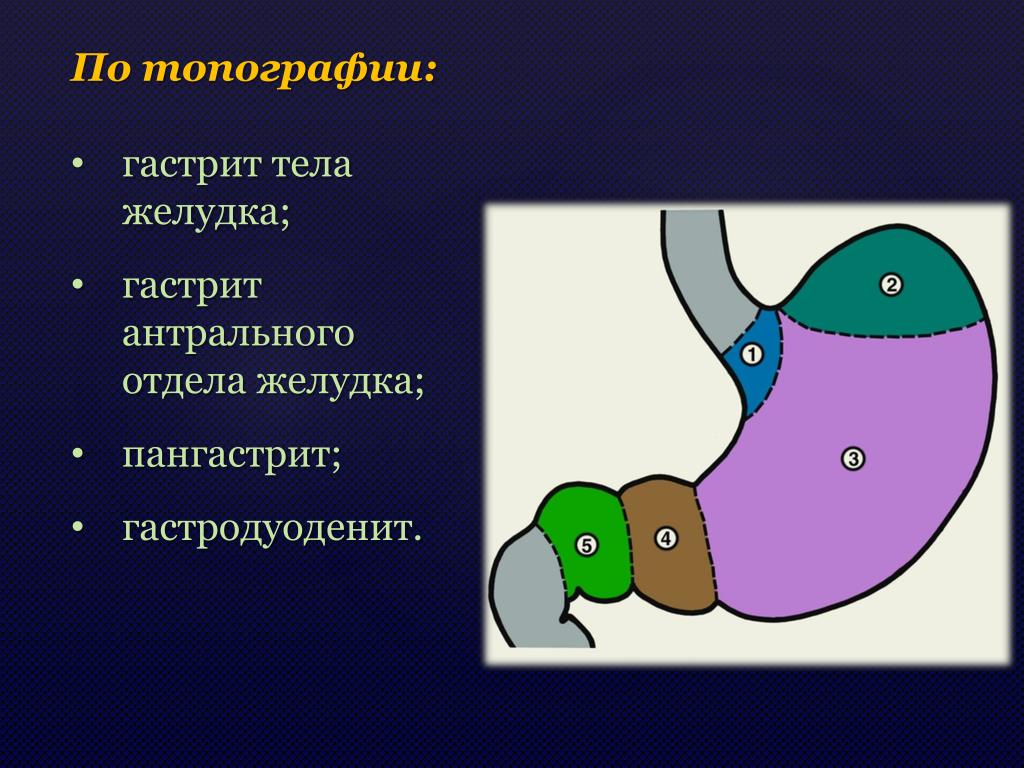 Прогрессирующее обострение атрофического гастрита впоследствии приводит к нарушению функции слизистой оболочки желудка.В самых крайних случаях атрофический гастрит в конечном итоге приводит к тому, что желудок постоянно не содержит кислоты. Тяжелый атрофический гастрит и отсутствие кислоты в желудке – это наиболее известные до сих пор независимые состояния риска рака желудка. Помимо риска злокачественных новообразований и язвенной болезни, бескислотный желудок и тяжелые формы атрофического гастрита могут быть связаны с нарушением всасывания основных витаминов, таких как витамин B12, микронутриентов (таких как железо, кальций, магний и цинк), диеты и лекарств. .
Прогрессирующее обострение атрофического гастрита впоследствии приводит к нарушению функции слизистой оболочки желудка.В самых крайних случаях атрофический гастрит в конечном итоге приводит к тому, что желудок постоянно не содержит кислоты. Тяжелый атрофический гастрит и отсутствие кислоты в желудке – это наиболее известные до сих пор независимые состояния риска рака желудка. Помимо риска злокачественных новообразований и язвенной болезни, бескислотный желудок и тяжелые формы атрофического гастрита могут быть связаны с нарушением всасывания основных витаминов, таких как витамин B12, микронутриентов (таких как железо, кальций, магний и цинк), диеты и лекарств. .
Ключевые слова: рак желудка, гастрит, Helicobacter pylori , язвенная болезнь
Введение
Хронический гастрит – одно из самых распространенных пожизненных, серьезных и коварных заболеваний человека.Можно оценить, что более половины населения мира в той или иной степени страдает этим заболеванием, что указывает на то, что даже многие сотни миллионов людей во всем мире могут иметь хронический гастрит в той или иной форме.
Значение хронического гастрита как серьезного заболевания в значительной степени недооценивается в клинической практике, хотя роль гастрита в патогенезе обычных пептических язв и рака желудка очевидна [1, 2, 3, 4]. Можно подсчитать, что ежегодно во всем мире могут происходить миллионы преждевременных смертей из-за рака и язвы, являющихся последствиями хронического гастрита.
Хронический гастрит проявляется в неатрофической или атрофической форме. Это формы и фенотипы гастрита, которые представляют разные стадии одного и того же пожизненного заболевания [2, 3, 5, 6, 7]. Морфологические проявления гастрита во всем мире очень похожи, то есть хронический гастрит, по-видимому, с его последствиями является одним и тем же заболеванием во всем мире.
Хронический гастрит известен и изучается с первых десятилетий 20-го века, но получил большее внимание только в 1982 году после открытия Helicobacter pylori Уорреном и Маршаллом [8].Стало ясно, что бактерия является причиной гастрита в подавляющем большинстве случаев, за возможным исключением гастрита аутоиммунного происхождения [3, 9]. Следовательно, стало очевидно, что хронический гастрит можно вылечить с помощью эрадикации H. pylori , что приведет к нормализации слизистой оболочки желудка, по крайней мере, в тех случаях, когда гастрит не переходит в конечную стадию атрофии (атрофический гастрит) [8 , 9, 10, 11, 12, 13].
Следовательно, стало очевидно, что хронический гастрит можно вылечить с помощью эрадикации H. pylori , что приведет к нормализации слизистой оболочки желудка, по крайней мере, в тех случаях, когда гастрит не переходит в конечную стадию атрофии (атрофический гастрит) [8 , 9, 10, 11, 12, 13].
Несмотря на то, что основные черты хронического гастрита хорошо известны, некоторые вопросы все еще остаются без ответа.Мы не знаем, например, значения аутоиммунитета или генетики в развитии и прогрессировании хронического гастрита H. pylori . Молекулярные механизмы и роль факторов окружающей среды, таких как диета, и роль микробов, отличных от H. pylori , в течении хронического гастрита, в значительной степени неизвестны. Мы не можем точно предсказать, у кого хронический гастрит обязательно будет прогрессировать до конечной атрофической стадии и смертельных последствий, или у кого этого не произойдет.Эта неопределенность также относится к деталям, благодаря которым гастрит приводит к появлению пептических язв или рака желудка. Однако мы знаем, что без наличия сопутствующего хронического гастрита или атрофического гастрита обычные пептические язвы или рак желудка встречаются редко.
Однако мы знаем, что без наличия сопутствующего хронического гастрита или атрофического гастрита обычные пептические язвы или рак желудка встречаются редко.
В этом обзоре описаны некоторые наблюдения и представлены некоторые субъективные мнения и замечания о течении и эпидемиологии хронического гастрита H. pylori и связанных с ним заболеваний, полученные в основном из нескольких исследований, проведенных в Эстонии и Финляндии за последние 40 лет [14, 15, 16, 17, 18, 19, 20, 21, 22].За прошедшие годы большинство этих исследований было опубликовано в этом журнале.
Естественное течение
Хронический гастрит – это многоступенчатое, прогрессирующее и пожизненное воспаление [3, 16, 20, 21, 22, 23, 24]. Обычно оно начинается в детстве как простое хроническое («поверхностное») мононуклеарное воспаление с сосуществованием острого («активного») нейтрофильного воспаления разной степени [25, 26]. Гастрит постепенно прогрессирует в течение лет и десятилетий до атрофического гастрита, который характеризуется потерей нормальных слизистых желез либо в антральном отделе, либо в теле (и дне), либо в обоих (, и) [7, 22, 23, 27]. Как правило, во всех популяциях повозрастная распространенность как неатрофического, так и атрофического гастрита имеет тенденцию к возрастанию с возрастом, как это было продемонстрировано в Финляндии в. В настоящее время рост повозрастной распространенности гастрита по возрасту более выражен и резок в развивающихся, чем в развитых, популяциях, т. Е. Распространенность гастрита в молодых возрастных группах или даже в детстве гораздо больше, чем в развитых. 50% в развивающихся популяциях, тогда как эта распространенность в развитых странах обычно намного меньше 50% [17, 27].
Как правило, во всех популяциях повозрастная распространенность как неатрофического, так и атрофического гастрита имеет тенденцию к возрастанию с возрастом, как это было продемонстрировано в Финляндии в. В настоящее время рост повозрастной распространенности гастрита по возрасту более выражен и резок в развивающихся, чем в развитых, популяциях, т. Е. Распространенность гастрита в молодых возрастных группах или даже в детстве гораздо больше, чем в развитых. 50% в развивающихся популяциях, тогда как эта распространенность в развитых странах обычно намного меньше 50% [17, 27].
Слизистая оболочка тела с «активным» хроническим гастритом (A): Воспаление является мононуклеарным, но сопровождается нейтрофилами и эозинофилами (стрелки), которые проникают в поверхностный эпителий. Нормальный (B): нормальная слизистая оболочка тела без каких-либо признаков воспаления показана в качестве эталона. Пятно HE × 500.
Слизистая оболочка тела. Нормальный (A): слой кислородных желез в норме, что позволяет предположить, что слизистая оболочка тела способна нормально секретировать соляную кислоту. Неатрофический гастрит (B): Легкое мононуклеарное воспаление наблюдается в верхнем слое (фовеолярной части) слизистой оболочки («поверхностный хронический гастрит»), как указано стрелками.Слой железы не поврежден, что свидетельствует о нормальной секреции кислоты, несмотря на гастрит. Умеренный атрофический гастрит в теле (C): Интенсивное хроническое мононуклеарное воспаление возникает также в нижних слоях слизистой оболочки и сопровождается заметной потерей (атрофией) нормальных оксинтических желез. Наблюдение предполагает, что желудок гипохлоргидный, но не ахлоргидный. Секреция кислоты нарушается из-за потери париетальных клеток. Тяжелый атрофический гастрит тела (D): хроническое воспаление слабое, но все кислородные железы полностью исчезли.В правом нижнем углу возникают некоторые очаги кишечной метаплазии. Желудок определенно не содержит кислоты (ахлоргидрат). Пациент подвержен риску мальабсорбции витамина B12, а также может быть нарушено всасывание микроэлементов (железа, кальция, магния и цинка).
Неатрофический гастрит (B): Легкое мононуклеарное воспаление наблюдается в верхнем слое (фовеолярной части) слизистой оболочки («поверхностный хронический гастрит»), как указано стрелками.Слой железы не поврежден, что свидетельствует о нормальной секреции кислоты, несмотря на гастрит. Умеренный атрофический гастрит в теле (C): Интенсивное хроническое мононуклеарное воспаление возникает также в нижних слоях слизистой оболочки и сопровождается заметной потерей (атрофией) нормальных оксинтических желез. Наблюдение предполагает, что желудок гипохлоргидный, но не ахлоргидный. Секреция кислоты нарушается из-за потери париетальных клеток. Тяжелый атрофический гастрит тела (D): хроническое воспаление слабое, но все кислородные железы полностью исчезли.В правом нижнем углу возникают некоторые очаги кишечной метаплазии. Желудок определенно не содержит кислоты (ахлоргидрат). Пациент подвержен риску мальабсорбции витамина B12, а также может быть нарушено всасывание микроэлементов (железа, кальция, магния и цинка). Патолог может столкнуться с трудностями при обнаружении бактерий Helicobacter pylori в подобных случаях, даже если атрофический гастрит имеет происхождение H. pylori . Вместо этого смешанная микробная флора (микробы, отличные от H.pylori ) часто встречается на поверхности слизистой оболочки в подобных случаях. Альциановый синий – PAS и модифицированные красители Гимза × 300.
Патолог может столкнуться с трудностями при обнаружении бактерий Helicobacter pylori в подобных случаях, даже если атрофический гастрит имеет происхождение H. pylori . Вместо этого смешанная микробная флора (микробы, отличные от H.pylori ) часто встречается на поверхности слизистой оболочки в подобных случаях. Альциановый синий – PAS и модифицированные красители Гимза × 300.
Слизистая оболочка антрального отдела. Нормальный (A): Нормальное количество антральных G-клеток с типичным «ореолом» встречается в области шеи пилорических желез (стрелки). Неатрофический хронический гастрит (B): мононуклеарное воспаление охватывает всю слизистую оболочку, создавая впечатление потери железы (атрофии). Атрофический гастрит от легкой до умеренной степени в антральном отделе (C): Воспаление относительно легкое, но большая часть пилорических желез утрачена и заменена метапластическими железами (IM), как указано стрелками.Тяжелый атрофический гастрит в антральном отделе (D): все пилорические железы отсутствуют, а вся слизистая оболочка «кишечно-кишечная». Воспаление слабое или самое большее умеренное. Также исчезают антральные G-клетки вместе с потерей нормальных пилорических желез. Следовательно, реакция обратной связи G-17 в физиологическом контроле секреции кислоты нарушается. HE и альциановый синий – пятна PAS × 300.
Воспаление слабое или самое большее умеренное. Также исчезают антральные G-клетки вместе с потерей нормальных пилорических желез. Следовательно, реакция обратной связи G-17 в физиологическом контроле секреции кислоты нарушается. HE и альциановый синий – пятна PAS × 300.
Средняя повозрастная распространенность тотального хронического гастрита и атрофического гастрита в биоптатах от ~ 500 последовательных эндоскопических финских амбулаторных пациентов в конце 80-х годов (больница Йорви, Эспоо, Финляндия).Средняя распространенность увеличивается с возрастом.
Утрата слизистых желез при атрофическом гастрите сменяется ростом новых незрелых железистых и эпителиальных элементов; то есть с железами кишечного типа («кишечная метаплазия (IM)»), напоминающими железы и эпителий в толстой и / или тонкой кишке, и / или с железами пилорического типа («псевдопилорическая метаплазия»), напоминающими пилорические железы и эпителий, из которых G-клетки (гастриновые клетки) исчезают. В рамках эволюции высокодифференцированные железы, эпителий и клетки разрушаются при атрофии (атрофический гастрит), а утраченные железы заменяются железами и эпителием с незрелыми кишечными свойствами [2, 5, 6, 7, 14, 17, 23 , 24, 27, 28].и приведем несколько примеров этих явлений при патологии эндоскопической биопсии.
В рамках эволюции высокодифференцированные железы, эпителий и клетки разрушаются при атрофии (атрофический гастрит), а утраченные железы заменяются железами и эпителием с незрелыми кишечными свойствами [2, 5, 6, 7, 14, 17, 23 , 24, 27, 28].и приведем несколько примеров этих явлений при патологии эндоскопической биопсии.
Первые проявления гастрита H. pylori этиологии имеют тенденцию к антральному, т.е. гастрит «преобладает в антральном отделе» [25, 27]. Воспаление, состоящее в основном из мононуклеарных воспалительных клеток и плазматических клеток, является «поверхностным» и занимает верхние слои слизистой оболочки, особенно в теле () [2, 20, 27, 28, 29]. Хроническое воспаление связано с нейтрофильным воспалением (), причем интенсивность этого острого и «активного» компонента гастрита, скорее всего, зависит от цитотоксичности H.pylori [22, 30]. Чем цитотоксичнее штамм, тем активнее и, очевидно, агрессивнее хронический гастрит. Наиболее агрессивными формами хронического гастрита являются те, которые с наибольшей вероятностью приводят к запущенным стадиям атрофического гастрита, т. Е. Представляют собой формы гастрита H. pylori с наибольшей вероятностью прогрессирования до конечной стадии атрофии [5, 6].
Е. Представляют собой формы гастрита H. pylori с наибольшей вероятностью прогрессирования до конечной стадии атрофии [5, 6].
Годовой риск прогрессирования хронического гастрита от одной стадии к другой оценивается в среднем в 2–3% [16, 20, 23, 27].Предполагается, что около 50% пациентов с хроническим гастритом (и инфекцией H. pylori ) в течение жизни заболеют атрофическим гастритом той или иной степени тяжести [27]. Примерно у 5% инфицированных атрофический гастрит переходит в тяжелую и запущенную стадию [23, 27].
Медленное расширение гастрита H. pylori с чисто антрального фенотипа до форм, поражающих также тело и глазное дно («атрофический пангастрит», мультифокальный атрофический гастрит »или« гастрит с преобладанием тела »), как правило, является обычным явлением [ 7, 15, 19, 21, 23, 27, 31].Это проксимальное (пилорокардиальное) распространение и постепенное обострение атрофического гастрита связаны с заметными изменениями морфологии и функции слизистой оболочки желудка. Эти поражения нарушают функции желудка, вызывая, в частности, нарушения секреции соляной кислоты и внутреннего фактора кислородными железами при атрофии тела, а также нарушения синтеза и секреции гастрина-17 антральными G-клетками при антральной атрофии [23, 27, 32, 33, 34].
Эти поражения нарушают функции желудка, вызывая, в частности, нарушения секреции соляной кислоты и внутреннего фактора кислородными железами при атрофии тела, а также нарушения синтеза и секреции гастрина-17 антральными G-клетками при антральной атрофии [23, 27, 32, 33, 34].
Тяжелый атрофический гастрит, который строго ограничен одним антральным отделом, очевидно, довольно редок.С другой стороны, развитая атрофия, которая возникает только в теле тела или одновременно занимает антральный и корпусный отделы, является относительно частым фенотипом хронического гастрита (до 5% людей с гастритом), по крайней мере, в Северной Европе [ 27, 31, 35]. Долгосрочные исследования показывают, что наряду с увеличением гастрита H. pylori вверх слизистая оболочка антрального отдела может даже зажить [20, 23, 27].
Из-за потери кислородных желез и париетальных клеток при атрофии тела, распространение атрофического гастрита на тело и глазное дно приводит к пожизненной и постоянной гипо- или ахлоргидрии. Впоследствии из-за низкой внутрижелудочной кислотности первоначальная инфекция H. pylori может, в свою очередь, спонтанно исчезнуть и, наконец, вылечить в случаях прогрессирующей атрофии, что продемонстрировано серологическими тестами в последующих наблюдениях [29, 36]. .
Впоследствии из-за низкой внутрижелудочной кислотности первоначальная инфекция H. pylori может, в свою очередь, спонтанно исчезнуть и, наконец, вылечить в случаях прогрессирующей атрофии, что продемонстрировано серологическими тестами в последующих наблюдениях [29, 36]. .
По мере прогрессирования хронического неатрофического гастрита до атрофических фенотипов, потенциально запускаются многочисленные случайные патогенетические процессы, даже канцерогенные, что является явлением в sc. «Каскад корреа» может, наконец, способствовать процессам, связывающим хронический гастрит с такими крайними последствиями, как рак [1, 7, 35, 37, 38, 39, 40, 41].Это можно проиллюстрировать на примере.
Схема естественного течения и прогрессирования гастрита Helicobacter pylori от неатрофической формы до злокачественного новообразования желудка (sc. Correa cascade). Некоторые потенциально патогенетические факторы и механизмы, связанные с канцерогенезом, играют определенную роль и запускаются поэтапно в течение и прогрессирования каскада.
Эпидемиология и феномен рождения когорты
Наблюдения, полученные в результате популяционных исследований хронического гастрита, могут помочь в некоторых фундаментальных выводах относительно эпидемиологии хронического гастрита и его последствий.
Хронический гастрит по-прежнему является относительно распространенным заболеванием, даже в развитых странах, даже несмотря на то, что его распространенность заметно снизилась, причем это снижение идет параллельно со снижением распространенности H. pylori [42, 43]. Вполне возможно, что практически каждый человек, даже в развитых странах, около 100 лет назад болел гастритом H. pylori , тогда как в настоящее время распространенность в среднем составляет менее 50%.
H. pylori гастрит в большинстве случаев приобретается в раннем детстве, тогда фенотип гастрита представляет собой безвредное и бессимптомное простое хроническое мононуклеарное («поверхностное») воспаление [25, 29]. Тяжелые симптоматические последствия хронического гастрита проявятся только в последние десятилетия жизни и, как правило, возникают у пациентов с поздними стадиями поражения [1, 39, 43].
Тяжелые симптоматические последствия хронического гастрита проявятся только в последние десятилетия жизни и, как правило, возникают у пациентов с поздними стадиями поражения [1, 39, 43].
После открытия H. pylori стало очевидно, что понимание эпидемиологии инфекции H. pylori является ключом к пониманию эпидемиологии хронического гастрита и его последствий. Поскольку хронический гастрит и его последствия (язвенная болезнь желудка и рак желудка) изначально были пандемической бактериальной инфекцией у детей, эпидемиологические характеристики хронического гастрита соответствуют тем же «пандемическим» принципам, что и H.pylori сама по себе.
Социально-экономические факторы и гигиена окружающей среды неизбежно являются наиболее важными фоновыми факторами передачи инфекции H. pylori во всем мире, причем эти социально-экономические факторы также являются фоновыми факторами в эпидемиологии хронического гастрита и его последствий [43, 44, 45] . Социально-экономический статус в детстве, экологическая и семейная гигиена, плотность домохозяйства, привычки приготовления пищи и т. Д. Являются вероятными факторами, которые определяют вероятность приобретения H.pylori в детстве. Улучшение этих условий снижает вероятность заражения или дальнейшей передачи инфекции желудочно-оральным путем [46]. Снижение уровня инфицирования в детском возрасте на уровне семьи со временем неизбежно приведет к снижению распространенности гастрита H. pylori и его последствий в среднем среди всего населения.
Социально-экономический статус в детстве, экологическая и семейная гигиена, плотность домохозяйства, привычки приготовления пищи и т. Д. Являются вероятными факторами, которые определяют вероятность приобретения H.pylori в детстве. Улучшение этих условий снижает вероятность заражения или дальнейшей передачи инфекции желудочно-оральным путем [46]. Снижение уровня инфицирования в детском возрасте на уровне семьи со временем неизбежно приведет к снижению распространенности гастрита H. pylori и его последствий в среднем среди всего населения.
Из-за «педиатрического» происхождения инфекции H. pylori эпидемиология H.pylori гастрит лучше всего понять и понять как «феномен когорты рождения», как это проиллюстрировано компьютерным моделированием в [43]. Уровень инфицирования в детском возрасте и повозрастная распространенность гастрита H. pylori высоки в когортах «старых» новорожденных, рожденных на десятилетия раньше, чем распространенность в когортах «молодых» новорожденных, родившихся позже и у которых уровень инфицирования H.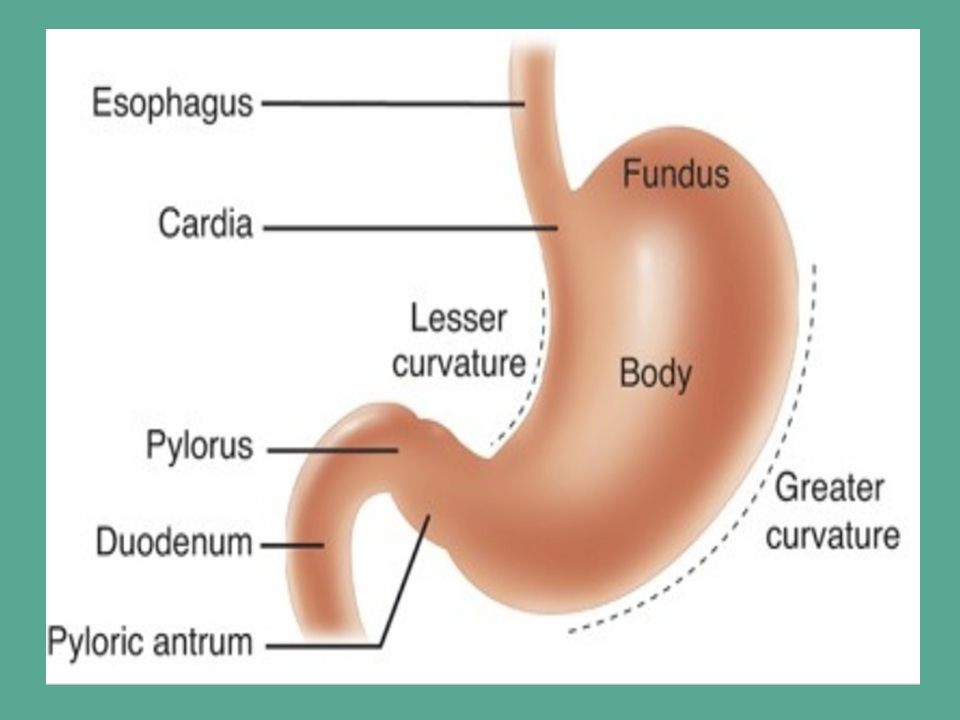 pylori в детстве низкий. Таким образом, средняя распространенность гастрита на популяционном уровне отражает среднее значение распространенности хронического гастрита в разных когортах рождения и средний показатель H.pylori в детском возрасте.
pylori в детстве низкий. Таким образом, средняя распространенность гастрита на популяционном уровне отражает среднее значение распространенности хронического гастрита в разных когортах рождения и средний показатель H.pylori в детском возрасте.
Компьютерное моделирование, демонстрирующее «феномен когорты рождения» в распространенности гастрита Helicobacter pylori в популяции, состоящей из когорт с разными годами рождения. Примерно на основании данных о гастрите в Финляндии примерно в конце 80-х годов (см.).
Эпидемиология заболеваемости раком желудка и эпидемиология смертности от рака желудка следуют принципам «феномена когорты рождения» и демонстрируют аналогичные глобальные «пандемические» характеристики, как и в случае с H.pylori гастрит [43]. Уровень заболеваемости раком желудка (или язвенной болезнью) был и будет низким в когортах «молодых» новорожденных, в которых частота гастрита H. pylori низкая и слизистая оболочка желудка остается здоровой на протяжении всей жизни. . Напротив, распространенность, заболеваемость и смертность от язвенной болезни или рака желудка высоки и остаются высокими в старых когортах, пока они живы.
. Напротив, распространенность, заболеваемость и смертность от язвенной болезни или рака желудка высоки и остаются высокими в старых когортах, пока они живы.
Аутоиммунный хронический гастрит
Хотя H.pylori , в конечном счете, является основной причиной (более чем в 90% случаев) гастрита, хронического мононуклеарного воспаления (гастрита) без продолжающейся инфекции H. pylori , но протекающего с тяжелым атрофическим гастритом тела и ахлоргидритом желудка. , и с сосуществованием аутоантител против париетальных клеток (протонная помпа) и / или внутреннего фактора, является хорошо установленным субъектом [3, 32, 47, 48, 49, 50]. Однако неясно, является ли этот гастрит «аутоиммунного» типа независимым заболеванием или H.pylori вызывает аутоиммунные реакции у некоторых ответственных лиц с обычной инфекцией H. pylori [3, 50, 51, 52]. Возможно, что первоначальная инфекция H. pylori может пройти спонтанно, когда атрофический гастрит перейдет в тяжелую атрофическую и ахлоргидрическую стадию, создавая, таким образом, ложное впечатление о чистой аутоиммунной этиологии заболевания.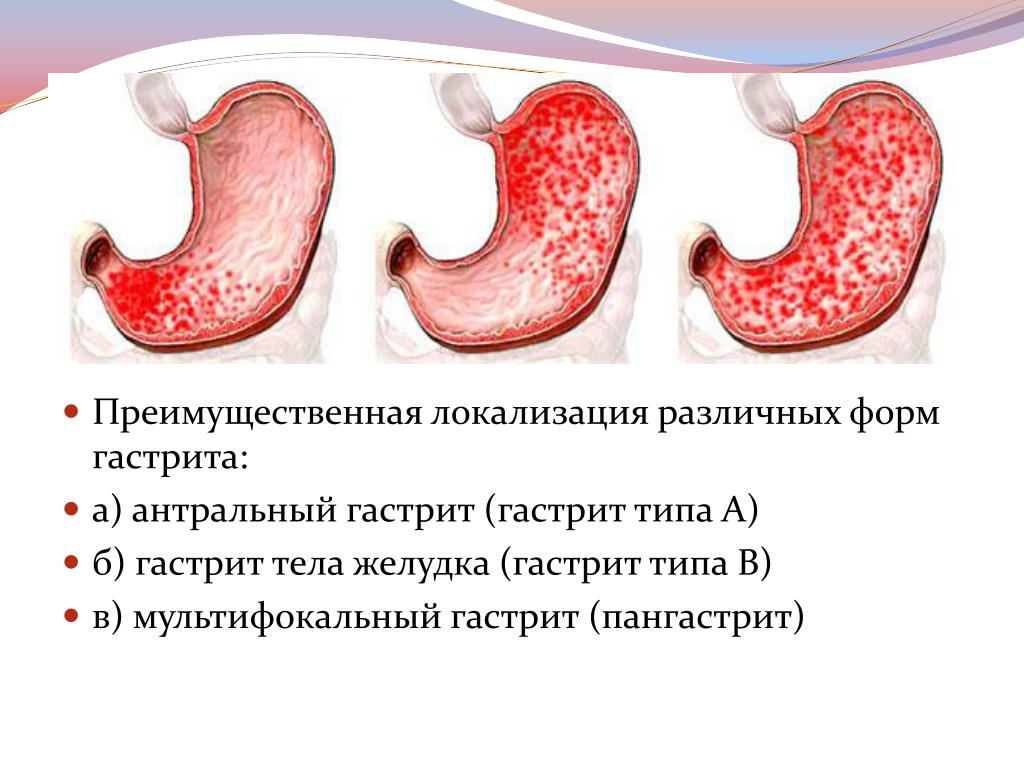
Гастрит, связанный с аутоиммунными явлениями, в любом случае может быть более прогрессирующим и более быстрым, чем чистый H.pylori гастрит [3, 23]. В связи с аутоиммунитетом и у лиц со склонностью к аутоиммунным заболеваниям (аутоиммунный тиреоидит, диабет и т. Д.) Прогрессирование гастрита H. pylori до атрофических фенотипов может быть заметно деструктивным, что может легко и быстро привести к ахлоргидрии и полная атрофия тела и дна желудка. В медицинской литературе описаны случаи тяжелого атрофического гастрита с аутоиммунными характеристиками и безкислотного желудка даже в детском возрасте.
Показано, что хронический гастрит аутоиммунного типа является рецессивным мультигенным заболеванием и, возможно, имеет североевропейское происхождение [32].
Влияние на физиологию желудка
Длительное (пожизненное) хроническое и активное воспаление не может быть безвредным и приведет к разрушению слизистой оболочки желудка посредством нескольких механизмов, которые могут взаимодействовать с обновлением, ростом, целостностью, дифференцировкой и функцией эпителия желудка [1, 24, 39, 53, 54]. Многочисленные аномальные экспрессии (повышающая и понижающая регуляция) функциональных и регуляторных генов, генные мутации, эпигенетические изменения, различные проявления цитокинов или факторов роста тканей происходят в регуляторных тканевых процессах слизистой оболочки желудка и эпителиальных клеток в связи с H. pylori. гастрит [53, 54]. Некоторые изменения являются обратными, могут проявляться даже на ранних стадиях воспаления, но могут особенно накапливаться со временем в предраковых состояниях, таких как атрофия и IM, и, по-видимому, чрезвычайно распространены и разнообразны при предраковых (дисплазия или интраэпителиальная неоплазия) и злокачественных новообразованиях. поражения [53, 54].
Многочисленные аномальные экспрессии (повышающая и понижающая регуляция) функциональных и регуляторных генов, генные мутации, эпигенетические изменения, различные проявления цитокинов или факторов роста тканей происходят в регуляторных тканевых процессах слизистой оболочки желудка и эпителиальных клеток в связи с H. pylori. гастрит [53, 54]. Некоторые изменения являются обратными, могут проявляться даже на ранних стадиях воспаления, но могут особенно накапливаться со временем в предраковых состояниях, таких как атрофия и IM, и, по-видимому, чрезвычайно распространены и разнообразны при предраковых (дисплазия или интраэпителиальная неоплазия) и злокачественных новообразованиях. поражения [53, 54].
Атрофия тела в конечном итоге приводит к нарушению секреции соляной кислоты и внутреннего фактора [23, 34]. В бескислотном и атрофическом желудке из-за нарушения секреции внутреннего фактора всасывание основных витаминов, таких как витамин B12, серьезно нарушено [55]. Мальабсорбция и последующий длительный и постоянный дефицит витамина B12 могут нарушать метаболизм метионина, гомоцистеина или фолиевой кислоты и, таким образом, могут быть механизмом, который способствует появлению эпигенетических повреждений ДНК из-за нарушения функции цикла метилирования в эпителиальных клетках.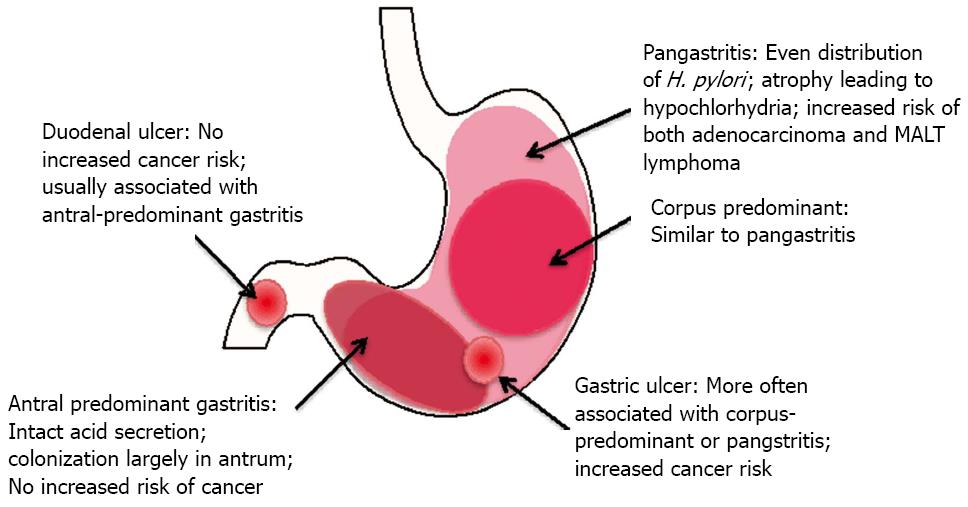 клетки [55, 56].
клетки [55, 56].
Диетический метаболизм и всасывание питательных микроэлементов, таких как железо, кальций, магний и цинк, или всасывание некоторых лекарств (например, дипиридамола, некоторых препаратов железа и противогрибковых препаратов, таких как флуконазол или итраконазол, тироксин и атазановир) нарушаются из-за кислоты свободный желудок тоже [57]. Бескислотный желудок в конечном итоге заселяется микробной флорой изо рта [58]. Микробы и бескислотный желудок способны продуцировать канцерогены класса 1, такие как ацетальдегид и нитрозоамины [39, 59].
Рак и язвенная болезнь
Рак желудка и язвенная болезнь (исключая язвы, вызванные приемом НПВП) являются наиболее серьезными заболеваниями, связанными с хроническим гастритом H. pylori [60, 61, 62, 63, 64, 65]. Успешная ликвидация H. pylori предотвращает рецидивы язвы, но также может предотвратить рак [66, 67].
Несмотря на ассоциации пептических язв и рака с гастритом H. pylori , эти связи также существенно различаются [62, 68]. Пептические язвы двенадцатиперстной кишки (ЯД) обычно возникают у людей с неатрофическим гастритом H. pylori , но нечасты или отсутствуют у субъектов, у которых гастрит прогрессировал до атрофических форм в теле и у которых желудок впоследствии стал хлоргидридным ( ). С другой стороны, язвы желудка часто связаны с фенотипами гастрита, при которых выраженная атрофия и IM возникают в антральном отделе и режущей кромке, и в этих случаях слизистая оболочка тела может быть даже слегка атрофичной, но никогда не бывает сильно атрофированной (и желудок бывает атрофичным). никогда не ахлоргидный) [62].Рак желудка, в частности кишечного типа, наблюдается у пациентов с гипохлоргидритом или ахлоргидридом желудка и, в частности, может возникать у субъектов с поздними стадиями атрофии и IM как в антральном отделе, так и в теле [39, 69].
Пептические язвы двенадцатиперстной кишки (ЯД) обычно возникают у людей с неатрофическим гастритом H. pylori , но нечасты или отсутствуют у субъектов, у которых гастрит прогрессировал до атрофических форм в теле и у которых желудок впоследствии стал хлоргидридным ( ). С другой стороны, язвы желудка часто связаны с фенотипами гастрита, при которых выраженная атрофия и IM возникают в антральном отделе и режущей кромке, и в этих случаях слизистая оболочка тела может быть даже слегка атрофичной, но никогда не бывает сильно атрофированной (и желудок бывает атрофичным). никогда не ахлоргидный) [62].Рак желудка, в частности кишечного типа, наблюдается у пациентов с гипохлоргидритом или ахлоргидридом желудка и, в частности, может возникать у субъектов с поздними стадиями атрофии и IM как в антральном отделе, так и в теле [39, 69].
Относительный риск язвенной болезни (двенадцатиперстной кишки или желудка) или рака желудка при различных фенотипах хронического атрофического Helicobacter pylori гастрита. Риски представлены как относительные риски по сравнению с рисками у субъектов с нормальной и здоровой слизистой оболочкой желудка (категория N / N; желтый).Риски экстраполируются и оцениваются на основе исследования случай-контроль, проведенного в Финляндии в 80-х годах [69]. Обратите внимание, что риски язвенной болезни и рака желудка связаны с очень разными фенотипами хронического гастрита.
Риски представлены как относительные риски по сравнению с рисками у субъектов с нормальной и здоровой слизистой оболочкой желудка (категория N / N; желтый).Риски экстраполируются и оцениваются на основе исследования случай-контроль, проведенного в Финляндии в 80-х годах [69]. Обратите внимание, что риски язвенной болезни и рака желудка связаны с очень разными фенотипами хронического гастрита.
Канцерогенез желудка неоднороден и чрезвычайно разнообразен на молекулярном уровне [53, 54]. Несмотря на то, что генных ошибок много, никаких специфических или всеобъемлющих молекулярных маркеров, генных ошибок или мутаций при раке или предраковых поражениях пока не обнаружено.Хотя два основных гистологических типа рака желудка, кишечный и диффузный, являются значимыми сущностями с клинической и морфологической точки зрения, и оба связаны с предшествующим или сосуществующим гастритом H. pylori , эти типы могут не быть полностью разными сущностями. . При диффузном типе фоновой морфологией часто является неатрофический гастрит H. pylori , что указывает на то, что канцерогенные механизмы при этом типе рака могут быть более тесно связаны с воспалением, чем с механизмами, которые появляются при атрофическом гастрите или кислоте. свободный желудок [37, 38].С другой стороны, при типе рака кишечника явные опухоли или предраковые поражения часто связаны с гипохлоргидритом желудка, выраженным атрофическим гастритом и обширным ИМ в подлежащей слизистой оболочке [37, 38, 70, 71]. Следовательно, канцерогенные процессы при этом типе рака могут быть связаны с механизмами, которые возникают при атрофическом гастрите или запускаются гипохлоргидридом или бескислотным желудком.
pylori , что указывает на то, что канцерогенные механизмы при этом типе рака могут быть более тесно связаны с воспалением, чем с механизмами, которые появляются при атрофическом гастрите или кислоте. свободный желудок [37, 38].С другой стороны, при типе рака кишечника явные опухоли или предраковые поражения часто связаны с гипохлоргидритом желудка, выраженным атрофическим гастритом и обширным ИМ в подлежащей слизистой оболочке [37, 38, 70, 71]. Следовательно, канцерогенные процессы при этом типе рака могут быть связаны с механизмами, которые возникают при атрофическом гастрите или запускаются гипохлоргидридом или бескислотным желудком.
Риск рака
Атрофический гастрит и бескислотный желудок являются наиболее важными независимыми состояниями риска рака желудка, известными на сегодняшний день.Статистически атрофический гастрит представляет собой более высокий риск рака, чем инфекция H. pylori в чистом виде [69]. Вероятность рака желудка при гастрите возрастает экспоненциально с прогрессированием гастрита H. pylori из неатрофической формы в атрофическую [69]. Риск может возрасти даже до 90 раз у пациентов с тяжелым атрофическим гастритом как антрального отдела, так и тела (тяжелая панатрофия; мультифокальный атрофический гастрит (MAG)) по сравнению с риском рака у пациентов с нормальной и здоровой слизистой оболочкой желудка () [69] .
pylori из неатрофической формы в атрофическую [69]. Риск может возрасти даже до 90 раз у пациентов с тяжелым атрофическим гастритом как антрального отдела, так и тела (тяжелая панатрофия; мультифокальный атрофический гастрит (MAG)) по сравнению с риском рака у пациентов с нормальной и здоровой слизистой оболочкой желудка () [69] .
Риск рака значительно ниже у людей без гастрита H. pylori , то есть у людей со здоровой слизистой оболочкой желудка. Риск увеличивается примерно в два раза у пациентов с чистой инфекцией H. pylori , т.е. у пациентов с неатрофическим гастритом H. pylori [60, 61, 69]. Таким образом, у пациентов с DU, которые обычно имеют неатрофический гастрит H. pylori , риск рака немного выше, чем риск рака у здоровых субъектов, но этот риск, тем не менее, все еще очень низок по сравнению с риском рака. у пациентов с тяжелым и запущенным атрофическим гастритом (см.).
Парадоксально, но нагрузка на слизистую оболочку желудка хеликобактериями обычно высока у субъектов с относительно низким риском рака, как и у обычных пациентов с ЯН. Как это ни парадоксально, нагрузка имеет тенденцию уменьшаться, когда повышается риск рака, как это имеет место у пациентов с далеко зашедшим атрофическим гастритом [69]. Риск рака может быть, например, высоким у субъектов с тяжелым атрофическим гастритом и бескислотным желудком, у которых может даже не быть объективных признаков продолжающегося H.pylori , то есть у пациентов, у которых, возможно, исчезла первоначальная инфекция H. pylori .
Как это ни парадоксально, нагрузка имеет тенденцию уменьшаться, когда повышается риск рака, как это имеет место у пациентов с далеко зашедшим атрофическим гастритом [69]. Риск рака может быть, например, высоким у субъектов с тяжелым атрофическим гастритом и бескислотным желудком, у которых может даже не быть объективных признаков продолжающегося H.pylori , то есть у пациентов, у которых, возможно, исчезла первоначальная инфекция H. pylori .
Сиднейская система и оперативное звено по классификации гастритов
Признание того, что инфекция H. pylori и последующий атрофический гастрит и отсутствие кислоты в желудке являются важными фоновыми состояниями рака желудка, позволяет сортировать пациентов в клинической практике по значимым группы относительно риска рака. Эта сортировка требует обследования субъектов с помощью эндоскопии и эндоскопической биопсии или может быть проведена с помощью неинвазивных анализов крови с использованием биомаркеров, специфичных для желудка [72, 73, 74, 75, 76, 77].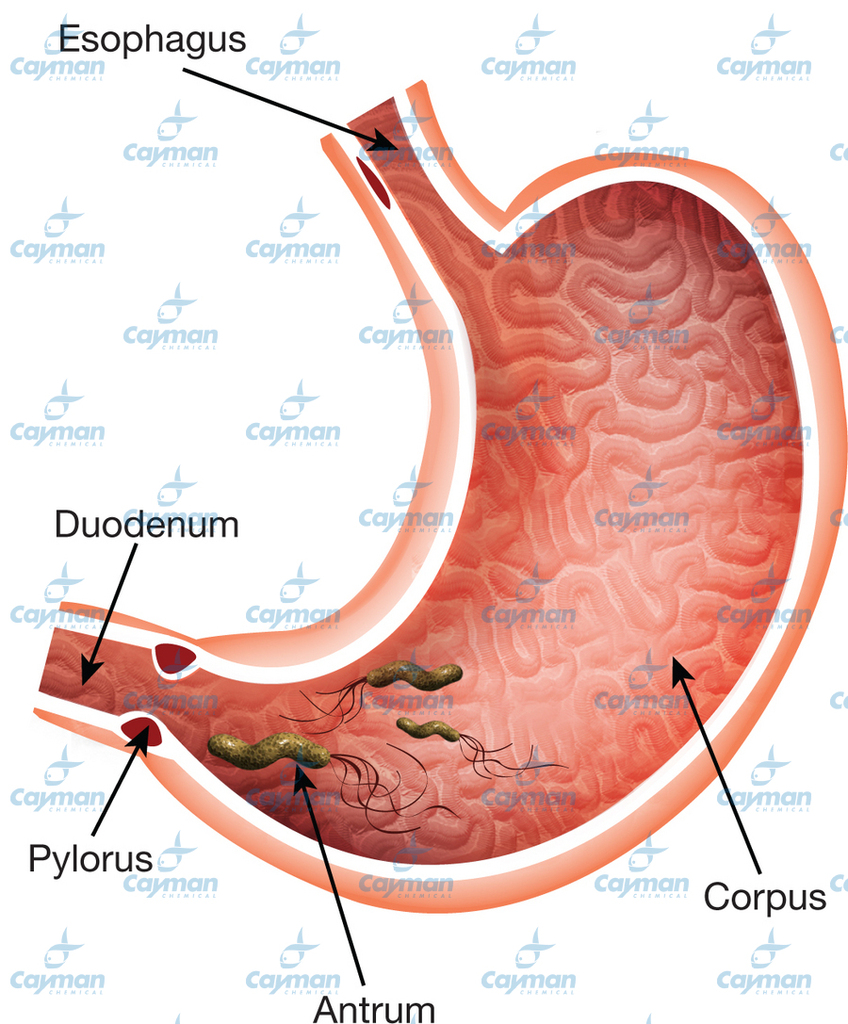
Сиднейская система и ее обновление являются руководящими принципами для интерпретации микроскопических проявлений биоптатов в практике эндоскопии [5, 6]. Надлежащий протокол биопсии и правильное считывание результатов биопсии под микроскопом являются фундаментальными требованиями для правильного и успешного разделения пациентов на клинически значимые группы риска [78, 79]. Такие классификации или родословные невозможны только с помощью эндоскопии или не могут быть выполнены с помощью тестирования H.pylori отдельно.
Стадия OLGA / OLGIM (Оперативная ссылка на гастрит / оценка IM) атрофического гастрита представляет собой практическую схему классификации пациентов в группы низкого, среднего и высокого риска рака желудка [79]. Эта классификация делит пациентов на пять подгрупп (0 – IV) с сильно различающейся вероятностью развития или заболеть раком желудка (). Классификация и сортировка могут объективно подсказать, какой из пациентов будет нуждаться в большинстве случаев эндоскопического наблюдения и последующего наблюдения [79, 80].
OLGA: стадия риска рака желудка. Изменено из статьи Рагге и др. [79]. Определение стадии – это практический инструмент для разделения пациентов на группы высокого (III – IV стадии) и низкого (0 – II стадии) риска рака, в частности рака желудка кишечного типа. Определение стадии требует эндоскопии и надлежащей практики биопсии, но также может быть выполнено неинвазивно с помощью анализа крови с применением определенных биомаркеров (пепсиноген I и II, гастрин-17 и серология Helicobacter pylori ), которые отражают функцию (секреция кислоты) и структура слизистой оболочки антрального отдела и тела в плазме / сыворотке крови.
Разделение субъектов на подкатегории OLGA может быть выполнено также неэндоскопически и неинвазивно с помощью простых анализов крови, основанных на оценке уровней биомаркеров, специфичных для желудка (пепсиногены I и II, гастрин-17 и H. pylori ) в плазме / сыворотке крови [72, 73, 74, 77, 80]. Это невозможно сделать с помощью одного теста H.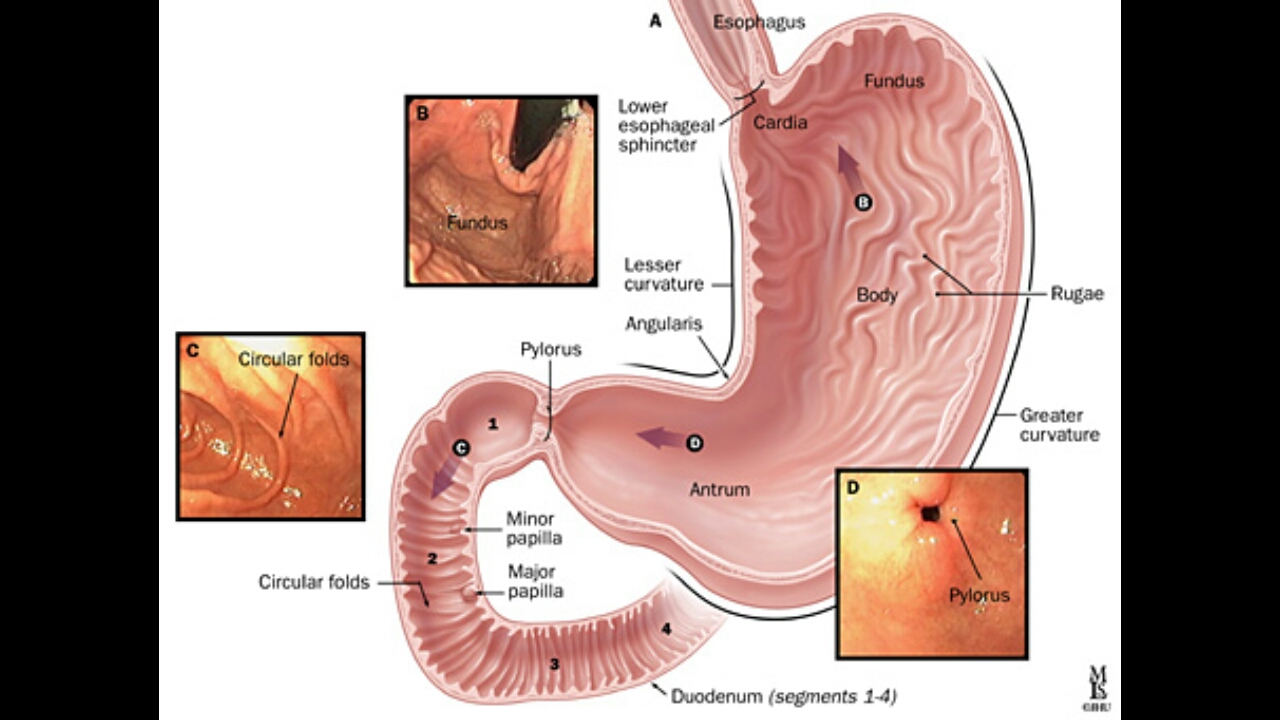 pylori .
pylori .
Плазменные биомаркеры в диагностике и скрининге атрофического гастрита
Очистка желудочных пепсиногенов в 70-е годы, понимание естественного течения H.pylori , уникальные инновации в методах вертикального измерения микропланшетов и разработка тестов ELISA со специфическими моноклональными антителами предоставили приложения для использования желудочных биомаркеров в неинвазивной диагностике и скрининге атрофического гастрита на основе простого образца крови [81, 82, 83 ]. В настоящее время эти анализы крови надежно могут быть выполнены в любой лаборатории и не требуют специальных мероприятий. Несколько подробных и всесторонних обзоров, согласованных отчетов и руководств по практическому использованию тестов на биомаркеры в диагностике атрофического гастрита были опубликованы ранее в этом и других медицинских журналах (см. Ссылки [72, 80, 84]).
Несколько коммерческих радиоиммуноанализов и тестов ELISA были доступны для пепсиногена 1 и 2 в течение довольно долгого времени. Однако у этих тестов есть ограничения, поскольку они могут использоваться только для диагностики атрофического гастрита тела [74]. Уровни пепсиногенов 1 и 2 в сыворотке крови не указывают на возможный атрофический гастрит в антральном отделе желудка, где, однако, сначала появляются атрофические и метапластические изменения. Более полный тест (GastroPanel®) включает анализ уровней G-17 в плазме в дополнение к анализам пепсиногена 1 и пепсиногена 2, а также включает анализ H.pylori серологический тест. Эта тестовая панель позволяет оценить атрофию также в антральном отделе желудка и дает намёки на внутрижелудочную кислотность в дополнение к информации о возможной атрофии тела, что делает возможной всестороннюю классификацию OLGA [72, 73, 77, 78, 80].
Однако у этих тестов есть ограничения, поскольку они могут использоваться только для диагностики атрофического гастрита тела [74]. Уровни пепсиногенов 1 и 2 в сыворотке крови не указывают на возможный атрофический гастрит в антральном отделе желудка, где, однако, сначала появляются атрофические и метапластические изменения. Более полный тест (GastroPanel®) включает анализ уровней G-17 в плазме в дополнение к анализам пепсиногена 1 и пепсиногена 2, а также включает анализ H.pylori серологический тест. Эта тестовая панель позволяет оценить атрофию также в антральном отделе желудка и дает намёки на внутрижелудочную кислотность в дополнение к информации о возможной атрофии тела, что делает возможной всестороннюю классификацию OLGA [72, 73, 77, 78, 80].
Антральный атрофический гастрит (потеря антральных желез) сопровождается потерей антральных G-клеток, потеря которых приводит к низким уровням в плазме как натощак, так и стимулированного гастрина-17 (после питья протеинового порошка, стимуляции бомбезином (гастрином).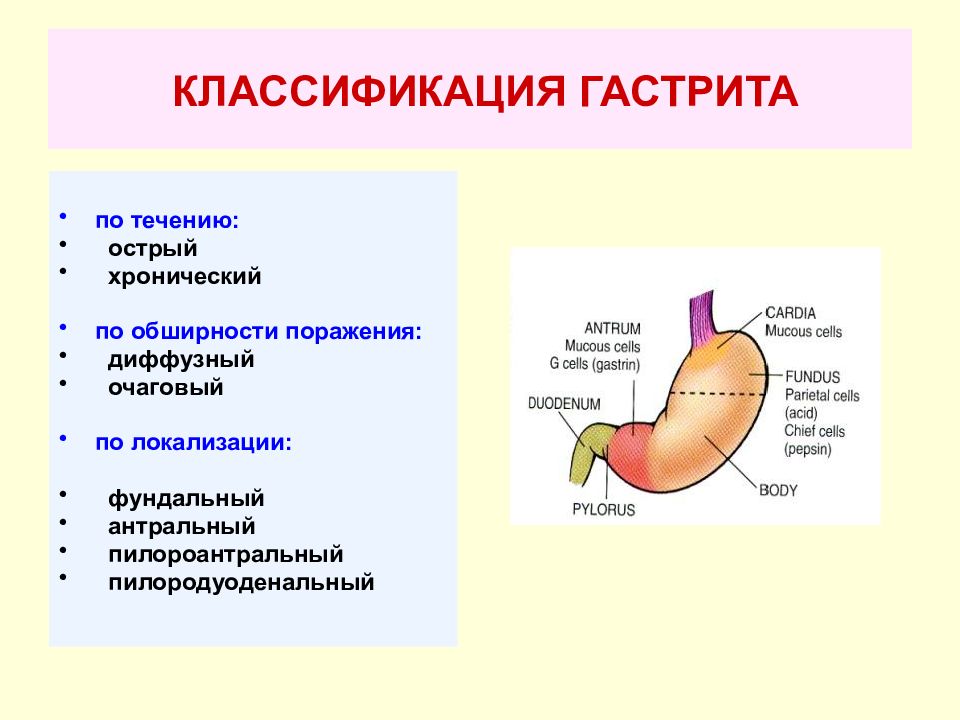 высвобождающий пептид) или стимуляция ингибитором протонной помпы (ИПП)).Низкий уровень G-17 в плазме натощак (1 пмоль / л или меньше) на практике указывает на два варианта. Либо имеется развитый атрофический гастрит в антральном отделе (класс III – IV по OLGA), либо низкий уровень G-17 является результатом высокой внутрижелудочной кислотности (низкий pH). Оба варианта являются показаниями для верхней ги-эндоскопии из-за риска рака из-за возможной атрофии антрального отдела и из-за риска язвенной болезни из-за гиперхлоргидрии (выделения с высоким содержанием кислоты) (см.)
высвобождающий пептид) или стимуляция ингибитором протонной помпы (ИПП)).Низкий уровень G-17 в плазме натощак (1 пмоль / л или меньше) на практике указывает на два варианта. Либо имеется развитый атрофический гастрит в антральном отделе (класс III – IV по OLGA), либо низкий уровень G-17 является результатом высокой внутрижелудочной кислотности (низкий pH). Оба варианта являются показаниями для верхней ги-эндоскопии из-за риска рака из-за возможной атрофии антрального отдела и из-за риска язвенной болезни из-за гиперхлоргидрии (выделения с высоким содержанием кислоты) (см.)
Отсутствие антител к H. pylori одновременно с наличием нормальных уровней пепсиногена 1 в плазме, нормальным соотношением пепсиногена 1 к пепсиногену 2 и нормальным гастрином-17 в плазме при условии, что возможное лечение ИПП находится под контролем, это результат теста, который достоверно свидетельствует о наличии нормальной и здоровой слизистой оболочки желудка (класс 0 по OLGA).Риск рака и язвенной болезни у таких «здоровых» людей крайне низок, практически нулевой. С другой стороны, риск рака желудка высок (класс III-IV по OLGA) у субъектов с низким уровнем пепсиногена 1 натощак (менее 30 мкг / л), с низким соотношением пепсиногена 1 к пепсиногену 2 (ниже 3 ) и с высоким содержанием гастрина-17 натощак (выше 7 пмоль / л), риск рака у этих пациентов высок независимо от того, есть ли у пациента текущая инфекция H. pylori (см.) [72, 80].Атрофический гастрит в этих случаях является развитым и обширным, занимает всю слизистую оболочку желудка (класс IV по OLGA), при этом желудок не содержит кислоты.
С другой стороны, риск рака желудка высок (класс III-IV по OLGA) у субъектов с низким уровнем пепсиногена 1 натощак (менее 30 мкг / л), с низким соотношением пепсиногена 1 к пепсиногену 2 (ниже 3 ) и с высоким содержанием гастрина-17 натощак (выше 7 пмоль / л), риск рака у этих пациентов высок независимо от того, есть ли у пациента текущая инфекция H. pylori (см.) [72, 80].Атрофический гастрит в этих случаях является развитым и обширным, занимает всю слизистую оболочку желудка (класс IV по OLGA), при этом желудок не содержит кислоты.
Будущие тенденции и инициатива в отношении здорового желудка
Несмотря на то, что гастрит H. pylori сокращается по распространенности, хронический гастрит по-прежнему будет чрезвычайно частым заболеванием во всем мире в течение нескольких будущих десятилетий. В связи с микробным происхождением и инфекционным фоном, а также знаниями эпидемиологии и естественным течением хронического H.pylori , можно предположить, что это заболевание может окончательно исчезнуть из общества вместе с улучшениями в гигиене и социально-экономическом развитии.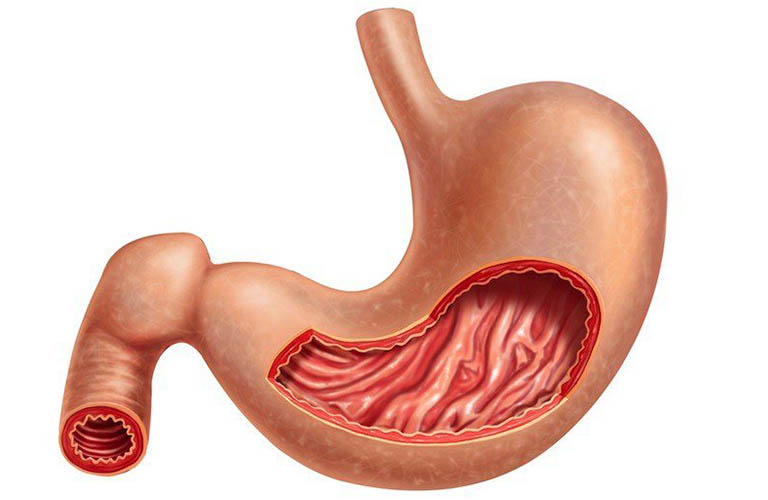 Благодаря этим улучшениям риск заражения H. pylori в детстве снизится. Как и в случае с туберкулезом, хронический гастрит может в ближайшие десятилетия отойти на периферию медицинской практики и значимости, по крайней мере, в развитых странах. Следовательно, пептические язвы будут редкими, а рак желудка станет редким злокачественным новообразованием.
Благодаря этим улучшениям риск заражения H. pylori в детстве снизится. Как и в случае с туберкулезом, хронический гастрит может в ближайшие десятилетия отойти на периферию медицинской практики и значимости, по крайней мере, в развитых странах. Следовательно, пептические язвы будут редкими, а рак желудка станет редким злокачественным новообразованием.
Среди самых молодых коренных жителей в когортах в западных странах около 90–100% людей уже сейчас имеют и будут иметь нормальный здоровый желудок на протяжении всей жизни, в результате чего в конечном итоге у подавляющего большинства людей есть здоровый желудок и, следовательно, не подвержены риску развития язвенной болезни или рака желудка. Попытки сохранить или получить здоровый желудок для всех будут инициативой и целью как будущих исследований, так и клинической практики («инициатива здорового желудка»; см .: www.hsinitiative.org).
Благодарности
Декларация интересов : Доктор Пентти Сиппонен является акционером и членом научного комитета Biohit Oyj. Компания разрабатывает и продает лабораторные тесты, в основном, на желудочно-кишечные заболевания.
Компания разрабатывает и продает лабораторные тесты, в основном, на желудочно-кишечные заболевания.
Ссылки
- IARC Шистосомы, печеночные двуустки и Helicobacter pylori. Рабочая группа МАИР по оценке канцерогенных рисков для людей. Лион, 7-14 июня 1994 г. IARC Monogr Eval Carcinog Risks Hum.1994; 61: 1–241. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Шиндлер Р. Хронический гастрит. Klin Wochenschr. 1966; 44: 601–12. [PubMed] [Google Scholar]
- Сирала М. История гастрита. Scand J Gastroenterol Suppl. 1991; 186: 1–3. [PubMed] [Google Scholar]
- Telaranta-Keerie A, Kara R, Paloheimo L, Härkönen M, Sipponen P. Распространенность недиагностированного прогрессирующего атрофического гастрита тела в Финляндии: обсервационное исследование среди 4256 добровольцев без особых жалоб.Сканд Дж Гастроэнтерол. 2010; 45: 1036–41. [PubMed] [Google Scholar]
- Price AB. Сиднейская система: гистологическое деление. J Gastroenterol Hepatol. 1991; 6: 209–22.
 [PubMed] [Google Scholar]
[PubMed] [Google Scholar] - Диксон М.Ф., Гента Р.М., Ярдли Дж. Х., Корреа П. Классификация и классификация гастрита. Обновленная Сиднейская система. Международный семинар по гистопатологии гастрита, Хьюстон, 1994. Am J Surg Pathol. 1996; 20: 1161–81. [PubMed] [Google Scholar]
- Корреа П. Хронический гастрит: клинико-патологическая классификация.Am J Gastroenterol. 1988; 83: 504–9. [PubMed] [Google Scholar]
- Маршалл Б.Дж., Уоррен-младший. Неопознанные изогнутые бациллы в желудке больных гастритом и язвенной болезнью. Ланцет. 1984; 323: 1311–15. [PubMed] [Google Scholar]
- Варис К. Семья поведения при хроническом гастрите. Ann Clin Res. 1981; 13: 123–9. [PubMed] [Google Scholar]
- Валле Дж., Сеппала К., Сиппонен П., Косунен Т. Исчезновение гастрита после искоренения Helicobacter pylori. Морфометрическое исследование.Сканд Дж Гастроэнтерол. 1991; 26: 1057–65. [PubMed] [Google Scholar]
- Ходзё М., Мива Х., Окуса Т., Окура Р., Куросава А.
 , Сато Н. Изменение гистологического гастрита после излечения от инфекции Helicobacter pylori. Алимент Pharmacol Ther. 2002; 16: 1923–32. [PubMed] [Google Scholar]
, Сато Н. Изменение гистологического гастрита после излечения от инфекции Helicobacter pylori. Алимент Pharmacol Ther. 2002; 16: 1923–32. [PubMed] [Google Scholar] - Аннибале Б., Ди Джулио Е., Каруана П., Ланер Е., Капурсо Г., Борди С. и др. Долгосрочные эффекты лечения инфекции Helicobacter pylori у пациентов с атрофическим гастритом тела. Алимент Pharmacol Ther. 2002; 16: 1723–31.[PubMed] [Google Scholar]
- Arkkila PE, Seppälä K, Färkkilä MA, Veijola L, Sipponen P. Эрадикация Helicobacter pylori в лечении атрофического гастрита: перспективное исследование в течение одного года. Сканд Дж Гастроэнтерол. 2006; 41: 782–90. [PubMed] [Google Scholar]
- Сиурала М., Варис К., Вильясало М. Исследования пациентов с атрофическим гастритом: наблюдение через 10–15 лет. Сканд Дж Гастроэнтерол. 1966; 1: 40–8. [PubMed] [Google Scholar]
- Виллако К., Кекки М., Тамм А., Таммур Р., Сависаар Э., Вийрсалу В. и др.Эпидемиология и динамика гастрита в репрезентативной выборке городского населения Эстонии.
 Сканд Дж Гастроэнтерол. 1982; 17: 601–7. [PubMed] [Google Scholar]
Сканд Дж Гастроэнтерол. 1982; 17: 601–7. [PubMed] [Google Scholar] - Ихамаки Т., Кекки М., Сиппонен П., Сиурала М. Последствия и течение хронического гастрита во время контрольного биопсийного исследования в течение 30–34 лет. Сканд Дж Гастроэнтерол. 1985; 20: 485–91. [PubMed] [Google Scholar]
- Маарус Х.И., Виллако К.П., Сиппонен П., Кекки М., Сирала М., Таммур Р. и др. Helicobacter pylori и хронический гастрит в материале биопсии желудка в группе случайно выбранных взрослых жителей Эстонии.Арх Патол. 1990; 52: 9–11. [PubMed] [Google Scholar]
- Кекки М., Маарус Х.И., Сиппонен П., Уйбо Р., Таммур Р., Тамм А. и др. Степень колонизации Helicobacter pylori по отношению к гастриту: последующее шестилетнее популяционное исследование. Scand J Gastroenterol Suppl. 1991; 186: 142–50. [PubMed] [Google Scholar]
- Виллако К., Кекки М., Маарус Х.И., Сиппонен П., Уйбо Р., Таммур Р. и др. Хронический гастрит: прогрессирование воспаления и атрофии при шестилетнем эндоскопическом наблюдении за случайной выборкой из 142 городских жителей Эстонии.
 Scand J Gastroenterol Suppl. 1991; 186: 135–41. [PubMed] [Google Scholar]
Scand J Gastroenterol Suppl. 1991; 186: 135–41. [PubMed] [Google Scholar] - Валле Дж., Кекки М., Сиппонен П., Ихамаки Т., Сирала М. Долгосрочное течение и последствия гастрита, вызванного Helicobacter pylori. Результаты 32-летнего наблюдения. Сканд Дж Гастроэнтерол. 1996; 31: 546–50. [PubMed] [Google Scholar]
- Виллако К., Кекки М., Маарус Х.И., Сиппонен П., Таммур Р., Тамм А. и др. 12-летнее контрольное исследование хронического гастрита и Helicobacter pylori в случайной выборке из популяции. Сканд Дж Гастроэнтерол.1995; 30: 964–7. [PubMed] [Google Scholar]
- Маарус Х.И., Воробьева Т., Сиппонен П., Таммур Р., Уйбо Р., Вадстрём Т. и др. 18-летнее катамнестическое исследование связи хронического гастрита и Helicobacter pylori положительности CagA с развитием атрофии и активностью гастрита. Сканд Дж Гастроэнтерол. 1999; 34: 864–9. [PubMed] [Google Scholar]
- Сиурала М., Сиппонен П., Кекки М. Хронический гастрит: динамические и клинические аспекты. Scand J Gastroenterol Suppl.
 1985; 109: 69–76. [PubMed] [Google Scholar]
1985; 109: 69–76. [PubMed] [Google Scholar] - Сиппонен П., Кекки М., Сирала М.Сиднейская система: эпидемиология и естественная история хронического гастрита. J Gastroenterol Hepatol. 1991; 6: 244–51. [PubMed] [Google Scholar]
- Maaroos HI, Rägo T., Sipponen P, Siurala M. Helicobacter pylori и гастрит у детей с жалобами на брюшную полость. Сканд Дж Гастроэнтерол. 1991; 26: 95–9. [PubMed] [Google Scholar]
- Maaroos HI, Kekki M, Villako K, Sipponen P, Tamm A, Sadeniemi L. Частота и степень колонизации Helicobacter pylori и профили антрального и телесного гастрита в выборке населения Эстонии.Сканд Дж Гастроэнтерол. 1990; 25: 1010–17. [PubMed] [Google Scholar]
- Кекки М., Сирала М., Варис К., Сиппонен П., Систонен П., Неванлинна HR. Принципы классификации и генетика хронического гастрита. Scand J Gastroenterol Suppl. 1987. 141: 1–28. [PubMed] [Google Scholar]
- Ихамаки Т., Сиппонен П., Варис К., Кекки М., Сирала М. Характеристики слизистой оболочки желудка, предшествующие возникновению злокачественного новообразования желудка: результаты длительного наблюдения трех семейных образцов.
 Scand J Gastroenterol Suppl.1991; 186: 16–23. [PubMed] [Google Scholar]
Scand J Gastroenterol Suppl.1991; 186: 16–23. [PubMed] [Google Scholar] - Maaroos HI, Kekki M, Villako K, Sipponen P, Tamm A, Sadeniemi L. Частота и степень колонизации Helicobacter pylori и профили антрального и телесного гастрита в выборке населения Эстонии. Сканд Дж Гастроэнтерол. 1990; 25: 1010–17. [PubMed] [Google Scholar]
- Раутелин Х., Сиппонен П., Сеппала К., Сарна С., Даниэльссон Д., Косунен Т.У. Воспаление желудка и штаммы Helicobacter pylori, активирующие нейтрофилы и продуцирующие цитотоксины.Сканд Дж Гастроэнтерол. 1996; 31: 639–42. [PubMed] [Google Scholar]
- Кекки М., Сирала М., Ихамаки Т. Обогащение комбинированного атрофического гастрита антрального отдела и тела («комбинированный АГ») у братьев и сестер пациентов с карциномой желудка. Scand J Gastroenterol Suppl. 1991; 186: 24–8. [PubMed] [Google Scholar]
- Варис К. Эпидемиология гастрита. Scand J Gastroenterol Suppl. 1982; 79: 44–51. [PubMed] [Google Scholar]
- Сиппонен П.
 , Валле Дж., Варис К., Кекки М., Ихамаки Т., Сирала М. Уровни сывороточного гастрина натощак при различных функциональных и морфологических состояниях слизистой оболочки антрофунда.Анализ 860 предметов. Сканд Дж Гастроэнтерол. 1990; 25: 513–19. [PubMed] [Google Scholar]
, Валле Дж., Варис К., Кекки М., Ихамаки Т., Сирала М. Уровни сывороточного гастрина натощак при различных функциональных и морфологических состояниях слизистой оболочки антрофунда.Анализ 860 предметов. Сканд Дж Гастроэнтерол. 1990; 25: 513–19. [PubMed] [Google Scholar] - Sipponen P, Kekki M, Seppälä K, Siurala M. Взаимосвязь между хроническим гастритом и секрецией желудочного сока. Алимент Pharmacol Ther. 1996; 10: 103–18. [PubMed] [Google Scholar]
- Кекки М., Ихамаки Т., Варис К., Сирала М. Профили хронического гастрита у братьев и сестер пробандов, рассчитанные как имеющие повышенный риск рака желудка. Scand J Gastroenterol Suppl. 1991; 186: 29–32. [PubMed] [Google Scholar]
- Коккола А., Косунен Т.У., Пуолаккайнен П., Сиппонен П., Херконен М., Лаксен Ф. и др.Спонтанное исчезновение антител к Helicobacter pylori у пациентов с запущенным атрофическим гастритом тела. APMIS. 2003; 111: 619–24. [PubMed] [Google Scholar]
- Сиппонен П., Кекки М., Сирала М.
 Возрастные тенденции гастрита и кишечной метаплазии у пациентов с карциномой желудка и в контрольной группе, представляющей население в целом. Br J Рак. 1984; 49: 521–30. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Возрастные тенденции гастрита и кишечной метаплазии у пациентов с карциномой желудка и в контрольной группе, представляющей население в целом. Br J Рак. 1984; 49: 521–30. [Бесплатная статья PMC] [PubMed] [Google Scholar] - Сиппонен П., Кекки М., Сирала М. Атрофический хронический гастрит и кишечная метаплазия при раке желудка.Сравнение с репрезентативной выборкой населения. Рак. 1983; 52: 1062–8. [PubMed] [Google Scholar]
- Корреа П., Пиасуэло МБ. Предраковый каскад желудка. J Dig Dis. 2012; 13: 2–9. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- You WC, Li JY, Blot WJ, Chang YS, Jin ML, Gail MH, et al. Эволюция предраковых поражений у сельского населения Китая с высоким риском рака желудка. Int J Cancer. 1999; 83: 615–19. [PubMed] [Google Scholar]
- Корреа П., Хансель В., Куэлло С., Завала Д., Фонтам Е., Зарама Г. и др.Предраковый процесс желудка в популяции высокого риска: когортное наблюдение. Cancer Res. 1990; 50: 4737–40. [PubMed] [Google Scholar]
- Sipponen P, Helske T.
 , Järvinen P, Hyvärinen H, Seppälä K, Siurala M. Снижение распространенности хронического гастрита за 15 лет: анализ амбулаторных исследований в Финляндии с 1977, 1985 и 1992. Gut. 1994; 35: 1167–71. [Бесплатная статья PMC] [PubMed] [Google Scholar]
, Järvinen P, Hyvärinen H, Seppälä K, Siurala M. Снижение распространенности хронического гастрита за 15 лет: анализ амбулаторных исследований в Финляндии с 1977, 1985 и 1992. Gut. 1994; 35: 1167–71. [Бесплатная статья PMC] [PubMed] [Google Scholar] - Сиппонен П. Гастрит с Helicobacter pylori – эпидемиология. J Gastroenterol. 1997. 32: 273–7.[PubMed] [Google Scholar]
- Уна М., Утт М., Нильссон И., Уйбо О., Воробьева Т., Маарус Х.И. Инфекция Helicobacter pylori у детей в Эстонии: снижение серологической распространенности в течение 11-летнего периода глубоких социально-экономических изменений. Helicobacter. 2004; 9: 223–41. [PubMed] [Google Scholar]
- Eusebi LH, Zagari RM, Bazzoli F. Эпидемиология инфекции Helicobacter pylori. Helicobacter. 2014; 19: 1–5. [PubMed] [Google Scholar]
- Axon AT. Обзорная статья: передается ли Helicobacter pylori желудочно-оральным путем? Алимент Pharmacol Ther.1995; 9: 585–8. [PubMed] [Google Scholar]
- Варис К., Стенман У.
 Х., Лехтола Дж., Сирала М. Поражение желудка и злокачественная анемия: семейное исследование. Acta Hepatogastroenterol (Stuttg) 1978; 25: 62–7. [PubMed] [Google Scholar]
Х., Лехтола Дж., Сирала М. Поражение желудка и злокачественная анемия: семейное исследование. Acta Hepatogastroenterol (Stuttg) 1978; 25: 62–7. [PubMed] [Google Scholar] - Варис К., Исокоски М. Скрининг гастрита типа А. Ann Clin Res. 1981; 13: 133–8. [PubMed] [Google Scholar]
- Кекки М., Варис К., Похьянпало Х., Исокоски М., Ихамаки Т., Сирала М. Течение антрального и телесного гастрита в семьях с злокачественной анемией. Dig Dis Sci.1983; 28: 698–704. [PubMed] [Google Scholar]
- Воробьева Т., Фаллер Г., Маарус Х.И., Сиппонен П., Виллако К., Уибо Р. и др. Значительное увеличение антигастральных аутоантител в долгосрочном катамнестическом исследовании гастрита, вызванного H.pylori. Арка Вирхова. 2000; 437: 37–45. [PubMed] [Google Scholar]
- Уйбо Р., Воробьева Т., Метцюла К., Кисанд К., Вадстрём Т., Кивик Т. Ассоциация Helicobacter pylori и желудочного аутоиммунитета: популяционное исследование. FEMS Immunol Med Microbiol. 1995; 11: 65–8. [PubMed] [Google Scholar]
- Воробьева Т.
 , Маарус Х.И., Uibo Иммунный ответ на Helicobacter pylori и его связь с динамикой хронического гастрита в антральном отделе и теле.APMIS. 2008. 116: 465–76. [PubMed] [Google Scholar]
, Маарус Х.И., Uibo Иммунный ответ на Helicobacter pylori и его связь с динамикой хронического гастрита в антральном отделе и теле.APMIS. 2008. 116: 465–76. [PubMed] [Google Scholar] - Тахара Э. Генетические пути двух типов рака желудка. IARC Sci Publ. 2004. 157: 327–49. [PubMed] [Google Scholar]
- Qu Y, Dang S, Hou P. Метилирование генов при раке желудка. Clin Chim Acta. 2013; 424: 56–65. [PubMed] [Google Scholar]
- Sipponen P, Laxén F, Huotari K, Härkönen M. Распространенность низкого содержания витамина B12 и высокого гомоцистеина в сыворотке крови у пожилых мужчин: связь с атрофическим гастритом и инфекцией Helicobacter pylori.Сканд Дж Гастроэнтерол. 2003. 38: 1209–16. [PubMed] [Google Scholar]
- Боландер-Гуай К. Сосредоточьтесь на гомоцистеине и витаминах, участвующих в его метаболизме. Франция: Спрингер-Верлаг; 2002. [Google Scholar]
- Sipponen P, Härkönen M. Гипохлоргидрат желудка: состояние риска мальабсорбции кальция и остеопороза? Сканд Дж Гастроэнтерол.
 2010; 45: 133–8. [PubMed] [Google Scholar]
2010; 45: 133–8. [PubMed] [Google Scholar] - Саласпуро, член парламента. Ацетальдегид, микробы и рак пищеварительного тракта. Критик Rev Clin Lab Sci.2003. 40: 183–208. [PubMed] [Google Scholar]
- Саласпуро М. Ацетальдегид как общий знаменатель и совокупный канцероген при раке пищеварительного тракта. Сканд Дж Гастроэнтерол. 2009; 44: 912–25. [PubMed] [Google Scholar]
- Сиппонен П. Хронический гастрит и риск язвы. Сканд Дж Гастроэнтерол. 1990; 25: 193–6. [PubMed] [Google Scholar]
- Sipponen P, Seppälä K, Äärynen M, Helske T., Kettunen P. Хронический гастрит и гастродуоденальная язва: исследование случай-контроль риска сосуществующей язвы двенадцатиперстной кишки или желудка у пациентов с гастритом.Кишечник. 1989; 30: 922–9. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Кекки М., Сиппонен П., Сирала М., Лашевич В. Язвенная болезнь и хронический гастрит: их связь с возрастом и полом, а также с локализацией язвы и гастрита. Гастроэнтерол Clin Biol.
 1990; 14: 217–23. [PubMed] [Google Scholar]
1990; 14: 217–23. [PubMed] [Google Scholar] - Sipponen P, Varis K, Fräki O, Korri UM, Seppälä K, Siurala M. Совокупный 10-летний риск развития симптоматической язвы двенадцатиперстной кишки и желудка у пациентов с хроническим гастритом или без него. Клиническое наблюдение с участием 454 амбулаторных больных.Сканд Дж Гастроэнтерол. 1990; 25: 966–7. [PubMed] [Google Scholar]
- Арккила П.Е., Сеппала К., Косунен Т.Ю., Хаапиайнен Р., Кивилааксо Е., Сиппонен П. и др. Ликвидация Helicobacter pylori улучшает скорость заживления и снижает частоту рецидивов некровоточащих язв у пациентов с кровоточащей язвенной болезнью. Am J Gastroenterol. 2003. 98: 2149–56. [PubMed] [Google Scholar]
- Axon AT. Терапия Helicobacter pylori: влияние на язвенную болезнь. J Gastroenterol Hepatol. 1991; 6: 131–7. [PubMed] [Google Scholar]
- Kosunen TU, Pukkala E, Sarna S, Seppälä K, Aromaa A, Knekt P, et al.Рак желудка у финских пациентов после излечения от инфекции Helicobacter pylori: когортное исследование.
 Int J Cancer. 2011; 128: 433–9. [PubMed] [Google Scholar]
Int J Cancer. 2011; 128: 433–9. [PubMed] [Google Scholar] - Ли Y-C, Chen TH-H, Chiu H-M, Shun CT, Chiang H, Liu TY и др. Польза от массового искоренения инфекции Helicobacter pylori: исследование профилактики рака желудка на уровне сообщества. Кишечник. 2013; 62: 676–82. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Маарус Х.И., Кекки М., Воробьева Т., Салупере В., Сиппонен П. Риск рецидива язвы желудка, хронического гастрита и степень колонизации Helicobacter pylori.Сканд Дж Гастроэнтерол. 1994; 29: 532–6. [PubMed] [Google Scholar]
- Сиппонен П., Кекки М., Хаапакоски Дж., Ихамаки Т., Сирала М. Риск рака желудка при хроническом атрофическом гастрите: статистические расчеты поперечных данных. Int J Cancer. 1985; 35: 173–7. [PubMed] [Google Scholar]
- Sipponen P, Kosunen TU, Valle J, Riihelä M, Seppälä K. Инфекция Helicobacter pylori и хронический гастрит при раке желудка. J Clin Pathol. 1992; 45: 319–23. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Варис К.
 , Тейлор П.Р., Сиппонен П., Самлофф И.М., Хейнонен О.П., Албейнс Д. и др.Рак желудка и предраковые поражения при атрофическом гастрите: контролируемое исследование влияния добавок с альфа-токоферолом и бета-каротином. Хельсинкская группа по изучению гастрита. Сканд Дж Гастроэнтерол. 1998. 33: 294–300. [PubMed] [Google Scholar]
, Тейлор П.Р., Сиппонен П., Самлофф И.М., Хейнонен О.П., Албейнс Д. и др.Рак желудка и предраковые поражения при атрофическом гастрите: контролируемое исследование влияния добавок с альфа-токоферолом и бета-каротином. Хельсинкская группа по изучению гастрита. Сканд Дж Гастроэнтерол. 1998. 33: 294–300. [PubMed] [Google Scholar] - Agréus L, Kuipers EJ, Kupcinskas L., Malfertheiner P, Di Mario F, Leja M, et al. Обоснование диагностики и скрининга атрофического гастрита с использованием биомаркеров плазмы, специфичных для желудка. Сканд Дж Гастроэнтерол. 2012; 47: 136–47. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- ди Марио Ф, Кавалларо LG.Неинвазивные тесты при желудочных заболеваниях. Dig Liver Dis. 2008; 40: 523–30. [PubMed] [Google Scholar]
- Динис-Рибейро М., да Коста-Перейра А., Лопес С., Барбоса Дж., Гильерме М., Морейра-Диас Л. и др. Достоверность соотношения пепсиногена I / II в сыворотке для диагностики дисплазии эпителия желудка и кишечной метаплазии во время наблюдения за пациентами из группы риска по аденокарциноме желудка кишечного типа.
 Неоплазия. 2004. 6: 449–56. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Неоплазия. 2004. 6: 449–56. [Бесплатная статья PMC] [PubMed] [Google Scholar] - Varis K, Kekki M, Härkönen M, Sipponen P, Samloff IM.Сывороточный пепсиноген I и сывороточный гастрин в скрининге атрофического пангастрита с высоким риском рака желудка. Scand J Gastroenterol Suppl. 1991; 186: 117–23. [PubMed] [Google Scholar]
- Кекки М., Самлофф И.М., Варис К., Ихамаки Т. Сывороточный пепсиноген I и сывороточный гастрин в скрининге тяжелого атрофического гастрита тела. Scand J Gastroenterol Suppl. 1991; 186: 109–16. [PubMed] [Google Scholar]
- Sipponen P, Härkönen M, Alanko A, Suovaniemi O. Диагностика атрофического гастрита по образцу сыворотки.Clin Lab. 2002; 48: 505–15. [PubMed] [Google Scholar]
- Sipponen P, Stolte M. Клиническое влияние рутинных биопсий антрального отдела желудка и тела. Эндоскопия. 1997. 29: 671–8. [PubMed] [Google Scholar]
- Рагге М., Меггио А, Пеннелли Дж., Пишоли Ф., Джакомелли Л., Де Претис Дж. И др. Стадия гастрита в клинической практике: стадия OLGA.
 Кишечник. 2007; 56: 631–6. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Кишечник. 2007; 56: 631–6. [Бесплатная статья PMC] [PubMed] [Google Scholar] - Sipponen P, Graham DY. Значение атрофического гастрита в диагностике и профилактике рака желудка: применение биомаркеров плазмы.Сканд Дж Гастроэнтерол. 2007; 42: 2–10. [PubMed] [Google Scholar]
- Самлофф И.М. Пепсиногены I и II: очистка слизистой оболочки желудка и радиоиммуноанализ в сыворотке крови. Гастроэнтерология. 1982; 82: 26–33. [PubMed] [Google Scholar]
- Суованиеми О. Автоматизированное оборудование для клинических и исследовательских лабораторий. Инновации и разработка фотометров с вертикальным световым лучом и электронных пипеток. Университет Хельсинки 1994; Академическая диссертация. [Google Scholar]
- www.biohithealthcare.com/about-us/history Доступно по адресу.
- Мики К. Скрининг рака желудка с помощью комбинированного анализа сывороточных антител IgG к Helicobacter pylori и уровней пепсиногена в сыворотке – «метод ABC» Proc Jpn Acad Ser B Phys Biol Sci.
 2011; 87: 405–14. [Бесплатная статья PMC] [PubMed] [Google Scholar]
2011; 87: 405–14. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Хронический гастрит
Scand J Gastroenterol. 2015 июн 3; 50 (6): 657–667.
Pentti Sipponen
a Patolab Oy, Эспоо, Финляндия и Тартуский государственный университет, Тарту, Эстония
Heidi-Ingrid Maaroos
a Patolab Oy, Espoo, Финляндия и Тартуский государственный университет
, Эстонский государственный университет
, Тартуский государственный университет
a Patolab Oy, Эспоо, Финляндия, и Тартуский государственный университет, Тарту, ЭстонияПоступила 28 января 2015 г .; Пересмотрено 11 февраля 2015 г .; Принята в печать 12 февраля 2015 г.
Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License (http://creativecommons.org/licenses/by/4.0/), которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии, что оригинал эта статья цитируется в других статьях в PMC.
Abstract
Распространенность хронического гастрита заметно снизилась в развитых популяциях за последние десятилетия. Однако хронический гастрит по-прежнему остается одной из наиболее распространенных серьезных пандемических инфекций с такими серьезными смертельными последствиями, как язвенная болезнь желудка или рак желудка.В настоящее время в мире в среднем более половины людей могут иметь хронический гастрит. Хеликобактер pylori Инфекция в детстве является основной причиной хронического гастрита, микробное происхождение которого является ключом к пониманию причудливой эпидемиологии и течения болезни. Продолжительное и агрессивное воспаление при гастрите со временем (годы и десятилетия) приводит к разрушению (атрофическому гастриту) слизистой оболочки желудка. Прогрессирующее обострение атрофического гастрита впоследствии приводит к нарушению функции слизистой оболочки желудка.В самых крайних случаях атрофический гастрит в конечном итоге приводит к тому, что желудок постоянно не содержит кислоты. Тяжелый атрофический гастрит и отсутствие кислоты в желудке – это наиболее известные до сих пор независимые состояния риска рака желудка. Помимо риска злокачественных новообразований и язвенной болезни, бескислотный желудок и тяжелые формы атрофического гастрита могут быть связаны с нарушением всасывания основных витаминов, таких как витамин B12, микронутриентов (таких как железо, кальций, магний и цинк), диеты и лекарств. .
Тяжелый атрофический гастрит и отсутствие кислоты в желудке – это наиболее известные до сих пор независимые состояния риска рака желудка. Помимо риска злокачественных новообразований и язвенной болезни, бескислотный желудок и тяжелые формы атрофического гастрита могут быть связаны с нарушением всасывания основных витаминов, таких как витамин B12, микронутриентов (таких как железо, кальций, магний и цинк), диеты и лекарств. .
Ключевые слова: рак желудка, гастрит, Helicobacter pylori , язвенная болезнь
Введение
Хронический гастрит – одно из самых распространенных пожизненных, серьезных и коварных заболеваний человека.Можно оценить, что более половины населения мира в той или иной степени страдает этим заболеванием, что указывает на то, что даже многие сотни миллионов людей во всем мире могут иметь хронический гастрит в той или иной форме.
Значение хронического гастрита как серьезного заболевания в значительной степени недооценивается в клинической практике, хотя роль гастрита в патогенезе обычных пептических язв и рака желудка очевидна [1, 2, 3, 4]. Можно подсчитать, что ежегодно во всем мире могут происходить миллионы преждевременных смертей из-за рака и язвы, являющихся последствиями хронического гастрита.
Можно подсчитать, что ежегодно во всем мире могут происходить миллионы преждевременных смертей из-за рака и язвы, являющихся последствиями хронического гастрита.
Хронический гастрит проявляется в неатрофической или атрофической форме. Это формы и фенотипы гастрита, которые представляют разные стадии одного и того же пожизненного заболевания [2, 3, 5, 6, 7]. Морфологические проявления гастрита во всем мире очень похожи, то есть хронический гастрит, по-видимому, с его последствиями является одним и тем же заболеванием во всем мире.
Хронический гастрит известен и изучается с первых десятилетий 20-го века, но получил большее внимание только в 1982 году после открытия Helicobacter pylori Уорреном и Маршаллом [8].Стало ясно, что бактерия является причиной гастрита в подавляющем большинстве случаев, за возможным исключением гастрита аутоиммунного происхождения [3, 9]. Следовательно, стало очевидно, что хронический гастрит можно вылечить с помощью эрадикации H. pylori , что приведет к нормализации слизистой оболочки желудка, по крайней мере, в тех случаях, когда гастрит не переходит в конечную стадию атрофии (атрофический гастрит) [8 , 9, 10, 11, 12, 13].
pylori , что приведет к нормализации слизистой оболочки желудка, по крайней мере, в тех случаях, когда гастрит не переходит в конечную стадию атрофии (атрофический гастрит) [8 , 9, 10, 11, 12, 13].
Несмотря на то, что основные черты хронического гастрита хорошо известны, некоторые вопросы все еще остаются без ответа.Мы не знаем, например, значения аутоиммунитета или генетики в развитии и прогрессировании хронического гастрита H. pylori . Молекулярные механизмы и роль факторов окружающей среды, таких как диета, и роль микробов, отличных от H. pylori , в течении хронического гастрита, в значительной степени неизвестны. Мы не можем точно предсказать, у кого хронический гастрит обязательно будет прогрессировать до конечной атрофической стадии и смертельных последствий, или у кого этого не произойдет.Эта неопределенность также относится к деталям, благодаря которым гастрит приводит к появлению пептических язв или рака желудка. Однако мы знаем, что без наличия сопутствующего хронического гастрита или атрофического гастрита обычные пептические язвы или рак желудка встречаются редко.
В этом обзоре описаны некоторые наблюдения и представлены некоторые субъективные мнения и замечания о течении и эпидемиологии хронического гастрита H. pylori и связанных с ним заболеваний, полученные в основном из нескольких исследований, проведенных в Эстонии и Финляндии за последние 40 лет [14, 15, 16, 17, 18, 19, 20, 21, 22].За прошедшие годы большинство этих исследований было опубликовано в этом журнале.
Естественное течение
Хронический гастрит – это многоступенчатое, прогрессирующее и пожизненное воспаление [3, 16, 20, 21, 22, 23, 24]. Обычно оно начинается в детстве как простое хроническое («поверхностное») мононуклеарное воспаление с сосуществованием острого («активного») нейтрофильного воспаления разной степени [25, 26]. Гастрит постепенно прогрессирует в течение лет и десятилетий до атрофического гастрита, который характеризуется потерей нормальных слизистых желез либо в антральном отделе, либо в теле (и дне), либо в обоих (, и) [7, 22, 23, 27]. Как правило, во всех популяциях повозрастная распространенность как неатрофического, так и атрофического гастрита имеет тенденцию к возрастанию с возрастом, как это было продемонстрировано в Финляндии в. В настоящее время рост повозрастной распространенности гастрита по возрасту более выражен и резок в развивающихся, чем в развитых, популяциях, т. Е. Распространенность гастрита в молодых возрастных группах или даже в детстве гораздо больше, чем в развитых. 50% в развивающихся популяциях, тогда как эта распространенность в развитых странах обычно намного меньше 50% [17, 27].
Как правило, во всех популяциях повозрастная распространенность как неатрофического, так и атрофического гастрита имеет тенденцию к возрастанию с возрастом, как это было продемонстрировано в Финляндии в. В настоящее время рост повозрастной распространенности гастрита по возрасту более выражен и резок в развивающихся, чем в развитых, популяциях, т. Е. Распространенность гастрита в молодых возрастных группах или даже в детстве гораздо больше, чем в развитых. 50% в развивающихся популяциях, тогда как эта распространенность в развитых странах обычно намного меньше 50% [17, 27].
Слизистая оболочка тела с «активным» хроническим гастритом (A): Воспаление является мононуклеарным, но сопровождается нейтрофилами и эозинофилами (стрелки), которые проникают в поверхностный эпителий. Нормальный (B): нормальная слизистая оболочка тела без каких-либо признаков воспаления показана в качестве эталона. Пятно HE × 500.
Слизистая оболочка тела. Нормальный (A): слой кислородных желез в норме, что позволяет предположить, что слизистая оболочка тела способна нормально секретировать соляную кислоту. Неатрофический гастрит (B): Легкое мононуклеарное воспаление наблюдается в верхнем слое (фовеолярной части) слизистой оболочки («поверхностный хронический гастрит»), как указано стрелками.Слой железы не поврежден, что свидетельствует о нормальной секреции кислоты, несмотря на гастрит. Умеренный атрофический гастрит в теле (C): Интенсивное хроническое мононуклеарное воспаление возникает также в нижних слоях слизистой оболочки и сопровождается заметной потерей (атрофией) нормальных оксинтических желез. Наблюдение предполагает, что желудок гипохлоргидный, но не ахлоргидный. Секреция кислоты нарушается из-за потери париетальных клеток. Тяжелый атрофический гастрит тела (D): хроническое воспаление слабое, но все кислородные железы полностью исчезли.В правом нижнем углу возникают некоторые очаги кишечной метаплазии. Желудок определенно не содержит кислоты (ахлоргидрат). Пациент подвержен риску мальабсорбции витамина B12, а также может быть нарушено всасывание микроэлементов (железа, кальция, магния и цинка).
Неатрофический гастрит (B): Легкое мононуклеарное воспаление наблюдается в верхнем слое (фовеолярной части) слизистой оболочки («поверхностный хронический гастрит»), как указано стрелками.Слой железы не поврежден, что свидетельствует о нормальной секреции кислоты, несмотря на гастрит. Умеренный атрофический гастрит в теле (C): Интенсивное хроническое мононуклеарное воспаление возникает также в нижних слоях слизистой оболочки и сопровождается заметной потерей (атрофией) нормальных оксинтических желез. Наблюдение предполагает, что желудок гипохлоргидный, но не ахлоргидный. Секреция кислоты нарушается из-за потери париетальных клеток. Тяжелый атрофический гастрит тела (D): хроническое воспаление слабое, но все кислородные железы полностью исчезли.В правом нижнем углу возникают некоторые очаги кишечной метаплазии. Желудок определенно не содержит кислоты (ахлоргидрат). Пациент подвержен риску мальабсорбции витамина B12, а также может быть нарушено всасывание микроэлементов (железа, кальция, магния и цинка). Патолог может столкнуться с трудностями при обнаружении бактерий Helicobacter pylori в подобных случаях, даже если атрофический гастрит имеет происхождение H. pylori . Вместо этого смешанная микробная флора (микробы, отличные от H.pylori ) часто встречается на поверхности слизистой оболочки в подобных случаях. Альциановый синий – PAS и модифицированные красители Гимза × 300.
Патолог может столкнуться с трудностями при обнаружении бактерий Helicobacter pylori в подобных случаях, даже если атрофический гастрит имеет происхождение H. pylori . Вместо этого смешанная микробная флора (микробы, отличные от H.pylori ) часто встречается на поверхности слизистой оболочки в подобных случаях. Альциановый синий – PAS и модифицированные красители Гимза × 300.
Слизистая оболочка антрального отдела. Нормальный (A): Нормальное количество антральных G-клеток с типичным «ореолом» встречается в области шеи пилорических желез (стрелки). Неатрофический хронический гастрит (B): мононуклеарное воспаление охватывает всю слизистую оболочку, создавая впечатление потери железы (атрофии). Атрофический гастрит от легкой до умеренной степени в антральном отделе (C): Воспаление относительно легкое, но большая часть пилорических желез утрачена и заменена метапластическими железами (IM), как указано стрелками.Тяжелый атрофический гастрит в антральном отделе (D): все пилорические железы отсутствуют, а вся слизистая оболочка «кишечно-кишечная».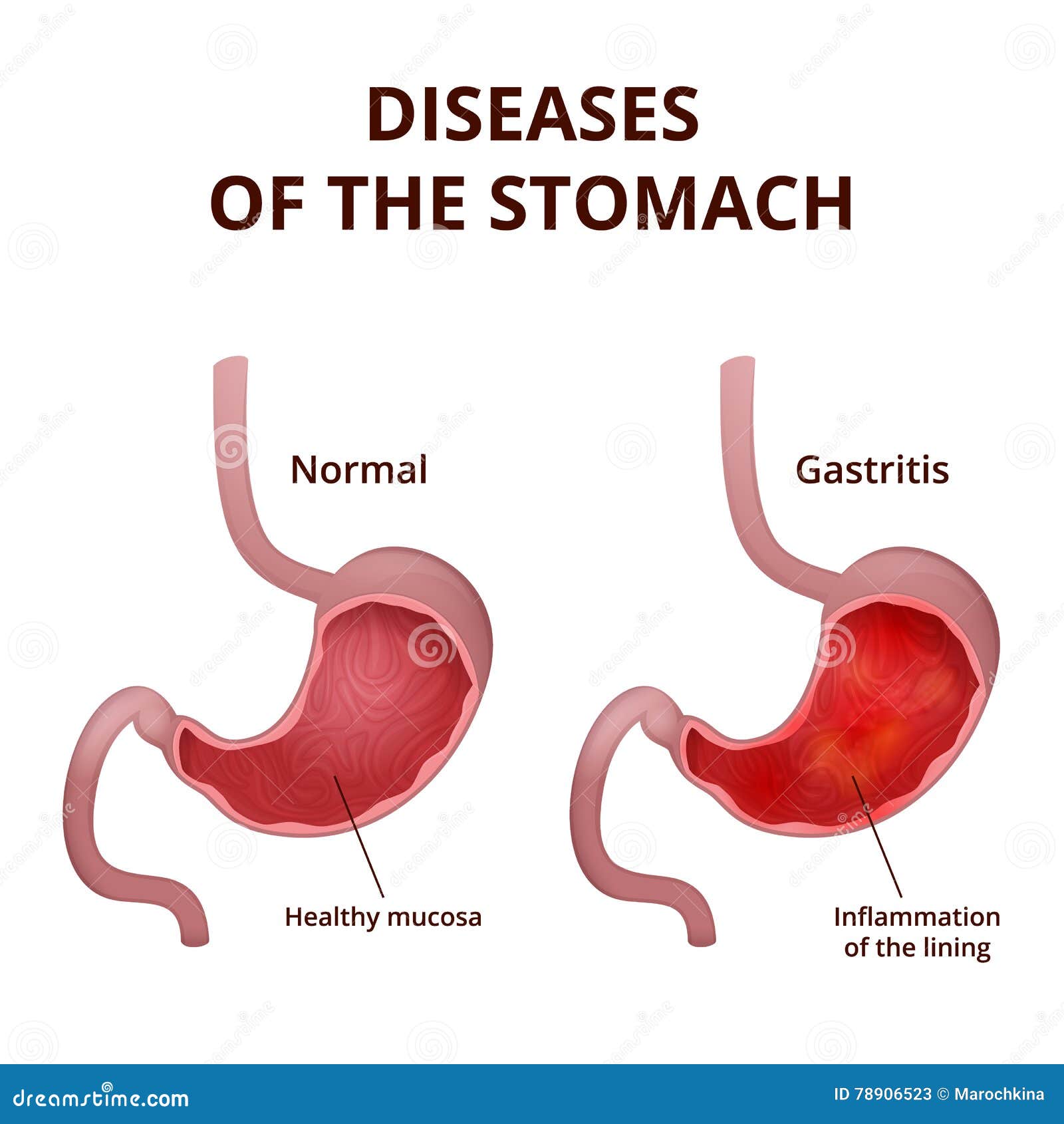 Воспаление слабое или самое большее умеренное. Также исчезают антральные G-клетки вместе с потерей нормальных пилорических желез. Следовательно, реакция обратной связи G-17 в физиологическом контроле секреции кислоты нарушается. HE и альциановый синий – пятна PAS × 300.
Воспаление слабое или самое большее умеренное. Также исчезают антральные G-клетки вместе с потерей нормальных пилорических желез. Следовательно, реакция обратной связи G-17 в физиологическом контроле секреции кислоты нарушается. HE и альциановый синий – пятна PAS × 300.
Средняя повозрастная распространенность тотального хронического гастрита и атрофического гастрита в биоптатах от ~ 500 последовательных эндоскопических финских амбулаторных пациентов в конце 80-х годов (больница Йорви, Эспоо, Финляндия).Средняя распространенность увеличивается с возрастом.
Утрата слизистых желез при атрофическом гастрите сменяется ростом новых незрелых железистых и эпителиальных элементов; то есть с железами кишечного типа («кишечная метаплазия (IM)»), напоминающими железы и эпителий в толстой и / или тонкой кишке, и / или с железами пилорического типа («псевдопилорическая метаплазия»), напоминающими пилорические железы и эпителий, из которых G-клетки (гастриновые клетки) исчезают. В рамках эволюции высокодифференцированные железы, эпителий и клетки разрушаются при атрофии (атрофический гастрит), а утраченные железы заменяются железами и эпителием с незрелыми кишечными свойствами [2, 5, 6, 7, 14, 17, 23 , 24, 27, 28].и приведем несколько примеров этих явлений при патологии эндоскопической биопсии.
В рамках эволюции высокодифференцированные железы, эпителий и клетки разрушаются при атрофии (атрофический гастрит), а утраченные железы заменяются железами и эпителием с незрелыми кишечными свойствами [2, 5, 6, 7, 14, 17, 23 , 24, 27, 28].и приведем несколько примеров этих явлений при патологии эндоскопической биопсии.
Первые проявления гастрита H. pylori этиологии имеют тенденцию к антральному, т.е. гастрит «преобладает в антральном отделе» [25, 27]. Воспаление, состоящее в основном из мононуклеарных воспалительных клеток и плазматических клеток, является «поверхностным» и занимает верхние слои слизистой оболочки, особенно в теле () [2, 20, 27, 28, 29]. Хроническое воспаление связано с нейтрофильным воспалением (), причем интенсивность этого острого и «активного» компонента гастрита, скорее всего, зависит от цитотоксичности H.pylori [22, 30]. Чем цитотоксичнее штамм, тем активнее и, очевидно, агрессивнее хронический гастрит. Наиболее агрессивными формами хронического гастрита являются те, которые с наибольшей вероятностью приводят к запущенным стадиям атрофического гастрита, т.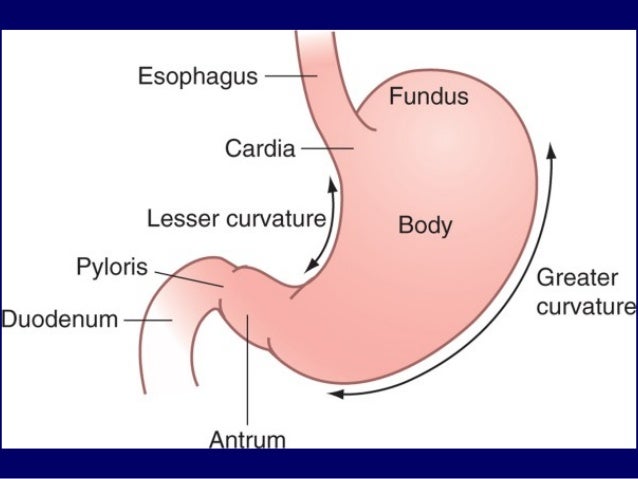 Е. Представляют собой формы гастрита H. pylori с наибольшей вероятностью прогрессирования до конечной стадии атрофии [5, 6].
Е. Представляют собой формы гастрита H. pylori с наибольшей вероятностью прогрессирования до конечной стадии атрофии [5, 6].
Годовой риск прогрессирования хронического гастрита от одной стадии к другой оценивается в среднем в 2–3% [16, 20, 23, 27].Предполагается, что около 50% пациентов с хроническим гастритом (и инфекцией H. pylori ) в течение жизни заболеют атрофическим гастритом той или иной степени тяжести [27]. Примерно у 5% инфицированных атрофический гастрит переходит в тяжелую и запущенную стадию [23, 27].
Медленное расширение гастрита H. pylori с чисто антрального фенотипа до форм, поражающих также тело и глазное дно («атрофический пангастрит», мультифокальный атрофический гастрит »или« гастрит с преобладанием тела »), как правило, является обычным явлением [ 7, 15, 19, 21, 23, 27, 31].Это проксимальное (пилорокардиальное) распространение и постепенное обострение атрофического гастрита связаны с заметными изменениями морфологии и функции слизистой оболочки желудка. Эти поражения нарушают функции желудка, вызывая, в частности, нарушения секреции соляной кислоты и внутреннего фактора кислородными железами при атрофии тела, а также нарушения синтеза и секреции гастрина-17 антральными G-клетками при антральной атрофии [23, 27, 32, 33, 34].
Эти поражения нарушают функции желудка, вызывая, в частности, нарушения секреции соляной кислоты и внутреннего фактора кислородными железами при атрофии тела, а также нарушения синтеза и секреции гастрина-17 антральными G-клетками при антральной атрофии [23, 27, 32, 33, 34].
Тяжелый атрофический гастрит, который строго ограничен одним антральным отделом, очевидно, довольно редок.С другой стороны, развитая атрофия, которая возникает только в теле тела или одновременно занимает антральный и корпусный отделы, является относительно частым фенотипом хронического гастрита (до 5% людей с гастритом), по крайней мере, в Северной Европе [ 27, 31, 35]. Долгосрочные исследования показывают, что наряду с увеличением гастрита H. pylori вверх слизистая оболочка антрального отдела может даже зажить [20, 23, 27].
Из-за потери кислородных желез и париетальных клеток при атрофии тела, распространение атрофического гастрита на тело и глазное дно приводит к пожизненной и постоянной гипо- или ахлоргидрии.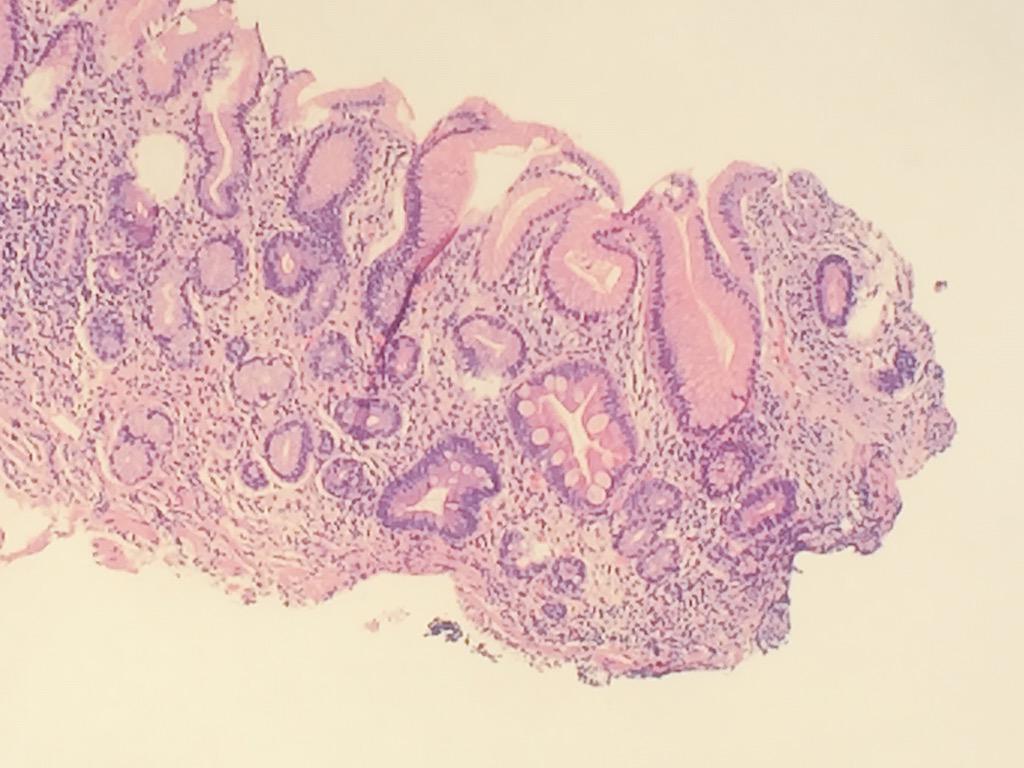 Впоследствии из-за низкой внутрижелудочной кислотности первоначальная инфекция H. pylori может, в свою очередь, спонтанно исчезнуть и, наконец, вылечить в случаях прогрессирующей атрофии, что продемонстрировано серологическими тестами в последующих наблюдениях [29, 36]. .
Впоследствии из-за низкой внутрижелудочной кислотности первоначальная инфекция H. pylori может, в свою очередь, спонтанно исчезнуть и, наконец, вылечить в случаях прогрессирующей атрофии, что продемонстрировано серологическими тестами в последующих наблюдениях [29, 36]. .
По мере прогрессирования хронического неатрофического гастрита до атрофических фенотипов, потенциально запускаются многочисленные случайные патогенетические процессы, даже канцерогенные, что является явлением в sc. «Каскад корреа» может, наконец, способствовать процессам, связывающим хронический гастрит с такими крайними последствиями, как рак [1, 7, 35, 37, 38, 39, 40, 41].Это можно проиллюстрировать на примере.
Схема естественного течения и прогрессирования гастрита Helicobacter pylori от неатрофической формы до злокачественного новообразования желудка (sc. Correa cascade). Некоторые потенциально патогенетические факторы и механизмы, связанные с канцерогенезом, играют определенную роль и запускаются поэтапно в течение и прогрессирования каскада.
Эпидемиология и феномен рождения когорты
Наблюдения, полученные в результате популяционных исследований хронического гастрита, могут помочь в некоторых фундаментальных выводах относительно эпидемиологии хронического гастрита и его последствий.
Хронический гастрит по-прежнему является относительно распространенным заболеванием, даже в развитых странах, даже несмотря на то, что его распространенность заметно снизилась, причем это снижение идет параллельно со снижением распространенности H. pylori [42, 43]. Вполне возможно, что практически каждый человек, даже в развитых странах, около 100 лет назад болел гастритом H. pylori , тогда как в настоящее время распространенность в среднем составляет менее 50%.
H. pylori гастрит в большинстве случаев приобретается в раннем детстве, тогда фенотип гастрита представляет собой безвредное и бессимптомное простое хроническое мононуклеарное («поверхностное») воспаление [25, 29]. Тяжелые симптоматические последствия хронического гастрита проявятся только в последние десятилетия жизни и, как правило, возникают у пациентов с поздними стадиями поражения [1, 39, 43].
Тяжелые симптоматические последствия хронического гастрита проявятся только в последние десятилетия жизни и, как правило, возникают у пациентов с поздними стадиями поражения [1, 39, 43].
После открытия H. pylori стало очевидно, что понимание эпидемиологии инфекции H. pylori является ключом к пониманию эпидемиологии хронического гастрита и его последствий. Поскольку хронический гастрит и его последствия (язвенная болезнь желудка и рак желудка) изначально были пандемической бактериальной инфекцией у детей, эпидемиологические характеристики хронического гастрита соответствуют тем же «пандемическим» принципам, что и H.pylori сама по себе.
Социально-экономические факторы и гигиена окружающей среды неизбежно являются наиболее важными фоновыми факторами передачи инфекции H. pylori во всем мире, причем эти социально-экономические факторы также являются фоновыми факторами в эпидемиологии хронического гастрита и его последствий [43, 44, 45] .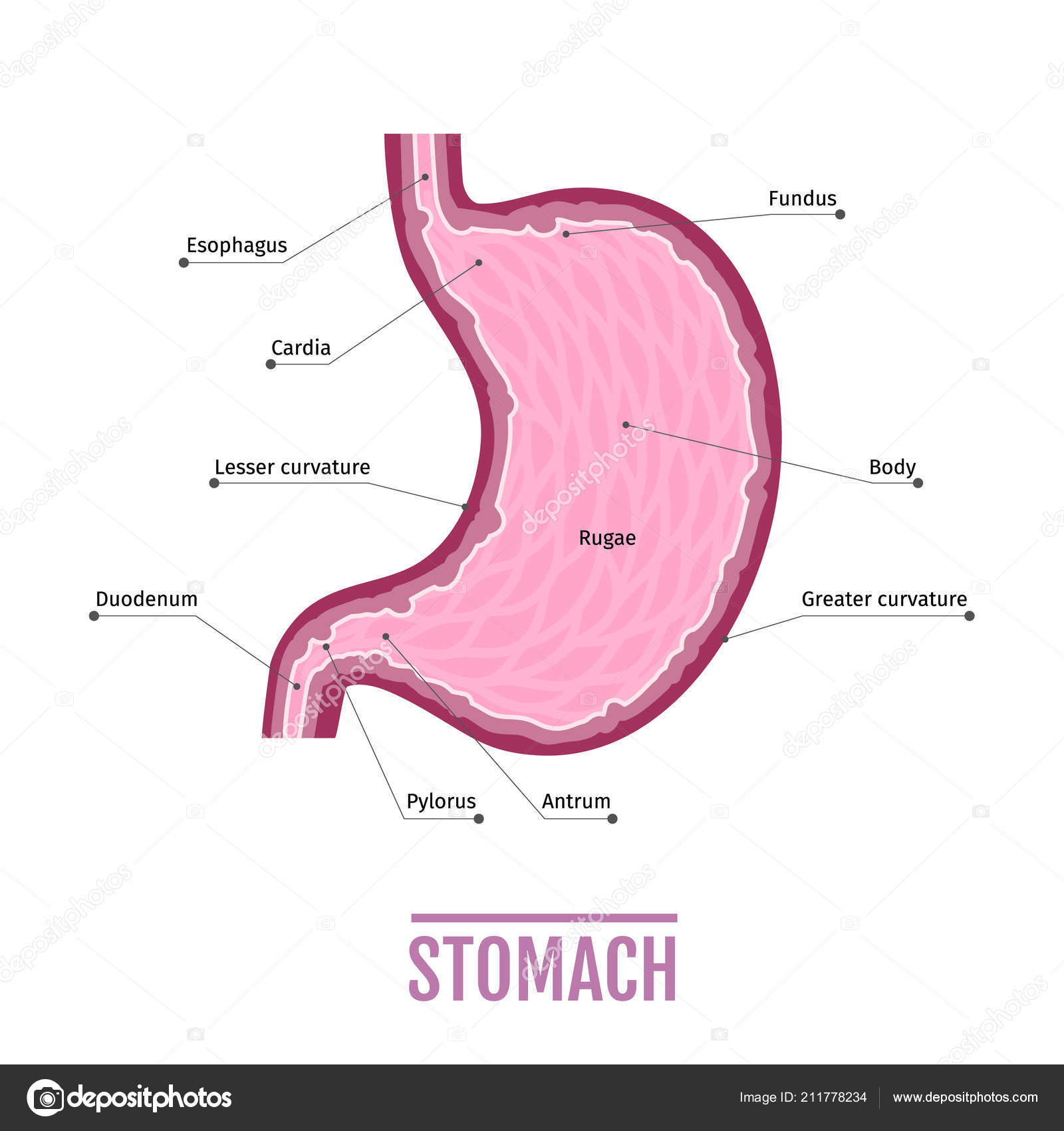 Социально-экономический статус в детстве, экологическая и семейная гигиена, плотность домохозяйства, привычки приготовления пищи и т. Д. Являются вероятными факторами, которые определяют вероятность приобретения H.pylori в детстве. Улучшение этих условий снижает вероятность заражения или дальнейшей передачи инфекции желудочно-оральным путем [46]. Снижение уровня инфицирования в детском возрасте на уровне семьи со временем неизбежно приведет к снижению распространенности гастрита H. pylori и его последствий в среднем среди всего населения.
Социально-экономический статус в детстве, экологическая и семейная гигиена, плотность домохозяйства, привычки приготовления пищи и т. Д. Являются вероятными факторами, которые определяют вероятность приобретения H.pylori в детстве. Улучшение этих условий снижает вероятность заражения или дальнейшей передачи инфекции желудочно-оральным путем [46]. Снижение уровня инфицирования в детском возрасте на уровне семьи со временем неизбежно приведет к снижению распространенности гастрита H. pylori и его последствий в среднем среди всего населения.
Из-за «педиатрического» происхождения инфекции H. pylori эпидемиология H.pylori гастрит лучше всего понять и понять как «феномен когорты рождения», как это проиллюстрировано компьютерным моделированием в [43]. Уровень инфицирования в детском возрасте и повозрастная распространенность гастрита H. pylori высоки в когортах «старых» новорожденных, рожденных на десятилетия раньше, чем распространенность в когортах «молодых» новорожденных, родившихся позже и у которых уровень инфицирования H. pylori в детстве низкий. Таким образом, средняя распространенность гастрита на популяционном уровне отражает среднее значение распространенности хронического гастрита в разных когортах рождения и средний показатель H.pylori в детском возрасте.
pylori в детстве низкий. Таким образом, средняя распространенность гастрита на популяционном уровне отражает среднее значение распространенности хронического гастрита в разных когортах рождения и средний показатель H.pylori в детском возрасте.
Компьютерное моделирование, демонстрирующее «феномен когорты рождения» в распространенности гастрита Helicobacter pylori в популяции, состоящей из когорт с разными годами рождения. Примерно на основании данных о гастрите в Финляндии примерно в конце 80-х годов (см.).
Эпидемиология заболеваемости раком желудка и эпидемиология смертности от рака желудка следуют принципам «феномена когорты рождения» и демонстрируют аналогичные глобальные «пандемические» характеристики, как и в случае с H.pylori гастрит [43]. Уровень заболеваемости раком желудка (или язвенной болезнью) был и будет низким в когортах «молодых» новорожденных, в которых частота гастрита H. pylori низкая и слизистая оболочка желудка остается здоровой на протяжении всей жизни.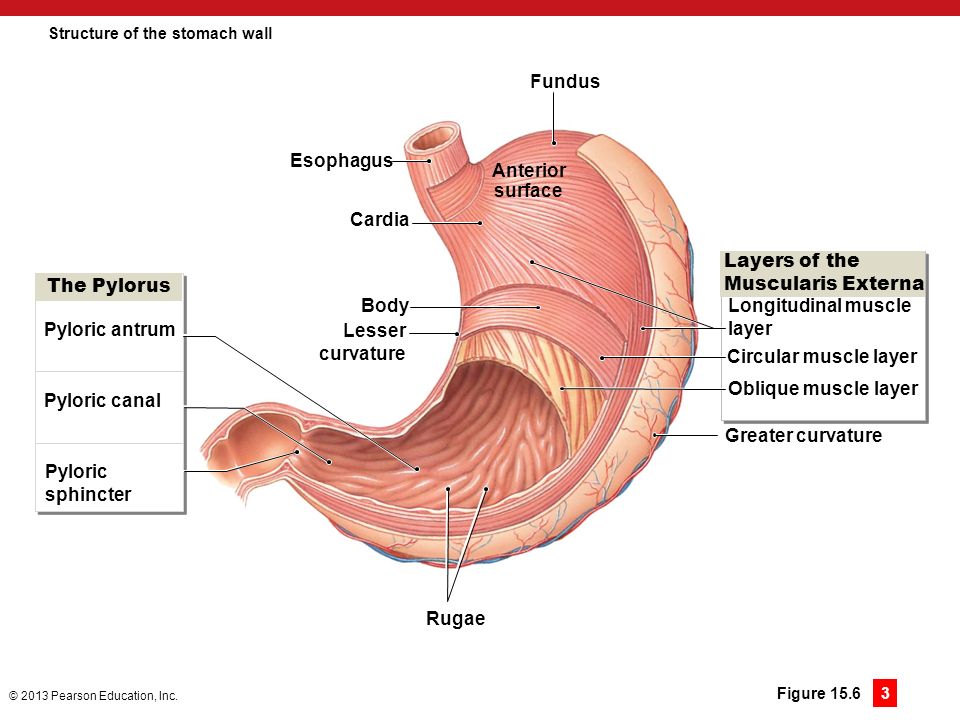 . Напротив, распространенность, заболеваемость и смертность от язвенной болезни или рака желудка высоки и остаются высокими в старых когортах, пока они живы.
. Напротив, распространенность, заболеваемость и смертность от язвенной болезни или рака желудка высоки и остаются высокими в старых когортах, пока они живы.
Аутоиммунный хронический гастрит
Хотя H.pylori , в конечном счете, является основной причиной (более чем в 90% случаев) гастрита, хронического мононуклеарного воспаления (гастрита) без продолжающейся инфекции H. pylori , но протекающего с тяжелым атрофическим гастритом тела и ахлоргидритом желудка. , и с сосуществованием аутоантител против париетальных клеток (протонная помпа) и / или внутреннего фактора, является хорошо установленным субъектом [3, 32, 47, 48, 49, 50]. Однако неясно, является ли этот гастрит «аутоиммунного» типа независимым заболеванием или H.pylori вызывает аутоиммунные реакции у некоторых ответственных лиц с обычной инфекцией H. pylori [3, 50, 51, 52]. Возможно, что первоначальная инфекция H. pylori может пройти спонтанно, когда атрофический гастрит перейдет в тяжелую атрофическую и ахлоргидрическую стадию, создавая, таким образом, ложное впечатление о чистой аутоиммунной этиологии заболевания.
Гастрит, связанный с аутоиммунными явлениями, в любом случае может быть более прогрессирующим и более быстрым, чем чистый H.pylori гастрит [3, 23]. В связи с аутоиммунитетом и у лиц со склонностью к аутоиммунным заболеваниям (аутоиммунный тиреоидит, диабет и т. Д.) Прогрессирование гастрита H. pylori до атрофических фенотипов может быть заметно деструктивным, что может легко и быстро привести к ахлоргидрии и полная атрофия тела и дна желудка. В медицинской литературе описаны случаи тяжелого атрофического гастрита с аутоиммунными характеристиками и безкислотного желудка даже в детском возрасте.
Показано, что хронический гастрит аутоиммунного типа является рецессивным мультигенным заболеванием и, возможно, имеет североевропейское происхождение [32].
Влияние на физиологию желудка
Длительное (пожизненное) хроническое и активное воспаление не может быть безвредным и приведет к разрушению слизистой оболочки желудка посредством нескольких механизмов, которые могут взаимодействовать с обновлением, ростом, целостностью, дифференцировкой и функцией эпителия желудка [1, 24, 39, 53, 54]. Многочисленные аномальные экспрессии (повышающая и понижающая регуляция) функциональных и регуляторных генов, генные мутации, эпигенетические изменения, различные проявления цитокинов или факторов роста тканей происходят в регуляторных тканевых процессах слизистой оболочки желудка и эпителиальных клеток в связи с H. pylori. гастрит [53, 54]. Некоторые изменения являются обратными, могут проявляться даже на ранних стадиях воспаления, но могут особенно накапливаться со временем в предраковых состояниях, таких как атрофия и IM, и, по-видимому, чрезвычайно распространены и разнообразны при предраковых (дисплазия или интраэпителиальная неоплазия) и злокачественных новообразованиях. поражения [53, 54].
Многочисленные аномальные экспрессии (повышающая и понижающая регуляция) функциональных и регуляторных генов, генные мутации, эпигенетические изменения, различные проявления цитокинов или факторов роста тканей происходят в регуляторных тканевых процессах слизистой оболочки желудка и эпителиальных клеток в связи с H. pylori. гастрит [53, 54]. Некоторые изменения являются обратными, могут проявляться даже на ранних стадиях воспаления, но могут особенно накапливаться со временем в предраковых состояниях, таких как атрофия и IM, и, по-видимому, чрезвычайно распространены и разнообразны при предраковых (дисплазия или интраэпителиальная неоплазия) и злокачественных новообразованиях. поражения [53, 54].
Атрофия тела в конечном итоге приводит к нарушению секреции соляной кислоты и внутреннего фактора [23, 34]. В бескислотном и атрофическом желудке из-за нарушения секреции внутреннего фактора всасывание основных витаминов, таких как витамин B12, серьезно нарушено [55]. Мальабсорбция и последующий длительный и постоянный дефицит витамина B12 могут нарушать метаболизм метионина, гомоцистеина или фолиевой кислоты и, таким образом, могут быть механизмом, который способствует появлению эпигенетических повреждений ДНК из-за нарушения функции цикла метилирования в эпителиальных клетках. клетки [55, 56].
клетки [55, 56].
Диетический метаболизм и всасывание питательных микроэлементов, таких как железо, кальций, магний и цинк, или всасывание некоторых лекарств (например, дипиридамола, некоторых препаратов железа и противогрибковых препаратов, таких как флуконазол или итраконазол, тироксин и атазановир) нарушаются из-за кислоты свободный желудок тоже [57]. Бескислотный желудок в конечном итоге заселяется микробной флорой изо рта [58]. Микробы и бескислотный желудок способны продуцировать канцерогены класса 1, такие как ацетальдегид и нитрозоамины [39, 59].
Рак и язвенная болезнь
Рак желудка и язвенная болезнь (исключая язвы, вызванные приемом НПВП) являются наиболее серьезными заболеваниями, связанными с хроническим гастритом H. pylori [60, 61, 62, 63, 64, 65]. Успешная ликвидация H. pylori предотвращает рецидивы язвы, но также может предотвратить рак [66, 67].
Несмотря на ассоциации пептических язв и рака с гастритом H. pylori , эти связи также существенно различаются [62, 68]. Пептические язвы двенадцатиперстной кишки (ЯД) обычно возникают у людей с неатрофическим гастритом H. pylori , но нечасты или отсутствуют у субъектов, у которых гастрит прогрессировал до атрофических форм в теле и у которых желудок впоследствии стал хлоргидридным ( ). С другой стороны, язвы желудка часто связаны с фенотипами гастрита, при которых выраженная атрофия и IM возникают в антральном отделе и режущей кромке, и в этих случаях слизистая оболочка тела может быть даже слегка атрофичной, но никогда не бывает сильно атрофированной (и желудок бывает атрофичным). никогда не ахлоргидный) [62].Рак желудка, в частности кишечного типа, наблюдается у пациентов с гипохлоргидритом или ахлоргидридом желудка и, в частности, может возникать у субъектов с поздними стадиями атрофии и IM как в антральном отделе, так и в теле [39, 69].
Пептические язвы двенадцатиперстной кишки (ЯД) обычно возникают у людей с неатрофическим гастритом H. pylori , но нечасты или отсутствуют у субъектов, у которых гастрит прогрессировал до атрофических форм в теле и у которых желудок впоследствии стал хлоргидридным ( ). С другой стороны, язвы желудка часто связаны с фенотипами гастрита, при которых выраженная атрофия и IM возникают в антральном отделе и режущей кромке, и в этих случаях слизистая оболочка тела может быть даже слегка атрофичной, но никогда не бывает сильно атрофированной (и желудок бывает атрофичным). никогда не ахлоргидный) [62].Рак желудка, в частности кишечного типа, наблюдается у пациентов с гипохлоргидритом или ахлоргидридом желудка и, в частности, может возникать у субъектов с поздними стадиями атрофии и IM как в антральном отделе, так и в теле [39, 69].
Относительный риск язвенной болезни (двенадцатиперстной кишки или желудка) или рака желудка при различных фенотипах хронического атрофического Helicobacter pylori гастрита. Риски представлены как относительные риски по сравнению с рисками у субъектов с нормальной и здоровой слизистой оболочкой желудка (категория N / N; желтый).Риски экстраполируются и оцениваются на основе исследования случай-контроль, проведенного в Финляндии в 80-х годах [69]. Обратите внимание, что риски язвенной болезни и рака желудка связаны с очень разными фенотипами хронического гастрита.
Риски представлены как относительные риски по сравнению с рисками у субъектов с нормальной и здоровой слизистой оболочкой желудка (категория N / N; желтый).Риски экстраполируются и оцениваются на основе исследования случай-контроль, проведенного в Финляндии в 80-х годах [69]. Обратите внимание, что риски язвенной болезни и рака желудка связаны с очень разными фенотипами хронического гастрита.
Канцерогенез желудка неоднороден и чрезвычайно разнообразен на молекулярном уровне [53, 54]. Несмотря на то, что генных ошибок много, никаких специфических или всеобъемлющих молекулярных маркеров, генных ошибок или мутаций при раке или предраковых поражениях пока не обнаружено.Хотя два основных гистологических типа рака желудка, кишечный и диффузный, являются значимыми сущностями с клинической и морфологической точки зрения, и оба связаны с предшествующим или сосуществующим гастритом H. pylori , эти типы могут не быть полностью разными сущностями. . При диффузном типе фоновой морфологией часто является неатрофический гастрит H.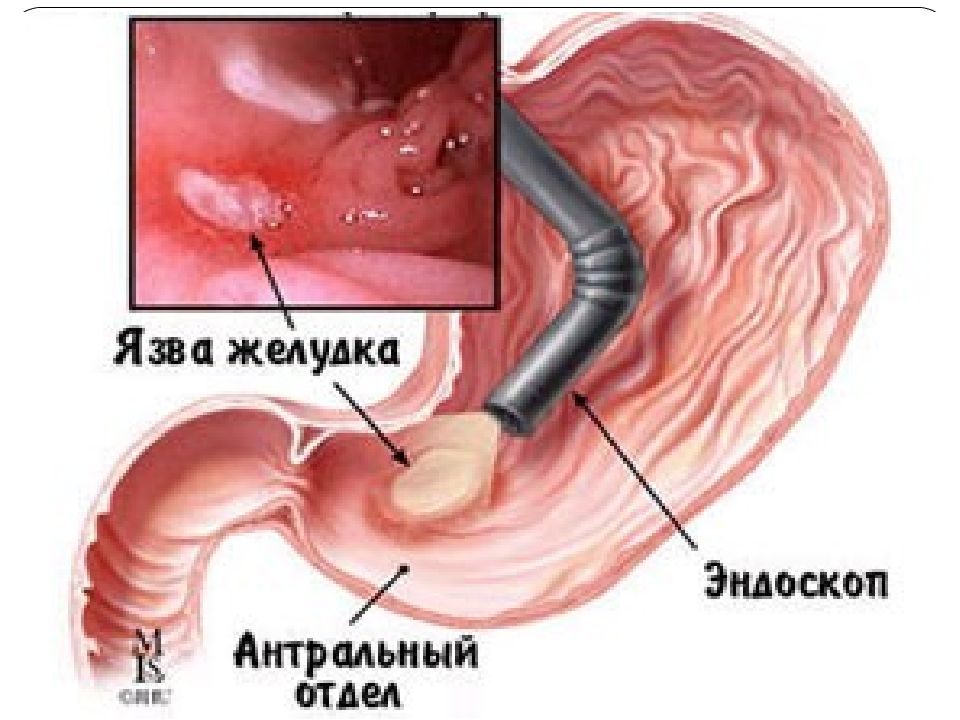 pylori , что указывает на то, что канцерогенные механизмы при этом типе рака могут быть более тесно связаны с воспалением, чем с механизмами, которые появляются при атрофическом гастрите или кислоте. свободный желудок [37, 38].С другой стороны, при типе рака кишечника явные опухоли или предраковые поражения часто связаны с гипохлоргидритом желудка, выраженным атрофическим гастритом и обширным ИМ в подлежащей слизистой оболочке [37, 38, 70, 71]. Следовательно, канцерогенные процессы при этом типе рака могут быть связаны с механизмами, которые возникают при атрофическом гастрите или запускаются гипохлоргидридом или бескислотным желудком.
pylori , что указывает на то, что канцерогенные механизмы при этом типе рака могут быть более тесно связаны с воспалением, чем с механизмами, которые появляются при атрофическом гастрите или кислоте. свободный желудок [37, 38].С другой стороны, при типе рака кишечника явные опухоли или предраковые поражения часто связаны с гипохлоргидритом желудка, выраженным атрофическим гастритом и обширным ИМ в подлежащей слизистой оболочке [37, 38, 70, 71]. Следовательно, канцерогенные процессы при этом типе рака могут быть связаны с механизмами, которые возникают при атрофическом гастрите или запускаются гипохлоргидридом или бескислотным желудком.
Риск рака
Атрофический гастрит и бескислотный желудок являются наиболее важными независимыми состояниями риска рака желудка, известными на сегодняшний день.Статистически атрофический гастрит представляет собой более высокий риск рака, чем инфекция H. pylori в чистом виде [69]. Вероятность рака желудка при гастрите возрастает экспоненциально с прогрессированием гастрита H. pylori из неатрофической формы в атрофическую [69]. Риск может возрасти даже до 90 раз у пациентов с тяжелым атрофическим гастритом как антрального отдела, так и тела (тяжелая панатрофия; мультифокальный атрофический гастрит (MAG)) по сравнению с риском рака у пациентов с нормальной и здоровой слизистой оболочкой желудка () [69] .
pylori из неатрофической формы в атрофическую [69]. Риск может возрасти даже до 90 раз у пациентов с тяжелым атрофическим гастритом как антрального отдела, так и тела (тяжелая панатрофия; мультифокальный атрофический гастрит (MAG)) по сравнению с риском рака у пациентов с нормальной и здоровой слизистой оболочкой желудка () [69] .
Риск рака значительно ниже у людей без гастрита H. pylori , то есть у людей со здоровой слизистой оболочкой желудка. Риск увеличивается примерно в два раза у пациентов с чистой инфекцией H. pylori , т.е. у пациентов с неатрофическим гастритом H. pylori [60, 61, 69]. Таким образом, у пациентов с DU, которые обычно имеют неатрофический гастрит H. pylori , риск рака немного выше, чем риск рака у здоровых субъектов, но этот риск, тем не менее, все еще очень низок по сравнению с риском рака. у пациентов с тяжелым и запущенным атрофическим гастритом (см.).
Парадоксально, но нагрузка на слизистую оболочку желудка хеликобактериями обычно высока у субъектов с относительно низким риском рака, как и у обычных пациентов с ЯН. Как это ни парадоксально, нагрузка имеет тенденцию уменьшаться, когда повышается риск рака, как это имеет место у пациентов с далеко зашедшим атрофическим гастритом [69]. Риск рака может быть, например, высоким у субъектов с тяжелым атрофическим гастритом и бескислотным желудком, у которых может даже не быть объективных признаков продолжающегося H.pylori , то есть у пациентов, у которых, возможно, исчезла первоначальная инфекция H. pylori .
Как это ни парадоксально, нагрузка имеет тенденцию уменьшаться, когда повышается риск рака, как это имеет место у пациентов с далеко зашедшим атрофическим гастритом [69]. Риск рака может быть, например, высоким у субъектов с тяжелым атрофическим гастритом и бескислотным желудком, у которых может даже не быть объективных признаков продолжающегося H.pylori , то есть у пациентов, у которых, возможно, исчезла первоначальная инфекция H. pylori .
Сиднейская система и оперативное звено по классификации гастритов
Признание того, что инфекция H. pylori и последующий атрофический гастрит и отсутствие кислоты в желудке являются важными фоновыми состояниями рака желудка, позволяет сортировать пациентов в клинической практике по значимым группы относительно риска рака. Эта сортировка требует обследования субъектов с помощью эндоскопии и эндоскопической биопсии или может быть проведена с помощью неинвазивных анализов крови с использованием биомаркеров, специфичных для желудка [72, 73, 74, 75, 76, 77].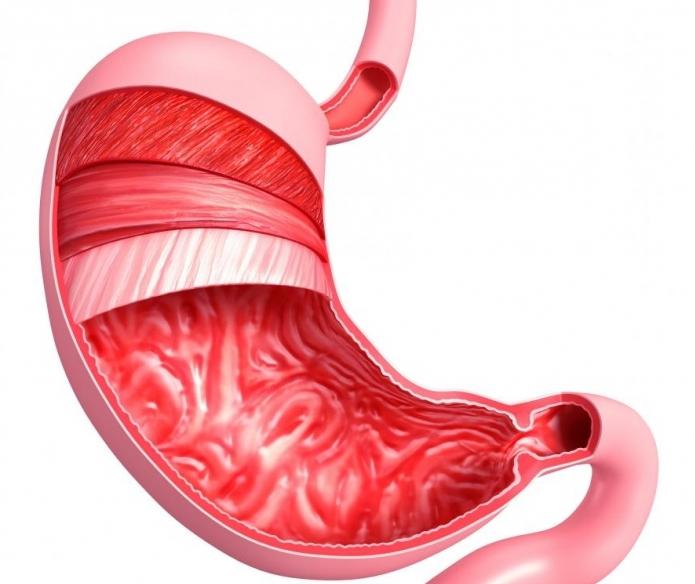
Сиднейская система и ее обновление являются руководящими принципами для интерпретации микроскопических проявлений биоптатов в практике эндоскопии [5, 6]. Надлежащий протокол биопсии и правильное считывание результатов биопсии под микроскопом являются фундаментальными требованиями для правильного и успешного разделения пациентов на клинически значимые группы риска [78, 79]. Такие классификации или родословные невозможны только с помощью эндоскопии или не могут быть выполнены с помощью тестирования H.pylori отдельно.
Стадия OLGA / OLGIM (Оперативная ссылка на гастрит / оценка IM) атрофического гастрита представляет собой практическую схему классификации пациентов в группы низкого, среднего и высокого риска рака желудка [79]. Эта классификация делит пациентов на пять подгрупп (0 – IV) с сильно различающейся вероятностью развития или заболеть раком желудка (). Классификация и сортировка могут объективно подсказать, какой из пациентов будет нуждаться в большинстве случаев эндоскопического наблюдения и последующего наблюдения [79, 80].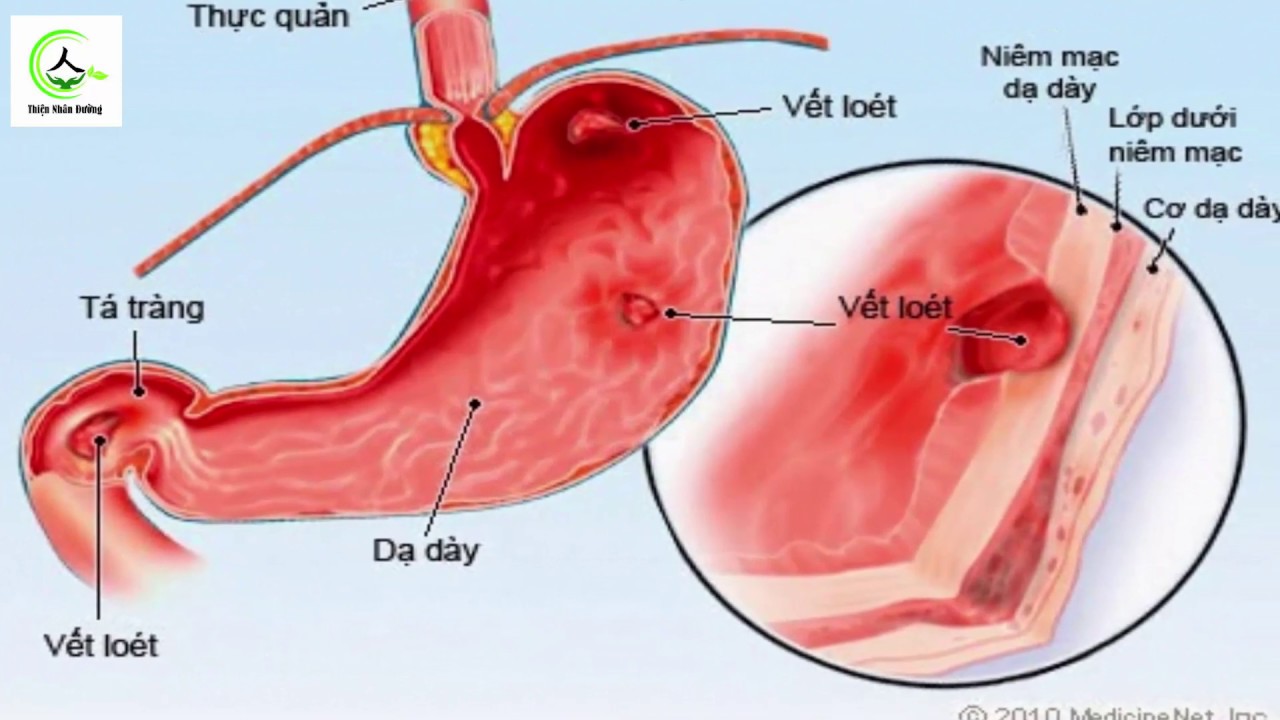
OLGA: стадия риска рака желудка. Изменено из статьи Рагге и др. [79]. Определение стадии – это практический инструмент для разделения пациентов на группы высокого (III – IV стадии) и низкого (0 – II стадии) риска рака, в частности рака желудка кишечного типа. Определение стадии требует эндоскопии и надлежащей практики биопсии, но также может быть выполнено неинвазивно с помощью анализа крови с применением определенных биомаркеров (пепсиноген I и II, гастрин-17 и серология Helicobacter pylori ), которые отражают функцию (секреция кислоты) и структура слизистой оболочки антрального отдела и тела в плазме / сыворотке крови.
Разделение субъектов на подкатегории OLGA может быть выполнено также неэндоскопически и неинвазивно с помощью простых анализов крови, основанных на оценке уровней биомаркеров, специфичных для желудка (пепсиногены I и II, гастрин-17 и H. pylori ) в плазме / сыворотке крови [72, 73, 74, 77, 80]. Это невозможно сделать с помощью одного теста H.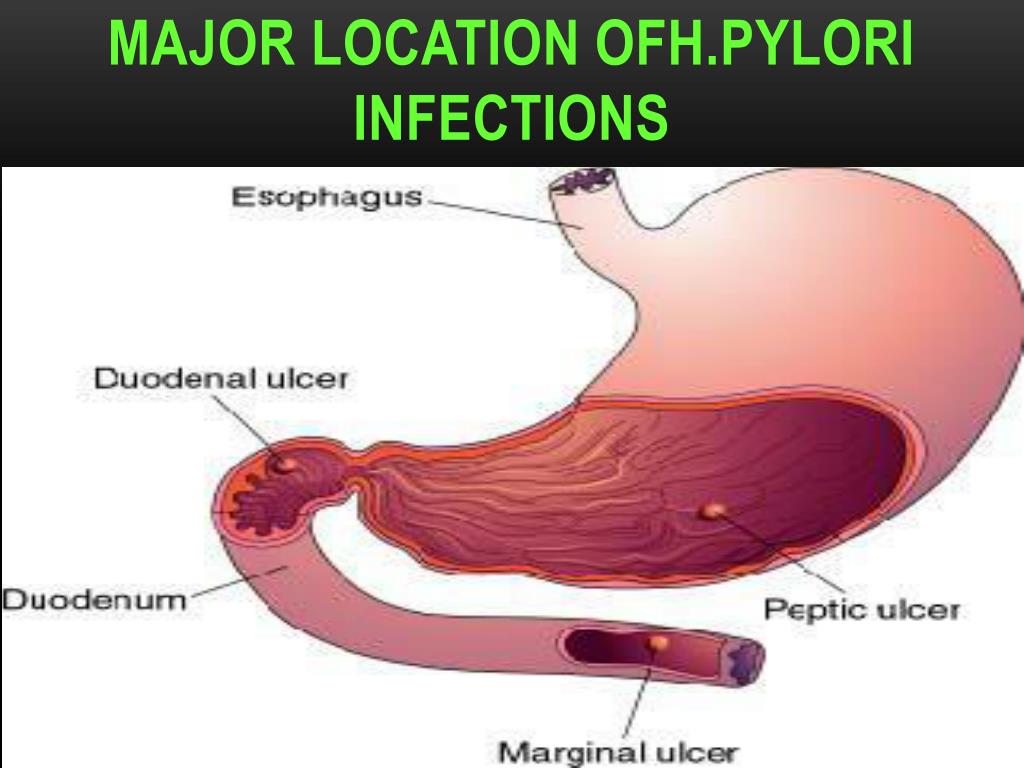 pylori .
pylori .
Плазменные биомаркеры в диагностике и скрининге атрофического гастрита
Очистка желудочных пепсиногенов в 70-е годы, понимание естественного течения H.pylori , уникальные инновации в методах вертикального измерения микропланшетов и разработка тестов ELISA со специфическими моноклональными антителами предоставили приложения для использования желудочных биомаркеров в неинвазивной диагностике и скрининге атрофического гастрита на основе простого образца крови [81, 82, 83 ]. В настоящее время эти анализы крови надежно могут быть выполнены в любой лаборатории и не требуют специальных мероприятий. Несколько подробных и всесторонних обзоров, согласованных отчетов и руководств по практическому использованию тестов на биомаркеры в диагностике атрофического гастрита были опубликованы ранее в этом и других медицинских журналах (см. Ссылки [72, 80, 84]).
Несколько коммерческих радиоиммуноанализов и тестов ELISA были доступны для пепсиногена 1 и 2 в течение довольно долгого времени. Однако у этих тестов есть ограничения, поскольку они могут использоваться только для диагностики атрофического гастрита тела [74]. Уровни пепсиногенов 1 и 2 в сыворотке крови не указывают на возможный атрофический гастрит в антральном отделе желудка, где, однако, сначала появляются атрофические и метапластические изменения. Более полный тест (GastroPanel®) включает анализ уровней G-17 в плазме в дополнение к анализам пепсиногена 1 и пепсиногена 2, а также включает анализ H.pylori серологический тест. Эта тестовая панель позволяет оценить атрофию также в антральном отделе желудка и дает намёки на внутрижелудочную кислотность в дополнение к информации о возможной атрофии тела, что делает возможной всестороннюю классификацию OLGA [72, 73, 77, 78, 80].
Однако у этих тестов есть ограничения, поскольку они могут использоваться только для диагностики атрофического гастрита тела [74]. Уровни пепсиногенов 1 и 2 в сыворотке крови не указывают на возможный атрофический гастрит в антральном отделе желудка, где, однако, сначала появляются атрофические и метапластические изменения. Более полный тест (GastroPanel®) включает анализ уровней G-17 в плазме в дополнение к анализам пепсиногена 1 и пепсиногена 2, а также включает анализ H.pylori серологический тест. Эта тестовая панель позволяет оценить атрофию также в антральном отделе желудка и дает намёки на внутрижелудочную кислотность в дополнение к информации о возможной атрофии тела, что делает возможной всестороннюю классификацию OLGA [72, 73, 77, 78, 80].
Антральный атрофический гастрит (потеря антральных желез) сопровождается потерей антральных G-клеток, потеря которых приводит к низким уровням в плазме как натощак, так и стимулированного гастрина-17 (после питья протеинового порошка, стимуляции бомбезином (гастрином). высвобождающий пептид) или стимуляция ингибитором протонной помпы (ИПП)).Низкий уровень G-17 в плазме натощак (1 пмоль / л или меньше) на практике указывает на два варианта. Либо имеется развитый атрофический гастрит в антральном отделе (класс III – IV по OLGA), либо низкий уровень G-17 является результатом высокой внутрижелудочной кислотности (низкий pH). Оба варианта являются показаниями для верхней ги-эндоскопии из-за риска рака из-за возможной атрофии антрального отдела и из-за риска язвенной болезни из-за гиперхлоргидрии (выделения с высоким содержанием кислоты) (см.)
высвобождающий пептид) или стимуляция ингибитором протонной помпы (ИПП)).Низкий уровень G-17 в плазме натощак (1 пмоль / л или меньше) на практике указывает на два варианта. Либо имеется развитый атрофический гастрит в антральном отделе (класс III – IV по OLGA), либо низкий уровень G-17 является результатом высокой внутрижелудочной кислотности (низкий pH). Оба варианта являются показаниями для верхней ги-эндоскопии из-за риска рака из-за возможной атрофии антрального отдела и из-за риска язвенной болезни из-за гиперхлоргидрии (выделения с высоким содержанием кислоты) (см.)
Отсутствие антител к H. pylori одновременно с наличием нормальных уровней пепсиногена 1 в плазме, нормальным соотношением пепсиногена 1 к пепсиногену 2 и нормальным гастрином-17 в плазме при условии, что возможное лечение ИПП находится под контролем, это результат теста, который достоверно свидетельствует о наличии нормальной и здоровой слизистой оболочки желудка (класс 0 по OLGA).Риск рака и язвенной болезни у таких «здоровых» людей крайне низок, практически нулевой.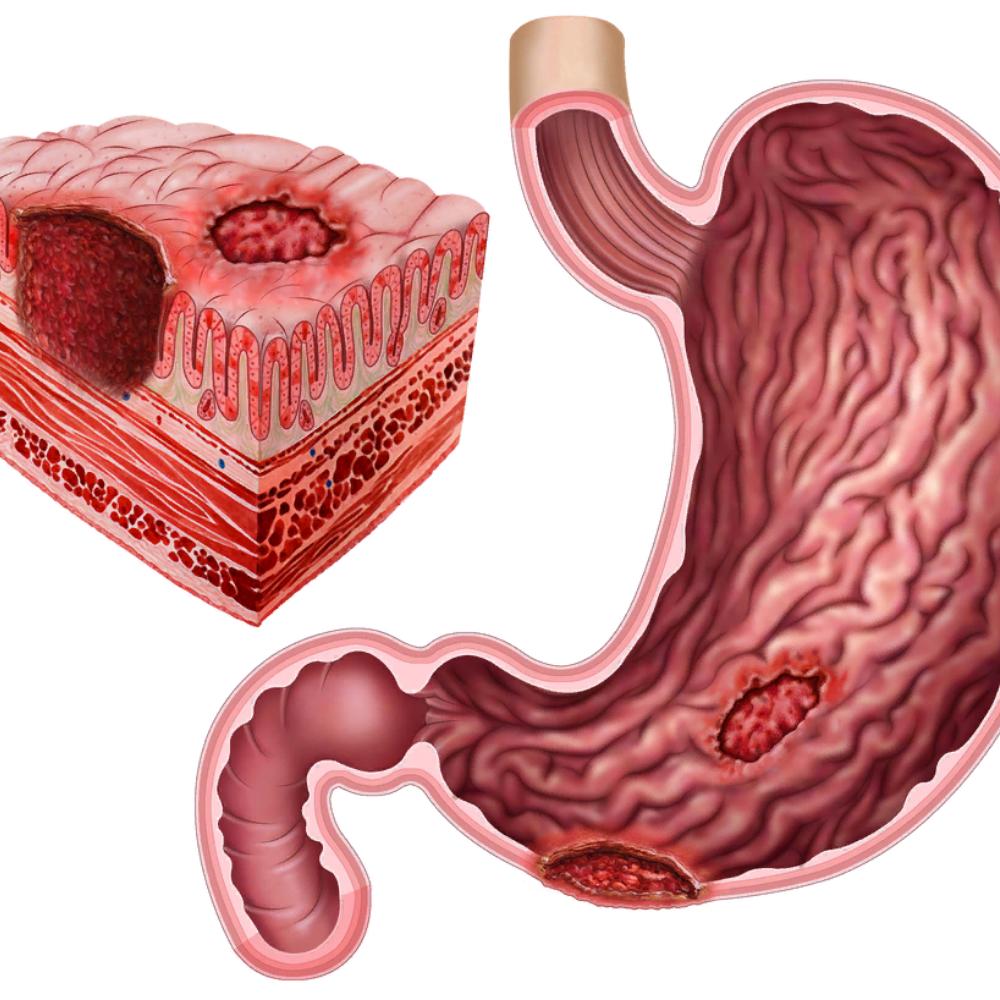 С другой стороны, риск рака желудка высок (класс III-IV по OLGA) у субъектов с низким уровнем пепсиногена 1 натощак (менее 30 мкг / л), с низким соотношением пепсиногена 1 к пепсиногену 2 (ниже 3 ) и с высоким содержанием гастрина-17 натощак (выше 7 пмоль / л), риск рака у этих пациентов высок независимо от того, есть ли у пациента текущая инфекция H. pylori (см.) [72, 80].Атрофический гастрит в этих случаях является развитым и обширным, занимает всю слизистую оболочку желудка (класс IV по OLGA), при этом желудок не содержит кислоты.
С другой стороны, риск рака желудка высок (класс III-IV по OLGA) у субъектов с низким уровнем пепсиногена 1 натощак (менее 30 мкг / л), с низким соотношением пепсиногена 1 к пепсиногену 2 (ниже 3 ) и с высоким содержанием гастрина-17 натощак (выше 7 пмоль / л), риск рака у этих пациентов высок независимо от того, есть ли у пациента текущая инфекция H. pylori (см.) [72, 80].Атрофический гастрит в этих случаях является развитым и обширным, занимает всю слизистую оболочку желудка (класс IV по OLGA), при этом желудок не содержит кислоты.
Будущие тенденции и инициатива в отношении здорового желудка
Несмотря на то, что гастрит H. pylori сокращается по распространенности, хронический гастрит по-прежнему будет чрезвычайно частым заболеванием во всем мире в течение нескольких будущих десятилетий. В связи с микробным происхождением и инфекционным фоном, а также знаниями эпидемиологии и естественным течением хронического H.pylori , можно предположить, что это заболевание может окончательно исчезнуть из общества вместе с улучшениями в гигиене и социально-экономическом развитии. Благодаря этим улучшениям риск заражения H. pylori в детстве снизится. Как и в случае с туберкулезом, хронический гастрит может в ближайшие десятилетия отойти на периферию медицинской практики и значимости, по крайней мере, в развитых странах. Следовательно, пептические язвы будут редкими, а рак желудка станет редким злокачественным новообразованием.
Благодаря этим улучшениям риск заражения H. pylori в детстве снизится. Как и в случае с туберкулезом, хронический гастрит может в ближайшие десятилетия отойти на периферию медицинской практики и значимости, по крайней мере, в развитых странах. Следовательно, пептические язвы будут редкими, а рак желудка станет редким злокачественным новообразованием.
Среди самых молодых коренных жителей в когортах в западных странах около 90–100% людей уже сейчас имеют и будут иметь нормальный здоровый желудок на протяжении всей жизни, в результате чего в конечном итоге у подавляющего большинства людей есть здоровый желудок и, следовательно, не подвержены риску развития язвенной болезни или рака желудка. Попытки сохранить или получить здоровый желудок для всех будут инициативой и целью как будущих исследований, так и клинической практики («инициатива здорового желудка»; см .: www.hsinitiative.org).
Благодарности
Декларация интересов : Доктор Пентти Сиппонен является акционером и членом научного комитета Biohit Oyj.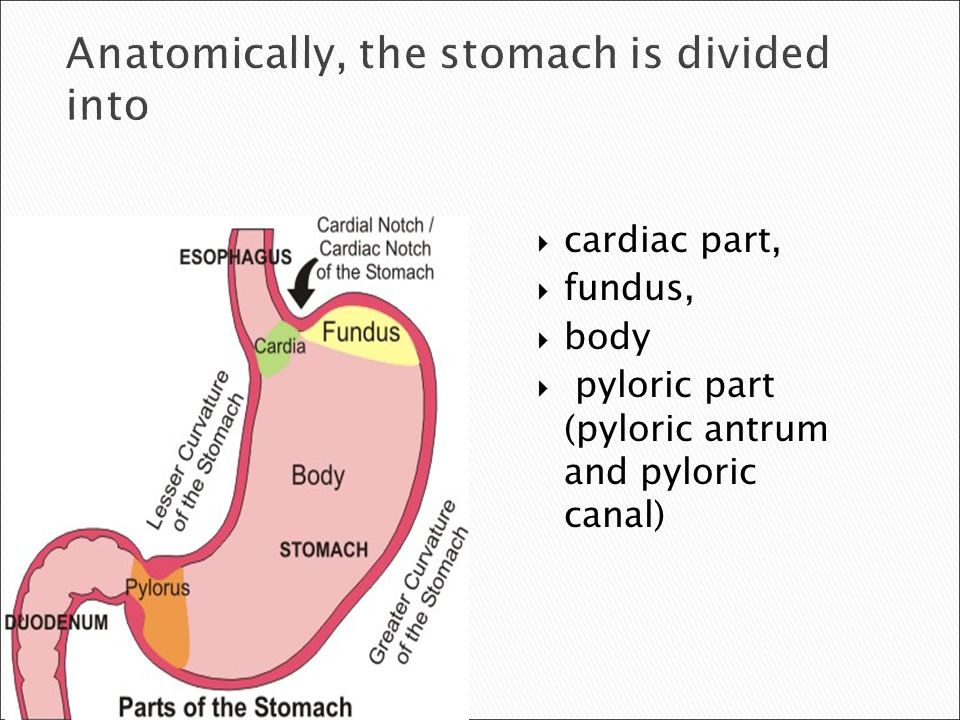 Компания разрабатывает и продает лабораторные тесты, в основном, на желудочно-кишечные заболевания.
Компания разрабатывает и продает лабораторные тесты, в основном, на желудочно-кишечные заболевания.
Ссылки
- IARC Шистосомы, печеночные двуустки и Helicobacter pylori. Рабочая группа МАИР по оценке канцерогенных рисков для людей. Лион, 7-14 июня 1994 г. IARC Monogr Eval Carcinog Risks Hum.1994; 61: 1–241. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Шиндлер Р. Хронический гастрит. Klin Wochenschr. 1966; 44: 601–12. [PubMed] [Google Scholar]
- Сирала М. История гастрита. Scand J Gastroenterol Suppl. 1991; 186: 1–3. [PubMed] [Google Scholar]
- Telaranta-Keerie A, Kara R, Paloheimo L, Härkönen M, Sipponen P. Распространенность недиагностированного прогрессирующего атрофического гастрита тела в Финляндии: обсервационное исследование среди 4256 добровольцев без особых жалоб.Сканд Дж Гастроэнтерол. 2010; 45: 1036–41. [PubMed] [Google Scholar]
- Price AB. Сиднейская система: гистологическое деление. J Gastroenterol Hepatol. 1991; 6: 209–22.
 [PubMed] [Google Scholar]
[PubMed] [Google Scholar] - Диксон М.Ф., Гента Р.М., Ярдли Дж. Х., Корреа П. Классификация и классификация гастрита. Обновленная Сиднейская система. Международный семинар по гистопатологии гастрита, Хьюстон, 1994. Am J Surg Pathol. 1996; 20: 1161–81. [PubMed] [Google Scholar]
- Корреа П. Хронический гастрит: клинико-патологическая классификация.Am J Gastroenterol. 1988; 83: 504–9. [PubMed] [Google Scholar]
- Маршалл Б.Дж., Уоррен-младший. Неопознанные изогнутые бациллы в желудке больных гастритом и язвенной болезнью. Ланцет. 1984; 323: 1311–15. [PubMed] [Google Scholar]
- Варис К. Семья поведения при хроническом гастрите. Ann Clin Res. 1981; 13: 123–9. [PubMed] [Google Scholar]
- Валле Дж., Сеппала К., Сиппонен П., Косунен Т. Исчезновение гастрита после искоренения Helicobacter pylori. Морфометрическое исследование.Сканд Дж Гастроэнтерол. 1991; 26: 1057–65. [PubMed] [Google Scholar]
- Ходзё М., Мива Х., Окуса Т., Окура Р., Куросава А.
 , Сато Н. Изменение гистологического гастрита после излечения от инфекции Helicobacter pylori. Алимент Pharmacol Ther. 2002; 16: 1923–32. [PubMed] [Google Scholar]
, Сато Н. Изменение гистологического гастрита после излечения от инфекции Helicobacter pylori. Алимент Pharmacol Ther. 2002; 16: 1923–32. [PubMed] [Google Scholar] - Аннибале Б., Ди Джулио Е., Каруана П., Ланер Е., Капурсо Г., Борди С. и др. Долгосрочные эффекты лечения инфекции Helicobacter pylori у пациентов с атрофическим гастритом тела. Алимент Pharmacol Ther. 2002; 16: 1723–31.[PubMed] [Google Scholar]
- Arkkila PE, Seppälä K, Färkkilä MA, Veijola L, Sipponen P. Эрадикация Helicobacter pylori в лечении атрофического гастрита: перспективное исследование в течение одного года. Сканд Дж Гастроэнтерол. 2006; 41: 782–90. [PubMed] [Google Scholar]
- Сиурала М., Варис К., Вильясало М. Исследования пациентов с атрофическим гастритом: наблюдение через 10–15 лет. Сканд Дж Гастроэнтерол. 1966; 1: 40–8. [PubMed] [Google Scholar]
- Виллако К., Кекки М., Тамм А., Таммур Р., Сависаар Э., Вийрсалу В. и др.Эпидемиология и динамика гастрита в репрезентативной выборке городского населения Эстонии.
 Сканд Дж Гастроэнтерол. 1982; 17: 601–7. [PubMed] [Google Scholar]
Сканд Дж Гастроэнтерол. 1982; 17: 601–7. [PubMed] [Google Scholar] - Ихамаки Т., Кекки М., Сиппонен П., Сиурала М. Последствия и течение хронического гастрита во время контрольного биопсийного исследования в течение 30–34 лет. Сканд Дж Гастроэнтерол. 1985; 20: 485–91. [PubMed] [Google Scholar]
- Маарус Х.И., Виллако К.П., Сиппонен П., Кекки М., Сирала М., Таммур Р. и др. Helicobacter pylori и хронический гастрит в материале биопсии желудка в группе случайно выбранных взрослых жителей Эстонии.Арх Патол. 1990; 52: 9–11. [PubMed] [Google Scholar]
- Кекки М., Маарус Х.И., Сиппонен П., Уйбо Р., Таммур Р., Тамм А. и др. Степень колонизации Helicobacter pylori по отношению к гастриту: последующее шестилетнее популяционное исследование. Scand J Gastroenterol Suppl. 1991; 186: 142–50. [PubMed] [Google Scholar]
- Виллако К., Кекки М., Маарус Х.И., Сиппонен П., Уйбо Р., Таммур Р. и др. Хронический гастрит: прогрессирование воспаления и атрофии при шестилетнем эндоскопическом наблюдении за случайной выборкой из 142 городских жителей Эстонии.
 Scand J Gastroenterol Suppl. 1991; 186: 135–41. [PubMed] [Google Scholar]
Scand J Gastroenterol Suppl. 1991; 186: 135–41. [PubMed] [Google Scholar] - Валле Дж., Кекки М., Сиппонен П., Ихамаки Т., Сирала М. Долгосрочное течение и последствия гастрита, вызванного Helicobacter pylori. Результаты 32-летнего наблюдения. Сканд Дж Гастроэнтерол. 1996; 31: 546–50. [PubMed] [Google Scholar]
- Виллако К., Кекки М., Маарус Х.И., Сиппонен П., Таммур Р., Тамм А. и др. 12-летнее контрольное исследование хронического гастрита и Helicobacter pylori в случайной выборке из популяции. Сканд Дж Гастроэнтерол.1995; 30: 964–7. [PubMed] [Google Scholar]
- Маарус Х.И., Воробьева Т., Сиппонен П., Таммур Р., Уйбо Р., Вадстрём Т. и др. 18-летнее катамнестическое исследование связи хронического гастрита и Helicobacter pylori положительности CagA с развитием атрофии и активностью гастрита. Сканд Дж Гастроэнтерол. 1999; 34: 864–9. [PubMed] [Google Scholar]
- Сиурала М., Сиппонен П., Кекки М. Хронический гастрит: динамические и клинические аспекты. Scand J Gastroenterol Suppl.
 1985; 109: 69–76. [PubMed] [Google Scholar]
1985; 109: 69–76. [PubMed] [Google Scholar] - Сиппонен П., Кекки М., Сирала М.Сиднейская система: эпидемиология и естественная история хронического гастрита. J Gastroenterol Hepatol. 1991; 6: 244–51. [PubMed] [Google Scholar]
- Maaroos HI, Rägo T., Sipponen P, Siurala M. Helicobacter pylori и гастрит у детей с жалобами на брюшную полость. Сканд Дж Гастроэнтерол. 1991; 26: 95–9. [PubMed] [Google Scholar]
- Maaroos HI, Kekki M, Villako K, Sipponen P, Tamm A, Sadeniemi L. Частота и степень колонизации Helicobacter pylori и профили антрального и телесного гастрита в выборке населения Эстонии.Сканд Дж Гастроэнтерол. 1990; 25: 1010–17. [PubMed] [Google Scholar]
- Кекки М., Сирала М., Варис К., Сиппонен П., Систонен П., Неванлинна HR. Принципы классификации и генетика хронического гастрита. Scand J Gastroenterol Suppl. 1987. 141: 1–28. [PubMed] [Google Scholar]
- Ихамаки Т., Сиппонен П., Варис К., Кекки М., Сирала М. Характеристики слизистой оболочки желудка, предшествующие возникновению злокачественного новообразования желудка: результаты длительного наблюдения трех семейных образцов.
 Scand J Gastroenterol Suppl.1991; 186: 16–23. [PubMed] [Google Scholar]
Scand J Gastroenterol Suppl.1991; 186: 16–23. [PubMed] [Google Scholar] - Maaroos HI, Kekki M, Villako K, Sipponen P, Tamm A, Sadeniemi L. Частота и степень колонизации Helicobacter pylori и профили антрального и телесного гастрита в выборке населения Эстонии. Сканд Дж Гастроэнтерол. 1990; 25: 1010–17. [PubMed] [Google Scholar]
- Раутелин Х., Сиппонен П., Сеппала К., Сарна С., Даниэльссон Д., Косунен Т.У. Воспаление желудка и штаммы Helicobacter pylori, активирующие нейтрофилы и продуцирующие цитотоксины.Сканд Дж Гастроэнтерол. 1996; 31: 639–42. [PubMed] [Google Scholar]
- Кекки М., Сирала М., Ихамаки Т. Обогащение комбинированного атрофического гастрита антрального отдела и тела («комбинированный АГ») у братьев и сестер пациентов с карциномой желудка. Scand J Gastroenterol Suppl. 1991; 186: 24–8. [PubMed] [Google Scholar]
- Варис К. Эпидемиология гастрита. Scand J Gastroenterol Suppl. 1982; 79: 44–51. [PubMed] [Google Scholar]
- Сиппонен П.
 , Валле Дж., Варис К., Кекки М., Ихамаки Т., Сирала М. Уровни сывороточного гастрина натощак при различных функциональных и морфологических состояниях слизистой оболочки антрофунда.Анализ 860 предметов. Сканд Дж Гастроэнтерол. 1990; 25: 513–19. [PubMed] [Google Scholar]
, Валле Дж., Варис К., Кекки М., Ихамаки Т., Сирала М. Уровни сывороточного гастрина натощак при различных функциональных и морфологических состояниях слизистой оболочки антрофунда.Анализ 860 предметов. Сканд Дж Гастроэнтерол. 1990; 25: 513–19. [PubMed] [Google Scholar] - Sipponen P, Kekki M, Seppälä K, Siurala M. Взаимосвязь между хроническим гастритом и секрецией желудочного сока. Алимент Pharmacol Ther. 1996; 10: 103–18. [PubMed] [Google Scholar]
- Кекки М., Ихамаки Т., Варис К., Сирала М. Профили хронического гастрита у братьев и сестер пробандов, рассчитанные как имеющие повышенный риск рака желудка. Scand J Gastroenterol Suppl. 1991; 186: 29–32. [PubMed] [Google Scholar]
- Коккола А., Косунен Т.У., Пуолаккайнен П., Сиппонен П., Херконен М., Лаксен Ф. и др.Спонтанное исчезновение антител к Helicobacter pylori у пациентов с запущенным атрофическим гастритом тела. APMIS. 2003; 111: 619–24. [PubMed] [Google Scholar]
- Сиппонен П., Кекки М., Сирала М.
 Возрастные тенденции гастрита и кишечной метаплазии у пациентов с карциномой желудка и в контрольной группе, представляющей население в целом. Br J Рак. 1984; 49: 521–30. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Возрастные тенденции гастрита и кишечной метаплазии у пациентов с карциномой желудка и в контрольной группе, представляющей население в целом. Br J Рак. 1984; 49: 521–30. [Бесплатная статья PMC] [PubMed] [Google Scholar] - Сиппонен П., Кекки М., Сирала М. Атрофический хронический гастрит и кишечная метаплазия при раке желудка.Сравнение с репрезентативной выборкой населения. Рак. 1983; 52: 1062–8. [PubMed] [Google Scholar]
- Корреа П., Пиасуэло МБ. Предраковый каскад желудка. J Dig Dis. 2012; 13: 2–9. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- You WC, Li JY, Blot WJ, Chang YS, Jin ML, Gail MH, et al. Эволюция предраковых поражений у сельского населения Китая с высоким риском рака желудка. Int J Cancer. 1999; 83: 615–19. [PubMed] [Google Scholar]
- Корреа П., Хансель В., Куэлло С., Завала Д., Фонтам Е., Зарама Г. и др.Предраковый процесс желудка в популяции высокого риска: когортное наблюдение. Cancer Res. 1990; 50: 4737–40. [PubMed] [Google Scholar]
- Sipponen P, Helske T.
 , Järvinen P, Hyvärinen H, Seppälä K, Siurala M. Снижение распространенности хронического гастрита за 15 лет: анализ амбулаторных исследований в Финляндии с 1977, 1985 и 1992. Gut. 1994; 35: 1167–71. [Бесплатная статья PMC] [PubMed] [Google Scholar]
, Järvinen P, Hyvärinen H, Seppälä K, Siurala M. Снижение распространенности хронического гастрита за 15 лет: анализ амбулаторных исследований в Финляндии с 1977, 1985 и 1992. Gut. 1994; 35: 1167–71. [Бесплатная статья PMC] [PubMed] [Google Scholar] - Сиппонен П. Гастрит с Helicobacter pylori – эпидемиология. J Gastroenterol. 1997. 32: 273–7.[PubMed] [Google Scholar]
- Уна М., Утт М., Нильссон И., Уйбо О., Воробьева Т., Маарус Х.И. Инфекция Helicobacter pylori у детей в Эстонии: снижение серологической распространенности в течение 11-летнего периода глубоких социально-экономических изменений. Helicobacter. 2004; 9: 223–41. [PubMed] [Google Scholar]
- Eusebi LH, Zagari RM, Bazzoli F. Эпидемиология инфекции Helicobacter pylori. Helicobacter. 2014; 19: 1–5. [PubMed] [Google Scholar]
- Axon AT. Обзорная статья: передается ли Helicobacter pylori желудочно-оральным путем? Алимент Pharmacol Ther.1995; 9: 585–8. [PubMed] [Google Scholar]
- Варис К., Стенман У.
 Х., Лехтола Дж., Сирала М. Поражение желудка и злокачественная анемия: семейное исследование. Acta Hepatogastroenterol (Stuttg) 1978; 25: 62–7. [PubMed] [Google Scholar]
Х., Лехтола Дж., Сирала М. Поражение желудка и злокачественная анемия: семейное исследование. Acta Hepatogastroenterol (Stuttg) 1978; 25: 62–7. [PubMed] [Google Scholar] - Варис К., Исокоски М. Скрининг гастрита типа А. Ann Clin Res. 1981; 13: 133–8. [PubMed] [Google Scholar]
- Кекки М., Варис К., Похьянпало Х., Исокоски М., Ихамаки Т., Сирала М. Течение антрального и телесного гастрита в семьях с злокачественной анемией. Dig Dis Sci.1983; 28: 698–704. [PubMed] [Google Scholar]
- Воробьева Т., Фаллер Г., Маарус Х.И., Сиппонен П., Виллако К., Уибо Р. и др. Значительное увеличение антигастральных аутоантител в долгосрочном катамнестическом исследовании гастрита, вызванного H.pylori. Арка Вирхова. 2000; 437: 37–45. [PubMed] [Google Scholar]
- Уйбо Р., Воробьева Т., Метцюла К., Кисанд К., Вадстрём Т., Кивик Т. Ассоциация Helicobacter pylori и желудочного аутоиммунитета: популяционное исследование. FEMS Immunol Med Microbiol. 1995; 11: 65–8. [PubMed] [Google Scholar]
- Воробьева Т.
 , Маарус Х.И., Uibo Иммунный ответ на Helicobacter pylori и его связь с динамикой хронического гастрита в антральном отделе и теле.APMIS. 2008. 116: 465–76. [PubMed] [Google Scholar]
, Маарус Х.И., Uibo Иммунный ответ на Helicobacter pylori и его связь с динамикой хронического гастрита в антральном отделе и теле.APMIS. 2008. 116: 465–76. [PubMed] [Google Scholar] - Тахара Э. Генетические пути двух типов рака желудка. IARC Sci Publ. 2004. 157: 327–49. [PubMed] [Google Scholar]
- Qu Y, Dang S, Hou P. Метилирование генов при раке желудка. Clin Chim Acta. 2013; 424: 56–65. [PubMed] [Google Scholar]
- Sipponen P, Laxén F, Huotari K, Härkönen M. Распространенность низкого содержания витамина B12 и высокого гомоцистеина в сыворотке крови у пожилых мужчин: связь с атрофическим гастритом и инфекцией Helicobacter pylori.Сканд Дж Гастроэнтерол. 2003. 38: 1209–16. [PubMed] [Google Scholar]
- Боландер-Гуай К. Сосредоточьтесь на гомоцистеине и витаминах, участвующих в его метаболизме. Франция: Спрингер-Верлаг; 2002. [Google Scholar]
- Sipponen P, Härkönen M. Гипохлоргидрат желудка: состояние риска мальабсорбции кальция и остеопороза? Сканд Дж Гастроэнтерол.
 2010; 45: 133–8. [PubMed] [Google Scholar]
2010; 45: 133–8. [PubMed] [Google Scholar] - Саласпуро, член парламента. Ацетальдегид, микробы и рак пищеварительного тракта. Критик Rev Clin Lab Sci.2003. 40: 183–208. [PubMed] [Google Scholar]
- Саласпуро М. Ацетальдегид как общий знаменатель и совокупный канцероген при раке пищеварительного тракта. Сканд Дж Гастроэнтерол. 2009; 44: 912–25. [PubMed] [Google Scholar]
- Сиппонен П. Хронический гастрит и риск язвы. Сканд Дж Гастроэнтерол. 1990; 25: 193–6. [PubMed] [Google Scholar]
- Sipponen P, Seppälä K, Äärynen M, Helske T., Kettunen P. Хронический гастрит и гастродуоденальная язва: исследование случай-контроль риска сосуществующей язвы двенадцатиперстной кишки или желудка у пациентов с гастритом.Кишечник. 1989; 30: 922–9. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Кекки М., Сиппонен П., Сирала М., Лашевич В. Язвенная болезнь и хронический гастрит: их связь с возрастом и полом, а также с локализацией язвы и гастрита. Гастроэнтерол Clin Biol.
 1990; 14: 217–23. [PubMed] [Google Scholar]
1990; 14: 217–23. [PubMed] [Google Scholar] - Sipponen P, Varis K, Fräki O, Korri UM, Seppälä K, Siurala M. Совокупный 10-летний риск развития симптоматической язвы двенадцатиперстной кишки и желудка у пациентов с хроническим гастритом или без него. Клиническое наблюдение с участием 454 амбулаторных больных.Сканд Дж Гастроэнтерол. 1990; 25: 966–7. [PubMed] [Google Scholar]
- Арккила П.Е., Сеппала К., Косунен Т.Ю., Хаапиайнен Р., Кивилааксо Е., Сиппонен П. и др. Ликвидация Helicobacter pylori улучшает скорость заживления и снижает частоту рецидивов некровоточащих язв у пациентов с кровоточащей язвенной болезнью. Am J Gastroenterol. 2003. 98: 2149–56. [PubMed] [Google Scholar]
- Axon AT. Терапия Helicobacter pylori: влияние на язвенную болезнь. J Gastroenterol Hepatol. 1991; 6: 131–7. [PubMed] [Google Scholar]
- Kosunen TU, Pukkala E, Sarna S, Seppälä K, Aromaa A, Knekt P, et al.Рак желудка у финских пациентов после излечения от инфекции Helicobacter pylori: когортное исследование.
 Int J Cancer. 2011; 128: 433–9. [PubMed] [Google Scholar]
Int J Cancer. 2011; 128: 433–9. [PubMed] [Google Scholar] - Ли Y-C, Chen TH-H, Chiu H-M, Shun CT, Chiang H, Liu TY и др. Польза от массового искоренения инфекции Helicobacter pylori: исследование профилактики рака желудка на уровне сообщества. Кишечник. 2013; 62: 676–82. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Маарус Х.И., Кекки М., Воробьева Т., Салупере В., Сиппонен П. Риск рецидива язвы желудка, хронического гастрита и степень колонизации Helicobacter pylori.Сканд Дж Гастроэнтерол. 1994; 29: 532–6. [PubMed] [Google Scholar]
- Сиппонен П., Кекки М., Хаапакоски Дж., Ихамаки Т., Сирала М. Риск рака желудка при хроническом атрофическом гастрите: статистические расчеты поперечных данных. Int J Cancer. 1985; 35: 173–7. [PubMed] [Google Scholar]
- Sipponen P, Kosunen TU, Valle J, Riihelä M, Seppälä K. Инфекция Helicobacter pylori и хронический гастрит при раке желудка. J Clin Pathol. 1992; 45: 319–23. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Варис К.
 , Тейлор П.Р., Сиппонен П., Самлофф И.М., Хейнонен О.П., Албейнс Д. и др.Рак желудка и предраковые поражения при атрофическом гастрите: контролируемое исследование влияния добавок с альфа-токоферолом и бета-каротином. Хельсинкская группа по изучению гастрита. Сканд Дж Гастроэнтерол. 1998. 33: 294–300. [PubMed] [Google Scholar]
, Тейлор П.Р., Сиппонен П., Самлофф И.М., Хейнонен О.П., Албейнс Д. и др.Рак желудка и предраковые поражения при атрофическом гастрите: контролируемое исследование влияния добавок с альфа-токоферолом и бета-каротином. Хельсинкская группа по изучению гастрита. Сканд Дж Гастроэнтерол. 1998. 33: 294–300. [PubMed] [Google Scholar] - Agréus L, Kuipers EJ, Kupcinskas L., Malfertheiner P, Di Mario F, Leja M, et al. Обоснование диагностики и скрининга атрофического гастрита с использованием биомаркеров плазмы, специфичных для желудка. Сканд Дж Гастроэнтерол. 2012; 47: 136–47. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- ди Марио Ф, Кавалларо LG.Неинвазивные тесты при желудочных заболеваниях. Dig Liver Dis. 2008; 40: 523–30. [PubMed] [Google Scholar]
- Динис-Рибейро М., да Коста-Перейра А., Лопес С., Барбоса Дж., Гильерме М., Морейра-Диас Л. и др. Достоверность соотношения пепсиногена I / II в сыворотке для диагностики дисплазии эпителия желудка и кишечной метаплазии во время наблюдения за пациентами из группы риска по аденокарциноме желудка кишечного типа.
 Неоплазия. 2004. 6: 449–56. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Неоплазия. 2004. 6: 449–56. [Бесплатная статья PMC] [PubMed] [Google Scholar] - Varis K, Kekki M, Härkönen M, Sipponen P, Samloff IM.Сывороточный пепсиноген I и сывороточный гастрин в скрининге атрофического пангастрита с высоким риском рака желудка. Scand J Gastroenterol Suppl. 1991; 186: 117–23. [PubMed] [Google Scholar]
- Кекки М., Самлофф И.М., Варис К., Ихамаки Т. Сывороточный пепсиноген I и сывороточный гастрин в скрининге тяжелого атрофического гастрита тела. Scand J Gastroenterol Suppl. 1991; 186: 109–16. [PubMed] [Google Scholar]
- Sipponen P, Härkönen M, Alanko A, Suovaniemi O. Диагностика атрофического гастрита по образцу сыворотки.Clin Lab. 2002; 48: 505–15. [PubMed] [Google Scholar]
- Sipponen P, Stolte M. Клиническое влияние рутинных биопсий антрального отдела желудка и тела. Эндоскопия. 1997. 29: 671–8. [PubMed] [Google Scholar]
- Рагге М., Меггио А, Пеннелли Дж., Пишоли Ф., Джакомелли Л., Де Претис Дж. И др. Стадия гастрита в клинической практике: стадия OLGA.
 Кишечник. 2007; 56: 631–6. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Кишечник. 2007; 56: 631–6. [Бесплатная статья PMC] [PubMed] [Google Scholar] - Sipponen P, Graham DY. Значение атрофического гастрита в диагностике и профилактике рака желудка: применение биомаркеров плазмы.Сканд Дж Гастроэнтерол. 2007; 42: 2–10. [PubMed] [Google Scholar]
- Самлофф И.М. Пепсиногены I и II: очистка слизистой оболочки желудка и радиоиммуноанализ в сыворотке крови. Гастроэнтерология. 1982; 82: 26–33. [PubMed] [Google Scholar]
- Суованиеми О. Автоматизированное оборудование для клинических и исследовательских лабораторий. Инновации и разработка фотометров с вертикальным световым лучом и электронных пипеток. Университет Хельсинки 1994; Академическая диссертация. [Google Scholar]
- www.biohithealthcare.com/about-us/history Доступно по адресу.
- Мики К. Скрининг рака желудка с помощью комбинированного анализа сывороточных антител IgG к Helicobacter pylori и уровней пепсиногена в сыворотке – «метод ABC» Proc Jpn Acad Ser B Phys Biol Sci.
 2011; 87: 405–14. [Бесплатная статья PMC] [PubMed] [Google Scholar]
2011; 87: 405–14. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Хронический гастрит
Scand J Gastroenterol. 2015 июн 3; 50 (6): 657–667.
Pentti Sipponen
a Patolab Oy, Эспоо, Финляндия и Тартуский государственный университет, Тарту, Эстония
Heidi-Ingrid Maaroos
a Patolab Oy, Espoo, Финляндия и Тартуский государственный университет
, Эстонский государственный университет
, Тартуский государственный университет
a Patolab Oy, Эспоо, Финляндия, и Тартуский государственный университет, Тарту, ЭстонияПоступила 28 января 2015 г .; Пересмотрено 11 февраля 2015 г .; Принята в печать 12 февраля 2015 г.
Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License (http://creativecommons.org/licenses/by/4.0/), которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии, что оригинал эта статья цитируется в других статьях в PMC.Abstract
Распространенность хронического гастрита заметно снизилась в развитых популяциях за последние десятилетия. Однако хронический гастрит по-прежнему остается одной из наиболее распространенных серьезных пандемических инфекций с такими серьезными смертельными последствиями, как язвенная болезнь желудка или рак желудка.В настоящее время в мире в среднем более половины людей могут иметь хронический гастрит. Хеликобактер pylori Инфекция в детстве является основной причиной хронического гастрита, микробное происхождение которого является ключом к пониманию причудливой эпидемиологии и течения болезни. Продолжительное и агрессивное воспаление при гастрите со временем (годы и десятилетия) приводит к разрушению (атрофическому гастриту) слизистой оболочки желудка. Прогрессирующее обострение атрофического гастрита впоследствии приводит к нарушению функции слизистой оболочки желудка.В самых крайних случаях атрофический гастрит в конечном итоге приводит к тому, что желудок постоянно не содержит кислоты. Тяжелый атрофический гастрит и отсутствие кислоты в желудке – это наиболее известные до сих пор независимые состояния риска рака желудка. Помимо риска злокачественных новообразований и язвенной болезни, бескислотный желудок и тяжелые формы атрофического гастрита могут быть связаны с нарушением всасывания основных витаминов, таких как витамин B12, микронутриентов (таких как железо, кальций, магний и цинк), диеты и лекарств. .
Ключевые слова: рак желудка, гастрит, Helicobacter pylori , язвенная болезнь
Введение
Хронический гастрит – одно из самых распространенных пожизненных, серьезных и коварных заболеваний человека.Можно оценить, что более половины населения мира в той или иной степени страдает этим заболеванием, что указывает на то, что даже многие сотни миллионов людей во всем мире могут иметь хронический гастрит в той или иной форме.
Значение хронического гастрита как серьезного заболевания в значительной степени недооценивается в клинической практике, хотя роль гастрита в патогенезе обычных пептических язв и рака желудка очевидна [1, 2, 3, 4]. Можно подсчитать, что ежегодно во всем мире могут происходить миллионы преждевременных смертей из-за рака и язвы, являющихся последствиями хронического гастрита.
Хронический гастрит проявляется в неатрофической или атрофической форме. Это формы и фенотипы гастрита, которые представляют разные стадии одного и того же пожизненного заболевания [2, 3, 5, 6, 7]. Морфологические проявления гастрита во всем мире очень похожи, то есть хронический гастрит, по-видимому, с его последствиями является одним и тем же заболеванием во всем мире.
Хронический гастрит известен и изучается с первых десятилетий 20-го века, но получил большее внимание только в 1982 году после открытия Helicobacter pylori Уорреном и Маршаллом [8].Стало ясно, что бактерия является причиной гастрита в подавляющем большинстве случаев, за возможным исключением гастрита аутоиммунного происхождения [3, 9]. Следовательно, стало очевидно, что хронический гастрит можно вылечить с помощью эрадикации H. pylori , что приведет к нормализации слизистой оболочки желудка, по крайней мере, в тех случаях, когда гастрит не переходит в конечную стадию атрофии (атрофический гастрит) [8 , 9, 10, 11, 12, 13].
Несмотря на то, что основные черты хронического гастрита хорошо известны, некоторые вопросы все еще остаются без ответа.Мы не знаем, например, значения аутоиммунитета или генетики в развитии и прогрессировании хронического гастрита H. pylori . Молекулярные механизмы и роль факторов окружающей среды, таких как диета, и роль микробов, отличных от H. pylori , в течении хронического гастрита, в значительной степени неизвестны. Мы не можем точно предсказать, у кого хронический гастрит обязательно будет прогрессировать до конечной атрофической стадии и смертельных последствий, или у кого этого не произойдет.Эта неопределенность также относится к деталям, благодаря которым гастрит приводит к появлению пептических язв или рака желудка. Однако мы знаем, что без наличия сопутствующего хронического гастрита или атрофического гастрита обычные пептические язвы или рак желудка встречаются редко.
В этом обзоре описаны некоторые наблюдения и представлены некоторые субъективные мнения и замечания о течении и эпидемиологии хронического гастрита H. pylori и связанных с ним заболеваний, полученные в основном из нескольких исследований, проведенных в Эстонии и Финляндии за последние 40 лет [14, 15, 16, 17, 18, 19, 20, 21, 22].За прошедшие годы большинство этих исследований было опубликовано в этом журнале.
Естественное течение
Хронический гастрит – это многоступенчатое, прогрессирующее и пожизненное воспаление [3, 16, 20, 21, 22, 23, 24]. Обычно оно начинается в детстве как простое хроническое («поверхностное») мононуклеарное воспаление с сосуществованием острого («активного») нейтрофильного воспаления разной степени [25, 26]. Гастрит постепенно прогрессирует в течение лет и десятилетий до атрофического гастрита, который характеризуется потерей нормальных слизистых желез либо в антральном отделе, либо в теле (и дне), либо в обоих (, и) [7, 22, 23, 27].Как правило, во всех популяциях повозрастная распространенность как неатрофического, так и атрофического гастрита имеет тенденцию к возрастанию с возрастом, как это было продемонстрировано в Финляндии в. В настоящее время рост повозрастной распространенности гастрита по возрасту более выражен и резок в развивающихся, чем в развитых, популяциях, т. Е. Распространенность гастрита в молодых возрастных группах или даже в детстве гораздо больше, чем в развитых. 50% в развивающихся популяциях, тогда как эта распространенность в развитых странах обычно намного меньше 50% [17, 27].
Слизистая оболочка тела с «активным» хроническим гастритом (A): Воспаление является мононуклеарным, но сопровождается нейтрофилами и эозинофилами (стрелки), которые проникают в поверхностный эпителий. Нормальный (B): нормальная слизистая оболочка тела без каких-либо признаков воспаления показана в качестве эталона. Пятно HE × 500.
Слизистая оболочка тела. Нормальный (A): слой кислородных желез в норме, что позволяет предположить, что слизистая оболочка тела способна нормально секретировать соляную кислоту. Неатрофический гастрит (B): Легкое мононуклеарное воспаление наблюдается в верхнем слое (фовеолярной части) слизистой оболочки («поверхностный хронический гастрит»), как указано стрелками.Слой железы не поврежден, что свидетельствует о нормальной секреции кислоты, несмотря на гастрит. Умеренный атрофический гастрит в теле (C): Интенсивное хроническое мононуклеарное воспаление возникает также в нижних слоях слизистой оболочки и сопровождается заметной потерей (атрофией) нормальных оксинтических желез. Наблюдение предполагает, что желудок гипохлоргидный, но не ахлоргидный. Секреция кислоты нарушается из-за потери париетальных клеток. Тяжелый атрофический гастрит тела (D): хроническое воспаление слабое, но все кислородные железы полностью исчезли.В правом нижнем углу возникают некоторые очаги кишечной метаплазии. Желудок определенно не содержит кислоты (ахлоргидрат). Пациент подвержен риску мальабсорбции витамина B12, а также может быть нарушено всасывание микроэлементов (железа, кальция, магния и цинка). Патолог может столкнуться с трудностями при обнаружении бактерий Helicobacter pylori в подобных случаях, даже если атрофический гастрит имеет происхождение H. pylori . Вместо этого смешанная микробная флора (микробы, отличные от H.pylori ) часто встречается на поверхности слизистой оболочки в подобных случаях. Альциановый синий – PAS и модифицированные красители Гимза × 300.
Слизистая оболочка антрального отдела. Нормальный (A): Нормальное количество антральных G-клеток с типичным «ореолом» встречается в области шеи пилорических желез (стрелки). Неатрофический хронический гастрит (B): мононуклеарное воспаление охватывает всю слизистую оболочку, создавая впечатление потери железы (атрофии). Атрофический гастрит от легкой до умеренной степени в антральном отделе (C): Воспаление относительно легкое, но большая часть пилорических желез утрачена и заменена метапластическими железами (IM), как указано стрелками.Тяжелый атрофический гастрит в антральном отделе (D): все пилорические железы отсутствуют, а вся слизистая оболочка «кишечно-кишечная». Воспаление слабое или самое большее умеренное. Также исчезают антральные G-клетки вместе с потерей нормальных пилорических желез. Следовательно, реакция обратной связи G-17 в физиологическом контроле секреции кислоты нарушается. HE и альциановый синий – пятна PAS × 300.
Средняя повозрастная распространенность тотального хронического гастрита и атрофического гастрита в биоптатах от ~ 500 последовательных эндоскопических финских амбулаторных пациентов в конце 80-х годов (больница Йорви, Эспоо, Финляндия).Средняя распространенность увеличивается с возрастом.
Утрата слизистых желез при атрофическом гастрите сменяется ростом новых незрелых железистых и эпителиальных элементов; то есть с железами кишечного типа («кишечная метаплазия (IM)»), напоминающими железы и эпителий в толстой и / или тонкой кишке, и / или с железами пилорического типа («псевдопилорическая метаплазия»), напоминающими пилорические железы и эпителий, из которых G-клетки (гастриновые клетки) исчезают. В рамках эволюции высокодифференцированные железы, эпителий и клетки разрушаются при атрофии (атрофический гастрит), а утраченные железы заменяются железами и эпителием с незрелыми кишечными свойствами [2, 5, 6, 7, 14, 17, 23 , 24, 27, 28].и приведем несколько примеров этих явлений при патологии эндоскопической биопсии.
Первые проявления гастрита H. pylori этиологии имеют тенденцию к антральному, т.е. гастрит «преобладает в антральном отделе» [25, 27]. Воспаление, состоящее в основном из мононуклеарных воспалительных клеток и плазматических клеток, является «поверхностным» и занимает верхние слои слизистой оболочки, особенно в теле () [2, 20, 27, 28, 29]. Хроническое воспаление связано с нейтрофильным воспалением (), причем интенсивность этого острого и «активного» компонента гастрита, скорее всего, зависит от цитотоксичности H.pylori [22, 30]. Чем цитотоксичнее штамм, тем активнее и, очевидно, агрессивнее хронический гастрит. Наиболее агрессивными формами хронического гастрита являются те, которые с наибольшей вероятностью приводят к запущенным стадиям атрофического гастрита, т. Е. Представляют собой формы гастрита H. pylori с наибольшей вероятностью прогрессирования до конечной стадии атрофии [5, 6].
Годовой риск прогрессирования хронического гастрита от одной стадии к другой оценивается в среднем в 2–3% [16, 20, 23, 27].Предполагается, что около 50% пациентов с хроническим гастритом (и инфекцией H. pylori ) в течение жизни заболеют атрофическим гастритом той или иной степени тяжести [27]. Примерно у 5% инфицированных атрофический гастрит переходит в тяжелую и запущенную стадию [23, 27].
Медленное расширение гастрита H. pylori с чисто антрального фенотипа до форм, поражающих также тело и глазное дно («атрофический пангастрит», мультифокальный атрофический гастрит »или« гастрит с преобладанием тела »), как правило, является обычным явлением [ 7, 15, 19, 21, 23, 27, 31].Это проксимальное (пилорокардиальное) распространение и постепенное обострение атрофического гастрита связаны с заметными изменениями морфологии и функции слизистой оболочки желудка. Эти поражения нарушают функции желудка, вызывая, в частности, нарушения секреции соляной кислоты и внутреннего фактора кислородными железами при атрофии тела, а также нарушения синтеза и секреции гастрина-17 антральными G-клетками при антральной атрофии [23, 27, 32, 33, 34].
Тяжелый атрофический гастрит, который строго ограничен одним антральным отделом, очевидно, довольно редок.С другой стороны, развитая атрофия, которая возникает только в теле тела или одновременно занимает антральный и корпусный отделы, является относительно частым фенотипом хронического гастрита (до 5% людей с гастритом), по крайней мере, в Северной Европе [ 27, 31, 35]. Долгосрочные исследования показывают, что наряду с увеличением гастрита H. pylori вверх слизистая оболочка антрального отдела может даже зажить [20, 23, 27].
Из-за потери кислородных желез и париетальных клеток при атрофии тела, распространение атрофического гастрита на тело и глазное дно приводит к пожизненной и постоянной гипо- или ахлоргидрии.Впоследствии из-за низкой внутрижелудочной кислотности первоначальная инфекция H. pylori может, в свою очередь, спонтанно исчезнуть и, наконец, вылечить в случаях прогрессирующей атрофии, что продемонстрировано серологическими тестами в последующих наблюдениях [29, 36]. .
По мере прогрессирования хронического неатрофического гастрита до атрофических фенотипов, потенциально запускаются многочисленные случайные патогенетические процессы, даже канцерогенные, что является явлением в sc. «Каскад корреа» может, наконец, способствовать процессам, связывающим хронический гастрит с такими крайними последствиями, как рак [1, 7, 35, 37, 38, 39, 40, 41].Это можно проиллюстрировать на примере.
Схема естественного течения и прогрессирования гастрита Helicobacter pylori от неатрофической формы до злокачественного новообразования желудка (sc. Correa cascade). Некоторые потенциально патогенетические факторы и механизмы, связанные с канцерогенезом, играют определенную роль и запускаются поэтапно в течение и прогрессирования каскада.
Эпидемиология и феномен рождения когорты
Наблюдения, полученные в результате популяционных исследований хронического гастрита, могут помочь в некоторых фундаментальных выводах относительно эпидемиологии хронического гастрита и его последствий.
Хронический гастрит по-прежнему является относительно распространенным заболеванием, даже в развитых странах, даже несмотря на то, что его распространенность заметно снизилась, причем это снижение идет параллельно со снижением распространенности H. pylori [42, 43]. Вполне возможно, что практически каждый человек, даже в развитых странах, около 100 лет назад болел гастритом H. pylori , тогда как в настоящее время распространенность в среднем составляет менее 50%.
H. pylori гастрит в большинстве случаев приобретается в раннем детстве, тогда фенотип гастрита представляет собой безвредное и бессимптомное простое хроническое мононуклеарное («поверхностное») воспаление [25, 29].Тяжелые симптоматические последствия хронического гастрита проявятся только в последние десятилетия жизни и, как правило, возникают у пациентов с поздними стадиями поражения [1, 39, 43].
После открытия H. pylori стало очевидно, что понимание эпидемиологии инфекции H. pylori является ключом к пониманию эпидемиологии хронического гастрита и его последствий. Поскольку хронический гастрит и его последствия (язвенная болезнь желудка и рак желудка) изначально были пандемической бактериальной инфекцией у детей, эпидемиологические характеристики хронического гастрита соответствуют тем же «пандемическим» принципам, что и H.pylori сама по себе.
Социально-экономические факторы и гигиена окружающей среды неизбежно являются наиболее важными фоновыми факторами передачи инфекции H. pylori во всем мире, причем эти социально-экономические факторы также являются фоновыми факторами в эпидемиологии хронического гастрита и его последствий [43, 44, 45] . Социально-экономический статус в детстве, экологическая и семейная гигиена, плотность домохозяйства, привычки приготовления пищи и т. Д. Являются вероятными факторами, которые определяют вероятность приобретения H.pylori в детстве. Улучшение этих условий снижает вероятность заражения или дальнейшей передачи инфекции желудочно-оральным путем [46]. Снижение уровня инфицирования в детском возрасте на уровне семьи со временем неизбежно приведет к снижению распространенности гастрита H. pylori и его последствий в среднем среди всего населения.
Из-за «педиатрического» происхождения инфекции H. pylori эпидемиология H.pylori гастрит лучше всего понять и понять как «феномен когорты рождения», как это проиллюстрировано компьютерным моделированием в [43]. Уровень инфицирования в детском возрасте и повозрастная распространенность гастрита H. pylori высоки в когортах «старых» новорожденных, рожденных на десятилетия раньше, чем распространенность в когортах «молодых» новорожденных, родившихся позже и у которых уровень инфицирования H. pylori в детстве низкий. Таким образом, средняя распространенность гастрита на популяционном уровне отражает среднее значение распространенности хронического гастрита в разных когортах рождения и средний показатель H.pylori в детском возрасте.
Компьютерное моделирование, демонстрирующее «феномен когорты рождения» в распространенности гастрита Helicobacter pylori в популяции, состоящей из когорт с разными годами рождения. Примерно на основании данных о гастрите в Финляндии примерно в конце 80-х годов (см.).
Эпидемиология заболеваемости раком желудка и эпидемиология смертности от рака желудка следуют принципам «феномена когорты рождения» и демонстрируют аналогичные глобальные «пандемические» характеристики, как и в случае с H.pylori гастрит [43]. Уровень заболеваемости раком желудка (или язвенной болезнью) был и будет низким в когортах «молодых» новорожденных, в которых частота гастрита H. pylori низкая и слизистая оболочка желудка остается здоровой на протяжении всей жизни. . Напротив, распространенность, заболеваемость и смертность от язвенной болезни или рака желудка высоки и остаются высокими в старых когортах, пока они живы.
Аутоиммунный хронический гастрит
Хотя H.pylori , в конечном счете, является основной причиной (более чем в 90% случаев) гастрита, хронического мононуклеарного воспаления (гастрита) без продолжающейся инфекции H. pylori , но протекающего с тяжелым атрофическим гастритом тела и ахлоргидритом желудка. , и с сосуществованием аутоантител против париетальных клеток (протонная помпа) и / или внутреннего фактора, является хорошо установленным субъектом [3, 32, 47, 48, 49, 50]. Однако неясно, является ли этот гастрит «аутоиммунного» типа независимым заболеванием или H.pylori вызывает аутоиммунные реакции у некоторых ответственных лиц с обычной инфекцией H. pylori [3, 50, 51, 52]. Возможно, что первоначальная инфекция H. pylori может пройти спонтанно, когда атрофический гастрит перейдет в тяжелую атрофическую и ахлоргидрическую стадию, создавая, таким образом, ложное впечатление о чистой аутоиммунной этиологии заболевания.
Гастрит, связанный с аутоиммунными явлениями, в любом случае может быть более прогрессирующим и более быстрым, чем чистый H.pylori гастрит [3, 23]. В связи с аутоиммунитетом и у лиц со склонностью к аутоиммунным заболеваниям (аутоиммунный тиреоидит, диабет и т. Д.) Прогрессирование гастрита H. pylori до атрофических фенотипов может быть заметно деструктивным, что может легко и быстро привести к ахлоргидрии и полная атрофия тела и дна желудка. В медицинской литературе описаны случаи тяжелого атрофического гастрита с аутоиммунными характеристиками и безкислотного желудка даже в детском возрасте.
Показано, что хронический гастрит аутоиммунного типа является рецессивным мультигенным заболеванием и, возможно, имеет североевропейское происхождение [32].
Влияние на физиологию желудка
Длительное (пожизненное) хроническое и активное воспаление не может быть безвредным и приведет к разрушению слизистой оболочки желудка посредством нескольких механизмов, которые могут взаимодействовать с обновлением, ростом, целостностью, дифференцировкой и функцией эпителия желудка [1, 24, 39, 53, 54].Многочисленные аномальные экспрессии (повышающая и понижающая регуляция) функциональных и регуляторных генов, генные мутации, эпигенетические изменения, различные проявления цитокинов или факторов роста тканей происходят в регуляторных тканевых процессах слизистой оболочки желудка и эпителиальных клеток в связи с H. pylori. гастрит [53, 54]. Некоторые изменения являются обратными, могут проявляться даже на ранних стадиях воспаления, но могут особенно накапливаться со временем в предраковых состояниях, таких как атрофия и IM, и, по-видимому, чрезвычайно распространены и разнообразны при предраковых (дисплазия или интраэпителиальная неоплазия) и злокачественных новообразованиях. поражения [53, 54].
Атрофия тела в конечном итоге приводит к нарушению секреции соляной кислоты и внутреннего фактора [23, 34]. В бескислотном и атрофическом желудке из-за нарушения секреции внутреннего фактора всасывание основных витаминов, таких как витамин B12, серьезно нарушено [55]. Мальабсорбция и последующий длительный и постоянный дефицит витамина B12 могут нарушать метаболизм метионина, гомоцистеина или фолиевой кислоты и, таким образом, могут быть механизмом, который способствует появлению эпигенетических повреждений ДНК из-за нарушения функции цикла метилирования в эпителиальных клетках. клетки [55, 56].
Диетический метаболизм и всасывание питательных микроэлементов, таких как железо, кальций, магний и цинк, или всасывание некоторых лекарств (например, дипиридамола, некоторых препаратов железа и противогрибковых препаратов, таких как флуконазол или итраконазол, тироксин и атазановир) нарушаются из-за кислоты свободный желудок тоже [57]. Бескислотный желудок в конечном итоге заселяется микробной флорой изо рта [58]. Микробы и бескислотный желудок способны продуцировать канцерогены класса 1, такие как ацетальдегид и нитрозоамины [39, 59].
Рак и язвенная болезнь
Рак желудка и язвенная болезнь (исключая язвы, вызванные приемом НПВП) являются наиболее серьезными заболеваниями, связанными с хроническим гастритом H. pylori [60, 61, 62, 63, 64, 65]. Успешная ликвидация H. pylori предотвращает рецидивы язвы, но также может предотвратить рак [66, 67].
Несмотря на ассоциации пептических язв и рака с гастритом H. pylori , эти связи также существенно различаются [62, 68].Пептические язвы двенадцатиперстной кишки (ЯД) обычно возникают у людей с неатрофическим гастритом H. pylori , но нечасты или отсутствуют у субъектов, у которых гастрит прогрессировал до атрофических форм в теле и у которых желудок впоследствии стал хлоргидридным ( ). С другой стороны, язвы желудка часто связаны с фенотипами гастрита, при которых выраженная атрофия и IM возникают в антральном отделе и режущей кромке, и в этих случаях слизистая оболочка тела может быть даже слегка атрофичной, но никогда не бывает сильно атрофированной (и желудок бывает атрофичным). никогда не ахлоргидный) [62].Рак желудка, в частности кишечного типа, наблюдается у пациентов с гипохлоргидритом или ахлоргидридом желудка и, в частности, может возникать у субъектов с поздними стадиями атрофии и IM как в антральном отделе, так и в теле [39, 69].
Относительный риск язвенной болезни (двенадцатиперстной кишки или желудка) или рака желудка при различных фенотипах хронического атрофического Helicobacter pylori гастрита. Риски представлены как относительные риски по сравнению с рисками у субъектов с нормальной и здоровой слизистой оболочкой желудка (категория N / N; желтый).Риски экстраполируются и оцениваются на основе исследования случай-контроль, проведенного в Финляндии в 80-х годах [69]. Обратите внимание, что риски язвенной болезни и рака желудка связаны с очень разными фенотипами хронического гастрита.
Канцерогенез желудка неоднороден и чрезвычайно разнообразен на молекулярном уровне [53, 54]. Несмотря на то, что генных ошибок много, никаких специфических или всеобъемлющих молекулярных маркеров, генных ошибок или мутаций при раке или предраковых поражениях пока не обнаружено.Хотя два основных гистологических типа рака желудка, кишечный и диффузный, являются значимыми сущностями с клинической и морфологической точки зрения, и оба связаны с предшествующим или сосуществующим гастритом H. pylori , эти типы могут не быть полностью разными сущностями. . При диффузном типе фоновой морфологией часто является неатрофический гастрит H. pylori , что указывает на то, что канцерогенные механизмы при этом типе рака могут быть более тесно связаны с воспалением, чем с механизмами, которые появляются при атрофическом гастрите или кислоте. свободный желудок [37, 38].С другой стороны, при типе рака кишечника явные опухоли или предраковые поражения часто связаны с гипохлоргидритом желудка, выраженным атрофическим гастритом и обширным ИМ в подлежащей слизистой оболочке [37, 38, 70, 71]. Следовательно, канцерогенные процессы при этом типе рака могут быть связаны с механизмами, которые возникают при атрофическом гастрите или запускаются гипохлоргидридом или бескислотным желудком.
Риск рака
Атрофический гастрит и бескислотный желудок являются наиболее важными независимыми состояниями риска рака желудка, известными на сегодняшний день.Статистически атрофический гастрит представляет собой более высокий риск рака, чем инфекция H. pylori в чистом виде [69]. Вероятность рака желудка при гастрите возрастает экспоненциально с прогрессированием гастрита H. pylori из неатрофической формы в атрофическую [69]. Риск может возрасти даже до 90 раз у пациентов с тяжелым атрофическим гастритом как антрального отдела, так и тела (тяжелая панатрофия; мультифокальный атрофический гастрит (MAG)) по сравнению с риском рака у пациентов с нормальной и здоровой слизистой оболочкой желудка () [69] .
Риск рака значительно ниже у людей без гастрита H. pylori , то есть у людей со здоровой слизистой оболочкой желудка. Риск увеличивается примерно в два раза у пациентов с чистой инфекцией H. pylori , т.е. у пациентов с неатрофическим гастритом H. pylori [60, 61, 69]. Таким образом, у пациентов с DU, которые обычно имеют неатрофический гастрит H. pylori , риск рака немного выше, чем риск рака у здоровых субъектов, но этот риск, тем не менее, все еще очень низок по сравнению с риском рака. у пациентов с тяжелым и запущенным атрофическим гастритом (см.).
Парадоксально, но нагрузка на слизистую оболочку желудка хеликобактериями обычно высока у субъектов с относительно низким риском рака, как и у обычных пациентов с ЯН. Как это ни парадоксально, нагрузка имеет тенденцию уменьшаться, когда повышается риск рака, как это имеет место у пациентов с далеко зашедшим атрофическим гастритом [69]. Риск рака может быть, например, высоким у субъектов с тяжелым атрофическим гастритом и бескислотным желудком, у которых может даже не быть объективных признаков продолжающегося H.pylori , то есть у пациентов, у которых, возможно, исчезла первоначальная инфекция H. pylori .
Сиднейская система и оперативное звено по классификации гастритов
Признание того, что инфекция H. pylori и последующий атрофический гастрит и отсутствие кислоты в желудке являются важными фоновыми состояниями рака желудка, позволяет сортировать пациентов в клинической практике по значимым группы относительно риска рака. Эта сортировка требует обследования субъектов с помощью эндоскопии и эндоскопической биопсии или может быть проведена с помощью неинвазивных анализов крови с использованием биомаркеров, специфичных для желудка [72, 73, 74, 75, 76, 77].
Сиднейская система и ее обновление являются руководящими принципами для интерпретации микроскопических проявлений биоптатов в практике эндоскопии [5, 6]. Надлежащий протокол биопсии и правильное считывание результатов биопсии под микроскопом являются фундаментальными требованиями для правильного и успешного разделения пациентов на клинически значимые группы риска [78, 79]. Такие классификации или родословные невозможны только с помощью эндоскопии или не могут быть выполнены с помощью тестирования H.pylori отдельно.
Стадия OLGA / OLGIM (Оперативная ссылка на гастрит / оценка IM) атрофического гастрита представляет собой практическую схему классификации пациентов в группы низкого, среднего и высокого риска рака желудка [79]. Эта классификация делит пациентов на пять подгрупп (0 – IV) с сильно различающейся вероятностью развития или заболеть раком желудка (). Классификация и сортировка могут объективно подсказать, какой из пациентов будет нуждаться в большинстве случаев эндоскопического наблюдения и последующего наблюдения [79, 80].
OLGA: стадия риска рака желудка. Изменено из статьи Рагге и др. [79]. Определение стадии – это практический инструмент для разделения пациентов на группы высокого (III – IV стадии) и низкого (0 – II стадии) риска рака, в частности рака желудка кишечного типа. Определение стадии требует эндоскопии и надлежащей практики биопсии, но также может быть выполнено неинвазивно с помощью анализа крови с применением определенных биомаркеров (пепсиноген I и II, гастрин-17 и серология Helicobacter pylori ), которые отражают функцию (секреция кислоты) и структура слизистой оболочки антрального отдела и тела в плазме / сыворотке крови.
Разделение субъектов на подкатегории OLGA может быть выполнено также неэндоскопически и неинвазивно с помощью простых анализов крови, основанных на оценке уровней биомаркеров, специфичных для желудка (пепсиногены I и II, гастрин-17 и H. pylori ) в плазме / сыворотке крови [72, 73, 74, 77, 80]. Это невозможно сделать с помощью одного теста H. pylori .
Плазменные биомаркеры в диагностике и скрининге атрофического гастрита
Очистка желудочных пепсиногенов в 70-е годы, понимание естественного течения H.pylori , уникальные инновации в методах вертикального измерения микропланшетов и разработка тестов ELISA со специфическими моноклональными антителами предоставили приложения для использования желудочных биомаркеров в неинвазивной диагностике и скрининге атрофического гастрита на основе простого образца крови [81, 82, 83 ]. В настоящее время эти анализы крови надежно могут быть выполнены в любой лаборатории и не требуют специальных мероприятий. Несколько подробных и всесторонних обзоров, согласованных отчетов и руководств по практическому использованию тестов на биомаркеры в диагностике атрофического гастрита были опубликованы ранее в этом и других медицинских журналах (см. Ссылки [72, 80, 84]).
Несколько коммерческих радиоиммуноанализов и тестов ELISA были доступны для пепсиногена 1 и 2 в течение довольно долгого времени. Однако у этих тестов есть ограничения, поскольку они могут использоваться только для диагностики атрофического гастрита тела [74]. Уровни пепсиногенов 1 и 2 в сыворотке крови не указывают на возможный атрофический гастрит в антральном отделе желудка, где, однако, сначала появляются атрофические и метапластические изменения. Более полный тест (GastroPanel®) включает анализ уровней G-17 в плазме в дополнение к анализам пепсиногена 1 и пепсиногена 2, а также включает анализ H.pylori серологический тест. Эта тестовая панель позволяет оценить атрофию также в антральном отделе желудка и дает намёки на внутрижелудочную кислотность в дополнение к информации о возможной атрофии тела, что делает возможной всестороннюю классификацию OLGA [72, 73, 77, 78, 80].
Антральный атрофический гастрит (потеря антральных желез) сопровождается потерей антральных G-клеток, потеря которых приводит к низким уровням в плазме как натощак, так и стимулированного гастрина-17 (после питья протеинового порошка, стимуляции бомбезином (гастрином). высвобождающий пептид) или стимуляция ингибитором протонной помпы (ИПП)).Низкий уровень G-17 в плазме натощак (1 пмоль / л или меньше) на практике указывает на два варианта. Либо имеется развитый атрофический гастрит в антральном отделе (класс III – IV по OLGA), либо низкий уровень G-17 является результатом высокой внутрижелудочной кислотности (низкий pH). Оба варианта являются показаниями для верхней ги-эндоскопии из-за риска рака из-за возможной атрофии антрального отдела и из-за риска язвенной болезни из-за гиперхлоргидрии (выделения с высоким содержанием кислоты) (см.)
Отсутствие антител к H. pylori одновременно с наличием нормальных уровней пепсиногена 1 в плазме, нормальным соотношением пепсиногена 1 к пепсиногену 2 и нормальным гастрином-17 в плазме при условии, что возможное лечение ИПП находится под контролем, это результат теста, который достоверно свидетельствует о наличии нормальной и здоровой слизистой оболочки желудка (класс 0 по OLGA).Риск рака и язвенной болезни у таких «здоровых» людей крайне низок, практически нулевой. С другой стороны, риск рака желудка высок (класс III-IV по OLGA) у субъектов с низким уровнем пепсиногена 1 натощак (менее 30 мкг / л), с низким соотношением пепсиногена 1 к пепсиногену 2 (ниже 3 ) и с высоким содержанием гастрина-17 натощак (выше 7 пмоль / л), риск рака у этих пациентов высок независимо от того, есть ли у пациента текущая инфекция H. pylori (см.) [72, 80].Атрофический гастрит в этих случаях является развитым и обширным, занимает всю слизистую оболочку желудка (класс IV по OLGA), при этом желудок не содержит кислоты.
Будущие тенденции и инициатива в отношении здорового желудка
Несмотря на то, что гастрит H. pylori сокращается по распространенности, хронический гастрит по-прежнему будет чрезвычайно частым заболеванием во всем мире в течение нескольких будущих десятилетий. В связи с микробным происхождением и инфекционным фоном, а также знаниями эпидемиологии и естественным течением хронического H.pylori , можно предположить, что это заболевание может окончательно исчезнуть из общества вместе с улучшениями в гигиене и социально-экономическом развитии. Благодаря этим улучшениям риск заражения H. pylori в детстве снизится. Как и в случае с туберкулезом, хронический гастрит может в ближайшие десятилетия отойти на периферию медицинской практики и значимости, по крайней мере, в развитых странах. Следовательно, пептические язвы будут редкими, а рак желудка станет редким злокачественным новообразованием.
Среди самых молодых коренных жителей в когортах в западных странах около 90–100% людей уже сейчас имеют и будут иметь нормальный здоровый желудок на протяжении всей жизни, в результате чего в конечном итоге у подавляющего большинства людей есть здоровый желудок и, следовательно, не подвержены риску развития язвенной болезни или рака желудка. Попытки сохранить или получить здоровый желудок для всех будут инициативой и целью как будущих исследований, так и клинической практики («инициатива здорового желудка»; см .: www.hsinitiative.org).
Благодарности
Декларация интересов : Доктор Пентти Сиппонен является акционером и членом научного комитета Biohit Oyj. Компания разрабатывает и продает лабораторные тесты, в основном, на желудочно-кишечные заболевания.
Ссылки
- IARC Шистосомы, печеночные двуустки и Helicobacter pylori. Рабочая группа МАИР по оценке канцерогенных рисков для людей. Лион, 7-14 июня 1994 г. IARC Monogr Eval Carcinog Risks Hum.1994; 61: 1–241. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Шиндлер Р. Хронический гастрит. Klin Wochenschr. 1966; 44: 601–12. [PubMed] [Google Scholar]
- Сирала М. История гастрита. Scand J Gastroenterol Suppl. 1991; 186: 1–3. [PubMed] [Google Scholar]
- Telaranta-Keerie A, Kara R, Paloheimo L, Härkönen M, Sipponen P. Распространенность недиагностированного прогрессирующего атрофического гастрита тела в Финляндии: обсервационное исследование среди 4256 добровольцев без особых жалоб.Сканд Дж Гастроэнтерол. 2010; 45: 1036–41. [PubMed] [Google Scholar]
- Price AB. Сиднейская система: гистологическое деление. J Gastroenterol Hepatol. 1991; 6: 209–22. [PubMed] [Google Scholar]
- Диксон М.Ф., Гента Р.М., Ярдли Дж. Х., Корреа П. Классификация и классификация гастрита. Обновленная Сиднейская система. Международный семинар по гистопатологии гастрита, Хьюстон, 1994. Am J Surg Pathol. 1996; 20: 1161–81. [PubMed] [Google Scholar]
- Корреа П. Хронический гастрит: клинико-патологическая классификация.Am J Gastroenterol. 1988; 83: 504–9. [PubMed] [Google Scholar]
- Маршалл Б.Дж., Уоррен-младший. Неопознанные изогнутые бациллы в желудке больных гастритом и язвенной болезнью. Ланцет. 1984; 323: 1311–15. [PubMed] [Google Scholar]
- Варис К. Семья поведения при хроническом гастрите. Ann Clin Res. 1981; 13: 123–9. [PubMed] [Google Scholar]
- Валле Дж., Сеппала К., Сиппонен П., Косунен Т. Исчезновение гастрита после искоренения Helicobacter pylori. Морфометрическое исследование.Сканд Дж Гастроэнтерол. 1991; 26: 1057–65. [PubMed] [Google Scholar]
- Ходзё М., Мива Х., Окуса Т., Окура Р., Куросава А., Сато Н. Изменение гистологического гастрита после излечения от инфекции Helicobacter pylori. Алимент Pharmacol Ther. 2002; 16: 1923–32. [PubMed] [Google Scholar]
- Аннибале Б., Ди Джулио Е., Каруана П., Ланер Е., Капурсо Г., Борди С. и др. Долгосрочные эффекты лечения инфекции Helicobacter pylori у пациентов с атрофическим гастритом тела. Алимент Pharmacol Ther. 2002; 16: 1723–31.[PubMed] [Google Scholar]
- Arkkila PE, Seppälä K, Färkkilä MA, Veijola L, Sipponen P. Эрадикация Helicobacter pylori в лечении атрофического гастрита: перспективное исследование в течение одного года. Сканд Дж Гастроэнтерол. 2006; 41: 782–90. [PubMed] [Google Scholar]
- Сиурала М., Варис К., Вильясало М. Исследования пациентов с атрофическим гастритом: наблюдение через 10–15 лет. Сканд Дж Гастроэнтерол. 1966; 1: 40–8. [PubMed] [Google Scholar]
- Виллако К., Кекки М., Тамм А., Таммур Р., Сависаар Э., Вийрсалу В. и др.Эпидемиология и динамика гастрита в репрезентативной выборке городского населения Эстонии. Сканд Дж Гастроэнтерол. 1982; 17: 601–7. [PubMed] [Google Scholar]
- Ихамаки Т., Кекки М., Сиппонен П., Сиурала М. Последствия и течение хронического гастрита во время контрольного биопсийного исследования в течение 30–34 лет. Сканд Дж Гастроэнтерол. 1985; 20: 485–91. [PubMed] [Google Scholar]
- Маарус Х.И., Виллако К.П., Сиппонен П., Кекки М., Сирала М., Таммур Р. и др. Helicobacter pylori и хронический гастрит в материале биопсии желудка в группе случайно выбранных взрослых жителей Эстонии.Арх Патол. 1990; 52: 9–11. [PubMed] [Google Scholar]
- Кекки М., Маарус Х.И., Сиппонен П., Уйбо Р., Таммур Р., Тамм А. и др. Степень колонизации Helicobacter pylori по отношению к гастриту: последующее шестилетнее популяционное исследование. Scand J Gastroenterol Suppl. 1991; 186: 142–50. [PubMed] [Google Scholar]
- Виллако К., Кекки М., Маарус Х.И., Сиппонен П., Уйбо Р., Таммур Р. и др. Хронический гастрит: прогрессирование воспаления и атрофии при шестилетнем эндоскопическом наблюдении за случайной выборкой из 142 городских жителей Эстонии.Scand J Gastroenterol Suppl. 1991; 186: 135–41. [PubMed] [Google Scholar]
- Валле Дж., Кекки М., Сиппонен П., Ихамаки Т., Сирала М. Долгосрочное течение и последствия гастрита, вызванного Helicobacter pylori. Результаты 32-летнего наблюдения. Сканд Дж Гастроэнтерол. 1996; 31: 546–50. [PubMed] [Google Scholar]
- Виллако К., Кекки М., Маарус Х.И., Сиппонен П., Таммур Р., Тамм А. и др. 12-летнее контрольное исследование хронического гастрита и Helicobacter pylori в случайной выборке из популяции. Сканд Дж Гастроэнтерол.1995; 30: 964–7. [PubMed] [Google Scholar]
- Маарус Х.И., Воробьева Т., Сиппонен П., Таммур Р., Уйбо Р., Вадстрём Т. и др. 18-летнее катамнестическое исследование связи хронического гастрита и Helicobacter pylori положительности CagA с развитием атрофии и активностью гастрита. Сканд Дж Гастроэнтерол. 1999; 34: 864–9. [PubMed] [Google Scholar]
- Сиурала М., Сиппонен П., Кекки М. Хронический гастрит: динамические и клинические аспекты. Scand J Gastroenterol Suppl. 1985; 109: 69–76. [PubMed] [Google Scholar]
- Сиппонен П., Кекки М., Сирала М.Сиднейская система: эпидемиология и естественная история хронического гастрита. J Gastroenterol Hepatol. 1991; 6: 244–51. [PubMed] [Google Scholar]
- Maaroos HI, Rägo T., Sipponen P, Siurala M. Helicobacter pylori и гастрит у детей с жалобами на брюшную полость. Сканд Дж Гастроэнтерол. 1991; 26: 95–9. [PubMed] [Google Scholar]
- Maaroos HI, Kekki M, Villako K, Sipponen P, Tamm A, Sadeniemi L. Частота и степень колонизации Helicobacter pylori и профили антрального и телесного гастрита в выборке населения Эстонии.Сканд Дж Гастроэнтерол. 1990; 25: 1010–17. [PubMed] [Google Scholar]
- Кекки М., Сирала М., Варис К., Сиппонен П., Систонен П., Неванлинна HR. Принципы классификации и генетика хронического гастрита. Scand J Gastroenterol Suppl. 1987. 141: 1–28. [PubMed] [Google Scholar]
- Ихамаки Т., Сиппонен П., Варис К., Кекки М., Сирала М. Характеристики слизистой оболочки желудка, предшествующие возникновению злокачественного новообразования желудка: результаты длительного наблюдения трех семейных образцов. Scand J Gastroenterol Suppl.1991; 186: 16–23. [PubMed] [Google Scholar]
- Maaroos HI, Kekki M, Villako K, Sipponen P, Tamm A, Sadeniemi L. Частота и степень колонизации Helicobacter pylori и профили антрального и телесного гастрита в выборке населения Эстонии. Сканд Дж Гастроэнтерол. 1990; 25: 1010–17. [PubMed] [Google Scholar]
- Раутелин Х., Сиппонен П., Сеппала К., Сарна С., Даниэльссон Д., Косунен Т.У. Воспаление желудка и штаммы Helicobacter pylori, активирующие нейтрофилы и продуцирующие цитотоксины.Сканд Дж Гастроэнтерол. 1996; 31: 639–42. [PubMed] [Google Scholar]
- Кекки М., Сирала М., Ихамаки Т. Обогащение комбинированного атрофического гастрита антрального отдела и тела («комбинированный АГ») у братьев и сестер пациентов с карциномой желудка. Scand J Gastroenterol Suppl. 1991; 186: 24–8. [PubMed] [Google Scholar]
- Варис К. Эпидемиология гастрита. Scand J Gastroenterol Suppl. 1982; 79: 44–51. [PubMed] [Google Scholar]
- Сиппонен П., Валле Дж., Варис К., Кекки М., Ихамаки Т., Сирала М. Уровни сывороточного гастрина натощак при различных функциональных и морфологических состояниях слизистой оболочки антрофунда.Анализ 860 предметов. Сканд Дж Гастроэнтерол. 1990; 25: 513–19. [PubMed] [Google Scholar]
- Sipponen P, Kekki M, Seppälä K, Siurala M. Взаимосвязь между хроническим гастритом и секрецией желудочного сока. Алимент Pharmacol Ther. 1996; 10: 103–18. [PubMed] [Google Scholar]
- Кекки М., Ихамаки Т., Варис К., Сирала М. Профили хронического гастрита у братьев и сестер пробандов, рассчитанные как имеющие повышенный риск рака желудка. Scand J Gastroenterol Suppl. 1991; 186: 29–32. [PubMed] [Google Scholar]
- Коккола А., Косунен Т.У., Пуолаккайнен П., Сиппонен П., Херконен М., Лаксен Ф. и др.Спонтанное исчезновение антител к Helicobacter pylori у пациентов с запущенным атрофическим гастритом тела. APMIS. 2003; 111: 619–24. [PubMed] [Google Scholar]
- Сиппонен П., Кекки М., Сирала М. Возрастные тенденции гастрита и кишечной метаплазии у пациентов с карциномой желудка и в контрольной группе, представляющей население в целом. Br J Рак. 1984; 49: 521–30. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Сиппонен П., Кекки М., Сирала М. Атрофический хронический гастрит и кишечная метаплазия при раке желудка.Сравнение с репрезентативной выборкой населения. Рак. 1983; 52: 1062–8. [PubMed] [Google Scholar]
- Корреа П., Пиасуэло МБ. Предраковый каскад желудка. J Dig Dis. 2012; 13: 2–9. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- You WC, Li JY, Blot WJ, Chang YS, Jin ML, Gail MH, et al. Эволюция предраковых поражений у сельского населения Китая с высоким риском рака желудка. Int J Cancer. 1999; 83: 615–19. [PubMed] [Google Scholar]
- Корреа П., Хансель В., Куэлло С., Завала Д., Фонтам Е., Зарама Г. и др.Предраковый процесс желудка в популяции высокого риска: когортное наблюдение. Cancer Res. 1990; 50: 4737–40. [PubMed] [Google Scholar]
- Sipponen P, Helske T., Järvinen P, Hyvärinen H, Seppälä K, Siurala M. Снижение распространенности хронического гастрита за 15 лет: анализ амбулаторных исследований в Финляндии с 1977, 1985 и 1992. Gut. 1994; 35: 1167–71. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Сиппонен П. Гастрит с Helicobacter pylori – эпидемиология. J Gastroenterol. 1997. 32: 273–7.[PubMed] [Google Scholar]
- Уна М., Утт М., Нильссон И., Уйбо О., Воробьева Т., Маарус Х.И. Инфекция Helicobacter pylori у детей в Эстонии: снижение серологической распространенности в течение 11-летнего периода глубоких социально-экономических изменений. Helicobacter. 2004; 9: 223–41. [PubMed] [Google Scholar]
- Eusebi LH, Zagari RM, Bazzoli F. Эпидемиология инфекции Helicobacter pylori. Helicobacter. 2014; 19: 1–5. [PubMed] [Google Scholar]
- Axon AT. Обзорная статья: передается ли Helicobacter pylori желудочно-оральным путем? Алимент Pharmacol Ther.1995; 9: 585–8. [PubMed] [Google Scholar]
- Варис К., Стенман У. Х., Лехтола Дж., Сирала М. Поражение желудка и злокачественная анемия: семейное исследование. Acta Hepatogastroenterol (Stuttg) 1978; 25: 62–7. [PubMed] [Google Scholar]
- Варис К., Исокоски М. Скрининг гастрита типа А. Ann Clin Res. 1981; 13: 133–8. [PubMed] [Google Scholar]
- Кекки М., Варис К., Похьянпало Х., Исокоски М., Ихамаки Т., Сирала М. Течение антрального и телесного гастрита в семьях с злокачественной анемией. Dig Dis Sci.1983; 28: 698–704. [PubMed] [Google Scholar]
- Воробьева Т., Фаллер Г., Маарус Х.И., Сиппонен П., Виллако К., Уибо Р. и др. Значительное увеличение антигастральных аутоантител в долгосрочном катамнестическом исследовании гастрита, вызванного H.pylori. Арка Вирхова. 2000; 437: 37–45. [PubMed] [Google Scholar]
- Уйбо Р., Воробьева Т., Метцюла К., Кисанд К., Вадстрём Т., Кивик Т. Ассоциация Helicobacter pylori и желудочного аутоиммунитета: популяционное исследование. FEMS Immunol Med Microbiol. 1995; 11: 65–8. [PubMed] [Google Scholar]
- Воробьева Т., Маарус Х.И., Uibo Иммунный ответ на Helicobacter pylori и его связь с динамикой хронического гастрита в антральном отделе и теле.APMIS. 2008. 116: 465–76. [PubMed] [Google Scholar]
- Тахара Э. Генетические пути двух типов рака желудка. IARC Sci Publ. 2004. 157: 327–49. [PubMed] [Google Scholar]
- Qu Y, Dang S, Hou P. Метилирование генов при раке желудка. Clin Chim Acta. 2013; 424: 56–65. [PubMed] [Google Scholar]
- Sipponen P, Laxén F, Huotari K, Härkönen M. Распространенность низкого содержания витамина B12 и высокого гомоцистеина в сыворотке крови у пожилых мужчин: связь с атрофическим гастритом и инфекцией Helicobacter pylori.Сканд Дж Гастроэнтерол. 2003. 38: 1209–16. [PubMed] [Google Scholar]
- Боландер-Гуай К. Сосредоточьтесь на гомоцистеине и витаминах, участвующих в его метаболизме. Франция: Спрингер-Верлаг; 2002. [Google Scholar]
- Sipponen P, Härkönen M. Гипохлоргидрат желудка: состояние риска мальабсорбции кальция и остеопороза? Сканд Дж Гастроэнтерол. 2010; 45: 133–8. [PubMed] [Google Scholar]
- Саласпуро, член парламента. Ацетальдегид, микробы и рак пищеварительного тракта. Критик Rev Clin Lab Sci.2003. 40: 183–208. [PubMed] [Google Scholar]
- Саласпуро М. Ацетальдегид как общий знаменатель и совокупный канцероген при раке пищеварительного тракта. Сканд Дж Гастроэнтерол. 2009; 44: 912–25. [PubMed] [Google Scholar]
- Сиппонен П. Хронический гастрит и риск язвы. Сканд Дж Гастроэнтерол. 1990; 25: 193–6. [PubMed] [Google Scholar]
- Sipponen P, Seppälä K, Äärynen M, Helske T., Kettunen P. Хронический гастрит и гастродуоденальная язва: исследование случай-контроль риска сосуществующей язвы двенадцатиперстной кишки или желудка у пациентов с гастритом.Кишечник. 1989; 30: 922–9. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Кекки М., Сиппонен П., Сирала М., Лашевич В. Язвенная болезнь и хронический гастрит: их связь с возрастом и полом, а также с локализацией язвы и гастрита. Гастроэнтерол Clin Biol. 1990; 14: 217–23. [PubMed] [Google Scholar]
- Sipponen P, Varis K, Fräki O, Korri UM, Seppälä K, Siurala M. Совокупный 10-летний риск развития симптоматической язвы двенадцатиперстной кишки и желудка у пациентов с хроническим гастритом или без него. Клиническое наблюдение с участием 454 амбулаторных больных.Сканд Дж Гастроэнтерол. 1990; 25: 966–7. [PubMed] [Google Scholar]
- Арккила П.Е., Сеппала К., Косунен Т.Ю., Хаапиайнен Р., Кивилааксо Е., Сиппонен П. и др. Ликвидация Helicobacter pylori улучшает скорость заживления и снижает частоту рецидивов некровоточащих язв у пациентов с кровоточащей язвенной болезнью. Am J Gastroenterol. 2003. 98: 2149–56. [PubMed] [Google Scholar]
- Axon AT. Терапия Helicobacter pylori: влияние на язвенную болезнь. J Gastroenterol Hepatol. 1991; 6: 131–7. [PubMed] [Google Scholar]
- Kosunen TU, Pukkala E, Sarna S, Seppälä K, Aromaa A, Knekt P, et al.Рак желудка у финских пациентов после излечения от инфекции Helicobacter pylori: когортное исследование. Int J Cancer. 2011; 128: 433–9. [PubMed] [Google Scholar]
- Ли Y-C, Chen TH-H, Chiu H-M, Shun CT, Chiang H, Liu TY и др. Польза от массового искоренения инфекции Helicobacter pylori: исследование профилактики рака желудка на уровне сообщества. Кишечник. 2013; 62: 676–82. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Маарус Х.И., Кекки М., Воробьева Т., Салупере В., Сиппонен П. Риск рецидива язвы желудка, хронического гастрита и степень колонизации Helicobacter pylori.Сканд Дж Гастроэнтерол. 1994; 29: 532–6. [PubMed] [Google Scholar]
- Сиппонен П., Кекки М., Хаапакоски Дж., Ихамаки Т., Сирала М. Риск рака желудка при хроническом атрофическом гастрите: статистические расчеты поперечных данных. Int J Cancer. 1985; 35: 173–7. [PubMed] [Google Scholar]
- Sipponen P, Kosunen TU, Valle J, Riihelä M, Seppälä K. Инфекция Helicobacter pylori и хронический гастрит при раке желудка. J Clin Pathol. 1992; 45: 319–23. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Варис К., Тейлор П.Р., Сиппонен П., Самлофф И.М., Хейнонен О.П., Албейнс Д. и др.Рак желудка и предраковые поражения при атрофическом гастрите: контролируемое исследование влияния добавок с альфа-токоферолом и бета-каротином. Хельсинкская группа по изучению гастрита. Сканд Дж Гастроэнтерол. 1998. 33: 294–300. [PubMed] [Google Scholar]
- Agréus L, Kuipers EJ, Kupcinskas L., Malfertheiner P, Di Mario F, Leja M, et al. Обоснование диагностики и скрининга атрофического гастрита с использованием биомаркеров плазмы, специфичных для желудка. Сканд Дж Гастроэнтерол. 2012; 47: 136–47. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- ди Марио Ф, Кавалларо LG.Неинвазивные тесты при желудочных заболеваниях. Dig Liver Dis. 2008; 40: 523–30. [PubMed] [Google Scholar]
- Динис-Рибейро М., да Коста-Перейра А., Лопес С., Барбоса Дж., Гильерме М., Морейра-Диас Л. и др. Достоверность соотношения пепсиногена I / II в сыворотке для диагностики дисплазии эпителия желудка и кишечной метаплазии во время наблюдения за пациентами из группы риска по аденокарциноме желудка кишечного типа. Неоплазия. 2004. 6: 449–56. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Varis K, Kekki M, Härkönen M, Sipponen P, Samloff IM.Сывороточный пепсиноген I и сывороточный гастрин в скрининге атрофического пангастрита с высоким риском рака желудка. Scand J Gastroenterol Suppl. 1991; 186: 117–23. [PubMed] [Google Scholar]
- Кекки М., Самлофф И.М., Варис К., Ихамаки Т. Сывороточный пепсиноген I и сывороточный гастрин в скрининге тяжелого атрофического гастрита тела. Scand J Gastroenterol Suppl. 1991; 186: 109–16. [PubMed] [Google Scholar]
- Sipponen P, Härkönen M, Alanko A, Suovaniemi O. Диагностика атрофического гастрита по образцу сыворотки.Clin Lab. 2002; 48: 505–15. [PubMed] [Google Scholar]
- Sipponen P, Stolte M. Клиническое влияние рутинных биопсий антрального отдела желудка и тела. Эндоскопия. 1997. 29: 671–8. [PubMed] [Google Scholar]
- Рагге М., Меггио А, Пеннелли Дж., Пишоли Ф., Джакомелли Л., Де Претис Дж. И др. Стадия гастрита в клинической практике: стадия OLGA. Кишечник. 2007; 56: 631–6. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Sipponen P, Graham DY. Значение атрофического гастрита в диагностике и профилактике рака желудка: применение биомаркеров плазмы.Сканд Дж Гастроэнтерол. 2007; 42: 2–10. [PubMed] [Google Scholar]
- Самлофф И.М. Пепсиногены I и II: очистка слизистой оболочки желудка и радиоиммуноанализ в сыворотке крови. Гастроэнтерология. 1982; 82: 26–33. [PubMed] [Google Scholar]
- Суованиеми О. Автоматизированное оборудование для клинических и исследовательских лабораторий. Инновации и разработка фотометров с вертикальным световым лучом и электронных пипеток. Университет Хельсинки 1994; Академическая диссертация. [Google Scholar]
- www.biohithealthcare.com/about-us/history Доступно по адресу.
- Мики К. Скрининг рака желудка с помощью комбинированного анализа сывороточных антител IgG к Helicobacter pylori и уровней пепсиногена в сыворотке – «метод ABC» Proc Jpn Acad Ser B Phys Biol Sci. 2011; 87: 405–14. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Хронический гастрит
Scand J Gastroenterol. 2015 июн 3; 50 (6): 657–667.
Pentti Sipponen
a Patolab Oy, Эспоо, Финляндия и Тартуский государственный университет, Тарту, Эстония
Heidi-Ingrid Maaroos
a Patolab Oy, Espoo, Финляндия и Тартуский государственный университет
, Эстонский государственный университет
, Тартуский государственный университет
a Patolab Oy, Эспоо, Финляндия, и Тартуский государственный университет, Тарту, ЭстонияПоступила 28 января 2015 г .; Пересмотрено 11 февраля 2015 г .; Принята в печать 12 февраля 2015 г.
Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License (http://creativecommons.org/licenses/by/4.0/), которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии, что оригинал эта статья цитируется в других статьях в PMC.Abstract
Распространенность хронического гастрита заметно снизилась в развитых популяциях за последние десятилетия. Однако хронический гастрит по-прежнему остается одной из наиболее распространенных серьезных пандемических инфекций с такими серьезными смертельными последствиями, как язвенная болезнь желудка или рак желудка.В настоящее время в мире в среднем более половины людей могут иметь хронический гастрит. Хеликобактер pylori Инфекция в детстве является основной причиной хронического гастрита, микробное происхождение которого является ключом к пониманию причудливой эпидемиологии и течения болезни. Продолжительное и агрессивное воспаление при гастрите со временем (годы и десятилетия) приводит к разрушению (атрофическому гастриту) слизистой оболочки желудка. Прогрессирующее обострение атрофического гастрита впоследствии приводит к нарушению функции слизистой оболочки желудка.В самых крайних случаях атрофический гастрит в конечном итоге приводит к тому, что желудок постоянно не содержит кислоты. Тяжелый атрофический гастрит и отсутствие кислоты в желудке – это наиболее известные до сих пор независимые состояния риска рака желудка. Помимо риска злокачественных новообразований и язвенной болезни, бескислотный желудок и тяжелые формы атрофического гастрита могут быть связаны с нарушением всасывания основных витаминов, таких как витамин B12, микронутриентов (таких как железо, кальций, магний и цинк), диеты и лекарств. .
Ключевые слова: рак желудка, гастрит, Helicobacter pylori , язвенная болезнь
Введение
Хронический гастрит – одно из самых распространенных пожизненных, серьезных и коварных заболеваний человека.Можно оценить, что более половины населения мира в той или иной степени страдает этим заболеванием, что указывает на то, что даже многие сотни миллионов людей во всем мире могут иметь хронический гастрит в той или иной форме.
Значение хронического гастрита как серьезного заболевания в значительной степени недооценивается в клинической практике, хотя роль гастрита в патогенезе обычных пептических язв и рака желудка очевидна [1, 2, 3, 4]. Можно подсчитать, что ежегодно во всем мире могут происходить миллионы преждевременных смертей из-за рака и язвы, являющихся последствиями хронического гастрита.
Хронический гастрит проявляется в неатрофической или атрофической форме. Это формы и фенотипы гастрита, которые представляют разные стадии одного и того же пожизненного заболевания [2, 3, 5, 6, 7]. Морфологические проявления гастрита во всем мире очень похожи, то есть хронический гастрит, по-видимому, с его последствиями является одним и тем же заболеванием во всем мире.
Хронический гастрит известен и изучается с первых десятилетий 20-го века, но получил большее внимание только в 1982 году после открытия Helicobacter pylori Уорреном и Маршаллом [8].Стало ясно, что бактерия является причиной гастрита в подавляющем большинстве случаев, за возможным исключением гастрита аутоиммунного происхождения [3, 9]. Следовательно, стало очевидно, что хронический гастрит можно вылечить с помощью эрадикации H. pylori , что приведет к нормализации слизистой оболочки желудка, по крайней мере, в тех случаях, когда гастрит не переходит в конечную стадию атрофии (атрофический гастрит) [8 , 9, 10, 11, 12, 13].
Несмотря на то, что основные черты хронического гастрита хорошо известны, некоторые вопросы все еще остаются без ответа.Мы не знаем, например, значения аутоиммунитета или генетики в развитии и прогрессировании хронического гастрита H. pylori . Молекулярные механизмы и роль факторов окружающей среды, таких как диета, и роль микробов, отличных от H. pylori , в течении хронического гастрита, в значительной степени неизвестны. Мы не можем точно предсказать, у кого хронический гастрит обязательно будет прогрессировать до конечной атрофической стадии и смертельных последствий, или у кого этого не произойдет.Эта неопределенность также относится к деталям, благодаря которым гастрит приводит к появлению пептических язв или рака желудка. Однако мы знаем, что без наличия сопутствующего хронического гастрита или атрофического гастрита обычные пептические язвы или рак желудка встречаются редко.
В этом обзоре описаны некоторые наблюдения и представлены некоторые субъективные мнения и замечания о течении и эпидемиологии хронического гастрита H. pylori и связанных с ним заболеваний, полученные в основном из нескольких исследований, проведенных в Эстонии и Финляндии за последние 40 лет [14, 15, 16, 17, 18, 19, 20, 21, 22].За прошедшие годы большинство этих исследований было опубликовано в этом журнале.
Естественное течение
Хронический гастрит – это многоступенчатое, прогрессирующее и пожизненное воспаление [3, 16, 20, 21, 22, 23, 24]. Обычно оно начинается в детстве как простое хроническое («поверхностное») мононуклеарное воспаление с сосуществованием острого («активного») нейтрофильного воспаления разной степени [25, 26]. Гастрит постепенно прогрессирует в течение лет и десятилетий до атрофического гастрита, который характеризуется потерей нормальных слизистых желез либо в антральном отделе, либо в теле (и дне), либо в обоих (, и) [7, 22, 23, 27].Как правило, во всех популяциях повозрастная распространенность как неатрофического, так и атрофического гастрита имеет тенденцию к возрастанию с возрастом, как это было продемонстрировано в Финляндии в. В настоящее время рост повозрастной распространенности гастрита по возрасту более выражен и резок в развивающихся, чем в развитых, популяциях, т. Е. Распространенность гастрита в молодых возрастных группах или даже в детстве гораздо больше, чем в развитых. 50% в развивающихся популяциях, тогда как эта распространенность в развитых странах обычно намного меньше 50% [17, 27].
Слизистая оболочка тела с «активным» хроническим гастритом (A): Воспаление является мононуклеарным, но сопровождается нейтрофилами и эозинофилами (стрелки), которые проникают в поверхностный эпителий. Нормальный (B): нормальная слизистая оболочка тела без каких-либо признаков воспаления показана в качестве эталона. Пятно HE × 500.
Слизистая оболочка тела. Нормальный (A): слой кислородных желез в норме, что позволяет предположить, что слизистая оболочка тела способна нормально секретировать соляную кислоту. Неатрофический гастрит (B): Легкое мононуклеарное воспаление наблюдается в верхнем слое (фовеолярной части) слизистой оболочки («поверхностный хронический гастрит»), как указано стрелками.Слой железы не поврежден, что свидетельствует о нормальной секреции кислоты, несмотря на гастрит. Умеренный атрофический гастрит в теле (C): Интенсивное хроническое мононуклеарное воспаление возникает также в нижних слоях слизистой оболочки и сопровождается заметной потерей (атрофией) нормальных оксинтических желез. Наблюдение предполагает, что желудок гипохлоргидный, но не ахлоргидный. Секреция кислоты нарушается из-за потери париетальных клеток. Тяжелый атрофический гастрит тела (D): хроническое воспаление слабое, но все кислородные железы полностью исчезли.В правом нижнем углу возникают некоторые очаги кишечной метаплазии. Желудок определенно не содержит кислоты (ахлоргидрат). Пациент подвержен риску мальабсорбции витамина B12, а также может быть нарушено всасывание микроэлементов (железа, кальция, магния и цинка). Патолог может столкнуться с трудностями при обнаружении бактерий Helicobacter pylori в подобных случаях, даже если атрофический гастрит имеет происхождение H. pylori . Вместо этого смешанная микробная флора (микробы, отличные от H.pylori ) часто встречается на поверхности слизистой оболочки в подобных случаях. Альциановый синий – PAS и модифицированные красители Гимза × 300.
Слизистая оболочка антрального отдела. Нормальный (A): Нормальное количество антральных G-клеток с типичным «ореолом» встречается в области шеи пилорических желез (стрелки). Неатрофический хронический гастрит (B): мононуклеарное воспаление охватывает всю слизистую оболочку, создавая впечатление потери железы (атрофии). Атрофический гастрит от легкой до умеренной степени в антральном отделе (C): Воспаление относительно легкое, но большая часть пилорических желез утрачена и заменена метапластическими железами (IM), как указано стрелками.Тяжелый атрофический гастрит в антральном отделе (D): все пилорические железы отсутствуют, а вся слизистая оболочка «кишечно-кишечная». Воспаление слабое или самое большее умеренное. Также исчезают антральные G-клетки вместе с потерей нормальных пилорических желез. Следовательно, реакция обратной связи G-17 в физиологическом контроле секреции кислоты нарушается. HE и альциановый синий – пятна PAS × 300.
Средняя повозрастная распространенность тотального хронического гастрита и атрофического гастрита в биоптатах от ~ 500 последовательных эндоскопических финских амбулаторных пациентов в конце 80-х годов (больница Йорви, Эспоо, Финляндия).Средняя распространенность увеличивается с возрастом.
Утрата слизистых желез при атрофическом гастрите сменяется ростом новых незрелых железистых и эпителиальных элементов; то есть с железами кишечного типа («кишечная метаплазия (IM)»), напоминающими железы и эпителий в толстой и / или тонкой кишке, и / или с железами пилорического типа («псевдопилорическая метаплазия»), напоминающими пилорические железы и эпителий, из которых G-клетки (гастриновые клетки) исчезают. В рамках эволюции высокодифференцированные железы, эпителий и клетки разрушаются при атрофии (атрофический гастрит), а утраченные железы заменяются железами и эпителием с незрелыми кишечными свойствами [2, 5, 6, 7, 14, 17, 23 , 24, 27, 28].и приведем несколько примеров этих явлений при патологии эндоскопической биопсии.
Первые проявления гастрита H. pylori этиологии имеют тенденцию к антральному, т.е. гастрит «преобладает в антральном отделе» [25, 27]. Воспаление, состоящее в основном из мононуклеарных воспалительных клеток и плазматических клеток, является «поверхностным» и занимает верхние слои слизистой оболочки, особенно в теле () [2, 20, 27, 28, 29]. Хроническое воспаление связано с нейтрофильным воспалением (), причем интенсивность этого острого и «активного» компонента гастрита, скорее всего, зависит от цитотоксичности H.pylori [22, 30]. Чем цитотоксичнее штамм, тем активнее и, очевидно, агрессивнее хронический гастрит. Наиболее агрессивными формами хронического гастрита являются те, которые с наибольшей вероятностью приводят к запущенным стадиям атрофического гастрита, т. Е. Представляют собой формы гастрита H. pylori с наибольшей вероятностью прогрессирования до конечной стадии атрофии [5, 6].
Годовой риск прогрессирования хронического гастрита от одной стадии к другой оценивается в среднем в 2–3% [16, 20, 23, 27].Предполагается, что около 50% пациентов с хроническим гастритом (и инфекцией H. pylori ) в течение жизни заболеют атрофическим гастритом той или иной степени тяжести [27]. Примерно у 5% инфицированных атрофический гастрит переходит в тяжелую и запущенную стадию [23, 27].
Медленное расширение гастрита H. pylori с чисто антрального фенотипа до форм, поражающих также тело и глазное дно («атрофический пангастрит», мультифокальный атрофический гастрит »или« гастрит с преобладанием тела »), как правило, является обычным явлением [ 7, 15, 19, 21, 23, 27, 31].Это проксимальное (пилорокардиальное) распространение и постепенное обострение атрофического гастрита связаны с заметными изменениями морфологии и функции слизистой оболочки желудка. Эти поражения нарушают функции желудка, вызывая, в частности, нарушения секреции соляной кислоты и внутреннего фактора кислородными железами при атрофии тела, а также нарушения синтеза и секреции гастрина-17 антральными G-клетками при антральной атрофии [23, 27, 32, 33, 34].
Тяжелый атрофический гастрит, который строго ограничен одним антральным отделом, очевидно, довольно редок.С другой стороны, развитая атрофия, которая возникает только в теле тела или одновременно занимает антральный и корпусный отделы, является относительно частым фенотипом хронического гастрита (до 5% людей с гастритом), по крайней мере, в Северной Европе [ 27, 31, 35]. Долгосрочные исследования показывают, что наряду с увеличением гастрита H. pylori вверх слизистая оболочка антрального отдела может даже зажить [20, 23, 27].
Из-за потери кислородных желез и париетальных клеток при атрофии тела, распространение атрофического гастрита на тело и глазное дно приводит к пожизненной и постоянной гипо- или ахлоргидрии.Впоследствии из-за низкой внутрижелудочной кислотности первоначальная инфекция H. pylori может, в свою очередь, спонтанно исчезнуть и, наконец, вылечить в случаях прогрессирующей атрофии, что продемонстрировано серологическими тестами в последующих наблюдениях [29, 36]. .
По мере прогрессирования хронического неатрофического гастрита до атрофических фенотипов, потенциально запускаются многочисленные случайные патогенетические процессы, даже канцерогенные, что является явлением в sc. «Каскад корреа» может, наконец, способствовать процессам, связывающим хронический гастрит с такими крайними последствиями, как рак [1, 7, 35, 37, 38, 39, 40, 41].Это можно проиллюстрировать на примере.
Схема естественного течения и прогрессирования гастрита Helicobacter pylori от неатрофической формы до злокачественного новообразования желудка (sc. Correa cascade). Некоторые потенциально патогенетические факторы и механизмы, связанные с канцерогенезом, играют определенную роль и запускаются поэтапно в течение и прогрессирования каскада.
Эпидемиология и феномен рождения когорты
Наблюдения, полученные в результате популяционных исследований хронического гастрита, могут помочь в некоторых фундаментальных выводах относительно эпидемиологии хронического гастрита и его последствий.
Хронический гастрит по-прежнему является относительно распространенным заболеванием, даже в развитых странах, даже несмотря на то, что его распространенность заметно снизилась, причем это снижение идет параллельно со снижением распространенности H. pylori [42, 43]. Вполне возможно, что практически каждый человек, даже в развитых странах, около 100 лет назад болел гастритом H. pylori , тогда как в настоящее время распространенность в среднем составляет менее 50%.
H. pylori гастрит в большинстве случаев приобретается в раннем детстве, тогда фенотип гастрита представляет собой безвредное и бессимптомное простое хроническое мононуклеарное («поверхностное») воспаление [25, 29].Тяжелые симптоматические последствия хронического гастрита проявятся только в последние десятилетия жизни и, как правило, возникают у пациентов с поздними стадиями поражения [1, 39, 43].
После открытия H. pylori стало очевидно, что понимание эпидемиологии инфекции H. pylori является ключом к пониманию эпидемиологии хронического гастрита и его последствий. Поскольку хронический гастрит и его последствия (язвенная болезнь желудка и рак желудка) изначально были пандемической бактериальной инфекцией у детей, эпидемиологические характеристики хронического гастрита соответствуют тем же «пандемическим» принципам, что и H.pylori сама по себе.
Социально-экономические факторы и гигиена окружающей среды неизбежно являются наиболее важными фоновыми факторами передачи инфекции H. pylori во всем мире, причем эти социально-экономические факторы также являются фоновыми факторами в эпидемиологии хронического гастрита и его последствий [43, 44, 45] . Социально-экономический статус в детстве, экологическая и семейная гигиена, плотность домохозяйства, привычки приготовления пищи и т. Д. Являются вероятными факторами, которые определяют вероятность приобретения H.pylori в детстве. Улучшение этих условий снижает вероятность заражения или дальнейшей передачи инфекции желудочно-оральным путем [46]. Снижение уровня инфицирования в детском возрасте на уровне семьи со временем неизбежно приведет к снижению распространенности гастрита H. pylori и его последствий в среднем среди всего населения.
Из-за «педиатрического» происхождения инфекции H. pylori эпидемиология H.pylori гастрит лучше всего понять и понять как «феномен когорты рождения», как это проиллюстрировано компьютерным моделированием в [43]. Уровень инфицирования в детском возрасте и повозрастная распространенность гастрита H. pylori высоки в когортах «старых» новорожденных, рожденных на десятилетия раньше, чем распространенность в когортах «молодых» новорожденных, родившихся позже и у которых уровень инфицирования H. pylori в детстве низкий. Таким образом, средняя распространенность гастрита на популяционном уровне отражает среднее значение распространенности хронического гастрита в разных когортах рождения и средний показатель H.pylori в детском возрасте.
Компьютерное моделирование, демонстрирующее «феномен когорты рождения» в распространенности гастрита Helicobacter pylori в популяции, состоящей из когорт с разными годами рождения. Примерно на основании данных о гастрите в Финляндии примерно в конце 80-х годов (см.).
Эпидемиология заболеваемости раком желудка и эпидемиология смертности от рака желудка следуют принципам «феномена когорты рождения» и демонстрируют аналогичные глобальные «пандемические» характеристики, как и в случае с H.pylori гастрит [43]. Уровень заболеваемости раком желудка (или язвенной болезнью) был и будет низким в когортах «молодых» новорожденных, в которых частота гастрита H. pylori низкая и слизистая оболочка желудка остается здоровой на протяжении всей жизни. . Напротив, распространенность, заболеваемость и смертность от язвенной болезни или рака желудка высоки и остаются высокими в старых когортах, пока они живы.
Аутоиммунный хронический гастрит
Хотя H.pylori , в конечном счете, является основной причиной (более чем в 90% случаев) гастрита, хронического мононуклеарного воспаления (гастрита) без продолжающейся инфекции H. pylori , но протекающего с тяжелым атрофическим гастритом тела и ахлоргидритом желудка. , и с сосуществованием аутоантител против париетальных клеток (протонная помпа) и / или внутреннего фактора, является хорошо установленным субъектом [3, 32, 47, 48, 49, 50]. Однако неясно, является ли этот гастрит «аутоиммунного» типа независимым заболеванием или H.pylori вызывает аутоиммунные реакции у некоторых ответственных лиц с обычной инфекцией H. pylori [3, 50, 51, 52]. Возможно, что первоначальная инфекция H. pylori может пройти спонтанно, когда атрофический гастрит перейдет в тяжелую атрофическую и ахлоргидрическую стадию, создавая, таким образом, ложное впечатление о чистой аутоиммунной этиологии заболевания.
Гастрит, связанный с аутоиммунными явлениями, в любом случае может быть более прогрессирующим и более быстрым, чем чистый H.pylori гастрит [3, 23]. В связи с аутоиммунитетом и у лиц со склонностью к аутоиммунным заболеваниям (аутоиммунный тиреоидит, диабет и т. Д.) Прогрессирование гастрита H. pylori до атрофических фенотипов может быть заметно деструктивным, что может легко и быстро привести к ахлоргидрии и полная атрофия тела и дна желудка. В медицинской литературе описаны случаи тяжелого атрофического гастрита с аутоиммунными характеристиками и безкислотного желудка даже в детском возрасте.
Показано, что хронический гастрит аутоиммунного типа является рецессивным мультигенным заболеванием и, возможно, имеет североевропейское происхождение [32].
Влияние на физиологию желудка
Длительное (пожизненное) хроническое и активное воспаление не может быть безвредным и приведет к разрушению слизистой оболочки желудка посредством нескольких механизмов, которые могут взаимодействовать с обновлением, ростом, целостностью, дифференцировкой и функцией эпителия желудка [1, 24, 39, 53, 54].Многочисленные аномальные экспрессии (повышающая и понижающая регуляция) функциональных и регуляторных генов, генные мутации, эпигенетические изменения, различные проявления цитокинов или факторов роста тканей происходят в регуляторных тканевых процессах слизистой оболочки желудка и эпителиальных клеток в связи с H. pylori. гастрит [53, 54]. Некоторые изменения являются обратными, могут проявляться даже на ранних стадиях воспаления, но могут особенно накапливаться со временем в предраковых состояниях, таких как атрофия и IM, и, по-видимому, чрезвычайно распространены и разнообразны при предраковых (дисплазия или интраэпителиальная неоплазия) и злокачественных новообразованиях. поражения [53, 54].
Атрофия тела в конечном итоге приводит к нарушению секреции соляной кислоты и внутреннего фактора [23, 34]. В бескислотном и атрофическом желудке из-за нарушения секреции внутреннего фактора всасывание основных витаминов, таких как витамин B12, серьезно нарушено [55]. Мальабсорбция и последующий длительный и постоянный дефицит витамина B12 могут нарушать метаболизм метионина, гомоцистеина или фолиевой кислоты и, таким образом, могут быть механизмом, который способствует появлению эпигенетических повреждений ДНК из-за нарушения функции цикла метилирования в эпителиальных клетках. клетки [55, 56].
Диетический метаболизм и всасывание питательных микроэлементов, таких как железо, кальций, магний и цинк, или всасывание некоторых лекарств (например, дипиридамола, некоторых препаратов железа и противогрибковых препаратов, таких как флуконазол или итраконазол, тироксин и атазановир) нарушаются из-за кислоты свободный желудок тоже [57]. Бескислотный желудок в конечном итоге заселяется микробной флорой изо рта [58]. Микробы и бескислотный желудок способны продуцировать канцерогены класса 1, такие как ацетальдегид и нитрозоамины [39, 59].
Рак и язвенная болезнь
Рак желудка и язвенная болезнь (исключая язвы, вызванные приемом НПВП) являются наиболее серьезными заболеваниями, связанными с хроническим гастритом H. pylori [60, 61, 62, 63, 64, 65]. Успешная ликвидация H. pylori предотвращает рецидивы язвы, но также может предотвратить рак [66, 67].
Несмотря на ассоциации пептических язв и рака с гастритом H. pylori , эти связи также существенно различаются [62, 68].Пептические язвы двенадцатиперстной кишки (ЯД) обычно возникают у людей с неатрофическим гастритом H. pylori , но нечасты или отсутствуют у субъектов, у которых гастрит прогрессировал до атрофических форм в теле и у которых желудок впоследствии стал хлоргидридным ( ). С другой стороны, язвы желудка часто связаны с фенотипами гастрита, при которых выраженная атрофия и IM возникают в антральном отделе и режущей кромке, и в этих случаях слизистая оболочка тела может быть даже слегка атрофичной, но никогда не бывает сильно атрофированной (и желудок бывает атрофичным). никогда не ахлоргидный) [62].Рак желудка, в частности кишечного типа, наблюдается у пациентов с гипохлоргидритом или ахлоргидридом желудка и, в частности, может возникать у субъектов с поздними стадиями атрофии и IM как в антральном отделе, так и в теле [39, 69].
Относительный риск язвенной болезни (двенадцатиперстной кишки или желудка) или рака желудка при различных фенотипах хронического атрофического Helicobacter pylori гастрита. Риски представлены как относительные риски по сравнению с рисками у субъектов с нормальной и здоровой слизистой оболочкой желудка (категория N / N; желтый).Риски экстраполируются и оцениваются на основе исследования случай-контроль, проведенного в Финляндии в 80-х годах [69]. Обратите внимание, что риски язвенной болезни и рака желудка связаны с очень разными фенотипами хронического гастрита.
Канцерогенез желудка неоднороден и чрезвычайно разнообразен на молекулярном уровне [53, 54]. Несмотря на то, что генных ошибок много, никаких специфических или всеобъемлющих молекулярных маркеров, генных ошибок или мутаций при раке или предраковых поражениях пока не обнаружено.Хотя два основных гистологических типа рака желудка, кишечный и диффузный, являются значимыми сущностями с клинической и морфологической точки зрения, и оба связаны с предшествующим или сосуществующим гастритом H. pylori , эти типы могут не быть полностью разными сущностями. . При диффузном типе фоновой морфологией часто является неатрофический гастрит H. pylori , что указывает на то, что канцерогенные механизмы при этом типе рака могут быть более тесно связаны с воспалением, чем с механизмами, которые появляются при атрофическом гастрите или кислоте. свободный желудок [37, 38].С другой стороны, при типе рака кишечника явные опухоли или предраковые поражения часто связаны с гипохлоргидритом желудка, выраженным атрофическим гастритом и обширным ИМ в подлежащей слизистой оболочке [37, 38, 70, 71]. Следовательно, канцерогенные процессы при этом типе рака могут быть связаны с механизмами, которые возникают при атрофическом гастрите или запускаются гипохлоргидридом или бескислотным желудком.
Риск рака
Атрофический гастрит и бескислотный желудок являются наиболее важными независимыми состояниями риска рака желудка, известными на сегодняшний день.Статистически атрофический гастрит представляет собой более высокий риск рака, чем инфекция H. pylori в чистом виде [69]. Вероятность рака желудка при гастрите возрастает экспоненциально с прогрессированием гастрита H. pylori из неатрофической формы в атрофическую [69]. Риск может возрасти даже до 90 раз у пациентов с тяжелым атрофическим гастритом как антрального отдела, так и тела (тяжелая панатрофия; мультифокальный атрофический гастрит (MAG)) по сравнению с риском рака у пациентов с нормальной и здоровой слизистой оболочкой желудка () [69] .
Риск рака значительно ниже у людей без гастрита H. pylori , то есть у людей со здоровой слизистой оболочкой желудка. Риск увеличивается примерно в два раза у пациентов с чистой инфекцией H. pylori , т.е. у пациентов с неатрофическим гастритом H. pylori [60, 61, 69]. Таким образом, у пациентов с DU, которые обычно имеют неатрофический гастрит H. pylori , риск рака немного выше, чем риск рака у здоровых субъектов, но этот риск, тем не менее, все еще очень низок по сравнению с риском рака. у пациентов с тяжелым и запущенным атрофическим гастритом (см.).
Парадоксально, но нагрузка на слизистую оболочку желудка хеликобактериями обычно высока у субъектов с относительно низким риском рака, как и у обычных пациентов с ЯН. Как это ни парадоксально, нагрузка имеет тенденцию уменьшаться, когда повышается риск рака, как это имеет место у пациентов с далеко зашедшим атрофическим гастритом [69]. Риск рака может быть, например, высоким у субъектов с тяжелым атрофическим гастритом и бескислотным желудком, у которых может даже не быть объективных признаков продолжающегося H.pylori , то есть у пациентов, у которых, возможно, исчезла первоначальная инфекция H. pylori .
Сиднейская система и оперативное звено по классификации гастритов
Признание того, что инфекция H. pylori и последующий атрофический гастрит и отсутствие кислоты в желудке являются важными фоновыми состояниями рака желудка, позволяет сортировать пациентов в клинической практике по значимым группы относительно риска рака. Эта сортировка требует обследования субъектов с помощью эндоскопии и эндоскопической биопсии или может быть проведена с помощью неинвазивных анализов крови с использованием биомаркеров, специфичных для желудка [72, 73, 74, 75, 76, 77].
Сиднейская система и ее обновление являются руководящими принципами для интерпретации микроскопических проявлений биоптатов в практике эндоскопии [5, 6]. Надлежащий протокол биопсии и правильное считывание результатов биопсии под микроскопом являются фундаментальными требованиями для правильного и успешного разделения пациентов на клинически значимые группы риска [78, 79]. Такие классификации или родословные невозможны только с помощью эндоскопии или не могут быть выполнены с помощью тестирования H.pylori отдельно.
Стадия OLGA / OLGIM (Оперативная ссылка на гастрит / оценка IM) атрофического гастрита представляет собой практическую схему классификации пациентов в группы низкого, среднего и высокого риска рака желудка [79]. Эта классификация делит пациентов на пять подгрупп (0 – IV) с сильно различающейся вероятностью развития или заболеть раком желудка (). Классификация и сортировка могут объективно подсказать, какой из пациентов будет нуждаться в большинстве случаев эндоскопического наблюдения и последующего наблюдения [79, 80].
OLGA: стадия риска рака желудка. Изменено из статьи Рагге и др. [79]. Определение стадии – это практический инструмент для разделения пациентов на группы высокого (III – IV стадии) и низкого (0 – II стадии) риска рака, в частности рака желудка кишечного типа. Определение стадии требует эндоскопии и надлежащей практики биопсии, но также может быть выполнено неинвазивно с помощью анализа крови с применением определенных биомаркеров (пепсиноген I и II, гастрин-17 и серология Helicobacter pylori ), которые отражают функцию (секреция кислоты) и структура слизистой оболочки антрального отдела и тела в плазме / сыворотке крови.
Разделение субъектов на подкатегории OLGA может быть выполнено также неэндоскопически и неинвазивно с помощью простых анализов крови, основанных на оценке уровней биомаркеров, специфичных для желудка (пепсиногены I и II, гастрин-17 и H. pylori ) в плазме / сыворотке крови [72, 73, 74, 77, 80]. Это невозможно сделать с помощью одного теста H. pylori .
Плазменные биомаркеры в диагностике и скрининге атрофического гастрита
Очистка желудочных пепсиногенов в 70-е годы, понимание естественного течения H.pylori , уникальные инновации в методах вертикального измерения микропланшетов и разработка тестов ELISA со специфическими моноклональными антителами предоставили приложения для использования желудочных биомаркеров в неинвазивной диагностике и скрининге атрофического гастрита на основе простого образца крови [81, 82, 83 ]. В настоящее время эти анализы крови надежно могут быть выполнены в любой лаборатории и не требуют специальных мероприятий. Несколько подробных и всесторонних обзоров, согласованных отчетов и руководств по практическому использованию тестов на биомаркеры в диагностике атрофического гастрита были опубликованы ранее в этом и других медицинских журналах (см. Ссылки [72, 80, 84]).
Несколько коммерческих радиоиммуноанализов и тестов ELISA были доступны для пепсиногена 1 и 2 в течение довольно долгого времени. Однако у этих тестов есть ограничения, поскольку они могут использоваться только для диагностики атрофического гастрита тела [74]. Уровни пепсиногенов 1 и 2 в сыворотке крови не указывают на возможный атрофический гастрит в антральном отделе желудка, где, однако, сначала появляются атрофические и метапластические изменения. Более полный тест (GastroPanel®) включает анализ уровней G-17 в плазме в дополнение к анализам пепсиногена 1 и пепсиногена 2, а также включает анализ H.pylori серологический тест. Эта тестовая панель позволяет оценить атрофию также в антральном отделе желудка и дает намёки на внутрижелудочную кислотность в дополнение к информации о возможной атрофии тела, что делает возможной всестороннюю классификацию OLGA [72, 73, 77, 78, 80].
Антральный атрофический гастрит (потеря антральных желез) сопровождается потерей антральных G-клеток, потеря которых приводит к низким уровням в плазме как натощак, так и стимулированного гастрина-17 (после питья протеинового порошка, стимуляции бомбезином (гастрином). высвобождающий пептид) или стимуляция ингибитором протонной помпы (ИПП)).Низкий уровень G-17 в плазме натощак (1 пмоль / л или меньше) на практике указывает на два варианта. Либо имеется развитый атрофический гастрит в антральном отделе (класс III – IV по OLGA), либо низкий уровень G-17 является результатом высокой внутрижелудочной кислотности (низкий pH). Оба варианта являются показаниями для верхней ги-эндоскопии из-за риска рака из-за возможной атрофии антрального отдела и из-за риска язвенной болезни из-за гиперхлоргидрии (выделения с высоким содержанием кислоты) (см.)
Отсутствие антител к H. pylori одновременно с наличием нормальных уровней пепсиногена 1 в плазме, нормальным соотношением пепсиногена 1 к пепсиногену 2 и нормальным гастрином-17 в плазме при условии, что возможное лечение ИПП находится под контролем, это результат теста, который достоверно свидетельствует о наличии нормальной и здоровой слизистой оболочки желудка (класс 0 по OLGA).Риск рака и язвенной болезни у таких «здоровых» людей крайне низок, практически нулевой. С другой стороны, риск рака желудка высок (класс III-IV по OLGA) у субъектов с низким уровнем пепсиногена 1 натощак (менее 30 мкг / л), с низким соотношением пепсиногена 1 к пепсиногену 2 (ниже 3 ) и с высоким содержанием гастрина-17 натощак (выше 7 пмоль / л), риск рака у этих пациентов высок независимо от того, есть ли у пациента текущая инфекция H. pylori (см.) [72, 80].Атрофический гастрит в этих случаях является развитым и обширным, занимает всю слизистую оболочку желудка (класс IV по OLGA), при этом желудок не содержит кислоты.
Будущие тенденции и инициатива в отношении здорового желудка
Несмотря на то, что гастрит H. pylori сокращается по распространенности, хронический гастрит по-прежнему будет чрезвычайно частым заболеванием во всем мире в течение нескольких будущих десятилетий. В связи с микробным происхождением и инфекционным фоном, а также знаниями эпидемиологии и естественным течением хронического H.pylori , можно предположить, что это заболевание может окончательно исчезнуть из общества вместе с улучшениями в гигиене и социально-экономическом развитии. Благодаря этим улучшениям риск заражения H. pylori в детстве снизится. Как и в случае с туберкулезом, хронический гастрит может в ближайшие десятилетия отойти на периферию медицинской практики и значимости, по крайней мере, в развитых странах. Следовательно, пептические язвы будут редкими, а рак желудка станет редким злокачественным новообразованием.
Среди самых молодых коренных жителей в когортах в западных странах около 90–100% людей уже сейчас имеют и будут иметь нормальный здоровый желудок на протяжении всей жизни, в результате чего в конечном итоге у подавляющего большинства людей есть здоровый желудок и, следовательно, не подвержены риску развития язвенной болезни или рака желудка. Попытки сохранить или получить здоровый желудок для всех будут инициативой и целью как будущих исследований, так и клинической практики («инициатива здорового желудка»; см .: www.hsinitiative.org).
Благодарности
Декларация интересов : Доктор Пентти Сиппонен является акционером и членом научного комитета Biohit Oyj. Компания разрабатывает и продает лабораторные тесты, в основном, на желудочно-кишечные заболевания.
Ссылки
- IARC Шистосомы, печеночные двуустки и Helicobacter pylori. Рабочая группа МАИР по оценке канцерогенных рисков для людей. Лион, 7-14 июня 1994 г. IARC Monogr Eval Carcinog Risks Hum.1994; 61: 1–241. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Шиндлер Р. Хронический гастрит. Klin Wochenschr. 1966; 44: 601–12. [PubMed] [Google Scholar]
- Сирала М. История гастрита. Scand J Gastroenterol Suppl. 1991; 186: 1–3. [PubMed] [Google Scholar]
- Telaranta-Keerie A, Kara R, Paloheimo L, Härkönen M, Sipponen P. Распространенность недиагностированного прогрессирующего атрофического гастрита тела в Финляндии: обсервационное исследование среди 4256 добровольцев без особых жалоб.Сканд Дж Гастроэнтерол. 2010; 45: 1036–41. [PubMed] [Google Scholar]
- Price AB. Сиднейская система: гистологическое деление. J Gastroenterol Hepatol. 1991; 6: 209–22. [PubMed] [Google Scholar]
- Диксон М.Ф., Гента Р.М., Ярдли Дж. Х., Корреа П. Классификация и классификация гастрита. Обновленная Сиднейская система. Международный семинар по гистопатологии гастрита, Хьюстон, 1994. Am J Surg Pathol. 1996; 20: 1161–81. [PubMed] [Google Scholar]
- Корреа П. Хронический гастрит: клинико-патологическая классификация.Am J Gastroenterol. 1988; 83: 504–9. [PubMed] [Google Scholar]
- Маршалл Б.Дж., Уоррен-младший. Неопознанные изогнутые бациллы в желудке больных гастритом и язвенной болезнью. Ланцет. 1984; 323: 1311–15. [PubMed] [Google Scholar]
- Варис К. Семья поведения при хроническом гастрите. Ann Clin Res. 1981; 13: 123–9. [PubMed] [Google Scholar]
- Валле Дж., Сеппала К., Сиппонен П., Косунен Т. Исчезновение гастрита после искоренения Helicobacter pylori. Морфометрическое исследование.Сканд Дж Гастроэнтерол. 1991; 26: 1057–65. [PubMed] [Google Scholar]
- Ходзё М., Мива Х., Окуса Т., Окура Р., Куросава А., Сато Н. Изменение гистологического гастрита после излечения от инфекции Helicobacter pylori. Алимент Pharmacol Ther. 2002; 16: 1923–32. [PubMed] [Google Scholar]
- Аннибале Б., Ди Джулио Е., Каруана П., Ланер Е., Капурсо Г., Борди С. и др. Долгосрочные эффекты лечения инфекции Helicobacter pylori у пациентов с атрофическим гастритом тела. Алимент Pharmacol Ther. 2002; 16: 1723–31.[PubMed] [Google Scholar]
- Arkkila PE, Seppälä K, Färkkilä MA, Veijola L, Sipponen P. Эрадикация Helicobacter pylori в лечении атрофического гастрита: перспективное исследование в течение одного года. Сканд Дж Гастроэнтерол. 2006; 41: 782–90. [PubMed] [Google Scholar]
- Сиурала М., Варис К., Вильясало М. Исследования пациентов с атрофическим гастритом: наблюдение через 10–15 лет. Сканд Дж Гастроэнтерол. 1966; 1: 40–8. [PubMed] [Google Scholar]
- Виллако К., Кекки М., Тамм А., Таммур Р., Сависаар Э., Вийрсалу В. и др.Эпидемиология и динамика гастрита в репрезентативной выборке городского населения Эстонии. Сканд Дж Гастроэнтерол. 1982; 17: 601–7. [PubMed] [Google Scholar]
- Ихамаки Т., Кекки М., Сиппонен П., Сиурала М. Последствия и течение хронического гастрита во время контрольного биопсийного исследования в течение 30–34 лет. Сканд Дж Гастроэнтерол. 1985; 20: 485–91. [PubMed] [Google Scholar]
- Маарус Х.И., Виллако К.П., Сиппонен П., Кекки М., Сирала М., Таммур Р. и др. Helicobacter pylori и хронический гастрит в материале биопсии желудка в группе случайно выбранных взрослых жителей Эстонии.Арх Патол. 1990; 52: 9–11. [PubMed] [Google Scholar]
- Кекки М., Маарус Х.И., Сиппонен П., Уйбо Р., Таммур Р., Тамм А. и др. Степень колонизации Helicobacter pylori по отношению к гастриту: последующее шестилетнее популяционное исследование. Scand J Gastroenterol Suppl. 1991; 186: 142–50. [PubMed] [Google Scholar]
- Виллако К., Кекки М., Маарус Х.И., Сиппонен П., Уйбо Р., Таммур Р. и др. Хронический гастрит: прогрессирование воспаления и атрофии при шестилетнем эндоскопическом наблюдении за случайной выборкой из 142 городских жителей Эстонии.Scand J Gastroenterol Suppl. 1991; 186: 135–41. [PubMed] [Google Scholar]
- Валле Дж., Кекки М., Сиппонен П., Ихамаки Т., Сирала М. Долгосрочное течение и последствия гастрита, вызванного Helicobacter pylori. Результаты 32-летнего наблюдения. Сканд Дж Гастроэнтерол. 1996; 31: 546–50. [PubMed] [Google Scholar]
- Виллако К., Кекки М., Маарус Х.И., Сиппонен П., Таммур Р., Тамм А. и др. 12-летнее контрольное исследование хронического гастрита и Helicobacter pylori в случайной выборке из популяции. Сканд Дж Гастроэнтерол.1995; 30: 964–7. [PubMed] [Google Scholar]
- Маарус Х.И., Воробьева Т., Сиппонен П., Таммур Р., Уйбо Р., Вадстрём Т. и др. 18-летнее катамнестическое исследование связи хронического гастрита и Helicobacter pylori положительности CagA с развитием атрофии и активностью гастрита. Сканд Дж Гастроэнтерол. 1999; 34: 864–9. [PubMed] [Google Scholar]
- Сиурала М., Сиппонен П., Кекки М. Хронический гастрит: динамические и клинические аспекты. Scand J Gastroenterol Suppl. 1985; 109: 69–76. [PubMed] [Google Scholar]
- Сиппонен П., Кекки М., Сирала М.Сиднейская система: эпидемиология и естественная история хронического гастрита. J Gastroenterol Hepatol. 1991; 6: 244–51. [PubMed] [Google Scholar]
- Maaroos HI, Rägo T., Sipponen P, Siurala M. Helicobacter pylori и гастрит у детей с жалобами на брюшную полость. Сканд Дж Гастроэнтерол. 1991; 26: 95–9. [PubMed] [Google Scholar]
- Maaroos HI, Kekki M, Villako K, Sipponen P, Tamm A, Sadeniemi L. Частота и степень колонизации Helicobacter pylori и профили антрального и телесного гастрита в выборке населения Эстонии.Сканд Дж Гастроэнтерол. 1990; 25: 1010–17. [PubMed] [Google Scholar]
- Кекки М., Сирала М., Варис К., Сиппонен П., Систонен П., Неванлинна HR. Принципы классификации и генетика хронического гастрита. Scand J Gastroenterol Suppl. 1987. 141: 1–28. [PubMed] [Google Scholar]
- Ихамаки Т., Сиппонен П., Варис К., Кекки М., Сирала М. Характеристики слизистой оболочки желудка, предшествующие возникновению злокачественного новообразования желудка: результаты длительного наблюдения трех семейных образцов. Scand J Gastroenterol Suppl.1991; 186: 16–23. [PubMed] [Google Scholar]
- Maaroos HI, Kekki M, Villako K, Sipponen P, Tamm A, Sadeniemi L. Частота и степень колонизации Helicobacter pylori и профили антрального и телесного гастрита в выборке населения Эстонии. Сканд Дж Гастроэнтерол. 1990; 25: 1010–17. [PubMed] [Google Scholar]
- Раутелин Х., Сиппонен П., Сеппала К., Сарна С., Даниэльссон Д., Косунен Т.У. Воспаление желудка и штаммы Helicobacter pylori, активирующие нейтрофилы и продуцирующие цитотоксины.Сканд Дж Гастроэнтерол. 1996; 31: 639–42. [PubMed] [Google Scholar]
- Кекки М., Сирала М., Ихамаки Т. Обогащение комбинированного атрофического гастрита антрального отдела и тела («комбинированный АГ») у братьев и сестер пациентов с карциномой желудка. Scand J Gastroenterol Suppl. 1991; 186: 24–8. [PubMed] [Google Scholar]
- Варис К. Эпидемиология гастрита. Scand J Gastroenterol Suppl. 1982; 79: 44–51. [PubMed] [Google Scholar]
- Сиппонен П., Валле Дж., Варис К., Кекки М., Ихамаки Т., Сирала М. Уровни сывороточного гастрина натощак при различных функциональных и морфологических состояниях слизистой оболочки антрофунда.Анализ 860 предметов. Сканд Дж Гастроэнтерол. 1990; 25: 513–19. [PubMed] [Google Scholar]
- Sipponen P, Kekki M, Seppälä K, Siurala M. Взаимосвязь между хроническим гастритом и секрецией желудочного сока. Алимент Pharmacol Ther. 1996; 10: 103–18. [PubMed] [Google Scholar]
- Кекки М., Ихамаки Т., Варис К., Сирала М. Профили хронического гастрита у братьев и сестер пробандов, рассчитанные как имеющие повышенный риск рака желудка. Scand J Gastroenterol Suppl. 1991; 186: 29–32. [PubMed] [Google Scholar]
- Коккола А., Косунен Т.У., Пуолаккайнен П., Сиппонен П., Херконен М., Лаксен Ф. и др.Спонтанное исчезновение антител к Helicobacter pylori у пациентов с запущенным атрофическим гастритом тела. APMIS. 2003; 111: 619–24. [PubMed] [Google Scholar]
- Сиппонен П., Кекки М., Сирала М. Возрастные тенденции гастрита и кишечной метаплазии у пациентов с карциномой желудка и в контрольной группе, представляющей население в целом. Br J Рак. 1984; 49: 521–30. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Сиппонен П., Кекки М., Сирала М. Атрофический хронический гастрит и кишечная метаплазия при раке желудка.Сравнение с репрезентативной выборкой населения. Рак. 1983; 52: 1062–8. [PubMed] [Google Scholar]
- Корреа П., Пиасуэло МБ. Предраковый каскад желудка. J Dig Dis. 2012; 13: 2–9. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- You WC, Li JY, Blot WJ, Chang YS, Jin ML, Gail MH, et al. Эволюция предраковых поражений у сельского населения Китая с высоким риском рака желудка. Int J Cancer. 1999; 83: 615–19. [PubMed] [Google Scholar]
- Корреа П., Хансель В., Куэлло С., Завала Д., Фонтам Е., Зарама Г. и др.Предраковый процесс желудка в популяции высокого риска: когортное наблюдение. Cancer Res. 1990; 50: 4737–40. [PubMed] [Google Scholar]
- Sipponen P, Helske T., Järvinen P, Hyvärinen H, Seppälä K, Siurala M. Снижение распространенности хронического гастрита за 15 лет: анализ амбулаторных исследований в Финляндии с 1977, 1985 и 1992. Gut. 1994; 35: 1167–71. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Сиппонен П. Гастрит с Helicobacter pylori – эпидемиология. J Gastroenterol. 1997. 32: 273–7.[PubMed] [Google Scholar]
- Уна М., Утт М., Нильссон И., Уйбо О., Воробьева Т., Маарус Х.И. Инфекция Helicobacter pylori у детей в Эстонии: снижение серологической распространенности в течение 11-летнего периода глубоких социально-экономических изменений. Helicobacter. 2004; 9: 223–41. [PubMed] [Google Scholar]
- Eusebi LH, Zagari RM, Bazzoli F. Эпидемиология инфекции Helicobacter pylori. Helicobacter. 2014; 19: 1–5. [PubMed] [Google Scholar]
- Axon AT. Обзорная статья: передается ли Helicobacter pylori желудочно-оральным путем? Алимент Pharmacol Ther.1995; 9: 585–8. [PubMed] [Google Scholar]
- Варис К., Стенман У. Х., Лехтола Дж., Сирала М. Поражение желудка и злокачественная анемия: семейное исследование. Acta Hepatogastroenterol (Stuttg) 1978; 25: 62–7. [PubMed] [Google Scholar]
- Варис К., Исокоски М. Скрининг гастрита типа А. Ann Clin Res. 1981; 13: 133–8. [PubMed] [Google Scholar]
- Кекки М., Варис К., Похьянпало Х., Исокоски М., Ихамаки Т., Сирала М. Течение антрального и телесного гастрита в семьях с злокачественной анемией. Dig Dis Sci.1983; 28: 698–704. [PubMed] [Google Scholar]
- Воробьева Т., Фаллер Г., Маарус Х.И., Сиппонен П., Виллако К., Уибо Р. и др. Значительное увеличение антигастральных аутоантител в долгосрочном катамнестическом исследовании гастрита, вызванного H.pylori. Арка Вирхова. 2000; 437: 37–45. [PubMed] [Google Scholar]
- Уйбо Р., Воробьева Т., Метцюла К., Кисанд К., Вадстрём Т., Кивик Т. Ассоциация Helicobacter pylori и желудочного аутоиммунитета: популяционное исследование. FEMS Immunol Med Microbiol. 1995; 11: 65–8. [PubMed] [Google Scholar]
- Воробьева Т., Маарус Х.И., Uibo Иммунный ответ на Helicobacter pylori и его связь с динамикой хронического гастрита в антральном отделе и теле.APMIS. 2008. 116: 465–76. [PubMed] [Google Scholar]
- Тахара Э. Генетические пути двух типов рака желудка. IARC Sci Publ. 2004. 157: 327–49. [PubMed] [Google Scholar]
- Qu Y, Dang S, Hou P. Метилирование генов при раке желудка. Clin Chim Acta. 2013; 424: 56–65. [PubMed] [Google Scholar]
- Sipponen P, Laxén F, Huotari K, Härkönen M. Распространенность низкого содержания витамина B12 и высокого гомоцистеина в сыворотке крови у пожилых мужчин: связь с атрофическим гастритом и инфекцией Helicobacter pylori.Сканд Дж Гастроэнтерол. 2003. 38: 1209–16. [PubMed] [Google Scholar]
- Боландер-Гуай К. Сосредоточьтесь на гомоцистеине и витаминах, участвующих в его метаболизме. Франция: Спрингер-Верлаг; 2002. [Google Scholar]
- Sipponen P, Härkönen M. Гипохлоргидрат желудка: состояние риска мальабсорбции кальция и остеопороза? Сканд Дж Гастроэнтерол. 2010; 45: 133–8. [PubMed] [Google Scholar]
- Саласпуро, член парламента. Ацетальдегид, микробы и рак пищеварительного тракта. Критик Rev Clin Lab Sci.2003. 40: 183–208. [PubMed] [Google Scholar]
- Саласпуро М. Ацетальдегид как общий знаменатель и совокупный канцероген при раке пищеварительного тракта. Сканд Дж Гастроэнтерол. 2009; 44: 912–25. [PubMed] [Google Scholar]
- Сиппонен П. Хронический гастрит и риск язвы. Сканд Дж Гастроэнтерол. 1990; 25: 193–6. [PubMed] [Google Scholar]
- Sipponen P, Seppälä K, Äärynen M, Helske T., Kettunen P. Хронический гастрит и гастродуоденальная язва: исследование случай-контроль риска сосуществующей язвы двенадцатиперстной кишки или желудка у пациентов с гастритом.Кишечник. 1989; 30: 922–9. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Кекки М., Сиппонен П., Сирала М., Лашевич В. Язвенная болезнь и хронический гастрит: их связь с возрастом и полом, а также с локализацией язвы и гастрита. Гастроэнтерол Clin Biol. 1990; 14: 217–23. [PubMed] [Google Scholar]
- Sipponen P, Varis K, Fräki O, Korri UM, Seppälä K, Siurala M. Совокупный 10-летний риск развития симптоматической язвы двенадцатиперстной кишки и желудка у пациентов с хроническим гастритом или без него. Клиническое наблюдение с участием 454 амбулаторных больных.Сканд Дж Гастроэнтерол. 1990; 25: 966–7. [PubMed] [Google Scholar]
- Арккила П.Е., Сеппала К., Косунен Т.Ю., Хаапиайнен Р., Кивилааксо Е., Сиппонен П. и др. Ликвидация Helicobacter pylori улучшает скорость заживления и снижает частоту рецидивов некровоточащих язв у пациентов с кровоточащей язвенной болезнью. Am J Gastroenterol. 2003. 98: 2149–56. [PubMed] [Google Scholar]
- Axon AT. Терапия Helicobacter pylori: влияние на язвенную болезнь. J Gastroenterol Hepatol. 1991; 6: 131–7. [PubMed] [Google Scholar]
- Kosunen TU, Pukkala E, Sarna S, Seppälä K, Aromaa A, Knekt P, et al.Рак желудка у финских пациентов после излечения от инфекции Helicobacter pylori: когортное исследование. Int J Cancer. 2011; 128: 433–9. [PubMed] [Google Scholar]
- Ли Y-C, Chen TH-H, Chiu H-M, Shun CT, Chiang H, Liu TY и др. Польза от массового искоренения инфекции Helicobacter pylori: исследование профилактики рака желудка на уровне сообщества. Кишечник. 2013; 62: 676–82. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Маарус Х.И., Кекки М., Воробьева Т., Салупере В., Сиппонен П. Риск рецидива язвы желудка, хронического гастрита и степень колонизации Helicobacter pylori.Сканд Дж Гастроэнтерол. 1994; 29: 532–6. [PubMed] [Google Scholar]
- Сиппонен П., Кекки М., Хаапакоски Дж., Ихамаки Т., Сирала М. Риск рака желудка при хроническом атрофическом гастрите: статистические расчеты поперечных данных. Int J Cancer. 1985; 35: 173–7. [PubMed] [Google Scholar]
- Sipponen P, Kosunen TU, Valle J, Riihelä M, Seppälä K. Инфекция Helicobacter pylori и хронический гастрит при раке желудка. J Clin Pathol. 1992; 45: 319–23. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Варис К., Тейлор П.Р., Сиппонен П., Самлофф И.М., Хейнонен О.П., Албейнс Д. и др.Рак желудка и предраковые поражения при атрофическом гастрите: контролируемое исследование влияния добавок с альфа-токоферолом и бета-каротином. Хельсинкская группа по изучению гастрита. Сканд Дж Гастроэнтерол. 1998. 33: 294–300. [PubMed] [Google Scholar]
- Agréus L, Kuipers EJ, Kupcinskas L., Malfertheiner P, Di Mario F, Leja M, et al. Обоснование диагностики и скрининга атрофического гастрита с использованием биомаркеров плазмы, специфичных для желудка. Сканд Дж Гастроэнтерол. 2012; 47: 136–47. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- ди Марио Ф, Кавалларо LG.Неинвазивные тесты при желудочных заболеваниях. Dig Liver Dis. 2008; 40: 523–30. [PubMed] [Google Scholar]
- Динис-Рибейро М., да Коста-Перейра А., Лопес С., Барбоса Дж., Гильерме М., Морейра-Диас Л. и др. Достоверность соотношения пепсиногена I / II в сыворотке для диагностики дисплазии эпителия желудка и кишечной метаплазии во время наблюдения за пациентами из группы риска по аденокарциноме желудка кишечного типа. Неоплазия. 2004. 6: 449–56. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Varis K, Kekki M, Härkönen M, Sipponen P, Samloff IM.Сывороточный пепсиноген I и сывороточный гастрин в скрининге атрофического пангастрита с высоким риском рака желудка. Scand J Gastroenterol Suppl. 1991; 186: 117–23. [PubMed] [Google Scholar]
- Кекки М., Самлофф И.М., Варис К., Ихамаки Т. Сывороточный пепсиноген I и сывороточный гастрин в скрининге тяжелого атрофического гастрита тела. Scand J Gastroenterol Suppl. 1991; 186: 109–16. [PubMed] [Google Scholar]
- Sipponen P, Härkönen M, Alanko A, Suovaniemi O. Диагностика атрофического гастрита по образцу сыворотки.Clin Lab. 2002; 48: 505–15. [PubMed] [Google Scholar]
- Sipponen P, Stolte M. Клиническое влияние рутинных биопсий антрального отдела желудка и тела. Эндоскопия. 1997. 29: 671–8. [PubMed] [Google Scholar]
- Рагге М., Меггио А, Пеннелли Дж., Пишоли Ф., Джакомелли Л., Де Претис Дж. И др. Стадия гастрита в клинической практике: стадия OLGA. Кишечник. 2007; 56: 631–6. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Sipponen P, Graham DY. Значение атрофического гастрита в диагностике и профилактике рака желудка: применение биомаркеров плазмы.Сканд Дж Гастроэнтерол. 2007; 42: 2–10. [PubMed] [Google Scholar]
- Самлофф И.М. Пепсиногены I и II: очистка слизистой оболочки желудка и радиоиммуноанализ в сыворотке крови. Гастроэнтерология. 1982; 82: 26–33. [PubMed] [Google Scholar]
- Суованиеми О. Автоматизированное оборудование для клинических и исследовательских лабораторий. Инновации и разработка фотометров с вертикальным световым лучом и электронных пипеток. Университет Хельсинки 1994; Академическая диссертация. [Google Scholar]
- www.biohithealthcare.com/about-us/history Доступно по адресу.
- Мики К. Скрининг рака желудка с помощью комбинированного анализа сывороточных антител IgG к Helicobacter pylori и уровней пепсиногена в сыворотке – «метод ABC» Proc Jpn Acad Ser B Phys Biol Sci. 2011; 87: 405–14. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Хронический гастрит: история вопроса, патофизиология, этиология
Сабо И.Л., Чеко К., Циммер Дж., Мозик Г. Диагностика гастрита – обзор от ранней патологической оценки до наших дней управление.Мозик Г, изд. Актуальные темы гастрита – 2012 . Риека, Хорватия: In Tech; 2012. Глава 1. [Полный текст].
Уоррен Дж. Р., Маршалл Б. Неопознанные изогнутые бациллы на эпителии желудка при активном хроническом гастрите. Ланцет . 4 июня 1983 г., 1 (8336): 1273-5. [Медлайн].
Gao L, Weck MN, Stegmaier C, Rothenbacher D, Brenner H. Употребление алкоголя и хронический атрофический гастрит: популяционное исследование среди 9 444 пожилых людей из Германии. Инт Дж. Рак . 2009 15 декабря. 125 (12): 2918-22. [Медлайн].
Диксон М.Ф., Гента Р.М., Ярдли Дж. Х., Корреа П. Классификация и классификация гастрита. Обновленная Сиднейская система. Международный семинар по гистопатологии гастрита, Хьюстон, 1994. Am J Surg Pathol . 1996 20 октября (10): 1161-81. [Медлайн].
Сепульведа А.Р., Патил М. Практический подход к патологической диагностике гастрита. Arch Pathol Lab Med .2008 октябрь 132 (10): 1586-93. [Медлайн].
Pounder RE, Ng D. Распространенность инфекции Helicobacter pylori в разных странах. Алимент Фармакол Тер . 1995. 9 Suppl 2: 33-9. [Медлайн].
Johnson KS, Ottemann KM. Колонизация, локализация и воспаление: роль хемотаксиса H. pylori in vivo. Curr Opin Microbiol . 2017 г. 1. 41: 51-7. [Медлайн].
Mommersteeg MC, Yu J, Peppelenbosch MP, Fuhler GM.Генетические факторы хозяина в канцерогенезе, индуцированном Helicobacter pylori: новые парадигмы. Biochim Biophys Acta . 2017 24 ноября 1869 (1): 42-52. [Медлайн].
Leker K, Lozano-Pope I, Bandyopadhyay K, Choudhury BP, Obonyo M. Сравнение липополисахаридного состава двух различных штаммов Helicobacter pylori. BMC Microbiol . 2017 декабрь 4. 17 (1): 226. [Медлайн].
McColl KE. Клиническая практика. Инфекция Helicobacter pylori. N Engl J Med . 29 апреля 2010 г., 362 (17): 1597-604. [Медлайн].
Консенсусная конференция NIH. Helicobacter pylori при язвенной болезни. Группа разработки консенсуса NIH по Helicobacter pylori при язвенной болезни. JAMA . 6 июля 1994 г. 272 (1): 65-9. [Медлайн].
Шиотани А., Нургалиева З. З., Ямаока Ю., Грэм Д. Я. Helicobacter pylori. Med Clin North Am . 2000 сентябрь 84 (5): 1125-36, viii. [Медлайн].
Ihan A, Pinchuk IV, Beswick EJ.Воспаление, иммунитет и вакцины от инфекции Helicobacter pylori. Хеликобактер . 2012 Сентябрь 17 (Дополнение 1): 16-21. [Медлайн]. [Полный текст].
Wilson KT, Crabtree JE. Иммунология Helicobacter pylori: понимание неудач иммунного ответа и перспективы исследований вакцин. Гастроэнтерология . 2007 июл.133 (1): 288-308. [Медлайн].
Zalewska-Ziob M, Adamek B, Strzelczyk JK, et al. Экспрессия TNF-альфа в слизистой оболочке желудка людей, инфицированных различными вирулентными штаммами Helicobacter pylori. Медицинский Научный Монит . 15 июня 2009 г. (6): BR166-71. [Медлайн].
Adamsson J, Ottsjo LS, Lundin SB, Svennerholm AM, Raghavan S. Желудочная экспрессия IL-17A и IFNγ у лиц, инфицированных Helicobacter pylori, связана с симптомами. Цитокин . 2017 ноябрь 99: 30-4. [Медлайн].
Уоллес JL. Изъязвление желудка: критические события на границе нейтрофил-эндотелий. Может J Physiol Pharmacol . 1993, январь 71 (1): 98-102.[Медлайн].
Грэхем Д.Ю., Опекун А., Лью Г.М., Эванс Д.И. Младший, Кляйн П.Д., Эванс Д.Г. Устранение чрезмерного высвобождения гастрина, вызванного приемом пищи, у пациентов с язвой двенадцатиперстной кишки после устранения инфекции Helicobacter (Campylobacter) pylori. Ам Дж. Гастроэнтерол . 1990 апр. 85 (4): 394-8. [Медлайн].
Грэм Д. Ю., Гоу М. Ф., Лью Г. М., Гента Р. М., Рехфельд Дж. Ф. Инфекция Helicobacter pylori и повышенное выделение гастрина. Эффекты воспаления и обработки прогастрина. Сканд Дж Гастроэнтерол . 1993 28 августа (8): 690-4. [Медлайн].
Салама Н.Р., Хартунг М.Л., Мюллер А. Жизнь в желудке человека: стратегии сохранения бактериального патогена Helicobacter pylori. Nat Rev Microbiol . 2013 июн.11 (6): 385-99. [Медлайн]. [Полный текст].
Gao L, Weck MN, Nieters A, Brenner H. Обратная связь между провоспалительным генетическим профилем и серопозитивностью Helicobacter pylori среди пациентов с хроническим атрофическим гастритом: усиленное устранение инфекции во время прогрессирования заболевания ?. евро J Cancer . 2009 ноябрь 45 (16): 2860-6. [Медлайн].
Wang SY, Shen XY, Wu CY и др. Анализ профилей полногеномной экспрессии хронического атрофического гастрита, связанного с Helicobacter pylori, с генотипами IL-1B-31CC / -511TT. Дж Dig Dis . 2009 Май. 10 (2): 99-106. [Медлайн].
Paniagua GL, Monroy E, Rodriguez R, et al. Частота маркеров вирулентности vacA, cagA и babA2 в штаммах Helicobacter pylori, выделенных от мексиканских пациентов с хроническим гастритом. Энн Клин Микробиол Антимикроб . 2009 30 апр. 8:14. [Медлайн]. [Полный текст].
Антонио-Ринкон Ф, Лопес-Видаль Y, Кастильо-Рохас G и др. Остров патогенности генотипов cag, vacA и IS605 в мексиканских штаммах Helicobacter pylori, ассоциированных с пептическими язвами. Энн Клин Микробиол Антимикроб . 2011 13 мая, 10:18. [Медлайн]. [Полный текст].
Conteduca V, Sansonno D, Lauletta G, Russi S, Ingravallo G, Dammacco F.Инфекция H.pylori и рак желудка: современное состояние (обзор). Инт Дж. Онкол . 2013 Январь 42 (1): 5-18. [Медлайн].
Уэмура Н., Окамото С., Ямамото С. и др. Инфекция Helicobacter pylori и развитие рака желудка. N Engl J Med . 2001 13 сентября. 345 (11): 784-9. [Медлайн].
Judaki A, Norozi S, Ahmadi MRH, Ghavam SM, Asadollahi K, Rahmani A. Расширение, опосредованное потоком, и толщина интимы сонной артерии у пациентов с хроническим гастритом, связанным с инфекцией Helicobacter pylori. Арк Гастроэнтерол . 2017 декабрь 54 (4): 300-4. [Медлайн].
Чжао Б., Чжао Дж., Ченг В.Ф. и др. Эффективность эрадикационной терапии Helicobacter pylori при функциональной диспепсии: метаанализ рандомизированных контролируемых исследований с 12-месячным периодом наблюдения. Дж Клин Гастроэнтерол . 2014 Март 48 (3): 241-7. [Медлайн].
Delgado JS, Landa E, Ben-Dor D. Гранулематозный гастрит и инфекция Helicobacter pylori. Isr Med Assoc J .2013 июн.15 (6): 317-8. [Медлайн].
Ueno M, Shimodate Y, Yamamoto S, Yamamoto H, Mizuno M. Рак желудка, связанный с рефрактерным цитомегаловирусным гастритом. Клин Дж. Гастроэнтерол . 2017 г. 10 (6): 498-502. [Медлайн].
Neumann WL, Coss E, Rugge M, Genta RM. Аутоиммунный атрофический гастрит – патогенез, патология и лечение. Нат Рев Гастроэнтерол Гепатол . 2013 Сентябрь 10 (9): 529-41. [Медлайн].
Hung OY, Maithel SK, Willingham FF, Farris AB 3rd, Kauh JS.Гипергастринемия, карциноидные опухоли желудка 1 типа: диагностика и лечение. Дж Клин Онкол . 2011 1 сентября. 29 (25): e713-5. [Медлайн].
Гиллиган CJ, Lawton GP, Tang LH, West AB, Modlin IM. Карциноидные опухоли желудка: биология и терапия загадочного и спорного поражения. Ам Дж. Гастроэнтерол . 1995 Март 90 (3): 338-52. [Медлайн].
Conn DA. Обнаружение антител I и II типа к внутреннему фактору. Медицинская лаборатория . 1986, апрель, 43 (2): 148-51. [Медлайн].
Экторс Н.Л., Диксон М.Ф., Гебоес К.Дж., Рутгеертс П.Дж., Десмет В.Дж., Вантраппен Г.Р. Гранулематозный гастрит: морфологический и диагностический подход. Гистопатология . 23 июля 1993 г. (1): 55-61. [Медлайн].
Wu TT, Hamilton SR. Лимфоцитарный гастрит: связь с этиологией и топологией. Am J Surg Pathol . 1999 г., 23 (2): 153-8. [Медлайн].
Вольбер Р., Оуэн Д., ДельБуоно Л., Аппельман Х., Фриман Х.Лимфоцитарный гастрит у пациентов с глютеновой спруой или спруоподобным кишечным заболеванием. Гастроэнтерология . 1990 Февраль 98 (2): 310-5. [Медлайн].
Feeley KM, Heneghan MA, Stevens FM, McCarthy CF. Лимфоцитарный гастрит и целиакия: данные о положительной связи. Дж. Клин Патол . 1998 Март 51 (3): 207-10. [Медлайн]. [Полный текст].
Haot J, Hamichi L, Wallez L, Mainguet P. Лимфоцитарный гастрит: недавно описанная сущность: ретроспективное эндоскопическое и гистологическое исследование. Кишечник . 1988 29 сентября (9): 1258-64. [Медлайн]. [Полный текст].
Lambert R, Andre C, Moulinier B, Bugnon B. Диффузный вариолиформный гастрит. Пищеварение . 1978. 17 (2): 159-67. [Медлайн].
Makinen JM, Niemela S, Kerola T, Lehtola J, Karttunen TJ. Разрастание эпителиальных клеток и атрофия желез при лимфоцитарном гастрите: эффект лечения H. pylori. Мир Дж. Гастроэнтерол . 2003 Декабрь 9 (12): 2706-10. [Медлайн].
Ruget O, Burtin P, Cerez H, Cales P, Boyer J. Хроническая диарея, связанная с атрофией ворсинок и лимфоцитарным гастритом, вызванная тиклопидином. Гастроэнтерол Клин Биол . 1992. 16 (3): 290. [Медлайн].
Sheikh RA, Prindiville TP, Pecha RE, Ruebner BH. Необычные проявления эозинофильного гастроэнтерита: серия случаев и обзор литературы. Мир Дж. Гастроэнтерол . 2009 7 мая. 15 (17): 2156-61. [Медлайн].[Полный текст].
Продам A, Jensen TS. Острая язва желудка, вызванная радиацией. Acta Radiol Ther Phys Biol . 1966, 4 августа (4): 289-97. [Медлайн].
Flobert C, Cellier C, Landi B и др. [Тяжелый геморрагический гастрит лучевого происхождения]. Гастроэнтерол Клин Биол . 1998 22 февраля (2): 232-4. [Медлайн].
Quentin V, Dib N, Thouveny F, L’Hoste P, Croue A, Boyer J. Хронический ишемический гастрит: отчет о сложном диагнозе и обзор литературы. Эндоскопия . 2006 май. 38 (5): 529-32. [Медлайн].
Chambon JP, Bianchini A, Massouille D, Perot C, Lancelevee J, Zerbib P. Ишемический гастрит: редкое, но летальное последствие ишемического синдрома целиакии. Минерва Чир . 2012 Октябрь 67 (5): 421-8. [Медлайн].
Sipponen P, Maaroos HI. Хронический гастрит. Сканд Дж Гастроэнтерол . 2015 июн. 50 (6): 657-67. [Медлайн].
Singhal AV, Sepulveda AR.Гастрит Helicobacter heilmannii: тематическое исследование с обзором литературы. Am J Surg Pathol . 2005 29 ноября (11): 1537-9. [Медлайн].
Hasegawa Y, Goto A, Nishimura S, Sukawa Y, Fujii K, Suzuki K. Цитомегаловирусный гастрит после лечения ритуксимабом. Эндоскопия . 2009 июл.41 (S 02): E199. [Медлайн].
Genta RM. Дифференциальный диагноз реактивной гастропатии. Semin Diagn Pathol . 2005 22 ноября (4): 273-83.[Медлайн].
Шапиро Дж. Л., Гольдблюм Дж. Р., Петрас РЭ. Клинико-патологическое исследование 42 пациентов с гранулематозным гастритом. Неужели существует «идиопатический» гранулематозный гастрит? Am J Surg Pathol . 1996, 20 апреля (4): 462-70. [Медлайн].
Maeng L, Lee A, Choi K, Kang CS, Kim KM. Гранулематозный гастрит: клинико-патологический анализ 18 случаев биопсии. Am J Surg Pathol . 2004 июл.28 (7): 941-5. [Медлайн].
Leung ST, Chandan VS, Murray JA, Wu TT.Коллагеновый гастрит: гистопатологические особенности и связь с другими желудочно-кишечными заболеваниями. Am J Surg Pathol . 2009 Май. 33 (5): 788-98. [Медлайн].
Габриэли Д., Чикконе Ф., Капанноло А. и др. Подтипы хронического гастрита у пациентов с глютеновой болезнью до и после безглютеновой диеты. United European Gastroenterol J . 2017 5 (6) октября: 805-10. [Медлайн].
Galiatsatos P, Gologan A, Lamoureux E.Аутичный энтероколит: факт или вымысел ?. Банка J Гастроэнтерол . 2009 23 февраля (2): 95-8. [Медлайн]. [Полный текст].
Rosenberg JJ. Helicobacter pylori. Педиатр Ред. . 2010, 31 февраля (2): 85–6; обсуждение 86. [Medline].
Everhart JE, Kruszon-Moran D, Perez-Perez GI, Tralka TS, McQuillan G. Распространенность серотипа и этнические различия в инфекции Helicobacter pylori среди взрослых в Соединенных Штатах. J Заразить Dis .2000 апр. 181 (4): 1359-63. [Медлайн].
Everhart JE. Последние события в эпидемиологии Helicobacter pylori. Гастроэнтерол Clin North Am . 2000 Сентябрь 29 (3): 559-78. [Медлайн].
Siao D, Somsouk M. Helicobacter pylori: обзор, основанный на фактах, с акцентом на иммигрантское население. J Gen Intern Med . 2014 29 марта (3): 520-8. [Медлайн]. [Полный текст].
Nabwera HM, Nguyen-Van-Tam JS, Logan RF, Logan RP.Распространенность инфекции Helicobacter pylori у кенийских школьников в возрасте 3-15 лет и факторы риска инфицирования. Eur J Гастроэнтерол Hepatol . 2000 Май. 12 (5): 483-7. [Медлайн].
Sathar MA, Gouws E, Simjee AE, Mayat AM. Сероэпидемиологическое исследование инфекции Helicobacter pylori у детей Южной Африки. Транс Р Соц Троп Мед Хиг . 1997 июль-авг. 91 (4): 393-5. [Медлайн].
Заякова А., Дауд Дж.Б., Айелло А.Е.Социально-экономические и расовые / этнические модели стойкого бремени инфекции среди взрослого населения США. J Gerontol A Biol Sci Med Sci . 2009 Февраль 64 (2): 272-9. [Медлайн]. [Полный текст].
Dattoli VC, Veiga RV, da Cunha SS, Pontes-de-Carvalho LC, Barreto ML, Alcantara-Neves NM. Распространенность серотипа и потенциальные факторы риска инфекции Helicobacter pylori у детей Бразилии. Хеликобактер . 2010 15 августа (4): 273-8. [Медлайн]. [Полный текст].
Цай С.Дж., Перри С., Санчес Л., Парсоннет Дж.Инфекция Helicobacter pylori у разных поколений латиноамериканцев в районе залива Сан-Франциско. Am J Epidemiol . 2005 15 августа. 162 (4): 351-7. [Медлайн].
Lin DB, Lin JB, Chen CY, Chen SC, Chen WK. Распространенность инфекции Helicobacter pylori среди школьников и учителей на Тайване. Хеликобактер . 2007 июн. 12 (3): 258-64. [Медлайн].
Rubio CA, Befritz R, Eriksson B, Christensson B, Duvander A, Larsson B.Топографическое распределение лимфоцитарного гастрита в образцах гастрэктомии. АПМИС . 1991 сентябрь 99 (9): 815-9. [Медлайн].
Jaskiewicz K, Цена SK, Zak J, Louwrens HD. Лимфоцитарный гастрит при неязвенной диспепсии. Dig Dis Sci . 1991 августа, 36 (8): 1079-83. [Медлайн].
Tanih NF, Dube C, Green E, et al. Африканский взгляд на Helicobacter pylori: распространенность инфекции среди людей, лекарственная устойчивость и альтернативные подходы к лечению. Энн Троп Мед Паразитол . 2009 Апрель 103 (3): 189-204. [Медлайн].
Gao L, Weck MN, Raum E, Stegmaier C, Rothenbacher D., Brenner H. Sibship size, Инфекция Helicobacter pylori и хронический атрофический гастрит: популяционное исследование среди 9444 пожилых людей из Германии. Int J Epidemiol . 2010 Февраль 39 (1): 129-34. [Медлайн].
Boelaert K, Newby PR, Simmonds MJ, et al. Распространенность и относительный риск других аутоиммунных заболеваний у субъектов с аутоиммунным заболеванием щитовидной железы. Am J Med . 2010 Февраль 123 (2): 183.e1-9. [Медлайн].
Laberge G, Mailloux CM, Gowan K, et al. Раннее начало заболевания и повышенный риск других аутоиммунных заболеваний при семейном генерализованном витилиго. Pigment Cell Res . 2005 18 августа (4): 300-5. [Медлайн].
де Вега Сантос Т., Замаррон Морено А., Паскуаль де Пабло Е., Лопес Лопес К. [Злокачественная анемия и первичный гиперпаратиреоз]. Рев. Clin Esp . 1995 Март.195 (3): 200-1. [Медлайн].
Асака М., Кимура Т., Кудо М. и др. Связь Helicobacter pylori с пепсиногенами сыворотки у бессимптомной популяции Японии. Гастроэнтерология . 1992 марта 102 (3): 760-6. [Медлайн].
Sugiyama T, Nishikawa K, Komatsu Y, et al. Приписываемый риск H. pylori при язвенной болезни: объясняет ли снижение распространенности инфекции среди населения в целом увеличение частоты язв, не связанных с H. pylori? Dig Dis Sci . 2001 Февраль 46 (2): 307-10. [Медлайн].
О’Донохо Дж. М., Салливан П. Б., Скотт Р., Роджерс Т., Брютон М. Дж., Барлтроп Д. Рецидивирующая боль в животе и Helicobacter pylori в выборке лондонских детей по месту жительства. Acta Paediatr . 1996 августа 85 (8): 961-4. [Медлайн].
Линдквист П., Асрат Д., Нильссон И. и др. Возраст на момент заражения инфекцией Helicobacter pylori: сравнение страны с высокой и низкой распространенностью. Scand J Infect Dis . 1996. 28 (2): 181-4. [Медлайн].
Gold BD, Colletti RB, Abbott M и др. Инфекция Helicobacter pylori у детей: рекомендации по диагностике и лечению. J Педиатр Гастроэнтерол Нутр . 2000 31 ноября (5): 490-7. [Медлайн].
Hall CA, Beebe RT. Раннее начало злокачественной анемии у двух братьев и сестер: генетический и аутоиммунный аспекты. Br J Haematol . 1973 25 декабря (6): 751-6. [Медлайн].
Annibale B, Lahner E, Fave GD. Диагностика и лечение злокачественной анемии. Curr Gastroenterol Rep . 2011 Декабрь 13 (6): 518-24. [Медлайн].
Min KU, Metcalfe DD. Эозинофильный гастроэнтерит. Immunol Allergy Clin North Am . 1991. 11: 799-813.
Ndip RN, Malange AE, Akoachere JF, MacKay WG, Titanji VP, Weaver LT. Антигены Helicobacter pylori в фекалиях бессимптомных детей в медицинских округах Буэа и Лимбе Камеруна: пилотное исследование. Trop Med Int Health . 2004 Сентябрь 9 (9): 1036-40. [Медлайн].
Ван Ф, Мэн В., Ван Б., Цяо Л. Воспаление желудка, вызванное Helicobacter pylori, и рак желудка. Cancer Lett . 2014 10 апреля. 345 (2): 196-202. [Медлайн].
Iacopini F, Consolazio A, Bosco D, et al. Окислительное повреждение слизистой оболочки желудка при хроническом атрофическом и неатрофическом гастрите с положительным результатом Helicobacter pylori до и после ликвидации. Хеликобактер .2003. 8 (5): 503-12. [Медлайн].
Уоррен-младший. Патология желудка, связанная с Helicobacter pylori. Гастроэнтерол Clin North Am . 2000 Сентябрь 29 (3): 705-51. [Медлайн].
Macintyre G, Kooi C, Wong F, Anderson R. О цитопатологии мембран вируса гепатита мышей по данным полупроницаемого лекарственного средства, ингибирующего трансляцию. Adv Exp Med Biol . 1990. 276: 67-72. [Медлайн].
Ито М., Таката С., Тацугами М. и др.Клиническая профилактика рака желудка с помощью эрадикационной терапии Helicobacter pylori: систематический обзор. Дж Гастроэнтерол . 2009. 44 (5): 365-71. [Медлайн].
Fukase K, Kato M, Kikuchi S, et al. Влияние эрадикации Helicobacter pylori на частоту метахронной карциномы желудка после эндоскопической резекции раннего рака желудка: открытое рандомизированное контролируемое исследование. Ланцет . 2 августа 2008 г. 372 (9636): 392-7. [Медлайн].
Камада Т., Хата Дж., Сугиу К. и др.Клинические особенности рака желудка, обнаруженные после успешной ликвидации Helicobacter pylori: результаты 9-летнего проспективного исследования в Японии. Алимент Фармакол Тер . 2005 г. 1. 21 (9): 1121-6. [Медлайн].
Ямамото К., Като М., Такахаши М. и др. Клинико-патологический анализ рака желудка на ранней стадии, обнаруженного после успешной ликвидации Helicobacter pylori. Хеликобактер . 2011 июн.16 (3): 210-6. [Медлайн].
Toh BH, van Driel IR, Gleeson PA.Злокачественная анемия. N Engl J Med . 1997 13 ноября. 337 (20): 1441-8. [Медлайн].
Сджоблом С.М., Сиппонен П., Ярвинен Х. Гастроскопическое наблюдение за пациентами с пернициозной анемией. Кишечник . 1993, январь, 34 (1): 28-32. [Медлайн]. [Полный текст].
Стабильный СП. Клиническая практика. Дефицит витамина B12. N Engl J Med . 2013, 10 января. 368 (2): 149-60. [Медлайн].
Arvanitakis C. Функциональные и морфологические аномалии слизистой оболочки тонкого кишечника при пернициозной анемии – проспективное исследование. Acta Гепатогастроэнтерол (Штутг) . 1978 25 августа (4): 313-8. [Медлайн].
Кумар Н. Неврологические аспекты дефицита кобаламина (B12). Handb Clin Neurol . 2014. 120: 915-26. [Медлайн].
Росс В.А., Гош С., Декович А.А., Лю С., Айерс Г.Д., Клири К.Р. Эндоскопическая биопсия, диагностика острой желудочно-кишечной реакции «трансплантат против хозяина»: биопсия ректосигмоида более чувствительна, чем биопсия верхних отделов желудочно-кишечного тракта. Ам Дж. Гастроэнтерол .2008 апр. 103 (4): 982-9. [Медлайн].
Тахара Т., Шибата Т., Накамура М. и др. Картина слизистой оболочки желудка с помощью эндоскопии с узкополосной увеличительной визуализацией четко различает гистологическую и серологическую тяжесть хронического гастрита. Гастроинтест Endosc . 2009 Август 70 (2): 246-53. [Медлайн].
Anagnostopoulos GK, Ragunath K, Shonde A, Hawkey CJ, Yao K. Диагностика аутоиммунного гастрита с помощью эндоскопии с увеличением с высоким разрешением. Мир Дж. Гастроэнтерол . 2006 28 июля, 12 (28): 4586-7. [Медлайн].
Ford AC, Marwaha A, Lim A., Moayyedi P. Какова распространенность клинически значимых эндоскопических результатов у субъектов с диспепсией? Систематический обзор и метаанализ. Клин Гастроэнтерол Гепатол . 2010 окт. 8 (10): 830-7, 837.e1-2. [Медлайн].
Oh B, Kim BS, Kim JW и др. Влияние пробиотиков на микробиоту кишечника во время эрадикации Helicobacter pylori: рандомизированное контролируемое исследование. Хеликобактер . 2016, 21 июня (3): 165-74. [Медлайн].
Чакраварти К., Гаур С. Роль пробиотиков в профилактике инфекции Helicobacter pylori. Карр Фарм Биотехнология . 2019. 20 (2): 137-45. [Медлайн].
Rahmani A, Abangah G, Moradkhani A, Hafezi Ahmadi MR, Asadollahi K. Коэнзим Q10 в сочетании со схемами тройной терапии улучшает окислительный стресс и перекисное окисление липидов при хроническом гастрите, связанном с H.pylori. Дж. Клин Фармакол . 2015 Август 55 (8): 842-7. [Медлайн].
Грэм Д.Ю., Белсон Г., Абудайе С., Осато М.С., Доре депутат, Эль-Зимайти Х.М. Дважды в день (в середине дня и вечером) четырехкратная терапия инфекции H. pylori в США. Dig Liver Dis . 2004 июн. 36 (6): 384-7. [Медлайн].
Malfertheiner P, Megraud F, O’Morain C и др. Для Европейской исследовательской группы Helicobacter Pylori (EHPSG). Современные концепции лечения инфекции Helicobacter pylori – Консенсусный отчет Маастрихта 2-2000. Алимент Фармакол Тер . 2002 16 февраля (2): 167-80. [Медлайн].
Chetty R, Roskell DE. Цитомегаловирусная инфекция желудочно-кишечного тракта. Дж. Клин Патол . 1994, ноябрь 47 (11): 968-72. [Медлайн]. [Полный текст].
Griffiths AP, Wyatt J, Jack AS, Dixon MF. Лимфоцитарный гастрит, аденокарцинома желудка и первичная лимфома желудка. Дж. Клин Патол . 1994 Декабрь 47 (12): 1123-4. [Медлайн]. [Полный текст].
Ingle SB, Петля CR, Dakhure S, Bhosale SS.Изолированная желудочная болезнь Крона. World J Clin Cases . 2013 16 мая. 1 (2): 71-3. [Медлайн]. [Полный текст].
Оберхубер Г., Хирш М., Штольте М. Высокая частота поражения верхних отделов желудочно-кишечного тракта при болезни Крона. Арка Вирхова . 1998, январь, 432 (1): 49-52. [Медлайн].
Школьник Л.Е., Шин Р.Д., Брабек Д.М., Ротман Р.Д. Симптоматический саркоидоз желудка у пациента с легочным саркоидозом в стадии ремиссии. BMJ Case Rep .2012 13 июля 2012: [Medline].
Weck MN, Gao L, Brenner H. Инфекция Helicobacter pylori и хронический атрофический гастрит: ассоциации в зависимости от тяжести заболевания. Эпидемиология . 2009 июл.20 (4): 569-74. [Медлайн].
[Рекомендации] Chey WD, Wong BC, Комитет параметров практики Американского колледжа гастроэнтерологии. Руководство Американского колледжа гастроэнтерологии по лечению инфекции Helicobacter pylori. Ам Дж. Гастроэнтерол . 2007 августа 102 (8): 1808-25. [Медлайн]. [Полный текст].
Stent A, Every AL, Chionh YT, Ng GZ, Sutton P. Супероксиддисмутаза из Helicobacter pylori подавляет выработку провоспалительных цитокинов во время инфекции in vivo. Хеликобактер . 2018 23 февраля (1). [Медлайн].
Gao X, Zhang Y, Brenner H. Ассоциации инфекции Helicobacter pylori и хронического атрофического гастрита с ускоренным эпигенетическим старением у пожилых людей. Br J Рак . 2017 Октябрь 10, 117 (8): 1211-4. [Медлайн].
Эстевам РБ, Вуд да Силва NMJ, Вуд да Силва и др.



 Подбираются врачом индивидуально. Курс терапии составляет в среднем 10 – 14 дней. После уничтожения Helicobacter pylori удастся предотвратить прогрессирование болезни и перетекание ее в хроническую форму.
Подбираются врачом индивидуально. Курс терапии составляет в среднем 10 – 14 дней. После уничтожения Helicobacter pylori удастся предотвратить прогрессирование болезни и перетекание ее в хроническую форму.
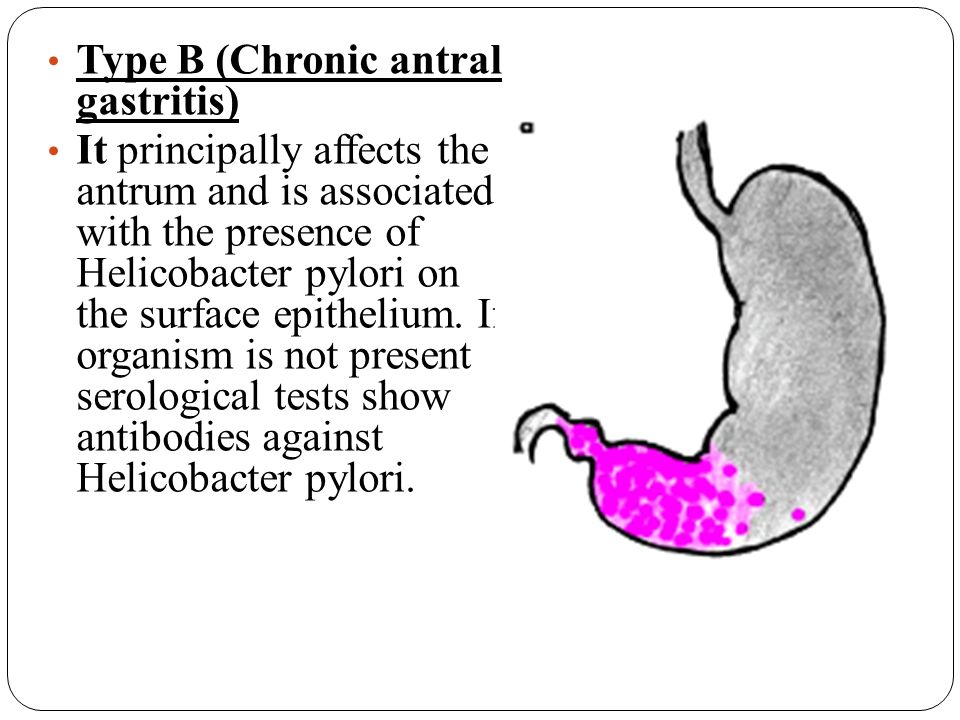 pylori (тип B) является большим фактором риска развития острого, а также хронического гастрита. Заболеваемость инфекцией H. pylori снижается в развитых странах с 1960-х годов, вероятно, из-за улучшения гигиены.
pylori (тип B) является большим фактором риска развития острого, а также хронического гастрита. Заболеваемость инфекцией H. pylori снижается в развитых странах с 1960-х годов, вероятно, из-за улучшения гигиены.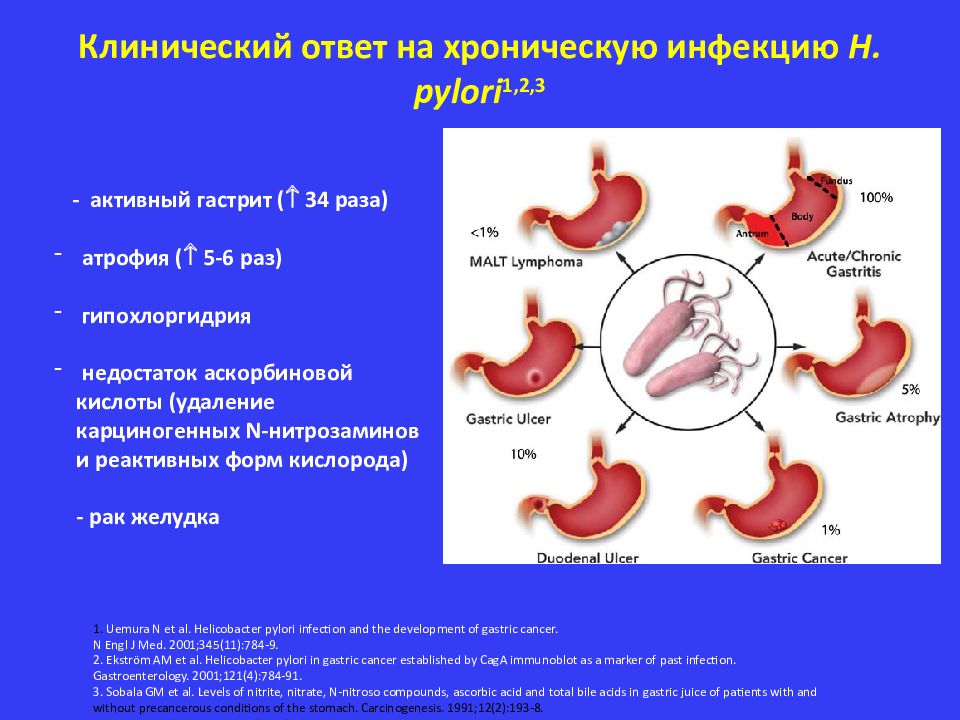 [PubMed] [Google Scholar]
[PubMed] [Google Scholar] , Сато Н. Изменение гистологического гастрита после излечения от инфекции Helicobacter pylori. Алимент Pharmacol Ther. 2002; 16: 1923–32. [PubMed] [Google Scholar]
, Сато Н. Изменение гистологического гастрита после излечения от инфекции Helicobacter pylori. Алимент Pharmacol Ther. 2002; 16: 1923–32. [PubMed] [Google Scholar] Сканд Дж Гастроэнтерол. 1982; 17: 601–7. [PubMed] [Google Scholar]
Сканд Дж Гастроэнтерол. 1982; 17: 601–7. [PubMed] [Google Scholar] Scand J Gastroenterol Suppl. 1991; 186: 135–41. [PubMed] [Google Scholar]
Scand J Gastroenterol Suppl. 1991; 186: 135–41. [PubMed] [Google Scholar] 1985; 109: 69–76. [PubMed] [Google Scholar]
1985; 109: 69–76. [PubMed] [Google Scholar]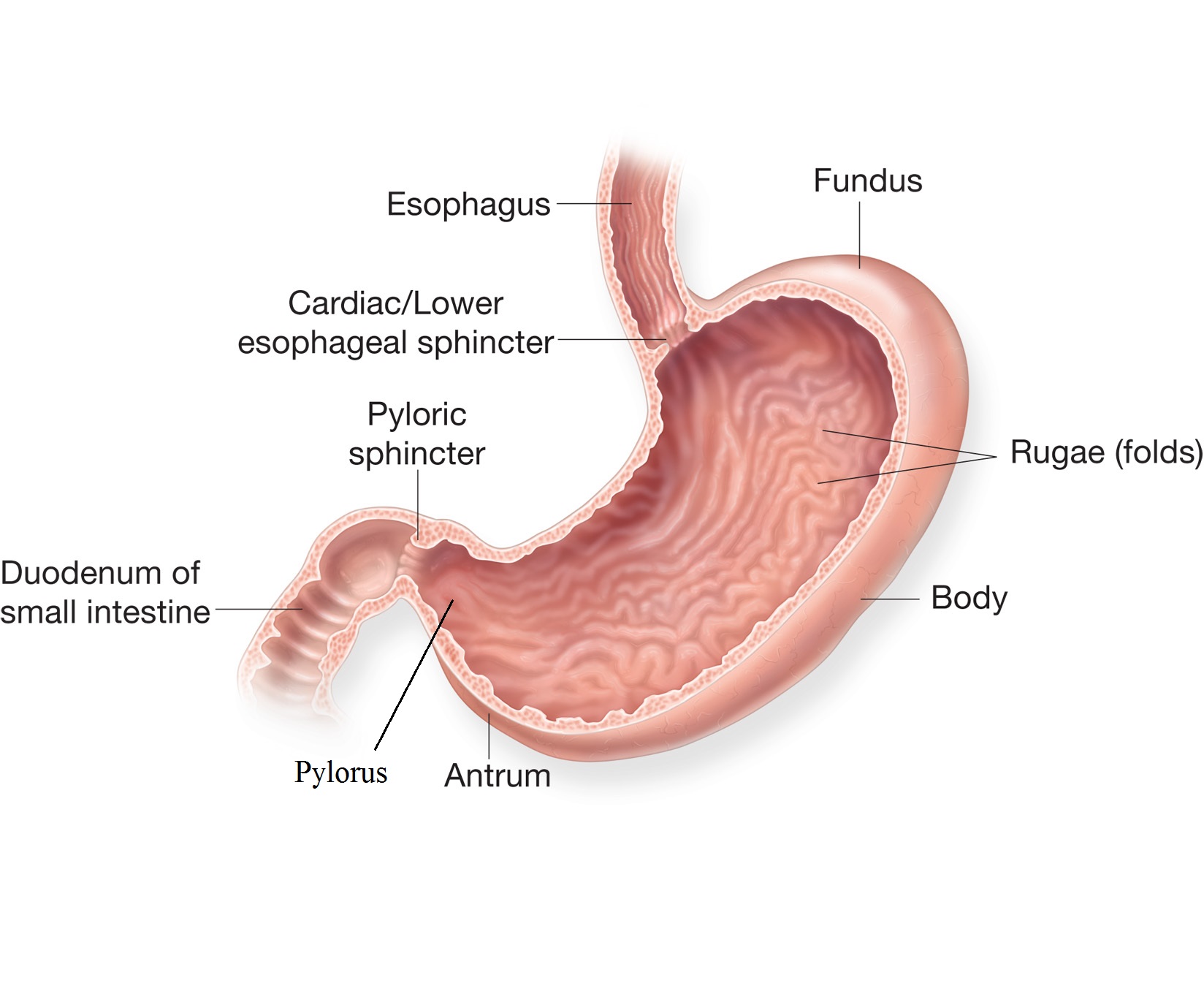 Scand J Gastroenterol Suppl.1991; 186: 16–23. [PubMed] [Google Scholar]
Scand J Gastroenterol Suppl.1991; 186: 16–23. [PubMed] [Google Scholar] , Валле Дж., Варис К., Кекки М., Ихамаки Т., Сирала М. Уровни сывороточного гастрина натощак при различных функциональных и морфологических состояниях слизистой оболочки антрофунда.Анализ 860 предметов. Сканд Дж Гастроэнтерол. 1990; 25: 513–19. [PubMed] [Google Scholar]
, Валле Дж., Варис К., Кекки М., Ихамаки Т., Сирала М. Уровни сывороточного гастрина натощак при различных функциональных и морфологических состояниях слизистой оболочки антрофунда.Анализ 860 предметов. Сканд Дж Гастроэнтерол. 1990; 25: 513–19. [PubMed] [Google Scholar] Возрастные тенденции гастрита и кишечной метаплазии у пациентов с карциномой желудка и в контрольной группе, представляющей население в целом. Br J Рак. 1984; 49: 521–30. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Возрастные тенденции гастрита и кишечной метаплазии у пациентов с карциномой желудка и в контрольной группе, представляющей население в целом. Br J Рак. 1984; 49: 521–30. [Бесплатная статья PMC] [PubMed] [Google Scholar] , Järvinen P, Hyvärinen H, Seppälä K, Siurala M. Снижение распространенности хронического гастрита за 15 лет: анализ амбулаторных исследований в Финляндии с 1977, 1985 и 1992. Gut. 1994; 35: 1167–71. [Бесплатная статья PMC] [PubMed] [Google Scholar]
, Järvinen P, Hyvärinen H, Seppälä K, Siurala M. Снижение распространенности хронического гастрита за 15 лет: анализ амбулаторных исследований в Финляндии с 1977, 1985 и 1992. Gut. 1994; 35: 1167–71. [Бесплатная статья PMC] [PubMed] [Google Scholar] Х., Лехтола Дж., Сирала М. Поражение желудка и злокачественная анемия: семейное исследование. Acta Hepatogastroenterol (Stuttg) 1978; 25: 62–7. [PubMed] [Google Scholar]
Х., Лехтола Дж., Сирала М. Поражение желудка и злокачественная анемия: семейное исследование. Acta Hepatogastroenterol (Stuttg) 1978; 25: 62–7. [PubMed] [Google Scholar]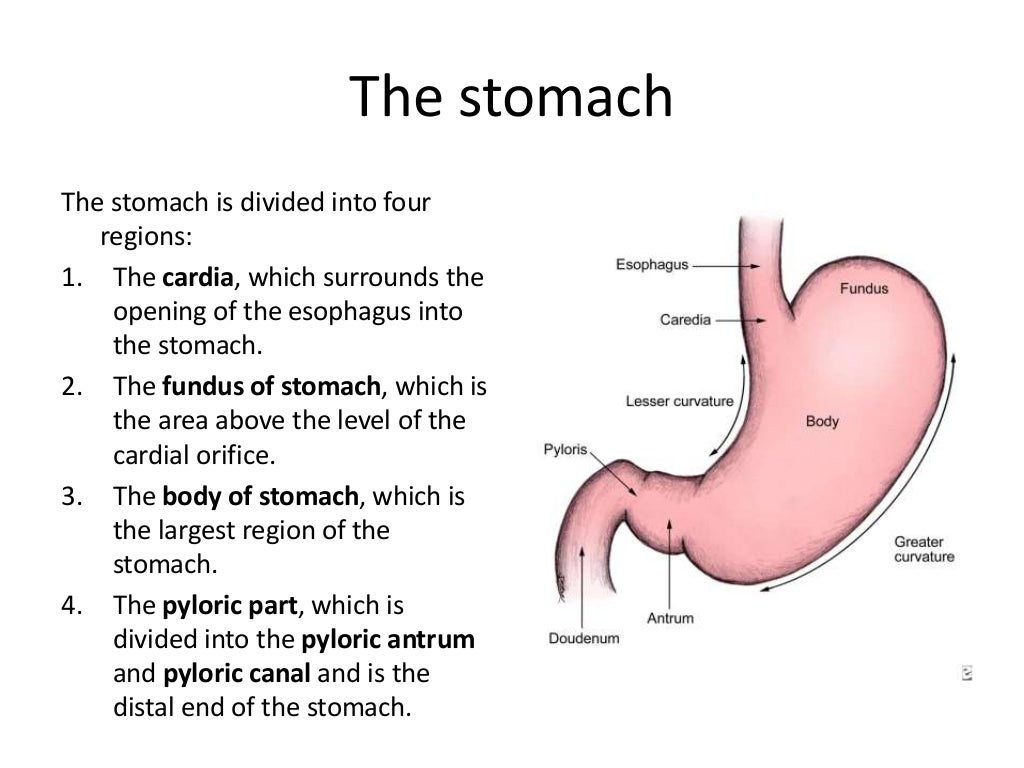 , Маарус Х.И., Uibo Иммунный ответ на Helicobacter pylori и его связь с динамикой хронического гастрита в антральном отделе и теле.APMIS. 2008. 116: 465–76. [PubMed] [Google Scholar]
, Маарус Х.И., Uibo Иммунный ответ на Helicobacter pylori и его связь с динамикой хронического гастрита в антральном отделе и теле.APMIS. 2008. 116: 465–76. [PubMed] [Google Scholar]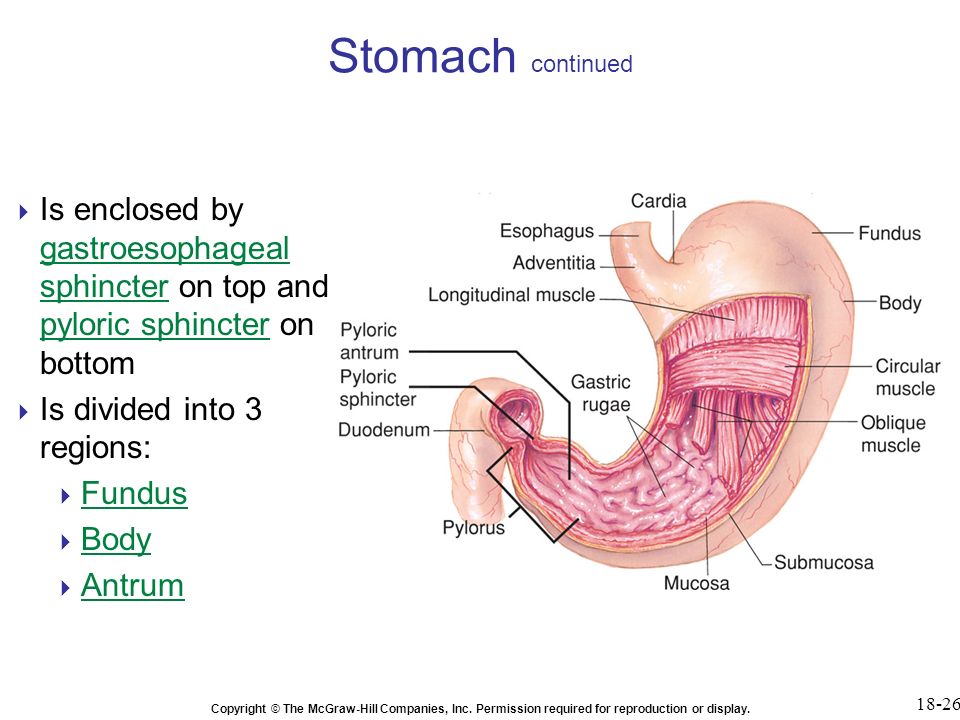 2010; 45: 133–8. [PubMed] [Google Scholar]
2010; 45: 133–8. [PubMed] [Google Scholar]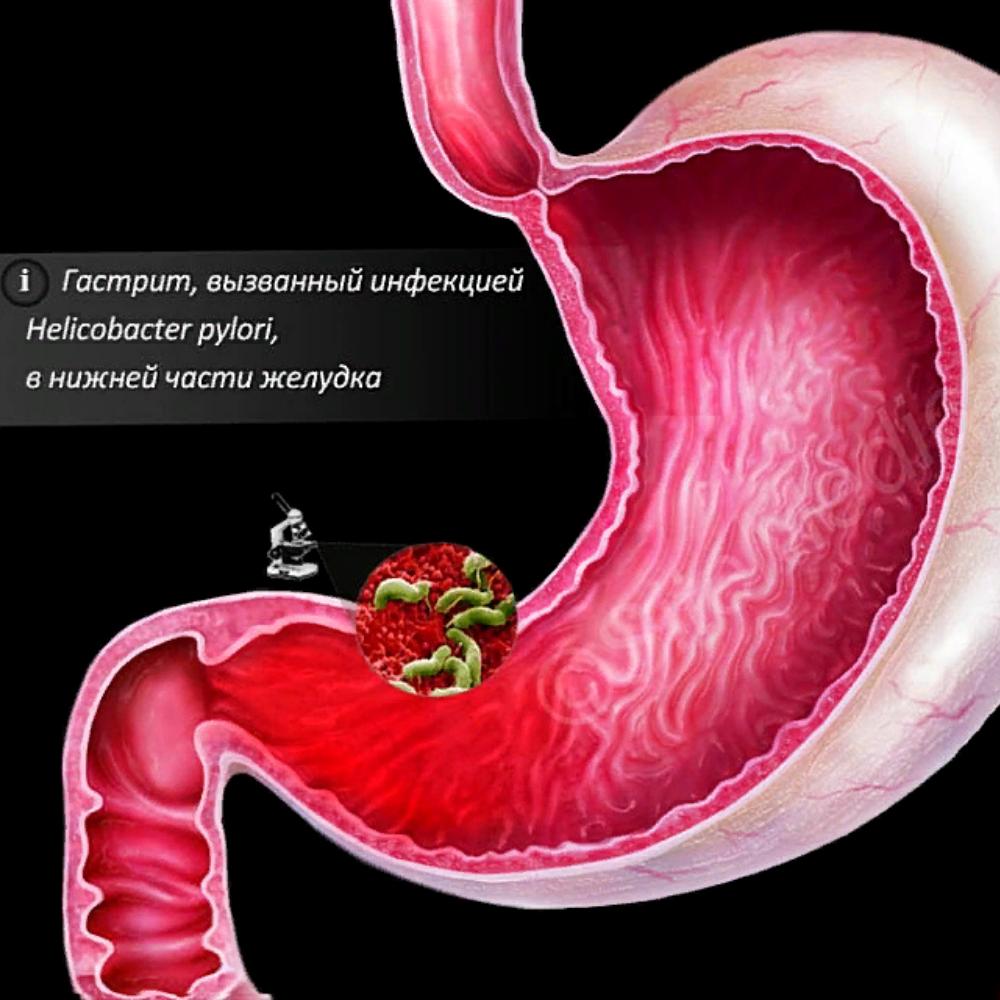 1990; 14: 217–23. [PubMed] [Google Scholar]
1990; 14: 217–23. [PubMed] [Google Scholar]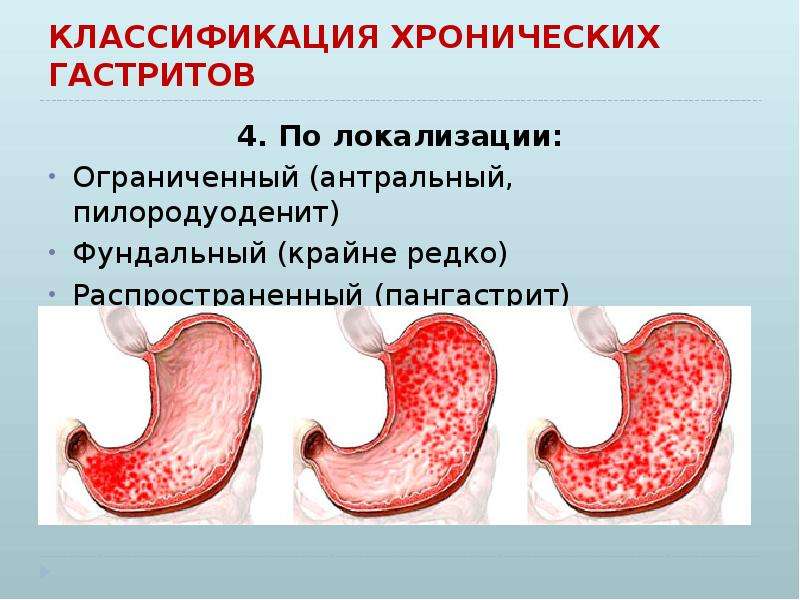 Int J Cancer. 2011; 128: 433–9. [PubMed] [Google Scholar]
Int J Cancer. 2011; 128: 433–9. [PubMed] [Google Scholar]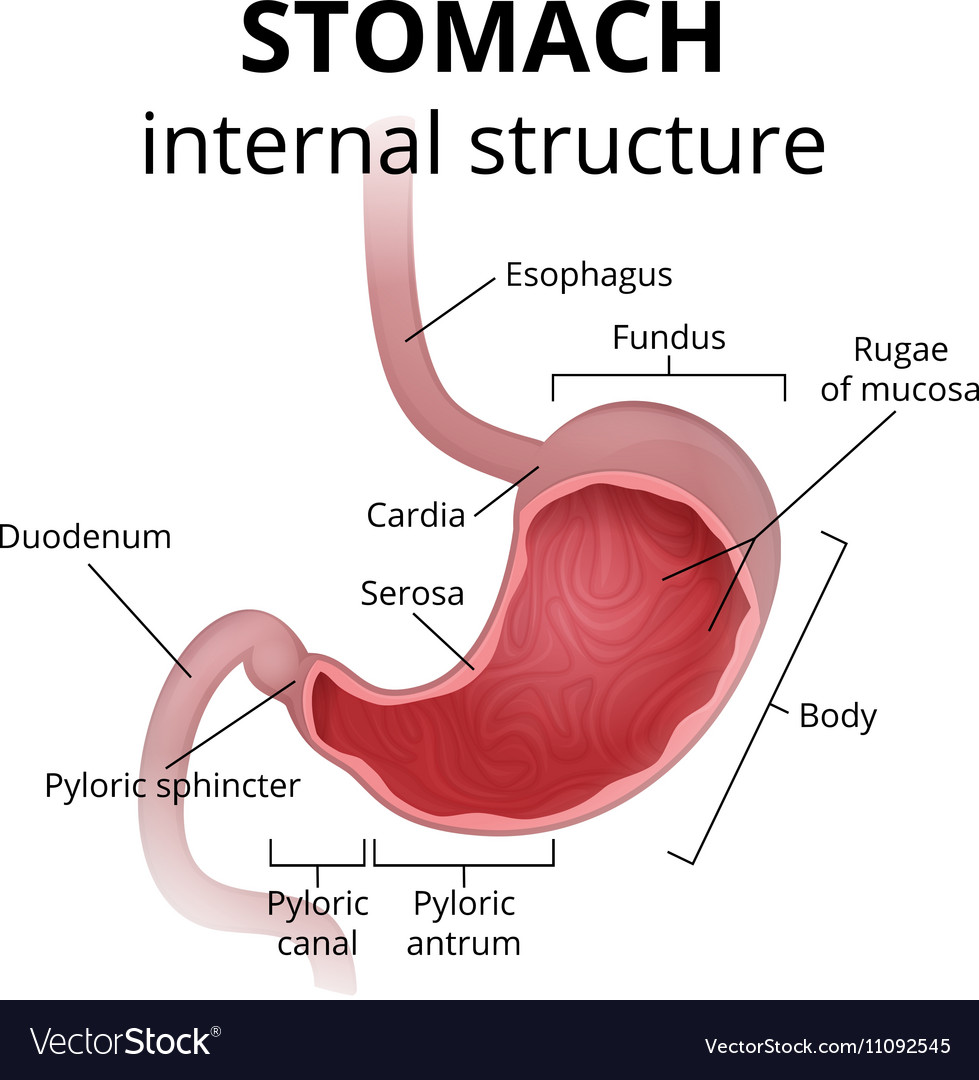 , Тейлор П.Р., Сиппонен П., Самлофф И.М., Хейнонен О.П., Албейнс Д. и др.Рак желудка и предраковые поражения при атрофическом гастрите: контролируемое исследование влияния добавок с альфа-токоферолом и бета-каротином. Хельсинкская группа по изучению гастрита. Сканд Дж Гастроэнтерол. 1998. 33: 294–300. [PubMed] [Google Scholar]
, Тейлор П.Р., Сиппонен П., Самлофф И.М., Хейнонен О.П., Албейнс Д. и др.Рак желудка и предраковые поражения при атрофическом гастрите: контролируемое исследование влияния добавок с альфа-токоферолом и бета-каротином. Хельсинкская группа по изучению гастрита. Сканд Дж Гастроэнтерол. 1998. 33: 294–300. [PubMed] [Google Scholar] Неоплазия. 2004. 6: 449–56. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Неоплазия. 2004. 6: 449–56. [Бесплатная статья PMC] [PubMed] [Google Scholar]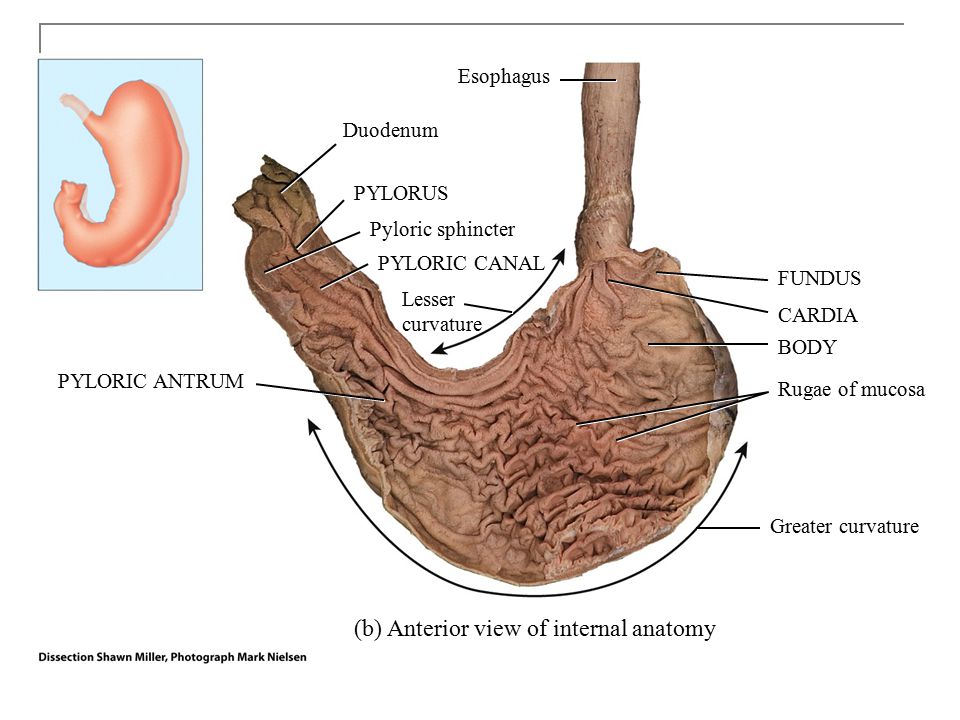 Кишечник. 2007; 56: 631–6. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Кишечник. 2007; 56: 631–6. [Бесплатная статья PMC] [PubMed] [Google Scholar] 2011; 87: 405–14. [Бесплатная статья PMC] [PubMed] [Google Scholar]
2011; 87: 405–14. [Бесплатная статья PMC] [PubMed] [Google Scholar]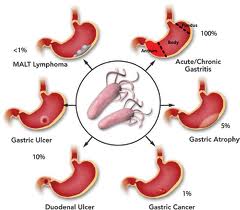 [PubMed] [Google Scholar]
[PubMed] [Google Scholar]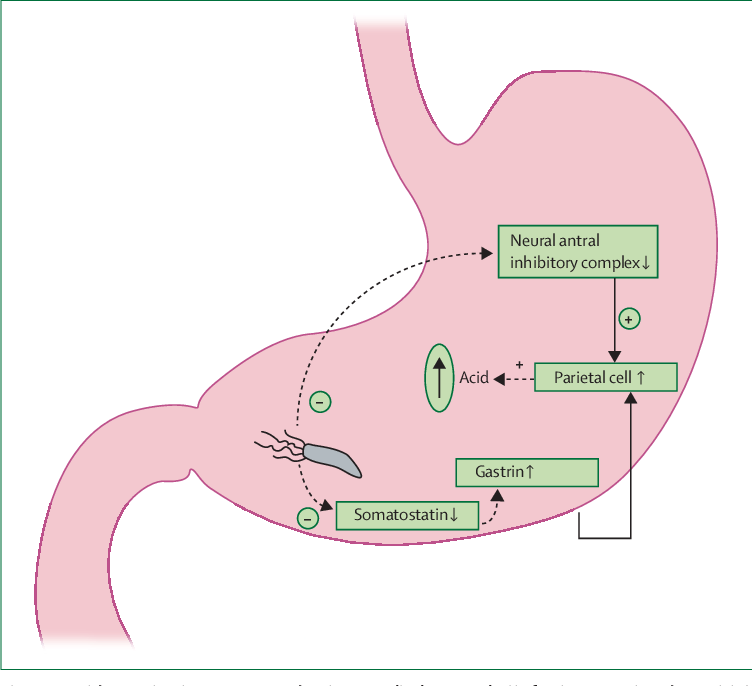 , Сато Н. Изменение гистологического гастрита после излечения от инфекции Helicobacter pylori. Алимент Pharmacol Ther. 2002; 16: 1923–32. [PubMed] [Google Scholar]
, Сато Н. Изменение гистологического гастрита после излечения от инфекции Helicobacter pylori. Алимент Pharmacol Ther. 2002; 16: 1923–32. [PubMed] [Google Scholar] Сканд Дж Гастроэнтерол. 1982; 17: 601–7. [PubMed] [Google Scholar]
Сканд Дж Гастроэнтерол. 1982; 17: 601–7. [PubMed] [Google Scholar]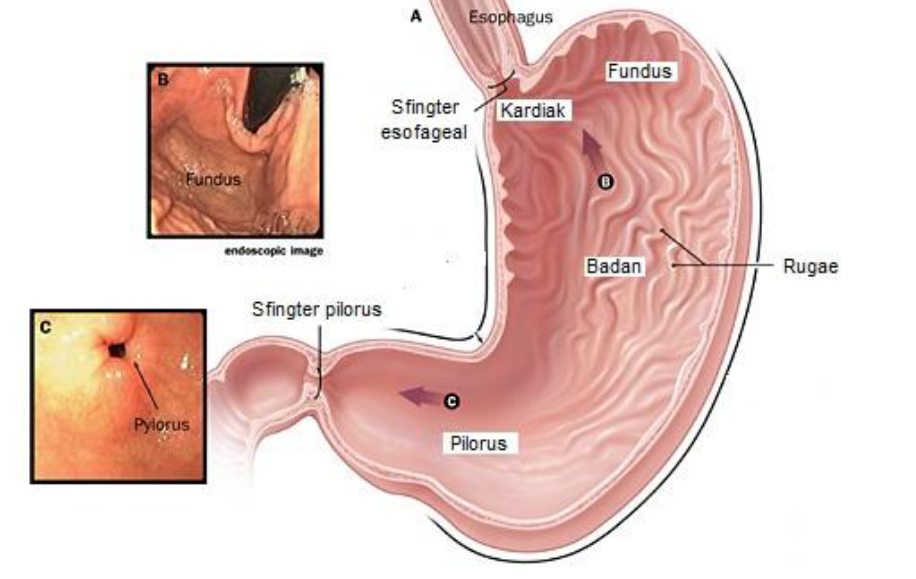 Scand J Gastroenterol Suppl. 1991; 186: 135–41. [PubMed] [Google Scholar]
Scand J Gastroenterol Suppl. 1991; 186: 135–41. [PubMed] [Google Scholar] 1985; 109: 69–76. [PubMed] [Google Scholar]
1985; 109: 69–76. [PubMed] [Google Scholar] Scand J Gastroenterol Suppl.1991; 186: 16–23. [PubMed] [Google Scholar]
Scand J Gastroenterol Suppl.1991; 186: 16–23. [PubMed] [Google Scholar]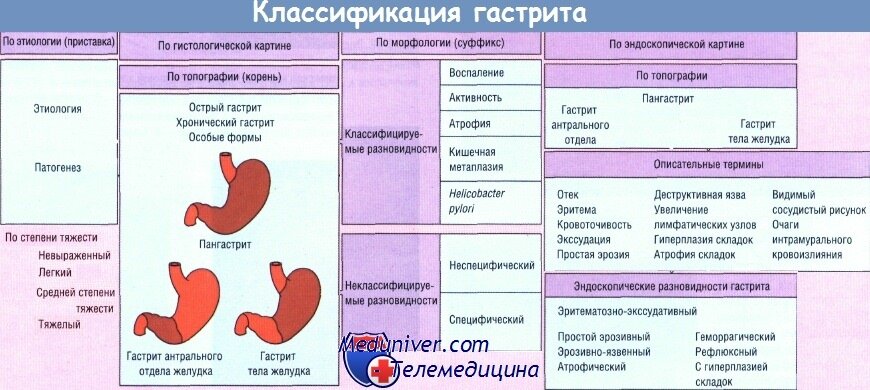 , Валле Дж., Варис К., Кекки М., Ихамаки Т., Сирала М. Уровни сывороточного гастрина натощак при различных функциональных и морфологических состояниях слизистой оболочки антрофунда.Анализ 860 предметов. Сканд Дж Гастроэнтерол. 1990; 25: 513–19. [PubMed] [Google Scholar]
, Валле Дж., Варис К., Кекки М., Ихамаки Т., Сирала М. Уровни сывороточного гастрина натощак при различных функциональных и морфологических состояниях слизистой оболочки антрофунда.Анализ 860 предметов. Сканд Дж Гастроэнтерол. 1990; 25: 513–19. [PubMed] [Google Scholar]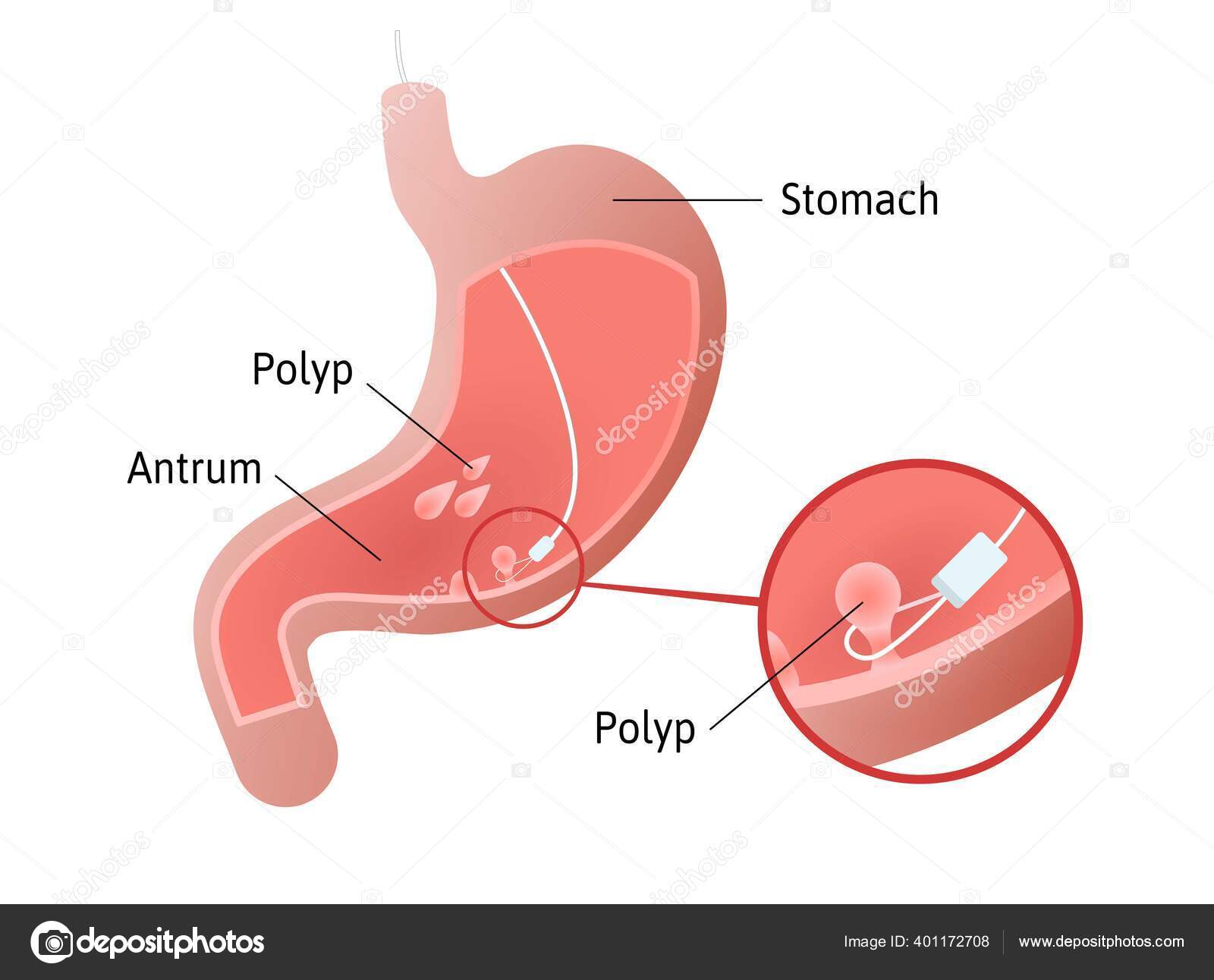 Возрастные тенденции гастрита и кишечной метаплазии у пациентов с карциномой желудка и в контрольной группе, представляющей население в целом. Br J Рак. 1984; 49: 521–30. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Возрастные тенденции гастрита и кишечной метаплазии у пациентов с карциномой желудка и в контрольной группе, представляющей население в целом. Br J Рак. 1984; 49: 521–30. [Бесплатная статья PMC] [PubMed] [Google Scholar] , Järvinen P, Hyvärinen H, Seppälä K, Siurala M. Снижение распространенности хронического гастрита за 15 лет: анализ амбулаторных исследований в Финляндии с 1977, 1985 и 1992. Gut. 1994; 35: 1167–71. [Бесплатная статья PMC] [PubMed] [Google Scholar]
, Järvinen P, Hyvärinen H, Seppälä K, Siurala M. Снижение распространенности хронического гастрита за 15 лет: анализ амбулаторных исследований в Финляндии с 1977, 1985 и 1992. Gut. 1994; 35: 1167–71. [Бесплатная статья PMC] [PubMed] [Google Scholar]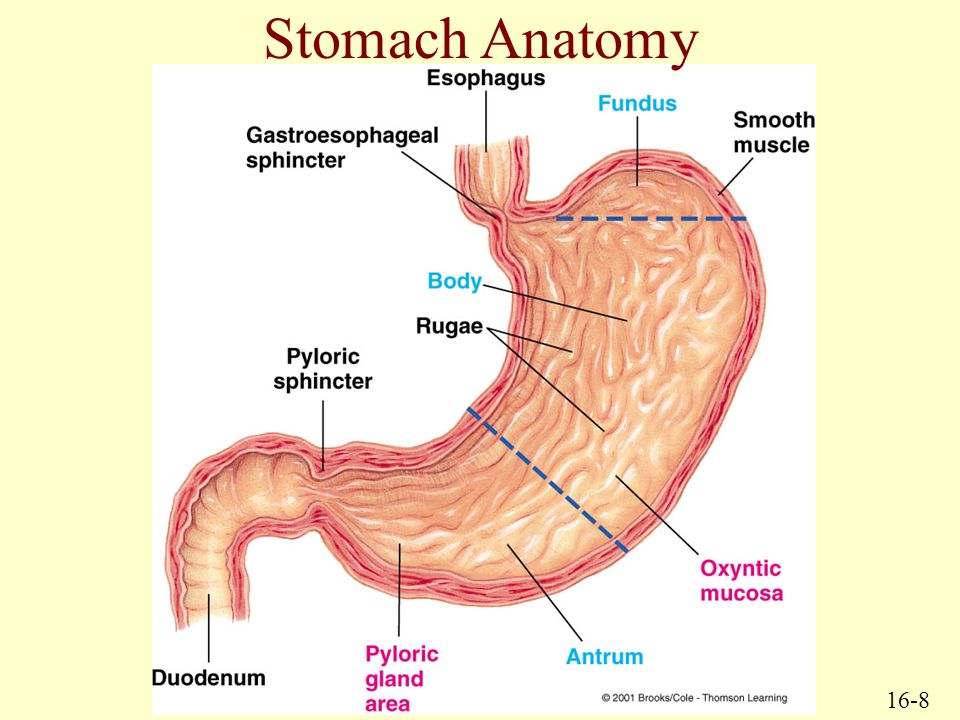 Х., Лехтола Дж., Сирала М. Поражение желудка и злокачественная анемия: семейное исследование. Acta Hepatogastroenterol (Stuttg) 1978; 25: 62–7. [PubMed] [Google Scholar]
Х., Лехтола Дж., Сирала М. Поражение желудка и злокачественная анемия: семейное исследование. Acta Hepatogastroenterol (Stuttg) 1978; 25: 62–7. [PubMed] [Google Scholar] , Маарус Х.И., Uibo Иммунный ответ на Helicobacter pylori и его связь с динамикой хронического гастрита в антральном отделе и теле.APMIS. 2008. 116: 465–76. [PubMed] [Google Scholar]
, Маарус Х.И., Uibo Иммунный ответ на Helicobacter pylori и его связь с динамикой хронического гастрита в антральном отделе и теле.APMIS. 2008. 116: 465–76. [PubMed] [Google Scholar]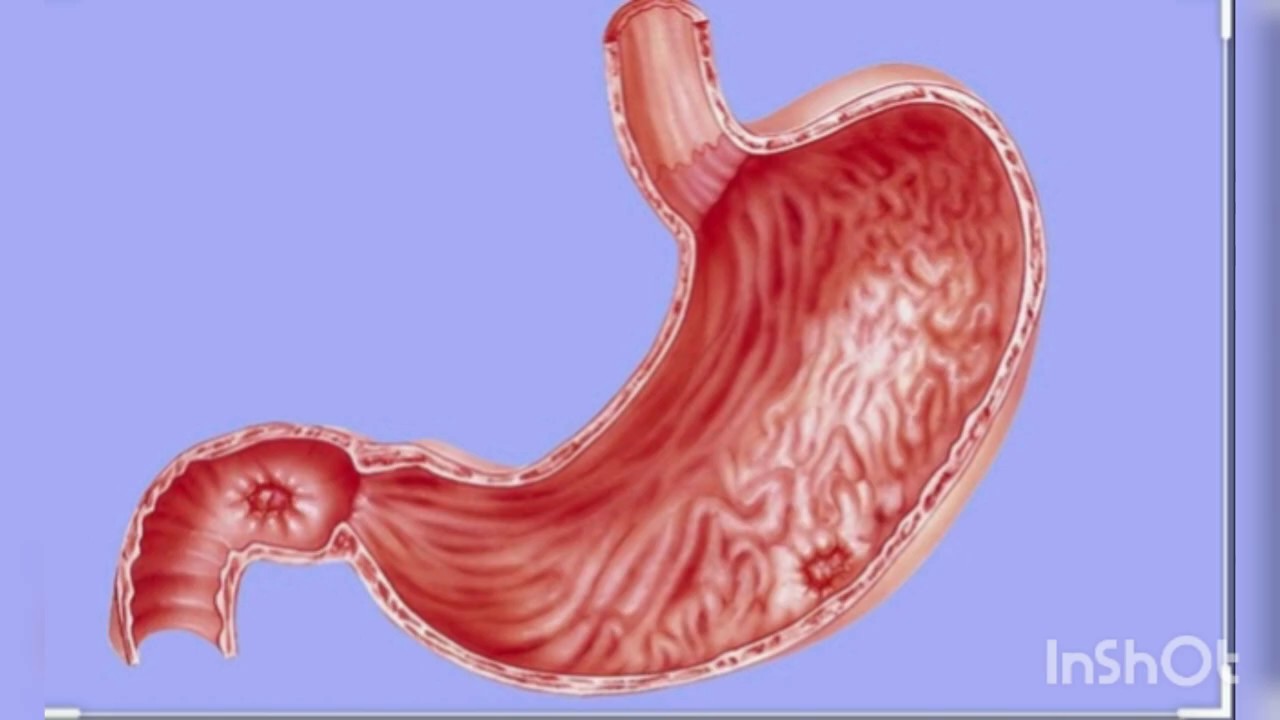 2010; 45: 133–8. [PubMed] [Google Scholar]
2010; 45: 133–8. [PubMed] [Google Scholar] 1990; 14: 217–23. [PubMed] [Google Scholar]
1990; 14: 217–23. [PubMed] [Google Scholar] Int J Cancer. 2011; 128: 433–9. [PubMed] [Google Scholar]
Int J Cancer. 2011; 128: 433–9. [PubMed] [Google Scholar]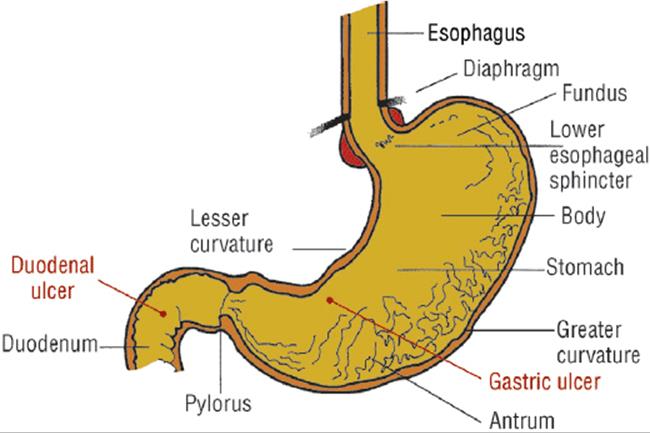 , Тейлор П.Р., Сиппонен П., Самлофф И.М., Хейнонен О.П., Албейнс Д. и др.Рак желудка и предраковые поражения при атрофическом гастрите: контролируемое исследование влияния добавок с альфа-токоферолом и бета-каротином. Хельсинкская группа по изучению гастрита. Сканд Дж Гастроэнтерол. 1998. 33: 294–300. [PubMed] [Google Scholar]
, Тейлор П.Р., Сиппонен П., Самлофф И.М., Хейнонен О.П., Албейнс Д. и др.Рак желудка и предраковые поражения при атрофическом гастрите: контролируемое исследование влияния добавок с альфа-токоферолом и бета-каротином. Хельсинкская группа по изучению гастрита. Сканд Дж Гастроэнтерол. 1998. 33: 294–300. [PubMed] [Google Scholar] Неоплазия. 2004. 6: 449–56. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Неоплазия. 2004. 6: 449–56. [Бесплатная статья PMC] [PubMed] [Google Scholar] Кишечник. 2007; 56: 631–6. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Кишечник. 2007; 56: 631–6. [Бесплатная статья PMC] [PubMed] [Google Scholar] 2011; 87: 405–14. [Бесплатная статья PMC] [PubMed] [Google Scholar]
2011; 87: 405–14. [Бесплатная статья PMC] [PubMed] [Google Scholar]