Атрофический гиперпластический гастрит лечение: Лечение хронического атрофического гастрита желудка в Екатеринбурге
Гиперпластический гастрит – причины, симптомы, диагностика и лечение
Гиперпластический гастрит – это особая форма поражения слизистой оболочки желудка, характеризующаяся усиленной пролиферацией эпителия с формированием толстых ригидных складок и полипов. Очень часто патология протекает бессимптомно, а при значительном утолщении слизистой желудка или формировании полипов возможно появление рвоты, диареи, скрытых кровотечений и других неспецифических симптомов хронического гастрита. Основной метод диагностики – ЭГДС с биопсией. Лечение заключается в нормализации моторной и секреторной функций желудка, назначении высокобелковой диеты.
Общие сведения
Гиперпластический гастрит относится к редким формам хронического поражения желудка. Понятие «гиперпластический гастрит» включает в себя разрозненную группу заболеваний, в основе которых лежит не воспалительный процесс, а первичная гиперплазия эпителия желудка.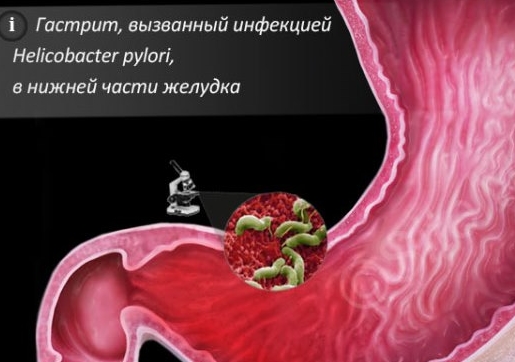 Каждое из этих заболеваний встречается достаточно редко, в целом группа гипертрофических гастритов составляет не более 5% всех хронических заболеваний желудка.
Каждое из этих заболеваний встречается достаточно редко, в целом группа гипертрофических гастритов составляет не более 5% всех хронических заболеваний желудка.
Мужчины болеют гиперпластическим гастритом в четыре раза чаще женщин, наиболее распространена эта патология в возрасте 30-50 лет. Специалисты в сфере современной гастроэнтерологии указывают, что при развитии гиперпластического гастрита в детском возрасте возможен регресс заболевания с полным восстановлением нормального строения слизистой, а у взрослых в исходе гипертрофического гастрита практически всегда наблюдается атрофия слизистой желудка.
Гиперпластический гастрит
Причины
Этиология гиперпластического гастрита пока досконально не изучена, это заболевание считается полиэтиологичным, для некоторых его форм характерна семейная предрасположенность. Наиболее значимыми для развития заболевания считаются нарушения питания, гиповитаминоз, хроническая интоксикация организма (при алкоголизме и наркомании, отравлении свинцом и др. ), нарушения обмена веществ и нейро-гуморальной регуляции, курение.
), нарушения обмена веществ и нейро-гуморальной регуляции, курение.
Патогенез
Большое значение в патогенезе придается пищевой аллергии – воздействие аллергенов на слизистую повышает ее проницаемость, в результате чего развивается дисплазия эпителия, в полость желудка пропотевает большое количество транссудата. Все это приводит к значительным потерям белка, что является характерным признаком практически всех форм гиперпластического гастрита. Некоторые авторы рассматривают патологию как проявление аномалии развития желудка либо как вариант доброкачественной опухоли. Под воздействием любого из перечисленных патогенных факторов клетки эпителия желудка начинают усиленно размножаться, слизистая значительно утолщается.
Классификация
Различные авторы предлагают несколько классификаций болезни. Так, Л.И.Аруин относит к гиперпластическому гастриту четыре вида гастропатий, при которых толщина слизистой составляет 1,5 мм и более: болезнь Менетрие, синдром Золлингера-Эллисона, гипертрофическую гиперсекреторную гастропатию. Различаются эти заболевания типом гиперплазии (мукозная, гландулярная, смешанная).
Различаются эти заболевания типом гиперплазии (мукозная, гландулярная, смешанная).
При болезни Менетрие (гигантский гипертрофический гастрит) происходит значительное увеличение и удлинение ямок эпителия желудка, в слизистой формируются огромные ригидные складки, не расправляющиеся при раздувании желудка воздухом. При этом отмечается кишечная метаплазия эпителия, разрастание и гиперплазия слизистых желез с практически полной атрофией основных желез, продуцирующих соляную кислоту. Указанные изменения могут приобретать как очаговый, так и диффузный характер.
При другой форме гиперпластического гастрита – синдроме Золлингера-Эллисона – под действием повышенной продукции гастрина происходит гиперплазия париетальных клеток, они обнаруживаются практически во всех отделах желудка. Желудочные ямки при этом уплощены и укорочены. Гиперплазия слизистой за счет париетальных клеток приводит к значительному повышению выработки соляной кислоты, образованию множества эрозий, а затем и пептических язв желудка. Синдром Золлингера-Эллисона чаще всего развивается на фоне гастрин-продуцирующей опухоли поджелудочной железы.
Синдром Золлингера-Эллисона чаще всего развивается на фоне гастрин-продуцирующей опухоли поджелудочной железы.
Наиболее редкая форма – гипертрофическая гиперсекреторная гастропатия – может протекать с потерей белка или без нее. При данной патологии отмечается гландулярная (железистая) или фовеолярная (эпителиальная) гиперплазия, не связанная с повышенной продукцией гастрина. Ямки и валики слизистой желудка имеют обычный вид. При железистой гиперплазии в слизистой могут обнаруживаться кисты, сформированные из увеличенных слизистых желез. Эта форма занимает промежуточное положение между болезнью Менетрие и синдромом Золлингера-Эллисона.
На основании эндоскопической оценки степени гипертрофии эпителия выделяют очаговый (зернистый), гигантский гипертрофический гастрит (распространенная форма болезни Менетрие), бородавчатый гастрит (единичные разрастания эпителия), полипозный гиперпластический гастрит (формирование гипертрофированных складок с множественными полипами на фоне полной атрофии слизистой желудка).
Симптомы гиперпластического гастрита
Очень часто на начальных стадиях заболевания пациенты не предъявляют жалоб. Симптомы обычно появляются при формировании значительных патологических изменений в слизистой. Проявления зависят от формы гиперпластического гастрита и кислотности желудочного сока.
Наиболее частым вариантом развития патологии является повышение кислотности в начале заболевания с постепенной атрофией слизистой и формированием ахилии. Так, при болезни Менетрие беспокоят достаточно выраженные боли в области эпигастрия, возникающие чаще всего после еды, чувство тяжести и распирания в желудке, отрыжка. На высоте боли может возникнуть рвота, а затем диарея. Аппетит значительно понижен, вплоть до анорексии, характерно похудение (за несколько месяцев пациент может потерять до 20 кг).
Синдрому Золлингера-Эллисона присуща язвенноподобная симптоматика – значительные голодные боли, уменьшающиеся после еды, потеря веса, возможна рвота кофейной гущей.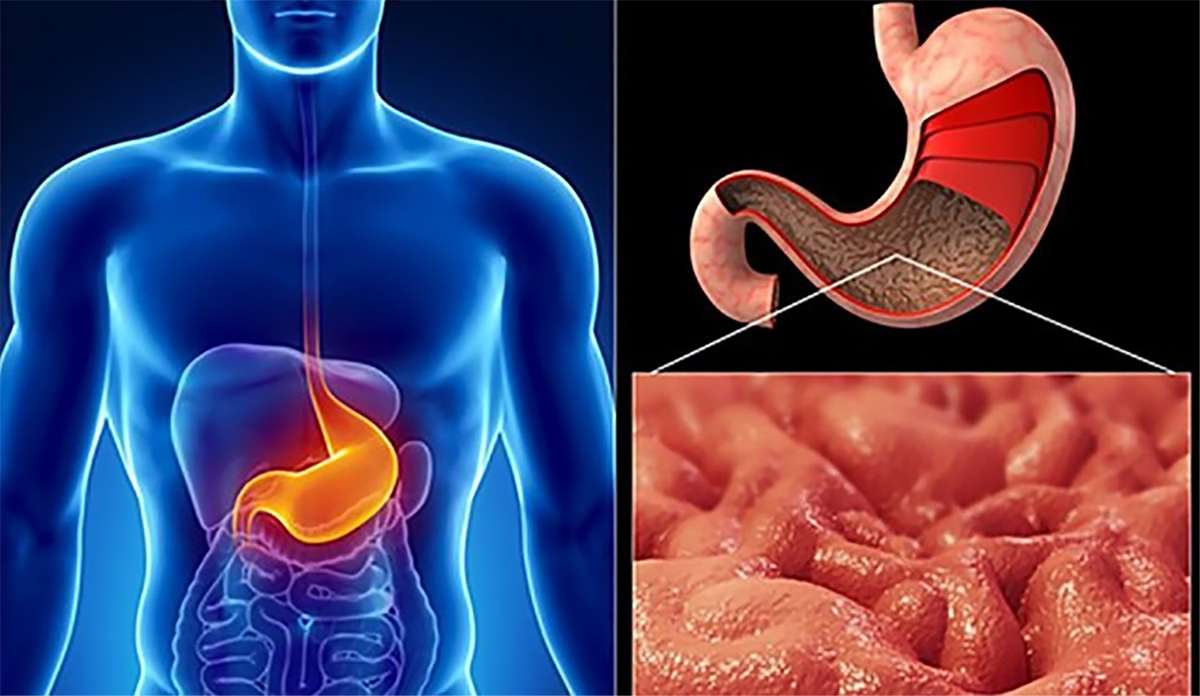 Для всех типов гиперпластического гастрита характерно развитие кровотечений из слизистой желудка, которые могут приводить к постепенной анемизации. Пациенты предъявляют жалобы на повышенную утомляемость, слабость. При значительной потере белка (болезнь Менетрие, гипертрофическая гиперсекреторная гастропатия) отмечаются периферические отеки.
Для всех типов гиперпластического гастрита характерно развитие кровотечений из слизистой желудка, которые могут приводить к постепенной анемизации. Пациенты предъявляют жалобы на повышенную утомляемость, слабость. При значительной потере белка (болезнь Менетрие, гипертрофическая гиперсекреторная гастропатия) отмечаются периферические отеки.
Осложнения
Диагностика
Консультация гастроэнтеролога обычно позволяет заподозрить наличие у пациента хронического поражения желудка, однако точно установить форму гастрита можно только после осмотра врача-эндоскописта. Гиперпластический гастрит – диагноз чисто морфологический, не имеющий какой-либо характерной симптоматики. Обычно гиперплазия эпителия является случайной находкой во время эзофагогастродуоденоскопии.
При проведении ЭГДС обнаруживаются значительно утолщенные складки слизистой, расположенные в виде очагов либо преимущественно по большой кривизне желудка. Перистальтика желудка при этом не нарушена. Дифференцировать различные виды гиперпластического гастрита позволяет раздувание желудка воздухом – при болезни Менетрие складки не расправляются даже при нагнетании давления выше 15 мм рт.ст.
Дифференцировать различные виды гиперпластического гастрита позволяет раздувание желудка воздухом – при болезни Менетрие складки не расправляются даже при нагнетании давления выше 15 мм рт.ст.
Диагноз подтверждается с помощью эндоскопической биопсии с морфологическим исследованием биоптатов. Следует помнить, что щипчики для биопсии имеют малый размер и зачастую не в состоянии захватить слизистую на всю ее толщу. В этом случае в препарат для морфологического исследования не попадут все слои гипертрофированной слизистой, и анализ будет недостаточно информативным. Однако он поможет определить степень и вид гиперплазии.
Вспомогательными методами исследования являются рентгенография желудка, внутрижелудочная pH-метрия, клинический и биохимический анализы крови, анализ кала на скрытую кровь. Они позволяют дополнить и уточнить диагноз, выявить осложнения, провести дифференциальную диагностику с другими заболеваниями желудка. Дифференцировать гиперпластический гастрит следует с другими формами хронического гастрита, различными диспепсиями, распространенным семейным полипозом ЖКТ, туберкулезом, сифилисом, онкологическими поражениями желудка.
Лечение гиперпластического гастрита
Этиотропного лечения не существует, так как причины возникновения заболевания до конца не изучены. Симптоматическая терапия зависит от проявлений патологии. При повышенной кислотности назначаются антисекреторные препараты, при развитии атрофии – заместительная терапия натуральным желудочным соком. Если при эндоскопическом исследовании обнаружены множественные эрозии или пептическая язва, терапия будет соответствовать язвенной болезни желудка. Показано назначение диеты, богатой белками и витаминами.
Хирургическое лечение проводится при обнаружении полипов (удаление полипов желудка при ЭГДС), а также при резистентной гипопротеинемии, частых рецидивирующих кровотечениях (частичная или полная резекция желудка). Все пациенты с диагностированным гиперпластическим гастритом должны состоять на диспансерном учете, проходить эндоскопическое обследование два раза в год для своевременного выявления онкопатологии.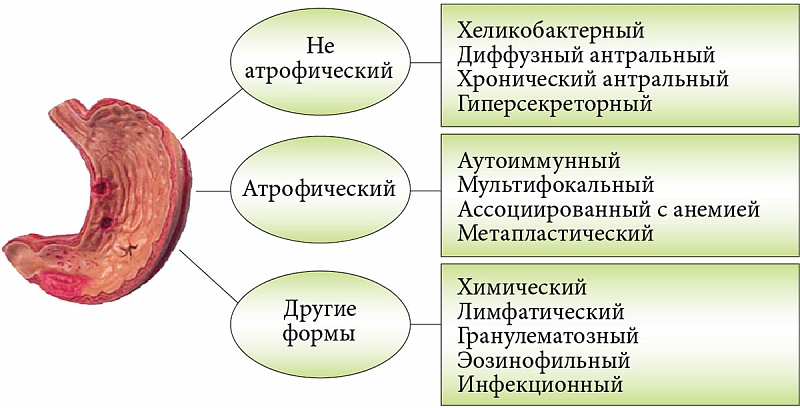
Прогноз и профилактика
Прогноз тесно связан с клинической формой заболевания и степенью гиперплазии. Случаи полного регресса изменений в слизистой достаточно редки, в основном это заболевание требует пожизненного наблюдения и лечения. При образовании полипов на гипертрофированных складках слизистой оболочки желудка прогноз ухудшается из-за повышения риска малигнизации. Профилактика гиперпластического гастрита не разработана, так как неизвестны точные причины его развития.
Гиперпластический гастрит – причины, симптомы, диагностика и лечение
Гиперпластический гастрит – это особая форма поражения слизистой оболочки желудка, характеризующаяся усиленной пролиферацией эпителия с формированием толстых ригидных складок и полипов. Очень часто патология протекает бессимптомно, а при значительном утолщении слизистой желудка или формировании полипов возможно появление рвоты, диареи, скрытых кровотечений и других неспецифических симптомов хронического гастрита. Основной метод диагностики – ЭГДС с биопсией. Лечение заключается в нормализации моторной и секреторной функций желудка, назначении высокобелковой диеты.
Основной метод диагностики – ЭГДС с биопсией. Лечение заключается в нормализации моторной и секреторной функций желудка, назначении высокобелковой диеты.
Общие сведения
Гиперпластический гастрит относится к редким формам хронического поражения желудка. Понятие «гиперпластический гастрит» включает в себя разрозненную группу заболеваний, в основе которых лежит не воспалительный процесс, а первичная гиперплазия эпителия желудка. Каждое из этих заболеваний встречается достаточно редко, в целом группа гипертрофических гастритов составляет не более 5% всех хронических заболеваний желудка.
Мужчины болеют гиперпластическим гастритом в четыре раза чаще женщин, наиболее распространена эта патология в возрасте 30-50 лет. Специалисты в сфере современной гастроэнтерологии указывают, что при развитии гиперпластического гастрита в детском возрасте возможен регресс заболевания с полным восстановлением нормального строения слизистой, а у взрослых в исходе гипертрофического гастрита практически всегда наблюдается атрофия слизистой желудка.
Гиперпластический гастрит
Причины
Этиология гиперпластического гастрита пока досконально не изучена, это заболевание считается полиэтиологичным, для некоторых его форм характерна семейная предрасположенность. Наиболее значимыми для развития заболевания считаются нарушения питания, гиповитаминоз, хроническая интоксикация организма (при алкоголизме и наркомании, отравлении свинцом и др.), нарушения обмена веществ и нейро-гуморальной регуляции, курение.
Патогенез
Большое значение в патогенезе придается пищевой аллергии – воздействие аллергенов на слизистую повышает ее проницаемость, в результате чего развивается дисплазия эпителия, в полость желудка пропотевает большое количество транссудата. Все это приводит к значительным потерям белка, что является характерным признаком практически всех форм гиперпластического гастрита. Некоторые авторы рассматривают патологию как проявление аномалии развития желудка либо как вариант доброкачественной опухоли. Под воздействием любого из перечисленных патогенных факторов клетки эпителия желудка начинают усиленно размножаться, слизистая значительно утолщается.
Под воздействием любого из перечисленных патогенных факторов клетки эпителия желудка начинают усиленно размножаться, слизистая значительно утолщается.
Классификация
Различные авторы предлагают несколько классификаций болезни. Так, Л.И.Аруин относит к гиперпластическому гастриту четыре вида гастропатий, при которых толщина слизистой составляет 1,5 мм и более: болезнь Менетрие, синдром Золлингера-Эллисона, гипертрофическую гиперсекреторную гастропатию. Различаются эти заболевания типом гиперплазии (мукозная, гландулярная, смешанная).
При болезни Менетрие (гигантский гипертрофический гастрит) происходит значительное увеличение и удлинение ямок эпителия желудка, в слизистой формируются огромные ригидные складки, не расправляющиеся при раздувании желудка воздухом. При этом отмечается кишечная метаплазия эпителия, разрастание и гиперплазия слизистых желез с практически полной атрофией основных желез, продуцирующих соляную кислоту. Указанные изменения могут приобретать как очаговый, так и диффузный характер.
При другой форме гиперпластического гастрита – синдроме Золлингера-Эллисона – под действием повышенной продукции гастрина происходит гиперплазия париетальных клеток, они обнаруживаются практически во всех отделах желудка. Желудочные ямки при этом уплощены и укорочены. Гиперплазия слизистой за счет париетальных клеток приводит к значительному повышению выработки соляной кислоты, образованию множества эрозий, а затем и пептических язв желудка. Синдром Золлингера-Эллисона чаще всего развивается на фоне гастрин-продуцирующей опухоли поджелудочной железы.
Наиболее редкая форма – гипертрофическая гиперсекреторная гастропатия – может протекать с потерей белка или без нее. При данной патологии отмечается гландулярная (железистая) или фовеолярная (эпителиальная) гиперплазия, не связанная с повышенной продукцией гастрина. Ямки и валики слизистой желудка имеют обычный вид. При железистой гиперплазии в слизистой могут обнаруживаться кисты, сформированные из увеличенных слизистых желез. Эта форма занимает промежуточное положение между болезнью Менетрие и синдромом Золлингера-Эллисона.
Эта форма занимает промежуточное положение между болезнью Менетрие и синдромом Золлингера-Эллисона.
На основании эндоскопической оценки степени гипертрофии эпителия выделяют очаговый (зернистый), гигантский гипертрофический гастрит (распространенная форма болезни Менетрие), бородавчатый гастрит (единичные разрастания эпителия), полипозный гиперпластический гастрит (формирование гипертрофированных складок с множественными полипами на фоне полной атрофии слизистой желудка).
Симптомы гиперпластического гастрита
Очень часто на начальных стадиях заболевания пациенты не предъявляют жалоб. Симптомы обычно появляются при формировании значительных патологических изменений в слизистой. Проявления зависят от формы гиперпластического гастрита и кислотности желудочного сока.
Наиболее частым вариантом развития патологии является повышение кислотности в начале заболевания с постепенной атрофией слизистой и формированием ахилии. Так, при болезни Менетрие беспокоят достаточно выраженные боли в области эпигастрия, возникающие чаще всего после еды, чувство тяжести и распирания в желудке, отрыжка. На высоте боли может возникнуть рвота, а затем диарея. Аппетит значительно понижен, вплоть до анорексии, характерно похудение (за несколько месяцев пациент может потерять до 20 кг).
Так, при болезни Менетрие беспокоят достаточно выраженные боли в области эпигастрия, возникающие чаще всего после еды, чувство тяжести и распирания в желудке, отрыжка. На высоте боли может возникнуть рвота, а затем диарея. Аппетит значительно понижен, вплоть до анорексии, характерно похудение (за несколько месяцев пациент может потерять до 20 кг).
Синдрому Золлингера-Эллисона присуща язвенноподобная симптоматика – значительные голодные боли, уменьшающиеся после еды, потеря веса, возможна рвота кофейной гущей. Для всех типов гиперпластического гастрита характерно развитие кровотечений из слизистой желудка, которые могут приводить к постепенной анемизации. Пациенты предъявляют жалобы на повышенную утомляемость, слабость. При значительной потере белка (болезнь Менетрие, гипертрофическая гиперсекреторная гастропатия) отмечаются периферические отеки.
Осложнения
Диагностика
Консультация гастроэнтеролога обычно позволяет заподозрить наличие у пациента хронического поражения желудка, однако точно установить форму гастрита можно только после осмотра врача-эндоскописта. Гиперпластический гастрит – диагноз чисто морфологический, не имеющий какой-либо характерной симптоматики. Обычно гиперплазия эпителия является случайной находкой во время эзофагогастродуоденоскопии.
Гиперпластический гастрит – диагноз чисто морфологический, не имеющий какой-либо характерной симптоматики. Обычно гиперплазия эпителия является случайной находкой во время эзофагогастродуоденоскопии.
При проведении ЭГДС обнаруживаются значительно утолщенные складки слизистой, расположенные в виде очагов либо преимущественно по большой кривизне желудка. Перистальтика желудка при этом не нарушена. Дифференцировать различные виды гиперпластического гастрита позволяет раздувание желудка воздухом – при болезни Менетрие складки не расправляются даже при нагнетании давления выше 15 мм рт.ст.
Диагноз подтверждается с помощью эндоскопической биопсии с морфологическим исследованием биоптатов. Следует помнить, что щипчики для биопсии имеют малый размер и зачастую не в состоянии захватить слизистую на всю ее толщу. В этом случае в препарат для морфологического исследования не попадут все слои гипертрофированной слизистой, и анализ будет недостаточно информативным. Однако он поможет определить степень и вид гиперплазии.
Однако он поможет определить степень и вид гиперплазии.
Вспомогательными методами исследования являются рентгенография желудка, внутрижелудочная pH-метрия, клинический и биохимический анализы крови, анализ кала на скрытую кровь. Они позволяют дополнить и уточнить диагноз, выявить осложнения, провести дифференциальную диагностику с другими заболеваниями желудка. Дифференцировать гиперпластический гастрит следует с другими формами хронического гастрита, различными диспепсиями, распространенным семейным полипозом ЖКТ, туберкулезом, сифилисом, онкологическими поражениями желудка.
Лечение гиперпластического гастрита
Этиотропного лечения не существует, так как причины возникновения заболевания до конца не изучены. Симптоматическая терапия зависит от проявлений патологии. При повышенной кислотности назначаются антисекреторные препараты, при развитии атрофии – заместительная терапия натуральным желудочным соком. Если при эндоскопическом исследовании обнаружены множественные эрозии или пептическая язва, терапия будет соответствовать язвенной болезни желудка. Показано назначение диеты, богатой белками и витаминами.
Показано назначение диеты, богатой белками и витаминами.
Хирургическое лечение проводится при обнаружении полипов (удаление полипов желудка при ЭГДС), а также при резистентной гипопротеинемии, частых рецидивирующих кровотечениях (частичная или полная резекция желудка). Все пациенты с диагностированным гиперпластическим гастритом должны состоять на диспансерном учете, проходить эндоскопическое обследование два раза в год для своевременного выявления онкопатологии.
Прогноз и профилактика
Прогноз тесно связан с клинической формой заболевания и степенью гиперплазии. Случаи полного регресса изменений в слизистой достаточно редки, в основном это заболевание требует пожизненного наблюдения и лечения. При образовании полипов на гипертрофированных складках слизистой оболочки желудка прогноз ухудшается из-за повышения риска малигнизации. Профилактика гиперпластического гастрита не разработана, так как неизвестны точные причины его развития.
Гиперпластический гастрит – причины, симптомы, диагностика и лечение
Гиперпластический гастрит – это особая форма поражения слизистой оболочки желудка, характеризующаяся усиленной пролиферацией эпителия с формированием толстых ригидных складок и полипов. Очень часто патология протекает бессимптомно, а при значительном утолщении слизистой желудка или формировании полипов возможно появление рвоты, диареи, скрытых кровотечений и других неспецифических симптомов хронического гастрита. Основной метод диагностики – ЭГДС с биопсией. Лечение заключается в нормализации моторной и секреторной функций желудка, назначении высокобелковой диеты.
Очень часто патология протекает бессимптомно, а при значительном утолщении слизистой желудка или формировании полипов возможно появление рвоты, диареи, скрытых кровотечений и других неспецифических симптомов хронического гастрита. Основной метод диагностики – ЭГДС с биопсией. Лечение заключается в нормализации моторной и секреторной функций желудка, назначении высокобелковой диеты.
Общие сведения
Гиперпластический гастрит относится к редким формам хронического поражения желудка. Понятие «гиперпластический гастрит» включает в себя разрозненную группу заболеваний, в основе которых лежит не воспалительный процесс, а первичная гиперплазия эпителия желудка. Каждое из этих заболеваний встречается достаточно редко, в целом группа гипертрофических гастритов составляет не более 5% всех хронических заболеваний желудка.
Мужчины болеют гиперпластическим гастритом в четыре раза чаще женщин, наиболее распространена эта патология в возрасте 30-50 лет. Специалисты в сфере современной гастроэнтерологии указывают, что при развитии гиперпластического гастрита в детском возрасте возможен регресс заболевания с полным восстановлением нормального строения слизистой, а у взрослых в исходе гипертрофического гастрита практически всегда наблюдается атрофия слизистой желудка.
Специалисты в сфере современной гастроэнтерологии указывают, что при развитии гиперпластического гастрита в детском возрасте возможен регресс заболевания с полным восстановлением нормального строения слизистой, а у взрослых в исходе гипертрофического гастрита практически всегда наблюдается атрофия слизистой желудка.
Гиперпластический гастрит
Причины
Этиология гиперпластического гастрита пока досконально не изучена, это заболевание считается полиэтиологичным, для некоторых его форм характерна семейная предрасположенность. Наиболее значимыми для развития заболевания считаются нарушения питания, гиповитаминоз, хроническая интоксикация организма (при алкоголизме и наркомании, отравлении свинцом и др.), нарушения обмена веществ и нейро-гуморальной регуляции, курение.
Патогенез
Большое значение в патогенезе придается пищевой аллергии – воздействие аллергенов на слизистую повышает ее проницаемость, в результате чего развивается дисплазия эпителия, в полость желудка пропотевает большое количество транссудата. Все это приводит к значительным потерям белка, что является характерным признаком практически всех форм гиперпластического гастрита. Некоторые авторы рассматривают патологию как проявление аномалии развития желудка либо как вариант доброкачественной опухоли. Под воздействием любого из перечисленных патогенных факторов клетки эпителия желудка начинают усиленно размножаться, слизистая значительно утолщается.
Все это приводит к значительным потерям белка, что является характерным признаком практически всех форм гиперпластического гастрита. Некоторые авторы рассматривают патологию как проявление аномалии развития желудка либо как вариант доброкачественной опухоли. Под воздействием любого из перечисленных патогенных факторов клетки эпителия желудка начинают усиленно размножаться, слизистая значительно утолщается.
Классификация
Различные авторы предлагают несколько классификаций болезни. Так, Л.И.Аруин относит к гиперпластическому гастриту четыре вида гастропатий, при которых толщина слизистой составляет 1,5 мм и более: болезнь Менетрие, синдром Золлингера-Эллисона, гипертрофическую гиперсекреторную гастропатию. Различаются эти заболевания типом гиперплазии (мукозная, гландулярная, смешанная).
При болезни Менетрие (гигантский гипертрофический гастрит) происходит значительное увеличение и удлинение ямок эпителия желудка, в слизистой формируются огромные ригидные складки, не расправляющиеся при раздувании желудка воздухом.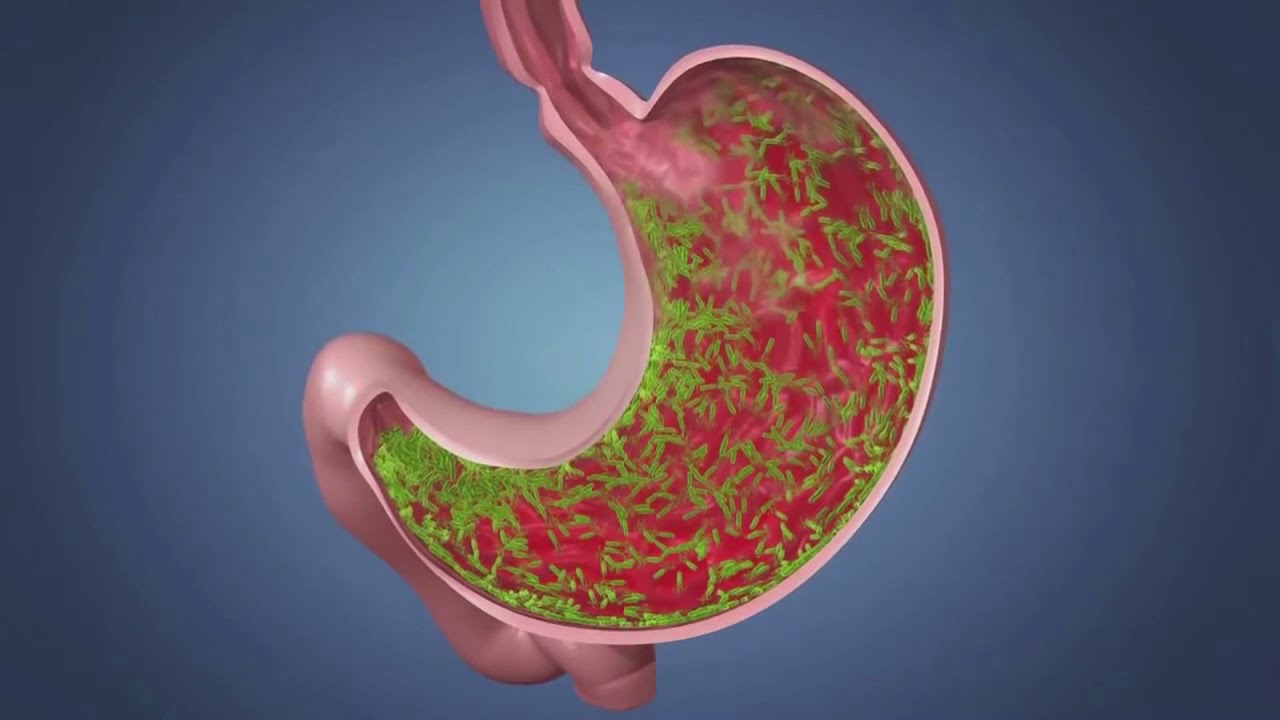 При этом отмечается кишечная метаплазия эпителия, разрастание и гиперплазия слизистых желез с практически полной атрофией основных желез, продуцирующих соляную кислоту. Указанные изменения могут приобретать как очаговый, так и диффузный характер.
При этом отмечается кишечная метаплазия эпителия, разрастание и гиперплазия слизистых желез с практически полной атрофией основных желез, продуцирующих соляную кислоту. Указанные изменения могут приобретать как очаговый, так и диффузный характер.
При другой форме гиперпластического гастрита – синдроме Золлингера-Эллисона – под действием повышенной продукции гастрина происходит гиперплазия париетальных клеток, они обнаруживаются практически во всех отделах желудка. Желудочные ямки при этом уплощены и укорочены. Гиперплазия слизистой за счет париетальных клеток приводит к значительному повышению выработки соляной кислоты, образованию множества эрозий, а затем и пептических язв желудка. Синдром Золлингера-Эллисона чаще всего развивается на фоне гастрин-продуцирующей опухоли поджелудочной железы.
Наиболее редкая форма – гипертрофическая гиперсекреторная гастропатия – может протекать с потерей белка или без нее. При данной патологии отмечается гландулярная (железистая) или фовеолярная (эпителиальная) гиперплазия, не связанная с повышенной продукцией гастрина. Ямки и валики слизистой желудка имеют обычный вид. При железистой гиперплазии в слизистой могут обнаруживаться кисты, сформированные из увеличенных слизистых желез. Эта форма занимает промежуточное положение между болезнью Менетрие и синдромом Золлингера-Эллисона.
Ямки и валики слизистой желудка имеют обычный вид. При железистой гиперплазии в слизистой могут обнаруживаться кисты, сформированные из увеличенных слизистых желез. Эта форма занимает промежуточное положение между болезнью Менетрие и синдромом Золлингера-Эллисона.
На основании эндоскопической оценки степени гипертрофии эпителия выделяют очаговый (зернистый), гигантский гипертрофический гастрит (распространенная форма болезни Менетрие), бородавчатый гастрит (единичные разрастания эпителия), полипозный гиперпластический гастрит (формирование гипертрофированных складок с множественными полипами на фоне полной атрофии слизистой желудка).
Симптомы гиперпластического гастрита
Очень часто на начальных стадиях заболевания пациенты не предъявляют жалоб. Симптомы обычно появляются при формировании значительных патологических изменений в слизистой. Проявления зависят от формы гиперпластического гастрита и кислотности желудочного сока.
Наиболее частым вариантом развития патологии является повышение кислотности в начале заболевания с постепенной атрофией слизистой и формированием ахилии. Так, при болезни Менетрие беспокоят достаточно выраженные боли в области эпигастрия, возникающие чаще всего после еды, чувство тяжести и распирания в желудке, отрыжка. На высоте боли может возникнуть рвота, а затем диарея. Аппетит значительно понижен, вплоть до анорексии, характерно похудение (за несколько месяцев пациент может потерять до 20 кг).
Так, при болезни Менетрие беспокоят достаточно выраженные боли в области эпигастрия, возникающие чаще всего после еды, чувство тяжести и распирания в желудке, отрыжка. На высоте боли может возникнуть рвота, а затем диарея. Аппетит значительно понижен, вплоть до анорексии, характерно похудение (за несколько месяцев пациент может потерять до 20 кг).
Синдрому Золлингера-Эллисона присуща язвенноподобная симптоматика – значительные голодные боли, уменьшающиеся после еды, потеря веса, возможна рвота кофейной гущей. Для всех типов гиперпластического гастрита характерно развитие кровотечений из слизистой желудка, которые могут приводить к постепенной анемизации. Пациенты предъявляют жалобы на повышенную утомляемость, слабость. При значительной потере белка (болезнь Менетрие, гипертрофическая гиперсекреторная гастропатия) отмечаются периферические отеки.
Осложнения
Диагностика
Консультация гастроэнтеролога обычно позволяет заподозрить наличие у пациента хронического поражения желудка, однако точно установить форму гастрита можно только после осмотра врача-эндоскописта. Гиперпластический гастрит – диагноз чисто морфологический, не имеющий какой-либо характерной симптоматики. Обычно гиперплазия эпителия является случайной находкой во время эзофагогастродуоденоскопии.
Гиперпластический гастрит – диагноз чисто морфологический, не имеющий какой-либо характерной симптоматики. Обычно гиперплазия эпителия является случайной находкой во время эзофагогастродуоденоскопии.
При проведении ЭГДС обнаруживаются значительно утолщенные складки слизистой, расположенные в виде очагов либо преимущественно по большой кривизне желудка. Перистальтика желудка при этом не нарушена. Дифференцировать различные виды гиперпластического гастрита позволяет раздувание желудка воздухом – при болезни Менетрие складки не расправляются даже при нагнетании давления выше 15 мм рт.ст.
Диагноз подтверждается с помощью эндоскопической биопсии с морфологическим исследованием биоптатов. Следует помнить, что щипчики для биопсии имеют малый размер и зачастую не в состоянии захватить слизистую на всю ее толщу. В этом случае в препарат для морфологического исследования не попадут все слои гипертрофированной слизистой, и анализ будет недостаточно информативным. Однако он поможет определить степень и вид гиперплазии.
Однако он поможет определить степень и вид гиперплазии.
Вспомогательными методами исследования являются рентгенография желудка, внутрижелудочная pH-метрия, клинический и биохимический анализы крови, анализ кала на скрытую кровь. Они позволяют дополнить и уточнить диагноз, выявить осложнения, провести дифференциальную диагностику с другими заболеваниями желудка. Дифференцировать гиперпластический гастрит следует с другими формами хронического гастрита, различными диспепсиями, распространенным семейным полипозом ЖКТ, туберкулезом, сифилисом, онкологическими поражениями желудка.
Лечение гиперпластического гастрита
Этиотропного лечения не существует, так как причины возникновения заболевания до конца не изучены. Симптоматическая терапия зависит от проявлений патологии. При повышенной кислотности назначаются антисекреторные препараты, при развитии атрофии – заместительная терапия натуральным желудочным соком. Если при эндоскопическом исследовании обнаружены множественные эрозии или пептическая язва, терапия будет соответствовать язвенной болезни желудка. Показано назначение диеты, богатой белками и витаминами.
Показано назначение диеты, богатой белками и витаминами.
Хирургическое лечение проводится при обнаружении полипов (удаление полипов желудка при ЭГДС), а также при резистентной гипопротеинемии, частых рецидивирующих кровотечениях (частичная или полная резекция желудка). Все пациенты с диагностированным гиперпластическим гастритом должны состоять на диспансерном учете, проходить эндоскопическое обследование два раза в год для своевременного выявления онкопатологии.
Прогноз и профилактика
Прогноз тесно связан с клинической формой заболевания и степенью гиперплазии. Случаи полного регресса изменений в слизистой достаточно редки, в основном это заболевание требует пожизненного наблюдения и лечения. При образовании полипов на гипертрофированных складках слизистой оболочки желудка прогноз ухудшается из-за повышения риска малигнизации. Профилактика гиперпластического гастрита не разработана, так как неизвестны точные причины его развития.
Гиперпластический гастрит – причины, симптомы, диагностика и лечение
Гиперпластический гастрит – это особая форма поражения слизистой оболочки желудка, характеризующаяся усиленной пролиферацией эпителия с формированием толстых ригидных складок и полипов.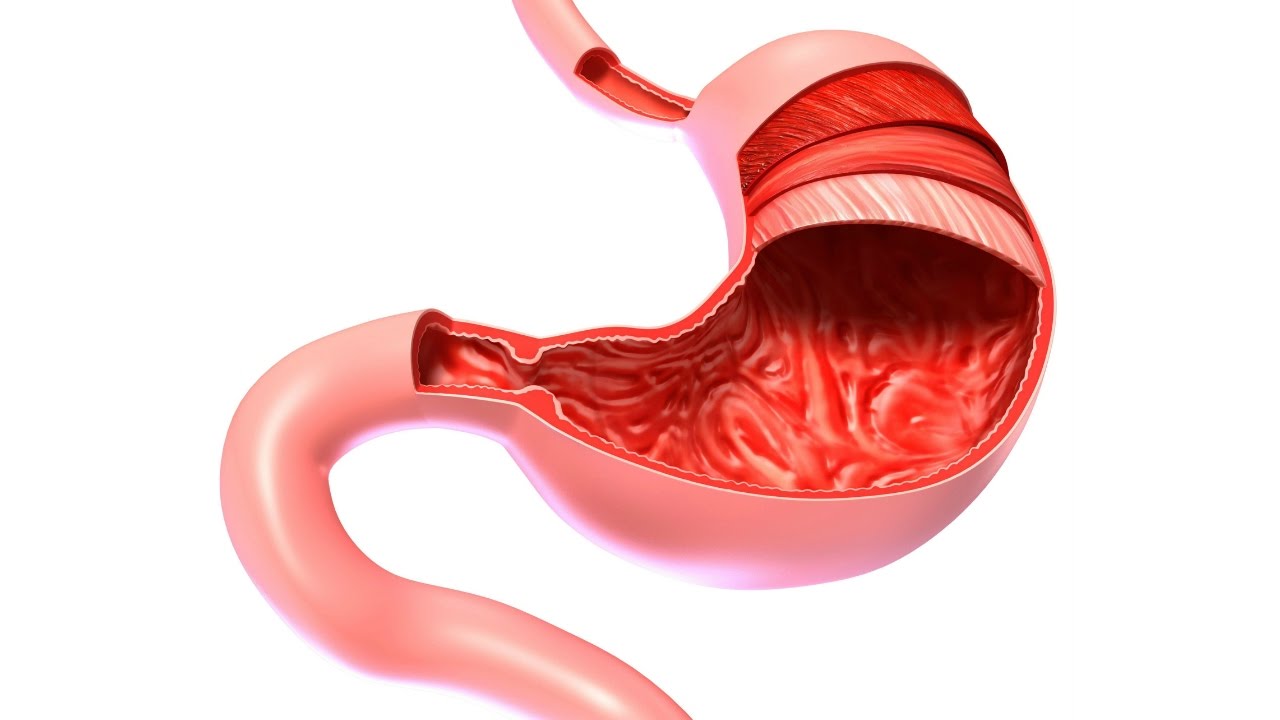 Очень часто патология протекает бессимптомно, а при значительном утолщении слизистой желудка или формировании полипов возможно появление рвоты, диареи, скрытых кровотечений и других неспецифических симптомов хронического гастрита. Основной метод диагностики – ЭГДС с биопсией. Лечение заключается в нормализации моторной и секреторной функций желудка, назначении высокобелковой диеты.
Очень часто патология протекает бессимптомно, а при значительном утолщении слизистой желудка или формировании полипов возможно появление рвоты, диареи, скрытых кровотечений и других неспецифических симптомов хронического гастрита. Основной метод диагностики – ЭГДС с биопсией. Лечение заключается в нормализации моторной и секреторной функций желудка, назначении высокобелковой диеты.
Общие сведения
Гиперпластический гастрит относится к редким формам хронического поражения желудка. Понятие «гиперпластический гастрит» включает в себя разрозненную группу заболеваний, в основе которых лежит не воспалительный процесс, а первичная гиперплазия эпителия желудка. Каждое из этих заболеваний встречается достаточно редко, в целом группа гипертрофических гастритов составляет не более 5% всех хронических заболеваний желудка.
Мужчины болеют гиперпластическим гастритом в четыре раза чаще женщин, наиболее распространена эта патология в возрасте 30-50 лет./29/29.jpg) Специалисты в сфере современной гастроэнтерологии указывают, что при развитии гиперпластического гастрита в детском возрасте возможен регресс заболевания с полным восстановлением нормального строения слизистой, а у взрослых в исходе гипертрофического гастрита практически всегда наблюдается атрофия слизистой желудка.
Специалисты в сфере современной гастроэнтерологии указывают, что при развитии гиперпластического гастрита в детском возрасте возможен регресс заболевания с полным восстановлением нормального строения слизистой, а у взрослых в исходе гипертрофического гастрита практически всегда наблюдается атрофия слизистой желудка.
Гиперпластический гастрит
Причины
Этиология гиперпластического гастрита пока досконально не изучена, это заболевание считается полиэтиологичным, для некоторых его форм характерна семейная предрасположенность. Наиболее значимыми для развития заболевания считаются нарушения питания, гиповитаминоз, хроническая интоксикация организма (при алкоголизме и наркомании, отравлении свинцом и др.), нарушения обмена веществ и нейро-гуморальной регуляции, курение.
Патогенез
Большое значение в патогенезе придается пищевой аллергии – воздействие аллергенов на слизистую повышает ее проницаемость, в результате чего развивается дисплазия эпителия, в полость желудка пропотевает большое количество транссудата. Все это приводит к значительным потерям белка, что является характерным признаком практически всех форм гиперпластического гастрита. Некоторые авторы рассматривают патологию как проявление аномалии развития желудка либо как вариант доброкачественной опухоли. Под воздействием любого из перечисленных патогенных факторов клетки эпителия желудка начинают усиленно размножаться, слизистая значительно утолщается.
Все это приводит к значительным потерям белка, что является характерным признаком практически всех форм гиперпластического гастрита. Некоторые авторы рассматривают патологию как проявление аномалии развития желудка либо как вариант доброкачественной опухоли. Под воздействием любого из перечисленных патогенных факторов клетки эпителия желудка начинают усиленно размножаться, слизистая значительно утолщается.
Классификация
Различные авторы предлагают несколько классификаций болезни. Так, Л.И.Аруин относит к гиперпластическому гастриту четыре вида гастропатий, при которых толщина слизистой составляет 1,5 мм и более: болезнь Менетрие, синдром Золлингера-Эллисона, гипертрофическую гиперсекреторную гастропатию. Различаются эти заболевания типом гиперплазии (мукозная, гландулярная, смешанная).
При болезни Менетрие (гигантский гипертрофический гастрит) происходит значительное увеличение и удлинение ямок эпителия желудка, в слизистой формируются огромные ригидные складки, не расправляющиеся при раздувании желудка воздухом. При этом отмечается кишечная метаплазия эпителия, разрастание и гиперплазия слизистых желез с практически полной атрофией основных желез, продуцирующих соляную кислоту. Указанные изменения могут приобретать как очаговый, так и диффузный характер.
При этом отмечается кишечная метаплазия эпителия, разрастание и гиперплазия слизистых желез с практически полной атрофией основных желез, продуцирующих соляную кислоту. Указанные изменения могут приобретать как очаговый, так и диффузный характер.
При другой форме гиперпластического гастрита – синдроме Золлингера-Эллисона – под действием повышенной продукции гастрина происходит гиперплазия париетальных клеток, они обнаруживаются практически во всех отделах желудка. Желудочные ямки при этом уплощены и укорочены. Гиперплазия слизистой за счет париетальных клеток приводит к значительному повышению выработки соляной кислоты, образованию множества эрозий, а затем и пептических язв желудка. Синдром Золлингера-Эллисона чаще всего развивается на фоне гастрин-продуцирующей опухоли поджелудочной железы.
Наиболее редкая форма – гипертрофическая гиперсекреторная гастропатия – может протекать с потерей белка или без нее. При данной патологии отмечается гландулярная (железистая) или фовеолярная (эпителиальная) гиперплазия, не связанная с повышенной продукцией гастрина. Ямки и валики слизистой желудка имеют обычный вид. При железистой гиперплазии в слизистой могут обнаруживаться кисты, сформированные из увеличенных слизистых желез. Эта форма занимает промежуточное положение между болезнью Менетрие и синдромом Золлингера-Эллисона.
Ямки и валики слизистой желудка имеют обычный вид. При железистой гиперплазии в слизистой могут обнаруживаться кисты, сформированные из увеличенных слизистых желез. Эта форма занимает промежуточное положение между болезнью Менетрие и синдромом Золлингера-Эллисона.
На основании эндоскопической оценки степени гипертрофии эпителия выделяют очаговый (зернистый), гигантский гипертрофический гастрит (распространенная форма болезни Менетрие), бородавчатый гастрит (единичные разрастания эпителия), полипозный гиперпластический гастрит (формирование гипертрофированных складок с множественными полипами на фоне полной атрофии слизистой желудка).
Симптомы гиперпластического гастрита
Очень часто на начальных стадиях заболевания пациенты не предъявляют жалоб. Симптомы обычно появляются при формировании значительных патологических изменений в слизистой. Проявления зависят от формы гиперпластического гастрита и кислотности желудочного сока.
Наиболее частым вариантом развития патологии является повышение кислотности в начале заболевания с постепенной атрофией слизистой и формированием ахилии. Так, при болезни Менетрие беспокоят достаточно выраженные боли в области эпигастрия, возникающие чаще всего после еды, чувство тяжести и распирания в желудке, отрыжка. На высоте боли может возникнуть рвота, а затем диарея. Аппетит значительно понижен, вплоть до анорексии, характерно похудение (за несколько месяцев пациент может потерять до 20 кг).
Так, при болезни Менетрие беспокоят достаточно выраженные боли в области эпигастрия, возникающие чаще всего после еды, чувство тяжести и распирания в желудке, отрыжка. На высоте боли может возникнуть рвота, а затем диарея. Аппетит значительно понижен, вплоть до анорексии, характерно похудение (за несколько месяцев пациент может потерять до 20 кг).
Синдрому Золлингера-Эллисона присуща язвенноподобная симптоматика – значительные голодные боли, уменьшающиеся после еды, потеря веса, возможна рвота кофейной гущей. Для всех типов гиперпластического гастрита характерно развитие кровотечений из слизистой желудка, которые могут приводить к постепенной анемизации. Пациенты предъявляют жалобы на повышенную утомляемость, слабость. При значительной потере белка (болезнь Менетрие, гипертрофическая гиперсекреторная гастропатия) отмечаются периферические отеки.
Осложнения
Диагностика
Консультация гастроэнтеролога обычно позволяет заподозрить наличие у пациента хронического поражения желудка, однако точно установить форму гастрита можно только после осмотра врача-эндоскописта.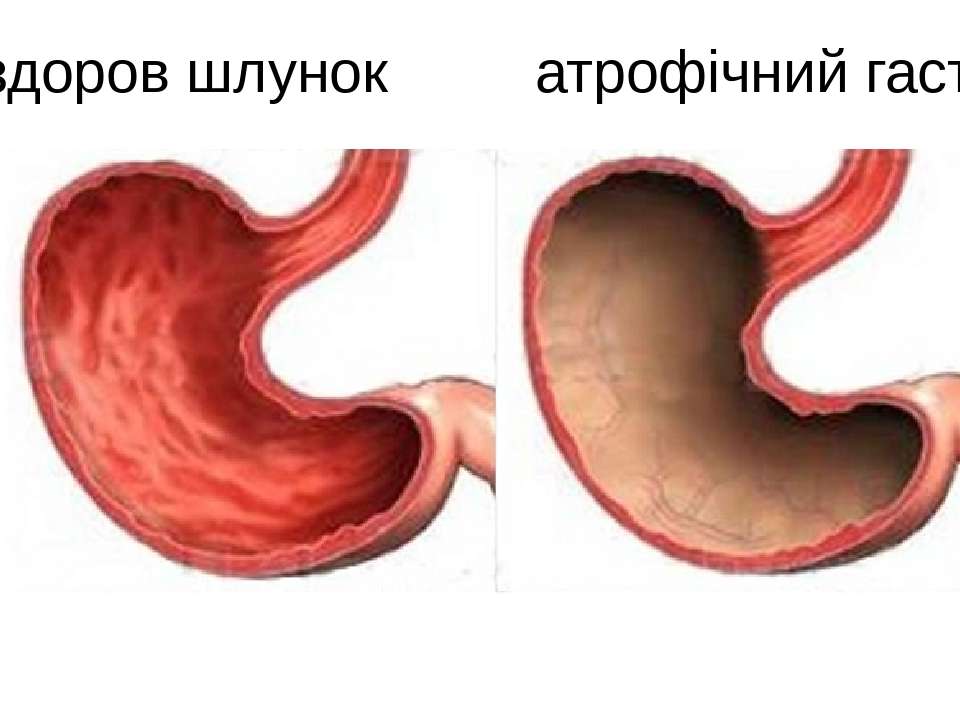 Гиперпластический гастрит – диагноз чисто морфологический, не имеющий какой-либо характерной симптоматики. Обычно гиперплазия эпителия является случайной находкой во время эзофагогастродуоденоскопии.
Гиперпластический гастрит – диагноз чисто морфологический, не имеющий какой-либо характерной симптоматики. Обычно гиперплазия эпителия является случайной находкой во время эзофагогастродуоденоскопии.
При проведении ЭГДС обнаруживаются значительно утолщенные складки слизистой, расположенные в виде очагов либо преимущественно по большой кривизне желудка. Перистальтика желудка при этом не нарушена. Дифференцировать различные виды гиперпластического гастрита позволяет раздувание желудка воздухом – при болезни Менетрие складки не расправляются даже при нагнетании давления выше 15 мм рт.ст.
Диагноз подтверждается с помощью эндоскопической биопсии с морфологическим исследованием биоптатов. Следует помнить, что щипчики для биопсии имеют малый размер и зачастую не в состоянии захватить слизистую на всю ее толщу. В этом случае в препарат для морфологического исследования не попадут все слои гипертрофированной слизистой, и анализ будет недостаточно информативным. Однако он поможет определить степень и вид гиперплазии.
Однако он поможет определить степень и вид гиперплазии.
Вспомогательными методами исследования являются рентгенография желудка, внутрижелудочная pH-метрия, клинический и биохимический анализы крови, анализ кала на скрытую кровь. Они позволяют дополнить и уточнить диагноз, выявить осложнения, провести дифференциальную диагностику с другими заболеваниями желудка. Дифференцировать гиперпластический гастрит следует с другими формами хронического гастрита, различными диспепсиями, распространенным семейным полипозом ЖКТ, туберкулезом, сифилисом, онкологическими поражениями желудка.
Лечение гиперпластического гастрита
Этиотропного лечения не существует, так как причины возникновения заболевания до конца не изучены. Симптоматическая терапия зависит от проявлений патологии. При повышенной кислотности назначаются антисекреторные препараты, при развитии атрофии – заместительная терапия натуральным желудочным соком. Если при эндоскопическом исследовании обнаружены множественные эрозии или пептическая язва, терапия будет соответствовать язвенной болезни желудка. Показано назначение диеты, богатой белками и витаминами.
Показано назначение диеты, богатой белками и витаминами.
Хирургическое лечение проводится при обнаружении полипов (удаление полипов желудка при ЭГДС), а также при резистентной гипопротеинемии, частых рецидивирующих кровотечениях (частичная или полная резекция желудка). Все пациенты с диагностированным гиперпластическим гастритом должны состоять на диспансерном учете, проходить эндоскопическое обследование два раза в год для своевременного выявления онкопатологии.
Прогноз и профилактика
Прогноз тесно связан с клинической формой заболевания и степенью гиперплазии. Случаи полного регресса изменений в слизистой достаточно редки, в основном это заболевание требует пожизненного наблюдения и лечения. При образовании полипов на гипертрофированных складках слизистой оболочки желудка прогноз ухудшается из-за повышения риска малигнизации. Профилактика гиперпластического гастрита не разработана, так как неизвестны точные причины его развития.
что это такое, основные симптомы, меры при обострении
Среди всех заболеваний желудка гастриты являются безусловными лидерами, ведь на их долю приходится более 80% случаев. Многие из нас уже так привыкли к ощущению тяжести или изжоги, что не обращают на эти симптомы особого внимания. А что еще хуже — сами себе прописывают широко рекламируемые средства для снятия неприятных симптомов, без посещения гастроэнтеролога и проведения хотя бы минимального обследования организма.
Безусловно, такое поведение недопустимо и способно привести к самым плачевным последствиям. Поскольку хронический гастрит — это вовсе не пустяковое заболевание. Некоторые его формы без должного лечения неминуемо переходят в онкологические заболевания. Поэтому сегодня мы хотим привлечь ваше внимание к наиболее опасной разновидности этого заболевания — хроническому атрофическому гастриту.
В чем опасность хронического атрофического гастрита
Единой и всеобъемлющей классификации хронических гастритов не существует, типологические разновидности этого заболевания выделяют обычно по нескольким основаниям. Наиболее часто выделяют острый, хронический, антацидный, атрофический гастрит и гастрит при повышенном уровне кислотности.
Самым опасным и коварным принято считать хронический атрофический гастрит. Сущность недуга отражает его название: подверженные процессу атрофии клетки железистой ткани со временем теряют возможность вырабатывать желудочный сок, что негативно отражается на пищеварительной деятельности ЖКТ. Специалисты выделяют две основных причины появления заболевания: бактериальные инфекции и аутоиммунные процессы.
Воспаление слизистой желудка очень часто происходит под воздействием бактерии Helicobacter pylori . Именно ее пагубным влиянием обусловлено снижение защитных свойств слизистой, в результате чего токсины и свободные радикалы получают возможность внедряться в ткани и повреждать клетки. Этот процесс приводит к перерождению клеток желудочного эпителия, вырабатывающих желудочный сок, в кишечные.
Внимание!
Сегодня Helicobacter pylori входит в перечень биологических канцерогенов. Считается, что она провоцирует возникновение раковой опухоли желудка. Стоит отметить, что по оценкам аналитиков, носителями этой инфекции в мире является более 80% населения.
С возрастом частота и степень выраженности гастритических изменений СОЖ возрастают. Если у молодежи до 30 лет атрофический гастрит диагностируется лишь в 5% случаев, то в возрастной группе от 31 до 50 лет — уже в 30%. А среди пожилых людей хронический атрофический гастрит диагностируется примерно у 70% больных.
Если говорить о важности своевременной диагностики и лечения, то необходимо подчеркнуть, что атрофический гастрит считается непосредственным предшественником рака желудка. Если метаплазии подвержено более 20% слизистой, то вероятность развития раковой опухоли приближается к 100%. Иными словами, хронический атрофический гастрит в 13% случаев перерастает в онкологическое заболевание. Этот показатель в 5 раз выше, чем при других видах гастрита.
Поэтому главная задача гастроэнтерологов — это разработка и широкое применение простых и эффективных методов точной диагностики гастрита на раннем этапе. Своевременная постановка диагноза и назначение грамотного лечения причины болезни позволяют восстановить работоспособность слизистой желудка и значительно сократить площадь перерожденного участка.
Конечно, атрофированные клетки стенок желудка на данном этапе развития медицины уже невозможно вернуть в исходное состояние. Но значительно снизить риск появления злокачественной опухоли желудка вполне возможно при условии правильной медикаментозной терапии, соблюдении диеты и приверженности правилам здорового образа жизни.
Симптомы и диагностические признаки хронического атрофического гастрита
Основным доказательством коварства этого заболевания является отсутствие определенных и ярко выраженных симптомов на ранней стадии. Нет даже болевых ощущений, которые могли бы заставить больного обратиться к врачу.
Симптомы хронического гастрита у взрослых, по большому счету, не имеют особой специфики и являются общими для всех типов этого заболевания. В качестве основной жалобы выступает чувство тяжести в желудке, которое появляется после еды. Однако по мере развития болезни у пациента возникают симптомы, позволяющие сформировать полную клиническую картину.
Например, диспепсический синдром , который проявляет себя тяжестью и тупой ноющей болью в верхней части живота, изжогой, срыгиванием, отрыжкой, тошнотой и даже рвотой с примесями слизи и желчи. Также одним из проявлений этого синдрома является снижение или полное отсутствие аппетита.
Стоит отметить, что нарушение пищеварения происходит и в других отделах желудочно-кишечного тракта. Характерен дискомфорт и вздутие живота, стул становится нерегулярным, с запорами или поносами. Язык покрывается серым налетом с отпечатками зубов, во рту появляется неприятный привкус и запах.
Из-за нарушения всасывания железа и витаминов развивается анемический синдром. Его проявлениями являются слабость, быстрая утомляемость, сонливость, хроническая усталость, а также бледность кожи и слизистых оболочек. Пациента мучает боль и жжение в области языка, нарушается чувствительность конечностей. Волосы становятся сухими, а ногти — ломкими, появляется одышка, колющие боли в сердце.
Диагностика
Между тем главные признаки гастрита можно выявить лишь в ходе всестороннего обследования с применением методов лабораторной диагностики, а также функциональных и инструментальных исследований. Свою эффективность доказали различные методы эндоскопического обследования в комплексе с биопсией.
Направления терапии при хроническом течении заболевания
При заражении Helicobacter pylori единственный путь к выздоровлению лежит через так называемую эрадикацию инфекционного агента . В ее задачи входит противодействие развитию инфекции, исключение возможности формирования невосприимчивости бактерии к антибиотикам, снижение длительности курса лечения и числа медикаментов и вероятности побочных эффектов.
В качестве средств, подавляющих активность бактерий, используются антибиотики из разряда тетрациклинов и пенициллинов, а также антибактериальные препараты на основе метронидазола, ингибиторы протонной помпы, препараты висмута и некоторые другие.
На заметку
Эрадикация — совокупность терапевтических приемов и методов, направленных на уничтожение Helicobacter pylori в слизистой оболочке желудка.
Подавлять аутоиммунные процессы при атрофических гастритах современный уровень развития медицины пока не позволяет. Гормональные препараты и иммунокорректоры не дают видимого эффекта. Однако в некоторых случаях гормональная терапия является незаменимым видом лечения.
Патогенетическая терапия атрофического гастрита основана на комплексном использовании разных групп медикаментов. Важную роль играют лекарства, способствующие пищеварению, — препараты соляной кислоты и ферментов желудочного сока. С этой же целью применяются минеральные воды с высоким содержанием солей, способствующие выработке соляной кислоты. В качестве стимуляторов секреторной функции также используются янтарная и лимонная кислота, витамин С и РР.
Для облегчения воспалительного процесса назначаются противовоспалительные препараты на основе натурального растительного сырья, такие как сок или гранулы подорожника, полынь, фенхель. Важную роль в лечении играют средства, регулирующие моторную функцию желудка и улучшающие перистальтику.
С целью повышения защитных свойств слизистой оболочки применяют гастропротекторы. К ним относятся препараты висмута, обладающие обволакивающим и вяжущим свойствами, а также препарат гидроксида алюминия. Усилить процессы регенерации слизистой желудка помогают средства для регуляции тканевого обмена — инозин, масло шиповника и облепихи, стероиды и анаболики.
Залогом выздоровления и продления активного периода жизнедеятельности является здоровый образ жизни и правильное питание . Именно это становится неотъемлемой частью лечения всех видов гастрита. Необходимо полностью отказаться от вредных привычек, соблюдать режим дня, высыпаться, давать телу необходимую физическую нагрузку. Например, гулять на свежем воздухе, кататься на велосипеде или роликовых коньках, посещать бассейн. Это поможет не только укрепить организм физически, но и снизить психологическую нагрузку, повысить стрессоустойчивость, положительный настрой, зарядиться бодростью и оптимизмом, столь необходимыми в борьбе с любой болезнью.
Что касается рациона питания, то он требует особенно пристального внимания. Базовой при атрофическом гастрите является диета №2 , разработанная М.И. Певзнером. Этот рацион предполагает полноценное питание, обеспечивающее стимуляцию функциональных желез. Рекомендованные способы приготовления блюд — отваривание, тушение и запекание. Важно, чтобы питание было полноценным и разнообразным.
В диету включаются продукты с богатым содержанием кислот, улучшающие аппетит и стимулирующие выделение желудочного сока. Диета допускает употребление разнообразных мясных и рыбных блюд, кисломолочных и мучных продуктов, яиц, овощей и фруктов. Больным разрешаются также подсушенный ржаной хлеб, каши на воде или с добавлением молока, пресный сыр, ветчина без жира, кисло-сладкие соки.
Полностью исключена любая трудно перевариваемая пища, которая способна оказать раздражающее воздействие на желудок и спровоцировать активное брожение в кишечнике. Под запретом все жирное, острое, соленое и холодное, а также свежий хлеб и сдоба. С осторожностью следует относиться к капусте и винограду.
Что делать при обострении хронического гастрита
Любая форма хронического гастрита, как правило, сопровождает человека в течение многих лет его жизни, а периоды ремиссии нередко сменяются обострениями. Обострение хронического гастрита может быть обусловлено как сезонным всплеском заболеваемости, так и спровоцировано употреблением продуктов и напитков из запрещенного списка, приемом лекарственных препаратов, психологическими факторами, такими как частые стрессы или переутомление, и другими обстоятельствами. Нередко к обострению воспалительного процесса в желудке приводят различные сопутствующие заболевания, профессиональные вредности или наследственные особенности работы ЖКТ.
Хронический гастрит в стадии обострения способен доставить немало неприятностей, поэтому для минимизации пагубных последствий следует при первых же симптомах обратиться за квалифицированной медицинской помощью и ни в коем случае не заниматься самолечением. Нередко для снятия острого приступа гастрита требуется стационарное лечение, многокомпонентная медикаментозная терапия и строжайшая лечебная диета.
При выраженном болевом синдроме назначается диета №1а с минимальной пищеварительной нагрузкой. Этот вариант лечебного питания выполняет свою главную задачу — снижение рефлекторной возбудимости СОЖ. Допускается пища исключительно в виде жидкости или пюре, приготовленная на пару, отваренная, протертая.
Когда острый воспалительный период стихнет, больной переводится на более лояльный вариант — диету №1 , способствующую восстановлению пострадавшей от воспаления слизистой, нормализации секреторной и моторной функции желудка.
Профилактика обострения хронического гастрита предполагает неукоснительное соблюдение прописанного гастроэнтерологом курса терапии. Как правило, он включает в себя медикаментозные препараты, лечебную диету, физиотерапевтические процедуры, прием минеральных вод и фитотерапию.
Стоит отметить, что ведущее место в борьбе с обострениями гастрита занимают гастропротекторы с местной бактерицидной активностью на основе трикалия дицитрата висмута. Эти лекарства нередко назначают именно для вторичной и третичной профилактики осложнений. Благодаря действующему веществу они быстро, эффективно и надолго снимают неприятные симптомы, а также устраняют саму причину воспаления, разрушая стенки Helicobacter pylori .
Препараты на основе висмута формируют защитный слой, который в течение длительного времени защищает пораженные участки слизистой оболочки от влияния агрессивных факторов, обладают противовоспалительным и вяжущим действием, а также помогают восстанавливать поврежденные клетки и активизировать регенерацию, что особенно актуально при лечении атрофического гастрита.
Безусловно, хронические заболевания существенно осложняют нам жизнь. Однако никогда не стоит опускать руки и пускать болезнь на самотек! Только мы сами в состоянии позаботиться о своем здоровье — нужно просто быть внимательнее к сигналам своего организма, вовремя и правильно реагировать на них, обращаясь за помощью к профессионалам.
причины, симптомы, диагностика, лечение, профилактика
Паталогическое состояние, возникающее на фоне поражения слизистой оболочки желудка и характеризующееся усиленной пролиферацией эпителия с образованием толстых ригидных складок и полипов.
На данный момент причины развития гиперпластического гастрита неизвестны. Заболевание считается полиэтиологичным. Чаще всего развитие гиперпластического гастрита связывают с нарушением питания, гиповитаминозом, хронической интоксикации организма, обусловленной приемом алкоголя, наркотических веществ, курением и отравлением свинцом. Помимо этого, данные, полученные во время исследований указывают на то, что заболевание может возникнуть на фоне нарушения обмена веществ и расстройства нейрогуморальной регуляции.
Иногда развитие заболевания связывают с наличием у больного пищевой аллергии. При влиянии аллергенов на слизистую усиливается ее проницаемость, вследствие чего возникает дисплазия эпителия, на фоне чего в полость желудка выпотевает значительное количество транссудата. Такие процессы сопровождаются значительной потерей белка, что считается одним из классических признаков этой формы гастрита.
Некоторые специалисты отмечают, что гиперпластический гастрит, представляет собой аномалию развития желудка либо особый вариант доброкачественной опухоли, вследствие чего клетки желудочного эпителия начинают усиленно делиться, что сопровождается значительным утолщением слизистой этого органа.
СимптомыНа начальных стадиях заболевания пациенты могут не подозревать о наличии у них заболевания. Первые симптомы появляются при возникновении выраженных патологических изменений в слизистой. Проявления зависят от формы гиперпластического гастрита и кислотности желудочного сока.
Чаще всего, у больных отмечается повышение кислотности в начале заболевания с постепенной атрофией слизистой и формированием ахилии. Иногда пациента могут беспокоить достаточно выраженные боли в области эпигастрия, которые появляются после еды, чувство тяжести и распирания в желудке, отрыжка. На высоте болей может возникнуть рвота, а затем диарея. Аппетит снижен, вплоть до анорексии, у больного отмечается прогрессирующее уменьшение массы тела.
При всех типах гиперпластического гастрита возможно развитие кровотечений из слизистого слоя желудка, которые могут приводить к постепенной анемизации. Пациенты предъявляют жалобы на повышенную утомляемость, слабость, упадок сил. При значительной потере белка возможно появление периферических отеков.
Все типы гиперпластического гастрита отличаются повышенной предрасположенностью к малигнизации или раковому перерождению, что связано с дисплазией и атрофией эпителия.
ДиагностикаТочная поставка диагноза возможна только после тщательного обследования. При подозрении на данную форму гастрита больному потребуется проведение эзофагогастродуоденоскопии с обязательным взятием биопсии и дальнейшим гистологическим и морфологическим изучением биоптата.
Вспомогательными методами исследования при гиперпластическом гастрите являются рентгенография желудка, внутрижелудочная pH-метрия, клинический и биохимический анализы крови, анализ кала на скрытую кровь.
ЛечениеЭтиотропного лечения гиперпластического гастрита пока не разработано. Симптоматическая терапия зависит от причин и степени выраженности патологических изменений.
При повышенной кислотности назначаются антисекреторные препараты, при развитии атрофии – заместительная терапия натуральным желудочным соком. Если при эндоскопическом исследовании обнаружены множественные эрозии или пептическая язва, терапия будет соответствовать язвенной болезни желудка. Показано назначение диеты, богатой белками и витаминами.
Необходимость в радикальных методах лечения возникает при выявлении полипов, при резистентной гипопротеинемии и частых рецидивирующих кровотечениях. Все пациенты с диагностированным гиперпластическим гастритом должны состоять на диспансерном учете для своевременного выявления онкопатологии.
ПрофилактикаВ связи с тем, что причины развития заболевания не установлены, невозможно разработать эффективные меры профилактики гиперпластического гастрита.
Атрофический гиперпластический гастрит: причины, симптомы и лечение
Атрофический гиперпластический гастрит считается редкой формой хронической заболевания ЖКТ, способствующего увеличению слизистой оболочки. Заболевание распространяется в антральной части желудка. Если поздно обратиться за помощью к врачу, увеличивается риск появления онкологической болезни.
Читайте также дополнительные материалы, это важно знать.Обычно заболевшему сложно обратить внимание на признак, способный сказать о наличии атрофического гастрита, симптом не бывает явно выраженным. Упомянутый вид болезни требует немедленной помощи врачей. Болезнь считается весьма коварным и серьёзным явлением, провоцирующим серьёзное истончение слизистой желудочной стенки. Иногда появляются язвы и желудочное кровотечение.
Причины появления атрофического гиперпластического гастрита
Медицине неизвестны точные причины возникновения развивающейся болезни. Присутствуют отдельные повторяющиеся признаки, провоцирующие развитие подобного вида гастрита: бактерия Хеликобактер Пилори, аутоиммунный фактор, заболевания ЖКТ, осложнение после приёма ряда лекарств, интоксикация организма, наследственный фактор и прочее.
Атрофический гиперпластический гастрит может возникать по причинам:
- Злоупотребление спиртными напитками;
- Попадание в организм химических веществ;
- Курение;
- Осложнение после перенесённых болезней, к примеру, брюшной тиф;
- Иногда хронический атрофический гастрит образуется в результате аллергической реакции на пищу;
- Наследственный фактор;
- Недостаток витаминных компонентов в организме.
Симптомы атрофического гиперпластического гастрита
Как правило, сложно выявить симптомы и лечение болезни, заболевание развивается медлительно и заметным образом не проявляется. Часто болезнь протекает с сопровождением болей в желудке, особенно после употреблённой пищи, переходящих в поясницу и лопаточную зону. В желудке ощущается переполненность и тяжесть, аппетит обычно отсутствует. После небольшого перекуса пациент ощущает насыщенность.
Различают признаки, периодически наблюдаемые у пациентов:
- Отрыжка тухлым;
- Высокая температура тела;
- Вздутый живот;
- Изжога;
- Слабое состояние и головокружение;
- Светлый налёт на языке;
- Сухая кожа;
- Бледность;
- Выпадение волос;
- Кровотечение дёсен;
- Рвота, возникающая вследствие нервного перевозбуждения.
Симптомы атрофированного гиперпластического гастрита
Признаки недомогания зависят от нескольких факторов, к примеру, от количества и локализации полипов. По причине бессимптомности болезни не каждый человек способен выявить наличие гастрита. В обострённый этап проявляются симптомы в виде тягучей боли в подложечной желудочной зоне.
Редкая форма гастрита
Кроме того, гиперпластичный гастрит выражает иные симптомы: чувство переедания, тяжесть в желудке после употребления продуктов питания, частая отрыжка, тошнота, изжога, сильное выделение слюны, резкое снижение веса и прочее.
Симптомы подобного вида гастрита не несут специфический характер, нередко заболевание путают с иными типами желудочного гастрита. Требуется тщательное исследование доктором, включая проведение гастроскопии и анализа крови.
Как правило, атрофия катара желудка показывает главные признаки:
- Высокая концентрация кислотности в желудке;
- Острые болевые ощущения в животе;
- Неприятный привкус горечи в ротовой полости;
- Запоры или поносы;
- Гнойничковые дефекты кожного покрова;
- Снижение иммунитета;
- Грибковые поражения пальцев ног, половых органов, грибок в полости рта.
Лечение атрофического гиперпластического гастрита
При образовании подобного заболевания многие пациенты задаются вопросом характера лечения. Большинство признаков гастрита свидетельствуют о прочих болезнях ЖКТ, положено провести дифференциальную диагностику. Если гиперпластический гастрит уже развивается у больного длительное время, лечение протекает годами.
Требуется вести здоровый образ жизни, тогда риск образования травмы организма снизится. Полезно вовремя посещать врачей, обследоваться на наличие гастрита дважды в год.
Многие профессионалы убеждены, что гиперпластический гастрит невозможно вылечить полностью, однако возможно предотвратить развитие. Обычно назначается специальное лечение, помогающее:
- Предотвратить развитие болезни и изменение желудка;
- Нейтрализовать симптомы атрофического гиперпластического гастрита;
- Обеспечить сбалансированность нервной системы и функций кишечника.
Во время лечения и диагностики человеку, страдающему заболеванием, требуется пройти медикаментозное лечение. Оно поможет избавиться от различных заболеваний и осложнений желудочно-кишечного тракта. Настоятельно рекомендуется строго следовать правилам диеты.
Различают множество рецептов отваров подходящего лечения, позволяющих снизить процесс развития атрофического гиперпластического гастрита. Как правило, большинство средств способно восстановить пищеварительную функцию и сбалансировать уровень концентрации кислотности. Отвары рекомендуется употреблять в количестве стакана исключительно натощак раз в сутки. Атрофический гастрит будет проявляться в меньшей степени благодаря сниженной активности болезни.
Чтобы увеличить концентрацию кислотности и уменьшить риск появления новых полипов, рекомендуется принимать несколько раз в сутки выжатый сок свежей капусты. Оптимальным вариантом станет белокочанная капуста.
В сбалансированности секреции и нейтрализации признаков очагового атрофического гиперпластического гастрита востребован массаж. При пробуждении больному следует массировать область желудка по часовой стрелке, потом разрешается выпить заваренный отвар из необходимых компонентов, к примеру, из цикория. Придётся ограничиться в потреблении продуктов питания, включающих немалое количество клетчатки.
Лечение с помощью диеты
Важным фактором врачевания болезней желудочно-кишечного такта считается диета, требующая строгого следования. Сосредоточена на возобновлении состояния слизистых желудочных стенок и уменьшении кислотности.
Людям, страдающим атрофическим гиперпластическим гастритом, профессионалы советуют придерживаться специальной диеты, которая различается смягчённой стимуляцией работы функциональности органов пищеварения.
Требуется принимать маленькие порции пищи пять раз в сутки, чтобы не появлялось риска увеличения нагрузки на пищеварительные органы при заболевании. Следует включать в рацион питания блюда, компоненты которых насыщают организм возможными полезными минералами.
Чтобы правильно лечить атрофический гиперпластический гастрит, рекомендуется соблюдать важное правило. Температура принимаемой еды должна составлять до шестидесяти пяти градусов. Чересчур малая или большая температура способна спровоцировать раздражительный эффект на слизистую оболочку. Первоначально лечение заболевания желудка требует исключить из рациона жирные виды мяса, свежеиспечённый хлеб, виноград, свежее молоко и продукты, включающих массу клетчатки, к примеру, фрукты.
Чтобы увеличить собственный аппетит, больному полезно потреблять мясные и рыбные супы или бульоны. На завтрак лучше принимать пюре из тыквы или яблок. Через 120 мин допускается приём маленьких порций каши из крупы.
Диетологи советуют отказаться от перечисленных продуктов:
- Супы из гороха или фасоли;
- Мясо птицы;
- Солёные, маринованные или острые блюда;
- Чеснок, лук;
- Свежие фрукты, содержащие клетчатку, ягоды;
- Десерты и другие сладкие блюда;
- Кофе и алкоголь;
- Кислые продукты;
- Жареные блюда и копчёности;
- Крепкий чай;
- Сладкая газировка.
Иные продукты, не входящие в запретный список, допускаются к потреблению. Отметим продукты, которые пациент обязан включить в рацион, превозмогая собственную нелюбовь. Сюда относятся:
- Каши, сваренные на молоке. Допускается добавление нежирного масла.
- Отварное мясо или нежирная рыба.
- Отварные, тушёные овощи.
- Молочные продукты.
- Настой с прополисом.
Если строго придерживаться диеты, атрофированный гастрит излечивается быстрее.
Медикаментозное лечение атрофического гиперпластического гастрита
Чтобы вылечить подобную болезнь, придётся использовать обилие лекарственных препаратов. Как показывает статистика, врачи специалисты рекомендуют специальные препараты для лечения атрофического гиперпластического гастрита. К списку относятся средства: Нольпаза, Актовегин, Омепразол, Каринат, Де-нол и прочее.
Нольпаза или Де-нол обычно назначаются на начальной стадии заболевания. Если действие неэффективно, медики назначают к дополнительному применению Омепразол или Актовегин.
Когда хронический атрофический гастрит находится на последних стадиях лечения, назначаются специальные препараты, к примеру, Каринат. Но подобная тактика проведения лечения является лишь примерной методикой в силу того, что лекарственные средства подбираются индивидуально для больного. Перед принятием описанных препаратов настоятельно рекомендуется проконсультироваться с лечащим врачом.
Желательно выявить развитие болезни как можно раньше, даже если катар желудка находится на крайне запущенной стадии. Пациентам, столкнувшимся с патологией и победившим болезнь, допускается провести профилактику, чтобы предотвратить появление краткосрочного рецидива заболевания. В противном случае, увеличивается риск повторного появления болезни через несколько лет.
Чтобы правильно проводить профилактику, рекомендуется регулярно следить за состоянием желудочно-кишечного тракта, выявлять и лечить осложнения и прочие болезни. Важно отказаться от самолечения.
Доктора советуют пациентам соблюдать правила питания, подразумевающие потребление маленьких порций еды. Пациент должен употреблять овощи, отвары с прополисом, зелёный чай каждые трое суток. Настоятельно рекомендуется ограничиться в потреблении алкоголя, кофе, полностью отказаться от курения. Весьма полезными признаны физические упражнения, совершаемые в пределах 30 мин в сутки.
Атрофический гастрит: симптомы, причины и диагностика
Атрофический гастрит возникает, когда слизистая оболочка желудка человека воспаляется в течение длительного периода, часто в течение нескольких лет.
Со временем воспаление, связанное с атрофическим гастритом, повреждает слизистую оболочку желудка, вызывая проблемы с пищеварением и дефицит питательных веществ.
Бактериальная инфекция обычно вызывает атрофический гастрит, но также может быть аутоиммунным заболеванием. Лечение различается в зависимости от причины, но диета и образ жизни могут улучшить прогноз в обоих случаях.
В этой статье мы рассмотрим симптомы, причины и методы лечения атрофического гастрита.
Гастрит – это медицинский термин, обозначающий воспаление желудка. Атрофический гастрит – хроническая форма гастрита.
Врачи чаще всего находят воспаление на слизистой оболочке желудка человека. Это приводит к различным проблемам с пищеварением.
На ранних стадиях атрофический гастрит может не вызывать никаких симптомов, поэтому состояние может сохраняться годами, даже если человек не подозревает, что он у него есть.
Когда человек страдает аутоиммунным атрофическим гастритом, его организм по ошибке атакует здоровые клетки желудка, включая вещество, называемое внутренним фактором.
Внутренний фактор помогает организму усваивать витамин B-12. Когда человек не может усвоить достаточное количество B-12, у него может развиться злокачественная анемия.
Пагубная анемия – это осложнение, при котором у человека затрудняется образование красных кровяных телец.
Бактериальная инфекция, вызванная Helicobacter pylori или H.pylori , обычно вызывает атрофический гастрит. Примерно у половины людей с гастритом, связанным с H. pylori , разовьется атрофический гастрит.
В противном случае атрофический гастрит может быть наследственным или генетическим заболеванием, которое называется аутоиммунным атрофическим гастритом. Здесь иммунная система атакует здоровые клетки слизистой оболочки желудка.
A Инфекция H. pylori является причиной большинства случаев атрофического гастрита. Эта инфекция очень распространена и часто протекает бессимптомно или бессимптомно, особенно в начале.
Атрофический гастрит часто начинается в детстве. Если не лечить, со временем это ухудшится и может привести к язве желудка.
Человек может контактировать с бактерией H. pylori разными способами. К ним относятся:
- питьевая загрязненная вода
- употребление в пищу продуктов, приготовленных или выращенных в зараженной воде
- , имеющих прямой контакт со слюной, рвотой или фекалиями человека, у которого H. pylori
Очень часто человек может не знать, что у них атрофический гастрит, так как у них может не быть каких-либо заметных симптомов.По этой причине диагноз этого состояния может никогда не случиться у человека, который страдает им в течение многих лет.
Симптомы различаются в зависимости от того, вызывают ли бактерии или аутоиммунное заболевание атрофический гастрит.
Когда бактериальная инфекция является причиной атрофического гастрита, человек может заметить следующие симптомы:
- необычная или непреднамеренная потеря веса
- рвота
- отсутствие аппетита
- тошнота
- железодефицитная анемия
- боль в желудок
- язвы
Когда причиной является аутоиммунный атрофический гастрит, человек может заметить симптомы дефицита витамина B-12 и злокачественной анемии.Симптомы включают:
- боль в груди
- общая усталость
- шум в ушах или звон в ушах
- головокружение
- головокружение
- учащенное сердцебиение
Дефицит витамина B-12 в некоторых случаях может привести к поражению нервов. повреждать. В этом случае человек может заметить:
- спутанность сознания
- неустойчивость при ходьбе
- покалывание или онемение в руках или ногах
Во-первых, врач, скорее всего, проведет физический осмотр и проведет тесты для диагностики атрофического гастрита.
Медицинский осмотр обычно заключается в том, чтобы врач ощупал область желудка на предмет болезненности.
Часто врач также назначает анализы крови для поиска:
- пониженного уровня B-12
- низкого уровня пепсиногена, белка, который клетки желудка вырабатывают
- антитела, которые атакуют внутренний фактор или клетки желудка
- более высокий уровень гормона, вырабатывающего желудочную кислоту, называемого гастрином
Если врач подозревает, что у человека H.pylori , они могут заказать проверку дыхания. Этот тест заключается в проглатывании вещества, содержащего определенные молекулы углерода, и последующем вдыхании в пробирку.
Если у человека H. pylori , желудок человека выделяет углерод. Углерод будет присутствовать в дыхании человека, когда он выдыхает.
Врач также может взять биопсию клеток желудка. Чтобы сделать биопсию, врач вставит эндоскоп, который представляет собой длинную трубку с подсветкой, через рот в желудок.Затем они используют небольшой инструмент внутри эндоскопа, чтобы взять образец клеток желудка.
Биопсия поможет врачу диагностировать причину симптомов человека и подтвердить, есть ли у него атрофический гастрит.
Человек подвергается наибольшему риску развития атрофического гастрита при контакте с H. pylori . Это глобальное заболевание наиболее распространено в районах мира, которые отличаются крайней нищетой или перенаселенностью.
Аутоиммунный атрофический гастрит встречается гораздо реже.Это чаще встречается у людей афроамериканского, азиатского, латиноамериканского или североевропейского происхождения.
Люди с другими заболеваниями более подвержены риску аутоиммунного атрофического гастрита. К этим состояниям относятся:
Кроме того, люди с атрофическим гастритом имеют более высокий риск развития рака желудка.
Поделиться на PinterestУколы витамина B-12 могут помочь предотвратить осложнения атрофического гастрита.Врач лечит атрофический гастрит, уделяя особое внимание первопричине.Как только они устранят причину, симптомы исчезнут.
Врач обычно назначает антибиотики для лечения случаев, когда бактерии вызывают атрофический гастрит. В некоторых случаях они также могут прописать лекарства для уменьшения выработки желудочного сока во время заживления желудка.
При аутоиммунном атрофическом гастрите врач может назначить инъекции B-12. Эти инъекции предотвратят или устранят осложнения дефицита B-12.
Кроме того, лечение аутоиммунного атрофического гастрита, вероятно, будет сосредоточено на том, чтобы у человека не было дефицита железа.
Помимо лечения, люди могут принимать меры в домашних условиях для лечения симптомов атрофического гастрита.
Для людей с аутоиммунным атрофическим гастритом диета, богатая витамином B-12, может помочь предотвратить дальнейшие осложнения из-за его дефицита. Хорошие источники B-12:
- моллюски
- говядина
- яйца
- обогащенные злаки
- молоко
- йогурт
- жирная рыба
Для предотвращения контакта с H.pylori , человек должен проявлять особую осторожность в отношении гигиены при поездках в страны, где зараженная вода вызывает беспокойство.
Некоторые шаги, которые люди могут предпринять для предотвращения контакта с этими бактериями, включают:
- Практика безопасного обращения с пищевыми продуктами путем тщательного мытья всех фруктов и овощей
- отказ от продуктов, выращенных с использованием загрязненной воды
- питьевая вода в бутылках, когда другая вода может быть заражена
Вылечить атрофический гастрит, вызванный бактериями, относительно легко с помощью лекарств.Обычно люди могут ожидать полного выздоровления после того, как врач определит и устранит причину.
Оба типа атрофического гастрита могут повысить риск заболевания некоторыми видами рака. Однако раннее выявление и лечение могут улучшить общий прогноз и снизить риск осложнений.
Люди с аутоиммунным атрофическим гастритом имеют хороший прогноз при раннем выявлении и лечении. Им могут потребоваться инъекции B-12, чтобы предотвратить осложнения.
Медицинское обслуживание, профилактика, долгосрочный мониторинг
Crafa P, Russo M, Miraglia C, et al.От Сидни до Ольги: обзор атрофического гастрита. Акта Биомед . 2018 17 декабря. 89 (8-S): 93-9. [Медлайн].
Родригес-Кастро К.И., Франчески М., Миралья С. и др. Аутоиммунные заболевания при аутоиммунном атрофическом гастрите. Акта Биомед . 2018 17 декабря. 89 (8-S): 100-3. [Медлайн].
Янаока К., Ока М., Охата Н. и др. Ликвидация Helicobacter pylori предотвращает развитие рака у субъектов с легкой атрофией желудка, определяемой по уровням пепсиногена в сыворотке крови. Инт Дж. Рак . 2009 декабрь 1. 125 (11): 2697-703. [Медлайн].
Vannella L, Lahner E, Annibale B. Риск неоплазий желудка у пациентов с хроническим атрофическим гастритом: критическая переоценка. Мир Дж. Гастроэнтерол . 2012 28 марта. 18 (12): 1279-85. [Медлайн]. [Полный текст].
Weck MN, Gao L, Brenner H. Инфекция Helicobacter pylori и хронический атрофический гастрит: ассоциации в зависимости от тяжести заболевания. Эпидемиология .2009 июл.20 (4): 569-74. [Медлайн].
Тахара Т., Шибата Т., Ван Ф.Й. и др. Аллель маннан-связывающего лектина B связан с риском развития более тяжелой атрофии слизистой оболочки желудка у японских пациентов, инфицированных Helicobacter pylori. Eur J Гастроэнтерол Hepatol . 2009 21 июля (7): 781-6. [Медлайн].
Gao L, Weck MN, Nieters A, Brenner H. Обратная связь между провоспалительным генетическим профилем и серопозитивностью Helicobacter pylori среди пациентов с хроническим атрофическим гастритом: усиленное устранение инфекции во время прогрессирования заболевания ?.
Родригес-Кастро К.И., Франчески М., Ното А. и др. Клинические проявления хронического атрофического гастрита. Акта Биомед . 2018 17 декабря. 89 (8-S): 88-92. [Медлайн].
Gao L, Weck MN, Stegmaier C, Rothenbacher D, Brenner H. Употребление алкоголя и хронический атрофический гастрит: популяционное исследование среди 9 444 пожилых людей из Германии. Инт Дж. Рак .2 июня 2009 г. 125 (12): 2918-22. [Медлайн]. [Полный текст].
Палладино М., Кьюзоло П., Реддиконто Г. и др. Полиморфизм MTHFR связан с дефицитом витамина B12, связанным с атрофическим гастритом. Биохимия Генет . 2009 окт.47 (9-10): 645-50. [Медлайн].
Lahner E, Norman GL, Severi C, et al. Повторная оценка внутреннего фактора и аутоантител к париетальным клеткам при атрофическом гастрите в отношении дефицита кобаламина. Ам Дж. Гастроэнтерол .2009 август 104 (8): 2071-9. [Медлайн].
Stummvoll GH, DiPaolo RJ, Huter EN, et al. Аутоиммунный гастрит, индуцированный эффекторными Т-клетками Th2, Th3 и Th27, различается по патологической картине и чувствительности к подавлению регуляторными Т-клетками. Дж Иммунол . 2008 г. 1. 181 (3): 1908-16. [Медлайн]. [Полный текст].
Huter EN, Stummvoll GH, DiPaolo RJ, Glass DD, Shevach EM. Предварительно дифференцированные эффекторные Т-клетки Th2 и Th27 при аутоиммунном гастрите: Ag-специфические регуляторные Т-клетки являются более мощными супрессорами, чем поликлональные регуляторные Т-клетки. Инт Иммунофармакол . 2009 Май. 9 (5): 540-5. [Медлайн].
Яги К., Накамура А., Секин А., Грэм Д. Особенности атрофической слизистой оболочки в трех случаях аутоиммунного гастрита, выявленные при увеличительной эндоскопии. Отчет о болезни Med . 2012. 2012: 368160. [Медлайн]. [Полный текст].
Zhang Y, Weck MN, Schottker B, et al. Антитела к париетальным клеткам желудка, инфекция Helicobacter pylori и хронический атрофический гастрит: данные крупного популяционного исследования в Германии. Биомаркеры эпидемиологии рака Предыдущая . 2013 май. 22 (5): 821-6. [Медлайн].
Chen WC, Warner RRP, Harpaz N, Zhu H, Roayaie S, Kim MK. Нейроэндокринная опухоль желудка и гастринома двенадцатиперстной кишки с хроническим аутоиммунным атрофическим гастритом. Поджелудочная железа . 2019 января 48 (1): 131-4. [Медлайн].
Massironi S, Cavalcoli F, Rossi RE, et al. Хронический аутоиммунный атрофический гастрит, связанный с первичным гиперпаратиреозом: трансверсальное проспективное исследование. евро J Эндокринол . 2013 май. 168 (5): 755-61. [Медлайн].
[Рекомендации] Early DS, Lightdale JR, Vargo JJ 2nd, et al, для Комитета по стандартам практики ASGE. Рекомендации по седации и анестезии при эндоскопии ЖКТ. Гастроинтест Эндоск . 2018 Февраль 87 (2): 327-37. [Медлайн].
Зоалфагари А., Алетаха Н., Рушан Н., Таслими Р., Фороутан Х., Фаридния Б. Точность пепсиногенов для ранней диагностики атрофического гастрита и рака желудка у населения Ирана. Med J Islam Repub Iran . 2014. 28: 150. [Медлайн].
Zagari RM, Rabitti S, Greenwood DC, Eusebi LH, Vestito A, Bazzoli F. Систематический обзор с метаанализом: диагностическая эффективность комбинации сывороточных анализов пепсиногена, гастрина-17 и анти-Helicobacter pylori для диагностики атрофический гастрит. Алимент Фармакол Тер . 2017 Октябрь 46 (7): 657-67. [Медлайн].
Питтман ME, Voltaggio L, Bhaijee F, Robertson SA, Montgomery EA.Аутоиммунный метапластический атрофический гастрит: выявление предшественников поражений для соответствующей оценки пациента. Am J Surg Pathol . 2015 Декабрь 39 (12): 1611-20. [Медлайн].
Capella C, Fiocca R, Cornaggia M. Аутоиммунный гастрит. Грэм Д.Ю., Гента Р.М., Диксон М.Ф., ред. Гастрит . Филадельфия, Пенсильвания: Липпинкотт Уильямс; 1999. 79-96.
Корреа П. Канцерогенез желудка человека: многоэтапный и многофакторный процесс – Лекция первой премии Американского онкологического общества по эпидемиологии и профилактике рака. Рак Res . 1992 15 декабря. 52 (24): 6735-40. [Медлайн].
Диксон М.Ф., Джента Р.М., Ярдли Дж. Х. Классификация и градация гастрита. Обновленная Сиднейская система. Международный семинар по гистопатологии гастрита, Хьюстон, 1994. Am J Surg Pathol . 1996 20 октября (10): 1161-81. [Медлайн].
Депутат Доре, Леандро Дж., Реалди Дж., Сепульведа А. Р., Грэм Д. Я. Влияние устойчивости антибиотиков к метронидазолу и кларитромицину перед лечением на исход терапии Helicobacter pylori: метааналитический подход. Dig Dis Sci . 2000, январь, 45 (1): 68-76. [Медлайн].
Franceschi F, Genta RM, Sepulveda AR. Слизистая оболочка желудка: отдаленные результаты после излечения от инфекции Helicobacter pylori. Дж Гастроэнтерол . 2002. 37 Suppl 13: 17-23. [Медлайн].
Gao L, Weck MN, Raum E, et al. Размер родства, инфекция Helicobacter pylori и хронический атрофический гастрит: популяционное исследование среди 9444 пожилых людей из Германии. Int J Epidemiol .2010 Февраль 39 (1): 129-34. [Медлайн].
Graham DY. Терапия Helicobacter pylori: текущее состояние и проблемы. Гастроэнтерология . 2000, февраль 118 (2 приложение 1): S2-8. [Медлайн].
Graham DY, Belson G, Abudayyeh S, et al. Дважды в день (днем и вечером) четырехкратная терапия инфекции H. pylori в Соединенных Штатах. Обезвреживание печени . 2004 июн. 36 (6): 384-7. [Медлайн].
Hershko C, Hoffbrand AV, Keret D, et al.Роль аутоиммунного гастрита, Helicobacter pylori и целиакии в рефрактерной или необъяснимой железодефицитной анемии. Haematologica . 2005 г., май. 90 (5): 585-95. [Медлайн].
Иноуэ Т., Уэдо Н., Исихара Р. и др. Автофлуоресцентная визуализирующая видеоэндоскопия в диагностике хронического атрофического фундального гастрита. Дж Гастроэнтерол . 2010 Январь 45 (1): 45-51. [Медлайн].
Konturek PC, Konturek SJ, Brzozowski T. Инфекция Helicobacter pylori в канцерогенезе желудка. Дж Физиол Фармакол . 2009 Сентябрь 60 (3): 3-21. [Медлайн].
Красинскас AM, Abraham SC, Metz DC, et al. Псевдополипы Oxyntic слизистой оболочки: проявление атрофического аутоиммунного гастрита. Am J Surg Pathol . 2003 27 февраля (2): 236-41. [Медлайн].
Лайемо А.О., Камангар Ф., Маркус П.М. и др. Атрофический гастрит и риск возникновения колоректального рака. Контроль причин рака . 2010 21 января (1): 163-70. [Медлайн].
Леунг В.К., Ким Дж. Дж., Ким Дж. Дж. Микросателлитная нестабильность в кишечной метаплазии желудка у пациентов с раком желудка и без него. Ам Дж. Патол . 2000 Февраль 156 (2): 537-43. [Медлайн].
Malfertheiner P, Megraud F, O’Morain C, et al. Современные концепции управления инфекцией Helicobacter pylori – Консенсусный отчет Маастрихта 2-2000. Алимент Фармакол Тер . 2002 16 февраля (2): 167-80. [Медлайн].
Rugge M, Genta RM.Стадия и классификация хронического гастрита. Хум Патол . 2005 марта, 36 (3): 228-33. [Медлайн].
Shin CM, Kim N, Lee HS, et al. Валидация диагностических тестов на Helicobacter pylori в отношении степени атрофического гастрита и / или кишечной метаплазии. Хеликобактер . 2009 14 декабря (6): 512-9. [Медлайн].
Сиппонен П., Харконен М., Аланко А. и др. Диагностика атрофического гастрита по образцу сыворотки крови. Клиническая лаборатория .2002. 48 (9-10): 505-15. [Медлайн].
Vaananen H, Vauhkonen M, Helske T. и др. Неэндоскопическая диагностика атрофического гастрита с помощью анализа крови. Корреляция между гистологией желудка и уровнями гастрина-17 и пепсиногена I в сыворотке крови: многоцентровое исследование. Eur J Гастроэнтерол Hepatol . 2003 15 августа (8): 885-91. [Медлайн].
Whittingham S, Mackay IR. Аутоиммунный гастрит: исторические предшественники, выдающиеся открытия и нерешенные проблемы. Int Rev Immunol . 2005 янв-апр. 24 (1-2): 1-29. [Медлайн].
Парсонс Б.Н., Иджаз У.З., Д’Амор Р. и др. Сравнение микробиоты желудка человека в гипохлоргидных состояниях, возникающих в результате атрофического гастрита, вызванного Helicobacter pylori, аутоиммунного атрофического гастрита и применения ингибиторов протонной помпы. Патогенный микроорганизм . 2017 13 ноября (11): e1006653. [Медлайн].
Мосс SF. Клинические доказательства связи Helicobacter pylori с раком желудка. Клетка Мол Гастроэнтерол Гепатол . 2017 марта 3 (2): 183-91. [Медлайн].
Икеда Ф., Шиката К., Хата Дж. И др. Комбинация антител Helicobacter pylori и сывороточного пепсиногена как хороший инструмент прогнозирования заболеваемости раком желудка: 20-летние проспективные данные исследования Hisayama Study. J Эпидемиол . 2016 5 декабря. 26 (12): 629-36. [Медлайн].
Kono S, Gotoda T, Yoshida S, et al. Может ли эндоскопическая атрофия предсказать гистологическую атрофию? Историческое исследование в Великобритании и Японии. Мир Дж. Гастроэнтерол . 2015 14 декабря. 21 (46): 13113-23. [Медлайн].
Аутоиммунный атрофический гастрит: современные перспективы
Clin Exp Gastroenterol. 2017; 10: 19–27.
Артем Миналян
1 Отделение гастроэнтерологии, гепатологии и парентерального питания
Джихане Н. Бенхамму
1 Отделение гастроэнтерологии, гепатологии и парентерального питания 0003
904 904 Aida Парентеральное питаниеМайкл С. Льюис
2 Департамент патологии и лабораторной медицины, VA Greater Los Angeles Healthcare System, Лос-Анджелес, Калифорния, США
Джозеф Р. Писенья
1 Отделение гастроэнтерологии, гепатологии и парентерального питания
1 Отделение гастроэнтерологии, гепатологии и парентерального питания
2 Отделение патологии и лабораторной медицины, VA Greater Los Angeles Healthcare System, Лос-Анджелес, Калифорния, США
Для переписки: Joseph R Pisegna, Отдел гастроэнтерологии, гепатологии и парентеральные нутри ции, Департамент по делам ветеранов, VA Greater Los Angeles Healthcare System (691 / 111C), 11301 Wilshire Boulevard, Los Angeles, CA, USA, тел. +1 310 268 3578, факс +1 310 268 4096, электронная почта ude.alcu @ angesipj Авторские права © 2017 Minalyan et al. Эта работа опубликована и лицензирована Dove Medical Press Limited. Полные условия этой лицензии доступны по адресу https://www.dovepress.com/terms.php и включают лицензию Creative Commons Attribution – Non Commercial (unported, v3.0) License ( http://creativecommons.org/licenses/by-nc/3.0/). Получая доступ к работе, вы тем самым принимаете Условия. Некоммерческое использование работы разрешено без какого-либо дополнительного разрешения Dove Medical Press Limited при условии надлежащей атрибуции работы.Эта статья цитировалась в других статьях в PMC.Реферат
В настоящее время не существует общепринятой классификации гастрита. Первая успешная классификация (Сиднейская система), которая до сих пор широко используется профессионалами-медиками, была впервые представлена Мисевичем и др. В Сиднее в 1990 году. Фактически, это была первая подробная классификация после открытия Helicobacter pylori Уорреном и Маршаллом. в 1982 г. В 1994 г. обновленная Сиднейская система была предложена во время Международного семинара по гистопатологии гастрита, за которым последовала публикация в журнале The American Journal of Surgical Pathology Dixon et al.Используя новую классификацию, было пересмотрено различие между атрофическим и неатрофическим гастритом, и была включена визуальная шкала оценки. Согласно обновленной классификации Сиднейской системы атрофический гастрит подразделяется на многоочаговый ( H. pylori, , факторы окружающей среды, специфическая диета) и преобладающий трупный (аутоиммунный). Поскольку метаплазия является ключевой гистологической характеристикой пациентов с атрофическим гастритом, было рекомендовано использовать слово «метапластический» в обоих вариантах атрофического гастрита: аутоиммунном метапластическом атрофическом гастрите (AMAG) и метапластическом атрофическом гастрите, вызванном окружающей средой.Несмотря на то, что существует много совпадений в ходе заболевания, и различие между этими двумя объектами может быть сложной задачей, цель этой обзорной статьи состояла в описании этиологии, эпидемиологии, патогенеза, диагностики, клинических проявлений и лечения пациентов с AMAG. Однако важно отметить, что H. pylori является наиболее распространенным этиологическим фактором развития гастрита в мире.
Ключевые слова: аутоиммунный гастрит, пернициозная анемия, карциноид желудка
Эпидемиология
Распространенность злокачественной анемии (ПА; одно из отличительных проявлений аутоиммунного метапластического атрофического гастрита [AMAG]) составляет ~ 0.1% среди населения в целом и ~ 2% среди лиц старше 60 лет.1 В течение многих лет предполагалось, что ПА является заболеванием пожилых женщин североевропейской национальности. Впоследствии было показано, что распространенность ПА одинакова среди всех популяций (белых, афроамериканцев и небелых латиноамериканцев) .2 Основываясь на анализе данных 156 пациентов, страдающих ПА, в 1978 году Кармель и Джонсон3 пришли к выводу, У чернокожих женщин ПА развивается в более молодом возрасте, чем у женщин всех других рас (53 ± 16 лет, p <0.001). Подобно другим аутоиммунным заболеваниям, AMAG чаще встречается у женщин, чем у мужчин (соотношение 3: 1). Сильная связь между AMAG и другими аутоиммунными заболеваниями хорошо задокументирована.4 Считается, что AMAG и PA могут недооцениваться во всех частях мира. Одним из объяснений может быть тот факт, что почти все формы микро- и макроцитарной анемии лечатся железом, фолиевой кислотой и кобаламином без дальнейшего определения этиологии анемии. Более того, во многих случаях образцы биопсии слизистой оболочки желудка неадекватны или взяты не в том месте.5
Патогенез
Понимание патогенеза AMAG несколько затруднительно по нескольким причинам: 1) распространенность AMAG относительно низкая, 2) во многих случаях имеется сопутствующий гастрит, вызванный Helicobacter pylori и , и 3) нет или минимальные проявления присутствуют на ранних стадиях заболевания. Тем не менее мы знаем, что как генетические факторы, так и факторы окружающей среды играют роль в развитии аутоиммунного гастрита. Используя мышиные модели, можно было обнаружить гены предрасположенности к аутоиммунному гастриту ( Gasa1, 2, 3 и 4 ) на хромосомах 4 и 6 и в области h3.Интересно, что три из этих гена расположены в том же локусе, что и гены восприимчивости к сахарному диабету (СД) мышей, не страдающих ожирением, что может объяснить сильную связь между AMAG и СД 1 типа (СД1) .6,7
Несмотря на отсутствие ожирения Для понимания сложных этапов патогенеза AMAG гистологические изменения хорошо изучены (и). Первоначальные изменения включают инфильтрацию кислородной слизистой оболочки лимфоцитами и плазматическими клетками. Неравномерное разрушение париетальных клеток с сохранившимися островками относительно нормальной оксинтической слизистой оболочки приводит к появлению «островков в море».Это явление, также известное как псевдополипоз желудка, похоже на поражение толстой кишки у пациентов с язвенным колитом.8,9 Гипохлоргидрия, или снижение / потеря секреции соляной кислоты, затем развивается в результате комбинации двух факторов: 1) потеря кислородной слизистой оболочки и 2) нарушение созревания париетальных клеток.10 Отсутствие отрицательной обратной связи от париетальных клеток вызывает гиперплазию G-клеток и повышенную желудочную секрецию в истерике, что, в свою очередь, приводит к псевдогипертрофии париетальных клеток, напоминающей ингибитор протонной помпы. индуцированное воздействие на париетальные клетки.11 Стоит отметить, что это явление не может развиваться в атрофических железах, поскольку антитела против париетальных клеток также избирательно связываются с H + / K + АТФазой. 12 Еще одним важным эффектом повышенной желудочной секреции является его прямая стимуляция и пролиферация энтерохромаффиноподобных (ECL) клетки, которые зависят от степени тяжести и могут быть гиперпластическими, диспластическими и неопластическими.13 Развитие гиперплазии клеток ECL до неопластического подтипа может привести к образованию карциноидной опухоли, что будет описано ниже.В теле и дне желудка развиваются области метаплазии: псевдопилорическая, кишечная метаплазия (IM) и панкреатическая. Псевдопилорическая метаплазия («оксинтическая антрализация») развивается в оксинтических железах из секретирующих слизь клеток, фенотипически напоминающих клетки слизистой антрального отдела. Хотя гистологически псевдопилорическая метаплазия может быть неотличима от клеток антральной железы, иммуноокрашивание пепсиногеном (PG) может быть полезным для дифференциации: пепсиноген I (PGI) характерен для клеток оксинтной слизистой оболочки и отсутствует в антральном отделе.14 В последнее время широко используется новый термин для описания псевдопилорической метаплазии: метаплазия, экспрессирующая спазмолитический полипептид (SPEM). Этиология СПЭМ не ясна. Было предложено несколько теорий: 1) длительное воспаление кислородной слизистой оболочки, 2) острое прямое действие токсических веществ на париетальные клетки (DMP-777) 15,16 и 3) трансдифференцировка главных клеток.17 Главные клетки и SPEM экспрессируют MAL2. Этот белок участвует в транспортировке везикул и считается первым белком трафика, который активируется в SPEM.18 Было показано, что SPEM представляет собой пренеопластическое поражение желудка, 19 которое также может трансформироваться в IM. 20 IM представляет собой замену железистого, фовеолярного и поверхностного эпителия слизистой оболочки желудка эпителием кишечника. В зависимости от гистологических особенностей были описаны два подтипа: тонкий кишечник и толстый кишечник. Их, в свою очередь, можно сгруппировать в три типа: тип 1 или тонкий кишечник, с щеточной каймой, «полные», которые полностью замещены эпителием тонкого кишечника со всеми типами клеток (бокаловидные, панетические и т. Д.), Экспрессирующие сиаломуцины. .Тип 3, или тип толстой кишки, без щеточной каймы, «неполный», представляют собой метапластические клетки, которые образуются по соседству с нормальными клетками желудка, экспрессируют сульфомуцины. Тип 2, или тип толстой кишки, без щеточной каймы, «неполный», где метаплазия подобна типу 3, экспрессирует муцины как желудка, так и кишечника.21 Помимо вышеупомянутых патологических изменений, воспалительные и гиперпластические полипы развиваются на более поздних стадиях AMAG. 22 Oxyntic слизистая может полностью отсутствовать на запущенной стадии заболевания.
Биопсия желудка человека показывает атрофию желудочной железы.
Биопсия желудка человека показывает лимфоцитарный инфильтрат.
Связь с
H. pyloriХорошо известно, что H. pylori может вызывать атрофический гастрит сам по себе. С другой стороны, важно помнить, что во многих случаях пациенты с AMAG могут иметь сопутствующую инфекцию H. pylori .23 Третий возможный сценарий – прогрессирование гастрита, вызванного H. pylori , в AMAG.Считается, что этиологией этого процесса является антигенная мимикрия или перекрестная реактивность. 24 Многие пациенты с H. pylori вырабатывают широкий спектр антител, включая антифовеолярные, антиканаликулярные и классический APCA. Наиболее часто обнаруживаемыми антителами являются антиканаликулярные антитела, которые, как и APCA, направлены против H + / K + АТФазы (протонной помпы) .25 Несмотря на множество совпадений в ходе заболевания, важно дифференцировать AMAG от H. pylori – индуцированный гастрит.AMAG влияет только на тело и дно желудка, в то время как поражения, вызванные H. pylori , имеют мультифокальный характер () .26 Другими важными факторами, которые помогают дифференцировать AMAG и H. pylori-индуцированный гастрит , являются 1 ) Гиперплазия ECL (чаще встречается при AMAG), 2) псевдогипертрофия париетальных клеток (при AMAG; может быть замечена в инфекции H. pylori , вторичной по отношению к применению ингибитора протонной помпы) и 3) поражение оксинных желез (более часто при AMAG).
Таблица 1
Сравнение AMAG с H.pylori -индуцированный атрофический гастрит
| Характеристики | Тип атрофического гастрита | |||
|---|---|---|---|---|
| Аутоиммунный метапластический | H. pylori индуцированный | |||
| Характер распределения | Тело и глазное дно (антральное отверстие сохраняется) | Гиперфокальное | Распространенное | EC Редко |
| Псевдогипертрофия париетальных клеток | Часто | Обычно вторично по отношению к использованию ИПП | ||
| Поражение оксинтных желез | Часто | Редко | ||
| Воспалительные изменения в плазме крови похожие на поражения | ||||
| Глубина воспаления | Собственная пластинка обычно поражена | Поверхностные слои | ||
| Уровень гастрина-17 | Высокий | Низкий, но может быть повышен | ||
| Уровень пепсиногена | ||||
| Пепсиноген Нормальный 9 0589 | ||||
| Уровень пепсиногена II | Нормальный | Различный | ||
| Антитела | Против париетальных клеток и внутреннего фактора | Против H.pylori | ||
| Клинические проявления | Бессимптомное течение или диспепсия; симптомы ассоциированных аутоиммунных состояний | Бессимптомные или диспепсия | ||
| Риск новообразований желудка | Повышенный риск рака желудка и карциноидов | Кроме того, повышенный риск рака желудка и карциноидов | ||
Связь с другими аутоиммунными состояниями
Хорошо известно, что AMAG имеет тенденцию чаще встречаться у пациентов с другими аутоиммунными состояниями.29 До одной трети пациентов с аутоиммунным заболеванием щитовидной железы (AITD) и 6–10% пациентов с TIDM имеют сопутствующий AMAG.30,31 Известно, что пациенты с полигландулярными аутоиммунными (PGA) синдромами (особенно PGA типа 3B, который всегда включает AITD) имеют высокую распространенность PA.32 Другие аутоиммунные состояния, которые, как известно, встречаются вместе с AMAG (или его распространенная форма PA) – это витилиго, болезнь Аддисона, миастения и периоральные кожные аутоиммунные состояния (особенно, эрозивный красный плоский лишай) 33–35
Были описаны семейные случаи злокачественной анемии (FPA), в том числе у близнецов, что предполагает генетический компонент болезни.36 Однако необходимо провести дополнительные исследования, чтобы пролить больше света на то, как генетические вариации предрасполагают к развитию AMAG.37 В литературе также описаны очень редкие случаи сосуществования двух наследственных заболеваний (FPA и наследственный гемохроматоз) .38
Диагноз
В этом разделе мы обсуждаем наиболее распространенные диагностические тесты, используемые для скрининга и подтверждения диагноза AMAG: серологические тесты, эндоскопия и гистопатология.
Серологические тесты
Обнаружение специфических антител было признано эффективным методом для целей скрининга и подтверждения.Среди антител, используемых для диагностики AMAG, наиболее широко используется следующая группа: APCA, антитела против внутреннего фактора (AIFA) и антитела против H. pylori (анти-HP-IgM и анти-HP-IgG). Значение измерения анти-HP-антител связано с частым сосуществованием гастрита, вызванного H. pylori , и AMAG. Известно, что APCA имеют высокую чувствительность (~ 80%), но низкую специфичность для PA.39 Напротив, AIFA менее чувствительны (~ 50%), но более специфичны для PA.40 У пациентов с ПА и отрицательным результатом AIFA сероконверсия может произойти позже по ходу заболевания. 41 Измерение уровня гастрина (в основном гастрина-17) – еще один диагностический тест, который может быть отклонен от нормы у пациентов с AMAG из-за атрофии кислородных желез, ведущей к к повышенной продукции гастрина G-клетками антрального отдела. Комбинированный анализ APCA, AIFA и анти-HP-антител вместе с измерением сывороточного гастрина (гастрина-17) также известен как «серологическая биопсия желудка». Было признано, что он эффективен для диагностических целей и хорошо коррелирует с гистологическими данными.42
Наблюдаемую гипергастринемию клинически трудно отличить от других причин гипергастринемии. Один из методов определения причины гипергастринемии – измерение уровня продукции желудочного сока. При атрофическом гастрите уровень выделения желудочного сока низкий (<5 мЭкв / ч), тогда как при гипергастринемии, связанной с синдромом Золлингера-Эллисона, выделение желудочного сока составляет> 10 мЭкв / ч. Кроме того, секретиновый тест дает отрицательный результат у> 80% пациентов.43 Другой часто упускаемой из виду причиной гипергастринемии является обструкция выходного отверстия желудка и нарушение моторики желудка, для оценки которых может потребоваться эндоскопия верхних отделов желудка и радиологические исследования.При нарушении моторики желудка комплемент париетальных клеток будет либо нормальным, либо увеличенным.44 Измерение PGI и PGII, а также соотношения PGI / PGII также может быть использовано для подозрения на AMAG. В частности, PGI секретируется главными клетками оксинтической слизистой оболочки тела и дна желудка, в то время как PGII продуцируется главными клетками и клетками слизистой шеи всей слизистой оболочки желудка. Следовательно, оксинтическая атрофия характерна для AMAG, что приводит к снижению уровня PGI наряду с низким соотношением PGI / PGII (<3).45 Уровень PGII в основном не зависит от атрофии оксинитной слизистой оболочки.
Пациентам с лабораторным подтверждением макроцитарной анемии требуется измерение уровня витамина B12 в сыворотке крови. При высоком подозрении на PA за нормальным уровнем витамина B12 должны следовать измерения гомоцистеина (HCys) и метилмалоновой кислоты (MMA ).46 Однако также было показано, что уровни сыворотки всех трех тестов (витамин B12, HCys и MMA) может меняться с течением времени и даже быть нормальным при расстройствах, связанных с кобаламином.47
Измерение уровня хромогранина A (CgA) в плазме было предложено для диагностики AMAG, гиперплазии ECL и карциноидов желудка. Было обнаружено, что уровни CgA хорошо коррелируют со степенью гиперплазии ECL у пациентов с AMAG. В одном исследовании считается, что повышенный уровень CgA связан с развитием неалкогольной жировой болезни печени (НАЖБП), и в настоящее время проводится дополнительное исследование.48 В то же время специфичность уровня CgA слишком низкая (23%), чтобы выявить желудочный карциноиды в этой группе пациентов.49
В других состояниях CgA может приводить к ложноположительным результатам, в том числе при воспалительных заболеваниях кишечника, гепатоцеллюлярной карциноме50 или других состояниях, например, при хроническом применении ингибиторов протонной помпы или при почечной недостаточности.
Эндоскопия
В западных странах эндоскопические методы диагностики AMAG использовались в основном для целей биопсии. Ограничения, связанные с эндоскопией, следующие: 1) низкая чувствительность, 2) низкая специфичность и 3) вариабельность между наблюдателями.51 Однако с появлением новых эндоскопических методов (увеличивающая эндоскопия, узкополосная визуализация [NBI] и автофлуоресцентная визуализация [AFI]) стало возможным обнаруживать минимальные атрофические изменения слизистой оболочки желудка52. показали, что нормальные микрососуды тела желудка и слизистой оболочки глазного дна характеризуются наличием 1) субэпителиальной капиллярной сети (SECN), напоминающей соты, и 2) собирающих венул правильной формы и внешнего вида. У пациентов с атрофическим гастритом этих нормальных результатов не наблюдается.53 Стоит отметить, что ни один из результатов эндоскопии не должен использоваться отдельно для постановки диагноза атрофического гастрита. Фактически, их комбинация (например, сосудистый рисунок и отек area gastrica ) может значительно улучшить диагностическую точность.54 Как упоминалось ранее, у пациентов с высоким подозрением на атрофический гастрит для получения образцов биопсии использовалась эндоскопия. Согласно обновленным рекомендациям Сиднейской системы, необходимо получить пять образцов биопсии: два из тела, два из антрального отдела и один из инцизуры угловой.55
Гистопатология
Биопсия с последующей гистологией считается наиболее надежным методом диагностики метапластического атрофического гастрита. Видны изменения, описанные в разделе «Патогенез». В некоторых случаях при наличии сильного воспаления достоверно оценить кислородную атрофию сложно. Другое ограничение может возникнуть при интерпретации гистологических результатов пациентов с ранними стадиями AMAG. Было предложено несколько диагностических указаний, которые могут быть характерны для AMAG перед глубокой потерей оксинтной слизистой оболочки: 1) инфильтраты лимфоцитов и плазматических клеток в lamina propria, 2) очаговая атрофия кислородной слизистой оболочки вместе с SPEM или IM, 3) псевдогипертрофия париетальных клеток и 4) гиперплазия ECL (по крайней мере, линейный уровень).
Поскольку гиперплазия ECL является предшественником карциноидных опухолей желудка, важно окрашивать образцы тела и дна CgA и синаптофизином.56 Кроме того, окрашивание на гастрин (отрицательное в случае биопсии тела / дна) может помочь в локализации места поражения образец биопсии.57
Клинические проявления
Симптомы, связанные с атрофическим гастритом, развиваются медленно и, по сути, могут иметь длительный бессимптомный период. Во многих случаях сложно диагностировать AMAG или его запущенную форму PA только на основании клинических проявлений.Пораженные пациенты могут иметь различные признаки и симптомы, начиная от слабости и заканчивая тяжелыми неврологическими проявлениями, такими как паранойя (мегалобластное безумие) .58 Вот почему среди медицинских работников ПА также известен как «великий претендент». В этой статье мы хотели бы разделить клинические проявления на три основные группы: гематологические, неврологические и желудочно-кишечные.
Гематологические проявления
Железодефицитная анемия (ЖДА) – одно из самых ранних проявлений АМАГ, которое развивается из-за ахлоргидрии в результате кислородной атрофии.Несколько исследований показали, что рефрактерная или необъяснимая ЖДА должна усиливать подозрения клиницистов на АМАГ не только у взрослых, но и у детей. 59–61 ПА является наиболее частой причиной дефицита кобаламина.62 Хотя лежащие в основе механизмы того, как дефицит кобаламина вызывает мегалобластоз, до конца не выяснены, считается, что это связано с важной ролью кобаламина в синтезе ДНК.63 Бессимптомное увеличение среднего корпускулярного объема и гиперсегментированных нейтрофилов обычно являются первоначальными лабораторными данными при ПА.По мере прогрессирования заболевания пациенты могут жаловаться на слабость, головокружение и сердцебиение. На поздних стадиях могут проявляться симптомы стенокардии и застойной сердечной недостаточности (периферические отеки и одышка). 64 Другие очень важные лабораторные данные включают тромбоцитопению, повышение уровня ЛДГ и билирубина (признаки гемолиза). В редких случаях шистоциты в периферическом мазке могут имитировать другие более серьезные состояния, такие как диссеминированная внутрисосудистая коагулопатия (ДВС) или тромботическая тромбоцитопеническая пурпура / гемолитико-уремический синдром (ТТП / ГУС).65 Дефицит кобаламина был связан с повышенным риском тромбоза, вероятно, в результате гипергомоцистеинемии. Повышенный уровень HCys вызывает эндоваскулярную дисфункцию. Это, в свою очередь, активирует систему свертывания, увеличивает агрегацию тромбоцитов и сужает сосуды. Острый инфаркт миокарда и тромбоэмболия легочной артерии были описаны у молодых пациентов с тяжелой гипергомоцистеинемией, вторичной по отношению к РА. 66,67
Неврологические проявления
Неврологические проявления дефицита кобаламина долгое время были связаны с демиелинизацией с последующим повреждением аксонов и, в конечном итоге, гибелью нейронов.68 Патофизиологические изменения до конца не изучены, однако было установлено, что накопление ММА оказывает прямое влияние на образование миелина и связано с множеством неврологических проблем у пациентов с дефицитом кобаламина.69 Интересно, что неврологические симптомы, связанные с дефицитом кобаламина, могут присутствовать в отсутствие гематологических изменений.70,71 Подострая комбинированная дегенерация (ВСС) – одно из наиболее ярких неврологических проявлений ПА. Поражаются задние и боковые столбики шейного и верхнегрудного сегментов спинного мозга.Это приводит к сенсорным аномалиям (обычно начальным симптомам), таким как потеря вибрационных ощущений и ощущений положения вместе с дистальными парестезиями. На поздних стадиях также может быть поражен кортикоспинальный тракт.72 Хотя во многих ситуациях неврологическое повреждение является необратимым, крайне важно своевременно лечить этих пациентов парентеральным введением витамина B12, чтобы остановить прогрессирование и улучшить неврологический дефицит.73 Еще одной проблемой является периферическая нейропатия. общее неврологическое проявление ПА. Первоначальные симптомы включают парестезию и онемение нижних конечностей.В связи с этим может быть очень трудно клинически отличить периферическую невропатию от ВСС.74 В медицинской литературе описаны как бессимптомные, так и явные случаи оптической невропатии.75
Нейропсихиатрические состояния, связанные с ПА, включают манию, депрессию, обсессивно-компульсивное расстройство (ОКР), психоз и деменция.76 Следует отметить, что использование высоких доз витаминов B12, B6 и фолиевой кислоты замедляет сокращение всего мозга, а также снижает церебральную атрофию у пациентов с болезнью Альцгеймера. болезнь (AD).77
Желудочно-кишечные проявления
Как ни странно, АМАГ редко вызывает желудочно-кишечные симптомы. Было высказано предположение, что это связано с тем, что большинство жалоб со стороны верхних отделов желудочно-кишечного тракта являются вторичными по отношению к повышенному уровню соляной кислоты. Следовательно, AMAG, приводящий к гипо- или даже ахлоргидрии, обычно проявляется только неопределенными диспептическими симптомами, такими как вздутие живота, раннее насыщение и дискомфорт в эпигастрии.78 Атрофический глоссит, который обычно проявляется в виде жжения в языке, также известен как раннее клиническое проявление. дефицита кобаламина.79
Неопластические осложнения
Заболеваемость новообразованиями желудка выше у пациентов с AMAG по сравнению с населением в целом.80,81 В целом, AMAG был связан с развитием двух типов новообразований желудка: кишечного типа GC и желудочного типа I карциноид (TIGC) .82
Рак желудка кишечного типа
Два основных фактора, которые, как известно, объясняют возникновение GC у пациентов с AMAG, – это IM и сопутствующая инфекция H. pylori , которая сама по себе является наиболее частым триггером. ИМ слизистой оболочки желудка.83 Следует отметить, что эрадикация H. pylori у пациентов с известными предраковыми поражениями (атрофия желудка, IM или дисплазия желудка) не снижает значительно частоту возникновения GC.84 Патогенез развития GC описан авторами Correa и Piazuelo85, более известный как «Каскад Корреа». Упрощенную модель каскада можно разделить на следующие этапы: 1) нормальная слизистая оболочка желудка, 2) неатрофический гастрит, 3) множественный атрофический гастрит без (первоначально) и с (позже) IM, 4) дисплазия, прогрессирующая от низкой степени до высокой степени. и 5) GC.86 Следует отметить, что AMAG без сопутствующей инфекции H. pylori не считается частью вышеупомянутого каскада. Не у всех пациентов с гастритом, вызванным H. pylori , развивается GC. Шансы выше, когда присутствуют определенные факторы вирулентности. Например, было показано, что CagA-положительные штаммы H. pylori имеют значительно более высокий риск развития язвенной болезни и GC по сравнению с CagA-отрицательными штаммами.87 Еще один хорошо известный фактор вирулентности, связанный с GC, – это Ген VacA.Вариации в этом гене можно объяснить наличием сигнальной (s) и средней (m) областей.88 Несколько исследований продемонстрировали повышенную частоту язвенной болезни и GC у пациентов, инфицированных s1m1, по сравнению с пациентами, инфицированными s2m2.89
Карциноид желудка типа I
Хотя было признано, что AMAG связан с повышенным риском развития TIGC, точная частота неизвестна. Существует три известных типа карциноидов желудка: тип I связан с AMAG, тип II может присутствовать у пациентов с множественной эндокринной неоплазией (MEN) I и синдромом Золлингера-Эллисона, а тип III, наиболее агрессивный вариант, обычно возникает спорадически.Уровни гастрина в сыворотке различаются в зависимости от типа карциноида желудка: типы I и II – высокие, а тип III – нормальные () .90 Патологические изменения T1GC инициируются потерей отрицательной обратной связи париетальными клетками на секрецию гастрина. Гипо / ахлоргидрия впоследствии приводит к гипергастринемии, которая, в свою очередь, оказывает трофическое воздействие на клетки ECL. Гиперплазия ECL с последующей дисплазией ECL считается предраковым поражением и со временем может прогрессировать до T1GC.91 Выявление полипов тела во время эндоскопии у пациентов с AMAG тесно связано с наличием TIGC.Пациенты с ТИГК обычно протекают бессимптомно, хотя могут присутствовать симптомы диспепсии и ЖДА. Поэтому диагноз обычно ставится во время гастроскопии.92
Таблица 2
Сравнение различных типов карциноидов желудка
| Параметры | Карциноид желудка | ||||
|---|---|---|---|---|---|
| Тип I | Тип II | Тип III | |||
| Частота | 65–80% | 5–6% | 14–25% | ||
| Общие в род. женщины | Половых различий нет | Чаще встречается у мужчин | |||
| Возраст (лет) | 40–60 | 45 | 50 | ||
| Сопутствующие условия | AMAG | MEN1; ZES | Нет | ||
| Эндоскопические особенности | Множественные, маленькие | Подобно типу I | Одиночные, большие, изъязвленные | ||
| Пораженные участки | Тело и глазное дно | Любое место | Любое место | Любой тип | Любой тип |
| Гастрин (уровень) | Повышенный | Повышенный | N | ||
| Гиперплазия G-клеток | Да | Нет | Нет | ||
| Да | |||||
| Ведение | Наблюдение, аналоги соматостатина, эндоскопическое или хирургическое иссечение | Аналогично типу I | Хирургическое (радикальное) | ||
| Риск метастазов в регионарные лимфатические узлы и печень | Очень низкий | Очень низкий | Очень низкий | Высокий | |
| Прогноз | Отличный | Excelle nt | Переменная | ||
Лечение
Стратегии ведения AMAG и его расширенной формы PA зависят от клинических проявлений, лабораторных и визуальных результатов.Терапия с добавлением железа, фолиевой кислоты и кобаламина обычно рекомендуется на ранних стадиях до прогрессирования ПА. Применяется пероральная добавка витамина B12, поскольку было показано, что 1% свободного витамина B12 может абсорбироваться в тонком кишечнике посредством пассивной диффузии.93 Однако пациентам с неврологическими проявлениями в настоящее время рекомендуется парентеральное введение витамина B12.
Учитывая тот факт, что AMAG тесно связан с другими аутоиммунными заболеваниями, необходимо провести соответствующее диагностическое исследование, особенно для таких заболеваний, как аутоиммунный тиреоидит и TIDM.
Выявление и последующее лечение инфекции H. pylori – еще одна очень важная терапевтическая стратегия из-за связанных рисков, связанных с коинфекцией H. pylori . Поскольку в нескольких исследованиях было подтверждено, что инфекция H. pylori может вызывать аутоиммунные процессы в слизистой оболочке желудка, включая оксинитную слизистую оболочку, эрадикация H. pylori может снизить уровни антител, связанных с AMAG, и была доказана эффективность лечения ранние стадии аутоиммунного гастрита.94,95
T1GC имеет отличный прогноз, поэтому были предложены различные подходы: наблюдение, полипэктомия и антрэктомия (удаление части желудка, продуцирующей гастрин) .96 Недавно было предложено одно из потенциальных методов лечения TIGC. Было показано, что нетазепид, антагонист рецепторов гастрина, снижает уровень CgA в плазме, а также количество и размер опухоли.97–99. Другой вариант лечения – рассмотреть возможность использования аналогов соматостатина. В одном проспективном исследовании с участием 107 человек с хроническим атрофическим гастритом авторы показали, что использование аналогов соматостатина привело к снижению среднего уровня гастрина и CgA и, таким образом, должно рассматриваться как эффективная терапия.100 Новой и появляющейся формой терапии нейроэндокринных опухолей является использование лучевой терапии пептидными рецепторами (PRRT), хотя эти новые методы лечения до настоящего времени проспективно не изучались для лечения аутоиммунного атрофического гастрита.101
Благодарности
Эта работа получила грантовая поддержка от Департамента по делам ветеранов RR&D Merit Review (JRP) I01 RX000194; Исследования на людях CORE через CURE: Исследовательский центр болезней пищеварения при поддержке NIH, грант P30DK41301 и NIH NIDDK T32 NIH5T32DK07180 (JNB).
Сноски
Раскрытие информации
Авторы сообщают об отсутствии конфликта интересов в этой работе.
Ссылки
2. Парк JY, Лам-Химлин Д., Вемулапалли Р. Обзор аутоиммунного метапластического атрофического гастрита. Gastrointest Endosc. 2013. 77 (2): 284–292. [PubMed] [Google Scholar] 3. Кармель Р., Джонсон CS. Расовые модели злокачественной анемии. Ранний возраст начала заболевания и повышенная частота антител к внутреннему фактору у чернокожих женщин. N Engl J Med. 1978. 298 (12): 647–650.[PubMed] [Google Scholar] 4. Лам-Цзе В.К., Батстра М.Р., Келеман Б.П. и др. Связь между аутоиммунным тиреоидитом, аутоиммунным гастритом и диабетом 1 типа. Pediatr Endocrinol Rev.2003; 1 (1): 22–37. [PubMed] [Google Scholar] 5. Нойман У.Л., Косс Э., Рагге М, Гента РМ. Аутоиммунный атрофический гастрит – патогенез, патология и лечение. Нат Рев Гастроэнтерол Гепатол. 2013. 10 (9): 529–541. [PubMed] [Google Scholar] 6. Силвейра П.А., Уилсон В.Е., Эстебан Л.М. и др. Идентификация генов предрасположенности к аутоиммунному гастриту Gasa3 и Gasa4 с использованием конгенных мышей и разделенных, сегрегативных анализов и анализов взаимодействий.Иммуногенетика. 2001. 53 (9): 741–750. [PubMed] [Google Scholar] 7. Baxter AG, Jordan MA, Silveira PA, Wilson WE, Van Driel IR. Генетический контроль предрасположенности к аутоиммунному гастриту. Int Rev Immunol. 2005. 24 (1–2): 55–62. [PubMed] [Google Scholar] 8. Икеда Т., Сеноуэ И., Хара М., Цуцуми Ю., Харасава С., Мива Т. Псевдополипоз желудка: новое клиническое проявление гастрита типа А. Am J Gastroenterol. 1985. 80 (2): 82–90. [PubMed] [Google Scholar] 9. Красинскас AM, Abraham SC, Metz DC, Furth EE. Псевдополипы Oxyntic слизистой оболочки: проявление атрофического аутоиммунного гастрита.Am J Surg Pathol. 2003. 27 (2): 236–241. [PubMed] [Google Scholar] 10. Джадд Л.М., Глисон П.А., То Б.Х., ван Дриел И.Р. Аутоиммунный гастрит приводит к нарушению развития эпителиальных клеток желудка. Am J Physiol. 1999; 277 (1 п.1): G209 – G218. [PubMed] [Google Scholar] 11. Хлумска А., Будова Л., Бенеш З., Замечник М. Аутоиммунный гастрит. Клинико-патологическое исследование 25 случаев. Cesk Patol. 2005. 41 (4): 137–142. [PubMed] [Google Scholar] 12. Stolte M, Bethke B, Ruhl G, Ritter M. Омепразол-индуцированная псевдогипертрофия париетальных клеток желудка.З. Гастроэнтерол. 1992. 30 (2): 134–138. [PubMed] [Google Scholar] 13. Solcia E, Fiocca R, Villani L, Luinetti O, Capella C. Гиперпластические, диспластические и неопластические энтерохромаффиноподобные пролиферации слизистой оболочки желудка. Классификация и гистогенез. Am J Surg Pathol. 1995; 19 (Приложение 1): S1 – S7. [PubMed] [Google Scholar] 14. Li P, He C, Sun L, Dong N, Yuan Y. Выражения пепсиногена I и II in situ и их корреляции с уровнями пезигногена в сыворотке при раке желудка и его предраковом заболевании.BMC Clin Pathol. 2013; 13 (1): 1–10. [Бесплатная статья PMC] [PubMed] [Google Scholar] 15. Голденринг-младший, Рэй Г.С., Коффи Р.Дж., младший и др. Обратимая лекарственная оксинитическая атрофия у крыс. Гастроэнтерология. 2000. 118 (6): 1080–1093. [PubMed] [Google Scholar] 16. Номура С., Ямагути Х., Огава М., Ван Т.С., Ли-младший, Голденринг-младший. Изменения в клонах слизистой оболочки желудка, вызванные острой кислородной атрофией у мышей дикого типа и мышей с дефицитом гастрина. Am J Physiol Gastrointest Liver Physiol. 2005; 288 (2): G362 – G375. [PubMed] [Google Scholar] 17.Нодзаки К., Огава М., Уильямс Дж. А. и др. Молекулярный признак метаплазии желудка, возникающий в ответ на острую потерю париетальных клеток. Гастроэнтерология. 2008. 134 (2): 511–522. [Бесплатная статья PMC] [PubMed] [Google Scholar] 18. Вайс В.Г., Петерсен С.П., Миллс Дж.С., Тума П.Л., Уайтхед Р.Х., Голденринг-младший. Создание новых in vitro культур главных клеток мышей и SPEM позволяет идентифицировать MAL2 как маркер метаплазии в желудке. Am J Physiol Gastrointest Liver Physiol. 2014; 307 (8): G777 – G792. [Бесплатная статья PMC] [PubMed] [Google Scholar] 19.Halldorsdottir AM, Sigurdardottrir M, Jonasson JG, et al. Спазмолитическая метаплазия, экспрессирующая полипептид (SPEM), связанная с раком желудка в Исландии. Dig Dis Sci. 2003. 48 (3): 431–441. [PubMed] [Google Scholar] 20. Голденринг Дж. Р., Нам К. Т., Ван Т. К., Миллс Дж. К., Райт Н. А.. Метаплазия, экспрессирующая спазмолитический полипептид, и кишечная метаплазия: время для переоценки метаплазий и происхождения рака желудка. Гастроэнтерология. 2010. 138 (7): 2207–2210. 2210.e1. [Бесплатная статья PMC] [PubMed] [Google Scholar] 21.Корреа П., Пиазуэло МБ, Уилсон К.Т. Патология кишечной метаплазии желудка: клинические проявления. Am J Gastroenterol. 2010. 105 (3): 493–498. [Бесплатная статья PMC] [PubMed] [Google Scholar] 22. Абрахам С.К., Сингх В.К., Ярдли Дж. Х., Ву ТТ. Гиперпластические полипы желудка: ассоциации с гистологическими паттернами гастрита и атрофии желудка. Am J Surg Pathol. 2001. 25 (4): 500–507. [PubMed] [Google Scholar] 23. Вейола Л.И., Оксанен А.М., Сиппонен П.И., Раутелин ХИК. Ассоциация аутоиммунного атрофического гастрита тела с инфекцией Helicobacter pylori .Мир Дж. Гастроэнтерол. 2010. 16 (1): 83–88. [Бесплатная статья PMC] [PubMed] [Google Scholar] 24. Негрини Р., Савио А., Поэзи С. и др. Антигенная мимикрия между Helicobacter pylori и слизистой оболочкой желудка в патогенезе атрофического гастрита тела. Гастроэнтерология. 1996. 111 (3): 655–665. [PubMed] [Google Scholar] 25. Faller G, Steininger H, Eck M, Hensen J, Hann EG, Kirchner T. Антижелудочные аутоантитела при гастрите Helicobacter pylori : распространенность, сайты связывания in-situ и ключи к клинической значимости.Арка Вирхова. 1996. 427 (5): 483–486. [PubMed] [Google Scholar] 26. Genta RM. Helicobacter pylori , воспаление, повреждение слизистой оболочки и апоптоз: патогенез и определение атрофии желудка. Гастроэнтерология. 1997; 113 (6 доп.): S51 – S55. [PubMed] [Google Scholar] 27. Торбенсон М, Абрахам С.К., Бойтнотт Дж., Ярдли Дж. Х., Ву ТТ. Аутоиммунный гастрит: отчетливые гистологические и иммуногистохимические признаки до полной потери кислородных желез. Мод Pathol. 2002. 15 (2): 102–109. [PubMed] [Google Scholar] 28.Де Ре В., Орзес Э., Канцоньери В. и др. Пепсиногены для различения пациентов с кишечной метаплазией желудка и инфекцией Helicobacter pylori среди групп риска по развитию рака желудка. Клин Транс Гастроэнтерол. 2016; 7 (7): e183. [Бесплатная статья PMC] [PubMed] [Google Scholar] 29. Касторо С., Ле Моли Р., Арпи М.Л. и др. Ассоциация аутоиммунных заболеваний щитовидной железы, хронического атрофического гастрита и карциноида желудка: опыт одного учреждения. J Endocrinol Invest. 2016; 39 (7): 779–784.[PubMed] [Google Scholar] 30. Чентанни М., Мариньяни М., Гаргано Л. и др. Атрофический гастрит тела у пациентов с аутоиммунным заболеванием щитовидной железы: недостаточно диагностированная ассоциация. Arch Intern Med. 1999. 159 (15): 1726–1730. [PubMed] [Google Scholar] 31. Де Блок CE, Де Лиу И.Х., Ван Гал Л.Ф. Аутоиммунный гастрит при диабете 1 типа: клинически ориентированный обзор. J Clin Endocrinol Metab. 2008. 93 (2): 363–371. [PubMed] [Google Scholar] 32. Несс-Абрамоф Р., Набриски Д.А., Браверман Л.Е. и др. Распространенность и оценка дефицита B12 у пациентов с аутоиммунным заболеванием щитовидной железы.Am J Med Sci. 2006. 332 (3): 119–122. [PubMed] [Google Scholar] 33. Америо П., Траканна М., Де Ремигис П. и др. Витилиго, ассоциированное с другими аутоиммунными заболеваниями: полигландулярный аутоиммунный синдром типов 3B + C и 4. Clin Exp Dermatol. 2006. 31 (5): 746–749. [PubMed] [Google Scholar] 34. Зелиссен П.М., Баст Э.Дж., Кроуз Р.Дж. Ассоциированный аутоиммунитет при болезни Аддисона. J Autoimmun. 1995. 8 (1): 121–130. [PubMed] [Google Scholar] 35. Чанг К.Х., Лю Р.К., Ро Л.С., Ву Ю.Р., Чен СМ. Сосуществование злокачественной анемии и миастении – редкое сочетание аутоиммунных заболеваний на Тайване.J Formos Med Assoc. 2006; 105 (11): 946–949. [PubMed] [Google Scholar] 36. Delva PL, MacDonell JE, MacIntosh OC. Мегалобластная анемия, возникающая одновременно у белых монозиготных близнецов женского пола. Кан Мед Асс Дж. 1965; 92 (21): 1129–1131. [Бесплатная статья PMC] [PubMed] [Google Scholar] 37. Банк С., Райан К., Томсон В., Ньюман В. Г.. Пагубная анемия – генетические открытия. Autoimmun Rev.2011; 10 (8): 455–459. [PubMed] [Google Scholar] 38. Бонафу Б., Генри Л., Дельфур С. и др. Ассоциация семейной злокачественной анемии и наследственного гемохроматоза.Acta Haematol. 2008. 119 (1): 12–14. [PubMed] [Google Scholar] 39. Русак Э., Чобот А., Кшивицка А., Венцлау Дж. Антитела против париетальных клеток – диагностическое значение. Adv Med Sci. 2016; 61 (2): 175–179. [PubMed] [Google Scholar] 40. Хан С., Дель-Дука С., Фентон Э. и др. Ограниченная ценность тестирования на антитела к внутреннему фактору с отрицательными антителами к париетальным клеткам желудка при пернициозной анемии. J Clin Pathol. 2009. 62 (5): 439–441. [PubMed] [Google Scholar] 41. Оттесен М., Фельдт-Расмуссен Ю.Ф., Андерсен Дж., Хиппе Э., Шубое А.Злокачественная анемия. Изучение начальных форм заболевания и диагностическое значение определения антител к внутреннему фактору и антител к париетальным клеткам. Ugeskr Laeger. 1992. 154 (52): 3758–3762. [PubMed] [Google Scholar] 42. Antico A, Tampoia M, Villalta D, Tonutti E, Tozzoli R, Bizzaro N. Клиническая ценность серологической биопсии желудка для диагностики хронического аутоиммунного гастрита. Clin Dev Immunol. 2012; 2012: 520970. [Бесплатная статья PMC] [PubMed] [Google Scholar] 43. Шах П., Сингх М.Х., Ян Й.X., Мец, округ Колумбия.Гипохлоргидрия и ахлоргидрия связаны с ложноположительным тестом на стимуляцию секретина при синдроме Золлингера-Эллисона. Поджелудочная железа. 2013; 42 (6): 932. [Бесплатная статья PMC] [PubMed] [Google Scholar] 44. Фан Дж., Бенхамму Дж. Н., Писенья Дж. Р. Гиперсекреторные состояния желудка: исследование и лечение. Варианты лечения Curr Gastroenterol. 2015; 13 (4): 386–397. [Бесплатная статья PMC] [PubMed] [Google Scholar] 45. Кармель Р. Пепсиногены и другие сывороточные маркеры при злокачественной анемии. Am J Clin Pathol. 1988. 90 (4): 442–445.[PubMed] [Google Scholar] 46. Уэйнрайт П., Нараянан С., Кук П. Неверный уровень витамина B12 приводит к развитию у пациента злокачественной анемии. Clin Biochem. 2015. 48 (18): 1366–1367. [PubMed] [Google Scholar] 47. Соломон LR. Кобаламин-чувствительные расстройства в амбулаторных условиях: ненадежность тестов на кобаламин, метилмалоновую кислоту и гомоцистеин. Кровь. 2005. 105 (3): 978–985. [PubMed] [Google Scholar] 48. Wu PB, Deng YZ, Shu YX, Tan SY, Li M, Fang G. Повышенные уровни CgA в плазме, связанные с неалкогольной жировой болезнью печени.Turk J Gastroenterol. 2015; 26 (5): 404–407. [PubMed] [Google Scholar] 49. Peracchi M, Gebbia C, Basilisco G и др. Хромогранин А плазмы у пациентов с аутоиммунным хроническим атрофическим гастритом, энтерохромаффиноподобными клеточными поражениями и карциноидами желудка. Eur J Endocrinol. 2005. 152 (3): 443–448. [PubMed] [Google Scholar] 50. Массирони С., Фракелли М., Пагги С. и др. Уровни хромогранина А при хроническом заболевании печени и гепатоцеллюлярной карциноме. Dig Liver Dis. 2009. 41 (1): 31–35. [PubMed] [Google Scholar] 51.Парк YH, Ким Н. Обзор атрофического гастрита и кишечной метаплазии как предракового поражения рака желудка. J Cancer Prev. 2015; 20 (1): 25–40. [Бесплатная статья PMC] [PubMed] [Google Scholar] 53. Анагностопулос Г.К., Рагунатх К., Шонде А., Хоуки К.Дж., Яо К. Диагностика аутоиммунного гастрита с помощью эндоскопии с увеличением с высоким разрешением. Мир Дж. Гастроэнтерол. 2006. 12 (28): 4586–4587. [Бесплатная статья PMC] [PubMed] [Google Scholar] 54. Номура С., Ида К., Терао С. и др. Эндоскопическая диагностика атрофии слизистой оболочки желудка: многоцентровое проспективное исследование.Dig Endosc. 2014. 26 (6): 709–719. [PubMed] [Google Scholar] 55. Диксон М.Ф., Гента Р.М., Ярдли Дж. Х., Корреа П. Классификация и классификация гастрита. Обновленная Сиднейская система. Международный семинар по гистопатологии гастрита, Хьюстон, 1994. Am J Surg Pathol. 1996. 20 (10): 1161–1181. [PubMed] [Google Scholar] 57. Сепульведа А.Р., Патил М. Практический подход к патологической диагностике гастрита. Arch Pathol Lab Med. 2008. 132 (10): 1586–1593. [PubMed] [Google Scholar] 59. Хершко С., Хоффбранд А., Керет Д. и др.Роль аутоиммунного гастрита, Helicobacter pylori и целиакии в рефрактерной или необъяснимой железодефицитной анемии. Haematologica. 2005. 90 (5): 585–595. [PubMed] [Google Scholar] 60. Гонсалвеш С., Оливейра М.Э., Палья А.М., Ферран А., Мораиш А., Лопес А.И. Аутоиммунный гастрит в детском возрасте, проявляющийся железодефицитной анемией. Мир Дж. Гастроэнтерол. 2014. 20 (42): 15780–15786. [Бесплатная статья PMC] [PubMed] [Google Scholar] 61. Мигель Н, Коста Э, Сантала М, младший и др. Рефрактерная железодефицитная анемия и аутоиммунный атрофический гастрит в детской возрастной группе: анализ 8 клинических случаев.J Pediatr Hematol Oncol. 2014. 36 (2): 134–139. [PubMed] [Google Scholar] 62. Stabler SP. Клиническая практика. Дефицит витамина B12. N Engl J Med. 2013. 368 (2): 149–160. [PubMed] [Google Scholar] 63. Теффери А., Прутхи РК. Биохимические основы дефицита кобаламина. Mayo Clin Proceed. 1994. 69 (2): 181–186. [PubMed] [Google Scholar] 64. Asimacopoulos PJ, Groves MD, Fischer DK, et al. Пагубная анемия, проявляющаяся стенокардией. Саут Мед Дж. 1994; 87 (6): 671–672. [PubMed] [Google Scholar] 65. Тадакамалла А.К., Таллури СК, Бесур С.Псевдотромботическая тромбоцитопеническая пурпура: редкое проявление злокачественной анемии. N Am J Med Sci. 2011. 3 (10): 472–474. [Бесплатная статья PMC] [PubMed] [Google Scholar] 66. Мельхем А., Десаи А., Хофманн М.А. Острый инфаркт миокарда и тромбоэмболия легочной артерии у молодого человека с тяжелой гипергомоцистеинемией, вызванной злокачественной анемией. Тромб Дж. 2009; 7 (1): 1–5. [Бесплатная статья PMC] [PubMed] [Google Scholar] 67. Шамкани В.А., Джафар Н.С., Нараянан С.Р., Раджаппан АК. Острый инфаркт миокарда у молодой женщины из-за дефицита витамина B12, вызванный гипергомоцистеинемией.Сердечные взгляды. 2015; 16 (1): 25–29. [Бесплатная статья PMC] [PubMed] [Google Scholar] 68. Метц Дж. Дефицит кобаламина и патогенез заболеваний нервной системы. Annu Rev Nutr. 1992; 12: 59–79. [PubMed] [Google Scholar] 69. Фрэнсис Г., Хохол К., Джавад З., Айер А., Тот С. Накопление метилмалоновой кислоты и развитие периферической невропатии (IN1-1.010) Неврология. 2012; 78 (1 доп.): IN1 – IN1. [Google Scholar] 70. Ралапанава DM, Jayawickreme KP, Ekanayake EM, Jayalath WA. Дефицит B (12) с неврологическими проявлениями при отсутствии анемии.BMC Res Notes. 2015; 8: 458. [Бесплатная статья PMC] [PubMed] [Google Scholar] 71. Линденбаум Дж., Хилтон Э. Б., Сэвидж Д. Г. и др. Психоневрологические расстройства, вызванные дефицитом кобаламина при отсутствии анемии или макроцитоза. N Engl J Med. 1988. 318 (26): 1720–1728. [PubMed] [Google Scholar] 72. Hemmer B, Glocker FX, Schumacher M, Deuschl G, Lücking CH. Подострая комбинированная дегенерация: данные клинической, электрофизиологической и магнитно-резонансной томографии. J Neurol Neurosurg Psychiatry. 1998. 65 (6): 822–827.[Бесплатная статья PMC] [PubMed] [Google Scholar] 73. Васконселос О.М., Поем Э.Х., Маккартер Р.Дж., Кэмпбелл В.В., Кесадо ZMN. Возможные факторы исхода при подострой комбинированной дегенерации: обзор обсервационных исследований. J Gen Intern Med. 2006. 21 (10): 1063–1068. [Бесплатная статья PMC] [PubMed] [Google Scholar] 74. Саперштейн Д.С., Барон Р.Дж. Периферическая невропатия из-за дефицита кобаламина. Варианты лечения Curr Neurol. 2002. 4 (3): 197–201. [PubMed] [Google Scholar] 75. Chu C, Scanlon P. Оптическая нейропатия, вызванная дефицитом витамина B12, обнаруженная бессимптомным скринингом.BMJ Case Rep.2011; 2011 bcr0220113823. [Бесплатная статья PMC] [PubMed] [Google Scholar] 76. Metzler D, Miller WH, Stephen Edwards C. Психиатрическое проявление дефицита витамина B-12: обновленная информация. Джефферсон Дж. Психиатрия. 1991; 9 (2) [Google Scholar] 77. Douaud G, Refsum H, de Jager CA и др. Предотвращение атрофии серого вещества, связанной с болезнью Альцгеймера, с помощью лечения витамином B. Proc Natl Acad Sci U S. A. 2013; 110 (23): 9523–9528. [Бесплатная статья PMC] [PubMed] [Google Scholar] 78. Ланер Э., Аннибале Б. Пагубная анемия: новые открытия с гастроэнтерологической точки зрения.Мир Дж. Гастроэнтерол. 2009. 15 (41): 5121–5128. [Бесплатная статья PMC] [PubMed] [Google Scholar] 79. Чжу Дж.С., Ван Ю.Ф., Шэн Дж., Чен FX, Тан Г.Й. Атрофический глоссит связывают с дефицитом кобаламина. Shanghai J Stomatol. 2013. 22 (1): 58–62. [PubMed] [Google Scholar] 80. Ваннелла Л., Ланер Э, Осборн Дж, Аннибале Б. Систематический обзор: заболеваемость раком желудка при пернициозной анемии. Алимент Pharmacol Ther. 2013. 37 (4): 375–382. [PubMed] [Google Scholar] 81. Ваннелла Л., Сброцци-Ванни А., Ланер Э. и др. Развитие карциноида желудка I типа у больных хроническим атрофическим гастритом.Алимент Pharmacol Ther. 2011. 33 (12): 1361–1369. [PubMed] [Google Scholar] 82. Ланер Э., Эспозито Дж., Галли Дж., Аннибале Б. Атрофический гастрит и предраковые поражения желудка. Перевод Gastrointest Cancer. 2015; 4 (4): 272–281. [Google Scholar] 83. Шнеллер Дж., Гупта Р., Мустафа Дж., Вильянуэва Р., Штраус Е. В., Раффаниелло Р. Д.. Инфекция Helicobacter pylori связана с высокой частотой кишечной метаплазии слизистой оболочки желудка у пациентов в городских больницах Нью-Йорка. Dig Dis Sci.2006. 51 (10): 1801–1809. [PubMed] [Google Scholar] 84. Вонг BC, Лам С.К., Вонг В.М. и др. Китайская группа по изучению рака желудка Эрадикация Helicobacter pylori для предотвращения рака желудка в регионе высокого риска в Китае: рандомизированное контролируемое исследование. ДЖАМА. 2004. 291 (2): 187–194. [PubMed] [Google Scholar] 86. Юн X, Тан Б., Ли Б-С и др. Helicobacter pylori Фактор вирулентности CagA способствует онкогенезу рака желудка посредством множественных сигнальных путей. Сигнал сотовой связи. 2015; 13 (1): 1–13.[Бесплатная статья PMC] [PubMed] [Google Scholar] 88. ван Дорн Л.Дж., Фигейредо С., Санна Р. и др. Клиническая значимость cagA, vacA и iceA статуса Helicobacter pylori . Гастроэнтерология. 1998. 115 (1): 58–66. [PubMed] [Google Scholar] 89. Вроблевски Л. Е., Пик Р. М., Уилсон К. Т.. Helicobacter pylori и рак желудка: факторы, влияющие на риск заболевания. Clin Microbiol Rev.2010; 23 (4): 713–739. [Бесплатная статья PMC] [PubMed] [Google Scholar] 90. Чжоу К., Хо В. Карциноиды желудка: классификация и диагностика.В: Pisegna RJ, редактор. Лечение нейроэндокринных опухолей поджелудочной железы. Нью-Йорк, Нью-Йорк: Springer Нью-Йорк; 2015. С. 83–93. [Google Scholar] 91. Burkitt MD, Pritchard DM. Обзорная статья: патогенез и лечение карциноидных опухолей желудка. Алимент Pharmacol Ther. 2006. 24 (9): 1305–1320. [PubMed] [Google Scholar] 92. Ли Ти, Цю Ф, Цянь З.Р., Ван Дж., Ци Х-К, Ву Би. Классификация, клинико-патологические особенности и лечение нейроэндокринных опухолей желудка. Мир Дж. Гастроэнтерол. 2014. 20 (1): 118–125. [Бесплатная статья PMC] [PubMed] [Google Scholar] 93.Андрес Э., Фотергилл Х., Месили М. Эффективность пероральной терапии кобаламином (витамин B12). Эксперт Opin Pharmacother. 2010. 11 (2): 249–256. [PubMed] [Google Scholar] 94. Столте М., Мейер Э, Майнинг А. Лечение аутоиммунного гастрита с помощью эрадикации Helicobacter pylori у 21-летнего мужчины. З. Гастроэнтерол. 1998. 36 (8): 641–643. [PubMed] [Google Scholar] 95. Фаллер Г., Винтер М., Штайнингер Х. и др. Снижение аутоантител желудка при гастрите Helicobacter pylori после излечения инфекции.Pathol Res Pract. 1999. 195 (4): 243–246. [PubMed] [Google Scholar] 97. Докрей GJ. Клиническая эндокринология и метаболизм. Гастрин. Лучшая практика Res Clin Endocrinol Metab. 2004. 18 (4): 555–568. [PubMed] [Google Scholar] 98. Мур А.Р., Бойс М., Стил И.А., Кэмпбелл Ф., Варро А., Причард Д.М. Нетазепид, антагонист рецепторов гастрина, нормализует биомаркеры опухолей и вызывает регрессию нейроэндокринных опухолей желудка 1 типа в нерандомизированном исследовании пациентов с хроническим атрофическим гастритом. PLoS One. 2013; 8 (10): e76462.[Бесплатная статья PMC] [PubMed] [Google Scholar] 99. Фоссмарк Р., Сордал О., Цзянь С.С. и др. Лечение карциноидов желудка 1 типа антагонистом гастриновых рецепторов нетазепидом (YF476) приводит к регрессии опухолей и нормализации сывороточного хромогранина A. Aliment Pharmacol Ther. 2012. 36 (11–12): 1067–1075. [PubMed] [Google Scholar] 100. Massironi S, Zilli A, Fanetti I, Ciafardini C, Conte D, Peracchi M. Прерывистое лечение рецидивирующих карциноидов желудка 1 типа аналогами соматостатина у пациентов с хроническим аутоиммунным атрофическим гастритом.Dig Liver Dis. 2015; 47 (11): 978–983. [PubMed] [Google Scholar] 101. Kwekkeboom DJ, Креннинг EP. Радионуклидная терапия пептидных рецепторов в лечении нейроэндокринных опухолей. Hematol Oncol Clin North Am. 2016; 30 (1): 179–191. [PubMed] [Google Scholar]Аутоиммунный атрофический гастрит: современные перспективы
Clin Exp Gastroenterol. 2017; 10: 19–27.
Артем Миналян
1 Отделение гастроэнтерологии, гепатологии и парентерального питания
Джихане Н. Бенхамму
1 Отделение гастроэнтерологии, гепатологии и парентерального питания 0003
904 904 Aida Парентеральное питаниеМайкл С. Льюис
2 Департамент патологии и лабораторной медицины, VA Greater Los Angeles Healthcare System, Лос-Анджелес, Калифорния, США
Джозеф Р. Писенья
1 Отделение гастроэнтерологии, гепатологии и парентерального питания
1 Отделение гастроэнтерологии, гепатологии и парентерального питания
2 Отделение патологии и лабораторной медицины, VA Greater Los Angeles Healthcare System, Лос-Анджелес, Калифорния, США
Для переписки: Joseph R Pisegna, Отдел гастроэнтерологии, гепатологии и парентеральные нутри ции, Департамент по делам ветеранов, VA Greater Los Angeles Healthcare System (691 / 111C), 11301 Wilshire Boulevard, Los Angeles, CA, USA, тел. +1 310 268 3578, факс +1 310 268 4096, электронная почта ude.alcu @ angesipj Авторские права © 2017 Minalyan et al. Эта работа опубликована и лицензирована Dove Medical Press Limited. Полные условия этой лицензии доступны по адресу https://www.dovepress.com/terms.php и включают лицензию Creative Commons Attribution – Non Commercial (unported, v3.0) License ( http://creativecommons.org/licenses/by-nc/3.0/). Получая доступ к работе, вы тем самым принимаете Условия. Некоммерческое использование работы разрешено без какого-либо дополнительного разрешения Dove Medical Press Limited при условии надлежащей атрибуции работы.Эта статья цитировалась в других статьях в PMC.Реферат
В настоящее время не существует общепринятой классификации гастрита. Первая успешная классификация (Сиднейская система), которая до сих пор широко используется профессионалами-медиками, была впервые представлена Мисевичем и др. В Сиднее в 1990 году. Фактически, это была первая подробная классификация после открытия Helicobacter pylori Уорреном и Маршаллом. в 1982 г. В 1994 г. обновленная Сиднейская система была предложена во время Международного семинара по гистопатологии гастрита, за которым последовала публикация в журнале The American Journal of Surgical Pathology Dixon et al.Используя новую классификацию, было пересмотрено различие между атрофическим и неатрофическим гастритом, и была включена визуальная шкала оценки. Согласно обновленной классификации Сиднейской системы атрофический гастрит подразделяется на многоочаговый ( H. pylori, , факторы окружающей среды, специфическая диета) и преобладающий трупный (аутоиммунный). Поскольку метаплазия является ключевой гистологической характеристикой пациентов с атрофическим гастритом, было рекомендовано использовать слово «метапластический» в обоих вариантах атрофического гастрита: аутоиммунном метапластическом атрофическом гастрите (AMAG) и метапластическом атрофическом гастрите, вызванном окружающей средой.Несмотря на то, что существует много совпадений в ходе заболевания, и различие между этими двумя объектами может быть сложной задачей, цель этой обзорной статьи состояла в описании этиологии, эпидемиологии, патогенеза, диагностики, клинических проявлений и лечения пациентов с AMAG. Однако важно отметить, что H. pylori является наиболее распространенным этиологическим фактором развития гастрита в мире.
Ключевые слова: аутоиммунный гастрит, пернициозная анемия, карциноид желудка
Эпидемиология
Распространенность злокачественной анемии (ПА; одно из отличительных проявлений аутоиммунного метапластического атрофического гастрита [AMAG]) составляет ~ 0.1% среди населения в целом и ~ 2% среди лиц старше 60 лет.1 В течение многих лет предполагалось, что ПА является заболеванием пожилых женщин североевропейской национальности. Впоследствии было показано, что распространенность ПА одинакова среди всех популяций (белых, афроамериканцев и небелых латиноамериканцев) .2 Основываясь на анализе данных 156 пациентов, страдающих ПА, в 1978 году Кармель и Джонсон3 пришли к выводу, У чернокожих женщин ПА развивается в более молодом возрасте, чем у женщин всех других рас (53 ± 16 лет, p <0.001). Подобно другим аутоиммунным заболеваниям, AMAG чаще встречается у женщин, чем у мужчин (соотношение 3: 1). Сильная связь между AMAG и другими аутоиммунными заболеваниями хорошо задокументирована.4 Считается, что AMAG и PA могут недооцениваться во всех частях мира. Одним из объяснений может быть тот факт, что почти все формы микро- и макроцитарной анемии лечатся железом, фолиевой кислотой и кобаламином без дальнейшего определения этиологии анемии. Более того, во многих случаях образцы биопсии слизистой оболочки желудка неадекватны или взяты не в том месте.5
Патогенез
Понимание патогенеза AMAG несколько затруднительно по нескольким причинам: 1) распространенность AMAG относительно низкая, 2) во многих случаях имеется сопутствующий гастрит, вызванный Helicobacter pylori и , и 3) нет или минимальные проявления присутствуют на ранних стадиях заболевания. Тем не менее мы знаем, что как генетические факторы, так и факторы окружающей среды играют роль в развитии аутоиммунного гастрита. Используя мышиные модели, можно было обнаружить гены предрасположенности к аутоиммунному гастриту ( Gasa1, 2, 3 и 4 ) на хромосомах 4 и 6 и в области h3.Интересно, что три из этих гена расположены в том же локусе, что и гены восприимчивости к сахарному диабету (СД) мышей, не страдающих ожирением, что может объяснить сильную связь между AMAG и СД 1 типа (СД1) .6,7
Несмотря на отсутствие ожирения Для понимания сложных этапов патогенеза AMAG гистологические изменения хорошо изучены (и). Первоначальные изменения включают инфильтрацию кислородной слизистой оболочки лимфоцитами и плазматическими клетками. Неравномерное разрушение париетальных клеток с сохранившимися островками относительно нормальной оксинтической слизистой оболочки приводит к появлению «островков в море».Это явление, также известное как псевдополипоз желудка, похоже на поражение толстой кишки у пациентов с язвенным колитом.8,9 Гипохлоргидрия, или снижение / потеря секреции соляной кислоты, затем развивается в результате комбинации двух факторов: 1) потеря кислородной слизистой оболочки и 2) нарушение созревания париетальных клеток.10 Отсутствие отрицательной обратной связи от париетальных клеток вызывает гиперплазию G-клеток и повышенную желудочную секрецию в истерике, что, в свою очередь, приводит к псевдогипертрофии париетальных клеток, напоминающей ингибитор протонной помпы. индуцированное воздействие на париетальные клетки.11 Стоит отметить, что это явление не может развиваться в атрофических железах, поскольку антитела против париетальных клеток также избирательно связываются с H + / K + АТФазой. 12 Еще одним важным эффектом повышенной желудочной секреции является его прямая стимуляция и пролиферация энтерохромаффиноподобных (ECL) клетки, которые зависят от степени тяжести и могут быть гиперпластическими, диспластическими и неопластическими.13 Развитие гиперплазии клеток ECL до неопластического подтипа может привести к образованию карциноидной опухоли, что будет описано ниже.В теле и дне желудка развиваются области метаплазии: псевдопилорическая, кишечная метаплазия (IM) и панкреатическая. Псевдопилорическая метаплазия («оксинтическая антрализация») развивается в оксинтических железах из секретирующих слизь клеток, фенотипически напоминающих клетки слизистой антрального отдела. Хотя гистологически псевдопилорическая метаплазия может быть неотличима от клеток антральной железы, иммуноокрашивание пепсиногеном (PG) может быть полезным для дифференциации: пепсиноген I (PGI) характерен для клеток оксинтной слизистой оболочки и отсутствует в антральном отделе.14 В последнее время широко используется новый термин для описания псевдопилорической метаплазии: метаплазия, экспрессирующая спазмолитический полипептид (SPEM). Этиология СПЭМ не ясна. Было предложено несколько теорий: 1) длительное воспаление кислородной слизистой оболочки, 2) острое прямое действие токсических веществ на париетальные клетки (DMP-777) 15,16 и 3) трансдифференцировка главных клеток.17 Главные клетки и SPEM экспрессируют MAL2. Этот белок участвует в транспортировке везикул и считается первым белком трафика, который активируется в SPEM.18 Было показано, что SPEM представляет собой пренеопластическое поражение желудка, 19 которое также может трансформироваться в IM. 20 IM представляет собой замену железистого, фовеолярного и поверхностного эпителия слизистой оболочки желудка эпителием кишечника. В зависимости от гистологических особенностей были описаны два подтипа: тонкий кишечник и толстый кишечник. Их, в свою очередь, можно сгруппировать в три типа: тип 1 или тонкий кишечник, с щеточной каймой, «полные», которые полностью замещены эпителием тонкого кишечника со всеми типами клеток (бокаловидные, панетические и т. Д.), Экспрессирующие сиаломуцины. .Тип 3, или тип толстой кишки, без щеточной каймы, «неполный», представляют собой метапластические клетки, которые образуются по соседству с нормальными клетками желудка, экспрессируют сульфомуцины. Тип 2, или тип толстой кишки, без щеточной каймы, «неполный», где метаплазия подобна типу 3, экспрессирует муцины как желудка, так и кишечника.21 Помимо вышеупомянутых патологических изменений, воспалительные и гиперпластические полипы развиваются на более поздних стадиях AMAG. 22 Oxyntic слизистая может полностью отсутствовать на запущенной стадии заболевания.
Биопсия желудка человека показывает атрофию желудочной железы.
Биопсия желудка человека показывает лимфоцитарный инфильтрат.
Связь с
H. pyloriХорошо известно, что H. pylori может вызывать атрофический гастрит сам по себе. С другой стороны, важно помнить, что во многих случаях пациенты с AMAG могут иметь сопутствующую инфекцию H. pylori .23 Третий возможный сценарий – прогрессирование гастрита, вызванного H. pylori , в AMAG.Считается, что этиологией этого процесса является антигенная мимикрия или перекрестная реактивность. 24 Многие пациенты с H. pylori вырабатывают широкий спектр антител, включая антифовеолярные, антиканаликулярные и классический APCA. Наиболее часто обнаруживаемыми антителами являются антиканаликулярные антитела, которые, как и APCA, направлены против H + / K + АТФазы (протонной помпы) .25 Несмотря на множество совпадений в ходе заболевания, важно дифференцировать AMAG от H. pylori – индуцированный гастрит.AMAG влияет только на тело и дно желудка, в то время как поражения, вызванные H. pylori , имеют мультифокальный характер () .26 Другими важными факторами, которые помогают дифференцировать AMAG и H. pylori-индуцированный гастрит , являются 1 ) Гиперплазия ECL (чаще встречается при AMAG), 2) псевдогипертрофия париетальных клеток (при AMAG; может быть замечена в инфекции H. pylori , вторичной по отношению к применению ингибитора протонной помпы) и 3) поражение оксинных желез (более часто при AMAG).
Таблица 1
Сравнение AMAG с H.pylori -индуцированный атрофический гастрит
| Характеристики | Тип атрофического гастрита | |||
|---|---|---|---|---|
| Аутоиммунный метапластический | H. pylori индуцированный | |||
| Характер распределения | Тело и глазное дно (антральное отверстие сохраняется) | Гиперфокальное | Распространенное | EC Редко |
| Псевдогипертрофия париетальных клеток | Часто | Обычно вторично по отношению к использованию ИПП | ||
| Поражение оксинтных желез | Часто | Редко | ||
| Воспалительные изменения в плазме крови похожие на поражения | ||||
| Глубина воспаления | Собственная пластинка обычно поражена | Поверхностные слои | ||
| Уровень гастрина-17 | Высокий | Низкий, но может быть повышен | ||
| Уровень пепсиногена | ||||
| Пепсиноген Нормальный 9 0589 | ||||
| Уровень пепсиногена II | Нормальный | Различный | ||
| Антитела | Против париетальных клеток и внутреннего фактора | Против H.pylori | ||
| Клинические проявления | Бессимптомное течение или диспепсия; симптомы ассоциированных аутоиммунных состояний | Бессимптомные или диспепсия | ||
| Риск новообразований желудка | Повышенный риск рака желудка и карциноидов | Кроме того, повышенный риск рака желудка и карциноидов | ||
Связь с другими аутоиммунными состояниями
Хорошо известно, что AMAG имеет тенденцию чаще встречаться у пациентов с другими аутоиммунными состояниями.29 До одной трети пациентов с аутоиммунным заболеванием щитовидной железы (AITD) и 6–10% пациентов с TIDM имеют сопутствующий AMAG.30,31 Известно, что пациенты с полигландулярными аутоиммунными (PGA) синдромами (особенно PGA типа 3B, который всегда включает AITD) имеют высокую распространенность PA.32 Другие аутоиммунные состояния, которые, как известно, встречаются вместе с AMAG (или его распространенная форма PA) – это витилиго, болезнь Аддисона, миастения и периоральные кожные аутоиммунные состояния (особенно, эрозивный красный плоский лишай) 33–35
Были описаны семейные случаи злокачественной анемии (FPA), в том числе у близнецов, что предполагает генетический компонент болезни.36 Однако необходимо провести дополнительные исследования, чтобы пролить больше света на то, как генетические вариации предрасполагают к развитию AMAG.37 В литературе также описаны очень редкие случаи сосуществования двух наследственных заболеваний (FPA и наследственный гемохроматоз) .38
Диагноз
В этом разделе мы обсуждаем наиболее распространенные диагностические тесты, используемые для скрининга и подтверждения диагноза AMAG: серологические тесты, эндоскопия и гистопатология.
Серологические тесты
Обнаружение специфических антител было признано эффективным методом для целей скрининга и подтверждения.Среди антител, используемых для диагностики AMAG, наиболее широко используется следующая группа: APCA, антитела против внутреннего фактора (AIFA) и антитела против H. pylori (анти-HP-IgM и анти-HP-IgG). Значение измерения анти-HP-антител связано с частым сосуществованием гастрита, вызванного H. pylori , и AMAG. Известно, что APCA имеют высокую чувствительность (~ 80%), но низкую специфичность для PA.39 Напротив, AIFA менее чувствительны (~ 50%), но более специфичны для PA.40 У пациентов с ПА и отрицательным результатом AIFA сероконверсия может произойти позже по ходу заболевания. 41 Измерение уровня гастрина (в основном гастрина-17) – еще один диагностический тест, который может быть отклонен от нормы у пациентов с AMAG из-за атрофии кислородных желез, ведущей к к повышенной продукции гастрина G-клетками антрального отдела. Комбинированный анализ APCA, AIFA и анти-HP-антител вместе с измерением сывороточного гастрина (гастрина-17) также известен как «серологическая биопсия желудка». Было признано, что он эффективен для диагностических целей и хорошо коррелирует с гистологическими данными.42
Наблюдаемую гипергастринемию клинически трудно отличить от других причин гипергастринемии. Один из методов определения причины гипергастринемии – измерение уровня продукции желудочного сока. При атрофическом гастрите уровень выделения желудочного сока низкий (<5 мЭкв / ч), тогда как при гипергастринемии, связанной с синдромом Золлингера-Эллисона, выделение желудочного сока составляет> 10 мЭкв / ч. Кроме того, секретиновый тест дает отрицательный результат у> 80% пациентов.43 Другой часто упускаемой из виду причиной гипергастринемии является обструкция выходного отверстия желудка и нарушение моторики желудка, для оценки которых может потребоваться эндоскопия верхних отделов желудка и радиологические исследования.При нарушении моторики желудка комплемент париетальных клеток будет либо нормальным, либо увеличенным.44 Измерение PGI и PGII, а также соотношения PGI / PGII также может быть использовано для подозрения на AMAG. В частности, PGI секретируется главными клетками оксинтической слизистой оболочки тела и дна желудка, в то время как PGII продуцируется главными клетками и клетками слизистой шеи всей слизистой оболочки желудка. Следовательно, оксинтическая атрофия характерна для AMAG, что приводит к снижению уровня PGI наряду с низким соотношением PGI / PGII (<3).45 Уровень PGII в основном не зависит от атрофии оксинитной слизистой оболочки.
Пациентам с лабораторным подтверждением макроцитарной анемии требуется измерение уровня витамина B12 в сыворотке крови. При высоком подозрении на PA за нормальным уровнем витамина B12 должны следовать измерения гомоцистеина (HCys) и метилмалоновой кислоты (MMA ).46 Однако также было показано, что уровни сыворотки всех трех тестов (витамин B12, HCys и MMA) может меняться с течением времени и даже быть нормальным при расстройствах, связанных с кобаламином.47
Измерение уровня хромогранина A (CgA) в плазме было предложено для диагностики AMAG, гиперплазии ECL и карциноидов желудка. Было обнаружено, что уровни CgA хорошо коррелируют со степенью гиперплазии ECL у пациентов с AMAG. В одном исследовании считается, что повышенный уровень CgA связан с развитием неалкогольной жировой болезни печени (НАЖБП), и в настоящее время проводится дополнительное исследование.48 В то же время специфичность уровня CgA слишком низкая (23%), чтобы выявить желудочный карциноиды в этой группе пациентов.49
В других состояниях CgA может приводить к ложноположительным результатам, в том числе при воспалительных заболеваниях кишечника, гепатоцеллюлярной карциноме50 или других состояниях, например, при хроническом применении ингибиторов протонной помпы или при почечной недостаточности.
Эндоскопия
В западных странах эндоскопические методы диагностики AMAG использовались в основном для целей биопсии. Ограничения, связанные с эндоскопией, следующие: 1) низкая чувствительность, 2) низкая специфичность и 3) вариабельность между наблюдателями.51 Однако с появлением новых эндоскопических методов (увеличивающая эндоскопия, узкополосная визуализация [NBI] и автофлуоресцентная визуализация [AFI]) стало возможным обнаруживать минимальные атрофические изменения слизистой оболочки желудка52. показали, что нормальные микрососуды тела желудка и слизистой оболочки глазного дна характеризуются наличием 1) субэпителиальной капиллярной сети (SECN), напоминающей соты, и 2) собирающих венул правильной формы и внешнего вида. У пациентов с атрофическим гастритом этих нормальных результатов не наблюдается.53 Стоит отметить, что ни один из результатов эндоскопии не должен использоваться отдельно для постановки диагноза атрофического гастрита. Фактически, их комбинация (например, сосудистый рисунок и отек area gastrica ) может значительно улучшить диагностическую точность.54 Как упоминалось ранее, у пациентов с высоким подозрением на атрофический гастрит для получения образцов биопсии использовалась эндоскопия. Согласно обновленным рекомендациям Сиднейской системы, необходимо получить пять образцов биопсии: два из тела, два из антрального отдела и один из инцизуры угловой.55
Гистопатология
Биопсия с последующей гистологией считается наиболее надежным методом диагностики метапластического атрофического гастрита. Видны изменения, описанные в разделе «Патогенез». В некоторых случаях при наличии сильного воспаления достоверно оценить кислородную атрофию сложно. Другое ограничение может возникнуть при интерпретации гистологических результатов пациентов с ранними стадиями AMAG. Было предложено несколько диагностических указаний, которые могут быть характерны для AMAG перед глубокой потерей оксинтной слизистой оболочки: 1) инфильтраты лимфоцитов и плазматических клеток в lamina propria, 2) очаговая атрофия кислородной слизистой оболочки вместе с SPEM или IM, 3) псевдогипертрофия париетальных клеток и 4) гиперплазия ECL (по крайней мере, линейный уровень).
Поскольку гиперплазия ECL является предшественником карциноидных опухолей желудка, важно окрашивать образцы тела и дна CgA и синаптофизином.56 Кроме того, окрашивание на гастрин (отрицательное в случае биопсии тела / дна) может помочь в локализации места поражения образец биопсии.57
Клинические проявления
Симптомы, связанные с атрофическим гастритом, развиваются медленно и, по сути, могут иметь длительный бессимптомный период. Во многих случаях сложно диагностировать AMAG или его запущенную форму PA только на основании клинических проявлений.Пораженные пациенты могут иметь различные признаки и симптомы, начиная от слабости и заканчивая тяжелыми неврологическими проявлениями, такими как паранойя (мегалобластное безумие) .58 Вот почему среди медицинских работников ПА также известен как «великий претендент». В этой статье мы хотели бы разделить клинические проявления на три основные группы: гематологические, неврологические и желудочно-кишечные.
Гематологические проявления
Железодефицитная анемия (ЖДА) – одно из самых ранних проявлений АМАГ, которое развивается из-за ахлоргидрии в результате кислородной атрофии.Несколько исследований показали, что рефрактерная или необъяснимая ЖДА должна усиливать подозрения клиницистов на АМАГ не только у взрослых, но и у детей. 59–61 ПА является наиболее частой причиной дефицита кобаламина.62 Хотя лежащие в основе механизмы того, как дефицит кобаламина вызывает мегалобластоз, до конца не выяснены, считается, что это связано с важной ролью кобаламина в синтезе ДНК.63 Бессимптомное увеличение среднего корпускулярного объема и гиперсегментированных нейтрофилов обычно являются первоначальными лабораторными данными при ПА.По мере прогрессирования заболевания пациенты могут жаловаться на слабость, головокружение и сердцебиение. На поздних стадиях могут проявляться симптомы стенокардии и застойной сердечной недостаточности (периферические отеки и одышка). 64 Другие очень важные лабораторные данные включают тромбоцитопению, повышение уровня ЛДГ и билирубина (признаки гемолиза). В редких случаях шистоциты в периферическом мазке могут имитировать другие более серьезные состояния, такие как диссеминированная внутрисосудистая коагулопатия (ДВС) или тромботическая тромбоцитопеническая пурпура / гемолитико-уремический синдром (ТТП / ГУС).65 Дефицит кобаламина был связан с повышенным риском тромбоза, вероятно, в результате гипергомоцистеинемии. Повышенный уровень HCys вызывает эндоваскулярную дисфункцию. Это, в свою очередь, активирует систему свертывания, увеличивает агрегацию тромбоцитов и сужает сосуды. Острый инфаркт миокарда и тромбоэмболия легочной артерии были описаны у молодых пациентов с тяжелой гипергомоцистеинемией, вторичной по отношению к РА. 66,67
Неврологические проявления
Неврологические проявления дефицита кобаламина долгое время были связаны с демиелинизацией с последующим повреждением аксонов и, в конечном итоге, гибелью нейронов.68 Патофизиологические изменения до конца не изучены, однако было установлено, что накопление ММА оказывает прямое влияние на образование миелина и связано с множеством неврологических проблем у пациентов с дефицитом кобаламина.69 Интересно, что неврологические симптомы, связанные с дефицитом кобаламина, могут присутствовать в отсутствие гематологических изменений.70,71 Подострая комбинированная дегенерация (ВСС) – одно из наиболее ярких неврологических проявлений ПА. Поражаются задние и боковые столбики шейного и верхнегрудного сегментов спинного мозга.Это приводит к сенсорным аномалиям (обычно начальным симптомам), таким как потеря вибрационных ощущений и ощущений положения вместе с дистальными парестезиями. На поздних стадиях также может быть поражен кортикоспинальный тракт.72 Хотя во многих ситуациях неврологическое повреждение является необратимым, крайне важно своевременно лечить этих пациентов парентеральным введением витамина B12, чтобы остановить прогрессирование и улучшить неврологический дефицит.73 Еще одной проблемой является периферическая нейропатия. общее неврологическое проявление ПА. Первоначальные симптомы включают парестезию и онемение нижних конечностей.В связи с этим может быть очень трудно клинически отличить периферическую невропатию от ВСС.74 В медицинской литературе описаны как бессимптомные, так и явные случаи оптической невропатии.75
Нейропсихиатрические состояния, связанные с ПА, включают манию, депрессию, обсессивно-компульсивное расстройство (ОКР), психоз и деменция.76 Следует отметить, что использование высоких доз витаминов B12, B6 и фолиевой кислоты замедляет сокращение всего мозга, а также снижает церебральную атрофию у пациентов с болезнью Альцгеймера. болезнь (AD).77
Желудочно-кишечные проявления
Как ни странно, АМАГ редко вызывает желудочно-кишечные симптомы. Было высказано предположение, что это связано с тем, что большинство жалоб со стороны верхних отделов желудочно-кишечного тракта являются вторичными по отношению к повышенному уровню соляной кислоты. Следовательно, AMAG, приводящий к гипо- или даже ахлоргидрии, обычно проявляется только неопределенными диспептическими симптомами, такими как вздутие живота, раннее насыщение и дискомфорт в эпигастрии.78 Атрофический глоссит, который обычно проявляется в виде жжения в языке, также известен как раннее клиническое проявление. дефицита кобаламина.79
Неопластические осложнения
Заболеваемость новообразованиями желудка выше у пациентов с AMAG по сравнению с населением в целом.80,81 В целом, AMAG был связан с развитием двух типов новообразований желудка: кишечного типа GC и желудочного типа I карциноид (TIGC) .82
Рак желудка кишечного типа
Два основных фактора, которые, как известно, объясняют возникновение GC у пациентов с AMAG, – это IM и сопутствующая инфекция H. pylori , которая сама по себе является наиболее частым триггером. ИМ слизистой оболочки желудка.83 Следует отметить, что эрадикация H. pylori у пациентов с известными предраковыми поражениями (атрофия желудка, IM или дисплазия желудка) не снижает значительно частоту возникновения GC.84 Патогенез развития GC описан авторами Correa и Piazuelo85, более известный как «Каскад Корреа». Упрощенную модель каскада можно разделить на следующие этапы: 1) нормальная слизистая оболочка желудка, 2) неатрофический гастрит, 3) множественный атрофический гастрит без (первоначально) и с (позже) IM, 4) дисплазия, прогрессирующая от низкой степени до высокой степени. и 5) GC.86 Следует отметить, что AMAG без сопутствующей инфекции H. pylori не считается частью вышеупомянутого каскада. Не у всех пациентов с гастритом, вызванным H. pylori , развивается GC. Шансы выше, когда присутствуют определенные факторы вирулентности. Например, было показано, что CagA-положительные штаммы H. pylori имеют значительно более высокий риск развития язвенной болезни и GC по сравнению с CagA-отрицательными штаммами.87 Еще один хорошо известный фактор вирулентности, связанный с GC, – это Ген VacA.Вариации в этом гене можно объяснить наличием сигнальной (s) и средней (m) областей.88 Несколько исследований продемонстрировали повышенную частоту язвенной болезни и GC у пациентов, инфицированных s1m1, по сравнению с пациентами, инфицированными s2m2.89
Карциноид желудка типа I
Хотя было признано, что AMAG связан с повышенным риском развития TIGC, точная частота неизвестна. Существует три известных типа карциноидов желудка: тип I связан с AMAG, тип II может присутствовать у пациентов с множественной эндокринной неоплазией (MEN) I и синдромом Золлингера-Эллисона, а тип III, наиболее агрессивный вариант, обычно возникает спорадически.Уровни гастрина в сыворотке различаются в зависимости от типа карциноида желудка: типы I и II – высокие, а тип III – нормальные () .90 Патологические изменения T1GC инициируются потерей отрицательной обратной связи париетальными клетками на секрецию гастрина. Гипо / ахлоргидрия впоследствии приводит к гипергастринемии, которая, в свою очередь, оказывает трофическое воздействие на клетки ECL. Гиперплазия ECL с последующей дисплазией ECL считается предраковым поражением и со временем может прогрессировать до T1GC.91 Выявление полипов тела во время эндоскопии у пациентов с AMAG тесно связано с наличием TIGC.Пациенты с ТИГК обычно протекают бессимптомно, хотя могут присутствовать симптомы диспепсии и ЖДА. Поэтому диагноз обычно ставится во время гастроскопии.92
Таблица 2
Сравнение различных типов карциноидов желудка
| Параметры | Карциноид желудка | ||||
|---|---|---|---|---|---|
| Тип I | Тип II | Тип III | |||
| Частота | 65–80% | 5–6% | 14–25% | ||
| Общие в род. женщины | Половых различий нет | Чаще встречается у мужчин | |||
| Возраст (лет) | 40–60 | 45 | 50 | ||
| Сопутствующие условия | AMAG | MEN1; ZES | Нет | ||
| Эндоскопические особенности | Множественные, маленькие | Подобно типу I | Одиночные, большие, изъязвленные | ||
| Пораженные участки | Тело и глазное дно | Любое место | Любое место | Любой тип | Любой тип |
| Гастрин (уровень) | Повышенный | Повышенный | N | ||
| Гиперплазия G-клеток | Да | Нет | Нет | ||
| Да | |||||
| Ведение | Наблюдение, аналоги соматостатина, эндоскопическое или хирургическое иссечение | Аналогично типу I | Хирургическое (радикальное) | ||
| Риск метастазов в регионарные лимфатические узлы и печень | Очень низкий | Очень низкий | Очень низкий | Высокий | |
| Прогноз | Отличный | Excelle nt | Переменная | ||
Лечение
Стратегии ведения AMAG и его расширенной формы PA зависят от клинических проявлений, лабораторных и визуальных результатов.Терапия с добавлением железа, фолиевой кислоты и кобаламина обычно рекомендуется на ранних стадиях до прогрессирования ПА. Применяется пероральная добавка витамина B12, поскольку было показано, что 1% свободного витамина B12 может абсорбироваться в тонком кишечнике посредством пассивной диффузии.93 Однако пациентам с неврологическими проявлениями в настоящее время рекомендуется парентеральное введение витамина B12.
Учитывая тот факт, что AMAG тесно связан с другими аутоиммунными заболеваниями, необходимо провести соответствующее диагностическое исследование, особенно для таких заболеваний, как аутоиммунный тиреоидит и TIDM.
Выявление и последующее лечение инфекции H. pylori – еще одна очень важная терапевтическая стратегия из-за связанных рисков, связанных с коинфекцией H. pylori . Поскольку в нескольких исследованиях было подтверждено, что инфекция H. pylori может вызывать аутоиммунные процессы в слизистой оболочке желудка, включая оксинитную слизистую оболочку, эрадикация H. pylori может снизить уровни антител, связанных с AMAG, и была доказана эффективность лечения ранние стадии аутоиммунного гастрита.94,95
T1GC имеет отличный прогноз, поэтому были предложены различные подходы: наблюдение, полипэктомия и антрэктомия (удаление части желудка, продуцирующей гастрин) .96 Недавно было предложено одно из потенциальных методов лечения TIGC. Было показано, что нетазепид, антагонист рецепторов гастрина, снижает уровень CgA в плазме, а также количество и размер опухоли.97–99. Другой вариант лечения – рассмотреть возможность использования аналогов соматостатина. В одном проспективном исследовании с участием 107 человек с хроническим атрофическим гастритом авторы показали, что использование аналогов соматостатина привело к снижению среднего уровня гастрина и CgA и, таким образом, должно рассматриваться как эффективная терапия.100 Новой и появляющейся формой терапии нейроэндокринных опухолей является использование лучевой терапии пептидными рецепторами (PRRT), хотя эти новые методы лечения до настоящего времени проспективно не изучались для лечения аутоиммунного атрофического гастрита.101
Благодарности
Эта работа получила грантовая поддержка от Департамента по делам ветеранов RR&D Merit Review (JRP) I01 RX000194; Исследования на людях CORE через CURE: Исследовательский центр болезней пищеварения при поддержке NIH, грант P30DK41301 и NIH NIDDK T32 NIH5T32DK07180 (JNB).
Сноски
Раскрытие информации
Авторы сообщают об отсутствии конфликта интересов в этой работе.
Ссылки
2. Парк JY, Лам-Химлин Д., Вемулапалли Р. Обзор аутоиммунного метапластического атрофического гастрита. Gastrointest Endosc. 2013. 77 (2): 284–292. [PubMed] [Google Scholar] 3. Кармель Р., Джонсон CS. Расовые модели злокачественной анемии. Ранний возраст начала заболевания и повышенная частота антител к внутреннему фактору у чернокожих женщин. N Engl J Med. 1978. 298 (12): 647–650.[PubMed] [Google Scholar] 4. Лам-Цзе В.К., Батстра М.Р., Келеман Б.П. и др. Связь между аутоиммунным тиреоидитом, аутоиммунным гастритом и диабетом 1 типа. Pediatr Endocrinol Rev.2003; 1 (1): 22–37. [PubMed] [Google Scholar] 5. Нойман У.Л., Косс Э., Рагге М, Гента РМ. Аутоиммунный атрофический гастрит – патогенез, патология и лечение. Нат Рев Гастроэнтерол Гепатол. 2013. 10 (9): 529–541. [PubMed] [Google Scholar] 6. Силвейра П.А., Уилсон В.Е., Эстебан Л.М. и др. Идентификация генов предрасположенности к аутоиммунному гастриту Gasa3 и Gasa4 с использованием конгенных мышей и разделенных, сегрегативных анализов и анализов взаимодействий.Иммуногенетика. 2001. 53 (9): 741–750. [PubMed] [Google Scholar] 7. Baxter AG, Jordan MA, Silveira PA, Wilson WE, Van Driel IR. Генетический контроль предрасположенности к аутоиммунному гастриту. Int Rev Immunol. 2005. 24 (1–2): 55–62. [PubMed] [Google Scholar] 8. Икеда Т., Сеноуэ И., Хара М., Цуцуми Ю., Харасава С., Мива Т. Псевдополипоз желудка: новое клиническое проявление гастрита типа А. Am J Gastroenterol. 1985. 80 (2): 82–90. [PubMed] [Google Scholar] 9. Красинскас AM, Abraham SC, Metz DC, Furth EE. Псевдополипы Oxyntic слизистой оболочки: проявление атрофического аутоиммунного гастрита.Am J Surg Pathol. 2003. 27 (2): 236–241. [PubMed] [Google Scholar] 10. Джадд Л.М., Глисон П.А., То Б.Х., ван Дриел И.Р. Аутоиммунный гастрит приводит к нарушению развития эпителиальных клеток желудка. Am J Physiol. 1999; 277 (1 п.1): G209 – G218. [PubMed] [Google Scholar] 11. Хлумска А., Будова Л., Бенеш З., Замечник М. Аутоиммунный гастрит. Клинико-патологическое исследование 25 случаев. Cesk Patol. 2005. 41 (4): 137–142. [PubMed] [Google Scholar] 12. Stolte M, Bethke B, Ruhl G, Ritter M. Омепразол-индуцированная псевдогипертрофия париетальных клеток желудка.З. Гастроэнтерол. 1992. 30 (2): 134–138. [PubMed] [Google Scholar] 13. Solcia E, Fiocca R, Villani L, Luinetti O, Capella C. Гиперпластические, диспластические и неопластические энтерохромаффиноподобные пролиферации слизистой оболочки желудка. Классификация и гистогенез. Am J Surg Pathol. 1995; 19 (Приложение 1): S1 – S7. [PubMed] [Google Scholar] 14. Li P, He C, Sun L, Dong N, Yuan Y. Выражения пепсиногена I и II in situ и их корреляции с уровнями пезигногена в сыворотке при раке желудка и его предраковом заболевании.BMC Clin Pathol. 2013; 13 (1): 1–10. [Бесплатная статья PMC] [PubMed] [Google Scholar] 15. Голденринг-младший, Рэй Г.С., Коффи Р.Дж., младший и др. Обратимая лекарственная оксинитическая атрофия у крыс. Гастроэнтерология. 2000. 118 (6): 1080–1093. [PubMed] [Google Scholar] 16. Номура С., Ямагути Х., Огава М., Ван Т.С., Ли-младший, Голденринг-младший. Изменения в клонах слизистой оболочки желудка, вызванные острой кислородной атрофией у мышей дикого типа и мышей с дефицитом гастрина. Am J Physiol Gastrointest Liver Physiol. 2005; 288 (2): G362 – G375. [PubMed] [Google Scholar] 17.Нодзаки К., Огава М., Уильямс Дж. А. и др. Молекулярный признак метаплазии желудка, возникающий в ответ на острую потерю париетальных клеток. Гастроэнтерология. 2008. 134 (2): 511–522. [Бесплатная статья PMC] [PubMed] [Google Scholar] 18. Вайс В.Г., Петерсен С.П., Миллс Дж.С., Тума П.Л., Уайтхед Р.Х., Голденринг-младший. Создание новых in vitro культур главных клеток мышей и SPEM позволяет идентифицировать MAL2 как маркер метаплазии в желудке. Am J Physiol Gastrointest Liver Physiol. 2014; 307 (8): G777 – G792. [Бесплатная статья PMC] [PubMed] [Google Scholar] 19.Halldorsdottir AM, Sigurdardottrir M, Jonasson JG, et al. Спазмолитическая метаплазия, экспрессирующая полипептид (SPEM), связанная с раком желудка в Исландии. Dig Dis Sci. 2003. 48 (3): 431–441. [PubMed] [Google Scholar] 20. Голденринг Дж. Р., Нам К. Т., Ван Т. К., Миллс Дж. К., Райт Н. А.. Метаплазия, экспрессирующая спазмолитический полипептид, и кишечная метаплазия: время для переоценки метаплазий и происхождения рака желудка. Гастроэнтерология. 2010. 138 (7): 2207–2210. 2210.e1. [Бесплатная статья PMC] [PubMed] [Google Scholar] 21.Корреа П., Пиазуэло МБ, Уилсон К.Т. Патология кишечной метаплазии желудка: клинические проявления. Am J Gastroenterol. 2010. 105 (3): 493–498. [Бесплатная статья PMC] [PubMed] [Google Scholar] 22. Абрахам С.К., Сингх В.К., Ярдли Дж. Х., Ву ТТ. Гиперпластические полипы желудка: ассоциации с гистологическими паттернами гастрита и атрофии желудка. Am J Surg Pathol. 2001. 25 (4): 500–507. [PubMed] [Google Scholar] 23. Вейола Л.И., Оксанен А.М., Сиппонен П.И., Раутелин ХИК. Ассоциация аутоиммунного атрофического гастрита тела с инфекцией Helicobacter pylori .Мир Дж. Гастроэнтерол. 2010. 16 (1): 83–88. [Бесплатная статья PMC] [PubMed] [Google Scholar] 24. Негрини Р., Савио А., Поэзи С. и др. Антигенная мимикрия между Helicobacter pylori и слизистой оболочкой желудка в патогенезе атрофического гастрита тела. Гастроэнтерология. 1996. 111 (3): 655–665. [PubMed] [Google Scholar] 25. Faller G, Steininger H, Eck M, Hensen J, Hann EG, Kirchner T. Антижелудочные аутоантитела при гастрите Helicobacter pylori : распространенность, сайты связывания in-situ и ключи к клинической значимости.Арка Вирхова. 1996. 427 (5): 483–486. [PubMed] [Google Scholar] 26. Genta RM. Helicobacter pylori , воспаление, повреждение слизистой оболочки и апоптоз: патогенез и определение атрофии желудка. Гастроэнтерология. 1997; 113 (6 доп.): S51 – S55. [PubMed] [Google Scholar] 27. Торбенсон М, Абрахам С.К., Бойтнотт Дж., Ярдли Дж. Х., Ву ТТ. Аутоиммунный гастрит: отчетливые гистологические и иммуногистохимические признаки до полной потери кислородных желез. Мод Pathol. 2002. 15 (2): 102–109. [PubMed] [Google Scholar] 28.Де Ре В., Орзес Э., Канцоньери В. и др. Пепсиногены для различения пациентов с кишечной метаплазией желудка и инфекцией Helicobacter pylori среди групп риска по развитию рака желудка. Клин Транс Гастроэнтерол. 2016; 7 (7): e183. [Бесплатная статья PMC] [PubMed] [Google Scholar] 29. Касторо С., Ле Моли Р., Арпи М.Л. и др. Ассоциация аутоиммунных заболеваний щитовидной железы, хронического атрофического гастрита и карциноида желудка: опыт одного учреждения. J Endocrinol Invest. 2016; 39 (7): 779–784.[PubMed] [Google Scholar] 30. Чентанни М., Мариньяни М., Гаргано Л. и др. Атрофический гастрит тела у пациентов с аутоиммунным заболеванием щитовидной железы: недостаточно диагностированная ассоциация. Arch Intern Med. 1999. 159 (15): 1726–1730. [PubMed] [Google Scholar] 31. Де Блок CE, Де Лиу И.Х., Ван Гал Л.Ф. Аутоиммунный гастрит при диабете 1 типа: клинически ориентированный обзор. J Clin Endocrinol Metab. 2008. 93 (2): 363–371. [PubMed] [Google Scholar] 32. Несс-Абрамоф Р., Набриски Д.А., Браверман Л.Е. и др. Распространенность и оценка дефицита B12 у пациентов с аутоиммунным заболеванием щитовидной железы.Am J Med Sci. 2006. 332 (3): 119–122. [PubMed] [Google Scholar] 33. Америо П., Траканна М., Де Ремигис П. и др. Витилиго, ассоциированное с другими аутоиммунными заболеваниями: полигландулярный аутоиммунный синдром типов 3B + C и 4. Clin Exp Dermatol. 2006. 31 (5): 746–749. [PubMed] [Google Scholar] 34. Зелиссен П.М., Баст Э.Дж., Кроуз Р.Дж. Ассоциированный аутоиммунитет при болезни Аддисона. J Autoimmun. 1995. 8 (1): 121–130. [PubMed] [Google Scholar] 35. Чанг К.Х., Лю Р.К., Ро Л.С., Ву Ю.Р., Чен СМ. Сосуществование злокачественной анемии и миастении – редкое сочетание аутоиммунных заболеваний на Тайване.J Formos Med Assoc. 2006; 105 (11): 946–949. [PubMed] [Google Scholar] 36. Delva PL, MacDonell JE, MacIntosh OC. Мегалобластная анемия, возникающая одновременно у белых монозиготных близнецов женского пола. Кан Мед Асс Дж. 1965; 92 (21): 1129–1131. [Бесплатная статья PMC] [PubMed] [Google Scholar] 37. Банк С., Райан К., Томсон В., Ньюман В. Г.. Пагубная анемия – генетические открытия. Autoimmun Rev.2011; 10 (8): 455–459. [PubMed] [Google Scholar] 38. Бонафу Б., Генри Л., Дельфур С. и др. Ассоциация семейной злокачественной анемии и наследственного гемохроматоза.Acta Haematol. 2008. 119 (1): 12–14. [PubMed] [Google Scholar] 39. Русак Э., Чобот А., Кшивицка А., Венцлау Дж. Антитела против париетальных клеток – диагностическое значение. Adv Med Sci. 2016; 61 (2): 175–179. [PubMed] [Google Scholar] 40. Хан С., Дель-Дука С., Фентон Э. и др. Ограниченная ценность тестирования на антитела к внутреннему фактору с отрицательными антителами к париетальным клеткам желудка при пернициозной анемии. J Clin Pathol. 2009. 62 (5): 439–441. [PubMed] [Google Scholar] 41. Оттесен М., Фельдт-Расмуссен Ю.Ф., Андерсен Дж., Хиппе Э., Шубое А.Злокачественная анемия. Изучение начальных форм заболевания и диагностическое значение определения антител к внутреннему фактору и антител к париетальным клеткам. Ugeskr Laeger. 1992. 154 (52): 3758–3762. [PubMed] [Google Scholar] 42. Antico A, Tampoia M, Villalta D, Tonutti E, Tozzoli R, Bizzaro N. Клиническая ценность серологической биопсии желудка для диагностики хронического аутоиммунного гастрита. Clin Dev Immunol. 2012; 2012: 520970. [Бесплатная статья PMC] [PubMed] [Google Scholar] 43. Шах П., Сингх М.Х., Ян Й.X., Мец, округ Колумбия.Гипохлоргидрия и ахлоргидрия связаны с ложноположительным тестом на стимуляцию секретина при синдроме Золлингера-Эллисона. Поджелудочная железа. 2013; 42 (6): 932. [Бесплатная статья PMC] [PubMed] [Google Scholar] 44. Фан Дж., Бенхамму Дж. Н., Писенья Дж. Р. Гиперсекреторные состояния желудка: исследование и лечение. Варианты лечения Curr Gastroenterol. 2015; 13 (4): 386–397. [Бесплатная статья PMC] [PubMed] [Google Scholar] 45. Кармель Р. Пепсиногены и другие сывороточные маркеры при злокачественной анемии. Am J Clin Pathol. 1988. 90 (4): 442–445.[PubMed] [Google Scholar] 46. Уэйнрайт П., Нараянан С., Кук П. Неверный уровень витамина B12 приводит к развитию у пациента злокачественной анемии. Clin Biochem. 2015. 48 (18): 1366–1367. [PubMed] [Google Scholar] 47. Соломон LR. Кобаламин-чувствительные расстройства в амбулаторных условиях: ненадежность тестов на кобаламин, метилмалоновую кислоту и гомоцистеин. Кровь. 2005. 105 (3): 978–985. [PubMed] [Google Scholar] 48. Wu PB, Deng YZ, Shu YX, Tan SY, Li M, Fang G. Повышенные уровни CgA в плазме, связанные с неалкогольной жировой болезнью печени.Turk J Gastroenterol. 2015; 26 (5): 404–407. [PubMed] [Google Scholar] 49. Peracchi M, Gebbia C, Basilisco G и др. Хромогранин А плазмы у пациентов с аутоиммунным хроническим атрофическим гастритом, энтерохромаффиноподобными клеточными поражениями и карциноидами желудка. Eur J Endocrinol. 2005. 152 (3): 443–448. [PubMed] [Google Scholar] 50. Массирони С., Фракелли М., Пагги С. и др. Уровни хромогранина А при хроническом заболевании печени и гепатоцеллюлярной карциноме. Dig Liver Dis. 2009. 41 (1): 31–35. [PubMed] [Google Scholar] 51.Парк YH, Ким Н. Обзор атрофического гастрита и кишечной метаплазии как предракового поражения рака желудка. J Cancer Prev. 2015; 20 (1): 25–40. [Бесплатная статья PMC] [PubMed] [Google Scholar] 53. Анагностопулос Г.К., Рагунатх К., Шонде А., Хоуки К.Дж., Яо К. Диагностика аутоиммунного гастрита с помощью эндоскопии с увеличением с высоким разрешением. Мир Дж. Гастроэнтерол. 2006. 12 (28): 4586–4587. [Бесплатная статья PMC] [PubMed] [Google Scholar] 54. Номура С., Ида К., Терао С. и др. Эндоскопическая диагностика атрофии слизистой оболочки желудка: многоцентровое проспективное исследование.Dig Endosc. 2014. 26 (6): 709–719. [PubMed] [Google Scholar] 55. Диксон М.Ф., Гента Р.М., Ярдли Дж. Х., Корреа П. Классификация и классификация гастрита. Обновленная Сиднейская система. Международный семинар по гистопатологии гастрита, Хьюстон, 1994. Am J Surg Pathol. 1996. 20 (10): 1161–1181. [PubMed] [Google Scholar] 57. Сепульведа А.Р., Патил М. Практический подход к патологической диагностике гастрита. Arch Pathol Lab Med. 2008. 132 (10): 1586–1593. [PubMed] [Google Scholar] 59. Хершко С., Хоффбранд А., Керет Д. и др.Роль аутоиммунного гастрита, Helicobacter pylori и целиакии в рефрактерной или необъяснимой железодефицитной анемии. Haematologica. 2005. 90 (5): 585–595. [PubMed] [Google Scholar] 60. Гонсалвеш С., Оливейра М.Э., Палья А.М., Ферран А., Мораиш А., Лопес А.И. Аутоиммунный гастрит в детском возрасте, проявляющийся железодефицитной анемией. Мир Дж. Гастроэнтерол. 2014. 20 (42): 15780–15786. [Бесплатная статья PMC] [PubMed] [Google Scholar] 61. Мигель Н, Коста Э, Сантала М, младший и др. Рефрактерная железодефицитная анемия и аутоиммунный атрофический гастрит в детской возрастной группе: анализ 8 клинических случаев.J Pediatr Hematol Oncol. 2014. 36 (2): 134–139. [PubMed] [Google Scholar] 62. Stabler SP. Клиническая практика. Дефицит витамина B12. N Engl J Med. 2013. 368 (2): 149–160. [PubMed] [Google Scholar] 63. Теффери А., Прутхи РК. Биохимические основы дефицита кобаламина. Mayo Clin Proceed. 1994. 69 (2): 181–186. [PubMed] [Google Scholar] 64. Asimacopoulos PJ, Groves MD, Fischer DK, et al. Пагубная анемия, проявляющаяся стенокардией. Саут Мед Дж. 1994; 87 (6): 671–672. [PubMed] [Google Scholar] 65. Тадакамалла А.К., Таллури СК, Бесур С.Псевдотромботическая тромбоцитопеническая пурпура: редкое проявление злокачественной анемии. N Am J Med Sci. 2011. 3 (10): 472–474. [Бесплатная статья PMC] [PubMed] [Google Scholar] 66. Мельхем А., Десаи А., Хофманн М.А. Острый инфаркт миокарда и тромбоэмболия легочной артерии у молодого человека с тяжелой гипергомоцистеинемией, вызванной злокачественной анемией. Тромб Дж. 2009; 7 (1): 1–5. [Бесплатная статья PMC] [PubMed] [Google Scholar] 67. Шамкани В.А., Джафар Н.С., Нараянан С.Р., Раджаппан АК. Острый инфаркт миокарда у молодой женщины из-за дефицита витамина B12, вызванный гипергомоцистеинемией.Сердечные взгляды. 2015; 16 (1): 25–29. [Бесплатная статья PMC] [PubMed] [Google Scholar] 68. Метц Дж. Дефицит кобаламина и патогенез заболеваний нервной системы. Annu Rev Nutr. 1992; 12: 59–79. [PubMed] [Google Scholar] 69. Фрэнсис Г., Хохол К., Джавад З., Айер А., Тот С. Накопление метилмалоновой кислоты и развитие периферической невропатии (IN1-1.010) Неврология. 2012; 78 (1 доп.): IN1 – IN1. [Google Scholar] 70. Ралапанава DM, Jayawickreme KP, Ekanayake EM, Jayalath WA. Дефицит B (12) с неврологическими проявлениями при отсутствии анемии.BMC Res Notes. 2015; 8: 458. [Бесплатная статья PMC] [PubMed] [Google Scholar] 71. Линденбаум Дж., Хилтон Э. Б., Сэвидж Д. Г. и др. Психоневрологические расстройства, вызванные дефицитом кобаламина при отсутствии анемии или макроцитоза. N Engl J Med. 1988. 318 (26): 1720–1728. [PubMed] [Google Scholar] 72. Hemmer B, Glocker FX, Schumacher M, Deuschl G, Lücking CH. Подострая комбинированная дегенерация: данные клинической, электрофизиологической и магнитно-резонансной томографии. J Neurol Neurosurg Psychiatry. 1998. 65 (6): 822–827.[Бесплатная статья PMC] [PubMed] [Google Scholar] 73. Васконселос О.М., Поем Э.Х., Маккартер Р.Дж., Кэмпбелл В.В., Кесадо ZMN. Возможные факторы исхода при подострой комбинированной дегенерации: обзор обсервационных исследований. J Gen Intern Med. 2006. 21 (10): 1063–1068. [Бесплатная статья PMC] [PubMed] [Google Scholar] 74. Саперштейн Д.С., Барон Р.Дж. Периферическая невропатия из-за дефицита кобаламина. Варианты лечения Curr Neurol. 2002. 4 (3): 197–201. [PubMed] [Google Scholar] 75. Chu C, Scanlon P. Оптическая нейропатия, вызванная дефицитом витамина B12, обнаруженная бессимптомным скринингом.BMJ Case Rep.2011; 2011 bcr0220113823. [Бесплатная статья PMC] [PubMed] [Google Scholar] 76. Metzler D, Miller WH, Stephen Edwards C. Психиатрическое проявление дефицита витамина B-12: обновленная информация. Джефферсон Дж. Психиатрия. 1991; 9 (2) [Google Scholar] 77. Douaud G, Refsum H, de Jager CA и др. Предотвращение атрофии серого вещества, связанной с болезнью Альцгеймера, с помощью лечения витамином B. Proc Natl Acad Sci U S. A. 2013; 110 (23): 9523–9528. [Бесплатная статья PMC] [PubMed] [Google Scholar] 78. Ланер Э., Аннибале Б. Пагубная анемия: новые открытия с гастроэнтерологической точки зрения.Мир Дж. Гастроэнтерол. 2009. 15 (41): 5121–5128. [Бесплатная статья PMC] [PubMed] [Google Scholar] 79. Чжу Дж.С., Ван Ю.Ф., Шэн Дж., Чен FX, Тан Г.Й. Атрофический глоссит связывают с дефицитом кобаламина. Shanghai J Stomatol. 2013. 22 (1): 58–62. [PubMed] [Google Scholar] 80. Ваннелла Л., Ланер Э, Осборн Дж, Аннибале Б. Систематический обзор: заболеваемость раком желудка при пернициозной анемии. Алимент Pharmacol Ther. 2013. 37 (4): 375–382. [PubMed] [Google Scholar] 81. Ваннелла Л., Сброцци-Ванни А., Ланер Э. и др. Развитие карциноида желудка I типа у больных хроническим атрофическим гастритом.Алимент Pharmacol Ther. 2011. 33 (12): 1361–1369. [PubMed] [Google Scholar] 82. Ланер Э., Эспозито Дж., Галли Дж., Аннибале Б. Атрофический гастрит и предраковые поражения желудка. Перевод Gastrointest Cancer. 2015; 4 (4): 272–281. [Google Scholar] 83. Шнеллер Дж., Гупта Р., Мустафа Дж., Вильянуэва Р., Штраус Е. В., Раффаниелло Р. Д.. Инфекция Helicobacter pylori связана с высокой частотой кишечной метаплазии слизистой оболочки желудка у пациентов в городских больницах Нью-Йорка. Dig Dis Sci.2006. 51 (10): 1801–1809. [PubMed] [Google Scholar] 84. Вонг BC, Лам С.К., Вонг В.М. и др. Китайская группа по изучению рака желудка Эрадикация Helicobacter pylori для предотвращения рака желудка в регионе высокого риска в Китае: рандомизированное контролируемое исследование. ДЖАМА. 2004. 291 (2): 187–194. [PubMed] [Google Scholar] 86. Юн X, Тан Б., Ли Б-С и др. Helicobacter pylori Фактор вирулентности CagA способствует онкогенезу рака желудка посредством множественных сигнальных путей. Сигнал сотовой связи. 2015; 13 (1): 1–13.[Бесплатная статья PMC] [PubMed] [Google Scholar] 88. ван Дорн Л.Дж., Фигейредо С., Санна Р. и др. Клиническая значимость cagA, vacA и iceA статуса Helicobacter pylori . Гастроэнтерология. 1998. 115 (1): 58–66. [PubMed] [Google Scholar] 89. Вроблевски Л. Е., Пик Р. М., Уилсон К. Т.. Helicobacter pylori и рак желудка: факторы, влияющие на риск заболевания. Clin Microbiol Rev.2010; 23 (4): 713–739. [Бесплатная статья PMC] [PubMed] [Google Scholar] 90. Чжоу К., Хо В. Карциноиды желудка: классификация и диагностика.В: Pisegna RJ, редактор. Лечение нейроэндокринных опухолей поджелудочной железы. Нью-Йорк, Нью-Йорк: Springer Нью-Йорк; 2015. С. 83–93. [Google Scholar] 91. Burkitt MD, Pritchard DM. Обзорная статья: патогенез и лечение карциноидных опухолей желудка. Алимент Pharmacol Ther. 2006. 24 (9): 1305–1320. [PubMed] [Google Scholar] 92. Ли Ти, Цю Ф, Цянь З.Р., Ван Дж., Ци Х-К, Ву Би. Классификация, клинико-патологические особенности и лечение нейроэндокринных опухолей желудка. Мир Дж. Гастроэнтерол. 2014. 20 (1): 118–125. [Бесплатная статья PMC] [PubMed] [Google Scholar] 93.Андрес Э., Фотергилл Х., Месили М. Эффективность пероральной терапии кобаламином (витамин B12). Эксперт Opin Pharmacother. 2010. 11 (2): 249–256. [PubMed] [Google Scholar] 94. Столте М., Мейер Э, Майнинг А. Лечение аутоиммунного гастрита с помощью эрадикации Helicobacter pylori у 21-летнего мужчины. З. Гастроэнтерол. 1998. 36 (8): 641–643. [PubMed] [Google Scholar] 95. Фаллер Г., Винтер М., Штайнингер Х. и др. Снижение аутоантител желудка при гастрите Helicobacter pylori после излечения инфекции.Pathol Res Pract. 1999. 195 (4): 243–246. [PubMed] [Google Scholar] 97. Докрей GJ. Клиническая эндокринология и метаболизм. Гастрин. Лучшая практика Res Clin Endocrinol Metab. 2004. 18 (4): 555–568. [PubMed] [Google Scholar] 98. Мур А.Р., Бойс М., Стил И.А., Кэмпбелл Ф., Варро А., Причард Д.М. Нетазепид, антагонист рецепторов гастрина, нормализует биомаркеры опухолей и вызывает регрессию нейроэндокринных опухолей желудка 1 типа в нерандомизированном исследовании пациентов с хроническим атрофическим гастритом. PLoS One. 2013; 8 (10): e76462.[Бесплатная статья PMC] [PubMed] [Google Scholar] 99. Фоссмарк Р., Сордал О., Цзянь С.С. и др. Лечение карциноидов желудка 1 типа антагонистом гастриновых рецепторов нетазепидом (YF476) приводит к регрессии опухолей и нормализации сывороточного хромогранина A. Aliment Pharmacol Ther. 2012. 36 (11–12): 1067–1075. [PubMed] [Google Scholar] 100. Massironi S, Zilli A, Fanetti I, Ciafardini C, Conte D, Peracchi M. Прерывистое лечение рецидивирующих карциноидов желудка 1 типа аналогами соматостатина у пациентов с хроническим аутоиммунным атрофическим гастритом.Dig Liver Dis. 2015; 47 (11): 978–983. [PubMed] [Google Scholar] 101. Kwekkeboom DJ, Креннинг EP. Радионуклидная терапия пептидных рецепторов в лечении нейроэндокринных опухолей. Hematol Oncol Clin North Am. 2016; 30 (1): 179–191. [PubMed] [Google Scholar]Аутоиммунный атрофический гастрит: современные перспективы
Clin Exp Gastroenterol. 2017; 10: 19–27.
Артем Миналян
1 Отделение гастроэнтерологии, гепатологии и парентерального питания
Джихане Н. Бенхамму
1 Отделение гастроэнтерологии, гепатологии и парентерального питания 0003
904 904 Aida Парентеральное питаниеМайкл С. Льюис
2 Департамент патологии и лабораторной медицины, VA Greater Los Angeles Healthcare System, Лос-Анджелес, Калифорния, США
Джозеф Р. Писенья
1 Отделение гастроэнтерологии, гепатологии и парентерального питания
1 Отделение гастроэнтерологии, гепатологии и парентерального питания
2 Отделение патологии и лабораторной медицины, VA Greater Los Angeles Healthcare System, Лос-Анджелес, Калифорния, США
Для переписки: Joseph R Pisegna, Отдел гастроэнтерологии, гепатологии и парентеральные нутри ции, Департамент по делам ветеранов, VA Greater Los Angeles Healthcare System (691 / 111C), 11301 Wilshire Boulevard, Los Angeles, CA, USA, тел. +1 310 268 3578, факс +1 310 268 4096, электронная почта ude.alcu @ angesipj Авторские права © 2017 Minalyan et al. Эта работа опубликована и лицензирована Dove Medical Press Limited. Полные условия этой лицензии доступны по адресу https://www.dovepress.com/terms.php и включают лицензию Creative Commons Attribution – Non Commercial (unported, v3.0) License ( http://creativecommons.org/licenses/by-nc/3.0/). Получая доступ к работе, вы тем самым принимаете Условия. Некоммерческое использование работы разрешено без какого-либо дополнительного разрешения Dove Medical Press Limited при условии надлежащей атрибуции работы.Эта статья цитировалась в других статьях в PMC.Реферат
В настоящее время не существует общепринятой классификации гастрита. Первая успешная классификация (Сиднейская система), которая до сих пор широко используется профессионалами-медиками, была впервые представлена Мисевичем и др. В Сиднее в 1990 году. Фактически, это была первая подробная классификация после открытия Helicobacter pylori Уорреном и Маршаллом. в 1982 г. В 1994 г. обновленная Сиднейская система была предложена во время Международного семинара по гистопатологии гастрита, за которым последовала публикация в журнале The American Journal of Surgical Pathology Dixon et al.Используя новую классификацию, было пересмотрено различие между атрофическим и неатрофическим гастритом, и была включена визуальная шкала оценки. Согласно обновленной классификации Сиднейской системы атрофический гастрит подразделяется на многоочаговый ( H. pylori, , факторы окружающей среды, специфическая диета) и преобладающий трупный (аутоиммунный). Поскольку метаплазия является ключевой гистологической характеристикой пациентов с атрофическим гастритом, было рекомендовано использовать слово «метапластический» в обоих вариантах атрофического гастрита: аутоиммунном метапластическом атрофическом гастрите (AMAG) и метапластическом атрофическом гастрите, вызванном окружающей средой.Несмотря на то, что существует много совпадений в ходе заболевания, и различие между этими двумя объектами может быть сложной задачей, цель этой обзорной статьи состояла в описании этиологии, эпидемиологии, патогенеза, диагностики, клинических проявлений и лечения пациентов с AMAG. Однако важно отметить, что H. pylori является наиболее распространенным этиологическим фактором развития гастрита в мире.
Ключевые слова: аутоиммунный гастрит, пернициозная анемия, карциноид желудка
Эпидемиология
Распространенность злокачественной анемии (ПА; одно из отличительных проявлений аутоиммунного метапластического атрофического гастрита [AMAG]) составляет ~ 0.1% среди населения в целом и ~ 2% среди лиц старше 60 лет.1 В течение многих лет предполагалось, что ПА является заболеванием пожилых женщин североевропейской национальности. Впоследствии было показано, что распространенность ПА одинакова среди всех популяций (белых, афроамериканцев и небелых латиноамериканцев) .2 Основываясь на анализе данных 156 пациентов, страдающих ПА, в 1978 году Кармель и Джонсон3 пришли к выводу, У чернокожих женщин ПА развивается в более молодом возрасте, чем у женщин всех других рас (53 ± 16 лет, p <0.001). Подобно другим аутоиммунным заболеваниям, AMAG чаще встречается у женщин, чем у мужчин (соотношение 3: 1). Сильная связь между AMAG и другими аутоиммунными заболеваниями хорошо задокументирована.4 Считается, что AMAG и PA могут недооцениваться во всех частях мира. Одним из объяснений может быть тот факт, что почти все формы микро- и макроцитарной анемии лечатся железом, фолиевой кислотой и кобаламином без дальнейшего определения этиологии анемии. Более того, во многих случаях образцы биопсии слизистой оболочки желудка неадекватны или взяты не в том месте.5
Патогенез
Понимание патогенеза AMAG несколько затруднительно по нескольким причинам: 1) распространенность AMAG относительно низкая, 2) во многих случаях имеется сопутствующий гастрит, вызванный Helicobacter pylori и , и 3) нет или минимальные проявления присутствуют на ранних стадиях заболевания. Тем не менее мы знаем, что как генетические факторы, так и факторы окружающей среды играют роль в развитии аутоиммунного гастрита. Используя мышиные модели, можно было обнаружить гены предрасположенности к аутоиммунному гастриту ( Gasa1, 2, 3 и 4 ) на хромосомах 4 и 6 и в области h3.Интересно, что три из этих гена расположены в том же локусе, что и гены восприимчивости к сахарному диабету (СД) мышей, не страдающих ожирением, что может объяснить сильную связь между AMAG и СД 1 типа (СД1) .6,7
Несмотря на отсутствие ожирения Для понимания сложных этапов патогенеза AMAG гистологические изменения хорошо изучены (и). Первоначальные изменения включают инфильтрацию кислородной слизистой оболочки лимфоцитами и плазматическими клетками. Неравномерное разрушение париетальных клеток с сохранившимися островками относительно нормальной оксинтической слизистой оболочки приводит к появлению «островков в море».Это явление, также известное как псевдополипоз желудка, похоже на поражение толстой кишки у пациентов с язвенным колитом.8,9 Гипохлоргидрия, или снижение / потеря секреции соляной кислоты, затем развивается в результате комбинации двух факторов: 1) потеря кислородной слизистой оболочки и 2) нарушение созревания париетальных клеток.10 Отсутствие отрицательной обратной связи от париетальных клеток вызывает гиперплазию G-клеток и повышенную желудочную секрецию в истерике, что, в свою очередь, приводит к псевдогипертрофии париетальных клеток, напоминающей ингибитор протонной помпы. индуцированное воздействие на париетальные клетки.11 Стоит отметить, что это явление не может развиваться в атрофических железах, поскольку антитела против париетальных клеток также избирательно связываются с H + / K + АТФазой. 12 Еще одним важным эффектом повышенной желудочной секреции является его прямая стимуляция и пролиферация энтерохромаффиноподобных (ECL) клетки, которые зависят от степени тяжести и могут быть гиперпластическими, диспластическими и неопластическими.13 Развитие гиперплазии клеток ECL до неопластического подтипа может привести к образованию карциноидной опухоли, что будет описано ниже.В теле и дне желудка развиваются области метаплазии: псевдопилорическая, кишечная метаплазия (IM) и панкреатическая. Псевдопилорическая метаплазия («оксинтическая антрализация») развивается в оксинтических железах из секретирующих слизь клеток, фенотипически напоминающих клетки слизистой антрального отдела. Хотя гистологически псевдопилорическая метаплазия может быть неотличима от клеток антральной железы, иммуноокрашивание пепсиногеном (PG) может быть полезным для дифференциации: пепсиноген I (PGI) характерен для клеток оксинтной слизистой оболочки и отсутствует в антральном отделе.14 В последнее время широко используется новый термин для описания псевдопилорической метаплазии: метаплазия, экспрессирующая спазмолитический полипептид (SPEM). Этиология СПЭМ не ясна. Было предложено несколько теорий: 1) длительное воспаление кислородной слизистой оболочки, 2) острое прямое действие токсических веществ на париетальные клетки (DMP-777) 15,16 и 3) трансдифференцировка главных клеток.17 Главные клетки и SPEM экспрессируют MAL2. Этот белок участвует в транспортировке везикул и считается первым белком трафика, который активируется в SPEM.18 Было показано, что SPEM представляет собой пренеопластическое поражение желудка, 19 которое также может трансформироваться в IM. 20 IM представляет собой замену железистого, фовеолярного и поверхностного эпителия слизистой оболочки желудка эпителием кишечника. В зависимости от гистологических особенностей были описаны два подтипа: тонкий кишечник и толстый кишечник. Их, в свою очередь, можно сгруппировать в три типа: тип 1 или тонкий кишечник, с щеточной каймой, «полные», которые полностью замещены эпителием тонкого кишечника со всеми типами клеток (бокаловидные, панетические и т. Д.), Экспрессирующие сиаломуцины. .Тип 3, или тип толстой кишки, без щеточной каймы, «неполный», представляют собой метапластические клетки, которые образуются по соседству с нормальными клетками желудка, экспрессируют сульфомуцины. Тип 2, или тип толстой кишки, без щеточной каймы, «неполный», где метаплазия подобна типу 3, экспрессирует муцины как желудка, так и кишечника.21 Помимо вышеупомянутых патологических изменений, воспалительные и гиперпластические полипы развиваются на более поздних стадиях AMAG. 22 Oxyntic слизистая может полностью отсутствовать на запущенной стадии заболевания.
Биопсия желудка человека показывает атрофию желудочной железы.
Биопсия желудка человека показывает лимфоцитарный инфильтрат.
Связь с
H. pyloriХорошо известно, что H. pylori может вызывать атрофический гастрит сам по себе. С другой стороны, важно помнить, что во многих случаях пациенты с AMAG могут иметь сопутствующую инфекцию H. pylori .23 Третий возможный сценарий – прогрессирование гастрита, вызванного H. pylori , в AMAG.Считается, что этиологией этого процесса является антигенная мимикрия или перекрестная реактивность. 24 Многие пациенты с H. pylori вырабатывают широкий спектр антител, включая антифовеолярные, антиканаликулярные и классический APCA. Наиболее часто обнаруживаемыми антителами являются антиканаликулярные антитела, которые, как и APCA, направлены против H + / K + АТФазы (протонной помпы) .25 Несмотря на множество совпадений в ходе заболевания, важно дифференцировать AMAG от H. pylori – индуцированный гастрит.AMAG влияет только на тело и дно желудка, в то время как поражения, вызванные H. pylori , имеют мультифокальный характер () .26 Другими важными факторами, которые помогают дифференцировать AMAG и H. pylori-индуцированный гастрит , являются 1 ) Гиперплазия ECL (чаще встречается при AMAG), 2) псевдогипертрофия париетальных клеток (при AMAG; может быть замечена в инфекции H. pylori , вторичной по отношению к применению ингибитора протонной помпы) и 3) поражение оксинных желез (более часто при AMAG).
Таблица 1
Сравнение AMAG с H.pylori -индуцированный атрофический гастрит
| Характеристики | Тип атрофического гастрита | |||
|---|---|---|---|---|
| Аутоиммунный метапластический | H. pylori индуцированный | |||
| Характер распределения | Тело и глазное дно (антральное отверстие сохраняется) | Гиперфокальное | Распространенное | EC Редко |
| Псевдогипертрофия париетальных клеток | Часто | Обычно вторично по отношению к использованию ИПП | ||
| Поражение оксинтных желез | Часто | Редко | ||
| Воспалительные изменения в плазме крови похожие на поражения | ||||
| Глубина воспаления | Собственная пластинка обычно поражена | Поверхностные слои | ||
| Уровень гастрина-17 | Высокий | Низкий, но может быть повышен | ||
| Уровень пепсиногена | ||||
| Пепсиноген Нормальный 9 0589 | ||||
| Уровень пепсиногена II | Нормальный | Различный | ||
| Антитела | Против париетальных клеток и внутреннего фактора | Против H.pylori | ||
| Клинические проявления | Бессимптомное течение или диспепсия; симптомы ассоциированных аутоиммунных состояний | Бессимптомные или диспепсия | ||
| Риск новообразований желудка | Повышенный риск рака желудка и карциноидов | Кроме того, повышенный риск рака желудка и карциноидов | ||
Связь с другими аутоиммунными состояниями
Хорошо известно, что AMAG имеет тенденцию чаще встречаться у пациентов с другими аутоиммунными состояниями.29 До одной трети пациентов с аутоиммунным заболеванием щитовидной железы (AITD) и 6–10% пациентов с TIDM имеют сопутствующий AMAG.30,31 Известно, что пациенты с полигландулярными аутоиммунными (PGA) синдромами (особенно PGA типа 3B, который всегда включает AITD) имеют высокую распространенность PA.32 Другие аутоиммунные состояния, которые, как известно, встречаются вместе с AMAG (или его распространенная форма PA) – это витилиго, болезнь Аддисона, миастения и периоральные кожные аутоиммунные состояния (особенно, эрозивный красный плоский лишай) 33–35
Были описаны семейные случаи злокачественной анемии (FPA), в том числе у близнецов, что предполагает генетический компонент болезни.36 Однако необходимо провести дополнительные исследования, чтобы пролить больше света на то, как генетические вариации предрасполагают к развитию AMAG.37 В литературе также описаны очень редкие случаи сосуществования двух наследственных заболеваний (FPA и наследственный гемохроматоз) .38
Диагноз
В этом разделе мы обсуждаем наиболее распространенные диагностические тесты, используемые для скрининга и подтверждения диагноза AMAG: серологические тесты, эндоскопия и гистопатология.
Серологические тесты
Обнаружение специфических антител было признано эффективным методом для целей скрининга и подтверждения.Среди антител, используемых для диагностики AMAG, наиболее широко используется следующая группа: APCA, антитела против внутреннего фактора (AIFA) и антитела против H. pylori (анти-HP-IgM и анти-HP-IgG). Значение измерения анти-HP-антител связано с частым сосуществованием гастрита, вызванного H. pylori , и AMAG. Известно, что APCA имеют высокую чувствительность (~ 80%), но низкую специфичность для PA.39 Напротив, AIFA менее чувствительны (~ 50%), но более специфичны для PA.40 У пациентов с ПА и отрицательным результатом AIFA сероконверсия может произойти позже по ходу заболевания. 41 Измерение уровня гастрина (в основном гастрина-17) – еще один диагностический тест, который может быть отклонен от нормы у пациентов с AMAG из-за атрофии кислородных желез, ведущей к к повышенной продукции гастрина G-клетками антрального отдела. Комбинированный анализ APCA, AIFA и анти-HP-антител вместе с измерением сывороточного гастрина (гастрина-17) также известен как «серологическая биопсия желудка». Было признано, что он эффективен для диагностических целей и хорошо коррелирует с гистологическими данными.42
Наблюдаемую гипергастринемию клинически трудно отличить от других причин гипергастринемии. Один из методов определения причины гипергастринемии – измерение уровня продукции желудочного сока. При атрофическом гастрите уровень выделения желудочного сока низкий (<5 мЭкв / ч), тогда как при гипергастринемии, связанной с синдромом Золлингера-Эллисона, выделение желудочного сока составляет> 10 мЭкв / ч. Кроме того, секретиновый тест дает отрицательный результат у> 80% пациентов.43 Другой часто упускаемой из виду причиной гипергастринемии является обструкция выходного отверстия желудка и нарушение моторики желудка, для оценки которых может потребоваться эндоскопия верхних отделов желудка и радиологические исследования.При нарушении моторики желудка комплемент париетальных клеток будет либо нормальным, либо увеличенным.44 Измерение PGI и PGII, а также соотношения PGI / PGII также может быть использовано для подозрения на AMAG. В частности, PGI секретируется главными клетками оксинтической слизистой оболочки тела и дна желудка, в то время как PGII продуцируется главными клетками и клетками слизистой шеи всей слизистой оболочки желудка. Следовательно, оксинтическая атрофия характерна для AMAG, что приводит к снижению уровня PGI наряду с низким соотношением PGI / PGII (<3).45 Уровень PGII в основном не зависит от атрофии оксинитной слизистой оболочки.
Пациентам с лабораторным подтверждением макроцитарной анемии требуется измерение уровня витамина B12 в сыворотке крови. При высоком подозрении на PA за нормальным уровнем витамина B12 должны следовать измерения гомоцистеина (HCys) и метилмалоновой кислоты (MMA ).46 Однако также было показано, что уровни сыворотки всех трех тестов (витамин B12, HCys и MMA) может меняться с течением времени и даже быть нормальным при расстройствах, связанных с кобаламином.47
Измерение уровня хромогранина A (CgA) в плазме было предложено для диагностики AMAG, гиперплазии ECL и карциноидов желудка. Было обнаружено, что уровни CgA хорошо коррелируют со степенью гиперплазии ECL у пациентов с AMAG. В одном исследовании считается, что повышенный уровень CgA связан с развитием неалкогольной жировой болезни печени (НАЖБП), и в настоящее время проводится дополнительное исследование.48 В то же время специфичность уровня CgA слишком низкая (23%), чтобы выявить желудочный карциноиды в этой группе пациентов.49
В других состояниях CgA может приводить к ложноположительным результатам, в том числе при воспалительных заболеваниях кишечника, гепатоцеллюлярной карциноме50 или других состояниях, например, при хроническом применении ингибиторов протонной помпы или при почечной недостаточности.
Эндоскопия
В западных странах эндоскопические методы диагностики AMAG использовались в основном для целей биопсии. Ограничения, связанные с эндоскопией, следующие: 1) низкая чувствительность, 2) низкая специфичность и 3) вариабельность между наблюдателями.51 Однако с появлением новых эндоскопических методов (увеличивающая эндоскопия, узкополосная визуализация [NBI] и автофлуоресцентная визуализация [AFI]) стало возможным обнаруживать минимальные атрофические изменения слизистой оболочки желудка52. показали, что нормальные микрососуды тела желудка и слизистой оболочки глазного дна характеризуются наличием 1) субэпителиальной капиллярной сети (SECN), напоминающей соты, и 2) собирающих венул правильной формы и внешнего вида. У пациентов с атрофическим гастритом этих нормальных результатов не наблюдается.53 Стоит отметить, что ни один из результатов эндоскопии не должен использоваться отдельно для постановки диагноза атрофического гастрита. Фактически, их комбинация (например, сосудистый рисунок и отек area gastrica ) может значительно улучшить диагностическую точность.54 Как упоминалось ранее, у пациентов с высоким подозрением на атрофический гастрит для получения образцов биопсии использовалась эндоскопия. Согласно обновленным рекомендациям Сиднейской системы, необходимо получить пять образцов биопсии: два из тела, два из антрального отдела и один из инцизуры угловой.55
Гистопатология
Биопсия с последующей гистологией считается наиболее надежным методом диагностики метапластического атрофического гастрита. Видны изменения, описанные в разделе «Патогенез». В некоторых случаях при наличии сильного воспаления достоверно оценить кислородную атрофию сложно. Другое ограничение может возникнуть при интерпретации гистологических результатов пациентов с ранними стадиями AMAG. Было предложено несколько диагностических указаний, которые могут быть характерны для AMAG перед глубокой потерей оксинтной слизистой оболочки: 1) инфильтраты лимфоцитов и плазматических клеток в lamina propria, 2) очаговая атрофия кислородной слизистой оболочки вместе с SPEM или IM, 3) псевдогипертрофия париетальных клеток и 4) гиперплазия ECL (по крайней мере, линейный уровень).
Поскольку гиперплазия ECL является предшественником карциноидных опухолей желудка, важно окрашивать образцы тела и дна CgA и синаптофизином.56 Кроме того, окрашивание на гастрин (отрицательное в случае биопсии тела / дна) может помочь в локализации места поражения образец биопсии.57
Клинические проявления
Симптомы, связанные с атрофическим гастритом, развиваются медленно и, по сути, могут иметь длительный бессимптомный период. Во многих случаях сложно диагностировать AMAG или его запущенную форму PA только на основании клинических проявлений.Пораженные пациенты могут иметь различные признаки и симптомы, начиная от слабости и заканчивая тяжелыми неврологическими проявлениями, такими как паранойя (мегалобластное безумие) .58 Вот почему среди медицинских работников ПА также известен как «великий претендент». В этой статье мы хотели бы разделить клинические проявления на три основные группы: гематологические, неврологические и желудочно-кишечные.
Гематологические проявления
Железодефицитная анемия (ЖДА) – одно из самых ранних проявлений АМАГ, которое развивается из-за ахлоргидрии в результате кислородной атрофии.Несколько исследований показали, что рефрактерная или необъяснимая ЖДА должна усиливать подозрения клиницистов на АМАГ не только у взрослых, но и у детей. 59–61 ПА является наиболее частой причиной дефицита кобаламина.62 Хотя лежащие в основе механизмы того, как дефицит кобаламина вызывает мегалобластоз, до конца не выяснены, считается, что это связано с важной ролью кобаламина в синтезе ДНК.63 Бессимптомное увеличение среднего корпускулярного объема и гиперсегментированных нейтрофилов обычно являются первоначальными лабораторными данными при ПА.По мере прогрессирования заболевания пациенты могут жаловаться на слабость, головокружение и сердцебиение. На поздних стадиях могут проявляться симптомы стенокардии и застойной сердечной недостаточности (периферические отеки и одышка). 64 Другие очень важные лабораторные данные включают тромбоцитопению, повышение уровня ЛДГ и билирубина (признаки гемолиза). В редких случаях шистоциты в периферическом мазке могут имитировать другие более серьезные состояния, такие как диссеминированная внутрисосудистая коагулопатия (ДВС) или тромботическая тромбоцитопеническая пурпура / гемолитико-уремический синдром (ТТП / ГУС).65 Дефицит кобаламина был связан с повышенным риском тромбоза, вероятно, в результате гипергомоцистеинемии. Повышенный уровень HCys вызывает эндоваскулярную дисфункцию. Это, в свою очередь, активирует систему свертывания, увеличивает агрегацию тромбоцитов и сужает сосуды. Острый инфаркт миокарда и тромбоэмболия легочной артерии были описаны у молодых пациентов с тяжелой гипергомоцистеинемией, вторичной по отношению к РА. 66,67
Неврологические проявления
Неврологические проявления дефицита кобаламина долгое время были связаны с демиелинизацией с последующим повреждением аксонов и, в конечном итоге, гибелью нейронов.68 Патофизиологические изменения до конца не изучены, однако было установлено, что накопление ММА оказывает прямое влияние на образование миелина и связано с множеством неврологических проблем у пациентов с дефицитом кобаламина.69 Интересно, что неврологические симптомы, связанные с дефицитом кобаламина, могут присутствовать в отсутствие гематологических изменений.70,71 Подострая комбинированная дегенерация (ВСС) – одно из наиболее ярких неврологических проявлений ПА. Поражаются задние и боковые столбики шейного и верхнегрудного сегментов спинного мозга.Это приводит к сенсорным аномалиям (обычно начальным симптомам), таким как потеря вибрационных ощущений и ощущений положения вместе с дистальными парестезиями. На поздних стадиях также может быть поражен кортикоспинальный тракт.72 Хотя во многих ситуациях неврологическое повреждение является необратимым, крайне важно своевременно лечить этих пациентов парентеральным введением витамина B12, чтобы остановить прогрессирование и улучшить неврологический дефицит.73 Еще одной проблемой является периферическая нейропатия. общее неврологическое проявление ПА. Первоначальные симптомы включают парестезию и онемение нижних конечностей.В связи с этим может быть очень трудно клинически отличить периферическую невропатию от ВСС.74 В медицинской литературе описаны как бессимптомные, так и явные случаи оптической невропатии.75
Нейропсихиатрические состояния, связанные с ПА, включают манию, депрессию, обсессивно-компульсивное расстройство (ОКР), психоз и деменция.76 Следует отметить, что использование высоких доз витаминов B12, B6 и фолиевой кислоты замедляет сокращение всего мозга, а также снижает церебральную атрофию у пациентов с болезнью Альцгеймера. болезнь (AD).77
Желудочно-кишечные проявления
Как ни странно, АМАГ редко вызывает желудочно-кишечные симптомы. Было высказано предположение, что это связано с тем, что большинство жалоб со стороны верхних отделов желудочно-кишечного тракта являются вторичными по отношению к повышенному уровню соляной кислоты. Следовательно, AMAG, приводящий к гипо- или даже ахлоргидрии, обычно проявляется только неопределенными диспептическими симптомами, такими как вздутие живота, раннее насыщение и дискомфорт в эпигастрии.78 Атрофический глоссит, который обычно проявляется в виде жжения в языке, также известен как раннее клиническое проявление. дефицита кобаламина.79
Неопластические осложнения
Заболеваемость новообразованиями желудка выше у пациентов с AMAG по сравнению с населением в целом.80,81 В целом, AMAG был связан с развитием двух типов новообразований желудка: кишечного типа GC и желудочного типа I карциноид (TIGC) .82
Рак желудка кишечного типа
Два основных фактора, которые, как известно, объясняют возникновение GC у пациентов с AMAG, – это IM и сопутствующая инфекция H. pylori , которая сама по себе является наиболее частым триггером. ИМ слизистой оболочки желудка.83 Следует отметить, что эрадикация H. pylori у пациентов с известными предраковыми поражениями (атрофия желудка, IM или дисплазия желудка) не снижает значительно частоту возникновения GC.84 Патогенез развития GC описан авторами Correa и Piazuelo85, более известный как «Каскад Корреа». Упрощенную модель каскада можно разделить на следующие этапы: 1) нормальная слизистая оболочка желудка, 2) неатрофический гастрит, 3) множественный атрофический гастрит без (первоначально) и с (позже) IM, 4) дисплазия, прогрессирующая от низкой степени до высокой степени. и 5) GC.86 Следует отметить, что AMAG без сопутствующей инфекции H. pylori не считается частью вышеупомянутого каскада. Не у всех пациентов с гастритом, вызванным H. pylori , развивается GC. Шансы выше, когда присутствуют определенные факторы вирулентности. Например, было показано, что CagA-положительные штаммы H. pylori имеют значительно более высокий риск развития язвенной болезни и GC по сравнению с CagA-отрицательными штаммами.87 Еще один хорошо известный фактор вирулентности, связанный с GC, – это Ген VacA.Вариации в этом гене можно объяснить наличием сигнальной (s) и средней (m) областей.88 Несколько исследований продемонстрировали повышенную частоту язвенной болезни и GC у пациентов, инфицированных s1m1, по сравнению с пациентами, инфицированными s2m2.89
Карциноид желудка типа I
Хотя было признано, что AMAG связан с повышенным риском развития TIGC, точная частота неизвестна. Существует три известных типа карциноидов желудка: тип I связан с AMAG, тип II может присутствовать у пациентов с множественной эндокринной неоплазией (MEN) I и синдромом Золлингера-Эллисона, а тип III, наиболее агрессивный вариант, обычно возникает спорадически.Уровни гастрина в сыворотке различаются в зависимости от типа карциноида желудка: типы I и II – высокие, а тип III – нормальные () .90 Патологические изменения T1GC инициируются потерей отрицательной обратной связи париетальными клетками на секрецию гастрина. Гипо / ахлоргидрия впоследствии приводит к гипергастринемии, которая, в свою очередь, оказывает трофическое воздействие на клетки ECL. Гиперплазия ECL с последующей дисплазией ECL считается предраковым поражением и со временем может прогрессировать до T1GC.91 Выявление полипов тела во время эндоскопии у пациентов с AMAG тесно связано с наличием TIGC.Пациенты с ТИГК обычно протекают бессимптомно, хотя могут присутствовать симптомы диспепсии и ЖДА. Поэтому диагноз обычно ставится во время гастроскопии.92
Таблица 2
Сравнение различных типов карциноидов желудка
| Параметры | Карциноид желудка | ||||
|---|---|---|---|---|---|
| Тип I | Тип II | Тип III | |||
| Частота | 65–80% | 5–6% | 14–25% | ||
| Общие в род. женщины | Половых различий нет | Чаще встречается у мужчин | |||
| Возраст (лет) | 40–60 | 45 | 50 | ||
| Сопутствующие условия | AMAG | MEN1; ZES | Нет | ||
| Эндоскопические особенности | Множественные, маленькие | Подобно типу I | Одиночные, большие, изъязвленные | ||
| Пораженные участки | Тело и глазное дно | Любое место | Любое место | Любой тип | Любой тип |
| Гастрин (уровень) | Повышенный | Повышенный | N | ||
| Гиперплазия G-клеток | Да | Нет | Нет | ||
| Да | |||||
| Ведение | Наблюдение, аналоги соматостатина, эндоскопическое или хирургическое иссечение | Аналогично типу I | Хирургическое (радикальное) | ||
| Риск метастазов в регионарные лимфатические узлы и печень | Очень низкий | Очень низкий | Очень низкий | Высокий | |
| Прогноз | Отличный | Excelle nt | Переменная | ||
Лечение
Стратегии ведения AMAG и его расширенной формы PA зависят от клинических проявлений, лабораторных и визуальных результатов.Терапия с добавлением железа, фолиевой кислоты и кобаламина обычно рекомендуется на ранних стадиях до прогрессирования ПА. Применяется пероральная добавка витамина B12, поскольку было показано, что 1% свободного витамина B12 может абсорбироваться в тонком кишечнике посредством пассивной диффузии.93 Однако пациентам с неврологическими проявлениями в настоящее время рекомендуется парентеральное введение витамина B12.
Учитывая тот факт, что AMAG тесно связан с другими аутоиммунными заболеваниями, необходимо провести соответствующее диагностическое исследование, особенно для таких заболеваний, как аутоиммунный тиреоидит и TIDM.
Выявление и последующее лечение инфекции H. pylori – еще одна очень важная терапевтическая стратегия из-за связанных рисков, связанных с коинфекцией H. pylori . Поскольку в нескольких исследованиях было подтверждено, что инфекция H. pylori может вызывать аутоиммунные процессы в слизистой оболочке желудка, включая оксинитную слизистую оболочку, эрадикация H. pylori может снизить уровни антител, связанных с AMAG, и была доказана эффективность лечения ранние стадии аутоиммунного гастрита.94,95
T1GC имеет отличный прогноз, поэтому были предложены различные подходы: наблюдение, полипэктомия и антрэктомия (удаление части желудка, продуцирующей гастрин) .96 Недавно было предложено одно из потенциальных методов лечения TIGC. Было показано, что нетазепид, антагонист рецепторов гастрина, снижает уровень CgA в плазме, а также количество и размер опухоли.97–99. Другой вариант лечения – рассмотреть возможность использования аналогов соматостатина. В одном проспективном исследовании с участием 107 человек с хроническим атрофическим гастритом авторы показали, что использование аналогов соматостатина привело к снижению среднего уровня гастрина и CgA и, таким образом, должно рассматриваться как эффективная терапия.100 Новой и появляющейся формой терапии нейроэндокринных опухолей является использование лучевой терапии пептидными рецепторами (PRRT), хотя эти новые методы лечения до настоящего времени проспективно не изучались для лечения аутоиммунного атрофического гастрита.101
Благодарности
Эта работа получила грантовая поддержка от Департамента по делам ветеранов RR&D Merit Review (JRP) I01 RX000194; Исследования на людях CORE через CURE: Исследовательский центр болезней пищеварения при поддержке NIH, грант P30DK41301 и NIH NIDDK T32 NIH5T32DK07180 (JNB).
Сноски
Раскрытие информации
Авторы сообщают об отсутствии конфликта интересов в этой работе.
Ссылки
2. Парк JY, Лам-Химлин Д., Вемулапалли Р. Обзор аутоиммунного метапластического атрофического гастрита. Gastrointest Endosc. 2013. 77 (2): 284–292. [PubMed] [Google Scholar] 3. Кармель Р., Джонсон CS. Расовые модели злокачественной анемии. Ранний возраст начала заболевания и повышенная частота антител к внутреннему фактору у чернокожих женщин. N Engl J Med. 1978. 298 (12): 647–650.[PubMed] [Google Scholar] 4. Лам-Цзе В.К., Батстра М.Р., Келеман Б.П. и др. Связь между аутоиммунным тиреоидитом, аутоиммунным гастритом и диабетом 1 типа. Pediatr Endocrinol Rev.2003; 1 (1): 22–37. [PubMed] [Google Scholar] 5. Нойман У.Л., Косс Э., Рагге М, Гента РМ. Аутоиммунный атрофический гастрит – патогенез, патология и лечение. Нат Рев Гастроэнтерол Гепатол. 2013. 10 (9): 529–541. [PubMed] [Google Scholar] 6. Силвейра П.А., Уилсон В.Е., Эстебан Л.М. и др. Идентификация генов предрасположенности к аутоиммунному гастриту Gasa3 и Gasa4 с использованием конгенных мышей и разделенных, сегрегативных анализов и анализов взаимодействий.Иммуногенетика. 2001. 53 (9): 741–750. [PubMed] [Google Scholar] 7. Baxter AG, Jordan MA, Silveira PA, Wilson WE, Van Driel IR. Генетический контроль предрасположенности к аутоиммунному гастриту. Int Rev Immunol. 2005. 24 (1–2): 55–62. [PubMed] [Google Scholar] 8. Икеда Т., Сеноуэ И., Хара М., Цуцуми Ю., Харасава С., Мива Т. Псевдополипоз желудка: новое клиническое проявление гастрита типа А. Am J Gastroenterol. 1985. 80 (2): 82–90. [PubMed] [Google Scholar] 9. Красинскас AM, Abraham SC, Metz DC, Furth EE. Псевдополипы Oxyntic слизистой оболочки: проявление атрофического аутоиммунного гастрита.Am J Surg Pathol. 2003. 27 (2): 236–241. [PubMed] [Google Scholar] 10. Джадд Л.М., Глисон П.А., То Б.Х., ван Дриел И.Р. Аутоиммунный гастрит приводит к нарушению развития эпителиальных клеток желудка. Am J Physiol. 1999; 277 (1 п.1): G209 – G218. [PubMed] [Google Scholar] 11. Хлумска А., Будова Л., Бенеш З., Замечник М. Аутоиммунный гастрит. Клинико-патологическое исследование 25 случаев. Cesk Patol. 2005. 41 (4): 137–142. [PubMed] [Google Scholar] 12. Stolte M, Bethke B, Ruhl G, Ritter M. Омепразол-индуцированная псевдогипертрофия париетальных клеток желудка.З. Гастроэнтерол. 1992. 30 (2): 134–138. [PubMed] [Google Scholar] 13. Solcia E, Fiocca R, Villani L, Luinetti O, Capella C. Гиперпластические, диспластические и неопластические энтерохромаффиноподобные пролиферации слизистой оболочки желудка. Классификация и гистогенез. Am J Surg Pathol. 1995; 19 (Приложение 1): S1 – S7. [PubMed] [Google Scholar] 14. Li P, He C, Sun L, Dong N, Yuan Y. Выражения пепсиногена I и II in situ и их корреляции с уровнями пезигногена в сыворотке при раке желудка и его предраковом заболевании.BMC Clin Pathol. 2013; 13 (1): 1–10. [Бесплатная статья PMC] [PubMed] [Google Scholar] 15. Голденринг-младший, Рэй Г.С., Коффи Р.Дж., младший и др. Обратимая лекарственная оксинитическая атрофия у крыс. Гастроэнтерология. 2000. 118 (6): 1080–1093. [PubMed] [Google Scholar] 16. Номура С., Ямагути Х., Огава М., Ван Т.С., Ли-младший, Голденринг-младший. Изменения в клонах слизистой оболочки желудка, вызванные острой кислородной атрофией у мышей дикого типа и мышей с дефицитом гастрина. Am J Physiol Gastrointest Liver Physiol. 2005; 288 (2): G362 – G375. [PubMed] [Google Scholar] 17.Нодзаки К., Огава М., Уильямс Дж. А. и др. Молекулярный признак метаплазии желудка, возникающий в ответ на острую потерю париетальных клеток. Гастроэнтерология. 2008. 134 (2): 511–522. [Бесплатная статья PMC] [PubMed] [Google Scholar] 18. Вайс В.Г., Петерсен С.П., Миллс Дж.С., Тума П.Л., Уайтхед Р.Х., Голденринг-младший. Создание новых in vitro культур главных клеток мышей и SPEM позволяет идентифицировать MAL2 как маркер метаплазии в желудке. Am J Physiol Gastrointest Liver Physiol. 2014; 307 (8): G777 – G792. [Бесплатная статья PMC] [PubMed] [Google Scholar] 19.Halldorsdottir AM, Sigurdardottrir M, Jonasson JG, et al. Спазмолитическая метаплазия, экспрессирующая полипептид (SPEM), связанная с раком желудка в Исландии. Dig Dis Sci. 2003. 48 (3): 431–441. [PubMed] [Google Scholar] 20. Голденринг Дж. Р., Нам К. Т., Ван Т. К., Миллс Дж. К., Райт Н. А.. Метаплазия, экспрессирующая спазмолитический полипептид, и кишечная метаплазия: время для переоценки метаплазий и происхождения рака желудка. Гастроэнтерология. 2010. 138 (7): 2207–2210. 2210.e1. [Бесплатная статья PMC] [PubMed] [Google Scholar] 21.Корреа П., Пиазуэло МБ, Уилсон К.Т. Патология кишечной метаплазии желудка: клинические проявления. Am J Gastroenterol. 2010. 105 (3): 493–498. [Бесплатная статья PMC] [PubMed] [Google Scholar] 22. Абрахам С.К., Сингх В.К., Ярдли Дж. Х., Ву ТТ. Гиперпластические полипы желудка: ассоциации с гистологическими паттернами гастрита и атрофии желудка. Am J Surg Pathol. 2001. 25 (4): 500–507. [PubMed] [Google Scholar] 23. Вейола Л.И., Оксанен А.М., Сиппонен П.И., Раутелин ХИК. Ассоциация аутоиммунного атрофического гастрита тела с инфекцией Helicobacter pylori .Мир Дж. Гастроэнтерол. 2010. 16 (1): 83–88. [Бесплатная статья PMC] [PubMed] [Google Scholar] 24. Негрини Р., Савио А., Поэзи С. и др. Антигенная мимикрия между Helicobacter pylori и слизистой оболочкой желудка в патогенезе атрофического гастрита тела. Гастроэнтерология. 1996. 111 (3): 655–665. [PubMed] [Google Scholar] 25. Faller G, Steininger H, Eck M, Hensen J, Hann EG, Kirchner T. Антижелудочные аутоантитела при гастрите Helicobacter pylori : распространенность, сайты связывания in-situ и ключи к клинической значимости.Арка Вирхова. 1996. 427 (5): 483–486. [PubMed] [Google Scholar] 26. Genta RM. Helicobacter pylori , воспаление, повреждение слизистой оболочки и апоптоз: патогенез и определение атрофии желудка. Гастроэнтерология. 1997; 113 (6 доп.): S51 – S55. [PubMed] [Google Scholar] 27. Торбенсон М, Абрахам С.К., Бойтнотт Дж., Ярдли Дж. Х., Ву ТТ. Аутоиммунный гастрит: отчетливые гистологические и иммуногистохимические признаки до полной потери кислородных желез. Мод Pathol. 2002. 15 (2): 102–109. [PubMed] [Google Scholar] 28.Де Ре В., Орзес Э., Канцоньери В. и др. Пепсиногены для различения пациентов с кишечной метаплазией желудка и инфекцией Helicobacter pylori среди групп риска по развитию рака желудка. Клин Транс Гастроэнтерол. 2016; 7 (7): e183. [Бесплатная статья PMC] [PubMed] [Google Scholar] 29. Касторо С., Ле Моли Р., Арпи М.Л. и др. Ассоциация аутоиммунных заболеваний щитовидной железы, хронического атрофического гастрита и карциноида желудка: опыт одного учреждения. J Endocrinol Invest. 2016; 39 (7): 779–784.[PubMed] [Google Scholar] 30. Чентанни М., Мариньяни М., Гаргано Л. и др. Атрофический гастрит тела у пациентов с аутоиммунным заболеванием щитовидной железы: недостаточно диагностированная ассоциация. Arch Intern Med. 1999. 159 (15): 1726–1730. [PubMed] [Google Scholar] 31. Де Блок CE, Де Лиу И.Х., Ван Гал Л.Ф. Аутоиммунный гастрит при диабете 1 типа: клинически ориентированный обзор. J Clin Endocrinol Metab. 2008. 93 (2): 363–371. [PubMed] [Google Scholar] 32. Несс-Абрамоф Р., Набриски Д.А., Браверман Л.Е. и др. Распространенность и оценка дефицита B12 у пациентов с аутоиммунным заболеванием щитовидной железы.Am J Med Sci. 2006. 332 (3): 119–122. [PubMed] [Google Scholar] 33. Америо П., Траканна М., Де Ремигис П. и др. Витилиго, ассоциированное с другими аутоиммунными заболеваниями: полигландулярный аутоиммунный синдром типов 3B + C и 4. Clin Exp Dermatol. 2006. 31 (5): 746–749. [PubMed] [Google Scholar] 34. Зелиссен П.М., Баст Э.Дж., Кроуз Р.Дж. Ассоциированный аутоиммунитет при болезни Аддисона. J Autoimmun. 1995. 8 (1): 121–130. [PubMed] [Google Scholar] 35. Чанг К.Х., Лю Р.К., Ро Л.С., Ву Ю.Р., Чен СМ. Сосуществование злокачественной анемии и миастении – редкое сочетание аутоиммунных заболеваний на Тайване.J Formos Med Assoc. 2006; 105 (11): 946–949. [PubMed] [Google Scholar] 36. Delva PL, MacDonell JE, MacIntosh OC. Мегалобластная анемия, возникающая одновременно у белых монозиготных близнецов женского пола. Кан Мед Асс Дж. 1965; 92 (21): 1129–1131. [Бесплатная статья PMC] [PubMed] [Google Scholar] 37. Банк С., Райан К., Томсон В., Ньюман В. Г.. Пагубная анемия – генетические открытия. Autoimmun Rev.2011; 10 (8): 455–459. [PubMed] [Google Scholar] 38. Бонафу Б., Генри Л., Дельфур С. и др. Ассоциация семейной злокачественной анемии и наследственного гемохроматоза.Acta Haematol. 2008. 119 (1): 12–14. [PubMed] [Google Scholar] 39. Русак Э., Чобот А., Кшивицка А., Венцлау Дж. Антитела против париетальных клеток – диагностическое значение. Adv Med Sci. 2016; 61 (2): 175–179. [PubMed] [Google Scholar] 40. Хан С., Дель-Дука С., Фентон Э. и др. Ограниченная ценность тестирования на антитела к внутреннему фактору с отрицательными антителами к париетальным клеткам желудка при пернициозной анемии. J Clin Pathol. 2009. 62 (5): 439–441. [PubMed] [Google Scholar] 41. Оттесен М., Фельдт-Расмуссен Ю.Ф., Андерсен Дж., Хиппе Э., Шубое А.Злокачественная анемия. Изучение начальных форм заболевания и диагностическое значение определения антител к внутреннему фактору и антител к париетальным клеткам. Ugeskr Laeger. 1992. 154 (52): 3758–3762. [PubMed] [Google Scholar] 42. Antico A, Tampoia M, Villalta D, Tonutti E, Tozzoli R, Bizzaro N. Клиническая ценность серологической биопсии желудка для диагностики хронического аутоиммунного гастрита. Clin Dev Immunol. 2012; 2012: 520970. [Бесплатная статья PMC] [PubMed] [Google Scholar] 43. Шах П., Сингх М.Х., Ян Й.X., Мец, округ Колумбия.Гипохлоргидрия и ахлоргидрия связаны с ложноположительным тестом на стимуляцию секретина при синдроме Золлингера-Эллисона. Поджелудочная железа. 2013; 42 (6): 932. [Бесплатная статья PMC] [PubMed] [Google Scholar] 44. Фан Дж., Бенхамму Дж. Н., Писенья Дж. Р. Гиперсекреторные состояния желудка: исследование и лечение. Варианты лечения Curr Gastroenterol. 2015; 13 (4): 386–397. [Бесплатная статья PMC] [PubMed] [Google Scholar] 45. Кармель Р. Пепсиногены и другие сывороточные маркеры при злокачественной анемии. Am J Clin Pathol. 1988. 90 (4): 442–445.[PubMed] [Google Scholar] 46. Уэйнрайт П., Нараянан С., Кук П. Неверный уровень витамина B12 приводит к развитию у пациента злокачественной анемии. Clin Biochem. 2015. 48 (18): 1366–1367. [PubMed] [Google Scholar] 47. Соломон LR. Кобаламин-чувствительные расстройства в амбулаторных условиях: ненадежность тестов на кобаламин, метилмалоновую кислоту и гомоцистеин. Кровь. 2005. 105 (3): 978–985. [PubMed] [Google Scholar] 48. Wu PB, Deng YZ, Shu YX, Tan SY, Li M, Fang G. Повышенные уровни CgA в плазме, связанные с неалкогольной жировой болезнью печени.Turk J Gastroenterol. 2015; 26 (5): 404–407. [PubMed] [Google Scholar] 49. Peracchi M, Gebbia C, Basilisco G и др. Хромогранин А плазмы у пациентов с аутоиммунным хроническим атрофическим гастритом, энтерохромаффиноподобными клеточными поражениями и карциноидами желудка. Eur J Endocrinol. 2005. 152 (3): 443–448. [PubMed] [Google Scholar] 50. Массирони С., Фракелли М., Пагги С. и др. Уровни хромогранина А при хроническом заболевании печени и гепатоцеллюлярной карциноме. Dig Liver Dis. 2009. 41 (1): 31–35. [PubMed] [Google Scholar] 51.Парк YH, Ким Н. Обзор атрофического гастрита и кишечной метаплазии как предракового поражения рака желудка. J Cancer Prev. 2015; 20 (1): 25–40. [Бесплатная статья PMC] [PubMed] [Google Scholar] 53. Анагностопулос Г.К., Рагунатх К., Шонде А., Хоуки К.Дж., Яо К. Диагностика аутоиммунного гастрита с помощью эндоскопии с увеличением с высоким разрешением. Мир Дж. Гастроэнтерол. 2006. 12 (28): 4586–4587. [Бесплатная статья PMC] [PubMed] [Google Scholar] 54. Номура С., Ида К., Терао С. и др. Эндоскопическая диагностика атрофии слизистой оболочки желудка: многоцентровое проспективное исследование.Dig Endosc. 2014. 26 (6): 709–719. [PubMed] [Google Scholar] 55. Диксон М.Ф., Гента Р.М., Ярдли Дж. Х., Корреа П. Классификация и классификация гастрита. Обновленная Сиднейская система. Международный семинар по гистопатологии гастрита, Хьюстон, 1994. Am J Surg Pathol. 1996. 20 (10): 1161–1181. [PubMed] [Google Scholar] 57. Сепульведа А.Р., Патил М. Практический подход к патологической диагностике гастрита. Arch Pathol Lab Med. 2008. 132 (10): 1586–1593. [PubMed] [Google Scholar] 59. Хершко С., Хоффбранд А., Керет Д. и др.Роль аутоиммунного гастрита, Helicobacter pylori и целиакии в рефрактерной или необъяснимой железодефицитной анемии. Haematologica. 2005. 90 (5): 585–595. [PubMed] [Google Scholar] 60. Гонсалвеш С., Оливейра М.Э., Палья А.М., Ферран А., Мораиш А., Лопес А.И. Аутоиммунный гастрит в детском возрасте, проявляющийся железодефицитной анемией. Мир Дж. Гастроэнтерол. 2014. 20 (42): 15780–15786. [Бесплатная статья PMC] [PubMed] [Google Scholar] 61. Мигель Н, Коста Э, Сантала М, младший и др. Рефрактерная железодефицитная анемия и аутоиммунный атрофический гастрит в детской возрастной группе: анализ 8 клинических случаев.J Pediatr Hematol Oncol. 2014. 36 (2): 134–139. [PubMed] [Google Scholar] 62. Stabler SP. Клиническая практика. Дефицит витамина B12. N Engl J Med. 2013. 368 (2): 149–160. [PubMed] [Google Scholar] 63. Теффери А., Прутхи РК. Биохимические основы дефицита кобаламина. Mayo Clin Proceed. 1994. 69 (2): 181–186. [PubMed] [Google Scholar] 64. Asimacopoulos PJ, Groves MD, Fischer DK, et al. Пагубная анемия, проявляющаяся стенокардией. Саут Мед Дж. 1994; 87 (6): 671–672. [PubMed] [Google Scholar] 65. Тадакамалла А.К., Таллури СК, Бесур С.Псевдотромботическая тромбоцитопеническая пурпура: редкое проявление злокачественной анемии. N Am J Med Sci. 2011. 3 (10): 472–474. [Бесплатная статья PMC] [PubMed] [Google Scholar] 66. Мельхем А., Десаи А., Хофманн М.А. Острый инфаркт миокарда и тромбоэмболия легочной артерии у молодого человека с тяжелой гипергомоцистеинемией, вызванной злокачественной анемией. Тромб Дж. 2009; 7 (1): 1–5. [Бесплатная статья PMC] [PubMed] [Google Scholar] 67. Шамкани В.А., Джафар Н.С., Нараянан С.Р., Раджаппан АК. Острый инфаркт миокарда у молодой женщины из-за дефицита витамина B12, вызванный гипергомоцистеинемией.Сердечные взгляды. 2015; 16 (1): 25–29. [Бесплатная статья PMC] [PubMed] [Google Scholar] 68. Метц Дж. Дефицит кобаламина и патогенез заболеваний нервной системы. Annu Rev Nutr. 1992; 12: 59–79. [PubMed] [Google Scholar] 69. Фрэнсис Г., Хохол К., Джавад З., Айер А., Тот С. Накопление метилмалоновой кислоты и развитие периферической невропатии (IN1-1.010) Неврология. 2012; 78 (1 доп.): IN1 – IN1. [Google Scholar] 70. Ралапанава DM, Jayawickreme KP, Ekanayake EM, Jayalath WA. Дефицит B (12) с неврологическими проявлениями при отсутствии анемии.BMC Res Notes. 2015; 8: 458. [Бесплатная статья PMC] [PubMed] [Google Scholar] 71. Линденбаум Дж., Хилтон Э. Б., Сэвидж Д. Г. и др. Психоневрологические расстройства, вызванные дефицитом кобаламина при отсутствии анемии или макроцитоза. N Engl J Med. 1988. 318 (26): 1720–1728. [PubMed] [Google Scholar] 72. Hemmer B, Glocker FX, Schumacher M, Deuschl G, Lücking CH. Подострая комбинированная дегенерация: данные клинической, электрофизиологической и магнитно-резонансной томографии. J Neurol Neurosurg Psychiatry. 1998. 65 (6): 822–827.[Бесплатная статья PMC] [PubMed] [Google Scholar] 73. Васконселос О.М., Поем Э.Х., Маккартер Р.Дж., Кэмпбелл В.В., Кесадо ZMN. Возможные факторы исхода при подострой комбинированной дегенерации: обзор обсервационных исследований. J Gen Intern Med. 2006. 21 (10): 1063–1068. [Бесплатная статья PMC] [PubMed] [Google Scholar] 74. Саперштейн Д.С., Барон Р.Дж. Периферическая невропатия из-за дефицита кобаламина. Варианты лечения Curr Neurol. 2002. 4 (3): 197–201. [PubMed] [Google Scholar] 75. Chu C, Scanlon P. Оптическая нейропатия, вызванная дефицитом витамина B12, обнаруженная бессимптомным скринингом.BMJ Case Rep.2011; 2011 bcr0220113823. [Бесплатная статья PMC] [PubMed] [Google Scholar] 76. Metzler D, Miller WH, Stephen Edwards C. Психиатрическое проявление дефицита витамина B-12: обновленная информация. Джефферсон Дж. Психиатрия. 1991; 9 (2) [Google Scholar] 77. Douaud G, Refsum H, de Jager CA и др. Предотвращение атрофии серого вещества, связанной с болезнью Альцгеймера, с помощью лечения витамином B. Proc Natl Acad Sci U S. A. 2013; 110 (23): 9523–9528. [Бесплатная статья PMC] [PubMed] [Google Scholar] 78. Ланер Э., Аннибале Б. Пагубная анемия: новые открытия с гастроэнтерологической точки зрения.Мир Дж. Гастроэнтерол. 2009. 15 (41): 5121–5128. [Бесплатная статья PMC] [PubMed] [Google Scholar] 79. Чжу Дж.С., Ван Ю.Ф., Шэн Дж., Чен FX, Тан Г.Й. Атрофический глоссит связывают с дефицитом кобаламина. Shanghai J Stomatol. 2013. 22 (1): 58–62. [PubMed] [Google Scholar] 80. Ваннелла Л., Ланер Э, Осборн Дж, Аннибале Б. Систематический обзор: заболеваемость раком желудка при пернициозной анемии. Алимент Pharmacol Ther. 2013. 37 (4): 375–382. [PubMed] [Google Scholar] 81. Ваннелла Л., Сброцци-Ванни А., Ланер Э. и др. Развитие карциноида желудка I типа у больных хроническим атрофическим гастритом.Алимент Pharmacol Ther. 2011. 33 (12): 1361–1369. [PubMed] [Google Scholar] 82. Ланер Э., Эспозито Дж., Галли Дж., Аннибале Б. Атрофический гастрит и предраковые поражения желудка. Перевод Gastrointest Cancer. 2015; 4 (4): 272–281. [Google Scholar] 83. Шнеллер Дж., Гупта Р., Мустафа Дж., Вильянуэва Р., Штраус Е. В., Раффаниелло Р. Д.. Инфекция Helicobacter pylori связана с высокой частотой кишечной метаплазии слизистой оболочки желудка у пациентов в городских больницах Нью-Йорка. Dig Dis Sci.2006. 51 (10): 1801–1809. [PubMed] [Google Scholar] 84. Вонг BC, Лам С.К., Вонг В.М. и др. Китайская группа по изучению рака желудка Эрадикация Helicobacter pylori для предотвращения рака желудка в регионе высокого риска в Китае: рандомизированное контролируемое исследование. ДЖАМА. 2004. 291 (2): 187–194. [PubMed] [Google Scholar] 86. Юн X, Тан Б., Ли Б-С и др. Helicobacter pylori Фактор вирулентности CagA способствует онкогенезу рака желудка посредством множественных сигнальных путей. Сигнал сотовой связи. 2015; 13 (1): 1–13.[Бесплатная статья PMC] [PubMed] [Google Scholar] 88. ван Дорн Л.Дж., Фигейредо С., Санна Р. и др. Клиническая значимость cagA, vacA и iceA статуса Helicobacter pylori . Гастроэнтерология. 1998. 115 (1): 58–66. [PubMed] [Google Scholar] 89. Вроблевски Л. Е., Пик Р. М., Уилсон К. Т.. Helicobacter pylori и рак желудка: факторы, влияющие на риск заболевания. Clin Microbiol Rev.2010; 23 (4): 713–739. [Бесплатная статья PMC] [PubMed] [Google Scholar] 90. Чжоу К., Хо В. Карциноиды желудка: классификация и диагностика.В: Pisegna RJ, редактор. Лечение нейроэндокринных опухолей поджелудочной железы. Нью-Йорк, Нью-Йорк: Springer Нью-Йорк; 2015. С. 83–93. [Google Scholar] 91. Burkitt MD, Pritchard DM. Обзорная статья: патогенез и лечение карциноидных опухолей желудка. Алимент Pharmacol Ther. 2006. 24 (9): 1305–1320. [PubMed] [Google Scholar] 92. Ли Ти, Цю Ф, Цянь З.Р., Ван Дж., Ци Х-К, Ву Би. Классификация, клинико-патологические особенности и лечение нейроэндокринных опухолей желудка. Мир Дж. Гастроэнтерол. 2014. 20 (1): 118–125. [Бесплатная статья PMC] [PubMed] [Google Scholar] 93.Андрес Э., Фотергилл Х., Месили М. Эффективность пероральной терапии кобаламином (витамин B12). Эксперт Opin Pharmacother. 2010. 11 (2): 249–256. [PubMed] [Google Scholar] 94. Столте М., Мейер Э, Майнинг А. Лечение аутоиммунного гастрита с помощью эрадикации Helicobacter pylori у 21-летнего мужчины. З. Гастроэнтерол. 1998. 36 (8): 641–643. [PubMed] [Google Scholar] 95. Фаллер Г., Винтер М., Штайнингер Х. и др. Снижение аутоантител желудка при гастрите Helicobacter pylori после излечения инфекции.Pathol Res Pract. 1999. 195 (4): 243–246. [PubMed] [Google Scholar] 97. Докрей GJ. Клиническая эндокринология и метаболизм. Гастрин. Лучшая практика Res Clin Endocrinol Metab. 2004. 18 (4): 555–568. [PubMed] [Google Scholar] 98. Мур А.Р., Бойс М., Стил И.А., Кэмпбелл Ф., Варро А., Причард Д.М. Нетазепид, антагонист рецепторов гастрина, нормализует биомаркеры опухолей и вызывает регрессию нейроэндокринных опухолей желудка 1 типа в нерандомизированном исследовании пациентов с хроническим атрофическим гастритом. PLoS One. 2013; 8 (10): e76462.[Бесплатная статья PMC] [PubMed] [Google Scholar] 99. Фоссмарк Р., Сордал О., Цзянь С.С. и др. Лечение карциноидов желудка 1 типа антагонистом гастриновых рецепторов нетазепидом (YF476) приводит к регрессии опухолей и нормализации сывороточного хромогранина A. Aliment Pharmacol Ther. 2012. 36 (11–12): 1067–1075. [PubMed] [Google Scholar] 100. Massironi S, Zilli A, Fanetti I, Ciafardini C, Conte D, Peracchi M. Прерывистое лечение рецидивирующих карциноидов желудка 1 типа аналогами соматостатина у пациентов с хроническим аутоиммунным атрофическим гастритом.Dig Liver Dis. 2015; 47 (11): 978–983. [PubMed] [Google Scholar] 101. Kwekkeboom DJ, Креннинг EP. Радионуклидная терапия пептидных рецепторов в лечении нейроэндокринных опухолей. Hematol Oncol Clin North Am. 2016; 30 (1): 179–191. [PubMed] [Google Scholar]Аутоиммунный атрофический гастрит: современные перспективы
Clin Exp Gastroenterol. 2017; 10: 19–27.
Артем Миналян
1 Отделение гастроэнтерологии, гепатологии и парентерального питания
Джихане Н. Бенхамму
1 Отделение гастроэнтерологии, гепатологии и парентерального питания 0003
904 904 Aida Парентеральное питаниеМайкл С. Льюис
2 Департамент патологии и лабораторной медицины, VA Greater Los Angeles Healthcare System, Лос-Анджелес, Калифорния, США
Джозеф Р. Писенья
1 Отделение гастроэнтерологии, гепатологии и парентерального питания
1 Отделение гастроэнтерологии, гепатологии и парентерального питания
2 Отделение патологии и лабораторной медицины, VA Greater Los Angeles Healthcare System, Лос-Анджелес, Калифорния, США
Для переписки: Joseph R Pisegna, Отдел гастроэнтерологии, гепатологии и парентеральные нутри ции, Департамент по делам ветеранов, VA Greater Los Angeles Healthcare System (691 / 111C), 11301 Wilshire Boulevard, Los Angeles, CA, USA, тел. +1 310 268 3578, факс +1 310 268 4096, электронная почта ude.alcu @ angesipj Авторские права © 2017 Minalyan et al. Эта работа опубликована и лицензирована Dove Medical Press Limited. Полные условия этой лицензии доступны по адресу https://www.dovepress.com/terms.php и включают лицензию Creative Commons Attribution – Non Commercial (unported, v3.0) License ( http://creativecommons.org/licenses/by-nc/3.0/). Получая доступ к работе, вы тем самым принимаете Условия. Некоммерческое использование работы разрешено без какого-либо дополнительного разрешения Dove Medical Press Limited при условии надлежащей атрибуции работы.Эта статья цитировалась в других статьях в PMC.Реферат
В настоящее время не существует общепринятой классификации гастрита. Первая успешная классификация (Сиднейская система), которая до сих пор широко используется профессионалами-медиками, была впервые представлена Мисевичем и др. В Сиднее в 1990 году. Фактически, это была первая подробная классификация после открытия Helicobacter pylori Уорреном и Маршаллом. в 1982 г. В 1994 г. обновленная Сиднейская система была предложена во время Международного семинара по гистопатологии гастрита, за которым последовала публикация в журнале The American Journal of Surgical Pathology Dixon et al.Используя новую классификацию, было пересмотрено различие между атрофическим и неатрофическим гастритом, и была включена визуальная шкала оценки. Согласно обновленной классификации Сиднейской системы атрофический гастрит подразделяется на многоочаговый ( H. pylori, , факторы окружающей среды, специфическая диета) и преобладающий трупный (аутоиммунный). Поскольку метаплазия является ключевой гистологической характеристикой пациентов с атрофическим гастритом, было рекомендовано использовать слово «метапластический» в обоих вариантах атрофического гастрита: аутоиммунном метапластическом атрофическом гастрите (AMAG) и метапластическом атрофическом гастрите, вызванном окружающей средой.Несмотря на то, что существует много совпадений в ходе заболевания, и различие между этими двумя объектами может быть сложной задачей, цель этой обзорной статьи состояла в описании этиологии, эпидемиологии, патогенеза, диагностики, клинических проявлений и лечения пациентов с AMAG. Однако важно отметить, что H. pylori является наиболее распространенным этиологическим фактором развития гастрита в мире.
Ключевые слова: аутоиммунный гастрит, пернициозная анемия, карциноид желудка
Эпидемиология
Распространенность злокачественной анемии (ПА; одно из отличительных проявлений аутоиммунного метапластического атрофического гастрита [AMAG]) составляет ~ 0.1% среди населения в целом и ~ 2% среди лиц старше 60 лет.1 В течение многих лет предполагалось, что ПА является заболеванием пожилых женщин североевропейской национальности. Впоследствии было показано, что распространенность ПА одинакова среди всех популяций (белых, афроамериканцев и небелых латиноамериканцев) .2 Основываясь на анализе данных 156 пациентов, страдающих ПА, в 1978 году Кармель и Джонсон3 пришли к выводу, У чернокожих женщин ПА развивается в более молодом возрасте, чем у женщин всех других рас (53 ± 16 лет, p <0.001). Подобно другим аутоиммунным заболеваниям, AMAG чаще встречается у женщин, чем у мужчин (соотношение 3: 1). Сильная связь между AMAG и другими аутоиммунными заболеваниями хорошо задокументирована.4 Считается, что AMAG и PA могут недооцениваться во всех частях мира. Одним из объяснений может быть тот факт, что почти все формы микро- и макроцитарной анемии лечатся железом, фолиевой кислотой и кобаламином без дальнейшего определения этиологии анемии. Более того, во многих случаях образцы биопсии слизистой оболочки желудка неадекватны или взяты не в том месте.5
Патогенез
Понимание патогенеза AMAG несколько затруднительно по нескольким причинам: 1) распространенность AMAG относительно низкая, 2) во многих случаях имеется сопутствующий гастрит, вызванный Helicobacter pylori и , и 3) нет или минимальные проявления присутствуют на ранних стадиях заболевания. Тем не менее мы знаем, что как генетические факторы, так и факторы окружающей среды играют роль в развитии аутоиммунного гастрита. Используя мышиные модели, можно было обнаружить гены предрасположенности к аутоиммунному гастриту ( Gasa1, 2, 3 и 4 ) на хромосомах 4 и 6 и в области h3.Интересно, что три из этих гена расположены в том же локусе, что и гены восприимчивости к сахарному диабету (СД) мышей, не страдающих ожирением, что может объяснить сильную связь между AMAG и СД 1 типа (СД1) .6,7
Несмотря на отсутствие ожирения Для понимания сложных этапов патогенеза AMAG гистологические изменения хорошо изучены (и). Первоначальные изменения включают инфильтрацию кислородной слизистой оболочки лимфоцитами и плазматическими клетками. Неравномерное разрушение париетальных клеток с сохранившимися островками относительно нормальной оксинтической слизистой оболочки приводит к появлению «островков в море».Это явление, также известное как псевдополипоз желудка, похоже на поражение толстой кишки у пациентов с язвенным колитом.8,9 Гипохлоргидрия, или снижение / потеря секреции соляной кислоты, затем развивается в результате комбинации двух факторов: 1) потеря кислородной слизистой оболочки и 2) нарушение созревания париетальных клеток.10 Отсутствие отрицательной обратной связи от париетальных клеток вызывает гиперплазию G-клеток и повышенную желудочную секрецию в истерике, что, в свою очередь, приводит к псевдогипертрофии париетальных клеток, напоминающей ингибитор протонной помпы. индуцированное воздействие на париетальные клетки.11 Стоит отметить, что это явление не может развиваться в атрофических железах, поскольку антитела против париетальных клеток также избирательно связываются с H + / K + АТФазой. 12 Еще одним важным эффектом повышенной желудочной секреции является его прямая стимуляция и пролиферация энтерохромаффиноподобных (ECL) клетки, которые зависят от степени тяжести и могут быть гиперпластическими, диспластическими и неопластическими.13 Развитие гиперплазии клеток ECL до неопластического подтипа может привести к образованию карциноидной опухоли, что будет описано ниже.В теле и дне желудка развиваются области метаплазии: псевдопилорическая, кишечная метаплазия (IM) и панкреатическая. Псевдопилорическая метаплазия («оксинтическая антрализация») развивается в оксинтических железах из секретирующих слизь клеток, фенотипически напоминающих клетки слизистой антрального отдела. Хотя гистологически псевдопилорическая метаплазия может быть неотличима от клеток антральной железы, иммуноокрашивание пепсиногеном (PG) может быть полезным для дифференциации: пепсиноген I (PGI) характерен для клеток оксинтной слизистой оболочки и отсутствует в антральном отделе.14 В последнее время широко используется новый термин для описания псевдопилорической метаплазии: метаплазия, экспрессирующая спазмолитический полипептид (SPEM). Этиология СПЭМ не ясна. Было предложено несколько теорий: 1) длительное воспаление кислородной слизистой оболочки, 2) острое прямое действие токсических веществ на париетальные клетки (DMP-777) 15,16 и 3) трансдифференцировка главных клеток.17 Главные клетки и SPEM экспрессируют MAL2. Этот белок участвует в транспортировке везикул и считается первым белком трафика, который активируется в SPEM.18 Было показано, что SPEM представляет собой пренеопластическое поражение желудка, 19 которое также может трансформироваться в IM. 20 IM представляет собой замену железистого, фовеолярного и поверхностного эпителия слизистой оболочки желудка эпителием кишечника. В зависимости от гистологических особенностей были описаны два подтипа: тонкий кишечник и толстый кишечник. Их, в свою очередь, можно сгруппировать в три типа: тип 1 или тонкий кишечник, с щеточной каймой, «полные», которые полностью замещены эпителием тонкого кишечника со всеми типами клеток (бокаловидные, панетические и т. Д.), Экспрессирующие сиаломуцины. .Тип 3, или тип толстой кишки, без щеточной каймы, «неполный», представляют собой метапластические клетки, которые образуются по соседству с нормальными клетками желудка, экспрессируют сульфомуцины. Тип 2, или тип толстой кишки, без щеточной каймы, «неполный», где метаплазия подобна типу 3, экспрессирует муцины как желудка, так и кишечника.21 Помимо вышеупомянутых патологических изменений, воспалительные и гиперпластические полипы развиваются на более поздних стадиях AMAG. 22 Oxyntic слизистая может полностью отсутствовать на запущенной стадии заболевания.
Биопсия желудка человека показывает атрофию желудочной железы.
Биопсия желудка человека показывает лимфоцитарный инфильтрат.
Связь с
H. pyloriХорошо известно, что H. pylori может вызывать атрофический гастрит сам по себе. С другой стороны, важно помнить, что во многих случаях пациенты с AMAG могут иметь сопутствующую инфекцию H. pylori .23 Третий возможный сценарий – прогрессирование гастрита, вызванного H. pylori , в AMAG.Считается, что этиологией этого процесса является антигенная мимикрия или перекрестная реактивность. 24 Многие пациенты с H. pylori вырабатывают широкий спектр антител, включая антифовеолярные, антиканаликулярные и классический APCA. Наиболее часто обнаруживаемыми антителами являются антиканаликулярные антитела, которые, как и APCA, направлены против H + / K + АТФазы (протонной помпы) .25 Несмотря на множество совпадений в ходе заболевания, важно дифференцировать AMAG от H. pylori – индуцированный гастрит.AMAG влияет только на тело и дно желудка, в то время как поражения, вызванные H. pylori , имеют мультифокальный характер () .26 Другими важными факторами, которые помогают дифференцировать AMAG и H. pylori-индуцированный гастрит , являются 1 ) Гиперплазия ECL (чаще встречается при AMAG), 2) псевдогипертрофия париетальных клеток (при AMAG; может быть замечена в инфекции H. pylori , вторичной по отношению к применению ингибитора протонной помпы) и 3) поражение оксинных желез (более часто при AMAG).
Таблица 1
Сравнение AMAG с H.pylori -индуцированный атрофический гастрит
| Характеристики | Тип атрофического гастрита | |||
|---|---|---|---|---|
| Аутоиммунный метапластический | H. pylori индуцированный | |||
| Характер распределения | Тело и глазное дно (антральное отверстие сохраняется) | Гиперфокальное | Распространенное | EC Редко |
| Псевдогипертрофия париетальных клеток | Часто | Обычно вторично по отношению к использованию ИПП | ||
| Поражение оксинтных желез | Часто | Редко | ||
| Воспалительные изменения в плазме крови похожие на поражения | ||||
| Глубина воспаления | Собственная пластинка обычно поражена | Поверхностные слои | ||
| Уровень гастрина-17 | Высокий | Низкий, но может быть повышен | ||
| Уровень пепсиногена | ||||
| Пепсиноген Нормальный 9 0589 | ||||
| Уровень пепсиногена II | Нормальный | Различный | ||
| Антитела | Против париетальных клеток и внутреннего фактора | Против H.pylori | ||
| Клинические проявления | Бессимптомное течение или диспепсия; симптомы ассоциированных аутоиммунных состояний | Бессимптомные или диспепсия | ||
| Риск новообразований желудка | Повышенный риск рака желудка и карциноидов | Кроме того, повышенный риск рака желудка и карциноидов | ||
Связь с другими аутоиммунными состояниями
Хорошо известно, что AMAG имеет тенденцию чаще встречаться у пациентов с другими аутоиммунными состояниями.29 До одной трети пациентов с аутоиммунным заболеванием щитовидной железы (AITD) и 6–10% пациентов с TIDM имеют сопутствующий AMAG.30,31 Известно, что пациенты с полигландулярными аутоиммунными (PGA) синдромами (особенно PGA типа 3B, который всегда включает AITD) имеют высокую распространенность PA.32 Другие аутоиммунные состояния, которые, как известно, встречаются вместе с AMAG (или его распространенная форма PA) – это витилиго, болезнь Аддисона, миастения и периоральные кожные аутоиммунные состояния (особенно, эрозивный красный плоский лишай) 33–35
Были описаны семейные случаи злокачественной анемии (FPA), в том числе у близнецов, что предполагает генетический компонент болезни.36 Однако необходимо провести дополнительные исследования, чтобы пролить больше света на то, как генетические вариации предрасполагают к развитию AMAG.37 В литературе также описаны очень редкие случаи сосуществования двух наследственных заболеваний (FPA и наследственный гемохроматоз) .38
Диагноз
В этом разделе мы обсуждаем наиболее распространенные диагностические тесты, используемые для скрининга и подтверждения диагноза AMAG: серологические тесты, эндоскопия и гистопатология.
Серологические тесты
Обнаружение специфических антител было признано эффективным методом для целей скрининга и подтверждения.Среди антител, используемых для диагностики AMAG, наиболее широко используется следующая группа: APCA, антитела против внутреннего фактора (AIFA) и антитела против H. pylori (анти-HP-IgM и анти-HP-IgG). Значение измерения анти-HP-антител связано с частым сосуществованием гастрита, вызванного H. pylori , и AMAG. Известно, что APCA имеют высокую чувствительность (~ 80%), но низкую специфичность для PA.39 Напротив, AIFA менее чувствительны (~ 50%), но более специфичны для PA.40 У пациентов с ПА и отрицательным результатом AIFA сероконверсия может произойти позже по ходу заболевания. 41 Измерение уровня гастрина (в основном гастрина-17) – еще один диагностический тест, который может быть отклонен от нормы у пациентов с AMAG из-за атрофии кислородных желез, ведущей к к повышенной продукции гастрина G-клетками антрального отдела. Комбинированный анализ APCA, AIFA и анти-HP-антител вместе с измерением сывороточного гастрина (гастрина-17) также известен как «серологическая биопсия желудка». Было признано, что он эффективен для диагностических целей и хорошо коррелирует с гистологическими данными.42
Наблюдаемую гипергастринемию клинически трудно отличить от других причин гипергастринемии. Один из методов определения причины гипергастринемии – измерение уровня продукции желудочного сока. При атрофическом гастрите уровень выделения желудочного сока низкий (<5 мЭкв / ч), тогда как при гипергастринемии, связанной с синдромом Золлингера-Эллисона, выделение желудочного сока составляет> 10 мЭкв / ч. Кроме того, секретиновый тест дает отрицательный результат у> 80% пациентов.43 Другой часто упускаемой из виду причиной гипергастринемии является обструкция выходного отверстия желудка и нарушение моторики желудка, для оценки которых может потребоваться эндоскопия верхних отделов желудка и радиологические исследования.При нарушении моторики желудка комплемент париетальных клеток будет либо нормальным, либо увеличенным.44 Измерение PGI и PGII, а также соотношения PGI / PGII также может быть использовано для подозрения на AMAG. В частности, PGI секретируется главными клетками оксинтической слизистой оболочки тела и дна желудка, в то время как PGII продуцируется главными клетками и клетками слизистой шеи всей слизистой оболочки желудка. Следовательно, оксинтическая атрофия характерна для AMAG, что приводит к снижению уровня PGI наряду с низким соотношением PGI / PGII (<3).45 Уровень PGII в основном не зависит от атрофии оксинитной слизистой оболочки.
Пациентам с лабораторным подтверждением макроцитарной анемии требуется измерение уровня витамина B12 в сыворотке крови. При высоком подозрении на PA за нормальным уровнем витамина B12 должны следовать измерения гомоцистеина (HCys) и метилмалоновой кислоты (MMA ).46 Однако также было показано, что уровни сыворотки всех трех тестов (витамин B12, HCys и MMA) может меняться с течением времени и даже быть нормальным при расстройствах, связанных с кобаламином.47
Измерение уровня хромогранина A (CgA) в плазме было предложено для диагностики AMAG, гиперплазии ECL и карциноидов желудка. Было обнаружено, что уровни CgA хорошо коррелируют со степенью гиперплазии ECL у пациентов с AMAG. В одном исследовании считается, что повышенный уровень CgA связан с развитием неалкогольной жировой болезни печени (НАЖБП), и в настоящее время проводится дополнительное исследование.48 В то же время специфичность уровня CgA слишком низкая (23%), чтобы выявить желудочный карциноиды в этой группе пациентов.49
В других состояниях CgA может приводить к ложноположительным результатам, в том числе при воспалительных заболеваниях кишечника, гепатоцеллюлярной карциноме50 или других состояниях, например, при хроническом применении ингибиторов протонной помпы или при почечной недостаточности.
Эндоскопия
В западных странах эндоскопические методы диагностики AMAG использовались в основном для целей биопсии. Ограничения, связанные с эндоскопией, следующие: 1) низкая чувствительность, 2) низкая специфичность и 3) вариабельность между наблюдателями.51 Однако с появлением новых эндоскопических методов (увеличивающая эндоскопия, узкополосная визуализация [NBI] и автофлуоресцентная визуализация [AFI]) стало возможным обнаруживать минимальные атрофические изменения слизистой оболочки желудка52. показали, что нормальные микрососуды тела желудка и слизистой оболочки глазного дна характеризуются наличием 1) субэпителиальной капиллярной сети (SECN), напоминающей соты, и 2) собирающих венул правильной формы и внешнего вида. У пациентов с атрофическим гастритом этих нормальных результатов не наблюдается.53 Стоит отметить, что ни один из результатов эндоскопии не должен использоваться отдельно для постановки диагноза атрофического гастрита. Фактически, их комбинация (например, сосудистый рисунок и отек area gastrica ) может значительно улучшить диагностическую точность.54 Как упоминалось ранее, у пациентов с высоким подозрением на атрофический гастрит для получения образцов биопсии использовалась эндоскопия. Согласно обновленным рекомендациям Сиднейской системы, необходимо получить пять образцов биопсии: два из тела, два из антрального отдела и один из инцизуры угловой.55
Гистопатология
Биопсия с последующей гистологией считается наиболее надежным методом диагностики метапластического атрофического гастрита. Видны изменения, описанные в разделе «Патогенез». В некоторых случаях при наличии сильного воспаления достоверно оценить кислородную атрофию сложно. Другое ограничение может возникнуть при интерпретации гистологических результатов пациентов с ранними стадиями AMAG. Было предложено несколько диагностических указаний, которые могут быть характерны для AMAG перед глубокой потерей оксинтной слизистой оболочки: 1) инфильтраты лимфоцитов и плазматических клеток в lamina propria, 2) очаговая атрофия кислородной слизистой оболочки вместе с SPEM или IM, 3) псевдогипертрофия париетальных клеток и 4) гиперплазия ECL (по крайней мере, линейный уровень).
Поскольку гиперплазия ECL является предшественником карциноидных опухолей желудка, важно окрашивать образцы тела и дна CgA и синаптофизином.56 Кроме того, окрашивание на гастрин (отрицательное в случае биопсии тела / дна) может помочь в локализации места поражения образец биопсии.57
Клинические проявления
Симптомы, связанные с атрофическим гастритом, развиваются медленно и, по сути, могут иметь длительный бессимптомный период. Во многих случаях сложно диагностировать AMAG или его запущенную форму PA только на основании клинических проявлений.Пораженные пациенты могут иметь различные признаки и симптомы, начиная от слабости и заканчивая тяжелыми неврологическими проявлениями, такими как паранойя (мегалобластное безумие) .58 Вот почему среди медицинских работников ПА также известен как «великий претендент». В этой статье мы хотели бы разделить клинические проявления на три основные группы: гематологические, неврологические и желудочно-кишечные.
Гематологические проявления
Железодефицитная анемия (ЖДА) – одно из самых ранних проявлений АМАГ, которое развивается из-за ахлоргидрии в результате кислородной атрофии.Несколько исследований показали, что рефрактерная или необъяснимая ЖДА должна усиливать подозрения клиницистов на АМАГ не только у взрослых, но и у детей. 59–61 ПА является наиболее частой причиной дефицита кобаламина.62 Хотя лежащие в основе механизмы того, как дефицит кобаламина вызывает мегалобластоз, до конца не выяснены, считается, что это связано с важной ролью кобаламина в синтезе ДНК.63 Бессимптомное увеличение среднего корпускулярного объема и гиперсегментированных нейтрофилов обычно являются первоначальными лабораторными данными при ПА.По мере прогрессирования заболевания пациенты могут жаловаться на слабость, головокружение и сердцебиение. На поздних стадиях могут проявляться симптомы стенокардии и застойной сердечной недостаточности (периферические отеки и одышка). 64 Другие очень важные лабораторные данные включают тромбоцитопению, повышение уровня ЛДГ и билирубина (признаки гемолиза). В редких случаях шистоциты в периферическом мазке могут имитировать другие более серьезные состояния, такие как диссеминированная внутрисосудистая коагулопатия (ДВС) или тромботическая тромбоцитопеническая пурпура / гемолитико-уремический синдром (ТТП / ГУС).65 Дефицит кобаламина был связан с повышенным риском тромбоза, вероятно, в результате гипергомоцистеинемии. Повышенный уровень HCys вызывает эндоваскулярную дисфункцию. Это, в свою очередь, активирует систему свертывания, увеличивает агрегацию тромбоцитов и сужает сосуды. Острый инфаркт миокарда и тромбоэмболия легочной артерии были описаны у молодых пациентов с тяжелой гипергомоцистеинемией, вторичной по отношению к РА. 66,67
Неврологические проявления
Неврологические проявления дефицита кобаламина долгое время были связаны с демиелинизацией с последующим повреждением аксонов и, в конечном итоге, гибелью нейронов.68 Патофизиологические изменения до конца не изучены, однако было установлено, что накопление ММА оказывает прямое влияние на образование миелина и связано с множеством неврологических проблем у пациентов с дефицитом кобаламина.69 Интересно, что неврологические симптомы, связанные с дефицитом кобаламина, могут присутствовать в отсутствие гематологических изменений.70,71 Подострая комбинированная дегенерация (ВСС) – одно из наиболее ярких неврологических проявлений ПА. Поражаются задние и боковые столбики шейного и верхнегрудного сегментов спинного мозга.Это приводит к сенсорным аномалиям (обычно начальным симптомам), таким как потеря вибрационных ощущений и ощущений положения вместе с дистальными парестезиями. На поздних стадиях также может быть поражен кортикоспинальный тракт.72 Хотя во многих ситуациях неврологическое повреждение является необратимым, крайне важно своевременно лечить этих пациентов парентеральным введением витамина B12, чтобы остановить прогрессирование и улучшить неврологический дефицит.73 Еще одной проблемой является периферическая нейропатия. общее неврологическое проявление ПА. Первоначальные симптомы включают парестезию и онемение нижних конечностей.В связи с этим может быть очень трудно клинически отличить периферическую невропатию от ВСС.74 В медицинской литературе описаны как бессимптомные, так и явные случаи оптической невропатии.75
Нейропсихиатрические состояния, связанные с ПА, включают манию, депрессию, обсессивно-компульсивное расстройство (ОКР), психоз и деменция.76 Следует отметить, что использование высоких доз витаминов B12, B6 и фолиевой кислоты замедляет сокращение всего мозга, а также снижает церебральную атрофию у пациентов с болезнью Альцгеймера. болезнь (AD).77
Желудочно-кишечные проявления
Как ни странно, АМАГ редко вызывает желудочно-кишечные симптомы. Было высказано предположение, что это связано с тем, что большинство жалоб со стороны верхних отделов желудочно-кишечного тракта являются вторичными по отношению к повышенному уровню соляной кислоты. Следовательно, AMAG, приводящий к гипо- или даже ахлоргидрии, обычно проявляется только неопределенными диспептическими симптомами, такими как вздутие живота, раннее насыщение и дискомфорт в эпигастрии.78 Атрофический глоссит, который обычно проявляется в виде жжения в языке, также известен как раннее клиническое проявление. дефицита кобаламина.79
Неопластические осложнения
Заболеваемость новообразованиями желудка выше у пациентов с AMAG по сравнению с населением в целом.80,81 В целом, AMAG был связан с развитием двух типов новообразований желудка: кишечного типа GC и желудочного типа I карциноид (TIGC) .82
Рак желудка кишечного типа
Два основных фактора, которые, как известно, объясняют возникновение GC у пациентов с AMAG, – это IM и сопутствующая инфекция H. pylori , которая сама по себе является наиболее частым триггером. ИМ слизистой оболочки желудка.83 Следует отметить, что эрадикация H. pylori у пациентов с известными предраковыми поражениями (атрофия желудка, IM или дисплазия желудка) не снижает значительно частоту возникновения GC.84 Патогенез развития GC описан авторами Correa и Piazuelo85, более известный как «Каскад Корреа». Упрощенную модель каскада можно разделить на следующие этапы: 1) нормальная слизистая оболочка желудка, 2) неатрофический гастрит, 3) множественный атрофический гастрит без (первоначально) и с (позже) IM, 4) дисплазия, прогрессирующая от низкой степени до высокой степени. и 5) GC.86 Следует отметить, что AMAG без сопутствующей инфекции H. pylori не считается частью вышеупомянутого каскада. Не у всех пациентов с гастритом, вызванным H. pylori , развивается GC. Шансы выше, когда присутствуют определенные факторы вирулентности. Например, было показано, что CagA-положительные штаммы H. pylori имеют значительно более высокий риск развития язвенной болезни и GC по сравнению с CagA-отрицательными штаммами.87 Еще один хорошо известный фактор вирулентности, связанный с GC, – это Ген VacA.Вариации в этом гене можно объяснить наличием сигнальной (s) и средней (m) областей.88 Несколько исследований продемонстрировали повышенную частоту язвенной болезни и GC у пациентов, инфицированных s1m1, по сравнению с пациентами, инфицированными s2m2.89
Карциноид желудка типа I
Хотя было признано, что AMAG связан с повышенным риском развития TIGC, точная частота неизвестна. Существует три известных типа карциноидов желудка: тип I связан с AMAG, тип II может присутствовать у пациентов с множественной эндокринной неоплазией (MEN) I и синдромом Золлингера-Эллисона, а тип III, наиболее агрессивный вариант, обычно возникает спорадически.Уровни гастрина в сыворотке различаются в зависимости от типа карциноида желудка: типы I и II – высокие, а тип III – нормальные () .90 Патологические изменения T1GC инициируются потерей отрицательной обратной связи париетальными клетками на секрецию гастрина. Гипо / ахлоргидрия впоследствии приводит к гипергастринемии, которая, в свою очередь, оказывает трофическое воздействие на клетки ECL. Гиперплазия ECL с последующей дисплазией ECL считается предраковым поражением и со временем может прогрессировать до T1GC.91 Выявление полипов тела во время эндоскопии у пациентов с AMAG тесно связано с наличием TIGC.Пациенты с ТИГК обычно протекают бессимптомно, хотя могут присутствовать симптомы диспепсии и ЖДА. Поэтому диагноз обычно ставится во время гастроскопии.92
Таблица 2
Сравнение различных типов карциноидов желудка
| Параметры | Карциноид желудка | ||||
|---|---|---|---|---|---|
| Тип I | Тип II | Тип III | |||
| Частота | 65–80% | 5–6% | 14–25% | ||
| Общие в род. женщины | Половых различий нет | Чаще встречается у мужчин | |||
| Возраст (лет) | 40–60 | 45 | 50 | ||
| Сопутствующие условия | AMAG | MEN1; ZES | Нет | ||
| Эндоскопические особенности | Множественные, маленькие | Подобно типу I | Одиночные, большие, изъязвленные | ||
| Пораженные участки | Тело и глазное дно | Любое место | Любое место | Любой тип | Любой тип |
| Гастрин (уровень) | Повышенный | Повышенный | N | ||
| Гиперплазия G-клеток | Да | Нет | Нет | ||
| Да | |||||
| Ведение | Наблюдение, аналоги соматостатина, эндоскопическое или хирургическое иссечение | Аналогично типу I | Хирургическое (радикальное) | ||
| Риск метастазов в регионарные лимфатические узлы и печень | Очень низкий | Очень низкий | Очень низкий | Высокий | |
| Прогноз | Отличный | Excelle nt | Переменная | ||
Лечение
Стратегии ведения AMAG и его расширенной формы PA зависят от клинических проявлений, лабораторных и визуальных результатов.Терапия с добавлением железа, фолиевой кислоты и кобаламина обычно рекомендуется на ранних стадиях до прогрессирования ПА. Применяется пероральная добавка витамина B12, поскольку было показано, что 1% свободного витамина B12 может абсорбироваться в тонком кишечнике посредством пассивной диффузии.93 Однако пациентам с неврологическими проявлениями в настоящее время рекомендуется парентеральное введение витамина B12.
Учитывая тот факт, что AMAG тесно связан с другими аутоиммунными заболеваниями, необходимо провести соответствующее диагностическое исследование, особенно для таких заболеваний, как аутоиммунный тиреоидит и TIDM.
Выявление и последующее лечение инфекции H. pylori – еще одна очень важная терапевтическая стратегия из-за связанных рисков, связанных с коинфекцией H. pylori . Поскольку в нескольких исследованиях было подтверждено, что инфекция H. pylori может вызывать аутоиммунные процессы в слизистой оболочке желудка, включая оксинитную слизистую оболочку, эрадикация H. pylori может снизить уровни антител, связанных с AMAG, и была доказана эффективность лечения ранние стадии аутоиммунного гастрита.94,95
T1GC имеет отличный прогноз, поэтому были предложены различные подходы: наблюдение, полипэктомия и антрэктомия (удаление части желудка, продуцирующей гастрин) .96 Недавно было предложено одно из потенциальных методов лечения TIGC. Было показано, что нетазепид, антагонист рецепторов гастрина, снижает уровень CgA в плазме, а также количество и размер опухоли.97–99. Другой вариант лечения – рассмотреть возможность использования аналогов соматостатина. В одном проспективном исследовании с участием 107 человек с хроническим атрофическим гастритом авторы показали, что использование аналогов соматостатина привело к снижению среднего уровня гастрина и CgA и, таким образом, должно рассматриваться как эффективная терапия.100 Новой и появляющейся формой терапии нейроэндокринных опухолей является использование лучевой терапии пептидными рецепторами (PRRT), хотя эти новые методы лечения до настоящего времени проспективно не изучались для лечения аутоиммунного атрофического гастрита.101
Благодарности
Эта работа получила грантовая поддержка от Департамента по делам ветеранов RR&D Merit Review (JRP) I01 RX000194; Исследования на людях CORE через CURE: Исследовательский центр болезней пищеварения при поддержке NIH, грант P30DK41301 и NIH NIDDK T32 NIH5T32DK07180 (JNB).
Сноски
Раскрытие информации
Авторы сообщают об отсутствии конфликта интересов в этой работе.
Ссылки
2. Парк JY, Лам-Химлин Д., Вемулапалли Р. Обзор аутоиммунного метапластического атрофического гастрита. Gastrointest Endosc. 2013. 77 (2): 284–292. [PubMed] [Google Scholar] 3. Кармель Р., Джонсон CS. Расовые модели злокачественной анемии. Ранний возраст начала заболевания и повышенная частота антител к внутреннему фактору у чернокожих женщин. N Engl J Med. 1978. 298 (12): 647–650.[PubMed] [Google Scholar] 4. Лам-Цзе В.К., Батстра М.Р., Келеман Б.П. и др. Связь между аутоиммунным тиреоидитом, аутоиммунным гастритом и диабетом 1 типа. Pediatr Endocrinol Rev.2003; 1 (1): 22–37. [PubMed] [Google Scholar] 5. Нойман У.Л., Косс Э., Рагге М, Гента РМ. Аутоиммунный атрофический гастрит – патогенез, патология и лечение. Нат Рев Гастроэнтерол Гепатол. 2013. 10 (9): 529–541. [PubMed] [Google Scholar] 6. Силвейра П.А., Уилсон В.Е., Эстебан Л.М. и др. Идентификация генов предрасположенности к аутоиммунному гастриту Gasa3 и Gasa4 с использованием конгенных мышей и разделенных, сегрегативных анализов и анализов взаимодействий.Иммуногенетика. 2001. 53 (9): 741–750. [PubMed] [Google Scholar] 7. Baxter AG, Jordan MA, Silveira PA, Wilson WE, Van Driel IR. Генетический контроль предрасположенности к аутоиммунному гастриту. Int Rev Immunol. 2005. 24 (1–2): 55–62. [PubMed] [Google Scholar] 8. Икеда Т., Сеноуэ И., Хара М., Цуцуми Ю., Харасава С., Мива Т. Псевдополипоз желудка: новое клиническое проявление гастрита типа А. Am J Gastroenterol. 1985. 80 (2): 82–90. [PubMed] [Google Scholar] 9. Красинскас AM, Abraham SC, Metz DC, Furth EE. Псевдополипы Oxyntic слизистой оболочки: проявление атрофического аутоиммунного гастрита.Am J Surg Pathol. 2003. 27 (2): 236–241. [PubMed] [Google Scholar] 10. Джадд Л.М., Глисон П.А., То Б.Х., ван Дриел И.Р. Аутоиммунный гастрит приводит к нарушению развития эпителиальных клеток желудка. Am J Physiol. 1999; 277 (1 п.1): G209 – G218. [PubMed] [Google Scholar] 11. Хлумска А., Будова Л., Бенеш З., Замечник М. Аутоиммунный гастрит. Клинико-патологическое исследование 25 случаев. Cesk Patol. 2005. 41 (4): 137–142. [PubMed] [Google Scholar] 12. Stolte M, Bethke B, Ruhl G, Ritter M. Омепразол-индуцированная псевдогипертрофия париетальных клеток желудка.З. Гастроэнтерол. 1992. 30 (2): 134–138. [PubMed] [Google Scholar] 13. Solcia E, Fiocca R, Villani L, Luinetti O, Capella C. Гиперпластические, диспластические и неопластические энтерохромаффиноподобные пролиферации слизистой оболочки желудка. Классификация и гистогенез. Am J Surg Pathol. 1995; 19 (Приложение 1): S1 – S7. [PubMed] [Google Scholar] 14. Li P, He C, Sun L, Dong N, Yuan Y. Выражения пепсиногена I и II in situ и их корреляции с уровнями пезигногена в сыворотке при раке желудка и его предраковом заболевании.BMC Clin Pathol. 2013; 13 (1): 1–10. [Бесплатная статья PMC] [PubMed] [Google Scholar] 15. Голденринг-младший, Рэй Г.С., Коффи Р.Дж., младший и др. Обратимая лекарственная оксинитическая атрофия у крыс. Гастроэнтерология. 2000. 118 (6): 1080–1093. [PubMed] [Google Scholar] 16. Номура С., Ямагути Х., Огава М., Ван Т.С., Ли-младший, Голденринг-младший. Изменения в клонах слизистой оболочки желудка, вызванные острой кислородной атрофией у мышей дикого типа и мышей с дефицитом гастрина. Am J Physiol Gastrointest Liver Physiol. 2005; 288 (2): G362 – G375. [PubMed] [Google Scholar] 17.Нодзаки К., Огава М., Уильямс Дж. А. и др. Молекулярный признак метаплазии желудка, возникающий в ответ на острую потерю париетальных клеток. Гастроэнтерология. 2008. 134 (2): 511–522. [Бесплатная статья PMC] [PubMed] [Google Scholar] 18. Вайс В.Г., Петерсен С.П., Миллс Дж.С., Тума П.Л., Уайтхед Р.Х., Голденринг-младший. Создание новых in vitro культур главных клеток мышей и SPEM позволяет идентифицировать MAL2 как маркер метаплазии в желудке. Am J Physiol Gastrointest Liver Physiol. 2014; 307 (8): G777 – G792. [Бесплатная статья PMC] [PubMed] [Google Scholar] 19.Halldorsdottir AM, Sigurdardottrir M, Jonasson JG, et al. Спазмолитическая метаплазия, экспрессирующая полипептид (SPEM), связанная с раком желудка в Исландии. Dig Dis Sci. 2003. 48 (3): 431–441. [PubMed] [Google Scholar] 20. Голденринг Дж. Р., Нам К. Т., Ван Т. К., Миллс Дж. К., Райт Н. А.. Метаплазия, экспрессирующая спазмолитический полипептид, и кишечная метаплазия: время для переоценки метаплазий и происхождения рака желудка. Гастроэнтерология. 2010. 138 (7): 2207–2210. 2210.e1. [Бесплатная статья PMC] [PubMed] [Google Scholar] 21.Корреа П., Пиазуэло МБ, Уилсон К.Т. Патология кишечной метаплазии желудка: клинические проявления. Am J Gastroenterol. 2010. 105 (3): 493–498. [Бесплатная статья PMC] [PubMed] [Google Scholar] 22. Абрахам С.К., Сингх В.К., Ярдли Дж. Х., Ву ТТ. Гиперпластические полипы желудка: ассоциации с гистологическими паттернами гастрита и атрофии желудка. Am J Surg Pathol. 2001. 25 (4): 500–507. [PubMed] [Google Scholar] 23. Вейола Л.И., Оксанен А.М., Сиппонен П.И., Раутелин ХИК. Ассоциация аутоиммунного атрофического гастрита тела с инфекцией Helicobacter pylori .Мир Дж. Гастроэнтерол. 2010. 16 (1): 83–88. [Бесплатная статья PMC] [PubMed] [Google Scholar] 24. Негрини Р., Савио А., Поэзи С. и др. Антигенная мимикрия между Helicobacter pylori и слизистой оболочкой желудка в патогенезе атрофического гастрита тела. Гастроэнтерология. 1996. 111 (3): 655–665. [PubMed] [Google Scholar] 25. Faller G, Steininger H, Eck M, Hensen J, Hann EG, Kirchner T. Антижелудочные аутоантитела при гастрите Helicobacter pylori : распространенность, сайты связывания in-situ и ключи к клинической значимости.Арка Вирхова. 1996. 427 (5): 483–486. [PubMed] [Google Scholar] 26. Genta RM. Helicobacter pylori , воспаление, повреждение слизистой оболочки и апоптоз: патогенез и определение атрофии желудка. Гастроэнтерология. 1997; 113 (6 доп.): S51 – S55. [PubMed] [Google Scholar] 27. Торбенсон М, Абрахам С.К., Бойтнотт Дж., Ярдли Дж. Х., Ву ТТ. Аутоиммунный гастрит: отчетливые гистологические и иммуногистохимические признаки до полной потери кислородных желез. Мод Pathol. 2002. 15 (2): 102–109. [PubMed] [Google Scholar] 28.Де Ре В., Орзес Э., Канцоньери В. и др. Пепсиногены для различения пациентов с кишечной метаплазией желудка и инфекцией Helicobacter pylori среди групп риска по развитию рака желудка. Клин Транс Гастроэнтерол. 2016; 7 (7): e183. [Бесплатная статья PMC] [PubMed] [Google Scholar] 29. Касторо С., Ле Моли Р., Арпи М.Л. и др. Ассоциация аутоиммунных заболеваний щитовидной железы, хронического атрофического гастрита и карциноида желудка: опыт одного учреждения. J Endocrinol Invest. 2016; 39 (7): 779–784.[PubMed] [Google Scholar] 30. Чентанни М., Мариньяни М., Гаргано Л. и др. Атрофический гастрит тела у пациентов с аутоиммунным заболеванием щитовидной железы: недостаточно диагностированная ассоциация. Arch Intern Med. 1999. 159 (15): 1726–1730. [PubMed] [Google Scholar] 31. Де Блок CE, Де Лиу И.Х., Ван Гал Л.Ф. Аутоиммунный гастрит при диабете 1 типа: клинически ориентированный обзор. J Clin Endocrinol Metab. 2008. 93 (2): 363–371. [PubMed] [Google Scholar] 32. Несс-Абрамоф Р., Набриски Д.А., Браверман Л.Е. и др. Распространенность и оценка дефицита B12 у пациентов с аутоиммунным заболеванием щитовидной железы.Am J Med Sci. 2006. 332 (3): 119–122. [PubMed] [Google Scholar] 33. Америо П., Траканна М., Де Ремигис П. и др. Витилиго, ассоциированное с другими аутоиммунными заболеваниями: полигландулярный аутоиммунный синдром типов 3B + C и 4. Clin Exp Dermatol. 2006. 31 (5): 746–749. [PubMed] [Google Scholar] 34. Зелиссен П.М., Баст Э.Дж., Кроуз Р.Дж. Ассоциированный аутоиммунитет при болезни Аддисона. J Autoimmun. 1995. 8 (1): 121–130. [PubMed] [Google Scholar] 35. Чанг К.Х., Лю Р.К., Ро Л.С., Ву Ю.Р., Чен СМ. Сосуществование злокачественной анемии и миастении – редкое сочетание аутоиммунных заболеваний на Тайване.J Formos Med Assoc. 2006; 105 (11): 946–949. [PubMed] [Google Scholar] 36. Delva PL, MacDonell JE, MacIntosh OC. Мегалобластная анемия, возникающая одновременно у белых монозиготных близнецов женского пола. Кан Мед Асс Дж. 1965; 92 (21): 1129–1131. [Бесплатная статья PMC] [PubMed] [Google Scholar] 37. Банк С., Райан К., Томсон В., Ньюман В. Г.. Пагубная анемия – генетические открытия. Autoimmun Rev.2011; 10 (8): 455–459. [PubMed] [Google Scholar] 38. Бонафу Б., Генри Л., Дельфур С. и др. Ассоциация семейной злокачественной анемии и наследственного гемохроматоза.Acta Haematol. 2008. 119 (1): 12–14. [PubMed] [Google Scholar] 39. Русак Э., Чобот А., Кшивицка А., Венцлау Дж. Антитела против париетальных клеток – диагностическое значение. Adv Med Sci. 2016; 61 (2): 175–179. [PubMed] [Google Scholar] 40. Хан С., Дель-Дука С., Фентон Э. и др. Ограниченная ценность тестирования на антитела к внутреннему фактору с отрицательными антителами к париетальным клеткам желудка при пернициозной анемии. J Clin Pathol. 2009. 62 (5): 439–441. [PubMed] [Google Scholar] 41. Оттесен М., Фельдт-Расмуссен Ю.Ф., Андерсен Дж., Хиппе Э., Шубое А.Злокачественная анемия. Изучение начальных форм заболевания и диагностическое значение определения антител к внутреннему фактору и антител к париетальным клеткам. Ugeskr Laeger. 1992. 154 (52): 3758–3762. [PubMed] [Google Scholar] 42. Antico A, Tampoia M, Villalta D, Tonutti E, Tozzoli R, Bizzaro N. Клиническая ценность серологической биопсии желудка для диагностики хронического аутоиммунного гастрита. Clin Dev Immunol. 2012; 2012: 520970. [Бесплатная статья PMC] [PubMed] [Google Scholar] 43. Шах П., Сингх М.Х., Ян Й.X., Мец, округ Колумбия.Гипохлоргидрия и ахлоргидрия связаны с ложноположительным тестом на стимуляцию секретина при синдроме Золлингера-Эллисона. Поджелудочная железа. 2013; 42 (6): 932. [Бесплатная статья PMC] [PubMed] [Google Scholar] 44. Фан Дж., Бенхамму Дж. Н., Писенья Дж. Р. Гиперсекреторные состояния желудка: исследование и лечение. Варианты лечения Curr Gastroenterol. 2015; 13 (4): 386–397. [Бесплатная статья PMC] [PubMed] [Google Scholar] 45. Кармель Р. Пепсиногены и другие сывороточные маркеры при злокачественной анемии. Am J Clin Pathol. 1988. 90 (4): 442–445.[PubMed] [Google Scholar] 46. Уэйнрайт П., Нараянан С., Кук П. Неверный уровень витамина B12 приводит к развитию у пациента злокачественной анемии. Clin Biochem. 2015. 48 (18): 1366–1367. [PubMed] [Google Scholar] 47. Соломон LR. Кобаламин-чувствительные расстройства в амбулаторных условиях: ненадежность тестов на кобаламин, метилмалоновую кислоту и гомоцистеин. Кровь. 2005. 105 (3): 978–985. [PubMed] [Google Scholar] 48. Wu PB, Deng YZ, Shu YX, Tan SY, Li M, Fang G. Повышенные уровни CgA в плазме, связанные с неалкогольной жировой болезнью печени.Turk J Gastroenterol. 2015; 26 (5): 404–407. [PubMed] [Google Scholar] 49. Peracchi M, Gebbia C, Basilisco G и др. Хромогранин А плазмы у пациентов с аутоиммунным хроническим атрофическим гастритом, энтерохромаффиноподобными клеточными поражениями и карциноидами желудка. Eur J Endocrinol. 2005. 152 (3): 443–448. [PubMed] [Google Scholar] 50. Массирони С., Фракелли М., Пагги С. и др. Уровни хромогранина А при хроническом заболевании печени и гепатоцеллюлярной карциноме. Dig Liver Dis. 2009. 41 (1): 31–35. [PubMed] [Google Scholar] 51.Парк YH, Ким Н. Обзор атрофического гастрита и кишечной метаплазии как предракового поражения рака желудка. J Cancer Prev. 2015; 20 (1): 25–40. [Бесплатная статья PMC] [PubMed] [Google Scholar] 53. Анагностопулос Г.К., Рагунатх К., Шонде А., Хоуки К.Дж., Яо К. Диагностика аутоиммунного гастрита с помощью эндоскопии с увеличением с высоким разрешением. Мир Дж. Гастроэнтерол. 2006. 12 (28): 4586–4587. [Бесплатная статья PMC] [PubMed] [Google Scholar] 54. Номура С., Ида К., Терао С. и др. Эндоскопическая диагностика атрофии слизистой оболочки желудка: многоцентровое проспективное исследование.Dig Endosc. 2014. 26 (6): 709–719. [PubMed] [Google Scholar] 55. Диксон М.Ф., Гента Р.М., Ярдли Дж. Х., Корреа П. Классификация и классификация гастрита. Обновленная Сиднейская система. Международный семинар по гистопатологии гастрита, Хьюстон, 1994. Am J Surg Pathol. 1996. 20 (10): 1161–1181. [PubMed] [Google Scholar] 57. Сепульведа А.Р., Патил М. Практический подход к патологической диагностике гастрита. Arch Pathol Lab Med. 2008. 132 (10): 1586–1593. [PubMed] [Google Scholar] 59. Хершко С., Хоффбранд А., Керет Д. и др.Роль аутоиммунного гастрита, Helicobacter pylori и целиакии в рефрактерной или необъяснимой железодефицитной анемии. Haematologica. 2005. 90 (5): 585–595. [PubMed] [Google Scholar] 60. Гонсалвеш С., Оливейра М.Э., Палья А.М., Ферран А., Мораиш А., Лопес А.И. Аутоиммунный гастрит в детском возрасте, проявляющийся железодефицитной анемией. Мир Дж. Гастроэнтерол. 2014. 20 (42): 15780–15786. [Бесплатная статья PMC] [PubMed] [Google Scholar] 61. Мигель Н, Коста Э, Сантала М, младший и др. Рефрактерная железодефицитная анемия и аутоиммунный атрофический гастрит в детской возрастной группе: анализ 8 клинических случаев.J Pediatr Hematol Oncol. 2014. 36 (2): 134–139. [PubMed] [Google Scholar] 62. Stabler SP. Клиническая практика. Дефицит витамина B12. N Engl J Med. 2013. 368 (2): 149–160. [PubMed] [Google Scholar] 63. Теффери А., Прутхи РК. Биохимические основы дефицита кобаламина. Mayo Clin Proceed. 1994. 69 (2): 181–186. [PubMed] [Google Scholar] 64. Asimacopoulos PJ, Groves MD, Fischer DK, et al. Пагубная анемия, проявляющаяся стенокардией. Саут Мед Дж. 1994; 87 (6): 671–672. [PubMed] [Google Scholar] 65. Тадакамалла А.К., Таллури СК, Бесур С.Псевдотромботическая тромбоцитопеническая пурпура: редкое проявление злокачественной анемии. N Am J Med Sci. 2011. 3 (10): 472–474. [Бесплатная статья PMC] [PubMed] [Google Scholar] 66. Мельхем А., Десаи А., Хофманн М.А. Острый инфаркт миокарда и тромбоэмболия легочной артерии у молодого человека с тяжелой гипергомоцистеинемией, вызванной злокачественной анемией. Тромб Дж. 2009; 7 (1): 1–5. [Бесплатная статья PMC] [PubMed] [Google Scholar] 67. Шамкани В.А., Джафар Н.С., Нараянан С.Р., Раджаппан АК. Острый инфаркт миокарда у молодой женщины из-за дефицита витамина B12, вызванный гипергомоцистеинемией.Сердечные взгляды. 2015; 16 (1): 25–29. [Бесплатная статья PMC] [PubMed] [Google Scholar] 68. Метц Дж. Дефицит кобаламина и патогенез заболеваний нервной системы. Annu Rev Nutr. 1992; 12: 59–79. [PubMed] [Google Scholar] 69. Фрэнсис Г., Хохол К., Джавад З., Айер А., Тот С. Накопление метилмалоновой кислоты и развитие периферической невропатии (IN1-1.010) Неврология. 2012; 78 (1 доп.): IN1 – IN1. [Google Scholar] 70. Ралапанава DM, Jayawickreme KP, Ekanayake EM, Jayalath WA. Дефицит B (12) с неврологическими проявлениями при отсутствии анемии.BMC Res Notes. 2015; 8: 458. [Бесплатная статья PMC] [PubMed] [Google Scholar] 71. Линденбаум Дж., Хилтон Э. Б., Сэвидж Д. Г. и др. Психоневрологические расстройства, вызванные дефицитом кобаламина при отсутствии анемии или макроцитоза. N Engl J Med. 1988. 318 (26): 1720–1728. [PubMed] [Google Scholar] 72. Hemmer B, Glocker FX, Schumacher M, Deuschl G, Lücking CH. Подострая комбинированная дегенерация: данные клинической, электрофизиологической и магнитно-резонансной томографии. J Neurol Neurosurg Psychiatry. 1998. 65 (6): 822–827.[Бесплатная статья PMC] [PubMed] [Google Scholar] 73. Васконселос О.М., Поем Э.Х., Маккартер Р.Дж., Кэмпбелл В.В., Кесадо ZMN. Возможные факторы исхода при подострой комбинированной дегенерации: обзор обсервационных исследований. J Gen Intern Med. 2006. 21 (10): 1063–1068. [Бесплатная статья PMC] [PubMed] [Google Scholar] 74. Саперштейн Д.С., Барон Р.Дж. Периферическая невропатия из-за дефицита кобаламина. Варианты лечения Curr Neurol. 2002. 4 (3): 197–201. [PubMed] [Google Scholar] 75. Chu C, Scanlon P. Оптическая нейропатия, вызванная дефицитом витамина B12, обнаруженная бессимптомным скринингом.BMJ Case Rep.2011; 2011 bcr0220113823. [Бесплатная статья PMC] [PubMed] [Google Scholar] 76. Metzler D, Miller WH, Stephen Edwards C. Психиатрическое проявление дефицита витамина B-12: обновленная информация. Джефферсон Дж. Психиатрия. 1991; 9 (2) [Google Scholar] 77. Douaud G, Refsum H, de Jager CA и др. Предотвращение атрофии серого вещества, связанной с болезнью Альцгеймера, с помощью лечения витамином B. Proc Natl Acad Sci U S. A. 2013; 110 (23): 9523–9528. [Бесплатная статья PMC] [PubMed] [Google Scholar] 78. Ланер Э., Аннибале Б. Пагубная анемия: новые открытия с гастроэнтерологической точки зрения.Мир Дж. Гастроэнтерол. 2009. 15 (41): 5121–5128. [Бесплатная статья PMC] [PubMed] [Google Scholar] 79. Чжу Дж.С., Ван Ю.Ф., Шэн Дж., Чен FX, Тан Г.Й. Атрофический глоссит связывают с дефицитом кобаламина. Shanghai J Stomatol. 2013. 22 (1): 58–62. [PubMed] [Google Scholar] 80. Ваннелла Л., Ланер Э, Осборн Дж, Аннибале Б. Систематический обзор: заболеваемость раком желудка при пернициозной анемии. Алимент Pharmacol Ther. 2013. 37 (4): 375–382. [PubMed] [Google Scholar] 81. Ваннелла Л., Сброцци-Ванни А., Ланер Э. и др. Развитие карциноида желудка I типа у больных хроническим атрофическим гастритом.Алимент Pharmacol Ther. 2011. 33 (12): 1361–1369. [PubMed] [Google Scholar] 82. Ланер Э., Эспозито Дж., Галли Дж., Аннибале Б. Атрофический гастрит и предраковые поражения желудка. Перевод Gastrointest Cancer. 2015; 4 (4): 272–281. [Google Scholar] 83. Шнеллер Дж., Гупта Р., Мустафа Дж., Вильянуэва Р., Штраус Е. В., Раффаниелло Р. Д.. Инфекция Helicobacter pylori связана с высокой частотой кишечной метаплазии слизистой оболочки желудка у пациентов в городских больницах Нью-Йорка. Dig Dis Sci.2006. 51 (10): 1801–1809. [PubMed] [Google Scholar] 84. Вонг BC, Лам С.К., Вонг В.М. и др. Китайская группа по изучению рака желудка Эрадикация Helicobacter pylori для предотвращения рака желудка в регионе высокого риска в Китае: рандомизированное контролируемое исследование. ДЖАМА. 2004. 291 (2): 187–194. [PubMed] [Google Scholar] 86. Юн X, Тан Б., Ли Б-С и др. Helicobacter pylori Фактор вирулентности CagA способствует онкогенезу рака желудка посредством множественных сигнальных путей. Сигнал сотовой связи. 2015; 13 (1): 1–13.[Бесплатная статья PMC] [PubMed] [Google Scholar] 88. ван Дорн Л.Дж., Фигейредо С., Санна Р. и др. Клиническая значимость cagA, vacA и iceA статуса Helicobacter pylori . Гастроэнтерология. 1998. 115 (1): 58–66. [PubMed] [Google Scholar] 89. Вроблевски Л. Е., Пик Р. М., Уилсон К. Т.. Helicobacter pylori и рак желудка: факторы, влияющие на риск заболевания. Clin Microbiol Rev.2010; 23 (4): 713–739. [Бесплатная статья PMC] [PubMed] [Google Scholar] 90. Чжоу К., Хо В. Карциноиды желудка: классификация и диагностика.В: Pisegna RJ, редактор. Лечение нейроэндокринных опухолей поджелудочной железы. Нью-Йорк, Нью-Йорк: Springer Нью-Йорк; 2015. С. 83–93. [Google Scholar] 91. Burkitt MD, Pritchard DM. Обзорная статья: патогенез и лечение карциноидных опухолей желудка. Алимент Pharmacol Ther. 2006. 24 (9): 1305–1320. [PubMed] [Google Scholar] 92. Ли Ти, Цю Ф, Цянь З.Р., Ван Дж., Ци Х-К, Ву Би. Классификация, клинико-патологические особенности и лечение нейроэндокринных опухолей желудка. Мир Дж. Гастроэнтерол. 2014. 20 (1): 118–125. [Бесплатная статья PMC] [PubMed] [Google Scholar] 93.Андрес Э., Фотергилл Х., Месили М. Эффективность пероральной терапии кобаламином (витамин B12). Эксперт Opin Pharmacother. 2010. 11 (2): 249–256. [PubMed] [Google Scholar] 94. Столте М., Мейер Э, Майнинг А. Лечение аутоиммунного гастрита с помощью эрадикации Helicobacter pylori у 21-летнего мужчины. З. Гастроэнтерол. 1998. 36 (8): 641–643. [PubMed] [Google Scholar] 95. Фаллер Г., Винтер М., Штайнингер Х. и др. Снижение аутоантител желудка при гастрите Helicobacter pylori после излечения инфекции.Pathol Res Pract. 1999. 195 (4): 243–246. [PubMed] [Google Scholar] 97. Докрей GJ. Клиническая эндокринология и метаболизм. Гастрин. Лучшая практика Res Clin Endocrinol Metab. 2004. 18 (4): 555–568. [PubMed] [Google Scholar] 98. Мур А.Р., Бойс М., Стил И.А., Кэмпбелл Ф., Варро А., Причард Д.М. Нетазепид, антагонист рецепторов гастрина, нормализует биомаркеры опухолей и вызывает регрессию нейроэндокринных опухолей желудка 1 типа в нерандомизированном исследовании пациентов с хроническим атрофическим гастритом. PLoS One. 2013; 8 (10): e76462.[Бесплатная статья PMC] [PubMed] [Google Scholar] 99. Фоссмарк Р., Сордал О., Цзянь С.С. и др. Лечение карциноидов желудка 1 типа антагонистом гастриновых рецепторов нетазепидом (YF476) приводит к регрессии опухолей и нормализации сывороточного хромогранина A. Aliment Pharmacol Ther. 2012. 36 (11–12): 1067–1075. [PubMed] [Google Scholar] 100. Massironi S, Zilli A, Fanetti I, Ciafardini C, Conte D, Peracchi M. Прерывистое лечение рецидивирующих карциноидов желудка 1 типа аналогами соматостатина у пациентов с хроническим аутоиммунным атрофическим гастритом.Dig Liver Dis. 2015; 47 (11): 978–983. [PubMed] [Google Scholar] 101. Kwekkeboom DJ, Креннинг EP. Радионуклидная терапия пептидных рецепторов в лечении нейроэндокринных опухолей. Hematol Oncol Clin North Am. 2016; 30 (1): 179–191. [PubMed] [Google Scholar]Атрофический гастрит – AMBOSS
Последнее обновление: 15 марта 2021 г.
Резюме
Атрофический гастрит – это состояние, характеризующееся хроническим воспалением слизистой оболочки желудка с атрофией, потерей желез и метапластическими изменениями.Существует два типа: аутоиммунный метапластический атрофический гастрит (AMAG) и метапластический атрофический гастрит, вызванный окружающей средой (EMAG), который обычно вызывается Helicobacter pylori (H. pylori). Пациенты с атрофическим гастритом часто протекают бессимптомно или могут испытывать только неспецифический дискомфорт в эпигастральной области. Важные диагностические шаги включают гастроскопию с биопсией и лабораторными исследованиями (например, гастрина). Терапевтический подход зависит от основной этиологии. AMAG лечат заменой витамина B12, тогда как люди с EMAG получают H.pylori эрадикационная терапия. Если не лечить атрофический гастрит, он может привести к язвенной болезни или развитию различных видов рака.
Эпидемиология
Эпидемиологические данные относятся к США, если не указано иное.
Этиология
- Инфекция Helicobacter pylori
- Факторы питания
- N-нитрозосоединения
- Употребление алкоголя
- Высокое потребление соли
Патофизиология
9000 2.Клинические особенности
Общие симптомы
Специфические симптомы при AMAG
Специфические симптомы в EMAG
Атрофический гастрит, связанный с Helicobacter, часто проявляется изъязвлениями. Атрофического гастрита аутоиммунного происхождения нет.
Диагностика
- Диагностический тест по выбору
- Для оценки слизистой оболочки желудка и взятия образцов биопсии из антрального отдела и тела желудка, возможно, также из глазного дна.
Диагностика Helicobacter pylori
Показания
[6]ИПП следует прекратить как минимум за 2 недели до тестирования на H.pylori, чтобы свести к минимуму количество ложноотрицательных результатов. [8]
Модальности
Как правило, следует использовать как минимум два метода. Диагноз обычно подтверждается при положительных результатах двух анализов.
- Инвазивные методы
- Забор биоптатов
- Гистология (золотой стандарт), включая окрашивание и прямую микроскопическую идентификацию, показывает изогнутые жгутиковые грамотрицательные палочки.
- Экспресс-тест на уреазу: определение выработки аммиака уреазой H.пилори
- Посев и резистограмма: для посева H. pylori требуется специальный питательный бульон
- Обнаружение ДНК H. pylori с помощью ПЦР: очень чувствительно и специфично, но почти никогда не используется в повседневной клинической практике
- Неинвазивные методы
- Тест на антиген стула H. pylori: обнаруживает присутствие антигенов H. pylori в образце стула
- Может использоваться для диагностики инфекции H. pylori и доказательства ее эрадикации после лечения
- Подходящий вариант в качестве начального теста (экономически эффективный)
- Дыхательный тест на мочевину: обнаружение меченого изотопа углерода в образцах выдыхаемого воздуха
- Сывороточные антитела IgG к H.pylori: антитела к H. pylori могут быть обнаружены даже после эрадикации → тест указывает на (прошлое) воздействие, не обязательно на текущую инфекцию (более низкая специфичность)
- Тест на антиген стула H. pylori: обнаруживает присутствие антигенов H. pylori в образце стула
Дополнительные тесты
Патология
Результаты микроскопии
Следующие микроскопические данные можно увидеть при обоих типах атрофического гастрита.
Типы болезней
Дифференциальные диагнозы
Перечисленные здесь дифференциальные диагнозы не являются исчерпывающими.
Лечение
Общие
Сукральфат не следует назначать одновременно с ИПП и / или антагонистами h3, поскольку он активируется кислой средой.
- Заместительная терапия витамином B12 (парентерально)
- При обнаружении H. pylori: попытка искоренить (может привести к заживлению)
- Поскольку существует риск злокачественного перерождения, необходимы регулярные эндоскопические осмотры.
Эрадикационная терапия Helicobacter pylori
Рассмотреть возможность лечения любого пациента, у которого положительный результат теста на H.pylori.
Варианты лечения первой линии
[6] [9]ИПП два раза в день ПЛЮС 2 антибиотика с / без висмута в течение 10–14 дней [6]
«Три дня C (AM) Ping : »Тройная терапия состоит из кларитромицина, амоксициллина ИЛИ метронидазола и ИПП.
Ведение второй линии при неэффективности лечения
Последующее наблюдение
- Подтверждение эрадикации после каждого режима терапии [8] [10]
- Дыхательный тест на мочевину, анализ стула на антиген или биопсия через 4–6 недель после завершения терапии.
- Серологический анализ не является предпочтительным для подтверждения эрадикации, поскольку он остается положительным в течение недель / месяцев после эрадикации.
- После подтверждения эрадикации антисекреторную терапию можно прекратить. [10]
Осложнения
Мы перечисляем наиболее важные осложнения. Выбор не исчерпывающий.
Список литературы
- Коати И., Фассан М., Фаринати Ф., Грэм Д. Ю., Гента Р. М., Рагге М. Аутоиммунный гастрит: точка зрения патолога. Мир J Гастроэнтерол . 2015; 21 год (42): с.12179-12189. DOI: 10.3748 / wjg.v21.i42.12179. | Открыть в режиме чтения QxMD
- Hilzenrat N, Lamoureux E, Weintrub I, Alpert E, Lichter M, Alpert L. Helicobacter heilmannii-like спиральные бактерии в биоптатах слизистой оболочки желудка. Распространенность и клиническое значение .. Arch Pathol Lab Med . 1995; 119 (12): с.1149-53.
- Канеко Х., Накада К., Мицума Т. и др.Инфекция Helicobacter pylori вызывает снижение концентрации иммунореактивного соматостатина в желудке человека .. Dig Dis Sci . 1992; 37 (3): с.409-16. DOI: 10.1007 / BF01307736. | Открыть в режиме чтения QxMD
- Суми М., Суми К., Тари А. и др. Экспрессия антральной мРНК гастрина и соматостатина у субъектов, инфицированных Helicobacter pylori .. Am J Gastroenterol . 1994; 89 (9): с.1515-9.
- Smoot DT, Mobley HL, Chippendale GR, Lewison JF, Resau JH.Активность уреазы Helicobacter pylori токсична для эпителиальных клеток желудка человека. Infect Immun . 1990; 58 (6): с.1992-4. DOI: 10.1128 / IAI.58.6.1992-1994.1990. | Открыть в режиме чтения QxMD
- Чей В.Д., Леонтиадис Г.И., Хауден К.В., Мосс С.Ф. Клинические рекомендации ACG: Лечение инфекции Helicobacter pylori. Ам Дж. Гастроэнтерол . 2017; 112 : с.212-238. DOI: 10.1038 / ajg.2016.563. | Открыть в режиме чтения QxMD
- Moayyedi PM, Lacy BE, Andrews CN, Enns RA, Howden CW, Vakil N.Клинические рекомендации ACG и CAG: ведение диспепсии. Ам Дж. Гастроэнтерол . 2017; 112 (7): с.988-1013. DOI: 10.1038 / ajg.2017.154. | Открыть в режиме чтения QxMD
- Fashner J, Gitu AC. Диагностика и лечение язвенной болезни и инфекции H. pylori. Am Fam Physician. . 2015; 91 (4): с.236-242.
- Hershko C, Ronson A, Souroujon M, Maschler I, Heyd J, Patz J. Различные гематологические проявления аутоиммунного гастрита: возрастное прогрессирование от дефицита железа до истощения кобаламина. Кровь . 2006; 107 (4): с.1673-1679. DOI: 10.1182 / кровь-2005-09-3534. | Открыть в режиме чтения QxMD
- Вонг Ф., Райнер-Хартли Э., Бирн М.Ф. Внекишечные проявления Helicobacter pylori: краткий обзор. Мир J Гастроэнтерол . 2014; 20 (34): с.11950-11961. DOI: 10.3748 / wjg.v20.i34.11950. | Открыть в режиме чтения QxMD
- Malfertheiner P, Megraud F, O’Morain CA и др.
