Что такое диффузное изменение поджелудочной железы лечение: Лечение диффузных изменений поджелудочной железы в Москве
Диффузные изменения поджелудочной железы на УЗИ
Умеренное употребление пищи — мать здоровья.
М.В. Ломоносов
Поговорим еще об одном часто встречаемом в ультразвуковой практике заключении: «Диффузные изменения паренхимы поджелудочной железы». Причем я уверена, что большинство пациентов не понимают, что ж это такое. «Поджелудка!» — говорят они родственникам, выходя из кабинета УЗИ.
Но что ж это за орган? Зачем он нужен? Почему он у всех страдает?
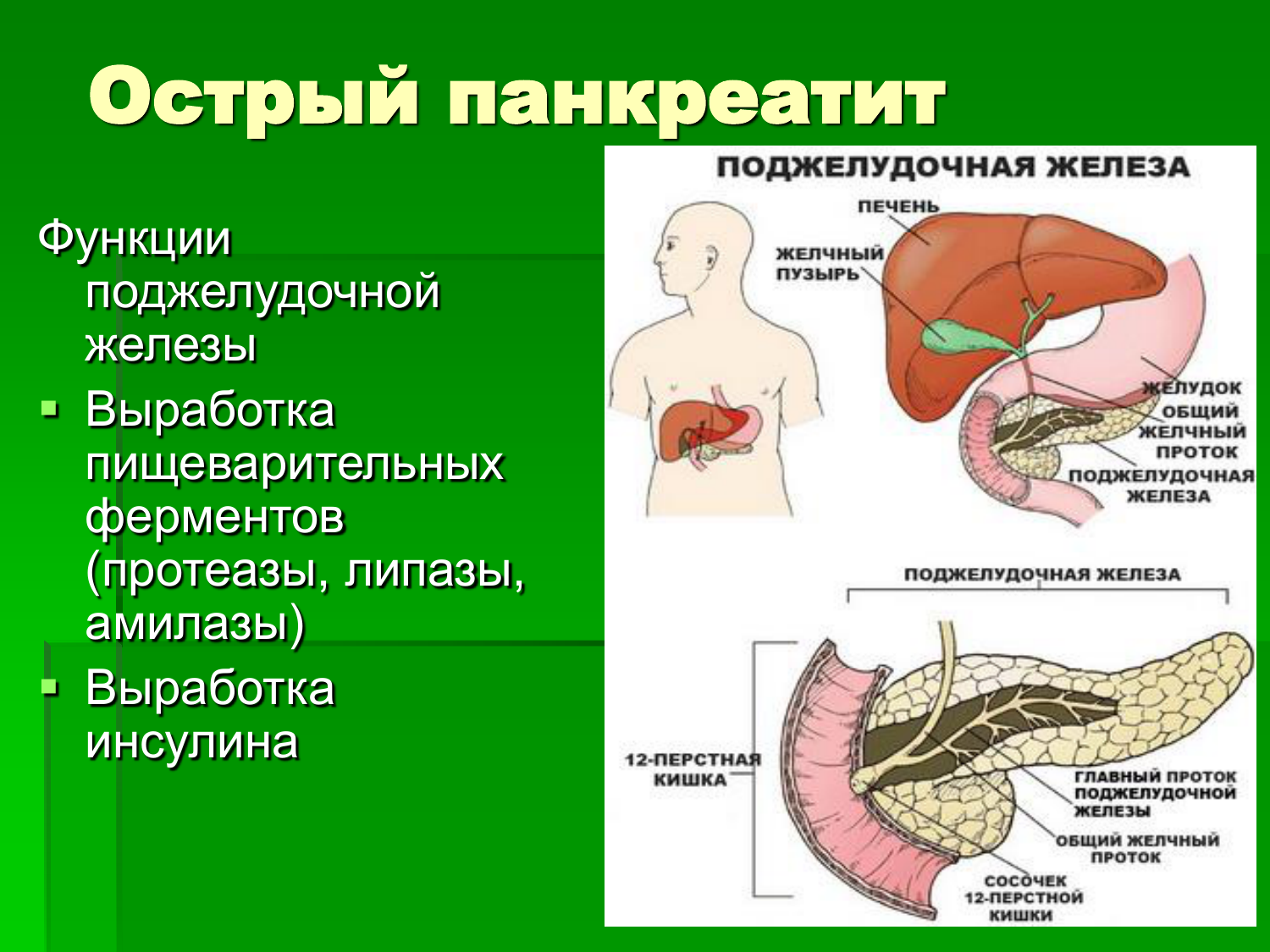
Поджелудочная железа расположена, как вы догадались, под желудком. Большая её часть (хвост) находится слева, меньшая часть срединно (тело) и справа (головка). Железа примыкает вплотную к разным органам (печень, двенадцатиперстная кишка и другие отделы кишечника, желудок, селезенка, почки, сосуды, выводные желчные протоки), поэтому, если вас беспокоят боли в верхних отделах живота, не надо все валить на бедную поджелудочную железу! Лучше провериться, ведь помимо перечисленных органов, боль сюда может проецироваться даже от сердца.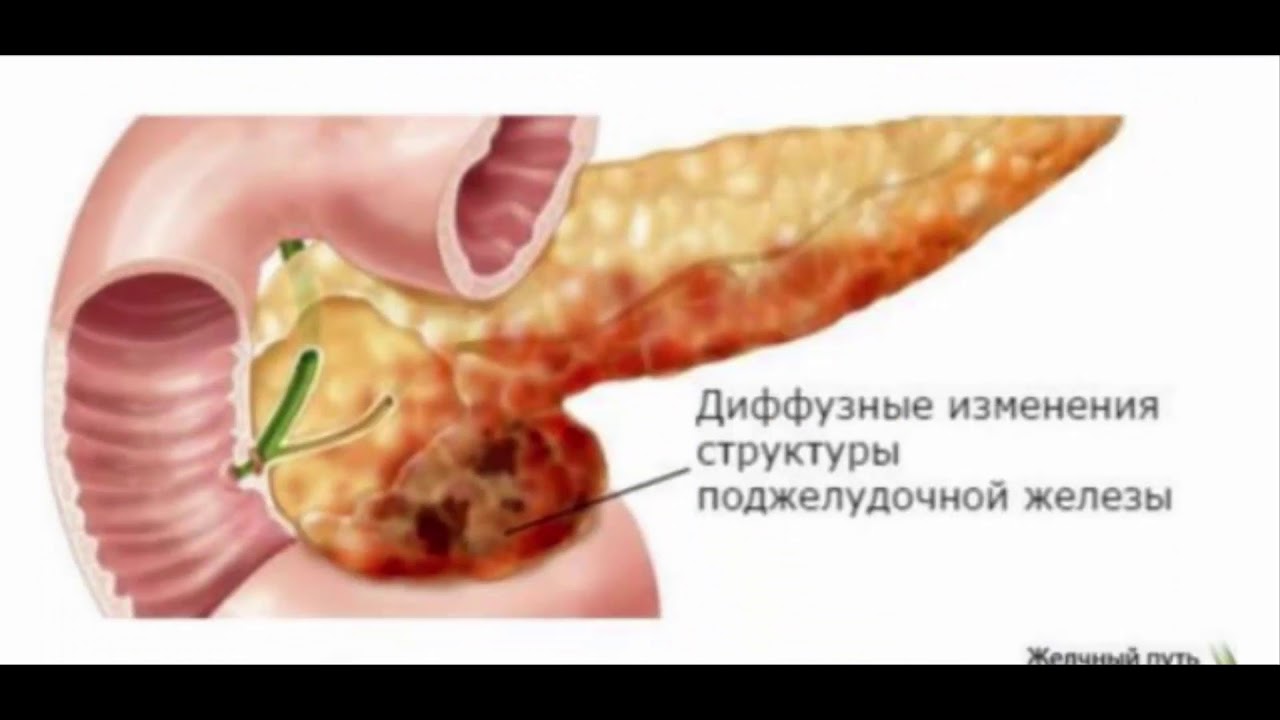
Продолжим. Почему она называется железой? Железой называют орган, который может производить какие-то важные для организма вещества. Так вот, поджелудочная железа весом у взрослого человека около 60–80 г в сутки вырабатывает около 1,5–2 л панкреатического сока! Большая часть клеток, из которых она состоит, вырабатывает именно этот сок, который по протоку поступает в кишечник и там помогает переваривать белки, жиры и углеводы. У пожилых масса органа уменьшается по причине возрастных изменений, а также после всех проблем, перенесенных за жизнь, поэтому и сока вырабатывается меньше. Значит питание с возрастом должно быть в небольших объёмах, легкоусвояемое, некалорийное. «Раньше меня так не вздувало!» — слышишь от пациентов, так и сока 10–20 лет назад поджелудочная вырабатывала больше, пища переваривалась быстрее, легче.
Только около 2% клеток поджелудочной железы вырабатывает инсулин
, который регулирует уровень сахара в крови, т.е. около 1,2–1,6 г клеток нам всего дано на всю жизнь, только вдумайтесь! А теперь прикиньте, сколько углеводов (сладостей) вы употребляете за жизнь? сколько покупаете «вкусняшек» вашим детям? В среднем в год человек съедает 24–28 кг сахара (в России — до 40 кг!). Прибавьте к этому около 50 тонн еды, которые в среднем съедает человек при продолжительности жизни 70 л. Ну, и не забудем про алкоголь, лекарства (которые свободно можно купить в аптеке!!!). А наша маленькая поджелудочная железа должна все это переварить!
Прибавьте к этому около 50 тонн еды, которые в среднем съедает человек при продолжительности жизни 70 л. Ну, и не забудем про алкоголь, лекарства (которые свободно можно купить в аптеке!!!). А наша маленькая поджелудочная железа должна все это переварить!Хотелось бы еще рассказать о влиянии сна на поджелудочную железу. Недосыпание приводит к появлению неправильно свёрнутых белков и потенциально может привести к гибели клеток, особенно в пожилом возрасте. Исследование учёных из Медицинской школы Пенсильванского университета (США) как раз об этом. А также исследования жозефа Баура (Joseph Baur) и его коллег. Неправильные белки организм должен либо исправить, либо утилизировать. Ученый обнаружил, что у старых животных реакция на такой стресс ослаблена, то есть с возрастом недостаток сна может сказываться всё сильнее.
Поэтому задумайтесь, прежде чем попить чайку на ночь глядя (а тем более что-то покрепче) или посмотреть любимый фильм до часу ночи.
Так вот, при современном изобилии в питании и разнообразии в образе жизни не стоит удивляться, если начались проблемы с пищеварением (вздутие, чувство тяжести, нарушения стула и пр. ) Многие на исследовании признаются: «Так я уже ничего такого и не ем, а не помогает!» Ключевое слово здесь «уже», т.е. в течение многих десятков лет мы едим все подряд, а «садимся» на диету только тогда, когда организм уже начнет выдавать нам неприятности с пищеварением или повышенный сахар в анализах. К сожалению, здесь уже иногда сложно помочь.
) Многие на исследовании признаются: «Так я уже ничего такого и не ем, а не помогает!» Ключевое слово здесь «уже», т.е. в течение многих десятков лет мы едим все подряд, а «садимся» на диету только тогда, когда организм уже начнет выдавать нам неприятности с пищеварением или повышенный сахар в анализах. К сожалению, здесь уже иногда сложно помочь.
Что же доктор видит на УЗИ?
Обычно при первых проблемах с железой на ультразвуке может не быть изменений, и это замечательно! Хотя многим хотелось бы их увидеть, и пациенты остаются разочарованы.
Запомните! Однократные воспаления в железе могут проходить бесследно и без изменений по УЗИ.
Но если доктор все-таки находит патологию, то это уже, вероятнее всего, необратимо или оставит свой след на работе органа.
В большинстве случаев доктор описывает примерно следующую картину: контуры железы неровные, нечеткие, эхогенность повышена или высокая, размеры могут быть нормальные, увеличены или уменьшены. Редко бывает расширение протока железы и даже камни в ней. В такой ситуации доктор пишет в заключении пресловутые «Диффузные изменения», т.е. железа многократно за жизнь испытывала нагрузки и часть её клеток погибли или заместились на жир и рубцовую ткань и она уже не может работать как прежде.
Редко бывает расширение протока железы и даже камни в ней. В такой ситуации доктор пишет в заключении пресловутые «Диффузные изменения», т.е. железа многократно за жизнь испытывала нагрузки и часть её клеток погибли или заместились на жир и рубцовую ткань и она уже не может работать как прежде.
Что с этим заключением делать? Обязательно необходимо дообследование (сначала гастроэнтеролог, терапевт), чтобы определить степень нарушений пищеварения и состояние организма в целом, ведь, если страдает поджелудочная железа, значит во всем организме есть проблемы (нарушение углеводного, жирового обмена, как правило сопутствует атеросклероз, могут быть кожные проявления и пр.).
А ситуация в целом, конечно, зависит от вас самих. Доктор пропишет лечение, поможет временно нормализовать беспокоящие вас симптомы. Но контроль за питанием полностью в ваших руках. Если у вас на ультразвуке уже выявлены диффузные изменения, не нагружайте поджелудочную железу, дайте ей возможность подольше обеспечить вам комфортную жизнь!
Все, что нужно знать о диффузных изменениях поджелудочной железы
Прежде, чем приступить к лечению этих изменений, необходимо поставить больному диагноз.
Вовсе не все диффузные изменения поджелудочной железы подлежат лечению. Чаще всего это незначительные изменения, которые не требуют ни дополнительного обследования, ни лечения. Для того, чтобы приступить к лечению таких изменений, нужно сначала поставить больному диагноз, передает СобКор со ссылкой на LadyHealth.
Кого лечить, а кого нет
Диффузные изменения поджелудочной железы – это не диагноз, а заключение одного из видов обследования – УЗИ. Это заключение само по себе ни о чем не говорит, предназначено оно для лечащего врача, к которому стекаются все данные диагностических исследований. Но почему-то заключение УЗИ очень пугает пациентов и вместо того, чтобы спросить своего врача, что же оно означает, они спрашивают об этом друг у друга в Интернете.
Насколько это опасно и требуется ли лечение, решает врач. Если такие диффузные изменения поджелудочной железы обнаруживают у человека, который ни на что не жалуется, то никаких дополнительных обследований и лечения ему не назначают.
Но если при обнаруженных диффузных изменениях у больного есть жалобы со стороны органов пищеварения, то его обследуют дальше и выявляют причину такого явления. После установления окончательного диагноза больного лечат.
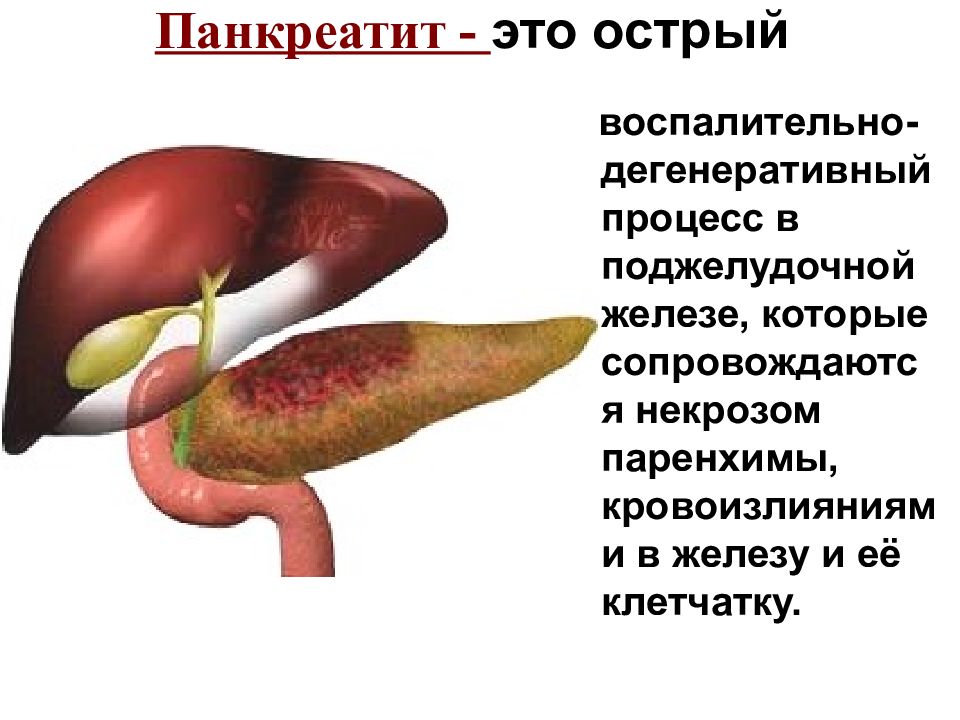
Наконец, иногда диффузные изменения в поджелудочной железе являются признаком острого панкреатита, что подтверждается лабораторными анализами и состоянием больного. Такой больной требует немедленной госпитализации.
Лечение больных с острым панкреатитом
При остром панкреатите происходит застой панкреатического сока в поджелудочной железе, ее отек, а затем самопереваривание. Все это сопровождается сильнейшими болями, рвотой и общим тяжелым состоянием больного.
Первая помощь при остром панкреатите – это снятие боли, максимальное расслабление гладкой мускулатуры органов желудочно-кишечного тракта и подавление функции поджелудочной железы.
Для снятия болей применяются нестероидные противовоспалительные препараты (например, диклофенак), а также наркотические лекарственные препараты (промедол, морфин). Для расслабления гладкой мускулатуры протоков поджелудочной железы, снятия спазмов и улучшения оттока панкреатического сока назначают спазмолитики (например, но-шпу). Для подавления секреции панкреатического сока вводят атропин и к животу прикладывают холод. Внутривенно капельно вводятся различные растворы, так как больной не может пить из-за болей и рвоты.
До тех пор, пока у больного держатся боли, он ничего не ест и только после улучшения состояния ему начинают маленькими порциями давать простоквашу. Расширение диеты медленное, с учетом общего состояния больного
Лечение больных с хроническим панкреатитом
Диффузные изменения в поджелудочной железе при хроническом панкреатите могут быть как в фазе обострения (это говорит об отеке железы), так и в фазе ремиссии, что является признаком диффузного разрастания в поджелудочной железе соединительной ткани.
Обострение хронического панкреатита протекает почти так же, как и острый панкреатит, но значительно легче, и требует такого же лечения.
В состоянии ремиссии на первый план выходят диета и коррекция внешнесекреторной недостаточности поджелудочной железы. Диета больного исключает употребление жирных, жареных, острых, консервированных продуктов, сладостей, сдобы и газированных напитков. Питание должно быть частым и дробным.
Способ коррекции при этом подбирается индивидуально для каждого больного. Назначаются ферментные препараты (мезим, креон, фестал). Под воздействием этих препаратов у больных проходят тошнота, вздутие живота, поносы.
Если у больных наблюдается значительное снижение функции поджелудочной железы и отсутствие ферментов для переваривания белковой пищи, им вводят внутривенно капельно смеси аминокислот. Для лучшего усвоения белка вводят вит амины группы В, С и анаболические гормоны (например, ретаболил).
Применяются препараты для повышения секреции поджелудочной железы, витаминотерапия.
Так как при хроническом панкреатите почти у всех больных нарушается секреция инсулина и развивается вторичный сахарный диабет, им назначается диета с ограничением углеводов и сахароснижающие лекарственные препараты.
Ранее СобКор писал о симптомах, указывающих на проблемы с щитовидкой.
Показывает ли УЗИ поджелудочной железы признаки рака, опухоли и диффузные изменения при хроническом панкреатите и липоматозе?
Ультразвуковое обследование органов – стандартный метод диагностирования, применяемый в каждой поликлинике.
Его рекомендуется проходить не только больным, но и здоровым людям в качестве профилактической меры при медицинском осмотре.
Зачастую в заключении врача-диагноста мы видим такую фразу: диффузные изменения паренхимы печени и поджелудочной железы. Но что это за диагноз и представляет ли это угрозу для здоровья? Давайте разберёмся.
Сделать пункцию поджелудочной железы
Что это означает
Метод ультразвуковой диагностики основан на отражающей способности тканей нашего организма. Звуковые волны, достигнув того или иного образования, встречают на своём пути препятствие. Чем плотнее это препятствие, тем больше звуковых волн будет отражено, тем меньше волн пройдёт через всё тело, и наоборот.
Звуковые волны, достигнув того или иного образования, встречают на своём пути препятствие. Чем плотнее это препятствие, тем больше звуковых волн будет отражено, тем меньше волн пройдёт через всё тело, и наоборот.
Таким образом, основа всей ультразвуковой диагностики – различная плотность тканей человеческого организма. В норме каждый орган имеет одну и ту же плотность во всех участках. В этом случае говорят о гомогенной плотности паренхимы без диффузных изменений ткани.
Если в нём возникает какой-то патологический процесс – воспаление, нарушения реологических свойств жидкости, обменные нарушения — то датчик воспринимает эти очаги как участки различных плотностей в пределах одного органа. Это и называют диффузными изменениями.
Читать далее
Признак помогающий определить участок поражения
Вернёмся к поджелудочной железе. Так же как и другие органы, железа в норме имеет однородную структуру ткани.
Если она воспаляется, подвергается жировому перерождению, если в ней образуются участки петрификатов и кальцификатов, то в заключении УЗИ врач напишет фразу «диффузные изменения паренхимы поджелудочной железы».
Так как поджелудочная железа находится в непосредственной близости от печени и билиарной системы, то наиболее часто в заключении пишется «диффузные изменения печени и поджелудочной железы».
Так как перестройки наблюдаются при многих патологических процессах, это заключение не может быть диагнозом. Это лишь признак, указывающий, что в органах имеется патология и больной нуждается в дальнейшем обследовании.
Важно! Диффузные изменения органа – это не диагноз, и даже не симптом. Это лишь признак, помогающий врачу определить участок поражения железы, поставить предварительный диагноз и назначить дополнительные лабораторные анализы и инструментальные методы обследования.
Формы диффузных изменений в печени и поджелудочной железе
- Жировое перерождение — липоматоз. Эта патология распространена среди всех людей преклонного возраста. При этом происходит замещение нормальной паренхимы поджелудочной железы на жировую ткань.
 Панкреатоциты замещаются адипоцитами. Проблема состоит в том, что адипоциты не способны выполнять те же внутрисекреторные и внешнесекреторные функции, присущие поджелудочной железе.
Панкреатоциты замещаются адипоцитами. Проблема состоит в том, что адипоциты не способны выполнять те же внутрисекреторные и внешнесекреторные функции, присущие поджелудочной железе.Данный симптом встречается и у молодых или зрелых людей, страдающих сахарным диабетом. Сама поджелудочная железа при этом становится более плотная, у больного наблюдаются незначительные симптомы ферментной недостаточности. В заключении врач указывает: диффузные изменения поджелудочной железы по типу липоматоза.
- Диффузное замещение паренхимы поджелудочной железы и печени соединительной тканью. Данный процесс получил название «фиброзирование». Перерождение паренхимы обусловлено воспалительным процессом или нарушениями общего обмена веществ. При этом воспалённые или ишемизированные участки замещаются соединительной тканью, которая также не способна выполнять функции поджелудочной железы.
Таким образом, причинами возникновения диффузных изменений могут быть:
- Панкреатит любой формы и этиологии.

- Сахарный диабет как первого, так и второго типов.
- Нарушения обмена веществ и системные заболевания, которые протекают с нарушениями общего обмена.
- Вторичные воспалительные процессы, переходящие с других органов.
- Хронические интоксикации – бесконтрольное потребление лекарственных препаратов, хронические заболевания пищеварительной системы, злоупотребление спиртных напитков, курение.
Предрасполагает к перерождению паренхимы пожилой и старческий возраст, неправильное питание и нарушение диеты, наследственная предрасположенность, частые стрессовые ситуации.
Важно! При тяжёлых состояниях – раковое перерождение, кисты и конкременты выводных протоков – заключение о наличии диффузных изменений не правомерно. Они могут быть только при хронических обменных, токсических или воспалительных заболеваниях, затрагивающих весь орган полностью, а не только его определённый участок.
Виды диффузных изменений
Диффузные перестройки могут быть двух видов: умеренные и выраженные.
Умеренные диффузные изменения поджелудочной железы наблюдаются при начальных стадиях фиброза и липоматоза. Перерождение ткани ещё не выражено, симптомов ферментной недостаточности не наблюдается.
Наиболее частая причина умеренных изменений – лёгкая форма панкреатита и отёк поджелудочной железы. Выявляются они редко, в подавляющем большинстве случаев случайно на профилактическом медицинском осмотре. Специального лечения не требуется.
Для предотвращения дальнейшего прогрессирования процесса достаточно консервативной терапии.
Поджелудочная железа узи расшифровка норма у детей
Выраженные изменения имеются при запущенных состояниях и хронических заболеваниях с длительным анамнезом. Они, как правило, уже не обратимы. У больного имеются симптомы ферментной недостаточности.
Для лечения помимо консервативной терапии врачом назначается заместительная ферментная терапия и терапия лекарственными препаратами. Данные методы являются симптоматическим лечением.
В дополнение проводится этиотропное лечение – терапия основного заболевания.
Изменения при панкреонекрозе и панкреатите на УЗИ
Острый панкреатит
При остром воспалении нарушается нормальный отток секрета. При этом он забрасывается обратно в протоки, откуда попадает в паренхиму.
Этот рефлюкс приводит к тому, что ткань железы переваривается под действием собственных ферментов, сам орган отекает. На УЗИ это отражается понижением плотности ткани, увеличением размеров поджелудочной железы.
Протоки при этом могут быть без патологии, в некоторых случаях в них обнаруживаются конкременты или стриктуры, мешающие оттоку ферментов.
Хронический панкреатит
При хроническом воспалительном процессе в стадии ремиссии и при панкреонекрозе плотность ткани повышается, паренхима становится более рыхлая из-за разрастающейся соединительной ткани. Размеры самого органа при этом не изменяются, отёк капсулы и паренхимы не наблюдается. Выводные протоки также без патологии.
Размеры самого органа при этом не изменяются, отёк капсулы и паренхимы не наблюдается. Выводные протоки также без патологии.
Изменения при сахарном диабете на УЗИ
При диабете нормальная железистая ткань замещается жировой. Это же наблюдается у здоровых людей в преклонном и пожилом возрасте.
Жировая ткань обладает более высокими звукоотталкивающими способностями, чем соединительная ткань и ткань поджелудочной железы.
Поэтому, если в заключении врач написал о диффузных изменениях поджелудочной железы с повышенной эхогенностью, то предполагают наличие липоматоза.
Что делать?
Если по заключению УЗИ вам было диагностировано наличие диффузных изменений, не нужно паниковать. Это не диагноз, зачастую они диагностируются у здоровых людей. В подавляющем большинстве случаев наличие диффузных перестроек – хорошая новость, так как они не возникают при серьёзных патологиях: рак, киста, абсцесс.
Если у вас не беспокоят боли в животе, понос, метеоризм и вздутие живота, то достаточно выяснить первопричину и скорректировать рацион питания. Если вышеуказанные симптомы вас беспокоят, то проводят полный спектр исследований для выявления заболевания, назначения соответствующего лечения.
Если вышеуказанные симптомы вас беспокоят, то проводят полный спектр исследований для выявления заболевания, назначения соответствующего лечения.
Принципы лечения
Лечения непосредственно самих диффузных изменений не существует. Не устраняются они и при оперативном вмешательстве, так как тотальное удаление поджелудочной железы проводят в крайних ситуациях.
Если диффузные изменения возникли на фоне полного здоровья, и обследование не показало наличия каких-либо нозологических заболеваний, то для лечения вам достаточно соблюдения диеты.
Диета и основы питания:
- Частые приёмы пищи — до 5-6 раз в день небольшими порциями.
- Тёплая температура подаваемых блюд.
- Исключение из рациона жирного, жареного. Не рекомендуется включать раздражающую пищу: острое, маринованное, солёное, пряное, сладкое.
- Блюда готовятся на пару или отвариваются.
- Основной упор при выборе продуктов нужно делать на овощи, мясо нежирных сортов, зерновые культуры.

- Отказ от приёма спиртных напитков, курения.
Если пациент предъявляет жалобы на нарушения пищеварения, боли в животе, то ему проводят полный спектр диагностических исследований. После выявления основного заболевания, установления диагноза назначается лечение, в ходе которого лечатся и диффузные изменения.
Помимо диеты, отказа от курения и алкоголя, больному прописывают симптоматические и средства и препараты для устранения патологии.
Симптоматические лекарственные средства:
- Заместительная ферментная терапия препаратами пищеварительных ферментов: Фестал, Панкреатин. Они устраняют диспепсические расстройства: тяжесть в животе, понос, вздутие живота.
- Анальгетики ряда нестероидных противовоспалительных препаратов: Найз, Кетонов, Диклофенак, Ибупрофен. Их пьют в период ощущения острых боле в животе.
- Препараты для усиления перистальтики: Метоклопрамид, Домперидон, Церукал.
Патогенетическая терапия для устранения основного заболевания подбирается индивидуально, в зависимости от нозологической группы патологии.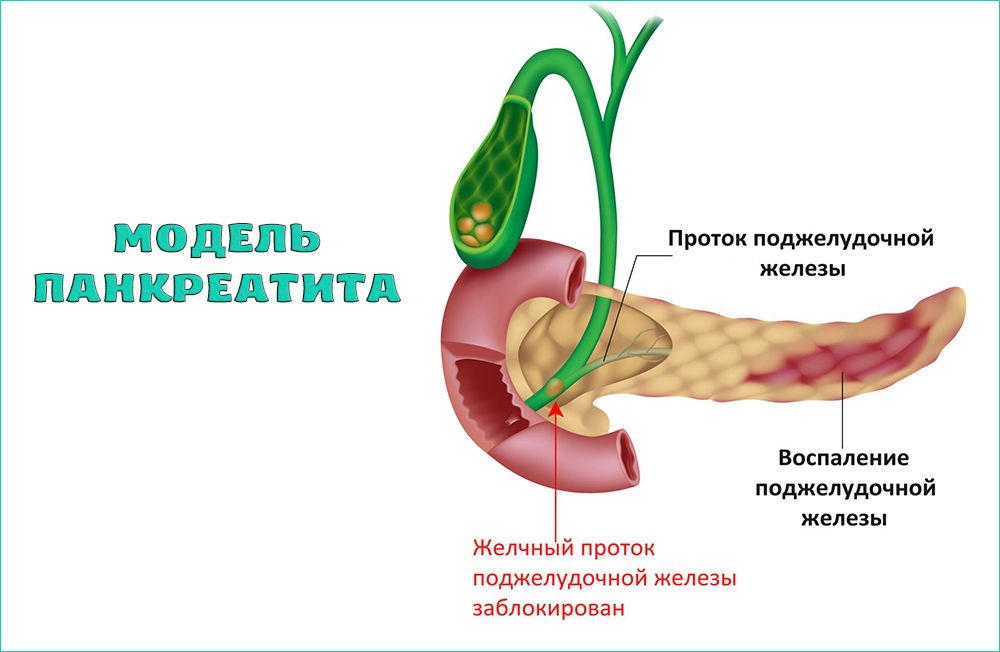
Рак поджелудочной железы на УЗИ: видна ли опухоль
Ультразвуковое исследование является традиционным методом диагностики различных опухолей в брюшной полости. Рак поджелудочной железы на УЗИ определяется в виде неоднородного образования в ткани органа. Заболевание отличается высокой злокачественностью. Пятилетняя выживаемость после операции составляет до 20%. Раннее выявление продлевает жизнь на несколько лет. Лечат онкологию поджелудочной железы оперативным методом, дополняя лучевой, гормональной и иммунной терапией.
Строение и функционал органа
Поджелудочная железа – орган пищеварительного тракта, расположенный в верхней части живота. Состоит из хвоста, головки и тела. Мелкие протоки поджелудочной, объединяясь с общим желчным ходом, открываются в двенадцатиперстную кишку.
Функционально железа состоит из двух частей: внешнесекреторной (основная масса клеток) и эндокринной. В экзокринной части синтезируются ферменты – амилаза, липазы, а также протеазы.
Эндокринная ткань сосредоточена в хвостовой части органа. Ее клетки синтезируют инсулин, глюкагон и другие биологически активные вещества.
Как работает ультразвуковое исследование
Ультразвуковой сканер позволяет визуализировать патологические новообразования. Датчик, находящийся в контакте с поверхностью тела, проводит звуковые волны через брюшную стенку. Далее сигнал пронизывает органы. Разные ткани отличаются по сопротивляемости к звуку.
Феномен называется акустическим сопротивлением. В месте препятствий часть волн отражается. Рак поджелудочной железы по УЗИ определяется как эхогенное препятствие ходу сигнала.
Во время исследования сонолог оценивает характер кровоснабжения образования, определяя степень его злокачественности.
В каких случаях нужна узи-диагностика
Назначают УЗИ, если у пациента есть признаки, характерные для поражения органа. Триадой симптомов рака поджелудочной железы являются:
- желтуха,
- боль в эпигастрии,
- резкое похудение.

Симптомы свидетельствуют о прогрессировании опухоли, сопровождающимся раковой интоксикацией.
Также показаниями для проведения исследования являются:
- травма в проекции органа,
- расстройство стула, метеоризм,
- сахарный диабет,
- дискомфорт в животе, связанный с приемом пищи,
- изменение лабораторных показателей в крови и моче,
- подозрение на злокачественных процесс в поджелудочной железе,
- метастазы в брюшине от опухолей другой локализации,
- ведение хронического панкреатита.
Разновидностью УЗИ является допплерография. Во время исследования с помощью специального датчика сонолог оценивает характер кровотока органа. Извилистые сосуды говорят о злокачественном процессе.
Подготовка к исследованию
Подготовку к процедуре начинают за 2-3 суток. Для точной диагностики РПЖ (рака поджелудочной железы) необходимо исключить продукты, способствующие усиленному газообразованию:
- бобовые,
- сдобная выпечка,
- фрукты и овощи с высоким содержанием клетчатки,
- цельное молоко,
- алкоголь.

Накануне проведения исследования пропускают ужин. Последний прием пищи должен состояться как минимум за 6-7 часов до процедуры.
Проведение диагностики
Исследование проводят утром. Диагностику выполняет врач-сонолог. Процедура абсолютно безболезненна. Проведение обследования практически не требует приложения усилий со стороны пациента.
Брюшную стенку перед началом процедуры оголяют. Для лучшей визуализации исследуемого просят надуть живот и на несколько секунд задержать дыхание. Для хорошего проведения сигнала на датчик наносят изоэлектрический гель.
Результаты исследования
Результаты зависят от локализации и размера опухоли. При единичном новообразовании заметен один очаг, при прогрессии – визуализируется плотный опухолевый конгломерат.
Признаки рака поджелудочной железы на УЗИ
УЗИ покажет онкологию при размере опухоли больше 2 мм. Современные датчики визуализируют образования меньшего диаметра, но доступны только в научно-исследовательских центрах.
Опухоль видна на мониторе УЗИ-аппарата в виде объемного образования неправильной формы с неровными краями. Измененные ткани низкой эхогенности. Структура образования неоднородная.
Часто тяжело дифференцировать рак от псевдотуморозной формы панкреатита. При данной патологии Вирсунгов проток значительно расширен, а при раке наблюдается неравномерное изменение его просвета.
Во время исследования оценивают возможность проведения операции. Расположение опухоли между ножками крупных артериальных сосудов является противопоказанием к хирургическому вмешательству.
Метастазы ищут в печени, почках, регионарных лимфоузлах. Они визуализируются в виде слабо эхогенных очагов.
Наиболее чувствительным методом является метод эндосонографии. В отличие от классического датчика УЗИ, используют гибкий видеоэндоскоп с ультразвуковым элементом. Вводится аппарат в кишечник и подводится непосредственно к образованию.
Метод позволяет выявить раннюю стадию опухоли. На мониторе видно рак со всеми его особенностями. Состояние сосудов оценивают с помощью допплеровского датчика. При злокачественном новообразовании кровоток приобретёт патологический характер.
На мониторе видно рак со всеми его особенностями. Состояние сосудов оценивают с помощью допплеровского датчика. При злокачественном новообразовании кровоток приобретёт патологический характер.
Сосуды становятся хрупкими, отмечается также контактная кровоточивость.
УЗИ-заключение не является диагнозом. Для подтверждения проводят компьютерную томографию и берут образец ткани. Только гистологическое исследование подтверждает онкологическое заболевание.
Какие еще патологии можно обнаружить
Как правило, во время УЗИ брюшной полости оценивают состояние печени и желчного пузыря, почек, селезенки.
Ультразвуковая диагностика позволяет выявить нефролитиаз (камни в почках), который тоже дает болевой синдром.
Холестаз (застой желчи), связанный с закупоркой желчных путей, вызывает желтушность кожных покровов. Также расширение желчных протоков служит причиной нарушения функции поджелудочной железы.
Диффузное увеличение органа говорит об остром воспалительном процессе. Наличие кист свидетельствует о хронической патологии поджелудочной. Часто кисты ошибочно принимают за раковую опухоль.
Наличие кист свидетельствует о хронической патологии поджелудочной. Часто кисты ошибочно принимают за раковую опухоль.
Насколько часто можно делать скрининги
Ультразвуковое исследование – абсолютно безобидная процедура. Она не требует специальной подготовки. На основании данных УЗИ и других методик предполагают диагнозы: рак поджелудочной железы, панкреатит, кисты. Заболевания поджелудочной железы быстро прогрессируют, вызывая необратимые последствия. Пациентам группы риска (отягощенный анамнез, курение, работа с вредными факторами производства) необходимо проходить исследование 1 раз в 6 месяцев.
Другие методы диагностики
Для лабораторной диагностики рака поджелудочной железы используют дополнительные методы исследования:
- В общем анализе крови выявляют увеличение количества лейкоцитов, СОЭ, тромбоцитов.
- При передавливании опухолью общего желчного протока в биохимическом анализе крови повышается концентрация печеночных ферментов (АЛТ, АСТ), билирубина, щелочной фосфатазы.
- В копрограмме (исследование кала) выявляют стеаторею (непереваренный жир).
- Специфическим методом является определение онкомаркера CA 19-9.
- Информативным является цитологическое исследование.
- Смыв дуоденального содержимого сканируют на наличие злокачественных клеток.
Из инструментальных методов применяются компьютерная томография (КТ) и магнитно-резонансное сканирование. Мультиспиральная компьютерная томография (МСКТ) и эндоУЗИ используются для выявления метастазов опухолей поджелудочной.
Лапароскопия – это метод хирургической диагностики, позволяющий обнаружить метастазы в брюшной полости. Во время процедуры проводят биопсию опухоли для дальнейшего гистологического исследования.
1
Узи признаки рака поджелудочной железы
Комплексное ультразвуковое исследование рака поджелудочной железы
На основании данных УЗИ выработан алгоритм обследования пациентов, страдающих раком поджелудочной железы:
- чрескожное исследование в В-режиме в реальном масштабе времени, широко используемое для выявления опухолей поджелудочной железы, по существу является скрининговым методом, с которого начинают обследование больного;
- цветовое допплеровское сканирование или исследование в В-режиме в сочетании с использованием двуокиси углерода (микропузырьков СО2) в качестве контрастного вещества, предоставляет дополнительные возможности в дифференциальной диагностике опухолевого процесса и воспалительных изменений поджелудочной железы;
- цветовое допплеровское сканирование с использованием режимов ЦДК или ЭДК дает информацию о характере взаимоотношения опухоли с сосудами системы воротной вены, системы нижней полой вены, а также аорты и ее ветвей.
Если диагноз окончательно не установлен, то на основании результатов комплексного УЗИ принимается решение о выборе необходимого дополнительного метода исследования или их сочетанного использования.
К ним относят: УЗ-эндоскопическое исследование, УЗ-внутрипротоковое исследование, чрескожная аспирационная биопсия поджелудочной железы под контролем УЗИ.
Интраоперационное ультразвуковое исследование позволяет уточнить вид и объем операции.
Диагностика рака поджелудочной железы в В-режиме в реальном масштабе времени основывается на прямых и косвенных признаках. К прямым признакам относятся выявление солитарного очага или полости неоднородной плотности с наличием линии демаркации между опухолью и паренхимой поджелудочной железы.
Опухолевая перестройка паренхимы поджелудочной железы — это основной прямой признак наличия опухоли. Перестройка структуры в зоне поражения вызывает изменение интенсивности отражения эхосигналов от опухоли.
Выделяют следующие варианты эхогенности опухоли: гипоэхогенный, гиперэхогенный, изоэхогенный и смешанный.
Согласно нашим данным УЗИ в В-режиме 131 больного аденокарциномой поджелудочной железы, локализацию процесса в головке отмечали в 62% наблюдений, в теле — в 12%, хвосте — 24% и тотальное поражение — в 2% случаев. В большинстве наблюдений диагностировали гипоэхогенные образования — 81,7%, смешанной эхогенности — в 10,7% случаев, гиперэхогенные — в 4,5 % и изоэхогенные — в 3,1 % наблюдений.
Возможность УЗИ в В-режиме в диагностике опухолей зависит от локализации и ее размеров. В зависимости от величины опухоли, размеры железы могут оставаться неизменными либо отмечается локальное или диффузное ее увеличение.
К косвенным признакам аденокарциномы относятся расширение панкреатического протока, расширение общего желчного протока (ОЖП). Обструкция главного панкреатического протока (ГПП), обусловленная сдавлением или прорастанием опухолью, может происходить непосредственно в области его перехода в ампулу с последующей дилатацией дистальнее уровня обструкции.
В этом случае визуализируется проток в теле и/или головке диаметром более 3 мм. Нами отмечена дилатация главного панкреатического протока от 4 до 11 мм в 71 % наблюдений при локализации опухоли в головке поджелудочной железы.
При локализации опухоли в головке поджелудочной железы и близком расположении к интрапанкреатической части общего желчного протока, вследствие опухолевой инвазии, циркулярного сдавления опухолью или роста опухоли в просвет протока развивается обструкция общего желчного протока.
При диаметре общий желчный проток 12-17 мм просвет внутрипеченочных желчных протоков достигал 8 мм в сочетании с увеличением размеров желчного пузыря. Расширение внутрипеченочных желчных протоков может быть обусловлено наличием опухоли в головке поджелудочной железы либо лимфатических узлов в области гепато-дуоденальной связки.
При локализации рака в области крючковидного отростка не всегда удается по данным УЗИ в В-режиме адекватно визуализировать и оценить изменения на ранней стадии заболевания.
По мере распространения процесса и инфильтрации головки поджелудочной железы опухолевые массы достигают уровня терминального отдела общего желчного протока. Однако эти изменения, как правило, диагностируются уже на поздней стадии заболевания.
Поэтому для опухоли, исходящей из крючковидного отростка, характерна дилатация общего желчного протока, ГПП и развитие желтухи на поздней стадии заболевания.
Дифференцировать эхографическую картину рака необходимо прежде всего с локальными формами панкреатита, раком большого дуоденального сосочка, иногда псевдокистами, лимфомами, метастазами в поджелудочной железе. Тактически важным является учет клинических и лабораторных данных в сочетании с результатами биопсии.
Дополнительные возможности в дифференциальной диагностике опухолевого процесса и воспалительных изменений поджелудочной железы открывает применение цветового допплеровского сканирования в режиме ЦДК, ЭДК и/или В-режиме в сочетании с использованием двуокиси углерода.
Нами проанализированы дополнительные возможности получения необходимой информации с помощью цветового допплеровского сканирования. При использовании данной методики определяли наличие сосудов, характер и скорость кровотока в них.
При дуплексном сканировании у больных раком поджелудочной железы отмечается либо отсутствие кровотока сосудов внутри опухоли, либо регистрируются сосуды преимущественно с артериальным кровотоком коллатерального типа, диаметром 1-3 мм, ЛСК- 10-30 см/с.
Ни в одном наблюдении не было выявлено сосудов, огибающих опухоль в виде ободка.
Для усиления ультразвукового сигнала, отражающегося от эритроцитов, используют эхоконтрастные вещества. В нашей работе был использован левовист. Проводили исследования в два этапа у трех больных раком поджелудочной железы и шести — хроническим панкреатитом. На первом этапе выполняли УЗ-исследование сосудистого русла в головке поджелудочной железы.
На втором — оценивали кровоток в сосудах головки поджелудочной железы после внутривенного введения 6 мл левовиста в концентрации 400 мг/мл, с последующим сравнением интенсивности сигналов от кровотока до и после применения левовиста. При раке поджелудочной железы на первом этапе исследования у трех больных отсутствовал кровоток внутри опухоли.
После введения левовиста через 15-20 с на протяжении одной-двух минут в двух случаях отчетливо визуализировали артериальные сосуды диаметром до 2 мм с коллатеральным типом кровотока. Среди 6 пациентов с ХП на первом этапе в четырех случаях в головке поджелудочной железы визуализировались артерии с магистральным типом кровотока и вены.
На втором этапе регистрация хода ранее зафиксированных сосудов заметно улучшилась. В остальных наблюдениях появилось изображение сосудов, преимущественно вен, которые не определяли ранее.
Таким образом, на основании накопленного опыта мы рекомендуем применение в сложных диагностических ситуациях цветового допплеровского сканирования в режимах ЦДК: ЭДК для дифференциальной диагностики заболеваний поджелудочной железы.
Наиболее простым веществом, усиливающим изображение в В-режиме, является двуокись углерода (микропузырьки СО2). Введение в чревный ствол микропузырьков СО2 во время агиографического исследования при изучении поджелудочной железы с помощью УЗИ в В-режиме является по существу комбинированным способом диагностики.
Использование двуокиси углерода дает возможность более четко подтвердить и дифференцировать характер процесса в поджелудочной железе. Согласно данным Kazumitsu Koito et al.
при обследовании 30 пациентов раком поджелудочной железы и 20 — хроническим панкреатитом, в зависимости от наполнения зоны поражения микропузырьками С02, диагностировали наличие и степень васкуляризации. Авторы выявили, что раковая опухоль в 91% наблюдений гиповаскулярная, зона ХП в 95% случаев — изоваскулярная.
Сопоставление результатов УЗИ в В-режиме с использованием двуокиси углерода, компьютерной томографии и дигитальной субтракцион-ной ангиографии в дифференциальной диагностике рака поджелудочной железы и ХП показало, что чувствительность методов составляет 98%, 73% и 67% соответственно.
Одним из ключевых моментов в определении резектабельности рака является оценка состояния магистральных сосудов и степень вовлечения их в опухолевый процесс. Уже на дооперационном этапе по данным УЗ-исследования можно получить необходимую информацию.
При локализации рака в головке поджелудочной железы, как правило, проводится целенаправленное исследование верхней брыжеечной вены, воротной вены и ее конфлюенса, верхней брыжеечной артерии, общей печеночной артерии и чревного ствола, в теле — чревного ствола, общей печеночной и селезеночной артерий, в хвосте — чревного ствола и селезеночных сосудов. В определении резектабельности опухоли имеет значение и состояние нижней полой вены. На наш взгляд, для оценки состояния сосудов по данным цветового допплеровского сканирования целесообразно проводить анализ:
- Локализации и анатомического расположения магистральных артерий и вен относительно опухоли (сосуд не контактирует с опухолью, контактирует с опухолью, располагается в структуре опухоли).
- Состояния стенки и просвета сосуда (эхогенность стенки сосуда не изменена, повышена; величина просвета не изменена, изменена на участке контакта с опухолью).
- Величины линейной скорости кровотока на всем протяжении сосуда, доступном УЗ-визуализации.
При контакте сосуда с опухолью регистрация локального увеличения ЛСК свидетельствует о наличии гемодинамически значимой экстравазальной компрессии сосуда опухолью. В такой ситуации для определения резектабельности опухоли первостепенное значение имеет информация об инвазии опухоли в стенку сосуда.
Повышение эхогенности стенки сосуда на участке контакта с опухолью свидетельствует либо о фиксации опухоли, либо о прорастании опухолью стенки сосуда. Повышение эхогенности стенки и наличие субстрата в просвете сосуда указывает на прорастание сосуда опухолью.
Отсутствие УЗ-изображения сосуда, анатомический ход которого располагается в структуре опухоли, также свидетельствует о прорастании сосуда. Кроме этого, при раке поджелудочной железы часто развивается пристеночный или обтурирующий тромб в верхней брыжеечной вене и/или селезеночной вене.
Тромбоз из этих вен может распространяться и на воротную вену.
На сегодняшний день трехмерная реконструкция опухоли поджелудочной железы и близлежащих магистральных сосудов при использовании сочетания В-режима и ангиографии позволяет оценить их анатомическое взаимоотношение и степень контакта.
Однако для решения вопроса о состоянии стенки сосуда на участке контакта с опухолью преимущественное значение имеют данные, полученные при использовании В-режима.
Сравнение возможностей В-режима при двухмерном сканировании и трехмерной реконструкции свидетельствует о более высокой разрешающей способности метода при трехмерном УЗ-изображении.
Более четко регистрируют структурные особенности и контур стенки, а также состояние ее эхогенности, что имеет важное клиническое значение при определении показаний к оперативному лечению пациентов, страдающих раком поджелудочной железы.
Методика трехмерной реконструкции эффективна в оценке состояния стенки сосудов и имеет меньшее клиническое значение в оценке УЗ-характеристик патологического очага.
Улучшение изображения опухоли в В-режиме при трехмерной реконструкции по сравнению с двухмерным сканированием (более ярко визуализируют границы опухоли, более четко определяют структурные особенности) не является строго необходимой информацией для решения вопроса о резектабельности рака поджелудочной железы.
Подобная информация на дооперационном этапе позволяет определить тактику ведения больного и решить вопрос о возможности удаления опухоли с реконструкцией или без реконструкции пораженного сегмента сосуда.
Анализируя наш материал, основанный на результатах обследования более 50 больных с очаговыми поражениями поджелудочной железы, мы пришли к выводу, что для оценки состояния стенки, просвета сосуда и решения вопроса о возможности выполнения оперативного лечения и его объема у больных раком поджелудочной железы, показанием к проведению трехмерной реконструкции является наличие опухоли поджелудочной железы, контактирующей с магистральными сосудами.
При раке поджелудочной: что покажет УЗИ
Ультразвуковая диагностика относится к традиционной методике выявления разных образований в брюшине. Рак поджелудочной железы на УЗИ выявляется в качестве опухоли неоднородной структуры, сформировавшейся в тканях. Болезнь имеет высокую злокачественность.
Около 20% пациентов живут после операции в среднем 5 лет. В случае раннего обнаружения патологии продолжительность жизни увеличивается на 2 года. Лечение онкологии органа проходит хирургическим путем, с дополнением лучевой, гормональной и иммунной терапии.
Вероятные симптомы
Вследствие особенностей размещения поджелудочной железы, которая контактирует со всеми пищеварительными органами, и имеет непосредственную рабочую взаимосвязь с ними, развитие выраженных симптомов заболевания указывает на болезненную процессию, которая уже зашла довольно далеко.
Признаки опухоли поджелудочной несколько отличаются, все зависит от размещения повреждения органа. Независимо от расположения онкологических распространенных образований, появляются такие симптомы:
- синдром боли;
- депрессивное состояние;
- пожелтение кожного покрова;
- утрачивается масса тела.
Болевой дискомфорт иногда имеет не четкую локализацию, однако часто выявляется в эпигастральной области, под левым и правым ребром, отдавая в спину.
Зона, где формируется симптом боли, зависит от поврежденной образованием область железы:
- в закупорке холедоха либо вирсунгова канала;
- перитонеальных явлений по причине обострения сопутствующего воспалительного процесса, который развивается в тканях, расположенных рядом;
- в сдавливании нервных стволов.
Оттого как формируются новообразования поджелудочной железы, происходит нарастание диспепсических расстройств.
- Отсутствует желание кушать.
- Подташнивает.
- Появляются отрыжки воздухом вследствие вздутия живота.
- Открывается рвота.
- Нарушается стул – диарея, запор.
Главный ранний симптом рака поджелудочной железы – стремительная утрата массы тела.
Пострадавший сильно сбавляет в весе в результате изменения пищеварительного процесса и отравления раком, которое определено продуктами разложения образования.
Атипичные быстро делящиеся клетки образования, утрачивают свою деятельность, не производя ферменты. Так как сдавливается вирсунговый канал или холедоха разрастающим образованием, в канал ДПК оканчивается приход.
- Пищеварительный сок с ферментами и распад ими углеводов, жиров, белков.
- Желчь, при наличии которой расщепляются жиры.
На последней стадии заболевания поджелудочной железы проявления опухоли прогрессируют, возникают новые. При раке тела и хвоста наблюдаются тромбозы сосудов, развивающиеся чаще, относительно ракового повреждения головки.
При развитии рака, симптомы меняются и может формироваться:
- сахарный диабет;
- снижение уровня глюкозы;
- панкреатический стул;
- пожелтение кожных покровов, слизистой.
Если больной ранее не сталкивался с диабетом, болезнь поражает орган, когда рак охватывает хвостовую часть железы. Это объединено с большим размещением этой зоне островков Лангерганса с клетками бета, вырабатываемые глюкозу, клетками альфа, которые синтезируют антагонист инсулина – глюкагон.
Вследствие неполноценной выработки инсулина происходит нарушение формирования глигогена из глюкозы, что в дальнейшем ведет к развитию сахарного диабета.
Диабет как следствие рака, характеризуется рядом симптомов.
- Головная боль.
- Невозможность концентрировать внимание.
- Увеличенная утомляемость.
- Увеличение количества выделяемой мочи.
- Сухость в ротовой полости.
- Возникновение галлюцинаций.
- Помрачение рассудка.
- Неакдекватность в поведении.
- Наличие судорог.
- Развитие комы.
При сахарном диабете необходимо обратить внимание на свое здоровье и проходить наблюдение у врача.
Панкреатический стул характеризуется такими проявлениями:
- серый цвет кала;
- жирный блеск;
- смрадный запах;
- опорожнение до нескольких раз в сутки.
Желтушность формируется по мере распространения рака. У больного желтеет кожный покров, склеры, слизистые, обесцвечиваются экскременты, темнеет моча, наблюдается также расширение желчных протоков.
Нарастание истеричности формируется от развития патологии. Больной жалуется на мучительный зуд, который усиливается по ночам, сильные боли.
Эти симптомы могут развиться на поздних стадиях, когда опухоли прорастают в ворота печени.
У беременных и детей симптоматические признаки требуют лечения, которое будет постоянно контролироваться врачом. Терапия рака требует разработки индивидуальной схемы.
При вынашивании ребенка лечение подбирается в зависимости от недели беременности, стадии опухоли. Если выявляется рак на тридцать первой неделе, проводится симптоматическая терапия по устранению боли, основное лечение проводится после рождения ребенка. До 12 недель выявления рака, женщине предлагают прервать беременность.
В случае развития рака, чтобы подтвердить диагноз, железе необходима диагностика. Назначают обследования с помощью УЗИ. В качестве дополнительной диагностики сдают анализы при раке поджелудочной железы, исследуются показатели крови и мочи, назначаются рентгенологические и другие методы диагностики.
Основной задачей УЗИ является выявление первичных показателей. Это размер поджелудочной железы, форма. Затем проверяют паренхиму и присутствие рака.
Что покажет исследование в случае рака
Определенной подготовки для УЗИ диагностики не требуется. Чтобы лучше просмотреть орган врач просит надуть живот и на некоторое время удержать дыхание.
Если у больных наблюдается вздутие, им советуют следовать бесшлакового диетического питания на протяжении 3 суток до проведения УЗИ и пить адсорбирующие препараты. Это активированный уголь, принимаемый по 2 пилюли 3 раза в сутки. Перед проведением УЗИ нельзя ужинать. Последняя трапеза проходит за 7 часов до обследования.
При осуществлении диагностики на УЗИ поджелудочной железы видно:
- при единичной локализации опухоли очаг рака один;
- в случае прогрессивности просматривается опухоль плотной структуры.
В основном, определение исследований проходит не только железы, а и всей системы пищеварения – брюшная полость, малый таз, мягкие ткани органа.
Разновидность УЗИ – доплерография, при проведении которой с помощью специального датчика сонологом оценивается особенность кровотока. В случае обнаружения извилистых сосудов на УЗИ, это указывает на рак.
Помимо рака на УЗИ обнаруживается ряд заболеваний.
Из инструментальных методик применяют КТ и магнитно-резонансное сканирование. Мультиспектральная томография позволяет выявить метастазы рака поджелудочной железы. Лапароскопия является хирургическим способом исследования, при котором возможно выявить рак в брюшине. При процедуре осуществляется биопсия рака для последующего гистологического анализа.
Узи признаки
Опухоль на мониторе аппарата УЗИ просматривается в качестве объемного новообразования, имеющая неправильную форму и неровные края. Наблюдается изменение тканей поджелудочной железы низкой эхогенности. Образование неоднородной структуры.
Нередко возникают сложности дифференциации образования от псевдотуморозной формы панкреатита, потому требуется тщательное исследование панкреатического канала. При болезни основной панкреатический проток выглядит расширенным, на своем протяжении его диаметр неравномерный.
Когда есть рак, канал расширяется только ниже опухоли.
Также благодаря УЗИ определяется, нужна ли операция образования. Для этого врач дает оценку расположения рака для сосудов значительных размеров.
- Нижняя полая и воротная вена.
- Аорта.
- Верхняя брыжеечная артерия.
В случае тесного соприкосновения с одним либо несколькими сосудами на значительном расстоянии, то лечение рака поджелудочной железы невозможно оперативным путем либо имеются определенные трудности в ее проведении.
Если подозревают рак в органе, на УЗИ смотрят, имеются ли опухоли в печени, лимфатических узлах. Образования имеют округлую форму. Явный симптом метастаза определяется неимением эхонегативной каемки по кругу. Раковое поражение лимфоузлов представляет собой округлые новообразования с четкими контурами, располагающиеся около аорты и органа.
Заключение УЗИ, не считается диагнозом. Чтобы подтвердить рак проводится КТ и берется образец ткани. Благодаря гистологическому исследованию подтверждается рак.
Клинический случай диагностики рака поджелудочной железы | Винник Ю.С., Серова Е.В., Бобкова А.В., Цедрик Н.И., Цедрик А.А., Репина Е.В., Бабкина О.А.
Представлен клинический случай диагностики рака поджелудочной железы
Для цитирования. Винник Ю.С., Серова Е.В., Бобкова А.В. и др. Клинический случай диагностики рака поджелудочной железы // РМЖ. 2016. No 8. С. 525–527Рак поджелудочной железы (РПЖ) – злокачественная опухоль, развивающаяся из эпителия протоков – дуктальная (81% случаев) или из паренхиматозных клеток поджелудочной железы – ацинарная (14% случаев). Также бывает неклассифицируемый РПЖ.
РПЖ является одним из наиболее распространенных злокачественных заболеваний. Данный вид заболевания в развитых странах находится на 5-м месте среди причин смерти в общей структуре онкологических заболеваний. На РПЖ приходится около 10% всех опухолей желудочно-кишечного тракта [1, 2].
Встречаемость в США составляет 11 случаев на 100 тыс. населения ежегодно, в Японии и Англии – 16, в Италии и Швеции – 18. В России заболеваемость РПЖ составляет 8,6 человека, а в Москве – 11,4 на 100 тыс. жителей. За последние 50 лет заболеваемость возросла в 4 раза.
Мужчины заболевают в 1,5 раза чаще, чем женщины, наибольшая заболеваемость приходится на возраст 60–70 лет.
При этом хронический панкреатит любой этиологии увеличивает риск развития РПЖ [2].
Так же как и для опухолей других локализаций, для РПЖ очень важна ранняя диагностика, позволяющая выбрать необходимую тактику ведения пациента и увеличить продолжительность его жизни. Поскольку длительное время течение этого заболевания остается бессимптомным, до 80% больных умирают в течение года после установления диагноза.
Главенствующая роль в диагностике РПЖ принадлежит УЗИ, КТ и МРТ [1].
Злокачественные опухоли могут образовываться в разных отделах поджелудочной железы: в 56–74% случаев – в головке, в 10–18% – в теле, в 6–8% – в хвосте, у 6–28% больных наблюдается тотальное поражение поджелудочной железы.
Более благоприятной является локализация рака небольших размеров в области хвоста, что связано с возможностью выполнения дистальной резекции поджелудочной железы с более оптимистичным исходом [3].
Клинический случай
Под нашим наблюдением находился больной Р., 73 лет, который был направлен в гастроэнтерологическое отделение КГБУЗ «Красноярская межрайонная клиническая больница № 7» с диагнозом: обострение хронического рецидивирующего панкреатита средней степени тяжести. Из анамнеза: в сентябре 2013 г. стали беспокоить боли в эпигастральной области и левом подреберье. Больной обратился за медицинской помощью в поликлинику по месту жительства. Был обследован амбулаторно: фиброэзофагогастродуоденоскопия показала недостаточность кардии, диффузный атрофический гастрит, ксантомы желудка. При ультрасонографии брюшной полости выявлены диффузные изменения печени, поджелудочной железы, протоковые изменения печени, эхо-взвесь в желчном пузыре. На амбулаторном этапе получал гиосцина бутилбромид, омепразол, алгелдрат + магния гидроксид, панкреатин – без положительного эффекта.
При поступлении больной предъявлял жалобы на ноющие боли в эпигастральной области и левом подреберье, усиливающиеся в ночное время, периодическое вздутие живота.
При обследовании на ультрасонографии (аппарат «SonoScapeSSI-8000») брюшной полости и почек выявлено: размеры печени 147×67×91 мм, контур ровный, четкий, структура однородная, нормоэхогенная, желчные протоки не расширены. Холедох – 4 мм. Диаметр воротной вены – 11 мм. Диаметр аорты – 22 мм, с множеством кальцинированных атеросклеротических бляшек. Желчный пузырь размером 61×18 мм, грушевидной формы, стенка не утолщена, в просвете дополнительных образований, эхо-взвеси не визуализируется. Поджелудочная железа: головка – 22 мм, тело – 12 мм, хвост – 24 мм, неоднородная, диффузно повышенной эхогенности, контур неровный, четкий, вирсунгов проток не визуализируется. Малый сальник не изменен. Свободная жидкость в брюшной полости не лоцируется. Петли кишечника не расширены. Лимфоузлы не визуализируются. Селезенка 109×39 мм, однородная, нормоэхогенная, с ровным контуром, в воротах овоидный, изоэхогенный (тканевой) участок 49×47 мм, с волнистым контуром, без связи с левой почкой (рис. 1). При цветном допплеровском картировании определяется кровоток в области контура. Диаметр селезеночной вены – 6 мм. Плевральные синусы – без патологии. В почках дополнительных образований, расширения чашечно-лоханочной системы нет.
Заключение: диффузные изменения поджелудочной железы. Атеросклероз брюшного отдела аорты. Объемное образование в воротах селезенки (трудно верифицировать органопринадлежность – надпочечник? селезенка? дифференцировать первичный, вторичный характер поражения).
Данные инструментального обследования: фиброэзофагогастродуоденоскопия: диффузный поверхностный гастрит. Рентгеноскопия желудка: органических изменений не выявлено. ЭКГ: признаки гипертрофии левого желудочка.
Лабораторные исследования: анемия (гемоглобин – 75 г/л, эритроциты – 2,73×1012/л), тромбоцитопения (113×109/л), лейкоциты – 4,5×109/л, эозинофилы – 0,7, базофилы – 1,3, сегментоядерные – 19,8, лимфоциты – 71,3, моноциты – 6,9, СОЭ – 31 мм/час, амилаза – 116 ЕД/л; билирубин, аминотрансферазы, глюкоза крови, мочевина, креатинин, тимоловая проба – в норме. Холестерин – 6,3 ммоль/л. Гамма-глутаминтранспептидаза – 56,8 ЕД/л. В общем анализе мочи – норма. Кал на скрытую кровь – слабо положительный.
На КТ (рис. 2) визуализируется значительное увеличение размеров хвоста поджелудочной железы с неоднородной структурой. Заключение КТ: рак поджелудочной железы; атеросклероз аорты.
Данные, выявленные при МРТ (PhilipsIntera, 1,5 Тесла), представлены на рисунках 3–6.
Поджелудочная железа значительно увеличена в размерах на уровне хвоста и частично тела, контуры ее недостаточно четкие, структура неоднородная на уровне указанных отделов за счет наличия кистозно-солидного образования неоднородной структуры (изо- и преимущественно гиперинтенсивного сигнала по Т2 и в режиме жироподавления, изо- и гипоинтенсивного сигнала по Т1), с преобладанием кистозного компонента, с наличием множественных перегородок, размерами 8,7×4,6×4,4 см.
При внутривенном динамическом контрастировании отмечается диффузно-неоднородное накопление контрастного препарата на уровне солидного компонента (аналогично неизмененной ткани железы) с отсутствием контрастирования на уровне кистозного компонента.
Размеры поджелудочной железы на уровне головки 1,8 см, на уровне неизмененных отделов тела 1,3 см, с признаками жировой дистрофии на этих уровнях. Панкреатический проток на уровне объемного образования не прослеживается, на остальных уровнях – не изменен. Парапанкреатическая клетчатка инфильтрирована на уровне объемного образования.
Отмечаются признаки распространения данного патологического процесса на передние отделы селезенки.
Кроме того, в проекциях S4, S7 печени отмечаются единичные очаги измененного МР-сигнала (гиперинтенсивного по Т2 и в режиме жироподавления, гипоинтенсивного по Т1), без четких контуров, размером от 0,3×0,3 см до 1,0×1,0 см, при внутривенном динамическом контрастировании не исключается секундарный генез патологических очагов.
Больной получал симптоматическое лечение, на фоне которого отмечено некоторое улучшение – уменьшение болевого синдрома. Выписан на 12-й день с рекомендациями лечения в Красноярском краевом клиническом онкологическом диспансере им. А.И. Крыжановского.
Больной не был оперирован – из-за возраста, сопутствующей сердечной патологии и распространенности онкологического процесса (опухолевая инфильтрация парапанкреатической клетчатки, метастатическое поражение печени). Продолжено симптоматическое лечение.
.
Панкреатит у детей – причины, симптомы, диагностика и лечение панкреатита у детей в Москве в детской клинике «СМ-Доктор»
ПОЛУЧИТЬ КОНСУЛЬТАЦИЮ Содержание:Описание заболевания
Симптомы
Причины
Диагностика
Лечение Панкреатит – это патология поджелудочной железы, которая сопровождается локальным воспалением и нарушением ее функции. Диагностикой и лечением заболевания у детей занимается педиатр, семейный врач или гастроэнтеролог.
О заболевании
Панкреатит – распространенная патология желудочно-кишечного тракта (ЖКТ), которая сопровождается локальным воспалением ткани поджелудочной железы и ее протоков. Рассматриваемый орган играет одну из ключевых ролей в процессе пищеварения, обеспечивая выброс большого количества ферментов в кишечник. Поджелудочная железа также участвует в контроле уровня глюкозы в крови посредством секреции инсулина. Панкреатит ведет к нарушению указанных функций, что может стать причиной серьезного ухудшения состояния ребенка.Заболевание протекает остро или хронически. У детей важно максимально быстро распознать патологию, чтобы своевременно назначить адекватное лечение. В противном случае болезнь прогрессирует и приводит к органическому поражению тканей железы и повышению риска развития серьезных осложнений – сахарный диабет, грубые расстройства пищеварения, коллаптоидные реакции (предобморок и потеря сознания).
Симптомы панкреатита
Панкреатит – болезнь, которая в 90% случаев сопровождается нарушением секреции пищеварительных ферментов железой. Результатом такого поражения является ухудшение работы ЖКТ ребенка с возникновением характерных симптомов.Наиболее частыми признаками панкреатита у детей являются:
- болевые ощущения в животе – дискомфорт носит опоясывающий характер с иррадиацией в спину;
- метеоризм;
- нарушение дефекации по типу диареи;
- потеря аппетита;
- тошнота, рвота;
- повышение температурных показателей тела до 37-38оС.
У грудничков и новорожденных симптомы панкреатита носят меньшую выраженность, чем у детей старшей возрастной группы. Иногда родители могут даже не заметить каких-то особых изменений в поведении малыша. У подростков симптоматика заболевания отличается яркостью и интенсивностью. Это обусловлено влиянием значительного числа провоцирующих факторов.
Клиническая картина заболевания зависит от формы и длительности патологического процесса, а также степени поражения поджелудочной железы. При хроническом течении воспаления боль может носить затяжной ноющий характер. Параллельно ребенок теряет массу тела, ухудшается состояние кожи, ногтей, волос.
При выявлении каких-либо из указанных признаков родителям стоит обратиться за помощью к врачу. Ранняя диагностика панкреатита с назначением адекватного лечения способствует быстрой стабилизации функции пищеварения малыша и минимизации рисков развития осложнений.
Причины панкреатита
Патогенетической основой панкреатита любого генеза является локальное воспаление тканей железы. Ключевым механизмом этого патологического процесса является высвобождение чрезмерного количества активных ферментов, которые начинают повреждать собственные структуры органа. Гиперактивация секреторной функции железы может быть как первичной, так и вторичной (развивается вследствие патологии других органов и систем).У новорожденных и грудничков панкреатит чаще возникает в результате врожденных аномалий развития органа и его протоков. Из-за отсутствия адекватного оттока ферменты скапливаются внутри железы и запускают процесс лизиса (химического разрушения) собственных тканей.
У детей школьного и подросткового возраста активация выделения биоактивных энзимов может быть спровоцирована следующими факторами:
- употребление большого количества жаренной и жирной пищи – пищеварительный тракт ребенка не приспособлен для переваривания «тяжелых» продуктов;
- вирусные или бактериальные поражения органов ЖКТ с проникновением возбудителя в поджелудочную железу;
- сужение панкреатических дуктусов на фоне неопластических процессов в брюшной полости.
Риск развития панкреатита также повышается при нерегулярном питании, употреблении большого количества фаст-фуда, газированных напитков. Поражение поджелудочной железы иногда возникает на фоне приема агрессивных медикаментов или попадания в ЖКТ малыша токсинов.
Диагностика панкреатита
Гастроэнтерологи и педиатры «СМ-Доктор» – это специалисты со стажем от 10 лет и более. Благодаря большому опыту и современному оборудованию, которым оснащена наша клиника, врачи могут быстро выявить панкреатит даже на ранних этапах развития. Все это создает оптимальные условия для назначения адекватного лечения и, следовательно, восстановления состояния ребенка в кратчайшие сроки.Врач устанавливает предварительный диагноз панкреатита еще на первой консультации. В этом ему помогает анамнез заболевания, особенности клинической картины. Для верификации диагноза назначаются следующие дополнительные исследования:
- общеклинический анализ крови и мочи;
- биохимический анализ крови – особое внимание обращается на уровень альфа-амилазы;
- ультразвуковое сканирование (УЗИ) органов брюшной полости;
- анализ кала на эластазу-1;
- КТ, МРТ органов брюшной полости (при необходимости в сложных клинических случаях).
При подозрениях на сопутствующее нарушение функции других внутренних органов и систем гастролог направляет ребенка на консультацию к смежным специалистам (инфекционист, невролог, нефролог).
Лечение панкреатита
Ключевым аспектом лечения панкреатита является обеспечение максимально возможного функционального покоя железе в острой фазе воспаления. Значительное снижение секреторной функции органа, создаваемое искусственно, способствует естественному затуханию активности патологического процесса.С этой целью врачи назначают постельный режим и дробное употребление воды без газа (в первые дни) с постепенным расширением рациона за счет использования пюреобразных блюд. Для купирования клинической картины с помощью медикаментов используются следующие группы препаратов:
- анальгетики и спазмолитические средства – для устранения болевого синдрома;
- антисекреторные препараты;
- ферменты – для стабилизации функции пищеварения;
- ингибиторы протеазы.
Аномалии развития панкреас иногда могут потребовать оперативного лечения. При выявлении бактериальной причины заболевания врач дополнительно использует антибиотики с целью уничтожения возбудителя.
Профилактика заболевания предусматривает соблюдение рациональной диеты, которая соответствует возрасту малыша, и своевременное лечение других заболеваний ЖКТ.
«СМ-Доктор» – современная клиника, специализирующаяся на предоставлении полного пакета услуг по диагностике и лечению всевозможных заболеваний ЖКТ детей от 0 и до 18 лет. Благодаря высокотехнологичному оборудованию и большому опыту наших врачей мы гарантируем быстрое улучшение самочувствия каждого пациента. Обращайтесь к квалифицированным специалистам в удобное время!
Врачи:
Записаться на прием
Мы гарантируем неразглашение персональных данных и отсутствие рекламных рассылок по указанному вами телефону. Ваши данные необходимы для обеспечения обратной связи и организации записи к специалисту клиники.
Атрофия поджелудочной железы – причины, симптомы, диагностика и лечение
Атрофия поджелудочной железы – это уменьшение объема органа, проявляющееся недостаточностью внешнесекреторной (продукция пищеварительных ферментов, бикарбоната) и внутрисекреторной (синтез инсулина, глюкагона) функции. Наиболее частыми причинами патологии являются хронический панкреатит, сахарный диабет, соматические заболевания с выраженным истощением, а также цирроз печени, нарушение кровоснабжения, сдавление опухолью. Диагностика основана на лабораторных данных, выявляющих дефицит ферментов и низкий уровень инсулина, УЗИ поджелудочной железы, результатах биопсии. Лечение заключается в назначении заместительной терапии: ферментных препаратов, инсулина; восстановлении кишечной флоры; коррекции дефицита нутриентов.
Общие сведения
Атрофия поджелудочной железы – состояние, характеризующееся уменьшением размеров органа, уплотнением его структуры и недостаточностью функций. Данный процесс может развиваться вследствие физиологических возрастных изменений, а также заболеваний, сопровождающихся повреждением паренхимы, сдавлением, нарушением кровоснабжения, при длительно протекающих истощающих заболеваниях. При этом вес железы, который в норме составляет около 80-90 г, уменьшается до 30-40 и ниже.
Атрофия поджелудочной железы
Причины
Атрофия поджелудочной железы может быть физиологической, развивающейся в результате естественных процессов старения организма. Она сопровождает тяжелые истощающие заболевания (кахектическая форма). Также атрофия является исходом всех форм хронического панкреатита, при этом значительная часть стромы замещается фиброзной тканью, что сопровождается прогрессированием эндокринной и экзокринной недостаточности.
Своеобразным типом атрофии является липоматоз, при котором большая часть паренхимы органа замещена жировой тканью. Отдельное место занимает атрофия панкреас при сахарном диабете. К более редким случаям заболевания в гастроэнтерологии относится атрофия железы при циррозе печени, системной склеродермии, сдавлении опухолью, перекрытии выводных протоков конкрементами.
Патанатомия
Данная патология сопровождается существенным уменьшением размеров железы – до 20-18 г, консистенция значительно уплотнена, поверхность органа бугристая, капсула сращена с окружающей ее жировой тканью, а также соседними органами. Изменяется структура поджелудочной железы, характерно избыточное развитие соединительной ткани, которая может пролиферировать вокруг долек (перилобулярный склероз) либо диффузно (интралобулярный склероз). На микроскопическом уровне поражение характеризуется диффузным разрастанием фиброзной ткани (интраацинозный склероз), гибелью клеток железистой паренхимы.
При липоматозе, несмотря на то, что данное состояние характеризуется сохранением или даже увеличением размеров органа (псевдогипертрофия), его большая часть замещена жировой тканью, в которой находятся отдельные железистые участки. По наблюдениям специалистов в области клинической гастроэнтерологии и эндокринологии, большинстве случаев при данной патологии сохраняется островковый аппарат и эндокринная функция органа.
Симптомы атрофии
Клиническая картина атрофии поджелудочной железы определяется причиной ее развития (сахарный диабет, хронический панкреатит и другие). Однако в любом случае характерными симптомами являются экзокринная и эндокринная недостаточность. Экзокринная (внешнесекреторная) недостаточность железы характеризуется пониженной продукцией пищеварительных ферментов, а также бикарбонатов и других электролитов, которые нейтрализуют содержимое желудка, обеспечивая благоприятную для действия панкреатических ферментов среду. Типичными симптомами являются послабление стула, ухудшение аппетита, снижение веса.
Ранним симптомом недостаточности внешнесекреторной функции является стеаторея (повышенное выведение жиров с калом). Этот признак развивается при снижении секреции на 10% от нормы. Снижение веса происходит вследствие нарушения переваривания пищи, всасывания веществ в кишечнике, потери аппетита. При длительно существующей патологии развиваются признаки дефицита витаминов.
Эндокринная (внутрисекреторная) недостаточность проявляется нарушениями углеводного обмена, протекающими по типу гипергликемического синдрома. При этом симптомы сахарного диабета развиваются лишь у половины пациентов. Это объясняется тем, что инсулинпродуцирующие клетки обладают способностью лучше сохраняться при патологии в сравнении с ацинарными. Развивается дефицит инсулина, глюкагона. Пациента может беспокоить выраженная слабость, головокружение, жажда.
Диагностика
При обследовании пациента с атрофией поджелудочной железы определяется дефицит массы тела. Кожные покровы сухие, шелушащиеся. При уменьшении размеров железы пропальпировать ее не удается. Если причиной состояния стал панкреатит, возможна болезненность при прощупывании. Алгоритм диагностики включает:
- Анализы. При проведении биохимических анализов крови определяется снижение активности панкреатических ферментов. Характерными симптомами являются выявляемые при проведении копрограммы стеаторея (обнаружение в кале более 9% жиров от суточного употребления) и креаторея (большое содержание в кале мышечных волокон). Зачастую диагностируется повышение уровня глюкозы крови, что является поводом для консультации у эндокринолога или диабетолога.
- Визуализирующие методики. При УЗИ поджелудочной железы определяется уменьшение ее размеров, уплотнение структуры, повышение эхогенности, неровность контуров. Для более детальной визуализации органа, выяснения причины атрофии проводится МРТ поджелудочной железы. С целью оценки состояния протоковой системы, изменения которой характерны для хронического панкреатита, показана РХПГ – эндоскопическая ретроградная холангиопанкреатография (контрастное рентгенологическое исследование). С ее помощью можно выявить сужение главного панкреатического протока, неровность стенок, извилистость. Для исключения новообразований панкреаса проводится ангиография.
- Биопсию. Важным диагностическим методом является биопсия поджелудочной железы. При исследовании биоптата оценивается степень фиброза и деструкции паренхимы, степень повреждения железистых элементов, островков Лангерганса (инсулинпродуцирующие зоны). В случае липоматоза обнаруживается жировая дистрофия органа. Проведение биопсии позволяет оценить прогноз заболевания.
КТ ОБП. Выраженное диффузное истончение поджелудочной железы, изменение ее структуры.
Лечение атрофии поджелудочной железы
Консервативные мероприятия
При атрофии панкреас обязательно назначается диетотерапия. Питание должно быть с минимальным содержанием жиров. Достаточно внимания следует уделять белково-энергетическому дефициту, коррекции гиповитаминозов. Обязательным мероприятием является полное прекращение курения, поскольку никотин нарушает продукцию бикарбонатов поджелудочной железой, в следствие чего значительно повышается кислотность содержимого двенадцатиперстной кишки.
Основным направлением терапии данной патологии является замещение экзокринной и эндокринной секреции поджелудочной железы. Для компенсации нарушенных процессов полостного пищеварения врач-гастроэнтеролог назначает ферментные препараты. Для достижения клинического эффекта препараты должны обладать высокой активностью липазы, быть устойчивыми к действию желудочного сока, обеспечивать быстрое высвобождение ферментов в тонкой кишке, активно содействовать полостному пищеварению. Данным требованиям соответствуют ферменты в виде микрогранул.
Поскольку именно липаза из всех ферментов панкреаса быстрее всего теряет активность, коррекция производится с учетом ее концентрации в препарате и выраженности стеатореи. Эффективность лечения оценивается по содержанию эластазы в кале и степени уменьшения стеатореи. Действие ферментных препаратов направлено и на устранение болевого синдрома, уменьшение вторичного энтерита, создание условий для нормализации кишечного микробиоценоза, улучшение углеводного обмена.
Коррекция эндокринной недостаточности проводится путем инсулинотерапии. При атрофии поджелудочной железы частично сохраняются островки Лангерганса, поэтому инсулин в организме продуцируется, но в малых количествах. Дозировка и режим введения инсулина определяются индивидуально в зависимости от течения патологии, этиологического фактора, данных суточного мониторирования глюкозы крови. Назначение ферментных препаратов значительно улучшает функцию поджелудочной железы в целом и углеводный обмен в том числе. Поэтому режим инсулинотерапии определяется в зависимости от дозировки и эффективности заместительной ферментной терапии.
Важным условием эффективной коррекции пищеварительных функций является нормализация микробиоценоза кишечника, поскольку на фоне приема ферментов создаются благоприятные условия для заселения патогенной флоры. Применяются пробиотики, пребиотики. Обязательно назначается витаминотерапия инъекционно, а также препараты магния, цинка, меди.
Хирургическое лечение
Хирургическое лечение данной патологии проводится в специализированных центрах. Осуществляется трансплантация островков Лангерганса с последующим удалением железы и заместительной ферментной терапией. Однако, поскольку атрофия зачастую является следствием тяжелых заболеваний с выраженным нарушением общего состояния пациента, такое лечение проводится редко.
Прогноз и профилактика
Прогноз при атрофии поджелудочной железы определяется степенью поражения экзокринных и эндокринных структур органа. Поскольку островковый аппарат частично сохранен, существует и остаточный синтез инсулина. Ввиду этого редко развивается кетоацидоз, но часто возникают гипогликемические состояния. Определение этиологии заболевания, устранение основной патологии, своевременное начало лечения позволяют достичь хороших результатов.
Профилактика заключается в своевременном лечении заболеваний, которые могут стать причиной атрофии панкреас. При наличии хронического панкреатита обязателен полный отказ от алкоголя, соблюдение диеты, поддержание достаточного уровня ферментативной активности железы.
Диффузные изменения поджелудочной железы могут стать началом панкреатита
Ультразвуковые исследования и заключения о том, что пациент имеет диффузные изменения поджелудочной железы, могут создать только общее мнение врача о состоянии здоровья пациента, которое в сочетании с результатами дополнительных исследований, дает основание делать диагностические выводы. На основании заключения УЗИ создаются условия для дополнительных исследований, которые могут выявить очаговые изменения в виде опухолей, камней, кисты и кровоизлияния в тканях железы.
При проведении всякого рода исследований системы органов печени и поджелудочной железы рассматриваются вместе как единая система функционирования. Пациент не всегда подозревает, что в его организме могут происходить диффузные изменения поджелудочной железы или печени, и медицинское заключение не рассматривается как диагноз с опасными симптомами. Все предположительные изменения, которые происходят в работе печени и желчевыводящих каналах сказываются как возможные изменения функций, выполняемых поджелудочной железой и наоборот.
Диагностика
Достижения современной техники по ультразвуковому обследованию позволяют оценить с коэффициентом высокой точности диагностические размеры, форму и параметры всех органов. В том числе оценить плотность и диффузные изменения паренхимы поджелудочной железы, выявить очаговые образования в них, которые несут угрозу рака печени, рака поджелудочной железы, а также опухоли, абсцессы, кисту, гематомы и т. д.
Диагностике на ранней стадии поддается даже незначительное количество свободной жидкости, скопившейся в брюшной полости, изменения структуры паренхимы железы и печени при наличии их диффузного поражения. Симптомы, определяющие в процессе диагностики и обследования диффузные изменения поджелудочной железы, могут стать начальным этапом весьма серьезного заболевания – панкреатита.
Причины возникновения и симптомы панкреатита
Хронический алкоголизм, отравление алкоголем, жирная и острая пища, психическое и нервное перевозбуждение сопровождаются резким повышением выделения панкреатической жидкости, а пагубное воздействие панкреатических ферментов провоцирует воспаление, что нарушает нормальное функционирование печени и вызывает диффузные изменения поджелудочной железы, как следствие происходит процесс развития панкреатита.
Острая, резкая боль в животе, которая не имеет четко выраженной локализации, является первым симптомом панкреатита. При воспалительном процессе всей поджелудочной железы, появляется сильная боль, она отдает в спину или левую лопатку. Такие симптомы свойственны при обострении хронического или возникновении острого панкреатита. Травма или сбои функций, воспаление желчных протоков могут спровоцировать возникновение острого приступа болезни.
Профилактические меры и лечение панкреатита
Если у пациента обнаружены диффузные изменения поджелудочной железы, лечение назначается во избежание чрезмерной нагрузки на печень и желчный пузырь. Основой такого лечения может стать запрет на употребление алкоголя, пряностей, острой, жирной и соленой пищи. В случае нарушения правил диетического питания, изменения, связанные с функциями работы поджелудочной железы и желчевыводящих органов, могут приобрести необратимый характер.
Лечением панкреатита может заниматься только медицинский работник специального профиля, оно должно проводиться в амбулаторных условиях, особенно при наличии острой формы заболевания. Строгое соблюдение правил питания соответствующей диеты в комплексе с ферментными и другими медицинскими препаратами выводят пациента из состояния, при котором выражаются болезненные ощущения, снижается уровень воспалительного процесса и острых приступов панкреатита.
Distribuiți pe rețelele sociale:înrudit
Различия между диффузным и очаговым аутоиммунным панкреатитом
World J Gastroenterol. 2012 7 мая; 18 (17): 2099–2104.
Таку Табата, Теруми Камисава, Кенсуке Такума, Сэйити Хара, Савако Курума, Ёсихико Инаба, отделение внутренней медицины, Токийская столичная больница Комагоме, 3-18-22 Хонкомагоме, Бункё-ку, Токио 113-8677, Япония
Авторский вклад : Табата Т. и Камисава Т. внесли равный вклад в эту работу, проанализировали данные и написали рукопись; Данные собирали Такума К., Хара С., Курума С. и Инаба Ю.Для корреспонденции: Теруми Камисава, доктор медицинских наук, отделение внутренней медицины, Токийская столичная больница Комагоме, 3-18-22 Хонкомагоме, Бункё-ку, Токио 113-8677, Япония. pj.kcic@awasimak
Телефон: + 81-3-38232101 Факс: + 81-3-38241552
Получено 31 мая 2011 г .; Пересмотрено 19 августа 2011 г .; Принято 27 августа 2011 г.
Copyright © 2012 Baishideng Publishing Group Co., Limited. Все права защищены.Эта статья цитировалась в других статьях в PMC.Abstract
ЦЕЛЬ: изучить различия в клинических характеристиках диффузного и очагового аутоиммунного панкреатита (AIP).
МЕТОДЫ. На основании радиологических данных, полученных с помощью компьютерной томографии и / или магнитно-резонансной томографии, мы разделили 67 пациентов с ОИП на диффузный тип (тип D) и очаговый тип (тип F). Далее мы разделили тип F на тип головы (тип H) и тип тела и / или хвоста (тип B / T) в зависимости от места увеличения. Наконец, мы разделили 67 пациентов с ОИП на три группы: тип D, тип H и тип B / T. Мы сравнили три типа AIP с точки зрения клинических, лабораторных, радиологических, функциональных и гистологических данных и клинического течения.
РЕЗУЛЬТАТЫ: 34 пациента с D-типом, 19 с H-типом и 14 с B / T-типом AIP. Хотя механическая желтуха часто выявлялась у пациентов D-типа (88%) и пациентов H-типа (68%), ни у одного из пациентов типа B / T не было желтухи в качестве начального симптома ( P <0,001). Не было различий в частоте боли в животе, но острый панкреатит чаще ассоциировался у пациентов типа B / T (36%), чем у пациентов типа D (3%) ( P = 0,017). Уровни сывороточного иммуноглобулина G (IgG) 4 были значительно выше у пациентов D-типа (медиана 309 мг / дл), чем у пациентов B / T-типа (133.5 мг / дл) ( P = 0,042). Уровни амилазы в сыворотке у пациентов B / T-типа (медиана: 114 МЕ / л) были значительно выше, чем у пациентов H-типа (72 МЕ / л) ( P = 0,049). Лимфоплазмоцитарный склерозирующий панкреатит (LPSP) был гистологически подтвержден у 6 пациентов D-типа, 7 H-типа и 4 B / T-типов; идиопатический протоковоцентрический панкреатит не наблюдался ни у одного пациента. Выраженный фиброз и обильная инфильтрация CD20-положительных B-лимфоцитов небольшим количеством IgG4-положительных плазматических клеток были обнаружены у 2 пациентов B / T-типа.Стероидная терапия была эффективной у всех 50 пациентов (31 тип D, 13 тип H и 6 тип B / T). Хотя AIP рецидивировал во время постепенного снижения дозы или после отмены стероидов у 3 пациентов D-типа и 3 H-типа, ни у одного пациента не было рецидивов B / T. В ходе последующего наблюдения рентгенологические характеристики 6 пациентов с типом B / T не изменились, а у 1 пациента с типом B / T улучшилось естественное улучшение.
ЗАКЛЮЧЕНИЕ: Клинические признаки AIP H-типа были аналогичны таковым у D-типа, но B / T-тип отличался от D и H. B / T-тип может включать другие заболевания, кроме LPSP.
Ключевые слова: Аутоиммунный панкреатит, иммуноглобулин G 4, лимфоплазмоцитарный склерозирующий панкреатит
ВВЕДЕНИЕ
Аутоиммунный панкреатит (AIP) – это тип панкреатита, который, как считается, имеет аутоиммунную этиологию. AIP резко реагирует на стероидную терапию, поэтому дифференцировать AIP от рака поджелудочной железы важно, чтобы избежать ненужной резекции поджелудочной железы [1-3]. Согласно Азиатским диагностическим критериям AIP [4], AIP диагностируется по следующим признакам: диффузное или очаговое увеличение поджелудочной железы и сужение главного протока поджелудочной железы; повышенный уровень сывороточного иммуноглобулина G (IgG) или IgG4 или присутствие аутоантител в сыворотке; гистологические данные о лимфоплазмоцитарной инфильтрации и фиброзе поджелудочной железы [лимфоплазмоцитарный склерозирующий панкреатит (LPSP) [5]]; и отзывчивость на стероиды.АИП часто встречается у пожилых мужчин. Первичный начальный симптом – механическая желтуха, а сахарный диабет встречается у половины пациентов. AIP редко ассоциируется с острым панкреатитом или язвенным колитом. AIP связан с несколькими склерозирующими экстрапанкреатическими поражениями, такими как склерозирующий холангит, склерозирующий сиаладенит и забрюшинный фиброз, и в настоящее время считается поражением поджелудочной железы системного заболевания, связанного с IgG4. AIP хорошо поддается стероидной терапии, но иногда имеет рецидивы [1,2].
Недавно была обнаружена другая гистологическая картина AIP, характеризующаяся протоковой эпителиальной гранулоцитарной инфильтрацией [6,7]. Этот паттерн называется идиопатическим протоковоцентрическим панкреатитом (IDCP) [6]. Клинические особенности пациентов с IDCP отличаются от пациентов с LPSP. Термины AIP типа 1 и типа 2 предлагаются для описания клинических особенностей, связанных с LPSP и IDCP, соответственно [8-11].
Радиологически AIP подразделяется на диффузный тип (тип D) и очаговый тип (тип F) [1-3,12-14].Хотя диффузное увеличение поджелудочной железы довольно специфично для AIP, AIP F-типа следует строго дифференцировать от рака поджелудочной железы. Однако лишь в нескольких исследованиях [13,14] изучались различия между AIP D- и F-типа, и неизвестно, является ли AIP F-типа начальной стадией AIP D-типа или другим типом AIP. Это исследование было направлено на выяснение различий в клинических характеристиках AIP D- и F-типа.
МАТЕРИАЛЫ И МЕТОДЫ
Пациенты, изучаемые
С 1988 по 2010 год, 67 пациентов с ОИП (47 мужчин и 20 женщин; средний возраст: 60 лет.3 года; диапазон: 27-83 года) были диагностированы в соответствии с Азиатскими диагностическими критериями AIP [4] в токийской столичной больнице Комагоме. На основании радиологических данных, полученных с помощью компьютерной томографии и / или магнитно-резонансной томографии, мы разделили пациентов с ОИП на D-тип и F. Далее мы разделили тип F на тип головы (тип H) и тип тела и / или хвоста (тип B / T) в зависимости от места увеличения. Наконец, мы разделили 67 пациентов с ОИП на три группы: тип D, тип H и тип B / T. Пациенты с AIP D-типа показали диффузное увеличение поджелудочной железы (Рисунок -), пациенты H-типа показали очаговое увеличение только головки поджелудочной железы (Рисунок -), а пациенты B / T-типа показали увеличение только тела поджелудочной железы и / или хвост (рисунок а).Мы сравнили клинические, лабораторные, радиологические, функциональные и гистологические данные, а также клиническое течение трех типов AIP.
Компьютерная томография, показывающая аутоиммунный панкреатит диффузного типа. Был замечен отек головы (A), тела (B) и хвоста (C) поджелудочной железы.
Компьютерная томография, показывающая аутоиммунный панкреатит головного типа. Отек только головки поджелудочной железы (A), но тело поджелудочной железы (B) и хвост (C) были нормального размера.
Компьютерная томография, показывающая аутоиммунный панкреатит по типу тела и / или хвоста.Тело и хвост поджелудочной железы опухли (A), но головка поджелудочной железы была в пределах нормального размера (B).
Клинические, радиологические и лабораторные анализы
Клинические оценки включали: возраст на момент постановки диагноза; секс; привычки к употреблению алкоголя и курения; наличие и / или наличие в анамнезе аллергических заболеваний; начальные симптомы, такие как механическая желтуха и боль в животе; и сопутствующие заболевания, такие как сахарный диабет, острый панкреатит и язвенный колит. Привычка к употреблению алкоголя была определена как употребление алкоголя> 80 г / день в течение> 7 лет.Привычка к курению была определена как курение> 20 пач-лет. Сахарный диабет диагностировали, если уровни глюкозы в сыворотке крови натощак и / или уровни гемоглобина A1c были выше нормального уровня (126 мг / дл и 6,1% соответственно) [15]. Острый панкреатит был диагностирован, когда наблюдались как сильная боль в животе, так и повышение уровня амилазы в сыворотке (> 3 раза от нормы; норма: 115 МЕ / л).
Стеноз нижнего желчного протока оценивали с помощью эндоскопической ретроградной холангиопанкреатографии и / или магнитно-резонансной холангиопанкреатографии.Радиологически были оценены три экстрапанкреатических поражения, которые часто связаны с ОИП (склерозирующий холангит прикорневых или внутрипеченочных желчных протоков, отек слюнных желез и забрюшинный фиброз).
Лабораторные данные были оценены, включая уровни сывороточного IgG ( n = 67), IgG4 ( n = 65) и иммуноглобулина E (IgE) ( n = 43), количество периферических эозинофилов ( n = 56) уровни амилазы в сыворотке ( n = 66) и аутоантитела, включая антинуклеарный антиген ( n = 60) и ревматоидный фактор ( n = 58).Уровни IgG4 в сыворотке измеряли нефелометрией с использованием наборов подкласса IgG (BS-NIA). Было использовано общепринятое пороговое значение 135 мг / дл.
Гистологические и иммуногистологические исследования
Поджелудочная железа оценивалась с помощью хирургической резекции ( n = 7), хирургической биопсии или биопсии под контролем УЗИ ( n = 6) и тонкоигольной аспирации под контролем эндоскопического ультразвукового исследования (EUS-FNA , n = 10) и исследовали гистологически и иммуногистохимически с использованием антител анти-CD3, анти-CD20 и анти-IgG4.
Клинический курс
Десяти пациентам первоначально было проведено хирургическое вмешательство при подозрении на рак поджелудочной железы (панкреатодуоденэктомия, n = 6; дистальная панкреатэктомия, n = 1; холедоходуоденостомия с биопсией поджелудочной железы, n = 3). Пятьдесят пациентов, в том числе один хирург, пролеченный пероральными стероидами. Преднизолон в начальной дозе 30-40 мг / сут назначался в течение 2-3 недель. Затем его снижали на 5 мг каждые 1-3 недели до 5 мг / сут. Поддерживающая терапия (2.5-5 мг / сут, 1-3 года) применялась у всех пациентов. Рецидив AIP был определен как повторное появление симптомов с развитием или повторным появлением патологий поджелудочной железы и / или экстрапанкреатических аномалий при визуализирующих исследованиях. Восемь пациентов наблюдались консервативно без стероидной терапии.
Статистический анализ
Различия между группами анализировали с использованием точного вероятностного критерия Фишера и критерия Манна-Уитни U . Значения P были скорректированы методом Бонферрони, а значения P <0.05 считали статистически значимым.
РЕЗУЛЬТАТЫ
Клинические, радиологические и лабораторные различия
Шестьдесят семь пациентов с ОИП были классифицированы на D-тип ( n = 34), H-тип ( n = 19) и B / T-тип ( n = 14) AIP. Между группами не было значительных различий по возрасту, полу, алкоголю, курению и аллергическим заболеваниям в анамнезе. Хотя механическая желтуха часто выявлялась у пациентов с D-типом (88%) и H-типом (68%), ни у одного пациента с типом B / T не было желтухи в качестве начального симптома ( P <0.001). Хотя не было различий в частоте болей в животе, острый панкреатит чаще встречался у пациентов типа B / T (36%), чем у пациентов типа D (3%) ( P = 0,017). Хотя стеноз нижнего желчного протока часто наблюдался у пациентов D-типа (94%) и H-типа (95%), ни у одного пациента типа B / T не было стеноза нижнего желчного протока ( P <0,001). Не было различий между группами по ассоциированным экстрапанкреатическим поражениям (таблица).
Таблица 1
Клинические и рентгенологические данные трех типов аутоиммунного панкреатита
| Тип D, n = 34 | H тип, n = 19 | B / Тип T, n = 14 | Значение P , D против H | P значение, D против B / T | P значение, H против B / T | |
| Средний возраст (лет) (квартильный диапазон) | 67.5 (59-71,5) | 64,0 (56-71) | 61,5 (50,3-72,5) | > 0,99 | > 0,99 | > 0,99 |
| Мужской / женский | 24/10 | 15 / 4 | 8/6 | > 0,99 | > 0,99 | > 0,99 |
| Привычка к употреблению алкоголя +/- (%) | 4/27 (15) | 4/15 (21) | 2 / 12 (14) | > 0,99 | > 0,99 | > 0,99 |
| Привычка к курению +/- (%) | 16/27 (59) | 12/16 (75) | 5/13 ( 39) | > 0.99 | > 0,99 | 0,198 |
| Аллергия +/- (%) | 8/25 (32) | 6/18 (33) | 7/13 (54) | > 0,99 | 0,885 | 0,879 |
| Желтуха +/- (%) | 30/4 (88) | 13/6 (68) | 0/14 (0) | 0,420 | <0,001 | <0,001 |
| Боль в животе +/- (%) | 6/28 (18) | 7/13 (37) | 5/9 (36) | 0.546 | 0,771 | > 0,999 |
| Диабет +/- (%) | 10/24 (29) | 11/8 (58) | 4/10 (29) | 0,231 | > 0,999 | > 0,999 |
| Острый панкреатит +/- (%) | 1/33 (3) | 1/18 (5) | 5/9 (36) | > 0,999 | 0,017 | 0,183 |
| Язвенный колит +/- (%) | 1/33 (3) | 0/19 (0) | 1/13 (7) | > 0.999 | > 0,999 | > 0,999 |
| Стеноз нижнего мерзкого протока +/- (%) | 32/34 (94) | 18/19 (95) | 0/14 (0) | > 0,999 | <0,001 | <0,001 |
| Экстрапанкреатические поражения +/- (%) | 13/21 (38) | 6/13 (32) | 5/9 (36) | > 0,999 | > 0,999 | > 0,999 |
Уровни сывороточного IgG4 были значительно выше у пациентов D-типа (медиана: 309 мг / дл), чем у пациентов B / T-типа (133.5 мг / дл) пациентов ( P = 0,042). Уровни сывороточного IgG4 были чаще повышены у пациентов D-типа (88%), чем у пациентов B / T-типа (50%) ( P = 0,030). Не было значительных различий в уровнях сывороточного IgE и количестве периферических эозинофилов между группами. Уровни амилазы в сыворотке у пациентов B / T-типа (медиана: 114 МЕ / л) были значительно выше, чем у пациентов H-типа (72 МЕ / л) ( P = 0,049). По соотношению антинуклеарного антигена и ревматоидного фактора различий между группами не было (таблица).
Таблица 2
Лабораторные данные трех типов аутоиммунного панкреатита
| тип D, n = 34 | тип H, n = 19 | тип B / T , n = 14 | P значение, D vs H | P значение, D vs B / T | P значение, H vs B / T | |
| Медиана IgG, мг / дл | 2163.5 (1637,5-2682,8) | 1920 (1398,5-2300) | 1619 (1369,5-2364,5) | 0,642 | > 0,999 | > 0,999 |
| (квартильный диапазон) | ||||||
| 309 (181-1015) | 351 (228-780) | 133,5 (60,8-326,5) | > 0,999 | 0,042 | 0,057 | |
| (квартильный диапазон) | 28/32 (88) | 16/19 (84) | 7/14 (50) | > 0.999 | 0,030 | 0,168 |
| Медиана IgE, МЕ / л | 406,9 (265,5-877) | 249,0 (74,75-589,75) | 264,0 (134,1-856) | 4 0,447> | 4 0,447 > 0,999 | |
| (квартильный диапазон) | ||||||
| IgE> 580, (МЕ / л) (%) | 8/20 (40,0) | 3/12 (25,0) | 4/11 (36,4) | > 0,999 | > 0,999 | > 0,999 |
| Медиана эозинофилов, мкл | 180 (72-440) | 238.5 (152,5-447,75) | 473 (114,5-621,5) | > 0,999 | 0,354 | > 0,999 |
| (квартильный диапазон) | ||||||
| Эозинофилы> 600 / мкл 13 (%) 3/3 | 32 90 (11) | 2/16 (13) | 3/13 (23) | > 0,999 | > 0,999 | > 0,999 |
| Медиана амилазы (МЕ / л) | 86 (49,5-119,5) | 72 (43-100) | 114 (73,3-589,3) | > 0.999 | > 0,999 | 0,049 |
| (квартильный диапазон) | ||||||
| Амилаза> 115 (МЕ / л) (%) | 8/33 (24) | 4/19 (21) | 7 / 14 (50) | > 0,999 | 0,300 | 0,408 |
| Положительный антинуклеарный антиген (%) | 14/29 (48) | 4/18 (22) | 6/13 (46) | 0,366 | > 0,999 | 0,738 |
| Положительный ревматоидный фактор (%) | 10/28 (36) | 2/17 (12) | 1/13 (7) | 0.288 | 0,378 | > 0,999 |
Гистологические и иммуногистохимические исследования
LPSP был гистологически подтвержден с обильной инфильтрацией CD3-положительных Т-лимфоцитов и IgG4-положительных плазматических клеток в 6 D-типе, 7 H-типе и 4 Пациенты типа B / T. В поджелудочной железе 2 пациентов B / T-типа (1 образец хирургической биопсии и 1 образец EUS-FNA) были обнаружены выраженный фиброз и обильная инфильтрация CD20-положительных В-лимфоцитов, а не Т-лимфоцитов, но мало IgG4-положительных плазматических клеток или нейтрофилы обнаружены.IDCP не наблюдался ни у одного пациента. EUS-FNA у 4 пациентов с ОИП не смог подтвердить гистологический диагноз из-за недостаточного количества образцов (таблица).
Таблица 3
Гистологические данные поджелудочной железы при трех типах аутоиммунного панкреатита
| D тип | H тип | B / T тип | LPSP ( n = 3) | LPSP ( n = 3) | LPSP ( n = 1) |
| Биопсия | LPSP ( n = 2) | LPSP ( n = 3) | Фиброз с обильной инфильтрацией В-лимфоцитов ( n = 1) |
| EUS-FNA | LPSP ( n = 1) | LPSP ( n = 1) | ( n = 3) |
| Несоответствующий материал ( n = 1) | Несоответствующий материал ( n = 2) | Фиброз с обильной инфильтрацией B-лимфоцитов ( n = 1) | 9 0175|
| Несоответствующий материал ( n = 1) |
Клинический курс
Стероидная терапия была эффективной у всех 50 пациентов (31 тип D, 13 H тип и 6 B / T тип).AIP рецидивировал во время постепенного снижения дозы или после прекращения приема стероидов у 3 пациентов D-типа и 3-х пациентов H-типа. У 8 пациентов, находящихся под консервативным наблюдением (1 тип H и 7 тип B / T), рентгенологические характеристики не изменились у семи пациентов, но увеличение хвоста поджелудочной железы улучшилось естественным образом у 1 пациента с типом B / T. В течение курса, предшествовавшего нашей госпитализации, очаговое увеличение головки поджелудочной железы развилось до диффузного увеличения в трех случаях, а очаговое увеличение хвоста поджелудочной железы развилось до диффузного увеличения в одном случае.
ОБСУЖДЕНИЕ
Радиологически AIP подразделяется на диффузные и очаговые формы. Диффузное увеличение поджелудочной железы, называемое колбасоподобным увеличением, является типичным признаком AIP. Однако AIP F-типа, иногда образующий массу, часто трудно отличить от рака поджелудочной железы [1-3,12-14]. Возможные различия в клинических проявлениях между типами D и F AIP неясны.
В настоящем исследовании мы классифицировали 67 пациентов с ОИП на тип D ( n = 34), тип H ( n = 19) и тип B / T ( n = 14).Типы D и H показали сходные клинические особенности. Однако тип B / T отличался от типов D и H в нескольких аспектах. Механическая желтуха и стеноз нижнего желчного протока часто выявлялись у пациентов с типом D и H, но ни у одного пациента с типом B / T эти особенности не наблюдались. По данным Ghazale et al [16], стеноз нижнего желчного протока имел место у 70% из 53 пациентов с ОИП. Хирано и др. [17] заявили, что как отек поджелудочной железы из-за воспаления головки поджелудочной железы, так и утолщение стенки желчных протоков влияют на стеноз нижнего желчного протока при AIP, на основании результатов EUS и того факта, что 93% случаев AIP с положительным поражением головки поджелудочной железы у пациентов был стеноз нижнего желчного протока, по сравнению только с 17% пациентов с отрицательным поражением.
В этом исследовании уровень сывороточного IgG4 был значительно ниже у пациентов B / T-типа, чем у пациентов с D-типом, а повышение уровня сывороточного IgG4 было меньше у пациентов с B / T-типом, чем у пациентов с D-типом. Острый панкреатит чаще наблюдался у пациентов B / T-типа, чем у пациентов с D-типом, а уровни амилазы в сыворотке крови были значительно выше у пациентов с B / T-типом, чем у пациентов с H-типом. Что касается диагноза и частоты острого панкреатита, высокий процент пациентов с типом B / T, по-видимому, в основном зависит от более высоких уровней амилазы.Острый панкреатит или некоторые острые воспалительные приступы в случаях хронического панкреатита могут не быть связаны с высокими уровнями амилазы из-за атрофической ацинарной ткани. Не было разницы в частоте болей в животе, поэтому некоторые случаи D-типа и H-типа могли быть упущены.
Ни у одного из пациентов типа B / T не рецидивов после стероидной терапии, по сравнению с 10% пациентов D-типа и 23% пациентов H-типа. Стало ясно, что существует два гистологических подтипа (LPSP и IDCP) в AIP [6-11].Большинство пациентов с AIP в Азии имеют LPSP, а половина пациентов с AIP в Европе имеют IDCP [8,10]. Клинические признаки этих двух подтипов существенно различаются. Как правило, сообщается, что пациенты с IDCP моложе на момент постановки диагноза, а пациенты с IDCP с меньшей вероятностью демонстрируют повышенные уровни IgG4 в сыворотке. IDCP чаще ассоциируется с острым панкреатитом и воспалительным заболеванием кишечника. Согласно сравнительному исследованию пациентов с LPSP и IDCP, проведенным Sah et al [9], пациенты с IDCP, как правило, имели больше очаговых особенностей, чем LPSP (84% против 60%), и рецидивов IDCP не наблюдалось ни у одного пациента, тогда как LPSP рецидивировал у 47% пациентов.Для диагностики IDCP необходимо гистологическое исследование адекватного образца поджелудочной железы, а необходимость гистологического исследования для диагностики IDCP в настоящее время затрудняет клиническую диагностику.
При гистологическом исследовании данных случаев LPSP был подтвержден у 17, но IDCP не был обнаружен. Клинические файлы AIP D-типа и H-типа были совместимы с файлами пациентов с LPSP. Однако, учитывая низкие уровни IgG4 в сыворотке и частую связь с острым панкреатитом, существует вероятность того, что некоторые случаи IDCP могут быть вовлечены в случаи B / T-типа.Например, 32-летний мужчина с AIP B / T типа показал нормальные уровни IgG4 в сыворотке, ассоциацию с язвенным колитом и хорошую чувствительность к стероидной терапии, но гистологический диагноз с помощью EUS-FNA не мог быть подтвержден из-за недостаточного образец биопсии. Интересно, что гистология двух пациентов B / T-типа включала обильную инфильтрацию B-клеток с небольшой инфильтрацией IgG4-положительных клеток или нейтрофилов, которые могли быть другим типом AIP, отличным от LPSP и IDCP. AIP B / T-типа может включать заболевание, отличное от LPSP.
Три пациента с типом H и один пациент с типом B / T перешли в тип D в течение естественного течения. Также сообщалось, что AIP H-типа переходит в D-тип [18,19], а AIP B / T-типа – в D-тип [20]. Также были сообщения о рецидивах в остаточной поджелудочной железе после резекции, таких как рецидив в остаточной головке поджелудочной железы через 1 год после дистальной панкреатэктомии [21] и рецидив в остаточной части поджелудочной железы и хвосте через 4 мес после панкреатодуоденэктомии [22]. Стероидная терапия была эффективной при прогрессировании или рецидиве поражений.Эти данные показывают, что очаговое воспаление может прогрессировать до последующих диффузных изменений по всей поджелудочной железе или развиваться повторно в разных местах и в разное время у некоторых пациентов с ОИП. Диффузное изменение поджелудочной железы может быть окончательным проявлением AIP, и то, влияет ли этот воспалительный процесс на железу диффузно или очагово, может просто отражать стадию заболевания. Из семи консервативно наблюдаемых пациентов типа B / T у шести не было никаких изменений, а у одного улучшилось естественным образом. Kubota и др. [23] сообщили, что у всех восьми пациентов с ОИП, у которых спонтанно улучшилось состояние, наблюдалось очаговое увеличение поджелудочной железы.AIP B / T-типа может включать заболевание, отличное от AIP D-типа и H.
В заключение, хотя клинические признаки AIP H-типа аналогичны клиническим характеристикам AIP D-типа, AIP B / T-типа в нескольких аспектах отличается от типов D и H. AIP B / T-типа может включать заболевание, отличное от LPSP.
КОММЕНТАРИИ
Предпосылки
Аутоиммунный панкреатит (АИП) – это особый тип панкреатита, который, как считается, имеет аутоиммунную этиологию. Недавно AIP был радиологически классифицирован на диффузный тип (тип D) и очаговый тип (тип F).Однако различия между AIP D- и F-типа малоизвестны.
Границы исследований
Были исследованы различия в клинических, радиологических, лабораторных и гистологических данных между AIP D- и F-типа.
Инновации и прорывы
Пациенты с ОИП были разделены на тип D и тип F. Кроме того, тип F был разделен на тип головы (тип H) и тип корпуса и / или хвоста (тип B / T). Ни у одного пациента типа B / T не была желтуха как начальный симптом, но острый панкреатит чаще ассоциировался с типом B / T, чем с типом D.Уровни амилазы в сыворотке были значительно выше у пациентов B / T-типа, чем у пациентов H-типа. Уровни сывороточного иммуноглобулина G (IgG) 4 были значительно выше у пациентов D-типа, чем у пациентов B / T-типа. Ни у одного из пациентов типа B / T после стероидной терапии не наблюдалось рецидива, по сравнению с 10% пациентов D-типа и 23% пациентов H-типа. У двух пациентов B / T-типа наблюдалась обильная инфильтрация B-клеток с небольшой инфильтрацией IgG4-положительных клеток или нейтрофилов.
Приложения
AIP B / T-типа отличается по нескольким аспектам от типов D и H, и некоторые AIP B / T-типа могут быть связаны с заболеванием, отличным от лимфоплазмоцитарного склерозирующего панкреатита.
Рецензирование
Само исследование кажется разумным, а результаты интересны и имеют этиологическое значение.
Сноски
При поддержке Исследовательского комитета по трудноизлечимым заболеваниям поджелудочной железы (главный исследователь; Тору Симосегава), предоставлены Министерством здравоохранения, труда и социального обеспечения Японии
Рецензенты: Сёитиро Суми, доктор медицины, доктор философии, младший профессор, Отделение реконструкции органов, Институт пограничных медицинских наук, Университет Киото, Сакё-ку, Киото 606-8507, Япония; Ацуши Масамунэ, доктор медицины, доктор философии, отделение гастроэнтерологии, Высшая школа медицины Университета Тохоку, 1-1 Сейрё-мати, Аоба-ку, Сендай 980-8574, Япония
S- редактор Lv S L- редактор Kerr C. E- редактор Li JY
Ссылки
1.Окадзаки К., Кава С., Камисава Т., Ито Т., Инуи К., Ирие Х, Ирисава А., Кубо К., Нотохара К., Хасебе О. и др. Японские клинические рекомендации по аутоиммунному панкреатиту. Поджелудочная железа. 2009; 38: 849–866. [PubMed] [Google Scholar] 2. Чари С.Т., Такахаши Н., Леви М.Дж., Смирк Т.К., Клейн Д.Е., Пирсон Р.К., Петерсен Б.Т., Топазиан М.А., Веге С.С. Диагностическая стратегия, позволяющая отличить аутоиммунный панкреатит от рака поджелудочной железы. Clin Gastroenterol Hepatol. 2009; 7: 1097–1103. [PubMed] [Google Scholar] 3. Камисава Т., Такума К., Эгава Н., Цурута К., Сасаки Т.Аутоиммунный панкреатит и склерозирующая болезнь, связанная с IgG4. Нат Рев Гастроэнтерол Гепатол. 2010; 7: 401–409. [PubMed] [Google Scholar] 4. Otsuki M, Chung JB, Okazaki K, Kim MH, Kamisawa T., Kawa S., Park SW, Shimosegawa T., Lee K, Ito T. и др. Азиатские диагностические критерии аутоиммунного панкреатита: консенсус Японско-корейского симпозиума по аутоиммунному панкреатиту. J Gastroenterol. 2008; 43: 403–408. [PubMed] [Google Scholar] 5. Кавагути К., Койке М., Цурута К., Окамото А., Табата И., Фудзита Н. Лимфоплазмоцитарный склерозирующий панкреатит с холангитом: вариант первичного склерозирующего холангита с обширным поражением поджелудочной железы.Hum Pathol. 1991; 22: 387–395. [PubMed] [Google Scholar] 6. Нотохара К., Бургарт Л.Дж., Ядав Д., Чари С., Смирк ТЦ. Идиопатический хронический панкреатит с перидуктальной лимфоплазмоцитарной инфильтрацией: клинико-патологические особенности 35 случаев. Am J Surg Pathol. 2003. 27: 1119–1127. [PubMed] [Google Scholar] 7. Zamboni G, Lüttges J, Capelli P, Frulloni L, Cavallini G, Pederzoli P, Leins A, Longnecker D, Klöppel G. Гистопатологические особенности диагностической и клинической значимости аутоиммунного панкреатита: исследование на 53 образцах резекции и 9 образцах биопсии.Арка Вирхова. 2004. 445: 552–563. [PubMed] [Google Scholar] 8. Park DH, Kim MH, Chari ST. Последние достижения в области аутоиммунного панкреатита. Кишечник. 2009. 58: 1680–1689. [PubMed] [Google Scholar] 9. Сах Р.П., Чари С.Т., Паннала Р., Сугумар А., Клэйн Дж.Э., Леви М.Дж., Пирсон Р.К., Смирк Т.С., Петерсен Б.Т., Топазиан М.Д. и др. Различия в клиническом профиле и частоте рецидивов аутоиммунного панкреатита 1 типа и 2 типа. Гастроэнтерология. 2010; 139: 140–148; викторина 140-148. [PubMed] [Google Scholar] 10. Камисава Т., Нотохара К., Симосегава Т.Два клинико-патологических подтипа аутоиммунного панкреатита: LPSP и IDCP. Гастроэнтерология. 2010; 139: 22–25. [PubMed] [Google Scholar] 11. Chari ST, Kloeppel G, Zhang L, Notohara K, Lerch MM, Shimosegawa T. Гистопатологические и клинические подтипы аутоиммунного панкреатита: согласованный документ гонолулу. Панкреатология. 2010. 10: 664–672. [PubMed] [Google Scholar] 12. Ирие Х, Хонда Х, Баба С., Куроива Т., Йошимицу К., Таджима Т., Джими М., Суми Т., Масуда К. Аутоиммунный панкреатит: характеристики КТ и МРТ.AJR Am J Roentgenol. 1998; 170: 1323–1327. [PubMed] [Google Scholar] 13. Wakabayashi T, Kawaura Y, Satomura Y, Fujii T., Motoo Y, Okai T., Sawabu N. Клиническое исследование хронического панкреатита с очаговым нерегулярным сужением главного протока поджелудочной железы и образованием массы: сравнение с хроническим панкреатитом, показывающим диффузное нерегулярное сужение основного протока. проток поджелудочной железы. Поджелудочная железа. 2002. 25: 283–289. [PubMed] [Google Scholar] 14. Фруллони Л., Скаттолини С., Фалькони М., Замбони Дж., Капелли П., Манфреди Р., Грациани Р., Д’Онофрио М., Кацотурчи А.М., Амодио А. и др.Аутоиммунный панкреатит: различия очаговой и диффузной форм у 87 больных. Am J Gastroenterol. 2009. 104: 2288–2294. [PubMed] [Google Scholar] 16. Ghazale A, Chari ST, Zhang L, Smyrk TC, Takahashi N, Levy MJ, Topazian MD, Clain JE, Pearson RK, Petersen BT и др. Иммуноглобулин G4-ассоциированный холангит: клинический профиль и ответ на терапию. Гастроэнтерология. 2008. 134: 706–715. [PubMed] [Google Scholar] 17. Хирано К., Тада М., Исаяма Х, Ямамото К., Мизуно С., Ягиока Х, Яшима Й, Сасаки Т, Когуре Х, Тогава О и др.Эндоскопическая оценка факторов, способствующих возникновению стриктуры интрапанкреатических желчевыводящих путей при аутоиммунном панкреатите. Gastrointest Endosc. 2010; 71: 85–90. [PubMed] [Google Scholar] 18. Horiuchi A, Kawa S, Akamatsu T., Aoki Y, Mukawa K, Furuya N, Ochi Y, Kiyosawa K. Характерный внешний вид протока поджелудочной железы при аутоиммунном хроническом панкреатите: отчет о болезни и обзор японской литературы. Am J Gastroenterol. 1998. 93: 260–263. [PubMed] [Google Scholar] 19. Кога Й, Ямагути К., Сугитани А., Чидзива К., Танака М.Аутоиммунный панкреатит, начинающийся как локализованная форма. J Gastroenterol. 2002. 37: 133–137. [PubMed] [Google Scholar] 20. Wakabayashi T, Kawaura Y, Satomura Y, Watanabe H, Motoo Y, Sawabu N. Долгосрочный прогноз хронического панкреатита с сужением протока: стратегия лечения стероидами. Поджелудочная железа. 2005; 30: 31–39. [PubMed] [Google Scholar] 21. Motoo Y, Minamoto T., Watanabe H, Sakai J, Okai T., Sawabu N. Склерозирующий панкреатит, демонстрирующий быстро прогрессирующие изменения с периодическим формированием массы. Int J Pancreatol.1997; 21: 85–90. [PubMed] [Google Scholar] 22. Бланк А, Мэйбоди М, Исом-Батц Дж, Рослин М, Диллон Э. Острый некротический панкреатит, вызванный Salmonella typhimurium. Dig Dis Sci. 2003. 48: 1472–1474. [PubMed] [Google Scholar] 23. Kubota K, Iida H, Fujisawa T., Ogawa M, Inamori M, Saito S, Kakuta Y, Oshiro H, Nakajima A. Клиническое значение опухшего дуоденального сосочка при аутоиммунном панкреатите. Поджелудочная железа. 2007; 35: e51 – e60. [PubMed] [Google Scholar]Различия между диффузным и очаговым аутоиммунным панкреатитом
World J Gastroenterol.2012 7 мая; 18 (17): 2099–2104.
Таку Табата, Теруми Камисава, Кенсуке Такума, Сэйити Хара, Савако Курума, Ёсихико Инаба, отделение внутренней медицины, Токийская столичная больница Комагоме, 3-18-22 Хонкомагоме, Бункё-ку, Токио 113-8677, Япония
Авторский вклад : Табата Т. и Камисава Т. внесли равный вклад в эту работу, проанализировали данные и написали рукопись; Данные собирали Такума К., Хара С., Курума С. и Инаба Ю.Для корреспонденции: Теруми Камисава, доктор медицинских наук, отделение внутренней медицины, Токийская столичная больница Комагоме, 3-18-22 Хонкомагоме, Бункё-ку, Токио 113-8677, Япония.pj.kcic@awasimak
Телефон: + 81-3-38232101 Факс: + 81-3-38241552
Получено 31 мая 2011 г .; Пересмотрено 19 августа 2011 г .; Принято 27 августа 2011 г.
Copyright © 2012 Baishideng Publishing Group Co., Limited. Все права защищены.Эта статья цитировалась в других статьях в PMC.Abstract
ЦЕЛЬ: изучить различия в клинических характеристиках диффузного и очагового аутоиммунного панкреатита (AIP).
МЕТОДЫ. На основании радиологических данных, полученных с помощью компьютерной томографии и / или магнитно-резонансной томографии, мы разделили 67 пациентов с ОИП на диффузный тип (тип D) и очаговый тип (тип F).Далее мы разделили тип F на тип головы (тип H) и тип тела и / или хвоста (тип B / T) в зависимости от места увеличения. Наконец, мы разделили 67 пациентов с ОИП на три группы: тип D, тип H и тип B / T. Мы сравнили три типа AIP с точки зрения клинических, лабораторных, радиологических, функциональных и гистологических данных и клинического течения.
РЕЗУЛЬТАТЫ: 34 пациента с D-типом, 19 с H-типом и 14 с B / T-типом AIP. Хотя механическая желтуха часто выявлялась у пациентов D-типа (88%) и пациентов H-типа (68%), ни у одного из пациентов типа B / T не было желтухи в качестве начального симптома ( P <0.001). Не было различий в частоте боли в животе, но острый панкреатит чаще ассоциировался у пациентов типа B / T (36%), чем у пациентов типа D (3%) ( P = 0,017). Уровни сывороточного иммуноглобулина G (IgG) 4 были значительно выше у пациентов D-типа (медиана 309 мг / дл), чем у пациентов B / T-типа (133,5 мг / дл) ( P = 0,042). Уровни амилазы в сыворотке крови у пациентов с B / T-типом (медиана: 114 МЕ / л) были значительно выше, чем у пациентов с H-типом (72 МЕ / л) ( P = 0.049). Лимфоплазмоцитарный склерозирующий панкреатит (LPSP) был гистологически подтвержден у 6 пациентов D-типа, 7 H-типа и 4 B / T-типов; идиопатический протоковоцентрический панкреатит не наблюдался ни у одного пациента. Выраженный фиброз и обильная инфильтрация CD20-положительных B-лимфоцитов небольшим количеством IgG4-положительных плазматических клеток были обнаружены у 2 пациентов B / T-типа. Стероидная терапия была эффективной у всех 50 пациентов (31 тип D, 13 тип H и 6 тип B / T). Хотя AIP рецидивировал во время постепенного снижения дозы или после отмены стероидов у 3 пациентов D-типа и 3 H-типа, ни у одного пациента не было рецидивов B / T.В ходе последующего наблюдения рентгенологические характеристики 6 пациентов с типом B / T не изменились, а у 1 пациента с типом B / T улучшилось естественное улучшение.
ЗАКЛЮЧЕНИЕ: Клинические признаки AIP H-типа были аналогичны таковым у D-типа, но B / T-тип отличался от D и H. B / T-тип может включать другие заболевания, кроме LPSP.
Ключевые слова: Аутоиммунный панкреатит, иммуноглобулин G 4, лимфоплазмоцитарный склерозирующий панкреатит
ВВЕДЕНИЕ
Аутоиммунный панкреатит (AIP) – это тип панкреатита, который, как считается, имеет аутоиммунную этиологию.AIP резко реагирует на стероидную терапию, поэтому дифференцировать AIP от рака поджелудочной железы важно, чтобы избежать ненужной резекции поджелудочной железы [1-3]. Согласно Азиатским диагностическим критериям AIP [4], AIP диагностируется по следующим признакам: диффузное или очаговое увеличение поджелудочной железы и сужение главного протока поджелудочной железы; повышенный уровень сывороточного иммуноглобулина G (IgG) или IgG4 или присутствие аутоантител в сыворотке; гистологические данные о лимфоплазмоцитарной инфильтрации и фиброзе поджелудочной железы [лимфоплазмоцитарный склерозирующий панкреатит (LPSP) [5]]; и отзывчивость на стероиды.АИП часто встречается у пожилых мужчин. Первичный начальный симптом – механическая желтуха, а сахарный диабет встречается у половины пациентов. AIP редко ассоциируется с острым панкреатитом или язвенным колитом. AIP связан с несколькими склерозирующими экстрапанкреатическими поражениями, такими как склерозирующий холангит, склерозирующий сиаладенит и забрюшинный фиброз, и в настоящее время считается поражением поджелудочной железы системного заболевания, связанного с IgG4. AIP хорошо поддается стероидной терапии, но иногда имеет рецидивы [1,2].
Недавно была обнаружена другая гистологическая картина AIP, характеризующаяся протоковой эпителиальной гранулоцитарной инфильтрацией [6,7]. Этот паттерн называется идиопатическим протоковоцентрическим панкреатитом (IDCP) [6]. Клинические особенности пациентов с IDCP отличаются от пациентов с LPSP. Термины AIP типа 1 и типа 2 предлагаются для описания клинических особенностей, связанных с LPSP и IDCP, соответственно [8-11].
Радиологически AIP подразделяется на диффузный тип (тип D) и очаговый тип (тип F) [1-3,12-14].Хотя диффузное увеличение поджелудочной железы довольно специфично для AIP, AIP F-типа следует строго дифференцировать от рака поджелудочной железы. Однако лишь в нескольких исследованиях [13,14] изучались различия между AIP D- и F-типа, и неизвестно, является ли AIP F-типа начальной стадией AIP D-типа или другим типом AIP. Это исследование было направлено на выяснение различий в клинических характеристиках AIP D- и F-типа.
МАТЕРИАЛЫ И МЕТОДЫ
Пациенты, изучаемые
С 1988 по 2010 год, 67 пациентов с ОИП (47 мужчин и 20 женщин; средний возраст: 60 лет.3 года; диапазон: 27-83 года) были диагностированы в соответствии с Азиатскими диагностическими критериями AIP [4] в токийской столичной больнице Комагоме. На основании радиологических данных, полученных с помощью компьютерной томографии и / или магнитно-резонансной томографии, мы разделили пациентов с ОИП на D-тип и F. Далее мы разделили тип F на тип головы (тип H) и тип тела и / или хвоста (тип B / T) в зависимости от места увеличения. Наконец, мы разделили 67 пациентов с ОИП на три группы: тип D, тип H и тип B / T. Пациенты с AIP D-типа показали диффузное увеличение поджелудочной железы (Рисунок -), пациенты H-типа показали очаговое увеличение только головки поджелудочной железы (Рисунок -), а пациенты B / T-типа показали увеличение только тела поджелудочной железы и / или хвост (рисунок а).Мы сравнили клинические, лабораторные, радиологические, функциональные и гистологические данные, а также клиническое течение трех типов AIP.
Компьютерная томография, показывающая аутоиммунный панкреатит диффузного типа. Был замечен отек головы (A), тела (B) и хвоста (C) поджелудочной железы.
Компьютерная томография, показывающая аутоиммунный панкреатит головного типа. Отек только головки поджелудочной железы (A), но тело поджелудочной железы (B) и хвост (C) были нормального размера.
Компьютерная томография, показывающая аутоиммунный панкреатит по типу тела и / или хвоста.Тело и хвост поджелудочной железы опухли (A), но головка поджелудочной железы была в пределах нормального размера (B).
Клинические, радиологические и лабораторные анализы
Клинические оценки включали: возраст на момент постановки диагноза; секс; привычки к употреблению алкоголя и курения; наличие и / или наличие в анамнезе аллергических заболеваний; начальные симптомы, такие как механическая желтуха и боль в животе; и сопутствующие заболевания, такие как сахарный диабет, острый панкреатит и язвенный колит. Привычка к употреблению алкоголя была определена как употребление алкоголя> 80 г / день в течение> 7 лет.Привычка к курению была определена как курение> 20 пач-лет. Сахарный диабет диагностировали, если уровни глюкозы в сыворотке крови натощак и / или уровни гемоглобина A1c были выше нормального уровня (126 мг / дл и 6,1% соответственно) [15]. Острый панкреатит был диагностирован, когда наблюдались как сильная боль в животе, так и повышение уровня амилазы в сыворотке (> 3 раза от нормы; норма: 115 МЕ / л).
Стеноз нижнего желчного протока оценивали с помощью эндоскопической ретроградной холангиопанкреатографии и / или магнитно-резонансной холангиопанкреатографии.Радиологически были оценены три экстрапанкреатических поражения, которые часто связаны с ОИП (склерозирующий холангит прикорневых или внутрипеченочных желчных протоков, отек слюнных желез и забрюшинный фиброз).
Лабораторные данные были оценены, включая уровни сывороточного IgG ( n = 67), IgG4 ( n = 65) и иммуноглобулина E (IgE) ( n = 43), количество периферических эозинофилов ( n = 56) уровни амилазы в сыворотке ( n = 66) и аутоантитела, включая антинуклеарный антиген ( n = 60) и ревматоидный фактор ( n = 58).Уровни IgG4 в сыворотке измеряли нефелометрией с использованием наборов подкласса IgG (BS-NIA). Было использовано общепринятое пороговое значение 135 мг / дл.
Гистологические и иммуногистологические исследования
Поджелудочная железа оценивалась с помощью хирургической резекции ( n = 7), хирургической биопсии или биопсии под контролем УЗИ ( n = 6) и тонкоигольной аспирации под контролем эндоскопического ультразвукового исследования (EUS-FNA , n = 10) и исследовали гистологически и иммуногистохимически с использованием антител анти-CD3, анти-CD20 и анти-IgG4.
Клинический курс
Десяти пациентам первоначально было проведено хирургическое вмешательство при подозрении на рак поджелудочной железы (панкреатодуоденэктомия, n = 6; дистальная панкреатэктомия, n = 1; холедоходуоденостомия с биопсией поджелудочной железы, n = 3). Пятьдесят пациентов, в том числе один хирург, пролеченный пероральными стероидами. Преднизолон в начальной дозе 30-40 мг / сут назначался в течение 2-3 недель. Затем его снижали на 5 мг каждые 1-3 недели до 5 мг / сут. Поддерживающая терапия (2.5-5 мг / сут, 1-3 года) применялась у всех пациентов. Рецидив AIP был определен как повторное появление симптомов с развитием или повторным появлением патологий поджелудочной железы и / или экстрапанкреатических аномалий при визуализирующих исследованиях. Восемь пациентов наблюдались консервативно без стероидной терапии.
Статистический анализ
Различия между группами анализировали с использованием точного вероятностного критерия Фишера и критерия Манна-Уитни U . Значения P были скорректированы методом Бонферрони, а значения P <0.05 считали статистически значимым.
РЕЗУЛЬТАТЫ
Клинические, радиологические и лабораторные различия
Шестьдесят семь пациентов с ОИП были классифицированы на D-тип ( n = 34), H-тип ( n = 19) и B / T-тип ( n = 14) AIP. Между группами не было значительных различий по возрасту, полу, алкоголю, курению и аллергическим заболеваниям в анамнезе. Хотя механическая желтуха часто выявлялась у пациентов с D-типом (88%) и H-типом (68%), ни у одного пациента с типом B / T не было желтухи в качестве начального симптома ( P <0.001). Хотя не было различий в частоте болей в животе, острый панкреатит чаще встречался у пациентов типа B / T (36%), чем у пациентов типа D (3%) ( P = 0,017). Хотя стеноз нижнего желчного протока часто наблюдался у пациентов D-типа (94%) и H-типа (95%), ни у одного пациента типа B / T не было стеноза нижнего желчного протока ( P <0,001). Не было различий между группами по ассоциированным экстрапанкреатическим поражениям (таблица).
Таблица 1
Клинические и рентгенологические данные трех типов аутоиммунного панкреатита
| Тип D, n = 34 | H тип, n = 19 | B / Тип T, n = 14 | Значение P , D против H | P значение, D против B / T | P значение, H против B / T | |
| Средний возраст (лет) (квартильный диапазон) | 67.5 (59-71,5) | 64,0 (56-71) | 61,5 (50,3-72,5) | > 0,99 | > 0,99 | > 0,99 |
| Мужской / женский | 24/10 | 15 / 4 | 8/6 | > 0,99 | > 0,99 | > 0,99 |
| Привычка к употреблению алкоголя +/- (%) | 4/27 (15) | 4/15 (21) | 2 / 12 (14) | > 0,99 | > 0,99 | > 0,99 |
| Привычка к курению +/- (%) | 16/27 (59) | 12/16 (75) | 5/13 ( 39) | > 0.99 | > 0,99 | 0,198 |
| Аллергия +/- (%) | 8/25 (32) | 6/18 (33) | 7/13 (54) | > 0,99 | 0,885 | 0,879 |
| Желтуха +/- (%) | 30/4 (88) | 13/6 (68) | 0/14 (0) | 0,420 | <0,001 | <0,001 |
| Боль в животе +/- (%) | 6/28 (18) | 7/13 (37) | 5/9 (36) | 0.546 | 0,771 | > 0,999 |
| Диабет +/- (%) | 10/24 (29) | 11/8 (58) | 4/10 (29) | 0,231 | > 0,999 | > 0,999 |
| Острый панкреатит +/- (%) | 1/33 (3) | 1/18 (5) | 5/9 (36) | > 0,999 | 0,017 | 0,183 |
| Язвенный колит +/- (%) | 1/33 (3) | 0/19 (0) | 1/13 (7) | > 0.999 | > 0,999 | > 0,999 |
| Стеноз нижнего мерзкого протока +/- (%) | 32/34 (94) | 18/19 (95) | 0/14 (0) | > 0,999 | <0,001 | <0,001 |
| Экстрапанкреатические поражения +/- (%) | 13/21 (38) | 6/13 (32) | 5/9 (36) | > 0,999 | > 0,999 | > 0,999 |
Уровни сывороточного IgG4 были значительно выше у пациентов D-типа (медиана: 309 мг / дл), чем у пациентов B / T-типа (133.5 мг / дл) пациентов ( P = 0,042). Уровни сывороточного IgG4 были чаще повышены у пациентов D-типа (88%), чем у пациентов B / T-типа (50%) ( P = 0,030). Не было значительных различий в уровнях сывороточного IgE и количестве периферических эозинофилов между группами. Уровни амилазы в сыворотке у пациентов B / T-типа (медиана: 114 МЕ / л) были значительно выше, чем у пациентов H-типа (72 МЕ / л) ( P = 0,049). По соотношению антинуклеарного антигена и ревматоидного фактора различий между группами не было (таблица).
Таблица 2
Лабораторные данные трех типов аутоиммунного панкреатита
| тип D, n = 34 | тип H, n = 19 | тип B / T , n = 14 | P значение, D vs H | P значение, D vs B / T | P значение, H vs B / T | |
| Медиана IgG, мг / дл | 2163.5 (1637,5-2682,8) | 1920 (1398,5-2300) | 1619 (1369,5-2364,5) | 0,642 | > 0,999 | > 0,999 |
| (квартильный диапазон) | ||||||
| 309 (181-1015) | 351 (228-780) | 133,5 (60,8-326,5) | > 0,999 | 0,042 | 0,057 | |
| (квартильный диапазон) | 28/32 (88) | 16/19 (84) | 7/14 (50) | > 0.999 | 0,030 | 0,168 |
| Медиана IgE, МЕ / л | 406,9 (265,5-877) | 249,0 (74,75-589,75) | 264,0 (134,1-856) | 4 0,447> | 4 0,447 > 0,999 | |
| (квартильный диапазон) | ||||||
| IgE> 580, (МЕ / л) (%) | 8/20 (40,0) | 3/12 (25,0) | 4/11 (36,4) | > 0,999 | > 0,999 | > 0,999 |
| Медиана эозинофилов, мкл | 180 (72-440) | 238.5 (152,5-447,75) | 473 (114,5-621,5) | > 0,999 | 0,354 | > 0,999 |
| (квартильный диапазон) | ||||||
| Эозинофилы> 600 / мкл 13 (%) 3/3 | 32 90 (11) | 2/16 (13) | 3/13 (23) | > 0,999 | > 0,999 | > 0,999 |
| Медиана амилазы (МЕ / л) | 86 (49,5-119,5) | 72 (43-100) | 114 (73,3-589,3) | > 0.999 | > 0,999 | 0,049 |
| (квартильный диапазон) | ||||||
| Амилаза> 115 (МЕ / л) (%) | 8/33 (24) | 4/19 (21) | 7 / 14 (50) | > 0,999 | 0,300 | 0,408 |
| Положительный антинуклеарный антиген (%) | 14/29 (48) | 4/18 (22) | 6/13 (46) | 0,366 | > 0,999 | 0,738 |
| Положительный ревматоидный фактор (%) | 10/28 (36) | 2/17 (12) | 1/13 (7) | 0.288 | 0,378 | > 0,999 |
Гистологические и иммуногистохимические исследования
LPSP был гистологически подтвержден с обильной инфильтрацией CD3-положительных Т-лимфоцитов и IgG4-положительных плазматических клеток в 6 D-типе, 7 H-типе и 4 Пациенты типа B / T. В поджелудочной железе 2 пациентов B / T-типа (1 образец хирургической биопсии и 1 образец EUS-FNA) были обнаружены выраженный фиброз и обильная инфильтрация CD20-положительных В-лимфоцитов, а не Т-лимфоцитов, но мало IgG4-положительных плазматических клеток или нейтрофилы обнаружены.IDCP не наблюдался ни у одного пациента. EUS-FNA у 4 пациентов с ОИП не смог подтвердить гистологический диагноз из-за недостаточного количества образцов (таблица).
Таблица 3
Гистологические данные поджелудочной железы при трех типах аутоиммунного панкреатита
| D тип | H тип | B / T тип | LPSP ( n = 3) | LPSP ( n = 3) | LPSP ( n = 1) |
| Биопсия | LPSP ( n = 2) | LPSP ( n = 3) | Фиброз с обильной инфильтрацией В-лимфоцитов ( n = 1) |
| EUS-FNA | LPSP ( n = 1) | LPSP ( n = 1) | ( n = 3) |
| Несоответствующий материал ( n = 1) | Несоответствующий материал ( n = 2) | Фиброз с обильной инфильтрацией B-лимфоцитов ( n = 1) | 9 0175|
| Несоответствующий материал ( n = 1) |
Клинический курс
Стероидная терапия была эффективной у всех 50 пациентов (31 тип D, 13 H тип и 6 B / T тип).AIP рецидивировал во время постепенного снижения дозы или после прекращения приема стероидов у 3 пациентов D-типа и 3-х пациентов H-типа. У 8 пациентов, находящихся под консервативным наблюдением (1 тип H и 7 тип B / T), рентгенологические характеристики не изменились у семи пациентов, но увеличение хвоста поджелудочной железы улучшилось естественным образом у 1 пациента с типом B / T. В течение курса, предшествовавшего нашей госпитализации, очаговое увеличение головки поджелудочной железы развилось до диффузного увеличения в трех случаях, а очаговое увеличение хвоста поджелудочной железы развилось до диффузного увеличения в одном случае.
ОБСУЖДЕНИЕ
Радиологически AIP подразделяется на диффузные и очаговые формы. Диффузное увеличение поджелудочной железы, называемое колбасоподобным увеличением, является типичным признаком AIP. Однако AIP F-типа, иногда образующий массу, часто трудно отличить от рака поджелудочной железы [1-3,12-14]. Возможные различия в клинических проявлениях между типами D и F AIP неясны.
В настоящем исследовании мы классифицировали 67 пациентов с ОИП на тип D ( n = 34), тип H ( n = 19) и тип B / T ( n = 14).Типы D и H показали сходные клинические особенности. Однако тип B / T отличался от типов D и H в нескольких аспектах. Механическая желтуха и стеноз нижнего желчного протока часто выявлялись у пациентов с типом D и H, но ни у одного пациента с типом B / T эти особенности не наблюдались. По данным Ghazale et al [16], стеноз нижнего желчного протока имел место у 70% из 53 пациентов с ОИП. Хирано и др. [17] заявили, что как отек поджелудочной железы из-за воспаления головки поджелудочной железы, так и утолщение стенки желчных протоков влияют на стеноз нижнего желчного протока при AIP, на основании результатов EUS и того факта, что 93% случаев AIP с положительным поражением головки поджелудочной железы у пациентов был стеноз нижнего желчного протока, по сравнению только с 17% пациентов с отрицательным поражением.
В этом исследовании уровень сывороточного IgG4 был значительно ниже у пациентов B / T-типа, чем у пациентов с D-типом, а повышение уровня сывороточного IgG4 было меньше у пациентов с B / T-типом, чем у пациентов с D-типом. Острый панкреатит чаще наблюдался у пациентов B / T-типа, чем у пациентов с D-типом, а уровни амилазы в сыворотке крови были значительно выше у пациентов с B / T-типом, чем у пациентов с H-типом. Что касается диагноза и частоты острого панкреатита, высокий процент пациентов с типом B / T, по-видимому, в основном зависит от более высоких уровней амилазы.Острый панкреатит или некоторые острые воспалительные приступы в случаях хронического панкреатита могут не быть связаны с высокими уровнями амилазы из-за атрофической ацинарной ткани. Не было разницы в частоте болей в животе, поэтому некоторые случаи D-типа и H-типа могли быть упущены.
Ни у одного из пациентов типа B / T не рецидивов после стероидной терапии, по сравнению с 10% пациентов D-типа и 23% пациентов H-типа. Стало ясно, что существует два гистологических подтипа (LPSP и IDCP) в AIP [6-11].Большинство пациентов с AIP в Азии имеют LPSP, а половина пациентов с AIP в Европе имеют IDCP [8,10]. Клинические признаки этих двух подтипов существенно различаются. Как правило, сообщается, что пациенты с IDCP моложе на момент постановки диагноза, а пациенты с IDCP с меньшей вероятностью демонстрируют повышенные уровни IgG4 в сыворотке. IDCP чаще ассоциируется с острым панкреатитом и воспалительным заболеванием кишечника. Согласно сравнительному исследованию пациентов с LPSP и IDCP, проведенным Sah et al [9], пациенты с IDCP, как правило, имели больше очаговых особенностей, чем LPSP (84% против 60%), и рецидивов IDCP не наблюдалось ни у одного пациента, тогда как LPSP рецидивировал у 47% пациентов.Для диагностики IDCP необходимо гистологическое исследование адекватного образца поджелудочной железы, а необходимость гистологического исследования для диагностики IDCP в настоящее время затрудняет клиническую диагностику.
При гистологическом исследовании данных случаев LPSP был подтвержден у 17, но IDCP не был обнаружен. Клинические файлы AIP D-типа и H-типа были совместимы с файлами пациентов с LPSP. Однако, учитывая низкие уровни IgG4 в сыворотке и частую связь с острым панкреатитом, существует вероятность того, что некоторые случаи IDCP могут быть вовлечены в случаи B / T-типа.Например, 32-летний мужчина с AIP B / T типа показал нормальные уровни IgG4 в сыворотке, ассоциацию с язвенным колитом и хорошую чувствительность к стероидной терапии, но гистологический диагноз с помощью EUS-FNA не мог быть подтвержден из-за недостаточного образец биопсии. Интересно, что гистология двух пациентов B / T-типа включала обильную инфильтрацию B-клеток с небольшой инфильтрацией IgG4-положительных клеток или нейтрофилов, которые могли быть другим типом AIP, отличным от LPSP и IDCP. AIP B / T-типа может включать заболевание, отличное от LPSP.
Три пациента с типом H и один пациент с типом B / T перешли в тип D в течение естественного течения. Также сообщалось, что AIP H-типа переходит в D-тип [18,19], а AIP B / T-типа – в D-тип [20]. Также были сообщения о рецидивах в остаточной поджелудочной железе после резекции, таких как рецидив в остаточной головке поджелудочной железы через 1 год после дистальной панкреатэктомии [21] и рецидив в остаточной части поджелудочной железы и хвосте через 4 мес после панкреатодуоденэктомии [22]. Стероидная терапия была эффективной при прогрессировании или рецидиве поражений.Эти данные показывают, что очаговое воспаление может прогрессировать до последующих диффузных изменений по всей поджелудочной железе или развиваться повторно в разных местах и в разное время у некоторых пациентов с ОИП. Диффузное изменение поджелудочной железы может быть окончательным проявлением AIP, и то, влияет ли этот воспалительный процесс на железу диффузно или очагово, может просто отражать стадию заболевания. Из семи консервативно наблюдаемых пациентов типа B / T у шести не было никаких изменений, а у одного улучшилось естественным образом. Kubota и др. [23] сообщили, что у всех восьми пациентов с ОИП, у которых спонтанно улучшилось состояние, наблюдалось очаговое увеличение поджелудочной железы.AIP B / T-типа может включать заболевание, отличное от AIP D-типа и H.
В заключение, хотя клинические признаки AIP H-типа аналогичны клиническим характеристикам AIP D-типа, AIP B / T-типа в нескольких аспектах отличается от типов D и H. AIP B / T-типа может включать заболевание, отличное от LPSP.
КОММЕНТАРИИ
Предпосылки
Аутоиммунный панкреатит (АИП) – это особый тип панкреатита, который, как считается, имеет аутоиммунную этиологию. Недавно AIP был радиологически классифицирован на диффузный тип (тип D) и очаговый тип (тип F).Однако различия между AIP D- и F-типа малоизвестны.
Границы исследований
Были исследованы различия в клинических, радиологических, лабораторных и гистологических данных между AIP D- и F-типа.
Инновации и прорывы
Пациенты с ОИП были разделены на тип D и тип F. Кроме того, тип F был разделен на тип головы (тип H) и тип корпуса и / или хвоста (тип B / T). Ни у одного пациента типа B / T не была желтуха как начальный симптом, но острый панкреатит чаще ассоциировался с типом B / T, чем с типом D.Уровни амилазы в сыворотке были значительно выше у пациентов B / T-типа, чем у пациентов H-типа. Уровни сывороточного иммуноглобулина G (IgG) 4 были значительно выше у пациентов D-типа, чем у пациентов B / T-типа. Ни у одного из пациентов типа B / T после стероидной терапии не наблюдалось рецидива, по сравнению с 10% пациентов D-типа и 23% пациентов H-типа. У двух пациентов B / T-типа наблюдалась обильная инфильтрация B-клеток с небольшой инфильтрацией IgG4-положительных клеток или нейтрофилов.
Приложения
AIP B / T-типа отличается по нескольким аспектам от типов D и H, и некоторые AIP B / T-типа могут быть связаны с заболеванием, отличным от лимфоплазмоцитарного склерозирующего панкреатита.
Рецензирование
Само исследование кажется разумным, а результаты интересны и имеют этиологическое значение.
Сноски
При поддержке Исследовательского комитета по трудноизлечимым заболеваниям поджелудочной железы (главный исследователь; Тору Симосегава), предоставлены Министерством здравоохранения, труда и социального обеспечения Японии
Рецензенты: Сёитиро Суми, доктор медицины, доктор философии, младший профессор, Отделение реконструкции органов, Институт пограничных медицинских наук, Университет Киото, Сакё-ку, Киото 606-8507, Япония; Ацуши Масамунэ, доктор медицины, доктор философии, отделение гастроэнтерологии, Высшая школа медицины Университета Тохоку, 1-1 Сейрё-мати, Аоба-ку, Сендай 980-8574, Япония
S- редактор Lv S L- редактор Kerr C. E- редактор Li JY
Ссылки
1.Окадзаки К., Кава С., Камисава Т., Ито Т., Инуи К., Ирие Х, Ирисава А., Кубо К., Нотохара К., Хасебе О. и др. Японские клинические рекомендации по аутоиммунному панкреатиту. Поджелудочная железа. 2009; 38: 849–866. [PubMed] [Google Scholar] 2. Чари С.Т., Такахаши Н., Леви М.Дж., Смирк Т.К., Клейн Д.Е., Пирсон Р.К., Петерсен Б.Т., Топазиан М.А., Веге С.С. Диагностическая стратегия, позволяющая отличить аутоиммунный панкреатит от рака поджелудочной железы. Clin Gastroenterol Hepatol. 2009; 7: 1097–1103. [PubMed] [Google Scholar] 3. Камисава Т., Такума К., Эгава Н., Цурута К., Сасаки Т.Аутоиммунный панкреатит и склерозирующая болезнь, связанная с IgG4. Нат Рев Гастроэнтерол Гепатол. 2010; 7: 401–409. [PubMed] [Google Scholar] 4. Otsuki M, Chung JB, Okazaki K, Kim MH, Kamisawa T., Kawa S., Park SW, Shimosegawa T., Lee K, Ito T. и др. Азиатские диагностические критерии аутоиммунного панкреатита: консенсус Японско-корейского симпозиума по аутоиммунному панкреатиту. J Gastroenterol. 2008; 43: 403–408. [PubMed] [Google Scholar] 5. Кавагути К., Койке М., Цурута К., Окамото А., Табата И., Фудзита Н. Лимфоплазмоцитарный склерозирующий панкреатит с холангитом: вариант первичного склерозирующего холангита с обширным поражением поджелудочной железы.Hum Pathol. 1991; 22: 387–395. [PubMed] [Google Scholar] 6. Нотохара К., Бургарт Л.Дж., Ядав Д., Чари С., Смирк ТЦ. Идиопатический хронический панкреатит с перидуктальной лимфоплазмоцитарной инфильтрацией: клинико-патологические особенности 35 случаев. Am J Surg Pathol. 2003. 27: 1119–1127. [PubMed] [Google Scholar] 7. Zamboni G, Lüttges J, Capelli P, Frulloni L, Cavallini G, Pederzoli P, Leins A, Longnecker D, Klöppel G. Гистопатологические особенности диагностической и клинической значимости аутоиммунного панкреатита: исследование на 53 образцах резекции и 9 образцах биопсии.Арка Вирхова. 2004. 445: 552–563. [PubMed] [Google Scholar] 8. Park DH, Kim MH, Chari ST. Последние достижения в области аутоиммунного панкреатита. Кишечник. 2009. 58: 1680–1689. [PubMed] [Google Scholar] 9. Сах Р.П., Чари С.Т., Паннала Р., Сугумар А., Клэйн Дж.Э., Леви М.Дж., Пирсон Р.К., Смирк Т.С., Петерсен Б.Т., Топазиан М.Д. и др. Различия в клиническом профиле и частоте рецидивов аутоиммунного панкреатита 1 типа и 2 типа. Гастроэнтерология. 2010; 139: 140–148; викторина 140-148. [PubMed] [Google Scholar] 10. Камисава Т., Нотохара К., Симосегава Т.Два клинико-патологических подтипа аутоиммунного панкреатита: LPSP и IDCP. Гастроэнтерология. 2010; 139: 22–25. [PubMed] [Google Scholar] 11. Chari ST, Kloeppel G, Zhang L, Notohara K, Lerch MM, Shimosegawa T. Гистопатологические и клинические подтипы аутоиммунного панкреатита: согласованный документ гонолулу. Панкреатология. 2010. 10: 664–672. [PubMed] [Google Scholar] 12. Ирие Х, Хонда Х, Баба С., Куроива Т., Йошимицу К., Таджима Т., Джими М., Суми Т., Масуда К. Аутоиммунный панкреатит: характеристики КТ и МРТ.AJR Am J Roentgenol. 1998; 170: 1323–1327. [PubMed] [Google Scholar] 13. Wakabayashi T, Kawaura Y, Satomura Y, Fujii T., Motoo Y, Okai T., Sawabu N. Клиническое исследование хронического панкреатита с очаговым нерегулярным сужением главного протока поджелудочной железы и образованием массы: сравнение с хроническим панкреатитом, показывающим диффузное нерегулярное сужение основного протока. проток поджелудочной железы. Поджелудочная железа. 2002. 25: 283–289. [PubMed] [Google Scholar] 14. Фруллони Л., Скаттолини С., Фалькони М., Замбони Дж., Капелли П., Манфреди Р., Грациани Р., Д’Онофрио М., Кацотурчи А.М., Амодио А. и др.Аутоиммунный панкреатит: различия очаговой и диффузной форм у 87 больных. Am J Gastroenterol. 2009. 104: 2288–2294. [PubMed] [Google Scholar] 16. Ghazale A, Chari ST, Zhang L, Smyrk TC, Takahashi N, Levy MJ, Topazian MD, Clain JE, Pearson RK, Petersen BT и др. Иммуноглобулин G4-ассоциированный холангит: клинический профиль и ответ на терапию. Гастроэнтерология. 2008. 134: 706–715. [PubMed] [Google Scholar] 17. Хирано К., Тада М., Исаяма Х, Ямамото К., Мизуно С., Ягиока Х, Яшима Й, Сасаки Т, Когуре Х, Тогава О и др.Эндоскопическая оценка факторов, способствующих возникновению стриктуры интрапанкреатических желчевыводящих путей при аутоиммунном панкреатите. Gastrointest Endosc. 2010; 71: 85–90. [PubMed] [Google Scholar] 18. Horiuchi A, Kawa S, Akamatsu T., Aoki Y, Mukawa K, Furuya N, Ochi Y, Kiyosawa K. Характерный внешний вид протока поджелудочной железы при аутоиммунном хроническом панкреатите: отчет о болезни и обзор японской литературы. Am J Gastroenterol. 1998. 93: 260–263. [PubMed] [Google Scholar] 19. Кога Й, Ямагути К., Сугитани А., Чидзива К., Танака М.Аутоиммунный панкреатит, начинающийся как локализованная форма. J Gastroenterol. 2002. 37: 133–137. [PubMed] [Google Scholar] 20. Wakabayashi T, Kawaura Y, Satomura Y, Watanabe H, Motoo Y, Sawabu N. Долгосрочный прогноз хронического панкреатита с сужением протока: стратегия лечения стероидами. Поджелудочная железа. 2005; 30: 31–39. [PubMed] [Google Scholar] 21. Motoo Y, Minamoto T., Watanabe H, Sakai J, Okai T., Sawabu N. Склерозирующий панкреатит, демонстрирующий быстро прогрессирующие изменения с периодическим формированием массы. Int J Pancreatol.1997; 21: 85–90. [PubMed] [Google Scholar] 22. Бланк А, Мэйбоди М, Исом-Батц Дж, Рослин М, Диллон Э. Острый некротический панкреатит, вызванный Salmonella typhimurium. Dig Dis Sci. 2003. 48: 1472–1474. [PubMed] [Google Scholar] 23. Kubota K, Iida H, Fujisawa T., Ogawa M, Inamori M, Saito S, Kakuta Y, Oshiro H, Nakajima A. Клиническое значение опухшего дуоденального сосочка при аутоиммунном панкреатите. Поджелудочная железа. 2007; 35: e51 – e60. [PubMed] [Google Scholar]Различия между диффузным и очаговым аутоиммунным панкреатитом
World J Gastroenterol.2012 7 мая; 18 (17): 2099–2104.
Таку Табата, Теруми Камисава, Кенсуке Такума, Сэйити Хара, Савако Курума, Ёсихико Инаба, отделение внутренней медицины, Токийская столичная больница Комагоме, 3-18-22 Хонкомагоме, Бункё-ку, Токио 113-8677, Япония
Авторский вклад : Табата Т. и Камисава Т. внесли равный вклад в эту работу, проанализировали данные и написали рукопись; Данные собирали Такума К., Хара С., Курума С. и Инаба Ю.Для корреспонденции: Теруми Камисава, доктор медицинских наук, отделение внутренней медицины, Токийская столичная больница Комагоме, 3-18-22 Хонкомагоме, Бункё-ку, Токио 113-8677, Япония.pj.kcic@awasimak
Телефон: + 81-3-38232101 Факс: + 81-3-38241552
Получено 31 мая 2011 г .; Пересмотрено 19 августа 2011 г .; Принято 27 августа 2011 г.
Copyright © 2012 Baishideng Publishing Group Co., Limited. Все права защищены.Эта статья цитировалась в других статьях в PMC.Abstract
ЦЕЛЬ: изучить различия в клинических характеристиках диффузного и очагового аутоиммунного панкреатита (AIP).
МЕТОДЫ. На основании радиологических данных, полученных с помощью компьютерной томографии и / или магнитно-резонансной томографии, мы разделили 67 пациентов с ОИП на диффузный тип (тип D) и очаговый тип (тип F).Далее мы разделили тип F на тип головы (тип H) и тип тела и / или хвоста (тип B / T) в зависимости от места увеличения. Наконец, мы разделили 67 пациентов с ОИП на три группы: тип D, тип H и тип B / T. Мы сравнили три типа AIP с точки зрения клинических, лабораторных, радиологических, функциональных и гистологических данных и клинического течения.
РЕЗУЛЬТАТЫ: 34 пациента с D-типом, 19 с H-типом и 14 с B / T-типом AIP. Хотя механическая желтуха часто выявлялась у пациентов D-типа (88%) и пациентов H-типа (68%), ни у одного из пациентов типа B / T не было желтухи в качестве начального симптома ( P <0.001). Не было различий в частоте боли в животе, но острый панкреатит чаще ассоциировался у пациентов типа B / T (36%), чем у пациентов типа D (3%) ( P = 0,017). Уровни сывороточного иммуноглобулина G (IgG) 4 были значительно выше у пациентов D-типа (медиана 309 мг / дл), чем у пациентов B / T-типа (133,5 мг / дл) ( P = 0,042). Уровни амилазы в сыворотке крови у пациентов с B / T-типом (медиана: 114 МЕ / л) были значительно выше, чем у пациентов с H-типом (72 МЕ / л) ( P = 0.049). Лимфоплазмоцитарный склерозирующий панкреатит (LPSP) был гистологически подтвержден у 6 пациентов D-типа, 7 H-типа и 4 B / T-типов; идиопатический протоковоцентрический панкреатит не наблюдался ни у одного пациента. Выраженный фиброз и обильная инфильтрация CD20-положительных B-лимфоцитов небольшим количеством IgG4-положительных плазматических клеток были обнаружены у 2 пациентов B / T-типа. Стероидная терапия была эффективной у всех 50 пациентов (31 тип D, 13 тип H и 6 тип B / T). Хотя AIP рецидивировал во время постепенного снижения дозы или после отмены стероидов у 3 пациентов D-типа и 3 H-типа, ни у одного пациента не было рецидивов B / T.В ходе последующего наблюдения рентгенологические характеристики 6 пациентов с типом B / T не изменились, а у 1 пациента с типом B / T улучшилось естественное улучшение.
ЗАКЛЮЧЕНИЕ: Клинические признаки AIP H-типа были аналогичны таковым у D-типа, но B / T-тип отличался от D и H. B / T-тип может включать другие заболевания, кроме LPSP.
Ключевые слова: Аутоиммунный панкреатит, иммуноглобулин G 4, лимфоплазмоцитарный склерозирующий панкреатит
ВВЕДЕНИЕ
Аутоиммунный панкреатит (AIP) – это тип панкреатита, который, как считается, имеет аутоиммунную этиологию.AIP резко реагирует на стероидную терапию, поэтому дифференцировать AIP от рака поджелудочной железы важно, чтобы избежать ненужной резекции поджелудочной железы [1-3]. Согласно Азиатским диагностическим критериям AIP [4], AIP диагностируется по следующим признакам: диффузное или очаговое увеличение поджелудочной железы и сужение главного протока поджелудочной железы; повышенный уровень сывороточного иммуноглобулина G (IgG) или IgG4 или присутствие аутоантител в сыворотке; гистологические данные о лимфоплазмоцитарной инфильтрации и фиброзе поджелудочной железы [лимфоплазмоцитарный склерозирующий панкреатит (LPSP) [5]]; и отзывчивость на стероиды.АИП часто встречается у пожилых мужчин. Первичный начальный симптом – механическая желтуха, а сахарный диабет встречается у половины пациентов. AIP редко ассоциируется с острым панкреатитом или язвенным колитом. AIP связан с несколькими склерозирующими экстрапанкреатическими поражениями, такими как склерозирующий холангит, склерозирующий сиаладенит и забрюшинный фиброз, и в настоящее время считается поражением поджелудочной железы системного заболевания, связанного с IgG4. AIP хорошо поддается стероидной терапии, но иногда имеет рецидивы [1,2].
Недавно была обнаружена другая гистологическая картина AIP, характеризующаяся протоковой эпителиальной гранулоцитарной инфильтрацией [6,7]. Этот паттерн называется идиопатическим протоковоцентрическим панкреатитом (IDCP) [6]. Клинические особенности пациентов с IDCP отличаются от пациентов с LPSP. Термины AIP типа 1 и типа 2 предлагаются для описания клинических особенностей, связанных с LPSP и IDCP, соответственно [8-11].
Радиологически AIP подразделяется на диффузный тип (тип D) и очаговый тип (тип F) [1-3,12-14].Хотя диффузное увеличение поджелудочной железы довольно специфично для AIP, AIP F-типа следует строго дифференцировать от рака поджелудочной железы. Однако лишь в нескольких исследованиях [13,14] изучались различия между AIP D- и F-типа, и неизвестно, является ли AIP F-типа начальной стадией AIP D-типа или другим типом AIP. Это исследование было направлено на выяснение различий в клинических характеристиках AIP D- и F-типа.
МАТЕРИАЛЫ И МЕТОДЫ
Пациенты, изучаемые
С 1988 по 2010 год, 67 пациентов с ОИП (47 мужчин и 20 женщин; средний возраст: 60 лет.3 года; диапазон: 27-83 года) были диагностированы в соответствии с Азиатскими диагностическими критериями AIP [4] в токийской столичной больнице Комагоме. На основании радиологических данных, полученных с помощью компьютерной томографии и / или магнитно-резонансной томографии, мы разделили пациентов с ОИП на D-тип и F. Далее мы разделили тип F на тип головы (тип H) и тип тела и / или хвоста (тип B / T) в зависимости от места увеличения. Наконец, мы разделили 67 пациентов с ОИП на три группы: тип D, тип H и тип B / T. Пациенты с AIP D-типа показали диффузное увеличение поджелудочной железы (Рисунок -), пациенты H-типа показали очаговое увеличение только головки поджелудочной железы (Рисунок -), а пациенты B / T-типа показали увеличение только тела поджелудочной железы и / или хвост (рисунок а).Мы сравнили клинические, лабораторные, радиологические, функциональные и гистологические данные, а также клиническое течение трех типов AIP.
Компьютерная томография, показывающая аутоиммунный панкреатит диффузного типа. Был замечен отек головы (A), тела (B) и хвоста (C) поджелудочной железы.
Компьютерная томография, показывающая аутоиммунный панкреатит головного типа. Отек только головки поджелудочной железы (A), но тело поджелудочной железы (B) и хвост (C) были нормального размера.
Компьютерная томография, показывающая аутоиммунный панкреатит по типу тела и / или хвоста.Тело и хвост поджелудочной железы опухли (A), но головка поджелудочной железы была в пределах нормального размера (B).
Клинические, радиологические и лабораторные анализы
Клинические оценки включали: возраст на момент постановки диагноза; секс; привычки к употреблению алкоголя и курения; наличие и / или наличие в анамнезе аллергических заболеваний; начальные симптомы, такие как механическая желтуха и боль в животе; и сопутствующие заболевания, такие как сахарный диабет, острый панкреатит и язвенный колит. Привычка к употреблению алкоголя была определена как употребление алкоголя> 80 г / день в течение> 7 лет.Привычка к курению была определена как курение> 20 пач-лет. Сахарный диабет диагностировали, если уровни глюкозы в сыворотке крови натощак и / или уровни гемоглобина A1c были выше нормального уровня (126 мг / дл и 6,1% соответственно) [15]. Острый панкреатит был диагностирован, когда наблюдались как сильная боль в животе, так и повышение уровня амилазы в сыворотке (> 3 раза от нормы; норма: 115 МЕ / л).
Стеноз нижнего желчного протока оценивали с помощью эндоскопической ретроградной холангиопанкреатографии и / или магнитно-резонансной холангиопанкреатографии.Радиологически были оценены три экстрапанкреатических поражения, которые часто связаны с ОИП (склерозирующий холангит прикорневых или внутрипеченочных желчных протоков, отек слюнных желез и забрюшинный фиброз).
Лабораторные данные были оценены, включая уровни сывороточного IgG ( n = 67), IgG4 ( n = 65) и иммуноглобулина E (IgE) ( n = 43), количество периферических эозинофилов ( n = 56) уровни амилазы в сыворотке ( n = 66) и аутоантитела, включая антинуклеарный антиген ( n = 60) и ревматоидный фактор ( n = 58).Уровни IgG4 в сыворотке измеряли нефелометрией с использованием наборов подкласса IgG (BS-NIA). Было использовано общепринятое пороговое значение 135 мг / дл.
Гистологические и иммуногистологические исследования
Поджелудочная железа оценивалась с помощью хирургической резекции ( n = 7), хирургической биопсии или биопсии под контролем УЗИ ( n = 6) и тонкоигольной аспирации под контролем эндоскопического ультразвукового исследования (EUS-FNA , n = 10) и исследовали гистологически и иммуногистохимически с использованием антител анти-CD3, анти-CD20 и анти-IgG4.
Клинический курс
Десяти пациентам первоначально было проведено хирургическое вмешательство при подозрении на рак поджелудочной железы (панкреатодуоденэктомия, n = 6; дистальная панкреатэктомия, n = 1; холедоходуоденостомия с биопсией поджелудочной железы, n = 3). Пятьдесят пациентов, в том числе один хирург, пролеченный пероральными стероидами. Преднизолон в начальной дозе 30-40 мг / сут назначался в течение 2-3 недель. Затем его снижали на 5 мг каждые 1-3 недели до 5 мг / сут. Поддерживающая терапия (2.5-5 мг / сут, 1-3 года) применялась у всех пациентов. Рецидив AIP был определен как повторное появление симптомов с развитием или повторным появлением патологий поджелудочной железы и / или экстрапанкреатических аномалий при визуализирующих исследованиях. Восемь пациентов наблюдались консервативно без стероидной терапии.
Статистический анализ
Различия между группами анализировали с использованием точного вероятностного критерия Фишера и критерия Манна-Уитни U . Значения P были скорректированы методом Бонферрони, а значения P <0.05 считали статистически значимым.
РЕЗУЛЬТАТЫ
Клинические, радиологические и лабораторные различия
Шестьдесят семь пациентов с ОИП были классифицированы на D-тип ( n = 34), H-тип ( n = 19) и B / T-тип ( n = 14) AIP. Между группами не было значительных различий по возрасту, полу, алкоголю, курению и аллергическим заболеваниям в анамнезе. Хотя механическая желтуха часто выявлялась у пациентов с D-типом (88%) и H-типом (68%), ни у одного пациента с типом B / T не было желтухи в качестве начального симптома ( P <0.001). Хотя не было различий в частоте болей в животе, острый панкреатит чаще встречался у пациентов типа B / T (36%), чем у пациентов типа D (3%) ( P = 0,017). Хотя стеноз нижнего желчного протока часто наблюдался у пациентов D-типа (94%) и H-типа (95%), ни у одного пациента типа B / T не было стеноза нижнего желчного протока ( P <0,001). Не было различий между группами по ассоциированным экстрапанкреатическим поражениям (таблица).
Таблица 1
Клинические и рентгенологические данные трех типов аутоиммунного панкреатита
| Тип D, n = 34 | H тип, n = 19 | B / Тип T, n = 14 | Значение P , D против H | P значение, D против B / T | P значение, H против B / T | |
| Средний возраст (лет) (квартильный диапазон) | 67.5 (59-71,5) | 64,0 (56-71) | 61,5 (50,3-72,5) | > 0,99 | > 0,99 | > 0,99 |
| Мужской / женский | 24/10 | 15 / 4 | 8/6 | > 0,99 | > 0,99 | > 0,99 |
| Привычка к употреблению алкоголя +/- (%) | 4/27 (15) | 4/15 (21) | 2 / 12 (14) | > 0,99 | > 0,99 | > 0,99 |
| Привычка к курению +/- (%) | 16/27 (59) | 12/16 (75) | 5/13 ( 39) | > 0.99 | > 0,99 | 0,198 |
| Аллергия +/- (%) | 8/25 (32) | 6/18 (33) | 7/13 (54) | > 0,99 | 0,885 | 0,879 |
| Желтуха +/- (%) | 30/4 (88) | 13/6 (68) | 0/14 (0) | 0,420 | <0,001 | <0,001 |
| Боль в животе +/- (%) | 6/28 (18) | 7/13 (37) | 5/9 (36) | 0.546 | 0,771 | > 0,999 |
| Диабет +/- (%) | 10/24 (29) | 11/8 (58) | 4/10 (29) | 0,231 | > 0,999 | > 0,999 |
| Острый панкреатит +/- (%) | 1/33 (3) | 1/18 (5) | 5/9 (36) | > 0,999 | 0,017 | 0,183 |
| Язвенный колит +/- (%) | 1/33 (3) | 0/19 (0) | 1/13 (7) | > 0.999 | > 0,999 | > 0,999 |
| Стеноз нижнего мерзкого протока +/- (%) | 32/34 (94) | 18/19 (95) | 0/14 (0) | > 0,999 | <0,001 | <0,001 |
| Экстрапанкреатические поражения +/- (%) | 13/21 (38) | 6/13 (32) | 5/9 (36) | > 0,999 | > 0,999 | > 0,999 |
Уровни сывороточного IgG4 были значительно выше у пациентов D-типа (медиана: 309 мг / дл), чем у пациентов B / T-типа (133.5 мг / дл) пациентов ( P = 0,042). Уровни сывороточного IgG4 были чаще повышены у пациентов D-типа (88%), чем у пациентов B / T-типа (50%) ( P = 0,030). Не было значительных различий в уровнях сывороточного IgE и количестве периферических эозинофилов между группами. Уровни амилазы в сыворотке у пациентов B / T-типа (медиана: 114 МЕ / л) были значительно выше, чем у пациентов H-типа (72 МЕ / л) ( P = 0,049). По соотношению антинуклеарного антигена и ревматоидного фактора различий между группами не было (таблица).
Таблица 2
Лабораторные данные трех типов аутоиммунного панкреатита
| тип D, n = 34 | тип H, n = 19 | тип B / T , n = 14 | P значение, D vs H | P значение, D vs B / T | P значение, H vs B / T | |
| Медиана IgG, мг / дл | 2163.5 (1637,5-2682,8) | 1920 (1398,5-2300) | 1619 (1369,5-2364,5) | 0,642 | > 0,999 | > 0,999 |
| (квартильный диапазон) | ||||||
| 309 (181-1015) | 351 (228-780) | 133,5 (60,8-326,5) | > 0,999 | 0,042 | 0,057 | |
| (квартильный диапазон) | 28/32 (88) | 16/19 (84) | 7/14 (50) | > 0.999 | 0,030 | 0,168 |
| Медиана IgE, МЕ / л | 406,9 (265,5-877) | 249,0 (74,75-589,75) | 264,0 (134,1-856) | 4 0,447> | 4 0,447 > 0,999 | |
| (квартильный диапазон) | ||||||
| IgE> 580, (МЕ / л) (%) | 8/20 (40,0) | 3/12 (25,0) | 4/11 (36,4) | > 0,999 | > 0,999 | > 0,999 |
| Медиана эозинофилов, мкл | 180 (72-440) | 238.5 (152,5-447,75) | 473 (114,5-621,5) | > 0,999 | 0,354 | > 0,999 |
| (квартильный диапазон) | ||||||
| Эозинофилы> 600 / мкл 13 (%) 3/3 | 32 90 (11) | 2/16 (13) | 3/13 (23) | > 0,999 | > 0,999 | > 0,999 |
| Медиана амилазы (МЕ / л) | 86 (49,5-119,5) | 72 (43-100) | 114 (73,3-589,3) | > 0.999 | > 0,999 | 0,049 |
| (квартильный диапазон) | ||||||
| Амилаза> 115 (МЕ / л) (%) | 8/33 (24) | 4/19 (21) | 7 / 14 (50) | > 0,999 | 0,300 | 0,408 |
| Положительный антинуклеарный антиген (%) | 14/29 (48) | 4/18 (22) | 6/13 (46) | 0,366 | > 0,999 | 0,738 |
| Положительный ревматоидный фактор (%) | 10/28 (36) | 2/17 (12) | 1/13 (7) | 0.288 | 0,378 | > 0,999 |
Гистологические и иммуногистохимические исследования
LPSP был гистологически подтвержден с обильной инфильтрацией CD3-положительных Т-лимфоцитов и IgG4-положительных плазматических клеток в 6 D-типе, 7 H-типе и 4 Пациенты типа B / T. В поджелудочной железе 2 пациентов B / T-типа (1 образец хирургической биопсии и 1 образец EUS-FNA) были обнаружены выраженный фиброз и обильная инфильтрация CD20-положительных В-лимфоцитов, а не Т-лимфоцитов, но мало IgG4-положительных плазматических клеток или нейтрофилы обнаружены.IDCP не наблюдался ни у одного пациента. EUS-FNA у 4 пациентов с ОИП не смог подтвердить гистологический диагноз из-за недостаточного количества образцов (таблица).
Таблица 3
Гистологические данные поджелудочной железы при трех типах аутоиммунного панкреатита
| D тип | H тип | B / T тип | LPSP ( n = 3) | LPSP ( n = 3) | LPSP ( n = 1) |
| Биопсия | LPSP ( n = 2) | LPSP ( n = 3) | Фиброз с обильной инфильтрацией В-лимфоцитов ( n = 1) |
| EUS-FNA | LPSP ( n = 1) | LPSP ( n = 1) | ( n = 3) |
| Несоответствующий материал ( n = 1) | Несоответствующий материал ( n = 2) | Фиброз с обильной инфильтрацией B-лимфоцитов ( n = 1) | 9 0175|
| Несоответствующий материал ( n = 1) |
Клинический курс
Стероидная терапия была эффективной у всех 50 пациентов (31 тип D, 13 H тип и 6 B / T тип).AIP рецидивировал во время постепенного снижения дозы или после прекращения приема стероидов у 3 пациентов D-типа и 3-х пациентов H-типа. У 8 пациентов, находящихся под консервативным наблюдением (1 тип H и 7 тип B / T), рентгенологические характеристики не изменились у семи пациентов, но увеличение хвоста поджелудочной железы улучшилось естественным образом у 1 пациента с типом B / T. В течение курса, предшествовавшего нашей госпитализации, очаговое увеличение головки поджелудочной железы развилось до диффузного увеличения в трех случаях, а очаговое увеличение хвоста поджелудочной железы развилось до диффузного увеличения в одном случае.
ОБСУЖДЕНИЕ
Радиологически AIP подразделяется на диффузные и очаговые формы. Диффузное увеличение поджелудочной железы, называемое колбасоподобным увеличением, является типичным признаком AIP. Однако AIP F-типа, иногда образующий массу, часто трудно отличить от рака поджелудочной железы [1-3,12-14]. Возможные различия в клинических проявлениях между типами D и F AIP неясны.
В настоящем исследовании мы классифицировали 67 пациентов с ОИП на тип D ( n = 34), тип H ( n = 19) и тип B / T ( n = 14).Типы D и H показали сходные клинические особенности. Однако тип B / T отличался от типов D и H в нескольких аспектах. Механическая желтуха и стеноз нижнего желчного протока часто выявлялись у пациентов с типом D и H, но ни у одного пациента с типом B / T эти особенности не наблюдались. По данным Ghazale et al [16], стеноз нижнего желчного протока имел место у 70% из 53 пациентов с ОИП. Хирано и др. [17] заявили, что как отек поджелудочной железы из-за воспаления головки поджелудочной железы, так и утолщение стенки желчных протоков влияют на стеноз нижнего желчного протока при AIP, на основании результатов EUS и того факта, что 93% случаев AIP с положительным поражением головки поджелудочной железы у пациентов был стеноз нижнего желчного протока, по сравнению только с 17% пациентов с отрицательным поражением.
В этом исследовании уровень сывороточного IgG4 был значительно ниже у пациентов B / T-типа, чем у пациентов с D-типом, а повышение уровня сывороточного IgG4 было меньше у пациентов с B / T-типом, чем у пациентов с D-типом. Острый панкреатит чаще наблюдался у пациентов B / T-типа, чем у пациентов с D-типом, а уровни амилазы в сыворотке крови были значительно выше у пациентов с B / T-типом, чем у пациентов с H-типом. Что касается диагноза и частоты острого панкреатита, высокий процент пациентов с типом B / T, по-видимому, в основном зависит от более высоких уровней амилазы.Острый панкреатит или некоторые острые воспалительные приступы в случаях хронического панкреатита могут не быть связаны с высокими уровнями амилазы из-за атрофической ацинарной ткани. Не было разницы в частоте болей в животе, поэтому некоторые случаи D-типа и H-типа могли быть упущены.
Ни у одного из пациентов типа B / T не рецидивов после стероидной терапии, по сравнению с 10% пациентов D-типа и 23% пациентов H-типа. Стало ясно, что существует два гистологических подтипа (LPSP и IDCP) в AIP [6-11].Большинство пациентов с AIP в Азии имеют LPSP, а половина пациентов с AIP в Европе имеют IDCP [8,10]. Клинические признаки этих двух подтипов существенно различаются. Как правило, сообщается, что пациенты с IDCP моложе на момент постановки диагноза, а пациенты с IDCP с меньшей вероятностью демонстрируют повышенные уровни IgG4 в сыворотке. IDCP чаще ассоциируется с острым панкреатитом и воспалительным заболеванием кишечника. Согласно сравнительному исследованию пациентов с LPSP и IDCP, проведенным Sah et al [9], пациенты с IDCP, как правило, имели больше очаговых особенностей, чем LPSP (84% против 60%), и рецидивов IDCP не наблюдалось ни у одного пациента, тогда как LPSP рецидивировал у 47% пациентов.Для диагностики IDCP необходимо гистологическое исследование адекватного образца поджелудочной железы, а необходимость гистологического исследования для диагностики IDCP в настоящее время затрудняет клиническую диагностику.
При гистологическом исследовании данных случаев LPSP был подтвержден у 17, но IDCP не был обнаружен. Клинические файлы AIP D-типа и H-типа были совместимы с файлами пациентов с LPSP. Однако, учитывая низкие уровни IgG4 в сыворотке и частую связь с острым панкреатитом, существует вероятность того, что некоторые случаи IDCP могут быть вовлечены в случаи B / T-типа.Например, 32-летний мужчина с AIP B / T типа показал нормальные уровни IgG4 в сыворотке, ассоциацию с язвенным колитом и хорошую чувствительность к стероидной терапии, но гистологический диагноз с помощью EUS-FNA не мог быть подтвержден из-за недостаточного образец биопсии. Интересно, что гистология двух пациентов B / T-типа включала обильную инфильтрацию B-клеток с небольшой инфильтрацией IgG4-положительных клеток или нейтрофилов, которые могли быть другим типом AIP, отличным от LPSP и IDCP. AIP B / T-типа может включать заболевание, отличное от LPSP.
Три пациента с типом H и один пациент с типом B / T перешли в тип D в течение естественного течения. Также сообщалось, что AIP H-типа переходит в D-тип [18,19], а AIP B / T-типа – в D-тип [20]. Также были сообщения о рецидивах в остаточной поджелудочной железе после резекции, таких как рецидив в остаточной головке поджелудочной железы через 1 год после дистальной панкреатэктомии [21] и рецидив в остаточной части поджелудочной железы и хвосте через 4 мес после панкреатодуоденэктомии [22]. Стероидная терапия была эффективной при прогрессировании или рецидиве поражений.Эти данные показывают, что очаговое воспаление может прогрессировать до последующих диффузных изменений по всей поджелудочной железе или развиваться повторно в разных местах и в разное время у некоторых пациентов с ОИП. Диффузное изменение поджелудочной железы может быть окончательным проявлением AIP, и то, влияет ли этот воспалительный процесс на железу диффузно или очагово, может просто отражать стадию заболевания. Из семи консервативно наблюдаемых пациентов типа B / T у шести не было никаких изменений, а у одного улучшилось естественным образом. Kubota и др. [23] сообщили, что у всех восьми пациентов с ОИП, у которых спонтанно улучшилось состояние, наблюдалось очаговое увеличение поджелудочной железы.AIP B / T-типа может включать заболевание, отличное от AIP D-типа и H.
В заключение, хотя клинические признаки AIP H-типа аналогичны клиническим характеристикам AIP D-типа, AIP B / T-типа в нескольких аспектах отличается от типов D и H. AIP B / T-типа может включать заболевание, отличное от LPSP.
КОММЕНТАРИИ
Предпосылки
Аутоиммунный панкреатит (АИП) – это особый тип панкреатита, который, как считается, имеет аутоиммунную этиологию. Недавно AIP был радиологически классифицирован на диффузный тип (тип D) и очаговый тип (тип F).Однако различия между AIP D- и F-типа малоизвестны.
Границы исследований
Были исследованы различия в клинических, радиологических, лабораторных и гистологических данных между AIP D- и F-типа.
Инновации и прорывы
Пациенты с ОИП были разделены на тип D и тип F. Кроме того, тип F был разделен на тип головы (тип H) и тип корпуса и / или хвоста (тип B / T). Ни у одного пациента типа B / T не была желтуха как начальный симптом, но острый панкреатит чаще ассоциировался с типом B / T, чем с типом D.Уровни амилазы в сыворотке были значительно выше у пациентов B / T-типа, чем у пациентов H-типа. Уровни сывороточного иммуноглобулина G (IgG) 4 были значительно выше у пациентов D-типа, чем у пациентов B / T-типа. Ни у одного из пациентов типа B / T после стероидной терапии не наблюдалось рецидива, по сравнению с 10% пациентов D-типа и 23% пациентов H-типа. У двух пациентов B / T-типа наблюдалась обильная инфильтрация B-клеток с небольшой инфильтрацией IgG4-положительных клеток или нейтрофилов.
Приложения
AIP B / T-типа отличается по нескольким аспектам от типов D и H, и некоторые AIP B / T-типа могут быть связаны с заболеванием, отличным от лимфоплазмоцитарного склерозирующего панкреатита.
Рецензирование
Само исследование кажется разумным, а результаты интересны и имеют этиологическое значение.
Сноски
При поддержке Исследовательского комитета по трудноизлечимым заболеваниям поджелудочной железы (главный исследователь; Тору Симосегава), предоставлены Министерством здравоохранения, труда и социального обеспечения Японии
Рецензенты: Сёитиро Суми, доктор медицины, доктор философии, младший профессор, Отделение реконструкции органов, Институт пограничных медицинских наук, Университет Киото, Сакё-ку, Киото 606-8507, Япония; Ацуши Масамунэ, доктор медицины, доктор философии, отделение гастроэнтерологии, Высшая школа медицины Университета Тохоку, 1-1 Сейрё-мати, Аоба-ку, Сендай 980-8574, Япония
S- редактор Lv S L- редактор Kerr C. E- редактор Li JY
Ссылки
1.Окадзаки К., Кава С., Камисава Т., Ито Т., Инуи К., Ирие Х, Ирисава А., Кубо К., Нотохара К., Хасебе О. и др. Японские клинические рекомендации по аутоиммунному панкреатиту. Поджелудочная железа. 2009; 38: 849–866. [PubMed] [Google Scholar] 2. Чари С.Т., Такахаши Н., Леви М.Дж., Смирк Т.К., Клейн Д.Е., Пирсон Р.К., Петерсен Б.Т., Топазиан М.А., Веге С.С. Диагностическая стратегия, позволяющая отличить аутоиммунный панкреатит от рака поджелудочной железы. Clin Gastroenterol Hepatol. 2009; 7: 1097–1103. [PubMed] [Google Scholar] 3. Камисава Т., Такума К., Эгава Н., Цурута К., Сасаки Т.Аутоиммунный панкреатит и склерозирующая болезнь, связанная с IgG4. Нат Рев Гастроэнтерол Гепатол. 2010; 7: 401–409. [PubMed] [Google Scholar] 4. Otsuki M, Chung JB, Okazaki K, Kim MH, Kamisawa T., Kawa S., Park SW, Shimosegawa T., Lee K, Ito T. и др. Азиатские диагностические критерии аутоиммунного панкреатита: консенсус Японско-корейского симпозиума по аутоиммунному панкреатиту. J Gastroenterol. 2008; 43: 403–408. [PubMed] [Google Scholar] 5. Кавагути К., Койке М., Цурута К., Окамото А., Табата И., Фудзита Н. Лимфоплазмоцитарный склерозирующий панкреатит с холангитом: вариант первичного склерозирующего холангита с обширным поражением поджелудочной железы.Hum Pathol. 1991; 22: 387–395. [PubMed] [Google Scholar] 6. Нотохара К., Бургарт Л.Дж., Ядав Д., Чари С., Смирк ТЦ. Идиопатический хронический панкреатит с перидуктальной лимфоплазмоцитарной инфильтрацией: клинико-патологические особенности 35 случаев. Am J Surg Pathol. 2003. 27: 1119–1127. [PubMed] [Google Scholar] 7. Zamboni G, Lüttges J, Capelli P, Frulloni L, Cavallini G, Pederzoli P, Leins A, Longnecker D, Klöppel G. Гистопатологические особенности диагностической и клинической значимости аутоиммунного панкреатита: исследование на 53 образцах резекции и 9 образцах биопсии.Арка Вирхова. 2004. 445: 552–563. [PubMed] [Google Scholar] 8. Park DH, Kim MH, Chari ST. Последние достижения в области аутоиммунного панкреатита. Кишечник. 2009. 58: 1680–1689. [PubMed] [Google Scholar] 9. Сах Р.П., Чари С.Т., Паннала Р., Сугумар А., Клэйн Дж.Э., Леви М.Дж., Пирсон Р.К., Смирк Т.С., Петерсен Б.Т., Топазиан М.Д. и др. Различия в клиническом профиле и частоте рецидивов аутоиммунного панкреатита 1 типа и 2 типа. Гастроэнтерология. 2010; 139: 140–148; викторина 140-148. [PubMed] [Google Scholar] 10. Камисава Т., Нотохара К., Симосегава Т.Два клинико-патологических подтипа аутоиммунного панкреатита: LPSP и IDCP. Гастроэнтерология. 2010; 139: 22–25. [PubMed] [Google Scholar] 11. Chari ST, Kloeppel G, Zhang L, Notohara K, Lerch MM, Shimosegawa T. Гистопатологические и клинические подтипы аутоиммунного панкреатита: согласованный документ гонолулу. Панкреатология. 2010. 10: 664–672. [PubMed] [Google Scholar] 12. Ирие Х, Хонда Х, Баба С., Куроива Т., Йошимицу К., Таджима Т., Джими М., Суми Т., Масуда К. Аутоиммунный панкреатит: характеристики КТ и МРТ.AJR Am J Roentgenol. 1998; 170: 1323–1327. [PubMed] [Google Scholar] 13. Wakabayashi T, Kawaura Y, Satomura Y, Fujii T., Motoo Y, Okai T., Sawabu N. Клиническое исследование хронического панкреатита с очаговым нерегулярным сужением главного протока поджелудочной железы и образованием массы: сравнение с хроническим панкреатитом, показывающим диффузное нерегулярное сужение основного протока. проток поджелудочной железы. Поджелудочная железа. 2002. 25: 283–289. [PubMed] [Google Scholar] 14. Фруллони Л., Скаттолини С., Фалькони М., Замбони Дж., Капелли П., Манфреди Р., Грациани Р., Д’Онофрио М., Кацотурчи А.М., Амодио А. и др.Аутоиммунный панкреатит: различия очаговой и диффузной форм у 87 больных. Am J Gastroenterol. 2009. 104: 2288–2294. [PubMed] [Google Scholar] 16. Ghazale A, Chari ST, Zhang L, Smyrk TC, Takahashi N, Levy MJ, Topazian MD, Clain JE, Pearson RK, Petersen BT и др. Иммуноглобулин G4-ассоциированный холангит: клинический профиль и ответ на терапию. Гастроэнтерология. 2008. 134: 706–715. [PubMed] [Google Scholar] 17. Хирано К., Тада М., Исаяма Х, Ямамото К., Мизуно С., Ягиока Х, Яшима Й, Сасаки Т, Когуре Х, Тогава О и др.Эндоскопическая оценка факторов, способствующих возникновению стриктуры интрапанкреатических желчевыводящих путей при аутоиммунном панкреатите. Gastrointest Endosc. 2010; 71: 85–90. [PubMed] [Google Scholar] 18. Horiuchi A, Kawa S, Akamatsu T., Aoki Y, Mukawa K, Furuya N, Ochi Y, Kiyosawa K. Характерный внешний вид протока поджелудочной железы при аутоиммунном хроническом панкреатите: отчет о болезни и обзор японской литературы. Am J Gastroenterol. 1998. 93: 260–263. [PubMed] [Google Scholar] 19. Кога Й, Ямагути К., Сугитани А., Чидзива К., Танака М.Аутоиммунный панкреатит, начинающийся как локализованная форма. J Gastroenterol. 2002. 37: 133–137. [PubMed] [Google Scholar] 20. Wakabayashi T, Kawaura Y, Satomura Y, Watanabe H, Motoo Y, Sawabu N. Долгосрочный прогноз хронического панкреатита с сужением протока: стратегия лечения стероидами. Поджелудочная железа. 2005; 30: 31–39. [PubMed] [Google Scholar] 21. Motoo Y, Minamoto T., Watanabe H, Sakai J, Okai T., Sawabu N. Склерозирующий панкреатит, демонстрирующий быстро прогрессирующие изменения с периодическим формированием массы. Int J Pancreatol.1997; 21: 85–90. [PubMed] [Google Scholar] 22. Бланк А, Мэйбоди М, Исом-Батц Дж, Рослин М, Диллон Э. Острый некротический панкреатит, вызванный Salmonella typhimurium. Dig Dis Sci. 2003. 48: 1472–1474. [PubMed] [Google Scholar] 23. Kubota K, Iida H, Fujisawa T., Ogawa M, Inamori M, Saito S, Kakuta Y, Oshiro H, Nakajima A. Клиническое значение опухшего дуоденального сосочка при аутоиммунном панкреатите. Поджелудочная железа. 2007; 35: e51 – e60. [PubMed] [Google Scholar]Различия между диффузным и очаговым аутоиммунным панкреатитом
World J Gastroenterol.2012 7 мая; 18 (17): 2099–2104.
Таку Табата, Теруми Камисава, Кенсуке Такума, Сэйити Хара, Савако Курума, Ёсихико Инаба, отделение внутренней медицины, Токийская столичная больница Комагоме, 3-18-22 Хонкомагоме, Бункё-ку, Токио 113-8677, Япония
Авторский вклад : Табата Т. и Камисава Т. внесли равный вклад в эту работу, проанализировали данные и написали рукопись; Данные собирали Такума К., Хара С., Курума С. и Инаба Ю.Для корреспонденции: Теруми Камисава, доктор медицинских наук, отделение внутренней медицины, Токийская столичная больница Комагоме, 3-18-22 Хонкомагоме, Бункё-ку, Токио 113-8677, Япония.pj.kcic@awasimak
Телефон: + 81-3-38232101 Факс: + 81-3-38241552
Получено 31 мая 2011 г .; Пересмотрено 19 августа 2011 г .; Принято 27 августа 2011 г.
Copyright © 2012 Baishideng Publishing Group Co., Limited. Все права защищены.Эта статья цитировалась в других статьях в PMC.Abstract
ЦЕЛЬ: изучить различия в клинических характеристиках диффузного и очагового аутоиммунного панкреатита (AIP).
МЕТОДЫ. На основании радиологических данных, полученных с помощью компьютерной томографии и / или магнитно-резонансной томографии, мы разделили 67 пациентов с ОИП на диффузный тип (тип D) и очаговый тип (тип F).Далее мы разделили тип F на тип головы (тип H) и тип тела и / или хвоста (тип B / T) в зависимости от места увеличения. Наконец, мы разделили 67 пациентов с ОИП на три группы: тип D, тип H и тип B / T. Мы сравнили три типа AIP с точки зрения клинических, лабораторных, радиологических, функциональных и гистологических данных и клинического течения.
РЕЗУЛЬТАТЫ: 34 пациента с D-типом, 19 с H-типом и 14 с B / T-типом AIP. Хотя механическая желтуха часто выявлялась у пациентов D-типа (88%) и пациентов H-типа (68%), ни у одного из пациентов типа B / T не было желтухи в качестве начального симптома ( P <0.001). Не было различий в частоте боли в животе, но острый панкреатит чаще ассоциировался у пациентов типа B / T (36%), чем у пациентов типа D (3%) ( P = 0,017). Уровни сывороточного иммуноглобулина G (IgG) 4 были значительно выше у пациентов D-типа (медиана 309 мг / дл), чем у пациентов B / T-типа (133,5 мг / дл) ( P = 0,042). Уровни амилазы в сыворотке крови у пациентов с B / T-типом (медиана: 114 МЕ / л) были значительно выше, чем у пациентов с H-типом (72 МЕ / л) ( P = 0.049). Лимфоплазмоцитарный склерозирующий панкреатит (LPSP) был гистологически подтвержден у 6 пациентов D-типа, 7 H-типа и 4 B / T-типов; идиопатический протоковоцентрический панкреатит не наблюдался ни у одного пациента. Выраженный фиброз и обильная инфильтрация CD20-положительных B-лимфоцитов небольшим количеством IgG4-положительных плазматических клеток были обнаружены у 2 пациентов B / T-типа. Стероидная терапия была эффективной у всех 50 пациентов (31 тип D, 13 тип H и 6 тип B / T). Хотя AIP рецидивировал во время постепенного снижения дозы или после отмены стероидов у 3 пациентов D-типа и 3 H-типа, ни у одного пациента не было рецидивов B / T.В ходе последующего наблюдения рентгенологические характеристики 6 пациентов с типом B / T не изменились, а у 1 пациента с типом B / T улучшилось естественное улучшение.
ЗАКЛЮЧЕНИЕ: Клинические признаки AIP H-типа были аналогичны таковым у D-типа, но B / T-тип отличался от D и H. B / T-тип может включать другие заболевания, кроме LPSP.
Ключевые слова: Аутоиммунный панкреатит, иммуноглобулин G 4, лимфоплазмоцитарный склерозирующий панкреатит
ВВЕДЕНИЕ
Аутоиммунный панкреатит (AIP) – это тип панкреатита, который, как считается, имеет аутоиммунную этиологию.AIP резко реагирует на стероидную терапию, поэтому дифференцировать AIP от рака поджелудочной железы важно, чтобы избежать ненужной резекции поджелудочной железы [1-3]. Согласно Азиатским диагностическим критериям AIP [4], AIP диагностируется по следующим признакам: диффузное или очаговое увеличение поджелудочной железы и сужение главного протока поджелудочной железы; повышенный уровень сывороточного иммуноглобулина G (IgG) или IgG4 или присутствие аутоантител в сыворотке; гистологические данные о лимфоплазмоцитарной инфильтрации и фиброзе поджелудочной железы [лимфоплазмоцитарный склерозирующий панкреатит (LPSP) [5]]; и отзывчивость на стероиды.АИП часто встречается у пожилых мужчин. Первичный начальный симптом – механическая желтуха, а сахарный диабет встречается у половины пациентов. AIP редко ассоциируется с острым панкреатитом или язвенным колитом. AIP связан с несколькими склерозирующими экстрапанкреатическими поражениями, такими как склерозирующий холангит, склерозирующий сиаладенит и забрюшинный фиброз, и в настоящее время считается поражением поджелудочной железы системного заболевания, связанного с IgG4. AIP хорошо поддается стероидной терапии, но иногда имеет рецидивы [1,2].
Недавно была обнаружена другая гистологическая картина AIP, характеризующаяся протоковой эпителиальной гранулоцитарной инфильтрацией [6,7]. Этот паттерн называется идиопатическим протоковоцентрическим панкреатитом (IDCP) [6]. Клинические особенности пациентов с IDCP отличаются от пациентов с LPSP. Термины AIP типа 1 и типа 2 предлагаются для описания клинических особенностей, связанных с LPSP и IDCP, соответственно [8-11].
Радиологически AIP подразделяется на диффузный тип (тип D) и очаговый тип (тип F) [1-3,12-14].Хотя диффузное увеличение поджелудочной железы довольно специфично для AIP, AIP F-типа следует строго дифференцировать от рака поджелудочной железы. Однако лишь в нескольких исследованиях [13,14] изучались различия между AIP D- и F-типа, и неизвестно, является ли AIP F-типа начальной стадией AIP D-типа или другим типом AIP. Это исследование было направлено на выяснение различий в клинических характеристиках AIP D- и F-типа.
МАТЕРИАЛЫ И МЕТОДЫ
Пациенты, изучаемые
С 1988 по 2010 год, 67 пациентов с ОИП (47 мужчин и 20 женщин; средний возраст: 60 лет.3 года; диапазон: 27-83 года) были диагностированы в соответствии с Азиатскими диагностическими критериями AIP [4] в токийской столичной больнице Комагоме. На основании радиологических данных, полученных с помощью компьютерной томографии и / или магнитно-резонансной томографии, мы разделили пациентов с ОИП на D-тип и F. Далее мы разделили тип F на тип головы (тип H) и тип тела и / или хвоста (тип B / T) в зависимости от места увеличения. Наконец, мы разделили 67 пациентов с ОИП на три группы: тип D, тип H и тип B / T. Пациенты с AIP D-типа показали диффузное увеличение поджелудочной железы (Рисунок -), пациенты H-типа показали очаговое увеличение только головки поджелудочной железы (Рисунок -), а пациенты B / T-типа показали увеличение только тела поджелудочной железы и / или хвост (рисунок а).Мы сравнили клинические, лабораторные, радиологические, функциональные и гистологические данные, а также клиническое течение трех типов AIP.
Компьютерная томография, показывающая аутоиммунный панкреатит диффузного типа. Был замечен отек головы (A), тела (B) и хвоста (C) поджелудочной железы.
Компьютерная томография, показывающая аутоиммунный панкреатит головного типа. Отек только головки поджелудочной железы (A), но тело поджелудочной железы (B) и хвост (C) были нормального размера.
Компьютерная томография, показывающая аутоиммунный панкреатит по типу тела и / или хвоста.Тело и хвост поджелудочной железы опухли (A), но головка поджелудочной железы была в пределах нормального размера (B).
Клинические, радиологические и лабораторные анализы
Клинические оценки включали: возраст на момент постановки диагноза; секс; привычки к употреблению алкоголя и курения; наличие и / или наличие в анамнезе аллергических заболеваний; начальные симптомы, такие как механическая желтуха и боль в животе; и сопутствующие заболевания, такие как сахарный диабет, острый панкреатит и язвенный колит. Привычка к употреблению алкоголя была определена как употребление алкоголя> 80 г / день в течение> 7 лет.Привычка к курению была определена как курение> 20 пач-лет. Сахарный диабет диагностировали, если уровни глюкозы в сыворотке крови натощак и / или уровни гемоглобина A1c были выше нормального уровня (126 мг / дл и 6,1% соответственно) [15]. Острый панкреатит был диагностирован, когда наблюдались как сильная боль в животе, так и повышение уровня амилазы в сыворотке (> 3 раза от нормы; норма: 115 МЕ / л).
Стеноз нижнего желчного протока оценивали с помощью эндоскопической ретроградной холангиопанкреатографии и / или магнитно-резонансной холангиопанкреатографии.Радиологически были оценены три экстрапанкреатических поражения, которые часто связаны с ОИП (склерозирующий холангит прикорневых или внутрипеченочных желчных протоков, отек слюнных желез и забрюшинный фиброз).
Лабораторные данные были оценены, включая уровни сывороточного IgG ( n = 67), IgG4 ( n = 65) и иммуноглобулина E (IgE) ( n = 43), количество периферических эозинофилов ( n = 56) уровни амилазы в сыворотке ( n = 66) и аутоантитела, включая антинуклеарный антиген ( n = 60) и ревматоидный фактор ( n = 58).Уровни IgG4 в сыворотке измеряли нефелометрией с использованием наборов подкласса IgG (BS-NIA). Было использовано общепринятое пороговое значение 135 мг / дл.
Гистологические и иммуногистологические исследования
Поджелудочная железа оценивалась с помощью хирургической резекции ( n = 7), хирургической биопсии или биопсии под контролем УЗИ ( n = 6) и тонкоигольной аспирации под контролем эндоскопического ультразвукового исследования (EUS-FNA , n = 10) и исследовали гистологически и иммуногистохимически с использованием антител анти-CD3, анти-CD20 и анти-IgG4.
Клинический курс
Десяти пациентам первоначально было проведено хирургическое вмешательство при подозрении на рак поджелудочной железы (панкреатодуоденэктомия, n = 6; дистальная панкреатэктомия, n = 1; холедоходуоденостомия с биопсией поджелудочной железы, n = 3). Пятьдесят пациентов, в том числе один хирург, пролеченный пероральными стероидами. Преднизолон в начальной дозе 30-40 мг / сут назначался в течение 2-3 недель. Затем его снижали на 5 мг каждые 1-3 недели до 5 мг / сут. Поддерживающая терапия (2.5-5 мг / сут, 1-3 года) применялась у всех пациентов. Рецидив AIP был определен как повторное появление симптомов с развитием или повторным появлением патологий поджелудочной железы и / или экстрапанкреатических аномалий при визуализирующих исследованиях. Восемь пациентов наблюдались консервативно без стероидной терапии.
Статистический анализ
Различия между группами анализировали с использованием точного вероятностного критерия Фишера и критерия Манна-Уитни U . Значения P были скорректированы методом Бонферрони, а значения P <0.05 считали статистически значимым.
РЕЗУЛЬТАТЫ
Клинические, радиологические и лабораторные различия
Шестьдесят семь пациентов с ОИП были классифицированы на D-тип ( n = 34), H-тип ( n = 19) и B / T-тип ( n = 14) AIP. Между группами не было значительных различий по возрасту, полу, алкоголю, курению и аллергическим заболеваниям в анамнезе. Хотя механическая желтуха часто выявлялась у пациентов с D-типом (88%) и H-типом (68%), ни у одного пациента с типом B / T не было желтухи в качестве начального симптома ( P <0.001). Хотя не было различий в частоте болей в животе, острый панкреатит чаще встречался у пациентов типа B / T (36%), чем у пациентов типа D (3%) ( P = 0,017). Хотя стеноз нижнего желчного протока часто наблюдался у пациентов D-типа (94%) и H-типа (95%), ни у одного пациента типа B / T не было стеноза нижнего желчного протока ( P <0,001). Не было различий между группами по ассоциированным экстрапанкреатическим поражениям (таблица).
Таблица 1
Клинические и рентгенологические данные трех типов аутоиммунного панкреатита
| Тип D, n = 34 | H тип, n = 19 | B / Тип T, n = 14 | Значение P , D против H | P значение, D против B / T | P значение, H против B / T | |
| Средний возраст (лет) (квартильный диапазон) | 67.5 (59-71,5) | 64,0 (56-71) | 61,5 (50,3-72,5) | > 0,99 | > 0,99 | > 0,99 |
| Мужской / женский | 24/10 | 15 / 4 | 8/6 | > 0,99 | > 0,99 | > 0,99 |
| Привычка к употреблению алкоголя +/- (%) | 4/27 (15) | 4/15 (21) | 2 / 12 (14) | > 0,99 | > 0,99 | > 0,99 |
| Привычка к курению +/- (%) | 16/27 (59) | 12/16 (75) | 5/13 ( 39) | > 0.99 | > 0,99 | 0,198 |
| Аллергия +/- (%) | 8/25 (32) | 6/18 (33) | 7/13 (54) | > 0,99 | 0,885 | 0,879 |
| Желтуха +/- (%) | 30/4 (88) | 13/6 (68) | 0/14 (0) | 0,420 | <0,001 | <0,001 |
| Боль в животе +/- (%) | 6/28 (18) | 7/13 (37) | 5/9 (36) | 0.546 | 0,771 | > 0,999 |
| Диабет +/- (%) | 10/24 (29) | 11/8 (58) | 4/10 (29) | 0,231 | > 0,999 | > 0,999 |
| Острый панкреатит +/- (%) | 1/33 (3) | 1/18 (5) | 5/9 (36) | > 0,999 | 0,017 | 0,183 |
| Язвенный колит +/- (%) | 1/33 (3) | 0/19 (0) | 1/13 (7) | > 0.999 | > 0,999 | > 0,999 |
| Стеноз нижнего мерзкого протока +/- (%) | 32/34 (94) | 18/19 (95) | 0/14 (0) | > 0,999 | <0,001 | <0,001 |
| Экстрапанкреатические поражения +/- (%) | 13/21 (38) | 6/13 (32) | 5/9 (36) | > 0,999 | > 0,999 | > 0,999 |
Уровни сывороточного IgG4 были значительно выше у пациентов D-типа (медиана: 309 мг / дл), чем у пациентов B / T-типа (133.5 мг / дл) пациентов ( P = 0,042). Уровни сывороточного IgG4 были чаще повышены у пациентов D-типа (88%), чем у пациентов B / T-типа (50%) ( P = 0,030). Не было значительных различий в уровнях сывороточного IgE и количестве периферических эозинофилов между группами. Уровни амилазы в сыворотке у пациентов B / T-типа (медиана: 114 МЕ / л) были значительно выше, чем у пациентов H-типа (72 МЕ / л) ( P = 0,049). По соотношению антинуклеарного антигена и ревматоидного фактора различий между группами не было (таблица).
Таблица 2
Лабораторные данные трех типов аутоиммунного панкреатита
| тип D, n = 34 | тип H, n = 19 | тип B / T , n = 14 | P значение, D vs H | P значение, D vs B / T | P значение, H vs B / T | |
| Медиана IgG, мг / дл | 2163.5 (1637,5-2682,8) | 1920 (1398,5-2300) | 1619 (1369,5-2364,5) | 0,642 | > 0,999 | > 0,999 |
| (квартильный диапазон) | ||||||
| 309 (181-1015) | 351 (228-780) | 133,5 (60,8-326,5) | > 0,999 | 0,042 | 0,057 | |
| (квартильный диапазон) | 28/32 (88) | 16/19 (84) | 7/14 (50) | > 0.999 | 0,030 | 0,168 |
| Медиана IgE, МЕ / л | 406,9 (265,5-877) | 249,0 (74,75-589,75) | 264,0 (134,1-856) | 4 0,447> | 4 0,447 > 0,999 | |
| (квартильный диапазон) | ||||||
| IgE> 580, (МЕ / л) (%) | 8/20 (40,0) | 3/12 (25,0) | 4/11 (36,4) | > 0,999 | > 0,999 | > 0,999 |
| Медиана эозинофилов, мкл | 180 (72-440) | 238.5 (152,5-447,75) | 473 (114,5-621,5) | > 0,999 | 0,354 | > 0,999 |
| (квартильный диапазон) | ||||||
| Эозинофилы> 600 / мкл 13 (%) 3/3 | 32 90 (11) | 2/16 (13) | 3/13 (23) | > 0,999 | > 0,999 | > 0,999 |
| Медиана амилазы (МЕ / л) | 86 (49,5-119,5) | 72 (43-100) | 114 (73,3-589,3) | > 0.999 | > 0,999 | 0,049 |
| (квартильный диапазон) | ||||||
| Амилаза> 115 (МЕ / л) (%) | 8/33 (24) | 4/19 (21) | 7 / 14 (50) | > 0,999 | 0,300 | 0,408 |
| Положительный антинуклеарный антиген (%) | 14/29 (48) | 4/18 (22) | 6/13 (46) | 0,366 | > 0,999 | 0,738 |
| Положительный ревматоидный фактор (%) | 10/28 (36) | 2/17 (12) | 1/13 (7) | 0.288 | 0,378 | > 0,999 |
Гистологические и иммуногистохимические исследования
LPSP был гистологически подтвержден с обильной инфильтрацией CD3-положительных Т-лимфоцитов и IgG4-положительных плазматических клеток в 6 D-типе, 7 H-типе и 4 Пациенты типа B / T. В поджелудочной железе 2 пациентов B / T-типа (1 образец хирургической биопсии и 1 образец EUS-FNA) были обнаружены выраженный фиброз и обильная инфильтрация CD20-положительных В-лимфоцитов, а не Т-лимфоцитов, но мало IgG4-положительных плазматических клеток или нейтрофилы обнаружены.IDCP не наблюдался ни у одного пациента. EUS-FNA у 4 пациентов с ОИП не смог подтвердить гистологический диагноз из-за недостаточного количества образцов (таблица).
Таблица 3
Гистологические данные поджелудочной железы при трех типах аутоиммунного панкреатита
| D тип | H тип | B / T тип | LPSP ( n = 3) | LPSP ( n = 3) | LPSP ( n = 1) |
| Биопсия | LPSP ( n = 2) | LPSP ( n = 3) | Фиброз с обильной инфильтрацией В-лимфоцитов ( n = 1) |
| EUS-FNA | LPSP ( n = 1) | LPSP ( n = 1) | ( n = 3) |
| Несоответствующий материал ( n = 1) | Несоответствующий материал ( n = 2) | Фиброз с обильной инфильтрацией B-лимфоцитов ( n = 1) | 9 0175|
| Несоответствующий материал ( n = 1) |
Клинический курс
Стероидная терапия была эффективной у всех 50 пациентов (31 тип D, 13 H тип и 6 B / T тип).AIP рецидивировал во время постепенного снижения дозы или после прекращения приема стероидов у 3 пациентов D-типа и 3-х пациентов H-типа. У 8 пациентов, находящихся под консервативным наблюдением (1 тип H и 7 тип B / T), рентгенологические характеристики не изменились у семи пациентов, но увеличение хвоста поджелудочной железы улучшилось естественным образом у 1 пациента с типом B / T. В течение курса, предшествовавшего нашей госпитализации, очаговое увеличение головки поджелудочной железы развилось до диффузного увеличения в трех случаях, а очаговое увеличение хвоста поджелудочной железы развилось до диффузного увеличения в одном случае.
ОБСУЖДЕНИЕ
Радиологически AIP подразделяется на диффузные и очаговые формы. Диффузное увеличение поджелудочной железы, называемое колбасоподобным увеличением, является типичным признаком AIP. Однако AIP F-типа, иногда образующий массу, часто трудно отличить от рака поджелудочной железы [1-3,12-14]. Возможные различия в клинических проявлениях между типами D и F AIP неясны.
В настоящем исследовании мы классифицировали 67 пациентов с ОИП на тип D ( n = 34), тип H ( n = 19) и тип B / T ( n = 14).Типы D и H показали сходные клинические особенности. Однако тип B / T отличался от типов D и H в нескольких аспектах. Механическая желтуха и стеноз нижнего желчного протока часто выявлялись у пациентов с типом D и H, но ни у одного пациента с типом B / T эти особенности не наблюдались. По данным Ghazale et al [16], стеноз нижнего желчного протока имел место у 70% из 53 пациентов с ОИП. Хирано и др. [17] заявили, что как отек поджелудочной железы из-за воспаления головки поджелудочной железы, так и утолщение стенки желчных протоков влияют на стеноз нижнего желчного протока при AIP, на основании результатов EUS и того факта, что 93% случаев AIP с положительным поражением головки поджелудочной железы у пациентов был стеноз нижнего желчного протока, по сравнению только с 17% пациентов с отрицательным поражением.
В этом исследовании уровень сывороточного IgG4 был значительно ниже у пациентов B / T-типа, чем у пациентов с D-типом, а повышение уровня сывороточного IgG4 было меньше у пациентов с B / T-типом, чем у пациентов с D-типом. Острый панкреатит чаще наблюдался у пациентов B / T-типа, чем у пациентов с D-типом, а уровни амилазы в сыворотке крови были значительно выше у пациентов с B / T-типом, чем у пациентов с H-типом. Что касается диагноза и частоты острого панкреатита, высокий процент пациентов с типом B / T, по-видимому, в основном зависит от более высоких уровней амилазы.Острый панкреатит или некоторые острые воспалительные приступы в случаях хронического панкреатита могут не быть связаны с высокими уровнями амилазы из-за атрофической ацинарной ткани. Не было разницы в частоте болей в животе, поэтому некоторые случаи D-типа и H-типа могли быть упущены.
Ни у одного из пациентов типа B / T не рецидивов после стероидной терапии, по сравнению с 10% пациентов D-типа и 23% пациентов H-типа. Стало ясно, что существует два гистологических подтипа (LPSP и IDCP) в AIP [6-11].Большинство пациентов с AIP в Азии имеют LPSP, а половина пациентов с AIP в Европе имеют IDCP [8,10]. Клинические признаки этих двух подтипов существенно различаются. Как правило, сообщается, что пациенты с IDCP моложе на момент постановки диагноза, а пациенты с IDCP с меньшей вероятностью демонстрируют повышенные уровни IgG4 в сыворотке. IDCP чаще ассоциируется с острым панкреатитом и воспалительным заболеванием кишечника. Согласно сравнительному исследованию пациентов с LPSP и IDCP, проведенным Sah et al [9], пациенты с IDCP, как правило, имели больше очаговых особенностей, чем LPSP (84% против 60%), и рецидивов IDCP не наблюдалось ни у одного пациента, тогда как LPSP рецидивировал у 47% пациентов.Для диагностики IDCP необходимо гистологическое исследование адекватного образца поджелудочной железы, а необходимость гистологического исследования для диагностики IDCP в настоящее время затрудняет клиническую диагностику.
При гистологическом исследовании данных случаев LPSP был подтвержден у 17, но IDCP не был обнаружен. Клинические файлы AIP D-типа и H-типа были совместимы с файлами пациентов с LPSP. Однако, учитывая низкие уровни IgG4 в сыворотке и частую связь с острым панкреатитом, существует вероятность того, что некоторые случаи IDCP могут быть вовлечены в случаи B / T-типа.Например, 32-летний мужчина с AIP B / T типа показал нормальные уровни IgG4 в сыворотке, ассоциацию с язвенным колитом и хорошую чувствительность к стероидной терапии, но гистологический диагноз с помощью EUS-FNA не мог быть подтвержден из-за недостаточного образец биопсии. Интересно, что гистология двух пациентов B / T-типа включала обильную инфильтрацию B-клеток с небольшой инфильтрацией IgG4-положительных клеток или нейтрофилов, которые могли быть другим типом AIP, отличным от LPSP и IDCP. AIP B / T-типа может включать заболевание, отличное от LPSP.
Три пациента с типом H и один пациент с типом B / T перешли в тип D в течение естественного течения. Также сообщалось, что AIP H-типа переходит в D-тип [18,19], а AIP B / T-типа – в D-тип [20]. Также были сообщения о рецидивах в остаточной поджелудочной железе после резекции, таких как рецидив в остаточной головке поджелудочной железы через 1 год после дистальной панкреатэктомии [21] и рецидив в остаточной части поджелудочной железы и хвосте через 4 мес после панкреатодуоденэктомии [22]. Стероидная терапия была эффективной при прогрессировании или рецидиве поражений.Эти данные показывают, что очаговое воспаление может прогрессировать до последующих диффузных изменений по всей поджелудочной железе или развиваться повторно в разных местах и в разное время у некоторых пациентов с ОИП. Диффузное изменение поджелудочной железы может быть окончательным проявлением AIP, и то, влияет ли этот воспалительный процесс на железу диффузно или очагово, может просто отражать стадию заболевания. Из семи консервативно наблюдаемых пациентов типа B / T у шести не было никаких изменений, а у одного улучшилось естественным образом. Kubota и др. [23] сообщили, что у всех восьми пациентов с ОИП, у которых спонтанно улучшилось состояние, наблюдалось очаговое увеличение поджелудочной железы.AIP B / T-типа может включать заболевание, отличное от AIP D-типа и H.
В заключение, хотя клинические признаки AIP H-типа аналогичны клиническим характеристикам AIP D-типа, AIP B / T-типа в нескольких аспектах отличается от типов D и H. AIP B / T-типа может включать заболевание, отличное от LPSP.
КОММЕНТАРИИ
Предпосылки
Аутоиммунный панкреатит (АИП) – это особый тип панкреатита, который, как считается, имеет аутоиммунную этиологию. Недавно AIP был радиологически классифицирован на диффузный тип (тип D) и очаговый тип (тип F).Однако различия между AIP D- и F-типа малоизвестны.
Границы исследований
Были исследованы различия в клинических, радиологических, лабораторных и гистологических данных между AIP D- и F-типа.
Инновации и прорывы
Пациенты с ОИП были разделены на тип D и тип F. Кроме того, тип F был разделен на тип головы (тип H) и тип корпуса и / или хвоста (тип B / T). Ни у одного пациента типа B / T не была желтуха как начальный симптом, но острый панкреатит чаще ассоциировался с типом B / T, чем с типом D.Уровни амилазы в сыворотке были значительно выше у пациентов B / T-типа, чем у пациентов H-типа. Уровни сывороточного иммуноглобулина G (IgG) 4 были значительно выше у пациентов D-типа, чем у пациентов B / T-типа. Ни у одного из пациентов типа B / T после стероидной терапии не наблюдалось рецидива, по сравнению с 10% пациентов D-типа и 23% пациентов H-типа. У двух пациентов B / T-типа наблюдалась обильная инфильтрация B-клеток с небольшой инфильтрацией IgG4-положительных клеток или нейтрофилов.
Приложения
AIP B / T-типа отличается по нескольким аспектам от типов D и H, и некоторые AIP B / T-типа могут быть связаны с заболеванием, отличным от лимфоплазмоцитарного склерозирующего панкреатита.
Рецензирование
Само исследование кажется разумным, а результаты интересны и имеют этиологическое значение.
Сноски
При поддержке Исследовательского комитета по трудноизлечимым заболеваниям поджелудочной железы (главный исследователь; Тору Симосегава), предоставлены Министерством здравоохранения, труда и социального обеспечения Японии
Рецензенты: Сёитиро Суми, доктор медицины, доктор философии, младший профессор, Отделение реконструкции органов, Институт пограничных медицинских наук, Университет Киото, Сакё-ку, Киото 606-8507, Япония; Ацуши Масамунэ, доктор медицины, доктор философии, отделение гастроэнтерологии, Высшая школа медицины Университета Тохоку, 1-1 Сейрё-мати, Аоба-ку, Сендай 980-8574, Япония
S- редактор Lv S L- редактор Kerr C. E- редактор Li JY
Ссылки
1.Окадзаки К., Кава С., Камисава Т., Ито Т., Инуи К., Ирие Х, Ирисава А., Кубо К., Нотохара К., Хасебе О. и др. Японские клинические рекомендации по аутоиммунному панкреатиту. Поджелудочная железа. 2009; 38: 849–866. [PubMed] [Google Scholar] 2. Чари С.Т., Такахаши Н., Леви М.Дж., Смирк Т.К., Клейн Д.Е., Пирсон Р.К., Петерсен Б.Т., Топазиан М.А., Веге С.С. Диагностическая стратегия, позволяющая отличить аутоиммунный панкреатит от рака поджелудочной железы. Clin Gastroenterol Hepatol. 2009; 7: 1097–1103. [PubMed] [Google Scholar] 3. Камисава Т., Такума К., Эгава Н., Цурута К., Сасаки Т.Аутоиммунный панкреатит и склерозирующая болезнь, связанная с IgG4. Нат Рев Гастроэнтерол Гепатол. 2010; 7: 401–409. [PubMed] [Google Scholar] 4. Otsuki M, Chung JB, Okazaki K, Kim MH, Kamisawa T., Kawa S., Park SW, Shimosegawa T., Lee K, Ito T. и др. Азиатские диагностические критерии аутоиммунного панкреатита: консенсус Японско-корейского симпозиума по аутоиммунному панкреатиту. J Gastroenterol. 2008; 43: 403–408. [PubMed] [Google Scholar] 5. Кавагути К., Койке М., Цурута К., Окамото А., Табата И., Фудзита Н. Лимфоплазмоцитарный склерозирующий панкреатит с холангитом: вариант первичного склерозирующего холангита с обширным поражением поджелудочной железы.Hum Pathol. 1991; 22: 387–395. [PubMed] [Google Scholar] 6. Нотохара К., Бургарт Л.Дж., Ядав Д., Чари С., Смирк ТЦ. Идиопатический хронический панкреатит с перидуктальной лимфоплазмоцитарной инфильтрацией: клинико-патологические особенности 35 случаев. Am J Surg Pathol. 2003. 27: 1119–1127. [PubMed] [Google Scholar] 7. Zamboni G, Lüttges J, Capelli P, Frulloni L, Cavallini G, Pederzoli P, Leins A, Longnecker D, Klöppel G. Гистопатологические особенности диагностической и клинической значимости аутоиммунного панкреатита: исследование на 53 образцах резекции и 9 образцах биопсии.Арка Вирхова. 2004. 445: 552–563. [PubMed] [Google Scholar] 8. Park DH, Kim MH, Chari ST. Последние достижения в области аутоиммунного панкреатита. Кишечник. 2009. 58: 1680–1689. [PubMed] [Google Scholar] 9. Сах Р.П., Чари С.Т., Паннала Р., Сугумар А., Клэйн Дж.Э., Леви М.Дж., Пирсон Р.К., Смирк Т.С., Петерсен Б.Т., Топазиан М.Д. и др. Различия в клиническом профиле и частоте рецидивов аутоиммунного панкреатита 1 типа и 2 типа. Гастроэнтерология. 2010; 139: 140–148; викторина 140-148. [PubMed] [Google Scholar] 10. Камисава Т., Нотохара К., Симосегава Т.Два клинико-патологических подтипа аутоиммунного панкреатита: LPSP и IDCP. Гастроэнтерология. 2010; 139: 22–25. [PubMed] [Google Scholar] 11. Chari ST, Kloeppel G, Zhang L, Notohara K, Lerch MM, Shimosegawa T. Гистопатологические и клинические подтипы аутоиммунного панкреатита: согласованный документ гонолулу. Панкреатология. 2010. 10: 664–672. [PubMed] [Google Scholar] 12. Ирие Х, Хонда Х, Баба С., Куроива Т., Йошимицу К., Таджима Т., Джими М., Суми Т., Масуда К. Аутоиммунный панкреатит: характеристики КТ и МРТ.AJR Am J Roentgenol. 1998; 170: 1323–1327. [PubMed] [Google Scholar] 13. Wakabayashi T, Kawaura Y, Satomura Y, Fujii T., Motoo Y, Okai T., Sawabu N. Клиническое исследование хронического панкреатита с очаговым нерегулярным сужением главного протока поджелудочной железы и образованием массы: сравнение с хроническим панкреатитом, показывающим диффузное нерегулярное сужение основного протока. проток поджелудочной железы. Поджелудочная железа. 2002. 25: 283–289. [PubMed] [Google Scholar] 14. Фруллони Л., Скаттолини С., Фалькони М., Замбони Дж., Капелли П., Манфреди Р., Грациани Р., Д’Онофрио М., Кацотурчи А.М., Амодио А. и др.Аутоиммунный панкреатит: различия очаговой и диффузной форм у 87 больных. Am J Gastroenterol. 2009. 104: 2288–2294. [PubMed] [Google Scholar] 16. Ghazale A, Chari ST, Zhang L, Smyrk TC, Takahashi N, Levy MJ, Topazian MD, Clain JE, Pearson RK, Petersen BT и др. Иммуноглобулин G4-ассоциированный холангит: клинический профиль и ответ на терапию. Гастроэнтерология. 2008. 134: 706–715. [PubMed] [Google Scholar] 17. Хирано К., Тада М., Исаяма Х, Ямамото К., Мизуно С., Ягиока Х, Яшима Й, Сасаки Т, Когуре Х, Тогава О и др.Эндоскопическая оценка факторов, способствующих возникновению стриктуры интрапанкреатических желчевыводящих путей при аутоиммунном панкреатите. Gastrointest Endosc. 2010; 71: 85–90. [PubMed] [Google Scholar] 18. Horiuchi A, Kawa S, Akamatsu T., Aoki Y, Mukawa K, Furuya N, Ochi Y, Kiyosawa K. Характерный внешний вид протока поджелудочной железы при аутоиммунном хроническом панкреатите: отчет о болезни и обзор японской литературы. Am J Gastroenterol. 1998. 93: 260–263. [PubMed] [Google Scholar] 19. Кога Й, Ямагути К., Сугитани А., Чидзива К., Танака М.Аутоиммунный панкреатит, начинающийся как локализованная форма. J Gastroenterol. 2002. 37: 133–137. [PubMed] [Google Scholar] 20. Wakabayashi T, Kawaura Y, Satomura Y, Watanabe H, Motoo Y, Sawabu N. Долгосрочный прогноз хронического панкреатита с сужением протока: стратегия лечения стероидами. Поджелудочная железа. 2005; 30: 31–39. [PubMed] [Google Scholar] 21. Motoo Y, Minamoto T., Watanabe H, Sakai J, Okai T., Sawabu N. Склерозирующий панкреатит, демонстрирующий быстро прогрессирующие изменения с периодическим формированием массы. Int J Pancreatol.1997; 21: 85–90. [PubMed] [Google Scholar] 22. Бланк А, Мэйбоди М, Исом-Батц Дж, Рослин М, Диллон Э. Острый некротический панкреатит, вызванный Salmonella typhimurium. Dig Dis Sci. 2003. 48: 1472–1474. [PubMed] [Google Scholar] 23. Kubota K, Iida H, Fujisawa T., Ogawa M, Inamori M, Saito S, Kakuta Y, Oshiro H, Nakajima A. Клиническое значение опухшего дуоденального сосочка при аутоиммунном панкреатите. Поджелудочная железа. 2007; 35: e51 – e60. [PubMed] [Google Scholar]Различия между диффузным и очаговым аутоиммунным панкреатитом
World J Gastroenterol.2012 7 мая; 18 (17): 2099–2104.
Таку Табата, Теруми Камисава, Кенсуке Такума, Сэйити Хара, Савако Курума, Ёсихико Инаба, отделение внутренней медицины, Токийская столичная больница Комагоме, 3-18-22 Хонкомагоме, Бункё-ку, Токио 113-8677, Япония
Авторский вклад : Табата Т. и Камисава Т. внесли равный вклад в эту работу, проанализировали данные и написали рукопись; Данные собирали Такума К., Хара С., Курума С. и Инаба Ю.Для корреспонденции: Теруми Камисава, доктор медицинских наук, отделение внутренней медицины, Токийская столичная больница Комагоме, 3-18-22 Хонкомагоме, Бункё-ку, Токио 113-8677, Япония.pj.kcic@awasimak
Телефон: + 81-3-38232101 Факс: + 81-3-38241552
Получено 31 мая 2011 г .; Пересмотрено 19 августа 2011 г .; Принято 27 августа 2011 г.
Copyright © 2012 Baishideng Publishing Group Co., Limited. Все права защищены.Эта статья цитировалась в других статьях в PMC.Abstract
ЦЕЛЬ: изучить различия в клинических характеристиках диффузного и очагового аутоиммунного панкреатита (AIP).
МЕТОДЫ. На основании радиологических данных, полученных с помощью компьютерной томографии и / или магнитно-резонансной томографии, мы разделили 67 пациентов с ОИП на диффузный тип (тип D) и очаговый тип (тип F).Далее мы разделили тип F на тип головы (тип H) и тип тела и / или хвоста (тип B / T) в зависимости от места увеличения. Наконец, мы разделили 67 пациентов с ОИП на три группы: тип D, тип H и тип B / T. Мы сравнили три типа AIP с точки зрения клинических, лабораторных, радиологических, функциональных и гистологических данных и клинического течения.
РЕЗУЛЬТАТЫ: 34 пациента с D-типом, 19 с H-типом и 14 с B / T-типом AIP. Хотя механическая желтуха часто выявлялась у пациентов D-типа (88%) и пациентов H-типа (68%), ни у одного из пациентов типа B / T не было желтухи в качестве начального симптома ( P <0.001). Не было различий в частоте боли в животе, но острый панкреатит чаще ассоциировался у пациентов типа B / T (36%), чем у пациентов типа D (3%) ( P = 0,017). Уровни сывороточного иммуноглобулина G (IgG) 4 были значительно выше у пациентов D-типа (медиана 309 мг / дл), чем у пациентов B / T-типа (133,5 мг / дл) ( P = 0,042). Уровни амилазы в сыворотке крови у пациентов с B / T-типом (медиана: 114 МЕ / л) были значительно выше, чем у пациентов с H-типом (72 МЕ / л) ( P = 0.049). Лимфоплазмоцитарный склерозирующий панкреатит (LPSP) был гистологически подтвержден у 6 пациентов D-типа, 7 H-типа и 4 B / T-типов; идиопатический протоковоцентрический панкреатит не наблюдался ни у одного пациента. Выраженный фиброз и обильная инфильтрация CD20-положительных B-лимфоцитов небольшим количеством IgG4-положительных плазматических клеток были обнаружены у 2 пациентов B / T-типа. Стероидная терапия была эффективной у всех 50 пациентов (31 тип D, 13 тип H и 6 тип B / T). Хотя AIP рецидивировал во время постепенного снижения дозы или после отмены стероидов у 3 пациентов D-типа и 3 H-типа, ни у одного пациента не было рецидивов B / T.В ходе последующего наблюдения рентгенологические характеристики 6 пациентов с типом B / T не изменились, а у 1 пациента с типом B / T улучшилось естественное улучшение.
ЗАКЛЮЧЕНИЕ: Клинические признаки AIP H-типа были аналогичны таковым у D-типа, но B / T-тип отличался от D и H. B / T-тип может включать другие заболевания, кроме LPSP.
Ключевые слова: Аутоиммунный панкреатит, иммуноглобулин G 4, лимфоплазмоцитарный склерозирующий панкреатит
ВВЕДЕНИЕ
Аутоиммунный панкреатит (AIP) – это тип панкреатита, который, как считается, имеет аутоиммунную этиологию.AIP резко реагирует на стероидную терапию, поэтому дифференцировать AIP от рака поджелудочной железы важно, чтобы избежать ненужной резекции поджелудочной железы [1-3]. Согласно Азиатским диагностическим критериям AIP [4], AIP диагностируется по следующим признакам: диффузное или очаговое увеличение поджелудочной железы и сужение главного протока поджелудочной железы; повышенный уровень сывороточного иммуноглобулина G (IgG) или IgG4 или присутствие аутоантител в сыворотке; гистологические данные о лимфоплазмоцитарной инфильтрации и фиброзе поджелудочной железы [лимфоплазмоцитарный склерозирующий панкреатит (LPSP) [5]]; и отзывчивость на стероиды.АИП часто встречается у пожилых мужчин. Первичный начальный симптом – механическая желтуха, а сахарный диабет встречается у половины пациентов. AIP редко ассоциируется с острым панкреатитом или язвенным колитом. AIP связан с несколькими склерозирующими экстрапанкреатическими поражениями, такими как склерозирующий холангит, склерозирующий сиаладенит и забрюшинный фиброз, и в настоящее время считается поражением поджелудочной железы системного заболевания, связанного с IgG4. AIP хорошо поддается стероидной терапии, но иногда имеет рецидивы [1,2].
Недавно была обнаружена другая гистологическая картина AIP, характеризующаяся протоковой эпителиальной гранулоцитарной инфильтрацией [6,7]. Этот паттерн называется идиопатическим протоковоцентрическим панкреатитом (IDCP) [6]. Клинические особенности пациентов с IDCP отличаются от пациентов с LPSP. Термины AIP типа 1 и типа 2 предлагаются для описания клинических особенностей, связанных с LPSP и IDCP, соответственно [8-11].
Радиологически AIP подразделяется на диффузный тип (тип D) и очаговый тип (тип F) [1-3,12-14].Хотя диффузное увеличение поджелудочной железы довольно специфично для AIP, AIP F-типа следует строго дифференцировать от рака поджелудочной железы. Однако лишь в нескольких исследованиях [13,14] изучались различия между AIP D- и F-типа, и неизвестно, является ли AIP F-типа начальной стадией AIP D-типа или другим типом AIP. Это исследование было направлено на выяснение различий в клинических характеристиках AIP D- и F-типа.
МАТЕРИАЛЫ И МЕТОДЫ
Пациенты, изучаемые
С 1988 по 2010 год, 67 пациентов с ОИП (47 мужчин и 20 женщин; средний возраст: 60 лет.3 года; диапазон: 27-83 года) были диагностированы в соответствии с Азиатскими диагностическими критериями AIP [4] в токийской столичной больнице Комагоме. На основании радиологических данных, полученных с помощью компьютерной томографии и / или магнитно-резонансной томографии, мы разделили пациентов с ОИП на D-тип и F. Далее мы разделили тип F на тип головы (тип H) и тип тела и / или хвоста (тип B / T) в зависимости от места увеличения. Наконец, мы разделили 67 пациентов с ОИП на три группы: тип D, тип H и тип B / T. Пациенты с AIP D-типа показали диффузное увеличение поджелудочной железы (Рисунок -), пациенты H-типа показали очаговое увеличение только головки поджелудочной железы (Рисунок -), а пациенты B / T-типа показали увеличение только тела поджелудочной железы и / или хвост (рисунок а).Мы сравнили клинические, лабораторные, радиологические, функциональные и гистологические данные, а также клиническое течение трех типов AIP.
Компьютерная томография, показывающая аутоиммунный панкреатит диффузного типа. Был замечен отек головы (A), тела (B) и хвоста (C) поджелудочной железы.
Компьютерная томография, показывающая аутоиммунный панкреатит головного типа. Отек только головки поджелудочной железы (A), но тело поджелудочной железы (B) и хвост (C) были нормального размера.
Компьютерная томография, показывающая аутоиммунный панкреатит по типу тела и / или хвоста.Тело и хвост поджелудочной железы опухли (A), но головка поджелудочной железы была в пределах нормального размера (B).
Клинические, радиологические и лабораторные анализы
Клинические оценки включали: возраст на момент постановки диагноза; секс; привычки к употреблению алкоголя и курения; наличие и / или наличие в анамнезе аллергических заболеваний; начальные симптомы, такие как механическая желтуха и боль в животе; и сопутствующие заболевания, такие как сахарный диабет, острый панкреатит и язвенный колит. Привычка к употреблению алкоголя была определена как употребление алкоголя> 80 г / день в течение> 7 лет.Привычка к курению была определена как курение> 20 пач-лет. Сахарный диабет диагностировали, если уровни глюкозы в сыворотке крови натощак и / или уровни гемоглобина A1c были выше нормального уровня (126 мг / дл и 6,1% соответственно) [15]. Острый панкреатит был диагностирован, когда наблюдались как сильная боль в животе, так и повышение уровня амилазы в сыворотке (> 3 раза от нормы; норма: 115 МЕ / л).
Стеноз нижнего желчного протока оценивали с помощью эндоскопической ретроградной холангиопанкреатографии и / или магнитно-резонансной холангиопанкреатографии.Радиологически были оценены три экстрапанкреатических поражения, которые часто связаны с ОИП (склерозирующий холангит прикорневых или внутрипеченочных желчных протоков, отек слюнных желез и забрюшинный фиброз).
Лабораторные данные были оценены, включая уровни сывороточного IgG ( n = 67), IgG4 ( n = 65) и иммуноглобулина E (IgE) ( n = 43), количество периферических эозинофилов ( n = 56) уровни амилазы в сыворотке ( n = 66) и аутоантитела, включая антинуклеарный антиген ( n = 60) и ревматоидный фактор ( n = 58).Уровни IgG4 в сыворотке измеряли нефелометрией с использованием наборов подкласса IgG (BS-NIA). Было использовано общепринятое пороговое значение 135 мг / дл.
Гистологические и иммуногистологические исследования
Поджелудочная железа оценивалась с помощью хирургической резекции ( n = 7), хирургической биопсии или биопсии под контролем УЗИ ( n = 6) и тонкоигольной аспирации под контролем эндоскопического ультразвукового исследования (EUS-FNA , n = 10) и исследовали гистологически и иммуногистохимически с использованием антител анти-CD3, анти-CD20 и анти-IgG4.
Клинический курс
Десяти пациентам первоначально было проведено хирургическое вмешательство при подозрении на рак поджелудочной железы (панкреатодуоденэктомия, n = 6; дистальная панкреатэктомия, n = 1; холедоходуоденостомия с биопсией поджелудочной железы, n = 3). Пятьдесят пациентов, в том числе один хирург, пролеченный пероральными стероидами. Преднизолон в начальной дозе 30-40 мг / сут назначался в течение 2-3 недель. Затем его снижали на 5 мг каждые 1-3 недели до 5 мг / сут. Поддерживающая терапия (2.5-5 мг / сут, 1-3 года) применялась у всех пациентов. Рецидив AIP был определен как повторное появление симптомов с развитием или повторным появлением патологий поджелудочной железы и / или экстрапанкреатических аномалий при визуализирующих исследованиях. Восемь пациентов наблюдались консервативно без стероидной терапии.
Статистический анализ
Различия между группами анализировали с использованием точного вероятностного критерия Фишера и критерия Манна-Уитни U . Значения P были скорректированы методом Бонферрони, а значения P <0.05 считали статистически значимым.
РЕЗУЛЬТАТЫ
Клинические, радиологические и лабораторные различия
Шестьдесят семь пациентов с ОИП были классифицированы на D-тип ( n = 34), H-тип ( n = 19) и B / T-тип ( n = 14) AIP. Между группами не было значительных различий по возрасту, полу, алкоголю, курению и аллергическим заболеваниям в анамнезе. Хотя механическая желтуха часто выявлялась у пациентов с D-типом (88%) и H-типом (68%), ни у одного пациента с типом B / T не было желтухи в качестве начального симптома ( P <0.001). Хотя не было различий в частоте болей в животе, острый панкреатит чаще встречался у пациентов типа B / T (36%), чем у пациентов типа D (3%) ( P = 0,017). Хотя стеноз нижнего желчного протока часто наблюдался у пациентов D-типа (94%) и H-типа (95%), ни у одного пациента типа B / T не было стеноза нижнего желчного протока ( P <0,001). Не было различий между группами по ассоциированным экстрапанкреатическим поражениям (таблица).
Таблица 1
Клинические и рентгенологические данные трех типов аутоиммунного панкреатита
| Тип D, n = 34 | H тип, n = 19 | B / Тип T, n = 14 | Значение P , D против H | P значение, D против B / T | P значение, H против B / T | |
| Средний возраст (лет) (квартильный диапазон) | 67.5 (59-71,5) | 64,0 (56-71) | 61,5 (50,3-72,5) | > 0,99 | > 0,99 | > 0,99 |
| Мужской / женский | 24/10 | 15 / 4 | 8/6 | > 0,99 | > 0,99 | > 0,99 |
| Привычка к употреблению алкоголя +/- (%) | 4/27 (15) | 4/15 (21) | 2 / 12 (14) | > 0,99 | > 0,99 | > 0,99 |
| Привычка к курению +/- (%) | 16/27 (59) | 12/16 (75) | 5/13 ( 39) | > 0.99 | > 0,99 | 0,198 |
| Аллергия +/- (%) | 8/25 (32) | 6/18 (33) | 7/13 (54) | > 0,99 | 0,885 | 0,879 |
| Желтуха +/- (%) | 30/4 (88) | 13/6 (68) | 0/14 (0) | 0,420 | <0,001 | <0,001 |
| Боль в животе +/- (%) | 6/28 (18) | 7/13 (37) | 5/9 (36) | 0.546 | 0,771 | > 0,999 |
| Диабет +/- (%) | 10/24 (29) | 11/8 (58) | 4/10 (29) | 0,231 | > 0,999 | > 0,999 |
| Острый панкреатит +/- (%) | 1/33 (3) | 1/18 (5) | 5/9 (36) | > 0,999 | 0,017 | 0,183 |
| Язвенный колит +/- (%) | 1/33 (3) | 0/19 (0) | 1/13 (7) | > 0.999 | > 0,999 | > 0,999 |
| Стеноз нижнего мерзкого протока +/- (%) | 32/34 (94) | 18/19 (95) | 0/14 (0) | > 0,999 | <0,001 | <0,001 |
| Экстрапанкреатические поражения +/- (%) | 13/21 (38) | 6/13 (32) | 5/9 (36) | > 0,999 | > 0,999 | > 0,999 |
Уровни сывороточного IgG4 были значительно выше у пациентов D-типа (медиана: 309 мг / дл), чем у пациентов B / T-типа (133.5 мг / дл) пациентов ( P = 0,042). Уровни сывороточного IgG4 были чаще повышены у пациентов D-типа (88%), чем у пациентов B / T-типа (50%) ( P = 0,030). Не было значительных различий в уровнях сывороточного IgE и количестве периферических эозинофилов между группами. Уровни амилазы в сыворотке у пациентов B / T-типа (медиана: 114 МЕ / л) были значительно выше, чем у пациентов H-типа (72 МЕ / л) ( P = 0,049). По соотношению антинуклеарного антигена и ревматоидного фактора различий между группами не было (таблица).
Таблица 2
Лабораторные данные трех типов аутоиммунного панкреатита
| тип D, n = 34 | тип H, n = 19 | тип B / T , n = 14 | P значение, D vs H | P значение, D vs B / T | P значение, H vs B / T | |
| Медиана IgG, мг / дл | 2163.5 (1637,5-2682,8) | 1920 (1398,5-2300) | 1619 (1369,5-2364,5) | 0,642 | > 0,999 | > 0,999 |
| (квартильный диапазон) | ||||||
| 309 (181-1015) | 351 (228-780) | 133,5 (60,8-326,5) | > 0,999 | 0,042 | 0,057 | |
| (квартильный диапазон) | 28/32 (88) | 16/19 (84) | 7/14 (50) | > 0.999 | 0,030 | 0,168 |
| Медиана IgE, МЕ / л | 406,9 (265,5-877) | 249,0 (74,75-589,75) | 264,0 (134,1-856) | 4 0,447> | 4 0,447 > 0,999 | |
| (квартильный диапазон) | ||||||
| IgE> 580, (МЕ / л) (%) | 8/20 (40,0) | 3/12 (25,0) | 4/11 (36,4) | > 0,999 | > 0,999 | > 0,999 |
| Медиана эозинофилов, мкл | 180 (72-440) | 238.5 (152,5-447,75) | 473 (114,5-621,5) | > 0,999 | 0,354 | > 0,999 |
| (квартильный диапазон) | ||||||
| Эозинофилы> 600 / мкл 13 (%) 3/3 | 32 90 (11) | 2/16 (13) | 3/13 (23) | > 0,999 | > 0,999 | > 0,999 |
| Медиана амилазы (МЕ / л) | 86 (49,5-119,5) | 72 (43-100) | 114 (73,3-589,3) | > 0.999 | > 0,999 | 0,049 |
| (квартильный диапазон) | ||||||
| Амилаза> 115 (МЕ / л) (%) | 8/33 (24) | 4/19 (21) | 7 / 14 (50) | > 0,999 | 0,300 | 0,408 |
| Положительный антинуклеарный антиген (%) | 14/29 (48) | 4/18 (22) | 6/13 (46) | 0,366 | > 0,999 | 0,738 |
| Положительный ревматоидный фактор (%) | 10/28 (36) | 2/17 (12) | 1/13 (7) | 0.288 | 0,378 | > 0,999 |
Гистологические и иммуногистохимические исследования
LPSP был гистологически подтвержден с обильной инфильтрацией CD3-положительных Т-лимфоцитов и IgG4-положительных плазматических клеток в 6 D-типе, 7 H-типе и 4 Пациенты типа B / T. В поджелудочной железе 2 пациентов B / T-типа (1 образец хирургической биопсии и 1 образец EUS-FNA) были обнаружены выраженный фиброз и обильная инфильтрация CD20-положительных В-лимфоцитов, а не Т-лимфоцитов, но мало IgG4-положительных плазматических клеток или нейтрофилы обнаружены.IDCP не наблюдался ни у одного пациента. EUS-FNA у 4 пациентов с ОИП не смог подтвердить гистологический диагноз из-за недостаточного количества образцов (таблица).
Таблица 3
Гистологические данные поджелудочной железы при трех типах аутоиммунного панкреатита
| D тип | H тип | B / T тип | LPSP ( n = 3) | LPSP ( n = 3) | LPSP ( n = 1) |
| Биопсия | LPSP ( n = 2) | LPSP ( n = 3) | Фиброз с обильной инфильтрацией В-лимфоцитов ( n = 1) |
| EUS-FNA | LPSP ( n = 1) | LPSP ( n = 1) | ( n = 3) |
| Несоответствующий материал ( n = 1) | Несоответствующий материал ( n = 2) | Фиброз с обильной инфильтрацией B-лимфоцитов ( n = 1) | 9 0175|
| Несоответствующий материал ( n = 1) |
Клинический курс
Стероидная терапия была эффективной у всех 50 пациентов (31 тип D, 13 H тип и 6 B / T тип).AIP рецидивировал во время постепенного снижения дозы или после прекращения приема стероидов у 3 пациентов D-типа и 3-х пациентов H-типа. У 8 пациентов, находящихся под консервативным наблюдением (1 тип H и 7 тип B / T), рентгенологические характеристики не изменились у семи пациентов, но увеличение хвоста поджелудочной железы улучшилось естественным образом у 1 пациента с типом B / T. В течение курса, предшествовавшего нашей госпитализации, очаговое увеличение головки поджелудочной железы развилось до диффузного увеличения в трех случаях, а очаговое увеличение хвоста поджелудочной железы развилось до диффузного увеличения в одном случае.
ОБСУЖДЕНИЕ
Радиологически AIP подразделяется на диффузные и очаговые формы. Диффузное увеличение поджелудочной железы, называемое колбасоподобным увеличением, является типичным признаком AIP. Однако AIP F-типа, иногда образующий массу, часто трудно отличить от рака поджелудочной железы [1-3,12-14]. Возможные различия в клинических проявлениях между типами D и F AIP неясны.
В настоящем исследовании мы классифицировали 67 пациентов с ОИП на тип D ( n = 34), тип H ( n = 19) и тип B / T ( n = 14).Типы D и H показали сходные клинические особенности. Однако тип B / T отличался от типов D и H в нескольких аспектах. Механическая желтуха и стеноз нижнего желчного протока часто выявлялись у пациентов с типом D и H, но ни у одного пациента с типом B / T эти особенности не наблюдались. По данным Ghazale et al [16], стеноз нижнего желчного протока имел место у 70% из 53 пациентов с ОИП. Хирано и др. [17] заявили, что как отек поджелудочной железы из-за воспаления головки поджелудочной железы, так и утолщение стенки желчных протоков влияют на стеноз нижнего желчного протока при AIP, на основании результатов EUS и того факта, что 93% случаев AIP с положительным поражением головки поджелудочной железы у пациентов был стеноз нижнего желчного протока, по сравнению только с 17% пациентов с отрицательным поражением.
В этом исследовании уровень сывороточного IgG4 был значительно ниже у пациентов B / T-типа, чем у пациентов с D-типом, а повышение уровня сывороточного IgG4 было меньше у пациентов с B / T-типом, чем у пациентов с D-типом. Острый панкреатит чаще наблюдался у пациентов B / T-типа, чем у пациентов с D-типом, а уровни амилазы в сыворотке крови были значительно выше у пациентов с B / T-типом, чем у пациентов с H-типом. Что касается диагноза и частоты острого панкреатита, высокий процент пациентов с типом B / T, по-видимому, в основном зависит от более высоких уровней амилазы.Острый панкреатит или некоторые острые воспалительные приступы в случаях хронического панкреатита могут не быть связаны с высокими уровнями амилазы из-за атрофической ацинарной ткани. Не было разницы в частоте болей в животе, поэтому некоторые случаи D-типа и H-типа могли быть упущены.
Ни у одного из пациентов типа B / T не рецидивов после стероидной терапии, по сравнению с 10% пациентов D-типа и 23% пациентов H-типа. Стало ясно, что существует два гистологических подтипа (LPSP и IDCP) в AIP [6-11].Большинство пациентов с AIP в Азии имеют LPSP, а половина пациентов с AIP в Европе имеют IDCP [8,10]. Клинические признаки этих двух подтипов существенно различаются. Как правило, сообщается, что пациенты с IDCP моложе на момент постановки диагноза, а пациенты с IDCP с меньшей вероятностью демонстрируют повышенные уровни IgG4 в сыворотке. IDCP чаще ассоциируется с острым панкреатитом и воспалительным заболеванием кишечника. Согласно сравнительному исследованию пациентов с LPSP и IDCP, проведенным Sah et al [9], пациенты с IDCP, как правило, имели больше очаговых особенностей, чем LPSP (84% против 60%), и рецидивов IDCP не наблюдалось ни у одного пациента, тогда как LPSP рецидивировал у 47% пациентов.Для диагностики IDCP необходимо гистологическое исследование адекватного образца поджелудочной железы, а необходимость гистологического исследования для диагностики IDCP в настоящее время затрудняет клиническую диагностику.
При гистологическом исследовании данных случаев LPSP был подтвержден у 17, но IDCP не был обнаружен. Клинические файлы AIP D-типа и H-типа были совместимы с файлами пациентов с LPSP. Однако, учитывая низкие уровни IgG4 в сыворотке и частую связь с острым панкреатитом, существует вероятность того, что некоторые случаи IDCP могут быть вовлечены в случаи B / T-типа.Например, 32-летний мужчина с AIP B / T типа показал нормальные уровни IgG4 в сыворотке, ассоциацию с язвенным колитом и хорошую чувствительность к стероидной терапии, но гистологический диагноз с помощью EUS-FNA не мог быть подтвержден из-за недостаточного образец биопсии. Интересно, что гистология двух пациентов B / T-типа включала обильную инфильтрацию B-клеток с небольшой инфильтрацией IgG4-положительных клеток или нейтрофилов, которые могли быть другим типом AIP, отличным от LPSP и IDCP. AIP B / T-типа может включать заболевание, отличное от LPSP.
Три пациента с типом H и один пациент с типом B / T перешли в тип D в течение естественного течения. Также сообщалось, что AIP H-типа переходит в D-тип [18,19], а AIP B / T-типа – в D-тип [20]. Также были сообщения о рецидивах в остаточной поджелудочной железе после резекции, таких как рецидив в остаточной головке поджелудочной железы через 1 год после дистальной панкреатэктомии [21] и рецидив в остаточной части поджелудочной железы и хвосте через 4 мес после панкреатодуоденэктомии [22]. Стероидная терапия была эффективной при прогрессировании или рецидиве поражений.Эти данные показывают, что очаговое воспаление может прогрессировать до последующих диффузных изменений по всей поджелудочной железе или развиваться повторно в разных местах и в разное время у некоторых пациентов с ОИП. Диффузное изменение поджелудочной железы может быть окончательным проявлением AIP, и то, влияет ли этот воспалительный процесс на железу диффузно или очагово, может просто отражать стадию заболевания. Из семи консервативно наблюдаемых пациентов типа B / T у шести не было никаких изменений, а у одного улучшилось естественным образом. Kubota и др. [23] сообщили, что у всех восьми пациентов с ОИП, у которых спонтанно улучшилось состояние, наблюдалось очаговое увеличение поджелудочной железы.AIP B / T-типа может включать заболевание, отличное от AIP D-типа и H.
В заключение, хотя клинические признаки AIP H-типа аналогичны клиническим характеристикам AIP D-типа, AIP B / T-типа в нескольких аспектах отличается от типов D и H. AIP B / T-типа может включать заболевание, отличное от LPSP.
КОММЕНТАРИИ
Предпосылки
Аутоиммунный панкреатит (АИП) – это особый тип панкреатита, который, как считается, имеет аутоиммунную этиологию. Недавно AIP был радиологически классифицирован на диффузный тип (тип D) и очаговый тип (тип F).Однако различия между AIP D- и F-типа малоизвестны.
Границы исследований
Были исследованы различия в клинических, радиологических, лабораторных и гистологических данных между AIP D- и F-типа.
Инновации и прорывы
Пациенты с ОИП были разделены на тип D и тип F. Кроме того, тип F был разделен на тип головы (тип H) и тип корпуса и / или хвоста (тип B / T). Ни у одного пациента типа B / T не была желтуха как начальный симптом, но острый панкреатит чаще ассоциировался с типом B / T, чем с типом D.Уровни амилазы в сыворотке были значительно выше у пациентов B / T-типа, чем у пациентов H-типа. Уровни сывороточного иммуноглобулина G (IgG) 4 были значительно выше у пациентов D-типа, чем у пациентов B / T-типа. Ни у одного из пациентов типа B / T после стероидной терапии не наблюдалось рецидива, по сравнению с 10% пациентов D-типа и 23% пациентов H-типа. У двух пациентов B / T-типа наблюдалась обильная инфильтрация B-клеток с небольшой инфильтрацией IgG4-положительных клеток или нейтрофилов.
Приложения
AIP B / T-типа отличается по нескольким аспектам от типов D и H, и некоторые AIP B / T-типа могут быть связаны с заболеванием, отличным от лимфоплазмоцитарного склерозирующего панкреатита.
Рецензирование
Само исследование кажется разумным, а результаты интересны и имеют этиологическое значение.
Сноски
При поддержке Исследовательского комитета по трудноизлечимым заболеваниям поджелудочной железы (главный исследователь; Тору Симосегава), предоставлены Министерством здравоохранения, труда и социального обеспечения Японии
Рецензенты: Сёитиро Суми, доктор медицины, доктор философии, младший профессор, Отделение реконструкции органов, Институт пограничных медицинских наук, Университет Киото, Сакё-ку, Киото 606-8507, Япония; Ацуши Масамунэ, доктор медицины, доктор философии, отделение гастроэнтерологии, Высшая школа медицины Университета Тохоку, 1-1 Сейрё-мати, Аоба-ку, Сендай 980-8574, Япония
S- редактор Lv S L- редактор Kerr C. E- редактор Li JY
Ссылки
1.Окадзаки К., Кава С., Камисава Т., Ито Т., Инуи К., Ирие Х, Ирисава А., Кубо К., Нотохара К., Хасебе О. и др. Японские клинические рекомендации по аутоиммунному панкреатиту. Поджелудочная железа. 2009; 38: 849–866. [PubMed] [Google Scholar] 2. Чари С.Т., Такахаши Н., Леви М.Дж., Смирк Т.К., Клейн Д.Е., Пирсон Р.К., Петерсен Б.Т., Топазиан М.А., Веге С.С. Диагностическая стратегия, позволяющая отличить аутоиммунный панкреатит от рака поджелудочной железы. Clin Gastroenterol Hepatol. 2009; 7: 1097–1103. [PubMed] [Google Scholar] 3. Камисава Т., Такума К., Эгава Н., Цурута К., Сасаки Т.Аутоиммунный панкреатит и склерозирующая болезнь, связанная с IgG4. Нат Рев Гастроэнтерол Гепатол. 2010; 7: 401–409. [PubMed] [Google Scholar] 4. Otsuki M, Chung JB, Okazaki K, Kim MH, Kamisawa T., Kawa S., Park SW, Shimosegawa T., Lee K, Ito T. и др. Азиатские диагностические критерии аутоиммунного панкреатита: консенсус Японско-корейского симпозиума по аутоиммунному панкреатиту. J Gastroenterol. 2008; 43: 403–408. [PubMed] [Google Scholar] 5. Кавагути К., Койке М., Цурута К., Окамото А., Табата И., Фудзита Н. Лимфоплазмоцитарный склерозирующий панкреатит с холангитом: вариант первичного склерозирующего холангита с обширным поражением поджелудочной железы.Hum Pathol. 1991; 22: 387–395. [PubMed] [Google Scholar] 6. Нотохара К., Бургарт Л.Дж., Ядав Д., Чари С., Смирк ТЦ. Идиопатический хронический панкреатит с перидуктальной лимфоплазмоцитарной инфильтрацией: клинико-патологические особенности 35 случаев. Am J Surg Pathol. 2003. 27: 1119–1127. [PubMed] [Google Scholar] 7. Zamboni G, Lüttges J, Capelli P, Frulloni L, Cavallini G, Pederzoli P, Leins A, Longnecker D, Klöppel G. Гистопатологические особенности диагностической и клинической значимости аутоиммунного панкреатита: исследование на 53 образцах резекции и 9 образцах биопсии.Арка Вирхова. 2004. 445: 552–563. [PubMed] [Google Scholar] 8. Park DH, Kim MH, Chari ST. Последние достижения в области аутоиммунного панкреатита. Кишечник. 2009. 58: 1680–1689. [PubMed] [Google Scholar] 9. Сах Р.П., Чари С.Т., Паннала Р., Сугумар А., Клэйн Дж.Э., Леви М.Дж., Пирсон Р.К., Смирк Т.С., Петерсен Б.Т., Топазиан М.Д. и др. Различия в клиническом профиле и частоте рецидивов аутоиммунного панкреатита 1 типа и 2 типа. Гастроэнтерология. 2010; 139: 140–148; викторина 140-148. [PubMed] [Google Scholar] 10. Камисава Т., Нотохара К., Симосегава Т.Два клинико-патологических подтипа аутоиммунного панкреатита: LPSP и IDCP. Гастроэнтерология. 2010; 139: 22–25. [PubMed] [Google Scholar] 11. Chari ST, Kloeppel G, Zhang L, Notohara K, Lerch MM, Shimosegawa T. Гистопатологические и клинические подтипы аутоиммунного панкреатита: согласованный документ гонолулу. Панкреатология. 2010. 10: 664–672. [PubMed] [Google Scholar] 12. Ирие Х, Хонда Х, Баба С., Куроива Т., Йошимицу К., Таджима Т., Джими М., Суми Т., Масуда К. Аутоиммунный панкреатит: характеристики КТ и МРТ.AJR Am J Roentgenol. 1998; 170: 1323–1327. [PubMed] [Google Scholar] 13. Wakabayashi T, Kawaura Y, Satomura Y, Fujii T., Motoo Y, Okai T., Sawabu N. Клиническое исследование хронического панкреатита с очаговым нерегулярным сужением главного протока поджелудочной железы и образованием массы: сравнение с хроническим панкреатитом, показывающим диффузное нерегулярное сужение основного протока. проток поджелудочной железы. Поджелудочная железа. 2002. 25: 283–289. [PubMed] [Google Scholar] 14. Фруллони Л., Скаттолини С., Фалькони М., Замбони Дж., Капелли П., Манфреди Р., Грациани Р., Д’Онофрио М., Кацотурчи А.М., Амодио А. и др.Аутоиммунный панкреатит: различия очаговой и диффузной форм у 87 больных. Am J Gastroenterol. 2009. 104: 2288–2294. [PubMed] [Google Scholar] 16. Ghazale A, Chari ST, Zhang L, Smyrk TC, Takahashi N, Levy MJ, Topazian MD, Clain JE, Pearson RK, Petersen BT и др. Иммуноглобулин G4-ассоциированный холангит: клинический профиль и ответ на терапию. Гастроэнтерология. 2008. 134: 706–715. [PubMed] [Google Scholar] 17. Хирано К., Тада М., Исаяма Х, Ямамото К., Мизуно С., Ягиока Х, Яшима Й, Сасаки Т, Когуре Х, Тогава О и др.Эндоскопическая оценка факторов, способствующих возникновению стриктуры интрапанкреатических желчевыводящих путей при аутоиммунном панкреатите. Gastrointest Endosc. 2010; 71: 85–90. [PubMed] [Google Scholar] 18. Horiuchi A, Kawa S, Akamatsu T., Aoki Y, Mukawa K, Furuya N, Ochi Y, Kiyosawa K. Характерный внешний вид протока поджелудочной железы при аутоиммунном хроническом панкреатите: отчет о болезни и обзор японской литературы. Am J Gastroenterol. 1998. 93: 260–263. [PubMed] [Google Scholar] 19. Кога Й, Ямагути К., Сугитани А., Чидзива К., Танака М.Аутоиммунный панкреатит, начинающийся как локализованная форма. J Gastroenterol. 2002. 37: 133–137. [PubMed] [Google Scholar] 20. Wakabayashi T, Kawaura Y, Satomura Y, Watanabe H, Motoo Y, Sawabu N. Долгосрочный прогноз хронического панкреатита с сужением протока: стратегия лечения стероидами. Поджелудочная железа. 2005; 30: 31–39. [PubMed] [Google Scholar] 21. Motoo Y, Minamoto T., Watanabe H, Sakai J, Okai T., Sawabu N. Склерозирующий панкреатит, демонстрирующий быстро прогрессирующие изменения с периодическим формированием массы. Int J Pancreatol.1997; 21: 85–90. [PubMed] [Google Scholar] 22. Бланк А, Мэйбоди М, Исом-Батц Дж, Рослин М, Диллон Э. Острый некротический панкреатит, вызванный Salmonella typhimurium. Dig Dis Sci. 2003. 48: 1472–1474. [PubMed] [Google Scholar] 23. Kubota K, Iida H, Fujisawa T., Ogawa M, Inamori M, Saito S, Kakuta Y, Oshiro H, Nakajima A. Клиническое значение опухшего дуоденального сосочка при аутоиммунном панкреатите. Поджелудочная железа. 2007; 35: e51 – e60. [PubMed] [Google Scholar]Лечение и рецидив аутоиммунного панкреатита
Кишечная печень.2008 июн; 2 (1): 1–7.
, , иСунг-Хун Мун
Кафедра внутренней медицины, Медицинский колледж Университета Ульсана, Медицинский центр Асан, Сеул, Корея.
Мён-Хван Ким
Кафедра внутренней медицины, Медицинский колледж Университета Ульсана, Медицинский центр Асан, Сеул, Корея.
До Хён Пак
Кафедра внутренней медицины, Медицинский колледж Университета Ульсана, Медицинский центр Асан, Сеул, Корея.
Кафедра внутренней медицины, Медицинский колледж Университета Ульсана, Медицинский центр Асан, Сеул, Корея.
Автор, ответственный за переписку. Для корреспонденции: Мён-Хван Ким. Кафедра внутренней медицины, Медицинский колледж Университета Ульсана, Медицинский центр Асан, 388-1, Пунгнап 2-донг, Сонгпа-гу, Сеул 138-736, Корея. Тел .: + 82-2-3010-3180, Факс: + 82-2-476-0824, rk.luoes.cma@mikhmПолучено 11 апреля 2008 г .; Принято 24 апреля 2008 г.
Copyright © 2008 Корейское общество гастроэнтерологов; Корейское общество эндоскопии желудочно-кишечного тракта; Корейская ассоциация изучения печени; Корейское общество нейрогастроэнтерологии и моторики; Корейская ассоциация по изучению заболеваний кишечника; Корейский колледж хеликобактер и исследований верхних отделов желудочно-кишечного тракта; Корейское общество панкреатобилиарных заболеваний Эту статью цитировали в других статьях в PMC.Abstract
Аутоиммунный панкреатит (АИП) – особый вид хронического панкреатита, в патогенезе которого задействованы аутоиммунные механизмы. Чувствительность к стероидам оказывает значительное влияние на диагностику AIP, поскольку пациенты с AIP и раком поджелудочной железы имеют много общих клинических особенностей. Этот обзор посвящен лечению и рецидиву AIP. Целью лечения AIP является ремиссия симптомов, серология, рентгенологические изменения или гистология, что также относится к рецидиву. Хотя общепринято считать, что стероиды следует предлагать пациентам с ОИП с активным заболеванием, не существует стандартизированной схемы приема стероидов для ОИП и единого мнения о дозе и продолжительности индукции стероидов и графике их постепенного снижения, а также об оптимальной продолжительности и дозе поддерживающей терапии.Достижение консенсуса по оптимальной схеме лечения очень важно для снижения частоты рецидивов. В этом обзоре мы обсуждаем схемы лечения, используемые во многих центрах.
Ключевые слова: Аутоиммунный панкреатит, лечение, рецидив
ВВЕДЕНИЕ
Аутоиммунный панкреатит (АИП) – особый тип хронического панкреатита, в патогенезе которого участвуют аутоиммунные механизмы. 1 С клинической точки зрения чувствительность к стероидам AIP подразумевает значительное влияние, поскольку пациенты с AIP и раком поджелудочной железы имеют много общих клинических характеристик. 2
Благодаря японским исследователям возможности диагностики AIP значительно улучшились за последнее десятилетие. Однако гораздо меньше известно о том, как лечить AIP после постановки диагноза. Этот обзор посвящен лечению и рецидиву AIP. Это потому, что некоторые сложности, связанные с «лечением», имеют отношение к «рецидиву» AIP. Например, достижение консенсуса по оптимальной схеме приема стероидов, в свою очередь, может привести к низкой частоте рецидивов.
ОПРЕДЕЛЕНИЕ РЕЗУЛЬТАТОВ ЛЕЧЕНИЯ
При обсуждении лечения в AIP важно использовать определенные термины, которые помогают определить цели лечения и реакции. 3 Несмотря на растущее количество статей, опубликованных в литературе, нет единого мнения относительно терминологии, относящейся к результатам лечения, включая ремиссию и рецидив. Достижение консенсуса по их определению будет важно для сравнения результатов лечения в разных центрах.
1. Ремиссия
Целью лечения AIP является достижение ремиссии. Ремиссия может относиться к симптомам, серологии, рентгенологическим изменениям или гистологии. 3 Полная ремиссия означает исчезновение симптомов, связанных с заболеванием, а также серологических, рентгенологических и гистологических отклонений. Разрешение симптомов (симптоматическая ремиссия) достигается быстро при AIP, поскольку механическая желтуха и сопутствующие симптомы могут исчезнуть в течение 2-3 недель. 3 , 4 Однако серологическая ремиссия (особенно при нормализации уровня IgG4 в сыворотке) и радиологическая ремиссия (разрешение массы поджелудочной железы и / или стриктур протоков) могут занять больше времени. 3 Гистологическую ремиссию подтвердить сложнее из-за трудностей с выполнением биопсии поджелудочной железы. 5 Таким образом, на практике конечной точкой лечения часто бывает симптоматическая ремиссия наряду с радиологической ремиссией. 3 Достижение консенсуса в отношении определения ремиссии очень важно, поскольку оно имеет отношение к определению конечной точки лечения.
В недавнем отчете из Великобритании 6 клиническая ремиссия была оценена с точки зрения пре- и постстероидных симптомов, биохимии печени и радиологических проявлений.Уровень сывороточного IgG4 не был включен в серологическую ремиссию. В их исследовании у всех пациентов, у которых уровни IgG4 не смогли вернуться к норме во время стероидной терапии, в конечном итоге произошел рецидив. После лечения стероидами у пациентов может наблюдаться стойкое повышение уровня сывороточного IgG4 без симптомов или рентгенологических свидетельств активности заболевания. 7 Неясно, отражает ли это субклиническую активность заболевания. Возможность того, что постоянно повышенный уровень IgG4 в сыворотке крови во время лечения может определять дальнейшее применение иммуносупрессии, требует дальнейшего изучения. 6 Некоторые пациенты с рецидивом, у которых уровень сывороточного IgG4 не нормализовался при лечении стероидами, может представлять собой обострение остаточного заболевания, а не истинный рецидив после полной ремиссии.
2. Рецидив
Как и в случае ремиссии, рецидив может быть симптоматическим, рентгенологическим, серологическим или гистологическим. 3 Симптоматический рецидив обычно связан с рентгенологическими и серологическими рецидивами. Однако только серологический рецидив (например, повышенный уровень сывороточной концентрации IgG4) может наблюдаться у пациентов без симптомов или радиологических свидетельств активности заболевания. 3 Определение рецидива у авторов неодинаково. Частота рецидивов может варьироваться в зависимости от применяемого определения. На практике рецидив обычно определяется как повторение рентгенологических проявлений AIP (с симптомами или без них) в поджелудочной железе или экстрапанкреатических органах. 3 При определении рецидива авторы обычно не делают различия между рецидивом поджелудочной железы и возникновением заболевания в другом органе, будь то de novo или истинный рецидив ранее леченного заболевания в этом органе. 3
ЛЕЧЕНИЕ
В отличие от обычного хронического панкреатита, AIP резко реагирует на стероидную терапию. 2 Стероидная терапия приводит к улучшению клинических симптомов и сопутствующих радиологических и серологических отклонений. В принципе, методы лечения AIP можно разделить на медикаментозную и хирургическую терапию. Роль резекционной хирургии еще не выяснена, и она обычно проводится без предоперационного подозрения на АИП. Это может быть лечебным путем, если полностью удалить воспаление в так называемом массообразующем AIP. 8 Однако нельзя исключить возможность поражения остаточной поджелудочной железы после операции. 9 Согласно исследованию Weber et al., 10 частота рецидивов после панкреатэктомии составила 28% (8/29), а стриктура желчных протоков была наиболее частым клиническим проявлением. Также существует опасение по поводу недостаточности поджелудочной железы у пациентов с рецидивом ОИП после частичной панкреатэктомии. Учитывая значительную частоту рецидивов после резекции поджелудочной железы и современную концепцию AIP как системного заболевания, связанного с IgG4, стероид 11 , 12 следует рассматривать как терапию первого выбора при AIP.
1. Показания к стероидной терапии
Хотя пациенты с AIP хорошо реагируют на преднизолон, остается неясным, является ли стероидная терапия незаменимой для всех пациентов с AIP. 13 Имеются отдельные сообщения о спонтанной ремиссии у пациентов с ОИП. 11 , 14 Хотя у некоторых пациентов с ОИП может произойти спонтанная ремиссия, использование стероидов может вызывать ремиссию постоянно и быстрее, чем в случаях без лечения. 13 , 15 Роль стероидов в лечении бессимптомных радиологических аномалий неясна. Неизвестно, будут ли у нелеченных бессимптомных пациентов больше рецидивов, чем у бессимптомных пациентов, принимающих стероиды. В таком случае лечение бессимптомных пациентов оправдано. Принято считать, что стероиды следует предлагать пациентам с AIP с «активным» заболеванием. 15 Клиническими проявлениями у пациентов с наиболее выраженными признаками активного заболевания являются механическая желтуха, вызванная стенозом желчных протоков или наличием других сопутствующих системных заболеваний, таких как забрюшинный фиброз. 11 Напротив, похоже, что стероиды не играют никакой роли у пациентов с атрофией поджелудочной железы в пост-острой фазе. 15
В то время как большинство пациентов с AIP получают стентирование желчевыводящих путей во время лечения желтухи, есть некоторые пациенты, у которых желтуха облегчается только с помощью стероидной терапии без необходимости в стентировании. 16 Неясно, можно ли лечить обструкцию желчевыводящих путей только стероидной терапией без необходимости стентирования перед назначением стероидов. 16 Если билиарный стент устанавливается при наличии стриктур желчных путей, у большинства пациентов удаление стента возможно через 2 месяца после начала приема стероидов.
2. Стероидный режим
На схеме () показана стратегия лечения AIP в нашем учреждении. После постановки диагноза начинают вводить индукционную дозу преднизолона. Ответ на стероиды оценивается с точки зрения пре- и постстероидных симптомов, биохимии печени, сывороточных уровней IgG / IgG4 и радиологических проявлений.После подтверждения клинической ремиссии дозу преднизолона постепенно снижают до поддерживающей. Поддерживающая терапия низкими дозами стероидов используется для предотвращения рецидива заболевания и поддержания ремиссии. Наконец, стероиды обычно полностью прекращают.
Алгоритм ведения аутоиммунного панкреатита.
До настоящего времени схема приема стероидов для AIP не стандартизирована, и нет единого мнения о дозе и продолжительности индукционного приема стероидов, графике постепенного снижения, а также оптимальной продолжительности и дозе поддерживающей терапии.Начальная доза преднизолона для индукции ремиссии в большинстве исследований колеблется от 30 до 40 мг. 17 – 20 Однако в некоторых исследованиях начальная доза составляла 50-60 мг преднизолона в день. 14 Индукционные дозы обычно назначаются в течение 1 месяца с последующим постепенным изменением продолжительности. В клинике Майо преднизолон применяют в дозе 40 мг / день в течение 4 недель, а затем снижают дозу до 5 мг / неделю в течение всего 11 недель терапии. 17 Это относительно короткий курс стероидов по сравнению с другими авторами.В клинике Мэйо поддерживающая терапия была ограничена рецидивом. В медицинском центре Асан ремиссия достигается при приеме преднизолона 0,5 мг / кг в день в течение 1-2 месяцев с последующим постепенным снижением дозы 5-10 мг в месяц до поддерживающей дозы 2,5-7,5 мг / день, которая была продолжалось в среднем 6 месяцев, а затем полностью прекратилось. 20 В Японии предпочтительная начальная доза преднизолона составляет 30-40 мг / день, и ее снижают на 5 мг каждые 1-2 недели. 11 , 21 Пациенты, у которых задокументировано полное радиологическое улучшение, прекращают прием лекарств, но большинству пациентов требуется продолжение поддерживающей терапии преднизолоном 5 мг / день. 22
Поддерживающая терапия включает использование иммуносупрессивной терапии для предотвращения рецидива заболевания и поддержания ремиссии. Остается установить, следует ли использовать поддерживающую терапию для всех пациентов или только для тех, у кого рецидив или вероятность рецидива после первоначального курса стероидов. 3 Высокая частота рецидивов заболевания побудила многих японских исследователей поддерживать пациентов на ежедневном приеме низких доз преднизолона (2,5-10 мг) в течение длительного времени. 19 Продолжительность поддерживающей терапии не установлена.Вопрос, требующий дальнейшего изучения, будет заключаться в оптимальной продолжительности поддерживающей терапии, поскольку продолжение терапии кортикостероидами может уменьшить рецидивы, но также может повысить риск побочных эффектов, вызванных стероидами. Некоторые авторы предпочитают продолжать прием низких доз стероидов на протяжении всей жизни у всех пациентов с ОИП даже после достижения полной ремиссии. С другой стороны, некоторые исследователи полностью прекращают поддерживающую терапию стероидами через 6–12 месяцев лечения. 21 Другой японский исследователь предполагает, что поддерживающие стероиды следует назначать как минимум в течение трех лет, потому что именно в этот период чаще всего возникают рецидивы.Что касается доз стероидов для поддерживающей терапии, исследования низких доз стероидов при ревматологических заболеваниях показывают, что дозы менее 7,5 мг в день имеют меньше побочных эффектов, чем более высокие дозы. 23 Однако это остается спорным, потому что средний возраст пациентов в этих исследованиях был моложе, чем обычно наблюдается в AIP.
Выбор поддерживающей терапии (низкие дозы стероидов по сравнению с другими иммуномодулирующими средствами) при рецидиве не установлен. 15 В клинике Майо, 15 , вместо долгосрочного использования низких доз стероидов, они решили использовать азатиоприн (2 мг / кг в день) для поддержания ремиссии у пациентов с рецидивом после отмены стероидов.Выбор препарата для поддержания ремиссии требует дальнейших исследований с большим количеством пациентов для оценки соотношения риск / польза (профилактический эффект от рецидива по сравнению с побочным эффектом лечения) каждого подхода. Согласно недавнему отчету, 24 пациента с AIP и IgG4-ассоциированным холангитом, резистентным к стероидам и 6-меркаптопурину, лечили только ритуксимабом. Ритуксимаб представляет собой химерное моноклональное антитело, направленное против CD 20, фосфопротеина, экспрессируемого на поверхности В-лимфоцитов.Предполагается, что механизм действия ритуксимаба заключается в истощении В-клеток, что приводит к снижению выработки патогенных аутоантител. Ритуксимаб может быть вариантом лечения пациентов с рефрактерным или рецидивирующим AIP или IgG4-ассоциированным холангитом. 24
РЕЛАПС
Рецидив после ремиссии AIP не редкость. Рецидивы AIP после ремиссии на стероидах обычно возникают примерно у трети пациентов. 16 Иногда поджелудочная железа может быть сохранена и задействован только экстрапанкреатический орган ().Похоже, что симптомы, вызванные стриктурами желчных протоков, могут быть наиболее частым клиническим проявлением рецидива. 16 Пациенты испытывают рецидив AIP либо во время поддерживающей стероидной терапии, либо после полного прекращения приема стероидов. 25
Серийные изображения 67-летнего мужчины с АИП. Первая атака: (A, B) Перед стероидной терапией компьютерная томография показывает диффузное увеличение поджелудочной железы, а ERCP показывает сужение (стрелка) дистального общего желчного протока (CBD) и расширение проксимального CBD.(C, D) После стероидной терапии увеличение поджелудочной железы улучшается с разрешением дилатации CBD. При рецидиве: (E) Перед стероидной терапией MRCP показывает мультифокальные стриктуры в прикорневых и внутрипеченочных желчных протоках без вовлечения протоков поджелудочной железы. (F) После повторного лечения стероидами разрешаются мультифокальные желчные стриктуры.
AIP, аутоиммунный панкреатит.
Согласно нашему исследованию, 20 в течение среднего периода наблюдения в 40 месяцев у 13 из 40 пациентов (33%) возник рецидив AIP.У семи из 13 пациентов произошел рецидив при приеме поддерживающей дозы преднизолона (2,5-7,5 мг / день), а у остальных 6 пациентов случился рецидив при отмене стероидов. При рецидиве все они снова ответили на высокие дозы преднизолона. У этих пациентов с рецидивом поддерживающая терапия стероидами проводилась с большей продолжительностью и более высокой дозой, чем у начальной поддерживающей терапии.
Клинические последствия рецидива AIP следующие. Более половины пациентов с множественными рецидивами имели кальцификаты поджелудочной железы или камни. 26 При множественных рецидивах AIP может привести к необратимым повреждениям с интенсивным фиброзом, аналогичным развитию обычного хронического панкреатита. 27 Хотя пациенты с AIP с первым рецидивом снова реагируют на стероиды, эта поздняя стадия AIP с множественными рецидивами может не проявлять чувствительности к стероидам. Поэтому для лучшего прогноза AIP важны более ранняя диагностика и лечение.
1. Предикторы рецидива
Идентификация клинических и / или генетических предикторов рецидива AIP может иметь решающее значение для прогноза и клинического исхода заболевания.Выявление предикторов рецидива может помочь нам определить пациентов с высоким риском, которым действительно будет полезна поддерживающая терапия. Для пациентов с AIP, у которых определены предикторы рецидива, может потребоваться корректировка стратегии лечения путем включения более высокой дозы или более длительного приема поддерживающей стероидной терапии или дополнительного лечения другим иммунодепрессивным агентом. Кроме того, этим пациентам может потребоваться более тщательное наблюдение.
1) Клинический предсказатель
Hirano et al. 13 проанализировали несколько факторов неблагоприятных событий. Это были возраст, пол, механическая желтуха, боль в животе, диффузное изменение протоков поджелудочной железы, уровень IgG4 в сыворотке и терапия кортикостероидами. Уровни сывороточного IgG4 в начале не коррелировали с прогнозом. Механическая желтуха и лечение кортикостероидами сохранили значение как независимые прогностические факторы при многофакторном анализе. Они пришли к выводу, что кортикостероидная терапия может уменьшить неблагоприятные события, связанные с AIP, и рекомендовали раннее введение кортикостероидной терапии, особенно для пациентов с механической желтухой.С другой стороны, Park et al. 20 проанализировали клинические предикторы рецидива AIP. Возраст, пол, потеря массы тела, сахарный диабет, механическая желтуха, уровень амилазы / липазы, исходный уровень сывороточного IgG / IgG4 и наличие поражения других органов не коррелировали с рецидивом. В одном японском исследовании, как и в нашем исследовании, на момент постановки первоначального диагноза не было выявлено никаких конкретных клинических предикторов рецидива. 26 Kubota et al. 28 сравнили клинико-патологические параметры у пациентов с рецидивом или без него.При однофакторном анализе уровень IgG в сыворотке крови, диффузное набухание поджелудочной железы и стриктура желчных протоков были достоверно связаны с рецидивом. Однако при многомерном анализе только диффузное набухание поджелудочной железы независимо предсказывало рецидив AIP. Ghazale et al. 29 сообщили, что факторами, предсказывающими рецидив, были повышенный уровень IgG4 и наличие проксимальных стриктур желчных путей. Возраст, пол пациентов, механическая желтуха и доля пациентов, чей сывороточный IgG4 нормализовался после лечения, не различались между рецидивирующими и не рецидивирующими.Необходимо дальнейшее изучение клинических предикторов рецидива.
2) Генетический предиктор
Недавно сообщалось, что замещение аспарагиновой кислоты неаспарагиновой кислотой (например, аланином, валином и серином) в DQβ1 57 является генетическим предиктором рецидива AIP. 20 Правдоподобное объяснение патогенетической роли замены аспарагиновой кислоты в DQβ1 57 при рецидиве AIP следующее. Остаток 57 DQβ1 расположен рядом с одним концом пептид-связывающей бороздки молекулы класса II, где он функционирует как молекулярный привратник для боковой цепи пептида в карманах связывания пептида, называемых P9.Положительно заряженный остаток аргинина находится в положении 76 DQα-цепи рядом с P9, и если боковая цепь пептида несет отрицательный заряд, такой как аспарагиновая кислота, образуется прочный и стабильный солевой мостик, и иммунная реакция антиген-антитело не происходит. . Однако, когда остаток 57 DQβ1 представляет собой небольшой незаряженный остаток, такой как аланин, аутоантигены могут занимать P9. Таким образом, генотипирование с высоким разрешением HLA с анализом аминокислотной последовательности может быть полезным для выявления подгруппы лиц, которые потенциально подвергаются большему риску рецидива AIP.Интересно, что пузырчатка обыкновенная, буллезный пемфигоид и атопический дерматит также связаны с высокими концентрациями IgG4 в сыворотке, как в AIP, 30 – 32 Замена аминокислоты в 57-м остатке DQβ1 имеет решающую роль. в восприимчивости к их болезням. Недавно японская группа исследовала роль полиморфизма антигена 4 цитотоксических Т-лимфоцитов (CTLA4) в рецидиве AIP. Генотипы + 49A / A и + 6230A / A были связаны с повышенным риском рецидива. 33 Эти данные убедительно свидетельствуют о том, что регуляторные функции Т-клеток, таких как CTLA4 и CD4 + CD25 + регулирующих клеток, участвуют в развитии и патофизиологии AIP. 34
ПОСЛЕДУЮЩИЕ ДЕЙСТВИЯ
Для раннего выявления рецидивов рекомендуется периодическое наблюдение за пациентами, которые изначально ответили на лечение. Последующие наблюдения должны включать биохимические исследования крови, такие как IgG4, результаты визуализации и клинические проявления, такие как желтуха и дискомфорт в животе. 21 Хотя однократно протестированные уровни IgG4 в сыворотке при первоначальном диагнозе вряд ли будут достаточно информативными для прогнозирования рецидива, изменения уровней IgG4 в сыворотке во время серийных проверок могут дать клинически полезную информацию. По нашему опыту (неопубликованные данные, 2008 г.), у всех пациентов с рецидивом уровень сывороточного IgG4 повышался до уровня выше верхней границы нормы непосредственно перед рецидивом. Протокол последующего наблюдения в клинике Мэйо во многом основан на задействованном органе. У пациентов со стриктурами желчных протоков лабораторные исследования (фермент печени, сывороточный IgG4) повторяются каждые 12 недель в течение первых 1-2 лет.У пациентов без заболеваний желчевыводящих путей они наблюдают за пациентами на предмет рецидивов симптомов и только после этого рассматривают возможность визуализации. 15 В исследовании Hirano et al., 13 визуализация выполнялась каждые 6 месяцев с лабораторным тестированием каждые 3-6 месяцев для оценки рецидива. Оптимальные методы визуализации и интервал для последующего наблюдения не установлены. В одном исследовании, проведенном в Соединенном Королевстве, вместо обследования ERCP, MRCP использовался для демонстрации поражения поджелудочной железы и желчных протоков у пациентов без механической желтухи. 6 Если диагностическая точность MRCP для последующего наблюдения за протоковыми изменениями у пациентов с AIP подтверждена, MRCP будет гораздо более подходящим инструментом для последующего наблюдения, чем ERCP, поскольку он неинвазивен и безопаснее, чем ERCP.
Недавно в литературе появились сообщения о раке поджелудочной железы, осложняющем ОИП через годы после его постановки диагноза. 35 – 37 Неясно, является ли последующее развитие рака поджелудочной железы истинным осложнением давнего AIP или случайным возникновением у пожилого мужчины, у которого также был AIP. 35 Необходимы долгосрочные исследования на больших когортах AIP, чтобы определить, предрасполагает ли AIP к последующему развитию рака поджелудочной железы, поскольку рак обычно возникает через десятилетия после начала хронического панкреатита. 35
ВЫВОДЫ
Хотя в нашем понимании диагностики AIP были достигнуты значительные успехи, до знания оптимального режима лечения и факторов прогнозирования рецидива еще предстоит пройти долгий путь. Достижение консенсуса по оптимальной схеме лечения очень важно, потому что это, в свою очередь, может привести к низкой частоте рецидивов.Следует выработать согласованные определения результатов лечения. Требуются дальнейшие исследования в этой области.
Ссылки
1. Ким К.П., Ким М.Х., Сон М.Х., Ли С.С., Со Д.В., Ли С.К. Аутоиммунный хронический панкреатит. Am J Gastroenterol. 2004. 99: 1605–1616. [PubMed] [Google Scholar] 2. Квон С., Ким М.Х., Чой Е.К. Диагностические критерии аутоиммунного хронического панкреатита: пора прийти к единому мнению. Поджелудочная железа. 2007. 34: 279–286. [PubMed] [Google Scholar] 3. Chari ST, Мюррей JA. Аутоиммунный панкреатит, часть II: рецидив.Гастроэнтерология. 2008. 134: 625–628. [PubMed] [Google Scholar] 4. Камисава Т., Эгава Н., Накадзима Х, Цурута К., Окамото А. Морфологические изменения после стероидной терапии при аутоиммунном панкреатите. Сканд Дж Гастроэнтерол. 2004; 39: 1154–1158. [PubMed] [Google Scholar] 5. Сонг М.Х., Ким М.Х., Ли С.К. и др. Регресс фиброза поджелудочной железы после стероидной терапии у пациентов с аутоиммунным хроническим панкреатитом. Поджелудочная железа. 2005; 30: 83–86. [PubMed] [Google Scholar] 6. Черч Н.И., Перейра С.П., Дехерагода М.Г. и др. Аутоиммунный панкреатит: клинические и радиологические особенности и объективный ответ на стероидную терапию в серии британских исследований.Am J Gastroenterol. 2007. 102: 2417–2425. [PubMed] [Google Scholar] 7. Айтал Г.П., Бреслин Н.П., Гумустоп Б. Высокие сывороточные концентрации IgG4 у пациентов со склерозирующим панкреатитом. N Engl J Med. 2001; 345: 147–148. [PubMed] [Google Scholar] 8. Фруллони Л., Каваллини Дж. Лечение пациентов с аутоиммунным панкреатитом: поиск оптимального лечения продолжается. Панкреатология. 2005; 5: 238–240. [Google Scholar] 9. Танигучи Т., Танио Х., Секо С. и др. Аутоиммунный панкреатит выявляется как образование в головке поджелудочной железы без гипергаммаглобулинемии, которое рецидивировало после операции: описание случая и обзор литературы.Dig Dis Sci. 2003. 48: 1465–1671. [PubMed] [Google Scholar] 10. Вебер С.М., Кубукку-Димопуло О., Палести Дж. А. и др. Лимфоплазмоцитарный склерозирующий панкреатит: воспалительная модель карциномы поджелудочной железы. J Gastrointest Surg. 2003. 7: 129–137. [PubMed] [Google Scholar] 12. Bjornsson E, Chari ST, Smyrk TC, Lindor K. Холангит, связанный с иммуноглобулином G4: описание возникающей клинической сущности на основе обзора литературы. Гепатология. 2007. 45: 1547–1554. [PubMed] [Google Scholar] 13. Хирано К., Тада М., Исаяма Х. и др.Долгосрочный прогноз аутоиммунного панкреатита с лечением кортикостероидами и без него. Кишечник. 2007; 56: 1719–1724. [Бесплатная статья PMC] [PubMed] [Google Scholar] 14. Erkelens GW, Vleggaar FP, Lesterhuis W, van Buuren HR, van der Werf SD. Склерозирующий панкреатохолангит, поддающийся стероидной терапии. Ланцет. 1999; 354: 43–44. [PubMed] [Google Scholar] 16. Chari ST. Современные концепции лечения аутоиммунного панкреатита. JOP. 2007; 8: 1–3. [PubMed] [Google Scholar] 17. Чари С.Т., Смирк Т.К., Леви М.Дж. и др.Диагностика аутоиммунного панкреатита: опыт клиники Мэйо. Clin Gastroenterol Hepatol. 2006; 4: 1010–1016. [PubMed] [Google Scholar] 18. Хамано Х., Кава С., Хориучи А. и др. Высокие сывороточные концентрации IgG4 у пациентов со склерозирующим панкреатитом. N Engl J Med. 2001; 344: 732–738. [PubMed] [Google Scholar] 19. Камисава Т., Йошиике М., Эгава Н., Накадзима Х., Цурута К., Окамото А. Лечение пациентов с аутоиммунным панкреатитом: результаты долгосрочного последующего исследования. Панкреатология. 2005. 5: 234–238.[PubMed] [Google Scholar] 20. Park DH, Kim MH, Oh HB и др. Замена аспарагиновой кислоты в положении 57 DQbeta1 влияет на рецидив аутоиммунного панкреатита. Гастроэнтерология. 2008. 134: 440–446. [PubMed] [Google Scholar] 21. Ито Т., Нисимори И., Иноуэ Н. и др. Лечение аутоиммунного панкреатита: консенсус по лечению пациентов с аутоиммунным панкреатитом в Японии. J Gastroenterol. 2007; 42 (Приложение 18): S50 – S58. [PubMed] [Google Scholar] 22. Вакабаяси Т., Мотоо Ю., Кодзима Ю., Макино Х., Савабу Н.Хронический панкреатит с диффузным нерегулярным сужением главного панкреатического протока. Dig Dis Sci. 1998. 43: 2415–2425. [PubMed] [Google Scholar] 23. Да Силва Дж. А., Джейкобс Дж. В., Кирван Дж. Р. и др. Безопасность лечения низкими дозами глюкокортикоидов при ревматоидном артрите: опубликованные доказательства и данные проспективных исследований. Ann Rheum Dis. 2006. 65: 285–293. [Бесплатная статья PMC] [PubMed] [Google Scholar] 24. Topazian M, Witzig TE, Smyrk TC и др. Терапия ритуксимабом рефрактерных стриктур желчных путей при холангите, ассоциированном с иммуноглобулином G4.Clin Gastroenterol Hepatol. 2008. 6: 364–366. [PubMed] [Google Scholar] 25. Wakabayashi T, Kawaura Y, Satomura Y, Watanabe H, Motoo Y, Sawabu N. Долгосрочный прогноз хронического панкреатита с сужением протока: стратегия лечения стероидами. Поджелудочная железа. 2005; 30: 31–39. [PubMed] [Google Scholar] 26. Такаяма М., Хамано Н., Очи Ю. и др. Рецидивирующие приступы аутоиммунного панкреатита приводят к образованию камней поджелудочной железы. Am J Gastroenterol. 2004. 99: 932–937. [PubMed] [Google Scholar] 27. Кава С., Хамано Х. Клинические особенности аутоиммунного панкреатита.J Gastroenterol. 2007; 42: S9 – S14. [Google Scholar] 28. Кубота К., Иида Х, Фудзисава Т. и др. Клинические факторы, позволяющие прогнозировать спонтанную ремиссию или рецидив аутоиммунного панкреатита. Gastrointest Endosc. 2007; 66: 1142–1151. [PubMed] [Google Scholar] 29. Газале А., Чари С.Т., Чжан Л. и др. Иммуноглобулин G4-ассоциированный холангит: клинический профиль и ответ на терапию. Гастроэнтерология. 2008. 134: 706–715. [PubMed] [Google Scholar] 30. Дельгадо Дж. К., Хамид А., Юнис Дж. Дж. И др. Ответ аутоантител Pemphigus vulgaris связан с HLA-DQB1 * 0503 у пакистанских пациентов.Hum Immunol. 1997. 57: 110–119. [PubMed] [Google Scholar] 31. Саэки Х., Кувата С., Накагава Х. и др. Анализ ассоциированных с заболеванием аминокислотных эпитопов на молекулах HLA класса II при атопическом дерматите. J Allergy Clin Immunol. 1995; 96: 1061–1068. [PubMed] [Google Scholar] 32. Юнис Дж. Дж., Мобини Н., Юнис Э. Дж. И др. Общие маркеры класса II главного комплекса гистосовместимости в клинических вариантах рубцового пемфигоида. Proc Natl Acad Sci U S. A. 1994; 91: 7747–7751. [Бесплатная статья PMC] [PubMed] [Google Scholar] 33.Умемура Т., Ота М., Хамано Х и др. Ассоциация аутоиммунного панкреатита с полиморфизмом гена антигена 4 цитотоксических Т-лимфоцитов у пациентов из Японии. Am J Gastroenterol. 2008. 103: 588–594. [PubMed] [Google Scholar] 34. Окадзаки К. Участвуют ли регуляторные молекулы Т-клеток в развитии аутоиммунного панкреатита? Am J Gastroenterol. 2008. 103: 595–596. [PubMed] [Google Scholar] 35. Ghazale A, Chari S. Является ли аутоиммунный панкреатит фактором риска рака поджелудочной железы? Поджелудочная железа. 2007; 35: 376. [PubMed] [Google Scholar] 36.Фукуи Т., Мицуяма Т., Такаока М., Учида К., Мацусита М., Окадзаки К. Рак поджелудочной железы, связанный с аутоиммунным панкреатитом в стадии ремиссии. Intern Med. 2008. 47: 151–155. [PubMed] [Google Scholar] 37. Иноуэ Х., Миятани Х., Савада Й., Йошида Й. Случай рака поджелудочной железы с аутоиммунным панкреатитом. Поджелудочная железа. 2006; 33: 208–209. [PubMed] [Google Scholar]Статьи из кишечника и печени любезно предоставлены Корейским обществом гастроэнтерологов, Корейским обществом эндоскопии желудочно-кишечного тракта, Корейским обществом нейрогастроэнтерологии и моторики, Корейским колледжем хеликобактерных и верхних отделов желудочно-кишечного тракта Корейская ассоциация по изучению заболеваний кишечника, Корейская ассоциация по изучению заболеваний печени, Корейское общество панкреатобилиарных заболеваний и Корейское общество рака желудочно-кишечного тракта
Диффузные изменения поджелудочной железы: что это такое, признаки узи, лечение
Симптомы ДИ зависят от основного заболевания, которое привело к появлению изменений.Основная симптоматика выглядит как ухудшение аппетита, частые запоры и диарея, чувство тяжести в желудке. Давайте рассмотрим симптомы диффузных изменений, характерных для определенных заболеваний.
- При остром панкреатите в протоке простаты возникает повышенное давление, которое вызывает повреждение организма и вывод пищеварительных ферментов через ткань железы. Это приводит к разрушению тканей поджелудочной железы и вызывает интоксикацию организма.Больной ощущает жуткую боль в левом подреберье, частую рвоту и тошноту. Появляются симптомы нарастающей тахикардии и пониженного артериального давления. Состояние не улучшается, вплоть до реанимации или хирургического лечения.
- При хроническом панкреатите симптоматика ЛПЛ сохраняется. На первом этапе повреждается железа, что приводит к ее набуханию и небольшим кровоизлияниям. Через некоторое время предстательная железа уменьшается в размерах и склерозируется, что приводит к нарушению выработки пищеварительных ферментов.По мере прогрессирования болезни у пациента появляются сильные боли.
- Если диффузные изменения поджелудочной железы вызваны фиброзом, то в начале заболевания симптоматика отсутствует. При фиброзном воспалении нормальные ткани железы переходят в соединительную. Это приводит к снижению выработки ферментов и гормонов, которые поддерживают метаболические процессы в организме и отвечают за процесс пищеварения. Начальная симптоматика заболевания аналогична симптомам панкреатита.Больной ощущает постоянную боль в левом подреберье и тошноту. Из-за нехватки ферментов появляются тошнота, диарея, рвота, резкое похудание. В дальнейшем из-за истощения запасов белка начинает развиваться аллергический организм и нарушается выработка инсулина, что приводит к сахарному диабету.
- Если изменения ПЖ вызваны липоматозом, то это необратимый процесс. Здоровая ткань железы заменяется жировой тканью. Поскольку жировые клетки не выполняют функции пищеварительных желез, организм начинает ощущать дефицит веществ, необходимых для нормального функционирования.Степень выраженности, то есть симптоматика липоматоза, полностью зависит от степени диффузных изменений поджелудочной железы. Итак, если болезнь имеет ограниченное распространение очага патологии, то процесс протекает бессимптомно. При неконтролируемом прогрессировании паренхима сдавливается массивным скоплением жировой ткани, что вызывает болезненные ощущения и приводит к нарушению работы простаты.
[11], [12]
Диффузные изменения паренхимы поджелудочной железы
Очень часто встречается в заключении УЗИ.Это не диагноз, а только результат исследования, указывающий на равномерное изменение тканей железы, отсутствие камней, локальных очагов, кист или опухолей. То есть УЗИ предполагает наличие изменений тканей паренхимы, причину которых необходимо выяснить.
Врачи выделяют следующие причины диффузных изменений паренхимы поджелудочной железы:
- Панкреатит (острая форма) – серьезное заболевание, возникающее в результате нарушения оттока секрета из-за воспалительного процесса в поджелудочной железе.Результат описанного выше процесса отражается диффузными изменениями паренхимы железы.
- Хронический панкреатит – одна из форм воспаления простаты. Заболевание может возникнуть из-за патологических процессов в желчном пузыре и печени или появиться самостоятельно.
- Сахарный диабет – это заболевание, при котором здоровая ткань железы заменяется жировой тканью. В результате при ультразвуковом исследовании видны диффузные изменения паренхимы органа.
Помимо диффузных изменений при исследовании паренхимы поджелудочной железы врачи могут диагностировать повышенную эхогенность органа. Эхогенность тканей считается одним из важных показателей, позволяющих оценить плотность внутренних органов. Если на УЗИ выявлена повышенная или пониженная эхогенность паренхимы поджелудочной железы, то необходимы дополнительные исследования для определения причины данной патологии. Как правило, повышенная эхогенность паренхимы поджелудочной железы возникает при:
- Воспалительный процесс с образованием фиброза – соединительная ткань рубцовывается, из-за чего участки ткани различаются по плотности.На УЗИ дает гиперэхосигнал. Заболевание может возникнуть из-за нарушения обмена веществ.
- Липоматоз простаты – это замена паренхимы тела здоровой тканью на жир. Из-за изменений наблюдается повышенная эхогенность.
- Острый и хронический панкреатит – воспалительное заболевание, приводящее к отеку органа, из-за чего изменяется плотность паренхимы, а значит, повышается эхогенность ткани.
[13], [14], [15], [16]
Диффузные изменения структуры поджелудочной железы
Бывают равномерный и неравномерный характер.Именно характер изменений указывает на то, что процессы, происходящие в железе, имеют общую, а не локальную форму. Ткани поджелудочной железы из-за воспаления и отека могут уплотняться или наоборот терять свою плотность.
При неравномерных диффузных изменениях структуры тканей железы чаще всего выявляются различные опухоли, кисты или склероз органа. Большинство изменений касается паренхимы железы, так как ее ткани имеют железистое строение.Причин, приводящих к изменению строения органа, много. Изменения говорят о нарушениях в организме, которые без дополнительной диагностики и лечения могут привести к серьезным последствиям. Поскольку простата отвечает не только за процесс пищеварения, но и за выработку жизненно важных гормонов, таких как глюкагон и инсулин.
Давайте рассмотрим наиболее распространенные факторы, которые приводят к структурным изменениям.
- Воспалительные заболевания и другие нарушения пищеварительной системы.
- Патологическая наследственность – очень часто заболевания правого желудочка передаются детям от родителей.
- Хроническое нервное перенапряжение, стресс, повышенная утомляемость.
- Неправильное питание, злоупотребление соленой, острой, жирной и сладкой пищей.
- Курение и алкоголизм.
- Возраст пациента – очень часто диффузные изменения структуры поджелудочной железы начинаются в позднем возрасте.
Задача врача – точно определить причину изменений.Но не забывайте, что изменение структуры простаты может быть симптомом многих заболеваний. То есть наличие только структурных изменений, это не повод для постановки окончательного диагноза. Врач руководствуется собранным анамнезом и результатами других исследований и анализов.
[17], [18], [19], [20]
Хронические диффузные изменения поджелудочной железы
Они могут долго не показываться. Хронические изменения указывают на наличие хронических заболеваний и воспалительных процессов.Причиной такого рода изменений может быть хронический панкреатит, фиброз или липоматоз.
- Липоматоз – это заболевание, при котором здоровые ткани железы заменяются жировыми клетками. От этого заболевания чаще всего страдают люди с сахарным диабетом.
- Если помимо хронических диффузных изменений поджелудочной железы на УЗИ выявлена повышенная эхогенность, но нормальные размеры железы сохранены, то это фиброз. Заболевание может быть вызвано нарушением обменных процессов или появиться в результате срастания соединительной ткани.
Хронические диффузные изменения поджелудочной железы указывают на однородные изменения в органе. Подобные результаты УЗИ не являются диагнозом, а служат сигналом для врача, который должен найти причину изменений и устранить ее.
[21], [22], [23]
Диффузные реактивные изменения поджелудочной железы
Означают вторичные изменения, то есть реакцию организма на болезнь. Диффузные реактивные изменения могут возникать при всех заболеваниях пищеварительной системы, поскольку функции всех органов и систем взаимосвязаны.Но чаще всего реактивные изменения указывают на проблемы с печенью или желчевыводящими путями, так как именно с ними ПЗ имеет наиболее тесную связь.
Реактивные изменения могут указывать на наличие вторичного панкреатита, который возникает у больных с заболеваниями органов пищеварения, вследствие регулярного переедания, употребления жареного, острого, соленого. Патология также возникает при определенных врожденных ферментативных нарушениях и из-за длительного приема лекарств или аномалий в развитии желчных протоков.
При ультразвуковом исследовании диффузные струйные изменения поджелудочной железы аналогичны таковым при остром панкреатите. Увеличивается одна из частей органа, чаще всего – хвост, наблюдается увеличение протока железы и изменения тканей органа. При вторичном ИМ пациент ждет полной диагностики ЖКТ, чтобы определить истинную причину данной патологии.
[24]
Диффузионные очаговые изменения поджелудочной железы
Может свидетельствовать о наличии в организме опухолевых процессов, кист или камней.Это вызвано местными, то есть очаговыми изменениями тканей поджелудочной железы. Подобные процессы могут происходить из-за заболеваний как желудочно-кишечного тракта, так и простаты.
Диффузионные очаговые изменения требуют дополнительных исследований и принудительного лечения. Как свидетельство патологического процесса в организме. Пациенты с такими результатами ультразвукового исследования должны быть готовы к длительному и, возможно, хирургическому лечению.
[25]
Диффузные фиброзные изменения поджелудочной железы
Это рубцевание, то есть уплотнение соединительной ткани.Данная патология может возникать из-за нарушения обмена веществ в организме, хронических воспалительных процессов, вирусной или алкогольной интоксикации или поражения гепатобилиарной системы. При проведении УЗИ фиброзные изменения характеризуются повышенной эхогенностью и плотностью тканей органа. Не всегда наблюдается уменьшение простаты, так как изменение размеров органа зависит от степени изменений ткани.
Фиброзные изменения могут указывать на развитие фиброзной ткани в тканях.Фиброма – доброкачественная опухоль, которая образуется из соединительной ткани, не дает метастазов и очень медленно растет. Заболевание не вызывает болезненных симптомов, поэтому диагностировать его можно только с помощью УЗИ. Но если опухоль большая, это приводит к сдавливанию простаты и органов, которые расположены рядом. В зависимости от локализации фибромы в поджелудочной железе существует определенная симптоматика:
- Боль в левом или правом подреберье, в пупке и эпигастрии – это признак поражения поджелудочной железы.
- Если фиброма расположена в головке простаты, то желтуха является симптоматической из-за закупорки протока.
- Если миома сдавливает двенадцатиперстную кишку, у пациента появляются симптомы, похожие на кишечную непроходимость (тошнота, рвота).
Фиброзные изменения требуют лечения. Лечение может проводиться как консервативное, т.е. медикаментозное, так и с помощью хирургического вмешательства. Помимо лечения пациента ждет длительный период восстановления, соблюдение здорового образа жизни и только диетическое питание (таблица диеты № 5).
[26], [27], [28]
Диффузно-дистрофические изменения поджелудочной железы
Это необратимый процесс, который связан с дефицитом жировой ткани, что приводит к патологическим изменениям в органе. Нормальные клетки простаты заменяются жировыми клетками, которые не могут стабильно функционировать и поддерживать функционирование органа. Диффузные дистрофические изменения – липодистрофия.
Жировая дегенерация возникает в результате гибели клеток органа под действием ряда факторов (воспалительные процессы, хронический панкреатит, опухоли).Из-за таких патологий организм не может восстановить свою целостность. Если дистрофия возникла из-за неисправности, а количество мертвых клеток невелико, то человек может даже не знать о подобных процессах в организме. С поджелудочной железой работать будет нормально. Если дистрофия прогрессирует, и клетки образуют очаги, то это приводит к остановке полноценной работы поджелудочной железы.
Отсутствует точная симптоматика, которая помогла бы диагностировать диффузные дистрофические изменения.Как правило, проблемы обнаруживаются при ультразвуковом обследовании. Все это говорит о том, что любые отклонения в работе простаты должны быть поводом для глубокой диагностики, которая могла бы подтвердить или опровергнуть диффузные дистрофические изменения.
[29], [30], [31], [32], [33], [34]
Диффузные изменения поджелудочной железы хвоста
Это патологический процесс, требующий детальной диагностики. Поджелудочная железа состоит из трех основных частей: головы, тела и хвоста, который уже является основной частью.Хвост имеет изогнутую грушевидную форму, поднимается вверх и плотно прилегает к селезенке. Оптимальная ширина хвоста поджелудочной железы 20-30 мм. В хвосте есть выводной проток, который имеет длину 15 см и проходит через все тело органа.
Как правило, диффузные изменения в хвосте поджелудочной железы указывают на ее уплотнение или расширение. Эти изменения связаны с нарушением проходимости селезеночной вены. На фоне этих изменений возможно развитие портальной гипертензии надпочечниковой формы.
Диффузные изменения хвоста поджелудочной железы составляют четверть всех заболеваний органов. Осмотрите хвост через селезенку или левую почку. Но лечить патологию хвоста очень сложно. Как правило, пациенту удаляют хвостовую часть простаты и блокируют кровеносные сосуды органа для поддержания его нормального функционирования. При незначительных или умеренных диффузных изменениях возможна консервативная терапия и регулярное наблюдение.
[35], [36], [37], [38]
Диффузные изменения паренхимы поджелудочной железы
Возникают при различных заболеваниях желудочно-кишечного тракта, в частности простаты.Следует отметить, что все органы человеческого тела делятся на паренхиматозные и полые. Паренхиматозные органы заполнены основной тканью, то есть паренхимой. Поджелудочная железа и печень являются паренхиматозными органами брюшной полости, поскольку они содержат железистую ткань, разделенную на множество долек соединительнотканными перегородками и покрытые капсулой.
Функционирование простаты, желчевыводящих путей и печени взаимосвязано, поскольку все эти органы имеют один проток для вывода желчи и панкреатического сока.Любые нарушения в печени отображаются на поджелудочной железе и наоборот. Диффузионные изменения паренхимы поджелудочной железы возникают в результате метаболически-дистрофических заболеваний, которые приводят к замещению нормальной ткани органа жировой или соединительной тканью.
Как правило, диффузные изменения паренхимы обнаруживаются у пожилых пациентов с сахарным диабетом, а также у людей с сердечно-сосудистыми заболеваниями и нарушениями кровообращения в простате. Изменения могут быть вызваны заболеваниями печени, органов желудочно-кишечного тракта, желчевыводящих путей или длительными инфекционно-воспалительными заболеваниями, вызывающими нарушение обмена веществ.

 Панкреатоциты замещаются адипоцитами. Проблема состоит в том, что адипоциты не способны выполнять те же внутрисекреторные и внешнесекреторные функции, присущие поджелудочной железе.
Панкреатоциты замещаются адипоцитами. Проблема состоит в том, что адипоциты не способны выполнять те же внутрисекреторные и внешнесекреторные функции, присущие поджелудочной железе.