Дисбактериоз кишечника лечение у взрослых после антибиотиков: Препараты для восстановления микрофлоры кишечника
кто виноват и что делать?
Сегодня почти все увлечены здоровым образом жизни и натуральными средствами, поэтому слово «антибиотики» для многих стало едва ли не ругательным. Действительно, антибиотикотерапия может сопровождаться неприятными побочными эффектами, однако отметать ее полностью нельзя. Без антибиотиков невозможно адекватное лечение серьезных инфекционных заболеваний; в такой ситуации «химией» пренебрегать нельзя. Запущенное воспаление может перейти в хроническую форму или спровоцировать серьезные осложнения, в результате чего организму может быть нанесен еще больший урон. В этом вопросе стоит доверять лечащему врачу: к примеру, антибиотики при тяжелой ангине, отите или пневмонии неизбежны, в противном случае здоровье и даже жизнь может оказаться в серьезной опасности.
Антибиотиков избегать нельзя: в лечении многих инфекций они незаменимы
Потребность в антибиотиках для лечения сильных воспалений очевидны. Но о побочных эффектах также стоит помнить. Один из самых распространенных – дисбактериоз после приема антибиотиков. Причина дисбактериоза заключается в том, что антибактериальные препараты уничтожают не только возбудителей инфекционных заболеваний, но и полезные бактерии кишечной микрофлоры, а также микрофлоры половых органов.
Но о побочных эффектах также стоит помнить. Один из самых распространенных – дисбактериоз после приема антибиотиков. Причина дисбактериоза заключается в том, что антибактериальные препараты уничтожают не только возбудителей инфекционных заболеваний, но и полезные бактерии кишечной микрофлоры, а также микрофлоры половых органов.
Если антибиотикотерапия была согласована с врачом и не была очень продолжительной, а пациент питался полноценно то дефицит полезных бактерий быстро компенсируется, и функция кишечника восстанавливается за 2-3 недели. Но если больной принимает антибиотики при выраженном дисбактериозе или занимается самолечением, проблем с микрофлорой кишечника не избежать. Особенно подвержены дисбактериозу дети и люди пожилого возраста.
Симптомы дисбактериоза после антибиотиковПроявляться эта неприятность может по-разному: от незначительного расстройства стула до целого комплекса тяжелых и неприятных симптомов. Самые распространенные из них – колики, метеоризм, вздутие живота, чередование запора и диареи. У малышей также может повышаться температура, из-за чего дисбактериоз у детей легко спутать с отравлением или кишечной инфекцией.
Самые распространенные из них – колики, метеоризм, вздутие живота, чередование запора и диареи. У малышей также может повышаться температура, из-за чего дисбактериоз у детей легко спутать с отравлением или кишечной инфекцией.
Симптомы дисбактериоза могут проявляться как непосредственно во время приема антибиотиков, так и после курса.
Неосторожный прием антибиотиков часто влечет за собой дисбиоз кишечника
Лечение дисбактериоза заключается в компенсации урона, нанесенного микрофлоре кишечника, а также поддержка пищеварения: недостаток полезных бактерий его значительно затрудняет. Поэтому основные составляющие терапии – это  Своевременная профилактика особенно важна, если нарушения кишечной микрофлоры или антибиотикотерапия имели место ранее.
Своевременная профилактика особенно важна, если нарушения кишечной микрофлоры или антибиотикотерапия имели место ранее.
Не менее важно соблюдать диету при дисбактериозе. В ежедневном рационе должны быть натуральные источники лактобактерий (пробиотики) – кисломолочные продукты, квашеные овощи, а также источники пектинов и пищевых волокон (пребиотики), которые служат питанием для полезных микроорганизмов – овощи, фрукты, ягоды, зелень, орехи. Для успешного лечения дисбактериоза
также необходимы препараты-пробиотики. Чтобы правильно выбрать такой препарат, нужно обращать внимание на его предназначение: составы препаратов от кишечного дисбактериоза и вагинального дисбиоза несколько отличаются. Разница есть и в составах детских пробиотиков и аналогичных средств для взрослых.Дисбактериоз после приема антибиотиков – что делать
23 марта 2016 1:00
Лечение антибиотиками закончилось дисбактериозом – как его лечить
Дисбактериоз – серьезная проблема не только для самого заболевшего, но и для окружающих.
Прием антибиотиков неизбежно наносит удар по микрофлоре кишечника. Вместе с болезнетворными, опасными бактериями уничтожаются и микробы-помощники, населяющие желудочно-кишечный тракт и способствующие перевариванию пищи. Результатом становится дисбактериоз и нарушение процессов пищеварения. Поступающая в организм еда переваривается плохо, не может полностью усвоиться организмом, в кишечнике остаются достаточно крупные и грубые ее частицы, которые начинают гнить с образованием большого количества газов – так развивается метеоризм. Проблема не только во внешних неприятных симптомах: вздутии и урчании живота, болях, жидком стуле. Токсичная смесь из кишечной слизи, гниющей недопереваренной пищи и пузырьков газа забивает складки слизистой оболочки кишечника, мешает усвоению полезных веществ из еды, и даже лекарств.
Дисбактериоз – серьезная проблема не только для самого заболевшего, но и для окружающих. Метеоризм, боли, нарушения стула, которые сопровождают дисбактериоз, мешают нормально питаться и спать, жить и работать, срывают важные рабочие и личные встречи. Неудивительно, что нередко единственное желание больного – поскорее избавиться от неприятных симптомов. В попытках справиться с ними принимаются различные препараты – спазмолитики, призванные снять боль и спазмы в растянутом газами кишечнике, пеногасители, связывающие пузырьки газа, и многие другие. Но все это – лишь тщетные попытки устранить последствия, не влияющие на основную причину проблемы – дисбактериоз. После того, как время действия лекарства закончится, все вернется на круги своя. Для того чтобы этого не случилось, нужно воздействовать не на симптомы дисбактериоза, а на сам дисбактериоз. Только так можно будет добиться быстрого и действительно стойкого результата!
Неудивительно, что нередко единственное желание больного – поскорее избавиться от неприятных симптомов. В попытках справиться с ними принимаются различные препараты – спазмолитики, призванные снять боль и спазмы в растянутом газами кишечнике, пеногасители, связывающие пузырьки газа, и многие другие. Но все это – лишь тщетные попытки устранить последствия, не влияющие на основную причину проблемы – дисбактериоз. После того, как время действия лекарства закончится, все вернется на круги своя. Для того чтобы этого не случилось, нужно воздействовать не на симптомы дисбактериоза, а на сам дисбактериоз. Только так можно будет добиться быстрого и действительно стойкого результата!
Существует и другое заблуждение: дисбактериоз – временное состояние, кишечная флора обладает способностью к самовосстановлению и со временем все пройдет. Опыт людей, годами страдающих дисбактериозом, прямо указывает на ошибочность такого утверждения. Любая флора, в том числе полезные бактерии кишечника, постепенно размножается и восстанавливается, но обилие токсичных продуктов, образующихся в кишечнике при гниении пищи, также угнетает развитие полезных бактерий. Получается замкнутый круг: пища не может нормально перевариваться, так как не хватает микробов-помощников, гниет и, тем самым, уничтожает полезную бактериальную флору, которой и так не хватает. В подобной ситуации без грамотной помощи организму никак не обойтись.
Получается замкнутый круг: пища не может нормально перевариваться, так как не хватает микробов-помощников, гниет и, тем самым, уничтожает полезную бактериальную флору, которой и так не хватает. В подобной ситуации без грамотной помощи организму никак не обойтись.
Врач-терапевт клиники «Борменталь», консультант раздела «Здоровье» мейл.ру, Ольга Александровна Торозова:
«Учитывая повсеместную доступность антибиотиков, их популярность среди пациентов, которые нередко принимают такие препараты необоснованно, у дисбактериоза есть все шансы превратиться в настоящее бедствие! Терпеть неприятные симптомы, надеясь, что организм сам справится, неразумно, но так же неразумно пытаться успокоить их при помощи подручных симптоматических средств.
Побороть дисбактериоз можно комплексом из двух мероприятий: нужно удалить токсичные продукты гниения из кишечника и населить его полезной для пищеварения флорой. Следует «работать» сразу в этих двух направлениях, приняв комплексный препарат. К подобным препаратам, обладающим двойным действием, относится, например, современный энтеросорбент Жидкий уголь, в состав которого входят яблочный пектин и инулин. Яблочный пектин собирает со стенок кишечника токсичные продукты обмена веществ, впитывает и выводит из организма естественным путем. А инулин служит питательным субстратом для пищеварительных бактерий, рост которых значительно ускоряется. Через 7-10 дней приема восстанавливается нормальное переваривание пищи. Именно таким образом, а не симптоматическим приемом обезболивающих, спазмолитиков и пеногасителей можно победить дисбактериоз».
К подобным препаратам, обладающим двойным действием, относится, например, современный энтеросорбент Жидкий уголь, в состав которого входят яблочный пектин и инулин. Яблочный пектин собирает со стенок кишечника токсичные продукты обмена веществ, впитывает и выводит из организма естественным путем. А инулин служит питательным субстратом для пищеварительных бактерий, рост которых значительно ускоряется. Через 7-10 дней приема восстанавливается нормальное переваривание пищи. Именно таким образом, а не симптоматическим приемом обезболивающих, спазмолитиков и пеногасителей можно победить дисбактериоз».
Правильное лечение дисбактериоза позволит справиться не только с неприятными симптомами, но и с их первопричиной, в результате проблема останется позади.
Возникновение дисбактериоза после антибиотиков. Бифилакт БИОТА
Другие статьи из рубрики «Болезни пищеварительной системы»:
Дисбактериоз: понятие, виды, тактика лечения. Бифилакт БИОТА
Хронический дисбактериоз кишечника, признаки и симптомы..gif) Бифилакт БИОТА
Бифилакт БИОТА
Хронический дисбактериоз, от чего возникает, симптомы и причины. Бифилакт биота
Диета во время дисбактериоза, продукты для взрослых и детей. Бифилакт БИОТА
Повышение температуры во время дисбактериоза. Бифилакт БИОТА
Сыпь при дисбактериозе: причины и симптомы у детей и взрослых. Бифилакт БИОТА
Основные причины развития дисбактериоза. Бифилакт БИОТА
Перечень лекарств от дисбактериоза. Бифилакт БИОТА
Возникновение дисбактериоза после антибиотиков. Бифилакт БИОТА
Диета при дисбактериозе. Бифилакт БИОТА
Какой врач лечит дисбактериоз кишечника: симптомы, причины заболевания. Бифилакт БИОТА
Грибковое поражение пищеварительной системы
Запор и его лечение, причины, профилактика. Бифилакт БИОТА
Средства от запора. Таблетки, прибиотики, слабительные. Бифилакт БИОТА
Эффективные домашние средства от запора. Бифилакт БИОТА
Что есть во время запора. Бифилакт БИОТА
Запор у пожилых, основные причины, терапия. Бифилакт БИОТА
Бифилакт БИОТА
Запор у взрослого человека, причины возникновения и лечение. Бифилакт БИОТА
Что делать при возникновении запора. Несколько действенных советов. Бифилакт БИОТА
Как в домашних условиях делать клизму, во время запора. Бифилакт БИОТА
Лактазная недостаточность. Бифилакт БИОТА
Вздутие кишечника: лечение вздутия кишечника. Бифилакт БИОТА
Причины вздутия живота и появления запора. Бифилакт БИОТА
Бифилакт БИОТА для лечения печени
Бифилакт БИОТА для лечения желудка
Синдром раздраженного кишечника. Бифилакт БИОТА
Колит: симптомы и лечение. Бифилакт БИОТА
Энтероколит: симптомы и лечение энттороколита. Бифилакт БИОТА
Бифилакт БИОТА для лечения кишечника
Организм человека подвергается воздействию антибиотиков не только при приеме антибиотиков в случае каких-то заболеваний у конкретного индивидуума, но и при поедании продуктов ( мясо животных или растений), подвергшихся воздействию антибиотиков.
 Антибиотики не помогают. Приходится ученым искать все новые и новые антибиотики и способы борьбы с патогенными бактериями и теми болезнями, которые они вызывают. Ученые и медики обеспокоены такими темпами нарастания устойчивости микрофлоры к антибиотикам и обращаются с призывами прекратить бесконтрольное применение антибиотиков. Антибиотики должен назначать только врач после правильного подбора антибиотика и определения чувствительности патогенных бактерий, вызвавших заболевание, к конкретным антибиотикам. Более того, прием антибиотиков должен быть строго дозированным по количеству и длительности применения. Особенное значение приобретает кишечная микрофлора, которая подвергается вредным изменениям после антибиотикотерапии и становится резервуаром измененных бактерий с генами устойчивости к антибиотикам.
Антибиотики не помогают. Приходится ученым искать все новые и новые антибиотики и способы борьбы с патогенными бактериями и теми болезнями, которые они вызывают. Ученые и медики обеспокоены такими темпами нарастания устойчивости микрофлоры к антибиотикам и обращаются с призывами прекратить бесконтрольное применение антибиотиков. Антибиотики должен назначать только врач после правильного подбора антибиотика и определения чувствительности патогенных бактерий, вызвавших заболевание, к конкретным антибиотикам. Более того, прием антибиотиков должен быть строго дозированным по количеству и длительности применения. Особенное значение приобретает кишечная микрофлора, которая подвергается вредным изменениям после антибиотикотерапии и становится резервуаром измененных бактерий с генами устойчивости к антибиотикам.Дисбактериоз после антибиотиков: как появляется патология
Если антибиотики назначаются в несоответствии с дозировкой, самостоятельно, используются некачественные или простроченные препараты, а также, если лечение продлевается без необходимости – все это ухудшает состав микрофлоры, развивая устойчивость к антибиотикам.
В зависимости от применяемых антибактериальных препаратов, как у взрослых, так и у детей, проявляются различные патологические изменения:
Аминопенициллины – после неконтролируемого и длительного использования происходит рост стафилококков и стрептококков;
Тетрациклины – после попадания внутрь, препараты негативно влияют на слизистую поверхность кишечника, нарушая ее, что приводит к увеличению роста вредных микроорганизмов, в частности клостидий, кандиды и стафилококков.
Фунгициды – под действием данных препаратов происходит размножение эшерихий и протейных бактерий.
Аминогликозиды – негативно сказываются на росте полезных бактерий.
Антибиотики вызывают такие мутации (изменения) генов у бактерий в кишечнике, которые приводят к тому, что ранее условно-патогенная бактерия становится патогенной и начинает проявлять свои агрессивные свойства, что приводит к острому проявлению заболевания. В частности часто встречаются диареи, связанные с приемом антибиотиков. Так, например, такие микроорганизмы, как Klebsiellapneumoniae(Клебсиелла пневмония) , Staphylococcusaureus(Золотистый стафилококк), Clostridiumdifficile (Клостридиядифициле) могут начать проявлять свою патогенность, что может вызывать у человека, трудноизлечимые, длительные рецидивирующие инфекции и даже потенциально смертельный псевдомембранозный колит. Защитную роль от этих состояний обнаруживают бифидумбактерии. Важно поддерживать их количество в кишечнике, чтобы избежать осложнений.
В частности часто встречаются диареи, связанные с приемом антибиотиков. Так, например, такие микроорганизмы, как Klebsiellapneumoniae(Клебсиелла пневмония) , Staphylococcusaureus(Золотистый стафилококк), Clostridiumdifficile (Клостридиядифициле) могут начать проявлять свою патогенность, что может вызывать у человека, трудноизлечимые, длительные рецидивирующие инфекции и даже потенциально смертельный псевдомембранозный колит. Защитную роль от этих состояний обнаруживают бифидумбактерии. Важно поддерживать их количество в кишечнике, чтобы избежать осложнений.
Кроме того, одним из опасных осложнений антибиотикотерапии у людей с ослабленным иммунитетом является сепсис, когда патогенные бактерии прорываются из кишечника в кровь. Так, было показано, что изменение генов (мутации) у энтерококков и появление у них устойчивости к ванкомицину способствует попаданию его в кровь и сепсису.
У недоношенных детей, которых лечили антибиотиками широкого спектра действия, часто развивался сепсис.
Помимо инфекционных осложнений неконтролируемый и длительный прием антибиотиков может приводить к нарушению иммунного гомеостаза. Так, атопический дерматит, воспалительные и аутоиммунные заболевания, астма являются проявлением дисбактериоза кишечника. Выявлена связь между применением антибиотиков у детей в раннем возрасте,у беременных и развитием этих заболеваний у детей впоследствии. Стало очевидно, что последствия дисбактериоза, вызванного антибиотикотерапией, более выражены, если они появляются в раннем детстве, когда иммунная система ребенка только формируется. В этом случае особенно важную роль играют бифидумбактерии. Их нужное количество в кишечнике и правильное функционирования связывают со становлением и поддержанием иммунологической толерантности (устойчивости) у детей и взрослых.
Синдром раздраженного кишечника, также является частым осложнение дисбактериоза после антибиотикотерапии.
Ожирение является результатом нарушения метаболизма человека и его связывают с дисбактериозом. Это согласуется с тем, что применение антибиотиков используется для повышения веса у сельскохозяйственных животных. Кроме этого, у людей с ожирением применение антибиотиков может приводить к развитию метаболического синдрома, который представляет из себя группу метаболических состояний, которые повышают риск развития сердечно-сосудистых заболеваний, жировой болезни печени (жировой гепатоз), стеатогепатита и диабета 2-го типа.
Это согласуется с тем, что применение антибиотиков используется для повышения веса у сельскохозяйственных животных. Кроме этого, у людей с ожирением применение антибиотиков может приводить к развитию метаболического синдрома, который представляет из себя группу метаболических состояний, которые повышают риск развития сердечно-сосудистых заболеваний, жировой болезни печени (жировой гепатоз), стеатогепатита и диабета 2-го типа.
Выявлена связь с применением антибиотиков и развитием инсулинозависимого диабета 1-го типа. Повторное употребление пенициллина, цефалоспоринов, макролидов и хинолонов приводит к увеличению риска развития диабета 1-го типа. И в этом случае доказана связь с изменением микрофлоры кишечника после антибиотикотерапии.
Применение антибиотиков негативно влияют на способность организма боротся с инфекциями. Они уменьшают способность бифидумбактерий и лактобактерий и других грамположительных микроорганизмов в кишечнике выделять антибиотикоподобные вещества, чтобы бороться с инфекциями.
Антибиотики, уничтожая полезные бактерии, способствуют возникновению истончения слизистой кишечника и хроническому воспалительному процессу в кишечнике.
При антибиотикотерапии снижается количество бифидумбактерий и лактобактерий, которые производят в кишечнике короткоцепочечные жирные кислоты: ацетат, пропионат, бутират. Эти соединения являются основными факторами поддержания целостности кишечной стенки, повышают иммунологический и метаболический (обменный) гомеостаз (постоянство) и имеют важные противовоспалительные и противоопухолевые свойства. Их отсутствие при дисбактериозе приводит к целому ряду тяжелых заболеваний, в том числе, к онкологии.
Развитию дисбиоза подвержены люди в любом возрасте, даже если антибиотик подобран с учетом особенностей заболевания, возраста, результатов диагностики и соблюдения необходимой дозировки. Своевременное обнаружение нарушения содержания бифидумбактерий и лактобактерий в кишечнике, и выявление патогенной микрофлоры,позволит подобрать правильные методы восстановления количества полезной микрофлоры и профилактики дисбактериоза. Для этого используются пробиотические препараты. Эффективно восстанавливают нормальное количество полезныхбактрий в кишечнике препараты с живыми бифидумбактериями и лактобактериями. Такие бактерии имеют способность приживаться в кишечнике и оставаться в нем. Сухие препараты бактерий, лишенные жизнедеятельности, помогают только временно и выводятся из кишечника после окончания приема. В этой связи очень важно применять во время антибиотикотерапии и после нее кисломолочный пробиотический лечебно-профилактический продукт бифилакт БИОТА с живыми и активными бифидумбактериями ,лактобактериями и лечебными продуктами их жизнедеятельности: кислотами, ферментами, витаминами, микроэлементами, антибактериальными веществами, аминокислотами (ПРЕИМУЩЕСТВА БИФИЛАКТА БИОТА). Биота быстро и эффективно восстанавливает микрофлору кишечника и все ее полезные свойства для организма человека (ЛЕЧЕБНЫЕ СВОЙСТВА БИФИЛАКТА БИОТА). Эффективность бифилакта БИОТА для лечения и профилактики дисбактериоза доказана клинически в детских и взрослых лечебно-профилактических учреждениях.
Для этого используются пробиотические препараты. Эффективно восстанавливают нормальное количество полезныхбактрий в кишечнике препараты с живыми бифидумбактериями и лактобактериями. Такие бактерии имеют способность приживаться в кишечнике и оставаться в нем. Сухие препараты бактерий, лишенные жизнедеятельности, помогают только временно и выводятся из кишечника после окончания приема. В этой связи очень важно применять во время антибиотикотерапии и после нее кисломолочный пробиотический лечебно-профилактический продукт бифилакт БИОТА с живыми и активными бифидумбактериями ,лактобактериями и лечебными продуктами их жизнедеятельности: кислотами, ферментами, витаминами, микроэлементами, антибактериальными веществами, аминокислотами (ПРЕИМУЩЕСТВА БИФИЛАКТА БИОТА). Биота быстро и эффективно восстанавливает микрофлору кишечника и все ее полезные свойства для организма человека (ЛЕЧЕБНЫЕ СВОЙСТВА БИФИЛАКТА БИОТА). Эффективность бифилакта БИОТА для лечения и профилактики дисбактериоза доказана клинически в детских и взрослых лечебно-профилактических учреждениях. Бифилакт БИОТА награжден 9 Золотыми медалями за качество и функциональность. Достаточно принимать по 1-2 стакана бифилакта БИОТА в день за 20-30 минут до еды или через 40 минут после еды во время антибиотикотерапии и в течение 1,5 – 2 месяцев после окончания применения антибиотиков, чтобы профилактировать дисбактериоз.
Бифилакт БИОТА награжден 9 Золотыми медалями за качество и функциональность. Достаточно принимать по 1-2 стакана бифилакта БИОТА в день за 20-30 минут до еды или через 40 минут после еды во время антибиотикотерапии и в течение 1,5 – 2 месяцев после окончания применения антибиотиков, чтобы профилактировать дисбактериоз.
Всегда ли возникает дисбактериоз после приема антибиотиков
Антибактериальная терапия назначается при многих патологических процессах и инфекционных заболеваниях, подбор препаратов должен проводить только лечащий врач на основании диагностики. Но даже самый точный поход и соблюдений всех рекомендаций, в том числе дозировки препарата не может дать гарантию того, что через некоторое время не появиться дисбактериоз.
Также некоторые пациенты самостоятельно продлевают лечения или проводят антибактериальную профилактику, что категорически нельзя. Поэтому можно сделать вывод, что при любых обстоятельствах избежать нарушения микрофлоры не удастся, разница лишь в тяжести течения и проявления симптоматики.
Необходимо учесть, что данная патология может появиться даже у детей, находящихся на грудном вскармливании, если во время беременности женщина принимала антибактериальные препараты.
Симптомы дисбактериоза
После приема антибактериальных препаратов, дисбактериоз может развиться не только в кишечнике, но и половых органах, по-другому называется кандидоз или молочница. При таком течении больной испытывает дискомфорт в интимной зоне, появляются творожистые выделения и кислый неприятный запах. Такое состояние требует обязательного лечения, поскольку кандидоз может привести к развитию осложнений, в том числе сказаться на репродуктивной системе. Очень часто, вагинальный дисбактериоз ( ДИСБАКТЕРИОЗ В ГИНЕКОЛОГИИ: ДИСБАКТЕРИОЗ ВЛАГАЛИЩА – ВАГИНИТ) сопровождается сильным зудом влагалища и половых органов. При несвоевременном лечении и присоединении других патологий появляется боль внизу живота, что может указывать на воспалительный процесс.
При дисбактериозе кишечника у больного появляется тошнота, изжога, вздутие живота, нарушается стул. Симптомы дисбактериоза могут появиться как через сутки после начала приема антибиотиков, так и по окончанию лечения. Нередко можно встретить сочетание вагинальногои кишечного дисбактериоза.
Симптомы дисбактериоза могут появиться как через сутки после начала приема антибиотиков, так и по окончанию лечения. Нередко можно встретить сочетание вагинальногои кишечного дисбактериоза.
Сразу после появления симптоматики необходимо проконсультироваться с врачом.
Признаки дисбактериоза
Признаки дисбактериоза зависят от тяжести патологического процесса, происходящего в кишечнике. Нарушение микрофлоры проявляется в следующих признаках:
появление болей в животе;
нарушение стула, смена диареи запорами;
дискомфорт в области живота;
тошнота;
потеря аппетита;
вздутие, повышенное газообразование;
изменение цвета фекалий;
иногда боль в голове;
раздражение в заднем проходе.
В детском возрасте, помимо данной симптоматики,дисбиоз сопровождается режущими болями в животе, которые проходят после опорожнения кишечника. Также ребенка может мучить тошнота, слабость и беспокойный сон.
Также ребенка может мучить тошнота, слабость и беспокойный сон.
Если антибактериальная терапия была проведена правильно, с выполнением всех рекомендаций врача, то симптомы присутствуют частично и имеют вялотекущий характер. Если же антибиотики были использованы самостоятельно либо без учета дозировки, то у больного отмечается совокупность признаков, что значительно ухудшает качество жизни. Дисбактериоз II-IV стадии обязательно нужно лечить ( ДИСБАКТЕРИОЗ И ПОЧЕМУ ЕГО НАДО ЛЕЧИТЬ)
Терапия дисбактериоза
Лечебные мероприятия по восстановлению состава микрофлоры могут потребовать продолжительного времени. Для того чтобы терапия была эффективной , необходимо обратиться к специалисту, который после ряда обследований и на основании жалоб больного сможет подобрать максимально эффективное средство от дисбактериоза.
При любом течении заболевания лечение включает в себя следующие пункты:
прием лекарственных препаратов, помогающих нормализовать микрофлору кишечника и восстановить баланс между полезными и патогенными микроорганизмами;
включение в терапию бактериофагов, которые помогают подавить рост и численность вредных бактерий, предназначенных для лечения 1 и 2 степени дисбиоза;
соблюдение правил питания, которое заключается в исключении группы продуктов, способствующих размножению вредных бактерий и включениепробиотических продуктов, богатых живыми полезными микроорганизмами
От того, насколько будет правильно и эффективно проведено лечение зависит дальнейшее состояние здоровье кишечника. Поскольку флора кишечника очень чувствительна к внешним раздражителям, то очень важно соблюдать все рекомендации по комплексному лечению и методам профилактики, что поможет снизить до минимума риск развития дисбиоза в будущем.
Поскольку флора кишечника очень чувствительна к внешним раздражителям, то очень важно соблюдать все рекомендации по комплексному лечению и методам профилактики, что поможет снизить до минимума риск развития дисбиоза в будущем.
Терапия дисбиоза основывается не только на тяжести течения болезни, но и причинах развития. Эффективность и исход лечения может быть только при условии комплексного подхода, который состоит из следующих восстановительных мероприятий:
восстановление уровня бактерий;
восстановление опорожнения кишечника;
восстановление иммунной защиты;
возобновление транспортировки питательных веществ, получаемых из пищи в межклеточное пространство, кровь и лимфатическую систему.
Лекарственные препараты позволяютвосстановить микрофлору кишечника, устранить неприятную симптоматику болезни, а также скорректировать иммунитет.
Наиболее эффективно восстанавливает бифидумбактерии и лактобактерии в кишечнике кисломолочный пробиотический продукт лечебно-профилактического питания бифилакт БИОТА, в котором эти бактерии находятся в живом состоянии, что позволяет им адгезироваться (прикрепляться) не стенки кишечника и эффективно размножаться ( БИФИЛАКТ БИОТА ДЛЯ ЛЕЧЕНИЯ ДИСБАКТЕРИОЗА У ВЗРОСЛЫХ)
Восстановительная диета
Для того чтобы избавиться от дисбактериоза одного медикаментозного лечения недостаточно, требуется пересмотреть свое питание, исключив все продукты, которые могут ухудшить течение болезни, вызывать процессы гниения и брожения, повышенное газообразование, воспаление и боли в животе.
Весь дневной рацион следует разделить на 4 приема пищи с равными промежутками времени, данному распорядку необходимо строго придерживаться. Если дисбиоз сопровождается жидким стулом, то из рациона необходимо исключить послабляющие продукты, а именно сырые фрукты и овощи, жирное мясо и рыбу, молочные продукты, газированные напитки и сдобную выпечку, которые оказывают раздражающее воздействие на кишечник.
Если при дисбактериозе у больного нарушается опорожнение кишечника, необходимо включить в рацион растительные масла и кисломолочные продукты, исключив крепкий кофе, чай, рис, шоколад и картофель.
Во время восстановления флоры кишечника необходимо снизить до минимума потребление капусты и бобовые продукты, которые способствуют повышению газообразования. Улучшить эффективность принимаемых препаратов можно яблоками, клюквой, малиной и черникой – продуктами, обладающие антимикробными свойствами и позволяющие восполнить недостатков важных микроэлементов и витаминов, при условии отсутствия на них негативной реакции организма.
Перечень продуктов, которые необходимо включить в свой рацион:
растительное и сливочное масло;
продукты пчеловодства;
некрепкий чай, компоты и кисели;
овощи и фрукты, в тушенном или запеченном виде;
ягоды;
отварное или тушенное нежирное мясо;
вареные куриные яйца или омлет;
кисломолочные продукты – бифилакт БИОТА ( ссылка «ОПИСАНИЕ БИФИЛАКТА БИОТА)
молоко и сметану в малых количествах можно включать в готовые блюда или использовать для их приготовления;
пшено, греча, кукуруза и рис в виде каши;
овощные супы.
Продукты, которые необходимо исключить из меню:
продукты, содержащие, добавки, красители и консерванты;
восточные сладости, конфеты, шоколад;
крабовые палочки и другие имитированные рыбные продукты;
приправы;
острое, копченное;
консервы;
маринованные продукты;
сыр, сладкие йогурты, мороженое;
жирное мясо и рыба;
сосиски, колбасы, фастфуд.

Меню можно составить самостоятельно или обратиться за помощью к специалисту.
Лекарства
Восстановление баланса микроорганизмов способствуют следующие группы препаратов:
Бактериофаги – помогают уничтожить вредные микроорганизмы. Поскольку данная группа не является токсичной, их можно применять при лечении дисбиоза у новорожденных.
Пребиотики – после попадания внутрь, обволакивают верхние отделы желудочно-кишечного тракта, что создает благоприятные условия для роста полезных бактерий.
Пробиотики – помогают восстановить микрофлору кишечника, могут содержаться в продуктах (пробиотический кисломолочный продукт лечебно-профилактического питания бифилкат БИОТА), медикаментах и БАДах.
Энтеросептики – предназначены для лечения тяжелых форм дисбактериоза, после попадания внутрь уничтожает пагубные бактерии, не затрагивая полезные.
Сорбенты – для снятия интоксикации.

Препараты для иммунитета.
Ферменты для улучшения переваривания пищи.
На сегодняшний день существует большое количествопробиотических препаратов, предназначенных для лечения дисбактериоза, но к самым популярным и эффективным относятся следующие медикаменты:
Кисломолочный пробиотический продукт лечебно-профилактического питания бифилакт БИОТА с живыми бифидумбактериями, лактобактериями. Подходит для профилактики и лечения дисбактериоза у детей и взрослых. Уникальный запатентованный продукт с доказанной высокой клинической эффективностью(ссылка « НАУЧНАЯ И КЛИНИЧЕСКАЯ РАБОТА С БИФИЛАКТОМ БИОТА).
Линекс – выпускаются в капсулах, применяется одновременно с антибиотиками, не имеет побочных эффектов и противопоказаний.
Хилак Форте – выпускается в виде жидкости, разрешено одновременно использовать с антибактериальными препаратами, а также во время беременности и кормления грудью.
 Подходит для лечения дисбактериоза в любом возрасте, не имеет противопоказаний и побочных эффектов.
Подходит для лечения дисбактериоза в любом возрасте, не имеет противопоказаний и побочных эффектов.Пробифор – сироп для нормализации микрофлоры кишечника, предназначен для ежедневного применения. Совместим с другими препаратами, в том числе с антибиотиками. Разрешено использовать детям от 6 месяцев.
БифидумБактерин – выпускается в капсулах или порошке для разведения эмульсии. Использование в детском возрасте, а также в период беременности и лактации только при назначении врача. Запрещено использовать при подтверждении кандидоза, а также во время лечения антибиотиками.
БиоБактон – выпускается в виде жидкости, разрешено использовать с детского возраста. При наличии кандидоза и аллергической реакции необходимо отменить прием, противопоказано употреблять одновременно с антибактериальными лекарствами.
Ацилакт – выпускается в таблетированной форме и в виде суспензии, запрещено использовать детям младше трех лет. При применении может быть отмечено появление аллергии, разрешено к использованию при лечении антибиотиками.
 При необходимости лечения во время беременности,требуетсяконсультация врача.
При необходимости лечения во время беременности,требуетсяконсультация врача.Лактобактерин – выпускается в таблетках и порошке для разведения суспензии, не рекомендуется использовать во время лечения антибиотиками, а также при обнаружении кандидоза. При ежедневном использовании может развиться аллергия.
Также, для лечения дисбактериоза специалист может назначить ректальные свечи, разрешенные к применению детям и взрослым: Виферон, Левомецитин, Анузол, Простопин, Лактонорм, Бифинорм – позволяют не только предотвратить воспалительный процесс в кишечнике, но и снабдить его полезными бактериями.
Лечение дисбактериоза после антибиотиков по курсу Лаважа Маткевича
ДИСБАКТЕРИОЗ: Восстановление микрофлоры после приема антибиотиков
Приём антибиотиков на протяжении длительного времени (10-14 дней) чреват таким неприятным последствием, как дисбактериоз или дисбаланс микрофлоры кишечника. Несмотря на то, что дисбактериоз не считается заболеванием, он сопровождается серьёзным дискомфортом. В некоторых случаях такое состояние проходит самостоятельно, но часто организм требует помощи в восстановлении естественного баланса.
В некоторых случаях такое состояние проходит самостоятельно, но часто организм требует помощи в восстановлении естественного баланса.
Лечение после антибиотиков часто предусматривает длительный курс пре- и пробиотиков, выпускаемых в виде таблеток, капсул, водорастворимых порошков (например, сюда можно отнести препараты бактистатин или линекс). Во многих случаях такую терапию сопровождает приём ферментных препаратов и энтеросорбентов (активированного и белого угля, диоксида кремния).
Некоторые пациенты, заработавшие дисбактериоз после длительного приема антибиотиков, пытаются лечиться не только аптечными лекарствами, но также кисломолочными продуктами, содержащими лакто- и бифидобактерии. Нередко в ход идут многочисленные народные средства: пивные дрожжи, мёд, травяные настои, растительная клетчатка.
Лечить дисбаланс кишечной микрофлоры у взрослого или ребёнка всегда нужно в комплексе. Назначая препараты после антибиотиков, врач в первую очередь порекомендует позаботиться о детоксикации организма. Эффективным способом очистки кишечника и нормализации флоры станет уникальная авторская процедура «Лаваж Маткевича», позволяющая очистить от токсинов весь желудочно-кишечный тракт от полости рта до прямой кишки, нормализовать обмен веществ и в кратчайшие сроки восстановить кишечный баланс.
Эффективным способом очистки кишечника и нормализации флоры станет уникальная авторская процедура «Лаваж Маткевича», позволяющая очистить от токсинов весь желудочно-кишечный тракт от полости рта до прямой кишки, нормализовать обмен веществ и в кратчайшие сроки восстановить кишечный баланс.
Для лечения дисбактериоза после антибиотиков рекомендован курс из 4-6 процедур «Лаважа Маткевича», предусматривающих прием внутрь специального очищающего раствора.
Положительные эффекты «Лаважа Маткевича»:
Удаляет болезнетворные микроорганизмы, не затрагивая полезные бифидо- и лактобактерии.
Быстро восстанавливает слизистую оболочку и флору кишечника.
Выводит токсины, облегчая работу печени, поджелудочной железы и почек.
Очищает кровь и лимфу.
Улучшает самочувствие, повышает общий тонус и иммунитет.
Нормализует сон.
К нам вы можете обратиться, чтобы заказать лечение у взрослых дерматита в Москве.
Эффективное лечение дисбактериоза | Клиника китайской медицины ТАО
Кишечник здорового человека содержит не менее 300 видов микроорганизмов, представляющих собой индивидуальную для каждого картину микромира. Состав микрофлоры формируется в первые несколько суток после рождения ребенка и изменяется на протяжении жизни в зависимости от множества обстоятельств (заболеваний, состояния иммунитета, питания, приема лекарственных препаратов). Нарушение микробного равновесия (изменение количественного и качественного состава микрофлоры) и есть дисбактериоз кишечника.
Читать полностьюДисбактериоз
Дисбактериоз кишечника. Причины
В настоящее время известно множество факторов, способствующих нарушению микрофлоры кишечника. В частности, следует отметить частое возникновение дисбиоза после перенесенных острых кишечных инфекций, после применения антибиотиков, способных подавлять не только патогенную, но и нормальную флору. Дисбактериоз кишечника нередко сопровождает аллергические заболевания, воспалительные болезни пищеварительной системы (язвенная болезнь желудка и кишечника, панкреатит, холецистит, колит). Провоцирующими факторами являются стресс, нерациональное питание, заболевания почек, анемия, опухоли.
В частности, следует отметить частое возникновение дисбиоза после перенесенных острых кишечных инфекций, после применения антибиотиков, способных подавлять не только патогенную, но и нормальную флору. Дисбактериоз кишечника нередко сопровождает аллергические заболевания, воспалительные болезни пищеварительной системы (язвенная болезнь желудка и кишечника, панкреатит, холецистит, колит). Провоцирующими факторами являются стресс, нерациональное питание, заболевания почек, анемия, опухоли.
Важно помнить, что дисбактериоз может носить как явный характер (сопровождаться нарушениями стула), так и быть скрытым (на его наличие могут указывать заболевания желудочно-кишечного тракта, частые простудные и инфекционные заболевания).
Представители традиционной китайской медицины связывают возникновение этого патологического состояния с нарушением энергетического баланса, ослаблением защитных сил организма.
Проявления дисбактериоза кишечника
Первым на возникновение дисбактериоза реагирует желудочно-кишечный тракт. У пациента возникает нарушение стула (понос, запор), метеоризм (вздутие и урчание в животе), позывы к дефекации, нередко, ложные и болезненные, ощущение неполного опорожнения кишечника, тошнота, рвота, неприятный привкус во рту, отрыжка, угнетение аппетита, боли в животе. Продолжительное течение патологического процесса сопровождается симптоматикой общей слабости, утомляемости, нарушением сна и работоспособности, головной болью, раздражительностью, снижением веса, анемией. У детей дисбактериоз вызывает аллергические высыпания на коже, зуд и сухость кожных покровов.
У пациента возникает нарушение стула (понос, запор), метеоризм (вздутие и урчание в животе), позывы к дефекации, нередко, ложные и болезненные, ощущение неполного опорожнения кишечника, тошнота, рвота, неприятный привкус во рту, отрыжка, угнетение аппетита, боли в животе. Продолжительное течение патологического процесса сопровождается симптоматикой общей слабости, утомляемости, нарушением сна и работоспособности, головной болью, раздражительностью, снижением веса, анемией. У детей дисбактериоз вызывает аллергические высыпания на коже, зуд и сухость кожных покровов.
Лечение дисбактериоза
Лечение дисбактериоза кишечника необходимо начинать с выявления причины и ее коррекции. Немаловажное значение имеет нормализация питания пациента, обязательными компонентами которого должны стать крупы, свежие овощи и фрукты, орехи, кисломолочные продукты, создающие благоприятные условия для роста и размножения нормальной микрофлоры кишечника — пребиотики. Кроме того, необходимо исключить влияние ряда факторов: например, антибиотики и сульфаниламидные препараты угнетают не только патогенные микроорганизмы, но и нормальную микрофлору, а в результате обильно размножаются микробы, попадающие извне или особо устойчивые к лекарственным средствам. Европейская медицина предлагает для лечения дисбактериоза комплекс лекарственных препаратов, содержащих живые микроорганизмы, генноинженерные штаммы микроорганизмов, а также продукты, так называемого, функционального питания, создающие в кишечнике человека благоприятную среду для роста флоры. Стоит, однако, отметить, что это лечение довольно длительное и дорогостоящее, а результат не всегда может удовлетворять пациента.
Кроме того, необходимо исключить влияние ряда факторов: например, антибиотики и сульфаниламидные препараты угнетают не только патогенные микроорганизмы, но и нормальную микрофлору, а в результате обильно размножаются микробы, попадающие извне или особо устойчивые к лекарственным средствам. Европейская медицина предлагает для лечения дисбактериоза комплекс лекарственных препаратов, содержащих живые микроорганизмы, генноинженерные штаммы микроорганизмов, а также продукты, так называемого, функционального питания, создающие в кишечнике человека благоприятную среду для роста флоры. Стоит, однако, отметить, что это лечение довольно длительное и дорогостоящее, а результат не всегда может удовлетворять пациента.
В отличие от европейской, в традиционной китайской медицине для лечения дисбактериоза применяется комплексный подход, основная цель которого — создание в организме пациента благоприятных условий для самовосстановления. То есть происходит нормализация энергетического баланса, восстановление работы кишечника и иммунитета. Врачи клиники китайской медицины «ТАО» практикуют эффективные и безопасные методики лечения дисбактериоза у женщин и мужчин, у взрослых и детей по индивидуальным программам.
Врачи клиники китайской медицины «ТАО» практикуют эффективные и безопасные методики лечения дисбактериоза у женщин и мужчин, у взрослых и детей по индивидуальным программам.
Дисбактериоз у ребенка после приема антибиотиков | Мамоведия
Очень часто случается так, что при лечении у ребенка таких заболеваний, как ангина, бронхит либо воспаление легких, без антибиотиков не обойтись. При таких болезнях применение антибиотиков в лечении является стандартным и необходимым решением.
Но, прием антибиотиков у ребенка может привести к нежелательным последствиям для здоровья малыша. Самым распространенным последствием после приема антибиотиков является дисбактериоз у ребенка.
При дисбактериозе у ребенка после приема антибиотиков происходит процесс качественного изменения нормального состава бактерий в кишечнике. Кроме этого, при дисбактериозе нарушается равновесие микрофлоры кишечника.
Прием антибиотиков ребенком приводит к тому, что в кишечнике уменьшается количество полезных бактерий, что является причиной возникновения таких симптомов дисбактериоза у ребенка, как вздутие живота, диарея или послабление стула, дискомфорт и распирающие боли в животе, метеоризм, иногда запор, чувство переполненного желудка, тошнота, отрыжка. Кроме этого, при дисбактериозе после приема антибиотиков происходит изменение характера стула малыша – он становится кашицеобразным, пенистым и имеет достаточно неприятный запах. Также дисбактериоз у ребенка может сопровождаться различными видами анемии и пищевой аллергии.
Кроме этого, при дисбактериозе после приема антибиотиков происходит изменение характера стула малыша – он становится кашицеобразным, пенистым и имеет достаточно неприятный запах. Также дисбактериоз у ребенка может сопровождаться различными видами анемии и пищевой аллергии.
У самых маленьких деток при дисбактериозе могут наблюдаться высыпания на плечах и лице, а также развиваться диатез.
В том случае, если прием антибиотиков является острой необходимостью, во избежание возникновения дисбактериоза у ребенка, вместе с приемом антибиотиков назначают одновременный прием пробиотиков. Во время того, как антибиотики занимаются уничтожением инфекции в организме ребенка, пробиотики способствуют росту и размножению полезных и необходимых бактерий в кишечнике.
Прием пробиотиков во время приема антибиотиков очень важен, поскольку лечить дисбактериоз потом – очень непростая задача. Связано это с тем, что процесс восстановления полезной микрофлоры кишечника у ребенка занимает достаточно много времени. Поэтому прием пробиотиков нужно начать с первого дня приема антибиотиков.
Поэтому прием пробиотиков нужно начать с первого дня приема антибиотиков.
Дисбиоз, связанный с антибиотиками, влияет на способность кишечной микробиоты контролировать воспаление кишечника при трансплантации фекальной микробиоты на экспериментальных моделях колита | Microbiome
Kamada N, Seo SU, Chen GY, Nunez G. Роль микробиоты кишечника в иммунитете и воспалительных заболеваниях. Nat Rev Immunol. 2013. 13 (5): 321–35.
CAS PubMed Статья PubMed Central Google ученый
Моди С.Р., Коллинз Дж. Дж., Релман Д.А.Антибиотики и микробиота кишечника. J Clin Invest. 2014. 124 (10): 4212–8.
PubMed PubMed Central Статья Google ученый
Баумлер А.Дж., Сперандио В. Взаимодействие между микробиотой и патогенными бактериями в кишечнике. Природа. 2016; 535 (7610): 85–93.
CAS PubMed PubMed Central Статья Google ученый

Ракофф-Нахум С., Паглино Дж., Эслами-Варзане Ф., Эдберг С., Меджитов Р.Распознавание комменсальной микрофлоры толл-подобными рецепторами необходимо для гомеостаза кишечника. Клетка. 2004. 118 (2): 229–41.
CAS PubMed Статья PubMed Central Google ученый
Скотт Н.А., Андрусайт А., Андерсен П., Лоусон М., Алкон-Гинер С., Леклер С., Кайм С., Ле Галл Г., Шоу Т., Коннолли Дж.П.Р и др. Антибиотики вызывают устойчивую дисрегуляцию кишечного Т-клеточного иммунитета, нарушая гомеостаз макрофагов.Sci Transl Med. 2018; 10 (464): eaao4755.
PubMed PubMed Central Статья CAS Google ученый
Burrello C, Garavaglia F, Cribiu FM, Ercoli G, Bosari S, Caprioli F, Facciotti F. Кратковременное пероральное лечение антибиотиками способствует воспалительной активации инвариантных Т-киллеров толстой кишки и обычных CD4 (+) Т-клеток . Фронт Мед (Лозанна). 2018; 5: 21.
2018; 5: 21.
Артикул Google ученый
Кронман М.П., Заутис Т.Э., Хейнс К., Фенг Р., Гроб С.Е. Воздействие антибиотиков и развитие ВЗК у детей: популяционное когортное исследование. Педиатрия. 2012; 130 (4): e794–803.
PubMed PubMed Central Статья Google ученый
Shaw SY, Blanchard JF, Bernstein CN. Связь между применением антибиотиков на первом году жизни и воспалительным заболеванием кишечника у детей. Am J Gastroenterol. 2010. 105 (12): 2687–92.
PubMed Статья Google ученый
Убеда C, Таур Y, Jenq RR, Equinda MJ, Son T, Samstein M, Viale A, Socci ND, van den Brink MR, Kamboj M, et al. Устойчивый к ванкомицину Enterococcus преобладание кишечной микробиоты становится возможным благодаря лечению антибиотиками у мышей и предшествует инвазии кровотока у людей. J Clin Invest. 2010. 120 (12): 4332–41.
2010. 120 (12): 4332–41.
CAS PubMed PubMed Central Статья Google ученый
Льюис ББ, Баффи К.Г., Картер Р.А., Лейнер И., Туссент, Северная Каролина, Миллер Л.С., Гобурн А., Линг Л., Памер Э.Г. Утрата опосредованной микробиотой устойчивости к колонизации инфекции Clostridium difficile при пероральном приеме ванкомицина по сравнению с метронидазолом. J Infect Dis. 2015; 212 (10): 1656–65.
CAS PubMed PubMed Central Статья Google ученый
Глик Л. Р., Соссенхаймер PH, Оллех Дж. Э., Коэн Р. Д., Хайман Н. Х., Херст Р. Д., Рубин Д. Т..Низкие дозы метронидазола связаны со снижением частоты эндоскопических рецидивов болезни Крона после резекции подвздошной кишки: ретроспективное когортное исследование. Колит Дж. Крона. 2019; 13 (9): 1158–62.
PubMed PubMed Central Статья Google ученый

Буррелло С., Джуффре М.Р., Макандог А.Д., Диас-Басабе А., Крибиу Ф.М., Лопес Г., Борго Ф., Нези Л., Каприоли Ф., Векки М. и др. Трансплантация фекальной микробиоты контролирует хроническое кишечное воспаление у мышей, модулируя функции иммунных клеток и состав кишечной микробиоты.Ячейки. 2019; 8 (6): 517.
CAS PubMed Central Статья PubMed Google ученый
Burrello C, Garavaglia F, Cribiu FM, Ercoli G, Lopez G, Troisi J, Colucci A, Guglietta S, Carloni S, Guglielmetti S, et al. Терапевтическая трансплантация фекальной микробиоты контролирует воспаление кишечника за счет секреции IL10 иммунными клетками. Nat Commun. 2018; 9 (1): 5184.
PubMed PubMed Central Статья CAS Google ученый
Альбанезе Д., Фонтана П., Де Филиппо С., Кавальери Д., Донати К. MICCA: полное и точное программное обеспечение для таксономического профилирования метагеномных данных. Научный доклад 2015; 5: 9743.
Научный доклад 2015; 5: 9743.
CAS PubMed PubMed Central Статья Google ученый
Ван К., Гаррити ГМ, Тидже Дж. М., Коул Дж. Р.. Наивный байесовский классификатор для быстрого отнесения последовательностей рРНК к новой бактериальной таксономии. Appl Environ Microbiol. 2007. 73 (16): 5261–7.
CAS PubMed PubMed Central Статья Google ученый
ДеСантис Т., Хугенхольц П., Келлер К., Броди Е., Ларсен Н., Пичено И., Фан Р., Андерсен Г.Л. NAST: сервер множественного выравнивания последовательностей для сравнительного анализа генов 16S рРНК. Nucleic Acids Res. 2006; 34 (приложение 2): W394–9.
CAS PubMed PubMed Central Статья Google ученый
ДеСантис Т.З., Хугенхольц П., Ларсен Н., Рохас М., Броди Е.Л., Келлер К., Хубер Т., Далеви Д., Ху П., Андерсен Г. Л. Greengenes, проверенная химерами база данных генов 16S рРНК и рабочая среда, совместимая с ARB. Appl Environ Microbiol. 2006. 72 (7): 5069–72.
Л. Greengenes, проверенная химерами база данных генов 16S рРНК и рабочая среда, совместимая с ARB. Appl Environ Microbiol. 2006. 72 (7): 5069–72.
CAS PubMed PubMed Central Статья Google ученый
Цена МН, Дехал П.С., Аркин А.П. FastTree 2 – деревья приблизительно максимального правдоподобия для больших трасс. PLoS One.2010; 5 (3): e9490.
PubMed PubMed Central Статья CAS Google ученый
МакМурди П.Дж., Холмс С. Филозек: пакет R для воспроизводимого интерактивного анализа и графики данных переписи микробиома. PLoS One. 2013; 8 (4): e61217.
CAS PubMed PubMed Central Статья Google ученый
Сегата Н., Изард Дж., Уолдрон Л., Геверс Д., Миропольский Л., Гарретт В.С., Хаттенхауэр К.Открытие и объяснение метагеномных биомаркеров. Genome Biol. 2011; 12 (6): R60.
PubMed PubMed Central Статья Google ученый
Брейман Л. Случайные леса. Машинное обучение. 2001. 45 (1): 5–32.
Артикул Google ученый
Мерфи М.А., Эванс Дж. С., Сторфер А. Количественная оценка связи Bufo boreas в Йеллоустонском национальном парке с ландшафтной генетикой.Экология. 2010. 91 (1): 252–61.
PubMed Статья Google ученый
Роггеро П., Лиотто Н., Поцци С., Брага Д., Троизи Дж., Менис С., Джанни М.Л., Берни Канани Р., Папаро Л., Ночерино Р. и др. Анализ созревания иммунитета, микробиоты и метаболома у младенцев в клинических испытаниях смеси, ферментированной Lactobacillus paracasei CBA L74. Nat Commun. 2020; 11 (1): 2703.
CAS PubMed PubMed Central Статья Google ученый
Sumner LW, Amberg A, Barrett D, Beale MH, Beger R, Daykin CA, Fan TW, Fiehn O, Goodacre R, Griffin JL, et al. Предлагаемые минимальные стандарты отчетности для химического анализа Инициатива по стандартам метаболомики Рабочей группы по химическому анализу (CAWG) (MSI). Метаболомика. 2007. 3 (3): 211–21.
Предлагаемые минимальные стандарты отчетности для химического анализа Инициатива по стандартам метаболомики Рабочей группы по химическому анализу (CAWG) (MSI). Метаболомика. 2007. 3 (3): 211–21.
CAS PubMed PubMed Central Статья Google ученый
Волд С., Сьёстрём М., Эрикссон Л. PLS-регрессия: основной инструмент хемометрики.PLS методы. 2001; 58: 109–30.
CAS Google ученый
Сиси-Ахо М., Катаямаа М., Етукури Л., Оресич М. Метод нормализации данных метаболомики с использованием оптимального выбора нескольких внутренних стандартов. Биоинформатика BMC. 2007; 8: 93.
PubMed PubMed Central Статья CAS Google ученый
Caprioli F, Pallone F, Monteleone G. Иммунный ответ Th27 при ВЗК: новый патогенетический механизм.Колит Дж. Крона. 2008. 2 (4): 291–5.
PubMed Статья Google ученый

Burrello C, Pellegrino G, Giuffre MR, Lovati G, Magagna I, Bertocchi A, Cribiu FM, Boggio F, Botti F, Trombetta E, et al. Микробиота, связанная со слизистой оболочкой, управляет патогенными функциями в кишечных iNKT-клетках, происходящих от ВЗК. Life Sci Alliance. 2019; 2 (1): e201800229.
PubMed PubMed Central Статья Google ученый
Мариотти С., Нисини Р.: Создание клонов Т-клеток человека. В: Протоколы Т-клеток. изд .: Springer; 2009: 65-93.
Team RC: язык и среда для статистических вычислений. R Фонд статистических вычислений, 2015; Вена, Австрия. В.; 2016.
Бенджамини Ю., Хохберг Ю. Контроль уровня ложных открытий: практичный и эффективный подход к множественному тестированию. J R Stat Soc B Methodol. 1995: 289–300.
Ревель В.Психология: процедуры психологических, психометрических и личностных исследований. Пакет R версии 1.3. 10. Эванстон: Северо-Западный университет; 2013.
Google ученый
Камп П., Вурм П., Грохениг Х.П., Венцл Х., Петрич В., Халвакс Б., Вагнер М., Штадлбауэр В., Эхерер А., Хоффманн К.М. и др. Таксономический состав кишечной микробиоты донора является основным фактором, влияющим на эффективность трансплантации фекальной микробиоты при терапии рефрактерного язвенного колита.Алимент Pharmacol Ther. 2018; 47 (1): 67–77.
CAS PubMed Статья PubMed Central Google ученый
Иванов И.И., Атараши К., Манель Н., Броди Е.Л., Шима Т., Караоз У, Вей Д., Гольдфарб К.С., Санти Калифорния, Линч С.В. Индукция кишечных клеток Th27 сегментированными нитчатыми бактериями. Клетка. 2009. 139 (3): 485–98.
CAS PubMed PubMed Central Статья Google ученый
An D, Oh SF, Olszak T, Neves JF, Avci FY, Erturk-Hasdemir D, Lu X, Zeissig S, Blumberg RS, Kasper DL. Сфинголипиды симбиотического микроба регулируют гомеостаз Т-клеток-естественных киллеров кишечника хозяина. Клетка. 2014. 156 (1-2): 123–33.
Сфинголипиды симбиотического микроба регулируют гомеостаз Т-клеток-естественных киллеров кишечника хозяина. Клетка. 2014. 156 (1-2): 123–33.
CAS PubMed PubMed Central Статья Google ученый
Проект микробиома человека C. Структура, функции и разнообразие здорового микробиома человека. Природа. 2012. 486 (7402): 207–14.
Артикул CAS Google ученый
Irrazabal T, Thakur BK, Kang M, Malaise Y, Streutker C, Wong EOY, Copeland J, Gryfe R, Guttman DS, Navarre WW, et al. Ограничение окислительного повреждения ДНК снижает вызванный микробами колоректальный колит, связанный с колитом. Nat Commun. 2020; 11 (1): 1802.
CAS PubMed PubMed Central Статья Google ученый
Белчева А., Ирразабал Т., Робертсон С.Дж., Стрейткер С., Моган Х., Рубино С., Морияма Е.Х., Коупленд Дж.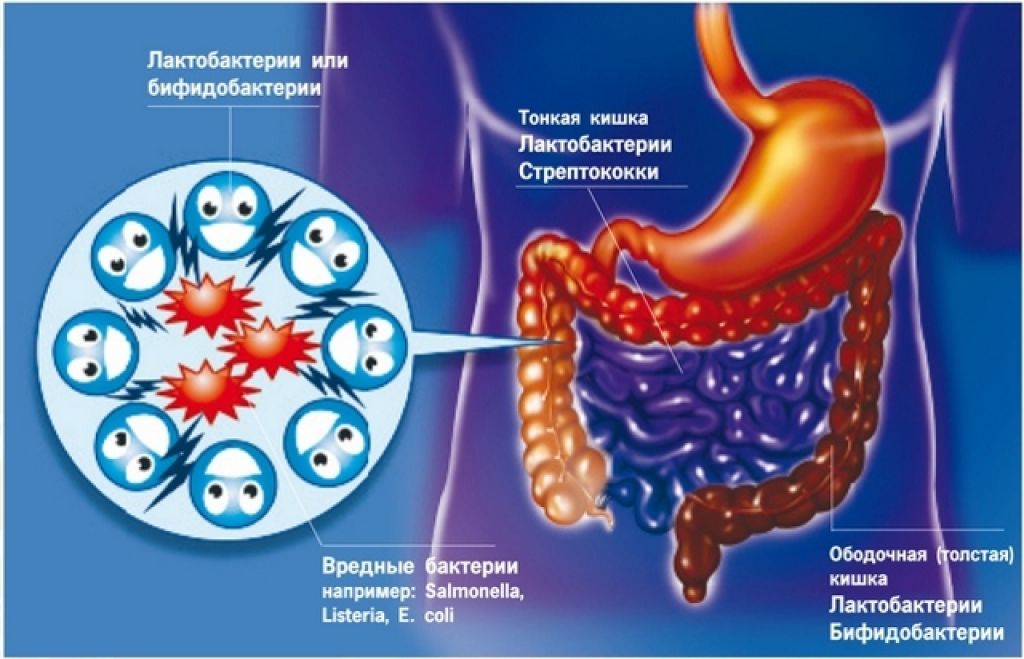 К., Сурендра А., Кумар С. и др. Микробный метаболизм кишечника управляет трансформацией эпителиальных клеток толстой кишки с дефицитом MSh3. Клетка. 2014. 158 (2): 288–99.
К., Сурендра А., Кумар С. и др. Микробный метаболизм кишечника управляет трансформацией эпителиальных клеток толстой кишки с дефицитом MSh3. Клетка. 2014. 158 (2): 288–99.
CAS PubMed Статья PubMed Central Google ученый
Кумар А., Ву Х., Кольер-Хьямс Л.С., Квон Ю.М., Хансон Дж.М., Нейш А.С. Бактериальный продукт ферментации, бутират, влияет на передачу сигналов эпителия посредством опосредованных реактивными формами кислорода изменений недилирования кулина-1.J Immunol. 2009. 182 (1): 538–46.
CAS PubMed PubMed Central Статья Google ученый
Смит П.М., Ховитт М.Р., Паников Н., Мишо М., Галлини К.А., Бохлули Ю.М., Гликман Дж. Н., Гарретт WS. Микробные метаболиты, короткоцепочечные жирные кислоты, регулируют гомеостаз Treg-клеток толстой кишки. Наука. 2013; 341 (6145): 569–73.
CAS PubMed Статья Google ученый

Фурусава И, Обата И, Фукуда С., Эндо Т.А., Накато Дж., Такахаши Д., Наканиши И., Уэтаке С., Като К., Като Т. и др. Бутират комменсального микроба индуцирует дифференцировку регуляторных Т-клеток толстой кишки. Природа. 2013. 504 (7480): 446–50.
CAS PubMed Статья Google ученый
Аморосо С., Перилло Ф., Страти Ф., Фантини М., Каприоли Ф., Фаччиотти Ф. Роль биомодуляторов кишечной микробиоты на иммунитет слизистой оболочки и воспаление кишечника.Ячейки. 2020; 9 (5): 1234.
CAS PubMed Central Статья PubMed Google ученый
Perillo F, Amoroso C, Strati F, Giuffre MR, Diaz-Basabe A, Lattanzi G, Facciotti F. Манипуляции с кишечной микробиотой как инструмент для лечения колоректального рака: последние достижения в ее использовании в терапевтических целях. Int J Mol Sci. 2020; 21 (15): 5389.
CAS PubMed Central Статья PubMed Google ученый

Гао Х, Цао Ц., Ченг И, Чжао Д., Ван З., Ян Х, Ву Ц., Ю Л., Ван И, Лин И и др. Хронический стресс способствует развитию колита, нарушая микробиоту кишечника и вызывая реакцию иммунной системы. Proc Natl Acad Sci U S. A. 2018; 115 (13): E2960–9.
PubMed PubMed Central Статья Google ученый
Ллойд-Прайс Дж., Арз К., Анантакришнан А.Н., Ширмер М., Авила-Пачеко Дж., Пун Т.В., Эндрюс Э., Аджами Н.Дж., Бонэм К.С., Брислон С.Дж. и др.Многокомпонентность микробной экосистемы кишечника при воспалительных заболеваниях кишечника. Природа. 2019; 569 (7758): 655–62.
CAS PubMed PubMed Central Статья Google ученый
Саррабайруз Дж., Ландольфи С., Посуэло М., Уилламил Дж., Варела Е., Кларк А., Кампос Д., Эррера С., Сантьяго А., Махильс К. и др. Микробная нагрузка слизистой оболочки при болезни Крона: потенциальный предиктор реакции на трансплантацию фекальной микробиоты. EBioMedicine.2020; 51: 102611.
PubMed PubMed Central Статья Google ученый
Belzer C, de Vos WM. Микробы внутри – от разнообразия к функциям: пример Аккермансии. ISME J. 2012; 6 (8): 1449–58.
CAS PubMed PubMed Central Статья Google ученый
Ventura M, Turroni F, Motherway MOC, MacSharry J, van Sinderen D. Взаимодействия между хозяином и микробом, которые способствуют колонизации кишечника комменсальными бифидобактериями.Trends Microbiol. 2012. 20 (10): 467–76.
CAS PubMed Статья Google ученый
Theriot CM, Koenigsknecht MJ, Carlson PE Jr, Hatton GE, Nelson AM, Li B, Huffnagle GB, ZL J, Young VB. Вызванные антибиотиками изменения в микробиоме и метаболоме кишечника мыши повышают восприимчивость к инфекции Clostridium difficile. Nat Commun. 2014; 5: 3114.
PubMed PubMed Central Статья CAS Google ученый
Matsubara T, Tanaka N, Krausz KW, Manna SK, Kang DW, Anderson ER, Luecke H, Patterson AD, Shah YM, Gonzalez FJ. Метаболомика идентифицирует воспалительный каскад, связанный с диоксином и вызванным диетой стеатогепатитом. Cell Metab. 2012; 16 (5): 634–44.
CAS PubMed PubMed Central Статья Google ученый
Fais S, Pallone F, Squarcia O, Biancone L, Ricci F, Paoluzi P, Boirivant M: антигены HLA-DR на эпителиальных клетках толстой кишки при воспалительном заболевании кишечника: I.Связь с состоянием активации лимфоцитов собственной пластинки и эпителиальной экспрессией других поверхностных маркеров. Clin Exp Immunol 1987, 68 (3): 605.
Fournier B, Parkos C. Роль нейтрофилов при воспалении кишечника. Mucosal Immunol. 2012. 5 (4): 354–66.
CAS PubMed Статья Google ученый
Hill C, Guarner F, Reid G, Gibson GR, Merenstein DJ, Pot B, Morelli L, Canani RB, Flint HJ, Salminen S.Консенсусное заявление Международной научной ассоциации пробиотиков и пребиотиков относительно области применения и надлежащего использования термина пробиотик. Нат Рев Гастроэнтерол Гепатол. 2014; 11 (8): 506–14.
PubMed Статья Google ученый
Марко М.Л., Хини Д., Бинда С., Чифелли С.Дж., Коттер П.Д., Фолинье Б., Гензле М., Корт Р., Пасин Дж., Пихланто А. Польза для здоровья ферментированных продуктов: микробиота и не только. Curr Opin Biotechnol.2017; 44: 94–102.
CAS PubMed Статья Google ученый
van Zanten GC, Krych L, Roytio H, Forssten S, Lahtinen SJ, Abu Al-Soud W., Sorensen S, Svensson B, Jespersen L, Jakobsen M. Synbiotic Lactobacillus acidophilus NCFM и целлобиоза человека не влияет разнообразие кишечных бактерий, но увеличивает количество лактобацилл, бифидобактерий и жирных кислот с разветвленной цепью: рандомизированное двойное слепое перекрестное исследование.FEMS Microbiol Ecol. 2014. 90 (1): 225–36.
PubMed Статья CAS Google ученый
Велкер К., Мартин А., Колле П., Зибек М., Гросс М. Повышенная кишечная проницаемость у пациентов с воспалительным заболеванием кишечника. Eur J Med Res. 2004. 9 (10): 456–60.
CAS PubMed Google ученый
Di Giacinto C, Marinaro M, Sanchez M, Strober W, Boirivant M.Пробиотики облегчают рецидивирующий Th2-опосредованный колит у мышей, индуцируя IL-10 и IL-10-зависимые TGF-β-несущие регуляторные клетки. J Immunol. 2005. 174 (6): 3237–46.
PubMed Статья Google ученый
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно.Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом.Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу.Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в cookie-файлах может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта.Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Медицинская помощь, хирургическая помощь, консультации
Хао В.Л., Ли Ю.К. Микрофлора желудочно-кишечного тракта: обзор. Методы Мол Биол . 2004. 268: 491-502. [Медлайн].
Бурес Дж., Сирани Дж., Кохутова Д. и др.Синдром избыточного бактериального роста в тонком кишечнике. Мир J Гастроэнтерол . 2010, 28 июня, 16 (24): 2978-90. [Медлайн]. [Полный текст].
Виралли-Монод М, Тильманс Д., Кеворкян Дж. П. и др. Хроническая диарея и сахарный диабет: преобладание избыточного бактериального роста в тонкой кишке. Метаболизм диабета . 1998 24 декабря (6): 530-6. [Медлайн].
Quigley EM, Abu-Shanab A. Избыточный бактериальный рост в тонком кишечнике. Инфекция Dis Clin North Am .2010 декабря 24 (4): 943-59, viii-ix. [Медлайн].
Макэвой А., Даттон Дж., Джеймс О.Ф. Бактериальное заражение тонкого кишечника – важная причина скрытой мальабсорбции у пожилых людей. Br Med J (Clin Res Ed) . 1983, 17 сентября. 287 (6395): 789-93. [Медлайн].
Parodi A, Paolino S, Greco A, Drago F, Mansi C, Rebora A. Избыточный бактериальный рост в тонком кишечнике при розацеа: клиническая эффективность его искоренения. Клин Гастроэнтерол Гепатол .2008 июл.6 (7): 759-64. [Медлайн].
Rubio-Tapia A, Barton SH, Rosenblatt JE, Murray JA. Распространенность избыточного бактериального роста в тонкой кишке, диагностированная с помощью количественного посева кишечного аспирата при целиакии. Дж Клин Гастроэнтерол . 2009 Февраль 43 (2): 157-61. [Медлайн].
Ghoshal UC, Ghoshal U, Misra A, Choudhuri G. Частично поддающаяся лечению глютеновая болезнь, возникающая в результате избыточного бактериального роста в тонком кишечнике и непереносимости лактозы. БМК Гастроэнтерол . 2004 22 мая. 4:10. [Медлайн].
Льюис С.Дж., Франко С., Янг Дж., О’Киф С.Дж. Нарушение функции кишечника и избыточный бактериальный рост в двенадцатиперстной кишке у пациентов, получавших омепразол. Алимент Фармакол Тер . 1996 10 августа (4): 557-61. [Медлайн].
Элфик Д.А., Чу Т.С., Хайэм С.Е., Берд Н., Ахмад А., Сандерс Д.С. Избыточный бактериальный рост в тонкой кишке у пожилых людей с симптомами: можно ли диагностировать раньше? Геронтология .2005 ноябрь-декабрь. 51 (6): 396-401. [Медлайн].
Hoverstad T, Bjorneklett A, Fausa O, Midtvedt T. Короткоцепочечные жирные кислоты при синдроме избыточного бактериального роста в тонкой кишке. Сканд Дж Гастроэнтерол . 1985 Май. 20 (4): 492-9. [Медлайн].
Kocoshis SA, Schletewitz K, Lovelace G, Laine RA. Дуоденальные желчные кислоты у детей: кетопроизводные и избыточный рост аэробных бактерий в тонкой кишке [опубликованная ошибка опубликована в J Pediatr Gastroenterol Nutr, 1988, январь-февраль; 7 (1): 155]. J Педиатр Гастроэнтерол Нутр . 1987 сентябрь-октябрь. 6 (5): 686-96. [Медлайн].
Чалмерс Р.А., Вальман Х.Б., Либерман ММ. Измерение 4-гидроксифенилуксусной ацидурии в качестве скринингового теста на заболевание тонкой кишки. Clin Chem . 1979 25 октября (10): 1791-4. [Медлайн].
Sherr HP, Sasaki Y, Newman A, et al. Обнаружение бактериальной деконъюгации солей желчных кислот с помощью удобной техники анализа дыхания. N Engl J Med . 1971 16 сентября.285 (12): 656-61. [Медлайн].
Саад Р.Дж., Чей В.Д. Дыхательный тест на избыточный бактериальный рост в тонком кишечнике: максимальная точность теста. Клин Гастроэнтерол Гепатол . 2014 12 (12) декабря: 1964-72; викторина e119-20. [Медлайн].
Гасбаррини А., Корацца Г.Р., Гасбаррини Г., Монтальто М., Ди Стефано М., Базилиско Г. Методология и показания тестирования h3-дыхания при желудочно-кишечных заболеваниях: Конференция Римского консенсуса. Алимент Фармакол Тер .2009 30 марта. 29 Дополнение 1: 1-49. [Медлайн].
Hofmann AF. оценка избыточного бактериального роста в тонком кишечнике: как, когда и почему. В: Перри Ф., Андриулли А., редакторы. Клиническое применение дыхательных тестов в гастроэнтерологии и гепатологии. 1998.
Stotzer PO, Kilander AF. Сравнение дыхательного теста на 1 грамм (14) C-D-ксилозы и дыхательного теста на 50 грамм водородной глюкозы для диагностики избыточного бактериального роста в тонком кишечнике. Пищеварение .2000. 61 (3): 165-71. [Медлайн].
Peralta S, Cottone C, Doveri T, Almasio PL, Craxi A. Избыточный бактериальный рост в тонком кишечнике и симптомы, связанные с синдромом раздраженного кишечника: опыт применения рифаксимина. Мир J Гастроэнтерол . 2009, 7 июня. 15 (21): 2628-31. [Медлайн].
Пиментел М. Обзор рифаксимина для лечения СИБР и СРК. Заключение эксперта по расследованию наркотиков . 2009 марта 18 (3): 349-58. [Медлайн].
Scarpellini E, Gabrielli M, Lauritano CE, Lupascu A, Merra G, Cammarota G.Рифаксимин в высоких дозах для лечения избыточного бактериального роста в тонком кишечнике. Алимент Фармакол Тер . 2007 г., 1. 25 (7): 781-6. [Медлайн].
Frissora CL, Cash BD. Обзорная статья: роль антибиотиков по сравнению с традиционной фармакотерапией в лечении симптомов синдрома раздраженного кишечника. Алимент Фармакол Тер . 2007, 1. 25 (11): 1271-81. [Медлайн].
Тамер MA, Сантора TR, Сандберг DH. Терапия холестирамином при трудноизлечимой диарее. Педиатрия . 1974 Февраль 53 (2): 217-20. [Медлайн].
Castiglione F, Rispo A, Di Girolamo E, Cozzolino A, Manguso F, Grassia R, et al. Лечение антибиотиками избыточного бактериального роста в тонкой кишке у пациентов с болезнью Крона. Алимент Фармакол Тер . 2003 18 декабря (11-12): 1107-12. [Медлайн].
Vanderhoof JA, Young RJ. Этиология и патогенез избыточного бактериального роста. Клинические проявления и диагностика избыточного бактериального роста.Лечение избыточного бактериального роста UpToDate online, vol 18.1; Уэлсли, 2010. http://www.uptodate.com. Доступно на http://www.uptodate.com.
Banwell JG, Sherr H. Влияние бактериальных энтеротоксинов на желудочно-кишечный тракт. Гастроэнтерология . 1973 Сентябрь 65 (3): 467-97. [Медлайн].
Quigley EM, Quera R. Разрастание бактерий в тонком кишечнике: роль антибиотиков, пребиотиков и пробиотиков. Гастроэнтерология .2006 февраль 130 (2 приложение 1): S78-90. [Медлайн].
Онг Д.К., Митчелл С.Б., Барретт Дж.С., Шеперд С.Дж., Ирвинг П.М., Биесекерски Дж. Р. и др. Манипуляции с диетическими углеводами с короткой цепью изменяют характер газообразования и генезис симптомов синдрома раздраженного кишечника. J Гастроэнтерол Hepatol . 2010 25 августа (8): 1366-73. [Медлайн].
Макинтош К., Рид Д.Е., Шнайдер Т., Данг Ф., Кештели А.Х., Де Пальма Дж. И др. FODMAP изменяют симптомы и метаболизм пациентов с СРК: рандомизированное контролируемое исследование. Кишечник . 2017 июл.66 (7): 1241-1251. [Медлайн].
Мари I, Дюкротте П., Дени П., Менар Дж. Ф., Левеск Х. Избыточный бактериальный рост тонкой кишки при системном склерозе. Ревматология (Оксфорд) . 2009 Октябрь 48 (10): 1314-9. [Медлайн].
Чжун Ц., Цюй Ц., Ван Б., Лян С., Цзэн Б. Пробиотики для предотвращения и лечения избыточного бактериального роста в тонком кишечнике: метаанализ и систематический обзор имеющихся данных. Дж Клин Гастроэнтерол .2017 Апрель 51 (4): 300-311. [Медлайн].
[Рекомендации] Pimentel M, Saad RJ, Long MD, Rao SSC. Клинические рекомендации ACG: избыточный бактериальный рост в тонком кишечнике. Ам Дж. Гастроэнтерол . 2020 Февраль 115 (2): 165-178. [Медлайн].
[Руководство] Резайе А., Буреси М., Лембо А., Лин Х., МакКаллум Р., Рао С. и др. Тестирование дыхания на основе водорода и метана при желудочно-кишечных расстройствах: Североамериканский консенсус. Ам Дж. Гастроэнтерол .2017 май. 112 (5): 775-784. [Медлайн].
Hill ID, Mann MD, Househam KC, Bowie MD. Использование перорального гентамицина, метронидазола и холестирамина для лечения тяжелой стойкой диареи у младенцев. Педиатрия . 1986, апрель, 77 (4): 477-81. [Медлайн].
Abraczinskas D, Goldfinger SE. Кишечные газы и вздутие живота. UpToDate в сети, 18.1. Уэлсли, 2010. http://www.uptodate.com. Доступно на http://www.uptodate.com.
Bouhnik Y, Alain S, Attar A, et al.Бактериальные популяции, загрязняющие верхний отдел кишечника у пациентов с синдромом избыточного бактериального роста в тонком кишечнике. Ам Дж. Гастроэнтерол . 1999 Май. 94 (5): 1327-31. [Медлайн].
Дональд И.П., Китчингмэм Дж., Дональд Ф., Купфер РМ. Диагноз избыточного бактериального роста в тонкой кишке у пожилых пациентов. Дж. Ам Гериатр Соц . 1992 июл. 40 (7): 692-6. [Медлайн].
Элфик Д.А., Чу Т.С., Хайэм С.Е., Берд Н., Ахмад А., Сандерс Д.С.Избыточный бактериальный рост в тонкой кишке у пожилых людей с симптомами: можно ли диагностировать раньше? Геронтология . 2005 ноябрь-декабрь. 51 (6): 396-401. [Медлайн].
Грейси М., Берк В., Ошин А. и др. Бактерии, соли желчных кислот и мальабсорбция кишечных моносахаридов. Кишечник . 1971 Сентябрь 12 (9): 683-92. [Медлайн].
Грегг CR. Кишечная бактериальная флора и синдром избыточного бактериального роста. Семин Гастроинтест Дис . 2002 окт.13 (4): 200-9. [Медлайн].
Haboubi NY, Lee GS, Montgomery RD. Морфометрия слизистой оболочки двенадцатиперстной кишки у пожилых пациентов с избыточным бактериальным ростом тонкого кишечника: ответ на лечение антибиотиками. Возраст старения . 1991, 20 января (1): 29-32. [Медлайн].
Килби AM, Dolby JM, Honor P, Walker-Smith JA. Бактериальная флора двенадцатиперстной кишки на ранних стадиях преходящей непереносимости моносахаридов у младенцев. Арч Дис Детский . 1977 г., 52 (3): 228-34.[Медлайн].
King CE, Toskes PP. Разрастание бактерий в тонком кишечнике. Гастроэнтерология . 1979 Май. 76 (5, п. 1): 1035-55. [Медлайн].
Клиш В.Дж., Удалл Дж. Н., Родригес Дж. Т. и др. Площадь поверхности кишечника у младенцев с приобретенной непереносимостью моносахаридов. Дж. Педиатр . 1978, апрель 92 (4): 566-71. [Медлайн].
Lin HC. Разрастание бактерий в тонком кишечнике: основа для понимания синдрома раздраженного кишечника. JAMA . 2004 18 августа. 292 (7): 852-8. [Медлайн].
Матиас Дж. Р., Кленч М. Х. Обзор: патофизиология диареи, вызванной избыточным бактериальным ростом тонкой кишки. Am J Med Sci . 1985 июн. 289 (6): 243-8. [Медлайн].
Мейерс Дж.С., Эренпрейс Э.Д., Крейг Р.М. Синдром избыточного бактериального роста в тонком кишечнике. Curr Treat Options Гастроэнтерол . 2001 Февраль 4 (1): 7-14. [Медлайн].
Николс В.Н., Фрейли Дж. К., Эванс К. Д., Николс Б. Л. мл.Приобретенная непереносимость моносахаридов у грудных детей. J Педиатр Гастроэнтерол Нутр . 1989, 8 (1): 51-7. [Медлайн].
Saltzman JR, Russell RM. Пищевые последствия чрезмерного бактериального роста в кишечнике. Компр Тер . 1994. 20 (9): 523-30. [Медлайн].
Tahan S, Melli LC, Mello CS, Rodrigues MS, Bezerra Filho H, de Morais MB. Эффективность триметоприм-сульфаметоксазола и метронидазола в лечении избыточного бактериального роста в тонком кишечнике у детей, живущих в трущобах. J Педиатр Гастроэнтерол Нутр . 2013 Сентябрь 57 (3): 316-8. [Медлайн].
Различные эффекты антибиотиков на микробиоту кишечника | AMB Express
Adamsson I, Nord CE, Lundquist P, Sjöstedt S, Edlund C (1999) Сравнительные эффекты омепразола, амоксициллина плюс метронидазола по сравнению с омепразолом, кларитромицином плюс метронидазолом на микрофлору
6 кишечника, кишечника и кишечника. инфицированные пациенты. J Antimicrob Chemother 44 (5): 629–640
CAS PubMed Статья PubMed Central Google ученый
Adebowale OO, Adeyemo FA, Bankole N, Olasoju M, Adesokan HK, Fasanmi O, Adeyemo O, Awoyomi O, Kehinde O, Fasina FO (2020) Восприятие фермерами и факторы использования противомикробных препаратов и злоупотребления ими в коммерческом свиноводстве , Штат Огун, Нигерия.Int J Environ Res Public Health 17 (10): 3579
CAS PubMed Central Статья Google ученый
Alhasan MM, Cait AM, Heimesaat MM, Blaut M, Klopfleisch R, Wedel A, Conlon TM, Yildirim AÖ, Sodemann EB, Mohn WW, Bereswill S, Conrad ML (2020) Использование антибиотиков во время беременности увеличивает тяжесть астмы у потомства дозозависимым образом. Аллергия 75 (8): 1979–1990
PubMed Статья CAS PubMed Central Google ученый
Andrade BGN, Goris T, Afli H, Coutinho FH, Dávila AMR, Cuadrat RRC (2021) Предполагаемые мобилизованные гены устойчивости к колистину в микробиоме кишечника человека.BMC Microbiol 21 (1): 220
PubMed PubMed Central Статья Google ученый
Bäckhed F, Fraser CM, Ringel Y, Sanders ME, Sartor RB, Sherman PM, Versalovic J, Young V, Finlay BB (2012) Определение здорового микробиома кишечника человека: современные концепции, направления будущего и клиническое применение. Микроб-хозяин клетки 12 (5): 611–622
PubMed Статья CAS PubMed Central Google ученый
Bajaj JS, Kakiyama G, Savidge T, Takei H, Kassam ZA, Fagan A, Gavis EA, Pandak WM, Nittono H, Hylemon PB, Boonma P, Haag A, Heuman DM, Fuchs M, John B, Sikaroodi M, Gillevet PM (2018) Нарушение состава и функции микробиоты при циррозе, связанное с антибиотиками, восстанавливается с помощью трансплантации фекалий.Гепатология 68 (4): 1549–1558
CAS PubMed Статья PubMed Central Google ученый
Баджинка О., Тан Й., Абдельхалим К.А., Оздемир Г., Цю Х (2020a) Внешние факторы, влияющие на микробы кишечника, немедленные последствия и восстановление эубиоза. AMB Express 10 (1): 130
CAS PubMed PubMed Central Статья Google ученый
Bajinka O, Darboe A, Tan Y, Abdelhalim KA, Cham LB (2020b) Микробиота кишечника и физиологические изменения кишечника человека.Энн Микробиол 70:65
CAS Статья Google ученый
Bajinka O, Simbilyabo L, Tan Y, Jabang J, Saleem SA (2021) Ось легкого и мозга. Crit Rev Microbiol. https://doi.org/10.1080/1040841X.2021.1960483
Статья PubMed PubMed Central Google ученый
Bazanella M, Maier TV, Clavel T, Lagkouvardos I, Lucio M, Maldonado-Gòmez MX, Autran C, Walter J, Bode L, Schmitt-Kopplin P, Haller D (2017) Рандомизированное контролируемое испытание по влиянию раннее вмешательство с бифидобактериями в здоровую фекальную микробиоту и метаболом ребенка.Am J Clin Nutr 106 (5): 1274–1286
CAS PubMed PubMed Central Google ученый
Caballero-Flores G, Pickard JM, Fukuda S, Inohara N, Núñez G (2020) Кишечный патоген подрывает устойчивость к колонизации, уклоняясь от конкуренции за аминокислоты в кишечнике. Клеточный микроб-хозяин 28 (4): 526–533
CAS PubMed Статья PubMed Central Google ученый
Cannon K, Byrne B, Happe J, Wu K, Ward L, Chesnel L, Louie T (2017) Профили кишечного микробиома во время рандомизированного клинического исследования фазы 2 суротомицина по сравнению с ванкомицином для лечения инфекции Clostridium difficile .J Antimicrob Chemother 72 (12): 3453–3461
CAS PubMed Статья PubMed Central Google ученый
Кардетти М., Родригес С., Сола А (2020) Uso (y abuso) de antibióticos en la medicina perinatal [Использование (и злоупотребление) антибиотиками в перинатальной медицине). An Pediatr (Engl Ed) 93 (3): 207.e1-207.e7
Статья Google ученый
Citron DM, Tyrrell KL, Dale SE, Chesnel L, Goldstein EJ (2016) Влияние суротомицина на микробиоту кишечника здоровых добровольцев в клиническом испытании фазы 1.Антимикробные агенты Chemother 60 (4): 2069–2074
CAS PubMed PubMed Central Статья Google ученый
Clemente JC, Ursell LK, Parfrey LW, Knight R (2012) Влияние микробиоты кишечника на здоровье человека: комплексный взгляд. Ячейка 148 (6): 1258–1270
CAS PubMed PubMed Central Статья Google ученый
Cox LM, Blaser MJ (2015) Антибиотики в раннем возрасте и ожирение.Nat Rev Endocrinol 11 (3): 182–190
PubMed Статья PubMed Central Google ученый
Цуй Дж, Сяо М, Лю М, Ван З, Лю Ф, Го Л, Мэн Х, Чжан Х, Ян Дж, Дэн Д., Хуанг С., Ма И, Лю С. (2017) Связь метагеномики с культивированием выберите специфические для хозяина пробиотические микроорганизмы для субтропической аквакультуры. J Appl Microbiol 123 (5): 1274–1285
CAS PubMed Статья PubMed Central Google ученый
Даниали М., Никфар С., Абдоллахи М. (2020) Распространение устойчивости к антибиотикам с помощью пробиотиков.Мнение эксперта Drug Metab Toxicol 16 (12): 1207–1215
CAS PubMed Статья PubMed Central Google ученый
Дэвис Дж., Дэвис Д. (2010) Происхождение и эволюция устойчивости к антибиотикам. Microbiol Mol Biol Rev 74 (3): 417–433
CAS PubMed PubMed Central Статья Google ученый
de Gunzburg J, Ghozlane A, Ducher A, Le Chatelier E, Duval X, Ruppé E, Armand-Lefevre L, Sablier-Gallis F, Burdet C, Alavoine L, Chachaty E, Augustin V, Varastet M, Levenez F, Кеннеди С., Понс Н., Ментре Ф, Андермонт А. (2018) Защита микробиома кишечника человека от антибиотиков.J Infect Dis 217 (4): 628–636
PubMed Статья CAS PubMed Central Google ученый
De La Cochetière MF, Durand T, Lepage P, Bourreille A, Galmiche JP, Doré J (2005) Устойчивость доминирующей фекальной микробиоты человека при кратковременном введении антибиотиков. J Clin Microbiol 43 (11): 5588–5592
Статья CAS Google ученый
Dethlefsen L, Relman DA (2011) Неполное восстановление и индивидуализированные ответы микробиоты дистального отдела кишечника человека на повторяющееся воздействие антибиотиков.Proc Natl Acad Sci USA 108 (Приложение 1): 4554–4561
CAS PubMed Статья PubMed Central Google ученый
Dethlefsen L, Huse S, Sogin ML, Relman DA (2008) Распространенные эффекты антибиотика на микробиоту кишечника человека, как показали глубокое секвенирование 16S рРНК. PLoS Biol 6 (11): e280
PubMed PubMed Central Статья CAS Google ученый
Девиллард Э., Макинтош FM, Пайлард Д., Томас Н.А., Шингфилд К.Дж., Уоллес Р.Дж. (2009) Различия между людьми в составе фекального бактериального сообщества и фекальном метаболизме линолевой кислоты.Microbiology (Reading) 155 (Pt 2): 513–520
CAS Статья Google ученый
Ding Y, Saw WY, Tan LWL, Moong DKN, Nagarajan N, Teo YY, Seedorf H (2020) Появление в микробиоте кишечника здоровых сингапурцев Enterobacteriaceae, устойчивых к тигециклину и эравациклину Tet (X4). J Antimicrob Chemother 75 (12): 3480–3484
CAS PubMed Статья PubMed Central Google ученый
Ferreyra JA, Wu KJ, Hryckowian AJ, Bouley DM, Weimer BC, Sonnenburg JL (2014) Сукцинат, продуцируемый кишечной микробиотой, способствует развитию C.difficile после лечения антибиотиками или нарушения моторики. Клеточный микроб-хозяин 16 (6): 770–777
CAS PubMed PubMed Central Статья Google ученый
Ghoshal UC, Srivastava D, Misra A, Ghoshal U (2016) Доказательство концепции, показывающее, что антибиотики более эффективны при синдроме раздраженного кишечника с избыточным бактериальным ростом в тонкой кишке, чем без него: рандомизированное двойное слепое исследование , плацебо-контролируемое исследование.Eur J Gastroenterol Hepatol 28 (3): 281–289
CAS PubMed Статья PubMed Central Google ученый
Guo L, Zhang D, Fu S, Zhang J, Zhang X, He J, Peng C, Zhang Y, Qiu Y, Ye C, Liu Y, Wu Z, Hu CA (2021) Анализ метагеномного секвенирования влияние сульфата колистина на микробиом кишечника свиней. Front Vet Sci 8: 663820
PubMed PubMed Central Статья Google ученый
Hansen TH, Thomassen MT, Madsen ML, Kern T, Bak EG, Kashani A, Allin KH, Hansen T., Pedersen O (2018) Влияние pH питьевой воды на микробиоту кишечника человека и регуляцию уровня глюкозы: результаты рандомизированное контролируемое перекрестное вмешательство.Научный доклад 8 (1): 16626
PubMed PubMed Central Статья CAS Google ученый
Harris VC, Haak BW, Handley SA, Jiang B, Velasquez DE, Hykes BL Jr, Droit L, Berbers GAM, Kemper EM, van Leeuwen EMM, Boele van Hensbroek M, Wiersinga WJ (2018) Эффект антибиотика- опосредованная модуляция микробиома на иммуногенность ротавирусной вакцины: рандомизированное контрольное испытание, доказывающее правильность концепции. Клеточный микроб-хозяин 24 (2): 197–207
CAS PubMed Статья PubMed Central Google ученый
Helaly AMN, El-Attar YA, Khalil M, Ahmed Ghorab DSE, El-Mansoury AM (2019) Злоупотребление антибиотиками вызывало гистопатологические и нейроповеденческие расстройства у мышей.Curr Drug Saf 14 (3): 199–208
PubMed Статья CAS PubMed Central Google ученый
Hoang PH, Awasthi SP, Do Nguyen P, Nguyen NL, Nguyen DT, Le NH, Van Dang C, Hinenoya A, Yamasaki S (2017) Профили устойчивости к противомикробным препаратам и молекулярная характеристика штаммов Escherichia coli , выделенных из здоровых взрослые в Хошимине, Вьетнам. J Vet Med Sci 79 (3): 479–485
CAS PubMed PubMed Central Статья Google ученый
Holmes M, Flaminio Z, Vardhan M, Xu F, Li X, Devinsky O, Saxena D (2020) Перекрестный разговор между лекарственно-устойчивой эпилепсией и микробиомом кишечника.Эпилепсия 61 (12): 2619–2628
PubMed Статья PubMed Central Google ученый
Huang YL, Chassard C, Hausmann M, von Itzstein M, Hennet T (2015) Катаболизм сиаловой кислоты вызывает воспаление кишечника и микробный дисбактериоз у мышей. Nat Commun 6: 8141
CAS PubMed Статья PubMed Central Google ученый
Имханн Ф., Бондер М.Дж., Вич Вила А, Фу Дж., Муджаджич З., Ворк Л., Тигчелаар Э.Ф., Янкиперсадсинг С.А., Сенит МС, Хармсен Х.Дж., Дейкстра Дж., Франке Л., Ксавьер Р.Дж., Йонкерс Д., Вейменга С., Веерсма Р.К., Жернакова А. (2016) Ингибиторы протонной помпы влияют на микробиом кишечника.Кишечник 65 (5): 740–748
CAS PubMed PubMed Central Статья Google ученый
Islam S, Urmi UL, Rana M, Sultana F, Jahan N, Hossain B, Iqbal S, Hossain MM, Mosaddek ASM, Nahar S (2020) Высокая распространенность гена устойчивости к колистину mcr-1 в курином кишечнике. бактерии в Бангладеш. Научный представитель 10 (1): 17292
CAS PubMed PubMed Central Статья Google ученый
Jackson MA, Goodrich JK, Maxan ME, Freedberg DE, Abrams JA, Poole AC, Sutter JL, Welter D, Ley RE, Bell JT, Spector TD, Steves CJ (2016) Ингибиторы протонной помпы изменяют состав кишечная микробиота.Gut 65 (5): 749–756
PubMed PubMed Central Статья CAS Google ученый
Jakobsson HE, Jernberg C, Andersson AF, Sjölund-Karlsson M, Jansson JK, Engstrand L (2010) Кратковременное лечение антибиотиками оказывает различное долгосрочное воздействие на микробиом горла и кишечника человека. PLoS ONE 5 (3): e9836
PubMed PubMed Central Статья CAS Google ученый
Jernberg C, Löfmark S, Edlund C, Jansson JK (2010) Долгосрочное воздействие антибиотиков на микробиоту кишечника человека.Microbiology (Reading) 156 (Pt 11): 3216–3223
CAS Статья Google ученый
Jiao J, Wu J, Wang M, Zhou C, Zhong R, Tan Z (2018) Добавка ревеня способствует гомеостазу врожденного иммунитета слизистой оболочки кишечника за счет модуляции микробиоты кишечного эпителия у козлят. J Agric Food Chem 66 (4): 1047–1057
CAS PubMed Статья PubMed Central Google ученый
Йоргенсен С.Ф., Макферсон М.Э., Бьёрнетро Т., Холм К., Куммен М., Рашиди А., Михельсен А.Е., Леква Т., Халворсен Б., Трёсейд М., Моллнес Т.Э., Берге Р.К., Индестад А., Уеланд Т., Карлсен P, Hov JR, Fevang B (2019) Рифаксимин изменяет профиль микробиоты кишечника, но не влияет на системное воспаление – рандомизированное контролируемое исследование иммунодефицита с общей переменной.Научный доклад 9 (1): 167
PubMed PubMed Central Статья CAS Google ученый
Kabbani TA, Pallav K, Dowd SE, Villafuerte-Galvez J, Vanga RR, Castillo NE, Hansen J, Dennis M, Leffler DA, Kelly CP (2017) Проспективное рандомизированное контролируемое исследование эффектов Saccharomyces boulardii CNCM I-745 и амоксициллин – клавуланат или их комбинация для микробиоты кишечника здоровых добровольцев. Кишечные микробы 8 (1): 17–32
CAS PubMed Статья PubMed Central Google ученый
Korpela K, Salonen A, Virta LJ, Kekkonen RA, Forslund K, Bork P, de Vos WM (2016) Кишечный микробиом связан с пожизненным использованием антибиотиков финскими детьми дошкольного возраста.Nat Commun 7: 10410
CAS PubMed PubMed Central Статья Google ученый
Korpela K, Salonen A, Vepsäläinen O, Suomalainen M, Kolmeder C, Varjosalo M, Miettinen S, Kukkonen K, Savilahti E, Kuitunen M, de Vos WM (2018) Пробиотическая добавка восстанавливает нормальный состав антибиотиков и восстанавливает нормальный состав антибиотиков. леченных и у младенцев, рожденных с помощью кесарева сечения. Микробиом 6 (1): 182
PubMed PubMed Central Статья Google ученый
Лэнгдон А., Крук Н., Дантас Г. (2016) Влияние антибиотиков на микробиом на протяжении всей разработки и альтернативные подходы к терапевтическому модуляции.Геном Мед 8 (1): 39
PubMed PubMed Central Статья CAS Google ученый
Lange K, Buerger M, Stallmach A, Bruns T (2016) Влияние антибиотиков на микробиоту кишечника. Dig Dis 34 (3): 260–268
PubMed Статья PubMed Central Google ученый
Lankelma JM, Cranendonk DR, Belzer C, de Vos AF, de Vos WM, van der Poll T., Wiersinga WJ (2017) Вызванное антибиотиками нарушение микробиоты кишечника во время эндотоксемии человека: рандомизированное контролируемое исследование.Кишечник 66 (9): 1623–1630
CAS PubMed Статья PubMed Central Google ученый
Левин А., Кори М., Киеркус Дж., Сигалл Бонех Р., Сладек М., Эшер Дж. К., Вино Е, Йерушалми Б., Амил Диас Дж., Шауль Р., Вереман Воутерс Дж., Боаз М., Абитбол Дж., Бусварос А., Тернер D (2019) Азитромицин и метронидазол в сравнении с терапией на основе метронидазола для индукции ремиссии при болезни Крона легкой и средней степени тяжести: рандомизированное контролируемое исследование.Кишечник 68 (2): 239–247
CAS PubMed Статья PubMed Central Google ученый
Li L, Wang Q, Gao Y, Liu L, Duan Y, Mao D, Luo Y (2021) Комбинаторное воздействие колистина и амоксициллина изменяет микробиоту кишечника человека и резистентность к антибиотикам в моделируемой микробиоте кишечника человека. Sci Total Environ 750: 141415
CAS PubMed Статья PubMed Central Google ученый
Liu D, Tan Y, Bajinka O, Wang L, Tang Z (2020b) Ось Th27 / IL-17, регулируемая микробами дыхательных путей, участвует в развитии астмы.Curr Allergy Asthma Rep 20 (4): 11
PubMed Статья PubMed Central Google ученый
Liu J, Chen F, Wang X, Peng H, Zhang H, Wang KJ (2020a) Синергетический эффект антимикробных пептидов грязевого краба сфистин и Sph 12–38 с антибиотиками азитромицином и рифампицином усиливает бактерицидную активность Синегнойная палочка . Front Cell Infect Microbiol 10: 572849
CAS PubMed PubMed Central Статья Google ученый
Looft T, Johnson TA, Allen HK, Bayles DO, Alt DP, Stedtfeld RD, Sul WJ, Stedtfeld TM, Chai B, Cole JR, Hashsham SA, Tiedje JM, Stanton TB (2012) Эффекты антибиотиков в корме на микробиом кишечника свиней.Proc Natl Acad Sci USA 109 (5): 1691–1696
CAS PubMed PubMed Central Статья Google ученый
Munita JM, Arias CA (2016) Механизмы устойчивости к антибиотикам. Microbiol Spectr. https://doi.org/10.1128/microbiolspec.VMBF-0016-2015
Статья PubMed PubMed Central Google ученый
Oh B, Kim BS, Kim JW, Kim JS, Koh SJ, Kim BG, Lee KL, Chun J (2016) Влияние пробиотиков на микробиоту кишечника во время искоренения Helicobacter pylori : рандомизированное контролируемое исследование.Helicobacter 21 (3): 165–174
CAS PubMed Статья PubMed Central Google ученый
Olmos Soto J (2021) Улучшение потребления корма, модуляция кишечной микробиоты и борьба с патогенами за счет использования видов Bacillus в аквакультуре креветок. World J Microbiol Biotechnol 37 (2): 28
PubMed Статья PubMed Central Google ученый
Ouwehand A, Isolauri E, Salminen S (2002) Роль кишечной микрофлоры для развития иммунной системы в раннем детстве.Eur J Nutr 41 (Дополнение 1): I32 – I37
PubMed PubMed Central Google ученый
Pang Z, Raudonis R, Glick BR, Lin TJ, Cheng Z (2019) Устойчивость к антибиотикам у Pseudomonas aeruginosa : механизмы и альтернативные терапевтические стратегии. Biotechnol Adv 37 (1): 177–192
CAS PubMed Статья PubMed Central Google ученый
Патангия Д.В., Райан К.А., Демпси Э., Стэнтон С., Росс Р.П. (2021) Вертикальный перенос антибиотиков и устойчивых к антибиотикам штаммов по оси мать / ребенок.Trends Microbiol. https://doi.org/10.1016/j.tim.2021.05.006
Статья PubMed PubMed Central Google ученый
Qiu X, Ye Q, Sun M, Wang L, Tan Y, Wu G (2020) Насыщенный водород улучшает нарушения липидного обмена и дисбактериоз, вызванные диетой с высоким содержанием жиров. Exp Biol Med (Maywood) 245 (6): 512–521
CAS Статья Google ученый
Qiu X, Bajinka O, Wang L, Wu G, Tan Y (2021) Влияние диеты с высоким содержанием жиров на эпителиальный мезенхимальный переход дыхательных путей через цикл глиоксиловой кислоты легочных микробов и вмешательство насыщенного водорода.Am J Transl Res 13 (6): 6016–6030
PubMed PubMed Central Google ученый
Rashid MU, Zaura E, Buijs MJ, Keijser BJ, Crielaard W., Nord CE, Weintraub A (2015) Определение долгосрочного эффекта введения антибиотиков на нормальную кишечную микробиоту человека с использованием методов культивирования и пиросеквенирования. Clin Infect Dis 60 (Дополнение 2): S77-84
CAS PubMed Статья PubMed Central Google ученый
Raymond F, Ouameur AA, Déraspe M, Iqbal N, Gingras H, Dridi B, Leprohon P, Plante PL, Giroux R, Bérubé È, Frenette J, Boudreau DK, Simard JL, Chabot I, Domingo MC, Trot S, Boissinot M, Huletsky A, Roy PH, Ouellette M, Bergeron MG, Corbeil J (2016) Исходное состояние микробиома кишечника человека определяет его изменение под действием антибиотиков.ISME J 10 (3): 707–720
CAS PubMed Статья PubMed Central Google ученый
Reijnders D, Goossens GH, Hermes GD, Neis EP, van der Beek CM, Most J, Holst JJ, Lenaerts K, Kootte RS, Nieuwdorp M, Groen AK, Olde Damink SW, Boekschoten MV, Smidt H, Zoetendal EG, Dejong CH, Blaak EE (2016) Влияние манипуляции кишечной микробиотой антибиотиками на метаболизм хозяина у людей с ожирением: рандомизированное двойное слепое плацебо-контролируемое исследование.Cell Metab 24 (1): 63–74
CAS PubMed Статья PubMed Central Google ученый
Shono Y, Docampo MD, Peled JU, Perobelli SM, Velardi E, Tsai JJ, Slingerland AE, Smith OM, Young LF, Gupta J, Lieberman SR, Jay HV, Ahr KF, Porosnicu Rodriguez KA, Xu K, Calarfiore M, Poeck H, Caballero S, Devlin SM, Rapaport F, Dudakov JA, Hanash AM, Gyurkocza B, Murphy GF, Gomes C, Liu C, Moss EL, Falconer SB, Bhatt AS, Taur Y, Pamer EG, van den Brink MRM, Jenq RR (2016) Повышение смертности, связанной с РТПХ, при использовании антибиотиков широкого спектра действия после трансплантации аллогенных гемопоэтических стволовых клеток пациентам-людям и мышам.Sci Transl Med 8 (339): 339ra71
PubMed PubMed Central Статья CAS Google ученый
Soldi S, Vasileiadis S, Lohner S, Uggeri F, Puglisi E, Molinari P, Donner E, Sieland C, Decsi T, Sailer M, Theis S (2019) Добавки пребиотиков в холодное время года и, в частности, во время лечения антибиотиками модулирует состав кишечной микробиоты детей 3–6 лет. Benef Microbes 10 (3): 253–263
CAS PubMed Статья PubMed Central Google ученый
Stewardson AJ, Gaïa N, François P, Malhotra-Kumar S, Delémont C, Martinez de Tejada B, Schrenzel J, Harbarth S, Lazarevic V (2015) Исследовательские группы SATURN WP1 и WP3.Сопутствующий ущерб от перорального приема ципрофлоксацина по сравнению с нитрофурантоином у амбулаторных пациентов с инфекциями мочевыводящих путей: анализ микробиоты кишечника без посева. Clin Microbiol Infect 21 (4): 344.e1-344.e11
CAS Статья Google ученый
Taur Y, Coyte K, Schluter J, Robilotti E, Figueroa C, Gjonbalaj M, Littmann ER, Ling L, Miller L, Gyaltshen Y, Fontana E, Morjaria S, Gyurkocza B, Perales MA, Castro-Malaspina , Tamari R, Ponce D, Koehne G, Barker J, Jakubowski A, Papadopoulos E, Dahi P, Sauter C, Shaffer B, Young JW, Peled J, Meagher RC, Jenq RR, van den Brink MRM, Giralt SA, Pamer EG , Xavier JB (2018) Восстановление микробиоты кишечника пациентов, принимающих антибиотики, путем трансплантации аутологичной фекальной микробиоты.Sci Transl Med 10 (460): eaap9489
PubMed PubMed Central Статья CAS Google ученый
Theriot CM, Koenigsknecht MJ, Carlson PE Jr, Hatton GE, Nelson AM, Li B, Huffnagle GB, Li JZ, Young VB (2014) Вызванные антибиотиками сдвиги в микробиоме кишечника и метаболоме мыши увеличивают восприимчивость к Clostridium difficile инфекция. Nat Commun 5: 3114
PubMed Статья CAS PubMed Central Google ученый
Tochitani S (2021) Вертикальная передача кишечной микробиоты: точки действия факторов окружающей среды, влияющих на развитие мозга.Neurosci Res 168: 83–94
CAS PubMed Статья PubMed Central Google ученый
Узан-Юлзари А, Турта О, Белоголовски А, Зив О, Кунц С, Першбахер С., Нойман Х, Пазолли Э, Оз А, Бен-Амрам Х, Кумар Х, Оллила Х, Калджонен А, Изолаури Э, Salminen S, Lagström H, Segata N, Sharon I, Louzoun Y, Ensenauer R, Rautava S, Koren O (2021) Воздействие антибиотиков на новорожденных ухудшает рост ребенка в течение первых шести лет жизни, нарушая микробную колонизацию кишечника.Nat Commun 12 (1): 443
CAS PubMed PubMed Central Статья Google ученый
Versluis D, de J. Bello González T, Zoetendal EG, Passel MWJV, Smidt H (2019) Высокопроизводительный скрининг на основе культивирования на пористых чипах из оксида алюминия позволяет целенаправленно изолировать кишечные бактерии человека, устойчивые к антибиотикам. PLoS ONE 14 (1): e0210970
CAS PubMed PubMed Central Статья Google ученый
Винсент С., Манжес АР (2015) Использование противомикробных препаратов, микробиота кишечника человека и Clostridium difficile колонизация и инфекция.Антибиотики (Базель) 4 (3): 230–253
CAS Статья Google ученый
Vogt SL, Finlay BB (2017) Защита кишечной микробиоты от диарейных инфекций. J Travel Med 24 (suppl_1): S39 – S43
PubMed PubMed Central Статья Google ученый
Vuong HE, Pronovost GN, Williams DW, Coley EJL, Siegler EL, Qiu A, Kazantsev M, Wilson CJ, Rendon T, Hsiao EY (2020) Материнский микробиом модулирует нейроразвитие плода у мышей.Nature 586 (7828): 281–286
CAS PubMed PubMed Central Статья Google ученый
Wang ZJ, Chen XF, Zhang ZX, Li YC, Deng J, Tu J, Song ZQ, Zou QH (2017) Влияние сопутствующей терапии анти- Helicobacter pylori и добавок пробиотиков на микробиоту горла и кишечника в люди. Microb Pathog 109: 156–161
PubMed Статья CAS PubMed Central Google ученый
Ван Ц., Ли П, Янь Ц., Чен Л., Ли Т, Чжан В., Ли Х, Чен Ц, Хан Х, Чжан С., Сюй М, Ли Б, Чжан Х, Ни Х, Ма И, Донг Б, Ли С., Лю С. (2019) Характеристика микробиома кишечника свиней и резистома к антибиотикам на промышленных откормочных площадках в Китае.mSystems 4 (6): e00206-19
PubMed PubMed Central Google ученый
Wei S, Mortensen MS, Stokholm J, Brejnrod AD, Thorsen J, Rasmussen MA, Tvedi U, Bisgaard H, Sørensen SJ (2018) Краткосрочное и долгосрочное влияние лечения азитромицином на микробиоту кишечника у детей: двойное слепое рандомизированное плацебо-контролируемое исследование. EBioMedicine 38: 265–272
PubMed PubMed Central Статья Google ученый
Йошиока Х., Исэки К., Фудзита К. (1983) Развитие и различия кишечной флоры в неонатальном периоде у младенцев, находящихся на грудном и искусственном вскармливании.Педиатрия 72 (3): 317–321
CAS PubMed PubMed Central Google ученый
Янг В.Б., Шмидт TM (2004) Диарея, связанная с антибиотиками, сопровождающаяся крупномасштабными изменениями в составе фекальной микробиоты. J Clin Microbiol 42 (3): 1203–1206
PubMed PubMed Central Статья Google ученый
Zaura E, Brandt BW, Teixeira de Mattos MJ, Buijs MJ, Caspers MP, Rashid MU, Weintraub A, Nord CE, Savell A, Hu Y, Coates AR, Hubank M, Spratt DA, Wilson M, Keijser BJ , Crielaard W (2015) Такое же воздействие, но два радикально разных ответа на антибиотики: устойчивость микробиома слюны по сравнению с долгосрочными микробными изменениями в кале.Mbio 6 (6): e01693-15
PubMed PubMed Central Статья CAS Google ученый
Zhang X, Borbet TC, Fallegger A, Wipperman MF, Blaser MJ, Müller A (2021) Микробиота, пораженная антибиотиками, ставит под угрозу развитие регуляторных Т-клеток толстой кишки и предрасполагает к нарушению регуляции иммунных ответов. Mbio 12 (1): e03335-20
PubMed PubMed Central Google ученый
Живкович AM, German JB, Lebrilla CB, Mills DA (2011) Гликобиом грудного молока и его влияние на микробиоту желудочно-кишечного тракта младенцев.Proc Natl Acad Sci USA 108 (Приложение 1): 4653–4658
CAS PubMed Статья PubMed Central Google ученый
Zuo T, Wong SH, Lam K, Lui R, Cheung K, Tang W, Ching JYL, Chan PKS, Chan MCW, Wu JCY, Chan FKL, Yu J, Sung JJY, Ng SC (2018) Перенос бактериофагов во время трансплантации фекальной микробиоты у Clostridium difficile инфекция связана с исходом лечения. Кишечник 67 (4): 634–643
CAS PubMed PubMed Central Google ученый
Полностью ли восстанавливается микробиом кишечника от антибиотиков?
Q.Каковы последствия приема антибиотиков для кишечного микробиома? Полностью ли восстанавливается кишечник?
A. Большинство кишечных бактерий быстро восстанавливаются, но прием антибиотиков может иметь долгосрочные последствия. Однако изменения не обязательно вредны.
Микробиом кишечника, примерно от 10 до 100 триллионов бактерий и других микроорганизмов, обитающих в пищеварительном тракте, способствует здоровью, синтезируя витамины, метаболизируя лекарства и борясь с патогенами.Все, что нарушает баланс микроорганизмов, например антибиотики, убивающие как «хорошие», так и «плохие» бактерии, потенциально может вызвать болезнь.
Данные исследования 2016 года показывают, что воздействие антибиотиков в младенчестве может изменить микробиом кишечника и ослабить иммунный ответ на долгие годы. Другие исследования связывают использование антибиотиков у детей с повышенным риском астмы, ожирения и воспалительного заболевания кишечника в течение всей жизни, которые, как считается, опосредуются микробиомом кишечника.
Антибиотики также могут оказывать долгосрочное воздействие на взрослых. Исследователи из Стэнфорда проанализировали более 900 000 генетических образцов стула здоровых мужчин и женщин, принимавших антибиотик ципрофлоксацин. Они обнаружили, что большая часть микробиома кишечника пришла в норму через четыре недели, но количество некоторых бактерий через шесть месяцев все еще оставалось низким. В более продолжительном и более крупном последующем исследовании они пришли к выводу: «Возмущение, связанное с антибиотиками, может вызвать переход к альтернативному стабильному состоянию, все последствия которого остаются неизвестными.”
В качестве примера потенциально полезного эффекта изменения микробиома кишечника данные свидетельствуют о том, что антибиотики могут подавлять образование молекулы в кишечнике, которая увеличивает риск сердечных заболеваний.
Проект Национального института здоровья по микробиому человека использует передовые генетические методы для секвенирования всего генетического материала микробиома кишечника. По мере появления новых данных появляется четкое понимание: антибиотики могут оказывать как положительное, так и вредное воздействие на микробиом кишечника.
У вас есть вопросы о здоровье? Ask Well
RACGP – Микробиом кишечника
Майенааз Сидху
Давид ван дер Поортен
Общие сведения
Более триллиона, в основном полезных, микробов обитают в нашем желудочно-кишечном тракте и отвечают за жизненно важные метаболические, иммунные и пищевые функции. Дисбиоз, то есть неадаптивный дисбаланс микробиома, связан со многими распространенными заболеваниями и является целью лечения.
Цель / с
В этой статье представлен обзор микробиома кишечника при его здоровье и болезнях, выделяя такие состояния, как инфекция Clostridium difficile, , воспалительное заболевание кишечника, синдром раздраженного кишечника, ожирение и неалкогольная жировая болезнь печени, сопровождающаяся дисбактериозом. связано. Обсуждается информация о методах лечения, влияющих на микробиом кишечника, включая пробиотики и трансплантацию фекальной микробиоты.
Обсуждение
По мере того, как наши знания о микробиоме расширяются, мы, вероятно, лучше поймем сложные взаимодействия, вызывающие заболевания, и разработаем новые и более эффективные методы лечения многих распространенных состояний.
Триллионы бактерий, вирусов, грибов, архей и эукариотических организмов живут в желудочно-кишечном тракте человека и составляют то, что в совокупности называется микробиомом кишечника. Эти организмы составляют более 50% клеток человеческого тела и весят до 2 кг в среднем у взрослого человека. 1,2 В желудке и тонком кишечнике относительно мало организмов из-за кислой среды, присутствия желчи и панкреатического сока, а также эффектов перистальтики, которые ограничивают стабильную колонизацию.Таким образом, именно в толстой кишке подавляющее большинство (10 12 ) микробиоты живет и взаимодействует с человеческим хозяином. Наши знания о микробиоме кишечника человека с точки зрения здоровья и болезней быстро расширились за последние 10 лет благодаря увеличению доступности и снижению стоимости секвенирования генов. 3 Это предоставило убедительные доказательства жизненно важной роли кишечного микробиома в нормальном метаболизме, питании, иммунной функции, физиологии и профилактике заболеваний. Помимо прямого воздействия на слизистую оболочку кишечника и кишечную нервную систему, многие химические медиаторы, вырабатываемые микробиомом кишечника, попадают в кровоток и взаимодействуют с дистальными органами, такими как мозг, сердце и печень. 4
Микробиом в здоровье
Хотя стандартного определения здорового микробиома кишечника не существует, важными характеристиками являются микробиом с высоким уровнем разнообразия, стабильности, устойчивости к изменениям, связанным со стрессом (антибиотики, инфекции, иммуносупрессия), и высоким уровнем избыточности метаболических путей. 5
Развивающийся микробиом кишечника
Исторически кишечник in utero воспринимался как стерильная среда; однако появляющиеся данные свидетельствуют о том, что контакт с микробами начинается еще до рождения с материнской микробиоты. 6 Более обширная колонизация начинается при рождении и во время родов защитными вагинальными микробами, такими как Lactobacillus . Однако младенцы, рожденные через кесарево сечение и дети, не вскармливаемые исключительно грудью, могут быть колонизированы кожными и внутрибольничными бактериями, такими как Staphylococcus и Acinetobacter , что приводит к тому, что микробиом изначально менее разнообразен и менее здоров. 6,7 Эти младенцы более подвержены развитию астмы, аллергического ринита, диабета и целиакии. 8 Развивающийся микробиом кишечника в первый год жизни похож на микробиом матери, но вскоре на него влияет множество факторов, включая диету, привычки питания и окружающую среду. 9 Зрелый микробиом кишечника устанавливается в возрасте от одного до трех лет и после этого становится относительно стабильным. К этому времени он в основном состоит из анаэробных бактерий, представленных более чем 50 типами и 1000 видами. Несмотря на это разнообразие, большинство микробов происходят из двух типов бактерий: Bacteroidetes и Firmicutes. 10
Метаболические и сигнальные функции
Микробиом кишечника отвечает за ряд жизненно важных метаболических и сигнальных функций, многие из которых недоступны одному человеческому организму. К ним относятся синтез всех витаминов группы B (B 1 –B 12 ) и витамина K, 11 обработка пищевых продуктов, переваривание сложных полисахаридов (крахмалы, целлюлоза и камеди), синтез незаменимых аминокислот, биотрансформация желчи, способствующая метаболизму глюкозы и холестерина, а также производство метаболитов короткоцепочечных жирных кислот, таких как бутират и ацетат, которые действуют как источник энергии для бактерий толстой кишки и могут оказывать противовоспалительное действие. 12 Некоторые частично усвояемые продукты, в свою очередь, могут обогатить определенные полезные микробные популяции, хотя прямая польза для здоровья еще не установлена. Примеры этих продуктов, часто называемых пребиотиками, включают злаки, спаржу, лук-порей, артишоки, бобовые, капусту и капусту. 12 Кишечная микробиота также может связываться с центральной нервной системой несколькими путями, включая блуждающий нерв, ось гипоталамус-гипофиз-надпочечники, производство нейротрансмиттеров или их предшественников, включая серотонин, триптофан, гамма-аминомасляную кислоту, дофамин, l -допа и норадреналин, а также через гормоны, такие как кортизол, грелин, лептин и глюкагоноподобный пептид -1. 13
Защитные иммунные функции
Нормальная микробиота кишечника – наша первая внутренняя линия защиты от патогенов и токсинов, защищающая организм от болезней в тандеме с иммунной системой хозяина. Одна из ключевых функций здорового микробиома – предотвращение колонизации болезнетворными микроорганизмами за счет барьерного эффекта. Это происходит за счет производства противомикробных соединений, таких как бактериоцин, и борьбы патогенов за питательные вещества и места прикрепления за счет огромной численности. 3 Кишечные бактерии также являются неотъемлемой частью развития врожденной иммунной системы слизистых оболочек за счет прямого взаимодействия с эпителиальными клетками кишечника. Раннее воздействие различных бактерий обеспечивает своего рода тренировку для иммунной системы, так что нормальные защитные реакции возникают на комменсалов, а соответствующие воспалительные реакции возникают при воздействии патогенов. И наоборот, уменьшение разнообразия микробов и воздействие на них в раннем возрасте может привести к иммунной системе, которая чрезмерно реагирует на антигены, что предрасполагает к аутоиммунным и аллергическим заболеваниям. 14
Микробиом и болезнь
Многие желудочно-кишечные заболевания связаны с изменениями микробиома кишечника, равно как и метаболические нарушения, заболевания печени, некоторые неврологические расстройства и расстройства настроения, артрит и иммунологические состояния. 15 Дисбиоз, означающий дисбаланс или дезадаптивное состояние микробиома, встречается почти во всех этих состояниях, хотя в большинстве случаев не установлено, является ли это причиной или следствием. Мы рассматриваем эти состояния с наибольшим количеством доказательств и обсуждаем исследования по модуляции кишечных бактерий в качестве терапии.
Инфекция, вызванная Clostridium difficileClostridium difficile – спорообразующий грамположительный анаэроб, продуцирующий токсины A и B; последний отвечает за воспаление толстой кишки и развитие псевдомембранозного колита. Заболеваемость и тяжесть инфекции C. difficile (CDI) в Австралии и во всем мире растет: в 2012 г. в австралийских больницах было зарегистрировано более 12 000 случаев, что привело к относительной смертности в 6–7%. 16 C. difficile редко вызывает заболевание у здоровых взрослых; скорее, это требует нарушения нормальных механизмов резистентности и флоры хозяина, что чаще всего вызвано антибиотиками широкого спектра действия, иммуносупрессией или применением ингибиторов протонной помпы. 17
Традиционным лечением ИКД является метронидазол или ванкомицин и удаление вызывающего нарушение антибиотика; однако это оказывается все более неэффективным с частотой рецидивов до 50% и увеличением заболеваемости молниеносной болезнью.После публикации 2013 года Академического медицинского центра в Амстердаме было показано, что 18 коррекция основного дисбактериоза с помощью трансплантации фекальной микробиоты (FMT) более эффективна и долговечна, чем терапия антибиотиками при рецидивирующей ИКД. Эти результаты были воспроизведены в Австралии. 19 Непосредственное влияние FMT при тяжелом псевдомембранозном колите показано на Рисунке 1.
Рис. 1. Тяжелая инфекция Clostridium difficile у пациента в возрасте 79 лет.
A. Псевдомембранозный колит; Б. Пять дней после трансплантации фекальной микробиоты
Воспалительное заболевание кишечника
Язвенный колит и болезнь Крона – хронические воспалительные состояния неизвестной этиологии, основной патогенез которых, по-видимому, связан с множеством факторов, включая генетическую предрасположенность, триггеры окружающей среды, измененную иммунную функцию и аномальные реакции на микробиом кишечника. Дисбиоз присутствует у пациентов с воспалительным заболеванием кишечника (ВЗК), характеризующимся более высоким соотношением патогенных и комменсальных бактерий, сниженным количеством бактерий в областях активного воспаления и участках бактериальной инвазии слизистой оболочки, что редко, если вообще когда-либо, наблюдается у здоровых людей. частные лица. 20 Модуляция кишечных бактерий антибиотиками, такими как ципрофлоксацин и метронидазол, является общепринятым методом лечения для уменьшения послеоперационных рецидивов болезни Крона, в то время как пробиотики могут быть эффективны при паучите, связанном с ВЗК, после колэктомии. 21,22 В ряде исследований FMT рассматривался как лечение ВЗК, но с противоречивыми результатами. Систематический обзор небольших серий случаев показал общую эффективность 36%, при этом пациенты с болезнью Крона с большей вероятностью ответят на лечение, чем пациенты с язвенным колитом. 23 Австралийское рандомизированное плацебо-контролируемое исследование показало аналогичную эффективность при язвенном колите (44% ремиссия без стероидов) с использованием интенсивного протокола FMT с помощью колоноскопии и клизм в течение восьми недель. 24 В двух дополнительных рандомизированных контролируемых испытаниях язвенного колита одно не показало преимуществ по сравнению с плацебо, 25 , в то время как в другом FMT достигла ремиссии в 24% по сравнению с 5% в группе плацебо. 26
Синдром раздраженного кишечника
Синдром раздраженного кишечника (СРК) – распространенное заболевание, характеризующееся дискомфортом в животе и изменением привычки кишечника при отсутствии основной органической причины.Патофизиология СРК остается неясной, но, вероятно, будет многофакторной, с важными изменениями моторики и обработки пищи, висцеральной гиперчувствительностью, генетической предрасположенностью и изменениями в микробиоме кишечника. 27 Лица с СРК с преобладанием диареи имеют дисбактериоз, характеризующийся более низкой экспрессией филотипа Clostridium thermosuccinogenes , 28 , тогда как у людей с СРК и запором увеличивается количество бактерий, которые производят и используют лактат, что приводит к более высокому производству сульфидов и водорода. 29 Кроме того, СРК, возникающий после гастроэнтерита, хорошо распознается (постинфекционный СРК), и у пораженных людей наблюдаются изменения в Bacteroidetes и Clostridia по сравнению со здоровыми людьми из контрольной группы. 30 Изменение кишечных бактерий с помощью антибиотиков может помочь, и рифаксимин, наиболее хорошо изученный, показал умеренное симптоматическое улучшение при СРК с преобладанием диареи. Это привело к одобрению этого показания в США, но не в Австралии. 31 Систематический обзор и метаанализ показали, что пробиотики оказывают умеренное благотворное влияние на общие показатели боли в животе, вздутие живота и метеоризм при СРК, а комбинированные схемы более эффективны. 32 Из-за неоднородности исследований не удалось выделить конкретные полезные штаммы или режимы дозирования. Было показано, что диета с низким содержанием FODMAP, направленная на снижение ферментируемых олигосахаридов, дисахаридов, моносахаридов и полиолов, эффективна при СРК, но сама по себе может ограничивать количество бактерий в фекалиях, включая полезные бактерии. 33
Болезнь обмена веществ
Мировая эпидемия ожирения и связанных с ним метаболических заболеваний в первую очередь объясняется диетой и отсутствием физических упражнений; однако теперь ясно, что микробиом кишечника также играет роль друга и врага.Микробиота кишечника необходима для набора веса, вызванного диетой (рис. 2A), при этом мыши без микробов набирают минимальный вес, несмотря на диету с высоким содержанием жиров / сахара, тогда как идентичные мыши, содержащие кишечные бактерии, становятся тучными. 34 Дисбиоз, характеризующийся снижением численности Bacteroidetes и увеличением количества Firmicutes, изменяя их нормальное соотношение, был причастен к ожирению у мышей и людей; 35 , однако, два недавних метаанализа объединенных исследований на людях не смогли выявить эти изменения в бактериальных типах, с лишь незначительным сокращением микробного разнообразия и богатства. 36,37 Тем не менее, метаболические фенотипы с ожирением и худой у мышей могут передаваться через FMT (Рисунок 2B), 38,39 процесс, более зависимый от микробиоты, чем от генетики (Рисунок 2C), поскольку FMT от однояйцевых близнецов не соответствует ожирению. по-прежнему приводил к передаче фенотипа худощавости или ожирения у мышей. 40 Совместное содержание двух групп, где мыши ели фекалии друг друга, привело к фенотипу постного мяса, предположительно из-за повторной инвазии определенных Bacteroidetes в тучных мышей. 40 В недавнем исследовании пациентов с метаболическим синдромом FMT от худощавого донора улучшил чувствительность к инсулину всего за шесть недель, что частично было вызвано увеличением количества кишечных бактерий, продуцирующих бутират. 41
Рисунок 2. Ожирение и микробиом
A. Мыши без микробов устойчивы к ожирению, вызванному диетой; B. Метаболический фенотип передается через трансплантацию микробиоты от худых доноров, производящих худых мышей, и от доноров с ожирением, производящих мышей с ожирением; С.Трансплантат микробиоты от однояйцевых близнецов, дискордантных по ожирению, также передает метаболический фенотип мышам, свободным от микробов, однако при совместном размещении преобладает худой фенотип; GF, без микробов; L, тощая N, нормальная; О, ожирение
Неалкогольная жировая болезнь печени
Помимо изменений микробиоты при ожирении, изменения кишечных бактерий при неалкогольной жировой болезни печени (НАЖБП) и неалкогольном стеатогепатите (НАСГ) связаны с кишечной бактериальной транслокацией, что приводит к увеличению доставки липополисахаридов, свободных жирных кислот. кислоты и другие токсины прямо в печень из воротной вены. 42 Кроме того, пациенты с НАСГ имеют большее количество бактерий семейства Escherichia , группы, которая ферментирует углеводы и производит эндогенный этанол. 43 Это приводит к периферическому повышению уровня алкоголя, что является возможным сопутствующим фактором в патогенезе жировой болезни печени. В настоящее время проводится ряд исследований для оценки роли пробиотиков, FMT или других кишечных модулирующих процедур у пациентов с НАЖБП.
Изменение микробиома кишечника
Трансплантат фекальной микробиоты
FMT был впервые использован в современной медицине в 1958 году, когда четыре пациента с псевдомембранозным колитом были излечены фекальной клизмой. 44 Существуют доказательства роли FMT в рецидивирующей ИКД, и появляются новые доказательства его роли при ВЗК и метаболических заболеваниях. 15 Процесс, лежащий в основе FMT, относительно прост. Доноры проходят скрининг на все известные патогены, передающиеся с кровью и калом, и должны быть здоровыми, худыми и не иметь заболеваний, потенциально передаваемых через кишечные бактерии. Донорский стул смешивают со стерильным физиологическим раствором / глицерином и можно давать свежим или замороженным. Стул, замороженный при –80 ° C, жизнеспособен и эффективен в течение как минимум шести-девяти месяцев. 19 Донорский стул может быть доставлен через назо-еюнальную трубку или в слепую кишку при колоноскопии. В целом процедура безопасна; Общие побочные эффекты включают вздутие живота, диарею и субфебрильную температуру, которые обычно проходят в течение 48 часов. 15 Серьезные события, связанные с эндоскопической процедурой, такие как перфорация кишечника и аспирация, случаются редко. Долгосрочные эффекты FMT неизвестны и могут включать в себя индукцию хронических заболеваний, связанных с изменениями кишечных бактерий или передачей нераспознанных в настоящее время инфекционных агентов. 15 Исследователи из банка стула OpenBiome в США, среди прочих, разработали фекальную капсулу, которая может сделать эту терапию, изменяющую кишечник, более доступной в будущем.
Антибиотики
Обработка кишечных бактерий с помощью антибиотиков, таких как ципрофлоксацин и метронидазол, в течение некоторого времени использовалась для лечения кишечных расстройств, таких как болезнь Крона; однако их способность уменьшать количество патогенных грамотрицательных бактерий, паразитов и анаэробов достигается за счет снижения бактериального разнообразия и устойчивости, а также ИКД. 12 Недавно минимально абсорбируемый антибиотик широкого спектра действия рифаксимин получил признание благодаря своей эффективности при печеночной энцефалопатии и СРК, а также низкому потенциалу развития бактериальной резистентности. 12
Пробиотики
Пробиотики определены Всемирной организацией здравоохранения как «живые бактерии или дрожжи, которые при введении в адекватных количествах приносят пользу здоровью потребителя». Однако доказательства их эффективности неоднозначны. Наиболее хорошо изученными бактериальными пробиотиками являются пробиотики видов Lactobacillus , Bifidobacterium и Lactococcus , а наиболее часто используемые дрожжи – это Saccharomyces boulardii . 12 Пробиотики временно колонизируют кишечник и могут оказывать положительное воздействие за счет усиления естественного кишечного барьера (как физического, так и слизистого), стимуляции секреции IgA, подавления выработки воспалительных цитокинов и прямого антагонизма патогенов. 45 На основе метаанализов рандомизированных контролируемых исследований пробиотики умеренно эффективны для уменьшения общих симптомов СРК (количество, необходимое для лечения [NNT] = 8), 32 и для уменьшения диареи, связанной с антибиотиками, у детей в возрасте от одного месяца до 18 лет (NNT = 10) 46 и взрослые до 64 лет (относительный риск = 0.47), но не у пожилых людей. 47 Продолжительность использования пробиотиков (5–21 день) не повлияла на пользу, и, в разной степени, результаты были штамм-специфичными; наибольшее преимущество было получено от Lactobacillus и S. boulardii . 47 Для других заболеваний результаты могут зависеть от препарата, и только дорогостоящий комбинированный пробиотик VSL # 3 (восемь видов Lactobacillus , Bifidobacterium и Streptococcus ; 130 долларов США) эффективен для профилактики и лечения паучита в ВЗК после колэктомии, 22 и Lactobacillus casei и смешанный исследовательский препарат L.acidophilus , L. delbruecki var bulgaris , Streptococcus thermphilus и B. bifidu в течение пяти дней, уменьшая продолжительность и тяжесть симптомов у детей с острой инфекционной диареей. 48 Доказательства того, что пробиотики помогают при внекишечных заболеваниях или помогают поддерживать общее состояние здоровья, остаются противоречивыми. Большинство коммерческих пробиотиков состоят из смеси штаммов, эффективность которых обычно приписывается конкретным штаммам и их количеству. Однако недавнее исследование показало, что только 58% имеют правильную маркировку. 49 Кроме того, существуют проблемы с поддержанием жизнеспособности пробиотиков во время хранения и их способности противостоять кислоте и желчи, чтобы достичь толстой кишки, где может произойти колонизация. 50 Хотя пробиотики кажутся безопасными для большинства людей, сообщения о случаях заболевания повышают вероятность оппортунистической инфекции из-за воздействия на комменсальную микрофлору, особенно у тяжелобольных взрослых и новорожденных, у которых после приема препарата иногда наблюдались бактериемия и фунгемия. Lactobacillus rhamnosus и S.boulardii . 51 Крупные рандомизированные испытания не подтвердили повышенный риск; Однако при использовании пробиотиков рекомендуется оценка риска и пользы.
Заключение
Микробиом кишечника – сложная и важная часть нашего тела, которая обеспечивает жизненно важную поддержку нормального обмена веществ и защиту от болезней. Дисбактериоз связан с множеством болезненных состояний и является целью лечения и будущих исследований.
Благодарности
Авторы выражают благодарность г-ну Эндрю Барнсу за его помощь в оформлении рисунка 2.
Авторы
Майенааз Сидху, бакалавр наук, специалист по гастроэнтерологии, больница Вестмид, Сидней, Новый Южный Уэльс
Дэвид ван дер Поортен Бакалавр медицинских наук, MBBS (с отличием) FRACP, доктор философии, штатный специалист-гастроэнтеролог больницы Вестмид, Сидней, Новый Южный Уэльс, и клинический доцент Сиднейского университета, Сидней, Новый Южный Уэльс. [email protected]
Конкурирующие интересы: Нет
Происхождение и экспертная оценка: заказано, внешняя экспертная оценка.
Список литературы
- Sender R, Fuchs S, Milo R. Пересмотренные оценки количества человеческих и бактериальных клеток в организме. PLoS Biol 2016; 14 (8): e1002533.
- Кларк Дж., Стиллинг Р. М., Кеннеди П. Дж., Стэнтон К., Крайан Дж. Ф., Динан Т. Г.. Мини-обзор: Микробиота кишечника: запущенный эндокринный орган. Мол Эндокринол 2014 Авг; 28 (8): 1221−38.
- Bull MJ, Plummer NT. Часть 1. Микробиом кишечника человека в условиях здоровья и болезней. Integr Med (Encinitas) 2014; 13 (6): 17–22.
- Эванс Дж. М., Моррис Л. С., Марчези младший. Микробиом кишечника: роль виртуального органа в эндокринологии хозяина. J Endocrinol 2013; 218 (3): R37–47.
- Bäckhed F, Fraser CM, Ringel Y, et al. Определение здорового микробиома кишечника человека: современные концепции, будущие направления и клиническое применение. Клеточный микроб-хозяин 2012; 12 (5): 611–22.
- Collado MC, Rautava S, Isolauri E, Salminen S. Микробиота кишечника: источник новых инструментов для снижения риска заболеваний человека? Педиатр Res 2015; 77 (1-2): 182–88.
- Хурре А., Каллиомяки М., Раутава С., Ринне М., Салминен С., Исолаури Э. Способ доставки – Влияние на микробиоту кишечника и гуморальный иммунитет. Неонатология 2008; 93 (4): 236–40.
- Neu J, Rushing J. Кесарево сечение по сравнению с вагинальными родами: долгосрочные результаты для новорожденных и гигиеническая гипотеза. Clin Perinatol 2011; 38 (2): 321–31.
- Маки Р.И., Сгир А., Гаскинс Х.Р. Микробная экология развития желудочно-кишечного тракта новорожденных. Am J Clin Nutr 1999; 69 (5): 1035S – 45S.
- Schloss PD, Handelsman J. Статус микробной переписи. Microbiol Mol Biol Rev 2004; 68 (4): 686–91.
- ЛеБлан Дж. Г., Милани С., де Джорджи Г. С., Сесма Ф, ван Синдерен Д., Вентура М. Бактерии как поставщики витаминов для своего хозяина: взгляд на микробиоту кишечника. Curr Opin Biotechnol 2013; 24 (2): 160–68.
- Галло А., Пассаро Г., Гасбаррини А., Ландольфи Р., Монтальто М. Модуляция микробиоты как лечение воспалительных заболеваний кишечника: обновление. Мировой журнал J Gastroenterol 2016; 22 (32): 7186–202.
- Scheperjans F. Кишечная микробиота, 1013 новых элементов в головоломке «Болезнь Паркинсона». Curr Opin Neurol 2016; 29 (6): 773–80.
- Björkstén B, Sepp E, Julge K, Voor T., Mikelsaar M. Развитие аллергии и кишечная микрофлора в течение первого года жизни. J Allergy Clin Immunol 2001; 108 (4): 516–20.
- Choi HH, Choi Y-S. Трансплантация фекальной микробиоты: текущие применения, эффективность и перспективы на будущее. Clin Endosc 2016; 49 (3): 257–65.
- Slimings C, Армстронг П., Бекингем В.Д. и др.Рост заболеваемости инфекцией Clostridium difficile, Австралия, 2011-2012 гг. Med J Aust 2014; 200 (5): 272–76.
- Bartlett JG. Описательный обзор: новая эпидемия кишечного заболевания, ассоциированного с Clostridium difficile, . Энн Интерн Мед 2006; 145 (10): 758–64.
- van Nood E, Vrieze A, Nieuwdorp M, et al. Дуоденальная инфузия донорских фекалий при рецидиве Clostridium difficile . N Engl J Med 2013; 368 (5): 407–15.
- Costello SP, Conlon MA, Vuaran MS, Робертс-Томсон IC, Эндрюс JM.Пересадка фекальной микробиоты при рецидивирующей инфекции Clostridium difficile с использованием длительного замороженного стула эффективна: данные о клинической эффективности и жизнеспособности бактерий. Aliment Pharmacol Ther 2015; 42 (8): 1011–18.
- Лопес Дж., Гринспан А. Трансплантация фекальной микробиоты при воспалительном заболевании кишечника. Гастроэнтерол Hepatol 2016; 12 (6): 374–79.
- Rutgeerts P, Hiele M, Geboes K и др. Контролируемое испытание лечения метронидазолом для профилактики рецидива Крона после резекции подвздошной кишки.Гастроэнтерология 1995; 108 (6): 1617–21.
- Сингх С., Страуд А.М., Голубар С.Д., Сандборн В.Дж., Парди Д.С. Лечение и профилактика поучита после анастомоза подвздошно-анальный мешок при хроническом язвенном колите. Кокрановская база данных Syst Rev 2015; (11): CD001176.
- Colman RJ, Rubin DT. Трансплантация фекальной микробиоты как терапия воспалительного заболевания кишечника: систематический обзор и метаанализ. J. Crohns Colitis 2014; 8 (12): 1569–81.
- Paramsothy S, Kamm M, van den Bogaerde J, Samuel D, Leong R.Трансплантация интенсивной фекальной микробиоты от нескольких доноров – эффективное лечение резистентного язвенного колита: рандомизированное плацебо-контролируемое исследование. J Gastroenterol Hepatol 2016; 150 (4): S122–23.
- Россен Н.Г., Фуэнтес С., ван дер Спек М.Дж. и др. Результаты рандомизированного контролируемого исследования трансплантации фекалий пациентам с язвенным колитом. Гастроэнтерология 2015; 149 (1): 110–14.
- Моайеди П., Суретт М.Г., Ким П.Т. и др. Трансплантация фекальной микробиоты вызывает ремиссию у пациентов с активным язвенным колитом в рандомизированном контролируемом исследовании.Гастроэнтерология 2015; 149 (1): 102–06.
- Камиллери М. Периферические механизмы при синдроме раздраженного кишечника. N Engl J Med 2013; 368 (6): 578–79.
- Lyra A, Rinttilä T, Nikkilä J и др. Синдром раздраженного кишечника с преобладанием диареи, различимый по количественной оценке филотипа гена 16S рРНК. Мировой журнал J Gastroenterol 2009; 15 (47): 5936–45.
- Chassard C, Dapoigny M, Scott KP и др. Функциональный дисбактериоз микробиоты кишечника у пациентов с синдромом раздраженного запора кишечника.Aliment Pharmacol Ther 2012; 35 (7): 828–38.
- Jalanka-Tuovinen J, Salojärvi J, Salonen A, et al. Состав фекальной микробиоты и перекрестный диалог между хозяином и микробом после гастроэнтерита и постинфекционного синдрома раздраженного кишечника. Gut 2014; 63 (11): 1737–45.
- Cremonini F, Lembo A. Рифаксимин для лечения синдрома раздраженного кишечника. Экспертное мнение Pharmacother 2012; 13 (3): 433–40.
- Ford AC, Quigley EMM, Lacy BE и др. Эффективность пребиотиков, пробиотиков и синбиотиков при синдроме раздраженного кишечника и хронических идиопатических запорах: систематический обзор и метаанализ.Am J Gastroenterol 2014; 109 (10): 1547–61 – quiz1546–1562.
- Так Си Джей, Мьюир Дж. Дж., Барретт Дж. С., Гибсон ПР. Ферментируемые олигосахариды, дисахариды, моносахариды и полиолы: роль в синдроме раздраженного кишечника. Exp Rev Gastroenterol Hepatol 2014; 8 (7): 819–34.
- Bäckhed F, Manchester JK, Semenkovich CF, Gordon JI. Механизмы, лежащие в основе устойчивости к ожирению, вызванному диетой, у стерильных мышей. Proc Natl Acad Sci USA 2007; 104 (3): 979–84.
- Kallus SJ, Brandt LJ.Микробиота кишечника и ожирение. J Clin Gastroenterol 2012; 46 (1): 16–24.
- Sze MA, Schloss PD. Ищем сигнал в шуме: возвращаемся к ожирению и микробиому. MBio 2016; 7 (4): e01018–16.
- Уолтерс В.А., Сюй З., Найт Р. Мета-анализ кишечных микробов человека, связанных с ожирением и ВЗК. FEBS Lett 2014; 588 (22): 4223–33.
- Лиу А.П., Пазюк М., Лювано Дж.М., Машинени С., Тернбо П.Дж., Каплан Л.М. Сохраненные сдвиги в микробиоте кишечника из-за обходного желудочного анастомоза снижают вес хозяина и ожирение.Sci Transl Med 2013; 5 (178): 178ra41.
- Turnbaugh PJ, Bäckhed F, Fulton L, Gordon JI. Ожирение, вызванное диетой, связано с заметными, но обратимыми изменениями в микробиоме дистального отдела кишечника мыши. Клеточный микроб-хозяин 2008; 3 (4): 213–23.
- Ридаура В.К., Фейт Дж. Дж., Рей Ф. Е., Ченг Дж., Дункан А. Э., Кау А. Л. и др. Микробиота кишечника близнецов, не согласных с ожирением, модулирует метаболизм у мышей. Наука 2013; 341 (6150): 1241214.
- Vrieze A, van Nood E, Holleman F, Salojärvi J, Kootte RS, Bartelsman JFWM, et al.Перенос кишечной микробиоты от худых доноров увеличивает чувствительность к инсулину у людей с метаболическим синдромом. Гастроэнтерология 2012; 143 (4): 913–17.
- Виланд А., Франк Д. Н., Харнке Б., Бамбха К. Систематический обзор: микробный дисбиоз и неалкогольная жировая болезнь печени. Aliment Pharmacol Ther 2015; 42 (9): 1051–63.
- Чжу Л., Бейкер С.С., Гилл С. и др. Характеристика микробиомов кишечника у пациентов с неалкогольным стеатогепатитом (НАСГ): связь между эндогенным алкоголем и НАСГ.Гепатология 2013; 57 (2): 601–09.
- Eiseman B, Silen W, Bascom GS, Kauvar AJ. Фекальная клизма как вспомогательное средство при лечении псевдомембранозного энтероколита. Хирургия 1958; 44 (5): 854–59.
- Вандерпул С, Ян Ф, Полк ДБ. Механизмы действия пробиотиков: значение для терапевтического применения при воспалительных заболеваниях кишечника. Воспаление кишечника 2008; 14 (11): 1585–96.
- Джонстон BC, Голденберг JZ, Parkin PC. Пробиотики и профилактика диареи, связанной с антибиотиками, у младенцев и детей.JAMA 2016; 316 (14): 1484-85.
- Джафарнеджад С., Шаб-Бидар С., Спикман Дж. Р., Парастуи К., Данеши-Маскуни М., Джафариан К. Пробиотики снижают риск диареи, связанной с антибиотиками, у взрослых (18–64 лет), но не пожилых людей (> 65 лет): Метаанализ. Nutr Clin Pract 2016; 31 (4): 502–13.
- Канани РБ, Чирилло П., Террин Дж. И др. Пробиотики для лечения острой диареи у детей: рандомизированное клиническое испытание пяти различных препаратов. BMJ 2007; 335 (7615): 340.
- Морович В., Хибберд А.А., Забель Б., Баррангу Р., Шталь Б. Генотипирование с помощью ПЦР и высокопроизводительное секвенирование коммерческих пробиотических продуктов выявляют систематические ошибки в составе. Front Microbiol 2016; 7: 1747.
- Сандерс М.Э., Ленуар-Вейнкооп И., Салминен С. и др. Пробиотики и пребиотики: перспективы для рекомендаций по общественному здоровью и питанию. Ann N Y Acad Sci 2014; 1309 (1): 19–29.
- Дидари Т., Солки С., Мозаффари С., Никфар С., Абдоллахи М. Систематический обзор безопасности пробиотиков.Мнение эксперта Drug Saf 2014; 13 (2): 227–39.
Переписка [email protected]
Открытие или сохранение файлов
Файлы на веб-сайте можно открывать или загружать и сохранять на свой компьютер или устройство.
Чтобы открыть, щелкните ссылку, ваш компьютер или устройство попытается открыть файл с помощью совместимого программного обеспечения.
Чтобы сохранить файл, щелкните ссылку правой кнопкой мыши или щелкните ссылку и выберите «Сохранить как …». Следуйте подсказкам, чтобы выбрать место.
Типы файлов
PDF Большинство документов на веб-сайте RACGP имеют формат Portable Document Format (PDF). Эти файлы будут иметь «PDF» в скобках вместе с размером файла для загрузки. Чтобы открыть файл PDF, вам потребуется совместимое программное обеспечение, такое как Adobe Reader. Если у вас его нет, вы можете бесплатно загрузить Adobe Reader.
DOC Некоторые документы на этом сайте представлены в формате Microsoft Word. Они будут иметь “DOC” в скобках вместе с размером файла для загрузки.Для просмотра этих документов вам понадобится программа, которая может читать формат Microsoft Word. Если у вас ничего нет, вы можете бесплатно скачать MS Word Viewer.
MP3 Большинство веб-браузеров воспроизводят аудио в формате MP3 в браузере
Кверцетин улучшает дисбактериоз кишечника у мышей, получавших антибиотики
Разнообразие и активность кишечной микробиоты людей и животных в значительной степени зависят от диеты.Кверцетин, один из типичных полифенолов в рационе человека, обладает широким спектром биологических свойств. Целью этого исследования было изучить пребиотические эффекты кверцетина у мышей, получавших антибиотики. Дисбактериоз кишечника был успешно индуцирован у мышей обработкой коктейлем антибиотиков. Для исследования содержания короткоцепочечных жирных кислот, а также разнообразия и состава кишечных микробов были использованы методы газовой хроматографии и высокопроизводительного секвенирования 16S рДНК. Результаты показали, что добавление кверцетина значительно улучшило разнообразие кишечного бактериального сообщества у мышей, получавших антибиотики ( P <0.05). Между тем, барьерная функция кишечника также заметно восстановилась, на что указывает снижение содержания сывороточной D -молочной кислоты и активности сывороточной диаминоксидазы ( P <0,05). Длина кишечных ворсинок и толщина слизистой оболочки также были значительно увеличены в ответ на лечение кверцетином ( P <0,05). Кроме того, продукция бутирата с фекалиями была значительно увеличена у мышей, получавших кверцетин ( P <0.05). В заключение, кверцетин эффективен для восстановления микробиоты кишечника у мышей после лечения антибиотиками и может действовать как пребиотик в борьбе с дисбактериозом кишечника.
У вас есть доступ к этой статье
Подождите, пока мы загрузим ваш контент… Что-то пошло не так. Попробуйте снова? .


 Подходит для лечения дисбактериоза в любом возрасте, не имеет противопоказаний и побочных эффектов.
Подходит для лечения дисбактериоза в любом возрасте, не имеет противопоказаний и побочных эффектов.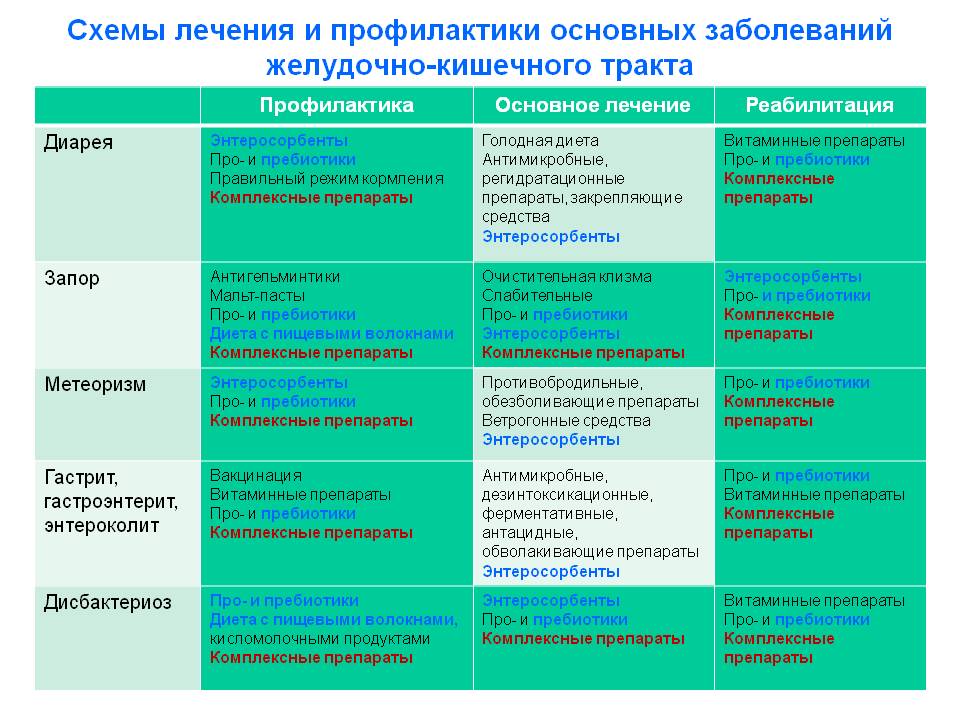 При необходимости лечения во время беременности,требуетсяконсультация врача.
При необходимости лечения во время беременности,требуетсяконсультация врача.