Дисбактериоз у грудничка лечение в домашних условиях: Лечение дисбактериоза кишечника у детей
Дисбактериоз у ребенка. Что делать? Народное лечение дисбактериоза
Дисбактериоз – термин, который используется в микробиологии. Им обозначается состояние микрофлоры на коже, в носу и влагалище, кишечнике человека. Чаще всего, если упоминают о дисбактериозе, то имеют в виду дизбактериоз кишечный.
В толстой кишке здорового человека находится более четырех сотен культур микроорганизмов, например, стрептококк, кишечная палочка, лактобактерии и прочие. Взаимодействуя, бактерии участвуют в пищеварительном тракте.
Микробиологи вывели оптимальное соотношение «хороших» и «плохих» микроорганизмов. Отклонение от нормы, то есть преобладание болезнетворных бактерий, провоцирует различные расстройства пищеварительной системы.
Симптомы дисбактериоза у детей
Степень проявления дисбактериоза у ребенка зависит от его возраста, особенностей защитных свойств организма и превалирующих патогенных микроорганизмов.
Среди основных признаков выделяют:
- разжижение каловых масс, говоря проще, диарея;
- кал приобретает зеленоватый оттенок;
- вздутие живота и колики;
- покраснение и шелушение кожи;
- потемнение зубной эмали;
- боли в нижней части живота.

Если дисбактериоз не был замечен сразу и вошел в хроническую стадию, то щечки малыша покрываются красными пятнышками. Внешне, это напоминает диатез, которым и является.
Кишечник не справляется с нейтрализацией токсинов и аллергенов, потому возникает аллергия, как реакция на «передозировку» вредными веществами.
В случае с грудничком определить дисбактериоз «на глаз» достаточно трудно, так как повышенное газообразование может быть результатом перекармливания или неправильного подбора смеси для кормления.
Тем не менее, дисбактериоз не является самостоятельным заболеванием. Оно подобно насморку при простуде – следствие более серьезных и глобальных проблем организма.
Причины дисбактериоза у детей
Изменение рациона питания может спровоцировать дисбаланс микроорганизмов в кишечнике. Особенно, если продукты были подобраны не по возрасту. Они не перевариваются и начинают разлагаться в кишечнике, где становятся отличной средой для размножения болезнетворных микроорганизмов. Тот же результат может спровоцировать перекармливание ребенка.
Тот же результат может спровоцировать перекармливание ребенка.
Добавление в пищу экзотических фруктов считается полезным. Тем более апельсины и бананы давно считаются «детскими» продуктами. Однако, в экзотических плодах и микробы экзотические для организма ребенка.
Тело матери также не вырабатывает необходимых микроорганизмов для их передачи малышу. В результате кишечник и другие органы принимают на себя атаку непривычных бактерий, от которых ребенок пока не готов защититься.
Причем вредоносные частички не обязательно попадают в организм прямо с прикормом. Часто они передаются вместе с материнским молоком.
Грязная вода, которая периодически появляется в наших кранах, также полна микроорганизмов. Смена места жительства или отдых на даче часто неудачно комбинируется с расстройством стула не только у детей, а и у взрослых. Причина в том, что организм вырабатывает защиту перед актуальной опасностью. Микробиологический состав воды разнится в зависимости от источника, потому тело оказывается беззащитным в борьбе с новыми вредителями.
Микробиологический состав воды разнится в зависимости от источника, потому тело оказывается беззащитным в борьбе с новыми вредителями.
Антибиотики широкого спектра редко назначают кормящей матери или малышу, но иногда этого не избежать. Состав препарата призван убить бактерии, без разбора на «хороших» и «плохих».
После приема антибиотика в кишечнике ребенка резко снижается количество микроорганизмов. Вопрос только в том, какие именно бактерии доберутся быстрее и заселят организм малыша.
Дисбактериоз у грудничков
Ребенок рождается на свет абсолютно стерильным. В первые часы и дни его жизни, кишечник заселяется бактериями. Больше половины из них мать малыша передает вместе с молоком.
Более того, в молозиве находится двойная или даже тройная (зависит от состояния женщины) порция полезных лакто- и бифидобактерий.
В некоторых случаях, мать не имеет возможности кормить ребенка традиционным способом.
Соответственно, ранний переход на смеси и их неправильный выбор становятся одной из основных, если не единственной, причиной дисбактериоза у грудничков.
Для грудничков лучшим лечением дисбактериоза является кормление грудным молоком или адекватный выбор смеси.
Возможные последствия дисбактериоза
Дисбактериоз – состояние организма, последствие других заболеваний. Однако продолжительный дисбаланс с перевесом патогенных организмов позволяет им заселить кишечник.
Поскольку бактерии участвуют в пищеварительном тракте на этапе расщепления пищи на ее составляющие, то дисбаланс микрофлоры не позволяет организму получить все питательные вещества из пищи. Ребенок просить больше еды, что является первым звоночком дисбактериоза.
Нарушение пищеварительного тракта на этапе всасывания воды приводит к мальабсорбции. Для родителей это значит, что кал станет жидким и пенистым.
Как сдать анализы на дисбактериоз у детей
Способствует неверию в дисбактериоз отсутствие достоверного анализа на состав микрофлоры кишечника. Поскольку есть возможность исследовать только каловые массы человека, то анализ на дисбактериоз напоминает гадание на чайной гуще.
Поскольку есть возможность исследовать только каловые массы человека, то анализ на дисбактериоз напоминает гадание на чайной гуще.
С калом организм освобождается от лишних или патогенных микроорганизмов, то есть избавляется от ненужного. На основание такого анализа нельзя делать вывод о микрофлоре внутри организма.
Анализа на дисбактериоз не существует. Есть только анализ на наличие патогенных микроорганизмов.
Именно такое исследование проводится при выявлении симптомов дисбактериоза.
Лечение дисбактериоза у детей
Врачи настоятельно рекомендуют не путать следствие с причиной, потому лечение дисбактериоза стоит не на первом месте.
Но для облегчение общего состояния ребенка есть как фармакологические средства, так и народные.
Препараты и средства для лечения дисбактериоза у детей
Несмотря на откровенно негативное отношение врачей к существованию дисбактериоза как самостоятельной болезни, они не запрещают родителям активно бороться против дисбактериоза даже с помощью фармакологических средств.
Всевозможные пробиотики, по утверждениям фармакологических компаний, содержат полезные лакто- и бифидобактерии. Но врачи предупреждают, что слюна, желудочный сок, желчь и прочие жидкости желудочного тракта полностью растворяют и обезвреживают эти микроорганизмы. Однако это не доказано.
Соответственно, никакого вреда, как и пользы, нанести организму они не могут.
В большинстве стран пробиотики находятся в категории «потенциально не опасных препаратов». Грубо говоря, это те же БАДы, только в профиль.
Аптеки предоставляют несколько препаратов, содержащих лактобактерии: Лактобактерин в форме таблеток и Биобактон или Ацилакт в виде порошка.
Полезные бифидобактерии содержатся в препаратах: Бифидумбактерин, выпускается в таблеточной форме, не рекомендуется детям до 3-х лет. Под таким же названием выпускают ректальные свечи.
Лечение дисбактериоза народными средствами
Рецепт №1
Нужно найти рынок или молочную кухню, где производится проверка продуктов на наличие болезнетворных микроорганизмов, и купить кефир.
Рецепт №2
Прокипятить литр молока и остудить его. Для закваски в молоко кладется 4 корочки черного хлеба. Через сутки нужно добавить еще 2 корочки, натертые чесноком. Уже через пару часов молоко превратится в чесночную простоквашу. Хранить в холодильнике. Ребенок может пить простоквашу за 20 минут до еды или через полчаса после. Баланс микрофлоры должен восстановиться за несколько дней.
Рецепт №3
Отвар череды – концентрат пребиотиков. Для целебного напитка потребуется 2 ст. л. сухой череды и 300 мл горячей воды. После остывания, отвар можно пить по 1 ст. л. перед каждым приемом пищи, то есть не менее 3-х раз. Курс лечения – не более одной недели.
Профилактика дисбактериоза у детей
В качестве профилактики, врачи советуют использовать пребиотики – натуральные продукты, стимулирующие рост полезных бактерий. Они расщепляются только в толстом кишечнике, то есть в целости и сохранности доставляют пищу для микроорганизмов с положительной репутацией.
В число продуктов, содержащих пребиотики, входят:
- кисломолочные продукты;
- крупы;
- хлеб;
- кукурузные хлопья;
- чеснок;
- репчатый лук;
- горох;
- фасоль;
- полевой цикорий.
Для грудничков лучшая профилактика — грудное вскармливание.
Дисбактериоз у детей: советы и отзывы
- Со стороны медицины есть один основной совет: искать основное заболевание, симптомом которого является дисбактериоз.

- Народное мнение сходится на устранении факторов, которые вызывают дисбаланс микрофлоры кишечника.
- Многие врачи не против комбинировать народные методы лечение и официальные. Именно такая комбинация позволяет устранить неприятные для малыша симптомы и искать основной диагноз.
Видео: Дисбактериоз — школа доктора Комаровского
Видео: Лечим дисбактериоз в домашних условиях
Налет Пристли – что это, диагностика, профилактика
Всем родителям приятно наблюдать, как их ребенок сбалансировано развивается и регулярно улыбается, имея красивые и здоровые зубы. Но в некоторых случаях даже на здоровых зубах образуется налет Пристли – это отложения темного цвета, которые невозможно удалить обычной чисткой зубов.
Что такое налет Пристли
Налет на молочных зубах желтоватого, черного или коричневого цвета появляется у ребенка при активном размножении бактерий в ротовой полости.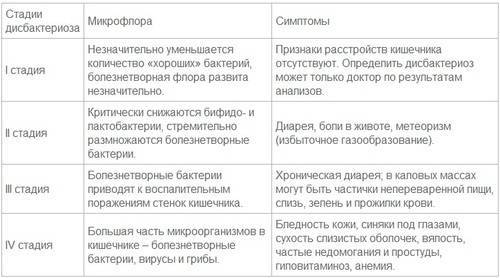 Налет Пристли часто наблюдается в раннем возрасте, но бывает и у детей старшего возраста. При появлении отложений зубы теряют свою привлекательность, что может негативно отразиться на психологическом состоянии ребенка. В случае развития симптоматики этого неприятного явления, следует незамедлительно обратиться к стоматологу для устранения налета Пристли у детей.
Налет Пристли часто наблюдается в раннем возрасте, но бывает и у детей старшего возраста. При появлении отложений зубы теряют свою привлекательность, что может негативно отразиться на психологическом состоянии ребенка. В случае развития симптоматики этого неприятного явления, следует незамедлительно обратиться к стоматологу для устранения налета Пристли у детей.
Причины появления черного налета у детей
Основные причины черного налета на зубах такие:
- Налет Пристли – главная причина появления отложений. Вырастая, ребенок избавляется от этой проблемы, так как налет почти никогда не оседает на постоянных зубах. Здоровью это явление не вредит и характеризуется, как чисто эстетический дефект.
- Кариес – это серьезное заболевание, которое может привести к потере зубов. Кариозный процесс сопровождается пожелтением, а впоследствии и почернением зубной эмали. При появлении первых симптомов необходимо в срочном порядке обратиться к стоматологу.
- Дисбактериоз – заболевание, которое ведет к появлению зубных отложений при нарушениях в работе пищеварительной системы.
 Причины болезни – это неправильное питание, длительный прием лекарств, хронические болезни, поражающие печень или кишечник.
Причины болезни – это неправильное питание, длительный прием лекарств, хронические болезни, поражающие печень или кишечник. - Перенасыщение организма железом. Назначение детям препаратов, содержащих железо, ведет к формированию, как черного зубного налета, так и отложений, имеющих темно-фиолетовый или коричневый цвет.
Кроме того, зубы могут потемнеть при недостатке кальция в организме, вызванном каким-либо заболеванием. В целом, точная причина будет выявлена на обследовании у стоматолога.
Опасен ли налет Пристли
Черный налет на молочных зубах – это эстетическая проблема, но ее нельзя игнорировать. Отложения могут свидетельствовать о развитии опасного для здоровья патологического процесса, который в запущенной форме потребует использования сложных терапевтических мероприятий.
К чему ведет игнорирование проблемы
Несвоевременное обращение к стоматологу при появлении налета на молочных зубах приводит к следующим негативным последствиям:
- развитие воспалительного процесса;
- кровоточивость десен, которая проявляется, если ребенок принимает пищу или чистит зубы;
- повышается вероятность развития таких болезней, как кариес, стоматит и пародонтоз;
- молочные зубы с черным налетом очень неэстетичны, что чревато развитием комплексов у ребенка;
- отложения могут сопровождаться неприятным запахом изо рта.

Диагностика и методы лечения налета Пристли
При появлении первых симптомов налета, следует обратиться к стоматологу, который, используя современные методы диагностики, поставит диагноз и назначит соответствующий курс лечения. Процедура под названием удаление налета Пристли выполняется специалистом с помощью инновационного оборудования, которое позволяет мягко очистить эмаль, не повредив ее.
Как убрать налет на зубах у ребенка в домашних условиях
За счет жесткой текстуры, невозможно удалить налет Пристли в домашних условиях. Такие попытки могут привести повреждению поверхности десен и развитию воспалительного процесса. Используя соду или зубной порошок, можно поцарапать поверхность эмали – в будущем в этих местах налет будет скапливаться еще больше.
Профилактика повторного появления черного налета на зубах
Профилактика появления налета включает:
- Регулярный уход за зубами и ротовой полостью. Младенцам очищают десны с помощью ватных дисков и специальных силиконовых насадок.
 Когда малышу исполнится два года, его нужно приучить правильно чистить зубы с помощью щетки и пасты, а также к регулярным полосканиям после еды.
Когда малышу исполнится два года, его нужно приучить правильно чистить зубы с помощью щетки и пасты, а также к регулярным полосканиям после еды. - Сбалансированное питание. Диета ребенка должна включать в себя меньше продуктов, насыщенных сахаром, и больше натуральных фруктов и разнообразных овощей.
- Своевременное ограничение использования соски и бутылочки. Длительное применение этих предметов ведет к появлению неправильного прикуса, развитию определенной зависимости, образованию так называемого «бутылочного кариеса». Если ребенок может обходиться без соски и бутылочки – от них следует избавиться.
Кроме того, следует постоянно следить за состоянием иммунной системы ребенка и поддерживать ее с помощью витаминов, которые оказывают благотворное влияние на здоровье зубов и всего организма. При соблюдении этих простых рекомендаций, ребенок будет всегда радовать родителей своей красивой и здоровой улыбкой.
Черный налет на зубах – налет Пристли у детей
Каждый родитель знаком с таким понятием, как прорезывание зубов. И с той радостью, которую испытываешь при появлении первого зубика.
Безусловно, все дети индивидуальны и течение этого физиологического состояния проходит по-разному: у кого-то меньше возникает проблем, у кого-то больше. Но каждый родитель обязан контролировать состояние молочных зубов, так как они также подвержены различным заболеваниям. И одним из таких заболеваний является налет Пристли.
Лечение зубов детям рекомендуется начинать вовремя, поэтому важно владеть актуальной информацией.
Что такое налет Пристли, как диагностировать, вылечить и предупредить – узнаете из этой статьи.
Налетом Пристли называют стоматологической проблемой, при которой обнаруживается налет на зубах у ребенка, имеющий черный или коричневый цвет. Чаще всего, такой налет можно встретить на нижней кромке зуба, ближе к деснам. Тонкая кайма появляется, в основном, на внутренней стороне зубов, а реже, в межзубном пространстве или на внешней поверхности зуба.
Отложения подобного рода, как правило, возникают в возрасте двух-трех лет, но могут появиться и на молочных зубках ребенка в возрасте года. Опасность этого заболевания состоит в том, что есть возможность распространения проблемы на постоянные зубы.
Важно учитывать тот факт, что налет Пристли накапливается на зубах медленно, что может повлечь за собой несвоевременное обнаружение, так как ребенок привыкнет к пятнам и не скажет о них родителям. Поэтому требуется самостоятельно осматривать полость рта ребенка и не откладывать визит в детскую стоматологию.
Бывают случаи, когда, вследствие понижения иммунной системы из-за перенесенной инфекции, отложения появились за ночь. Но для того чтобы убедиться, что здоровью ребенка ничего серьезного не угрожает, стоматолог порекомендует сдать дополнительные анализы.
Причинами возникновения налета Пристли – различные. Выделяют следующие:
- Наследственная предрасположенность или особенность, обусловленная генетикой
- Нарушение развития зубов во внутриутробном периоде
- Гипоплазия эмали зубов
- Неправильный прикус зубов
- Кариес
- Наличие болезней: сахарный диабет, заболевание щитовидной железы, заражение паразитами
- Дисбактериоз
- Обезвоживание
- Неверно подобранные средства гигиены
Детская стоматология предупреждает, что лечение в домашних условиях налета Пристли не возможно. В случае обнаружения симптомов рекомендуется обратиться к специалистам для осмотра. С помощью лазерной диагностики определяется глубина и размер поражения. На основании анамнеза детский стоматолог проводит дополнительное обследование, чтобы выявить причину появления отложений. Такой тщательный подход позволит ему выполнить качественное лечение зубов детям.
Косметическая проблема решается специалистом с помощью профессиональной чистки зубов и нанесения реминерализующего состава на эмаль, при необходимости. И далее детский стоматолог порекомендует дополнительное лечение, исходя из причины возникновения налета. Это может быть коррекция прикуса или подбор набора для домашней гигиены с обучением ребенка правильно чистить зубы, или рекомендация биологически активных добавок и диетического питания.
Для профилактики налета Пристли у детей необходимо проведение гигиенических процедур родителями с момента появления первого зуба специальным напальчником. Такая процедура позволит очистить и помассировать десны. На образование черного налета у малыша влияет состояние желудочно-кишечного тракта и его пищевые привычки.
Таким образом, детская стоматология рекомендует соблюдать следующие правила:
- вводить прикорм поэтапно
- иметь отдельную посуду для ребенка, включая ложку
- ребенку употреблять достаточное количество питьевой воды
- ребенок, по возможности, должен пить из чашки, а не бутылочки или соски
- регулярно совершать визиты к стоматологу
На основании вышеизложенного, мы можем сказать, что налет Пристли — это, прежде всего, проблема, признак о том, что в детском организме произошли изменения и бактерии стали размножаться, создавая отложения на зубах. Чтобы предупредить проблему, нужно заниматься гигиеной полости рта с момента появления первых молочных зубов малыша. Ну а если болезнь все-таки настигла, то отчаиваться не стоит, а стоит обратиться к специалисту детской стоматологии.
дисбактериоз, лактазная недостаточность и посев молока на стерильность
Как-то раз я получила задание от своего руководства ответить на вопрос нашей американской коллеги, консультанта по грудному вскармливанию из La Lache League: “На родительских конференциях в интернете российские мамочки очень часто обсуждают три вопроса: лактазная недостаточность, дисбактериоз и посев молока на стерильность. Что имеется в виду?”
Первые два состояния напоминают, то, что они, в LLL называют дисбалансом переднего и заднего молока и дисбиозом. Но эти состояния не являются страшной патологией, а на сайтах они обсуждаются именно с такой точки зрения. Про посев молока на стерильность – американка и вовсе спросила, а зачем проводят ??
Начну по порядку.
Лактазная недостаточность (или непереносимость лактозы)
По данным специальной литературы, болезни углеводного обмена, связанные изменением активности ферментов, расщепляющих сахара, в том числе лактозу, встречаются в популяции крайне редко. Данные по разным странам различны. Частота таких заболеваний изменяется от 1 на 20 000 до 1 на 200 000 детей. Почему же педиатры говорят о лактозной непереносимости чуть ли не у каждого второго ребенка?
Как смогло выжить человечество, если это заболевание, приводящее, например, к гипотрофии при отсутствии лечения и гибели, встречается у большинства младенцев? Человечество смогло дожить до нынешних времен потому, что истинная лактозная непереносимость, обусловленная генетически и связанная с полным отсутствием или серьезным недостатком необходимых ферментов встречается очень редко. А что же встречается очень часто? С чем же постоянно сталкиваются современные врачи? С лактозной непереносимостью, образовавшейся в результате неправильно организованного грудного вскармливания.
Если мама кормит ребенка 6-7 раз в сутки, «копит» молоко к кормлению, сцеживает после кормлений, перекладывает ребенка во время кормления то к одной, то к другой груди – очень велика вероятность развития лактозной непереносимости. Это та самая лактозная непереносимость, причиной развития которой является дисбаланс между «передней» и «задней» порциями молока. Получается, что ребенок питается преимущественно «передней» порцией молока, более жидкой, содержащей большое количество лактозы. В груди между кормлениями также собирается преимущественно «переднее» молоко, «заднее» молоко, густое, более жирное, образуется преимущественно во время сосания ребенка. Если мама переложит малыша минут через 5-10 после начала кормления к другой груди, он и из нее высосет переднее молоко. Заднее молоко мама сцедит. Малыш будет не очень хорошо прибавлять в весе, иногда просто мало. У него может быть жидкий стул с зеленью и пеной. Мама будет считать, что у нее плохое молоко, хотя его и много.
Такая же ситуация может быть, если мама ограничивает ребенка в сосании, например, строго по 15-20 минут. Ребенок часто не успевает добраться до «заднего» молока. И, кроме того, он недостаточно стимулирует грудь на выработку молока, если по 15-20 минут он сосет 6-7 раз в сутки. Поэтому параллельно, в описанных выше ситуациях, будет развиваться недостаток молока. Когда ребенка начнут прикармливать безлактозной смесью, он начнет толстеть, все вздохнут с облегчением и в сознании укрепится миф о том, что молоко может быть плохим и его вообще мало у современных женщин. Встречается также и транзиторная, временная лактазная недостаточность. У ребенка на правильно организованном грудном вскармливании, с хорошей прибавкой в весе, вообще с хорошим самочувствием, в первые 2-3 месяца жизни (а иногда и дольше) стул пенистый. Если мама скажет об этом врачу, будет назначено обследование, в анализе будут обнаружены сахара. Ребенка переведут на безлактозную смесь. Однако неполное поглощение лактозы является обычным явлением для ребенка на грудном вскармливании!!! (66% детей в возрасте 6 недель и 60% детей в возрасте 3 месяцев).
Одной маме, например, в такой ситуации было сказано: «Ваш ребенок испытывает сильнейшие боли! Посмотрите, какое у него газообразование! А вы продолжаете кормить его своим молоком! Оно для него – яд!!!» Я не утверждаю, что так действуют все врачи. Я знаю педиатров, которые, видя что ребенок вполне благополучен, не начинают его лечить, опираясь только на полученные лабораторные результаты, и даже не назначают излишние обследования! Давайте вспомним о том, что последние лет 50 врачи имели дело преимущественно с детьми, которых кормили смесями. Соответственно, многие знания и лабораторные тесты применимы только к этой группе детей. Наличие сахара в стуле ребенка на искусственном вскармливании является патологией. Наличие сахара в стуле ребенка на грудном вскармливании нормально!
Значительное количество сахара может быть следствием неправильных рекомендаций по кормлению ребенка (частая перемена груди во время кормления, ограничение продолжительности сосания, сцеживание после кормления), т.к. ребенок получает много богатого лактозой переднего молока. Лактозная непереносимость и новорожденный ребенок – неслыханное сочетание!!!
Дисбактериоз новорожденного
Это состояние необычайно популярно. Малыш, как известно, рождается со стерильным кишечником. Если с момента родов к нему в рот не попадает ничего, кроме материнского соска (на что он, кстати, природой только и рассчитан), то довольно быстро желудочно-кишечный тракт ребенка засевается нормальной микрофлорой. В молозиве и в материнском молоке содержатся факторы, способствующие росту нормальной микрофлоры и подавляющие патогенную. В случае, если грудное вскармливание было организованно неправильно (а случай этот, к сожалению, самый распространенный), если уже в первые сутки после родов, до знакомства с материнской микрофлорой, малыш начал получать через рот разнообразные жидкости, заселение кишечника происходит далеко не идеально.
Но даже в этом случае материнское молоко поможет справиться с проблемами. Самое интересное происходит при появлении ребенка дома. Нормальный стул ребенка на грудном вскармливании жидкий, желтый, с белыми комочками, может быть 7-10 раз в сутки по чуть-чуть или 1 раз в несколько суток, но большим объемом. Чаще всего стул бывает 3-5 раз в день, у малышей первых месяцев жизни. Участковые педиатры называют эти нормальные детские какашки поносом и отправляют сдавать маму анализ кала на дисбактериоз.
При этом совершенно не учитывается тот факт, что малыш первые полгода жизни имеет право на дисбиоз в своем кишечнике и на любой стул, особенно, если при этом он хорошо растет и развивается. Потом начинается лечение, одним из главных пунктов которого является перевод ребенка, например, на кисломолочную смесь. Педиатры не виноваты. Они привыкли к стулу ребенка на искусственном вскармливании – более густому и однообразному. Еще более интересная ситуация встречается потом, когда несмотря на питье, например, различных биопрепаратов, у ребенка продолжают высеваться микроорганизмы, не подходящие для его кишечника. В этом случае маме говорится, что все дело в ее молоке, и настаивают на прекращении грудного вскармливания.
Показателен в этом отношении следующий случай. У малыша на грудном вскармливании постоянно высевались грибы Candida и гемолизирующая кишечная палочка, в больших количествах. Никакое лечение на данных микроорганизмов действия не оказывало. Маме все время говорилось, что виновато молоко. Докормив ребенка до года, мама отняла его от груди. Ребенок начал часто болеть, а грибы и палочки остались в прежних количествах.
Посев молока на стерильность
При посеве молока на стерильность в 50-70% случаев высеваются различные микроорганизмы, чаще всего стафилококки золотистый и эпидермальный. Очень часто, при обнаружении этих организмов, маме прописывается курс лечения антибиотиками, в это время ребенка неделю кормят смесью, после чего он обычно отказывается от груди. Это худший вариант, но часто встречающийся. Или маму и ребенка начинают лечить, используя биопрепараты, или мама и ребенок пьют хлорофиллипт. Между тем, наличие стафилококков в молоке ничего не означает! И золотистый и эпидермальный стафилококки живут на коже человека, а также имеются на большинстве окружающих его предметов. Например, стафилококк обладает тропностью к хлопчатобумажной ткани. При перемещении стопки пеленок количество стафилококков в воздухе резко увеличивается! Вместе с материнским молоком ребенок получает специфические антитела, помогающие ему справляться со стафилококком при необходимости.
Получается, что стафилококк материнского молока поступает к ребенку вместе с защитой от него же. Он не опасен для ребенка! Больше того, ребенку необходимо, в первые часы после родов, заселиться маминым стафилококком. От этого стафилококка он будет защищен мамиными антителами, которые он будет получать с молозивом и молоком, и которые он уже получал трансплацентарно! Вся микрофлора маминого организма уже «знакома» иммунной системе ребенка, благодаря проникающим трансплацентарно антителам. Для ребенка опасно заселение микрофлорой роддома, в том числе и госпитальными штаммами стафилококка, устойчивого к антибиотикам! С этими микроорганизмами он не знаком и заселение ими его кожи и желудочно-кишечного тракта опасно для младенца. Если ребенок не имеет возможности «заселиться» маминой микрофлорой, он заселяется тем, что есть вокруг. Как говорится, свято место пусто не бывает. Если нет возможности «домашнему» штамму Staphyloccocus aureus поселится на младенце, его место займет госпитальный штамм. Но это не страшно ребенку на грудном вскармливании, организм матери, выработкой соответствующих антител, поможет ребенку. Если, конечно, в жизни ребенка будет место грудному вскармливанию.
Наличие стафилококка в молоке никак не сказывается на его качестве. Стафилококковый энтероколит, которым часто пугают мам, убеждая их перестать кормить своим «ядовитым» молоком – состояние крайне редкое, встречающееся при заболеваниях иммунной системы, и возникновению которого способствует искусственное вскармливание! Надо полагать потому, что если даже у малыша, по каким-то внутренним причинам, ослаблен иммунитет, с материнским молоком он все же будет получать значимую поддержку. При переводе на искусственное вскармливание он лишается этой поддержки.
Обращение к педиатрам
Уважаемые коллеги! Если наблюдаемый вами соматически здоровый ребенок, находящийся на грудном вскармливании, плохо набирает в весе, имеет зеленый, неустойчивый стул, проблемы с кожей, прежде чем переводить его на искусственное вскармливание, назначать обследование и лечение, постарайтесь выяснить, а правильно ли организовано грудное вскармливание данного младенца? Грудное вскармливание – процесс очень простой, если не сказать, элементарный. Но! Только в том случае, если мама, кормящая грудью, выполняет несколько простых правил и действий.
Эти правила и действия, относящиеся к области культуры материнства, в течение тысячелетий были повсеместно известны и использовались. А ныне почти утрачены. Без знания этих правил полноценное грудное вскармливание не может состояться.
Если мама кормит малыша 6-7 раз в сутки, использует пустышку, допаивает младенца чайком или водичкой, сцеживается, не кормит ночью – она совершает действия, на которые ни ребенок, ни она сама природой не рассчитаны. Невозможно наладить естественный процесс, действуя противоестественно! Если у ребенка неправильное прикладывание к груди, и никто этого не замечает – это очень грустно, т.к. природа не рассчитывала, что у начинающей кормить женщины не накопится опыт наблюдения в течение жизни за другими кормящими женщинами и не будет рядом опытной матери, способной ее исправить.
Без правильного прикладывания не будет достаточной стимуляции груди для выработки необходимых количеств молока, даже при частых кормлениях и ребенку с неправильным прикладыванием трудно извлекать из груди «заднее», жирное, густое молоко! В такой ситуации необходимо обучить маму и ребенка правильному прикладыванию к груди, наладить частые кормления по требованию ребенка, исключить использование других оральных объектов и допаивание, наладить полноценные ночные кормления, свести на нет сцеживания, если они имеются. Через 2-4 недели посмотрите на ребенка опять. В 99% случаев ни искусственное питание, ни обследование, ни лечение ребенку не понадобятся.
Автор: Лилия Казакова, педиатр,
руководитель «Службы консультантов по грудному вскармливанию и уходу за ребенком»
Профессиональная гигиена полости рта для детей
Зачем нужна профессиональная гигиена зубов для детей?
По нашей внутренней статистике, более 90% пациентов не умеют чистить зубы. Поэтому взрослые, чаще всего, не могут научить своих детей чистить зубы правильно.
Но для ребенка делать это качественно еще важнее, чем для взрослого человека – вероятность заболевания кариесом при плохой гигиене у молочных зубов приближается к 100%. А от здоровья первых зубов зависит здоровье постоянных.
Поэтому так важно, чтобы родители уделяли пристальное внимание уходу за зубами ребенка – причем, не только домашнему, но и кабинетному, профессиональному.
Спросите, неужели детям делают процедуру зубной профгигиены, т.е. профессиональной чистки зубов? Конечно! Процедура детской регулярной профгигиены – это основной метод профилактики кариеса у детей и воспаления десен.
Образуется ли у детей зубной камень?
Ничуть не меньше, чем у взрослых. При недостаточной гигиене молочных зубов, а она, скорее всего, в любом случае желает лучшего, – мягкий зубной налет накапливается, уплотняется и постепенно превращается в зубной камень, который не только начинает механически давить на десну, но и становится источником бактериальной инфекции. В результате дёсна воспаляются и при малейшем прикосновении начинают кровоточить.
Ребенок избегает чистить этот участок, и проблема только усугубляется.
В некоторых случаях, при наличии у ребенка заболеваний ЖКТ или дисбактериоза, налет начинает впитывать пигмент и становится черным, похожим на налет курильщика.
Избавиться от такого налета в домашних условиях невозможно.
Памятка для родителей: как сохранить здоровье зубов ребенка.
- Ребенок должен чистить зубы 2 раза в день – утром и вечером, специальной детской щеткой и пастой, подходящей для его возраста.
- Научите ребенка пользоваться зубной нитью для удаления остатков пищи между зубами.
- Чтобы предупредить развитие «бутылочного кариеса» сведите количество перекусов, особенно сладких, к минимуму.
- Даже, если нет никаких проблем, посещать детского стоматолога нужно регулярно каждые полгода, начиная с годичного возраста. При необходимости врач назначит вашему ребенку процедуру профгигиены, это, также, прекрасный способ научить малыша не бояться стоматолога.
Чем отличается процедура детской профессиональной гигиены от «взрослой»?
Эмаль молочных зубов, а также постоянных зубов, которые только что прорезались в сменном прикусе, очень хрупкая и нежная, поэтому при детской гигиене врач выполняет процедуру вручную, без использования аппарата AirFlow, максимально бережно, не использует абразивные порошки и пасты.
Как проходит детская профессиональная гигиена полости рта?
- 1. В начале приема врач знакомится с ребенком и устанавливает с ним контакт – ведь мы будем играть в «Миссия: чистота».
- 2. Врач наносит на зубки специальный раствор, для индикации зубного налета.
- 3. Специальной циркулярной щеточкой и полировочной пастой врач полностью очищает зубки от зубных отложений. Во время процедуры эффективно удаляется налет из труднодоступных мест – десневой борозды и пришеечной области.
- 4. В некоторых случаях, при наличии твердого зубного налета, врач использует ручные инструменты или ультразвуковой скалер для его удаления.
- 5. После очистки зубы покрываются реминерализующим лаком, содержащим фтор, который укрепляет детскую зубную эмаль и уменьшает ее чувствительность. Такая процедура поможет справиться даже с кариесом в начальной стадии «белого пятна».
- 6. По показаниям врач может предложить процедуру герметизации фиссур – это запечатывание специальным промбировочным материалом с фтором очень уязвимых для кариеса «ямочек» зуба.
- 7. В конце процедуры врач научит ребенка правильно чистить зубки дома и подберет правильную щетку и пасту.
Как часто ребенку нужно проходить процедуру профессиональной гигиены?
Такую процедуру рекомендуется делать ребенку раз в полгода начиная с 2,5-3- х лет. Но не следует забывать, что есть и индивидуальные особенности, и, прежде всего, это – качество ежедневной гигиены и отсутствие сопутствующих заболеваний, которые провоцируют повышенное образование зубного налета. Одному ребенку будет достаточно провести гигиену раз в год, а другому – и раз в месяц будет мало.
При ортодонтическом лечении, если зубки расположены скученно, профессиональную гигиену проводят чаще – индивидуальный график должен установить ваш лечащий врач.
Лечение пульпита молочных зубов
Лечение поверхностного кариеса методом инфильтрации
Лечение кариеса или пульпита зубов детям до 14 лет
Детская ортодонтия
Налет Пристли
Вернуться к списку статейВ некоторых случаях на зубах ребёнка появляется чёрный налет, который невозможно удалить в домашних условиях. Естественно, родители пугаются этого и не могут понять, так себя проявляет кариес или это следствие некачественной чистки зубов. Пришло время узнать, что же такое налет Пристли и каковы причины его появления.
Налет Пристли или иначе «Black stains» — это бактериальный, пигментированный налёт желтоватого, коричневого, а порой даже чёрного цвета. У детей он встречается почти в 10 раз чаще, чем у взрослых. Причиной возникновения налёта Пристли является индивидуальная особенность микрофлоры полости рта ребёнка и образуется он в результате роста колоний пигментообразующих бактерий и сокращения численности полезных бактерий. Физиологические изменения в кишечнике и дисбактериоз вполне могут вызвать появление налёта Пристли. Такой налет может проявляться слабее или сильнее в разные периоды жизни ребёнка.
Во рту у любого человека насчитывается более 160 видов микроорганизмов, часть из них является патогенной флорой. Колонии отдельных видов бактерий и вызывают появление тёмного налёта. При некоторых условиях качественный и количественный состав микрофлоры может начать меняться и начинают превалировать пигментообразующие бактерии.
Как бороться с налётом Пристли?
Удалять налет Пристли детям в домашних условиях с помощью абразивных чистящих средств с крупными элементами не рекомендуется, так как может пострадать итак тонкая эмаль детских зубов. Необходимо записаться на прием к стоматологу на профессиональную гигиену полости рта, в рамках которой будет удалён налет с помощью лазера или ультразвука.
Также рекомендуется обратиться к гастроэтерологу для установления причины дисбаланса микрофлоры в ротовой полости.
Чёрный налет на зубах вызывает эстетический дискомфорт у ребёнка, а также может спровоцировать образование твёрдых зубных отложений. К тому же под налётом могут скрываться кариозные полости, которые будет сложно заметить родителю при визуальном осмотре зубов. Существует мнение, что если у ребёнка есть налет Пристли, то кариес ему не грозит. Такие заявления делаются на основании того, что для развития кариеса требуется кислая среда, а налет развивается, напротив, в щелочной среде. Но все же наличие или отсутствие кариеса у детей под налётом может диагностировать только стоматолог. В любом случае рекомендуется проходить профосмотр у детского стоматолога с периодичностью раз в полгода, чтобы избежать появления кариеса или же остановить кариозный процесс в самом начале.
Если вы заметили подозрительный налет на зубах ребёнка не откладывайте визит в детскую стоматологию, это может быть как некачественная гигиена полости рта, так и возникновение налёта Пристли, справиться с которым вам поможет стоматолог.
Записаться на прием
Лечение астматического бронхита
При лечении астматического бронхита необходимо учитывать фазу заболевания. Например, в период обострения назначают бронхоспазмолитические средства, а в случае наличия инфекции возможно назначение антибиотиков. Большинство специалистов рекомендуют прием витаминов. Лечебная гимнастика и массаж применяются при отсутствии острых воспалительных реакций, а в период ремиссии хорошие результаты дает санаторно-курортное лечение.
Клиника «Мединеф» имеет большой опыт в лечении астматического бронхита. Мы обладаем современным оборудованием, а наши специалисты необходимыми знаниями и опытом. Высококвалифицированный персонал поможет справиться с болезнью и вернуть больного к полноценной жизни.
Астматический бронхит
Астматический бронхит является формой респираторного аллергоза. В ряде случаев возможна трансформация в бронхиальную астму. Астматический бронхит в основном наблюдается у детей в раннем возрасте.
Причиной астматического бронхита могут быть как неинфекционные, так и инфекционные факторы. В качестве аллергенов, вызывающих астматический бронхит для детей раннего возраста может выступать пища, лекарства или вакцина. При астматическом бронхите отсутствуют приступы выраженного удушья.
Особенности протекания заболевания
Характерной особенностью астматического бронхита является повторяемость симптомов. В период обострения заболевания наблюдается упорный кашель, который возникает чаще ночью. Причинами его возникновения могут быть физические и эмоциональные факторы. Вначале кашель сухой, но затем может переходить во влажный. Прослушиваются различные хрипы, но удушья не возникает. При неинфекционной природе заболевания приступы прекращаются при нахождении вне дома. Обострение может длиться от нескольких часов до 4 недель. В основном наблюдается осенью и зимой.
У значительного числа больных в раннем возрасте наблюдаются диатез, а в дошкольном — нейродермит.
Диагностика астматического бронхита
Диагностика астматического бронхита осуществляется на основании анамнеза, характера физических и рентгенологических изменений, а также кожных проб и анализа крови. Подтверждением диагноза служит элиминационный эффект.
Рецидивы заболевания часто приводят к постановке неправильного диагноза – пневмонии. В связи с этим следует особо тщательно подходить к диагностике астматического бронхита.
Записаться на прием к врачу можно ежедневно по многоканальному телефону в г. Санкт-Петербурге 8 (812) 603-03-03 и в г. Кириши 8 (81368) 535-66.
Дисбактериоз у детей, рожденных путем кесарева сечения – FullText – Annals of Nutrition and Metabolism 2018, Vol. 73, Прил. 3
Аннотация
Частота родов с помощью кесарева сечения в США увеличилась на 60% с 1996 по 2013 год и в настоящее время составляет> 30% родов [CDC, 2017]. Цель этого обзора – представить текущее понимание как микробных факторов риска, повышающих вероятность кесарева сечения, так и микробного дисбактериоза, который, как считается, является результатом кесарева сечения.Мы приводим примеры исследований влияния микробного дисбиоза в раннем возрасте на развитие младенцев и долгосрочные последствия для здоровья, а также рассматриваем эффективность и долгосрочные последствия микробиомной терапии для смягчения этого дисбиоза. Резкий рост частоты родов с помощью кесарева сечения делает необходимым понимание потенциала модуляции микробиоты для лечения дисбактериоза.
© 2018 S. Karger AG, Базель
Введение
Микробиота кишечника играет решающую роль в иммунном и метаболическом развитии младенцев, а способ родоразрешения является основным определяющим фактором воздействия и колонизации в раннем возрасте [Madan et al., 2016]. Желудочно-кишечный тракт человека практически не колонизируется внутриутробно, поэтому воздействие микробов во время родов и в окружающей среде сразу после рождения является ключом к созданию микробиоты. В случае естественных родов младенец контактирует с влагалищным и кишечным содержимым матери [Rutayisire et al., 2016]. Младенцы, рожденные естественным путем, колонизированы микробами, включая Lactobacillus , Prevotella , Bacteroides , Escherichia / Shigella и Bifidobacterium [Dominguez-Bello et al., 2010], которые были обнаружены в образцах влагалища и фекалий взрослых матерей. Микробный дисбиоз во время беременности часто связан с осложнениями, которые могут указывать на кесарево сечение, такими как преждевременные роды, крайние значения индекса массы тела (ИМТ) матери, инфекция, крайние размеры ребенка и гестационный диабет [Neu and Rushing, 2011]. Роды с помощью кесарева сечения прерывают нормальный паттерн микробной колонизации; младенцы больше не подвергаются воздействию материнских вагинальных или кишечных микробов во время родов.Вместо этого в младенцах, перенесших кесарево сечение, преобладают кожные и ротовые бактерии человека, включая Staphylococcus , Streptococcus , Corynebacterium , Veillonella и Propionibacterium [Dominguez-Bello et al., 2010; Bäckhed et al., 2015]. Микробиота кишечника тесно связана с тренировкой врожденной иммунной системы, и ее нарушение в раннем возрасте может привести к инфекциям, сепсису и системным иммунным и метаболическим нарушениям, которые влияют на риск заболевания в течение всей жизни [Zhu et al., 2015]. Микробный дисбактериоз, вызванный кесаревым сечением, был связан с повышенным риском таких состояний, как астма [Couzin-Frankel, 2010], ожирение [Mueller et al., 2015], пищевая аллергия [Lieberman et al., 2018], диабет 1 типа (T1D) [Kostic, 2015], системные нарушения соединительной ткани, ювенильный артрит, воспалительное заболевание кишечника (IBD) и лейкемия [Sevelsted et al., 2015], как показано в таблице 1. Цель этого обзора – представить текущее понимание как микробных факторов риска, которые увеличивают вероятность кесарева сечения, так и микробного дисбактериоза, который, как считается, является его результатом.
Таблица 1.
Неполный список недавних исследований, изучающих связь родоразрешения с помощью кесарева сечения с долгосрочными последствиями для здоровья
Материнский микробиом во время беременности
Материнская микробиота может влиять на течение беременности и потенциально определять исходы для здоровья младенцев. Во время беременности в организме матери происходят радикальные физиологические колебания гормонов и иммунного статуса [Fox and Eichelberger, 2015]. Недавние исследования показали, что эти изменения совпадают с изменениями в микробиоме кишечника матери, причем значительные сдвиги происходят с первого по третий триместр [Koren et al., 2012]. В этот период численность типов, протеобактерий и актинобактерий увеличивается, а общее видовое богатство уменьшается [Koren et al., 2012]. Однако другие исследования показали, что микробиом кишечника и полости рта остается относительно стабильным во время беременности, в то время как микробиом влагалища претерпевает значительные изменения [Bisanz et al., 2015].
Понимание эффектов микробной колонизации во время беременности является ключевым моментом для потенциальных клинических применений, включая стратификацию риска на основе материнского микробиома.Известно, что определенные профили микробных сообществ влагалища коррелируют с исходами беременности, такими как преждевременные роды [Hyman et al., 2014; Haque et al., 2017; Стаут и др., 2017]. На микробиом матери влияет лечение антибиотиками [Bennet et al., 1986], заболевания пародонта [Michalowicz et al., 2006] и статус курения, и это связано с неблагоприятными исходами беременности [Paropkari et al., 2016]. Хотя долгое время считалось, что внутренняя часть амниотического мешка является стерильной средой и что первый контакт с микробами происходит во время родов [Funkhouser and Bordenstein, 2013], недавние исследования охарактеризовали бактериальную ДНК в амниотической жидкости [DiGiulio et al., 2008], пуповинная кровь [Jiménez et al., 2005], меконий [Jiménez et al., 2008; Hu et al., 2013; Ardissone et al., 2014] и плаценты [Aagaard et al., 2014; Collado et al., 2016]. Образцы микробиома с этих участков дают низкую биомассу, потенциально уязвимую для заражения из других источников ДНК [Kliman, 2014; Лаудер и др., 2016]. Кроме того, было трудно отличить живые бактериальные клетки от продуктов ДНК; хотя в некоторых отчетах использовались методы на основе культур для количественного определения бактерий в тканях плаценты, оказалось, что не все плаценты содержат бактерии [Stout et al., 2013]. В целом, еще предстоит определить, является ли наличие внутриутробной микробиоты частью здоровой и нормальной беременности. Однако у некоторых других видов, таких как морские губки, домашние куры и черепахи, передача микробов от матери происходит до рождения [Funkhouser and Bordenstein, 2013]. Действительно, идентификация микробов в меконии предполагает, что кишечник плода может быть засеян бактериями еще до рождения [Neu, 2015]. Если передача микробов от матери до рождения действительно происходит при здоровой беременности, это может иметь широкие последствия для развития иммунной системы [Tamburini et al., 2016].
Причины кесарева сечения и сопутствующие факторы
Взаимосвязь хозяина и микробиоты оказывает явное влияние на здоровье: известно, что микробный дисбактериоз вызывает широкий спектр заболеваний слизистой оболочки и системных иммуноопосредованных заболеваний, включая ВЗК [Bager et al., 2012 ], аутоиммунные состояния и аллергия [Kelly et al., 2007]. Однако осложнения, которые могут указывать на кесарево сечение, такие как преждевременные роды, экстремальный ИМТ матери, инфекция, крайние размеры ребенка и гестационный диабет, часто связаны с микробным дисбактериозом во время беременности [Neu and Rushing, 2011].Эти показания для кесарева сечения могут сами по себе повлиять на микробиоту и, следовательно, затруднить наше понимание микробиоты при проведении кесарева сечения.
Преждевременные роды как особый случай
Несмотря на усовершенствованные технологии и диагностику, преждевременные роды (определяемые как <37 недель беременности) по-прежнему представляют собой глобально значимое эпидемиологическое бремя [Purisch and Gyamfi-Bannerman, 2017]. Только в Соединенных Штатах Америки, на преждевременные роды приходится примерно 1 из 10 родов, и у таких детей вероятность родов с помощью кесарева сечения выше [Racusin et al., 2016]. Это снижает их воздействие на материнские вагинальные и кишечные микробы и приводит к дифференцированному развитию иммунной системы, которая может формировать микробную колонизацию в их уже незрелом кишечнике.
Кроме того, они чаще подвергаются искусственному вскармливанию [Madan et al., 2016], инвазивным процедурам, антибиотикам [Yassour et al., 2016] и другим лекарствам, которые изменяют рН желудочно-кишечного тракта, и все это способствует измененная сборка микробного сообщества [Donders et al., 2010]. Наконец, у недоношенных новорожденных, находящихся в отделении интенсивной терапии новорожденных (ОИТН) в течение длительного времени, преобладают микробы, связанные с окружающей средой ОИТН, многие из которых несут гены устойчивости к антибиотикам [Brooks et al., 2014].
Ни одной причины преждевременных родов не выявлено, но многие факторы риска включают микробный дисбиоз, включая восходящие урогенитальные инфекции [Goldenberg et al., 2008], нисходящие инфекции пародонта [Michalowicz et al., 2006] и аномальные вагинальные инфекции. микробиота [Donders et al., 2010].
Как упоминалось выше, в литературе предполагаются значительные различия в микробиоме влагалища у женщин с исходами доношенных и преждевременных родов, что подразумевает потенциальную диагностическую значимость [Haque et al., 2017]. Кроме того, эпидемиологические исследования установили корреляцию между флорой полости рта, заболеваниями пародонта и преждевременными родами [Michalowicz et al., 2006]. Исследования Hällström et al. [Hällström et al., 2004] обнаружили связь между измененной кишечной колонизацией и родоразрешением путем кесарева сечения у недоношенных детей, а также выявили изменения в фекальной микробиоте с началом некротического энтероколита.Несмотря на то, что недоношенные дети составляют значительную часть младенцев, рожденных с помощью кесарева сечения, существует множество смешивающих факторов, и для целей этого обзора мы будем рассматривать только доношенных детей, родившихся с помощью кесарева сечения.
Другие смешанные условия
К другим состояниям, которые приводят к увеличению частоты кесарева сечения, относятся экстремальный ИМТ матери, инфекция, гестационный диабет и размер ребенка. Высокий ИМТ матери объясняется не только генетическими факторами, но и микробным составом [Zhu et al., 2015]. Микробный дисбиоз кишечника может влиять на всасывание питательных веществ, воспаление и микробную транслокацию, а также на колонизацию кишечника плода и развитие метаболических тканей плода [Gohir et al., 2014]. Во время беременности женщины находятся в измененном иммунном состоянии и поэтому более восприимчивы к патогенам, таким как вирус иммунодефицита человека [Yee et al., 2018], гепатит C [Yi et al., 2018], вирус Зика [Magnani et al., 2018], Listeria monocytogenes , Plasmodium spp., Вирусы гриппа, Chlamydia trachomatis , группа B Streptococcus , Treponema pallidum и вирусы герпеса [Guo et al., 2018]. Эти патогены могут вызывать тяжелые синдромы в зависимости от времени инфицирования во время беременности [Vermillion and Klein, 2018]. Например, цитомегаловирус является наиболее распространенной врожденной инфекцией во всем мире, и прямое инфицирование плода может привести к нейросенсорному дефициту, неспособности к обучению, микроцефалии и психическим расстройствам [Racicot and Mor, 2017]. Когда цитомегаловирус является латентным или реактивируется у матери, даже без непосредственного заражения плода, это может привести к задержке роста плода, спонтанной потере беременности или преэклампсии – всем симптомам ранней плацентарной недостаточности [Racicot and Mor, 2017].Примечательно, что хотя известно, что эти состояния нарушают материнскую микробиоту и увеличивают вероятность родоразрешения путем кесарева сечения, они могут дополнительно оказывать микробиологическое воздействие на здоровье младенца, независимо от способа родоразрешения.
Кесарево сечение и отдаленные результаты для здоровья
Как упоминалось ранее, микробиота человека может влиять на здоровье беременных и детей. В частности, микробиота младенцев и, следовательно, дисбактериоз, связанный с кесаревым сечением, могут играть роль в долгосрочных последствиях для здоровья, как показано на Рисунке 1.Хотя микробиота младенцев изучалась на разных участках тела, основная часть литературы и основное внимание нашего обзора посвящено микробиоте кишечника младенца и иммунным ответам на воздействие микробов.
Рис. 1.
Краткое изложение наших текущих представлений о факторах, указывающих на родоразрешение с помощью кесарева сечения, и условиях, связанных с ним. Развивающаяся микробиота кишечника, воздействие микробов из окружающей среды и генетика хозяина взаимодействуют, опосредуя иммунные реакции младенца.Некоторые показатели кесарева сечения, включая преждевременные роды, крайние значения индекса массы тела матери (ИМТ), инфекцию, крайние размеры ребенка и гестационный диабет, могут независимо вызывать микробный дисбактериоз и затруднять наше понимание последствий кесарева сечения. Микробный дисбактериоз, вызванный кесаревым сечением, связан с повышенным риском воспалительного заболевания кишечника (ВЗК) и широким спектром аутоиммунных, аллергических и метаболических состояний.
Иммунное и метаболическое здоровье
В последнее время роль микробиоты кишечника была признана важной для иммунного и метаболического развития в раннем возрасте.У младенцев, рожденных с помощью кесарева сечения, типичная передача микробов от матери ребенку нарушена, поэтому иммунное и метаболическое развитие нарушено [Sevelsted et al., 2015a]. Это имеет важные последствия для долгосрочных иммуноопосредованных результатов для здоровья: у младенцев после кесарева сечения увеличилась частота СД1, ВЗК и аутоиммунных / аллергических состояний [Kelly et al., 2007].
Kostic Kostic, 2015 изучил динамику микробиома кишечника младенца человека в процессе прогрессирования СД1 в когорте из 33 детей из Финляндии и Эстонии, генетически предрасположенных к СД1.Хотя они отметили большие различия в общем таксономическом составе между младенцами и внутри них с течением времени, было значительно меньше различий в метаболическом потенциале микробиома. Они также наблюдали снижение видового разнообразия, изменения функций провоспалительных генов и изменения уровней метаболитов в сыворотке и стуле у младенцев, у которых развился СД1. Наблюдаемые ими тенденции, отличающие прогрессирующих СД1 от непрогрессоров, могут иметь потенциальное диагностическое применение [Kostic, 2015].Кроме того, другие исследования также предположили, что патогенез и клиническое течение T1D являются результатом взаимодействия между генетической предрасположенностью, воздействием окружающей среды в раннем возрасте и врожденным иммунным ответом [Vehik and Dabelea, 2012].
Влияние кесарева сечения на заболевания, связанные с иммунитетом, все еще находится в стадии становления. Тем не менее, в другом исследовании изучалась когорта из 2 миллионов датских детей, родившихся в срок в период с 1997 по 2012 год, и было определено, что кесарево сечение является фактором риска иммунных заболеваний, включая астму, системные нарушения соединительной ткани, ювенильный артрит, ВЗК, иммунодефицит и т. Д. и лейкоз [Sevelsted et al., 2015а]. Результаты предполагают, что события в раннем возрасте могут диктовать иммунные нарушения, которые повышают риск заболеваний в более позднем возрасте.
Исходы со стороны желудочно-кишечного тракта
Антибиотики широко используются во время беременности, а также до и непосредственно перед родами кесарева сечения для предотвращения инфекции. Однако исследования микробиома кишечника взрослых, не основанные на культуре, показывают, что воздействие антибиотиков может нарушать микробиоту желудочно-кишечного тракта в течение многих лет [Murgas Torrazza and Neu, 2011].Более того, рост устойчивости к антибиотикам у детей может привести к инфекциям и дисбактериозу кишечника [Medernach and Logan, 2018].
Микробные нарушения в желудочно-кишечном тракте связаны с болезнью Крона. В датском национальном когортном исследовании с участием 2,1 миллиона человек, родившихся в период 1973–2008 годов, в общей сложности 8 142 человека были диагностированы ВЗК в возрасте до 36 лет. Основным фактором, связанным с повышенным риском ВЗК, было кесарево сечение. Доставка.Кроме того, большинство диагнозов ВЗК было поставлено после 15 лет, что означает, что дисбактериоз в результате кесарева сечения в начале жизни может иметь последствия для здоровья на протяжении всей жизни [Bager et al., 2012].
Риск атопии и аллергических заболеваний
Пищевая аллергия – глобальная проблема общественного здравоохранения, от которой страдают до 8% детей и до 5% взрослых в США, Великобритании, Канаде и Австралии. Хотя движущие силы аллергических заболеваний остаются неясными, данные указывают на взаимодействие генов с окружающей средой, которое начинается на раннем этапе развития [Lieberman et al., 2018]. В частности, было показано, что кесарево сечение увеличивает пищевую аллергию [Dominguez-Bello et al., 2016]. Кроме того, вероятность развития аллергии у младенца зависит от режима кормления (грудное молоко или смесь), который представляет собой первые связанные с питанием микробы, попадающие в организм человека [Cabrera-Rubio et al., 2012]. Таким образом, режим кормления играет важную роль в воздействии пищевых аллергенов и реакции на них на раннем этапе развития. Bager et al. [Bager et al., 2008] провели метаанализ 26 исследований, чтобы определить связь родоразрешения с помощью кесарева сечения с риском атопии и аллергических заболеваний.Они пришли к выводу, что кесарево сечение увеличивает риск аллергического ринита, астмы, госпитализации по поводу астмы и, возможно, пищевой аллергии / пищевой атопии, но не влияет на риск ингаляционной атопии или атопического дерматита.
Метаболический синдром
ИМТ матери может быть определяющим фактором микробного сообщества кишечника младенца в период лактации. Исследования показали, что грудное молоко от матерей с ожирением, как правило, содержит отчетливое и менее разнообразное микробное сообщество по сравнению с молоком от матерей с нормальным весом [Cabrera-Rubio et al., 2012]. Микробиота грудного молока также различается у матерей, родивших с помощью кесарева сечения, и вагинальных, что может быть связано с хирургическим вмешательством, наличием физиологического стресса или гормональных сигналов. Поскольку грудное молоко представляет собой один из наиболее важных послеродовых источников передачи микробов от матери ребенку, необходима дальнейшая работа для количественной оценки воздействия микробиоты грудного молока на кишечник ребенка. В исследовании «Матери и дети Северного Манхэттена» участвовали 436 диад мать-ребенок до 7 лет, чтобы изучить влияние использования антибиотиков матерью во втором или третьем триместре беременности.Результаты показали, что у детей, получавших антибиотики во втором или третьем триместре, риск ожирения был на 84% выше. Кесарево сечение было независимо связано с повышением риска детского ожирения на 46%, независимо от использования антибиотиков и независимо от того, было ли кесарево сечение плановым или невыборным [Mueller et al., 2015].
Терапия по восстановлению микробиоты для младенцев
Нарушенная микробиота кишечника младенца может быть возвращена к исходному состоянию посредством повторного введения комменсальных бактерий вместе с грудным вскармливанием и / или с помощью пре / пробиотических препаратов [Neut et al., 1987; Азад и др., 2013]. Однако Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США еще не одобрило какие-либо пре / пробиотические препараты для лечения микробного дисбактериоза, вызванного кесаревым сечением. Тем не менее, продолжающееся клиническое испытание в Соединенном Королевстве (клинический идентификатор: ISRCTN116
Аналогичным образом, растет число исследований Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США, посвященных проверке безопасности и эффективности пре / пробиотиков, направленных на лечение заболеваний, связанных с кесаревым сечением. Одним из примеров является недавнее испытание добавки Lactobacillus rhamnosus GG в раннем возрасте у младенцев с высоким риском астмы. Добавка способствовала тонкому, но важному таксономическому и метаболическому ремоделированию в кишечнике младенца, и Durack et al. [Durack et al., 2018] наблюдали увеличение количества регуляторных Т-клеток ex vivo в возрасте 6 месяцев, что свидетельствует об иммуномодуляции.Следует отметить, что эффективность этой добавки в профилактике астмы еще предстоит определить.
Еще одна стратегия восстановления здоровой микробиоты называется «посев из влагалища», при котором младенцы после кесарева сечения подвергаются воздействию содержимого влагалища матери [Braegger et al., 2011]. Недавние результаты показывают, что микробиом фекалий, кожи и полости рта новорожденных, рожденных через естественные родовые пути, больше напоминает микробиом новорожденных, родившихся через естественные родовые пути, чем у детей, рожденных с помощью кесарева сечения [Dominguez-Bello et al., 2010]. Хотя эффективность и долгосрочные последствия для здоровья вагинального посева остаются неясными, эти результаты демонстрируют, что вагинальные микробы, передаваемые от матери, могут быть частично восстановлены при рождении у младенцев, рожденных с помощью кесарева сечения.Хотя эта стратегия ограничена, поскольку она не подвергает младенца воздействию кишечного содержимого матери, она закладывает основу для разработки новых микробных методов лечения и / или малых молекул для восстановления состава и развития здоровой детской микробиоты.
В целом связь между микробным дисбактериозом у младенцев, рожденных с помощью кесарева сечения, и долгосрочными последствиями для здоровья – это новая область исследований. В дальнейшем необходимо будет выяснить вовлеченные механизмы, такие как метаболические и иммунные пути, а также микробная функция, чтобы применить это исследование к персонализированной терапии на основе микробиома.
Заявление о раскрытии информации
Все авторы не имеют финансовых отношений, имеющих отношение к этой статье. Все авторы не сообщают о конфликте интересов.
Список литературы
- Аагаард К., Ма Дж., Энтони К. М., Гану Р., Петросино Дж., Версалович Дж.: Плацента содержит уникальный микробиом.Sci Transl Med 2014; 6: 237ra65.
- Костич А.Д. и др.: Динамика микробиома кишечника младенца человека в развитии и прогрессировании к диабету 1 типа. Cell Host Microbe 2015; 17: 260–273.
- Александрия А.Н., де ла Круз Д.М., Дэвис-Ричардсон А.Г., Речцигл К.Т., Ли Н., Дрю Дж.К., Мургас-Торрацца Р. и др.: Анализ микробиома мекония выявляет бактерии, связанные с преждевременным рождением.PLoS One 2014; 9: e.
- Azad MB, Konya T, Maughan H, Guttman DS, Field CJ, Chari RS, Sears MR и др.: Микробиота кишечника здоровых канадских младенцев: профили по способам родоразрешения и питанию младенцев в 4 месяца. CMAJ 2013; 185: 385–394.
- Бэкхед Ф., Росвалл Дж., Пэн Й., Фэн К., Цзя Х., Ковачева-Датчари П., Ли Й. и др.: Динамика и стабилизация микробиома кишечника человека в течение первого года жизни.Cell Host Microbe 2015; 17: 690–703.
- Багер П., Вольфарт Дж., Вестергард Т.: Кесарево сечение и риск атопии и аллергических заболеваний: метаанализы. Clin Exp Allergy 2008; 38: 634–642.
- Багер П., Симонсен Дж., Нильсен Н.М., Фриш М.: Кесарево сечение и риск воспалительного заболевания кишечника у потомства: национальное когортное исследование.Воспаление кишечника 2012; 18: 857–862.
- Bennet R, Eriksson M, Nord CE, Zetterström R: Фекальная бактериальная микрофлора новорожденных во время интенсивной терапии и лечения пятью схемами антибиотиков. Pediatr Infect Dis 1986; 5: 533–539.
- Bernstein CN, Banerjee A, Targownik LE, Singh H, Ghia JE, Burchill C, Chateau D, Roos LL: Кесарево сечение не является фактором риска развития воспалительного заболевания кишечника: популяционный анализ.Клин Гастроэнтерол Гепатол 2016; 14: 50–57.
- Bisanz JE, Enos MK, PrayGod G, Seney S, Macklaim JM, Chilton S, Willner D, et al: Микробиота на нескольких участках тела во время беременности в сельском населении Танзании и влияние пробиотического йогурта с добавлением моринги. Appl Environ Microbiol 2015; 81: 4965–4975.
- Bonifacio E, Warncke K, Winkler C, Wallner M, Ziegler AG: кесарево сечение и индуцированный интерфероном полиморфизм гена геликазы в сочетании повышают риск диабета 1 типа у детей. Диабет 2011; 60: 3300–3306.
- Braegger C, Chmielewska A, Decsi T, Kolacek S, Mihatsch W, Moreno L, Piescik M и др.: Дополнение детской смеси пробиотиками и / или пребиотиками: систематический обзор и комментарий комитета ESPGHAN по питанию.J Педиатр Гастроэнтерол Нутр 2011; 52: 238–250.
- Брукс Б., Фирк Б.А., Миллер С.С., Шарон И., Томас Б.К., Бейкер Р., Моровиц М.Дж., Банфилд Дж.Ф .: Микробы в отделении интенсивной терапии новорожденных напоминают микробы, обнаруживаемые в кишечнике недоношенных детей. Microbiome 2014; 2: 1.
- Cabrera-Rubio R, Collado MC, Laitinen K, Salminen S, Isolauri E, Mira A: Микробиом грудного молока изменяется в период лактации и определяется весом матери и способом родоразрешения.Am J Clin Nutr 2012; 96: 544–551.
- Cardwell CR, Stene LC, Joner G, Cinek O, Svensson J, Goldacre MJ, Parslow RC, et al: Кесарево сечение связано с повышенным риском развития сахарного диабета 1 типа в детстве: метаанализ обсервационных исследований. Диабетология 2008; 51: 726–735.
- CDC: Центры по контролю и профилактике заболеваний, 2017. https://www.cdc.gov/index.htm.
- Clausen TD, Bergholt T, Bouaziz O, Arpi M, Eriks son F, Rasmussen S, Keiding N, Løkkegaard EC: Лечение антибиотиками широкого спектра действия и последующий детский диабет 1 типа: общенациональное датское когортное исследование.PLoS One 2016; 11: e0161654.
- Collado MC, Rautava S, Aakko J, Isolauri E, Salminen S: Колонизация кишечника человека может быть инициирована внутриутробно различными микробными сообществами в плаценте и околоплодных водах. Sci Rep 2016; 6: 23129.
- Кузен-Франкель Дж .: Бактерии и астма: распутывание связей.Наука 2010; 330: 1168–1169.
- Дармассилан К., Хайд М.Дж., Сантакумаран С., Гейл С., Моди Н.: Способ родов и индекс массы тела потомства, избыточный вес и ожирение во взрослой жизни: систематический обзор и метаанализ. PloS One 2014; 9: e87896.
- ДиДжиулио Д.Б., Ромеро Р., Амоган Х.П., Кусанович Дж. П., Бик Э.М., Готч Ф., Ким С.Дж., Эрез О., Эдвин С., Релман Д.А.: Распространенность, разнообразие и изобилие микробов в околоплодных водах во время преждевременных родов: молекулярное и культуральное исследование .PloS One 2008; 3: e3056.
- Домингес-Белло М.Г., Костелло Е.К., Контрерас М., Магрис М., Идальго Г., Фирер Н., Найт Р. Режим доставки формирует приобретение и структуру исходной микробиоты в различных средах обитания новорожденных. Proc Natl Acad Sci U S A 2010; 107: 11971–11975.
- Домингес-Белло М.Г., Де Жезус-Лабой К.М., Шен Н., Кокс Л.М., Амир А., Гонсалес А., Бокулич Н.А. и др.: Частичное восстановление микробиоты младенцев, рожденных после кесарева сечения, посредством вагинального микробного переноса. Nat Med 2016; 22: 250–253.
- Donders GG, Van Calsteren C, Bellen G, Reybrouck R, Van den Bosch T., Riphagen I, Van Lierde S: Связь между аномальной флорой влагалища и длиной шейки матки как факторами риска преждевременных родов.Ультразвук Obstet Gynecol 2010, Epub опережает печать.
- Дурак Дж., Кимес Н.Е., Лин Д.Л., Раух М., Маккин М., МакКоли К., Панцер А.Р., Мар Дж.С., Кабана, доктор медицины, Линч С.В.Nat Commun 2018; 9: 707.
- Фокс C, Eichelberger K: Материнский микробиом и исходы беременности. Fertil Steril 2015; 104: 1358–1363.
- Funkhouser LJ, Bordenstein SR: Мама знает лучше всех: универсальность передачи микробов от матери.PLoS Biol 2013; 11: e1001631.
- Гохир В., Рэтклифф Е.М., Слобода Д.М.: Из ошибок, которые нас формируют: материнское ожирение, микробиом кишечника и долгосрочный риск заболеваний. Pediatr Res 2014; 77: 196–204.
- Guo L, Qu P, Zhang R, Zhao D, Wang H, Liu R, Mi B, Yan H, Dang S.Sci Rep 2018; 8: 5154.
- Hällström M, Eerola E, Vuento R, Janas M, Tammela O: Влияние способа родоразрешения и некротизирующего энтероколита на микрофлору кишечника у недоношенных детей. Eur J Clin Microbiol Infect Dis 2004; 23: 463–470.
- Haque MM, Merchant M, Kumar PN, Dutta A, Mande SS: Разнообразие влагалищного микробиома в первом триместре: потенциальный индикатор риска преждевременных родов.Sci Rep 2017; 7: 16145.
- Ху Дж., Номура Й., Башир А., Фернандес-Эрнандес Х., Ицковиц С., Пей З., Стоун Дж., Лаудон Х., Петр I. На разнообразную микробиоту мекония влияет статус материнского диабета. PLoS One 2013; 8: e78257.
- Хуан Л., Чен Кью, Чжао Ю., Ван В., Фанг Ф, Бао И .: Связано ли плановое кесарево сечение с повышенным риском астмы? Метаанализ.”J Asthma 2015; 52: 16-25.
- Хайман Р.В., Фукусима М., Цзян Х., Фунг Э., Рэнд Л., Джонсон Б., Во KC, Каугей А.Б., Хилтон Дж.Ф., Дэвис Р.В., Джудис Л.С.: разнообразие микробиома влагалища коррелирует с преждевременными родами. Reprod Sci 2014; 1: 32–40.
- ISRCTN – ISRCTN116
- : Продвижение здорового кишечного микробиома при прибытии с плановым кесаревым сечением (PROMESA) путем добавления младенческих пробиотиков к новорожденным, находящимся на грудном вскармливании, 2018.
- Хименес Э., Фернандес Л., Марин М.Л., Мартин Р., Одриозола Дж. М., Нуэно-Палоп С., Нарбад А., Оливарес М., Хаус Дж., Родригес Дж. М.: Выделение комменсальных бактерий из пуповинной крови здоровых новорожденных, рожденных с помощью кесарева сечения. Curr Microbiol 2005; 51: 270–274.
- Хименес Э., Марин М.Л., Мартин Р., Одриозола Дж. М., Оливарес М., Хаус Дж., Фернандес Л., Родригес Дж. М .: Действительно ли меконий от здоровых новорожденных бесплоден? Res Microbiol 2008; 159: 187–193.
- Келли Д., Кинг Т., Аминов Р.: Важность микробной колонизации кишечника в раннем возрасте для развития иммунитета. Mutat Res 2007; 622: 58–69.
- Климан Х.Дж.: Комментарий по поводу «плацента таит в себе уникальный микробиом.”Научный перевод медицины 2014; 6: 254le4.
- Корен О., Гудрич Дж. К., Каллендер Т. К., Спор А, Лайтинен К., Бекхед Х. К., Гонсалес А., Вернер Дж. Дж., Ангенент Л. Т., Найт Р., Бекхед Ф., Исолаури Е., Салминен С., Лей Р. Э. Ремоделирование микробиома кишечника и метаболизма хозяина. изменения во время беременности.Cell 2012; 150: 470–480.
- Гольденберг Р.Л., Калхейн Дж. Ф., Ямс Дж. Д., Ромеро Р.: Эпидемиология и причины преждевременных родов. Lancet 2008; 371: 75–84.
- Лаудер А.П., Рош А.М., Шерилл-Микс С., Бейли А., Лафлин А.Л., Биттингер К., Лейт Р., Эловиц М.А., Парри С., Бушман Ф.Д.: Сравнение образцов плаценты с контрольными показателями контаминации не дает доказательств отдельной микробиоты плаценты.Microbiome 2016; 4:29.
- Ли Х.Т., Чжоу Ю.Б., Лю Дж.М.: Влияние кесарева сечения на избыточный вес и ожирение у потомства: систематический обзор и метаанализ. Int J Obes (Лондон) 2013; 37: 893–899.
- Либерман JA, Greenhawt M, Nowak-Wegrzyn A: Окружающая среда и пищевая аллергия.Ann Allergy Asthma Immunol 2018; 120: 455–457.
- Мадан Дж. К., Хоен А. Г., Лундгрен С. Н., Фарзан С. Ф., Коттингем К. Л., Моррисон Г. Г., Согин М. Л., Ли Х., Мур Дж. Х., Карагас М. Р.: Ассоциация кесарева сечения и добавления смеси с кишечным микробиомом 6-недельных младенцев.JAMA Pediatr 2016; 170: 212–219.
- Magnani DM, Rogers TF, Maness NJ, Grubaugh ND, Beutler N, Bailey VK, Gonzalez-Nieto L, Gutman MJ, Pedreño-Lopez N, Kwal JM, Ricciardi MJ, Myers TA, Julander JG, Bohm RP, Gilbert MH, Schiro F, Aye PP, Blair RV, Martins MA, Falkenstein KP, Kaur A, Curry CL, Kallas EG, Desrosiers RC, Goldschmidt-Clermont PJ, Whitehead SS, Andersen KG, Bonaldo MC, Lackner AA, Panganiban AT, Burton DR, Watkins DI: Гибель плода и неудачная терапия антителами во время инфицирования беременных макак вирусом Зика.Nat Commun 2018; 9: 1624.
- Медернах Р.Л., Логан Л.К .: Растущая угроза устойчивости к антибиотикам у детей. Infect Dis Clin North Am 2018; 32: 1–17.
- Michalowicz BS, Hodges JS, DiAngelis AJ, Lupo VR, Novak MJ, Ferguson JE, Buchanan W, Bofill J, Papapanou PN, Mitchell DA, Matseoane S, Tschida PA: Лечение заболеваний пародонта и риск преждевременных родов.N Engl J Med 2006; 355: 1885–1894.
- Мюллер Н.Т., Уайатт Р., Хёпнер Л., Оберфилд С., Домингес-Белло М.Г., Виден Е.М., Хассун А., Перера Ф., Рандл А.: Пренатальное воздействие антибиотиков, кесарево сечение и риск детского ожирения. Int J Obes 2015; 39: 665–670.
- Mueller NT, Bakacs E, Combellick J, Grigoryan Z, Dominguez-Bello MG: Развитие микробиома младенца: мама имеет значение.Тенденции Мол Мед 2015; 21: 109–117.
- Murgas Torrazza R, Neu J: Развивающийся микробиом кишечника и его связь со здоровьем и болезнями новорожденного. J Perinatol 2011; 31 (добавление 1): S29 – S34.
- Negele K, Heinrich J, Borte M, von Berg A, Schaaf B., Lehmann I, Wichmann HE, Bolte G; LISA Study Group: Способ доставки и развитие атопического заболевания в течение первых 2 лет жизни.Pediatr Allergy Immunol 2004; 15: 48–54.
- Neu J: Аспекты развития микробиоты кишечника матери, плода и младенца и их влияние на долгосрочное здоровье. Matern Health Neonatol Perinatol 2015; 1: 6.
- Neu J, Rushing J: Кесарево сечение по сравнению с вагинальными родами: долгосрочные исходы для новорожденных и гипотеза гигиены.Clin Perinatol 2011; 38: 321–331.
- Neut C, Bezirtzoglou E, Romond C, Beerens H, Delcroix M, Noel AM: Бактериальная колонизация толстой кишки у новорожденных, рожденных путем кесарева сечения. Zentralbl Bakteriol Mikrobiol Hyg A 1987; 266: 330–337.
- Паропкари А.Д., Леблебичиоглу Б., Кристиан Л.М., Кумар П.С.: Курение, беременность и поддесневой микробиом.Sci Rep 2016; 6: 30388.
- Purisch SE, Gyamfi-Bannerman C: Эпидемиология преждевременных родов. Семин Перинатол 2017; 41: 387–391.
- Racicot K, Mor G: Риски, связанные с вирусными инфекциями во время беременности.J Clin Invest 12017; 27: 1591–1599.
- Racusin DA, Antony KM, Haase J, Bondy M, Aagaard KM: Способ родоразрешения у недоношенных новорожденных: имеет ли это значение? AJP Rep 2016; 6: e251 – e259.
- Rutayisire E, Huang K, Liu Y, Tao F Способ родоразрешения влияет на разнообразие и характер колонизации кишечной микробиоты в течение первого года жизни младенцев: систематический обзор.БМК Гастроэнтерол 2016; 16: 86.
- Sevelsted A, Stokholm J, Bønnelykke K, Bisgaard H: Кесарево сечение и хронические иммунные расстройства. Педиатрия 2015; 135: e92 – e98.
- Stene LC, Magnus P, Lie RT, Søvik O, Joner G: Нет связи между преэклампсией или кесаревым сечением и заболеваемостью диабетом 1 типа среди детей: крупное популяционное когортное исследование.Pediatr Res 2003; 54: 487–490.
- Stout MJ, Goetzinger KR, Tuuli MG, Cahill AG, Macones GA, Odibo AO: аналиты сыворотки первого триместра, характеристики матери и ультразвуковые маркеры для прогнозирования беременностей с риском преждевременных родов. Плацента 2013; 34: 14–19.
- Стаут MJ, Zhou Y, Wylie KM, Tarr PI, Macones GA, Tuuli MG: Тенденции влагалищного микробиома на ранних сроках беременности и преждевременные роды.Am J Obstet Gynecol 2017; 217: 356.e1–356.e18.
- Tamburini S, Shen N, Wu HC, Clemente JC: Микробиом в раннем возрасте: последствия для здоровья. Nat Med 2016; 22: 713–722.
- Thavagnanam S, Fleming J, Bromley A, Shields MD, Cardwell CR: метаанализ связи между кесаревым сечением и детской астмой.Clin Exp Allergy 2008; 38: 629–633.
- Вехик К., Дабелеа Д: Почему роды с использованием кесарева сечения связаны с диабетом 1 типа у детей? »Диабет 2012; 61: 36–37.
- Vermillion MS, Klein SL: Беременность и инфекция: использование патогенеза болезни для информирования стратегии вакцинации.NPJ Vaccines 20118; 3: 6.
- Yassour M, Vatanen T, Siljander H, Hämäläinen AM, Härkönen T., Ryhänen SJ, Franzosa EA, Vlamakis H, Huttenhower C, Gevers D, Lander ES, Knip M: Естественная история микробиома кишечника младенца и влияние лечения антибиотиками на бактериальный разнообразие и стабильность штаммов.Sci Transl Med 2016; 8: 343ra81–343ra81.
- Yee LM, McGregor DV, Sutton SH, Garcia PM, Miller ES: Связь между раскрытием материнского ВИЧ и факторами риска перинатальной передачи. J Perinatol 2018; 38: 639–644.
- Yi W, Pan CQ, Li MH, Wan G, Lv YW, Liu M, Hu YH, Zhang ZY, Xie Y: характеристики и предикторы обострения послеродового гепатита у женщин с хроническим гепатитом B.Am J Gastroenterol 2018; 113: 686–693.
- Юань С., Гаскинс А.Дж., Блейн А.И., Чжан С., Гиллман М.В., Миссмер С.А., Филд А.Е., Чаварро Дж. Э .: Связь между кесаревым сечением и риском ожирения у потомства в детстве, подростковом и раннем взрослом возрасте. JAMA Pediatr 2016; 170: e162385.
- Zhu T, Tang J, Zhao F, Qu Y, Mu D: Связь между материнским ожирением и оценкой по шкале Апгар у потомства или pH пуповины: систематический обзор и метаанализ. Sci Rep 2015; 5: 18386.
Автор Контакты
Мелисса Дсуза
Commense Inc.,
501 Boylston St. Suite 6102
Boston, MA 02116 (США)
Электронная почта [email protected]
Подробности статьи / публикации
Предварительный просмотр первой страницы
Опубликовано онлайн: 24 июля 2018 г.
Дата выпуска: июль 2018 г.
Количество страниц для печати: 9
Количество рисунков: 1
Количество столов: 1
ISSN: 0250-6807 (печатный)
eISSN: 1421-9697 (онлайн)
Для дополнительной информации: https: // www.karger.com/ANM
Авторские права / Дозировка препарата / Заявление об ограничении ответственности
Авторские права: Все права защищены. Никакая часть данной публикации не может быть переведена на другие языки, воспроизведена или использована в любой форме и любыми средствами, электронными или механическими, включая фотокопирование, запись, микрокопирование, или какой-либо системой хранения и поиска информации, без письменного разрешения издателя. .
Дозировка лекарства: авторы и издатель приложили все усилия, чтобы гарантировать, что выбор и дозировка лекарства, указанные в этом тексте, соответствуют текущим рекомендациям и практике на момент публикации.Тем не менее, ввиду продолжающихся исследований, изменений в правительственных постановлениях и постоянного потока информации, касающейся лекарственной терапии и реакций на них, читателю рекомендуется проверять листок-вкладыш для каждого препарата на предмет любых изменений показаний и дозировки, а также дополнительных предупреждений. и меры предосторожности. Это особенно важно, когда рекомендованным агентом является новый и / или редко применяемый препарат.
Отказ от ответственности: утверждения, мнения и данные, содержащиеся в этой публикации, принадлежат исключительно отдельным авторам и соавторам, а не издателям и редакторам.Появление в публикации рекламы и / или ссылок на продукты не является гарантией, одобрением или одобрением рекламируемых продуктов или услуг или их эффективности, качества или безопасности. Издатель и редактор (-ы) не несут ответственности за любой ущерб, причиненный людям или имуществу в результате любых идей, методов, инструкций или продуктов, упомянутых в контенте или рекламе.
границ | Грибковый дисбактериоз и воспаление кишечника у детей с бета-клеточным аутоиммунитетом
Введение
Диабет 1 типа (T1D) – это иммуноопосредованное заболевание, при котором аутоиммунные механизмы считаются ответственными за разрушение продуцирующих инсулин бета-клеток поджелудочной железы.Хотя триггеры болезненного процесса остаются открытыми, развитие местного воспаления в островках поджелудочной железы и образование аутоантител против антигенов бета-клеток являются ранними событиями в развитии T1D (1–4). Аутоантитела появляются против различных антигенов бета-клеток, таких как инсулин, глутаматдекарбоксилаза, островковый антиген 2 и переносчик цинка 8, за несколько лет до клинического проявления заболевания, и риск СД1 коррелирует с количеством аутоантител к бета-клеткам.Другие иммунологические отклонения при T1D включают активацию путей IFNG и IL-17 (5–9). Ранее мы показали, что у детей с бета-клеточным аутоиммунитетом снижено количество бактерий, продуцирующих бутират, и повышено количество бактерий, принадлежащих к типу Bacteroidetes, в микробиоте кишечника (10, 11). Подобные изменения в бактериальном сообществе у детей с бета-клеточным аутоиммунитетом были подтверждены в нескольких более поздних исследованиях (12–14). Воспаление кишечника было связано с СД1, о чем свидетельствует повышенная экспрессия молекулы HLA класса II и цитокинов IFNG, TNFA и мРНК IL-4 в биоптатах тощей кишки (15).
Роль кишечной микробиоты как регулятора аутоиммунного диабета хорошо известна на животных моделях СД1, в которых модуляция микробиоты влияет на развитие болезни (16). На сегодняшний день исследования микробиома в отношении T1D сосредоточены на бактериальном сообществе микробиоты кишечника, однако микробиом человека представляет собой сложную экосистему, состоящую из бактерий, грибов, архей и вирусов. В желудочно-кишечном тракте человека было идентифицировано несколько видов грибов (17, 18), что составляет 0.1–1,0% кишечной микробиоты (обычно обозначаемой как микобиота ). Количество грибковых клеток меньше, чем у бактериальных, но, как эукариотические организмы, грибы имеют значительно более разнообразные биохимические пути, чем бактерии (19). Таким образом, когда принимается во внимание биоактивная способность кишечной микробиоты, роль микобиоты имеет большое значение с замечательным потенциалом для модуляции клеточных функций хозяина. Тем не менее, текущие знания об участии микобиоты в нарушениях микробных сообществ и здоровья хозяина ограничены.Роль микобиоты как регулятора воспаления кишечника и воспалительных заболеваний была подчеркнута недавними исследованиями воспалительных заболеваний кишечника, аллергии и астмы (20–22).
Более того, изменения в бактериальной микробиоте могут быть связаны с изменениями микобиоты, которые, вероятно, нарушают межцерковные взаимодействия внутри микробиома, как это видно при болезни Крона (21, 22). Действительно, микобиота кишечника может модулировать состав бактериального компартмента либо путем прямого взаимодействия с бактериями, либо через иммунную систему хозяина (18, 23).
В текущем исследовании мы проанализировали состав грибковой и бактериальной микробиоты кишечника, а также маркеры кишечного воспаления в когорте детей с положительной и отрицательной реакцией на островковые аутоантитела, несущих HLA-обусловленную генетическую предрасположенность к T1D. Затем мы проследили когорту развития СД1 в течение 8 лет и 8 месяцев. Объединив данные о грибах и бактериях, дети с генетическим риском СД1 были сгруппированы в три основных кластера, определяемых относительной численностью Saccharomyces , Clostridiales и Bacteroidales (Firmicutes и Bacteroidetes phyla соответственно).Повышенное соотношение Bacteroidales и Clostridiales было обнаружено у детей с положительной реакцией на аутоантитела, в то время как у детей, у которых во время последующего наблюдения также развился клинический СД1, было обнаружено высокое содержание Saccharomyces и Candida , а также признаки воспаления кишечника, т. Е. повышенный уровень фекального HBD2 и циркулирующего IgG к ASCA. Наши результаты показывают, что дисбактериоз грибковой и бактериальной кишечной микробиоты, а также воспаление кишечника связаны с развитием СД1.
Материалы и методы
Объекты исследования
Экспериментальный план текущего исследования представлен на рисунке 1. Здесь мы собрали образцы фекалий и крови у 52 детей с HLA-предрасположенностью к T1D (таблица 1) и проследили их развитие в течение 8 лет и 8 лет. месяцев (диапазон от 8 лет и 2 месяцев до 9 лет и 1 месяца). Детей, изучаемых на фекальный микробиом, набирали из участников исследований по питанию (24–26).Мы определили 26 детей с положительным результатом по крайней мере на одно T1D-ассоциированное аутоантитело (IAA, GADA, IA-2A или ICA) (случаи), и отобрали здоровых контрольных детей с отрицательными аутоантителами, соответствующих возрасту, полу, генотипу HLA-DQB1 и раннему возрасту. питание жизни. В начале наблюдения образцы фекалий собирали (в период с февраля 2009 г. по февраль 2010 г.) с использованием пробирок для сбора стула и сразу же хранили в домашних морозильных камерах (-20 ° C). Замороженные образцы были доставлены в исследовательский центр, и образцы хранили при -80 ° C до обработки.На момент сбора образцов кала у испытуемых не было гастроэнтерита, и они не получали лечение антибиотиками в течение последних 3 месяцев. За время наблюдения у девяти детей развился СД1. Дети контрольной группы остались недиабетическими и отрицательными по всем четырем проанализированным аутоантителам. Исследование было одобрено комитетами по этике участвующих больниц, и семьи и / или дети, принимающие участие в исследовании, дали свое письменное информированное согласие.
Рисунок 1 .Дизайн исследования: состав микробиома, воспаление кишечника и развитие клинического диабета 1 типа (СД1) в период наблюдения. Образцы фекалий и крови были собраны у 26 детей, у которых был обнаружен положительный результат по крайней мере на одно аутоантитело, ассоциированное с диабетом (IAA, GADA, IA-2A или ICA), и у соответствующих детей с отрицательными аутоантителами и предрасположенностью к HLA к T1D. Пары случай-контроль были сопоставлены по гаплотипу HLA-DQB1, возрасту, полу и питанию в раннем детстве. Секвенирование бактериального 16S и ITS2 грибов и анализ маркеров кишечного воспаления, а именно HBD2, кальпротектина и общего секреторного IgA, проводили с использованием образцов фекалий.Образцы крови анализировали на уровни ASCA IgA / IgG и циркулирующих цитокинов IFNG, IL-17 и IL-22. После анализа дети наблюдались на предмет развития клинического СД1 (в среднем 8 лет и 8 месяцев). В ходе последующего наблюдения девяти детям с положительным результатом на аутоантитела был поставлен диагноз СД1, в то время как ни у одного из детей с отрицательным результатом на аутоантитела не развился СД1.
Таблица 1 . Характеристики изучаемых предметов. AAb + – это дети, положительные по крайней мере в отношении одного аутоантитела, связанного с диабетом, а дети AAb- отрицательны в отношении аутоантител к бета-клеткам.Субъекты исследования были участниками пилотных исследований TRIGR и FINDIA.
Анализ аутоантител
Биохимически определенные аутоантитела IAA, IA-2A и GADA были проанализированы с помощью метода специфического радиоактивного связывания, а ICA – с помощью стандартного метода иммунофлуоресценции, как описано ранее в (24–26). Использованные пороговые уровни составляли 2,80 относительных единиц (RU) для IAA, 5,36 RU для GADA и 0,78 RU для IA-2A, определенных как уровень выше 99 процентилей у более чем 350 финских детей, не страдающих диабетом.Антитела островковых клеток измеряли с использованием метода непрямой иммунофлуоресценции с использованием порогового значения 2,5 единиц фонда Juvenile Diabetes Foundation.
Генотипирование HLA
Скрининг аллелей риска HLA проводился, как описано ранее (24–26). Первоначальное типирование HLA-DQB1 для связанных с риском (DQB1 * 02, DQB1 * 03: 02) и защитных (DQB1 * 03: 01, DQB1 * 06: 02 и DQB1 * 06: 03) аллелей было дополнено типированием DQA1 для Аллели DQA1 * 02: 01 и DQA1 * 05 у пациентов с DQB1 * 02 без защитных аллелей или аллеля основного риска DQB1 * 03: 02.
Извлечение ДНК
ДНКэкстрагировали из образцов фекалий с помощью набора QIAamp Fast DNA Stool Mini Kit (Qiagen, Германия). Вкратце, образцы фекалий (180–220 мг) размораживали в 1 мл буфера InhibitEX, встряхивали в течение 1 мин и инкубировали при 95 ° C в течение 10 мин для усиления лизиса трудно лизируемых таксонов. После центрифугирования 200 мкл супернатанта переносили в новую пробирку с протеиназой К и буфером AL и тщательно перемешивали. Лизат инкубировали при 70 ° C в течение 10 мин с последующим добавлением 0.3 т. абсолютного этанола. Затем образцы встряхивали, переносили пипеткой на спин-колонку QIAamp и центрифугировали при 20000 × g в течение 1 мин. Колонку промывали буферами AW1 и AW2, чистую ДНК элюировали 200 мкл буфера ATE и хранили при -20 ° C. Количество и качество ДНК определяли с помощью спектрофотометра NanoDrop ND-1000 (Thermo Fisher Scientific, Уилмингтон, Делавэр, США).
Амплификация бактериальной 16s рРНК и области ITS2 грибов
Бактериальные гипервариабельные области V4-V5 гена 16S рРНК амплифицировали с использованием праймеров F519 (5′-CAGCMGCCGCGGTAATWC-3 ‘) и R926 (5′-CCGTCAATTCCTTTRAGTTT-3′).Праймер F519 содержал последовательность А адаптера пиросеквенирования Ion Torrent (Thermo Fisher Scientific, США), уникальную последовательность штрих-кода длиной 9 п.н. и один нуклеотидный линкер. Праймер R926 содержал последовательность trP1 адаптера Ion Torrent. Для грибкового анализа область ITS2 амплифицировали с использованием праймеров fITS7 (5’-GTGARTCATCGAATCTTTG-3 ‘) и ITS4 (5′-TCCTCCGCTTATTGATATGC-3’), включая адаптер пиросеквенирования Ion Torrent со штрих-кодовой последовательностью 10 п.н. для праймера ITS4 ( 27). Реакции ПЦР проводили в трех повторах, каждый из которых содержал 1x буфер Phusion GC, 0.4 мкМ прямого и обратного праймеров, 200 мкМ dNTP, 0,5 ед. ДНК-полимеразы Phusion High-Fidelity (Thermo Fisher Scientific) и 50 нг ДНК геномного сообщества в качестве матрицы и вода молекулярной чистоты в общем объеме реакции 50 мкл. Для бактерий условия цикла ПЦР были следующими: начальная денатурация при 98 ° C в течение 3 минут, 35 циклов амплификации при 98 ° C в течение 10 секунд, 64 ° C в течение 10 секунд и 72 ° C в течение 20 секунд, затем заключительный этап удлинения 72 ° C в течение 7 мин. Для грибов температура отжига была доведена до 56 ° C, в то время как другие условия цикла ПЦР оставались неизменными.После амплификации продукты ПЦР из объединенных трех повторностей реакций очищали с помощью гранул Agencourt AMPure XP (Agencourt Bioscience, Массачусетс, США) и количественно оценивали с помощью Agilent 2,100 Bioanalyzer (Agilent Technologies, Калифорния, США). Затем ампликоны из каждого образца объединяли в эквимолярных концентрациях для создания библиотек секвенирования. Секвенирование проводили в Центре секвенирования Biocenter Oulu с использованием системы Ion Torrent PGM на чипе 316v2 с использованием химии 400 п.н. (Thermo Fisher Scientific, США).
Биоинформатический анализ
Данные бактериального и грибкового секвенирования обрабатывали с помощью QIIME v.1.9.1 (28). Качество считываемых данных контролировалось с помощью конвейера фильтров качества usearch, таким образом, потенциальные химерные последовательности были идентифицированы и удалены с помощью учиме (29). После фильтрации низкокачественных и химерных считываний набор бактериальных данных состоял из 1,202 миллиона считываний по 52 образцам, в среднем 23 120 считываний на образец. Соответствующий окончательный набор данных о грибах состоял из 130 000 высококачественных считываний без химер из 52 образцов, в среднем 2501 считывание на образец.Последовательности были сгруппированы в операционные таксономические единицы (OTU) с порогом сходства 97% с usearch (30). OTU с низкой численностью (представленные <5 считываний) были удалены из наборов данных. Таксономия была присвоена с использованием справочной базы данных генов 16S рРНК Greengenes (31) для бактерий (v.13_8) и базы данных UNITE ITS для грибов (выпуск 2019 г., v.8) (32). Перед последующим анализом таблицы OTU бактерий и грибов были уменьшены до 5 800 и 327 считываний на образец соответственно, чтобы избежать систематических ошибок, вызванных различиями в глубине секвенирования между образцами (33).Все необработанные данные секвенирования были депонированы в базе данных NCBI-SRA с регистрационным номером SUB3267498.
Мы оценили бета-разнообразие, используя невзвешенные и взвешенные расстояния UniFrac (а также нефилогенетическое несходство Брея-Кертиса) между выборками. Оба показателя UniFrac учитывают филогенетические расстояния между таксонами, но в то время как невзвешенный UniFrac сравнивает микробные сообщества на основе информации о наличии / отсутствии, взвешенный UniFrac также учитывает различия в численности таксонов (34).Различия в структуре микробиоты кишечника грибков и бактерий у детей визуализировали с помощью анализа главных координат (PCoA) с помощью EMPeror (35).
Измерения фекального HBD2, общего IgA и кальпротектина
Размороженные образцы фекалий смешивали с буфером для экстракции и тщательно встряхивали. Затем супернатант собирали и хранили при -20 ° C до анализа уровней общего IgA, HBD2 и кальпротектина. Концентрации общего IgA анализировали, как описано ранее (36).Анализ HBD2 выполняли с помощью коммерческого набора для ELISA согласно инструкциям производителя (Immunodiagnostik AG, Бенсхайм, Германия). Уровни кальпротектина в фекалиях определяли с помощью теста Calprolab calprotectin ELISA в соответствии с инструкциями производителя (Calpro AS, Lysaker, Норвегия).
ELISA-анализ сывороточных уровней ASCA IgA / IgG
Сывороточные концентрации ASCA IgA и IgG анализировали с помощью коммерческого набора для ELISA в соответствии с инструкциями производителя (Demeditec, Германия), за исключением того, что использовали разведение образцов сыворотки 1:10.Образцам ниже нижнего предела обнаружения (LOD) давали произвольное значение 50% LOD, составляющее 0,5 Ед / мл как для ASCA IgA, так и для IgG.
Анализ цитокинов сыворотки
Концентрации IFNG, IL-17A и IL-22 в сыворотке крови анализировали с использованием набора Milliplex MAP (HTh27MAG-14K) в соответствии с рекомендациями производителя (Merck-Millipore Corp., Billerica, MA, USA). Количественную оценку маркеров проводили с помощью прибора Bio-plex 200 Luminex и программного обеспечения Bio-Plex Manager (Bio-Rad, Швеция).Образцам ниже минимальной определяемой концентрации (MinDC) DC давали произвольное значение 50% MinDC.
Статистический анализ
Graph Pad Prism 6.04 (Graph Pad Inc., Ла-Холла, Калифорния, США), SPSS 22 (SPSS, Чикаго, Иллинойс, США) и статистическое программное обеспечение JMP 13.0.0 использовали для статистического анализа, если не указано иное. Непараметрический критерий Манна – Уитни U использовался для сравнения между двумя группами. Групповые сравнения проводились с помощью теста Краскела – Уоллиса.Корреляции между переменными анализировались с помощью непараметрического корреляционного теста Спирмена. Точный тест Фишера был использован для анализа распределения аутоантител-положительных детей и прогрессистов заболевания в различных кластерах. Все статистические анализы были двусторонними. P <0,05 считали статистически значимым. Несмотря на совпадение аутоантител-положительных и отрицательных детей по возрасту, генотипу риска СД1 и полу, пары считались независимыми при статистическом анализе.
Для анализа иерархической кластеризации данные об относительной численности были импортированы в JMP 13.0.0 (SAS Institute Inc. Cary, Северная Каролина, США). Все значения численности обрабатывались как числовые значения, и иерархическая кластеризация Уорда выполнялась с использованием стандартизованных данных с настройками по умолчанию. Статистическая значимость группировки выборок для анализа бета-разнообразия была определена с помощью перестановочного многомерного дисперсионного анализа (PERMANOVA) и анализа сходства (ANOSIM) (999 перестановок), реализованных функциями adonis и anosim в веганском R-пакете ( 37).
Результаты
Дизайн исследования и клинический СД1 в ходе последующего наблюдения
В этом исследовании мы проанализировали микробиом кишечника детей с положительным и отрицательным результатом на аутоантитела с риском развития СД1 по HLA (рис. 1). Мы объединили секвенирование (1) гена бактериальной 16S рибосомальной РНК (рРНК) (2) и области внутреннего транскрибируемого спейсера 2 (ITS2) гриба и соединили это с (3) анализом маркеров кишечного воспаления, а именно фекального HBD2, секреторного общий IgA и кальпротектин.Образцы крови были проверены на уровни ASCA IgA / IgG и циркулирующих цитокинов IFNG IL-17 и IL-22. Наконец, дети в когорте наблюдались на предмет развития клинического СД1 (в среднем 8 лет и 8 месяцев). В течение периода наблюдения девяти детям с положительным результатом на аутоантитела был поставлен диагноз СД1, и ни у одного из детей с отрицательным результатом на аутоантитела не развился СД1 или аутоантитела.
Грибковый и бактериальный дисбактериоз у детей с бета-клеточным аутоиммунитетом
Микобиота кишечника состояла из двух типов грибов, Ascomycota и Basidiomycota, но преобладали Ascomycota (в среднем 93%) на уровне типа и Saccharomyces на уровне рода (в среднем 43%) (Рисунки 2A, B).Все 52 объекта исследования были положительными на Ascomycota, а 29 из них (56%) положительными на Basidiomycota (11 из 26 положительных по аутоантителам и 18 из 26 отрицательных индивидуумов, 42 и 69%, соответственно). У детей с аутоантителами наблюдалось незначительное увеличение численности Ascomycota и снижение уровня Basidiomycota (рис. 2A). Наиболее часто наблюдаемыми родами были Saccharomyces (обнаружены у всех 52 особей), Candida (обнаружены у 9 из 26 положительных по аутоантителам и 13 из 26 отрицательных по аутоантителам индивидуумов, 35 и 50%) и Debaryomyces (обнаружены у 9 из них). 26 аутоантител-положительных и 4 из 26 аутоантител-отрицательных индивидуумов, 35 и 15%).У детей с аутоантителами увеличилась численность Debaryomyces и уменьшилась численность Malassezia (Рисунки 2B – D). Однако количество детей, положительных на Debaryomyce s или Malassezia , было низким, и 25,0 и 23,1% исследованных детей были положительными на Debaryomyces (13/52) и Malassezia (12/52) , соответственно. У детей с положительной реакцией на аутоантитела, у которых во время последующего наблюдения развился клинический СД1, численность рода Verticillium значительно снизилась по сравнению с детьми с аутоантителами или без них (рис. 2E). Verticillium положительный результат был обнаружен у 16 из 26 (62%) положительных по аутоантителам и у 17 из 26 (65%) отрицательных по аутоантителам детей. Мы не наблюдали различий в количестве ОТЕ между детьми с аутоантителами или без них (рис. 2F). Дети, у которых развился СД1, имели меньшее разнообразие грибов (Шеннон) по сравнению с детьми с множественными аутоантителами (рис. 2G). Анализ основных координат, основанный на взвешенных и невзвешенных расстояниях UniFrac, не показал четких различий между детьми с отрицательными и отрицательными антителами (дополнительные рисунки 1C, D).Состав грибного сообщества согласуется с сообществами микобиомов кишечника, о которых ранее сообщалось для людей (18, 38, 39). Список наиболее распространенных видов грибов среди детей с отрицательными и положительными антителами представлен в дополнительной таблице 1.
Рисунок 2 . Характеристики грибкового сообщества у детей с аутоантителами, ассоциированными с T1D, или без них. (A) Относительная численность грибов типа Ascomycota (левые столбцы) и Basidiomycota (правые столбцы).Дети без аутоантител: черные столбцы и дети с аутоантителами: серые столбцы. (B) Относительная численность 20 наиболее распространенных родов грибов у детей с (серые столбцы) и без аутоантител (черные столбцы). (C – E) Относительная численность Debaryomyces (C) , Malessezia (D) и Verticillium (E) у здоровых детей без аутоантител, у детей с другим числом аутоантител и у детей, которые перешли от аутоантител-положительного состояния к клиническому СД1. (F, G) Число ОТЕ и индекс разнообразия Шеннона у здоровых детей без аутоантител, у детей с другим количеством аутоантител и у детей, которые перешли от аутоантителположительного состояния к клиническому СД1. Здоровые дети без аутоантител отмечены светлыми кружками, дети с 1–4 аутоантителами – черными кружками, а дети, у которых клиническое заболевание прогрессирует, – красным кружком. Значения p были рассчитаны с помощью критерия Манна – Уитни U .* p <0,05, ** p <0,01.
Затем мы обратились ко всей микробиоте и выполнили комбинированный анализ грибковых и бактериальных сообществ. Наш иерархический кластерный анализ, основанный на комбинированных данных о грибах и бактериях, выявил наличие трех основных кластеров, определяемых различными комбинациями грибов, принадлежащих к типу Ascomycota и бактериальным типам Bacteroidetes и Firmicutes (Рисунки 3A – C). Структуры грибковых и бактериальных сообществ различались у детей, отнесенных к разным кластерам ( p <0.001, ПЕРМАНОВА) (см. Дополнительную таблицу 2). Кластер 1 ( n = 17, 33%) характеризовался высокой численностью Clostridiales и низкой численностью Bacteroidales в сочетании с высокой численностью Saccharomyces (Рисунки 3B, C и дополнительный рисунок 2A). Напротив, кластеры 4 ( n = 22, 42%) и 5 ( n = 8,15%) характеризовались высокой численностью Bacteroidales и низкой численностью Clostridiales, а кластер 4 также показал высокую численность Candida . по сравнению с кластером 1 (рисунки 3B, C и дополнительный рисунок 2B).Хотя численность Ascomycota была высокой в кластерах 1 и 4, численность Saccharomyces и Candida значительно различалась между кластерами (Рисунок 3B, дополнительные рисунки 2A, B и дополнительные таблицы 2, 3). Относительная численность Debaryomyces, Malassezia и Verticillium в кластерах 1, 4 и 5 показана на дополнительных рисунках 2C – E. Относительные количества Saccharomyces и Candida у детей с аутоантителами или без них показаны на дополнительных рисунках 2F, G.Анализ сходства грибковых и бактериальных сообществ между различными кластерами показал, что кластеры 4 и 5 отличаются от кластера 1 как для грибковых, так и для бактериальных сообществ (дополнительная таблица 3). Пол хозяина не имел статистически значимого ( p > 0,05, PERMANOVA) объяснительного эффекта на грибковые и бактериальные сообщества (дополнительная таблица 2). Детский возраст и класс HLA-риска внесли статистически значимый вклад в общую изменчивость бактериального сообщества ( p = 0.02, R 2 = 0,08, p <0,001, R 2 = 0,14, для возраста хозяина и класса HLA-риска соответственно), хотя и с относительно низким коэффициентом детерминации, и без -существенный ( p > 0,05) вклад обоих факторов в структуру сообщества микобиома (дополнительная таблица 2).
Рисунок 3 . Иерархическая кластеризация по таксонам бактерий и грибов и участкам PCoA грибных и бактериальных сообществ. (A) Тепловая карта, показывающая кластеризацию относительной численности. В результате кластеризации были образованы три основных кластера (кластеры 1, 4 и 5), определяемые дифференциальной численностью грибов, принадлежащих к типу Ascomycota и бактериальным типам Firmicutes и Bacteroidetes. Кластеры 1, 4 и 5 обведены черной рамкой. На тепловой карте дети с аутоантителами обозначены AAb + (красный шрифт), а дети с отрицательными аутоантителами – AAb (синий шрифт). Дети, у которых наблюдается прогрессирование аутоантител-положительного состояния до клинического заболевания, обозначаются СД1 и красным кружком на тепловой карте.Интенсивность цвета тепловой карты увеличивается с относительной численностью таксонов от низкого (синий) до высокого (красный). (B, C) Биплоты анализа основных координат (PCoA) (включают информацию о таксономии) взвешенных расстояний UniFrac между грибами (B) и бактериями (C) Профили кишечных микробных сообществ детей из группы риска 1-го типа развитие диабета. Каждая точка представляет собой отдельную выборку и окрашена в соответствии с основными кластерами таксонов (кластеры 1, 4, 5 и другие), как определено анализом иерархической кластеризации.Порядок и таксономия на уровне родов, отображаемые стрелками двух графиков, показывают, что численность (B) , Saccharomyces и Candida способствует разделению кластера 1 и кластера 4, а (C) Clostridiales и Bacteroidales вносят вклад в отчетливые шаблоны кластеризации кластера 1 по сравнению с кластерами 4 и 5. Значения p были рассчитаны с помощью теста Манна – Уитни U . * p <0,05, ** p <0.01. Значимость группировки определялась с использованием PERMANOVA (999 перестановок) с функцией adonis в веганском пакете R ( p <0,001).
Затем мы проанализировали распределение детей с положительным и отрицательным результатом на аутоантитела в этих трех основных кластерах микробиома. Дети с бета-клеточным аутоиммунитетом были обогащены в кластерах 4 и 5 (кластер 1 против кластера 4, p = 0,004, кластер 1 против кластера 5, p = нс и кластер 4 против кластера.Кластер 5, p = нс, точный критерий Фишера), в то время как дети, отрицательные по бета-клеточному аутоиммунитету и, следовательно, считающиеся здоровыми детьми, были обогащены в кластере 1 (показанном на рисунке 3A и в таблице 2). К концу периода наблюдения у 6 из 22 детей в кластере 4 (27%) развился СД1, у одного из восьми детей в кластере 5 (13%) и только у одного из 17 детей в кластере 1 (6%). были диагностированы СД1 (кластер 4 против 5, p = 0,64 и кластер 4 против 1, p = 0,11, соответственно).У одного ребенка, который не был включен ни в один из трех основных кластеров, развился СД1.
Таблица 2 . Распределение детей с отрицательными аутоантителами, детей с одним или несколькими аутоантителами и прогрессоров заболевания в различных кластерах.
Воспаление кишечника у детей с грибковым и бактериальным дисбиозом
Чтобы выяснить связь между составом кишечной микробиоты и воспалительной реакцией хозяина, мы проанализировали фекальные концентрации HBD2, который представляет собой антимикробный пептид, секретируемый эпителиальными клетками в ответ на микробный стимул и активацию пути IL-17 / IL-22 ( 40).Интересно, что у детей в кластере 4 были более высокие уровни HBD2 в фекалиях по сравнению с детьми в кластерах 1 и 5 (рис. 4A), и, следовательно, у детей с положительным результатом на аутоантитела уровень HBD2 в кале был выше, чем у детей с отрицательным результатом на аутоантитела (рисунок 4B). Однако у детей с положительной реакцией на антитела в кластере 4 уровень HBD2 в кале был выше, чем у детей в кластере 5 (дополнительный рисунок 3). Примечательно, что у детей с одним аутоантителом уровень HBD2 в кале был выше, чем у детей без аутоантител (рис. 4C).Уровни кальпротектина в фекалиях не различались между детьми с отрицательными и положительными антителами или между группами видов (дополнительные рисунки 4D – F).
Рисунок 4 . Маркеры воспаления в различных кластерах и у детей с аутоиммунитетом бета-клеток или без них. (A) Фекальные концентрации HBD2 в кластерах 1, 4 и 5. Уровни HBD2 были выше в кластере видов 4 по сравнению с кластерами 1 и 5. (B) Дети с аутоантителами имели повышенные уровни HBD2 в фекалиях по сравнению с детям с отрицательными аутоантителами. (C) Дети с одним аутоантителом имели повышенный уровень HBD2 в фекалиях по сравнению с детьми без аутоантител. (D) Концентрации IgG ASCA в сыворотке крови были значительно выше в кластерах 1 и 4 по сравнению с кластером 5. (E) Концентрации IgG ASCA в сыворотке крови у детей с AAb- и AAb +. (F) У детей с положительным результатом на аутоантитела, у которых развилось клиническое заболевание, было повышено содержание антител IgG к ASCA в сыворотке крови по сравнению с детьми с отрицательным результатом на аутоантитела. (G) Взаимосвязь между уровнями сывороточного ASCA IgA и продолжительностью серопозитивности в кластере видов 4. (H) Взаимосвязь между общим IgA в кале и относительной численностью сахаромицетов в кластере 4. (I) Взаимосвязь между общий IgA в кале и относительное содержание Saccharomyces в кластере 4. Здоровые дети без аутоантител отмечены светлыми кружками, дети с 1–4 аутоантителами – черными кружками и дети, у которых клиническое заболевание прогрессировало, – красным кружком.Горизонтальные линии представляют медианные значения. Значения p были рассчитаны с помощью критерия Манна – Уитни U . Корреляции рассчитывались с помощью теста ранговой корреляции Спирмена. * p <0,05, ** p <0,01.
Поскольку высокая численность отряда Saccharomycetales (наиболее многочисленными родами в наборе данных, принадлежащих к Saccharomycetales были: Saccharomyces, Candida и Debaryomyces ) была ключевой особенностью детей в кластерах 1 и 4, мы измерили Ранее было показано, что уровни сывороточного ASCA связаны с грибковым дисбиозом при болезни Крона (41, 42).Уровни ASCA IgG были значительно выше у детей, принадлежащих к кластерам 1 и 4, по сравнению с детьми в кластере 5 (рис. 4D), что позволяет предположить, что продукция ASCA IgG действительно вызвана высокой численностью сахаромицетов, которая наблюдалась у детей в кластерах 1. и 4. Уровни ASCA IgG, однако, не коррелировали с численностью Saccharomycetes или Saccharomyces ни у детей в кластере 1, ни в 4 ( p = 0,33 и p = 0,73). Действительно, самые высокие уровни ASCA IgG наблюдались у детей, которые прогрессировали до клинического СД1, независимо от назначенного кластера (рисунки 4E, F).Более того, уровни ASCA IgG показали тенденцию к положительной корреляции с продолжительностью позитивности аутоантител у детей кластера 4 (рисунок 4G). Уровни ASCA IgA существенно не различались между кластерами, но следует отметить, что у большинства исследованных лиц уровни ASCA IgA были ниже нижнего предела обнаружения (дополнительные рисунки 4G – I). Мы также наблюдали положительную корреляцию между уровнями общего IgA в кале и численностью Saccharomyces (а также Saccharomyces ) в кластере 4, предполагая местный иммуностимулирующий эффект на кишечник Saccharomyces у детей в кластере 4 (рисунки 4H, I).
Соотношение Bacteroidetes и Firmicutes как регулятор системного воспаления низкой степени
Учитывая, что иммунитет Th2 и Th27 ранее был связан с грибковым дисбиозом (43) и T1D (6, 9, 44), мы измерили концентрации циркулирующих цитокинов IFNG, IL-17A и IL-22 в образцах сыворотки участники исследования. В кластере 1, обогащенном аутоантител-отрицательными детьми и представляющем, таким образом, здоровых детей, концентрации как IFNG, так и IL-17A положительно коррелировали с численностью Bacteroidetes (Рисунки 5A, D) и обратно пропорционально численностью Firmicutes (Рисунки 5B, E).В соответствии с этим мы обнаружили, что дети в кластере 5, характеризующиеся повышенным соотношением Bacteroidetes к Firmicutes, показали повышенные уровни циркулирующих IFNG и IL-17A (рисунки 5C, F). В кластере 4, обогащенном аутоантителположительными детьми с воспалением кишечника, не наблюдалось корреляций между циркулирующими цитокинами и составом микробиоты. Не было обнаружено корреляции между относительной численностью Saccharomyces и циркулирующими цитокинами (рисунки 5G, H) в кластере 1.Концентрации IFNG и IL-17A в сыворотке крови у детей с бета-клеточным аутоиммунитетом или без него показаны на дополнительном рисунке 5.
Рисунок 5 . Концентрация цитокинов в сыворотке крови в разных кластерах. (A, B) Взаимосвязь между IFNG в сыворотке и относительной численностью фекальных Bacteroidetes и Firmicutes в кластере 1. (D, E) Взаимосвязь между сывороточным IL-17A и относительной численностью фекальных Bacteroidetes и Firmicutes в кластере 1. Уровни (C, F) IFNG и IL-17A были значительно выше в кластере 5 по сравнению с кластерами 1 и 4. (G, H) Взаимосвязь между IFNG в сыворотке и относительной численностью фекальных Bacteroidetes и Firmicutes в кластере 1. Горизонтальные линии представляют медианные значения. Значения p были рассчитаны с помощью критерия Манна – Уитни U . Корреляции рассчитывались с помощью теста ранговой корреляции Спирмена. * p <0,05, ** p <0,01.
Обсуждение
В проспективном исследовании с участием 52 детей с риском СД1 мы показали, что дисбактериоз кишечника связан с более поздним развитием СД1 и характеризуется измененными грибковыми и бактериальными сообществами и воспалением кишечника.Признаки воспаления кишечника и повышенной проницаемости ранее были связаны с клиническим СД1 (15, 26, 45–47). Bosi et al. (48) показали повышенную кишечную проницаемость также при предиабете (48). Однако, насколько нам известно, такого рода ассоциации между составом кишечного микробиома, кишечными воспалительными маркерами и их потенциальным вкладом в прогрессирование заболевания ранее не наблюдались у детей из группы риска СД1.
Комбинированный иерархический кластерный анализ таксонов грибов и бактерий позволил разделить детей с положительным результатом на аутоантитела на две группы, которые различались по прогрессированию до СД1 в течение периода наблюдения.Долгосрочные последующие исследования редки, но показывают, что почти у всех детей с положительным результатом на множественные аутоантитела и генетический риск СД1 клиническое заболевание развивается через 15–20 лет (49). Таким образом, детей, у которых развился СД1, в нашей когорте можно рассматривать как быстро прогрессирующих (кластер 4) по сравнению с аутоантителопозитивными детьми, которые остались здоровыми (кластер 5). Уровни HBD2 в кале, указывающие на воспаление эпителия кишечника, были самыми высокими у детей с быстрым прогрессированием заболевания (т.е., кластер 4), предполагая, что воспаление кишечника является маркером прогрессирования заболевания. Измененное бактериальное сообщество, которое наблюдалось в кластерах 4 и 5, вероятно, связано с развитием аутоиммунитета бета-клеток как такового. Мы не обнаружили значительных различий в уровнях кальпротектина в кале между группами или детьми с аутоиммунитетом бета-клеток или без него, что позволяет предположить, что активация нейтрофилов не опосредует воспаление кишечника. Уровни фекального кальпротектина в нашей группе исследования были сопоставимы с уровнями, о которых сообщалось ранее у здоровых детей (50).
Наши данные о микобиоме предполагают, что грибковый дисбиоз может играть роль в нарушении гомеостаза кишечника и развитии субклинического субклинического воспаления кишечника низкой степени, которое ассоциируется с прогрессированием заболевания.
Измененное количество грибов, отнесенных к таксонам Malassezia и Debaryomyces , было обнаружено у детей с бета-клеточным аутоиммунитетом, а снижение численности грибов, отнесенных к роду Verticillium , наблюдалось у детей, у которых позже развился клинический СД1.Fecal Debaryomyces и Malassezia время от времени сообщалось в исследованиях на людях, но в настоящее время нет единого мнения о том, являются ли эти грибковые таксоны постоянными резидентами кишечной микробиоты человека (17). Verticillium очень редко встречается у людей (51, 52). В соответствии с недавним всеобъемлющим обзором микобиоты кишечника человека (18), роды Saccharomyces и Candida были наиболее часто наблюдаемыми таксонами грибов с самой высокой относительной численностью среди детей в нашей когорте.
Важно отметить, что высокая относительная численность Candida была характерна для грибкового дисбиоза, который отделял аутоантител-положительных детей с быстрым прогрессированием заболевания от остальных аутоантител-положительных детей, у которых не развился СД1, и детей с аутоантител-отрицательными детьми. Таким образом, повышенная колонизация Candida может быть важным фактором, способствующим воспалению кишечника и дальнейшему прогрессированию СД1.
Candida является членом здорового кишечного микробиома, а степень колонизации Candida регулируется факторами, связанными с хозяином, такими как целостность эпителия и иммунитет к IL-17 / IL-22, а также состав комменсальных бактерий. сообщество (43, 53–56).Комменсальные бактерии препятствуют колонизации грибов и конкурируют за поверхность и питательные вещества, а продуцируемые бактериями короткоцепочечные жирные кислоты (SCFA) могут ингибировать вирулентность Candida , предотвращая переход дрожжей в гиф (57). Бактерии также могут модулировать функцию и целостность эпителиального барьера с помощью своих метаболитов SCFA, таких как бутират, и путем регулирования выработки слизи, IL-22 и антимикробных пептидов (54, 55, 58). Таким образом, низкая относительная численность Clostridiales и бутират-продуцирующих бактерий, обнаруженная у детей с положительной реакцией на аутоантитела, может способствовать увеличению колонизации грибами Candida .В более ранних исследованиях также сообщалось о низкой численности бутират-продуцирующих бактерий у детей с положительной реакцией на аутоантитела (10, 59). Однако, несмотря на низкую численность Clostridiales как в кластере 4, так и в 5, увеличение количества грибов Candida наблюдалось только в кластере 4, включая быстро прогрессирующие. У людей для эффективного контроля и уничтожения Candida требуется активация IL17A и продуцирующих IFNG клеток Th27 (60, 61). Таким образом, возможно, что наблюдаемые высокие уровни циркулирующих IL-17 и IFNG в кластере 5 могут обеспечить устойчивость к колонизации грибами.Действительно, численность Saccharomyces была значительно снижена в кластере 5 с самыми высокими уровнями циркулирующих IL-17 и IFNG. Повышение уровня IL-17 и IFNG в кластере 5 на самом деле может быть следствием бактериального дисбактериоза, характеризующегося низкой численностью Firmicutes и высокой численностью Bacteroidetes, аналогично тому, как это наблюдается у детей с отрицательными аутоантителами в кластере 1, которые показали положительную корреляцию с циркулирующий IL-17 и IFNG и высокое соотношение Bacteroidetes к Firmicutes.Вместо этого в кластере 4 дети не реагировали на бактериальный дисбиоз с помощью активации IL-17 и IFNG, что могло обеспечить нишу для колонизации Candida и, наконец, на местное воспаление слизистой оболочки кишечника. Когда мы анализировали взаимосвязь между относительной численностью Saccharomyces или Candida и циркулирующими цитокинами, мы не наблюдали значительной корреляции у детей в кластере 1, что подчеркивает важность Bacteroidetes и Firmicutes в регуляции ответов IFNG и IL-17 у здоровых людей. штат.
Микробиота кишечника человека – это динамическая система бактерий, грибов, протистов и вирусов, которые сосуществуют и, таким образом, могут объединяться в ответ на различные внешние или внутренние раздражители. Ранее сообщалось о взаимосвязях между бактериями и грибами в микробиоме кишечника при болезни Крона, когда разные роды грибов были положительно коррелированы с несколькими таксонами бактерий (21, 22). Способность микобиоты регулировать бактериальный компартмент подтверждается исследованиями на животных, показавшими, что восстановление бактериального компартмента после истощения антибиотиков бактериями сильно зависело от колонизации C.albicans (62). В модели повреждения печени на мышах введение Saccharomyces boulardii изменило состав бактериального компартмента кишечника за счет увеличения относительной численности Bacteroidetes и уменьшения относительной численности бактерий, принадлежащих к Firmicutes (63). Интересно, что энтеробактерии, такие как Escherichia coli , взаимодействуют с дрожжами, способствуя их колонизации и воспалительным свойствам в кишечнике на животной модели язвенного колита (64).Смысл этих данных заключается в том, что кишечные грибковые и бактериальные сообщества могут регулировать друг друга, но понимание экологической сети и ее перекрестные связи с хозяином остаются в значительной степени неизвестными.
Мы признаем, что наше исследование имеет ограничения, такие как относительно небольшое количество исследованных лиц и отсутствие продольно собранных образцов кала и крови во время последующего наблюдения. Хотя мы наблюдали изменения в бактериальных и грибковых сообществах и в маркерах кишечного воспаления в образцах, собранных за несколько лет до появления клинических признаков СД1, продольный отбор образцов и механистические исследования укрепили бы исследование, которое в настоящее время носит описательный характер.Временная взаимосвязь бактериального и грибкового дисбиоза, связанного с развитием кишечного воспаления, бета-клеточного аутоиммунитета и СД1, требует дальнейших проспективных и механистических исследований, и, как всегда, результаты должны быть воспроизведены в независимых когортах, прежде чем результаты можно будет обобщить.
Существует острая потребность в новых биомаркерах, которые можно было бы использовать для идентификации лиц с повышенным риском аутоиммунитета к бета-клеткам и для прогнозирования прогрессирования от аутоантител-положительности к T1D.Возникает соблазн предположить, что увеличение численности грибка Candida и связанное с ним воспаление кишечника, измеряемое по повышенным уровням ASCA и HBD2, может предоставить новые инструменты для более точного прогнозирования СД1.
Продольные исследования необходимы для получения информации о последовательном порядке изменений микробиоты кишечника, воспаления кишечника и периферического иммунитета, ведущих к бета-клеточному аутоиммунитету и клиническому СД1. Несмотря на ограничения настоящего исследования, наши результаты показывают, что микобиота кишечника разнообразна и может быть проанализирована в образцах фекалий у детей.Наши результаты подчеркивают важность грибкового дисбиоза, помимо бактериального дисбактериоза, в формировании гомеостаза кишечника и воспаления, предшествующего T1D.
Заявление о доступности данных
Все данные микробиома были загружены в базу данных NCBI BioProject с регистрационным номером PRJNA420169 и PRJNA420171. Остальные наборы данных доступны по запросу первому автору (JH).
Заявление об этике
Исследования с участием людей были рассмотрены и одобрены этическим комитетом больничного округа Хельсинки и Уусимаа.Письменное информированное согласие на участие в этом исследовании было предоставлено законным опекуном / ближайшими родственниками участников.
Авторские взносы
JH, JK и OV придумали первоначальную идею. Рукопись написали JH и OV. JK, AL и MT отвечали за анализ ДНК и биоинформатику микробиологических исследований. DM отвечал за кластерный анализ. AV провела анализ сывороточного ASCA Ig и цитокинов. JH, LO, JK, AL, MT, AV, CF и DM проанализировали данные. TR и KL координировали набор субъектов исследования и сбор образцов.МК способствовал набору субъектов исследования и редактировал рукопись. JK, AL и AP внесли свой вклад в написание и критически рассмотрели рукопись. MK и TH отвечали за анализ аутоантител. JI отвечал за типирование HLA. LO провела анализ HBD2, общего IgA и кальпротектина. OV отвечал за дизайн исследования.
Финансирование
Эта работа была поддержана Финским культурным фондом (JH), Финским фондом исследований диабета (JH и OV), Академией Финляндии (OV), Фондом Пяйвикки и Сакари Зольберг (OV) и Европейским фондом изучения Диабет (OV).
Конфликт интересов
DM использовался компанией AstraZeneca, но AstraZeneca не участвовала в исследовании.
Остальные авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Благодарности
Марко Суокас из центра секвенирования Biocenter Oulu (Университет Оулу, Оулу, Финляндия) признателен за предоставление услуг по секвенированию.
Дополнительные материалы
Дополнительные материалы к этой статье можно найти в Интернете по адресу: https://www.frontiersin.org/articles/10.3389/fimmu.2020.00468/full#supplementary-material
Дополнительный рисунок 1. Разнообразие грибных сообществ. (A) Кривые разрежения, показывающие альфа-разнообразие грибкового сообщества во всех образцах, и (B) у детей с 1-4 β-клеточными аутоантителами (красная кривая) и отрицательными по аутоантителам образцами (синяя кривая).Каждая кривая показывает среднее количество OTU, обнаруженных в заданном количестве выбранных последовательностей после разрежения на глубине 327 последовательностей на выборку. Графики анализа главных координат (PCoA) основаны на взвешенных (C) и невзвешенных (D) UniFrac расстояниях между фекальными грибковыми сообществами у детей с (красные точки) или без (синие точки) аутоантителами.
Дополнительный рисунок 2. Относительная численность грибов родов Saccharomyce s, Candida, Debaryomyces, Malassezia и Verticillium в различных кластерах и у детей с аутоантителами, ассоциированными с СД1 или без них.Относительная численность Saccharomyces (A) и Candida (B) в основных кластерах 1, 4 и 5. (C – E) относительная численность Debaryomyces, Malassezia и Verticillium в образцы фекалий от детей в основных кластерах. (F, G) Здоровые дети без аутоантител отмечены светлыми кружками, дети с 1–4 аутоантителами – черными кружками, а дети, у которых клиническое заболевание прогрессировало, – красным кружком. P -значения были рассчитаны с помощью теста Манна – Уитни U . * p <0,05, ** p <0,01.
Дополнительный рисунок 3. Воспаление кишечника у детей с аутоантителами в кластерах 4 и 5. Дети AAb + в кластере 5 имели значительно более низкие уровни HBD2 в фекалиях по сравнению с детьми AAb + в кластере 4. Горизонтальные линии представляют медианные значения. Дети с 1–4 аутоантителами отмечены черными кружками, а дети, у которых клиническое заболевание прогрессирует, – красным кружком.Пунктирная линия представляет наивысшее наблюдаемое значение в кластере 5. 81% людей в кластере 4 имели уровень HBD2 выше, чем наивысшее значение в кластере 5. p -значения были рассчитаны с помощью шкалы Манна-Уитни U – контрольная работа. * p <0,05.
Дополнительный рисунок 4. Воспалительные маркеры в различных кластерах и у детей с аутоиммунитетом или без бета-клеточного иммунитета. (A) Концентрация общего IgA в кале в кластерах 1, 4 и 5 основных видов. (B) Концентрации общего IgA в фекалиях у детей с AAb + и AAb- детей. (C) Концентрация общего IgA в кале у детей с AAb, у детей с другим количеством аутоантител и у детей, у которых клинически развился СД1. (D) Концентрация кальпротектина в фекалиях у основных видов, кластеры 1, 4 и 5. (E) Концентрация кальпротектина в фекалиях у детей с AAb + и AAb- детей. (F) Концентрация кальпротектина в кале у детей с AAb, у детей с различным количеством аутоантител и у детей, у которых клинически развился СД1. (G) Уровни сывороточных антител IgA к ASCA в различных кластерах видов. (H) Сывороточные уровни ASCA IgA у детей AAb- и AAb +. (I) Концентрация ASCA IgA в сыворотке у детей с AAb- и у детей с одним или несколькими аутоантителами, а также у тех детей, у которых болезнь прогрессировала. (J) Уровни IL-22 в сыворотке крови в различных кластерах видов. (K) Уровни IL-22 у детей AAb- и AAb +. (L) Уровни IL-22 у детей AAb и детей с различным количеством аутоантител.
Дополнительный рисунок 5. (A, B) Концентрация IFNG и IL-17A в сыворотке у детей с бета-клеточным аутоиммунитетом или без него.
Дополнительная таблица 1. 25 самых распространенных видов грибов (на основе наблюдаемых последовательностей) распространены среди аутоантител-отрицательных детей и детей с аутоантителами.
Дополнительная таблица 2. Резюме перестановочного многомерного дисперсионного анализа (PERMANOVA). Статистические тесты PERMANOVA проводились на взвешенных расстояниях UniFrac и различиях Брея Кертиса между (1) профилями грибковых и (2) бактериальных микробных сообществ кишечника детей с риском развития диабета 1 типа.Статистические тесты проводились с использованием функции adonis в пакете R vegan (с 999 перестановками). Значимые (<0,05) значения выделены жирным шрифтом.
Дополнительная таблица 3. Резюме анализа сходства (ANOSIM). Статистические тесты ANOSIM проводились на взвешенных расстояниях UniFrac и различиях Брея Кертиса между (1) профилями грибковых и (2) бактериальных микробных сообществ кишечника детей из группы риска развития диабета 1 типа. Статистические тесты проводились с использованием функции anosim в пакете R vegan (с 999 перестановками).Для расчета q-значений использовалась поправка Бенджамини-Хохберга на частоту ложных обнаружений (FDR) для множественного тестирования. Значимые (<0,05) значения выделены жирным шрифтом.
Список литературы
1. Бенделак А, Карно С, Буитар С, Бах Дж. Ф. Сингенная передача аутоиммунного диабета от диабетических мышей NOD к здоровым новорожденным. потребность как в L3T4 +, так и в Lyt-2 + Т-клетках. J Exp Med. (1987) 166: 823–32. DOI: 10.1084 / jem.166.4.823
PubMed Аннотация | CrossRef Полный текст | Google Scholar
2.Bottazzo GF, Florin-Christensen A, Doniach D. Антитела островковых клеток при сахарном диабете с аутоиммунной полиэндокринной недостаточностью. Ланцет. (1974) 2: 1279–83. DOI: 10.1016 / S0140-6736 (74)
PubMed Аннотация | CrossRef Полный текст | Google Scholar
3. Маккуиш А.С., Ирвин В.Дж., Барнс Е.В., Дункан Л.Дж. Антитела к клеткам островков поджелудочной железы у инсулинозависимых диабетиков с сопутствующим аутоиммунным заболеванием. Ланцет. (1974) 2: 1529–31. DOI: 10.1016 / S0140-6736 (74)
-5PubMed Аннотация | CrossRef Полный текст | Google Scholar
5.Феррейра Р.К., Го Х., Колсон Р.М., Смит Д.Д., Пекальски М.Л., Буррен О.С. и др. Транскрипционная сигнатура интерферона I типа предшествует аутоиммунитету у детей, генетически подверженных риску диабета 1 типа. Диабет. (2014) 63: 2538–50. DOI: 10.2337 / db13-1777
PubMed Аннотация | CrossRef Полный текст | Google Scholar
7. Каллионпаа Х., Эло Л.Л., Лааяла Э., Микканен Дж., Рикано-Понсе I, Ваарма М. и др. Врожденная иммунная активность выявляется до сероконверсии у детей с предрасположенностью к HLA-ассоциированному диабету 1 типа. Диабет. (2014) 63: 2402–14. DOI: 10.2337 / db13-1775
PubMed Аннотация | CrossRef Полный текст | Google Scholar
8. Марваха А.К., Кром С.К., Панагиотопулос С., Берг К.Б., Цинь Х., Оуян К. и др. На переднем крае: увеличение количества Т-клеток, секретирующих IL-17, у детей с впервые возникшим диабетом 1 типа. J Immunol. (2010) 185: 3814–8. DOI: 10.4049 / jimmunol.1001860
PubMed Аннотация | CrossRef Полный текст | Google Scholar
9. Райнерт-Хартвалл Л., Хонканен Дж., Сало Х.М., Ниеминен Дж. К., Луопаярви К., Харконен Т. и др.Пластичность Th2 / Th27 является маркером развитого аутоиммунитета бета-клеток и нарушения толерантности к глюкозе у людей. J Immunol. (2015) 194: 68–75. DOI: 10.4049 / jimmunol.1401653
PubMed Аннотация | CrossRef Полный текст | Google Scholar
10. де Гоффау М.С., Луопаярви К., Книп М., Илонен Дж., Руохтула Т., Харконен Т. и др. Состав фекальной микробиоты у детей с бета-клеточным аутоиммунитетом и без него различается. Диабет. (2013) 62: 1238–44. DOI: 10.2337 / db12-0526
PubMed Аннотация | CrossRef Полный текст | Google Scholar
11. Гионго А., Гано К.А., Крабб Д.Б., Мукерджи Н., Новело Л.Л., Казелла Дж. И др. К определению аутоиммунного микробиома диабета 1 типа. ISME J. (2011) 5: 82–91. DOI: 10.1038 / ismej.2010.92
PubMed Аннотация | CrossRef Полный текст | Google Scholar
12. Костич А.Д., Геверс Д., Сильяндер Х., Ватанен Т., Хиотилайнен Т., Хамалайнен А.М. и др. Динамика микробиома кишечника младенца человека в развитии и прогрессировании к диабету 1 типа. Клеточный микроб-хозяин. (2015) 17: 260–73. DOI: 10.1016 / j.chom.2015.01.001
PubMed Аннотация | CrossRef Полный текст | Google Scholar
13. Ватанен Т., Франзоза Э.А., Швагер Р., Трипати С., Артур Т.Д., Вехик К. и др. Микробиом кишечника человека при диабете типа 1 с ранним началом из исследования TEDDY. Природа. (2018) 562: 589–94. DOI: 10.1038 / s41586-018-0620-2
PubMed Аннотация | CrossRef Полный текст | Google Scholar
14. Ватанен Т., Костич А.Д., д’Хеннезель Э., Сильяндер Х., Франзоса Э.А., Яссур М. и др.Вариабельность иммуногенности LPS микробиома способствует развитию аутоиммунитета у людей. Cell. (2016) 165: 842–53. DOI: 10.1016 / j.cell.2016.04.007
CrossRef Полный текст | Google Scholar
15. Вестерхольм-Ормио М., Ваарала О., Пихкала П., Илонен Дж., Савилахти Э. Иммунологическая активность слизистой оболочки тонкой кишки у педиатрических пациентов с диабетом 1 типа. Диабет. (2003) 52: 2287–95. DOI: 10.2337 / диабет.52.9.2287
PubMed Аннотация | CrossRef Полный текст | Google Scholar
16.Вен Л., Лей Р.Е., Волчков П.Ю., Странджес ПБ, Аванесян Л., Стоунбрейкер А.С. и др. Врожденный иммунитет и микробиота кишечника в развитии диабета 1 типа. Природа. (2008) 455: 1109–13. DOI: 10.1038 / nature07336
PubMed Аннотация | CrossRef Полный текст | Google Scholar
18. Ричард М.Л., Сокол Х. Микобиота кишечника: понимание анализа, взаимодействия с окружающей средой и роли в желудочно-кишечных заболеваниях. Nat Rev Gastroenterol Hepatol. (2019) 16: 331–45.DOI: 10.1038 / s41575-019-0121-2
PubMed Аннотация | CrossRef Полный текст | Google Scholar
20. Fujimura KE, Sitarik AR, Havstad S, Lin DL, Levan S, Fadrosh D, et al. Микробиота кишечника новорожденных связана с мультисенсибилизированной атопией у детей и дифференцировкой Т-клеток. Nat Med. (2016) 22: 1187–91. DOI: 10,1038 / нм 4176
PubMed Аннотация | CrossRef Полный текст | Google Scholar
21. Hoarau G, Mukherjee PK, Gower-Rousseau C, Hager C., Chandra J, Retuerto MA, et al.Взаимодействие бактериома и микобиома подчеркивает микробный дисбактериоз при семейной болезни Крона. МБио. (2016) 7: e01250–16. DOI: 10.1128 / mBio.01250-16
PubMed Аннотация | CrossRef Полный текст | Google Scholar
25. Сджорос М., Иития А., Илонен Дж., Рейхонен Х., Ловгрен Т. Анализ гибридизации с тройной меткой для аллелей HLA, связанных с диабетом 1 типа. Биотехнологии. (1995) 18: 870–7.
PubMed Аннотация | Google Scholar
26. Ваарала О., Илонен Дж., Руохтула Т., Песола Дж., Виртанен С.М., Харконен Т. и др.Удаление бычьего инсулина из смеси коровьего молока и раннее инициирование бета-клеточного аутоиммунитета в пилотном исследовании FINDIA. Arch Pediatr Adolesc Med. (2012) 166: 608–14. DOI: 10.1001 / archpediatrics.2011.1559
PubMed Аннотация | CrossRef Полный текст | Google Scholar
27. Ихрмарк К., Бодекер И.Т., Крус-Мартинес К., Фриберг Х., Кубартова А., Шенк Дж. И др. Новые праймеры для амплификации грибковой области ITS2 – оценка с помощью секвенирования 454 искусственных и естественных сообществ. FEMS Microbiol Ecol. (2012) 82: 666–77. DOI: 10.1111 / j.1574-6941.2012.01437.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
28. Капорасо Дж. Г., Кучински Дж., Стомбо Дж., Биттингер К., Бушман Ф. Д., Костелло Е. К. и др. QIIME позволяет анализировать данные секвенирования сообщества с высокой пропускной способностью. Нат. Методы. (2010) 7: 335–6. DOI: 10.1038 / nmeth.f.303
PubMed Аннотация | CrossRef Полный текст | Google Scholar
29. Эдгар Р.С., Хаас Б.Дж., Клементе Дж.С., Айва К., Найт Р.UCHIME улучшает чувствительность и скорость обнаружения химер. Биоинформатика. (2011) 27: 2194–200. DOI: 10.1093 / биоинформатика / btr381
PubMed Аннотация | CrossRef Полный текст | Google Scholar
31. Макдональд Д., Прайс М.Н., Гудрич Дж., Навроцки Е.П., де Сантис Т.З., Пробст А. и др. Усовершенствованная таксономия greengenes с явными рангами для экологического и эволюционного анализа бактерий и архей. ISME J. (2012) 6: 610–8. DOI: 10.1038 / ismej.2011.139
PubMed Аннотация | CrossRef Полный текст | Google Scholar
32.Nilsson RH, Larsson KH, Taylor AFS, Bengtsson-Palme J, Jeppesen TS, Schigel D, et al. База данных UNITE для молекулярной идентификации грибов: работа с темными таксонами и параллельная таксономическая классификация. Nucleic Acids Res. (2019) 47: D259–64. DOI: 10.1093 / nar / gky1022
PubMed Аннотация | CrossRef Полный текст | Google Scholar
33. Вайс С., Сюй З.З., Педдада С., Амир А., Биттингер К., Гонсалес А. и др. Стратегии нормализации и дифференциальной численности микробов зависят от характеристик данных. Микробиом. (2017) 5:27. DOI: 10.1186 / s40168-017-0237-y
PubMed Аннотация | CrossRef Полный текст | Google Scholar
34. Lozupone CA, Hamady M, Kelley ST, Knight R. Количественные и качественные измерения бета-разнообразия позволяют по-разному взглянуть на факторы, которые структурируют микробные сообщества. Appl Environ Microbiol. (2007) 73: 1576–85. DOI: 10.1128 / AEM.01996-06
PubMed Аннотация | CrossRef Полный текст | Google Scholar
35.Vazquez-Baeza Y, Pirrung M, Gonzalez A, Knight R. EMPeror: инструмент для визуализации данных микробного сообщества с высокой пропускной способностью. Gigascience. (2013) 2:16. DOI: 10.1186 / 2047-217X-2-16
PubMed Аннотация | CrossRef Полный текст | Google Scholar
36. Lehtonen OP, Grahn EM, Stahlberg TH, Laitinen LA. Количество и авидность антител в слюне и сыворотке крови к Streptococcus mutans в двух группах людей с различной восприимчивостью к кариесу. Infect Immun. (1984) 43: 308–13. DOI: 10.1128 / IAI.43.1.308-313.1984
PubMed Аннотация | CrossRef Полный текст | Google Scholar
38. Hoffmann C, Dollive S, Grunberg S, Chen J, Li H, Wu GD и др. Археи и грибы микробиома кишечника человека: корреляция с диетой и бактериальными жителями. PLoS ONE. (2013) 8: e66019. DOI: 10.1371 / journal.pone.0066019
PubMed Аннотация | CrossRef Полный текст | Google Scholar
39. Мотоока Д., Фудзимото К., Танака Р., Ягути Т., Гото К., Маэда Ю. и др.Стратегии глубокого секвенирования ITS1 грибов для реконструкции состава сообщества из 26 видов и оценки микобиоты кишечника здоровых японцев. Front Microbiol. (2017) 8: 238. DOI: 10.3389 / fmicb.2017.00238
PubMed Аннотация | CrossRef Полный текст | Google Scholar
40. Лян С.К., Тан XY, Люксенберг Д.П., Карим Р., Дунусси-Джоаннопулос К., Коллинз М. и др. Интерлейкин (IL) -22 и IL-17 коэкспрессируются клетками Th27 и совместно усиливают экспрессию антимикробных пептидов. J Exp Med. (2006) 203: 2271–9. DOI: 10.1084 / jem.20061308
PubMed Аннотация | CrossRef Полный текст | Google Scholar
41. Израильский E, Грот I, Гилбурд Б., Балисер Р.Д., Голдин Э., Виик А. и др. Анти-Saccharomyces cerevisiae и антинейтрофильные цитоплазматические антитела как предикторы воспалительного заболевания кишечника. Gut. (2005) 54: 1232–6. DOI: 10.1136 / gut.2004.060228
PubMed Аннотация | CrossRef Полный текст | Google Scholar
44.Каллманн Б.А., Хутер М., Тубес М., Фельдкамп Дж., Бертрамс Дж., Грис Ф.А. и др. Системная предвзятость производства цитокинов в сторону клеточно-опосредованной иммунной регуляции при IDDM и в сторону гуморального иммунитета при болезни Грейвса. Диабет. (1997) 46: 237–43. DOI: 10.2337 / диабет.46.2.237
PubMed Аннотация | CrossRef Полный текст | Google Scholar
45. Kuitunen M, Saukkonen T., Ilonen J, Akerblom HK, Savilahti E. Кишечная проницаемость для маннита и лактулозы у детей с диабетом 1 типа с аллелем HLA-DQB1 * 02. Аутоиммунитет. (2002) 35: 365–8. DOI: 10.1080 / 08021000008526
PubMed Аннотация | CrossRef Полный текст | Google Scholar
46. Тийттанен М., Вестерхольм-Ормио М., Веркасало М., Савилахти Е., Ваарала О. Инфильтрация P3-экспрессирующих клеток вилочного бокса в слизистую оболочку тонкой кишки при глютеновой болезни, но не при диабете 1 типа. Clin Exp Immunol. (2008) 152: 498–507. DOI: 10.1111 / j.1365-2249.2008.03662.x
CrossRef Полный текст | Google Scholar
47.Ваарала О., Аткинсон М.А., Ной Дж. Идеальный шторм для диабета 1 типа: сложное взаимодействие между кишечной микробиотой, проницаемостью кишечника и иммунитетом слизистых оболочек. Диабет. (2008) 57: 2555–62. DOI: 10.2337 / db08-0331
PubMed Аннотация | CrossRef Полный текст | Google Scholar
48. Бози Э., Молтени Л., Радаэлли М.Г., Фолини Л., Фермо I, Баззигалуппи Э. и др. Повышенная кишечная проницаемость предшествует клиническому началу диабета 1 типа. Diabetologia. (2006) 49: 2824–7.DOI: 10.1007 / s00125-006-0465-3
PubMed Аннотация | CrossRef Полный текст | Google Scholar
49. Ziegler AG, Rewers M, Simell O, Simell T, Lempainen J, Steck A, et al. Сероконверсия к множественным островковым аутоантителам и риск развития диабета у детей. JAMA. (2013) 309: 2473–9. DOI: 10.1001 / jama.2013.6285
PubMed Аннотация | CrossRef Полный текст | Google Scholar
50. Колхо К.Л., Сиппонен Т., Валтонен Э., Савилахти Е. Уровни фекального кальпротектина, MMP-9 и человеческого бета-дефенсина-2 при воспалительных заболеваниях кишечника у детей. Int J Colorectal Dis. (2014) 29: 43–50. DOI: 10.1007 / s00384-013-1775-9
PubMed Аннотация | CrossRef Полный текст | Google Scholar
51. Хамад И., Сохна С., Рауль Д., Биттар Ф. Молекулярное обнаружение эукариот в одном образце стула человека из Сенегала. PLoS ONE. (2012) 7: e40888. DOI: 10.1371 / journal.pone.0040888
PubMed Аннотация | CrossRef Полный текст | Google Scholar
52. Scanlan PD, Marchesi JR. Микроэукариотическое разнообразие микробиоты дистального отдела кишечника человека: качественная оценка с использованием культурально-зависимого и независимого анализа фекалий. ISME J. (2008) 2: 1183–93. DOI: 10.1038 / ismej.2008.76
PubMed Аннотация | CrossRef Полный текст | Google Scholar
53. де Лука А., Зеланте Т., Д’Анджело С., Загарелла С., Фалларино Ф, Спрека А. и др. IL-22 определяет новый иммунный путь устойчивости к противогрибковым препаратам. Mucosal Immunol. (2010) 3: 361–73. DOI: 10,1038 / mi.2010.22
PubMed Аннотация | CrossRef Полный текст | Google Scholar
54. Киннебрю М.А., Баффи К.Г., Диль Г.Е., Зеневич Л.А., Лейнер И., Холь TM и др.Продукция интерлейкина 23 дендритными клетками CD103 (+) CD11b (+) кишечника в ответ на бактериальный флагеллин усиливает врожденную иммунную защиту слизистых оболочек. Иммунитет. (2012) 36: 276–87. DOI: 10.1016 / j.immuni.2011.12.011
PubMed Аннотация | CrossRef Полный текст | Google Scholar
55. Шаубер Дж., Сванхольм С., Термен С., Иффланд К., Мензель Т., Шеппах В. и др. Экспрессия кателицидина LL-37 модулируется короткоцепочечными жирными кислотами в колоноцитах: актуальность сигнальных путей. Gut. (2003) 52: 735–41. DOI: 10.1136 / gut.52.5.735
PubMed Аннотация | CrossRef Полный текст | Google Scholar
56. Fan D, Coughlin LA, Neubauer MM, Kim J, Kim MS, Zhan X, et al. Активация HIF-1α и LL-37 комменсальными бактериями подавляет колонизацию Candida albicans . Nat Med. (2015) 21: 808–14. DOI: 10,1038 / нм.3871
PubMed Аннотация | CrossRef Полный текст | Google Scholar
58. Отте Дж. М., Здебик А. Э., Бренд С., Хромик А. М., Штраус С., Шмитц Ф. и др.Влияние кателицидина LL-37 на целостность кишечного эпителиального барьера. Regul Pept. (2009) 156: 104–17. DOI: 10.1016 / j.regpep.2009.03.009
PubMed Аннотация | CrossRef Полный текст | Google Scholar
60. Бахер П., Хонштейн Т., Бирбаум Э., Рокер М., Бланго М.Г., Кауфманн С. и др. Человеческий противогрибковый иммунитет и патология Th27 зависят от перекрестной реактивности против Candida albicans . Cell. (2019) 176: 1340–55.e15. DOI: 10.1016 / j.cell.2019.01.041
PubMed Аннотация | CrossRef Полный текст | Google Scholar
61. Зелински К.Э., Меле Ф., Ашенбреннер Д., Ярроссей Д., Рончи Ф., Гатторно М. и др. Индуцированные патогеном клетки Th27 человека продуцируют IFN-γ или IL-10 и регулируются IL-1β. Природа. (2012) 484: 514–8. DOI: 10.1038 / nature10957
PubMed Аннотация | CrossRef Полный текст | Google Scholar
62. Эрб Даунворд мл., Фальковски Н. Р., Мейсон К. Л., Муралья Р., Хаффнэгл, Великобритания. Модуляция повторной сборки бактериального сообщества после приема антибиотиков и ответ хозяина с помощью Candida albicans . Научный доклад (2013) 3: 2191. DOI: 10.1038 / srep02191
PubMed Аннотация | CrossRef Полный текст | Google Scholar
63. Yu L, Zhao XK, Cheng ML, Yang GZ, Wang B, Liu HJ, et al. Введение Saccharomyces boulardii изменяет микробиоту кишечника и ослабляет повреждение печени, вызванное D-галактозамином. Научный доклад (2017) 7: 1359. DOI: 10.1038 / s41598-017-01271-9
PubMed Аннотация | CrossRef Полный текст | Google Scholar
64. Sovran B, Planchais J, Jegou S, Straube M, Lamas B, Natividad JM и др. Enterobacteriaceae необходимы для изменения степени тяжести колита, вызываемого грибами. Микробиом. (2018) 6: 152. DOI: 10.1186 / s40168-018-0538-9
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Микробиом | Источник питания
Перейти к:
Что такое микробиом?
Как микробиота приносит пользу организму
Роль пробиотиков
Может ли диета повлиять на микробиоту человека?
Будущие направления исследований
Что такое микробиом?
Представьте себе шумный город утром в будний день, тротуары заполнены людьми, спешащими на работу или на встречи.Теперь представьте это на микроскопическом уровне, и вы получите представление о том, как выглядит микробиом внутри нашего тела, состоящий из триллионов микроорганизмов (также называемых микробиотой или микробами) тысяч различных видов. [1] К ним относятся не только бактерии, но и грибы, паразиты и вирусы. У здорового человека эти «жучки» мирно сосуществуют, причем наибольшее их количество обнаруживается в тонком и толстом кишечнике, а также по всему телу. Микробиом даже называют поддерживающим органом, потому что он играет очень много ключевых ролей в обеспечении бесперебойной повседневной работы человеческого тела.
У каждого человека есть совершенно уникальная сеть микробиоты, которая изначально определяется его ДНК. Человек впервые подвергается воздействию микроорганизмов в младенчестве, во время родов через родовые пути и через грудное молоко матери. [1] То, каким именно микроорганизмам подвергается младенец, зависит исключительно от вида, обнаруженного у матери. Позже воздействие окружающей среды и диета могут изменить микробиом человека, сделав его полезным для здоровья или подвергнуть его большему риску заболевания.
Микробиом состоит из полезных и потенциально вредных микробов. Большинство из них являются симбиотическими (от которых выигрывают и человеческое тело, и микробиота), а некоторые, в меньшем количестве, являются патогенными (способствуют развитию болезни). В здоровом организме без проблем сосуществуют патогенная и симбиотическая микробиота. Но если есть нарушение этого баланса, вызванное инфекционными заболеваниями, определенными диетами или длительным применением антибиотиков или других препаратов, уничтожающих бактерии, возникает дисбактериоз, прекращающий эти нормальные взаимодействия.В результате организм может стать более восприимчивым к болезням.
Как микробиота приносит пользу организму
Микробиота стимулирует иммунную систему, расщепляет потенциально токсичные пищевые соединения и синтезирует определенные витамины и аминокислоты [2], включая витамины группы B и витамин K. Например, ключевые ферменты, необходимые для образования витамина B12, содержатся только в бактериях, не у растений и животных. [3]
Сахара, такие как столовый сахар и лактоза (молочный сахар), быстро всасываются в верхней части тонкой кишки, но более сложные углеводы, такие как крахмалы и волокна, не так легко перевариваются и могут перемещаться ниже в толстую кишку.Там микробиота помогает расщеплять эти соединения с помощью их пищеварительных ферментов. Ферментация неперевариваемых волокон вызывает производство короткоцепочечных жирных кислот (SCFA), которые могут использоваться организмом в качестве источника питательных веществ, но также играют важную роль в функции мышц и, возможно, в профилактике хронических заболеваний, включая некоторые виды рака и расстройства кишечника. . Клинические исследования показали, что SCFA могут быть полезны при лечении язвенного колита, болезни Крона и диареи, связанной с антибиотиками.[2]
Микробиота здорового человека также обеспечивает защиту от патогенных организмов, попадающих в организм, например, через питье или употребление зараженной воды или пищи.
Крупные семейства бактерий, обнаруженных в кишечнике человека, включают Prevotella , Ruminococcus , Bacteroides и Firmicutes . [4] В толстой кишке, в среде с низким содержанием кислорода, вы найдете анаэробные бактерии Peptostreptococcus, Bifidobacterium , Lactobacillus и Clostridium .[4] Считается, что эти микробы предотвращают чрезмерный рост вредных бактерий, конкурируя за питательные вещества и места прикрепления к слизистой оболочке кишечника, которая является основным местом иммунной активности и производства антимикробных белков. [5,6]
Роль пробиотиков
Если микробиота так жизненно важна для нашего здоровья, как мы можем гарантировать, что у нас есть достаточное количество или правильные типы? Возможно, вы знакомы с пробиотиками или, возможно, уже используете их. Это либо продукты, которые от природы содержат микробиоту, либо таблетки-добавки, содержащие живые активные бактерии, рекламируемые для улучшения здоровья пищеварительной системы.Продажи пробиотических добавок превысили 35 миллиардов долларов в 2015 году с прогнозируемым увеличением до 65 миллиардов долларов к 2024 году. Верите ли вы в заявления о здоровье или думаете, что это еще одна афера со змеиным маслом, они составляют многомиллиардную отрасль, которая развивается в тандеме с быстро появляющиеся исследования.
Доктор Аллан Уокер, профессор питания Гарвардской школы общественного здравоохранения и Гарвардской медицинской школы, считает, что, хотя опубликованные исследования противоречат друг другу, существуют определенные ситуации, в которых пробиотические добавки могут быть полезны.«Пробиотики могут быть наиболее эффективными для обоих концов возрастного спектра, потому что тогда ваши микробы не так устойчивы, как обычно», – объясняет Уокер. «В эти периоды вы можете более эффективно влиять на этот огромный процесс бактериальной колонизации с помощью пробиотиков». Он также отмечает ситуации стресса для организма, когда пробиотики могут быть полезны, например, уменьшение тяжести диареи после контакта с патогенами или восстановление нормальных бактерий в кишечнике после того, как пациент принимает антибиотики.Тем не менее, Уокер подчеркивает, что «это все обстоятельства, при которых происходит нарушение баланса в кишечнике. Если вы имеете дело со здоровым взрослым или более старшим ребенком, который не принимает антибиотики, я не думаю, что введение пробиотика будет столь же эффективным для общего улучшения их здоровья ».
Поскольку пробиотики относятся к категории добавок, а не продуктов питания, они не регулируются Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США.Это означает, что, если компания, производящая добавки, добровольно не раскроет информацию о качестве, например, наличие USP (U.S. Pharmacopeial Convention) печать, которая обеспечивает стандарты качества и чистоты, пробиотические таблетки могут не содержать количества, указанные на этикетке, или даже не гарантировать, что бактерии живы и активны во время использования.
Может ли диета повлиять на микробиоту?
Помимо семейных генов, окружающей среды и использования лекарств, диета играет большую роль в определении того, какие виды микробиоты обитают в толстой кишке. [2] Все эти факторы создают уникальный микробиом от человека к человеку.В частности, диета с высоким содержанием клетчатки влияет на тип и количество микробиоты в кишечнике. Пищевые волокна могут быть расщеплены и ферментированы только ферментами микробиоты, живущей в толстой кишке. Короткоцепочечные жирные кислоты (SCFA) высвобождаются в результате ферментации. Это снижает рН толстой кишки, что, в свою очередь, определяет тип присутствующей микробиоты, которая выживет в этой кислой среде. Более низкий уровень pH ограничивает рост некоторых вредных бактерий, таких как Clostridium difficile . Растущие исследования SCFA исследуют их широкое влияние на здоровье, включая стимуляцию активности иммунных клеток и поддержание нормального уровня глюкозы и холестерина в крови.
Продукты, поддерживающие повышенный уровень SCFA, – это неперевариваемые углеводы и волокна, такие как инулин, резистентные крахмалы, камеди, пектины и фруктоолигосахариды. Эти волокна иногда называют пребиотиками, потому что они питают нашу полезную микробиоту. Хотя существуют добавки, содержащие пребиотические волокна, существует множество полезных для здоровья продуктов, содержащих пребиотики. Больше всего содержится в сырых версиях следующих ингредиентов: чеснок, лук, лук-порей, спаржа, топинамбур, зелень одуванчика, бананы и водоросли.В целом, фрукты, овощи, бобы и цельнозерновые продукты, такие как пшеница, овес и ячмень, являются хорошими источниками пребиотических волокон.
Имейте в виду, что высокое потребление пребиотических продуктов, особенно если их вводить внезапно, может увеличить газообразование (метеоризм) и вздутие живота. Людям с чувствительностью желудочно-кишечного тракта, например с синдромом раздраженного кишечника, следует вводить эти продукты в небольших количествах, чтобы сначала оценить переносимость. При продолжении использования переносимость может улучшиться с меньшим количеством побочных эффектов.
Если человек не чувствителен к пище, важно постепенно внедрять диету с высоким содержанием клетчатки, потому что диета с низким содержанием клетчатки может не только уменьшить количество полезной микробиоты, но и увеличить рост патогенных бактерий, которые процветают в менее кислой среде. .
Продукты с пробиотиками содержат полезную живую микробиоту, которая может еще больше изменить микробиом человека. К ним относятся ферментированные продукты, такие как кефир, йогурт с живыми активными культурами, маринованные овощи, темпе, чайный гриб, кимчи, мисо и квашеная капуста.
Будущие направления исследований
Микробиом – это живая динамическая среда, в которой относительная численность видов может колебаться ежедневно, еженедельно и ежемесячно в зависимости от диеты, лекарств, физических упражнений и множества других факторов окружающей среды.Однако ученые все еще находятся на ранних этапах понимания широкой роли микробиома для здоровья и масштабов проблем, которые могут возникнуть в результате прерывания нормальных взаимодействий между микробиомом и его хозяином. [7]
Некоторые актуальные темы исследований:
- Как микробиом и их метаболиты (вещества, вырабатываемые метаболизмом) влияют на здоровье и болезни человека.
- Какие факторы влияют на структуру и баланс микробиома.
- Разработка пробиотиков в качестве функционального продукта питания и решение нормативных вопросов.
Конкретные области интересов:
- Факторы, влияющие на микробиом беременных женщин, младенцев и педиатрического населения.
- Манипулирование микробами, чтобы противостоять болезням и лучше реагировать на лечение.
- Различия в микробиоме здоровых людей и людей с хроническими заболеваниями, такими как диабет, желудочно-кишечные заболевания, ожирение, рак и сердечно-сосудистые заболевания.
- Разработка диагностических биомаркеров микробиома для выявления болезней до их развития.
- Изменение микробиома в результате трансплантации микробов между людьми (например, трансплантация фекалий).
Связанные Ссылки
- Ursell, L.K., et al. Определение микробиома человека. Nutr Ред. , август 2012 г .; 70 (Дополнение 1): S38 – S44.
- den Besten, Gijs., Et al. Роль короткоцепочечных жирных кислот во взаимодействии между диетой, кишечной микробиотой и энергетическим метаболизмом хозяина .J Lipid Res. 2013 сен; 54 (9): 2325–2340.
- Morowitz, M.J., Carlisle, E., Alverdy, J.C. Вклад кишечных бактерий в питание и метаболизм у критически больных. Surg Clin North Am. 2011 августа; 91 (4): 771–785.
- Arumugam, M., et al. Энтеротипы микробиома кишечника человека. Природа. 12 мая 2011 г .; 473 (7346): 174-80.
- Кэнни, Г.О., Маккормик, Б.А. Бактерии в кишечнике, полезные жители или враги изнутри. Инфекция и иммунитет. Август 2008 г. 76 нет. 8, 3360-3373.
- Джандхьяла, С. Роль нормальной микробиоты кишечника. World J Gastroenterol. , 7 августа 2015 г .; 21 (29): 8787–8803.
- Proctor, L.M. The Human Microbiome Project в 2011 г. и позже. Клеточный хозяин и микроб. Том 10, выпуск 4, 20 октября 2011 г., стр. 287-91.
Условия использования
Содержание этого веб-сайта предназначено для образовательных целей и не предназначено для предоставления личных медицинских консультаций.Вам следует обратиться за советом к своему врачу или другому квалифицированному поставщику медицинских услуг с любыми вопросами, которые могут у вас возникнуть относительно состояния здоровья. Никогда не пренебрегайте профессиональным медицинским советом и не откладывайте его обращение из-за того, что вы прочитали на этом веб-сайте. Nutrition Source не рекомендует и не поддерживает какие-либо продукты.
Новая парадигма детского питания
6 -я Международная конференция и выставка по пробиотикам, функциональному и детскому питанию
2–3 октября 2017 г. Лондон, Великобритания
Дэвид Дж. Кайл
Evolve Biosystems, США
Основной доклад : J Prob Health
Аннотация :Постановка проблемы: грудное молоко было единственным источником питания для младенцев на протяжении миллионов лет и богато специфические олигосахариды (HMOs).В естественном микробиоме кишечника младенцев преобладает один вид бифидобактерий, исключительно конкурентоспособны при потреблении ОПЗ. Из-за непредвиденных последствий кормления смесью, использования антибиотиков и Кесарево сечение, этот естественный микробиом был радикально изменен, так что сегодня более 90% новорожденных в США дисбактериоз. Целью этой работы является разработка решения для спасения естественного микробиома от дисбактериоза с помощью раннее ремоделирование, которое возвращает микросреду толстой кишки в ее естественное состояние.Методология: рандомизированное параллельное контролируемое проспективное клиническое исследование (n = 68) было проведено в пяти исследованиях в Дэвисе, Калифорния, США. США со здоровыми доношенными детьми, находящимися на грудном вскармливании, зарегистрированными на четвертый день жизни. Половина когорты получала добавки ежедневно в течение 21 дня. с активированными Bifidobacteria infantis, и половина из них обеспечивала стандартный уход. Результаты: у всех младенцев, получавших добавки, независимо от способа родов, в микробиоме преобладали более 80% бактерий B. infantis. тогда как младенцы без добавок были лишены B.Infantis и 21 из 34 младенцев вообще не имели бифидобактерий. Различия в Также были отмечены зрелость стула, pH, микробиологические и химические различия. Заключение и значение: естественный микробиом hi-bif был утрачен за последние 50-80 лет в развитых странах. В возникающий в результате дисбактериоз может иметь значительное влияние на запрограммированное развитие иммунной системы и ее становление. метаболических уставок. Мы показали, что этот дисбактериоз можно исправить и восстановить микросреду с помощью добавление активированного B.Infantis.
Биография :Дэвид Дж. Кайл – генеральный директор Evolve Biosystems Inc., дочернего предприятия Института продуктов питания для здоровья Калифорнийского университета в Дэвисе. За свою карьеру он основал несколько компаний, в том числе Martek Biosciences Corp, где он руководил исследованиями и разработками и коммерческим развитием более 15 лет. Его продукты DHA и ARA теперь присутствуют практически во всех детских смесях по всему миру. В 2011 году он был приобретен DSM за 1,2 миллиарда долларов. Он получил степень доктора биохимии в Университете Альберты, Канада.За свою выдающуюся карьеру он опубликовал более 80 научных статей и отредактировал две книги. В 2009 году он был занесен в Зал славы космических технологий США за вклад в науку и промышленность.
Что ДЕЙСТВИТЕЛЬНО лечит раздраженный кишечник у детей
Исцеление дырявого кишечника – одна из самых востребованных задач в моей педиатрической практике питания. Многие родители удивляются, когда я говорю, что – это , что можно вылечить негерметичный кишечник у детей всех возрастов.
Но что действительно работает? О диетических подходах, пробиотиках и добавках много говорят, а исследования дырявого кишечника вызывают меньше, чем нам хотелось бы, особенно когда речь идет о младенцах, малышах, малышах или подростках.Тем не менее, после двадцати лет моей клинической педиатрической практики в области питания я могу сказать вам, какие пищевые добавки, которые я видел, постоянно работают, а какие стратегии часто терпят неудачу.
Во-первых, давайте поговорим о том, что такое дырявый кишечник, а что нет. Это не означает, что в кишечнике вашего ребенка есть настоящие язвы или дыры, которые «протекают». Но это может означать, что стенка кишечника потеряла некоторую целостность и стала слишком терпимой к размеру молекул, которые она позволяет проходить в ваш кровоток.
Другой способ, которым вы можете услышать описание дырявого кишечника, – это «кишечная проницаемость» или «повышенная проницаемость» – опять же, выражение состояния, при котором обычно очень избирательный, плотный процесс переваривания и всасывания пищи в кишечнике стал, ну, в общем, рыхлым и отрывочным!
Практикующие, в том числе и я, могут тщательно изучить зонулин, исследования микробов в кале (микробиологические культуры или методы ПЦР ДНК), воспалительные маркеры, такие как кальпротектин, или иммунные маркеры, такие как иммуноглобулин А, в образце стула, чтобы измерить среду кишечника.Некоторые врачи могут назначить тест на лактулозу и маннозу, во время которого пациенты пьют концентрированный раствор из этих сахаров. То, как эти два сахара разного размера выводятся с мочой, может дать оценку проницаемости кишечника. Чтобы узнать больше о тестах на кишечную проницаемость, а также об их плюсах и минусах, нажмите здесь. Также можно измерить пищевую аллергию и пищевые реакции, не относящиеся к IgE, для чего требуется анализ крови.
Ключ к восстановлению дырявого кишечника….Ключ к восстановлению здорового кишечника – это восстановление «плотных соединений» – это микроскопические структуры кишечника, нарушающие работу гаишников.Они образуют плотное соединение между клетками стенки кишечника. Когда эти соединения повреждаются, они разрушаются – и молекулы большего размера, чем идеальные, переходят из кишечника в кровоток, вызывая всевозможные реакции на наполнение, которое ваш кровоток и отдаленные ткани никогда не должны были видеть в первую очередь. Это может быть что угодно, от полипептидов (огромные фрагменты молекул пищевого белка, которые могут маскироваться под ложные гормоны, ложные нейротрансмиттеры или вторгающиеся антигены) до токсинов, получающих доступ к вашему телу из кишечника, когда они не должны этого делать.Этот сценарий проницаемости является ловушкой-22, поскольку он может легко сохраниться, поскольку в кишечнике сохраняется все больше травм.
Кишечник – это крупнейший интерфейс нашей иммунной системы с внешним миром, поэтому дырявый кишечник также может нанести ущерб иммунной системе, от аутоиммунных проблем до частых инфекций и болезней.
Что повреждает кишечник? Многое из-за того, что это усложняет то, что симптомы дырявого кишечника часто бывают разрозненными и коварными. Они могут развиваться постепенно или с внезапным началом, которое так и не разрешится.Дырявый кишечник, конечно, может вызывать симптомы в желудочно-кишечном тракте, но также и далеко от кишечника, такие как головные боли или боли в суставах, скованность, боль, усталость или частые простуды и инфекции.
, изображение предоставлено Джилл Карнахан, MD
Вот обычные подозреваемые в срабатывании дырявого кишечника- использование антибиотиков
- Кишечные Candida или другие грибковые инфекции
- невыявленная пищевая аллергия или пищевая чувствительность
- кишечный грипп или вирус
- пищевое отравление
- Чувствительность к глютену без глютена
- Плохо переносимые плановые прививки
- хронический стресс
- черепно-мозговая травма или сотрясение мозга
- Рождение с кесаревым сечением (ребенок упускает возможность воздействия полезной микрофлоры влагалища)
- мама, принимающая антибиотики во время беременности или родов по любой причине
- Мастит (маме нужны антибиотики при кормлении грудью)
- лучевая терапия
- недостаточный вес, особенно если вы младенец, ребенок или подросток
У большинства детей был хотя бы один из предметов из этого списка.Но последнее является ключевым. Сам по себе недостаточный вес может вызвать кишечную проницаемость, особенно у детей . Вы можете устранить все остальные триггеры, но если у вашего ребенка недостаточный вес, то есть более чем на пятнадцать процентов ниже его или ее ожидаемого образца , кишечник вашего ребенка может оставаться «негерметичным». На борту просто не хватает сырья и энергии для того, чтобы ткань могла восстановить себя, в то время как ваш ребенок тоже пытается расти.
Вот загвоздка: как правило, никто так внимательно не изучает характер роста вашего ребенка (я буду честен и скажу вам, что даже вижу, что гастроэнтерологические обследования упускают такой уровень деталей – и я регулярно читаю отчеты своих пациентов от их специалистов по желудочно-кишечным трактам по всей стране) .Без определения фактической ожидаемой модели роста вашего ребенка – то есть того, где ваш ребенок должен быть сегодня, учитывая родительский рост, историю беременности, историю рождений / родов и историю роста с момента рождения – тогда вы не будете знать, имеет ли ваш ребенок недостаточный вес или недоедание. Вы можете узнать об этом больше здесь.
Я встречаю много детей с недостаточным весом. Иногда это происходит из-за того, что семьи садят детей на слишком строгие диеты. Или некоторые семьи настолько травмированы пугающей реакцией на еду, что просто не знают, как и чем кормить своих детей, а значит, и не знают.Иногда это вызвано добрыми намерениями практикующего, который не следил за ростом и потреблением пищи, потому что вместо этого они сосредоточились на лабораторных тестах и добавках, не давали никаких указаний о том, что на самом деле есть, и поощряли ограничительную диету без эффективных заменителей принимаемой пищи. вне. Я также видел недостаточный вес, вызванный лекарствами от рефлюкса, которые могут снизить аппетит и пищеварение при использовании более нескольких недель или месяцев. Когда дело доходит до разборчивости в еде, это также снижает рост у детей, а также травмирует кишечник из-за недостаточного веса и неправильного питания.
Обратной стороной медали является оценка того, что ест ваш ребенок – сколько и что, и единственный способ узнать, достаточно ли ваш ребенок ест, не вызывая реакции, питательной пищи – это составить дневник питания (часть каждого нового приема пациента I делать), а затем согласовать его с оценкой роста. Пища, которую ест ваш ребенок, – это древесина, которая будет использоваться для восстановления кишечника. – так что это должна быть правильная еда в нужном количестве. Добавки (включая глютамин, который является полезной аминокислотой, но не источником энергии), травы и пробиотики не обеспечивают этот строительный материал.Я встречаю много детей, которым дали много добавок, лабораторные анализы, противогрибковые препараты, специальные диеты и меры по устранению проницаемости кишечника. Но они все еще борются, потому что эта важная часть роста и питания теряется в беспорядке. Но составьте правильный план кормления с правильными дополнительными опорами и стрелой – теперь вы говорите!
Вот что работает для восстановления дырявого кишечника у детей- Сбалансируйте среду кишечных микробов с помощью трав или препаратов, отпускаемых по рецепту, чтобы напрямую решить проблему грибковой нагрузки, бремени клостридий (даже комменсальные штаммы могут быть проблематичными, если они намного превосходят другие полезные штаммы), стрептококков или клебсиелл, паразитов, простейших и всего, что обнаруживается при тестировании.Совместите это с пробиотическими добавками, которые соответствуют исследованиям стула вашего ребенка. Мои предпочтительные инструменты для оценки – GI MAP и Doctors Data Stool Microbiology.
- Составьте специальную диету для вашего ребенка. Избегайте догматичных, универсальных подходов.
- Дайте достаточно белка! Детям может потребоваться от 1 до 2 граммов белка на килограмм веса тела в день в зависимости от степени нарушения роста.
- Дайте правильный белок; Сначала оцените, какие белки вызывают срабатывание, с помощью лабораторных исследований.Замените триггерные белки равными или более ценными не триггерными источниками белка и поддерживайте их разнообразие.
- Используйте свободные аминокислоты. Добавление смесей аминокислот, которые содержат все 8 незаменимых аминокислот (а не только глютамин), было большим преимуществом в моей практике для детей, которым требуется глубокое восстановление кишечника. Доступны формулы и порошки. Это дает кишечнику прямой доступ к строительным блокам для роста и восстановления новых тканей. Я употребляю от 5 до 15 или даже 30 граммов этого источника белка в день, в зависимости от потребностей или статуса ребенка.Предостережение: Они не будут работать нормально без адекватной полноценной диеты, поддерживающей энергетические потребности.
- Давайте достаточно полноценной пищи, включая «чистые» (несладкие) углеводы, которые имеют решающее значение для роста детей (углеводы сохраняют структуру и функции белка и не позволяют ему сжигаться для получения энергии), а также большое количество полезных жиров и масел. Детям может потребоваться в 4-6 раз больше калорий на фунт, чем взрослым, в зависимости от возраста и статуса роста. Не кормите их, как маленьких взрослых, – давайте им высококалорийную и богатую питательными веществами пищу.
- Мастичная камедь, корень солодки, цинк-карнозин, глутатион, богатые минералами продукты или такие продукты, как Restore, – это лишь крошечная часть из тысяч продуктов, которые могут помочь в восстановлении тканей кишечника. Проконсультируйтесь с опытным врачом, который раньше использовал их у детей. Использование этих инструментов – обычная часть моей практики.
- Правильный режим сна, чтобы ваш ребенок мог спать крепко и просыпаться отдохнувшим. Сон – это когда наши органы заняты восстановлением и очисткой. Подсказка: дети, которые недоедают, как правило, плохо спят и чаще просыпаются.
- Сведите к минимуму стресс в мире вашего ребенка. Не обсуждайте «дырявый кишечник» с детьми младшего возраста и не считайте еду или их тело проблемой. Используйте позитивный язык и подчеркивайте силу исцеления, которая есть у всех нас.
- Дайте ему время (например, месяцы), расслабьтесь и помните, что тело вашего ребенка – это чудо, обладающее врожденным стремлением расти, восстанавливать и лечить.
- Использование жестких диетических стратегий для растущих детей может быть слишком ограничивающим, чтобы поддерживать рост, рост и восстановление кишечника.Бездрожжевая диета, GAPS, кетогенная диета, AIP, SCD, Paleo или Body Ecology – все они имеют свои достоинства (и преданные!), И я использую их компоненты в своей практике. Но сами по себе они не были созданы для детей (кроме кетогенных диет для контроля припадков) и могут потерпеть неудачу, когда дети уже изо всех сил пытаются поправиться или вырасти. Если вы не видите хорошего роста, улучшения и прогресса в поведении или пищевых реакциях с помощью одной из этих стратегий в течение 2–4 недель или если первоначальные улучшения быстро исчезают, то это, вероятно, не подходит для вашего ребенка.Вместо этого настройте под своего ребенка!
- Требуется, чтобы вашему ребенку понравилось что-либо из этого, включая прием пищевых добавок, анализ крови или прием другой пищи. Ты взрослый. Они не облегчат вам задачу – это само собой разумеющееся. Подсказка. Придирчивый аппетит можно улучшить, выполнив эти три шага – не думайте, что ваш ребенок «не станет это есть».
- Принимать лекарства от рефлюкса в течение нескольких месяцев. Они будут работать против ваших усилий по заживлению кишечника, поддерживая слишком низкий уровень pH в желудке, чтобы инициировать хорошее переваривание белка.Они также заставят вашего ребенка со временем чувствовать себя менее голодным, меньше есть и стать более разборчивым, в результате чего ваш ребенок останется недокормленным и недоеденным для выполнения задачи восстановления кишечника. Узнайте больше о недостатках лекарств от рефлюкса здесь.
- Используйте глутамин, витамины, минералы или большое количество добавок, прежде чем вы определите правильную стратегию кормления для вашего ребенка. Стратегия кормления означает знание того, какие продукты использовать, сколько и какие источники белка, жиров и углеводов и как долго, чтобы поддерживать ожидаемый вес и рост вашего ребенка.
- Быть агрессивным с ферментированными продуктами, пробиотиками или слишком большим количеством Saccharomyces boulardii. Они могут иметь неприятные последствия, если их использовать слишком долго или в слишком высоких дозах, и даже могут вызвать собственный дисбактериоз или дискомфорт.
- Оставление грибка, паразита, SIBO или SIFO или другого дисбактериоза без лечения или недостаточного лечения. Это может нарушить аппетит, пищеварение и дефекацию, а также предотвратить закупорку плотных контактов.
- Сдаю через 2-4 недели. Это восстановление и ремонт, которые могут занять месяцы, в зависимости от того, как долго кишечник вашего ребенка находился в сорняках.
Нужна помощь? Это очень много! Позвольте мне отсортировать лучшие варианты для вашего ребенка . Свяжитесь со мной сегодня, чтобы назначить время для работы со мной удаленно или лично. Или ознакомьтесь с моими вариантами поддержки книг и онлайн-курсов.
Перейти к основному содержанию ИскатьИскать
- Где угодно
Искать JCSMSearch
Расширенный поиск Авторизоваться Пропустить основную навигацию Закрыть меню ящика Открыть меню ящика Меню- На главную
- Проблемы
- Текущий
- Архив
- Принятые статьи
- RSS-канал
- Коллекции Стандарты
- 85 : Резиденты / стипендиаты
- COVID-19
- 15-летний юбилей
- Преимущества для авторов
- Правила подачи заявок
- Редакционный совет JC 905
- Перепечатки и разрешения
- Рецензенты
- Рекламодатели
- Политика журнала
- Подписаться
Проблемы
Проблемы
- Текущий
- Архив
- Принятые статьи
- Новостная лента
Коллекции
Коллекции
- Стандарты практики
- REM: резиденты / стипендиаты
- COVID-19
- 15-летний юбилей
Отправить
Отправить
- Преимущества для авторов
- Правила подачи документов
Информация
Информация
- О компании JCSM
- Редакция журнала
- Заработайте CME
- Перепечатки и разрешения
- Рецензенты
- Рекламодатели
- Политика журнала
- Подписаться
- Подпишитесь на нас в Твиттер
- RSS
© 2021 Американская академия медицины сна Условия эксплуатации
Члены Американской академии медицины сна
Войти через аккаунт AASMАмериканский альянс за здоровый сон участников
Войдите в систему через учетную запись AAHSлучших медицинских специалистов собираются для решения проблем с дисбактериозом кишечника младенцев
ДЭВИС, Калифорния., 4 июня 2019 г. / PRNewswire / – Evolve BioSystems, производитель детского пробиотика Evivo® , сегодня объявила о созыве Консультативного совета по здоровью младенцев, в состав которого вошли ведущие эксперты медицинского и научно-исследовательского сообщества в области здоровья младенцев. Консультативный совет провел свое первое заседание 29 мая, на котором обсуждались способы восстановления полезных бактерий, необходимых для создания функционального микробиома младенца, и снижения риска краткосрочных и долгосрочных проблем со здоровьем.
Во время этого первоначального и последующих заседаний Консультативный совет по здоровью младенцев изучит, как безопасно и эффективно вернуть жизненно важные бактерии в микробиомы младенцев.В состав Консультативного совета по здоровью младенцев входят :
.- д-р Крис Дамман, доктор медицины, старший сотрудник по программам, Глобальное здравоохранение, Фонд Билла и Мелинды Гейтс; Доцент кафедры гастроэнтерологии Вашингтонского университета
- Д-р Бенджамин Голд, доктор медицины, детский гастроэнтеролог, Детский центр здоровья пищеварительной системы, Атланта,
- д-р Джэ Ким, доктор медицинских наук, неонатолог и детский гастроэнтеролог, Детская больница Рэди, Сан-Диего; Клинический профессор педиатрии Калифорнийского университета, Сан-Диего,
- Доктор.Брайан Скоттолайн, доктор медицинских наук, неонатолог, доцент педиатрии, Орегонский университет медицинских наук,
- доктор Эрин Гамильтон Спенс, доктор медицины, неонатолог, Детская больница Кука, Форт-Уэрт; Медицинский директор, Банк материнского молока Северного Техаса,
- Д-р Карл Сильвестр, доктор медицины, профессор хирургии и педиатрии, заместитель декана по исследованию здоровья матери и ребенка, Стэнфордский университет
«Проблема дисбактериоза проявляется по-разному. Жизненно важно объединить вместе исследователей и клиницистов из разных дисциплин», – сказал д-р.Эрин Гамильтон Спенс, доктор медицины, неонатолог, Детская больница Кука, Форт-Уэрт, и медицинский директор, Банк материнского молока в Северном Техасе. «Каждый из нас видит проблемы через свой объектив. Консультативный совет Evolve BioSystems Infant Health предоставляет форум для обмена данными и генерации идей. Исходя из нашей первоначальной встречи, я очень взволнован нашим потенциалом пролить свет на очень запутанные и все более сложные вопросы. распространенные проблемы со здоровьем младенцев в США и за их пределами ».
Основные полезные бактерии, B.infantis, клинически доказано, что снижает количество кишечных патогенов, таких как Clostridium и E. coli , которые связаны со все более распространенными аутоиммунными состояниями, такими как астма, аллергия, экзема и диабет 1 типа. Хотя B. infantis исторически присутствовал в кишечнике младенцев, важные современные медицинские практики, такие как антибиотики, кормление смесью и кесарево сечение, предотвратили естественный перенос полезных бактерий от матери к младенцу при рождении.Действительно, недавних исследований показали, что до девяти из 10 младенцев, рожденных в США, в раннем возрасте отсутствовали в кишечном микробиоме B. infantis .
«Ведущие практики в области неонатальной и педиатрической науки и медицины начинают понимать, что дисбактериоз, характеризующийся нарушением нормального кишечного микробиома и нарушением симбиотических отношений между хозяином и связанными с ним микробами, становится все более распространенным среди детей в США», сказал докторБенджамин Голд, доктор медицины, детский гастроэнтеролог, Детский центр здоровья пищеварительной системы, Атланта. “Это нарушение нормальной микрофлоры может затем привести к развитию заболеваний, в частности аутоиммунных, воспалительных и аллергических заболеваний, которые становятся настоящим кризисом для общественного здравоохранения. К счастью, мы добились больших успехов в поиске методов восстановления кишечник ребенка до нормального здорового состояния. Мы должны использовать эти мощные открытия и начать применять эту технологию к ряду различных парадигм болезней, чтобы определить, можно ли успешно снизить риск развития болезни путем восстановления нормального микробиома младенца.«
О компании Evolve BioSystems
Evolve BioSystems, Inc. – это частная микробиомная компания, занимающаяся разработкой следующего поколения продуктов для создания, восстановления и поддержания здорового микробиома кишечника. Evolve недавно завершила раунд финансирования серии C на сумму 40 миллионов долларов, который совместно возглавляли Фонд Билла и Мелинды Гейтс и Horizons Ventures, венчурное подразделение Фонда Ли Ка Шинга. Evolve – это ответвление Института продуктов питания для здоровья (FFHI) Калифорнийского университета в Дэвисе, основанное на более чем десятилетних исследованиях, направленных на понимание уникального партнерства микробиома кишечника младенца и компонентов грудного молока.Благодаря разработке и коммерческому запуску продуктов для лечения дисбактериоза кишечника новорожденных, в том числе Evivo® EVC001 для младенцев, открытая платформа Evolve теперь применяется для решения проблемы дисбактериоза кишечника на протяжении всего жизненного цикла человека и животных. В дополнение к знаменательному испытанию, подтверждающему концепцию, Evolve проводит дальнейшие клинические исследования для создания своего набора решений на основе микробиома.
Контактное лицо: Crisel Ortiz, 1-415-989-9000, [адрес электронной почты защищен]
ИСТОЧНИК Evolve BioSystems, Inc.
Ссылки по теме
https://www.evolvebiosystems.com/



 Причины болезни – это неправильное питание, длительный прием лекарств, хронические болезни, поражающие печень или кишечник.
Причины болезни – это неправильное питание, длительный прием лекарств, хронические болезни, поражающие печень или кишечник.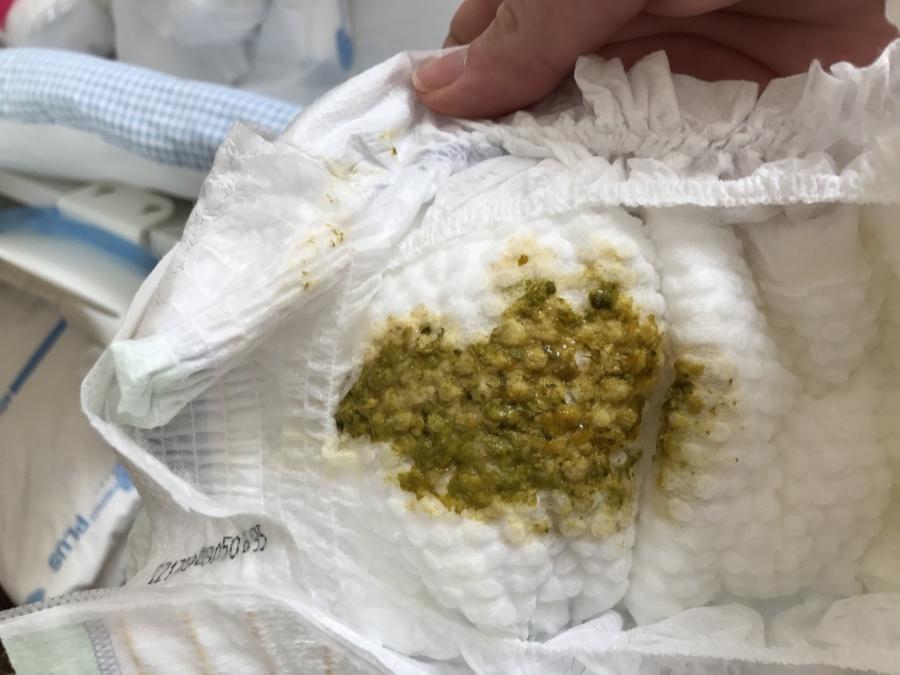
 Когда малышу исполнится два года, его нужно приучить правильно чистить зубы с помощью щетки и пасты, а также к регулярным полосканиям после еды.
Когда малышу исполнится два года, его нужно приучить правильно чистить зубы с помощью щетки и пасты, а также к регулярным полосканиям после еды.