Хеликобактер пилори лечение антибиотиками: Устойчивость к антибиотикам Helicobacter pylori: обзор эпидемиологических тенденций и проблемы терапии | Ахметова Д.Г., Балтабекова А.Ж., Шустов А.В.
Устойчивость к антибиотикам Helicobacter pylori: обзор эпидемиологических тенденций и проблемы терапии | Ахметова Д.Г., Балтабекова А.Ж., Шустов А.В.
В статье представлены обзор эпидемиологических тенденций и проблемы терапии устойчивости к антибиотикам Helicobacter pylori
Введение
Бактерия H. pylori является глобально распространенным условно-патогенным микроорганизмом и колонизирует примерно 50% населения мира [1]. Данный патоген был впервые обнаружен в биопсиях желудка в 1983 г. [2]. H.pylori — это грамотрицательная бацилла, которая колонизирует слизистую оболочку желудка человека. У многих людей такая инфекция со временем приводит к хроническому гастриту, язвенной болезни желудка, лимфоме лимфоидной ткани слизистой оболочки (MALT) и карциноме желудка. Не так давно было высказано предположение, что H.pylori может быть связанаи с внекишечными заболеваниями, такими как тромбоцитопеническая пурпура, железодефицитная анемия и дефицит витамина В12 [3, 4].
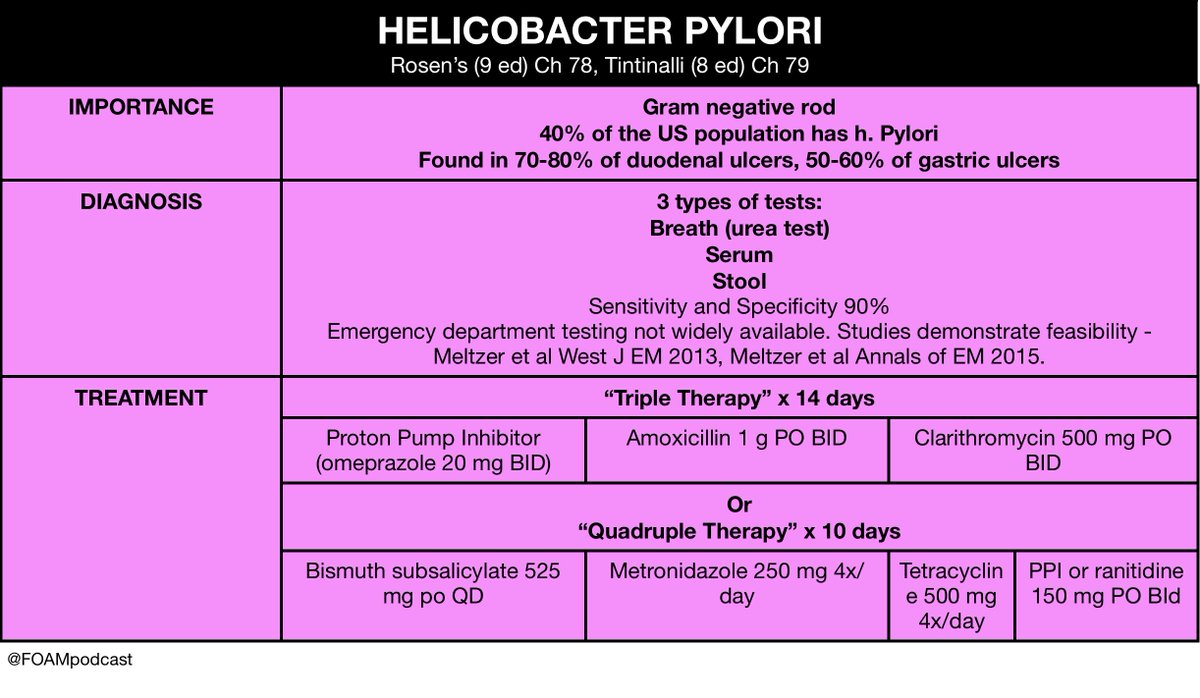
Современное состояние терапии хеликобактерной инфекции характеризуется большим числом неуспешных случаев лечения, так, в США примерно в 20% случаев не удается добиться эрадикации возбудителя из организма пациента. Процент успешности антибиотикотерапии в некоторых странах ниже — до 60%. Считается, что неуспешные случаи терапии вызваны антибиотико-резистентными изолятами. Значение антибиотико-
 Целью разработки новых схем лечения объявлено достижение 100% эрадикации [7].
Целью разработки новых схем лечения объявлено достижение 100% эрадикации [7].Распространенность инфекции H. pylori
Заражение H. pylori происходит во всем мире, но при этом наблюдаются географические различия в распространенности инфекции. Многочисленные исследования показали, что низкий социально-экономический статус ассоциируется с повышенным риском инфекции H.pylori. В когортных исследованиях обнаружено, что инфицированность в обследованных популяциях возрастает с возрастом. В Европе распространенность H. pylori варьирует от 11% в Швеции до 60,3% в Испании. В Китае сообщили об очень высоком уровне встречаемости — до 83,4% [8]. Во многих странах, включая Китай, Японию и Болгарию, отмечен рост распространенности инфекции H.pylori в течение последних 20 лет (рис. 1) [9–13]. В Канаде распространенность инфекции в среднем составляет 30%, однако у коренных народов этой страны превышает 95%. В США серопозитивность на иммунологические маркеры инфекции составляет 30% [14].
Распространенность устойчивости к антибиотикам
Распространенность антибиотикорезистентности H. py-lori разнится по географическим районам [15]. Распространенность хеликобактерной инфекции в США не изменилась с 2000 по 2010 г., но частота успешной эрадикации инфекции снизилась в этот период [1, 6, 13, 16].
Европейское многоцентровое исследование, проведенное с 2008 по 2009 г., показало частоту встречаемости резистентности случаев инфекции H. pylori к кларитромицину, метронидазолу и левофлоксацину: 17,5%, 34,9% и 14,1% соответственно [5]. Исследование, выполненное в Японии в 2002–2005 гг., выявило быстрый рост случаев инфекции, вызванных кларитромицин-устойчивым штаммом H. pylori; уровень резистентности к кларитромицину увеличился с 18,9 до 27,7% за указанный 3-летний период. Резистентность к метронидазолу в этот период оставалась на одном уровне (3,3–5,3%), а устойчивость к амоксициллину практически не встречалась.
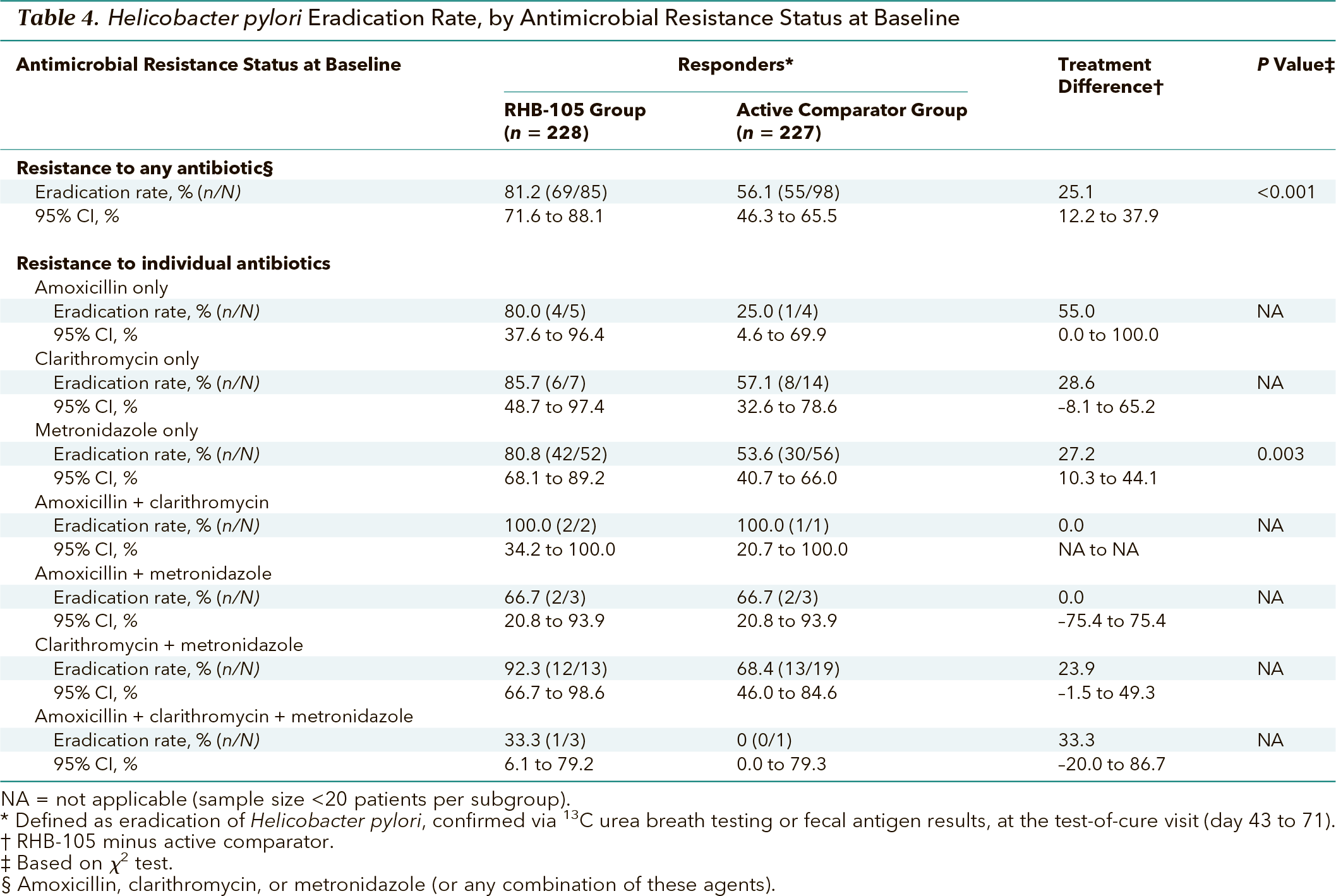 В исследовании консорциума SHARP (Surveillance of H. pylori Antimicrobial Resistance Partnership) выполнен метаанализ данных, собранных с 1993 по 1999 г., и показано, что уровень резистентности к кларитромицину, метронидазолу и амоксициллину составил 10,1, 36,9 и 1,4% соответственно. Проспективное многоцентровое исследование HARP (Helicobacter pylori Antimicrobial Resistance Monitoring Program) проводилось в период 1998–2002 гг. и продемонстрировало резистентность к кларитромицину, метронидазолу и амоксициллину в 12,9, 25,1 и 0,9% случаев соответственно.
В исследовании консорциума SHARP (Surveillance of H. pylori Antimicrobial Resistance Partnership) выполнен метаанализ данных, собранных с 1993 по 1999 г., и показано, что уровень резистентности к кларитромицину, метронидазолу и амоксициллину составил 10,1, 36,9 и 1,4% соответственно. Проспективное многоцентровое исследование HARP (Helicobacter pylori Antimicrobial Resistance Monitoring Program) проводилось в период 1998–2002 гг. и продемонстрировало резистентность к кларитромицину, метронидазолу и амоксициллину в 12,9, 25,1 и 0,9% случаев соответственно.Существует веские данные в пользу того, что встречаемость резистентных штаммов положительно коррелирует с объемом потребления антибиотиков в общей популяции [5]. В работе, посвященной исследованию эпидемиологии инфекции
 pylori, и из этих пациентов 92% ранее получали лечение макролидами. Более того, наблюдался эффект зависимости от дозы: частота встречаемости резистентности к кларитромицину была тем выше, чем большее количество курсов лечения макролидами было в подгруппах обследованных. В этой популяции подобная связь была найдена между частотой резистентности к метронидазолу и объемом использования метронидазола в индивидуальной истории больных [17].
pylori, и из этих пациентов 92% ранее получали лечение макролидами. Более того, наблюдался эффект зависимости от дозы: частота встречаемости резистентности к кларитромицину была тем выше, чем большее количество курсов лечения макролидами было в подгруппах обследованных. В этой популяции подобная связь была найдена между частотой резистентности к метронидазолу и объемом использования метронидазола в индивидуальной истории больных [17]. Кларитромицин
Распространенность устойчивости к кларитромицину увеличивается во многих странах (рис. 2а) [5, 18–23]. Исследования показали, что в странах, где низок общий уровень серопозитивности к маркерам инфекции H. pylori, распространенность антибиотикорезистентности не меняется со временем. Например, указанная серопозитивность в Швеции остается приблизительно постоянной (~20%) с 1995 г. Распространенность кларитромицин-резистентных штаммов в этой стране также остается низкой (менее 5%). Напротив, страны с высокой встречаемостью серологических маркеров H. pylori сталкиваются с ростом устойчивости возбудителя
pylori сталкиваются с ростом устойчивости возбудителя к кларитромицину. Например, распространенность устойчивости к кларитромицину значительно возросла (с 1,8% в 1996 г. до 27,1% в 2008 г.) в Японии; серопозитивность за период 2000–2013 гг. выросла с 40 до 55%, а встречаемость кларитромицин-резистентных случаев достигла 31,1%. Аналогично в Китае с 2000 по 2014 г. встречаемость резистентности
Метронидазол
Во многих странах мира отмечена резистентность H. pylori к метронидазолу, и ее уровень растет (рис. 2б) [18–22, 25–28]. Распространенность резистентности H.pylori к метронидазолу в Европе в общей популяции варьирует на уровне от 20 до 40% со средней цифрой 33,1% без явных различий между Южной и Северной Европой. Зато в Центральной и Восточной Европе уровни резистентности ниже. С другой стороны, в развивающихся странах за пределами Европы резистентность H. pylori к метронидазолу встречается значительно чаще (50–80%), например в Мексике — 76,3%. В развитых странах за пределами Европы резистентность к метронидазолу в общей популяции встречается реже, чем средняя цифра по Европе: в Японии — 9–12%, в Канаде — 18–22%, в США — 21,5% [23]. Ряд авторов объясняет различия в частоте встречаемости резистентности неодинаковыми объемами предшествующего использования метронидазола в обследованных регионах. Обследование коренных народов Аляски показало статистически значимо бóльшую частоту встречаемости устойчивости среди женщин по сравнению с мужчинами, причем уровни резистентности коррелировали с количеством перенесенных курсов терапии метронидазолом.
pylori к метронидазолу, и ее уровень растет (рис. 2б) [18–22, 25–28]. Распространенность резистентности H.pylori к метронидазолу в Европе в общей популяции варьирует на уровне от 20 до 40% со средней цифрой 33,1% без явных различий между Южной и Северной Европой. Зато в Центральной и Восточной Европе уровни резистентности ниже. С другой стороны, в развивающихся странах за пределами Европы резистентность H. pylori к метронидазолу встречается значительно чаще (50–80%), например в Мексике — 76,3%. В развитых странах за пределами Европы резистентность к метронидазолу в общей популяции встречается реже, чем средняя цифра по Европе: в Японии — 9–12%, в Канаде — 18–22%, в США — 21,5% [23]. Ряд авторов объясняет различия в частоте встречаемости резистентности неодинаковыми объемами предшествующего использования метронидазола в обследованных регионах. Обследование коренных народов Аляски показало статистически значимо бóльшую частоту встречаемости устойчивости среди женщин по сравнению с мужчинами, причем уровни резистентности коррелировали с количеством перенесенных курсов терапии метронидазолом.
Другие антибиотики
Частота встречаемости устойчивости H. pylori к тетрациклину низкая: 0,7% в Испании, 0,5% в Великобритании, 0,5% в Гонконге, причем в ряде стран сообщили об отсутствии выявления случаев резистентности к тетрациклину [5]. Некоторые исследования определяли распространенность устойчивости к фторхинолонам [1].В Китае, Италии и США резистентность к левофлоксацину обнаружена в 34,5, 22,1 и 31,9% случаев соответственно [19, 21, 23]. Распространенность резистентности к левофлоксацину в Европе известна на примере Португалии — 20,9%. Эпидемиология резистентности к левофлоксацину изучена гораздо хуже, чем к другим упомянутым препаратам, однако ряд авторов указывает на тенденцию к увеличению встречаемости устойчивости H. pylori к левофлоксацину со временем (рис. 2в) [5, 19, 21–23, 25, 27, 28]. В Нидерландах обнаружено, что в 4,7% случаев выделенные штаммы H. pylori устойчивы к терапевтическим концентрациям нового антибиотика тровафлоксацина.
 Во Франции резистентность к фторхинолонам описана в 3,3% случаев, в странах Восточной Европы — в 3,9%. Также описано, что новый фторхинолоновый антибиотик ситафлоксацин, по-видимому, не обладает выраженной кросс-резистентностью с другими фторхинолонами (которые уже имеют историю использования в популяции) и поэтому эффективно эрадицирует H. pylori [29, 30].
Во Франции резистентность к фторхинолонам описана в 3,3% случаев, в странах Восточной Европы — в 3,9%. Также описано, что новый фторхинолоновый антибиотик ситафлоксацин, по-видимому, не обладает выраженной кросс-резистентностью с другими фторхинолонами (которые уже имеют историю использования в популяции) и поэтому эффективно эрадицирует H. pylori [29, 30].Устойчивость H. pylori к амоксициллину в европейских странах встречается редко (от 0 до
Диагностика инфекции H. pylori
Тестирование пациентов с болями в эпигастральной области и диспепсией на инфекцию H. pylori стало распространенной диагностической практикой. Важность хеликобактерной инфекции значительно возросла в связи с обнаружением статистической связи между данной инфекцией и раком желудка. Международное агентство по изучению рака (International Agency for Research on Cancer) считаетСпособы обследования на инфекцию H. pylori делятся на инвазивные и неинвазивные.
 Неинвазивные методы рекомендованы для пациентов H. pylori в стуле пациента. Серологическое тестирование обнаруживает иммуноглобулины IgG к антигенам H. pylori в сыворотке; впрочем, есть и рекомендации не использовать серологический метод для диагностики данной инфекции из-за того, что уровень сероконверсии существенно ниже 100% [1]. Серологический тест не пригоден для мониторинга эффективности терапии, поскольку успешное лечение не изменяет уровня IgG в краткосрочной перспективе. Альтернативный серологический метод предусматривает обнаружение антител другого класса — IgM к антигенам H.pylori, которые появляются в период острой фазы инфекции сразу после заражения, однако период времени, в течение которого IgM присутствуют в определяемых концентрациях, слишком короткий.
Неинвазивные методы рекомендованы для пациентов H. pylori в стуле пациента. Серологическое тестирование обнаруживает иммуноглобулины IgG к антигенам H. pylori в сыворотке; впрочем, есть и рекомендации не использовать серологический метод для диагностики данной инфекции из-за того, что уровень сероконверсии существенно ниже 100% [1]. Серологический тест не пригоден для мониторинга эффективности терапии, поскольку успешное лечение не изменяет уровня IgG в краткосрочной перспективе. Альтернативный серологический метод предусматривает обнаружение антител другого класса — IgM к антигенам H.pylori, которые появляются в период острой фазы инфекции сразу после заражения, однако период времени, в течение которого IgM присутствуют в определяемых концентрациях, слишком короткий. Уреазный дыхательный тест с мочевиной, меченной 13C, в настоящее время является «золотым стандартом» для диагностирования инфекции H. pylori. Этот тест использует мочевину, в молекулу которой включен нерадиоактивный, но редкий изотоп углерода 13С, для выявления активности фермента уреазы (у человека нет эндогенной уреазы, но этот фермент производят многие бактерии, и в частности H.
 pylori). Наличие изотопа 13C в выдыхаемом воздухе статистически связано с инфекцией H. pylori. Еще один неинвазивный тест обнаруживает антиген H. pylori в стуле больного с помощью реакции с соответствующими антителами и последующей детекции образовавшихся комплексов антиген — антитело. Важное преимущество дыхательного теста с мочевиной и теста на антиген в стуле больного заключается в пригодности указанных методов для контроля полноты эрадикации патогена в результате лечения [33, 34].
pylori). Наличие изотопа 13C в выдыхаемом воздухе статистически связано с инфекцией H. pylori. Еще один неинвазивный тест обнаруживает антиген H. pylori в стуле больного с помощью реакции с соответствующими антителами и последующей детекции образовавшихся комплексов антиген — антитело. Важное преимущество дыхательного теста с мочевиной и теста на антиген в стуле больного заключается в пригодности указанных методов для контроля полноты эрадикации патогена в результате лечения [33, 34].Гастроэндоскопия (инвазивная процедура) рекомендована для пациентов с впервые выявленной диспепсией, сопровождаемой сигнальными симптомами, среди которых непреднамеренная потеря веса, желудочно-кишечные кровотечения, железодефицитная анемия или дисфагия. Для больных с впервые выявленной диспепсией в отсутствие сигнальных симптомов гастроэндоскопия показана, если возраст больного >54 лет (впрочем, граничный возраст, при котором следует назначать гастроэндоскопию, является предметом дискуссий и может варьировать в зависимости от популяционной группы, а именно от локальной частоты рака желудка в данной группе) [1].
 Если при обследовании больного можно быстро получить биопсию, рекомендовано проведение быстрого уреазного теста. В быстром уреазном тесте исследуют биоптаты антрального отдела и тела желудка для обнаружения активности уреазы. Уреазный тест быстрее гистологического исследования, но на практике если есть возможность взять биопсию, то образец также отправляется на гистологическое исследование из-за его высокой диагностической ценности — оно позволяет оценить тяжесть воспаления и обнаружить присоединяющиеся патологии, в т. ч. лимфому или карциному желудка [7]. Для микроскопического выявления H.pylori в биопсиях предложены несколько методов окрашивания (например, модифицированный метод Гимза или окрашивание по Уортину — Старри, или иммуногистохимические методы).
Если при обследовании больного можно быстро получить биопсию, рекомендовано проведение быстрого уреазного теста. В быстром уреазном тесте исследуют биоптаты антрального отдела и тела желудка для обнаружения активности уреазы. Уреазный тест быстрее гистологического исследования, но на практике если есть возможность взять биопсию, то образец также отправляется на гистологическое исследование из-за его высокой диагностической ценности — оно позволяет оценить тяжесть воспаления и обнаружить присоединяющиеся патологии, в т. ч. лимфому или карциному желудка [7]. Для микроскопического выявления H.pylori в биопсиях предложены несколько методов окрашивания (например, модифицированный метод Гимза или окрашивание по Уортину — Старри, или иммуногистохимические методы).Стратегии антибиотикотерапии
Для лечения инфекции H. pylori разработано много протоколов терапии (рис. 3). В том случае если не удается достигнуть эрадикации, предложены протоколы консервативного поддерживающего лечения.
Тройная терапия
Эффективность применения антибиотиков зависит от ряда факторов, таких как эффективность антимикробного действия выбранного препарата с учетом возможной резистентности, способа применения, продолжительности курса. При назначении лечения также следует учитывать эффекты, определяющие приверженность больного протоколу лечения, которые связаны со стоимостью препарата, его побочными действиями и переносимостью. Внастоящее время стандартный протокол лечения инфекции H. pylori в регионах, где распространенность резистентности к кларитромицину ниже 15%, представляет собой тройную терапию, которая включает ингибиторы протонной помпы (ИПП), кларитромицин и амоксициллин [35]. Эта терапевтическая схема широко используется в мире уже более 10 лет, однако ее эффективность постепенно снижается. В случае аллергии к пенициллинам у больного амоксициллин можно заменить метронидазолом без потери эффективности тройной терапии. Основной причиной неудачи эрадикации для стандартного протокола тройной терапии считается повышенная устойчивость изолята H. pylori у больного к кларитромицину. Другие факторы, которые могут повлиять на показатели эффективности лечения, включают приверженность терапии (соблюдение пациентом назначений), повышенную массу тела, генотип H. pylori, уровень бактериальной нагрузки, кислотность желудочного сока и наличие у пациента атрофического гастрита. Некоторые авторы предлагают в регионах, где высока встречаемость резистентности к кларитромицину, избегать стандартного протокола (включающего кларитромицин) для проведения терапии первой линии [16, 36]. В соответствии с Маастрихтским консенсусом рекомендуется тестирование чувствительности до назначения лечения в регионах, где уровень резистентности превышает 20% в популяционной группе (например, выделенной по полу и возрасту), к которой относится пациент [1]. Кроме этого, рекомендовано учитывать индивидуальную историю применения макролидных антибиотиков, потому что такой анамнез повышает вероятность обнаружить устойчивость к кларитромицину [17].
pylori у больного к кларитромицину. Другие факторы, которые могут повлиять на показатели эффективности лечения, включают приверженность терапии (соблюдение пациентом назначений), повышенную массу тела, генотип H. pylori, уровень бактериальной нагрузки, кислотность желудочного сока и наличие у пациента атрофического гастрита. Некоторые авторы предлагают в регионах, где высока встречаемость резистентности к кларитромицину, избегать стандартного протокола (включающего кларитромицин) для проведения терапии первой линии [16, 36]. В соответствии с Маастрихтским консенсусом рекомендуется тестирование чувствительности до назначения лечения в регионах, где уровень резистентности превышает 20% в популяционной группе (например, выделенной по полу и возрасту), к которой относится пациент [1]. Кроме этого, рекомендовано учитывать индивидуальную историю применения макролидных антибиотиков, потому что такой анамнез повышает вероятность обнаружить устойчивость к кларитромицину [17]. Европейские рекомендации предусматривают назначение тройной терапии с 7-дневным курсом в районах, где встречаемость устойчивости к кларитромицину 20% [1].
 Рандомизированное исследование, проведенное Paoluzi et al., посвящено сравнению частоты эрадикации H. pylori в группах пациентов, получавших стандартную тройную терапию (амоксициллин, кларитромицин и омепразол) в течение 7 или 14 дней. Уровень резистентности в обеих группах в данном исследовании не определяли и не сравнивали, однако результаты показали, что 14-дневный курс приводит к лучшим результатам по эрадикации по сравнению с 7-дневным (77% против 66%).
Рандомизированное исследование, проведенное Paoluzi et al., посвящено сравнению частоты эрадикации H. pylori в группах пациентов, получавших стандартную тройную терапию (амоксициллин, кларитромицин и омепразол) в течение 7 или 14 дней. Уровень резистентности в обеих группах в данном исследовании не определяли и не сравнивали, однако результаты показали, что 14-дневный курс приводит к лучшим результатам по эрадикации по сравнению с 7-дневным (77% против 66%).4-компонентная терапия, включающая соли висмута
4-компонентная терапия включает ИПП, препараты висмута и 2 антибиотика (обычно 2 из следующего перечня: тетрациклин, кларитромицин и метронидазол) [1]. Эффективность данного протокола в качестве терапии первой линии была проверена в регионах с высоким уровнем резистентности к кларитромицину или метронидазолу, а также в группах пациентов с историей недавнего или многократного предшествующего лечения указанными антибиотиками [1]. Основным преимуществом этой схемы является то, что она позволяет преодолеть устойчивость к кларитромицину или метронидазолу, и с этой целью данный протокол предусматривает одновременное применение кларитромицина и метронидазола. Метаанализ, выполненный Fisch и Evans, показал лучшую эффективность 4-компонентной терапии по сравнению со стандартной тройной терапией в регионах с повышенной частотой встречаемости резистентности к кларитромицину или метронидазолу.
Метаанализ, выполненный Fisch и Evans, показал лучшую эффективность 4-компонентной терапии по сравнению со стандартной тройной терапией в регионах с повышенной частотой встречаемости резистентности к кларитромицину или метронидазолу.Доксициклин или амоксициллин можно применять как замену для тетрациклина и солей висмута в регионах, где последние препараты недоступны. Однако данные об эффективности такой замены неоднозначны [37]. При назначении 4-компонентной терапии следует учитывать пониженную приверженность лечению у пациентов в связи с увеличением количества наименований препаратов и более частым приемом.
Последовательная терапия
Последовательная терапия была впервые проведена по протоколу, описанному Zullo et al., она состоит из 10-дневного лечения, включающего 5 дней комбинации ИПП + амоксициллин, затем 5 дней тройной терапии сочетанием ИПП + кларитромицин + метронидазол [1]. Левофлоксацин может быть использован у пациентов с аллергией на пенициллины или в районах с высоким уровнем резистентности к кларитромицину. Хотя последовательная терапия включает кларитромицин, она считается альтернативой стандартной тройной терапии, пригодной для использования в местностях с высокой встречаемостью устойчивости к кларитромицину [1]. Этот терапевтический режим использует назначение амоксициллина перед применением кларитромицина с целью преодоления устойчивости к кларитромицину. Амоксициллин разрушает клеточные стенки H. pylori и препятствует работе мембранных каналов экспорта кларитромицина из бактериальной клетки (один из механизмов устойчивости данной бактерии). Недостатком этой схемы терапии является ее сложность в отношении режима приема препаратов, которая снижает приверженность [16]. Если пациент не соблюдает протокол лечения, есть вероятность развития множественной лекарственной устойчивости. Последовательная терапия использует основные антибиотики, эффективные против H. pylori, и это означает, что неуспех последовательной терапии ограничивает возможности терапии второй линии.
Хотя последовательная терапия включает кларитромицин, она считается альтернативой стандартной тройной терапии, пригодной для использования в местностях с высокой встречаемостью устойчивости к кларитромицину [1]. Этот терапевтический режим использует назначение амоксициллина перед применением кларитромицина с целью преодоления устойчивости к кларитромицину. Амоксициллин разрушает клеточные стенки H. pylori и препятствует работе мембранных каналов экспорта кларитромицина из бактериальной клетки (один из механизмов устойчивости данной бактерии). Недостатком этой схемы терапии является ее сложность в отношении режима приема препаратов, которая снижает приверженность [16]. Если пациент не соблюдает протокол лечения, есть вероятность развития множественной лекарственной устойчивости. Последовательная терапия использует основные антибиотики, эффективные против H. pylori, и это означает, что неуспех последовательной терапии ограничивает возможности терапии второй линии.Сопутствующая терапия
Сопутствующая терапия представляет собой назначение курса лечения с использованием ИПП, кларитромицина, амоксициллина и метронидазола в течение по крайней мере 10 дней. В рандомизированных клинических испытаниях сопутствующая терапия превзошла по эффективности стандартную тройную терапию [38]. Метаанализ данных, полученных в Японии, Великобритании, Германии, Испании и Италии, показал уровень эрадикации >90%. Исследование в Тайване сравнило эффективность сопутствующей терапии и последовательной терапии с эффективностью использования одного и того же сочетания препаратов: ИПП, левофлоксацина, амоксициллина и метронидазола. Распространенность резистентности в группе больных до начала лечения была следующей: резистентность к левофлоксацину — 10,2%, к амоксициллину — 0,6%, к кларитромицину — 6,6% и к метронидазолу — 33,5%. Эффективность эрадикации с использованием 2-х терапевтических схем оказалась сравнимой: 92,2% для сопутствующей терапии и 93,3% для последовательной терапии [39].Теоретически преимуществом сопутствующей терапии может быть эффективность против штаммов с множественной лекарственной устойчивостью [40], однако на практике встречаемость даже двойной устойчивости (устойчивости клинических изолятов H. pylori одновременно к 2 антибиотикам разных классов) не изучена.
Гибридная терапия (последовательно-сопутствующая)
В одной из работ предложена гибридная терапевтическая схема, которая представляет собой комбинацию ступенчатой и сопутствующей терапии [41]. Гибридная схема включает первоначальный курс ИПП + амоксициллин в течение 7 дней, после которого назначается 4-компонентная терапия сочетанием ИПП, амоксициллина, метронидазола и кларитромицина в течение 7 дней. Частота эрадикации была отличная — 99% (!), причем отмечена эрадикация штаммов с двойной устойчивостью (к кларитромицину и метронидазолу) [42]. Авторы указанного исследования предполагают, что высокая эффективность гибридной терапии связана с более длительным приемом амоксициллина (в течение 14 дней) по сравнению с последовательной или сопутствующей терапевтическими схемами. Действительно, одно рандомизированное клиническое испытание показало, что гибридная терапия эквивалентна по уровням эрадикации удлиненному (14-дневному) курсу сопутствующей терапии [43].Терапия второй линии на основе хинолонов
В случаях, когда не удается эрадицировать H. pylori с использованием стандартной тройной терапии, предложено использовать терапию второй линии (salvage therapy): ИПП + левофлоксацин + амоксициллин в течение 10 дней [44]. Ряд исследований в Европе и Тайване продемонстрировал варьирующие конечные (после прохождения терапии первой и второй линии) уровни эрадикации (65–96%) что, вероятно, отражает различную встречаемость устойчивости к левофлоксацину в разных географических регионах [44].Другой режим терапии второй линии (так называемый LOAD (от Levofloxacin, Omeprazole, Nitazoxanide, Doxycycline)) включает прием комбинации левофлоксацина, омепразола, нитазоксанида и доксициклина в течение 7 или 10 дней. Исследование эффективности лечения когорты из 653 пациентов показало, что применение схемы LOAD привело к более высоким конечным уровням эрадикации (90%) по сравнению с таковым при применении стандартной тройной терапии (73%), независимо от продолжительности курса [45]. Кроме этого, данное исследование показало, что у пациентов на фоне LOAD-терапии статистически значимо реже наблюдались рецидивы в течение 1-летнего периода наблюдения [45].
Терапия третьей линии: левофлоксацин, рифабутин, фуразолидон
Для пациентов, у которых не произошло эрадикации возбудителя после курсов терапии первой и второй линии, предлагается использование левофлоксацина. В одном исследовании в качестве терапии третьей линии предложено использование левофлоксацина в сочетании с рабепразолом, субцитратом висмута и амоксициллином. В данном исследовании, несмотря на наличие множественной лекарственной устойчивости, 10-дневный курс лечения привел к конечному уровню эрадикации в 84%. При этом в подгруппе пациентов, у которых была обнаружена резистентность возбудителя к амоксициллину или левофлоксацину, конечный уровень эрадикации был ниже.Выбор терапии с использованием хинолонов должен быть основан на результатах испытаний антибиотикочувствительности или хотя бы на данных о встречаемости резистентности в данном географическом регионе. Частота встречаемости резистентности к хинолонам возрастает по мере роста использования хинолонов для лечения инфекций дыхательных и мочеполовых путей [1]. Таким образом, описанный режим лечения на основе хинолонов не рекомендуется в качестве первой линии терапии. Иногда этот режим используется в качестве терапии второй линии в популяциях, где уровень устойчивости к кларитромицину >15–20%, к хинолонам
Терапия на основе рифабутина
На основании результатов исследований in vitro была предложена стратегия терапии на основе рифабутина (антибиотик, изначально нашедший терапевтическое применение для лечения туберкулеза), которая включает курс сочетанием ИПП + амоксициллин + рифабутин. Оптимальная продолжительность лечения по указанному протоколу не ясна (предложены курсы 7, 10 или 14 дней). Важным, но не частым осложнением при применении рифабутина является миелотоксичность [46]. В связи с потенциалом развития резистентности к рифабутину у возбудителя туберкулеза, циркулирующего в человеческой популяции, применение рифабутина не должно быть рутинным, вышеуказанная терапевтическая схема предложена только как терапия третьей линии. Кроме того, данная терапевтическая схема рекомендована для использования в случаях, когда невозможно использовать соли висмута и тетрациклин [1, 46].Терапия на основе фуразолидона
Схема с применением фуразолидона включает недельный курс терапии сочетанием лансопразола, висмута трикалия дицитрата, тетрациклина и фуразолидона. Данная схема используется в случае неуспеха терапии второй линии. Конечная эффективность эрадикации достигает 90%. Проблемами, возникающими при применении этой схемы, являются высокая частота побочных эффектов и влияние существующей в популяции патогена перекрестной резистентности с метронидазолом.Двухкомпонентная терапия высокими дозами
Двухкомпонентная терапия высокими дозами была использована в регионах с высокой частотой встречаемости резистентности к кларитромицину. Эта схема включает применение ИПП и амоксициллина 3 р./сут в течение 14 дней [47]. Уровень эрадикации составил 78,4%, что несущественно ниже эффективности стандартной тройной терапии.Заключение
Инфекция H. pylori повсеместно распространена в мире, однако встречаемость устойчивости к антибиотикам у изолятов H. pylori сильно варьирует между географическими регионами и, по имеющимся данным, имеет тенденцию к росту. Во многих странах встречаемость устойчивости H. pylori к антибиотикам перешагнула порог в 15–20%. В течение последних 20 лет эффективность эрадикации в ходе терапии упала ниже уровня 80–90%. Важнейшими причинами неуспеха терапии являются устойчивость к антибиотикам и несоблюдение режима приема препаратов из-за недостаточной приверженности пациентов лечению. Распространение резистентности у микроорганизмов коррелирует с объемом потребления антибиотиков, что показано и на примере хеликобактерной инфекции. С течением времени растет необходимость определения антибиотикорезистентности перед назначением терапии. По всей видимости, в будущем следует ожидать изменения парадигмы терапии — перехода от стандартной схемы лечения к индивидуально подобранной терапии..
|
Введение В начале 80-х годов Warren и Marshall изолировали бактерию из желудка пациента с хронической диспепсией и антрум-гастритом. Вскоре после того, как один из исследователей проглотил культуру этой высеянной бактерии, у него самого появились жалобы на диспепсию и гистологически доказанный антрум-гастрит. Таким образом был выполнен один из постулатов Коха и показана причинная связь между этой инфекцией и гастритом. Высеянная бактерия была таксономически отнесена к виду Campylobacter и изначально называлась C.pyloridis, а позже получила название Helicobacter pylori. Распространенность инфекции H.pylori На Западе 30 – 50% взрослого населения инфицированы H.pylori. Однако распространенность инфекции, по-видимому, снижается, с одной стороны, благодаря радикальному медикаментозному лечению, с другой – в связи с феноменом возрастных групп. Этот феномен заключается в том, что имеется явно повышенная распространенность инфекции Н. рylori у пациентов, которым сейчас 50 – 55 лет, даже если принимать во внимание постепенное увеличение распространенности инфекции как следствие большей возможности контакта с возрастом. Люди этой возрастной группы родились во время войны и подвергались воздействию бактерии в большей степени, вероятно, из-за худших гигиенических и социально-экономических условий. Картины болезней, ассоциированных с инфекцией H.pylori Спектр картин болезней, ассоциированных с инфекцией Н. pylori, весьма широк. Хронический активный гастрит с мононуклеарным инфильтратом патогномоничен для этой инфекции. Инфекция в 5 – 20% случаев проявляется как язва двенадцатиперстной кишки, в отношении которой теперь установлено, что связь с H.pylori имеется в 95 – 100% случаев, если не считать тех, когда развитие язвы связано с приемом нестероидных противовоспалительных препаратов (НСПВП) или ацетилсалициловой кислоты. Обзор 30 исследований показывает, что средняя частота рецидива (в течение 1 – 2 лет) язвы двенадцатиперстной кишки составляет 63% у пациентов с персистирующей инфекцией H.pylori, тогда как после ликвидации инфекции – только 3%. Диагностика инфекции H.pylori Золотым стандартом для выявления инфекции H.pylori являются посев и гистологическое исследование биоптатов желудка. При одновременном назначении ингибиторов протонного насоса рекомендуется брать биоптаты как из преддверия, так и из тела желудка. Важным дополнительным преимуществом этого метода является то, что одновременно могут быть диагностированы язва и(или) другие патологические отклонения. Благодаря этому возможно адекватное лечение. Кроме того, могут быть получена антибиотикограмма и осуществлен направленный выбор антибиотика. Ликвидация H.pylori Хотя H.pylori чувствительна in vitro ко многим антибиотикам, попытки ликвидации in vivo часто терпят неудачу. H. pylori находятся в слизистой и под ней, и антибиотики не достигают микроорганизма или их концентрация оказывается недостаточной. В кислой среде желудка происходит быстрая денатурация чувствительных к кислоте антибиотиков. Биологическая доступность частично определяется тем, что некоторые антибиотики оказывают локальное действие в желудке, тогда как другие действуют системно и иногда после резорбции активно выделяются в просвет желудка. Тройная терапия препаратами висмута Тройная терапия висмутом – первая ликвидационная терапия, которая оказалась успешной в среднем у 80% пациентов. Эта схема лечения включает коллоидный оксид висмута (120 мг 4 раза в день), тетрациклин (250 – 500 мг 4 раза в день) и метронидазол (200 – 500мг 3 раза в день) на протяжении 1 – 2 нед. Средний уровень ликвидации инфекции составляет 88% при недельном курсе и 89% при 2-недельном курсе (по данным исследований как с метронидазолустойчивой, так и с метронидазолчувствительной H.pylori; см. таблицу). При замене тетрациклина амоксициллином (1500 – 2000 мг/сут) эффективность снижается до 78 и 83% после соответственно 1 и 2 нед лечения. У 30 – 50% пациентов наблюдаются те или иные побочные явления, однако это приводит к преждевременному прекращению лечения менее чем в 5% случаев. Побочные явления менее выражены, если доза компонентов уменьшается, увеличивается кратность приема и общая длительность лечения не превышает 1 нед. Существенным недостатком этой схемы лечения является снижение эффективности при наличии устойчивой к метронидазолу H.pylori (в среднем с 89 до 38%). Для крупных городов и многих регионов третьего мира, где резистентность к метронидазолу встречается часто, это большой недостаток. Лечение антиацидотическими средствами и антибиотиками Защитное воздействие антиацидотического лечения на чувствительные к кислоте антибиотики, такие как амоксициллин, позволяет комбинировать ингибиторы протонного насоса или блокаторы Н2-рецепторов в схемах ликвидационного лечения. Дополнительным преимуществом подобной комбинации является быстрое уменьшение жалоб при пептической язвенной болезни. Вывод В настоящее время лечение, направленное на ликвидацию Н. pylori, показано только пациентам с явзвенной болезнью, связанной с инфекцией H.pylori. До настоящего времени не получено подтверждения, что ликвидация H.pylori уменьшает жалобы при функциональной диспепсии. В будущем станет ясно, следует ли проводить лечение, направленное на ликвидацию H.pylori, с целью предотвращения карциномы желудка и MALT-лимфомы. Идеальная антихеликобактерная терапия проста, дешева и эффективна как минимум у 70% пролеченных пациентов при отсутствии существенных побочных реакций или развития резистентности. Нецелесообразно применять двойную терапию с использованием ингибиторов протонного насоса в связи с ее низкой эффективностью. Если известен первичный характер резистентности H.pylori, то может проводиться направленное антибактериальное лечение. При отсутствии антибиотикограммы можно ориентироваться на показатель встречаемости резистентности к метронидазолу и кларитромицину у населения данного региона. В регионах, где встречаемость резистентности к метронидазолу ниже 20%, можно выбирать между тройной терапией висмутом, тройной терапией с применением ингибиторов протонного насоса и терапией четырьмя медикаментами. Если частота резистентности к метронидазолу превышает 20%, то выбирают между тройной терапией с ингибиторами протонного насоса без метронидазола и терапией четырьмя препаратами. В регионах с высокой устойчивостью к кларитромицину могут назначаться тройная терапия висмутом, тройная терапия с ингибиторами протонного насоса без кларитромицина или терапия четырьмя препаратами. При высокой встречаемости резистентности как к кларитромицину, так и к метронидазолу терапией выбора должна быть схема с применением четырех медикаментов. Взято из Ned Tijdschr Geneeskd 1996;140(18):967-70 с разрешения главной редакции и авторов. Литература: 1. Warren JR, Marshall BJ. Unidentified curved bacilli on gastric epithelium in active chronic gastritis [letter]. Lancet 1983;1:1273-5. 2. Marshall BJ, Armstrong JA, McGechie DB, Clancy RJ. Attempt to fulfil Koch’s postulates for pyloric Campylobacter. Med J Aust 1985;142:436-9. 3. Varshall BJ. Helicobacter pylori. Am J Gastroenterol 1994;89 Suppl: II 6-28. 4. Kuipers EJ, PeЦa AS, Kamp G van, Uyterlind AV, Pals NFM, Kurz-Pohlman E, et al. Seroconversion for Helicobacter pylori. Lancet 1993;342:328-31. 5. Webb PM, Knight T, Greaves S, Wilson A, Newell DG, Elder J, et al. Relation between infection with Helicobacter pylori and living conditions in childhood: evidence for person transmission in early life. BMJ 1994;308:750-3. 6. Pounder RE, N g D. The prevalence of Helicobacter pylori infection in different countries. Aliment Pharmacol Ther 1995;Suppl:33-9. 7. Rauws EAJ, Langenberg W, Houthoff HJ, Zanen HC, Tytgat GNJ. Campylobacter pyloridis-associated chronic antral gastritis. A prospective study of its prevalence and the effects of antibacterial and antiulcer treatment. Gastroenterol 1988;94:33-40. 8. Hulst RWM van der, Tytgat GNJ, Helicobacter pylori and peptic ulcer disease. Scand J Gastroenterol [ter perse]. 9. NIH Consensus Conference. Helicobacter pylori in peptic ulcer disease. JAMA 1994;272:65-9. 10. Tally NJ. A critique of therapeutic trials in Helicobacter pylori-positive functional dyspepsia. Gastroenterology 1994;106:1174-83. 11. Parsonnet J, Friedman GD, Vandersteen DP, Chang Y, Vogelman JH, Orentreich N, et al. Helicobacter pylori infection and the risk of gastric carcinoma. N Engl J Med 1991;325:1127-31. 12. Parsonnet J, Hansen S, Rodriguez L, Gelb AB, Warnke RA, Jellum E, et al. Heliobacter pylori infection and gastric lymphoma. N Engl J Med 1994;330:1267-71. 13. Kuipers EJ, Uyterlinde AM, PeЦa AS, Roosendaal R. Pals G. Nelis GF, et al. Long-term sequelae of Helicobacter pylori gastritis. Lancet 1995;345:1525-28. 14. Bayerdorffer E, Neubauer A, Rudolph B, Thiede C, Lehn N. Eidt S, et al. Regression of primary gastric lymphoma of mucosa-associated lymphoid tissue type after cure of Helicobacter pylori infection. Lancet 1995;345:1591-4. 15. Chiba N, Rao BV, Rademaker JW, Hunt RH. Meta-analysis of the efficacy of antibiotic therapy in eradicating Helicobacter pylori. Am J Gastroenterol 1992;87:1716-27. 16. Hulst RWM van der, Keller JJ, Rauws EAJ, Tytgat GNJ. Treatment of Helicobacter pylori infection. Review of the world literature. Helicobacter 1996;1:6-19. 17. Borody TJ, Brandl S, Andrews P, Ferch N, Jankiewicz E, Hyland L. Use of high efficacy, lower dose triple therapy to reduce side effects of eradicating Helicobacter pylori. Am J Gastroenterol 1994;89:33-8. 18. Noach LA, Langenberg WL, Bertola MA, Dankert J, Tytgat GNJ. Impact of metronidazole resistance on the eradication of Helicobacter pylori. Scand J Infect Dis 1994;26:321-7. 19. Axon ATR. The role of acid inhibition in the treatment of Helicobacter pylori infection. Scand J Gastroenterol 1994;29 Suppl 201;16-23. 20. Labenz J, Gyenes E, Ruhl GH, Borsch G. Amoxicillin plus omeprazole versus triple therapy for eradication of Helicobacter pylori in duodenal ulcer disease: a prospective, randomized, and controlled study. Gut 1993;34:1167-70. 21. Bayerdorffer E, Miehlke S, Mannes GA, Sommer A, Hochter W, Weingart J, et al. Double-blind trial of omeprazole and amoxicillin to cure Helicobacter pylori infection in patients with duodenal ulcers. Gastroenterology 1995;108:1412-7. 22. Hulst RWM van der, Weel JFL, Verheul SB, Keller JJ, Kate FJW ten, Ende AE van der, et al. Treatment of Helicobacter pylori infection with low or high dose omeprazole combined with amoxicillin and the effect of early retreatment: a prospective randomized double-blind study. Aliment Ther Pharmacol 1996;10:165-71. 23. Cayla R, Zerbib F, Megraud F, Lamouliatte H. Clarithromycin resistance of Helicobacter pylori strains before and after treatment: a key factor of treatment failures [abstract]. Gastroenterol 1995;108:68. 24. Hentschel E, BrandstКtter G, Dragosics B, Hirschl AM, Nemec H, Schutze K, et al. Effect of ranitidine and amoxicillin plus metronidazole on the eradication of Helicobacter pylori and the recurrence of duodenal ulcer. N Engl J Med 1993;328:308-12. 25. Bazzoli F, Zagari RM, Fossi S, Pozzato P, Alampi G, Simoni P, et al. Short term low-dose triple therapy for the eradication of Helicobacter pylori. Eur J Gastroenterol Hepatol 1994;6:773-7. 26. Moayyedi P, Sahay P, Tompkins DS, A[on ATR. Efficacy and optimum dose of omeprazole in a new 1-week triple therapy regimen to eradicate Helicobacter pylori. Eur J Gastroenterol Hepatol 1995;7:835-40. 27. Boer W de, Driessen W, Jansz A, Tytgat G. Effect of acid suppression on efficacy of treatment for Helicobacter pylori infection. Lancet 1995;345:817-20. | ||||
| Схема лечения | Длительность, нед | Число исследований | Число пациентов | Средний уровень ликвидации, % (95 % интервал достоверности) |
| В – Т – М | 1 | 13 | 826 | 87,9 (85,7 – 90,1) |
| В – Т – М | 2 | 25 | 2291 | 89,2 (87,9 – 90,4) |
| В – А – М | 1 | 13 | 755 | 78,0 (75,1 – 81,0) |
| В – А – М | 2 | 12 | 570 | 83,0 (79,9 – 86,1) |
| О (1 раз в день) – А | 2 | 34 | 1260 | 54,8 (52,1 – 57,6) |
| О (2 раза в день) – А | 2 | 53 | 2275 | 61,9 (59,9 – 63,9) |
| О (1 раз в день) – К | 2 | 16 | 467 | 66,8 (62,5 – 71,1) |
| О (2 раза в день) – К | 2 | 14 | 411 | 74,7 (70,5 – 78,9) |
| О – К – М | 1-2 | 21 | 1119 | 88,7 (86,8 – 90,5) |
| О – К – А | 1-2 | 14 | 651 | 88,0 (85,5 – 90,5) |
| О – А – М | 1-2 | 14 | 621 | 79,7 (76,5 – 82,9) |
| О – В – Т – М | 1-2 | 8 | 412 | 96,4 (94,1 – 97,9) |
| Примечание. В – оксид висмута; Т – тетрациклин; М – метронидазол; А – амоксициллин; О – омепразол; К – кларитромицин. | ||||
.
Прием N-ацетилцистеина с антибиотиками для лечения инфекции Helicobacter pylori
Вопрос обзора
Безопасно ли добавление N-ацетилцистеина к антибиотикам и улучшает ли показатели излечения инфекции Helicobacter pylori?
Актуальность
Helicobacter pylori (H pylori) – это бактерия, которая живет в желудке и может вызывать ряд заболеваний, таких как рак желудка, язвенная болезнь и другие. Колонизация происходит примерно у половины населения мира и чаще встречается в странах с плохими санитарными условиями. Люди заражаются при употреблении загрязненной воды.
Инфекция лечится с помощью антибиотиков и лекарств, которые снижают выработку кислоты в желудке. Однако устойчивость к антибиотикам во всем мире растет, что снижает показатели излечения даже при использовании лекарств. Для улучшения показателей излечения проходят испытания новые лекарства. Одно из таких лекарств – N-ацетилцистеин (NAC). NAC – это препарат, который помогает растворить слизь при заболеваниях дыхательных путей. NAC можно принимать перорально или вводить внутривенно. NAC может нарушить некоторые механизмы выживания H pylori и улучшить показатели излечения.
Характеристика исследований
Мы включили 8 исследований (рандомизированные контролируемые испытания (РКИ)) с участием 559 человек в возрасте от 17 до 76 лет. Доказательства актуальны на апрель 2018 года. Во всех исследованиях участвовали амбулаторные пациенты из центров эндоскопии (центров, которые специализируются на обследовании с использованием гибкой трубки с камерой, вводимой в желудок) в нескольких странах. Испытуемые комбинации антибиотиков во включенных исследованиях сильно отличались, как и дозы NAC (от 600 до 1 800 мг в день). NAC сравнивали с плацебо (фиктивной таблеткой) или отсутствием лечения.
Основные результаты
Мы не уверены, улучшает ли добавление NAC к антибиотикам показатели излечения инфекции H. pylori по сравнению с добавлением плацебо или отсутствием NAC. Любой возможный полезный эффект NAC следует рассматривать с осторожностью, поскольку включенные исследования были очень разными и имели низкую степень достоверности и недостатки, которые могли повлиять на их результаты и, следовательно, результаты обзора.
Мы не уверены, связан ли прием NAC с более высоким риском желудочно-кишечных или аллергических неблагоприятных событий в сравнении с плацебо или отсутствием NAC. О токсических неблагоприятных событиях во включенных исследованиях не сообщали.
Необходимы крупные рандомизированные клинические исследования с надлежащими дизайном, сбором данных по эффективности и безопасности и сообщением результатов, особенно в отношении рекомендуемых комбинаций антибиотиков.
Качество доказательств
Общая уверенность в доказательствах относительно показателей эрадикации варьировала от очень низкой до низкой. В пяти исследованиях были представлены сведения о неблагоприятных событиях (побочных эффектах), но уверенность в доказательствах была очень низкой. Включенные исследования были плохо проведены, и это уменьшило нашу уверенность в результатах.
Бактерия хеликобактер пилори: средства, препараты и лекарства
Причины развития язвы желудка и двенадцатиперстной кишки долгое время оставались для ученых загадкой. Но в 1979 году был обнаружен основной подозреваемый — бактерия хеликобактер пилори, живущая в желудочно-кишечном тракте. Она может существовать там на протяжении долгого времени, не причиняя вреда здоровью, но при благоприятных — для бактерии — обстоятельствах она начинает активно размножаться и повреждать слизистые оболочки.
Бактерия хеликобактер пилори — опасный враг ЖКТ
Широко распространенный и опасный микроорганизм — бактерия хеликобактер пилори (Helicobacter pylori), которая в большинстве случаев становится причиной язвы желудка и двенадцатиперстной кишки. Ей не страшна соляная кислота, содержащаяся в желудочном соке. Бактерия может годами жить в этой среде и разрушать слизистые оболочки, провоцируя развитие гастрита, гастродуоденита, язвенной болезни желудка и двенадцатиперстной кишки. При запущенной язве не исключено и развитие онкологии.
Заражение хеликобактер пилори обычно происходит при контакте, чаще всего, через слюну. Однако получить инфекцию можно также с загрязненной едой или водой. Заражение данной бактерией воздушно-капельным путем невозможно. Поскольку хеликобактер пилори передается преимущественно контактно-бытовым путем, врачи называют ее «семейным» микробом: если у одного из домочадцев обнаружена эта бактерия, то она, скорее всего, есть и у остальных — вероятность этого составляет 95%.
По некоторым данным, число инфицированных достигает 60%, однако далеко не в каждом случае антибактериальная терапия действительно необходима. Чаще всего концентрация бактерии мала и не может нанести вреда здоровью. Наша иммунная система держит количество бактерий под контролем, однако иногда защита ослабевает — к этому могут привести физическое и нервное перенапряжение, инфекционные болезни, вредные привычки и неправильный образ жизни. Тогда хеликобактер пилори активизируется и начинает интенсивно размножаться. Это случается примерно в 15% всех случаев заражения хеликобактер пилори. Ослабить защиту может и нездоровое питание — кислая или острая еда, маринады и копчености, которые раздражают желудочную оболочку, открывая доступ бактериям. К такому же исходу может привести и нарушение режима питания — вопреки рекомендациям врачей, советующих есть часто и понемногу, большинство горожан питается, в лучшем случае, дважды в день или перебивается фаст-фудом: выпечкой, снеками и разной другой сухомяткой.
Как правило, на начальной стадии развивается гастрит, затем — язва, а без должного лечения нужно быть готовым к крайне тяжелым последствиям — прободению язвы, кровотечениям и возникновению онкологической патологии. Кроме того, в таком случае определенные структурные изменения возможны не только в ЖКТ, но и в печени и поджелудочной железе.
Интересный факт
В 1970-х считалось, что гастрит и язву желудка вызывают стрессы и несбалансированный рацион. Один из первооткрывателей хеликобактер пилори, австралийский ученый Барри Маршалл, был уверен, что именно эта бактерия, а вовсе не чипсы с газировкой, провоцируют патологии. Чтобы доказать свою правоту, он, будучи совершенно здоровым, выпил концентрат культуры хеликобактер пилори. Уже через несколько дней у него возникли признаки гастрита. Страдания были не напрасны — за научную работу о Helicobacter pylori Маршалл и его коллеги получили в 2005 году Нобелевскую премию.
При гастрите, гастродуодените и язвенной болезни врач обязательно направит вас на анализы. Цель исследований — найти виновника, то есть бактерию хеликобактер пилори, а также оценить ущерб, причиненный инфекцией. Для этого делают общий и биохимический анализ крови, анализ желудочного сока, биопсию, а также высокоточный ПЦР-анализ, который позволяет найти ДНК хеликобактер пилори даже в том случае, если ее концентрация невелика.
Лекарства от инфекций, вызванных бактерией хеликобактер
За последние 30 лет было разработано несколько эффективных методик уничтожения хеликобактер пилори. В 2005 году в Нидерландах состоялся всемирный консенсус гастроэнтерологов, на котором были разработаны и утверждены протоколы лечения болезней, спровоцированных Helicobacter pylori. Эти схемы дают положительный эффект в 80% случаев, а частота возникновения побочных эффектов не превышает 15%.
Обычно лечение занимает 14 дней и основывается на лекарственных средствах. Однако чтобы терапия была эффективной, необходимо также изменить образ жизни и придерживаться определенной диеты.
На заметку
Многие проблемы с кожей — акне, атопический дерматит, псориаз — могут быть связаны с деятельностью Helicobacter pylori. Абсолютно точных данных у ученых пока нет, однако уже сейчас очевидно, что эти патологии у инфицированных хеликобактер встречаются чаще.
Как уничтожить бактерию хеликобактер пилори? Лечение состоит из трех этапов. Первая линия препаратов для борьбы с этой бактерией зачастую приносит ожидаемый эффект, но если она оказывается недостаточно эффективной, врачи назначают вторую линию препаратов. Если же и вторая линия не справилась с бактерией, то используются средства третьей линии.
Препараты эрадикации первой линииЭту схему лечения называют трехкомпонентной, поскольку в ней используется сочетание трех лекарств. Она состоит из антибиотиков кларитромицина и амоксициллина, убивающих бактерии, и ингибиторов протонной помпы (действующее вещество омепразол и т.д.) — препаратов, регулирующих кислотность. Благодаря применению ингибиторов протонной помпы пациент избавляется от многих проявлений гастрита и язвенной болезни, кроме того, он может придерживаться менее строгой диеты во время лечения — хотя, конечно, питание все равно должно быть здоровым и сбалансированным. В некоторых случаях препараты на основе амоксициллина меняют на другое антибактериальное средство — метронидазол или нифурател.
Иногда врач может добавить и четвертый компонент — препараты висмута, оказывающие гастропротекторное, противовоспалительное и вяжущее воздействие, однако обычно такие средства назначают на втором этапе. Тем не менее данные препараты оказывают положительное влияние на течение болезни: они образуют на внутренних стенках желудка своеобразную пленку, благодаря чему притупляется болевой синдром и снимается воспалительный процесс.
Для пациентов пожилого возраста используется более мягкая схема, которая включает в себя только один антибиотик (амоксициллин), препараты висмута и ингибиторы протонной помпы.
Стандартная продолжительность первого этапа — одна неделя. При недостаточной эффективности курс может быть продлен до 2 недель, но не более. Примерно для 90–95% пациентов такая терапия оказывается действенной и второй этап не требуется вообще. Однако если к окончанию первого этапа не все бактерии погибли, схема лечения требует преобразования.
Препараты эрадикации второй линииСхему лечения второго этапа называют четырехкомпонентной. Она включает в себя один ингибитор протонной помпы, препарат висмута и два антибиотика, взаимно усиливающие действие друг друга. Как правило, используются средства с действующими веществами тетрациклин и метронидазол, если они не применялись на первом этапе. Обычно выбирают такие антибиотики, которые еще не использовались в лечении, поскольку если бактерия хеликобактер пилори пережила первое воздействие определенных антибактериальных средств, то очевидно, что данный штамм к ним нечувствителен.
Второй вариант этой терапии состоит из препаратов на основе амоксициллина, антибиотика из группы нитрофуранов, ингибитора протонной помпы и препарата висмута. На этом этапе их очень часто включают в схему лечения.
Средства с трикалия дицитратом висмута оказывают бактерицидное действие, стимулируют цитопротекторные механизмы, повышают устойчивость слизистой оболочки к вредным воздействиям. Препараты восстанавливают защитные функции желудка и могут предотвратить рецидивы болезни.
Чтобы не снижать эффективность действующего вещества, рекомендуется во время приема средств на основе висмута отказаться от употребления в пищу фруктов, соков и молока.
Продолжительность терапии составляет от 10 до 14 дней.
Препараты эрадикации третьей линииВ очень редких случаях положительного эффекта не удается добиться и после применения препаратов второй линии. Тогда проводятся тесты, которые определяют чувствительность бактерий к различным типам антибиотиков, и в схему включаются самые эффективные антибактериальные препараты. В целом же этот этап мало отличается от второго — назначаются ингибиторы протонной помпы, препараты висмута и два антибиотика, показавшие во время лабораторных исследований наибольшую эффективность.
Лекарства на основе висмута на этом этапе также играют важную роль, поскольку они обеспечивают комплексное лечение. Препараты с действующим веществом трикалия дицитрат висмута не только эффективно снимают неприятные симптомы болезни (изжогу, боль, вздутие), но и оказывают местное бактерицидное действие в отношении Helicobacter pylori, помогают активизировать регенерацию поврежденных клеток стенок желудка. Поэтому роль таких средств в эффективном лечении и уничтожении бактерии Helicobacter pylori трудно переоценить.
Следует отметить, что не всегда бактерия хеликобактер пилори является причиной язвы, к ней может привести и постоянное раздражение слизистой оболочки желудка некоторыми медикаментами (например, средствами с действующими веществами ацетилсалициловая кислота и ибупрофен, которые часто принимаются без рекомендации врача). Травмы желудка и некоторые хронические болезни (диабет, гепатит, туберкулез) также могут привести к подобным изменениям. Но в 75% случаев язва и гастрит — «дело рук» хеликобактер пилори. Чтобы обезопасить себя от заражения, нужно строго следовать правилам личной гигиены — не употреблять в пищу немытые фрукты и овощи, ни с кем не делить посуду, мыть руки перед едой, не доедать ничего из чужих тарелок. Впрочем, заражение все равно вероятно — для передачи инфекции достаточно одного поцелуя.
Не стоит давать вредоносной бактерии шанс. Если вы не уверены, инфицированы ли вы, пройдите лабораторное исследование, например, ПЦР-тест на хеликобактер пилори. Даже если бактерия обнаружится, это еще не значит, что вам необходимо лечение. Хеликобактер не всегда является причиной гастрита, но присутствует в организме у каждого. Как было сказано выше, здоровая иммунная система может контролировать концентрацию этой бактерии. Для профилактики развития заболеваний, связанных с хеликобактер, нужно придерживаться здоровой диеты, исключающей все, что может раздражать слизистую желудка — маринады, специи и острые приправы, жареное, алкоголь, кофе и газированные напитки, кислые овощи и фрукты. Но если все-таки диагностирован гастрит, вне зависимости от причины его возникновения обязательно следует защищать желудок, и лучше всех с этим справляются препараты висмута, оказывающие гастропротекторное, противовоспалительное и вяжущее воздействие.
FDA одобрило новый препарат для борьбы с H. Pylori » Медвестник
Резистентность H. Pylori к антибиотикам достигла тревожного уровня по всему миру, в частности, резистентность к кларитромицину увеличилась более чем в два раза с 2009 по 2013 год, что в значительной степени повлияло на эффективность лечения. Применение рифабутина в антихеликобактерной терапии давно рассматривалось, однако до настоящего времени так и не было зарегистрировано соответствующего препарата.
Talicia представляет собой капсулы с модифицированным высвобождением, содержащие комбинацию двух антибиотиков и ингибитора протонной помпы (ИПП): амоксициллина 250 мг, рифабутина 12,5 мг и омепразола 10 мг.
В клинических исследованиях третьей фазы приняли участие взрослые добровольцы с хеликобактерной инфекцией, которые жаловались на боль и/или дискомфорт в эпигастральной области. Четыре из 305 пациентов (1%) прекратили лечение по причине возникновения нежелательных реакций (НР). Наиболее частыми НР были тошнота, рвота, заложенность носа и назофарингит.
«Talicia предлагает новый вариант лечения хеликобактерной инфекции с отличным профилем безопасности и эффективности. Клинические исследования показали высокую эффективность препарата и нулевую резистентность к рифабутину, тогда как резистентность к кларитромицину, который в настоящее время является стандартом лечения, составила 17%, что согласуется с имеющейся информацией о неэффективности терапии с использованием кларитромицина в 25-40% случаев», – говорит профессор микробиологии и вирусологии в Медицинском колледже Бейлора, доктор Дэвид Грэхем (David Graham), руководивший третьей фазой клинических исследований.
«За последнее десятилетие лечение хеликобактерной инфекции усложнилось вследствие растущей резистентности и недостатка альтернативных вариантов терапии», – отмечает глава отделения гастроэнтерологии в Научном центре здоровья Университета Теннесси (UTHSC) доктор Колин Хоуден (Colin Howden). По его мнению, со временем Talicia может стать рекомендованным препаратом первого ряда для эрадикации H. Pylori.
В данный момент рифабутин используется в терапии туберкулеза и микобактериоза в комбинации с другими препаратами и, следовательно, он должен применяться с осторожностью и строго по показаниям во избежание развития резистентности у микобактерий.
Препарат выйдет на рынок США в первом квартале 2020 года и будет представлен в течение 8 лет со статусом Qualified Infectious Disease Product (QIDP), который присваивается антибактериальным и противогрибковым препаратам для лечения серьезных или угрожающих жизни инфекций. Патентная защита будет действительна до 2034 года.
Антибиотик-ассоциированная диарея и эрадикация Helicobacter pylori: пути профилактики uMEDp
Антибиотик-ассоциированная диарея (ААД) является одним из частых осложнений антибактериальной терапии. В 10–30% случаев ААД обусловлена Clostridium difficile, в 80–90% – другими микроорганизмами. C. difficile вызывает псевдомебранозный колит. В отсутствие своевременной диагностики и патогенетической терапии заболевание приводит к развитию жизнеугрожающих осложнений. Для предупреждения ААД необходимо оптимизировать применение антибактериальных препаратов и разработать схемы профилактики. В статье описана роль пробиотических препаратов как для профилактики, так и для повышения эффективности терапии на примере лечения инфекции Нelicobacter рylori.
Широкое использование антибактериальных средств привело к увеличению числа побочных эффектов. К наиболее распространенным нежелательным явлениям относятся желудочно-кишечные расстройства, такие как тошнота и диарея, обусловленные негативным влиянием антибиотиков на слизистую оболочку кишечника и кишечную микробиоту. Антибиотик-ассоциированная диарея (AAД) возникает, когда антибиотик нарушает экологию кишечной микробиоты, изменяя разнообразие и количество бактерий в кишечнике. Такие изменения могут повлиять на способность резидентной микробиоты противостоять инвазии патогенных микроорганизмов или разрастанию видов условно патогенных микроорганизмов, которые эндогенно присутствуют в микробиоте [1, 2].
AAД диагностируется при возникновении трех или более эпизодов неоформленного стула в течение двух или более последовательных дней на фоне приема антибактериальных препаратов или на протяжении восьми недель по его окончании [3].
Заболеваемость ААД среди детей составляет 5–30% [4], среди взрослых – 5–70% [5, 6] и зависит от конкретного типа антибиотика, состояния здоровья пациентов и воздействия патогенных факторов.
К антибиотикам, наиболее часто вызывающим AAД, относятся цефалоспорины, клиндамицин, пенициллины широкого спектра действия и фторхинолоны, такие как ципрофлоксацин и левофлоксацин. В 8–26% случаев ААД развивается при использовании клиндамицина или линкомицина, до 9% – при лечении пенициллинами, в основном амоксициллином и ампициллином [7].
AAД может возникнуть через несколько часов после приема антибиотика или спустя несколько месяцев после его прекращения [8].
AAД может быть инфекционной природы (патоген-специфической) и неинфекционной (идиопатической).
10–33% всех случаев ААД связано с Clostridium difficile [9, 10]. В 80–90% ААД вызывают другие бактериальные патогены, включая C. perfringens, Staphylococcus aureus и Klebsiella oxytoca [11]. Например, грамположительный спорообразующий анаэроб C. perfringens может вызывать многочисленные заболевания, включая пищевые отравления, газовую гангрену, некротические энтериты, синдром внезапной смерти и энтеротоксемию [12].
У большинства пациентов инфекция C. difficile вызывает заболевание легкой и умеренной степени, но в ряде случаев могут развиться тяжелые формы, такие как псевдомембранозный колит, или даже осложненные токсическим мегаколоном [13]. Подобное состояние достаточно редкое (
За последнее десятилетие уровень заболеваемости C. difficile резко возрос во всем мире как по частоте, так и по степени тяжести. В дополнение к антибиотикотерапии широкого спектра выявлено множество других потенциальных факторов риска инфекции C. difficile (пожилой возраст, женский пол, сопутствующие заболевания, госпитализация, длительное пребывание в стационаре, иммуносупрессивная терапия и применение ингибиторов протонной помпы) [11].
Патогенез ААД обусловлен нарушением нормальной микрофлоры, что приводит к чрезмерному росту патогенных микроорганизмов, продуцирующих цитотоксины и энтеротоксины [15]. Бактериальные токсины снижают активность мембранных пищеварительных ферментов в тонкой кишке, что приводит к нарушению переваривания. Колонизация тонкой кишки условно патогенной флорой способствует деконъюгации желчных кислот и нарушает метаболизм углеводов. Макролидные антибиотики, прежде всего эритромицин, стимулируют синтез мотилина, усиливающий перистальтическую активность. Токсины C. difficile вызывают воспалительный ответ за счет рекрутирования нейтрофилов и мастоцитов, выделяющих цитокины. Как следствие – образование псевдомембран. Данные механизмы приводят к развитию диарейного синдрома, нарушению целостности кишечного эпителия и воспалению [16, 17].
В настоящее время принята следующая классификация: ААД без признаков колита, антибиотик-ассоциированный колит и псевдомембранозный колит, вызванный C. difficile. В свою очередь колит, вызванный C. difficile, подразделяют на диарею без колита, колит без псевдомембран, псевдомембранозный и фульминантный колит [18].
Антибиотик-ассоциированные состояния должны быть заподозрены у любого пациента с диареей, получавшего антибиотики в предшествующие два месяца. Важным компонентом диагностики и дифференциальной диагностики является тщательная оценка особенностей клинической картины заболевания.
С целью диагностики колитов, связанных с C. difficile, используют лабораторные методы исследования, направленные на выявление продуктов жизнедеятельности бактерий в образцах кала. Согласно международным рекомендациям, предпочтительны двух- и трехступенчатые алгоритмы. В качестве скрининга рекомендован иммуноферментный анализ на выявление токсинов C. difficile А и В (чувствительность метода – 75–95%), а также глутаматдегидрогеназы. Этот метод используется реже, однако его чувствительность превышает 90%. Кроме того, используется высокочувствительный метод полимеразной цепной реакции [3].
Эндоскопическое исследование с оценкой гистологического материала считается достоверным методом диагностики псевдомембранозного колита при наличии типичных изменений в толстой кишке.
Основной принцип лечения идиопатической ААД заключается в отмене антибактериальных препаратов. При необходимости назначают антидиарейные средства, а также средства для коррекции дегидратации, пробиотики, способствующие восстановлению нормальной микрофлоры кишечника. Основными препаратами для лечения инфекции C. difficile являются метронидазол и ванкомицин с различными режимами введения. Пероральный прием позволяет поддержать максимальную концентрацию в просвете кишки.
С учетом актуальности проблемы продолжается поиск новых эффективных препаратов. В литературе описано применение фидаксомицина и тигециклина, биологических препаратов и др. [19].
Иногда наблюдаются рецидивы заболевания, связанные с прорастанием спор C. difficile в вегетативные формы после прекращения антибактериальной терапии. Используемые для лечения антибактериальные средства эффективны только в отношении вегетативных форм. По данным литературы, рецидив встречается в 15–25% случаев в течение двух месяцев после первоначального эпизода [20].
Для уменьшения вероятности развития рецидива предлагается использовать метод постепенной отмены ванкомицина со снижением его суточной дозы в зависимости от стартовой или пульс-терапию ванкомицином в дозе от 125–500 мг через день либо через два дня (каждые вторые-третьи сутки) в течение трех-четырех недель.
Как показал ретроспективный анализ разных режимов, наилучшие результаты по предупреждению повторных рецидивов связаны с режимом пульс-терапии ванкомицином (частота рецидивов – 14%). Несколько ниже результаты лечения с постепенным снижением дозы ванкомицина (31%). При стандартном режиме лечения частота рецидивов достигает 54% [8].
Для лечения рецидивирующей формы инфекции C. difficile предлагается трансплантация фекальной микробиоты. Впервые это было описано B. Eisman в 1958 г. при лечении псевдомембранозного энтероколита. Первое рандомизированное исследование, результаты которого были опубликованы в 2013 г., продемонстрировало эффективность инфузии донорского кала в двенадцатиперстную кишку через назодуоденальную трубку у пациентов с рецидивирующей инфекцией C. difficile. Согласно полученным результатам, в отношении лечения рецидивирующей инфекции C. difficile трансплантация донорского кала значительно эффективнее, чем использование ванкомицина [21]. Механизм, объясняющий высокую эффективность трансплантации фекальной микробиоты, является многофакторным и не до конца изучен [22, 23].
Прогноз при антибиотикотерапии зависит от степени тяжести C. difficile-ассоциированных диареи/колита, характера течения, наличия осложнений. При легком и среднетяжелом течении прогноз благоприятный. В отсутствие серьезных осложнений, таких как перфорация кишки, кишечная непроходимость, токсический мегаколон, практически все пациенты отвечают на проводимую терапию.
Наиболее частой причиной ААД в практике гастроэнтеролога является лечение Helicobacter pylori-ассоциированных заболеваний. Стандартная тройная терапия, включающая в себя кларитромицин, амоксициллин или метронидазол, а также ингибитор протонной помпы, в течение 14 дней остается золотым стандартом в лечении инфекции H. pylori [24]. Несмотря на первоначальные успехи семидневной стандартной тройной терапии, в период с 2009 по 2014 г. отмечалось постоянное снижение уровня эрадикации H. pylori как у взрослых, так и у детей – с 75 до 55% [25]. Основными причинами снижения эффективности терапии стали возрастающая резистентность к антибиотикам и плохое соблюдение режима лечения вследствие развития побочных эффектов (тошнота, рвота и диарея, вызванные антибиотиками) [26]. Развитие побочных эффектов вынуждает пациентов прерывать курс антибактериальной терапии, что приводит к неэффективности лечения и развитию резистентности H. pylori к антибиотикам.
Эрадикационная терапия обычно переносится хорошо. Тем не менее все компоненты тройной эрадикационной терапии H. pylori являются потенциальными факторами риска развития инфекции C. difficile. Однако о тяжелых побочных эффектах, таких как псевдомембранозный колит, после эрадикационной терапии сообщалось крайне редко [13].
Таким образом, при назначении схем лечения инфекции Н. рylori врач сталкивается с рядом проблем. Ключом к их решению является разработка профилактических мер. В связи с этим предлагается использовать пробиотические добавки как для профилактики ААД, так и для повышения эффективности лечения. Применение пробиотиков способно повысить переносимость лекарственных средств и приверженность пациентов лечению.
В последние годы активно рассматривают вопросы профилактики ААД пробиотическими препаратами. Назначение пробиотиков в комплексной терапии ААД многие авторы считают вполне оправданным, поскольку эти агенты способствуют восстановлению нормальной кишечной флоры и тем самым препятствуют прогрессированию клостридиальной инфекции [27, 28]. Пробиотики в отсутствие антибиотиков рекомендуют использовать в легких случаях ААД, протекающей без признаков колита. При умеренной и тяжелой форме ААД, в том числе вызванной клостридией, пробиотики рассматривают в качестве дополнения к стандартной терапии C. difficile-ассоциированной диареи [29]. Эксперты консенсуса Маастрихт V отметили положительный эффект отдельных пробиотиков в снижении частоты и выраженности побочных эффектов во время проведения эрадикационной терапии. При этом снижение частоты ААД на фоне приема пробиотиков способствует повышению приверженности пациентов
лечению [24].
Пробиотики – это живые микроорганизмы, которые при введении в адекватных количествах приносят пользу здоровью хозяина [30].
Основное преимущество пробиотиков заключается в том, что они способствуют поддержанию сбалансированной микробиоты и, следовательно, создают благоприятную среду для кишечника. Кроме того, пробиотики поддерживают здоровье пищеварительного тракта и иммунной системы [31].
Положительное влияние пробиотиков на здоровье кишечника при различных состояниях (антибиотик-ассоциированная и инфекционная диарея, синдром раздраженного кишечника, некротический энтероколит и т.д.) оценивали в ряде рандомизированных контролируемых клинических исследований [32]. Пробиотики противодействуют болезнетворным микроорганизмам, конкурируя с патогенами за питательные вещества и места адгезии на слизистой оболочке желудочно-кишечного тракта (ЖКТ) в процессе конкурентного связывания. Пробиотики также могут снижать патогенность за счет вмешательства в передачу сигналов между бактериями путем деградации молекул. Кроме того, прямой антагонизм может возникнуть в результате производства бактериоцинов или метаболитов, обладающих антимикробной активностью в отношении патогенных микроорганизмов. Наконец, пробиотики способны модулировать и стимулировать местные и системные иммунные реакции [33].
Наиболее изучены Lactobacillus, Bifidobacterium и Saccharomyces. Показано, что некоторые виды Lactobacillus модифицируют иммунный ответ, уменьшая уровни провоспалительных цитокинов, стимулируют секрецию муцина, подавляют рост патогенных бактерий и ингибируют адгезию H. рylori к эпителию желудка. L. salivarius уменьшает секрецию интерлейкина (ИЛ) 8 эпителиальными клетками желудка, L. acidophilus инактивирует пути воспаления Smad7 и NFB, а L. bulgaricus ингибирует активацию сигнального пути TLR4 и продукцию ИЛ-8. L. acidophilus содержит аутолизин, белковое соединение и антибактериальное вещество, которое высвобождается после лизиса клеток. L. reuteri продуцирует реутерин, который подавляет рост бактерий, а также ингибирует бактериальную адгезию и колонизацию путем связывания спиральной бактерии с гликолипидными белковыми рецепторами [34, 35].
Состав микробиоты различается у детей и взрослых в разные периоды жизни. Межиндивидуальные различия обнаружены в микробном составе на уровне рода и вида. Например, установлено, что микробиота фекалий детей бактериологически менее сложная. В то же время с пожилым возрастом ассоциируются уменьшение бифидобактерий и увеличение разнообразия видов бактероидов. Предполагается, что изменения в микробном составе кишечника с возрастом могут изменять метаболическую способность микробиоты кишечника, что очень важно для возникновения заболеваний [36].
Появляется все больше доказательств того, что лактобациллы и бифидобактерии, населяющие ЖКТ, развивают антимикробную активность, которая участвует в защите хозяина.
Эффективность пробиотиков может зависеть от вида, дозы и заболевания, а продолжительность терапии – от клинических показаний. Отмечено, что дозировка 5 млрд колониеобразующих единиц или более в день значительно эффективнее более низкой дозировки [37].
Систематический обзор и метаанализ 31 рандомизированного контролируемого исследования с участием 8672 пациентов продемонстрировали, что пробиотики эффективны в профилактике ААД и снижают риск клостридиальной инфекции на 60% [38].
Каждый пробиотический штамм имеет уникальный механизм действия, который может быть более или менее эффективным в качестве профилактики ААД. Пробиотик L. rhamnosus GG эффективно предотвращает диарею, связанную с антибиотиками, у детей и взрослых и снижает риск развития AAД у пациентов, получавших антибиотики, с 22,4 до 12,3% [5].
Кокрейновский обзор пробиотиков для профилактики ААД у детей (23 исследования, 3938 участников) показал, что в группе пробиотиков по сравнению с группой контроля реже наблюдалась диарея, вызванная антибиотиками. Обзор показал эффективность L. rhamnosus или S. boulardii в количестве от 5 до 40 млрд колониеобразующих единиц в день. Побочные эффекты отмечались редко [39].
Данные об эффективности пробиотиков в качестве дополнения к антибиотикотерапии для улучшения эрадикации H. pylori противоречивы. Метаанализ девяти РКИ с участием 1163 детей и взрослых показал, что использование пробиотиков, содержащих лактобациллы, в качестве дополнения к антибиотикам увеличивает эффективность эрадикации H. pylori по сравнению с группой контроля [40]. Однако, согласно метаанализу 21 рандомизированного клинического исследования с участием 3452 взрослых пациентов, пробиотики в качестве дополнения к антибиотикам не улучшают эрадикацию инфекции H. pylori (отношение шансов 1,44; 95%-ный доверительный интервал 0,87–2,39) по сравнению с плацебо [41]. Тем не менее при добавлении пробиотиков в схемы эрадикации значительно снижается количество побочных эффектов, включая тошноту, рвоту, боль в эпигастральной области и диарею [27, 34].
Наряду с пробиотиками пребиотики также благотворно влияют на микробный состав ЖКТ, избирательно стимулируя рост и активность одной или ограниченного числа бактерий в толстой кишке [42].
В настоящее время все большую популярность приобретают мультиштаммовые и мультивидовые пробиотики. Перспективность их использования для профилактики и лечения ААД, а также возможность применения в схемах лечения инфекции H. pylori изучается. Эффективность терапии может зависеть от типа штамма и количества штаммов в пробиотике, дозы, продолжительности лечения и т.д.
Разработанный компанией Protexin мультипробиотик Bio-Kult (Великобритания), зарегистрированный в России под названием БАК-СЕТ, применялся во многих исследованиях компании, в основном у детей с заболеваниями ЖКТ, атопическим дерматитом и пищевой аллергией. С учетом возрастных особенностей состава кишечной микробиоты пробиотический комплекс выпускают в двух сбалансированных формах – БАК-СЕТ Беби и БАК-СЕТ Форте. БАК-СЕТ Беби содержит семь штаммов микроорганизмов – L. casei, L. rhamnosus, L. acidophilus, B. breve, B. infantis, B. longum, S. thermophilus, а также наиболее оптимальный для пищеварения детей раннего возраста пребиотик (фруктоолигосахариды из инулина), усиливающий действие пробиотических бактерий. Разрешен к применению у детей с рождения. В состав БАК-СЕТ Форте входит 14 видов живых пробиотических бактерий в высоких концентрациях – L. casei, L. plantarum, L. rhamnosus, B. bifidum, B. breve, B. longum, L. acidophilus, L. lactis, S. thermophilus, B. infantis, L. bulgaricus, L. helveticus, L. salivarius, L. fermentum, что позволяет им достигать толстой кишки без потери активности и жизнеспособности.
У пациентов гастроэнтерологического профиля мультипробиотик БАК-СЕТ исследовался компанией Protexin при синдроме раздраженного кишечника с диареей, ААД, возникшей на фоне эрадикации H. рylori, а также при метаболическом синдроме и ожирении.
В исследовании препарата БАК-СЕТ, проведенном под руководством доктора Э. Харпера, 66 детям в возрасте от трех до 14 лет назначали эрадикационную терапию H. pylori. Добавление мультипробиотика к тройной терапии существенно повысило эффективность эрадикации – до 90% (в группе без пробиотика – 70%) (p = 0,04). Кроме того, в группе пациентов, не получавших мультипробиотик, возникли нежелательные явления (тошнота и рвота – 27%, диарея – 24%). На фоне терапии с включением мультиштаммового пробиотика нежелательные явления возникли лишь в 6% случаев [43].
Новая концепция пробиотиков – мультипробиотики. Их мультивидовой состав обеспечивает микробное разнообразие, повышая биологическую активность за счет синергии разных видов бактерий.
Таким образом, развитие ААД ограничивает возможности антибактериальной терапии, в том числе для эрадикации Н. pylori, при проведении которой используются высокие суточные дозы двух антибиотиков в течение 14 дней. Это послужило толчком к интенсивному проведению исследований преимуществ использования разных пробиотиков в качестве дополнительного компонента в схемах эрадикационной терапии. Опубликованные данные гетерогенны и во многом определяются свойствами штаммов пробиотиков. Результаты большинства исследований демонстрируют преимущества этой стратегии, прежде всего для снижения частоты и выраженности нежелательных явлений антибактериальной терапии. В качестве одного из перспективных рассматривается мультипробиотический препарат БАК-СЕТ, доказательная база эффективности которого расширится в ходе дальнейших исследований.
В чем секрет Helicobacter pylori?
Сегодня кишечные бактерии являются одной из самых горячих тем в медицинской науке. По мере того, как ученые стремительно расширяют список заболеваний, связанных с этими возбудителями, становится все более важным понимание того, каким образом бактериям удается избегать воздействия лекарственных средств и иммунной системы.
Так, Helicobacter pylori – это бактерия, обладающая невероятной способностью колонизировать организм человека. Согласно последним оценкам, ее выявляют в желудках примерно половины всех людей в мире.
Helicobacter pylori может быть как безвредной, так и провоцировать развитие рака желудка и язвенной болезни.
Ученые сообщают, что около 75% случаев рака желудка и 5,5% злокачественных новообразований во всем мире связаны с воспалением и травмами, вызванными Helicobacter pylori.
Особенности поведения Helicobacter pylori
Несмотря на широкую распространенность Helicobacter pylori, ученые до сих пор не до конца изучили поведение данной бактерии в желудке.
Исследователи из медицинского факультета Стэнфордского университета (Stanford University School of Medicine), США, недавно провели ряд исследований, чтобы понять, каким образом Helicobacter pylori удается так длительно колонизировать желудок человека.
Используя передовые инструменты визуализации, ученым удалось определить «убежище» Helicobacter pylori в желудке. Результаты исследования опубликованы в издании «PLOS Biology».
Helicobacter pylori является высокоспециализированной бактерией для колонизации желудка, который представляет собой чрезвычайно негостеприимное место для жизни. По сути желудок — это чан с соляной кислотой. Несмотря на это, данные бактерии способны сохранять свое место обитания на протяжении десятилетий.
Антибиотики могут убивать Helicobacter pylori, но, как правило, они не уничтожают бактерии полностью, и вскоре популяция вырастает заново. Старший автор исследования доктор Мануэль Амиева (Manuel Amieva) объясняет, что вновь возникающий штамм Helicobacter pylori неизменно совпадает с тем, который считался искорененным.
Такая особенность поведения подразумевает, что бактерии Helicobacter pylori нашли способ находить «укрытия» в желудке и в дальнейшем безопасно восстанавливаться.
Место для убежища
У Helicobacter pylori есть длинные вращающиеся жгутики, которые позволяют бактериям перемещаться в окружающей среде. Ученые считают, что данные бактерии используют свои жгутики для создания туннелей в слизистой оболочке желудка.
Слизистый слой защищает оболочку желудка и, следовательно, также способен обеспечить некоторую защиту для Helicobacter pylori.
Ученые установили, что эта тактика, безусловно, играет определенную роль в защите Helicobacter pylori. Однако они открыли и другой метод, которым пользуются бактерия для сохранения своей жизнедеятельности.
Более ранние исследования этой же группы ученых показали, что Helicobacter pylori укрывается в желудочных железах, которые представляют собой крошечные ямки в стенках желудка.
Ученые провели исследование, в ходе которого заразили мышей 2 штаммами Helicobacter pylori. Оба были генетически модифицированы. Первый излучал флуоресцентный зеленый свет, а второй – флуоресцентный красный свет. Ученые также использовали технику, названную CLARITY, которая позволяет проникнуть через неповрежденную ткань и создать трехмерное изображение того, где именно локализуются бактерии.
Конкурентная борьба
Новое исследование раскрывает процесс, который происходит после того, как Helicobacter pylori заселяют желудочные железы. Ученые ожидали, что 2 штамма бактерий (которые были идентичны, кроме их окраски) смешаются и превратятся в общую популяцию двух цветов. Однако они выявили, что, как только бактерия – красная или зеленая – поселяется в желудочной железе, она снижает способность других бактерий проникать в эту железу. Таким образом, несмотря на то что эти бактерии были одного и того же штамма одного и того же вида, исследователи определили, что они способны обойти в конкурентной борьбе свой собственный вид.
Как только красная или зеленая бактерия заселит одну железу и размножится, она перейдет к заселению соседних. Благодаря такому процессу на слизистой оболочке желудка зараженной мыши ученые наблюдали лоскутный узор красного и зеленого цвета.
До сих пор не ясно, как именно каждая бактерия захватывает железу и заявляет о ней как о своей собственности. Для того чтобы это выяснить, ученые отключили у Helicobacter pylori химический сенсорный механизм, которым пользуется бактерия для навигации. В результате такие бактерии не смогли создать исключительно красные или зеленые колонии.
Таким образом, данное исследование дает более четкую картину того, как Helicobacter pylori удается выживать в условиях желудка. Ученые надеются, что полученные данные послужат толчком для разработки эффективных методов лечения заболеваний, вызванных данной бактерией.
По материалам www.medicalnewstoday.com
Цікава інформація для Вас:
Лечение Helicobacter pylori: антибиотики или пробиотики
Helicobacter pylori – это обычная бактерия, поражающая около половины населения мира, с более высокой распространенностью в развивающихся странах, где H. pylori может заразить до 80% населения (Moayyedi and Hunt 2004), чем в развитых.
H. pylori связан с развитием желудочно-кишечных расстройств, таких как хронический гастрит, язвенная болезнь и аденокарцинома желудка (Kuipers 1997). H. pylori также участвует в развитии других внегастральных заболеваний, таких как лимфома лимфоидной ткани слизистой оболочки (MALT), идиопатическая тромбоцитопеническая пурпура, дефицит витамина B 12 и дефицит железа (Kuipers 1997). Ликвидация H. pylori может помочь в лечении этих -ассоциированных с H. pylori заболеваний.
В течение последних двух десятилетий рекомендованным лечением эрадикации H. pylori является стандартная тройная терапия (Papastergiou et al.2014a, b) с использованием ингибитора протонной помпы или цитрата висмута ранитидина в сочетании с кларитромицином и амоксициллином или метронидазолом.
В 90-е годы из-за того, что эти методы лечения достигли высоких показателей эрадикации [более 90%] вместе с профилем безопасности, эти тройные методы лечения были очень популярны среди клиницистов (Malfertheiner et al. 2007). Эффективность этих тройных схем в последнее время снизилась до показателей ниже 70% из-за устойчивости H. pylori к основным антибиотикам, в основном к кларитромицину, но также к метронидазолу и левофлоксацину (Agudo et al.2010а, б; Де Франческо и др. 2009 г.).
Эти низкие показатели успешного лечения неприемлемы в соответствии с Маастрихтским консенсусом, который указывает, что показатели, которые постоянно ниже 80% в зависимости от намерения лечить, неприемлемы для лечения H. pylori (Graham et al. 2007). Информация о местной резистентности к антибиотикам должна быть принята во внимание, прежде чем составлять план лечения для пациента, чтобы избежать повторного лечения. Несколько воздействий на лечение антибиотиками могут привести к большему количеству побочных эффектов и снижению процента устойчивости к антибиотикам.
По этой причине данный обзор представляет собой обзор эрадикации H. pylori , ориентированный на используемые методы лечения второй линии, такие как последовательная терапия и четырехкратная терапия. Однако из-за повышения устойчивости к антибиотикам некоторые исследования начали уделять внимание пробиотикам как терапевтическому подходу. Пробиотики определяются как живые виды микробов, которые могут включать противовоспалительные и антиоксидантные механизмы, которые могут улучшить микроэкологию кишечника и общее состояние здоровья (Lu et al.2016). Пробиотики – это живые микроорганизмы, которые при введении в адекватных количествах приносят пользу здоровью хозяина. Наиболее часто используемые пробиотические бактерии – это Lactobacillus и Bifidobacterium (Ruggiero 2014). Пробиотики могут улучшить эрадикацию H. pylori и уменьшить побочные эффекты во время терапии (Kim et al. 2008). Часть этого пересмотра будет посвящена использованию пробиотиков против H. pylori .
H. pylori устойчивость к антибиотикамКлассическое лечение
В 90-е годы стандартная тройная терапия была золотым стандартом в лечении H.pylori инфекции. Стандартная тройная терапия основана на применении ингибитора протонной помпы, кларитромицина и амоксициллина или метронидазола. Увеличение распространенности устойчивости к этим антибиотикам, особенно к ключевому антибиотику, кларитромицину, снизило эффективность стандартных схем лечения (Malfertheiner et al. 2002).
В недавнем систематическом обзоре сообщалось, что глобальная частота первичной устойчивости H. pylori к кларитромицину достигает 17.2%, что свидетельствует о росте во всем мире (Kuipers 1997). Распространенность устойчивости H. pylori к кларитромицину варьируется в разных странах, например, от 10,6 до 25% в Северной Америке, 16% в Японии и от 1,7 до 23,4% в Европе (Elitsur et al. 2006; Horiki et al. 2012 ; Колецко и др., 2006). Это различие в уровнях устойчивости, по-видимому, коррелирует с национальным уровнем потребления макролидов и различной политикой в отношении потребления антибиотиков в разных странах (Agudo et al. 2010a, b), например, 49% устойчивости к кларитромицину было зарегистрировано в некоторых регионах Испании. , но только 1% в Нидерландах, что отражает более строгую политику Северной Европы в отношении использования антибиотиков, чем в странах Южной Европы (Seck et al.2013). Новые макролиды начали продаваться в Европе в начале 90-х; пациенты получали макролиды с целью лечения респираторных инфекций антибиотиками этой группы. Дополнительные аспекты, такие как географические особенности, факторы вирулентности штаммов H. pylori или некоторые аспекты хозяина [возраст, место рождения], могут способствовать значительному изменению распространенности устойчивости к антибиотикам (Van Doorn et al. 2000).
Метронидазол – ключевой компонент тройной терапии (Malfertheiner et al.2002), что связано с высоким уровнем сопротивления. Распространенность устойчивости к метронидазолу оценивается от 17 до 44% в Европе и Америке соответственно (Ogata et al. 2013; De Francesco et al. 2010). Самый высокий уровень устойчивости к этому антибиотику в Европе зарегистрирован в Западной Европе, где от 20 до 45% изолятов H. pylori устойчивы к метронидазолу (Lopez-Brea et al. 2001). Сообщается, что процент устойчивости к метронидазолу в развивающихся странах составляет от 50 до 100% вместо 90% в Африке (Falsafi et al.2004 г.). Устойчивость к метронидазолу настолько высока в развивающихся странах, потому что этот антибиотик широко используется для лечения паразитарных и / или гинекологических инфекций у пациентов женского пола (John et al. 2006). Кроме того, есть некоторые исследования, в которых описывается, что устойчивость к метронидазолу связана с факторами вирулентности штаммов, причем штаммы без гена cagA являются более устойчивыми (Taneike et al. 2009). О более низких показателях резистентности к метронидазолу сообщалось в Японии, около 10% (De Francesco et al.2010).
На основании этих публикаций стандартные тройные методы лечения больше не могут быть рекомендованы для эмпирического использования. Из-за высокого уровня резистентности к двум ключевым антибиотикам стандартной тройной терапии, кларитромицину и метронидазолу, а также к различным моделям резистентности в разных популяциях, стандартные тройные терапии должны быть адаптированы к местному типу резистентности, и, когда это возможно, лечение должно быть изменено. на основе данных о чувствительности, полученных при тестировании штамма после культивирования.
Альтернативные стратегии реализуются в клинической практике для лечения штаммов H. pylori, устойчивых к . Это включало разработку и использование новых и более эффективных методов лечения и использование пробиотиков для улучшения режимов эрадикации и уменьшения побочных эффектов антибиотиков.
В ходе этого пересмотра будут обсуждаться новые методы лечения против H. pylori и пробиотики.
Четырехкратная терапия висмутом
Эта терапия включает два антибиотика, тетрациклин и метронидазол, плюс висмут и ИПП в течение 14 дней (Harb et al.2015). Эта терапия предпочтительна в качестве варианта лечения первой линии для регионов с высокой частотой резистентности к кларитромицину, а также в качестве терапии второй линии, когда первое лечение классической тройной терапией против H. pylori не удалось (Papastergiou et al. 2014a, б). Эта терапия работает совершенно независимо от кларитромицина, наиболее проблемного антибиотика с точки зрения устойчивости. Что касается метронидазола, то использование высоких доз и увеличенная продолжительность лечения позволяет минимизировать воздействие на штаммы, устойчивые к метронидазолу, обеспечивая высокие темпы эрадикации даже в областях с высоким уровнем устойчивости к этому антибиотику (Lee et al.2014).
Потенциальная токсичность висмута, а также недоступность солей висмута или тетрациклина в некоторых странах являются основным препятствием, связанным с этой терапией. В некоторых исследованиях тетрациклин был заменен амоксициллином (Perri et al. 2002).
Девять рандомизированных контролируемых испытаний были проанализированы в метаанализе (Luther et al. 2010), в котором сравнивали четырехкратную терапию висмутом и тройную терапию кларитромицином; они обнаружили, что четырехкратная терапия висмутом достигла эрадикации у 78 пациентов.3% пациентов, тогда как тройная терапия кларитромицином достигла 77% степени эрадикации. Был сделан вывод о том, что четырех- и трехкратная терапия имеют такие же показатели эрадикации, как и первичная терапия инфекции H. pylori . С другой стороны, эффективность этой терапии была подтверждена в качестве терапии второй линии в метаанализе, основанном на 30 исследованиях, показывающих 77% эрадикации после неэффективности стандартной тройной терапии (Gisbert 2012).
Последовательная терапия
Последовательная терапия использует те же антибиотики, что и стандартная тройная терапия, но их назначают последовательно: 5 дней с ИПП плюс амоксициллин, затем 5 дней с ИПП плюс кларитромицин и амоксициллин (Kuipers 1997).
Амоксициллин вводится первым из-за того, что амоксициллин разрушает стенки бактериальных клеток, предотвращая развитие каналов оттока, по которым остальные антибиотики переносятся из бактерий (Webber and Piddock 2003). Были опубликованы некоторые исследования, большинство из них в Италии, где результат последовательной терапии превосходил обычную стандартную тройную терапию. Более поздние данные исследований, проведенных в Южной Америке и Азии, показывают, что уровень ликвидации составляет менее 80% (Kuipers 1997).
В недавнем метаанализе было рассмотрено 36 рандомизированных клинических испытаний. Уровень эрадикации составил 84,1% для последовательной терапии по сравнению с 75,1% для стандартной тройной терапии. Последовательная терапия кажется более эффективной против пациентов с единственным штаммом, устойчивым к кларитромицину; Частота эрадикации составила 80,9% для последовательной терапии и 40,7% для стандартной тройной терапии (Feng et al. 2015).
Четырехкратная терапия без висмута
Это еще одна эффективная терапия в странах с высокой частотой возникновения резистентности к кларитромицину.Эта терапия содержит ИПП [но без висмута], кларитромицин, амоксициллин и метронидазол в течение 10 дней. Основным недостатком этого лечения является большое количество таблеток по сравнению с другими методами лечения (Papastergiou et al. 2014a, b).
В метаанализе, проведенном в 2012 г., включая рандомизированные контролируемые исследования, сравнивающие четырехкратную терапию без висмута и стандартную тройную терапию, частота эрадикации составила 90% против 78% соответственно. Резистентность к кларитромицину может снизить эффективность четверной терапии без висмута, хотя снижение частоты эрадикации, по-видимому, намного ниже, чем при стандартной тройной терапии (Gisbert and Cavet 2012).
Гибридная терапия
Эта терапия основана на 7-дневной терапии ИПП и амоксициллином, за которой следует 7-дневная четырехкратная терапия ИПП, амоксициллин, кларитромицин и метронидазол. В литературе не так много данных, сравнивающих эту терапию с другими, стандартными или последовательными методами лечения, но результаты не показывают, что гибридная терапия будет лучше последовательной терапии (Papastergiou et al. 2014a, b).
Имеется обзор, в котором было выявлено пять исследований, сравнивающих гибридную терапию и последовательную терапию, и три, сравнивающих гибридную терапию и сопутствующую терапию.Пять рандомизированных контролируемых испытаний не выявили существенных различий между гибридной терапией и последовательной терапией, а три рандомизированных контрольных испытания не показали существенных различий между гибридной терапией и сопутствующей терапией (He et al., 2015).
Терапия на основе левофлоксацина
В связи с увеличением резистентности к кларитромицину левофлоксацин, хинолон широкого спектра действия, используется для эрадикации H. pylori , чтобы заменить кларитромицин в тройных или последовательных схемах.Уровень искоренения терапии, содержащей левофлоксацин, может составлять более 90%, особенно в регионах, где местная резистентность к левофлоксацину низкая [менее 10%]. Что касается кларитромицина и метронидазола, наблюдается повышение устойчивости к левофлоксацину из-за того, что хинолоны часто используются для лечения инфекций мочевыводящих путей. Устойчивость к хинолонам составляет около 20% в Европе, 15% в Америке и 10% в Азии (Liang et al. 2014).
В связи с быстрым развитием вторичной резистентности к хинолонам, использование левофлоксацина первой линии обычно не рекомендуется, и препарат резервируется для использования в схемах второй линии после неудачи схем на основе кларитромицина и / или метронидазола (Gisbert et al.2015).
Пробиотический микроорганизм
Пробиотики – это живые микроорганизмы, которые при введении в адекватных количествах могут улучшить микробный баланс в кишечнике и оказывать положительное влияние на здоровье хозяина (FAO / WHO 2002), включая положительное влияние на предотвращение кишечных инфекции, сердечно-сосудистые заболевания, рак и противоаллергические эффекты (Pianoa et al. 2006).
Пробиотики могут быть микроорганизмами из группы бактерий или дрожжей. Однако большинство пробиотиков – это бактерии, в том числе молочнокислые бактерии, обычно связанные с желудочно-кишечным трактом человека, которые наиболее широко используются (Rodes et al.2013b). В их число входят Gram (+) кокки и палочки Lactobacillus и Bifidobacterium , которые являются двумя наиболее распространенными видами, используемыми в качестве пробиотиков и широко исследуемыми на предмет их положительного воздействия на хозяина, включая содействие созреванию и целостности кишечника, антагонизм против патогенов. и модуляция иммунной системы и опухолевые агенты. Общей чертой этих бактерий является способность к анаэробному перевариванию сахаридов и выработке молочной кислоты.Эти микроорганизмы отличаются устойчивостью к низкому pH и толерантностью к широкому диапазону температур. Естественная экосистема молочнокислых бактерий – это пищеварительный тракт, слизистая оболочка рта и половые пути людей и животных (Rodes et al. 2013a).
В связи с тем, что H. pylori считается трудноизлечимой инфекцией, в основном из-за приобретенной устойчивости к широко используемым антибиотикам, растет интерес к использованию пробиотиков в сочетании со схемами антибиотиков для уничтожения H.пилори. Доказано, что пробиотики полезны при лечении нескольких кишечных заболеваний, таких как диарея, в дополнение к преимуществам пробиотических бактерий в кишечнике; Сообщалось о некоторых благотворных эффектах на желудок. Среди них была изучена активность против Helicobacter pylori (Aiba et al. 2015).
Преимущества пробиотической терапии в случае H. pylori заключаются в увеличении эрадикации и улучшенной переносимости за счет предотвращения возникновения лечения и связанных с ним побочных эффектов.
Кроме того, пробиотики могут помочь в лечении заболеваний, связанных с H. pylori- . Клинический исход инфекции H. pylori определяется несколькими факторами, включая тип штамма H. pylori , степень воспаления и плотность колонизации H. pylori . Сообщалось, что риск развития язвенной болезни и рака желудка увеличивается с увеличением уровня инфекции. Следовательно, постоянное или долгосрочное подавление H.pylori может снизить риск развития заболеваний, связанных с H. pylori- (Yang et al. 2014).
Было проведено несколько исследований, чтобы показать благоприятный эффект различных пробиотиков против H. pylori и прояснить механизм действия пробиотиков против H. pylori , включая прочность слизистого барьера, конкуренцию за адгезию и иммуномодулирующие механизмы. (Папастержиу и др., 2014а, б).
Механизм действия
Неиммунологический механизм
Первой линией защиты от патогенных бактерий является кислотность желудка и барьер слизистой оболочки желудка.Было высказано предположение, что при приеме пробиотиков эта первая линия защиты может быть более сильной из-за выработки антимикробных веществ, конкурирующих с H. pylori за рецепторы адгезии, стимулирующих выработку муцина и стабилизацию барьера слизистой оболочки кишечника.
Противомикробные вещества
Пробиотики могут подавлять рост H. pylori , выделяя короткоцепочечные жирные кислоты и антибактериальные вещества. Короткоцепочечные жирные кислоты, такие как уксусная, пропионовая и молочная кислоты, продуцируются пробиотиками в процессе метаболизма углеводов, и, как следствие, происходит снижение pH.В 1989 году Bhatia et al. (1989) были первой группой, которая наблюдала антагонистический эффект штамма Lactobacillus против H. pylori , относящегося к короткоцепочечным жирным кислотам. Кроме того, антимикробная активность может быть связана с ингибированием уреазной активности H. pylori , как было показано в других публикациях (Sgouras et al. 2004).
Определенные виды Lactobacillus синтезируют противомикробные соединения, относящиеся к классам бактериоцинов. Бактериоцины – это белковые токсины с потенциалом анти- H.pylori активности. Это небольшие диализируемые пептидные структуры с антимикробной активностью. Антимикробная активность бактериоцинов варьировала среди штаммов H. pylori , а также тип бактериоцинов, продуцируемых Lactobacillus sp. Некоторые бактериоцины показали более сильную антибактериальную активность против штаммов H. pylori , чем другие, хотя оба были продуцированы Lactobacillus spp. (Ким и др., 2003).
Конкуренция за адгезию
Существует несколько возможных механизмов, с помощью которых пробиотические бактерии могут ингибировать адгезию H.пилори. Адгезия H. pylori к эпителиальным клеткам важна для определения исхода болезней, ассоциированных с H. pylori ; На способность бактерий устанавливать физический контакт с эпителием желудка влияет влияние слизистой оболочки эпителия, рецепторов, связанных с адгезией H. pylori к эпителию, и иммунных клеток (Zhang et al.2014).
Существует несколько возможных механизмов, с помощью которых пробиотические бактерии могут ингибировать адгезию H.pylori , в основном, молочная кислота и бактериоцины (Lesbros-Pantoflickova et al. 2007).
Барьер слизистой оболочки
Поверхности слизистой оболочки обладают защитными стратегиями для защиты от вредных веществ и патогенов, обнаруженных в просвете кишечника. Некоторые стратегии, такие как муцины, большие сложные гликопротеины, которые защищают поверхность слизистой оболочки кишечника от микробных патогенов, ограничивая доступ вещества окружающей среды к их эпителиальным клеткам (Mack et al. 2003). Идентифицировано несколько муцинов. H. pylori , как известно, подавляет экспрессию генов MUCI и MUC5 в линии клеток желудка человека (Hanisch et al. 2014). Было показано, что исследования in vitro с пробиотиками, такими как L. plantarum и L. rhamnosus , увеличивают экспрессию генов MUC2 и MUC3, и, следовательно, внеклеточная секреция муцина культурами клеток толстой кишки может подавлять прилипание патогенных бактерий. Эта способность этих штаммов восстанавливает проницаемость слизистой оболочки желудка и подавляет прилипание патогенных бактерий, таких как H.pylori .
Иммунологические механизмы
Воспалительная реакция на желудочную инфекцию H. pylori характеризуется высвобождением различных медиаторов воспаления, таких как хемокины и цитокины. Пробиотики могут изменять иммунологический ответ путем модуляции секреции противовоспалительных цитокинов, что может привести к снижению активности желудка и воспалению (Wiese et al. 2012).
Клинические испытания пробиотиков против
H. pyloriОбзорные статьи, касающиеся пробиотиков и H.pylori искали в PUBMED в течение последних 10 лет (с января 2004 г. по июль 2017 г.), вводя такие ключевые слова, как «обзор», «пробиотики», « Helicobacter » и «лечение»; Было получено 159 статей, но только 34 из них касались пробиотиков и H. pylori . На основании данных, содержащихся в этих статьях, пробиотики не могут рассматриваться как альтернатива лечению против H. pylori , но их использование в сочетании со стандартным лечением против H. pylori может улучшить лечение H.pylori за счет увеличения скорости эрадикации, а также уменьшения побочных эффектов текущей медикаментозной терапии. К такому выводу пришли четыре метаанализа, связанных с лечением H. pylori и пробиотиками, опубликованные в период с 2016 по 2017 год (Lü et al., 2016, McFarland et al., 2016, Feng et al., 2017, Wang et al., 2017). .
Существует научный отчет, опубликованный Nature в 2016 году, в котором описывается метаанализ, включавший соответствующие критериям рандомизированные контролируемые испытания с целью определения, могут ли добавки с пробиотиками улучшить состояние H.pylori и уменьшить побочные эффекты во время терапии (Dang et al., 2014). Авторы исследовали эффект комбинирования пробиотиков с плацебо или без него, без стандартной терапии. По сравнению с группой плацебо, в группе пробиотиков было ликвидировано инфекции H. pylori при анализе намерения лечить и согласно протоколу анализа, соответственно, . Пробиотики с тройной терапией плюс 14-дневный курс лечения не улучшили эрадикацию инфекции H. pylori по сравнению с плацебо.Однако пробиотики действительно уменьшили побочные эффекты диареи и тошноты. Эти объединенные данные предполагают, что использование пробиотиков в сочетании со стандартной терапией не улучшает скорость эрадикации инфекции H. pylori по сравнению с плацебо. Некоторые метаанализы показали, что добавление пробиотиков может улучшить скорость эрадикации H. pylori по сравнению с одной терапией. Возможно, широко распространено мнение, что пробиотики могут улучшить эрадикацию H. pylori и уменьшить побочные эффекты при стандартной терапии, но некоторые виды из группы пробиотических бактерий могут помочь в фармакотерапии.Потребление ферментированных продуктов с пищей (например, 250 г кисломолочного продукта) может улучшить работу желудочно-кишечного тракта с хорошими микроорганизмами в желудочно-кишечном тракте. Эти данные свидетельствуют о том, что использование пробиотиков в сочетании со стандартной терапией не улучшает скорость эрадикации инфекции H. pylori по сравнению с плацебо. Плацебо – это имитация или иным образом неэффективное с медицинской точки зрения лечение заболевания или другого медицинского состояния, цель которого – обмануть получателя. Хорошо известно, что физиологические явления тесно связаны с заболеваниями желудка.Кроме того, эффект плацебо вызывает чередование уровней системных и кишечных гормонов и эффектов ожидания субъекта (Dong et al. 2012; Lesbros-Pantoflickova et al. 2007; Ruggiero 2014; Vítor and Vale 2011; Patel et al. 2014; Сачдева и Нагпал 2009; Зоу и др. 2009; Франчески и др. 2007; Лионетти и др. 2010; Чжэн и др. 2013; Патель и др. 2014; Пасифико и др. 2014; Сабби 2011; Тонг и др. 2007; Вильгельм и др., 2011 г .; Готтеланд и др., 2006 г.). Мета-анализ показывает, что уровень эрадикации H.pylori в группе пробиотиков по сравнению с группами плацебо и без плацебо в анализе ITT и оценивает OR с 95% -ным интервалом ковалентности и массовым процентом.
Лечение Helicobacter pylori: антибиотики или пробиотики
Helicobacter pylori – это обычная бактерия, поражающая около половины населения мира, с более высокой распространенностью в развивающихся странах, где H. pylori может заразить до 80% населения (Moayyedi and Hunt 2004), чем в развитых.
H. pylori связан с развитием желудочно-кишечных расстройств, таких как хронический гастрит, язвенная болезнь и аденокарцинома желудка (Kuipers 1997). H. pylori также участвует в развитии других внегастральных заболеваний, таких как лимфома лимфоидной ткани слизистой оболочки (MALT), идиопатическая тромбоцитопеническая пурпура, дефицит витамина B 12 и дефицит железа (Kuipers 1997). Искоренение H. pylori может помочь в борьбе с этими H.pylori -ассоциированные расстройства.
В течение последних двух десятилетий рекомендованным лечением эрадикации H. pylori является стандартная тройная терапия (Papastergiou et al. 2014a, b) с использованием ингибитора протонной помпы или цитрата висмута ранитидина в сочетании с кларитромицином и амоксициллином или метронидазолом. .
В 90-е годы из-за того, что эти методы лечения достигли высоких показателей эрадикации [более 90%] вместе с профилем безопасности, эти тройные методы лечения были очень популярны среди клиницистов (Malfertheiner et al.2007). Эффективность этих тройных схем в последнее время снизилась до показателей ниже 70% из-за устойчивости H. pylori к основным антибиотикам, в основном к кларитромицину, но также к метронидазолу и левофлоксацину (Agudo et al.2010a, b; De Francesco et al. 2009 г.).
Эти низкие показатели успешного лечения неприемлемы в соответствии с Маастрихтским консенсусом, который указывает на то, что показатели, которые постоянно ниже 80% в зависимости от намерения лечить, неприемлемы для лечения H. pylori (Graham et al.2007). Информация о местной резистентности к антибиотикам должна быть принята во внимание, прежде чем составлять план лечения для пациента, чтобы избежать повторного лечения. Несколько воздействий на лечение антибиотиками могут привести к большему количеству побочных эффектов и снижению процента устойчивости к антибиотикам.
По этой причине данный обзор представляет собой обзор эрадикации H. pylori , ориентированный на используемые методы лечения второй линии, такие как последовательная терапия и четырехкратная терапия. Однако из-за повышения устойчивости к антибиотикам некоторые исследования начали уделять внимание пробиотикам как терапевтическому подходу.Пробиотики определяются как живые виды микробов, которые могут включать противовоспалительные и антиоксидантные механизмы, которые могут улучшить микроэкологию кишечника и общее состояние здоровья (Lu et al., 2016). Пробиотики – это живые микроорганизмы, которые при введении в адекватных количествах приносят пользу здоровью хозяина. Наиболее часто используемые пробиотические бактерии – это Lactobacillus и Bifidobacterium (Ruggiero 2014). Пробиотики могут улучшить эрадикацию H. pylori и уменьшить побочные эффекты во время терапии (Kim et al.2008 г.). Часть этого пересмотра будет посвящена использованию пробиотиков против H. pylori .
Устойчивость к антибиотикам H. pyloriКлассическое лечение
В 90-е годы стандартная тройная терапия была золотым стандартом в лечении инфекций H. pylori . Стандартная тройная терапия основана на применении ингибитора протонной помпы, кларитромицина и амоксициллина или метронидазола. Увеличение распространенности устойчивости к этим антибиотикам, особенно к ключевому антибиотику, кларитромицину, снизило эффективность стандартных схем лечения (Malfertheiner et al.2002).
В недавнем систематическом обзоре сообщалось, что глобальная частота первичной устойчивости H. pylori к кларитромицину достигает 17,2%, что свидетельствует о росте во всем мире (Kuipers 1997). Распространенность устойчивости H. pylori к кларитромицину варьируется в разных странах, например, от 10,6 до 25% в Северной Америке, 16% в Японии и от 1,7 до 23,4% в Европе (Elitsur et al. 2006; Horiki et al. 2012 ; Колецко и др., 2006). Это различие в уровнях устойчивости, по-видимому, коррелирует с национальным уровнем потребления макролидов и различной политикой потребления антибиотиков в разных странах (Agudo et al.2010a, b), например, 49% устойчивости к кларитромицину было зарегистрировано в некоторых регионах Испании, но только 1% в Нидерландах, что отражает более строгую политику использования антибиотиков в Северной Европе, чем в странах Южной Европы (Seck et al. 2013) . Новые макролиды начали продаваться в Европе в начале 90-х; пациенты получали макролиды с целью лечения респираторных инфекций антибиотиками этой группы. Дополнительные аспекты, такие как географические особенности, факторы вирулентности H.pylori или некоторые аспекты хозяина [возраст, место рождения] могут способствовать значительному изменению распространенности устойчивости к антибиотикам (Van Doorn et al. 2000).
Метронидазол является ключевым компонентом тройной терапии (Malfertheiner et al. 2002), что связано с высоким уровнем резистентности. Распространенность устойчивости к метронидазолу оценивается от 17 до 44% в Европе и Америке соответственно (Ogata et al. 2013; De Francesco et al. 2010).Самый высокий уровень устойчивости к этому антибиотику в Европе зарегистрирован в Западной Европе, где от 20 до 45% изолятов H. pylori устойчивы к метронидазолу (Lopez-Brea et al. 2001). Сообщается, что процент устойчивости к метронидазолу в развивающихся странах составляет от 50 до 100% вместо 90% в Африке (Falsafi et al. 2004). Устойчивость к метронидазолу настолько высока в развивающихся странах, потому что этот антибиотик широко используется для лечения паразитарных и / или гинекологических инфекций у пациентов женского пола (John et al.2006 г.). Кроме того, есть некоторые исследования, в которых описывается, что устойчивость к метронидазолу связана с факторами вирулентности штаммов, причем штаммы без гена cagA являются более устойчивыми (Taneike et al. 2009). О более низких показателях резистентности к метронидазолу сообщалось в Японии, около 10% (De Francesco et al. 2010).
На основании этих публикаций стандартные тройные методы лечения больше не могут быть рекомендованы для эмпирического использования. Из-за высокого уровня резистентности к двум ключевым антибиотикам стандартной тройной терапии, кларитромицину и метронидазолу, а также к различным моделям резистентности в разных популяциях, стандартные тройные терапии должны быть адаптированы к местному типу резистентности, и, когда это возможно, лечение должно быть изменено. на основе данных о чувствительности, полученных при тестировании штамма после культивирования.
Альтернативные стратегии реализуются в клинической практике для лечения штаммов H. pylori, устойчивых к . Это включало разработку и использование новых и более эффективных методов лечения и использование пробиотиков для улучшения режимов эрадикации и уменьшения побочных эффектов антибиотиков.
В ходе этого пересмотра будут обсуждаться новые методы лечения против H. pylori и пробиотики.
Четырехкратная терапия висмутом
Эта терапия включает два антибиотика, тетрациклин и метронидазол, плюс висмут и ИПП в течение 14 дней (Harb et al.2015). Эта терапия предпочтительна в качестве варианта лечения первой линии для регионов с высокой частотой резистентности к кларитромицину, а также в качестве терапии второй линии, когда первое лечение классической тройной терапией против H. pylori не удалось (Papastergiou et al. 2014a, б). Эта терапия работает совершенно независимо от кларитромицина, наиболее проблемного антибиотика с точки зрения устойчивости. Что касается метронидазола, то использование высоких доз и увеличенная продолжительность лечения позволяет минимизировать воздействие на штаммы, устойчивые к метронидазолу, обеспечивая высокие темпы эрадикации даже в областях с высоким уровнем устойчивости к этому антибиотику (Lee et al.2014).
Потенциальная токсичность висмута, а также недоступность солей висмута или тетрациклина в некоторых странах являются основным препятствием, связанным с этой терапией. В некоторых исследованиях тетрациклин был заменен амоксициллином (Perri et al. 2002).
Девять рандомизированных контролируемых испытаний были проанализированы в метаанализе (Luther et al. 2010), в котором сравнивали четырехкратную терапию висмутом и тройную терапию кларитромицином; они обнаружили, что четырехкратная терапия висмутом достигла эрадикации у 78 пациентов.3% пациентов, тогда как тройная терапия кларитромицином достигла 77% степени эрадикации. Был сделан вывод о том, что четырех- и трехкратная терапия имеют такие же показатели эрадикации, как и первичная терапия инфекции H. pylori . С другой стороны, эффективность этой терапии была подтверждена в качестве терапии второй линии в метаанализе, основанном на 30 исследованиях, показывающих 77% эрадикации после неэффективности стандартной тройной терапии (Gisbert 2012).
Последовательная терапия
Последовательная терапия использует те же антибиотики, что и стандартная тройная терапия, но их назначают последовательно: 5 дней с ИПП плюс амоксициллин, затем 5 дней с ИПП плюс кларитромицин и амоксициллин (Kuipers 1997).
Амоксициллин вводится первым из-за того, что амоксициллин разрушает стенки бактериальных клеток, предотвращая развитие каналов оттока, по которым остальные антибиотики переносятся из бактерий (Webber and Piddock 2003). Были опубликованы некоторые исследования, большинство из них в Италии, где результат последовательной терапии превосходил обычную стандартную тройную терапию. Более поздние данные исследований, проведенных в Южной Америке и Азии, показывают, что уровень ликвидации составляет менее 80% (Kuipers 1997).
В недавнем метаанализе было рассмотрено 36 рандомизированных клинических испытаний. Уровень эрадикации составил 84,1% для последовательной терапии по сравнению с 75,1% для стандартной тройной терапии. Последовательная терапия кажется более эффективной против пациентов с единственным штаммом, устойчивым к кларитромицину; Частота эрадикации составила 80,9% для последовательной терапии и 40,7% для стандартной тройной терапии (Feng et al. 2015).
Четырехкратная терапия без висмута
Это еще одна эффективная терапия в странах с высокой частотой возникновения резистентности к кларитромицину.Эта терапия содержит ИПП [но без висмута], кларитромицин, амоксициллин и метронидазол в течение 10 дней. Основным недостатком этого лечения является большое количество таблеток по сравнению с другими методами лечения (Papastergiou et al. 2014a, b).
В метаанализе, проведенном в 2012 г., включая рандомизированные контролируемые исследования, сравнивающие четырехкратную терапию без висмута и стандартную тройную терапию, частота эрадикации составила 90% против 78% соответственно. Резистентность к кларитромицину может снизить эффективность четверной терапии без висмута, хотя снижение частоты эрадикации, по-видимому, намного ниже, чем при стандартной тройной терапии (Gisbert and Cavet 2012).
Гибридная терапия
Эта терапия основана на 7-дневной терапии ИПП и амоксициллином, за которой следует 7-дневная четырехкратная терапия ИПП, амоксициллин, кларитромицин и метронидазол. В литературе не так много данных, сравнивающих эту терапию с другими, стандартными или последовательными методами лечения, но результаты не показывают, что гибридная терапия будет лучше последовательной терапии (Papastergiou et al. 2014a, b).
Имеется обзор, в котором было выявлено пять исследований, сравнивающих гибридную терапию и последовательную терапию, и три, сравнивающих гибридную терапию и сопутствующую терапию.Пять рандомизированных контролируемых испытаний не выявили существенных различий между гибридной терапией и последовательной терапией, а три рандомизированных контрольных испытания не показали существенных различий между гибридной терапией и сопутствующей терапией (He et al., 2015).
Терапия на основе левофлоксацина
В связи с увеличением резистентности к кларитромицину левофлоксацин, хинолон широкого спектра действия, используется для эрадикации H. pylori , чтобы заменить кларитромицин в тройных или последовательных схемах.Уровень искоренения терапии, содержащей левофлоксацин, может составлять более 90%, особенно в регионах, где местная резистентность к левофлоксацину низкая [менее 10%]. Что касается кларитромицина и метронидазола, наблюдается повышение устойчивости к левофлоксацину из-за того, что хинолоны часто используются для лечения инфекций мочевыводящих путей. Устойчивость к хинолонам составляет около 20% в Европе, 15% в Америке и 10% в Азии (Liang et al. 2014).
В связи с быстрым развитием вторичной резистентности к хинолонам, использование левофлоксацина первой линии обычно не рекомендуется, и препарат резервируется для использования в схемах второй линии после неудачи схем на основе кларитромицина и / или метронидазола (Gisbert et al.2015).
Пробиотический микроорганизм
Пробиотики – это живые микроорганизмы, которые при введении в адекватных количествах могут улучшить микробный баланс в кишечнике и оказывать положительное влияние на здоровье хозяина (FAO / WHO 2002), включая положительное влияние на предотвращение кишечных инфекции, сердечно-сосудистые заболевания, рак и противоаллергические эффекты (Pianoa et al. 2006).
Пробиотики могут быть микроорганизмами из группы бактерий или дрожжей. Однако большинство пробиотиков – это бактерии, в том числе молочнокислые бактерии, обычно связанные с желудочно-кишечным трактом человека, которые наиболее широко используются (Rodes et al.2013b). В их число входят Gram (+) кокки и палочки Lactobacillus и Bifidobacterium , которые являются двумя наиболее распространенными видами, используемыми в качестве пробиотиков и широко исследуемыми на предмет их положительного воздействия на хозяина, включая содействие созреванию и целостности кишечника, антагонизм против патогенов. и модуляция иммунной системы и опухолевые агенты. Общей чертой этих бактерий является способность к анаэробному перевариванию сахаридов и выработке молочной кислоты.Эти микроорганизмы отличаются устойчивостью к низкому pH и толерантностью к широкому диапазону температур. Естественная экосистема молочнокислых бактерий – это пищеварительный тракт, слизистая оболочка рта и половые пути людей и животных (Rodes et al. 2013a).
В связи с тем, что H. pylori считается трудноизлечимой инфекцией, в основном из-за приобретенной устойчивости к широко используемым антибиотикам, растет интерес к использованию пробиотиков в сочетании со схемами антибиотиков для уничтожения H.пилори. Доказано, что пробиотики полезны при лечении нескольких кишечных заболеваний, таких как диарея, в дополнение к преимуществам пробиотических бактерий в кишечнике; Сообщалось о некоторых благотворных эффектах на желудок. Среди них была изучена активность против Helicobacter pylori (Aiba et al. 2015).
Преимущества пробиотической терапии в случае H. pylori заключаются в увеличении эрадикации и улучшенной переносимости за счет предотвращения возникновения лечения и связанных с ним побочных эффектов.
Кроме того, пробиотики могут помочь в лечении заболеваний, связанных с H. pylori- . Клинический исход инфекции H. pylori определяется несколькими факторами, включая тип штамма H. pylori , степень воспаления и плотность колонизации H. pylori . Сообщалось, что риск развития язвенной болезни и рака желудка увеличивается с увеличением уровня инфекции. Следовательно, постоянное или долгосрочное подавление H.pylori может снизить риск развития заболеваний, связанных с H. pylori- (Yang et al. 2014).
Было проведено несколько исследований, чтобы показать благоприятный эффект различных пробиотиков против H. pylori и прояснить механизм действия пробиотиков против H. pylori , включая прочность слизистого барьера, конкуренцию за адгезию и иммуномодулирующие механизмы. (Папастержиу и др., 2014а, б).
Механизм действия
Неиммунологический механизм
Первой линией защиты от патогенных бактерий является кислотность желудка и барьер слизистой оболочки желудка.Было высказано предположение, что при приеме пробиотиков эта первая линия защиты может быть более сильной из-за выработки антимикробных веществ, конкурирующих с H. pylori за рецепторы адгезии, стимулирующих выработку муцина и стабилизацию барьера слизистой оболочки кишечника.
Противомикробные вещества
Пробиотики могут подавлять рост H. pylori , выделяя короткоцепочечные жирные кислоты и антибактериальные вещества. Короткоцепочечные жирные кислоты, такие как уксусная, пропионовая и молочная кислоты, продуцируются пробиотиками в процессе метаболизма углеводов, и, как следствие, происходит снижение pH.В 1989 году Bhatia et al. (1989) были первой группой, которая наблюдала антагонистический эффект штамма Lactobacillus против H. pylori , относящегося к короткоцепочечным жирным кислотам. Кроме того, антимикробная активность может быть связана с ингибированием уреазной активности H. pylori , как было показано в других публикациях (Sgouras et al. 2004).
Определенные виды Lactobacillus синтезируют противомикробные соединения, относящиеся к классам бактериоцинов. Бактериоцины – это белковые токсины с потенциалом анти- H.pylori активности. Это небольшие диализируемые пептидные структуры с антимикробной активностью. Антимикробная активность бактериоцинов варьировала среди штаммов H. pylori , а также тип бактериоцинов, продуцируемых Lactobacillus sp. Некоторые бактериоцины показали более сильную антибактериальную активность против штаммов H. pylori , чем другие, хотя оба были продуцированы Lactobacillus spp. (Ким и др., 2003).
Конкуренция за адгезию
Существует несколько возможных механизмов, с помощью которых пробиотические бактерии могут ингибировать адгезию H.пилори. Адгезия H. pylori к эпителиальным клеткам важна для определения исхода болезней, ассоциированных с H. pylori ; На способность бактерий устанавливать физический контакт с эпителием желудка влияет влияние слизистой оболочки эпителия, рецепторов, связанных с адгезией H. pylori к эпителию, и иммунных клеток (Zhang et al.2014).
Существует несколько возможных механизмов, с помощью которых пробиотические бактерии могут ингибировать адгезию H.pylori , в основном, молочная кислота и бактериоцины (Lesbros-Pantoflickova et al. 2007).
Барьер слизистой оболочки
Поверхности слизистой оболочки обладают защитными стратегиями для защиты от вредных веществ и патогенов, обнаруженных в просвете кишечника. Некоторые стратегии, такие как муцины, большие сложные гликопротеины, которые защищают поверхность слизистой оболочки кишечника от микробных патогенов, ограничивая доступ вещества окружающей среды к их эпителиальным клеткам (Mack et al. 2003). Идентифицировано несколько муцинов. H. pylori , как известно, подавляет экспрессию генов MUCI и MUC5 в линии клеток желудка человека (Hanisch et al. 2014). Было показано, что исследования in vitro с пробиотиками, такими как L. plantarum и L. rhamnosus , увеличивают экспрессию генов MUC2 и MUC3, и, следовательно, внеклеточная секреция муцина культурами клеток толстой кишки может подавлять прилипание патогенных бактерий. Эта способность этих штаммов восстанавливает проницаемость слизистой оболочки желудка и подавляет прилипание патогенных бактерий, таких как H.pylori .
Иммунологические механизмы
Воспалительная реакция на желудочную инфекцию H. pylori характеризуется высвобождением различных медиаторов воспаления, таких как хемокины и цитокины. Пробиотики могут изменять иммунологический ответ путем модуляции секреции противовоспалительных цитокинов, что может привести к снижению активности желудка и воспалению (Wiese et al. 2012).
Клинические испытания пробиотиков против
H. pyloriОбзорные статьи, касающиеся пробиотиков и H.pylori искали в PUBMED в течение последних 10 лет (с января 2004 г. по июль 2017 г.), вводя такие ключевые слова, как «обзор», «пробиотики», « Helicobacter » и «лечение»; Было получено 159 статей, но только 34 из них касались пробиотиков и H. pylori . На основании данных, содержащихся в этих статьях, пробиотики не могут рассматриваться как альтернатива лечению против H. pylori , но их использование в сочетании со стандартным лечением против H. pylori может улучшить лечение H.pylori за счет увеличения скорости эрадикации, а также уменьшения побочных эффектов текущей медикаментозной терапии. К такому выводу пришли четыре метаанализа, связанных с лечением H. pylori и пробиотиками, опубликованные в период с 2016 по 2017 год (Lü et al., 2016, McFarland et al., 2016, Feng et al., 2017, Wang et al., 2017). .
Существует научный отчет, опубликованный Nature в 2016 году, в котором описывается метаанализ, включавший соответствующие критериям рандомизированные контролируемые испытания с целью определения, могут ли добавки с пробиотиками улучшить состояние H.pylori и уменьшить побочные эффекты во время терапии (Dang et al., 2014). Авторы исследовали эффект комбинирования пробиотиков с плацебо или без него, без стандартной терапии. По сравнению с группой плацебо, в группе пробиотиков было ликвидировано инфекции H. pylori при анализе намерения лечить и согласно протоколу анализа, соответственно, . Пробиотики с тройной терапией плюс 14-дневный курс лечения не улучшили эрадикацию инфекции H. pylori по сравнению с плацебо.Однако пробиотики действительно уменьшили побочные эффекты диареи и тошноты. Эти объединенные данные предполагают, что использование пробиотиков в сочетании со стандартной терапией не улучшает скорость эрадикации инфекции H. pylori по сравнению с плацебо. Некоторые метаанализы показали, что добавление пробиотиков может улучшить скорость эрадикации H. pylori по сравнению с одной терапией. Возможно, широко распространено мнение, что пробиотики могут улучшить эрадикацию H. pylori и уменьшить побочные эффекты при стандартной терапии, но некоторые виды из группы пробиотических бактерий могут помочь в фармакотерапии.Потребление ферментированных продуктов с пищей (например, 250 г кисломолочного продукта) может улучшить работу желудочно-кишечного тракта с хорошими микроорганизмами в желудочно-кишечном тракте. Эти данные свидетельствуют о том, что использование пробиотиков в сочетании со стандартной терапией не улучшает скорость эрадикации инфекции H. pylori по сравнению с плацебо. Плацебо – это имитация или иным образом неэффективное с медицинской точки зрения лечение заболевания или другого медицинского состояния, цель которого – обмануть получателя. Хорошо известно, что физиологические явления тесно связаны с заболеваниями желудка.Кроме того, эффект плацебо вызывает чередование уровней системных и кишечных гормонов и эффектов ожидания субъекта (Dong et al. 2012; Lesbros-Pantoflickova et al. 2007; Ruggiero 2014; Vítor and Vale 2011; Patel et al. 2014; Сачдева и Нагпал 2009; Зоу и др. 2009; Франчески и др. 2007; Лионетти и др. 2010; Чжэн и др. 2013; Патель и др. 2014; Пасифико и др. 2014; Сабби 2011; Тонг и др. 2007; Вильгельм и др., 2011 г .; Готтеланд и др., 2006 г.). Мета-анализ показывает, что уровень эрадикации H.pylori в группе пробиотиков по сравнению с группами плацебо и без плацебо в анализе ITT и оценивает OR с 95% -ным интервалом ковалентности и массовым процентом.
Лечение Helicobacter pylori: антибиотики или пробиотики
Helicobacter pylori – это обычная бактерия, поражающая около половины населения мира, с более высокой распространенностью в развивающихся странах, где H. pylori может заразить до 80% населения (Moayyedi and Hunt 2004), чем в развитых.
H. pylori связан с развитием желудочно-кишечных расстройств, таких как хронический гастрит, язвенная болезнь и аденокарцинома желудка (Kuipers 1997). H. pylori также участвует в развитии других внегастральных заболеваний, таких как лимфома лимфоидной ткани слизистой оболочки (MALT), идиопатическая тромбоцитопеническая пурпура, дефицит витамина B 12 и дефицит железа (Kuipers 1997). Искоренение H. pylori может помочь в борьбе с этими H.pylori -ассоциированные расстройства.
В течение последних двух десятилетий рекомендованным лечением эрадикации H. pylori является стандартная тройная терапия (Papastergiou et al. 2014a, b) с использованием ингибитора протонной помпы или цитрата висмута ранитидина в сочетании с кларитромицином и амоксициллином или метронидазолом. .
В 90-е годы из-за того, что эти методы лечения достигли высоких показателей эрадикации [более 90%] вместе с профилем безопасности, эти тройные методы лечения были очень популярны среди клиницистов (Malfertheiner et al.2007). Эффективность этих тройных схем в последнее время снизилась до показателей ниже 70% из-за устойчивости H. pylori к основным антибиотикам, в основном к кларитромицину, но также к метронидазолу и левофлоксацину (Agudo et al.2010a, b; De Francesco et al. 2009 г.).
Эти низкие показатели успешного лечения неприемлемы в соответствии с Маастрихтским консенсусом, который указывает на то, что показатели, которые постоянно ниже 80% в зависимости от намерения лечить, неприемлемы для лечения H. pylori (Graham et al.2007). Информация о местной резистентности к антибиотикам должна быть принята во внимание, прежде чем составлять план лечения для пациента, чтобы избежать повторного лечения. Несколько воздействий на лечение антибиотиками могут привести к большему количеству побочных эффектов и снижению процента устойчивости к антибиотикам.
По этой причине данный обзор представляет собой обзор эрадикации H. pylori , ориентированный на используемые методы лечения второй линии, такие как последовательная терапия и четырехкратная терапия. Однако из-за повышения устойчивости к антибиотикам некоторые исследования начали уделять внимание пробиотикам как терапевтическому подходу.Пробиотики определяются как живые виды микробов, которые могут включать противовоспалительные и антиоксидантные механизмы, которые могут улучшить микроэкологию кишечника и общее состояние здоровья (Lu et al., 2016). Пробиотики – это живые микроорганизмы, которые при введении в адекватных количествах приносят пользу здоровью хозяина. Наиболее часто используемые пробиотические бактерии – это Lactobacillus и Bifidobacterium (Ruggiero 2014). Пробиотики могут улучшить эрадикацию H. pylori и уменьшить побочные эффекты во время терапии (Kim et al.2008 г.). Часть этого пересмотра будет посвящена использованию пробиотиков против H. pylori .
Устойчивость к антибиотикам H. pyloriКлассическое лечение
В 90-е годы стандартная тройная терапия была золотым стандартом в лечении инфекций H. pylori . Стандартная тройная терапия основана на применении ингибитора протонной помпы, кларитромицина и амоксициллина или метронидазола. Увеличение распространенности устойчивости к этим антибиотикам, особенно к ключевому антибиотику, кларитромицину, снизило эффективность стандартных схем лечения (Malfertheiner et al.2002).
В недавнем систематическом обзоре сообщалось, что глобальная частота первичной устойчивости H. pylori к кларитромицину достигает 17,2%, что свидетельствует о росте во всем мире (Kuipers 1997). Распространенность устойчивости H. pylori к кларитромицину варьируется в разных странах, например, от 10,6 до 25% в Северной Америке, 16% в Японии и от 1,7 до 23,4% в Европе (Elitsur et al. 2006; Horiki et al. 2012 ; Колецко и др., 2006). Это различие в уровнях устойчивости, по-видимому, коррелирует с национальным уровнем потребления макролидов и различной политикой потребления антибиотиков в разных странах (Agudo et al.2010a, b), например, 49% устойчивости к кларитромицину было зарегистрировано в некоторых регионах Испании, но только 1% в Нидерландах, что отражает более строгую политику использования антибиотиков в Северной Европе, чем в странах Южной Европы (Seck et al. 2013) . Новые макролиды начали продаваться в Европе в начале 90-х; пациенты получали макролиды с целью лечения респираторных инфекций антибиотиками этой группы. Дополнительные аспекты, такие как географические особенности, факторы вирулентности H.pylori или некоторые аспекты хозяина [возраст, место рождения] могут способствовать значительному изменению распространенности устойчивости к антибиотикам (Van Doorn et al. 2000).
Метронидазол является ключевым компонентом тройной терапии (Malfertheiner et al. 2002), что связано с высоким уровнем резистентности. Распространенность устойчивости к метронидазолу оценивается от 17 до 44% в Европе и Америке соответственно (Ogata et al. 2013; De Francesco et al. 2010).Самый высокий уровень устойчивости к этому антибиотику в Европе зарегистрирован в Западной Европе, где от 20 до 45% изолятов H. pylori устойчивы к метронидазолу (Lopez-Brea et al. 2001). Сообщается, что процент устойчивости к метронидазолу в развивающихся странах составляет от 50 до 100% вместо 90% в Африке (Falsafi et al. 2004). Устойчивость к метронидазолу настолько высока в развивающихся странах, потому что этот антибиотик широко используется для лечения паразитарных и / или гинекологических инфекций у пациентов женского пола (John et al.2006 г.). Кроме того, есть некоторые исследования, в которых описывается, что устойчивость к метронидазолу связана с факторами вирулентности штаммов, причем штаммы без гена cagA являются более устойчивыми (Taneike et al. 2009). О более низких показателях резистентности к метронидазолу сообщалось в Японии, около 10% (De Francesco et al. 2010).
На основании этих публикаций стандартные тройные методы лечения больше не могут быть рекомендованы для эмпирического использования. Из-за высокого уровня резистентности к двум ключевым антибиотикам стандартной тройной терапии, кларитромицину и метронидазолу, а также к различным моделям резистентности в разных популяциях, стандартные тройные терапии должны быть адаптированы к местному типу резистентности, и, когда это возможно, лечение должно быть изменено. на основе данных о чувствительности, полученных при тестировании штамма после культивирования.
Альтернативные стратегии реализуются в клинической практике для лечения штаммов H. pylori, устойчивых к . Это включало разработку и использование новых и более эффективных методов лечения и использование пробиотиков для улучшения режимов эрадикации и уменьшения побочных эффектов антибиотиков.
В ходе этого пересмотра будут обсуждаться новые методы лечения против H. pylori и пробиотики.
Четырехкратная терапия висмутом
Эта терапия включает два антибиотика, тетрациклин и метронидазол, плюс висмут и ИПП в течение 14 дней (Harb et al.2015). Эта терапия предпочтительна в качестве варианта лечения первой линии для регионов с высокой частотой резистентности к кларитромицину, а также в качестве терапии второй линии, когда первое лечение классической тройной терапией против H. pylori не удалось (Papastergiou et al. 2014a, б). Эта терапия работает совершенно независимо от кларитромицина, наиболее проблемного антибиотика с точки зрения устойчивости. Что касается метронидазола, то использование высоких доз и увеличенная продолжительность лечения позволяет минимизировать воздействие на штаммы, устойчивые к метронидазолу, обеспечивая высокие темпы эрадикации даже в областях с высоким уровнем устойчивости к этому антибиотику (Lee et al.2014).
Потенциальная токсичность висмута, а также недоступность солей висмута или тетрациклина в некоторых странах являются основным препятствием, связанным с этой терапией. В некоторых исследованиях тетрациклин был заменен амоксициллином (Perri et al. 2002).
Девять рандомизированных контролируемых испытаний были проанализированы в метаанализе (Luther et al. 2010), в котором сравнивали четырехкратную терапию висмутом и тройную терапию кларитромицином; они обнаружили, что четырехкратная терапия висмутом достигла эрадикации у 78 пациентов.3% пациентов, тогда как тройная терапия кларитромицином достигла 77% степени эрадикации. Был сделан вывод о том, что четырех- и трехкратная терапия имеют такие же показатели эрадикации, как и первичная терапия инфекции H. pylori . С другой стороны, эффективность этой терапии была подтверждена в качестве терапии второй линии в метаанализе, основанном на 30 исследованиях, показывающих 77% эрадикации после неэффективности стандартной тройной терапии (Gisbert 2012).
Последовательная терапия
Последовательная терапия использует те же антибиотики, что и стандартная тройная терапия, но их назначают последовательно: 5 дней с ИПП плюс амоксициллин, затем 5 дней с ИПП плюс кларитромицин и амоксициллин (Kuipers 1997).
Амоксициллин вводится первым из-за того, что амоксициллин разрушает стенки бактериальных клеток, предотвращая развитие каналов оттока, по которым остальные антибиотики переносятся из бактерий (Webber and Piddock 2003). Были опубликованы некоторые исследования, большинство из них в Италии, где результат последовательной терапии превосходил обычную стандартную тройную терапию. Более поздние данные исследований, проведенных в Южной Америке и Азии, показывают, что уровень ликвидации составляет менее 80% (Kuipers 1997).
В недавнем метаанализе было рассмотрено 36 рандомизированных клинических испытаний. Уровень эрадикации составил 84,1% для последовательной терапии по сравнению с 75,1% для стандартной тройной терапии. Последовательная терапия кажется более эффективной против пациентов с единственным штаммом, устойчивым к кларитромицину; Частота эрадикации составила 80,9% для последовательной терапии и 40,7% для стандартной тройной терапии (Feng et al. 2015).
Четырехкратная терапия без висмута
Это еще одна эффективная терапия в странах с высокой частотой возникновения резистентности к кларитромицину.Эта терапия содержит ИПП [но без висмута], кларитромицин, амоксициллин и метронидазол в течение 10 дней. Основным недостатком этого лечения является большое количество таблеток по сравнению с другими методами лечения (Papastergiou et al. 2014a, b).
В метаанализе, проведенном в 2012 г., включая рандомизированные контролируемые исследования, сравнивающие четырехкратную терапию без висмута и стандартную тройную терапию, частота эрадикации составила 90% против 78% соответственно. Резистентность к кларитромицину может снизить эффективность четверной терапии без висмута, хотя снижение частоты эрадикации, по-видимому, намного ниже, чем при стандартной тройной терапии (Gisbert and Cavet 2012).
Гибридная терапия
Эта терапия основана на 7-дневной терапии ИПП и амоксициллином, за которой следует 7-дневная четырехкратная терапия ИПП, амоксициллин, кларитромицин и метронидазол. В литературе не так много данных, сравнивающих эту терапию с другими, стандартными или последовательными методами лечения, но результаты не показывают, что гибридная терапия будет лучше последовательной терапии (Papastergiou et al. 2014a, b).
Имеется обзор, в котором было выявлено пять исследований, сравнивающих гибридную терапию и последовательную терапию, и три, сравнивающих гибридную терапию и сопутствующую терапию.Пять рандомизированных контролируемых испытаний не выявили существенных различий между гибридной терапией и последовательной терапией, а три рандомизированных контрольных испытания не показали существенных различий между гибридной терапией и сопутствующей терапией (He et al., 2015).
Терапия на основе левофлоксацина
В связи с увеличением резистентности к кларитромицину левофлоксацин, хинолон широкого спектра действия, используется для эрадикации H. pylori , чтобы заменить кларитромицин в тройных или последовательных схемах.Уровень искоренения терапии, содержащей левофлоксацин, может составлять более 90%, особенно в регионах, где местная резистентность к левофлоксацину низкая [менее 10%]. Что касается кларитромицина и метронидазола, наблюдается повышение устойчивости к левофлоксацину из-за того, что хинолоны часто используются для лечения инфекций мочевыводящих путей. Устойчивость к хинолонам составляет около 20% в Европе, 15% в Америке и 10% в Азии (Liang et al. 2014).
В связи с быстрым развитием вторичной резистентности к хинолонам, использование левофлоксацина первой линии обычно не рекомендуется, и препарат резервируется для использования в схемах второй линии после неудачи схем на основе кларитромицина и / или метронидазола (Gisbert et al.2015).
Пробиотический микроорганизм
Пробиотики – это живые микроорганизмы, которые при введении в адекватных количествах могут улучшить микробный баланс в кишечнике и оказывать положительное влияние на здоровье хозяина (FAO / WHO 2002), включая положительное влияние на предотвращение кишечных инфекции, сердечно-сосудистые заболевания, рак и противоаллергические эффекты (Pianoa et al. 2006).
Пробиотики могут быть микроорганизмами из группы бактерий или дрожжей. Однако большинство пробиотиков – это бактерии, в том числе молочнокислые бактерии, обычно связанные с желудочно-кишечным трактом человека, которые наиболее широко используются (Rodes et al.2013b). В их число входят Gram (+) кокки и палочки Lactobacillus и Bifidobacterium , которые являются двумя наиболее распространенными видами, используемыми в качестве пробиотиков и широко исследуемыми на предмет их положительного воздействия на хозяина, включая содействие созреванию и целостности кишечника, антагонизм против патогенов. и модуляция иммунной системы и опухолевые агенты. Общей чертой этих бактерий является способность к анаэробному перевариванию сахаридов и выработке молочной кислоты.Эти микроорганизмы отличаются устойчивостью к низкому pH и толерантностью к широкому диапазону температур. Естественная экосистема молочнокислых бактерий – это пищеварительный тракт, слизистая оболочка рта и половые пути людей и животных (Rodes et al. 2013a).
В связи с тем, что H. pylori считается трудноизлечимой инфекцией, в основном из-за приобретенной устойчивости к широко используемым антибиотикам, растет интерес к использованию пробиотиков в сочетании со схемами антибиотиков для уничтожения H.пилори. Доказано, что пробиотики полезны при лечении нескольких кишечных заболеваний, таких как диарея, в дополнение к преимуществам пробиотических бактерий в кишечнике; Сообщалось о некоторых благотворных эффектах на желудок. Среди них была изучена активность против Helicobacter pylori (Aiba et al. 2015).
Преимущества пробиотической терапии в случае H. pylori заключаются в увеличении эрадикации и улучшенной переносимости за счет предотвращения возникновения лечения и связанных с ним побочных эффектов.
Кроме того, пробиотики могут помочь в лечении заболеваний, связанных с H. pylori- . Клинический исход инфекции H. pylori определяется несколькими факторами, включая тип штамма H. pylori , степень воспаления и плотность колонизации H. pylori . Сообщалось, что риск развития язвенной болезни и рака желудка увеличивается с увеличением уровня инфекции. Следовательно, постоянное или долгосрочное подавление H.pylori может снизить риск развития заболеваний, связанных с H. pylori- (Yang et al. 2014).
Было проведено несколько исследований, чтобы показать благоприятный эффект различных пробиотиков против H. pylori и прояснить механизм действия пробиотиков против H. pylori , включая прочность слизистого барьера, конкуренцию за адгезию и иммуномодулирующие механизмы. (Папастержиу и др., 2014а, б).
Механизм действия
Неиммунологический механизм
Первой линией защиты от патогенных бактерий является кислотность желудка и барьер слизистой оболочки желудка.Было высказано предположение, что при приеме пробиотиков эта первая линия защиты может быть более сильной из-за выработки антимикробных веществ, конкурирующих с H. pylori за рецепторы адгезии, стимулирующих выработку муцина и стабилизацию барьера слизистой оболочки кишечника.
Противомикробные вещества
Пробиотики могут подавлять рост H. pylori , выделяя короткоцепочечные жирные кислоты и антибактериальные вещества. Короткоцепочечные жирные кислоты, такие как уксусная, пропионовая и молочная кислоты, продуцируются пробиотиками в процессе метаболизма углеводов, и, как следствие, происходит снижение pH.В 1989 году Bhatia et al. (1989) были первой группой, которая наблюдала антагонистический эффект штамма Lactobacillus против H. pylori , относящегося к короткоцепочечным жирным кислотам. Кроме того, антимикробная активность может быть связана с ингибированием уреазной активности H. pylori , как было показано в других публикациях (Sgouras et al. 2004).
Определенные виды Lactobacillus синтезируют противомикробные соединения, относящиеся к классам бактериоцинов. Бактериоцины – это белковые токсины с потенциалом анти- H.pylori активности. Это небольшие диализируемые пептидные структуры с антимикробной активностью. Антимикробная активность бактериоцинов варьировала среди штаммов H. pylori , а также тип бактериоцинов, продуцируемых Lactobacillus sp. Некоторые бактериоцины показали более сильную антибактериальную активность против штаммов H. pylori , чем другие, хотя оба были продуцированы Lactobacillus spp. (Ким и др., 2003).
Конкуренция за адгезию
Существует несколько возможных механизмов, с помощью которых пробиотические бактерии могут ингибировать адгезию H.пилори. Адгезия H. pylori к эпителиальным клеткам важна для определения исхода болезней, ассоциированных с H. pylori ; На способность бактерий устанавливать физический контакт с эпителием желудка влияет влияние слизистой оболочки эпителия, рецепторов, связанных с адгезией H. pylori к эпителию, и иммунных клеток (Zhang et al.2014).
Существует несколько возможных механизмов, с помощью которых пробиотические бактерии могут ингибировать адгезию H.pylori , в основном, молочная кислота и бактериоцины (Lesbros-Pantoflickova et al. 2007).
Барьер слизистой оболочки
Поверхности слизистой оболочки обладают защитными стратегиями для защиты от вредных веществ и патогенов, обнаруженных в просвете кишечника. Некоторые стратегии, такие как муцины, большие сложные гликопротеины, которые защищают поверхность слизистой оболочки кишечника от микробных патогенов, ограничивая доступ вещества окружающей среды к их эпителиальным клеткам (Mack et al. 2003). Идентифицировано несколько муцинов. H. pylori , как известно, подавляет экспрессию генов MUCI и MUC5 в линии клеток желудка человека (Hanisch et al. 2014). Было показано, что исследования in vitro с пробиотиками, такими как L. plantarum и L. rhamnosus , увеличивают экспрессию генов MUC2 и MUC3, и, следовательно, внеклеточная секреция муцина культурами клеток толстой кишки может подавлять прилипание патогенных бактерий. Эта способность этих штаммов восстанавливает проницаемость слизистой оболочки желудка и подавляет прилипание патогенных бактерий, таких как H.pylori .
Иммунологические механизмы
Воспалительная реакция на желудочную инфекцию H. pylori характеризуется высвобождением различных медиаторов воспаления, таких как хемокины и цитокины. Пробиотики могут изменять иммунологический ответ путем модуляции секреции противовоспалительных цитокинов, что может привести к снижению активности желудка и воспалению (Wiese et al. 2012).
Клинические испытания пробиотиков против
H. pyloriОбзорные статьи, касающиеся пробиотиков и H.pylori искали в PUBMED в течение последних 10 лет (с января 2004 г. по июль 2017 г.), вводя такие ключевые слова, как «обзор», «пробиотики», « Helicobacter » и «лечение»; Было получено 159 статей, но только 34 из них касались пробиотиков и H. pylori . На основании данных, содержащихся в этих статьях, пробиотики не могут рассматриваться как альтернатива лечению против H. pylori , но их использование в сочетании со стандартным лечением против H. pylori может улучшить лечение H.pylori за счет увеличения скорости эрадикации, а также уменьшения побочных эффектов текущей медикаментозной терапии. К такому выводу пришли четыре метаанализа, связанных с лечением H. pylori и пробиотиками, опубликованные в период с 2016 по 2017 год (Lü et al., 2016, McFarland et al., 2016, Feng et al., 2017, Wang et al., 2017). .
Существует научный отчет, опубликованный Nature в 2016 году, в котором описывается метаанализ, включавший соответствующие критериям рандомизированные контролируемые испытания с целью определения, могут ли добавки с пробиотиками улучшить состояние H.pylori и уменьшить побочные эффекты во время терапии (Dang et al., 2014). Авторы исследовали эффект комбинирования пробиотиков с плацебо или без него, без стандартной терапии. По сравнению с группой плацебо, в группе пробиотиков было ликвидировано инфекции H. pylori при анализе намерения лечить и согласно протоколу анализа, соответственно, . Пробиотики с тройной терапией плюс 14-дневный курс лечения не улучшили эрадикацию инфекции H. pylori по сравнению с плацебо.Однако пробиотики действительно уменьшили побочные эффекты диареи и тошноты. Эти объединенные данные предполагают, что использование пробиотиков в сочетании со стандартной терапией не улучшает скорость эрадикации инфекции H. pylori по сравнению с плацебо. Некоторые метаанализы показали, что добавление пробиотиков может улучшить скорость эрадикации H. pylori по сравнению с одной терапией. Возможно, широко распространено мнение, что пробиотики могут улучшить эрадикацию H. pylori и уменьшить побочные эффекты при стандартной терапии, но некоторые виды из группы пробиотических бактерий могут помочь в фармакотерапии.Потребление ферментированных продуктов с пищей (например, 250 г кисломолочного продукта) может улучшить работу желудочно-кишечного тракта с хорошими микроорганизмами в желудочно-кишечном тракте. Эти данные свидетельствуют о том, что использование пробиотиков в сочетании со стандартной терапией не улучшает скорость эрадикации инфекции H. pylori по сравнению с плацебо. Плацебо – это имитация или иным образом неэффективное с медицинской точки зрения лечение заболевания или другого медицинского состояния, цель которого – обмануть получателя. Хорошо известно, что физиологические явления тесно связаны с заболеваниями желудка.Кроме того, эффект плацебо вызывает чередование уровней системных и кишечных гормонов и эффектов ожидания субъекта (Dong et al. 2012; Lesbros-Pantoflickova et al. 2007; Ruggiero 2014; Vítor and Vale 2011; Patel et al. 2014; Сачдева и Нагпал 2009; Зоу и др. 2009; Франчески и др. 2007; Лионетти и др. 2010; Чжэн и др. 2013; Патель и др. 2014; Пасифико и др. 2014; Сабби 2011; Тонг и др. 2007; Вильгельм и др., 2011 г .; Готтеланд и др., 2006 г.). Мета-анализ показывает, что уровень эрадикации H.pylori в группе пробиотиков по сравнению с группами плацебо и без плацебо в анализе ITT и оценивает OR с 95% -ным интервалом ковалентности и массовым процентом.
Лечение Helicobacter pylori: антибиотики или пробиотики
Helicobacter pylori – это обычная бактерия, поражающая около половины населения мира, с более высокой распространенностью в развивающихся странах, где H. pylori может заразить до 80% населения (Moayyedi and Hunt 2004), чем в развитых.
H. pylori связан с развитием желудочно-кишечных расстройств, таких как хронический гастрит, язвенная болезнь и аденокарцинома желудка (Kuipers 1997). H. pylori также участвует в развитии других внегастральных заболеваний, таких как лимфома лимфоидной ткани слизистой оболочки (MALT), идиопатическая тромбоцитопеническая пурпура, дефицит витамина B 12 и дефицит железа (Kuipers 1997). Искоренение H. pylori может помочь в борьбе с этими H.pylori -ассоциированные расстройства.
В течение последних двух десятилетий рекомендованным лечением эрадикации H. pylori является стандартная тройная терапия (Papastergiou et al. 2014a, b) с использованием ингибитора протонной помпы или цитрата висмута ранитидина в сочетании с кларитромицином и амоксициллином или метронидазолом. .
В 90-е годы из-за того, что эти методы лечения достигли высоких показателей эрадикации [более 90%] вместе с профилем безопасности, эти тройные методы лечения были очень популярны среди клиницистов (Malfertheiner et al.2007). Эффективность этих тройных схем в последнее время снизилась до показателей ниже 70% из-за устойчивости H. pylori к основным антибиотикам, в основном к кларитромицину, но также к метронидазолу и левофлоксацину (Agudo et al.2010a, b; De Francesco et al. 2009 г.).
Эти низкие показатели успешного лечения неприемлемы в соответствии с Маастрихтским консенсусом, который указывает на то, что показатели, которые постоянно ниже 80% в зависимости от намерения лечить, неприемлемы для лечения H. pylori (Graham et al.2007). Информация о местной резистентности к антибиотикам должна быть принята во внимание, прежде чем составлять план лечения для пациента, чтобы избежать повторного лечения. Несколько воздействий на лечение антибиотиками могут привести к большему количеству побочных эффектов и снижению процента устойчивости к антибиотикам.
По этой причине данный обзор представляет собой обзор эрадикации H. pylori , ориентированный на используемые методы лечения второй линии, такие как последовательная терапия и четырехкратная терапия. Однако из-за повышения устойчивости к антибиотикам некоторые исследования начали уделять внимание пробиотикам как терапевтическому подходу.Пробиотики определяются как живые виды микробов, которые могут включать противовоспалительные и антиоксидантные механизмы, которые могут улучшить микроэкологию кишечника и общее состояние здоровья (Lu et al., 2016). Пробиотики – это живые микроорганизмы, которые при введении в адекватных количествах приносят пользу здоровью хозяина. Наиболее часто используемые пробиотические бактерии – это Lactobacillus и Bifidobacterium (Ruggiero 2014). Пробиотики могут улучшить эрадикацию H. pylori и уменьшить побочные эффекты во время терапии (Kim et al.2008 г.). Часть этого пересмотра будет посвящена использованию пробиотиков против H. pylori .
Устойчивость к антибиотикам H. pyloriКлассическое лечение
В 90-е годы стандартная тройная терапия была золотым стандартом в лечении инфекций H. pylori . Стандартная тройная терапия основана на применении ингибитора протонной помпы, кларитромицина и амоксициллина или метронидазола. Увеличение распространенности устойчивости к этим антибиотикам, особенно к ключевому антибиотику, кларитромицину, снизило эффективность стандартных схем лечения (Malfertheiner et al.2002).
В недавнем систематическом обзоре сообщалось, что глобальная частота первичной устойчивости H. pylori к кларитромицину достигает 17,2%, что свидетельствует о росте во всем мире (Kuipers 1997). Распространенность устойчивости H. pylori к кларитромицину варьируется в разных странах, например, от 10,6 до 25% в Северной Америке, 16% в Японии и от 1,7 до 23,4% в Европе (Elitsur et al. 2006; Horiki et al. 2012 ; Колецко и др., 2006). Это различие в уровнях устойчивости, по-видимому, коррелирует с национальным уровнем потребления макролидов и различной политикой потребления антибиотиков в разных странах (Agudo et al.2010a, b), например, 49% устойчивости к кларитромицину было зарегистрировано в некоторых регионах Испании, но только 1% в Нидерландах, что отражает более строгую политику использования антибиотиков в Северной Европе, чем в странах Южной Европы (Seck et al. 2013) . Новые макролиды начали продаваться в Европе в начале 90-х; пациенты получали макролиды с целью лечения респираторных инфекций антибиотиками этой группы. Дополнительные аспекты, такие как географические особенности, факторы вирулентности H.pylori или некоторые аспекты хозяина [возраст, место рождения] могут способствовать значительному изменению распространенности устойчивости к антибиотикам (Van Doorn et al. 2000).
Метронидазол является ключевым компонентом тройной терапии (Malfertheiner et al. 2002), что связано с высоким уровнем резистентности. Распространенность устойчивости к метронидазолу оценивается от 17 до 44% в Европе и Америке соответственно (Ogata et al. 2013; De Francesco et al. 2010).Самый высокий уровень устойчивости к этому антибиотику в Европе зарегистрирован в Западной Европе, где от 20 до 45% изолятов H. pylori устойчивы к метронидазолу (Lopez-Brea et al. 2001). Сообщается, что процент устойчивости к метронидазолу в развивающихся странах составляет от 50 до 100% вместо 90% в Африке (Falsafi et al. 2004). Устойчивость к метронидазолу настолько высока в развивающихся странах, потому что этот антибиотик широко используется для лечения паразитарных и / или гинекологических инфекций у пациентов женского пола (John et al.2006 г.). Кроме того, есть некоторые исследования, в которых описывается, что устойчивость к метронидазолу связана с факторами вирулентности штаммов, причем штаммы без гена cagA являются более устойчивыми (Taneike et al. 2009). О более низких показателях резистентности к метронидазолу сообщалось в Японии, около 10% (De Francesco et al. 2010).
На основании этих публикаций стандартные тройные методы лечения больше не могут быть рекомендованы для эмпирического использования. Из-за высокого уровня резистентности к двум ключевым антибиотикам стандартной тройной терапии, кларитромицину и метронидазолу, а также к различным моделям резистентности в разных популяциях, стандартные тройные терапии должны быть адаптированы к местному типу резистентности, и, когда это возможно, лечение должно быть изменено. на основе данных о чувствительности, полученных при тестировании штамма после культивирования.
Альтернативные стратегии реализуются в клинической практике для лечения штаммов H. pylori, устойчивых к . Это включало разработку и использование новых и более эффективных методов лечения и использование пробиотиков для улучшения режимов эрадикации и уменьшения побочных эффектов антибиотиков.
В ходе этого пересмотра будут обсуждаться новые методы лечения против H. pylori и пробиотики.
Четырехкратная терапия висмутом
Эта терапия включает два антибиотика, тетрациклин и метронидазол, плюс висмут и ИПП в течение 14 дней (Harb et al.2015). Эта терапия предпочтительна в качестве варианта лечения первой линии для регионов с высокой частотой резистентности к кларитромицину, а также в качестве терапии второй линии, когда первое лечение классической тройной терапией против H. pylori не удалось (Papastergiou et al. 2014a, б). Эта терапия работает совершенно независимо от кларитромицина, наиболее проблемного антибиотика с точки зрения устойчивости. Что касается метронидазола, то использование высоких доз и увеличенная продолжительность лечения позволяет минимизировать воздействие на штаммы, устойчивые к метронидазолу, обеспечивая высокие темпы эрадикации даже в областях с высоким уровнем устойчивости к этому антибиотику (Lee et al.2014).
Потенциальная токсичность висмута, а также недоступность солей висмута или тетрациклина в некоторых странах являются основным препятствием, связанным с этой терапией. В некоторых исследованиях тетрациклин был заменен амоксициллином (Perri et al. 2002).
Девять рандомизированных контролируемых испытаний были проанализированы в метаанализе (Luther et al. 2010), в котором сравнивали четырехкратную терапию висмутом и тройную терапию кларитромицином; они обнаружили, что четырехкратная терапия висмутом достигла эрадикации у 78 пациентов.3% пациентов, тогда как тройная терапия кларитромицином достигла 77% степени эрадикации. Был сделан вывод о том, что четырех- и трехкратная терапия имеют такие же показатели эрадикации, как и первичная терапия инфекции H. pylori . С другой стороны, эффективность этой терапии была подтверждена в качестве терапии второй линии в метаанализе, основанном на 30 исследованиях, показывающих 77% эрадикации после неэффективности стандартной тройной терапии (Gisbert 2012).
Последовательная терапия
Последовательная терапия использует те же антибиотики, что и стандартная тройная терапия, но их назначают последовательно: 5 дней с ИПП плюс амоксициллин, затем 5 дней с ИПП плюс кларитромицин и амоксициллин (Kuipers 1997).
Амоксициллин вводится первым из-за того, что амоксициллин разрушает стенки бактериальных клеток, предотвращая развитие каналов оттока, по которым остальные антибиотики переносятся из бактерий (Webber and Piddock 2003). Были опубликованы некоторые исследования, большинство из них в Италии, где результат последовательной терапии превосходил обычную стандартную тройную терапию. Более поздние данные исследований, проведенных в Южной Америке и Азии, показывают, что уровень ликвидации составляет менее 80% (Kuipers 1997).
В недавнем метаанализе было рассмотрено 36 рандомизированных клинических испытаний. Уровень эрадикации составил 84,1% для последовательной терапии по сравнению с 75,1% для стандартной тройной терапии. Последовательная терапия кажется более эффективной против пациентов с единственным штаммом, устойчивым к кларитромицину; Частота эрадикации составила 80,9% для последовательной терапии и 40,7% для стандартной тройной терапии (Feng et al. 2015).
Четырехкратная терапия без висмута
Это еще одна эффективная терапия в странах с высокой частотой возникновения резистентности к кларитромицину.Эта терапия содержит ИПП [но без висмута], кларитромицин, амоксициллин и метронидазол в течение 10 дней. Основным недостатком этого лечения является большое количество таблеток по сравнению с другими методами лечения (Papastergiou et al. 2014a, b).
В метаанализе, проведенном в 2012 г., включая рандомизированные контролируемые исследования, сравнивающие четырехкратную терапию без висмута и стандартную тройную терапию, частота эрадикации составила 90% против 78% соответственно. Резистентность к кларитромицину может снизить эффективность четверной терапии без висмута, хотя снижение частоты эрадикации, по-видимому, намного ниже, чем при стандартной тройной терапии (Gisbert and Cavet 2012).
Гибридная терапия
Эта терапия основана на 7-дневной терапии ИПП и амоксициллином, за которой следует 7-дневная четырехкратная терапия ИПП, амоксициллин, кларитромицин и метронидазол. В литературе не так много данных, сравнивающих эту терапию с другими, стандартными или последовательными методами лечения, но результаты не показывают, что гибридная терапия будет лучше последовательной терапии (Papastergiou et al. 2014a, b).
Имеется обзор, в котором было выявлено пять исследований, сравнивающих гибридную терапию и последовательную терапию, и три, сравнивающих гибридную терапию и сопутствующую терапию.Пять рандомизированных контролируемых испытаний не выявили существенных различий между гибридной терапией и последовательной терапией, а три рандомизированных контрольных испытания не показали существенных различий между гибридной терапией и сопутствующей терапией (He et al., 2015).
Терапия на основе левофлоксацина
В связи с увеличением резистентности к кларитромицину левофлоксацин, хинолон широкого спектра действия, используется для эрадикации H. pylori , чтобы заменить кларитромицин в тройных или последовательных схемах.Уровень искоренения терапии, содержащей левофлоксацин, может составлять более 90%, особенно в регионах, где местная резистентность к левофлоксацину низкая [менее 10%]. Что касается кларитромицина и метронидазола, наблюдается повышение устойчивости к левофлоксацину из-за того, что хинолоны часто используются для лечения инфекций мочевыводящих путей. Устойчивость к хинолонам составляет около 20% в Европе, 15% в Америке и 10% в Азии (Liang et al. 2014).
В связи с быстрым развитием вторичной резистентности к хинолонам, использование левофлоксацина первой линии обычно не рекомендуется, и препарат резервируется для использования в схемах второй линии после неудачи схем на основе кларитромицина и / или метронидазола (Gisbert et al.2015).
Пробиотический микроорганизм
Пробиотики – это живые микроорганизмы, которые при введении в адекватных количествах могут улучшить микробный баланс в кишечнике и оказывать положительное влияние на здоровье хозяина (FAO / WHO 2002), включая положительное влияние на предотвращение кишечных инфекции, сердечно-сосудистые заболевания, рак и противоаллергические эффекты (Pianoa et al. 2006).
Пробиотики могут быть микроорганизмами из группы бактерий или дрожжей. Однако большинство пробиотиков – это бактерии, в том числе молочнокислые бактерии, обычно связанные с желудочно-кишечным трактом человека, которые наиболее широко используются (Rodes et al.2013b). В их число входят Gram (+) кокки и палочки Lactobacillus и Bifidobacterium , которые являются двумя наиболее распространенными видами, используемыми в качестве пробиотиков и широко исследуемыми на предмет их положительного воздействия на хозяина, включая содействие созреванию и целостности кишечника, антагонизм против патогенов. и модуляция иммунной системы и опухолевые агенты. Общей чертой этих бактерий является способность к анаэробному перевариванию сахаридов и выработке молочной кислоты.Эти микроорганизмы отличаются устойчивостью к низкому pH и толерантностью к широкому диапазону температур. Естественная экосистема молочнокислых бактерий – это пищеварительный тракт, слизистая оболочка рта и половые пути людей и животных (Rodes et al. 2013a).
В связи с тем, что H. pylori считается трудноизлечимой инфекцией, в основном из-за приобретенной устойчивости к широко используемым антибиотикам, растет интерес к использованию пробиотиков в сочетании со схемами антибиотиков для уничтожения H.пилори. Доказано, что пробиотики полезны при лечении нескольких кишечных заболеваний, таких как диарея, в дополнение к преимуществам пробиотических бактерий в кишечнике; Сообщалось о некоторых благотворных эффектах на желудок. Среди них была изучена активность против Helicobacter pylori (Aiba et al. 2015).
Преимущества пробиотической терапии в случае H. pylori заключаются в увеличении эрадикации и улучшенной переносимости за счет предотвращения возникновения лечения и связанных с ним побочных эффектов.
Кроме того, пробиотики могут помочь в лечении заболеваний, связанных с H. pylori- . Клинический исход инфекции H. pylori определяется несколькими факторами, включая тип штамма H. pylori , степень воспаления и плотность колонизации H. pylori . Сообщалось, что риск развития язвенной болезни и рака желудка увеличивается с увеличением уровня инфекции. Следовательно, постоянное или долгосрочное подавление H.pylori может снизить риск развития заболеваний, связанных с H. pylori- (Yang et al. 2014).
Было проведено несколько исследований, чтобы показать благоприятный эффект различных пробиотиков против H. pylori и прояснить механизм действия пробиотиков против H. pylori , включая прочность слизистого барьера, конкуренцию за адгезию и иммуномодулирующие механизмы. (Папастержиу и др., 2014а, б).
Механизм действия
Неиммунологический механизм
Первой линией защиты от патогенных бактерий является кислотность желудка и барьер слизистой оболочки желудка.Было высказано предположение, что при приеме пробиотиков эта первая линия защиты может быть более сильной из-за выработки антимикробных веществ, конкурирующих с H. pylori за рецепторы адгезии, стимулирующих выработку муцина и стабилизацию барьера слизистой оболочки кишечника.
Противомикробные вещества
Пробиотики могут подавлять рост H. pylori , выделяя короткоцепочечные жирные кислоты и антибактериальные вещества. Короткоцепочечные жирные кислоты, такие как уксусная, пропионовая и молочная кислоты, продуцируются пробиотиками в процессе метаболизма углеводов, и, как следствие, происходит снижение pH.В 1989 году Bhatia et al. (1989) были первой группой, которая наблюдала антагонистический эффект штамма Lactobacillus против H. pylori , относящегося к короткоцепочечным жирным кислотам. Кроме того, антимикробная активность может быть связана с ингибированием уреазной активности H. pylori , как было показано в других публикациях (Sgouras et al. 2004).
Определенные виды Lactobacillus синтезируют противомикробные соединения, относящиеся к классам бактериоцинов. Бактериоцины – это белковые токсины с потенциалом анти- H.pylori активности. Это небольшие диализируемые пептидные структуры с антимикробной активностью. Антимикробная активность бактериоцинов варьировала среди штаммов H. pylori , а также тип бактериоцинов, продуцируемых Lactobacillus sp. Некоторые бактериоцины показали более сильную антибактериальную активность против штаммов H. pylori , чем другие, хотя оба были продуцированы Lactobacillus spp. (Ким и др., 2003).
Конкуренция за адгезию
Существует несколько возможных механизмов, с помощью которых пробиотические бактерии могут ингибировать адгезию H.пилори. Адгезия H. pylori к эпителиальным клеткам важна для определения исхода болезней, ассоциированных с H. pylori ; На способность бактерий устанавливать физический контакт с эпителием желудка влияет влияние слизистой оболочки эпителия, рецепторов, связанных с адгезией H. pylori к эпителию, и иммунных клеток (Zhang et al.2014).
Существует несколько возможных механизмов, с помощью которых пробиотические бактерии могут ингибировать адгезию H.pylori , в основном, молочная кислота и бактериоцины (Lesbros-Pantoflickova et al. 2007).
Барьер слизистой оболочки
Поверхности слизистой оболочки обладают защитными стратегиями для защиты от вредных веществ и патогенов, обнаруженных в просвете кишечника. Некоторые стратегии, такие как муцины, большие сложные гликопротеины, которые защищают поверхность слизистой оболочки кишечника от микробных патогенов, ограничивая доступ вещества окружающей среды к их эпителиальным клеткам (Mack et al. 2003). Идентифицировано несколько муцинов. H. pylori , как известно, подавляет экспрессию генов MUCI и MUC5 в линии клеток желудка человека (Hanisch et al. 2014). Было показано, что исследования in vitro с пробиотиками, такими как L. plantarum и L. rhamnosus , увеличивают экспрессию генов MUC2 и MUC3, и, следовательно, внеклеточная секреция муцина культурами клеток толстой кишки может подавлять прилипание патогенных бактерий. Эта способность этих штаммов восстанавливает проницаемость слизистой оболочки желудка и подавляет прилипание патогенных бактерий, таких как H.pylori .
Иммунологические механизмы
Воспалительная реакция на желудочную инфекцию H. pylori характеризуется высвобождением различных медиаторов воспаления, таких как хемокины и цитокины. Пробиотики могут изменять иммунологический ответ путем модуляции секреции противовоспалительных цитокинов, что может привести к снижению активности желудка и воспалению (Wiese et al. 2012).
Клинические испытания пробиотиков против
H. pyloriОбзорные статьи, касающиеся пробиотиков и H.pylori искали в PUBMED в течение последних 10 лет (с января 2004 г. по июль 2017 г.), вводя такие ключевые слова, как «обзор», «пробиотики», « Helicobacter » и «лечение»; Было получено 159 статей, но только 34 из них касались пробиотиков и H. pylori . На основании данных, содержащихся в этих статьях, пробиотики не могут рассматриваться как альтернатива лечению против H. pylori , но их использование в сочетании со стандартным лечением против H. pylori может улучшить лечение H.pylori за счет увеличения скорости эрадикации, а также уменьшения побочных эффектов текущей медикаментозной терапии. К такому выводу пришли четыре метаанализа, связанных с лечением H. pylori и пробиотиками, опубликованные в период с 2016 по 2017 год (Lü et al., 2016, McFarland et al., 2016, Feng et al., 2017, Wang et al., 2017). .
Существует научный отчет, опубликованный Nature в 2016 году, в котором описывается метаанализ, включавший соответствующие критериям рандомизированные контролируемые испытания с целью определения, могут ли добавки с пробиотиками улучшить состояние H.pylori и уменьшить побочные эффекты во время терапии (Dang et al., 2014). Авторы исследовали эффект комбинирования пробиотиков с плацебо или без него, без стандартной терапии. По сравнению с группой плацебо, в группе пробиотиков было ликвидировано инфекции H. pylori при анализе намерения лечить и согласно протоколу анализа, соответственно, . Пробиотики с тройной терапией плюс 14-дневный курс лечения не улучшили эрадикацию инфекции H. pylori по сравнению с плацебо.Однако пробиотики действительно уменьшили побочные эффекты диареи и тошноты. Эти объединенные данные предполагают, что использование пробиотиков в сочетании со стандартной терапией не улучшает скорость эрадикации инфекции H. pylori по сравнению с плацебо. Некоторые метаанализы показали, что добавление пробиотиков может улучшить скорость эрадикации H. pylori по сравнению с одной терапией. Возможно, широко распространено мнение, что пробиотики могут улучшить эрадикацию H. pylori и уменьшить побочные эффекты при стандартной терапии, но некоторые виды из группы пробиотических бактерий могут помочь в фармакотерапии.Потребление ферментированных продуктов с пищей (например, 250 г кисломолочного продукта) может улучшить работу желудочно-кишечного тракта с хорошими микроорганизмами в желудочно-кишечном тракте. Эти данные свидетельствуют о том, что использование пробиотиков в сочетании со стандартной терапией не улучшает скорость эрадикации инфекции H. pylori по сравнению с плацебо. Плацебо – это имитация или иным образом неэффективное с медицинской точки зрения лечение заболевания или другого медицинского состояния, цель которого – обмануть получателя. Хорошо известно, что физиологические явления тесно связаны с заболеваниями желудка.Кроме того, эффект плацебо вызывает чередование уровней системных и кишечных гормонов и эффектов ожидания субъекта (Dong et al. 2012; Lesbros-Pantoflickova et al. 2007; Ruggiero 2014; Vítor and Vale 2011; Patel et al. 2014; Сачдева и Нагпал 2009; Зоу и др. 2009; Франчески и др. 2007; Лионетти и др. 2010; Чжэн и др. 2013; Патель и др. 2014; Пасифико и др. 2014; Сабби 2011; Тонг и др. 2007; Вильгельм и др., 2011 г .; Готтеланд и др., 2006 г.). Мета-анализ показывает, что уровень эрадикации H.pylori в группе пробиотиков по сравнению с группами плацебо и без плацебо в анализе ITT и оценивает OR с 95% -ным интервалом ковалентности и массовым процентом.
Соображения по подходу, медицинское обслуживание, профилактика
[Рекомендации] Сугано К., Тэк Дж., Койперс Э.Дж. и др. Для преподавателей Киотской конференции по глобальному консенсусу. Киотский глобальный консенсусный отчет по гастриту Helicobacter pylori. Кишечник . 2015 Сентябрь 64 (9): 1353-67. [Медлайн].
Младенова I, Дураццо М.Передача Helicobacter pylori. Минерва Гастроэнтерол Диетол . 2018 сентябрь 64 (3): 251-4. [Медлайн].
Хорики Н., Омата Ф., Уэмура М. и др. Ежегодное изменение первичной устойчивости к кларитромицину среди изолятов Helicobacter pylori с 1996 по 2008 год в Японии. Хеликобактер . 2009 14 октября (5): 86-90. [Медлайн].
Fallone CA. Эпидемиология устойчивости Helicobacter pylori к антибиотикам в Канаде. Банка J Гастроэнтерол .2000 14 ноября (10): 879-82. [Медлайн].
Hage N, Renshaw JG, Winkler GS, Gellert P, Stolnik S, Falcone FH. Улучшенная экспрессия и очистка адгезина BabA Helicobacter pylori за счет включения гекса-лизиновой метки. Протеин Expr Purif . 2015 фев. 106: 25-30. [Медлайн]. [Полный текст].
Tomb JF, White O, Kerlavage AR и др. Полная последовательность генома возбудителя желудочного сока Helicobacter pylori. Природа .1997, 7 августа. 388 (6642): 539-47. [Медлайн].
Lowenthal AC, Hill M, Sycuro LK, et al. Функциональный анализ белков переключателей жгутиков Helicobacter pylori. Дж Бактериол . 2009 декабрь 191 (23): 7147-56. [Медлайн]. [Полный текст].
Гианнакис М., Чен С.Л., Карам С.М. и др. Эволюция Helicobacter pylori при прогрессировании хронического атрофического гастрита до рака желудка и ее влияние на стволовые клетки желудка. Proc Natl Acad Sci U S A .2008 Март 105 (11): 4358-63. [Медлайн].
Lehours P. Фактический диагноз инфекции Helicobacter pylori. Минерва Гастроэнтерол Диетол . 2018 Сентябрь 64 (3): 267-79. [Медлайн].
Pullen LC. Объясняет ли эрадикация H.pylori рост ожирения? Медицинские новости Medscape от WebMD. 9 июня 2014 г. Доступно по адресу http://www.medscape.com/viewarticle/826406. Доступ: 19 июня 2014 г.
Кредитор Н., Талли, штат Нью-Джерси, Энк П. и др.Обзорная статья: связь между Helicobacter pylori и ожирением – экологическое исследование. Алимент Фармакол Тер . 2014 июл. 40 (1): 24-31. [Медлайн].
[Рекомендации] Shah SC, Iyer PG, Moss SF. Обновление клинической практики AGA по ведению рефрактерной инфекции Helicobacter pylori: экспертный обзор. Гастроэнтерология . 2021 Апрель 160 (5): 1831-41. [Медлайн]. [Полный текст].
Koletzko L, Macke L, Schulz C, Malfertheiner P.Эрадикация Helicobacter pylori при диспепсии: новые доказательства симптоматической пользы. Лучший Практик Рес Клин Гастроэнтерол . 2019 июн – август 40–1: 101637. [Медлайн].
Лютер Дж., Дэйв М., Хиггинс П.П., Као Дж. Связь между инфекцией Helicobacter pylori и воспалительным заболеванием кишечника: метаанализ и систематический обзор литературы. Воспаление кишечника . 2010 июн.16 (6): 1077-84. [Медлайн].
Джексон Л., Бриттон Дж., Льюис С.А. и др.Популяционное эпидемиологическое исследование инфекции Helicobacter pylori и ее связи с системным воспалением. Хеликобактер . 2009 октября, 14 (5): 108-13. [Медлайн].
[Рекомендации] Тараскони А., Кокколини Ф., Биффл В.Л., et al. Перфорированная и кровоточащая язвенная болезнь: рекомендации WSES. Мир J Emerg Surg . 2020. 15: 3. [Медлайн]. [Полный текст].
Hsu PI, Wu DC, Chen WC, et al. Рандомизированное контролируемое исследование, сравнивающее 7-дневную тройную, 10-дневную последовательную и 7-дневную сопутствующую терапию инфекции Helicobacter pylori. Противомикробные агенты Chemother . 2014 Октябрь 58 (10): 5936-42. [Медлайн].
Pellicano R, Zagari RM, Zhang S, Saracco GM, Moss SF. Фармакологические соображения и пошаговое предложение по лечению инфекции Helicobacter pylori в 2018 году. Minerva Gastroenterol Dietol . 2018 Сентябрь 64 (3): 310-21. [Медлайн].
Papastergiou V, Georgopoulos SD, Karatapanis S. Лечение инфекции Helicobacter pylori: решение проблемы устойчивости к противомикробным препаратам. Мир Дж. Гастроэнтерол . 2014 7 августа. 20 (29): 9898-911. [Медлайн].
Gisbert JP, Castro-Fernandez M, Perez-Aisa A, et al. Спасательная терапия четвертой линии с рифабутином у пациентов с тремя неудачами эрадикации Helicobacter pylori. Алимент Фармакол Тер . 2012 апр. 35 (8): 941-7. [Медлайн]. [Полный текст].
Лю X, Ван Х, Lv Z, и др. Спасательная терапия с ингибитором протонной помпы плюс амоксициллин и рифабутин для инфекции Helicobacter pylori: систематический обзор и метаанализ. Гастроэнтерол Рес Прак . 2015. 2015: 415648. [Медлайн]. [Полный текст].
Сафаров Т., Киран Б., Багирова М., Аллахвердиев А.М., Абамор Э.С. Обзор основанных на нанотехнологиях подходов к лечению Helicobacter Pylori. Expert Rev Anti Infect Ther . 2019 8 октября [Medline].
Ниаз Т., Ихсан А., Аббаси Р., Шаббир С., Нур Т., Имран М. Основанные на хитозане-альбумине нано-антимикробные вещества оболочки и короны для уничтожения резистентных желудочных патогенов. Инт Дж Биол Макромол . 1 октября 2019 г. 138: 1006-18. [Медлайн].
Zhi X, Liu Y, Lin L и др. Устные pH-чувствительные нанозонды GNS @ ab для таргетной терапии Helicobacter pylori без нарушения микробиома кишечника. Наномедицина . 20 августа 2019: 10 [Медлайн].
de Avila BE, Angsantikul P, Li J, et al. Активная доставка лекарств с помощью микромотора для лечения желудочной инфекции in vivo. Нац Коммуна . 2017 16 августа.8 (1): 272. [Медлайн]. [Полный текст].
Гринберг Э. Р., Андерсон Г. Л., Морган Д. Р. и др. 14-дневная тройная, 5-дневная сопутствующая и 10-дневная последовательная терапия инфекции Helicobacter pylori в семи странах Латинской Америки: рандомизированное исследование. Ланцет . 2011 6 августа. 378 (9790): 507-14. [Медлайн].
Liou JM, Lin JT, Chang CY и др. Тройная терапия на основе левофлоксацина и кларитромицина в качестве терапии первого и второго ряда при инфекции Helicobacter pylori: рандомизированное сравнительное исследование с перекрестным дизайном. Кишечник . 2010 май. 59 (5): 572-8. [Медлайн].
Apostolopoulos P, Koumoutsos I, Ekmektzoglou K, et al. Сопутствующая терапия по сравнению с последовательной терапией для лечения инфекции Helicobacter pylori: греческое рандомизированное проспективное исследование. Сканд Дж Гастроэнтерол . 2016 Февраль 51 (2): 145-51. [Медлайн].
Юн Х., Ким Н., Ли Б.Х. и др. Тройная терапия, содержащая моксифлоксацин, в качестве лечения второй линии при инфекции Helicobacter pylori: влияние продолжительности лечения и устойчивости к антибиотикам на скорость эрадикации. Хеликобактер . 2009 октября, 14 (5): 77-85. [Медлайн].
Malfertheiner P, Bazzoli F, Delchier JC, et al. Эрадикация Helicobacter pylori с помощью капсулы, содержащей субцитрат висмута калия, метронидазол и тетрациклин, с омепразолом по сравнению с тройной терапией на основе кларитромицина: рандомизированное открытое исследование не меньшей эффективности, фаза 3. Ланцет . 2011 12 марта. 377 (9769): 905-13. [Медлайн].
Ли С.Б., Ян Дж.В., Ким С.С.Связь между MALT-лимфомой конъюнктивы и Helicobacter pylori. Br J Офтальмол . 2008 апр. 92 (4): 534-6. [Медлайн].
Aanpreung P. Предполагаемые параметры эрадикационной терапии у детей с гастритом Helicobacter pylori. J Med Assoc Thai . 2005 г., ноябрь 88, приложение 8: S21-6. [Медлайн].
Adachi K, Hashimoto T, Komazawa Y, et al. Инфекция Helicobacter pylori влияет на симптоматический ответ на антисекреторную терапию у пациентов с ГЭРБ – перекрестное сравнительное исследование с фамотидином и низкими дозами лансопразола. Dig Liver Dis . 2005 июл. 37 (7): 485-90. [Медлайн].
Александр Г.А., Броули О.В. Связь инфекции Helicobacter pylori с раком желудка. Мил Мед . 2000, январь, 165 (1): 21-7. [Медлайн].
Ceponis PJ, Jones NL. Модуляция путей передачи сигнала клетки-хозяина инфекцией Helicobacter pylori. Банка J Гастроэнтерол . 2005 июля 19 (7): 415-20. [Медлайн].
Chelimsky G, Czinn SJ.Инфекция Helicobacter pylori у детей: обновленная информация. Curr Opin Pediatr . 2000 октября, 12 (5): 460-2. [Медлайн].
Cheng TY, Lin JT, Chen LT и др. Ассоциация полиморфизмов регуляторных генов Т-клеток с предрасположенностью к лимфоме лимфоидной ткани, ассоциированной со слизистой оболочкой желудка. Дж Клин Онкол . 20 июля 2006 г. 24 (21): 3483-9. [Медлайн].
Чицази М.Т., Фаттахи Э., Фарахани Р.М. и др. Helicobacter pylori в зубном налете: имеет ли значение для диагностики желудочной инфекции ?. Med Oral Patol Oral Cir Bucal . 1 июля 2006 г. 11 (4): E325-8. [Медлайн].
Краанен М.Э., Блок П., Деккер В. и др. Helicobacter pylori и ранний рак желудка. Кишечник . 1994 окт. 35 (10): 1372-4. [Медлайн].
Давыдов Л, Ченг Ж. Связь инфекции и ишемической болезни сердца: обновленная информация. Заключение эксперта по расследованию наркотиков . 2000 ноября, 9 (11): 2505-17. [Медлайн].
Demirel A, Oncel S, Caydere M, et al.Инфекция Helicobacter pylori в образцах гастрэктомии. Интернет-журнал гастроэнтерологии 2000; 1 (1) . [Полный текст].
Данн Б.Е., Коэн Х., Блазер М.Дж. Helicobacter pylori. Clin Microbiol Ред. . 1997.10.10 (4): 720-41. [Медлайн].
Итон К.А., Бенсон Л.Х., Хэгер Дж. И др. Роль экспрессии фактора транскрипции T-bet клетками CD4 + при гастрите, вызванном Helicobacter pylori у мышей. Заражение иммунной .2006 Август 74 (8): 4673-84. [Медлайн].
Эль-Омар Э.М., Кэррингтон М., Чоу WH и др. Полиморфизм интерлейкина-1, связанный с повышенным риском рака желудка. Природа . 2000 23 марта. 404 (6776): 398-402. [Медлайн].
Эрджан И., Чакир Б.О., Узел Т.С. и др. Роль желудочной инфекции Helicobacter pylori в ларингофарингеальной рефлюксной болезни. Отоларингол Хирургия головы и шеи . 2006 июль 135 (1): 52-5. [Медлайн].
Fallone CA, Barkun AN, Friedman G, et al.Связана ли эрадикация Helicobacter pylori с гастроэзофагеальной рефлюксной болезнью? Ам Дж. Гастроэнтерол . 2000 апр. 95 (4): 914-20. [Медлайн].
Farag TH, Stoltzfus RJ, Khalfan SS, et al. Инфекция Helicobacter pylori связана с тяжелой анемией беременных на острове Пемба, Занзибар. Ам Дж. Троп Мед Хиг . 2007 Март 76 (3): 541-8. [Медлайн].
Фиорини Г., Вакил Н., Зулло А. и др. Селекционная терапия на основе культур для пациентов, которые не ответили на предыдущее лечение инфекции Helicobacter pylori. Клин Гастроэнтерол Гепатол . 2013 май. 11 (5): 507-10. [Медлайн].
Fischbach W. Первичная лимфома желудка MALT: соображения патогенеза, диагностики и лечения. Банка J Гастроэнтерол . 2000 14 ноября Дополнение D: 44D-50D. [Медлайн].
Фок К.М., Кателарис П., Сугано К. и др. Второе Азиатско-Тихоокеанское согласованное руководство по инфекции Helicobacter pylori. Дж Гастроэнтерол Гепатол . 2009 24 октября (10): 1587-600.[Медлайн].
Фрестон JW. Лечение язвенной болезни: новые вопросы. Мир J Surg . 2000 марта, 24 (3): 250-5. [Медлайн].
Гарсия-Альтес А., Рота Р., Баренис М. и др. Экономическая эффективность стратегии «оценка и масштаб» для лечения диспепсии. Eur J Гастроэнтерол Hepatol . 2005 июл.17 (7): 709-19. [Медлайн].
Gatopoulou A, Mimidis K, Giatromanolaki A, et al. Влияние инфекции Helicobacter pylori на гистологические изменения при неэрозивной рефлюксной болезни. Мир Дж. Гастроэнтерол . 2004 15 апреля. 10 (8): 1180-2. [Медлайн].
Грэм Д.Ю. Терапия Helicobacter pylori: текущее состояние и проблемы. Гастроэнтерология . 2000, февраль 118 (2 приложение 1): S2-8. [Медлайн].
Graham DY, Lew GM, Lechago J. Количество G-клеток и D-клеток антрального отдела при инфекции Helicobacter pylori: эффект эрадикации H. pylori. Гастроэнтерология . 1993 июн.104 (6): 1655-60. [Медлайн].
Graham DY, Lew GM, Malaty HM, et al.Факторы, влияющие на эрадикацию Helicobacter pylori при тройной терапии. Гастроэнтерология . 1992 февраль 102 (2): 493-6. [Медлайн].
Graham DY, Malaty HM, Evans DG, et al. Эпидемиология Helicobacter pylori у бессимптомной популяции в США. Влияние возраста, расы и социально-экономического статуса. Гастроэнтерология . 1991 июн.100 (6): 1495-501. [Медлайн].
Guslandi M. Иммуноанализ кала на Helicobacter pylori недостаточно специфичен. BMJ . 2000 г. 3 июня. 320 (7248): 1541. [Медлайн].
Howden CW, Hunt RH. Руководство по лечению инфекции Helicobacter pylori. Специальный комитет по параметрам практики Американского колледжа гастроэнтерологии. Ам Дж. Гастроэнтерол . 1998 декабрь 93 (12): 2330-8. [Медлайн].
Джеймисон Г.Г. Современное состояние показаний к операции при язвенной болезни. Мир J Surg . 2000 марта, 24 (3): 256-8. [Медлайн].
Jia CL, Jiang GS, Li CH, Li CR. Влияние контроля зубного налета на инфекцию Helicobacter pylori в слизистой оболочке желудка. Дж Периодонтол . 2009 Октябрь 80 (10): 1606-9. [Медлайн].
Kusters JG, van Vliet AH, Kuipers EJ. Патогенез инфекции Helicobacter pylori. Clin Microbiol Ред. . 2006 июл.19 (3): 449-90. [Медлайн].
Лейнонен М., Сайкку П. Инфекции и атеросклероз. Сканд Кардиоваск J .2000. 34 (1): 12-20. [Медлайн].
Льюис Дж. Д. Популяционный скрининг и лечение Helicobacter pylori. Гастроэнтерология . 2000 Декабрь 119 (6): 1795-7. [Медлайн].
Логан Р. Эпидемиология может дать новые способы борьбы с инфекцией H. pylori. Ланцет . 1999 18 сентября. 354 (9183): 1006. [Медлайн].
Lopes AI, Victorino RM, Palha AM, et al. Субпопуляции лимфоцитов слизистой оболочки и экспрессия антигена HLA-DR при педиатрическом гастрите, ассоциированном с Helicobacter pylori. Clin Exp Immunol . 2006 июл.145 (1): 13-20. [Медлайн].
Мескита М.А., Лорена С.Л., Алмейда Дж. Р. и др. Однонедельная двойная терапия ранитидином цитратом висмута и кларитромицином для лечения инфекции Helicobacter pylori у бразильских пациентов с язвенной болезнью. Мир Дж. Гастроэнтерол . 2005 21 июня. 11 (23): 3566-9. [Медлайн].
Мюллер А., Сайи А., Хитцлер И. Защитные и патогенные функции Т-клеток неотделимы во время взаимодействия Helicobacter-хозяин. Дисков Мед . 2009 8 августа (41): 68-73. [Медлайн].
Накадзима С., Кришнан Б., Ота Н. и др. Участие тучных клеток в гастрите с инфекцией Helicobacter pylori или без нее. Гастроэнтерология . 1997 сентябрь 113 (3): 746-54. [Медлайн].
О’Морайн С., Монтегю С. Проблемы терапии в будущем. Хеликобактер . 2000. 5 Suppl 1: S23-6; обсуждение S27-31. [Медлайн].
Padol S, Yuan Y, Thabane M, et al.Влияние полиморфизма CYP2C19 на скорость эрадикации H. pylori при терапии двойным и тройным ИПП первой линии: метаанализ. Ам Дж. Гастроэнтерол . 2006 июль 101 (7): 1467-75. [Медлайн].
Персик HG, Барнетт, NE. Детерминанты базального уровня гастрина в плазме в общей популяции. Дж Гастроэнтерол Гепатол . 2000 15 ноября (11): 1267-71. [Медлайн].
Pratt JS, Sachen KL, Wood HD и др. Модуляция иммунных ответов хозяина цитотоксическим токсином Helicobacter hepaticus. Заражение иммунной . 2006 г., август 74 (8): 4496-504. [Медлайн].
Рейрат Дж. М., Раппуоли Р., Телфорд Дж. Л. Обзор структуры цитотоксина Helicobacter. Int J Med Microbiol . 2000 Октябрь 290 (4-5): 375-9. [Медлайн].
Rodrigues MN, Queiroz DM, Bezerra Filho JG, et al. Распространенность инфекции Helicobacter pylori у детей из городских поселений на северо-востоке Бразилии и факторы риска инфицирования. Eur J Гастроэнтерол Hepatol .2004 Февраль 16 (2): 201-5. [Медлайн].
Santacroce L, Bufo P, Latorre V и др. [Роль тучных клеток в физиопатологии поражений желудка, вызванных Helicobacter pylori]. Чир Итал . 2000 сен-окт. 52 (5): 527-31. [Медлайн].
Smoot DT, Mobley HL, Chippendale GR и др. Активность уреазы Helicobacter pylori токсична для эпителиальных клеток желудка человека. Заражение иммунной . 1990 июн. 58 (6): 1992-4. [Медлайн].
Stahler FN, Odenbreit S, Haas R, et al.Новый насос для оттока металла Helicobacter pylori CznABC необходим для обеспечения устойчивости к кадмию, цинку и никелю, модуляции уреазы и колонизации желудка. Заражение иммунной . 2006 июль 74 (7): 3845-52. [Медлайн].
Цай С.Дж., Перри С., Санчес Л. и др. Инфекция Helicobacter pylori у разных поколений латиноамериканцев в районе залива Сан-Франциско. Am J Epidemiol . 2005 15 августа. 162 (4): 351-7. [Медлайн].
Tytgat GN.Обзорная статья: Helicobacter pylori: где мы и куда идем ?. Алимент Фармакол Тер . 2000, 14 октября, Дополнение 3: 55-8. [Медлайн].
Неопознанные изогнутые палочки на эпителии желудка при активном хроническом гастрите. Ланцет . 4 июня 1983 г., 1 (8336): 1273-5. [Медлайн].
Вайра Д., Гатта Л., Риччи С. и др. Язвенная болезнь и Helicobacter pylori: обновленная информация о тестировании и лечении. Постградская медицина . 2005 июн.117 (6): 17-22, 46. [Medline].
Ван Х, Ваттис Р., Пагглиасиа С. и др. Топология мембраны цитотоксина VacA из H. pylori. FEBS Lett . 2000, 15 сентября. 481 (2): 96-100. [Медлайн].
Вт TL. Курение, Helicobacter pylori и пародонтит. BMJ . 2006 24 июня. 332 (7556): 1513. [Медлайн].
Wotherspoon AC. Критический обзор влияния эрадикации Helicobacter pylori на MALT-лимфому желудка. Curr Gastroenterol Rep . 2000 Декабрь 2 (6): 494-8. [Медлайн].
Чао CY, Ван Ч., Че YJ, Као CY, Wu JJ, Lee GB. Интегрированная микрофлюидная система для диагностики устойчивости Helicobacter pylori к антибиотикам на основе хинолонов. Биосенс Биоэлектрон . 2016 15 апреля. 78: 281-9. [Медлайн].
Lee YC, Chiang TH, Liou JM, Chen HH, Wu MS, Graham DY. Массовое уничтожение Helicobacter pylori для предотвращения рака желудка: теоретические и практические соображения. Печень кишечника . 2016 23 января 10 (1): 12-26. [Медлайн].
Kono Y, Okada H, Takenaka R, et al. Усиливает ли Helicobacter pylori повреждение слизистой оболочки желудка у пользователей нестероидных противовоспалительных препаратов? Многоцентровое ретроспективное исследование случай-контроль. Печень кишечника . 2016 23 января 10 (1): 69-75. [Медлайн].
Исаева Г.С., Фагуни С. Биологические свойства и факторы патогенности Helicobacter pylori. Минерва Гастроэнтерол Диетол .2018 Сентябрь 64 (3): 255-66. [Медлайн].
Два основных вопроса помогают лечить H. pylori
Как одна из наиболее распространенных хронических бактериальных инфекций, Helicobacter pylori является известным врагом из-за своей способности вызывать язвенную болезнь желудка и рак желудка. Но в сегодняшнюю эпоху устойчивости к антибиотикам инфекция требует больше боеприпасов. быть побежденным.
В течение многих лет стандартное лечение для H.pylori был тройной терапией кларитромицином, комбинацией кларитромицина, амоксициллина или метронидазол и ингибитор протонной помпы (ИПП) в течение 14 дней. Но трехкомпонентный режим попал в немилость, сказал гастроэнтеролог Колин В. Хауден, доктор медицины, во время своего сеанса. об общих проблемах верхних отделов желудочно-кишечного тракта на конференции по внутренней медицине 2018
Лучшие и самые экономичные методы лечения H.pylori – это те, которые работают, по словам Колина В. Хаудена, доктора медицины. Фото Кевина Берн«В большей части страны я бы сказал, что это больше не рекомендуется и это лечение в значительной степени устарело », – сказал он.
Итак, какие методы лечения инфекции H. pylori являются лучшими и наиболее экономически эффективными? Проще говоря, те, которые работают, сказал д-р.Хауден, профессор медицины в Центре медицинских наук Университета Теннесси в Мемфисе.
«Независимо от долларов и центов, самое дорогое лечение – это не работает », – сказал он. «И есть чертовски много способов лечения. там для H. pylori , которые не работают ».
Новое руководство по лечению
Хотя тестирование на чувствительность к противомикробным препаратам часто определяет лечение других бактериальных инфекции, он обычно не доступен для H.pylori , – отметил доктор Хауден. «Это дорого, трудно достать, и многие из у нас нет к нему доступа, поэтому лечение инфекции H. pylori в значительной степени является эмпирическим ».
Недавнее руководство предлагает новое направление. В 2017 году Американский колледж гастроэнтерологии опубликовали обновленное клиническое руководство по лечению инфекции H. pylori .Доктор Хауден, соавтор руководства, обрисовал в общих чертах две схемы лечения. на что терапевты должны сосредоточить внимание при ведении большинства своих пациентов.
Первая четырехкратная терапия на основе висмута, включающая висмут, тетрациклин, метронидазол, и PPI от 10 до 14 дней, но предпочтительно 14 дней, сказал он. «На основе висмута четырехкратная терапия была одним из начальных методов лечения H.pylori и теперь снова в моде ».
Вторая схема, называемая сопутствующей терапией, включает кларитромицин, амоксициллин, метронидазол и ИПП в течение 10–14 дней (опять же, предпочтительно 14 дней). “Его своего рода подход к кухне-раковине. Бросьте все на жука, – сказал доктор Хауден. «По сути, сопутствующая терапия представляет собой тройную терапию кларитромицином с добавление метронидазола.”
Поскольку лечение в значительной степени эмпирическое, «Мы должны быть осторожны, когда выбираем особый режим лечения для конкретного пациента », – предупредил он.
Доктор Хауден сказал, что при выборе схемы лечения следует учитывать два ключевых вопроса. индивидуальный пациент:
- 1. Были ли контакты с макролидными антибиотиками в прошлом (например,г., кларитромицин, азитромицин, эритромицин) по любой причине, и
- 2. Есть ли у пациента аллергия на пенициллин?
Дополнительным соображением является местная картина устойчивости к антибиотикам, хотя это «информация не всегда доступна», – отметил он.
«Если пациент по какой-либо причине подвергся воздействию макролидов, вам следует вероятно, следует избегать кларитромицина для лечения H.pylori , – сказал доктор Хауден. Почему? Потому что жук наверняка помнит, как противостоять он сказал, отметив, что практически все взрослые с H. pylori заразились инфекцией в детстве.
«Этот жук живет в их желудке большую часть жизни», – сказал доктор Хауден. «Каждая таблетка антибиотика, которую когда-либо проглотил этот пациент, был обнаружен H.pylori , и если пациент ранее получал макролиды, от респираторной инфекции например, вы должны предположить, что жук устойчив к кларитромицину ».
Что касается аллергии на пенициллин, ожидайте, что это большая редкость. «До 10% взрослого Население США утверждает, что у него аллергия на пенициллин, но это просто неправда. Из из них около 90% имеют отрицательные кожные пробы, свидетельствующие об отсутствии аллергии », – сказал он. отметил, подчеркнув, что ненужный отказ от пенициллина является проблемой общественного здравоохранения потому что это приводит к чрезмерному использованию небета-лактамных антибиотиков.
Это важно при лечении инфекции H. pylori , потому что амоксициллин остается важнейшим лекарством, сказал доктор Хауден. « H. pylori практически никогда не становится устойчивым к амоксициллину. Просто нужно понюхать кларитромицин. и он устойчив к нему, но по непонятным, по крайней мере мне, причинам, амоксициллин устойчивость среди H. pylori чрезвычайно редка », – сказал он.
При отсутствии в анамнезе применения макролидов или аллергии на пенициллин, четырехкратная терапия висмутом и сопутствующая терапия – хороший выбор, сказал доктор Хауден, добавив, что кларитромицин тройную терапию также можно использовать, если уровень местной резистентности к кларитромицину у штаммов H. pylori ниже 15%. «Я готов поспорить, что большая часть Соединенных Штатов не будет соответствуют этому критерию », – сказал он.
Если нет аллергии на пенициллин, но пациент ранее получал макролид, тогда четырехкратная терапия висмутом была бы идеальной, – сказал доктор Хауден. Если пациент аллергия на пенициллин, но никогда не получал макролиды, четырехкратная терапия висмутом по-прежнему является хорошим вариантом, хотя также можно использовать тройную терапию кларитромицином если амоксициллин заменить метронидазолом, сказал он.Для тех, кто страдает аллергией для пенициллина и предыдущих пользователей макролидов четырехкратная терапия висмутом по существу – единственный вариант, – сказал доктор Хауден.
«Я говорю стипендиатам, где я работаю, [что] четырехкратная висмутовая терапия никогда не неправильный ответ »при лечении инфекции H. pylori , – сказал он.
После лечения
Несмотря на эффективность 14-дневного курса четырех разных лекарств, схема пациентам сложно принимать.Доктор Хауден советует обсудить обе причины. схемы и любых ожидаемых нежелательных явлений.
Во-первых, важно, чтобы пациенты придерживались полного режима. Неспособность принять на По крайней мере, 80% прописанных лекарств позволяют предсказать неэффективность эрадикации, и неудача эрадикации часто приводит к появлению устойчивых к антибиотикам штаммов бактерий, он сказал.
«Я бы предпочел, чтобы вы проигнорировали инфекцию H. pylori и не лечили ее, чем лечили ее неадекватно или назначили неэффективную схему лечения. потому что это только способствует появлению устойчивых штаммов », – сказал доктор Хауден. сказал.
Что касается побочных эффектов, диарея очень распространена при применении этих комбинаций антибиотиков, Он отметил, что кларитромицин и метронидазол также могут вызывать нарушение вкуса.В Кроме того, существует взаимодействие алкоголя с метронидазолом. “Это не серьезно, но это не особенно приятно, поэтому пациентам следует рекомендовать избегать употребления алкоголя когда они принимают метронидазол, – сказал доктор Хауден.
Хотя диагностика и лечение H. pylori важны, поскольку инфекция может быть связана с серьезными долгосрочными последствиями, «Не менее убедительный довод в пользу того, что заражение прошло успешно. вылечили, потому что уровень повторного заражения очень, очень низкий, менее 1% в течение года », он сказал.«Как только эта инфекция излечена, она, как правило, остается излеченной».
Кроме того, общий уровень эрадикации составляет всего от 70% до 80% (даже при полном соблюдении режима лечения), и такие симптомы, как диспепсия, не указывают на успех или неудачу искоренения. – сказал Хауден. «Мы считаем, что есть веские основания для рутинного пост-лечения. тестирование ».
Следовательно, управление H.pylori включает тестирование, лечение и повторное тестирование. Доктор Хауден подчеркнул, что после лечения Тестирование должно проводиться с тестом на активную инфекцию H. pylori , например, дыхательный тест на мочевину, тест на фекальный антиген или тест на основе биопсии если пациенту проводят эндоскопию. Серология после лечения – большой запрет.
«Я говорю своим пациентам:« Если кто-нибудь предложит анализ крови на H.pylori , будьте вежливы, вспомните Нэнси Рейган, просто скажите «нет». «… Вы можете вылечить инфекцию H. pylori , и серологические исследования будут оставаться положительными в течение многих лет, если не до бесконечности», он сказал. «Я видел пациентов с излеченной инфекцией H. pylori , которых отправляли обратно ко мне из-за положительного анализа крови».
Тестирование для подтверждения ликвидации должно быть проведено не ранее, чем через четыре недели после его окончания. лечения, и пациенту не следует принимать ИПП, антибиотики или висмут. за две недели до теста Dr.- сказал Хауден.
Два главных предиктора неудачи эрадикации – плохое соблюдение схем лечения. и устойчивость к антибиотикам (особенно к кларитромицину), сказал он.
«Повторное лечение с первоначальной неудачной схемой – это то, что я вижу неоднократно. в клинической практике, особенно с кларитромицином », – сказал д-р Хауден. “Если Терапия на основе кларитромицина однажды не удастся, она снова потерпит неудачу.Так что просто не делай Это.” Четырехкратная терапия висмутом особенно подходит, когда пациенты не – ответил он на схему, содержащую кларитромицин.
В общем, избегайте повторного использования тех же антибиотиков снова, если терапия первой линии не дает результатов. – сказал доктор Хауден. «Двумя исключениями являются амоксициллин и тетрациклин. … Устойчивость к этим антибиотикам практически равна нулю.”
И когда лечение не помогает: «Думаю, тебе следует проконсультироваться со своим гастроэнтеролог, и схемы спасения нужно подбирать тщательно », – сказал он. сказал. «Рекомендации Американского колледжа гастроэнтерологии дают несколько советов. об этом.”
Если лечение не помогло три раза или более, доктор Хауден сказал, что, возможно, пришло время отказаться от лечения. сейчас.Он посоветовал лечить симптомы диспепсии в меру ваших возможностей и успокоить пациенты, которые могут стать доступными для лечения инфекции.
«Когда ничего не помогает, как, например, при лечении инфекции H. pylori , я напоминаю пациентам, что есть вещи похуже, с которыми можно жить, чем H. pylori », – сказал он.
Лечение инфекции Helicobacter pylori
US Pharm. 2018; 43 (4): 27-32.
РЕЗЮМЕ: Инфекция Helicobacter pylori распространена примерно у половины населения мира. Заражение H pylori связано с развитием язвенной болезни, рака желудка и лимфомы лимфоидной ткани слизистой оболочки. Значительный научный прогресс был достигнут в лечении инфекции H. pylori у взрослых; эти достижения рассматриваются в обновленных рекомендациях Американского колледжа гастроэнтерологии и Торонтского консенсуса.Растущая распространенность H pylori , устойчивого к традиционным методам лечения на основе кларитромицина, является глобальной проблемой, требующей обзора доказательств для включения дополнительных схем.
Helicobacter pylori – грамотрицательная бактерия, колонизирующая желудок человека. Обычно он приобретается в детстве и передается от человека к человеку. 1,2 Факторы риска заражения H. pylori включают низкий социально-экономический статус, увеличение числа братьев и сестер и наличие инфицированного родителя. 1
Почти половина населения мира инфицирована H. pylori . Значительная глобальная распространенность и растущая устойчивость к антибиотикам побудили Всемирную организацию здравоохранения признать H. pylori в качестве высокоприоритетного патогена в 2017 году. Распространенность H. pylori варьируется в зависимости от географического региона, и, по оценкам, 30% США население заражено. 1,3,4 H pylori является основным патогеном, вызывающим желудочно-кишечные заболевания, такие как язвенная болезнь (ЯБ), рак желудка и лимфома, ассоциированная со слизистой оболочкой, лимфоидная ткань (MALT), и он связан с нежесточными заболеваниями, включая железодефицитная анемия (ЖДА) и идиопатическая тромбоцитопеническая пурпура (ИТП). 5,6 Обновленные рекомендации США и Канады включают последние данные по управлению инфекциями H. pylori .
ДиагнозИсторически, тестирование H. pylori было показано пациентам с клиническими проявлениями инфекции H. pylori , включая в анамнезе активную ЯБ-лимфому или лимфому MALT. 1,2,5 Последние данные способствовали расширению тестирования и включили в него группы пациентов, которые ранее считались спорными.Помимо желудочно-кишечных проявлений инфекции H pylori , данные также подтверждают использование теста H pylori при негастральных заболеваниях, таких как необъяснимые ЖДА и ИТП. 1,2,5 См. ТАБЛИЦУ 1 .
Тесты на H. pylori делятся на неэндоскопические и эндоскопические ( ТАБЛИЦА 2 ). При выборе диагностического теста следует учитывать возможность его проведения, клиническую ситуацию и стоимость.Хотя не существует стандартного теста для определения H pylori , дыхательный тест с мочевиной (UBT) предпочтительнее у пациентов без тревожных симптомов, поскольку он неинвазивен, недорог, а также высокочувствителен и специфичен. 2 Культура, еще один метод диагностики H pylori , позволяет проводить тесты на чувствительность; тем не менее, он не широко доступен в культуре США, и тестирование на чувствительность следует рассматривать в областях с высокой резистентностью к кларитромицину или при неудачной терапии, потому что неудача схемы первого ряда указывает на 60-70% вероятность резистентности.
Фармацевты должны знать о лекарствах, которые могут повлиять на различные типы тестов. 2,5 Чтобы избежать ложноотрицательных результатов экспресс-теста на уреазу, UBT или теста на антиген стула (SAT), прием ингибиторов протонной помпы (ИПП) следует прекратить по крайней мере за 2 недели до тестирования, а также следует прекратить прием висмута и антибиотиков. отказано по крайней мере за 4 недели до этого. Антагонисты рецептора H 2 оказывают минимальное влияние на чувствительность диагностических тестов для H. pylori , и нет рекомендаций по отмене их до тестирования.Антациды не влияют на диагностические тесты и могут использоваться для облегчения симптомов, пока не назначают терапию ИПП. 2
ЛечениеЛечение H. pylori следует назначать всем пациентам с положительным результатом теста на активную инфекцию, а выбранная схема лечения должна обеспечивать уровень эрадикации не менее 90%. H pylori Схемы включают тройную терапию, последовательную терапию (пациенту назначают одно лечение, затем другое), четырехкратную терапию и тройную терапию на основе левофлоксацина ( ТАБЛИЦА 3 ). 7 При выборе наиболее подходящей эмпирической схемы лечения для H pylori необходимо учитывать предыдущее воздействие антибиотиков, региональные особенности устойчивости к антибиотикам и уровень эрадикации, поскольку эти факторы могут повлиять на успешное лечение. Успешное лечение также зависит от факторов хозяина, таких как аллергия и приверженность. 8-10
Две схемы тройной терапии, которые считаются первой линией, содержат кларитромицин, ИПП и амоксициллин или метронидазол. 1,7-9,11 Терапия на основе кларитромицина считалась наиболее переносимой и безопасной; однако рост устойчивости к антибиотикам привел к снижению эффективности. 12,13 Показатели эрадикации при терапии на основе кларитромицина ниже 80%; Таким образом, эту терапию следует применять только в тех географических регионах, где устойчивость к кларитромицину составляет менее 15%, а также для пациентов, ранее не подвергавшихся воздействию макролидов. 1,7-9,12
H pylori Механизм устойчивости к кларитромицину изучается, но считается, что он связан с двумя основными мутациями (A2142G и A2143G) в области пептидилтрансферазы, кодируемой в домене V 23S рРНК. 6,13 Текущие результаты также предполагают, что по крайней мере четыре семейства эффлюкс-помпы кластеров генов в штаммах H. pylori могут иметь синергетические эффекты, вызывающие устойчивость к антибиотикам. 13 Дополнительные схемы становятся терапией первой линии для искоренения инфекций H. pylori , чтобы вылечить нынешний кризис резистентности к кларитромицину.
Четырехкратная терапия висмутом обеспечивает скорость эрадикации, аналогичную таковой при терапии на основе кларитромицина. 1,2,9 Этот режим первого ряда рекомендуется в областях с высокой резистентностью, в случаях предшествующего воздействия макролидов и в случаях, когда терапия на основе кларитромицина не принесла результата. Недостатком этого режима является большое количество таблеток; однако приверженность и переносимость аналогичны таковым для терапии на основе кларитромицина. FDA одобрило комбинированный продукт (Pylera), который содержит субцитрат висмута, тетрациклин и метронидазол в сочетании с ИПП; Эти агенты не одобрены FDA для лечения, если они назначаются отдельно. 1,2,9
Невисмутовая четырехкомпонентная терапия (т. Е. Сопутствующая) в течение 10–14 дней (Торонтский консенсус настоятельно рекомендует 14 дней) является еще одной схемой первой линии. 1,2,9 Этот режим также может использоваться в качестве терапии спасения у пациентов с персистирующей инфекцией H. pylori , когда первичная или предпочтительная терапия не дает результатов. Хотя никакие рандомизированные контролируемые исследования в Северной Америке не оценивали сопутствующую терапию, Американский колледж гастроэнтерологии (ACG) рекомендует ее использование на основе метаанализа 19 исследований, включающих более 2000 пациентов, которые продемонстрировали высокие показатели эрадикации (в среднем 88%) даже в регионах с высокой устойчивостью к кларитромицину и метронидазолу. 1,8,14 Примечательно, что, как и в случае с кларитромицином, уровень резистентности к метронидазолу также вызывает тревогу (> 20%). 1,6
Аллергия на пенициллинКакая схема лечения H pylori лучше всего подходит для пациентов с заявленной аллергией на пенициллин? Литература предполагает, что большинство пациентов с задокументированной историей аллергии на пенициллин не имеют истинной гиперчувствительности, которая исключала бы использование схем, содержащих амоксициллин. 1 Амоксициллин является ключевым компонентом нескольких видов терапии H pylori , поскольку показатели устойчивости остаются относительно низкими.Четырехкратная терапия висмутом не содержит амоксициллина и может применяться у пациентов с истинной аллергией на пенициллин. Если у пациента с аллергией на пенициллин не удалось добиться эрадикации после одной или двух схем, следует рассмотреть возможность тестирования на аллергию, чтобы определить, можно ли безопасно использовать схемы спасения, содержащие амоксициллин. Кроме того, метаанализ подтвердил, что тройная и четверная схемы лечения, содержащие доксициклин, эффективны в эрадикации H. pylori и могут быть рассмотрены для использования у пациентов, которые не могут принимать амоксициллин. 1,15
Альтернативные схемы первого рядаACG условно рекомендует использовать последовательные, гибридные схемы и схемы на основе фторхинолонов в качестве лечения первого ряда, тогда как Торонтский консенсус не рекомендует их использование на основании недостаточных доказательств. . 1,9 В настоящее время терапия на основе левофлоксацина является вариантом лечения спасения, но ACG считает, что она предлагает наиболее надежные данные об эффективности первой линии, основанные на международных исследованиях. 1
Эффективность последовательной терапии зависит от географического региона. 1,2,9 Мета-анализ глобальных данных показал, что уровень искоренения составляет 84%; однако последовательная терапия не превосходит тройную терапию (в течение 14 дней) или терапию на основе висмута и невисмута. 8,14 Североамериканские исследования, оценивающие эффективность последовательной терапии, не обнаружили разницы в эффективности по сравнению с терапией на основе кларитромицина и предложили ее в качестве жизнеспособной альтернативы.Последовательная терапия может быть эффективным вариантом первой линии, если используется в течение 14 дней, но необходимы дальнейшие исследования. Кроме того, последовательный режим сложен, что может увеличить частоту неудач. 1,7,8,16
Гибридная терапия сочетает в себе последовательную и сопутствующую терапию и признана ACG многообещающей, поскольку в международных исследованиях она показала высокие показатели излечения. 1,9 Терапия на основе левофлоксацина сравнима с тройной терапией кларитромицином, но в Северной Америке нет достаточных указаний по уровням резистентности к фторхинолонам, и данные свидетельствуют о том, что резистентность может быть выше по сравнению с кларитромицином.(Показатели устойчивости к антибиотикам штаммов H. pylori в США с 2009 по 2011 г. показали, что более 30% штаммов устойчивы к левофлоксацину. 1 ) Тройной режим рифабутина с ИПП и амоксициллином и двойная терапия высокими дозами с ИПП и амоксициллин не имеют достаточных доказательств и не рекомендуются. 1,9
В целом, Торонтский консенсус и ACG пришли к согласию в отношении искоренения H. pylori и рекомендуют более длительную продолжительность лечения (14 дней), ограничение терапии на основе кларитромицина и использование в первую очередь четырехкратного висмута. терапия и сопутствующая терапия. 1,9 Учитывая ограниченные режимы антибиотиков для лечения H pylori и повышенный уровень устойчивости к этим антибиотикам, существует потребность в более эффективных долгосрочных решениях для предотвращения и борьбы с этим патогеном человека.
Фармацевты могут выполнять важную функцию при лечении инфекций H. pylori , собирая анамнез предыдущего воздействия антибиотиков и аллергии на лекарства, а также будучи знакомыми с рекомендованными схемами первого и альтернативного первого или вспомогательного лечения, а также факторами, влияющими на эмпирический режим выбор, например модели сопротивления в их географической зоне.Фармацевты также могут обучать пациентов их режиму лечения, подчеркивая важность приема назначенных лекарств для повышения вероятности успешного искоренения.
ПробиотикиИспользование пробиотиков для лечения H. pylori является спорным из-за противоречивых данных, а также из-за того, что составы, оптимальная доза, время (до, во время или после эрадикации) и продолжительность терапии не соответствуют друг другу. стандартизированный. 1,9 Хотя ACG предполагает, что пробиотическая терапия может быть многообещающей, Торонтский консенсус рекомендует не добавлять пробиотики.В некоторых литературных источниках предлагается добавлять пробиотики, такие как виды Saccharomyces boulardii и Lactobacillus , в тройные схемы для увеличения показателей эрадикации (абсолютное увеличение на 9% и 5% соответственно) и для уменьшения побочных эффектов, в первую очередь диареи (абсолютное снижение на 14% и 5% соответственно). 7% соответственно). 8,17,18 Однако добавление пробиотиков увеличивает стоимость и нагрузку на таблетки и без того сложного режима.
МониторингВ идеале все пациенты должны пройти тестирование на эрадикацию H. pylori для подтверждения успешного лечения, а также для отслеживания показателей H. pylori ; однако подтверждение эрадикации во всех группах лечения не является рентабельным.Показания для подтверждающего исследования H pylori – эрадикация включают H pylori – ассоциированную язву, стойкие диспепсические симптомы, H pylori – ассоциированную лимфому MALT и удаление раннего рака желудка. Подтверждающие тесты следует проводить через 4-8 недель после терапии. 5 UBT – лучший вариант для подтверждения эрадикации H. pylori ; SAT – альтернатива. 2,5 Серология может выявить прошлые инфекции H. pylori и не должна использоваться для контроля эффективности. 2,9
ЗаключениеH. pylori является глобально распространенным патогеном высокого риска. Рекомендуемое тестирование для H pylori было расширено, и все пациенты с положительным результатом должны получить лечение. UBT лучше всего подходит для обнаружения и искоренения. Антибиотики и висмут следует держать не менее 4 недель, а ИПП следует проводить не менее 2 недель до всех диагностических тестов H pylori , кроме серологических. Успешная ликвидация H pylori основана на бактериальных факторах и факторах хозяина.Тройная терапия кларитромицином исторически была лечением первой линии; однако увеличение резистентности к кларитромицину требует дополнительных терапий первой линии. Чтобы выбрать наиболее эффективный эмпирический режим, пациентов следует спросить о предыдущем приеме макролидов и об аллергии на лекарства. Доказательства относительно пробиотиков для лечения H pylori противоречивы. Фармацевты должны быть знакомы со схемами лечения H pylori и разъяснять пациентам важность соблюдения режима лечения.Тестирование на эрадикацию рекомендуется в определенных группах пациентов через 4-8 недель после завершения лечения.
ССЫЛКИ 1. Chey WD, Leontiadis GI, Howden CW, Moss SF. Клинические рекомендации ACG: лечение инфекции Helicobacter pylori . Ам Дж. Гастроэнтерол . 2017; 112: 212-239.
2. Malfertheiner P, Megraud F, O’Morain CA, et al. Управление инфекцией Helicobacter pylori – Маастрихтский отчет V / Флорентийский консенсусный доклад. Кишечник . 2017; 66: 6-30.
3. Глобальное руководство Всемирной гастроэнтерологической организации: Helicobacter pylori в развивающихся странах. Дж Клин Гастроэнтерол . 2011; 45: 383-388.
4. Хант Р.Х., Сяо С.Д., Меграуд Ф. и др. Helicobacter pylori в развивающихся странах. Глобальное руководство Всемирной гастроэнтерологической организации. J Gastrointestin Liver Dis. 2011; 20: 299-304.
5. Chey WD, Wong BCY. Руководство Американского колледжа гастроэнтерологии по ведению инфекции Helicobacter pylori . Ам Дж. Гастроэнтерол . 2007; 102: 1808-1825.
6. Альба С., Бланко А., Аларкон Т. Устойчивость к антибиотикам в Helicobacter pylori . Curr Opin Infect Dis . 2017; 30: 489-497.
7. Де Франческо В., Беллезия А., Ридола Л. и др. Терапия первой линии для ликвидации Helicobacter pylori : критическая переоценка обновленных рекомендаций. Энн Гастроэнтерол . 2017; 30: 373-379.
8. Fashner J, Gitu AC. Диагностика и лечение язвенной болезни H.pylori инфекция. Am Fam Physician . 2015; 91: 236-242.
9. Fallone CA, Chiba N, van Zanten SV, et al. Торонтский консенсус по лечению инфекции Helicobacter pylori у взрослых. Гастроэнтерология . 2016; 151: 51-69.e14.
10. Грэм Д.Ю., Фишбах Л. Лечение Helicobacter pylori в эпоху повышения устойчивости к антибиотикам. Кишечник . 2010; 59: 1143-1153.
11. Дак В.М., Собел Дж., Пруклер Дж. М. и др. Частота возникновения устойчивости к противомикробным препаратам и факторы риска среди Helicobacter pylori –инфицированных лиц, США. Emerg Infect Dis . 2004; 10: 1088-1094.
12. McNulty CA, Lasseter G, Shaw I., et al. Нужен ли Helicobacter pylori надзор за устойчивостью к антибиотикам и как его можно проводить? Aliment Pharmacol Ther . 2012; 35: 1221-1230.
13. Abadi ATB. Устойчивость к кларитромицину и постоянство роли гастроэнтеролога в номинации Helicobacter pylori в качестве высокоприоритетного патогена Всемирной организацией здравоохранения. Мир Дж. Гастроэнтерол .2017; 23: 6379-6384.
14. Гисберт Дж. П., Кальвет X. Последние данные о четырехкратной (сопутствующей) терапии без висмута для эрадикации Helicobacter pylori . Clin Exp Gastroenterol . 2012; 5: 23-34.
15. Niv Y. Доксициклин в эрадикационной терапии Helicobacter pylori – систематический обзор и метаанализ. Пищеварение . 2016; 93: 167-173.
16. Георгопулос С.Д., Ксироучакис Э., Мартинес-Гонсалес Б. и др. Рандомизированное клиническое испытание, сравнивающее десятидневную сопутствующую и последовательную терапию для эрадикации Helicobacter pylori в зоне с высокой устойчивостью к кларитромицину. Eur J Intern Med . 2016; 32: 84-90.
17. Вильгельм С.М., Джонсон Дж. Л., Кале-Прадхан ПБ. Лечение клопов с помощью клопов: роль пробиотиков в качестве дополнительной терапии для Helicobacter pylori . Энн Фармакотер . 2011; 45: 960-966.
18. Szajewska H, Horvath A, Piwowarczyk A. Мета-анализ: влияние добавок Saccharomyces boulardii на скорость эрадикации Helicobacter pylori и побочные эффекты во время лечения.
