Лечение хеликобактер пилори антибиотиками: все современные методы эрадикационной терапии
Роль препаратов висмута в повышении эффективности эрадикации инфекции Helicobacter pylori | Шептулин
1. Malfertheiner P., Megraud F., O’Morain C.A. et al. Management of Helicobacter pylori infection the Maastricht V/Florence Consensus Report. Gut 2016 October 5. doi: org/10.1136/gutjnl-2016-312288.
2. Sugano K., Tack J., Kuipers E.J. et al. Kyoto global consensus report on Helicobacter pylori gastritis. Gut 2015; 64:1353-67.
3. McNicholl A.G., Nyssen O.P., Bordin D.S. et al. PanEuropean registry on H.pylоri management (HP-EUREG): first-line trеаtments and interim analysis of 20000 patients. United European Gastroenterology Week. Barcelona; 2018. Oral presentation.
4.
5. Leya M. The epidemiology of H. pylori infection and associated diseases. United European Gastroenterology Week. Postgraduate Teaching Programm. Barcelona; 2018. Oral presentation.
6. Alkim H., Koksai A.R. Boga S. et al. Role of bismuth in the eradication of Helicobacter pylori. Am J Ther 2017; 24(6):751-7.
7. Megraud F. Failed eradication for Нelicobacter pylori. What should be done? Dig Dis 2016; 34(5):505-9.
8. Graham D.Y., Dore M.P. Helicobacter pylori therapy: a paradigm shift.
9. Mendis A.H.W., Marshall B.J. Helicobacter pylori and Bismuth In: Biolo-gical Chemistry of Arsenic, Antimont and Bismuth. Ed. Sun H. Wiley; 2011. P. 241-62.
10. Malferheiner P. Welcome and introduction. Satellite Symposium «What’s new in Helicobacter pylori eradication. The renaissance of bismuth». EHMSG XXIXth International Workshop. Magdeburg; 2016. Oral presentation.
11. Оковитый С.В., Ивкин Д.Ю. Препараты висмута фармакологические основы клинического эффекта. Лечащий врач 2015; 10:67-73 [Okovity S.V., Ivkin D.Yu. Bismuth drugs – pharmacological basis of clinical efficacy. Lechashchy vrach 2015; 10:67-73].
12. Marshall B.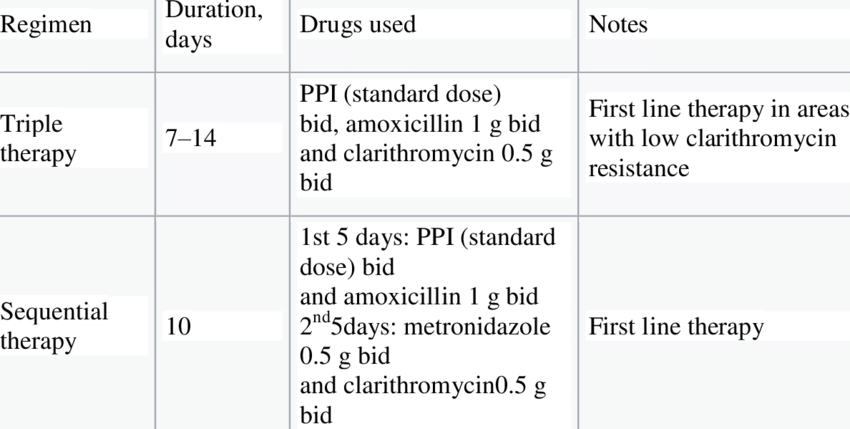 J. Helicibacter Connections, Nobel lecture. In: The Nobel Prizes. Ed. Grandin K. Stockholm; 2006. P. 250-77.
J. Helicibacter Connections, Nobel lecture. In: The Nobel Prizes. Ed. Grandin K. Stockholm; 2006. P. 250-77.
13. Wang Y., Hu L., Xu F. Integrative approach for the analysis of the proteome-wide response to bismuth drugs in Helicobacter pylori. Chem Sci 2017; 8(6):46-26.
14. Li H., Sun H. Recent advances in bioinorganic chemistry of bismuth. Curr Opin Chem Biol 2012; 16:74-83.
15. Chen Z., Zhou Q., Ge R. Inhibition of fumarase by bismuth (III): implications for the tricarboxili acid cycle as a potential target of bismuth drugs in Helicobacter pylori. Biometals 2012; 25:95-102.
16. Marcus E.A., Sachs G., Scott D.R. Colloidal bismuth subcitrate (CBS) impedes proton entry into Helicobacter pylori and increases the efficacy of growth dependent antibiotics. Aliment Pharmacol Ther 2015; 42(7):922-33.
Aliment Pharmacol Ther 2015; 42(7):922-33.
17. Marcus E.A., Sachs G., Scott D.R. Eradication of Helicobacter pylori infection. Cur Gastroenterol Rep 2018; 18(7):33.
18. Ford A.C., Malfertheiner H., Giguere M. et al. Adverse events with bismuth salts for Helicobacter pylori eradication: systematic review and meta-analysis. World J Gastroenterol 2008; 15(48):7361-70.
19. Bazzoli F. Update on management of Helicobacter pylori infection and the role of bismuth. Satellite Symposium «What’s new in Helicobacter pylori eradication. The renaissance of bismuth». EHMSG XXIXth International Workshop. Magdeburg; 2016. Oral presentation.
20. Сhey W.D., Leonitiadis G.I., Howden C.W., Moss S.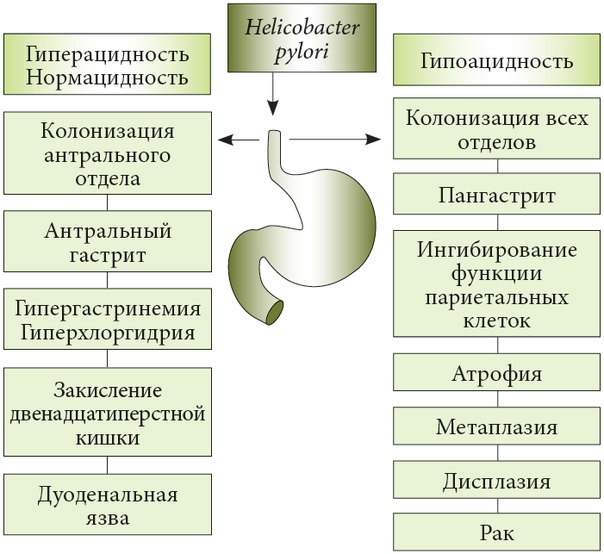 F. ACG clinical guideline: treatment of Helicobacter pylori Infection. Am J Gastroenterol 2017; 1123:212-38.
F. ACG clinical guideline: treatment of Helicobacter pylori Infection. Am J Gastroenterol 2017; 1123:212-38.
21. Dore M.P., Lu H., Graham D.J. Role of bismuth in improving Helicobacter pylori eradication with triple therapy. Gut 2016; 0: 1-9 doi:10.1136/gutjn-2015-311019.
22. Ивашкин В.Т., Маев И.В., Лапина Т.Л., Шептулин А.А. и комитет экспертов. Рекомендации по диагностике и лечению инфекции Helicobacter pylori у взрослых. Рос журн гастроэнтерол гепатол колопроктол 2012; 22(1):87-9.23. Liao J., Zheng Q., Liang X. еt al. Effect of fluoroquinolone resistance on 14-day levofloxacin triple and triple plus bismuth quadruple therapy. Helicobacter 2013; 18:373-7.
24. Zhang W., Chen Q. , Liang X. et al. Bismuth, lansoprazole, amoxicillin and metronidazole or clarithromycin as first-line Helicobacter pylori therapy. Gut 2015; 64(11):1715-20.
, Liang X. et al. Bismuth, lansoprazole, amoxicillin and metronidazole or clarithromycin as first-line Helicobacter pylori therapy. Gut 2015; 64(11):1715-20.
25. Chen Q., Zhang W., Fu Q. et al. Rescue Therapy for Helicobacter pylori eradication: a randomized noninferiority trial of amoxicillin or tetracycline in bismuth quadruple therapy. Am J Gastroenterol 2016; 111(12): 1736-42.
26. Marušić M., Dominković L., Majstorović Barać K. et. Bismuth-based quadruple therapy modified with moxifloxacin for Helicobacter pylori eradication. Minerca Gastroenterol Dietol 2017; 63(2):80-4.
27. Ивашкин В.Т., Маев И.В., Лапина Т.Л., Шептулин А.А. Лечение инфекции Helicobacter pylori: мейнстрим и новации (Обзор литературы и резолюция Экспертного совета Российской гастроэнтерологической ассоциации). Рос журн гастроэнтерол гепатол колопроктол 2017; 27(4):4-21.
Рос журн гастроэнтерол гепатол колопроктол 2017; 27(4):4-21.
29. Keogan D.M., Griffith D.M. Current and potential applications of bismuth-based drugs. Molecules 2014; 19:15258-97.
Базис и надстройка схем эрадикационной терапии Helicobacter pylori
Юрий Павлович Успенский, профессор, доктор медицинских наук:
– Уважаемые коллеги, следующая часть нашей гастроэнтерологической секции посвящена проблеме хеликобактериоза человека. И я с удовольствием хотел бы предоставить слово глубокоуважаемой Татьяне Львовне Лапиной с таким философичным докладом: «Базис и надстройка схем эрадикационной терапии Helicobacter pylori».
Татьяна Львовна Лапина, доцент, кандидат медицинских наук:
– Спасибо большое, Юрий Павлович. Итак, дорогие коллеги, действительно из старой философии взяты эти термины: «Базис и надстройка схем эрадикационной терапии пилорического хеликобактера». Если говорить о многообразии схем, которые применялись когда-либо и описаны в литературе для того, чтобы провести эрадикацию пилорического хеликобактера, то это многообразие схем невозможно описать. Это такое обилие различных лекарственных препаратов, самые разные комбинации, самая разная продолжительность, попытка давать двухступенчатые схемы и так далее. Но если обратиться к современным стандартным схемам, то по большому счету они известны наперечет. Вот те схемы, которые представлены в IV Маастрихтском консенсусе. В первую очередь, это стандартная тройная терапия с кларитромицином (ингибитор протонной помпы + кларитромицин + амоксициллин). Затем, конечно, нужно говорить о квадротерапии с препаратом висмута (ингибитор протонной помпы + препарат висмута + тетрациклин + метронидазол).
Российская Гастроэнтерологическая Ассоциация в своих рекомендациях по диагностике и лечению инфекции пилорического хеликобактера постаралась очень четко для практикующих врачей обозначить порядок обращения к этим схемам лечения. В качестве первой линии мы можем выбрать стандартную тройную терапию или квадротерапию. В случае неудачи терапии первой линии мы можем обратиться к квадротерапии с препаратом висмута. А в случае неудачи этой схемы лечения мы можем обратиться к резервному антибиотику в составе тройной терапии с «Левофлоксацином».
Так вот, вроде бы мы занимаемся лечением микробного агента. Может быть, главное в схеме эрадикационной терапии, базис – это антибактериальные препараты. Вы знаете, я бы все-таки говорила о том, что главное в схеме эрадикационной терапии, базис – это ингибиторы протонной помпы. Обратите внимание, при перечислении всех схем на первое место установлены препараты из группы ингибиторов протонной помпы. Почему ингибиторы протонной помпы имеют такое принципиальное значение для эрадикационной терапии? Все дело в том, что мы очень хорошо можем предсказать эффективность ингибиторов протонной помпы. Если обратиться к вот этой классической схеме необходимого поддержания уровня интрагастрального pH для лечения кислотозависимых заболеваний, то мы здесь видим полученный pH >3 для успешного заживления дуоденальной язвы. Напомню, это классическая работа – мета-анализ Борже. (00:04:24) Мы видим здесь пороговое значение – надо выдерживать pH>4 энтерогастрально в течение длительного достаточно периода времени, в течение суток, для того, чтобы успешно заживить эрозии при эрозивном эзофагите.
Может быть, главное в схеме эрадикационной терапии, базис – это антибактериальные препараты. Вы знаете, я бы все-таки говорила о том, что главное в схеме эрадикационной терапии, базис – это ингибиторы протонной помпы. Обратите внимание, при перечислении всех схем на первое место установлены препараты из группы ингибиторов протонной помпы. Почему ингибиторы протонной помпы имеют такое принципиальное значение для эрадикационной терапии? Все дело в том, что мы очень хорошо можем предсказать эффективность ингибиторов протонной помпы. Если обратиться к вот этой классической схеме необходимого поддержания уровня интрагастрального pH для лечения кислотозависимых заболеваний, то мы здесь видим полученный pH >3 для успешного заживления дуоденальной язвы. Напомню, это классическая работа – мета-анализ Борже. (00:04:24) Мы видим здесь пороговое значение – надо выдерживать pH>4 энтерогастрально в течение длительного достаточно периода времени, в течение суток, для того, чтобы успешно заживить эрозии при эрозивном эзофагите. Это работа Белла – тоже классический мета-анализ. Но вот самое интересное, что нас больше всего интересует сегодня, почему, собственно, мы говорим об ингибиторах протонной помпы как о базисе в схемах эрадикационной терапии – это поддержание энтерогастрального pH>5. Для того, чтобы успешно прошла эрадикация пилорического хеликобактера, для действия кислотосупрессивных препаратов установлены самые жесткие значения поддержания энтерогастрального pH. Почему?
Это работа Белла – тоже классический мета-анализ. Но вот самое интересное, что нас больше всего интересует сегодня, почему, собственно, мы говорим об ингибиторах протонной помпы как о базисе в схемах эрадикационной терапии – это поддержание энтерогастрального pH>5. Для того, чтобы успешно прошла эрадикация пилорического хеликобактера, для действия кислотосупрессивных препаратов установлены самые жесткие значения поддержания энтерогастрального pH. Почему?
Вернемся к классическим представлениям о пилорическом хеликобактере (Helicobacter pylori). Любая бактерия продуцирует АТФ (ATP) с помощью так называемой протон-движущей силы, то есть электрохимического градиента ионов водорода. Вот редукс-помпа (на схеме это окислительно-восстановительный насос) создает отрицательный заряд электрохимического градиента внутри клетки, что, собственно, и используется для образования АТФ (ATP). Таким образом, клетка бактериальная функционирует нормально. Подсчитано, что если пилорический хеликобактер (Helicobacter pylori) находится в среде с pH-7, то внутренняя среда бактерии имеет pH – 8 и 4. То есть градиент pH составляет 1,4 и в электрическом выражении он равен 90 милливольтам. Это очень удобное хорошее состояние для пилорического хеликобактера (Helicobacter pylori), нормальная жизнедеятельность его. Но мы понимаем, что хеликобактер живет в кислой среде желудка. Насколько она кислая под слоем слизи на поверхности эпителиальных клеток, конечно, сказать сложно, но если pH в желудке где-то порядка, например, 2-х, то может быть, в пристеночном слое слизи pH составляет порядка 4-х.
То есть градиент pH составляет 1,4 и в электрическом выражении он равен 90 милливольтам. Это очень удобное хорошее состояние для пилорического хеликобактера (Helicobacter pylori), нормальная жизнедеятельность его. Но мы понимаем, что хеликобактер живет в кислой среде желудка. Насколько она кислая под слоем слизи на поверхности эпителиальных клеток, конечно, сказать сложно, но если pH в желудке где-то порядка, например, 2-х, то может быть, в пристеночном слое слизи pH составляет порядка 4-х.
Что позволяет хеликобактеру активно выживать? Фермент уреаза, который разлагает мочевину с образованием ионов аммония. Ионы аммония по сути дела предохраняют вот этот самый электрохимический градиент ионов водорода. Совершенно другая ситуация складывается, когда мы назначаем пациенту ингибиторы протонной помпы, и мы искусственно приводим к желаемым значениям pH энтерогастральным для того, чтобы у нас успешно рубцевалась дуоденальная язва, заживали эрозии при гастроэзофагеальной рефлюксной болезни или проходила эрадикация пилорического хеликобактера. Все дело в том, что пилорический хеликобактер плохо выдерживает защелачивание внешних условий среды. И это, в общем-то, очень хорошо знает любой практикующий врач, потому что он понимает, что ели он назначит даже два очень хороших антибиотика, то эрадикация, скорее всего, не получится.
Все дело в том, что пилорический хеликобактер плохо выдерживает защелачивание внешних условий среды. И это, в общем-то, очень хорошо знает любой практикующий врач, потому что он понимает, что ели он назначит даже два очень хороших антибиотика, то эрадикация, скорее всего, не получится.
Позвольте представить вам очень старое классическое исследование. Мы видим здесь две группы столбиков. Первые столбики показывают нам процент эрадикации при назначении любимых наших антибиотиков «Амоксициллина» и «Кларитромицина», но только желтый столбик без ингибиторов протонной помпы. Посмотрите, пожалуйста – никакой эрадикации, по сути дела, не наступает. А вот если мы даем три препарата на основе ингибиторов протонной помпы, то разница в проценте эрадикации просто колоссальная.
То же самое касается других вариантов стандартной тройной терапии: «Кларитромицин», «Метронидазол». Мы видим, что если мы даем пациенту только «Кларитромицин» с «Метронидазолом» без ингибитора протонной помпы, то существует очень большой прирост в эффективной эрадикации, который дает нам ингибитор протонной помпы..gif) И, естественно, если мы назначаем мототерапию с ингибитором протонной помпы, то пилорический хеликобактер пытается как-то сохранить свою стандартную хорошую жизнедеятельность. Например, в основном существовал он в антральном отделе, там, где ему было относительно кислотно и практически не очень щелочно. А когда мы назначаем ингибиторы протонной помпы, происходит транслокация пилорического хеликобактера в тело желудка. Там, где расположены железы желудка, там, где среда будет покислее и на фоне ингибиторов протонной помпы приближается к более желанным условиям pH. Для того, чтобы не допустить увеличения плацдарма хронического гастрита, в качестве одного из положения IV Маастрихтского консенсуса рекомендуется проводить эрадикационную терапию тем пациентам, которым планируется длительное лечение ингибиторами протонной помпы. Для чего? Для того, чтобы вылечить гастрит, для того, чтобы у них не было пилорического хеликобактера, для того, чтобы не допустить изменений транслокаций пилорического хеликобактера по поверхности желудка.
И, естественно, если мы назначаем мототерапию с ингибитором протонной помпы, то пилорический хеликобактер пытается как-то сохранить свою стандартную хорошую жизнедеятельность. Например, в основном существовал он в антральном отделе, там, где ему было относительно кислотно и практически не очень щелочно. А когда мы назначаем ингибиторы протонной помпы, происходит транслокация пилорического хеликобактера в тело желудка. Там, где расположены железы желудка, там, где среда будет покислее и на фоне ингибиторов протонной помпы приближается к более желанным условиям pH. Для того, чтобы не допустить увеличения плацдарма хронического гастрита, в качестве одного из положения IV Маастрихтского консенсуса рекомендуется проводить эрадикационную терапию тем пациентам, которым планируется длительное лечение ингибиторами протонной помпы. Для чего? Для того, чтобы вылечить гастрит, для того, чтобы у них не было пилорического хеликобактера, для того, чтобы не допустить изменений транслокаций пилорического хеликобактера по поверхности желудка.
Итак, ингибиторы протонной помпы – действительно основа схем эрадикационной терапии, и они тем лучше работают, тем лучше они могут поддерживать энтерогастральный pH>5. Почему? Потому что именно в таких условиях пилорический хеликобактер становится особо чувствительным для действия тех антибиотиков, которые составляют надстройку схемы эрадикационной терапии. В основном мы сегодня будем в качестве примера базиса схемы эрадикационной терапии оперировать препаратом «Рабепразол». С удовольствием обращаю ваше внимание на график биоэквивалентности «Рабепразола» производства компании КРКА оригинальному препарату.
Итак, что является базисом для назначения схемы эрадикационной терапии? Конечно, способность ингибиторов протонной помпы поддерживать энтерогастральный pH в заданных пределах в течение заданного периода времени. И если мы посмотрим недавний мета-анализ, то действительно ингибиторы протонной помпы последнего поколения, в том числе «Рабепразол», с точки зрения процента среднего времени pH>4 при курсовом приеме стандартной дозы, показывают, конечно, очень и очень хороший результат.
Вернемся к схемам эрадикационной терапии. В качестве схемы первой линии лечения принята стандартная тройная схема эрадикационной терапии: ингибитор протонной помпы (ИПП) в стандартной дозе два раза в день, «Кларитромицин» (КЛА) 500 миллиграмм два раза в суки, «Амоксициллин» (АМО) 1000 миллиграмм два раза в сутки.
Возможно выбрать квадротерапию с препаратом висмута в определенных клинических ситуациях. Например, нам очень важно дать схему с максимально высокой эффективностью, например, в случае MALT-лимфомы желудка, когда мы планируем эрадикацию пилорического хеликобактера для того, чтобы достичь гистологической ремиссии опухоли. Это, конечно, комбинация ингибитора протонной помпы в стандартной дозе два раза в сутки, «Висмута трикалия дицитрата» (ВТД) 120 миллиграмм четыре раза в сутки, «Тетрациклина» (ТЕТ) и «Метронидазола» (МЕТ).
В качестве схемы, которую могут назначать гастроэнтерологи в спорных, сложных случаях Российская Гастроэнтерологическая Ассоциация рекомендует использование схемы с «Левофлоксацином». Еще раз повторюсь, конечно, это не назначение врача первичного звена здравоохранения, это все-таки назначение, которое должен делать гастроэнтеролог. Есть ли в России данные по последовательной терапии? К сожалению, не очень много данных, хотя есть единичные работы, которые говорят о том, что можно применять эту схему. Опять же, вот эта последовательная терапия достаточно сложная, которая стоит из двух этапов назначения препаратов для эрадикации пилорического хеликобактера, скорее, входит в арсенал гастроэнтеролога, чем врача первичного звена здравоохранения. Давайте посмотрим, как работает стандартная тройная терапия на основе «Рабепразола». Посмотрите, пожалуйста, доза «Рабепразола» здесь достаточно маленькая, 10 миллиграмм два раза в сутки. И, несмотря на то, что это азиатская популяция, в которой всегда сложно добиться успешной эрадикации пилорического хеликобактера, все-таки в реальной клинической практике процент эрадикации превышает 80.
Еще раз повторюсь, конечно, это не назначение врача первичного звена здравоохранения, это все-таки назначение, которое должен делать гастроэнтеролог. Есть ли в России данные по последовательной терапии? К сожалению, не очень много данных, хотя есть единичные работы, которые говорят о том, что можно применять эту схему. Опять же, вот эта последовательная терапия достаточно сложная, которая стоит из двух этапов назначения препаратов для эрадикации пилорического хеликобактера, скорее, входит в арсенал гастроэнтеролога, чем врача первичного звена здравоохранения. Давайте посмотрим, как работает стандартная тройная терапия на основе «Рабепразола». Посмотрите, пожалуйста, доза «Рабепразола» здесь достаточно маленькая, 10 миллиграмм два раза в сутки. И, несмотря на то, что это азиатская популяция, в которой всегда сложно добиться успешной эрадикации пилорического хеликобактера, все-таки в реальной клинической практике процент эрадикации превышает 80.
Можно ли увеличить эффективность стандартной тройной терапии? Можно, причем работая как с базисом схемы, так и с надстройкой схемы. Например, мы можем добавить к стандартной тройной терапии препарат висмута. Я думаю, что это очень удачное дополнение к надстройке схемы. Мы можем увеличить дозу ингибитора протонной помпы, и этот дополнительный антикислотный эффект скажется на приросте эрадикации инфекции пилорического хеликобактера. Мы можем увеличить продолжительность стандартной тройной терпи. Сложно, конечно, сказать, что любой из нас получит вот такой замечательный прирост в проценте эрадикации, в зависимости от того, 7, 10 или 14 дней мы назначаем стандартную тройную терапию. Но все-таки современная тенденция, конечно, говорит о том, что чем дольше мы проводим эрадикационную терапию в рамках обозначенных сроков, тем выше процент эрадикации.
Например, мы можем добавить к стандартной тройной терапии препарат висмута. Я думаю, что это очень удачное дополнение к надстройке схемы. Мы можем увеличить дозу ингибитора протонной помпы, и этот дополнительный антикислотный эффект скажется на приросте эрадикации инфекции пилорического хеликобактера. Мы можем увеличить продолжительность стандартной тройной терпи. Сложно, конечно, сказать, что любой из нас получит вот такой замечательный прирост в проценте эрадикации, в зависимости от того, 7, 10 или 14 дней мы назначаем стандартную тройную терапию. Но все-таки современная тенденция, конечно, говорит о том, что чем дольше мы проводим эрадикационную терапию в рамках обозначенных сроков, тем выше процент эрадикации.
И, конечно, хочется обратить внимание еще раз на базисные препараты в схемах эрадикационной терапии. Посмотрите, пожалуйста, 35 исследований, практически 6 тысяч больных. Мета-анализ, который изучал: есть ли преимущества более современных ингибиторов протонной помпы, «Рабепразола» и «Эзомепразола», по сравнению с более старыми, более классическими ингибиторами протонной помпы. И, видите, здесь число больных, которых необходимо пролечить – 23. Действительно есть данные о том, что схемы на основе «Рабепразола» обладают большей эффективностью. Что мне хочется показать? Мне хочется показать этот мета-анализ с точки зрения разных дозировок ингибиторов протонной помпы. Посмотрите, пожалуйста: здесь 10 миллиграмм два раза в сутки «Рабепразол» использовался. А вот этот же мета-анализ – 20 миллиграмм два раза в сутки. И мы видим, что благодаря мощному, кислотоподавляющему эффекту «Рабепразола» здесь даже доза 10 миллиграмм два раза в сутки отлично действует для эрадикации пилорического хеликобактера.
И, видите, здесь число больных, которых необходимо пролечить – 23. Действительно есть данные о том, что схемы на основе «Рабепразола» обладают большей эффективностью. Что мне хочется показать? Мне хочется показать этот мета-анализ с точки зрения разных дозировок ингибиторов протонной помпы. Посмотрите, пожалуйста: здесь 10 миллиграмм два раза в сутки «Рабепразол» использовался. А вот этот же мета-анализ – 20 миллиграмм два раза в сутки. И мы видим, что благодаря мощному, кислотоподавляющему эффекту «Рабепразола» здесь даже доза 10 миллиграмм два раза в сутки отлично действует для эрадикации пилорического хеликобактера.
Я должна сказать, что когда я увидела вот этот терракотовый барельеф Римской эпохи – вы видите Геракла с дубиной, он расправляется с лернейской гидрой – мне сразу показалось, что лернейская гидра кого-то мне сильно напоминает. Мне кажется, что аналогия с пилорическим хеликобактером здесь налицо. И очень приятно сказать в заключение моей лекции, что действительно у нас есть оружие для того, чтобы победить гидру пилорического хеликобактера – это схемы эрадикационной терапии инфекции пилорического хеликобактера. Только должны мы четко соблюдать стандарты ведения пациентов с инфекцией пилорического хеликобактера.
Только должны мы четко соблюдать стандарты ведения пациентов с инфекцией пилорического хеликобактера.
Helicobacter pylori – насколько опасна эта инфекция?
2021.01.01
Helicobacter pylori – насколько опасна эта инфекция?
Helicobacter pylori (H. pylori) – это разновидность бактерий. Попадая в организм человека, эти микробы поселяются в пищеварительном тракте. В течение длительного периода времени они могут вызвать язвы на слизистой оболочке желудка или в верхней части тонкой кишки. Около двух третей населения мира являются носителями этой инфекции. У большинства людей это не вызывает никаких жалоб, язв или других серьезных проблем со здоровьем. Люди живут, даже не подозревая, что они носители инфекции H. pylori. Тем не менее бытует мнение, что Helicobacter pylori вызывает такие заболевания желудка и двенадцатиперстной кишки, как эрозии, язвы, хронический гастрит, аденокарцинома. Но даже при этих проблемах со здоровьем существуют лекарства, которые могут убить эти микробы и помочь вылечить язвы, и, соблюдая правила гигиены, вы можете защитить себя и своих детей от H.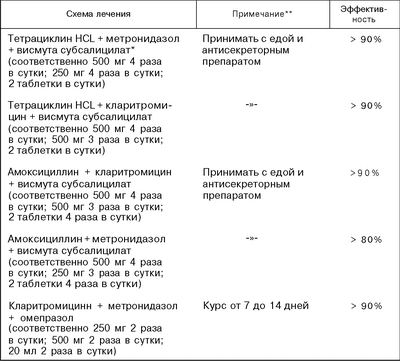 pylori.
pylori.
Чем может вам навредить H. pylori?
Язва часто поражает людей трудоспособного возраста, что может привести к повреждению желудка или двенадцатиперстной кишки. На протяжении десятилетий врачи считали, что люди страдают язвой из-за стресса, острой пищи, курения или других вредных привычек образа жизни. Однако ученые в 1982 г. обнаружил H. pylori, обнаружил, что эти желудки являются причиной большинства язв желудка. Попадая в ваш пищеварительный тракт, H. pylori оседает на слизистой оболочке желудка, которая обычно защищает более глубокие слои стенки желудка от воздействия желудочной кислоты. Когда бактерии нарушают целостность слизистой оболочки, кислота поражает более глубокие слои, эрозии и более поздние язвы. Они могут кровоточить, открывать двери для инфекций или мешать перемещению пищи по пищеварительному тракту. Заражение может происходить через пищу, воду, контакт со слюной или другими биологическими жидкостями инфицированных людей. Многие люди заражаются H. pylori в детстве, но могут заболеть и взрослые. До появления симптомов этой инфекции микробы жили в организме в течение многих лет, но большинство людей, переносящих эту инфекцию, никогда не болеют язвами. Нет точного объяснения того, почему только у некоторых людей, инфицированных этой бактерией, развиваются эрозии, язвы, гастрит или даже рак желудка.
pylori в детстве, но могут заболеть и взрослые. До появления симптомов этой инфекции микробы жили в организме в течение многих лет, но большинство людей, переносящих эту инфекцию, никогда не болеют язвами. Нет точного объяснения того, почему только у некоторых людей, инфицированных этой бактерией, развиваются эрозии, язвы, гастрит или даже рак желудка.
Симптомы
Когда у вас развивается язва желудка, вы можете почувствовать покалывание или жгучую боль в верхней части живота. Боль может возникать спонтанно, но более выражена, когда желудок пуст, например между приемами пищи или посреди ночи. Это может занять минуты или часы. Вы можете чувствовать себя лучше после еды, питья молока или приема антацидов. Другие признаки язвы включают:
- Дует
- Рев
- Потеря аппетита
- Тошнота
- Рвота
- Неприятный запах изо рта
- Снижение веса без видимой причины
Язвы могут кровоточить в желудке или кишечнике, что может быть опасно. Немедленно обратитесь к врачу, если у вас есть какие-либо из следующих симптомов:
Немедленно обратитесь к врачу, если у вас есть какие-либо из следующих симптомов:
- Кровавый, темно-красный или черный стул
- Респираторный дистресс
- Головокружение или обмороки
- Без причины вы чувствуете себя очень уставшим
- Бледный цвет кожи
- Рвота с примесью крови или похожей на кофейную гущу
- Сильная острая боль в животе
Это нетипично, но инфекция H. pylori может спровоцировать рак желудка. Поначалу у болезни мало симптомов, и люди не всегда обращают внимание на такую жалобу, как изжога. Со временем могут появиться и другие жалобы:
- Тошнота
- Чувство переполнения желудка
- Чувство сытости после приема небольшого количества пищи
- Рвота
- Снижение веса без причины
Диагностика
- Анализы крови и стула, которые помогают диагностировать инфекцию H. pylori
- Секретный анализ крови стула для проверки стула на наличие крови, видимой невооруженным глазом
- Важным обследованием будет – гастроскопия.
 Во время процедуры есть возможность взять образцы и провести тест на наличие бактерий, взять биопсию при подозрении на рак. Процедура проводится под местной или внутривернозной анестезией.
Во время процедуры есть возможность взять образцы и провести тест на наличие бактерий, взять биопсию при подозрении на рак. Процедура проводится под местной или внутривернозной анестезией. - Компьютерная томография (КТ) или магнитно-резонансная томография. Это сложные рентгеновские снимки с подробными рентгеновскими снимками вашего тела.
Лечение H. pylori Если у вас есть язвы, которые могли быть вызваны H. pylori, вам потребуется лечение, чтобы убить микробы, вылечить слизистую оболочку желудка и язвы. Обычно для улучшения состояния требуется от 1 до 2 недель лечения. Ваш врач, вероятно, посоветует вам принимать несколько разных лекарств. Возможные варианты:
- Антибиотики для уничтожения бактерий H. pylori
- Лекарства, снижающие количество кислоты в желудке
- Лекарства, которые блокируют гистамин, который стимулирует выработку кислоты в желудке.
Лечение может означать, что вы принимаете много таблеток в день в течение нескольких недель, даже если вам это может показаться большим количеством лекарств, но действительно важно принимать все, что прописывает ваш врач, и следовать его инструкциям. Неправильное использование антибиотиков может сделать бактерии в организме устойчивыми к антибиотикам, что затруднит лечение инфекций. Если лекарства беспокоят вас, поговорите со своим врачом о других вариантах лечения и о том, как бороться с побочными эффектами.
Неправильное использование антибиотиков может сделать бактерии в организме устойчивыми к антибиотикам, что затруднит лечение инфекций. Если лекарства беспокоят вас, поговорите со своим врачом о других вариантах лечения и о том, как бороться с побочными эффектами.
Профилактика
- Мойте руки перед тем, как пойти в туалет, а также перед приготовлением или едой.
- Учите и своих детей вести себя.
- Избегайте нечистой пищи или воды.
- Не ешьте плохо приготовленные продукты.
- Избегайте еды, которую подают люди, не вымыв рук.
Хотя стресс и острая пища не вызывают язв, они могут предотвратить быстрое заживление язв или усилить болевые ощущения. Поговорите со своим врачом о том, как справиться со стрессом, улучшить свой рацион, а если вы курите, как получить помощь, чтобы бросить эту привычку. Чего ожидать после лечения H. pylori? Многие язвы, вызванные H. pylori, заживают через несколько недель лечения. Вам следует избегать безответственного приема нестероидные противовоспалительные препараты, так как эти лекарства могут повредить слизистую оболочку желудка, и если вам нужны обезболивающие, спросите их у врача.
“Залить” кефиром гастрит не получится — Российская газета
Можно ли “подхватить” гастрит через поцелуй? В каких случаях не стоит лечить ребенка от хеликобактерной инфекции? Об этом “РГ” рассказал главный гастроэнтеролог департамента здравоохранения Москвы, доктор медицинских наук, профессор Дмитрий Бордин.
Дмитрий Станиславович, рак желудка – из самых распространенных онкоболезней в России. Кто в зоне риска?
Дмитрий Бордин: Рак желудка занимает четвертое место среди онкологических заболеваний у мужчин и женщин. В 90% случаев его вызывает бактерия Helicobacter pylori. Эта инфекция одна из самых распространенных в России, она вызывает хронические воспаления слизистой оболочки желудка (то есть активный гастрит) у всех инфицированных. Долгое время он может никак себя не проявлять, но при этом спровоцировать развитие язвы, аденокарциномы или мальтомы желудка. В особой зоне риска люди, чьи родственники уже столкнулись с этими болезнями. Им обязательно нужно обследоваться на хеликобактерную инфекцию и, если она обнаружена, лечиться.
Статистика говорит сама за себя: в Москве с 1994 по 2016 год заболеваемость язвой желудка и двенадцатиперстной кишки упала на 77 процентов. Благодаря тому, что ученым удалось доказать ключевую роль Helicobacter pylori при болезнях желудка и разработать эффективное лечение. За это австралийские исследователи Робин Уоррен и Барри Маршалл в 2005 году получили Нобелевскую премию.
Нужно ли проверять на инфекцию всю семью?
Дмитрий Бордин: Да. Хотя вероятность инфицирования всей семьи не абсолютна. Были случаи, когда у одного из супругов инфекцию находили, а у второго – нет, хотя они и прожили вместе многие годы. Так что не стоит пугаться “страшилок” о том, что гастрит можно “подцепить” через поцелуй. Гораздо важнее соблюдать обычные правила гигиены: Helicobacter pylori передается именно через грязные руки.
Стоит ли лечить гастрит у маленького ребенка?
Дмитрий Бордин: Это очень непростой вопрос. Если у взрослых поводом для лечения является сам по себе позитивный тест, то маленьких детей, если нет осложнений, в большинстве случаев лечить не стоит. Почему? Есть высокий риск, что ребенок заразится хеликобактерией снова. К тому же лечение предполагает прием антибиотиков и других препаратов в течение двух недель. Это серьезная нагрузка для детского организма, она должна быть обоснована. А вот у взрослых вероятность повторного заражения при соблюдении мер гигиены не высока, всего 1-3 процента в год. У них лечить гастрит нужно обязательно: это профилактика рака желудка, профилактика язвы и устранение источника инфекции. Только так можно справиться с эпидемией. Наглядный пример: в Тайване благодаря массовому лечению хеликобактерной инфекции заболеваемость раком желудка за 13 лет снизилась более чем на 50 процентов.
Не стоит пугаться “страшилок” о том, что гастрит можно “подцепить” через поцелуй
Гастроскопия – не самая приятная процедура. Правда ли, что гастрит можно диагностировать “по воздуху”?
Дмитрий Бордин: Если есть минимальные симптомы – боль или дискомфорт в верхних отделах живота, то гастроскопию сделать надо, так как за этими симптомами может скрываться серьезное заболевание. Если симптомов нет и возраст пациента меньше 30-35 лет, то для обнаружения хеликобактерной инфекции идеально подходит 13С-уреазный дыхательный тест. Пациент натощак делает выдох в специальный мешок, выпивает тестовый раствор и через полчаса выдыхает в другой мешок. Прибор оценивает эти пробы и сразу показывает результат. Главное условие – месяц перед исследованием не принимать антибиотики и две недели – препараты, снижающие кислотность желудка.
Кроме того, дыхательный тест – это еще и самый оптимальный метод оценки успешности лечения, которую нужно провести через месяц после его окончания. Контролировать эффективность терапии нужно повсеместно, в том числе и для того, чтобы была возможность вовремя корректировать рекомендации для врачей, оставляя в них только эффективные схемы. На днях этот тест включен в федеральный перечень медицинских услуг. Мы будем ходатайствовать о внесении 13С-уреазного дыхательного теста в систему ОМС.
В Европе ученые собирают банк геномов Helicobacter pylori. Бактерия мутирует?
Дмитрий Бордин: Эта бактерия вызывает гастрит у всех, а язву и рак – далеко не у всех зараженных. Ученые хотят понять, какие факторы, в том числе и генетические, ответственны за развитие таких тяжелых последствий. В этом направлении мы ждем серьезных открытий. Глобальная же тенденция такая: Helicobacter pylori становится более устойчивой к антибиотикам. И за это тоже отвечают генетические мутации бактерии. Эффективный ранее 7-дневный курс лечения из трех препаратов перестал работать. Сегодня терапию назначают на 14 дней. Обычно в связке идут два сильных антибиотика и таблетки, понижающие кислотность в желудке. Эффективность терапии улучшается при добавлении препаратов висмута, которые повышают чувствительность бактерии к антибиотикам.
Знания быстро обновляются. Но, к сожалению, врачи нередко используют устаревшие клинические рекомендации и назначают утратившие эффективность схемы лечения. Ситуацию нужно менять. Но для этого мы должны дать врачам возможность контроля эффективности лечения.
А модные пробиотики и пребиотики в борьбе с гастритом не помогут?
Дмитрий Бордин: В желудке в норме живет хорошо сбалансированное сообщество бактерий. Часть из них при наличии хеликобактера могут способствовать развитию заболевания. Другие, наоборот, могут защищать (например, некоторые штаммы лактобактерии). Поэтому пробиотики, которые положительно влияют на микрофлору, улучшают эффективность и переносимость антихеликобактерной терапии. Но “залить” кефиром гастрит не получится: его можно вылечить только у квалифицированного врача.
*Это расширенная версия текста, опубликованного в номере “РГ”
ТЕКСТ. Инфографика: Инфографика «РГ» / Леонид Кулешов / Ксения Колесникова
Helicobacter pylori infection in Ukraine. How to increase efficiency of eradication?
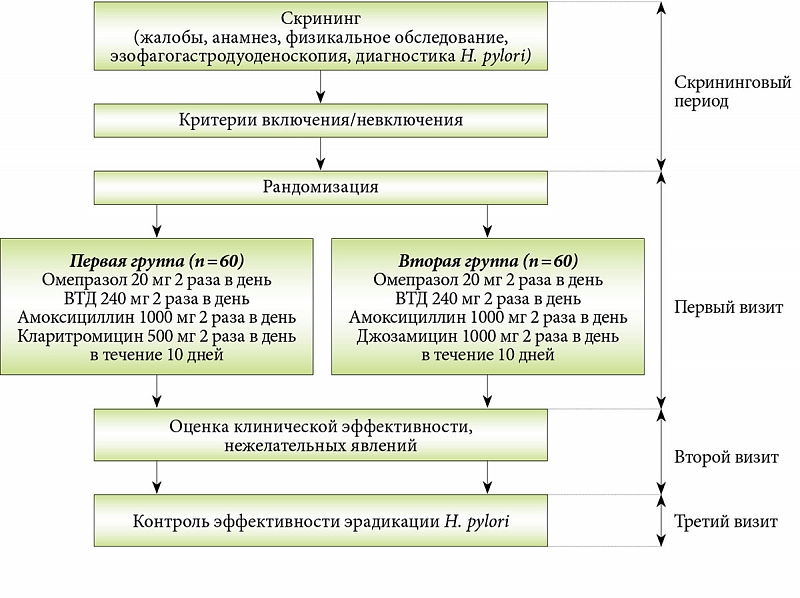
SummaryИнфекция Helicobacter pylori (Нр) остается одной из самых распространенных в нашей стране. До 80 % взрослых инфицированы этой бактерией. Известно, что данная инфекция может проявляться в очень широком диапазоне — от бессимптомного носительства до рака желудка. К сожалению, в Украине инфицирование происходит в достаточно раннем возрасте, из-за чего пациенты успевают дожить до одного из самых неблагоприятных проявлений хеликобактериоза — рака желудка. Целью работы было изучение эффективности антихеликобактерной терапии первой линии, включающей ингибиторы протонной помпы (ИПП), кларитромицин, амоксициллин с добавлением коллоидного субцитрата висмута у больных с высоким риском развития устойчивости к кларитромицину. Предварительно мы проанализировали данные последних четырех лет. Оценивали эффективность стандартной трехкомпонентной эрадикационной терапии (ИПП, амоксициллин, кларитромицин) у больных, принимавших в предшествующие 3 месяца любые макролиды. Таких пациентов было 59. Устранение инфекции было достигнуто у 41 из них, т.е. у 69,5 %, что явно недостаточно эффективно. Затем среди вновь обращающихся больных мы выявили 27 человек (8 с пептической язвой и 19 с функциональной диспепсией), принимавших макролиды на протяжении предшествующих трех месяцев, т.е относящихся к группе повышенного риска развития резистентности к кларитромицину. У всех этих пациентов наличие Helicobacter pylori подтверждалось 13С-уреазным дыхательным тестом (IRIS) и/или быстрым уреазным тестом, проводившимся во время эндоскопии. В группе больных высокого риска резистентности к кларитромицину добавление к стандартной трехкомпонентной терапии коллоидного субцитрата висмута привело к увеличению эффективности эрадикации на 22,1 % (с 69,5 до 92,6). Четырехкомпонентные висмутсодержащие схемы первой линии эрадикации Нр показали свою высокую эффективность (более 90 %) во всех регионах Украины. Таким образом, выделение группы пациентов с высоким риском устойчивости к кларитромицину позволяет дифференцированно подходить к выбору стартовой антихеликобактерной терапии. У людей с предшествующим лечением макролидами добавление к стандартной трехкомпонентной терапии (ИПП, амоксициллин, кларитромицин) коллоидного субцитрата висмута позволяет более чем на 22 % увеличить эффективность эрадикации Нр.
Інфекція Helicobacter pylori (Нр) залишається однією з найпоширеніших у нашій країні. До 80 % дорослих інфіковані цією бактерією. Відомо, що ця інфекція може проявлятися в дуже широкому діапазоні — від безсимптомного носійства до раку шлунка. На жаль, в Україні інфікування відбувається в досить ранньому віці, через що пацієнти встигають дожити до одного з найбільш несприятливих проявів хелікобактеріозу — раку шлунка. Метою роботи було вивчення ефективності антихелікобактерної терапії першої лінії, що включає інгібітори протонної помпи (ІПП), кларитроміцин, амоксицилін із додаванням колоїдного субцитрата вісмуту у хворих із високим ризиком розвитку стійкості до кларитроміцину. Попередньо ми проаналізували дані останніх 4 років. Оцінювали ефективність стандартної трикомпонентної ерадикаційної терапії (ІПП, амоксицилін, кларитроміцин) у хворих, які приймали в попередні 3 місяці будь-які макроліди. Таких пацієнтів було 59. Усунення інфекції було досягнуто у 41 з них, тобто у 69,5 %, що явно недостатньо ефективно. Потім серед нових хворих ми виявили 27 осіб (8 з виразковою хворобою і 19 з функціональною диспепсією), які отримували макроліди протягом попередніх трьох місяців, тобто відносяться до групи підвищеного ризику розвитку резистентності до кларитроміцину. У всіх цих пацієнтів наявність Helicobacter pylori підтверджувалася 13С-уреазним дихальним тестом (IRIS) і/або швидким уреазним тестом, що проводилися під час ендоскопії. У групі хворих високого ризику резистентності до кларитроміцину додавання до стандартної трикомпонентної терапії колоїдного субцитрата вісмуту призвело до збільшення ефективності ерадикації на 22,1 % (з 69,5 до 92,6). Чотирьохкомпонентні вісмутумісні схеми першої лінії ерадикації Нр показали свою високу ефективність (більше 90 %) у всіх регіонах України. Таким чином, виділення групи пацієнтів із високим ризиком стійкості до кларитроміцину дозволяє диференційовано підходити до вибору стартової антихелікобактерної терапії. У людей із попереднім лікуванням макролідами додавання до стандартної трикомпонентної терапії (ІПП, амоксицилін, кларитроміцин) колоїдного субцитрата вісмуту дозволяє більш ніж на 22 % збільшити ефективність ерадикації Нр.
Helicobacter pylori (Hp) infection is currently one of the most common in our country. Up to 80 % of adults are infected with this bacterium. It is known that this infection can manifest itself in a very wide range — from asymptomatic carriage to gastric cancer. Unfortunately, in Ukraine infection occurs at a fairly early age, because of which patients manage to survive to one of the most unfavorable manifestations of helicobacteriosis — gastric cancer. The purpose of the study was to investigate the effectiveness of the first line anti-Helicobacter therapy, including proton pump inhibitors (PPI), clarithromycin, amoxicillin, with the addition of colloidal bismuth subcitrate in patients at high risk of clarithromycin resistance. Previously, we analyzed the data of the last 4 years. The effectiveness of standard triple eradication therapy (PPI, amoxicillin, clarithromycin) was evaluated in patients taking any macrolides in the preceding 3 months. There were 59 such patients. Elimination of infection was achieved in 41 of them, i.e. in 69.5 %, which is clearly insufficiently effective. Then, among the newly treated patients, we identified 27 people (8 with peptic ulcer and 19 with functional dyspepsia) who took macrolides during the previous three months, i.e. those at increased risk of clarithromycin resistance. In all these patients, the presence of Helicobacter pylori was confirmed by a 13C-urease respiratory test (IRIS) and/or a rapid urease test conducted during endoscopy. In the group of patients at high risk of clarithromycin resistance, addition of colloidal bismuth subcitrate to the standard triple therapy resulted in an increase of eradication efficiency by 22.1 % (from 69.5 to 92.6 %). First line bismuth-containing quadruple schemes of Hp eradication showed their high efficiency (more than 90 %) in all regions of Ukraine. Thus, the isolation of a group of patients at high risk of clarithromycin resistance allows for a differentiated approach to the choice of initial anti-Helicobacter therapy. In people with prior treatment using macrolides, addition of colloidal bismuth subcitrate to standard triple therapy (PPI, amoxicillin, clarithromycin) allows to increase the eradication efficiency of Hp by more than 22 %.
Среди заболеваний желудочно-кишечного тракта важное место занимает патология, ассоциированная с инфекцией Helicobacter pylori (Нр). По сути являясь инфекционным заболеванием, она традиционно лечится гастроэнтерологами и врачами общей практики. Поэтому для повышения качества диагностики и лечения такой патологии на протяжении двух последних десятилетий уже в пятый раз выходят международные рекомендации — Маастрихтский консенсус. Последняя, обновленная версия — Maastricht V/Florence Consensus Report опубликована в 2017 году в журнале «Gut» (Malfertheiner P. et al., 2017). Подробный анализ этого консенсуса дан в статье Ю.М. Степанова и И.Я. Будзак (2018). Хорошо известно, что распространенность Нр-инфекции значительно различается в экономически развитых и развивающихся странах (Hooi J.K.Y. et al., 2017). Для нашей страны характерен тип инфицирования, присущий развивающейся стране, — начало в достаточно раннем детском возрасте и очень широкая распространенность у взрослых, доходящая до 80 % (Наказ, 2012). Еще одной особенностью нашего «национального» Нр является выраженный канцерогенный потенциал, что сопровождается высокой заболеваемостью раком желудка (РЖ).
Известна тесная корреляция между инфицированностью Нр и некардиальным РЖ (Venneman K. et al., 2018). В 2016 году в Украине более 8 тыс. человек заболели РЖ и почти 60 % из них умерли в течение первого года. Для нашей страны характерно достаточно позднее выявление РЖ (при профосмотре он был найден только у 8 % больных), поэтому 56 % пациентов получали только симптоматическое лечение (Колесник О.О., 2018). Становится понятным, что весьма актуальной проблемой для Украины является не только раннее выявление РЖ, но и его первичная профилактика. Одним из самых перспективных способов такой профилактики служит своевременная борьба с Нр (Malfertheiner P. et al., 2017). В настоящее время доказано, что эрадикация Нр приводит к достоверному снижению заболеваемости РЖ как при первичной, так и при вторичной его профилактике (Lee Y.C. et al., 2016; Choi I.J. et al., 2018). Следует помнить, что Нр-ассоциированный канцерогенез — процесс длительный и многоэтапный, поэтому своевременное устранение инфекции способно значительно уменьшить частоту развития РЖ. Существует своеобразная «точка невозврата» (по-видимому, это стадия дисплазии либо выраженной метаплазии), при достижении которой даже полное устранение Нр уже не в состоянии остановить канцерогенез (Cheung K.S., Leung W.K., 2018). По–этому для канцеропревенции следует проводить эрадикацию Нр еще на стадии атрофического гастрита (Malfertheiner P. et al., 2017).
Однако одной канцеропревенцией показания к эрадикации Нр не ограничиваются. Хорошо известно, что устранение Нр приводит к ускорению заживления и предупреждению рецидивов при пептической гастродуоденальной язве. Для профилактики ульцерации и кровотечений целесообразно устранять Нр-инфекцию перед назначением нестероидных противовоспалительных препаратов (НПВП) и/или «кардиальных» доз ацетилсалициловой кислоты, особенно при высоком риске изъязвления (Malfertheiner P. et al., 2017). К сожалению, в нашей стране большинство кардиологов, ревматологов и неврологов для этой цели в лучшем случае назначают антисекреторные препараты, а антихеликобактерное лечение проводят лишь единицы. Еще одним показанием к эрадикации Нр является наличие симптомов диспепсии. В настоящее время доказано, что исчезновение диспептических симптомов после успешного устранения инфекции Нр является основанием для выставления диагноза диспепсии, ассоциированной с Helicobacter pylori (Sugano K. et al., 2015). И хотя, по нашим данным, в Украине симптоматика прекращается только у четверти подобных больных, успешная эрадикация в качестве «бонуса» также уменьшает риск развития пептической язвы и РЖ (Дорофеев А.Э. и соавт., 2014; El-Serag H.B. et al., 2018). Еще одной группой пациентов, требующих эрадикации, являются больные гастроэзофагеальной рефлюксной болезнью (ГЭРБ), нуждающиеся в длительной антисекреторной терапии. Известно, что Нр в таких случаях увеличивает риск развития атрофического гастрита с последующим запуском каскада канцерогенеза. Реже к устранению Нр-инфекции приходится прибегать при MALTоме желудка и таких заболеваниях, как железодефицитная анемия, дефицит витамина В12 и тромбоцитопеническая пурпура (Malfertheiner P. et al., 2017).
Лечение Нр-инфекции должно носить максимально персонифицированный характер и учитывать как региональные особенности резистентности возбудителя, так и индивидуальный опыт применения антибактериальных препаратов на протяжении предшествующего года (El-Serag H.B. et al., 2018). В идеале также следует обращать внимание на этническую принадлежность, от которой зависит распространенность полиморфизма гена цитохрома Р450 — СYP2С19, влияющего на скорость печеночного метаболизма ингибиторов протонной помпы (ИПП). В недавно опубликованном Хьюстонском консенсусе по диагностике Нр подчеркивается, что в настоящее время вполне возможен подбор антихеликобактерной терапии, обеспечивающий более чем 95% эффективность эрадикации. Там же отмечается, что для подтверждения эрадикации следует использовать 13С-уреазный дыхательный тест, определение антигена Нр в фекалиях, а в случае проведения эндоскопии — морфологическую диагностику (El-Serag H.B. et al., 2018). Другие, не 13С дыхательные тесты, к сожалению, широко применяемые в нашей стране, неинформативны.
Во всем мире актуальна проблема резистентности Нр к антибактериальным препаратам. По данным WHO Pathogens Priority List Working Group, инфекция Helicobacter pylori является проблемой мирового масштаба и отличается широкой распространенностью штаммов, резистентных к антибиотикам (Tacconelli E. et al., 2018). Так, в Италии резистентность к кларитромицину достигает 35,9 %, к метронидазолу — 40,2 %, левофлоксацину — 29,3 %. Интересно отметить, что на протяжении последних 3 лет наблюдается стабилизация этих показателей и прекращение нарастания резистентности (Fiorini G. et al., 2018). Эти данные достаточно важны и для Украины, так как наши соотечественники, достаточно часто работающие в Италии, оказываются инфицированы подобными резистентными штаммами. В то же время в соседней с Италией Словении резистентность Нр к кларитромицину меньше 15 %, поэтому в этой стране 7-дневные 3-компонентные схемы, содержащие кларитромицин, сохраняют высокую (более 85 %) эффективность (Tepes B. et al., 2017).
Распространенность резистентных штаммов Нр в нашей стране мало изучена, поэтому часто приходится ориентироваться на исследования у ближайших соседей. В небольшом польском исследовании найдена высокая распространенность Нр, устойчивой к метронидазолу, — 56,7 %, кларитромицину — 55,2 %, левофлоксацину — 5,9 %. Одновременная устойчивость к двум препаратам выявлялась у 39,2 % больных (Ferenc S. et al., 2017). В более ранней работе отмечалась меньшая распространенность резистентности к кларитромицину — 15,4 %, при близкой частоте устойчивости к метронидазолу — 41,7 % (Iwanczak B. et al., 2014). В обоих исследованиях практически отсутствовали штаммы Нр, резистентные к амоксициллину и тетрациклину. В соседней с нами России стабильно высокая резистентность к метронидазолу составляет 55–85 %, устойчивость к левофлоксацину достигает 27 %. При этом резистентность к кларитромицину превысила критический уровень только в некоторых мегаполисах (Санкт-Петербург, Москва, Уфа). В этой стране также отсутствует клинически значимая резистентность Нр к амоксициллину и тетрациклину (Маев И.В. и соавт., 2014; Симаненков В.И. и соавт., 2015). В граничащей с Украиной Ростовской области резистентность к кларитромицину составляет 8 %, к метронидазолу — 38 % (Березняк Е.А. и соавт., 2011). По данным мультицентрового регистра, в России для эрадикации Нр чаще использовались 10-дневные схемы эрадикации со средней эффективностью 82,6 % (Бордин Д.С. и соавт., 2016).
Каковы же методы лечения Нр-инфекции в регионах с высокой распространенностью резистентных штаммов микроорганизма? Оптимальным вариантом подбора антибактериальной терапии в странах с такими штаммами является предварительное определение мутаций генов микроорганизма, обеспечивающих резистентность к кларитромицину и фторхинолонам. Такой подход даже при семидневном режиме лечения обеспечил более чем 90% эрадикацию резистентных штаммов Нр (Papastergiou V. et al., 2018). Однако в настоящее время в нашей стране о таком подходе приходится только мечтать.
Одним из предложенных способов преодоления резистентности Нр к метронидазолу может быть увеличение его суточной дозы более 1,5 г, что позволяет повысить эффективность эрадикации на 25 % (Ji Y., Lu H., 2018). К сожалению, в популяции с широкой распространенностью резистентности к метронидазолу (74 %), кларитромицину (24 %) и к обоим препаратам (18 %) тройная терапия (эзомепразол, кларитромицин и метронидазол 1,6 г/сут) оказалась недостаточно эффективной — всего 67,7 %. Только добавление висмута (суточная доза 480 мг) позволило повысить уровень эрадикации до 90,3 %. Отмечается, что частота побочных эффектов при добавлении препаратов висмута не увеличивалась (Long X. et al., 2018). Еще одним методом лечения пациентов, инфицированных Нр, резистентными к метронидазолу, является замена последнего на фуразолидон. По данным метаанализа 10 рандомизированных конт–ролируемых исследований, такая замена увеличивает эффективность эрадикации на 10 %, и в 4-компонентных схемах с висмутом она достигает 92,9 %. Однако использование фуразолидона сопровождается увеличением числа побочных эффектов — в первую очередь тошноты и рвоты (Zhuge L. et al., 2018).
В ситуации с высокой распространенностью резистентности к кларитромицину существует достаточно простой способ выявления подгруппы таких пациентов. В испанском исследовании у людей, получавших макролиды в течение предшествующего года, эффективность тройной терапии с включением кларитромицина составляла 60 %, а у не получавших — более 90 % (Muñoz-Gómez P. et al., 2018). В нашем исследовании учитывался прием макролидов на протяжении предшествующих 3 месяцев. По-видимому, именно более коротким интервалом объясняется меньшая эффективность 3-компонентной терапии (85 %), полученная нами, по сравнению с испанским исследованием — 90 % (Дорофеев А.Э. и соавт., 2016).
Одной из причин недостаточной эффективности антибиотиков в устранении Нр является способность бактерии образовывать биопленку, расположенную в глубине желудочных желез. Поэтому Нр оказывается защищенным от антибиотиков и воздействия иммунной системы белково-гликопротеиновым матриксом такой пленки. Для преодоления подобного типа резистентности предложено воздействовать на биопленку с помощью муколитиков или препаратов висмута (Hathroubi S. et al., 2018). В настоящее время показано, что комплексные соединения висмута, особенно в сочетании с антибиотиками, способны разрушать биопленку, образуемую некоторыми микроорганизмами, и повышать их чувствительность к антибиотикам (Varposhti M. et al., 2014).
С чего же на практике следует начинать антихеликобактерную терапию? В итальянском обзоре в странах с низкой распространенностью резистентности к кларитромицину рекомендуется использование стандартной 3-компонентной терапии первой линии (ИПП + кларитромицин + амоксициллин) продолжительностью 10–14 дней. В ситуации высокой региональной резистентности к кларитромицину (> 15 %) или при предшествующем использовании кларитромицина начинать лечение лучше с 4-компо–нентной терапии, включающей ИПП, висмут, тетрациклин и метронидазол. В качестве терапии второй линии целесообразно использовать 4-компонентную терапию с обязательным включением солей висмута. Альтернативой может быть 3-компонентная схема, содержащая левофлоксацин, либо индивидуально подобранная терапия с определением чувствительности Нр к антибиотикам. При отсутствии возможности определить резистентность Нр в качестве терапии третьей линии можно использовать схемы, содержащие рифабутин и фуразолидон. Также надо помнить, что продолжительность лечения не должна быть меньше 10 дней (Yuan Y. et al., 2013). Отмечается, что последовательная терапия оказалась менее эффективной, чем сопутствующая (Wang Y. et al., 2018). Следует подчеркнуть, что 10-дневное использование у итальянских пациентов, инфицированных мультирезистентными штаммами Нр (73 % одновременно резистентных к метронидазолу, кларитромицину и левофлоксацину), препарата висмута в сочетании с эзомепразолом, тетрациклином и метронидазолом позволило добиться удовлетворительного уровня эрадикации — 81 % (Fiorini G. et al., 2017). У пациентов с ускоренным метаболизмом ИПП, большинство которых относятся к этническим европейцам, рекомендовано удваивать дозу ИПП и/или назначать ИПП с другим путем метаболизма (рабепразол или эзомепразол) (Malfertheiner P. et al., 2017). Также возможна замена ИПП на калий-конкурентный блокатор секреции соляной кислоты — вонопразан (Pellicano R. et al., 2018). В случае аллергии к бета-лактамам амоксициллин в терапии первой линии можно заменить на высокую (более 1,5 г) суточную дозу метронидазола либо на нитрофураны. Еще одним из методов, позволяющих повысить эффективность эрадикационной терапии, может быть одновременное использование некоторых штаммов пробиотических микроорганизмов. В настоящее время достаточно хорошо изучена роль Lactobacillus, Bifidobacteria и Saccharomyces boulardii в эрадикационных схемах. Показано, что они увеличивают частоту эрадикации на 17 % и вдвое уменьшают число побочных эффектов антибиотиков (Wang F. et al., 2017; Goderska K. et al., 2018). В метаанализе 16 рандомизированных клинических исследований (РКИ) показано, что добавление пробиотика к висмутсодержащей 4-компонентной терапии увеличивает частоту достижения эрадикации с 80,4 до 90,8 % (Si X.B. et al., 2017).
Как видно из приведенных данных, в странах с широкой распространенностью антибиотикорезистентных штаммов Нр чаще всего для его эрадикации используют препараты висмута, среди которых предпочтение отдается коллоидному субцитрату висмута. Чем же объясняется такое предпочтение? Только в форме коллоидного субцитрата висмут оказался растворим в воде и смог обеспечить разрушение микроорганизма. Подробнее это описывается в статье M.P. Dore et al. (2016). Также подчеркивается, что имеются различия в эффективности висмутсодержащей терапии между странами Азии и Европы, а также в группах с высокой и низкой распространенностью антибиотикорезистентных штаммов. Делается вывод, что добавление коллоидного субцитрата висмута к стандартной 3-компонентной терапии увеличивает эффективность эрадикации на 30–40 %, особенно при наличии резистентных штаммов. В то же время у «быстрых и сверхбыстрых метаболизаторов» ИПП, часто встречающихся в европейских странах, может потребоваться дополнительная кислотосупрессия. Считается, что среди пациентов с неудачей первой и второй линии эрадикационной терапии могут накапливаться именно такие «метаболизаторы» (Dore M.P. et al., 2016). Важным преимуществом висмутсодержащей терапии второй линии является ее высокая эффективность в эрадикации даже мультирезистентных штаммов Нр. Именно благодаря такой эффективности оказалось возможным назначение лечения без определения чувствительности бактерии к антибиотику, что особенно актуально для нашей страны (Malfertheiner P. et al., 2017).
Эффективность висмутсодержащих схем антихеликобактерной терапии в Украине изучалась рядом ученых. По данным Ю.М. Степанова и соавт. (2016), при использовании 10-дневной четырехкомпонентной схемы (висмута субцитрат, амоксициллин, кларитромицин, ИПП) в качестве терапии первой линии эрадикация была достигнута в 94,3 % случаев. По нашим данным, использование 4-компонентной терапии первой линии, содержащей коллоидный субцитрат висмута, позволило после 10 дней лечения добиться эрадикации почти у 93 % больных, причем даже у пациентов с предшествующим применением макролидов (Доро–феев А.Э. и соавт., 2016). В качестве терапии второй линии целесообразно использовать 4-компонентную висмутсодержащую схему эрадикации (включающую ИПП, амоксициллин, субцитрат висмута и нитрофураны) длительностью не менее 14 дней (Malfertheiner P., Megraud F., O’Morain C.A. et al., 2017).
Также следует заметить, что в Украине и соседних странах практически отсутствуют штаммы Нр, резистентные к амоксициллину и тетрациклину. К сожалению, в нашей стране зарегистрированы только 100-миллиграммовые таблетки тетрациклина. По–этому для достижения целевой суточной дозы приходится принимать большое количество лекарственных средств, что доставляет неудобство пациенту и значительно снижает приверженность к лечению. Распространенность резистентности Нр к левофлоксацину в нашей стране мало изучена.
Еще одним, по нашему мнению, важным компонентом эрадикационной терапии хеликобактерной инфекции являются пробиотики. Основываясь на нашем многолетнем опыте и данных из других регионов Украины, можно рекомендовать использование штаммов Lactobacillus, Bifidobacteria и Saccharomyces boulardii параллельно с антибактериальными препаратами (Дорофеев А.Э. и соавт., 2012; Бондаренко А.О., Агибалов А.Н., 2018).
Выводы
1. В Украине широко распространена инфекция Helicobacter pylori. Инфицирование наступает в достаточно раннем возрасте и может приводить к развитию рака желудка.
2. Резистентность Нр к антибиотикам в нашей стране имеет региональные особенности, что необходимо учитывать при назначении лечения.
3. По данным Dore M.P. et al. (2016), добавление коллоидного субцитрата висмута к стандартной 3-компонентной терапии увеличивает эффективность эрадикации на 30–40 %, особенно при наличии резистентных штаммов.
4. В качестве терапии первой линии в регионах с высокой распространенностью резистентности к кларитромицину (или пациентам с предшествующим приемом макролидов) следует назначать 4-компонентную схему с обязательным включением коллоидного субцитрата висмута. У остальных больных возможно использование стандартной 3-компонентной терапии длительностью 10–14 дней.
5. В качестве терапии второй линии целесообразно использовать 4-компонентную висмутсодержащую схему эрадикации (включающую ИПП, амоксициллин, субцитрат висмута и нитрофураны) длительностью не менее 14 дней.
6. Для повышения приверженности к лечению и уменьшения побочных эффектов следует назначать пробиотики.
7. Контроль эффективности эрадикации следует проводить не ранее чем через 4 недели после окончания антибактериальной терапии и через 2 недели после приема ИПП.
8. Для контроля следует применять только методы с доказанной информативностью (13С-уреазный дыхательный тест или стул-тест с использованием моноклональных антител).
Конфликт интересов. Не заявлен.
Bibliography1. Березняк Е.А., Игнатов В.Н., Карпова И.О., Терентьев А.Н. Антибиотикорезистентность штаммов Helicobacter pylori, циркулирующих в Ростовской области // Эпидемиология и вакцинопрофилактика. 2011; 6 (1): 66-70.
2. Бондаренко О.А., Агибалов А.Н. Маастрихтский консенсус V: персонифицированный подход к эрадикационной терапии с учетом региональных особенностей Украины // Здоров’я України. Тематичний номер «Гастроентерологія, гепатологія, колопроктологія». 2018; № 1 (47): 39-40.
3. Бордин Д.С., Янова О.В., Абдулхаков В.В. и соавт. Европейский регистр Helicobacter pylori (протокол Hp-EuReg): первые результаты российских центров // Терапевт. архив. 2016; 88 (2): 33-38.
4. Дорофеев А.Э., Агибалов А.Н., Руденко Н.Н. и соавт. Аспекты диагностики и лечения H.pylori-ассоциированных заболеваний: практический опыт восточного и западного регионов Украины // Сучасна гастроентерол. 2012; 6 (68): 22-26.
5. Дорофеев А.Э., Агибалов А.Н., Руденко Н.Н. и соавт. Функциональная диспепсия и хеликобактерная инфекция: практические аспекты ведения больного // Здоров’я України. Гастроэнтерология. 2014; № 3: 19-20.
6. Дорофеев А.Э., Руденко Н.Н., Ткач С.М., Сибилев А.В. Лечение хеликобактер-ассоциированных заболеваний в Украине, место препарата коллоидного висмута субцитрата в комплексной терапии таких больных // Гастроэнтерология. 2015; № 4 (58): 15-20.
7. Дорофеев А.Э., Руденко Н.Н., Сибилев А.В. Коллоидный субцитрат висмута в лечении хеликобактерной инфекции // Гастроэнтерология. 2016; № 1 (59): 25-29.
8. Колесник О.О. Рак в Україні, 2016–2017 // Бюл. нац. канцер-реєстру Укр. 2018; 19: 24-25.
9. Маев В.И., Кучерявый Ю.А., Андреев Д.Н. и соавт. Антибиотикорезистентность Helicobacter pylori: от клинического значения до молекулярных механизмов // Леч. врач. 2014; № 2.
10. Наказ Міністерства охорони здоров’я 03.08.2012 № 600. Ведення диспепсії у дорослих. — К., 2012.
11. Симаненков В.И., Захарова Н.В., Жебрун А.Б. и соавт. Резистентность Helicobacter pylori к антимикробным препаратам по результатам бактериологического тестирования // Леч. врач. 2015; № 4.
12. Степанов Ю.М., Мосійчук Л.М. Роль вісмуту в лікуванні гастродуоденальної патології (огляд літератури та власні дослідження) // Гастроэнтерология. 2016; № 3 (61): 9-16.
13. Степанов Ю.М., Будзак И.Я. Маастрихтский консенсус-5: аналитический обзор положений // Новости медицины и фармации. Гастроэнтерология. Проктология. 2018; 644: 39-47.
14. Фадеенко Г.Д. Антихеликобактерная терапия в Украине: результаты исследований // Здоров’я України. Тематичний номер «Гастроентерологія, гепатологія, колопроктологія». 2016; 2 (40): 4.
15. Cheung K.S., Leung W.K. Risk of gastric cancer development after eradication of Helicobacter pylori // World J. Gastrointest. Oncol. 2018 May 15; 10 (5): 115-123.
16. Choi I.J., Kook M.C., Kim Y.I. et al. Helicobacter pylori Therapy for the Prevention of Metachronous Gastric Cancer // N. Engl. J. Med. 2018 Mar 22; 378 (12): 1085-1095.
17. Dore M.P., Lu H., Graham D.Y. Role of bismuth in impro–ving Helicobacter pylori eradication with triple therapy // Gut. 2016 May; 65 (5): 870-8.
18. El-Serag H.B., Kao J.Y., Kanwal F. et al. Houston Consensus Conference on Testing for Helicobacter pylori Infection in the United States // Clin. Gastroenterol. Hepatol. 2018 Mar 17. pii: S1542-3565. [Epub ahead of print].
19. Ferenc S., Gnus J., Kościelna M. et al. High antibiotic resistance of Helicobacter pylori and its effect on tailored and empiric eradication of the organism in Lower Silesia, Poland // Helicobacter. 2017 Apr; 22 (2). doi: 10.1111/hel.12365.
20. Fiorini G., Saracino I.M., Zullo A. et al. Rescue therapy with bismuth quadruple regimen in patients with Helicobacter pylori-resistant strains // Helicobacter. 2017 Dec; 22 (6). doi: 10.1111/hel.
21. Fiorini G., Zullo A., Saracino I.M. et al. Antibiotic resistance pattern of Helicobacter pylori strains isolated in Italy during 2010–2016 // Scand. J. Gastroenterol. 2018 Apr 24: 1-4. [Epub ahead of print].
22. Goderska K., Agudo Pena S., Alarcon T. Helicobacter pylori treatment: antibiotics or probiotics // Appl. Microbiol. Biotechnol. 2018 Jan; 102 (1): 1-7.
23. Hathroubi S., Servetas S.L., Windham I. et al. Helicobacter pylori Biofilm Formation and Its Potential Role in Pathogenesis // Microbiol. Mol. Biol. Rev. 2018 May 9; 82 (2).
24. Hooi J.K.Y., Lai W.Y., Ng W.K. et al. Global Prevalence of Helicobacter pylori Infection: Systematic Review and Meta-Analysis // Gastroenterology. 2017 Aug; 153 (2): 420-429.
25. Iwanczak B., Laszewicz W., Iwanczak F. et al. Genotypic and clinical differences of seropositive Helicobacter pylori children and adults in the Polish population // J. Physiol. Pharmacol. 2014 Dec; 65 (6): 801-7.
26. Ji Y., Lu H. Meta-analysis: High-dose vs. low-dose metronidazole-containing therapies for Helicobacter pylori eradication treatment // PLoS One. 2018 Jan 25; 13 (1): e0189888
27. Lee Y.C., Chiang T.H., Chou C.K. et al. Association Between Helicobacter pylori Eradication and Gastric Cancer Incidence: A Systematic Review and Meta-analysis // Gastroenterology. 2016 May; 150 (5): 1113-1124.
28. Long X., Chen Q., Yu L. et al. Bismuth improves efficacy of proton-pump inhibitor clarithromycin, metronidazole triple Helicobacter pylori therapy despite a high prevalence of antimicrobial resistance // Helicobacter. 2018 Apr 25: e12485. [Epub ahead of print].
29. Malfertheiner P., Megraud F., O’Morain C.A. et al. Ma–nagement of Helicobacter pylori infection-the Maastricht V/Florence Consensus Report // Gut. 2017 Jan; 66 (1): 6-30.
30. Muñoz-Gómez P., Jordán-Castro J.A. et al. Macrolide use in the previous years is associated with failure to eradicate Helicobacter pylori with clarithromycin-containing regimens // Helicobacter. 2018 Feb; 23 (1). doi: 10.1111.
31. Papastergiou V., Mathou N., Licousi S. et al. Seven-day genotypic resistance-guided triple Helicobacter pylori eradication therapy can be highly effective // Ann. Gastroenterol. 2018 Mar-Apr; 31 (2): 198-204.
32. Pellicano R., Zagari R.M., Zhang S. et al. Pharmacological considerations and step-by-step proposal for the treatment of Helicobacter pylori infection in the year 2018 // Minerva Gastroenterol Dietol. 2018 Mar 30. [Epub ahead of print].
33. Si X.B., Lan Y., Qiao L. A meta-analysis of randomized controlled trials of bismuth-containing quadruple therapy combined with probiotic supplement for eradication of Helicobacter pylori // Zhonghua Nei Ke Za Zhi. 2017 Oct 1; 56 (10): 752-759.
34. Sugano K., Tack J., Kuipers E.J. et al. Kyoto global consensus report on Helicobacter pylori gastritis // Gut. 2015; 64: 1353-67.
35. Tacconelli E., Carrara E., Savoldi A. et al. Discovery, research, and development of new antibiotics: the WHO priority list of antibiotic-resistant bacteria and tuberculosis // Lancet Infect. Dis. 2018 Mar; 18 (3): 318-327.
36. Tepes B., Kastelic M., Vujasinovic M. et al. Helicobacter Pylori Treatment Results in Slovenia in the Period 2013-2015 as a Part of European Registry on Helicobacter Pylori Management // Radiol. Oncol. 2017 Dec 7; 52 (1): 1-6.
37. Varposhti M., Abdi Ali A., Mohammadi P. Synergistic Effects of Bismuth Thiols and Various Antibiotics Against Pseudomonas aeruginosa Biofilm // Jundishapur J. Microbiol. 2014 Mar; 7 (3): e9142.
38. Venneman K., Huybrechts I., Gunter M.J. et al. The epidemiology of Helicobacter pylori infection in Europe and the impact of lifestyle on its natural evolution toward stomach cancer after infection: A systematic review // Helicobacter. 2018 Apr 10: e12483. [Epub ahead of print].
39. Wang F., Feng J., Chen P. et al. Probiotics in Helicobacter pylori eradication therapy: Systematic review and network meta-analy–sis // Clin. Res. Hepatol. Gastroenterol. 2017 Sep; 41 (4): 466-475.
40. Wang Y., Zhao R., Wang B. et al. Sequential versus concomitant therapy for treatment of Helicobacter pylori infection: an updated systematic review and meta-analysis // Eur. J. Clin. Pharmacol. 2018 Jan; 74 (1): 1-13.
41. Yuan Y., Ford A.C., Khan K.J. et al. Optimum duration of regimens for Helicobacter pylori eradication // Cochrane Database Syst. Rev. 2013 Dec 11; (12): CD008337.
42. Zhuge L., Wang Y., Wu S. et al. Furazolidone treatment for Helicobacter Pylori infection: A systematic review and meta-analysis // Helicobacter. 2018 Apr; 23 (2): e12468
Хеликобактер пилори (Helicobacter pylori). Информация для пациентов
– (хеликобактер пилори, хеликобактерная инфекция, хеликобактерез) – это бактерия, поражающая пилорический отдел желудка и двенадцатиперстную кишку.
На картинке показаны желудок, пищевод, двенадцатиперстная кишка, пилорический отдел желудка
Эта инфекция очень распространена в мире, она встречается почти у 50% населения Земли.
Наука уже больше ста лет знакома с бактериями, которые способны выживать в агрессивной кислой среде желудка. Но только в 70х годах прошлого века врачи выявили связь между этими бактериями и гастритом.
На фото хеликобактер пилори Еще через 10 лет пришло более глубокое понимание влияния этих микроорганизмов на заболевания желудочно-кишечного тракта. Тогда удалось выделить и культивировать бактерию Campylobacter pyloridis (кампелобактер пилоридис), названную после дальнейшего изучения и окончательного классифицирования Helicobacter pylori (хеликобактер пилори).
Хеликобактер пилори. Цифры и факты
Считается, что 75% глобального бремени рака желудка связано с инфицированностью хеликобактер пилори.
У людей с хеликобактер пилори рак желудка встречается в 6 раз чаще, чем у тех, кто не инфицирован.
По результатам исследований от 60 до 100% язв желудка связаны с хеликобактер пилори.
Как же хеликобактер пилори выживает в кислой среде желудка? Дело в том, что бактерия имеет длинные жгутики, которыми проникает под слизистую оболочку. Слизистая оболочка защищает стенки желудка, а, значит, и саму бактерию, от воздействия соляной кислоты.
Кроме того, в процессе своей жизнедеятельности микроорганизм формирует вокруг себя облако щелочной среды. Это позволяет хеликобактер пилори выживать в агрессивной среде желудочно-кишечного тракта.
Хеликобактерная инфекция может быть причиной ряда проблем, в том числе и крайне серьезных:
Бывают случаи, когда у человека имеются симптомы поражения желудка и/или двенадцатиперстной кишки, но не обнаруживается объективных признаков болезни. Это называется функциональной диспепсией.
Несмотря на большое число научных исследований сегодня все еще неизвестно, почему у одних людей, инфицированных хеликобактер, бактерия не вызывает никаких проблем со здоровьем, а у других – серьезные заболевания.
Распространенность инфекции, вызванной хеликобактер пилори
По самым консервативным оценкам, хеликобактер пилори встречается у 50% населения Земли. В развитых странах инфицировано преимущественно взрослое население. В странах с низким социально-экономическим уровнем жизни инфицированность выявляется даже у детей в возрасте до 10 лет.
Как передается хеликобактер пилори?
Несмотря на большое количество длительных исследований до сих пор точно не установлены пути передачи бактерии хеликобактер пилори. Есть три основные версии о путях передачи бактерии:
- фекально-оральный
- орально-оральный
Фекально-оральный путь передачи бактерии хеликобактер пилори считается сегодня основным путем передачи, т.е. бактерия попадает в организм человека через загрязненную воду, продукты питания, при несоблюдении правил гигиены.
В свое время хеликобактер пилори была выявлена в слюне и зубном налете инфицированных, и есть основания предполагать, что микроорганизм может передаваться орально-оральным путем, например, через поцелуи, общие личные вещи.
В ряде исследований демонстрировалась наследственная предрасположенность к хеликобактреной инфекции, но, все же наследственный фактор не является доказанным.
Бактерии также в свое время выявлялись в слюне и желудке кошек и овец, но роль животных в путях передачи инфекции тоже пока науке неизвестна.
Симптомы поражения хеликобактер пилори
Как уже упоминалось выше, в большинстве случаев хиликобактер пилори никак не проявляет себя. Если же инфекция вызвала заболевание, то появляются симптомы, характерные для какого-то конкретного заболевания. Чаще всего это:
- Боли или дискомфорт в верхней части живота
- Вздутие
- Тошнота, рвота
- Чувство переполненного желудка после приема незначительного количества пищи
- Изжога
- Симптомы характерные для дефицита железа
- Черный стул
Не все язвы и/или воспалительные заболевания желудка или двенадцатиперстной кишки вызываются хеликобактерной инфекцией. Они могут развиться на фоне приема лекарственных препаратов, например, обезболивающих.
Как выявляется хеликобактер пилори?
Есть несколько тестов, которые позволяют выявить инфицирован ли человек хеликобактером.
- Анализ крови. Важно понимать, что анализ крови демонстрирует лишь то, что пациент встречался с хеликобактерной инфекцией и не может ответить на вопрос о том, есть ли заболевание на данный момент времени.
- Анализ кала на антиген к хеликобактер пилори.
- Дыхательный уреазный тест
- Биопсия
Тесты на наличие хеликобактер пилори показаны в следующих случаях:
Врач может рекомендовать исследование на носительство хеликобактер и в других случаях:
- Семейная история рака желудка
- Атрофический гастрит
- Дефицит железа
Если у человека нет симптомов поражения хеликобактерной инфекцией, то нет никакой необходимости в обследовании. “На всякий случай” обследования проводить смысла нет.
Нужно ли проводить гастроскопию (эзофагогастродуаденоскопию, ФГДС, эндоскопическое исследование желудка и двенадцатиперстной кишки) при подозрении или в контроле лечения хеликобактерной инфекции?
Подозрение на наличие хеликобактерной инфекции не является показанием к эндоскопическому исследованию. Но данное исследование может быть назначено, если врач заподозрит, например, кровоточащую язву. Обычно в ходе исследования проводится биопсия тканей желудка. Биопсия позволяет выявить хеликобактер пилори в биоптате (кусочке ткани желудка). Однако отсутствие бактерии в биоптате не исключает инфицированность.
Как лечить хеликобактерную инфекцию?
Обычно лечение заболеваний, вызванных хеликобактер пилори, требует назначения трех и более препаратов. Два из них – это антибиотики. В схему лечения также обязательно входит препарат из группы ингибиторов протонной помпы, наиболее известный представитель – омепразол (омез) и препараты висмута. Лечение длится от десяти до четырнадцати дней.
На схеме показан врачебный подход к выбору лечения пациента с хеликобактер пилори
Важно пройти курс лечения в полном объеме.
Своевременное лечение (эрадикация) хеликобактерной инфекции позволит избежать многих проблем.
Лечение способствует быстрому заживлению язв желудка и двенадцатиперстной кишки, разрешению железодефицита и/или повышению эффективности его лечения, а также снижает риск рецидивов язвенной болезни и язвенных кровотечений, уменьшает риск развития рака желудка.
Повторное заражение хеликобактер пилори встречается достаточно редко. В ряде исследований показано, что реинфекции подвержены не более, чем у 2% пациентов в год.
Побочные эффекты. Диета
Лечение заболеваний, вызванной бактерией хеликобактер пилори, может сопровождаться побочными эффектами, но обычно они незначительны и достаточно легко переносятся.
От антибиотиков, например, часто появляется металлический вкус во рту.
Возможны диарея и спастические боли.
Если в схеме лечения присутствуют препараты висмута, то они могут приводить к запорам и окраске стула в темный цвет.
Если в схеме лечения присутствует метронидазол, в период терапии следует воздержаться от приема алкоголя.
Если у пациента наблюдаются побочные эффекты, ему нужно обратиться к своему врачу, который подскажет, как эти побочные эффекты минимизировать, или предпримет иные действия, направленные на предотвращение негативного влияния препаратов.
Дополнительного соблюдения диеты обычно не требуется, то есть пациенту можно употреблять любую привычную пищу, не вызывающую дискомфорта.
Насколько эффективно лечение? Нужно ли контролировать результат?
Современные схемы лечения весьма эффективны. Это подтверждается контрольными исследованиями, которые определяют результат эрадикации. Эффективной терапией считается та, в результате которой из организма полностью исчезает хеликобактер пилори. Но около 20% людей не излечиваются после первого курса терапии. Обычно это требует либо продления лечения еще на две недели, либо – смены, как минимум, одного антибиотика.
Для контроля эффективности обычно используется:
- Дыхательный уреазный тест
- Исследование кала на антиген к хеликобактер пилори.
В чем секрет Helicobacter pylori?
Сегодня кишечные бактерии являются одной из самых горячих тем в медицинской науке. По мере того, как ученые стремительно расширяют список заболеваний, связанных с этими возбудителями, становится все более важным понимание того, каким образом бактериям удается избегать воздействия лекарственных средств и иммунной системы.
Так, Helicobacter pylori – это бактерия, обладающая невероятной способностью колонизировать организм человека. Согласно последним оценкам, ее выявляют в желудках примерно половины всех людей в мире.
Helicobacter pylori может быть как безвредной, так и провоцировать развитие рака желудка и язвенной болезни.
Ученые сообщают, что около 75% случаев рака желудка и 5,5% злокачественных новообразований во всем мире связаны с воспалением и травмами, вызванными Helicobacter pylori.
Особенности поведения Helicobacter pylori
Несмотря на широкую распространенность Helicobacter pylori, ученые до сих пор не до конца изучили поведение данной бактерии в желудке.
Исследователи из медицинского факультета Стэнфордского университета (Stanford University School of Medicine), США, недавно провели ряд исследований, чтобы понять, каким образом Helicobacter pylori удается так длительно колонизировать желудок человека.
Используя передовые инструменты визуализации, ученым удалось определить «убежище» Helicobacter pylori в желудке. Результаты исследования опубликованы в издании «PLOS Biology».
Helicobacter pylori является высокоспециализированной бактерией для колонизации желудка, который представляет собой чрезвычайно негостеприимное место для жизни. По сути желудок — это чан с соляной кислотой. Несмотря на это, данные бактерии способны сохранять свое место обитания на протяжении десятилетий.
Антибиотики могут убивать Helicobacter pylori, но, как правило, они не уничтожают бактерии полностью, и вскоре популяция вырастает заново. Старший автор исследования доктор Мануэль Амиева (Manuel Amieva) объясняет, что вновь возникающий штамм Helicobacter pylori неизменно совпадает с тем, который считался искорененным.
Такая особенность поведения подразумевает, что бактерии Helicobacter pylori нашли способ находить «укрытия» в желудке и в дальнейшем безопасно восстанавливаться.
Место для убежища
У Helicobacter pylori есть длинные вращающиеся жгутики, которые позволяют бактериям перемещаться в окружающей среде. Ученые считают, что данные бактерии используют свои жгутики для создания туннелей в слизистой оболочке желудка.
Слизистый слой защищает оболочку желудка и, следовательно, также способен обеспечить некоторую защиту для Helicobacter pylori.
Ученые установили, что эта тактика, безусловно, играет определенную роль в защите Helicobacter pylori. Однако они открыли и другой метод, которым пользуются бактерия для сохранения своей жизнедеятельности.
Более ранние исследования этой же группы ученых показали, что Helicobacter pylori укрывается в желудочных железах, которые представляют собой крошечные ямки в стенках желудка.
Ученые провели исследование, в ходе которого заразили мышей 2 штаммами Helicobacter pylori. Оба были генетически модифицированы. Первый излучал флуоресцентный зеленый свет, а второй – флуоресцентный красный свет. Ученые также использовали технику, названную CLARITY, которая позволяет проникнуть через неповрежденную ткань и создать трехмерное изображение того, где именно локализуются бактерии.
Конкурентная борьба
Новое исследование раскрывает процесс, который происходит после того, как Helicobacter pylori заселяют желудочные железы. Ученые ожидали, что 2 штамма бактерий (которые были идентичны, кроме их окраски) смешаются и превратятся в общую популяцию двух цветов. Однако они выявили, что, как только бактерия – красная или зеленая – поселяется в желудочной железе, она снижает способность других бактерий проникать в эту железу. Таким образом, несмотря на то что эти бактерии были одного и того же штамма одного и того же вида, исследователи определили, что они способны обойти в конкурентной борьбе свой собственный вид.
Как только красная или зеленая бактерия заселит одну железу и размножится, она перейдет к заселению соседних. Благодаря такому процессу на слизистой оболочке желудка зараженной мыши ученые наблюдали лоскутный узор красного и зеленого цвета.
До сих пор не ясно, как именно каждая бактерия захватывает железу и заявляет о ней как о своей собственности. Для того чтобы это выяснить, ученые отключили у Helicobacter pylori химический сенсорный механизм, которым пользуется бактерия для навигации. В результате такие бактерии не смогли создать исключительно красные или зеленые колонии.
Таким образом, данное исследование дает более четкую картину того, как Helicobacter pylori удается выживать в условиях желудка. Ученые надеются, что полученные данные послужат толчком для разработки эффективных методов лечения заболеваний, вызванных данной бактерией.
По материалам www.medicalnewstoday.com
Цікава інформація для Вас:
Бактериальная инфекция H. pylori: симптомы, диагностика, лечение, профилактика
Helicobacter pylori ( H. pylori ) – это разновидность бактерий. Эти микробы могут проникнуть в ваше тело и жить в пищеварительном тракте. Через много лет они могут вызвать язвы, называемые язвами, на слизистой оболочке желудка или в верхней части тонкой кишки. У некоторых людей инфекция может привести к раку желудка.
Заражение H. pylori является обычным явлением. Около двух третей населения мира находится в организме.У большинства людей он не вызывает язвы или каких-либо других симптомов. Если у вас есть проблемы, существуют лекарства, которые могут убить микробы и помочь заживлению ран.
По мере того, как все больше людей в мире получает доступ к чистой воде и санитарии, все меньше людей заражаются бактериями . Имея хорошие привычки в отношении здоровья, вы можете защитить себя и своих детей от H. pylori .
Как H. pylori вызывает заболевание
На протяжении десятилетий врачи считали, что язвы у людей возникают в результате стресса, острой пищи, курения или других привычек образа жизни.Но когда в 1982 году ученые обнаружили H. pylori , они обнаружили, что микробы были причиной большинства язв желудка .
После того, как H. pylori попадает в ваше тело, он атакует слизистую оболочку желудка, которая обычно защищает вас от кислоты, которую ваше тело использует для переваривания пищи. Как только бактерии нанесут достаточно вреда, кислота может проникнуть через слизистую оболочку, что приведет к язвам. Они могут кровоточить, вызывать инфекции или препятствовать прохождению пищи через пищеварительный тракт.
Вы можете получить H. pylori из еды, воды или посуды. Это чаще встречается в странах или сообществах, где отсутствует чистая вода или хорошая канализация. Вы также можете заразить бактерии при контакте со слюной или другими биологическими жидкостями инфицированных людей.
Многие люди заражаются H. pylori в детстве, но могут заразиться и взрослые. Микробы живут в организме годами до появления симптомов, но у большинства людей язвы никогда не появятся. Врачи не знают, почему только у некоторых людей появляются язвы после инфекции.
Симптомы
Если у вас язва, вы можете почувствовать тупую или жгучую боль в животе. Это может приходить и уходить, но вы, вероятно, почувствуете это больше всего, когда у вас пустой желудок, например, между приемами пищи или посреди ночи. Это может длиться от нескольких минут до нескольких часов. Вы можете почувствовать себя лучше после еды, питья молока или приема антацидов.
К другим признакам язвы относятся:
Язвы могут кровоточить в желудок или кишечник, что может быть опасно для вашего здоровья.Немедленно обратитесь за медицинской помощью, если у вас есть какие-либо из этих симптомов:
Это нечасто, но инфекция H. pylori может вызвать рак желудка. Поначалу у болезни мало симптомов, например, изжога. Со временем вы можете заметить:
- Боль или опухоль в животе
- Тошнота
- Отсутствие чувства голода
- Чувство сытости после небольшого количества еды
- Рвота
- Потеря веса без причины
Диагноз
Если у вас нет симптомов язвы, ваш врач, вероятно, не будет проверять вас на H.pylori . Но если они у вас есть сейчас или были в прошлом, лучше пройти обследование. Лекарства, такие как нестероидные противовоспалительные препараты (НПВП), также могут повредить слизистую оболочку желудка, поэтому важно выяснить, что вызывает ваши симптомы, чтобы вы могли получить правильное лечение.
Для начала ваш врач спросит вас о вашей истории болезни, симптомах и лекарствах, которые вы принимаете. Затем вам проведут медицинский осмотр, в том числе надавят на живот, чтобы проверить, нет ли отека, болезненности или боли.Вы также можете иметь:
- Анализы крови и стула, , которые могут помочь найти инфекцию.
- Дыхательный тест на мочевину. Вы выпьете особую жидкость, которая содержит вещество, называемое мочевиной. Затем вы вдохнете в сумку, которую врач отправит в лабораторию для тестирования. Если у вас H. pylori , бактерии превратят мочевину в вашем организме в углекислый газ, а лабораторные тесты покажут, что в вашем дыхании уровень газа выше нормы.
Для более внимательного изучения ваших язв ваш врач может использовать:
- Эндоскопия верхних отделов желудочно-кишечного тракта. В больнице врач с помощью трубки с маленькой камерой, называемой эндоскопом, будет смотреть вниз по горлу, в желудок и верхнюю часть тонкой кишки. Эту процедуру также можно использовать для сбора образца, который будет исследован на наличие бактерий. Вы можете спать или бодрствовать во время процедуры, но вы получите лекарство, чтобы вам было комфортнее.
- Тесты верхнего GI . В больнице вы выпьете жидкость, содержащую вещество, называемое барием, и ваш врач сделает вам рентгеновский снимок.Жидкость покрывает ваше горло и желудок, выделяя их на изображении.
- Компьютерная томография (КТ). Это мощный рентгеновский снимок, который делает подробные снимки внутренней части вашего тела.
Если у вас H. pylori , ваш врач может также проверить вас на рак желудка. Сюда входят:
- Физический осмотр
- Анализы крови для проверки на анемию, когда в вашем организме недостаточно эритроцитов. Это может произойти, если у вас кровоточащая опухоль.
- Анализ кала на скрытую кровь, который проверяет ваш стул на наличие крови, невидимой невооруженным глазом.
- Эндоскопия.
- Биопсия, когда врач берет небольшой кусочек ткани вашего желудка, чтобы найти признаки рака. Ваш врач может сделать это во время эндоскопии.
- Тесты, позволяющие сделать подробные снимки внутренних органов вашего тела, такие как компьютерная томография или магнитно-резонансная томография (МРТ)
Лечение H. pylori
Если у вас есть язвы, вызванные H.pylori , вам понадобится лечение, чтобы убить микробы, вылечить слизистую оболочку желудка и предотвратить повторное появление язв . Обычно для выздоровления требуется 1-2 недели лечения.
Ваш врач, вероятно, посоветует вам принимать несколько различных типов лекарств. Возможные варианты:
- Антибиотики для уничтожения бактерий в организме, такие как амоксициллин, кларитромицин (биаксин), метронидазол (флагил), тетрациклин (сумицин) или тинидазол (тиндамакс). Скорее всего, вы возьмете как минимум двоих из этой группы.
- Лекарства, которые уменьшают количество кислоты в желудке, блокируя крошечные насосы, которые ее производят. К ним относятся декслансопразол (Dexilant), эзомепразол (Nexium), лансопразол (Prevacid), омепразол (Prilosec), пантопразол (Protonix) или рабепразол (Aciphex).
- Субсалицилат висмута, который также может помочь убить H. pylori вместе с вашими антибиотиками.
- Лекарства, блокирующие химический гистамин, который заставляет ваш желудок вырабатывать больше кислоты. Это циметидин (Тагамет), фамотидин (Флюксид, Пепцид), низатидин (Аксид) или ранитидин (Зантак).
Ваше лечение может означать, что вы будете принимать 14 или более таблеток в день в течение нескольких недель, что кажется большим количеством лекарства. Но действительно важно принимать все, что прописывает врач, и следовать его инструкциям. Если вы не принимаете антибиотики правильно, бактерии в вашем организме могут стать к ним устойчивыми, что затруднит лечение инфекций. Если ваши лекарства беспокоят вас, поговорите со своим врачом о вариантах лечения и о том, как вы можете справиться с побочными эффектами.
Примерно через 1-2 недели после окончания лечения врач может снова проверить ваше дыхание или стул, чтобы убедиться, что инфекция исчезла.
Профилактика
Вы можете защитить себя от заражения H. pylori , выполнив те же действия, что и другие микробы:
- Мойте руки после посещения туалета и перед приготовлением или приемом пищи. Учите детей делать то же самое.
- Избегайте нечистой пищи и воды.
- Не ешьте плохо приготовленные продукты.
- Избегайте еды, которую подают люди, которые не мыли руки.
Хотя стресс и острая пища не вызывают язв, они могут помешать их быстрому заживлению или усугубить вашу боль.Поговорите со своим врачом о том, как справиться со стрессом, улучшить свое питание и, если вы курите, как вам помочь бросить курить.
Чего мне ожидать после инфицирования H. pylori?
Большинство язв, вызванных H. pylori , заживают через несколько недель лечения. Если вы принимали один, вам следует избегать приема НПВП от боли, поскольку эти препараты могут повредить слизистую оболочку желудка. Если вам нужно обезболивающее, попросите врача порекомендовать его.
Где я могу найти информацию или поддержку?
Вы можете найти информацию о H.pylori и язвы от Американского колледжа гастроэнтерологии. Чтобы получить информацию о раке желудка, а также о группах поддержки в Интернете и на местном уровне, посетите Американское онкологическое общество.
Бактерии H. pylori: симптомы, диагностика, лечение, профилактика
Helicobacter pylori ( H. pylori ) – это разновидность бактерий. Эти микробы могут проникнуть в ваше тело и жить в пищеварительном тракте. Через много лет они могут вызвать язвы, называемые язвами, на слизистой оболочке желудка или в верхней части тонкой кишки.У некоторых людей инфекция может привести к раку желудка.
Заражение H. pylori является обычным явлением. Около двух третей населения мира находится в организме. У большинства людей он не вызывает язвы или каких-либо других симптомов. Если у вас есть проблемы, существуют лекарства, которые могут убить микробы и помочь заживлению ран.
По мере того, как все больше людей в мире получает доступ к чистой воде и санитарии, все меньше людей заражаются бактериями . Имея хорошие привычки в отношении здоровья, вы можете защитить себя и своих детей от H.pylori .
Как H. pylori вызывает заболевание
На протяжении десятилетий врачи считали, что язвы у людей возникают в результате стресса, острой пищи, курения или других привычек образа жизни. Но когда в 1982 году ученые обнаружили H. pylori , они обнаружили, что микробы были причиной большинства язв желудка .
После того, как H. pylori попадает в ваше тело, он атакует слизистую оболочку желудка, которая обычно защищает вас от кислоты, которую ваше тело использует для переваривания пищи. Как только бактерии нанесут достаточно вреда, кислота может проникнуть через слизистую оболочку, что приведет к язвам.Они могут кровоточить, вызывать инфекции или препятствовать прохождению пищи через пищеварительный тракт.
Вы можете получить H. pylori из еды, воды или посуды. Это чаще встречается в странах или сообществах, где отсутствует чистая вода или хорошая канализация. Вы также можете заразить бактерии при контакте со слюной или другими биологическими жидкостями инфицированных людей.
Многие люди заражаются H. pylori в детстве, но могут заразиться и взрослые. Микробы живут в организме годами до появления симптомов, но у большинства людей язвы никогда не появятся.Врачи не знают, почему только у некоторых людей появляются язвы после инфекции.
Симптомы
Если у вас язва, вы можете почувствовать тупую или жгучую боль в животе. Это может приходить и уходить, но вы, вероятно, почувствуете это больше всего, когда у вас пустой желудок, например, между приемами пищи или посреди ночи. Это может длиться от нескольких минут до нескольких часов. Вы можете почувствовать себя лучше после еды, питья молока или приема антацидов.
К другим признакам язвы относятся:
Язвы могут кровоточить в желудок или кишечник, что может быть опасно для вашего здоровья.Немедленно обратитесь за медицинской помощью, если у вас есть какие-либо из этих симптомов:
Это нечасто, но инфекция H. pylori может вызвать рак желудка. Поначалу у болезни мало симптомов, например, изжога. Со временем вы можете заметить:
- Боль или опухоль в животе
- Тошнота
- Отсутствие чувства голода
- Чувство сытости после небольшого количества еды
- Рвота
- Потеря веса без причины
Диагноз
Если у вас нет симптомов язвы, ваш врач, вероятно, не будет проверять вас на H.pylori . Но если они у вас есть сейчас или были в прошлом, лучше пройти обследование. Лекарства, такие как нестероидные противовоспалительные препараты (НПВП), также могут повредить слизистую оболочку желудка, поэтому важно выяснить, что вызывает ваши симптомы, чтобы вы могли получить правильное лечение.
Для начала ваш врач спросит вас о вашей истории болезни, симптомах и лекарствах, которые вы принимаете. Затем вам проведут медицинский осмотр, в том числе надавят на живот, чтобы проверить, нет ли отека, болезненности или боли.Вы также можете иметь:
- Анализы крови и стула, , которые могут помочь найти инфекцию.
- Дыхательный тест на мочевину. Вы выпьете особую жидкость, которая содержит вещество, называемое мочевиной. Затем вы вдохнете в сумку, которую врач отправит в лабораторию для тестирования. Если у вас H. pylori , бактерии превратят мочевину в вашем организме в углекислый газ, а лабораторные тесты покажут, что в вашем дыхании уровень газа выше нормы.
Для более внимательного изучения ваших язв ваш врач может использовать:
- Эндоскопия верхних отделов желудочно-кишечного тракта. В больнице врач с помощью трубки с маленькой камерой, называемой эндоскопом, будет смотреть вниз по горлу, в желудок и верхнюю часть тонкой кишки. Эту процедуру также можно использовать для сбора образца, который будет исследован на наличие бактерий. Вы можете спать или бодрствовать во время процедуры, но вы получите лекарство, чтобы вам было комфортнее.
- Тесты верхнего GI . В больнице вы выпьете жидкость, содержащую вещество, называемое барием, и ваш врач сделает вам рентгеновский снимок.Жидкость покрывает ваше горло и желудок, выделяя их на изображении.
- Компьютерная томография (КТ). Это мощный рентгеновский снимок, который делает подробные снимки внутренней части вашего тела.
Если у вас H. pylori , ваш врач может также проверить вас на рак желудка. Сюда входят:
- Физический осмотр
- Анализы крови для проверки на анемию, когда в вашем организме недостаточно эритроцитов. Это может произойти, если у вас кровоточащая опухоль.
- Анализ кала на скрытую кровь, который проверяет ваш стул на наличие крови, невидимой невооруженным глазом.
- Эндоскопия.
- Биопсия, когда врач берет небольшой кусочек ткани вашего желудка, чтобы найти признаки рака. Ваш врач может сделать это во время эндоскопии.
- Тесты, позволяющие сделать подробные снимки внутренних органов вашего тела, такие как компьютерная томография или магнитно-резонансная томография (МРТ)
Лечение H. pylori
Если у вас есть язвы, вызванные H.pylori , вам понадобится лечение, чтобы убить микробы, вылечить слизистую оболочку желудка и предотвратить повторное появление язв . Обычно для выздоровления требуется 1-2 недели лечения.
Ваш врач, вероятно, посоветует вам принимать несколько различных типов лекарств. Возможные варианты:
- Антибиотики для уничтожения бактерий в организме, такие как амоксициллин, кларитромицин (биаксин), метронидазол (флагил), тетрациклин (сумицин) или тинидазол (тиндамакс). Скорее всего, вы возьмете как минимум двоих из этой группы.
- Лекарства, которые уменьшают количество кислоты в желудке, блокируя крошечные насосы, которые ее производят. К ним относятся декслансопразол (Dexilant), эзомепразол (Nexium), лансопразол (Prevacid), омепразол (Prilosec), пантопразол (Protonix) или рабепразол (Aciphex).
- Субсалицилат висмута, который также может помочь убить H. pylori вместе с вашими антибиотиками.
- Лекарства, блокирующие химический гистамин, который заставляет ваш желудок вырабатывать больше кислоты. Это циметидин (Тагамет), фамотидин (Флюксид, Пепцид), низатидин (Аксид) или ранитидин (Зантак).
Ваше лечение может означать, что вы будете принимать 14 или более таблеток в день в течение нескольких недель, что кажется большим количеством лекарства. Но действительно важно принимать все, что прописывает врач, и следовать его инструкциям. Если вы не принимаете антибиотики правильно, бактерии в вашем организме могут стать к ним устойчивыми, что затруднит лечение инфекций. Если ваши лекарства беспокоят вас, поговорите со своим врачом о вариантах лечения и о том, как вы можете справиться с побочными эффектами.
Примерно через 1-2 недели после окончания лечения врач может снова проверить ваше дыхание или стул, чтобы убедиться, что инфекция исчезла.
Профилактика
Вы можете защитить себя от заражения H. pylori , выполнив те же действия, что и другие микробы:
- Мойте руки после посещения туалета и перед приготовлением или приемом пищи. Учите детей делать то же самое.
- Избегайте нечистой пищи и воды.
- Не ешьте плохо приготовленные продукты.
- Избегайте еды, которую подают люди, которые не мыли руки.
Хотя стресс и острая пища не вызывают язв, они могут помешать их быстрому заживлению или усугубить вашу боль.Поговорите со своим врачом о том, как справиться со стрессом, улучшить свое питание и, если вы курите, как вам помочь бросить курить.
Чего мне ожидать после инфицирования H. pylori?
Большинство язв, вызванных H. pylori , заживают через несколько недель лечения. Если вы принимали один, вам следует избегать приема НПВП от боли, поскольку эти препараты могут повредить слизистую оболочку желудка. Если вам нужно обезболивающее, попросите врача порекомендовать его.
Где я могу найти информацию или поддержку?
Вы можете найти информацию о H.pylori и язвы от Американского колледжа гастроэнтерологии. Чтобы получить информацию о раке желудка, а также о группах поддержки в Интернете и на местном уровне, посетите Американское онкологическое общество.
Доксициклин в эрадикационной терапии Helicobacter pylori – Систематический обзор и метаанализ – FullText – Digestion 2016, Vol. 93, № 2
Абстрактные
Справочная информация: Поскольку резистентность Helicobacter pylori очень быстро развивается во всем мире, срочно необходимы новые схемы лечения. Цель: Сравнить степень успешности эрадикации схем лечения H. pylori с доксициклином и без него. Методы: В английской медицинской литературе был проведен поиск схем, включающих доксициклин, для эрадикации H. pylori . Поиск проводился до 31 августа 2015 г. с использованием MEDLINE, PubMed, EMBASE, Scopus и CENTRAL. Мета-анализ проводился с использованием комплексного программного обеспечения для мета-анализа. Объединенные OR и 95% CI были рассчитаны при сравнении схем лечения для эрадикации H.pylori с доксициклином и без него. Результаты: ОШ для показателя успеха эрадикации в фиксированной модели было в пользу схем лечения доксициклином: 1,292, 95% ДИ 1,048–1,594, p = 0,016. Во включенных исследованиях не было значительной неоднородности: Q = 15,130, d.f. (Q) = 8, I 2 = 47,126, p> 0,10. Когда схемы лечения доксициклином сравнивались только со схемами лечения тетрациклином, не было обнаружено значительных различий в степени успешности эрадикации: OR 0.95, 95% ДИ 0,68–1,32, p = 0,77. Но когда схемы лечения доксициклином сравнивались с схемами лечения без тетрациклина, OR в пользу доксициклина было еще выше: OR 1,59, 95% ДИ 1,21-2,09, p Заключение: В этом метаанализе мы подтвердили эффективность доксициклина в искоренение H. pylori . Таким образом, следует рассмотреть возможность трех-, четырехкратной или даже двойной терапии высокими дозами со схемами, содержащими доксициклин.
© 2016 С.Karger AG, Базель
Введение
Поскольку резистентность Helicobacter pylori очень быстро развивается во многих странах по всему миру, срочно необходимы новые схемы лечения. Амоксициллин – очень эффективный компонент любого режима, и устойчивость к этому антибиотику встречается очень редко. Пациентам, страдающим аллергией на пенициллин, нельзя принимать амоксициллин, и требуется его заменитель. Тетрациклин имеет тот же терапевтический диапазон, что и амоксициллин, и может быть активен против H.pylori . Замена доксициклина тетрациклином гидрохлоридом дает преимущества, заключающиеся в менее частом дозировании и дополнительной экскреции через почки. Доксициклин был впервые продемонстрирован как эффективное лекарство против H. pylori в 1992 году с МИК 0,25–8,0 мкг / мл [1]. Первые сообщения о доксициклине, заменяющем тетрациклин, в этом отношении разочаровали [2, 3]. Но результаты статьи Realdi et al. [3] несколько сбивали с толку из-за высокой устойчивости не только к доксициклину (33.3%), но и амоксициллин (26%). Напротив, Usta et al. [4] обнаружили более высокий уровень эрадикации у детей при четырехкомпонентной терапии второй линии, включая доксициклин, по сравнению с двумя трехкомпонентными препаратами первой линии у детей, 64,6 против 60,5 и 55,8% соответственно. Недавно комбинация эзомепразола, левофлоксацина и доксициклина была опробована в качестве терапии третьей линии с низкой эффективностью эрадикации, которая несколько усиливалась пробиотиками [5].
В этом метаанализе мы рассмотрели исследования, в которых сравнивали степень успешной ликвидации H.pylori схемы лечения с доксициклином и без него. Высокий уровень успешной эрадикации дает основание использовать доксициклин вместо амоксициллина в случаях аллергии на пенициллин или в качестве спасательной четырехкратной терапии.
Методы
Стратегия поиска
В английской медицинской литературе был проведен поиск схем лечения, которые включали доксициклин для эрадикации H. pylori . Поиск проводился до 31 августа 2015 г. с использованием MEDLINE, PubMed, EMBASE, Scopus и CENTRAL.Условия поиска: (‘доксициклин’ (термины MeSH) ИЛИ ‘доксициклин’ (все поля)) И (‘Helicobacter pylori’ (термины MeSH) ИЛИ (‘Helicobacter’ (все поля) И ‘pylori’ (все поля)) ИЛИ ‘Helicobacter pylori’ (Все поля)). Ручной поиск статей выполнялся после первоначального поиска и включал библиографию статей. Были включены только полностью опубликованные исследования людей на английском языке (рис. 1).
Рис. 1
Блок-схема статей, определенных для метаанализа.
Выбор исследования
Исследования случай-контроль, сравнивающие схемы лечения для эрадикации H.pylori , с доксициклином и без него. Инфекция H. pylori должна быть диагностирована с помощью 13 дыхательного теста с мочевиной, стула, экспресс-теста на уреазу или гистологического исследования и успешной эрадикации с помощью одного из тех же тестов, по крайней мере, через месяц после лечения и как минимум через 2 недели без лечение антибиотиками, висмутом или ингибиторами протонной помпы. Мы выбрали только рандомизированные проспективные контролируемые исследования, в которых для выражения результатов использовался метод намерения лечить.
Извлечение данных
Показатели успешной эрадикации были извлечены для схем лечения с доксициклином и без него.В исследованиях, в которых проводились вспомогательные исследования, такие как сравнение первой и второй схем, пола, спецификаций лечения, таких как тройная, четверная, сопутствующая или последовательная схемы, их результаты сравнивались в исследованиях врожденных.
Мета-анализ выполнялся с использованием комплексного программного обеспечения для мета-анализа (версия 3, Biostat Inc., Энглвуд, штат Нью-Джерси, США). Объединенные OR и 95% CI были рассчитаны для сравнения успешности эрадикации в отдельных исследованиях с использованием модели фиксированных эффектов.
Неоднородность между исследованиями оценивалась с использованием критерия Q Кокрана, и она считалась присутствующей, если значение p критерия Q было <0,10. Статистика I 2 использовалась для измерения доли несогласованности в отдельных исследованиях, при этом I 2 > 50% представляли существенную неоднородность. Мы также рассчитали потенциальную систематическую ошибку публикации.
Результаты
Всего мы нашли 53 подходящих исследования. Двадцать одно исследование было отклонено из-за языка, проведения на животных или отсутствия полного текста.Двадцать четыре статьи были исключены как редакционные, обзорные или из-за дублирования. Нам осталось 8 исследований случай-контроль из 8 стран, сравнивающих методы лечения H. pylori с доксициклином или без него, которые соответствовали критериям включения, опубликованным до 31 августа 2015 г. [2,3,6,7,8, 9,10,11] (рис. 1; таблица 1). Существует 15 подисследований (врожденные исследования, данные с разбивкой по схеме лечения или продолжительности). В исследовании из Техаса [3] было проведено 5 дополнительных исследований, в которых сравнивали одну и ту же схему приема доксициклина с 5 различными схемами без доксициклина.Исследования из Италии, Ирана и Нью-Йорка [6,8,10] включают по 2 дополнительных исследования. Поскольку Техас и Нью-Йорк – большие штаты в США с разными демографическими характеристиками (много чернокожих в Нью-Йорке и много латиноамериканцев в Техасе), мы предпочли разделить результаты. Используемые схемы были разными, и исследования из Техаса и Нью-Йорка были опубликованы с разницей в 12 лет.
Таблица 1
Исследования случай-контроль, сравнивающие схем эрадикационного лечения H. pylori с доксициклином и без него
Из 15 дополнительных исследований результаты 8 достигли значимости (таблица 1) [2,3,6,10 ].В 5 дополнительных исследованиях схемы лечения доксициклином имели значительно более высокий уровень эрадикации, чем схемы лечения без доксициклина (таблица 1) [3,6,10]. В 3 дополнительных исследованиях схемы лечения без доксициклина показали лучшие результаты (таблица 1) [2,3]. В 6 дополнительных исследованиях схемы лечения доксициклином сравнивались со схемами лечения, содержащими тетрациклин (таблица 1) [2,3,6,9,11]. В 2 дополнительных исследованиях тетрациклин был лучше [2,3], в 1 дополнительном исследовании доксициклин был лучше [6], а в другом не было продемонстрировано никакой разницы между ними (таблица 1) [6,9,11].
OR для уровня эрадикации в фиксированной модели был в пользу схем лечения доксициклином: 1,292, 95% ДИ 1,048–1,594, p = 0,016 (рис. 2). Воронкообразный график отрицает значительную предвзятость публикации (рис. 3). Во включенных исследованиях не было значительной неоднородности: Q = 15,130, d.f. (Q) = 8, I 2 = 47,126, p> 0,10.
Рис. 2
Метаанализ исследований, сравнивающих частоту успешной эрадикации схем лечения с доксициклином и без него (8 статей и 15 исследований). a Метаанализ исследований, сравнивающих степень успешности эрадикации схем лечения доксициклином и тетрациклином (5 статей и 6 исследований). b Метаанализ исследований, сравнивающих степень успешности эрадикации схем лечения доксициклином и схемами без тетрациклина (4 статьи и 9 исследований). D = доксициклин; B = субцитрат висмута; М = метронидазол; Т = тетрациклин; О = омепразол; А = амоксициллин; C = кларитромицин; L = лансопразол; R = ранитидин; F = фуразолидон; СО = коамоксилав; N = нитаноксанид; LE = левофлоксацин; E = эзомепразол; d = дни.
Рис. 3
Воронкообразный график для систематической ошибки публикации.
Когда сравнивались только схемы лечения доксициклином и схемы лечения тетрациклином, не было обнаружено значительных различий в частоте успеха эрадикации: OR 0,95, 95% ДИ 0,68–1,32, p = 0,77 (рис. 2a). Но когда схемы лечения доксициклином сравнивались со схемами лечения без тетрациклина, OR в пользу доксициклина было еще выше: OR 1,59, 95% ДИ 1,21–2,09, p <0,001.
Обсуждение
Доксициклин был клинически разработан в начале 1960-х годов и одобрен FDA в 1967 году [12].Он принадлежит к группе антибиотиков тетрациклиновой группы с повышенной стабильностью и фармакологической эффективностью. Тетрациклин и доксициклин имеют терапевтический диапазон, аналогичный пенициллину, поэтому теоретически могут заменить амоксициллин в схеме лечения H. pylori . Это может быть особенно важно у пациентов с аллергией на пенициллин. Оба препарата, тетрациклин и доксициклин, действуют системно после всасывания из верхних отделов желудочно-кишечного тракта. Основным преимуществом доксициклина перед тетрациклином является его более длительная активность, и его можно принимать дважды или один раз в день.Пиковая концентрация обоих препаратов одинакова, но в случае доксициклина время достижения максимальной концентрации короче, а период полураспада значительно больше [13].
В этом метаанализе мы подтвердили эффективность доксициклина в эрадикации H. pylori . Схемы лечения, содержащие доксициклин, имели такую же степень успеха эрадикации, как схемы, содержащие тетрациклин, но лучше, чем схемы без представителя семейства тетрациклиновых антибиотиков. Когда схемы лечения тетрациклином HCL были исключены, OR для схем, содержащих доксициклин, достигал 1.59 и очень значимо (p <0,001).
Я считаю, что согласно этому метаанализу, тройная, учетверенная или даже двойная терапия высокими дозами с режимами, содержащими доксициклин, будет рассматриваться как терапевтический вариант. Это наблюдение особенно важно в эпоху лекарственной устойчивости и возрастающей потребности в альтернативных схемах эрадикации и спасательной терапии [14].
Это исследование ограничено отсутствием многих испытаний схем лечения, содержащих доксициклин, в которых сообщалось только о 8 исследованиях случай-контроль.Кроме того, в некоторых исследованиях описывалась терапия первой линии и некоторая «спасательная» терапия, таким образом, успех искоренения варьировал и составлял <85%. Таким образом, к результатам следует относиться с осторожностью, и для окончательных выводов необходимы дополнительные рандомизированные контролируемые исследования.
Резюме
В этом метаанализе мы рассмотрели исследования, в которых сравнивалась степень успешной ликвидации схем лечения H. pylori с доксициклином и без него. ОШ для скорости эрадикации в фиксированной модели было в пользу схем лечения доксициклином: 1.292, 95% ДИ 1,048–1,594, p = 0,016. Во включенных исследованиях не было значительной неоднородности: Q = 15,130, d.f. (Q) = 8, I 2 = 47,126, p> 0,10. Когда схемы лечения доксициклином сравнивались только с режимами лечения тетрациклином, не было обнаружено значительных различий в степени успешности эрадикации. Но когда схемы лечения доксициклином сравнивались со схемами лечения без тетрациклина, OR в пользу доксициклина было еще выше. Таким образом, следует рассмотреть возможность трех-, четырехкратной или даже двойной терапии высокими дозами со схемами, содержащими доксициклин.
Заявление о раскрытии информации
Профессор Я. Нив не заявляет о конфликте интересов.
Заявление об обмене данными
Техническое приложение, статистический код и набор данных можно получить у соответствующего автора по адресу [email protected]. Никаких дополнительных данных нет.
Список литературы
- Loo VG, Sherman P, Matlow AG: Инфекция Helicobacter pylori в педиатрической популяции: чувствительность in vitro к омепразолу и восьми противомикробным агентам.Антимикробные агенты Chemother 1992; 36: 1133-1135.
- Бороди Т.Дж., Джордж Л.Л., Брандл С., Эндрюс П., Ленн Дж., Мур-Джонс Д., Девайн М., Уолтон М.: искоренение Helicobacter pylori с помощью тройной терапии доксициклин-метронидазол-висмут субцитратом. Scand J Gastroenterol 1992; 27: 281-284.
- Realdi G, Dore MP, Piana A, Atzei A, Carta M, Cugia L, Manca A, Are BM, Massarelli G, Mura I, Maida A, Graham DY: устойчивость к антибиотикам перед лечением при инфекции Helicobacter pylori: результаты трех рандомизированных контролируемых исследований . Helicobacter 1999; 4: 106-112.
- Usta Y, Saltik-Temizel IN, Demir H, Uslu N, Ozen H, Gurakan F, et al: Сравнение краткосрочных и долгосрочных протоколов лечения и результатов четверной терапии второй линии у детей с инфекцией Helicobacter pylori.Дж. Гастроэнтерол 2008; 43: 429-433.
- Паолузи О.А., Дель Веккио Бланко G, Висконти Э, Коппола М., Фонтана С., Фаваро М., Паллоне Ф: низкая эффективность тройной терапии на основе левофлоксацина-доксициклина для эрадикации Helicobacter pylori в Италии. Всемирный журнал J Gastroenterol 2015; 21: 6698-6705.
- Perri F, Festa V, Merla A, Quitadamo M, Clemente R, Andriulli A: Комбинации амоксициллина / тетрациклина неадекватны в качестве альтернативных методов лечения инфекции Helicobacter pylori. Helicobacter 2002; 7: 99-104.
- Санчес Б., Коэльо Л., Морецсон Л., Виейра Дж. Младший: Неудача лечения Helicobacter pylori после режимов, содержащих кларитромицин: новые практические терапевтические возможности.Helicobacter 2008; 13: 572-576.
- Тагави С.А., Джафари А., Эшрагян А.: Эффективность нового терапевтического режима по сравнению с двумя обычно назначаемыми методами лечения для искоренения Helicobacter pylori: рандомизированное двойное слепое исследование доксициклина, коамоксиклава и омепразола у иранских пациентов.Dig Dis Sci 2009; 54: 599-603.
- Akyildiz M, Akay S, Musoglu A, Tuncyurek M, Aydin A: Эффективность режимов ранитидин-цитрата висмута, амоксициллина и доксициклина или тетрациклина в качестве лечения первой линии для эрадикации Helicobacter pylori. Eur J Intern Med 2009; 20: 53-57.
- Басу П.П., Раяпуди К., Пакана Т., Шах Н.Дж., Кришнасвами Н., Флинн М.: рандомизированное исследование, сравнивающее левофлоксацин, омепразол, нитазоксанид и доксициклин с тройной терапией для искоренения Helicobacter pylori. Am J Gastroenterol 2011; 106: 1970-1975.
- Wang Z, Wu S: Четырехместный режим на основе доксициклина по сравнению с обычным четырехкратным режимом для экстренной ликвидации Helicobacter pylori: открытое контрольное исследование у китайских пациентов.Singapore Med J 2012; 53: 273-276.
- Нельсон М.Л., Леви С.Б.: История тетрациклинов. Энн Н. И. Акад. Наук 2011; 1241: 17-32.
- Agwuh KN, MacGowan A: Фармакокинетика и фармакодинамика тетрациклинов, включая глицилциклины.Журнал Antimicrob Chemother 2006; 58: 256-265.
- Ghotaslou R, Leylabadlo HE, Asl YM: Распространенность устойчивости к антибиотикам у Helicobacter pylori: недавний обзор литературы. World J Methodol 2015; 5: 164-174.
Автор Контакты
Профессор Ярон Нив, доктор медицинских наук, AGAF, FACG
Отделение гастроэнтерологии
Медицинский центр Рабина, ул. Жаботинского, 39
Петах-Тиква, 49100 (Израиль)
E-Mail yniv @ clalit.org.il
Подробности статьи / публикации
Предварительный просмотр первой страницы
Поступила: 8 сентября 2015 г.
Принята к публикации: 28 декабря 2015 г.
Опубликована онлайн: 6 февраля 2016 г.
Дата выпуска: март 2016 г.
Количество страниц для печати: 7
Количество рисунков: 3
Количество столов: 1
ISSN: 0012-2823 (печатный)
eISSN: 1421-9867 (онлайн)
Для дополнительной информации: https: // www.karger.com/DIG
Авторские права / Дозировка препарата / Заявление об ограничении ответственности
Авторские права: Все права защищены. Никакая часть данной публикации не может быть переведена на другие языки, воспроизведена или использована в любой форме или любыми средствами, электронными или механическими, включая фотокопирование, запись, микрокопирование, или с помощью какой-либо системы хранения и поиска информации, без письменного разрешения издателя. .
Дозировка лекарств: авторы и издатель приложили все усилия, чтобы гарантировать, что выбор и дозировка лекарств, указанные в этом тексте, соответствуют текущим рекомендациям и практике на момент публикации.Однако с учетом продолжающихся исследований, изменений в правительственных постановлениях и постоянного потока информации, касающейся лекарственной терапии и реакций на них, читателю рекомендуется проверять листок-вкладыш для каждого препарата на предмет любых изменений показаний и дозировки, а также дополнительных предупреждений. и меры предосторожности. Это особенно важно, когда рекомендованным агентом является новое и / или редко применяемое лекарство.
Отказ от ответственности: утверждения, мнения и данные, содержащиеся в этой публикации, принадлежат исключительно отдельным авторам и соавторам, а не издателям и редакторам.Появление в публикации рекламы и / или ссылок на продукты не является гарантией, одобрением или одобрением рекламируемых продуктов или услуг или их эффективности, качества или безопасности. Издатель и редактор (-ы) не несут ответственности за любой ущерб, причиненный людям или имуществу в результате любых идей, методов, инструкций или продуктов, упомянутых в контенте или рекламе.
Новые концепции устойчивости в лечении инфекций Helicobacter pylori
Megraud F (2007) Helicobacter pylori и устойчивость к антибиотикам. Кишечник 56 : 1502
Артикул Google Scholar
Ди Марио Ф. и др. . (2006) «Спасательные» методы лечения инфекции Helicobacter pylori . Dig Dis 24 : 113–130
Артикул Google Scholar
Connolly LE и др. . (2007) Почему для лечения туберкулеза требуется длительная терапия? PLoS Med 4 : e120
Артикул Google Scholar
Керен I и др. .(2004) Клетки-персистеры и толерантность к противомикробным препаратам. FEMS Microbiol Lett 230 : 13–18
CAS Статья Google Scholar
Льюис К. (2007) Клетки-персистеры, покой и инфекционные заболевания. Nat Rev Microbiol 5 : 48–56
CAS Статья Google Scholar
Graham DY (1997) Можно ли когда-либо отказать в терапии при инфекции Helicobacter pylori ? Гастроэнтерология 113 (Дополнение 6): S113 – S117
CAS Статья Google Scholar
Axon A and Forman D (1997) Helicobacter гастродуоденит: серьезное инфекционное заболевание. BMJ 314 : 1430–1431
CAS Статья Google Scholar
Graham DY и Dore MP (1998) Вариабельность исходов лечения инфекции Helicobacter pylori : критический анализ. В Helicobacter pylori: Основные механизмы клинического лечения , 426–440 (Эдс Хант Р.Х. и Титгат GNJ) Дордрехт: Kluwer Academic Publishers
Chapter Google Scholar
Graham DY (2000) Терапия Helicobacter pylori : текущее состояние и проблемы. Гастроэнтерология 118 (Приложение 1): S2 – S8
CAS Статья Google Scholar
Джордж LL и др. . (1990) Лечение язвы двенадцатиперстной кишки после уничтожения Helicobacter pylori . Med J Aust 153 : 145–149
CAS PubMed Google Scholar
de Boer W et al .(1995) Эффект подавления кислоты на эффективность лечения инфекции Helicobacter pylori . Ланцет 345 : 817–820
CAS Статья Google Scholar
de Boer WA (1999) Тройная терапия висмутом: все еще очень важная лекарственная схема для лечения инфекции Helicobacter pylori . Eur J Gastroenterol Hepatol 11 : 697–700
CAS Статья Google Scholar
Бардхан К. и др. .(2000) Исследование HOMER: эффект увеличения дозы метронидазола вместе с омепразолом и амоксициллином для лечения инфекции Helicobacter pylori . Helicobacter 5 : 196–201
CAS Статья Google Scholar
Graham DY et al . (2007) Табель успеваемости для лечения класса Helicobacter pylori . Helicobacter 12 : 275–278
Артикул Google Scholar
Malfertheiner P et al .(2007) Современные концепции управления инфекцией Helicobacter pylori : Маастрихтский консенсусный отчет III. Кишечник 56 : 772–781
CAS Статья Google Scholar
Vakil N и Megraud F (2007) Эрадикационная терапия для Helicobacter pylori . Гастроэнтерология 133 : 985–1001
CAS Статья Google Scholar
Chey WD и Wong BC (2007) Руководство Американского колледжа гастроэнтерологии по ведению инфекции Helicobacter pylori . Am J Гастроэнтерол 102 : 1808–1825
CAS Статья Google Scholar
Вакил N и др. . (2004) Семидневная терапия против Helicobacter pylori в США. Aliment Pharmacol Ther 20 : 99–107
CAS Статья Google Scholar
Fuccio L и др. .(2007) Мета-анализ: продолжительность тройной терапии на основе ингибиторов протонной помпы первой линии для эрадикации Helicobacter pylori . Ann Intern Med 147 : 553–562
Статья Google Scholar
Загари RM и др. . (2007) Сравнение 1 и 2 недель лечения омепразолом, амоксициллином и кларитромицином для эрадикации Helicobacter pylori : исследование HYPER. Кишечник 56 : 475–479
CAS Статья Google Scholar
Фишбах Л. и Эванс Е.Л. (2007) Мета-анализ: влияние статуса устойчивости к антибиотикам на эффективность тройной и четверной терапии первой линии для Helicobacter pylori . Aliment Pharmacol Ther 26 : 343–357
CAS Статья Google Scholar
Ли YC и др. . (2006) Общинное исследование терапии Helicobacter pylori с использованием стратегии тестирования, лечения, повторного тестирования и повторного лечения неудачных исходов лечения. Helicobacter 11 : 418–424
Артикул Google Scholar
Osato MS et al .(2001) Сравнение Etest и одобренного NCCLS метода разбавления агара для выявления устойчивости к метронидазолу и кларитромицину Helicobacter pylori . Int J Antimicrob Agents 17 : 39–44
CAS Статья Google Scholar
Schabereiter-Gurtner C et al . (2004) Новый анализ ПЦР в реальном времени для выявления инфекции Helicobacter pylori и одновременное определение чувствительности к кларитромицину в образцах кала и биопсии. J Clin Microbiol 42 : 4512–4518
CAS Статья Google Scholar
Модер К.А. и др. . (2007) Быстрый скрининг устойчивости к кларитромицину у Helicobacter pylori с помощью пиросеквенирования. J Med Microbiol 56 : 1370–1376
CAS Статья Google Scholar
Calabresi L et al .(2004) Фармакокинетические взаимодействия омепразола / пантопразола и кларитромицина у здоровых добровольцев. Pharmacol Res 49 : 493–499
CAS Статья Google Scholar
Klotz U (2000) Фармакокинетические соображения при ликвидации Helicobacter pylori . Clin Pharmacokinet 38 : 243–270
CAS Статья Google Scholar
Лампа KC и др. .(1999) Фармакокинетика и фармакодинамика противомикробных препаратов нитроимидазола. Clin Pharmacokinet 36 : 353–373
CAS Статья Google Scholar
Майнц D et al . (2002) Фармакокинетика лансопразола, амоксициллина и кларитромицина после одновременного и однократного приема. J Antimicrob Chemother 50 : 699–706
CAS Статья Google Scholar
Pommerien W et al .(1996) Фармакокинетические и фармакодинамические взаимодействия между омепразолом и амоксициллином у Helicobacter pylori -позитивных здоровых субъектов. Aliment Pharmacol Ther 10 : 295–301
CAS Статья Google Scholar
Furuta T et al . (2007) Разработанный на основе фармакогеномики режим по сравнению со стандартным терапевтическим режимом для эрадикации H. pylori . Clin Pharmacol Ther 81 : 521–528
CAS Статья Google Scholar
Klotz U (2006) Клиническое влияние полиморфизма CYP2C19 на действие ингибиторов протонной помпы: обзор специальной проблемы. Int J Clin Pharmacol Ther 44 : 297–302
CAS Статья Google Scholar
Dojo M и др. . (2001) Влияние полиморфизма гена CYP2C19 на частоту излечения от инфекции Helicobacter pylori тройной терапией ингибитором протонной помпы (омепразол или рабепразол), амоксициллином и кларитромицином в Японии. Dig Liver Dis 33 : 671–675
CAS Статья Google Scholar
Schwab M et al .(2004) Полиморфизм CYP2C19 является основным предиктором неэффективности лечения у белых пациентов при использовании четырехкомпонентной терапии на основе лансопразола для эрадикации Helicobacter pylori . Clin Pharmacol Ther 76 : 201–209
CAS Статья Google Scholar
Furuta T et al . (2003) Терапевтическое влияние фармакогенетики CYP2C19 на эрадикационную терапию на основе ингибиторов протонной помпы для Helicobacter pylori . Методы Найдите Exp Clin Pharmacol 25 : 131–143
CAS Статья Google Scholar
Kawabata H et al . (2003) Влияние различных ингибиторов протонной помпы, различия в генотипе CYP2C19 и устойчивость к антибиотикам на скорость эрадикации инфекции Helicobacter pylori с помощью 1-недельного режима приема ингибитора протонной помпы, амоксициллина и кларитромицина. Aliment Pharmacol Ther 17 : 259–264
CAS Статья Google Scholar
Кита Т и др. .(2002) Оптимальная доза омепразола для интенсивных метаболизаторов CYP2C19 при терапии против Helicobacter pylori : фармакокинетические соображения. Biol Pharm Bull 25 : 923–927
CAS Статья Google Scholar
Miyoshi M et al . (2001) Рандомизированное открытое испытание для сравнения ингибиторов протонной помпы, омепразола и рабепразола, в двойной терапии инфекции Helicobacter pylori по сравнению с генетическим полиморфизмом CYP2C19 . J Гастроэнтерол Гепатол 16 : 723–728
CAS Статья Google Scholar
Shirai N et al . (2007) Двойная терапия высокими дозами рабепразола и амоксициллина по сравнению с тройной терапией рабепразолом, амоксициллином и метронидазолом в качестве схемы спасения от инфекции Helicobacter pylori после стандартной тройной терапии. Eur J Clin Pharmacol 63 : 743–749
CAS Статья Google Scholar
Padol S et al .(2006) Влияние полиморфизмов CYP2C19 на скорость эрадикации H. pylori при терапии двойным и тройным ИПП первой линии: метаанализ. Am J Гастроэнтерол 101 : 1467–1475
CAS Статья Google Scholar
van Zanten SV и Thompson K (2006) Должно ли присутствие полиморфизмов ферментов CYP2C19 влиять на выбор ингибитора протонной помпы для лечения инфекции Helicobacter pylori ? Am J Гастроэнтерол 101 : 1476–1478
Артикул Google Scholar
Miehlke S et al .(2008) Однонедельная тройная терапия эзомепразолом, моксифлоксацином и рифабутином один раз в день для искоренения стойкого Helicobacter pylori , устойчивого как к метронидазолу, так и к кларитромицину. Helicobacter 13 : 69–74
CAS Статья Google Scholar
de Boer WA и Tytgat GN (1995) Лучшая терапия для инфекции Helicobacter pylori : должен ли эффективность или профиль побочных эффектов определять наш выбор? Scand J Gastroenterol 30 : 401–407
CAS Статья Google Scholar
Suzuki T и др. .(2007) Влияние курения и генотипов CYP2C19 на успех ликвидации H. pylori . Epidemiol Infect 135 : 171–176
CAS Статья Google Scholar
Furuta T et al . (2007) Влияние полиморфизма MDR1 C3435T на частоту излечения инфекции Helicobacter pylori тройной терапией лансопразолом, амоксициллином и кларитромицином в отношении генотипов CYP2C19 и генотипов 23S рРНК H.pylori . Aliment Pharmacol Ther 26 : 693–703
CAS Статья Google Scholar
Furuta T et al . (2001) Влияние генотипических различий в статусе CYP2C19 на частоту излечения от инфекции Helicobacter pylori при двойной терапии рабепразолом плюс амоксициллин. Фармакогенетика 11 : 341–348
CAS Статья Google Scholar
Ли С.Б. и др. .(2003) Эффективность тройной терапии рабепразолом при инфекции Helicobacter pylori по отношению к генотипу CYP2C19 . Korean J Gastroenterol 42 : 468–475
PubMed Google Scholar
Sapone A и др. . (2003) Клиническая роль генотипов цитохрома p450 в управлении Helicobacter pylori . Am J Гастроэнтерол 98 : 1010–1015
CAS Статья Google Scholar
Sugimoto M et al .(2006) Влияние провоспалительных и противовоспалительных полиморфизмов цитокинов на скорость эрадикации чувствительных к кларитромицину штаммов Helicobacter pylori при тройной терапии. Clin Pharmacol Ther 80 : 41–50
CAS Статья Google Scholar
Гавронска-Шкларц B и др. . (2005) Влияние полиморфизмов CYP2C19 и MDR1 на частоту излечения у пациентов с кислотно-зависимыми расстройствами с инфекцией Helicobacter pylori . Eur J Clin Pharmacol 61 : 375–379
CAS Статья Google Scholar
Bigger JW (1944) Лечение стафилококковых инфекций пенициллином путем периодической стерилизации. Ланцет 247 : 497–500
Артикул Google Scholar
Скотт Д. и др. . (1998) Жизнь и смерть Helicobacter pylori . Кишечник 43 (Дополнение 1): S56 – S60
CAS Статья Google Scholar
van der Hulst RWM et al . (1996) Лечение инфекции Helicobacter pylori у человека : обзор мировой литературы. Helicobacter 1 : 6–19
CAS Статья Google Scholar
Линд Т. и др. .(1999) Исследование MACh3: роль омепразола в искоренении Helicobacter pylori с помощью тройной терапии в течение 1 недели. Гастроэнтерология 116 : 248–253
CAS Статья Google Scholar
Megraud F et al . (1999) Тестирование чувствительности к противомикробным препаратам Helicobacter pylori в большом многоцентровом исследовании: исследование MACH 2. Антимикробные агенты Chemother 43 : 2747–2752
CAS Статья Google Scholar
Линд Т. и др. .(1996) Искоренение Helicobacter pylori с использованием однонедельной тройной терапии, сочетающей омепразол с двумя противомикробными препаратами: исследование MACH I. Helicobacter 1 : 138–144
CAS Статья Google Scholar
Schwartz H et al . (1998) Тройная терапия по сравнению с двойной терапией для искоренения Helicobacter pylori и предотвращения рецидива язвы: рандомизированное двойное слепое многоцентровое исследование лансопразола, кларитромицина и / или амоксициллина в различных режимах дозирования. Am J Гастроэнтерол 93 : 584–590
CAS Статья Google Scholar
Zullo A et al . (2007) Схема последовательной терапии для эрадикации Helicobacter pylori : анализ объединенных данных. Кишечник 56 : 1353–1357
CAS Статья Google Scholar
Вайра Д. и др. .(2007) Последовательная терапия по сравнению со стандартной тройной лекарственной терапией для эрадикации Helicobacter pylori : рандомизированное исследование. Ann Intern Med 146 : 556–563
Статья Google Scholar
Каталано Ф и др. . (2000) Helicobacter pylori -положительная язва двенадцатиперстной кишки: трехдневный режим эрадикации антибиотиками. Aliment Pharmacol Ther 14 : 1329–1334
CAS Статья Google Scholar
Gisbert JP et al .(2001) Высокая эффективность ранитидина цитрата висмута, амоксициллина, кларитромицина и метронидазола два раза в день в течение всего пяти дней при ликвидации Helicobacter pylori . Helicobacter 6 : 157–162
CAS Статья Google Scholar
Нагахара А и др. . (2000) Добавление метронидазола к режиму рабепразол – амоксициллин – кларитромицин для инфекции Helicobacter pylori обеспечивает отличный показатель излечения при пятидневной терапии. Helicobacter 5 : 88–93
CAS Статья Google Scholar
Нагахара А и др. . (2001) Пятидневная четырехкратная терапия на основе ингибиторов протонной помпы более эффективна, чем семидневная трехкратная терапия для инфекции Helicobacter pylori . Aliment Pharmacol Ther 15 : 417–421
CAS Статья Google Scholar
Невилл PM и др. .(1999) Оптимальная комбинация антибиотиков в 5-дневном режиме эрадикации Helicobacter pylori . Aliment Pharmacol Ther 13 : 497–501
CAS Статья Google Scholar
Okada M et al . (1998) Новая четырехкратная терапия для уничтожения Helicobacter pylori : влияние предварительной обработки омепразолом на частоту излечения. Дж Гастроэнтерол 33 : 640–645
CAS Статья Google Scholar
Okada M et al .(1999) Новая четырехкратная терапия для Helicobacter pylori : влияние устойчивых штаммов на результат лечения. Aliment Pharmacol Ther 13 : 769–774
CAS Статья Google Scholar
Treiber G и др. . (1998) Амоксициллин / метронидазол / омепразол / кларитромицин: новая короткая четырехкратная терапия для ликвидации Helicobacter pylori . Helicobacter 3 : 54–58
CAS Статья Google Scholar
Treiber G и др. .(2002) Клинический результат и влияющие факторы новой краткосрочной четырехкратной терапии для эрадикации Helicobacter pylori : рандомизированное контролируемое исследование (исследование MACLOR). Arch Intern Med 162 : 153–160
CAS Статья Google Scholar
Furuta T et al . (2003) Терапия высокими дозами рабепразола / амоксициллина в качестве схемы второго ряда после неспособности уничтожить H.pylori путем тройной терапии обычными дозами ингибитора протонной помпы, кларитромицина и амоксициллина. Гепатогастроэнтерология 50 : 2274–2278
CAS PubMed Google Scholar
Саад Р.Дж. и др. . (2006) Тройная терапия на основе левофлоксацина в сравнении с четверной терапией на основе висмута для стойкой инфекции Helicobacter pylori : метаанализ. Am J Гастроэнтерол 101 : 488–496
CAS Статья Google Scholar
де Бортоли N и др. .(2007) Ликвидация Helicobacter pylori : рандомизированное проспективное исследование тройной терапии по сравнению с тройной терапией плюс лактоферрин и пробиотики. Am J Гастроэнтерол 102 : 951–956
CAS Статья Google Scholar
Тонг JL и др. . (2007) Мета-анализ: влияние добавления пробиотиков на частоту эрадикации и побочные эффекты во время эрадикационной терапии Helicobacter pylori . Aliment Pharmacol Ther 25 : 155–168
CAS Статья Google Scholar
Gotoh A et al . (2002) Дополнительный эффект проназы на эффективность эрадикационной терапии против Helicobacter pylori . Helicobacter 7 : 183–191
CAS Статья Google Scholar
Ликвидация Лечение инфекции Helicobacter pylori на основе Molecu
Введение
Helicobacter pylori ( H.pylori ), которым заражено более 50% всего населения мира, стала глобальной проблемой здравоохранения, связанной с многочисленными доброкачественными и злокачественными заболеваниями желудка, включая хронический гастрит, язвы желудка и двенадцатиперстной кишки, рак желудка и желудочный MALT (лимфоид, связанный со слизистой оболочкой). ткани) лимфомы. 1-3 В развивающихся странах H. pylori был обнаружен в желудках от 70% до 90% людей, а в западных странах от 25% до 50% всего населения являются носителями H.pylori . 3 Множество исследований за последние десятилетия продемонстрировали, что эрадикационное лечение инфекции H. pylori имеет большое значение для болезней, связанных с H. pylori , таких как заживление язв, регресс лимфомы MALT и снижение риска рака. 4
Четыре важных консенсусных отчета по лечению инфекции H. pylori были опубликованы за последние 4 года, включая Управление инфекции H. pylori – Маастрихтский V / Флорентийский консенсусный отчет, Киотский глобальный консенсусный отчет по H.pylori гастрита, Торонтский консенсус по лечению инфекции H. pylori у взрослых и Пятый китайский национальный консенсусный доклад по лечению инфекции H. pylori . 5–8 Схемы эрадикационного лечения инфекции H. pylori , рекомендованные этими руководящими принципами, включали тройную терапию на основе кларитромицина (ингибитор протонной помпы / ИПП + амоксициллин + кларитромицин), четырехкратную терапию без висмута (последовательная, сопутствующая и гибридная терапия) и висмут -содержащая четверная терапия. 8
Для стандартной четырехкратной терапии висмутом наш Пятый национальный консенсус рекомендует семь схем терапии и обычно используются шесть антибиотиков, включая амоксициллин, кларитромицин, левофлоксацин, метронидазол, фуразолидон и тетрациклин. 8 Однако, к сожалению, скорость уничтожения при лечении H. pylori заметно снижается, и основной причиной является устойчивость к антибиотикам. 5–8 Что касается первичной устойчивости, недавние исследования показали, что уровни устойчивости H.pylori на кларитромицин, метронидазол и левофлоксацин составляют 20–50%, 40–70% и 20–50% соответственно. 8–11 Для повышения скорости эрадикации H. pylori выполнение теста на лекарственную чувствительность перед лечением может иметь сравнительное преимущество. 8,12
С быстрым развитием молекулярной патологии было подтверждено, что некоторые молекулярные маркеры связаны с устойчивостью к антибиотикам, например точечные мутации 23S рРНК, включая A2143G, A2142G и A2142C домена V, которые были обнаружены более чем в 90% пациенты с резистентностью к кларитромицину. 13–15 Для устойчивости к антибиотикам при инфекции H. pylori Институт клинических лабораторных стандартов (CLSI) рекомендует бактериальный посев и метод дисковой диффузии. 16–18 Однако по сравнению с культурой H. pylori обнаружение молекулярных патологий на основе молекулярных маркеров, таких как полимеразная цепная реакция (ПЦР) в реальном времени и традиционный анализ ПЦР, является очень простым и экономичным подходом, который также требует меньше времени. Наше исследование было разработано для определения эффективности и безопасности H.pylori , основанная на результатах молекулярной патологической устойчивости к антибиотикам.
Материалы и методы
Пациенты, критерии включения и исключения
Ретроспективно был проанализирован в общей сложности 261 пациент, которые подверглись лечению H. pylori на основании молекулярной патологической устойчивости к антибиотикам, в том числе 111 пациентов, которые лечились впервые (одна группа как первая группа) и 150 пациентов. кто потерпел неудачу хотя бы один раз в четырехкратной терапии висмутом (другая группа как повторное лечение).Весь процесс нашего исследования полностью соответствует принципам Хельсинкской декларации, и наш исследовательский проект был одобрен Комитетом по этике исследований на людях нашей больницы. Письменное информированное согласие было получено от всех пациентов. Критерии включения: (1) пациенты в возрасте от 18 до 80 лет; (2) пациенты, которым при гистопатологическом исследовании был поставлен диагноз «инфекция H. pylori »; и (3) пациенты, за которыми можно успешно наблюдать.Критерии исключения включали: (1) пациенты, получавшие антимикробную терапию за 2 месяца до обследования с помощью гастроскопа; (2) пациенты, перенесшие операцию на верхних отделах желудочно-кишечного тракта; (3) пациенты, у которых были диагностированы злокачественные новообразования; и (4) пациенты с серьезными заболеваниями сердца, легких, печени или почек.
Сбор образцов
У каждого пациента были взяты биопсии тела желудка и / или антрального отдела при эндоскопии верхних отделов желудочно-кишечного тракта. Биопсии желудка были подготовлены в соответствии с требованиями молекулярного патологического обнаружения и должны быть достаточными для дальнейшей полимеразной цепной реакции (ПЦР) и анализа ПЦР в реальном времени.
Обнаружение генотипов мочевины и CYP2C19 при биопсии желудка с помощью ПЦР
Для подтверждения наличия инфекции H. pylori в биоптатах желудка был обнаружен ген UreA с помощью обычного метода ПЦР. 19,20 Праймеры для ПЦР-амплификации мочевины (F: 5ʹ-GCCAATGGTAAATTAGTT-3 ‘R: 5ʹ-CTCCTTAATTGTTTTTAC-3’) 20 были разработаны в соответствии с опубликованным исследованием и синтезированы в NewLife Inc. (Китай). Кроме того, на эффект ИПП при лечении эрадикационной терапией H. pylori может влиять полиморфизм гена CYP2C19. 21 Было обнаружено три основных аллеля, включая CYP2C19 * 1 (дикий тип), CYP2C19 * 2 (мутация в экзоне 5) и CYP2C19 * 3 (мутация в экзоне 4). 21,22 Последовательности праймеров были разработаны и синтезированы для CYP2C19 * 2 (F: 5ʹ-AATTACAACCAGAGCTTGGC-3 ‘R: 5ʹ-TATCA CTTTCCATAAAAGCAAG-3’) и CYP2C19 * 3 (F: 5ʹ-TATTATTATCTGA R: 5ʹ-ACTTCAGGGCTTGGTCAATA-3 ‘). 21 Они были обнаружены с помощью ПЦР-амплификации, а продукты были проанализированы и секвенированы в NewLife Inc.
Обнаружение мутаций, связанных с устойчивостью к кларитромицину с помощью ПЦР в реальном времени
Было обнаружено, что три основные точечные мутации 23S рРНК, включая A2143G, A2142G и A2142C домена V ( Дополнительная таблица 1 ), связаны с более чем 90% пациентов с устойчивостью к кларитромицину. 13–15,20 Анализ аллельной дискриминации TaqMan в реальном времени (NewLife, Пекин, Китай) был использован для определения этих точечных мутаций в соответствии с описанием, приведенным в ранее опубликованных ссылках. 15,20 Праймеры и зонды были сконструированы как для ДНК дикого типа, так и для мутированной ДНК, и последовательности показаны в дополнительной таблице 2 . Было использовано прикрепление связующего с малыми бороздками (MGB) к олигонуклеотидам и более короткие флуорогенные зонды, 20,23 , и зонды были помечены двумя разными флуоресцентными красителями (красителем VIC и красителем FAM). Обнаружение ПЦР в реальном времени выполняли в соответствии с инструкциями производителя. Положительный и отрицательный контроли использовались одновременно, и все образцы детектировались дважды.
Обычная ПЦР и секвенирование для обнаружения мутаций, связанных с устойчивостью к амоксициллину, фторхинолону и тетрациклину
Как показано в дополнительной таблице , мутации генов PBP1, gyrA и 16S рРНК были подтверждены как связанные с устойчивостью H. pylori к амоксициллину, фторхинолону и тетрациклину, соответственно. 24–28 Обычный метод ПЦР и секвенирования был использован для обнаружения этих сайтов мутаций, и Дополнительная таблица 3 показывает последовательности праймеров, ориентированных на гены-мишени.Все реакции проводили в объеме 25 мкл, а амплификации ПЦР выполняли с использованием аппарата для ПЦР MJR PTN-200 (MJ Research Inc, Уотертаун, США) в соответствии с инструкциями производителя. Продукты амплификации ПЦР разделяли электрофорезом в 2% агарозном геле, и дальнейшее секвенирование было выполнено NewLife, Китай.
Ликвидационное лечение
H. pylori Инфекция на основе молекулярно-патологической устойчивости к антибиотикамДо начала эрадикационной терапии у всех пациентов был диагностирован H.pylori при гистологическом исследовании (окрашивание серебром Вартина-Старри) и обнаружении гена UreA с помощью ПЦР. Они прошли курс эрадикационной терапии H. pylori в течение 14 дней на основании результатов молекулярно-патологических тестов на устойчивость к антибиотикам. Через четыре недели после окончания эрадикационного лечения этих пациентов выявляли с помощью UBT ( 13 дыхательный тест с C-мочевиной) и / или гистопатологических исследований для определения статуса инфекции H. pylori . Через восемь недель после лечения этим пациентам были повторены UBT, чтобы подтвердить эффект H.pylori эрадикационная терапия. В конце лечения изучались функции печени и почек, регистрировались и сравнивались нежелательные явления. Показатели эрадикации использовались в качестве основного критерия результатов.
Статистический анализ
SPSS 20.0 для Windows (SPSS Inc., Чикаго, Иллинойс, США) были выполнены для статистического анализа. Тест хи-квадрат или точный тест Фишера использовался для сравнения показателей эрадикации, большинства демографических характеристик пациентов, результатов устойчивости к антибиотикам при молекулярно-патологических исследованиях, схем лечения H.pylori и частота нежелательных явлений. Уровень эрадикации в каждой группе анализировался для каждого намерения лечить и согласно протоколу с 95% доверительным интервалом. Значение P <0,05 считалось значимым, и все приведенные значения P двусторонние.
Результаты
Демографические данные пациентов
Двести шестьдесят один пациент был проанализирован ретроспективно, в том числе 111 пациентов, получавших первое лечение, и 150 пациентов, получавших повторное лечение (рис. 1). Демографические данные пациентов представлены в таблице 1.Средний возраст 261 пациента составил 52,3 ± 15,4 года, 116 пациентов были мужчинами. Эндоскопия верхних отделов желудочно-кишечного тракта показала, что у 146 пациентов был диагностирован хронический поверхностный гастрит (CSG), а у 115 пациентов – хронический атрофический гастрит (CAG). Кроме того, язвенная болезнь была обнаружена у 42 пациентов, в том числе у 34 – с язвой двенадцатиперстной кишки и у 8 – с язвой желудка (таблица 1).
Таблица 1 Демографические данные пациентов |
Рис. 1 Блок-схема данного исследования. |
Диагноз инфекции H. pylori был подтвержден двумя методами, включая окрашивание серебром Вартина-Старри и определение гена мочевины мочевины с помощью ПЦР. Перед эрадикационной терапией H. pylori была определена устойчивость к антибиотикам, и схемы лечения были выбраны на основе результатов выявления молекулярных патологических исследований. Полиморфизм гена CYP2C19 был получен у 237 пациентов, включая 108 пациентов с быстрым метаболизмом (RM), 105 пациентов с промежуточным метаболизмом (IM) и 24 пациента со слабым метаболизмом (PM).Как показано в Таблице 1, по сравнению с пациентами, которые не получали ранее эрадикационную терапию H. pylori , у тех пациентов, которые не прошли четырехкратную терапию висмутом, был более высокий процент пациентов женского пола (42,3% против 65,3%, P = 0,033). Не было обнаружено значимых различий при однофакторном анализе среднего возраста, результатов эндоскопических исследований и полиморфизмов гена CYP2C19 (таблица 1).
Устойчивость к антибиотикам
H. pylori Инфекция при молекулярно-патологических исследованияхЧетыре антибиотика, обычно используемые для лечения H.pylori , включая амоксициллин (AMPC / A), кларитромицин (CAM / C), фторхинолон (FLQ / F) и тетрациклин (TET / T). Выбор антибиотиков в схемах лечения эрадикации H. pylori был основан на устойчивости к антибиотикам при молекулярно-патологических исследованиях. Метронидазол (MNZ) и фуразолидон (FZD) не были определены в нашем исследовании, и фуразолидон также можно было использовать для лечения H. pylori , учитывая, что процент устойчивости к фуразолидону был очень низким в нашей стране. 29,30
В таблице 2 и на рисунке 2 показаны результаты молекулярно-патологических исследований. Общая устойчивость к амоксициллину, кларитромицину, фторхинолону и тетрациклину составила 9,0%, 63,6%, 58,5% и 22,2% соответственно. Для 111 пациентов, впервые получавших лечение, уровень устойчивости к антибиотикам составлял 5,5% (AMPC), 42,1% (CAM), 41,7% (FLQ) и 12,9% (TET), соответственно; тогда как для 150 пациентов, получавших повторное лечение, частота составила 11,7% (AMPC), 79,7% (CAM), 70,7% (FLQ) и 30,0% (TET), соответственно.Существенные различия были обнаружены с помощью однофакторного анализа показателей устойчивости к антибиотикам к кларитромицину (P <0,001), фторхинолону (P <0,001) и тетрациклину (P = 0,002) между пациентами, впервые получавшими лечение, и пациентами, получавшими повторное лечение (Таблица 2).
Таблица 2 Устойчивость к антибиотикам H. pylori : молекулярно-патологические результаты |
Рисунок 2 Распространенность устойчивости к антибиотикам определяется молекулярными патологическими тестами.Серая гистограмма показывает процент устойчивости к антибиотикам у впервые пролеченных пациентов, которые лечились впервые, а черная гистограмма показывает процент пациентов, получавших повторное лечение, которые не прошли четырехкратную терапию висмутом. Как было продемонстрировано, уровни устойчивости к амоксициллину, кларитромицину, фторхинолону и тетрациклину составляли 5,5%, 42,1%, 41,7% и 12,9% у пациентов, впервые получавших лечение, тогда как у пациентов, получавших лечение впервые, 11,7%, 79,7%, 70,7% и 30,0% соответственно. -Лечение больных. |
Кроме того, мы проанализировали процентную долю пациентов, у которых была лекарственная устойчивость к двум антибиотикам, и сравнили различия между пациентами, впервые получавшими лечение, и пациентами, получавшими повторное лечение (Таблица 2).Поскольку уровень устойчивости к амоксициллину был низким и только 23 пациента имели устойчивость к амоксициллину, количество пациентов, у которых была устойчивость к антибиотикам к AMPC + CAM, AMPC + FLQ и AMPC + TET, составляло 14, 13 и 10, соответственно, и не было значительных различий. между этими пациентами. Как показано в Таблице 2, по сравнению с пациентами, получавшими первое лечение, у этих пациентов, получавших повторное лечение, были более высокие показатели устойчивости к антибиотикам к CAM + FLQ (25,0% против 58,0%, P <0,001), CAM + TET (9,9% против 24,6%, P = 0,005) и FLQ + TET (8.1% против 21,7%, P = 0,006).
Схема лечения
H. pylori ЛиквидацияДля всех 261 пациента, независимо от того, лечились ли они впервые или повторно, применялась четырехкратная терапия висмутом, и два антибиотика были выбраны на основе результатов молекулярно-патологических исследований устойчивости к антибиотикам. В нашем исследовании семь пациентов не получали лечения по какой-либо схеме, потому что 6 пациентов были устойчивы ко всем доступным антибиотикам, а один пациент не лечился (рис. 1).У 254 пациентов, получивших эрадикационную терапию H. pylori , для более чем 90% из них использовались четыре режима лечения (таблица 3), включая AMPC + CAM (59 пациентов, 23,2%), AMPC + FLQ (65, 25,6%). %), AMPC + TET (62, 24,4%) и AMPC + FZD (43, 16,9%). Между пациентами, впервые получавшими лечение, и пациентами, получавшими повторное лечение, были обнаружены значимые различия для всех этих четырех схем (P <0,001, P = 0,015, P = 0,001 и P = 0,014).
Таблица 3 Схема лечения H.pylori Искоренение |
Уровень эрадикации
H. pylori ИнфекцияКак показано на рисунке 1, 261 пациент был включен в анализ намерения лечить (ITT), а после завершения нашего исследования 248 пациентов были включены в анализ по протоколу (PP). Шесть пациентов были потеряны для наблюдения. Показатели эрадикации в анализах ITT и PP составили 92,79% (95% доверительный интервал / ДИ, 87,98–97,60%, n = 111) и 98,10% (95% ДИ, 95,48–100%, n = 105), соответственно, в пациенты, получившие первое лечение, и 90.67% (95% ДИ, 86,01–95,32%, n = 150) и 95,10% (95% ДИ, 91,57–98,64%, n = 143), соответственно, у пациентов, получавших повторное лечение (рис. 3). Не было обнаружено значительных различий в анализах ITT (P = 0,445) и PP (P = 0,309).
Рисунок 3 Скорость эрадикации H. pylori на основе молекулярной патологической устойчивости к антибиотикам. Серые и черные гистограммы показывают уровень эрадикации у пациентов, впервые получавших лечение, и пациентов, получавших повторное лечение. Сокращения: ITT, анализ намерения лечить; PP, анализ по протоколу. |
Безопасность и сравнение нежелательных явлений
Было зарегистрированопобочных эффектов, включая диарею, черный стул, боль в животе, изжогу, метеоризм, тошноту / рвоту, отрыжку, кожную сыпь, головную боль, дисгевзию, лихорадку, запор, анорексию, утомляемость и головокружение. Помимо дисгевзии, вызванной препаратом кларитромицин, существенных различий не наблюдалось (таблица 4).
Таблица 4 Безопасность и сравнение нежелательных явлений |
Обсуждение
Учитывая заметно сниженный уровень эрадикации H.pylori и быстрое развитие молекулярной патологии, наше исследование было направлено на определение эффективности и безопасности схем эрадикационной терапии H. pylori на основе результатов молекулярно-патологических исследований устойчивости к антибиотикам. В наше исследование были включены 111 пациентов, которые не получали предшествующего лечения эрадикацией, и 150 пациентов, у которых хотя бы один раз не получилось пройти четырехкратную терапию висмутом, и было обнаружено, что хороший эффект и безопасность могут быть получены как у пациентов, впервые получавших лечение, так и у пациентов, получавших повторное лечение, когда схемы лечения были определены. на основе молекулярной патологической устойчивости к антибиотикам.
Первичная устойчивость и вторичная устойчивость – это два вида устойчивости к антибиотикам H. pylori , а вторичная устойчивость означает лекарственную устойчивость после неудачного лечения. 8 Пятый китайский национальный консенсусный доклад по ведению инфекции H. pylori упоминает, что первичная резистентность к кларитромицину, метронидазолу и левофлоксацину составляет 20–50%, 40–70% и 20–50% соответственно. 8 В нашем исследовании частота первичной резистентности к кларитромицину и фторхинолону составляет 42.1% и 41,7%, что аналогично результатам предыдущих отчетов.
Что касается вторичной резистентности, наше исследование демонстрирует, что уровни резистентности к кларитромицину и фторхинолону составляют 79,7% и 70,7% у пациентов, у которых хотя бы один раз не удалось пройти четырехкратную терапию висмутом. По сравнению с показателями первичной резистентности эти числа показали, что приобретенная лекарственная устойчивость к кларитромицину и фторхинолону была легче, чем к другим антибиотикам, например амоксициллину и тетрациклину.В консенсусном отчете Маастрихт V / Флоренции упоминается, что, когда уровень устойчивости к кларитромицину превышает 15%, следует отказаться от тройной терапии, содержащей ИПП-кларитромицин, без предварительного тестирования на чувствительность. 5 Учитывая высокую устойчивость к кларитромицину и фторхинолонам в нашей стране, 8 выполнение теста на лекарственную чувствительность перед лечением может иметь сравнительное преимущество.
Многочисленные исследования показывают, что устойчивость H. pylori к кларитромицину является наиболее важным фактором неэффективности эрадикации. 31,32 Существуют ли какие-либо определенные временные рамки и / или внешние факторы, влияющие на возникновение устойчивости к кларитромицину и точечных мутаций 23S рРНК? Одно исследование было проведено для оценки первичной устойчивости к кларитромицину и связанных мутаций у детей в Польше в 1998–2000 годах. 33 Авторы обнаружили, что большая часть первичной резистентности была вызвана мутацией A2143G, а распространенность резистентности к кларитромицину у детей увеличилась с 17,0% до 23.5% за 3 года. 33 Некоторые исследователи из Испании показали, что резистентность к кларитромицину в значительной степени связана с пациентами, которые ранее лечились, с пациентами, родившимися в Испании, и с педиатрическими пациентами. 34 Кроме того, они обнаружили взаимосвязь между устойчивостью к кларитромицину, генотипом vacA s2 / m2 и отрицательной экспрессией cagA. 34 Хакеми Вала и др. Пришли к выводу, что первичная резистентность может быть связана с перекрестной реактивностью между другими макролидами. 32
Как показано в таблице 1, процент пациентов женского пола, у которых не удалось отреагировать на четырехкратную терапию висмутом, был выше, чем у пациентов мужского пола. Это соответствует некоторым предыдущим исследованиям. 35,36 Одно исследование показало, что женский пол (OR, 1,73; 95% ДИ, 1,15–4,25) и резистентность к кларитромицину (OR, 19,13; 95% ДИ, 9,35–35,09) были тесно связаны с неудачей эрадикации. 35 Другое исследование также показало, что женский пол и курение были связаны с неудачей лечения. 36 Причина также может быть связана с устойчивостью к кларитромицину и точечной мутацией. Исследования показали, что точечная мутация 2143G в 23S рРНК является фактором риска неэффективности эрадикации, а присутствие 2143G в значительной степени связано с женским полом. 37
Наше исследование также показывает, что уровни первичной и вторичной устойчивости H. pylori к амоксициллину составляют 5,5% и 11,7%, тогда как эти показатели к тетрациклину составляют 12,9% и 30,0% соответственно.Проспективное серийное исследование, проведенное в Пекине, Китай, показало, что первичная резистентность H. pylori составляла 6,7% и 4,9% к амоксициллину и тетрациклину. 9 Другое исследование, проведенное в Шанхае, Китай, показало, что уровень устойчивости к амоксициллину составляет 8,3%. 38 Для устойчивости к амоксициллину мы получили аналогичный результат; однако для тетрациклина частота немного выше, чем для других, и причина может быть связана с популяцией пациентов и ранее использовавшимися препаратами того же класса. 8 Поскольку показатели первичной резистентности к амоксициллину и тетрациклину в нашей стране остаются низкими, возможно, нет необходимости рассматривать тест на чувствительность к лекарствам перед использованием. 8
Что касается эффективности и безопасности эрадикационного лечения H. pylori , наше исследование показало, что ER в анализах ITT и PP составляли 92,79% и 98,10%, соответственно, у пациентов, впервые получавших лечение, и 90,67% и 95,10%, соответственно. , у повторно пролеченных пациентов. Мы сравнили наши результаты с другими из разных географических регионов. 39–41 В одном исследовании, проведенном в Японии, использовалась эрадикационная терапия на основе фонопразана, и было обнаружено, что ER составляли 91,24% (427/468) и 95,45% (42/44), соответственно, для терапии первой линии и терапия второй линии. 39 Исследователи из Ирана оценили эффективность четверной терапии на основе висмута и показали, что ER в анализах ITT и PP составили 90,2% и 91,9% соответственно. 40 В другом исследовании, проведенном на северо-западе Эфиопии, была принята стандартная тройная терапия, и общий уровень эрадикации составил 90.3% (379/421). 41 По сравнению с этими исследованиями в нашем исследовании были получены хороший эффект и безопасность как для пациентов, впервые получавших лечение, так и для пациентов, получавших повторное лечение, хотя были обнаружены высокие показатели устойчивости к некоторым антибиотикам, и более чем у половины пациентов четырехкратная терапия висмутом не прошла . Наши результаты показали, что удовлетворительный ER может быть также получен на основе молекулярной патологической устойчивости к антибиотикам.
Лучшее усилие заключалось в том, что устойчивость к антибиотикам H. pylori была определена с помощью молекулярных патологических исследований, включая обнаружение ПЦР в реальном времени и традиционный метод ПЦР и секвенирования, особенно анализ аллельной дискриминации TaqMan в режиме реального времени, который использовался для обнаружения устойчивость к кларитромицину.По сравнению с Е-тестом и методом разведения в агаре, 42,43 молекулярные патологические исследования дали аналогичные результаты. Более того, были получены удовлетворительные показатели эрадикации, что указывало на то, что эти исследования можно использовать в повседневной практике.
Первое ограничение может заключаться в том, что наше исследование проводилось в одном крупном медицинском центре Китая, и нельзя избежать систематической ошибки отбора. Популяция пациентов может отличаться от пациентов, получающих лечение в малых и средних больницах, не говоря уже о больницах, расположенных в отдаленных регионах и регионах проживания этнических меньшинств.Кроме того, значительная часть платы за молекулярно-патологические исследования была оплачена пациентами. Второе ограничение может заключаться в том, что в наше исследование был включен только 261 пациент с инфекцией H. pylori . Мы хотим, чтобы наши результаты и выводы были подтверждены на большем количестве пациентов, большем количестве больниц и большем количестве исследований.
В заключение следует отметить, что хороший эффект и безопасность достигаются как у пациентов, получавших лечение, так и у пациентов, получавших повторное лечение, когда схемы лечения определялись на основе молекулярной патологической устойчивости к антибиотикам, хотя требуются дополнительные проспективные исследования.По сравнению с методом культивирования и дисковой диффузии H. pylori , молекулярное патологическое обнаружение на основе молекулярных маркеров является очень простым и экономичным подходом, который также занимает меньше времени. Мы надеемся, что молекулярная патологическая устойчивость к антибиотикам может найти широкое применение.
Одобрение этических норм и информированное согласие
Весь процесс нашего исследования полностью соответствует принципам Хельсинкской декларации, и наш исследовательский проект был одобрен Комитетом по этике исследований на людях больницы китайско-японской дружбы Министерства здравоохранения.Письменное информированное согласие было получено от всех пациентов.
Авторские взносы
Все авторы участвовали в анализе данных, составлении и редактировании документа, окончательно одобрили версию, которая будет опубликована, и согласны нести ответственность за все аспекты работы.
Финансирование
Эта работа была поддержана Z131107000413067 из Пекинской программы NOVA муниципальной комиссии по науке и технологиям Пекина.
Раскрытие
Авторы сообщают об отсутствии конфликта интересов в этой работе.
Список литературы
1. Смит С.М., О’Морайн С., Макнамара Д. Устойчивость Helicobacter pylori к современным методам лечения. Curr Opin Gastroenterol . 2019; 35 (1): 6–13. DOI: 10.1097 / MOG.0000000000000497
2. Quaglia NC, Dambrosio A. Helicobacter pylori: возбудитель пищевого происхождения? Мир Дж. Гастроэнтерол . 2018; 24 (31): 3472–3487. DOI: 10.3748 / wjg.v24.i31.3472
3. Сьомина О., Павлова Ю., Нив Ю., Лея М. Эпидемиология инфекции Helicobacter pylori. Хеликобактер .2018; 23 (Приложение 1): e12514. DOI: 10.1111 / hel.2018.23.issue-S1
4. Mansour-Ghanaei F, Pedarpour Z, Shafaghi A, Joukar F. Кларитромицин против гемифлоксацина в четырехкратных терапевтических схемах для искоренения инфекции Helicobacter pylori. Ближний Восток J Dig Dis . 2017; 9 (2): 100–106. DOI: 10.15171 / mejdd.2017.58
5. Мальфертхайнер П., Мегро Ф., О’Мораин Калифорния и др. Управление инфекцией Helicobacter pylori – консенсусный доклад Маастрихта V / Флоренции. Кишечник . 2017; 66 (1): 6–30.
6. Sugano K, Tack J, Kuipers EJ, et al. Киотский глобальный консенсусный отчет по гастриту Helicobacter pylori. Кишечник . 2015; 64 (9): 1353–1367. DOI: 10.1136 / gutjnl-2015-309252
7. Fallone CA, Chiba N, van Zanten SV, et al. Консенсус Торонто по лечению инфекции Helicobacter pylori у взрослых. Гастроэнтерология . 2016; 151 (1): 51–69 e14. DOI: 10.1053 / j.gastro.2016.04.006
8. Лю WZ, Xie Y, Lu H и др. Пятый отчет Китая о национальном консенсусе по лечению инфекции Helicobacter pylori. Хеликобактер . 2018; 23 (2): e12475. DOI: 10.1111 / hel.2018.23.issue-2
9. Zhang YX, Zhou LY, Song ZQ и др. Первичная устойчивость к антибиотикам штаммов Helicobacter pylori, выделенных от пациентов с диспепсическими симптомами в Пекине: проспективное серийное исследование. Мир Дж. Гастроэнтерол . 2015; 21 (9): 2786–2792. DOI: 10.3748 / wjg.v21.i9.2786
10. Чжоу Л., Чжан Дж., Сонг З. и др. Индивидуальная терапия по сравнению с тройной добавкой висмута или сопутствующей терапией в качестве начального лечения Helicobacter pylori: рандомизированное исследование. Хеликобактер . 2016; 21 (2): 91–99. DOI: 10.1111 / hel.2016.21.issue-2
11. Xie C, Lu NH. Обзор: клиническое ведение инфекции Helicobacter pylori в Китае. Хеликобактер . 2015; 20 (1): 1–10. DOI: 10.1111 / hel.12178
12. Cosme A, Lizasoan J, Montes M, et al. Сравнение чувствительности к противомикробным препаратам и сопутствующей эмпирической терапии для искоренения Helicobacter pylori в регионе с высокой устойчивостью к кларитромицину. Хеликобактер .2016; 21 (1): 29–34. DOI: 10.1111 / hel.2016.21.issue-1
13. Beckman E, Saracino I, Fiorini G, et al. Новый ПЦР-тест кала на Helicobacter pylori может с высокой скоростью прогнозировать устойчивость к кларитромицину и искоренение инфекции. Дж. Клин Микробиол . 2017; 55 (8): 2400–2405. DOI: 10.1128 / JCM.00506-17
14. Поуракбари Б., Махмуди С., Пархиз Дж. И др. Высокая частота метронидазола и устойчивой к кларитромицину Helicobacter pylori в фиксированных формалином и парафиновых биоптатах желудка. Br J Biomed Sci . 2018; 75 (2): 61–65. DOI: 10.1080 / 09674845.2017.13
15. де Франческо В., Марджотта М., Зулло А. и др. Первичная устойчивость к кларитромицину в Италии оценивалась на последовательностях ДНК Helicobacter pylori с помощью полимеразной цепной реакции TaqMan в реальном времени. Алимент Фармакол Тер . 2006. 23 (3): 429–435. DOI: 10.1111 / апр.2006.23.issue-3
16. Ханафия А., Бинмаил Х., Раджа Али Р.А., Мохамед Роуз I, Лопес Б.С. Молекулярная характеристика и распространенность устойчивости к антибиотикам у изолятов Helicobacter pylori в Куала-Лумпуре, Малайзия. Устойчивость к лекарствам от инфекций . 2019; 12: 3051–3061. DOI: 10.2147 / IDR.S219069
17. Коуитчеу Мабеку Л. Б., Эюм Билле Б., Тепап Земноу С., Тали Нгуфак Л. Д., Леунджи Х. Устойчивость широкого спектра у Helicobacter pylori, выделенных из биопсии желудка пациентов с диспепсией в Камеруне, и выявление множественной резистентности, опосредованной оттоком, в изолятах МЛУ. BMC Infect Dis . 2019; 19 (1): 880. DOI: 10.1186 / s12879-019-4536-8
18. Lee JY, Kim N, Nam RH, et al. Первичная и вторичная устойчивость Helicobacter pylori к антибиотикам в Корее с 2003 по 2018 год. Хеликобактер . 2019; e12660.
19. Патель С.К., Пратап С.Б., Джайн А.К., Гулати А.К., Нат Г. Диагностика Helicobacter pylori: что должно быть золотым стандартом? Мир Дж. Гастроэнтерол . 2014. 20 (36): 12847–12859. DOI: 10.3748 / wjg.v20.i36.12847
20. Крашиас Г., Башиардес С., Потамиту А., Потамитис Г.С., Христодулу С. Распространенность генов cagA и vacA Helicobacter pylori у кипрских пациентов. J Infect Dev Ctries . 2013. 7 (9): 642–650. DOI: 10.3855 / jidc.2923
21. Lin YA, Wang H, Gu ZJ, et al. Влияние полиморфизма гена CYP2C19 на тройную терапию ингибитором протонной помпы, амоксициллин и левофлоксацин для эрадикации Helicobacter pylori. Медицинский Научный Монит . 2017; 23: 2701–2707. DOI: 10.12659 / MSM.
22. Peng X, Song Z, He L, et al. ПЦР в реальном времени на основе желудочного сока для индивидуализированного лечения Helicobacter pylori: практический подход. Int J Med Sci . 2017; 14 (6): 595–601. DOI: 10.7150 / ijms.18996
23.Афонина И., Зиварц М., Кутявин И. и др. Эффективное праймирование ПЦР короткими олигонуклеотидами, конъюгированными с связывающим веществом малой бороздки. Nucleic Acids Res . 1997. 25 (13): 2657–2660. DOI: 10.1093 / nar / 25.13.2657
24. Ким Б.Дж., Ким Дж.Г. Замены пенициллин-связывающего белка 1 в устойчивых к амоксициллину штаммах Helicobacter pylori, выделенных от корейских пациентов. Кишечная печень . 2013. 7 (6): 655–660. DOI: 10.5009 / gnl.2013.7.6.655
25. Gonzalez-Hormazabal P, Musleh M, Escandar S, et al.Распространенность устойчивости к кларитромицину у Helicobacter pylori в Сантьяго, Чили, по оценке с помощью ПЦР в реальном времени непосредственно на слизистой оболочке желудка. БМК Гастроэнтерол . 2018; 18 (1): 91. DOI: 10.1186 / s12876-018-0820-0
26. Ли С.М., Ким Н., Квон Ю.Х. и др. rdxA, frxA и оттокная помпа у метронидазолустойчивого Helicobacter pylori: их связь с клиническими исходами. Дж Гастроэнтерол Гепатол . 2018; 33 (3): 681–688. DOI: 10.1111 / jgh.13906
27. Римбара Э, Ногучи Н, Кавай Т., Сасацу М.Устойчивость к фторхинолонам у Helicobacter pylori: роль мутаций в положениях 87 и 91 GyrA на уровне устойчивости и идентификация мутации устойчивости в GyrB. Хеликобактер . 2012; 17 (1): 36–42. DOI: 10.1111 / hel.2011.17.issue-1
28. Wu JY, Kim JJ, Reddy R et al. Тетрациклинорезистентные клинические изоляты Helicobacter pylori с мутациями и без мутаций в генах, кодирующих 16S рРНК. Противомикробные агенты Chemother . 2005. 49 (2): 578–583. DOI: 10.1128 / AAC.49.2.578-583.2005
29. Zhang YW, Hu WL, Cai Y et al. Результаты четырехкратной терапии на основе фуразолидона и амоксициллина при инфекции Helicobacter pylori и предикторы неудачной эрадикации. Мир Дж. Гастроэнтерол . 2018; 24 (40): 4596–4605. DOI: 10.3748 / wjg.v24.i40.4596
30. Xie Y, Zhang Z, Hong J, et al. Фуразолидон-содержащая тройная и четырехкратная эрадикационная терапия для начального лечения инфекции Helicobacter pylori: многоцентровое рандомизированное контролируемое исследование в Китае. Хеликобактер . 2018; 23 (5): e12496. DOI: 10.1111 / hel.2018.23.issue-5
31. Дженнане-Хадиби Ф., Бахтарзи М, Лаяида К. и др. Высокий уровень первичной устойчивости Helicobacter pylori к кларитромицину в Алжире, Алжир: проспективное многоцентровое молекулярное исследование. Microb Drug Resist . 2016; 22 (3): 223–226. DOI: 10.1089 / mdr.2015.0209
32. Хакеми Вала М., Эйвази С., Гоударзи Х., Сари Х.Р., Голами М. Оценка устойчивости к кларитромицину иранских изолятов Helicobacter pylori с помощью Е-теста и методов полимеразной цепной реакции в реальном времени. Jundishapur J Microbiol . 2016; 9 (5): e29839. DOI: 10.5812 / jjm
33. Dzierzanowska-Fangrat K, Rozynek E, Jozwiak P, et al. Первичная устойчивость к кларитромицину клинических штаммов Helicobacter pylori, выделенных от детей в Польше. Int J Антимикробные агенты . 2001. 18 (4): 387–390. DOI: 10.1016 / S0924-8579 (01) 00421-6
34. Агудо С., Перес-Перес Г., Аларкон Т., Лопес-Бреа М. Высокая распространенность устойчивых к кларитромицину штаммов Helicobacter pylori и факторы риска, связанные с устойчивостью в Мадриде, Испания. Дж. Клин Микробиол . 2010. 48 (10): 3703–3707. DOI: 10.1128 / JCM.00144-10
35. Chang YW, Ko WJ, Oh CH, et al. Устойчивость к кларитромицину и женский пол влияют на неэффективность эрадикации Helicobacter pylori при хроническом гастрите. Korean J Intern Med . 2019; 34 (5): 1022–1029. DOI: 10.3904 / kjim.2018.054
36. Ким С.Е., Парк М.И., Парк С.Дж. и др. Тенденции в уровне эрадикации Helicobacter pylori тройной терапией первой линии и связанные с ней факторы эрадикационной терапии. Korean J Intern Med .2015; 30 (6): 801–807. DOI: 10.3904 / kjim.2015.30.6.801
37. Park CG, Kim S, Lee EJ, Jeon HS, Han S. Клиническая значимость точечных мутаций в гене 23S рРНК в эрадикации Helicobacter pylori: проспективное обсервационное исследование. Медицина (Балтимор) . 2018; 97 (33): e11835. DOI: 10.1097 / MD.0000000000011835
38. Chen Q, Zhang W, Fu Q, et al. Спасательная терапия для эрадикации Helicobacter pylori: рандомизированное исследование не меньшей эффективности амоксициллина или тетрациклина в четырехкратной терапии висмутом. Ам Дж. Гастроэнтерол . 2016; 111 (12): 1736–1742. DOI: 10.1038 / ajg.2016.443
39. Ашида К., Хонда И., Санада К., Такемура Ю., Сакамото С. Безопасность и эффективность эрадикационной терапии Helicobacter pylori на основе фонопразана; проспективное постмаркетинговое наблюдение. Мнение экспертов по лекарствам . 2019; 18: 1–7.
40. Mansour-Ghanaei F, Samadi A, Joukar F, et al. Эффективность и переносимость четырнадцатидневного последовательного четырехкратного режима: пантопразол, висмут, амоксициллин, метронидазол и / или фуразолидон в качестве терапии первой линии для эрадикации Helicobacter pylori: рандомизированное двойное слепое клиническое исследование. ИСКЛЮЧИТЕЛЬНО J . 2019; 18: 644–652. DOI: 10.17179 / excli2019-1613
41. Гебейеху Э., Нигату Д., Энгидаворк Э. Уровень эрадикации Helicobacter pylori стандартной тройной терапией и факторы, влияющие на уровень ликвидации, в администрации города Бахир-Дар, Северо-запад Эфиопии: проспективное последующее исследование. PLoS One . 2019; 14 (6): e0217645. DOI: 10.1371 / journal.pone.0217645
42. Сильва Г. М., Сильва Н. М., Насименто Дж. И др. Устойчивость к противомикробным препаратам Helicobacter pylori в педиатрической популяции. Хеликобактер . 2018; 23 (5): e12528. DOI: 10.1111 / hel.12528
43. Дехнич Н., Иванчик Н., Козлов Р. и др. Динамика антимикробной устойчивости изолятов Helicobacter pylori в Смоленской области Российской Федерации. Хеликобактер . 2018; 23 (6): e12545. DOI: 10.1111 / hel.2018.23.issue-6
Внутрипросветная терапия моноантибиотиками при инфекции Helicobacter Pylori – Сравнение порошка левофлоксацина и раствора левофлоксацина – Просмотр полного текста
Helicobacter pylori (H.pylori) является важным причинным фактором хронического гастрита, язвенной болезни, рака желудка и лимфомы желудка. Всемирная организация здравоохранения классифицировала H. pylori как канцероген группы 1 в 1994 году. Эндоскопическое обследование показано для подтверждения вышеуказанного диагноза пациенту с инфекцией H. pylori. Ликвидация H. pylori может снизить частоту рецидивов язвенной болезни и даже может предотвратить рак желудка. H. pylori – наиболее распространенная хроническая бактериальная инфекция у людей.Распространенность H. pylori составляет около 30-50% среди взрослого населения западных стран. По оценкам, около 50% людей инфицированы этой бактерией на Тайване.
Тройная терапия, включающая ингибитор протонной помпы и два антибиотика, среди которых кларитромицин, амоксициллин и метронидазол, является наиболее часто используемым режимом для эрадикации H. pylori. Продолжительность лечения от 7 до 14 дней. Однако уровень искоренения стандартной тройной терапии во многих странах упал ниже 80% из-за растущей во всем мире распространенности штаммов, устойчивых к антибиотикам.
Было предложено несколько стратегий для увеличения скорости эрадикации в терапии первой линии или в качестве спасательной терапии, включая увеличение продолжительности лечения до 14 дней, увеличение доз антибиотиков, использование схемы из четырех или даже пяти препаратов (последовательных, сопутствующих , четырехкратная или пятикратная терапия) и другие антибиотики, такие как левофлоксацин. Однако эти методы лечения могут увеличивать побочные эффекты и стоимость лечения, снижать комплаентность пациентов и неуклонно повышать уровень устойчивости к антибиотикам во всем мире.ВОЗ включила H. Pylori в список 16 устойчивых к антибиотикам бактерий, которые представляют наибольшую угрозу для здоровья человека в феврале 2017 года.
Наиболее часто применяемыми пероральными антибиотиками для лечения H. pylori являются амоксициллин, кларитромицин, метронидазол, левофлоксацин и тетрациклин.
Однако, с увеличением показателей устойчивости к антибиотикам кларитромицина и метронидазола, кларитромицин и метронидазол были заменены левофлоксацином в качестве лечения первой или второй линии в некоторых регионах.Однако уровень эрадикации тройной терапии, содержащей левофлоксацин, во многих странах неоптимален. Исследователи стремятся сравнить эффективность различных препаратов порошка левофлоксацина и раствора левофлоксацина при внутрипросветной терапии левофлоксацином, а также повысить эффективность эрадикационной терапии тройной терапии, содержащей левофлоксацин в течение одной недели, с помощью внутрипросветной терапии.
Ликвидация Helicobacter pylori – последняя информация о последних методах лечения
Джулиан Яксли
Бхаскар Чакраварти
Предпосылки
Ликвидация Helicobacter pylori (H.pylori) при определенных обстоятельствах может быть сложной задачей. В настоящее время не существует терапии первой линии, которая лечила бы всех пациентов.
Цель / с
В этой статье обобщается роль новых методов лечения в лечении H. pylori . Считается, что эти новые терапевтические стратегии, известные как последовательная терапия и терапия спасения, обеспечивают более высокую скорость эрадикации по сравнению с рекомендованными в настоящее время терапиями первой линии. В этой статье описывается растущий объем доказательств, подтверждающих их эффективность.
Обсуждение
Последовательная терапия и терапия спасения недавно появились как альтернативные схемы для уничтожения H. pylori . Хотя текущие руководства по-прежнему рекомендуют традиционные методы лечения H. pylori первой линии, врачи общей практики должны знать об этих новых стратегиях, чтобы эти варианты можно было применять, когда традиционная терапия не помогает.
Связь между Helicobacter pylori ( H.pylori ) и язвенной болезни. Колонизация H. pylori является основным признанным фактором риска развития язвенной болезни (PUD), и ее искоренение произвело революцию в современном лечении язвенной болезни. Примерно 15 лет назад основой терапии было кратковременное заживление язв и облегчение симптомов без уничтожения организма. Это потребовало длительной поддерживающей терапии и способствовало высокой частоте рецидивов.
Сегодня новые схемы эрадикации меняют естественное течение пептической язвы и все чаще предлагают долгосрочное лечение.Тем не менее, постоянно меняющееся лицо терапии H. pylori , вызванное устойчивостью организма к различным антибиотикам, по-прежнему представляет собой проблему для врачей.
Патогенез болезни, вызванной H. pylori
H. pylori – это грамотрицательная палочка, которая естественным образом колонизирует желудок человека не менее 50 000 лет. 1 Обычно он приобретается в детстве и в какой-то момент жизни колонизирует слизистую желудка около 50% населения мира. 1 В западных странах распространенность инфекции H. pylori составляет примерно 30%. 1
H. pylori был впервые идентифицирован и выделен из образца биопсии желудка в 1983 году. 2 Открытие было сделано в Австралии Маршаллом и Уорреном, которые осознали, что почти все пациенты с язвой желудка или двенадцатиперстной кишки, которых они наблюдали в период с 1979 по 1984 год, были заражены одним и тем же организмом. 3 H. pylori с тех пор превратился в важный патоген, связанный с гастродуоденальной областью, играющий важную роль в патогенезе большинства случаев ЯБД. 2
Инфекция H. pylori вызывает стойкий иммунный ответ. Поскольку организм обладает многочисленными адаптациями, предотвращающими обнаружение иммунной системы, выведение организмом никогда не бывает полным. В результате устойчивые воспалительные процессы в желудке вызывают сокращение популяции D-клеток, продуцирующих соматостатин. 1 Это вызывает последующее повышение секреции гастрина с последующим увеличением выделения кислоты желудочного сока, что может привести к язвенной болезни у некоторых пациентов.
Во всем мире более 80% язв двенадцатиперстной кишки и более 60% язв желудка связаны с H. pylori . 1 У большинства пациентов, инфицированных этим организмом, не развиваются пептические язвы, хотя у большинства разовьется гастрит. Пожизненный риск язвы желудка или двенадцатиперстной кишки составляет всего 10%, 4 , что несколько меньше, чем риск колонизации H. pylori . Причина, по которой только у некоторых развиваются язвы, остается нерешенной, хотя комбинация различий в штаммах бактерий, восприимчивости хозяина и факторов окружающей среды, вероятно, сыграет свою роль. 1
Обследование и диагностика инфекции
Ретроспективное исследование, проведенное в Калифорнии в 1998 году, показало, что менее половины пациентов с диагнозом ЯБЛ были обследованы на H. pylori их терапевтом. 5 К счастью, по мере того, как растет понимание естественного течения язв желудка и двенадцатиперстной кишки, тестирование H. pylori стало более распространенным за последнее десятилетие.
Язвенная болезнь, связанная с H. pylori , должна рассматриваться у пациентов с болью в эпигастрии или диспепсией.Колонизацию также следует заподозрить и провести скрининг у пациентов с семейным анамнезом рака желудка или лимфоидной лимфомой, связанной со слизистой оболочкой желудка (MALT). 6 Также важно провести скрининг на инфекцию H. pylori у любого пациента, которому предстоит краткосрочная или длительная терапия нестероидными противовоспалительными препаратами (НПВП), поскольку эрадикация снижает частоту язвенной болезни у этих пациентов. . 7
Было бы нецелесообразно исследовать H.pylori первоначально при наличии тревожных симптомов, таких как потеря веса, кровотечение, дисфагия или симптомы у пациента старше 55 лет. 4 В этом контексте исследования в первую очередь должны быть направлены на исключение злокачественных новообразований, например, с помощью гастроскопии.
Исследования H. pylori в целом делятся на инвазивные и неинвазивные методы. У каждого метода есть свои преимущества и недостатки ( Таблица 1 ). Наиболее широко используемым неинвазивным тестом в общей практике является серологический тест.Если у пациента наблюдается высокий титр, это указывает на активную инфекцию, тогда как низкий титр может просто отражать предыдущее воздействие H. pylori . Дыхательный тест с мочевиной – лучший тест для контроля успеха эрадикации после лечения, хотя он может быть доступен не всем терапевтам.
| Тест | Механизм | Примечания |
|---|---|---|
| Инвазивный | ||
| Быстрый тест на уреазу |
|
|
| Культура |
|
|
| Гистология |
|
|
| Неинвазивный | ||
| Серологический |
|
|
| Дыхательный тест на мочевину |
|
|
| Анализ стула на антиген |
|
|
| IgG, иммуноглобулин G; СОЛОД, лимфоидная ткань, связанная со слизистой оболочкой | ||
Традиционные схемы ликвидации
Схемы ликвидации H. pylori продолжали развиваться в течение последних 20 лет.Первоначально основная терапия включала блокаторы гистаминовых рецепторов H 2 с антибиотиком. Уровень успешного искоренения составил 73–84%. 5 Со временем эта терапия использовалась все реже, так как появились новые схемы с лучшими результатами.
Примерно 15 лет назад были внедрены тройная терапия на основе висмута и двойная терапия на основе ингибиторов протонной помпы (ИПП). Они стали наиболее широко используемыми методами лечения в течение следующего десятилетия или около того, пока их не вытеснили более новые альтернативы.Двойная терапия на основе ИПП не имела адекватных показателей успеха, в то время как тройная и четверная терапия на основе висмута имела значительные побочные эффекты. Эти побочные эффекты часто наблюдались пожилыми пациентами, которые попадали в больницу в анекдотическом опыте одного из авторов.
Сегодня тройная терапия на основе ИПП является наиболее широко используемым методом во всем мире. 8 Эта схема включает использование ИПП в сочетании с амоксициллином и кларитромицином. Текущие терапевтические рекомендации в Австралии, пересмотренные в июле 2013 года, рекомендуют тройную терапию на основе ИПП в качестве меры первой линии для эрадикации H.pylori 9 ( Таблица 2 ).
| Эрадикационная терапия | Компоненты | Примечания |
|---|---|---|
| Тройная терапия на основе ИПП |
|
|
| Четверная терапия |
|
|
| ACG, Американский колледж гастроэнтерологии | ||
В этих рекомендациях указывается, что устойчивость к кларитромицину до лечения в Австралии составляет 5–7% и указывает на вероятность ее роста. 9 Следовательно, чтобы избежать неудачи лечения, было бы разумно рассмотреть рекомендацию Американского колледжа гастроэнтерологии (ACG) о том, что в областях с известной высокой устойчивостью к кларитромицину может быть предпочтительна четырехкратная терапия на основе висмута. 10 Однако висмут доступен только в Австралии по схеме особого доступа. 9
Эффективность тройной терапии была широко проверена и не доказала превосходства схем, применявшихся два десятилетия назад. 11,12 Стандартная тройная терапия на основе ИПП дает 70–85% успеха. 1 Кроме того, недавнее рандомизированное исследование 169 пациентов, которые испытали четырехкратную терапию после неудачной тройной терапии, показало, что четырехкратная терапия, рекомендованная при резистентности к кларитромицину, также не дает результатов в 20–25% случаев. 13 Сопоставимые результаты были получены в обширном шведском объединенном анализе, в котором тройная терапия на основе ИПП сравнивалась с различными другими традиционными методами лечения H.pylori . 14 Они включали четырехкратную терапию, терапию на основе висмута и двойную терапию на основе ИПП. Во всех группах лечения показатель успешной эрадикации был одинаковым. Вывод, который следует сделать из шведского исследования, заключается в том, что при всех традиционно прописываемых схемах эрадикация успешна лишь частично.
Доказательства для новых методов лечения
Последовательная терапия
В то время как стандартная тройная терапия остается протоколом первой линии для инфекции H. pylori , 15 растущая устойчивость к антибиотикам, используемым в этом лечении, вызывает озабоченность.В последнее время это привело к возрождению интереса к новым терапевтическим стратегиям, одной из которых является последовательная терапия.
Доказательства в пользу последовательной терапии обнадеживают: в ряде исследований сообщается, что уровень эрадикации выше, чем у любого широко используемого в настоящее время лечения. Последовательная терапия – это двухэтапная 10-дневная программа, состоящая из введения ИПП с амоксициллином в течение первых 5 дней с последующей тройной терапией, которая включает ИПП, кларитромицин и тинидазол в течение следующих 5 дней.
Примером схемы лечения может быть эзомепразол 20 мг два раза в день в сочетании с амоксициллином 1 г два раза в день, назначаемый в течение 5 дней. Затем необходимо провести тройную терапию эзомепразолом 20 мг два раза в день, кларитромицином 500 мг два раза в день и тинидазолом 500 мг дважды в течение следующих 5 дней. 16
В январе 2013 года Lancet опубликовал рандомизированное контролируемое исследование, в котором сравнивали последовательную терапию с тройной терапией на основе ИПП. Было обнаружено, что группа последовательного лечения давала более высокие показатели эрадикации по сравнению со стандартной терапией 87.0% и 82,3% соответственно. 17 В этом испытании также была протестирована 14-дневная последовательная терапия, которая оказалась еще более эффективной с 90,7% успешностью. 15
Последовательная терапия доказала свою высокую эффективность в других исследованиях. Недавний анализ намерения лечить 22 рандомизированных исследования последовательной терапии с участием 2388 пациентов показал уровень эрадикации порядка 91,3%. 18 Если этот ряд данных расширен до анализа протокола, последовательная терапия предвещает 93.7% Уровень эрадикации H. pylori . 18
Спасательная терапия
Несмотря на высокую эффективность последовательной терапии, некоторые пациенты не реагируют. Имеются некоторые данные по варианту второй линии для этой когорты, называемому «спасательной терапией». Спасательная терапия представляет собой тройную терапию, включающую ИПП, амоксициллин и левофлоксацин, вводимые в течение 10 дней. Предлагаемый рецепт будет включать эзомепразол 20 мг два раза в день, амоксициллин 500 мг два раза в день и левофлоксацин 500 мг два раза в день. 18
Ограниченные данные, основанные на доказательствах, доступные в настоящее время в Австралии, позволяют предположить, что терапия спасения достигает высоких показателей успеха. 9 ACG сообщает, что спасательная обработка эффективна на 76% при реализации после неудачного последовательного режима. 8 Небольшое проспективное пилотное исследование, проведенное Зулло и другими, также показало, что спасательная терапия является действенной альтернативой в случае неэффективности эрадикации при последовательной терапии. 19 В исследование были включены 35 пациентов, получавших 10-дневную тройную терапию рабепразолом, левофлоксацином и амоксициллином после неудачной последовательной терапии.При анализе намерения лечить это лечение было успешным в 85,7% случаев. 19
Решение проблемы устойчивости к антибиотикам
Устойчивость к противомикробным препаратам к антибиотикам является проблемой при проведении эрадикационной терапии. Считается, что неэффективность лечения обычно происходит из-за роста устойчивости к противомикробным препаратам. Несколько исследований показали, что эрадикация H. pylori более успешна, если до начала лечения проводится тестирование чувствительности. 6 Это позволяет выбирать антибиотики в соответствии с восприимчивостью организма.
Также важно спросить пациентов о предыдущих лекарствах. Имеющиеся данные свидетельствуют о том, что предыдущее воздействие метронидазола или макролидных антибиотиков на пациента снижает успех эрадикации. 9 Если они подвергались подобному воздействию в прошлом, следует выбирать препараты замещающих классов, чтобы избежать неудачного лечения.
За последние 10 лет было отмечено снижение эффективности стандартной тройной терапии. 17 Хотя данные указывают на более низкую частоту неудач лечения с помощью новых методов лечения, вполне вероятно, что они также испытают подобное явление. 17 Поскольку развитие лекарственной устойчивости останется проблемой, новые методы лечения должны быть внедрены раньше, чем позже. Таким образом, важно подчеркнуть, что после первоначальной неудачи стандартной тройной терапии эту схему не следует повторять, 9 скорее следует уделить внимание испытаниям последовательной или спасительной терапии.
Обеспечение соответствия
Хорошее соблюдение пациентом режима лечения также является важным предиктором результата. 10 Поэтому важно подчеркнуть его актуальность для пациентов.Плохое соблюдение не только способствует устойчивости к антибиотикам, но и пациенты, которые не завершили полный курс лечения антибиотиками, также с большей вероятностью не пройдут лечение. В Австралии неполное соблюдение режима лечения является наиболее частой причиной неудачной эрадикации. 9
Побочные эффекты являются основной причиной несоблюдения схем эрадикации. Хотя они встречаются примерно у 5–20% пациентов, 10 было бы разумно сообщить пациентам о возможных побочных эффектах до начала лечения.Важные побочные эффекты перечислены в Таблице 3 . Профили побочных эффектов последовательной терапии и стандартной тройной терапии аналогичны. 16
Финансовые затраты на последовательную и спасительную терапию также являются проблемой, определяющей соблюдение пациентом режима лечения. Поскольку 10-дневная последовательная терапия дает результаты лишь незначительно уступающие результатам 14-дневной последовательной терапии, экономически выгодно рекомендовать более короткое лечение. 9,16
| Противомикробное средство | Побочные эффекты | |
|---|---|---|
| Часто | Нечасто | |
| Ингибитор протонной помпы (ИПП) |
|
|
| Кларитромицин |
| |
| Амоксициллин | ||
| Метронидазол |
|
|
| Соли висмута |
|
|
| Тетрациклин | ||
| Тинидазол |
|
|
| Левофлоксацин |
|
|
Заключение
H.pylori остается серьезной причиной заболеваемости во всем мире. На сегодняшний день полностью успешная терапевтическая стратегия остается труднодостижимой, однако последовательная терапия и терапия спасения становятся эффективными альтернативами первой и второй линии. Хотя пока преждевременно рекомендовать их рутинное использование во всех случаях, эти новые варианты следует рассматривать для лечения инфекции H. pylori , когда стандартная тройная терапия не помогает.
Конкурирующие интересы: Нет.
Происхождение и экспертная оценка: Не введен в эксплуатацию; внешняя экспертная оценка.
Список литературы
- Лонг Д., Фаучи А., Каспер Д. и др. Принципы внутренней медицины Харрисона. Нью-Йорк: McGraw Hill Companies; 2012.
- Феннерти М., Либерман Д., Вакил Н. и др. Эффективность лечения Helicobacter pylori в условиях клинической практики. Arch Intern Med 1999; 159: 1562–66.
- Уоррен Дж., Маршалл Б. Неопознанные изогнутые бациллы на эпителии желудка при активном хроническом гастрите.Ланцет 1983; 1: 1273–75.
- Рамакришнан К., Салинас Р. Язвенная болезнь. Am Fam Physician 2007; 76: 1005–12.
- Peura D. Helicobacter pylori: варианты рационального ведения. Am J Med 1998; 105: 424–30.
- Stenstroem B, Mendis A, Marshall B. Helicobacter pylori: новейшие достижения в диагностике и лечении. Врач Aust Fam, 2008; 37: 608–12.
- Талли Н., Вакил Н. Руководство по ведению диспепсии. Am J Gastroenterol 2005; 100: 2324–37.
- Malfertheiner P, Megraud F, O’Morain C и др.Современные концепции лечения инфекции Helicobacter pylori: Маастрихтский консенсусный отчет III. Кишечник 2007; 56: 772–81.
- Группа экспертов по антибиотикам. Ликвидация Helicobacter pylori и заживление язв В: eTG Complete [Интернет] Мельбурн. ООО «Терапевтические рекомендации», 2013 г. Доступно на сайте www.tg.org.au [Доступно с 15 марта 2013 г.].
- Chey W, Wong B. Руководство Американского колледжа гастроэнтерологии по лечению инфекции Helicobacter pylori. Am J Gastroenterol 2007; 102: 1808–25.
- Лайне Л., Феннерти М., Осато М. и др. Эрадикационная терапия Helicobacter pylori на основе эзомепразола и эффект устойчивости к антибиотикам: результаты трех многоцентровых двойных слепых исследований в США. Am J Gastroenterol 2000; 95: 3393–98.
- Vakil N, Lanza F, Schwartz H, Barth J. Семидневная терапия Helicobacter pylori в Соединенных Штатах. Aliment Pharmacol Ther 2004; 20: 99–107.
- Юн Дж, Байк Дж, Ким Й и др. Сравнение скорости эрадикации между 1-недельной и 2-недельной висмутсодержащей четырехкратной спасательной терапией для эрадикации Helicobacter pylori.Кишечная печень 2012; 6: 434–39.
- Унге П. Какие еще схемы лечения инфекции Helicobacter pylori исследуются? Гастроэнтерол 1997; 113: 131–48.
- Эдвардс П. Искоренение Helicobacter pylori: какова последняя рекомендованная терапия? Curr Ther 1996; январь: 49–54.
- Кроу С. Схемы лечения Helicobacter pylori. Сан-Диего: UpToDate; 2013.
- Liou J, Chen C, Chen M и др. Последовательная и тройная терапия для лечения Helicobacter pylori первой линии: многоцентровое открытое рандомизированное исследование.Ланцет 2013; 381: 205–13.
- Vaira D, Zullo A, Hassan C, Fiorini G, Vakil N. Последовательная терапия для ликвидации Helicobacter pylori: время пришло! Ther Adv Gastroenterol 2009; 2: 317–22.
- Зулло А., Франческо В., Хассан С., Панелла С., Морини С., Иерарди Е. Лечение второй линии для эрадикации Helicobacter pylori после неудачной последовательной терапии: пилотное исследование. Future Med 2006; 3: 251–54.
- Ди Каро С., Францески Ф., Мариани А. и др. Тройные схемы на основе левофлоксацина второго ряда для эрадикации Helicobacter pylori.Dig Liver Dis 2009; 41: 480–85.
- Micomedix 2.0. 2013 г. [обновлено 13 марта 2013 г.] Доступно по адресу: http://healthcare.thomsonreuters.com/ micromedexMobile / [по состоянию на 26 марта 2013 г.].
- Австралийский справочник по лекарственным средствам. Аделаида: Фармацевтическое общество Австралии; 2010.
Переписка [email protected]
Открытие или сохранение файлов
Файлы на веб-сайте можно открывать или загружать и сохранять на свой компьютер или устройство.
Чтобы открыть, щелкните ссылку, ваш компьютер или устройство попытается открыть файл с помощью совместимого программного обеспечения.
Чтобы сохранить файл, щелкните ссылку правой кнопкой мыши или щелкните ссылку и выберите «Сохранить как …». Следуйте подсказкам, чтобы выбрать место.
Типы файлов
PDF Большинство документов на веб-сайте RACGP имеют формат Portable Document Format (PDF). Эти файлы будут иметь «PDF» в скобках вместе с размером файла для загрузки. Чтобы открыть файл PDF, вам потребуется совместимое программное обеспечение, такое как Adobe Reader.Если у вас его нет, вы можете бесплатно загрузить Adobe Reader.
DOC Некоторые документы на этом сайте представлены в формате Microsoft Word.

 Во время процедуры есть возможность взять образцы и провести тест на наличие бактерий, взять биопсию при подозрении на рак. Процедура проводится под местной или внутривернозной анестезией.
Во время процедуры есть возможность взять образцы и провести тест на наличие бактерий, взять биопсию при подозрении на рак. Процедура проводится под местной или внутривернозной анестезией.