Наладить микрофлору кишечника лекарства: Препараты для восстановления микрофлоры кишечника
Какие продукты помогут восстановить микрофлору кишечника
Эксперты назвали продукты, которые справляются с восстановлением микрофлоры кишечника лучше, чем лекарственные препараты.
В нашем кишечнике находится миллионы бактерий, и не все из них полезные. В результате различных заболеваний в микрофлоре кишечника образуются вредоносные микроорганизмы, которые нарушают его работу и усугубляют самочувствие.
Нарушение микрофлоры может вызывать не только неправильное питание или прием антибиотиков. Врачи утверждают, что в результате таких заболеваний, как онкология, астма, колит, экзема, сахарный диабет и даже рассеянный склероз, кишечник дает сбой.
Следим за рационом
Если вы хотите, чтобы проблема перестала вас беспокоить, то обязательно включите в свое меню продукты, содержащие клетчатку, пектин. Как отмечают гастроэнтерологи, эти вещества особой питательно ценности не имеют, но без них невозможна здоровая работа пищеварения. Налегаем на овощи, фрукты, зерна. Пектин – прекрасный субстрат для «хороших» бактерий. Он в большом количестве содержится в черной смородине, свекле, яблоках, сливах, абрикосах, крыжовнике и тыкве. Если нет возможности приобрести эти продукты, то прекрасной альтернативой станет натуральная пастила без сахара. Она эффективнее аптечных пробиотиков.
Налегаем на овощи, фрукты, зерна. Пектин – прекрасный субстрат для «хороших» бактерий. Он в большом количестве содержится в черной смородине, свекле, яблоках, сливах, абрикосах, крыжовнике и тыкве. Если нет возможности приобрести эти продукты, то прекрасной альтернативой станет натуральная пастила без сахара. Она эффективнее аптечных пробиотиков.
Нужна кислая среда
Поддержать микрофлору кишечника поможет квашеная капуста. Она содержит уйму молочнокислых бактерий Lactobacillaceae, которыми охотно делится с желудком и кишечником.
А брусника и клюква хороши и в квашеном, и в свежем виде. Кислая среда, которую создают ягоды в кишечнике, губительна для патогенных микроорганизмов. Кроме того, в них огромное количество пектина, который помогает жить и размножаться «хорошим» бактериям.
На что наложить табу
Чтобы восстановление микрофлоры прошло намного эффективнее, вам придется отказаться от многих продуктов, с высоким содержанием быстрых углеводов.
Ранее «Кубанские новости» рассказывали о том, какие продукты необходимы при сахарном диабете.
Восстановление микрофлоры кишечника: лучшие препараты, средства и лекарства для лечения после антибиотиков, прибиотики – что принимать
Микрофлора кишечника ― очень важная часть организма человека. В первую очередь ― это правильная работа иммунной системы, но при дисбалансе микрофлоры страдают и другие биохимические процессы, происходящие в нашем организме. Например, работа пищеварительного тракта ― здоровая микрофлора кишечника участвует в нейтрализации жирных кислот, в переваривании пищи, растворении клетчатки и гидролизе белков, в формировании кислой среды в кишечнике для предупреждения размножения патогенной микрофлоры.
Состав нормальной микрофлоры
Здоровая микрофлора кишечника — это оптимальный баланс бактерий, которые участвуют в процессах пищеварения и в работе иммунной системы. В норме в кишечнике человека находятся около 500 видов микроорганизмов, от безусловно полезных до патогенных. Примерное количество микрофлоры кишечника определяется как 1014, или около 2 килограммов микроорганизмов.
В составе нормальной микрофлоры кишечника присутствуют:
-
бифидобактерии
-
лактобактерии
-
бактероиды
-
эшерихии
-
кокковая флора (пептококки, пептострептококки, стрептококки, стафилококки)
-
эубактерии
-
клостридии
-
дрожжеподобные грибы
-
клебсиеллы
-
энтеробактерии
Наиболее многочисленны два вида бактерий — это бифидобактерии, составляющие до 90% кишечной флоры, и лактобактерии, на долю которых приходится до 9% от общего количества микроорганизмов.
Причины нарушений баланса микрофлоры кишечника
Микрофлора кишечника очень чувствительна к негативным воздействиям, поэтому возможных причин нарушения ее баланса насчитываются десятки. Поговорим о наиболее распространенных.
Чаще всего причиной развития дисбактериоза выступает длительный или бесконтрольный прием препаратов-антибиотиков.
Баланс микрофлоры и иммунная система неразрывно связаны между собой. При снижении иммунитета в кишечнике начинается активный рост условно-патогенной и патогенной микрофлоры. К снижению иммунитета приводят системные хронические заболевания, острые инфекционные заболевания, терапия гормональными препаратами и цитостатиками, воздействие ионизирующего излучения.
К числу частых причин нарушения баланса кишечной микрофлоры относятся погрешности в питании. Так, это рацион с преобладанием углеводов, жиров и животных белков и с минимумом клетчатки, кисломолочных продуктов, свежих овощей и фруктов.
К другим причинам развития дисбаланса кишечной микрофлоры относятся паразитарные заболевания, старческий возраст, детская недоношенность. Дисбаланс микрофлоры всегда требует медицинской помощи― коррекции рациона и применения препаратов для восстановления микрофлоры кишечника.
Как проявляется дисбаланс кишечной микрофлоры
О том, что человеку требуются препараты для восстановления микрофлоры кишечника после антибиотиков, или воздействия других негативных факторов, говорят такие симптомы:
-
Расстройства стула. Чаще всего такое расстройство проявляется диареей из-за избыточного образования желчных кислот, усиления перистальтики кишечника и нарушения процесса всасывания жидкости кишечными стенками. Стул в этом случае приобретает гнилостный запах, в нем может наблюдаться слизь, примесь крови, непереваренные кусочки пищи.
 При развитии дисбактериоза у людей старшего возраста возможны запоры, вызванные нарушением двигательной функции кишечника из-за недостатка нормальной микрофлоры. Расстройства стула сопровождаются вздутием и «урчанием» живота.
При развитии дисбактериоза у людей старшего возраста возможны запоры, вызванные нарушением двигательной функции кишечника из-за недостатка нормальной микрофлоры. Расстройства стула сопровождаются вздутием и «урчанием» живота.
-
Схваткообразные боли. Болевой синдром при дисбактериозе возникает из-за повышения давления внутри кишечника, интенсивность болей снижается после дефекации или активного отхождения газов.
-
Диспепсические расстройства. При дисбактериозе почти всегда наблюдаются отрыжка, снижение аппетита, тошнота, периодически возникающая рвота.
-
Аллергические реакции. Восстановление микрофлоры желудка и кишечника потребуется при аллергии в виде кожного зуда и высыпаний, которые появляются даже после употребления продуктов, ранее не вызывавших недружественной реакции. Такие проявления могут быть вызваны нарушением микрофлоры кишечника и снижением ее противоаллергических свойств.

-
Признаки общей интоксикации организма. Это могут быть головные и суставные боли, нарушения сна, общие вялость и слабость, повышение температуры до 37-37,5 градусов.
Чем опасен дисбаланс микрофлоры кишечника
При развитии дисбактериоза у детей они плохо набирают вес, часто болеют простудными недугами, могут отставать от сверстников в физическом и психомоторном развитии.
Для взрослых дисбаланс кишечной микрофлоры может повлечь нарушения белкового обмена с избыточным усвоением жиров и набором лишнего веса, вызвать развитие железодефицитной анемии и таких хронических заболеваний желудочно-кишечного тракта, как гастрит, колит, гастродуоденит.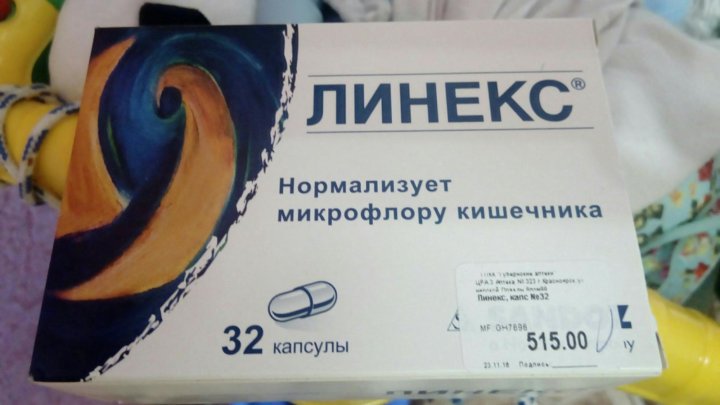 На фоне возникающих при дисбактериозе запорах у людей старшего возраста могут развиваться геморрой и анальные трещины. Длительное нарушение обмена веществ, что характерно для дисбактериоза, увеличивает риск развития сахарного диабета.
На фоне возникающих при дисбактериозе запорах у людей старшего возраста могут развиваться геморрой и анальные трещины. Длительное нарушение обмена веществ, что характерно для дисбактериоза, увеличивает риск развития сахарного диабета.
Препараты для восстановления естественной микрофлоры кишечника
Средства для восстановления микрофлоры кишечника после антибиотиков или других дисбалансирующих факторов всегда должен назначать врач. В арсенале современных врачей-гастроэнтерологов есть разные группы средств для восстановления микрофлоры кишечника. Все они делятся на три основные группы ― пробиотики, пребиотики и синбиотики.
Пребиотиками называются средства, обладающие бифидогенными свойствами ― они создают питательную среду, в которой размножаются полезные бифидо- и лактобактерии. К препаратам этой группы относятся, например, капли Хилак Форте.
Лучшие пробиотики для восстановления микрофлоры кишечника, или эубиотики ― препараты, которые содержат живые компоненты нормальной микрофлоры, восполняющие дефицит бифидобактерий и/или лактобактерий. Препараты этой группы ― Бифидумбактерин и Лактобактерин. Это распространенные и недорогие препараты для восстановления микрофлоры кишечника. И пребиотики, и пробиотики, как правило, принимают 2-3 раза в день.
Препараты этой группы ― Бифидумбактерин и Лактобактерин. Это распространенные и недорогие препараты для восстановления микрофлоры кишечника. И пребиотики, и пробиотики, как правило, принимают 2-3 раза в день.
Наиболее перспективные лекарства для восстановления микрофлоры кишечника относятся к группе синбиотиков, и содержат в своем составе и пребиотики, и пробиотики. Синбиотики одновременно и замещают дефицит нормальной кишечной флоры, и стимулируют ее рост, создавая благоприятный условия для жизнедеятельности бифидобактерий и лактобактерий. Пример недорогого, но эффективного препарата для восстановления микрофлоры кишечника ― Максилак. В его составе 9 различных штаммов полезных микроорганизмов-составляющих нормальной кишечной флоры, а их концентрация в одной дозе (4,5 млрд) позволяет принимать препарат всего 1 раз в день. Выбирая, что пить для восстановления микрофлоры кишечника обязательно вспомните про Максилак! Полезные микроорганизмы в его составе благодаря инновационной технологии защиты капсулы MURE® начинают работать именно там, где это необходимо ― в кишечнике, успешно преодолевая такие естественные барьеры, как желудочный сок, воздействие желчных кислот и пищеварительных ферментов.
Диета при нарушении баланса микрофлоры кишечника
Даже лучшие препараты для восстановления микрофлоры кишечника предполагают соблюдение диеты на весь период лечения дисбактериоза. Важно исключить из рациона алкоголь, пряности, острые приправы, существенно ограничить жирную, жареную пищу и копчености, а также любые продукты, усиливающие процессы брожения в кишечнике. К таким продуктам относятся соленья (в том числе домашние) и маринады, сдоба и сладости. Важно не употреблять в пищу и продукты, способствующие повышенному газообразованию ― газированные напитки, любые бобовые, хлеб с отрубями, свежие овощи и фрукты. Основу рациона во время восстановления микрофлоры кишечника после антибиотиков у взрослых и детей должны составлять нежирные сорта рыбы и мяса, некрепкие бульоны, овощные супы и запеченные овощи, зерновые каши, кисломолочные продукты, особенно обогащенные биокультурами.
Поделиться ссылкой:Как восстановить микрофлору кишечника с помощью питания и лекарственных препаратов?
В кишечнике каждого человека обитает около 50 триллионов разнообразных микроорганизмов, без которых пищеварительный тракт не смог бы полноценно выполнять свою основную функцию – усваивать питательные вещества из продуктов. Общий вес этих маленьких «жильцов» может достигать 3 кг, все они образуют кишечную микрофлору.
Общий вес этих маленьких «жильцов» может достигать 3 кг, все они образуют кишечную микрофлору.
У здорового человека микрофлора состоит из 1% условно-патогенных микроорганизмов, среди которых дрожжеподобные грибки, стафилококки и клостридии. Остальные 99% совершенно безвредны. К ним относят бифидо- и лактобактерии, кишечные палочки, энтерококков, аэробов. Если баланс микроорганизмов отклоняется в сторону вредных, и их численность начинает превышать положенный 1%, а популяция полезных бактерий сокращается, значит у человека развивается дисбактериоз.
Внимание! Нарушение микрофлоры кишечника возникает по многочисленным причинам. Основные – затяжной прием слабительных, гормональных, антибактериальных препаратов, неправильное питание, диеты и голодания, болезни эндокринной системы, снижение иммунитета, оперативные вмешательства, частые стрессы и депрессии, переутомления, вредные привычки, последствия самостоятельной чистки организма.Очень важно поддерживать микрофлору кишечника. С этими задачами справляется комплекс пробиотиков Эльбифид – Essential Probiotics, который поддерживает баланс естественной микрофлоры кишечника, ответственной за качество иммунного ответа и гармонизацию работы пищеварительной системы.
Cтоит также обратить ваше внимание на Бифидогенный бальзам – Сибирский прополис Агатовый, который также плодотворно влияет на естественный баланс микрофлоры кишечника, стимулируя её рост. Улучшенная формула бальзама содержит ещё больше лактулозы и сибирских целебных трав.
Лекарственная терапия
При выраженном дисбактериозе микрофлору кишечника восстанавливают медикаментозным способом. Самостоятельно принимать препараты нельзя, поскольку можно еще сильнее усугубить ситуацию. Следует обратиться к врачу, который подберет наиболее подходящий метод лечения дисбактериоза и лекарственные средства.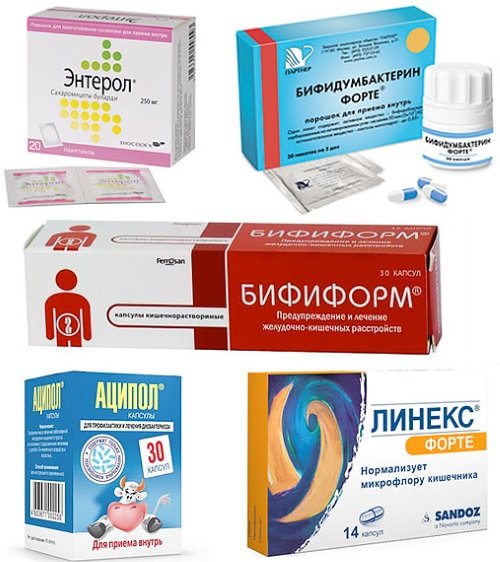 Могут быть назначены:
Могут быть назначены:
- антибиотики – показаны только в запущенных случаях для устранения вредной флоры;
- пребиотики – для создания благоприятных условий для жизни полезных микроорганизмов;
- пробиотики – живые микроорганизмы, аналогичные тем, которые обитают в здоровом кишечнике;
- симбиотики – для заселения кишечника полезными бактериями и создания подходящих условий для их жизнедеятельности;
- ферменты – для улучшения процесса переваривания пищи.
На какое средство падет выбор врача, зависит от симптоматики у больного. При диарее назначаются пробиотики, при задержке стула – пребиотики, при непостоянном стуле – симбиотики.
Питание
Микрофлору помогают восстановить некоторые продукты и народные средства. Соблюдение правильного питания – одно из важнейших условий для эффективного лечения дисбактериоза. Именно грамотно подобранные продукты позволяют наладить пищеварение, избавиться от проблем со стулом и снабдить организм недостающими микроорганизмами и витаминами.
При задержке стула рекомендовано употребление чернослива, свеклы, отрубей, семян льна, овсяной каши. При диарее – цветной капусты, печеных яблок, моркови, риса, приготовленных на пару рыбных и мясных блюд. При метеоризме – легкие бульоны, картофель, омлеты. Исключить в последнем случае придется бобовые, молоко, сладости и выпечку.
Ощутить комфорт и лёгкость в желудке благодаря уникальной композиции сибирских трав вам поможет Фиточай из диких трав № 5 (Комфортное пищеварение) из серии Baikal Tea Collection. Ромашка, курильский чай, подорожник и володушка нормализуют работу пищеварительной системы и восстанавливают микрофлору кишечника.
В качестве перекуса можно использовать Питательный коктейль Ванильная лукума – Yoo Gо, богатый витаминами, аминокислотами и полезными жирами. Каждая порция – это полноценный полезный перекус, наполненный пищевыми волокнами, омега-3 ПНЖК, белком и L-карнитином. Сбалансированный состав обеспечивает организм жизненно важными нутриентами и помогает сохранить ощущение сытости долгое время.
Сбалансированный состав обеспечивает организм жизненно важными нутриентами и помогает сохранить ощущение сытости долгое время.
Внимание! Для восстановления кишечной микрофлоры в домашних условиях все равно придется принимать пребиотики и пробиотики. Первые можно получить из чеснока, лука, банана, спаржи, отрубей. Вторые – из кефира и натурального йогурта. Обоими компонентами организм можно снабдить с помощью пищевых добавок.
При дисбактериозе полезно употреблять в пищу паровые овощи, запеченные фрукты, некислые соки, легкие супы, молочные и кисломолочные продукты, цельнозерновые крупы, миндаль. Можно включить в рацион нежирные сорта мяса и рыбы, зачерствелый белый хлеб, отруби, галеты. Под строгим запретом – жирные сорта мяса и рыбы, копчености, соленые, острые, маринованные, кислые продукты, жареные блюда, консервы, мороженое, мучные и кондитерские изделия, концентрированные бульоны, шоколад, перловка, соуса, крепкий чай и кофе, бобовые, грибы, алкоголь.
Нормализуем работу кишечника
15 мая 2020 г.
Кишечник человека населяют сотни видов различных микроорганизмов, которые отвечают за защиту его слизистой, переваривание пищи и усвоение полезных веществ. Для правильной работы кишечника необходимо, чтобы в нём поддерживался баланс “хороших” и “плохих” бактерий – своих и чужеродных.
Баланс этих бактерий легко нарушить при неправильном питании, приёме антибиотиков, стрессах и некоторых диетах. При возникновении дисбаланса в кишечной флоре патогенные бактерии атакуют иммунную систему, проникая в организм и вызывая изменения.
Нарушения иммунитета могут выражаться по-разному: от акне и частых простуд до тяжелейших заболеваний, способных навредить человеку. Нормализовать работу кишечника могут помочь различные препараты, которые стоит подбирать в зависимости от ситуации.
За микрофлору кишечника отвечают бифидобактерии.
Эти микроорганизмы отвечают за такие важные функции как: синтез витаминов, пищеварение, абсорбирование желчных кислот и холестерина, предупреждение запоров и поносов, стимуляция иммунных реакций.
Одним из источников бифидобактерий является Симбиоз Альфлорекс, он поможет вам восстановить микрофлору кишечника и нормализовать пищеварение.
БАДы в помощь для восстановления микрофлоры кишечника после приёма антибиотиков.
В процессе приёма некоторых препаратов (например, антибиотиков) полезные бактерии погибают, баланс нарушается и микрофлора кишечника страдает. Это выливается в неприятные последствия в виде запоров или диареи.
Для устранения этих последствий есть несколько БАДов, которые себя хорошо зарекомендовали на рынке.
Если вы не любите глотать таблетки, для вас подойдёт Витастронг Флориоза в удобной форме саше.
Если форма выпуска для вас не принципиальна, то на ваш выбор:
- Линекс Форте, успевший зарекомендовать себя среди покупателей;
- Аципол Актив с приятным грушевым вкусом, где один флакон рассчитан на один приём.
Микрофлора кишечника у малышей.
К сожалению, малыши также могут столкнуться с дисбалансом в кишечнике. Восстановить бифидобактерии в этом случае поможет Бифиформ бэби. Также многие педиатры назначают Аципол малыш в удобной форме капель, который содержит в себе и лакто- и бифидобактерии.
Восстановить бифидобактерии в этом случае поможет Бифиформ бэби. Также многие педиатры назначают Аципол малыш в удобной форме капель, который содержит в себе и лакто- и бифидобактерии.
С расстройством кишечника могут сталкиваться и малыши, и взрослые, поэтому в целях удобства и экономии есть возможность приобрести нужные препараты сразу в необходимых объёмах для всей семьи.
Не забывайте проверять противопоказания и консультироваться с лечащим врачом по поводу принимаемых препаратов!
ИМЕЮТСЯ ПРОТИВОПОКАЗАНИЯ. ПЕРЕД ПРИМЕНЕНИЕМ НЕОБХОДИМО ПРОКОНСУЛЬТИРОВАТЬСЯ СО СПЕЦИАЛИСТОМ
Как восстановить микрофлору кишечника | Городской медицинский центр GormedC
Чтобы привести микрофлору в норму, необходим комплексный подход к лечению. В него будут входить некоторые народные средства, правильное питание и медикаменты.
Противостоять бактериям и предотвращать их проникновение в желудочно-кишечный тракт должна микрофлора. Именно поэтому для постоянной правильной работы кишечника необходимо постоянное поступление определенных микроорганизмов. Они, прежде всего, необходимы для борьбы с патогенами. Всем известный дисбактериоз – нарушение баланса, связанного с их недостаточностью. Чащу всего подобное случается после принятия курса антибиотиков.
Восстановление микрофлоры кишечника
Чтобы привести микрофлору в норму, необходим комплексный подход к лечению. В него будут входить некоторые народные средства, правильное питание и медикаменты. Прежде чем начать лечение, необходимо проконсультироваться с гастроэнтерологом.
В зависимости от симптомов, выделяют 5 типов препаратов. В любом случае, можно предоставить проблему до ее появления. Употребляйте пробиотики вместе с антибиотиками. Стоит помнить, что последние назначают только при большом количестве патогенов. Перед их назначением следует сдать анализы, чтобы определить, восприимчивы они к подобному лечению. В инструкции к каждому препарату указывается правильная дозировка, частота применения. Не нужно превышать дозировку, так как это может оказать негативный эффект. К детским препаратам относят Хилак Форте и Линекс. Не стоит полагаться на отзывы на форумах, так как решающую роль при выборе лекарства всегда будет играть специалист-медик.
Можно сочетать медикаменты и народные средства. К ним можно отнести специальную брагу. Для ее изготовления нам потребуется пол-литра теплой воды, сахар и мед по одной столовой ложке и 2 грамма дрожжей. Достаточно просто все смешать и поставить в теплое место. Пить ее стоит между приемами пищи. Полезным может оказаться настрой из эвкалипта, укропа и мяты. Необходимо смешать три части перечной мяты, одну часть семян укропа и пять эвкалипта. Все это литром теплой воды и дать настояться час. Пейте по стакану смеси перед приемом пищи. Перед использованием этих народных рецептов стоит получить консультацию врача.
Диетический рацион
Придерживайтесь правильного рациона, так как это поможет снизить нагрузку на ваше пищеварение. Вся кисломолочная продукция помогает заполнить желудок нужными бактериями. Лучшим другом должны стать каши из круп, так как они не только помогают нормализовать обмен веществ, но и выведут токсины.
Дисбактериоз у новорожденных и грудных детей | Bifiform ru
В норме микрофлора кишечника состоит в среднем из 1 млн микробов на 1 мл содержимого. Нормальную микрофлору составляют 15-20 представителей анаэробных (бактерии, которые не могут жить в присутствии кислорода) и аэробных (способных существовать в присутствии кислорода) бактерий основных родов: бактероиды, бифидобактерии, лактобактерии и другие. Бифидобактерии относятся к доминирующей микрофлоре (Ig10-11)1,2
Здоровая микрофлора участвует в пищеварительных процессах организма, усиливает активность пищеварительных ферментов, действует на моторику желудочно-кишечного тракта, способствует выработке витаминов, гормонов, аминокислот и повышает иммунитет.
Также микрофлора выполняет детоксикационную и антиаллергенную функции. Защитные функции кишечника сводятся к созданию барьера для размножения болезнетворных бактерий и разрушения аллергенов. Нормальная микрофлора также обладает антиоксидантными, антимутагенными и противораковыми функциями1,2
Формирование микрофлоры
Формирование и функционирование иммунной системы происходит в 2 этапа. Первый заключается в формировании клонов Т- и В-лимфоцитов на основе генетического материала, который был представлен в период раннего эмбриогенеза (ранние этапы беременности).
Второй этап – начинается после рождения человека и заселения микробами слизистых оболочек, в том числе и ЖКТ. Кишечник – представляет собой не только часть пищеварительной системы, но и является иммунным органом, до 80% иммунных клеток располагаются именно в кишечнике. Таким образом, формирование собственного кишечного иммунитета у грудного ребенка происходит с период ранней микробной колонизации и начинается сразу после рождения ребенка. Поэтому момент появления на свет является одним из ключевых этапов в формировании здорового ЖКТ3.
В становлении нормальной микрофлоры ребенка особенно важную роль играют бифидобактерии. Количество бифидобактерий в кишечнике ребенка, находящегося на грудном вскармливании, быстро нарастает в первые недели его жизни. В течение первого года жизни меняется видовой состав кишечной микрофлоры, что связано с различными периодами в жизни ребенка: периодом грудного вскармливания до введения прикорма, после введения прикорма, после появления в рационе твердой пищи, после прекращения грудного вскармливания. Беременность мамы, микрофлора родовых путей, течение родов, рождение раньше срока, наличие и продолжительность грудного вскармливания, раннее введение прикорма, частые простудные заболевания определяют становление этого процесса.
Нормальная микрофлора ребенка
Микрофлора обусловливает защиту слизистой кишечника от внедрения патогенных микроорганизмов, поддерживает и активирует иммунную систему, участвует в обмене белков, липидов, углеводов, выполняет антиаллергическую функцию, участвует в синтезе аминокислот, витаминов, гормонов, влияет на пищеварительные функции желудочно-кишечного тракта 1.
Пробиотический комплекс Бифиформ Бэби можно давать даже новорожденным с первых дней жизни. Его основное назначение – формирование сбалансированной микрофлоры кишечника, в том числе, при различных проблемах, связанных с кормлением. Особый комплекс бактерий может способствовать профилактикекишечных расстройств различного характера, включая колики 4.
Нормальную микрофлору кишечника составляют множество видов микроорганизмов. Одни из значимых и изученных на сегодняшний день:
Бифидобактерии
Представители рода Bifidobacterium являются наиболее важным компонентом нормальной микробиоты желудочно-кишечного тракта человека. Большая часть бифидобактерий находится в толстой кишке, составляя у детей более 90% всех микроорганизмов 5 Начинают доминировать в кишечной микрофлоре младенцев к концу первой недели жизни. Синтезируют аминокислоты и белки, витамин К, пантотеновую кислоту, витамины группы В: B1 — тиамин, B2 — рибофлавин, B3 — никотиновую кислоту, фолиевую кислоту, B6 — пиридоксин. Способствуют усилению процессов всасывания через стенки кишечника ионов кальция, железа, витамина D 6.
Лактобактерии
Уменьшают активность пероксидазы, оказывая антиоксидантный эффект, обладают противоопухолевой активностью, стимулируют продукцию иммуноглобулина А (IgA), подавляют рост патогенной микрофлоры и стимулируют рост лакто- и бифидофлоры, оказывают противовирусное действие 6
Нарушения микрофлоры
Дисбактериоз является нарушением качественного и количественного состава микрофлоры кишечника. Это означает, что патогенных микроорганизмов может стать значительно больше, чем полезных. Иногда сам организм может справиться с временно возникшими изменениями в кишечной микрофлоре, но при определенных ситуациях для лечения дисбактериоза используются пробиотики, содержащие полезные микроорганизмы 2.
Дисбактериоз у грудных детей может проявляться в виде изменения частоты, состава и цвета стула, нарушения процессов переваривания пищи, повышенного газообразования, беспокойного поведения ребенка, плача, повышенной раздражительности, плохого аппетита и сна, ухудшение состояния кожного покрова и даже аллергических реакций 3.
Причины возникновения дисбактериоза у новорожденных и грудничков
В группе риска по нарушению баланса микрофлоры находятся дети, мамы которых имели различные осложнения в период беременности и родах, а также дети, находящиеся на искусственном вскармливании, недоношенные. Простудные заболевания, прием некоторых лекарственных препаратов (лечение антибиотиками) могут приводить к нарушениям баланса микрофлоры кишечника. Внешними проявлениями этого состояния могут быть нарушения сна, плаксивость, нарушение аппетита, аллергические высыпания, колики и постоянное бурчание в животе после кормления 1,3.
Сдача анализов
При возникновении симптомов недомогания у Вашего ребенка, обязательно проконсультируйтесь с врачом. Для постановки диагноза дисбактериоза врач может порекомендовать сдать анализ кала на дисбактериоз.
Как правильно собрать кал для анализа на дисбактериоз:
Кал собирается в стерильную баночку, предварительно прокипяченную вместе с крышкой в течение 20 минут. Посуда для анализа, на основании результатов которого будет проводиться лечение дисбактериоза у грудных детей, должна храниться в холодильнике не более суток. Собранный в стерильную емкость анализ доставляется в лабораторию в течение 2 часов (не позднее). Результаты подготавливаются через 7-10 дней.
Для получения информации о том, где можно приобрести Бифиформ Бэби , посетите раздел «Где купить».
БАД. НЕ ЯВЛЯЕТСЯ ЛЕКАРСТВЕННЫМ СРЕДСТВОМ
- Донских Е.Е. Микрофлора – Дисбактериоз у детей http://lekmed.ru/info/literatyra/disbakterioz-y-detei.html
- Корниенко Е.А., Мазанкова Л.Н., Горелов А.В. Применение пробиотиков в педиатрии: анализ лечебного и профилактического действия с позиций доказательной медицины. Лечащий врач 2015.
- И.А. Беляева. Пробиотические добавки для коррекции младенческих колик: перспективы использоавния.
- Беляева И.А., Митиш М.Д., Катосова Л.К. Эффективность использования пробиотиков у недоношенных детей. РМЖ 2009.
- Рыбальченко О.В., Бондаренко В.М. Оценка микробиоты и пробиотических штаммов с позиций новых научных технологий. Фарматека №11, 2016
- Бельмер С.В., Малкоч А.В. Кишечная микрофлора и значение пребиотиков для ее функционирования. Лечащий врач 2006, 4
PP-BIB-RUS-0082
Диетическое питание при нарушении микрофлоры | Bifiform ru
В диетологии и гастроэнтерологии в зависимости от вида заболевания, степени тяжести его проявления и длительности процесса существуют лечебные диеты с различным набором продуктов и степенью их кулинарной обработки. Диета необходима для того, чтобы обеспечить пациенту щадящий режим питания 1. Но врач, наблюдающий пациента, обязательно обращает внимание на то, насколько долго его подопечный бывает ограничен в потреблении ряда полезных продуктов, и при возможности расширяет диету.
Первый принцип организации терапевтического питания – обеспечение пациента полноценным питанием (речь идет о витаминах, минералах, белках, углеводах и жирах) и энергией в необходимых ему количествах.
Второй принцип – объем съедаемого и возможность пациента усвоить этот объем еды должны быть сбалансированы.
Третий – следует обязательно учитывать общее воздействие назначенной диеты на организм пациента.
Четвертый – обязательно следует использовать различные диетические прописи, в которых предложен щадящий, тренировочный и разгрузочный рационы.
Пятый – в режиме приема пищи на день важно точно обозначить время – распределить часы завтраков, обедов, ужинов, промежутки между ними.
Шестое правило – составление терапевтического рациона питания непременно должно быть индивидуально ориентированным, в нем следует учесть местные и национальные особенности, тип конституции человека, сопутствующие заболевания.
Для диетолога при расчете суточного количества калорий важны параметры, касающиеся возраста, пола, конституции больного, характеристики, предписанного ему режима.
В случае увеличения энергопотерь, например, во время инфекционных заболеваний, после тяжелой травмы или хирургического вмешательства, для того, чтобы восполнить дефицит калорий, их количество увеличивают иногда вдвое.
Расчет оптимального соотношения «питательные вещества – калории», которое необходимо пациенту в сутки, выглядит следующим образом:
14% калорий дают белки;
30% получают, благодаря жирам;
56% должны приносить углеводы.
Если составлять рацион без учета этих требований, то эффект от воздействия сопутствующей терапии может быть снижен и могут развиться дополнительные нарушения [2].
Белки животного и растительного происхождения пациент должен получать в одинаковых долях. Но всегда есть исключения: например, при некоторых заболеваниях почек следует снизить количество белка, но при этом организм должен получать незаменимые аминокислоты хотя бы в минимальном количестве. Если этого не обеспечить, то следствием будет развитие белковой недостаточности.
Организм человека нуждается в ежедневном поступлении жиров, углеводов, витаминов, минеральных веществ.
В случае некоторых болезней необходимо восполнять потерю организмом полезных веществ, в количестве, превышающем физиологические нормы.
Для восстановления баланса микрофлоры кишечника важно насытить рацион питания продуктами, которые в значительном количестве содержат клетчатку и пектины. Это такие продукты как злаки, фрукты, овощи. Ограничение потребления сладких, мучных и копченых продуктов питания – обязательное условия для восстановления здоровья кишечника.
Неоценима польза кисломолочных продуктов (кефир, йогурт, ацидофиллин, простокваша), содержащих лактобактерии, которые, активно подавляя процессы гниения в кишечнике, восстанавливают баланс его микрофлоры. С их помощью можно привести в норму баланс кишечных микроорганизмов, усилить иммунную защиту, расщепить углеводы, помочь в синтезе витаминов К и группы В2. Включение в диету круп и хлеба грубого помола способствует нормализации стула, восстановлению активной моторики кишечника и функций слизистой ЖКТ. Существуют состояния организма, когда баланс микрофлоры нарушается достаточно глубоко: частые стрессовые ситуации, перенесенные инфекции, смена климата и характера питания, прием антибиотиков. И тогда приема молочнокислых продуктов и соблюдения режима питания бывает недостаточно. В таких ситуациях на помощь могут прийти пробиотические комплексы, содержащие живые полезные бактерии, такие как пробиотики Бифиформ.
Но перед приемом любого средства или в случае ухудшения вашего состояния всегда нужно проконсультироваться с врачом!
Диетическое питание, став нормой жизни, зачастую позволяет избежать многих проблем со здоровьем в будущем. Грамотный рацион будет профилактикой многих заболеваний, а не лекарством от них. Сейчас диетическое питание – это не только еда для людей с проблемами пищеварения, а следование принципам здорового образа жизни, повышающее ее качество.
Недаром греческое слово «диета» (греч.δίαιτα) означает образ жизни, режим питания.
The Nutrition Source Healthy Eating Plate & Healthy Eating Pyramid \2017 The President and Fellows of Harvard College
The dilatory supplement pyramid
PP-BIF-RUS-0327
Влияние часто используемых лекарств на состав и метаболическую функцию микробиоты кишечника
Употребление наркотиков
В этом исследовании мы использовали три голландские когорты: общую популяционную когорту, когорту пациентов с ВЗК и когорту случай-контроль. пациенты с СРК (см. методы). 1126 из 1883 участников из всех трех когорт принимали хотя бы один препарат во время отбора проб фекалий. Количество препаратов, использованных на одного участника, варьировалось от 0 до 12 со средним значением 0 для когорты населения (среднее значение 1.03, n = 1124), 2 для когорты IBD (среднее 2,35, n = 454) и 1 для когорты IBS (среднее 1,6, n = 305) (таблица 1, дополнительные данные 1 и 2) . В общей сложности мы наблюдали 537 различных комбинаций лекарств, наиболее частой из которых была комбинация бета-симпатомиметического ингалятора со стероидным ингалятором (18 пользователей) (дополнительные данные 2). Использование стероидных ингаляторов сильно коррелировало с использованием бета-симпатомиметических ингаляторов (R популяция-когорта = 0.78, R IBD-когорта = 0,65, R IBS-когорта = 0,78, корреляция Спирмена, частота ложного обнаружения [FDR] <0,05) (дополнительные данные 3–5). У пациентов с ВЗК наиболее сильная корреляция наблюдалась между добавками кальция и витамина D (R = 0,84, корреляция Спирмена, FDR <2 × 10 -16 ). Месалазины (36%), тиопурины (33%) и агенты против TNFα (25%) присутствовали в 10 наиболее часто используемых лекарствах в когорте ВЗК (Таблица 1). Поскольку тиопурины и агенты против TNFα использовались исключительно в когорте пациентов с ВЗК, эти препараты не были включены в наши анализы с участием нескольких препаратов.
Таблица 1 Употребление наркотиков на когорту. Число и процент потребителей наркотиков в каждой когорте.Микробная экосистема и употребление наркотиков
Сначала мы исследовали влияние каждого отдельного препарата на богатство и общий микробный состав кишечника. Как описано ранее, когорты с заболеванием имели более низкое микробное богатство по сравнению с общей популяционной когортой (популяционная когорта Shannon Index , среднее значение = 2,26 (0.96–2.91), когорта Shannon Index IBD, среднее = 2.1 (0,38–2,78), когортный индекс Шеннона СРК среднее значение = 2,02 (1,01–2,65)) 15 . Внутри когорт мы не наблюдали каких-либо значительных изменений микробного богатства, связанного с использованием какого-либо лекарства или количества различных используемых лекарств (корреляция Спирмена, FDR> 0,05, дополнительные данные 6, рис. 1). Тем не менее, мы наблюдали различия между количеством используемых препаратов и общим микробным составом во всех когортах (критерий пермутационного многомерного дисперсионного анализа (PERMANOVA); популяционная когорта: r 2 = 0.006, FDR = 0,001; Когорта IBD: r 2 = 0,015, FDR = 0,001; Когорта IBS: r 2 = 0,014, FDR = 0,0014; Дополнительные данные 7). ИПП были единственным индивидуальным препаратом, связанным с изменениями состава во всех когортах (PERMANOVA, популяционная когорта: r 2 = 0,007, FDR = 0,006; когорта IBD: r 2 = 0,023, FDR = 0,0006; когорта IBS : r 2 = 0,021, FDR = 0,01).
Рис. 1: Микробное богатство (индекс Шеннона) для каждого участника, стратифицированного по количеству использованных лекарств.Точки представляют значение богатства для каждого образца в исследовании. Коробчатая диаграмма показывает медианный и межквартильный размах (25-е и 75-е). Усы показывают диапазон 1,5 * IQR. Черные линии показывают линейную регрессию с фиолетовой тенью, обозначающей доверительный интервал 95%. Слева направо когорта IBD ( N = 454 выборки, линейная регрессия, коэффициент = -0,001, p = 0,88), популяционная когорта ( N = 1124 выборки, линейная регрессия, коэффициент = -0,002, р = 0.77) и когорты IBS ( N = 305 образцов, линейная регрессия, коэффициент = -0,016, p = 0,06). (Исходные данные представлены в виде файла исходных данных).
Таксоны и пути, связанные с употреблением наркотиков
В метаанализе, учитывающем возраст, пол, ИМТ и глубину секвенирования хозяина, 154 связи между отдельными таксонами и 17 группами лекарств оказались статистически значимыми (метаанализ обратной дисперсии , FDR <0,05, рис. 2а, дополнительные данные 8).ИПП, метформин, добавки витамина D и слабительные были отдельными препаратами с наибольшим количеством ассоциаций (> 10) в анализе отдельных препаратов. Интересным наблюдением было то, что изменения численности определенных таксонов были связаны с несколькими независимыми лекарствами. Например, численность Streptococcus salivarius увеличилась у потребителей опиатов, пероральных стероидов, ингибиторов агрегации тромбоцитов, ИПП, антидепрессантов СИОЗС и добавок витамина D (метаанализ обратной дисперсии, FDR <0.05). Однако мы также наблюдали особенности, характерные для отдельных лекарств: повышенная численность Bifidobacterium dentium была характерна для пользователей ИПП (метаанализ обратной дисперсии, FDR = 9,38 × 10 −17 ) и повышенное количество бактерий. Eubacterium ramulus был специфичным для участников, принимавших антидепрессанты СИОЗС (метаанализ обратной дисперсии, FDR = 0,047). Использование лекарств также было связано с функциональными изменениями кишечника. В том же анализе 411 микробных путей были связаны с 11 лекарствами (метаанализ обратной дисперсии, FDR <0.05, рис. 2b, дополнительные данные 9).
Рис. 2: Обзор количества связанных микробных признаков.a , b Столбчатые диаграммы, показывающие количество ассоциаций между каждым типом лекарственного средства и таксонами микробов a и микробными путями b . Цвета столбцов указывают на результаты отдельных когорт и результаты метаанализов. Черные столбцы показывают когорту населения, темно-серые столбцы – когорту IBS, светло-серые столбцы – когорту IBD, а красные столбцы – результаты метаанализов.Модель с одним лекарством показывает связь при одновременном рассмотрении одного препарата с учетом возраста, пола и ИМТ. Модель с несколькими лекарствами рассматривает использование нескольких типов наркотиков с учетом возраста, пола и ИМТ. (Исходные данные представлены в виде файла исходных данных).
Чтобы рассмотреть несколько групп лекарств, назначаемых одновременно, мы протестировали каждое лекарство, добавляя другие лекарства в качестве ковариат в линейных моделях. В целом было обнаружено 47 ассоциаций между относительной численностью микробов и использованием шести препаратов (метаанализ обратной дисперсии, FDR <0.05, рис. 1b, дополнительные данные 10). ИПП, слабительные и метформин показали наибольшее количество ассоциаций с микробной таксономией и путями. Несмотря на небольшое количество пользователей антибиотиков, в этом метаанализе (метаанализ обратной дисперсии, FDR = 0,001) наблюдалось снижение количества Bifidobacterium рода . Пользователи слабительных показали более высокую численность видов Alistipes и Bacteroides в своем микробиоме (метаанализ обратной дисперсии, FDR <0,05).Связь между применением антидепрессантов СИОЗС и Eubacterium ramulus оставалась значимой после рассмотрения использования нескольких лекарственных препаратов (метаанализ обратной дисперсии, FDR = 0,032). В этом мультилекарственном анализе 271 путь был связан с четырьмя категориями лекарств: ИПП, слабительные, антибиотики и метформин (метаанализ обратной дисперсии, FDR <0,05, дополнительные данные 11). Интересно, что в то время как использование антибиотиков было связано с более низким распространением микробных путей, таких как биосинтез аминокислот, использование метформина было связано с повышенным метаболическим потенциалом бактерий (метаанализ обратной дисперсии, FDR <0.05). В категории антибиотиков тетрациклины показали самую сильную связь с измененными путями (двусторонний тест Вилкоксона, FDR <0,05, дополнительные данные 12). Более того, обилие микробных путей у потребителей слабительных и ИПП действительно показало некоторое сходство, включая увеличение использования глюкозы (усиление путей гликолиза) и снижение путей деградации крахмала и биосинтеза ароматических соединений (метаанализ обратной дисперсии, FDR <0,05). ). Все связи между таксономией, путями и отдельными лекарствами можно найти в дополнительных данных 13–46.
Когортоспецифические изменения в составе микробиома кишечника
Изменения в составе микробиоты кишечника у пациентов с ВЗК и СРК наблюдались до 15,20,21 . Поэтому мы исследовали, присутствовали ли эти изменения также в ассоциациях между микробиотой и использованием лекарства. В когорте пациентов с ВЗК употребление бензодиазепинов было связано с увеличением численности Haemophilus parainfluenzae (линейная регрессия, t -тест, FDR = 0.008, Дополнительные данные 47). Интересно, что эта бактерия чаще встречается у пациентов с ВЗК, чем у здоровых людей. Использование трициклических антидепрессантов было связано с увеличением численности Clostridium leptum , а прием левотироксина было связано с более высокой численностью Actinomyces в когорте ВЗК (линейная регрессия, t -тест, FDR = 0,005 и 0,005, соответственно, Дополнительные данные 47). Кроме того, 17 пользователей стероидных ингаляторов в когорте СРК показали более высокую численность Streptococcus mutans и Bifidobacterium dentium в микробиоме кишечника (линейная регрессия, t -тест FDR = 0.001 и 0,01 соответственно, дополнительные данные 40). Интересно, что пациенты с ВЗК, принимавшие пероральные стероиды, показали более высокое содержание Methanobrevibacter smithii (линейная регрессия, t -тест, FDR = 0,004, дополнительные данные 47). Эта связь также отражалась на уровне пути: четыре пути, связанные с использованием этого препарата, также показали высокую корреляцию с численностью Methanobrevibacter smithii (корреляция Спирмена, rho> 0,93, FDR <2 × 10 −16 , Дополнительные данные 48 и рис.3). Два из этих путей участвуют в метаногенезе, один – в биосинтезе витамина В2, а другой – в биосинтезе нуклеозидов. И наоборот, использование других лекарств, обычно назначаемых для лечения ВЗК, не показало сильной связи с микробным составом. Было обнаружено, что только численность видов Erysipelotrichaceae несколько увеличилась у пользователей месалазина (линейная регрессия, t -тест, FDR = 0,047, дополнительные данные 49).
Рис. 3: Корреляция между относительной численностью Methanobrevibacter smithii и путями, связанными с пероральными стероидами.Точки раскрашены по когортам исследования. Синим цветом обозначена когорта пациентов с ВЗК, желтым – когорта населения, а серым – когорта случай-контроль. X – ось представляет относительную численность Methanobrevibacter smithii и Y – ось чтения на килобазу (RPK) каждого пути. Корреляция Спирмена использовалась для расчета корреляции и значимости. (Исходные данные представлены в виде файла исходных данных).
Сигнатура микробиома пользователей ИПП
ИПП составили наибольшее количество ассоциаций, в общей сложности 40 измененных таксонов и 166 измененных микробных путей в анализах одного лекарства (метаанализ обратной дисперсии, FDR <0.05, дополнительные данные 8 и 9).
При поправке на влияние других типов лекарств 24 таксона и 133 микробных пути оставались значимо связанными с ИПП (метаанализ обратной дисперсии, FDR <0,05). Мы наблюдали повышенную численность Veillonella parvula , которая, как известно, устанавливает мутуалистическую связь с Streptococcus mutans путем совместной агрегации и трансформации продуктов метаболизма бактерий, ферментирующих углеводы 22 (метаанализ обратной дисперсии, FDR = 1.61 × 10 −6 и 6,13 × 10 −24 соответственно).
Функциональные изменения включали увеличение биосинтеза жирных кислот и липидов, ферментационный метаболизм NAD и биосинтез L-аргинина. Пути, связанные с использованием ИПП, включают функции, которые имеют широкий таксономический вклад. Однако более пристальный взгляд на прогнозируемый микробный вклад и семейства генов, участвующих в каждом пути, показал, что обогащение конкретных микробных механизмов, вероятно, объясняется изменениями, наблюдаемыми в таксономическом составе.Распад дезоксирибонуклеозида пурина, путь, используемый в качестве источника энергии и углерода, был предсказан на основе геномов более 25 различных родов бактерий (рис. 4). Увеличение этой функции в микробиоме кишечника потребителей ИПП можно объяснить увеличением численности видов Streptococcus ( S. salivaris, S. parasanguinis и S. vestibularis ) (двусторонний тест Вилкоксона, FDR <0,05). ). Три пути, участвующие в биосинтезе L-аргинина (MetaCyc ID: PWY-7400, ARGSYNBSUB и ARGSYN), были более распространены в микробиоме пользователей ИПП.В то время как несколько бактериальных таксонов, включая видов Bifidobacterium и Ruminococcus , по прогнозам, вносят вклад в эти пути, только Streptococcus mutans путей показали значительное обогащение (двусторонний тест Вилкоксона, FDR <0,05, дополнительные данные 50). Эти анализы также проводились в отношении метформина, антибиотиков и слабительных средств (дополнительные данные 51–53).
Рис. 4: Вклад микробов в путь деградации пурин-дезоксирибонуклеозида.Коробчатые диаграммы представляют относительный вклад каждого микроба в общую количественную оценку пути для каждой когорты отдельно. Сверху представлена когорта IBD, в середине – когорта IBS, а в нижнем ряду – когорта LLD. Графики в синем ящике представляют значения пользователей PPI. Красные прямоугольные диаграммы представляют значения пользователей, не использующих PPI. Звездочки указывают на статистически значимые различия между пользователями ИПП и непользователями (тест Вилкоксона, FDR <0,05). Коробчатые диаграммы показывают медианы и первый и третий квартили (25-й и 75-й процентили) соответственно.Верхние и нижние усы увеличивают наибольшее и наименьшее значение не более чем на 1,5 * IQR, соответственно. Выбросы наносятся индивидуально.
Различные типы ИПП, а именно омепразол, эзомепразол и пантопразол, проявляют аналогичное действие на микробиом кишечника. Кроме того, из 133 микробных путей, связанных с использованием ИПП, 46 путей также продемонстрировали дозозависимые эффекты (двусторонний тест Вилкоксона, FDR <0,05, дополнительные данные 12). Например, участники, использующие более высокую дозировку ИПП (больше или равную 40 мг / день), показали заметное уменьшение пути, участвующего в биосинтезе аминокислот (PWY-724), по сравнению с участниками, принимавшими низкие дозы (двусторонняя Тест Вилкоксона, FDR = 0.00065, Дополнительные данные 12).
Метформин связан с изменениями метаболического потенциала
В то время как изменения в численности видов Streptococcus , Coprococcus и Escherichia изначально были обогащены у потребителей метформина, эти ассоциации больше не были значимыми после корректировки на употребление других видов наркотиков. Однако предполагаемая ассоциация с Escherichia coli (линейная регрессия, t -тест, FDR = 0.08, дополнительные данные 10), а в когорте ВЗК количество Streptococcus mutans несколько увеличилось у участников, принимавших этот препарат (линейная регрессия, t -тест, FDR = 0,05) (дополнительные данные 47).
Поразительно, но функциональные последствия использования метформина были значительными даже после поправки на использование других лекарств: 48 микробных путей изменились по сравнению с теми, кто не принимал наркотики (метаанализ обратной дисперсии, FDR <0,05, дополнительные данные 11).Использование метформина было связано с изменениями метаболического потенциала микробиома, в частности, с увеличением производства бутаноата, биосинтеза хинона, деградации производных сахара и путей устойчивости к полимиксину (дополнительные данные 11). Интересно, что прогнозирование метагеномного пути и анализ семейств генов показали, что виды Enterobacteriaceae, в основном Escherichia coli , вносили основной вклад в функциональные изменения, связанные с использованием метформина. Наши данные показывают, что физиологические изменения, вызванные метформином, могут обеспечить конкурентное преимущество энтеробактериальным видам, что потенциально может иметь последствия для здоровья (двусторонний тест Вилкоксона, FDR <0.05, Дополнительные данные 51). Кроме того, мы не выявили дозозависимых эффектов использования метформина на ассоциированные пути (двусторонний тест Вилкоксона, FDR> 0,05, дополнительные данные 12).
Эффект от приема антидепрессантов СИОЗС у пациентов с СРК
Антидепрессанты СИОЗС входили в десятку наиболее часто используемых препаратов в когорте СРК. У пользователей СИОЗС единственными таксонами, которые оставались статистически значимыми в метаанализе с несколькими лекарственными препаратами, была повышенная численность Eubacterium ramulus (метаанализ обратной дисперсии, FDR = 0.032, Дополнительные данные 10). Эта категория лекарств включала шесть различных подтипов лекарств, в которых пароксетин составлял 32% пользователей СИОЗС (дополнительные данные 1). Интересно, что, несмотря на низкие числа, повышенная численность Eubacterium ramulus в основном наблюдалась у пользователей пароксетина (двусторонний тест Вилкоксона, FDR = 0,054, -значение P = 0,003, дополнительные данные 12).
Кроме того, путь, участвующий в созревании пептидогликана, был снижен в метаанализе нескольких лекарственных препаратов пользователей антидепрессантов СИОЗС по сравнению с теми, кто их не принимал (метаанализ обратной дисперсии, FDR = 0.13). Однако этот результат в основном наблюдался в когорте IBS (линейная регрессия, t -тест, FDR = 0,002, дополнительные данные 38).
Употребление наркотиков связано с разными профилями резистома
Становятся доступными доказательства in vitro, указывающие, что не только использование антибиотиков может усиливать АР: неантибиотические препараты также могут способствовать этому механизму 11 . Чтобы решить эту проблему, мы сначала проанализировали для всех трех когорт отдельно, увеличилось ли общее количество генов AR у потребителей отдельных наркотиков по сравнению с теми, кто не принимал никаких наркотиков.Для общей популяции общее количество генов AR было увеличено для пользователей метформина и ИПП (двусторонний тест Вилкоксона, FDR = 0,04 и 0,04, соответственно, дополнительные данные 54). В когорте СРК после поправки на множественное тестирование ни один из препаратов не был связан с увеличением генов AR (двусторонний тест Вилкоксона, FDR> 0,05). В когорте ВЗК это увеличение наблюдалось у потребителей опиатов и трициклических антидепрессантов (двусторонний тест Вилкоксона, FDR = 0,04 и 0,04, соответственно).Если мы воспользуемся менее строгим пороговым значением FDR <0,25, 15 препаратов будут связаны с количеством маркеров AR в трех когортах. Чтобы определить, какие группы препаратов были связаны с увеличением отдельных генов AR, мы проанализировали количество отдельных генов AR. Во всех трех когортах мы выявили последовательное увеличение трех маркеров гена AR у пользователей ИПП по сравнению с участниками, не принимающими никаких наркотиков (двусторонний тест Вилкоксона, FDR <0,05, дополнительные данные 55). Эти гены принадлежат к tetA , tetB и Mel (ARO: 3004033, ARO: 3004032 и ARO: 3000616 соответственно), которые являются частями оттокных насосов, которые выкачивают определенные типы антибиотиков из бактерий и тем самым подавляют функциональные механизмы этих антибиотиков 23,24 .Для tetA и tetB это влияет на тетрациклины группы антибиотиков 23 . Для Mel влияет на антибиотики группы макролидов 24 .
Эти маркеры AR имеют самые высокие корреляции с Streptococcus parasanguinis (корреляция Спирмена, rho между 0,56–0,75, FDR <0,05). Мы идентифицировали три АР, которые также были протестированы in vitro 11 . Например, известно, что AR TolC участвует в работе нескольких насосов оттока нескольких лекарственных препаратов 23 и статистически значимо увеличивался в шести группах препаратов: три в нашей общей популяции (ИПП, статин и метформин), два в наша когорта СРК (стероидный спрей для носа и левотироксин) и одна в нашей когорте ВЗК (трициклические антидепрессанты) (двусторонний тест Вилкоксона, FDR <0.05). Другим примером AR, протестированного in vitro, является mdtP , еще одна оттокная помпа с множественной лекарственной устойчивостью, которая была увеличена у пользователей метформина в нашей общей популяции (двусторонний тест Вилкоксона, FDR = 0,001) и у пользователей трициклических антидепрессантов в когорта IBD (двусторонний тест Вилкоксона, FDR = 0,017, дополнительные данные 55).
18 распространенных лекарств, связанных с измененным микробиомом кишечника
По данным голландских исследователей, почти половина из 41 распространенного класса лекарств связана с изменениями микробиоты кишечника человека.
Обширные изменения в таксономической структуре, метаболической активности и резистоме (гены устойчивости к антибиотикам) были замечены в образцах фекалий человека после использования 18 из 41 общей категории лекарств, при этом четырьмя наиболее частыми виновниками были ингибиторы протонной помпы (ИПП), метформин, об антибиотиках и слабительных, сообщил Арнау Вич Вила, магистр медицинских наук из Университетского медицинского центра Гронингена на Объединенной европейской неделе гастроэнтерологии в Барселоне.
Вич Вила и его коллеги выполнили секвенирование метагеномики на 1883 свежезамороженных образцах кала из трех независимых когорт: популяционная группа, пациенты с воспалительным заболеванием кишечника и пациенты с синдромом раздраженного кишечника, смешанные со здоровыми контрольными группами.
Различия между потребителями наркотиков и лицами, не употребляющими наркотики, оценивались путем изучения эффекта от приема одного лекарства, а также с учетом использования нескольких препаратов каждым участником. Когортные результаты были объединены в метаанализ с использованием обратной дисперсии.
«Наша работа подчеркивает важность учета роли микробиоты кишечника при разработке методов лечения, а также указывает на новые гипотезы, которые могут объяснить определенные побочные эффекты, связанные с использованием лекарств», – сказал Вич Вила.Эти ассоциации должны быть функционально исследованы в свете важности микробиоты кишечника для здоровья и широкого использования многих лекарств.
Изменения микробиоты кишечника, вызванные лекарственными препаратами, могут увеличить риск кишечных инфекций и ожирения, отмечает Вич Вила.
После внесения поправки на полипрагмазию, семь категорий лекарств оставались значимо связанными с изменениями в 46 кишечных таксонах и путях.
Микробиота кишечника пользователей ИПП, например, показала большее количество стрептококковых бактерий верхних отделов желудочно-кишечного тракта и повышенный биосинтез жирных кислот, в то время как у пользователей метформина были более высокие уровни потенциально инфекционной кишечной палочки .
В других ассоциациях:
- Увеличение механизмов устойчивости к антибиотикам было связано с восемью различными категориями лекарств: антиандрогенными пероральными контрацептивами, бета-симпатомиметическими ингаляторами, слабительными, метформином, другими пероральными противодиабетическими средствами, ИПП, нестероидными противовоспалительными препаратами и triptans
- Селективные депрессанты-ингибиторы обратного захвата серотонина были связаны с обилием Eubacterium ramulus , обычно считающихся полезным разрушителем пищевых флавоноидов
- Пероральные стероиды были связаны с обогащением метаногенными бактериями, которые были связаны с повышенным индексом массы тела
«Мы уже знаем, что на эффективность и токсичность некоторых лекарств влияет бактериальный состав желудочно-кишечного тракта и что микробиота кишечника связана с множеством заболеваний», – сказал Вич Вила в пресс-релизе UEGW.«Поэтому очень важно понять, каковы последствия использования лекарств для микробиома кишечника».
Исследователи указали на увеличение количества сообщений об изменениях микробиоты кишечника, связанных с ожирением, диабетом, заболеваниями печени и нейродегенеративными заболеваниями, а также раком.
Гейл Креши, доктор философии, доктор медицинских наук из клиники Кливленда в Огайо, которая не участвовала в исследовании, отметила, что хорошо известно, что лекарства могут изменять состав и разнообразие кишечных микробов, в частности тех, которые изменяют pH желудочного сока (например, ИПП), уничтожают бактерии (антибиотики) или изменяют моторику (слабительные).
«Секвенирование метагеномики в настоящее время продвигает вперед область, касающуюся функции микробиома кишечника и медицинских методов лечения», – сказала она MedPage Today. «Это было замечено с иммунотерапевтическими агентами, использующими состав и функцию микробиома как средство для измерения ответа и токсичности иммунной терапии рака, а также с использованием пребиотиков, пробиотиков, постбиотиков и трансплантации фекальной микробиоты для модуляции иммунной терапии», – сказал Креши, не принимал участия в голландских исследованиях.
Точно так же Дэвид Т.Рубин, доктор медицины из Чикагского университета, сказал, что это исследование способствует развитию понимания того, насколько изменчивой может быть кишечная микробиота. «Конечно, понятно, что диета и воспаление влияют на состав кишечной микробиоты, но оценка воздействия многих медицинских методов лечения ранее не описывалась», – сказал он агентству MedPage Today.
«Открытие того, что большинство этих методов лечения действительно влияет на состав микробиоты кишечника прямым или косвенным образом, имеет значение для того, как эти лекарства могут влиять на другие биологические функции, включая метаболизм», – сказал Рубин, не участвовавший в исследовании.«Будет интересно глубже понять продольные изменения с течением времени, а также то, возвращается ли микробиом к своему исходному уровню или компенсируется другими способами».
Охарактеризовав исследование как ассоциативное, Джек Гилберт, доктор философии из Калифорнийского университета в Сан-Диего, сказал, что оно, тем не менее, выявило потенциально важные изменения, связанные с лекарствами. «Это предварительная информация, но она дает некоторые проверяемые гипотезы для будущей работы», – сказал он MedPage Today.
Дайана Свифт – независимый медицинский журналист из Торонто.
Раскрытие информации
Это исследование было поддержано Исследовательским советом Нидерландов и Университетом Гронингена. Авторы не сообщили о конфликте интересов. Креши, Рубин и Гилберт сообщили об отсутствии конкурирующих интересов в отношении своих комментариев.
Взаимодействие между лекарствами и микробиомом кишечника
Ингибиторы протонной помпы
ИПП являются одними из наиболее часто используемых лекарств во всем мире и используются для лечения связанных с кислотой расстройств, таких как язвенная болезнь, гастроэзофагеальный рефлюкс и диспепсия, а также для профилактики неагрессивных заболеваний. стероидно-противовоспалительная лекарственная гастродуоденопатия и кровотечение.Поскольку ИПП очень эффективны и имеют очень благоприятный профиль безопасности, их использование очень быстро расширилось за последние несколько десятилетий. В Нидерландах два миллиона человек (~ 12% населения) в настоящее время принимают пантопразол или омепразол по рецепту, и аналогичный процент использования был зарегистрирован для других стран, таких как Великобритания20. оценивается в более чем 100 миллионов фунтов стерлингов в год22. Кроме того, поскольку ИЦП продаются без рецепта в Нидерландах и во многих других странах, общее количество пользователей ИЦП будет намного выше, чем оценка, основанная только на рецептах. .В последние годы значительное внимание было уделено профилю безопасности и потенциальным побочным эффектам хронического использования ИПП. Хотя относительный риск нежелательной реакции на лекарственные препараты (НЛР) низок, большое количество пользователей ИПП во всем мире означает, что абсолютное число пациентов с НЛР может быть высоким. Несмотря на наличие четких доказательных показаний к применению ИПП, было высказано предположение, что до 70% назначений ИПП могут быть ненужными, 22 при использовании ИПП в качестве профилактики стрессовых язв у пациентов, которые не получают рецептов, основанных на фактических данных. Критерии в значительной степени способствовали этому.Еще один важный фактор здесь заключается в том, что после начала приема ИПП мало пересматривается первоначальное показание, по которому был прописан ИПП, а последующие попытки отменить их приводят к ненужному хроническому применению23 24.
Крупное популяционное исследование, проведенное в Нидерландах, показало, что ИПП были лекарствами, наиболее связанными с уменьшением разнообразия и таксономических изменений в микробиоме кишечника.17 Расширение этого анализа для включения 16-секундных данных из когорты с воспалительным заболеванием кишечника и когорты с синдромом раздраженного кишечника воспроизвели эти изменения во всех трех когортах и показали, что относительная численность до 20% бактериальных таксонов была изменена (уменьшена или увеличена) у пользователей ИПП по сравнению с теми, кто их не принимал.25 Аналогичные результаты, показывающие более низкое микробное разнообразие и меньшее количество кишечных комменсалов, наблюдались в исследовании, в котором анализировались 16-секундные данные образцов фекалий 1827 близнецов26. начальные ИЦП.11
В целом таксономические изменения в образцах фекалий потребителей ИПП показывают снижение численности комменсальных бактерий кишечника и увеличение количества бактерий из полости рта. Эти изменения включают увеличение семейств Enterobacteriaceae, Enterococcaceae и Lactobacillaceae и уменьшение количества Ruminococcaceae и Bifidobacteriaceae, в то время как сдвиг в сторону типичных бактерий полости рта отражается увеличением количества видов Rothia dentocariosa и Rothia mucilaginosa 8, род. и семейство Micrococcaceae.25 Более того, похоже, что наблюдаемые изменения являются классовым эффектом ИПП, поскольку омепразол, эзомепразол и пантопразол показали аналогичные изменения. Более высокая дозировка также, по-видимому, связана с более значительными микробными изменениями19.
В недавнем исследовании, в котором использовались данные метагеномной последовательности, позволяющие проводить как таксономию с высоким разрешением, так и анализ прогнозируемых путей, изучалось влияние 41 широко используемого препарата на микробиом кишечника и снова было обнаружено, что ИПП составляют наибольшее количество ассоциаций.19 После корректировки воздействия сопутствующего приема других лекарств, ИПП были достоверно связаны с 24 таксонами и 133 путями. Прогнозируемые функциональные изменения включали увеличение биосинтеза жирных кислот и липидов, ферментацию метаболизма никотинамидадениндинуклеотида (НАД), биосинтез L-аргинина и деградацию пуриндезоксирибонуклеозида. Эти изменения путей можно объяснить наблюдаемыми изменениями численности конкретных таксонов. Например, биосинтез L-аргинина был более распространен в микробиоме пользователей ИПП.Хотя предполагается, что несколько бактериальных таксонов, в том числе виды Bifidobacterium и Ruminococcus , вносят вклад в эти пути, статистический анализ показал, что только изменения в Streptococcus mutans способствовали прогнозируемым изменениям пути из-за использования ИПП19. Считается, что кислотность желудочного сока, вызванная ИПП, ответственна за наблюдаемые микробные изменения, поскольку она позволяет бактериям полости рта колонизировать микробиом кишечника, что приводит к изменениям в таксономическом гомеостазе (рис. 1).Это подтверждается наблюдением «оральной обработки» микробиома кишечника у пользователей ИПП.25 Однако исследование in vitro, оценивающее прямое воздействие обычно используемых лекарств, включая ИПП, на кишечные комменсалы, показало заметные изменения в скорости роста бактерий, что означает существует также прямой эффект, который потенциально опосредуется связыванием ИПП с бактериальными H + / K + АТФ-азами.27
Важно понимать, что изменения микробиома, вызванные ИПП, могут на самом деле способствовать возникновению клинически важных заболеваний.Например, в предыдущих исследованиях были определены изменения в микробиоме кишечника, которые приводят к снижению устойчивости к колонизации кишечных инфекций, включая Clostridium difficile , Campylobacter и Salmonella , которые аналогичны тем, которые сейчас наблюдаются у пользователей ИПП28. 29 У пользователей ИПП ОШ составляет от 1,5 до 1,8 для C. difficile и от 2,0 до 4,0 для других патогенных бактерий.30 Как известно, инфекций, вызванных C. difficile , развиваются в измененной микробной среде кишечника после назначение антибиотиков 31 потенциально может быть справедливо и при применении ИПП.Кроме того, начало и отмена ИПП влияет на клиническое течение декомпенсированного цирроза печени, возможно, через изменения микробиоты кишечника.32 Наконец, повышенное использование ИПП в раннем детстве может вызвать долгосрочные изменения в развивающемся микробиоме кишечника, что может привести к ожирение в более старшем возрасте.33
Хотя профили эффективности и безопасности ИПП по-прежнему очень благоприятны, когда они назначаются по доказательным показаниям, медицинское сообщество должно начать переосмысливать их широкое и хроническое использование и их доступность без рецепта.Мы подошли к тому моменту, когда нам необходимо тщательно оценить долгосрочные эффекты вызванных ИПП изменений в микробиоме примерно у одной пятой населения западного общества, сдвиг, который произошел за относительно короткий период времени. время в истории человечества, и конкретно изучить влияние изменения развивающегося микробиома кишечника в раннем возрасте и его влияние на здоровье и болезни в более позднем возрасте.
Метформин
Метформин – это соединение, снижающее уровень глюкозы в крови, используемое при лечении диабета 2 типа (T2D).Хотя его точный рабочий механизм сложен и до конца не изучен, метформин действительно ингибирует глюконеогенез в печени, и исследования все чаще предполагают, что некоторые из его полезных эффектов опосредованы микробиотой кишечника.34 35 По сравнению с ИПП, которые используются для широкого ряда заболеваний. По показаниям или симптомам, метформин (почти) исключительно используется при диабете, что затрудняет отделение воздействия препарата на микробиом от изменений в микробиоме кишечника, которые связаны с основным заболеванием.Тем не менее, это было сделано с помощью эпохального исследования, которое показало, что ранее наблюдаемые изменения в микробиоме кишечника, которые, как считалось, были вызваны лежащим в основе СД2, на самом деле были вызваны использованием метформина (12).
В дополнительном интервенционном исследовании на здоровых добровольцах использование метформина привело к изменению у> 80 видов по сравнению с контрольной группой, получавшей плацебо. Примечательно, что лечение метформином значительно увеличивает количество Escherichia coli и снижает численность Intestinibacter , что согласуется с данными перекрестных когорт, которые сравнивали нелеченных пациентов с пациентами с T2D, получавшими метформин.12 36 Впоследствии авторы трансплантировали образцы фекалий от доноров, получавших метформин или получавших плацебо, беспроблемным мышам и наблюдали более низкие уровни глюкозы в крови у мышей, получавших образцы фекалий от добровольцев, получавших метформин, что подразумевает прямое влияние микробиома кишечника. на уровень глюкозы в крови. Считается, что этот эффект опосредован действием метформина на бактерии, продуцирующие короткоцепочечные жирные кислоты (бутират), и численностью Akkermansia muciniphila , а также через общие биологические пути и гены, кодируемые в различных бактериях, пораженных метформином, например , металлопротеины или переносчики металлов.Более того, клинически хорошо известно, что до одной трети пациентов, принимающих метформин, сообщают о побочных эффектах со стороны желудочно-кишечного тракта, таких как диарея, вздутие живота и тошнота, а также об обнаруженных изменениях, вызванных метформином, включая повышение факторов вирулентности и генов газового метаболизма (в основном происходящих из увеличение количества видов E. coli на ( видов)), может способствовать этим побочным эффектам.12 36
Взаимосвязь между метформином и микробиомом кишечника показывает, как обычно используемое лекарство может изменить микробиом кишечника и объяснить часть терапевтической функции лекарства, а также некоторые его побочные эффекты.В нем также подчеркивается необходимость строгого контроля таких факторов, как употребление наркотиков (включая метформин, антибиотики, ИПП и другие препараты), при проведении исследований микробиома, направленных на изучение конкретных заболеваний или состояний.
Другие часто используемые неантибиотические препараты
Крупные популяционные исследования микробиома с использованием перекрестных данных когорт из Великобритании, Нидерландов и Бельгии оценили сотни факторов, включая употребление наркотиков. В дополнение к ИПП и метформину эти исследования показали, что другие часто используемые препараты, включая слабительные, статины, антидепрессанты и опиоиды, могут объяснить некоторые вариации в составе микробиома кишечника.15 18 37
При рассмотрении микробных изменений, вызванных употреблением слабительных, следует принимать во внимание тот факт, что время прохождения через кишечник, консистенция стула и количество бактерий (например, микробная нагрузка на образец) – все это влияет на характеристики микробиома.38 39 Например, увеличение численности из Bacteroides видов наблюдаются у лиц, принимающих слабительные, а также в образцах стула с низкой консистенцией. Однако в независимом исследовании мышей, подвергшихся воздействию полиэтиленгликоля (ПЭГ), было обнаружено аналогичное увеличение Bacteroides .В этом исследовании индукция легкой осмотической диареи путем введения ПЭГ вызвала долгосрочные изменения микробиома кишечника, временное нарушение слизистого барьера и последующие врожденные и адаптивные иммунные ответы.40 После введения ПЭГ семейство S24-7 (в пределах отряд Bacteroidales) исчез и был полностью заменен вырастанием семейства Bacteroidaceae. Этот эффект был постоянным, если не было заменено семейство S24-7. Другие таксоны, такие как Verrucomicrobia и Gammaproteobacteria, показали временные изменения, но в конечном итоге вернулись к исходным уровням.Немногочисленные данные о пациентах, принимающих препараты для кишечника, также показали краткосрочные преходящие изменения в показателях разнообразия микробиома, но подробные исследования отсутствуют.41 Однако, учитывая данные, полученные на мышах, вполне вероятно, что использование слабительных имеет как краткосрочное, так и краткосрочное воздействие. долгосрочное воздействие на состав микробиома кишечника, которое не зависит от консистенции стула и количества бактерий в образце.
Многие распространенные лекарства могут изменить ваш микробиом
Роберт ПрейдтHealthDay Reporter
СРЕДА, октябрь.23, 2019 (HealthDay News) – Некоторые широко используемые лекарства изменяют популяцию микробов в кишечнике, а некоторые из них повышают риск устойчивости к антибиотикам, как показывает новое голландское исследование.
Микробиом кишечника включает не менее 1000 видов бактерий и находится под влиянием ряда различных факторов, в том числе лекарств. Исследования показывают, что изменения микробиома кишечника связаны с ожирением, диабетом, заболеваниями печени, раком и нейродегенеративными заболеваниями.
«Мы уже знаем, что на эффективность и токсичность некоторых лекарств влияет бактериальный состав желудочно-кишечного тракта и что микробиота кишечника связана с множеством заболеваний; поэтому очень важно понять, какие последствия использование лекарств в микробиоме кишечника », – сказал ведущий исследователь Арнау Вич Вила из Университетского медицинского центра Гронингена.
В этом исследовании исследователи изучили 41 широко используемую категорию лекарств и оценили 1883 образца фекалий людей, которые принимали и не принимали лекарства, в том числе некоторые с синдромом раздраженного кишечника (СРК) и воспалительным заболеванием кишечника (ВЗК).
Восемнадцать категорий лекарств оказали серьезное влияние на микробиом кишечника, а восемь повышали риск устойчивости к противомикробным препаратам.
Категории, оказавшие наибольшее влияние на микробиом, были:
- Ингибиторы протонной помпы (ИПП), используемые для лечения расстройства желудка, язвенной болезни, H.pylori , гастро-рефлюкс и пищевод Барретта.
- Метформин, используемый для лечения диабета 2 типа.
- Антибиотики, применяемые для лечения бактериальных инфекций.
- Слабительные, применяемые для лечения и профилактики запоров.
Микробиомы кишечника потребителей ИПП имели более высокие уровни бактерий верхних отделов желудочно-кишечного тракта и повышенное производство жирных кислот, а у потребителей метформина были более высокие уровни потенциально вредных бактерий E. coli .
По словам исследователей, семь других категорий лекарств были связаны со значительными изменениями в популяциях бактерий в кишечнике.
Например, использование антидепрессантов СИОЗС людьми с СРК было связано с повышенным уровнем потенциально вредных видов бактерий Eubacterium ramulus .
Между тем, использование пероральных стероидов было связано с высоким уровнем метаногенных бактерий, связанных с ожирением и увеличением индекса массы тела (оценка жира в организме на основе веса и роста).
Исследование должно было быть представлено в среду на ежегодном собрании UEG (United European Gastroenterology) в Барселоне.Такое исследование считается предварительным, пока оно не будет опубликовано в рецензируемом журнале.
«Наша работа подчеркивает важность учета роли микробиоты кишечника при разработке методов лечения, а также указывает на новые гипотезы, которые могут объяснить определенные побочные эффекты, связанные с использованием лекарств», – сказал Вила в пресс-релизе встречи.
Обычные лекарства могут изменять кишечные бактерии и увеличивать риски для здоровья
Новое исследование показало, что многие распространенные лекарства, в том числе те, которые лечат диабет, проблемы с пищеварением, бактериальные инфекции и даже депрессию, могут на самом деле предрасполагать людей к определенным типам инфекций. влияя на баланс их кишечного микробиома.
Лекарства, отпускаемые по рецепту, помогают лечить болезни, облегчать инфекции и управлять симптомами определенных хронических заболеваний.
Однако иногда они могут вызывать побочные эффекты различной степени тяжести. Врачи и исследователи не всегда осведомлены обо всех возможных неблагоприятных исходах.
Новое исследование, проведенное Университетским медицинским центром Гронингена и Медицинским центром Маастрихтского университета в Нидерландах, обнаружило доказательства того, что многие распространенные лекарства – от антибиотиков до антидепрессантов – оказывают значительное влияние на микробиом кишечника.Они могут даже нарушить хрупкое равновесие бактериальных популяций.
По словам исследователей, это может увеличить риск развития кишечных инфекций и других проблем со здоровьем, включая ожирение и устойчивость к противомикробным препаратам.
В исследовании, которое команда представила вчера на Единой европейской гастроэнтерологической неделе в Барселоне, Испания, изучалось влияние 41 распространенного типа рецептурных лекарств.
Для этого они собрали и проанализировали 1883 образца фекалий у людей с воспалительным заболеванием кишечника или синдромом раздраженного кишечника (СРК), а также у группы здоровых участников контрольной группы.
Исследователи сравнили результаты людей, принимавших лекарства по рецепту, с результатами людей, которые этого не делали. Они также изучили эффекты отдельных лекарств по сравнению с комбинациями лекарств.
Они обнаружили, что 18 распространенных категорий лекарств оказывают важное влияние на бактериальный состав микробиома кишечника, что может привести к нежелательным последствиям для здоровья. Такие последствия могут включать кишечные инфекции, ожирение и различные состояния, связанные со здоровьем кишечника.
Восемь из этих категорий, по-видимому, увеличивают устойчивость к противомикробным препаратам.
Кроме того, четыре категории препаратов оказали сильнейшее влияние на баланс бактерий в кишечнике. Это были:
- ингибиторы протонной помпы (ИПП), снижающие выработку кислоты в желудке
- метформин, помогающий людям справляться с симптомами диабета 2 типа
- антибиотики, которые борются с бактериальными инфекциями
- слабительные, которые помогают лечить запоры
Анализы показали, что у людей, принимавших ИПП, было больше бактерий верхних отделов желудочно-кишечного тракта, и что их тела производили больше жирных кислот.Между тем, у тех, кто принимал метформин, был более высокий уровень Escherichia coli , бактерии, которая может вызывать диарею и инфекции мочевыводящих путей.
Кроме того, класс антидепрессантов, называемых селективными ингибиторами обратного захвата серотонина, был связан с повышенным уровнем Eubacterium ramulus – другой потенциально опасной бактерии – у людей с СРК.
Между тем пероральные стероиды были связаны с более высоким уровнем метан-продуцирующих бактерий, которые могли способствовать увеличению веса и ожирению.
«Мы уже знаем, что на эффективность и токсичность некоторых лекарств влияет бактериальный состав желудочно-кишечного тракта, и что микробиота кишечника связана с множеством заболеваний», – говорит ведущий исследователь Арнау Вич Вила.
«[T] поэтому очень важно понять, каковы последствия использования лекарств для микробиома кишечника», – добавляет он.
«Наша работа подчеркивает важность учета роли кишечной микробиоты при разработке методов лечения, а также указывает на новые гипотезы, которые могут объяснить определенные побочные эффекты, связанные с использованием лекарств.”
Arnau Vich Vila
Влияние микробиоты кишечника на биодоступность пероральных препаратов
Доступно онлайн 28 сентября 2020 г.
Реферат
Благодаря безопасности, удобству, низкой стоимости и хорошей совместимости пероральный прием привлекает много внимания. Однако эффективность многих пероральных препаратов ограничивается их неудовлетворительной биодоступностью в желудочно-кишечном тракте. Одним из важнейших и наиболее часто игнорируемых факторов является симбиотическая микробиота кишечника, которая может модулировать биодоступность пероральных препаратов, участвуя в биотрансформации пероральных препаратов, влияя на процесс транспорта лекарств и изменяя некоторые желудочно-кишечные свойства.В этом обзоре мы обобщили существующие исследования, изучающие возможную взаимосвязь между микробиотой кишечника и биодоступностью пероральных препаратов, которые могут дать отличные идеи и полезные инструкции для разработки новых систем доставки лекарств или достижения персонализированной медицины.
Графический аннотация
Микробиота кишечника может влиять на биодоступность пероральных лекарств за счет активности микробных ферментов, влияя на транспорт лекарств или изменяя желудочно-кишечные свойства.Это может дать нам несколько советов по предотвращению возможного взаимодействия лекарств и лекарств и предложить нам некоторые полезные стратегии для разработки системы доставки лекарств.
- Загрузить: Загрузить изображение в высоком разрешении (156KB)
- Загрузить: Загрузить полноразмерное изображение
КЛЮЧЕВЫЕ СЛОВА
Микробиота кишечника
Пероральные препараты
Биодоступность
Пробиотики
Система доставки лекарств в толстую кишку
Сокращения
5-ASA5-аминосалициловая кислота
ACSамфипатическое производное хитозана
безрецептурный препаратбезрецептурный препарат
BCRPбелок устойчивости к раку молочной железы
BCSбиофармацевтическая система классификации
BDDCSклассификация лекарств система
BDEPTбактериально-направленная ферментная пролекарственная терапия
CDCAхенодезоксихолевая кислота
cgr опероноперон сердечной гликозидредуктазы
CPPклеточно-проникающий пептид
DRPsпродукты восстановления дигоксина FOCC7
EcheriaПродовольствие и сельское хозяйство Или ganization of the United Nations
GCDCгликохенодезоксихолат
IBDвоспалительное заболевание кишечника
MATEsпротеины множественной лекарственной и токсиновой экструзии
MDR1ген множественной лекарственной устойчивости 1
MDR1aпротеин множественной лекарственной устойчивости 9002 MR-1 NEC
некротический энтероколит
NMEновых молекулярных объекта
НПВПнестероидных противовоспалительных препаратов
ОАТтранспортеров органических анионов
OCTNsорганических цвиттерионов / катионов
OCTорганических транспортеров катионов
PPIs, слабых ингибиторов протонов 9000 PW4, насосов воды-растворимые лекарственные средства
SCFAsкороткоцепочечные жирные кислоты
SGLT-1натрий-связанный переносчик глюкозы 1
SLNтвердые липидные наночастицы
SVCT-1/2натрий-зависимый переносчик витамина C-1/2
T1DMтипа 1 сахарный диабет
TCDCтаурохенодезоксихолат
GI трактжелудочно-кишечный тракт
TMEмикросреда опухоли
ВОЗВсемирная организация здравоохранения
Рекомендуемые статьи Цитирующие статьи (0)
© 2021 Китайская фармацевтическая ассоциация и Институт Materia Medica Китайской академии медицинских наук.Производство и хостинг Elsevier B.V.
Рекомендуемые статьи
Цитирующие статьи
Фармакомикробиомика: использование взаимодействий лекарств и микробиоты в противоопухолевой терапии | Microbiome
Sender R, Fuchs S, Milo R. Пересмотренные оценки количества человеческих и бактериальных клеток в организме. PLoS Biol. 2016; 14 (8): e1002533.
Артикул PubMed PubMed Central CAS Google Scholar
Джандхьяла С.М., Талукдар Р., Субраманьям С., Вуйюру Х., Сашикала М., Нагешвар Р. Д.. Роль нормальной микробиоты кишечника. Мир Дж. Гастроэнтерол. 2015; 21 (29): 8787–803.
Артикул PubMed PubMed Central CAS Google Scholar
Рой С., Тринкьери Г. Микробиота: ключевой организатор терапии рака. Нат Рев Рак. 2017; 17 (5): 271–85.
Артикул PubMed CAS Google Scholar
Panebianco C, Potenza A, Andriulli A, Pazienza V. Изучение микробиоты для лучшего понимания физиологии рака желудочно-кишечного тракта. Clin Chem Lab Med; 2018. https://doi.org/10.1515/cclm-2017-1163. [Epub перед печатью]
Поуп Дж. Л., Томкович С., Ян Й., Джобин С. Микробиота как медиатор прогрессирования и лечения рака. Перевод Рез. 2017; 179: 139–54.
Артикул PubMed CAS Google Scholar
Гатти Л., Зунино Ф. Обзор механизмов химиорезистентности опухолевых клеток. Методы Mol Med. 2005; 111: 127–48.
PubMed CAS Google Scholar
Шекарян Т., Вальсезия-Виттманн С., Ко С., Марабель А. Сдвиг парадигмы в онкологии: нацеливание на иммунную систему, а не на раковые клетки. Мутагенез. 2015; 30 (2): 205–11.
Артикул PubMed CAS Google Scholar
Александр Дж. Л., Уилсон И. Д., Тир Дж., Марчези Дж. Р., Николсон Дж. К., Кинросс Дж. М.. Модуляция кишечной микробиоты на эффективность и токсичность химиотерапии. Нат Рев Гастроэнтерол Гепатол. 2017; 14 (6): 356–65.
Артикул PubMed CAS Google Scholar
Цитвогель Л., Галлуцци Л., Виуд С., Ветизу М., Дайллер Р., Мерад М., Кремер Г. Рак и микробиота кишечника: неожиданная связь. Sci Transl Med. 2015; 7 (271): 271ps271.
Артикул CAS Google Scholar
Foxx-Orenstein AE, Chey WD. Манипуляции с микробиотой кишечника как новая стратегия лечения желудочно-кишечных расстройств. Am J Gastroenterol Suppl. 2012; 1: 41–6.
Артикул CAS Google Scholar
Schrezenmeir J, de Vrese M. Пробиотики, пребиотики и синбиотики – приближаясь к определению. Am J Clin Nutr. 2001; 73 (2 доп.): 361С – 4С.
Артикул PubMed CAS Google Scholar
Пател Р.М., Деннинг П.В. Терапевтическое использование пребиотиков, пробиотиков и постбиотиков для предотвращения некротического энтероколита: каковы текущие доказательства? Clin Perinatol. 2013. 40 (1): 11–25.
Артикул PubMed PubMed Central Google Scholar
Geller LT, Barzily-Rokni M, Danino T, Jonas OH, Shental N, Nejman D, Gavert N, Zwang Y, Cooper ZA, Shee K, Thaiss CA, Reuben A, Livny J, Avraham R, Фредерик Д.Т., Лигорио М. и др.Возможная роль внутриопухолевых бактерий в опосредовании устойчивости опухоли к химиотерапевтическому препарату гемцитабину. Наука. 2017; 357 (6356): 1156–60.
Артикул PubMed PubMed Central CAS Google Scholar
Lehouritis P, Cummins J, Stanton M, Murphy CT, McCarthy FO, Reid G, Urbaniak C, Byrne WL, Tangney M. Местные бактерии влияют на эффективность химиотерапевтических препаратов. Научный доклад 2015; 5: 14554.
Артикул PubMed PubMed Central CAS Google Scholar
Vande Voorde J, Sabuncuoglu S, Noppen S, Hofer A, Ranjbarian F, Fieuws S, Balzarini J, Liekens S. Ферменты, катаболизирующие нуклеозиды в культурах опухолевых клеток, инфицированных микоплазмой, нарушают цитостатическую активность противоракового препарата гемцитабина. J Biol Chem. 2014. 289 (19): 13054–65.
Артикул PubMed PubMed Central CAS Google Scholar
Хуанг С., Ли Дж.Й., Ву Дж, Мэн Л., Шоу СС. Микоплазменные инфекции и различные карциномы человека.Мир Дж. Гастроэнтерол. 2001. 7 (2): 266–9.
Артикул PubMed PubMed Central CAS Google Scholar
Vande Voorde J, Balzarini J, Liekens S. Микоплазмы и рак: внимание к метаболизму нуклеозидов. EXCLI J. 2014; 13: 300–22.
PubMed PubMed Central Google Scholar
Нокс Р.Дж., Фридлос Ф., Боланд М.П. Биоактивация CB 1954 и его использование в качестве пролекарства в антитело-направленной ферментной пролекарственной терапии (ADEPT).Раковые метастазы Rev.1993; 12 (2): 195–212.
Артикул PubMed CAS Google Scholar
Gui QF, Lu HF, Zhang CX, Xu ZR, Yang YH. Хорошо сбалансированная комменсальная микробиота способствует противораковому ответу на мышиной модели рака легких. Genet Mol Res. 2015; 14 (2): 5642–51.
Артикул PubMed Google Scholar
Iida N, Dzutsev A, Stewart CA, Smith L, Bouladoux N, Weingarten RA, Molina DA, Salcedo R, Back T, Cramer S, Dai RM, Kiu H, Cardone M, Naik S, Patri AK , Ван Э. и др.Комменсальные бактерии контролируют реакцию рака на терапию, модулируя микросреду опухоли. Наука. 2013; 342 (6161): 967–70.
Артикул PubMed CAS Google Scholar
Viaud S, Saccheri F, Mignot G, Yamazaki T, Daillere R, Hannani D, Enot DP, Pfirschke C, Engblom C, Pittet MJ, Schlitzer A, Ginhoux F, Apetoh L, Chachaty E, Woerther PL , Эберл Г. и др. Микробиота кишечника модулирует противоопухолевые иммунные эффекты циклофосфамида.Наука. 2013. 342 (6161): 971–6.
Артикул PubMed PubMed Central CAS Google Scholar
Дайллер Р., Ветизу М., Вальдшмитт Н., Ямадзаки Т., Иснард С., Пуарье-Колам В., Дуонг CPM, Фламент С, Лепаж П., Роберти М.П., Роути Б., Жакло Н., Апето Л., Бехареф С., Русакевич С., Лангелла П. и др. Enterococcus hirae и Barnesiella gastinihominis способствуют терапевтическому иммуномодулирующему действию, вызванному циклофосфамидом.Иммунитет. 2016; 45 (4): 931–43.
Артикул PubMed CAS Google Scholar
Wallace BD, Wang H, Lane KT, Scott JE, Orans J, Koo JS, Venkatesh M, Jobin C, Yeh LA, Mani S, Redinbo MR. Снижение токсичности лекарств от рака путем ингибирования бактериального фермента. Наука. 2010. 330 (6005): 831–5.
Артикул PubMed PubMed Central CAS Google Scholar
Xu Y, Вильялона-Калеро, Массачусетс. Иринотекан: механизмы резистентности опухоли и новые стратегии регулирования его активности. Энн Онкол. 2002. 13 (12): 1841–51.
Артикул PubMed CAS Google Scholar
Гатри Л., Гупта С., Дейли Дж., Келли Л. Сигнатуры микробиома человека дифференциального метаболизма лекарств от колоректального рака. NPJ Biofilms Microbiomes. 2017; 3: 27.
Артикул PubMed PubMed Central Google Scholar
Forsgard RA, Marrachelli VG, Korpela K, Frias R, Collado MC, Korpela R, Monleon D, Spillmann T, Osterlund P. Желудочно-кишечная токсичность, вызванная химиотерапией, связана с изменениями в метаболоме сыворотки и мочи и фекальной микробиоте у мужчин Sprague-Dawley крысы. Cancer Chemother Pharmacol. 2017; 80 (2): 317–32.
Артикул PubMed PubMed Central CAS Google Scholar
Фрэнк М., Хенненберг Е.М., Эйкинг А., Рунзи М., Геркен Дж., Скотт П., Паркхилл Дж., Уокер А.В., Карио Э.Передача сигналов TLR модулирует побочные эффекты противоопухолевой терапии в тонком кишечнике. J Immunol. 2015; 194 (4): 1983–95.
Артикул PubMed PubMed Central CAS Google Scholar
Шен С., Лим Дж., Ю З, Дин В, Хуанг П., Ран С., Доэни Дж., Караван П., Тейт С., Ху К., Ким Х, МакКейб М., Хуанг Б., Се З, Квон Д. , Чен Л. и др. Микробиота кишечника имеет решающее значение для индукции боли, вызванной химиотерапией. Nat Neurosci. 2017; 20 (9): 1213–6.
Артикул PubMed PubMed Central CAS Google Scholar
Buchbinder EI, Desai A. Пути CTLA-4 и PD-1: сходства, различия и последствия их ингибирования. Am J Clin Oncol. 2016; 39 (1): 98–106.
Артикул PubMed PubMed Central CAS Google Scholar
Jahrsdorfer B, Weiner GJ. CpG-олигодезоксинуклеотиды как иммунотерапия рака.Обновите Cancer Ther. 2008. 3 (1): 27–32.
Артикул PubMed PubMed Central Google Scholar
Vetizou M, Pitt JM, Daillere R, Lepage P, Waldschmitt N, Flament C, Rusakiewicz S, Routy B, Roberti MP, Duong CP, Poirier-Colame V, Roux A, Becharef S, Formenti S, Golden E, Cording S и др. Противораковая иммунотерапия путем блокады CTLA-4 зависит от микробиоты кишечника. Наука. 2015; 350 (6264): 1079–84.
Артикул PubMed PubMed Central CAS Google Scholar
Dubin K, Callahan MK, Ren B, Khanin R, Viale A, Ling L, No D, Gobourne A, Littmann E, Huttenhower C, Pamer EG, Wolchok JD. Анализы кишечного микробиома выявляют пациентов с меланомой, подверженных риску колита, вызванного блокадой контрольных точек. Nat Commun. 2016; 7: 10391.
Артикул PubMed PubMed Central CAS Google Scholar
Ван Ф, Инь Кью, Чен Л., Дэвис ММ. Bifidobacterium может смягчать кишечную иммунопатологию в контексте блокады CTLA-4.Proc Natl Acad Sci U S. A. 2018; 115 (1): 157–61.
Артикул PubMed CAS Google Scholar
Alsaab HO, Sau S, Alzhrani R, Tatiparti K, Bhise K, Kashaw SK, Iyer AK. Ингибирование передачи сигналов контрольных точек PD-1 и PD-L1 для иммунотерапии рака: механизм, комбинации и клинический результат. Front Pharmacol. 2017; 8: 561.
Артикул PubMed PubMed Central Google Scholar
Сиван А., Корралес Л., Хуберт Н., Уильямс Дж. Б., Акино-Майклс К., Эрли З. М., Беньямин Ф. В., Лей Ю. М., Джабри Б., Алегре М. Л., Чанг Э. Б., Гаевски Т.Ф. Commensal Bifidobacterium повышает противоопухолевый иммунитет и усиливает эффективность против PD-L1. Наука. 2015; 350 (6264): 1084–9.
Артикул PubMed PubMed Central CAS Google Scholar
Gopalakrishnan V, Spencer CN, Nezi L, Reuben A, Andrews MC, Karpinets TV, Prieto PA, Vicente D, Hoffman K, Wei SC, Cogdill AP, Zhao L, Hudgens CW, Hutchinson DS, Manzo T. , Петачча де Маседо М. и др.Микробиом кишечника модулирует ответ на иммунотерапию анти-PD-1 у пациентов с меланомой. Наука. 2018; 359 (6371): 97–103.
Артикул PubMed CAS Google Scholar
Матсон В., Фесслер Дж., Бао Р., Чонгсуват Т., Чжа Й., Алегре М.Л., Люк Дж. Дж., Гаевски Т.Ф. Комменсальный микробиом связан с эффективностью анти-PD-1 у пациентов с метастатической меланомой. Наука. 2018; 359 (6371): 104–8.
Артикул PubMed CAS Google Scholar
Routy B, Le Chatelier E, Derosa L, Duong CPM, Alou MT, Daillere R, Fluckiger A, Messaoudene M, Rauber C, Roberti MP, Fidelle M, Flament C, Poirier-Colame V, Opolon P, Klein C, Iribarren K, et al. Микробиом кишечника влияет на эффективность иммунотерапии на основе PD-1 против эпителиальных опухолей. Наука. 2018; 359 (6371): 91–7.
Артикул PubMed CAS Google Scholar
Джобин К. Точная медицина с использованием микробиоты. Наука.2018; 359 (6371): 32–4.
Артикул PubMed CAS Google Scholar
Lapthorne S, Bines JE, Fouhy F, Dellios NL, Wilson G, Thomas SL, Scurr M, Stanton C, Cotter PD, Pereira-Fantini PM. Изменения микробиоты толстой кишки и экспрессии генов цитокинов кишечника после минимальной хирургической операции на кишечнике. Мир Дж. Гастроэнтерол. 2015; 21 (14): 4150–8.
Артикул PubMed PubMed Central CAS Google Scholar
Von Bultzingslowen I, Adlerberth I, Wold AE, Dahlen G, Jontell M. Микрофлора полости рта и кишечника у крыс, получавших 5-фторурацил, транслокация в шейные и брыжеечные лимфатические узлы и влияние пробиотических бактерий. Oral Microbiol Immunol. 2003. 18 (5): 278–84.
Артикул PubMed CAS Google Scholar
Стрингер А.М., Гибсон Р.Дж., Логан Р.М., Боуэн Дж.М., Йео А.С., Гамильтон Дж., Киф Д.М. Желудочно-кишечная микрофлора и муцины могут играть решающую роль в развитии желудочно-кишечного мукозита, вызванного 5-фторурацилом.Exp Biol Med (Maywood). 2009. 234 (4): 430–41.
Артикул CAS Google Scholar
van Vliet MJ, Tissing WJ, Dun CA, Meessen NE, Kamps WA, de Bont ES, Harmsen HJ. Химиотерапевтическое лечение у педиатрических пациентов с острым миелоидным лейкозом, получающих противомикробную профилактику, приводит к относительному увеличению колонизации потенциально патогенными бактериями в кишечнике. Clin Infect Dis. 2009. 49 (2): 262–70.
Артикул PubMed CAS Google Scholar
Ян Дж., Лю К. Х., Цюй Дж. М., Ван Х. Д. Изменения кишечного барьера и микрофлоры мышей под действием циклофосфамида. Eur J Pharmacol. 2013; 714 (1-3): 120–4.
Артикул PubMed CAS Google Scholar
Xu X, Zhang X. Влияние циклофосфамида на иммунную систему и микробиоту кишечника у мышей. Microbiol Res. 2015; 171: 97–106.
Артикул PubMed CAS Google Scholar
Лин ХБ, Дилеман Л.А., Кетаби А., Бибова И., Сойер М.Б., Сюэ Х., Филд СиДжей, Баракос В.Е., Ганзле М.Г. Химиотерапия иринотеканом (CPT-11) изменяет кишечную микробиоту у крыс с опухолями. PLoS One. 2012; 7 (7): e39764.
Артикул PubMed PubMed Central CAS Google Scholar
Montassier E, Gastinne T, Vangay P, Al-Ghalith GA, Bruley des Varannes S, Massart S, Moreau P, Potel G, de La Cochetiere MF, Batard E, Knights D.Дисбиоз кишечного микробиома, вызванный химиотерапией. Алимент Pharmacol Ther. 2015; 42 (5): 515–28.
Артикул PubMed CAS Google Scholar
Панебианко С., Адамберг К., Яагура М., Копетти М., Фонтана А., Адамберг С., Колк К., Вилу Р., Андриулли А. и Пазиенца В. Влияние химиотерапии гемцитабином на микробиоту мышей с ксенотрансплантатом рака поджелудочной железы. Chemother Pharmacol. 2018. 81 (4): 773–782.
Экбург ПБ, Бик Э.М., Бернштейн К.Н., Пурдом Э., Детлефсен Л., Сарджент М., Гилл С.Р., Нельсон К.Е., Релман Д.А. Разнообразие микробной флоры кишечника человека. Наука. 2005. 308 (5728): 1635–8.
Артикул PubMed PubMed Central Google Scholar
van Vliet MJ, Harmsen HJ, de Bont ES, Tissing WJ. Роль кишечной микробиоты в развитии и тяжести мукозита, вызванного химиотерапией. PLoS Pathog. 2010; 6 (5): e1000879.
Артикул PubMed PubMed Central CAS Google Scholar
Ядав М., Верма МК, Чаухан Н.С. Обзор метаболического потенциала микробиома кишечника человека в питании человека. Arch Microbiol. 2017; 200 (2): 203–17.
Артикул PubMed CAS Google Scholar
Бойл Р.Дж., Робинс-Браун Р.М., Тан М.Л. Использование пробиотиков в клинической практике: каковы риски? Am J Clin Nutr.2006. 83 (6): 1256–64. викторина 1446-1257
Статья PubMed CAS Google Scholar
Mego M, Holec V, Drgona L, Hainova K, Ciernikova S, Zajac V. Пробиотические бактерии у онкологических больных, проходящих химиотерапию и лучевую терапию. Дополнение Ther Med. 2013. 21 (6): 712–23.
Артикул PubMed Google Scholar
Гогинени В.К., Морроу Л.Е., Малескер М.А.Пробиотики: механизмы действия и клиническое применение. J Пробное здоровье. 2013; 1: 101. https://doi.org/10.4172/2329-8901.1000101.
Пандей К.Р., Наик С.Р., Вакил Б.В. Пробиотики, пребиотики и синбиотики – обзор. J Food Sci Technol. 2015; 52 (12): 7577–87.
Артикул PubMed PubMed Central CAS Google Scholar
Serban DE. Рак желудочно-кишечного тракта: влияние микробиоты кишечника, пробиотиков и пребиотиков.Cancer Lett. 2013; 345 (2): 258–70.
Артикул PubMed CAS Google Scholar
Mego M, Ebringer L, Drgona L, Mardiak J, Trupl J, Greksak R, Nemova I, Oravcova E, Zajac V, Koza I. Профилактика лихорадочной нейтропении у онкологических больных с помощью пробиотического штамма Enterococcus faecium M- 74. Пилотный этап исследования I. Новообразование. 2005. 52 (2): 159–64.
PubMed CAS Google Scholar
Mego M, Koncekova R, Mikuskova E, Drgona L, Ebringer L, Demitrovicova L, Nemova I, Trupl J, Mardiak J, Koza I, Zajac V. Профилактика фебрильной нейтропении у онкологических больных с помощью пробиотического штамма Enterococcus faecium M-74. Фаза II исследования. Поддержка лечения рака. 2006. 14 (3): 285–90.
Артикул PubMed CAS Google Scholar
Mauger CA, Butler RN, Geier MS, Tooley KL, Howarth GS. Действие пробиотиков на мукозит, вызванное 5-фторурацилом, оценивали с помощью дыхательного теста с сахарозой у крыс.Dig Dis Sci. 2007. 52 (3): 612–9.
Артикул PubMed CAS Google Scholar
Bowen JM, Stringer AM, Gibson RJ, Yeoh AS, Hannam S, Keefe DM. Лечение пробиотиками VSL # 3 снижает диарею, вызванную химиотерапией, и снижение веса. Cancer Biol Ther. 2007. 6 (9): 1449–54.
Артикул PubMed Google Scholar
Osterlund P, Ruotsalainen T, Korpela R, Saxelin M, Ollus A, Valta P, Kouri M, Elomaa I, Joensuu H.Добавка Lactobacillus при диарее, связанной с химиотерапией колоректального рака: рандомизированное исследование. Br J Рак. 2007. 97 (8): 1028–34.
Артикул PubMed PubMed Central CAS Google Scholar
Kato S, Hamouda N, Kano Y, Oikawa Y, Tanaka Y, Matsumoto K, Amagase K, Shimakawa M. Пробиотик Bifidobacterium bifidum G9-1 ослабляет вызванный 5-фторурацилом кишечный мукозит у мышей путем подавления дисбиоза связанные вторичные воспалительные реакции.Clin Exp Pharmacol Physiol. 2017; 44 (10): 1017–25.
Артикул PubMed CAS Google Scholar
Йунг С.Ю., Чан В.Т., Цзян Ц.Б., Ченг М.Л., Лю Ц.И., Чанг С.В., Чанг Чиау Д.С., Ли Х.С. Коррекция: уменьшение кишечного мукозита, вызванного химиотерапией, путем перорального введения пробиотиков на мышиной модели. PLoS One. 2015; 10 (10): e0141402.
Артикул PubMed PubMed Central CAS Google Scholar
Whitford EJ, Cummins AG, Butler RN, Prisciandaro LD, Fauser JK, Yazbeck R, Lawrence A, Cheah KY, Wright TH, Lymn KA, Howarth GS. Влияние Streptococcus thermophilus TH-4 на кишечный мукозит, вызванный химиотерапевтическим средством 5-фторурацил (5-FU). Cancer Biol Ther. 2009. 8 (6): 505–11.
Артикул CAS Google Scholar
Вада М., Нагата С., Сайто М., Симидзу Т., Ямасиро Ю., Мацуки Т., Асахара Т., Номото К.Влияние энтерального введения Bifidobacterium breve на пациентов, проходящих химиотерапию по поводу детских злокачественных новообразований. Поддержка лечения рака. 2010. 18 (6): 751–9.
Артикул PubMed Google Scholar
Шарма А., Рат Г.К., Чаудхари С.П., Такар А., Моханти Б.К., Бахадур С. Леденцы CD2 с Lactobacillus brevis уменьшают мукозит, вызванный лучевой и химиотерапией, у пациентов с раком головы и шеи: рандомизированное двойное слепое плацебо -контролируемое исследование.Eur J Cancer. 2012. 48 (6): 875–81.
Артикул PubMed CAS Google Scholar
Sharma A, Tilak T, Bakhshi S, Raina V, Kumar L, Chaudhary SP, Sahoo RK, Gupta R, Thulkar S. Пастилки CD2 Lactobacillus brevis предотвращают оральный мукозит у пациентов, проходящих высокодозную химиотерапию с последующим гематопоэтическим лечением трансплантация клеток. ESMO Open. 2017; 1 (6): e000138.
Артикул PubMed PubMed Central Google Scholar
Гибсон GR, Роберфроид МБ. Диетическое регулирование микробиоты толстой кишки человека: введение в понятие пребиотиков. J Nutr. 1995. 125 (6): 1401–12.
PubMed CAS Google Scholar
McLoughlin RF, Berthon BS, Jensen ME, Baines KJ, Wood LG. Короткоцепочечные жирные кислоты, пребиотики, синбиотики и системное воспаление: систематический обзор и метаанализ. Am J Clin Nutr. 2017; 106 (3): 930–45.
PubMed CAS Google Scholar
Браунс Ф., Кеттлиц Б., Арригони Э. Устойчивый крахмал и «революция бутирата». Trends Food Sci Technol. 2002. 13 (8): 251–61.
Артикул CAS Google Scholar
Panebianco C, Adamberg K, Adamberg S, Saracino C, Jaagura M, Kolk K, Di Chio AG, Graziano P, Vilu R, Pazienza V. Разработанная диета с устойчивым крахмалом (ERS) формирует профиль микробиоты толстой кишки в параллельно с замедлением роста опухоли в моделях рака поджелудочной железы in vitro и in vivo.Питательные вещества. 2017; 9 (4). https://doi.org/10.3390/nu
31.
Конус HS, Roberfroid MB. Нетоксическое усиление химиотерапии рака диетической олигофруктозой или инулином. Nutr Cancer. 2000. 38 (1): 1–5.
Артикул PubMed CAS Google Scholar
Конус HS, Roberfroid MB. Возможна адъювантная терапия рака двумя пребиотиками – инулином или олигофруктозой. In Vivo. 2005. 19 (1): 201–4.
PubMed CAS Google Scholar
Schoener CA, Carillo-Conde B, Hutson HN, Peppas NA. Конъюгат инулина и доксорубицина для улучшения лечения рака. J Drug Deliv Sci Technol. 2013. 23 (2): 111–8.
Артикул PubMed PubMed Central CAS Google Scholar
Функ М.А., Бейкер Д.Х. Влияние клетчатки, источника белка и времени кормления на токсичность метотрексата у крыс. J Nutr. 1991. 121 (10): 1673–83.
Артикул PubMed CAS Google Scholar
Mao Y, Nobaek S, Kasravi B, Adawi D, Stenram U, Molin G, Jeppsson B. Влияние штаммов Lactobacillus и овсяной клетчатки на вызванный метотрексатом энтероколит у крыс. Гастроэнтерология. 1996. 111 (2): 334–44.
Артикул PubMed CAS Google Scholar
Mao Y, Kasravi B, Nobaek S, Wang LQ, Adawi D, Roos G, Stenram U, Molin G, Bengmark S, Jeppsson B. Энтеральная диета с добавлением пектина снижает тяжесть энтерального энтерального питания, вызванного метотрексатом, у крыс .Сканд Дж Гастроэнтерол. 1996. 31 (6): 558–67.
Артикул PubMed CAS Google Scholar
Lin XB, Farhangfar A, Valcheva R, Sawyer MB, Dieleman L, Schieber A, Ganzle MG, Baracos V. Роль кишечной микробиоты в развитии токсичности иринотекана и в снижении токсичности через пищевые волокна у крыс. PLoS One. 2014; 9 (1): e83644.
Артикул PubMed PubMed Central CAS Google Scholar
Смит К.Л., Гейер М.С., Язбек Р., Торрес Д.М., Батлер Р.Н., Ховарт Г.С. Lactobacillus fermentum BR11 и фруктоолигосахарид частично уменьшают воспаление тощей кишки на модели кишечного мукозита у крыс. Nutr Cancer. 2008. 60 (6): 757–67.
Артикул PubMed CAS Google Scholar
Motoori M, Yano M, Miyata H, Sugimura K, Saito T, Omori T, Fujiwara Y, Miyoshi N, Akita H, Gotoh K, Takahashi H, Kobayashi S, Noura S, Ohue M, Asahara T. , Номото К. и др.Рандомизированное исследование влияния синбиотиков во время неоадъювантной химиотерапии на нежелательные явления у пациентов с раком пищевода. Clin Nutr. 2017; 36 (1): 93–9.
Артикул PubMed Google Scholar
Цилингири К., Ресчиньо М. Постбиотики: что еще? Benef Microbes. 2013; 4 (1): 101–7.
Артикул PubMed CAS Google Scholar
Присциандаро Л.Д., Гейер М.С., Батлер Р.Н., Камминз АГ, Ховарт Г.С.Пробиотические факторы частично улучшают параметры кишечного мукозита, вызванного 5-фторурацилом, у крыс. Cancer Biol Ther. 2011; 11 (7): 671–7.
Артикул PubMed CAS Google Scholar
An J, Ha EM. Комбинированная терапия супернатантом Lactobacillus plantarum и 5-флуоурацилом увеличивает химиочувствительность клеток колоректального рака. J Microbiol Biotechnol. 2016; 26 (8): 1490–503.
Артикул PubMed CAS Google Scholar
Flieger D, Klassert C, Hainke S, Keller R, Kleinschmidt R, Fischbach W. Фаза II клинических испытаний по профилактике отсроченной диареи с помощью холестирамина / левофлоксацина во второй линии лечения иринотеканом у пациентов с метастатической колоректальной карциномой раз в две недели. Онкология. 2007. 72 (1-2): 10–6.
Артикул PubMed CAS Google Scholar
Derosa L, Routy B, Enot D, Baciarello G, Massard C, Loriot Y, Fizazi K, Escudier B, Zitvogel L, Albiges L.Назначение антибиотиков для снижения выживаемости без прогрессирования (PFS) и общей выживаемости (OS) у пациентов с запущенными формами рака, леченных ингибиторами иммунных контрольных точек PD1 / PDl1. J Clin Oncol. 2017; 35 (15): 3015.
Артикул Google Scholar
Lalani A, Xie W, Lin X, Steinharter JA, Martini DJ, Duquette A, Bosse D, McKay RR, Simantov R, Wei XX, McGregor BA, Harshman LC, Choueiri TK. Использование антибиотиков и результаты системной терапии метастатической почечно-клеточной карциномы (мПКР).Сан-Франциско: ASCO GU; 2018.
Google Scholar
Pflug N, Kluth S, Vehreschild JJ, Bahlo J, Tacke D, Biehl L, Eichhorst B, Fischer K, Cramer P, Fink AM, von Bergwelt-Baildon M, Stilgenbauer S, Hallek M, Cornely OA , Верещильд MJ. Эффективность противоопухолевого лечения связана с использованием антибиотиков, которые модулируют кишечную микробиоту. Онкоиммунология. 2016; 5 (6): e1150399.
Артикул PubMed PubMed Central CAS Google Scholar
ElRakaiby M, Dutilh BE, Rizkallah MR, Boleij A, Cole JN, Aziz RK. Фармакомикробиомика: влияние вариаций микробиома человека на системную фармакологию и персонализированную терапию. ОМИКС. 2014. 18 (7): 402–14.
Артикул PubMed PubMed Central CAS Google Scholar
Сандерс М.Э., Аккерманс Л.М., Халлер Д., Хаммерман С., Хаймбах Дж., Хорманнспергер Г., Хьюис Г., Леви Д.Д., Лутгендорф Ф., Мак Д., Фотират П., Солано-Агилар Г., Воган Э.Оценка безопасности пробиотиков для использования человеком. Кишечные микробы. 2010. 1 (3): 164–85.
Артикул PubMed PubMed Central Google Scholar

 При развитии дисбактериоза у людей старшего возраста возможны запоры, вызванные нарушением двигательной функции кишечника из-за недостатка нормальной микрофлоры. Расстройства стула сопровождаются вздутием и «урчанием» живота.
При развитии дисбактериоза у людей старшего возраста возможны запоры, вызванные нарушением двигательной функции кишечника из-за недостатка нормальной микрофлоры. Расстройства стула сопровождаются вздутием и «урчанием» живота.