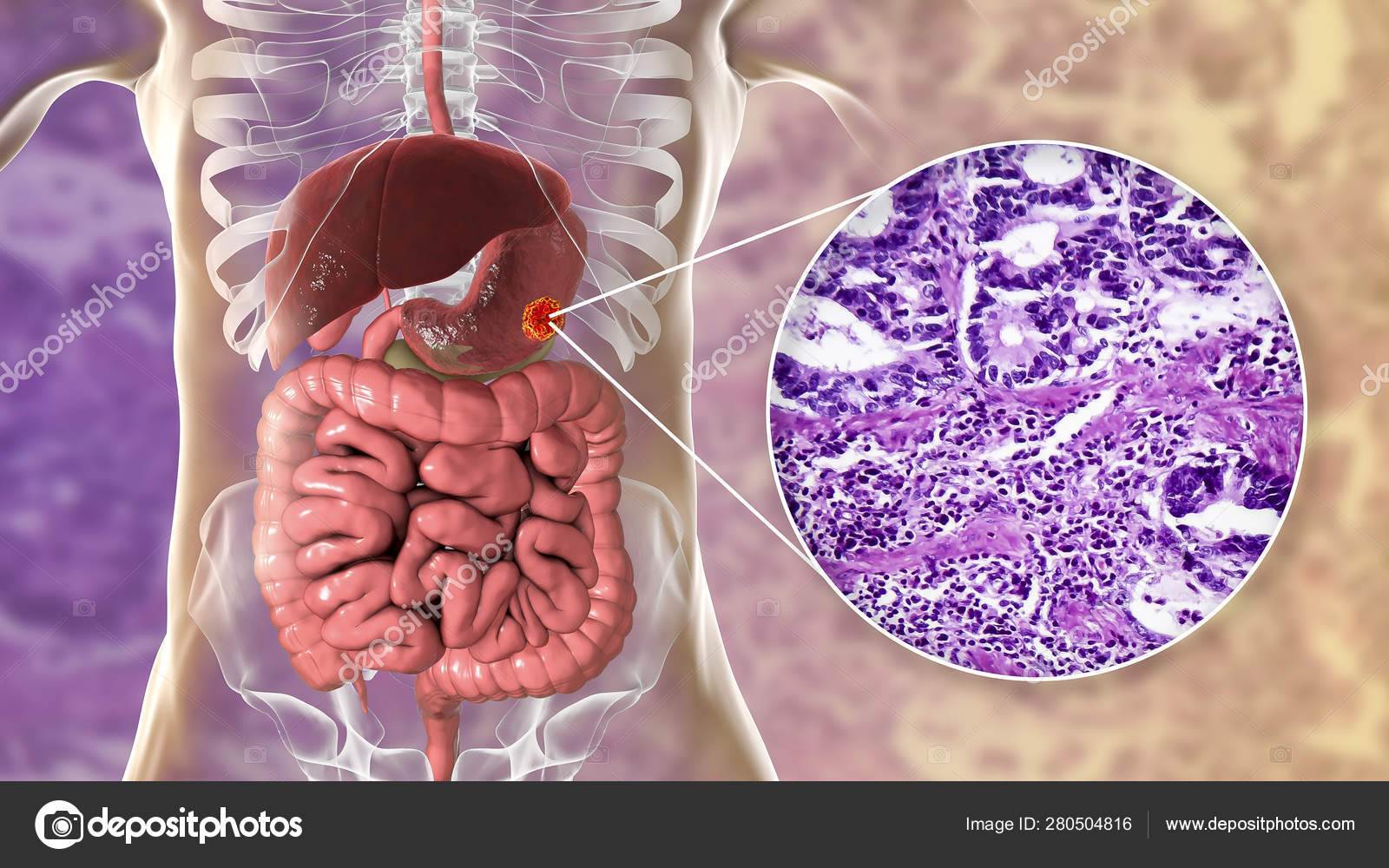
Аденокарцинома желудка что это: Карцинома желудка – лечение аденокарциномы желудка в Израиле по доступной цене, запись на диагностику и лечение аденокарцинома желудка в Израильских клиниках
Аденокарцинома желудка: причины, признаки, лечение
Причины возникновения патологии
Достоверная причина возникновения аденокарциномы желудка неизвестна – данный тип рака рассматривается онкологами как результат воздействия на организм пациента канцерогенных веществ при нарушении кровообращения органа и угнетения его функций. Одной из частых причин развития патологии становится инфицирование пациента бактерией Helicobacter pylori, вызывающей гастрит и язвенную болезнь.
В группе риска оказываются люди старше 55 лет. Мужчины страдают от раковых поражений органов пищеварительного тракта в три раза чаще женщин. Употребление алкоголя (особенно крепких напитков) создает условия для развития очагов дисплазии, которые обладают потенциалом к малигнизации.
Благоприятными условиями для формирования аденокарциномы становятся предраковые состояния тканей желудка:
- полипы;
- хронические гастриты;
- хронические язвы;
- проведенные ранее резекции органов ЖКТ.

Своевременное выявление этих патологий и курс поддерживающей терапии существенно снижают риск малигнизации новообразований.
Симптомы аденокарциномы желудка
Наиболее распространенным признаком рака желудка становится болевой синдром. Степень его проявления не связана с количеством употребляемой пищи или временем ее приема. Этот симптом дополняется тошнотой, рвотой, отрыжкой, потерей аппетита. Систематические нарушения стула (запоры или диареи) приводят к слабости, апатии, колебаниям веса. Пациент может потерять чувство удовольствия при употреблении пищи, вкус привычных блюд будет восприниматься иначе.
Местные симптомы часто проявляются после того, как опухоль начинает оказывать влияние на работу желудка. Новообразование в выходном отделе провоцирует сужение пилоруса, отделяющего орган от двенадцатиперстной кишки. При поражении внутренних отделов желудка пациент долгое время не замечает никаких признаков рака до появления симптомов общей интоксикации организма.
Опухоль в кардиальном отделе провоцирует дисфагию (затрудненное глотание). Значительные размеры новообразования могут препятствовать прохождению жидкой пищи через желудок. Прорастание раковых клеток в соседние органы существенно влияет на клиническую картину заболевания.
Обращение к врачу
Описанные выше симптомы аденокарциномы желудка предполагают проведение консультации с врачом. Пациенту требуется осмотр онколога и гастроэнтеролога. Выявление злокачественной опухоли на ранней стадии оставляет возможность для её успешного удаления до образования метастазов.
Диагностика патологии
После составления анамнеза пациента врач-онколог приступает к объективному обследованию. Наиболее тщательно изучаются типичные зоны метастазирования рака желудка: лимфатические узлы шеи, печень, легкие, яичники у женщин. Точная постановка диагноза осуществляется на основании:
- гастроскопии, позволяющей визуализировать патологические изменения тканей;
- рентгенографии желудка, обеспечивающей диагностику состояния внутренних стенок желудка;
- эндосонографии, создающей условия для выявления метастазов и проведения биопсии подозрительных участков;
- анализов крови, содержащих данные об онкомаркерах;
- гистологических исследований, дающих возможность определить степень дифференцировки раковых клеток.

Аппаратные методы диагностики играют важную роль при планировании операции. Магнитно-резонансная и компьютерная томографии применяются для выявления размеров опухоли и определения степени поражения прилежащих органов и тканей. Дифференциальная диагностика позволяет исключить из диагноза пациента гастрит, язву и полипы желудка.
Лечение патологии
Оперативное вмешательство остается основным методом лечения патологии. Лучевая и химиотерапия используются как самостоятельные способы в исключительных случаях – при наличии противопоказаний к операции или в качестве паллиативной поддержки на четвертой стадии заболевания.
Хирургическое иссечение опухоли проводится по двум сценариям:
- гастрэктомия – удаление желудка, части пищевода, тонкого кишечника и региональных лимфатических узлов;
- резекция – удаление части органа, пораженного опухолью, вместе с небольшим участком окружающих тканей.

Стратегия определяется размерами, локализацией и гистологическими характеристиками злокачественного новообразования. При невозможности полного иссечения опухоли, перекрывающей желудок, выполняется стентирование – введение в орган трубки, сохраняющей достаточный для самостоятельного питания пациента просвет. Альтернативное решение – эндолюминальная лазерная терапия, заключающаяся в удалении раковых клеток под действием лазера.
Химиотерапия остается малоэффективным способом лечения аденокарциномы. Ее курс назначают пациентам, которые ожидают операции. После хирургического вмешательства «химия2 и лучевая терапия применяются для полного уничтожения оставшихся в организме человека раковых клеток.
Лучевые методы лечения рака желудка используются как самостоятельный способ терапии при выявлении опухолей на четвертой стадии. Паллиативный эффект позволяет снизить интенсивность болевого синдрома у пациентов.
Прогноз и профилактика
Прогностические оценки при аденокарциноме желудка зависят от стадий и локализаций опухолей.
Прогноз успешности лечения аденокарциномы желудка учитывает и стадию, на которой выявлена патология. Ранние этапы развития рака этого органа диагностируются у 20% пациентов. Поздняя диагностика существенно ухудшает предполагаемые онкологами исходы лечения.
Профилактические меры предполагают отказ от употребления канцерогенов (алкоголя и табака), соблюдение принципов правильного питания, обилие органических продуктов в рационе и минимальное содержание блюд с консервантами и пищевыми красителями.
Консультации в онкоцентре «София»
Записаться на прием к специалистам онкологического центра «София» можно на сайте – пациенту необходимо внести в соответствующие поля свое имя, номер телефона и адрес электронной почты. Администраторы клиники совершат ответный звонок после обработки полученных данных.
Администраторы клиники совершат ответный звонок после обработки полученных данных.
Специалисты информационной службы клиники готовы ответить на любые вопросы и забронировать удобную для пациентов дату визита по телефону +7(495)995-00-34.
Онкологический центр «София» расположен на территории центрального административного округа Москвы по адресу 2-й Тверской-Ямской переулок, дом 10. Удобная локация позволит пациентам быстро добраться до клиники от станций метро «Маяковская», «Новослободская», «Тверская», «Чеховская» и «Белорусская».
Аденокарцинома желудка: прогноз, сколько живут после операции, лечение и стадии, классификация
Аденокарцинома желудка — это одна из наиболее часто встречающихся разновидностей рака данной локализации. На ее долю приходится до 95% всех злокачественных новообразований желудка. Заболевание коварно тем, что на начальных стадиях никак себя не проявляет, затем возникают боли, тошнота, потеря аппетита, на фоне этих симптомов нарастает слабость и потеря веса.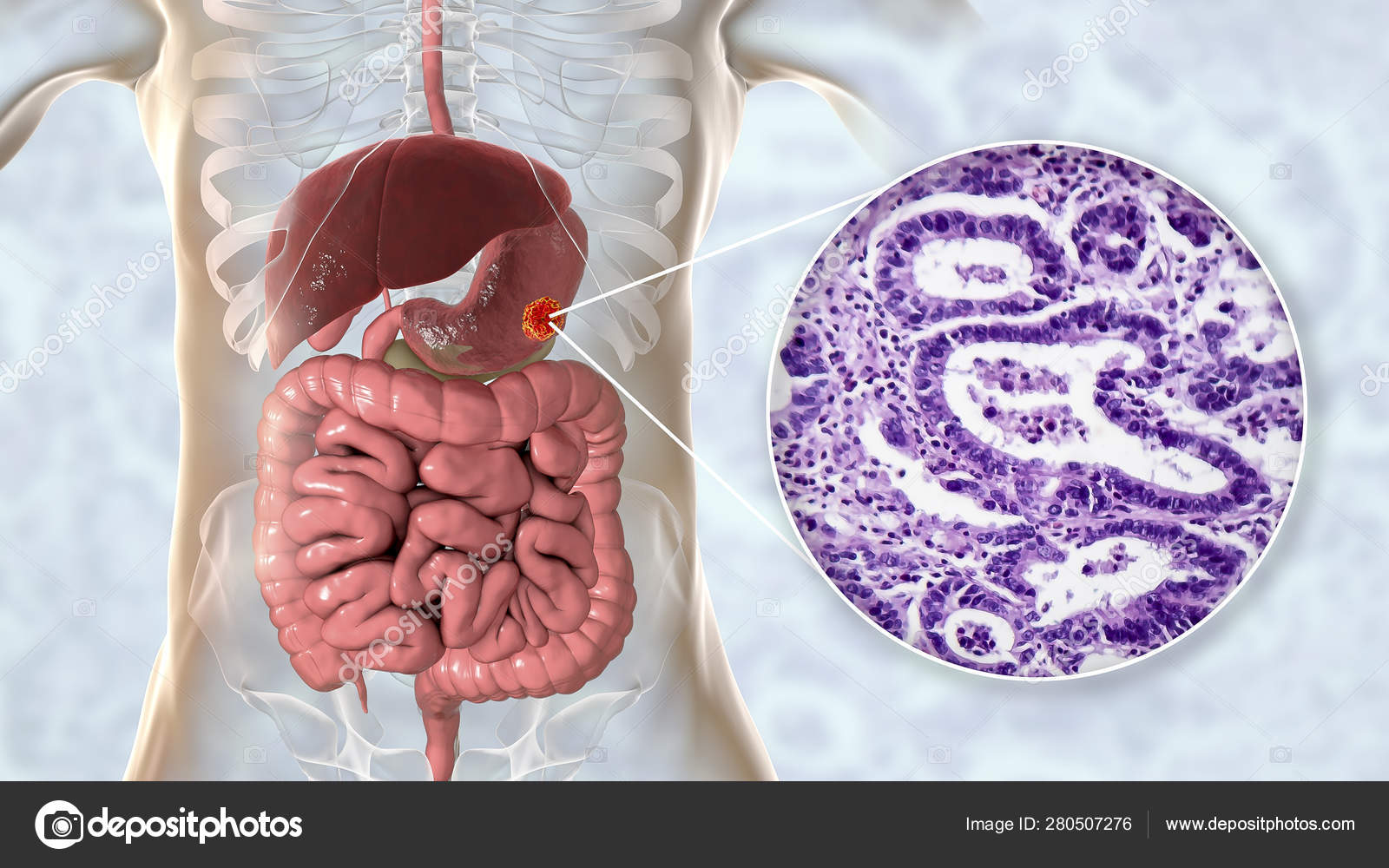 Единственный на сегодняшний день радикальный метод лечения аденокарциномы это хирургическая операция. Лучевая терапия и химиотерапия назначаются в качестве дополнительного лечения или при невозможности хирургического вмешательства.
Единственный на сегодняшний день радикальный метод лечения аденокарциномы это хирургическая операция. Лучевая терапия и химиотерапия назначаются в качестве дополнительного лечения или при невозможности хирургического вмешательства.
Причины развития
Причина злокачественной трансформации клеток слизистой оболочки до конца не выявлены, но ученые определили несколько факторов, которые достоверно повышают такую вероятность:
- Хронический атрофический гастрит. На его фоне развивается до 60% всех случаев рака желудка. При локализации атрофического процесса в теле желудка, риск увеличивается в 3-5 раз, в антральной его части — в 18 раз, а если поражен весь желудок — в 90 раз.
- Нарушение питания — употребление большого количества острых и соленых продуктов, маринадов, копченостей, вяленого мяса, а также жиров, особенно подвергшихся термической обработке. Имеет значение характер приема пищи. Переедание, недостаточно тщательное пережевывание пищи может привести к хронической травматизации стенки желудка и на этом фоне — к злокачественному перерождению клеток.

- Инфицирование бактерией Хеликобактер пилори увеличивает риски в 3-4 раза.
- Курение и злоупотребление алкоголем.
- Наличие в анамнезе операций на желудке. Риск развития рака увеличивается в 4 раза.
- Пернициозная анемия — злокачественная анемия, связанная с невозможностью усвоения витамина В12. На этом фоне происходит снижение иммунитета, что в 10% случаев приводит к развитию рака.
- Иммунодефицитные состояния, в том числе СПИД.
- Наследственная предрасположенность по данным разных авторов увеличивает риск на 5-20%. В научной литературе описаны случаи наследования аденокарциномы желудка.
- Работа с вредными производственными факторами (никель, асбест).
- Язва желудка. При ее расположении в теле желудка, риски малигнизации увеличиваются в 2 раза, а при поражении антрального отдела данной закономерности не отмечается.
Виды аденокарциномы желудка
Согласно современной классификации выделяют следующие виды аденокарцином, поражающих желудок:
- Папиллярная — визуально напоминает полип.

- Тубулярная. Произрастает из клеток кубического или цилиндрического эпителия.
- Муцинозная. Произрастает из слизисто-продуцирующих клеток.
По степени дифференцировки выделяют следующие формы:
- Высокодифференцированная аденокарцинома желудка. Клетки опухоли имеют высокий уровень дифференцировки и «напоминают» здоровую ткань. Характеризуется медленным ростом и, при своевременной диагностике, хорошо поддается излечению. Главная проблема заключается в том, что в самом начале данную опухоль сложно обнаружить, даже при эндоскопическом обследовании, а ее выявление на поздних стадиях не позволяет достичь желаемого результата.
- Умеренно дифференцированная аденокарцинома желудка. Клетки этой опухоли сложно идентифицировать с тканью, из которой она произрастает. Характеризуется умеренной злокачественностью и скоростью роста.
- Низкодифференцированная аденокарцинома желудка. Клетки данной опухоли невозможно идентифицировать с определенной тканью.
 Это наиболее злокачественный тип рака желудка. Характеризуется быстрым ростом и метастазированием.
Это наиболее злокачественный тип рака желудка. Характеризуется быстрым ростом и метастазированием.
Симптомы
- Потеря аппетита.
- Явления диспепсии — вздутие живота, тошнота, отрыжка, чувство тяжести. Если опухоль имеет большие размеры, она может перекрывать просвет желудка, что вызывает рвоту при приеме пищи, но это происходит уже на последних стадиях.
- Слабость и апатия.
- Боль. Как правило, она возникает не сразу, а преимущественно на распространенных стадиях. В это время она носит постоянный характер и не зависит от приема пищи. Возникает без видимых причин и часто усиливается после еды. На последних стадиях она настолько сильная, что не купируется привычными анальгетиками.
Как мы видим, эти симптомы неспецифичны, и человек может долгое время пытаться купировать их самостоятельно.
Диагностика аденокарциномы желудка
Своевременная диагностика рака желудка имеет важнейшее значение, поскольку прогноз на ранних стадиях заболевания куда более благоприятен, чем при распространенном опухолевом процессе. Но аденокарцинома на начальных стадиях характеризуется либо бессимптомным течением, либо ее симптомы воспринимаются как признаки другого заболевания, например, гастрита, язвы, желчнокаменной болезни, панкреатита. В результате пациенты не обращаются к врачу, купируя симптомы самостоятельно с помощью препаратов, купленных в аптеке.
Но аденокарцинома на начальных стадиях характеризуется либо бессимптомным течением, либо ее симптомы воспринимаются как признаки другого заболевания, например, гастрита, язвы, желчнокаменной болезни, панкреатита. В результате пациенты не обращаются к врачу, купируя симптомы самостоятельно с помощью препаратов, купленных в аптеке.
Стадии аденокарциномы
- 0 стадия или рак in situ. Злокачественные клетки не распространяются на пределы эпителиального слоя.
- 1 стадия. Опухоль прорастает эпителий и распространяется на другие слои стенки желудка, но не выходит за ее пределы.
- 2 стадия. Опухоль увеличивается в размерах и дает метастазы в регионарные лимфатические узлы.
- 3 стадия. Аденокарцинома прорастает в соседние органы (поджелудочная железа, печень) и/или дает метастазы в несколько групп лимфатических узлов.
- На четвертой стадии, аденокарцинома дает метастазы в отдаленно расположенные органы и лимфатические узлы.
Диагностика
Диагностика аденокарциномы желудка носит комплексный характер и включает ряд обследований, которые не только помогают определить тип опухоли, но и стадию заболевания:
- ФГДС — обследование, которое осуществляется с использованием специального прибора — гибкого эндоскопа.
 С его помощью производится визуальный осмотр слизистой оболочки желудка, причем прибор транслирует увеличенное изображение исследуемого участка на монитор, что позволяет обнаружить незначительные изменения слизистой. Во-вторых, эндоскоп оснащен специальной манипуляционной системой, с помощью которой можно взять кусочек ткани на гистологический анализ и точно определить вид опухоли и степень дифференцировки ее клеток.
С его помощью производится визуальный осмотр слизистой оболочки желудка, причем прибор транслирует увеличенное изображение исследуемого участка на монитор, что позволяет обнаружить незначительные изменения слизистой. Во-вторых, эндоскоп оснащен специальной манипуляционной системой, с помощью которой можно взять кусочек ткани на гистологический анализ и точно определить вид опухоли и степень дифференцировки ее клеток. - УЗИ. Этот метод исследования позволяет уточнить размер опухоли, ее соотношение с соседними органами, наличие метастазов в регионарные лимфатические узлы.
- КТ и МРТ также помогают верифицировать размеры злокачественного новообразования и его врастание в окружающие ткани, но главной целью является поиск метастазов в лимфоузлы и отдаленные органы (например, легкие).
- ПЭТ-КТ (позитронно-эмиссионная компьютерная томография) позволяет обнаружить отдаленные метастазы размером до 1 мм.
- Определение онкомаркеров РЭА, СА72-4, СА19-9. При раке желудка эти маркеры не имеют диагностического значения как такового, но при исходном повышении нормы, их можно использовать в качестве контроля лечения и возникновения рецидива.
 После операции уровень онкомаркеров должен снизиться, он может достичь нормы. При возникновении рецидива или прогрессирования заболевания, он будет опять нарастать.
После операции уровень онкомаркеров должен снизиться, он может достичь нормы. При возникновении рецидива или прогрессирования заболевания, он будет опять нарастать.
Доктор М.С. Бурдюков проводит диагностическое обследование желудка – ФГДС
Метастазирование аденокарциномы желудка
Для аденокарциномы характерно лимфогенное, гематогенное и имплантационное метастазирование.
Имплантационное метастазирование предполагает распространение клеток посредством контакта опухоли с воспринимающей поверхностью. В случае рака желудка такой поверхностью может быть брюшина, плевра, перикард, диафрагма. На четвертой стадии часто обнаруживается канцероматоз (массивное метастазирование в различные ткани).
Лимфогенное метастазирование подразумевает распространение опухоли по лимфатическим сосудам. Сначала поражаются близлежащие лимфатические узлы, а потом и более отдаленные. При раке желудка существуют специфические формы лимфогенных метастазов:
- Поражение узлов левой надключичной области — метастазы Вирхова.

- Поражение параректальных ЛУ — метастазы Шницлера.
- Поражение подмышечных ЛУ — метастазы Айриша.
Гематогенное метастазирование предполагает перенос раковых клеток по кровеносным сосудам. Чаще всего поражается печень в результате миграции клеток по воротной вене. Также возможно поражение легких, почек, головного мозга, костного мозга.
Лечение аденокарциномы желудка
Лечение аденокарциномы зависит от стадии заболевания и гистологического типа опухоли. Как правило, оно носит комплексный характер и предполагает сочетание хирургической операции с химио- или лучевой терапией. Хирургический компонент здесь является ключевым фактором.
В рамках лечения может проводиться удаление всего желудка (гастрэктомия), или его части (резекция желудка). Одновременно удаляются ткани, пораженные злокачественными клетками — регионарные лимфатические узлы, части органов, куда проросла опухоль (печень, тонкая кишка, брюшина и др).
Химиотерапия и лучевая терапия могут применяться в дооперационном (неоадъювантный режим) и послеоперационном периоде (адъювантный режим).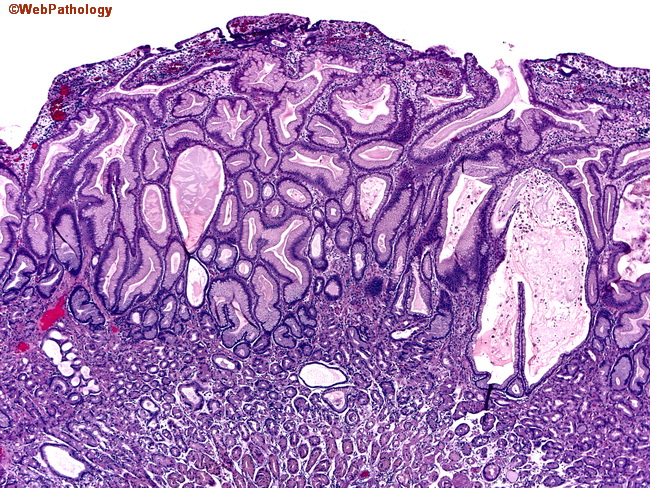 В первом случае их целью является уменьшение размеров опухоли, чтобы ее можно было удалить с наименьшим объемом тканей, а во втором — уничтожение оставшихся раковых клеток. Кроме того, применение химиотерапии и лучевой терапии может уменьшить выраженность болевого синдрома.
В первом случае их целью является уменьшение размеров опухоли, чтобы ее можно было удалить с наименьшим объемом тканей, а во втором — уничтожение оставшихся раковых клеток. Кроме того, применение химиотерапии и лучевой терапии может уменьшить выраженность болевого синдрома.
Если радикальное удаление образования невозможно, проводится паллиативное лечение. В этом случае оно направлено на устранение осложнений, вызванных аденокарциномой, и улучшение качества жизни больного. Например, если опухоль перекрыла просвет желудка, накладываются обходные анастамозы или выводится гастростома, благодаря чему пациент сможет питаться.
Прогноз аденокарциномы желудка
Прогноз при аденокарциноме зависит от стадии заболевания. Чем раньше начать лечение, тем более эффективным оно будет:
- При первой стадии пятилетняя выживаемость достигает 80%. Причем высоки шансы на полное выздоровление. К сожалению, на этой стадии рак желудка выявляется очень редко, как правило, случайно.

- На второй стадии пятилетняя выживаемость приближается к 55%. Половина из этих людей имеет шансы на полное излечение. Согласно данным литературы, менее 10% злокачественных опухолей желудка выявляются на второй стадии.
- При третьей стадии пятилетняя выживаемость находится на уровне менее 40%, а при четвертой — не превышает 5%. К сожалению, до 75% аденокарцином выявляется именно на четвертой стадии.
Профилактика
Профилактика рака желудка направлена на предотвращение или снижение воздействия факторов риска, приводящих к развитию данного заболевания:
- Нормализация питания. Употребление в пищу достаточного количества пищевых волокон (овощи, фрукты, каши), ограничение употребления соли, пряностей, маринадов и копченостей.
- Отказ от курения и злоупотребления алкоголем.
- Лечение инфекций и предраковых заболеваний — хронический гастрит, полипы желудка.
- Поддержание достаточного уровня физической активности
Рак желудка — профилактика, стадии, симптомы и методы лечения
Введение
Процесс пищеварения
Желудок находится в верхней части брюшной полости.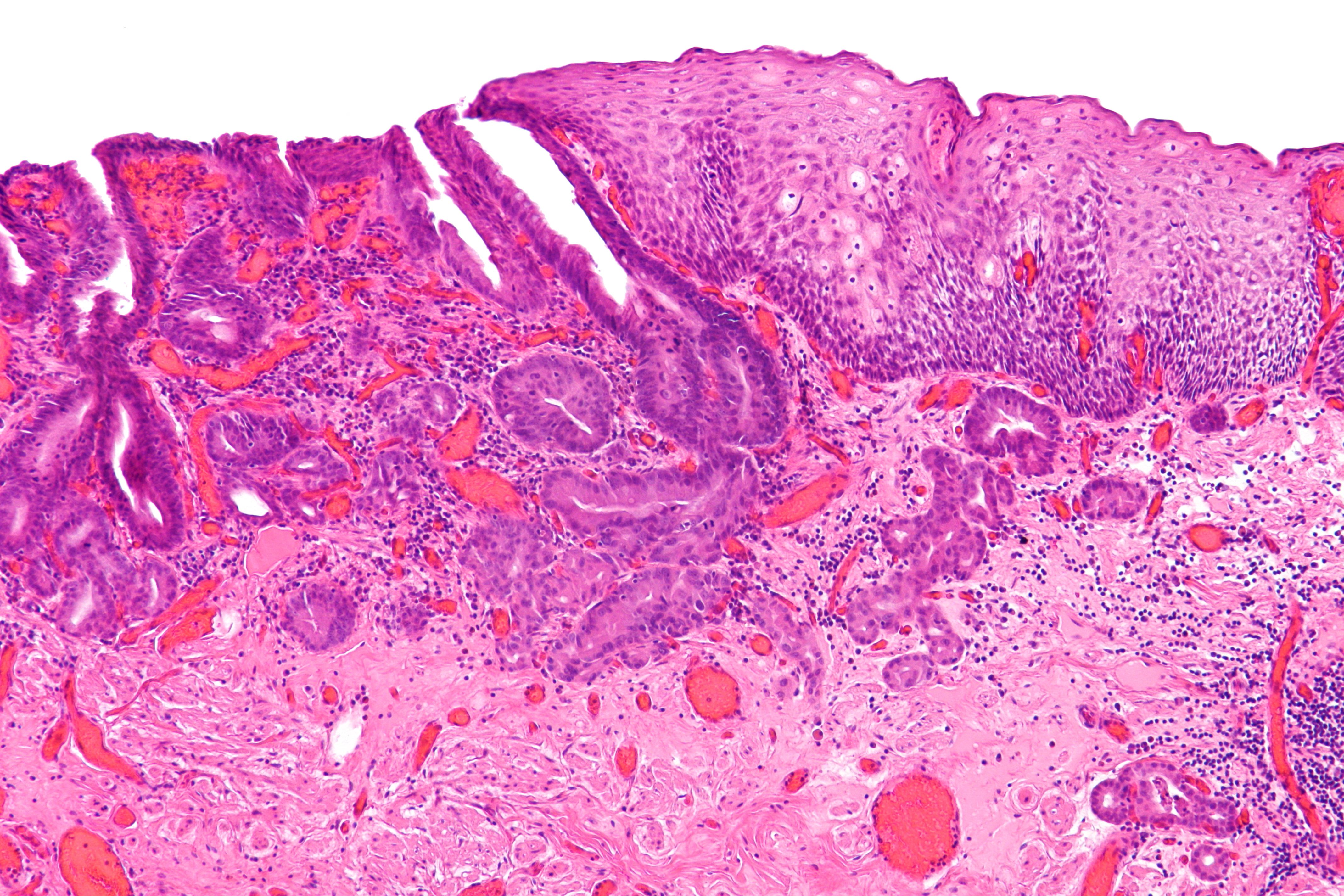 Он играет важнейшую роль в пищеварении. После проглатывания пища проходит вниз по мышечной трубке (пищевод), соединяющей горло с желудком. При попадании в желудок пища смешивается – вырабатывается желудочный сок, способствующий ее измельчению. Затем пищевой комок перемещается в тонкий кишечник для дальнейшего переваривания.
Он играет важнейшую роль в пищеварении. После проглатывания пища проходит вниз по мышечной трубке (пищевод), соединяющей горло с желудком. При попадании в желудок пища смешивается – вырабатывается желудочный сок, способствующий ее измельчению. Затем пищевой комок перемещается в тонкий кишечник для дальнейшего переваривания.
Виды рака желудка
Рак желудка начинается, когда здоровые клетки ткани изменяются и неконтролируемо растут. Следует различать раковую и доброкачественную опухоли. Раковая (злокачественная) может разрастаться, захватывая соседние органы и системы. Доброкачественная – растёт, но не переходит на другие ткани.
Основная форма онкопроцесса желудка – аденокарцинома. Это означает, что новообразование развилось в железистой ткани, выстилающей внутреннюю часть желудка. Другие виды раковых опухолей включают в себя лимфому, карциному желудка и нейроэндокринную опухоль, но они возникают редко.
Стадии
Стадия определяет расположение опухоли, ее распространенность, а также ее влияние на организм в целом.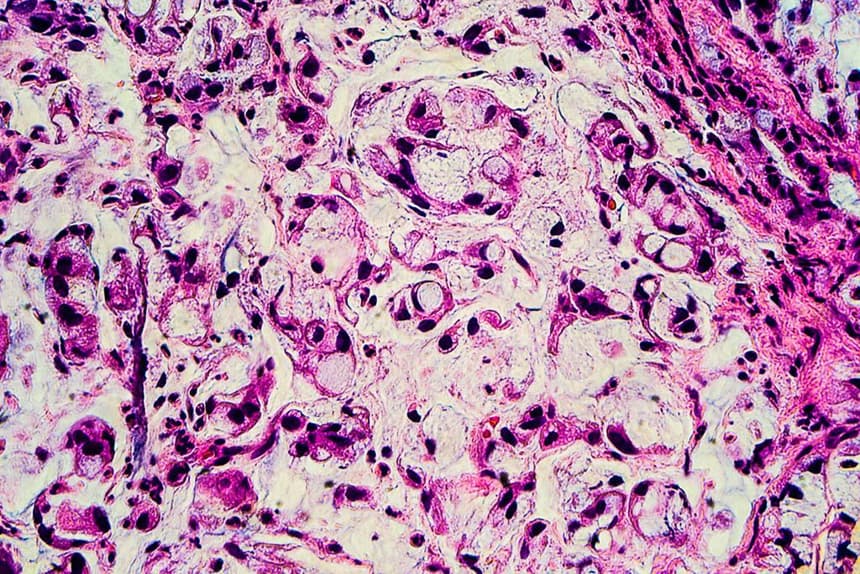 Врачам может потребоваться информация, основанная на образцах ткани, полученных при операции, поэтому определение стадии обычно продолжается до проведения всех анализов. Эта информация помогает врачу определить, какое лечение является оптимальным, спрогнозировать возможность выздоровления.
Врачам может потребоваться информация, основанная на образцах ткани, полученных при операции, поэтому определение стадии обычно продолжается до проведения всех анализов. Эта информация помогает врачу определить, какое лечение является оптимальным, спрогнозировать возможность выздоровления.
Система классификации аденосаркомы (наиболее распространённый рак желудка) TNM:
- Опухоль (T): Распространенность новообразования в стенку желудка.
- Лимфатические узлы (N): Распространенность опухоли на лимфоузлы.
- Метастазы (M): Распространенность онкопроцесса на другие органы.
Для определения стадии рака каждого пациента результаты объединяются. Выделяют 5 стадий: стадия 0 (ноль), которая представляет собой неинвазивную протоковую карциному in situ (ПКИС), и стадии с I по IV (с 1 по 4).
Разберем подробно каждый элемент системы TNM для рака желудка:
Опухоль (T)
В системе TNM буква T плюс буква или цифра (от 0 до 4) используются для описания того, насколько далеко опухоль проросла.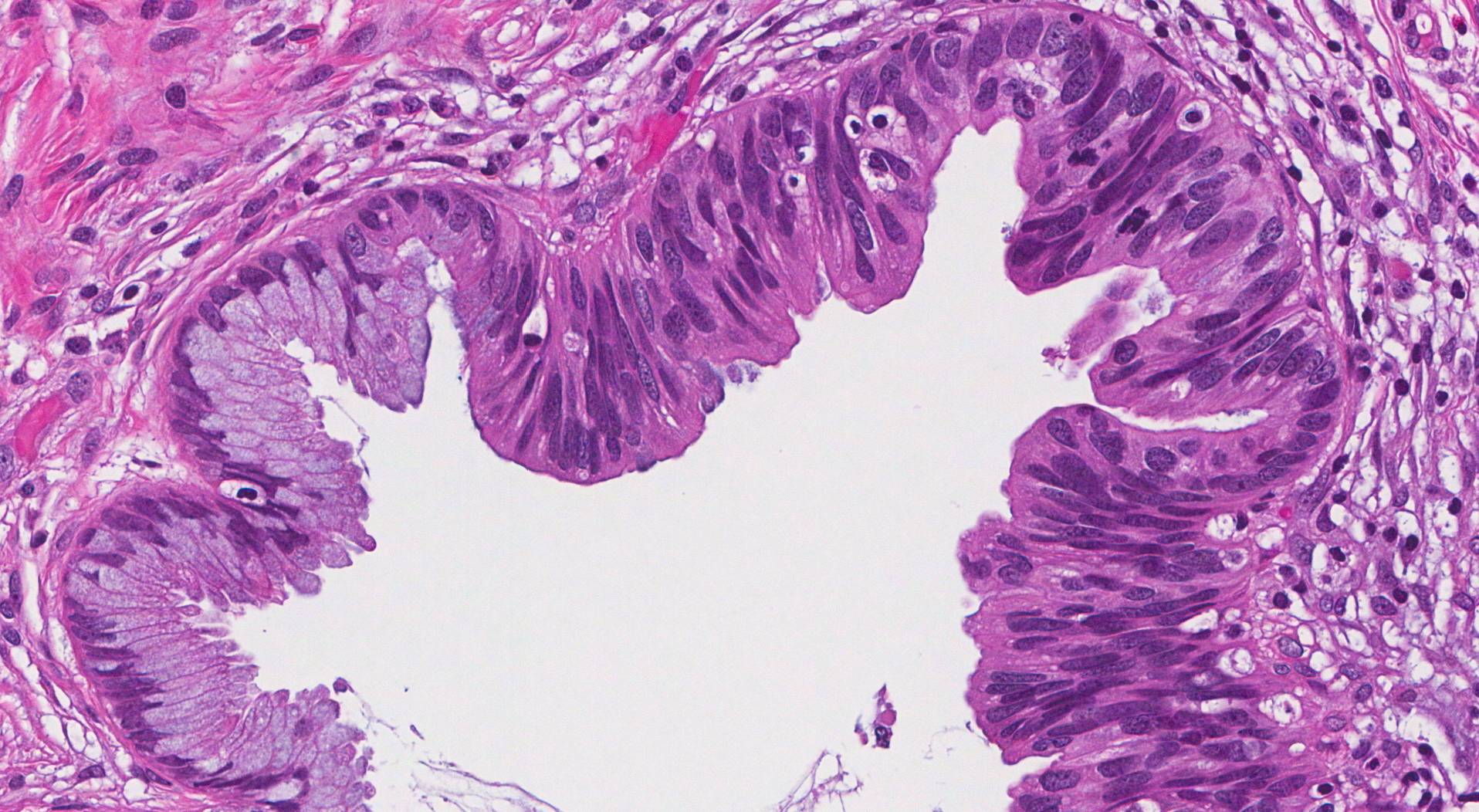 Размер образования измеряется в сантиметрах (см).
Размер образования измеряется в сантиметрах (см).
Стадии также делятся на более мелкие подгруппы, помогающие еще подробнее охарактеризовать опухоль.
TX: Новообразование не оценивается.
T0 (T плюс ноль): Данных об опухоли нет.
Tis: Эта стадия описывает карциному in situ. Рак обнаружен только в клетках на поверхности внутреннего слоя, называемого эпителием. Процесс не затрагивает другие слои желудка.
T1: Опухоль проросла в собственную пластинку, мышечный и подслизистый слои (внутренний слой стенки).
T1a: Опухоль проросла в собственную пластинку или мышечную оболочку.
T1b: Опухоль проросла в подслизистый слой.
T2: Опухоль проросла в мышечный слой желудка.
T3: Опухоль проросла сквозь все слои мышечной ткани в соединительную ткань за пределами желудка. Она не задевает слизистую или серозную оболочку брюшины.
T4: Опухоль проросла сквозь все слои мышечной ткани в соединительную ткань за пределами желудка. Опухоль также проросла в слизистую, серозную оболочку или органы, окружающие желудок.
T4a: Новообразование распространилась на серозный слой.
T4b: Новообразование проросло в органы, окружающие желудок.
Лимфатические узлы (N)
N в системе TNM означает лимфатические узлы. Это маленькие органы в форме фасолины, помогают противостоять инфекциям. Лимфоузлы в брюшной полости называются регионарными, а в других органах – отдаленными лимфоузлами. Общий прогноз для пациентов с онкологией основан на том, сколько регионарных лимфоузлов имеют патологические признаки.
NX: Регионарные лимфатические узлы не могут быть оценены
N0 (N плюс ноль): Рак не распространился в регионарные лимфатические узлы.
N1: Процесс находится в 1-2 регионарных лимфатических узла.
N2: В 3-6 регионарных лимфоузлах.
N3: В 7 и более лимфоузлах.
N3a: В 7- 15 регионарных лимфатических узлов.
N3b: В 16 и более регионарных лимфатических узлов.
Mетастазы (M)
Буква M в системе TNM означает разрастание опухоли в другие (часто соседние) органы. Это называют отдаленными метастазами.
MX: Не могут быть оценены.
M0 (M плюс ноль): Онкопроцесс не распространился на другие отделы организма.
M1: Раковая опухоль захватила другие органы.
Врачи устанавливают стадию рака, комбинируя классификации T, N и M.
Стадия 0: Также называется карцинома in situ. Опухоль расположена только на поверхности эпителия, не прорастая в другие слои желудка. Это считается онкопроцессом на начальной стадии (Tis, N0, M0).
Стадия IA: Рак пророс во внутренние слои стенки желудка, не распространяясь на лимфоузлы и другие органы (T1, N0, M0).
Стадия IB: Рак желудка относится к стадии IB при выполнении одного из 2 условий:
- Опухоль проросла во внутренние слои стенки желудка. Она распространяется только на 1-2 лимфоузла (T1, N1, M0).
- Рак пророс в наружные мышечные слои стенки желудка, но не распространился на лимфоузлы или другие органы (T2, N0, M0).
Стадия IIA: Рак желудка относится к стадии IIA при выполнении одного из условий:
- Новообразование проросло во внутренние слои стенки желудка. Он распространился на 3-6 лимфоузлов, но больше никуда (T1, N2, M0).
- Рак пророс в наружные мышечные слои стенки желудка. Он распространился на 1-2 лимфоузла, но больше никуда (T2, N1, M0).
- Онкопроцесс проходит сквозь все слои мышечной ткани в соединительную ткань за пределами желудка. Он не перешел в слизистую оболочку брюшины или в серозную оболочку и не распространился в лимфоузлы или окружающие органы (T3, N0, M0).
Стадия IIB: Рак желудка относится к стадии IIB при выполнении одного из следующих условий:
- Рак пророс во внутренние слои стенки желудка. Он распространился на 7-15 лимфоузлов, но больше никуда (T1, N3a, M0).
- Онкология имеет инвазию в наружные мышечные слои стенки желудка. Захватывает 3-6 лимфоузлов, но больше ничего (T2, N2, M0).
- Онкопроцесс прошёл сквозь все слои мышечной ткани в соединительную ткань вне желудка, но не пророс в слизистую оболочку брюшины или в серозную оболочку. Он распространился на 1-2 лимфоузла, но больше никуда (T3, N1, M0).
- Рак пророс сквозь все слои мышечной ткани в соединительную ткань за пределами желудка. Он пророс в слизистую оболочку брюшины или в серозную оболочку, не захватывая лимфоузлы или окружающие органы (T4a, N0, M0).
Стадия IIIA: Рак желудка относится к стадии IIIA при выполнении одного из следующих условий:
- Опухоль проросла в наружные мышечные слои стенки желудка. Она распространилась на 7-15 лимфоузлов, но не в другие органы (T2, N3a, M0).
- Рак прошел сквозь все слои мышечной ткани в соединительную ткань за пределами желудка, но не пророс в слизистую оболочку брюшины или в серозную оболочку. Он распространился на 3-6 лимфоузлов, но не в другие органы (T3, N2, M0).
- Онкопроцесс захватил все слои мышечной ткани в соединительную ткань за пределами желудка. Опухоль проросла в слизистую оболочку брюшины или в серозную оболочку и распространилась на 1-2 лимфоузла, но не в другие органы (T4a, N1, M0).
- Рак пророс сквозь все слои мышечной ткани в соединительную ткань за пределами желудка и пророс в прилежащие органы или структуры. Он не распространился на лимфоузлы или отдалённые части тела (T4b, N0, M0).
Стадия IIIB: Рак желудка относится к стадии IIIB при выполнении одного из следующих условий:
- Онкопроцесс захватил внутренние слои стенки желудка или наружные мышечные слои стенки желудка. Он распространился на 16 или более лимфоузлов, но не в отдаленные части тела (T1 or T2, N3b, M0).
- Опухоль проросла сквозь все слои мышечной ткани в соединительную ткань за пределами желудка, но не перешла в слизистую оболочку брюшины или в серозную оболочку. Она распространилась на 7- 15 лимфоузлов, но без инвазии в прилежащие органы (T3, N3a, M0).
- Новообразование прошло сквозь все слои мышечной ткани в соединительную ткань за пределами желудка, проросло в слизистую оболочку брюшины или в серозную оболочку. Процесс распространился на 7- 15 лимфоузлов, но больше никуда (T4a, N3a, M0).
- Рак пророс сквозь все слои мышечной ткани в соединительную ткань за пределами желудка, в прилежащие органы или структуры. Он распространился или не распространился на 1-6 лимфоузлов, но не в отдалённые части тела (T4b, N1 or N2, M0).
Стадия IIIC: Рак желудка относится к стадии IIIC при выполнении одного из следующих условий:
- Злокачественный процесс задел все слои мышечной ткани, соединительную ткань за пределами желудка, иногда прорастая в слизистую оболочку брюшины или в серозную оболочку. Он распространился на 16 или более лимфоузлов, но не в отдалённые части тела (T3 or T4a, N3b, M0).
- Опухоль проросла сквозь все слои мышечной ткани в соединительную ткань за пределами желудка, а также прилежащие органы. Она распространилась на 7 или более лимфоузлов, но не в другие части тела (T4b, N3a or N3b, M0).
Стадия IV: IV стадия рака желудка описывает рак любого размера, который распространился в отдаленные части тела, помимо области вокруг желудка (любые T, любые N, M1).
Рецидив
Рецидив рака – это возвращение онкологии после лечения. Локальный (регионарный) рецидив повторно проявляется в том же месте. Могут образовываться и отдаленные метастазы. В случае рецидива потребуется снова сдать все анализы для определения его степени.
Японская система классификации
В Японии существует другой метод определения стадии рака желудка, основанный на расположении вокруг желудка лимфатических узлов, содержащих раковые клетки. Хирургическое вмешательство при раке желудка можно характеризовать с использованием японской системы. Тип операции определяется тем, какие лимфоузлы удалены помимо желудка. D0: Лимфоузлы не удалены
D1: Удалены лимфоузлы, ближайшие к желудку.
D2: Удалены лимфоузлы в более широкой области.
Информация о стадии рака поможет врачу порекомендовать специальный план лечения.
Симптомы
Онкология не обнаруживается на ранней стадии, так как не вызывает никаких специфических симптомов. Ниже приведены симптомы рака желудка.
- Несварение или изжога
- Боль и дискомфорт в области живота
- Тошнота и рвота, в частности, рвота твердой пищей вскоре после еды
- Диарея или запор
- Вздутие живота после еды
- Потеря аппетита
- Чувство, что еда застревает в горле во время приема пищи
К симптомокомплексу распространенного рака относятся:
- Слабость и утомляемость
- Кровавая рвота и кровь в стуле
- Необъяснимая потеря веса
Важно помнить, что жалобы также могут быть вызваны многими другими заболеваниями, в частности, желудочным вирусом или язвой.
Методы лечения
«Стандарт оказания медицинской помощи» означает лучшие из известных методов лечения. В качестве онкопомощи рекомендуются также клинические исследования. Они помогают проверять новый подход к лечению. Врачи хотят узнать, является ли это лечение безопасным, эффективным и, возможно, более приемлемым, чем стандартное. Клинические исследования могут проверять лекарственную новинку, комбинацию проверенных методик или вариации дозировок стандартных препаратов или других методов лечения. Клинические исследования являются вариантом онкопомощи на каждой стадии процесса. Ваш врач может помочь вам рассмотреть все варианты терапии.
Обзор лечения
Междисциплинарная команда составляет общий план лечения. При раке желудка в такие команды могут входить следующие врачи:
- Гастроэнтеролог – специализируется на желудочно-кишечном тракте, в частности, на желудке и кишечнике;
- Хирург или хирург-онколог – специализируется на лечении рака с помощью хирургического вмешательства;
- Онколог – специализируется на лечении рака с помощью медикаментов;
- Онколог-радиолог – специализируется на лечении рака с помощью лучевой терапии;
- Гистолог – специализируется на интерпретации лабораторных анализов и оценке клеток, тканей и органов для диагностики заболевания;
- Радиолог – специализируется на использовании визуальных методов для диагностики заболевания.
Лечение рака желудка состоит из хирургического вмешательства, радиотерапии, химиотерапии, таргетной терапии или иммунотерапии. Варианты лечения и рекомендации зависят от нескольких факторов, включая тип и стадию рака, возможные негативные реакции организма, личные предпочтения, наличие хронической патологии. Для лечения онкологии чаще всего рекомендуется комбинация разных методик. Лечение опухоли может усложняться в связи с тем, что ее часто обнаруживают только на последних стадиях.
Уделите время изучению всех вариантов лечения и обязательно задайте вопросы обо всем, что непонятно. Обсудите с врачом цель каждого вида терапии и что вам следует ожидать во время лечения. Такие беседы называются «совместным принятием решения».
Хирургическое лечение
Это устранение новообразования прилегающей здоровой ткани с помощью оперативного вмешательства. Вид операции зависит от стадии онкопроцесса.
При раке на очень ранней стадии (T1a) некоторые врачи могут порекомендовать нехирургическое лечение, называемое эндоскопической резекцией слизистой оболочки. При начальных стадиях (стадии 0 или I), когда рак еще находится только в желудке, хирургическое вмешательство используется для иссечения части желудка, содержащей рак, и соседних лимфоузлов. Это называется субтотальной или частичной гастрэктомией. При частичной гастрэктомии хирург сшивает небольшую часть желудка с пищеводом или тонким кишечником.
Если рак пророс в наружную стенку желудка с разрастанием в лимфатические узлы или без, можно использовать хирургическое вмешательство плюс химиотерапию или химиотерапию с радиотерапией. Хирург может выполнить субтотальную гастрэктомию или полную гастрэктомию, то есть, удаление всего желудка. При тотальной гастрэктомии хирург соединяет пищевод непосредственно с тонким кишечником.
Гастрэктомия является обширным хирургическим вмешательством, влекущим за собой неприятные последствия. После этой операции пациенту разрешается съедать только небольшое количество пищи за один раз. Распространенный побочный эффект – группа симптомов, называемых «демпинг-синдром», включающих судороги, тошноту, диарею и головокружение после еды. Это происходит, когда пища слишком быстро попадает в тонкий кишечник. Врач может предложить способы избежать симптомокомплекс и назначить лекарства для контроля над ними. Симптомы обычно уменьшаются или исчезают через несколько месяцев, но у некоторых людей они появляются постоянно. Пациентам, у которых был удален весь желудок, могут потребоваться регулярные инъекции витамина B12, так как они больше не в состоянии получать его через желудок.
Регионарные лимфоузлы часто удаляются во время операции, потому что на них может распространиться рак. Это называется лимфаденэктомия.
Лучевая терапия
Это применение высокоэнергетического рентгеновского излучения или других частиц для разрушения раковых клеток. Схема терапии состоит из нескольких процедур, проводимых в течение определенного временного отрезка. Пациентам с раком желудка назначается дистанционная радиотерапия, когда излучение исходит из аппарата вне тела. Лучевая терапия может назначаться перед хирургическим вмешательством для уменьшения опухоли или после операции для уничтожения оставшихся раковых клеток.
Побочные эффекты от лучевой терапии проявляются усталостью, легкими кожными реакциями, расстройством желудка и жидким стулом. Большинство побочных эффектов исчезают вскоре после окончания лечения, но возможны и долгосрочные последствия.
Медикаментозная терапия
Системная терапия – это введение в кровоток лекарства для уничтожения клеток злокачественной опухоли.
Обычные способы системного лечения включают установку внутривенного (ВВ) катетера в вену с помощью иглы или проглатывание (пероральный прием) таблетированной формы лекарства.
При раке желудка применяются следующие виды системной терапии:
- Химиотерапия
- Таргетная терапия
- Иммунотерапия
В зависимости от ряда факторов пациенту рекомендуют как 1 вид системной терапии, так и комбинацию нескольких видов одновременно. Они также могут быть частью плана лечения, включающего хирургическую и/или радиотерапию.
Важно также сообщить врачу, принимаете ли вы другие препараты или пищевые добавки. Растительные препараты, пищевые добавки и другие лекарства взаимодействуют с противораковыми препаратами.
Химиотерапия – это применение препаратов, разрушающих опухолевые клетки, не позволяя им расти и делиться.
Режим (или схема) химиотерапии обычно состоит из нескольких циклов процедур. Проводятся они в течение некоторого временного отрезка. Одновременно пациент может получать 1 препарат или комбинацию разных препаратов.
Целью химиотерапии является разрушение раковых клеток, оставшихся после хирургического вмешательства, замедление роста клеток опухоли или снижение симптомов, связанных с раком. Ее также могут комбинировать с радиотерапией. Побочные эффекты химиотерапии зависят от индивидуальных особенностей организма, лекарственной дозировки. Могут наблюдаться утомляемость, выраженная слабость, риск инфицирования, диспепсию, облысение, снижение аппетита.
Таргетная терапия – это лечение, направленное на специфические гены, белки или тканевую среду рака, способствующую росту и выживанию рака. Таргетная терапия блокирует рост и распространение раковых клеток, одновременно ограничивая повреждение здоровых.
Не все опухоли имеют одинаковые мишени. Чтобы разработать наиболее действенное лечение, врач проводит анализы для определения генов, белков и других факторов вашей опухоли.
При лечении рака желудка применяется следующая таргетная терапия:
- HER2-таргетная терапия. Некоторые виды рака могут вырабатывать слишком много белка, называемого вторым рецептором фактора роста эпидермиса (HER2). Такой вид рака называется HER2-положительным раком.
- Антиангиогенная терапия. Направлена на остановку ангиогенеза, то есть, процесса создания новых кровеносных сосудов. Для развития опухоли нужны питательные вещества, поставляемые по кровеносным сосудам. Поэтому целью антиангиогенной терапии является «истощение» опухоли.
Иммунотерапия
Биологическая терапия (другое название) предназначена для повышения естественной защиты от рака. В ней используются вещества, вырабатываемые организмом или произведенные в лаборатории для улучшения, направления или восстановления функции иммунной системы.
Разные виды иммунотерапии могут вызывать разные негативные реакции. К общим побочным эффектам относятся кожные реакции, гриппоподобные симптомы, диарея и изменение веса.
Физические, эмоциональные и социальные последствия рака
Рак и его лечение вызывают физические симптомы и побочные эффекты, а также эмоциональные, социальные и финансовые последствия. Управление всеми этими эффектами называется паллиативной, или поддерживающей терапией. Это важная часть вашего лечения, не менее важная, чем терапия, направленная на замедление, остановку или устранения рака.
Паллиативная помощь направлена на улучшение самочувствия во время лечения путем контроля симптомов и поддержки немедицинских потребностей пациентов и их семей. Любой человек, независимо от возраста, типа и стадии рака, может получать такую помощь. Она является наиболее эффективной, если ее начать сразу же после диагностики болезни.
Паллиативное лечение очень разнообразно и часто включает медикаментозное лечение, изменение в питании, методы релаксации, эмоциональную и духовную поддержку и другие методы лечения (химиотерапия, хирургическое вмешательство или радиотерапия).
Метастатический рак желудка
Если опухоль распространяется в другую часть тела, за пределы органа, в котором она возникла, врачи называют это метастатическим раком. У специалистов существуют разные взгляды на оптимальный стандартный план лечения. В качества варианта лечения можно также рассмотреть клинические исследования.
Целью лечения на этой стадии обычно является продление жизни пациента и устранение симптомов, так как метастатический рак желудка считается инкурабельным. Любое лечение, включая химиотерапию или лучевую терапию, считается паллиативным. Основным видом онкопомощи является химиотерапия. Важно отметить, что исследования показали, что применение паллиативной химиотерапии может улучшить и качество, и продолжительность жизни.
Ремиссия и возможность выздоровления
Это состояние, при котором в организме невозможно обнаружить рак, и его симптомы также отсутствуют.
Ремиссия бывает временной или постоянной. Эта неопределенность вызывает у многих беспокойство по поводу возможного возвращения рака. Во многих случаях ремиссия бывает временной, поэтому важно обсудить с врачом вероятность возвращения онкопроцесса. Понимание риска рецидива и возможностей лечения поможет вам чувствовать себя более подготовленными.
Если рак возвращается после первичного лечения, он называется рецидивирующим. Может повторно проявиться в том же месте (местный), рядом (регионарный) или в другом месте (отдаленный). После проведения анализов вам следует обсудить с врачом дальнейшую онкопомощь. План лечения часто включает вышеописанные виды лечения, такие как хирургическое лечение, химиотерапия и лучевая терапия, но они могут использоваться в других сочетаниях или с другой интенсивностью. Иногда, если размер рецидивирующей опухоли невелик или ее распространение ограничено, то есть, при локализованном рецидиве, вам может быть предложено хирургическое лечение.
Если лечение не помогает
Рак не всегда возможно вылечить. Если заболевание нельзя вылечить или контролировать, заболевание называется прогрессирующим или терминальным.
Подобный диагноз – большой стресс, и многим очень трудно обсуждать прогрессирующий рак. Важно открыто и честно разговаривать с командой медицинской помощи, объясняя свои чувства, предпочтения и страхи. Медицинская команда обладает специальными навыками, опытом и знаниями для поддержки пациентов, их семей и всегда готова прийти на помощь.
Факторы риска и профилактика
Это все то, что увеличивает вероятность развития рака у человека. И хотя факторы риска зачастую влияют на развитие заболевания, большинство из них непосредственно не вызывают онкологию. Знание своих факторов риска и обсуждение их с врачом может помочь вам сделать более осознанный выбор образа жизни и медицинского обслуживания.
Следующие факторы повышают риск развития рака:
- Возраст. Новообразование чаще всего возникает у людей старше 55 лет. Большинство пациентов, у которых диагностирован рак желудка, старше 60-70 лет.
- Пол. У мужчин вероятность развития онкологии в два раза выше.
- Бактерии. Довольно распространенная бактерия, называемая Helicobacter pylori, или H. pylori, вызывает воспаление и язву желудка. Она также считается одной из основных причин онкопроцесса. Существует анализ на H. рylori, инфекцию можно лечить антибиотиками.
- Семейный анамнез/ генетическая предрасположенность. Люди, у которых родитель, ребенок или родной брат/сестра болели онкологией, отличаются более высоким риском заболевания. Некоторые наследственные генетические нарушения, такие как наследственный диффузный рак желудка, синдром Линча, наследственный рак молочной железы и яичников и семейный аденоматозный полипоз, повышают риск развития опухоли.
- Расовая / этническая принадлежность. Онкология чаще встречается у чернокожих, латиноамериканцев и азиатов, чем у белых.
- Диета. Диета с высоким содержанием соли связана с повышенным риском развития онкопроцесса. Сюда входят продукты, сохраняемые путем сушки, копчения, соления или маринования, а также продукты с высоким содержанием соли. Употребление в пищу свежих фруктов и овощей может способствовать снижению риска.
- Проведенные ранее операции или состояние здоровья. Люди, перенесшие операцию на желудке, пернициозную анемию или ахлоргидрию, имеют повышенный риск развития онкологии. Пернициозная анемия — это значительное уменьшение количества эритроцитов, вызванное тем, что желудок не способен правильно усваивать витамин B12. Хлоргидрия — это недостаток соляной кислоты в желудочном соке.
- Профессиональные факторы. Воздействие определенных видов пыли и паров повышает риск развития патологии.
- Табак и алкоголь. Употребление табака и злоупотребление алкоголем может повысить риск развития рака желудка.
- Ожирение. Избыточная масса тела повышает риск развития онкологии у мужчин. Непонятно, увеличивает ли ожирение риск развития рака желудка у женщины.
Последующее наблюдение и контроль
Лечение людей, у которых диагностирован рак, не заканчивается после завершения активной терапии. Ваши врачи будут продолжать проверять, не произошел ли рецидив рака, контролировать все возможные побочные эффекты и общее состояние здоровья. Это называется последующим наблюдением. Оно включает в себя регулярные медицинские осмотры и медицинские анализы. Врачи стремятся отслеживать выздоровление в последующие месяцы и годы.
Контроль рецидива
Целью последующего наблюдения является контроль рецидива. Болезнь рецидивирует из-за того, что в организме могут остаться небольшие области необнаруженных раковых клеток. Со временем эти клетки могут увеличиваться до тех пор, пока они не появятся в результатах анализов или не вызовут признаки и симптомы. Во время последующего наблюдения врач, знакомый с вашей историей болезни, может предоставить вам персональную информацию о риске рецидива. Ваш врач задаст конкретные вопросы о здоровье. Некоторым может потребоваться сдать анализы крови или пройти визуальную диагностику в рамках регулярного последующего наблюдения, но рекомендации по последующему наблюдению зависят от нескольких факторов, включая тип и стадию первоначально диагностированного рака и вид проведенного лечения.
Контроль долгосрочных и отложенных побочных эффектов
Люди, пережившие лечение, часто удивляются, что некоторые побочные эффекты могут сохраняться после периода лечения. Это долгосрочные побочные эффекты. Другие побочные эффекты, называемые отложенными, могут развиться спустя месяцы или даже годы. К долгосрочным и отсроченным последствиям могут относиться физические и эмоциональные изменения.
Рак желудка – Лечение рака желудка
Рак желудка
Что такое рак желудка?
Злокачественному перерождению могут подвергаться любые клетки, выстилающие стенку желудка изнутри. Раковая опухоль способна формировать разрастание или язву на внутренней оболочке органа либо проникает через все слои желудочной стенки. Самым распространенным видом (более 95%) рака желудка является аденокарцинома.
Обычно рак желудка развивается у людей в возрасте от 50 до 70 лет. Как правило, данная опухоль поражает мужчин.
Причины развития опухоли желудка
У пациентов с аденокарциномой желудка крайне часто обнаруживается инфицирование бактерией под название Хеликобактер пилори (Helicobacter pylori).
Тем не менее, у подавляющего большинства людей присутствие данного микроорганизма в желудке развитием злокачественной опухоли не сопровождается. Риск развития аденокарциномы желудка существенно увеличивается при злоупотреблении копчеными продуктами, соленым мясом и рыбой, маринованной пищей.
С другой стороны, большое количество в рационе овощей и фруктов, богатых витаминами С и А, снижает риск развития аденокарциномы желудка.
Симптомы и признаки
У большинства пациентов появляются такие неспецифические жалобы, как неприятные ощущения в области живота или нарушения пищеварения. В редких случаях, опухоль нарушает проходимость пищи из желудка в кишечник, поскольку представляет собой разрастание ткани. Следовательно, у пациента возникает рвота. Кроме этого, на фоне хронической кровопотери возможно появление симптомов анемии.
Диагностика желудка на рак
Обследование
Настороженность у врача должны вызвать общеклинические анализы крови, в которых обнаруживается анемия или дефицит эритроцитов (эритроцитопения). Другим немаловажным признаком аденокарциномы желудка считается появление крови в стуле.
Рентген. В ходе диагностики опухоли желудка назначается рентгеновское обследование с взвесью бария. Во время процедуры пациент выпивает жидкий раствор, содержащий барий. После этого проводится рентгеновское исследование для отображения контуров желудочной стенки, которое позволяет выявить изъязвление и новообразования. Затем требуется проведение эндоскопического исследования, в ходе которого в желудок через рот вводится оптоволоконный прибор, что позволяет также произвести биопсию тканей желудочной стенки.
Биопсия
Биопсия. Данная процедура неприятна, но длится всего 10-20 минут. Она проводится амбулаторно с использованием легких обезболивающих препаратов. В ходе биопсии удаляется небольшой участок ткани, которая затем исследуется под микроскопом. Это позволяет врачу сказать, является ли изъязвление или новообразование доброкачественным или злокачественным. В целом, точность эндоскопического исследования, по сравнению с рентгеноскопией с бариевой взвесью, более высока.
Рентгенография — выявление метастаз рака желудка. После постановки диагноза аденокарциномы желудка проводится рентгенография грудной клетки и КТ органов брюшной полости, что позволяет выявить метастазирование опухоли.
ЭФФЕКТИВНОСТЬ КОМБИНИРОВАННОГО ЛЕЧЕНИЯ С ПРИМЕНЕНИЕМ НЕОАДЪЮВАНТНОЙ ДИСТАНЦИОННОЙ ГАММА-ТЕРАПИИ ПРИ РАКЕ ДИСТАЛЬНОГО ОТДЕЛА ЖЕЛУДКА
ВВЕДЕНИЕ
Рак желудка (РЖ), несмотря на снижение заболеваемости, продолжает занимать ведущее место в структуре онкологической патологии населения в Украине и в мире [1, 11]. Украина входит в десятку стран мира с наиболее высокой заболеваемостью РЖ: ежегодно заболевают 14–16 тыс. человек и умирают 10,5–12,0 тыс. человек [10, 11]. По СНГ в среднем 5-летняя выживаемость больных РЖ не превышает 4%, а продолжительность жизни от момента установления диагноза составляет около 9,5 мес [4, 7, 13].
Существуют 2 основных пути повышения выживаемости при РЖ (параллельно с решением социальных вопросов) — улучшение ранней диагностики и усовершенствование методов лечения. Актуальность ранней диагностики РЖ связана с обратнопропорциональной зависимостью выживаемости от распространенности опухолевого процесса. Так, 5-летняя выживаемость при поражении только слизистой оболочки желудка составляет 90,3%, подслизистой — 71,3%, мышечной — 52,3%, серозной оболочки — 20,3% [12].
В Японии, вследствие проведения массового скрининга с применением комплекса современных диагностических методик, доля раннего РЖ среди больных, поступающих в стационар для лечения, увеличилась до 50% и более, а радикальные операции выполняются у 93% больных; в западных странах эти показатели составляют 8–15 и 50–75% соответственно [14, 17, 19].
В нашей стране, в сформировавшихся сложных социально-экономических условиях, при проведении профилактических осмотров комплексное применение современных методов диагностики недоступно, а обследование больных, уже предъявляющих жалобы, позволяет выявить РЖ на ранней стадии не более чем в 5% случаев [9, 12]. Таким образом, в Украине в 75% случаев РЖ выявляется в III– IV стадиях, что предопределяет неудовлетворительные результаты лечения и плохой прогноз [8].
Расчет на увеличение выживаемости при РЖ, исходя из возможностей улучшения ранней диагностики, имеет перспективу, однако на сегодняшний день комплексное применение терапевтических ме-
тодик является более актуальным методом помощи больным местно-распространенными формами РЖ. Крупные клинические исследования показали, что в структуре причин летальности от РЖ на долю локорегионарного рецидива приходится 32–44%, перитонеальной диссеминации — 43–44%, гематогенных метастазов — 34–54% [17, 19].
Хирургический метод лечения при РЖ, имея в своем арсенале операции от эндоскопических резекций при раннем раке до расширенных радикальных гастрэктомий при местно-распространенных формах заболевания, как самостоятельный метод, приблизился к максимуму своего развития. Пути улучшения отдаленных результатов лечения РЖ многие авторы закономерно связывают с разработкой комбинированных методов лечения, поскольку в этом направлении совершенно очевидна необходимость дополнить хирургическое лечение другими видами воздействия. Предупреждение развития рецидивов и метастазов возможно в значительной мере с помощью лекарственных и лучевых методов, нарушающих потенцию опухолевых клеток к репродукции и имплантации.
Попытка повлиять на карциному желудка лу-
чевой терапией (ЛТ) была впервые предпринята в 1896 г. V. Despeignеs, всего через год после открытия рентгеновских лучей. В дальнейшем ввиду неудовлетворительных результатов рентгенотерапии при РЖ как с паллиативной целью, так и дополнительно к операции и в связи с развитием значительных побочных реакций, установилось мнение о высокой радиорезистентности карциномы желудка. Однако в конце 60-х и начале 70-х годов ХХ века появились сведения о возможностях и перспективах развития ЛТ больных как с местно-распространенными, так и с генерализованными формами опухолей желудка [2, 3, 6, 15–20]. На сегодняшний день проведено большое количество клинических исследований с применением различных методик ЛТ при РЖ с положительными результатами. В то же время преимущество комбинированного метода лечения с применением предоперационной ЛТ по сегодняшний день не является общепризнанным. Не решены методологические аспекты применения ЛТ, такие как выбор доз и режимов облучения в зависимости от распространенности и локализации опухолевого процесса.
Цель нашего исследования — оценка эффектив-
ности и сравнение результатов комбинированного и хирургического лечения при раке нижней трети тела и антрального отдела желудка.
ОбъЕКТ И мЕТОДЫ ИССлЕДОВаНИя
В ретроспективное исследование включено 345 больных раком нижней трети тела и антрального отдела желудка, которые получали лечение в период с 1995 по 2002 г. в Днепропетровском областном клиническом онкологическом диспансере. Из них 91 пациент был пролечен комбини-
рованным методом с применением в неоадъювантном режиме дистанционной гамма-терапии (нДГТ) с последующим оперативным вмешательством. Контрольную группу составили 254 пациента, которые получали только хирургическое лечение. В исследование не вошли пациенты, у которых лучевое лечение было прервано, вследствие ухудшения общего состояния или прогрессирования основного заболевания. ЛТ проводили больным с распространенностью опухолевого процесса Т3N+M0 и Т4NхM0 при отсутствии противопоказаний к ее проведению (декомпенсированный стеноз привратника, выраженная кахексия и анемия, кровотечение из опухоли в анамнезе). Клинический диагноз у всех пациентов был установлен до начала лечения в соответствии с клинической классификацией с достоверностью С1 на основании данных анамнеза, клинической картины, фиброэзофагогастродуоденоскопии с гастробиопсией и гистологическим исследованием биоптата, рентгенографии желудка, рентгенографии органов грудной полости, сонологического исследования органов брюшной полости (печень, забрюшинные лимфоузлы) и малого таза.
Применяли методику широкопольного облу-
чения с двух встречных противолежащих фигурных полей на аппарате Рокус М в режиме среднего фракционирования дозы (РОД 4 Гр) 3 раза в неделю, до СОД 40–43 Гр. В поле облучения включали область первичной опухоли, пути регионарного метастазирования, парааортальные лимфоузлы и лимфоузлы ворот печени. Оперативное вмешательство выполняли через 21–28 дней после окончания нДГТ (в зависимости от переносимости последней и выраженности постлучевых реакций). Интраоперационно оценивали распространенность опухолевого процесса в брюшной полости с выполнением объема оперативного вмешательства в соответствии с полученными данными. Стадию устанавливали у всех больных в соответствии с патогистологической классификацией TNM (5-е издание) на основании гистологического исследования удаленного во время операции материала. В работе анализировали распространенность опухолевого процесса, объем и характер выполненных оперативных вмешательств, степень дифференцировки опухоли, показатели лечебного патоморфоза, а также показатели выживаемости пролеченных больных с учетом распределения пациентов по полу, возрасту и стадиям заболевания. Оценку достоверности различий полученных результатов осуществляли с использованием непараметрического критерия χ2.
рЕЗулЬТаТЫ И ИХ ОбСужДЕНИЕ
В основную группу включен 91 пациент, в контрольную — 254 пациента. В основной группе достоверно преобладают лица мужского пола (р = 0,043) (табл. 1).
Таблица 1 Распределение пациентов основной и контрольной групп
по полу
Группа | Мужчины | Женщины | ||
Абс. число | % | Абс. число | % | |
Основная | 67 | 73,6 ± 4,6 | 24 | 26,4 ± 4,6 |
Контрольная | 155 | 61,0 ± 3,1 | 99 | 39,0 ± 3,1 |
При сравнительном анализе обеих групп достоверных различий по возрасту не выявлено. Наибольшее количество пациентов относилось к возрастной категории от 50 до 69 лет (табл. 2).
Таблица 2 Распределение пациентов основной и контрольной групп
Возраст па- циентов, лет | Основная группа | Контрольная группа | ||
Абс. число | % | Абс. число | % | |
20–29 | 0 | 0,0 ± 0,0 | 5 | 2,0 ± 0,9 |
30–39 | 1 | 1,1 ± 1,1 | 20 | 7,9 ± 1,7 |
40–49 | 15 | 16,5 ± 3,9 | 37 | 14,6 ± 2,2 |
50–59 | 31 | 34,1 ± 5,0 | 70 | 27,5 ± 2,8 |
60–69 | 35 | 38,5 ± 5,1 | 99 | 39,0 ± 3,1 |
70–79 | 9 | 9,8 ± 3,1 | 23 | 9,0 ± 1,8 |
по возрасту
Несмотря на значительную первичную распространенность опухолевого процесса, проведение нДГТ позволило повысить количество хирургических вмешательств в радикальном объеме (71,5% в основной группе в сравнении с 67,7% в контрольной). Отмечено статистически значимое преобладание количества ГЭ в основной группе при I–II стадиях (22,20 ± 6,93 против 7,89 ± 3,09%, р = 0,05) и в целом (26,37 ±
4,62 против 15,35 ± 2,26% в контрольной, р = 0,04). Этот факт объясняется тем, что объем оперативного вмешательства планировали до начала ЛТ и не изменяли при регрессе опухолевого очага и интраоперационной возможности выполнения меньшего объема резекции после проведения нДГТ.
В структуре послеоперационных осложнений и летальности достоверных различий между группами не отмечали (табл. 4).
До начала терапии в основной и контрольной группах болевой синдром имел место у 48 (52,75 ± 5,23%) и 96 (37,8 ± 3,04%, р = 0,016), похудание —
у 68 (74,73 ± 4,56%) и 183 (72,05 ± 2,82%), явления
желудочной диспепсии — у 21 (23,08 ± 4,42%) и 63 (24,8 ± 2,71%), пальпируемую опухоль в эпигастрии определяли у 5 (5,49 ± 2,39%) и 11 (4,33 ± 1,28%) пациентов соответственно.
ЛТ пациенты переносили удовлетворительно. В ходе лучевого лечения у 12 (13,19 ± 3,55%) пациентов отмечали тошноту и рвоту, которые купировали введением антиэметиков за 15–20 мин до сеанса нДГТ; явления лучевого энтероколита имели место у 4 (4,4 ± 2,15%) пациентов, у 85 (93,41 ± 2,6%) на коже наблюдались проявления сухого эпидермита. На момент проведения оперативного вмешательства все постлучевые реакции были купированы. В результате проведения нДГТ отмечалось значительное снижение выраженности клинической симптоматики. После реализации эффекта ЛТ к моменту проведения оперативного вмешательства болевой синдром отмечался у 32 (35,16 ± 5,01%, р = 0,025 в сравнении с показателем до лечения), 18 пациентов набрали в весе 5 кг и более, явления желудочной диспепсии имели место у 8 (8,79 ± 2,97%, р = 0,015 в сравнении с частотой до лечения).
Объем оперативного вмешательства зависел от интраоперационных данных. В резектабельных случаях выполняли субтотальную дистальную резекцию желудка (СРЖ) или гастрэктомию (ГЭ), при нерезектабельном процессе — пробную лапаротомию или симптоматические вмешательства (табл. 3).
Таблица 3 Объемы выполненных оперативных вмешательств
Резектабельные случаи | |||
Группа | Всего, n (%) | СРЖ, n (%) | ГЭ, n (%) |
Основная | 65 (71,48 ± 4,74) | 41 (45,05 ± 5,22) | 24 (26,37 ± 4,62) |
Контрольная | 172 (67,72 ± 2,93) | 133 (52,36 ± 3,13) | 39 (15,35 ± 2,26) |
Нерезектабельные случаи | |||
Группа | Всего, n (%) | Пробная лапаротомия, n (%) | Симптоматические вмеша- тельства, n (%) |
Основная | 26 (28,57 ± 4,74) | 19 (20,88 ± 4,26) | 7 (7,69 ± 2,79) |
Контрольная | 82 (32,28 ± 2,93) | 54 (21,26 ± 2,57) | 28 (11,02 ± 1,97) |
Таблица 4 Частота и характер послеоперационных осложнений и летальность
Осложнения, летальность | Основная группа | Контрольная группа | ||
Абс. число | % | Абс. число | % | |
Несостоятельность швов анастомоза | 3 | 3,30 ± 1,87 | 7 | 2,76 ± 1,03 |
Перитонит | 1 | 1,10 ± 1,09 | 5 | 1,97 ± 0,87 |
Абсцесс брюшной полости | 1 | 1,10 ± 1,09 | 3 | 1,18 ± 0,68 |
Нагноение лапаротом- ной раны | 4 | 4,40 ± 2,15 | 11 | 4,33 ± 1,28 |
Кровотечение | 2 | 2,20 ± 1,54 | 3 | 1,18 ± 0,68 |
Пневмония, плеврит | 9 | 9,89 ± 3,13 | 37 | 14,57 ± 2,21 |
Панкреатит | 0 | 0,00 ± 0,00 | 1 | 0,39 ± 0,39 |
Спаечная кишечная непро- ходимость | 1 | 1,10 ± 1,09 | 0 | 0,00 ± 0,00 |
ТЭЛА | 2 | 2,20 ± 1,54 | 5 | 1,97 ± 0,87 |
Послеоперационная летальность | 2 | 2,20 ± 1,54 | 6 | 2,36 ± 0,95 |
Несостоятельность швов анастомоза имела место при выполнении 8 оперативных вмешательств в объеме ГЭ и только в 2 случаях после СРЖ. При выполнении ГЭ с наложением эзофагоеюноанастомоза по методике Г.В. Бондаря несостоятельности швов не было. В 2 случаях (по 1 в каждой группе) исходом несостоятельности швов анастомоза стало формирование абсцесса в брюшной полости. Еще 2 случая абсцесса в контрольной группе развились в результате неадекватного дренирования левого поддиафрагмального пространства после спленэктомии. Возникновение в 1 случае панкреатита связано с выполнением комбинированной ГЭ со спленэктомией и резекцией поджелудочной железы. Послеоперационная летальность связана преимущественно с тромбоэмболией легочной артерии (ТЭЛА) (2 летальных исхода в основной группе и 5 из 6 в контрольной).
После стадирования процесса обращает на себя внимание в основной группе большая часть пациентов с I B стадией заболевания (18,68 ± 4,09 в сравнении с 11,02 ± 1,97% в контрольной, р < 0,1) и меньшая часть пациентов с III B стадией (5,49 ± 2,39 в сравнении с 12,20 ± 2,05%, р = 0,1) за счет достоверно большего количества в основной группе пациентов с распространенностью опухолевого процесса pN0 (39,56 ± 5,13 против 23,62 ± 2,67%,
р = 0,006) и меньшего количества пациентов с pN2 (12,09 ± 3,42 против 31,89 ± 2,92%, р < 0,0001). При
этом достоверных различий между группами по критерию рТ не выявлено. В структуре основной и контрольной групп Т3–Т4 опухолевые процессы составляют 76,92 ± 4,42 и 78,35 ± 2,58% соответственно. В основной группе была ниже частота пациентов с III–IV стадией заболевания (59,34 ± 5,15 против 70,8 ± 2,87%, р = 0,081 ). Учитывая первичный критерий для отбора пациентов в основную группу (распространенность опухоли Т3N+M0 и Т4NхM0), большое количество ГЭ при I–II стадиях заболевания, а также преобладание в основной группе ранних стадий процесса могут быть связаны с эффектом уменьшения стадии после проведенной ЛТ.
Объективное подтверждение этому можно получить при анализе лечебного патоморфоза опухолей пациентов основной группы. Биологическое действие ЛТ направлено, прежде всего, на торможение размножения опухолевых клеток и состоит в прямом или опосредованном повреждении клеточных мембран, органелл и, особенно, ядерного аппарата. Реализация действия ЛТ приводит к непосредственной интерфазной гибели опухолевых клеток и к отсроченным постлучевым повреждениям, обусловливающим торможение опухолевого роста и гибель неопластических клеток последующих поколений. Типичные стойкие изменения, которые отражают закономерности изменчивости опухолевого процесса, детерминированные лечением, относятся к понятию лечебного патоморфоза (ЛП) опухолевой болезни [5].
При проведении нДГТ ЛП III–IV степени отмечали в 47,69 ± 6,20% случая. Наиболее часто ЛП III–IV (рис. 1, 2) степени был прослежен в опухолях с умеренной степенью дифференцировки (61,11 ± 11,49%), немного реже при недифференцированных (рис. 3, 4) опухолях (50,00 ± 15,81%). При низкой дифференцировке опухолей дистального отдела желудка ЛП II–IV степени составил 69,44 ± 7,68%. Принимая во внимание безусловную научную и практическую целесообразность изучения ЛП опухолей, не следует опускать, что морфологический анализ опухолевого очага (как локального проявления опухолевой болезни) не дает в полной мере целостного представления об эффективности лечения больного. Поэтому результаты оценки ЛП опухолей по возможности должны быть сопоставлены со сроками выживаемости, которые в конечном счете имеют главенствующее значение для интегральной оценки эффективности лечения опухолевой болезни. При анализе непосредственных результатов лечения отмечено снижение показателей летальности до 1 года при проведении нДГТ, особенно в зависимости от степени дифференцировки опухоли: при G3 24,00% против 34,62%, при G2 5,88%
против 14,71%.
Рис. 1. Умеренно дифференцированная аденокарцинома желудка. а — гастробиоптат. б — патоморфоз III степени после ЛТ. Окраска гематоксилином-эозином
Рис. 2. Умеренно дифференцированная аденокарцинома желудка. а — гастробиоптат. б — патоморфоз IV степени после ЛТ. Окраска гематоксилином-эозином
Рис. 3. Низкодифференцированная аденокарцинома желудка. а — гастробиоптат. б — патоморфоз III степени после ЛТ. Окраска гематоксилином-эозином
Рис. 4. Низкодифференцированная аденокарцинома желудка с перстневидноклеточным компонентом. а — гастробиоптат. б — патоморфоз IV степени после ЛТ. Окраска гематоксилином-эозином
ВЫВОДЫ
Методика комбинированного лечения при раке нижней трети тела и антрального отдела желудка с применением нДГТ позволяет достоверно снизить выраженность клинических проявлений опухолевого процесса.
Применение нДГТ позволило улучшить показатели резектабельности при оперативном лечении и не повлияло на течение раннего послеоперационного периода.
Несмотря на то что первичный отбор пациентов в основную группу проводился по критерию Т3N+M0 и Т4NхM0, при послеоперационном стадировании (рТрN) у большинства пациентов из этой группы установлен диагноз I–II стадии, что может свидетельствовать об эффекте понижения стадии заболевания после проведенной ЛТ.
При проведении нДГТ ЛП III–IV степени выявлен в опухолях 47,69 ± 6,20% пациентов основной группы, причем его наиболее выраженные явления отмечали у больных с умеренной и низкой степенью дифференцировки опухолевой ткани.
Проведение нДГТ позволяет снизить показатели летальности до года, особенно у пациентов с умеренной и низкой степенью дифференцировки опухоли.
лИТЕраТура
Аксель ЕМ, Двойрин ВВ, Трапезников НН. Заболеваемость злокачественными заболеваниями и смертность от них населения стран СНГ в 1995 г. Москва, 1996. 286 с.
Андросов НС, Фирсова ПП, Андросова РА. Применение лучевой терапии в комплексном лечении рака желудка. Материалы V съезда рентгенол радиол УССР. Киев, 1972: 238–40.
Корнев ИИ, Барканов АИ, Попова ЗП. Лучевая терапия как один из методов лечения рака культи желудка. Вест хирургии им. Грекова 1972; (2): 40–3.
Лемешко ЗА. Ультразвуковое исследование желудка. Руководство по гастроэнтерологии. В 3 т. Т 1. Болезни пищевода и желудка / Под ред ФИ Комарова, АЛ Гребенева, АА Шептулина / Москва: Медицина, 1995: 313–31.
Лушников ЕФ. Лечебный патоморфоз опухолей. В кн: Паталогоанатомическая диагностика опухолей человека / Под ред НА Краевского, АВ Смолянникова, ДС Саркисова / 4-е изд перераб и доп. Москва: Медицина, 1993. 560 с.
Симонов НН, Гуляев АВ, Правосудов ИВ и др. Приоритетные направления и перспективы в лечении рака желудка. Вопр онкологии 1998; 44 (2): 246–50.
Переслегин ИА, Саркисян ЮХ. Возможности и перспективы развития лучевой терапии опухолей желудочнокишечного тракта. Мед радиол 1974; (4): 7–12.
Пиманов СИ, Крылов ЮВ. Совершенствование ультразвуковой диагностики рака желудка. Вопр онкологии 1991; (5): 588–92.
Поддубный БК, Кувшинов ЮП, Кашин СВ и др. Современные эндоскопические методики диагностики и лечения предопухолевой патологии и раннего рака желудка. Росс ж гастроэнтерол, гематол, колопроктол 2002; 12 (3): 52–6.
Пономарев ВА. Возможности различных методов обследования в диагностике рака желудка. В кн: Злокачественные опухоли желудочно-кишечного тракта. Челябинск, 1987: 14–8.
Попович АЮ, Бондарь ВГ, Заика АИ. Рак желудка сегодня: профилактика, диагностика, лечение. Международн мед журн 2002; 8 (4): 118–23.
Рак в Украине, 2003–2004. Бюл национального канцер-реестра Украины. Киев, 2005; (6).
Чиссов ВИ, Старинский ВВ, Петрова ГВ. Злокачественные заболевания в России в 2002 г. ( заболеваемость и смертность). Москва, 2004: 4.
Cuschies A, Weeden S, Fielding J, et al. Patient survival after D1 resection for gastric cancer: long-term results of the MKC randomized surgical trial. Brit J Cancer 1999; 79: 1522–30.
Despeignes V. Obervation concernant uncas cancer de l’estomac traite par les rayons Rentgen. Lyon med 1896; 82: 428–503.
Grauss G, Reisner K, Haase W. Die Strahleutherapie des inoperablen Magen Karzinoms. Stahlen ther 1982; 158: 524.
Maechara Y, Hasuda S, Koda T, et al. Postoperative outcome and sites of reccurence in patients following curative resections of gastric cancer. Brit J Surg 2000; 87: 353–7.
Mantell BS. Radiotherapy for dysphagia den to gastric carcinoma. Brit J Surg 1982; 69 (2): 69–70.
Yoo CY, Noh SH, Shin DW, et al. Reccurens following curative resection for gastric carcinoma. Brit J Surg 2000; 87: 236–42.
Zuppinger A. Spezielle Strahlentherapie maligner tumoren. Spinger, Berlin–Heidelberg–New York, 1972. 543 s.
что нам ожидать от новых методов лечения?
Новости онкологии
08.04.2019
Рак желудка: что нам ожидать от новых методов лечения?
Рак пищевода и рак желудка – это агрессивные онкологические заболевания, в лечении которых наступает новая эра. Роль некоторых молекулярных механизмов, как, например, факторов VEGF, EGFR, рецепторов фактора роста фибробластов, PIK3CA и PARP-1, были изучены, и в ближайшем будущем ожидается разработка новых препаратов на основе этих сигнальных путей. Согласно отчету проекта «Атлас ракового генома» в 80% случаев опухолей, вызванных вирусом Эпштейна-Барр (EBV), и в 42% случаев опухолей, ассоциированных с микросателлитной нестабильностью, имеются мутации в гене PIK3CA. Это дает возможность предположить, что данный молекулярный механизм можно использовать для разработки нового вида системной терапии рака желудка. Следует отметить, что при раке желудка обнаруживается повышенная экспрессия PARP-1, что может свидетельствовать о более поздней стадии заболевания и о более неблагоприятном прогнозе. Кроме того, при раке желудка наблюдаются такие явления, как экспрессия PD-L1, высокая микросателлитная нестабильность и дефект репарации неспаренных оснований. Это позволяет думать, что у подобных пациентов иммунотерапия может также играть важную роль. В данной статье обсуждаются основные направления возможных новых видов лечения для пациентов с раком пищевода и раком желудка, которые могут появиться в ближайшем будущем.
Относительная частота рака желудка снизилась в последние десятилетия: если в 1975 году это был самый частый вид рака, то в настоящий момент рак желудка находится на пятом месте по распространенности онкологических заболеваний. Также рак желудка является третьей ведущей причиной смерти от онкологических заболеваний по всему миру у пациентов обоих полов [1,2]. Кроме того, рак желудка является ведущим видом онкологических заболеваний, возникших на фоне инфекций [3], так как в его этиологии играют роль Helicobacter pylori и вирус Эпштейна-Барр (EBV). Рак желудка в два раза чаще встречается у мужчин, чем у женщин. Его распространенность в мире неодинакова: самая высокая частота возникновения и смертности наблюдается в странах Азии, таких как Корея, Япония и Китай, а самый низкий показатель – в странах Запада, в частности, в Северной Америке, где он является одним из наименее распространенных видов онкологических заболеваний [4,5]. Южная Европа, где данное заболевание находится на шестом месте по распространенности злокачественных заболеваний, также считается регионом с высоким риском [6]. Среди факторов риска развития рака желудка такие факторы, как высокое потребление переработанных продуктов из красного мяса или копченых консервированных продуктов, курение, большое потребление алкоголя и инфекция Helicobacter pylori, которая является основной причиной возникновения рака внекардиальных отделов желудка; однако в странах с низким доходом, где высока частота встречаемости рака желудка, было проведено очень небольшое количество исследований [7].
По гистологическому признаку аденкарциномы желудка подразделяются на кишечный тип (85-90%) и диффузный тип (10-15%). Большинство случаев желудочных аденокарцином являются спорадическими (90-95%), и только в 5-10% случаев отмечается семейная предрасположенность. С анатомической точки зрения опухоли проксимального отдела более распространены в странах Запада, а опухоли вне проксимального отдела желудка чаще встречаются в странах Азии [6]. Опухоли проксимального отдела желудка, которые распространяются за пределы желудочно-пищеводного перехода, по системе стадирования Американского объединенного комитета по раку (AJCC) относятся к раку пищевода, соответственно подход к их лечению такой же, как при раке пищевода [8].
МОЛЕКУЛЯРНАЯ КЛАССИФИКАЦИЯ
Традиционно рак желудка подразделяется на кишечный и диффузный гистологические подтипы по так называемой классификации Lauren, но наблюдается и смешанный подтип [9]. Тщательный анализ драйверных мутаций в желудочных аденокарциномах выявил, что в развитии и прогрессировании этого вида рака принимает участие множество генов, в том числе TP53, ARID1A, PIK3CA и RHOA [10-12]. Некоторые из этих мутаций ассоциируются с определенным видом рака желудка; например, мутации RHOA встречаются практически исключительно при диффузном типе рака желудка. Кроме того, встречаются такие генетические аберрации, как амплификация генов ERBB2, FGFR2, MET и KRAS, приводящие к активации нисходящего сигнального пути рецептора тирозинкиназы и RAS, что открывает новые возможности для таргетной терапии (см. ниже). Однако в этом случае, как и при других типах аденокарцином, ответ на лечение монотаргетными препаратами часто бывает неудовлетворительным, что предполагает более комплексный подход и необходимость поиска дополнительных биомаркеров.
В своей основной публикации проект «Атлас ракового генома» (АРГ) предлагает разделять раковые опухоли желудка в зависимости от вида генетических нарушений на четыре молекулярных подтипа: EBV-ассоциированные опухоли (с повторными мутациями PIK3CA, крайне высокой степенью гиперметилирования ДНК и с амплификацией JAK2, PD-L1 и PD-L2), опухоли, обусловленные микросателлитной нестабильностью (MSI), генетически стабильные опухоли и опухоли с хромосомной нестабильностью (т.е. опухоли с выраженной анеуплоидией и с фокальной амплификацией гена рецептора тирозинкиназ) [13]. Чтобы объединить ситуации не только геномных аберраций, но и эпигенетических модификаций и гетерогенность микроокружения, в том числе, свойства иммунного инфильтрата и статус активации стромы, была разработана подробная классификация на основе экспрессии генов. Первые исследования были направлены на изучение профиля генной экспрессии, ассоциированной с раком кишечного типа и с диффузным раком желудка [14]. Tan et al [15] использовали репрезентативные клеточные линии для создания профилей, которые позволяли бы различить два подтипа рака желудка на основе данных экспрессии генов. Такое различение имеет также прогностическую ценность, поскольку клеточные линии, характерные для кишечного типа, как правило, отвечали на терапию оксалиплатином, тогда как клеточные линии диффузного рака желудка лучше отвечали на терапию цисплатином. В дальнейшем эта классификация была расширена и было определено три подтипа: пролиферативный тип, метаболический тип и мезенхимальный тип [16]. В этом случае ответ разных подтипов на терапию также отличался: опухоли желудка мезенхимального подтипа были чувствительны к применению ингибиторов PIK3CA, AKT и mTOR, а метаболический тип рака желудка был особо чувствителен к терапии фторурацилом. Позднее Азиатская группа по изучению рака (ACRG – Asian Cancer Research Group) предложила другую классификацию на основе экспрессии генов. В этой классификации было четыре подтипа опухолей: тип опухолей с микросателлитной нестабильностью, опухоли мезенхимоподобного типа, а также p53-активный и p53-неактивный типы опухолей [17]. Клиническое значение этих классификаций лучше всего показано для классификаций АРГ и ACRG.
Что касается классификации АРГ, наилучший прогноз был у опухолей EBV-ассоциированного типа, на втором месте были опухоли с микросателлитной нестабильностью и с хромосомной нестабильностью, а опухоли с геномной нестабильностью ассоциировались с наихудшим прогнозом [18]. Классификация ACRG также продемонстрировала прогностическую ценность в нескольких когортных исследованиях, поскольку было выявлено, что подтип опухолей с микросателлитной нестабильностью ассоциируется с хорошим прогнозом, а мезенхимоподобный тип – с неблагоприятным исходом заболевания. В самом деле, определение подтипа опухоли (по классификации АРГ или ACRG) может помочь с определением тактики лечения, прогноза и в исследовании новых видов таргетной терапии.
Опухоли с хромосомной нестабильностью представляют 50% от всех случаев рака желудка [18]. При исследовании этого вида опухолей выявляется повторная амплификация таких генов, как HER2, EGFR, MET, CCNE1, CCND1, CDK6, VEGFA и FGFR2, которые могут представлять собой потенциальную мишень.
Подгруппа с высоким уровнем MSI составляет 22% всех случаев рака желудка и характеризуется повышенным уровнем мутаций и гиперметилирования. Медиана возраста при данном виде опухолей составляет 72 года, большинство пациентов (56%) – женщины. Более высокий уровень мутаций повышает вероятность образования неоантигенов, по этой причине опухоли с высоким уровнем MSI представляют собой потенциальную мишень для иммунотерапии [18,19].
Генетически стабильные опухоли составляют 20% всех случаев рака желудка. При этом подтипе могут обнаруживаться отдельные генетические изменения, такие как мутация гена сигнального пути RHOA, гибридный ген CLDN18-ARHGAP26 и амплификация гена рецептора фактора роста фибробластов (FGFR) 2 и гена VEGFA [5].
EBV-ассоциированный подтип, как правило, локализован на дне или в теле желудка, чаще встречается у мужчин (81%) и составляет 9% от всех злокачественных опухолей желудка. Данный вид опухоли характеризуется высоким уровнем гиперметилирования промоторов ДНК, повышенной экспрессией PD-L1 и PD-L2, амплификацией JAK2 и мутацией гена PIK3CA. Таким образом, повышенная экспрессия PD-L1 и PD-L2 повышает возможности для иммунной терапии данной подгруппы опухолей, равно как и опухолей с высокой микросателлитной нестабильностью. Амплификация гена JAK-2 и мутации в гене PIK3CA также могут служить возможными мишенями для терапии у данной группы пациентов (рис. 1).
Рисунок 1. Молекулярные механизмы и наиболее перспективные биомаркеры при раке желудка.
Сокращения: ACK1 – активированная Cdc42-ассоциированная киназа 1; AQP3 – аквапорин 3; BMP2 – костный морфогенетический белок-2; BMP4 – костный морфогенетический белок-4, CCND1 – циклин D1; CCNE1 – циклин E1; CDh2 – ген кадгерина-1; CDK6 – циклинзависимая протеинкиназа 6; CIMP – фенотип метилирования CpG-островков; EphA2 – эритропоэтинпродуцирующий гепатоцеллюлярный рецептор A2; FGFR2 – рецептор фактора роста фибробластов 2; hMLh2 – ген человека, кодирующий белок MLh2; p16 – ген-суппрессор опухолевого роста p16; MET – эпителиально-мезенхимальный переход; PIK3CA – ген, кодирующий PI3K; PLA2G2A – фосфолипаза A2 группы IIA; RUNX3 – транскрипционный фактор RUNX3 домена runt; SULF2 – ген SULF2.
ЛЕЧЕНИЕ
В 2017 году рак желудка составлял 1,7% от всех случаев рака в США, ежегодно здесь регистрируют 28 000 новых случаев. (В России в общей структуре онкологической заболеваемости рак желудка составлял 6,2% в 2016 году, было зарегистрировано 37 135 новых случаев – прим.) Показатель относительной пятилетней выживаемости в США составлял 67,2% при локализованной форме заболевания, 30,7% в случае местнораспространенного рака и 5,2% при метастатической болезни.
В США примерно 50% пациентов диагноз рака ставится на поздних стадиях заболевания, однако в некоторых странах, таких как Япония и Южная Корея, где скрининговые обследования являются рутинной процедурой, ранняя диагностика чаще имеет место [2]. Продолжительность пятилетней общей выживаемости (ОВ) при метастатическом раке желудка колеблется от 3 месяцев при проведении только симптоматической терапии до 16 месяцев в случае пациентов, имевших возможность принять участие в клинических исследованиях; таким образом, рак желудка остается одной из проблем в онкологии, решить которую еще только предстоит [20]. В большинстве стран Запада рак желудка и рак дистального отдела пищевода часто объединяют, применяя к ним единый подход в лечении и единые критерии включения пациентов в клинические исследования. В США рак пищевода является пятым по частоте раком желудочно-кишечного тракта, при этом ежегодно регистрируется 16 940 новых случаев. В мире это шестой по распространенности вид рака [21]. Примерно половина пациентов узнает о диагнозе рака пищевода на этапе, когда опухоль является неоперабельной или когда имеются метастазы. Терапия таких пациентов сводится к лечению дисфагии и других симптомов заболевания, улучшению качества жизни и продлению жизни. За прошедшие два десятилетия был достигнут умеренный успех в лечении неоперабельного рака без метастазов у пациентов, которым не показано хирургическое лечение, и у пациентов с нерезектабельной опухолью при местно-распространенном раке. В случае метастатического рака пищевода в качестве терапии первой линии было разработано несколько двухкомпонентных или трехкомпонентных режимов химиотерапии. Более того, за последние несколько лет были опубликованы отдаленные результаты нескольких крупных рандомизированных исследований III фазы с применением дополнительной таргетной терапии, которые могут повлиять на имеющиеся в настоящее время стандарты лечения и на дальнейшее направление научных исследований [21]. В данной статье мы бы хотели обсудить возможные терапевтические подходы в будущем, а также применение биомаркеров в лечении рака пищевода и рака желудка на поздних стадиях заболевания.
Какие методы лечения рака желудка на поздних стадиях существуют сегодня?
В настоящий момент лечение рака желудка на поздних стадиях представляет собой серьезную проблему для онкологов по всему миру. Режимы химиотерапии, в том числе различные схемы с препаратами платины, фторпиримидинами, таксанами и антрациклинами, являются основой терапии первой линии при лечении этого вида рака на поздних стадиях [22,23]. Тем не менее, в последние годы в этот стандарт были включены некоторые новые виды терапии. Исследования показали, что пациенты с HER2-позитивным раком желудка демонстрируют гораздо лучшие результаты лечения при добавлении трастузумаба к комбинации платины с фторпиримидином [24]. Кроме того, по результатам клинических исследований III фазы RAINBOW и REGARD рамуцирумаб, представляющий собой антиангиогенное моноклональное антитело, был одобрен в виде монотерапии или в комбинации с паклитакселом в качестве терапии второй линии для лечения рака желудка [25,26]. Ингибитор тирозинкиназы (ТКИ) апатиниб, блокирующий VEGFR-2, продемонстрировал определенную эффективность у пациентов с раком желудка на поздних стадиях заболевания и с метастатическим раком желудка, резистентным к химиотерапии, что позволяет рассматривать его как возможный препарат третьей или последующих линий терапии [26]. Но, несмотря на все вышеизложенное, роль препаратов таргетной терапии в лечении рака желудка остается ограниченной. Тем не менее, дальнейшие исследования в этой области могут сделать терапию пациентов с раком желудка более эффективной.
Новые мишени и новое лечение
HER2
Гиперэкспрессия HER2 при раке желудка наблюдается в 9-23% случаев и встречается чаще при кишечном подтипе рака. Прогностическая ценность данного маркера остается пока неясной, однако анализ на HER2 методом модифицированного иммуногистохимического исследования следует делать всем пациентам, которым был диагностирован рак желудка с метастазами [27]. После получения крайне успешных результатов для рака молочной железы этот рецептор стал объектом изучения различных клинических исследований рака желудка.
В исследовании ToGA медиана ОВ составила 13,8 месяца у тех пациентов, которые были распределены в группу лечения трастузумабом в дополнение к химиотерапии, и 11,1 месяца в группе пациентов, получавших только химиотерапию. По результатам этого исследования Управление по надзору за качеством пищевых продуктов и медикаментов США (Food and Drug Administration – FDA) в 2010 г. одобрило трастузумаб в комбинации с химиотерапией в качестве еще одного возможного стандарта лечения пациентов с HER2-позитивным раком желудка или раком гастроэзофагеального перехода (ГЭП) на поздних стадиях [24]. Более того, в настоящее время проводится ряд исследований, изучающих методы лечения HER2-позитивных пациентов различными комбинациями моноклональных антител, таких как трастузумаб, пертузумаб, TDM-1 или ТКИ лапатиниб, в сочетании с химиотерапией или с лучевой терапией (ЛТ). Таким образом, у различных комбинаций таргетных препаратов при лечении HER2-позитивных видов рака есть большой клинический потенциал. В настоящее время на сайте ClinicalTrials.gov зарегистрировано более 118 клинических исследований, изучающих терапию HER2-позитивного рака желудка. Информация об отдельных клинических исследованиях, которые авторы данной статьи сочли значимыми, приведена в таблице 1.
Таблица 1. Клинические исследования III фазы по изучению препаратов для терапии рака желудка с опубликованными результатами (опубликована в Газете RUSSCO №4 – 2019 (см. архив)).
В 2017 г. Doi et al. [28] опубликовали любопытные данные клинического исследования I фазы, которое изучало безопасность и противоопухолевую активность лекарственного средства трастузумаб дерукстекан, который является конъюгатом антитела к HER2 и препарата, при лечении пациентов на поздних стадиях рака молочной железы, рака желудка и гастроэзофагеального рака. Doi et al. оценивали данные 23 пациентов, у 10 (43%) из которых отмечался объективный ответ на терапию, а у 21 (91%) был достигнут контроль опухолевого процесса. Самыми частыми видами токсичности степени 3 и 4 были лимфопения, нейтропения и анемия. Таким образом, конъюгат трастузумаб дерукстекан продемонстрировал выраженную противоопухолевую активность в случае опухолей с гиперэкспрессией HER2. Необходимо дальнейшее проведение исследований II и III фазы, чтобы оценить роль этого препарата в лечении пациентов с РПЖ [28].
Следует подчеркнуть, однако, что, в отличие от рака молочной железы, результаты таргетной терапии HER2-позитивных опухолей у пациентов с РПЖ не были стабильно положительными. В недавно проведенном исследовании JACOB (NCT01774786) 780 пациентов с HER2-позитивным метастатическим или местнораспространенным неоперабельным раком ГЭП или раком желудка получали в качестве терапии первой линии трастузумаб в комбинации с химиотерапией и с пертузумабом либо без него. К сожалению, в данном исследовании не было обнаружено преимущества в ОВ у пациентов, получавших терапию комбинацией пертузумаб, трастузумаб и химиотерапия, по сравнению с пациентами, получавшими трастузумаб, химиотерапию и плацебо. ОВ в первой группе составила 17,5 месяца, а в группе плацебо – 14,2 месяца (отношение рисков [Hazard ratio, HR] 0,84; 95% ДИ 0,71-1,00; p=,0565) [40]. Помимо этого, были проведены исследования TRIO-013/LOGIC и TyTan, в которых участвовали 545 пациентов. Медиана ОВ в группах лечения лапатинибом и плацебо составила 12,2 мес. (95% ДИ 10,6-14,2 мес.) и 10,5 мес. (95% ДИ 9,0-11,3 мес.) соответственно. Таким образом, статистически значимой разницы выявлено не было (HR 0,91; 95% ДИ 0,73-1,12). Несмотря на то, что исследования TRIO-013/LOGIC и TyTan дали отрицательные результаты [35,38], были и другие исследования терапии HER2-позитивного рака желудка лапатинибом, продемонстрировавшие более многообещающие результаты. Одним из таких протоколов было исследование MAGIC-B, в котором изучалось добавление лапатиниба или бевацизумаба к предоперационной химиотерапии эпирубицином, цисплатином и капецитабином. Исследование должно было закончиться в декабре 2017 г., его результаты пока не получены.
Наконец, было проведено клиническое исследование II фазы (NCT02015169), целью которого было изучить эффективность и безопасность комбинации схемы XELOX (капецитабин и оксалиплатин) с лапатинибом для лечения пациентов с HER2-позитивным раком желудка с метастазами в печень. Первичным критерием эффективности была частота полной резекции (частота случаев R0 резекции). Предполагаемая дата окончания исследования – май 2017 г. Несмотря на небольшое количество участников (32 пациента), это исследование может помочь определить актуальные проблемы других видов анти-HER2 терапии помимо трастузумаба.
Ингибиторы EGFR
Трансмембранный гликопротеин EGFR активирует каскад сигнальных тирозинкиназных путей Ras/Raf или Akt/mTOR. Таргетная терапия для этого рецептора успешно используется для лечения метастатического колоректального рака с диким типом опухоли по гену KRAS с применением терапии моноклональными антителами панитумумаб и цетуксимаб, а терапия цетуксимабом применяется для лечения плоскоклеточного рака головы и шеи. Кроме того, анти-EGFR ТКИ, такие как эрлотиниб, были одобрены для лечения рака легкого.
EGFR может служить независимым прогностическим фактором неблагоприятного исхода у пациентов с раком желудка [41]; его гиперэкспрессия наблюдается в 30-50% случаев гастроэзофагеальных опухолей, в этом случае данный рецептор может служить потенциальной мишенью таргетной терапии [23].
Препараты цетуксимаб (в исследовании EXPAND) и панитумумаб (в исследовании REAL3) не смогли продемонстрировать клиническое преимущество при лечении гастроэзофагеальных опухолей на поздних стадиях. Возможно, что гиперэкспрессия EGFR не является ведущим онкогенным механизмом, однако в этих исследованиях пациенты не отбирались на основании гиперэкспрессии EGFR; подобный подход следует применить при разработке новых исследований или для анализа в подгруппах [42].
В более позднем клиническом исследовании II фазы другого анти-EGFR моноклонального антитела – нимутузумаба – для лечения пациентов с раком желудка на поздних стадиях увеличения ОВ или выживаемости без прогрессирования в популяции в целом не отмечалось, однако у пациентов с гиперэкспрессией EGFR данные показатели были значительно лучше, что в очередной раз говорит о целесообразности отбора пациентов для анти-EGFR таргетной терапии на основании статуса EGFR [43]. Интересный ретроспективный анализ биомаркеров в исследовании COG [44] дает основания предполагать, что субпопуляция опухолей с числом копий гена EGFR может отвечать на анти-EGFR терапию. Это говорит о том, что выявление биомаркера EGFR может приводить к положительным результатам.
Ингибиторы контрольных точек иммунитета
Злокачественные новообразования верхнего отдела желудочно-кишечного тракта, а именно рак пищевода, рак ГЭП и рак желудка, отличаются высоким уровнем соматических мутаций, уступая по частоте мутаций в опухолевых клетках только меланоме, раку легкого и раку мочевого пузыря [45]. Принимая во внимание успешность иммунотерапии при лечении этих видов рака с высоким уровнем мутаций, в последнее время был проведен ряд фундаментальных и клинических исследований злокачественных опухолей верхних отделов желудочно-кишечного тракта, результаты лечения которых стандартной химиотерапией по-прежнему неудовлетворительны.
Целью иммунотерапии является изменение баланса между провоспалительными иммунными клетками-эффекторами и противовоспалительными клетками-супрессорами. Понятие «контрольные точки иммунитета» относится к различным ингибиторным сигнальным путям иммунной системы, которые играют важную роль в аутотолерантности, уменьшая выраженность и длительность физиологических иммунных реакций. Опухолевые клетки используют этот механизм для создания опухолевой резистентности посредством взаимодействия лиганд-рецептор. Ингибиторы контрольных точек потенциально могут усиливать противоопухолевый иммунитет, оказывая влияние на лиганд-рецепторное взаимодействие между опухолевыми клетками и T-клетками [46].
В настоящее время FDA одобрило два класса иммунотерапии: ингибиторы рецептора PD-1 и его лиганда (PD-L1) и ингибиторы CTLA-4 [47]. Экспрессия PD-L1 наблюдается в 35-45% случаев рака пищевода [48,49], что позволяет говорить о целесообразности применения иммунотерапии для этого вида рака. Недавно завершенные, а также проходящие в настоящий момент клинические исследования изучают применение ингибиторов PD-1/PD-L1 и CTLA-4 в качестве монотерапии или в комбинации с другими видами терапии для лечения злокачественных заболеваний ЖКТ.
Экспрессия PD-L1, высокий уровень MSI, а также дефект репарации неспаренных оснований обнаруживаются и при раке желудка, что может говорить о целесообразности иммунотерапии при лечении пациентов с данным заболеванием. Пембролизумаб, гуманизированное моноклональное анти-PD-1 антитело, изначально изучался в исследовании IB фазы в качестве препарата для лечения пациентов с раком пищевода или ГЭП с противоопухолевой терапией в анамнезе, у которых экспрессия PD-L1 была более 1% [28]. Общий ответ на лечение составил 30,4% (95% ДИ 13,2-52,9%). При анализе в подгруппах доля пациентов, ответивших на лечение, среди пациентов с аденокарциномой составила 40,0%, а среди пациентов с плоскоклеточным раком – 29,4%. В более позднем клиническом исследовании II фазы с участием пациентов с раком желудка и ГЭП на поздних стадиях общий ответ на лечение составил 13,3% (95% ДИ 8,2-20%), при этом полный ответ отмечался в 1,4% случаев [50], а частичный ответ – в 11,9% случаев [51]. В исследовании могли участвовать пациенты с уровнем экспрессии PD-L1 в опухолевых или стромальных клетках не ниже 1% на основе данных иммуногистохимического исследования. В результате было получено ускоренное одобрение FDA этого препарата для лечения пациентов с рецидивирующей, местнораспространенной или метастатической формой аденокарценомы желудка или ГЭП. В более крупном исследовании III фазы, в котором пембролизумаб изучался в качестве препарата терапии второй линии при лечении пациентов с аденокарциномой желудка или ГЭП на поздних стадиях, первичная конечная точка, которой служил показатель ОВ у пациентов с экспрессией PD-L1 в опухолевых клетках более 1%, не была достигнута (HR 0,82; 95% ДИ 0,66-1,03; p=,042) [52]. Есть вероятность, что PD-L1 не является оптимальным биомаркером при раке желудка либо что минимальный уровень экспрессии, определенный как 1%, оказался недостаточным. Возможно, что при отборе пациентов с более высоким уровнем экспрессии PD-L1 результаты терапии были бы более благоприятными.
Ниволумаб является полностью человеческим моноклональным антителом IgG4, ингибирующим PD-1, который экспрессируется на активированных T-клетках. В исследовании II фазы принимали участие пациенты с раком пищевода на поздних стадиях, ранее получавшие противоопухолевую терапию. PD-L1 статус не являлся критерием отбора. Объективный ответ на лечение был получен в 17% случаев (95% ДИ 10-28%) [50,53]. Похожие результаты были получены в исследовании III фазы, в котором участвовали больные раком желудка или ГЭП на поздних стадиях, получившие, по крайней мере, две линии химиотерапии, у которых при этом отмечалась непереносимость данной терапии. Ответ на лечение в этом исследовании составлял 11%. Также отмечалось улучшение показателя 12-месячной ОВ у пациентов, получавших ниволумаб, который в этой группе составил 26,2% (95% ДИ 20,7-32,0%), в сравнении с 10,9% (95% ДИ 6,2-17,0%) в группе плацебо [54]. В настоящее время проходит прямое сравнительное исследование III фазы, в котором лечение ниволумабом сравнивается со стандартной химиотерапией доцетакселом или паклитакселом у аналогичной когорты пациентов с рефрактерностью к химиотерапии [55].
Тремелимумаб ингибирует CTLA-4, белковый рецептор, относящийся к суперсемейству иммуноглобулинов, который является контрольной точкой иммунитета. При экспрессии на поверхности клетки Т-хелпера он передает ингибирующий сигнал Т-клеткам при связывании с CD80 или CD86 на поверхности антиген-презентирующих клеток [56]. В исследовании II фазы с участием пациентов с метастатическим раком желудка или пищевода, ранее получавших противоопухолевую терапию, при лечении тремелимумабом объективного ответа на лечение выявлено не было. Несмотря на это, показатель длительности ответа в отдельной небольшой группе больных был обнадеживающим [57].
В настоящий момент имеются ограниченные данные о том, что комбинированная иммунотерапия более эффективна по сравнению с монотерапией. В исследовании I/II фазы с участием пациентов с раком желудка, пищевода или ГЭП, ранее получавших интенсивную противоопухолевую терапию, изучалось лечение ипилимумабом в комбинации с ниволумабом. На фоне данной терапии отмечался длительный ответ на лечение и повышение долгосрочной ОВ [58]. В настоящий момент проводится несколько исследований, изучающих комбинацию могамулизумаба, гуманизированного моноклонального антитела, связывающегося с хемокиновым рецептором, и ниволумаба для лечения рака верхних отделов ЖКТ на поздних стадиях [59,60]. В других текущих исследованиях с участием пациентов с метастатическим раком верхних отделов желудочно-кишечного тракта изучается комбинация LAG525, который связывается с молекулой LAG-3, и спартализумаба, комбинированного анти-PD-1 препарата [61]. Кроме того, изучается комбинация тремелимумаба с дурвалумабом, человеческим моноклональным антителом иммуноглобулин G1 каппа, которое блокирует взаимодействие PD-L1 с молекулами PD-1 и CD80 [62].
Традиционно химиотерапия и лучевая терапия применяются на разных стадиях рака верхних отделов ЖКТ. При метастатическом раке верхних отделов ЖКТ частота ответа на лечение химиотерапией составляет от 35% до 40%, а преимущество по медиане выживаемости составляет 9-11 месяцев. Лучевая терапия применяется в случае местнораспространенного рака, а также в качестве паллиативного лечения у пациентов с метастатическим раком. Поскольку при лечении метастатического рака химиотерапией эффект лечения является довольно скромным, следующим логическим шагом было изучить эффективность иммунотерапии. Несмотря на то, что в доклинических исследованиях были получены обнадеживающие результаты, на стадии клинических испытаний терапевтическое преимущество при лечении рака верхних отделов ЖКТ было небольшим, а улучшения эффективности по сравнению с применением химиотерапии выявлено не было. Поскольку химиотерапия обладает доказанным преимуществом, в настоящее время проводятся исследования, в которых изучается комбинация химиотерапии с иммунотерапией и/или лучевой терапией.
Научное обоснование целесообразности комбинирования химиотерапии с иммунотерапией базируется на данных доклинических исследований. Их результаты говорят о том, что цитотоксические препараты могут выступать в роли иммуномодулятора посредством презентации опухолевых антигенов. В результате происходит стимуляция экспрессии опухолевых антигенов и молекул главного комплекса гистосовместимости I класса, с которыми связывается антиген. Также существует альтернативный молекулярный механизм, при котором химиотерапевтический препарат может также способствовать усилению выработки ко-стимулирующих молекул, таких как B7-1, или подавлению выработки ко-ингибирующих молекул, таких как PD-L1/B7-1H или B7-h5, экспрессирующихся на поверхности опухоли. При этом увеличивается выраженность эффекторной активности Т-клеток, происходит истощение популяции регуляторных T-клеток, высвобождаются гомеостатические или провоспалительные цитокины [63-66]. Химиотерапевтические агенты также могут делать клетки опухоли более чувствительными к лизису, опосредованному Т-клетками, с помощью fas-, перфорин- и гнанзим B- зависимых механизмов [67,68].
С учетом этих механизмов начали проводить клинические исследования, в которых изучается комбинированное применение химиотерапии и иммунотерапии при злокачественных опухолях верхних отделов желудочно-кишечного тракта. В настоящее время проходит клиническое исследование III фазы, в котором оценивается применение ниволумаба и ипилимумаба, ниволумаба в комбинации с фторурацилом и цисплатином либо в комбинации только с фторурацилом или только с цисплатином [69,70]. Первичными конечными точками в этом исследовании выступают выживаемость без прогрессирования и ОВ у пациентов на поздних стадиях неоперабельного, рецидивирующего или метастатического плоскоклеточного рака пищевода, ранее не получавших противоопухолевую терапию. Также в настоящее время проводятся исследования пембролизумаба, применяемого самостоятельно или в комбинации с химиотерапией, в сравнении с лечением только химиотерапией у пациентов с аденокарциномой желудка или ГЭП в качестве первой линии [70], а также в качестве адъювантной и неоадъювантной терапии [71]. Целью еще одного исследования I/II фазы является оценка безопасности дурвалумаба в комбинации с оксалиплатином/капецитабином при лечении рака с метастазами.
ЛТ является ключевым методом лечения многих форм рака пищевода. Также как и химиотерапия, лучевая терапия в доклинических исследованиях проявляла иммуномодулирующие свойства, задействуя различные механизмы, в том числе образование неоантигенов, увеличение экспрессии провоспалительных цитокинов, которые являются активаторами лейкоцитов, а также активацию иммунных клеток и привлечение их в зону опухолевого микроокружения [72,73]. Было обнаружено, что при воздействии на мышей ионизирующего облучения в микроокружении опухоли активируется экспрессия PD-L1 [74]. Подобное повышение экспрессии PD-L1 подавляет противоопухолевые свойства эффекторных Т-клеток, что говорит о целесообразности комбинации иммунотерапии и ЛТ.
Доклинические модели [63,75,76] дают лишь ограниченное представление об эффектах сочетания ЛТ и иммунотерапии. Проведенный ранее небольшой ретроспективный анализ серии случаев продемонстрировал приемлемую переносимость и некоторое улучшение в ответе на лечение при сочетании иммунотерапии и ЛТ при различных формах заболевания [77,78]. На основе этих данных в настоящее время проводятся клинические исследования с участием пациентов с раком верхних отделов желудочно-кишечного тракта. Пембролизумаб в сочетании с ЛТ изучается для лечения пациентов с метастатическим раком пищевода [79], а также с раком желудка и ГЭП на поздних стадиях [80]. В качестве неоадъювантной терапии пембролизумаб, дурвалумаб, ниволумаб и ипилимумаб изучаются при их сочетании с химиолучевой терапией [81-83].
И, наконец, открытие опухолевых специфических антигенов позволяет говорить о специфических мишенях для новых видов иммунотерапии, в том числе о применении этих опухолевых специфических антигенов в клеточной терапии аутологичными Т-клетками, которые специфично связываются с данными антигенами у пациентов, опухоли которых их экспрессируют. Два наиболее часто встречающихся антигена, изученных в настоящий момент, которые экспрессируются при раке пищевода, – это ассоциированный с меланомой антиген 3 и NY-ESO-1. В 2017 г. Lu et al. [84] изучали случаи 17 пациентов с метастатическим раком, которые получали лечение с использованием главного комплекса гистосовместимости II – рестриктированного Т-клеточного рецептора, мишенью терапии был ассоциированный с меланомой эмбриональный раковый антиген 3. Пациенты получали лечение на базе противолимфоцитарной подготовительной терапии, после которого проводился адоптивный перенос очищенных CD4+ T-клеток, в которые с помощью ретровируса внедрялся Т-клеточный рецептор к ассоциированному с меланомой антигену 3, плюс системная терапия высокими дозами интерлейкина-2. Из девяти пациентов, которые получили самые высокие дозы, объективный частичный ответ наблюдался у пациента с раком пищевода (продолжительность – 4 месяца) [84]. Следует надеяться, что проходящие в настоящий момент исследования помогут выявить наилучшие сочетания при применении иммунотерапии, химиотерапии и/или лучевой терапии в оптимальных дозах и режимах.
PIK3CA
Сигнальный путь PI3K/Akt/mTOR играет важную роль в различных клеточных механизмах, таких как клеточный рост, клеточная пролиферация, трансляция белка и метаболизм. Нарушение регуляции этого пути, компонентом которого являются различные тирозинкиназы, часто наблюдается при многих опухолях. Это послужило основой для разработки разных видов таргетной терапии, которые воздействуют на звенья этого пути. Эти виды терапии испытывались на нескольких видах солидных опухолей, в том числе при раке желудка [85]. Согласно отчету АРГ, в 80% случаев EBV-ассоциированных опухолей и в 42% случаев MSI опухолей имеются мутации PIK3CA. Это дает основания предполагать, что данный сигнальный путь может служить потенциальной мишенью для новых видов терапии рака желудка.
В клиническом исследовании III фазы GRANITE, в котором изучался эверолимус для лечения пациентов с раком желудка на поздних стадиях, ранее получавших противоопухолевую терапию, улучшения выживаемости не происходило; однако в этом исследовании не изучались мутации PIK3CA, наличие мутаций PIK3CA у пациентов не проверялось и отбора пациентов по этому признаку не проводилось [34]. Перспективной тактикой лечения пациентов с раком желудка в будущем может стать предварительное определение мутации PIK3CA и проведение таргетной терапии, направленной на данный сигнальный путь, только пациентам с мутацией PIK3CA. Также в настоящее время для лечения рака желудка исследуются некоторые ингибиторы AKT, например, афуресертиб и AZD5363. Результаты этих исследований ожидаются в скором времени [5].
Ангиогенез
Важная роль образования новых сосудов в формировании и развитии резистентности злокачественных новообразований хорошо изучена [86]. VEGF, белок, представленный в различных изоформах, является стимулятором роста клеток эндотелия. Он в большом количестве экспрессируется в клетках различных солидных опухолей, особенно в зонах некроза и гипоксии. Гиперэкспрессия биомаркеров – факторов ангиогенеза ассоциируется с более агрессивным течением заболевания, таким образом, эти биомаркеры являются потенциальными мишенями при терапии рака желудка.
Бевацизумаб является анти-VEGF антителом, которое широко применяется при разных видах солидных опухолей, таких как колоректальный рак, рак яичников, рак молочной железы и рак легкого [85,87], однако при раке желудка его клиническая польза по-прежнему не определена. В клинических исследованиях III фазы AVATAR и AVAGAST клинического преимущества бевацизумаба при лечении рака желудка или ГЭП на поздних стадиях выявлено не было [29,30]. Тем не менее, рамуцирумаб, полностью человеческое моноклональное антитело, связывающееся с VEGFR-2, в клинических исследованиях III фазы REGARD [26] и RAINBOW [25] продемонстрировал клиническое преимущество при применении в качестве терапии второй линии у пациентов с раком желудка на поздних стадиях. В исследовании REGARD на фоне монотерапии рамуцирумабом в качестве второй линии терапии наблюдалось повышение ОВ в сравнении с оптимальной поддерживающей терапией. Медиана ОВ составила 5,2 мес. (межквартильный размах – 2,3-9,9 мес.) у пациентов группы рамуцирумаба и 3,8 мес. (межквартильный размах – 1,7-7,1 мес.) у пациентов группы плацебо (HR 0,776; 95% ДИ 0,603-0,998) [26]. В исследовании RAINBOW на фоне лечения рамуцирумабом в комбинации с паклитакселом наблюдалось повышение выживаемости без прогрессирования и ОВ по сравнению с группой лечения плацебо плюс паклитаксел. ОВ была значимо выше в группе лечения комбинацией рамуцирумаб плюс паклитаксел по сравнению с группой плацебо плюс паклитаксел (медиана – 9,6 мес. [95% ДИ 8,5-10,8 мес.] в сравнении с 7,4 мес. [95% ДИ 6,3-8,4 мес.]; HR 0,807; 95% ДИ 0,678-0,962) [25].
ТКИ апатиниб блокирует VEGFR-2. Данный препарат продемонстрировал эффективность и безопасность в клинических исследованиях II и III фазы у пациентов с метастатическим раком желудка или раком желудка на поздних стадиях, с резистентностью к химиотерапии, что позволяет говорить о том, что препарат может потенциально служить терапией третьей или последующих линий [88]. Несмотря на положительные результаты предшествующих исследований, существуют некоторые опасения относительно клинической пользы рамуцирумаба и апатиниба при лечении рака желудка. Небольшое клиническое преимущество наблюдалось при лечении афатинибом (1,8 месяца) и рамуцирумабом (1,4-2,2 месяца), однако, возможно, дальнейшие исследования биомаркеров, комбинированной терапии, результатов секвенирования и поддерживающей терапии обеспечат более значимые результаты таргетной анти-VEGF терапии при раке желудка [89,90].
PARP
PARP – это группа ферментов, катализирующих АДФ-рибозилирование различных внутриклеточных белков [91]. Ферменты PARP участвуют в различных клеточных процессах, таких как транскрипция, репликация, рекомбинация и репарация ДНК [92]. Особенно важна их роль в репарации ДНК, поскольку некоторые опухоли, в которых поврежден механизм гомологичной рекомбинации, используют репарацию ДНК, опосредованную PARP, и могут быть чувствительны к ингибированию этого механизма репарации [93]. Ингибирование PARP уже занимает значимое место в лечении BRCA-ассоциированного рака молочной железы и рака яичников и может также играть важную роль в лечении других видов рака, таких как аденокарцинома желудка [94]. При раке желудка обнаруживается повышенная экспрессия PARP-1, что может говорить о более поздней стадии заболевания и менее благоприятном прогнозе.
После получения довольно многообещающих результатов в клиническом исследовании II фазы было проведено клиническое исследование III фазы GOLD, в котором на фоне лечения ингибитором PARP олапарибом значимого увеличения ОВ у пациентов с раком желудка на поздних стадиях, в том числе у группы пациентов с негативным результатом анализа на мутантный белок атаксии-телеангиэктазии, не отмечалось [33]. Возможно, причиной того, что в некоторых исследованиях конечные точки эффективности не были достигнуты, были особенности методов статистического анализа (например, определение статистически значимого p-значения < 0,025) и отсутствие стратификации по биомаркерам BRCA. Другие исследования, изучающие применение ингибиторов PARP для лечения рака желудка, к настоящему моменту не завершены. Клиническое исследование I фазы (NCT01123876) изучает применение ингибитора PARP велапариба в комбинации с FOLFIRI при раке желудка. В исследовании I/II фазы (NCT03008278) продолжается набор пациентов для оценки эффективности олапариба и рамуцирумаба (анти-VEGFR-2 антитело) при лечении пациентов с неоперабельным метастатическим или местнораспространенным рецидивирующим раком желудка или ГЭП. Новые комбинации препаратов и потенциальное использование биомаркеров для выбора тактики терапии являются теми проблемами, решение которых может изменить подход к лечению в ближайшем будущем.
FGFR
Факторы роста фибробластов – это семейство протеинов, которые связываются с четырьмя видами трансмембранных тирозинкиназных рецепторов (FGFR) [95]. FGFR участвуют в различных внутриклеточных сигнальных каскадах, в том числе RAS-MAPK, PI3K-AKT и STAT, регулируя, таким образом, различные клеточные процессы, такие как пролиферация, клеточная миграция, выживание, дифференцировка и метаболизм [36,95]. Нарушение работы этих сигнальных путей, например, при амплификации генов, хромосомной транслокации или при мутациях, приводит к образованию опухолевых клеток, их выживанию, пролиферации и опухолевой инвазии, особенно при раке диффузного типа, как, например, в случае рака желудка [96].
К настоящему моменту на сайте ClinicalTrials.gov зарегистрировано 11 исследований, в которых изучается анти-FGFR таргетная терапия при раке желудка. В исследовании II фазы SHINE изучалось применение AZD4547, ТКИ FGFR2, в сравнении с паклитакселом у пациентов с раком желудка с амплификацией/полисомией FGFR2. В данном исследовании улучшение по основной конечной точке эффективности, которой являлся показатель выживаемости без прогрессирования, не было доказано [97].
Некоторые препараты, такие как довитиниб, форетиниб и пазопаниб, являются мульти-ТКИ и ингибируют в том числе и FGFR [95]. Исследование II фазы (NCT01719549) изучало мульти-TKI довитиниб при лечении рака желудка у пациентов с амплификацией FGFR2. Другое исследование II фазы (NCT01921673) оценивало роль комбинированной терапии довитинибом с доцетакселом в качестве химиотерапии второй линии у пациентов с метастатическим или неоперабельным раком желудка. Оба исследования были завершены, однако их результаты еще не опубликованы. В настоящий момент непонятно, достаточно ли при применении таргетной терапии блокировать только один FGFR для лечения рака желудка, однако, возможно, будущее за препаратами, которые являются мульти-ТКИ и ингибируют FGFR наряду с другими киназными сигнальными путями.
ВЫВОДЫ И ДАЛЬНЕЙШИЕ ПЕРСПЕКТИВЫ
В настоящий момент лечение опухолей желудочно-кишечного тракта на поздних стадиях по-прежнему остается серьезной проблемой для онкологов и пациентов по всему миру. Злокачественные новообразования желудочно-кишечного тракта отличаются от других видов злокачественных опухолей, таких как рак простаты, рак легкого или меланома, поскольку до сих пор не существует всеохватывающих инновационных и эффективных методов лечения, основанных на драйверных мутациях и иммунотерапии. На сегодняшний день единственным подтвержденным предиктивным биомаркером, позволяющим определять тактику лечения пациентов, является экспрессия HER2. В настоящий момент существуют только два хорошо изученных препарата для лечения рака желудка на поздних стадиях: трастузумаб и рамуцирумаб. Не так давно в исследовании ATTRACTION-2 препарат ниволумаб продемонстрировал определенную эффективность при терапии опухолей желудочно-кишечного тракта на поздних стадиях у пациентов, получивших несколько линий химиотерапии в прошлом [54]. Новые принципы молекулярной классификации, как, например, классификация, предложенная АРГ, и классификация ACRG, призваны помочь выявлению потенциальных биомаркеров для разработки новых видов таргетной терапии, проведению новых клинических исследований, а также ретроспективного субанализа завершенных исследований. В случае опухолей с амплификацией HER2 каскады VEGF, PARP, EGFR, PIK3CA и FGFR являются теми молекулярными сигнальными путями, которые потенциально могут служить мишенями для новых видов таргетных препаратов в ближайшем будущем. Однако для разработки этих новейших подходов необходимо проведение большого количества трансляционных и клинических исследований.
Статья подготовлена редакцией газеты RUSSCO по материалам лекции Рамона Андраде де Мелло с соавторами на ежегодном конгрессе ASCO 2018.
Источники:
- Ferlay J, Soerjomataram I, Dikshit R, et al. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012. Int J Cancer. 2015; 136: E359-E386. Medline, Google Scholar.
- Siegel RL, Miller KD, Jemal A. Cancer statistics, 2018. CA Cancer J Clin. 2018; 68: 7-30. Medline, Google Scholar.
- Corral JE, Delgado Hurtado JJ, Domínguez RL, et al. The descriptive epidemiology of gastric cancer in Central America and comparison with United States Hispanic populations. J Gastrointest Cancer. 2015; 46: 21-28. Medline, Google Scholar.
- Irino T, Takeuchi H, Terashima M, et al. Gastric cancer in Asia: unique features and management. Am Soc Clin Oncol Educ Book. 2017; 37: 279-291. Google Scholar.
- Fontana E, Smyth EC. Novel targets in the treatment of advanced gastric cancer: a perspective review. Ther Adv Med Oncol. 2016; 8: 113-125. Google Scholar.
- De Mello RA. Gastric cancer in southern Europe: high-risk disease. Am Soc Clin Oncol Educ Book. 2017; 37: 261-266. Google Scholar.
- Sanchez FA. Best practices and practical nuances in the treatment of gastric cancer in high-risk global areas. Am Soc Clin Oncol Educ Book. 2017; 37: 258-260. Google Scholar.
- Edge SB, Compton CC. The American Joint Committee on Cancer: the 7th edition of the AJCC cancer staging manual and the future of TNM. Ann Surg Oncol. 2010; 6: 1471-1474. Google Scholar.
- Lauren P. The two histological main types of gastric carcinoma: diffuse and so‐called intestinal‐type carcinoma. Acta Pathol Microbiol Scand. 1965; 64: 31-49. Medline, Google Scholar.
- Wang K, Kan J, Yuen ST, et al. Exome sequencing identifies frequent mutation of ARID1A in molecular subtypes of gastric cancer. Nat Genet. 2011; 43: 1219-1223. Medline, Google Scholar.
- Wang K, Yuen ST, Xu J, et al. Whole-genome sequencing and comprehensive molecular profiling identify new driver mutations in gastric cancer. Nat Genet. 2014; 46: 573-582. Medline, Google Scholar.
- Zang ZJ, Cutcutache I, Poon SL, et al. Exome sequencing of gastric adenocarcinoma identifies recurrent somatic mutations in cell adhesion and chromatin remodeling genes. Nat Genet. 2012; 44: 570-574. Medline, Google Scholar.
- Cancer Genome Atlas Research Network. Comprehensive molecular characterization of gastric adenocarcinoma. Nature. 2014; 513: 202-209. Medline, Google Scholar.
- Boussioutas A, Li H, Liu J, et al. Distinctive patterns of gene expression in premalignant gastric mucosa and gastric cancer. Cancer Res. 2003; 63: 2569-2577. Google Scholar.
- Tan IB, Ivanova T, Lim KH, et al. Intrinsic subtypes of gastric cancer, based on gene expression pattern, predict survival and respond differently to chemotherapy. Gastroenterology 2011; 2: 476-485. Google Scholar.
- Lei Z, Tan IB, Das K, et al. Identification of molecular subtypes of gastric cancer with different responses to PI3-kinase inhibitors and 5-fluorouracil. Gastroenterology. 2013; 145: 554-565. Google Scholar.
- Cristescu R, Lee J, Nebozhyn M, et al. Molecular analysis of gastric cancer identifies subtypes associated with distinct clinical outcomes. Nat Med. 2015;21:449-456. Medline, Google Scholar.
- Sohn BH, Hwang J-E, Jang H-J, et al. Clinical significance of four molecular subtypes of gastric cancer identified by The Cancer Genome Atlas Project. Clin Cancer Res. 2017; 15: 4441-4449. Google Scholar
- van der Post RS, Gullo I, Oliveira C, et al. Histopathological, molecular, and genetic profile of hereditary diffuse gastric cancer: current knowledge and challenges for the future. In Stem Cells, Pre-Neoplasia, and Early Cancer of the Upper Gastrointestinal Tract. New York: Springer, 2016; 371-391. Google Scholar.
- Shaib WL, Nammour JPA, Gill H, et al. The future prospects of immune therapy in gastric and esophageal adenocarcinoma. J Clin Med. 2016; 5: E100. Google Scholar.
- van Rossum PSN, Mohammad NH, Vleggaar FP, et al. Treatment for unresectable or metastatic oesophageal cancer: current evidence and trends. Nat Rev Gastroenterol Hepatol. Epub 2017 Dec 13. Google Scholar.
- Luis M, Tavares A, Carvalho LS, et al. Personalizing therapies for gastric cancer: molecular mechanisms and novel targeted therapies. World J Gastroenterol. 2013; 19: 6383-6397. Medline, Google Scholar.
- de Mello RA, Marques AM, Araújo A. HER2 therapies and gastric cancer: a step forward. World J Gastroenterol. 2013; 19: 6165-6169. Medline, Google Scholar.
- Bang Y-J, Van Cutsem E, Feyereislova A, et al; ToGA Trial Investigators. Trastuzumab in combination with chemotherapy versus chemotherapy alone for treatment of HER2-positive advanced gastric or gastro-oesophageal junction cancer (ToGA): a phase 3, open-label, randomised controlled trial. Lancet. 2010; 376: 687-697. Medline, Google Scholar.
- Wilke H, Muro K, Van Cutsem E, et al; RAINBOW Study Group. Ramucirumab plus paclitaxel versus placebo plus paclitaxel in patients with previously treated advanced gastric or gastro-oesophageal junction adenocarcinoma (RAINBOW): a double-blind, randomised phase 3 trial. Lancet Oncol. 2014;15:1224-1235. Medline, Google Scholar.
- Fuchs CS, Tomasek J, Yong CJ, et al; REGARD Trial Investigators. Ramucirumab monotherapy for previously treated advanced gastric or gastro-oesophageal junction adenocarcinoma (REGARD): an international, randomised, multicentre, placebo-controlled, phase 3 trial. Lancet. 2014; 383: 31-39. Medline, Google Scholar.
- Hofmann M, Stoss O, Shi D, et al. Assessment of a HER2 scoring system for gastric cancer: results from a validation study. Histopathology. 2008; 52: 797-805. Medline, Google Scholar.
- Doi T, Shitara K, Naito Y, et al. Safety, pharmacokinetics, and antitumour activity of trastuzumab deruxtecan (DS-8201), a HER2-targeting antibody-drug conjugate, in patients with advanced breast and gastric or gastro-oesophageal tumours: a phase 1 dose-escalation study. Lancet Oncol. 2017; 18: 1512-1522. Google Scholar.
- Ohtsu A, Shah MA, Van Cutsem E, et al. Bevacizumab in combination with chemotherapy as first-line therapy in advanced gastric cancer: a randomized, double-blind, placebo-controlled phase III study. J Clin Oncol. 2011; 29: 3968-3976. Link, Google Scholar.
- Shen L, Li J, Xu J, et al. Bevacizumab plus capecitabine and cisplatin in Chinese patients with inoperable locally advanced or metastatic gastric or gastroesophageal junction cancer: randomized, double-blind, phase III study (AVATAR study). Gastric Cancer. 2015; 18: 168-176. Google Scholar.
- Lordick F, Kang YK, Chung HC, et al; Arbeitsgemeinschaft Internistische Onkologie and EXPAND Investigators. Capecitabine and cisplatin with or without cetuximab for patients with previously untreated advanced gastric cancer (EXPAND): a randomised, open-label phase 3 trial. Lancet Oncol. 2013; 14: 490-499. Medline, Google Scholar.
- Thuss-Patience PC, Shah MA, Ohtsu A, et al. Trastuzumab emtansine versus taxane use for previously treated HER2-positive locally advanced or metastatic gastric or gastro-oesophageal junction adenocarcinoma (GATSBY): an international randomised, open-label, adaptive, phase 2/3 study. Lancet Oncol. 2017; 18: 640-653. Google Scholar.
- Bang Y-J, Xu R-H, Chin K, et al. Olaparib in combination with paclitaxel in patients with advanced gastric cancer who have progressed following first-line therapy (GOLD): a double-blind, randomised, placebo-controlled, phase 3 trial. Lancet Oncol. 2017; 18: 1637-1651. Google Scholar.
- Ohtsu A, Ajani JA, Bai Y-X, et al. Everolimus for previously treated advanced gastric cancer: results of the randomized, double-blind, phase III GRANITE-1 study. J Clin Oncol. 2013; 31: 3935-3943. Link, Google Scholar.
- Hecht JR, Bang Y-J, Qin SK, et al. Lapatinib in combination with capecitabine plus oxaliplatin in human epidermal growth factor receptor 2–positive advanced or metastatic gastric, esophageal, or gastroesophageal adenocarcinoma: TRIO-013/LOGiC—a randomized phase III trial. J Clin Oncol. 2016; 34: 443-451. Link, Google Scholar.
- Waddell T, Chau I, Cunningham D, et al. Epirubicin, oxaliplatin, and capecitabine with or without panitumumab for patients with previously untreated advanced oesophagogastric cancer (REAL3): a randomised, open-label phase 3 trial. Lancet Oncol. 2013; 14: 481-489. Medline, Google Scholar.
- Catenacci DVT, Tebbutt NC, Davidenko I, et al. Rilotumumab plus epirubicin, cisplatin, and capecitabine as first-line therapy in advanced MET-positive gastric or gastro-oesophageal junction cancer (RILOMET-1): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol. 2017; 18: 1467-1482. Medline, Google Scholar.
- Satoh T, Xu R-H, Chung HC, et al. Lapatinib plus paclitaxel versus paclitaxel alone in the second-line treatment of HER2-amplified advanced gastric cancer in Asian populations: TyTAN—a randomized, phase III study. J Clin Oncol. 2014; 32: 2039-2049. Link, Google Scholar.
- Van Cutsem E, de Haas S, Kang YK, et al. Bevacizumab in combination with chemotherapy as first-line therapy in advanced gastric cancer: a biomarker evaluation from the AVAGAST randomized phase III trial. J Clin Oncol. 2012; 30: 2119-2127. Link, Google Scholar.
- Tabernero J, Hoff P, Shen L, et al. 616O: pertuzumab (P)+ trastuzumab (H)+ chemotherapy (CT) for HER2-positive metastatic gastric or gastro-oesophageal junction cancer (mGC/GEJC): final analysis of a phase III study (JACOB). Ann Oncol. 2017;28(suppl_5):mdx369. Google Scholar.
- Lieto E, Ferraraccio F, Orditura M, et al. Expression of vascular endothelial growth factor (VEGF) and epidermal growth factor receptor (EGFR) is an independent prognostic indicator of worse outcome in gastric cancer patients. Ann Surg Oncol. 2008; 15: 69-79. Medline, Google Scholar.
- Lazăr DC, Tăban S, Cornianu M, et al. New advances in targeted gastric cancer treatment. World J Gastroenterol. 2016; 22: 6776-6799. Google Scholar.
- Satoh T, Lee KH, Rha SY, et al. Randomized phase II trial of nimotuzumab plus irinotecan versus irinotecan alone as second-line therapy for patients with advanced gastric cancer. Gastric Cancer. 2015; 18: 824-832. Medline, Google Scholar.
- Dutton SJ, Ferry DR, Blazeby JM, et al. Gefitinib for oesophageal cancer progressing after chemotherapy (COG): a phase 3, multicentre, double-blind, placebo-controlled randomised trial. Lancet Oncol. 2014; 15: 894-904. Medline, Google Scholar.
- Lawrence MS, Stojanov P, Polak P, et al. Mutational heterogeneity in cancer and the search for new cancer-associated genes. Nature. 2013; 499: 214-218. Medline, Google Scholar.
- Pardoll DM. The blockade of immune checkpoints in cancer immunotherapy. Nat Rev Cancer. 2012; 12: 252-264. Medline, Google Scholar.
- Michot JM, Bigenwald C, Champiat S, et al. Immune-related adverse events with immune checkpoint blockade: a comprehensive review. Eur J Cancer. 2016;54:139-148. Medline, Google Scholar.
- Derks S, Nason KS, Liao X, et al. Epithelial PD-L2 expression marks Barrett’s esophagus and esophageal adenocarcinoma. Cancer Immunol Res. 2015; 3: 1123-1129. Medline, Google Scholar.
- Ohigashi Y, Sho M, Yamada Y, et al. Clinical significance of programmed death-1 ligand-1 and programmed death-1 ligand-2 expression in human esophageal cancer. Clin Cancer Res. 2005; 11: 2947-2953. Medline, Google Scholar.
- Kudo T, Hamamoto Y, Kato K, et al. Nivolumab treatment for oesophageal squamous-cell carcinoma: an open-label, multicentre, phase 2 trial. Lancet Oncol. 2017; 18: 631-639. Medline, Google Scholar.
- Fuchs CS, Doi T, Jang RW-J, et al. KEYNOTE-059 cohort 1: efficacy and safety of pembrolizumab (pembro) monotherapy in patients with previously treated advanced gastric cancer. J Clin Oncol. 2017; 15: 4003. Google Scholar.
- Ohtsu A, Tabernero J, Bang Y-J, et al. Pembrolizumab (MK-3475) versus paclitaxel as second-line therapy for advanced gastric or gastroesophageal junction (GEJ) adenocarcinoma: phase 3 KEYNOTE-061 study. J Clin Oncol. 2016; 4 (4_suppl): TPS183. Google Scholar.
- Kojima T, Hara H, Yamaguchi K, et al. Phase II study of nivolumab (ONO-4538/BMS-936558) in patients with esophageal cancer: preliminary report of overall survival. J Clin Oncol. 2016; 4 (4_suppl): TPS175. Google Scholar.
- Kang Y-K, Boku N, Satoh T, et al. Nivolumab in patients with advanced gastric or gastro-oesophageal junction cancer refractory to, or intolerant of, at least two previous chemotherapy regimens (ONO-4538-12, ATTRACTION-2): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet. 2017; 390: 2461-2471. Medline, Google Scholar.
- NCT02569242. Study of Nivolumab in Unresectable Advanced or Recurrent Esophageal Cancer. clinicaltrials.gov/ct2/show/NCT02569242. Accessed March 12, 2018. Google Scholar.
- Krummel MF, Allison JP. CD28 and CTLA-4 have opposing effects on the response of T cells to stimulation. J Exp Med. 1995; 182: 459-465. Medline, Google Scholar.
- Ralph C, Elkord E, Burt DJ, et al. Modulation of lymphocyte regulation for cancer therapy: a phase II trial of tremelimumab in advanced gastric and esophageal adenocarcinoma. Clin Cancer Res. 2010; 16: 1662-1672. Google Scholar.
- Janjigian YY, Ott PA, Calvo E, et al. Nivolumab±ipilimumab in pts with advanced (adv)/metastatic chemotherapy-refractory (CTx-R) gastric (G), esophageal (E), or gastroesophageal junction (GEJ) cancer: CheckMate 032 study. J Clin Oncol. 2017; 15: 4014. Google Scholar.
- NCT02476123. Phase 1 Study of Combination Therapy With Mogamulizumab (KW-0761) and Nivolumab (ONO-4538/BMS-936558) in Subjects With Advanced Solid Tumors. clinicaltrials.gov/ct2/show/NCT02476123. Accessed March 12, 2018. Google Scholar.
- UMIN000021480. Phase I Study of Pre-Operative Combination Therapy With Mogamulizumab (Anti-CCR4) and Nivolumab (Anti-PD-1) Against Solid Cancer Patients. upload.umin.ac.jp/cgi-open-bin/ctr_e/ctr_view.cgi?recptno=R000024753. Accessed March 12, 2018. Google Scholar.
- NCT02460224. Safety and Efficacy of LAG525 Single Agent and in Combination with PDR001 in Patients With Advanced Malignancies. clinicaltrials.gov/ct2/show/NCT02460224. Accessed March 12, 2018. Google Scholar.
- NCT02340975. A Phase 1b/2 Study of MEDI4736 With Tremelimumab, MEDI4736 or Tremelimumab Monotherapy in Gastric or GEJ Adenocarcinoma. clinicaltrials.gov/ct2/show/NCT02340975. Accessed March 12, 2018. Google Scholar.
- Banissi C, Ghiringhelli F, Chen L, et al. Treg depletion with a low-dose metronomic temozolomide regimen in a rat glioma model. Cancer Immunol Immunother. 2009;58:1627-1634. Medline, Google Scholar.
- Ercolini AM, Ladle BH, Manning EA, et al. Recruitment of latent pools of high-avidity CD8(+) T cells to the antitumor immune response. J Exp Med. 2005; 201: 1591-1602. Medline, Google Scholar.
- Schiavoni G, Mattei F, Di Pucchio T, et al. Cyclophosphamide induces type I interferon and augments the number of CD44(hi) T lymphocytes in mice: implications for strategies of chemoimmunotherapy of cancer. Blood. 2000; 95: 2024-2030. Medline, Google Scholar.
- Machiels J-PH, Reilly RT, Emens LA, et al. Cyclophosphamide, doxorubicin, and paclitaxel enhance the antitumor immune response of granulocyte/macrophage-colony stimulating factor-secreting whole-cell vaccines in HER-2/neu tolerized mice. Cancer Res. 2001; 61: 3689-3697. Medline, Google Scholar.
- Chen G, Emens LA. Chemoimmunotherapy: reengineering tumor immunity. Cancer Immunol Immunother. 2013; 62: 203-216. Google Scholar.
- Peng J, Hamanishi J, Matsumura N, et al. Chemotherapy induces programmed cell death-ligand 1 overexpression via the nuclear factor-κB to foster an immunosuppressive tumor microenvironment in ovarian cancer. Cancer Res. 2015; 75: 5034-5045. Google Scholar.
- NCT03143153. A Study to Evaluate Efficacy in Subjects With Esophageal Cancer Treated With Nivolumab and Ipilimumab or Nivolumab Combined With Fluorouracil Plus Cisplatin Versus Fluorouracil Plus Cisplatin (CheckMate 648). clinicaltrials.gov/ct2/show/NCT03143153. Accessed March 12, 2018. Google Scholar.
- NCT02494583. Study of Pembrolizumab (MK-3475) as First-Line Monotherapy and Combination Therapy for Treatment of Advanced Gastric or Gastroesophageal Junction Adenocarcinoma (MK-3475-062/KEYNOTE-062). clinicaltrials.gov/ct2/show/NCT02494583. Accessed March 12, 2018. Google Scholar.
- NCT03221426. Study of Pembrolizumab (MK-3475) Plus Chemotherapy Versus Placebo Plus Chemotherapy in Participants With Gastric or Gastroesophageal Junction (GEJ) Adenocarcinoma (MK-3475-585/KEYNOTE-585). clinicaltrials.gov/ct2/show/NCT03221426. Accessed March 12, 2018. Google Scholar.
- Corso CD, Ali AN, Diaz R. Radiation-induced tumor neoantigens: imaging and therapeutic implications. Am J Cancer Res. 2011; 1: 390-412. Google Scholar.
- Kaur P, Asea A. Radiation-induced effects and the immune system in cancer. Front Oncol. 2012; 2: 191. Google Scholar.
- Deng L, Liang H, Burnette B, et al. Irradiation and anti-PD-L1 treatment synergistically promote antitumor immunity in mice. J Clin Invest. 2014; 124: 687-695. Medline, Google Scholar.
- Verbrugge I, Hagekyriakou J, Sharp LL, et al. Radiotherapy increases the permissiveness of established mammary tumors to rejection by immunomodulatory antibodies. Cancer Res. 2012; 72: 3163-3174. Medline, Google Scholar.
- Zeng J, See AP, Phallen J, et al. Anti-PD-1 blockade and stereotactic radiation produce long-term survival in mice with intracranial gliomas. Int J Radiat Oncol Biol Phys. 2013; 86: 343-349. Medline, Google Scholar.
- Kwon ED, Drake CG, Scher HI, et al; CA184-043 Investigators. Ipilimumab versus placebo after radiotherapy in patients with metastatic castration-resistant prostate cancer that had progressed after docetaxel chemotherapy (CA184-043): a multicentre, randomised, double-blind, phase 3 trial. Lancet Oncol. 2014; 15: 700-712. Medline, Google Scholar.
- Qin R, Olson A, Singh B, et al. Safety and efficacy of radiation therapy in advanced melanoma patients treated with ipilimumab. Int J Radiat Oncol Biol Phys. 2016; 96: 72-77. Google Scholar.
- NCT02642809. Pembrolizumab With Locally Delivered Radiation Therapy for the Treatment of Metastatic Esophageal Cancers. clinicaltrials.gov/ct2/show/NCT02642809. Accessed March 12, 2018. Google Scholar.
- NCT02830594. Pembrolizumab and Palliative Radiation Therapy in Treating Patients With Metastatic Esophagus, Stomach, or Gastroesophageal Junction Cancer. clinicaltrials.gov/ct2/show/NCT02830594. Accessed March 12, 2018. Google Scholar.
- NCT02735239. Study of Anti-PD-L1 in Combination With Chemo(radio)therapy for Oesophageal Cancer. clinicaltrials.gov/ct2/show/NCT02735239. Accessed March 12, 2018. Google Scholar.
- NCT02730546. Pembrolizumab, Combination Chemotherapy, and Radiation Therapy Before Surgery in Treating Adult Patients With Locally Advanced Gastroesophageal Junction or Gastric Cardia Cancer That Can Be Removed by Surgery. clinicaltrials.gov/ct2/show/NCT02730546. Accessed March 12, 2018. Google Scholar.
- NCT03044613. Nivolumab or Nivolumab/Ipilimumab Prior to Chemoradiation Plus Nivolumab With II/III Gastro/Esophageal Cancer. clinicaltrials.gov/ct2/show/NCT03044613. Accessed March 12, 2018. Google Scholar.
- Lu Y-C, Parker LL, Lu T, et al. Treatment of patients with metastatic cancer using a major histocompatibility complex class II–restricted T-cell receptor targeting the cancer germline antigen MAGE-A3. J Clin Oncol. 2017; 35: 3322-3329. Link, Google Scholar.
- Marques I, Araújo A, de Mello RA. Anti-angiogenic therapies for metastatic colorectal cancer: current and future perspectives. World J Gastroenterol. 2013; 19: 7955-7971. Google Scholar.
- Hanahan D, Weinberg RA. Hallmarks of cancer: the next generation. Cell. 2011; 144: 646-674. Medline, Google Scholar.
- de Mello RA, Costa BM, Reis RM, Hespanhol V. Insights into angiogenesis in non-small cell lung cancer: molecular mechanisms, polymorphic genes, and targeted therapies. Recent Pat Anticancer Drug Discov. 2012; 7: 118-131. Medline, Google Scholar.
- Zhang Y, Han C, Li J, et al. Efficacy and safety for apatinib treatment in advanced gastric cancer: a real world study. Sci Rep. 2017; 7: 13208. Google Scholar.
- de Mello RA, de Oliveira J, Antoniou G. Angiogenesis and apatinib: a new hope for patients with advanced gastric cancer? Future Oncol. 2017; 13: 295-298. Google Scholar.
- Ilson DH. Targeting the vascular endothelial growth factor pathway in gastric cancer: a hit or a miss? J Clin Oncol. 2016; 34: 1431-1432. Link, Google Scholar.
- Park S-H, Jang KY, Kim MJ, et al. Tumor suppressive effect of PARP1 and FOXO3A in gastric cancers and its clinical implications. Oncotarget. 2015; 6: 44819-44831. Google Scholar.
- Qin Q, Lu J, Zhu H, et al. PARP-1 Val762Ala polymorphism and risk of cancer: a meta-analysis based on 39 case-control studies. PLoS One. 2014; 9: e98022. Google Scholar.
- Morales J, Li L, Fattah FJ, et al. Review of poly (ADP-ribose) polymerase (PARP) mechanisms of action and rationale for targeting in cancer and other diseases. Crit Rev Eukaryot Gene Expr. 2014; 24: 15-28. Google Scholar.
- Verdaguer H, Saurí T, Macarulla T. Predictive and prognostic biomarkers in personalized gastrointestinal cancer treatment. J Gastrointest Oncol. 2017; 8: 405-417. Google Scholar.
- Hierro C, Alsina M, Sánchez M, et al. Targeting the fibroblast growth factor receptor 2 in gastric cancer: promise or pitfall? Ann Oncol. 2017; 28: 1207-1216. Google Scholar.
- Carlomagno N, Incollingo P, Tammaro V, et al. Diagnostic, predictive, prognostic, and therapeutic molecular biomarkers in third millennium: a breakthrough in gastric cancer. BioMed Res Int. 2017; 2017: 7869802. Google Scholar.
- Van Cutsem E, Bang Y-J, Mansoor W, et al. A randomized, open-label study of the efficacy and safety of AZD4547 monotherapy versus paclitaxel for the treatment of advanced gastric adenocarcinoma with FGFR2 polysomy or gene amplification. Ann Oncol. 2017; 28: 1316-1324. Google Scholar.
ᐈ Первые симптомы рака желудка
Онкологические заболевания – настоящий бич современного человечества. Несмотря на достижение медицины, их распространенность остается очень высокой. И на 4 месте по онкозаболеваемости во всем мире стоит рак желудка.
Что считают раком желудка
Раком желудка называют злокачественное новообразование, которое происходит из слизистой оболочки любого отдела желудка. Такая опухоль не имеет четкого отграничения от здоровых клеток, она легко прорастает в окружающие ткани, преодолевает наружную серозную оболочку и распространяется за пределы органа. Поэтому на поздних стадиях в брюшной полости образуется конгломерат, в который могут вовлекаться все смежные анатомические образования.
Кроме того, рак желудка быстро прорастает в стенки сосудов и начинает распространяться гематогенным и лимфогенным путем (по кровеносному и лимфатическому руслу). Ее частицы оседают в виде метастазов в лимфатических узлах и органах, излюбленные места для таких раковых отсевов – печень, легкие, головной мозг, а у женщин еще и яичники.
Но на первой стадии рак желудка ограничивается слизистой оболочкой (стадия 1А) или подслизистым слоем (стадия 1В), регионарных и тем более отдаленных метастазов пока нет. Опухоль при этом небольшая, ее влияние на работу органа и весь организм еще незначительное. Поэтому появляющиеся первые признаки рака желудка не доставляют пациенту выраженного дискомфорта. В большинстве случаев они игнорируются или принимаются за проявления банального гастрита или даже переедания. Поэтому люди с первыми симптомами рака желудка предпочитают самолечение, не обращаются к врачу и не видят повода для самостоятельного обследования. Это и приводит к поздней выявляемости этого грозного заболевания.
Почему при раке желудка так важна ранняя диагностика
Рак желудка – достаточно распространенное заболевание. Ежегодно только на территории РФ диагностируется чуть менее 40 тысяч новых случаев этого заболеваний. Причем во большинстве случаев он выявляется уже при прорастании опухолевой ткани за пределы слизистой оболочки или даже ее распространении за пределы органа. Это намного ухудшает прогноз, утяжеляет и усложняет лечение.
Именно такая тенденция к поздней диагностике объясняет высокую летальность от рака желудка: по показателю смертности он занимает 2 место среди всех онкологических болезней. И эта ситуация, к сожалению, в последнее десятилетие в РФ остается неизменной. В 2016 году официально зарегистрированная заболеваемость раком желудка составила 38 тыс. новых случаев, а летальность – аж 32 тыс! Ведь 5-летняя выживаемость пациентов с раком 3 стадии составляет не более 15%.
А вот ранняя диагностика дает совсем другой, гораздо более благоприятный прогноз.
Среди пациентов, обратившихся к врачу с первыми симптомами рака желудка, 5-летняя выживаемость составляет более 80%. Это очень высокий показатель для онкологических заболеваний с поражением внутренних органов.
Первые признаки рака желудка: когда стоит насторожиться?
При раке желудка первые симптомы в большинстве случаев местные, обусловленные с возникающей дисфункцией пораженного опухолью органа. Но не исключены и общие неспецифические проявления. Причем на начальных этапах болезни они связаны не с раковой интоксикацией, как при развитых стадиях, а с анемией на фоне рецидивирующих (повторяющихся) желудочных кровотечений.
Первыми симптомами рака желудка могут быть:
- Дискомфорт в области желудка вскоре после приема пищи. Испытываемые болевые ощущения обычно вполне переносимы по интенсивности, многие пациенты описывают их как чувство переполнения, неприятного распирания на фоне небольшого (привычного) объема съеденного.
- Появление склонности к отрыжке, причем обычно она носит кислый характер и не связана с перееданием.
- Повышенная кислотность желудочного сока, из-за чего отрыжка нередко сопровождается чувством изжоги.
- Слабость, утомляемость, дискомфорт и склонность к несистемному головокружению при физической нагрузке. Обычно такие жалобы при начальном раке желудка – первые симптомы развившейся исподволь хронической анемии. К ее появлению приводят повторные небольшие по объему кровотечения из разрушаемых опухолью поверхностных сосудов. Они могут сопровождаться изменением густоты и цвета стула, он становится вязким и темнеет. Но многие пациенты не обращают на это внимания. Но во многих случаях такие ранние кровотечения при раке желудка выявляются лишь с помощью исследования кала на скрытую кровь.
- Умеренное изменение вкуса и пищевых предпочтений, что тоже можно объяснить проявлением анемии. Но эти симптомы все же более характерны для более поздних стадий рака.
Некоторые пациенты отмечают небольшое снижение веса. Но на ранних стадиях болезни это еще не типичная раковая кахексия (истощение), а скорее следствие изменения аппетита и уменьшения объема съедаемой пищи.
Когда же обращаться к врачу?
Первые признаки рака желудка малоотличимы от симптомов вялотекущего гастрита. Поэтому самостоятельно распознать начало заболевания очень сложно, особенно если опухоль у пациента появляется на фоне предшествующей хронической патологии пищеварительного тракта.
Единственное верное решение в такой ситуации – обращение к врачу-гастроэнтерологу при появлении даже небольших изменений в характере, интенсивности, продолжительности и комбинации симптомов. Кроме того, людям с хроническими гастроэнтерологическими заболеваниями рекомендуется регулярно проходить профилактические обследования. Это поможет контролировать состояние слизистой оболочки желудка и выявлять злокачественные опухоли на 1 или даже 0 (предраковой) стадии, когда они еще представляют собой небольшой поверхностно расположенный островок клеток.
Как диагностировать рак желудка
Общеклинические исследования крови и сопоставление симптомов при первых стадиях рака желудка не дадут достоверной информации. Подтвердить наличие злокачественной опухоли может лишь гистологическое исследование тканей, которые получены путем биопсии подозрительных на опухоль участков. Поэтому золотой стандарт диагностики рака желудка – ФГС (фиброгастроскопия).
Эту методику не может заменить ни один другой способ визуализации. Ведь именно ФГС позволяет врачу в режиме реального времени и с увеличением осматривать слизистую оболочку желудка, откуда и происходят раковые клетки. А биопсия дает возможность гистологического подтверждения диагноза, что является единственным абсолютно достоверным методом диагностики онкологических заболеваний.
Согласно современным клиническим рекомендациям, пациентам с повышенным риском развития рака желудка необходимо проходить ФГС 1 раз в год. Причем малейшие подозрения на онкопатологию в виде появления новых симптомов или изменения характера уже имеющихся – однозначный повод для внепланового обследования.
Где пройти ФГС
ФГС не относится к инновационным и редким диагностическим методикам, многие медицинские учреждения предлагают услуги по такому обследованию. Но по возможности предпочтение все же стоит отдавать специализированным центрам, оснащенным наиболее современными моделями эндоскопических аппаратов.
ICLINIC – многопрофильная клиника, на базе которой функционирует Центр профилактики рака пищеварительной системы. Поэтому специалисты ICLINIC имеют богатый клинический опыт выявления самых ранних признаков малигнизации (озлокачествления) слизистой оболочки желудка. А новейшие модели фиброгастроскопов с высокоточными оптическими системами, атравматическими трубками малого диаметра и чувствительными манипуляторами позволяют проводить обследование прицельно, быстро, с высокой степенью достоверности и при этом с минимальным для пациента дискомфортом.
Мы рекомендуем:
ФГДС
ФГДС с консультацией ведущего специалиста
Взятие биопсии при эндоскопических исследованиях
Прием врача-гастроэнтеролога
Тест на вероятность рака желудка
Ваш возраст более 45 лет?
Да Нет
У Ваших родственников были онкологические заболевания?
Да Нет
У Вас есть хронические заболеваний желудочно-кишечного тракта:
– хронический гастрит,
– язвенная болезнь,
– хронический колит и другие воспалительные заболевания кишечника,
– болезнь Крона,
– неспецифический язвенный колит,
– выявленные ранее полипы желудка и кишечника,
– выявленные подслизистые эпителиальные образования желудочно-кишечного тракта?
Да Нет
Вы переносили операции на желудке и кишечнике?
Да Нет
У Вас есть рубцово-спаечные изменения желудочно-кишечного тракта?
Да Нет
Вы курите (более 1 сигареты в день)?
Да Нет
Вы допускаете погрешности в диете (низкое потребление овощей и фруктов, высокое потребление мяса и животных жиров)?
Да Нет
У Вас есть хотя-бы один из перечисленных симптомов:
– лишний вес,
– затруднения при глотании,
– раздражительность,
– бледность кожи,
– боли за грудиной,
– немотивированная слабость,
– нарушение сна,
– снижение аппетита,
– неприятный запах изо рта,
– отрыжка,
– тошнота и/или рвота,
– чувство тяжести в животе,
– изменение стула (запоры и/или поносы),
– следы крови в стуле,
– боли в животе.
Да Нет
Запишитесь на прием
В чем преимущества ICLINIC?Высочайший уровень специалистов: среди них доктора медицинских наук и члены мировых врачебных сообществ, а средний стаж врачей клиники – 16 лет безупречной работы.
Современное экспертное оборудование: диагностические аппараты медицинского центра выпущены в 2017 году ведущими мировыми производителями (Pentax и другими того же уровня).
Безупречная точность эндоскопической диагностики благодаря высокому разрешению изображения в 1,25 млн.пикселей.
Уникальные технологии ранней диагностики рака, среди которых i-scan – виртуальная хромоэндоскопия. С помощью данной технологии можно распознать даже самые мелкие, начальные опухолевые изменения.
Все для комфорта пациента: эффективное обезболивание, включая общий наркоз; тонкие эндоскопы менее 10мм в диаметре; быстрое и точное проведение манипуляций.
Безопасность: автоматизированная дезинфекция оборудования с контролем качества, мониторинг жизненно важных функций пациента в процессе исследований.
Узкая специализация: медцентр занимается заболеваниями пищеварительной системы, постоянно совершенствуясь именно в своей отрасли. Наши специалисты постоянно проходят повышение квалификации, участвуют в международных конференциях, тренингах и семинарах в России и Европе.
Удобное расположение: Петроградский район Санкт-Петербурга расположен недалеко от ценра. Сюда удобно добираться как на машине, так и на общественном транспорте. Совсем рядом с клиникой находится станция метро Чкаловская, также недалеко от медицинского центра станции СПб Спортивная, Петроградская и Горьковская.
Наш профессионализм всегда на страже вашего здоровья.
Аденокарцинома желудка
Рак желудка является вторым по распространенности во всем мире раком, частота которого сильно варьируется в разных географических регионах. 1 Это относительно редко встречающееся новообразование в Северной Америке, но оно вносит существенный вклад в бремя смертности от рака. 2–5 В Северной Америке рак желудка является третьим по распространенности злокачественным новообразованием желудочно-кишечного тракта после рака прямой кишки и поджелудочной железы и третьим по частоте летальным исходом новообразованием в целом. 4 Несмотря на снижение заболеваемости во всем мире, на рак желудка приходится от 3% до 10% всех смертей, связанных с раком. 6 Хотя выживаемость при раке желудка неуклонно повышается в таких странах, как Япония, этого не происходит в Северной Америке. 3 Несмотря на технические достижения в хирургии и использование адъювантной терапии, преобладала высокая смертность, связанная с раком желудка.
Девяносто процентов всех опухолей желудка являются злокачественными, а аденокарцинома желудка составляет 95% от общего числа злокачественных новообразований. 7 Лечебная терапия включает хирургическую резекцию, чаще всего полную или субтотальную резекцию желудка, с сопутствующей лимфаденэктомией.Общая 5-летняя выживаемость пациентов с операбельным раком желудка колеблется от 10% до 30%. 8–10
ЭПИДЕМИОЛОГИЯ
Рак желудка редко встречается в возрасте до 40 лет, но после этого частота его заболеваемости неуклонно растет и достигает пика в седьмом десятилетии жизни. 11 По оценкам, в 2000 году было диагностировано 876 340 случаев первичного рака желудка, что привело к почти 650 000 смертей во всем мире. 4 В Северной Америке вероятность развития и смерти от рака желудка в течение жизни равна 1.5% и 1,0% соответственно. 4 В целом стандартизованные по возрасту коэффициенты смертности снизились у женщин (с 9,9 до 4,2 на 100 000) и мужчин (с 21,2 до 9,1 на 100 000) за последние 30 лет в Канаде. 5 В США ежегодно регистрируется 24 000 новых случаев заболевания и 14 000 случаев смерти. 12 В ретроспективном исследовании с участием более 50000 пациентов, пролеченных по поводу первичного рака желудка, Hundahl et al. 13 продемонстрировали, что 65% рака желудка в США находятся на поздней стадии (T3 / T4), из них почти 85%. опухолей, сопровождающихся метастазами в лимфатические узлы при постановке диагноза.Эта проблема еще более усложняется тем, что у пациентов, подвергнутых резекции с лечебной целью, частота рецидивов составляет от 40% до 65%. 14 В отсутствие официальных программ скрининга у большинства пациентов наблюдается продвинутая патологическая стадия, и средняя выживаемость при опухолях, резецированных с лечебной целью, может составлять 24 месяца (20–30% 5-летняя выживаемость), средняя выживаемость составляет 8,1 месяца. после паллиативных процедур и медиана выживаемости всего 5,4 месяца при запущенном заболевании без операции. 15–17
ФАКТОРЫ РИСКА
Сравнительные исследования между азиатскими и западными странами демонстрируют поразительные различия в заболеваемости и общей выживаемости рака желудка, что указывает на этническое происхождение как возможный фактор риска. 3,11,18 Самый высокий уровень заболеваемости в Японии (> 40 на 100 000), Восточной Азии, Южной Америке и Восточной Европе; тогда как Канада (10 на 100 000), Северная Европа, Африка и США имеют самые низкие показатели заболеваемости. 19 Национальный институт рака при изучении этнической принадлежности как фактора риска рака желудка выделил 3 группы: группы с высоким (корейцы, вьетнамцы, японцы, коренные американцы и гавайцы), среднего уровня (латиноамериканцы, китайцы и чернокожие). ), и низкая заболеваемость раком желудка с поправкой на возраст (филиппинцы и белые). 4
Мигранты первого поколения из стран с высокой заболеваемостью в страны с низкой заболеваемостью сохраняют уровень риска своей родной страны, тогда как последующие поколения приобретают уровень риска своей новой среды. 11,20 Это говорит о том, что этиологическое влияние может быть больше связано с факторами окружающей среды, чем с факторами этнической принадлежности. 11 С тех пор были подробно изучены некоторые диетические и поведенческие факторы. В исследовании случай-контроль Ramon et al. 21 определили, что диеты, богатые солью, копчеными или плохо консервированными продуктами, нитратами, нитритами и вторичными аминами, связаны с повышенным риском рака желудка.Считается, что эта связь возникает из-за длительного чрезмерного употребления соленой или маринованной пищи, что приводит к атрофическому гастриту и изменению желудочной среды с образованием канцерогенных N-нитрозосоединений. 11 Напротив, диета, богатая фруктами и овощами, может быть связана со снижением риска рака. Haung et al, 20 в ретроспективном опросе 877 японских пациентов с раком желудка предположили, что частое употребление сырых овощей и фруктов значительно снижает риск смерти, связанной с раком желудка (отношение рисков, 0.74; 95% доверительный интервал [ДИ] 0,56–0,98) за счет их антиоксидантного действия. Постулируется, что кальций, витамин А и витамин С оказывают защитное действие на слизистую оболочку желудка за счет снижения образования N-нитрозоканцерогенных соединений. 11,20 Исследования методом случай-контроль показывают, что у курильщиков сигарет риск развития проксимального рака желудка в 2–3 раза выше. 22 Эти результаты были подтверждены в исследовании Haung et al, 20 , которые продемонстрировали отношение шансов, равное 2.53 (ДИ 1,22–5,29) для постоянных курильщиков и тенденция к значимости для пациентов с привычным потреблением алкоголя.
Большинство случаев рака желудка возникает спорадически, в то время как от 8% до 10% имеют наследственный семейный компонент. 23 Карцинома желудка иногда развивается в семьях с мутациями зародышевой линии в p53 (синдром Ли-Фраумени) и BRCA2. 19 В 1-3% случаев рака желудка мутации зародышевой линии в гене, кодирующем белок клеточной адгезии E-кадгерин, приводят к аутосомно-доминантной предрасположенности к карциноме желудка, называемой наследственным диффузным раком желудка, которая имеет пенетрантность примерно 70%. 19,24–27 Huntsman et al. 24 предположили, что идентификация мутации E-кадгерина должна способствовать профилактической гастрэктомии у пораженных родственников. Рак желудка может развиваться как часть синдрома наследственного неполипозного рака толстой кишки (HNPCC), а также как часть синдромов желудочно-кишечного полипоза, включая семейный аденоматозный полипоз (FAP) и синдром Пейтца-Егерса. 19
Важным событием в эпидемиологии рака желудка стало признание связи с инфекцией Helicobacter pylori . 19 В трех независимых исследованиях сообщалось о значительном повышении риска у субъектов, у которых была подтверждена инфекция H. pylori за 10 или более лет до постановки диагноза рака. 28–30 Последующий метаанализ 42 обсервационных исследований, проведенных Eslick et al. 31 , показал значительную взаимосвязь между H. pylori и раком желудка (отношение шансов [OR], 2,04; CI, 1,69–2,45 ). H. pylori , как было впоследствии показано, вызывает изменения слизистой оболочки желудка и желудочной флоры, предрасполагающие к развитию карциномы у людей. 19 Кроме того, H. pylori способен прикрепляться к антигену группы крови Льюиса и может быть важным фактором, способствующим хронической инфекции и последующему повышенному риску рака, наблюдаемому у пациентов с фенотипом группы крови А. 19
К другим факторам, связанным с повышенным риском рака желудка, относятся хронический атрофический гастрит (например, злокачественная анемия, токсические и диетические агенты, предыдущие операции на желудке с рефлюксом желчи), гипертрофическая гастропатия (болезнь Метенье), полипы желудка, низкие социально-экономические показатели. статус и ожирение. 11,19
АДЕНОКАРЦИНОМА ЖЕЛУДКА: КЛИНИЧЕСКИЕ СООБРАЖЕНИЯ
Определение / описание случая
Диагноз рака желудка требует гистопатологической оценки тканей или цитологической оценки чистки / промываний желудка. Было предложено несколько систем классификации, чтобы помочь описать рак желудка либо с помощью макроскопических признаков (Borrmann), либо на основе микроскопической конфигурации (Ming, Carniero и Goseki). 19,32 Двумя наиболее часто используемыми являются системы Лорена и Всемирной организации здравоохранения (ВОЗ). 19
Классификация Лорена делит рак желудка на 2 основных гистологических типа: кишечный или диффузный. 11,33,34 Эта система описывает опухоли на основе микроскопической конфигурации и характера роста. 11 Рак диффузного типа имеет некогезионные опухолевые клетки, диффузно инфильтрирующие строму желудка, и часто проявляется глубокая инфильтрация стенки желудка с небольшим образованием желез или без них. 19,32 Диффузные опухоли могут проявлять выраженную десмоплазию и ассоциированное воспаление с относительной щадью покрывающей слизистой оболочки. 32 По сравнению с раком желудка кишечного типа, рак желудка диффузного типа в меньшей степени связан с влиянием окружающей среды, имеет повышенную относительную заболеваемость, чаще встречается у молодых пациентов и связан с худшим прогнозом. 19 Эти виды рака не связаны с кишечной метаплазией, не локализуются в антральном отделе и могут возникать в результате одноклеточных мутаций в нормальных железах желудка, как в случае недавно описанной наследственной диффузной карциномы желудка. 23,24,35
Рак кишечного типа демонстрирует узнаваемое образование желез, похожее по микроскопическому виду на слизистую оболочку толстой кишки. 11,19,32 Железистые образования варьируются от хорошо до низкодифференцированных опухолей, которые растут по расширяющимся, а не инфильтративным структурам. 6,11 Считается, что рак кишечника возникает вторично по отношению к хроническому атрофическому гастриту. 11,19
H. pylori и аутоиммунный гастрит являются наиболее частыми этиологическими поражениями, которые создают среду, способствующую воспалению желудка.Если гастрит не проходит, возникает атрофия желудка с последующей кишечной метаплазией, которая, в свою очередь, может привести к дисплазии. Дисплазия может возникать как в собственном желудочном, так и в «кишечном» желудочном эпителии. 19 Термин «аденома» применяется, когда диспластическая пролиферация вызывает макроскопическое выступающее поражение и морфологически описывается как тубулярная, тубуловиллярная или ворсинчатая аденома. 19 Аденомы, как правило, возникают в дистальных отделах желудка, часто имеют длительную предраковую фазу и расширяющийся характер роста. 6,11,19 Карцинома диагностируется, когда опухоль проникает в собственную пластинку или через мышечную слизистую оболочку. 19 До 80% диспластических поражений могут прогрессировать до инвазии.
Классификация Лорена оказалась полезной при оценке естественного течения рака желудка, особенно в отношении тенденций заболеваемости, клинико-патологических корреляций и этиологических предшественников. 6,11,33 Несмотря на очевидное использование классификации Лорена, ВОЗ 19 пересмотрела определение рака желудка на «злокачественные эпителиальные опухоли слизистой оболочки желудка с железистой дифференцировкой».«Система ВОЗ оценивает аденокарциному на основании степени сходства с метапластической тканью кишечника. 6,19,32 Он подразделяет гистологические образцы на 5 подтипов: аденокарцинома (кишечная и диффузная), папиллярная, трубчатая, муцинозная и клетка с перстневым кольцом. 19,32
Клинические проявления
Карцинома желудка часто не вызывает специфических симптомов, если она поверхностна и потенциально поддается хирургическому лечению, хотя до 50% пациентов могут иметь неспецифические желудочно-кишечные жалобы, такие как диспепсия. 11 В западных странах, даже при эндоскопическом обследовании, рак желудка обнаруживается только у 1-2% пациентов с диспепсией. Отсутствие ранних патогномоничных симптомов часто задерживает постановку диагноза. Следовательно, от 80% до 90% пациентов с раком желудка имеют местнораспространенные или метастатические опухоли с низкой степенью резектабельности. 19 Пациенты могут иметь анорексию и потерю веса (95%), а также боль в животе, которая носит неопределенный и коварный характер. Тошнота, рвота и преждевременное насыщение могут возникать при объемных опухолях, закупоривающих просвет желудочно-кишечного тракта, или при инфильтративных поражениях, которые ухудшают вздутие живота. 11 Язвенные опухоли могут вызывать кровотечение, которое проявляется в виде кровавой рвоты, мелены или массивного кровотечения из верхних отделов желудочно-кишечного тракта.
Физикальное обследование рака желудка на ранней стадии обычно неинформативно. Пациенты с запущенными опухолями могут проявлять пальпируемое образование в брюшной полости, кахексию, непроходимость кишечника, асцит, гепатомегалию и отек нижних конечностей. 11,36,37 Посев в брюшину может вызвать поражение яичников (опухоль Крукенберга) или тазового тупика (полка Блюмера), обнаруживаемого при ректальном исследовании. 37 Метастазы могут проявляться в виде увеличенного надключичного лимфатического узла (узел Вирхова), левого подмышечного лимфатического узла (узел Ирриша) или околопупочного лимфатического узла (узел сестры Мэри-Джозеф). 11,37
Скрининг рака желудка
Целью массового скрининга (бессимптомные группы населения) или наблюдения (группы риска) является обнаружение и диагностика рака желудка на ранней и, следовательно, потенциально излечимой стадии. 19 Массовый скрининг для раннего выявления рака желудка является рентабельным и рекомендуется в регионах с высокой заболеваемостью, таких как Япония и Китай, где от 50% до 80% обнаруженных злокачественных новообразований приходится на ранний рак желудка. 19 В Северной Америке нет официальных программ проверки. Американское общество эндоскопии желудочно-кишечного тракта рекомендует проводить эндоскопическое наблюдение за лицами с высоким риском (аденома желудка в анамнезе, FAP, HNCC, синдром Пейтца-Егерса и болезнь Метенье) каждые 1-2 года. 11 Массовый эндоскопический / радиологический скрининг не рекомендуется в регионах с низкой заболеваемостью, таких как Канада и США. 11
Диагностика и стадирование
Эндоскопия считается наиболее чувствительным и специфическим методом диагностики у пациентов с подозрением на рак желудка. 12 Эндоскопия позволяет напрямую визуализировать расположение опухоли, степень поражения слизистой оболочки и проводить биопсию (или цитологическую чистку) для диагностики тканей. 38 В сочетании с эндоскопией и радиологическими методами эндоскопическое ультразвуковое исследование (EUS) может максимально повысить стадию опухоли, предоставляя информацию о глубине инвазии опухоли и оценивая степень перигастральной лимфаденопатии. Willis et al., , 39, предполагают, что EUS в настоящее время является наиболее ценным диагностическим инструментом для предоперационной стадии рака желудка (точность 82% при оценке глубины инвазии опухоли) и для определения резектабельности опухоли.Karpeh et al., , 12, предполагают, что комбинированное использование EUS и лапароскопического определения стадии облегчает выбор пациента, предоставляя информацию о глубине опухоли и вовлечении перигастральных лимфатических узлов. Однако они предупреждают, что EUS менее точен (50–87%) при определении статуса лимфатических узлов.
Исследование бария в верхних отделах желудочно-кишечного тракта (UGI) включает закапывание жидкого бария в желудок и комбинацию 4 техник: оценка с наполнением барием, двойное контрастирование, рельеф слизистой оболочки и сжатие желудка. 40 Процедура позволяет выявить неровности слизистой оболочки. Halvorsen et al. 40 предположили, что, хотя эндоскопия все чаще становится методом выбора, эти 2 метода дополняют друг друга и имеют эквивалентную диагностическую эффективность.
Компьютерная томография (КТ) – наиболее часто используемый метод определения стадии рака желудка. 40 КТ может обнаруживать метастазы в печени, региональную и отдаленную лимфаденопатию и может прогнозировать прямое вторжение в соседние структуры.Кунц и др. 41 предположили, что КТ имеет чувствительность 88% для обнаружения опухолей. Способность КТ точно определять инфильтрацию опухоли (стадия Т 58%) или статус перигастральных лимфатических узлов (25–86%) широко варьировала и не считалась надежным предиктором степени заболевания в нескольких исследованиях. 41–43
Магнитно-резонансная томография (МРТ) имела ограниченное применение для определения стадии рака желудка, главным образом из-за трудностей с артефактами движения, стоимости, времени, необходимого для обследования, и отсутствия подходящего перорального контрастного вещества. 44,45 Однако в недавнем исследовании, сравнивающем МРТ с КТ, Sohn et al. 44 задокументировали распространенный рак желудка, который легко обнаруживался с помощью обоих методов. Они показали, что МРТ была немного лучше, чем КТ при Т-стадии рака желудка. 44 Точно так же Kim et al. 46 документально подтвердили, что точность определения стадии Т МРТ была выше, чем КТ (81% против 73%, P <0,05). Это исследование показало, что МРТ склонна к завышению патологической толщины опухоли. 46 Сообщается, что общая точность определения стадии T составляет от 73% до 88%. 45 Использование МРТ для определения стадии N затруднено из-за тех же трудностей, что и при постановке КТ, при которой статус узлов оценивается на основе размера лимфатических узлов. Несколько исследований показывают, что точность постановки узлов на МРТ ниже, чем при постановке КТ (65% против 73% соответственно, P > 0,05), причем оба метода имеют тенденцию к снижению узлового статуса. 45,46 Наконец, Мотохара и др. 45 рассмотрели способность МРТ выявлять внегастральные метастазы и пришли к выводу, что МРТ имеет большую чувствительность, чем КТ, в обнаружении диссеминации печени, костей и брюшины.Очевидное преимущество постановки МРТ заключается, прежде всего, в ее многоплоскостных возможностях, отсутствии ионизирующего излучения и использовании у пациентов с гиперчувствительностью к контрасту. 44 Другие методы стадирования включают УЗИ брюшной полости, позитронно-эмиссионную томографию и стадионную лапароскопию. 36
ХИРУРГИЧЕСКАЯ ТЕРАПИЯ
Общая, промежуточная и проксимальная гастрэктомия
Выбор хирургической процедуры при резектабельном раке желудка продиктован размером, расположением и возможностью достичь хирургических границ, свободных от макроскопических и микроскопических заболеваний.Несколько европейских исследований показали, что для достижения адекватных границ, свободных от болезни, должно быть расстояние 5 см от опухоли до ближайшей линии резекции в опухолях кишечного типа и 10 см в опухолях диффузного типа. 39,47–49
Обычно опухоли, ограниченные проксимальной третью желудка, лечат тотальной гастрэктомией, чтобы гарантировать адекватные границы резекции. Спорный вопрос, связана ли проксимальная гастрэктомия с плохим функциональным исходом дистального остатка желудка по сравнению с тотальной гастрэктомией с реконструкцией.Хотя исследований, посвященных этой проблеме, немного, но Harrison et al, 50 в ретроспективном обзоре продемонстрировали, что пациенты с проксимальным раком желудка, перенесшие тотальную гастрэктомию или проксимальную гастрэктомию, имели одинаковую общую продолжительность жизни и частоту рецидивов. Это исследование показало, что обе процедуры могут быть выполнены безопасно. Авторы предполагают, что, хотя эти 2 процедуры эквивалентны с точки зрения выживания и рецидива, необходимы дальнейшие исследования для оценки питания и качества жизни.Исследования продемонстрировали улучшение качества жизни при субтотальной гастрэктомии по сравнению с группой тотальной гастрэктомии 51–53 ; однако только одно исследование 53 конкретно продемонстрировало снижение качества жизни проксимальной гастрэктомии по сравнению с тотальной и дистальной субтотальной резекциями.
Остается спорным вопрос о выборе процедуры при опухолях средней и дистальной трети желудка. В большом европейском опросе, в котором участвовали 62 центра, Heberer et al. 54 продемонстрировали, что 44% хирургов предпочитают тотальную гастрэктомию при диффузном типе рака желудка антрального отдела на основании улучшенного клиренса опухоли и частоты местных рецидивов.При анализе 6400 пациентов в Национальной базе данных рака США, Hundahl et al 13 показали, что 12,3% пациентов с раком антрального отдела или привратника, независимо от типа опухоли, лечились тотальной гастрэктомией. В многоцентровом рандомизированном исследовании 618 пациентов Bozzetti et al 1 пришли к выводу, что пациенты с раком средней и дистальной трети желудка, перенесшие либо субтотальную, либо полную гастрэктомию, имели одинаковую 5-летнюю выживаемость. Это исследование показало, что пациенты, перенесшие субтотальную резекцию желудка, имели более короткое пребывание в больнице, лучший статус питания, меньше осложнений и лучшее качество жизни. 1 Кроме того, пациенты, перенесшие тотальную гастрэктомию, имели более высокий уровень спленэктомии с увеличением послеоперационных осложнений и восприимчивостью к инфекции, что подтверждает роль субтотальной гастрэктомии, когда это возможно. 1 Авторы пришли к выводу, что если рак желудка поражает соседние органы, эти органы должны быть удалены en bloc с желудком, при условии, что комбинированная процедура позволяет достичь четких границ резекции. 47,48
Ограниченная или расширенная лимфаденэктомия
Частота поражения лимфатических узлов колеблется от 3% до 5% для опухолей, ограниченных слизистой оболочкой, от 16% до 25% для опухолей, ограниченных подслизистой оболочкой, и от 80% до 90 % у пациентов с III или IV стадией заболевания. 11,55 Существуют значительные разногласия относительно надлежащей степени диссекции лимфатических узлов (LND). Ретроспективные исследования, проведенные в Японии, с участием более 10 000 пациентов, предполагают, что расширенная LND в сочетании с гастрэктомией продлевает выживаемость по сравнению с ограниченной LND. 56–59 Расширенная LND обеспечила общую 5-летнюю выживаемость от 50% до 62% по сравнению с 15% до 30%, полученной при ограниченных резекциях в США. 10,58,60 Японские исследователи утверждают, что расширенная LND (D2) удаляет опухоль в регионарных лимфатических узлах до того, как она может метастазировать.Кроме того, утверждается, что расширенный LND улучшает точность постановки. 55–59
Несоответствие общих показателей выживаемости между японскими и западными центрами после расширенной LND привело к 2 крупным многоцентровым рандомизированным проспективным испытаниям. Голландская группа по лечению рака желудка 61 рандомизировала 711 пациентов (380 в ограниченную [D1] и 331 – в расширенную [D2]) для проведения резекции с лечебной целью. Это исследование показало, что пациенты в группе D2 имели значительно более высокий уровень послеоперационных осложнений, чем пациенты в группе D1 (43% vs.25%; P <0,001), большее количество послеоперационных смертей (10% против 4%; P = 0,004) и более длительное пребывание в больнице (медиана, 16 дней против 14; P <0,001). 61 Кроме того, Пятилетняя выживаемость была схожей в 2 группах (45% в группе D1 и 47% в группе D2). 61 В голландском исследовании авторы отметили, что миграция стадий произошла в 30% группы D2 и может объяснили разницу в выживаемости между Востоком и Западом у пациентов, соответствующих стадии. 61 Авторы пришли к выводу, что результаты не подтверждают рутинное использование D2 LND. Однако в анализе подгрупп они показали значительную разницу у пациентов со стадией II и IIIA, которым предложили резекцию D2, наблюдение, подтвержденное Siewert и др. 62 в Немецком исследовании рака желудка. Кроме того, Hundahl et al, 13 , изучая зрелые результаты голландского исследования, отметили, что риск рецидива выше в группе D1, чем в группе D2 (41% против 29%; P = 0.02), что подтверждает роль расширенной резекции лимфатических узлов.
Cuschieri et al. 63 провели рандомизированное сравнение резекций D1 (n = 200) и D2 (n = 200) для потенциально излечимого распространенного рака желудка в исследовании Совета по медицинским исследованиям (MRC). Результаты исследования продемонстрировали значительную разницу между группой D2 и группой D1 по послеоперационной смертности (13% против 6,5%; P = 0,04) и заболеваемости (46% против 28%; P <0,001). , без разницы в общей 5-летней выживаемости для D2 по сравнению с D1 (33% vs.35%). 63 Как и в голландском исследовании, MRC не продемонстрировал преимущества в выживаемости с классической японской расширенной резекцией; однако анализ подгрупп исследования MRC продемонстрировал несколько интересных результатов. Во-первых, наибольшим фактором послеоперационной заболеваемости и смертности в группе D2 было добавление панкреатикоспленэктомии (отношение рисков 1,53; ДИ 1,17–2,01). 63 Во-вторых, сохранение поджелудочной железы и селезенки с сопутствующей резекцией D2 может обеспечить лучшую выживаемость, чем резекция D1, и может быть выполнено с низкой послеоперационной заболеваемостью и смертностью. 63 Интересно, что и в исследованиях, проведенных в Голландии, и в исследованиях MRC, когда для всех пациентов требовалась как минимум резекция D1 (удаление как минимум узлов уровня N1), общая 5-летняя выживаемость в группе D1 резко увеличилась. Выживаемость от 20% до 34% (MRC) и 45% (голландцы), что снова указывает на сильную связь между выживаемостью и адекватным расслоением LN. 13 Cuschieri et al. 63 пришли к выводу, что «резекция D2 без панкреатико-спленэктомии может быть лучше, чем стандартная резекция D1, и не может быть отклонена по результатам этого исследования.
В нескольких последующих исследованиях, основанных на результатах Нидерландов и MRC, изучалась роль расширенной LND с сохранением поджелудочной железы и селезенки на послеоперационную заболеваемость, смертность и общую выживаемость. 10,55,56,62,64–69 Эти исследования продемонстрировали, что расширенная LND с сохранением селезенки и поджелудочной железы может быть выполнена при послеоперационной заболеваемости и смертности, эквивалентной ограниченной LND. Несколько хорошо проведенных проспективных исследований 10,62,64–66,69 продемонстрировали, что расширенная LND не связана с увеличением заболеваемости или смертности при проведении в опытных центрах и значительно улучшает долгосрочную выживаемость у пациентов со стадией II, IIIA 10,62,64–66,69 и, возможно, болезнь IIIB. 10 На основании этих исследований, гастрэктомия с расширенной лимфодиссекцией остается процедурой выбора в специализированных центрах. 56,69–73
Новые проблемы лимфаденэктомии при раке желудка
Ранние версии критериев стадирования TNM касались статуса N, определяемого расположением метастазов в лимфатические узлы (ЛУ) относительно первичной опухоли. 74 Это вызвало разногласия в отношении подходящих резекций лимфатических узлов и предотвратило обобщение результатов азиатских исследований, проводимых в соответствии с Японской классификацией рака желудка (JCGC). 75 JCGC классифицировал степень метастазов в LN на основе анатомической станции LN (). Наличие метастазов в каждой группе LN отражает статус N и составляет основу категорий D (). 74 С признанием преимущества расширенных резекций (D2) на выживаемость, пятое издание TNM AJCC было изменено, чтобы включить доступные клинические, радиологические, эндоскопические и хирургические средства для оценки степени заболевания. 76 Пятое издание классифицирует метастазы LN на основе количества положительных узлов, в которых по крайней мере 15 LN должны быть рассечены и исследованы для точного определения стадии (). 75,76 В исторической когорте Karpeh et al. 75 продемонстрировали, что количество положительных узлов обеспечивает лучший прогноз, чем анатомическое расположение, как определено в более ранней редакции TNM. Точно так же Kodera et al. 77 применили стадию TNM 1997 года к 493 японским пациентам, у которых была резекция D2 или D3, и пришли к выводу, что количество вовлеченных узлов было сильным прогностическим индикатором, который должен заменить категорию N в JCGC. С тех пор это открытие было поддержано несколькими группами, которые аналогичным образом обнаружили, что увеличение количества LN улучшает прогноз, сводит к минимуму эффекты миграции стадий, улучшает стадирование узлов в разных регионах и странах, помогает выбрать подходящую мультимодальную терапию и дает лучшее представление о бремени болезни. 75,76,78 В 1995 году патологическая стадия N определялась количеством метастатических ЛУ, таким образом достигая единой унифицированной системы стадирования. 75
ТАБЛИЦА 1. Японская классификация рака желудка (JCGC)
ТАБЛИЦА 2. Классификация рака желудка Американским объединенным комитетом (AJCC) (5-е издание)
растет консенсус о том, что для точного определения стадии опухоли необходимо извлечение как минимум 15 LN.Однако в хирургических центрах Северной Америки и Европы наблюдается значительное несоблюдение режима лечения. Mullaney et al. 76 показали, что только 31% (диапазон 10–44%) хирургически удаленных случаев можно точно оценить на предмет статуса лимфатических узлов. Недостаток LN для определения стадии имеет значение как для прогноза, так и для миграции стадии. 76 Это наблюдение было подтверждено исследованием 1038 пациентов в одном американском учреждении и обнаружило, что до 27% случаев обследовали менее 15 узлов. 75 Еще более тревожным был отчет из Национальной базы данных США, который продемонстрировал, что всего у 18% пациентов в США проанализировано ≥15 LN. 13 Авторы предполагают, что у этих пациентов высока вероятность остаточного нелеченого поражения регионарных лимфатических узлов. Несоблюдение режима может быть непринятием обширных резекций для улучшения прогноза, незнанием степени резекции, необходимой для достижения минимального количества ЛУ, и неадекватной патологической оценки. 13,75,76,78
Адъювантная или неоадъювантная терапия
Пациенты с локализованным раком желудка без лимфоузлов имеют 5-летнюю выживаемость, которая приближается к 75% при лечении только хирургическим вмешательством. 79 В этом отличие от пациентов с поражением лимфатических узлов, у которых выживаемость колеблется от 10% до 30%. 9 Исход рака желудка осложняется высокой частотой местных рецидивов и отдаленных метастазов после радикальных хирургических вмешательств, что вызвало интерес к адъювантной терапии в надежде на улучшение результатов лечения. 58 Исследования адъювантной и неоадъювантной терапии при лечении рака желудка дали противоречивые результаты. Несоответствие может быть отражением различий между изученными популяциями (группы высокого и низкого риска), 80 патологической классификации, 81 степени хирургической процедуры (D2 по сравнению с D1) 68 , а также различий в содержание и сроки адъювантной терапии (немедленная или отсроченная). Было опубликовано несколько метаанализов 82–88 в попытке устранить расхождения, описанные в литературе, результаты которых суммированы в.
ТАБЛИЦА 3. Мета-анализ рандомизированных клинических испытаний адъювантной химиотерапии
Три из 7 метаанализов предполагают небольшое, но значительное преимущество адъювантной химиотерапии в лечении полностью резецированного рака желудка. 83,84,87 Однако эти авторы предлагают интерпретировать результаты с осторожностью, потому что результаты имеют пограничную значимость 83 и могут зависеть от ряда систематических ошибок, а также низкого методологического качества. 84 Этот вывод отражал более ранний отчет, в котором рассматривались результаты 43 рандомизированных исследований, проведенных в период с 1967 по 1993 год по всем адъювантным методам лечения рака желудка, включая опубликованные в японской литературе. 89 В этом обзоре сделан вывод о том, что результаты рандомизированных исследований в Северной Америке и Европе не подтверждают рутинное использование адъювантной химиотерапии при раке желудка. 89
Janunger et al, 85 в систематическом обзоре 153 научных статей (с участием 12 367 пациентов) исследовали эффекты адъювантной химиотерапии при раке желудка.В их метаанализе было продемонстрировано значительное улучшение общей выживаемости (). Однако раздельный анализ западных и азиатских исследований продемонстрировал значительную разницу в результатах в азиатских (OR, 0,58; 95% ДИ, 0,44–0,76), но не в западных (OR, 0,96; 95% ДИ, 0,83–1,12) отчетах. разница объясняется сроками постановки диагноза, объемом операции и переносом стадии. 85 В более позднем метаанализе, Jununger et al., 88 , применяя современные комбинации лекарств в течение последних 10 лет, не смогли продемонстрировать какого-либо значительного улучшения выживаемости ().В целом, в настоящее время недостаточно данных, чтобы рекомендовать послеоперационную химиотерапию в качестве стандартного адъювантного лечения в западных центрах. 82–85,88
Неоадъювантная терапия (химиотерапия, химиолучевая терапия, лучевая или иммунотерапия, отдельно или в комбинации) использовалась при местнораспространенных опухолях и опухолях с высоким риском рецидива, несмотря на очевидно излечивающую операцию. Сообщалось о степени резектабельности от 40% до 100% и потенциально излечивающих резекциях в 37-80% случаев. 85 Однако только 2 рандомизированных исследования касались неоадъювантной химиотерапии, ни одно из которых убедительно не демонстрирует явного преимущества. 90–92 Исследования адъювантной внутрибрюшинной химиотерапии также неубедительны и обычно не проводятся вне рамок клинических испытаний. 85
Предварительные исследования адъювантной химиолучевой терапии показали многообещающие результаты у пациентов, подвергнутых резекции с лечебной целью. 93,94 Роль адъювантной химиолучевой терапии изучалась в первую очередь в исследовании Intergroup 0116 95 , в котором 566 пациентов со стадией IB-IVM0 полностью резецировали желудочную или гастроэзофагеальную аденокарциному для проведения только хирургического вмешательства или хирургического вмешательства плюс химиолучевой терапии (5f + лейковорин с последующей 45 Гр излучения).В группе только хирургического вмешательства дела обстояли значительно хуже по сравнению с группой адъювантной химиолучевой терапии с точки зрения безрецидивной выживаемости (отношение рисков 1,52; 95% ДИ 1,23–1,86) и смерти (отношение рисков 1,35; 95% ДИ 1,09–1,66. ). 14 Добавление адъювантной химиолучевой терапии значительно улучшило медианное значение выживаемости ( P = 0,005) с 27 до 36 месяцев. 14 Отдаленный рецидив был наиболее частым местом рецидива в группе адъюванта (33% против 18%), тогда как местный рецидив был более распространен в группе, получавшей только хирургическое вмешательство (29% против 18%).19%). 14 Значительная токсичность (степень 3 или выше) наблюдалась в группе химиолучевой терапии, при этом 3 пациента (1%) умерли от токсичности, связанной с лечением. Кроме того, хотя хирургический протокол рекомендовал обширную резекцию лимфатических узлов, менее 10% пациентов получили формальную диссекцию D2, тогда как 54% подверглись диссекции D0. 14 Авторы приходят к выводу, что наибольшая польза от химиолучевой терапии может быть у пациентов из группы высокого риска, получавших неадекватные резекции D2.Несмотря на результаты этого исследования, некоторые учреждения рекомендуют только адъювантную химиотерапию пациентам, не переносящим лучевую терапию; однако оптимальный режим в этой ситуации еще предстоит определить. 92
Неоперабельное местнораспространенное или метастатическое заболевание
Более 50% пациентов поступают с неоперабельной местнораспространенной или метастатической аденокарциномой желудка. 96 У большинства пациентов, в том числе с ранней стадией заболевания, в какой-то момент в течение болезни появляются метастазы.Облегчение симптомов в этой группе пациентов имеет первостепенное значение и может рассматриваться как местная и / или системная терапия. Лечение местных симптомов включает паллиативную хирургию, лучевую терапию и / или эндоскопические процедуры. У пациентов с метастатическим заболеванием системная химиотерапия является единственным методом лечения, который продемонстрировал значительное улучшение выживаемости. 88 Было показано, что у выбранных пациентов с хорошим статусом работоспособности по сравнению с одной только лучшей поддерживающей терапией комбинированная химиотерапия улучшает среднюю выживаемость на 3–9 месяцев, а также демонстрирует улучшение или сохранение качества жизни. 97–100 Было изучено множество традиционных режимов химиотерапии с одним агентом, при этом различные комбинации, оцененные в исследованиях фазы III, продемонстрировали частоту ответа от 25% до 40%. 101 Несмотря на количество оцененных схем, единой комбинированной схемы не появилось. 88 Стандартные протоколы в Северной Америке включают эпирубицин, цисплатин и непрерывную инфузию 5FU (ECF), 102 цисплатин и 5-дневную инфузию 5FU (CF), а также этопозид, лейковорин и болюсный 5FU (ELF). 103 Комбинированные схемы третьего поколения включают новые агенты, такие как иринотекан, оксалиплатин и таксаны, все из которых в настоящее время проходят оценку фазы II – III. Несмотря на использование традиционной комбинированной химиотерапии, средняя выживаемость редко превышает 10 месяцев.
ПРОГНОСТИЧЕСКИЕ ПЕРЕМЕННЫЕ
Стадия
Было доказано, что патологическая стадия имеет прогностическое значение как для 5-летней выживаемости, так и для частоты местных рецидивов. 62,104–106 Siewert et al, 62 в проспективном многоцентровом наблюдательном исследовании продемонстрировали, что соотношение лимфатических узлов более 20% (между положительными и удаленными узлами) было единственным наиболее важным независимым прогностическим фактором ( P <0.0001), затем следует статус остаточной опухоли ( P <0,0001) и категория T ( P <0,0001). В многомерном подгрупповом анализе полностью резецированных опухолей (R0) они подтвердили, что узловой статус был наиболее важным предиктором, за которым следовала категория T. 62
Степень
Степень относится к степени дифференцировки опухолевых клеток и, как было показано, коррелирует с агрессивностью новообразования. 6 По степени патологии опухоли подразделяются на 1 из 3 категорий: хорошо, умеренно или слабо дифференцированные / анапластические. 6 Хотя степень злокачественности обычно указывается в патологических отчетах, прогностическое влияние рака желудка еще предстоит выяснить, поскольку в нескольких ретроспективных исследованиях не удалось определить степень как независимый прогностический фактор. 106–108
Размер
Размер первичной опухоли, измеренный в наибольшем измерении, был определен в нескольких ретроспективных исследованиях как имеющий прогностическое значение. 9,105,106 Эти исследования показывают, что увеличение диаметра опухоли связано с метастазами в лимфатические узлы и 5-летней выживаемостью.Это было подтверждено в проспективном рандомизированном исследовании, которое продемонстрировало, что размер опухоли является независимым прогностическим фактором в многофакторном анализе ( P = 0,0002; ДИ 1,3–2,2) у пациентов с свободными от опухоли краями. 62
Местоположение опухоли
Влияние местоположения опухоли имеет несколько важных значений при лечении и прогнозе рака желудка. Хотя есть исследования, которые не показали связи между локализацией и прогнозом, 105,107–109 несколько исследований показали, что карцинома желудка проксимальной трети желудка представляет собой отдельную клиническую сущность с прогностическим значением. 2,9,11,105,106,110,111 Недавнее исследование показало, что проксимальные опухоли чаще имеют больший размер, обширное проникновение в стенки, венозную инвазию, узловые метастазы и более позднюю стадию, с общей худшей выживаемостью по сравнению с дистальными опухолями. 111 Проксимальные опухоли могут потребовать другого хирургического подхода, основанного на потенциально другом биологическом поведении.
Лимфатическая и сосудистая инвазия
Присутствие опухолевых эмболов в перитууморальных сосудах и лимфатических сосудах недавно вызвало интерес как потенциальный независимый прогностический индикатор.Исследования показали, что поражение лимфатических узлов является статистически значимым предиктором выживаемости, а наличие опухолевых эмболов значительно влияет на рецидив опухоли и смерть после радикальной резекции. 72,105,110 Yokota et al. 110 обнаружили, что лимфатическая инвазия сохранила свою значимость (относительный риск, 11,43; ДИ, 2,63–49,55), даже в условиях конкуренции с другими значимыми переменными в многофакторном анализе. Эти данные были недавно подтверждены в отчете Hyung et al, 112 , который сообщил о плохом прогнозе, связанном с продвинутой стадией T и наличием сосудистой инвазии.Kooby et al., , 113, аналогичным образом продемонстрировали, что у пациентов с адекватной стадией поражения лимфатических узлов сосудистая инвазия является независимым негативным прогностическим фактором и может быть предиктором биологической агрессивности.
Возраст и пол
Ни возраст, ни пол окончательно не показали прогностического значения для смерти от рецидивирующего или метастатического рака. 62,109,114 Два небольших ретроспективных исследования в анализе подгрупп определили возраст как значительную прогностическую переменную, 105,108 , тогда как в другом исследовании влияние возраста не имело независимой прогностической ценности. 114 Это исследование показало, что выживаемость определялась стадией и полнотой резекции.
Другие факторы
Несколько других факторов связаны с увеличением местных рецидивов и снижением выживаемости при раке желудка. Предполагаемые опухолевые маркеры (p53, E-cadherin, CD-34, c-ErbB2, CA 72–4, CEA) в последнее время приобрели популярность в качестве потенциальных прогностических индикаторов для прогнозирования поведения опухоли. 111,115–117 Эти маркеры, вероятно, будут приобретать все большее значение, поскольку область анализа экспрессии генов продолжает расширяться. 117 Другие факторы включают перфорацию опухоли, экстренную операцию и переливание крови.
Анализ выживаемости и его применение при раке желудка
Использование определения прогноза заболевания является двукратным. Прогнозирование предоставляет пациентам и врачам информацию о будущем течении и естественном течении болезни и позволяет проводить сравнительный анализ данного исхода между двумя или более популяциями. 118,119
Прогностические исследования часто включают сравнения между 2 или более группами пациентов, которые различаются по статусу болезни.Кривые выживаемости для каждой группы могут быть построены, и соответствующие кривые могут быть сравнены с помощью логарифмического рангового теста. 118 В качестве альтернативы, многомерные модели могут использоваться для включения в анализ как времени, так и влияния множества факторов на время достижения заданного результата. 118 Этот анализ может использоваться для определения комбинации факторов, которые лучше всего предсказывают прогноз в группе пациентов или влияние отдельных факторов независимо.
Методы анализа выживаемости широко применялись при изучении рака желудка для определения значимости прогностических факторов при принятии клинических решений.Недавно в ходе исследований выживаемости были созданы многомерные прогностические модели, основанные на клинико-патологических факторах и связанные с молекулярными путями. Этот подход включает профили экспрессии генов, представляющие биологическое поведение опухолей, полученные в результате исследований на микроматрицах, в прогностические модели, и может использоваться для руководства хирургической и адъювантной терапией.
Будущие направления
Некоторые виды эпителиального рака, по-видимому, развиваются по многоступенчатому пути канцерогенеза. В этих опухолях корреляция между генетическими аномалиями и последовательными фенотипическими изменениями позволила получить точную клиническую и патологическую характеристику. 36,120–123 Однако рак желудка демонстрирует неоднородность гистопатологии и молекулярных изменений, которые препятствуют его полному молекулярному разграничению. 121 Только несколько генов (например, c-met, c-erbB2, K-sam, E-cadherin) участвуют в развитии рака желудка. 124 Из них только E-кадгерин был окончательно связан как маркер наследственного диффузного рака желудка. 23,25–27,35 Как уже упоминалось, большинство случаев рака желудка возникает спорадически, при этом от 8% до 10% имеют наследственный семейный компонент.Чаще всего рак желудка возникает без каких-либо устойчивых мутаций. Патогенез значительно варьируется, от постепенного прогрессирования изменений (гастрит → метаплазия → инвазивная карцинома) до опухолей, возникающих при отсутствии предшествующего поражения. 121 Новые технологии, такие как профилирование экспрессии генов на основе микрочипов, предоставляют информацию об экспрессии многих генов, участвующих в раковых заболеваниях человека. 125 Этот подход обещает изменить наше понимание молекулярных взаимодействий, которые в конечном итоге описывают фенотип и поведение опухоли.
Профилирование экспрессии генов на основе микрочипов
ПоследовательностиДНК не говорят нам, как экспрессия генов вызывает фенотип или как экспрессия генов изменяет последующие молекулярные побочные продукты. 126 Текущие ограничения для понимания желудочного канцерогенеза – это методы, позволяющие связать структурные знания генов с функциональными изменениями, которые происходят между компонентами, тем самым обеспечивая понимание поведения опухоли. 124,126,127 Характеристика генов, которые дифференциально экспрессируются при раке желудка, имеет важное значение для точной диагностики и характеристики опухоли, а также для принятия обоснованных решений о хирургической и адъювантной терапии, разработки новых терапевтических средств и описания поведения опухоли для более точного прогноза. 124
Микромассивы расширили молекулярные исследования, выходящие за рамки подхода генов-кандидатов, и начинают устанавливать связь между экспрессией генов и функциональными взаимодействиями. 121,124–129 Преимущество микрочипов состоит в том, что это инструмент трансляции, который включает функциональные взаимодействия в попытке понять биологию, а не просто идентифицировать составные части пути. 126 Исследования экспрессии генов позволяют охарактеризовать гены, которые дифференциально экспрессируются или транскрибируются из геномной ДНК. 122,124 Полученный набор генов, называемый профилем экспрессии, считается основным детерминантом клеточного фенотипа и функции. 126 Понимание различий в экспрессии генов между нормальной тканью и злокачественной тканью, а также реакции экспрессии генов на стимулы окружающей среды является центральным для понимания регуляторных механизмов, участвующих в развитии и прогрессировании рака. 125,126,129
Многомерный регрессионный анализ широко применялся при изучении рака.Эти исследования позволили определить большое количество важных клинико-патологических факторов, которыми клиницисты могут руководствоваться при выборе стратегии ведения. Несмотря на это, традиционные прогностические факторы имеют ограниченную прогностическую силу и изменили текущие стратегии лечения только для нескольких типов рака. 130 Однако технология микрочипов в сочетании с многомерными прогностическими моделями вызвала интерес к использованию профилей экспрессии генов в качестве прогностических моделей.
Статус лимфатических узлов, статус рецепторов, протоонкогены и генные мутации коррелировали с прогнозом рака груди. 131 Однако рак груди сложен, и знание индивидуальных прогностических факторов дает ограниченную информацию о биологии рака груди. Несколько недавних исследований, связывающих новые данные об экспрессии генов с многомерными прогностическими моделями, были использованы для изучения выживаемости и разработки более точных маркеров биологического поведения, чтобы преодолеть ограничения современных методов прогнозного моделирования. 130–132 Эти исследования продемонстрировали, что микроматричный анализ может точно идентифицировать отдельные подклассы рака груди 131 132 и независимо предсказывать общую и безрецидивную выживаемость на основе «прогностических наборов генов», которые превосходят доступные в настоящее время клинические и гистологические прогностические модели. . 130,132
Применение микроматричного анализа к таким заболеваниям, как немелкоклеточный рак легкого, гепатоцеллюлярная карцинома, карцинома пищевода и пищевод Барретта, аналогичным образом продемонстрировало использование микроматрицы для документирования различных прогностических групп, систем молекулярного стадирования, моделей, способных точно прогнозировать общая и специфическая для болезни выживаемость и частота рецидивов за пределами существующих методов. 133–135 Таким образом, применение профилей экспрессии генов может иметь потенциал для уточнения диагноза, прогноза и ведения пациентов. 134
Большинство исследований с использованием микроматриц, изучающих аденокарциному желудка, было направлено на разработку исследовательских профилей генов опухолей желудка или клеточных линий рака желудка для идентификации генов, связанных с раком желудка, определения молекулярных фенотипов, демонстрации подтипов опухолей и выявления функциональных кластеров генов. как потенциальные маркеры биологического поведения. 124,136–141 Есть несколько исследований, в которых применялись комбинированные микроматрицы и методология прогнозного моделирования к раку желудка.Недавние исследования показали, что микроматрица в сочетании со статистическим моделированием точно предсказывает поведение опухоли в отношении прогрессирования опухоли, метастатического потенциала, рецидива опухоли и общего прогноза. 142,143 Хотя анализ экспрессии генов в сочетании с прогностическими моделями находится в зачаточном состоянии, он обещает расширить наше понимание карциномы желудка. Относительная скудность имеющихся данных, связывающих профили генов рака желудка с прогнозом и успешность лечения различных других видов рака, сильно усиливает необходимость дальнейшего изучения этого метода.С помощью методов, способных амплифицировать небольшие количества опухолевой РНК, можно предположить, что образцы ткани, полученные эндоскопически, могут быть использованы для создания предоперационных прогностических кластеров генов. При этом идентификация функциональных кластеров генов может позволить улучшить отбор пациентов для неоадъювантной и адъювантной терапии, индивидуализированные хирургические резекции, выявить новые кластеры генов для дизайна таргетной терапии и улучшить прогноз, чтобы облегчить принятие решений как врачом, так и пациентом.
Аденокарцинома желудка
Рак желудка является вторым по распространенности во всем мире раком, частота которого сильно варьируется в разных географических регионах. 1 Это относительно редко встречающееся новообразование в Северной Америке, но оно вносит существенный вклад в бремя смертности от рака. 2–5 В Северной Америке рак желудка является третьим по распространенности злокачественным новообразованием желудочно-кишечного тракта после рака прямой кишки и поджелудочной железы и третьим по частоте летальным исходом новообразованием в целом. 4 Несмотря на снижение заболеваемости во всем мире, на рак желудка приходится от 3% до 10% всех смертей, связанных с раком. 6 Хотя выживаемость при раке желудка неуклонно повышается в таких странах, как Япония, этого не происходит в Северной Америке. 3 Несмотря на технические достижения в хирургии и использование адъювантной терапии, преобладала высокая смертность, связанная с раком желудка.
Девяносто процентов всех опухолей желудка являются злокачественными, а аденокарцинома желудка составляет 95% от общего числа злокачественных новообразований. 7 Лечебная терапия включает хирургическую резекцию, чаще всего полную или субтотальную резекцию желудка, с сопутствующей лимфаденэктомией. Общая 5-летняя выживаемость пациентов с операбельным раком желудка колеблется от 10% до 30%. 8–10
ЭПИДЕМИОЛОГИЯ
Рак желудка редко встречается в возрасте до 40 лет, но после этого частота его заболеваемости неуклонно растет и достигает пика в седьмом десятилетии жизни. 11 По оценкам, в 2000 году было диагностировано 876 340 случаев первичного рака желудка, что привело к почти 650 000 смертей во всем мире. 4 В Северной Америке вероятность развития и смерти от рака желудка в течение жизни составляет 1,5% и 1,0% соответственно. 4 В целом стандартизованные по возрасту коэффициенты смертности снизились у женщин (с 9,9 до 4,2 на 100 000) и мужчин (с 21,2 до 9,1 на 100 000) за последние 30 лет в Канаде. 5 В США ежегодно регистрируется 24 000 новых случаев заболевания и 14 000 случаев смерти. 12 В ретроспективном исследовании с участием более 50000 пациентов, пролеченных по поводу первичного рака желудка, Hundahl et al. 13 продемонстрировали, что 65% рака желудка в США находятся на поздней стадии (T3 / T4), из них почти 85%. опухолей, сопровождающихся метастазами в лимфатические узлы при постановке диагноза.Эта проблема еще более усложняется тем, что у пациентов, подвергнутых резекции с лечебной целью, частота рецидивов составляет от 40% до 65%. 14 В отсутствие официальных программ скрининга у большинства пациентов наблюдается продвинутая патологическая стадия, и средняя выживаемость при опухолях, резецированных с лечебной целью, может составлять 24 месяца (20–30% 5-летняя выживаемость), средняя выживаемость составляет 8,1 месяца. после паллиативных процедур и медиана выживаемости всего 5,4 месяца при запущенном заболевании без операции. 15–17
ФАКТОРЫ РИСКА
Сравнительные исследования между азиатскими и западными странами демонстрируют поразительные различия в заболеваемости и общей выживаемости рака желудка, что указывает на этническое происхождение как возможный фактор риска. 3,11,18 Самый высокий уровень заболеваемости в Японии (> 40 на 100 000), Восточной Азии, Южной Америке и Восточной Европе; тогда как Канада (10 на 100 000), Северная Европа, Африка и США имеют самые низкие показатели заболеваемости. 19 Национальный институт рака при изучении этнической принадлежности как фактора риска рака желудка выделил 3 группы: группы с высоким (корейцы, вьетнамцы, японцы, коренные американцы и гавайцы), среднего уровня (латиноамериканцы, китайцы и чернокожие). ), и низкая заболеваемость раком желудка с поправкой на возраст (филиппинцы и белые). 4
Мигранты первого поколения из стран с высокой заболеваемостью в страны с низкой заболеваемостью сохраняют уровень риска своей родной страны, тогда как последующие поколения приобретают уровень риска своей новой среды. 11,20 Это говорит о том, что этиологическое влияние может быть больше связано с факторами окружающей среды, чем с факторами этнической принадлежности. 11 С тех пор были подробно изучены некоторые диетические и поведенческие факторы. В исследовании случай-контроль Ramon et al. 21 определили, что диеты, богатые солью, копчеными или плохо консервированными продуктами, нитратами, нитритами и вторичными аминами, связаны с повышенным риском рака желудка.Считается, что эта связь возникает из-за длительного чрезмерного употребления соленой или маринованной пищи, что приводит к атрофическому гастриту и изменению желудочной среды с образованием канцерогенных N-нитрозосоединений. 11 Напротив, диета, богатая фруктами и овощами, может быть связана со снижением риска рака. Haung et al, 20 в ретроспективном опросе 877 японских пациентов с раком желудка предположили, что частое употребление сырых овощей и фруктов значительно снижает риск смерти, связанной с раком желудка (отношение рисков, 0.74; 95% доверительный интервал [ДИ] 0,56–0,98) за счет их антиоксидантного действия. Постулируется, что кальций, витамин А и витамин С оказывают защитное действие на слизистую оболочку желудка за счет снижения образования N-нитрозоканцерогенных соединений. 11,20 Исследования методом случай-контроль показывают, что у курильщиков сигарет риск развития проксимального рака желудка в 2–3 раза выше. 22 Эти результаты были подтверждены в исследовании Haung et al, 20 , которые продемонстрировали отношение шансов, равное 2.53 (ДИ 1,22–5,29) для постоянных курильщиков и тенденция к значимости для пациентов с привычным потреблением алкоголя.
Большинство случаев рака желудка возникает спорадически, в то время как от 8% до 10% имеют наследственный семейный компонент. 23 Карцинома желудка иногда развивается в семьях с мутациями зародышевой линии в p53 (синдром Ли-Фраумени) и BRCA2. 19 В 1-3% случаев рака желудка мутации зародышевой линии в гене, кодирующем белок клеточной адгезии E-кадгерин, приводят к аутосомно-доминантной предрасположенности к карциноме желудка, называемой наследственным диффузным раком желудка, которая имеет пенетрантность примерно 70%. 19,24–27 Huntsman et al. 24 предположили, что идентификация мутации E-кадгерина должна способствовать профилактической гастрэктомии у пораженных родственников. Рак желудка может развиваться как часть синдрома наследственного неполипозного рака толстой кишки (HNPCC), а также как часть синдромов желудочно-кишечного полипоза, включая семейный аденоматозный полипоз (FAP) и синдром Пейтца-Егерса. 19
Важным событием в эпидемиологии рака желудка стало признание связи с инфекцией Helicobacter pylori . 19 В трех независимых исследованиях сообщалось о значительном повышении риска у субъектов, у которых была подтверждена инфекция H. pylori за 10 или более лет до постановки диагноза рака. 28–30 Последующий метаанализ 42 обсервационных исследований, проведенных Eslick et al. 31 , показал значительную взаимосвязь между H. pylori и раком желудка (отношение шансов [OR], 2,04; CI, 1,69–2,45 ). H. pylori , как было впоследствии показано, вызывает изменения слизистой оболочки желудка и желудочной флоры, предрасполагающие к развитию карциномы у людей. 19 Кроме того, H. pylori способен прикрепляться к антигену группы крови Льюиса и может быть важным фактором, способствующим хронической инфекции и последующему повышенному риску рака, наблюдаемому у пациентов с фенотипом группы крови А. 19
К другим факторам, связанным с повышенным риском рака желудка, относятся хронический атрофический гастрит (например, злокачественная анемия, токсические и диетические агенты, предыдущие операции на желудке с рефлюксом желчи), гипертрофическая гастропатия (болезнь Метенье), полипы желудка, низкие социально-экономические показатели. статус и ожирение. 11,19
АДЕНОКАРЦИНОМА ЖЕЛУДКА: КЛИНИЧЕСКИЕ СООБРАЖЕНИЯ
Определение / описание случая
Диагноз рака желудка требует гистопатологической оценки тканей или цитологической оценки чистки / промываний желудка. Было предложено несколько систем классификации, чтобы помочь описать рак желудка либо с помощью макроскопических признаков (Borrmann), либо на основе микроскопической конфигурации (Ming, Carniero и Goseki). 19,32 Двумя наиболее часто используемыми являются системы Лорена и Всемирной организации здравоохранения (ВОЗ). 19
Классификация Лорена делит рак желудка на 2 основных гистологических типа: кишечный или диффузный. 11,33,34 Эта система описывает опухоли на основе микроскопической конфигурации и характера роста. 11 Рак диффузного типа имеет некогезионные опухолевые клетки, диффузно инфильтрирующие строму желудка, и часто проявляется глубокая инфильтрация стенки желудка с небольшим образованием желез или без них. 19,32 Диффузные опухоли могут проявлять выраженную десмоплазию и ассоциированное воспаление с относительной щадью покрывающей слизистой оболочки. 32 По сравнению с раком желудка кишечного типа, рак желудка диффузного типа в меньшей степени связан с влиянием окружающей среды, имеет повышенную относительную заболеваемость, чаще встречается у молодых пациентов и связан с худшим прогнозом. 19 Эти виды рака не связаны с кишечной метаплазией, не локализуются в антральном отделе и могут возникать в результате одноклеточных мутаций в нормальных железах желудка, как в случае недавно описанной наследственной диффузной карциномы желудка. 23,24,35
Рак кишечного типа демонстрирует узнаваемое образование желез, похожее по микроскопическому виду на слизистую оболочку толстой кишки. 11,19,32 Железистые образования варьируются от хорошо до низкодифференцированных опухолей, которые растут по расширяющимся, а не инфильтративным структурам. 6,11 Считается, что рак кишечника возникает вторично по отношению к хроническому атрофическому гастриту. 11,19
H. pylori и аутоиммунный гастрит являются наиболее частыми этиологическими поражениями, которые создают среду, способствующую воспалению желудка.Если гастрит не проходит, возникает атрофия желудка с последующей кишечной метаплазией, которая, в свою очередь, может привести к дисплазии. Дисплазия может возникать как в собственном желудочном, так и в «кишечном» желудочном эпителии. 19 Термин «аденома» применяется, когда диспластическая пролиферация вызывает макроскопическое выступающее поражение и морфологически описывается как тубулярная, тубуловиллярная или ворсинчатая аденома. 19 Аденомы, как правило, возникают в дистальных отделах желудка, часто имеют длительную предраковую фазу и расширяющийся характер роста. 6,11,19 Карцинома диагностируется, когда опухоль проникает в собственную пластинку или через мышечную слизистую оболочку. 19 До 80% диспластических поражений могут прогрессировать до инвазии.
Классификация Лорена оказалась полезной при оценке естественного течения рака желудка, особенно в отношении тенденций заболеваемости, клинико-патологических корреляций и этиологических предшественников. 6,11,33 Несмотря на очевидное использование классификации Лорена, ВОЗ 19 пересмотрела определение рака желудка на «злокачественные эпителиальные опухоли слизистой оболочки желудка с железистой дифференцировкой».«Система ВОЗ оценивает аденокарциному на основании степени сходства с метапластической тканью кишечника. 6,19,32 Он подразделяет гистологические образцы на 5 подтипов: аденокарцинома (кишечная и диффузная), папиллярная, трубчатая, муцинозная и клетка с перстневым кольцом. 19,32
Клинические проявления
Карцинома желудка часто не вызывает специфических симптомов, если она поверхностна и потенциально поддается хирургическому лечению, хотя до 50% пациентов могут иметь неспецифические желудочно-кишечные жалобы, такие как диспепсия. 11 В западных странах, даже при эндоскопическом обследовании, рак желудка обнаруживается только у 1-2% пациентов с диспепсией. Отсутствие ранних патогномоничных симптомов часто задерживает постановку диагноза. Следовательно, от 80% до 90% пациентов с раком желудка имеют местнораспространенные или метастатические опухоли с низкой степенью резектабельности. 19 Пациенты могут иметь анорексию и потерю веса (95%), а также боль в животе, которая носит неопределенный и коварный характер. Тошнота, рвота и преждевременное насыщение могут возникать при объемных опухолях, закупоривающих просвет желудочно-кишечного тракта, или при инфильтративных поражениях, которые ухудшают вздутие живота. 11 Язвенные опухоли могут вызывать кровотечение, которое проявляется в виде кровавой рвоты, мелены или массивного кровотечения из верхних отделов желудочно-кишечного тракта.
Физикальное обследование рака желудка на ранней стадии обычно неинформативно. Пациенты с запущенными опухолями могут проявлять пальпируемое образование в брюшной полости, кахексию, непроходимость кишечника, асцит, гепатомегалию и отек нижних конечностей. 11,36,37 Посев в брюшину может вызвать поражение яичников (опухоль Крукенберга) или тазового тупика (полка Блюмера), обнаруживаемого при ректальном исследовании. 37 Метастазы могут проявляться в виде увеличенного надключичного лимфатического узла (узел Вирхова), левого подмышечного лимфатического узла (узел Ирриша) или околопупочного лимфатического узла (узел сестры Мэри-Джозеф). 11,37
Скрининг рака желудка
Целью массового скрининга (бессимптомные группы населения) или наблюдения (группы риска) является обнаружение и диагностика рака желудка на ранней и, следовательно, потенциально излечимой стадии. 19 Массовый скрининг для раннего выявления рака желудка является рентабельным и рекомендуется в регионах с высокой заболеваемостью, таких как Япония и Китай, где от 50% до 80% обнаруженных злокачественных новообразований приходится на ранний рак желудка. 19 В Северной Америке нет официальных программ проверки. Американское общество эндоскопии желудочно-кишечного тракта рекомендует проводить эндоскопическое наблюдение за лицами с высоким риском (аденома желудка в анамнезе, FAP, HNCC, синдром Пейтца-Егерса и болезнь Метенье) каждые 1-2 года. 11 Массовый эндоскопический / радиологический скрининг не рекомендуется в регионах с низкой заболеваемостью, таких как Канада и США. 11
Диагностика и стадирование
Эндоскопия считается наиболее чувствительным и специфическим методом диагностики у пациентов с подозрением на рак желудка. 12 Эндоскопия позволяет напрямую визуализировать расположение опухоли, степень поражения слизистой оболочки и проводить биопсию (или цитологическую чистку) для диагностики тканей. 38 В сочетании с эндоскопией и радиологическими методами эндоскопическое ультразвуковое исследование (EUS) может максимально повысить стадию опухоли, предоставляя информацию о глубине инвазии опухоли и оценивая степень перигастральной лимфаденопатии. Willis et al., , 39, предполагают, что EUS в настоящее время является наиболее ценным диагностическим инструментом для предоперационной стадии рака желудка (точность 82% при оценке глубины инвазии опухоли) и для определения резектабельности опухоли.Karpeh et al., , 12, предполагают, что комбинированное использование EUS и лапароскопического определения стадии облегчает выбор пациента, предоставляя информацию о глубине опухоли и вовлечении перигастральных лимфатических узлов. Однако они предупреждают, что EUS менее точен (50–87%) при определении статуса лимфатических узлов.
Исследование бария в верхних отделах желудочно-кишечного тракта (UGI) включает закапывание жидкого бария в желудок и комбинацию 4 техник: оценка с наполнением барием, двойное контрастирование, рельеф слизистой оболочки и сжатие желудка. 40 Процедура позволяет выявить неровности слизистой оболочки. Halvorsen et al. 40 предположили, что, хотя эндоскопия все чаще становится методом выбора, эти 2 метода дополняют друг друга и имеют эквивалентную диагностическую эффективность.
Компьютерная томография (КТ) – наиболее часто используемый метод определения стадии рака желудка. 40 КТ может обнаруживать метастазы в печени, региональную и отдаленную лимфаденопатию и может прогнозировать прямое вторжение в соседние структуры.Кунц и др. 41 предположили, что КТ имеет чувствительность 88% для обнаружения опухолей. Способность КТ точно определять инфильтрацию опухоли (стадия Т 58%) или статус перигастральных лимфатических узлов (25–86%) широко варьировала и не считалась надежным предиктором степени заболевания в нескольких исследованиях. 41–43
Магнитно-резонансная томография (МРТ) имела ограниченное применение для определения стадии рака желудка, главным образом из-за трудностей с артефактами движения, стоимости, времени, необходимого для обследования, и отсутствия подходящего перорального контрастного вещества. 44,45 Однако в недавнем исследовании, сравнивающем МРТ с КТ, Sohn et al. 44 задокументировали распространенный рак желудка, который легко обнаруживался с помощью обоих методов. Они показали, что МРТ была немного лучше, чем КТ при Т-стадии рака желудка. 44 Точно так же Kim et al. 46 документально подтвердили, что точность определения стадии Т МРТ была выше, чем КТ (81% против 73%, P <0,05). Это исследование показало, что МРТ склонна к завышению патологической толщины опухоли. 46 Сообщается, что общая точность определения стадии T составляет от 73% до 88%. 45 Использование МРТ для определения стадии N затруднено из-за тех же трудностей, что и при постановке КТ, при которой статус узлов оценивается на основе размера лимфатических узлов. Несколько исследований показывают, что точность постановки узлов на МРТ ниже, чем при постановке КТ (65% против 73% соответственно, P > 0,05), причем оба метода имеют тенденцию к снижению узлового статуса. 45,46 Наконец, Мотохара и др. 45 рассмотрели способность МРТ выявлять внегастральные метастазы и пришли к выводу, что МРТ имеет большую чувствительность, чем КТ, в обнаружении диссеминации печени, костей и брюшины.Очевидное преимущество постановки МРТ заключается, прежде всего, в ее многоплоскостных возможностях, отсутствии ионизирующего излучения и использовании у пациентов с гиперчувствительностью к контрасту. 44 Другие методы стадирования включают УЗИ брюшной полости, позитронно-эмиссионную томографию и стадионную лапароскопию. 36
ХИРУРГИЧЕСКАЯ ТЕРАПИЯ
Общая, промежуточная и проксимальная гастрэктомия
Выбор хирургической процедуры при резектабельном раке желудка продиктован размером, расположением и возможностью достичь хирургических границ, свободных от макроскопических и микроскопических заболеваний.Несколько европейских исследований показали, что для достижения адекватных границ, свободных от болезни, должно быть расстояние 5 см от опухоли до ближайшей линии резекции в опухолях кишечного типа и 10 см в опухолях диффузного типа. 39,47–49
Обычно опухоли, ограниченные проксимальной третью желудка, лечат тотальной гастрэктомией, чтобы гарантировать адекватные границы резекции. Спорный вопрос, связана ли проксимальная гастрэктомия с плохим функциональным исходом дистального остатка желудка по сравнению с тотальной гастрэктомией с реконструкцией.Хотя исследований, посвященных этой проблеме, немного, но Harrison et al, 50 в ретроспективном обзоре продемонстрировали, что пациенты с проксимальным раком желудка, перенесшие тотальную гастрэктомию или проксимальную гастрэктомию, имели одинаковую общую продолжительность жизни и частоту рецидивов. Это исследование показало, что обе процедуры могут быть выполнены безопасно. Авторы предполагают, что, хотя эти 2 процедуры эквивалентны с точки зрения выживания и рецидива, необходимы дальнейшие исследования для оценки питания и качества жизни.Исследования продемонстрировали улучшение качества жизни при субтотальной гастрэктомии по сравнению с группой тотальной гастрэктомии 51–53 ; однако только одно исследование 53 конкретно продемонстрировало снижение качества жизни проксимальной гастрэктомии по сравнению с тотальной и дистальной субтотальной резекциями.
Остается спорным вопрос о выборе процедуры при опухолях средней и дистальной трети желудка. В большом европейском опросе, в котором участвовали 62 центра, Heberer et al. 54 продемонстрировали, что 44% хирургов предпочитают тотальную гастрэктомию при диффузном типе рака желудка антрального отдела на основании улучшенного клиренса опухоли и частоты местных рецидивов.При анализе 6400 пациентов в Национальной базе данных рака США, Hundahl et al 13 показали, что 12,3% пациентов с раком антрального отдела или привратника, независимо от типа опухоли, лечились тотальной гастрэктомией. В многоцентровом рандомизированном исследовании 618 пациентов Bozzetti et al 1 пришли к выводу, что пациенты с раком средней и дистальной трети желудка, перенесшие либо субтотальную, либо полную гастрэктомию, имели одинаковую 5-летнюю выживаемость. Это исследование показало, что пациенты, перенесшие субтотальную резекцию желудка, имели более короткое пребывание в больнице, лучший статус питания, меньше осложнений и лучшее качество жизни. 1 Кроме того, пациенты, перенесшие тотальную гастрэктомию, имели более высокий уровень спленэктомии с увеличением послеоперационных осложнений и восприимчивостью к инфекции, что подтверждает роль субтотальной гастрэктомии, когда это возможно. 1 Авторы пришли к выводу, что если рак желудка поражает соседние органы, эти органы должны быть удалены en bloc с желудком, при условии, что комбинированная процедура позволяет достичь четких границ резекции. 47,48
Ограниченная или расширенная лимфаденэктомия
Частота поражения лимфатических узлов колеблется от 3% до 5% для опухолей, ограниченных слизистой оболочкой, от 16% до 25% для опухолей, ограниченных подслизистой оболочкой, и от 80% до 90 % у пациентов с III или IV стадией заболевания. 11,55 Существуют значительные разногласия относительно надлежащей степени диссекции лимфатических узлов (LND). Ретроспективные исследования, проведенные в Японии, с участием более 10 000 пациентов, предполагают, что расширенная LND в сочетании с гастрэктомией продлевает выживаемость по сравнению с ограниченной LND. 56–59 Расширенная LND обеспечила общую 5-летнюю выживаемость от 50% до 62% по сравнению с 15% до 30%, полученной при ограниченных резекциях в США. 10,58,60 Японские исследователи утверждают, что расширенная LND (D2) удаляет опухоль в регионарных лимфатических узлах до того, как она может метастазировать.Кроме того, утверждается, что расширенный LND улучшает точность постановки. 55–59
Несоответствие общих показателей выживаемости между японскими и западными центрами после расширенной LND привело к 2 крупным многоцентровым рандомизированным проспективным испытаниям. Голландская группа по лечению рака желудка 61 рандомизировала 711 пациентов (380 в ограниченную [D1] и 331 – в расширенную [D2]) для проведения резекции с лечебной целью. Это исследование показало, что пациенты в группе D2 имели значительно более высокий уровень послеоперационных осложнений, чем пациенты в группе D1 (43% vs.25%; P <0,001), большее количество послеоперационных смертей (10% против 4%; P = 0,004) и более длительное пребывание в больнице (медиана, 16 дней против 14; P <0,001). 61 Кроме того, Пятилетняя выживаемость была схожей в 2 группах (45% в группе D1 и 47% в группе D2). 61 В голландском исследовании авторы отметили, что миграция стадий произошла в 30% группы D2 и может объяснили разницу в выживаемости между Востоком и Западом у пациентов, соответствующих стадии. 61 Авторы пришли к выводу, что результаты не подтверждают рутинное использование D2 LND. Однако в анализе подгрупп они показали значительную разницу у пациентов со стадией II и IIIA, которым предложили резекцию D2, наблюдение, подтвержденное Siewert и др. 62 в Немецком исследовании рака желудка. Кроме того, Hundahl et al, 13 , изучая зрелые результаты голландского исследования, отметили, что риск рецидива выше в группе D1, чем в группе D2 (41% против 29%; P = 0.02), что подтверждает роль расширенной резекции лимфатических узлов.
Cuschieri et al. 63 провели рандомизированное сравнение резекций D1 (n = 200) и D2 (n = 200) для потенциально излечимого распространенного рака желудка в исследовании Совета по медицинским исследованиям (MRC). Результаты исследования продемонстрировали значительную разницу между группой D2 и группой D1 по послеоперационной смертности (13% против 6,5%; P = 0,04) и заболеваемости (46% против 28%; P <0,001). , без разницы в общей 5-летней выживаемости для D2 по сравнению с D1 (33% vs.35%). 63 Как и в голландском исследовании, MRC не продемонстрировал преимущества в выживаемости с классической японской расширенной резекцией; однако анализ подгрупп исследования MRC продемонстрировал несколько интересных результатов. Во-первых, наибольшим фактором послеоперационной заболеваемости и смертности в группе D2 было добавление панкреатикоспленэктомии (отношение рисков 1,53; ДИ 1,17–2,01). 63 Во-вторых, сохранение поджелудочной железы и селезенки с сопутствующей резекцией D2 может обеспечить лучшую выживаемость, чем резекция D1, и может быть выполнено с низкой послеоперационной заболеваемостью и смертностью. 63 Интересно, что и в исследованиях, проведенных в Голландии, и в исследованиях MRC, когда для всех пациентов требовалась как минимум резекция D1 (удаление как минимум узлов уровня N1), общая 5-летняя выживаемость в группе D1 резко увеличилась. Выживаемость от 20% до 34% (MRC) и 45% (голландцы), что снова указывает на сильную связь между выживаемостью и адекватным расслоением LN. 13 Cuschieri et al. 63 пришли к выводу, что «резекция D2 без панкреатико-спленэктомии может быть лучше, чем стандартная резекция D1, и не может быть отклонена по результатам этого исследования.
В нескольких последующих исследованиях, основанных на результатах Нидерландов и MRC, изучалась роль расширенной LND с сохранением поджелудочной железы и селезенки на послеоперационную заболеваемость, смертность и общую выживаемость. 10,55,56,62,64–69 Эти исследования продемонстрировали, что расширенная LND с сохранением селезенки и поджелудочной железы может быть выполнена при послеоперационной заболеваемости и смертности, эквивалентной ограниченной LND. Несколько хорошо проведенных проспективных исследований 10,62,64–66,69 продемонстрировали, что расширенная LND не связана с увеличением заболеваемости или смертности при проведении в опытных центрах и значительно улучшает долгосрочную выживаемость у пациентов со стадией II, IIIA 10,62,64–66,69 и, возможно, болезнь IIIB. 10 На основании этих исследований, гастрэктомия с расширенной лимфодиссекцией остается процедурой выбора в специализированных центрах. 56,69–73
Новые проблемы лимфаденэктомии при раке желудка
Ранние версии критериев стадирования TNM касались статуса N, определяемого расположением метастазов в лимфатические узлы (ЛУ) относительно первичной опухоли. 74 Это вызвало разногласия в отношении подходящих резекций лимфатических узлов и предотвратило обобщение результатов азиатских исследований, проводимых в соответствии с Японской классификацией рака желудка (JCGC). 75 JCGC классифицировал степень метастазов в LN на основе анатомической станции LN (). Наличие метастазов в каждой группе LN отражает статус N и составляет основу категорий D (). 74 С признанием преимущества расширенных резекций (D2) на выживаемость, пятое издание TNM AJCC было изменено, чтобы включить доступные клинические, радиологические, эндоскопические и хирургические средства для оценки степени заболевания. 76 Пятое издание классифицирует метастазы LN на основе количества положительных узлов, в которых по крайней мере 15 LN должны быть рассечены и исследованы для точного определения стадии (). 75,76 В исторической когорте Karpeh et al. 75 продемонстрировали, что количество положительных узлов обеспечивает лучший прогноз, чем анатомическое расположение, как определено в более ранней редакции TNM. Точно так же Kodera et al. 77 применили стадию TNM 1997 года к 493 японским пациентам, у которых была резекция D2 или D3, и пришли к выводу, что количество вовлеченных узлов было сильным прогностическим индикатором, который должен заменить категорию N в JCGC. С тех пор это открытие было поддержано несколькими группами, которые аналогичным образом обнаружили, что увеличение количества LN улучшает прогноз, сводит к минимуму эффекты миграции стадий, улучшает стадирование узлов в разных регионах и странах, помогает выбрать подходящую мультимодальную терапию и дает лучшее представление о бремени болезни. 75,76,78 В 1995 году патологическая стадия N определялась количеством метастатических ЛУ, таким образом достигая единой унифицированной системы стадирования. 75
ТАБЛИЦА 1. Японская классификация рака желудка (JCGC)
ТАБЛИЦА 2. Классификация рака желудка Американским объединенным комитетом (AJCC) (5-е издание)
растет консенсус о том, что для точного определения стадии опухоли необходимо извлечение как минимум 15 LN.Однако в хирургических центрах Северной Америки и Европы наблюдается значительное несоблюдение режима лечения. Mullaney et al. 76 показали, что только 31% (диапазон 10–44%) хирургически удаленных случаев можно точно оценить на предмет статуса лимфатических узлов. Недостаток LN для определения стадии имеет значение как для прогноза, так и для миграции стадии. 76 Это наблюдение было подтверждено исследованием 1038 пациентов в одном американском учреждении и обнаружило, что до 27% случаев обследовали менее 15 узлов. 75 Еще более тревожным был отчет из Национальной базы данных США, который продемонстрировал, что всего у 18% пациентов в США проанализировано ≥15 LN. 13 Авторы предполагают, что у этих пациентов высока вероятность остаточного нелеченого поражения регионарных лимфатических узлов. Несоблюдение режима может быть непринятием обширных резекций для улучшения прогноза, незнанием степени резекции, необходимой для достижения минимального количества ЛУ, и неадекватной патологической оценки. 13,75,76,78
Адъювантная или неоадъювантная терапия
Пациенты с локализованным раком желудка без лимфоузлов имеют 5-летнюю выживаемость, которая приближается к 75% при лечении только хирургическим вмешательством. 79 В этом отличие от пациентов с поражением лимфатических узлов, у которых выживаемость колеблется от 10% до 30%. 9 Исход рака желудка осложняется высокой частотой местных рецидивов и отдаленных метастазов после радикальных хирургических вмешательств, что вызвало интерес к адъювантной терапии в надежде на улучшение результатов лечения. 58 Исследования адъювантной и неоадъювантной терапии при лечении рака желудка дали противоречивые результаты. Несоответствие может быть отражением различий между изученными популяциями (группы высокого и низкого риска), 80 патологической классификации, 81 степени хирургической процедуры (D2 по сравнению с D1) 68 , а также различий в содержание и сроки адъювантной терапии (немедленная или отсроченная). Было опубликовано несколько метаанализов 82–88 в попытке устранить расхождения, описанные в литературе, результаты которых суммированы в.
ТАБЛИЦА 3. Мета-анализ рандомизированных клинических испытаний адъювантной химиотерапии
Три из 7 метаанализов предполагают небольшое, но значительное преимущество адъювантной химиотерапии в лечении полностью резецированного рака желудка. 83,84,87 Однако эти авторы предлагают интерпретировать результаты с осторожностью, потому что результаты имеют пограничную значимость 83 и могут зависеть от ряда систематических ошибок, а также низкого методологического качества. 84 Этот вывод отражал более ранний отчет, в котором рассматривались результаты 43 рандомизированных исследований, проведенных в период с 1967 по 1993 год по всем адъювантным методам лечения рака желудка, включая опубликованные в японской литературе. 89 В этом обзоре сделан вывод о том, что результаты рандомизированных исследований в Северной Америке и Европе не подтверждают рутинное использование адъювантной химиотерапии при раке желудка. 89
Janunger et al, 85 в систематическом обзоре 153 научных статей (с участием 12 367 пациентов) исследовали эффекты адъювантной химиотерапии при раке желудка.В их метаанализе было продемонстрировано значительное улучшение общей выживаемости (). Однако раздельный анализ западных и азиатских исследований продемонстрировал значительную разницу в результатах в азиатских (OR, 0,58; 95% ДИ, 0,44–0,76), но не в западных (OR, 0,96; 95% ДИ, 0,83–1,12) отчетах. разница объясняется сроками постановки диагноза, объемом операции и переносом стадии. 85 В более позднем метаанализе, Jununger et al., 88 , применяя современные комбинации лекарств в течение последних 10 лет, не смогли продемонстрировать какого-либо значительного улучшения выживаемости ().В целом, в настоящее время недостаточно данных, чтобы рекомендовать послеоперационную химиотерапию в качестве стандартного адъювантного лечения в западных центрах. 82–85,88
Неоадъювантная терапия (химиотерапия, химиолучевая терапия, лучевая или иммунотерапия, отдельно или в комбинации) использовалась при местнораспространенных опухолях и опухолях с высоким риском рецидива, несмотря на очевидно излечивающую операцию. Сообщалось о степени резектабельности от 40% до 100% и потенциально излечивающих резекциях в 37-80% случаев. 85 Однако только 2 рандомизированных исследования касались неоадъювантной химиотерапии, ни одно из которых убедительно не демонстрирует явного преимущества. 90–92 Исследования адъювантной внутрибрюшинной химиотерапии также неубедительны и обычно не проводятся вне рамок клинических испытаний. 85
Предварительные исследования адъювантной химиолучевой терапии показали многообещающие результаты у пациентов, подвергнутых резекции с лечебной целью. 93,94 Роль адъювантной химиолучевой терапии изучалась в первую очередь в исследовании Intergroup 0116 95 , в котором 566 пациентов со стадией IB-IVM0 полностью резецировали желудочную или гастроэзофагеальную аденокарциному для проведения только хирургического вмешательства или хирургического вмешательства плюс химиолучевой терапии (5f + лейковорин с последующей 45 Гр излучения).В группе только хирургического вмешательства дела обстояли значительно хуже по сравнению с группой адъювантной химиолучевой терапии с точки зрения безрецидивной выживаемости (отношение рисков 1,52; 95% ДИ 1,23–1,86) и смерти (отношение рисков 1,35; 95% ДИ 1,09–1,66. ). 14 Добавление адъювантной химиолучевой терапии значительно улучшило медианное значение выживаемости ( P = 0,005) с 27 до 36 месяцев. 14 Отдаленный рецидив был наиболее частым местом рецидива в группе адъюванта (33% против 18%), тогда как местный рецидив был более распространен в группе, получавшей только хирургическое вмешательство (29% против 18%).19%). 14 Значительная токсичность (степень 3 или выше) наблюдалась в группе химиолучевой терапии, при этом 3 пациента (1%) умерли от токсичности, связанной с лечением. Кроме того, хотя хирургический протокол рекомендовал обширную резекцию лимфатических узлов, менее 10% пациентов получили формальную диссекцию D2, тогда как 54% подверглись диссекции D0. 14 Авторы приходят к выводу, что наибольшая польза от химиолучевой терапии может быть у пациентов из группы высокого риска, получавших неадекватные резекции D2.Несмотря на результаты этого исследования, некоторые учреждения рекомендуют только адъювантную химиотерапию пациентам, не переносящим лучевую терапию; однако оптимальный режим в этой ситуации еще предстоит определить. 92
Неоперабельное местнораспространенное или метастатическое заболевание
Более 50% пациентов поступают с неоперабельной местнораспространенной или метастатической аденокарциномой желудка. 96 У большинства пациентов, в том числе с ранней стадией заболевания, в какой-то момент в течение болезни появляются метастазы.Облегчение симптомов в этой группе пациентов имеет первостепенное значение и может рассматриваться как местная и / или системная терапия. Лечение местных симптомов включает паллиативную хирургию, лучевую терапию и / или эндоскопические процедуры. У пациентов с метастатическим заболеванием системная химиотерапия является единственным методом лечения, который продемонстрировал значительное улучшение выживаемости. 88 Было показано, что у выбранных пациентов с хорошим статусом работоспособности по сравнению с одной только лучшей поддерживающей терапией комбинированная химиотерапия улучшает среднюю выживаемость на 3–9 месяцев, а также демонстрирует улучшение или сохранение качества жизни. 97–100 Было изучено множество традиционных режимов химиотерапии с одним агентом, при этом различные комбинации, оцененные в исследованиях фазы III, продемонстрировали частоту ответа от 25% до 40%. 101 Несмотря на количество оцененных схем, единой комбинированной схемы не появилось. 88 Стандартные протоколы в Северной Америке включают эпирубицин, цисплатин и непрерывную инфузию 5FU (ECF), 102 цисплатин и 5-дневную инфузию 5FU (CF), а также этопозид, лейковорин и болюсный 5FU (ELF). 103 Комбинированные схемы третьего поколения включают новые агенты, такие как иринотекан, оксалиплатин и таксаны, все из которых в настоящее время проходят оценку фазы II – III. Несмотря на использование традиционной комбинированной химиотерапии, средняя выживаемость редко превышает 10 месяцев.
ПРОГНОСТИЧЕСКИЕ ПЕРЕМЕННЫЕ
Стадия
Было доказано, что патологическая стадия имеет прогностическое значение как для 5-летней выживаемости, так и для частоты местных рецидивов. 62,104–106 Siewert et al, 62 в проспективном многоцентровом наблюдательном исследовании продемонстрировали, что соотношение лимфатических узлов более 20% (между положительными и удаленными узлами) было единственным наиболее важным независимым прогностическим фактором ( P <0.0001), затем следует статус остаточной опухоли ( P <0,0001) и категория T ( P <0,0001). В многомерном подгрупповом анализе полностью резецированных опухолей (R0) они подтвердили, что узловой статус был наиболее важным предиктором, за которым следовала категория T. 62
Степень
Степень относится к степени дифференцировки опухолевых клеток и, как было показано, коррелирует с агрессивностью новообразования. 6 По степени патологии опухоли подразделяются на 1 из 3 категорий: хорошо, умеренно или слабо дифференцированные / анапластические. 6 Хотя степень злокачественности обычно указывается в патологических отчетах, прогностическое влияние рака желудка еще предстоит выяснить, поскольку в нескольких ретроспективных исследованиях не удалось определить степень как независимый прогностический фактор. 106–108
Размер
Размер первичной опухоли, измеренный в наибольшем измерении, был определен в нескольких ретроспективных исследованиях как имеющий прогностическое значение. 9,105,106 Эти исследования показывают, что увеличение диаметра опухоли связано с метастазами в лимфатические узлы и 5-летней выживаемостью.Это было подтверждено в проспективном рандомизированном исследовании, которое продемонстрировало, что размер опухоли является независимым прогностическим фактором в многофакторном анализе ( P = 0,0002; ДИ 1,3–2,2) у пациентов с свободными от опухоли краями. 62
Местоположение опухоли
Влияние местоположения опухоли имеет несколько важных значений при лечении и прогнозе рака желудка. Хотя есть исследования, которые не показали связи между локализацией и прогнозом, 105,107–109 несколько исследований показали, что карцинома желудка проксимальной трети желудка представляет собой отдельную клиническую сущность с прогностическим значением. 2,9,11,105,106,110,111 Недавнее исследование показало, что проксимальные опухоли чаще имеют больший размер, обширное проникновение в стенки, венозную инвазию, узловые метастазы и более позднюю стадию, с общей худшей выживаемостью по сравнению с дистальными опухолями. 111 Проксимальные опухоли могут потребовать другого хирургического подхода, основанного на потенциально другом биологическом поведении.
Лимфатическая и сосудистая инвазия
Присутствие опухолевых эмболов в перитууморальных сосудах и лимфатических сосудах недавно вызвало интерес как потенциальный независимый прогностический индикатор.Исследования показали, что поражение лимфатических узлов является статистически значимым предиктором выживаемости, а наличие опухолевых эмболов значительно влияет на рецидив опухоли и смерть после радикальной резекции. 72,105,110 Yokota et al. 110 обнаружили, что лимфатическая инвазия сохранила свою значимость (относительный риск, 11,43; ДИ, 2,63–49,55), даже в условиях конкуренции с другими значимыми переменными в многофакторном анализе. Эти данные были недавно подтверждены в отчете Hyung et al, 112 , который сообщил о плохом прогнозе, связанном с продвинутой стадией T и наличием сосудистой инвазии.Kooby et al., , 113, аналогичным образом продемонстрировали, что у пациентов с адекватной стадией поражения лимфатических узлов сосудистая инвазия является независимым негативным прогностическим фактором и может быть предиктором биологической агрессивности.
Возраст и пол
Ни возраст, ни пол окончательно не показали прогностического значения для смерти от рецидивирующего или метастатического рака. 62,109,114 Два небольших ретроспективных исследования в анализе подгрупп определили возраст как значительную прогностическую переменную, 105,108 , тогда как в другом исследовании влияние возраста не имело независимой прогностической ценности. 114 Это исследование показало, что выживаемость определялась стадией и полнотой резекции.
Другие факторы
Несколько других факторов связаны с увеличением местных рецидивов и снижением выживаемости при раке желудка. Предполагаемые опухолевые маркеры (p53, E-cadherin, CD-34, c-ErbB2, CA 72–4, CEA) в последнее время приобрели популярность в качестве потенциальных прогностических индикаторов для прогнозирования поведения опухоли. 111,115–117 Эти маркеры, вероятно, будут приобретать все большее значение, поскольку область анализа экспрессии генов продолжает расширяться. 117 Другие факторы включают перфорацию опухоли, экстренную операцию и переливание крови.
Анализ выживаемости и его применение при раке желудка
Использование определения прогноза заболевания является двукратным. Прогнозирование предоставляет пациентам и врачам информацию о будущем течении и естественном течении болезни и позволяет проводить сравнительный анализ данного исхода между двумя или более популяциями. 118,119
Прогностические исследования часто включают сравнения между 2 или более группами пациентов, которые различаются по статусу болезни.Кривые выживаемости для каждой группы могут быть построены, и соответствующие кривые могут быть сравнены с помощью логарифмического рангового теста. 118 В качестве альтернативы, многомерные модели могут использоваться для включения в анализ как времени, так и влияния множества факторов на время достижения заданного результата. 118 Этот анализ может использоваться для определения комбинации факторов, которые лучше всего предсказывают прогноз в группе пациентов или влияние отдельных факторов независимо.
Методы анализа выживаемости широко применялись при изучении рака желудка для определения значимости прогностических факторов при принятии клинических решений.Недавно в ходе исследований выживаемости были созданы многомерные прогностические модели, основанные на клинико-патологических факторах и связанные с молекулярными путями. Этот подход включает профили экспрессии генов, представляющие биологическое поведение опухолей, полученные в результате исследований на микроматрицах, в прогностические модели, и может использоваться для руководства хирургической и адъювантной терапией.
Будущие направления
Некоторые виды эпителиального рака, по-видимому, развиваются по многоступенчатому пути канцерогенеза. В этих опухолях корреляция между генетическими аномалиями и последовательными фенотипическими изменениями позволила получить точную клиническую и патологическую характеристику. 36,120–123 Однако рак желудка демонстрирует неоднородность гистопатологии и молекулярных изменений, которые препятствуют его полному молекулярному разграничению. 121 Только несколько генов (например, c-met, c-erbB2, K-sam, E-cadherin) участвуют в развитии рака желудка. 124 Из них только E-кадгерин был окончательно связан как маркер наследственного диффузного рака желудка. 23,25–27,35 Как уже упоминалось, большинство случаев рака желудка возникает спорадически, при этом от 8% до 10% имеют наследственный семейный компонент.Чаще всего рак желудка возникает без каких-либо устойчивых мутаций. Патогенез значительно варьируется, от постепенного прогрессирования изменений (гастрит → метаплазия → инвазивная карцинома) до опухолей, возникающих при отсутствии предшествующего поражения. 121 Новые технологии, такие как профилирование экспрессии генов на основе микрочипов, предоставляют информацию об экспрессии многих генов, участвующих в раковых заболеваниях человека. 125 Этот подход обещает изменить наше понимание молекулярных взаимодействий, которые в конечном итоге описывают фенотип и поведение опухоли.
Профилирование экспрессии генов на основе микрочипов
ПоследовательностиДНК не говорят нам, как экспрессия генов вызывает фенотип или как экспрессия генов изменяет последующие молекулярные побочные продукты. 126 Текущие ограничения для понимания желудочного канцерогенеза – это методы, позволяющие связать структурные знания генов с функциональными изменениями, которые происходят между компонентами, тем самым обеспечивая понимание поведения опухоли. 124,126,127 Характеристика генов, которые дифференциально экспрессируются при раке желудка, имеет важное значение для точной диагностики и характеристики опухоли, а также для принятия обоснованных решений о хирургической и адъювантной терапии, разработки новых терапевтических средств и описания поведения опухоли для более точного прогноза. 124
Микромассивы расширили молекулярные исследования, выходящие за рамки подхода генов-кандидатов, и начинают устанавливать связь между экспрессией генов и функциональными взаимодействиями. 121,124–129 Преимущество микрочипов состоит в том, что это инструмент трансляции, который включает функциональные взаимодействия в попытке понять биологию, а не просто идентифицировать составные части пути. 126 Исследования экспрессии генов позволяют охарактеризовать гены, которые дифференциально экспрессируются или транскрибируются из геномной ДНК. 122,124 Полученный набор генов, называемый профилем экспрессии, считается основным детерминантом клеточного фенотипа и функции. 126 Понимание различий в экспрессии генов между нормальной тканью и злокачественной тканью, а также реакции экспрессии генов на стимулы окружающей среды является центральным для понимания регуляторных механизмов, участвующих в развитии и прогрессировании рака. 125,126,129
Многомерный регрессионный анализ широко применялся при изучении рака.Эти исследования позволили определить большое количество важных клинико-патологических факторов, которыми клиницисты могут руководствоваться при выборе стратегии ведения. Несмотря на это, традиционные прогностические факторы имеют ограниченную прогностическую силу и изменили текущие стратегии лечения только для нескольких типов рака. 130 Однако технология микрочипов в сочетании с многомерными прогностическими моделями вызвала интерес к использованию профилей экспрессии генов в качестве прогностических моделей.
Статус лимфатических узлов, статус рецепторов, протоонкогены и генные мутации коррелировали с прогнозом рака груди. 131 Однако рак груди сложен, и знание индивидуальных прогностических факторов дает ограниченную информацию о биологии рака груди. Несколько недавних исследований, связывающих новые данные об экспрессии генов с многомерными прогностическими моделями, были использованы для изучения выживаемости и разработки более точных маркеров биологического поведения, чтобы преодолеть ограничения современных методов прогнозного моделирования. 130–132 Эти исследования продемонстрировали, что микроматричный анализ может точно идентифицировать отдельные подклассы рака груди 131 132 и независимо предсказывать общую и безрецидивную выживаемость на основе «прогностических наборов генов», которые превосходят доступные в настоящее время клинические и гистологические прогностические модели. . 130,132
Применение микроматричного анализа к таким заболеваниям, как немелкоклеточный рак легкого, гепатоцеллюлярная карцинома, карцинома пищевода и пищевод Барретта, аналогичным образом продемонстрировало использование микроматрицы для документирования различных прогностических групп, систем молекулярного стадирования, моделей, способных точно прогнозировать общая и специфическая для болезни выживаемость и частота рецидивов за пределами существующих методов. 133–135 Таким образом, применение профилей экспрессии генов может иметь потенциал для уточнения диагноза, прогноза и ведения пациентов. 134
Большинство исследований с использованием микроматриц, изучающих аденокарциному желудка, было направлено на разработку исследовательских профилей генов опухолей желудка или клеточных линий рака желудка для идентификации генов, связанных с раком желудка, определения молекулярных фенотипов, демонстрации подтипов опухолей и выявления функциональных кластеров генов. как потенциальные маркеры биологического поведения. 124,136–141 Есть несколько исследований, в которых применялись комбинированные микроматрицы и методология прогнозного моделирования к раку желудка.Недавние исследования показали, что микроматрица в сочетании со статистическим моделированием точно предсказывает поведение опухоли в отношении прогрессирования опухоли, метастатического потенциала, рецидива опухоли и общего прогноза. 142,143 Хотя анализ экспрессии генов в сочетании с прогностическими моделями находится в зачаточном состоянии, он обещает расширить наше понимание карциномы желудка. Относительная скудность имеющихся данных, связывающих профили генов рака желудка с прогнозом и успешность лечения различных других видов рака, сильно усиливает необходимость дальнейшего изучения этого метода.С помощью методов, способных амплифицировать небольшие количества опухолевой РНК, можно предположить, что образцы ткани, полученные эндоскопически, могут быть использованы для создания предоперационных прогностических кластеров генов. При этом идентификация функциональных кластеров генов может позволить улучшить отбор пациентов для неоадъювантной и адъювантной терапии, индивидуализированные хирургические резекции, выявить новые кластеры генов для дизайна таргетной терапии и улучшить прогноз, чтобы облегчить принятие решений как врачом, так и пациентом.
Аденокарцинома желудка
Рак желудка является вторым по распространенности во всем мире раком, частота которого сильно варьируется в разных географических регионах. 1 Это относительно редко встречающееся новообразование в Северной Америке, но оно вносит существенный вклад в бремя смертности от рака. 2–5 В Северной Америке рак желудка является третьим по распространенности злокачественным новообразованием желудочно-кишечного тракта после рака прямой кишки и поджелудочной железы и третьим по частоте летальным исходом новообразованием в целом. 4 Несмотря на снижение заболеваемости во всем мире, на рак желудка приходится от 3% до 10% всех смертей, связанных с раком. 6 Хотя выживаемость при раке желудка неуклонно повышается в таких странах, как Япония, этого не происходит в Северной Америке. 3 Несмотря на технические достижения в хирургии и использование адъювантной терапии, преобладала высокая смертность, связанная с раком желудка.
Девяносто процентов всех опухолей желудка являются злокачественными, а аденокарцинома желудка составляет 95% от общего числа злокачественных новообразований. 7 Лечебная терапия включает хирургическую резекцию, чаще всего полную или субтотальную резекцию желудка, с сопутствующей лимфаденэктомией. Общая 5-летняя выживаемость пациентов с операбельным раком желудка колеблется от 10% до 30%. 8–10
ЭПИДЕМИОЛОГИЯ
Рак желудка редко встречается в возрасте до 40 лет, но после этого частота его заболеваемости неуклонно растет и достигает пика в седьмом десятилетии жизни. 11 По оценкам, в 2000 году было диагностировано 876 340 случаев первичного рака желудка, что привело к почти 650 000 смертей во всем мире. 4 В Северной Америке вероятность развития и смерти от рака желудка в течение жизни составляет 1,5% и 1,0% соответственно. 4 В целом стандартизованные по возрасту коэффициенты смертности снизились у женщин (с 9,9 до 4,2 на 100 000) и мужчин (с 21,2 до 9,1 на 100 000) за последние 30 лет в Канаде. 5 В США ежегодно регистрируется 24 000 новых случаев заболевания и 14 000 случаев смерти. 12 В ретроспективном исследовании с участием более 50000 пациентов, пролеченных по поводу первичного рака желудка, Hundahl et al. 13 продемонстрировали, что 65% рака желудка в США находятся на поздней стадии (T3 / T4), из них почти 85%. опухолей, сопровождающихся метастазами в лимфатические узлы при постановке диагноза.Эта проблема еще более усложняется тем, что у пациентов, подвергнутых резекции с лечебной целью, частота рецидивов составляет от 40% до 65%. 14 В отсутствие официальных программ скрининга у большинства пациентов наблюдается продвинутая патологическая стадия, и средняя выживаемость при опухолях, резецированных с лечебной целью, может составлять 24 месяца (20–30% 5-летняя выживаемость), средняя выживаемость составляет 8,1 месяца. после паллиативных процедур и медиана выживаемости всего 5,4 месяца при запущенном заболевании без операции. 15–17
ФАКТОРЫ РИСКА
Сравнительные исследования между азиатскими и западными странами демонстрируют поразительные различия в заболеваемости и общей выживаемости рака желудка, что указывает на этническое происхождение как возможный фактор риска. 3,11,18 Самый высокий уровень заболеваемости в Японии (> 40 на 100 000), Восточной Азии, Южной Америке и Восточной Европе; тогда как Канада (10 на 100 000), Северная Европа, Африка и США имеют самые низкие показатели заболеваемости. 19 Национальный институт рака при изучении этнической принадлежности как фактора риска рака желудка выделил 3 группы: группы с высоким (корейцы, вьетнамцы, японцы, коренные американцы и гавайцы), среднего уровня (латиноамериканцы, китайцы и чернокожие). ), и низкая заболеваемость раком желудка с поправкой на возраст (филиппинцы и белые). 4
Мигранты первого поколения из стран с высокой заболеваемостью в страны с низкой заболеваемостью сохраняют уровень риска своей родной страны, тогда как последующие поколения приобретают уровень риска своей новой среды. 11,20 Это говорит о том, что этиологическое влияние может быть больше связано с факторами окружающей среды, чем с факторами этнической принадлежности. 11 С тех пор были подробно изучены некоторые диетические и поведенческие факторы. В исследовании случай-контроль Ramon et al. 21 определили, что диеты, богатые солью, копчеными или плохо консервированными продуктами, нитратами, нитритами и вторичными аминами, связаны с повышенным риском рака желудка.Считается, что эта связь возникает из-за длительного чрезмерного употребления соленой или маринованной пищи, что приводит к атрофическому гастриту и изменению желудочной среды с образованием канцерогенных N-нитрозосоединений. 11 Напротив, диета, богатая фруктами и овощами, может быть связана со снижением риска рака. Haung et al, 20 в ретроспективном опросе 877 японских пациентов с раком желудка предположили, что частое употребление сырых овощей и фруктов значительно снижает риск смерти, связанной с раком желудка (отношение рисков, 0.74; 95% доверительный интервал [ДИ] 0,56–0,98) за счет их антиоксидантного действия. Постулируется, что кальций, витамин А и витамин С оказывают защитное действие на слизистую оболочку желудка за счет снижения образования N-нитрозоканцерогенных соединений. 11,20 Исследования методом случай-контроль показывают, что у курильщиков сигарет риск развития проксимального рака желудка в 2–3 раза выше. 22 Эти результаты были подтверждены в исследовании Haung et al, 20 , которые продемонстрировали отношение шансов, равное 2.53 (ДИ 1,22–5,29) для постоянных курильщиков и тенденция к значимости для пациентов с привычным потреблением алкоголя.
Большинство случаев рака желудка возникает спорадически, в то время как от 8% до 10% имеют наследственный семейный компонент. 23 Карцинома желудка иногда развивается в семьях с мутациями зародышевой линии в p53 (синдром Ли-Фраумени) и BRCA2. 19 В 1-3% случаев рака желудка мутации зародышевой линии в гене, кодирующем белок клеточной адгезии E-кадгерин, приводят к аутосомно-доминантной предрасположенности к карциноме желудка, называемой наследственным диффузным раком желудка, которая имеет пенетрантность примерно 70%. 19,24–27 Huntsman et al. 24 предположили, что идентификация мутации E-кадгерина должна способствовать профилактической гастрэктомии у пораженных родственников. Рак желудка может развиваться как часть синдрома наследственного неполипозного рака толстой кишки (HNPCC), а также как часть синдромов желудочно-кишечного полипоза, включая семейный аденоматозный полипоз (FAP) и синдром Пейтца-Егерса. 19
Важным событием в эпидемиологии рака желудка стало признание связи с инфекцией Helicobacter pylori . 19 В трех независимых исследованиях сообщалось о значительном повышении риска у субъектов, у которых была подтверждена инфекция H. pylori за 10 или более лет до постановки диагноза рака. 28–30 Последующий метаанализ 42 обсервационных исследований, проведенных Eslick et al. 31 , показал значительную взаимосвязь между H. pylori и раком желудка (отношение шансов [OR], 2,04; CI, 1,69–2,45 ). H. pylori , как было впоследствии показано, вызывает изменения слизистой оболочки желудка и желудочной флоры, предрасполагающие к развитию карциномы у людей. 19 Кроме того, H. pylori способен прикрепляться к антигену группы крови Льюиса и может быть важным фактором, способствующим хронической инфекции и последующему повышенному риску рака, наблюдаемому у пациентов с фенотипом группы крови А. 19
К другим факторам, связанным с повышенным риском рака желудка, относятся хронический атрофический гастрит (например, злокачественная анемия, токсические и диетические агенты, предыдущие операции на желудке с рефлюксом желчи), гипертрофическая гастропатия (болезнь Метенье), полипы желудка, низкие социально-экономические показатели. статус и ожирение. 11,19
АДЕНОКАРЦИНОМА ЖЕЛУДКА: КЛИНИЧЕСКИЕ СООБРАЖЕНИЯ
Определение / описание случая
Диагноз рака желудка требует гистопатологической оценки тканей или цитологической оценки чистки / промываний желудка. Было предложено несколько систем классификации, чтобы помочь описать рак желудка либо с помощью макроскопических признаков (Borrmann), либо на основе микроскопической конфигурации (Ming, Carniero и Goseki). 19,32 Двумя наиболее часто используемыми являются системы Лорена и Всемирной организации здравоохранения (ВОЗ). 19
Классификация Лорена делит рак желудка на 2 основных гистологических типа: кишечный или диффузный. 11,33,34 Эта система описывает опухоли на основе микроскопической конфигурации и характера роста. 11 Рак диффузного типа имеет некогезионные опухолевые клетки, диффузно инфильтрирующие строму желудка, и часто проявляется глубокая инфильтрация стенки желудка с небольшим образованием желез или без них. 19,32 Диффузные опухоли могут проявлять выраженную десмоплазию и ассоциированное воспаление с относительной щадью покрывающей слизистой оболочки. 32 По сравнению с раком желудка кишечного типа, рак желудка диффузного типа в меньшей степени связан с влиянием окружающей среды, имеет повышенную относительную заболеваемость, чаще встречается у молодых пациентов и связан с худшим прогнозом. 19 Эти виды рака не связаны с кишечной метаплазией, не локализуются в антральном отделе и могут возникать в результате одноклеточных мутаций в нормальных железах желудка, как в случае недавно описанной наследственной диффузной карциномы желудка. 23,24,35
Рак кишечного типа демонстрирует узнаваемое образование желез, похожее по микроскопическому виду на слизистую оболочку толстой кишки. 11,19,32 Железистые образования варьируются от хорошо до низкодифференцированных опухолей, которые растут по расширяющимся, а не инфильтративным структурам. 6,11 Считается, что рак кишечника возникает вторично по отношению к хроническому атрофическому гастриту. 11,19
H. pylori и аутоиммунный гастрит являются наиболее частыми этиологическими поражениями, которые создают среду, способствующую воспалению желудка.Если гастрит не проходит, возникает атрофия желудка с последующей кишечной метаплазией, которая, в свою очередь, может привести к дисплазии. Дисплазия может возникать как в собственном желудочном, так и в «кишечном» желудочном эпителии. 19 Термин «аденома» применяется, когда диспластическая пролиферация вызывает макроскопическое выступающее поражение и морфологически описывается как тубулярная, тубуловиллярная или ворсинчатая аденома. 19 Аденомы, как правило, возникают в дистальных отделах желудка, часто имеют длительную предраковую фазу и расширяющийся характер роста. 6,11,19 Карцинома диагностируется, когда опухоль проникает в собственную пластинку или через мышечную слизистую оболочку. 19 До 80% диспластических поражений могут прогрессировать до инвазии.
Классификация Лорена оказалась полезной при оценке естественного течения рака желудка, особенно в отношении тенденций заболеваемости, клинико-патологических корреляций и этиологических предшественников. 6,11,33 Несмотря на очевидное использование классификации Лорена, ВОЗ 19 пересмотрела определение рака желудка на «злокачественные эпителиальные опухоли слизистой оболочки желудка с железистой дифференцировкой».«Система ВОЗ оценивает аденокарциному на основании степени сходства с метапластической тканью кишечника. 6,19,32 Он подразделяет гистологические образцы на 5 подтипов: аденокарцинома (кишечная и диффузная), папиллярная, трубчатая, муцинозная и клетка с перстневым кольцом. 19,32
Клинические проявления
Карцинома желудка часто не вызывает специфических симптомов, если она поверхностна и потенциально поддается хирургическому лечению, хотя до 50% пациентов могут иметь неспецифические желудочно-кишечные жалобы, такие как диспепсия. 11 В западных странах, даже при эндоскопическом обследовании, рак желудка обнаруживается только у 1-2% пациентов с диспепсией. Отсутствие ранних патогномоничных симптомов часто задерживает постановку диагноза. Следовательно, от 80% до 90% пациентов с раком желудка имеют местнораспространенные или метастатические опухоли с низкой степенью резектабельности. 19 Пациенты могут иметь анорексию и потерю веса (95%), а также боль в животе, которая носит неопределенный и коварный характер. Тошнота, рвота и преждевременное насыщение могут возникать при объемных опухолях, закупоривающих просвет желудочно-кишечного тракта, или при инфильтративных поражениях, которые ухудшают вздутие живота. 11 Язвенные опухоли могут вызывать кровотечение, которое проявляется в виде кровавой рвоты, мелены или массивного кровотечения из верхних отделов желудочно-кишечного тракта.
Физикальное обследование рака желудка на ранней стадии обычно неинформативно. Пациенты с запущенными опухолями могут проявлять пальпируемое образование в брюшной полости, кахексию, непроходимость кишечника, асцит, гепатомегалию и отек нижних конечностей. 11,36,37 Посев в брюшину может вызвать поражение яичников (опухоль Крукенберга) или тазового тупика (полка Блюмера), обнаруживаемого при ректальном исследовании. 37 Метастазы могут проявляться в виде увеличенного надключичного лимфатического узла (узел Вирхова), левого подмышечного лимфатического узла (узел Ирриша) или околопупочного лимфатического узла (узел сестры Мэри-Джозеф). 11,37
Скрининг рака желудка
Целью массового скрининга (бессимптомные группы населения) или наблюдения (группы риска) является обнаружение и диагностика рака желудка на ранней и, следовательно, потенциально излечимой стадии. 19 Массовый скрининг для раннего выявления рака желудка является рентабельным и рекомендуется в регионах с высокой заболеваемостью, таких как Япония и Китай, где от 50% до 80% обнаруженных злокачественных новообразований приходится на ранний рак желудка. 19 В Северной Америке нет официальных программ проверки. Американское общество эндоскопии желудочно-кишечного тракта рекомендует проводить эндоскопическое наблюдение за лицами с высоким риском (аденома желудка в анамнезе, FAP, HNCC, синдром Пейтца-Егерса и болезнь Метенье) каждые 1-2 года. 11 Массовый эндоскопический / радиологический скрининг не рекомендуется в регионах с низкой заболеваемостью, таких как Канада и США. 11
Диагностика и стадирование
Эндоскопия считается наиболее чувствительным и специфическим методом диагностики у пациентов с подозрением на рак желудка. 12 Эндоскопия позволяет напрямую визуализировать расположение опухоли, степень поражения слизистой оболочки и проводить биопсию (или цитологическую чистку) для диагностики тканей. 38 В сочетании с эндоскопией и радиологическими методами эндоскопическое ультразвуковое исследование (EUS) может максимально повысить стадию опухоли, предоставляя информацию о глубине инвазии опухоли и оценивая степень перигастральной лимфаденопатии. Willis et al., , 39, предполагают, что EUS в настоящее время является наиболее ценным диагностическим инструментом для предоперационной стадии рака желудка (точность 82% при оценке глубины инвазии опухоли) и для определения резектабельности опухоли.Karpeh et al., , 12, предполагают, что комбинированное использование EUS и лапароскопического определения стадии облегчает выбор пациента, предоставляя информацию о глубине опухоли и вовлечении перигастральных лимфатических узлов. Однако они предупреждают, что EUS менее точен (50–87%) при определении статуса лимфатических узлов.
Исследование бария в верхних отделах желудочно-кишечного тракта (UGI) включает закапывание жидкого бария в желудок и комбинацию 4 техник: оценка с наполнением барием, двойное контрастирование, рельеф слизистой оболочки и сжатие желудка. 40 Процедура позволяет выявить неровности слизистой оболочки. Halvorsen et al. 40 предположили, что, хотя эндоскопия все чаще становится методом выбора, эти 2 метода дополняют друг друга и имеют эквивалентную диагностическую эффективность.
Компьютерная томография (КТ) – наиболее часто используемый метод определения стадии рака желудка. 40 КТ может обнаруживать метастазы в печени, региональную и отдаленную лимфаденопатию и может прогнозировать прямое вторжение в соседние структуры.Кунц и др. 41 предположили, что КТ имеет чувствительность 88% для обнаружения опухолей. Способность КТ точно определять инфильтрацию опухоли (стадия Т 58%) или статус перигастральных лимфатических узлов (25–86%) широко варьировала и не считалась надежным предиктором степени заболевания в нескольких исследованиях. 41–43
Магнитно-резонансная томография (МРТ) имела ограниченное применение для определения стадии рака желудка, главным образом из-за трудностей с артефактами движения, стоимости, времени, необходимого для обследования, и отсутствия подходящего перорального контрастного вещества. 44,45 Однако в недавнем исследовании, сравнивающем МРТ с КТ, Sohn et al. 44 задокументировали распространенный рак желудка, который легко обнаруживался с помощью обоих методов. Они показали, что МРТ была немного лучше, чем КТ при Т-стадии рака желудка. 44 Точно так же Kim et al. 46 документально подтвердили, что точность определения стадии Т МРТ была выше, чем КТ (81% против 73%, P <0,05). Это исследование показало, что МРТ склонна к завышению патологической толщины опухоли. 46 Сообщается, что общая точность определения стадии T составляет от 73% до 88%. 45 Использование МРТ для определения стадии N затруднено из-за тех же трудностей, что и при постановке КТ, при которой статус узлов оценивается на основе размера лимфатических узлов. Несколько исследований показывают, что точность постановки узлов на МРТ ниже, чем при постановке КТ (65% против 73% соответственно, P > 0,05), причем оба метода имеют тенденцию к снижению узлового статуса. 45,46 Наконец, Мотохара и др. 45 рассмотрели способность МРТ выявлять внегастральные метастазы и пришли к выводу, что МРТ имеет большую чувствительность, чем КТ, в обнаружении диссеминации печени, костей и брюшины.Очевидное преимущество постановки МРТ заключается, прежде всего, в ее многоплоскостных возможностях, отсутствии ионизирующего излучения и использовании у пациентов с гиперчувствительностью к контрасту. 44 Другие методы стадирования включают УЗИ брюшной полости, позитронно-эмиссионную томографию и стадионную лапароскопию. 36
ХИРУРГИЧЕСКАЯ ТЕРАПИЯ
Общая, промежуточная и проксимальная гастрэктомия
Выбор хирургической процедуры при резектабельном раке желудка продиктован размером, расположением и возможностью достичь хирургических границ, свободных от макроскопических и микроскопических заболеваний.Несколько европейских исследований показали, что для достижения адекватных границ, свободных от болезни, должно быть расстояние 5 см от опухоли до ближайшей линии резекции в опухолях кишечного типа и 10 см в опухолях диффузного типа. 39,47–49
Обычно опухоли, ограниченные проксимальной третью желудка, лечат тотальной гастрэктомией, чтобы гарантировать адекватные границы резекции. Спорный вопрос, связана ли проксимальная гастрэктомия с плохим функциональным исходом дистального остатка желудка по сравнению с тотальной гастрэктомией с реконструкцией.Хотя исследований, посвященных этой проблеме, немного, но Harrison et al, 50 в ретроспективном обзоре продемонстрировали, что пациенты с проксимальным раком желудка, перенесшие тотальную гастрэктомию или проксимальную гастрэктомию, имели одинаковую общую продолжительность жизни и частоту рецидивов. Это исследование показало, что обе процедуры могут быть выполнены безопасно. Авторы предполагают, что, хотя эти 2 процедуры эквивалентны с точки зрения выживания и рецидива, необходимы дальнейшие исследования для оценки питания и качества жизни.Исследования продемонстрировали улучшение качества жизни при субтотальной гастрэктомии по сравнению с группой тотальной гастрэктомии 51–53 ; однако только одно исследование 53 конкретно продемонстрировало снижение качества жизни проксимальной гастрэктомии по сравнению с тотальной и дистальной субтотальной резекциями.
Остается спорным вопрос о выборе процедуры при опухолях средней и дистальной трети желудка. В большом европейском опросе, в котором участвовали 62 центра, Heberer et al. 54 продемонстрировали, что 44% хирургов предпочитают тотальную гастрэктомию при диффузном типе рака желудка антрального отдела на основании улучшенного клиренса опухоли и частоты местных рецидивов.При анализе 6400 пациентов в Национальной базе данных рака США, Hundahl et al 13 показали, что 12,3% пациентов с раком антрального отдела или привратника, независимо от типа опухоли, лечились тотальной гастрэктомией. В многоцентровом рандомизированном исследовании 618 пациентов Bozzetti et al 1 пришли к выводу, что пациенты с раком средней и дистальной трети желудка, перенесшие либо субтотальную, либо полную гастрэктомию, имели одинаковую 5-летнюю выживаемость. Это исследование показало, что пациенты, перенесшие субтотальную резекцию желудка, имели более короткое пребывание в больнице, лучший статус питания, меньше осложнений и лучшее качество жизни. 1 Кроме того, пациенты, перенесшие тотальную гастрэктомию, имели более высокий уровень спленэктомии с увеличением послеоперационных осложнений и восприимчивостью к инфекции, что подтверждает роль субтотальной гастрэктомии, когда это возможно. 1 Авторы пришли к выводу, что если рак желудка поражает соседние органы, эти органы должны быть удалены en bloc с желудком, при условии, что комбинированная процедура позволяет достичь четких границ резекции. 47,48
Ограниченная или расширенная лимфаденэктомия
Частота поражения лимфатических узлов колеблется от 3% до 5% для опухолей, ограниченных слизистой оболочкой, от 16% до 25% для опухолей, ограниченных подслизистой оболочкой, и от 80% до 90 % у пациентов с III или IV стадией заболевания. 11,55 Существуют значительные разногласия относительно надлежащей степени диссекции лимфатических узлов (LND). Ретроспективные исследования, проведенные в Японии, с участием более 10 000 пациентов, предполагают, что расширенная LND в сочетании с гастрэктомией продлевает выживаемость по сравнению с ограниченной LND. 56–59 Расширенная LND обеспечила общую 5-летнюю выживаемость от 50% до 62% по сравнению с 15% до 30%, полученной при ограниченных резекциях в США. 10,58,60 Японские исследователи утверждают, что расширенная LND (D2) удаляет опухоль в регионарных лимфатических узлах до того, как она может метастазировать.Кроме того, утверждается, что расширенный LND улучшает точность постановки. 55–59
Несоответствие общих показателей выживаемости между японскими и западными центрами после расширенной LND привело к 2 крупным многоцентровым рандомизированным проспективным испытаниям. Голландская группа по лечению рака желудка 61 рандомизировала 711 пациентов (380 в ограниченную [D1] и 331 – в расширенную [D2]) для проведения резекции с лечебной целью. Это исследование показало, что пациенты в группе D2 имели значительно более высокий уровень послеоперационных осложнений, чем пациенты в группе D1 (43% vs.25%; P <0,001), большее количество послеоперационных смертей (10% против 4%; P = 0,004) и более длительное пребывание в больнице (медиана, 16 дней против 14; P <0,001). 61 Кроме того, Пятилетняя выживаемость была схожей в 2 группах (45% в группе D1 и 47% в группе D2). 61 В голландском исследовании авторы отметили, что миграция стадий произошла в 30% группы D2 и может объяснили разницу в выживаемости между Востоком и Западом у пациентов, соответствующих стадии. 61 Авторы пришли к выводу, что результаты не подтверждают рутинное использование D2 LND. Однако в анализе подгрупп они показали значительную разницу у пациентов со стадией II и IIIA, которым предложили резекцию D2, наблюдение, подтвержденное Siewert и др. 62 в Немецком исследовании рака желудка. Кроме того, Hundahl et al, 13 , изучая зрелые результаты голландского исследования, отметили, что риск рецидива выше в группе D1, чем в группе D2 (41% против 29%; P = 0.02), что подтверждает роль расширенной резекции лимфатических узлов.
Cuschieri et al. 63 провели рандомизированное сравнение резекций D1 (n = 200) и D2 (n = 200) для потенциально излечимого распространенного рака желудка в исследовании Совета по медицинским исследованиям (MRC). Результаты исследования продемонстрировали значительную разницу между группой D2 и группой D1 по послеоперационной смертности (13% против 6,5%; P = 0,04) и заболеваемости (46% против 28%; P <0,001). , без разницы в общей 5-летней выживаемости для D2 по сравнению с D1 (33% vs.35%). 63 Как и в голландском исследовании, MRC не продемонстрировал преимущества в выживаемости с классической японской расширенной резекцией; однако анализ подгрупп исследования MRC продемонстрировал несколько интересных результатов. Во-первых, наибольшим фактором послеоперационной заболеваемости и смертности в группе D2 было добавление панкреатикоспленэктомии (отношение рисков 1,53; ДИ 1,17–2,01). 63 Во-вторых, сохранение поджелудочной железы и селезенки с сопутствующей резекцией D2 может обеспечить лучшую выживаемость, чем резекция D1, и может быть выполнено с низкой послеоперационной заболеваемостью и смертностью. 63 Интересно, что и в исследованиях, проведенных в Голландии, и в исследованиях MRC, когда для всех пациентов требовалась как минимум резекция D1 (удаление как минимум узлов уровня N1), общая 5-летняя выживаемость в группе D1 резко увеличилась. Выживаемость от 20% до 34% (MRC) и 45% (голландцы), что снова указывает на сильную связь между выживаемостью и адекватным расслоением LN. 13 Cuschieri et al. 63 пришли к выводу, что «резекция D2 без панкреатико-спленэктомии может быть лучше, чем стандартная резекция D1, и не может быть отклонена по результатам этого исследования.
В нескольких последующих исследованиях, основанных на результатах Нидерландов и MRC, изучалась роль расширенной LND с сохранением поджелудочной железы и селезенки на послеоперационную заболеваемость, смертность и общую выживаемость. 10,55,56,62,64–69 Эти исследования продемонстрировали, что расширенная LND с сохранением селезенки и поджелудочной железы может быть выполнена при послеоперационной заболеваемости и смертности, эквивалентной ограниченной LND. Несколько хорошо проведенных проспективных исследований 10,62,64–66,69 продемонстрировали, что расширенная LND не связана с увеличением заболеваемости или смертности при проведении в опытных центрах и значительно улучшает долгосрочную выживаемость у пациентов со стадией II, IIIA 10,62,64–66,69 и, возможно, болезнь IIIB. 10 На основании этих исследований, гастрэктомия с расширенной лимфодиссекцией остается процедурой выбора в специализированных центрах. 56,69–73
Новые проблемы лимфаденэктомии при раке желудка
Ранние версии критериев стадирования TNM касались статуса N, определяемого расположением метастазов в лимфатические узлы (ЛУ) относительно первичной опухоли. 74 Это вызвало разногласия в отношении подходящих резекций лимфатических узлов и предотвратило обобщение результатов азиатских исследований, проводимых в соответствии с Японской классификацией рака желудка (JCGC). 75 JCGC классифицировал степень метастазов в LN на основе анатомической станции LN (). Наличие метастазов в каждой группе LN отражает статус N и составляет основу категорий D (). 74 С признанием преимущества расширенных резекций (D2) на выживаемость, пятое издание TNM AJCC было изменено, чтобы включить доступные клинические, радиологические, эндоскопические и хирургические средства для оценки степени заболевания. 76 Пятое издание классифицирует метастазы LN на основе количества положительных узлов, в которых по крайней мере 15 LN должны быть рассечены и исследованы для точного определения стадии (). 75,76 В исторической когорте Karpeh et al. 75 продемонстрировали, что количество положительных узлов обеспечивает лучший прогноз, чем анатомическое расположение, как определено в более ранней редакции TNM. Точно так же Kodera et al. 77 применили стадию TNM 1997 года к 493 японским пациентам, у которых была резекция D2 или D3, и пришли к выводу, что количество вовлеченных узлов было сильным прогностическим индикатором, который должен заменить категорию N в JCGC. С тех пор это открытие было поддержано несколькими группами, которые аналогичным образом обнаружили, что увеличение количества LN улучшает прогноз, сводит к минимуму эффекты миграции стадий, улучшает стадирование узлов в разных регионах и странах, помогает выбрать подходящую мультимодальную терапию и дает лучшее представление о бремени болезни. 75,76,78 В 1995 году патологическая стадия N определялась количеством метастатических ЛУ, таким образом достигая единой унифицированной системы стадирования. 75
ТАБЛИЦА 1. Японская классификация рака желудка (JCGC)
ТАБЛИЦА 2. Классификация рака желудка Американским объединенным комитетом (AJCC) (5-е издание)
растет консенсус о том, что для точного определения стадии опухоли необходимо извлечение как минимум 15 LN.Однако в хирургических центрах Северной Америки и Европы наблюдается значительное несоблюдение режима лечения. Mullaney et al. 76 показали, что только 31% (диапазон 10–44%) хирургически удаленных случаев можно точно оценить на предмет статуса лимфатических узлов. Недостаток LN для определения стадии имеет значение как для прогноза, так и для миграции стадии. 76 Это наблюдение было подтверждено исследованием 1038 пациентов в одном американском учреждении и обнаружило, что до 27% случаев обследовали менее 15 узлов. 75 Еще более тревожным был отчет из Национальной базы данных США, который продемонстрировал, что всего у 18% пациентов в США проанализировано ≥15 LN. 13 Авторы предполагают, что у этих пациентов высока вероятность остаточного нелеченого поражения регионарных лимфатических узлов. Несоблюдение режима может быть непринятием обширных резекций для улучшения прогноза, незнанием степени резекции, необходимой для достижения минимального количества ЛУ, и неадекватной патологической оценки. 13,75,76,78
Адъювантная или неоадъювантная терапия
Пациенты с локализованным раком желудка без лимфоузлов имеют 5-летнюю выживаемость, которая приближается к 75% при лечении только хирургическим вмешательством. 79 В этом отличие от пациентов с поражением лимфатических узлов, у которых выживаемость колеблется от 10% до 30%. 9 Исход рака желудка осложняется высокой частотой местных рецидивов и отдаленных метастазов после радикальных хирургических вмешательств, что вызвало интерес к адъювантной терапии в надежде на улучшение результатов лечения. 58 Исследования адъювантной и неоадъювантной терапии при лечении рака желудка дали противоречивые результаты. Несоответствие может быть отражением различий между изученными популяциями (группы высокого и низкого риска), 80 патологической классификации, 81 степени хирургической процедуры (D2 по сравнению с D1) 68 , а также различий в содержание и сроки адъювантной терапии (немедленная или отсроченная). Было опубликовано несколько метаанализов 82–88 в попытке устранить расхождения, описанные в литературе, результаты которых суммированы в.
ТАБЛИЦА 3. Мета-анализ рандомизированных клинических испытаний адъювантной химиотерапии
Три из 7 метаанализов предполагают небольшое, но значительное преимущество адъювантной химиотерапии в лечении полностью резецированного рака желудка. 83,84,87 Однако эти авторы предлагают интерпретировать результаты с осторожностью, потому что результаты имеют пограничную значимость 83 и могут зависеть от ряда систематических ошибок, а также низкого методологического качества. 84 Этот вывод отражал более ранний отчет, в котором рассматривались результаты 43 рандомизированных исследований, проведенных в период с 1967 по 1993 год по всем адъювантным методам лечения рака желудка, включая опубликованные в японской литературе. 89 В этом обзоре сделан вывод о том, что результаты рандомизированных исследований в Северной Америке и Европе не подтверждают рутинное использование адъювантной химиотерапии при раке желудка. 89
Janunger et al, 85 в систематическом обзоре 153 научных статей (с участием 12 367 пациентов) исследовали эффекты адъювантной химиотерапии при раке желудка.В их метаанализе было продемонстрировано значительное улучшение общей выживаемости (). Однако раздельный анализ западных и азиатских исследований продемонстрировал значительную разницу в результатах в азиатских (OR, 0,58; 95% ДИ, 0,44–0,76), но не в западных (OR, 0,96; 95% ДИ, 0,83–1,12) отчетах. разница объясняется сроками постановки диагноза, объемом операции и переносом стадии. 85 В более позднем метаанализе, Jununger et al., 88 , применяя современные комбинации лекарств в течение последних 10 лет, не смогли продемонстрировать какого-либо значительного улучшения выживаемости ().В целом, в настоящее время недостаточно данных, чтобы рекомендовать послеоперационную химиотерапию в качестве стандартного адъювантного лечения в западных центрах. 82–85,88
Неоадъювантная терапия (химиотерапия, химиолучевая терапия, лучевая или иммунотерапия, отдельно или в комбинации) использовалась при местнораспространенных опухолях и опухолях с высоким риском рецидива, несмотря на очевидно излечивающую операцию. Сообщалось о степени резектабельности от 40% до 100% и потенциально излечивающих резекциях в 37-80% случаев. 85 Однако только 2 рандомизированных исследования касались неоадъювантной химиотерапии, ни одно из которых убедительно не демонстрирует явного преимущества. 90–92 Исследования адъювантной внутрибрюшинной химиотерапии также неубедительны и обычно не проводятся вне рамок клинических испытаний. 85
Предварительные исследования адъювантной химиолучевой терапии показали многообещающие результаты у пациентов, подвергнутых резекции с лечебной целью. 93,94 Роль адъювантной химиолучевой терапии изучалась в первую очередь в исследовании Intergroup 0116 95 , в котором 566 пациентов со стадией IB-IVM0 полностью резецировали желудочную или гастроэзофагеальную аденокарциному для проведения только хирургического вмешательства или хирургического вмешательства плюс химиолучевой терапии (5f + лейковорин с последующей 45 Гр излучения).В группе только хирургического вмешательства дела обстояли значительно хуже по сравнению с группой адъювантной химиолучевой терапии с точки зрения безрецидивной выживаемости (отношение рисков 1,52; 95% ДИ 1,23–1,86) и смерти (отношение рисков 1,35; 95% ДИ 1,09–1,66. ). 14 Добавление адъювантной химиолучевой терапии значительно улучшило медианное значение выживаемости ( P = 0,005) с 27 до 36 месяцев. 14 Отдаленный рецидив был наиболее частым местом рецидива в группе адъюванта (33% против 18%), тогда как местный рецидив был более распространен в группе, получавшей только хирургическое вмешательство (29% против 18%).19%). 14 Значительная токсичность (степень 3 или выше) наблюдалась в группе химиолучевой терапии, при этом 3 пациента (1%) умерли от токсичности, связанной с лечением. Кроме того, хотя хирургический протокол рекомендовал обширную резекцию лимфатических узлов, менее 10% пациентов получили формальную диссекцию D2, тогда как 54% подверглись диссекции D0. 14 Авторы приходят к выводу, что наибольшая польза от химиолучевой терапии может быть у пациентов из группы высокого риска, получавших неадекватные резекции D2.Несмотря на результаты этого исследования, некоторые учреждения рекомендуют только адъювантную химиотерапию пациентам, не переносящим лучевую терапию; однако оптимальный режим в этой ситуации еще предстоит определить. 92
Неоперабельное местнораспространенное или метастатическое заболевание
Более 50% пациентов поступают с неоперабельной местнораспространенной или метастатической аденокарциномой желудка. 96 У большинства пациентов, в том числе с ранней стадией заболевания, в какой-то момент в течение болезни появляются метастазы.Облегчение симптомов в этой группе пациентов имеет первостепенное значение и может рассматриваться как местная и / или системная терапия. Лечение местных симптомов включает паллиативную хирургию, лучевую терапию и / или эндоскопические процедуры. У пациентов с метастатическим заболеванием системная химиотерапия является единственным методом лечения, который продемонстрировал значительное улучшение выживаемости. 88 Было показано, что у выбранных пациентов с хорошим статусом работоспособности по сравнению с одной только лучшей поддерживающей терапией комбинированная химиотерапия улучшает среднюю выживаемость на 3–9 месяцев, а также демонстрирует улучшение или сохранение качества жизни. 97–100 Было изучено множество традиционных режимов химиотерапии с одним агентом, при этом различные комбинации, оцененные в исследованиях фазы III, продемонстрировали частоту ответа от 25% до 40%. 101 Несмотря на количество оцененных схем, единой комбинированной схемы не появилось. 88 Стандартные протоколы в Северной Америке включают эпирубицин, цисплатин и непрерывную инфузию 5FU (ECF), 102 цисплатин и 5-дневную инфузию 5FU (CF), а также этопозид, лейковорин и болюсный 5FU (ELF). 103 Комбинированные схемы третьего поколения включают новые агенты, такие как иринотекан, оксалиплатин и таксаны, все из которых в настоящее время проходят оценку фазы II – III. Несмотря на использование традиционной комбинированной химиотерапии, средняя выживаемость редко превышает 10 месяцев.
ПРОГНОСТИЧЕСКИЕ ПЕРЕМЕННЫЕ
Стадия
Было доказано, что патологическая стадия имеет прогностическое значение как для 5-летней выживаемости, так и для частоты местных рецидивов. 62,104–106 Siewert et al, 62 в проспективном многоцентровом наблюдательном исследовании продемонстрировали, что соотношение лимфатических узлов более 20% (между положительными и удаленными узлами) было единственным наиболее важным независимым прогностическим фактором ( P <0.0001), затем следует статус остаточной опухоли ( P <0,0001) и категория T ( P <0,0001). В многомерном подгрупповом анализе полностью резецированных опухолей (R0) они подтвердили, что узловой статус был наиболее важным предиктором, за которым следовала категория T. 62
Степень
Степень относится к степени дифференцировки опухолевых клеток и, как было показано, коррелирует с агрессивностью новообразования. 6 По степени патологии опухоли подразделяются на 1 из 3 категорий: хорошо, умеренно или слабо дифференцированные / анапластические. 6 Хотя степень злокачественности обычно указывается в патологических отчетах, прогностическое влияние рака желудка еще предстоит выяснить, поскольку в нескольких ретроспективных исследованиях не удалось определить степень как независимый прогностический фактор. 106–108
Размер
Размер первичной опухоли, измеренный в наибольшем измерении, был определен в нескольких ретроспективных исследованиях как имеющий прогностическое значение. 9,105,106 Эти исследования показывают, что увеличение диаметра опухоли связано с метастазами в лимфатические узлы и 5-летней выживаемостью.Это было подтверждено в проспективном рандомизированном исследовании, которое продемонстрировало, что размер опухоли является независимым прогностическим фактором в многофакторном анализе ( P = 0,0002; ДИ 1,3–2,2) у пациентов с свободными от опухоли краями. 62
Местоположение опухоли
Влияние местоположения опухоли имеет несколько важных значений при лечении и прогнозе рака желудка. Хотя есть исследования, которые не показали связи между локализацией и прогнозом, 105,107–109 несколько исследований показали, что карцинома желудка проксимальной трети желудка представляет собой отдельную клиническую сущность с прогностическим значением. 2,9,11,105,106,110,111 Недавнее исследование показало, что проксимальные опухоли чаще имеют больший размер, обширное проникновение в стенки, венозную инвазию, узловые метастазы и более позднюю стадию, с общей худшей выживаемостью по сравнению с дистальными опухолями. 111 Проксимальные опухоли могут потребовать другого хирургического подхода, основанного на потенциально другом биологическом поведении.
Лимфатическая и сосудистая инвазия
Присутствие опухолевых эмболов в перитууморальных сосудах и лимфатических сосудах недавно вызвало интерес как потенциальный независимый прогностический индикатор.Исследования показали, что поражение лимфатических узлов является статистически значимым предиктором выживаемости, а наличие опухолевых эмболов значительно влияет на рецидив опухоли и смерть после радикальной резекции. 72,105,110 Yokota et al. 110 обнаружили, что лимфатическая инвазия сохранила свою значимость (относительный риск, 11,43; ДИ, 2,63–49,55), даже в условиях конкуренции с другими значимыми переменными в многофакторном анализе. Эти данные были недавно подтверждены в отчете Hyung et al, 112 , который сообщил о плохом прогнозе, связанном с продвинутой стадией T и наличием сосудистой инвазии.Kooby et al., , 113, аналогичным образом продемонстрировали, что у пациентов с адекватной стадией поражения лимфатических узлов сосудистая инвазия является независимым негативным прогностическим фактором и может быть предиктором биологической агрессивности.
Возраст и пол
Ни возраст, ни пол окончательно не показали прогностического значения для смерти от рецидивирующего или метастатического рака. 62,109,114 Два небольших ретроспективных исследования в анализе подгрупп определили возраст как значительную прогностическую переменную, 105,108 , тогда как в другом исследовании влияние возраста не имело независимой прогностической ценности. 114 Это исследование показало, что выживаемость определялась стадией и полнотой резекции.
Другие факторы
Несколько других факторов связаны с увеличением местных рецидивов и снижением выживаемости при раке желудка. Предполагаемые опухолевые маркеры (p53, E-cadherin, CD-34, c-ErbB2, CA 72–4, CEA) в последнее время приобрели популярность в качестве потенциальных прогностических индикаторов для прогнозирования поведения опухоли. 111,115–117 Эти маркеры, вероятно, будут приобретать все большее значение, поскольку область анализа экспрессии генов продолжает расширяться. 117 Другие факторы включают перфорацию опухоли, экстренную операцию и переливание крови.
Анализ выживаемости и его применение при раке желудка
Использование определения прогноза заболевания является двукратным. Прогнозирование предоставляет пациентам и врачам информацию о будущем течении и естественном течении болезни и позволяет проводить сравнительный анализ данного исхода между двумя или более популяциями. 118,119
Прогностические исследования часто включают сравнения между 2 или более группами пациентов, которые различаются по статусу болезни.Кривые выживаемости для каждой группы могут быть построены, и соответствующие кривые могут быть сравнены с помощью логарифмического рангового теста. 118 В качестве альтернативы, многомерные модели могут использоваться для включения в анализ как времени, так и влияния множества факторов на время достижения заданного результата. 118 Этот анализ может использоваться для определения комбинации факторов, которые лучше всего предсказывают прогноз в группе пациентов или влияние отдельных факторов независимо.
Методы анализа выживаемости широко применялись при изучении рака желудка для определения значимости прогностических факторов при принятии клинических решений.Недавно в ходе исследований выживаемости были созданы многомерные прогностические модели, основанные на клинико-патологических факторах и связанные с молекулярными путями. Этот подход включает профили экспрессии генов, представляющие биологическое поведение опухолей, полученные в результате исследований на микроматрицах, в прогностические модели, и может использоваться для руководства хирургической и адъювантной терапией.
Будущие направления
Некоторые виды эпителиального рака, по-видимому, развиваются по многоступенчатому пути канцерогенеза. В этих опухолях корреляция между генетическими аномалиями и последовательными фенотипическими изменениями позволила получить точную клиническую и патологическую характеристику. 36,120–123 Однако рак желудка демонстрирует неоднородность гистопатологии и молекулярных изменений, которые препятствуют его полному молекулярному разграничению. 121 Только несколько генов (например, c-met, c-erbB2, K-sam, E-cadherin) участвуют в развитии рака желудка. 124 Из них только E-кадгерин был окончательно связан как маркер наследственного диффузного рака желудка. 23,25–27,35 Как уже упоминалось, большинство случаев рака желудка возникает спорадически, при этом от 8% до 10% имеют наследственный семейный компонент.Чаще всего рак желудка возникает без каких-либо устойчивых мутаций. Патогенез значительно варьируется, от постепенного прогрессирования изменений (гастрит → метаплазия → инвазивная карцинома) до опухолей, возникающих при отсутствии предшествующего поражения. 121 Новые технологии, такие как профилирование экспрессии генов на основе микрочипов, предоставляют информацию об экспрессии многих генов, участвующих в раковых заболеваниях человека. 125 Этот подход обещает изменить наше понимание молекулярных взаимодействий, которые в конечном итоге описывают фенотип и поведение опухоли.
Профилирование экспрессии генов на основе микрочипов
ПоследовательностиДНК не говорят нам, как экспрессия генов вызывает фенотип или как экспрессия генов изменяет последующие молекулярные побочные продукты. 126 Текущие ограничения для понимания желудочного канцерогенеза – это методы, позволяющие связать структурные знания генов с функциональными изменениями, которые происходят между компонентами, тем самым обеспечивая понимание поведения опухоли. 124,126,127 Характеристика генов, которые дифференциально экспрессируются при раке желудка, имеет важное значение для точной диагностики и характеристики опухоли, а также для принятия обоснованных решений о хирургической и адъювантной терапии, разработки новых терапевтических средств и описания поведения опухоли для более точного прогноза. 124
Микромассивы расширили молекулярные исследования, выходящие за рамки подхода генов-кандидатов, и начинают устанавливать связь между экспрессией генов и функциональными взаимодействиями. 121,124–129 Преимущество микрочипов состоит в том, что это инструмент трансляции, который включает функциональные взаимодействия в попытке понять биологию, а не просто идентифицировать составные части пути. 126 Исследования экспрессии генов позволяют охарактеризовать гены, которые дифференциально экспрессируются или транскрибируются из геномной ДНК. 122,124 Полученный набор генов, называемый профилем экспрессии, считается основным детерминантом клеточного фенотипа и функции. 126 Понимание различий в экспрессии генов между нормальной тканью и злокачественной тканью, а также реакции экспрессии генов на стимулы окружающей среды является центральным для понимания регуляторных механизмов, участвующих в развитии и прогрессировании рака. 125,126,129
Многомерный регрессионный анализ широко применялся при изучении рака.Эти исследования позволили определить большое количество важных клинико-патологических факторов, которыми клиницисты могут руководствоваться при выборе стратегии ведения. Несмотря на это, традиционные прогностические факторы имеют ограниченную прогностическую силу и изменили текущие стратегии лечения только для нескольких типов рака. 130 Однако технология микрочипов в сочетании с многомерными прогностическими моделями вызвала интерес к использованию профилей экспрессии генов в качестве прогностических моделей.
Статус лимфатических узлов, статус рецепторов, протоонкогены и генные мутации коррелировали с прогнозом рака груди. 131 Однако рак груди сложен, и знание индивидуальных прогностических факторов дает ограниченную информацию о биологии рака груди. Несколько недавних исследований, связывающих новые данные об экспрессии генов с многомерными прогностическими моделями, были использованы для изучения выживаемости и разработки более точных маркеров биологического поведения, чтобы преодолеть ограничения современных методов прогнозного моделирования. 130–132 Эти исследования продемонстрировали, что микроматричный анализ может точно идентифицировать отдельные подклассы рака груди 131 132 и независимо предсказывать общую и безрецидивную выживаемость на основе «прогностических наборов генов», которые превосходят доступные в настоящее время клинические и гистологические прогностические модели. . 130,132
Применение микроматричного анализа к таким заболеваниям, как немелкоклеточный рак легкого, гепатоцеллюлярная карцинома, карцинома пищевода и пищевод Барретта, аналогичным образом продемонстрировало использование микроматрицы для документирования различных прогностических групп, систем молекулярного стадирования, моделей, способных точно прогнозировать общая и специфическая для болезни выживаемость и частота рецидивов за пределами существующих методов. 133–135 Таким образом, применение профилей экспрессии генов может иметь потенциал для уточнения диагноза, прогноза и ведения пациентов. 134
Большинство исследований с использованием микроматриц, изучающих аденокарциному желудка, было направлено на разработку исследовательских профилей генов опухолей желудка или клеточных линий рака желудка для идентификации генов, связанных с раком желудка, определения молекулярных фенотипов, демонстрации подтипов опухолей и выявления функциональных кластеров генов. как потенциальные маркеры биологического поведения. 124,136–141 Есть несколько исследований, в которых применялись комбинированные микроматрицы и методология прогнозного моделирования к раку желудка.Недавние исследования показали, что микроматрица в сочетании со статистическим моделированием точно предсказывает поведение опухоли в отношении прогрессирования опухоли, метастатического потенциала, рецидива опухоли и общего прогноза. 142,143 Хотя анализ экспрессии генов в сочетании с прогностическими моделями находится в зачаточном состоянии, он обещает расширить наше понимание карциномы желудка. Относительная скудность имеющихся данных, связывающих профили генов рака желудка с прогнозом и успешность лечения различных других видов рака, сильно усиливает необходимость дальнейшего изучения этого метода.С помощью методов, способных амплифицировать небольшие количества опухолевой РНК, можно предположить, что образцы ткани, полученные эндоскопически, могут быть использованы для создания предоперационных прогностических кластеров генов. При этом идентификация функциональных кластеров генов может позволить улучшить отбор пациентов для неоадъювантной и адъювантной терапии, индивидуализированные хирургические резекции, выявить новые кластеры генов для дизайна таргетной терапии и улучшить прогноз, чтобы облегчить принятие решений как врачом, так и пациентом.
Лечение рака желудка (PDQ®) – версия для пациента
О PDQ
Запрос данных врача (PDQ) – это обширная база данных по раку Национального института рака (NCI). База данных PDQ содержит резюме последней опубликованной информации о профилактике, обнаружении, генетике, лечении, поддерживающей терапии, а также дополнительной и альтернативной медицине. Большинство резюме представлено в двух версиях. Версии для медицинских работников содержат подробную информацию на техническом языке.Версии для пациентов написаны на понятном нетехническом языке. Обе версии содержат точную и актуальную информацию о раке, и большинство версий также доступно на испанском языке.
PDQ – это служба NCI. NCI является частью Национальных институтов здравоохранения (NIH). NIH – это центр биомедицинских исследований при федеральном правительстве. Обзоры PDQ основаны на независимом обзоре медицинской литературы. Это не политические заявления NCI или NIH.
Цель этого обзора
В этом обзоре информации о раке PDQ содержится текущая информация о лечении рака желудка.Он предназначен для информирования и помощи пациентам, семьям и лицам, осуществляющим уход. Он не дает официальных руководящих принципов или рекомендаций для принятия решений в отношении здравоохранения.
Рецензенты и обновления
Редакционные коллегии составляют сводки информации о раке PDQ и поддерживают их в актуальном состоянии. Эти советы состоят из экспертов в области лечения рака и других специальностей, связанных с раком. Резюме регулярно пересматриваются, и в них вносятся изменения при появлении новой информации. Дата в каждой сводке («Обновлено») – это дата самого последнего изменения.
Информация в этом обзоре пациентов была взята из версии для медицинских работников, которая регулярно проверяется и обновляется по мере необходимости редакционной коллегией PDQ по лечению взрослых.
Информация о клиническом испытании
Клиническое испытание – это исследование, призванное дать ответ на научный вопрос, например, лучше ли одно лечение, чем другое. Испытания основаны на прошлых исследованиях и на том, что было изучено в лаборатории. Каждое испытание отвечает на определенные научные вопросы, чтобы найти новые и более эффективные способы помощи больным раком.Во время клинических испытаний лечения собирается информация об эффектах нового лечения и о том, насколько хорошо оно работает. Если клиническое испытание покажет, что новое лечение лучше, чем то, что используется в настоящее время, новое лечение может стать «стандартным». Пациенты могут захотеть принять участие в клиническом исследовании. Некоторые клинические испытания открыты только для пациентов, которые еще не начали лечение.
Клинические испытания можно найти в Интернете на сайте NCI. Для получения дополнительной информации позвоните в Информационную службу рака (CIS), контактный центр NCI, по телефону 1-800-4-CANCER (1-800-422-6237).
Разрешение на использование данного обзора
PDQ является зарегистрированным товарным знаком. Содержимое документов PDQ можно свободно использовать как текст. Его нельзя идентифицировать как сводную информацию о раке NCI PDQ, если не отображается вся сводка и не обновляется регулярно. Тем не менее, пользователю будет разрешено написать предложение, например: «В сводке информации о раке PDQ NCI о профилактике рака груди указываются риски следующим образом: [включить выдержку из резюме]».
Лучше всего процитировать это резюме PDQ:
Редакционная коллегия PDQ® Adult Treatment.PDQ Лечение рака желудка. Бетесда, Мэриленд: Национальный институт рака. Обновлено <ММ / ДД / ГГГГ>. Доступно по адресу: https://www.cancer.gov/types/stomach/patient/stomach-treatment-pdq. Дата обращения <ММ / ДД / ГГГГ>. [PMID: 26389328]
Изображения в этом резюме используются с разрешения автора (ов), художника и / или издателя только для использования в обзорах PDQ. Если вы хотите использовать изображение из сводки PDQ и не используете все сводки, вы должны получить разрешение от владельца. Он не может быть предоставлен Национальным институтом рака.Информацию об использовании изображений в этом обзоре, а также многих других изображений, связанных с раком, можно найти в Visuals Online. Visuals Online – это коллекция из более чем 3000 научных изображений.
Заявление об отказе от ответственности
Информация, содержащаяся в этом резюме, не должна использоваться для принятия решений о страховом возмещении. Более подробную информацию о страховом покрытии можно найти на сайте Cancer.gov на странице «Управление онкологическими услугами».
Свяжитесь с нами
Подробнее о том, как связаться с нами или получить помощь при раке.gov можно найти на нашей странице “Свяжитесь с нами для получения помощи”. Вопросы также можно отправить на Cancer.gov через электронную почту веб-сайта.
Рак желудка – NORD (Национальная организация по редким заболеваниям)
Лечение
Терапевтическое ведение пациентов с раком желудка может потребовать скоординированных усилий группы медицинских специалистов, например врачей, специализирующихся на диагностике и лечении заболевания пищеварительной системы (гастроэнтерологи), врачи, специализирующиеся на диагностике и лечении рака (медицинские онкологи), врачи, специализирующиеся на диагностике и лечении рака с помощью хирургии (хирургические онкологи), врачи, специализирующиеся на использовании лучевой терапии для лечения рака (радиационные онкологи), медсестры онкологии, психиатры, диетологи и другие специалисты в области здравоохранения.Психосоциальная поддержка также важна для всей семьи.
Конкретные терапевтические процедуры и вмешательства могут различаться в зависимости от множества факторов, таких как стадия заболевания; размер опухоли; специфический подтип рака желудка; распространился ли рак; наличие или отсутствие определенных симптомов; возраст и общее состояние здоровья человека; и / или другие элементы. Решения относительно использования конкретных схем приема лекарств и / или других методов лечения должны приниматься врачами и другими членами медицинской бригады после тщательных консультаций с пациентом, исходя из специфики его или ее случая; подробное обсуждение потенциальных преимуществ и рисков, включая возможные побочные и долгосрочные эффекты; предпочтения пациентов; и другие соответствующие факторы.
Хирургия – это основной метод лечения рака желудка. Точная операция и объем операции зависят от типа и стадии рака. Хирургия может включать эндоскопическую резекцию, при которой рак не распространился на близлежащие лимфатические узлы. Хирурги проводят тонкую гибкую трубку по горлу к желудку. Они могут направлять инструменты по трубке, что позволяет им хирургическим путем удалить опухоль и любые пораженные ткани стенки желудка. Рак желудка, диагностированный в Соединенных Штатах, редко бывает тонким и достаточно маленьким, чтобы можно было провести эндоскопическую резекцию.Кроме того, этот метод зависит от опыта врача, выполняющего процедуру.
Для большинства пациентов с раком желудка, ограниченным желудком и прилегающими лимфатическими узлами, хирурги должны удалить часть желудка вместе с опухолью. Это называется субтотальной (частичной) гастрэктомией. Если рак находится в верхней части желудка, иногда может потребоваться удаление части пищевода. Если рак находится в нижней части желудка, иногда может потребоваться удаление верхней части нижней части кишечника, называемой двенадцатиперстной кишкой.
Иногда хирурги должны удалить весь желудок и часть окружающих тканей. Это называется тотальной гастрэктомией. Чаще всего рекомендуется, когда рак распространился по желудку. Во время этой операции конец пищевода соединяется непосредственно с двенадцатиперстной кишкой, чтобы обеспечить прохождение пищи.
Распространенной частью операции по удалению части или всего желудка является удаление соседних лимфатических узлов. Эта часть операции может называться лимфаденопатией или лимфаденопатией.
Иногда химиотерапия или лучевая терапия могут проводиться до или после операции. Это называется неоадъювантной или адъювантной терапией. При использовании вместе с хирургическим вмешательством, химиотерапия может быть назначена до операции (неоадъювантная) для уменьшения опухоли или после операции (адъювантная терапия) для удаления любых оставшихся раковых клеток и снижения риска рецидива. Иногда химиотерапия может быть назначена до и после операции (в периоперационном периоде). Могут использоваться различные комбинации лекарств; это называется режимом химиотерапии.Когда назначается химиотерапия, конкретный режим химиотерапии может варьироваться. У разных медицинских центров могут быть свои предпочтения в отношении наилучшего подхода к лечению и того, какой режим химиотерапии лучше всего подходит для каждого человека.
5FU / лейковорин и оксалиплатин часто используются в качестве первой терапии для лечения рака желудка, который является местнораспространенным или распространился на другие части тела. Доцетаксел (Таксотер) одобрен для лечения аденокарциномы желудка или гастроэзофагеального перехода, которая прогрессирует у людей, которые не получали химиотерапию по поводу запущенного заболевания.
Лучевая терапия также может использоваться в качестве адъювантной терапии. Лучевая терапия – это использование высоких доз радиации для уничтожения раковых клеток и уменьшения размеров опухолей. Лучевая терапия преимущественно разрушает или повреждает быстро делящиеся клетки, в первую очередь раковые. Радиация проходит через пораженную ткань, чтобы разрушить раковые клетки, сводя к минимуму воздействие и повреждение нормальных клеток. Лучевая терапия разрушает раковые клетки, выделяя энергию, которая повреждает генетический материал клеток, предотвращая или замедляя их рост и репликацию.Лучевая терапия иногда назначается одновременно с химиотерапией (химиолучевой терапией). Например, при лечении рака желудочно-пищеводного перехода химиолучевую терапию часто проводят после операции.
Ликвидация инфекции H. pylori с помощью антибактериальных препаратов имеет важное значение.
ЦЕЛЕВЫЕ ТЕРАПИИ
Таргетные методы лечения нацелены на конкретную молекулу, белок или вещество, чтобы блокировать рост и распространение рака, а не уничтожать раковые клетки (цитотоксические методы лечения), такие как химиотерапия или лучевая терапия.Таргетная терапия с меньшей вероятностью повредит здоровые клетки. Есть несколько таргетных методов лечения, которые были одобрены Управлением по контролю за продуктами и лекарствами США (FDA) для лечения рака желудка.
В 2010 году FDA одобрило Герцептин (трастузумаб) вместе с химиотерапией для лечения рака желудка или гастроэзофагеального рака (аденокарциномы), который производит слишком много белка HER2 и имеет распространение (метастазирует). Пораженные люди должны еще не получать другого лечения метастатического заболевания.
В 2015 году FDA одобрило Цирамзу (рамуцирумаб) для лечения распространенного рака желудка или рака желудочно-пищеводного перехода, который не поддается лечению другими методами.
В 2017 году FDA предоставило ускоренное одобрение препарата Кейтруда (пембролизумаб) для лечения рака желудка или рака желудочно-пищеводного перехода, который является рецидивирующим и местно распространенным или распространился (метастатический). Он одобрен для больных, у которых рак имеет белок PD-1 и его состояние ухудшилось, несмотря на два или более других лечения.Пембролизумаб – это новый вид терапии, называемый иммунотерапией. Этот вид лечения направлен на усиление врожденной способности организма бороться с раковыми клетками с помощью иммунной системы. Например, наиболее распространенная форма иммунотерапии, называемая блокадой PD-1 или PD-L1, снимает «тормоза» иммунной системы, которые используются некоторыми видами рака, чтобы попытаться уклониться от иммунных клеток.
Совсем недавно, в 2021 году, FDA одобрило Opdivo (ниволумаб) в сочетании с некоторыми видами химиотерапии для начального лечения пациентов с запущенным или метастатическим раком желудка, раком желудочно-пищеводного перехода и аденокарциномой пищевода.Это первая одобренная FDA иммунотерапия для лечения рака желудка первой линии.
Симптомы и лечение рака желудка – Болезни и состояния
Рекомендуемые методы лечения рака желудка будут зависеть от вашего общего состояния здоровья и степени распространения рака.
В большинстве больниц работают многопрофильные бригады, состоящие из разных специалистов (см. Ниже), которые работают вместе, чтобы спланировать и провести наилучшее лечение с учетом ваших обстоятельств.
Не стесняйтесь обсуждать лечение со своей командой в любое время и задавать вопросы.
Ваш план лечения
Основными видами лечения рака желудка являются хирургия, химиотерапия и лучевая терапия. Вам может быть назначено одно из этих методов лечения или их комбинация.
Если рекомендовано хирургическое вмешательство, вы можете предварительно пройти курс химиотерапии. Если опухоль находится в верхней части желудка, включая соединение между пищеводом и желудком, вам также может быть назначена лучевая терапия перед операцией.
Хирургия в основном используется, если рак желудка диагностируется на ранней стадии, тогда как химиотерапия и лучевая терапия, как правило, используются, когда заболевание диагностируется на более поздней стадии.
По возможности, основной целью лечения является полное удаление опухоли и любых других раковых клеток в организме. Подсчитано, что излечение возможно в 20-30% случаев рака желудка.
Если опухоль удалить невозможно, врачи постараются не допустить, чтобы опухоль стала больше и не причиняла дальнейшего вреда вашему организму.Это можно сделать с помощью хирургического вмешательства или химиотерапии.
В некоторых случаях невозможно устранить рак или замедлить его развитие. В этом случае ваше лечение будет направлено на облегчение ваших симптомов и обеспечение максимального комфорта, обычно с помощью операции или лучевой терапии.
Относительно новый препарат под названием трастузумаб (см. Ниже) также может использоваться для лечения некоторых типов запущенного рака желудка.
Ваша медицинская бригада обсудит с вами наиболее подходящие методы лечения.
Хирургия
Если у вас диагностирован рак желудка на ранней стадии, возможно, он удастся полностью удалить во время операции.
В некоторых случаях можно провести тонкую гибкую трубку (эндоскоп) по пищеводу (пищеводу) вместо того, чтобы делать надрезы в животе. Это называется эндоскопической хирургией, и ее можно использовать для удаления образца опухоли для исследования (биопсии). Его также можно использовать для полного удаления опухоли, если рак желудка диагностирован на ранней стадии.
Однако, если рак распространился за пределы желудка, полностью удалить его может быть невозможно. Если это так, вам все равно может быть сделана операция по удалению любого рака, блокирующего ваш желудок, чтобы облегчить симптомы. Это будет зависеть от того, можно ли контролировать ваши симптомы, а также от рисков и побочных эффектов проведения серьезной операции.
Любая операция при раке желудка требует большой операции и длительного периода восстановления. Если у вас операция по поводу рака желудка, вам обычно нужно оставаться в больнице около 2 недель.Вам также понадобится несколько недель дома, чтобы выздороветь.
Операция по удалению желудка
Возможно, вам потребуется удалить часть или весь желудок.
Операция по удалению части желудка известна как частичная или субтотальная гастрэктомия, а операция по удалению всего желудка известна как полная гастрэктомия. В некоторых случаях хирург может удалить часть пищевода, а также весь желудок, используя процедуру, известную как эзофагогастрэктомия.
Эти операции могут выполняться с использованием либо большого разреза на животе (открытая операция), либо нескольких меньших разрезов, через которые можно провести хирургические инструменты (лапароскопическая операция или операция «замочная скважина»).Оба эти метода выполняются под общим наркозом, что означает, что вы будете без сознания на протяжении всей процедуры.
Во время этих операций ваш хирург также удалит лимфатические узлы (маленькие железы, которые помогают бороться с инфекцией), ближайшие к раку. Возможно, ваш рак желудка распространился на эти лимфатические узлы, и их удаление помогает предотвратить возвращение рака.
Частичная резекция желудка
Если ваш рак находится в нижней части желудка, вам может потребоваться частичная гастрэктомия, чтобы удалить его.
После операции ваш живот будет меньше, чем был до операции. Однако верхняя часть желудка, в которую впадает пищевод, не пострадает.
Тотальная гастрэктомия или эзофагогастрэктомия
Если ваш рак находится в средней или верхней части желудка, вам может потребоваться полная гастрэктомия. Если рак находится близко к концу пищевода, там, где он встречается с желудком, вам может потребоваться эзофагогастрэктомия.
Если у вас полная резекция желудка, конец пищевода будет соединен с верхушкой тощей кишки (верхняя часть тонкой кишки).Если у вас есть эзофагогастрэктомия, оставшаяся часть пищевода присоединится к тощей кишке.
Операция по облегчению симптомов
Если рак желудка распространился за пределы желудка, удалить его хирургическим путем может быть невозможно.
Однако, если ваш желудок серьезно пострадал от рака, он может вызвать закупорку, которая препятствует правильному перевариванию пищи. Заложенный желудок может вызывать такие симптомы, как боль в животе, рвота и чувство сытости после еды.
Если желудок заблокирован, есть несколько вариантов:
- стентирование – стент представляет собой трубку из пластмассы или проволочной сетки, вводимую через пищевод с помощью эндоскопа под местной анестезией; после установки стент расширяется и открывает желудок
- частичная или полная гастрэктомия – для устранения закупорки и улучшения симптомов
- шунтирование – операция, при которой часть желудка над блокировкой соединяется с тонкой кишкой, оставляя заблокированную часть желудка вне пищеварительной системы
Химиотерапия
Химиотерапия – это специальное лечение рака, при котором используются лекарства, называемые цитотоксическими лекарствами, для остановки деления и размножения раковых клеток.По мере того, как оно циркулирует по вашему телу, лекарство может нацеливаться на раковые клетки в вашем желудке и любые клетки, которые могли распространиться на другие части вашего тела.
Вы можете пройти химиотерапию рака желудка перед операцией, чтобы уменьшить количество рака, который необходимо удалить во время операции. Химиотерапию также можно использовать после операции, чтобы уничтожить оставшиеся раковые клетки и предотвратить рецидив рака.
Химиотерапия также может помочь замедлить прогрессирование рака и облегчить симптомы более запущенного рака желудка, который может не подходить для хирургического вмешательства.
If можно вводить перорально (в виде таблеток) или внутривенно (путем инъекции или капельного введения через вену непосредственно в кровоток) или их комбинации.
Внутривенная химиотерапия обычно проводится в больнице, а пероральная химиотерапия – дома. Химиотерапия часто проводится циклами, продолжительность каждого из которых составляет около трех недель.
В качестве альтернативы химиотерапия может вводиться через небольшую помпу, которая дает вам постоянную низкую дозу в течение нескольких недель или месяцев.Насосы портативны, и их можно носить дома, что означает меньшее количество поездок в больницу.
Побочные эффекты химиотерапии
Химиотерапия предотвращает быстрый рост раковых клеток. Однако он также разрушает незлокачественные клетки, такие как волосяные фолликулы, красные и белые кровяные тельца. Побочные эффекты могут включать:
- усталость
- тошнота и рвота
- повреждение нервов (периферическая невропатия)
- выпадение волос
- диарея
- анемия (недостаток эритроцитов)
- потеря веса
- изменения кожи, такие как покраснение, отек и покалывание в ладонях рук и / или подошвах ног
Побочные эффекты, которые вы испытываете после химиотерапии, будут зависеть от типа химиотерапии и количества необходимых вам сеансов лечения.Вам сообщат, к кому обратиться, если вы испытываете серьезные побочные эффекты от химиотерапии, и очень важно, чтобы эта контактная информация была тщательно записана.
Если вы испытываете тошноту и рвоту в результате химиотерапии, вы можете принять противозачаточные препараты, чтобы противостоять этому. Его можно вводить внутривенно (путем инъекции непосредственно в кровоток) одновременно с химиотерапией.
Побочные эффекты химиотерапии будут длиться до тех пор, пока длится ваш курс лечения.По окончании лечения волосяные фолликулы и клетки крови восстановятся. Это означает, что ваши волосы снова отрастут, хотя они могут выглядеть или ощущаться иначе, чем до химиотерапии (например, они могут быть немного другого цвета, мягче или вьющимися, чем раньше).
Радиотерапия
Радиотерапия использует лучи высокоэнергетического излучения для уничтожения раковых клеток. Его не часто используют для лечения рака желудка, потому что есть риск того, что другие органы, расположенные рядом с вашим желудком, могут быть повреждены в результате лечения.
Однако, если у вас запущенный рак желудка, вызывающий боль или кровотечение, вам может потребоваться лучевая терапия. В некоторых случаях после операции вам могут пройти химиотерапию и / или лучевую терапию, чтобы предотвратить рецидив рака желудка.
Если рак кровоточит медленно и вызывает анемию, можно использовать одну фракцию лучевой терапии, чтобы попытаться предотвратить дальнейшее кровотечение.
Если вам нужна лучевая терапия, ваше лечение обычно начинается через 2 или 3 месяца после операции или химиотерапии, чтобы дать вашему организму шанс выздороветь.Это безболезненная процедура, когда вы лежите под аппаратом лучевой терапии, пока он направляет излучение на ваш живот. Вас назначит рентгенолог (специалист по лучевой терапии), чтобы аппарат нацелился на раковые клетки и избегал как можно большего количества здоровых тканей.
Радиотерапия часто включает сеансы лечения 5 дней в неделю. Каждое занятие длится всего несколько минут. После этого излучение не остается в вашем организме, и в перерывах между процедурами находиться рядом с другими людьми совершенно безопасно.
Как долго вам понадобится лучевая терапия, будет зависеть от того, как она используется. Радиотерапия, используемая после операции для предотвращения рецидива рака желудка, обычно длится 5 недель. Если его используют для контроля симптомов прогрессирующего рака желудка, он может длиться всего 1-2 недели.
Побочные эффекты лучевой терапии
После лучевой терапии могут возникнуть следующие побочные эффекты:
- усталость
- тошнота
- диарея
- раздражение и потемнение кожи в месте лечения
Эти побочные эффекты обычно проходят в течение нескольких недель после окончания лечения.
Трастузумаб
Трастузумаб (продается под торговой маркой Герцептин) – это лекарство, используемое для лечения рака груди и некоторых случаев распространенного рака желудка.
Некоторые виды рака желудка стимулируются белком, который называется рецептором 2 эпидермального фактора роста человека (HER2). Трастузумаб блокирует действие этого белка. Это не лечит рак желудка, но может замедлить его рост и увеличить время выживания.
Если у вас диагностирован рак желудка на поздней стадии и анализы показывают высокий уровень белка HER2 в раковых клетках, ваши врачи могут порекомендовать лечение с использованием комбинации химиотерапии и трастузумаба.
Трастузумаб вводят внутривенно, капельно, и вам предстоит лечение в больнице. Каждый сеанс лечения занимает до 1 часа, и вам обычно требуется сеанс один раз в 3 недели.
Трастузумаб может вызывать побочные эффекты, в том числе проблемы с сердцем. Поэтому он может не подходить, если у вас проблемы с сердцем, такие как стенокардия, неконтролируемое высокое кровяное давление (гипертония) или заболевание сердечного клапана. Если вам нужно принять трастузумаб, вам также потребуются регулярные анализы сердца, чтобы проверять наличие каких-либо проблем.
Другие побочные эффекты трастузумаба могут включать:
- первая аллергическая реакция на лекарство, которая может вызвать тошноту, хрипы, озноб и жар
- диарея
- усталость
- боли
Симптомы, лечение и возможные причины
Рак желудка начинается, когда раковые клетки образуются во внутренней оболочке желудка. Эти клетки могут перерасти в опухоль. Заболевание, также называемое раком желудка, обычно медленно нарастает в течение многих лет.
Если вам известны симптомы, которые он вызывает, вы и ваш врач можете обнаружить его на ранней стадии, когда легче всего вылечить.
Что вызывает рак желудка?
Ученые точно не знают, что заставляет раковые клетки расти в желудке. Но они знают несколько вещей, которые могут повысить риск заболевания. Один из них – это заражение распространенной бактерией H. pylori , вызывающей язвы. Воспаление кишечника, называемое гастритом, определенный тип хронической анемии, называемой злокачественной анемией, и новообразования в желудке, называемые полипами, также могут повысить вероятность заболевания раком.
Другие факторы, которые, по-видимому, играют роль в повышении риска, включают:
- Курение
- Избыточный вес или ожирение
- Диета с высоким содержанием копченой, маринованной или соленой пищи
- Операция на желудке при язве
- Тип- A Кровь
- Инфекция вируса Эпштейна-Барра
- Определенные гены
- Работа в угольной, металлургической, лесной или резиновой промышленности
- Воздействие асбеста
Симптомы
Рак желудка на ранней стадии может вызвать:
Просто несварение желудка или изжога после еды не означает, что у вас рак.Но если вы часто чувствуете эти симптомы, поговорите со своим врачом. Они могут увидеть, есть ли у вас другие факторы риска, и протестировать вас на предмет каких-либо проблем.
По мере роста опухоли желудка у вас могут появиться более серьезные симптомы, такие как:
Получение диагноза
Врачи обычно не проводят плановых обследований на рак желудка. Это в основном потому, что это не так часто, поэтому дополнительные тесты часто бесполезны.
Если вы подвержены более высокому риску этого заболевания, поговорите со своим врачом, чтобы узнать, как следить за этим.Вы можете пройти те же тесты, что и если бы у вас были симптомы и вы искали диагноз.
Чтобы выяснить, есть ли у вас рак желудка, врач начинает с медицинского осмотра. Они также спросят о вашей истории болезни, чтобы узнать, есть ли у вас какие-либо факторы риска рака желудка или у кого-либо из членов семьи, у которых он был. Затем они могут дать вам несколько тестов, в том числе:
- Анализы крови , чтобы найти признаки рака в вашем теле.
- Верхняя эндоскопия .Ваш врач вставит вам в горло тонкую гибкую трубку с маленькой камерой, чтобы заглянуть в ваш желудок.
- Тест серии Upper GI . Вы выпьете меловую жидкость с веществом под названием барий. Жидкость покрывает ваш желудок и делает его более четким на рентгеновских снимках.
- КТ . Это мощный рентгеновский снимок, который делает подробные снимки внутренней части вашего тела.
- Биопсия . Врач берет небольшой кусочек ткани вашего желудка, чтобы посмотреть под микроскопом на наличие признаков раковых клеток.Они могут сделать это во время эндоскопии.
Лечение
Многие методы лечения могут помочь в борьбе с раком желудка. То, что вы выберете и ваш врач, будет зависеть от того, как долго вы страдаете заболеванием или насколько оно распространилось по вашему телу, что называется стадией вашего рака:
Стадия 0. Это когда внутренняя оболочка вашего В желудке есть группа нездоровых клеток, которые могут перерасти в рак. Обычно это лечит хирургическое вмешательство. Врач может удалить часть или весь желудок, а также близлежащие лимфатические узлы – небольшие органы, которые являются частью системы борьбы с микробами вашего тела.
Стадия I. На данный момент у вас опухоль в слизистой оболочке желудка, которая, возможно, распространилась на ваши лимфатические узлы. Как и на стадии 0, вам, скорее всего, предстоит операция по удалению части или всего желудка и близлежащих лимфатических узлов. Вы также можете пройти химиотерапию или химиолучевую терапию. Эти методы лечения можно использовать до операции, чтобы уменьшить опухоль, а после нее убить любой оставшийся рак.
Химиотерапия использует лекарства для поражения раковых клеток. Химиолучевая терапия – это химиотерапия плюс лучевая терапия, которая разрушает раковые клетки лучами высокой энергии.
II этап. Рак распространился на более глубокие слои желудка и, возможно, на близлежащие лимфатические узлы. Основным лечением по-прежнему является операция по удалению части или всего желудка, а также близлежащих лимфатических узлов. Вы, скорее всего, получите химиотерапию или химиолучевую терапию заранее, а также можете пройти одну из них после.
III этап. Рак теперь может быть во всех слоях желудка, а также в других близлежащих органах, таких как селезенка или толстая кишка. Или он может быть меньше, но проникать глубоко в лимфатические узлы.
Обычно вам делают операцию по удалению всего желудка, а также химиотерапию или химиолучевую терапию. Иногда это может вылечить. В противном случае это может, по крайней мере, помочь с симптомами.
Если вы слишком больны для операции, вы можете пройти курс химиотерапии, лучевой терапии или и то, и другое, в зависимости от того, с чем может справиться ваше тело.
IV этап. На этой последней стадии рак широко распространился на такие органы, как печень, легкие или мозг. Вылечить это намного сложнее, но ваш врач может помочь вам справиться с этим и облегчить симптомы.
Если опухоль блокирует часть вашей желудочно-кишечной системы, вы можете получить:
- Процедура, при которой часть опухоли разрушается с помощью лазера на эндоскопе, тонкой трубке, которая скользит по горлу.
- Тонкая металлическая трубка, называемая стентом, поддерживающая поток. Вы можете получить один из них между желудком и пищеводом или между желудком и тонкой кишкой.
- Операция обходного желудочного анастомоза для создания обходного пути вокруг опухоли.
- Операция по удалению части желудка.
На этом этапе также можно использовать химию, облучение или и то, и другое. Вы также можете пройти таргетную терапию. Эти препараты атакуют раковые клетки, но оставляют в покое здоровые, что может означать меньше побочных эффектов.
Как предотвратить рак желудка?
Лечение желудочных инфекций. Если у вас есть язвы, вызванные инфекцией H. pylori , обратитесь за лечением. Антибиотики могут убить бактерии, а другие лекарства залечивают язвы на слизистой оболочке желудка, снижая риск рака.

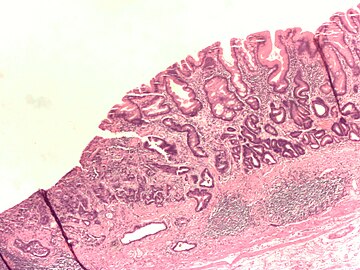
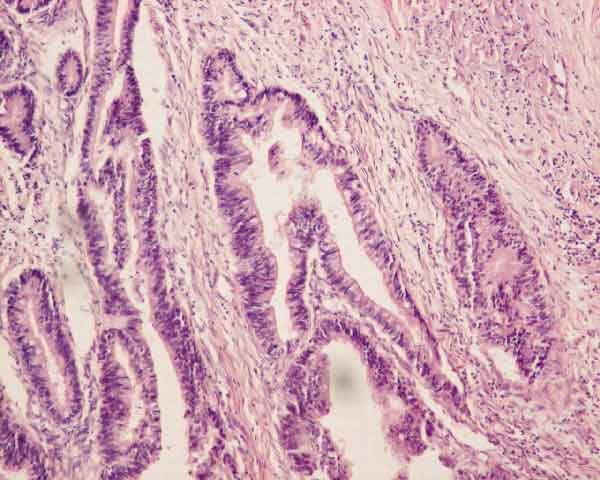
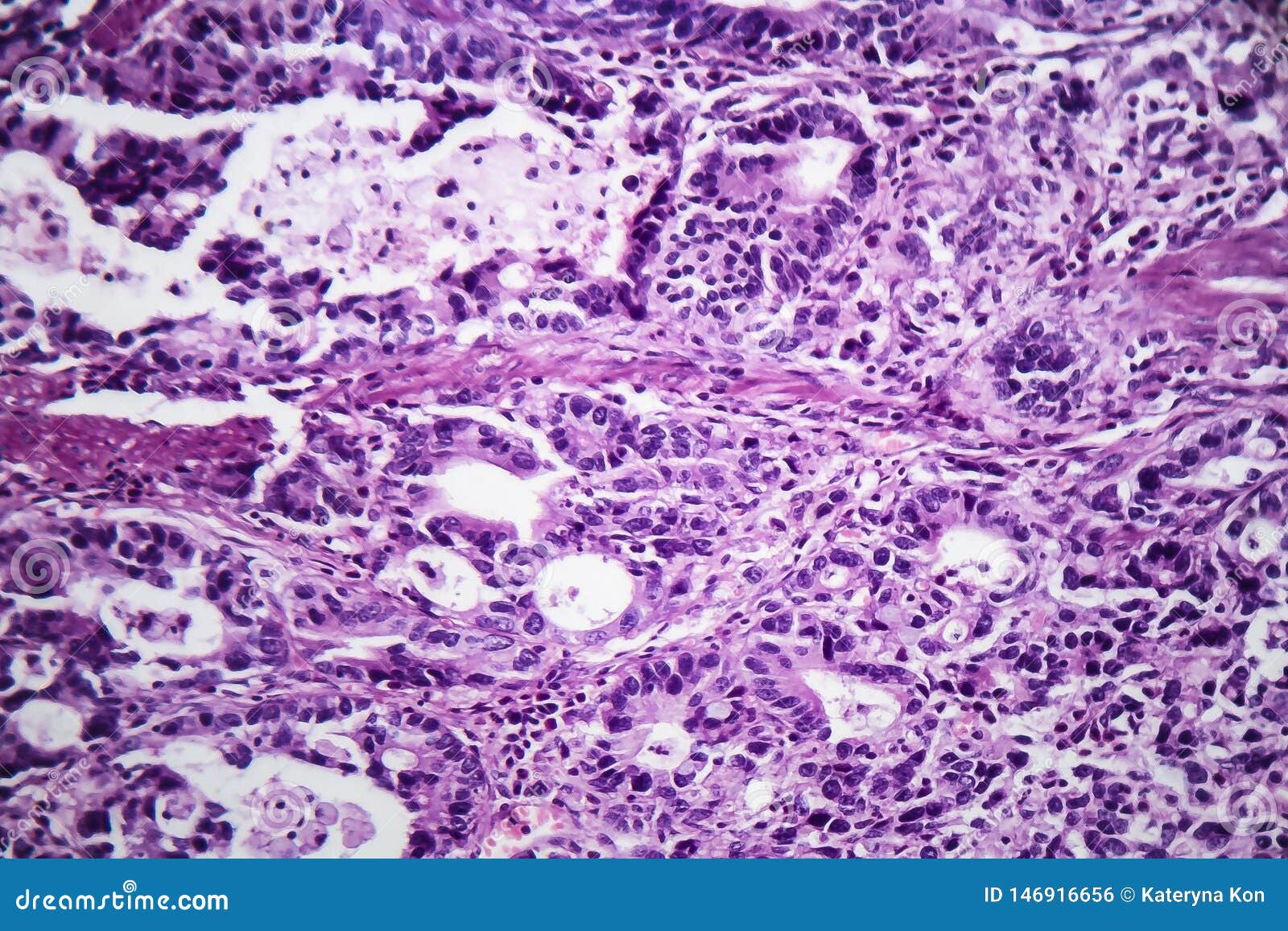
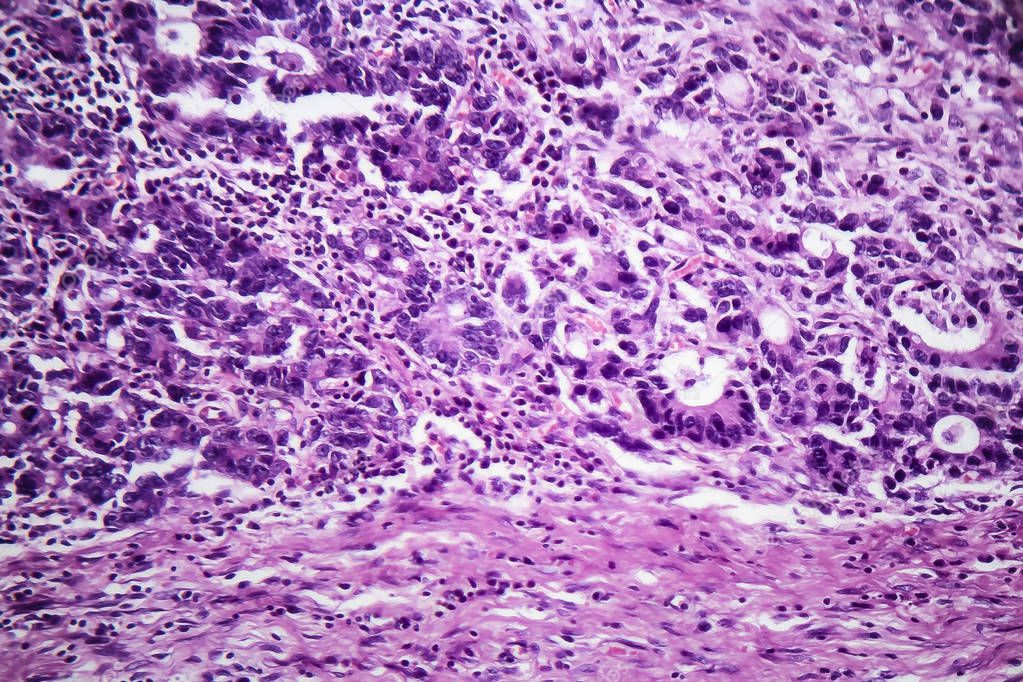
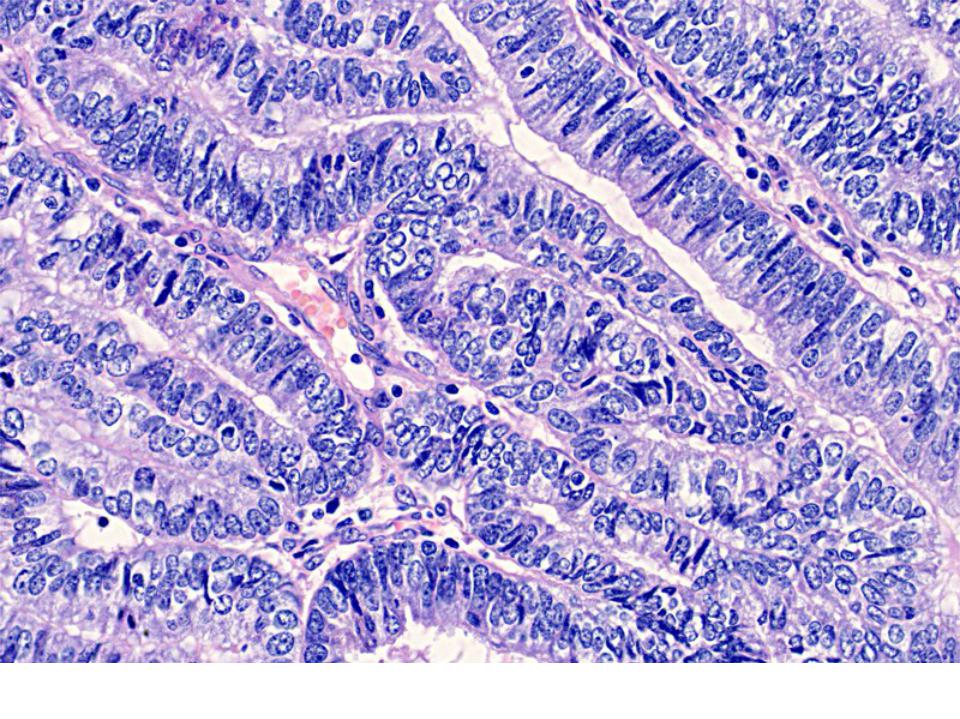
 Это наиболее злокачественный тип рака желудка. Характеризуется быстрым ростом и метастазированием.
Это наиболее злокачественный тип рака желудка. Характеризуется быстрым ростом и метастазированием.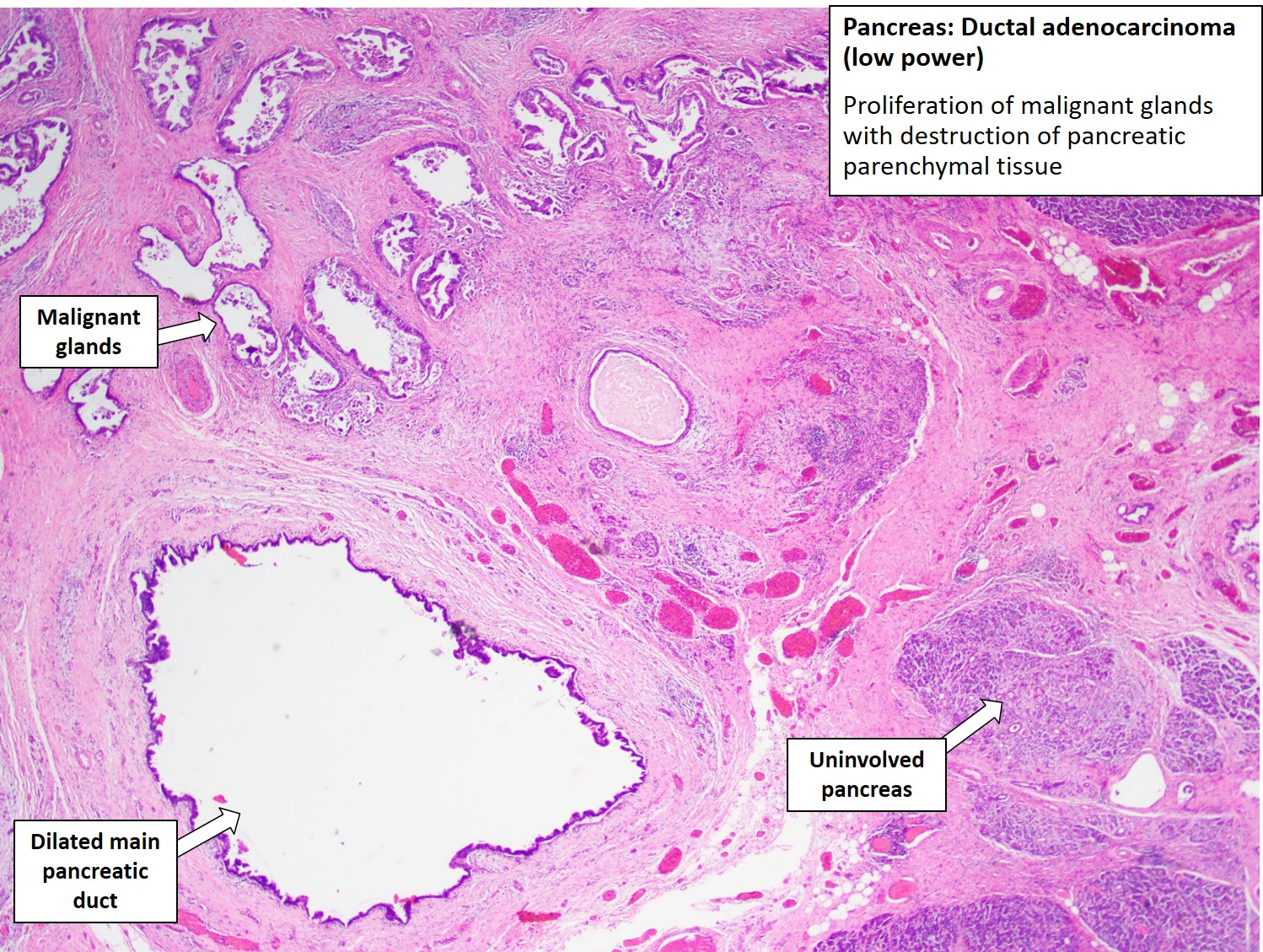 С его помощью производится визуальный осмотр слизистой оболочки желудка, причем прибор транслирует увеличенное изображение исследуемого участка на монитор, что позволяет обнаружить незначительные изменения слизистой. Во-вторых, эндоскоп оснащен специальной манипуляционной системой, с помощью которой можно взять кусочек ткани на гистологический анализ и точно определить вид опухоли и степень дифференцировки ее клеток.
С его помощью производится визуальный осмотр слизистой оболочки желудка, причем прибор транслирует увеличенное изображение исследуемого участка на монитор, что позволяет обнаружить незначительные изменения слизистой. Во-вторых, эндоскоп оснащен специальной манипуляционной системой, с помощью которой можно взять кусочек ткани на гистологический анализ и точно определить вид опухоли и степень дифференцировки ее клеток.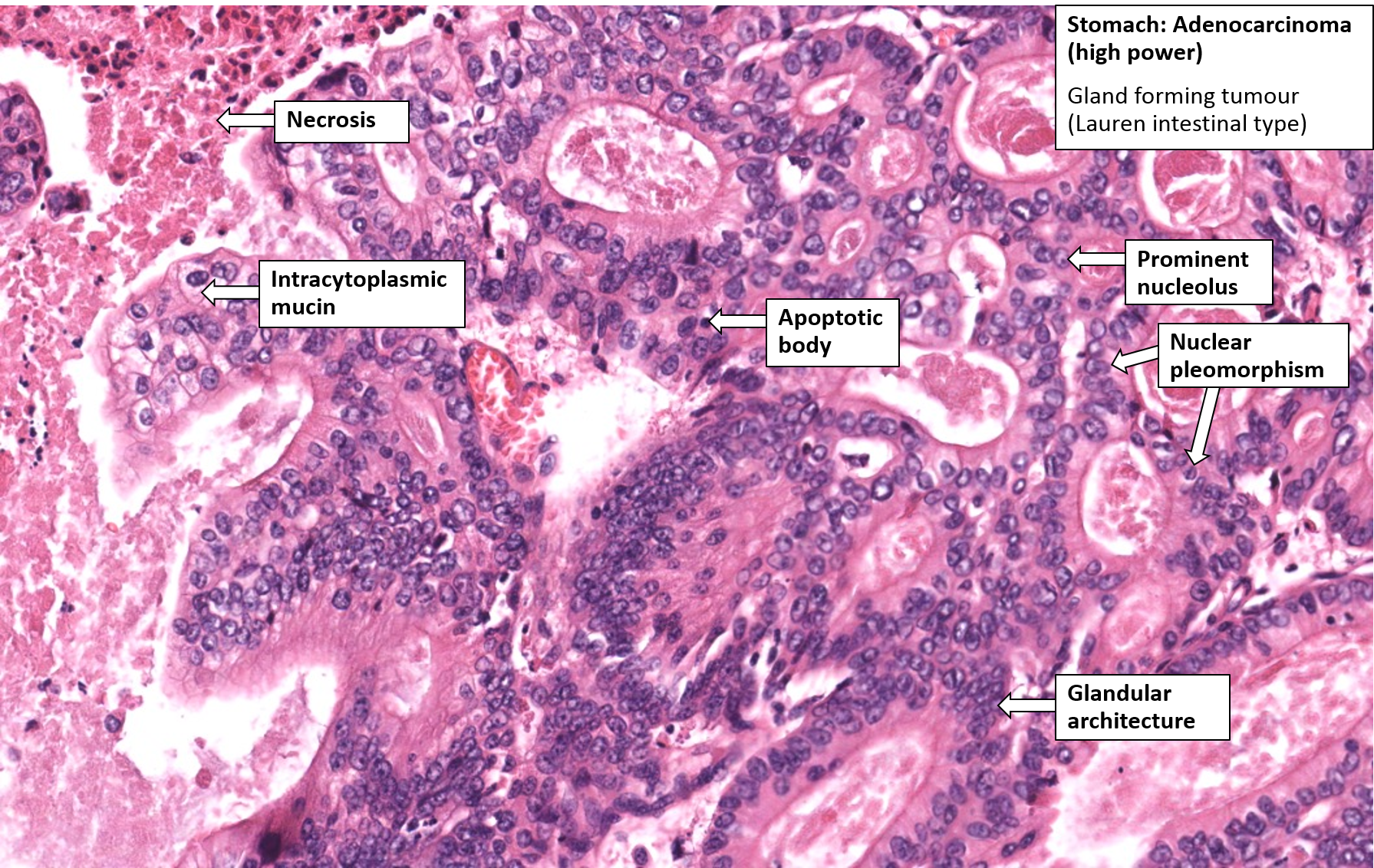 После операции уровень онкомаркеров должен снизиться, он может достичь нормы. При возникновении рецидива или прогрессирования заболевания, он будет опять нарастать.
После операции уровень онкомаркеров должен снизиться, он может достичь нормы. При возникновении рецидива или прогрессирования заболевания, он будет опять нарастать.