Антибиотики для желудочно кишечного тракта: Аптека Ригла – забронировать лекарства в аптеке и забрать самовывозом по низкой цене в Москва г.
Как антибиотики влияют на микрофлору кишечника
Оглавление
Антибиотики спасли огромное количество человеческих жизней по всему миру, они необходимы для лечения и профилактики широкого спектра опасных бактериальных инфекций. Однако микрофлора после антибиотиков подвержена их влиянию, что говорит о сопряжении этих препаратов с рядом негативных для человека последствий [1-5].
Реакция микрофлоры
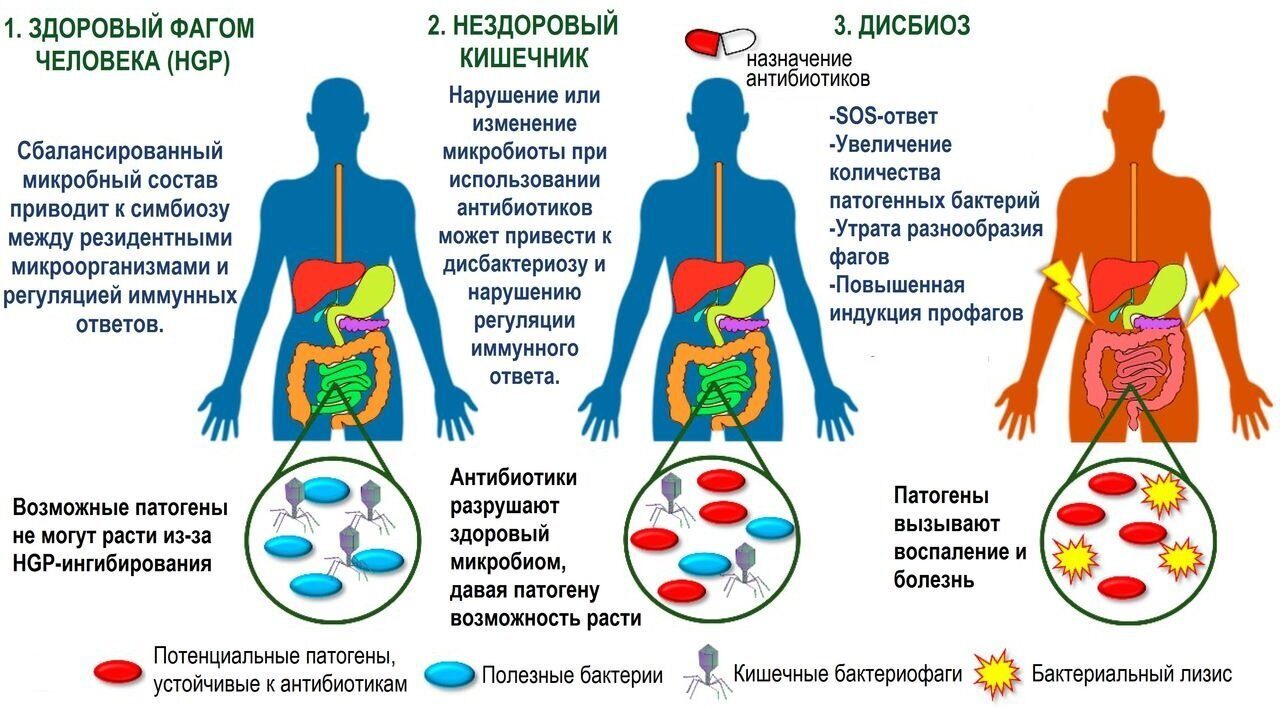
Применение антибиотиков может вызвать дисбактериоз, то есть нарушение нормального состава и функций кишечной микрофлоры. Антибиотики широкого спектра действия, эффективные по отношению к множеству различных бактерий, могут поражать до 30% бактерий, в норме заселяющих желудочно-кишечный тракт [1].
Даже недельный курс антибиотиков приводит к тому, что на восстановление микрофлоры после антибиотиков может потребоваться от 6 месяцев до 2 лет после окончания их приёма [2].
Сложные соединения, которые содержатся в антибиотике, действуют на возбудителя бактериальной инфекции, разрушая клеточную стенку, повреждая ядро. Вирусные заболевания антибиотиками не лечат — у вируса, в отличие от микроба, есть только РНК и ДНК.
Влияние антибиотикотерапии
Измененная под действием антибиотиков микрофлора не может выполнять свои жизненно важные функции, такие как пищеварительная, синтетическая и др. [3] Последствия нарушения этих функций затрагивают весь организм. К дисбиозопосредованным состояниям относят:
- диабет
- ожирение
- бронхиальную астму
При нарушении баланса микрофлоры повышается риск развития инфекционных заболеваний [1].
Но самыми частыми нежелательными реакциями на фоне применения антибиотиков, являются нарушения со стороны желудочно-кишечного тракта. У пациентов отмечается раздражённый кишечник, тошнота, рвота, боли в животе, диарея [4]. Именно диарея является наиболее частым из негативных последствий приема антибиотиков, для неё существует специальный термин – «антибиотикоассоциированная диарея» [5].
Антибиотики являются причиной каждого 4-го случая диареи, вызванной приемом лекарственных средств [4].
Антибиотикоассоциированная диарея – это не связанная с другими причинами диарея, определяемая как 3 и более эпизодов неоформленного стула в течение минимум 2 дней подряд, резвившаяся на фоне применения антибиотиков [4].
С чего начинать лечение кишечника
Для профилактики и терапии ААД рекомендуется поддержание и восстановление баланса микрофлоры при помощи специальных препаратов [4].
Существуют препараты, которые оказывают влияние на функции кишечной микрофлоры — метабиотики. Они содержат аналоги продуктов метаболизма кишечных бактерий, которые практически в полном составе могут достигать цели. Один из метабиотиков — препарат нового поколения Актофлор-С.
Его действие направлено на стимуляцию роста собственной полезной микрофлоры кишечника и её физиологической активности, тем самым препарат способствует предотвращению побочных эффектов приема антибиотиков и может назначаться с первого дня их применения [6]. Актофлор-с легко принимать а его компоненты не создают дополнительной микробной нагрузки на микрофлору.
Актофлор-с легко принимать а его компоненты не создают дополнительной микробной нагрузки на микрофлору.
Список литературы:
1. Francino M. P. Antibiotics and the human gut microbiome: dysbioses and accumulation of resistances //Frontiers in microbiology. – 2016. – Т. 6. – С. 1543
2. Jernberg, C. et al. Long-term ecological impacts of antibiotic administration on the human intestinal microbiota / C. Jernberg et al. // The ISME journal. – 2007. – Vol. 1, № 1. – P. 56-66.
3. Guarner F, Malagelada J-R. Gut flora in health and disease. Lancet, 2003, 361: 512-9. doi:10.1016/S0140-6736(03)12489-0.
4. Захаренко С. М., Андреева И. В., Стецюк О. У. Нежелательные лекарственные реакции со стороны ЖКТ и антибиотикоассоциированная диарея при применении антибиотиков в амбулаторной практике: профилактика и лечение //Клиническая микробиология и антимикробная химиотерапия. – 2019. – Т. 21. – №. 3.
5. McFarland, L. V. (2009). Evidence-based review of probiotics for antibiotic-associated diarrhea and Clostridium difficile infections. Anaerobe, 15(6), 274–280.
Anaerobe, 15(6), 274–280.
6. Согласно инструкции по применению препарата Актофлор-С.
Антибиотик-индуцированные изменения микробиома желудочно-кишечного тракта и их коррекция | Усенко Д.В.
Широкое применение антибиотиков в течение последних 80 лет спасло миллионы человеческих жизней, однако явилось причиной антибиотико-ассоциированного нарушения микробиома человека. Помимо формирования антибиотикорезистентных штаммов микроорганизмов применение антибиотиков в значительной степени разрушает экологию микробиома человека. Дисбиотически измененный микробиом не может выполнять жизненно важные функции, такие как пищеварительная, синтетическая, а также обеспечение колонизационной резистентности и регуляции иммунной системы организма. В настоящем обзоре обобщены современные исследования о краткосрочных и долгосрочных последствиях воздействия антибиотиков на организм, а также возможностях применения пробиотиков для их нивелирования.
антибиотико-ассоциированная диарея (ААД). Описаны возможности профилактики ААД, включающие наряду с рациональной антибиотикотерапией использование эубиотиков — пре- и пробиотиков.
Ключевые слова: антибиотики, пробиотики, дети, Lactobacillus GG, микробиом, желудочно-кишечный тракт, микробиота.
Для цитирования: Усенко Д.В. Антибиотик-индуцированные изменения микробиома желудочно-кишечного тракта и их коррекция. РМЖ. 2018;2(ll):96-99.
Antibiotic-induced changes in the microbiota of the gastrointestinal tract and their correctionUsenko D.
 V.
V.Central Research Institute of Epidemiology of The Federal Service on Customers’ Rights Protection and Human Well-being Surveillance, Moscow
The widespread use of antibiotics in the last 80 years has saved millions of human lives, but it has caused another important problem — antibiotic-associated violations of human microbiome. In addition to the formation of antibiotic-resistant strains of microorganisms, the use of antibiotics significantly destroys the ecology of the human microbiome. Microbiome with dysbiotic changes can not perform the vital functions, such as digestive, synthetic, as well as providing colonization resistance and regulation of the body’s immune system. This review summarizes current studies of the short-term and long-term effects of antibiotic use, as well as the possibilities of using probiotics for their correction. Probiotics are living microorganisms, mostly the representatives of obligate human microflora, which, when ingested into the gastrointestinal tract of a person in sufficient quantity, retain their activity, vitality and have a positive impact on human health.
Key words: antibiotics, probiotics, children, lactobacillus GG, microbiome, gastrointestinal tract, microbiota.
For citation: Usenko D.V. Antibiotic-induced changes in the microbiota of the gastrointestinal tract and their correction //
RMJ. 2018. № 2(II). P. 96–99.
Статья посвящена проблеме антибиотик-индуцированных изменений микробиома желудочно-кишечного тракта и их коррекции. Обобщены современные исследования о краткосрочных и долгосрочных последствиях воздействия антибиотиков на организм, а также возможностях применения пробиотиков для их нивелирования. Подробно рассмотрено негативное последствие антибактериальной терапии — антибиотико-ассоциированная диарея.
Введение
В течение последних двух десятилетий микробиота кишечника была признана фундаментальным «игроком», который отвечает как за течение физиологических процессов, так и за развитие патологических состояний человека. Триллионы бактерий, обитающие в желудочно-кишечном тракте (ЖКТ) человека, формируют его микробиом, несущий в себе огромный генетический материал [1]. Невозможно отделить геном человека и регулируемые им физиологические процессы от генома микробиоты, вместе формирующих метагеном. Это означает, что хозяин может выполнять функции, которые не кодируются собственным геномом: комменсалы защищают от инвазии патогенов, регулируют извлечение энергии из пищи, синтезируют ключевые молекулы для развития тканей, при этом их видовой состав четко ассоциирован с конкретным отделом ЖКТ [2–4].Состав микробиоты ЖКТ
В настоящее время определены 4 основные филы, охватывающие более 90% общей популяции бактерий, присутствующих в ЖКТ, а именно: Firmicutes, Bacteroidetes, Actinobacteria, Proteobacteria, и многие дополнительные незначительные филы, включая Verrucomicrobia и Fusobacteria. Фила Firmicutes состоит в основном из грамположительных, аэробных и анаэробных бактерий. Ее ключевыми представителями являются бактерии Clostridia, в числе которых присутствуют как полезные (например, C. scindens, кластер IV–XIVa), так и потенциально патогенные (например, C. difficile, C. perfrigens) виды. Потенциально патогенные стрептококки, энтерококки и стафилококки также относятся к филе Firmicutes. Bacteroidetes
Фила Firmicutes состоит в основном из грамположительных, аэробных и анаэробных бактерий. Ее ключевыми представителями являются бактерии Clostridia, в числе которых присутствуют как полезные (например, C. scindens, кластер IV–XIVa), так и потенциально патогенные (например, C. difficile, C. perfrigens) виды. Потенциально патогенные стрептококки, энтерококки и стафилококки также относятся к филе Firmicutes. Bacteroidetes coli и K. pneumoniae. В норме их не очень много, но при дисбактериозе их количество увеличивается.
coli и K. pneumoniae. В норме их не очень много, но при дисбактериозе их количество увеличивается.
Антибиотики и микробиота
По мере накопления знаний о составе и функциях микробиоты ЖКТ стало очевидно, что помимо большого числа внешних факторов, приводящих к снижению концентрации ее нормальных обитателей, существенно большее негативное влияние на микробиоту оказывают антибактериальные препараты. Открытие пенициллина, а в последующем и новых групп антимикробных препаратов радикально изменило подходы к лечению инфекционных заболеваний и его результаты. Ученые и врачи в конце 1960-х гг. уже предвидели победу в борьбе с инфекционными болезнями благодаря появлению антибиотиков и развитию вакцинации. В своем выступлении в конгрессе США в 1969 г. президент Международной ассоциации хирургов Вильям Стюарт заявил: «Учитывая достижения антибактериальной терапии и программ вакцинации, в ближайшее время можно будет закрыть книгу инфекционных болезней…». Сегодня мы прекрасно понимаем ошибочность данных оценок. Приходится констатировать, что возможности контроля над микробным сообществом снижаются. Патогенные микроорганизмы приобрели генетическую устойчивость к широкому спектру антибиотиков вследствие их избыточного и неконтролируемого применения.
Приходится констатировать, что возможности контроля над микробным сообществом снижаются. Патогенные микроорганизмы приобрели генетическую устойчивость к широкому спектру антибиотиков вследствие их избыточного и неконтролируемого применения.Помимо формирования антибиотикорезистентных штаммов микроорганизмов применение антибиотиков в значительной степени разрушает экологию микробиома человека. Дисбиотически измененный микробиом не может выполнять жизненно важные функции, такие как пищеварительная, синтетическая, а также обеспечение колонизационной резистентности и регуляции иммунной системы организма [3]. Влияние этих процессов выходит далеко за пределы ЖКТ, а спектр патологических состояний и дисбиоз-опосредованных состояний включает метаболические (ожирение, диабет 1 и 2 типа), иммунологические (атопический дерматит, бронхиальная астма) заболевания, а также повышенную восприимчивость к развитию инфекционных заболеваний (повышенный риск развития Clostridium difficile-обусловленных заболеваний, Pseudomonas aeruginosa, Klebsiella oxytoca, Staphylococcus aureus, а также Candida) [4].
 Необходимо понимать, что все эти последствия являются непреднамеренными результатами применения антибиотиков, а следовательно, требуют проведения дополнительных мероприятий по их коррекции и предотвращению.
Необходимо понимать, что все эти последствия являются непреднамеренными результатами применения антибиотиков, а следовательно, требуют проведения дополнительных мероприятий по их коррекции и предотвращению.
Антибиотико-ассоциированная диарея
Наиболее частым и клинически значимым негативным последствием антибактериальной терапии принято считать антибиотико-ассоциированную диарею (ААД). Выраженность симптомокомплекса, развившегося на фоне антибиотикотерапии, может варьировать от незначительного преходящего интестинального дискомфорта до тяжелых форм диареи и колита [5–7].
Практически все антибактериальные препараты, особенно активные в отношении анаэробов, способны вызывать ААД. По данным L. McFarland [8], ААД встречается в 5–10% случаев при применении ампициллина, в 10–25% — цефалоспоринов II поколения и лишь в 2–5% случаев — при использовании других антибактериальных препаратов, таких как тетрациклин, макролиды (эритромицин), нитрофурантоин, ко-тримоксазол, фторхинолоны, аминогликозиды (канамицин, гентамицин).
 Было показано, что у больных, в терапии которых использовались ампициллин и амоксициллин/клавуланат, ААД наблюдалась в 5–10 и 10–25% случаев соответственно. При этом на вероятность развития ААД не влияет способ введения препарата. К примеру, при пероральном приеме наряду с влиянием на кишечную микрофлору антибиотики оказывают местное воздействие — непосредственно на слизистую оболочку тонкой кишки; при парентеральном введении антибактериальные препараты воздействуют на микробиоценоз кишечника, выделяясь со слюной, желчью, секретом тонкой и толстой кишки. Существенно повышают риск развития ААД увеличение длительности антибактериальной терапии и проведение ее повторных курсов, комбинация нескольких препаратов, а также использование антибиотиков, выводящихся с желчью. Особенно риск развития ААД возрастает при проведении антибактериальной терапии в педиатрической практике. Так, по данным анкетирования 16 200 пациентов, получавших антибиотики, чаще всего ААД наблюдалась у новорожденных и детей до 5 лет (24%), что подчеркивает важность поддержания микрофлоры ЖКТ у детей в процессе терапии антибактериальными средствами.
Было показано, что у больных, в терапии которых использовались ампициллин и амоксициллин/клавуланат, ААД наблюдалась в 5–10 и 10–25% случаев соответственно. При этом на вероятность развития ААД не влияет способ введения препарата. К примеру, при пероральном приеме наряду с влиянием на кишечную микрофлору антибиотики оказывают местное воздействие — непосредственно на слизистую оболочку тонкой кишки; при парентеральном введении антибактериальные препараты воздействуют на микробиоценоз кишечника, выделяясь со слюной, желчью, секретом тонкой и толстой кишки. Существенно повышают риск развития ААД увеличение длительности антибактериальной терапии и проведение ее повторных курсов, комбинация нескольких препаратов, а также использование антибиотиков, выводящихся с желчью. Особенно риск развития ААД возрастает при проведении антибактериальной терапии в педиатрической практике. Так, по данным анкетирования 16 200 пациентов, получавших антибиотики, чаще всего ААД наблюдалась у новорожденных и детей до 5 лет (24%), что подчеркивает важность поддержания микрофлоры ЖКТ у детей в процессе терапии антибактериальными средствами. Несмотря на то, что в большинстве случаев инфекционный агент остается неустановленным, микробиологические исследования показали связь ААД с различными микроорганизмами, такими как Clostridium difficile, Pseudomonas aeruginosa, Klebsiella oxytoca, Staphylococcus aureus, а также грибы рода Candida [9, 10]. Однако наиболее тяжелые формы ААД, в частности псевдомембранозный колит, обусловлены воздействием C. difficile. Наряду с вышеуказанными микроорганизмами причиной ААД могут выступать и другие микробы. Так, J. Boyce et al. сообщают о том, что метициллинрезистентные штаммы S. аureus могут вызывать нозокомиальную ААД, что обусловлено их способностью продуцировать энтеротоксин [11]. В большинстве (до 80%) случаев диарея на фоне антибактериальной терапии имеет неинфекционную природу. И лишь в 15–20% случаев этиологическими факторами являются C. difficile, Clostridium perfringens, S. aureus, K. oxytoca, Candida spp. и Salmonella.
Несмотря на то, что в большинстве случаев инфекционный агент остается неустановленным, микробиологические исследования показали связь ААД с различными микроорганизмами, такими как Clostridium difficile, Pseudomonas aeruginosa, Klebsiella oxytoca, Staphylococcus aureus, а также грибы рода Candida [9, 10]. Однако наиболее тяжелые формы ААД, в частности псевдомембранозный колит, обусловлены воздействием C. difficile. Наряду с вышеуказанными микроорганизмами причиной ААД могут выступать и другие микробы. Так, J. Boyce et al. сообщают о том, что метициллинрезистентные штаммы S. аureus могут вызывать нозокомиальную ААД, что обусловлено их способностью продуцировать энтеротоксин [11]. В большинстве (до 80%) случаев диарея на фоне антибактериальной терапии имеет неинфекционную природу. И лишь в 15–20% случаев этиологическими факторами являются C. difficile, Clostridium perfringens, S. aureus, K. oxytoca, Candida spp. и Salmonella.До настоящего времени нет единого мнения о длительности сохранения нарушений микробиоты после применения антибиотиков.
 Недавние исследования показали, что последствия применения некоторых антибиотиков имеют долгосрочный характер для фекальной микрофлоры [12–15]. Например, применение клиндамицина приводило к снижению разнообразия Bacteroides в образцах фекалий, росту числа антибиотикоустойчивых клонов Bacteroides, в частности В. thetaiotamicron, а также к сохраняющемуся на протяжении как минимум 2-х лет персистированию гена erm (B) (эритромицинрезистентной метилазы) и к возможности не только формирования клона резистентных штаммов, но и его горизонтальной передачи другим бактериям. После применения ципрофлоксацина изменения состава микробиоты ЖКТ регистрировались на протяжении как минимум 6 мес.
Недавние исследования показали, что последствия применения некоторых антибиотиков имеют долгосрочный характер для фекальной микрофлоры [12–15]. Например, применение клиндамицина приводило к снижению разнообразия Bacteroides в образцах фекалий, росту числа антибиотикоустойчивых клонов Bacteroides, в частности В. thetaiotamicron, а также к сохраняющемуся на протяжении как минимум 2-х лет персистированию гена erm (B) (эритромицинрезистентной метилазы) и к возможности не только формирования клона резистентных штаммов, но и его горизонтальной передачи другим бактериям. После применения ципрофлоксацина изменения состава микробиоты ЖКТ регистрировались на протяжении как минимум 6 мес.Нарушение метаболической активности облигатной микрофлоры, а также ее количественный дефицит сопровождаются формированием различных нарушений пищеварения, в первую очередь переваривания углеводов, что обусловливает развитие осмотической диареи с потерей больших объемов жидкости.
 Параллельно с этим снижается синтез нормальными представителями микрофлоры ЖКТ короткоцепочечных жирных кислот, что приводит к уменьшению абсорбции жидкости и электролитов колоноцитами. Метаболическая концепция неинфекционной ААД, развившейся в 1–3-и сут от начала лечения, может быть подтверждена спонтанным купированием симптомов в течение 2 дней после отмены антибиотиков.
Параллельно с этим снижается синтез нормальными представителями микрофлоры ЖКТ короткоцепочечных жирных кислот, что приводит к уменьшению абсорбции жидкости и электролитов колоноцитами. Метаболическая концепция неинфекционной ААД, развившейся в 1–3-и сут от начала лечения, может быть подтверждена спонтанным купированием симптомов в течение 2 дней после отмены антибиотиков.ААД, возникшая в более поздние сроки, в большинстве случаев имеет инфекционную природу и, по всей видимости, обусловлена колонизацией кишечника условно-патогенными штаммами бактерий. Из инфекционных причинно-значимых агентов ААД диареи наиболее серьезным и опасным является Clostridium difficile. По данным зарубежных авторов, диарея, обусловленная Clostridium difficile, составляет 30% всех ААД, 50–75% антибиотико-ассоциированных колитов [16, 17]. Практически все случаи псевдомембранозного колита обусловлены данным микроорганизмом. Несмотря на относительно низкое носительство С.
 difficile в популяции здорового населения (не более 3%), частота обнаружения данного микроорганизма у пациентов, получающих антибиотики, возрастает до 20%. Как показали данные L. McFarlanda, это связано с экзогенным инфицированием пациентов, а не с активацией микроба при асимптоматическом носительстве бактерий. Наиболее высокий показатель выявления клостридий данного вида регистрируется у новорожденных, хотя и протекает без клинической манифестации, что, по всей видимости, обусловлено отсутствием у них на слизистой оболочке ЖКТ рецепторов к токсинам возбудителей.
difficile в популяции здорового населения (не более 3%), частота обнаружения данного микроорганизма у пациентов, получающих антибиотики, возрастает до 20%. Как показали данные L. McFarlanda, это связано с экзогенным инфицированием пациентов, а не с активацией микроба при асимптоматическом носительстве бактерий. Наиболее высокий показатель выявления клостридий данного вида регистрируется у новорожденных, хотя и протекает без клинической манифестации, что, по всей видимости, обусловлено отсутствием у них на слизистой оболочке ЖКТ рецепторов к токсинам возбудителей. У 15–35% пациентов после первого эпизода С. difficile-ассоциированной диареи наблюдаются рецидивы инфекции, которые связаны с длительным персистированием в кишечнике спор возбудителя или реинфекцией новым штаммом. Исследования последних лет показывают, что восприимчивость к этой инфекции в значительной мере определяется характером иммунного ответа макроорганизма на токсины, продуцируемые С. difficile.

На сегодняшний день установлено, что ААД вызывают только токсигенные штаммы С. difficile. При этом ключевым моментом запуска патогенного потенциала данного микроорганизма является нарушение состава эндогенной микрофлоры, сопровождающееся снижением колонизационной резистентности. Только в этих условиях C. difficile способна колонизировать слизистую оболочку толстой кишки. Токсины А и В, продуцируемые токсинообразующими штаммами клостридий, нарушают процессы всасывания воды, повреждают стенку кишки, вызывая воспаление, как следствие, возникают диарея и серьезные нарушения электролитного баланса. Примерно у половины больных с ААД заболевание прогрессирует, развивается довольно тяжелое состояние, сопровождающееся глубоким повреждением кишечной стенки, – псевдомембранозный колит.
Причиной ААД, вероятно, могут быть и другие микробы. В частности, метициллинрезистентные штаммы S. aureus, Pseudomonas aeruginosa, Klebsiella oxytoca могут вызывать нозокомиальную ААД, что обусловлено их способностью продуцировать энтеротоксин.

Профилактика антибиотико-ассоциированной диареи
Высокая частота развития диарейного синдрома у пациентов, получающих антибиотики, обусловливает поиск методов профилактики ААД. Одним из основных подходов к профилактике ААД, наряду с рациональной антибиотикотерапией, является использование эубиотиков — пре- и пробиотиков. К пробиотикам относят живые микроорганизмы — представители в основном облигатной микрофлоры человека, которые при попадании в ЖКТ в достаточном количестве сохраняют свою активность, жизнеспособность и оказывают положительное влияние на здоровье. Механизмы действия пробиотиков включают поддержание колонизационной резистентности, подавление роста патогенных и условно-патогенных микроорганизмов, а также регуляцию иммунной системы ЖКТ [18–22].Механизмы, обеспечивающие колонизационную устойчивость, включают формирование агрессивной среды за счет снижения рН в просвете кишки путем выработки короткоцепочечных жирных кислот, лактата, ацетата, перекисей, продукцию антибиотикоподобных веществ, конкуренцию за субстраты, питающие патогенные бактерии, недоступность для адгезии специфических мест связывания [23].
Современные исследования подтверждают, что потребление пробиотиков здоровыми людьми может улучшать функцию эпителия кишечника, повышая сопротивляемость инфекциям. Для ряда пробиотиков подтверждена способность усиливать эпителиальную барьерную функцию путем модуляции сигнальных механизмов, таких как каскады, зависимые от нуклеарного транскрипционного фактора
kB (NF-kB), протеинкиназы Akt, митоген-активируемой протеинкиназы (mitogen-activated protein kinase — MAPK). Это приводит к усилению секреции слизи [24] или повышению функционирования плотных контактов (tight junctions), которые представляют собой запирающие межклеточные контакты, задействованные в сигнальных путях, регулирующих пролиферацию, поляризацию и дифференциацию эпителиальных клеток [25, 26]. Исследования in vitro обнаружили, что некоторые пробиотики продуцируют особые метаболиты, которые непосредственно меняют эпителиальную проницаемость и укрепляют целостность защитного барьера.
Одновременно микроорганизмы-пробиотики могут самостоятельно подавлять рост патогенных микроорганизмов.
 Например, в исследованиях in vitro показано, что
Например, в исследованиях in vitro показано, что штамм Lactobacillus acidophilus Lai вырабатывает соединение с антимикробной активностью, снижающее жизнеспособность Helicobacter pylori [27]. Штамм L. casei
spp. rhamnosus GG продуцирует дефенсины, ингибирующие рост ряда грамотрицательных и грамположительных микроорганизмов [28]. Установлено, что штамм Lactobacillus casei spp. rhamnosus Lcr35 не только синтезирует вещества с антимикробной активностью, но и в экспериментах in vitro препятствует адгезии некоторых энтеропатогенных микроорганизмов к эпителиоцитам кишечника человека.
С каждым годом опыт применения пробиотиков с целью профилактики ААД пополняется новыми клиническими исследованиями. Согласно заключению рабочей группы по пробиотикам и пребиотикам Европейского общества детских гастроэнтерологов, гепатологов и нутрициологов (ESPGHAN), опубликованному в Journal of Pediatric Gastroenterology & Nutrition (март 2016 г.
 ), наиболее убедительно подтверждена эффективность в профилактике ААД пробиотика S. boulardii и L. casei spp. rhamnosus GG [29]. По результатам анализа 21 рандомизированного плацебо-контролируемого клинического исследования, их использование снижало частоту развития ААД на 52% (с 21,2% до 9,1%, отношение шансов (ОШ) 0,48, 95% доверительный интервал (ДИ) 0,37–0,61)). Их профилактическая эффективность в предотвращении
), наиболее убедительно подтверждена эффективность в профилактике ААД пробиотика S. boulardii и L. casei spp. rhamnosus GG [29]. По результатам анализа 21 рандомизированного плацебо-контролируемого клинического исследования, их использование снижало частоту развития ААД на 52% (с 21,2% до 9,1%, отношение шансов (ОШ) 0,48, 95% доверительный интервал (ДИ) 0,37–0,61)). Их профилактическая эффективность в предотвращении C. difficile-ассоциированной диареи была установлена в 4 исследованиях, в которых участвовали 938 детей (ОШ 0,34, 95% ДИ 0,15–0,76). При этом было показано, что значимый профилактический эффект достигается при использовании пробиотиков в суточной дозировке 1–2 × 1010 КОЕ для L. casei spp. rhamnosus GG, а также не менее 250 мг, но не более 500 мг — для S. boulardii.
На отечественном рынке пробиотик Lactobacillus rhamnosus GG в комбинации с пребиотическими фруктоолигосахаридами представлен в синбиотическом средстве Нормобакт L («Польфарма» АО, Польша), разрешенном к применению с 1-го мес.
 жизни. Необходимо отметить, что профилактика ААД является не единственной целью применения Нормобакта L во время проведения антибиотикотерапии. Не менее важной целью является восстановление дисбаланса микробиома ЖКТ, что, возможно, требует длительной коррекции (не менее 4 нед.).
жизни. Необходимо отметить, что профилактика ААД является не единственной целью применения Нормобакта L во время проведения антибиотикотерапии. Не менее важной целью является восстановление дисбаланса микробиома ЖКТ, что, возможно, требует длительной коррекции (не менее 4 нед.).Литература
1. Kinch M. S., Patridge E., Plummer M., Hoyer D. An analysis of FDA-approved drugs for infectious disease: antibacterial agents // Drug Discov Today. 2014. Vol. 19. P. 1283–1287. doi:10.1016/j.drudis.2014.07.005.
2. Review on Antimibrobial Resistance. Antimicrobial resistance: tackling a crisis for the health and wealth of nations. 2014 (Электронный ресурс). URL: http://amr-review.org/sites/default/files/AMR%20Review%20Paper%20-%20Tackling%20a%20crisis%20for%20the%20health%20and%20wealth%20of%20nations_1.pdf. (дата обращения: 12.03.2017).
3. Guarner F. , Malagelada J.-R. Gut flora in health and disease // Lancet. 2003. Vol. 361. P. 512–519. doi:10.1016/S0140–6736 (03) 12489–0.
, Malagelada J.-R. Gut flora in health and disease // Lancet. 2003. Vol. 361. P. 512–519. doi:10.1016/S0140–6736 (03) 12489–0.
4. Holmes E., Loo R. L., Stamler J. et al. Human metabolic phenotype diversity and its association with diet and blood pressure // Nature. 2008. Vol. 453. P. 396–400. doi:10.1038/nature06882.
5. McFarland L. V. Evidence-based review of probiotics for antibiotic-associated diarrhea and Clostridium difficile infection // Anae-robe. 2009. Vol. 15. P. 274–280.
6. LaRosa M., Bottaro G., Gulino N. et al. Prevention of antibiotic-associated diarrhea with Lactobacillus sporogens and fructooligosaccharides in children: a multi-centric double-blind vs. placebo study // Minerva Pediatr. 2003. Vol. 55. P. 447–452.
7. Turck D., Bernet J. P., Marx J. et al. Incidence and risk factors for of oral antibiotic-associated diarrhea in an outpatient pediatric population // J Pediatr Gastroenterol Nutr. 2003. Vol. 37. P. 22–26.
8. Hickson M., D’Souza A., Muthu N. et al. Use of probiotic Lactobacillus preparation to prevent diarrhoea associated with antibiotics: randomised double blind placebo controlled trial // BMJ. 2007. Vol. 335. P. 80–85.
Use of probiotic Lactobacillus preparation to prevent diarrhoea associated with antibiotics: randomised double blind placebo controlled trial // BMJ. 2007. Vol. 335. P. 80–85.
9. McFarland L. V. Epidemiology, risk factors and treatments for antibiotic-associated diarrhea (review) // Dig Dis. 1998. Vol. 16. P. 292–307.
10. Ayyagari A., Agarwal J., Garg A. Antibiotic associated diarrhoea: Infectious causes // Indian Journal of Medical Microbiology. 2003. Vol. 21 (1). P. 6–11.
11. Barlett J. G. Antibiotic-associated diarrhoea // N Engl J Med. 2002. Vol. 346. P. 334–339.
12. Boyce J. M., Havill N. L. Nosocomial antibiotic-associated diarrhea associated with enterotoxin-producing strains of methicillin-resistant Staphylococcus aureus // Am J Gastroenterol. 2005. Vol. 100 (8). P. 1828–1834.
13. Jernberg C., Lofmark S., Edlund C., Jansson J. K. Long-term ecological impacts of antibiotic administration on the human intestinal microbiota // Isme J. 2007. Vol. 1. P. 56–66.
14. Sjölund M., Tano E., Blaser M. J. et al. Persistence of resistant Staphylococcus epidermidis after single course of clarithromycin // Emerg Infect Dis. 2005. Vol. 11. P. 1389–1393.
Sjölund M., Tano E., Blaser M. J. et al. Persistence of resistant Staphylococcus epidermidis after single course of clarithromycin // Emerg Infect Dis. 2005. Vol. 11. P. 1389–1393.
15. Jakobsson H., Wreiber K., Fall K. et al. Macrolide resistance in the normal microbiota after Helicobacter pylori treatment // Scand J Infect Dis. 2007. Vol. 39. P. 757–763.
16. Löfmark S., Jernberg C., Jansson J. K., Edlund C. Clindamycin-induced enrichment and long-term persistence of resistant Bacteroides spp. and resistance genes // J Antimicrob Chemother. 2006. Vol. 58. P. 1160–1167.
17. Hogenauer C., Hammer H. F., Krejs G. J., Reisinger E. C. Mechanism and management of antibiotic-associated diarrhoea // Clin Infect Dis. 1998. Vol. 27. P. 702–710.
18. Fuller R. Probiotics in man and animals // J. Appl. Bacteriol. 1989. Vol. 66. P. 365–378.
19. Шендеров Б. А. Медико-физиологическое обоснование создания композиций синбиотиков для различных возрастных групп населения: Материалы научно-практической конференции «Новые пробиотические препараты в комплексной терапии больных с дисбактериозом кишечника». М., 2003. С. 6–8 [Shenderov B. A. Mediko-fiziologicheskoe obosnovanie sozdanija kompozicij sinbiotikov dlja razlichnyh vozrastnyh grupp naselenija: Materialy nauchno-prakticheskoj konferencii «Novye probioticheskie preparaty v kompleksnoj terapii bol’nyh s disbakteriozom kishechnika». M., 2003. S. 6–8 (in Russian)].
М., 2003. С. 6–8 [Shenderov B. A. Mediko-fiziologicheskoe obosnovanie sozdanija kompozicij sinbiotikov dlja razlichnyh vozrastnyh grupp naselenija: Materialy nauchno-prakticheskoj konferencii «Novye probioticheskie preparaty v kompleksnoj terapii bol’nyh s disbakteriozom kishechnika». M., 2003. S. 6–8 (in Russian)].
20. Mercenier А., Pavan S., Pot В. Probiotics as biotherapeutic agent: present khuwledge and future prospects // Curr.Pharm.Des. 2003. Vol. 9. P. 175–191.
21. Fuller R. Probiotic foods. Current use and future developments // Int.Food Ingred. 1993. Vol. 3. P. 23–26.
22. Lee Y.-K., Salminen S. The coming ot age of probiotics // Trends Food Sci.technol., 1995. Vol. 6. P. 241–245.
23. Fons M., Gomez A., Karjalainen T. Mechanisms of colonization and colonization resistance of the digestive tract. Microbial Ecol // Health Dis.Suppl. 2000. Vol. 2. P. 240–246.
24. Mack D. R., Ahrne S., Hyde L. et al. Extracellular MUC3 mucin secretion follows adherence of Lactobacillus strains to intestinal epithelial cells in vitro // Gut 2003. Vol. 52. P. 827–833.
Vol. 52. P. 827–833.
25. Mack D. R., Ahrne S., Hyde L. et al. Extracellular MUC3 mucin secretion follows adherence of Lactobacillus strains to intestinal epithelial cells in vitro // Gut. 2003. Vol. 52. P. 827–833.
26. Rao R. K., Samak G. Protection and Restitution of Gut Barrier by Probiotics: Nutritional and Clinical Implications // Curr Nutr Food Sci. 2013. Vol. 9. P. 99–107.
27. Michetti P., Dorta G., Wiesel P. H. et al. Effect of whey-based culture supernatant of Lactobacillus acidophilus (johnsonii) La1 on Helicobacter pylori infection in human // Digestion. 1999. Vol. 60. P. 203–209.
28. Silva M., Jacobus N. V., Deneke C. et al. Antimicrobial substance from a human Lactobacillus strain. Antimicrob // Agents Chemother. 1987. Vol. 31. P. 1231–1233.
29. Szajewska H., Canani R. B., Guarino A. et al.; ESPGHAN Working Group for ProbioticsPrebiotics. Probiotics for the Prevention of Antibiotic-Associated Diarrhea in Children // J Pediatr Gastroenterol Nutr. 2016. Vol. 62 (3). P. 495–506. doi: 10.1097/MPG.0000000000001081.
62 (3). P. 495–506. doi: 10.1097/MPG.0000000000001081.
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Поделитесь статьей в социальных сетях
Порекомендуйте статью вашим коллегам
Антибиотики без побочек. Как правильно принимать эти лекарства?
Продукты, которые есть нельзя!Чтобы антибиотики не принесли вреда здоровью, на время лечения придётся отказаться от некоторых продуктов, в первую очередь от алкоголя. Ведь алкоголь, по сути, – это яд для наших клеток. Да, в небольшом количестве он образуется и у нас в организме, в кишечнике при расщеплении бактериями растительной пищи. И с малыми дозами этого вещества здоровый человек справиться может. Но на фоне заболевания, когда на организм воздействуют не только вирусы и бактерии, но и антибиотики, приём алкоголя – удар по системе детоксикации.
 Такого она попросту может не выдержать, и тогда проблем с печенью не избежать.
Такого она попросту может не выдержать, и тогда проблем с печенью не избежать.Ещё один напиток, с которым придётся на время попрощаться, – молоко. Кальций, содержащийся в молочных продуктах, вступает в реакцию с компонентами антибактериальных препаратов, тем самым дезактивируя их. В результате лекарства попросту не будут работать. К тому же молоко снижает количество полезных бактерий, а на фоне дисбиоза (нарушения баланса между полезной и условно-патогенной микрофлорой) ухудшается способность переваривать лактозу – молочный сахар. Поэтому в сочетании с молоком антибиотики могут привести к брожению в кишечнике и вздутию живота.
Также на фоне приёма лекарств стоит максимально уменьшить количество углеводистой пищи, особенно простых углеводов. Как мы уже говорили, они могут спровоцировать рост условно-патогенной микрофлоры.
Откажитесь от острого, жареного, перчёного – такая пища раздражает слизистую желудка, которая из-за антибиотиков и так не в лучшем состоянии. Жиров тоже должно быть по минимуму – жирная пища перегружает печень..gif)
Питание на фоне приёма антибиотиков должно включать продукты, которые защищают слизистую желудочно-кишечного тракта, а также поддерживают дружественную нам микрофлору. Это прежде всего овощи, в которых много клетчатки (именно пищевые волокна служат пищей для полезной микрофлоры). Это могут быть сельдерей, кабачки, баклажаны, зелень. Можно включить в меню немного фруктов – слишком большое их количество не рекомендуется из-за довольно высокого содержания сахара. Но и овощи, и фрукты нужно термически обрабатывать (отваривать, тушить, запекать) – ферментированная клетчатка быстрее и легче усвоится бактериями.
Не забывайте и про крепкие мясные бульоны – они помогают защитить и восстановить слизистую кишечника. Неслучайно они так часто используются в лечебном питании.
Влияние антибиотиков и пробиотиков на микробиом желудочно-кишечного тракта Текст научной статьи по специальности «Фундаментальная медицина»
10.21518/2079-701X-2016-16-98-102
Д. В. УСЕНКО, д.м.н., Центральный НИИ эпидемиологии Роспотребнадзора, Москва
В. УСЕНКО, д.м.н., Центральный НИИ эпидемиологии Роспотребнадзора, Москва
ВЛИЯНИЕ АНТИБИОТИКОВ И ПРОБИОТИКОВ
НА МИКРОБИОМ ЖЕЛУДОЧНО-КИШЕЧНОГО ТРАКТА
Широкое применение антибиотиков в течение последних 80 лет спасло миллионы человеческих жизней, однако явилось причиной возникновения важной проблемы – антибиотикоассоциированного нарушения микробиома человека. В настоящем обзоре обобщены результаты современных исследований, в которых изучались краткосрочные и долгосрочные последствия воздействия антибиотиков на организм, а также идет речь о возможностях применения пробиотиков для нивелирования этих последствий.
Ключевые слова: антибиотики, пробиотики, дети, Lactobacillus GG.
D.V. USENKO, MD, Central Research Institute of Epidemiology, Rospotrebnadzor, Moscow THE EFFECT OF ANTIBIOTICS AND PROBIOTICS ON THE GASTROINTESTINAL MICROBIOME
The widespread use of antibiotics over the last 80 years has saved millions of lives, however became the cause of another, no less crucial challenge – antibiotic-associated alterations of the human microbiome. The review summarizes current findings on the short- and long-term effects of antibiotics on the body, and the potential of probiotics in mitigating those effects.
The review summarizes current findings on the short- and long-term effects of antibiotics on the body, and the potential of probiotics in mitigating those effects.
Keywords: antibiotics, probiotics, children, Lactobacillus GG.
Открытие пенициллина, а в последующем и новых групп антимикробных препаратов радикально изменило подходы и результаты лечения инфекционных заболеваний. Ученые и врачи середины 70-х гг. ХХ в. уже предвидели победу в борьбе с инфекционными болезнями благодаря появлению антибиотиков и развитию вакцинации. В своем выступлении в конгрессе США в 1969 г. президент Международной ассоциации хирургов Вильям Стюарт заявил, что, «учитывая достижения антибактериальной терапии и программ вакцинации, в ближайшее время можно будет закрыть книгу инфекционных болезней…». Сегодня мы прекрасно понимаем ошибочность данных оценок. Приходится констатировать, что возможности контроля над микробным сообществом снижаются.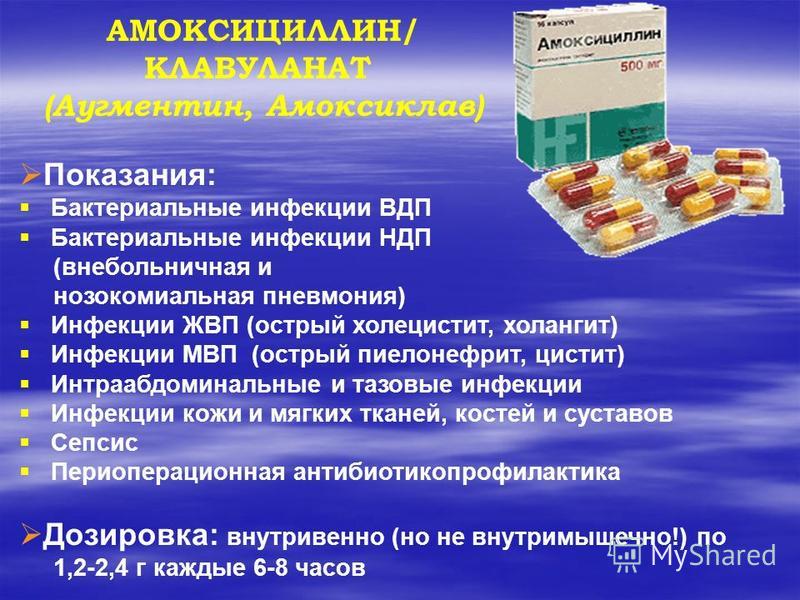 Патогенные микроорганизмы приобрели генетическую способность противостоять действию широкого спектра антибиотиков вследствие избыточного и неконтролируемого их применения. Частота выявления устойчивых к антибиотикам возбудителей резко возрастает, в то время как скорость открытия новых антибиотиков замедляется [1]. По оценкам экспертного сообщества, в 2015 г. антибиотикорезистентные штаммы патогенных микроорганизмов явились причиной более 50 тыс. смертей в Европе и США, а прогнозируемый уровень летальности от данных возбудителей во всем мире к 2050 г. возрастет до 10 млн смертей [2]. Многие специалисты начинают говорить об окончании эры антибиотиков.
Патогенные микроорганизмы приобрели генетическую способность противостоять действию широкого спектра антибиотиков вследствие избыточного и неконтролируемого их применения. Частота выявления устойчивых к антибиотикам возбудителей резко возрастает, в то время как скорость открытия новых антибиотиков замедляется [1]. По оценкам экспертного сообщества, в 2015 г. антибиотикорезистентные штаммы патогенных микроорганизмов явились причиной более 50 тыс. смертей в Европе и США, а прогнозируемый уровень летальности от данных возбудителей во всем мире к 2050 г. возрастет до 10 млн смертей [2]. Многие специалисты начинают говорить об окончании эры антибиотиков.
Помимо формирования антибиотикорезистентных штаммов микроорганизмов применение антибиотиков в значительной степени разрушает экологию микробиома человека. Под термином «микробиом» в настоящее время принято объединять все сообщество клеток, генов и мета-
болитов бактерий, эукариот и вирусов, обитающих в организме человека. Дисбиотически измененный микробиом не может выполнять жизненно важные функции, такие как пищеварительная, синтетическая, а также обеспечение колонизационной резистентности и регуляции иммунной системы организма [3]. Влияние этих процессов выходит далеко за пределы желудочно-кишечного тракта (ЖКТ), а спектр патологических и дисбиозопосре-дованных состояний включает метаболические (ожирение, диабет 1-го и 2-го типа), иммунологические (атопи-ческий дерматит, бронхиальная астма) заболевания, а также повышенную восприимчивость к развитию инфекционных заболеваний (повышенный риск развития Clostridium difficile-обусловленных заболеваний, Pseudomonas aeruginosa, Klebsiella oxytoca, Staphylococcus aureus, а также Candida) [4]. Однако необходимо понимать, что все эти последствия являются непреднамеренными результатами применения антибиотиков, а следовательно, требуют проведения дополнительных мероприятий по их коррекции и предотвращению.
Дисбиотически измененный микробиом не может выполнять жизненно важные функции, такие как пищеварительная, синтетическая, а также обеспечение колонизационной резистентности и регуляции иммунной системы организма [3]. Влияние этих процессов выходит далеко за пределы желудочно-кишечного тракта (ЖКТ), а спектр патологических и дисбиозопосре-дованных состояний включает метаболические (ожирение, диабет 1-го и 2-го типа), иммунологические (атопи-ческий дерматит, бронхиальная астма) заболевания, а также повышенную восприимчивость к развитию инфекционных заболеваний (повышенный риск развития Clostridium difficile-обусловленных заболеваний, Pseudomonas aeruginosa, Klebsiella oxytoca, Staphylococcus aureus, а также Candida) [4]. Однако необходимо понимать, что все эти последствия являются непреднамеренными результатами применения антибиотиков, а следовательно, требуют проведения дополнительных мероприятий по их коррекции и предотвращению.
Наиболее частым и клинически значимым негативным последствием антибактериальной терапии принято считать антибиотикоассоциированную диарею (ААД). Выраженность симптомокомплекса, развившегося на фоне антибиотикотерапии, может варьировать от незначительного преходящего интестинального дискомфорта до тяжелых форм диареи и колита. По мнению Экспертного комитета ВОЗ (2010), ААД составляет до 30% среди побочных реакций антибиотикотерапии [5]. Современными критериями диагноза ААД принято считать 3 и более эпизода неоформленного стула в течение 2 или более дней на фоне применения антибиотиков либо в течение 8 нед. после их отмены.
Выраженность симптомокомплекса, развившегося на фоне антибиотикотерапии, может варьировать от незначительного преходящего интестинального дискомфорта до тяжелых форм диареи и колита. По мнению Экспертного комитета ВОЗ (2010), ААД составляет до 30% среди побочных реакций антибиотикотерапии [5]. Современными критериями диагноза ААД принято считать 3 и более эпизода неоформленного стула в течение 2 или более дней на фоне применения антибиотиков либо в течение 8 нед. после их отмены.
Популяционные исследования свидетельствуют о том, что наиболее часто ААД развивается у детей младше 6 лет или пожилых лиц (старше 65 лет) [6]. При этом если у новорожденных и детей младше 6 лет высокая (24%) частота развития ААД может быть обусловлена в том числе продолжающимся процессом становления микрофлоры ЖКТ и ее выраженной лабильностью, то в популяции лиц старше 65 лет в 20-100 раз возрастала частота обнаружения токсинпродуцирующих штаммов Clostridium difficile в фекалиях. Помимо возрастных особенностей состава микробиоты ЖКТ большое значение имеет наличие предшествующей хронической гастроэнтерологической патологии, ранее перенесенной ААД, а также тяжелых хронических заболеваний и иммунодефицита. Длительное пребывание в стационаре, а также проведение хирургических и эндоскопических манипуляций также повышают риск внутрибольничного заражения клостридиальной инфекцией и развития ААД. Так, по данным M. Hickson с соавт., частота ААД в отделениях ортопедического профиля и в палатах ухода за пожилыми пациентами в трех лондонских больницах составила 34% [7].
Помимо возрастных особенностей состава микробиоты ЖКТ большое значение имеет наличие предшествующей хронической гастроэнтерологической патологии, ранее перенесенной ААД, а также тяжелых хронических заболеваний и иммунодефицита. Длительное пребывание в стационаре, а также проведение хирургических и эндоскопических манипуляций также повышают риск внутрибольничного заражения клостридиальной инфекцией и развития ААД. Так, по данным M. Hickson с соавт., частота ААД в отделениях ортопедического профиля и в палатах ухода за пожилыми пациентами в трех лондонских больницах составила 34% [7].
Практически все антибактериальные препараты, особенно активные в отношении анаэробов, способны вызывать ААД. По данным L. McFarLand [8], ААД встречается в 5-10% случаев при применении ампициллина, в 10-25% – цефалоспоринов II поколения и лишь в 2-5% случаев – при использовании других антибактериальных препаратов, таких как тетрациклин, макролиды (эритромицин), нитрофурантоин, ко-тримоксазол, фтор-хинолоны, аминогликозиды (канамицин, гентамицин). Было показано, что у больных, в терапии которых использовались ампициллин и амоксициллин/клавула-нат, ААД наблюдалась в 5-10 и 10-25% случаев соответственно. При этом на вероятность развития ААД не влияет способ введения препарата. К примеру, при пероральном приеме наряду с влиянием на кишечную микрофлору антибиотики оказывают воздействие непосредственно на слизистую оболочку тонкой кишки; при парентеральном введении антибактериальные препараты воздействуют на микробиоценоз кишечника, выделяясь со слюной, желчью, секретами тонкой и толстой кишки. Существенно повышают риск развития ААД увеличение длительности антибактериальной терапии и
Было показано, что у больных, в терапии которых использовались ампициллин и амоксициллин/клавула-нат, ААД наблюдалась в 5-10 и 10-25% случаев соответственно. При этом на вероятность развития ААД не влияет способ введения препарата. К примеру, при пероральном приеме наряду с влиянием на кишечную микрофлору антибиотики оказывают воздействие непосредственно на слизистую оболочку тонкой кишки; при парентеральном введении антибактериальные препараты воздействуют на микробиоценоз кишечника, выделяясь со слюной, желчью, секретами тонкой и толстой кишки. Существенно повышают риск развития ААД увеличение длительности антибактериальной терапии и
По оценкам экспертного сообщества, в 2015 г. антибиотикорезистентные штаммы патогенных микроорганизмов явились причиной более 50 тыс. смертей в Европе и США, а прогнозируемый уровень летальности от данных возбудителей во всем мире к 2050 г. возрастет до 10 млн смертей
проведение ее повторных курсов, комбинация нескольких препаратов, а также использование антибиотиков, выводящихся с желчью. Особенно риск развития ААД возрастает при проведении антибактериальной терапии
Особенно риск развития ААД возрастает при проведении антибактериальной терапии
в педиатрической практике. Так, по данным анкетирования 16 200 пациентов, получавших антибиотики, чаще всего ААД наблюдалась у новорожденных и детей до 5 лет (24%), что подчеркивает важность поддержания
Наиболее частым и клинически значимым негативным последствием антибактериальной терапии принято считать антибиотико-ассоциированную диарею. Выраженность симптомокомплекса, развившегося на фоне, антибиотикотерапии, может варьировать от незначительного преходящего интестинального дискомфорта до тяжелых форм диареи и колита
микрофлоры ЖКТ у детей в процессе терапии антибактериальными средствами. Несмотря на то, что в большинстве случаев инфекционный агент остается неустановленным, микробиологические исследования показали связь ААД с различными микроорганизмами, такими как Clostridium difficile, Pseudomonas aeruginosa, Klebsiella oxytoca, Staphylococcus aureus, а также грибами рода Candida [9, 10]. Однако наиболее тяжелые формы ААД, в частности псевдомембранозный колит, обусловлены C. difficile. Наряду с вышеуказанными микроорганизмами причиной ААД могут выступать и другие микробы. Так, J. Boyce и соавт. сообщают о способности метицил-линрезистентных штаммов S. aureus вызывать нозокоми-альную ААД, что обусловлено их способностью продуцировать энтеротоксин [11]. В большинстве (до 80%) случаев диарея на фоне антибактериальной терапии имеет неинфекционную природу. И лишь в 15-20% случаев этиологическими факторами являются C. difficile, Clostridium perfringens, S. aureus, K. oxytoca, Candida spp. и Salmonella.
Однако наиболее тяжелые формы ААД, в частности псевдомембранозный колит, обусловлены C. difficile. Наряду с вышеуказанными микроорганизмами причиной ААД могут выступать и другие микробы. Так, J. Boyce и соавт. сообщают о способности метицил-линрезистентных штаммов S. aureus вызывать нозокоми-альную ААД, что обусловлено их способностью продуцировать энтеротоксин [11]. В большинстве (до 80%) случаев диарея на фоне антибактериальной терапии имеет неинфекционную природу. И лишь в 15-20% случаев этиологическими факторами являются C. difficile, Clostridium perfringens, S. aureus, K. oxytoca, Candida spp. и Salmonella.
Неинфекционная, или идиопатическая, ААД является результатом влияния ряда антибиотиков на моторику и функцию ЖКТ. Известно, что 14-членные макролиды способны стимулировать моторику ЖКТ, обладая мотилино-подобным действием. Клавулановая кислота, а также парентеральные (выделяющиеся с желчью – цефоперазон и цефтриаксон) и пероральные цефалоспорины (цефик-сим) оказывают послабляющее действие. Помимо этого, ряд антибактериальных препаратов (хлорамфеникол, тетрациклин) оказывают непосредственное токсическое действие на слизистую оболочку кишечника, а также способны приводить к скрытой индукции мальабсорбции. Нарушение состава нормальной микрофлоры кишечника является еще одним из механизмов формирования диа-рейного синдрома на фоне приема антибиотиков. Установлено, что при использовании ампициллина наблюдается существенное угнетение роста как аэробной, так и анаэробной микрофлоры, тогда как при применении амоксициллина наблюдается рост популяции представителей рода Enterobacteriacea и в меньшей степени – снижение активности большинства представителей облигат-ной микрофлоры. Аналогичным образом на микробиоценоз кишечника воздействует комбинированный препарат
Помимо этого, ряд антибактериальных препаратов (хлорамфеникол, тетрациклин) оказывают непосредственное токсическое действие на слизистую оболочку кишечника, а также способны приводить к скрытой индукции мальабсорбции. Нарушение состава нормальной микрофлоры кишечника является еще одним из механизмов формирования диа-рейного синдрома на фоне приема антибиотиков. Установлено, что при использовании ампициллина наблюдается существенное угнетение роста как аэробной, так и анаэробной микрофлоры, тогда как при применении амоксициллина наблюдается рост популяции представителей рода Enterobacteriacea и в меньшей степени – снижение активности большинства представителей облигат-ной микрофлоры. Аналогичным образом на микробиоценоз кишечника воздействует комбинированный препарат
амоксициллина и клавулановой кислоты. Среди цефало-споринов можно выделить группу препаратов, включающую пероральные цефподоксим, цефпрозил и цефтибу-тен, на фоне применения которых происходит активация роста микроорганизмов рода Enterobacteriacea, энтерококков и С. difficile в кишечнике. В то же время такие препараты, как цефаклор и цефрадин, практически не оказывают влияния на кишечную микрофлору.
difficile в кишечнике. В то же время такие препараты, как цефаклор и цефрадин, практически не оказывают влияния на кишечную микрофлору.
Существенно повышают риск развития ААД увеличение длительности антибактериальной терапии и проведение ее повторных курсов, комбинация нескольких препаратов, а также использование антибиотиков, выводящихся с желчью. Особенно риск развития ААД возрастает при проведении антибактериальной терапии в педиатрической практике
До настоящего времени нет единого мнения о длительности сохранения нарушений микробиоты после применения антибиотиков. Недавние исследования показали, что последствия применения некоторых антибиотиков имеют долгосрочный характер для фекальной микрофлоры [12-15]. Например, применение клиндами-цина приводило к снижению разнообразия Bacteroides в образцах фекалий, росту числа антибиотикоустойчивых клонов Bacteroides, в частности В. Thetaiotamicron, а также сохраняющемуся на протяжении как минимум 2-х лет персистированию гена erm(B) (эритромицин-резистентной метилазы) и возможности не только формирования клона резистентных штаммов, но и его горизонтальной передачи другим бактериям. После применения ципроф-локсацина изменения состава микробиоты ЖКТ регистрировались на протяжении как минимум 6 мес.
После применения ципроф-локсацина изменения состава микробиоты ЖКТ регистрировались на протяжении как минимум 6 мес.
Нарушение метаболической активности облигатной микрофлоры, а также ее количественный дефицит сопровождаются формированием различных нарушений пищеварения, в первую очередь переваривания углеводов, что обусловливает развитие осмотической диареи с потерей больших объемов жидкости. Параллельно с этим снижается синтез нормальными представителями микрофлоры ЖКТ короткоцепочечных жирных кислот, что приводит к уменьшению абсорбции жидкости и электролитов коло-ноцитами. Метаболическая концепция неинфекционной ААД, развившейся в 1-3 сут от начала лечения, по мнению В.А. Малова, может быть подтверждена спонтанным купированием симптомов в течение 2-х дней после отмены антибиотиков.
ААД, возникшая в более поздние сроки, в большинстве случаев имеет инфекционную природу и, по всей видимости, обусловлена колонизацией кишечника условно-патогенными штаммами бактерий. Из инфекционных причинно-значимых агентов ААД наиболее серьезным и опасным является Clostridium difficile. По данным зарубежных авторов, диарея, обусловленная Clostridium difficile, составляет 30% всех ААД, 50-75% антибиотико-ассоциированных колитов [16, 17]. Практически все слу-
Из инфекционных причинно-значимых агентов ААД наиболее серьезным и опасным является Clostridium difficile. По данным зарубежных авторов, диарея, обусловленная Clostridium difficile, составляет 30% всех ААД, 50-75% антибиотико-ассоциированных колитов [16, 17]. Практически все слу-
чаи псевдомембранозного колита обусловлены данным микроорганизмом. Несмотря на относительно низкое носительство С. difficile в популяции здорового населения (не более 3%), частота обнаружения данного микроорганизма у пациентов, получающих антибиотики, возрастает до 20%. Как показали данные L. McFarLanda, это связано с экзогенным инфицированием пациентов, а не с активацией микроба при асимптоматическом носительстве бактерий. Наиболее высокий показатель выявления кло-стридий данного вида регистрируется у новорожденных, хотя и протекает без клинической манифестации, что, по всей видимости, обусловлено отсутствием у них на слизистой оболочке ЖКТ рецепторов к токсинам возбудителей. У 15-35% пациентов после первого эпизода С. difficile-ассоциированной диареи наблюдаются рецидивы инфекции, которые связаны с длительным персистированием в кишечнике спор возбудителя или реинфекцией новым штаммом. Исследования последних лет показывают, что восприимчивость к этой инфекции в значительной мере определяется характером иммунного ответа макроорганизма на токсины, продуцируемые С. difficile.
У 15-35% пациентов после первого эпизода С. difficile-ассоциированной диареи наблюдаются рецидивы инфекции, которые связаны с длительным персистированием в кишечнике спор возбудителя или реинфекцией новым штаммом. Исследования последних лет показывают, что восприимчивость к этой инфекции в значительной мере определяется характером иммунного ответа макроорганизма на токсины, продуцируемые С. difficile.
На сегодняшний день установлено, что ААД вызывают только токсигенные штаммы С. difficile. При этом ключевым моментом запуска патогенного потенциала данного микроорганизма является нарушение состава эндогенной микрофлоры, сопровождающееся снижением колонизационной резистентности. Только в этих условиях C. difficile способна колонизировать слизистую оболочку толстой кишки. Токсины А и В, продуцируемые токсино-образующими штаммами клостридий, нарушают процессы всасывания воды, повреждают стенку кишки, вызывая воспаление, и, как следствие, возникают диарея, а также серьезные нарушения электролитного баланса. Примерно у половины больных с ААД заболевание прогрессирует, и развивается довольно тяжелое состояние, сопровождающееся глубоким повреждением кишечной стенки, – псев-домембранозный колит (ПМК).
Примерно у половины больных с ААД заболевание прогрессирует, и развивается довольно тяжелое состояние, сопровождающееся глубоким повреждением кишечной стенки, – псев-домембранозный колит (ПМК).
Согласно заключению рабочей группы по пробиотикам и пребиотикам Европейского общества детских гастроэнтерологов, гепатологов и нутрициологов (ESPGHAN), опубликованному в Journal of Pediatric Gastroenterology & Nutrition (март 2016 г.), наиболее убедительно подтверждена эффективность в профилактике ААД пробиотика S. boulardii и L. casei spp. rhamnosus GG
Причиной ААД, вероятно, могут быть и другие микробы. В частности, по данным J.M. Boyce с соавт., метицил-линрезистентные штаммы S. aureus, Pseudomonas aeruginosa, Klebsiella oxytoca могут вызывать нозокоми-альную ААД, что обусловлено их способностью продуцировать энтеротоксин [15].
Высокая частота развития диарейного синдрома у пациентов, получающих антибиотики, обусловливает поиск методов профилактики ААД. Одним из основных
Одним из основных
подходов к профилактике ААД наряду с рациональной антибиотикотерапией является использование эубиоти-ков – пре- и пробиотиков. К пробиотикам относят живые микроорганизмы – представители в основном облигат-ной микрофлоры человека, которые при попадании в ЖКТ в достаточном количестве сохраняют свою активность, жизнеспособность и оказывают положительное влияние на его здоровье. Механизмы действия пробиотиков включают поддержание колонизационной резистентности, подавление роста патогенных и условно-патогенных микроорганизмов, а также регуляцию иммунной системы ЖКТ [18-22].
Механизмы, обеспечивающие колонизационную устойчивость, включают формирование агрессивной среды за счет снижения рН в просвете кишки путем выработки короткоцепочечных жирных кислот, лактата, ацетата, перекисей, продукцию антибиотикоподобных веществ, конкуренцию за субстраты, питающие патогенные бактерии, недоступность для адгезии специфических мест связывания [23]. -кВ), протеинкиназы
-кВ), протеинкиназы
Akt, митоген-активируемой протеинкиназы (mitogen-activated protein kinase (MAPK)), что приводит к усилению секреции слизи [24] или повышению функционирования плотных контактов (tight junctions), представляющих собой запирающие межклеточные контакты, задействованные в сигнальных путях, регулирующих пролиферацию, поляризацию и дифференциацию эпителиальных клеток [25, 26]. В исследованиях in vitro обнаружено, что некоторые пробиотики продуцируют особые метаболиты, которые непосредственно меняют эпителиальную проницаемость и укрепляют целостность защитного барьера.
Одновременно микроорганизмы-пробиотики могут самостоятельно подавлять рост патогенных микроорганизмов. Например, в исследованиях in vitro показано, что штамм Lactobacillus acidophilus Lai вырабатывает соединение с антимикробной активностью, снижающее жизнеспособность Helicobacter pylori [27]. Штамм L. casei spp. rhamnosus GG продуцирует дефенсины, ингибирующие рост ряда грамотрицательных и грамположительных микроорганизмов [28]. Установлено, что штамм Lactobacillus casei spp. rhamnosus Lcr35 не только синтезирует вещества с антимикробной активностью, но и в экспериментах in vitro препятствует адгезии некоторых энтеропатогенных микроорганизмов к эпителиоцитам кишечника человека.
rhamnosus GG продуцирует дефенсины, ингибирующие рост ряда грамотрицательных и грамположительных микроорганизмов [28]. Установлено, что штамм Lactobacillus casei spp. rhamnosus Lcr35 не только синтезирует вещества с антимикробной активностью, но и в экспериментах in vitro препятствует адгезии некоторых энтеропатогенных микроорганизмов к эпителиоцитам кишечника человека.
С каждым годом опыт применения пробиотиков в профилактике ААД пополняется данными новых клини-
ческих исследований. Согласно заключению рабочей группы по пробиотикам и пребиотикам Европейского общества детских гастроэнтерологов, гепатологов и нутрициологов (ESPGHAN), опубликованному в Journal of
На отечественном рынке пробиотик Lactobacillus rhamnosus GG в концентрации 4 х 109 КОЕ в комбинации с пребиотическими фруктоолиго-сахаридами представлен в синбиотическом препарате Нормобакт L, разрешенном к применению с первого месяца жизни. Необходимо отметить, что профилактика ААД является не единственной целью применения Нормобакта L во время проведения антибиотикотерапии
Необходимо отметить, что профилактика ААД является не единственной целью применения Нормобакта L во время проведения антибиотикотерапии
Pediatric Gastroenterology & Nutrition (март 2016 г.), наиболее убедительно подтверждена эффективность в профилактике ААД пробиотика S. boulardii и L. casei spp. rhamnosus GG [29]. По результатам анализа 21 рандомизированного плацебо-контролируемого клинического исследования (РПКИ), их использование снижало частоту развития ААД на 52% (с 21,2 до 9,1%, RR 0,48, 95% CI 0,37-0,61). Их профилактическая эффективность в пре-
дотвращении C. difficile-ассоциированной диареи была установлена в 4 РПКИ с общим числом участников 938 (RR 0,34, 95% CI 0,15-0,76). При этом было показано, что значимый профилактический эффект достигается при использовании пробиотиков в суточной дозировке 1-2 х 1010 КОЕ для L.casei spp. rhamnosus GG и не менее 250 мг, но не более 500 мг – для S. boulardii.
boulardii.
На отечественном рынке пробиотик Lactobacillus rhamnosus GG в концентрации 4 х 109 КОЕ в комбинации с пребиотическими фруктоолигосахаридами представлен в синбиотическом препарате Нормобакт L, разрешенном к применению с первого месяца жизни. Необходимо отметить, что профилактика ААД является не единственной целью применения Нормобакта L во время проведения антибиотикотерапии. Не менее важные цели – восстановление дисбаланса микробиома ЖКТ и укрепление местного иммунитета, что, возможно, требует длительной пробиотической коррекции (не менее 4 нед.). Благодаря особенностям производства и удобной форме выпуска (порошок-саше) Нормобакт L можно применять с первого дня антибиотикотерапии, растворять в молоке или йогурте, что очень удобно при использовании у маленьких детей, а также можно хранить без холодильника. ф
ЛИТЕРАТУРА
1. Kinch MS, Patridge E, Plummer M, Hoyer D. An analysis of FDA-approved drugs for infectious disease: antibacterial agents. Drug DiscovToday. 2014, 19: 1283-7. doi:10.1016/j.drudis.2014.07.005.
Kinch MS, Patridge E, Plummer M, Hoyer D. An analysis of FDA-approved drugs for infectious disease: antibacterial agents. Drug DiscovToday. 2014, 19: 1283-7. doi:10.1016/j.drudis.2014.07.005.
2. Review on Antimibrobial Resistance. Antimicrobial resistance: tackling a crisis for the health and wealth of nations. 2014. http:// amr-review.org/sites/default/files/AMR%20 Review%20Paper%20-%20Tackling%20a%20 crisis%20for%20the%20health%20and%20 wealth%20of%20nations_1.pdf. Accessed 5 Apr 2016.
3. Guarner F, Malagelada J-R. Gut flora in health and disease. Lancet, 2003, 361: 512-9. doi:10.1016/S0140-6736(03)12489-0.
4. Holmes E, Loo RL, Stamler J, Bictash M, Yap IKS, Chan О et al. Human metabolic phenotype diversity and its association with diet and blood pressure. Nature, 2008, 453: 396-400. doi:10.1038/nature06882.
5. McFarland LV. Evidence-based review of probi-otics for antibiotic-associated diarrhea and Clostridium difficile infection. Anae-robe, 2009, 15: 274-280.
McFarland LV. Evidence-based review of probi-otics for antibiotic-associated diarrhea and Clostridium difficile infection. Anae-robe, 2009, 15: 274-280.
6. LaRosa M, Bottaro G, Gulino N et al. Prevention of antibiotic-associated diarrhea with Lactobacillus sporogens and fructooligosac-charides in children: a multi-centric doubleblind vs. placebo study. Minerva Pediatr, 2003, 55: 447-52.
7. Turck D, Bernet JP, Marx J et al. Incidence and risk factors for of oral antibiotic-associated diarrhea in an outpatient pediatric population. J Pediatr Gastroenterol Nutr, 2003, 37: 22-6.
8. Hickson M, D’Souza A, Muthu N et al. Use of probiotic Lactobacillus preparation to prevent diarrhoea associated with antibiotics: randomised double blind placebo controlled trial. BMJ, 2007, 335: 80-5.
9. McFarland LV. Epidemiology, risk factors and treatments for antibiotic-associated diarrhea [review]. Dig Dis, 1998, 16: 292-307.
McFarland LV. Epidemiology, risk factors and treatments for antibiotic-associated diarrhea [review]. Dig Dis, 1998, 16: 292-307.
10. Ayyagari A, Agarwal J, Garg A. Antibiotic associated diarrhoea: Infectious causes. Indian Journal of Medical Microbiology, 2003, 21 (1): 6-11.
11. Barlett JG. Antibiotic-associated diarrhoea. N Engl J Med, 2002, 346: 334-339.
12. Boyce JM, Havill NL. Nosocomial antibiotic-associated diarrhea associated with enterotox-in-producing strains of methicillin-resistant Staphylococcus aureus. Am J Gastroenterol. 2005 Aug, 100(8): 1828-34.
13. Jernberg C, Lofmark S, Edlund C, Jansson JK. Long-term ecological impacts of antibiotic administration on the human intestinal micro-biota. Isme J, 2007, 1: 56-66.
14. Sjolund M, Tano E, Blaser MJ, Andersson DI, Engstrand L. Persistence of resistant Staphylococcus epidermidis after single course of clarithromycin. Emerg Infect Dis, 2005, 11: 1389-1393.
Sjolund M, Tano E, Blaser MJ, Andersson DI, Engstrand L. Persistence of resistant Staphylococcus epidermidis after single course of clarithromycin. Emerg Infect Dis, 2005, 11: 1389-1393.
15. Jakobsson H, Wreiber K, Fall K, Fjelstad B, Nyren O et al. Macrolide resistance in the normal microbiota after Helicobacter pylori treatment. Scand J Infect Dis, 2007, 39: 757-763.
16. Lofmark S, Jernberg C, Jansson JK, Edlund C. Clindamycin-induced enrichment and long-term persistence of resistant Bacteroides spp. and resistance genes. JAntimicrob Chemother, 2006, 58: 1160-1167.
17. Hogenauer C, Hammer HF. Krejs GJ, Reisinger EC. Mechanism and management of antibiotic-associated diarrhoea. Clin Infect Dis, 1998, 27: 702-710.
18. Fuller R. Probiotics in man and animals. J. Appl. Bacteriol. , 1989, 66: 365-78.
, 1989, 66: 365-78.
19. Шендеров Б.А. Медико-физиологическое обоснование создания композиций синбиотиков для различных возрастных групп населения. Материалы научно-практической конференции «Новые пробиотические препараты в
комплексной терапии больных с дисбактери-озом кишечника». М., 2003: 6-8.
20. Mercenier A, Pavan S, Pot B. Probiotics as biother-apeutic agent: present khuwledge and future prospects. Curr. Pharm. Des., 2003, 9: 175-91.
21. Fuller R. Probiotic foods. Current use and future developments. Int. Food Ingred., 1993, 3: 23-6.
22. Lee Y-K, Salminen S. The coming ot age of probiotics. Trends Food Sci. technol,, 1995, 6: 241-5.
23. Fons M, Gomez A, Karjalainen T. Mechanisms of colonization and colonization resistance of the digestive tract. Microbial Ecol. Health Dis. Suppl., 2000, 2: 240-6.
Mechanisms of colonization and colonization resistance of the digestive tract. Microbial Ecol. Health Dis. Suppl., 2000, 2: 240-6.
24. Mack DR, Ahrne S, Hyde L, Wei S, Hollingsworth MA. Extracellular MUC3 mucin secretion follows adherence of Lactobacillus strains to intestinal epithelial cells in vitro. Gut, 2003, 52: 827-833.
25. Mack DR, Ahrne S, Hyde L, Wei S, Hollingsworth MA. Extracellular MUC3 mucin secretion follows adherence of Lactobacillus strains to intestinal epithelial cells in vitro. Gut, 2003, 52: 827-833.
26. Rao RK, Samak G. Protection and Restitution of Gut Barrier by Probiotics: Nutritional and Clinical Implications. Curr Nutr Food Sci, 2013, 9: 99-107.
27. Michetti P, Dorta G, Wiesel PH et al. Effect of whey-based culture supernatant of Lactobacillus acidophilus (johnsonii) La1 on Helicobacter pylori infection in human. Digestion, 1999, 60: 203-9.
Digestion, 1999, 60: 203-9.
28. Silva M, Jacobus NV, Deneke C et al. Antimicrobial substance from a human Lactobacillus strain. Antimicrob. Agents Chemother, 1987, 31: 1231-3.
29. Szajewska H, Canani RB, Guarino A, Hojsak
I, Indrio F, Kolacek S, Orel R, Shamir R, Vandenplas Y, van Goudoever JB, Weizman Z. ESPGHAN Working Group for ProbioticsPrebiotics. Probiotics for the Prevention of Antibiotic-Associated Diarrhea in Children. J Pediatr Gastroenterol Nutr, 2016 Mar, 62(3): 495-506. doi: 10.1097/ MPG.0000000000001081.
Влияние антибиотиков и пробиотиков на микробиом желудочно-кишечного тракта | Усенко
1. Kinch MS, Patridge E, Plummer M, Hoyer D. An analysis of FDA-approved drugs for infectious disease: antibacterial agents. Drug Discov Today, 2014, 19: 1283-7. doi:10.1016/j.drudis.2014.07.005.
Drug Discov Today, 2014, 19: 1283-7. doi:10.1016/j.drudis.2014.07.005.
2. Review on Antimibrobial Resistance. Antimicrobial resistance: tackling a crisis for the health and wealth of nations. 2014. http://amr-review.org/sites/default/files/AMR%20Review%20Paper%20-%20Tackling%20a%20crisis%20for%20the%20health%20and%20wealth%20of%20nations_1.pdf. Accessed 5 Apr 2016.
3. Guarner F, Malagelada J-R. Gut flora in health and disease. Lancet, 2003, 361: 512-9. doi:10.1016/S0140-6736(03)12489-0.
4. Holmes E, Loo RL, Stamler J, Bictash M, Yap IKS, Chan Q et al. Human metabolic phenotype diversity and its association with diet and blood pressure. Nature, 2008, 453: 396-400. doi:10.1038/nature06882.
5. McFarland LV. Evidence-based review of probiotics for antibiotic-associated diarrhea and Clostridium difficile infection. Anae-robe, 2009, 15: 274-280.
McFarland LV. Evidence-based review of probiotics for antibiotic-associated diarrhea and Clostridium difficile infection. Anae-robe, 2009, 15: 274-280.
6. LaRosa M, Bottaro G, Gulino N et al. Prevention of antibiotic-associated diarrhea with Lactobacillus sporogens and fructooligosaccharides in children: a multi-centric doubleblind vs. placebo study. Minerva Pediatr, 2003, 55: 447-52.
7. Turck D, Bernet JP, Marx J et al. Incidence and risk factors for of oral antibiotic-associated diarrhea in an outpatient pediatric population. J Pediatr Gastroenterol Nutr, 2003, 37: 22-6.
8. Hickson M, D’Souza A, Muthu N et al. Use of probiotic Lactobacillus preparation to prevent diarrhoea associated with antibiotics: randomised double blind placebo controlled trial. BMJ, 2007, 335: 80-5.
BMJ, 2007, 335: 80-5.
9. McFarland LV. Epidemiology, risk factors and treatments for antibiotic-associated diarrhea [review]. Dig Dis, 1998, 16: 292-307.
10. Ayyagari A, Agarwal J, Garg A. Antibiotic associated diarrhoea: Infectious causes. Indian Journal of Medical Microbiology, 2003, 21 (1): 6-11.
11. Barlett JG. Antibiotic-associated diarrhoea. N Engl J Med, 2002, 346: 334-339.
12. Boyce JM, Havill NL. Nosocomial antibioticassociated diarrhea associated with enterotoxin-producing strains of methicillin-resistant Staphylococcus aureus. Am J Gastroenterol, 2005 Aug, 100(8): 1828-34.
13. Jernberg C, Lofmark S, Edlund C, Jansson JK. Long-term ecological impacts of antibiotic administration on the human intestinal microbiota. Isme J, 2007, 1: 56-66.
Long-term ecological impacts of antibiotic administration on the human intestinal microbiota. Isme J, 2007, 1: 56-66.
14. Sjölund M, Tano E, Blaser MJ, Andersson DI, Engstrand L. Persistence of resistant Staphylococcus epidermidis after single course of clarithromycin. Emerg Infect Dis, 2005, 11: 1389-1393.
15. Jakobsson H, Wreiber K, Fall K, Fjelstad B, Nyren O et al. Macrolide resistance in the normal microbiota after Helicobacter pylori treatment. Scand J Infect Dis, 2007, 39: 757-763.
16. Löfmark S, Jernberg C, Jansson JK, Edlund C. Clindamycin-induced enrichment and longterm persistence of resistant Bacteroides spp. and resistance genes. J Antimicrob Chemother, 2006, 58: 1160-1167.
17. Hogenauer C, Hammer HF. Krejs GJ, Reisinger EC. Mechanism and management of antibioticassociated diarrhoea. Clin Infect Dis, 1998, 27: 702-710.
Hogenauer C, Hammer HF. Krejs GJ, Reisinger EC. Mechanism and management of antibioticassociated diarrhoea. Clin Infect Dis, 1998, 27: 702-710.
18. Fuller R. Probiotics in man and animals. J. Appl. Bacteriol., 1989, 66: 365-78.
19. Шендеров Б.А. Медико-физиологическое обоснование создания композиций синбиотиков для различных возрастных групп населения. Материалы научно-практической конференции «Новые пробиотические препараты в комплексной терапии больных с дисбактериозом кишечника». М., 2003: 6-8.
20. Mercenier A, Pavan S, Pot B. Probiotics as biotherapeutic agent: present khuwledge and future prospects. Curr. Pharm. Des., 2003, 9: 175-91.
21. Fuller R. Probiotic foods. Current use and future developments. Int. Food Ingred., 1993, 3: 23-6.
Int. Food Ingred., 1993, 3: 23-6.
22. Lee Y-K, Salminen S. The coming ot age of probiotics. Trends Food Sci. technol., 1995, 6: 241-5.
23. Fons M, Gomez A, Karjalainen T. Mechanisms of colonization and colonization resistance of the digestive tract. Microbial Ecol. Health Dis. Suppl., 2000, 2: 240-6.
24. Mack DR, Ahrne S, Hyde L, Wei S, Hollingsworth MA. Extracellular MUC3 mucin secretion follows adherence of Lactobacillus strains to intestinal epithelial cells in vitro. Gut, 2003, 52: 827-833.
25. Mack DR, Ahrne S, Hyde L, Wei S, Hollingsworth MA. Extracellular MUC3 mucin secretion follows adherence of Lactobacillus strains to intestinal epithelial cells in vitro. Gut, 2003, 52: 827-833.
26. Rao RK, Samak G. Protection and Restitution of Gut Barrier by Probiotics: Nutritional and Clinical Implications. Curr Nutr Food Sci, 2013, 9: 99-107.
27. Michetti P, Dorta G, Wiesel PH et al. Effect of whey-based culture supernatant of Lactobacillus acidophilus (johnsonii) La1 on Helicobacter pylori infection in human. Digestion, 1999, 60: 203-9.
28. Silva M, Jacobus NV, Deneke C et al. Antimicrobial substance from a human Lactobacillus strain. Antimicrob. Agents Chemother, 1987, 31: 1231-3.
29. Szajewska H, Canani RB, Guarino A, Hojsak I, Indrio F, Kolacek S, Orel R, Shamir R, Vandenplas Y, van Goudoever JB, Weizman Z. ESPGHAN Working Group for ProbioticsPrebiotics. Probiotics for the Prevention of Antibiotic-Associated Diarrhea in Children. J Pediatr Gastroenterol Nutr, 2016 Mar, 62(3): 495-506. doi: 10.1097/MPG.0000000000001081.
J Pediatr Gastroenterol Nutr, 2016 Mar, 62(3): 495-506. doi: 10.1097/MPG.0000000000001081.
Восстановление организма после приёма антибиотиков
Сейчас практически всё человечество переживает непростой период — страны охвачены новой, малоизученной инфекцией — COVID-19. Большое количество людей уже столкнулись с этим недугом и благополучно поправились — но не без помощи антибиотиков. Ни для кого не секрет, что прием антибиотиков не только избавляет человека от болезнетворных бактерий, но и, к сожалению, наносит здоровью некоторый сопутствующий вред.Нежелательные последствия приёма антибиотиков заключаются в том, что антибактериальные препараты убивают не только патогенные микроорганизмы, но и полезную микрофлору, населяющую кишечник. К тому же от химических составляющих таблеток страдает и печень, поскольку через неё происходит процесс вывода лекарственных средств из организма.

Именно поэтому после приёма антибиотиков нужно помочь своему организму в восстановлении.
Восстановление микрофлоры кишечника и иммунитета
Длительный приём антибиотиков значительно ухудшает микрофлору кишечника. Последствиями такого нарушения могут быть запоры, боль в животе, чрезмерное газообразование и, как следствие, вздутие живота. Из-за нарушения работы кишечника происходит и снижение иммунитета, т. к. 60% иммунных клеток производится именно в кишечнике.
Для предотвращения нарушений микробиоты кишечника следует принимать пробиотики. Это нужно делать как во время лечения антибиотиками, так и после, ведь лакто- и бифидобактерии повышают неспецифическую резистентность организма, активизируют иммунную систему, синтезируют в кишечнике витамины группы K, B, аминокислоты, усиливают пристеночное кишечное пищеварение, процессы всасывания кальция, железа, витамина D.
Рекомендуем следующие препараты:
• БАК-СЕТ Колд/Флю* — новинка английского производства, содержащая в себе 17 штаммов полезных бактерий, которые усиливают действие друг друга. Не содержит лактозу, ГМО, искусственные красители, поэтому может быть предложена взрослым и детям с 2 лет.
Не содержит лактозу, ГМО, искусственные красители, поэтому может быть предложена взрослым и детям с 2 лет.
• Иммуцил* — помимо бифидобактерий содержит в составе витамин C и цинк — неотъемлемых соратников крепкого иммунитета. Удобная форма выпуска (порошок, растворяемый в полости рта) позволит получать лечение без отрыва от повседневных дел.
• Синобактин Forte* — это зарубежное средство производства Канады. Доступная цена, удобный прием (1 капсула 1 раз в день), не требует хранения в холодильнике.
• Флорасан-D* — препарат, входящий в отраслевой стандарт лечения синдрома раздраженного кишечника (утвержден Российской гастроэнтерологической ассоциацией). Не содержит генетически модифицированных микроорганизмов, лактозу, глютен и сахарозу, поэтому может быть рекомендован покупателям, страдающим непереносимостью этих
веществ.
• Бифицин* — препарат произведен по стандартам GMP в США. Благодаря особенности капсул, изготовленных по технологии Bifi Guard®, полезные бактерии защищены от кислого содержимого желудочного сока, солей желчи и пищеварительных ферментов. Такая защита позволяет им беспрепятственно пройти желудок, адаптироваться и прижиться в просвете кишечника, сохранив высокую биологическую активность. Восстановление микрофлоры влагалища Попадая в организм, антибиотики борются с возбудителем инфекции, но одновременно губят и другие микроорганизмы, полезные, в том числе — лактобактерии. Именно лактобактерии защищают вагинальную среду от активации патогенов.
Такая защита позволяет им беспрепятственно пройти желудок, адаптироваться и прижиться в просвете кишечника, сохранив высокую биологическую активность. Восстановление микрофлоры влагалища Попадая в организм, антибиотики борются с возбудителем инфекции, но одновременно губят и другие микроорганизмы, полезные, в том числе — лактобактерии. Именно лактобактерии защищают вагинальную среду от активации патогенов.
При снижении концентрации полезных лактобактерий происходит разрастание вредных микроорганизмов, вызывающих нежелательную симптоматику. Как правило, патогены более активны и агрессивны, они успевают размножиться раньше, чем приходит в норму содержание «хороших» бактерий. В итоге возникает дисбиоз влагалища.
Одним из самых распространенных результатов такого дисбиоза после приема антибиотиков является кандидоз. Его симптомы: появление нетипичных выделений, которые отличаются по плотности, консистенции, цвету и запаху, зуд, жжение и раздражение. Точный диагноз может поставить только врач, — но в связи со сложившейся неблагоприятной эпидемиологической обстановкой покупатель может обратиться к фармацевту за рекомендацией и покупкой безрецептурных препаратов. Это препараты на основе флуконазола:
Это препараты на основе флуконазола:
Дифлюкан и Флуконазол Медисорб. Если течение заболевания не очень тяжелое, достаточно будет однократного приема 150 г. препарата. При рецидивирующем хроническом течении нужно немедленно обратиться к врачу.
Если же покупательнице более привычна такая лекарственная форма, как вагинальные суппозитории, рекомендуем препараты на основе натамицина (Пимафуцин, Экофуцин, Примафунгин) или сертаконазола (Залаин). Последний станет настоящим спасением для женщин, не любящих длительное лечение.
Также не стоит забывать, что микрофлора влагалища нуждается в восстановлении. Приём Синобактин Forte* отлично скажется на женском здоровье — он содержит штамм Lactobacillus сasei HA-108,который не только способствует восстановлению микробиома, но и помогает снизить риск повторного возникновения молочницы.
Восстановление печени
Печень выполняет множество функций, в том числе нейтрализует токсичные вещества, которые попали в наш организм. Приём антибиотиков, особенно длительный, может привести к развитию острого токсического гепатита и печеночного холестаза, кроме того, может негативно влиять на желчные протоки. Исходя из этого можно с уверенностью сказать, что после приёма антибиотиков печень нуждается в восстановлении, причём даже в том случае, если негативные последствия незаметны.
Приём антибиотиков, особенно длительный, может привести к развитию острого токсического гепатита и печеночного холестаза, кроме того, может негативно влиять на желчные протоки. Исходя из этого можно с уверенностью сказать, что после приёма антибиотиков печень нуждается в восстановлении, причём даже в том случае, если негативные последствия незаметны.
Для поддержания работы печени следует обратить внимание на следующие средства:
• Комплекс экстрактов овса и расторопши*. Экстракт расторопши способствует регенерации клеток печени и скорейшей замене гибнущих клеток молодыми. Экстракт овса полезен при интоксикации организма, так как способствует выведению из печени вредных веществ. Также он улучшает процессы образования желчи и её выведения, тем самым ускоряя разложение токсинов и последующее их удаление из организма.
• Катрилан* содержит силимарин, при помощи которого происходит активация синтеза белков в повреждённых клетках печени — это способствует их восстановлению. Одной упаковки препарата хватает на курс приёма.
Одной упаковки препарата хватает на курс приёма.
• Эсфолил* — богатый источник эссенциальных фосфолипидов, которые способны восстанавливать повреждённые стенки клеток, тем самым защищая печень от вредных воздействий.
• Лецират* содержит экстракт артишока, который улучшает дезинтоксикационную функцию печени, и лецитин — вещество, из которого строятся стенки клеточных мембран, поэтому его приём стимулирует регенерацию повреждённых клеток печени.
После перенесённого заболевания организм человека ослаблен и уязвим для новых инфекций, поэтому ему требуется определенная поддержка, а значит, следует позаботиться о приёме таких средств, как витамин C, цинк, витамин D и витаминно-минеральные комплексы (ВМК).
• Verrum-Vit* — в серии представлены ВМК для детей и взрослых, а новая форма выпуска (шипучие таблетки) позволит удовлетворить запросы всех покупателей.
• Цинк* и Цинкорол*. Исследования показывают, что цинк может препятствовать молекулярному процессу, который вызывает образование слизи и размножение бактерий в носовых проходах. Цинк оказывает антивирусное действие, присоединяясь к рецепторам в носовых эпителиальных клетках и блокируя их влияние.
Цинк оказывает антивирусное действие, присоединяясь к рецепторам в носовых эпителиальных клетках и блокируя их влияние.
• Витамин D запускает в клетках кожи и эпителия респираторного и желудочнокишечного трактов синтез собственных антимикробных веществ, уничтожающих вирусы, бактерии и грибы, благодаря чему способствует снижению риска развития простудных заболеваний. Рекомендуем капли (ДэТриФерол, Детримакс*), таблетки (Детримакс*, Космо-D3*) или капсулы (Витамин D* 400 и 2000 мг), исходя из дозировок и предпочтений.
Вовремя принятые меры помогут вам не только перенести лечение с наименьшими последствиями, но и защитить свое здоровье в будущем!
ИМЕЮТСЯ ПРОТИВОПОКАЗАНИЯ, НЕОБХОДИМО ОЗНАКОМИТЬСЯ С ИНСТРУКЦИЕЙ ИЛИ ПРОКОНСУЛЬТИРОВАТЬСЯ СО СПЕЦИАЛИСТОМ.
БИОЛОГИЧЕСКИ АКТИВНАЯ ДОБАВКА. НЕ ЯВЛЯЕТСЯ ЛЕКАРСТВЕННЫМ ПРЕПАРАТОМ.
Как антибиотики и другие препараты влияют на микробиоту кишечника
Мы получили много вопросов об антибиотиках и решили подготовить материал о том, как на микробиоту влияют разные лекарства.
 Рассказываем о самых популярных.
Рассказываем о самых популярных.Антибиотики
Антибиотики — вид препаратов, которые уничтожают бактерии, уменьшают их размножение и распространение. Их используют для лечения бактериальных инфекций и только в тех случаях, когда без них не обойтись. По типу действия антибиотики можно разделить на два вида: бактерицидные и бактериостатические. Первые убивают микроорганизмы, а вторые не дают им размножаться.
Также антибиотики бывают широкого спектра и узконаправленные. В первом случае они бьют по разным видам микроорганизмов, во втором — только по определенным штаммам. Как правило, если неизвестно, какая бактерия привела к развитию симптомов — применяют антибиотики широкого спектра.
Исследование семи разных антибиотиков на мышах показало, что с высоким ростом патогена C. difficile связаны цефоперазон, метронидазол и стрептомицин. А наибольший рост бактерии ассоциирован с приемом ампицилина.
Часто для лечения заболеваний используется комплекс из нескольких антибиотиков.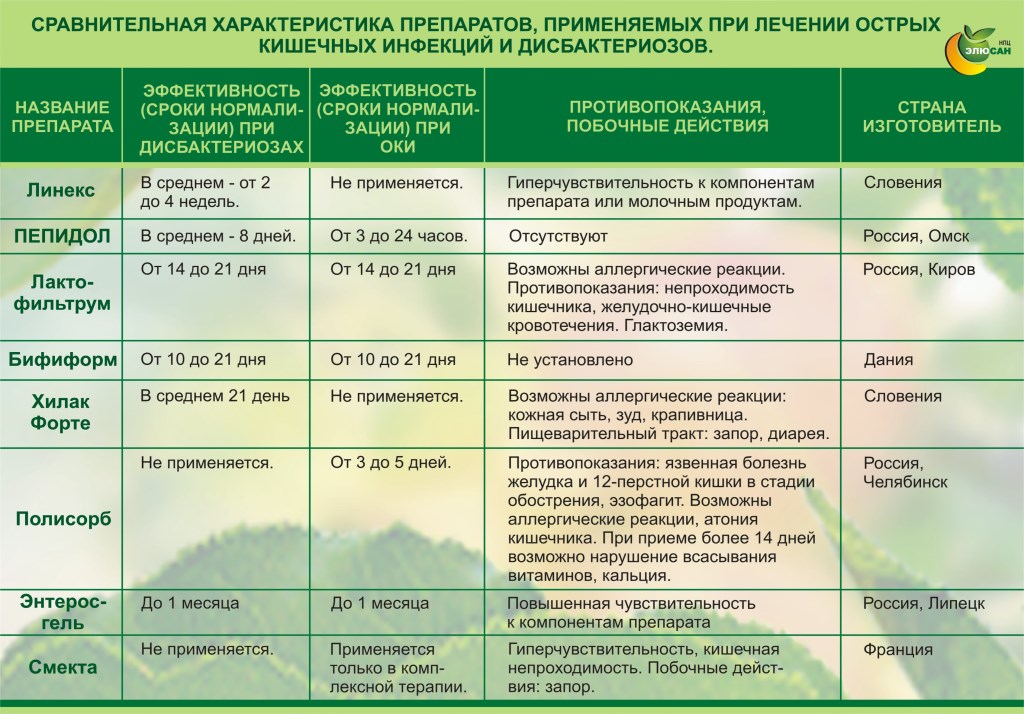 Чтобы изучить влияние терапии в этом случае, исследователи Университета Копенгагена отобрали 12 мужчин после 4-дневного лечения меропенемом, гентамицином и ванкомицином.
Чтобы изучить влияние терапии в этом случае, исследователи Университета Копенгагена отобрали 12 мужчин после 4-дневного лечения меропенемом, гентамицином и ванкомицином.
Лечение привело почти к полному уничтожению микробиоты. Спустя 6 месяцев большинство видов смогло восстановиться и вернуться к прежним уровням, однако участникам все равно не хватало 9 полезных представителей микробиоты, которые были в кишечнике до лечения.
Не все бактерии восстанавливаются после бомбардировки антибиотиками. Некоторые виды пропадают навсегда.
Антибиотики по-разному воздействуют на микробиоту в зависимости от способа поступления в организм. Пероральный прием антибиотиков гораздо сильнее стимулирует развитие устойчивости, чем введение препарата в вену.
Ответ микробиоты на лечение антибиотиками зависит еще от индивидуальных особенностей, таких как возраст, образ жизни и состав бактерий в кишечнике. Например, их применение у новорожденных и младенцев приводит к нарушениям развития разнообразной и сбалансированной микробиоты. Также антибиотики ослабляют микробиоту внутриутробно, когда беременная женщина проходит терапию.
Также антибиотики ослабляют микробиоту внутриутробно, когда беременная женщина проходит терапию.
Исследователи приходят к тому, что антибиотики должны подбираться индивидуально, как химиотерапия для лечения рака. Уже сегодня разрабатываются алгоритмы, которые смогут по образцу микробиоты предсказать, как бактерии отреагируют на лечение антибиотиками. Для восстановления кишечника после терапии применяют пробиотические бактерии.
Видео о том, как бактерии становятся устойчивыми к антибиотикам, и почему это ведет к кризису в лечении заболеваний. Есть русские субтитры.Обезболивающее
Нестероидные противовоспалительные средства (НПВС), или по-простому обезболивающие, применяются для избавления от боли, уменьшения воспаления и снижения температуры. К обезболивающим относится ибупрофен, аспирин, напроксен, диклофенак, мефенамовая кислота, индометацин и другие препараты. Несмотря на похожие свойства, парацетамол не относится к НПВС.
Несмотря на похожие свойства, парацетамол не относится к НПВС.
Исследование образцов микробиоты 155 взрослых, которые за последние 30 дней приняли обезболивающие препараты хотя бы один раз, показало, что на изменения сильнее влияет тип лекарства, а не количество. Кетопрофен, напроксен и кеторолак агрессивнее действуют на желудочно-кишечный тракт, чем ибупрофен и целекосиб.
Кроме того состав микробиоты отличался, когда НПВС применяли вместе с другими лекарствами, например антидепрессантами, слабительными и ингибиторами протонной помпы.
В недавнем исследовании на мышах выяснилось, что обезболивающий препарат индометацин усугубляет течение инфекции C. difficile. Ученые предполагают, что ибупрофен и аспирин работают так же, потому что у этих лекарств схожий механизм действия. Однако нужно больше исследований, чтобы это выяснить.
Асперин вероятно уменьшает представленность бактерий, связанных с развитием рака прямой кишки. Низкие дозы этого препарата часто назначают принимать регулярно тем, у кого высокий риск болезней сердца и сосудов. С другой стороны, прием аспирина увеличивает риск кровотечений в ЖКТ.
С другой стороны, прием аспирина увеличивает риск кровотечений в ЖКТ.
Антидепрессанты
Антидепрессанты — препараты, которые применяются для лечения депрессии. Есть разные виды этих лекарств, но самые распространенные — ингибиторы обратного захвата серотонина и/или норэпинефрина. Известно, что микробиота кишечника влияет на производство серотонина, гамма-аминомасляной кислоты (ГАМК) и дофамина — нейромедиаторов, от которых зависит наше настроение и самочувствие.
Сравнение образцов микробиоты пациентов с депрессией и здоровых взрослых показало, что у первых было больше бактерии Flavonifractor. В другом исследовании выяснили, что микробиота людей с депрессией, которые принимали антидепрессанты, содержит меньше бактерий Coprococcus и Dialister.
Исследования в пробирке (in vitro) показывают, что лекарства от депрессии обладают и антибактериальными свойствами. Влияние антидепрессантов изучали также на мышах. У них препараты ухудшали разнообразие и меняли состав бактерий кишечника..gif)
Предполагается, что часть положительного эффекта от приема антидепрессантов происходит из-за изменений микробиоты.
Однако к этому исследованию стоит относиться осторожно: антидепрессанты вводили прямо в брюшко, чтобы добиться определенных концентраций, поэтому на результат мог повлиять стресс, который испытывали животные. Исследователи предполагают, что часть положительного эффекта антидепрессантов обусловлена воздействием на микробиоту.
Видео, как наш организм переваривает лекарства. Есть русские субтитры.Ингибиторы протонной помпы
Ингибиторы протонной помпы (ИПП) используются для лечения заболеваний желудочно-кишечного тракта. Часто их назначают при язвенной болезни желудка и двенадцатиперстной кишки, диспепсии, хроническом гастрите, дуодените и панкреатите..gif)
Каждая клетка желудка содержит так называемую протонную помпу, от активности которой зависит производство кислоты для переваривания пищи. Иногда кислоты становится много, и она начинает разрушать здоровые клетки. Ингибиторы подавляют ее производство.
В другом исследовании сравнивали изменения микробиоты до и после курса приема ИПП. Оказалось, что у пациентов после лечения была выше представленность Lactobacillus — пробиотической бактерии, которая обычно связана со здоровьем кишечника. Исследователи отмечают, что большая представленность Lactobacillus встречается у пациентов с сахарным диабетом 2 типа и болезнью Паркинсона. Поэтому остается неясным, полезно ли в этом случае увеличение доли бактерии.
Разнообразие бактерий после приема ИПП уменьшается. Ученые предполагают, что это главная причина повышения риска инфекций и воспаления после приема препаратов.
От состояния микробиоты может зависеть, насколько хорошо или плохо будет действовать тот или иной препарат.
Сейчас доступно множество лекарств, и каждая микробиота может реагировать на них по-разному, уменьшая или улучшая свойства препарата. В будущем мы сможем подбирать более эффективные препараты в зависимости от состава бактерий кишечника (как по вариантам генов в фармакогенетике), но до этого еще далеко. Большую часть взаимодействий между организмом, бактериями и лекарствами еще предстоит изучить.
Узнать свой состав бактерий кишечника можно с помощью Теста микробиоты. Мы анализируем ДНК бактерий кишечника, что позволяет получить гораздо больше данных в сравнении с обычным посевом в питательной среде.
- Palleja, A., Mikkelsen, K. H., Forslund, S. K., Kashani, A., Allin, K. H., Nielsen, T., Hansen, T. H., Liang, S., Feng, Q., Zhang, C., Pyl, P. T., Coelho, L. P., Yang, H., Wang, J., Typas, A., Nielsen, M. F., Nielsen, H. B., Bork, P., Wang, J., … Pedersen, O. (2018). Recovery of gut microbiota of healthy adults following antibiotic exposure.
 Nature Microbiology, 3(11), 1255–1265
Nature Microbiology, 3(11), 1255–1265 - Zhang, L., Huang, Y., Zhou, Y., Buckley, T., & Wang, H. H. (2013). Antibiotic Administration Routes Significantly Influence the Levels of Antibiotic Resistance in Gut Microbiota. Antimicrobial Agents and Chemotherapy, 57(8), 3659–3666..
- Ianiro, G., Tilg, H., & Gasbarrini, A. (2016). Antibiotics as deep modulators of gut microbiota: between good and evil. Gut, 65(11), 1906–1915.
- Rogers, M. A. M., & Aronoff, D. M. (2016). The influence of non-steroidal anti-inflammatory drugs on the gut microbiome. Clinical Microbiology and Infection, 22(2), 178.e1-178.e9.
- Common pain relievers may worsen C. difficile infection
- Jiang, H., Ling, Z., Zhang, Y., Mao, H., Ma, Z., Yin, Y., Wang, W., Tang, W., Tan, Z., Shi, J., Li, L., & Ruan, B. (2015). Altered fecal microbiota composition in patients with major depressive disorder. Brain, Behavior, and Immunity, 48, 186–194.
- Munoz-Bellido, J. ., Munoz-Criado, S.
 , & Garcı̀a-Rodrı̀guez, J. . (2000). Antimicrobial activity of psychotropic drugs. International Journal of Antimicrobial Agents, 14(3), 177–180.
, & Garcı̀a-Rodrı̀guez, J. . (2000). Antimicrobial activity of psychotropic drugs. International Journal of Antimicrobial Agents, 14(3), 177–180. - Lukić, I., Getselter, D., Ziv, O., Oron, O., Reuveni, E., Koren, O., & Elliott, E. (2019). Antidepressants affect gut microbiota and Ruminococcus flavefaciens is able to abolish their effects on depressive-like behavior. Translational Psychiatry, 9(1).
- Prizment, A. E., Menk, J., Staley, C., Vivek, S., Onyeaghala, G., Thyagarajan, B., … Church, T. (2019). Abstract 5060: Effect of aspirin on gut microbiome in a pilot randomized double-blind trial. Epidemiology. Presented at the Proceedings: AACR Annual Meeting 2019; March 29-April 3, 2019; Atlanta, GA.
Бактериальный гастроэнтерит Лекарства: антибиотики
Guandalini S, Pensabene L, Zikri MA, et al. Lactobacillus GG, вводимый в растворе для пероральной регидратации детям с острой диареей: многоцентровое европейское исследование. J Педиатр Гастроэнтерол Нутр . 2000 30 января (1): 54-60. [Медлайн].
J Педиатр Гастроэнтерол Нутр . 2000 30 января (1): 54-60. [Медлайн].
Simakachorn N, Pichaipat V, Rithipornpaisarn P, et al. Клиническая оценка добавления лиофилизированных, убитых нагреванием Lactobacillus acidophilus LB к пероральной регидратационной терапии при лечении острой диареи у детей. J Педиатр Гастроэнтерол Нутр . 2000, 30 января (1): 68-72. [Медлайн].
Дугган С., Нурко С. «Питание кишечника»: научная основа непрерывного энтерального питания при острой диарее. J Педиатр . 1997 декабрь 131 (6): 801-8. [Медлайн].
Салминен С., Изолаури Э., Оннела Т. Флора кишечника в нормальном и неупорядоченном состоянии. Химиотерапия . 1995. 41 прил. 1: 5-15. [Медлайн].
Марки МИ.Инфекционная диарея: введение и комментарий. Педиатр Энн . 1994 23 октября (10): 526-7. [Медлайн].
Педиатр Энн . 1994 23 октября (10): 526-7. [Медлайн].
Liebelt EL. Клиническая и лабораторная оценка и ведение детей с рвотой, диареей и обезвоживанием. Curr Opin Pediatr . 1998.10.10 (5): 461-9. [Медлайн].
Хамер Д.Х., Горбач С.Л. Инфекционная диарея и бактериальное пищевое отравление. Feldman M, Scharschmidt BF, Sleisenger MH, ред. Болезни желудочно-кишечного тракта и печени Слайзингера и Фордтрана .6-е изд. Филадельфия, Пенсильвания: У. Б. Сондерс; 1998. 1594-1632.
Xu F, Gonzalez-Escalona N, Haendiges J, et al. Vibrio parahaemolyticus, последовательность типа 631, новый патоген пищевого происхождения в Северной Америке. Дж. Клин Микробиол . 2016 14 декабря. [Medline].
Кэдл Р.М., Мансури М.Д., Логан Н.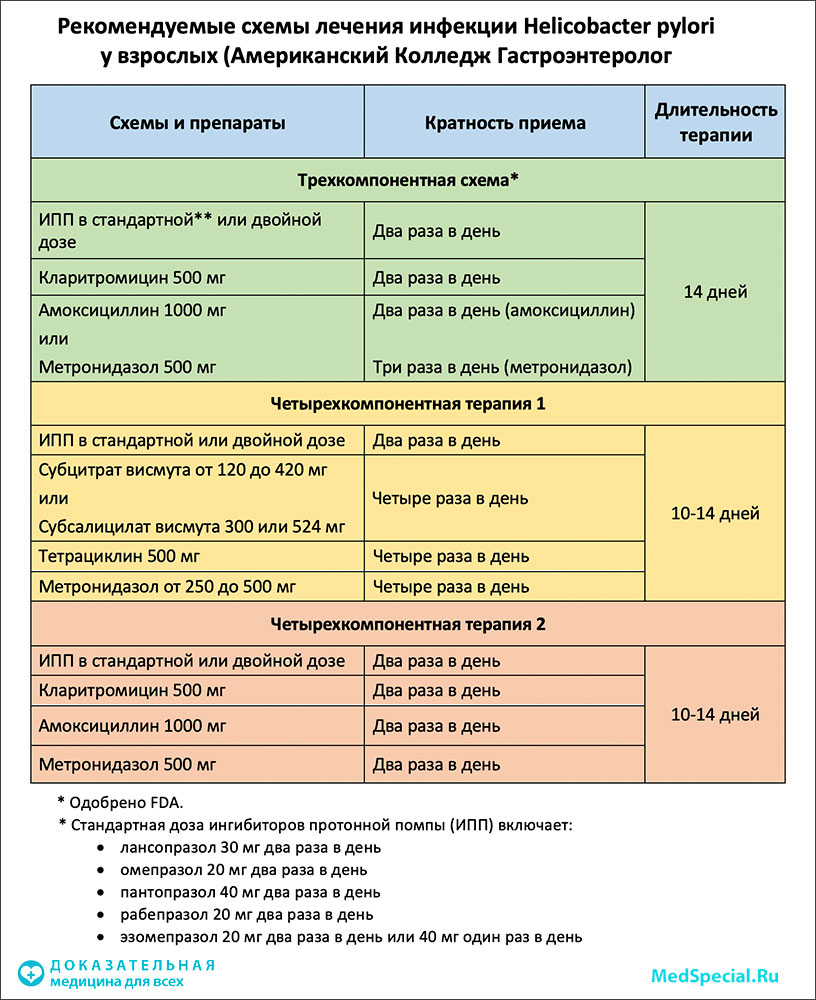 , Кудва Д.Р., Мушер Д.М. Связь ингибиторов протонной помпы с исходами колита Clostridium difficile. Am J Health Syst Pharm . 2007 15 ноя.64 (22): 2359-63. [Медлайн].
, Кудва Д.Р., Мушер Д.М. Связь ингибиторов протонной помпы с исходами колита Clostridium difficile. Am J Health Syst Pharm . 2007 15 ноя.64 (22): 2359-63. [Медлайн].
Wei L, Ratnayake L, Phillips G, et al. Лекарства для подавления кислоты и бактериальный гастроэнтерит: популяционное когортное исследование. Br J Clin Pharmacol . 2017 5 января. 27 (1): 40-51. [Медлайн].
Штеффен Р., Коллард Ф., Торнипорт Н. и др. Эпидемиология, этиология и влияние диареи путешественников на Ямайке. JAMA . 1999, 3 марта. 281 (9): 811-7. [Медлайн]. [Полный текст].
Streit JM, Jones RN, Toleman MA, Stratchounski LS, Fritsche TR.Распространенность и чувствительность к противомикробным препаратам среди возбудителей гастроэнтерита, выявленных в Европе и Латинской Америке, и изолятов сальмонеллы, выделенных при инфекциях кровотока в Северной Америке и Латинской Америке: отчет программы SENTRY Antimicrobial Surveillance Programme (2003). Int J Антимикробные агенты . 2006 май. 27 (5): 367-75. [Медлайн].
Vital Signs: Preventing Clostridium difficile. MMWR Morb Mortal Wkly Rep .2012 9 марта. 61: 157-62. [Медлайн].
Всемирная организация здравоохранения. Холера: информационный бюллетень № 107. Ноябрь 2008 г. Доступно по адресу http://www.who.int/mediacentre/factsheets/fs107/en/. Доступ: 19 февраля 2009 г.
May FJ, Polkinghorne BG, Fearnley EJ. Эпидемиология вспышек пищевого гастроэнтерита, опосредованного бактериальным токсином, в Австралии, 2001–2013 гг. Commun Dis Intell Q Rep . 2016 24 декабря. 40 (4): E460-E469. [Медлайн].
Ли Л.А., Гербер А.Р., Лонсвей Д.Р. и др.Yersinia enterocolitica O: 3 инфекции у младенцев и детей, связанные с домашним приготовлением детенышей. N Engl J Med . 1990, апр. 5. 322 (14): 984-7. [Медлайн].
Центры по контролю и профилактике заболеваний. Yersinia enterocolitica. 25 октября 2005 г. Доступно по адресу http://www.cdc.gov/ncidod/dbmd/diseaseinfo/yersinia_g.htm. Доступ: 18 февраля 2009 г.
Центры по контролю и профилактике заболеваний (CDC). Смертность от гастроэнтерита увеличилась вдвое.Доступно по адресу http://www.cdc.gov/media/releases/2012/p0314_gastroenteritis.html.
Гарсия Родригес Л.А., Руигомес А., Панес Дж. Острый гастроэнтерит сопровождается повышенным риском воспалительного заболевания кишечника. Гастроэнтерология . 2006 май. 130 (6): 1588-94. [Медлайн].
Calbo E, Freixas N, Xercavins M, et al. Нозокомиальная вспышка пищевого происхождения Klebsiella pneumoniae, продуцирующая SHV1 и CTX-M-15: эпидемиология и меры борьбы. Clin Infect Dis .2011 Март 52 (6): 743-9. [Медлайн].
Бисвас Дж. С., Аль-Али А., Раджпут П., Смит Д., Гольденберг С. Д.. Параллельное исследование диагностической точности трех молекулярных панелей для выявления бактериального гастроэнтерита. евро J Clin Microbiol Infect Dis . 2014 ноябрь 33 (11): 2075-81. [Медлайн].
Хамфрис, Линскотт, AJ. Лабораторная диагностика бактериального гастроэнтерита. Clin Microbiol Ред. . 2015 28 января (1): 3-31. [Медлайн].
Коди Ш., Эббот С.Л., Марфин А.А. и др. Две вспышки инфекции Salmonella serotype typhimurium DT104 с множественной лекарственной устойчивостью, связанной с сыром из сырого молока, в Северной Калифорнии. JAMA . 1999, 19 мая. 281 (19): 1805-10. [Медлайн]. [Полный текст].
Всемирная организация здравоохранения. Устойчивые к лекарствам сальмонеллы: информационный бюллетень № 139. Отредактировано в апреле 2005 г. Доступно по адресу http://www.who.int/mediacentre/factsheets/fs139/en/. Доступ: 19 февраля 2009 г.
Guandalini S, Dincer AP. Управление питанием при диарейных заболеваниях. Байер Клин Гастроэнтерол . 1998 12 декабря (4): 697-717. [Медлайн].
Салливан ПБ. Питание при острой диарее. Питание . 1998, 14 октября (10): 758-62. [Медлайн].
Ruiz-Palacios GM, Perez-Schael I, Velazquez FR, et al., Для группы изучения вакцины против ротавируса человека. Безопасность и эффективность аттенуированной вакцины против тяжелого ротавирусного гастроэнтерита. N Engl J Med . 2006, 5 января. 354 (1): 11-22. [Медлайн]. [Полный текст].
Brooks M. FDA одобрило новый тест на инфекционный гастроэнтерит. Медицинские новости Medscape. 15 января 2013 г. Доступно по адресу http://www.medscape.com/viewarticle/777671. Доступ: 9 февраля 2013 г.
DuPont HL, Комитет параметров практики Американского колледжа гастроэнтерологии. Рекомендации по острой инфекционной диарее у взрослых. Ам Дж. Гастроэнтерол .1997 ноябрь 92 (11): 1962-75. [Медлайн].
Гарсия Родригес Л.А., Руигомес А., Панес Дж. Использование препаратов, подавляющих кислотность, и риск бактериального гастроэнтерита. Клин Гастроэнтерол Гепатол . 2007 декабрь 5 (12): 1418-23. [Медлайн].
Gibreel A, Taylor DE. Устойчивость к макролидам у Campylobacter jejuni и Campylobacter coli. J Antimicrob Chemother . 2006 августа 58 (2): 243-55. [Медлайн]. [Полный текст].
Каур С., Вайшнави С., Прасад К.К., Рэй П., Кочхар Р.Сравнительная роль антибиотика и ингибитора протонной помпы в экспериментальной инфекции Clostridium difficile у мышей. Микробиол Иммунол . 2007. 51 (12): 1209-14. [Медлайн]. [Полный текст].
Mines D, Stahmer S, Shepherd SM. Отравления: пища, рыба, моллюски. Emerg Med Clin North Am . 1997 15 февраля (1): 157-77. [Медлайн].
Натаро Дж. П., Штайнер Т., Геррант Р.Л. Энтероагрегантная кишечная палочка. Emerg Infect Dis .1998 апрель-июнь. 4 (2): 251-61. [Медлайн].
Патерсон DL. Устойчивость к грамотрицательным бактериям: Enterobacteriaceae. Am J Med . 2006 июн. 119 (6 приложение 1): S20-8; обсуждение С62-70. [Медлайн].
Родригес Л.А., Руигомес А. Повышенный риск синдрома раздраженного кишечника после бактериального гастроэнтерита: когортное исследование. BMJ . 1999, 27 февраля. 318 (7183): 565-6. [Медлайн]. [Полный текст].
Трахтман Х, Кристен Э.Патогенез, лечение и терапевтические испытания при гемолитико-уремическом синдроме. Curr Opin Pediatr . 1999 г., 11 (2): 162-8. [Медлайн].
Wong CS, Jelacic S, Habeeb RL, Watkins SL, Tarr PI. Риск гемолитико-уремического синдрома после лечения антибиотиками инфекций, вызванных Escherichia coli O157: H7. N Engl J Med . 2000, 29 июня. 342 (26): 1930-6. [Медлайн]. [Полный текст].
Campylobacter (кампилобактериоз). Центры по контролю и профилактике заболеваний (CDC).Доступно по адресу https://www.cdc.gov/campylobacter/technical.html. Доступ: 15 февраля 2018 г.
Кайперс В.Л., Джейкобс Дж., Вонг В., Клемм Э.Дж., Деборггрейв С., Ван Пуйвельде С. Устойчивость к фторхинолонам у сальмонелл: выводы с помощью секвенирования всего генома. Микроб Геном . 2018 5 июля. [Medline].
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США. FDA обновляет предупреждения для фторхинолоновых антибиотиков о рисках для психического здоровья и побочных реакциях на низкий уровень сахара в крови.Доступно на https://www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/ucm612995.htm. 10 июля 2018 г .; Доступ: 18 июля 2018 г.
Frellick M. FDA: Более строгие предупреждения о фторхинолонах для психического здоровья и гипогликемии. Доступно на https://www.medscape.com/viewarticle/899142. 10 июля 2018 г .; Доступ: 18 июля 2018 г.
Mylius M, Dreesman J, Pulz M и др. Escherichia coli O103, продуцирующая токсин шига: вспышка вируса h3 в Германии после школьной поездки в Австрию из-за сырого коровьего молока, 2017 г. – Важная роль международного сотрудничества в расследовании вспышек. Int J Med Microbiol . 2018 июл.308 (5): 539-44. [Медлайн].
Кальдераро А., Мартинелли М., Буттрини М. и др. Вклад панели FilmArray (R) Gastrointestinal Panel в лабораторную диагностику гастроэнтерита в когорте детей: двухлетнее проспективное исследование. Int J Med Microbiol . 2018 июл.308 (5): 514-21. [Медлайн].
Гольденберг Дж. З., Яп С., Литвин Л. и др. Пробиотики для профилактики диареи, связанной с Clostridium difficile, у взрослых и детей. Кокрановская база данных Syst Rev . 2017 19 декабря. 12: CD006095. [Медлайн].
Сурана Н.К., Каспер Д.Л. Выходя за рамки ассоциаций микробиома, к идентификации причинных микробов. Природа . 2017 декабрь 14, 552 (7684): 244-7. [Медлайн].
[Рекомендации] Беренджер Б., Чуй Л., Реймер А.Р. и др., Для Канадской сети лабораторий общественного здравоохранения. Заявление о позиции Канадской сети лабораторий общественного здравоохранения: Диагностика гастроэнтерита, не основанная на культуре, и значение для исследований в области общественного здравоохранения. Can Commun Dis Rep . 2017 декабрь 7. 43 (12): 279-81. [Медлайн].
Ли Х., Ку Х.Дж., Ли Д.Х. и др. Характеристика и геномное исследование нового бактериофага HY01, инфицирующего Escherichia coli O157: H7 и Shigella flexneri: потенциал в качестве агента биоконтроля в пище. PLoS One . 2016. 11 (12): e0168985. [Медлайн].
Чен Й, Лю Б., Гласс К., Ду В., Бэнкс Е., Кирк М. Использование ингибиторов протонной помпы и риск госпитализации по поводу инфекционного гастроэнтерита. PLoS One . 2016. 11 (12): e0168618. [Медлайн].
Список из 16 препаратов для лечения гастроэнтерита по сравнению
Гастроэнтерит – это инфекция или раздражение желудочно-кишечного тракта, которое обычно приводит к боли в животе, диарее и / или рвоте. Это также может называться пищевым отравлением, диареей путешественника, желудочным или кишечным гриппом.
Гастроэнтерит может возникнуть в любом возрасте, но особенно часто встречается у детей. Вспышки вирусного гастроэнтерита также могут регулярно происходить в местах скопления большого количества людей, таких как круизные лайнеры, общежития колледжей, детские сады или дома престарелых.Люди с ослабленной иммунной системой, например, больные раком, ВИЧ / СПИДом или принимающие определенные лекарства (например, обычные стероиды), также подвержены более высокому риску гастроэнтерита.
Что вызывает гастроэнтерит?
Есть несколько различных причин гастроэнтерита; однако к наиболее распространенным относятся:
- Вирусы, особенно ротавирус у детей, норовирус (частая причина гастроэнтерита на круизных лайнерах)
- Бактерии, особенно Campylobacter, Escherichia coli (E.coli), сальмонелла
- Паразиты, такие как лямблии.
Гастроэнтерит очень заразен, поскольку вызывающие его микробы легко передаются через зараженную пищу или воду, при контакте от человека к человеку, а некоторые вирусы могут передаваться через инфицированные капли, взвешенные в воздухе, или через загрязненные поверхности.
Каковы симптомы гастроэнтерита?
Симптомы могут развиться в течение одного-нескольких дней после заражения в диапазоне от легких до тяжелых.
Симптомы гастроэнтерита различаются, но могут включать:
- Боль в животе
- Судороги
- Легкое обезвоживание
- Диарея (водянистая, неотложная, частая, а иногда и взрывная дефекация)
- Головная боль
- Недержание кала (потеря контроля над дефекацией)
- Потеря аппетита
- Легкая лихорадка и озноб
- Мышечные и общие боли в теле
- Тошнота и / или рвота
- Плохое вскармливание младенцев
- Усталость и общая слабость тела.
Симптомы обычно длятся от одного до двух дней, но могут сохраняться до десяти дней. Прежде чем идти на прием, позвоните своему врачу, чтобы получить совет, если вы беспокоитесь о своем состоянии, поскольку гастроэнтерит очень заразен, и вы рискуете его распространить.
Всегда говорите со своим врачом, если ваши симптомы длились дольше пяти дней или стали хуже, а не лучше, если в вашем стуле есть кровь или гной, если боль в животе постоянная, или если у вас появились значительные признаки обезвоживания, такие как сильная жажда, темная или сильно пахнущая моча или выделение небольшого количества мочи, сухость во рту и губах и отсутствие слез, ваша кожа не втягивается при ущемлении или чувствуется очень вялой.
Младенцы особенно склонны к обезвоживанию, и вам следует обратиться за дополнительным советом, если их подгузники сохнут дольше 4–6 часов или у них образовался впалый родничок (мягкое пятно на макушке головы ребенка).
Как диагностируется гастроэнтерит?
Гастроэнтерит обычно диагностируется только по вашим симптомам, например, если вы страдаете диареей и / или рвотой, ваш врач скажет, что у вас гастроэнтерит. Дальнейшее тестирование обычно проводится только в том случае, если симптомы тяжелые или стойкие и могут включать образцы стула для определения причины.
Как лечится гастроэнтерит?
Основное лечение гастроэнтерита – это покой, питье и ограничение диеты на несколько дней, пока у вас есть симптомы. Например:
- Ограничьте потребление твердой пищи (это позволяет желудку успокоиться)
- Избегайте алкоголя, кофеина и молочных продуктов
- Бросьте курить или употреблять продукты, содержащие никотин
- Избегайте сладких, жирных или сильно приправленных продуктов, вместо этого ешьте мягкие сухие продукты, такие как крекеры, тосты, рис или картофель
- Часто делайте небольшие глотки жидкости (жидкие бульоны, супы, разбавленные напитки без кофеина и растворы для замены электролитов)
- Избегайте приема лекарств, которые могут вызвать дополнительное раздражение желудка, таких как НПВП (например, аспирин, ибупрофен, диклофенак).Вместо него можно использовать ацетаминофен, но с осторожностью
- Продолжайте кормить грудью, если у вашего ребенка гастроэнтерит, и поговорите со своим врачом о том, чтобы предложить ему растворы для регидратации или обычную смесь.
Рассмотрите возможность приема лекарств от диареи (например, лоперамида) для замедления диареи
Антибиотики обычно не назначают в большинстве случаев гастроэнтерита, поскольку они неэффективны, если причиной является вирус и способствует развитию устойчивых к антибиотикам штаммов бактерий.
Следующий список лекарств так или иначе связаны с этим состоянием или используются для его лечения.
Всегда консультируйтесь со своим врачом, чтобы убедиться, что информация, отображаемая на этой странице, применима к вашим личным обстоятельствам.
Лечение антибиотиками может сопровождаться кишечными инфекциями. Почему?
Ученые из Медицинской школы Стэнфордского университета объясняют, почему два потенциально смертельных патогена после лечения антибиотиками закрепляются в неблагоприятной среде кишечника.
Исследователи написали в журнале Nature , что их результаты могут помочь определить способы противодействия последствиям истощения «дружественных кишечных бактерий» после лечения антибиотиками.
Некоторые кишечные патогены могут вызывать серьезные проблемы во время курса антибиотиков. Старший автор, Джастин Зонненбург, доктор философии, сказал: «Антибиотики открывают двери для этих патогенов, чтобы они прижились. Но как именно это происходит, не совсем понятно ».
Авторы объяснили, что количество углеводов в кишечнике значительно увеличивается через двадцать четыре часа после приема пероральных антибиотиков.Этот временный избыток углеводов плюс уменьшение количества «полезных бактерий» в кишечнике позволяет как минимум двум потенциально опасным для жизни патогенам быстро размножаться.
За последние десять лет ученые добились огромного прогресса в понимании того, что происходит в «сложной микробной экосистеме», которая существует в толстом кишечнике каждого здорового млекопитающего, включая человека ».
Примерно 1000 различных типов микробов гармонично сосуществуют в кишечнике типичного здорового человека.Эти бактериальные штаммы, обитающие в этой сложной, но богатой питательными веществами нише, адаптировались чрезвычайно хорошо, даже настолько хорошо, что без них нам было бы сложно выжить.
Дружественные, обитающие в кишечнике бактерии синтезируют витамины, они являются ключом к управлению нашей иммунной системой, они участвуют в развитии и поддержании наших собственных тканей – они даже помогают регулировать кровяное давление.
Антибиотики разрушают экосистему кишечных микробов . Хорошие бактерии начинают быстро размножаться в течение нескольких дней, а в течение месяца их количество возвращается к норме.Однако, по словам авторов, «экосистема, по-видимому, страдает безвозвратной утратой некоторых из составляющих ее бактериальных штаммов».
Ученые сравнивают эти полезные бактерии с газоном, который побеждает сорняки (патогенные бактерии) с богатыми удобрениями, которые проходят через наш кишечник. Предыдущие исследования показали, что наши дружелюбные клопы выделяют химические вещества, которые мешают патогенным бактериям взять под контроль.
Существует теория, согласно которой, когда нарушается наша внутренняя микробная экосистема, страдает реакция нашей иммунной системы.
Зонненбург сказал:
«Хотя эти гипотезы ни в коем случае не исключают друг друга, наша работа специально поддерживает предположение, что наши местные микробы сдерживают патогены, конкурируя за питательные вещества».
Когда эта защита ослаблена, как это обычно бывает вскоре после начала курса антибиотиков, патогенные микроорганизмы, такие как Clostridium difficile , могут найти точку опоры.
Как только эти два паразитических захватчика размножаются до достаточного количества, они вызывают воспаление. Хотя воспаление не является хорошей средой для восстановления полезных бактерий, в нем процветают C. difficile и сальмонелла .
Зонненбург и его коллеги сосредоточились на двух конкретных питательных веществах в кишечнике – фукозе и сиаловой кислоте – обоих членах семейства сахаров. Это не сахара, с которыми большинство людей знакомо, но они жизненно важны для здорового выживания и производятся в каждой клетке человеческого тела. Они также содержатся в молочных продуктах, яйцах и мясе.
Клетки, выстилающие кишечник, вытесняют длинные цепочки знакомых и экзотических сахаров, которые связаны вместе с образованием слизи.
Слизь выполняет две функции:
- она предотвращает прохождение резидентных микробов через стенку кишечника в кровоток
- это жизненно важный источник пищи нескольких сахаров, включая сиаловую кислоту и фукозу, для местных микробов
Зонненбург сказал «Наши кишечные микробы стали очень искусными в поедании слизи».
Зонненбург и его коллеги проводили эксперименты на лабораторных мышах, которые были выращены в среде, свободной от микробов. Эти мыши сильно отличались от нормальных мышей – в их кишечнике не было бактерий.
Ученые ввели единственный бактериальный штамм этим стерильным животным – Bacteroides thetaiotaomicron , дружественный бактериальный штамм, который обитает в кишечнике нормальных мышей и людей. B. theta содержит ферменты, которые отделяют молекулы сахара от цепочек слизи, свисающих со слизистой оболочки кишечника. B. theta не содержит ферментов, расщепляющих молекулы сиаловой кислоты.
Может показаться бессмысленным для B. theta расщеплять молекулы сахара, которые он не может расщепить для употребления в пищу.Однако в нормальном кишечнике есть несколько других микробов, которые могут расщеплять молекулы сиаловой кислоты и фукозы. Нормальный кишечник полон микробов, которые могут измельчать продукты, в которых B. theta не может, но нуждается.
Авторы называют это бартерной системой, экологи – симбиозом. (Возможно, B. theta разрыхляет эти сахарные остатки, чтобы добраться до других, съедобных остатков сахара под ними.)
В ряде экспериментов ученые вводили либо C. difficile , либо штамм Salmonella S.typhimurium у мышей, ранее свободных от микробов, которым вводили B. theta . Оба эти штамма бактерий потенциально опасны для жизни, когда вызывают заболевание у пациентов, получающих антибиотики. Они также потребляют сиаловую кислоту для получения энергии, но не могут удалить ее из кишечной слизи.
Обнаружив, что C. difficile не может ни расщеплять фукозу, ни потреблять ее, команда сконцентрировалась на том, как эти два патогена использовали сиаловую кислоту.
Путем введения одного патогенного и одного дружественного бактериального штамма в кишечник мышей, ранее лишенных микробов, исследователи смогли продемонстрировать, что уровни сиаловой кислоты значительно увеличились в отсутствие полноценной микробной экосистемы кишечника, которая остановила бы их рост. .Наличие всего лишь одного штамма хороших бактерий в кишечнике мышей было приближенным к экосистеме кишечных микробов, уничтоженной антибиотиками.
И B theta , и S. typhimurium реплицировались быстрее в присутствии этих сахаров и никаких других конкурирующих микробов. B. theta создавал избыток сиаловой кислоты, который был настоящим праздником для патогенного штамма .
Затем ученые наблюдали, какое действие антибиотики могут оказывать на «нормальных» мышей с кишечными экосистемами.Они сообщили о таком же увеличении сиаловой кислоты и популяционном взрыве патогенных бактерий. Если мышей лечили только антибиотиками и не подвергали воздействию патогенов, уровни сиаловой кислоты приходили в норму в течение примерно трех дней, поскольку полезные бактерии начинали восстанавливаться.
Зонненбург сказал:
«Плохие парни в кишечнике поглощают питательные вещества, которые были высвобождены хорошими парнями, которые являются жертвами побочного ущерба, нанесенного антибиотиками. Антибиотики заставляют наши дружественные кишечные бактерии невольно помогать этим патогенам.
Мы считаем, что бактериальные патогены в кишечнике вызывают заболевание в два этапа. Другие показали, что как только эти патогены достигают достаточного количества, они используют уловки, вызывающие воспаление, чтобы уничтожить наших местных дружественных микробов – бесплатно для самих патогенов, потому что они разработали способы борьбы с этим. Но сначала они должны преодолеть критическое препятствие: в отсутствие воспаления, которое они пытаются вызвать, они должны каким-то образом достичь этой критической массы. Наша работа показывает, как они это делают после приема антибиотиков.Они пользуются преимуществом временного всплеска доступных сахаров, выделяемых из кишечной слизи, оставленной убитыми комменсальными микробами ».
Команда полагает, что однажды мы сможем создать лекарство, которое подавляет ферменты, используемые дружественными кишечными бактериями для высвобождения сиаловой кислоты из слизи, тем самым лишая патогены возможности их употребления. Затем лекарство можно было бы назначать вместе с антибиотиками. Они добавили, что пробиотики в виде штаммов бактерий, которые быстро переваривают сиаловую кислоту, также могут достичь аналогичного эффекта.
Исследование финансировалось Фондом Burroughs Wellcome и Национальными институтами здравоохранения (грант R01-DK085025).
Все об антибиотиках | Общество желудочно-кишечного тракта
Инфекции имеют разное происхождение, например, пневмонию (бактериальную), простуду (вирусную), микоз (грибковую) и лямблиоз (паразитарный). Организм предотвращает эти инфекции и борется с ними с помощью сложной иммунной системы. Когда инфекции слишком сильны, чтобы иммунная система могла их преодолеть, врачи обычно назначают лекарства.В этой статье речь пойдет об одном из этих лекарств – антибиотиках (также называемых антибактериальными средствами). Мы рассмотрим, как они работают, их ограничения, способы их безопасного использования и последние достижения в этих важных лекарствах для борьбы с инфекциями.
Бактерии – это микроорганизмы, то есть они являются формами жизни. Слово «антибиотик» делится на «анти» (против) и «биотик» (жизнь). Антибиотики подавляют рост или убивают микроорганизмы, предотвращая их распространение и размножение.Первые – и до сих пор наиболее распространенные – антибиотики получают из грибов (например, пенициллин) и специально борются с бактериями. До разработки антибиотиков для широкого применения, около 70 лет назад, был высокий уровень смертности от бактериальных инфекций, таких как туберкулез, пневмония и инфекционные заболевания, передаваемые половым путем.
Сегодня существует множество форм антибиотиков для лечения нескольких различных типов инфекций, включая паразитарные инфекции и некоторые грибковые инфекции. Однако антибиотики не действуют на вирусы, потому что вирусы не являются живыми организмами и «не являются живыми».В отличие от живых организмов со своими собственными клетками, вирусы – это сегменты ДНК (или РНК), которые внедряются в живые клетки, заставляя эти клетки выполнять работу по воспроизведению большего количества вирусной ДНК.
Вот почему ваш врач не пропишет антибиотики от простуды или гриппа. Когда мы больны, мы часто не знаем всей природы инфекции, поражающей наш организм. Нам просто плохо. Это может сбивать с толку, потому что, например, когда вирус простуды атакует наш организм, наша иммунная система работает очень усердно, и мы становимся уязвимыми для развития других типов инфекций, таких как пневмония или стрептококковая ангина, которые являются бактериальными инфекциями и обычно лечится антибиотиками.
Знаете ли вы?
Ученые нашли доказательства того, что люди могли использовать антибиотики против болезней еще 2000 лет назад. В 1928 году доктор Александр Флеминг вернулся в свою лабораторию после отпуска и обнаружил, что грибок под названием penicillium заразил одну из чашек Петри, содержащую бактерию, которую он изучал ( стафилококков ). Бактерии вокруг грибковой плесени погибли. Затем Флеминг проанализировал плесень и обнаружил, что она производит химическое вещество, убивающее бактерии, которое он назвал пенициллином.Несколько других ученых поддержали это первоначальное открытие, усовершенствовав процесс и применив его в медицине как лекарство, производимое серийно. В настоящее время существуют десятки типов пенициллинов, а также множество других химических классов антибиотиков.
Бактерии: друзья и враги
Бактерии – одноклеточные микроорганизмы (микробы). В человеческом теле обитают триллионы микробов, из которых около 10 000 видов бактерий обитают в наших телах и на их поверхности. Никакие два человека – даже близнецы – не имеют идентичных сочетаний бактерий (микробиомов), которые начинают развиваться при рождении, особенно если мы родились через родовые пути, богатые микробами.
В течение долгого времени ученые сосредотачивались только на вызывающих инфекцию (патогенных) бактериях и считали, что непатогенные бактерии в лучшем случае не важны. Тем не менее, количество микробных клеток превышает количество человеческих клеток примерно в десять раз, и теперь ученые начинают понимать, что они играют важную роль в нашем благополучии, особенно в иммунной и пищеварительной системах. В пищеварении, например, есть бактерии, которые питаются продуктами, которые мы не можем переварить только нашими человеческими клетками.Продукты жизнедеятельности этих бактерий являются питательными веществами для наших человеческих систем. Некоторые из этих непатогенных бактерий также участвуют в постоянной борьбе с патогенными бактериями, помогая поддерживать здоровый микробиом, сохраняя количество «плохих» бактерий на минимальном уровне.
Пробиотики относятся к живым микроорганизмам, которые, как считается, обладают благотворным действием, и широко распространенные знания об этом привели к резкому увеличению использования пробиотиков; однако другие бактерии оказывают вредное воздействие, особенно когда они перенаселяют определенные области нашего тела.Заражение патогенными бактериями может произойти после травмы, когда обычные внешние бактерии попадают в организм человека через кровоток, или в результате заражения недружественными микроорганизмами, производящими токсичные побочные продукты, как во многих случаях пищевого отравления.
Как работают антибиотики
Антибиотики действуют, разрушая бактериальные клетки несколькими способами, например, подавляя способность бактерии строить свою клеточную стенку, блокируя ее размножение или препятствуя ее способности накапливать и использовать энергию.Антибиотики обычно не влияют на клетки человека, поэтому мы можем безопасно принимать их внутрь для использования в качестве лекарства. Однако, как и на все лекарства, некоторые люди могут реагировать на антибиотики или иметь побочные эффекты. Некоторые антибиотики атакуют широкий спектр бактерий (антибиотики широкого спектра действия), в то время как исследователи разрабатывают другие, чтобы атаковать только определенные патогенные штаммы (антибиотики узкого спектра действия). Есть антибиотики, которые действуют только против бактерий, которым нужен кислород (аэробные), и другие, которые действуют против бактерий, живущих в отсутствие кислорода (анаэробные).
Когда вы проглатываете таблетку или жидкость антибиотика, они попадают в ваш пищеварительный тракт и всасываются в кровоток так же, как питательные вещества из пищи. Оттуда он циркулирует по всему телу, вскоре достигая целевой области, где патогенные бактерии вызывают инфекцию. В некоторых ситуациях, например, когда инфекция особенно серьезна, врачи могут вводить антибиотики путем внутривенной инъекции непосредственно в кровоток. При определенных кожных инфекциях наиболее эффективный способ быстро доставить антибиотик патогенным организмам – это нанести его непосредственно на инфекцию в виде крема или мази для местного применения.Это ограничивает воздействие препарата на организм на небольшой площади, когда нет необходимости в его циркуляции в кровотоке.
Ваш врач выбирает конкретный антибиотик и способ его введения на основе ряда факторов, таких как точный тип и степень инфекции. Иногда необходимо провести анализ образца в лаборатории, чтобы определить точный вид и штамм бактерий, вызывающих инфекцию. Ваш врач может также назначить антибиотики перед операцией на кишечнике или другой медицинской процедурой, которая сопряжена с высоким риском бактериальной инфекции, которая является профилактическим (профилактическим) использованием антибиотиков.
Одним из распространенных побочных эффектов от приема антибиотиков является жидкий стул (диарея), так как антибиотик разрушает нормальные, здоровые бактерии в кишечнике, которые поддерживают вашу регулярность. Ваш врач может порекомендовать использовать пробиотики после лечения антибиотиками, чтобы помочь вашему организму повторно заселить здоровые штаммы бактерий. Если вы обнаружили кровь или слизь в стуле, или испытываете сильную боль в животе или спазмы, вам следует немедленно обратиться к врачу, чтобы определить, может ли быть вторичная инфекция, например C.difficile . (См. Стр. 11.) Когда один антибиотик не может уничтожить инфекцию, вашему врачу, возможно, придется перейти к менее традиционным лекарствам, которые могут быть более дорогими или иметь более серьезные побочные эффекты. Врачи резервируют эти антибиотики только для использования в определенных ситуациях и обстоятельствах, чтобы избежать развития устойчивости к антибиотикам.
Устойчивость к антибиотикам и супербактерии
Антибиотики изменяют течение опасных для жизни инфекций, снижая смертность и потерю органов или конечностей.Однако каждый раз, когда человек использует антибиотик для лечения, вероятность развития устойчивых бактериальных штаммов увеличивается, и они могут в конечном итоге перерасти в супербактерии. Термин «супербактерия» относится к любым микроорганизмам, которые стали устойчивыми к лечению обычными противоинфекционными средствами, которые ранее были эффективны против них. Хотя супербактерии были более серьезной проблемой в больницах, в сообществе растет число их вспышек. Лучшее, что вы можете сделать, – это принимать антибиотики в точном соответствии с указаниями врача – правильную дозу и в течение всего срока действия рецепта, даже если вы чувствуете себя лучше в середине лечения.Это очень важно. Прекращение лечения антибиотиками в середине курса или прием только части доз, даже если симптомы инфекции исчезли, резко увеличивает риск развития устойчивости бактерий.
Ученые определили критическую концентрацию определенного антибиотика в организме, чтобы убить инфекцию, но если вы не достигнете этого уровня антибиотика, циркулирующего в организме, это может создать среду, в которой умирают только самые слабые патогенные клетки, в то время как более сильные и устойчивые бактерии остаются, размножаются и видоизменяются (становятся устойчивыми).По мере того, как мутантные бактерии переходят к другим, становится все труднее найти антибиотик для борьбы с ними. Это также может произойти, если вы не принимаете весь курс лечения, как предписано, где все еще существует низкий уровень патогенных бактерий, что позволяет бактериям либо повторно заразить вас, либо стать устойчивыми. Исследователи постоянно разрабатывают новые антибиотики для борьбы с этими появляющимися супербактериями. См. Страницу 11 для получения информации о новом антибиотике узкого спектра действия, Dificid ™, который нацелен на C.difficile , сохраняя при этом здоровые штаммы бактерий. В дополнение к этим развивающимся исследованиям, пациенты играют чрезвычайно важную роль в предотвращении развития новых или более сильных супербактерий, просто принимая лекарства в соответствии с предписаниями.
Ключевые сообщения
- Большинство антибиотиков лечат бактериальные инфекции, а некоторые антибиотики лечат определенные паразитарные или грибковые инфекции. Антибиотики НИКОГДА не действуют против вирусных инфекций. (Существуют противовирусные препараты и / или вакцины от некоторых типов вирусных инфекций.)
- Всегда принимайте антибиотики в точном соответствии с предписаниями врача и заканчивайте полный курс лечения (если у вас нет серьезной побочной реакции и проконсультируйтесь с врачом). Никогда не принимайте антибиотики, прописанные вам другим врачом, или антибиотики, прописанные вам врачом от предыдущего недуга, который вы еще не преодолели.
- Супербактерии – растущая проблема, особенно в больницах, и каждый играет свою роль в замедлении их развития.
Это по сравнению с
| Антибиотики (например,грамм. пенициллин) – это селективных противомикробных препарата , которые атакуют только бактериальные микробы, убивая их или блокируя их размножение. | Дезинфицирующие средства (например, отбеливатель) – это неселективных противомикробных средства , которые атакуют многие типы микроорганизмов, поэтому они не могут использоваться в нашем организме и могут повредить клетки человека. |
| Бактерицидные агенты убивают бактерии, препятствуя репликации клеточной стенки и / или содержимого бактерии. | Бактериостатические агенты останавливают размножение бактерий или препятствуют синтезу белка, но не обязательно убивают бактерии. |
| Антибиотики широкого спектра действия (например, пенициллины, аминогликозиды, цефалоспорины, сульфаниламиды) работают против широкого спектра бактериальных инфекций. | Антибиотики узкого спектра действия (например, макролиды, ванкомицин, фидаксомицин) эффективны только против нескольких типов патогенных бактерий. |
| Аэробные бактериальные инфекции, такие как бактерии, вызывающие стрептококковое горло, выживают в областях тела, подверженных воздействию кислорода. Пенициллины и другие виды антибиотиков борются с этими инфекциями. | Анаэробные бактериальные инфекции (например, гангрена, столбняк и ботулизм) поражают глубокие ткани или органы, в которых нет кислорода, например желудочно-кишечный тракт или под значительными ранами. Против них эффективны специализированные антибиотики, такие как метронидазол или клиндамицин, среди многих других. |
Новое нетоксичное дезинфицирующее средство
Группа исследователей из Университета Сен-Бонифас (USB) в Манитобе доказала эффективность дезинфицирующего средства, которое может произвести революцию в борьбе с супербактериями в больничной системе.
COVID-19: не забывайте о желудочно-кишечном тракте! – FullText – Болезни пищеварения 2020, Vol. 38, №4
Инфекция SARS-CoV2 поражает преимущественно верхние дыхательные пути и дыхательные пути, но часто распространяется на внелегочную систему и может проявляться в других системах органов.Ряд клинических отчетов, опубликованных за последние недели, также указывает на значительное поражение желудочно-кишечного тракта инфекцией SARS-CoV2.
Есть два основных аспекта, вызывающих беспокойство: один связан с желудочно-кишечными симптомами (ГИС) и их влиянием на течение болезни; другая связана с выделением вируса (или его фрагментов РНК) с фекалиями пациента и возможной ролью фекально-оральной передачи. Научная оценка обоих аспектов, вероятно, предоставит важную информацию о процессе болезни и подчеркнет необходимость осведомленности о вовлечении желудочно-кишечного тракта и поможет улучшить клиническое ведение.
ГИС в контексте COVID-19 включают потерю аппетита (анорексию), тошноту, рвоту, диарею и боль в животе. Имеющиеся отчеты показывают широкий диапазон распространенности этих симптомов, что лучше всего объясняется ретроспективным характером этих исследований. Распространенность ГИС составляла 11,4% среди 651 включенного пациента в Ханчжоу [1], но была 50% среди 204 пациентов в провинции Хубэй [2]. Cheung et al. [3] опубликовали метаанализ с участием более 4000 пациентов, в котором сообщается о распространенности ГИС 17%.Это отличалось от данных по их местной когорте пациентов в Гонконге (59 пациентов), в которой распространенность составляла 25% [3]. Менее чем у 10% взрослых пациентов ГИС были начальными симптомами COVID-19, причем частота была выше у детей. Недавний опыт показал, что ГИС часто ассоциируются с более тяжелым течением болезни. Безусловно, анорексия считается наиболее частым симптомом, но она также является наиболее неспецифическим среди ГИС и может быть связана в первую очередь с системным воспалением и недомоганием (утомляемостью), вызванными вирусной инфекцией, а не с существенной патологией желудочно-кишечного тракта.
Диарея представляет собой наиболее значимый клинический аспект поражения желудочно-кишечного тракта. Распространенность диареи, о которой сообщалось в 3 исследованиях, варьировала от 11 до 17% [1-3], но достигала 31% в группе медицинских работников с пневмонией, вызванной SARS-CoV2 [4]. Помимо влияния на общее состояние пациента, диарея способствует ухудшению клинического течения COVID-19. Основное лечение тяжелой диареи, такое как восполнение жидкости и электролитов, должно сопровождаться применением противодиарейных препаратов.Различные механизмы могут способствовать развитию диареи у пациентов с COVID-19, и их необходимо учитывать при выборе терапевтических мер. Последнее включает в себя прекращение приема антибиотиков (если таковые вводятся) или переход на другой тип, введение веществ, модулирующих микробиом кишечника (например, пробиотиков и рифаксимина), чтобы помочь вылечиться от дисбактериоза, и введение обычных антидиарейных препаратов. средства против повреждения эпителия кишечника.В особых случаях также может быть рассмотрено использование биологических препаратов для модуляции иммунной системы.
Пациенты с хроническим воспалительным заболеванием кишечника и другими аутоиммунными заболеваниями пищеварительной системы относятся к группе высокого риска COVID-19, поскольку эти пациенты часто проходят иммуносупрессивное или иммуномодулирующее лечение. Патофизиологическое воздействие инфекции и клеточное взаимодействие вируса со слизистой оболочкой кишечника недавно были рассмотрены в другом месте [5].
Другой важной особенностью желудочно-кишечных заболеваний у пациентов с COVID-19 является более высокая доля образцов стула, положительных на вирусную РНК, у пациентов с диареей, чем у пациентов без него [4].Серьезную озабоченность вызывает длительная экскреция SARS-CoV2 с фекалиями, которая может сохраняться после того, как мазки из зева станут отрицательными. Это может привести к стойкой инфекционности за пределами периода времени, когда считается, что пациенты больше не подвержены риску передачи инфекции. Исследования, изучающие этот аспект, сообщают о сохранении фекальной вирусной РНК у 23–82% в течение до 11 дней после получения отрицательного результата анализа ротоглотки и мокроты [6]. У некоторых пациентов вирусная РНК сохраняется более месяца.Очевидно, это может оказать важное влияние на возможность передачи вируса, а также на необходимость и степень гигиенических мер, которые необходимо принять. Остается большая неопределенность относительно того, жизнеспособен ли SARS-CoV2 в фекалиях или же соответствующие анализы сообщают о нежизнеспособных вирусных фрагментах РНК, отщепляющихся вместе с эпителиальными клетками кишечника. На данный момент эти данные получены в ретроспективных небольших исследованиях и неубедительны.
Тем не менее, исходя из имеющейся информации, крайне важно применять соответствующие гигиенические и медицинские стратегии:
Члены семей инфицированных пациентов должны быть проинформированы о возможных путях передачи SARS-CoV2, чтобы соблюдать особые меры предосторожности, такие как использование отдельных туалетов, где это возможно, тщательное и частое мытье рук и регулярная стирка отдельных полотенец.
Плановые (плановые) эндоскопические обследования пациентов с COVID-19 должны быть тщательно спланированы и должны быть приняты особые меры предосторожности для защиты пациентов и группы обследований.
Трансплантация фекальной микробиоты стала очень чувствительным аспектом во времена COVID-19. Чтобы предотвратить фекальную передачу SARS-CoV-2, группа экспертов предложила провести оценку потенциальных доноров на предмет наличия типичных симптомов COVID-19 в течение 30 дней до сдачи крови.Также необходим подробный анамнез, включая тесный контакт с людьми с доказанной или подозреваемой инфекцией в течение предыдущих 30 дней, и, что наиболее важно, обширное и специализированное тестирование на SARS-CoV2 в стуле и верхних дыхательных путях [7]. (По нашему мнению, использование трансплантации фекальной микробиоты должно оставаться максимально ограничительным, за исключением рефрактерных случаев колита C. difficile , не отвечающих на все новые медицинские варианты.)
Следует учитывать лекарства, которые могут потенциально продлить инфекцию за счет изменения pH желудочного сока (т.е., кислотоподавляющие средства) или вмешиваясь в иммунологию слизистых оболочек (т. е. антибиотики).
Программа клинических исследований желудочно-кишечного тракта, связанных с COVID-19, предлагает множество возможностей. Это, безусловно, требует исследований а) патогенеза и воздействия прямого вирусного поражения всей пищеварительной системы; и (b) факторы, способствующие возникновению диареи, связанной с COVID-19, с особым упором на микробиом кишечника и ведение борьбы с диареей. Особое внимание следует уделять роли пищеварительной системы в передаче инфекции, а также способам сокращения продолжительности о заразности и о том, какие меры предосторожности следует соблюдать в этом отношении.
Заявление о раскрытии информации
Ни один из авторов не имеет конфликта интересов.
Вклад авторов
Все авторы в равной степени внесли свой вклад в написание этой редакционной статьи.
Список литературы
- Цзинь X, Лиан Дж. С., Ху Дж. Х., Гао Дж., Чжэн Л., Чжан Ю. М. и др.Эпидемиологическая, клиническая и вирусологическая характеристика 74 случаев заболевания коронавирусом 2019 г. (COVID-19) с желудочно-кишечными симптомами. Кишечник. 2020.
- Пан Л., Му М, Ян П, Сунь И, Ван Р., Ян Дж. И др. Клинические характеристики пациентов с COVID-19 с пищеварительными симптомами в провинции Хубэй, Китай: описательное, перекрестное, многоцентровое исследование.Am J Gastroenterol. 2020; 115 (5): 766–73.
- Cheung KS, Hung IF, Chan PP, Lung KC, Tso E, Liu R и др. Желудочно-кишечные проявления инфекции SARS-CoV-2 и вирусная нагрузка в образцах кала из Гонконгской когорты, а также систематический обзор и метаанализ. Гастроэнтерология.2020 апр.
- Wei XS, Wang X, Niu YR, Ye LL, Peng WB, Wang ZH и др. Диарея связана с продолжительными симптомами и вирусным носительством COVID-19. Clin Gastroenterol Hepatol. 2020 апр.
- Neurath MF.Covid-19 и иммуномодуляция при ВЗК. Кишечник. 2020.
- Тиан И, Ронг Л., Ниан В., Хе Й. Обзорная статья: особенности желудочно-кишечного тракта при COVID-19 и возможность передачи через фекалии. Алимент Pharmacol Ther. 2020; 51 (9): 843–51.
- Ианиро Дж., Маллиш Б. Х., Келли С. Р., Сокол Х., Кассам З., Нг С. и др.Скрининг доноров фекальных трансплантатов микробиоты во время вспышки COVID-19: предложения международной группы экспертов по срочным обновлениям. Ланцет Гастроэнтерол Гепатол. 2020; 5 (5): 430–2.
Автор Контакты
Проф. Питер Малфертхайнер
Мед. Klinik und Poliklinik II
Marchionini Str.15
DE – 81377 München (Германия)
Подробности статьи / публикации
Поступила: 28 апреля 2020 г.
Дата принятия: 29 апреля 2020 г.
Опубликована онлайн: 29 апреля 2020 г.
Дата выпуска: июль 2020
Количество страниц для печати: 2
Количество рисунков: 0
Количество столов: 0
ISSN: 0257-2753 (печатный)
eISSN: 1421-9875 (онлайн)
Для дополнительной информации: https: // www.karger.com/DDI
Авторские права / Дозировка препарата / Заявление об ограничении ответственности
Авторские права: Все права защищены. Никакая часть данной публикации не может быть переведена на другие языки, воспроизведена или использована в любой форме и любыми средствами, электронными или механическими, включая фотокопирование, запись, микрокопирование, или с помощью любой системы хранения и поиска информации, без письменного разрешения издателя. .
Дозировка лекарств: авторы и издатель приложили все усилия, чтобы гарантировать, что выбор и дозировка лекарств, указанные в этом тексте, соответствуют текущим рекомендациям и практике на момент публикации.Тем не менее, ввиду продолжающихся исследований, изменений в правительственных постановлениях и постоянного потока информации, касающейся лекарственной терапии и реакций на них, читателю рекомендуется проверять листок-вкладыш для каждого препарата на предмет любых изменений показаний и дозировки, а также дополнительных предупреждений. и меры предосторожности. Это особенно важно, когда рекомендованным агентом является новое и / или редко применяемое лекарство.
Отказ от ответственности: утверждения, мнения и данные, содержащиеся в этой публикации, принадлежат исключительно отдельным авторам и соавторам, а не издателям и редакторам.Появление в публикации рекламы и / или ссылок на продукты не является гарантией, одобрением или одобрением рекламируемых продуктов или услуг или их эффективности, качества или безопасности. Издатель и редактор (-ы) не несут ответственности за любой ущерб, причиненный людям или имуществу в результате любых идей, методов, инструкций или продуктов, упомянутых в контенте или рекламе.
Бактериальный гастроэнтерит | Johns Hopkins Medicine
Что такое гастроэнтерит?
Гастроэнтерит – воспаление желудка и кишечника.Это может вызвать симптомы от легких до тяжелых. Гастроэнтерит может вызвать вирус, бактерия или паразит. Когда это вызвано какой-либо бактерией, это называется бактериальным гастроэнтеритом.
Гастроэнтерит – очень распространенное заболевание. Бактериальный гастроэнтерит встречается реже, чем вирусный. Но это по-прежнему серьезный риск для здоровья. Это потому, что вы можете получить обезвоживание из-за рвоты и / или диареи.
Что вызывает гастроэнтерит?
Наиболее распространенные типы бактерий, которые могут вызывать гастроэнтерит, включают:
- E.кишечная палочка
- Сальмонелла
- Campylobacter
Каковы симптомы гастроэнтерита?
Симптомы могут варьироваться от легкого дискомфорта до опасных для жизни. Каждый человек может испытывать симптомы по-разному. Симптомы могут включать:
- Тошнота
- Рвота
- Лихорадка (иногда очень высокая)
- Спазмы и боли в животе
- Диарея, возможно, с кровью
- Обезвоживание
- Электролитный дисбаланс
Эти симптомы могут возникать при всех формах гастроэнтерита (как вирусных, так и бактериальных).Высокая температура и кровавый понос чаще встречаются при бактериальном гастроэнтерите.
Симптомы бактериального гастроэнтерита могут быть похожи на другие заболевания или проблемы. Всегда консультируйтесь со своим врачом для постановки диагноза.
Как диагностируется гастроэнтерит?
Ваш лечащий врач проведет осмотр и спросит о вашей истории болезни. Ваш лечащий врач, скорее всего, попросит образец стула, чтобы определить источник вашего заболевания и его бактериальный или вирусный характер.
Как лечится гастроэнтерит?
После того, как врач диагностирует ваш бактериальный гастроэнтерит, его легко вылечить. Антибиотики излечивают некоторые формы бактериального гастроэнтерита в течение нескольких дней. Вам может потребоваться дополнительное лечение для восполнения жидкости и электролитов в вашем организме. Это будет зависеть от тяжести вашего заболевания. В некоторых случаях может потребоваться замена жидкости внутривенно.
Можно ли предотвратить гастроэнтерит?
Лучший способ предотвратить бактериальный гастроэнтерит – соблюдать гигиену.
- Тщательно мойте руки, когда берете пищу или готовите ее.
- Не откладывайте еду слишком долго, когда подаете ее. Выбросьте его, если есть вероятность, что он испортился.
- Если вы узнали о вспышке зараженных продуктов или напитков из новостей, избегайте употребления этих продуктов.
- Ограничьте контакты с людьми, у которых есть такие симптомы, как рвота и / или диарея.
- Избегайте недоваренной пищи.
- Используйте дезинфицирующие средства для рук на спиртовой основе.
Когда мне следует позвонить своему врачу?
Если у вас есть какие-либо из описанных выше симптомов, и они не улучшаются через день или два, обратитесь к своему врачу для диагностики и лечения.
Основные сведения о гастроэнтерите
- Бактериальный гастроэнтерит – это проблема пищеварения, вызываемая бактериями.
- Симптомы включают тошноту, рвоту, лихорадку, диарею, спазмы в животе и боль.
- В тяжелых случаях возможно обезвоживание и нарушение электролитного баланса.
- Бактериальный гастроэнтерит иногда лечат антибиотиками.
- Если не лечить тяжелые случаи, они могут привести к серьезному обезвоживанию, неврологическим проблемам, почечной недостаточности и даже смерти.
- Хорошая гигиена – лучший способ предотвратить бактериальный гастроэнтерит.
Следующие шаги
Советы, которые помогут вам получить максимальную пользу от визита к врачу:
- Знайте причину вашего визита и то, что вы хотите.
- Перед визитом запишите вопросы, на которые хотите получить ответы.
- Возьмите с собой кого-нибудь, кто поможет вам задать вопросы и запомнить, что вам говорит врач.
- Во время посещения запишите название нового диагноза и любые новые лекарства, методы лечения или тесты. Также запишите все новые инструкции, которые дает вам ваш лечащий врач.
- Узнайте, почему прописано новое лекарство или лечение и как они вам помогут. Также знайте, каковы побочные эффекты.
- Спросите, можно ли вылечить ваше состояние другими способами.
- Знайте, почему рекомендуется тест или процедура и что могут означать результаты.
- Знайте, чего ожидать, если вы не примете лекарство, не пройдете тест или процедуру.
- Если вам назначена повторная встреча, запишите дату, время и цель этого визита.
- Узнайте, как вы можете связаться с вашим лечащим врачом, если у вас возникнут вопросы.
Раздражение пищевода | Советы по предотвращению раздражения пищевода |
|---|---|
Некоторым людям трудно глотать таблетки или капсулы без жидкости или иногда принимать лекарства.Таблетки или капсулы, которые остаются в пищеводе, могут выделять химические вещества, которые могут раздражать слизистую оболочку пищевода. Это может вызвать язвы, кровотечение, перфорацию и сужение (стриктуры) пищевода. Риск этих видов травм выше у лиц с заболеваниями пищевода, включая следующие:
Некоторые лекарства также могут вызывать язвы в пищеводе, когда они остаются там.К ним относятся аспирин, некоторые антибиотики, хинидин, хлорид калия, витамин С и железо. |
|
О пищеводном рефлюксе | Советы по предотвращению рефлюкса |
Некоторые лекарства мешают работе мышцы сфинктера, расположенной между пищеводом и желудком. Эта мышца позволяет пище попадать в желудок после глотания. Это может увеличить вероятность рефлюкса или скопления кислого содержимого желудка в пищевод. К классам лекарств, которые могут увеличить тяжесть рефлюкса, относятся следующие: |
|
Раздражение желудка | Советы по предотвращению раздражения желудка |
Одним из наиболее распространенных раздражителей слизистой оболочки желудка являются нестероидные противовоспалительные препараты (НПВП). Сюда входят лекарства, такие как ибупрофен и другие распространенные болеутоляющие.Эти лекарства ослабляют способность слизистой оболочки противостоять кислоте, вырабатываемой в желудке, и иногда могут привести к воспалению слизистой оболочки желудка (гастриту), язвам, кровотечению или перфорации слизистой оболочки. |
|
Запор | Советы по предотвращению запора |
Запор может вызвать множество лекарств. Это происходит потому, что эти лекарства влияют на нервную и мышечную активность толстой кишки, что приводит к медленному и затрудненному отхождению стула. |
|
Диарея | Советы по предотвращению диареи |
Диарея чаще всего вызывается антибиотиками, которые поражают бактерии, обычно присутствующие в толстой кишке.Эти изменения кишечных бактерий приводят к чрезмерному росту бактерий Clostridium difficile (C. difficile), что вызывает более серьезную диарею, вызванную антибиотиками. Присутствие этих бактерий может вызвать колит, в результате чего стул будет жидким и водянистым. К наиболее распространенным антибиотикам, вызывающим этот тип диареи, относятся следующие: Этот колит обычно лечат другим антибиотиком, который действует на C. difficile. Некоторые лекарства могут также изменять движения или содержание жидкости в толстой кишке, не вызывая колита.Колхицин и антациды, содержащие магний, могут вызывать диарею. |
|


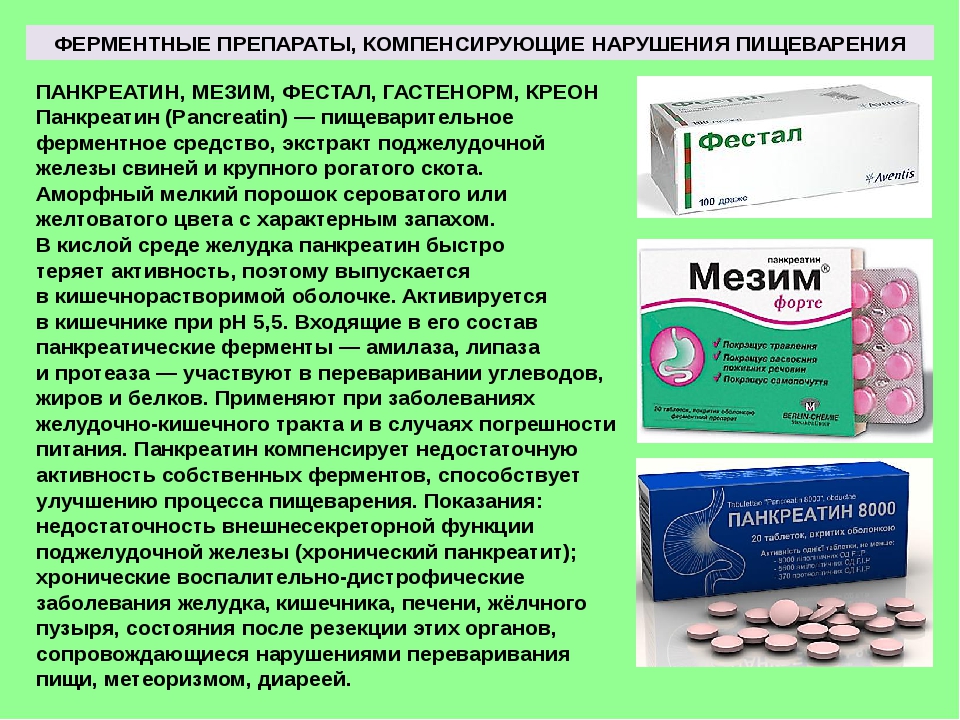
 Nature Microbiology, 3(11), 1255–1265
Nature Microbiology, 3(11), 1255–1265 , & Garcı̀a-Rodrı̀guez, J. . (2000). Antimicrobial activity of psychotropic drugs. International Journal of Antimicrobial Agents, 14(3), 177–180.
, & Garcı̀a-Rodrı̀guez, J. . (2000). Antimicrobial activity of psychotropic drugs. International Journal of Antimicrobial Agents, 14(3), 177–180.