Антиген в кале: Giardia lamblia, антиген
Сдать анализ: Лямблия (Giardia lamblia), антиген в кале
Описание анализа:
Лямблия (Giardia lamblia), антиген в кале – анализ, определяющий наличие в человеческом кале молекул, характерных только для клеток лямблий – простейших, паразитирующих в тонком кишечнике (иногда также в желчном пузыре) человека. Их существование в человеческом организме провоцирует развитие лямблиоза.
Заражение лямблиями происходит через пищу и воду, инфицированные предметы бытового обихода и загрязненные руки. Лямблия может существовать в активной форме (трофозоит) или в форме цисты (пассивное состояние, когда вокруг клетки формируется защитная оболочка). В наружной среде выживают только цисты, именно ими заражается организм.
После того как цисты проглатываются человеком, в тонком кишечнике лямблии освобождаются от защитных оболочек, переходят в активную форму и начинают процесс размножения. При попадании в толстую кишку, вокруг лямблии создается защитная оболочка (формируется циста) и в таком виде паразит выходит наружу, готовый к заражению нового хозяина.
С момента заражения до появления симптомов лямблиоза может проходить от 3 до 42 дней, однако возможно бессимптомное течение, при котором болезнь длится от 1 до 3 месяцев. Чаще всего болеют маленькие дети (1-4 года), у которых инфекция протекает тяжелее всего.
Находясь в организме, паразит вырабатывает специфический антиген GSA-65, против которого иммунная система человека вырабатывает антитела. Данный анализ позволяет выявить лямблиоз у 50-70% пациентов, а троекратное повторение обследования обнаруживает паразита у 9 зараженных из 10.
Показания к назначению анализа
Обследование на антиген лямблии обычно назначается педиатром, терапевтом, инфекционистом, возможно назначение дерматологом или аллергологом (паразит может спровоцировать развитие дерматита и аллергических реакций).
Показанием обычно служат симптомы лямблиоза:
- диарея;
- ухудшение аппетита;
- рвота;
- дисбактериоз.
Также на инфицирование паразитом может указывать аллергический дерматит, экзема, иммунодефицит, бронхиальная астма, блефарит, артрит и ринит. Анализ может назначаться в качестве скринингового для людей из групп риска, а также контактировавшим с больными лямблиозом или со скрытыми носителями.
Анализ может назначаться в качестве скринингового для людей из групп риска, а также контактировавшим с больными лямблиозом или со скрытыми носителями.
Значение результатов
Если антиген обнаружен, значит, у пациента есть лямблиоз или же он бессимптомный носитель паразита. Если же не обнаружен, то, возможно, лямблий в организме нет. Однако для точного результата необходимы дополнительные обследования и анализ состояния пациента врачом. При наличии симптомов болезни обследование назначается повторно.
Подготовка к обследованию
Готовиться к обследованию не нужно, но максимальная концентрация паразита в организме наблюдается в первую неделю после появления симптомов – этот период является наилучшим для отбора материала на анализ.
Материал для исследования: кал.
Метод исследования: иммуноферментный анализ.
Срок проведения: 2 рабочих дня.
Запись на анализы
Антигены простейших (лямблии, амёбы, криптоспоридии) в кале сдать анализ в Ижевске
Биоматериал: Кал
Срок выполнения (в лаборатории): 2 р. д.
д.
* На сайте указан максимально возможный срок выполнения исследования. Он отражает время выполнения исследования в лаборатории и не включает время на доставку биоматериала до лаборатории. Приведенная информация носит справочный характер и не является публичной офертой. Для получения актуальной информации обратитесь в медицинский центр Исполнителя или call-центр.
Номенклатура МЗРФ (Приказ №804н): A26.19.096.000.01 “Иммунохроматографическое экспресс-исследование кала на антигены лямблии (Giardia intestinalis), криптоспоридии (Cryptosporidium), амёбы (Amoeba)”
Описание
Исследование кала, направленное на выявление антигенов гельминтов и простейших в кале. В норме данные показатели в кале не должны присутствовать, в случае выявления антигенов паразитов врач может сделать заключение о паразитарной инвазии. В данном исследовании проводится определение антигенов Entamoeba histolytica — возбудитель амебиаза, Giardia lamblia —возбудитель лямблиоза, Cryptosporidium parvum — возбудитель криптоспороидоза.
Обнаружение антигенов простейших позволяет опредлить их видовое происхождение, а значит уточнить диагноз и назначить спеицифическую терапию.
Показания к назначению
- диагностика паразитарного заражения;
- оценка эффективности противопаразитарного лечения.
Подготовка к исследованию
Образцы кала должны быть получены как можно скорее после получения симптомов заболевания. В судно или на дно унитаза помещают стерильную бумагу (или проглаженный лист) либо одноразовую пластиковую тарелку. Испражнения собирают сразу после дефекации специальной ложечкой, вмонтированной в крышку пластикового контейнера в объеме 1-2 г. Исследованию подлежит средняя порция испражнений. Избегать попадания мочи и кусочков не переваренной пищи. Нельзя производить сбор кала с памперсов. У грудных детей материал собирать со стерильной пеленки или предварительно проглаженных ползунков. В случае сбора жидкого кала его можно собрать, подстелив под малыша клеенку. При невозможности опорожнить кишечник в утренние часы, сбор материала производится вечером. Для получения достоверного результата материал для исследования берется до начала антибактериальной терапии или в интервалах между курсами лечения, но не ранее двух недель после ее окончания.
Для получения достоверного результата материал для исследования берется до начала антибактериальной терапии или в интервалах между курсами лечения, но не ранее двух недель после ее окончания.
Нельзя проводить исследование кала, полученного после клизмы и приема слабительных препаратов, а также рентгенологического исследования желудка и кишечника с использованием контрастных препаратов.
Интерпретация результатов/Информация для специалистов
Не центрифугировать.
Условия хранения и транспортировки: 2 сут. при 2-8 °C; более 2 сут. при -20 °C. Избегать повторных циклов замораживания и оттаивания.
Примечания: Анализ проводится до начала антибактериальной терапии или в интервалах между курсами лечения, но не ранее двух недель после ее окончания.
Правила взятия:
Кал для исследования собирается в стерильный одноразовый контейнер.
Хеликобактер пилори (Helicobacter pylori) антиген в кале
Хеликобактер пилори (Helicobacter pylori) антиген в кале
Хеликобактер пилори (Helicobacter pylori) антиген в кале – анализ, который помогает выявить в кале молекулы, присутствующие в бактериях Helicobacter pylori.
Хеликобактер очень распространенная бактериальная инфекция – ею заражено более 50% человечества. У половины инфицированных людей не наблюдается никаких симптомов присутствия хеликобактера, а гастрит или язва развиваются примерно у 15-20% зараженных. Также установлено, что хеликобактер повышает риск развития рака желудка. Инкубационный период составляет примерно 7 дней. Особенно подвержены болезни люди с дефицитом иммунитета.
Определение антигена хеликобактера в кале пациента – высокочувствительный и безопасный метод исследования, позволяющий выявить инфекцию у 90% зараженных пациентов. Метод высокочувствительный и специфичный (около 90 %), малоинвазивен, прост в применении.
Преимущества метода:
- Неинвазивный метод (диагностика без использования фиброгастроскопии).
- Детекция как активных, так и кокковых форм бактерии.
- Высокая точность, чувствительность и специфичность (до 95-98%).
- Используется у взрослых и детей.
- Не требуется предварительной подготовки.

Показания к назначению
Показаниями к анализу являются такие факторы:
- диагностика хеликобактерной инфекции
- контроль эффективности лечения хеликобактера
- когда необходимо подтверждение полной ликвидации инфекции
- наличие близких родственников пациента с раком желудка
- боли и дискомфорт в области желудка
- пациенты с болезнями сердечно-сосудистой системы (атеросклероз, инсульт, инфаркт)
Референсные значения (нормы лаборатории)
Результат анализа должен быть отрицательным – антиген бактерии не выявлен и инфицирования Helicobacter pylori нет.
Повышение показателя
Повышение показателя (в данном случаем положительный результат) означает, что пациент заражен хеликобактером и есть высокий риск развития рака желудка, язвенной болезни, гастрита.
Понижение показателя
Понижение показателя невозможно. Если не удается интерпретировать результат, то анализ необходимо повторить или прибегнуть к другим методам выявления Хеликобактер пилори (Helicobacter pylori) антиген в кале.
Лямблии (Giardia Liamblia ), антиген в кале
Выбрана услуга:
Выбор услуги специлиста Нажмите для выбора услугиНазад
Повторной считается консультация одного специалиста в течение 30 дней с даты предыдущего приёма.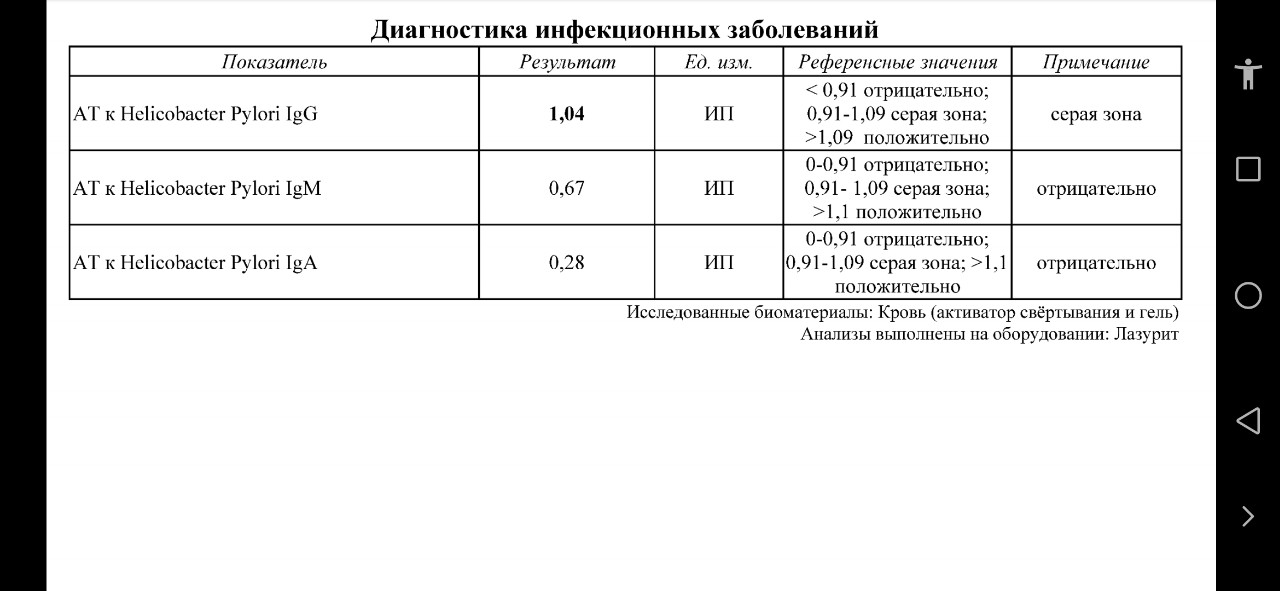
Giardia Lamblia, антиген — ОВУМ – медицинская лаборатория в Кемерοво
Лямблии (Giardia lamblia) — жгутиковые простейшие, вызывают паразитарное заболевание тонкого кишечника человека — лямблиоз. Лямблии в организме человека существуют в двух формах: вегетативной (активные, способные к размножению возбудители, паразитируют в тонкой кишке) и в форме цист (статическая форма, цисты содержатся в толстой кишке и выделяются с калом во внешнюю среду). Цисты лямблий могут длительно сохраняться во внешней среде.
Заражение чаще происходит от больного человека или носителя инфекции. Цисты лямблий передаются фекально-оральным путем при нарушении правил гигиены через воду, пищу, загрязненные предметы, при контакте с зараженными домашними животными.
Проявления заражения лямблиями различны. Лямблиоз может протекать бессимптомно или в виде острой или хронической форм заболевания. Инкубационный (скрытый) период инфекции длится от 1 до 3 недель от попадания лямблий в организм.
Острый лямблиоз начинается внезапно с появления жидкого стула, подъема температуры, болей и вздутия живота, появления тошноты и рвоты. Болезнь может закончиться выздоровлением или перейти в хроническую форму.
При хроническом лямблиозе могут беспокоить слабость, утомляемость, нарушение аппетита, тошнота, периодические боли и вздутие живота, нарушения стула (запоры или поносы), снижение веса. При лямблиозе могут возникать высыпания на коже, аллергические реакции (кожный зуд, крапивница, ринит и др.).
Как можно установить инфицирование лямблиям
Методы лабораторной диагностики лямблиоза делятся на прямые и косвенные.
- Прямые – методы определения самого возбудителя или его частиц.
 Вегетативные формы или цисты лямблий могут быть обнаружены в содержимом двенадцатиперстной кишки (полученном при дуоденальном зондировании) или пробах кала. Определение цист или вегетативных форм лямблий в кале при микроскопии является наиболее распространенным, традиционным методом диагностики лямблиоза, но его чувствительность составляет лишь 50% при однократном исследовании. Микроскопическое исследование с применением систем PARASEP, когда материал для анализа концентрируют с помощью специальных фильтров, увеличивает чувствительность анализа в 10-15 раз по сравнению с традиционным методом. Из-за особенностей жизненного цикла лямблий и прерывистого выделения цист, рекомендовано 3-х кратное исследование кала с интервалом в несколько дней. Определение антигена лямблий в кале проводится иммунологическими методами.
Вегетативные формы или цисты лямблий могут быть обнаружены в содержимом двенадцатиперстной кишки (полученном при дуоденальном зондировании) или пробах кала. Определение цист или вегетативных форм лямблий в кале при микроскопии является наиболее распространенным, традиционным методом диагностики лямблиоза, но его чувствительность составляет лишь 50% при однократном исследовании. Микроскопическое исследование с применением систем PARASEP, когда материал для анализа концентрируют с помощью специальных фильтров, увеличивает чувствительность анализа в 10-15 раз по сравнению с традиционным методом. Из-за особенностей жизненного цикла лямблий и прерывистого выделения цист, рекомендовано 3-х кратное исследование кала с интервалом в несколько дней. Определение антигена лямблий в кале проводится иммунологическими методами. - Косвенные — методы исследования антител (иммуноглобулинов). Антитела к антигенам (белкам) микроорганизма вырабатываются в ответ на проникновение возбудителя в организм и отражают реакцию организма на инфекцию.
 Наиболее распространенным методом определения антител является ИФА (иммуноферментный анализ).
Наиболее распространенным методом определения антител является ИФА (иммуноферментный анализ).
Что показывает анализ на антиген лямблий в кале
Исследование антигена лямблий в кале является прямым методом обнаружения возбудителя, проводится методом ИФА.
Метод обладает высокой специфичностью и чувствительностью. Исследование выявляет вегетативные формы и цисты лямблий, в том числе возбудителей с измененной морфологией. Метод лишен субъективизма микроскопического анализа.
У пациентов с лямблиозом антиген лямблий в кале выявляется в 50-70% после единичного исследования и 90% после троекратного исследования.
Кому показано исследование на антиген лямблий в кале
- Пациентам с признаками лямблиоза.
- Пациентам с хроническими заболеваниями желудочно-кишечного тракта.
- Пациентам с аллергией.
- Пациентам с заболеваниями кожи.

- Людям, бывшим в контакте с больными лямблиозом.
Результат анализа
Полученный результат анализа обязательно должен интерпретировать лечащий врач с учетом всех эпидемиологических данных (о контактах с больными лямблиозом), состояния здоровья пациента, комплекса проведенных инструментальных и лабораторных исследований.
Баклаборатория. Сбор кала на хеликобактер
Правила сбора и доставки кала на исследование с целью обнаружения Helicobacter pylori
- Оптимальным является отбор проб испражнений, полученных естественным путем в день исследования.
- Допустим предварительный прием слабительных средств растительного происхождения (свекла, чернослив, препараты сенны и др.)
- Обязательно следует сделать тщательный туалет наружных половых органов и области заднего прохода мыльным раствором с последующим омыванием кипяченой водой.
- Предварительно помочиться.

- Сбор материала производят из судна, горшка или другой посуды, продезинфицированной и тщательно промытой горячей водой для удаления следов дезинфектанта.
- Материал забирают в стерильный флакон, полученный в лаборатории. С помощью сте- рильной лопаточки, вмонтированной во флакон, отбирают частицы кала из глубины мас- сы в разных местах в количестве 1-2 грамма.
- Доставка материала в лабораторию желательна в день забора образца.
При невозможности получения испражнений в день исследования допускается хранение пробы не более1 -2-ух дней в холодильнике при температуре 2-4° С.
Не рекомендуется:
- проводить исследование ранее, чем через 2 недели после приема антибактериальных препаратов, кишечных антисептиков, препаратов группы ИПП (омепразол, лансопразол, эзомепразол и др.), препаратов висмута (Де-Нол, вентрисол, трибамол, викаир, викалин).
- проводить исследование кала раньше, чем через 2 дня после высокой клизмы, рентгенологического исследования желудка и кишечника, колоноскопии.

- использовать слабительные не растительного происхождения, а также принимать активированный уголь накануне отбора пробы кала.
- использовать ректальные свечи на жировой основе накануне отбора пробы кала.
- допускать попадание в пробу фекалий мочи и воды.
- проводить исследование кала у женщин во время менструации.
Анализ на хеликобактер (Helicobacter pylori), антиген в кале ✔️ Показания, подготовка, результаты анализа
Где сдать анализы?
Днепр
Днепр
Синельниково
Никополь
Покров
Межевая
Петропавловка
Першотравенск
Каменское
Новомосковск
Верхнеднепровск
Петриковка
Кринички
пгт. Покровское
Терновка
Все виды исследования
Медицинский офис
пр. Мира, 71, пом. 5
Время работыПН-ПТ: 7:00 – 16:00
СБ: 8:00 – 13:00
ВС : Выходной
Медицинский офис
пр. Б. Хмельницкого, 19 (территория городской больницы №16)
Время работыПН-ПТ: 7:00 – 16:00
СБ: 8:00 – 13:00
ВС : Выходной
Медицинский офис
пр. Слобожанский, 115/38
Слобожанский, 115/38
ПН-ПТ: 7:00 – 16:00
СБ: 8:00 – 13:00
ВС : Выходной
Медицинский офис
ул. Ближняя, 31 (1 этаж главный корпус городской больницы №4)
Время работыПН-ПТ: 7:30 – 14:30
СБ: 8:00 – 13:00
ВС : Выходной
Медицинский офис
пр. Героев, 22А
Время работыПН-ПТ: 7:00 – 16:00
СБ: 8:00 – 14:00
ВС : Выходной
Медицинский офис
ул. Батумская,13 (городская больница №6, возле корпуса травматологии)
Время работыПН-ПТ: 7:00 – 14:00
СБ-ВС : Выходной
Медицинский офис
ул. Героев Украины, 5А
Время работыПН – ПТ: 7:30 – 14:30
СБ: 8:00 – 12:00
ВС : Выходной
Медицинский офис
ул. Светлая, 1А
Время работыПН -ПТ: 7:30 – 14:30
СБ-ВС : Выходной
Медицинский офис
ул. Музыкальная, 29
Время работыПН – ПТ: 7:00 – 14:00
СБ: 8:00 – 12:00
ВС : Выходной
Медицинский офис
ул. Школьная, 25
Время работыПН – ПТ: 8:00 – 14:00
СБ: 8:00 – 12:00
ВС : Выходной
Медицинский офис
ул. Мира, 50
Мира, 50
ПН – ПТ: 8:00 – 14:00
СБ: 8:00 – 12:00
ВС : Выходной
Медицинский офис
ул. Чернышевского, 11А (вход с пр. Гагарина)
Время работыПН-ПТ: 7:00 – 16:00
СБ: 8:00 – 13:00
ВС : Выходной
Медицинский офис
пр. Аношкина, 72 (территория городской больницы №9)
Время работыПН-ПТ: 7:00 – 14:00
СБ: 8:00 – 13:00
ВС : Выходной
Медицинский офис
пер. Парусный, 10к
Время работыПН-ПТ: 7:00 – 16:00
СБ: 8:00 – 13:00
ВС : Выходной
МЕДИЦИНСКИЙ ОФИС
ул. Холодильная, 60 (ЦРБ)
Время работыПН-ПТ: 7:30 – 14:30
СБ-ВС : Выходной
МЕДИЦИНСКИЙ ОФИС
ул. Гетьманская, 238
Время работыПН-ПТ: 8:00 – 14:00
СБ-ВС : Выходной
Медицинский офис
пр. Слобожанский, 1
Время работыПН-ПТ: 7:00 – 16:00
СБ: 8:00 – 13:00
ВС : Выходной
Медицинский офис
ул. Космическая, 13 (1 этаж детской поликлиники)
Время работыПН-ПТ: 8:00 – 14:00
СБ-ВС : Выходной
Медицинский офис
пр. А. Поля, 17
А. Поля, 17
ПН – ПТ: 8:00 – 14:00
СБ: 8:00 – 12:00
ВС : Выходной
Медицинский офис
пр. П. Калнышевского, 67
Время работыПН-ПТ: 7:30 – 14:30
СБ: 8-00 – 12:00
ВС : Выходной
МЕДИЦИНСКИЙ ОФИС
ж/м Тополь-2, 28
Время работыПН-ПТ: 7:00 – 16:00
СБ: 8:00 – 13:00
ВС : Выходной
Медицинский офис
ул. Центральная, 18
Время работыПН – ПТ: 8:00 – 14:00
СБ: 8:00 – 14:00
ВС : Выходной
Медицинский офис
ул. Привокзальная, 4
Время работыПН-ПТ: 7:00 – 16:00
Суббота: 8:00 – 13:00
Медицинский офис
ул. Первомайская, 58
Время работыПН-ПТ: 7:30 – 13:30
СБ-ВС: Выходной
Медицинский офис
ул. Соборная, 118
Время работыПН – ПТ: 7:30 – 14:30
СБ: 8:00 -13:00
ВС: Выходной
Медицинский офис
ул.Широкая, 43б
Время работыПН-ПТ: 8:00 – 15:00
СБ: 8:00 – 13:00
МЕДИЦИНСКИЙ ОФИС
ул. Донецкое шоссе, 7а
Время работыПН-ПТ: 7:00 – 16:00
СБ: 8:00 – 13:00
ВС : Выходной
Медицинский офис
пл.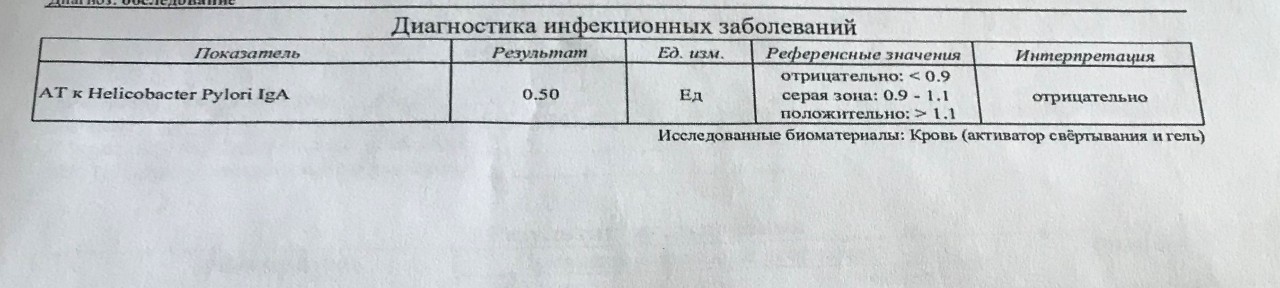 Соборная, 14Г
Соборная, 14Г
ПН-ПТ: 7:00 – 16:00
СБ: 8:00 – 13:00
ВС: Выходной
Медицинский офис
ул. Полевая, 2А
Время работыПН-ПТ: 7:30 – 14:30
СБ: Выходной
ВС : Выходной
Как подготовиться к анализу?
Внимание! Исполнение правил подготовки к лабораторным исследованиям влияет на качество результатов, поэтому необходимо точно придерживаться техники подготовки.
Внимание! Исполнение правил подготовки к лабораторным исследованиям влияет на качество результатов, поэтому необходимо точно придерживаться техники подготовки.
Приём материала в своей посуде не допускается.
Накануне исключить свечи, слабительные препараты, клизмы, приём препаратов железа, красящих продуктов (свекла).
Утром, после естественной дефекации необходимо собрать кал в чистую одноразовую посуду и мерной ложечкой в аптечный контейнер собрать из трёх точек, не более 1/3 контейнера, без примесей мочи и воды. За 2 часа доставить в лабораторию. Грудным детям допускается сбор кала из памперса, сразу после дефекации, не касаясь ложечкой памперса, в количестве не менее заполненного конуса.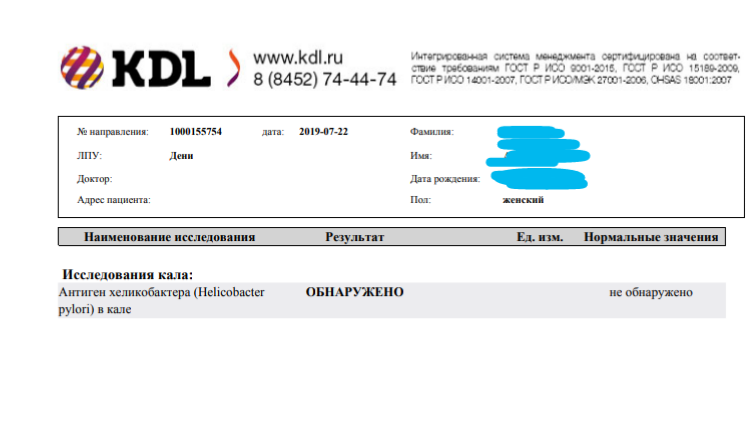 В случае если пациент не может самостоятельно сходить в туалет, предложить 3 дня придерживаться диеты (усиленный питьевой режим, клетчатка, кисломолочные продукты).
В случае если пациент не может самостоятельно сходить в туалет, предложить 3 дня придерживаться диеты (усиленный питьевой режим, клетчатка, кисломолочные продукты).
Допускается вечерняя порция (после 20:00), хранить в холодильнике.
Анализ стула: антиген H. Pylori (для родителей)
Что это такое
Helicobacter pylori ( H. pylori ) – частая причина пептических язв (язв на слизистой оболочке желудка, тонкой кишки или пищевода). В этом тесте образец стула (кала) используется для определения присутствия антигенов H. pylori в желудочно-кишечной (ЖКТ) системе вашего ребенка. Антигены – это вещества, которые заставляют иммунную систему бороться с инфекцией.
Почему это сделано
Врач может запросить анализ стула на антиген H. pylori , если у вашего ребенка есть симптомы, которые могут указывать на наличие язвенной болезни, такие как несварение желудка, боль в животе, ощущение переполнения или вздутия живота, тошнота, частая отрыжка или рвота.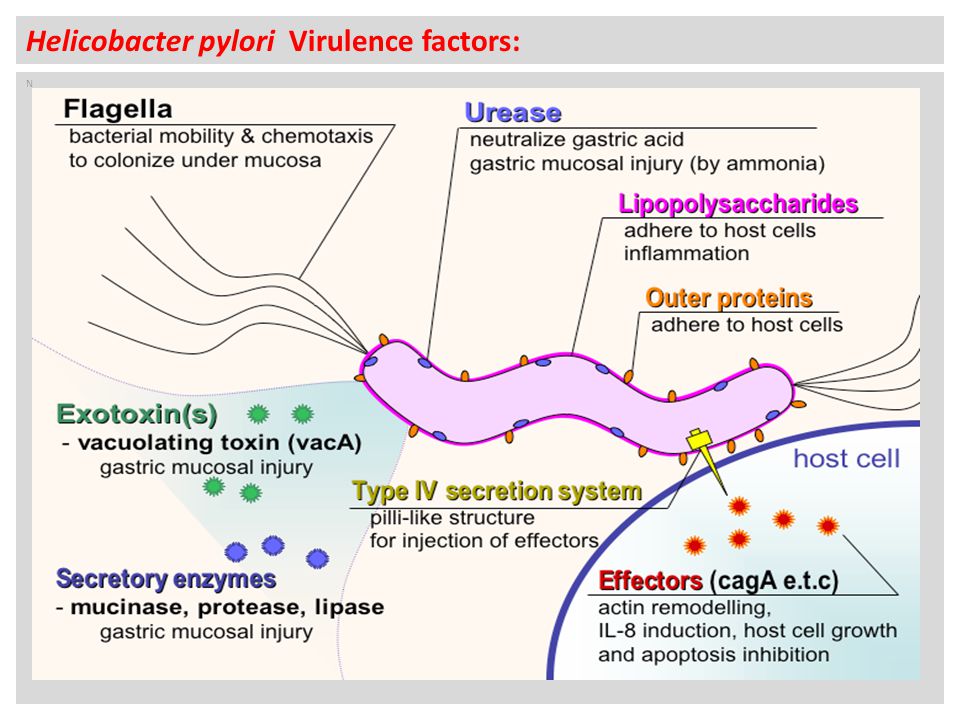 Тест также может быть назначен после того, как ваш ребенок завершит курс антибиотиков для H. pylori , чтобы определить, ликвидирует ли он инфекцию.
Тест также может быть назначен после того, как ваш ребенок завершит курс антибиотиков для H. pylori , чтобы определить, ликвидирует ли он инфекцию.
Препарат
В отличие от большинства других лабораторных тестов, образец стула часто берут родители дома, а не медицинские работники в больнице или клинике.За 2 недели до теста вашего ребенка могут попросить избегать приема некоторых лекарств, таких как антибиотики, антациды, висмут и лекарства от язвенной болезни, такие как ингибиторы протонной помпы (ИПП) и блокаторы h3.
p
Процедура
Врач или больничная лаборатория обычно предоставляют письменные инструкции о том, как собирать образец стула. Если инструкции не предоставлены, вот советы по сбору образца стула у вашего ребенка:
- Обязательно наденьте защитные перчатки и после этого вымойте руки и руки ребенка.
- Некоторые маленькие дети не всегда могут заранее сообщить родителям о дефекации. Поэтому для сбора образца стула используется пластиковая крышка в форме шляпы.
 Это улавливающее устройство можно быстро разместить над унитазом или под попкой ребенка для сбора пробы. Использование улавливающего устройства может предотвратить загрязнение стула водой и грязью. Другой способ собрать образец стула – это накинуть на сиденье унитаза неплотно полиэтиленовую пленку. Затем поместите образец стула в чистый герметичный контейнер, прежде чем отнести его в лабораторию.
Это улавливающее устройство можно быстро разместить над унитазом или под попкой ребенка для сбора пробы. Использование улавливающего устройства может предотвратить загрязнение стула водой и грязью. Другой способ собрать образец стула – это накинуть на сиденье унитаза неплотно полиэтиленовую пленку. Затем поместите образец стула в чистый герметичный контейнер, прежде чем отнести его в лабораторию. - Пластиковую пленку также можно использовать для выстилки подгузника младенца или малыша, который еще не пользуется туалетом. Повязку следует размещать так, чтобы моча попадала в подгузник, а не в подгузник. Стул не должен касаться внутренней части одноразовых подгузников, потому что подкладка обычно обладает антибактериальными свойствами, которые могут повлиять на результаты теста.
- Ваш ребенок не должен мочиться в контейнер. Если возможно, попросите ребенка опорожнить мочевой пузырь перед дефекацией.
- Стул следует собирать в чистые сухие пластиковые банки с завинчивающейся крышкой.
 Вашего ребенка могут попросить сдать образец стула один или несколько раз. Для достижения наилучших результатов стул следует сразу же доставить в лабораторию. Если это невозможно, стул следует охладить, а затем как можно скорее доставить в лабораторию.
Вашего ребенка могут попросить сдать образец стула один или несколько раз. Для достижения наилучших результатов стул следует сразу же доставить в лабораторию. Если это невозможно, стул следует охладить, а затем как можно скорее доставить в лабораторию.
В качестве альтернативы врач или медсестра могут взять небольшой образец стула, вставив тампон в прямую кишку вашего ребенка.
p
Чего ожидать
Когда образец поступает в лабораторию, небольшое количество стула помещается в крошечные пузырьки.Добавляются специальные химические вещества и проявитель цвета. В конце теста наличие синего цвета указывает на присутствие антигенов H. pylori .
Получение результатов
Как правило, результат теста стула H. pylori сообщается через 1–4 дня.
Риски
Сбор образцов стула не представляет никакого риска.
Помощь вашему ребенку
Взять образец стула безболезненно. Скажите ребенку, что сбор стула не повредит, но это нужно делать осторожно. Достаточно взрослый ребенок может самостоятельно собрать образец, чтобы избежать затруднений. Расскажите ребенку, как это делать правильно. Если образец взят тампоном, ваш ребенок может почувствовать легкое давление в прямой кишке во время процедуры.
Достаточно взрослый ребенок может самостоятельно собрать образец, чтобы избежать затруднений. Расскажите ребенку, как это делать правильно. Если образец взят тампоном, ваш ребенок может почувствовать легкое давление в прямой кишке во время процедуры.
Если у вас есть вопросы
Если у вас есть вопросы по тесту стула H. pylori , поговорите со своим врачом.
Анализы стула на антиген для лечения инфекции Helicobacter pylori
World J Gastroenterol.2013 Dec 7; 19 (45): 8188–8191.
Тадаси Симояма, Отделение гастроэнтерологии, Высшая школа медицины Университета Хиросаки, Хиросаки 036-8562, Япония
Вклад автора: Симояма Т. внес свой вклад в эту рукопись.Для корреспонденции: Тадаси Симояма, доктор медицины, доктор философии, отделение гастроэнтерологии, Высшая школа медицины Университета Хиросаки, 5 Zaifu-cho, Hirosaki 036-8562, Япония. pj.ca.nimu@ikh-omist
Телефон: + 81-172-395053 Факс: + 81-172-375946
Получено 26 сентября 2013 г . ; Пересмотрено 29 октября 2013 г .; Принята в печать 12 ноября 2013 г.
; Пересмотрено 29 октября 2013 г .; Принята в печать 12 ноября 2013 г.
Abstract
Тесты на антигены стула (SAT) – это неинвазивные диагностические модули для инфекции Helicobacter pylori ( H. pylori ). Для диагностики инфекции H. pylori существуют два типа SAT: один основан на иммуноферментном анализе (EIA), а другой – на иммунохроматографии (ICA). Для SAT не требуются дорогостоящие химические вещества или специальное оборудование; следовательно, они дешевле по сравнению с дыхательным тестом на мочевину.Как европейские, так и японские руководства показали, что SAT на основе EIA с использованием моноклональных антител полезны для первичной диагностики, а также для оценки эрадикационной терапии. Тесты на основе ICA не требуют специального оборудования и поэтому полезны в развивающихся странах. SAT также полезны для диагностики инфекции H. pylori у детей и пациентов после операции на желудке. Тесты SAT, выполненные с помощью EIA, позволяют оценить инфекцию H. pylori у большого числа субъектов почти так же, как и серологические исследования.Таким образом, тесты SAT могут быть полезны для выявления текущей инфекции в таком обследовании для выявления и искоренения инфекции H. pylori . Точность SAT ниже, если образцы стула не сформированы или водянистые, потому что специфических антигенов H. pylori в образцах стула разбавлены. Температура и интервал между сбором пробы стула и измерением также влияют на результаты тестов SAT. Выбор тестового набора зависит от чувствительности и специфичности в каждом регионе и от обстоятельств каждого пациента.
pylori у детей и пациентов после операции на желудке. Тесты SAT, выполненные с помощью EIA, позволяют оценить инфекцию H. pylori у большого числа субъектов почти так же, как и серологические исследования.Таким образом, тесты SAT могут быть полезны для выявления текущей инфекции в таком обследовании для выявления и искоренения инфекции H. pylori . Точность SAT ниже, если образцы стула не сформированы или водянистые, потому что специфических антигенов H. pylori в образцах стула разбавлены. Температура и интервал между сбором пробы стула и измерением также влияют на результаты тестов SAT. Выбор тестового набора зависит от чувствительности и специфичности в каждом регионе и от обстоятельств каждого пациента.
Ключевые слова: Helicobacter pylori , определение антигена стула, диагностика, иммуноферментный анализ, иммунохроматография
Основной совет: Тесты на антигены стула (SAT) – относительно недорогие неинвазивные тесты. Несколько руководств по инфекции Helicobacter pylori ( H. pylori ) со всего мира указывают, что SAT с использованием моноклональных антител полезны для первичной диагностики, а также для оценки результатов эрадикационной терапии.SAT также полезны для диагностики инфекции H. pylori у детей и пациентов после операции на желудке. Выбор тестового набора зависит от точности в каждой популяции и от обстоятельств каждого пациента.
Несколько руководств по инфекции Helicobacter pylori ( H. pylori ) со всего мира указывают, что SAT с использованием моноклональных антител полезны для первичной диагностики, а также для оценки результатов эрадикационной терапии.SAT также полезны для диагностики инфекции H. pylori у детей и пациентов после операции на желудке. Выбор тестового набора зависит от точности в каждой популяции и от обстоятельств каждого пациента.
ВВЕДЕНИЕ
Инфекция, вызванная Helicobacter pylori ( H. pylori ), вовлечена в патогенез желудочно-дуоденальных заболеваний. Несколько руководств по заражению H. pylori со всего мира указывают на то, что ликвидация H.pylori приведет к снижению заболеваемости гастродуоденальными заболеваниями, включая рак желудка, и уменьшит количество новых инфекций в будущих поколениях [1,2]. Следуя рекомендациям японских руководств по лечению инфекции H. pylori (пересмотренное издание 2009 г. ), в 2013 г. японская система медицинского страхования утвердила покрытие диагностики и ликвидации H. pylori у всех инфицированных пациентов [ 3]. Следовательно, расширение роли H.pylori диагностических тестов будет сопровождать рост числа пациентов, подвергнутых тестам и искоренению H. pylori .
), в 2013 г. японская система медицинского страхования утвердила покрытие диагностики и ликвидации H. pylori у всех инфицированных пациентов [ 3]. Следовательно, расширение роли H.pylori диагностических тестов будет сопровождать рост числа пациентов, подвергнутых тестам и искоренению H. pylori .
– это неинвазивные диагностические модули для инфекции H. pylori , которые были введены после дыхательного теста с мочевиной (UBT). Ранние тесты SAT использовали иммуноферментный анализ (EIA) на основе поликлональных антител. Хотя они предоставили надежные результаты в диагностике инфекции H. pylori , при пост-эрадикационной оценке иногда наблюдались противоречивые результаты из-за ложноположительных результатов [4,5].Методы, основанные на моноклональных антителах, обычно имеют более высокую специфичность. Были разработаны SAT на основе моноклональных антител, которые оказались более точными, чем тесты с использованием поликлональных антител [6,7]. Метаанализ также показал, что специфичность SAT на основе моноклональных антител составляла 0,97 (95% ДИ: 0,96–0,98) [8]. Как европейские, так и японские руководства показали, что SAT с использованием моноклональных антител полезны для первичной диагностики, а также для оценки эрадикационной терапии [1,3].
Метаанализ также показал, что специфичность SAT на основе моноклональных антител составляла 0,97 (95% ДИ: 0,96–0,98) [8]. Как европейские, так и японские руководства показали, что SAT с использованием моноклональных антител полезны для первичной диагностики, а также для оценки эрадикационной терапии [1,3].
Для диагностики инфекции H. pylori существуют два типа SAT, один на основе EIA, а другой – на основе иммунохроматографии (ICA). Хотя оба типа тестов обладают высокой чувствительностью и специфичностью, недавнее исследование показало, что доступные в настоящее время тесты на основе ICA дают менее надежные результаты, чем тесты на основе EIA [9]. Тем не менее, тесты на основе ICA просты в выполнении и полезны для оперативной диагностики инфекции H. pylori [10]. Тесты на основе ICA не требуют специального оборудования; поэтому они были бы полезны в развивающихся странах.
ДИАГНОСТИКА
Сравнение с UBT
Среди неинвазивных диагностических тестов SAT и UBT имеют более высокую точность, чем серологические тесты или тесты на антитела в моче [1,3]. Американская гастроэнтерологическая ассоциация рекомендует как SAT, так и UBT для диагностики инфекции H. pylori у пациентов с диспепсией [4]. Хотя UBT считается наиболее надежным неинвазивным тестом для диагностики инфекции H. pylori , у него есть несколько ограничений.Стоимость UBT все еще относительно высока из-за цены 13 C-мочевины (приблизительно 30,3 долларов США) и стоимости измерения 13 CO 2 . Напротив, SAT не требуют дорогих химических веществ и специального оборудования и, следовательно, менее дороги (1400 иен; примерно 14,2 доллара США). Кроме того, пациенты должны голодать перед тестом UBT, но не перед тестом SAT. Кроме того, введение ингибитора протонной помпы (ИПП) модулирует pH желудочного сока, что приводит к снижению активности уреазы H.pylori в желудке. UBT определяет активность уреазы слизистой оболочки желудка; поэтому у пациентов, принимавших ИПП, отмечаются ложноотрицательные результаты [11]. Поэтому обычно рекомендуется прекратить прием ИПП за 2 недели до теста UBT [1].
Американская гастроэнтерологическая ассоциация рекомендует как SAT, так и UBT для диагностики инфекции H. pylori у пациентов с диспепсией [4]. Хотя UBT считается наиболее надежным неинвазивным тестом для диагностики инфекции H. pylori , у него есть несколько ограничений.Стоимость UBT все еще относительно высока из-за цены 13 C-мочевины (приблизительно 30,3 долларов США) и стоимости измерения 13 CO 2 . Напротив, SAT не требуют дорогих химических веществ и специального оборудования и, следовательно, менее дороги (1400 иен; примерно 14,2 доллара США). Кроме того, пациенты должны голодать перед тестом UBT, но не перед тестом SAT. Кроме того, введение ингибитора протонной помпы (ИПП) модулирует pH желудочного сока, что приводит к снижению активности уреазы H.pylori в желудке. UBT определяет активность уреазы слизистой оболочки желудка; поэтому у пациентов, принимавших ИПП, отмечаются ложноотрицательные результаты [11]. Поэтому обычно рекомендуется прекратить прием ИПП за 2 недели до теста UBT [1]. ИПП могут аналогичным образом влиять на результаты SAT [12,13], но некоторые SAT на основе моноклональных антител, доступные в настоящее время, не подвержены действию ИПП [14]. Такие SAT, которые не требуют прекращения PPI, полезны для управления H.pylori у пациентов с гастроэзофагеальной рефлюксной болезнью или у лиц, принимающих нестероидные противовоспалительные препараты.
ИПП могут аналогичным образом влиять на результаты SAT [12,13], но некоторые SAT на основе моноклональных антител, доступные в настоящее время, не подвержены действию ИПП [14]. Такие SAT, которые не требуют прекращения PPI, полезны для управления H.pylori у пациентов с гастроэзофагеальной рефлюксной болезнью или у лиц, принимающих нестероидные противовоспалительные препараты.
Диагностика у детей и пациентов после хирургических вмешательств на желудке
Систематический обзор и метаанализ показали, что SAT с использованием ИФА на основе моноклональных антител полезны для диагностики инфекции H. pylori у детей [15]. UBT также очень точен у детей старше 6 лет, в то время как исследования, проведенные в развитых странах, показали, что его специфичность была менее 90% у очень маленьких детей [16,17].Напротив, как моноклональные SAT, так и UBT были надежными у маленьких детей в возрасте 6-30 месяцев в развивающихся странах Южной Америки [18]. Эти результаты показывают, что тесты SAT на основе моноклональных антител являются наиболее эффективными тестами для детей в популяциях с высокой и низкой распространенностью инфекции H. pylori [18,19].
pylori [18,19].
У пациентов, перенесших дистальную резекцию желудка, точность UBT была ниже, чем у биопсийного уреазного теста [20]. Однако у японских пациентов, перенесших дистальную резекцию желудка, специфичность SAT была 90.5%, тогда как UBT составлял всего 59,1% [21].
Массовое обследование и скрининг
В массовых обследованиях, что касается техники и стоимости, обычно использовалась серология, несмотря на ее более низкую специфичность [3]. Тесты SAT, выполненные с помощью EIA, могут оценить инфекцию H. pylori у большого числа субъектов почти так же, как серологические. У 994 здоровых взрослых японцев, принявших участие в массовом опросе, соответствие результатов SAT и серологии составило более 90% [22]. Однако в этом исследовании положительность тестов SAT была значительно ниже, чем у серологических, у 303 пациентов с тяжелым атрофическим гастритом.В слизистой оболочке желудка пациентов с тяжелым атрофическим гастритом и кишечной метаплазией колонизация H. pylori снижена или отсутствует. Следовательно, в условиях массового обследования серология полезна для выявления как текущей, так и перенесенной инфекции. SAT должны использоваться для выявления текущей инфекции в таком обследовании, чтобы идентифицировать и искоренить инфекцию H. pylori для предотвращения злокачественных новообразований желудка.
pylori снижена или отсутствует. Следовательно, в условиях массового обследования серология полезна для выявления как текущей, так и перенесенной инфекции. SAT должны использоваться для выявления текущей инфекции в таком обследовании, чтобы идентифицировать и искоренить инфекцию H. pylori для предотвращения злокачественных новообразований желудка.
ОЦЕНКА ЭРАДИКАЦИИ
На сегодняшний день многие исследования продемонстрировали полезность SAT для оценки результатов эрадикационной терапии.Недавние руководства Европейской исследовательской группы по хеликобактерам (EHSG) рекомендуют как UBT, так и лабораторный моноклональный SAT [1]. После эрадикационной терапии количество колоний H. pylori в желудке будет уменьшено, даже если эрадикационная терапия оказалась безуспешной. Таким образом, SAT должны быть выполнены для обнаружения уменьшенного количества бактерий. Среди лабораторных моноклональных тестов SAT Premier Platinum HpSA Plus (HpSA ELISA II; Meridian Diagnostics, Inc. , Цинциннати, Огайо, США), в котором используются множественные мышиные моноклональные антитела, кажется точным.Ранее мы продемонстрировали значительно более высокую чувствительность HpSA ELISA II по сравнению с тестом Testmate Pylori Antigen EIA (TPAg EIA; Wakamoto Pharmaceutical Co. Ltd. и Kyowa Medex, Токио, Япония), в котором используется одно моноклональное антитело [23]. HpSA ELISA II дает более высокую прогностическую ценность положительного результата, хотя TPAg EIA дает эффективные результаты [24].
, Цинциннати, Огайо, США), в котором используются множественные мышиные моноклональные антитела, кажется точным.Ранее мы продемонстрировали значительно более высокую чувствительность HpSA ELISA II по сравнению с тестом Testmate Pylori Antigen EIA (TPAg EIA; Wakamoto Pharmaceutical Co. Ltd. и Kyowa Medex, Токио, Япония), в котором используется одно моноклональное антитело [23]. HpSA ELISA II дает более высокую прогностическую ценность положительного результата, хотя TPAg EIA дает эффективные результаты [24].
В руководствах EHSG для оценки результатов лечения рекомендуются лабораторные, но не служебные тесты [1].Однако недавние наблюдения показывают, что некоторые лабораторные тесты на основе моноклональных антител могут точно оценить результаты лечения эрадикацией [9,25]. Кабинетные тесты позволяют врачам оценить результаты эрадикационной терапии за одно посещение, а следующая эрадикационная терапия может быть начата в тот же день у пациентов, не подвергшихся эрадикации. Офисные тесты не требуют специального оборудования; следовательно, они подходят для институтов, которые не могут измерять 13 CO 2 .
Введение ИПП следует прекратить за 2 недели до оценки результатов лечения с помощью UBT или SAT [1]. Однако, как описано выше, ИПП не влияют на результаты некоторых тестов SAT [13]. Фактически, на небольшой серии из 22 японских пациентов мы показали, что результаты эрадикационной терапии, оцененные с помощью TPAg EIA во время введения PPI, были такими же, как и результаты, определенные UBT через 4 недели после отмены PPI у 21 пациента [26].
В некоторых руководствах оценка результатов эрадикационной терапии с помощью SAT должна проводиться по крайней мере через 4 недели после окончания лечения [1,3].Однако считается, что рецидив после эрадикации в основном представляет собой рецидив той же инфекции, а не повторное инфицирование. Поэтому были внесены предложения о продлении срока до 6 или 8 недель после окончания лечения. Тест EIA на основе моноклональных антител может определить результаты лечения через 6 недель после окончания лечения, а также через 8 недель [26].
НА ЗАМЕТКУ ПРИ ВЫПОЛНЕНИИ SAT
На результаты SAT влияют несколько факторов. Точность тестов SAT ниже, если образцы стула несформированные или водянистые, потому что H.pylori -специфические антигены в образцах стула разводятся. Поэтому не следует использовать водянистый стул, особенно при определении результатов эрадикационной терапии. Чувствительность SAT также ниже у пациентов с кровотечением из верхних отделов желудочно-кишечного тракта [27].
Точность тестов SAT ниже, если образцы стула несформированные или водянистые, потому что H.pylori -специфические антигены в образцах стула разводятся. Поэтому не следует использовать водянистый стул, особенно при определении результатов эрадикационной терапии. Чувствительность SAT также ниже у пациентов с кровотечением из верхних отделов желудочно-кишечного тракта [27].
Температура и интервал между сбором пробы стула и измерением также влияют на результаты тестов SAT. Такая информация доступна для двух комплектов. Querioz et al [18] изучили результаты HpSA ELISA II и показали заметное снижение значения OD, когда образцы стула выдерживались при 37 ° C в течение 48 часов.Они также повторно протестировали образец стула со значением OD 0,183 после 6 часов инкубации при 37 ° C и обнаружили, что значение OD упало ниже порогового значения (0,120). В образцах, протестированных с помощью TPAg EIA, мы обнаружили, что значения OD для исходно отрицательных образцов стула увеличивались и были почти аналогичны пороговому уровню, если образцы поддерживались при 40 ° C [9]. Однако значения OD не изменялись до 7 дней при температуре от -5 ° C до 25 ° C, когда суспензии образцов стула хранились в специальных устройствах для сбора. Следовательно, образцы стула следует хранить при низкой температуре и анализировать в течение короткого периода, если устройства для сбора недоступны.Чтобы сохранить антигенность в течение длительного времени, образцы стула следует хранить при -80 ° C.
Однако значения OD не изменялись до 7 дней при температуре от -5 ° C до 25 ° C, когда суспензии образцов стула хранились в специальных устройствах для сбора. Следовательно, образцы стула следует хранить при низкой температуре и анализировать в течение короткого периода, если устройства для сбора недоступны.Чтобы сохранить антигенность в течение длительного времени, образцы стула следует хранить при -80 ° C.
Различия в антигенности штаммов H. pylori иногда влияют на точность SAT в разных популяциях [28]. Следовательно, чувствительность и специфичность SAT следует тестировать в каждой популяции перед использованием для лечения инфекции H. pylori .
ЗАКЛЮЧЕНИЕ
Таким образом, SAT – это относительно недорогие неинвазивные тесты. SAT с использованием моноклональных антител полезны для первичной диагностики, а также для оценки эрадикационной терапии.SAT также полезны при лечении инфекции H. pylori у детей и пациентов после хирургического вмешательства на желудке.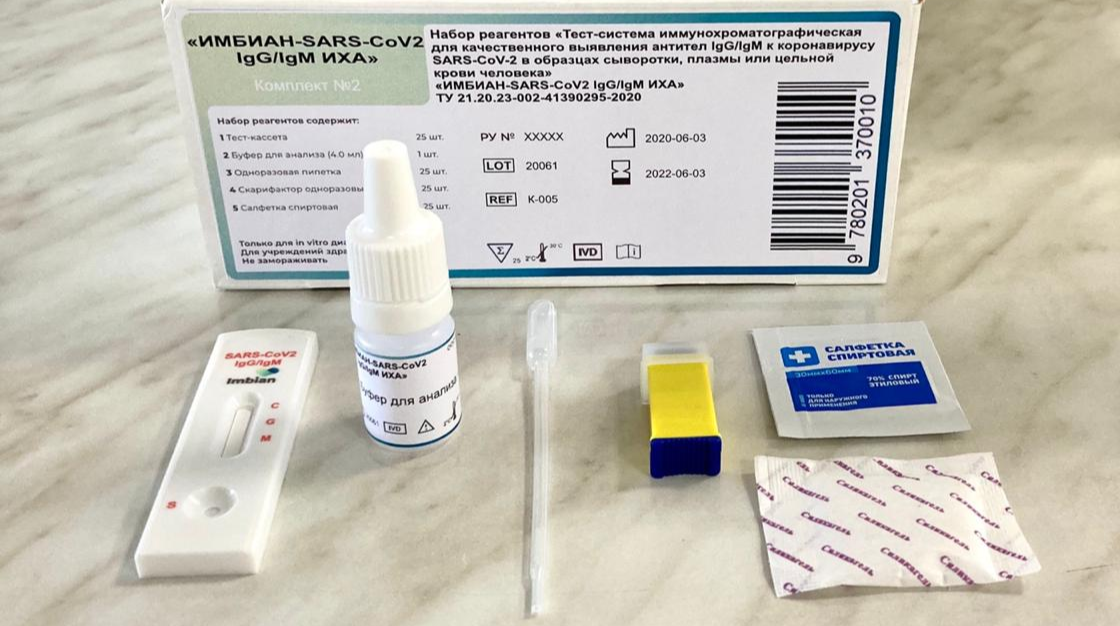 В будущем SAT следует использовать в массовых обследованиях для выявления и искоренения инфекции H. pylori для профилактики злокачественных новообразований желудка. Выбор тестового набора зависит от чувствительности и специфичности в каждом регионе и от обстоятельств каждого пациента.
В будущем SAT следует использовать в массовых обследованиях для выявления и искоренения инфекции H. pylori для профилактики злокачественных новообразований желудка. Выбор тестового набора зависит от чувствительности и специфичности в каждом регионе и от обстоятельств каждого пациента.
Сноски
P- Рецензенты: Naito Y, Nagahara H, Said ZNA, Slomiany BL S- Редактор: Gou SX L- Редактор: Стюарт GJ E- Редактор: Zhang DN
Ссылки
1.Мальфертхайнер П., Меграуд Ф., О’Морайн К.А., Атертон Дж., Аксон А.Т., Баццоли Ф., Дженсини Г.Ф., Гисберт Дж. П., Грэм Д. Ю., Роккас Т. Управление инфекцией Helicobacter pylori – Маастрихтский отчет IV / Флорентийский консенсусный доклад. Кишечник. 2012. 61: 646–664. [PubMed] [Google Scholar] 2. Фок К.М., Кателарис П., Сугано К., Энг Т.Л., Хант Р., Талли, штат Нью-Джерси, Лам С.К., Сяо С.Д., Тан Х.Дж., Ву С.Й. и др. Вторые руководящие принципы Азиатско-Тихоокеанского консенсуса по инфекции Helicobacter pylori. J Gastroenterol Hepatol. 2009; 24: 1587–1600. [PubMed] [Google Scholar] 3.Асака М., Като М., Такахаши С., Фукуда Й., Сугияма Т., Ота Х, Уэмура Н., Мураками К., Сато К., Сугано К. Руководство по лечению инфекции Helicobacter pylori в Японии: пересмотренное издание 2009 г. Helicobacter. 2010; 15: 1–20. [PubMed] [Google Scholar] 4. Odaka T, Yamaguchi T., Koyama H, Saisho H, Nomura F. Оценка теста на антиген стула Helicobacter pylori для мониторинга эрадикационной терапии. Am J Gastroenterol. 2002; 97: 594–599. [PubMed] [Google Scholar] 5. Вейола Л., Оксанен А., Лёфгрен Т., Сиппонен П., Карвонен А.Л., Раутелин Х.Сравнение трех тестов стула на антиген для подтверждения эрадикации Helicobacter pylori у взрослых. Сканд Дж Гастроэнтерол. 2005; 40: 395–401. [PubMed] [Google Scholar] 6. Домингес Дж., Форне М., Бланко С., Прат С., Гали Н., Латорре И., Вивер Дж. М., Аусина В. Сравнение моноклонального и поликлонального иммуноферментного анализа стула на основе антител при диагностике инфекции Helicobacter pylori до и после эрадикационной терапии.
2009; 24: 1587–1600. [PubMed] [Google Scholar] 3.Асака М., Като М., Такахаши С., Фукуда Й., Сугияма Т., Ота Х, Уэмура Н., Мураками К., Сато К., Сугано К. Руководство по лечению инфекции Helicobacter pylori в Японии: пересмотренное издание 2009 г. Helicobacter. 2010; 15: 1–20. [PubMed] [Google Scholar] 4. Odaka T, Yamaguchi T., Koyama H, Saisho H, Nomura F. Оценка теста на антиген стула Helicobacter pylori для мониторинга эрадикационной терапии. Am J Gastroenterol. 2002; 97: 594–599. [PubMed] [Google Scholar] 5. Вейола Л., Оксанен А., Лёфгрен Т., Сиппонен П., Карвонен А.Л., Раутелин Х.Сравнение трех тестов стула на антиген для подтверждения эрадикации Helicobacter pylori у взрослых. Сканд Дж Гастроэнтерол. 2005; 40: 395–401. [PubMed] [Google Scholar] 6. Домингес Дж., Форне М., Бланко С., Прат С., Гали Н., Латорре И., Вивер Дж. М., Аусина В. Сравнение моноклонального и поликлонального иммуноферментного анализа стула на основе антител при диагностике инфекции Helicobacter pylori до и после эрадикационной терапии. Алимент Pharmacol Ther. 2006; 23: 1735–1740. [PubMed] [Google Scholar] 7. Дегучи Р., Мацусима М, Сузуки Т, Майн Т, Фукуда Р., Нишина М., Одзава Х., Такаги А.Сравнение иммуноферментного анализа кала на моноклональные и поликлональные антитела при диагностике инфекции Helicobacter pylori после эрадикационной терапии. J Gastroenterol. 2009. 44: 713–716. [PubMed] [Google Scholar] 8. Gisbert JP, de la Morena F, Abraira V. Точность теста на моноклональный антиген стула для диагностики инфекции H. pylori: систематический обзор и метаанализ. Am J Gastroenterol. 2006; 101: 1921–1930. [PubMed] [Google Scholar] 9. Коркмаз Х., Кесли Р., Карабаглы П., Терзи Ю. Сравнение диагностической точности пяти различных тестов на антигены стула для диагностики инфекции Helicobacter pylori.Helicobacter. 2013; 18: 384–391. [PubMed] [Google Scholar] 10. Симояма Т., Савая М., Исигуро А., Ханабата Н., Йошимура Т., Фукуда С. Применимость экспресс-теста на антиген стула с использованием моноклональных антител к каталазе для лечения инфекции Helicobacter pylori.
Алимент Pharmacol Ther. 2006; 23: 1735–1740. [PubMed] [Google Scholar] 7. Дегучи Р., Мацусима М, Сузуки Т, Майн Т, Фукуда Р., Нишина М., Одзава Х., Такаги А.Сравнение иммуноферментного анализа кала на моноклональные и поликлональные антитела при диагностике инфекции Helicobacter pylori после эрадикационной терапии. J Gastroenterol. 2009. 44: 713–716. [PubMed] [Google Scholar] 8. Gisbert JP, de la Morena F, Abraira V. Точность теста на моноклональный антиген стула для диагностики инфекции H. pylori: систематический обзор и метаанализ. Am J Gastroenterol. 2006; 101: 1921–1930. [PubMed] [Google Scholar] 9. Коркмаз Х., Кесли Р., Карабаглы П., Терзи Ю. Сравнение диагностической точности пяти различных тестов на антигены стула для диагностики инфекции Helicobacter pylori.Helicobacter. 2013; 18: 384–391. [PubMed] [Google Scholar] 10. Симояма Т., Савая М., Исигуро А., Ханабата Н., Йошимура Т., Фукуда С. Применимость экспресс-теста на антиген стула с использованием моноклональных антител к каталазе для лечения инфекции Helicobacter pylori. J Gastroenterol. 2011; 46: 487–491. [PubMed] [Google Scholar] 11. Грэм Д.Ю., Опекун А.Р., Хаммуд Ф., Ямаока Ю., Редди Р., Осато М.С., Эль-Зимайти Х.М. Исследования, касающиеся механизма ложноотрицательных дыхательных тестов на мочевину с ингибиторами протонной помпы.Am J Gastroenterol. 2003; 98: 1005–1009. [PubMed] [Google Scholar] 12. Erzin Y, Altun S, Dobrucali A, Aslan M, Erdamar S, Dirican A, Kocazeybek B. Оценка двух иммуноферментных анализов для обнаружения Helicobacter pylori в образцах стула пациентов с диспепсией после эрадикационной терапии. J Med Microbiol. 2005; 54: 863–866. [PubMed] [Google Scholar] 13. Асфельдт AM, Løchen ML, Straume B, Steigen SE, Florholmen J, Goll R, Nestegard O, Paulssen EJ. Точность анализа стула на антиген на основе моноклональных антител в диагностике инфекции Helicobacter pylori.Сканд Дж Гастроэнтерол. 2004; 39: 1073–1077. [PubMed] [Google Scholar] 14. Кодама М., Мураками К., Окимото Т., Фукуда Й., Симояма Т., Окуда М., Като С., Кобаяши И., Фудзиока Т.
J Gastroenterol. 2011; 46: 487–491. [PubMed] [Google Scholar] 11. Грэм Д.Ю., Опекун А.Р., Хаммуд Ф., Ямаока Ю., Редди Р., Осато М.С., Эль-Зимайти Х.М. Исследования, касающиеся механизма ложноотрицательных дыхательных тестов на мочевину с ингибиторами протонной помпы.Am J Gastroenterol. 2003; 98: 1005–1009. [PubMed] [Google Scholar] 12. Erzin Y, Altun S, Dobrucali A, Aslan M, Erdamar S, Dirican A, Kocazeybek B. Оценка двух иммуноферментных анализов для обнаружения Helicobacter pylori в образцах стула пациентов с диспепсией после эрадикационной терапии. J Med Microbiol. 2005; 54: 863–866. [PubMed] [Google Scholar] 13. Асфельдт AM, Løchen ML, Straume B, Steigen SE, Florholmen J, Goll R, Nestegard O, Paulssen EJ. Точность анализа стула на антиген на основе моноклональных антител в диагностике инфекции Helicobacter pylori.Сканд Дж Гастроэнтерол. 2004; 39: 1073–1077. [PubMed] [Google Scholar] 14. Кодама М., Мураками К., Окимото Т., Фукуда Й., Симояма Т., Окуда М., Като С., Кобаяши И., Фудзиока Т. Влияние лечения ингибиторами протонной помпы на тест на антиген стула Helicobacter pylori. Мир Дж. Гастроэнтерол. 2012; 18: 44–48. [Бесплатная статья PMC] [PubMed] [Google Scholar] 15. Леал Ю.А., Седильо-Ривера Р., Симон Дж. А., Веласкес Дж. Р., Флорес Л.Л., Торрес Дж. Полезность тестов на основе образцов стула для диагностики инфекции Helicobacter pylori у детей.J Pediatr Gastroenterol Nutr. 2011; 52: 718–728. [PubMed] [Google Scholar] 16. Мегро Ф. Сравнение неинвазивных тестов для выявления инфекции Helicobacter pylori у детей и подростков: результаты многоцентрового европейского исследования. J Pediatr. 2005. 146: 198–203. [PubMed] [Google Scholar] 17. Имри К., Роуленд М., Бурк Б., Драмм Б. Ограничения дыхательного теста с меченной углеродом 13 мочевиной на Helicobacter pylori у младенцев. J Pediatr. 2001; 139: 734–737. [PubMed] [Google Scholar] 18. Queiroz DM, Saito M, Rocha GA, Rocha AM, Melo FF, Checkley W, Braga LL, Silva IS, Gilman RH, Crabtree JE.Инфекция Helicobacter pylori у младенцев и детей ясельного возраста в Южной Америке: соответствие между дыхательным тестом на [13C] мочевину и моноклональным тестом на антиген стула H.
Влияние лечения ингибиторами протонной помпы на тест на антиген стула Helicobacter pylori. Мир Дж. Гастроэнтерол. 2012; 18: 44–48. [Бесплатная статья PMC] [PubMed] [Google Scholar] 15. Леал Ю.А., Седильо-Ривера Р., Симон Дж. А., Веласкес Дж. Р., Флорес Л.Л., Торрес Дж. Полезность тестов на основе образцов стула для диагностики инфекции Helicobacter pylori у детей.J Pediatr Gastroenterol Nutr. 2011; 52: 718–728. [PubMed] [Google Scholar] 16. Мегро Ф. Сравнение неинвазивных тестов для выявления инфекции Helicobacter pylori у детей и подростков: результаты многоцентрового европейского исследования. J Pediatr. 2005. 146: 198–203. [PubMed] [Google Scholar] 17. Имри К., Роуленд М., Бурк Б., Драмм Б. Ограничения дыхательного теста с меченной углеродом 13 мочевиной на Helicobacter pylori у младенцев. J Pediatr. 2001; 139: 734–737. [PubMed] [Google Scholar] 18. Queiroz DM, Saito M, Rocha GA, Rocha AM, Melo FF, Checkley W, Braga LL, Silva IS, Gilman RH, Crabtree JE.Инфекция Helicobacter pylori у младенцев и детей ясельного возраста в Южной Америке: соответствие между дыхательным тестом на [13C] мочевину и моноклональным тестом на антиген стула H. pylori. J Clin Microbiol. 2013; 51: 3735–3740. [Бесплатная статья PMC] [PubMed] [Google Scholar] 19. Карденас В.М., Домингес Д.К., Пуэнтес Ф.А., Арагаки С.С., Гудман К.Дж., Грэм Д.Ю., Фукуда Ю. Оценка нового теста на антиген нативной каталазы в стуле для инфекции Helicobacter pylori у бессимптомных детей Северной Америки. J Pediatr Gastroenterol Nutr. 2008. 46: 399–402.[PubMed] [Google Scholar] 20. Adamopoulos AB, Stergiou GS, Sakizlis GN, Tiniakos DG, Nasothimiou EG, Sioutis DK, Achimastos AD. Диагностическая ценность экспресс-теста на уреазу и дыхательного теста с мочевиной для обнаружения Helicobacter pylori у пациентов с гастрэктомией по Бильроту II: проспективное контролируемое исследование. Dig Liver Dis. 2009; 41: 4–8. [PubMed] [Google Scholar] 21. Ян Дж., Ямагути Т., Одака Т., Сузуки Т., Охьяма Н., Хара Т., Судо К., Накамура К., Денда Т., Такигучи Н. и др. Тест на антиген в кале – надежный метод обнаружения Helicobacter pylori в желудочном остатке после дистальной резекции желудка по поводу рака желудка.
pylori. J Clin Microbiol. 2013; 51: 3735–3740. [Бесплатная статья PMC] [PubMed] [Google Scholar] 19. Карденас В.М., Домингес Д.К., Пуэнтес Ф.А., Арагаки С.С., Гудман К.Дж., Грэм Д.Ю., Фукуда Ю. Оценка нового теста на антиген нативной каталазы в стуле для инфекции Helicobacter pylori у бессимптомных детей Северной Америки. J Pediatr Gastroenterol Nutr. 2008. 46: 399–402.[PubMed] [Google Scholar] 20. Adamopoulos AB, Stergiou GS, Sakizlis GN, Tiniakos DG, Nasothimiou EG, Sioutis DK, Achimastos AD. Диагностическая ценность экспресс-теста на уреазу и дыхательного теста с мочевиной для обнаружения Helicobacter pylori у пациентов с гастрэктомией по Бильроту II: проспективное контролируемое исследование. Dig Liver Dis. 2009; 41: 4–8. [PubMed] [Google Scholar] 21. Ян Дж., Ямагути Т., Одака Т., Сузуки Т., Охьяма Н., Хара Т., Судо К., Накамура К., Денда Т., Такигучи Н. и др. Тест на антиген в кале – надежный метод обнаружения Helicobacter pylori в желудочном остатке после дистальной резекции желудка по поводу рака желудка. J Clin Gastroenterol. 2010; 44: 73–74. [PubMed] [Google Scholar] 22. Симояма Т., Ояма Т., Мацудзака М., Данджо К., Накадзи С., Фукуда С. Сравнение теста на антиген стула и серологии для диагностики инфекции Helicobacter pylori в массовом опросе. Helicobacter. 2009; 14: 87–90. [PubMed] [Google Scholar] 23. Сато М., Шимояма Т., Такахаши Р., Кадзияма Х., Сано И., Сакаедани Н., Като А., Хирата Н., Фукуда Ю. Характеристика и полезность тестов на антигены стула с использованием моноклональных антител к каталазе Helicobacter pylori.J Gastroenterol Hepatol. 2012; 27 Дополнение 3: 23–28. [PubMed] [Google Scholar] 24. Симояма Т., Кобаяси И., Като С., Кодама М., Фукуда Ю. Сравнение тестов стула на основе моноклональных антител для определения результатов эрадикационной терапии Helicobacter pylori. Сканд Дж Гастроэнтерол. 2010; 45: 1431–1434. [PubMed] [Google Scholar] 25. Какликкая Н., Акдоган Р.А., Озгур О, Узун Д.Ю., Кобаноглу Ю., Динч Ю., Гунгор Э., Дабанца П.А., Арслан М., Айдын Ф. и др. Оценка нового теста экспресс-хроматографии с боковым потоком для диагностики Helicobacter pylori.
J Clin Gastroenterol. 2010; 44: 73–74. [PubMed] [Google Scholar] 22. Симояма Т., Ояма Т., Мацудзака М., Данджо К., Накадзи С., Фукуда С. Сравнение теста на антиген стула и серологии для диагностики инфекции Helicobacter pylori в массовом опросе. Helicobacter. 2009; 14: 87–90. [PubMed] [Google Scholar] 23. Сато М., Шимояма Т., Такахаши Р., Кадзияма Х., Сано И., Сакаедани Н., Като А., Хирата Н., Фукуда Ю. Характеристика и полезность тестов на антигены стула с использованием моноклональных антител к каталазе Helicobacter pylori.J Gastroenterol Hepatol. 2012; 27 Дополнение 3: 23–28. [PubMed] [Google Scholar] 24. Симояма Т., Кобаяси И., Като С., Кодама М., Фукуда Ю. Сравнение тестов стула на основе моноклональных антител для определения результатов эрадикационной терапии Helicobacter pylori. Сканд Дж Гастроэнтерол. 2010; 45: 1431–1434. [PubMed] [Google Scholar] 25. Какликкая Н., Акдоган Р.А., Озгур О, Узун Д.Ю., Кобаноглу Ю., Динч Ю., Гунгор Э., Дабанца П.А., Арслан М., Айдын Ф. и др. Оценка нового теста экспресс-хроматографии с боковым потоком для диагностики Helicobacter pylori. Сауди Мед Дж. 2006; 27: 799–803. [PubMed] [Google Scholar] 26. Симояма Т., Като С., Кодама М., Кобаяси И., Фукуда Ю. Применимость теста на антиген стула на основе моноклональных антител для оценки результатов эрадикационной терапии Helicobacter pylori. Jpn J Infect Dis. 2009. 62: 225–227. [PubMed] [Google Scholar] 27. Саез Дж., Бельда С., Сантибаньес М., Родригес Дж. К., Сола-Вера Дж., Галиана А., Руис-Гарсия М., Бротонс А., Лопес-Жирона Е., Жирона Е. и др. ПЦР в реальном времени для диагностики инфекции Helicobacter pylori у пациентов с кровотечением из верхних отделов желудочно-кишечного тракта: сравнение с другими классическими методами диагностики.J Clin Microbiol. 2012; 50: 3233–3237. [Бесплатная статья PMC] [PubMed] [Google Scholar] 28. Ричи Б., Брюстер Д., Тран С. Д., Макнил Ю., Захаракис Б., Дэвидсон Г. П., Батлер Р. Н.. Недостаточная диагностическая точность теста на антиген моноклонального кала для выявления инфекции Helicobacter pylori у маленьких австралийских детей аборигенов.
Сауди Мед Дж. 2006; 27: 799–803. [PubMed] [Google Scholar] 26. Симояма Т., Като С., Кодама М., Кобаяси И., Фукуда Ю. Применимость теста на антиген стула на основе моноклональных антител для оценки результатов эрадикационной терапии Helicobacter pylori. Jpn J Infect Dis. 2009. 62: 225–227. [PubMed] [Google Scholar] 27. Саез Дж., Бельда С., Сантибаньес М., Родригес Дж. К., Сола-Вера Дж., Галиана А., Руис-Гарсия М., Бротонс А., Лопес-Жирона Е., Жирона Е. и др. ПЦР в реальном времени для диагностики инфекции Helicobacter pylori у пациентов с кровотечением из верхних отделов желудочно-кишечного тракта: сравнение с другими классическими методами диагностики.J Clin Microbiol. 2012; 50: 3233–3237. [Бесплатная статья PMC] [PubMed] [Google Scholar] 28. Ричи Б., Брюстер Д., Тран С. Д., Макнил Ю., Захаракис Б., Дэвидсон Г. П., Батлер Р. Н.. Недостаточная диагностическая точность теста на антиген моноклонального кала для выявления инфекции Helicobacter pylori у маленьких австралийских детей аборигенов. Pediatr Infect Dis J. 2009; 28: 287–289. [PubMed] [Google Scholar]
Pediatr Infect Dis J. 2009; 28: 287–289. [PubMed] [Google Scholar]Тесты стула на антиген для лечения инфекции Helicobacter pylori
World J Gastroenterol. 2013 Dec 7; 19 (45): 8188–8191.
Тадаси Симояма, Отделение гастроэнтерологии, Высшая школа медицины Университета Хиросаки, Хиросаки 036-8562, Япония
Вклад автора: Симояма Т. внес свой вклад в эту рукопись.Для корреспонденции: Тадаси Симояма, доктор медицины, доктор философии, отделение гастроэнтерологии, Высшая школа медицины Университета Хиросаки, 5 Zaifu-cho, Hirosaki 036-8562, Япония. pj.ca.nimu@ikh-omist
Телефон: + 81-172-395053 Факс: + 81-172-375946
Получено 26 сентября 2013 г .; Пересмотрено 29 октября 2013 г .; Принята в печать 12 ноября 2013 г.
Copyright © 2013 Baishideng Publishing Group Co., Limited. Все права защищены.Эта статья цитировалась в других статьях в PMC.Abstract
Тесты на антигены стула (SAT) – это неинвазивные диагностические модули для инфекции Helicobacter pylori ( H. pylori ). Для диагностики инфекции H. pylori существуют два типа SAT: один основан на иммуноферментном анализе (EIA), а другой – на иммунохроматографии (ICA). Для SAT не требуются дорогостоящие химические вещества или специальное оборудование; следовательно, они дешевле по сравнению с дыхательным тестом на мочевину.Как европейские, так и японские руководства показали, что SAT на основе EIA с использованием моноклональных антител полезны для первичной диагностики, а также для оценки эрадикационной терапии. Тесты на основе ICA не требуют специального оборудования и поэтому полезны в развивающихся странах. SAT также полезны для диагностики инфекции H. pylori у детей и пациентов после операции на желудке. Тесты SAT, выполненные с помощью EIA, позволяют оценить инфекцию H. pylori у большого числа субъектов почти так же, как и серологические исследования.Таким образом, тесты SAT могут быть полезны для выявления текущей инфекции в таком обследовании для выявления и искоренения инфекции H.
pylori ). Для диагностики инфекции H. pylori существуют два типа SAT: один основан на иммуноферментном анализе (EIA), а другой – на иммунохроматографии (ICA). Для SAT не требуются дорогостоящие химические вещества или специальное оборудование; следовательно, они дешевле по сравнению с дыхательным тестом на мочевину.Как европейские, так и японские руководства показали, что SAT на основе EIA с использованием моноклональных антител полезны для первичной диагностики, а также для оценки эрадикационной терапии. Тесты на основе ICA не требуют специального оборудования и поэтому полезны в развивающихся странах. SAT также полезны для диагностики инфекции H. pylori у детей и пациентов после операции на желудке. Тесты SAT, выполненные с помощью EIA, позволяют оценить инфекцию H. pylori у большого числа субъектов почти так же, как и серологические исследования.Таким образом, тесты SAT могут быть полезны для выявления текущей инфекции в таком обследовании для выявления и искоренения инфекции H. pylori . Точность SAT ниже, если образцы стула не сформированы или водянистые, потому что специфических антигенов H. pylori в образцах стула разбавлены. Температура и интервал между сбором пробы стула и измерением также влияют на результаты тестов SAT. Выбор тестового набора зависит от чувствительности и специфичности в каждом регионе и от обстоятельств каждого пациента.
pylori . Точность SAT ниже, если образцы стула не сформированы или водянистые, потому что специфических антигенов H. pylori в образцах стула разбавлены. Температура и интервал между сбором пробы стула и измерением также влияют на результаты тестов SAT. Выбор тестового набора зависит от чувствительности и специфичности в каждом регионе и от обстоятельств каждого пациента.
Ключевые слова: Helicobacter pylori , определение антигена стула, диагностика, иммуноферментный анализ, иммунохроматография
Основной совет: Тесты на антигены стула (SAT) – относительно недорогие неинвазивные тесты. Несколько руководств по инфекции Helicobacter pylori ( H. pylori ) со всего мира указывают, что SAT с использованием моноклональных антител полезны для первичной диагностики, а также для оценки результатов эрадикационной терапии.SAT также полезны для диагностики инфекции H. pylori у детей и пациентов после операции на желудке.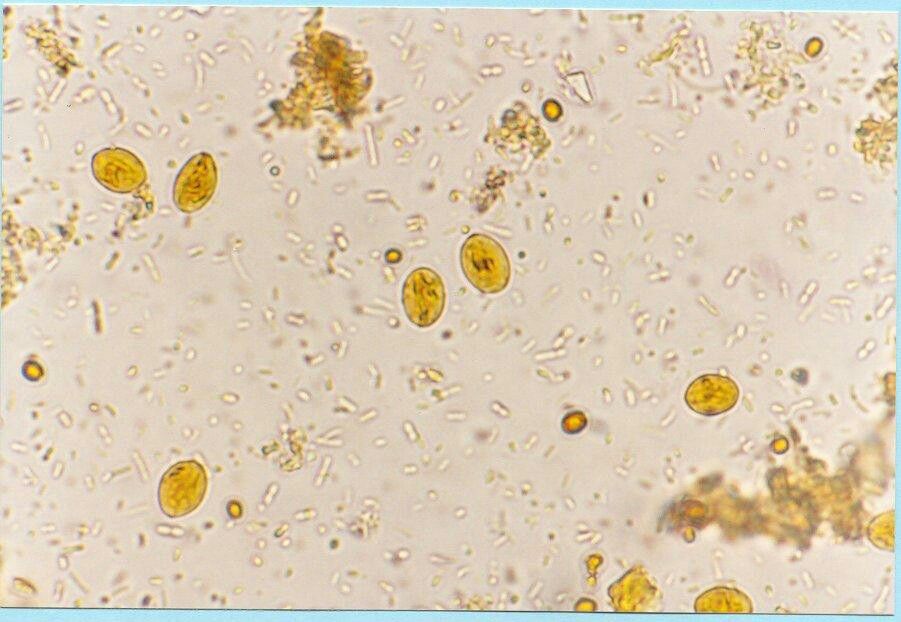 Выбор тестового набора зависит от точности в каждой популяции и от обстоятельств каждого пациента.
Выбор тестового набора зависит от точности в каждой популяции и от обстоятельств каждого пациента.
ВВЕДЕНИЕ
Инфекция, вызванная Helicobacter pylori ( H. pylori ), вовлечена в патогенез желудочно-дуоденальных заболеваний. Несколько руководств по заражению H. pylori со всего мира указывают на то, что ликвидация H.pylori приведет к снижению заболеваемости гастродуоденальными заболеваниями, включая рак желудка, и уменьшит количество новых инфекций в будущих поколениях [1,2]. Следуя рекомендациям японских руководств по лечению инфекции H. pylori (пересмотренное издание 2009 г.), в 2013 г. японская система медицинского страхования утвердила покрытие диагностики и ликвидации H. pylori у всех инфицированных пациентов [ 3]. Следовательно, расширение роли H.pylori диагностических тестов будет сопровождать рост числа пациентов, подвергнутых тестам и искоренению H. pylori .
Тесты на антиген стула (SAT) – это неинвазивные диагностические модули для инфекции H. pylori , которые были введены после дыхательного теста с мочевиной (UBT). Ранние тесты SAT использовали иммуноферментный анализ (EIA) на основе поликлональных антител. Хотя они предоставили надежные результаты в диагностике инфекции H. pylori , при пост-эрадикационной оценке иногда наблюдались противоречивые результаты из-за ложноположительных результатов [4,5].Методы, основанные на моноклональных антителах, обычно имеют более высокую специфичность. Были разработаны SAT на основе моноклональных антител, которые оказались более точными, чем тесты с использованием поликлональных антител [6,7]. Метаанализ также показал, что специфичность SAT на основе моноклональных антител составляла 0,97 (95% ДИ: 0,96–0,98) [8]. Как европейские, так и японские руководства показали, что SAT с использованием моноклональных антител полезны для первичной диагностики, а также для оценки эрадикационной терапии [1,3].
pylori , которые были введены после дыхательного теста с мочевиной (UBT). Ранние тесты SAT использовали иммуноферментный анализ (EIA) на основе поликлональных антител. Хотя они предоставили надежные результаты в диагностике инфекции H. pylori , при пост-эрадикационной оценке иногда наблюдались противоречивые результаты из-за ложноположительных результатов [4,5].Методы, основанные на моноклональных антителах, обычно имеют более высокую специфичность. Были разработаны SAT на основе моноклональных антител, которые оказались более точными, чем тесты с использованием поликлональных антител [6,7]. Метаанализ также показал, что специфичность SAT на основе моноклональных антител составляла 0,97 (95% ДИ: 0,96–0,98) [8]. Как европейские, так и японские руководства показали, что SAT с использованием моноклональных антител полезны для первичной диагностики, а также для оценки эрадикационной терапии [1,3].
Для диагностики инфекции H. pylori существуют два типа SAT, один на основе EIA, а другой – на основе иммунохроматографии (ICA). Хотя оба типа тестов обладают высокой чувствительностью и специфичностью, недавнее исследование показало, что доступные в настоящее время тесты на основе ICA дают менее надежные результаты, чем тесты на основе EIA [9]. Тем не менее, тесты на основе ICA просты в выполнении и полезны для оперативной диагностики инфекции H. pylori [10]. Тесты на основе ICA не требуют специального оборудования; поэтому они были бы полезны в развивающихся странах.
Хотя оба типа тестов обладают высокой чувствительностью и специфичностью, недавнее исследование показало, что доступные в настоящее время тесты на основе ICA дают менее надежные результаты, чем тесты на основе EIA [9]. Тем не менее, тесты на основе ICA просты в выполнении и полезны для оперативной диагностики инфекции H. pylori [10]. Тесты на основе ICA не требуют специального оборудования; поэтому они были бы полезны в развивающихся странах.
ДИАГНОСТИКА
Сравнение с UBT
Среди неинвазивных диагностических тестов SAT и UBT имеют более высокую точность, чем серологические тесты или тесты на антитела в моче [1,3]. Американская гастроэнтерологическая ассоциация рекомендует как SAT, так и UBT для диагностики инфекции H. pylori у пациентов с диспепсией [4]. Хотя UBT считается наиболее надежным неинвазивным тестом для диагностики инфекции H. pylori , у него есть несколько ограничений.Стоимость UBT все еще относительно высока из-за цены 13 C-мочевины (приблизительно 30,3 долларов США) и стоимости измерения 13 CO 2 . Напротив, SAT не требуют дорогих химических веществ и специального оборудования и, следовательно, менее дороги (1400 иен; примерно 14,2 доллара США). Кроме того, пациенты должны голодать перед тестом UBT, но не перед тестом SAT. Кроме того, введение ингибитора протонной помпы (ИПП) модулирует pH желудочного сока, что приводит к снижению активности уреазы H.pylori в желудке. UBT определяет активность уреазы слизистой оболочки желудка; поэтому у пациентов, принимавших ИПП, отмечаются ложноотрицательные результаты [11]. Поэтому обычно рекомендуется прекратить прием ИПП за 2 недели до теста UBT [1]. ИПП могут аналогичным образом влиять на результаты SAT [12,13], но некоторые SAT на основе моноклональных антител, доступные в настоящее время, не подвержены действию ИПП [14]. Такие SAT, которые не требуют прекращения PPI, полезны для управления H.pylori у пациентов с гастроэзофагеальной рефлюксной болезнью или у лиц, принимающих нестероидные противовоспалительные препараты.
Напротив, SAT не требуют дорогих химических веществ и специального оборудования и, следовательно, менее дороги (1400 иен; примерно 14,2 доллара США). Кроме того, пациенты должны голодать перед тестом UBT, но не перед тестом SAT. Кроме того, введение ингибитора протонной помпы (ИПП) модулирует pH желудочного сока, что приводит к снижению активности уреазы H.pylori в желудке. UBT определяет активность уреазы слизистой оболочки желудка; поэтому у пациентов, принимавших ИПП, отмечаются ложноотрицательные результаты [11]. Поэтому обычно рекомендуется прекратить прием ИПП за 2 недели до теста UBT [1]. ИПП могут аналогичным образом влиять на результаты SAT [12,13], но некоторые SAT на основе моноклональных антител, доступные в настоящее время, не подвержены действию ИПП [14]. Такие SAT, которые не требуют прекращения PPI, полезны для управления H.pylori у пациентов с гастроэзофагеальной рефлюксной болезнью или у лиц, принимающих нестероидные противовоспалительные препараты.
Диагностика у детей и пациентов после хирургических вмешательств на желудке
Систематический обзор и метаанализ показали, что SAT с использованием ИФА на основе моноклональных антител полезны для диагностики инфекции H. pylori у детей [15]. UBT также очень точен у детей старше 6 лет, в то время как исследования, проведенные в развитых странах, показали, что его специфичность была менее 90% у очень маленьких детей [16,17].Напротив, как моноклональные SAT, так и UBT были надежными у маленьких детей в возрасте 6-30 месяцев в развивающихся странах Южной Америки [18]. Эти результаты показывают, что тесты SAT на основе моноклональных антител являются наиболее эффективными тестами для детей в популяциях с высокой и низкой распространенностью инфекции H. pylori [18,19].
У пациентов, перенесших дистальную резекцию желудка, точность UBT была ниже, чем у биопсийного уреазного теста [20]. Однако у японских пациентов, перенесших дистальную резекцию желудка, специфичность SAT была 90. 5%, тогда как UBT составлял всего 59,1% [21].
5%, тогда как UBT составлял всего 59,1% [21].
Массовое обследование и скрининг
В массовых обследованиях, что касается техники и стоимости, обычно использовалась серология, несмотря на ее более низкую специфичность [3]. Тесты SAT, выполненные с помощью EIA, могут оценить инфекцию H. pylori у большого числа субъектов почти так же, как серологические. У 994 здоровых взрослых японцев, принявших участие в массовом опросе, соответствие результатов SAT и серологии составило более 90% [22]. Однако в этом исследовании положительность тестов SAT была значительно ниже, чем у серологических, у 303 пациентов с тяжелым атрофическим гастритом.В слизистой оболочке желудка пациентов с тяжелым атрофическим гастритом и кишечной метаплазией колонизация H. pylori снижена или отсутствует. Следовательно, в условиях массового обследования серология полезна для выявления как текущей, так и перенесенной инфекции. SAT должны использоваться для выявления текущей инфекции в таком обследовании, чтобы идентифицировать и искоренить инфекцию H. pylori для предотвращения злокачественных новообразований желудка.
pylori для предотвращения злокачественных новообразований желудка.
ОЦЕНКА ЭРАДИКАЦИИ
На сегодняшний день многие исследования продемонстрировали полезность SAT для оценки результатов эрадикационной терапии.Недавние руководства Европейской исследовательской группы по хеликобактерам (EHSG) рекомендуют как UBT, так и лабораторный моноклональный SAT [1]. После эрадикационной терапии количество колоний H. pylori в желудке будет уменьшено, даже если эрадикационная терапия оказалась безуспешной. Таким образом, SAT должны быть выполнены для обнаружения уменьшенного количества бактерий. Среди лабораторных моноклональных тестов SAT Premier Platinum HpSA Plus (HpSA ELISA II; Meridian Diagnostics, Inc., Цинциннати, Огайо, США), в котором используются множественные мышиные моноклональные антитела, кажется точным.Ранее мы продемонстрировали значительно более высокую чувствительность HpSA ELISA II по сравнению с тестом Testmate Pylori Antigen EIA (TPAg EIA; Wakamoto Pharmaceutical Co. Ltd. и Kyowa Medex, Токио, Япония), в котором используется одно моноклональное антитело [23]. HpSA ELISA II дает более высокую прогностическую ценность положительного результата, хотя TPAg EIA дает эффективные результаты [24].
Ltd. и Kyowa Medex, Токио, Япония), в котором используется одно моноклональное антитело [23]. HpSA ELISA II дает более высокую прогностическую ценность положительного результата, хотя TPAg EIA дает эффективные результаты [24].
В руководствах EHSG для оценки результатов лечения рекомендуются лабораторные, но не служебные тесты [1].Однако недавние наблюдения показывают, что некоторые лабораторные тесты на основе моноклональных антител могут точно оценить результаты лечения эрадикацией [9,25]. Кабинетные тесты позволяют врачам оценить результаты эрадикационной терапии за одно посещение, а следующая эрадикационная терапия может быть начата в тот же день у пациентов, не подвергшихся эрадикации. Офисные тесты не требуют специального оборудования; следовательно, они подходят для институтов, которые не могут измерять 13 CO 2 .
Введение ИПП следует прекратить за 2 недели до оценки результатов лечения с помощью UBT или SAT [1]. Однако, как описано выше, ИПП не влияют на результаты некоторых тестов SAT [13]. Фактически, на небольшой серии из 22 японских пациентов мы показали, что результаты эрадикационной терапии, оцененные с помощью TPAg EIA во время введения PPI, были такими же, как и результаты, определенные UBT через 4 недели после отмены PPI у 21 пациента [26].
Фактически, на небольшой серии из 22 японских пациентов мы показали, что результаты эрадикационной терапии, оцененные с помощью TPAg EIA во время введения PPI, были такими же, как и результаты, определенные UBT через 4 недели после отмены PPI у 21 пациента [26].
В некоторых руководствах оценка результатов эрадикационной терапии с помощью SAT должна проводиться по крайней мере через 4 недели после окончания лечения [1,3].Однако считается, что рецидив после эрадикации в основном представляет собой рецидив той же инфекции, а не повторное инфицирование. Поэтому были внесены предложения о продлении срока до 6 или 8 недель после окончания лечения. Тест EIA на основе моноклональных антител может определить результаты лечения через 6 недель после окончания лечения, а также через 8 недель [26].
НА ЗАМЕТКУ ПРИ ВЫПОЛНЕНИИ SAT
На результаты SAT влияют несколько факторов. Точность тестов SAT ниже, если образцы стула несформированные или водянистые, потому что H.pylori -специфические антигены в образцах стула разводятся. Поэтому не следует использовать водянистый стул, особенно при определении результатов эрадикационной терапии. Чувствительность SAT также ниже у пациентов с кровотечением из верхних отделов желудочно-кишечного тракта [27].
Поэтому не следует использовать водянистый стул, особенно при определении результатов эрадикационной терапии. Чувствительность SAT также ниже у пациентов с кровотечением из верхних отделов желудочно-кишечного тракта [27].
Температура и интервал между сбором пробы стула и измерением также влияют на результаты тестов SAT. Такая информация доступна для двух комплектов. Querioz et al [18] изучили результаты HpSA ELISA II и показали заметное снижение значения OD, когда образцы стула выдерживались при 37 ° C в течение 48 часов.Они также повторно протестировали образец стула со значением OD 0,183 после 6 часов инкубации при 37 ° C и обнаружили, что значение OD упало ниже порогового значения (0,120). В образцах, протестированных с помощью TPAg EIA, мы обнаружили, что значения OD для исходно отрицательных образцов стула увеличивались и были почти аналогичны пороговому уровню, если образцы поддерживались при 40 ° C [9]. Однако значения OD не изменялись до 7 дней при температуре от -5 ° C до 25 ° C, когда суспензии образцов стула хранились в специальных устройствах для сбора. Следовательно, образцы стула следует хранить при низкой температуре и анализировать в течение короткого периода, если устройства для сбора недоступны.Чтобы сохранить антигенность в течение длительного времени, образцы стула следует хранить при -80 ° C.
Следовательно, образцы стула следует хранить при низкой температуре и анализировать в течение короткого периода, если устройства для сбора недоступны.Чтобы сохранить антигенность в течение длительного времени, образцы стула следует хранить при -80 ° C.
Различия в антигенности штаммов H. pylori иногда влияют на точность SAT в разных популяциях [28]. Следовательно, чувствительность и специфичность SAT следует тестировать в каждой популяции перед использованием для лечения инфекции H. pylori .
ЗАКЛЮЧЕНИЕ
Таким образом, SAT – это относительно недорогие неинвазивные тесты. SAT с использованием моноклональных антител полезны для первичной диагностики, а также для оценки эрадикационной терапии.SAT также полезны при лечении инфекции H. pylori у детей и пациентов после хирургического вмешательства на желудке. В будущем SAT следует использовать в массовых обследованиях для выявления и искоренения инфекции H. pylori для профилактики злокачественных новообразований желудка. Выбор тестового набора зависит от чувствительности и специфичности в каждом регионе и от обстоятельств каждого пациента.
Выбор тестового набора зависит от чувствительности и специфичности в каждом регионе и от обстоятельств каждого пациента.
Сноски
P- Рецензенты: Naito Y, Nagahara H, Said ZNA, Slomiany BL S- Редактор: Gou SX L- Редактор: Стюарт GJ E- Редактор: Zhang DN
Ссылки
1.Мальфертхайнер П., Меграуд Ф., О’Морайн К.А., Атертон Дж., Аксон А.Т., Баццоли Ф., Дженсини Г.Ф., Гисберт Дж. П., Грэм Д. Ю., Роккас Т. Управление инфекцией Helicobacter pylori – Маастрихтский отчет IV / Флорентийский консенсусный доклад. Кишечник. 2012. 61: 646–664. [PubMed] [Google Scholar] 2. Фок К.М., Кателарис П., Сугано К., Энг Т.Л., Хант Р., Талли, штат Нью-Джерси, Лам С.К., Сяо С.Д., Тан Х.Дж., Ву С.Й. и др. Вторые руководящие принципы Азиатско-Тихоокеанского консенсуса по инфекции Helicobacter pylori. J Gastroenterol Hepatol. 2009; 24: 1587–1600. [PubMed] [Google Scholar] 3.Асака М., Като М., Такахаши С., Фукуда Й., Сугияма Т., Ота Х, Уэмура Н., Мураками К., Сато К., Сугано К. Руководство по лечению инфекции Helicobacter pylori в Японии: пересмотренное издание 2009 г. Helicobacter. 2010; 15: 1–20. [PubMed] [Google Scholar] 4. Odaka T, Yamaguchi T., Koyama H, Saisho H, Nomura F. Оценка теста на антиген стула Helicobacter pylori для мониторинга эрадикационной терапии. Am J Gastroenterol. 2002; 97: 594–599. [PubMed] [Google Scholar] 5. Вейола Л., Оксанен А., Лёфгрен Т., Сиппонен П., Карвонен А.Л., Раутелин Х.Сравнение трех тестов стула на антиген для подтверждения эрадикации Helicobacter pylori у взрослых. Сканд Дж Гастроэнтерол. 2005; 40: 395–401. [PubMed] [Google Scholar] 6. Домингес Дж., Форне М., Бланко С., Прат С., Гали Н., Латорре И., Вивер Дж. М., Аусина В. Сравнение моноклонального и поликлонального иммуноферментного анализа стула на основе антител при диагностике инфекции Helicobacter pylori до и после эрадикационной терапии. Алимент Pharmacol Ther. 2006; 23: 1735–1740. [PubMed] [Google Scholar] 7. Дегучи Р., Мацусима М, Сузуки Т, Майн Т, Фукуда Р., Нишина М., Одзава Х., Такаги А.Сравнение иммуноферментного анализа кала на моноклональные и поликлональные антитела при диагностике инфекции Helicobacter pylori после эрадикационной терапии. J Gastroenterol. 2009. 44: 713–716. [PubMed] [Google Scholar] 8. Gisbert JP, de la Morena F, Abraira V. Точность теста на моноклональный антиген стула для диагностики инфекции H. pylori: систематический обзор и метаанализ. Am J Gastroenterol. 2006; 101: 1921–1930. [PubMed] [Google Scholar] 9. Коркмаз Х., Кесли Р., Карабаглы П., Терзи Ю. Сравнение диагностической точности пяти различных тестов на антигены стула для диагностики инфекции Helicobacter pylori.Helicobacter. 2013; 18: 384–391. [PubMed] [Google Scholar] 10. Симояма Т., Савая М., Исигуро А., Ханабата Н., Йошимура Т., Фукуда С. Применимость экспресс-теста на антиген стула с использованием моноклональных антител к каталазе для лечения инфекции Helicobacter pylori. J Gastroenterol. 2011; 46: 487–491. [PubMed] [Google Scholar] 11. Грэм Д.Ю., Опекун А.Р., Хаммуд Ф., Ямаока Ю., Редди Р., Осато М.С., Эль-Зимайти Х.М. Исследования, касающиеся механизма ложноотрицательных дыхательных тестов на мочевину с ингибиторами протонной помпы.Am J Gastroenterol. 2003; 98: 1005–1009. [PubMed] [Google Scholar] 12. Erzin Y, Altun S, Dobrucali A, Aslan M, Erdamar S, Dirican A, Kocazeybek B. Оценка двух иммуноферментных анализов для обнаружения Helicobacter pylori в образцах стула пациентов с диспепсией после эрадикационной терапии. J Med Microbiol. 2005; 54: 863–866. [PubMed] [Google Scholar] 13. Асфельдт AM, Løchen ML, Straume B, Steigen SE, Florholmen J, Goll R, Nestegard O, Paulssen EJ. Точность анализа стула на антиген на основе моноклональных антител в диагностике инфекции Helicobacter pylori.Сканд Дж Гастроэнтерол. 2004; 39: 1073–1077. [PubMed] [Google Scholar] 14. Кодама М., Мураками К., Окимото Т., Фукуда Й., Симояма Т., Окуда М., Като С., Кобаяши И., Фудзиока Т. Влияние лечения ингибиторами протонной помпы на тест на антиген стула Helicobacter pylori. Мир Дж. Гастроэнтерол. 2012; 18: 44–48. [Бесплатная статья PMC] [PubMed] [Google Scholar] 15. Леал Ю.А., Седильо-Ривера Р., Симон Дж. А., Веласкес Дж. Р., Флорес Л.Л., Торрес Дж. Полезность тестов на основе образцов стула для диагностики инфекции Helicobacter pylori у детей.J Pediatr Gastroenterol Nutr. 2011; 52: 718–728. [PubMed] [Google Scholar] 16. Мегро Ф. Сравнение неинвазивных тестов для выявления инфекции Helicobacter pylori у детей и подростков: результаты многоцентрового европейского исследования. J Pediatr. 2005. 146: 198–203. [PubMed] [Google Scholar] 17. Имри К., Роуленд М., Бурк Б., Драмм Б. Ограничения дыхательного теста с меченной углеродом 13 мочевиной на Helicobacter pylori у младенцев. J Pediatr. 2001; 139: 734–737. [PubMed] [Google Scholar] 18. Queiroz DM, Saito M, Rocha GA, Rocha AM, Melo FF, Checkley W, Braga LL, Silva IS, Gilman RH, Crabtree JE.Инфекция Helicobacter pylori у младенцев и детей ясельного возраста в Южной Америке: соответствие между дыхательным тестом на [13C] мочевину и моноклональным тестом на антиген стула H. pylori. J Clin Microbiol. 2013; 51: 3735–3740. [Бесплатная статья PMC] [PubMed] [Google Scholar] 19. Карденас В.М., Домингес Д.К., Пуэнтес Ф.А., Арагаки С.С., Гудман К.Дж., Грэм Д.Ю., Фукуда Ю. Оценка нового теста на антиген нативной каталазы в стуле для инфекции Helicobacter pylori у бессимптомных детей Северной Америки. J Pediatr Gastroenterol Nutr. 2008. 46: 399–402.[PubMed] [Google Scholar] 20. Adamopoulos AB, Stergiou GS, Sakizlis GN, Tiniakos DG, Nasothimiou EG, Sioutis DK, Achimastos AD. Диагностическая ценность экспресс-теста на уреазу и дыхательного теста с мочевиной для обнаружения Helicobacter pylori у пациентов с гастрэктомией по Бильроту II: проспективное контролируемое исследование. Dig Liver Dis. 2009; 41: 4–8. [PubMed] [Google Scholar] 21. Ян Дж., Ямагути Т., Одака Т., Сузуки Т., Охьяма Н., Хара Т., Судо К., Накамура К., Денда Т., Такигучи Н. и др. Тест на антиген в кале – надежный метод обнаружения Helicobacter pylori в желудочном остатке после дистальной резекции желудка по поводу рака желудка.J Clin Gastroenterol. 2010; 44: 73–74. [PubMed] [Google Scholar] 22. Симояма Т., Ояма Т., Мацудзака М., Данджо К., Накадзи С., Фукуда С. Сравнение теста на антиген стула и серологии для диагностики инфекции Helicobacter pylori в массовом опросе. Helicobacter. 2009; 14: 87–90. [PubMed] [Google Scholar] 23. Сато М., Шимояма Т., Такахаши Р., Кадзияма Х., Сано И., Сакаедани Н., Като А., Хирата Н., Фукуда Ю. Характеристика и полезность тестов на антигены стула с использованием моноклональных антител к каталазе Helicobacter pylori.J Gastroenterol Hepatol. 2012; 27 Дополнение 3: 23–28. [PubMed] [Google Scholar] 24. Симояма Т., Кобаяси И., Като С., Кодама М., Фукуда Ю. Сравнение тестов стула на основе моноклональных антител для определения результатов эрадикационной терапии Helicobacter pylori. Сканд Дж Гастроэнтерол. 2010; 45: 1431–1434. [PubMed] [Google Scholar] 25. Какликкая Н., Акдоган Р.А., Озгур О, Узун Д.Ю., Кобаноглу Ю., Динч Ю., Гунгор Э., Дабанца П.А., Арслан М., Айдын Ф. и др. Оценка нового теста экспресс-хроматографии с боковым потоком для диагностики Helicobacter pylori.Сауди Мед Дж. 2006; 27: 799–803. [PubMed] [Google Scholar] 26. Симояма Т., Като С., Кодама М., Кобаяси И., Фукуда Ю. Применимость теста на антиген стула на основе моноклональных антител для оценки результатов эрадикационной терапии Helicobacter pylori. Jpn J Infect Dis. 2009. 62: 225–227. [PubMed] [Google Scholar] 27. Саез Дж., Бельда С., Сантибаньес М., Родригес Дж. К., Сола-Вера Дж., Галиана А., Руис-Гарсия М., Бротонс А., Лопес-Жирона Е., Жирона Е. и др. ПЦР в реальном времени для диагностики инфекции Helicobacter pylori у пациентов с кровотечением из верхних отделов желудочно-кишечного тракта: сравнение с другими классическими методами диагностики.J Clin Microbiol. 2012; 50: 3233–3237. [Бесплатная статья PMC] [PubMed] [Google Scholar] 28. Ричи Б., Брюстер Д., Тран С. Д., Макнил Ю., Захаракис Б., Дэвидсон Г. П., Батлер Р. Н.. Недостаточная диагностическая точность теста на антиген моноклонального кала для выявления инфекции Helicobacter pylori у маленьких австралийских детей аборигенов. Pediatr Infect Dis J. 2009; 28: 287–289. [PubMed] [Google Scholar]Тесты стула на антиген для лечения инфекции Helicobacter pylori
World J Gastroenterol. 2013 Dec 7; 19 (45): 8188–8191.
Тадаси Симояма, Отделение гастроэнтерологии, Высшая школа медицины Университета Хиросаки, Хиросаки 036-8562, Япония
Вклад автора: Симояма Т. внес свой вклад в эту рукопись.Для корреспонденции: Тадаси Симояма, доктор медицины, доктор философии, отделение гастроэнтерологии, Высшая школа медицины Университета Хиросаки, 5 Zaifu-cho, Hirosaki 036-8562, Япония. pj.ca.nimu@ikh-omist
Телефон: + 81-172-395053 Факс: + 81-172-375946
Получено 26 сентября 2013 г .; Пересмотрено 29 октября 2013 г .; Принята в печать 12 ноября 2013 г.
Copyright © 2013 Baishideng Publishing Group Co., Limited. Все права защищены.Эта статья цитировалась в других статьях в PMC.Abstract
Тесты на антигены стула (SAT) – это неинвазивные диагностические модули для инфекции Helicobacter pylori ( H. pylori ). Для диагностики инфекции H. pylori существуют два типа SAT: один основан на иммуноферментном анализе (EIA), а другой – на иммунохроматографии (ICA). Для SAT не требуются дорогостоящие химические вещества или специальное оборудование; следовательно, они дешевле по сравнению с дыхательным тестом на мочевину.Как европейские, так и японские руководства показали, что SAT на основе EIA с использованием моноклональных антител полезны для первичной диагностики, а также для оценки эрадикационной терапии. Тесты на основе ICA не требуют специального оборудования и поэтому полезны в развивающихся странах. SAT также полезны для диагностики инфекции H. pylori у детей и пациентов после операции на желудке. Тесты SAT, выполненные с помощью EIA, позволяют оценить инфекцию H. pylori у большого числа субъектов почти так же, как и серологические исследования.Таким образом, тесты SAT могут быть полезны для выявления текущей инфекции в таком обследовании для выявления и искоренения инфекции H. pylori . Точность SAT ниже, если образцы стула не сформированы или водянистые, потому что специфических антигенов H. pylori в образцах стула разбавлены. Температура и интервал между сбором пробы стула и измерением также влияют на результаты тестов SAT. Выбор тестового набора зависит от чувствительности и специфичности в каждом регионе и от обстоятельств каждого пациента.
Ключевые слова: Helicobacter pylori , определение антигена стула, диагностика, иммуноферментный анализ, иммунохроматография
Основной совет: Тесты на антигены стула (SAT) – относительно недорогие неинвазивные тесты. Несколько руководств по инфекции Helicobacter pylori ( H. pylori ) со всего мира указывают, что SAT с использованием моноклональных антител полезны для первичной диагностики, а также для оценки результатов эрадикационной терапии.SAT также полезны для диагностики инфекции H. pylori у детей и пациентов после операции на желудке. Выбор тестового набора зависит от точности в каждой популяции и от обстоятельств каждого пациента.
ВВЕДЕНИЕ
Инфекция, вызванная Helicobacter pylori ( H. pylori ), вовлечена в патогенез желудочно-дуоденальных заболеваний. Несколько руководств по заражению H. pylori со всего мира указывают на то, что ликвидация H.pylori приведет к снижению заболеваемости гастродуоденальными заболеваниями, включая рак желудка, и уменьшит количество новых инфекций в будущих поколениях [1,2]. Следуя рекомендациям японских руководств по лечению инфекции H. pylori (пересмотренное издание 2009 г.), в 2013 г. японская система медицинского страхования утвердила покрытие диагностики и ликвидации H. pylori у всех инфицированных пациентов [ 3]. Следовательно, расширение роли H.pylori диагностических тестов будет сопровождать рост числа пациентов, подвергнутых тестам и искоренению H. pylori .
Тесты на антиген стула (SAT)– это неинвазивные диагностические модули для инфекции H. pylori , которые были введены после дыхательного теста с мочевиной (UBT). Ранние тесты SAT использовали иммуноферментный анализ (EIA) на основе поликлональных антител. Хотя они предоставили надежные результаты в диагностике инфекции H. pylori , при пост-эрадикационной оценке иногда наблюдались противоречивые результаты из-за ложноположительных результатов [4,5].Методы, основанные на моноклональных антителах, обычно имеют более высокую специфичность. Были разработаны SAT на основе моноклональных антител, которые оказались более точными, чем тесты с использованием поликлональных антител [6,7]. Метаанализ также показал, что специфичность SAT на основе моноклональных антител составляла 0,97 (95% ДИ: 0,96–0,98) [8]. Как европейские, так и японские руководства показали, что SAT с использованием моноклональных антител полезны для первичной диагностики, а также для оценки эрадикационной терапии [1,3].
Для диагностики инфекции H. pylori существуют два типа SAT, один на основе EIA, а другой – на основе иммунохроматографии (ICA). Хотя оба типа тестов обладают высокой чувствительностью и специфичностью, недавнее исследование показало, что доступные в настоящее время тесты на основе ICA дают менее надежные результаты, чем тесты на основе EIA [9]. Тем не менее, тесты на основе ICA просты в выполнении и полезны для оперативной диагностики инфекции H. pylori [10]. Тесты на основе ICA не требуют специального оборудования; поэтому они были бы полезны в развивающихся странах.
ДИАГНОСТИКА
Сравнение с UBT
Среди неинвазивных диагностических тестов SAT и UBT имеют более высокую точность, чем серологические тесты или тесты на антитела в моче [1,3]. Американская гастроэнтерологическая ассоциация рекомендует как SAT, так и UBT для диагностики инфекции H. pylori у пациентов с диспепсией [4]. Хотя UBT считается наиболее надежным неинвазивным тестом для диагностики инфекции H. pylori , у него есть несколько ограничений.Стоимость UBT все еще относительно высока из-за цены 13 C-мочевины (приблизительно 30,3 долларов США) и стоимости измерения 13 CO 2 . Напротив, SAT не требуют дорогих химических веществ и специального оборудования и, следовательно, менее дороги (1400 иен; примерно 14,2 доллара США). Кроме того, пациенты должны голодать перед тестом UBT, но не перед тестом SAT. Кроме того, введение ингибитора протонной помпы (ИПП) модулирует pH желудочного сока, что приводит к снижению активности уреазы H.pylori в желудке. UBT определяет активность уреазы слизистой оболочки желудка; поэтому у пациентов, принимавших ИПП, отмечаются ложноотрицательные результаты [11]. Поэтому обычно рекомендуется прекратить прием ИПП за 2 недели до теста UBT [1]. ИПП могут аналогичным образом влиять на результаты SAT [12,13], но некоторые SAT на основе моноклональных антител, доступные в настоящее время, не подвержены действию ИПП [14]. Такие SAT, которые не требуют прекращения PPI, полезны для управления H.pylori у пациентов с гастроэзофагеальной рефлюксной болезнью или у лиц, принимающих нестероидные противовоспалительные препараты.
Диагностика у детей и пациентов после хирургических вмешательств на желудке
Систематический обзор и метаанализ показали, что SAT с использованием ИФА на основе моноклональных антител полезны для диагностики инфекции H. pylori у детей [15]. UBT также очень точен у детей старше 6 лет, в то время как исследования, проведенные в развитых странах, показали, что его специфичность была менее 90% у очень маленьких детей [16,17].Напротив, как моноклональные SAT, так и UBT были надежными у маленьких детей в возрасте 6-30 месяцев в развивающихся странах Южной Америки [18]. Эти результаты показывают, что тесты SAT на основе моноклональных антител являются наиболее эффективными тестами для детей в популяциях с высокой и низкой распространенностью инфекции H. pylori [18,19].
У пациентов, перенесших дистальную резекцию желудка, точность UBT была ниже, чем у биопсийного уреазного теста [20]. Однако у японских пациентов, перенесших дистальную резекцию желудка, специфичность SAT была 90.5%, тогда как UBT составлял всего 59,1% [21].
Массовое обследование и скрининг
В массовых обследованиях, что касается техники и стоимости, обычно использовалась серология, несмотря на ее более низкую специфичность [3]. Тесты SAT, выполненные с помощью EIA, могут оценить инфекцию H. pylori у большого числа субъектов почти так же, как серологические. У 994 здоровых взрослых японцев, принявших участие в массовом опросе, соответствие результатов SAT и серологии составило более 90% [22]. Однако в этом исследовании положительность тестов SAT была значительно ниже, чем у серологических, у 303 пациентов с тяжелым атрофическим гастритом.В слизистой оболочке желудка пациентов с тяжелым атрофическим гастритом и кишечной метаплазией колонизация H. pylori снижена или отсутствует. Следовательно, в условиях массового обследования серология полезна для выявления как текущей, так и перенесенной инфекции. SAT должны использоваться для выявления текущей инфекции в таком обследовании, чтобы идентифицировать и искоренить инфекцию H. pylori для предотвращения злокачественных новообразований желудка.
ОЦЕНКА ЭРАДИКАЦИИ
На сегодняшний день многие исследования продемонстрировали полезность SAT для оценки результатов эрадикационной терапии.Недавние руководства Европейской исследовательской группы по хеликобактерам (EHSG) рекомендуют как UBT, так и лабораторный моноклональный SAT [1]. После эрадикационной терапии количество колоний H. pylori в желудке будет уменьшено, даже если эрадикационная терапия оказалась безуспешной. Таким образом, SAT должны быть выполнены для обнаружения уменьшенного количества бактерий. Среди лабораторных моноклональных тестов SAT Premier Platinum HpSA Plus (HpSA ELISA II; Meridian Diagnostics, Inc., Цинциннати, Огайо, США), в котором используются множественные мышиные моноклональные антитела, кажется точным.Ранее мы продемонстрировали значительно более высокую чувствительность HpSA ELISA II по сравнению с тестом Testmate Pylori Antigen EIA (TPAg EIA; Wakamoto Pharmaceutical Co. Ltd. и Kyowa Medex, Токио, Япония), в котором используется одно моноклональное антитело [23]. HpSA ELISA II дает более высокую прогностическую ценность положительного результата, хотя TPAg EIA дает эффективные результаты [24].
В руководствах EHSG для оценки результатов лечения рекомендуются лабораторные, но не служебные тесты [1].Однако недавние наблюдения показывают, что некоторые лабораторные тесты на основе моноклональных антител могут точно оценить результаты лечения эрадикацией [9,25]. Кабинетные тесты позволяют врачам оценить результаты эрадикационной терапии за одно посещение, а следующая эрадикационная терапия может быть начата в тот же день у пациентов, не подвергшихся эрадикации. Офисные тесты не требуют специального оборудования; следовательно, они подходят для институтов, которые не могут измерять 13 CO 2 .
Введение ИПП следует прекратить за 2 недели до оценки результатов лечения с помощью UBT или SAT [1]. Однако, как описано выше, ИПП не влияют на результаты некоторых тестов SAT [13]. Фактически, на небольшой серии из 22 японских пациентов мы показали, что результаты эрадикационной терапии, оцененные с помощью TPAg EIA во время введения PPI, были такими же, как и результаты, определенные UBT через 4 недели после отмены PPI у 21 пациента [26].
В некоторых руководствах оценка результатов эрадикационной терапии с помощью SAT должна проводиться по крайней мере через 4 недели после окончания лечения [1,3].Однако считается, что рецидив после эрадикации в основном представляет собой рецидив той же инфекции, а не повторное инфицирование. Поэтому были внесены предложения о продлении срока до 6 или 8 недель после окончания лечения. Тест EIA на основе моноклональных антител может определить результаты лечения через 6 недель после окончания лечения, а также через 8 недель [26].
НА ЗАМЕТКУ ПРИ ВЫПОЛНЕНИИ SAT
На результаты SAT влияют несколько факторов. Точность тестов SAT ниже, если образцы стула несформированные или водянистые, потому что H.pylori -специфические антигены в образцах стула разводятся. Поэтому не следует использовать водянистый стул, особенно при определении результатов эрадикационной терапии. Чувствительность SAT также ниже у пациентов с кровотечением из верхних отделов желудочно-кишечного тракта [27].
Температура и интервал между сбором пробы стула и измерением также влияют на результаты тестов SAT. Такая информация доступна для двух комплектов. Querioz et al [18] изучили результаты HpSA ELISA II и показали заметное снижение значения OD, когда образцы стула выдерживались при 37 ° C в течение 48 часов.Они также повторно протестировали образец стула со значением OD 0,183 после 6 часов инкубации при 37 ° C и обнаружили, что значение OD упало ниже порогового значения (0,120). В образцах, протестированных с помощью TPAg EIA, мы обнаружили, что значения OD для исходно отрицательных образцов стула увеличивались и были почти аналогичны пороговому уровню, если образцы поддерживались при 40 ° C [9]. Однако значения OD не изменялись до 7 дней при температуре от -5 ° C до 25 ° C, когда суспензии образцов стула хранились в специальных устройствах для сбора. Следовательно, образцы стула следует хранить при низкой температуре и анализировать в течение короткого периода, если устройства для сбора недоступны.Чтобы сохранить антигенность в течение длительного времени, образцы стула следует хранить при -80 ° C.
Различия в антигенности штаммов H. pylori иногда влияют на точность SAT в разных популяциях [28]. Следовательно, чувствительность и специфичность SAT следует тестировать в каждой популяции перед использованием для лечения инфекции H. pylori .
ЗАКЛЮЧЕНИЕ
Таким образом, SAT – это относительно недорогие неинвазивные тесты. SAT с использованием моноклональных антител полезны для первичной диагностики, а также для оценки эрадикационной терапии.SAT также полезны при лечении инфекции H. pylori у детей и пациентов после хирургического вмешательства на желудке. В будущем SAT следует использовать в массовых обследованиях для выявления и искоренения инфекции H. pylori для профилактики злокачественных новообразований желудка. Выбор тестового набора зависит от чувствительности и специфичности в каждом регионе и от обстоятельств каждого пациента.
Сноски
P- Рецензенты: Naito Y, Nagahara H, Said ZNA, Slomiany BL S- Редактор: Gou SX L- Редактор: Стюарт GJ E- Редактор: Zhang DN
Ссылки
1.Мальфертхайнер П., Меграуд Ф., О’Морайн К.А., Атертон Дж., Аксон А.Т., Баццоли Ф., Дженсини Г.Ф., Гисберт Дж. П., Грэм Д. Ю., Роккас Т. Управление инфекцией Helicobacter pylori – Маастрихтский отчет IV / Флорентийский консенсусный доклад. Кишечник. 2012. 61: 646–664. [PubMed] [Google Scholar] 2. Фок К.М., Кателарис П., Сугано К., Энг Т.Л., Хант Р., Талли, штат Нью-Джерси, Лам С.К., Сяо С.Д., Тан Х.Дж., Ву С.Й. и др. Вторые руководящие принципы Азиатско-Тихоокеанского консенсуса по инфекции Helicobacter pylori. J Gastroenterol Hepatol. 2009; 24: 1587–1600. [PubMed] [Google Scholar] 3.Асака М., Като М., Такахаши С., Фукуда Й., Сугияма Т., Ота Х, Уэмура Н., Мураками К., Сато К., Сугано К. Руководство по лечению инфекции Helicobacter pylori в Японии: пересмотренное издание 2009 г. Helicobacter. 2010; 15: 1–20. [PubMed] [Google Scholar] 4. Odaka T, Yamaguchi T., Koyama H, Saisho H, Nomura F. Оценка теста на антиген стула Helicobacter pylori для мониторинга эрадикационной терапии. Am J Gastroenterol. 2002; 97: 594–599. [PubMed] [Google Scholar] 5. Вейола Л., Оксанен А., Лёфгрен Т., Сиппонен П., Карвонен А.Л., Раутелин Х.Сравнение трех тестов стула на антиген для подтверждения эрадикации Helicobacter pylori у взрослых. Сканд Дж Гастроэнтерол. 2005; 40: 395–401. [PubMed] [Google Scholar] 6. Домингес Дж., Форне М., Бланко С., Прат С., Гали Н., Латорре И., Вивер Дж. М., Аусина В. Сравнение моноклонального и поликлонального иммуноферментного анализа стула на основе антител при диагностике инфекции Helicobacter pylori до и после эрадикационной терапии. Алимент Pharmacol Ther. 2006; 23: 1735–1740. [PubMed] [Google Scholar] 7. Дегучи Р., Мацусима М, Сузуки Т, Майн Т, Фукуда Р., Нишина М., Одзава Х., Такаги А.Сравнение иммуноферментного анализа кала на моноклональные и поликлональные антитела при диагностике инфекции Helicobacter pylori после эрадикационной терапии. J Gastroenterol. 2009. 44: 713–716. [PubMed] [Google Scholar] 8. Gisbert JP, de la Morena F, Abraira V. Точность теста на моноклональный антиген стула для диагностики инфекции H. pylori: систематический обзор и метаанализ. Am J Gastroenterol. 2006; 101: 1921–1930. [PubMed] [Google Scholar] 9. Коркмаз Х., Кесли Р., Карабаглы П., Терзи Ю. Сравнение диагностической точности пяти различных тестов на антигены стула для диагностики инфекции Helicobacter pylori.Helicobacter. 2013; 18: 384–391. [PubMed] [Google Scholar] 10. Симояма Т., Савая М., Исигуро А., Ханабата Н., Йошимура Т., Фукуда С. Применимость экспресс-теста на антиген стула с использованием моноклональных антител к каталазе для лечения инфекции Helicobacter pylori. J Gastroenterol. 2011; 46: 487–491. [PubMed] [Google Scholar] 11. Грэм Д.Ю., Опекун А.Р., Хаммуд Ф., Ямаока Ю., Редди Р., Осато М.С., Эль-Зимайти Х.М. Исследования, касающиеся механизма ложноотрицательных дыхательных тестов на мочевину с ингибиторами протонной помпы.Am J Gastroenterol. 2003; 98: 1005–1009. [PubMed] [Google Scholar] 12. Erzin Y, Altun S, Dobrucali A, Aslan M, Erdamar S, Dirican A, Kocazeybek B. Оценка двух иммуноферментных анализов для обнаружения Helicobacter pylori в образцах стула пациентов с диспепсией после эрадикационной терапии. J Med Microbiol. 2005; 54: 863–866. [PubMed] [Google Scholar] 13. Асфельдт AM, Løchen ML, Straume B, Steigen SE, Florholmen J, Goll R, Nestegard O, Paulssen EJ. Точность анализа стула на антиген на основе моноклональных антител в диагностике инфекции Helicobacter pylori.Сканд Дж Гастроэнтерол. 2004; 39: 1073–1077. [PubMed] [Google Scholar] 14. Кодама М., Мураками К., Окимото Т., Фукуда Й., Симояма Т., Окуда М., Като С., Кобаяши И., Фудзиока Т. Влияние лечения ингибиторами протонной помпы на тест на антиген стула Helicobacter pylori. Мир Дж. Гастроэнтерол. 2012; 18: 44–48. [Бесплатная статья PMC] [PubMed] [Google Scholar] 15. Леал Ю.А., Седильо-Ривера Р., Симон Дж. А., Веласкес Дж. Р., Флорес Л.Л., Торрес Дж. Полезность тестов на основе образцов стула для диагностики инфекции Helicobacter pylori у детей.J Pediatr Gastroenterol Nutr. 2011; 52: 718–728. [PubMed] [Google Scholar] 16. Мегро Ф. Сравнение неинвазивных тестов для выявления инфекции Helicobacter pylori у детей и подростков: результаты многоцентрового европейского исследования. J Pediatr. 2005. 146: 198–203. [PubMed] [Google Scholar] 17. Имри К., Роуленд М., Бурк Б., Драмм Б. Ограничения дыхательного теста с меченной углеродом 13 мочевиной на Helicobacter pylori у младенцев. J Pediatr. 2001; 139: 734–737. [PubMed] [Google Scholar] 18. Queiroz DM, Saito M, Rocha GA, Rocha AM, Melo FF, Checkley W, Braga LL, Silva IS, Gilman RH, Crabtree JE.Инфекция Helicobacter pylori у младенцев и детей ясельного возраста в Южной Америке: соответствие между дыхательным тестом на [13C] мочевину и моноклональным тестом на антиген стула H. pylori. J Clin Microbiol. 2013; 51: 3735–3740. [Бесплатная статья PMC] [PubMed] [Google Scholar] 19. Карденас В.М., Домингес Д.К., Пуэнтес Ф.А., Арагаки С.С., Гудман К.Дж., Грэм Д.Ю., Фукуда Ю. Оценка нового теста на антиген нативной каталазы в стуле для инфекции Helicobacter pylori у бессимптомных детей Северной Америки. J Pediatr Gastroenterol Nutr. 2008. 46: 399–402.[PubMed] [Google Scholar] 20. Adamopoulos AB, Stergiou GS, Sakizlis GN, Tiniakos DG, Nasothimiou EG, Sioutis DK, Achimastos AD. Диагностическая ценность экспресс-теста на уреазу и дыхательного теста с мочевиной для обнаружения Helicobacter pylori у пациентов с гастрэктомией по Бильроту II: проспективное контролируемое исследование. Dig Liver Dis. 2009; 41: 4–8. [PubMed] [Google Scholar] 21. Ян Дж., Ямагути Т., Одака Т., Сузуки Т., Охьяма Н., Хара Т., Судо К., Накамура К., Денда Т., Такигучи Н. и др. Тест на антиген в кале – надежный метод обнаружения Helicobacter pylori в желудочном остатке после дистальной резекции желудка по поводу рака желудка.J Clin Gastroenterol. 2010; 44: 73–74. [PubMed] [Google Scholar] 22. Симояма Т., Ояма Т., Мацудзака М., Данджо К., Накадзи С., Фукуда С. Сравнение теста на антиген стула и серологии для диагностики инфекции Helicobacter pylori в массовом опросе. Helicobacter. 2009; 14: 87–90. [PubMed] [Google Scholar] 23. Сато М., Шимояма Т., Такахаши Р., Кадзияма Х., Сано И., Сакаедани Н., Като А., Хирата Н., Фукуда Ю. Характеристика и полезность тестов на антигены стула с использованием моноклональных антител к каталазе Helicobacter pylori.J Gastroenterol Hepatol. 2012; 27 Дополнение 3: 23–28. [PubMed] [Google Scholar] 24. Симояма Т., Кобаяси И., Като С., Кодама М., Фукуда Ю. Сравнение тестов стула на основе моноклональных антител для определения результатов эрадикационной терапии Helicobacter pylori. Сканд Дж Гастроэнтерол. 2010; 45: 1431–1434. [PubMed] [Google Scholar] 25. Какликкая Н., Акдоган Р.А., Озгур О, Узун Д.Ю., Кобаноглу Ю., Динч Ю., Гунгор Э., Дабанца П.А., Арслан М., Айдын Ф. и др. Оценка нового теста экспресс-хроматографии с боковым потоком для диагностики Helicobacter pylori.Сауди Мед Дж. 2006; 27: 799–803. [PubMed] [Google Scholar] 26. Симояма Т., Като С., Кодама М., Кобаяси И., Фукуда Ю. Применимость теста на антиген стула на основе моноклональных антител для оценки результатов эрадикационной терапии Helicobacter pylori. Jpn J Infect Dis. 2009. 62: 225–227. [PubMed] [Google Scholar] 27. Саез Дж., Бельда С., Сантибаньес М., Родригес Дж. К., Сола-Вера Дж., Галиана А., Руис-Гарсия М., Бротонс А., Лопес-Жирона Е., Жирона Е. и др. ПЦР в реальном времени для диагностики инфекции Helicobacter pylori у пациентов с кровотечением из верхних отделов желудочно-кишечного тракта: сравнение с другими классическими методами диагностики.J Clin Microbiol. 2012; 50: 3233–3237. [Бесплатная статья PMC] [PubMed] [Google Scholar] 28. Ричи Б., Брюстер Д., Тран С. Д., Макнил Ю., Захаракис Б., Дэвидсон Г. П., Батлер Р. Н.. Недостаточная диагностическая точность теста на антиген моноклонального кала для выявления инфекции Helicobacter pylori у маленьких австралийских детей аборигенов. Pediatr Infect Dis J. 2009; 28: 287–289. [PubMed] [Google Scholar]Тесты стула на антиген для лечения инфекции Helicobacter pylori
World J Gastroenterol. 2013 Dec 7; 19 (45): 8188–8191.
Тадаси Симояма, Отделение гастроэнтерологии, Высшая школа медицины Университета Хиросаки, Хиросаки 036-8562, Япония
Вклад автора: Симояма Т. внес свой вклад в эту рукопись.Для корреспонденции: Тадаси Симояма, доктор медицины, доктор философии, отделение гастроэнтерологии, Высшая школа медицины Университета Хиросаки, 5 Zaifu-cho, Hirosaki 036-8562, Япония. pj.ca.nimu@ikh-omist
Телефон: + 81-172-395053 Факс: + 81-172-375946
Получено 26 сентября 2013 г .; Пересмотрено 29 октября 2013 г .; Принята в печать 12 ноября 2013 г.
Copyright © 2013 Baishideng Publishing Group Co., Limited. Все права защищены.Эта статья цитировалась в других статьях в PMC.Abstract
Тесты на антигены стула (SAT) – это неинвазивные диагностические модули для инфекции Helicobacter pylori ( H. pylori ). Для диагностики инфекции H. pylori существуют два типа SAT: один основан на иммуноферментном анализе (EIA), а другой – на иммунохроматографии (ICA). Для SAT не требуются дорогостоящие химические вещества или специальное оборудование; следовательно, они дешевле по сравнению с дыхательным тестом на мочевину.Как европейские, так и японские руководства показали, что SAT на основе EIA с использованием моноклональных антител полезны для первичной диагностики, а также для оценки эрадикационной терапии. Тесты на основе ICA не требуют специального оборудования и поэтому полезны в развивающихся странах. SAT также полезны для диагностики инфекции H. pylori у детей и пациентов после операции на желудке. Тесты SAT, выполненные с помощью EIA, позволяют оценить инфекцию H. pylori у большого числа субъектов почти так же, как и серологические исследования.Таким образом, тесты SAT могут быть полезны для выявления текущей инфекции в таком обследовании для выявления и искоренения инфекции H. pylori . Точность SAT ниже, если образцы стула не сформированы или водянистые, потому что специфических антигенов H. pylori в образцах стула разбавлены. Температура и интервал между сбором пробы стула и измерением также влияют на результаты тестов SAT. Выбор тестового набора зависит от чувствительности и специфичности в каждом регионе и от обстоятельств каждого пациента.
Ключевые слова: Helicobacter pylori , определение антигена стула, диагностика, иммуноферментный анализ, иммунохроматография
Основной совет: Тесты на антигены стула (SAT) – относительно недорогие неинвазивные тесты. Несколько руководств по инфекции Helicobacter pylori ( H. pylori ) со всего мира указывают, что SAT с использованием моноклональных антител полезны для первичной диагностики, а также для оценки результатов эрадикационной терапии.SAT также полезны для диагностики инфекции H. pylori у детей и пациентов после операции на желудке. Выбор тестового набора зависит от точности в каждой популяции и от обстоятельств каждого пациента.
ВВЕДЕНИЕ
Инфекция, вызванная Helicobacter pylori ( H. pylori ), вовлечена в патогенез желудочно-дуоденальных заболеваний. Несколько руководств по заражению H. pylori со всего мира указывают на то, что ликвидация H.pylori приведет к снижению заболеваемости гастродуоденальными заболеваниями, включая рак желудка, и уменьшит количество новых инфекций в будущих поколениях [1,2]. Следуя рекомендациям японских руководств по лечению инфекции H. pylori (пересмотренное издание 2009 г.), в 2013 г. японская система медицинского страхования утвердила покрытие диагностики и ликвидации H. pylori у всех инфицированных пациентов [ 3]. Следовательно, расширение роли H.pylori диагностических тестов будет сопровождать рост числа пациентов, подвергнутых тестам и искоренению H. pylori .
Тесты на антиген стула (SAT)– это неинвазивные диагностические модули для инфекции H. pylori , которые были введены после дыхательного теста с мочевиной (UBT). Ранние тесты SAT использовали иммуноферментный анализ (EIA) на основе поликлональных антител. Хотя они предоставили надежные результаты в диагностике инфекции H. pylori , при пост-эрадикационной оценке иногда наблюдались противоречивые результаты из-за ложноположительных результатов [4,5].Методы, основанные на моноклональных антителах, обычно имеют более высокую специфичность. Были разработаны SAT на основе моноклональных антител, которые оказались более точными, чем тесты с использованием поликлональных антител [6,7]. Метаанализ также показал, что специфичность SAT на основе моноклональных антител составляла 0,97 (95% ДИ: 0,96–0,98) [8]. Как европейские, так и японские руководства показали, что SAT с использованием моноклональных антител полезны для первичной диагностики, а также для оценки эрадикационной терапии [1,3].
Для диагностики инфекции H. pylori существуют два типа SAT, один на основе EIA, а другой – на основе иммунохроматографии (ICA). Хотя оба типа тестов обладают высокой чувствительностью и специфичностью, недавнее исследование показало, что доступные в настоящее время тесты на основе ICA дают менее надежные результаты, чем тесты на основе EIA [9]. Тем не менее, тесты на основе ICA просты в выполнении и полезны для оперативной диагностики инфекции H. pylori [10]. Тесты на основе ICA не требуют специального оборудования; поэтому они были бы полезны в развивающихся странах.
ДИАГНОСТИКА
Сравнение с UBT
Среди неинвазивных диагностических тестов SAT и UBT имеют более высокую точность, чем серологические тесты или тесты на антитела в моче [1,3]. Американская гастроэнтерологическая ассоциация рекомендует как SAT, так и UBT для диагностики инфекции H. pylori у пациентов с диспепсией [4]. Хотя UBT считается наиболее надежным неинвазивным тестом для диагностики инфекции H. pylori , у него есть несколько ограничений.Стоимость UBT все еще относительно высока из-за цены 13 C-мочевины (приблизительно 30,3 долларов США) и стоимости измерения 13 CO 2 . Напротив, SAT не требуют дорогих химических веществ и специального оборудования и, следовательно, менее дороги (1400 иен; примерно 14,2 доллара США). Кроме того, пациенты должны голодать перед тестом UBT, но не перед тестом SAT. Кроме того, введение ингибитора протонной помпы (ИПП) модулирует pH желудочного сока, что приводит к снижению активности уреазы H.pylori в желудке. UBT определяет активность уреазы слизистой оболочки желудка; поэтому у пациентов, принимавших ИПП, отмечаются ложноотрицательные результаты [11]. Поэтому обычно рекомендуется прекратить прием ИПП за 2 недели до теста UBT [1]. ИПП могут аналогичным образом влиять на результаты SAT [12,13], но некоторые SAT на основе моноклональных антител, доступные в настоящее время, не подвержены действию ИПП [14]. Такие SAT, которые не требуют прекращения PPI, полезны для управления H.pylori у пациентов с гастроэзофагеальной рефлюксной болезнью или у лиц, принимающих нестероидные противовоспалительные препараты.
Диагностика у детей и пациентов после хирургических вмешательств на желудке
Систематический обзор и метаанализ показали, что SAT с использованием ИФА на основе моноклональных антител полезны для диагностики инфекции H. pylori у детей [15]. UBT также очень точен у детей старше 6 лет, в то время как исследования, проведенные в развитых странах, показали, что его специфичность была менее 90% у очень маленьких детей [16,17].Напротив, как моноклональные SAT, так и UBT были надежными у маленьких детей в возрасте 6-30 месяцев в развивающихся странах Южной Америки [18]. Эти результаты показывают, что тесты SAT на основе моноклональных антител являются наиболее эффективными тестами для детей в популяциях с высокой и низкой распространенностью инфекции H. pylori [18,19].
У пациентов, перенесших дистальную резекцию желудка, точность UBT была ниже, чем у биопсийного уреазного теста [20]. Однако у японских пациентов, перенесших дистальную резекцию желудка, специфичность SAT была 90.5%, тогда как UBT составлял всего 59,1% [21].
Массовое обследование и скрининг
В массовых обследованиях, что касается техники и стоимости, обычно использовалась серология, несмотря на ее более низкую специфичность [3]. Тесты SAT, выполненные с помощью EIA, могут оценить инфекцию H. pylori у большого числа субъектов почти так же, как серологические. У 994 здоровых взрослых японцев, принявших участие в массовом опросе, соответствие результатов SAT и серологии составило более 90% [22]. Однако в этом исследовании положительность тестов SAT была значительно ниже, чем у серологических, у 303 пациентов с тяжелым атрофическим гастритом.В слизистой оболочке желудка пациентов с тяжелым атрофическим гастритом и кишечной метаплазией колонизация H. pylori снижена или отсутствует. Следовательно, в условиях массового обследования серология полезна для выявления как текущей, так и перенесенной инфекции. SAT должны использоваться для выявления текущей инфекции в таком обследовании, чтобы идентифицировать и искоренить инфекцию H. pylori для предотвращения злокачественных новообразований желудка.
ОЦЕНКА ЭРАДИКАЦИИ
На сегодняшний день многие исследования продемонстрировали полезность SAT для оценки результатов эрадикационной терапии.Недавние руководства Европейской исследовательской группы по хеликобактерам (EHSG) рекомендуют как UBT, так и лабораторный моноклональный SAT [1]. После эрадикационной терапии количество колоний H. pylori в желудке будет уменьшено, даже если эрадикационная терапия оказалась безуспешной. Таким образом, SAT должны быть выполнены для обнаружения уменьшенного количества бактерий. Среди лабораторных моноклональных тестов SAT Premier Platinum HpSA Plus (HpSA ELISA II; Meridian Diagnostics, Inc., Цинциннати, Огайо, США), в котором используются множественные мышиные моноклональные антитела, кажется точным.Ранее мы продемонстрировали значительно более высокую чувствительность HpSA ELISA II по сравнению с тестом Testmate Pylori Antigen EIA (TPAg EIA; Wakamoto Pharmaceutical Co. Ltd. и Kyowa Medex, Токио, Япония), в котором используется одно моноклональное антитело [23]. HpSA ELISA II дает более высокую прогностическую ценность положительного результата, хотя TPAg EIA дает эффективные результаты [24].
В руководствах EHSG для оценки результатов лечения рекомендуются лабораторные, но не служебные тесты [1].Однако недавние наблюдения показывают, что некоторые лабораторные тесты на основе моноклональных антител могут точно оценить результаты лечения эрадикацией [9,25]. Кабинетные тесты позволяют врачам оценить результаты эрадикационной терапии за одно посещение, а следующая эрадикационная терапия может быть начата в тот же день у пациентов, не подвергшихся эрадикации. Офисные тесты не требуют специального оборудования; следовательно, они подходят для институтов, которые не могут измерять 13 CO 2 .
Введение ИПП следует прекратить за 2 недели до оценки результатов лечения с помощью UBT или SAT [1]. Однако, как описано выше, ИПП не влияют на результаты некоторых тестов SAT [13]. Фактически, на небольшой серии из 22 японских пациентов мы показали, что результаты эрадикационной терапии, оцененные с помощью TPAg EIA во время введения PPI, были такими же, как и результаты, определенные UBT через 4 недели после отмены PPI у 21 пациента [26].
В некоторых руководствах оценка результатов эрадикационной терапии с помощью SAT должна проводиться по крайней мере через 4 недели после окончания лечения [1,3].Однако считается, что рецидив после эрадикации в основном представляет собой рецидив той же инфекции, а не повторное инфицирование. Поэтому были внесены предложения о продлении срока до 6 или 8 недель после окончания лечения. Тест EIA на основе моноклональных антител может определить результаты лечения через 6 недель после окончания лечения, а также через 8 недель [26].
НА ЗАМЕТКУ ПРИ ВЫПОЛНЕНИИ SAT
На результаты SAT влияют несколько факторов. Точность тестов SAT ниже, если образцы стула несформированные или водянистые, потому что H.pylori -специфические антигены в образцах стула разводятся. Поэтому не следует использовать водянистый стул, особенно при определении результатов эрадикационной терапии. Чувствительность SAT также ниже у пациентов с кровотечением из верхних отделов желудочно-кишечного тракта [27].
Температура и интервал между сбором пробы стула и измерением также влияют на результаты тестов SAT. Такая информация доступна для двух комплектов. Querioz et al [18] изучили результаты HpSA ELISA II и показали заметное снижение значения OD, когда образцы стула выдерживались при 37 ° C в течение 48 часов.Они также повторно протестировали образец стула со значением OD 0,183 после 6 часов инкубации при 37 ° C и обнаружили, что значение OD упало ниже порогового значения (0,120). В образцах, протестированных с помощью TPAg EIA, мы обнаружили, что значения OD для исходно отрицательных образцов стула увеличивались и были почти аналогичны пороговому уровню, если образцы поддерживались при 40 ° C [9]. Однако значения OD не изменялись до 7 дней при температуре от -5 ° C до 25 ° C, когда суспензии образцов стула хранились в специальных устройствах для сбора. Следовательно, образцы стула следует хранить при низкой температуре и анализировать в течение короткого периода, если устройства для сбора недоступны.Чтобы сохранить антигенность в течение длительного времени, образцы стула следует хранить при -80 ° C.
Различия в антигенности штаммов H. pylori иногда влияют на точность SAT в разных популяциях [28]. Следовательно, чувствительность и специфичность SAT следует тестировать в каждой популяции перед использованием для лечения инфекции H. pylori .
ЗАКЛЮЧЕНИЕ
Таким образом, SAT – это относительно недорогие неинвазивные тесты. SAT с использованием моноклональных антител полезны для первичной диагностики, а также для оценки эрадикационной терапии.SAT также полезны при лечении инфекции H. pylori у детей и пациентов после хирургического вмешательства на желудке. В будущем SAT следует использовать в массовых обследованиях для выявления и искоренения инфекции H. pylori для профилактики злокачественных новообразований желудка. Выбор тестового набора зависит от чувствительности и специфичности в каждом регионе и от обстоятельств каждого пациента.
Сноски
P- Рецензенты: Naito Y, Nagahara H, Said ZNA, Slomiany BL S- Редактор: Gou SX L- Редактор: Стюарт GJ E- Редактор: Zhang DN
Ссылки
1.Мальфертхайнер П., Меграуд Ф., О’Морайн К.А., Атертон Дж., Аксон А.Т., Баццоли Ф., Дженсини Г.Ф., Гисберт Дж. П., Грэм Д. Ю., Роккас Т. Управление инфекцией Helicobacter pylori – Маастрихтский отчет IV / Флорентийский консенсусный доклад. Кишечник. 2012. 61: 646–664. [PubMed] [Google Scholar] 2. Фок К.М., Кателарис П., Сугано К., Энг Т.Л., Хант Р., Талли, штат Нью-Джерси, Лам С.К., Сяо С.Д., Тан Х.Дж., Ву С.Й. и др. Вторые руководящие принципы Азиатско-Тихоокеанского консенсуса по инфекции Helicobacter pylori. J Gastroenterol Hepatol. 2009; 24: 1587–1600. [PubMed] [Google Scholar] 3.Асака М., Като М., Такахаши С., Фукуда Й., Сугияма Т., Ота Х, Уэмура Н., Мураками К., Сато К., Сугано К. Руководство по лечению инфекции Helicobacter pylori в Японии: пересмотренное издание 2009 г. Helicobacter. 2010; 15: 1–20. [PubMed] [Google Scholar] 4. Odaka T, Yamaguchi T., Koyama H, Saisho H, Nomura F. Оценка теста на антиген стула Helicobacter pylori для мониторинга эрадикационной терапии. Am J Gastroenterol. 2002; 97: 594–599. [PubMed] [Google Scholar] 5. Вейола Л., Оксанен А., Лёфгрен Т., Сиппонен П., Карвонен А.Л., Раутелин Х.Сравнение трех тестов стула на антиген для подтверждения эрадикации Helicobacter pylori у взрослых. Сканд Дж Гастроэнтерол. 2005; 40: 395–401. [PubMed] [Google Scholar] 6. Домингес Дж., Форне М., Бланко С., Прат С., Гали Н., Латорре И., Вивер Дж. М., Аусина В. Сравнение моноклонального и поликлонального иммуноферментного анализа стула на основе антител при диагностике инфекции Helicobacter pylori до и после эрадикационной терапии. Алимент Pharmacol Ther. 2006; 23: 1735–1740. [PubMed] [Google Scholar] 7. Дегучи Р., Мацусима М, Сузуки Т, Майн Т, Фукуда Р., Нишина М., Одзава Х., Такаги А.Сравнение иммуноферментного анализа кала на моноклональные и поликлональные антитела при диагностике инфекции Helicobacter pylori после эрадикационной терапии. J Gastroenterol. 2009. 44: 713–716. [PubMed] [Google Scholar] 8. Gisbert JP, de la Morena F, Abraira V. Точность теста на моноклональный антиген стула для диагностики инфекции H. pylori: систематический обзор и метаанализ. Am J Gastroenterol. 2006; 101: 1921–1930. [PubMed] [Google Scholar] 9. Коркмаз Х., Кесли Р., Карабаглы П., Терзи Ю. Сравнение диагностической точности пяти различных тестов на антигены стула для диагностики инфекции Helicobacter pylori.Helicobacter. 2013; 18: 384–391. [PubMed] [Google Scholar] 10. Симояма Т., Савая М., Исигуро А., Ханабата Н., Йошимура Т., Фукуда С. Применимость экспресс-теста на антиген стула с использованием моноклональных антител к каталазе для лечения инфекции Helicobacter pylori. J Gastroenterol. 2011; 46: 487–491. [PubMed] [Google Scholar] 11. Грэм Д.Ю., Опекун А.Р., Хаммуд Ф., Ямаока Ю., Редди Р., Осато М.С., Эль-Зимайти Х.М. Исследования, касающиеся механизма ложноотрицательных дыхательных тестов на мочевину с ингибиторами протонной помпы.Am J Gastroenterol. 2003; 98: 1005–1009. [PubMed] [Google Scholar] 12. Erzin Y, Altun S, Dobrucali A, Aslan M, Erdamar S, Dirican A, Kocazeybek B. Оценка двух иммуноферментных анализов для обнаружения Helicobacter pylori в образцах стула пациентов с диспепсией после эрадикационной терапии. J Med Microbiol. 2005; 54: 863–866. [PubMed] [Google Scholar] 13. Асфельдт AM, Løchen ML, Straume B, Steigen SE, Florholmen J, Goll R, Nestegard O, Paulssen EJ. Точность анализа стула на антиген на основе моноклональных антител в диагностике инфекции Helicobacter pylori.Сканд Дж Гастроэнтерол. 2004; 39: 1073–1077. [PubMed] [Google Scholar] 14. Кодама М., Мураками К., Окимото Т., Фукуда Й., Симояма Т., Окуда М., Като С., Кобаяши И., Фудзиока Т. Влияние лечения ингибиторами протонной помпы на тест на антиген стула Helicobacter pylori. Мир Дж. Гастроэнтерол. 2012; 18: 44–48. [Бесплатная статья PMC] [PubMed] [Google Scholar] 15. Леал Ю.А., Седильо-Ривера Р., Симон Дж. А., Веласкес Дж. Р., Флорес Л.Л., Торрес Дж. Полезность тестов на основе образцов стула для диагностики инфекции Helicobacter pylori у детей.J Pediatr Gastroenterol Nutr. 2011; 52: 718–728. [PubMed] [Google Scholar] 16. Мегро Ф. Сравнение неинвазивных тестов для выявления инфекции Helicobacter pylori у детей и подростков: результаты многоцентрового европейского исследования. J Pediatr. 2005. 146: 198–203. [PubMed] [Google Scholar] 17. Имри К., Роуленд М., Бурк Б., Драмм Б. Ограничения дыхательного теста с меченной углеродом 13 мочевиной на Helicobacter pylori у младенцев. J Pediatr. 2001; 139: 734–737. [PubMed] [Google Scholar] 18. Queiroz DM, Saito M, Rocha GA, Rocha AM, Melo FF, Checkley W, Braga LL, Silva IS, Gilman RH, Crabtree JE.Инфекция Helicobacter pylori у младенцев и детей ясельного возраста в Южной Америке: соответствие между дыхательным тестом на [13C] мочевину и моноклональным тестом на антиген стула H. pylori. J Clin Microbiol. 2013; 51: 3735–3740. [Бесплатная статья PMC] [PubMed] [Google Scholar] 19. Карденас В.М., Домингес Д.К., Пуэнтес Ф.А., Арагаки С.С., Гудман К.Дж., Грэм Д.Ю., Фукуда Ю. Оценка нового теста на антиген нативной каталазы в стуле для инфекции Helicobacter pylori у бессимптомных детей Северной Америки. J Pediatr Gastroenterol Nutr. 2008. 46: 399–402.[PubMed] [Google Scholar] 20. Adamopoulos AB, Stergiou GS, Sakizlis GN, Tiniakos DG, Nasothimiou EG, Sioutis DK, Achimastos AD. Диагностическая ценность экспресс-теста на уреазу и дыхательного теста с мочевиной для обнаружения Helicobacter pylori у пациентов с гастрэктомией по Бильроту II: проспективное контролируемое исследование. Dig Liver Dis. 2009; 41: 4–8. [PubMed] [Google Scholar] 21. Ян Дж., Ямагути Т., Одака Т., Сузуки Т., Охьяма Н., Хара Т., Судо К., Накамура К., Денда Т., Такигучи Н. и др. Тест на антиген в кале – надежный метод обнаружения Helicobacter pylori в желудочном остатке после дистальной резекции желудка по поводу рака желудка.J Clin Gastroenterol. 2010; 44: 73–74. [PubMed] [Google Scholar] 22. Симояма Т., Ояма Т., Мацудзака М., Данджо К., Накадзи С., Фукуда С. Сравнение теста на антиген стула и серологии для диагностики инфекции Helicobacter pylori в массовом опросе. Helicobacter. 2009; 14: 87–90. [PubMed] [Google Scholar] 23. Сато М., Шимояма Т., Такахаши Р., Кадзияма Х., Сано И., Сакаедани Н., Като А., Хирата Н., Фукуда Ю. Характеристика и полезность тестов на антигены стула с использованием моноклональных антител к каталазе Helicobacter pylori.J Gastroenterol Hepatol. 2012; 27 Дополнение 3: 23–28. [PubMed] [Google Scholar] 24. Симояма Т., Кобаяси И., Като С., Кодама М., Фукуда Ю. Сравнение тестов стула на основе моноклональных антител для определения результатов эрадикационной терапии Helicobacter pylori. Сканд Дж Гастроэнтерол. 2010; 45: 1431–1434. [PubMed] [Google Scholar] 25. Какликкая Н., Акдоган Р.А., Озгур О, Узун Д.Ю., Кобаноглу Ю., Динч Ю., Гунгор Э., Дабанца П.А., Арслан М., Айдын Ф. и др. Оценка нового теста экспресс-хроматографии с боковым потоком для диагностики Helicobacter pylori.Сауди Мед Дж. 2006; 27: 799–803. [PubMed] [Google Scholar] 26. Симояма Т., Като С., Кодама М., Кобаяси И., Фукуда Ю. Применимость теста на антиген стула на основе моноклональных антител для оценки результатов эрадикационной терапии Helicobacter pylori. Jpn J Infect Dis. 2009. 62: 225–227. [PubMed] [Google Scholar] 27. Саез Дж., Бельда С., Сантибаньес М., Родригес Дж. К., Сола-Вера Дж., Галиана А., Руис-Гарсия М., Бротонс А., Лопес-Жирона Е., Жирона Е. и др. ПЦР в реальном времени для диагностики инфекции Helicobacter pylori у пациентов с кровотечением из верхних отделов желудочно-кишечного тракта: сравнение с другими классическими методами диагностики.J Clin Microbiol. 2012; 50: 3233–3237. [Бесплатная статья PMC] [PubMed] [Google Scholar] 28. Ричи Б., Брюстер Д., Тран С. Д., Макнил Ю., Захаракис Б., Дэвидсон Г. П., Батлер Р. Н.. Недостаточная диагностическая точность теста на антиген моноклонального кала для выявления инфекции Helicobacter pylori у маленьких австралийских детей аборигенов. Pediatr Infect Dis J. 2009; 28: 287–289. [PubMed] [Google Scholar]Тестирование антигена стула H. pylori
Более половины населения мира инфицировано H.pylori , самой распространенной в мире бактериальной инфекции (1, 2). Даже в развитых странах, где общий уровень инфицирования снижается, врачи сталкиваются с высокими показателями распространенности, которые еще выше среди иммигрантов и пациентов из экономически неблагополучных семей. Серологическое тестирование – это распространенный способ обнаружения антител H. pylori , но, поскольку пациенты могут оставаться серопозитивными в течение многих лет после инфекции, они не подходят для определения текущего заболевания. Как тогда можно принять решение о диагнозе и лечении?
H.pylori ПатологияH. pylori обычно приобретается в детстве. Если его не лечить, он сохраняется и остается передаваемым на протяжении всей жизни пациента (3, 4). Показатели распространенности увеличиваются с возрастом, но более низкие показатели инфицирования H. pylori среди детей отражают недавние улучшения в контроле и передаче инфекции среди молодых. Передача инфекции между членами семьи является частой (1, 4), а бабушки и дедушки являются обычным, ничего не подозревающим источником инфекции (5).
Симптомы H.pylori первоначально включают боль в животе или верхней части живота. Бактерии проникают через защитную слизистую желудка, вызывая раздражение, инвазию нейтрофилов и воспаление поверхности желудка, что приводит к гастриту (6). Неизвестно, какая часть подвергшихся воздействию людей избегает активного воспаления или подавляет его, но для тех, у кого постоянная колонизация, гастрит и секреция кислоты создают почву для дальнейших осложнений (7).
У 10-20% инфицированных пациентов хроническое и активное воспаление приводит к последующему развитию язвенной болезни (6).Для пациентов с интактной секрецией кислоты H. pylori будет более распространенным, а воспаление ткани более выраженным в антральном отделе желудка с меньшим количеством бактерий и меньшим воспалением в теле (6). У этих пациентов чаще развиваются язвы антрального отдела и двенадцатиперстной кишки. Ранее инфекция H. pylori была причиной 90% язв двенадцатиперстной кишки и 80% язв желудка (1). В настоящее время в развитых странах, хотя число случаев инфицирования H. pylori и сокращается, все большая часть язвенной болезни связана с использованием нестероидных противовоспалительных препаратов (НПВП) (1, 8).Пациенты, которые планируют длительную терапию НПВП, должны быть проверены на инфекцию H. pylori , так как комбинация еще больше увеличивает риск развития язвы (9). Это изменение заболеваемости подчеркивает важность правильной диагностики диспепсии и язв, чтобы отличить заболевание, вызванное лекарственными препаратами, от заболевания, вызванного инфекцией H. pylori .
У пациентов с пониженной секрецией кислоты, особенно у тех, кто принимает ингибиторы протонной помпы (ИПП), может развиться гастрит по всему желудку с язвами, возникающими там, где воспаление наиболее выражено (6).Язвы могут иметь серьезные осложнения, включая кровотечение, перфорацию и стриктуры. Если кровоточащие язвы вызваны H. pylori , существует высокий риск рецидива; Антибактериальная терапия для уничтожения бактерий обычно бывает успешной и снижает этот риск (6). Когда низкая секреция кислоты позволяет воспалению оставаться хронически активным, у пациентов может развиться метаплазия и, в конечном итоге, вызванный воспалением рак желудка. Атрофический гастрит является предшественником рака желудка и еще больше снижает секрецию кислоты (10).
Общие Инфекция H. pylori связана с 2-3-кратным увеличением риска рака желудка или лимфомы лимфоидного типа (MALT) слизистой оболочки (1). Раньше рак желудка был распространенным типом рака в Соединенных Штатах. Параллельно со снижением заболеваемости инфекциями H. pylori сократилось число случаев рака желудка, и, по оценкам, он занимает 15-е место по распространенности в США. Тем не менее, 5-летняя общая выживаемость составляет всего 31%, а 10 800 человек в США и более 700 000 человек во всем мире ежегодно умирают от рака желудка (1, 9, 11).Для 35% пациентов с метастазами относительная 5-летняя выживаемость составляет всего 5% (11). Поскольку колонизация H. pylori является самым большим фактором риска рака желудка (1) и поскольку бактерии классифицируются как канцероген класса I, диагностика инфекции имеет клиническое значение.
H. pylori ЛечениеСпособность лечить и вылечить инфекций H. pylori с помощью антибиотиков произвела революцию в клинической помощи пациентам и изменила давние тенденции болезней.Улучшение того, что было пожизненным ухудшающимся состоянием, ликвидация H. pylori уменьшает воспаление, и если терапия проводится до наступления атрофических изменений, даже риск рака может быть практически устранен (10).
Есть несколько методов лечения, которые могут быть успешными (12). Широко используется тройная терапия, состоящая из ИПП, амоксициллина и кларитромицина в течение 10-14 дней (9). Последовательная терапия включает амоксициллин и ИПП в течение первых 5 дней, затем переходят к тройной терапии ИПП и двух антибиотиков, таких как кларитромицин и тинидазол (9).Ликвидация H. pylori становится все труднее из-за повышения устойчивости штаммов H. pylori к кларитромицину, что делает эти методы лечения менее эффективными (13). Недавние исследования показывают, что устойчивость к кларитромицину составляет 32% в США и 50% в Японии (4), а устойчивость к метронидазолу в Африке превышает 90% (9). В результате в Рекомендациях AGC 2017 предлагается использовать схемы лечения без кларитромицина, если уровень местной резистентности превышает 20% (3). Эта резистентность привела к разработке четырехкратной терапии с использованием ИПП, продукта висмута и антибиотиков, таких как метронидазол и тетрациклин, в течение 10-14 дней (9).Однако для беременных, инфицированных H. pylori , висмут, тетрациклин и фторхинолоны являются потенциальными тератогенами, и их следует избегать (9).
Из-за резистентности к антибиотикам попытки уничтожить H. pylori с помощью этих схем увеличивают частоту неудач, и больше нельзя предполагать искоренение. Устранение бактерий должно быть подтверждено через 4 недели после окончания лечения с помощью теста, такого как анализ стула на антиген, а не серологического теста (антитела к H.pylori образуются в течение 3 недель после заражения) (9). Руководящие принципы рекомендуют последующее тестирование через четыре недели после лечения, поскольку эти временные рамки позволяют любому выжившему H. pylori повторно вырасти до обнаруживаемых уровней (3).
H. pylori ДиагностикаНесколько профессиональных гастроэнтерологических групп одобрили подход «тест-лечение-тест», который включает в себя сначала использование неинвазивного диагностического теста, чтобы определить, инфицирован ли пациент с диспепсией H.pylori , лечение при наличии инфекции, затем последующее обследование для подтверждения удаления бактерий (3, 7, 12). Для пациентов это снижает расходы, неудобства и дискомфорт при эндоскопии. Врачи могут быстро поставить диагноз и уверенно начать терапию.
H. pylori Инфекции и связанные с ними симптомы и воспаления могут усиливаться и уменьшаться. Пациенты обычно обращаются за медицинской помощью по поводу тревожных симптомов в период активного воспаления. Если H.pylori положительный результат, они должны пройти курс эрадикационной терапии, чтобы предотвратить обострение болезни и потенциально обратить вспять и излечить их текущие поражения. В рекомендациях AGC 2017 указано, что если врач планирует проверить пациента на H. pylori , тогда пациента следует лечить в случае положительного результата (3). Таким образом, фундаментальное решение заключается не в том, лечить ли, а в том, какой тест следует использовать для диагностики активной инфекции.
Тесты на H. pylori делятся на две основные категории: инвазивные и неинвазивные.В инвазивных тестах эндоскопия используется как средство наблюдения поражений и получения биопсий для гистологии, экспресс-теста на уреазу, анализов полимеразной цепной реакции (ПЦР) и посева. Неинвазивные тесты включают серологию на антител, направленных против H. pylori , дыхательные тесты на мочевину и тесты на антиген стула.
Антиген H. Pylori, стул | Данные врача
Этот микроорганизм, который можно найти на слизистой оболочке желудка инфицированных людей, вызывает очень частые и в большинстве своем скрытые инфекции, которые могут вызвать гастрит, язву желудка и другие серьезные патологии.Этот неинвазивный тест, одобренный FDA, непосредственно измеряет антиген в стуле (не антитела) и используется для диагностики инфекций Helicobacter pylori . Он также используется для контроля терапевтической эффективности во время и после лечения.
Подробнее »
Срок выполнения
от 5 до 7 дней
Протестировано аналитов
Щелкните любое название аналита, чтобы получить дополнительную клиническую информацию, включая контрольные диапазоны, сбор образцов, критерии стабильности и отклонения.
Прейскурантная цена применяется при регистрации в страховке или Medicare или при выставлении счета пациенту напрямую.
Цена на своевременную оплату применяется при выставлении счета на счет врача или при получении предоплаты вместе с тестом.
Doctor’s Data предлагает профили, содержащие несколько аналитов. * Счет за несколько аналитов может быть выставлен с использованием одного кода CPT. Многие аналиты можно заказать индивидуально. Цены могут отличаться. Нажмите на конкретный аналит для получения дополнительной информации или ознакомьтесь с нашими подробными правилами выставления счетов и платежей.
Коды CPT, указанные на нашем веб-сайте, предназначены только для информационных целей. Эта информация является нашей интерпретацией требований к кодированию CPT и не обязательно может быть правильной. Рекомендуется ознакомиться с Руководством по кодированию CPT, опубликованным Американской медицинской ассоциацией. Doctor’s Data, Inc. не несет ответственности за ошибки при выставлении счетов, вызванные использованием вами какой-либо информации CPT с нашего веб-сайта.
Войдите в систему в верхней части любой страницы, чтобы просмотреть цены и заказать тесты. Или нажмите здесь, чтобы создать учетную запись.Вы также можете связаться с нами для помощи в размещении заказа.
Подробная информация
Осведомленность о Helicobacter pylori при желудочно-кишечных заболеваниях значительно возросла с тех пор, как Маршалл и Уоррен описали присутствие Campylobacter-подобных организмов в антральной слизистой оболочке пациентов с гистологическими доказательствами антрального гастрита и язвенной болезни, особенно язвы двенадцатиперстной кишки. Сильная корреляция между присутствием H.pylori и гистологически подтвержденный гастрит, язвенная болезнь и карцинома желудка, а также разрешение болезни после эрадикации H. pylori указывает на причинную связь.
Экологическая ниша у людей ограничена желудком и двенадцатиперстной кишкой. Пациенты, являющиеся носителями этого микроорганизма, делятся на две основные группы: а) колонизированные и б) инфицированные. Пациенты с положительным результатом теста на H. pylori , но при этом не имеют признаков или симптомов желудочно-кишечного заболевания, считаются «колонизированными».«Пациенты с положительным результатом теста на H. pylori и с признаками или симптомами желудочно-кишечного заболевания считаются« инфицированными ». Процесс заражения колонизированного человека остается неясным. Процесс, посредством которого пациенты становятся колонизированными, также все еще исследуется
Прямое обнаружение требует проведения инвазивной биопсии из верхних отделов желудочно-кишечного тракта.


 Вегетативные формы или цисты лямблий могут быть обнаружены в содержимом двенадцатиперстной кишки (полученном при дуоденальном зондировании) или пробах кала. Определение цист или вегетативных форм лямблий в кале при микроскопии является наиболее распространенным, традиционным методом диагностики лямблиоза, но его чувствительность составляет лишь 50% при однократном исследовании. Микроскопическое исследование с применением систем PARASEP, когда материал для анализа концентрируют с помощью специальных фильтров, увеличивает чувствительность анализа в 10-15 раз по сравнению с традиционным методом. Из-за особенностей жизненного цикла лямблий и прерывистого выделения цист, рекомендовано 3-х кратное исследование кала с интервалом в несколько дней. Определение антигена лямблий в кале проводится иммунологическими методами.
Вегетативные формы или цисты лямблий могут быть обнаружены в содержимом двенадцатиперстной кишки (полученном при дуоденальном зондировании) или пробах кала. Определение цист или вегетативных форм лямблий в кале при микроскопии является наиболее распространенным, традиционным методом диагностики лямблиоза, но его чувствительность составляет лишь 50% при однократном исследовании. Микроскопическое исследование с применением систем PARASEP, когда материал для анализа концентрируют с помощью специальных фильтров, увеличивает чувствительность анализа в 10-15 раз по сравнению с традиционным методом. Из-за особенностей жизненного цикла лямблий и прерывистого выделения цист, рекомендовано 3-х кратное исследование кала с интервалом в несколько дней. Определение антигена лямблий в кале проводится иммунологическими методами. Наиболее распространенным методом определения антител является ИФА (иммуноферментный анализ).
Наиболее распространенным методом определения антител является ИФА (иммуноферментный анализ).

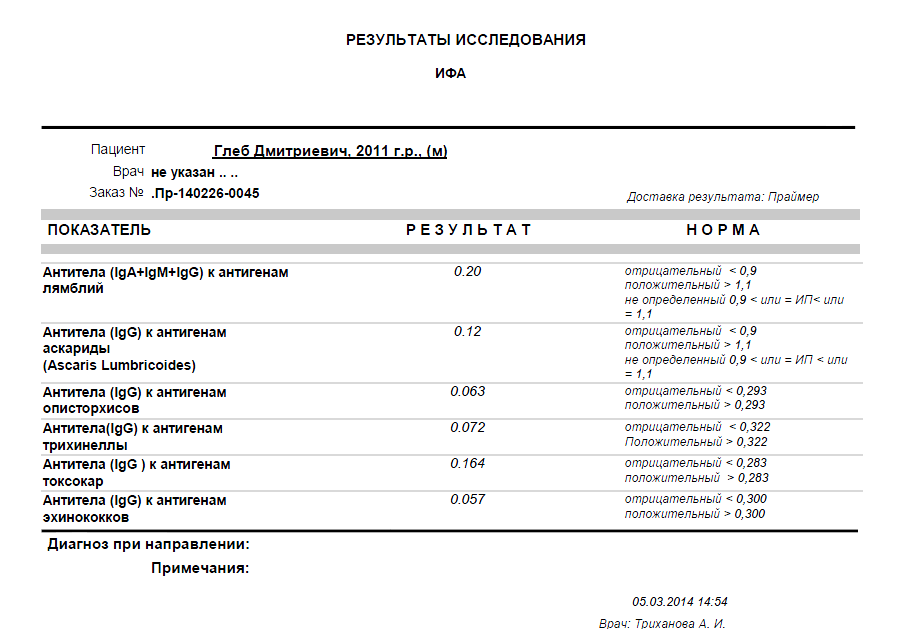
 Это улавливающее устройство можно быстро разместить над унитазом или под попкой ребенка для сбора пробы. Использование улавливающего устройства может предотвратить загрязнение стула водой и грязью. Другой способ собрать образец стула – это накинуть на сиденье унитаза неплотно полиэтиленовую пленку. Затем поместите образец стула в чистый герметичный контейнер, прежде чем отнести его в лабораторию.
Это улавливающее устройство можно быстро разместить над унитазом или под попкой ребенка для сбора пробы. Использование улавливающего устройства может предотвратить загрязнение стула водой и грязью. Другой способ собрать образец стула – это накинуть на сиденье унитаза неплотно полиэтиленовую пленку. Затем поместите образец стула в чистый герметичный контейнер, прежде чем отнести его в лабораторию. Вашего ребенка могут попросить сдать образец стула один или несколько раз. Для достижения наилучших результатов стул следует сразу же доставить в лабораторию. Если это невозможно, стул следует охладить, а затем как можно скорее доставить в лабораторию.
Вашего ребенка могут попросить сдать образец стула один или несколько раз. Для достижения наилучших результатов стул следует сразу же доставить в лабораторию. Если это невозможно, стул следует охладить, а затем как можно скорее доставить в лабораторию.