Болезнь випла: Болезнь Уиппла: обзор литературы и клиническое наблюдение | Куприянова И.Н., Бердников Р.Б., Бозров Р.М.
Болезнь Уиппла | Белов Б.С.
Введение Болезнь Уиппла (БУ) – редкое хроническое системное заболевание инфекционной этиологии. Оно было описано в 1907 г. американским патологом Дж. Х. Уипплом (George Hoit Whipple) при секционном наблюдении 36-летнего больного, врача по профессии, страдавшего в течение 5 лет лихорадкой, артритом, стойким и упорным кашлем, диареей и прогрессирующим похудением. При вскрытии выявлены выраженное увеличение мезентеральных лимфатических узлов и полисерозит. В кишечнике и лимфоузлах обращали на себя внимание множественные отложения липидов и большое число макрофагов с аргирофильными палочкообразными структурами. Дж. Уиппл рассматривал нарушение метаболизма липидов как наиболее вероятную причину болезни и предложил термин «интестинальная липодистрофия», между тем не исключая и инфекционную этиологию заболевания [1].
Болезнь Уиппла (БУ) – редкое хроническое системное заболевание инфекционной этиологии. Оно было описано в 1907 г. американским патологом Дж.
В дальнейшем Дж. Уиппл к данному заболеванию не обращался и занялся разработкой проблем лечения и профилактики пернициозной анемии, за что в 1934 г. получил Нобелевскую премию. Однако его имя до сих пор тесно ассоциируется с описанным им заболеванием – БУ.
Этиология и патогенез
В 1949 г. B. Black-Schaffer показал, что в биоптатах лимфоузлов и тонкого кишечника у пациентов с БУ содержатся PAS (periodic acid Schiff)-позитивные макрофаги, содержащие гликопротеин или мукополисахариды [2]. Через 3 года появилось первое описание успешного применения хлорамфеникола у больного БУ с быстрым обратным развитием клинической симптоматики и патоморфологических признаков. В 1961 г. J. Gardley, T. Hendrix выявили палочкообразные тельца в цитоплазме макрофагов при электронной микроскопии, тем самым подтвердив бактериальную природу заболевания [3]. Но только в работах последних 20 лет [4–6] с помощью метода полимеразной цепной реакции (ПЦР) из инфицированных тканей пациентов была выделена грамположительная бацилла, получившая название Tropheryma whipplei (TW, от греч. trophe – питание, eryma – барьер). По своим филогенетическим данным TW принадлежит к актиномицетам, имеет размеры 0,2х2,0 mм, 3-слойную клеточную стенку, единственную круговую хромосому и небольшой размер генома (925 кД). Предполагается, что патогенными могут быть не все, а строго определенные штаммы возбудителя.
Через 3 года появилось первое описание успешного применения хлорамфеникола у больного БУ с быстрым обратным развитием клинической симптоматики и патоморфологических признаков. В 1961 г. J. Gardley, T. Hendrix выявили палочкообразные тельца в цитоплазме макрофагов при электронной микроскопии, тем самым подтвердив бактериальную природу заболевания [3]. Но только в работах последних 20 лет [4–6] с помощью метода полимеразной цепной реакции (ПЦР) из инфицированных тканей пациентов была выделена грамположительная бацилла, получившая название Tropheryma whipplei (TW, от греч. trophe – питание, eryma – барьер). По своим филогенетическим данным TW принадлежит к актиномицетам, имеет размеры 0,2х2,0 mм, 3-слойную клеточную стенку, единственную круговую хромосому и небольшой размер генома (925 кД). Предполагается, что патогенными могут быть не все, а строго определенные штаммы возбудителя.
TW относится к убиквитарным (повсеместно распространенным) бактериям-комменсалам. Ее выделяют из фекалий здоровых носителей в 1,5–7% случаев, а среди персонала городских очистных сооружений – в 12–25% [7–9]. По данным популяционного исследования, выполненного в Сенегале, этот показатель составил 31,2% [10]. Частота выявления IgG-антител к TW, определенных методом Western blot, среди взрослых здоровых лиц колеблется от 50 до 70% в зависимости от географического региона [10–12].
По данным популяционного исследования, выполненного в Сенегале, этот показатель составил 31,2% [10]. Частота выявления IgG-антител к TW, определенных методом Western blot, среди взрослых здоровых лиц колеблется от 50 до 70% в зависимости от географического региона [10–12].
Первичное инфицирование происходит фекально-оральным путем в раннем детстве и протекает асимптомно или в виде одной из острых форм (рис. 1). При наличии определенного иммунологического дефекта после длительного периода (иногда несколько десятилетий) TW-персистенции развиваются локальные хронические формы или происходит генерализация процесса с классической симптоматикой БУ [14]. Наряду с генерализацией инфекции в патогенезе заболевания большую роль играют иммунологические нарушения, в частности снижение Т-клеточного соотношения СD4/CD8 и экспрессии CD11, уменьшение продукции интерлейкина (ИЛ) -12 и γ-интерферона. Параметры гуморального иммунитета изменяются мало. Предполагаемый иммунологический дефект имеет высокую специфичность по отношению к TW, т.
Таким образом, при сохранной функции фагоцитоза макрофаги теряют способность к лизису TW, а также не отвечают на присутствие микробных антигенов выработкой специфических антител либо данный ответ выражен очень слабо [7]. Последнее, вероятно, связано с гликолизацией антигенных структур возбудителя [16].
Накапливаются данные, свидетельствующие об определенном значении иммуносупрессии в патогенезе БУ. В частности, описано развитие БУ (включая эндокардит) у пациентов, получавших ингибиторы фактора некроза опухоли-α (ФНО-α) по поводу спондилоартропатий и атипично протекавшего ревматоидного артрита [17–21].
Эпидемиология
БУ относится к редким заболеваниям с предполагаемой частотой 0,5–1 случай на 1 млн населения. Мужчины поражаются почти в 8 раз чаще женщин, преимущественно в возрасте 40–49 лет [15]. Наиболее часто заболевают представители белой расы – жители Центральной Европы (55%) и Северной Америки (38%). Единичные случаи болезни описаны среди испанцев, негров, индусов и представителей монголоидной расы. Среди заболевших преобладают жители сельской местности, чаще – фермеры. Имеются сообщения о семейных случаях БУ [11].
Клиническая картина
Мультисистемность поражения при БУ обусловливает чрезвычайную вариабельность клинической симптоматики.
Суставной синдром при БУ – наиболее ранний и очень часто (75%) единственный признак, предшествующий развернутой клинической картине болезни в течение в среднем 6,7 года. Типичный случай поражения суставов был описан Уипплом как «приступообразный артрит, захватывающий различные суставы и вовлекающий почти все суставы, пораженные к этому моменту времени.
 Спондилоартропатии, как правило, сочетаются с периферическим артритом. Возможно развитие одно- или двустороннего сакроилеита с дальнейшим анкилозированием крестцово-подвздошных сочленений. Имеются описания развития дерматомиозита и иных миопатий.
Спондилоартропатии, как правило, сочетаются с периферическим артритом. Возможно развитие одно- или двустороннего сакроилеита с дальнейшим анкилозированием крестцово-подвздошных сочленений. Имеются описания развития дерматомиозита и иных миопатий.В развернутой стадии заболевания примерно в 50% случаев наблюдаются лихорадочный синдром, сопровождающийся ознобом с последующим профузным потоотделением, а также генерализованная лимфаденопатия. Отмечаются сухость кожи и ее диффузная гиперпигментация, преимущественно на открытых участках тела (но не на слизистых!), хейлит, глоссит, ломкость ногтей, алопеция, отеки. Описано развитие пурпуры (без тромбоцитопении).
Желудочно-кишечные расстройства являются классическими признаками заболевания. У 60–85% больных наблюдаются диарея (чаще – стеаторея), сопровождающаяся болью в животе (60–81%), синдром мальабсорбции и прогрессирующая потеря массы тела (79–93%). Это приводит к полигиповитаминозу и разнообразным нарушениям водно-электролитного обмена.
Поражение органов дыхания (плевральный выпот, пневмонит, гранулематозная медиастинальная лимфаденопатия) отмечается в 30–40% случаев.
У 30–55% больных наблюдаются клинические симптомы поражения сердечно-сосудистой системы. Поражается любая из оболочек сердца, однако наиболее часто развивается эндокардит. По данным германских исследователей, TW как причина эндокардита по частоте (6,3%) занимала 4-е место после наиболее широко распространенных возбудителей этой болезни: стрептококков, стафилококков и энтерококков (36,5, 36,5 и 11,8% соответственно) [23]. Выявлен ряд особенностей, присущих TW-эндокардиту, по сравнению с таковыми, вызванными другими возбудителями: отсутствие предшествовавшей клапанной патологии сердца (69%), нормальная температура тела (61–75%), отрицательная гемокультура (100%), позитивные данные Эхо-КГ отмечаются только в 75–79% случаев [24–26]. Описано более 20 случаев эндокардита при БУ без гастроэнтерологической симптоматики [25, 27–29]. Нередко развиваются гипотензия, артериальные эмболии различной локализации и прогрессирующая застойная сердечная недостаточность.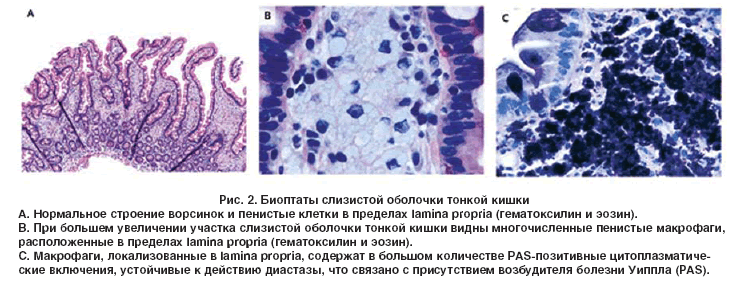
Поражение ЦНС встречается в 10–50% случаев. Неврологическая симптоматика может быть как первым проявлением заболевания, так и развиваться спустя несколько лет на фоне манифестной клинической картины БУ. Наиболее частые симптомы: деменция, супрануклеарная офтальмоплегия и миоклония, которые встречаются в 25–50% случаев среди больных с патологией ЦНС при БУ. Также описаны эпилептические припадки, церебральная атаксия, инсомния. Сочетание медленного плавного конвергентно-дивергентного маятникообразного нистагма с синхронным сокращением жевательных мышц (oculomasticatory myorhytmia) или лицевых мышц (oculofaciosceletal myorhytmia) наблюдается у 20% больных с вовлечением ЦНС и, несмотря на относительную редкость, рассматривается как патогномоничное для БУ [30].

Наиболее распространенными формами поражения глаз при БУ являются увеит и офтальмоплегия. Встречаются диффузный хориоретинит, глаукома, кератит.
В 10–15% случаев выявляют гепатомегалию, спленомегалию, асцит. Патология со стороны мочевыделительной и эндокринной систем встречается крайне редко.
Принимая во внимание возможность изолированного поражения органов или систем (артрит, эндокардит, патология ЦНС и т. д.) без «классических» проявлений БУ, предлагается рассматривать указанные клинические ситуации как отдельные формы хронической TW-инфекции, как упоминалось выше (рис. 1) [13, 32].
Диагностика
С учетом полиморфизма клинических проявлений диагностика БУ весьма часто вызывает существенные трудности. Наибольшие диагностические проблемы возникают у больных с внекишечными формами болезни. По данным отечественных авторов, диагноз БУ устанавливается в среднем спустя 6 лет после первых клинических проявлений [33].
В таблице 2 представлен перечень клинических ситуаций, при которых показано дополнительное обследование для верификации (или исключения) диагноза БУ [15].
Какие-либо специфические изменения лабораторных показателей не наблюдаются. У больных значительно повышены СОЭ, число лейкоцитов и тромбоцитов, уровень СРБ, снижен уровень гемоглобина, железа, кальция, калия, белка, альбуминов, холестерина (как следствие мальабсорбции). Отмечаются положительные результаты функциональных проб с ксилозой, нагрузкой глюкозой и др.
Важная роль в диагностике БУ отводится морфологическому исследованию слизистой оболочки тонкой кишки. При эндоскопии выявляют отек, гиперемию и резкое утолщение складок кишки по причине лимфостаза, а также неровность рельефа слизистой из-за многочисленных желтовато-белых бляшек. При световой микроскопии биоптатов, полученных из тощей и двенадцатиперстной (ДПК) кишок нелеченных больных с БУ, наблюдаются булавовидные ворсинки, содержащие большое количество лимфы. Часто отмечают внутри- и внеклеточное накопление жира в слизистой оболочке тонкой кишки. В собственной пластинке слизистой оболочки наблюдается большое количество пенистых макрофагов, содержащих крупнозернистые цитоплазматические включения с PAS-позитивной реакцией.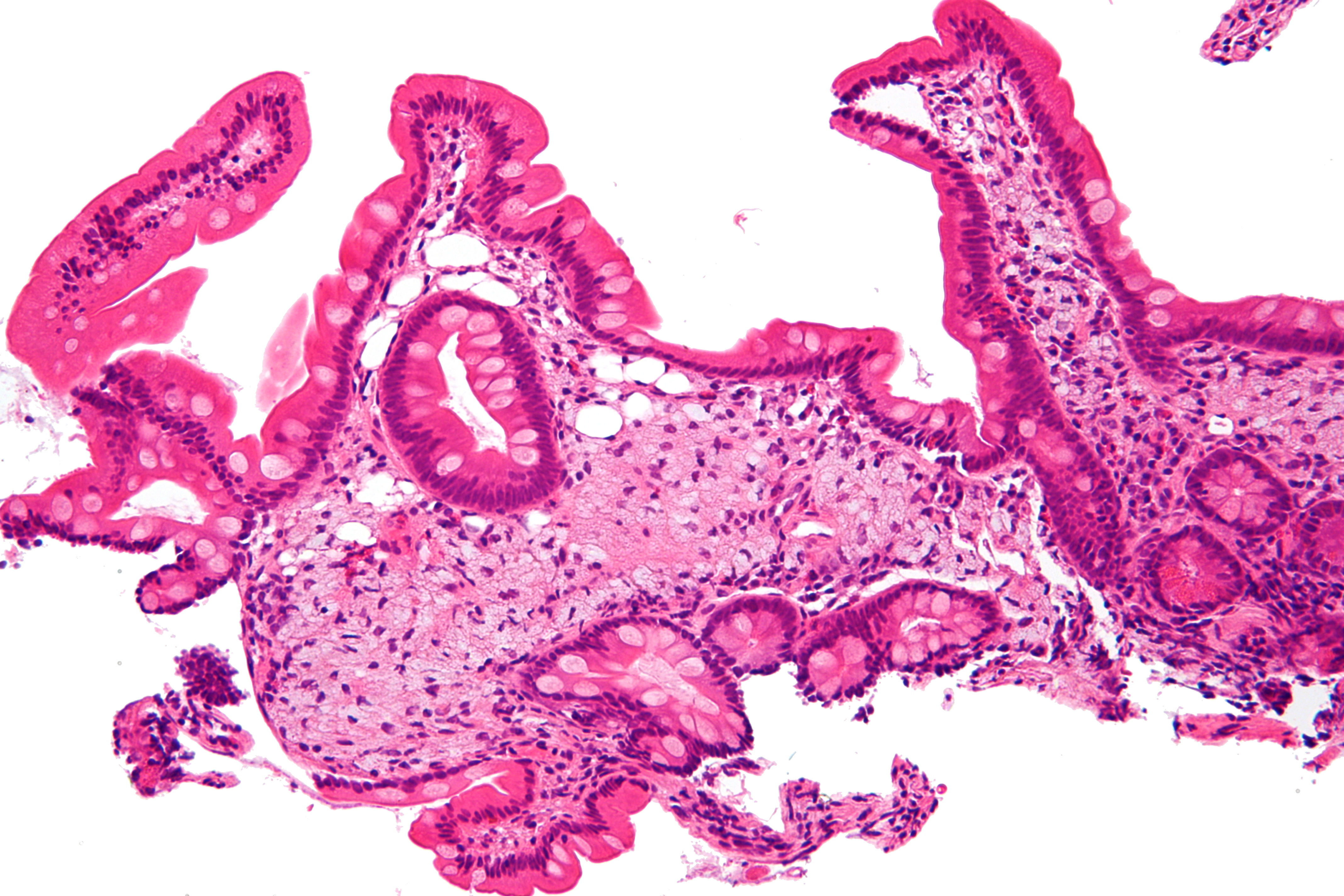 PAS-позитивные макрофаги могут также обнаруживаться в периферических или брыжеечных лимфоузлах, печени, селезенке, сердечных клапанах, мозговой ткани, стекловидном теле и синовиальной оболочке.
PAS-позитивные макрофаги могут также обнаруживаться в периферических или брыжеечных лимфоузлах, печени, селезенке, сердечных клапанах, мозговой ткани, стекловидном теле и синовиальной оболочке.
Считают, что PAS-позитивное вещество – это продукты распада фагоцитированных бактерий. Выявление PAS-позитивных включений в цитоплазме макрофагов не является патогномоничным для БУ (как полагали ранее), а может иметь место при других инфекциях, вызванных комплексом Mycobacterium avium-intracellulare (у ВИЧ-инфицированных больных), коринебактериозе, гистоплазмозе, микозах, саркоидозе. В то же время PAS-реакция имеет чрезвычайно важное дифференциально-диагностическое значение, в частности, при разграничении БУ с первичной (болезнь Вальдмана) и приобретенными лимфангиэктазиями.
Электронная микроскопия позволяет выявить в пораженных тканях палочковидные бактерии, локализующиеся как внутриклеточно, так и в межклеточном пространстве.
Несоблюдение правил проведения биопсии (взятие материала из верхней, а не из нижней части ДПК) и предшествовавшая антимикробная терапия могут повлечь за собой отрицательные результаты патоморфологического исследования даже при характерной для БУ клинической картине.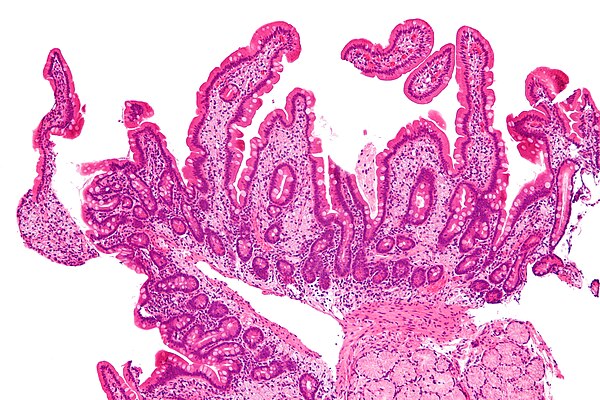 В подобных ситуациях особенно необходимой представляется ПЦР-диагностика. Использование праймеров, комплементарных консервативным участкам рибосомных генов (16S- и 23S-РНК), и дальнейшее определение полной нуклеотидной последовательности (секвенирование) амплифицированной ДНК позволяют с высокой степенью вероятности идентифицировать TW. Для выполнения ПЦР могут быть использованы биоптаты слизистой ДПК, лимфоузлов, сердечных клапанов (удаленных во время кардиохирургической операции), а также пунктаты синовиальной жидкости или ликвора. Несмотря на высокую чувствительность и специфичность ПЦР, существует определенная вероятность получения как ложноположительных, так и ложноотрицательных результатов. Поэтому залогом успешной диагностики БУ (как и любого другого заболевания) является комплексная оценка клинической картины и данных дополнительных исследований.
В подобных ситуациях особенно необходимой представляется ПЦР-диагностика. Использование праймеров, комплементарных консервативным участкам рибосомных генов (16S- и 23S-РНК), и дальнейшее определение полной нуклеотидной последовательности (секвенирование) амплифицированной ДНК позволяют с высокой степенью вероятности идентифицировать TW. Для выполнения ПЦР могут быть использованы биоптаты слизистой ДПК, лимфоузлов, сердечных клапанов (удаленных во время кардиохирургической операции), а также пунктаты синовиальной жидкости или ликвора. Несмотря на высокую чувствительность и специфичность ПЦР, существует определенная вероятность получения как ложноположительных, так и ложноотрицательных результатов. Поэтому залогом успешной диагностики БУ (как и любого другого заболевания) является комплексная оценка клинической картины и данных дополнительных исследований.
Весьма перспективным представляется использование в диагностике БУ метода флуоресцентной гибридизации in situ, позволяющего дифференцировать активную инфекцию от TW-носительства. Однако в настоящее время выполнение данного исследования доступно только в высокоспециализированных лабораториях [14].
Однако в настоящее время выполнение данного исследования доступно только в высокоспециализированных лабораториях [14].
Дифференциальную диагностику БУ проводят с заболеваниями, имеющими сходную клиническую симптоматику (табл. 3). Необходимо заметить, что БУ обязательно должна быть включена в алгоритм диагностического поиска при лихорадке неясного генеза.
Лечение
В доантибиотическую эру БУ заканчивалась летально в 100% наблюдений. Поиски оптимальных схем антибактериальной терапии продолжаются до сегодняшнего дня. К сожалению, редкая встречаемость БУ, а также проблемы, связанные с культурированием TW, служат труднопреодолимым препятствием для проведения рандомизированных клинических исследований.
До 1980-х гг. весьма популярной была комбинация пенициллина и стрептомицина, назначавшаяся в течение 2 нед., с последующим длительным приемом тетрациклина. В дальнейшем было установлено, что основной причиной смерти пациентов, принимавших тетрациклин, были неврологические осложнения, развивавшиеся во время рецидивов.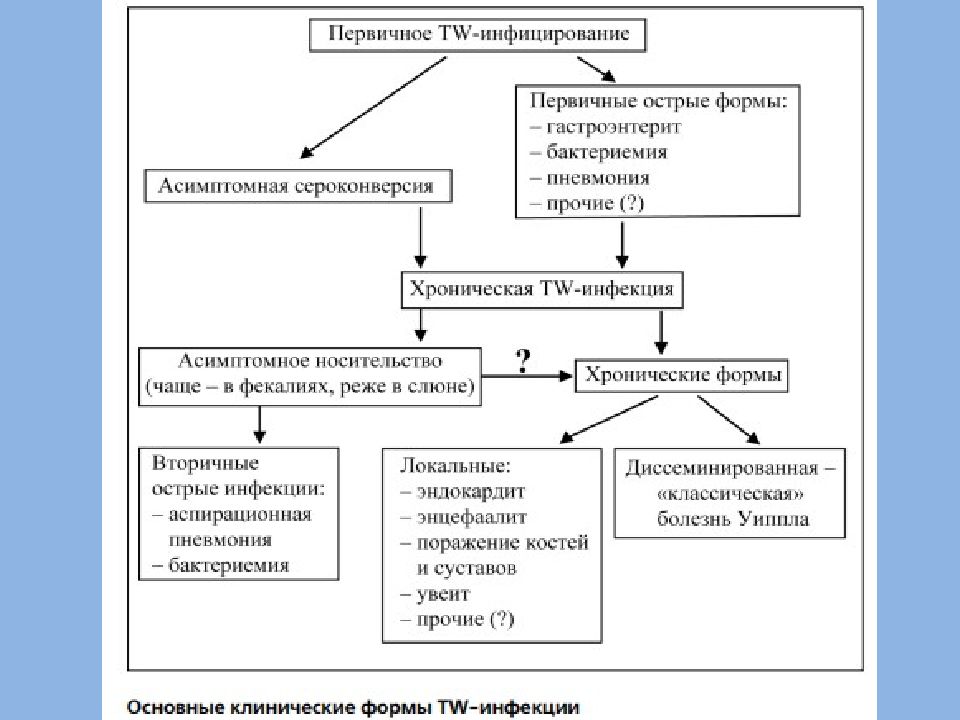 Данное обстоятельство побудило клиницистов к применению ко-тримоксазола – комбинированного препарата, 1 таблетка которого содержит 80 мг триметоприма и 400 мг сульфаметоксазола. Препарат хорошо проникает через гематоэнцефалический барьер и достигает терапевтических концентраций в ликворе даже при неизмененных мозговых оболочках. По сводным данным, объединившим результаты 4-х небольших исследований, минимальная частота рецидивов (4,35%) была среди больных, пролеченных ко-тримоксазолом. В группах пациентов, получавших пенициллин со стрептомицином или тетрациклин, эти показатели составляли 11,8 и 32,2% соответственно [34].
Данное обстоятельство побудило клиницистов к применению ко-тримоксазола – комбинированного препарата, 1 таблетка которого содержит 80 мг триметоприма и 400 мг сульфаметоксазола. Препарат хорошо проникает через гематоэнцефалический барьер и достигает терапевтических концентраций в ликворе даже при неизмененных мозговых оболочках. По сводным данным, объединившим результаты 4-х небольших исследований, минимальная частота рецидивов (4,35%) была среди больных, пролеченных ко-тримоксазолом. В группах пациентов, получавших пенициллин со стрептомицином или тетрациклин, эти показатели составляли 11,8 и 32,2% соответственно [34].
По мнению ряда авторов, лечение следует начинать с 2-недельного парентерального введения бактерицидных антибиотиков, обладающих хорошей пенетрацией в спинномозговую жидкость, с последующим длительным (1–2 года) поддерживающим лечением ко-тримоксазолом. Однако в работах последних лет отмечается нарастание резистентности TW к ко-тримоксазолу. Последнее объясняют мутациями бактериального гена, кодирующего выработку синтетазы, являющейся основной мишенью для сульфаметоксазола [35].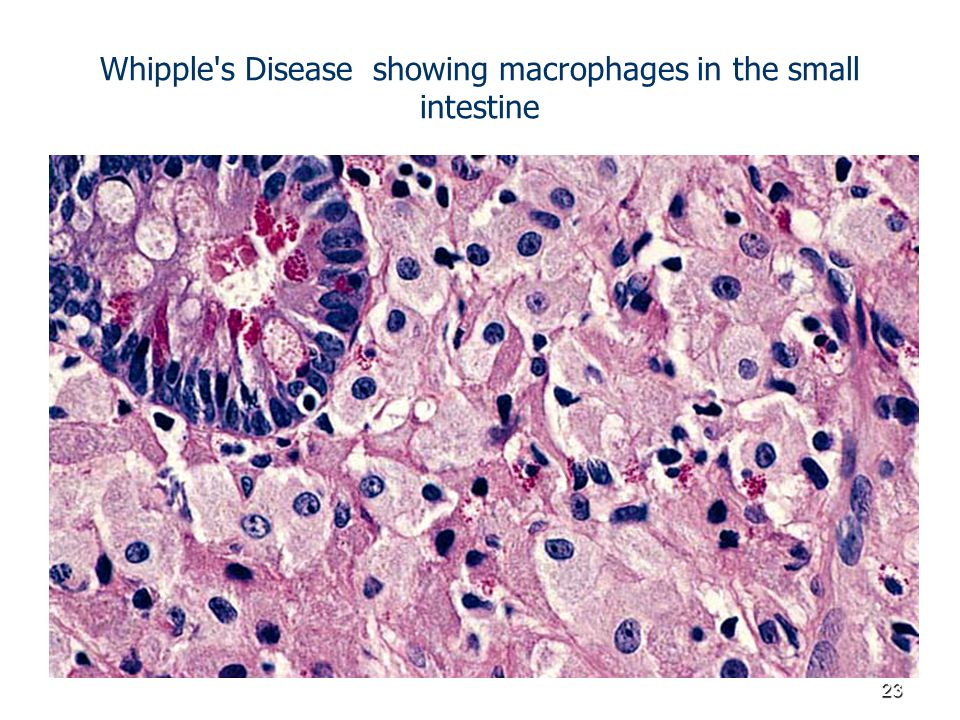 В связи с этим в качестве альтернативы рекомендуется комбинация доксициклина с гидроксихлорохином. Показано, что добавление последнего повышает активность доксициклина in vitro путем увеличения pH в фаголизосомах макрофагов [36]. При наличии неврологической симптоматики к указанной схеме целесообразно добавить сульфадиазин в высоких дозах. Схема лечения БУ представлена в таблице 4.
В связи с этим в качестве альтернативы рекомендуется комбинация доксициклина с гидроксихлорохином. Показано, что добавление последнего повышает активность доксициклина in vitro путем увеличения pH в фаголизосомах макрофагов [36]. При наличии неврологической симптоматики к указанной схеме целесообразно добавить сульфадиазин в высоких дозах. Схема лечения БУ представлена в таблице 4.
Многие авторы отмечают выраженную положительную динамику при своевременно начатой и активной терапии. Так, лихорадка и диарея купируются к концу 1 нед. лечения, суставной синдром полностью регрессирует в течение 1 мес. В эти сроки отмечаются явное улучшение общего самочувствия, прибавка в весе. Обратное развитие неврологической симптоматики происходит значительно медленнее.
Вспомогательное значение имеет применение глюкокортикоидов (преднизолон 30–40 мг/сут с постепенным снижением дозы вплоть до полной отмены).
При необходимости в план лечения включают мероприятия, направленные на ликвидацию последствий синдрома мальабсорбции (коррекция метаболических нарушений, водно-электролитного обмена, восполнение дефицита железа и витаминов и т. д.).
д.).
Длительность антибактериальной терапии должна составлять не менее 1 года. Контроль за лечением осуществляют с помощью повторных морфологических исследований биоптатов тонкого кишечника либо ПЦР-методик. При отсутствии ответа на антибактериальную терапию представляется перспективным применение γ-интерферона.
На фоне проводимой (и первоначально эффективной) антибактериальной терапии в 10% случаев наблюдается развитие синдрома иммунной реконституции. Он более характерен для больных, у которых в качестве первоначальных диагнозов фигурировали анкилозирующий спондилит или ревматоидный артрит, в связи с чем этим пациентам назначали активное иммуносупрессивное лечение, в т. ч. глюкокортикоиды, цитостатики и ингибиторы ФНО-α. Основные проявления данного синдрома включают лихорадку, артрит, плеврит, нодозную эритему, воспалительную орбитопатию, перфорацию кишечника и гипоталамический синдром. В подобных ситуациях после исключения других системных инфекций рекомендуют назначение преднизолона в суточной дозе 1,5 мг/кг массы тела [37].
Прогноз БУ в большинстве случаев благоприятный. При возникновении рецидивов (8–35%) терапия аналогична вышеуказанной.
Наиболее неблагоприятными в прогностическом плане считают неврологические осложнения, возникающие во время рецидивов, как следствие первично нераспознанной локализации инфекции или неадекватной терапии. Вероятность развития рецидивов существует даже при верифицированной эрадикации возбудителя, достигнутой в результате адекватной терапии первого эпизода болезни, что свидетельствует о стойко высокой восприимчивости этих пациентов к системной TW-инфекции. Данное обстоятельство поднимает вопросы пожизненной профилактики БУ с применением доксициклина [13, 38].
Таким образом, БУ представляет собой мультисистемное заболевание с верифицированным инфекционным этиологическим агентом. Обладая широким спектром клинических проявлений, БУ может встретиться в практике врача любой специальности, в т. ч. ревматолога. Дальнейшие исследования должны быть направлены на совершенствование диагностических подходов и разработку тактики лечения этого коварного заболевания.
Литература
1. Whipple G.H. A hitherto undescribed disease characterized anatomically by deposits of fat and fatty acids in the intestinal mesenteric lymphatic issues // John Hopkins Hospital Bulletin. 1907. Vol. 18. Р. 382–391.
2. Black-Schaffer B. The tinctorial demonstration of a glycoprotein in Whipple’s disease // Proc. Soc. Exp. Biol. Med. 1949. Vol. 72. Р. 225–227.
3. Gardley J., Hendrix T.R. Combined electron and light microscopy in Whipple’s disease: demonstration of “bacillary bones” in the intestine. Bull // Johns Hopkins Hosp. 1961. Vol. 10. Р. 80–98.
4. Wilson K.H., Blitchington R., Frothingham R., Wilson J.A. Phylogeny of the Whipple’s disease – associated bacterium // Lancet. 1991. Vol. 338. Р. 474–475.
5. Relman D.A., Schmidt T.M., Mac Dermott R.P., Falkow S. Identification of the uncultured bacillus of the Whipple’s disease // N. Engl. J. Med. 1992. Vol. 327. Р. 293–301.
6. Raoult D.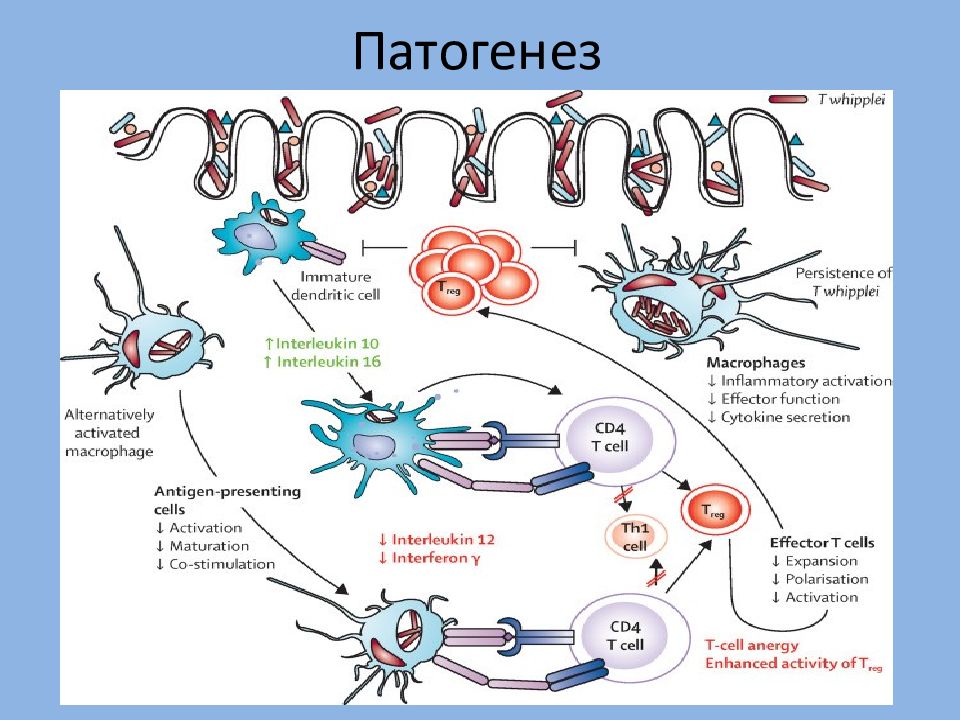 , Birg M.L., La Scola B., Fournier P.E., Enea M., Lepidi H., Roux V., Piette J.C., Vandenesch F., Vital-Durand D., Marrie T.J. Cultivation of the bacillus of Whipple’s disease // N. Engl. J. Med. 2000. Vol. 342. Р. 620–625.
, Birg M.L., La Scola B., Fournier P.E., Enea M., Lepidi H., Roux V., Piette J.C., Vandenesch F., Vital-Durand D., Marrie T.J. Cultivation of the bacillus of Whipple’s disease // N. Engl. J. Med. 2000. Vol. 342. Р. 620–625.
7. Fenollar F., Puéchal X., Raoult D. Whipple’s disease // N Engl J Med. 2007. Vol. 356 (1). Р. 55–66.
8. Schöniger-Hekele M., Petermann D., Weber B., Müller C. Tropheryma whipplei in the environment: survey of sewage plant influxes and sewage plant workers // Appl Environ Microbiol. 2007. Vol. 73 (6). Р. 2033–2035.
9. Fenollar F., Trani M., Davoust B., Salle B., Birg M.L., Rolain J.M., Raoult D. Prevalence of asymptomatic Tropheryma whipplei carriage among humans and nonhuman primates // J Infect Dis. 2008. Vol. 197 (6). Р. 880–887.
10. Keita A.K., Bassene H., Tall A., Sokhna C., Ratmanov P., Trape J.F., Raoult D., Fenollar F. Tropheryma whipplei: a common bacterium in rural Senegal // PLoS Negl Trop Dis. 2011. Vol. 5 (12). Р. 1403.
1403.
11. Fenollar F., Keita A.K., Buffet S., Raoult D. Intrafamilial circulation of Tropheryma whipplei, France // Emerg Infect Dis. 2012. Vol. 18 (6). Р. 949–955.
12. Fenollar F., Amphoux B., Raoult D. A paradoxical Tropheryma whipplei western blot differentiates patients with whipple disease from asymptomatic carriers // Clin Infect Dis. Vol. 49 (5). Р. 717–723.
13. Fenollar F., Lagier J.C., Raoult D. Tropheryma whipplei and Whipple’s disease // J Infect. 2014. Vol. 69 (2). Р. 103–112.
14. Moos V., Schneider T. Changing paradigms in Whipple’s disease and infection with Tropheryma whipplei // Eur J Clin Microbiol Infect Dis. 2011. Vol. 30 (10). Р. 1151–1158.
15. Puéchal X. Whipple’s disease // Ann Rheum Dis. 2013. Vol. 72 (6). Р. 797–803.
16. Bonhomme C.J., Renesto P., Desnues B., Ghigo E., Lepidi H., Fourquet P., Fenollar F., Henrissat B., Mege J.L., Raoult D. Tropheryma whipplei glycosylation in the pathophysiologic profile of Whipple’s disease // J Infect Dis. 2009. Vol. 199 (7). Р. 1043–1052.
2009. Vol. 199 (7). Р. 1043–1052.
17. Sparsa L., Fenollar F., Gossec L., Leone J., Pennaforte J.L., Dougados M., Roux C. [Whipple disease revealed by anti-TNFα therapy] // Rev Med Interne. 2013. Vol. 34 (2). Р. 105–109.
18. Gaddy J.R., Khan Z.Z., Chaser B., Scofield R.H. Whipple’s disease diagnosis following the use of TNF-α blockade // Rheumatology (Oxford). 2012. Vol. 51 (5). Р. 946.
19. Ansemant T., Celard M., Tavernier C., Maillefert J.F., Delahaye F., Ornetti P. Whipple’s disease endocarditis following anti-TNF therapy for atypical rheumatoid arthritis // Joint Bone Spine. 2010. Vol. 77 (6). Р. 622–623.
20. Hoppé E., Masson C., Audran M., Drillon M., Andreu M., Saraux A., Berthelot J.M., Maugars Y., Hmamouchi I., Morel J. Whipple’s disease diagnosed during biological treatment for joint disease // Joint Bone Spine. 2010. Vol. 77 (4). Р. 335–339.
21. Daïen C.I., Cohen J.D., Makinson A., Battistella P., Bilak E.J., Jorgensen C., Reynes J. , Raoult D. Whipple’s endocarditis as a complication of tumour necrosis factor-alpha antagonist treatment in a man with ankylosing spondylitis // Rheumatology (Oxford). 2010. Vol. 49 (8). Р. 1600–1602.
, Raoult D. Whipple’s endocarditis as a complication of tumour necrosis factor-alpha antagonist treatment in a man with ankylosing spondylitis // Rheumatology (Oxford). 2010. Vol. 49 (8). Р. 1600–1602.
22. Meunier M., Puechal X., Hoppé E., Soubrier M., Dieudé P., Berthelot J.M., Caramaschi P., Gottenberg J.E., Gossec L., Morel J., Maury E., Wipff J., Kahan A., Allanore Y. Rheumatic and musculoskeletal features of Whipple disease: a report of 29 cases // J Rheumatol. 2013. Vol. 40 (12). Р. 2061–2066.
23. Geissdörfer W., Moos V., Moter A., Loddenkemper C., Jansen A., Tandler R., Morguet A.J., Fenollar F., Raoult D., Bogdan C., Schneider T. High frequency of Tropheryma whipplei in culture-negative endocarditis // J Clin Microbiol. 2012. Vol. 50 (2). Р. 216–222.
24. Fenollar F., Lepidi H., Raoult D. Whipple’s endocarditis: review of the literature and comparisons with Q fever, bartonella infection, and blood culture-positive endocarditis // Clin Infect Dis. 2001. Vol. 33 (8). Р. 1309–1316.
Vol. 33 (8). Р. 1309–1316.
25. Lagier J.C., Lepidi H., Raoult D., Fenollar F. Systemic Tropheryma whipplei: clinical presentation of 142 patients with infections diagnosed or confirmed in a reference center // Medicine (Baltimore). 2010. Vol. 89 (5). Р. 337–345.
26. Fenollar F, Célard M, Lagier JC, Lepidi H, Fournier PE, Raoult D. Tropheryma whipplei endocarditis // Emerg Infect Dis. 2013. Vol. 19 (11). Р. 1721–1730.
27. Gubler J.G., Kuster M., Dutly F., Bannwart F., Krause M., Vogelin H.P., Garzoli G., Altwegg M. Whipple endocarditis without overt gastrointestinal disease: report of four cases // Ann. Intern. Med. 1999. Vol. 131 (2). Р. 112–116.
28. Richardson D.C., Burrows L.L., Korithoski B. et al. Tropheryma whippelii as a cause of afebrile culture-negative endocarditis: the evolving spectrum of Whipple’s disease // J. Infect. 2003. Vol. 47 (2). Р. 170–173.
29. Chan V., Wang B., Veinot J.P., Suh K.N., Rose G., Desjardins M., Mesana T. G. Tropheryma whipplei aortic valve endocarditis without systemic Whipple’s disease // Int J Infect Dis. 2011. Vol. 15 (11). Р. 804–806.
G. Tropheryma whipplei aortic valve endocarditis without systemic Whipple’s disease // Int J Infect Dis. 2011. Vol. 15 (11). Р. 804–806.
30. Ratnaike R.W. Whipple’s disease. Postgrad // Med. J. 2000. Vol. 76. Р. 760–766.
31. Mohamed W., Neil E., Kupsky W.J., Juhász C., Mittal S., Santhakumar S. Isolated intracranial Whipple’s disease–report of a rare case and review of the literature // J Neurol Sci. 2011. Vol. 308 (1-2). Р. 1–8.
32. Moos V, Loddenkemper C, Schneider T. [Tropheryma whipplei infection. Colonization, self-limiting infection and Whipple’s disease] // Pathologe. 2011. Vol. 32 (5). Р. 362–370.
33. Логинов А.С., Парфенов А.И., Полева Н.И. Болезнь Уиппла: результаты длительного наблюдения // Тер. арх. 1998. № 9. С. 35–41.
34. Misbah S.A., Mapstone N.P. Whipple’s disease revisited // J. Clin. Pathol. 2000. Vol. 53. Р. 750–755.
35. Bakkali N., Fenollar F., Biswas S., Rolain J.M., Raoult D. Acquired resistance to trimethoprim-sulfamethoxazole during Whipple disease and expression of the causative target gene // J Infect Dis. 2008 Jul 1. Vol. 198 (1). Р. 101–108.
2008 Jul 1. Vol. 198 (1). Р. 101–108.
36. Van La M., Barbry P., Raoult D., Renesto P. Molecular basis of Tropheryma whipplei doxycycline susceptibility examined by transcriptional profiling // J Antimicrob Chemother. 2007. Vol. 59 (3). Р. 370–377.
37. Feurle G.E., Moos V., Schinnerling K., Geelhaar A., Allers K., Biagi F., Bläker H., Moter A., Loddenkemper C., Jansen A., Schneider T. The immune reconstitution inflammatory syndrome in whipple disease: a cohort study // Ann Intern Med. 2010. Vol. 153 (11). Р. 710–717.
38. Lagier J.C., Fenollar F., Lepidi H., Raoult D. Evidence of lifetime susceptibility to Tropheryma whipplei in patients with Whipple’s disease // J Antimicrob Chemother. 2011. Vol. 66 (5). Р. 1188–1189.
.
Болезнь Уиппла: описание клинического случая
БУ — болезнь Уиппла
ЛУ — лимфатические узлы
СОТК — слизистая оболочка тонкой кишки
Болезнь Уиппла (БУ) относится к редким заболеваниям. В недавно опубликованном обзоре U. Gunther и соавт. [1] собрали сведения о 191 пациенте с классической клинической картиной болезни. Мы располагаем собственным опытом лечения 9 больных, наблюдавшихся в ЦНИИГ с 1987 г. [2, 3]. В 2007 г. в журнале «Терапевтический архив» опубликована наша статья, приуроченная к 100-летнему юбилею описания Уипплом этой болезни [4].
Gunther и соавт. [1] собрали сведения о 191 пациенте с классической клинической картиной болезни. Мы располагаем собственным опытом лечения 9 больных, наблюдавшихся в ЦНИИГ с 1987 г. [2, 3]. В 2007 г. в журнале «Терапевтический архив» опубликована наша статья, приуроченная к 100-летнему юбилею описания Уипплом этой болезни [4].
БУ — системное заболевание, вызываемое бактерией Tropherymawhippelii. Микроб поселяется в лимфатических сосудах тонкой кишки и других органов, вызывая нарушение их проходимости. В слизистой оболочке тонкой кишки (СОТК) T. whippelii захватывается крупными «пенистыми» клетками — PAS-положительными макрофагами, не способными метаболизировать микроб. В биоптатах тонкой кишки и мезентериальных ЛУ больного находят макрофаги с включениями, содержащими продукты распада бактерий. Из Л.У. T. whippeliiраспространяется в синовиальные оболочки, плевру, перикард, головной мозг и другие органы.
Заболевание начинается постепенно и имеет хроническое течение. Первая стадия заболевания, как правило, проявляется полиартритами, лимфаденопатией, повышением температуры тела, иногда с ознобом и проливными потами. На второй стадии появляются диарея и синдром нарушенного всасывания с потерей массы тела и метаболическими расстройствами. Третья стадия БУ характеризуется кахексией и симптомами поражения центральной нервной системы, органов дыхания, сердца, глаз. Диагноз устанавливают на основании морфологического исследования тонкой кишки, реже — по данным полимеразной цепной реакции. От появления первых симптомов до постановки диагноза обычно проходит 7 лет и более. Поздняя диагностика объясняется незнанием врачами этой редкой болезни.
Первая стадия заболевания, как правило, проявляется полиартритами, лимфаденопатией, повышением температуры тела, иногда с ознобом и проливными потами. На второй стадии появляются диарея и синдром нарушенного всасывания с потерей массы тела и метаболическими расстройствами. Третья стадия БУ характеризуется кахексией и симптомами поражения центральной нервной системы, органов дыхания, сердца, глаз. Диагноз устанавливают на основании морфологического исследования тонкой кишки, реже — по данным полимеразной цепной реакции. От появления первых симптомов до постановки диагноза обычно проходит 7 лет и более. Поздняя диагностика объясняется незнанием врачами этой редкой болезни.
Основу лечения составляет длительная многомесячная антибактериальная терапия доксициклином, цераксоном, ко-тримексазолом и другими препаратами с контрольными биопсиями СОТК [1—5].
Приводим наше наблюдение.
Больная К., 56 лет. Считает себя больной с декабря 2015 г., когда пропал аппетит, быстро нарастали слабость, головокружение, боли в суставах, лихорадка до 38 °C. Вскоре появились поносы до 5—7 раз в сутки, отеки ног, судороги, за 2 мес похудела на 20 кг. В анамнезе мочекаменная болезнь с приступами почечной колики.
Вскоре появились поносы до 5—7 раз в сутки, отеки ног, судороги, за 2 мес похудела на 20 кг. В анамнезе мочекаменная болезнь с приступами почечной колики.
Обследована по месту жительства: при компьютерной томографии и магнитно-резонансной томографии обнаружено увеличение брыжеечных и забрюшинных ЛУ. C предполагаемой лимфомой поступила на лечение в МКНЦ с указанными выше жалобами. Состояние средней степени тяжести, пониженного питания, индекс массы тела 17 кг/м2. Кожные покровы и видимые слизистые оболочки бледные. Отеки ног до бедер. Периферические Л.У. не увеличены. При объективном осмотре патологии опорно-двигательного аппарата, сердца и легких не обнаружено. Язык влажный, не обложен. Передняя брюшная стенка пастозная. Живот при пальпации мягкий, болезненный в эпигастральной области. Печень, селезенка и почки не пальпируется. Симптом Пастернацкого отрицательный. Сознание ясное, полностью ориентирована в пространстве и времени.
В анализе крови отмечались повышение скорости оседания эритроцитов до 52 мм/ч, снижение уровня гемоглобина — 117 г/л, белка —51,3 г/л, альбумина — 27,8 г/л, железа —2,6 ммоль/л, кальция — 1,96 ммоль/л, повышение уровня глюкозы — 6,23 ммоль/л и С-реактивного белка —74,2 мг/л. В моче: относительная плотность 1,015, белок — 0,1 г/л, лейкоциты — 500 мкл, эритроцитов до 100 в п/зр. Эзофагогастродуоденоскопия: слизистая оболочка желудка и двенадцатиперстной кишки бледно-розовая с лимфангиэктазиями. Складки утолщены. При гистологическом исследовании в слизистой оболочке и подслизистом слое двенадцатиперстной кишки обнаружены крупные PAS-положительные макрофаги. Кишечные ворсины с булавовидными расширениями, местами с лимфангиэктазиями (см. рисунок). Заключение: морфологическая картина может соответствовать БУ.
В моче: относительная плотность 1,015, белок — 0,1 г/л, лейкоциты — 500 мкл, эритроцитов до 100 в п/зр. Эзофагогастродуоденоскопия: слизистая оболочка желудка и двенадцатиперстной кишки бледно-розовая с лимфангиэктазиями. Складки утолщены. При гистологическом исследовании в слизистой оболочке и подслизистом слое двенадцатиперстной кишки обнаружены крупные PAS-положительные макрофаги. Кишечные ворсины с булавовидными расширениями, местами с лимфангиэктазиями (см. рисунок). Заключение: морфологическая картина может соответствовать БУ.
Интенсивное окрашивание в PAS-реакции цитоплазматических гранул макрофагов в СОТК при Б.У. Микрофотография, ув. 500.
Энтерография: заполнение петель тонкой кишки неравномерное, ускоренное. Ширина просвета обычная, керкринговы складки утолщены.
Ультразвуковое исследование: левая чашечно-лоханочная система расширена. В верхней трети левого мочеточника определяется камень, размером 0,8 см. В правой почке определяется камень диаметром 9 мм.
Установлен диагноз: болезнь Уиппла с синдромом энтеропатии с потерей белка. Мочекаменная болезнь с приступами почечной колики.
Больной в урологическом отделении выполнены лазерная контактная уретеролитотрипсия и стентирование верхних мочевых путей слева с рекомендацией удалить мочеточниковый стент через 3 нед. Больной назначена безжировая диета и антибактериальная терапия: ко-тримексазол 2 г/сут. Наступило улучшение, однако в биоптатах СОТК, полученных через 1 мес, оставалось большое количество РAS-положительных макрофагов. После удаления стента больная выписана с рекомендацией продолжить лечение антибиотиками под наблюдением специалистов поликлиники и МКНЦ.
Таким образом, у больной установлена типичная БУ с увеличением забрюшинных и брыжеечных ЛУ и синдромом энтеропатии с потерей белка. Правильную диагностику обеспечило обязательное следование алгоритму обследования пациентов с хронической диареей и синдромом нарушенного всасывания, применяемому в МКНЦ [6]. Больной выполнена множественная биопсия СОТК (двенадцатиперстной кишки 3—5 фрагментов) с обязательной постановкой PAS-реакции, на основании которой и установлен диагноз спустя 4 мес после появления первых симптомов болезни и быстрого прогрессирования симптомов энтеропатии с потерей белка.
Больной выполнена множественная биопсия СОТК (двенадцатиперстной кишки 3—5 фрагментов) с обязательной постановкой PAS-реакции, на основании которой и установлен диагноз спустя 4 мес после появления первых симптомов болезни и быстрого прогрессирования симптомов энтеропатии с потерей белка.
Заслуживает обсуждения и мочекаменная болезнь, обусловившая необходимость хирургического вмешательства. Образование камней в почках — одно из возможных проявлений Б.У. Причиной развития мочекаменной болезни служит нарушение всасывания жирных кислот с длинной углеродной цепью вследствие тромбирования лимфатических сосудов кишки макрофагами, содержащими бактерии T. whippelii. Невсосавшиеся жирные кислоты легко соединяются с кальцием, образуют неабсорбируемые мыла и выделяются с калом. В результате оксалаты, в норме образующие с кальцием нерастворимые соли, в большом количестве всасываются. Развивается гипероксалурия с образованием оксалатных камней.
Наконец, обращает внимание длительное поражение СОТК у больной, несмотря на продолжающуюся антибактериальную терапию. При этом улучшение состояния наступило уже на протяжении 1-го месяца лечения: исчезли лихорадка, диарея, появился аппетит, нормализовались показатели крови. Наличие PAS-положительных макрофагов в СОТК подтверждает необходимость длительного лечения антибиотиками до полного исчезновения патогистологических признаков болезни.
При этом улучшение состояния наступило уже на протяжении 1-го месяца лечения: исчезли лихорадка, диарея, появился аппетит, нормализовались показатели крови. Наличие PAS-положительных макрофагов в СОТК подтверждает необходимость длительного лечения антибиотиками до полного исчезновения патогистологических признаков болезни.
Конфликт интересов отсутствует .
Болезнь Уиппла | Белов | Современная ревматология
1. <div><p>Whipple G.H. A hitherto undescribed disease characterized anatomically by deposits of fat and fatty acids in the intestinal mesenteric lymphatic issues. Johns Hopkins Hosp Bull 1907;18:382-91.</p><p>Black-Schaffer B. The tinctorial demonstration of a glycoprotein in Whipple’s disease. Proc Soc Exp Biol Med 1949;72:225-7.</p><p>Gardley J., Hendrix T.R. Combined electron and light microscopy in Whipple’s disease: demonstration of “bacillary bones” in the intestine. Bull Johns Hopkins Hosp 1961;10:80-98.</p><p>Wilson K.H., Blitchington R., Frothingham R., Wilson J.A. Phylogeny of the Whipple’s disease — associated bacterium. Lancet 1991;338:474-5.</p><p>Relman D.A., Schmidt T.M., Mac Dermott R.P., Falkow S. Identification of the uncul tured bacillus of the Whipple’s disease. N Engl J Med 1992;327:293-301.</p><p>Raoult D., Birg M.L., La Scola B. et al. Cultivation of the bacillus of Whipple’s disease. N Engl J Med 2000;342:620-5.</p><p>Fenollar F., Puechal X., Raoult D. Whipple’s disease. N Engl J Med 2007;356(1):55-66.</p><p>Schöniger-Hekele M., Petermann D., Weber B., Müller C. Tropheryma whipplei in the environment: survey of sewage plant influxes and sewage plant workers. Appl Environ Microbiol 2007;73(6):2033-5.</p><p>Fenollar F., Trani M., Davoust B. et al. Prevalence of asymptomatic Tropheryma whipplei carriage among humans and nonhuman primates. J Infect Dis 2008;197(6):880-7.
Bull Johns Hopkins Hosp 1961;10:80-98.</p><p>Wilson K.H., Blitchington R., Frothingham R., Wilson J.A. Phylogeny of the Whipple’s disease — associated bacterium. Lancet 1991;338:474-5.</p><p>Relman D.A., Schmidt T.M., Mac Dermott R.P., Falkow S. Identification of the uncul tured bacillus of the Whipple’s disease. N Engl J Med 1992;327:293-301.</p><p>Raoult D., Birg M.L., La Scola B. et al. Cultivation of the bacillus of Whipple’s disease. N Engl J Med 2000;342:620-5.</p><p>Fenollar F., Puechal X., Raoult D. Whipple’s disease. N Engl J Med 2007;356(1):55-66.</p><p>Schöniger-Hekele M., Petermann D., Weber B., Müller C. Tropheryma whipplei in the environment: survey of sewage plant influxes and sewage plant workers. Appl Environ Microbiol 2007;73(6):2033-5.</p><p>Fenollar F., Trani M., Davoust B. et al. Prevalence of asymptomatic Tropheryma whipplei carriage among humans and nonhuman primates. J Infect Dis 2008;197(6):880-7. </p><p>Keita A.K., Bassene H., Tall A. et al. Tropheryma whipplei: a common bacterium in rural Senegal. PLoS Negl Trop Dis 2011;5(12):e1403.</p><p>Fenollar F., Keita A.K., Buffet S., Raoult D. Intrafamilial circulation of Tropheryma whipplei, France. Emerg Infect Dis 2012;18(6):949-55.</p><p>Moos V., Schneider T. Changing paradigms in Whipple’s disease and infection with Tropheryma whipplei. Eur J Clin Microbiol Infect Dis 2011;30(10):1151-8.</p><p>Puechal X. Whipple’s disease. Ann Rheum Dis. Published online: 2013 Jan 3 URL: http:ard.bmj.com/content/early/2013/01/037a nnrheumdis-2012-202684.full</p><p>Bonhomme C.J., Renesto P., Desnues B. et al. Tropheryma whipplei glycosylation in the pathophysiologic profile of Whipple’s disease. J Infect Dis 2009;199(7):1043-52.</p><p>Sparsa L., Fenollar F., Gossec L. et al. Whipple disease revealed by anti-TNFa therapy. Rev Med Int 2013;34(2):105-9.</p><p>Gaddy J.R.
</p><p>Keita A.K., Bassene H., Tall A. et al. Tropheryma whipplei: a common bacterium in rural Senegal. PLoS Negl Trop Dis 2011;5(12):e1403.</p><p>Fenollar F., Keita A.K., Buffet S., Raoult D. Intrafamilial circulation of Tropheryma whipplei, France. Emerg Infect Dis 2012;18(6):949-55.</p><p>Moos V., Schneider T. Changing paradigms in Whipple’s disease and infection with Tropheryma whipplei. Eur J Clin Microbiol Infect Dis 2011;30(10):1151-8.</p><p>Puechal X. Whipple’s disease. Ann Rheum Dis. Published online: 2013 Jan 3 URL: http:ard.bmj.com/content/early/2013/01/037a nnrheumdis-2012-202684.full</p><p>Bonhomme C.J., Renesto P., Desnues B. et al. Tropheryma whipplei glycosylation in the pathophysiologic profile of Whipple’s disease. J Infect Dis 2009;199(7):1043-52.</p><p>Sparsa L., Fenollar F., Gossec L. et al. Whipple disease revealed by anti-TNFa therapy. Rev Med Int 2013;34(2):105-9.</p><p>Gaddy J.R. , Khan Z.Z., Chaser B., Scofield R.H. Whipple’s disease diagnosis following the use of TNF-a blockade. Rheumatology (Oxford). 2012;51(5):946.</p><p>Ansemant T., Celard M., Tavernier C. et al. Whipple’s disease endocarditis following anti-TNF therapy for atypical rheumatoid arthritis. J Bone Spine 2010;77(6):622-3.</p><p>Hoppe E., Masson C., Audran M. et al. Whipple’s disease diagnosed during biological treatment for joint disease. J Bone Spine 2010;77(4):335-9.</p><p>Daien C.I., Cohen J.D., Makinson A. et al. Whipple’s endocarditis as a complication of tumour necrosis factor-alpha antagonist treatment in a man with ankylosing spondylitis. Rheumatology (Oxford) 2010;49(8):1600-2.</p><p>Marth T., Raoult D. Whipple’s disease. Lancet 2003;361:239-46.</p><p>Ayoub W.T., Davis D.E., Torreri D., Viozzi F.J. Bone destruction and ankylosis in Whipple’s disease. J Rheum 1982;9:930-1.</p><p>Puechal X. Whipple’s disease. J Bone Spine 2002;68:133-40.
, Khan Z.Z., Chaser B., Scofield R.H. Whipple’s disease diagnosis following the use of TNF-a blockade. Rheumatology (Oxford). 2012;51(5):946.</p><p>Ansemant T., Celard M., Tavernier C. et al. Whipple’s disease endocarditis following anti-TNF therapy for atypical rheumatoid arthritis. J Bone Spine 2010;77(6):622-3.</p><p>Hoppe E., Masson C., Audran M. et al. Whipple’s disease diagnosed during biological treatment for joint disease. J Bone Spine 2010;77(4):335-9.</p><p>Daien C.I., Cohen J.D., Makinson A. et al. Whipple’s endocarditis as a complication of tumour necrosis factor-alpha antagonist treatment in a man with ankylosing spondylitis. Rheumatology (Oxford) 2010;49(8):1600-2.</p><p>Marth T., Raoult D. Whipple’s disease. Lancet 2003;361:239-46.</p><p>Ayoub W.T., Davis D.E., Torreri D., Viozzi F.J. Bone destruction and ankylosis in Whipple’s disease. J Rheum 1982;9:930-1.</p><p>Puechal X. Whipple’s disease. J Bone Spine 2002;68:133-40. </p><p>Geissdörfer W., Moos V., Moter A. et al. High frequency of Tropheryma whipplei in culture-negative endocarditis. J Clin Microbiol 2012;50(2):216-22.</p><p>Fenollar F., Lepidi H., Raoult D. Whipple’s endocarditis: review of the literature and comparisons with Q fever, bartonella infection, and blood culture-positive endocarditis. Clin Infect Dis 2001;33(8):1309—16.</p><p>Lagier J.C., Lepidi H., Raoult D., Fenollar F. Systemic Tropheryma whipplei: clinical presentation of 142 patients with infections diagnosed or confirmed in a reference center. Medicine (Baltimore) 2010;89(5):337-45.</p><p>Gubler J.G., Kuster M., Dutly F. et al. Whipple endocarditis without overt gastrointestinal disease: report of four cases. Ann Int Med.1999;131(2):112-6.</p><p>Richardson D.C., Burrows L.L., Korithoski B. et al. Tropheryma whipplei as a cause of afebrile culture-negative endocarditis: the evolving spectrum of Whipple’s disease. J Infect 2003;47(2):170-3.
</p><p>Geissdörfer W., Moos V., Moter A. et al. High frequency of Tropheryma whipplei in culture-negative endocarditis. J Clin Microbiol 2012;50(2):216-22.</p><p>Fenollar F., Lepidi H., Raoult D. Whipple’s endocarditis: review of the literature and comparisons with Q fever, bartonella infection, and blood culture-positive endocarditis. Clin Infect Dis 2001;33(8):1309—16.</p><p>Lagier J.C., Lepidi H., Raoult D., Fenollar F. Systemic Tropheryma whipplei: clinical presentation of 142 patients with infections diagnosed or confirmed in a reference center. Medicine (Baltimore) 2010;89(5):337-45.</p><p>Gubler J.G., Kuster M., Dutly F. et al. Whipple endocarditis without overt gastrointestinal disease: report of four cases. Ann Int Med.1999;131(2):112-6.</p><p>Richardson D.C., Burrows L.L., Korithoski B. et al. Tropheryma whipplei as a cause of afebrile culture-negative endocarditis: the evolving spectrum of Whipple’s disease. J Infect 2003;47(2):170-3. </p><p>Chan V., Wang B., Veinot J.P. et al. Tropheryma whipplei aortic valve endocarditis without systemic Whipple’s disease. Int J Infect Dis 2011;15(11):e804-6.</p><p>Ratnaike R.W. Whipple’s disease. Postgrad Med J 2000;76:760-6.</p><p>Mohamed W., Neil E., Kupsky W.J. et al. Isolated intracranial Whipple’s disease -report of a rare case and review of the literature. J Neurol Sci 2011;308(1—2):1—8.</p><p>Moos V., Loddenkemper C., Schneider T. Tropheryma whipplei infection. Colonization, self-limiting infection and Whipple’s disease. Pathologe 2011;32(5):362-70.</p><p>Логинов А.С., Парфенов А.И., Полева Н.И. Болезнь Уиппла: результаты длительного наблюдения. Тер арх 1998;9:35-41.</p><p>Misbah S.A., Mapstone N.P. Whipple’s disease revisited. J Clin Pathol 2000;53:750-5.</p><p>Feurle G.E., Junga N.S., Marth T. Efficacy of ceftriaxone or meropenem as initial therapies in Whipple’s disease. Gastroenterology 2010;138(2):478—86.
</p><p>Chan V., Wang B., Veinot J.P. et al. Tropheryma whipplei aortic valve endocarditis without systemic Whipple’s disease. Int J Infect Dis 2011;15(11):e804-6.</p><p>Ratnaike R.W. Whipple’s disease. Postgrad Med J 2000;76:760-6.</p><p>Mohamed W., Neil E., Kupsky W.J. et al. Isolated intracranial Whipple’s disease -report of a rare case and review of the literature. J Neurol Sci 2011;308(1—2):1—8.</p><p>Moos V., Loddenkemper C., Schneider T. Tropheryma whipplei infection. Colonization, self-limiting infection and Whipple’s disease. Pathologe 2011;32(5):362-70.</p><p>Логинов А.С., Парфенов А.И., Полева Н.И. Болезнь Уиппла: результаты длительного наблюдения. Тер арх 1998;9:35-41.</p><p>Misbah S.A., Mapstone N.P. Whipple’s disease revisited. J Clin Pathol 2000;53:750-5.</p><p>Feurle G.E., Junga N.S., Marth T. Efficacy of ceftriaxone or meropenem as initial therapies in Whipple’s disease. Gastroenterology 2010;138(2):478—86. </p><p>Marth T., Schneider T. Whipple’s disease. In: Mandel, Douglas and Bennet’s principles and practice of infectious diseases. Elsevier, 2010;1435—41.</p><p>Van La M., Barbry P., Raoult D., Renesto P. Molecular basis of Tropheryma whipplei doxycycline susceptibility examined by transcriptional profiling. J Antimicrob Chemother 2007;59(3):370-7.</p><p>Feurle G.E., Moos V., Schnnerling K. et al. The immune reconstitution inflammatory syndrome in whipple disease: a cohort study. Ann Int Med 2010;153(11):710-7.</p><p>Lagier J.C., Fenollar F., Lepidi H., Raoult D. Evidence of lifetime susceptibility to Tropheryma whipplei in patients with Whipple’s disease. J Antimicrob Chemother 2011;66(5):1188-9.</p></div><br />
</p><p>Marth T., Schneider T. Whipple’s disease. In: Mandel, Douglas and Bennet’s principles and practice of infectious diseases. Elsevier, 2010;1435—41.</p><p>Van La M., Barbry P., Raoult D., Renesto P. Molecular basis of Tropheryma whipplei doxycycline susceptibility examined by transcriptional profiling. J Antimicrob Chemother 2007;59(3):370-7.</p><p>Feurle G.E., Moos V., Schnnerling K. et al. The immune reconstitution inflammatory syndrome in whipple disease: a cohort study. Ann Int Med 2010;153(11):710-7.</p><p>Lagier J.C., Fenollar F., Lepidi H., Raoult D. Evidence of lifetime susceptibility to Tropheryma whipplei in patients with Whipple’s disease. J Antimicrob Chemother 2011;66(5):1188-9.</p></div><br />
Случай 13-летнего наблюдения пациента, страдающего болезнью Уиппла | Жиляев
1. Григорьев П.Я., Яковенко А.В. Клиническая гастроэнтерология. М.: МИА, 2001:435-437.
Григорьев П.Я., Яковенко А.В. Клиническая гастроэнтерология. М.: МИА, 2001:435-437.
2. Парфенов А.И. Болезни кишечника: Рук-во для врачей. М.: Медицина, 2000. 613 с.
3. Ткаченко Е.И., Лисовский В.А. Ошибки в гастроэнтерологии. М.: Бином, 2002:342–364.
4. Рациональная фармакотерапия заболеваний органов пищеварения. Под ред. В.Т. Ивашкина. М.: Литтерра, 2003:474-477.
5. Irving E.J., Hunt R.H. Evidence- based gastroenterology. Ontario, 2001. 350 р.
6. Lange U., Teichman J. Whipple arthritis diagnosis by molecular analysis of synovial fluid – current status of diagnosis and therapy. Rheumatology. 2003;42:473-480.
7. Feurle G., Dorken B., Shopf E. et al. HLA-B27 and defects in the T-cell system in Whipple, s disease. Eur J Clin Invest. 1979;9:385-389.
8. Torres D.M., Harrison S.A. Sleisenger and Fordtran’s Gastrointestinal and Liver Disease: Pathophysiology, Diagnosis, Management. Edited by M. Feldman, L.S. Friedman, L.J. Brandt. 10th ed. 2015.
9. Desnues B., Lepidi H., Raoult D. et al. Whipple’s disease: intestinal infiltrating cells exhibit a transportional pattern of M2/alternatively activated macrophages. J Infect Dis. 2005;192:1642-1646.
10. Benoit M., Fenollar F., Raoult D. et al. Increased levels of circulating IL-16 and in Whipples disease. J Immunol. 2005;175:4575- 4582.
Болезнь Уиппла | Симптомы | Диагностика | Лечение
Болезнь Уиппла представляет собой заболевание, которое поражает тонкую кишку и другие внутренние органы. В таком случае болезнетворные бациллы скапливаются в тонкокишечной слизистой, что является причиной всасывания в кровь расщепленных пищеварительными ферментами питательных веществ.
В таком случае болезнетворные бациллы скапливаются в тонкокишечной слизистой, что является причиной всасывания в кровь расщепленных пищеварительными ферментами питательных веществ.
Основная группа риска при таком заболевании – мужчины в возрасте 50 лет и старше. При этом в последнее время недуг встречается и у молодых людей.
- период внекишечных проявлений;
- период нарушения всасывания в кишке;
- стадия полиорганных проявлений.
Причины
Болезнь Уиппла развивается при проникновении в организм и накоплении бацилл Tropheryma whippelii, которые поражают слизистую оболочку тонкой кишки, при этом инфекция может распространяться и на другие органы (к примеру, мозг, сердце, глаза, суставы и т.д.).
Симптомы болезни Уиппла
Симптомы болезни Уиппла выражаются так:
Если Вы обнаружили у себя схожие симптомы, незамедлительно обратитесь к врачу. Легче предупредить болезнь, чем бороться с последствиями.
Диагностика
Диагностику болезни Уиппла проводит врач – гастроэнтеролог. Осмотр при подозрении на болезнь Уиппла может включать в себя:
Осмотр при подозрении на болезнь Уиппла может включать в себя:
Полноценную диагностику можно пройти в любом современном гастроэнтерологическом центре.
Лечение болезни Уиппла
Лечение болезни Уиппла требует длительной терапии – не менее года. Основные методики сводится к таким мероприятиям:
- высокобелковая диета с ограничением жиров;
- курс приема антибиотиков;
- курс приема антимикробных средств;
- гормональная терапия;
- прием препаратов кальция, магния, железа и калия;
- витаминная терапия (витамины D, A, B).
Опасность
При отсутствии своевременного лечения болезнь Уиппла может привести к серьезным нарушениям жизнедеятельности организма, на фоне которых может произойти летальный исход. В случае отсутствия терапии и при наличии симптоматики пациент погибает уже на второй стадии этого заболевания.
Профилактика
Профилактика сводится к таким мероприятиям:
Данная статья размещена исключительно в познавательных целях и не является научным материалом или профессиональным медицинским советом..jpg)
Болезнь Уиппла | Белов | Антибиотики и Химиотерапия
1. Whipple G.H. A hitherto undescribed disease characterized anatomically by deposits of fat and fatty acids in the intestinal mesenteric lymphatic issues. John Hopkins Hospital Bulletin 1907; 18: 382-391.
2. Black-Schaffer B. The tinctorial demonstration of a glycoprotein in Whipple’s disease. Proc Soc Exp Biol Med 1949; 72: 225-227.
3. Gardley J., Hendrix T.R. Combined electron and light microscopy in Whipple’s disease: demonstration of «bacillary bones» in the intestine. Bull Johns Hopkins Hosp 1961; 10: 80-98.
4. Wilson K.H., Blitchington R., Frothingham R., Wilson J.A. Phylogeny of the Whipple’s disease – associated bacterium. Lancet 1991; 338: 474-475.
Lancet 1991; 338: 474-475.
5. Relman D.A., Schmidt T.M., Mac Dermott R.P., Falkow S. Identification of the uncultured bacillus of the Whipple’s disease. New Engl J Med 1992; 327: 293-301.
6. Raoult D., Birg M.L., La Scola B. et al. Cultivation of the bacillus of Whipple’s disease. New Engl J Med 2000; 342: 620-625.
7. Dolmans R.A., Boel C.H., Lacle M.M., Kusters J.G. Clinical Manifestations, Treatment, and Diagnosis of Tropheryma whipplei Infections. Clin Microbiol Rev 2017; 30 (2): 529-555.
8. Rollin D.C., Paddock C.D., Pritt B.S. et al. Genotypic analysis of Tropheryma whipplei from patients with Whipple disease in the Americas. J Clin Pathol 2017; 70 (10): 891-895.
9. Fenollar F., Puechal X., Raoult D. Whipple’s disease New Engl J Med 2007; 356 (1): 55-66.
Fenollar F., Puechal X., Raoult D. Whipple’s disease New Engl J Med 2007; 356 (1): 55-66.
10. Schöniger-Hekele M., Petermann D., Weber B., Müller C. Tropheryma whipplei in the environment: survey of sewage plant influxes and sewage plant workers.Appl Environ Microbiol 2007; 73 (6): 2033-2035.
11. Fenollar F., Trani M., Davoust B. et al. Prevalence of asymptomatic Tropheryma whipplei carriage among humans and nonhuman primates. J Infect Dis 2008; 197 (6): 880-887.
12. Keita A.K., Bassene H., Tall A. et al. Tropheryma whipplei: a common bacterium in rural Senegal. PLoS Negl Trop Dis 2011; 5 (12): e1403.
13. Fenollar F., Keita A.K., Buffet S., Raoult D. Intrafamilial circulation of Tropheryma whipplei, France. Emerg Infect Dis 2012; 18 (6): 949-955.
Emerg Infect Dis 2012; 18 (6): 949-955.
14. Fenollar F., Amphoux B., Raoult D. A paradoxical Tropheryma whipplei western blot differentiates patients with whipple disease from asymptomatic carriers. Clin Infect Dis 2009; 49 (5): 717-723.
15. Lagier J.C., Fenollar F., Raoult D. Acute infections caused by Tropheryma whipplei. Future Microbiol 2017; 12: 247-254.
16. Moos V., Schneider T. Changing paradigms in Whipple’s disease and infection with Tropheryma whipplei. Eur J Clin Microbiol Infect Dis 2011; 30 (10): 1151-1158.
17. Pudchal X. Whipple’s disease. Ann Rheum Dis 2013; 72 (6): 797-803.
18. Bonhomme C.J., Renesto P., Desnues B. et al. Tropheryma whipplei glycosylation in the pathophysiologic profile of Whipple’s disease. J Infect Dis 2009; 199 (7): 1043-1052.
Bonhomme C.J., Renesto P., Desnues B. et al. Tropheryma whipplei glycosylation in the pathophysiologic profile of Whipple’s disease. J Infect Dis 2009; 199 (7): 1043-1052.
19. Marth T. Systematic review: Whipple’s disease (Tropheryma whipplei infection) and its unmasking by tumour necrosis factor inhibitors. Aliment Pharmacol Ther 2015; 41 (8): 709-724.
20. Glaser C., Rieg S., Wiech T. et al. Whipple’s disease mimicking rheumatoid arthritis can cause misdiagnosis and treatment failure. Orphanet J Rare Dis 2017; 12 (1): 99.
21. Geissderfer W., Moos V., Moter A. et al. High frequency of Tropheryma whipplei in culture-negative endocarditis. J Clin Microbiol 2012; 50 (2): 216-222.
22. Fenollar F., C?lard M., Lagier J.C. et al. Tropheryma whipplei endocarditis. Emerg Infect Dis 2013; 19 (11): 1721-1730.
Fenollar F., C?lard M., Lagier J.C. et al. Tropheryma whipplei endocarditis. Emerg Infect Dis 2013; 19 (11): 1721-1730.
23. Lagier J.C., Lepidi H., Raoult D., Fenollar F. Systemic Tropheryma whipplei: clinical presentation of 142 patients with infections diagnosed or confirmed in a reference center. Medicine (Baltimore) 2010; 89 (5): 337-345.
24. El-Abassi R., Soliman M.Y., Williams F., England J.D. Whipple’s disease. J Neurol Sci 2017; 377: 197-206.
25. Fenollar F., Lagier J.C., Raoult D. Tropheryma whipplei and Whipple’s disease. J Infect. 2014; 69 (2): 103-112.
26. Marth T. Tropheryma whipplei, Immunosuppression and Whipple’s Disease: From a Low-Pathogenic, Environmental Infectious Organism to a Rare, Multifaceted Inflammatory Complex. Dig Dis 2015; 33 (2): 190-199.
Dig Dis 2015; 33 (2): 190-199.
27. Marth T., Moos V., Müller C. et al. Tropheryma whipplei infection and Whipple’s disease. Lancet Infect Dis 2016 Mar; 16 (3): e13-22.
28. Pudchal X. Whipple’s arthritis. Joint Bone Spine 2016 Dec; 83 (6): 631-635.
29. Логинов A.C., Парфенов A.И., Полева Н.И. Болезнь Уиппла: результаты длительного наблюдения. Тер арх 1998; 9: 35-41.
30. Günther U., Moos V., Offenmüller G. et al. Gastrointestinal diagnosis of classical Whipple disease: clinical, endoscopic, and histopathologic features in 191 patients. Medicine (Baltimore) 2015; 94 (15): e714.
31. Hujoel I.A., Johnson D. H., Lebwohl B. et al. Tropheryma whipplei Infection (Whipple Disease) in the USA. Dig Dis Sci 2018 Mar 23. doi: 10.1007/s10620-018-5033-4.
H., Lebwohl B. et al. Tropheryma whipplei Infection (Whipple Disease) in the USA. Dig Dis Sci 2018 Mar 23. doi: 10.1007/s10620-018-5033-4.
32. Misbah S.A., Mapstone N.P. Whipple’s disease revisited. J Clin Pathol 2000; 53: 750-755.
33. Bakkali N., Fenollar F., Biswas S. et al. Acquired resistance to trimethoprim-sulfamethoxazole during Whipple disease and expression of the causative target gene.J Infect Dis 2008 Jul 1; 198 (1): 101.
34. Van La M., Barbry P., Raoult D., Renesto P. Molecular basis of Tropheryma whipplei doxycycline susceptibility examined by transcriptional profiling. J Antimicrob Chemother 2007; 59 (3): 370-377.
35. Feurle G.E., Moos V., Schinnerling K. et al. The immune reconstitution inflammatory syndrome in Whipple disease: a cohort study. Ann Intern Med 2010; 153 (11): 710-717.
The immune reconstitution inflammatory syndrome in Whipple disease: a cohort study. Ann Intern Med 2010; 153 (11): 710-717.
36. Lagier J.C., Fenollar F., Lepidi H., Raoult D. Evidence of lifetime susceptibility to Tropheryma whipplei in patients with Whipple’s disease. J Antimicrob Chemother 2011; 66 (5): 1188-1189.
37. Marth T., Schneider T. Whipple’s disease. In: Mandell Douglas and Bennet’s Principles and Practice ofInfectious Diseases. / Eds. J.E. Bennet, R.Dolin, M.J. Blaser. Elsevier, Philadelphia,2015; 2418-2424.
Болезнь Уиппла – справочник болезней — ЗдоровьеИнфо
Лечение болезни Уиппла осуществляется с помощью антибиотиков, которые могут уничтожить болезнетворные бактерии.
Лечение является долгосрочным, обычно длится год или два. Но облегчение симптомов обычно наступает намного быстрее, обычно в течение первой недели или двух. Большинство людей, у которых не отмечалось симптомов поражения центральной нервной системы, полностью выздоравливают.
Большинство людей, у которых не отмечалось симптомов поражения центральной нервной системы, полностью выздоравливают.
При выборе антибиотиков врачи часто ориентируется на те, которые не только воздействуют на инфекции в просвете кишечника, но и проходят через гематоэнцефалический барьер – на случай, если бактерии попали в мозг и центральную нервную систему.
В виду длительности использования антибиотиков врачу придется наблюдать за вами, на предмет вырабатывания устойчивости к антибиотикам. Если по ходу лечения развивается рецидив, может потребоваться смена препарата.
Терапия для стандартных случаев
В большинстве случаев лечение болезни Уиппла начинается с 2-4 недельного внутривенного курса цефтриаксона или пенициллинов. После вводной терапии, осуществляют переход на пероральные формы сульфаметоксазола-триметоприма на год или два. Более короткий курс может привести к рецидивам заболевания.
Возможные побочные эффекты антибиотиков – диарея, тошнота, рвота.
Терапия в тяжелых случаях
Если у вас развивается неврологическая симптоматика, лечение незамедлительно с 12-18 месячного курса пероральных форм доксициклина, совмещенного с противомалярийным средством – гидроксихлорохином. Также вам будут показаны антибиотики, проникающие в ЦНС – такие, как сульфаметоксазол-триметоприм.
Возможные побочные эффекты доксициклина – потеря аппетита, тошнота, рвота, чувствительность к солнечному свету. Гидроксихлорохин может вызывать снижение аппетита, диарею, головные боли, судороги в животе и слабость.
Симптоматическое лечение
Симптомы должны стать меньше через 1-2 недели приема антибиотиков и полностью исчезнуть в течение месяца.
Но даже если симптомы исчезнут быстро, дальнейшие лабораторные исследования могут выявлять наличие бактерий в течение двух лет и более после начала приема антибиотиков. Дополнительные исследования помогут определить время, когда возможно будет прекратить прием антибиотиков. Регулярный контроль также может помочь обнаружить развитие резистентности к определенному лекарству, которая обычно выражается в виде появления симптомов.
Регулярный контроль также может помочь обнаружить развитие резистентности к определенному лекарству, которая обычно выражается в виде появления симптомов.
Даже после успешного излечения болезнь Уиппла может возникнуть вновь. Врачи рекомендуют регулярно обследоваться. Если у вас рецидив, вас следует возобновить антибактериальную терапию.
Пищевые добавки
Поскольку болезнь Уиппла связана с нарушением усваивания питательных веществ, врач может посоветовать вам прием витаминов и минеральных веществ для поддержания адекватного пищеварительного статуса. Вам могут потребоваться витамин D, фолиевая кислота, кальций, железо и магний.
| Болезни | Симптомы | Возбудитель / причина | Лечение |
|---|---|---|---|
| Астра желтая | Листья желтые и узкие, а не овальные. Образуется аномально большое количество побегов. | Фитоплазма | Удалить зараженные растения. Контролировать цикадку. |
| Бактериальная инфекция | Образуется аномально большое количество побегов. | Rhodococcus fascians | Удалить зараженные растения. |
| Черная корневая гниль | Растения желтеют, низкорослые и погибают. | Thielaviopsis basicola | Старайтесь поддерживать pH почвы ниже 6,2 там, где растут фиалки. Обеспечьте хороший дренаж почвы. Применяйте фунгицид для защиты растений. |
| Гниль кроны | У отмирающих растений на стеблях по линии почвы появляются белые грибы. Маленькие золотисто-коричневые структуры размером с горчичное зерно усеивают белый рост. | Sclerotium rolfsii | Удалите зараженные растения.Держите мульчу подальше от основания растений. |
| Ложная мучнистая роса | Листья имеют пурпурные или пожелтевшие участки. | Peronospora или Bremiella | Используйте фунгицид для защиты растений весной, когда преобладает прохладная влажная погода. |
| Грибковые пятна на листьях | Маленькие пятна, обычно на нижних листьях, увеличиваются и становятся темно-пурпурными или черными, диаметром 1/4 дюйма или более с перистыми краями. Затем листья желтые. | Cercospora, Alternaria, Ascochyta, Botrytis, Centrospora, Ciborinia, Colletotrichum, Cryptostictis, Cylindrosporium, Heterosporium, Marssonina, Phyllosticta, Ramularia, Septoria | Не допускайте попадания воды на листву при поливе. Применяйте фунгицид для защиты растений. |
| Мучнистая роса | На верхней поверхности листьев развивается белый грибок. | Sphaerotheca | Применяйте фунгицид для защиты растений, как только наблюдается рост белых грибов. |
| Корневая гниль Pythium | Растения увядают и погибают, так как нижние стебли и корни обесцвечиваются и отмирают. | Pythium | Удалите зараженные растения. Применяйте фунгицид для защиты растений. |
| Гниль стебля Rhizoctonia | Корни и стебли коричневые по мере увядания и отмирания растений. | Rhizoctonia | Удалите зараженные растения. Нанесите фунгицид для защиты растений. |
| Ржавчина | Пустулы желто-оранжевые споры образуются на нижней стороне листьев.Верхняя часть пятна желтая. | Puccinia или Uromyces | Избегайте полива сверху. Применяйте фунгицид для защиты растений. |
| Парша | Белые пятна с пурпурными краями образуют слегка вздутые участки вдоль черешков и жилок листа. | Sphaceloma violae | Примените фунгицид для защиты растений. |
Что такое легкое? Таинственная болезнь в Призраках поместья Блай
Эпизод 8 из Призраки поместья Блай углубляется в историю происхождения призрачного английского поместья, где происходит действие сериала, фокусируясь на человеческой жизни призрачной, кровожадной леди в озере, известной как Виола Уиллоуби.
Виола – старшая из двух сестер-сирот, которые соревнуются за привязанность мужчины в Хэмпшире 17-го века. Рассматриваемый жених, Артур, предпочитает Виолу своей младшей сестре Пердите, вызывая негодование, которое никогда не проходит. Но через несколько лет после замужества Виола заболевает смертельной болезнью, от которой она кашляет кровью и в конечном итоге оставляет ее прикованной к постели.
Сначала Виола и ее родственники напуганы тем, что у нее чума, которая все еще свирепствовала в Англии в 17 веке.Но когда врач приходит осмотреть Виолу, он подтверждает, что у нее нет чумы – у нее есть «легкое». Мы разрушаем то, что все это означает.
Как умирает Виола?
Когда врач Виолы выходит из спальни, одетый в чумную маску, он предупреждает Пердиту и Артура, что, хотя Виола свободна от чумы, ее прогноз все еще мрачный. «У нее легкое», – говорит он. Пердита в замешательстве пытается спросить, что это означает (то же самое, Пердита), но Артур прерывает ее, просто спрашивая: «Как долго, доктор?» Врач отвечает, что у Виолы «максимум месяцы», и говорит, что не верит, что сможет ее вылечить.
Врач также рекомендует изолировать Виолу от остальных членов ее семьи, поскольку ее болезнь очень заразна. Это опустошает ее – ее не только уводят с любимого брачного ложа, но, что еще более болезненно, разлучают со своей маленькой дочерью Изобель. Негодование Виолы по поводу карантина вызывает глубокую ярость, которая определит остальную часть ее существования и в конечном итоге превратит ее в мстительный дух, навсегда преследующий земли Блая. Но не будем забегать вперед.
Прогнозы доктора на «максимум месяцев» оказываются неверными, потому что Виола упорно отказывается умирать или даже признавать, что могла. Она отказывается принять последний обряд от викария, говоря ему: «Скажи своему Богу, что я не пойду». Кажется, это не победа, потому что Виола в течение пяти лет находится в адском состоянии неопределенности между жизнью и смертью. Все это время она поглощена гневом и обидой на сестру и мужа, и, наконец, Пердита убивает ее, потому что она так измучена своим насилием.
Что такое «легкое»?
Мы не получаем никаких подтверждений того, что врач подразумевает под «легкими», но, судя по временному периоду и симптомам Виолы, заболевание, вероятно, является туберкулезом, иначе туберкулезом. Это заболевание легких было распространено в 17 веке, и его было нелегко вылечить, поэтому мрачный прогноз врача имеет смысл. Туберкулез часто встречается в поп-культуре под разными названиями – это то же самое, что и чахотка, болезнь, убившая Николь Кидман в Мулен Руж года.
ТБ достиг пика эпидемии в Великобритании в 17 веке, в то же время, когда имеет место этот эпизод. К середине века каждая пятая смерть в Лондоне была вызвана этой болезнью. Но были случаи, когда люди выживали, так что Виола, проживавшая столько же времени, не является неправдоподобной.
Хотя пребывание в карантине из-за заразного и смертельного заболевания легких может показаться слишком реальным в 2020 году, хорошая новость заключается в том, что история туберкулеза является напоминанием о силе современной медицины. Болезнь все еще существует сегодня – по сути, это ведущая инфекционная причина смерти во всем мире – но благодаря комбинации вакцинации и эффективных методов лечения она теперь широко контролируется и излечима. Еще один повод полюбить науку!
Болезнь все еще существует сегодня – по сути, это ведущая инфекционная причина смерти во всем мире – но благодаря комбинации вакцинации и эффективных методов лечения она теперь широко контролируется и излечима. Еще один повод полюбить науку!
Этот контент создается и поддерживается третьей стороной и импортируется на эту страницу, чтобы помочь пользователям указать свои адреса электронной почты.Вы можете найти больше информации об этом и подобном контенте на сайте piano.io.
Что такое легкое? Объяснение болезни Виолы в Призраках поместья Блай
В «Призраках поместья Блай» Виола Ллойд страдает загадочной болезнью легких; состояние, в котором она была осуждена, веками было убийцей мирового масштаба.
ВНИМАНИЕ: спойлеры для The Haunting of Bly Manor впереди
На сайте Призраки поместья Блай Виола Ллойд страдала от « Легкого » или, как это известно сегодня, туберкулеза. The Haunting of Bly Manor – еще одна адаптация новеллы Генри Джеймса The Turn of the Screw (и включает в себя другие его работы) и является долгожданным продолжением The Haunting of Hill House . Сериал ужасов антологии Netflix был создан Майком Фланаганом и повествует историю молодой американки Дэни Клейтон, которую бизнесмен-алкоголик нанял для ухода за его осиротевшими племянником и племянницей Майлзом и Флорой. Дети и небольшой персонал состоят из домработницы, повара и садовника, которые проживают в величественном, но жутком особняке в английской сельской местности.
The Haunting of Bly Manor – еще одна адаптация новеллы Генри Джеймса The Turn of the Screw (и включает в себя другие его работы) и является долгожданным продолжением The Haunting of Hill House . Сериал ужасов антологии Netflix был создан Майком Фланаганом и повествует историю молодой американки Дэни Клейтон, которую бизнесмен-алкоголик нанял для ухода за его осиротевшими племянником и племянницей Майлзом и Флорой. Дети и небольшой персонал состоят из домработницы, повара и садовника, которые проживают в величественном, но жутком особняке в английской сельской местности.
Действие происходит в 1980-х годах, в сериале используется линейное повествование, переплетенное с воспоминаниями и последовательностями снов, чтобы исследовать предыстории главных героев, как живых, так и мертвых. Предпоследний эпизод «Призраки поместья Блай», «Роман о некой старой одежде», раскрывает тайны, окружающие самого злого призрака поместья, «Леди в озере». Уроженка Виола Уиллоуби, она и ее сестра Пердита выросли в этом доме в 17 веке. После смерти их отца Виола разработала план, чтобы обезопасить будущее ее и Пердиты и сохранить поместье Блай. Она вышла замуж за дальнего кузена Артура Ллойда, понимая, что Виола сохранит контроль над своим домом.В конце концов, она полюбила Артура, и у них родилась дочь Изабель.
Предпоследний эпизод «Призраки поместья Блай», «Роман о некой старой одежде», раскрывает тайны, окружающие самого злого призрака поместья, «Леди в озере». Уроженка Виола Уиллоуби, она и ее сестра Пердита выросли в этом доме в 17 веке. После смерти их отца Виола разработала план, чтобы обезопасить будущее ее и Пердиты и сохранить поместье Блай. Она вышла замуж за дальнего кузена Артура Ллойда, понимая, что Виола сохранит контроль над своим домом.В конце концов, она полюбила Артура, и у них родилась дочь Изабель.
СВЯЗАННЫЙ: Призраки поместья Блай: все ключи к [SPOILER] Twist
Вскоре после рождения Изабеллы у Виолы начался непрекращающийся кашель, который вскоре стал кровоточащим.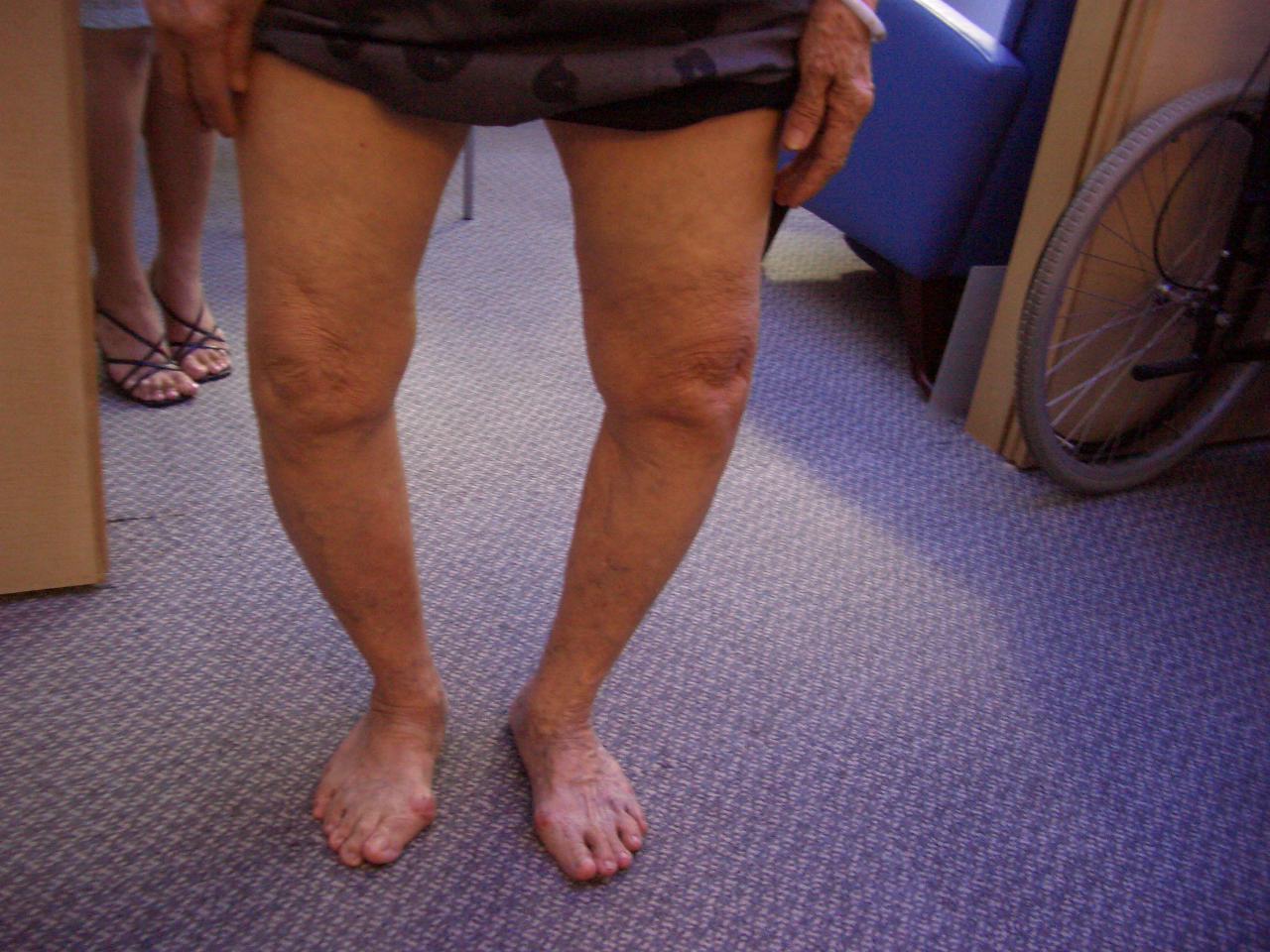 Пердита и Артур опасались, что это была «Великая чума» (разновидность бубонной чумы), которая опустошила Англию в 1665–1666 годах и унесла жизни около 100 000 человек. Врач, чей призрак бродил по поместью столетия спустя, диагностировал Виолу неопределенное заболевание под названием « the Lung », которое, скорее всего, было туберкулезом, инфекционным заболеванием, обычно вызываемым бактериями Mycobacterium tuberculosis. В 2008 году ученые обнаружили скелетные останки, которые подтвердили, что туберкулез существовал еще 9000 лет назад в истории человечества.На протяжении всей истории туберкулез был также известен как потребление из-за быстрой потери веса и истощения инфицированного человека. Это было также известно как «Великая белая чума» или «Белая смерть» из-за бледности пациента. Другие симптомы включают боль в груди, жар, усталость, потерю веса и ночную потливость. Болезнь распространяется через кашель и чихание, поэтому Виола была изолирована от своей семьи, особенно от Изабель.
Пердита и Артур опасались, что это была «Великая чума» (разновидность бубонной чумы), которая опустошила Англию в 1665–1666 годах и унесла жизни около 100 000 человек. Врач, чей призрак бродил по поместью столетия спустя, диагностировал Виолу неопределенное заболевание под названием « the Lung », которое, скорее всего, было туберкулезом, инфекционным заболеванием, обычно вызываемым бактериями Mycobacterium tuberculosis. В 2008 году ученые обнаружили скелетные останки, которые подтвердили, что туберкулез существовал еще 9000 лет назад в истории человечества.На протяжении всей истории туберкулез был также известен как потребление из-за быстрой потери веса и истощения инфицированного человека. Это было также известно как «Великая белая чума» или «Белая смерть» из-за бледности пациента. Другие симптомы включают боль в груди, жар, усталость, потерю веса и ночную потливость. Болезнь распространяется через кашель и чихание, поэтому Виола была изолирована от своей семьи, особенно от Изабель. Туберкулез был основной причиной смерти в Европе 17 века.
Туберкулез был основной причиной смерти в Европе 17 века.
В 19 веке туберкулез был романтизирован плодовитыми литературными деятелями того времени, включая Джона Китса и Эмили Бронте, оба из которых умерли от болезни.Милли, главный герой фильма Джеймса «Крылья голубя», , как полагали, был вдохновлен его кузеном, который умер от туберкулеза, что еще больше усиливает аргумент о том, что это таинственная болезнь, которая преследовала Виолу. Процедуры включали купирование, очистку, ведение, отдых, масла, травы, упражнения, оздоровительные процедуры, диетические изменения и свежий воздух. Только в 1946 году медицинская наука начала добиваться реальных успехов в борьбе с туберкулезом с помощью антибиотиков.
Виола прожила гораздо дольше, чем кто-либо ожидал, прожив почти шесть лет после того, как ей поставили диагноз.К сожалению, все эти годы она страдала и все более подозрительно относилась к растущей привязанности между Артуром и Пердитой. В конце концов, Виола умерла бы от туберкулеза, но чтобы подавить невыразимые страдания, которые болезнь принесла ее сестре, а в свою очередь, Пердита задушила беспомощную Виолу. Даже после своей смерти Виола отказалась принять свою судьбу, оставив ее стать Леди в озере и создать проклятие, которое не давало мертвым обрести покой на Призраки поместья Блай .
ДАЛЕЕ: Каждый актерский состав поместья Блай возвращается на полуночную мессу
Искусство доктора Стрэнджа 2 раскрывает первый взгляд на MCU America Чавес
Об авторе Дженнифер Линд-Вестбрук (Опубликовано 293 статей) Дженнифер восемь лет работала внештатным писателем, работая над BuddyTV, TVRage, Hidden Remote, Gossip On This и PopMatters. Она предпочитает просмотр старых серий «Офиса» (британская и американская версии) долгим прогулкам по пляжу. Она все еще надеется, что Happy Endings возродятся.
Она предпочитает просмотр старых серий «Офиса» (британская и американская версии) долгим прогулкам по пляжу. Она все еще надеется, что Happy Endings возродятся.
Каким заболеванием легких страдает Виола?
Добро пожаловать всем и каждому! Мы здесь, чтобы обсудить The Haunting of Bly Manor , в частности, какой болезнью болела Виола Ллойд (Кейт Сигел) в ее последние годы.Эпизод, объясняющий личность Леди в озере, – один из самых интересных в этом сезоне.
Причина, по которой безликие духи связаны с поместьем, раскрывается в восьмом эпизоде сезона под названием «Романтика некоторых старых вещей». Зрители узнают, что сестры Виола и Пердита (Кэтрин Паркер) осиротели и ушли управлять имением после того, как их отец умер примерно за 400 лет до начала сериала.
Чтобы обезопасить свой дом, Виола приглашает их дальнего кузена, Артура Ллойда, посетить поместье. Несмотря на то, что Пердита начала испытывать чувства к Артуру, именно Виола в конечном итоге завоевывает его расположение. Виола и Артур женаты, и вскоре у пары родится дочь по имени Изабель. Вскоре после рождения Изабель Виола заболевает неуточненным заболеванием легких.
Несмотря на то, что Пердита начала испытывать чувства к Артуру, именно Виола в конечном итоге завоевывает его расположение. Виола и Артур женаты, и вскоре у пары родится дочь по имени Изабель. Вскоре после рождения Изабель Виола заболевает неуточненным заболеванием легких.
Объяснение болезни легких в Призраке поместья Блай
Даже когда ее состояние ухудшается, заставляя Виолу проводить большую часть своего времени в карантине вдали от своей семьи, она остается в живых по чистой воле. Болезнь вызывает у Виолу горечь и обиду, особенно на сестру.Это приводит к тому, что Пердита душит Виолу до смерти и выходит замуж за Артура для хорошей меры.
Чтобы выяснить, от какого заболевания легких страдала Виола, давайте проанализируем, как ее состояние было представлено в шоу. Сообщается, что она чувствует «щекотку» в легких, и мы видим, как она кашляет кровью. После посещения врача Пердите и Артуру говорят, что Виола «легкое» и ей осталось жить несколько месяцев. С этого момента Виола спит отдельно от своей семьи, подразумевая, что любая болезнь, которая у нее есть, заразна.
Как сообщает PopSugar, наиболее вероятным виновником является туберкулез, также известный как чахотка. Туберкулез – инфекционное заболевание, которое в 17 веке обычно приводило к летальному исходу.
После того, как Пердита убивает свою сестру, беспокойная душа Виолы становится все более ожесточенной. Гнев, который она чувствовала в последние годы своей жизни, настолько силен, что она создает свою собственную зловещую гравитацию вокруг поместья Блай, поэтому души, которые умирают там, никогда не могут двигаться дальше.
Цветы альта: защита от болезней | Воспитан в Норфолке
Выращенный в Норфолке эксперт по садоводству Мартин Дэви отвечает на все ваши вопросы о цветах альта.
Если вы хотите получить ответ на какой-либо вопрос о садоводстве, напишите нашему главному производителю по адресу [email protected] , чтобы поделиться своими мыслями о наших советах по садоводству.
Уважаемый Мартин,
Помогите, пожалуйста. Я вырастила в саду несколько цветов виолы из растений, купленных в октябре в известном садовом центре. Растения начали хорошо расти и начали цвести, однако на листьях появилось много черных пятен, и они выглядят так, как будто вот-вот умрут.Что мне делать? Я не знаю, нормально это или нет, раньше я выращивал их только в горшках, и у меня не было никаких проблем. Не могли бы вы посоветовать мне, что мне делать, чтобы их спасти?
Я вырастила в саду несколько цветов виолы из растений, купленных в октябре в известном садовом центре. Растения начали хорошо расти и начали цвести, однако на листьях появилось много черных пятен, и они выглядят так, как будто вот-вот умрут.Что мне делать? Я не знаю, нормально это или нет, раньше я выращивал их только в горшках, и у меня не было никаких проблем. Не могли бы вы посоветовать мне, что мне делать, чтобы их спасти?
Г. Барнс, Тетфорд
Уважаемый читатель,
Анютины глазки и цветы виолы могут быть поражены различными болезнями пятнистости листьев, которые уродуют растения. В равной степени могут быть затронуты растения в контейнерах и в земле. Пятна и разводы на листьях анютиных глазок вызывают грибковые возбудители Ramularia lactea, R.agrestis и Mycocentrospora acerina. Анютины глазки также страдают от ложной мучнистой росы, вызываемой грибоподобным (оомицетом) организмом Peronospora violae.
Симптомы различаются в зависимости от виновного заболевания;
Ramularia lactea: на листьях появляются темные жирные пятна, которые становятся коричневыми в центре.
Ramularia agrestis: На листьях появляются бледно-коричневые пятна и пятна, похожие на химический ожог.
Mycocentrospora acerina: Очень темные пятна появляются на листьях и стеблях, а крона растения может загнить.
Peronospora violae: желтоватые пятна появляются на верхней поверхности листа, что соответствует серому, нечеткому грибовидному наросту на нижней поверхности.
Все эти патогены образуют споры на листьях, которые разносятся дождем на короткие расстояния (пятна на листьях) или ветром на большие расстояния (ложная мучнистая роса). Mycocentrospora acerina и Peronospora violae также образуют жесткие покоящиеся структуры в мертвых тканях, которые могут загрязнять почву в течение нескольких лет, и виды Ramularia.наверное тоже это сделаю.
Ramularia spp. и Peronospora violae поражают только анютины глазки и фиалки, но Mycocentrospora acerina поражает широкий спектр растений, а также вызывает гниение в моркови.
Культурный контроль включает недопущение повторных посевов на одном и том же участке для предотвращения накопления этих патогенов в почве. Споры грибковых пятен не переносятся ветром или семенами, поэтому имейте в виду, что наиболее вероятным источником инфекции являются растения, которые уже заражены на момент покупки.Не покупайте растения с признаками пятнистости листьев.
Споры грибковых пятен не переносятся ветром или семенами, поэтому имейте в виду, что наиболее вероятным источником инфекции являются растения, которые уже заражены на момент покупки.Не покупайте растения с признаками пятнистости листьев.
Дикие анютины глазки и фиалки могут быть источниками инфекции садовых анютиных глазок.
Химический контроль
Фунгицид тебуконазол с трифлоксистробином (Provanto Fungus Fighter Plus, Toprose Fungus Control & Protect) имеет рекомендацию по борьбе с пятнистостью листьев на декоративных растениях. Кроме того, фунгициды тебуконазол (Provanto Fungus Fighter Concentrate) и тритиконазол (Scotts Fungus Clear Ultra и Scotts Fungus Clear Ultra Gun) помечены для борьбы с другими болезнями декоративных растений и, следовательно, могут быть использованы на законных основаниях для лечения анютиных глазок (на риск владельца). ), чтобы попытаться контролировать пятнистость листьев.Ни один из этих фунгицидов не борется с ложной мучнистой росой.
Обрезайте тузы, березу и виноград перед Рождеством, чтобы избежать кровотечения.
Лиственные деревья и кустарники еще можно сажать и пересаживать.
Закройте водопроводные краны и защитите нежные растения от предстоящей зимы.
Мартин Дэви – главный производитель
Обозреватель EDP по садоводству
Диагностика распространенных проблем с анютиными глазками – Новости продукции для теплиц
Брайан Э.Уипкер, Джеймс Л. Гибсон, Дхармалингам С. Питчай, Пол В. Нельсон, Джеймс Р. Бейкер, Джеймс Э. Фауст, Пол А. Томас, Майк Бенсон, Тодд Дж. Кэвинс и Джин Л. Уильямс-Вудворд
При изготовлении анютиных глазок может возникнуть множество проблем. Фонд Фреда Глёкнера поддержал совместный проект с участием Университета штата Северная Каролина, Университета Клемсона и Университета Джорджии, в ходе которого были изучены наиболее распространенные проблемы, с которыми сталкиваются производители. Ниже приводится список этих проблем, включая описание симптомов и методы предотвращения или устранения каждой проблемы.Для более полного обсуждения производства анютиных глазок также доступны пакет карманных диагностических карточек и руководство по производству. Контактная информация находится в конце статьи.
Ниже приводится список этих проблем, включая описание симптомов и методы предотвращения или устранения каждой проблемы.Для более полного обсуждения производства анютиных глазок также доступны пакет карманных диагностических карточек и руководство по производству. Контактная информация находится в конце статьи.
Заболевания листвы
Болезни листвы анютиных глазок вызывают многочисленные грибы, но производители часто испытывают трудности с постановкой правильного диагноза возбудителя; Симптоматические пятна часто очень похожи. К счастью, меры контроля в целом такие же.
Болезням листвы способствует продолжительное увлажнение листьев. Полив в конце дня, чтобы растения пережили вечер с мокрыми листьями, может усилить болезнь. Это связано с тем, что большинству грибов, вызывающих пятнистость листьев, требуется как минимум от восьми до 12 часов постоянной влажности листьев, чтобы заразить растение. Заражение не может произойти, если вода не будет присутствовать на листе в течение необходимого времени.
Незамедлительно удаляйте зараженные листья и сильно зараженные растения, чтобы уменьшить распространение болезни.Один зараженный лист или растение, если оставить его в лотке или теплице, может распространить болезнь на все остальные растения. Фунгициды могут уменьшить заражение новых листьев, но не вылечить уже зараженные листья. Помните, что проверка эффективности фунгицидного спрея заключается не в том, исчезнут ли существующие пятна на листьях (потому что они никогда не исчезнут), а в том, останется ли новый рост свободным от инфекции. Для борьбы с этими заболеваниями потребуется повторное применение.
Пятнистость листьев Cercospora: это наиболее распространенное заболевание пятнистости листьев анютиных глазок на юге.На нижних листьях начинаются большие распространяющиеся пурпурные пятна; пятна имеют опушенный край. По мере развития болезни на верхних листьях появляются крошечные пурпурные пятна и крапинки. Со временем пятна на листьях приобретают коричневые центры с пурпурной каймой. Пятна часто бывают неправильными по размеру и форме. Нижние листья часто желтеют и опадают, снижая жизнеспособность и внешний вид растений.
Пятна часто бывают неправильными по размеру и форме. Нижние листья часто желтеют и опадают, снижая жизнеспособность и внешний вид растений.
: Вызывается Cercospora violae (грибок, специфичный для анютиных глазок), это заболевание способствует теплой температуре и влажным условиям и чаще всего проявляется осенью и поздней весной.Сначала грибок поражает нижние листья. Зараженные листья опадают с растения, и предполагается, что гриб выживает в остатках листьев. Внутри пятен образуются многочисленные споры, которые обычно распространяются при разбрызгивании воды на соседние листья или растения.
Управление: Удалите сильно инфицированные растения, чтобы уменьшить распространение болезни. Все растительные остатки следует выбросить или уничтожить в конце производственного цикла, чтобы снизить выживаемость патогенов. Применение фунгицидов, включая манкозеб, миклобутанил, хлороталонил, флудиоксонил или тиофанатметил + манкозеб, с интервалом от семи до 14 дней может снизить развитие и распространение болезни.
Антракноз: это еще одно очень распространенное пятно на листьях анютиных глазок. Пятна на листьях обычно бледные или серые с толстыми черными краями, которые иногда выглядят как концентрические кольца. Пятна могут иметь размер от 1/8 до 1/4 дюйма. На черешках, цветоносах или стеблях инфицированных растений часто образуются впалые продолговатые поражения от коричневого до коричневого цвета. Поражения в конечном итоге опоясывают стебель, убивая растение. Антракноз также может вызывать появление коричневых пятен на инфицированных цветках.
Цикл болезни: Антракноз вызывается грибком Colletotrichum violae-tricoloris.Инфекция может быть связана с стрессом или повреждением ткани. Заболевание наиболее тяжело проявляется в теплые влажные периоды осенью и поздней весной. Грибок производит множество спор в пятнах листьев или других пораженных частях растения, которые распространяются на соседние растения при разбрызгивании воды. Грибок выживает из года в год в зараженных растительных остатках.
Управление: Удаление и уничтожение инфицированных растений, а также растительных остатков в конце производственного сезона может снизить выживаемость и распространение болезни.Применение фунгицидов, таких как манкозеб или тиофанатметил + манкозеб, при первых признаках болезни может уменьшить распространение болезни. Избегайте стресса растений и продолжительных периодов увлажнения растений, которые могут способствовать заражению антракнозом.
Болезни корней
Анютины глазки могут быть инфицированы обычными возбудителями корневой гнили, такими как Pythium, Rhizoctonia и Fusarium, но они также восприимчивы к Thielaviopsis, причине «черной корневой гнили». Черная корневая гниль – самое серьезное корневое заболевание анютиных глазок, прежде всего потому, что с ней очень трудно бороться.
Заболевания корневой гнили обычно возникают на влажных субстратах из-за чрезмерного полива, плохого дренажа или стоящих в воде контейнеров. Все возбудители корневых гнилей передаются через почву, что означает, что они выживают в субстратах и мусоре.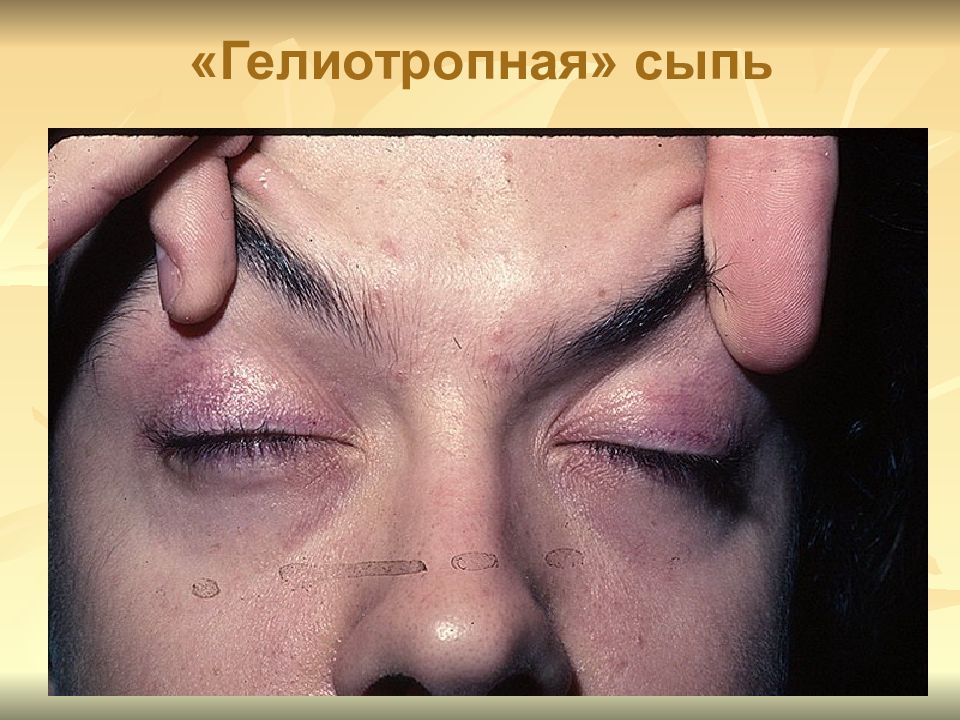 Обычно они возникают в производственных помещениях из-за плохой санитарии, такой как повторное использование почвенного субстрата и грязных контейнеров, а также из-за растительного и почвенного мусора на скамейках и полах.
Обычно они возникают в производственных помещениях из-за плохой санитарии, такой как повторное использование почвенного субстрата и грязных контейнеров, а также из-за растительного и почвенного мусора на скамейках и полах.
Все, что движется или содержит субстрат (грязь и мусор), потенциально может занести или распространить патогены корневой гнили, включая грязь на обуви, внешних сторонах мешков с почвенной смесью, инструментах, шлангах и руках.
Листва симптомы корневых болезней очень похожи. Растения часто бывают хлоротичными или пурпурными, увядшими, низкорослыми и слабыми. Заболевание корневой гнилью нельзя диагностировать, исследуя только листву. Лучший способ диагностировать заболевание корневой гнилью – посмотреть на корни.
Черная корневая гниль (Thielaviopsis): Анютины глазки, инфицированные черной корневой гнилью, вызывают наземные симптомы, типичные для других болезней корневой гнили. Зараженные растения могут быть низкорослыми и / или увядшими, но наиболее диагностируемым признаком является пожелтение листьев (хлороз).
На корнях, пораженных черной корневой гнилью, образуются темные пятна или полосы, которые легко увидеть на фоне обычно белых корней анютиных глазок. Раннее заражение чаще всего наблюдается на концах вторичных питающих корней, но по мере развития болезни вся корневая система становится черной и пропитанной водой. Обесцвечивание в черный цвет связано с грибковыми спорами в корне. Споры можно увидеть с помощью увеличительного стекла 15-20x, ручной линзы или микроскопа. Все стадии анютиных глазок можно заразить и убить.Заболевание может быть особенно разрушительным в конце летних месяцев, когда температура высока и когда pH субстрата выше 6,0.
Цикл болезни: Черная корневая гниль, вызываемая грибком Thielaviopsis basicola (также известным как Chalara elegans), является широко распространенным и разрушительным корневым заболеванием анютиных глазок. Тиэлавиопсис выживает в почве и растительных остатках. Здоровые корни заражаются при контакте с инфицированными корнями или спорами грибка в зараженном субстрате и / или мусоре. Затем грибок быстро растет и размножается, производя споры внутри инфицированных растений. Споры также могут распространяться из горшка в горшок при разбрызгивании воды.
Затем грибок быстро растет и размножается, производя споры внутри инфицированных растений. Споры также могут распространяться из горшка в горшок при разбрызгивании воды.
Заболевание может быть занесено в теплицы из зараженных пробок. Всегда внимательно проверяйте свечи на наличие симптомов инфекции, таких как неравномерный рост и плохой цвет листвы, прежде чем помещать их в производственные зоны. Если вы подозреваете, что проблема связана с пробками, немедленно отправьте пробный лоток для пробок в диагностическую клинику. Споры Thielaviopsis могут сохраняться на скамейках в теплицах и лотках для пробок до двух месяцев (и в растительных остатках под скамейками в течение более длительных периодов времени).
Управление: Хорошая санитария, надлежащий уход за растениями и фунгициды могут помочь уменьшить развитие болезни черной корневой гнили. Используйте только новую почвенную смесь, свободную от патогенов. Никогда не используйте повторно заливочные смеси! Используйте новые контейнеры для каждой посадки и содержите все оборудование и зону посадки в чистоте от старого почвенного субстрата и мусора. Избегайте водного и теплового стресса, особенно в конце лета.
Избегайте водного и теплового стресса, особенно в конце лета.
Не удобряйте растения чрезмерно. Применяйте рекомендованную норму азота для выращивания анютиных глазок, но избегайте удобрений с высоким содержанием аммонийного азота.Поддерживайте рН корневого субстрата от 5,4 до 5,8. Всегда регулярно проверяйте свои растения на наличие признаков болезней и немедленно избавляйтесь от зараженных растений. При необходимости фунгициды, такие как тиофанатметил, трифлумизол или флудиоксонил, могут уменьшить заражение черной корневой гнилью, но они не «излечивают» уже инфицированные растения.
Корневая гниль Pythium: зараженные корни кажутся коричневыми или коричневыми, пропитанными водой или слизистыми. Внешний корень корня легко отделяется от нитевидного внутреннего корня (стелы) пальцами.Pythium обычно сначала атакует кончики корней, а затем продвигается вверх по корневой системе. Нижние листья зараженных растений часто желтые. Pythium также вызывает затухание.
Цикл болезни: Pythium очень распространен, и его нельзя исключить из тепличного производства. Питиум выживает в почве и на всем, что содержит почва, включая руки, обувь, горшки и оборудование, а также в загрязненных источниках воды. Чрезмерный полив и чрезмерное запотевание во время размножения будут способствовать развитию болезни, поскольку создают идеальные условия для прорастания и передвижения спор Pythium.Болезнь легко распространяется от горшка к горшку при разбрызгивании воды или движении почвы. Высокая концентрация растворимой соли в почвенном субстрате также способствует заражению Pythium, вызывая нагрузку на корневую систему.
Питиум выживает в почве и на всем, что содержит почва, включая руки, обувь, горшки и оборудование, а также в загрязненных источниках воды. Чрезмерный полив и чрезмерное запотевание во время размножения будут способствовать развитию болезни, поскольку создают идеальные условия для прорастания и передвижения спор Pythium.Болезнь легко распространяется от горшка к горшку при разбрызгивании воды или движении почвы. Высокая концентрация растворимой соли в почвенном субстрате также способствует заражению Pythium, вызывая нагрузку на корневую систему.
Лечение: Фунгициды, обычно используемые для борьбы с Pythium, такие как этридиазол, фосетил-Al, мефеноксам и пропамокарб, могут замедлить рост молодых анютиных глазок, поэтому применяйте фунгициды с осторожностью в течение первой недели после трансплантации.
Вредители
Анютины глазки (пестрые рябчики) – маленькие колючие гусеницы, названные так, потому что они питаются анютиными глазками и другими растениями семейства фиалковых. Это незрелая стадия одной из группы четвероногих бабочек, называемых рябчиками. Пестрый рябчик – это коричневато-оранжевая пятнистая и крапчатая бабочка среднего размера, которую иногда замечают на анютиных глазках в середине-конце лета и в начале осени.
Это незрелая стадия одной из группы четвероногих бабочек, называемых рябчиками. Пестрый рябчик – это коричневато-оранжевая пятнистая и крапчатая бабочка среднего размера, которую иногда замечают на анютиных глазках в середине-конце лета и в начале осени.
Урон: Очень маленькие гусеницы срывают листья, демонстрируя те же признаки, что и слизни. Старые гусеницы грызут листья или совсем поедают листья. Гусеницы также оставляют на листьях неприглядный темный помет.Часто помет более заметен, чем молодые гусеницы.
История жизни: Анютины глазки зимуют как гусеницы, питаясь анютиными глазками, фиалкой, алиссумом, джамп-апом и другими растениями семейства фиалковых. Весной гусеницы линяют в куколку (куколку), и на этой стадии появляется поколение взрослых бабочек. Эти бабочки не особенно редки; они распространены по всей территории США, за исключением Тихоокеанского Северо-Запада, поэтому часто можно встретить анютиных червей, питающихся анютиными глазками по всему Юго-востоку.
Управление: Анютины глазки не устойчивы к пестицидам, поэтому химический контроль несложен; однако черви достаточно малы, чтобы нанести ущерб до того, как их обнаружат. Пестролистные рябчики достаточно большие, чтобы их можно было легко исключить из теплиц и затененных домов с экранированием.
Питание растений
Симптомы дефицита бора (B) первоначально проявляются на новых листьях и стеблях, при этом рост искажается или становится тупым. В сложных условиях может произойти отмирание точки роста, что приведет к росту подмышечных отростков.При первом появлении симптомов важно устранить дефицит витамина В, поскольку отмирание меристематической ткани или деформация листьев не могут быть восстановлены. Избыточные уровни K или Ca могут иметь антагонистический эффект на доступность B. B менее растворим в беспочвенных субстратах и при pH выше 6,2.
Стратегия в отношении бора: Поливная вода может содержать достаточный или даже чрезмерный уровень B. Проверьте поливную воду, чтобы определить доступные уровни. Добавьте B в вашу программу оплодотворения, если B равен 1.5 частей на миллион.
Проверьте поливную воду, чтобы определить доступные уровни. Добавьте B в вашу программу оплодотворения, если B равен 1.5 частей на миллион.
Непрерывное удобрение: Большинство коммерческих удобрений, которые содержат микроэлементы, включают B. Не забудьте добавить дополнительные внесения B, если вы используете нитрат кальция (Ca (NO3) 2) + нитрат калия (KNO3) и в вашей поливной воде не хватает B.
Корректирующий Внесение удобрений: Корректирующие поливочные работы Borax или Solubor в концентрации 6,25 частей на миллион B (см. Нормы смешивания ниже) могут применяться к беспочвенным субстратам. (Видимые улучшения будут очень медленными.) Важно исправить дефицит витамина B, когда симптомы впервые появляются, потому что отмирание меристематической ткани или деформация листьев не могут быть обращены вспять.(Тщательно измеряйте, передозировка может быть смертельной для анютиных глазок.)
Для корректирующего применения добавьте 0,75 унции. (21,3 г) буры (11 процентов B) на 100 галлонов воды, или 0,43 унции. (12,2 г) Solubor (20 процентов B) на 100 галлонов воды.
(12,2 г) Solubor (20 процентов B) на 100 галлонов воды.
Дефицит азота: Растения с дефицитом азота демонстрируют медленный рост, задержку роста, отсутствие роста боковых побегов или (в сложных условиях) нижние листья, которые сначала становятся зеленовато-пурпурными или желтыми (хлороз). Опадание листьев происходит после длительных условий дефицита.N – подвижный элемент в установке; поэтому симптомы дефицита сначала проявятся на нижних, более старых листьях.
Избыточный уровень азота приведет к темно-зеленой окраске, замедлению роста растений и задержке цветения. Избыточный азот может снизить поглощение калия (К).
Стратегия в отношении азота (N): Анютины глазки чувствительны к аммиачно-азотной токсичности (Nh5-N). Симптомы проявляются в виде межжилкового V-образного хлороза с зелеными прожилками и купирования молодых листьев книзу.Аммиачно-азотной токсичности можно избежать, добавив> 75 процентов N в нитратной (NO3-) форме. (При расчете соотношения классифицируйте азот мочевины и аммиачный азот. )
)
: Используйте удобрение, которое обеспечивает постоянное внесение жидких удобрений с концентрацией азота 125 ppm или постоянное внесение жидких удобрений от 175 до 200 ppm с чрезмерным выщелачиванием (выращивание вне помещений). Примеры включают нитрат кальция (Ca (NO3) 2) с нитратом калия (KNO3), 20-10-20, 15-5-25, Excel 15-5-15 Cal-Mag, 15-2-20 и другие.
При использовании нитрата кальция (Ca (NO3) 2) с нитратом калия (KNO3) не забудьте обеспечить растения фосфором, магнием и питательными микроэлементами.
Если вы используете 20-10-20 или 20-20-20, не забудьте добавить в растения Ca и Mg.
Корректирующее удобрение: Применения включают нитрат кальция (Ca (NO3) 2), нитрат калия (KNO3) или Excel 15-5-15 Cal-Mag с нормой от 300 до 400 частей на миллион N. Однократное корректирующее азотное удобрение вернет опустите листья до нормального зеленого цвета в течение одной-двух недель.Не перегружайте. При первых симптомах важно устранить дефицит азота, потому что в тяжелых условиях может произойти опадание листьев.
Синдром пятнистых анютиных глазок
Во время осеннего выращивания в середине 1980-х годов производители в теплых регионах начали замечать синдром пятнистых анютиных глазок (MPS). Анютины глазки, которые выражают это заболевание, имеют пестрые листья, которые впервые появляются на стадии пробки.
Если ночные температуры прохладные, а дневные максимумы около 80 ° F, растение теряет пестроту и выглядит нормально до теплового стресса.Однако при дневной жаре и теплых ночах пестрота возобновляется на новом росте.
По мере прогрессирования этого синдрома листья искажаются, на них появляются пальцеобразные выступы или они становятся перистыми. Этот странный рост будет продолжаться до тех пор, пока не снизятся температуры или не повысится плодородие. Учтите, что повышение фертильности или снижение температуры не являются лекарством. Как только потребитель поместит растение на улицу, пятнистые и искаженные листья вернутся с более теплой погодой.
Источник проблемы: несмотря на то, что были проведены обширные тесты на вирусы, микоплазмоподобные организмы, бактерии и дефицит питательных веществ, МПС остается загадкой, связанной с генетическим дефектом анютиных глазок и альтов.В отличие от случайных пестрых листьев в пробках, этот дефект может привести к значительной потере урожая. Это выразилось в нескольких линиях анютиных глазок, распространяемых большинством крупных поставщиков.
Корректирующее действие: выбросить растение. Вилки почти сразу дают пестрые листья, что позволяет цветоводу держать поддон для заглушек на солнце и удалять пораженные саженцы. Осматривая лотки для пробок, производители могут избавиться от этих растений до того, как они станут проблемой. Стоимость разведки составляет лишь часть потенциальных производственных потерь.
Обзор уклонения: 1) Проверяйте лотки с пробками по мере их поступления. Удалите все пестролистные пробки. Следите за новообразованием на пересаженных пробках на предмет появления ланцетных, скрученных или удлиненных листьев. Поддерживайте прохладную производственную среду для анютиных глазок. Осмотрите весь урожай на предмет признаков пестрых листьев в теплых температурных условиях.
Поддерживайте прохладную производственную среду для анютиных глазок. Осмотрите весь урожай на предмет признаков пестрых листьев в теплых температурных условиях.
2) Купите качественные семена и сообщите поставщику семян о значительном количестве разновидностей. Не пытайтесь вырастить пораженные пробки. Применение бора, железа и магния только маскирует генетическую проблему в идеальных условиях и может привести к потере деловой репутации и дохода после продажи растения и повторного проявления симптомов.
Об авторе:
Авторы выражают признательность и благодарность Фреду. C. Gloeckner Foundation за финансовую поддержку этого проекта.
Брайан Э. Випкер, Пол В. Нельсон, Джеймс Р. Бейкер и Майк Бенсон – преподаватели Университета штата Северная Каролина; Джеймс Л. Гибсон, Тодд Дж. Кэвинс и Дхармалингам С. Питчай – аспиранты NCSU; 0 Джеймс Э. Фауст – преподаватель Университета Клемсона; и Пол А. Томас и Джин Л.Уильямс-Вудворд – преподаватели Университета Джорджии в Афинах.
Что такое «Легкое» в поместье Блай? Узнайте подробности о причине всех неудач
Когда Виола из сериала Призраки поместья Блай заболевает легочной болезнью, многие зрители задавались вопросом, что это за болезнь. В финальном эпизоде была раскрыта настоящая причина происшествий в поместье Блай. Виола, умершая от неопределенной болезни, на самом деле страдала от «болезни легких».Это та, кто часто посещает дом, и ее вспоминают как «хозяйку озера». Это она убивает свою сестру. В рассказе она скончалась из-за болезни легких. Вот все, что нужно знать о болезни легких в 1800-х годах.
Также читают | Если вам понравился «Призраки усадьбы Блай», вот что вам стоит посмотреть дальше
Что такое «Легкое» в поместье Блай?
В истории поместья Блай Пердита была замужем за овдовевшим мужем Виолы.Таким образом в отместку хозяйка озера убивает ее. Поводом для всех опасений является болезнь «легких», о которой, по словам врача, унесшего жизнь Виолы. В то время, когда разворачивалась история, болезнь Виолы было нелегко вылечить, и в большинстве случаев она приводила к смерти. Лишь позже медицинские достижения привели к выявлению болезни. Виоле не разрешили находиться рядом с мужем и дочерью, так как болезнь была очень заразной. Таким образом, преследование и смерти вызваны тем, что Виола скончалась в агонии.
В то время, когда разворачивалась история, болезнь Виолы было нелегко вылечить, и в большинстве случаев она приводила к смерти. Лишь позже медицинские достижения привели к выявлению болезни. Виоле не разрешили находиться рядом с мужем и дочерью, так как болезнь была очень заразной. Таким образом, преследование и смерти вызваны тем, что Виола скончалась в агонии.
Также читают | Пасхальные яйца в поместье Блай: есть ли в «Призраке поместья Блай» скрытые призраки?
Bly Manor объяснил
Болезнь легких в 1800-х годах называлась дезориентацией или раздражением легких. Причин болезни может быть целый ряд. Основными причинами могут быть грипп, пневмония и туберкулез, рак легких и др. Однако в этой ужасной истории болезнь легких убивает многих, а остальные задаются вопросом, что же несет трагедию.
В начале 19 века было несколько смертей, вызванных неопределенной «болезнью легких», которая является сюжетом истории Блай Мэнора. До тех пор, пока болезнь не была охарактеризована как туберкулез, болезнь называлась «легкое», что означало преждевременную смерть в то время..jpg) Болезнь легких вызывала наибольшие опасения среди американцев в 1800-х годах. В фильме Майка Флэнагана The Haunting of Bly Manor также говорится о смертельной болезни.
Болезнь легких вызывала наибольшие опасения среди американцев в 1800-х годах. В фильме Майка Флэнагана The Haunting of Bly Manor также говорится о смертельной болезни.
« Haunting Of Bly Manor» «» разворачивается в ползучем особняке, который принесет серию леденящих кровь сюжетов в часовых эпизодах.Драма обязательно принесет ужас. Для индийской аудитории 9 октября 2020 года на Netflix был выпущен фильм The Haunting of Bly Manor .
Призраки поместья Блай на Netflix, в главных ролях – Виктория Педретти и Оливер Джексон-Коэн. Некоторые другие актеры, которые пытаются сыграть заметные роли в сериале ужасов, – это Генри Томас, Амелия Ева и Т’Ния Миллер. В ролях второго плана входят Рахул Кохли, Тахира Шариф, Амели Беа Смит и Бенджамин Эван Эйнсворт.Netflix резюмирует шоу как «»: «Мертвый не значит ушел. Помощница по хозяйству погружается в пучину пугающих секретов в этом готическом романе от создателя «Призрака дома на холме».
