Болюсное контрастирование при кт: Мультиспиральная компьютерная томография с внутривенным болюсным усилением (КТ с болюсным контрастированием)
Компьютерная томография болюсным контрастированием в клинике СМТ
Компьютерная томография с контрастным веществом (КВ) необходима для улучшения визуализации структур, сходных по рентгенологической плотности. Контраст не только позволяет дифференцировать одни органы от других, но и отличить патологические структуры от нормальных.
В клинике «СМТ» введение КВ выполняется 2мя основными способами:
-
Внутривенное болюсное. При данном способе препарат вводится с большой скоростью через автомат.
-
Пероральное. Пациент выпивает препарат за 30-60 минут до назначенного сканирования.
Внутривенное контрастирование:
Компьютерная томография с внутривенным контрастированием позволяет оценить накопление рентгенконтрастного препарата тканями органов через кровеносные сосуды.
С помощью КВ можно выявить очаги патологии,не определяющиеся при нативной КТ, а также уточнить природу патологических изменений.Внутривенное контрастирование позволяет оценить следующие особенности:
-
Нарушение гематоэнцефалического барьера.Особенности кровообращения исследуемого органа.
-
Границы, размеры и форму патологических очагов, что особенно актуально при диагностике злокачественных новообразований.
-
Выявить патологические особенности кровеносных сосудов: аневризмы, тромбозы, мальформацию, сужение просвета сосудов, оценить состояние сосудистых анастомозов и трансплантатов.
-
Данную информацию можно получить посредством компьютерной томографической ангиографии (т.е. болюсное введение).
-
В качестве внутривенного контраста используются йодсодержащие препараты, среди которых различают ионные и неионные контрасты.

-
Ионные КВ могут повышать осмолярность плазмы и приводить к развитию аллергических реакций.
-
В клинике «СМТ» такие препараты не используются. Неионные контрасты лишены таких недостатков, с их применением частота побочных реакций снизилась в 7 раз.
-
Низкие риски неионных КВ позволили сделать компьютерную томографию с контрастированием рутинной амбулаторной процедурой, отличающейся высокой информативностью.
-
Данные препараты в основном выводятся почками, в меньшей степени со слюной и потом.
Учитывая то, что применение КТ хоть и редко, но все же может спровоцировать осложнения, проводится ряд мероприятий,направленных на их профилактику:
-
В первую очередь исследуется функция почек с помощью биохимического анализа крови (измеряют уровень креатинина) – контраст выводится почками и может оказать на них токсическое действие.

-
Если у пациента имеются заболевания почек, следует выбирать контраст с наименьшей осмолярностью, поскольку он оказывает минимальное воздействие на почечные канальцы.
-
Также, чтобы предотвратить осложнения, пациенту назначают специальные препараты для защиты почек и адекватный питьевой режим.
-
Особое внимание уделяется больным сахарным диабетом, принимающим метформин. У них компьютерная томография с контрастным веществом может вызвать нарушение биохимических свойств крови (лактоацидоз).
-
Чтобы его предотвратить, метформин в день исследования отменяют и назначают только после оценки уровня креатинина, но не ранее, чем через 48 часов.
-
У пациентов, имеющих признаки гипертиреоза, проводят лабораторную оценку состояния щитовидной железы.

-
В случае если у пациента установлен диагноз рака щитовидной железы или гипертиреоза и планируется лечение с помощью радиоактивного йода, нужно учитывать, что контрастное КТ может на несколько недель снизить йод-поглощающую активность железы. Поэтому терапию радиоактивным йодом откладывают на несколько недель.
-
В случае наличия у пациента в анамнезе аллергических реакций при проведении компьютерной томографии с внутривенным контрастированием, ему проводят предварительную премедикацию с использованием стероидных и антигистаминных препаратов.
-
Кроме того, исследование проводится строго натощак, чтобы при потере сознания не произошла аспирация желудочного содержимого (рвота).
Как проводится исследование?
Как мы уже отмечали, мы используем только болюсное введение контраста. Ручное введение подразумевает однократную инъекцию КВ в вену пациента. После чего сразу начинается сканирование.
Ручное введение подразумевает однократную инъекцию КВ в вену пациента. После чего сразу начинается сканирование.
Данный тип контрастирования сейчас практически не применяется, т.к. его возможностей не хватает для современных компьютерных томографов.
Для того чтобы получить максимально информативное изображение, контраст должен сохраняться в нужных концентрациях в исследуемой области как можно дольше. Этого позволяет добиться компьютерная томография с болюсным контрастированием.
Для введения КВ используются иглы с минимальным диаметром 1 мм, а еще лучше 1,2-1,4 мм, что соответствует размеру 18G и 17G. В процессе выполнения данной процедуры важно проконтролировать, что игла установлена правильно и кровеносный сосуд проходим для адекватной дозы и скорости введения препарата.
-
С этой целью проводят пробную инъекцию физраствора.
-
В норме не должно быть никаких припухлостей и отеков.

-
Компьютерная томография с внутривенным болюсным усилением отвечает всем требованиям современной диагностики и позволяет получить максимум информации за одно исследование.
-
Его суть заключается в дозированной подаче контраста с определенной скоростью и синхронизации сканирования с распределением КВ в тканях.
Сначала выполняется нативное исследование (т.е. без контраста), затем, через определенный интервал времени после введения дозы контраста, производится второе сканирование, во время которого визуализируется артериальная фаза,т.е. в это время контраст заполняет артерии.
Еще через некоторое время томограф опять сканирует ту же зону, но при этом уже определяется венозное наполнение, т.е. к этому времени КВ поступает в вены.
Также есть отсроченная фаза, при которой можно изучать выделение контраста почками и нижележащими отделами мочевыделительной системы.
Побочные реакции:
При использовании современных контрастов побочные реакции наблюдаются крайне редко. В большинстве случаев для их предотвращения достаточно провести тщательный опрос пациента и выявить в его анамнезе случаи аллергии.
При их наличии исследование проводится под прикрытием антигистаминных и стероидных препаратов.В целом из побочных реакций отмечаются различные проявления аллергии и крайне редко тиреотоксический криз.
-
Обычно они развиваются в первые пять минут от начала введения препарата, гораздо реже, около 15% случаев аллергий, развивается в течение получаса от момента введения контраста.
-
Все случаи аллергии должны тщательно фиксироваться в истории болезни пациента, чтобы в дальнейшем при необходимости применения контрастирования, врачи назначили премедикацию, либо выбрали другой метод диагностики.

Тиреотоксический криз является еще одним осложнением йодсодержащих контрастных веществ. При применении современных препаратов встречается крайне редко, но, тем не менее, риски его возникновения нужно учитывать и проводить профилактические мероприятия:
-
Так, например, пациентам, имеющим в анамнезе гипертиреоз, при назначении контрастной компьютерной томографии проводят предварительную блокаду функции щитовидки с помощью тиреостатиков.
-
Контроль действия этих препаратов проверяется с помощью лабораторного анализа на гормоны.
-
Риски развития тиреотоксикоза особенно велики у пациентов с латентным гипертиреозом.
-
Ситуация осложняется тем, что тиреотоксикоз возникает отсрочено, через 4-6 недель после применения контраста,поэтому не всегда можно установить его точную причину.

-
В большинстве случаев данное осложнение не требует медицинского вмешательства и проходит самостоятельно.
Компьютерная томография с пероральным применением контрастных препаратов (КП):
Пероральное применение контраста проводится при исследовании органов пищеварительной системы. Препарат помогает лучше визуализировать петли кишечника и дифференцировать одни органы от других.
Так, например, визуализация двенадцатиперстной кишки и поджелудочной железы возможна только с помощью КВ.
-
Для исследования пациент должен выпить определенное количество раствора в течение заданного интервала времени.
-
Для исследования верхних отделов ЖКТ достаточно 500 мл раствора.
-
Чтобы он равномерно распределился по пищеварительной трубке, нужно подождать около получаса.

-
При исследовании нижних отделов ЖКТ потребуется около литра препарата, время на его равномерное распределение достигает 45-60 минут.
-
Контрастный препарат выводится с помощью стула, никаких последствий для организма он не несет.
-
Ректальное применение контрастирования необходимо для нормальной визуализации органов мочеполовой системы.
-
С этой целью в прямую кишку вводится 200-300 мг препарата. В качестве подготовки к пероральному или ректальному контрастированию пациент должен произвести очищение кишечника с помощью клизм или слабительного, а также использовать низкошлаковую диету в течение 4-5 суток до назначенной процедуры.
 Сейчас данное исследование стало рутинным, и без него невозможно диагностика большинства имеющихся патологий.
Сейчас данное исследование стало рутинным, и без него невозможно диагностика большинства имеющихся патологий.Памятка: подготовка к КТ и МРТ исследованиям.pdf
Особенности компьютерной томографии с контрастным усилением
Компьютерная томография (КТ) — один из самых эффективных и наиболее точных методов современной диагностики. В отличие от обычной рентгенографии, компьютерная томография позволяет получить объемное изображение исследуемой области организма. При этом толщина среза может составлять до 0,5 мм. При КТ тело визуализируется в поперечных срезах, что позволяет получать 3Д-изображения сложных структур. Обычная рентгенограмма — это двумерное представление трехмерной структуры. Часто бывает трудно разделить перекрывающие друг друга структуры на обычном снимке, например, в грудной клетке, а КТ эффективно устраняет эту проблему. Кроме того, КТ гораздо более чувствительна к различиям в плотности и может выявлять аномалии, не обнаруживаемые при обычной рентгенографии.
КТ с контрастом назначается далеко не в каждом случае использования методики компьютерной томографии. Этот способ обследования является очень точным, позволяя рассмотреть даже мельчайшие опухоли, тромбы и гематомы и применяется при необходимости детализации картины заболевания.
Вводя контрастный препарат внутривенно, мы отвечаем сразу на несколько вопросов: есть ли гипо- или гиперваскулярные опухоли в интересующей нас зоне и каковы ее размеры,
есть ли в ней некроз или кровоизлияние,
нет ли тромбозов , аневризм, инвазий сосудов,
нет ли нарушения целостности сосудистой стенки, нет транзиторных нарушений перфузии исследуемого органа.
КТ с контрастом выполняется в случаях, когда нужно очень четко разделять нормальные и аномальные структуры в человеческом организме. Такая дифференцировка достигается посредством усиления сигнала от больных тканей. Эффект контрастирования при КТ основывается на том, что большинство опухолей, особенно, злокачественных, кровоснабжается лучше, чем здоровые ткани. Поэтому контрастное вещество будет накапливаться в них, давая картину отличия от прочих тканей. Кроме того, контраст необходим для изучения состояния сосудов – вен, артерий. На снимках КТ контраст будет выделяться белым цветом, что позволит хорошо изучить этот участок.
Поэтому контрастное вещество будет накапливаться в них, давая картину отличия от прочих тканей. Кроме того, контраст необходим для изучения состояния сосудов – вен, артерий. На снимках КТ контраст будет выделяться белым цветом, что позволит хорошо изучить этот участок.
В большинстве случаев процедура рекомендуется при подозрении на онкологический процесс, либо для дифференцирования доброкачественной опухоли со злокачественной. Так, рекомендуется КТ с контрастным веществом при:
- Опухолях паренхиматозных органов брюшной полости и забрюшинного пространства (при раке почек, карциноме печени, поджелудочной железы, селезенки).
- Раке полых органов брюшной полости – кишечника, желчного пузыря.
- Образованиях грудной клетки – легких, средостения, сердца.
- Опухолях головного мозга и основания черепа.
- Новообразованиях опорно-двигательного аппарата.
Томография с контрастированием позволит различить банальную и часто встречающуюся кисту почки от почечно-клеточного рака или доброкачественной липомы, ангиомы. При изучении состояния печени КТ поможет дифференцировать цирроз печени, доброкачественные опухоли и гепатоцеллюлярный рак.
При изучении состояния печени КТ поможет дифференцировать цирроз печени, доброкачественные опухоли и гепатоцеллюлярный рак.
Применяется КТ с контрастным усилением при лимфомах – для отличия их от другого ракового заболевания (лимфогранулематоз) или от простого лимфаденита. Контрастирование позволит установить степень ракового заболевания, его распространенность, поражение регионарных лимфоузлов, наличие метастазов. Часто назначают КТ и при малигнизации доброкачественных опухолей, которая будет заметна по ряду специфических признаков (васкуляризация, увеличение в размерах и т.д.).
Компьютерная томография с контрастным усилением весьма информативна при диагностике внутри просветных тромбов, а также тромбированных аневризм, зон сужения тромбами аорты. Также контраст позволит детально изучить сосудистые мальформации, в том числе – перед оперативным вмешательством по поводу их удаления. Обследование даст полную картину при истончении стенок вен, варикозе глубоких вен и при тромбофлебите, а также при атеросклерозе артерий.
Компьютерная томография с контрастированием применяется при заболеваниях таких зон организма:
- Полых органов – желудка, кишечника, пищевода.
- Легких, бронхов и трахеи.
- Гортани и голосовых связок.
- Головного мозга, спинного мозга.
- Основания черепа.
- Всех отделов позвоночника.
- Костей.
- Челюстей.
- Носа и пазух.
Для процедуры применяются различные препараты – ионные и неионные, с содержанием йода. Именно йод повышает интенсивность изображения, при этом вред от его проникновения в организм практически отсутствует. Самыми распространенными являются ионные препараты, но неионные еще более предпочтительны (их токсичность равна нулю).
К ионным средствам относят – Метризоат, Диатризоат, Иоксаглат,
к неионным – Йопромид, Йопамидол, Йогексол и другие.
До введения препарата врач обязательно уточняет наличие некоторых заболеваний и состояний у пациента, которые могут стать противопоказаниями к процедуре.
До обследования пациент должен сдать ряд лабораторных анализов
(биохимия крови: мочевина (2,4-6,4 ммоль/л) и креатинин (мужчины старше 15 лет — 80-150 мкмоль/л, старше 60 лет — 71-115; женщины старше 18 лет — 53-97, старше 50 лет — 53-106).
При повышении указанных показателей проведение контрастирования не проводится. Количество контрастного вещества рассчитывается исходя из веса человека.
Есть разные способы введения контраста, основные из них таковы:
- Болюсный. При болюсном способе введения в локтевую или другую вену устанавливается шприц-инжектор, у которого нормируется скорость подачи препарата.
- Внутривенный однократный. Препарат один раз вводится в вену обычным шприцем.
- Пероральный. В этом случае средство принимается через рот.
- Ректальный. Для сканирования кишечника контрастное вещество вводится через прямую кишку однократно.
Противопоказаниями при КТ с конрастными веществами, содержащими йодсодержащие препараты являются:
• Тяжелая форма бронхиальной астмы и сахарного диабета
• Аллергия на контрастное вещество
• Гипертиреоз
• Тяжелая почечная недостаточность
• Миеломная болезнь
Строгим противопоказанием к любой КТ является беременность, ведь исследование предполагает использование рентгеновского излучения. Относительное противопоказание – грудное вскармливание: после процедуры в течение 1-2 суток следует исключать кормление грудью. У томографа есть ограничение по весу пациента, и при выполнении КТ у людей с массой тела более 110-120 кг могут возникнуть сложности.
Относительное противопоказание – грудное вскармливание: после процедуры в течение 1-2 суток следует исключать кормление грудью. У томографа есть ограничение по весу пациента, и при выполнении КТ у людей с массой тела более 110-120 кг могут возникнуть сложности.
Обычно рекомендуется не выполнять процедуру чаще, чем раз в 6 месяцев. Это ограничение связано не с применением контраста, а с получением лучевой нагрузки во время КТ. Тем не менее, эта нагрузка минимальна, и по жизненным показаниям КТ может быть проведена чаще. Следует помнить, что у ряда пациентов (1-3%) наблюдаются патологические реакции на введение контрастного вещества, что также может ограничить частоту выполнения процедуры. К таким реакциям относятся:
• Отек лица
• Одышка
• Сыпь на теле
• Крапивница
• Кожный зуд
• Бронхоспазм
• Снижение давления
• Тошнота
• Рвота и т.д.
Такие реакции считаются признаками аллергии на контрастное вещество и требуют врачебной помощи. Нормальными являются лишь легкий металлический привкус во рту, боль в области инъекции, чувство тепла в теле.
Подготовка к КТ с контрастным усилением включает такие меры:
• Не принимать пищу в течение 4-8 часов перед процедурой (в зависимости от конкретной зоны исследования)
• Принять препарат для снижения газообразования (при обследовании органов ЖКТ)
• Придти в удобной, свободной одежде
• Снять все украшения из металла, съемные медицинские устройства
Пациента укладывают на кушетку, вводят ему контрастное вещество, либо устанавливают шприц-инжектор. Через определенный промежуток времени начинают процедуру сканирования – закатывают человека под дугу томографа и выполняют серию снимков. Чем дальше изучаемый орган расположен от сердца, тем дольше нужно контрасту для его окрашивания.
Основные отличия КТ с контрастным усилением и без
При обследовании полых органов обычная нативная КТ без контраста покажет их как однородную серую массу без выделения. Если ввести контрастное вещество, стенки органов окрасятся, что даст возможность рассмотреть любые заболевания их слизистой оболочки и мышечного слоя.
Во время изучения сосудов только проникновение контрастного вещества в них позволит выявить тромбы и бляшки атеросклероза, а также детализировать границы аневризм, сужений и сплетений сосудов между собой. Нативная КТ не даст такой точной информации даже при подключении «сосудистого режима».
При диагностике раковых опухолей различия между процедурой с контрастом и без такового проявляются наиболее сильно. Именно злокачественные новообразования питаются наибольшим количеством сосудов, поэтому окрашиваются четко, ярко, с видимыми границами. Поэтому зачастую после нативной КТ, на которой обнаружена опухоль, рекомендуют КТ с контрастированием для уточнения диагноза.
В целом, отличия между процедурами таковы:
-
КТ с контрастным усилением за одно обследование дает намного больше информации для врача.
-
Компьютерная томография с контрастом делает снимки отдельных анатомических зон более детальными, четкими.
Заболевания, при которых применяется компьютерная томография с контрастом:
• Раковые опухоли
• Полипы
• Кисты
• Аденомы
• Липомы
• Тромбы
• Сосудистые мальформации
• Аневризмы
• Язвы и эрозии
• Стеноз вен и артерий
• Стеноз аорты
• Расслоение аорты
• Атеросклероз сосудов
• Бронхиальная астма
• Бронхоэктазы
• Абсцессы
• Флегмоны
КТ – современное исследование, которое поможет найти различные патологии в организме, зачастую – не обнаруженные прочими методами. Контрастное вещество во время КТ позволит четко визуализировать все отклонения и заболевания.
Смирнов В.В. к.м.н, врач высшей квалификацинной категории
Саввова М.В. врач высшей квалификацинной категории
МСКТ – МРТ, КТ, МСКТ – Памятка пациенту – Помощь
Многослойная («мультиспиральная», «мультисрезовая» компьютерная томография — МСКТ) была впервые представлена компанией Elscint Co. в 1992 году. Принципиальное отличие МСКТ томографов от спиральных томографов предыдущих поколений в том, что по окружности гантри расположены не один, а два и более ряда детекторов. Для того, чтобы рентгеновское излучение могло одновременно приниматься детекторами, расположенными на разных рядах, была разработана новая — объёмная геометрическая форма пучка. В 1992 году появились первые двухсрезовые (двухспиральные) МСКТ томографы с двумя рядами детекторов, а в 1998 году — четырёхсрезовые (четырёхспиральные), с четырьмя рядами детекторов соответственно. Кроме вышеотмеченных особенностей, было увеличено количество оборотов рентгеновской трубки с одного до двух в секунду. Таким образом, четырёхспиральные МСКТ томографы пятого поколения на сегодняшний день в восемь раз быстрее, чем обычные спиральные КТ томографы четвертого поколения. В 2004—2005 годах были представлены 32-, 64- и 128-срезовые МСКТ томографы, в том числе — с двумя рентгеновскими трубками. Сегодня же в некоторых больницах уже имеются 320-срезовые компьютерные томографы. Эти томографы, впервые представленные в 2007 году компанией Toshiba, являются новым витком эволюции рентгеновской компьютерной томографии. Они позволяют не только получать изображения, но и дают возможность наблюдать почти что «в реальном» времени физиологические процессы, происходящие в головном мозге и в сердце! Особенностью подобной системы является возможность сканирования целого органа (сердце, суставы, головной мозг и т.д.)за один оборот лучевой трубки, что значительно сокращает время обследования, а также возможность сканировать сердце даже у пациентов, страдающих аритмиями. Несколько 320-ти срезовых сканеров уже установлены и функционируют в России.
Преимущества МСКТ перед обычной спиральной КТ
- улучшение временного разрешения
- улучшение пространственного разрешения вдоль продольной оси z
- увеличение скорости сканирования
- улучшение контрастного разрешения
- увеличение отношения сигнал/шум
- эффективное использование рентгеновской трубки
- большая зона анатомического покрытия
- уменьшение лучевой нагрузки на пациента
Все эти факторы значительно повышают скорость и информативность исследований.
Контрастное усиление
Для улучшения дифференцировки органов друг от друга, а также нормальных и патологических структур, используются различные методики контрастного усиления (чаще всего, с применением йодсодержащих контрастных препаратов).
Двумя основными разновидностями введения контрастного препарата являются пероральное (пациент с определенным режимом выпивает раствор препарата) и внутривенное (производится медицинским персоналом). Главной целью первого метода является контрастирование полых органов желудочно-кишечного тракта; второй метод позволяет оценить характер накопления контрастного препарата тканями и органами через кровеносную систему. Методики внутривенного контрастного усиления во многих случаях позволяют уточнить характер выявленных патологических изменений (в том числе достаточно точно указать наличие опухолей, вплоть до предположения их гистологической структуры) на фоне окружающих их мягких тканей, а также визуализировать изменения, не выявляемые при обычном («нативном») исследовании.
В свою очередь, внутривенное контрастирование можно проводить двумя способами: «ручное» внутривенное контрастирование и болюсное контрастирование.
При первом способе контраст вводится вручную рентгенлаборантом, время и скорость введения не регулируются, исследование начинается после введения контрастного вещества. Этот способ применяется на «медленных» аппаратах первых поколений, при МСКТ «ручное» введение контрастного препарата уже не соответствует значительно возросшим возможностям метода.
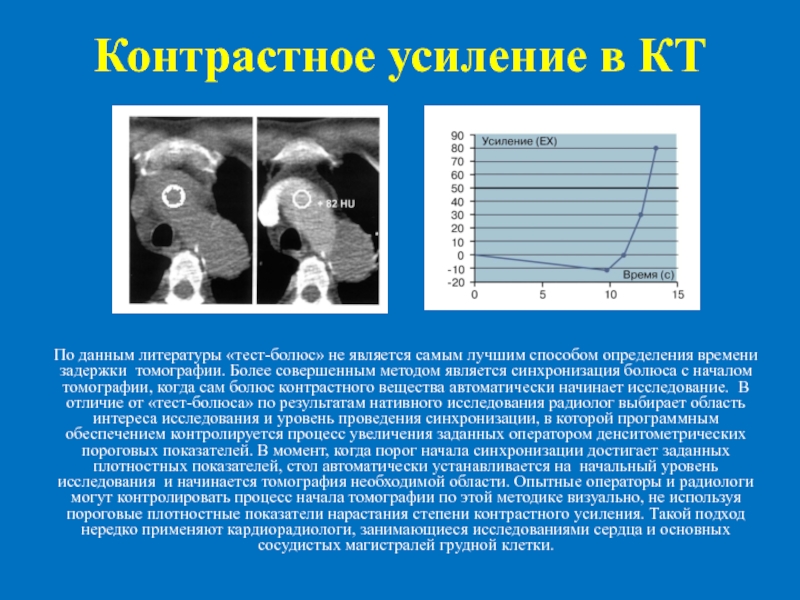
При болюсном контрастном усилении контрастный препарат вводится внутривенно шприцем-инжектором с установленными скоростью и временем подачи вещества. Цель болюсного контрастного усиления — разграничение фаз контрастирования. Время сканирования различается на разных аппаратах, при разных скоростях введения контрастного препарата и у разных пациентов; в среднем при скорости введения препарата 4-5 мл/сек сканирование начинается примерно через 20-30 секунд после начала введения инжектором контраста, при этом визуализируется наполнение артерий (артериальная фаза контрастирования). Через 40-60 секунд аппарат повторно сканирует эту же зону для выделения портально-венозной фазы, в которую визуализируется контрастирование вен. Также выделяют отсроченную фазу (180 секунд после начала введения), при которой наблюдается выведение контрастного препарата через мочевыделительную систему.
Показания к компьютерной томографии
Компьютерная томография широко используется в медицине для нескольких целей:
1. Как скрининговый тест — при следующих состояниях:
- Головная боль
- Травма головы, не сопровождающаяся потерей сознания
- Обморок
- Исключение рака легких. В случае использования компьютерной томографии для скрининга, исследование делается в плановом порядке
2. Для диагностики по экстренным показаниям — экстренная компьютерная томографи:
- Тяжелые травмы
- Подозрение на кровоизлияние в мозг
- Подозрение на повреждение сосуда (например, расслаивающая аневризма аорты)
- Подозрение на некоторые другие острые повреждения полых и паренхиматозных органов (осложнения как основного заболевания, так и в результате проводимого лечения)
3. Компьютерная томография для плановой диагностики:
- Большинство КТ исследований делается в плановом порядке, по направлению врача, для окончательного подтверждения диагноза. Как правило, перед проведением компьютерной томографии, делаются более простые исследования — рентген, УЗИ, анализы и т. д.
4. Для контроля результатов лечения.
5. Для проведения лечебных и диагностических манипуляций, например пункция под контролем компьютерной томографии и др.
Некоторые абсолютные и относительные противопоказания
Без контраста:
- Беременность
- Масса тела более максимальной для прибор.
С контрастом:
- Наличие аллергии на контрастный препарат
- Почечная недостаточность
- Тяжёлый сахарный диабет
- Беременность (тератогенное воздействие рентгеновского излучения)
- Тяжёлое общее состояние пациента
- Масса тела более максимальной для прибора
- Заболевания щитовидной железы
- Миеломная болезнь.
Компьютерная томография – Контрастное усиление
– один из “золотых стандартов” во всём мире, при обследовании пациентов с онкологическими, хирургическими и многими другими заболеваниями.
Преимущества внутривенного контрастирования:
Улучшает дифференцировку органов, тканей, сосудов.
Позволяет выявить поражения не визуализирующиеся на УЗИ.
N.B! КТ паренхиматозных органов (печень, почки и т.д.) без контрастного усиления может быть менее информативна, чем УЗИ!
Позволяет оценить не только локализацию процесса, но и его распространённость, отношение к окружающим органам (инвазия, сдавление).
Даёт возможность неинвазивным методом оценить сосудистое русло (КТ-ангиография).
Исследования без внутривенного контрастирования пригодны только для структур с естественным высоким контрастированием (кости, выявление камней, паренхима лёгких) и для обнаружения гематом. Почти все прочие виды мягкотканых КТ-исследований выигрывают от применения внутривенного контрастного усиления. Новые методы компьютерной томографии в Киеве основаны на анализе различных фаз перфузии после контрастирования.
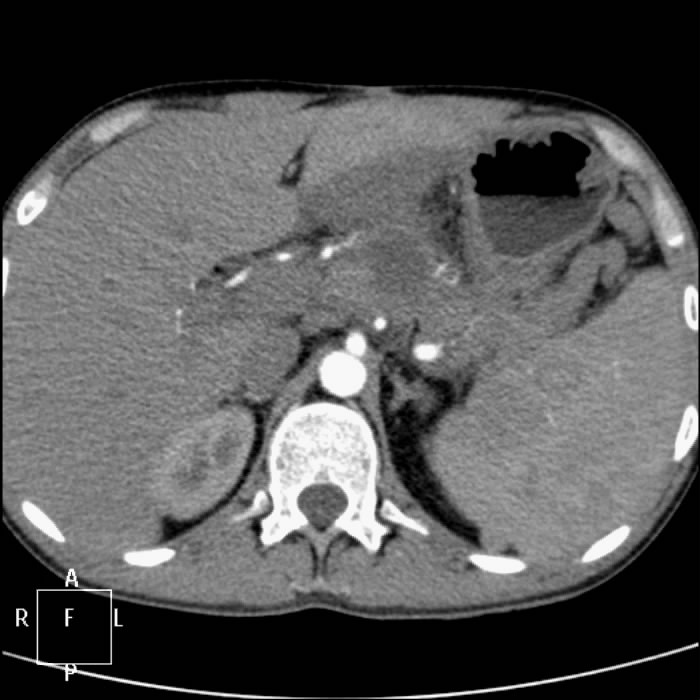
КТ органов брюшной полости. Множественные метастазы в печени.
Без в/в контрастирования.
С в/в контрастированием.
Метастаз головного мозга
Без в/в контрастирования.
С в/в контрастированием.
Какие вещества используют для
внутривенного контрастирования.Современные контрастные препараты для внутривенного введения обычно содержат йод. Различают ионные (Урографин, Триомбраст, Тразограф и т.д.) и неионные (Томогексол, Омнипак, Ультравист и т.д.) контрастные препараты. Изначально были разработаны ионные йодсодержащие контрастные препараты, но внутривенное их введение чревато большим количеством осложнений и в настоящее время они чаще всего используются для контрастирования желудочно-кишечного тракта, так как они абсолютно не всасываются в желудке и кишечнике и выходят неизмененными естественным путем.
Для внутривенного контрастирования сейчас во всем мире пользуются неионными контрастными препаратами, йод в которых связан ковалентными связями, что значительно снижает риск осложнений. По мировой статистике частота осложнений при в/в введении неионных контрастных препаратов составляет 1 на 10000 случаев, т.е. 0,01%. Как правило это случается у людей со склонностью к аллергическим реакциям. Поэтому если Вы склонны к аллергии и Вам предстоит пройти КТ с в/в контрастированием ОБЯЗАТЕЛЬНО сообщите об этом нашему администратору или медсестре.
Как проходит контрастирование и что ощущает пациент в это время.
Для проведения внутривенного контрастирования, перед исследованием медсестра поставит Вам внутривенный катетер в локтевую вену. Непосредственно во время сканирования через этот катетер будет вводиться неионный контрастный препарат. Вводится он не вручную, с помощью специального прибора – инжектора, который делает это с заданными параметрами (объем вещества, скорость введения). Эти параметры имеют большое значение в соблюдении определенных фаз контрастирования, что дает огромное преимущество в последующей постановке диагноза. Объем введенного контрастного препарата варьируется в зависимости от массы тела человека и задач исследования (от 50 до 150 мл).
Инжектор
Во время введения Вы ощутите разливающееся по телу тепло, которое быстро пройдет. Крайне редко возникает крапивница (красноватая аллергическая сыпь на коже), которая быстро проходит при введении антигистаминных препаратов. При любых неприятных ощущениях сразу же сообщите медсестре.
Уже на пятой минуте, практически 90% введенного Вам контрастного вещества, оказывается в моче. Остальное выводится в течение суток.
Для контрастирования желудочно-кишечного тракта может использоваться обычная вода или разведенный раствор ионного контрастного вещества. Объем, который придется выпить, может составлять от 1литра до 1,5-2 литров. Раствор имеет слегка горьковатый привкус. Каких-либо неприятных ощущений не вызывает. Изредка может отмечаться незначительное послабление стула. Связано это с тем, что раствор имеет высокую плотность и вызывает приток жидкости в просвет кишечника, но он абсолютно не всасывается в кишечнике и выходит неизмененным естественным путем. Этот эффект похож на тот, который возникает если выпить насыщенный солевой раствор.
Показания для внутривенного контрастирования
Спектр показаний для внутривенного контрастирования довольно широк. Отметим только самые основные:
При любом подозрении на онкологическую или хирургическую патологию, либо, если данная патология установлена и требуется определить ее распространенность – внутривенное контрастирование проводится ВСЕГДА – это ЗОЛОТОЙ СТАНДАРТ во всем мире.
КТ-исследование органов брюшной полости, забрюшинного пространства, полости таза за редким исключением (травма, поиск камней мочевыделительной системы) делается без в/в контрастирования.
Противопоказания для внутривенного контрастирования
Абсолютным противопоказанием к внутривенному контрастированию является установленная в анамнезе непереносимость неионных рентгенконтрастных веществ, т.е. если Вам их уже вводили и, у Вас возникла серьезная реакция на них. Об этом факте ОБЯЗАТЕЛЬНО сообщите перед исследованием медсестре. Все остальные противопоказания, описанные в литературе (тяжелое состояние пациента, сердечная, почечная недостаточность, гипертиреоз и т.д.)
ОТНОСИТЕЛЬНЫ, так как если остро стоит вопрос о жизни и здоровье пациента и другими способами поставить правильный диагноз не представляется возможным, то при соответствующей предварительной подготовке, в/в контрастирование проводить можно и нужно
И, самое главное! Вопрос о необходимости использования контрастирования (внутривенного или какого-либо другого) решает врач-рентгенолог!!! И только он!!!
За рубежом, если пациент без веских оснований отказывается от проведения контрастного усиления, ему могут отказать в исследовании. Так как целесообразность и диагностическая ценность такого исследования будет низкой.
Узнать сколько стоит КТ диагностика в КиевеЧто такое Контрастное Усиление | Доктор Филин
Контрастное усиление (контрастирование) – метод дифференциации внутренних тканей и органов, а также нормальных и патологических структур путем введения в полый орган или кровоток контрастного вещества (чаще всего, йодосодержащего). Контрастное усиление позволяют уточнить характер патологических изменений, в том числе, достаточно точно указать наличие и характер опухолей на фоне окружающих их мягких тканей, а также визуализировать изменения, не выявляемые при обычном исследовании без контрастирования. Необходимость применения контрастного вещества определяется врачом-рентгенологом.
Существует два основных вида контрастирования, которые часто совмещаются:
- Пероральное – пациент с определенным режимом выпивает раствор препарата. При этом улучшается контрастирование полых органов желудочно-кишечного тракта;
- Внутривенное – препарат вводится в вену пациента во время исследования и позволяет оценить характер накопления контрастного препарата тканями и органами через кровеносную систему.
Внутривенное контрастирование, в свою очередь, проводится двумя способами:
- «Ручное», когда контраст вводится медперсоналом вручную, время и скорость введения не регулируются. Это устаревший способ и он не соответствует значительно возросшим возможностям метода МСКТ;
- Болюсное контрастирование, когда препарат вводится автоматизированным инжектором (Vistron CT, Medrad) с точно установленными скоростью и временем подачи вещества. При этом учитываются клиническая задача, возраст, вес и другие особенности пациента.
МСКТ с болюсным контрастированием позволяет выявить и дифференцировать опухолевые образования любых локализаций, в частности, очаговых образований паренхиматозных органов (печени, почек, поджелудочной железы, селезенки, в головном мозге), а также оценить распространение злокачественного опухолевого процесса, резектабельность опухоли, выявить метастатическое поражение лимфоузлов и паренхиматозных органов.
Противопоказания к применению контрастного усиления
КТ контрастирование в Cortex.kg
Виды КТ с контрастированиемСуществует несколько способов введения контрастного вещества, от которых зависит результат и качество исследования. Среди них:
- Простое внутривенное введение контраста;
- Внутривенное болюсное введение контраста;
- Прием контраста внутрь (пероральное введение контраста).
Способ перорального приема контрастного вещества применяется для исследования преимущественно различных отделов желудочно-кишечного тракта, органов брюшной полости и малого таза в целом.
Компьютерная томография с внутривенным контрастированиемПростое внутривенное введение контрастного вещества является менее информативным, но более легким в выполнении и экономичным методом, в сравнении с более современным – внутривенным болюсным введением.
Внутривенное болюсное контрастирование
Методика внутривенного болюсного введения контрастного вещества полностью автоматизирована и осуществляется непосредственно при проведении спиральной компьютерной томографии. Предварительно пациенту устанавливают интродюсер (внутривенный катетер с клапаном) в локтевую вену. Во время проведения компьютерной томографии с помощью специального инжектора-дозатора стерильный раствор контрастного вещества подается в вену со скоростью 3 мл в секунду. От удаленности от сердца исследуемого органа или сосуда зависит время регистрации рентгеновского излучения. Врач компьютерной диагностики ориентируется на сроки распространения контраста в тот или иной сосуд и выполняет исследование строго по времени. Так из локтевой вены в сосуды сердца и восходящую аорту контрастный препарат попадает через 15-18 секунд, в грудную аорту – через 20 секунд, а в брюшной отдел аорты – через 25 секунд. Так время исследования соответствует распространению контраста в исследуемый орган.
Компьютерная томография с внутривенным контрастированием болюсным методом проводится для исследования аорты, сосудов шеи, сосудов головного мозга, брюшной аорты, почек. Она менее травматична, чем обычная ангиография и дает не менее точные результаты, позволяет оценить не только просвет сосуда, но и качество его стенки, атеросклеротические и тромботические наслоения, состояние мягких тканей, окружающих сосуд.
Для исследований с контрастированием используются йодсодержащие рентгенконтрастные вещества, преимущественно водорастворимые. Водорастворимые контрастные вещества делятся на ионные и неионные. Меньший риск побочных эффектов, но большую стоимость имеют неионные контрасты. Они и применяются чаще для КТ с разными способами контрастирования.
Противопоказания к компьютерной томографии с контрастированиемВ некоторых случаях риск от введения контрастного препарат превышает необходимость КТ исследования. Поэтому при наличии у пациента аллергии на йод, морепродукты, сахарного диабета, бронхиальной астмы, некоторых тяжёлых заболеваний сердца и почек, печени показания к проведению КТ устанавливаются в индивидуальном порядке, а исследование проводится с большой осторожностью. При проведении КТ с контрастированием необходимы результаты биохимического анализа крови: креатинин, мочевина, АЛТ, АСТ (исследования функции печени и почек), так как почечная и печеночная недостаточность являются прямым противопоказанием к введению контрастного вещества. Всё это необходимо учитывать при планировании КТ исследования.
В день проведения исследования пациенту рекомендуется увеличенное потребление жидкости (до 3-х литров в сутки).
Брюшная полость с болюсным контрастированием
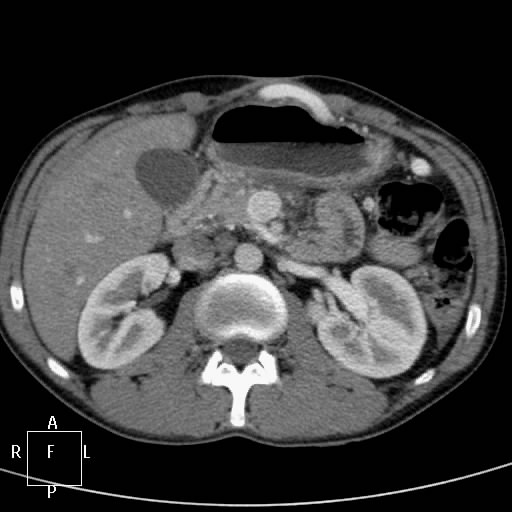
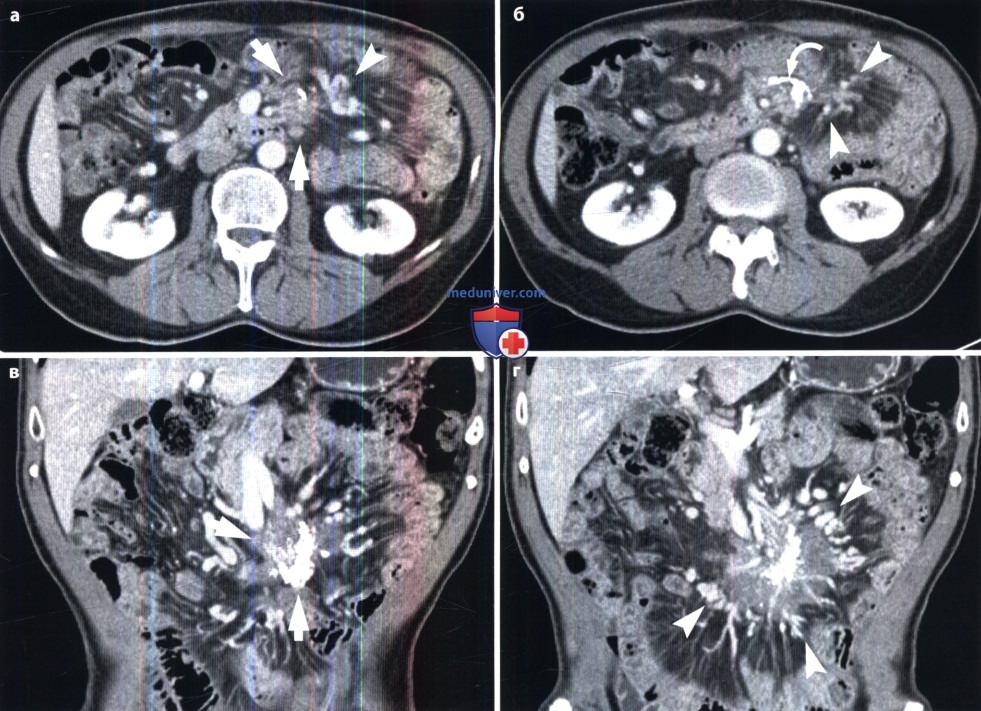
Показания для проведения мультиспиральной компьютерной томографии брюшной полости с болюсным контрастированием:
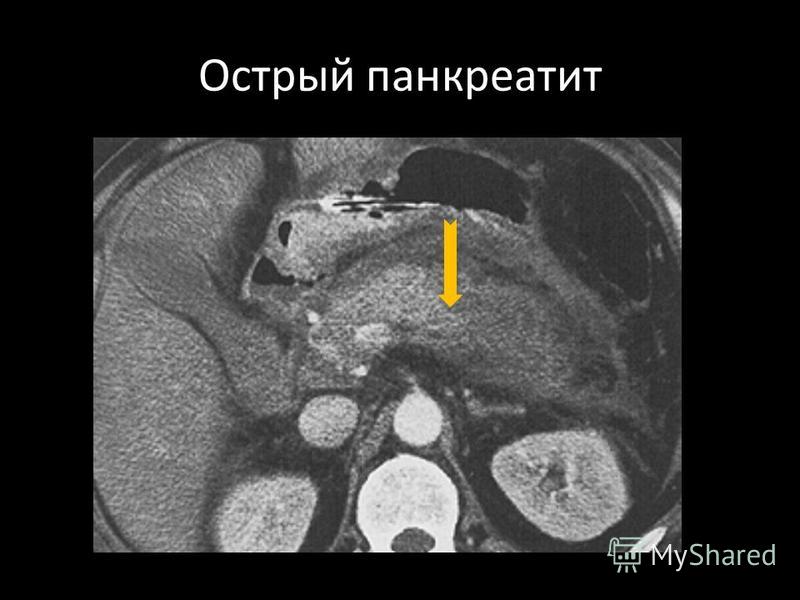
- сомнения в болезни поджелудочной железы – образование кисты, острый панкреатит
- для подтверждения или опровержения подозрения опухоли в данной полости
- если при проведении эхографии желчного пузыря появились противоречивые данные
- подготовка к проведению операции на органах брюшной полости, а также контрольпроцесса лечения после нее
- чтобы оценить эффективность лечения рака, увеличение размеров печени и селезенки
- с целью диагностики жирового гепатоза и гемохроматоза печени
- получение травмы живота, метастазирование в лимфатические узлы
- абсцесс в печени и селезенке, подозрение на опухоли в почках
- появление необъяснимых болевых ощущений в районе брюха
- нарушения в сосудах, приводящие к вторичным изменениям в органах
- прощупываемые объемные образования в области брюха
- если у больного имеются противопоказания к проведению МРТ
- диференциальная диагностика доброкачественного и злокачественного поражения в зоне исследования
- диференциальная диагностика между первичным и вторичным характером злокачественного поражения
МСКТ брюшной полости с болюсным контрастированием выявляет
МСКТ с болюсным внутривенным введением контрастного вещества в рутинных исследованиях, прежде всего, применяется для выявления и дифференцирования опухолевых образований любых локализаций, в частности:
- выявление и дифференциальная диагностика очаговых образований паренхиматозных органов (печени, почек, поджелудочной железы, селезенки)
- оценка местной распространенности злокачественного опухолевого процесса, оценка резектабельности опухоли, выявление метастатического поражения лимфоузлов и паренхиматозных органов
- важным аспектом использования МСКТ с болюсным введением контрастного вещества является оценка состояния органов брюшной полости при ургентных состояниях (угрожающих жизни и требующих проведения неотложных лечебных мероприятий: травматическом повреждении органов, острой боли в животе, ОНМК и др.)
Противопоказания к МСКТ брюшной полости с болюсным контрастированием:
- однозначным противопоказанием для проведения МСКТ является беременность, независимо от сроков беременности
- пациентам младше 14 лет не рекомендуется проведение исследования
- большой вес пациента, так как большинство компьютерных томографов имеют определенные ограничения по весу
- относительным противопоказанием является гиперкинез (нервное расстройство, сопровождающееся непроизвольными движениями, подёргиваниями конечностей) и другие невротические состояния
- аллергия на йод
- почечная недостаточность
- тяжёлый сахарный диабет
- период лактации
- заболевания щитовидной железы
- бронхиальная астма
- если при биохимическом анализе крови содержание креатинина больше 1,5 мг/дл
- миеломная болезнь – при проведении ангиографии
Подготовка к проведению МСКТ головного мозга с контрастированием:
Пациентам с повышенным риском возникновения аллергических реакций и сниженной функцией почек следует проводить предварительную терапию антигистаминными препаратами, а так же отказаться от приема мочегонных и нефротоксических препаратов в день исследования.
В наших центрах используют контрастное вещество Ультравист® 300 и Ультравист® 370 Bayer Pharma AG, D-13342, Berlin, Germany
Длительность исследования 10 минут.
Записаться на прием
Методика двойного болюсного внутривенного введения контрастного вещества для мультирегионального детского тела CT
Цели: Оптимальное усиление сосудов и паренхимы для многозональной детской компьютерной томографии (КТ) имеет много проблем. В настоящее время используются различные подходы, связанные с различным качеством изображения и дозой облучения. Мы представляем методику двойного болюсного внутривенного контраста (DBI) для получения изображений грудной клетки, брюшной полости и таза за один прием с оценкой многокомпонентного сосудистого усиления.
Методы: Режим DBI был разработан для использования с программируемым двухголовым насос-форсункой. За большим начальным болюсом (объем в две трети) следует болюс меньшего размера (объем в одну треть) перед визуализацией грудной клетки, брюшной полости и таза за один прием, через 45-65 секунд от начала первоначальной инъекции. Скорость потока и время второго болюса были адаптированы к весу пациента и объему контраста с использованием пяти весовых категорий.Мультикомпартментное помутнение сосудов и качество изображения оценивалось в когорте из 130 пациентов.
Полученные результаты: Методика DBI привела к согласованному усилению сосудов, состоящих из нескольких частей (грудной аорты, легочной артерии, брюшной аорты и воротной вены). Наблюдались ранние артефакты увеличения паренхимы селезенки и изменения в увеличении почек.
Заключение: Мы представляем методику внутривенного контрастирования с двойным болюсом, стратифицированного по весу, для улучшения качества изображения при компьютерной томографии многих областей тела у детей.
Ключевые моменты: • У детей оптимальное усиление сосудов и паренхимы при многообластной компьютерной томографии является сложной задачей.• Метод двойного болюсного контрастирования обеспечивает согласованное помутнение артерий и воротной вены. • Адаптация к размеру пациента достигается за счет стратификации на пять весовых категорий. • Можно избежать штрафов за дозу при «перекрытии» и «двухфазной» визуализации.
Автоматическое отслеживание болюса в сравнении с методом фиксированной задержки в двухфазной мультидетекторной компьютерной томографии брюшной полости
Иран Дж. Радиол. 2014 Янв; 11 (1): e4617.
Атооса Адиби
1 Отделение радиологии Исфаханского университета медицинских наук, Исфахан, Иран
Али Шахбази
1 Отделение радиологии Исфаханского университета медицинских наук, Исфахан, Иран
1 Отделение радиологии, Исфаханский университет медицинских наук, Исфахан, Иран
* Автор, ответственный за переписку: Атооса Адиби, отделение радиологии, больница Альзахра, Исфаханский университет медицинских наук, проспект Соффе., Исфахан, Иран. Тел .: +983116255555, Факс: + 98-3116687898, Электронная почта: ri.ca.ium.dem@ibida_aПолучено 3 апреля 2012 г .; Пересмотрено 14 августа 2012 г .; Принято 13 октября 2012 г.
Авторские права © 2014, Тегеранский университет медицинских наук и Иранское общество радиологов; Опубликовано Kowsar Corp.Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии правильного цитирования оригинальной работы.
Эта статья цитируется в других статьях в PMC.Аннотация
Предпосылки
Отслеживание болюса позволяет индивидуализировать временную задержку для начала сканирования в спиральной компьютерной томографии (КТ).
Объективы
Мы сравнили автоматический метод отслеживания болюса с методом фиксированной задержки при двухфазном усилении контраста во время мультидетекторной компьютерной томографии брюшной полости.
Пациенты и методы
Взрослые пациенты, направленные на спиральную КТ брюшной полости, были рандомизированы на две группы; в группе 1 артериальная и портальная фазы спирального сканирования начинались через 25 и 55 с после начала введения контрастного вещества; в группе 2 с использованием программного обеспечения автоматического отслеживания болюса повторяющиеся мониторинговые сканирования выполнялись в просвете нисходящей аорты как интересующей области с порогом запуска диагностического сканирования 60 HU.Повышение контрастности аорты, печени и селезенки сравнивали между группами.
Результаты
В исследование были включены 48 пациентов (23 мужчины, 25 женщин, средний возраст = 56,4 ± 13,5 лет). Увеличение контраста аорты, печени и селезенки в артериальной фазе было одинаковым между двумя группами (P> 0,05). Что касается портальной фазы, то аорта и селезенка были более усилены в группе с отслеживанием болюса (P <0,001). Болюсное отслеживание обеспечивало более однородное усиление контраста у разных пациентов, чем метод фиксированной задержки по времени в печени в портальной фазе, но не в артериальной фазе.
Выводы
Метод автоматического болюсного отслеживания приводит к более высокому контрастному усилению аорты и селезенки на портальной фазе, но не влияет на улучшение функции печени. Однако отслеживание болюса связано с уменьшением вариабельности улучшения печени у разных пациентов.
Ключевые слова: Многодетекторная компьютерная томография, томография, спиральные вычисления
1. Предпосылки
Благодаря последним достижениям в технологии спиральной компьютерной томографии (КТ), теперь стало возможным получение изображений всей печени с помощью многодетекторной компьютерной томографии (МДКТ). менее чем за 20 секунд с двумя или более различными фазами перфузии (1).При таком быстром сканировании важно оптимизировать временную задержку между инъекцией контрастного вещества и началом диагностического сканирования, особенно для артериальной фазы (2). Индивидуальные вариации в отношении массы тела, частоты сердечных сокращений, времени кровообращения и сердечных нарушений могут влиять на временное окно, а также на необходимую скорость и объем контрастного вещества и, таким образом, могут быть проблематичными при достижении оптимального усиления контраста (3-5). Хотя отслеживание небольшого болюса контрастного вещества (10-20 мл) перед диагностическим сканированием может помочь индивидуализировать временную задержку, это трудоемкий метод (6).Чтобы преодолеть эти ограничения, недавно была разработана компьютерная система отслеживания болюса, которая автоматически запускает диагностическое сканирование, запускаемое самим контрастным усилением. Используя сканирование с низкой дозой (около 50 мА), эта технология позволяет запускать сканирование вручную или автоматически, когда усиление контрастности повышается до предварительно определенного порога в интересующей области (ROI) (7). Некоторые исследования показали, что автоматическое отслеживание болюса может лучше индивидуализировать временную задержку для начала диагностического сканирования печени, а также поджелудочной железы и, таким образом, улучшить степень усиления контраста и заметность поражения паренхимы (8-10).Однако по этому поводу все еще существуют разногласия, и результаты предыдущих исследований были другими. Некоторые исследования рекомендуют болюсное отслеживание только в том случае, если пациенты старше 70 лет и / или имеют сердечно-сосудистые заболевания, и / или когда нет адекватной антекубитальной вены для инъекции контрастного вещества для снижения дополнительной дозы облучения (11). Кроме того, некоторые исследования показали, что при использовании метода отслеживания болюса 35% пациентов могут не достичь порога на 50 HU выше исходного уровня через 60 секунд после начала инъекции, и тогда потребуется использование установленной задержки (12).
2. Цели
Таким образом, это исследование было проведено для сравнения автоматического отслеживания болюса с фиксированной временной задержкой при двухфазном усилении контраста аорты, печени и селезенки во время МДКТ.
3. Пациенты и методы лечения
3.1. Набор пациентов
Это проспективное исследование было проведено с участием 48 последовательных взрослых пациентов, направленных с августа по ноябрь 2010 г. в отделение MDCT больницы Альзахра (Исфахан, Иран) для проведения КТ брюшной полости с контрастным усилением. Показаниями были неуверенные поражения печени при ультразвуковом исследовании (n = 19), подозрительные метастазы (n = 15) и гепатоцеллюлярная карцинома (HCC) (n = 14).Пациенты с сердечной недостаточностью в исследование не включались. Комитет по этике Исфаханского университета медицинских наук одобрил исследование, и от всех пациентов было получено информированное согласие.
3.2. Метод визуализации
Пациенты были обследованы с помощью многодетекторного компьютерного томографа (LightSpeed VCT 64, GE Healthcare, Солт-Лейк-Сити, Юта, США). Параметры сканирования: коллимация 64 × 0,625 мм; толщина среза 5 мм; смола 1,375; скорость стола / вращение портала 55 мм; кВ 140; и мА 240.Перед введением контрастного вещества была проведена спиральная КТ печени без усиления. Для двухфазной спиральной компьютерной томографии печень сканировали в артериальной и портально-венозной фазах перфузии печени. С помощью механического инжектора 100 мл Иопромида (Ultravist 300, Schering, Берлин, Германия) вводили в антекубитальную вену со скоростью 4,0 мл / с.
Пациенты были рандомизированы на две группы с использованием случайной таблицы, созданной с помощью программного обеспечения случайного распределения (13). В группе 1 сканирование по спирали в артериальной и воротно-венозной фазах было начато через 25 и 55 с соответственно после начала введения контрастного вещества.В группе 2 эталонное сканирование, которое определяет уровень сканирования монитора с отслеживанием болюса, было размещено на 1 см ниже уровня диафрагмы на инспираторной топограмме. Программное обеспечение для автоматического отслеживания болюса (Snapshot Pulse / GE Healthcare, Солт-Лейк-Сити, Юта, США) было реализовано на сканере. Повторные мониторинговые сканирования выполнялись на уровне одного среза во время дыхания при 50 мА с продолжительностью сканирования 0,5 с. Контрольные сканирования начинались с задержкой в 8 с и повторялись каждые 2 с при спокойном дыхании.Как только порог контрастного усиления (60 HU) был достигнут в пределах ROI (просвет нисходящей аорты), было начато диагностическое спиральное сканирование (8). Примерно через 6-9 с (для перемещения стола и команды дыхания пациенту) после превышения порогового уровня запускалось сканирование по спирали артериальной фазы. Портально-венозное сканирование автоматически запускалось через 15 секунд после завершения сканирования артериальной фазы (8).
3.3. Оценки
У всех пациентов плотность печени перед контрастированием измерялась путем вычисления среднего из шести измерений ROI (площадь каждой ROI составляла не менее 3 см 2 ), определенных на шести различных уровнях среза от купола печени до его нижние части.Интервал между выбранными разрезами КТ печени составлял около 2 см. На постконтрастных сканированиях среднее ослабление нормальной паренхимы для каждого среза оценивалось отдельно по среднему значению трех измерений ROI с площадью не менее 3 см 2 . При всех измерениях ROI избегали больших внутрипеченочных сосудов, поражений печени или эффектов частичного объема. Рассчитывали максимальную плотность печени в артериальной фазе и среднюю плотность печени в портально-венозной фазе. Кроме того, определялась предконтрастная и постконтрастная плотность аорты примерно на два сантиметра ниже диафрагмы и селезенки в центральной части ее паренхимы (8).
3.4. Статистический анализ
Статистический анализ выполняли с использованием программного обеспечения SPSS для Windows 16.0 (SPSS Inc., Чикаго, Иллинойс, США) с помощью t-критерия независимой выборки для несопоставленных выборок, сравнивая группу 1 с группой 2. Уровень значимости рассматривался при P <0,05. .
4. Результаты
За исследуемый период обследовано 23 пациента мужского и 25 женского пола со средним возрастом 56,4 ± 13,5 года. Средний вес составил 68,0 ± 8,3 кг в группе 1 и 70,3 ± 8,3 кг во 2 группе (P> 0.05). Порог усиления в аорте 60 HU был достигнут у всех пациентов через 15-23 с (17,7 ± 2,2 с) после начала введения контраста. Количество сканирований монитора варьировалось от 3 до 7 сканирований (4,5 ± 1,1), что соответствовало дополнительному воздействию 227,0 ± 57,0 мАс (50 мА на срез, время сканирования 0,5 с). представляет плотность до контрастирования и усиление (в единицах HU) аорты, печени и селезенки на артериальной и портальной фазах в двух группах. Эти две группы были схожи в отношении плотности аорты, печени и селезенки перед контрастированием (P> 0.05). Не было существенной разницы между двумя группами в максимальном контрастировании аорты, печени и селезенки в артериальной фазе (P> 0,05). Что касается портальной фазы, то аорта и селезенка были более усилены в группе с отслеживанием болюса (P <0,001). Рисуя кривые нормального распределения, болюсное отслеживание обеспечивало более однородное усиление контраста у разных пациентов, чем метод фиксированной задержки по времени в печени в портальной фазе, но не значительно в артериальной фазе (и).
Повышение контрастности печени в A, артериальной и B, портальной фазе с фиксированным временем задержки
Повышение контрастности печени в A, артериальной и B, портальной фазе с методом болюсного отслеживания
Таблица 1.
Предконтрастная плотность и усиление (HU) аорты, печени и селезенки на артериальной и портальной фазах
| Фиксированная задержка времени a (n = 24) | Болюс Отслеживание (n = 24) | Значение P | |||
|---|---|---|---|---|---|
| Аорта | Исходный уровень | 42.7 ± 7,3 | 45,4 ± 8,4 | 0,256 | |
| Усиление артериальной фазы | 231,7 ± 104,7 | 264,7 ± 82,2 | 0,231 | ||
| 374 | Портал 9014 ± | ± 121,1 | <0,001 | ||
| Печень | Исходный уровень | 58,4 ± 10,5 | 57,8 ± 8,3 | 0,833 | |
| Улучшение артериальной фазы14 | 7 ± 4,55,0 ± 5,1 | 0,637 | |||
| Усиление фазы портала | 43,8 ± 20,9 | 42,9 ± 15,5 | 0,858 | ||
| 0,820 | |||||
| Усиление артериальной фазы | 37,4 ± 29,9 | 30,8 ± 14,8 | 0,340 | ||
| Усиление портальной фазы | 80.2 ± 19,1 | 112,2 ± 34,7 | <0,001 |
5. Обсуждение
Объем контрастного вещества и скорость введения являются контролируемыми факторами, которые влияют на степень увеличения контрастности при КТ печени. Однако индивидуальные вариации, такие как масса тела, частота сердечных сокращений и нарушения кровообращения, являются другими важными влияющими факторами, которые нельзя контролировать или легко учесть (3-5). Таким образом, такая техника, как автоматическое отслеживание болюса, которое может индивидуализировать временную задержку между введением контрастного вещества и началом диагностической визуализации, имеет большую ценность.Мы исследовали, может ли автоматическое болюсное отслеживание, по сравнению с фиксированной временной задержкой, обеспечить лучшее усиление контраста аорты, печени и селезенки во время двухфазной МДКТ. Мы обнаружили, что метод болюсного отслеживания полезен для усиления контраста при визуализации аорты и селезенки в портальной фазе, но не было положительного эффекта для этого метода визуализации печени. В этом отношении результаты предыдущих исследований были другими. Динкель и его коллеги (14) обнаружили повышенное печеночное усиление на портальной фазе с помощью болюсного отслеживания (порог 31 HU) по сравнению с методом фиксированной задержки (80 с).Itoh и его коллеги (11) сравнили отслеживание болюса (порог 130 HU) с фиксированной временной задержкой (30 с) при визуализации печени в поздней артериальной и портально-венозной фазах у пациентов с гепатоцеллюлярной карциномой (ГЦК) и не обнаружили разницы между эти два метода – увеличение или получение контраста или заметное поражение печени. В другом исследовании Mehnert et al. (9), отслеживание болюса (порог 40 HU) сравнивалось с исследованиями с временной задержкой (65 с) для монофазной спиральной КТ печени, и не было обнаружено различий в паренхиматозном усилении между двумя методами.Однако при автоматическом отслеживании болюса наблюдалась значительно большая разница в плотности поражения печени (8). В другом исследовании этих исследователей на двухфазной спиральной КТ печени авторы обнаружили более высокое максимальное усиление паренхимы печени в группе с фиксированной временной задержкой. Исследователи предположили, что это более высокое усиление может снизить способность очертить артериализованное поражение в печени (9). Brodoefel и его коллеги (15) сравнили отслеживание болюса (порог 50 HU) с точки зрения улучшения состояния печени, видимого поражения печени и вариабельности между изображениями в последовательных МДКТ пациентов с метастазами в печени и сравнили его с эмпирической задержкой. 65 с.Авторы обнаружили более высокое улучшение печени (около 11 UH) и заметность гипоусиливающих поражений (около 20 HU) с запуском паренхимы по сравнению с методом фиксированной задержки по времени (15).
Разница между предыдущими исследованиями может быть связана с используемым протоколом; порог и соответствующая задержка сканирования (интервал между обнаружением повышения порога и инициированием визуализации), ROI для порога, а также объем контраста и скорость впрыска (16, 17). В исследовании Kitamura et al.(18) болюсное отслеживание с разными порогами (120, 160 и 200 HU аорты) сравнивалось с визуализацией в двойной артериальной фазе (25 и 40 с) для выявления гиперваскулярного ГЦК. Авторы обнаружили, что отслеживание болюса с порогом 200 HU привело к более заметному ослаблению (42 ± 18 HU), чем с 120 HU (23 ± 11 HU) и 160 HU (25 ± 11 HU), а также к более высокой чувствительности (92,7%). ), чем 120 HU (72,4%) и 160 HU (71,1%) (18). Sandstede et al. (19) также сравнили шесть протоколов с комбинацией 5- или 10-секундных задержек сканирования и пороговых значений 50, 75 или 100 HU (в аорте).Авторы обнаружили, что 10-секундная задержка после порога 75HU привела к оптимальной артериальной фазе у большинства пациентов (определяемой как 20-30% -ное улучшение функции печени в фазе воротной вены). Однако, по сравнению со стандартной задержкой, отслеживание болюса выявило только тенденцию к различию (19). Результаты исследования Kim et al. (20) предлагает оптимальную задержку сканирования для изображений артериальной фазы при обнаружении ГЦК примерно от 14 до 30 секунд от порога 100 HU, в то время как в другом исследовании Goshima и его коллег (21) было предложено от 10 до 15 секунд для артериальная фаза и от 45 до 55 секунд для фазы воротной вены после повышения порога обнаружения на 50 HU в нижнем грудном отделе аорты 21.По данным Osimani et al. (22) слишком раннее сканирование приводит к изображениям, которые получают до усиления сосудистого пика, в то время как слишком позднее сканирование приводит к увеличению питания паренхимы печени в портальной фазе. Хорошие характеристики были получены при задержке сканирования от 10 до 19 секунд с момента запуска (22).
Мы обнаружили, что отслеживание болюса обеспечивает более однородное усиление контраста, чем метод фиксированной задержки у разных пациентов. Frush и его коллеги (23) в исследовании, проведенном на детях, также обнаружили, что метод болюсного отслеживания не только улучшил контрастное усиление, но также привел к более однородному усилению от верхнего до нижнего уровней печени, чем метод фиксированной задержки по времени.Brodoefel (15) также обнаружил, что отслеживание болюса в печени связано с уменьшением вариабельности улучшения печени у разных пациентов и в ходе последовательных контрольных обследований отдельных пациентов, что позволяет более точно наблюдать за пациентами.
Результаты этого исследования показали, что метод автоматического болюсного отслеживания с порогом 60 HU на аорте приводит к более высокому контрастному усилению аорты и селезенки на портальной фазе, но не влияет на улучшение функции печени.Кроме того, болюсное отслеживание связано с уменьшением вариабельности улучшения состояния печени у разных пациентов. Необходимы дальнейшие исследования, чтобы найти оптимальный протокол, включая порог и соответствующую задержку сканирования, ROI для порога, а также объем контраста и скорость инъекции. Мы предлагаем другое исследование с большими объемами образцов при различных патологиях печени, сравнивая эти постконтрастные методы, сравнивая индивидуальную патологию печени отдельно.
Благодарности
Благодарностей нет.
Сноски
Значение для политики / практики / исследований / медицинского образования в области здравоохранения: Результаты текущего исследования могут помочь рентгенологам повысить качество изображения КТ брюшной полости с помощью мутидетектора брюшной полости с использованием метода автоматического болюсного отслеживания вместо метода фиксированной задержки, поскольку он показывает более высокое контрастное усиление портальной фазы в некоторых органах брюшной полости.
Вклад авторов: Все авторы в равной степени участвовали в этом исследовании.
Раскрытие финансовой информации: Конфликт интересов отсутствует.
Финансирование / поддержка: Исследование финансировалось за счет собственных средств.
Список литературы
1. Ото А., Тамм Е.П., Шкларук Дж. Многодетекторная рядная компьютерная томография печени. Radiol Clin North Am. 2005; 43 (5): 827-48. DOI: 10.1016 / j.rcl.2005.05.002. [PubMed] [CrossRef] [Google Scholar] 2. Итикава Т., Эртурк С.М., Араки Т. Многофазная многорядная КТ печени с контрастным усилением: теория повышения контрастности и практический протокол сканирования с комбинацией фиксированной продолжительности инъекции и дозы контрастного вещества, адаптированной к массе тела пациента.Eur J Radiol. 2006. 58 (2): 165–76. DOI: 10.1016 / j.ejrad.2005.11.037. [PubMed] [CrossRef] [Google Scholar] 3. Bae KT, Seeck BA, Hildebolt CF, Tao C, Zhu F, Kanematsu M, et al. Повышение контрастности в MDCT сердечно-сосудистой системы: влияние массы тела, роста, площади поверхности тела, индекса массы тела и ожирения. AJR Am J Roentgenol. 2008. 190 (3): 777–84. DOI: 10.2214 / AJR.07.2765. [PubMed] [CrossRef] [Google Scholar] 4. Bae KT, Tao C, Gurel S, Hong C, Zhu F, Gebke TA и др. Влияние веса пациента и продолжительности сканирования на усиление контраста во время мультидетекторной КТ-ангиографии легких.Радиология. 2007. 242 (2): 582–9. DOI: 10.1148 / radiol.2422052132. [PubMed] [CrossRef] [Google Scholar] 5. Brink JA. Оптимизация контрастности и синхронизация сканирования для одно- и многорядной компьютерной томографии. J Comput Assist Tomogr. 2003; 27 Приложение 1: С3–8. [PubMed] [Google Scholar] 6. Лаги А. Многодетекторная компьютерная томография (64 среза) печени: методы исследования. Eur Radiol. 2007. 17 (3): 675–83. DOI: 10.1007 / s00330-006-0405-0. [PubMed] [CrossRef] [Google Scholar] 7. Сильверман П.М., Робертс С., Теффт М.С., Браун Б., Фокс С.Х., Купер С. и др.Спиральная компьютерная томография печени: клиническое применение автоматизированного компьютерного метода SmartPrep для получения изображений с оптимальным усилением контраста. AJR Am J Roentgenol. 1995. 165 (1): 73–8. DOI: 10.2214 / ajr.165.1.7785637. [PubMed] [CrossRef] [Google Scholar] 8. Mehnert F, Pereira PL, Trubenbach J, Kopp AF, Claussen CD. Автоматическое отслеживание болюса в однофазной спиральной компьютерной томографии печени: заметность поражения печени. Eur Radiol. 2001. 11 (4): 580–4. [PubMed] [Google Scholar] 9. Mehnert F, Pereira PL, Trubenbach J, Kopp AF, Claussen CD.Двухфазная спиральная КТ печени: автоматическое болюсное отслеживание или временная задержка? Eur Radiol. 2001. 11 (3): 427–31. [PubMed] [Google Scholar] 10. Фукукура Ю., Такуми К., Камияма Т., Шиндо Т., Хигаши Р., Накаджо М. Аденокарцинома поджелудочной железы: сравнение автоматического отслеживания болюса и задержки эмпирического сканирования. Визуализация брюшной полости. 2010. 35 (5): 548–55. DOI: 10.1007 / s00261-009-9560-5. [PubMed] [CrossRef] [Google Scholar] 11. Ито С., Икеда М., Ачива М., Сатаке Х., Ивано С., Исигаки Т. Визуализация печени в поздней артериальной и воротно-венозной фазах с помощью мультиспирального компьютерного томографа у пациентов без нарушений кровообращения: автоматическое отслеживание болюса или задержка эмпирического сканирования? Eur Radiol.2004. 14 (9): 1665–73. DOI: 10.1007 / s00330-004-2321-5. [PubMed] [CrossRef] [Google Scholar] 12. Полсон EK, Фишер AJ, Делонг DM, Паркер DD, Нельсон RC. Спиральная компьютерная томография печени с компьютерной технологией отслеживания болюса: можно ли предсказать, какие пациенты не достигнут порога улучшения? Радиология. 1998. 209 (3): 787–92. DOI: 10.1148 / radiology.209.3.9844675. [PubMed] [CrossRef] [Google Scholar] 14. Динкель HP, Маттич Дж. [Многорядная детекторная КТ-ангиография брюшной аорты: отслеживание болюса по сравнению с фиксированной задержкой начала].Рофо. 2003. 175 (11): 1567–71. DOI: 10,1055 / с-2003-43394. [PubMed] [CrossRef] [Google Scholar] 15. Brodoefel H, Tognolini A, Zamboni GA, Gourtsoyianni S, Claussen CD, Raptopoulos V. Стандартизация MDCT печени путем отслеживания усиления паренхимы печени для запуска визуализации. Eur Radiol. 2012; 22 (4): 812–20. DOI: 10.1007 / s00330-011-2310-4. [PubMed] [CrossRef] [Google Scholar] 16. Симидзу Т., Мисаки Т., Ямамото К., Суэёси К., Нарабаяши И. Спиральная компьютерная томография печени с компьютерной технологией отслеживания болюса: задержка сканирования артериального фазового сканирования и влияние скорости потока.J Comput Assist Tomogr. 2000. 24 (2): 219–23. [PubMed] [Google Scholar] 17. Копка Л., Роденвальдт Дж., Фишер Ю., Мюллер Д. В., Остман Дж. В., Граббе Э. Двухфазная спиральная КТ печени: эффекты болюсного отслеживания и различных объемов контрастного вещества. Радиология. 1996. 201 (2): 321–6. DOI: 10.1148 / радиология.201.2.8888218. [PubMed] [CrossRef] [Google Scholar] 18. Китамура Т., Итикава Т., Эртурк С.М., Накадзима Х., Соу Х., Араки Т. и др. Обнаружение гиперваскулярной гепатоцеллюлярной карциномы с помощью многорядной КТ: визуализация одной артериальной фазы с помощью компьютерной техники автоматического болюсного отслеживания по сравнению с двойной визуализацией в артериальной фазе.J Comput Assist Tomogr. 2008. 32 (5): 724–9. DOI: 10.1097 / RCT.0b013e318154b1f5. [PubMed] [CrossRef] [Google Scholar] 19. Sandstede JJ, Werner A, Kaupert C, Roth A, Jenett M, Harz C, et al. Проспективное исследование, сравнивающее различные концентрации йода для трехфазной мультидетекторной рядной КТ верхней части живота. Eur J Radiol. 2006. 60 (1): 95–9. DOI: 10.1016 / j.ejrad.2006.05.012. [PubMed] [CrossRef] [Google Scholar] 20. Ким Т., Мураками Т., Хори М., Такамура М., Такахаши С., Окада А. и др. Небольшая гиперваскулярная гепатоцеллюлярная карцинома, выявленная при двойной артериальной фазе КТ, выполненной с однократным сканированием с задержкой дыхания и автоматическим болюсным отслеживанием.AJR Am J Roentgenol. 2002. 178 (4): 899–904. DOI: 10.2214 / ajr.178.4.1780899. [PubMed] [CrossRef] [Google Scholar] 21. Госима С., Канемацу М., Кондо Х., Йокояма Р., Миёси Т., Като Х. и др. Поджелудочная железа: оптимальная задержка сканирования для многодетекторной КТ с контрастным усилением. Радиология. 2006. 241 (1): 167–74. DOI: 10.1148 / radiol.2411051338. [PubMed] [CrossRef] [Google Scholar] 22. Осимани М., Ренго М., Паолантонио П., Феррари Р., Де Чекко С. Н., Беллини Д. и др. Компьютерная томографическая ангиография с шестьюдесятью четырьмя многодетекторными рядами и болюсным отслеживанием во времени визуализации артериальной фазы в здоровой печени: существует ли корреляция между количественными и качественными показателями? J Comput Assist Tomogr.2010. 34 (6): 883–91. DOI: 10.1097 / RCT.0b013e3181dd80c8. [PubMed] [CrossRef] [Google Scholar] 23. Фруш Д.П., Спенсер Э.Б., Доннелли Л.Ф., Чжэн Дж.Й., Делонг Д.М., Биссет Г.С., 3-е место. Оптимизация КТ брюшной полости с контрастным усилением у младенцев и детей с помощью болюсного отслеживания. AJR Am J Roentgenol. 1999. 172 (4): 1007–13. DOI: 10.2214 / ajr.172.4.10587137. [PubMed] [CrossRef] [Google Scholar]Автоматическое отслеживание болюса по сравнению с методом фиксированной задержки времени в двухфазной мультидетекторной компьютерной томографии брюшной полости
Иран Дж. Радиол.2014 Янв; 11 (1): e4617.
Атооса Адиби
1 Отделение радиологии Исфаханского университета медицинских наук, Исфахан, Иран
Али Шахбази
1 Отделение радиологии Исфаханского университета медицинских наук, Исфахан, Иран
1 Отделение радиологии, Исфаханский университет медицинских наук, Исфахан, Иран
* Автор, ответственный за переписку: Атооса Адиби, отделение радиологии, больница Альзахра, Исфаханский университет медицинских наук, проспект Соффе., Исфахан, Иран. Тел .: +983116255555, Факс: + 98-3116687898, Электронная почта: ri.ca.ium.dem@ibida_aПолучено 3 апреля 2012 г .; Пересмотрено 14 августа 2012 г .; Принято 13 октября 2012 г.
Авторские права © 2014, Тегеранский университет медицинских наук и Иранское общество радиологов; Опубликовано Kowsar Corp.Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии правильного цитирования оригинальной работы.
Эта статья цитируется в других статьях в PMC.Аннотация
Предпосылки
Отслеживание болюса позволяет индивидуализировать временную задержку для начала сканирования в спиральной компьютерной томографии (КТ).
Объективы
Мы сравнили автоматический метод отслеживания болюса с методом фиксированной задержки при двухфазном усилении контраста во время мультидетекторной компьютерной томографии брюшной полости.
Пациенты и методы
Взрослые пациенты, направленные на спиральную КТ брюшной полости, были рандомизированы на две группы; в группе 1 артериальная и портальная фазы спирального сканирования начинались через 25 и 55 с после начала введения контрастного вещества; в группе 2 с использованием программного обеспечения автоматического отслеживания болюса повторяющиеся мониторинговые сканирования выполнялись в просвете нисходящей аорты как интересующей области с порогом запуска диагностического сканирования 60 HU.Повышение контрастности аорты, печени и селезенки сравнивали между группами.
Результаты
В исследование были включены 48 пациентов (23 мужчины, 25 женщин, средний возраст = 56,4 ± 13,5 лет). Увеличение контраста аорты, печени и селезенки в артериальной фазе было одинаковым между двумя группами (P> 0,05). Что касается портальной фазы, то аорта и селезенка были более усилены в группе с отслеживанием болюса (P <0,001). Болюсное отслеживание обеспечивало более однородное усиление контраста у разных пациентов, чем метод фиксированной задержки по времени в печени в портальной фазе, но не в артериальной фазе.
Выводы
Метод автоматического болюсного отслеживания приводит к более высокому контрастному усилению аорты и селезенки на портальной фазе, но не влияет на улучшение функции печени. Однако отслеживание болюса связано с уменьшением вариабельности улучшения печени у разных пациентов.
Ключевые слова: Многодетекторная компьютерная томография, томография, спиральные вычисления
1. Предпосылки
Благодаря последним достижениям в технологии спиральной компьютерной томографии (КТ), теперь стало возможным получение изображений всей печени с помощью многодетекторной компьютерной томографии (МДКТ). менее чем за 20 секунд с двумя или более различными фазами перфузии (1).При таком быстром сканировании важно оптимизировать временную задержку между инъекцией контрастного вещества и началом диагностического сканирования, особенно для артериальной фазы (2). Индивидуальные вариации в отношении массы тела, частоты сердечных сокращений, времени кровообращения и сердечных нарушений могут влиять на временное окно, а также на необходимую скорость и объем контрастного вещества и, таким образом, могут быть проблематичными при достижении оптимального усиления контраста (3-5). Хотя отслеживание небольшого болюса контрастного вещества (10-20 мл) перед диагностическим сканированием может помочь индивидуализировать временную задержку, это трудоемкий метод (6).Чтобы преодолеть эти ограничения, недавно была разработана компьютерная система отслеживания болюса, которая автоматически запускает диагностическое сканирование, запускаемое самим контрастным усилением. Используя сканирование с низкой дозой (около 50 мА), эта технология позволяет запускать сканирование вручную или автоматически, когда усиление контрастности повышается до предварительно определенного порога в интересующей области (ROI) (7). Некоторые исследования показали, что автоматическое отслеживание болюса может лучше индивидуализировать временную задержку для начала диагностического сканирования печени, а также поджелудочной железы и, таким образом, улучшить степень усиления контраста и заметность поражения паренхимы (8-10).Однако по этому поводу все еще существуют разногласия, и результаты предыдущих исследований были другими. Некоторые исследования рекомендуют болюсное отслеживание только в том случае, если пациенты старше 70 лет и / или имеют сердечно-сосудистые заболевания, и / или когда нет адекватной антекубитальной вены для инъекции контрастного вещества для снижения дополнительной дозы облучения (11). Кроме того, некоторые исследования показали, что при использовании метода отслеживания болюса 35% пациентов могут не достичь порога на 50 HU выше исходного уровня через 60 секунд после начала инъекции, и тогда потребуется использование установленной задержки (12).
2. Цели
Таким образом, это исследование было проведено для сравнения автоматического отслеживания болюса с фиксированной временной задержкой при двухфазном усилении контраста аорты, печени и селезенки во время МДКТ.
3. Пациенты и методы лечения
3.1. Набор пациентов
Это проспективное исследование было проведено с участием 48 последовательных взрослых пациентов, направленных с августа по ноябрь 2010 г. в отделение MDCT больницы Альзахра (Исфахан, Иран) для проведения КТ брюшной полости с контрастным усилением. Показаниями были неуверенные поражения печени при ультразвуковом исследовании (n = 19), подозрительные метастазы (n = 15) и гепатоцеллюлярная карцинома (HCC) (n = 14).Пациенты с сердечной недостаточностью в исследование не включались. Комитет по этике Исфаханского университета медицинских наук одобрил исследование, и от всех пациентов было получено информированное согласие.
3.2. Метод визуализации
Пациенты были обследованы с помощью многодетекторного компьютерного томографа (LightSpeed VCT 64, GE Healthcare, Солт-Лейк-Сити, Юта, США). Параметры сканирования: коллимация 64 × 0,625 мм; толщина среза 5 мм; смола 1,375; скорость стола / вращение портала 55 мм; кВ 140; и мА 240.Перед введением контрастного вещества была проведена спиральная КТ печени без усиления. Для двухфазной спиральной компьютерной томографии печень сканировали в артериальной и портально-венозной фазах перфузии печени. С помощью механического инжектора 100 мл Иопромида (Ultravist 300, Schering, Берлин, Германия) вводили в антекубитальную вену со скоростью 4,0 мл / с.
Пациенты были рандомизированы на две группы с использованием случайной таблицы, созданной с помощью программного обеспечения случайного распределения (13). В группе 1 сканирование по спирали в артериальной и воротно-венозной фазах было начато через 25 и 55 с соответственно после начала введения контрастного вещества.В группе 2 эталонное сканирование, которое определяет уровень сканирования монитора с отслеживанием болюса, было размещено на 1 см ниже уровня диафрагмы на инспираторной топограмме. Программное обеспечение для автоматического отслеживания болюса (Snapshot Pulse / GE Healthcare, Солт-Лейк-Сити, Юта, США) было реализовано на сканере. Повторные мониторинговые сканирования выполнялись на уровне одного среза во время дыхания при 50 мА с продолжительностью сканирования 0,5 с. Контрольные сканирования начинались с задержкой в 8 с и повторялись каждые 2 с при спокойном дыхании.Как только порог контрастного усиления (60 HU) был достигнут в пределах ROI (просвет нисходящей аорты), было начато диагностическое спиральное сканирование (8). Примерно через 6-9 с (для перемещения стола и команды дыхания пациенту) после превышения порогового уровня запускалось сканирование по спирали артериальной фазы. Портально-венозное сканирование автоматически запускалось через 15 секунд после завершения сканирования артериальной фазы (8).
3.3. Оценки
У всех пациентов плотность печени перед контрастированием измерялась путем вычисления среднего из шести измерений ROI (площадь каждой ROI составляла не менее 3 см 2 ), определенных на шести различных уровнях среза от купола печени до его нижние части.Интервал между выбранными разрезами КТ печени составлял около 2 см. На постконтрастных сканированиях среднее ослабление нормальной паренхимы для каждого среза оценивалось отдельно по среднему значению трех измерений ROI с площадью не менее 3 см 2 . При всех измерениях ROI избегали больших внутрипеченочных сосудов, поражений печени или эффектов частичного объема. Рассчитывали максимальную плотность печени в артериальной фазе и среднюю плотность печени в портально-венозной фазе. Кроме того, определялась предконтрастная и постконтрастная плотность аорты примерно на два сантиметра ниже диафрагмы и селезенки в центральной части ее паренхимы (8).
3.4. Статистический анализ
Статистический анализ выполняли с использованием программного обеспечения SPSS для Windows 16.0 (SPSS Inc., Чикаго, Иллинойс, США) с помощью t-критерия независимой выборки для несопоставленных выборок, сравнивая группу 1 с группой 2. Уровень значимости рассматривался при P <0,05. .
4. Результаты
За исследуемый период обследовано 23 пациента мужского и 25 женского пола со средним возрастом 56,4 ± 13,5 года. Средний вес составил 68,0 ± 8,3 кг в группе 1 и 70,3 ± 8,3 кг во 2 группе (P> 0.05). Порог усиления в аорте 60 HU был достигнут у всех пациентов через 15-23 с (17,7 ± 2,2 с) после начала введения контраста. Количество сканирований монитора варьировалось от 3 до 7 сканирований (4,5 ± 1,1), что соответствовало дополнительному воздействию 227,0 ± 57,0 мАс (50 мА на срез, время сканирования 0,5 с). представляет плотность до контрастирования и усиление (в единицах HU) аорты, печени и селезенки на артериальной и портальной фазах в двух группах. Эти две группы были схожи в отношении плотности аорты, печени и селезенки перед контрастированием (P> 0.05). Не было существенной разницы между двумя группами в максимальном контрастировании аорты, печени и селезенки в артериальной фазе (P> 0,05). Что касается портальной фазы, то аорта и селезенка были более усилены в группе с отслеживанием болюса (P <0,001). Рисуя кривые нормального распределения, болюсное отслеживание обеспечивало более однородное усиление контраста у разных пациентов, чем метод фиксированной задержки по времени в печени в портальной фазе, но не значительно в артериальной фазе (и).
Повышение контрастности печени в A, артериальной и B, портальной фазе с фиксированным временем задержки
Повышение контрастности печени в A, артериальной и B, портальной фазе с методом болюсного отслеживания
Таблица 1.
Предконтрастная плотность и усиление (HU) аорты, печени и селезенки на артериальной и портальной фазах
| Фиксированная задержка времени a (n = 24) | Болюс Отслеживание (n = 24) | Значение P | |||
|---|---|---|---|---|---|
| Аорта | Исходный уровень | 42.7 ± 7,3 | 45,4 ± 8,4 | 0,256 | |
| Усиление артериальной фазы | 231,7 ± 104,7 | 264,7 ± 82,2 | 0,231 | ||
| 374 | Портал 9014 ± | ± 121,1 | <0,001 | ||
| Печень | Исходный уровень | 58,4 ± 10,5 | 57,8 ± 8,3 | 0,833 | |
| Улучшение артериальной фазы14 | 7 ± 4,55,0 ± 5,1 | 0,637 | |||
| Усиление фазы портала | 43,8 ± 20,9 | 42,9 ± 15,5 | 0,858 | ||
| 0,820 | |||||
| Усиление артериальной фазы | 37,4 ± 29,9 | 30,8 ± 14,8 | 0,340 | ||
| Усиление портальной фазы | 80.2 ± 19,1 | 112,2 ± 34,7 | <0,001 |
5. Обсуждение
Объем контрастного вещества и скорость введения являются контролируемыми факторами, которые влияют на степень увеличения контрастности при КТ печени. Однако индивидуальные вариации, такие как масса тела, частота сердечных сокращений и нарушения кровообращения, являются другими важными влияющими факторами, которые нельзя контролировать или легко учесть (3-5). Таким образом, такая техника, как автоматическое отслеживание болюса, которое может индивидуализировать временную задержку между введением контрастного вещества и началом диагностической визуализации, имеет большую ценность.Мы исследовали, может ли автоматическое болюсное отслеживание, по сравнению с фиксированной временной задержкой, обеспечить лучшее усиление контраста аорты, печени и селезенки во время двухфазной МДКТ. Мы обнаружили, что метод болюсного отслеживания полезен для усиления контраста при визуализации аорты и селезенки в портальной фазе, но не было положительного эффекта для этого метода визуализации печени. В этом отношении результаты предыдущих исследований были другими. Динкель и его коллеги (14) обнаружили повышенное печеночное усиление на портальной фазе с помощью болюсного отслеживания (порог 31 HU) по сравнению с методом фиксированной задержки (80 с).Itoh и его коллеги (11) сравнили отслеживание болюса (порог 130 HU) с фиксированной временной задержкой (30 с) при визуализации печени в поздней артериальной и портально-венозной фазах у пациентов с гепатоцеллюлярной карциномой (ГЦК) и не обнаружили разницы между эти два метода – увеличение или получение контраста или заметное поражение печени. В другом исследовании Mehnert et al. (9), отслеживание болюса (порог 40 HU) сравнивалось с исследованиями с временной задержкой (65 с) для монофазной спиральной КТ печени, и не было обнаружено различий в паренхиматозном усилении между двумя методами.Однако при автоматическом отслеживании болюса наблюдалась значительно большая разница в плотности поражения печени (8). В другом исследовании этих исследователей на двухфазной спиральной КТ печени авторы обнаружили более высокое максимальное усиление паренхимы печени в группе с фиксированной временной задержкой. Исследователи предположили, что это более высокое усиление может снизить способность очертить артериализованное поражение в печени (9). Brodoefel и его коллеги (15) сравнили отслеживание болюса (порог 50 HU) с точки зрения улучшения состояния печени, видимого поражения печени и вариабельности между изображениями в последовательных МДКТ пациентов с метастазами в печени и сравнили его с эмпирической задержкой. 65 с.Авторы обнаружили более высокое улучшение печени (около 11 UH) и заметность гипоусиливающих поражений (около 20 HU) с запуском паренхимы по сравнению с методом фиксированной задержки по времени (15).
Разница между предыдущими исследованиями может быть связана с используемым протоколом; порог и соответствующая задержка сканирования (интервал между обнаружением повышения порога и инициированием визуализации), ROI для порога, а также объем контраста и скорость впрыска (16, 17). В исследовании Kitamura et al.(18) болюсное отслеживание с разными порогами (120, 160 и 200 HU аорты) сравнивалось с визуализацией в двойной артериальной фазе (25 и 40 с) для выявления гиперваскулярного ГЦК. Авторы обнаружили, что отслеживание болюса с порогом 200 HU привело к более заметному ослаблению (42 ± 18 HU), чем с 120 HU (23 ± 11 HU) и 160 HU (25 ± 11 HU), а также к более высокой чувствительности (92,7%). ), чем 120 HU (72,4%) и 160 HU (71,1%) (18). Sandstede et al. (19) также сравнили шесть протоколов с комбинацией 5- или 10-секундных задержек сканирования и пороговых значений 50, 75 или 100 HU (в аорте).Авторы обнаружили, что 10-секундная задержка после порога 75HU привела к оптимальной артериальной фазе у большинства пациентов (определяемой как 20-30% -ное улучшение функции печени в фазе воротной вены). Однако, по сравнению со стандартной задержкой, отслеживание болюса выявило только тенденцию к различию (19). Результаты исследования Kim et al. (20) предлагает оптимальную задержку сканирования для изображений артериальной фазы при обнаружении ГЦК примерно от 14 до 30 секунд от порога 100 HU, в то время как в другом исследовании Goshima и его коллег (21) было предложено от 10 до 15 секунд для артериальная фаза и от 45 до 55 секунд для фазы воротной вены после повышения порога обнаружения на 50 HU в нижнем грудном отделе аорты 21.По данным Osimani et al. (22) слишком раннее сканирование приводит к изображениям, которые получают до усиления сосудистого пика, в то время как слишком позднее сканирование приводит к увеличению питания паренхимы печени в портальной фазе. Хорошие характеристики были получены при задержке сканирования от 10 до 19 секунд с момента запуска (22).
Мы обнаружили, что отслеживание болюса обеспечивает более однородное усиление контраста, чем метод фиксированной задержки у разных пациентов. Frush и его коллеги (23) в исследовании, проведенном на детях, также обнаружили, что метод болюсного отслеживания не только улучшил контрастное усиление, но также привел к более однородному усилению от верхнего до нижнего уровней печени, чем метод фиксированной задержки по времени.Brodoefel (15) также обнаружил, что отслеживание болюса в печени связано с уменьшением вариабельности улучшения печени у разных пациентов и в ходе последовательных контрольных обследований отдельных пациентов, что позволяет более точно наблюдать за пациентами.
Результаты этого исследования показали, что метод автоматического болюсного отслеживания с порогом 60 HU на аорте приводит к более высокому контрастному усилению аорты и селезенки на портальной фазе, но не влияет на улучшение функции печени.Кроме того, болюсное отслеживание связано с уменьшением вариабельности улучшения состояния печени у разных пациентов. Необходимы дальнейшие исследования, чтобы найти оптимальный протокол, включая порог и соответствующую задержку сканирования, ROI для порога, а также объем контраста и скорость инъекции. Мы предлагаем другое исследование с большими объемами образцов при различных патологиях печени, сравнивая эти постконтрастные методы, сравнивая индивидуальную патологию печени отдельно.
Благодарности
Благодарностей нет.
Сноски
Значение для политики / практики / исследований / медицинского образования в области здравоохранения: Результаты текущего исследования могут помочь рентгенологам повысить качество изображения КТ брюшной полости с помощью мутидетектора брюшной полости с использованием метода автоматического болюсного отслеживания вместо метода фиксированной задержки, поскольку он показывает более высокое контрастное усиление портальной фазы в некоторых органах брюшной полости.
Вклад авторов: Все авторы в равной степени участвовали в этом исследовании.
Раскрытие финансовой информации: Конфликт интересов отсутствует.
Финансирование / поддержка: Исследование финансировалось за счет собственных средств.
Список литературы
1. Ото А., Тамм Е.П., Шкларук Дж. Многодетекторная рядная компьютерная томография печени. Radiol Clin North Am. 2005; 43 (5): 827-48. DOI: 10.1016 / j.rcl.2005.05.002. [PubMed] [CrossRef] [Google Scholar] 2. Итикава Т., Эртурк С.М., Араки Т. Многофазная многорядная КТ печени с контрастным усилением: теория повышения контрастности и практический протокол сканирования с комбинацией фиксированной продолжительности инъекции и дозы контрастного вещества, адаптированной к массе тела пациента.Eur J Radiol. 2006. 58 (2): 165–76. DOI: 10.1016 / j.ejrad.2005.11.037. [PubMed] [CrossRef] [Google Scholar] 3. Bae KT, Seeck BA, Hildebolt CF, Tao C, Zhu F, Kanematsu M, et al. Повышение контрастности в MDCT сердечно-сосудистой системы: влияние массы тела, роста, площади поверхности тела, индекса массы тела и ожирения. AJR Am J Roentgenol. 2008. 190 (3): 777–84. DOI: 10.2214 / AJR.07.2765. [PubMed] [CrossRef] [Google Scholar] 4. Bae KT, Tao C, Gurel S, Hong C, Zhu F, Gebke TA и др. Влияние веса пациента и продолжительности сканирования на усиление контраста во время мультидетекторной КТ-ангиографии легких.Радиология. 2007. 242 (2): 582–9. DOI: 10.1148 / radiol.2422052132. [PubMed] [CrossRef] [Google Scholar] 5. Brink JA. Оптимизация контрастности и синхронизация сканирования для одно- и многорядной компьютерной томографии. J Comput Assist Tomogr. 2003; 27 Приложение 1: С3–8. [PubMed] [Google Scholar] 6. Лаги А. Многодетекторная компьютерная томография (64 среза) печени: методы исследования. Eur Radiol. 2007. 17 (3): 675–83. DOI: 10.1007 / s00330-006-0405-0. [PubMed] [CrossRef] [Google Scholar] 7. Сильверман П.М., Робертс С., Теффт М.С., Браун Б., Фокс С.Х., Купер С. и др.Спиральная компьютерная томография печени: клиническое применение автоматизированного компьютерного метода SmartPrep для получения изображений с оптимальным усилением контраста. AJR Am J Roentgenol. 1995. 165 (1): 73–8. DOI: 10.2214 / ajr.165.1.7785637. [PubMed] [CrossRef] [Google Scholar] 8. Mehnert F, Pereira PL, Trubenbach J, Kopp AF, Claussen CD. Автоматическое отслеживание болюса в однофазной спиральной компьютерной томографии печени: заметность поражения печени. Eur Radiol. 2001. 11 (4): 580–4. [PubMed] [Google Scholar] 9. Mehnert F, Pereira PL, Trubenbach J, Kopp AF, Claussen CD.Двухфазная спиральная КТ печени: автоматическое болюсное отслеживание или временная задержка? Eur Radiol. 2001. 11 (3): 427–31. [PubMed] [Google Scholar] 10. Фукукура Ю., Такуми К., Камияма Т., Шиндо Т., Хигаши Р., Накаджо М. Аденокарцинома поджелудочной железы: сравнение автоматического отслеживания болюса и задержки эмпирического сканирования. Визуализация брюшной полости. 2010. 35 (5): 548–55. DOI: 10.1007 / s00261-009-9560-5. [PubMed] [CrossRef] [Google Scholar] 11. Ито С., Икеда М., Ачива М., Сатаке Х., Ивано С., Исигаки Т. Визуализация печени в поздней артериальной и воротно-венозной фазах с помощью мультиспирального компьютерного томографа у пациентов без нарушений кровообращения: автоматическое отслеживание болюса или задержка эмпирического сканирования? Eur Radiol.2004. 14 (9): 1665–73. DOI: 10.1007 / s00330-004-2321-5. [PubMed] [CrossRef] [Google Scholar] 12. Полсон EK, Фишер AJ, Делонг DM, Паркер DD, Нельсон RC. Спиральная компьютерная томография печени с компьютерной технологией отслеживания болюса: можно ли предсказать, какие пациенты не достигнут порога улучшения? Радиология. 1998. 209 (3): 787–92. DOI: 10.1148 / radiology.209.3.9844675. [PubMed] [CrossRef] [Google Scholar] 14. Динкель HP, Маттич Дж. [Многорядная детекторная КТ-ангиография брюшной аорты: отслеживание болюса по сравнению с фиксированной задержкой начала].Рофо. 2003. 175 (11): 1567–71. DOI: 10,1055 / с-2003-43394. [PubMed] [CrossRef] [Google Scholar] 15. Brodoefel H, Tognolini A, Zamboni GA, Gourtsoyianni S, Claussen CD, Raptopoulos V. Стандартизация MDCT печени путем отслеживания усиления паренхимы печени для запуска визуализации. Eur Radiol. 2012; 22 (4): 812–20. DOI: 10.1007 / s00330-011-2310-4. [PubMed] [CrossRef] [Google Scholar] 16. Симидзу Т., Мисаки Т., Ямамото К., Суэёси К., Нарабаяши И. Спиральная компьютерная томография печени с компьютерной технологией отслеживания болюса: задержка сканирования артериального фазового сканирования и влияние скорости потока.J Comput Assist Tomogr. 2000. 24 (2): 219–23. [PubMed] [Google Scholar] 17. Копка Л., Роденвальдт Дж., Фишер Ю., Мюллер Д. В., Остман Дж. В., Граббе Э. Двухфазная спиральная КТ печени: эффекты болюсного отслеживания и различных объемов контрастного вещества. Радиология. 1996. 201 (2): 321–6. DOI: 10.1148 / радиология.201.2.8888218. [PubMed] [CrossRef] [Google Scholar] 18. Китамура Т., Итикава Т., Эртурк С.М., Накадзима Х., Соу Х., Араки Т. и др. Обнаружение гиперваскулярной гепатоцеллюлярной карциномы с помощью многорядной КТ: визуализация одной артериальной фазы с помощью компьютерной техники автоматического болюсного отслеживания по сравнению с двойной визуализацией в артериальной фазе.J Comput Assist Tomogr. 2008. 32 (5): 724–9. DOI: 10.1097 / RCT.0b013e318154b1f5. [PubMed] [CrossRef] [Google Scholar] 19. Sandstede JJ, Werner A, Kaupert C, Roth A, Jenett M, Harz C, et al. Проспективное исследование, сравнивающее различные концентрации йода для трехфазной мультидетекторной рядной КТ верхней части живота. Eur J Radiol. 2006. 60 (1): 95–9. DOI: 10.1016 / j.ejrad.2006.05.012. [PubMed] [CrossRef] [Google Scholar] 20. Ким Т., Мураками Т., Хори М., Такамура М., Такахаши С., Окада А. и др. Небольшая гиперваскулярная гепатоцеллюлярная карцинома, выявленная при двойной артериальной фазе КТ, выполненной с однократным сканированием с задержкой дыхания и автоматическим болюсным отслеживанием.AJR Am J Roentgenol. 2002. 178 (4): 899–904. DOI: 10.2214 / ajr.178.4.1780899. [PubMed] [CrossRef] [Google Scholar] 21. Госима С., Канемацу М., Кондо Х., Йокояма Р., Миёси Т., Като Х. и др. Поджелудочная железа: оптимальная задержка сканирования для многодетекторной КТ с контрастным усилением. Радиология. 2006. 241 (1): 167–74. DOI: 10.1148 / radiol.2411051338. [PubMed] [CrossRef] [Google Scholar] 22. Осимани М., Ренго М., Паолантонио П., Феррари Р., Де Чекко С. Н., Беллини Д. и др. Компьютерная томографическая ангиография с шестьюдесятью четырьмя многодетекторными рядами и болюсным отслеживанием во времени визуализации артериальной фазы в здоровой печени: существует ли корреляция между количественными и качественными показателями? J Comput Assist Tomogr.2010. 34 (6): 883–91. DOI: 10.1097 / RCT.0b013e3181dd80c8. [PubMed] [CrossRef] [Google Scholar] 23. Фруш Д.П., Спенсер Э.Б., Доннелли Л.Ф., Чжэн Дж.Й., Делонг Д.М., Биссет Г.С., 3-е место. Оптимизация КТ брюшной полости с контрастным усилением у младенцев и детей с помощью болюсного отслеживания. AJR Am J Roentgenol. 1999. 172 (4): 1007–13. DOI: 10.2214 / ajr.172.4.10587137. [PubMed] [CrossRef] [Google Scholar]Автоматическое отслеживание болюса по сравнению с методом фиксированной задержки времени в двухфазной мультидетекторной компьютерной томографии брюшной полости
Иран Дж. Радиол.2014 Янв; 11 (1): e4617.
Атооса Адиби
1 Отделение радиологии Исфаханского университета медицинских наук, Исфахан, Иран
Али Шахбази
1 Отделение радиологии Исфаханского университета медицинских наук, Исфахан, Иран
1 Отделение радиологии, Исфаханский университет медицинских наук, Исфахан, Иран
* Автор, ответственный за переписку: Атооса Адиби, отделение радиологии, больница Альзахра, Исфаханский университет медицинских наук, проспект Соффе., Исфахан, Иран. Тел .: +983116255555, Факс: + 98-3116687898, Электронная почта: ri.ca.ium.dem@ibida_aПолучено 3 апреля 2012 г .; Пересмотрено 14 августа 2012 г .; Принято 13 октября 2012 г.
Авторские права © 2014, Тегеранский университет медицинских наук и Иранское общество радиологов; Опубликовано Kowsar Corp.Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии правильного цитирования оригинальной работы.
Эта статья цитируется в других статьях в PMC.Аннотация
Предпосылки
Отслеживание болюса позволяет индивидуализировать временную задержку для начала сканирования в спиральной компьютерной томографии (КТ).
Объективы
Мы сравнили автоматический метод отслеживания болюса с методом фиксированной задержки при двухфазном усилении контраста во время мультидетекторной компьютерной томографии брюшной полости.
Пациенты и методы
Взрослые пациенты, направленные на спиральную КТ брюшной полости, были рандомизированы на две группы; в группе 1 артериальная и портальная фазы спирального сканирования начинались через 25 и 55 с после начала введения контрастного вещества; в группе 2 с использованием программного обеспечения автоматического отслеживания болюса повторяющиеся мониторинговые сканирования выполнялись в просвете нисходящей аорты как интересующей области с порогом запуска диагностического сканирования 60 HU.Повышение контрастности аорты, печени и селезенки сравнивали между группами.
Результаты
В исследование были включены 48 пациентов (23 мужчины, 25 женщин, средний возраст = 56,4 ± 13,5 лет). Увеличение контраста аорты, печени и селезенки в артериальной фазе было одинаковым между двумя группами (P> 0,05). Что касается портальной фазы, то аорта и селезенка были более усилены в группе с отслеживанием болюса (P <0,001). Болюсное отслеживание обеспечивало более однородное усиление контраста у разных пациентов, чем метод фиксированной задержки по времени в печени в портальной фазе, но не в артериальной фазе.
Выводы
Метод автоматического болюсного отслеживания приводит к более высокому контрастному усилению аорты и селезенки на портальной фазе, но не влияет на улучшение функции печени. Однако отслеживание болюса связано с уменьшением вариабельности улучшения печени у разных пациентов.
Ключевые слова: Многодетекторная компьютерная томография, томография, спиральные вычисления
1. Предпосылки
Благодаря последним достижениям в технологии спиральной компьютерной томографии (КТ), теперь стало возможным получение изображений всей печени с помощью многодетекторной компьютерной томографии (МДКТ). менее чем за 20 секунд с двумя или более различными фазами перфузии (1).При таком быстром сканировании важно оптимизировать временную задержку между инъекцией контрастного вещества и началом диагностического сканирования, особенно для артериальной фазы (2). Индивидуальные вариации в отношении массы тела, частоты сердечных сокращений, времени кровообращения и сердечных нарушений могут влиять на временное окно, а также на необходимую скорость и объем контрастного вещества и, таким образом, могут быть проблематичными при достижении оптимального усиления контраста (3-5). Хотя отслеживание небольшого болюса контрастного вещества (10-20 мл) перед диагностическим сканированием может помочь индивидуализировать временную задержку, это трудоемкий метод (6).Чтобы преодолеть эти ограничения, недавно была разработана компьютерная система отслеживания болюса, которая автоматически запускает диагностическое сканирование, запускаемое самим контрастным усилением. Используя сканирование с низкой дозой (около 50 мА), эта технология позволяет запускать сканирование вручную или автоматически, когда усиление контрастности повышается до предварительно определенного порога в интересующей области (ROI) (7). Некоторые исследования показали, что автоматическое отслеживание болюса может лучше индивидуализировать временную задержку для начала диагностического сканирования печени, а также поджелудочной железы и, таким образом, улучшить степень усиления контраста и заметность поражения паренхимы (8-10).Однако по этому поводу все еще существуют разногласия, и результаты предыдущих исследований были другими. Некоторые исследования рекомендуют болюсное отслеживание только в том случае, если пациенты старше 70 лет и / или имеют сердечно-сосудистые заболевания, и / или когда нет адекватной антекубитальной вены для инъекции контрастного вещества для снижения дополнительной дозы облучения (11). Кроме того, некоторые исследования показали, что при использовании метода отслеживания болюса 35% пациентов могут не достичь порога на 50 HU выше исходного уровня через 60 секунд после начала инъекции, и тогда потребуется использование установленной задержки (12).
2. Цели
Таким образом, это исследование было проведено для сравнения автоматического отслеживания болюса с фиксированной временной задержкой при двухфазном усилении контраста аорты, печени и селезенки во время МДКТ.
3. Пациенты и методы лечения
3.1. Набор пациентов
Это проспективное исследование было проведено с участием 48 последовательных взрослых пациентов, направленных с августа по ноябрь 2010 г. в отделение MDCT больницы Альзахра (Исфахан, Иран) для проведения КТ брюшной полости с контрастным усилением. Показаниями были неуверенные поражения печени при ультразвуковом исследовании (n = 19), подозрительные метастазы (n = 15) и гепатоцеллюлярная карцинома (HCC) (n = 14).Пациенты с сердечной недостаточностью в исследование не включались. Комитет по этике Исфаханского университета медицинских наук одобрил исследование, и от всех пациентов было получено информированное согласие.
3.2. Метод визуализации
Пациенты были обследованы с помощью многодетекторного компьютерного томографа (LightSpeed VCT 64, GE Healthcare, Солт-Лейк-Сити, Юта, США). Параметры сканирования: коллимация 64 × 0,625 мм; толщина среза 5 мм; смола 1,375; скорость стола / вращение портала 55 мм; кВ 140; и мА 240.Перед введением контрастного вещества была проведена спиральная КТ печени без усиления. Для двухфазной спиральной компьютерной томографии печень сканировали в артериальной и портально-венозной фазах перфузии печени. С помощью механического инжектора 100 мл Иопромида (Ultravist 300, Schering, Берлин, Германия) вводили в антекубитальную вену со скоростью 4,0 мл / с.
Пациенты были рандомизированы на две группы с использованием случайной таблицы, созданной с помощью программного обеспечения случайного распределения (13). В группе 1 сканирование по спирали в артериальной и воротно-венозной фазах было начато через 25 и 55 с соответственно после начала введения контрастного вещества.В группе 2 эталонное сканирование, которое определяет уровень сканирования монитора с отслеживанием болюса, было размещено на 1 см ниже уровня диафрагмы на инспираторной топограмме. Программное обеспечение для автоматического отслеживания болюса (Snapshot Pulse / GE Healthcare, Солт-Лейк-Сити, Юта, США) было реализовано на сканере. Повторные мониторинговые сканирования выполнялись на уровне одного среза во время дыхания при 50 мА с продолжительностью сканирования 0,5 с. Контрольные сканирования начинались с задержкой в 8 с и повторялись каждые 2 с при спокойном дыхании.Как только порог контрастного усиления (60 HU) был достигнут в пределах ROI (просвет нисходящей аорты), было начато диагностическое спиральное сканирование (8). Примерно через 6-9 с (для перемещения стола и команды дыхания пациенту) после превышения порогового уровня запускалось сканирование по спирали артериальной фазы. Портально-венозное сканирование автоматически запускалось через 15 секунд после завершения сканирования артериальной фазы (8).
3.3. Оценки
У всех пациентов плотность печени перед контрастированием измерялась путем вычисления среднего из шести измерений ROI (площадь каждой ROI составляла не менее 3 см 2 ), определенных на шести различных уровнях среза от купола печени до его нижние части.Интервал между выбранными разрезами КТ печени составлял около 2 см. На постконтрастных сканированиях среднее ослабление нормальной паренхимы для каждого среза оценивалось отдельно по среднему значению трех измерений ROI с площадью не менее 3 см 2 . При всех измерениях ROI избегали больших внутрипеченочных сосудов, поражений печени или эффектов частичного объема. Рассчитывали максимальную плотность печени в артериальной фазе и среднюю плотность печени в портально-венозной фазе. Кроме того, определялась предконтрастная и постконтрастная плотность аорты примерно на два сантиметра ниже диафрагмы и селезенки в центральной части ее паренхимы (8).
3.4. Статистический анализ
Статистический анализ выполняли с использованием программного обеспечения SPSS для Windows 16.0 (SPSS Inc., Чикаго, Иллинойс, США) с помощью t-критерия независимой выборки для несопоставленных выборок, сравнивая группу 1 с группой 2. Уровень значимости рассматривался при P <0,05. .
4. Результаты
За исследуемый период обследовано 23 пациента мужского и 25 женского пола со средним возрастом 56,4 ± 13,5 года. Средний вес составил 68,0 ± 8,3 кг в группе 1 и 70,3 ± 8,3 кг во 2 группе (P> 0.05). Порог усиления в аорте 60 HU был достигнут у всех пациентов через 15-23 с (17,7 ± 2,2 с) после начала введения контраста. Количество сканирований монитора варьировалось от 3 до 7 сканирований (4,5 ± 1,1), что соответствовало дополнительному воздействию 227,0 ± 57,0 мАс (50 мА на срез, время сканирования 0,5 с). представляет плотность до контрастирования и усиление (в единицах HU) аорты, печени и селезенки на артериальной и портальной фазах в двух группах. Эти две группы были схожи в отношении плотности аорты, печени и селезенки перед контрастированием (P> 0.05). Не было существенной разницы между двумя группами в максимальном контрастировании аорты, печени и селезенки в артериальной фазе (P> 0,05). Что касается портальной фазы, то аорта и селезенка были более усилены в группе с отслеживанием болюса (P <0,001). Рисуя кривые нормального распределения, болюсное отслеживание обеспечивало более однородное усиление контраста у разных пациентов, чем метод фиксированной задержки по времени в печени в портальной фазе, но не значительно в артериальной фазе (и).
Повышение контрастности печени в A, артериальной и B, портальной фазе с фиксированным временем задержки
Повышение контрастности печени в A, артериальной и B, портальной фазе с методом болюсного отслеживания
Таблица 1.
Предконтрастная плотность и усиление (HU) аорты, печени и селезенки на артериальной и портальной фазах
| Фиксированная задержка времени a (n = 24) | Болюс Отслеживание (n = 24) | Значение P | |||
|---|---|---|---|---|---|
| Аорта | Исходный уровень | 42.7 ± 7,3 | 45,4 ± 8,4 | 0,256 | |
| Усиление артериальной фазы | 231,7 ± 104,7 | 264,7 ± 82,2 | 0,231 | ||
| 374 | Портал 9014 ± | ± 121,1 | <0,001 | ||
| Печень | Исходный уровень | 58,4 ± 10,5 | 57,8 ± 8,3 | 0,833 | |
| Улучшение артериальной фазы14 | 7 ± 4,55,0 ± 5,1 | 0,637 | |||
| Усиление фазы портала | 43,8 ± 20,9 | 42,9 ± 15,5 | 0,858 | ||
| 0,820 | |||||
| Усиление артериальной фазы | 37,4 ± 29,9 | 30,8 ± 14,8 | 0,340 | ||
| Усиление портальной фазы | 80.2 ± 19,1 | 112,2 ± 34,7 | <0,001 |
5. Обсуждение
Объем контрастного вещества и скорость введения являются контролируемыми факторами, которые влияют на степень увеличения контрастности при КТ печени. Однако индивидуальные вариации, такие как масса тела, частота сердечных сокращений и нарушения кровообращения, являются другими важными влияющими факторами, которые нельзя контролировать или легко учесть (3-5). Таким образом, такая техника, как автоматическое отслеживание болюса, которое может индивидуализировать временную задержку между введением контрастного вещества и началом диагностической визуализации, имеет большую ценность.Мы исследовали, может ли автоматическое болюсное отслеживание, по сравнению с фиксированной временной задержкой, обеспечить лучшее усиление контраста аорты, печени и селезенки во время двухфазной МДКТ. Мы обнаружили, что метод болюсного отслеживания полезен для усиления контраста при визуализации аорты и селезенки в портальной фазе, но не было положительного эффекта для этого метода визуализации печени. В этом отношении результаты предыдущих исследований были другими. Динкель и его коллеги (14) обнаружили повышенное печеночное усиление на портальной фазе с помощью болюсного отслеживания (порог 31 HU) по сравнению с методом фиксированной задержки (80 с).Itoh и его коллеги (11) сравнили отслеживание болюса (порог 130 HU) с фиксированной временной задержкой (30 с) при визуализации печени в поздней артериальной и портально-венозной фазах у пациентов с гепатоцеллюлярной карциномой (ГЦК) и не обнаружили разницы между эти два метода – увеличение или получение контраста или заметное поражение печени. В другом исследовании Mehnert et al. (9), отслеживание болюса (порог 40 HU) сравнивалось с исследованиями с временной задержкой (65 с) для монофазной спиральной КТ печени, и не было обнаружено различий в паренхиматозном усилении между двумя методами.Однако при автоматическом отслеживании болюса наблюдалась значительно большая разница в плотности поражения печени (8). В другом исследовании этих исследователей на двухфазной спиральной КТ печени авторы обнаружили более высокое максимальное усиление паренхимы печени в группе с фиксированной временной задержкой. Исследователи предположили, что это более высокое усиление может снизить способность очертить артериализованное поражение в печени (9). Brodoefel и его коллеги (15) сравнили отслеживание болюса (порог 50 HU) с точки зрения улучшения состояния печени, видимого поражения печени и вариабельности между изображениями в последовательных МДКТ пациентов с метастазами в печени и сравнили его с эмпирической задержкой. 65 с.Авторы обнаружили более высокое улучшение печени (около 11 UH) и заметность гипоусиливающих поражений (около 20 HU) с запуском паренхимы по сравнению с методом фиксированной задержки по времени (15).
Разница между предыдущими исследованиями может быть связана с используемым протоколом; порог и соответствующая задержка сканирования (интервал между обнаружением повышения порога и инициированием визуализации), ROI для порога, а также объем контраста и скорость впрыска (16, 17). В исследовании Kitamura et al.(18) болюсное отслеживание с разными порогами (120, 160 и 200 HU аорты) сравнивалось с визуализацией в двойной артериальной фазе (25 и 40 с) для выявления гиперваскулярного ГЦК. Авторы обнаружили, что отслеживание болюса с порогом 200 HU привело к более заметному ослаблению (42 ± 18 HU), чем с 120 HU (23 ± 11 HU) и 160 HU (25 ± 11 HU), а также к более высокой чувствительности (92,7%). ), чем 120 HU (72,4%) и 160 HU (71,1%) (18). Sandstede et al. (19) также сравнили шесть протоколов с комбинацией 5- или 10-секундных задержек сканирования и пороговых значений 50, 75 или 100 HU (в аорте).Авторы обнаружили, что 10-секундная задержка после порога 75HU привела к оптимальной артериальной фазе у большинства пациентов (определяемой как 20-30% -ное улучшение функции печени в фазе воротной вены). Однако, по сравнению со стандартной задержкой, отслеживание болюса выявило только тенденцию к различию (19). Результаты исследования Kim et al. (20) предлагает оптимальную задержку сканирования для изображений артериальной фазы при обнаружении ГЦК примерно от 14 до 30 секунд от порога 100 HU, в то время как в другом исследовании Goshima и его коллег (21) было предложено от 10 до 15 секунд для артериальная фаза и от 45 до 55 секунд для фазы воротной вены после повышения порога обнаружения на 50 HU в нижнем грудном отделе аорты 21.По данным Osimani et al. (22) слишком раннее сканирование приводит к изображениям, которые получают до усиления сосудистого пика, в то время как слишком позднее сканирование приводит к увеличению питания паренхимы печени в портальной фазе. Хорошие характеристики были получены при задержке сканирования от 10 до 19 секунд с момента запуска (22).
Мы обнаружили, что отслеживание болюса обеспечивает более однородное усиление контраста, чем метод фиксированной задержки у разных пациентов. Frush и его коллеги (23) в исследовании, проведенном на детях, также обнаружили, что метод болюсного отслеживания не только улучшил контрастное усиление, но также привел к более однородному усилению от верхнего до нижнего уровней печени, чем метод фиксированной задержки по времени.Brodoefel (15) также обнаружил, что отслеживание болюса в печени связано с уменьшением вариабельности улучшения печени у разных пациентов и в ходе последовательных контрольных обследований отдельных пациентов, что позволяет более точно наблюдать за пациентами.
Результаты этого исследования показали, что метод автоматического болюсного отслеживания с порогом 60 HU на аорте приводит к более высокому контрастному усилению аорты и селезенки на портальной фазе, но не влияет на улучшение функции печени.Кроме того, болюсное отслеживание связано с уменьшением вариабельности улучшения состояния печени у разных пациентов. Необходимы дальнейшие исследования, чтобы найти оптимальный протокол, включая порог и соответствующую задержку сканирования, ROI для порога, а также объем контраста и скорость инъекции. Мы предлагаем другое исследование с большими объемами образцов при различных патологиях печени, сравнивая эти постконтрастные методы, сравнивая индивидуальную патологию печени отдельно.
Благодарности
Благодарностей нет.
Сноски
Значение для политики / практики / исследований / медицинского образования в области здравоохранения: Результаты текущего исследования могут помочь рентгенологам повысить качество изображения КТ брюшной полости с помощью мутидетектора брюшной полости с использованием метода автоматического болюсного отслеживания вместо метода фиксированной задержки, поскольку он показывает более высокое контрастное усиление портальной фазы в некоторых органах брюшной полости.
Вклад авторов: Все авторы в равной степени участвовали в этом исследовании.
Раскрытие финансовой информации: Конфликт интересов отсутствует.
Финансирование / поддержка: Исследование финансировалось за счет собственных средств.
Список литературы
1. Ото А., Тамм Е.П., Шкларук Дж. Многодетекторная рядная компьютерная томография печени. Radiol Clin North Am. 2005; 43 (5): 827-48. DOI: 10.1016 / j.rcl.2005.05.002. [PubMed] [CrossRef] [Google Scholar] 2. Итикава Т., Эртурк С.М., Араки Т. Многофазная многорядная КТ печени с контрастным усилением: теория повышения контрастности и практический протокол сканирования с комбинацией фиксированной продолжительности инъекции и дозы контрастного вещества, адаптированной к массе тела пациента.Eur J Radiol. 2006. 58 (2): 165–76. DOI: 10.1016 / j.ejrad.2005.11.037. [PubMed] [CrossRef] [Google Scholar] 3. Bae KT, Seeck BA, Hildebolt CF, Tao C, Zhu F, Kanematsu M, et al. Повышение контрастности в MDCT сердечно-сосудистой системы: влияние массы тела, роста, площади поверхности тела, индекса массы тела и ожирения. AJR Am J Roentgenol. 2008. 190 (3): 777–84. DOI: 10.2214 / AJR.07.2765. [PubMed] [CrossRef] [Google Scholar] 4. Bae KT, Tao C, Gurel S, Hong C, Zhu F, Gebke TA и др. Влияние веса пациента и продолжительности сканирования на усиление контраста во время мультидетекторной КТ-ангиографии легких.Радиология. 2007. 242 (2): 582–9. DOI: 10.1148 / radiol.2422052132. [PubMed] [CrossRef] [Google Scholar] 5. Brink JA. Оптимизация контрастности и синхронизация сканирования для одно- и многорядной компьютерной томографии. J Comput Assist Tomogr. 2003; 27 Приложение 1: С3–8. [PubMed] [Google Scholar] 6. Лаги А. Многодетекторная компьютерная томография (64 среза) печени: методы исследования. Eur Radiol. 2007. 17 (3): 675–83. DOI: 10.1007 / s00330-006-0405-0. [PubMed] [CrossRef] [Google Scholar] 7. Сильверман П.М., Робертс С., Теффт М.С., Браун Б., Фокс С.Х., Купер С. и др.Спиральная компьютерная томография печени: клиническое применение автоматизированного компьютерного метода SmartPrep для получения изображений с оптимальным усилением контраста. AJR Am J Roentgenol. 1995. 165 (1): 73–8. DOI: 10.2214 / ajr.165.1.7785637. [PubMed] [CrossRef] [Google Scholar] 8. Mehnert F, Pereira PL, Trubenbach J, Kopp AF, Claussen CD. Автоматическое отслеживание болюса в однофазной спиральной компьютерной томографии печени: заметность поражения печени. Eur Radiol. 2001. 11 (4): 580–4. [PubMed] [Google Scholar] 9. Mehnert F, Pereira PL, Trubenbach J, Kopp AF, Claussen CD.Двухфазная спиральная КТ печени: автоматическое болюсное отслеживание или временная задержка? Eur Radiol. 2001. 11 (3): 427–31. [PubMed] [Google Scholar] 10. Фукукура Ю., Такуми К., Камияма Т., Шиндо Т., Хигаши Р., Накаджо М. Аденокарцинома поджелудочной железы: сравнение автоматического отслеживания болюса и задержки эмпирического сканирования. Визуализация брюшной полости. 2010. 35 (5): 548–55. DOI: 10.1007 / s00261-009-9560-5. [PubMed] [CrossRef] [Google Scholar] 11. Ито С., Икеда М., Ачива М., Сатаке Х., Ивано С., Исигаки Т. Визуализация печени в поздней артериальной и воротно-венозной фазах с помощью мультиспирального компьютерного томографа у пациентов без нарушений кровообращения: автоматическое отслеживание болюса или задержка эмпирического сканирования? Eur Radiol.2004. 14 (9): 1665–73. DOI: 10.1007 / s00330-004-2321-5. [PubMed] [CrossRef] [Google Scholar] 12. Полсон EK, Фишер AJ, Делонг DM, Паркер DD, Нельсон RC. Спиральная компьютерная томография печени с компьютерной технологией отслеживания болюса: можно ли предсказать, какие пациенты не достигнут порога улучшения? Радиология. 1998. 209 (3): 787–92. DOI: 10.1148 / radiology.209.3.9844675. [PubMed] [CrossRef] [Google Scholar] 14. Динкель HP, Маттич Дж. [Многорядная детекторная КТ-ангиография брюшной аорты: отслеживание болюса по сравнению с фиксированной задержкой начала].Рофо. 2003. 175 (11): 1567–71. DOI: 10,1055 / с-2003-43394. [PubMed] [CrossRef] [Google Scholar] 15. Brodoefel H, Tognolini A, Zamboni GA, Gourtsoyianni S, Claussen CD, Raptopoulos V. Стандартизация MDCT печени путем отслеживания усиления паренхимы печени для запуска визуализации. Eur Radiol. 2012; 22 (4): 812–20. DOI: 10.1007 / s00330-011-2310-4. [PubMed] [CrossRef] [Google Scholar] 16. Симидзу Т., Мисаки Т., Ямамото К., Суэёси К., Нарабаяши И. Спиральная компьютерная томография печени с компьютерной технологией отслеживания болюса: задержка сканирования артериального фазового сканирования и влияние скорости потока.J Comput Assist Tomogr. 2000. 24 (2): 219–23. [PubMed] [Google Scholar] 17. Копка Л., Роденвальдт Дж., Фишер Ю., Мюллер Д. В., Остман Дж. В., Граббе Э. Двухфазная спиральная КТ печени: эффекты болюсного отслеживания и различных объемов контрастного вещества. Радиология. 1996. 201 (2): 321–6. DOI: 10.1148 / радиология.201.2.8888218. [PubMed] [CrossRef] [Google Scholar] 18. Китамура Т., Итикава Т., Эртурк С.М., Накадзима Х., Соу Х., Араки Т. и др. Обнаружение гиперваскулярной гепатоцеллюлярной карциномы с помощью многорядной КТ: визуализация одной артериальной фазы с помощью компьютерной техники автоматического болюсного отслеживания по сравнению с двойной визуализацией в артериальной фазе.J Comput Assist Tomogr. 2008. 32 (5): 724–9. DOI: 10.1097 / RCT.0b013e318154b1f5. [PubMed] [CrossRef] [Google Scholar] 19. Sandstede JJ, Werner A, Kaupert C, Roth A, Jenett M, Harz C, et al. Проспективное исследование, сравнивающее различные концентрации йода для трехфазной мультидетекторной рядной КТ верхней части живота. Eur J Radiol. 2006. 60 (1): 95–9. DOI: 10.1016 / j.ejrad.2006.05.012. [PubMed] [CrossRef] [Google Scholar] 20. Ким Т., Мураками Т., Хори М., Такамура М., Такахаши С., Окада А. и др. Небольшая гиперваскулярная гепатоцеллюлярная карцинома, выявленная при двойной артериальной фазе КТ, выполненной с однократным сканированием с задержкой дыхания и автоматическим болюсным отслеживанием.AJR Am J Roentgenol. 2002. 178 (4): 899–904. DOI: 10.2214 / ajr.178.4.1780899. [PubMed] [CrossRef] [Google Scholar] 21. Госима С., Канемацу М., Кондо Х., Йокояма Р., Миёси Т., Като Х. и др. Поджелудочная железа: оптимальная задержка сканирования для многодетекторной КТ с контрастным усилением. Радиология. 2006. 241 (1): 167–74. DOI: 10.1148 / radiol.2411051338. [PubMed] [CrossRef] [Google Scholar] 22. Осимани М., Ренго М., Паолантонио П., Феррари Р., Де Чекко С. Н., Беллини Д. и др. Компьютерная томографическая ангиография с шестьюдесятью четырьмя многодетекторными рядами и болюсным отслеживанием во времени визуализации артериальной фазы в здоровой печени: существует ли корреляция между количественными и качественными показателями? J Comput Assist Tomogr.2010. 34 (6): 883–91. DOI: 10.1097 / RCT.0b013e3181dd80c8. [PubMed] [CrossRef] [Google Scholar] 23. Фруш Д.П., Спенсер Э.Б., Доннелли Л.Ф., Чжэн Дж.Й., Делонг Д.М., Биссет Г.С., 3-е место. Оптимизация КТ брюшной полости с контрастным усилением у младенцев и детей с помощью болюсного отслеживания. AJR Am J Roentgenol. 1999. 172 (4): 1007–13. DOI: 10.2214 / ajr.172.4.10587137. [PubMed] [CrossRef] [Google Scholar]Автоматическое отслеживание болюса по сравнению с методом фиксированной задержки времени в двухфазной мультидетекторной компьютерной томографии брюшной полости
Иран Дж. Радиол.2014 Янв; 11 (1): e4617.
Атооса Адиби
1 Отделение радиологии Исфаханского университета медицинских наук, Исфахан, Иран
Али Шахбази
1 Отделение радиологии Исфаханского университета медицинских наук, Исфахан, Иран
1 Отделение радиологии, Исфаханский университет медицинских наук, Исфахан, Иран
* Автор, ответственный за переписку: Атооса Адиби, отделение радиологии, больница Альзахра, Исфаханский университет медицинских наук, проспект Соффе., Исфахан, Иран. Тел .: +983116255555, Факс: + 98-3116687898, Электронная почта: ri.ca.ium.dem@ibida_aПолучено 3 апреля 2012 г .; Пересмотрено 14 августа 2012 г .; Принято 13 октября 2012 г.
Авторские права © 2014, Тегеранский университет медицинских наук и Иранское общество радиологов; Опубликовано Kowsar Corp.Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии правильного цитирования оригинальной работы.
Эта статья цитируется в других статьях в PMC.Аннотация
Предпосылки
Отслеживание болюса позволяет индивидуализировать временную задержку для начала сканирования в спиральной компьютерной томографии (КТ).
Объективы
Мы сравнили автоматический метод отслеживания болюса с методом фиксированной задержки при двухфазном усилении контраста во время мультидетекторной компьютерной томографии брюшной полости.
Пациенты и методы
Взрослые пациенты, направленные на спиральную КТ брюшной полости, были рандомизированы на две группы; в группе 1 артериальная и портальная фазы спирального сканирования начинались через 25 и 55 с после начала введения контрастного вещества; в группе 2 с использованием программного обеспечения автоматического отслеживания болюса повторяющиеся мониторинговые сканирования выполнялись в просвете нисходящей аорты как интересующей области с порогом запуска диагностического сканирования 60 HU.Повышение контрастности аорты, печени и селезенки сравнивали между группами.
Результаты
В исследование были включены 48 пациентов (23 мужчины, 25 женщин, средний возраст = 56,4 ± 13,5 лет). Увеличение контраста аорты, печени и селезенки в артериальной фазе было одинаковым между двумя группами (P> 0,05). Что касается портальной фазы, то аорта и селезенка были более усилены в группе с отслеживанием болюса (P <0,001). Болюсное отслеживание обеспечивало более однородное усиление контраста у разных пациентов, чем метод фиксированной задержки по времени в печени в портальной фазе, но не в артериальной фазе.
Выводы
Метод автоматического болюсного отслеживания приводит к более высокому контрастному усилению аорты и селезенки на портальной фазе, но не влияет на улучшение функции печени. Однако отслеживание болюса связано с уменьшением вариабельности улучшения печени у разных пациентов.
Ключевые слова: Многодетекторная компьютерная томография, томография, спиральные вычисления
1. Предпосылки
Благодаря последним достижениям в технологии спиральной компьютерной томографии (КТ), теперь стало возможным получение изображений всей печени с помощью многодетекторной компьютерной томографии (МДКТ). менее чем за 20 секунд с двумя или более различными фазами перфузии (1).При таком быстром сканировании важно оптимизировать временную задержку между инъекцией контрастного вещества и началом диагностического сканирования, особенно для артериальной фазы (2). Индивидуальные вариации в отношении массы тела, частоты сердечных сокращений, времени кровообращения и сердечных нарушений могут влиять на временное окно, а также на необходимую скорость и объем контрастного вещества и, таким образом, могут быть проблематичными при достижении оптимального усиления контраста (3-5). Хотя отслеживание небольшого болюса контрастного вещества (10-20 мл) перед диагностическим сканированием может помочь индивидуализировать временную задержку, это трудоемкий метод (6).Чтобы преодолеть эти ограничения, недавно была разработана компьютерная система отслеживания болюса, которая автоматически запускает диагностическое сканирование, запускаемое самим контрастным усилением. Используя сканирование с низкой дозой (около 50 мА), эта технология позволяет запускать сканирование вручную или автоматически, когда усиление контрастности повышается до предварительно определенного порога в интересующей области (ROI) (7). Некоторые исследования показали, что автоматическое отслеживание болюса может лучше индивидуализировать временную задержку для начала диагностического сканирования печени, а также поджелудочной железы и, таким образом, улучшить степень усиления контраста и заметность поражения паренхимы (8-10).Однако по этому поводу все еще существуют разногласия, и результаты предыдущих исследований были другими. Некоторые исследования рекомендуют болюсное отслеживание только в том случае, если пациенты старше 70 лет и / или имеют сердечно-сосудистые заболевания, и / или когда нет адекватной антекубитальной вены для инъекции контрастного вещества для снижения дополнительной дозы облучения (11). Кроме того, некоторые исследования показали, что при использовании метода отслеживания болюса 35% пациентов могут не достичь порога на 50 HU выше исходного уровня через 60 секунд после начала инъекции, и тогда потребуется использование установленной задержки (12).
2. Цели
Таким образом, это исследование было проведено для сравнения автоматического отслеживания болюса с фиксированной временной задержкой при двухфазном усилении контраста аорты, печени и селезенки во время МДКТ.
3. Пациенты и методы лечения
3.1. Набор пациентов
Это проспективное исследование было проведено с участием 48 последовательных взрослых пациентов, направленных с августа по ноябрь 2010 г. в отделение MDCT больницы Альзахра (Исфахан, Иран) для проведения КТ брюшной полости с контрастным усилением. Показаниями были неуверенные поражения печени при ультразвуковом исследовании (n = 19), подозрительные метастазы (n = 15) и гепатоцеллюлярная карцинома (HCC) (n = 14).Пациенты с сердечной недостаточностью в исследование не включались. Комитет по этике Исфаханского университета медицинских наук одобрил исследование, и от всех пациентов было получено информированное согласие.
3.2. Метод визуализации
Пациенты были обследованы с помощью многодетекторного компьютерного томографа (LightSpeed VCT 64, GE Healthcare, Солт-Лейк-Сити, Юта, США). Параметры сканирования: коллимация 64 × 0,625 мм; толщина среза 5 мм; смола 1,375; скорость стола / вращение портала 55 мм; кВ 140; и мА 240.Перед введением контрастного вещества была проведена спиральная КТ печени без усиления. Для двухфазной спиральной компьютерной томографии печень сканировали в артериальной и портально-венозной фазах перфузии печени. С помощью механического инжектора 100 мл Иопромида (Ultravist 300, Schering, Берлин, Германия) вводили в антекубитальную вену со скоростью 4,0 мл / с.
Пациенты были рандомизированы на две группы с использованием случайной таблицы, созданной с помощью программного обеспечения случайного распределения (13). В группе 1 сканирование по спирали в артериальной и воротно-венозной фазах было начато через 25 и 55 с соответственно после начала введения контрастного вещества.В группе 2 эталонное сканирование, которое определяет уровень сканирования монитора с отслеживанием болюса, было размещено на 1 см ниже уровня диафрагмы на инспираторной топограмме. Программное обеспечение для автоматического отслеживания болюса (Snapshot Pulse / GE Healthcare, Солт-Лейк-Сити, Юта, США) было реализовано на сканере. Повторные мониторинговые сканирования выполнялись на уровне одного среза во время дыхания при 50 мА с продолжительностью сканирования 0,5 с. Контрольные сканирования начинались с задержкой в 8 с и повторялись каждые 2 с при спокойном дыхании.Как только порог контрастного усиления (60 HU) был достигнут в пределах ROI (просвет нисходящей аорты), было начато диагностическое спиральное сканирование (8). Примерно через 6-9 с (для перемещения стола и команды дыхания пациенту) после превышения порогового уровня запускалось сканирование по спирали артериальной фазы. Портально-венозное сканирование автоматически запускалось через 15 секунд после завершения сканирования артериальной фазы (8).
3.3. Оценки
У всех пациентов плотность печени перед контрастированием измерялась путем вычисления среднего из шести измерений ROI (площадь каждой ROI составляла не менее 3 см 2 ), определенных на шести различных уровнях среза от купола печени до его нижние части.Интервал между выбранными разрезами КТ печени составлял около 2 см. На постконтрастных сканированиях среднее ослабление нормальной паренхимы для каждого среза оценивалось отдельно по среднему значению трех измерений ROI с площадью не менее 3 см 2 . При всех измерениях ROI избегали больших внутрипеченочных сосудов, поражений печени или эффектов частичного объема. Рассчитывали максимальную плотность печени в артериальной фазе и среднюю плотность печени в портально-венозной фазе. Кроме того, определялась предконтрастная и постконтрастная плотность аорты примерно на два сантиметра ниже диафрагмы и селезенки в центральной части ее паренхимы (8).
3.4. Статистический анализ
Статистический анализ выполняли с использованием программного обеспечения SPSS для Windows 16.0 (SPSS Inc., Чикаго, Иллинойс, США) с помощью t-критерия независимой выборки для несопоставленных выборок, сравнивая группу 1 с группой 2. Уровень значимости рассматривался при P <0,05. .
4. Результаты
За исследуемый период обследовано 23 пациента мужского и 25 женского пола со средним возрастом 56,4 ± 13,5 года. Средний вес составил 68,0 ± 8,3 кг в группе 1 и 70,3 ± 8,3 кг во 2 группе (P> 0.05). Порог усиления в аорте 60 HU был достигнут у всех пациентов через 15-23 с (17,7 ± 2,2 с) после начала введения контраста. Количество сканирований монитора варьировалось от 3 до 7 сканирований (4,5 ± 1,1), что соответствовало дополнительному воздействию 227,0 ± 57,0 мАс (50 мА на срез, время сканирования 0,5 с). представляет плотность до контрастирования и усиление (в единицах HU) аорты, печени и селезенки на артериальной и портальной фазах в двух группах. Эти две группы были схожи в отношении плотности аорты, печени и селезенки перед контрастированием (P> 0.05). Не было существенной разницы между двумя группами в максимальном контрастировании аорты, печени и селезенки в артериальной фазе (P> 0,05). Что касается портальной фазы, то аорта и селезенка были более усилены в группе с отслеживанием болюса (P <0,001). Рисуя кривые нормального распределения, болюсное отслеживание обеспечивало более однородное усиление контраста у разных пациентов, чем метод фиксированной задержки по времени в печени в портальной фазе, но не значительно в артериальной фазе (и).
Повышение контрастности печени в A, артериальной и B, портальной фазе с фиксированным временем задержки
Повышение контрастности печени в A, артериальной и B, портальной фазе с методом болюсного отслеживания
Таблица 1.
Предконтрастная плотность и усиление (HU) аорты, печени и селезенки на артериальной и портальной фазах
| Фиксированная задержка времени a (n = 24) | Болюс Отслеживание (n = 24) | Значение P | |||
|---|---|---|---|---|---|
| Аорта | Исходный уровень | 42.7 ± 7,3 | 45,4 ± 8,4 | 0,256 | |
| Усиление артериальной фазы | 231,7 ± 104,7 | 264,7 ± 82,2 | 0,231 | ||
| 374 | Портал 9014 ± | ± 121,1 | <0,001 | ||
| Печень | Исходный уровень | 58,4 ± 10,5 | 57,8 ± 8,3 | 0,833 | |
| Улучшение артериальной фазы14 | 7 ± 4,55,0 ± 5,1 | 0,637 | |||
| Усиление фазы портала | 43,8 ± 20,9 | 42,9 ± 15,5 | 0,858 | ||
| 0,820 | |||||
| Усиление артериальной фазы | 37,4 ± 29,9 | 30,8 ± 14,8 | 0,340 | ||
| Усиление портальной фазы | 80.2 ± 19,1 | 112,2 ± 34,7 | <0,001 |
5. Обсуждение
Объем контрастного вещества и скорость введения являются контролируемыми факторами, которые влияют на степень увеличения контрастности при КТ печени. Однако индивидуальные вариации, такие как масса тела, частота сердечных сокращений и нарушения кровообращения, являются другими важными влияющими факторами, которые нельзя контролировать или легко учесть (3-5). Таким образом, такая техника, как автоматическое отслеживание болюса, которое может индивидуализировать временную задержку между введением контрастного вещества и началом диагностической визуализации, имеет большую ценность.Мы исследовали, может ли автоматическое болюсное отслеживание, по сравнению с фиксированной временной задержкой, обеспечить лучшее усиление контраста аорты, печени и селезенки во время двухфазной МДКТ. Мы обнаружили, что метод болюсного отслеживания полезен для усиления контраста при визуализации аорты и селезенки в портальной фазе, но не было положительного эффекта для этого метода визуализации печени. В этом отношении результаты предыдущих исследований были другими. Динкель и его коллеги (14) обнаружили повышенное печеночное усиление на портальной фазе с помощью болюсного отслеживания (порог 31 HU) по сравнению с методом фиксированной задержки (80 с).Itoh и его коллеги (11) сравнили отслеживание болюса (порог 130 HU) с фиксированной временной задержкой (30 с) при визуализации печени в поздней артериальной и портально-венозной фазах у пациентов с гепатоцеллюлярной карциномой (ГЦК) и не обнаружили разницы между эти два метода – увеличение или получение контраста или заметное поражение печени. В другом исследовании Mehnert et al. (9), отслеживание болюса (порог 40 HU) сравнивалось с исследованиями с временной задержкой (65 с) для монофазной спиральной КТ печени, и не было обнаружено различий в паренхиматозном усилении между двумя методами.Однако при автоматическом отслеживании болюса наблюдалась значительно большая разница в плотности поражения печени (8). В другом исследовании этих исследователей на двухфазной спиральной КТ печени авторы обнаружили более высокое максимальное усиление паренхимы печени в группе с фиксированной временной задержкой. Исследователи предположили, что это более высокое усиление может снизить способность очертить артериализованное поражение в печени (9). Brodoefel и его коллеги (15) сравнили отслеживание болюса (порог 50 HU) с точки зрения улучшения состояния печени, видимого поражения печени и вариабельности между изображениями в последовательных МДКТ пациентов с метастазами в печени и сравнили его с эмпирической задержкой. 65 с.Авторы обнаружили более высокое улучшение печени (около 11 UH) и заметность гипоусиливающих поражений (около 20 HU) с запуском паренхимы по сравнению с методом фиксированной задержки по времени (15).
Разница между предыдущими исследованиями может быть связана с используемым протоколом; порог и соответствующая задержка сканирования (интервал между обнаружением повышения порога и инициированием визуализации), ROI для порога, а также объем контраста и скорость впрыска (16, 17). В исследовании Kitamura et al.(18) болюсное отслеживание с разными порогами (120, 160 и 200 HU аорты) сравнивалось с визуализацией в двойной артериальной фазе (25 и 40 с) для выявления гиперваскулярного ГЦК. Авторы обнаружили, что отслеживание болюса с порогом 200 HU привело к более заметному ослаблению (42 ± 18 HU), чем с 120 HU (23 ± 11 HU) и 160 HU (25 ± 11 HU), а также к более высокой чувствительности (92,7%). ), чем 120 HU (72,4%) и 160 HU (71,1%) (18). Sandstede et al. (19) также сравнили шесть протоколов с комбинацией 5- или 10-секундных задержек сканирования и пороговых значений 50, 75 или 100 HU (в аорте).Авторы обнаружили, что 10-секундная задержка после порога 75HU привела к оптимальной артериальной фазе у большинства пациентов (определяемой как 20-30% -ное улучшение функции печени в фазе воротной вены). Однако, по сравнению со стандартной задержкой, отслеживание болюса выявило только тенденцию к различию (19). Результаты исследования Kim et al. (20) предлагает оптимальную задержку сканирования для изображений артериальной фазы при обнаружении ГЦК примерно от 14 до 30 секунд от порога 100 HU, в то время как в другом исследовании Goshima и его коллег (21) было предложено от 10 до 15 секунд для артериальная фаза и от 45 до 55 секунд для фазы воротной вены после повышения порога обнаружения на 50 HU в нижнем грудном отделе аорты 21.По данным Osimani et al. (22) слишком раннее сканирование приводит к изображениям, которые получают до усиления сосудистого пика, в то время как слишком позднее сканирование приводит к увеличению питания паренхимы печени в портальной фазе. Хорошие характеристики были получены при задержке сканирования от 10 до 19 секунд с момента запуска (22).
Мы обнаружили, что отслеживание болюса обеспечивает более однородное усиление контраста, чем метод фиксированной задержки у разных пациентов. Frush и его коллеги (23) в исследовании, проведенном на детях, также обнаружили, что метод болюсного отслеживания не только улучшил контрастное усиление, но также привел к более однородному усилению от верхнего до нижнего уровней печени, чем метод фиксированной задержки по времени.Brodoefel (15) также обнаружил, что отслеживание болюса в печени связано с уменьшением вариабельности улучшения печени у разных пациентов и в ходе последовательных контрольных обследований отдельных пациентов, что позволяет более точно наблюдать за пациентами.
Результаты этого исследования показали, что метод автоматического болюсного отслеживания с порогом 60 HU на аорте приводит к более высокому контрастному усилению аорты и селезенки на портальной фазе, но не влияет на улучшение функции печени.Кроме того, болюсное отслеживание связано с уменьшением вариабельности улучшения состояния печени у разных пациентов. Необходимы дальнейшие исследования, чтобы найти оптимальный протокол, включая порог и соответствующую задержку сканирования, ROI для порога, а также объем контраста и скорость инъекции. Мы предлагаем другое исследование с большими объемами образцов при различных патологиях печени, сравнивая эти постконтрастные методы, сравнивая индивидуальную патологию печени отдельно.
Благодарности
Благодарностей нет.
Сноски
Значение для политики / практики / исследований / медицинского образования в области здравоохранения: Результаты текущего исследования могут помочь рентгенологам повысить качество изображения КТ брюшной полости с помощью мутидетектора брюшной полости с использованием метода автоматического болюсного отслеживания вместо метода фиксированной задержки, поскольку он показывает более высокое контрастное усиление портальной фазы в некоторых органах брюшной полости.
Вклад авторов: Все авторы в равной степени участвовали в этом исследовании.
Раскрытие финансовой информации: Конфликт интересов отсутствует.
Финансирование / поддержка: Исследование финансировалось за счет собственных средств.
Список литературы
1. Ото А., Тамм Е.П., Шкларук Дж. Многодетекторная рядная компьютерная томография печени. Radiol Clin North Am. 2005; 43 (5): 827-48. DOI: 10.1016 / j.rcl.2005.05.002. [PubMed] [CrossRef] [Google Scholar] 2. Итикава Т., Эртурк С.М., Араки Т. Многофазная многорядная КТ печени с контрастным усилением: теория повышения контрастности и практический протокол сканирования с комбинацией фиксированной продолжительности инъекции и дозы контрастного вещества, адаптированной к массе тела пациента.Eur J Radiol. 2006. 58 (2): 165–76. DOI: 10.1016 / j.ejrad.2005.11.037. [PubMed] [CrossRef] [Google Scholar] 3. Bae KT, Seeck BA, Hildebolt CF, Tao C, Zhu F, Kanematsu M, et al. Повышение контрастности в MDCT сердечно-сосудистой системы: влияние массы тела, роста, площади поверхности тела, индекса массы тела и ожирения. AJR Am J Roentgenol. 2008. 190 (3): 777–84. DOI: 10.2214 / AJR.07.2765. [PubMed] [CrossRef] [Google Scholar] 4. Bae KT, Tao C, Gurel S, Hong C, Zhu F, Gebke TA и др. Влияние веса пациента и продолжительности сканирования на усиление контраста во время мультидетекторной КТ-ангиографии легких.Радиология. 2007. 242 (2): 582–9. DOI: 10.1148 / radiol.2422052132. [PubMed] [CrossRef] [Google Scholar] 5. Brink JA. Оптимизация контрастности и синхронизация сканирования для одно- и многорядной компьютерной томографии. J Comput Assist Tomogr. 2003; 27 Приложение 1: С3–8. [PubMed] [Google Scholar] 6. Лаги А. Многодетекторная компьютерная томография (64 среза) печени: методы исследования. Eur Radiol. 2007. 17 (3): 675–83. DOI: 10.1007 / s00330-006-0405-0. [PubMed] [CrossRef] [Google Scholar] 7. Сильверман П.М., Робертс С., Теффт М.С., Браун Б., Фокс С.Х., Купер С. и др.Спиральная компьютерная томография печени: клиническое применение автоматизированного компьютерного метода SmartPrep для получения изображений с оптимальным усилением контраста. AJR Am J Roentgenol. 1995. 165 (1): 73–8. DOI: 10.2214 / ajr.165.1.7785637. [PubMed] [CrossRef] [Google Scholar] 8. Mehnert F, Pereira PL, Trubenbach J, Kopp AF, Claussen CD. Автоматическое отслеживание болюса в однофазной спиральной компьютерной томографии печени: заметность поражения печени. Eur Radiol. 2001. 11 (4): 580–4. [PubMed] [Google Scholar] 9. Mehnert F, Pereira PL, Trubenbach J, Kopp AF, Claussen CD.Двухфазная спиральная КТ печени: автоматическое болюсное отслеживание или временная задержка? Eur Radiol. 2001. 11 (3): 427–31. [PubMed] [Google Scholar] 10. Фукукура Ю., Такуми К., Камияма Т., Шиндо Т., Хигаши Р., Накаджо М. Аденокарцинома поджелудочной железы: сравнение автоматического отслеживания болюса и задержки эмпирического сканирования. Визуализация брюшной полости. 2010. 35 (5): 548–55. DOI: 10.1007 / s00261-009-9560-5. [PubMed] [CrossRef] [Google Scholar] 11. Ито С., Икеда М., Ачива М., Сатаке Х., Ивано С., Исигаки Т. Визуализация печени в поздней артериальной и воротно-венозной фазах с помощью мультиспирального компьютерного томографа у пациентов без нарушений кровообращения: автоматическое отслеживание болюса или задержка эмпирического сканирования? Eur Radiol.2004. 14 (9): 1665–73. DOI: 10.1007 / s00330-004-2321-5. [PubMed] [CrossRef] [Google Scholar] 12. Полсон EK, Фишер AJ, Делонг DM, Паркер DD, Нельсон RC. Спиральная компьютерная томография печени с компьютерной технологией отслеживания болюса: можно ли предсказать, какие пациенты не достигнут порога улучшения? Радиология. 1998. 209 (3): 787–92. DOI: 10.1148 / radiology.209.3.9844675. [PubMed] [CrossRef] [Google Scholar] 14. Динкель HP, Маттич Дж. [Многорядная детекторная КТ-ангиография брюшной аорты: отслеживание болюса по сравнению с фиксированной задержкой начала].Рофо. 2003. 175 (11): 1567–71. DOI: 10,1055 / с-2003-43394. [PubMed] [CrossRef] [Google Scholar] 15. Brodoefel H, Tognolini A, Zamboni GA, Gourtsoyianni S, Claussen CD, Raptopoulos V. Стандартизация MDCT печени путем отслеживания усиления паренхимы печени для запуска визуализации. Eur Radiol. 2012; 22 (4): 812–20. DOI: 10.1007 / s00330-011-2310-4. [PubMed] [CrossRef] [Google Scholar] 16. Симидзу Т., Мисаки Т., Ямамото К., Суэёси К., Нарабаяши И. Спиральная компьютерная томография печени с компьютерной технологией отслеживания болюса: задержка сканирования артериального фазового сканирования и влияние скорости потока.J Comput Assist Tomogr. 2000. 24 (2): 219–23. [PubMed] [Google Scholar] 17. Копка Л., Роденвальдт Дж., Фишер Ю., Мюллер Д. В., Остман Дж. В., Граббе Э. Двухфазная спиральная КТ печени: эффекты болюсного отслеживания и различных объемов контрастного вещества. Радиология. 1996. 201 (2): 321–6. DOI: 10.1148 / радиология.201.2.8888218. [PubMed] [CrossRef] [Google Scholar] 18. Китамура Т., Итикава Т., Эртурк С.М., Накадзима Х., Соу Х., Араки Т. и др. Обнаружение гиперваскулярной гепатоцеллюлярной карциномы с помощью многорядной КТ: визуализация одной артериальной фазы с помощью компьютерной техники автоматического болюсного отслеживания по сравнению с двойной визуализацией в артериальной фазе.J Comput Assist Tomogr. 2008. 32 (5): 724–9. DOI: 10.1097 / RCT.0b013e318154b1f5. [PubMed] [CrossRef] [Google Scholar] 19. Sandstede JJ, Werner A, Kaupert C, Roth A, Jenett M, Harz C, et al. Проспективное исследование, сравнивающее различные концентрации йода для трехфазной мультидетекторной рядной КТ верхней части живота. Eur J Radiol. 2006. 60 (1): 95–9. DOI: 10.1016 / j.ejrad.2006.05.012. [PubMed] [CrossRef] [Google Scholar] 20. Ким Т., Мураками Т., Хори М., Такамура М., Такахаши С., Окада А. и др. Небольшая гиперваскулярная гепатоцеллюлярная карцинома, выявленная при двойной артериальной фазе КТ, выполненной с однократным сканированием с задержкой дыхания и автоматическим болюсным отслеживанием.AJR Am J Roentgenol. 2002. 178 (4): 899–904. DOI: 10.2214 / ajr.178.4.1780899. [PubMed] [CrossRef] [Google Scholar] 21. Госима С., Канемацу М., Кондо Х., Йокояма Р., Миёси Т., Като Х. и др. Поджелудочная железа: оптимальная задержка сканирования для многодетекторной КТ с контрастным усилением. Радиология. 2006. 241 (1): 167–74. DOI: 10.1148 / radiol.2411051338. [PubMed] [CrossRef] [Google Scholar] 22. Осимани М., Ренго М., Паолантонио П., Феррари Р., Де Чекко С. Н., Беллини Д. и др. Компьютерная томографическая ангиография с шестьюдесятью четырьмя многодетекторными рядами и болюсным отслеживанием во времени визуализации артериальной фазы в здоровой печени: существует ли корреляция между количественными и качественными показателями? J Comput Assist Tomogr.2010. 34 (6): 883–91. DOI: 10.1097 / RCT.0b013e3181dd80c8. [PubMed] [CrossRef] [Google Scholar] 23. Фруш Д.П., Спенсер Э.Б., Доннелли Л.Ф., Чжэн Дж.Й., Делонг Д.М., Биссет Г.С., 3-е место. Оптимизация КТ брюшной полости с контрастным усилением у младенцев и детей с помощью болюсного отслеживания. AJR Am J Roentgenol. 1999. 172 (4): 1007–13. DOI: 10.2214 / ajr.172.4.10587137. [PubMed] [CrossRef] [Google Scholar]Автоматическое отслеживание болюса по сравнению с методом фиксированной задержки времени в двухфазной мультидетекторной компьютерной томографии брюшной полости
Иран Дж. Радиол.2014 Янв; 11 (1): e4617.
Атооса Адиби
1 Отделение радиологии Исфаханского университета медицинских наук, Исфахан, Иран
Али Шахбази
1 Отделение радиологии Исфаханского университета медицинских наук, Исфахан, Иран
1 Отделение радиологии, Исфаханский университет медицинских наук, Исфахан, Иран
* Автор, ответственный за переписку: Атооса Адиби, отделение радиологии, больница Альзахра, Исфаханский университет медицинских наук, проспект Соффе., Исфахан, Иран. Тел .: +983116255555, Факс: + 98-3116687898, Электронная почта: ri.ca.ium.dem@ibida_aПолучено 3 апреля 2012 г .; Пересмотрено 14 августа 2012 г .; Принято 13 октября 2012 г.
Авторские права © 2014, Тегеранский университет медицинских наук и Иранское общество радиологов; Опубликовано Kowsar Corp.Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии правильного цитирования оригинальной работы.
Эта статья цитируется в других статьях в PMC.Аннотация
Предпосылки
Отслеживание болюса позволяет индивидуализировать временную задержку для начала сканирования в спиральной компьютерной томографии (КТ).
Объективы
Мы сравнили автоматический метод отслеживания болюса с методом фиксированной задержки при двухфазном усилении контраста во время мультидетекторной компьютерной томографии брюшной полости.
Пациенты и методы
Взрослые пациенты, направленные на спиральную КТ брюшной полости, были рандомизированы на две группы; в группе 1 артериальная и портальная фазы спирального сканирования начинались через 25 и 55 с после начала введения контрастного вещества; в группе 2 с использованием программного обеспечения автоматического отслеживания болюса повторяющиеся мониторинговые сканирования выполнялись в просвете нисходящей аорты как интересующей области с порогом запуска диагностического сканирования 60 HU.Повышение контрастности аорты, печени и селезенки сравнивали между группами.
Результаты
В исследование были включены 48 пациентов (23 мужчины, 25 женщин, средний возраст = 56,4 ± 13,5 лет). Увеличение контраста аорты, печени и селезенки в артериальной фазе было одинаковым между двумя группами (P> 0,05). Что касается портальной фазы, то аорта и селезенка были более усилены в группе с отслеживанием болюса (P <0,001). Болюсное отслеживание обеспечивало более однородное усиление контраста у разных пациентов, чем метод фиксированной задержки по времени в печени в портальной фазе, но не в артериальной фазе.
Выводы
Метод автоматического болюсного отслеживания приводит к более высокому контрастному усилению аорты и селезенки на портальной фазе, но не влияет на улучшение функции печени. Однако отслеживание болюса связано с уменьшением вариабельности улучшения печени у разных пациентов.
Ключевые слова: Многодетекторная компьютерная томография, томография, спиральные вычисления
1. Предпосылки
Благодаря последним достижениям в технологии спиральной компьютерной томографии (КТ), теперь стало возможным получение изображений всей печени с помощью многодетекторной компьютерной томографии (МДКТ). менее чем за 20 секунд с двумя или более различными фазами перфузии (1).При таком быстром сканировании важно оптимизировать временную задержку между инъекцией контрастного вещества и началом диагностического сканирования, особенно для артериальной фазы (2). Индивидуальные вариации в отношении массы тела, частоты сердечных сокращений, времени кровообращения и сердечных нарушений могут влиять на временное окно, а также на необходимую скорость и объем контрастного вещества и, таким образом, могут быть проблематичными при достижении оптимального усиления контраста (3-5). Хотя отслеживание небольшого болюса контрастного вещества (10-20 мл) перед диагностическим сканированием может помочь индивидуализировать временную задержку, это трудоемкий метод (6).Чтобы преодолеть эти ограничения, недавно была разработана компьютерная система отслеживания болюса, которая автоматически запускает диагностическое сканирование, запускаемое самим контрастным усилением. Используя сканирование с низкой дозой (около 50 мА), эта технология позволяет запускать сканирование вручную или автоматически, когда усиление контрастности повышается до предварительно определенного порога в интересующей области (ROI) (7). Некоторые исследования показали, что автоматическое отслеживание болюса может лучше индивидуализировать временную задержку для начала диагностического сканирования печени, а также поджелудочной железы и, таким образом, улучшить степень усиления контраста и заметность поражения паренхимы (8-10).Однако по этому поводу все еще существуют разногласия, и результаты предыдущих исследований были другими. Некоторые исследования рекомендуют болюсное отслеживание только в том случае, если пациенты старше 70 лет и / или имеют сердечно-сосудистые заболевания, и / или когда нет адекватной антекубитальной вены для инъекции контрастного вещества для снижения дополнительной дозы облучения (11). Кроме того, некоторые исследования показали, что при использовании метода отслеживания болюса 35% пациентов могут не достичь порога на 50 HU выше исходного уровня через 60 секунд после начала инъекции, и тогда потребуется использование установленной задержки (12).
2. Цели
Таким образом, это исследование было проведено для сравнения автоматического отслеживания болюса с фиксированной временной задержкой при двухфазном усилении контраста аорты, печени и селезенки во время МДКТ.
3. Пациенты и методы лечения
3.1. Набор пациентов
Это проспективное исследование было проведено с участием 48 последовательных взрослых пациентов, направленных с августа по ноябрь 2010 г. в отделение MDCT больницы Альзахра (Исфахан, Иран) для проведения КТ брюшной полости с контрастным усилением. Показаниями были неуверенные поражения печени при ультразвуковом исследовании (n = 19), подозрительные метастазы (n = 15) и гепатоцеллюлярная карцинома (HCC) (n = 14).Пациенты с сердечной недостаточностью в исследование не включались. Комитет по этике Исфаханского университета медицинских наук одобрил исследование, и от всех пациентов было получено информированное согласие.
3.2. Метод визуализации
Пациенты были обследованы с помощью многодетекторного компьютерного томографа (LightSpeed VCT 64, GE Healthcare, Солт-Лейк-Сити, Юта, США). Параметры сканирования: коллимация 64 × 0,625 мм; толщина среза 5 мм; смола 1,375; скорость стола / вращение портала 55 мм; кВ 140; и мА 240.Перед введением контрастного вещества была проведена спиральная КТ печени без усиления. Для двухфазной спиральной компьютерной томографии печень сканировали в артериальной и портально-венозной фазах перфузии печени. С помощью механического инжектора 100 мл Иопромида (Ultravist 300, Schering, Берлин, Германия) вводили в антекубитальную вену со скоростью 4,0 мл / с.
Пациенты были рандомизированы на две группы с использованием случайной таблицы, созданной с помощью программного обеспечения случайного распределения (13). В группе 1 сканирование по спирали в артериальной и воротно-венозной фазах было начато через 25 и 55 с соответственно после начала введения контрастного вещества.В группе 2 эталонное сканирование, которое определяет уровень сканирования монитора с отслеживанием болюса, было размещено на 1 см ниже уровня диафрагмы на инспираторной топограмме. Программное обеспечение для автоматического отслеживания болюса (Snapshot Pulse / GE Healthcare, Солт-Лейк-Сити, Юта, США) было реализовано на сканере. Повторные мониторинговые сканирования выполнялись на уровне одного среза во время дыхания при 50 мА с продолжительностью сканирования 0,5 с. Контрольные сканирования начинались с задержкой в 8 с и повторялись каждые 2 с при спокойном дыхании.Как только порог контрастного усиления (60 HU) был достигнут в пределах ROI (просвет нисходящей аорты), было начато диагностическое спиральное сканирование (8). Примерно через 6-9 с (для перемещения стола и команды дыхания пациенту) после превышения порогового уровня запускалось сканирование по спирали артериальной фазы. Портально-венозное сканирование автоматически запускалось через 15 секунд после завершения сканирования артериальной фазы (8).
3.3. Оценки
У всех пациентов плотность печени перед контрастированием измерялась путем вычисления среднего из шести измерений ROI (площадь каждой ROI составляла не менее 3 см 2 ), определенных на шести различных уровнях среза от купола печени до его нижние части.Интервал между выбранными разрезами КТ печени составлял около 2 см. На постконтрастных сканированиях среднее ослабление нормальной паренхимы для каждого среза оценивалось отдельно по среднему значению трех измерений ROI с площадью не менее 3 см 2 . При всех измерениях ROI избегали больших внутрипеченочных сосудов, поражений печени или эффектов частичного объема. Рассчитывали максимальную плотность печени в артериальной фазе и среднюю плотность печени в портально-венозной фазе. Кроме того, определялась предконтрастная и постконтрастная плотность аорты примерно на два сантиметра ниже диафрагмы и селезенки в центральной части ее паренхимы (8).
3.4. Статистический анализ
Статистический анализ выполняли с использованием программного обеспечения SPSS для Windows 16.0 (SPSS Inc., Чикаго, Иллинойс, США) с помощью t-критерия независимой выборки для несопоставленных выборок, сравнивая группу 1 с группой 2. Уровень значимости рассматривался при P <0,05. .
4. Результаты
За исследуемый период обследовано 23 пациента мужского и 25 женского пола со средним возрастом 56,4 ± 13,5 года. Средний вес составил 68,0 ± 8,3 кг в группе 1 и 70,3 ± 8,3 кг во 2 группе (P> 0.05). Порог усиления в аорте 60 HU был достигнут у всех пациентов через 15-23 с (17,7 ± 2,2 с) после начала введения контраста. Количество сканирований монитора варьировалось от 3 до 7 сканирований (4,5 ± 1,1), что соответствовало дополнительному воздействию 227,0 ± 57,0 мАс (50 мА на срез, время сканирования 0,5 с). представляет плотность до контрастирования и усиление (в единицах HU) аорты, печени и селезенки на артериальной и портальной фазах в двух группах. Эти две группы были схожи в отношении плотности аорты, печени и селезенки перед контрастированием (P> 0.05). Не было существенной разницы между двумя группами в максимальном контрастировании аорты, печени и селезенки в артериальной фазе (P> 0,05). Что касается портальной фазы, то аорта и селезенка были более усилены в группе с отслеживанием болюса (P <0,001). Рисуя кривые нормального распределения, болюсное отслеживание обеспечивало более однородное усиление контраста у разных пациентов, чем метод фиксированной задержки по времени в печени в портальной фазе, но не значительно в артериальной фазе (и).
Повышение контрастности печени в A, артериальной и B, портальной фазе с фиксированным временем задержки
Повышение контрастности печени в A, артериальной и B, портальной фазе с методом болюсного отслеживания
Таблица 1.
Предконтрастная плотность и усиление (HU) аорты, печени и селезенки на артериальной и портальной фазах
| Фиксированная задержка времени a (n = 24) | Болюс Отслеживание (n = 24) | Значение P | |||
|---|---|---|---|---|---|
| Аорта | Исходный уровень | 42.7 ± 7,3 | 45,4 ± 8,4 | 0,256 | |
| Усиление артериальной фазы | 231,7 ± 104,7 | 264,7 ± 82,2 | 0,231 | ||
| 374 | Портал 9014 ± | ± 121,1 | <0,001 | ||
| Печень | Исходный уровень | 58,4 ± 10,5 | 57,8 ± 8,3 | 0,833 | |
| Улучшение артериальной фазы14 | 7 ± 4,55,0 ± 5,1 | 0,637 | |||
| Усиление фазы портала | 43,8 ± 20,9 | 42,9 ± 15,5 | 0,858 | ||
| 0,820 | |||||
| Усиление артериальной фазы | 37,4 ± 29,9 | 30,8 ± 14,8 | 0,340 | ||
| Усиление портальной фазы | 80.2 ± 19,1 | 112,2 ± 34,7 | <0,001 |
5. Обсуждение
Объем контрастного вещества и скорость введения являются контролируемыми факторами, которые влияют на степень увеличения контрастности при КТ печени. Однако индивидуальные вариации, такие как масса тела, частота сердечных сокращений и нарушения кровообращения, являются другими важными влияющими факторами, которые нельзя контролировать или легко учесть (3-5). Таким образом, такая техника, как автоматическое отслеживание болюса, которое может индивидуализировать временную задержку между введением контрастного вещества и началом диагностической визуализации, имеет большую ценность.Мы исследовали, может ли автоматическое болюсное отслеживание, по сравнению с фиксированной временной задержкой, обеспечить лучшее усиление контраста аорты, печени и селезенки во время двухфазной МДКТ. Мы обнаружили, что метод болюсного отслеживания полезен для усиления контраста при визуализации аорты и селезенки в портальной фазе, но не было положительного эффекта для этого метода визуализации печени. В этом отношении результаты предыдущих исследований были другими. Динкель и его коллеги (14) обнаружили повышенное печеночное усиление на портальной фазе с помощью болюсного отслеживания (порог 31 HU) по сравнению с методом фиксированной задержки (80 с).Itoh и его коллеги (11) сравнили отслеживание болюса (порог 130 HU) с фиксированной временной задержкой (30 с) при визуализации печени в поздней артериальной и портально-венозной фазах у пациентов с гепатоцеллюлярной карциномой (ГЦК) и не обнаружили разницы между эти два метода – увеличение или получение контраста или заметное поражение печени. В другом исследовании Mehnert et al. (9), отслеживание болюса (порог 40 HU) сравнивалось с исследованиями с временной задержкой (65 с) для монофазной спиральной КТ печени, и не было обнаружено различий в паренхиматозном усилении между двумя методами.Однако при автоматическом отслеживании болюса наблюдалась значительно большая разница в плотности поражения печени (8). В другом исследовании этих исследователей на двухфазной спиральной КТ печени авторы обнаружили более высокое максимальное усиление паренхимы печени в группе с фиксированной временной задержкой. Исследователи предположили, что это более высокое усиление может снизить способность очертить артериализованное поражение в печени (9). Brodoefel и его коллеги (15) сравнили отслеживание болюса (порог 50 HU) с точки зрения улучшения состояния печени, видимого поражения печени и вариабельности между изображениями в последовательных МДКТ пациентов с метастазами в печени и сравнили его с эмпирической задержкой. 65 с.Авторы обнаружили более высокое улучшение печени (около 11 UH) и заметность гипоусиливающих поражений (около 20 HU) с запуском паренхимы по сравнению с методом фиксированной задержки по времени (15).
Разница между предыдущими исследованиями может быть связана с используемым протоколом; порог и соответствующая задержка сканирования (интервал между обнаружением повышения порога и инициированием визуализации), ROI для порога, а также объем контраста и скорость впрыска (16, 17). В исследовании Kitamura et al.(18) болюсное отслеживание с разными порогами (120, 160 и 200 HU аорты) сравнивалось с визуализацией в двойной артериальной фазе (25 и 40 с) для выявления гиперваскулярного ГЦК. Авторы обнаружили, что отслеживание болюса с порогом 200 HU привело к более заметному ослаблению (42 ± 18 HU), чем с 120 HU (23 ± 11 HU) и 160 HU (25 ± 11 HU), а также к более высокой чувствительности (92,7%). ), чем 120 HU (72,4%) и 160 HU (71,1%) (18). Sandstede et al. (19) также сравнили шесть протоколов с комбинацией 5- или 10-секундных задержек сканирования и пороговых значений 50, 75 или 100 HU (в аорте).Авторы обнаружили, что 10-секундная задержка после порога 75HU привела к оптимальной артериальной фазе у большинства пациентов (определяемой как 20-30% -ное улучшение функции печени в фазе воротной вены). Однако, по сравнению со стандартной задержкой, отслеживание болюса выявило только тенденцию к различию (19). Результаты исследования Kim et al. (20) предлагает оптимальную задержку сканирования для изображений артериальной фазы при обнаружении ГЦК примерно от 14 до 30 секунд от порога 100 HU, в то время как в другом исследовании Goshima и его коллег (21) было предложено от 10 до 15 секунд для артериальная фаза и от 45 до 55 секунд для фазы воротной вены после повышения порога обнаружения на 50 HU в нижнем грудном отделе аорты 21.По данным Osimani et al. (22) слишком раннее сканирование приводит к изображениям, которые получают до усиления сосудистого пика, в то время как слишком позднее сканирование приводит к увеличению питания паренхимы печени в портальной фазе. Хорошие характеристики были получены при задержке сканирования от 10 до 19 секунд с момента запуска (22).
Мы обнаружили, что отслеживание болюса обеспечивает более однородное усиление контраста, чем метод фиксированной задержки у разных пациентов. Frush и его коллеги (23) в исследовании, проведенном на детях, также обнаружили, что метод болюсного отслеживания не только улучшил контрастное усиление, но также привел к более однородному усилению от верхнего до нижнего уровней печени, чем метод фиксированной задержки по времени.Brodoefel (15) также обнаружил, что отслеживание болюса в печени связано с уменьшением вариабельности улучшения печени у разных пациентов и в ходе последовательных контрольных обследований отдельных пациентов, что позволяет более точно наблюдать за пациентами.
Результаты этого исследования показали, что метод автоматического болюсного отслеживания с порогом 60 HU на аорте приводит к более высокому контрастному усилению аорты и селезенки на портальной фазе, но не влияет на улучшение функции печени.Кроме того, болюсное отслеживание связано с уменьшением вариабельности улучшения состояния печени у разных пациентов. Необходимы дальнейшие исследования, чтобы найти оптимальный протокол, включая порог и соответствующую задержку сканирования, ROI для порога, а также объем контраста и скорость инъекции. Мы предлагаем другое исследование с большими объемами образцов при различных патологиях печени, сравнивая эти постконтрастные методы, сравнивая индивидуальную патологию печени отдельно.
Благодарности
Благодарностей нет.
Сноски
Значение для политики / практики / исследований / медицинского образования в области здравоохранения: Результаты текущего исследования могут помочь рентгенологам повысить качество изображения КТ брюшной полости с помощью мутидетектора брюшной полости с использованием метода автоматического болюсного отслеживания вместо метода фиксированной задержки, поскольку он показывает более высокое контрастное усиление портальной фазы в некоторых органах брюшной полости.
Вклад авторов: Все авторы в равной степени участвовали в этом исследовании.
Раскрытие финансовой информации: Конфликт интересов отсутствует.
Финансирование / поддержка: Исследование финансировалось за счет собственных средств.
Список литературы
1. Ото А., Тамм Е.П., Шкларук Дж. Многодетекторная рядная компьютерная томография печени. Radiol Clin North Am. 2005; 43 (5): 827-48. DOI: 10.1016 / j.rcl.2005.05.002. [PubMed] [CrossRef] [Google Scholar] 2. Итикава Т., Эртурк С.М., Араки Т. Многофазная многорядная КТ печени с контрастным усилением: теория повышения контрастности и практический протокол сканирования с комбинацией фиксированной продолжительности инъекции и дозы контрастного вещества, адаптированной к массе тела пациента.Eur J Radiol. 2006. 58 (2): 165–76. DOI: 10.1016 / j.ejrad.2005.11.037. [PubMed] [CrossRef] [Google Scholar] 3. Bae KT, Seeck BA, Hildebolt CF, Tao C, Zhu F, Kanematsu M, et al. Повышение контрастности в MDCT сердечно-сосудистой системы: влияние массы тела, роста, площади поверхности тела, индекса массы тела и ожирения. AJR Am J Roentgenol. 2008. 190 (3): 777–84. DOI: 10.2214 / AJR.07.2765. [PubMed] [CrossRef] [Google Scholar] 4. Bae KT, Tao C, Gurel S, Hong C, Zhu F, Gebke TA и др. Влияние веса пациента и продолжительности сканирования на усиление контраста во время мультидетекторной КТ-ангиографии легких.Радиология. 2007. 242 (2): 582–9. DOI: 10.1148 / radiol.2422052132. [PubMed] [CrossRef] [Google Scholar] 5. Brink JA. Оптимизация контрастности и синхронизация сканирования для одно- и многорядной компьютерной томографии. J Comput Assist Tomogr. 2003; 27 Приложение 1: С3–8. [PubMed] [Google Scholar] 6. Лаги А. Многодетекторная компьютерная томография (64 среза) печени: методы исследования. Eur Radiol. 2007. 17 (3): 675–83. DOI: 10.1007 / s00330-006-0405-0. [PubMed] [CrossRef] [Google Scholar] 7. Сильверман П.М., Робертс С., Теффт М.С., Браун Б., Фокс С.Х., Купер С. и др.Спиральная компьютерная томография печени: клиническое применение автоматизированного компьютерного метода SmartPrep для получения изображений с оптимальным усилением контраста. AJR Am J Roentgenol. 1995. 165 (1): 73–8. DOI: 10.2214 / ajr.165.1.7785637. [PubMed] [CrossRef] [Google Scholar] 8. Mehnert F, Pereira PL, Trubenbach J, Kopp AF, Claussen CD. Автоматическое отслеживание болюса в однофазной спиральной компьютерной томографии печени: заметность поражения печени. Eur Radiol. 2001. 11 (4): 580–4. [PubMed] [Google Scholar] 9. Mehnert F, Pereira PL, Trubenbach J, Kopp AF, Claussen CD.Двухфазная спиральная КТ печени: автоматическое болюсное отслеживание или временная задержка? Eur Radiol. 2001. 11 (3): 427–31. [PubMed] [Google Scholar] 10. Фукукура Ю., Такуми К., Камияма Т., Шиндо Т., Хигаши Р., Накаджо М. Аденокарцинома поджелудочной железы: сравнение автоматического отслеживания болюса и задержки эмпирического сканирования. Визуализация брюшной полости. 2010. 35 (5): 548–55. DOI: 10.1007 / s00261-009-9560-5. [PubMed] [CrossRef] [Google Scholar] 11. Ито С., Икеда М., Ачива М., Сатаке Х., Ивано С., Исигаки Т. Визуализация печени в поздней артериальной и воротно-венозной фазах с помощью мультиспирального компьютерного томографа у пациентов без нарушений кровообращения: автоматическое отслеживание болюса или задержка эмпирического сканирования? Eur Radiol.2004. 14 (9): 1665–73. DOI: 10.1007 / s00330-004-2321-5. [PubMed] [CrossRef] [Google Scholar] 12. Полсон EK, Фишер AJ, Делонг DM, Паркер DD, Нельсон RC. Спиральная компьютерная томография печени с компьютерной технологией отслеживания болюса: можно ли предсказать, какие пациенты не достигнут порога улучшения? Радиология. 1998. 209 (3): 787–92. DOI: 10.1148 / radiology.209.3.9844675. [PubMed] [CrossRef] [Google Scholar] 14. Динкель HP, Маттич Дж. [Многорядная детекторная КТ-ангиография брюшной аорты: отслеживание болюса по сравнению с фиксированной задержкой начала].Рофо. 2003. 175 (11): 1567–71. DOI: 10,1055 / с-2003-43394. [PubMed] [CrossRef] [Google Scholar] 15. Brodoefel H, Tognolini A, Zamboni GA, Gourtsoyianni S, Claussen CD, Raptopoulos V. Стандартизация MDCT печени путем отслеживания усиления паренхимы печени для запуска визуализации. Eur Radiol. 2012; 22 (4): 812–20. DOI: 10.1007 / s00330-011-2310-4. [PubMed] [CrossRef] [Google Scholar] 16. Симидзу Т., Мисаки Т., Ямамото К., Суэёси К., Нарабаяши И. Спиральная компьютерная томография печени с компьютерной технологией отслеживания болюса: задержка сканирования артериального фазового сканирования и влияние скорости потока.J Comput Assist Tomogr. 2000. 24 (2): 219–23. [PubMed] [Google Scholar] 17. Копка Л., Роденвальдт Дж., Фишер Ю., Мюллер Д. В., Остман Дж. В., Граббе Э. Двухфазная спиральная КТ печени: эффекты болюсного отслеживания и различных объемов контрастного вещества. Радиология. 1996. 201 (2): 321–6. DOI: 10.1148 / радиология.201.2.8888218. [PubMed] [CrossRef] [Google Scholar] 18. Китамура Т., Итикава Т., Эртурк С.М., Накадзима Х., Соу Х., Араки Т. и др. Обнаружение гиперваскулярной гепатоцеллюлярной карциномы с помощью многорядной КТ: визуализация одной артериальной фазы с помощью компьютерной техники автоматического болюсного отслеживания по сравнению с двойной визуализацией в артериальной фазе.J Comput Assist Tomogr. 2008. 32 (5): 724–9. DOI: 10.1097 / RCT.0b013e318154b1f5. [PubMed] [CrossRef] [Google Scholar] 19. Sandstede JJ, Werner A, Kaupert C, Roth A, Jenett M, Harz C, et al. Проспективное исследование, сравнивающее различные концентрации йода для трехфазной мультидетекторной рядной КТ верхней части живота. Eur J Radiol. 2006. 60 (1): 95–9. DOI: 10.1016 / j.ejrad.2006.05.012. [PubMed] [CrossRef] [Google Scholar] 20. Ким Т., Мураками Т., Хори М., Такамура М., Такахаши С., Окада А. и др. Небольшая гиперваскулярная гепатоцеллюлярная карцинома, выявленная при двойной артериальной фазе КТ, выполненной с однократным сканированием с задержкой дыхания и автоматическим болюсным отслеживанием.AJR Am J Roentgenol. 2002. 178 (4): 899–904. DOI: 10.2214 / ajr.178.4.1780899. [PubMed] [CrossRef] [Google Scholar] 21. Госима С., Канемацу М., Кондо Х., Йокояма Р., Миёси Т., Като Х. и др. Поджелудочная железа: оптимальная задержка сканирования для многодетекторной КТ с контрастным усилением. Радиология. 2006. 241 (1): 167–74. DOI: 10.1148 / radiol.2411051338. [PubMed] [CrossRef] [Google Scholar] 22. Осимани М., Ренго М., Паолантонио П., Феррари Р., Де Чекко С. Н., Беллини Д. и др. Компьютерная томографическая ангиография с шестьюдесятью четырьмя многодетекторными рядами и болюсным отслеживанием во времени визуализации артериальной фазы в здоровой печени: существует ли корреляция между количественными и качественными показателями? J Comput Assist Tomogr.2010. 34 (6): 883–91. DOI: 10.1097 / RCT.0b013e3181dd80c8. [PubMed] [CrossRef] [Google Scholar] 23. Фруш Д.П., Спенсер Э.Б., Доннелли Л.Ф., Чжэн Дж.Й., Делонг Д.М., Биссет Г.С., 3-е место. Оптимизация КТ брюшной полости с контрастным усилением у младенцев и детей с помощью болюсного отслеживания. AJR Am J Roentgenol. 1999. 172 (4): 1007–13. DOI: 10.2214 / ajr.172.4.10587137. [PubMed] [CrossRef] [Google Scholar]Оптимизированный болюсный тест для компьютерной томографии ангиографии легких и его применение при 80 кВ с 10 мл контрастного вещества
Ди Низио, М., ван Эс, Н. и Бюллер, Х. Р. Тромбоз глубоких вен и тромбоэмболия легочной артерии. Ланцет 388 , 3060–3073 (2016).
Артикул Google ученый
Zhang, L.J. и др. . Компьютерная томография острой тромбоэмболии легочной артерии: современное состояние. Европейская радиология 25 , 2547–2557 (2015).
Артикул Google ученый
Бэ, К. Т. Внутривенное введение контрастного вещества и время сканирования при КТ: соображения и подходы. Радиология 256 , 32–61 (2010).
Артикул Google ученый
Henzler, T. et al. . Двухэнергетическая КТ-ангиография легких: сравнение тестовых болюсных и болюсных методов отслеживания для определения задержки сканирования. Европейский журнал радиологии 81 , 132–138 (2012).
Артикул Google ученый
Шейман, Р. Г., Раптопулос, В., Карузо, П., Врахлиотис, Т. и Перлман, Дж. Сравнение адаптированных и эмпирических задержек сканирования для КТ-ангиографии брюшной полости. Американский журнал рентгенологии 167 , 725–729 (1996).
CAS Статья Google ученый
Bae, K. T. Тест-болюс против методов болюс-трекинга для определения времени КТ-ангиографии. Радиология 236 , 369–370 (2005).
Артикул Google ученый
Hinzpeter, R. et al. . КТ-ангиография аорты: выбор времени контрастирования с использованием фиксированной задержки запуска по сравнению с индивидуальной для пациента. Радиология 291 , 531–538 (2019).
Артикул Google ученый
Ван, М., Ли, В., Лун-Хоу, Д., Ли, Дж. И Чжай, Р. Оптимизация компьютерной томографии ангиографии легких с использованием болюсного мониторинга правого предсердия в сочетании со спонтанным дыханием. Европейская радиология 25 , 2541–2546 (2015).
Артикул Google ученый
Мамлук, М. Д. и др. . Легочная эмболия при КТ-ангиографии: значение для целесообразности, стоимости и лучевой нагрузки у 2003 пациентов. Радиология 256 , 625–632 (2010).
Артикул Google ученый
Pontana, F. et al. . Низковольтная КТ-ангиография грудной клетки с пониженной дозой и итеративной реконструкцией с подтверждением синограммы по сравнению с обратной проекцией с фильтром стандартной дозы. Радиология 267 , 609–618 (2013).
Артикул Google ученый
Лу, Г. М. и др. . Высокочастотная компьютерная томография и ангиография легких с итеративной реконструкцией при 80 кВп и объеме контрастного вещества 20 мл. Европейская радиология 24 , 3260–3268 (2014).
Артикул Google ученый
Wichmann, J. L. et al. . Контраст-индуцированная нефропатия. Тираж 132 , 1931–1936 (2015).
Артикул Google ученый
Ньюхаус, Дж. Х. и Ройчоудхури, А. Количественное определение нефропатии, вызванной контрастным веществом: контроль над контролем. Радиология 267 , 4–8 (2013).
Артикул Google ученый
Yazıcı, S. et al. . Связь контрастной нефропатии с нежелательными явлениями у пациентов с тромбоэмболией легочной артерии, диагностированных с помощью контрастной КТ. Американский журнал экстренной медицины 34 , 1247–1250 (2016).
Артикул Google ученый
Макдональд, Дж.С. и др. . Острая травма почек после внутривенного и внутриартериального введения контрастного вещества в парной когорте. Следственная радиология 51 , 804–809 (2016).
CAS Статья Google ученый
Schönenberger, E. et al. . Повреждение почек после внутривенного по сравнению с внутриартериальным контрастным веществом у пациентов с подозрением на ишемическую болезнь сердца: рандомизированное исследование. Радиология 292 , 664–672 (2019).
Артикул Google ученый
Стакул, Ф. и др. . Контраст-индуцированная нефропатия: обновленные рекомендации Комитета по безопасности контрастных материалов ESUR. Европейская радиология 21 , 2527–2541 (2011).
Артикул Google ученый
Хендрикс, Б. М. Ф. и др. .Оптимизация компьютерной томографии эмболии легочной артерии в эпоху индивидуализированной медицины: проспективное клиническое исследование. Следственная радиология 53 , 306–312 (2018).
Артикул Google ученый
Wu, C.C., Lee, E.W., Suh, R.D., Levine, B.S. & Barack, B.M. Ангиография легких на 64-канальной рентгенограмме с 30 мл контрастного вещества внутривенно: усиление сосудов и качество изображения. Американский журнал рентгенологии 199 , 1247–1251 (2012).
Артикул Google ученый
Керл, Дж. М. и др. . Внутривенное введение контрастного вещества при высокоточной КТ-ангиографии легких с двумя источниками: тестовый болюс против болюсного отслеживания. Европейский журнал радиологии 81 , 2887–2891 (2012).
Артикул Google ученый
Родригес, Дж. К. Л., Матиас, Х., Negus, I.S, Manghat, N.E. & Hamilton, M.C. Внутривенное введение контрастного вещества на 128-м ряду мультидетекторных КТ ангиографии легких: отслеживание болюса по сравнению с тестовым болюсом и последствия для диагностического качества и эффективной дозы. Клиническая радиология 67 , 1053–1060 (2012).
CAS Статья Google ученый
Bae, K. T. Повышение пикового контраста при КТ и МР-ангиографии: когда это происходит и почему? фармакокинетическое исследование на модели свиней. Радиология 227 , 809–816 (2003).
Артикул Google ученый
Goble, E. W. & Abdulkarim, J. A. КТ ангиография легких с использованием уменьшенного объема высококонцентрированного йодированного контрастного вещества и многофазной инъекции для достижения снижения дозы. Клиническая радиология 69 , 36–40 (2014).
CAS Статья Google ученый
Laqmani, A. et al. . КТ-ангиография легких при уменьшенном облучении и объеме контрастного материала с использованием итеративной реконструкции модели и метода iDose4 в сравнении с FBP. PLoS One 11 , e0162429 (2016).
Артикул Google ученый
Юань, р. и др. . Снижение йодной нагрузки при КТ-ангиографии легких с двухэнергетической монохроматической визуализацией: сравнение со стандартной КТ-ангиографией легких – проспективное рандомизированное исследование. Радиология 262 , 290–297 (2012).
Артикул Google ученый
Szucs-Farkas, Z. et al. . Обнаружение легочной эмболии с помощью КТ-ангиографии при уменьшенном лучевом воздействии и объеме контрастного вещества: сравнение протоколов 80 кВп и 120 кВп в подобранной когорте. Следственная радиология 44 , 793–799 (2009).
Артикул Google ученый
Faggioni, L. и др. . КТ-ангиография легких 80 кВ с 40 мл йодсодержащего контрастного вещества у худых пациентов: сравнение улучшения сосудов с йодиксанолом (320 мг I / мл) и иомепролом (400 мг I / мл). Американский журнал рентгенологии 199 , 1220–1225 (2012).
Артикул Google ученый
Meier, A. et al. . Двухэнергетическая КТ легочная ангиография с 6 г йода – исследование с оценкой склонности. PLoS One 11 , e0167214 (2016).
Артикул Google ученый
Мерфи, Д. Дж., Агаев, А. и Штайнер, М. Л. КТ сосудов и МРТ: практическое руководство по протоколам визуализации. Insights Imaging 9 , 215–236 (2018).
CAS Статья Google ученый
Ли, Ю. Дж., Лау, К. К., Ардли, Н. и Лау, Т.Эффективность «задержки дыхания» во время CTPA в улучшении контрастного усиления легочных артерий. Журнал медицинской визуализации и радиационной онкологии 57 , 415–422 (2013).
Артикул Google ученый
Мин, У., Вэнь, Л., Дай, Л. Х., Ли, Дж. И Чжай, Р. Оптимизация CTPA с помощью болюсного мониторинга правого предсердия в сочетании со спонтанным дыханием. Европейская радиология 25 , 2541–2546 (2015).
Артикул Google ученый
Saade, C. et al. . Оптимизированный индивидуальный подход к введению контрастного вещества для КТ ангиографии легких. Европейская радиология 23 , 3205–3212 (2013).
Артикул Google ученый
Schueller-Weidekamm, C., Schaefer-Prokop, C.M., Weber, M., Herold, C.J., Prokop, M.КТ-ангиография легочных артерий для выявления тромбоэмболии легочной артерии: улучшение сосудистого расширения с настройками низкого напряжения. Радиология 241 , 899–907 (2006).
Артикул Google ученый
Альбрехт, М. Х. и др. . Современная КТ-ангиография легких при острой тромбоэмболии легочной артерии. Американский журнал рентгенологии 208 , 495–504 (2017).
Артикул Google ученый
Wichmann, J. L. et al. . Возможности легочной ангиографии при компьютерной томографии 70 кВп для снижения йодной нагрузки и дозы облучения. Журнал торакальной визуализации 30 , 69–76 (2015).
Артикул Google ученый
Sabel, B.O. et al. . Высокочастотная КТ легочная ангиография в КТ с двумя источниками третьего поколения: качество изображения в не выбранной популяции пациентов.