Де нол при хеликобактер пилори: Бактерия хеликобактер пилори, консультация гастроэнтеролога
Бактерия хеликобактер пилори, консультация гастроэнтеролога
Многие желают узнать, как передается и лечится хеликобактер пилори – опасная бактерия, живущая в желудке, виновница хронического гастрита, эрозий, язв и даже рака желудка.
Что это за бактерия?
Хеликобактери пилори – в переводе с латыни – это спиралевидная бактерия, живущая в привратнике. И действительно микроскопическая бактерия похожа на спираль, окруженную волосками. С помощью этих волосков – жгутиков она довольно быстро перебирается по внутренним органам к месту своего постоянного жительства – привратнику – нижнему ярусу желудка и начальному отделу кишечника – луковице двенадцатиперстной кишки. Бактерия хеликобактер опровергла миф о том, что соляная кислота желудка убивает все микробы. Напротив, маленькая хищница в разрушающей кислоте чувствует себя как дома, благодаря ферменту уреазе, который расщепляет соляную кислоту.
Как же воздействует хеликобактер на желудок? Уничтожает париетальные (пристеночные) клетки слизистой (внутренней) оболочки желудка, выбрасывая ядовитые продукты – токсины.
Как хеликобактер попадает в организм? Поскольку хеликобактер живет в желудке, то заражение возможно при попадании бактерии в организм человека через рот. Это и привычка брать еду или посуду немытыми руками, и желание попробовать еду в чужой тарелке или откусить от яблока или бутерброда товарища, когда предлагают попробовать – так часто заражаются дети.
Так что же теперь и в кафе со своей посудой ходить? К счастью, хеликобактер не устойчивая бактерия и обработки посуды в посудомоечной машине достаточно, чтобы ее уничтожить. Хорошие рестораны и кафе конечно оборудованы такими машинами, и посещать их можно без риска заражения.
Как узнать, есть ли у меня инфекция хеликобактер пилори?
Выявить присутствие коварной бактерии в организме можно разными способами. В первую очередь это гистологический метод, когда при проведении ФГДС (фиброгастродуоденоскопии) – обследования желудка, которое можно провести в Челябинске в Клинике Вся Медицина – берут для исследования клетки слизистой оболочки желудка. Выявляется не только бактерия хеликобактер пилори, но и оценивается состояние внутренней оболочки желудка – выраженность воспаления и степень изменения клеток слизистой на фоне воспаления.
 Чаще для контроля эффективности лечения хеликобактерной инфекции проводится анализ кала. Он основан на выявлении в кале ДНК хеликобактера и является качественным – показывает обнаружен хеликобактер или нет, без оценки степени обсемененности. Метод можно применять и для диагностики наличия инфекции до лечения, например, у детей, как простой и безболезненный.
Чаще для контроля эффективности лечения хеликобактерной инфекции проводится анализ кала. Он основан на выявлении в кале ДНК хеликобактера и является качественным – показывает обнаружен хеликобактер или нет, без оценки степени обсемененности. Метод можно применять и для диагностики наличия инфекции до лечения, например, у детей, как простой и безболезненный.У меня выявлен хеликобактер пилори – что делать?
При выявлении положительного анализа на хеликобактер пилори нужно обратиться за консультацией к гастроэнтерологу или терапевту. В лечении инфекции используются антибиотики, и назначает их только врач.
Можно ли вылечить хеликобактер приемом препарата де-нол, как показывают в рекламе, или народными средствами? Полностью избавиться от инфекции хеликобактер пилори можно только определенными антибиотиками.
Нужно ли мне травить себя антибиотиками, если меня ничего не беспокоит, а результат анализа на хеликобактер положительный? Инфекция может и не беспокоить, в 70% случаев так и происходит, гастрит годами протекает «молча», но через несколько лет вследствие вялотекущего воспаления возникает атрофия слизистой оболочки и нельзя исключить ее переход в рак желудка.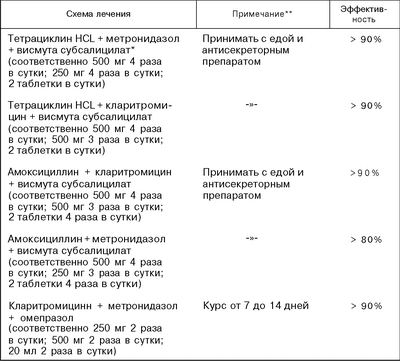 В каждом конкретном случае решение о проведении лечения принимает лечащий врач.
В каждом конкретном случае решение о проведении лечения принимает лечащий врач.
Инфекция хеликобактер пилори очень распространена среди населения, есть ли смысл в лечении, если потом можно повторно заразиться? Да, повторное инфицирование возможно, но происходит не часто – примерно 6 человек из 100 пролеченных приобретают инфекцию вновь при несоблюдении правил профилактики. Они очень просты – мыть руки перед едой, не пробовать чужую еду, не есть в сомнительных забегаловках, где нет уверенности в правильной обработке посуды, не целовать не очень близких людей. Важно также при выявлении инфекции хеликобактер пилори проверить на нее всех членов семьи, начиная с подросткового возраста, и в идеале – пролечиться одновременно всем инфицированным. Детей, если ничего не беспокоит, лечат с подросткового возраста – с 12-13 лет. Если ребенок жалуется на боли в животе или тошноту, то обследование и лечение проводят по показаниям в более раннем возрасте.
Люди очень часто жалуются на обострение гастрита. А ведь во многих случаях его можно вылечить, избавившись от бактерии, которая вызвала воспаление желудка. Если инфекцию оставить без внимания, со временем, гастрит перейдет в атрофический. Тогда пациенту нужно будет минимум раз в год брать биопсию в 5-7 местах желудка, чтобы не пропустить рак.
А ведь во многих случаях его можно вылечить, избавившись от бактерии, которая вызвала воспаление желудка. Если инфекцию оставить без внимания, со временем, гастрит перейдет в атрофический. Тогда пациенту нужно будет минимум раз в год брать биопсию в 5-7 местах желудка, чтобы не пропустить рак.
Лечение заболеваний, ассоциированных с инфекцией Helicobacter pylori | #07/10
Необходимость установления единого подхода к диагностике и терапии инфекции Helicobacter pylori (HP-инфекции), основанного на опыте лучших европейских исследователей, привела к созыву в г. Маастрихт (Нидерланды) в феврале 1996 г. конференции, организованной Европейской группой по изучению H. pylori. На конференции был обсужден и принят документ под названием «Current European Concepts in the Management of Helicobacter pylori Infection — The Maastricht Consensus Report» (Маастрихт-1). В этом первом соглашении были установлены основные показания к эрадикации и рекомендованы оптимальные схемы лечения.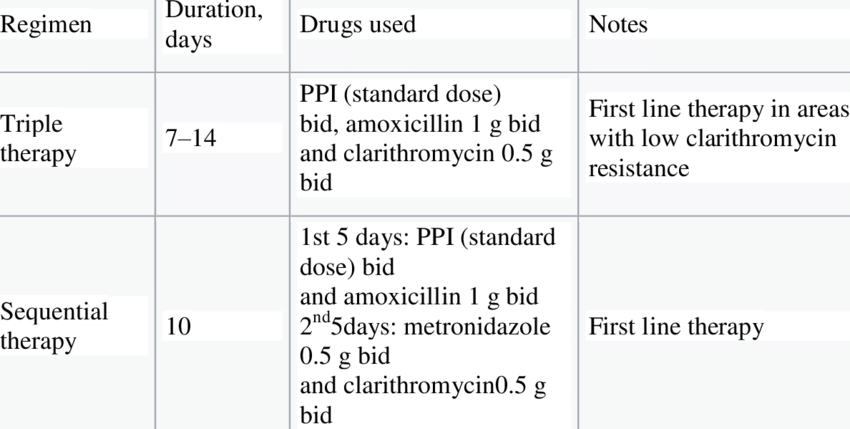
В 2005 г. во Флоренции был принят последний, третий Консенсус (Маастрихт-3) по ведению HP-инфекции. Целью его была выработка глобального подхода и анализ ключевых вопросов, в частности, показаний к эрадикации, стратегии и тактики ведения пациентов. Учитывая высокий уровень доказательности необходимости эрадикации Н. pylori в первой группе показаний (обязательных), принятых Консенсусом Маастрихт-2, они не подвергались повторному пересмотру. При выработке последнего Консенсуса Маастрихт-3 участники вернулись к обсуждению и принятию только тех показаний, которые значились как целесообразные (ГЭРБ, функциональная диспепсия, прием НПВС). На основании анализа последних научных данных была признана необходимость проведения эрадикации Н. pilory при функциональной диспепсии, поскольку морфологически при наличии НР-инфекции практически в 100% обнаруживается хронический гастрит, который является прогрессирующим заболеванием с определенным риском последующего язвообразования и малигнизации.
Проведенные рандомизированные исследования показали, что после эрадикации Н. pylori улучшение состояния больных наблюдается в 50%, а полное исчезновение симптомов — у 30%. В то же время при персистировании инфекции улучшение отмечается лишь у 38%, а исчезновение — у 18% [1]. Показания к эрадикации Н. pylori при ГЭРБ были обоснованы тем, что НР-инфекция сопровождается гиперхлоргидрией у большинства пациентов, а после эрадикации секреторная функция нормализуется. Эрадикация Н. pylori не повышает риск развития ГЭРБ в сравнении с терапией ингибиторами протонной помпы (ИПП). Напротив, монотерапия ИПП, снижая желудочную секрецию, способствует распространению Н. pylori и заселению им тела желудка, что сопровождается развитием фундального гастрита с более высоким риском атрофии. Целесообразность эрадикации Н. pylori при необходимости приема НПВС была аргументирована повышением риска язвообразования при сочетании двух ульцерогенных факторов (Н. pylori и НПВС). Так, по данным C.
Консенсус Маастрихт-3 впервые включил показания к эрадикации Н. pylori при двух внежелудочных состояниях: железодефицитной анемии (ЖДА) и идиопатической тромбоцитопенической пурпуре (ИТП). Роль Н. pylori в развитии ЖДА была доказана на основании выявления дефицита железа вследствие потребления его микроорганизмом, а также восстановлением показателей после эрадикации Н. pylori. Целесообразность эрадикационной терапии при ИТП была доказана снижением уровня антитромбоцитарных антител у больных после эрадикации Н. pylori.
Таким образом, в соответствии с рекомендациями Консенсуса Маастрихт-3, показаниями к эрадикации Н. pylori являются:
pylori являются:
Язвенная болезнь желудка и (или) двенадцатиперстной кишки (независимо от стадии.
MALT-ома.
Атрофический гастрит.
Состояния после резекции по поводу рака желудка.
Близкие родственники больных раком желудка.
Функциональная диспепсия. ГЭРБ.
Длительный прием НПВС8. ЖДА неясного генеза.
ИТП.
Педиатрические аспекты инфекции Н. pylori впервые обсуждались в 1997 г. в г. Эшторил (Португалия) по инициативе Европейской группы по изучению Н. pylori, затем обсуждение было продолжено на состоявшихся в Будапеште второй (1998 г.) и в Хельсинки третьей (1999 г.) встречах педиатров-экспертов [3, 4]. Итогом работы явилось формирование рабочего алгоритма обследования и лечения детей, включающего следующие этапы:
Выявление Н.
 pylori с помощью неинвазивного метода (желательно, дыхательного теста) у ребенка с жалобами на боли в животе (в сочетании с другими жалобами или без них) в течение более двух недель.
pylori с помощью неинвазивного метода (желательно, дыхательного теста) у ребенка с жалобами на боли в животе (в сочетании с другими жалобами или без них) в течение более двух недель.Проведение эрадикационной терапии.
При отсутствии эффекта проведение обследования Н. pylori-позитивных больных с применением эзофагогастродуоденоскопии.
Проведение повторной эрадикации Н. pylori при обнаружении язвенного дефекта (по другой схеме в соответствии с чувствительностью).
Проведение лечения при обнаружении гастродуоденита (тактику терапии определяет врач в соответствии с чувствительностью).
Проведение исследования на присутствие Н. pylori с помощью неинвазивного метода (желательно, дыхательного теста) через две недели и шесть месяцев после окончания терапии.
Принятые в Риме в 1999 г. рекомендации ESPGHAN по ведению инфекции Н. pylori предусматривают простой алгоритм показаний к эрадикации:
pylori предусматривают простой алгоритм показаний к эрадикации:
Дети должны обследоваться на Н. pylori, когда симптоматика наводит на мысль об органическом заболевании, а выраженность симптомов оправдывает риск терапии.
Если Н. pylori обнаружен при эндоскопии, лечение должно быть назначено.
Педиатрические аспекты инфекции Н. pylori обсуждались и при принятии Консенсуса Маастрихт-3, в частности, были подчеркнуты следующие положения:
У детей нельзя ограничиваться только язвенной болезнью как показанием к эрадикации.
При несвоевременном лечении Н. pylori у детей высок риск развития атрофии слизистой оболочки желудка, что повышает потенциальный риск развития рака.
ЖДА у детей, не связанная с язвой, после полного обследования может быть показанием к эрадикации Н. pylori.
Важные требования к эрадикационной терапии HР-инфекции были опубликованы в «Рекомендациях по диагностике и лечению инфекции Н. pylori у взрослых при язвенной болезни желудка и двенадцатиперстной кишки» Российской гастроэнтерологической ассоциации и Российской группы по изучению Н. pylori [5]:
pylori у взрослых при язвенной болезни желудка и двенадцатиперстной кишки» Российской гастроэнтерологической ассоциации и Российской группы по изучению Н. pylori [5]:
достигать в контролируемых исследованиях уничтожения Н. pylori как минимум в 80% случаев при продолжительности курса не более 7–14 дней;
вызывать не более 5% побочных эффектов, требующих вынужденной отмены терапии врачом или прекращения пациентом приема лекарств по схеме, рекомендованной врачом.
В отличие от других микроорганизмов Н. pylori in vitro чувствителен к большинству антимикробных препаратов. Еще в 1988 г. в исследованиях McNulty C. A. M. и Dent J. C. [6] показали его чувствительность к 21 антибактериальному агенту.
Н. pylori чувствителен к подавляющему большинству антибиотиков пенициллинового ряда и большинству цефалоспоринов (цефуроксиму, цефокситину, цефалексину), причем их минимальная подавляющая концентрация для 90% бактерий (МПК-90) не превышает 0,5 мг/л. Макролиды и фторхинолоны in vitro также проявляют достаточно высокую активность в отношении Н. pylori, их МПК-90 ниже 0,5 мг/л. Весьма эффективны и антибиотики других групп (нитрофураны, гентамицин, тетрациклин, рифампицин). Метронидазол обладает активностью средней степени. Н. pylori устойчив к ванкомицину, цефсулодину, триметоприму и сульфаниламидам, поэтому эти антибактериальные средства используют при его культивировании для подавления конкурентной флоры. Среди противоязвенных средств ни одно не обладает существенной активностью против H. pylori in vitro, кроме солей висмута: трикалия дицитрата (Де-нола), субсалицилата, субгаллата.
Макролиды и фторхинолоны in vitro также проявляют достаточно высокую активность в отношении Н. pylori, их МПК-90 ниже 0,5 мг/л. Весьма эффективны и антибиотики других групп (нитрофураны, гентамицин, тетрациклин, рифампицин). Метронидазол обладает активностью средней степени. Н. pylori устойчив к ванкомицину, цефсулодину, триметоприму и сульфаниламидам, поэтому эти антибактериальные средства используют при его культивировании для подавления конкурентной флоры. Среди противоязвенных средств ни одно не обладает существенной активностью против H. pylori in vitro, кроме солей висмута: трикалия дицитрата (Де-нола), субсалицилата, субгаллата.
Несмотря на активность in vitro, при назначении in vivo вышеперечисленные антибактериальные препараты отнюдь не отличаются столь же высокой эффективностью. Одной из причин этого является снижение их активности в кислой среде желудка. Исследования, проведенные МсNulty C. A. M. [7], показали, что активность пенициллина и ампициллина в условиях кислой среды снижается более чем в 10 раз, цефалексина — в 16 раз, ципрофлоксацина — в 10 раз, а эритромицина — более чем в 100 раз. Макролиды последнего поколения (кларитромицин, Вильпрафен® Солютаб), в отличие от эритромицина, гораздо более устойчивы в кислой среде [8]. Незначительное изменение активности наблюдается у тетрациклина и фуразолидона. Активность же метронидазола и Де-нола не изменяется при кислых значениях рН [9], поэтому они успешно применяются в лечении НР-инфекции.
Макролиды последнего поколения (кларитромицин, Вильпрафен® Солютаб), в отличие от эритромицина, гораздо более устойчивы в кислой среде [8]. Незначительное изменение активности наблюдается у тетрациклина и фуразолидона. Активность же метронидазола и Де-нола не изменяется при кислых значениях рН [9], поэтому они успешно применяются в лечении НР-инфекции.
Другой причиной снижения эффективности антибактериальных препаратов in vivo является неспособность некоторых их них накапливаться в слизи, покрывающей желудочный эпителий. Неионизированные молекулы эритромицина и ципрофлоксацина из слизистой оболочки быстро диффундируют в просвет желудка. При меньших значениях рН возможен их переход в ионизированную форму и задержка в слизистом слое, но снижение рН само по себе приводит к их почти полному разрушению. Поэтому эритромицин практически не эффективен при лечении НР-инфекции. В отличие от эритромицина, кларитромицин и рокситромицин отличаются хорошим проникновением в ткани и слизистый слой [10].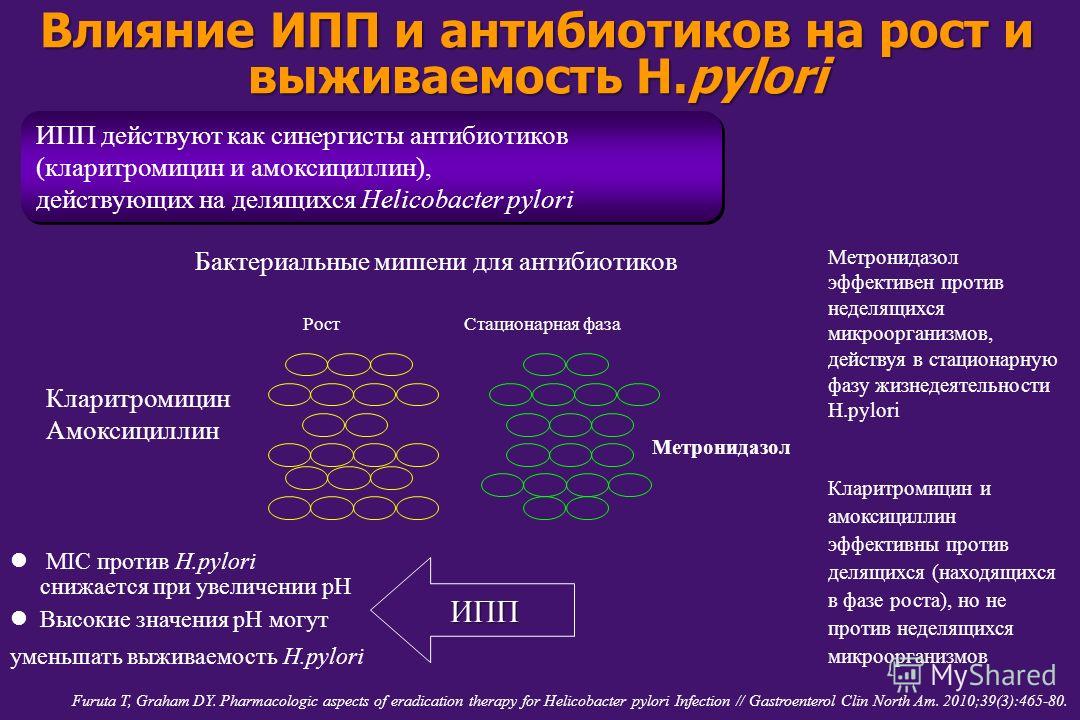 Ципрофлоксацин и другие фторхинолоны не применяются в терапии Н. pylori еще и потому, что при их назначении очень быстро формируются резистентные штаммы ко всей группе хиноловых препаратов [11].
Ципрофлоксацин и другие фторхинолоны не применяются в терапии Н. pylori еще и потому, что при их назначении очень быстро формируются резистентные штаммы ко всей группе хиноловых препаратов [11].
Амоксициллин (Флемоксин Солютаб®) — один из наиболее эффективных антибиотиков, применяемых при лечении Н. pylori-ассоциированных заболеваний. Препарат относится к группе бета-лактамных антибиотиков, подгруппе аминопенициллинов. При низких значениях рН амоксициллин сохраняет высокую активность. Максимальную активность проявляет при нейтральных значениях рН [12]. Является амфотерным соединением и при рН 3–6 проникает в ткани несколько хуже, тогда как в слизь, которая на 90% состоит из воды, способен проникать в большей степени [13], что позволяет добиться высокой его концентрации в слизистой желудка (вплоть до собственной пластинки слизистой оболочки) и в желудочном содержимом.
Солютаб — это особая технология производства препарата, при которой каждая таблетка состоит из отдельных микросфер, заключенных в наполнитель. Под воздействием любой жидкости таблетка начинает распадаться на микросферы, которая становится проницаемой только при воздействии бикарбонатов в кишечнике. Таким образом, действующее вещество высвобождается в зоне максимального всасывания. Это в свою очередь обеспечивает более равномерное и максимально полное всасывание активных компонентов препаратов, произведенных по указанной технологии, по сравнению с аналогами. Форма Солютаб также обеспечивает минимальную остаточную концентрацию действующего вещества в кишечнике, что гарантирует как предсказуемую эффективность, так и благоприятный профиль безопасности вследствие минимального влияния препарата на микрофлору кишечника и минимального раздражающего действия.
Под воздействием любой жидкости таблетка начинает распадаться на микросферы, которая становится проницаемой только при воздействии бикарбонатов в кишечнике. Таким образом, действующее вещество высвобождается в зоне максимального всасывания. Это в свою очередь обеспечивает более равномерное и максимально полное всасывание активных компонентов препаратов, произведенных по указанной технологии, по сравнению с аналогами. Форма Солютаб также обеспечивает минимальную остаточную концентрацию действующего вещества в кишечнике, что гарантирует как предсказуемую эффективность, так и благоприятный профиль безопасности вследствие минимального влияния препарата на микрофлору кишечника и минимального раздражающего действия.
Таблетки Солютаб можно как проглотить целиком, так и растворить в воде с образованием сиропа или суспензии с приятным вкусом, который с удовольствием пьют как дети, так и взрослые.
Механизм воздействия амоксициллина на Н. pylori заключается в ингибировании процессов синтеза в мембране бактериальной клетки пенициллин-связывающих белков (ПСБ) — ферментов, осуществляющих завершающие стадии биосинтеза основного компонента клеточной стенки микроорганизма — пептидогликана [14]. Это приводит к нарушению синтеза клеточных оболочек и лишает микробную клетку способности противостоять осмотическому градиенту, в результате чего стенки набухают и разрушаются. Таким образом, амоксициллин оказывает бактерицидное действие, тогда как подавляющее большинство других бета-лактамов являются бактериостатиками. Данное обстоятельство объясняет нецелесообразность применения для лечения Н. pylori других антибиотиков данной группы (в том числе и родственного ампициллина).
Это приводит к нарушению синтеза клеточных оболочек и лишает микробную клетку способности противостоять осмотическому градиенту, в результате чего стенки набухают и разрушаются. Таким образом, амоксициллин оказывает бактерицидное действие, тогда как подавляющее большинство других бета-лактамов являются бактериостатиками. Данное обстоятельство объясняет нецелесообразность применения для лечения Н. pylori других антибиотиков данной группы (в том числе и родственного ампициллина).
Побочными эффектами, характерными для амоксициллина, являются: диарея, аллергическая реакция и псевдомембранозный колит. При проведении антихеликобактерной терапии детям рекомендуется суточная доза 60 мг/кг в сутки дважды в день во время или после еды. При приеме амоксициллина до еды его местное антибактериальное действие усиливается.
Н. pylori весьма чувствителен к тетрациклину, который ингибирует бактериальный синтез белка и подобно амоксициллину проявляет интралюминальную активность, причем даже при низких значениях рН [15]. В литературе нет сообщений о резистентности Н. pylori к тетрациклину, но этот препарат дает довольно большое количество побочных реакций: гепатотоксическое действие, тошноту, а также стойкое повреждение растущих зубов, вследствие чего не рекомендуется для использования в педиатрической практике.
В литературе нет сообщений о резистентности Н. pylori к тетрациклину, но этот препарат дает довольно большое количество побочных реакций: гепатотоксическое действие, тошноту, а также стойкое повреждение растущих зубов, вследствие чего не рекомендуется для использования в педиатрической практике.
Эффективность другой группы антибиотиков — макролидов в отношении Н. pylori была доказана во многих исследованиях [16]. Основу химической структуры макролидов составляет макроциклическое лактонное кольцо. Все они обладают противовоспалительным и иммуномодулирующим действием, накапливаясь в клетках организма (в том числе и в полиморфно-ядерных лейкоцитах) и влияя на миграцию нейтрофилов, окислительные реакции в фагоцитах и продукцию многих цитокинов. Механизм действия макролидов состоит в торможении синтеза белка в микробных клетках при их размножении путем связывания с каталитическим пептидилтрансферазным центром рибосомальной 50S-субъединицы. Это приводит к торможению реакции транслокации и транспептидации и нарушению процесса формирования и наращивания (элонгации) пептидной цепи. Обладают преимущественно бактериостатическим действием. Поскольку макролиды являются слабыми основаниями, их активность возрастает при рН 5,5–8,5.
Обладают преимущественно бактериостатическим действием. Поскольку макролиды являются слабыми основаниями, их активность возрастает при рН 5,5–8,5.
Наиболее активным в отношении Н. pylori является кларитромицин. В отличие от других макролидов, которые в кислой среде подвергаются усиленному гидролизу, кларитромицин устойчив в кислоте желудочного сока. По данным Miki и соавторов (2003) [17], монотерапия кларитромицином приводит к уничтожению Н. pylori в 54% случаев, а согласно исследованиям Gisbert — в 15% случаев, что, тем не менее, является впечатляющим результатом.
Другие представители макролидов, в частности, джозамицин и рокситромицин мало уступают кларитромицину в клинической эффективности, но в меньшей степени вступают во взаимодействие с другими лекарственными препаратами, реже вызывают побочные эффекты и поэтому могут являться альтернативой кларитромицину [18].
Одним из основных препаратов, входящих в схемы антихеликобактерной терапии, является трикалия дицитрат висмута (ТДВ, Де-нол). При рН менее 5 ТДВ образует преципитаты в виде двух солей висмута — оксихлорида и цитрата, оптимум рН составляет 3,5 [19]. В области дна язвы препарат создает защитную пленку, образуя агрегаты с белками плазмы [20]. Он также способен образовывать кристаллы различной формы в зависимости от рН среды, которые, в частности, могут адгезироваться в местах некроза эпителиальных клеток [21].
При рН менее 5 ТДВ образует преципитаты в виде двух солей висмута — оксихлорида и цитрата, оптимум рН составляет 3,5 [19]. В области дна язвы препарат создает защитную пленку, образуя агрегаты с белками плазмы [20]. Он также способен образовывать кристаллы различной формы в зависимости от рН среды, которые, в частности, могут адгезироваться в местах некроза эпителиальных клеток [21].
ТДВ оказывает влияние на плотность и проницаемость слоя желудочной слизи, образуя комплекс висмут–протеогликан и замедляя диффузию Н+, но не влияя на диффузию других ионов [22]. ТДВ обладает также антипепсиновой активностью — вероятно, за счет связывания пепсина [23], а при кислых значениях рН способен связывать желчные кислоты [24]. ТДВ достоверно увеличивает секрецию простагландинов [25] и бикарбонатов [26] в желудке и двенадцатиперстной кишке.
Одним из основных свойств ТДВ является его бактерицидное действие на Н. pylori. Оно незначительно превосходит аналогичное действие других солей висмута in vitro, но многократно — in vivo. Это объясняется наибольшей растворимостью ТДВ в желудочном соке и слизи в самом широком диапазоне рН, что позволяет препарату легко проникать в слизистый слой и желудочные ямки. ТДВ препятствует адгезии Н. pylori к желудочному эпителию, приводит к повреждению и фрагментации мембраны бактериальной клетки, вакуолизации ее [27]. Он ингибирует ферменты Н. pylori: уреазу, каталазу, фосфолипазу и его протеолитическую активность [28]. В результате всего комплекса воздействий ТДВ наступает лизис бактериальной клетки в непосредственной близости от эпителия желудка. Очень важно, что препарат способен воздействовать как на вегетативные, так и на кокковые формы Н. pylori. Несмотря на различные механизмы действия, он обладает синергизмом с антибиотиками, поэтому может быть эффективно использован в сочетании с ними. К препарату не развивается резистентность. Более того, согласно данным Williamson R., Pipkin G. A. [29], ТДВ предотвращает развитие первичной и вторичной резистентности к антибиотикам.
Это объясняется наибольшей растворимостью ТДВ в желудочном соке и слизи в самом широком диапазоне рН, что позволяет препарату легко проникать в слизистый слой и желудочные ямки. ТДВ препятствует адгезии Н. pylori к желудочному эпителию, приводит к повреждению и фрагментации мембраны бактериальной клетки, вакуолизации ее [27]. Он ингибирует ферменты Н. pylori: уреазу, каталазу, фосфолипазу и его протеолитическую активность [28]. В результате всего комплекса воздействий ТДВ наступает лизис бактериальной клетки в непосредственной близости от эпителия желудка. Очень важно, что препарат способен воздействовать как на вегетативные, так и на кокковые формы Н. pylori. Несмотря на различные механизмы действия, он обладает синергизмом с антибиотиками, поэтому может быть эффективно использован в сочетании с ними. К препарату не развивается резистентность. Более того, согласно данным Williamson R., Pipkin G. A. [29], ТДВ предотвращает развитие первичной и вторичной резистентности к антибиотикам.
Многочисленные исследования оценки эффективности терапии Де-нолом НР-инфекции показали, что после курса монотерапии у большинства больных удается добиться подавления инфекции и стойкого клинического улучшения [30], однако в дальнейшем восстанавливается прежняя степень обсемененности слизистой оболочки. То есть Де-нол в качестве монотерапии не в состоянии стойко подавить Н. pylori, поэтому используется комбинированная терапия. ТДВ, а также некоторые другие соли висмута: субсалицилат и, реже, субгаллат, в сочетании с антибиотиками широко используются в комплексной терапии НР-инфекции [31].
То есть Де-нол в качестве монотерапии не в состоянии стойко подавить Н. pylori, поэтому используется комбинированная терапия. ТДВ, а также некоторые другие соли висмута: субсалицилат и, реже, субгаллат, в сочетании с антибиотиками широко используются в комплексной терапии НР-инфекции [31].
Хотя действие этих препаратов реализуется местно, все же незначительные концентрации висмута обнаруживаются в крови и моче в процессе лечения и достигают стабильных значений спустя четыре недели от его начала [32]. В экспериментах на животных было показано, что высокие дозы висмута могут вызвать побочные реакции со стороны ЦНС (т. н. «висмутовая энцефалопатия»). Пороговыми концентрациями висмута в крови у человека считаются 50–100 мг/л, однако в реальных условиях при назначении обычных доз Де-нола (8 мг/кг у детей, 480 мг/сут у взрослых) такие концентрации никогда не регистрируются и никаких побочных реакций со стороны ЦНС не возникает [33]. Исследование П. Л. Щербакова [34], проведенное у детей, показало, что на фоне стандартной антихеликобактерной терапии, включавшей обычные дозы Де-нола, концентрация висмута в крови у детей не превышала 55 мг/л, что соответствует нижней границе нормы пороговых значений и 10-кратно ниже концентраций, наблюдаемых при висмутовой энцефалопатии.
То есть Де-нол является безопасным и эффективным антихеликобактерным препаратом и может быть без опасений назначен детям. Однако, поскольку висмут медленно выводится из организма, его не рекомендуют назначать пациентам с почечной недостаточностью [35]. Кроме вышеописанных, из побочных действий препаратов висмута обычно наблюдается почернение стула вследствие образования в кишечнике сульфида висмута, в литературе имеется несколько сообщений о возникновении диареи, описаны редкие случаи аллергии на препарат в виде кожных сыпей [36]. В желудке препарат может связываться с пищей и антацидными препаратами, терапевтическое его действие в этом случае становится невозможным. Поэтому препарат рекомендуют принимать за 30 мин до еды и на ночь, не ранее чем через 2 часа после последнего приема пищи, и не сочетают с приемом антацидов. В детской практике рекомендуется назначать Де-нол детям старше 5 лет в дозе 8 мг/кг/с в 2 приема за 30 мин до еды.
В соответствии с рекомендациями ESPGHAN и NASPGHAN (2000 г. ), оптимальными схемами для эрадикационной терапии хеликобактериоза являются следующие [37]:
), оптимальными схемами для эрадикационной терапии хеликобактериоза являются следующие [37]:
1 линия:
ИПП + амоксициллин + кларитромицин.
ИПП + амоксициллин + метронидазол.
ИПП + кларитромицин + метронидазол.
2 линия:
КСВ + ИПП + амоксициллин + метронидазол (тетрациклин после 12 лет).
В соответствии с рекомендациями ESPGHAN и NASPGHAN [77], оптимальными дозами препаратов, входящих в стандартные схемы, являются следующие: омепразол — 1 мг/кг до 20 мг 2 раза, амоксициллин 50 мг/кг до 1 г 2 раза, кларитромицин, джозамицин, рокситромицин 15 мг/кг до 500 мг 2 раза, метронидазол 20 мг/кг до 500 мг 2 раза, тетрациклин (с 12 лет) 50 мг/кг до 1 г 2 раза, трикалия дицитрат висмута (КСВ) 120 мг 3–4 раза.
В соответствии с этими рекомендациями и Консенсусом Маастрихт-2, в качестве 7-дневных схем эрадикации первой линии рекомендована схема, включающая ИПП, кларитромицин (джозамицин или другой представитель макролидов) и амоксициллин (ИКА), и в меньшей степени — схема, в которой вместо амоксициллина применяется метронидазол (ИКМ) [38]. Поскольку компоненты первой схемы были наиболее удачно сбалансированы по эффективности и минимальны по побочным действиям, она получила название «стандартной тройной терапии». Уровень эрадикации при использовании этой комбинации препаратов составил 78–91% [39]. По результатам G. M. Buzas, J. Jozan (2004) [40] эффективность схемы, включающей кларитромицин и амоксициллин, составила 79,6%, кларитромицин и нитроимидазол — 84,1%, амоксициллин с нитроимидазолом — 72,5%. В аналогичном исследовании, проведенном в Южной Корее и включавшем 352 пациента с дуоденальной язвой и неязвенной диспепсией, сравнивали комбинацию омепразола (20 мг 2 раза в сутки), кларитромицина (500 мг 2 раза в сутки) и амоксициллина (1,0 г 2 раза в сутки) или тинидазола (500 мг 2 раза в сутки), эффективность оказалась одинаковой (65,7% и 64,8%) [41]. К важному выводу о целесообразности включения в режим эрадикации кларитромицина пришли исследователи, которые сравнивали комбинацию лансопразола (30 г 2 раза в сутки), амоксициллина (1,0 г 2 раза в сутки) и метронидазола (400 мг 3 раза в сутки) с режимом, включавшим лансопразол и амоксициллин в той же дозе, но с заменой метронидазола на кларитромицин (500 мг 2 раза в сутки).
Поскольку компоненты первой схемы были наиболее удачно сбалансированы по эффективности и минимальны по побочным действиям, она получила название «стандартной тройной терапии». Уровень эрадикации при использовании этой комбинации препаратов составил 78–91% [39]. По результатам G. M. Buzas, J. Jozan (2004) [40] эффективность схемы, включающей кларитромицин и амоксициллин, составила 79,6%, кларитромицин и нитроимидазол — 84,1%, амоксициллин с нитроимидазолом — 72,5%. В аналогичном исследовании, проведенном в Южной Корее и включавшем 352 пациента с дуоденальной язвой и неязвенной диспепсией, сравнивали комбинацию омепразола (20 мг 2 раза в сутки), кларитромицина (500 мг 2 раза в сутки) и амоксициллина (1,0 г 2 раза в сутки) или тинидазола (500 мг 2 раза в сутки), эффективность оказалась одинаковой (65,7% и 64,8%) [41]. К важному выводу о целесообразности включения в режим эрадикации кларитромицина пришли исследователи, которые сравнивали комбинацию лансопразола (30 г 2 раза в сутки), амоксициллина (1,0 г 2 раза в сутки) и метронидазола (400 мг 3 раза в сутки) с режимом, включавшим лансопразол и амоксициллин в той же дозе, но с заменой метронидазола на кларитромицин (500 мг 2 раза в сутки).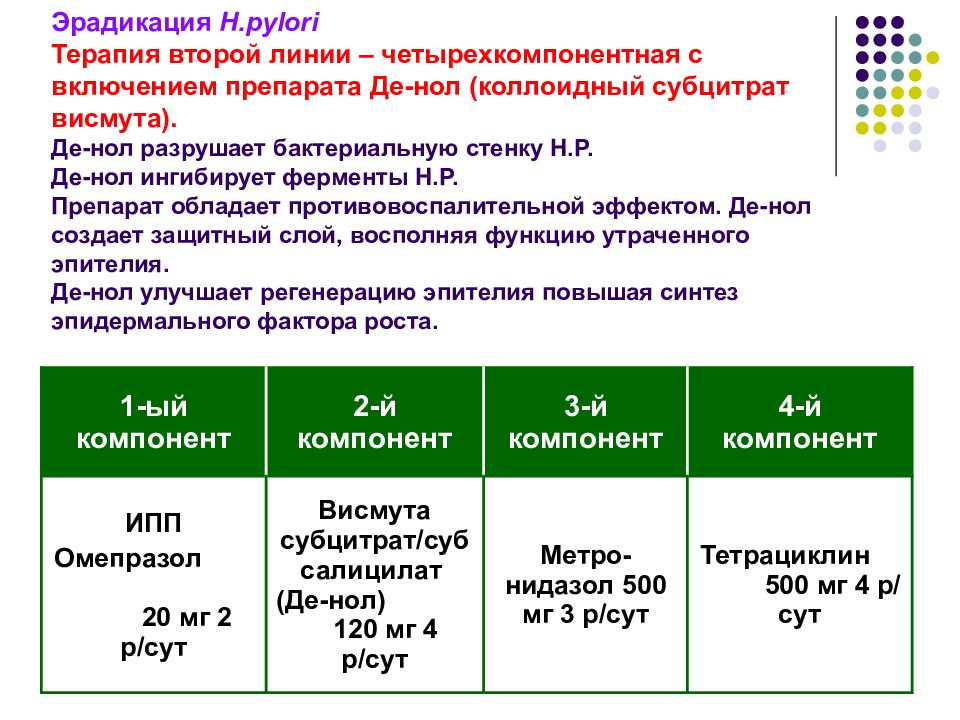 Эффективность последнего варианта оказалась значительно более высокой (91% и 78%) [42].
Эффективность последнего варианта оказалась значительно более высокой (91% и 78%) [42].
В 1999–2002 гг. в Европе было проведено проспективное мультицентровое исследование, включавшее 16 педиатрических центров в 14 странах. Всего было обследовано 1233 пациента, 41% которых были родом из Африки и Ближнего Востока. Исследовалась как первичная (до лечения), так и вторичная (при неудачном лечении) резистентность. Первичная резистентность к кларитромицину была выявлена у 20% детей, вторичная — у 42%. Первичная резистентность к кларитромицину была достоверно выше у детей до 6 лет, чем у подростков старше 12 лет, и преобладала у жителей Южной Европы по сравнению с Северной. Эти различия легко объяснимы более частым назначением макролидов для лечения внежелудочных (в основном, респираторных) заболеваний у детей раннего возраста и существованием определенных ограничений в назначении препаратов этой группы в североевропейских странах. В Восточной Европе отдельные исследования также показали высокую резистентность к кларитромицину у детей. Так, в Болгарии она составила 12,4%, а в Польше — 23,5% [43].
Так, в Болгарии она составила 12,4%, а в Польше — 23,5% [43].
Основной причиной роста резистентности Н. pylori к кларитромицину является не столько предшествующая неэффективная эрадикационная терапия, сколько широкое использование макролидов при лечении других заболеваний. Поскольку дети чаще получают препараты этой группы, то и распространенность устойчивых штаммов Н. pylori среди них существенно выше, чем у взрослых. Так, исследование, проведенное в японских семьях, показало, что хотя члены одной семьи обычно заражены идентичными штаммами Н. pylori, резистентность к кларитромицину выше у детей [44]. В целом резистентность Н. pylori к кларитромицину возрастает пропорционально его потреблению в данном регионе [45].
В странах Восточной Европы с невысоким уровнем жизни (в том числе и в странах СНГ) первично-резистентные к нитроимидазолу штаммы Н. pylori составляют 20–40%; в России в 1998 году резистентность к метронидазолу составила почти 30%, в Москве — 36% [46]. В странах Западной Европы, по данным Европейского многоцентрового исследования, средний уровень первичной резистентности Н. pylori к метронидазолу составляет 25,6% [47].
В странах Западной Европы, по данным Европейского многоцентрового исследования, средний уровень первичной резистентности Н. pylori к метронидазолу составляет 25,6% [47].
В 1997 г. впервые сообщалось о появлении резистентных к амоксициллину штаммов Н. pylori, составивших 1,4–7% в развитых странах [48]. Устойчивость Н. pylori к бета-лактамам определяется модификацией ПСБ микроорганизмов. Описаны модификации (результат мутаций) в ПСБ-1а и ПСБ-4; поскольку гены ПСБ локализованы в бактериальной хромосоме, устойчивость в популяции Н. pylori происходит, вероятно, по клональному типу. Если за период с 1985 по 1996 год в Японии не было выявлено ни одного резистентного штамма, то в 1997 г. их доля составила 1,1%, а в 2003 г. — 1,5% [49].
В 2005 году F. Megraud [50] представил данные о резистентности Н. pylori к антибактериальным препаратам, определившие последующий выбор тех или иных схем эрадикации. Так, показатели резистентности штаммов микроорганизма к метронидазолу находятся в пределах 19–42% в странах Европы и 33–37% — в США, 9–12% — в Японии, 53% — в Бразилии и 77% — в Мексике. В отношении кларитромицина эти показатели составляют в США и Японии около 13%. В европейских странах они колеблются в широких пределах: сравнительно низки в странах Северной (4,4%) и Центральной (8,7%) Европы и, напротив, очень высокие (24%) — в странах Южной Европы. В нашей стране к 2003 г. количество штаммов Н. pylori, резистентных к метронидазолу, достигло 55,5%. Опасной можно назвать тенденцию к росту доли полирезистентных штаммов — 11,1% [50].
В отношении кларитромицина эти показатели составляют в США и Японии около 13%. В европейских странах они колеблются в широких пределах: сравнительно низки в странах Северной (4,4%) и Центральной (8,7%) Европы и, напротив, очень высокие (24%) — в странах Южной Европы. В нашей стране к 2003 г. количество штаммов Н. pylori, резистентных к метронидазолу, достигло 55,5%. Опасной можно назвать тенденцию к росту доли полирезистентных штаммов — 11,1% [50].
Исследование эффективности схемы, рекомендованной в качестве стандартной Консенсусом Маастрихт-3 в Европе (эзомепразол + кларитромицин + метронидазол) в рекомендуемых дозах продолжительностью 10 дней, проведенное нами у 20 детей с Н. pylori-ассоциированными гастродуоденальными заболеваниями, показало низкую эффективность — 14,3%. Столь низкий результат объясняется высоким уровнем резистентности Н. pylori как к кларитромицину, так и к метронидазолу. В связи с полученными неутешительными результатами, мы не можем рекомендовать эту стандартную схему к использованию в России.
С учетом локальных особенностей штаммов Н. pylori, Консенсус Маастрихт-3 внес одну очень важную поправку: если устойчивость Н. pylori к кларитромицину в популяции конкретного региона превышает 15–20%, а к метронидазолу выше 40%, эти антибактериальные препараты не должны применяться в схемах эрадикации.
При высокой эффективности квадротерапии, не является ли целесообразным ее назначение в качестве терапии первой линии, особенно в условиях высокой антибиотикорезистентности? На этот вопрос позволяет ответить метаанализ 102 исследований эрадикации, включающий 398 вариантов и 25 644 пациента, не выявивший преимуществ квадротерапии по сравнению с тройной (эффективность 80,4% и 81,1% соответственно). Аналогичные результаты были получены в североамериканском исследовании, включавшем 275 пациентов. В данном исследовании сравнивали тройную терапию: омепразол (20 мг 2 раза в сутки) + кларитромицин (500 мг 2 раза в сутки) + амоксициллин (1,0 г 2 раза в сутки), с квадротерапией: омепразол (20 мг 2 раза в сутки) + висмута бискальцитрат (120 мг 4 раза в сутки) + метронидазол (375 мг 4 раза в сутки) + тетрациклин (375 мг 4 раза в сутки). Эффективность этих схем оказалась практически одинаковой (83,2% и 87,7% соответственно). Тройные (омепразол + амоксициллин + кларитромицин) и квадротерапия (омепразол + висмут + тетрациклин + метронидазол), используемые в качестве терапии первой линии, оказались эффективными в равной степени (87% vs 86%).
Эффективность этих схем оказалась практически одинаковой (83,2% и 87,7% соответственно). Тройные (омепразол + амоксициллин + кларитромицин) и квадротерапия (омепразол + висмут + тетрациклин + метронидазол), используемые в качестве терапии первой линии, оказались эффективными в равной степени (87% vs 86%).
Согласно нашим данным, эффективность тройной терапии с амоксициллином (омепразол + амоксициллин + метронидазол) составляет 73%, а сходной квадротерапии (омепразол + амоксициллин + метронидазол + Де-нол) — 76%. Однако совсем другие результаты были получены при использовании схем с кларитромицином. Эффективность стандартной схемы, рекомендованной Консенсусом Маастрихт-3 (эзомепразол + кларитромицин + метронидазол), составила всего 14,3%, дополнение этой же схемы Де-нолом повысило эффективность до 65%. Полученные нами данные согласуются с результатами европейского исследования, проведенного Williamson R., Pipkin G. A. [32], по мнению которых Де-нол способен преодолевать как первичную, так и вторичную антибиотикорезистентность Н. pylori. Это позволяет рекомендовать Де-нол в схемах эрадикации Н. pylori и делает целесообразным назначение этого препарата уже в ходе первой линии терапии.
pylori. Это позволяет рекомендовать Де-нол в схемах эрадикации Н. pylori и делает целесообразным назначение этого препарата уже в ходе первой линии терапии.
В случае неэффективности схем эрадикации первой и второй линии Консенсус Маастрихт-3 предлагает практическому врачу несколько приемлемых вариантов дальнейшей терапии. Поскольку к амоксициллину в процессе его применения не вырабатывается устойчивость штаммов Н. pylori, возможно назначение его высоких доз (0,75 г 4 раза в сутки в течение 14 дней) в комбинации с высокими (4-кратными) дозами ИПП в виде двойной терапии, однако, по нашему мнению, мегадозы этих препаратов могут обернуться значительным увеличением числа побочных реакций. Другим вариантом может быть замена метронидазола в схеме квадротерапии на нитрофураны. Согласно последним российским исследованиям, наиболее приемлемы нифурател (Макмирор 15 мг/кг/сут) или нифуроксазид (Энтерофурил 200 мг 2 раза в день). Альтернативой служит применение комбинации ИПП с амоксициллином и рифабутином (300 мг в сутки) или левофлоксацином (500 мг в сутки). Попытки замены кларитромицина на другие макролидные антибиотики также предпринималась. В исследовании, проведенном в США, сравнивалась эффективность квадротерапии, включающей ИПП (лансопразол), препараты висмута, амоксициллин и кларитромицин/азитромицин. В первом случае частота эрадикации равнялась 84,6%, во втором — 55,5%. То есть по эффективности азитромицин уступает кларитромицину.
Попытки замены кларитромицина на другие макролидные антибиотики также предпринималась. В исследовании, проведенном в США, сравнивалась эффективность квадротерапии, включающей ИПП (лансопразол), препараты висмута, амоксициллин и кларитромицин/азитромицин. В первом случае частота эрадикации равнялась 84,6%, во втором — 55,5%. То есть по эффективности азитромицин уступает кларитромицину.
Таким образом, в России, в условиях высокой резистентности Н. pylori к кларитромицину и метронидазолу, в качестве эрадикационной терапии первой линии могут быть рекомендованы следующие схемы:
ИПП + Де-нол + амоксициллин 10 дней.
ИПП + Де-нол 10 дней + амоксициллин (первые 5 дней), джозамицин (последующие 5 дней).
ИПП + амоксициллин + нифурател (или нифуроксазид) 10 дней.
Контроль эффективности терапии (достижение эрадикации) следует проводить через 4–6 недель после окончания лечения. Для контроля целесообразно использовать неинвазивные методы, прежде всего, дыхательные (С13-углеродный тест или Хелик-тест). При отрицательном результате теста (эрадикации Н. pylori) дальнейшего лечения не требуется. При положительном результате повторная терапия проводится по другой схеме с использованием других антибиотиков, в частности, может быть назначена классическая схема второй линии — квадротерапия, включающая ИПП + Де-нол + тетрациклин (с 12 лет) + метронидазол. Если при проведении терапии первой линии не использовались нитрофураны, то вместо метронидазола оптимально назначение нифуратела или нифуроксазида.
Для контроля целесообразно использовать неинвазивные методы, прежде всего, дыхательные (С13-углеродный тест или Хелик-тест). При отрицательном результате теста (эрадикации Н. pylori) дальнейшего лечения не требуется. При положительном результате повторная терапия проводится по другой схеме с использованием других антибиотиков, в частности, может быть назначена классическая схема второй линии — квадротерапия, включающая ИПП + Де-нол + тетрациклин (с 12 лет) + метронидазол. Если при проведении терапии первой линии не использовались нитрофураны, то вместо метронидазола оптимально назначение нифуратела или нифуроксазида.
Эрадикационную терапию как первой, так и второй линии следует дополнять назначением современных пробиотиков. Исследования, проведенные как в России, так и за рубежом, показали повышение эффективности лечения и уменьшение побочных реакций при параллельном назначении пробиотиков. В работе П. Л. Щербакова с соавт. было показано повышение процента эрадикации Н. pylori с 84% при назначении стандартной тройной схемы до 92% при параллельном приеме Линекса. Нами были изучены показатели местного и общего иммунного статуса и результативность стандартной тройной терапии (ИПП + амоксициллин + метронидазол) при параллельном назначении Бифиформа. Исследование показало повышение эффективности лечения с 73% до 84%, уменьшение побочных реакций и дисбиотических отклонений в кале. Лечение пробиотиком сопровождалось повышением уровня секреторного IgA, фагоцитарной активности, а также снижением уровня IgE в крови. В литературе имеются данные об антихеликобактерной эффективности Saccharomyces boulardii и некоторых штаммов лактобацилл На основании этого с целью профилактики хеликобактериоза можно рекомендовать йогурты с лактобациллами определенных штаммов.
pylori с 84% при назначении стандартной тройной схемы до 92% при параллельном приеме Линекса. Нами были изучены показатели местного и общего иммунного статуса и результативность стандартной тройной терапии (ИПП + амоксициллин + метронидазол) при параллельном назначении Бифиформа. Исследование показало повышение эффективности лечения с 73% до 84%, уменьшение побочных реакций и дисбиотических отклонений в кале. Лечение пробиотиком сопровождалось повышением уровня секреторного IgA, фагоцитарной активности, а также снижением уровня IgE в крови. В литературе имеются данные об антихеликобактерной эффективности Saccharomyces boulardii и некоторых штаммов лактобацилл На основании этого с целью профилактики хеликобактериоза можно рекомендовать йогурты с лактобациллами определенных штаммов.
Литература
Malferthiener P. Prevention of gastric cancer by Helicobacter pylori eradication // Maastricht-3 Guidelines for Helicobacter pylori infection.
 13 United European Gastroenterology Week. Copenhagen, 2005.
13 United European Gastroenterology Week. Copenhagen, 2005.Perri F., Qasim A., Marras L., O’Morain C. Treatment of Helicobacter pylori infection // Helicobacter. 2003. Vol. 8, Suppl. 1. P. 53–60.
Корсунский А. А. Инфекция Helicobacter pylori в педиатрической практике/В сб. «Helicobacter pylori: революция в гастроэнтерологии». Под ред. акад. РАМН В. Т. Ивашкина, проф. Ф. Мегро, Т. Л. Лапиной. М., 1999. C. 224–243.
Drumm B., Koletzko S., Oderda G. Helicobacter pylori infection in children: a consensus statement. European Paediatric Task Force on Helicobacter pylori // J Pediatr. Gastroenterol Nutr. 2000. V. 30. № 2. P. 207–213.
Рекомендации по диагностике и лечению инфекции Helicobacter pylori у взрослых при язвенной болезни желудка и двенадцатиперстной кишки // Рос. журн. гастроэнтерол. гепатол. колопроктол. 1998. № 1. С. 105–107.
McNulty C.
 A. M., Dent J. C. Susceptibility of Campylobacter pylori to twenty-one antimicrobal agents // Eur. J. Clin. Microbiol. Infect.Dis., 1988, v. 7, p. 566–569.
A. M., Dent J. C. Susceptibility of Campylobacter pylori to twenty-one antimicrobal agents // Eur. J. Clin. Microbiol. Infect.Dis., 1988, v. 7, p. 566–569.McNulty C. A. M. Bacteriological and pharmacological basis for the treatment of Campylobacter pylori infection. In: Rathbone B. J., Heatley R. V.e ds. Campylobacter pylori and gastroduodenal disease. Blackwell, Oxford, 1989, p. 209–216.
Tejada M., Malizia T., Marchetti F. et al. The Third International Conference of the Macrolides, Azalides and Streptograminis. Lisbon, 1996, Abs., p. 50.
Григорьев П. Я., Яковенко Э. П. Современные представления о пилорическом геликобактериозе // Практикующий врач, 1998, № 2 (13), с. 14–17.
Megraund F., Brugmann D., Darmillac V. The Third International Conference of the Macrolides, Azalides and Streptograminis. Lisbon, 1996, Abs., p. 47.
Glupczynski Y.
 , Burette A. Drug therapy of Helicobacter pylori infection: Problems and pitfalls // Amer. J. Gastroent., 1990, v. 85, p. 1545–1550.
, Burette A. Drug therapy of Helicobacter pylori infection: Problems and pitfalls // Amer. J. Gastroent., 1990, v. 85, p. 1545–1550.Guggenbichler J. Josamycin, ein Macrolid-Antibioticum mit bemerkenswerten Eigenschaften //Arzneimitterpraxis. 1997. Bd. 27, № 4/5. S. 1061–1064.
Корниенко Е. А., Дмитриенко М. А., Ломакина Е. А. Аммиачный дыхательный тест в диагностике инфекции Нelicobacter pylori // Клиническая лабораторная диагностика. 2000. № 1. С. 41–43.
Watanabe K., Tanaka A., Imase K. et al. Amoxicillin resistance in Helicobacter pylori: studies from Tokyo, Japan from 1985 to 2003 // Helicobacter. 2005. Vol. 10, № 1. P. 4–11.
Isakov V., Domareva I., Koudryavtseva L., Maev I., Ganskaya Z. Furazolidone-based triple «rescue therapy» vs. quadruple «rescue therapy» for the eradication of Helicobacter pylori resistant to metronidazole // Aliment. Pharmacol. Ther.
 2002. Vol. 16, № 7. P. 1277–1282.
2002. Vol. 16, № 7. P. 1277–1282.Kawabata H., Habu Y., Tomioka H. et al. Effect of different proton pump inhibitors, differences in CYP2C19 genotype and antibiotic resistance on the eradication rate of Helicobacter pylori infection by a 1-week regimen of proton pump inhibitor, amoxicillin and clarithromycin // Aliment. Pharmacol. Ther. 2003. Vol. 17, № 2. P. 259–264.
Miki I., Aoyama N., Sakai T. et al. Impact of clarithromycin resistance and CYP2 C19 genetic polymorphism on treatment efficacy of Helicobacter pylori infection with lansoprazole– or rabeprazole-based triple therapy in Japan // Eur. J. Gastroenterol. Hepatol. 2003. Vol. 15, № 1. P. 27–33.
Щербаков П. Л., Вартапетова Е. Е., Филин В. А., Салмова В. С. Алгоритм современной диагностики и лечения хеликобактерной инфекции у детей с заболеваниями верхних отделов пищеварительного тракта // Педиатрия. 2003. № 6. С. 86–91.
Heep M.
 , Kist M., Strobel S. et al. Secondary resistance among 554 isolates of Helicobacter pylori after failure of therapy // Eur. J. Clin. Microbiol. Infect. Dis. 2000. Vol. 19, № 7. P. 538–541.
, Kist M., Strobel S. et al. Secondary resistance among 554 isolates of Helicobacter pylori after failure of therapy // Eur. J. Clin. Microbiol. Infect. Dis. 2000. Vol. 19, № 7. P. 538–541.Моисеев С. В. Джозамицин: отличительные особенности и перспективы применения //Клин. фармакол. и терапия. 2005. № 14 (4). C. 1–4.
Grayson M. L., Eliopoulos G. M., Ferraro M. J., Moellering R. C. Jr. Effect of varying pH on the susceptibility of Campylobacter pylori to antimicrobial agents // Eur. J. Clin. Microbiol. Infect. Dis. 1989. Vol. 8, № 10. P. 888–889.
Lee S. P. A potential mechanism of action of colloidal bismuth subcitrate: diffusion barrier to hydrochloric aci // Scand. J. Gastroenterol., 1982, v. 17, s. 80, p. 17–21.
Soutar R. L., Coghill S. B. Interaction of tripotassum dicitrato bismuthate with macrophages in the rat and in vitro // Gastroenterology, 1986, v.
 91, p. 84–93.
91, p. 84–93.Coghill S. B. Experimental studies using colloidal bismuth subcitrate; possible models of action. In: Proceedings of an international symposium organised under the auspices of the university of Cairo. Pathogenesis and treatment of peptic ulcer disease. Excerpta Medica, Cairo, 1985, p. 7–12.
Tasman-Jones C., Maher C., Thomsen L. et al. Mucosal defences and gastroduodenal disease. Digestion, 1987, v. 37, s. 2, p. 1–7.
За остальным списком литературы обращайтесь в редакцию.
Обязательные показания
Целесообразные показания
П. Л. Щербаков*, доктор медицинских наук, профессор
В. С. Кашников**, кандидат медицинских наук
Е. А. Корниенко***, доктор медицинских наук, профессор
*Центральный НИИ гастроэнтерологии, Москва
**Ставропольская детская клиническая больница, Ставрополь
***СПбГПМА, Санкт-Петербург
Контактная информация об авторах для переписки: petersh@su29. ru.
ru.
Экспресс-тест для диагностики инфекции Helicobacter pylori — Пермский клинический центр
Хеликобактер пилори (Helicobacter Pilori) – спиралевидная кислотоустойчивая бактерия, обитающая в желудке и двенадцатиперстной кишке человека.
По данным медицинской статистики, хеликобактером заражены около 60 % всего населения Земли, хеликобактериоз является наиболее распространенным инфекционным заболеванием людей после герпеса. Заражение бактерией хеликобактер происходит через загрязенную воду или пищу, а также после контакта с инфицированным человеком через слюну или мокроту, выделяемую при кашле, чихании, поцелуе, пользовании общими предметами быта.
Инфицирование Helicobacter Pilori происходит настолько легко, что считается семейным заболеванием – при заражении одного члена семьи, в 95 % случаев оказываются инфицированными все остальные, причем, долгое время зараженный человек может не догадываться о заболевании и не испытывать никаких болезненных симптомов.
Под воздействием стрессов, простудных инфекций, травм, интоксикаций, гормональных сбоев, дремлющая в организме и долгое время не дающая о себе знать бактерия «просыпается» и начинает свое болезнетворное воздействие. Helicobacter Pilori является ведущим фактором в развитии:
1. Хронического гастрита, атрофического гастрита, гастродуоденита;
2. Язвенной болезни желудка и двенадцатиперстной кишки;
3. MALT-лимфомы желудка;
4. Аденокарциномы желудка (разновидность рака желудка).
Также большую роль Helicobacter Pilori оказывает на течение таких заболеваний как: гастоэзофагеальная рефлюксная болезнь (ГЭРБ), железодефицитная анемия, гастропатия на фоне применения нестероидных противовоспалительных препаратов.
Для своевременного лечения хеликобактерной инфекции необходима точная диагностика. В нашем лечебном учреждении вы можете провести тест на наличие инфекции Helicobacter pylori.
Для диагностики Helicobacter pylori мы используем экспресс-тест, разработанный финской компанией Biohit, основанный на определении активности фермента уреазы в биоптате. Биоптат (кусочек слизистой оболочки желудка) сразу подвергается исследованию. Результат теста можно узнать через 30 минут.
Биоптат (кусочек слизистой оболочки желудка) сразу подвергается исследованию. Результат теста можно узнать через 30 минут.
Чтобы вышеописанный тест был максимально достоверным , пациент перед проведением теста не должен принимать антибиотики, препараты висмута (де-нол) в течение 3-х недель, Н2-гистаминоблокаторы и ингибиторы протонной помпы – в течение 2-х недель.
РЕКОМЕНДАЦИИ ПО ЛЕЧЕНИЮ ИНФЕКЦИИ HELICOBACTER PYLORI | Лапина Т.Л.
В статье подробно обсуждается вопрос эрадикации H. pylori. На основе собственного материала и международного соглашения по лечению инфекции H. pylori даются конкретные рекомендации для практических врачей. Подчеркивается необходимость единого подхода к диагностике и терапии H. pylori.
The paper discusses H.pylori eradication more specifically. Based on her own findings and the International Consensus Committee’s recommendations for treating H.pylori infection, the author provides guidelines for the practitioners.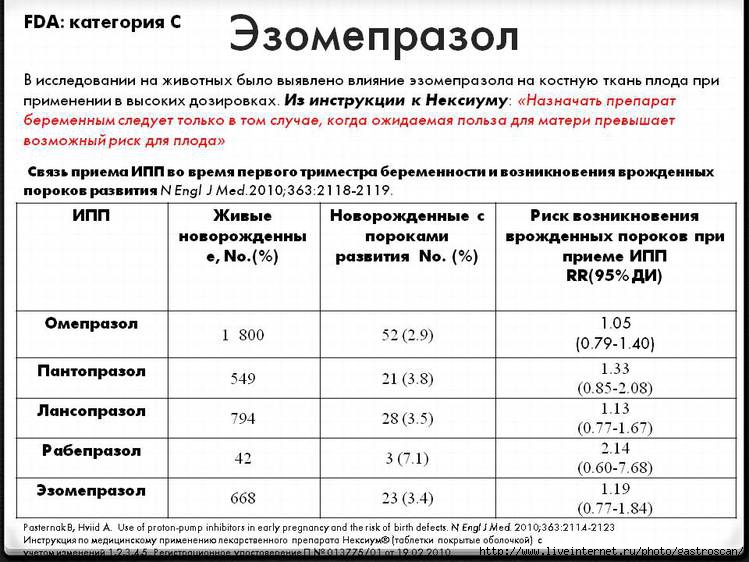 The paper underlines the need for applying a uniform approach to the diagnosis and treatment of H.pylori infection.
The paper underlines the need for applying a uniform approach to the diagnosis and treatment of H.pylori infection.
Т.Л. Лапина – ассистент курса “Функциональная диагностика и фармакотерапия в гастроэнтерологии”, кафедры семейной медицины факультета послевузовского профессионального образования
ММА им. И.М. Сеченова
T.L.Lapina, Assistant, Course “Functional Diagnosis and Pharmacotherapy in Gastroenterology”, Department of Family Medicine, Faculty of Postgraduate Training I.M. Sechenov Moscow Medical Academy
С 1983 г., когда впервые был выделен в культуре новый вид микрооганизма – Helicobacter pylori (H. pylori), многочисленными исследованиями доказано его патогенетическое значение (табл. 1). Изучение H. pylori ведется с использованием современнейших научных методов и продвигается вперед огромными шагами. Такое “стремительное” накопление теоретических знаний в данной области, к сожалению, ведет к некоторому отставанию популяризации этой информации среди практических врачей. В итоге это оборачивается ошибками в диагностике, а главное, в выборе лечения инфекции H. pylori. К сожалению, большинство литературных источников, в которых методически правильно описывается практика эрадикационной терапии, т.е. терапии, направленной на уничтожение H. pylori, англоязычны, на русском языке опубликованы пока единичные работы.
В итоге это оборачивается ошибками в диагностике, а главное, в выборе лечения инфекции H. pylori. К сожалению, большинство литературных источников, в которых методически правильно описывается практика эрадикационной терапии, т.е. терапии, направленной на уничтожение H. pylori, англоязычны, на русском языке опубликованы пока единичные работы.
Пожалуй, первый документ, направленный на то, чтобы “сделать легитимной” и унифицировать терапию инфекции H. pylori, был принят в феврале 1994 г. специальной конференцией Национального института здоровья США [1]. На конференции был достигнут консенсус по проблеме “Helicobacter pylori и язвенная болезнь”: больных язвенной болезнью с инфекцией H. pylori необходимо лечить антимикробными средствами и при обострении заболевания, и в период ремиссии, причем были рекомендованы определенные схемы терапии.
Однако уже через 2 года эти рекомендации устарели, так как появились данные о более эффективных комбинациях лекарственных препаратов для эрадикации H. pylori. В нескольких странах Европы независимо друг от друга были разработаны аналогичные документы, но необходимость единого подхода к диагностике и терапии H. pylori, основанного на опыте лучших европейских исследователей, привела к созыву в городе Маастрихт в феврале 1996 г. специальной конференции. Конференция, организованная Европейской группой по изучению H. pylori, собрала ученых-экспертов в этой области, практикующих врачей и представителей Национальных обществ гастроэнтерологов. После серьезного обсуждения были приняты рекомендации по лечению инфекции H. pylori, отвечающие современным требованиям [2]. “Маастрихтский консенсус” является руководством для практикующих врачей европейских стран и дает ответы на вопросы о H. pylori, которые могут возникнуть в их повседневной деятельности и ведении гастроэнтерологических больных.
pylori. В нескольких странах Европы независимо друг от друга были разработаны аналогичные документы, но необходимость единого подхода к диагностике и терапии H. pylori, основанного на опыте лучших европейских исследователей, привела к созыву в городе Маастрихт в феврале 1996 г. специальной конференции. Конференция, организованная Европейской группой по изучению H. pylori, собрала ученых-экспертов в этой области, практикующих врачей и представителей Национальных обществ гастроэнтерологов. После серьезного обсуждения были приняты рекомендации по лечению инфекции H. pylori, отвечающие современным требованиям [2]. “Маастрихтский консенсус” является руководством для практикующих врачей европейских стран и дает ответы на вопросы о H. pylori, которые могут возникнуть в их повседневной деятельности и ведении гастроэнтерологических больных.
Таблица 1. H. pylori и патология человека
|
Патологические состояния |
Связь с инфекцией H. |
| Хронический гастрит, вызванный инфекцией H. pylori Язвенная болезнь желудка и двенадцатиперстной кишки Рак желудка MALT лимфома |
Установлена |
| Неязвенная диспепсия Болезнь Менетрие Ишемическая болезнь сердца Задержка роста детей |
Вероятна |
| Гастроэзофагоеюнальная рефлюксная болезнь Гастродуоденальные изъязвления, связанные с приемом нестероидных противовоспалительных препаратов |
Спорна |
“Рекомендации по диагностике и лечению инфекции Helicobacter pylori у взрослых при язвенной болезни желудка и двенадцатиперстной кишки”, разработанные Российской группой по изучению H. pylori, прошли обсуждение на научной конференции, посвященной 100-летию со дня рождения В.Х. Василенко в апреле 1997 г. и на III Национальной гастроэнтерологической неделе в ноябре 1997 г. Они опубликованы в Российском журнале гастроэнтерологии, гепатологии, колопроктологии [3] и с помощью Российской гастроэнтерологической ассоциации (РГА) распространены по различным регионам России. Рекомендации предельно конкретны и призваны помочь практикующим врачам и организаторам здравоохранения.
pylori, прошли обсуждение на научной конференции, посвященной 100-летию со дня рождения В.Х. Василенко в апреле 1997 г. и на III Национальной гастроэнтерологической неделе в ноябре 1997 г. Они опубликованы в Российском журнале гастроэнтерологии, гепатологии, колопроктологии [3] и с помощью Российской гастроэнтерологической ассоциации (РГА) распространены по различным регионам России. Рекомендации предельно конкретны и призваны помочь практикующим врачам и организаторам здравоохранения.
Таблица 2. Показания к лечению инфекии H. pylori
|
Показания |
Степень научной очевидности |
|
| Российская
гастроэнтерологическая ассоциация по изучению H. апрель 1997 г. |
Европейская группа по изучению H. pylori Маастрихт, сентябрь 1996 г. | |
| Язвенная болезнь желудка и двенадцатиперстной кишки в стадии обострения и в стадии ремиссии | Обязательно | |
| язвенная болезнь | безусловная | |
| МАLTома желудка | безусловная | |
| гастрит | вероятная | |
| после операции резекции жедудка по поводу рака | вероятная | |
| Желательно | ||
| функциональная диспепсия | возможная | |
| наследственность, отягощенная раком желудка, | возможная | |
| долгий прием ингибиторов протонной помпы по поводу гастроэзофагоеюнальной рефлюксной болезни | вероятная | |
| терапия нестероидными противовоспали-
тельными средствами |
возможная | |
| после операций по поводу язвенной болезни | вероятная | |
| желание пациента | вероятная | |
| Возможно | ||
| для предотвращения рака желудка | возможная | |
| бессимптомные носители | возможная | |
| экстраалиментарные заболевания(ишемическая болезнь сердца, задержка роста у детей) | возможная | |
Принципиальное значение для практики имеет разделение методики диагностики H. pylori до лечения (первичная диагностика – обнаружение инфекции для обоснования назначения лечения) и после проведения эрадикационной терапии (диагностика эрадикации – контроль успешности антибактериальной схемы). Дело в том, что H. pylori обнаруживаются в 100% случаев при хроническом гастрите, язвенной болезни желудка и двенадцатиперстной кишки. Поэтому для того, чтобы начать антихеликобактерную терапию, достаточно подтвердить наличие бактерии одним из доступных методов (естественно, при соблюдении правил выполнения этих методов и надлежащей стерилизации эндоскопической аппаратуры). Эти методы перечислены в “Рекомендациях”:
pylori до лечения (первичная диагностика – обнаружение инфекции для обоснования назначения лечения) и после проведения эрадикационной терапии (диагностика эрадикации – контроль успешности антибактериальной схемы). Дело в том, что H. pylori обнаруживаются в 100% случаев при хроническом гастрите, язвенной болезни желудка и двенадцатиперстной кишки. Поэтому для того, чтобы начать антихеликобактерную терапию, достаточно подтвердить наличие бактерии одним из доступных методов (естественно, при соблюдении правил выполнения этих методов и надлежащей стерилизации эндоскопической аппаратуры). Эти методы перечислены в “Рекомендациях”:
1. Бактериологический: посев биоптата слизистой оболочки желудка на дифференциально-диагностическую среду.
2. Морфологические:
– гистологический “золотой стандарт” диагностики H. pylori: окраска бактерии в гистологических препаратах слизистой оболочки желудка по Гимзе, толуидиновым синим, Вартину – Старри, Генте;
– цитологический: окраска бактерии в мазках-отпечатках биоптатов слизистой оболочки желудка по Гимзе, Граму.
3. Дыхательный: определение в выдыхаемом больным воздухе изотопов 14С или 13С, которые выделяются в результате расщепления в желудке больного меченной мочевины под действием уреазы бактерии H. pylori.
4. Уреазный: определение уреазной активности в биоптате слизистой оболочки желудка путем помещения его в жидкую или гелеобразную среду, содержащую субстрат, буфер и индикатор.
Таблица 3. Тройная терапия на основе препаратов висмута
|
Препарат висмута |
Антибактериальные препараты |
|||
| Коллоидный субцитрат висмута или субсалицилат висмута или галлат висмута по 120 мг 4 раза в день(в пересчете на окись вимута) | + | Тетрациклин
по 500 мг 4 раза в день |
+ |
Метронидазол |
|
Продолжительность лечения – 7 дней |
||||
В “Рекомендациях” дано определение понятия “эрадикация” – это полное уничтожение бактерии H. pylori (как вегетативной, так и кокковидной форм) в желудке и двенадцатиперстной кишке человека. Эрадикационная терапия – серьезная задача для врача, и не всегда приводит к успеху. Для ведущих научных центров эрадикация H. pylori в 80% случаев является отличным показателем эффективности терапии.
pylori (как вегетативной, так и кокковидной форм) в желудке и двенадцатиперстной кишке человека. Эрадикационная терапия – серьезная задача для врача, и не всегда приводит к успеху. Для ведущих научных центров эрадикация H. pylori в 80% случаев является отличным показателем эффективности терапии.
Таблица 4. Соли висмута угнетают H. pylori in vitro
|
Соль висмута |
MIC90, нг/л |
| Висмута субцитрат |
4 – 32 |
| Висмута субсалицилат |
64 |
| Ранитидин-висмут-цитрат |
16 |
| Висмута субгаллат |
32 |
| Висмута субнитрат |
> 128 |
Применение антибактериальных лекарственных препаратов резко снижает количество H. pylori в гастродуоденальной слизистой оболочке. Поэтому сразу после окончания эрадикационного лечения даже в случае его неудачи H. pylori не обнаруживается. Ложноотрицательные результаты обусловлены тем, что H. pylori может отсутствовать в случайно взятых единичных биоптатах слизистой оболочки или находится там в таких незначительных количествах, которые не воспринимаются диагностическими методами (морфологический, уреазный). С уменьшением количества H. pylori связаны сложности его обнаружения после монотерапии висмут-содержащими препаратами, метронидазолом, любыми антибактериальными препаратами, использованными по другим показаниям (например, аугментин по поводу ангины, фурадонин по поводу цистита и др.).
pylori в гастродуоденальной слизистой оболочке. Поэтому сразу после окончания эрадикационного лечения даже в случае его неудачи H. pylori не обнаруживается. Ложноотрицательные результаты обусловлены тем, что H. pylori может отсутствовать в случайно взятых единичных биоптатах слизистой оболочки или находится там в таких незначительных количествах, которые не воспринимаются диагностическими методами (морфологический, уреазный). С уменьшением количества H. pylori связаны сложности его обнаружения после монотерапии висмут-содержащими препаратами, метронидазолом, любыми антибактериальными препаратами, использованными по другим показаниям (например, аугментин по поводу ангины, фурадонин по поводу цистита и др.).
Таблица 5. Тройная терапия на основе ингибиторов протонной помпы париетальных клеток
| Ингибиторы протонной помпы Антибактериальные препараты | ||
|
Омепразол |
+ |
Кларитромицин по 250 мг 2 раза в день + метронидазол по 400 мг 3 раза в день |
|
Или |
или |
|
|
пантопразол |
амоксициллин по 1000 мг 2 раза в день + кларитромицин 500 мг 2 раза в день |
|
|
Или |
или |
|
|
Лансопразол |
Амоксициллин по 500 мг 3 раза в день + метронидазол по 400 мг 3 разав день |
|
|
Продолжительность лечения – 7 дней |
||
Таблица 6..gif) Квадротерапия
Квадротерапия
|
Блокаторы протонной помпы |
Препарат висмута |
Антибактериальные препараты |
||
|
Омепразол по 20 мг |
Коллоидный субцитрат висмута |
Тетрациклин по 500 мг 4 раза в день |
||
|
или |
Или |
+ |
||
|
Пантопразол по 40 мг 2 раза в день |
Субсалицилат висмута |
Метронидазол по 250 мг 4 раза в день |
||
|
или |
или |
или |
||
|
Лансопразол |
Галлат висмута по 120 мг 4 раза в день |
Тинидазол |
||
|
Продолжительность лечения – 7 дней |
||||
Важно отметить, что применение любых ингибиторов протонной помпы (омепразола, пантопразола, лансопразола) в силу особенностей адаптации H. pylori к определенным значениям рН приводит к перераспределению H. pylori по слизистой оболочке: бактерии элиминируются из антрального отдела и в большем количестве обнаруживаются в теле желудка. Считается, что мощная антисекреторная терапия приводит и к уменьшению общего количества бактерий H. pylori. Таким образом, если проводить исследование на H. pylori во время или сразу после курса терапии ингибиторами протонной помпы не исключен ложноотрицательный результат, особенно если ограничиться биоптатами из антрального отдела [4]. Известен факт ложноотрицательной диагностики H. pylori после лечения омепразолом и с помощью дыхательного теста, для которого не требуется биопсия.
pylori к определенным значениям рН приводит к перераспределению H. pylori по слизистой оболочке: бактерии элиминируются из антрального отдела и в большем количестве обнаруживаются в теле желудка. Считается, что мощная антисекреторная терапия приводит и к уменьшению общего количества бактерий H. pylori. Таким образом, если проводить исследование на H. pylori во время или сразу после курса терапии ингибиторами протонной помпы не исключен ложноотрицательный результат, особенно если ограничиться биоптатами из антрального отдела [4]. Известен факт ложноотрицательной диагностики H. pylori после лечения омепразолом и с помощью дыхательного теста, для которого не требуется биопсия.
Таблица 7. Терапия на основе ранитидин-висмут-цитрата
|
Ранитидин-висмут-цитрат |
Ранитидин-висмут-цитрат |
Ранитидин-висмут-цитрат |
|
+ |
+ |
+ |
|
тетрациклин |
кларитромицин |
Кларитромицин |
|
+ |
+ |
|
|
Метронидазол |
метронидазол |
|
|
14 дней |
14 дней |
7 дней |
Таблица 8. Принципы терапии инфекции H. pylori
| • Использование многокомпонентных схем лечения – тройная терапия – квадротерапия • Строгое соблюдение выбранной схемы лечения – определенные лекарственные препараты – определенные дозы – определенная продолжительность терапии • Учет синергизма лекарственных препаратов |
Поэтому контроль успешности проведения антибактериального лечения требует особого подхода. Правила диагностики эрадикации по “Рекомендациям” следующие:
1. Диагностика эрадикации должна осуществляться не ранее 4 – 6 недель после окончания курса антихеликобактерной терапии, либо лечения любыми антибиотиками или антисекреторными средствами сопутствующих заболеваний.
2. Диагностика эрадикации осуществляется, как минимум, двумя из указанных диагностических методов, причем при использовании методов непосредственного обнаружения бактерии в биоптате слизистой оболочки желудка (бактериологический, морфологический, уреазный) необходимо исследование 2 биоптатов из тела желудка и 1 биоптата из антрального отдела.
3. Цитологический метод для установления эрадикации неприменим.
Особое место в диагностике инфекции H. pylori имеют иммуноферментный анализ и экспресс-тесты на основе иммунопреципитации, которые позволяют обнаруживать в сыворотке крови или в капиллярной крови пациентов антитела к H. pylori. Эти методы могут быть использованы в качестве скрининговых или в случае установленной болезни для первичной диагностики инфекции H. pylori. Понятно, что для обнаружения H. pylori после лечения серологические методы неприменимы, так как даже после эрадикации бактерии антихеликобактерные антитела продолжают циркулировать в крови.
“Рекомендации по диагностике и лечению инфекции Helicobacter pylori у взрослых при язвенной болезни желудка и двенадцатиперстной кишки” устанавливают в качестве показания к эрадикационному лечению только язвенную болезнь как в стадии обострения, так и в стадии ремиссии. Значение H. pylori в патологии человека значительно шире, хотя результаты эрадикационной терапии действительно лучше изучены при этом заболевании. Маастрихтские рекомендации охватывают гораздо более широкий круг показаний для антихеликобактерного лечения, причем указывают степень важности проведения такого лечения и его научную обоснованность (табл. 2). Вероятно, по мере накопления новой информации показания к эрадикационной терапии в Российских рекомендациях будут расширены.
Особенности терапии инфекции H. pylori нашли свое отражение в определенных принципах лечения, которые сформулированы в “Рекомендациях” следующим образом:
Основой лечения является использование комбинированной (трехкомпонентной) терапии:
• способной уничтожать бактерию H. pylori, как минимум, в 80% случаев;
• не вызывающей вынужденной отмены терапии врачом, вследствие побочных эффектов (допустимо менее чем в 5% случаев) или прекращения пациентом приема лекарств по схеме, рекомендованной врачом;
• эффективной при продолжительности курса не более 7 – 14 дней.
Действительно, наиболее эффективные схемы эрадикационной терапии являются трехкомпонентными. К сожалению, лечение с помощью двух лекарственных препаратов оказывается недостаточным для того, чтобы уничтожить H. pylori как минимум у 80% пролеченных пациентов. Давно не используется в клинической практике сочетание де-нола с метронидазолом, эрадикация с помощью такой схемы практически недостижима. Исследования 1995 – 1996 гг. показали, что сочетание омепразола с одним антибиотиком дает слишком большой разброс результатов эрадикации H. pylori. Так, двойная терапия омепразолом с амоксициллином результативна, по данным разных авторов, в 29 – 92% случаев. В среднем эффективность двойной терапии оценивается в пределах 50 – 70%. Эрадикация в контролируемых исследованиях наступает менее чем у 80% пролеченных, и двойной режим лечения не может быть рекомендован для практического здравоохранения. Таким образом, эрадикационные схемы стали трехкомпонентными и даже четырехкомпонентными.
Эрадикационная терапия – это терапия антибиотиками, поэтому естественными являются требования к безопасности и хорошей переносимости такого лечения. К сожалению, укороченный курс менее 7 дней, как правило, приводит к неудаче – эрадикация не наступает. Поэтому, если попытка эрадикационной терапии привела к побочным проявлениям, вынудившим прервать курс (например, аллергическая реакция), с уверенностью можно говорить о персистировании инфекции H. pylori.
Рекомендуемые схемы для эрадикации H. pylori приведены в табл. 3, 5, 6, 7.
Схемы лечения на основе препаратов висмута, в первую очередь коллоидного субцитрата висмута, раньше всего стали использовать по поводу инфекции H. pylori. Препараты висмута в сочетании с тетрациклином и метронидазолом называют даже классической тройной терапией. Дело в том, что соли висмута обладают бактерицидными свойствами в отношении Н.pylori: разрушают бактериальную стенку, ингибируют ферменты бактерий (уреазу, каталазу, липазу/фосфолипазу), предотвращают адгезию Н. рylori к эпителиальным клеткам желудка. Для солей висмута определены минимальные концентрации, ингибирующие Н. рylori (MIC) (табл. 4).
В настоящее время оптимальной считается схема тройной терапии с ингибитором протонной помпы (табл. 5). Благодаря своим особенностям ингибиторы протонного насоса являются незаменимыми в антихеликобактерном лечении. В начале 90-х годов рядом авторов было показано, что монотерапия омепразолом приводит к подавлению Н. pylori (при исследовании биоптатов антрального отдела сразу после курса антисекреторной терапии ингибитором протонного насоса бактерию часто не обнаруживали). Как уже было описано, использование омепразола приводит к перераспределению микроорганизма в слизистой оболочке желудка: их число в антральном отделе снижается, причем часто значительно, а в теле желудка возрастает. Механизм такого регулирующего влияния ингибиторов протонного насоса связан с мощным угнетением желудочной секреции. Синтез АТФ Н. pylori осуществляется благодаря наличию электрохимического градиента ионов водорода. Уреаза бактерии, разлагая мочевину с выделением ионов аммония, приводит к защелачиванию микроокружения бактерии, предохраняющего ее от действия соляной кислоты желудочного сока; в этих условиях синтез АТФ продолжается. Но применение ингибиторов протонного насоса приводит к повышению рН, а эффект уреазы – к суммарному повышению рН, до уровня, который несовместим с жизнедеятельностью микроорганизма. Таким образом, Н. pylori является толерантным к кислым значениям рН (благодаря уникальной уреазной активности), но неустойчивым к щелочной реакции среды “нейтрофилом”. При использовании ингибиторов протонного насоса бактерии приходится переселяться в отделы желудка с более низкими значениями рН, т. е. в тело желудка из антрального отдела.
Самые мощные из известных на сегодняшний день антисекреторных препаратов – ингибиторы протонной помпы – не только угнетают Н. pylori в антральном отделе, но и стимулируют защитные механизмы макроорганизма в отношении бактерии. Антитела к Н. pylori, секретируемые на поверхность слизистой оболочки желудка, быстро деградируют под влиянием протеолитических ферментов желудочного сока. Сдвиг рН в щелочную сторону при использовании блокаторов Н+, К+-АТФазы заметно снижает протеолитическую активность содержимого желудка и удлиняет период полужизни антител и их концентрацию. Функциональная активность нейтрофилов также зависит от pH и возрастает при его сдвиге в щелочную сторону. Ингибиторы протонного насоса обладают синергизмом с антибактериальными препаратами. Активность многих антибиотиков повышается при сдвиге значений рН из кислой среды в щелочную. Кроме того, уменьшение объема секрета повышает концентрацию антибактериальных препаратов в желудочном соке [4].
Однако антихеликобактерный эффект ингибиторов протонного насоса объясняется не только подавлением секреции. Эти препараты обладают специфической, присущей только этому классу препаратов способностью подавлять H. pylori in vitro и, вероятно, in vivo. Имеются данные, свидетельствующие о том, что они угнетают уреазу бактерии и одну из ее АТФаз. Подавление уреазной активности микроорганизма не так давно показано не только in vitro, но и в клинических экспериментах. Все производные бензимидазола – омепразол, пантопразол, лансопразол – приводят к одинаковому перераспределению бактерии в слизистой оболочке желудка и обладают сходным бактериостатическим эффектом (известны минимальные ингибирующие концентрации каждого из этих препаратов). Таким образом, антихеликобактерный эффект – это свойство ингибиторов протонного насоса как класса лекарственных препаратов.
Квадротерапию следует рассматривать как терапию резерва. Ее эффективность в отношении H. pylori оценивается как максимальная (табл. 6). Комбинацию четырех лекарственных препаратов целесобразно использовать как лечение “второй линии”, после неудачи первого эрадикационного курса, или в особых случаях (например, при лечении MALTомы желудка.)
Новая формула – ранитидин-висмут-цитрат – представляет собой соединение, сочетающее лекарственную активность антисекреторного агента и бактерицидные особенности висмута. Эффект этого комбинированного препарата превосходит суммарные возможности сочетания блокатора Н2-рецепторов гистамина и соли висмута, за счет особого синергизма, присущего данной химической структуре. Особые свойства ранитидин-висмут-цитрата позволяют комбинировать его только с одним антибиотиком – кларитромицином, хотя по сути это сочетание уже трехкомпонентно (табл. 7).
Значительно снижает успешность эрадикационной терапии развитие резистентности H. pylori к антибиотикам. Наиболее распространена устойчивость микроорганизма к метронидазолу, хотя описаны штаммы H. pylori, устойчивые к кларитромицину и амоксициллину. Резистентность, как правило, возникает вследствие бесконтрольного неграмотного назначения антибактериального агента. К сожалению, ситуация с метронидазолом в России может быть описана именно таким образом. По данным Л.В. Кудрявцевой, доложенным на III Российской гастроэнтерологической неделе (1997), первичная резистентность H. pylori к метронидазолу обнаруживается в 30% случаев, при повторном курсе метронидазола бактерия устойчива к нему практически в 100% случаев. Самой серьезной и наиболее частой ошибкой в назначении антибактериальных препаратов при язвенной болезни является использование метронидазола не в составе описанных схем, а в качестве дополнительного препарата вместе с блокаторами Н2-рецепторов гистамина, де-нолом или в качестве монотерапии.
Репаративные свойства метронидазола, если они и есть, настолько слабы, что при использовании современных ингибиторов Н2-рецепторов гистамина или протонной помпы, приводящих к заживлению язвы за 2 нед, рассчитывать на них просто бессмысленно. А вот устойчивость H. pylori к метронидазолу в случае его необоснованного применения возникает неизбежно.
Именно в связи с проблемой резистентности в “Рекомендациях” выделены правила применения антихеликобактерной терапии:
1. Если использование схемы лечения не приводит к наступлению эрадикации, повторять ее не следует.
2. Если использованная схема не привела к эрадикации, это означает, что бактерия приобрела устойчивость к одному из компонентов схемы лечения (производным нитроимидазола, макролидам).
3. Если использование одной, а затем другой схемы лечения не приводит к эрадикации, то следует определять чувствительность штамма H. pylori ко всему спектру используемых антибиотиков.
4. Появление бактерии в организме больного спустя год после лечения следует расценивать как рецидив инфекции, а не реинфекцию*. При рецидиве инфекции необходимо применение более эффективной схемы лечения.
Распространенной ошибкой является уменьшение дозы антибактериальных препаратов или продолжительности лечения, произвольная замена компонентов схемы. Даже замена тетрациклина на доксициклин приводит к уменьшению эффективности лечения, замена кларитромицина на эритромицин практически сводит на нет усилия врача по эрадикации инфекции H. pylori. В большинстве случаев неадекватной является замена ингибиторов протонной помпы антагонистами Н2-рецепторов гистамина (табл. 8). К сожалению, встречается даже “поэтапное” назначение компонентов схемы: сначала неделя омепразола с метронидазолом, а затем неделя приема кларитромицина. Итог один – эрадикация не наступает, больной принимает антибиотики без всякого смысла, число резистентных штаммов H. pylori возрастает.
Таким образом, лишь строгое соблюдение отработанных схем терапии (вид лекарственных препаратов, их сочетание, дозы и продолжительность лечения) дает возможность добиться эрадикации H. pylori у большинства пациентов.
Литература:
1. NIH сonsensus development panel on Helicobacter pylori in peptic ulcer disease. JAMA 1994; 272:65–9.
2. Current European concepts in the management of Helicobacter pylori infection. The Maastricht Consensus Report. Gut 1997; 41(1):8–13.
3. Рекомендации по диагностике и лечению инфекции Helicobacter pylori у взрослых при язвенной болезни желудка и двенадцатиперстной кишки. // Российский журнал гастроэнтерологии, гепатологии, колопроктологии, 1998; № 1.
4. Hunt R.H. The role of acid suppression in the treatment of H. pylori infection. In: Helicobacter pylori. Basic mechanisms to clinical cure. Ed. by R.H. Hunt, G.N.J. Tytgat. Kluwer academic publishers. Dordrecht, Boston, London, 1995; 584–93.
.
Три угрозы рака желудка и один способ его избежать
А одной из самых частых разновидностей онкологии становится рак желудка. Именно он, например, довел до могилы Наполеона I, лишил жизни жизнерадостную Анну Самохину и погубил Льва Яшина.
А начинается все нередко с какой-то маленькой бактерии. Откуда она берется в организме?
ХЕЛИКОБАКТЕР – МАЛЕНЬКАЯ «НОБЕЛЕВСКАЯ» БАКТЕРИЯ
По-научному она называется Helicobacter pylori. Этакая спиралька, которая поселяется в человеческом организме и инфицирует различные области желудка и двенадцатиперстной кишки. Со временем соляная кислота (она постоянно присутствует в желудке и нужна нам для пищеварения) поражает незащищенные стенки органов и вызывает эрозии. А они со временем могут стать причиной размножения раковых клеток.
5 интересных фактов о Helicobacter pylori:
• Она считается самой распространенной бактерией в мире – две трети населения Земли инфицированы хеликобактером(2).
• Ученые нашли эту бактерию в слюне человека, в зубном налете и прочих выделениях(3), а значит, «подхватить» ее можно даже при поцелуях или пользуясь чужой зубной щеткой или посудой.
• Helicobacter pylori обитает не только в желудке человека, но и в организме некоторых птиц и животных-млекопитающих(4).
• За открытие причинно-следственной связи бактерии и возникновения гастрита, язвы желудка и двенадцатиперстной кишки в 2005 году была вручена Нобелевская премия(5) . Ее получил Барри Маршалл. А его путь к «Нобелевке» лежал в прямом смысле через его собственный желудок: ученый специально заразился бактерией, чтобы доказать ее пагубное влияние на человеческий организм.
• До того считалось, что большинство язв желудка и гастритов развивается только в результате стресса или из-за острой пищи(5).
КСТАТИ
В 1994 году Всемирная Организация Здравоохранения (ВОЗ) занесла бактерию Helicobacter Pylori в разряд канцерогенов первого класса(6).
ОТ ГАСТРИТА И ЯЗВЫ ЖЕЛУДКА ДО РАКА – ОДИН ШАГ
Итак, в человеческом организме поселяется Хеликобактер пилори. А что дальше? Зависит от иммунитета человека и организма в целом. У кого-то бактерия не вызывает никаких проблем. Но значительный процент людей заболевает. И тогда в 90% случаев гастрита, язвы или полипов в желудке у пациента находят Helicobacter pylori(7).
Человек начинает замечать непривычные для себя симптомы:
• Участившиеся проявления изжоги
• Появление «кислой» отрыжки
• Чувство сдавленности и даже боли в верхней части живота, особенно после еды
• Белый, «обложенный» язык
Тошнота, рвота, расстройства стула
• Иногда – повышение температуры
Это все «звоночки» о том, что с желудком начались проблемы. И если заболевания запустить, то следующим пунктом в их цепочке станет предраковое состояние. А потом и рак желудка. В среднем от предрака до рака проходит от 10 до 20 лет .
КАК ПРЕДУПРЕДИТЬ РАК ЖЕЛУДКА
В России он находится на втором месте по смертности среди всех онкологических заболеваний(8). Причем одной из причин рака может стать… лечение. Это тот самый случай, когда «одно лечат, а другое калечат». Такое, например, бывает, если больному гастритом назначают исключительно кислотоснижающие препараты. На самом деле, такая терапия часто только усугубляет ситуацию и ускоряет возникновение предраковых изменений.
Чтобы этого не случилось, терапия должна преследовать две цели: с одной стороны, защищать слизистую желудка, а с другой – подавлять жизнедеятельность бактерий. Для этого:
1. Принимайте «Де-Нол» это препарат как раз работает в двух направлениях. Во-первых, подавляет вредоносную бактерию, не давая ей прикрепиться к слизистой желудка и снижая ее подвижность и агрессивность (препарат проникает в самые глубокие слои слизистой). А во-вторых, заживляет слизистую желудка, ускоряя процессы рубцевания язвы и уменьшая раздражающее действие соляной кислоты(9).
2. Будьте осторожнее с приемом лекарств. Доказано, что сильная медикаментозная терапия также провоцирует обострения. Кстати, «Де-Нол» антибиотиком не является, то есть безопасен для нормальной микрофлоры кишечника. Разрешен к применению уже с 4-летнего возраста.
3. Регулярно проходите фиброгастроскопию, чтобы своевременно выявить прогрессирование заболевания.
4. Откажитесь от пищи с избытком жирного, жареного, острого и копченого. Переедание на ночь грозит вам не только лишним весом, но и осложнениями в случае гастрита и язвы.
5. Будьте осторожнее с овощами и фруктами! В них может быть предостаточно нитратов и нитритов. Мойте овощи тщательно и горячей водой. Иначе химическая активность нарушит целостность клеток слизистой оболочки желудка, спровоцировав тем самым их перерождение.
6. Алкоголь – а точнее, содержащийся в нем этиловый спирт – также может стать мощным провокатором злокачественных новообразований. Не раз доказано, что он вызывает острые эрозивные процессы в желудке. Что же касается курения, то чем дольше человек курит, тем выше вероятность появления у него рака.
Источники:
1. Всемирная организация здравоохранения (WHO) // Неинфекционные заболевания URL: http://www.who.int/mediacentre/factsheets/fs355/ru/
2. Сводная Энциклопедия Wikipedia // Статья Helicobacter pylori URL: https://ru.wikipedia.org/wiki/Helicobacter_pylori
3. Helicobacter pylori detection in gastric biopsies, saliva and dental plaque of Brazilian dyspeptic patients // (Rasmussen L.T., Labio R.W.) URL: http://www.ncbi.nlm.nih.gov/pubmed/20512249
4. Центр по контролю за заболеваниями США (СDC) / Spiral Bacteria in the Human Stomach: The Gastric Helicobacters (Andre Dubois) / URL: http://wwwnc.cdc.gov/eid/article/1/3/95-0302_article
5. Сводная Энциклопедия Wikipedia/ Статья посвященная врачу, лауреату Нобелевской премии Барри Маршаллу // URL: https://en.wikipedia.org/wiki/Barry_Marshall
6. СанПиН 1.2.2353-08 Канцерогенные факторы и основные требования к профилактике канцерогенной опасности URL: http://www.gosthelp.ru/text/SanPiN12235308Kancerogenn.html
7. Диагностика и лечение инфекции Helicobacter pylori – отчет согласительной конференции Маастрихт IV/ Флоренция // Вестник практического врача. Спецвыпуск 1. 2012. С. 6-22. URL: http://www.gastroscan.ru/literature/authors/6904
8. Хирургическое лечение рака проксимального отдела желудка: эволюция стандартов (М.И. Давыдов, Тер-Ованесов М.Д. и др.) // V Российская онкологическая конфереция // http://www.rosoncoweb.ru/library/congress/ru/05/24.php
9. Адаптировано из инструкции по применению лекарственного препарата для медицинского применения Де-Нол® (П N012626/01- 20.11.2012)
Таблетки Де-Нол®, РУ П N012626/01 от 23.08.2010
АО «Астеллас Фарма» 109147, Россия, Москва, ул. Марксистская, 16. Тел: +7 (495) 737 0756
На правах рекламы.
Скажи “Да” здоровому желудку! :: Новости :: ТВ Центр
Гастрит – многие даже не подозревают, что могут быть больны. Неприятные ощущения в области живота, тошнота и изжога, нарушения пищеварения – для некоторых это привычные вещи. Поэтому обратиться к специалисту за консультацией или пройти обследование по поводу этих симптомов не приходит в голову большинству из нас. В настоящее время гастрит, пожалуй, можно назвать заболеванием века: в лёгкой или тяжёлой форме им страдают как взрослые, так и дети.
В народе укрепилось мнение, что гастрит может быть вызван нарушениями в питании или возникнуть из-за стресса. На самом деле это не соответствует действительности. Основной причиной гастрита является наличие у человека бактерии Хеликобактер пилори (Helicobacter pylori).
Присутствие этого вовсе не безобидного микроорганизма в слизистой оболочке приводит к её повреждению. Вырабатываемые бактерией вещества вызывают растворение защитной слизи желудка, в результате чего соляная кислота и пепсин получают непосредственный доступ к оголённой слизистой желудка и начинают её разъедать, вызывая химический ожог, воспаление и изъязвление слизистой1.
Вызванный инфекцией Хеликобактер пилори хронический гастрит служит патологическим фоном, на котором возникают такие серьёзные заболевания, как язвенная болезнь желудка и двенадцатиперстной кишки, а также рак желудка2.
Итак, гастрит – болезнь, лечением которой не стоит пренебрегать. Проявляться она может по-разному, что обусловлено её различными видами. Выделяют острый и хронический гастрит. При остром гастрите основными симптомами являются боли в желудке, которые часто сопровождаются тошнотой, рвотой, вздутием живота и диареей. При грамотном лечении и правильном питании острый гастрит заканчивается полным выздоровлением человека, однако, если симптомы игнорировать, то в дальнейшем может наступить затяжное течение недуга, а именно – хронический гастрит. И это уже повод для серьёзного беспокойства, так как без проведения должной терапии многие страдают хроническим гастритом на протяжении практически всей жизни, зачастую испытывая дискомфорт после каждого приёма пищи. Терпеть желудочные боли и другие сопутствующие неприятные ощущения нельзя! Необходимо обратиться за помощью к специалисту и пройти курс лечения, дабы избежать серьёзных осложнений, так как существуют факторы риска развития рака желудка, связанные с бактерией Хеликобактер пилори и хроническим гастритом. И если вы уже заболели, чтобы не усугубить своё состояние, стоит придерживаться некоторых правил. В первую очередь важно соблюдать правильное и сбалансированное питание. В вашем рационе должны присутствовать каши, супы, нежирные сорта мяса, фрукты, овощи. И, напротив, воздержитесь от сладких газированных напитков, шоколада, сосисок и колбас, чипсов и жирных сортов мяса.
В лечении гастрита нужно руководствоваться принципом комплексности. И, помимо диеты, необходимо бороться с бактерией Хеликобактер пилори. А она очень коварна: отлично чувствует себя в кислой среде желудка, где другие известные микробы просто не выживают.
Справиться с бактерией при лечении желудка может помочь препарат Де-Нол® в составе комплексной схемы, которую вам назначит врач. Это средство оказывает бактерицидное действие в отношении Хеликобактер пилори. Де-Нол® также обладает противовоспалительным и вяжущим действием, образуя защитную плёнку на поверхности язв и эрозий. Препарат способствует заживлению слизистой оболочки желудка, повышая её устойчивость к агрессивному воздействию соляной кислоты, ферментов и желчных кислот3.
Де-Нол® не является антибиотиком, а это значит, что устойчивость бактерии Хеликобактер пилори (Helicobacter pylori) к препарату не развивается4.
Правильное питание, отсутствие вредных факторов в виде стрессов и употреблении непроверенных, а порой только усугубляющих состояние лекарств, поможет в терапевтических целях при борьбе с недугом. Назначение специалистом особых медикаментов также приведёт к положительному результату. И одним из таких препаратов является Де-Нол®.
Это оригинальный*, запатентованный препарат, имеющий сложное технологическое производство и прошедший весь цикл клинических исследований, в отличие от дженериков.
За 30 лет применения в России Де-Нол® заслужил доверие миллионов людей. Оригинальное качество препарата сделало его надёжным помощником в борьбе с бактерией Хеликобактер пилори.
* C 01 июля 2015 года референтный лекарственный препарат – лекарственный препарат, который впервые зарегистрирован в Российской Федерации, качество, эффективность и безопасность которого доказаны на основании результатов доклинических исследований лекарственных средств и клинических исследований лекарственных препаратов, проведенных в соответствии с требованиями части 3 статьи 18 Федерального закона «Об обращении лекарственных средств», и который используется для оценки биоэквивалентности или терапевтической эквивалентности, качества, эффективности и безопасности воспроизведенного или биоаналогового (биоподобного) лекарственного препарата (п.11 ст. 4 ФЗ “Об обращении лекарственных средств”).
Источники:
1. Свободная энциклопедия “Википедия” https://ru.wikipedia.org/wiki/Helicobacter_pylori
2. Сайт Гастрит.ру http://gastrit.ru/Helicobacter/
3. Инструкция по медицинскому применению препарата Де-Нол® (П N012626/01- 20.11.2012)
4. Исаков В.А., Домарадский И.В. Хеликобактериоз. Медпрактика-М. Москва, 2003, стр. 342-356
Таблетки Де-Нол®, РУ № П N012626/01 от 23.08.2010
АО “Астеллас Фарма”, 109147, Москва, ул. Марксистская, д. 16., Тел. +7(495) 737-07-56.
Имеются противопоказания, перед применением необходимо ознакомиться с инструкцией или получить консультацию специалиста.
На правах рекламы.
Хеликобактер пилори: лечиться или нет? 👩🔬
Гастроэнтерологи всего мира уже сошлись во мнении, что бороться с хеликобактер с тем же размахом, как эпидемиологи в своё время боролись с оспой, неразумно. Чтобы полностью сжить со света эту бактерию, антибиотики придётся прописывать каждому второму.
В итоге, как полагает медицинское сообщество, мы получим множество случаев заболевания псевдомембранозным колитом — острым воспалением толстой кишки из-за приёма антибиотиков, а зловредную хеликобактер не изведём. Ведь у всех бактерий есть свойство мутировать, борясь за выживание.
В каких случаях нужно бороться с бактерией хеликобактер?
Споры от том, «лечить или не лечить», «выявлять или не выявлять», кипят так долго, что в итоге появился так называемый Маастрихтский консенсус. Это рекомендации врачей, выработанные на консилиуме по вопросам борьбы с бактерией.
Первая встреча медиков состоялась в городе Маастрихт, отсюда название свода рекомендаций на основе лабораторных исследований, которые регулярно обновляются. На сегодняшний день издано четыре консенсуса.
Выводы медиков, сделанные в свете последних научных знаний о хеликобактер пилори:
- Лечение требуется при язве двенадцатиперстной кишки или желудка.
- Антибактериальная терапия назначается ближайшим родственникам пациентов с раком желудка.
- Эрадикация или полное уничтожение рекомендована при атрофическом гастрите. Именно он считается предраковым заболеванием, а отнюдь не язва желудка.
- Нужно лечение, если выявлена железодефицитная анемия. Впрочем, сначала врачам потребуется выяснить: пациент теряет железо или оно не всасывается из-за бактерии.
Всё, что перечислено выше, относится к случаям, когда бактерия уже выявлена. Однако перед медиками стоит и ещё один вопрос: нужно ли искать хеликобактер у всех людей подряд? Ответ, который чаще всего дают гастроэнтерологи: скорее нет, чем да. Список примерных кандидатов на анализ у специалистов уже есть.
Когда следует искать бактерию хеликобактер
- От болей в желудке не помогают ингибиторы протонной помпы — препараты, снижающие агрессивность желудочного сока.
- Наряду с утомляемостью появляется железодефицит — первый признак рака желудка.
- Пациент входит в группу риска: родственники болели раком желудка.
- Во время исследования выявлены дисплазия желудка, кишечная метаплазия или атрофический гастрит.
В рамках диспансеризации, даже если нет жалоб на боли в верхней части живота, можно раз в 7 лет делать гастроскопию и биопсию с целью выявления бактерии.
Схема эрадикации хеликобактер пилори
- 1–2 недели пациент получает комплексную медикаментозную терапию: ингибиторы протонной помпы, препараты висмута, антибиотики. Врач должен назначить и препараты, которые восполнят дефицит полезных микроорганизмов в желудке и кишечнике после приёма антибиотиков. Популярные средства: «Де-Нол», амоксициллин, «Флемоксин»; кларитромицин; азитромицин; тетрациклин; левофлоксацин.
- Больной повторно сдаёт анализы. Если бактерия осталась, через 5–6 недель врач снова назначает курс лечения, но уже с другими антибиотиками.
- Если после второго этапа лечения тест на хеликобактер снова окажется положительным, методика лечения выбирается в индивидуальном порядке.
Какие продукты следует исключить из рациона, если выявлена бактерия хеликобактер
- макароны;
- картофель;
- сладости;
- выпечка.
[СРАВНИТЕЛЬНОЕ ИЗУЧЕНИЕ ДЕ-НОЛА И НОВОБИСМОЛА В РЕЖИМАХ ЭРАДИКАЦИИ У БОЛЬНЫХ H. PYLORI – СВЯЗАННЫМИ ЗАБОЛЕВАНИЯМИ]
Цели: Целью данного исследования является оценка эффективности и безопасности усиленной эрадикационной терапии H. pylori.
Методы: В течение 2013-2014 гг. Обследовано 40 амбулаторных больных.В исследование были включены мужчины и женщины 18-65 лет. Путем рандомизированного выбора они были разделены на 2 группы (по 20 пациентов в каждой группе). Пациенты получали усиленную эрадикационную терапию H. pylori: ИПП (40 мг / каждые 12 часов), кларитромицин (500 мг / каждые 12 часов), амоксициллин (1000 мг / каждые 12 часов), субцитрат висмута (240 мг / каждые 12 часов) в течение 10 дней. Первой группе назначали субцитрат висмута – Де-Нол, второй группе – новобисмол. Эрадикация была подтверждена дыхательным тестом с 13C-мочевиной и тестом на моноклональный антиген стула через 6-8 недель после терапии.
Полученные результаты: Эрадикационное лечение прошли 34 пациента. Два пациента были потеряны для последующего наблюдения (по одному пациенту в каждой группе), четыре пациента (два пациента в каждой группе) не завершили лечение из-за нежелательных явлений. Показатели эрадикации составили 97,1% (95% ДИ, 88,9–100,0%) по протоколу (PP) и 82,5% (95% ДИ, 69,4–92,5%) по назначению лечения (ITT) в двух случаях. группы.ITT-анализ показал частоту 85% (95% ДИ, 66,5-96,9) для 10-дневной усиленной терапии ДеНолом и 80% (95% ДИ: 60,2-94,1) для 10-дневной усиленной терапии Новобисмолом ( P = 0,68), в то время как анализ PP дал 100% (95% ДИ, 94,5–100,0) и 94,1% (95% ДИ: 78,3–99,9), соответственно (P = 0,31).
Заключение: Усиленная терапия эрадикации H. pylori (10-дневная стандартная тройная терапия, содержащая ИПП с высоким содержанием висмута) позволяет достичь значительно высоких показателей эрадикации у пациентов с H.pylori – ассоциированные заболевания. Оба препарата (Де-Нол и Новобисмол) эффективны и безопасны для первой линии эрадикации H. pylori.
Лекарственные взаимодействия ДЭ-НОЛ и омепразола
В этом отчете показаны возможные лекарственные взаимодействия для следующих 2 препаратов:
- DE-NOL (калий субцитрат висмута)
- омепразол
Редактировать список (добавлять / удалять препараты)
Взаимодействие между вашими наркотиками
Не было обнаружено взаимодействий между DE-NOL и омепразолом.Это не обязательно означает, что никаких взаимодействий не существует. Всегда консультируйтесь со своим врачом.
DE-NOL
В общей сложности 7 препаратов известны взаимодействием с DE-NOL.
омепразол
В общей сложности 196 наркотиков известны взаимодействием с омепразол.
Взаимодействие с лекарствами и пищевыми продуктами
Взаимодействий не обнаружено. Это не обязательно означает, что никаких взаимодействий не существует.Всегда консультируйтесь со своим врачом.
Предупреждения о терапевтическом дублировании
Для выбранных вами препаратов предупреждений не обнаружено.
Предупреждения о терапевтическом дублировании возвращаются только тогда, когда количество препаратов в одной группе превышает рекомендованный максимум терапевтического дублирования.
Классификация лекарственного взаимодействия
| Major | Очень клинически значимо. Избегайте комбинаций; риск взаимодействия перевешивает пользу. |
|---|---|
| Умеренная | Умеренно клинически значимо. Обычно избегают комбинаций; используйте его только при особых обстоятельствах. |
| Незначительный | Минимально клинически значимое. Минимизировать риск; оценить риск и рассмотреть альтернативный препарат, предпринять шаги, чтобы избежать риска взаимодействия и / или разработать план мониторинга. |
| Неизвестно | Информация о взаимодействии отсутствует. |
Дополнительная информация
Всегда консультируйтесь со своим врачом, чтобы убедиться, что информация, отображаемая на этой странице, применима к вашим личным обстоятельствам.
Заявление об ограничении ответственности за медицинское обслуживание
Лечение язвы желудка с помощью гастропротекторного против антисекреторного лечения
Lanzon-Miller S, Pounder S, Hamilton MR: 24-часовая внутрижелудочная кислотность и концентрация гастрина в плазме у здоровых субъектов и у пациентов с язвой двенадцатиперстной кишки или желудка или пагубная анемия.Aliment Pharmacol Ther 1: 225–227, 1987
PubMed Google Scholar
Johnsons HD: классификация язвы желудка, характеристики групп крови, паттерны секреции и патогенез. Ann Surg 162: 996–1004, 1965
PubMed Google Scholar
Wormsley KG, Grossman MJ: Максимальный гистологический тест у контрольных субъектов и пациентов с язвенной болезнью. Gut 6: 427–435, 1965
PubMed Google Scholar
Сиппонен П., Варис К., Фраки О, Корри Ю.М., Сеппала К., Сирала М. Гастрит предшествует симптоматической язве двенадцатиперстной кишки и желудка. 10-летнее наблюдение 454 амбулаторных больных с гастритом или без него. Сканд Дж. Гастроэнтерол 25: 960–973, 1990
Google Scholar
Tytgat GNJ: Приспосабливается ли желудок к Helicobacter pylori? Scand J Gastroenterol 27 (приложение 193): 28–32, 1992
Google Scholar
Yeomans ND: Бактерии в патогенезе язвы. Baillere’s Clin Gastroenterol 2: 573–591, 1988
Google Scholar
Асад Р.Т., Тедеско Ф.Дж., Хардун Р.Д., Браунштейн Р.Э .: Пролиферация антрального эпителия у пациентов с язвой желудка. Гастроэнтерология 82: 1010–1015, 1982
Google Scholar
Szabo S: Механизмы повреждения слизистой оболочки желудка и двенадцатиперстной кишки – анализ временной последовательности морфологических, функциональных, биохимических и гистохимических исследований.Scand J Gastroenterol 22 (приложение 127): 21–28, 1987
Google Scholar
Halter F, Eigenmann F, Schürer-Maly C-C, Flogerzi B, Yarga L, Inauen W: Гастрин: защита слизистой оболочки и заживление язв. Механизмы заживления язвенной болезни. Дордрехт, Kluwer Academic Publishers, 1991, стр 83–91
Google Scholar
Марка ИН: Современная терапия язвенной болезни. Наркотики 20: 283–299, 1980
PubMed Google Scholar
Tytgat GNJ: Коллоидный субцитрат висмута при язвенной болезни. South Afr Med J 70: 31–33, 1986
Google Scholar
Koelz HR: Защитные препараты в лечении гастродуоденальной болезни. Scand J Gastroenterol 21 (доп. 125): 156–163, 1986
Google Scholar
Маршалл Б. Дж., Уоррен Дж. Р., Фрэнсис Дж. Дж .: Экспресс-тест уреазы при лечении гастрита, ассоциированного с Campylobacter pyloridis .Am J Gastroenterol 82: 200–210, 1987
PubMed Google Scholar
Konturek SJ, Radecki T, Piastuski I., Brzozowski T, Brozdowicz D: Гастропротекция коллоидным субцитратом висмута (Де-Нол) и сукральфатом. Роль эндогенных простагландинов. Gut 28: 201–205, 1987
PubMed Google Scholar
Бьянки-Порро Б., Лаццарони М., Паренте Ф., Петрилло М.: Влияние коллоидного субцитрата висмута на рецидив язвы двенадцатиперстной кишки.Scand J Gastroenterol 21 (прил. 122): 35–38, 1988
Google Scholar
Lam SK, Lee NW, Koo J, Hui WM, Fok KH, Ng M: рандомизированное перекрестное испытание трикалиевого дицитратовисмутата и циметидина в высоких дозах для язв двенадцатиперстной кишки, устойчивых к стандартным дозам циметидина. Gut 25: 703–706, 1984
PubMed Google Scholar
Миллер Дж. Ф., Фарагер Э. Б.: Рецидивы язвы двенадцатиперстной кишки: Имеет ли значение, какой препарат используется при начальном лечении? Br Med J 293: 1117–1118, 1986 (редакционная статья)
Google Scholar
Martin DF, Hollander D, May SJ, Ravenscroft M, Tweedle DEF, Miller JP: Разница в частоте рецидивов заживления язвы двенадцатиперстной кишки с помощью циметидина или диэтратовисмутата калия. Ланцет 1: 7–10, 1981
PubMed Google Scholar
Pounder R: Антагонисты рецепторов гистамина H 2 . Baillere’s Clin Gastroenterol 2: 593–608, 1988
Google Scholar
Howden CW, Jones DB, Peace KE: Лечение язвы желудка антисекреторными препаратами: зависимость фармакологического эффекта от скорости заживления. Dig Dis Sci 33: 619–624, 1988
PubMed Google Scholar
Waklan A, Bader JR, Classen M, Lamers CBHW, Piper DW, Rutgersson K: Омепразол и ранитидин в лечении доброкачественной язвы желудка: международное многоцентровое исследование. Кишечник 28: A1340, 1987
Google Scholar
Classen M, Damman HG: Abheilungsraten nach Omeprazole und Ranitidine-Behandlung des Ulcus ventriculi. Dtsche Med Wochenschr 110: 628–633, 1985
Google Scholar
Барбара Л., Саджоре А., Оссо Дж., Систернио М., Франчески М.: Омепразол 120 мг ом и ранитидин 150 мг 2 раза в день в лечении доброкачественных язв желудка – итальянское многоцентровое исследование. Кишечник 28: A1341, 1987
Google Scholar
Исследование для оценки эффективности и безопасности трикалия дицитрата висмута (Де-Нола) в сочетании с монотерапией пантопразолом и пантопразолом при лечении пациентов с гастропатией, индуцированной нестероидными противовоспалительными препаратами (НПВП) – Просмотр полного текста
Модифицированная шкала Ланза 0–2 балла (включительно) должна рассматриваться как полное выздоровление
Модифицированная шкала Ланза 0–2 балла (включительно) должна рассматриваться как полное выздоровление
Субъекты, достигшие полного заживления язв желудка и эрозий, вызванных НПВП, к визиту 2 также должны быть проанализированы
Субъекты, достигшие полного заживления язв желудка и эрозий, вызванных НПВП, к 2-му визиту также должны быть проанализированы. субъекты, достигшие полного выздоровления от гастропатии, вызванной НПВП, у субъектов с гастропатией, вызванной НПВП, с модифицированной шкалой Ланца, большей или равной 5 и <7 при скрининге в каждой группе лечения на неделе 2 [Временные рамки: неделя 2]
Модифицированная шкала Ланца используется для оценки степени гастрита.Модифицированная шкала Ланца 0–2 балла (включительно) должна рассматриваться как полное выздоровление.
Для оценки степени гастрита используют модифицированную шкалу Ланца. Модифицированная шкала Ланца 0-2 балла (включительно) должна рассматриваться как полное излечение
Модифицированная шкала Ланца используется для оценки степени гастрита.Модифицированная шкала Ланза 0–2 балла (включительно) считается полным заживлением. Субъекты, достигшие полного заживления язв и эрозий желудка, вызванных НПВП, к визиту 2 также должны быть проанализированы. каждая группа лечения на 4-й неделе [Временные рамки: 4-я неделя]
Для оценки степени гастрита используют модифицированную шкалу Ланца.Модифицированная шкала Ланза 0–2 балла (включительно) считается полным заживлением. Субъекты, достигшие полного заживления язв и эрозий желудка, вызванных НПВП, к визиту 2 также должны быть проанализированы.
Субъекты достижение полного заживления язв и эрозий желудка, вызванных НПВП, к визиту 2 также необходимо проанализировать
Модифицированная шкала Lanza используется для оценки степени гастрита
Модифицированная шкала Lanza используется для оценки степени гастрита
Модифицированная шкала Ланца используется для оценки степени гастрита
Модифицированная шкала Lanza используется для оценки степени гастрита
Модифицированная шкала Ланца используется для оценки степени гастрита
Шкала оценки желудочно-кишечных симптомов (GSRS). GSRS содержит список вопросов о самочувствии субъекта в период с момента последнего посещения субъектом исследовательского центра
Шкала оценки желудочно-кишечных симптомов (GSRS). GSRS содержит список вопросов о самочувствии субъекта в период с момента последнего посещения объекта исследования местом исследования
GSRS содержит список вопросов о самочувствии субъекта в период с момента последнего посещения субъектом места исследования.Модифицированная шкала Lanza используется для оценки степени гастрита
GSRS содержит список вопросов о самочувствии субъекта в период с момента последнего посещения субъектом места исследования. Для оценки степени гастрита используется модифицированная шкала Lanza.
GSRS содержит список вопросы о самочувствии субъекта в период с момента последнего посещения субъектом исследовательского центра
НЯ определяется как любое Неблагоприятное медицинское происшествие у субъекта, которому вводили исследуемый препарат или который прошел процедуры исследования и который не обязательно имеет причинно-следственную связь с этим лечением
Неблагоприятное событие (НЯ) считается «серьезным», если исследователь или спонсор рассматривают любой из следующих исходов: смерть, угроза жизни, стойкая или значительная инвалидность / вкл. дееспособность, врожденная аномалия или врожденный дефект, госпитализация или важные с медицинской точки зрения события
Число участников с потенциально клинически значимыми значения физического осмотра
Число участников с потенциально клинически значимыми значениями показателей жизненно важных функций
Во время эзофагогастродуоденоскопии необходимо оценить количество содержимого желудка и его характер (слизь, желчь, кровь), состояние слизистой оболочки желудка (отек, гиперемия, эрозии, кровоизлияния в слизистую, атрофия, гипертрофия).
Количество участников с потенциально клинически значимыми лабораторными значениями
Цитрат висмута – обзор
Схемы ликвидации Helicobacter Pylori
[SEDA-33, 749]Эзомепразол + тетрациклин + субцитрат висмута + метронидазол или амоксициллин В рандомизированном контролируемом исследовании участвовало 120 пациентов, которым не удалось пройти первую линию H.pylori , получали эзомепразол 40 мг 2 раза в день, тетрациклин 500 мг 1 раз в день, субцитрат висмута 120 мг 1 раз в день и либо метронидазол 250 мг 1 раз в день, либо амоксициллин 500 мг 1 раз в день в течение 1 недели; последнее было связано с более низкой частотой нежелательных явлений (19% против 44%), особенно тошноты, анорексии и головной боли [61 C ].
Лансопразол + амоксициллин + кларитромицин или метронидазол + тетрациклин В рандомизированном открытом исследовании 138 пациентов принимали лансопразол 30 мг 2 раза в день, амоксициллин 1 г 2 раза в день и кларитромицин 500 мг 2 раза в день в течение 14 дней и 144 принимали лансопразол 30 мг 2 раза в день в течение 14 дней. 1 г 2 раза в день в течение 7 дней, затем метронидазол 500 мг 2 раза в день, тетрациклин 500 мг 1 раз в день и лансопразол 30 мг 2 раза в день в течение еще 7 дней.Частота нежелательных явлений в первой группе была значительно выше (25% против 15%), в частности металлического привкуса , афтозных поражений языка (9,4% против 1,4%) и диареи (7,2% против 3,7%). %) [62 c ].
Лансопразол + моксифлоксацин + тетрациклин В открытом исследовании 56 пациентов принимали лансопразол 30 мг 2 раза в день, моксифлоксацин 400 мг / день и тетрациклин 500 мг 1 раз в день, а затем лансопразол 30 мг / день в течение следующих 30 дней [63 c ].Отмечена высокая частота нежелательных явлений, включая тошноту (75%), рвоту (52%), боль в эпигастрии (73%), диарею (3,6%), нарушение вкуса (46%). ), запор (8,9%), головная боль (32%), кожный зуд (11%) и высыпаний (1,8%).
Омепразол + амоксициллин + кларитромицин + левофлоксацин или левофлоксацин + рифаксимин В двойном слепом рандомизированном исследовании 268 пациентов принимали одну из трех схем: омепразол 20 мг, амоксициллин 1 г и кларитромицин 500 мг два раза в день. омепразол 20 мг, амоксициллин 1 г и левофлоксацин 200 мг два раза в день в течение 7 дней; омепразол 20 мг, амоксициллин 1 г, левофлоксацин 200 мг и рифаксимин 400 мг два раза в день в течение 7 дней [64 C ].Частота умеренных и тяжелых побочных реакций была значительно выше в первой группе (32%, 20% и 9,9% соответственно). В частности, наиболее частыми жалобами были диарея, (17%, 12% и 3,3%) и изменений вкуса (7,8%, 1,1% и 2,2%).
Пантопразол + метронидазол + тетрациклин + субцитрат висмута В рандомизированном открытом исследовании 417 пациентов принимали пантопразол 20 мг, тетрациклин 500 мг, метронидазол 500 мг и субцитрат висмута в капсулах по 240 мг два раза в день в течение 10 или 14 дней.Побочные реакции в группах были обычно легкими и сходными; однако утомляемость , дискомфорт и рвота чаще встречались у тех, кто лечился в течение 14 дней [65 c ].
De-noltab (снято с производства в Великобритании)
Для чего это используется?
- Лечение язвы желудка и двенадцатиперстной кишки (язвенной болезни).
Как это работает?
Таблетки Де-нолтаб содержат активный ингредиент трикалия дицитратобисмутат, который представляет собой соединение, содержащее висмут.Он используется для облегчения заживления язв желудка и кишечника (пептических язв).
Лекарство действует, образуя защитный барьер над язвой. Это защищает язву от желудочного сока и дает время на заживление.
Лекарство также помогает убить в желудке вид бактерий, называемых Helicobacter pylori. Эти бактерии могут способствовать образованию язвенной болезни.
Это лекарство можно назначать в сочетании с антибиотиками и ингибитором протонной помпы (например, омепразолом), чтобы помочь уничтожить Helicobacter pylori из желудка.Это лекарство обычно используется только в том случае, если схемы лечения антибиотиками первой линии и ингибиторами протонной помпы не смогли уничтожить эти бактерии.
Предупреждение!
- Вы не должны принимать какие-либо другие лекарства, пищу или напитки, в частности антациды, молоко, фрукты или фруктовые соки, в течение получаса до или после приема препарата Де-нолтаб, поскольку они могут повлиять на его действие.
- Продолжительность одного курса лечения этим лекарством не должна превышать двух месяцев. Это лекарство не следует принимать постоянно, чтобы предотвратить язвы.
Используйте с осторожностью в
- Снижение функции почек.
- Люди на диете с низким содержанием калия.
Не использовать в
- Сильно сниженная функция почек.
- Беременность.
- Это лекарство не рекомендуется детям.
Это лекарство не следует использовать, если у вас аллергия на один или любой из его ингредиентов. Пожалуйста, сообщите своему врачу или фармацевту, если вы ранее испытывали такую аллергию.
Если вы чувствуете, что у вас возникла аллергическая реакция, прекратите использование этого лекарства и немедленно сообщите об этом своему врачу или фармацевту.
Беременность и кормление грудью
Некоторые лекарства нельзя применять во время беременности или кормления грудью. Однако другие лекарства можно безопасно использовать во время беременности или грудного вскармливания, при этом польза для матери перевешивает риски для будущего ребенка. Всегда сообщайте своему врачу, если вы беременны или планируете беременность, прежде чем принимать какие-либо лекарства.
- Безопасность препарата при беременности не установлена. Поэтому производитель рекомендует избегать этого во время беременности. Обратитесь за медицинской помощью к своему врачу.
- Неизвестно, попадает ли это лекарство в грудное молоко. Если вы кормите грудью, посоветуйтесь с врачом, прежде чем принимать это лекарство.
Побочные эффекты
Лекарства и их возможные побочные эффекты могут влиять на отдельных людей по-разному.Ниже приведены некоторые из побочных эффектов, которые, как известно, связаны с этим лекарством. Тот факт, что здесь указывается побочный эффект, не означает, что все люди, принимающие это лекарство, испытают этот или какой-либо побочный эффект.
Обычный (затрагивает от 1 из 10 до 1 из 100 человек)
- Почернение стула (фекалий) или потемнение языка. Это нормально, беспокоиться не о чем, оно исчезнет, когда вы прекратите лечение.
Нечасто (затрагивает от 1 из 100 до 1 из 1000 человек)
- Чувство тошноты и рвота.
- Запор.
- Диарея.
- Сыпь.
- Зуд.
Перечисленные выше побочные эффекты могут не включать все побочные эффекты, о которых сообщает производитель лекарства.
Для получения дополнительной информации о любых других возможных рисках, связанных с этим лекарством, прочтите информацию, прилагаемую к лекарству, или проконсультируйтесь со своим врачом или фармацевтом.
Как это лекарство может повлиять на другие лекарства?
Перед тем, как начать лечение этим лекарством, важно сообщить своему врачу или фармацевту, какие лекарства вы уже принимаете, в том числе купленные без рецепта, и лекарственные травы.Точно так же посоветуйтесь со своим врачом или фармацевтом, прежде чем принимать какие-либо новые лекарства во время приема этого, чтобы убедиться, что комбинация безопасна.
Вы не должны принимать какие-либо другие лекарства в течение получаса до или после приема этого лекарства, так как они могут повлиять на его действие.
Это лекарство может уменьшить всасывание антибиотиков тетрациклинового ряда из кишечника, что может сделать их менее эффективными. Если вам прописали с этим лекарством антибиотик тетрациклинового ряда, вам следует попытаться разделить каждую дозу этих двух лекарств как минимум на два часа, чтобы свести к минимуму эту проблему.Спросите совета у фармацевта.
Пока вы принимаете это лекарство, не рекомендуется принимать какие-либо другие лекарства, содержащие висмут.
Другие лекарственные средства, содержащие то же действующее вещество
В настоящее время в Великобритании нет других лекарств, содержащих трикалия дицитратобисмутат в качестве активного ингредиента.
Последнее обновление
Этот контент создается и поддерживается третьей стороной и импортируется на эту страницу, чтобы помочь пользователям указать свои адреса электронной почты.Вы можете найти больше информации об этом и подобном контенте на сайте piano.io.
Де-Нол таб п / в 120 мг пленка 112 шт.
Описание
Состав
Действующее вещество:
1 таблетка содержит: трикалия дицитратобисмутат висмута -304,6 мг, в пересчете на оксид висмута Bi2O3 -120 мг.
Вспомогательные вещества:
Кукурузный крахмал, повидон KZ0, полиакриллат калия, макрогол 6000, магния стеарат. оболочка: Opadry OY-S-7366, состоящая из гипромеллозы и макрогола 6000.№
Описание:
Таблетки круглой формы, двояковыпуклые, покрытые оболочкой кремово-белого цвета, с надписью «gbr 152 ″, с тиснением на одной стороне и графическим рисунком в виде квадрата со сломанными сторонами и скругленными углами с тиснением на другой.
Форма выпуска:
По 8 таблеток в блистере из алюминиевой фольги по 4,7 или 14 блистеров вместе с инструкцией по применению в картонной упаковке.
Противопоказания
Выраженное нарушение функции почек, беременность, период лактации, гиперчувствительность к препарату.
Дозировка
120 мг
Показания
Язва желудка и двенадцатиперстной кишки в фазе обострения, в том числе связанные с Helicobacter pylori.
Хронические гастриты и гастродуодениты в фазе обострения, в том числе связанные с Helicobacter pylori.
Синдром раздраженного кишечника, протекающий в основном с симптомами диареи.
Функциональная диспепсия не связана с органическим заболеванием желудочно-кишечного тракта.
Взаимодействие с другими лекарственными средствами
В течение получаса до и после приема Де Нол не подходит для применения в составе других препаратов, а также приема пищи и жидкости, в частности, антацидов, молока, фруктовых и фруктовых соков.Это связано с тем, что они при приеме внутрь могут влиять на эффективность Де Нола.
Передозировка
Передозировка лекарством, вызванная длительным приемом доз, превышающих рекомендованные, может вызвать почечную дисфункцию. Эти симптомы полностью обратимы при отмене Де-Нола.
При появлении симптомов отравления препаратом следует промыть желудок, использовать активированный уголь и солевые слабительные. В дальнейшем лечение должно быть симптоматическим. В случае нарушения функции почек, сопровождающегося повышенным уровнем висмута в плазме, возможно введение комплексообразователей – димеркаптоянтарную и димеркаптопропансульфоновую кислоту.В случае выраженного гемодиализа почек человека показан.
Фармакологическое действие
Фармакологическая группа:
Антисептик и вяжущее средство кишечное.
Фармакодинамика:
Противоязвенное средство с антибактериальной активностью в отношении Helicobacter pylori. Также обладает противовоспалительным и вяжущим действием. В кислой среде желудка выпадает в осадок нерастворимый оксихлорид висмута и хелатное соединение цитрата, образующее из белкового субстрата защитную пленку на поверхности язв и эрозий.За счет увеличения синтеза простагландина Е, секреции слизи и бикарбоната, стимулирует активность цитопротекторных механизмов, повышает сопротивляемость слизистой оболочки желудочно-кишечного тракта к действию пепсина, соляной кислоты, ферментов и солей желчных кислот. Приводит к накоплению эпидермального фактора роста в области дефекта. Снижает активность пепсина и пепсиногена.
Фармакокинетика:
Субцитрат висмута практически не абсорбируется из ЖКТ. Появляется в основном с калом.Незначительное количество висмута, поступившего с плазмой, выводится почками.
Условия отпуска из аптек
Без рецепта.
побочные эффекты
Со стороны пищеварительной системы: может вызывать тошноту, рвоту, учащение стула, запор. Эти явления не опасны для здоровья и носят временный характер. Аллергические реакции: кожная сыпь, кожный зуд.
При длительном применении в высоких дозах – энцефалопатия, связанная с накоплением висмута в ЦНС.
Особые указания
Препарат нельзя применять более 8 недель.Также не рекомендуется во время лечения превышать суточную дозу взрослым и детям. Во время лечения
Де нолом не следует применять другие препараты, содержащие висмут. По окончании курса лечения в рекомендуемых дозах концентрация действующего начала в плазме крови не превышает 3-58 г / л, а токсичность наблюдается только при концентрациях выше 100 г / л. №
При применении Де Нола возможно окрашивание кала в темный цвет из-за образования сульфида висмута.Иногда наблюдается небольшое потемнение языка.
Условия хранения
Хранить при температуре не выше 25 С.
Хранить в недоступном для детей месте.
Способ применения и дозы
Взрослым и детям старше 12 лет препарат назначают по 1 таблетке 4 раза в день за 30 минут до еды и перед сном или по 2 таблетки 2 раза в день за 30 минут до еды.
Детям от 8 до 12 лет препарат назначают по 1 таблетке 2 раза в день за 30 минут до еды.
Детям от 4 до 8 лет: в дозе 8 мг / кг / сут; суточная доза делится на 2 приема.Принимать за 3 минуты до еды.
Таблетки необходимо запить водой.
Продолжительность лечения 4-8 недель. В течение следующих 8 недель не следует применять препараты, содержащие висмут.
Для искоренения Helicobacter pylori целесообразно использовать Де-Нол в сочетании с другими антибактериальными средствами, обладающими активностью Helicobacter.

 pylori с помощью неинвазивного метода (желательно, дыхательного теста) у ребенка с жалобами на боли в животе (в сочетании с другими жалобами или без них) в течение более двух недель.
pylori с помощью неинвазивного метода (желательно, дыхательного теста) у ребенка с жалобами на боли в животе (в сочетании с другими жалобами или без них) в течение более двух недель. 13 United European Gastroenterology Week. Copenhagen, 2005.
13 United European Gastroenterology Week. Copenhagen, 2005. A. M., Dent J. C. Susceptibility of Campylobacter pylori to twenty-one antimicrobal agents // Eur. J. Clin. Microbiol. Infect.Dis., 1988, v. 7, p. 566–569.
A. M., Dent J. C. Susceptibility of Campylobacter pylori to twenty-one antimicrobal agents // Eur. J. Clin. Microbiol. Infect.Dis., 1988, v. 7, p. 566–569. , Burette A. Drug therapy of Helicobacter pylori infection: Problems and pitfalls // Amer. J. Gastroent., 1990, v. 85, p. 1545–1550.
, Burette A. Drug therapy of Helicobacter pylori infection: Problems and pitfalls // Amer. J. Gastroent., 1990, v. 85, p. 1545–1550. 2002. Vol. 16, № 7. P. 1277–1282.
2002. Vol. 16, № 7. P. 1277–1282. , Kist M., Strobel S. et al. Secondary resistance among 554 isolates of Helicobacter pylori after failure of therapy // Eur. J. Clin. Microbiol. Infect. Dis. 2000. Vol. 19, № 7. P. 538–541.
, Kist M., Strobel S. et al. Secondary resistance among 554 isolates of Helicobacter pylori after failure of therapy // Eur. J. Clin. Microbiol. Infect. Dis. 2000. Vol. 19, № 7. P. 538–541. 91, p. 84–93.
91, p. 84–93. Pylori
Pylori pylori,
pylori,