Дисбактериоз после антибиотиков: симптомы, причины, диагностика, лечение и профилактика
Антибиотик-ассоциированный дисбактериоз кишечника | Бельмер С.В.
Многочисленный микробиоценоз кишечника человека представлен более 500 видов микроорганизмов, причем в различных отделах желудочно–кишечного тракта количество их колеблется от 103 до 1012 КОЕ/мл. Наиболее многочисленными представителями микробного сообщества кишечника человека являются Bifidobacterium sp., E. coli, Lactobacillus sp., Bacterioides sp., анаэробные стрептококки, Clostridium sp. и многие другие. Микроорганизмы желудочно–кишечного тракта обеспечивает процессы переваривания и всасывания, трофику кишечника, антиинфекционную защиту, синтез витаминов и мн. др. Самыми многочисленными и наиболее хорошо изученными являются микроорганизмы толстой кишки, насчитывающие около 1012 КОЕ/мл.
Различные факторы внешней и внутренней среды могут существенно влиять на состав кишечной микрофлоры, что может не только нарушать нормальное течение физиологических процессов, но даже приводить к тяжелым патологическим состояниям.
Другими причинами возникновения дисбактериоза являются воспалительные заболевания слизистой оболочки кишечника как инфекционной, так и неинфекционной природы. Значительную роль среди неинфекционных факторов играют длительные функциональные расстройства желудочно–кишечного тракта, в том числе желчевыделительной системы, а также ферментопатии и аллергическое поражение слизистой оболочки кишечника. Сушественное изменение микрофлоры кишечника происходит под воздействием экологически неблагоприятных факторов внешней среды и стрессовых состояний организма: физических и психических перегрузках. Отмечено влияние возрастного фактора на микробиоценоз кишечника.
Комплекс патологических сдвигов в составе кишечной микрофлоры с соответствующими клиническими проявлениями, связанный с дисбактериозом, развившимся вследствие применения антибиотиков, в зарубежной литературе часто обозначают как антибиотик–ассоциированная диарея (antibiotic associated diarrhea). Исходя из наших представлений об этом процессе термин «антибиотик–ассоциированный дисбактериоз кишечника» можно считать более патогенетически обоснованным. Частота данного состояния, по данным различных авторов, колеблется от 5 до 39%. Естественно, что у этих пациентов практически всегда эндоскопически и гистологически можно выявить признаки колита, что делает обоснованным также термин «антибиотик–ассоциированный колит». Факторами риска его развития являются возраст пациента (младше 6 лет и старше 65 лет), сопутствующие заболевания органов пищеварения, а также снижение функции иммунной системы.
Исходя из наших представлений об этом процессе термин «антибиотик–ассоциированный дисбактериоз кишечника» можно считать более патогенетически обоснованным. Частота данного состояния, по данным различных авторов, колеблется от 5 до 39%. Естественно, что у этих пациентов практически всегда эндоскопически и гистологически можно выявить признаки колита, что делает обоснованным также термин «антибиотик–ассоциированный колит». Факторами риска его развития являются возраст пациента (младше 6 лет и старше 65 лет), сопутствующие заболевания органов пищеварения, а также снижение функции иммунной системы.
Большинство современных антибиотиков могут стать причиной кишечного дисбактериоза, хотя действие каждого из них имеет определенные особенности. В частности, ампициллин в значительной степени подавляет рост как аэробной, так и анаэробной микрофлоры, тогда как амоксициллин лишь минимально подавляя активность большинства нормальных кишечных микроорганизмов, способствует некоторому увеличению популяции представителей рода Enterobacteriacaea. Аналогично на микробиоценоз кишечника влияет комбинированный препарат амоксициллина и клавулановой кислоты. При этом большинство современных пенициллинов не способствуют размножению грибов и С. difficile. Пероральные цефподоксим, цефпрозил и цефтибутен определенно способствуют росту численности представителей рода Enterobacteriacaea в кишечнике, тогда как цефаклор и цефрадин практически не оказывают влияния на кишечную микрофлору, а применение цефиксима ведет к значительному снижению анаэробных микроорганизмов. Важно, что большинство цефалоспоринов способствует росту численности энтерококков и
Аналогично на микробиоценоз кишечника влияет комбинированный препарат амоксициллина и клавулановой кислоты. При этом большинство современных пенициллинов не способствуют размножению грибов и С. difficile. Пероральные цефподоксим, цефпрозил и цефтибутен определенно способствуют росту численности представителей рода Enterobacteriacaea в кишечнике, тогда как цефаклор и цефрадин практически не оказывают влияния на кишечную микрофлору, а применение цефиксима ведет к значительному снижению анаэробных микроорганизмов. Важно, что большинство цефалоспоринов способствует росту численности энтерококков и
Наиболее тяжелым и даже угрожающим жизни состоянием, связанным с антибиотик–ассоциированным дисбактериозом кишечника, является т.н. С. difficile–ассоциированный колит, вызванный избыточным размножением в кишечнике С. difficile. Последний в норме выявляют при бактериологическом исследовании у 1–3% здоровых лиц, но более чем у 20% пациентов, получающих антибактериальную терапию. У некоторых больных, на фоне угнетения нормальной флоры приемом антибиотиков происходит лавинообразный рост популяции С. difficile с изменением его токсигенных свойств, в т.ч. повышением синтеза энтеротоксина А и цитотоксина В. Результатом этого становится тяжелое поражение слизистой оболочки толстой кишки. Чаще всего С.difficile–ассоциированный колит развивается при применении клиндамицина или линкомицина, полусинтетических пенициллинов, реже – цефалоспоринов с широким спектром антибактериального действия. Наиболее тяжелой формой С. difficile–ассоциированного колита является псевдомембранозный колит, летальность при развитии которого достигает 30% [2,3,4].
difficile. Последний в норме выявляют при бактериологическом исследовании у 1–3% здоровых лиц, но более чем у 20% пациентов, получающих антибактериальную терапию. У некоторых больных, на фоне угнетения нормальной флоры приемом антибиотиков происходит лавинообразный рост популяции С. difficile с изменением его токсигенных свойств, в т.ч. повышением синтеза энтеротоксина А и цитотоксина В. Результатом этого становится тяжелое поражение слизистой оболочки толстой кишки. Чаще всего С.difficile–ассоциированный колит развивается при применении клиндамицина или линкомицина, полусинтетических пенициллинов, реже – цефалоспоринов с широким спектром антибактериального действия. Наиболее тяжелой формой С. difficile–ассоциированного колита является псевдомембранозный колит, летальность при развитии которого достигает 30% [2,3,4].
Типичными симптомами псевдомембранозного колита являются сильные боли в животе, подъем температуры до 40°С, частый (10–20 раз в сутки) жидкий стул с примесью слизи и крови.
Первый год жизни ребенка, и особенно первые его месяцы, являются наиболее уязвимыми с точки зрения развития любого дисбактериоза кишечника, в т.ч. антибиотик–ассоциированного. Это связано с тем, что в это время происходит первичное формирование кишечной микрофлоры, что в сочетании с незрелостью иммунной системы делает ее весьма неустойчивой по отношению ко многим экзогенным факторам.
Факторы, обеспечивающие благоприятные условия для формирования нормальной микрофлоры кишечника, способствуют профилактике антибиотик–ассоциированного дисбактериоза не только в этот возрастной период, но, в большей или меньшей степени, на протяжении дальнейшей жизни ребенка. Большое значение для становления кишечной микрофлоры имеет естественное вскармливание как за счет иммунологических факторов, присутствующих в женском молоке, так и в связи с наличием в молоке пребиотиков. Первое обстоятельство имеет значение в связи с относительной незрелостью иммунной системы новорожденного ребенка, в то время как заселение кишечника определенными видами микроорганизмов должно контролироваться как специфическими, так и неспецифическими механизмами. В частности, новорожденный ребенок может синтезировать в достаточном количестве только иммуноглобулины класса М, в то время как иммуноглобулины класса А в течение первого месяца жизни практически не образуются и поступают в желудочно–кишечный тракт младенца с молоком матери.
В женском молоке присутствуют также обеспечивающие рост и размножение нормальной кишечной микрофлоры нутриенты, получившие название «пребиотики». Пребиотики – это частично или полностью неперевариваемые компоненты пищи, которые избирательно стимулируют рост и/или метаболизм одной или нескольких групп микроорганизмов, обитающих в толстой кишке, обеспечивая нормальный состав кишечного микробиоценоза. Пребиотиками женского молока являются лактоза и олигосахариды. Последние до недавнего времени отсутствовали в смесях для искусственного вскармливания, однако в настоящее время активно в них вводятся, в частности, различные комбинации галакто– и фруктоолигосахаридов. Механизм действия всех пребиотиков един: не расщепляясь в тонкой кишке ферментными системами макроорганизма, они утилизируются микрофлорой, преимущественно, бифидо– и лактобактериями, обеспечивая их рост и активность.
Таким образом, становится очевидным, что многочисленные внешние факторы способны нарушить становление кишечной микрофлоры у новорожденного ребенка. Антибиотикотерапия, даже обоснованная, у детей первого года жизни может привести к тяжелому дисбактериозу кишечника, однако у детей более старшего возраста и даже у взрослых она может серьезно нарушить уже сформированный кишечный биоценоз.
В этой связи одной из проблем, возникших в последние годы, является развитие дисбактериоза кишечника на фоне эрадикации H. pylori. В состав антихеликобактерных схем в различных комбинациях могут входить различные антибактериальные препараты, такие как амоксициллин, макролиды (кларитромицин, рокситромицин, азитромицин), метронидазол, фуразолидон, субцитрат висмута, а также современные препараты, снижающие желудочную секрецию (блокаторы протонного насоса или блокаторы Н2–гистаминовых рецепторов), также способные, хотя и косвенно, снизить резистентность естественной кишечной микрофлоры. Многочисленные исследования свидетельствуют о необходимости включения в комплексную терапию хеликобактер–ассоциированных заболеваний верхних отделов пищеварительного тракта биопрепаратов, в частности, бифидум–содержащих, что позволяет уменьшить частоту развития и глубину выраженности дисбиотических изменений и, как следствие, уменьшить выраженность и длительность сохранения болевого абдоминального и диспепсического синдромов у детей [7].
Многочисленные исследования свидетельствуют о необходимости включения в комплексную терапию хеликобактер–ассоциированных заболеваний верхних отделов пищеварительного тракта биопрепаратов, в частности, бифидум–содержащих, что позволяет уменьшить частоту развития и глубину выраженности дисбиотических изменений и, как следствие, уменьшить выраженность и длительность сохранения болевого абдоминального и диспепсического синдромов у детей [7].
Профилактика и коррекция антибиотик–ассоциированного дисбактериоза кишечника является достаточно трудной задачей, особенно у детей первого года жизни, особенно, если антибактериальную терапию следует продолжать по жизненным показаниям. Основой профилактики дисбактериоза кишечника является рациональная антибиотикотерапия и исключение необоснованных случаев назначения антибактериальных средств. У детей первого года жизни важным фактором профилактики является сохранение грудного вскармливания или, при невозможности, использование смесей с пребиотиками. Обычно лечение включает следующие направления: снижение избыточного микробного обсеменения тонкой кишки и восстановление нормальной микрофлоры.
Обычно лечение включает следующие направления: снижение избыточного микробного обсеменения тонкой кишки и восстановление нормальной микрофлоры.
Для снижения микробного обсеменения тонкой кишки во взрослой практике принято использование антибиотиков и других антисептиков (нитрофуранов, налидиксовой кислоты). Но у детей раннего возраста при отсутствии клинических и лабораторных признаков энтероколита предпочтительно использование не антибиотиков, а препаратов, относящихся к группе пробиотиков. Это прежде всего споровые монокомпонентные пробиотики. Для детей старше 2 лет наиболее предпочтителен монокомпонентный пробиотик, содержащий дрожжевые грибы, – энтерол.
На втором этапе терапии основное внимание уделяется восстановлению нормальной микрофлоры. С этой целью используются как широко известные монокомпонентные (бифидумбактерин и др.), так и поликомпонентные (примадофилюс и др.) и комбинированные пробиотики. В некоторые поливалентные препараты наряду со штаммами бифидо– и лактобактерий включены штаммы энтерококков, обладающих высокой антагонистической активностью по отношению к условно–патогенным и патогенным возбудителям (Линекс). Это значительно повышает активность препаратов по сравнению с монокомпонентными пробиотиками.
Это значительно повышает активность препаратов по сравнению с монокомпонентными пробиотиками.
В лечении ассоциированного с антибиотиками дисбактериоза кишечника в настоящее время ключевое положение занимают пробиотики – препараты, содержащие микроорганизмы, которые оказывают положительное влияние на кишечный микробиоценоз. Основоположником концепции пробиотиков стал И.И. Мечников, удостоенный за серию работ в этом направлении Нобелевской премии в области медицины в 1908 г. В частности, он показал, что отдельные микроорганизмы способны угнетать рост холерного вибриона, а другие – наоборот, стимулировать. С тех пор было изучено большое количество микроорганизмов, которые могли бы найти применение в повседневной медицинской практике в составе пробиотических препаратов и продуктов питания, однако лишь немногие из них сегодня официально признаются таковыми. Основным критерием при этом является пробиотический эффект, доказанный в двойных слепых плацебо–контролируемых исследованиях. Этот «экзамен» прошли B. bifidum, Lactobacillus acidophilus, Lactobacillus GG, Lactobacillus fermentum, Strepto (Entero) coccus faecium SF68, S. termophilus, Saccharomyces boulardii. Перечисленные микроорганизмы входят в состав многочисленных препаратов, как монобактериальных, так и комбинированных. С другой стороны, микроорганизм с минимальными потерями должен преодолеть верхние отделы пищеварительного тракта, в связи с чем возникает необходимость размещения его в рН–чувствительной капсуле. Наконец, длительное сохранение микроорганизмов в процессе хранения обеспечивается их лиофилизацией.
bifidum, Lactobacillus acidophilus, Lactobacillus GG, Lactobacillus fermentum, Strepto (Entero) coccus faecium SF68, S. termophilus, Saccharomyces boulardii. Перечисленные микроорганизмы входят в состав многочисленных препаратов, как монобактериальных, так и комбинированных. С другой стороны, микроорганизм с минимальными потерями должен преодолеть верхние отделы пищеварительного тракта, в связи с чем возникает необходимость размещения его в рН–чувствительной капсуле. Наконец, длительное сохранение микроорганизмов в процессе хранения обеспечивается их лиофилизацией.
Препаратом, который соответствует перечисленным выше требованиям, является Линекс, представляющий собой комплекс 3–х живых лиофилизированных бактерий Bifidobacterium infantis v.liberorum, Lactobacillus acidophilus и Streptococcus faecium в количестве не менее 1,2х107. Важной особенностью микроорганизмов, входящих в состав Линекса, является их устойчивость к антибиотикам и химиотерапевтическим средствам, резистентность к пенициллинам, в т. ч. полусинтетическим, макролидам, цефалоспоринам, фторхинолонам и тетрациклинам. Это обстоятельство позволяет применять Линекс при необходимости в комбинации с антибиотиками с целью профилактики дисбактериоза. Перечисленные особенности позволяют выделить Линекс в ряду препаратов для коррекции дисбактериоза кишечника различного происхождения.
ч. полусинтетическим, макролидам, цефалоспоринам, фторхинолонам и тетрациклинам. Это обстоятельство позволяет применять Линекс при необходимости в комбинации с антибиотиками с целью профилактики дисбактериоза. Перечисленные особенности позволяют выделить Линекс в ряду препаратов для коррекции дисбактериоза кишечника различного происхождения.
Нами был проведен анализ результатов коррекции антибиотик–ассоциированного дисбактериоза кишечника препаратом Линекс у 8 детей в возрасте от 6 до 12 мес (1–я группа) и 19 детей в возрасте от 1 года до 5 лет (2–я группа), у которых развитие дисбактериоза кишечника можно было связать с применением пероральных антибиотиков из группы пенициллинов и цефалоспоринов в возрастных дозировках. Назначение этих препаратов было связано с лечением острых заболеваний органов дыхания. Во всех случаях на фоне приема антибиотика в конце курса отмечалось учащение стула (до 8 раз в сутки), который имел кашицеобразный или жидкий характер и содержал примеси слизи и зелени. Общее состояние ребенка во всех случаях определялось характером основного патологического процесса, а неустойчивый стул сохранялся и после его купирования. В связи с нарушением стула дети обследовались в сроки от нескольких дней до 2 недель от момента появления кишечных нарушений. При бактериологическом исследовании фекалий у всех был выявлен дисбактериоз кишечника, общей характеристикой которого было значительно снижение бифидо– и лактофлоры. С целью его коррекции дети получали по 1 капсуле препарата Линекс 2 раза в день. Клиническое улучшение (нормализация стула) наблюдалось у 6 детей из 1–й группы и 14 детей из 2–й группы в течение 7 дней, у 7 детей из 1–й группы и 16 детей из 2–й группы в течение 14 дней, у 17 детей из 2–й группы в течение 21 дня. За указанный срок у 1 ребенка из 1–й группы и у 2 детей из 2–й группы стул не нормализовался полностью, оставаясь кашицеобразным, хотя примеси слизи и зелени исчезли. Через 21 день микробиологическое улучшение было отмечено у всех детей, хотя нормализация показателей количества бифидо– и лактобактерий отмечалась только в половине случаев (у 5 детей из 1–й группы и 10 детей из 2–й группы).
Общее состояние ребенка во всех случаях определялось характером основного патологического процесса, а неустойчивый стул сохранялся и после его купирования. В связи с нарушением стула дети обследовались в сроки от нескольких дней до 2 недель от момента появления кишечных нарушений. При бактериологическом исследовании фекалий у всех был выявлен дисбактериоз кишечника, общей характеристикой которого было значительно снижение бифидо– и лактофлоры. С целью его коррекции дети получали по 1 капсуле препарата Линекс 2 раза в день. Клиническое улучшение (нормализация стула) наблюдалось у 6 детей из 1–й группы и 14 детей из 2–й группы в течение 7 дней, у 7 детей из 1–й группы и 16 детей из 2–й группы в течение 14 дней, у 17 детей из 2–й группы в течение 21 дня. За указанный срок у 1 ребенка из 1–й группы и у 2 детей из 2–й группы стул не нормализовался полностью, оставаясь кашицеобразным, хотя примеси слизи и зелени исчезли. Через 21 день микробиологическое улучшение было отмечено у всех детей, хотя нормализация показателей количества бифидо– и лактобактерий отмечалась только в половине случаев (у 5 детей из 1–й группы и 10 детей из 2–й группы). Эффект от проводимого лечения не зависел от длительности и характера проводимой антибактериальной терапии, ставшей причиной дисбактериоза кишечника. Полученные данные позволяют сделать вывод об эффективности коррекции антибиотик–ассоциированного дисбактериоза у детей Линексом, содержащим живые лифилизированные лактобактерии, бифидобактерии и энтерококк. Совместное применение Линекса и адсорбента–мукоцитопротектора диосмектита повышало эффективность терапии: симптомы купировались у 8 детей из 10 в возрасте 4–7 лет. Назначение препарата Линекс во время курса антибиотков исключало развитие клинически явного дисбактериоза кишеника примерно в половине случаев (у 6 из 11 детей).
Эффект от проводимого лечения не зависел от длительности и характера проводимой антибактериальной терапии, ставшей причиной дисбактериоза кишечника. Полученные данные позволяют сделать вывод об эффективности коррекции антибиотик–ассоциированного дисбактериоза у детей Линексом, содержащим живые лифилизированные лактобактерии, бифидобактерии и энтерококк. Совместное применение Линекса и адсорбента–мукоцитопротектора диосмектита повышало эффективность терапии: симптомы купировались у 8 детей из 10 в возрасте 4–7 лет. Назначение препарата Линекс во время курса антибиотков исключало развитие клинически явного дисбактериоза кишеника примерно в половине случаев (у 6 из 11 детей).
Таким образом, даже обоснованное применение антибиотиков может привести к развитию серьезного дисбактериоза кишечника, следствием которого может быть колит. Совместное применение пробиотиков с антибиотиками позволяет снизить риск ассоциированного с антибиотиками дисбактериоза или уменьшить его тяжесть. В случае развития антибиотик–ассоциированного дисбактериоза кишечника у детей показано назначение биопрепаратов, эффект которых может быть усилен энтеросорбентами. Развитие C. difficile–ассоциированного колита требует особой терапевтической тактики, включающей применение специфических антибактериальных препаратов, но также не исключающей пробиотики.
Развитие C. difficile–ассоциированного колита требует особой терапевтической тактики, включающей применение специфических антибактериальных препаратов, но также не исключающей пробиотики.
Литература:
1. Edlund C., Nord C.E.. Effect on the human normal microflora of oral antibiotics for treatment of urinary tract infection.// J.Antimicrob.Chemoter.– 2000.– Vol.46 Suppl.S1.– P.41–41.
2. Ерюхин И.А., Шляпников С.А., Лебедев В.Ф., Иванов Г.А.. Псевдомембранозный колит и «кишечный сепсис» – следствие дисбактериоза, вызванного антибиотиками.// Вестник хирургии им.И.И.Грекова.– 1997.– том 156.– N2.– С.108–111.
3. Sullivan A., Edlund C., Nord C.E. Effect of antimicrobial agents on the ecological balance of human microflora.// Lancet Infect.Dis.– 2001.– Vol.1.– N2.– P.101–114.
4. McFarland L.V. Risk factor for antibiotic–associated diarrhea.// Ann.Med.Intern. (Paris).– 1998.– Vol.149.– N.5.– P.261–266.
5. Fanaro S, Chierici R, Guerrini P, Vigi V. Intestinal microflora in early infancy: composition and development.// Acta Paediatr.– 2003.– Vol.91. Suppl.– P.48–55.
Fanaro S, Chierici R, Guerrini P, Vigi V. Intestinal microflora in early infancy: composition and development.// Acta Paediatr.– 2003.– Vol.91. Suppl.– P.48–55.
6. Benno Y, Sawada K, Mitsuoka T. The intestinal microflora of infants: composition of fecal flora in breast–fed and bottle–fed infants.// Microbiol.Immunol.– 1984.– Vol.28.– N9.– P.975–986.
7. Цветкова Л.Н., Щербаков П.Л., Салмова В.С., Вартапетова Е.Е. Результаты биокоррекционной поддержки у детей, получавших антигеликобактерную терапию.// Детская гастроэнтерология 2002.– С.482–484.
.
Дисбактериоз после приема антибиотиков – что делать
Дисбактериоз – серьезная проблема не только для самого заболевшего, но и для окружающих.
Прием антибиотиков неизбежно наносит удар по микрофлоре кишечника. Вместе с болезнетворными, опасными бактериями уничтожаются и микробы-помощники, населяющие желудочно-кишечный тракт и способствующие перевариванию пищи. Результатом становится дисбактериоз и нарушение процессов пищеварения. Поступающая в организм еда переваривается плохо, не может полностью усвоиться организмом, в кишечнике остаются достаточно крупные и грубые ее частицы, которые начинают гнить с образованием большого количества газов – так развивается метеоризм. Проблема не только во внешних неприятных симптомах: вздутии и урчании живота, болях, жидком стуле. Токсичная смесь из кишечной слизи, гниющей недопереваренной пищи и пузырьков газа забивает складки слизистой оболочки кишечника, мешает усвоению полезных веществ из еды, и даже лекарств.
Поступающая в организм еда переваривается плохо, не может полностью усвоиться организмом, в кишечнике остаются достаточно крупные и грубые ее частицы, которые начинают гнить с образованием большого количества газов – так развивается метеоризм. Проблема не только во внешних неприятных симптомах: вздутии и урчании живота, болях, жидком стуле. Токсичная смесь из кишечной слизи, гниющей недопереваренной пищи и пузырьков газа забивает складки слизистой оболочки кишечника, мешает усвоению полезных веществ из еды, и даже лекарств.
Дисбактериоз – серьезная проблема не только для самого заболевшего, но и для окружающих. Метеоризм, боли, нарушения стула, которые сопровождают дисбактериоз, мешают нормально питаться и спать, жить и работать, срывают важные рабочие и личные встречи. Неудивительно, что нередко единственное желание больного – поскорее избавиться от неприятных симптомов. В попытках справиться с ними принимаются различные препараты – спазмолитики, призванные снять боль и спазмы в растянутом газами кишечнике, пеногасители, связывающие пузырьки газа, и многие другие. Но все это – лишь тщетные попытки устранить последствия, не влияющие на основную причину проблемы – дисбактериоз. После того, как время действия лекарства закончится, все вернется на круги своя. Для того чтобы этого не случилось, нужно воздействовать не на симптомы дисбактериоза, а на сам дисбактериоз. Только так можно будет добиться быстрого и действительно стойкого результата!
Но все это – лишь тщетные попытки устранить последствия, не влияющие на основную причину проблемы – дисбактериоз. После того, как время действия лекарства закончится, все вернется на круги своя. Для того чтобы этого не случилось, нужно воздействовать не на симптомы дисбактериоза, а на сам дисбактериоз. Только так можно будет добиться быстрого и действительно стойкого результата!
Существует и другое заблуждение: дисбактериоз – временное состояние, кишечная флора обладает способностью к самовосстановлению и со временем все пройдет. Опыт людей, годами страдающих дисбактериозом, прямо указывает на ошибочность такого утверждения. Любая флора, в том числе полезные бактерии кишечника, постепенно размножается и восстанавливается, но обилие токсичных продуктов, образующихся в кишечнике при гниении пищи, также угнетает развитие полезных бактерий. Получается замкнутый круг: пища не может нормально перевариваться, так как не хватает микробов-помощников, гниет и, тем самым, уничтожает полезную бактериальную флору, которой и так не хватает. В подобной ситуации без грамотной помощи организму никак не обойтись.
В подобной ситуации без грамотной помощи организму никак не обойтись.
Врач-терапевт клиники «Борменталь», консультант раздела «Здоровье» мейл.ру, Ольга Александровна Торозова:
«Учитывая повсеместную доступность антибиотиков, их популярность среди пациентов, которые нередко принимают такие препараты необоснованно, у дисбактериоза есть все шансы превратиться в настоящее бедствие! Терпеть неприятные симптомы, надеясь, что организм сам справится, неразумно, но так же неразумно пытаться успокоить их при помощи подручных симптоматических средств.
Побороть дисбактериоз можно комплексом из двух мероприятий: нужно удалить токсичные продукты гниения из кишечника и населить его полезной для пищеварения флорой. Следует «работать» сразу в этих двух направлениях, приняв комплексный препарат. К подобным препаратам, обладающим двойным действием, относится, например, современный энтеросорбент Жидкий уголь, в состав которого входят яблочный пектин и инулин. Яблочный пектин собирает со стенок кишечника токсичные продукты обмена веществ, впитывает и выводит из организма естественным путем. А инулин служит питательным субстратом для пищеварительных бактерий, рост которых значительно ускоряется. Через 7-10 дней приема восстанавливается нормальное переваривание пищи. Именно таким образом, а не симптоматическим приемом обезболивающих, спазмолитиков и пеногасителей можно победить дисбактериоз».
А инулин служит питательным субстратом для пищеварительных бактерий, рост которых значительно ускоряется. Через 7-10 дней приема восстанавливается нормальное переваривание пищи. Именно таким образом, а не симптоматическим приемом обезболивающих, спазмолитиков и пеногасителей можно победить дисбактериоз».
Правильное лечение дисбактериоза позволит справиться не только с неприятными симптомами, но и с их первопричиной, в результате проблема останется позади.
Помогают ли пробиотики восстановить микрофлору кишечника?
- Марта Энрикес
- BBC Future
Автор фото, Unsplash
Лечение антибиотиками может уничтожить не только вредные бактерии, но и полезные. Однако помогают ли пробиотики восстановить микрофлору кишечника, как настаивает их повсеместная реклама?
Пробиотики активно рекламируют как средство от самых разных проблем – от ожирения до психических расстройств. Но чаще всего их рекомендуют для восстановления микрофлоры кишечника после курса антибиотиков.
Но чаще всего их рекомендуют для восстановления микрофлоры кишечника после курса антибиотиков.
Логика проста: во время лечения инфекции антибиотики уничтожают все бактерии, как вредные, так и полезные, а потому кишечник необходимо заселить новыми бактериями.
Впрочем, эффективность этого метода практически не доказана. Более того, исследователи обнаружили, что употребление пробиотиков после антибиотиков на самом деле задерживает восстановление флоры кишечника.
Проблема в том, что достаточного количества исследований какого-либо определенного пробиотика просто не существует. Даже когда ученые используют штаммы живых бактерий, состав коктейля может сильно варьироваться в разных лабораториях.
Такого мнения придерживается Сидней Ньюберри из компании Rand Corporation, который в 2012 году проанализировал большую базу данных по применению пробиотиков для лечения диареи, вызванной антибиотиками.
Ньюберри сделал обзор 82 исследований с участием 12 тысяч пациентов в целом. Он пришел к выводу, что применение пробиотиков действительно помогало снизить риск расстройств пищеварения, но выяснить, какой именно пробиотик или смесь пробиотиков были эффективными, невозможно.
Он пришел к выводу, что применение пробиотиков действительно помогало снизить риск расстройств пищеварения, но выяснить, какой именно пробиотик или смесь пробиотиков были эффективными, невозможно.
Автор фото, Getty Images
Підпис до фото,Широко распространено мнение, что антибиотики вместе с вредными уничтожают и полезные бактерии в кишечнике
Прежде всего, беспокоит недостаток исследований, которые доказали бы безопасность приема пробиотиков. Организму здорового человека пробиотики, как правило, не причиняют вреда.
Но существуют и более тревожные данные о том, что пробиотики могут способствовать распространению грибковой инфекции в крови у более уязвимых пациентов.
Недавно ученые Института науки Вайцмана в Израиле доказали, что даже у здоровых людей применение пробиотиков после антибиотиков не было таким уж безопасным.
Пробиотики, как выяснили ученые, препятствовали самому процессу восстановления, то есть их действие на самом деле было противоположным.
Ученые разделили участников эксперимента, которые только что завершили прием антибиотиков, на три группы.
Одна группа начала принимать пробиотики, вторая – контрольная – ничего не принимала, а третьей сделали трансплантацию фекалий. Участникам этой группы пересадили образец кала, который взяли у них до приема антибиотиков.
Автор фото, Getty Images
Підпис до фото,Пробиотики не имеют одинакового действия на всех, поскольку микробиом кишечника у всех людей разный
Результат был неожиданным. Худший результат оказался у тех, кто принимал пробиотики, а лучший – у группы, получившей трансплантацию фекалий. Только в течение нескольких дней микрофлора кишечника у них полностью восстановилась.
Доказательств того, что пробиотики могут причинить вред нездоровому кишечнику, в последнее время становится все больше.
Одно недавнее исследование показало, что пробиотики не принесли никакой пользы детям, попавшим в больницу с гастроэнтеритом.
Впрочем, несмотря на такие выводы, спрос на пробиотики не только не уменьшается, но и растет. В 2017 году рынок сбыта пробиотиков составил более 1,8 млрд долларов, к 2024 году он может вырасти до 66 млрд долларов.
“Учитывая такие масштабы производства, очень важно, чтобы польза пробиотиков была должным образом доказана”, – отмечает Эран Элинав из Института Вайцмана.
“Это также причина того, что регулятивные органы, например, Американское управление по контролю качества пищевых и медицинских продуктов и аналогичные европейские институты пока не одобрили клиническое применение пробиотиков”, – добавляет ученый.
Автор фото, Getty Images
Підпис до фото,Пробиотики могут причинить вред нездоровому кишечнику
Это все, однако, не означает, что от пробиотиков надо полностью отказаться. Проблема, очевидно, не с самими пробиотиками, а с тем, как мы их принимаем.
Такие препараты часто покупают без рецепта, а потребитель не имеет представления, что именно он приобрел и живы ли вообще бактерии в нем.
Элинав и его коллеги также попытались выяснить, кому употребление пробиотиков может пойти на пользу.
Исследуя работу генов, связанных с иммунной системой, ученые смогли предсказать, будет ли кишечник пациента восприимчивым к насыщению полезными бактериями, или они просто пройдут мимо, не задерживаясь.
“Это интересное и важное исследование, поскольку оно также говорит, что наша иммунная система взаимодействует с пробиотическими бактериями”, – объясняет Элинав.
Оно прокладывает путь к разработке персонализированных методов лечения пробиотиками на основе генетического профиля человека.
Такой подход является “абсолютно реалистичным, и его можно разработать сравнительно быстро”, отмечает Элинав, но пока это только теоретический аргумент.
Для разработки понадобится больше исследований индивидуального подбора пробиотиков и тестирование различных штаммов бактерий на больших группах людей.
Отсутствие последовательных исследований пробиотиков пока объясняется также и тем, что к ним всегда относились, как к обычным лекарствам.
Когда вы принимаете таблетку парацетамола, вы более или менее уверены, что его активный компонент подействует на рецепторы вашего мозга и уменьшит болевые ощущения. Ведь механизм возникновения боли у большинства людей примерно одинаков.
Но микробиом не является рецептором, а скорее экосистемой, которую по сложности иногда сравнивают с тропическим лесом.
И следовательно, подбор пробиотиков, которые помогут восстановить такую сложную и индивидуальную внутреннюю экосистему, непростая задача.
И также вполне понятно, почему пакетик сухих бактерий с полки супермаркета вряд ли справится с этой задачей.
Эффективное восстановление микрофлоры кишечника препаратом Стимбифид Плюс
При развитии инфекционно-воспалительного процесса, к препаратам первой линии относят антибиотики, которые оказывают не только терапевтический эффект, но и способствуют развитию дисбактериоза кишечника.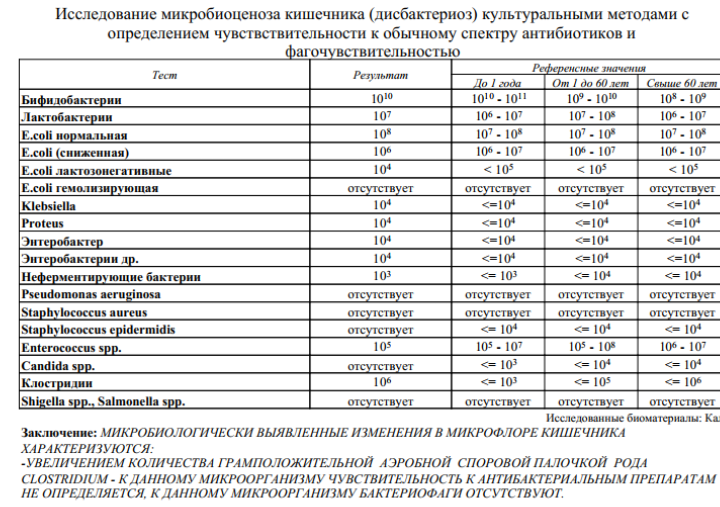 Когда микрофлора после антибиотиков нарушена, на первый план выходят такие симптомы, как диарея, избыточное газообразование в просвете кишечника (метеоризм), тошнота, расстройства стула в виде запоров или диареи, кожная сыпь, нарушение процесса всасывания веществ, поступающих с пищей. Дисбактериоз, спровоцированный приемом антибиотиков, требует своевременного и правильного лечения. Как восстановить микрофлору кишечника после антибиотиков, будет подробно рассмотрено ниже.
Когда микрофлора после антибиотиков нарушена, на первый план выходят такие симптомы, как диарея, избыточное газообразование в просвете кишечника (метеоризм), тошнота, расстройства стула в виде запоров или диареи, кожная сыпь, нарушение процесса всасывания веществ, поступающих с пищей. Дисбактериоз, спровоцированный приемом антибиотиков, требует своевременного и правильного лечения. Как восстановить микрофлору кишечника после антибиотиков, будет подробно рассмотрено ниже.
Причины дисбактериоза при приеме антибиотиков
Чувствительность микрофлоры к антибиотикам не избирательна. Даже современные препараты, обладающие антибактериальной активностью, не способны воздействовать только на отдельные патогенные микроорганизмы. Лекарственные медикаменты, которые используются для лечения инфекционных заболеваний, уничтожают не только болезнетворные микроорганизмы, но и положительную микрофлору кишечника. Результатом такого процесса становится дисбактериоз. Для того чтобы избежать негативных последствий антибиотикотерапии, необходимо воспользоваться дополнительными методами поддержания баланса нормальной микробиоты кишечника.
Для того чтобы избежать негативных последствий антибиотикотерапии, необходимо воспользоваться дополнительными методами поддержания баланса нормальной микробиоты кишечника.
Симптомы дисбактериоза
Распознать дисбаланс кишечной микрофлоры, связанный с приемом антибактериальных средств, можно по таким характерным клиническим признакам:
- Расстройства стула, которые выражаются в виде запоров, чередующихся с диареей.
- Избыточное газообразование в кишечнике (метеоризм).
- Болевые ощущения, которые локализуются в околопупочной области.
- Боль в животе, усиливающаяся после приема пищи.
- Слабость и общее недомогание.
- Снижение аппетита.
- Ухудшение состояния кожных покровов, появление сыпи.
- Увеличение показателей температуры тела в пределах 37,1-37,4 градусов.
Наиболее распространенным последствием приёма антибиотиков, является дисбактериоз кишечника, который приводит не только к ухудшению общего состояния, но и к развитию тяжелых осложнений.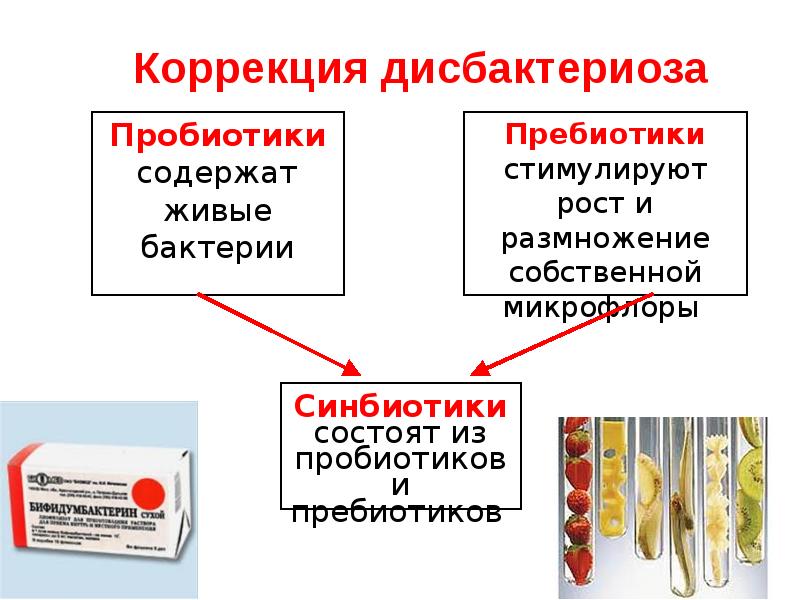
Диагностика
Определить наличие дисбактериоза, спровоцированного приемом антибактериальных лекарственных средств, можно по характерным клиническим признакам. К специфическим методам диагностики этого патологического состояния, относят бактериальный посев кала и лабораторный анализ на дисбактериоз. Для того чтобы определить дисбактериоз тонкого кишечника, выполняется исследование аспирата или соскоба из тощей кишки. Косвенные признаки дисбаланса микрофлоры определяются при выполнении газожидкостного анализа и биохимического исследования кала.
Лечение
Людям, столкнувшимся с кишечным дисбиозом на фоне антибиотикотерапии, показан диетический стол № 4 по Певзнеру, который помогает нормализовать моторно-эвакуаторную функцию толстого кишечника и снизить интенсивность бродильных, а также гнилостных процессов в просвете ЖКТ. В ежедневный рацион включают продукты, богаты растительными волокнами, а также кисломолочную продукцию, которая содержит бифидум и лактобактерии.
Коррекция состава микрофлоры проводится с использованием антибактериальных средств, которые не всасываются в системный кровоток (Рифаксимин). Также, широко применяются кишечные антисептики (Нифуроксазид). Для восстановления баланса кишечной микробиоты, используются такие группы препаратов:
- Пробиотики (препараты, содержащие культуры полезных кишечных микроорганизмов).
- Пребиотики (вещества, стимулирующие рост и размножение нормальной кишечной микрофлоры).
- Синбиотики (комплексные препараты, содержащие как полезные микроорганизмы, так и питательный субстрат для них).
Новейшим и наиболее эффективным способом восстановления микрофлоры после приема антибиотиков, является приём метапребиотиков, которые содержат питательную среду для кишечной микрофлоры (фруктополисахариды и фруктоолигосахариды), а также лактат кальция, стимулирующий процесс размножения и рост полезных бактерий в кишечнике. Для подтверждения эффективности метапребиотиков в борьбе с дисбактериозом, был проведён сравнительный эксперимент, в ходе которого был использован метапребиотик Стимбифид Плюс и другие препараты, используемые для восстановления микрофлоры после антибиотиков. Максимальная результативность была доказана в отношении метапребиотика Стимбифид Плюс, который за короткий промежуток времени помогал восстановить необходимое количество собственных бифидобактерий, обитающих в просвете ЖКТ. По сравнению с другими препаратами, содержащими пробиотики и пребиотики, метапребиотик Стимбифид Плюс обладает такими преимуществами:
Для подтверждения эффективности метапребиотиков в борьбе с дисбактериозом, был проведён сравнительный эксперимент, в ходе которого был использован метапребиотик Стимбифид Плюс и другие препараты, используемые для восстановления микрофлоры после антибиотиков. Максимальная результативность была доказана в отношении метапребиотика Стимбифид Плюс, который за короткий промежуток времени помогал восстановить необходимое количество собственных бифидобактерий, обитающих в просвете ЖКТ. По сравнению с другими препаратами, содержащими пробиотики и пребиотики, метапребиотик Стимбифид Плюс обладает такими преимуществами:
- Для восстановления кишечника после антибиотиков может быть использован одновременно с антибак..териальными средствами с первого дня их приема.
- Помогает эффективно восстановить собственную микрофлору кишечника человека.
- Не вызывает побочные реакции.
- Одинаково эффективен и безопасен для людей любого возраста.

- Благоприятно влияет на состояние желудочно-кишечного тракта на всей его протяженности.
- Снижает интенсивность воспалительного процесса, который может развиваться при дисбактериозе.
- Помогает ускорить процесс естественного восстановления эпителия слизистой оболочки желудочно-кишечного тракта.
Если говорить о том, что пить с антибиотиками для восстановления микрофлоры, то метапребиотик Стимбифид Плюс является лучшим выбором
Прогноз и профилактика
При своевременно начатом лечении, прогноз относительно выздоровления при кишечном дисбактериозе на фоне антибиотикотерапии, является благоприятным. Снизить вероятность развития данного состояния помогает соблюдение точной дозировки и кратности приема антибактериальных средств, которые были назначены лечащим врачом. Для восстановления кишечника после антибиотиков, рекомендовано принимать антибактериальное средство в комбинации с Стимбифид Плюс, который эффективен не только с лечебной, но и с профилактической целью. Комбинированное использование двух препаратов не повлияет на эффективность каждого из них.
Комбинированное использование двух препаратов не повлияет на эффективность каждого из них.
/ Доктор Стимбифид
Поделиться в соцсетях:
кто виноват и что делать?
Сегодня почти все увлечены здоровым образом жизни и натуральными средствами, поэтому слово «антибиотики» для многих стало едва ли не ругательным. Действительно, антибиотикотерапия может сопровождаться неприятными побочными эффектами, однако отметать ее полностью нельзя. Без антибиотиков невозможно адекватное лечение серьезных инфекционных заболеваний; в такой ситуации «химией» пренебрегать нельзя. Запущенное воспаление может перейти в хроническую форму или спровоцировать серьезные осложнения, в результате чего организму может быть нанесен еще больший урон. В этом вопросе стоит доверять лечащему врачу: к примеру, антибиотики при тяжелой ангине, отите или пневмонии неизбежны, в противном случае здоровье и даже жизнь может оказаться в серьезной опасности.
В этом вопросе стоит доверять лечащему врачу: к примеру, антибиотики при тяжелой ангине, отите или пневмонии неизбежны, в противном случае здоровье и даже жизнь может оказаться в серьезной опасности.
Антибиотиков избегать нельзя: в лечении многих инфекций они незаменимы
Потребность в антибиотиках для лечения сильных воспалений очевидны. Но о побочных эффектах также стоит помнить. Один из самых распространенных – дисбактериоз после приема антибиотиков. Причина дисбактериоза заключается в том, что антибактериальные препараты уничтожают не только возбудителей инфекционных заболеваний, но и полезные бактерии кишечной микрофлоры, а также микрофлоры половых органов.
Если антибиотикотерапия была согласована с врачом и не была очень продолжительной, а пациент питался полноценно то дефицит полезных бактерий быстро компенсируется, и функция кишечника восстанавливается за 2-3 недели. Но если больной принимает антибиотики при выраженном дисбактериозе или занимается самолечением, проблем с микрофлорой кишечника не избежать. Особенно подвержены дисбактериозу дети и люди пожилого возраста.
Но если больной принимает антибиотики при выраженном дисбактериозе или занимается самолечением, проблем с микрофлорой кишечника не избежать. Особенно подвержены дисбактериозу дети и люди пожилого возраста.
Проявляться эта неприятность может по-разному: от незначительного расстройства стула до целого комплекса тяжелых и неприятных симптомов. Самые распространенные из них – колики, метеоризм, вздутие живота, чередование запора и диареи. У малышей также может повышаться температура, из-за чего дисбактериоз у детей легко спутать с отравлением или кишечной инфекцией.
Симптомы дисбактериоза могут проявляться как непосредственно во время приема антибиотиков, так и после курса.
Неосторожный прием антибиотиков часто влечет за собой дисбиоз кишечника
Лечение дисбактериоза заключается в компенсации урона, нанесенного микрофлоре кишечника, а также поддержка пищеварения: недостаток полезных бактерий его значительно затрудняет. Поэтому основные составляющие терапии – это пробиотики и пребиотики, ферментные препараты и щадящая диета. А еще лучше – вовремя принять профилактические меры: если принимать пробиотики одновременно с антибактериальной терапией, риск развития дисбактериоза значительно снижается. Своевременная профилактика особенно важна, если нарушения кишечной микрофлоры или антибиотикотерапия имели место ранее.
Поэтому основные составляющие терапии – это пробиотики и пребиотики, ферментные препараты и щадящая диета. А еще лучше – вовремя принять профилактические меры: если принимать пробиотики одновременно с антибактериальной терапией, риск развития дисбактериоза значительно снижается. Своевременная профилактика особенно важна, если нарушения кишечной микрофлоры или антибиотикотерапия имели место ранее.
Не менее важно соблюдать диету при дисбактериозе. В ежедневном рационе должны быть натуральные источники лактобактерий (пробиотики) – кисломолочные продукты, квашеные овощи, а также источники пектинов и пищевых волокон (пребиотики), которые служат питанием для полезных микроорганизмов – овощи, фрукты, ягоды, зелень, орехи. Для успешного лечения дисбактериоза также необходимы препараты-пробиотики. Чтобы правильно выбрать такой препарат, нужно обращать внимание на его предназначение: составы препаратов от кишечного дисбактериоза и вагинального дисбиоза несколько отличаются. Разница есть и в составах детских пробиотиков и аналогичных средств для взрослых.
Разница есть и в составах детских пробиотиков и аналогичных средств для взрослых.
как восстановить микрофлору кишечника ЖКТ после антибиотиков — Семейная Клиника
Открытие антибиотиков стало для медицины настоящей революцией. Более 90 лет они эффективно лечат многие болезни, в основе которых бактериальные инфекции и снимают осложнения буквально за считанные часы. Эффективность настолько высокая, что, даже зная о серьёзных побочных последствиях после их применения, современная медицина от них не отказывается, потому что замены этому виду лекарственных препаратов нет. Сегодня мировой рынок этого вида лекарственных препаратов оценивается в 50 млрд. долларов и продолжает расти быстрыми темпами.
Что такое антибиотики, как они действуют и, каким образом можно восстановить желудочно-кишечный тракт после их применения?
Антибиотики или, как их ещё называют «противомикробные препараты», – это вещества, способные блокировать развитие или вызывать гибель определённых микроорганизмов. Другими словами, это настоящий яд, действие которого направлено на уничтожение бактерий.
Другими словами, это настоящий яд, действие которого направлено на уничтожение бактерий.
Между бактериями и клетками человеческого организма есть сходства и одно принципиальное отличие. Дело в том, что у клеток человека в отличие от бактерий нет клеточной стенки, а антибиотики уничтожают бактерии именно, действуя на стенку и нарушая механизм формирования белка или ДНК, которые у бактерий весьма специфичны. При этом уничтожаются как вредные бактерии, так и полезные, что вызывает дисбактериоз, который если не лечить может затянуть проблемы с желудочно-кишечным трактом на длительное время.
Основные симптомы дисбактериоза:- боли в области желудка;
- тошнота и отрыжка, частая изжога;
- частицы не переваренной пиши в стуле;
- сухость кожи, бывают случая появления высыпаний;
- ломкость и слоение ногтей;
- сухость волос;
- потеря веса, снижение иммунитета, ухудшение общего состояния.

Проблемы могут усилиться при наличии стрессов, хронических болезней, включая заболевания ЖКТ, неправильного питания, употребления алкоголя, газированной воды. Вот почему многие пациенты, которые прошли курс лечения этими препаратами, задают вопрос, как восстановить ЖКТ после антибиотиков.
Важно! Появление болей и других симптомов являются сигналом для немедленного обследования и лечения у врача-гастроэнтеролога.Диагностика этого заболевания складывается из анамнеза, жалоб больного, клинической картины, результатов гастроскопии желудка и лабораторных исследований. Главное – вовремя принять меры, которые направлены на восстановление ЖКТ после антибиотиков.
При восстановлении микрофлоры гастроэнтерологи советуют включить в рацион кисломолочные продукты, рыбу и мясо нежирных сортов в запеченном или отварном виде, различные супы-пюре с перетёртыми овощами, компоты, кисели, слизистые каши.
Под запретом:
- алкоголь;
- курение;
- еда всухомятку;
- жирные мясо и рыба;
- яйца в варёном и жареном виде;
- свежий белый хлеб;
- молоко и свежевыжатые соки;
- соусы и приправы.

Лечение дисбактериоза врачами гастроэнтерологами Екатеринбурга в медицинском центре «Семейная клиника»
Правильно установленный диагноз и профессионально разработанная тактика лечения являются ключевыми условиями успешного лечения дисбактериоза и быстрого восстановления микрофлоры желудочно-кишечного тракта.
В зависимости от результатов анализов гастроэнтерологи Екатеринбурга нашей клиники могут назначить ряд лекарственных препаратов таких как:
- пребиотики – препараты, подавляющие патогенную флору, препятствующие её развитию и укрепляющие иммунитет;
- пробиотики – препараты, содержащие комплекс живых микроорганизмов, способных вести борьбу с вредными бактериями;
- антисептики – средства, которые уничтожают патогенную флору;
- бактериофаги – препараты, способные бороться с сальмонеллами, энтерококками, стафилококками.
Внимание! Медикаментозное лечение должно быть назначено только врачом-гастроэнтерологом. Попытки самолечения могут запустить болезнь и ещё больше усложнить проблемы с ЖКТ.
Попытки самолечения могут запустить болезнь и ещё больше усложнить проблемы с ЖКТ.
Дисбактериоз кишечника у детей при антибиотикотерапии Текст научной статьи по специальности «Клиническая медицина»
Н.Л. ПАХОМОВСКАЯ, к.м.н., А.С. ПОТАПОВ, д.м.н., профессор, Г.В. ВОЛЫНЕЦ, д.м.н., Научный центр здоровья детей, Москва
ДИСБАКТЕРИОЗ КИШЕЧНИКА
У ДЕТЕЙ ПРИ АНТИБИОТИКОТЕРАПИИ
Нарушения микробиоценоза у детей – распространенная и актуальная проблема, чаще всего обусловленная необоснованным назначением антибактериальных препаратов. В статье рассмотрены причины и следствия нарушения микрофлоры кишечника в результате проведения антибактериальной терапии, методы восстановления нормобиоценоза толстой кишки. Особая роль отводится пробиотикам, которые способствуют восстановлению микробиоты толстой кишки, стимуляции жизнедеятельности и активности собственной облигатной микрофлоры.
Особая роль отводится пробиотикам, которые способствуют восстановлению микробиоты толстой кишки, стимуляции жизнедеятельности и активности собственной облигатной микрофлоры.
Ключевые слова:
антибиотики, микрофлора дети
дисбактериоз
антибиотикоассоциированная диарея
пробиотики
РиоФлора
В настоящее время антибактериальные препараты широко используются в педиатрии. С 40-х гг. прошлого века антибиотики получили широкое распространение в медицинской практике, что позволило кардинально решить проблему лечения и смертности от инфекционной патологии. Однако широкое, а иногда и необоснованное их применение нередко приводит к осложнениям, наиболее частым из которых является нарушение микробиоценоза желудочно-кишечного тракта. Назначая антибиотики, педиатр должен учитывать не только особенности их противомикробного действия, показания и противопоказания к применению, но и основные побочные эффекты. Среди современных антибактериальных препаратов весьма сложно найти такие, которые не оказывали бы нежелательного действия на микрофлору пищеварительного тракта.
Назначая антибиотики, педиатр должен учитывать не только особенности их противомикробного действия, показания и противопоказания к применению, но и основные побочные эффекты. Среди современных антибактериальных препаратов весьма сложно найти такие, которые не оказывали бы нежелательного действия на микрофлору пищеварительного тракта.
Важнейшим фактором, под воздействием которого происходит становление нормальной микрофлоры, является питание новорожденного ребенка. Так, у детей, находящихся на грудном вскармливании, основным компонентом биоценоза являются бифидобактерии, выполняющие защитные функции и способствующие созреванию механизмов иммунного ответа ребенка. В то же время у детей, находящихся на искусственном вскармливании, состав кишечной микрофлоры более разнообразен и содержит одинаковые количества бифидобактерий и бактероидов. В возрасте 12 мес. у детей состав и количество анаэробных микроорганизмов в толстом кишечнике приближается к показателям взрослых людей [1, 2].
Нормальная микрофлора (общим весом около 1,5 кг) является очень важным органом и по защитным функциям приравнивается к печени. Она выполняет массу важнейших для макроорганизма функций: формирует иммунобиологическую реактивность организма, защищает от внедрения и размножения в нем патогенных микроорга-
низмов, участвует в утилизации непереваренных пищевых веществ и печеночно-кишечной циркуляции компонентов желчи, обладает дезинтоксикационной функцией [3]. Микрофлора обеспечивает человека питательными веществами, участвует в синтезе витаминов В1 В2, В6, В12, С, К, никотиновой, фолиевой кислот и биотина, а также короткоцепочечных жирных кислот. Последние являются главными источниками энергии для эпителиальных клеток. Кишечная микрофлора поддерживает низкой степени хроническое «физиологическое» воспаление, которое важно для созревания и нормальной функции иммунной системы слизистых оболочек [4].
Дисбактериоз – вторичное нарушение микробиоценоза кишечника под влиянием заболевания или нарушения моторики, связанное в основном с изменениями питательных субстратов в разных отделах кишечника. По выздоровлении флора кишечника нормализуется. Важно понимать, что «дисбактериоз» толстой кишки – не заболевание, а клинико-лабораторный синдром, развивающийся вторично вследствие приема антибактериальных препаратов, изменения среды обитания и характера питания, различных гастроэнтерологических заболеваний. Клиническое значение могут иметь вызванные антибиотиками диареи, особенно у детей [5].
Нарушения микробиоценоза кишечника связаны с угнетением иммунобиологической защиты организма, его аллергизацией, хронической интоксикацией, повышением восприимчивости к инфекционным заболеваниям. По мнению исследователей, дисбиозы способствуют затяжному рецидивирующему течению заболеваний, развитию осложнений [6]. При длительно существующем дисбалансе кишечной микрофлоры развиваются изменения слизистой оболочки, липопротеинов межклеточных мембран эпителиоцитов, образуются тканевые антигены. Повышенная проницаемость кишечного барьера для макромолекул белковой природы способствует развитию аллергических реакций, непереносимости определенных пищевых продуктов.
При длительно существующем дисбалансе кишечной микрофлоры развиваются изменения слизистой оболочки, липопротеинов межклеточных мембран эпителиоцитов, образуются тканевые антигены. Повышенная проницаемость кишечного барьера для макромолекул белковой природы способствует развитию аллергических реакций, непереносимости определенных пищевых продуктов.
На взаимосвязь пищевой аллергии и нарушений инте-стинальной микрофлоры указывали еще в начале 1990-х гг. российские ученые (Куваева И.Б., Ладодо К.С., 1991). Проведенные исследования показали снижение риска развития атопической экземы к первому году жизни у детей из группы риска при назначении пробиотиков на
фоне приема антибактериальных препаратов по сравнению с группой «плацебо». При этом уровень общего и специфического 1дЕ не различался [4].
Барьер из представителей нормальной микрофлоры желудочно-кишечного тракта предупреждает гиперчувствительность организма к пищевым антигенам, и нарушения данного процесса отражаются в иммунопатологических реакциях. В ряде клинических исследований продемонстрировано значение нарушений нормального биоценоза в патогенезе аутоиммунных заболеваний. Так, показано повышение риска развития гиперчувствительности к белкам коровьего молока, что связано с предрасположенностью к инсулинозависимому диабету (К1тр1так1 Т., Егкко1а М., КогИопеп Б., 2001). Среди проявлений аллергии к белкам коровьего молока в первую очередь необходимо отметить атопический дерматит, крапивницу, отек Квинке, аллергическое поражение желудочно-кишечного тракта. Необходимо отметить, что в группе риска по развитию аллергии на фоне антибактериальной терапии в первую очередь находятся дети.
В ряде клинических исследований продемонстрировано значение нарушений нормального биоценоза в патогенезе аутоиммунных заболеваний. Так, показано повышение риска развития гиперчувствительности к белкам коровьего молока, что связано с предрасположенностью к инсулинозависимому диабету (К1тр1так1 Т., Егкко1а М., КогИопеп Б., 2001). Среди проявлений аллергии к белкам коровьего молока в первую очередь необходимо отметить атопический дерматит, крапивницу, отек Квинке, аллергическое поражение желудочно-кишечного тракта. Необходимо отметить, что в группе риска по развитию аллергии на фоне антибактериальной терапии в первую очередь находятся дети.
Многочисленные клинические наблюдения подтверждают роль кишечной микрофлоры в генезе воспаления при хронических воспалительных заболеваниях кишечника. Поскольку дистальный отдел подвздошной кишки и толстая кишка особенно обильно колонизированы бактериями, именно они чаще других поражаются при воспалительных заболеваниях кишечника [4].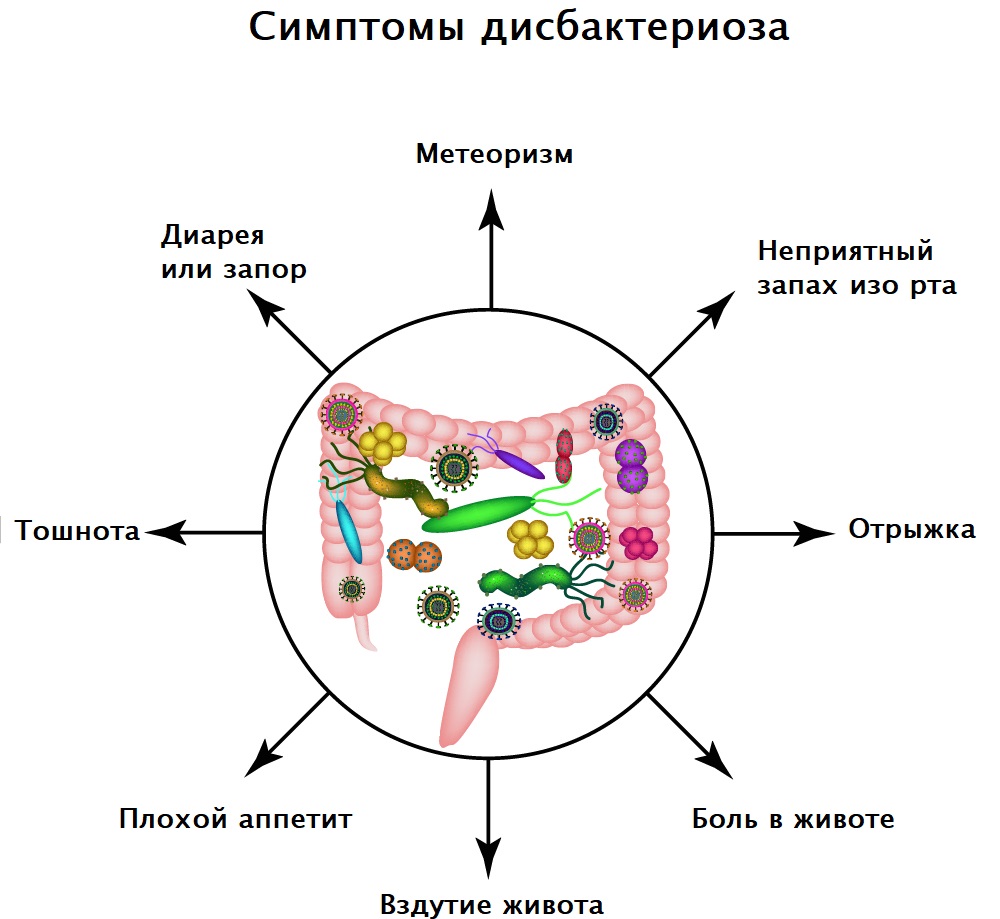
Клиническим проявлением дисбиоза в структуре патологии кишечника является неустойчивый стул, вздутие живота, урчание, болевой абдоминальный синдром, который чаще всего обусловлен повышенным газообразованием. Нередко возникают диспепсические явления: тошнота, отрыжка, горечь во рту.
Причиной нарушения кишечного микробиоценоза может стать практически любое заболевание органов пищеварения, в первую очередь сопровождающееся нарушением процессов переваривания и всасывания, вследствие чего меняется состав внутренней среды в кишке.
Другая возможная причина развития дисбактериоза кишечника – применение антибактериальных препаратов, которые прямо влияют на микроорганизмы и существенно изменяют «микробный пейзаж» пищеварительного тракта. Антибактериальные препараты подавляют рост не только патогенных микроорганизмов, но и нормальной микрофлоры кишечника. В результате размножаются сапрофитные микробы с высокой устойчивостью к лекарственным препаратам, приобретающие патогенные свойства, такие как стафилококки, протей, энтерококки, дрожжевые грибы, клебсиелла, синегнойная палочка. При этом способ введения антибактериальных средств не имеет особого значения. Так, при пероральном приеме антибиотиков, помимо влияния на кишечную микрофлору, происходит их местное воздействие непосредственно на слизистую оболочку тонкой кишки. При парентеральном введении они воздействуют на микробиоценоз кишечника, выделяясь со слюной, желчью, секретами тонкой и толстой кишки [7].
В результате размножаются сапрофитные микробы с высокой устойчивостью к лекарственным препаратам, приобретающие патогенные свойства, такие как стафилококки, протей, энтерококки, дрожжевые грибы, клебсиелла, синегнойная палочка. При этом способ введения антибактериальных средств не имеет особого значения. Так, при пероральном приеме антибиотиков, помимо влияния на кишечную микрофлору, происходит их местное воздействие непосредственно на слизистую оболочку тонкой кишки. При парентеральном введении они воздействуют на микробиоценоз кишечника, выделяясь со слюной, желчью, секретами тонкой и толстой кишки [7].
Причиной кишечного дисбиоза могут стать практически все современные антибактериальные препараты, но
действие каждого из них имеет определенные особенности. Макролидные антибиотики влияют на микрофлору кишечника, умеренно угнетая рост симбионтной микрофлоры и одновременно увеличивая пропорцию клебси-елл, протея и псевдомонад. При их использовании угнетаются нетоксигенные клостридии, и имеет место избыточный рост С. difficile и B. fragilis [8, 9]. Цефалоспорины угнетают рост E. coLi, лакто- и бифидобактерий и способствуют росту численности энтерококков, клебсиелл, протеев, синегнойной палочки, стафилококков, С. difficile и энтеротоксинпродуцирующих C. perfringens [5, 6]. Ампициллин в значительной степени подавляет рост как аэробной, так и анаэробной микрофлоры, тогда как амок-сициллин, лишь минимально подавляя активность большинства нормальных кишечных микроорганизмов, способствует некоторому увеличению популяции представителей рода Enterobacteriacaea. Аналогично на микробиоценоз кишечника влияет комбинированный препарат амоксициллина и клавулановой кислоты [10, 11].
При их использовании угнетаются нетоксигенные клостридии, и имеет место избыточный рост С. difficile и B. fragilis [8, 9]. Цефалоспорины угнетают рост E. coLi, лакто- и бифидобактерий и способствуют росту численности энтерококков, клебсиелл, протеев, синегнойной палочки, стафилококков, С. difficile и энтеротоксинпродуцирующих C. perfringens [5, 6]. Ампициллин в значительной степени подавляет рост как аэробной, так и анаэробной микрофлоры, тогда как амок-сициллин, лишь минимально подавляя активность большинства нормальных кишечных микроорганизмов, способствует некоторому увеличению популяции представителей рода Enterobacteriacaea. Аналогично на микробиоценоз кишечника влияет комбинированный препарат амоксициллина и клавулановой кислоты [10, 11].
Микрофлора обеспечивает человека питательными веществами, участвует в синтезе витаминов B1 В2, B& В12, С, К, никотиновой, фолиевой кислот и биотина, а также короткоцепочечных жирных кислот
Комплекс патологических сдвигов в составе микрофлоры кишечника с соответствующими клиническими проявлениями, развившийся вследствие применения антибиотиков, получил название «антибиотик-ассоции-рованной диареи» [12]. Антибиотик-ассоциированная диарея (ААД) – это как минимум три и более эпизода неоформленного стула, развившихся на фоне применения антибактериальных препаратов или вплоть до 4-8 нед. после их отмены, если не выявлена другая причина диареи. Факторами риска развития ААД являются использование антибиотиков более 3 дней, возраст ребенка младше 7 лет, наличие сопутствующих заболеваний, иммунодефицитные состояния [12, 13, 14]. Доказано также, что ААД чаще всего наблюдается у новорожденных и детей в возрасте до 5 лет, что связано с процессом становления кишечной микрофлоры [15, 16]. Одной из актуальных проблем является развитие ААД у детей на фоне эрадикации Helicobacter pylori, что значительно затрудняет переносимость и приверженность терапии. Частота ААД, по данным различных авторов, колеблется от 5 до 39%, достигая в отдельных наблюдениях 62% [14, 17]. Причиной ААД чаще всего являются такие препараты, как клиндамицин,линкомицин, аминопенициллины, цефалоспорины, тетрациклин, эритромицин [12, 13, 18]. По данным разных источников, при использовании цефалоспо-ринов ААД возникает в 9-43%, амоксициллина/клавула-ната – в 23-71%, других пенициллинов широкого спектра действия – в 11%, эритромицина – в 16%, других макролидов – в 8% [14, 19]. Таким образом, среди индукторов ААД у детей лидируют производные пенициллина и цефалоспорины, что обусловлено их широким приме-
нением в педиатрии. Не отмечено ни одного случая появления ААД после монотерапии ко-тримоксазолом и фтор-хинолонами по результатам мультицентрового исследования, проведенного в Швеции [19]. Другие авторы также отмечают минимальное влияние фторхинолонов на микроэкологию кишечника [20, 21]. Однако в настоящее время в большинстве развитых стран фторхинолоны не разрешены к применению в педиатрии.
Считается, что патогенез ААД, развившийся в первые трое суток от начала приема антибактериального препарата, обусловлен метаболическими расстройствами, а развитие ААД в более поздние сроки – колонизацией кишечника условно-патогенными штаммами бактерий [22]. Инфекционными агентами, наиболее часто ассоциирующимися с возникновением ААД, являются C. difficile, C. perfringens, B. fragilis, S. aureus, род Klebsiella, род Salmonella, грибы рода Candida. Именно антибактериальная терапия может оказаться причиной подавления роста индигенной и усиления роста условно-патогенной флоры в пищеварительном тракте, что нередко сопровождается развитием диареи [15, 16].
«Дисбактериоз» толстой кишки -не заболевание, а клинико-лабораторный синдром, развивающийся вторично вследствие приема антибактериальных препаратов, изменения среды обитания и характера питания, различных гастроэнтерологических заболеваний
Клиническая симптоматика ААД может варьировать от маловыраженной до тяжелой. В случае нетяжелой ААД у ребенка во время или после приема антибиотиков возникает нерезко выраженное послабление стула без патологических примесей в течение 1-3 дней, а также появляются жалобы на схваткообразные боли в животе умеренной интенсивности. Признаки интоксикации, лихорадка и лейкоцитоз обычно отсутствуют.
Наиболее грозным является вариант ААД, ассоциированный с C. difficile, и его крайнее проявление – псевдомембра-нозный колит, при развитии которого летальность может достигать 30%. Бессимптомное носительство C. difficile обнаружено у 3% взрослых и 50-70% новорожденных. С. difficile является причиной 15-25% случаев ААД и 98% – псевдомембранозного колита [21]. Эти процессы связаны с подавлением нормальной микрофлоры кишечника, в частности с резким снижением количества неток-сигенных Clostridium spp. и с избыточным, а иногда лавинообразным размножением C. difficile на фоне антибактериальной терапии, что сопровождается изменением ток-сигенных свойств штаммов C. difficile. Свое патологическое действие микроорганизм оказывает за счет продукции в просвете кишечника энтеротоксина А, цитотоксина В и белка, угнетающего перистальтику кишечника. Воздействие токсинов на слизистую оболочку кишечника способствует развитию воспалительных изменений и повышает интенсивность апоптоза клеток.
В группе риска по развитию C. difficile-ассоциированной диареи находятся стационарные больные, особенно пациенты хирургических, нефрологических детских отделений. Необходимо учитывать преморбидный фон у детей, принимающих антибиотики, а также наличие сопутствующей патологии – кишечной непроходимости различного генеза, хронических воспалительных заболеваний кишечника (неспецифический язвенный колит и болезнь Крона), стафилококковой инфекции, врожденных и приобретенных иммунодефицитов, оперативных вмешательств на органах брюшной полости [15, 16].
Диарейный синдром при C. difficile-ассоциированной ААД обычно развивается после 3-го дня лечения антибиотиками (чаще – линкозамидами, реже – полусинтетическими пенициллинами, цефалоспоринами, макролидами) и длится без лечения от 10 дней до 8 нед. [12, 19]. При развитии псевдомембранозного колита болезнь проявляется сильными болями в животе схваткообразного или постоянного характера, гипертермией, обильной водянистой диареей с частотой стула до 10-20 раз в сутки, часто с примесью крови. В крови наблюдается нейтрофильный лейкоцитоз. При проведении колоноскопии визуализируются типичные псевдомембраны – желтовато-белые пленчатые наложения фибрина на слизистой оболочке толстой кишки. К осложнениям псевдомембранозного колита относят гиповолемический шок, токсический мегаколон, гипо-альбуминемию. Реже встречаются перфорация толстой кишки, перитонит и сепсис [15, 16].
Коррекция дисбиоза толстой кишки предполагает комплексный подход. Прежде всего, это патогенетическое лечение основного заболевания. При легкой выраженности дисбиоза, незначительных изменениях в составе микрофлоры возможна лишь диетическая коррекция, а медикаментозное лечение не требуется. Необходимое условие – восстановление нарушенных функций кишечника. Так, при восстановлении моторно-эвакуаторных функций кишечника нормализуется окислительно-восстановительный потенциал внутриполостной среды и, как следствие, баланс аэробных и анаэробных популяций микроорганизмов. При более выраженных нарушениях, которые проявляют себя определенными симптомами, назначаются препараты, нормализующие состав микрофлоры.
При развитии ААД главный принцип лечения – отмена антибактериального препарата или снижение его дозы (при необходимости продолжения лечения). При лечении ААД, связанной с C. difficile, эффективны ванкомицин в дозе 40-60 мг/кг/сут, рифаксимин в дозе 20 мг/кг/сут, метронидазол в дозе 20 мг/кг/сут курсом 7-14 дней [18]. Наиболее перспективным направлением в комплексном лечении, и особенно профилактике ААД у детей, считается использование пробиотиков [12, 24].
Пробиотики – препараты и биологически активные добавки (БАД), содержащие живые микроорганизмы, являющиеся представителями нормальной микрофлоры толстой кишки, прежде всего бифидо- и лактобактерий, энтерококков (фекальных стрептококков). Микроорганизмы в
пробиотиках являются короткоживущими и не колонизируют пищеварительный тракт, через неделю после прекращения приема препарата бактерии из пробиотиков не обнаруживаются в микрофлоре ЖКТ. Это обстоятельство объясняет, почему необходимо принимать пробиоти-ки в течение длительного времени, чтобы получить долгосрочный положительный эффект от их применения. Антисептические свойства пробиотиков связаны с продукцией антимикробных факторов – органических кислот, бактериоцинов и ингибиторных белков. Пробиотики могут изменять свойства слоя слизи и усиливать целостность клеточного барьера, стимулируя выработку бактерицидных веществ клетками слизистой оболочки, они участвуют в борьбе против патогенных бактерий. Состав пробиотиков различен (монокультура или комбинация из нескольких видов микроорганизмов), поэтому большое значение имеет выбор конкретного пробиотического комплекса. Учитывая вариабельность «микробного пейзажа» пищеварительного тракта, очевидно, что эффективность пробиотика напрямую связана с количеством микробных штаммов. Чем больше штаммов бактерий в препарате, тем выше его эффективность [12].
Фармакологами постоянно предлагаются все новые средства данной группы. С 2011 г. на отечественном рынке представлены два пробиотических комплекса для взрослых и детей старше 3 лет, разработанных компанией WincLove B.V. (Нидерланды), – РиоФлора Баланс Нео и РиоФлора Иммуно Нео.
РиоФлора Баланс Нео – мультипробиотический комплекс, представляющий собой комбинацию из 8 жизнеспособных бактерий следующих штаммов: Bifidobacterium bifidum W23, B. lactis W51, Lactobacillus acidophilus W37, L. acidophilus W55, L. paracasei W20, L. plantarum W62, L. rhamnosus W71, L. salivarius W24. Каждая кишечно-растворимая капсула содержит не менее 5х108 КОЕ/г пробиотических микроорганизмов. Применяется по 2 капсулы 2 раза в день в течение 10-14 дней, желательно натощак (утром и перед сном). Возможно растворение содержимого капсулы в теплой воде, молоке или йогурте (при невозможности проглотить целую капсулу). При необходимости курс приема можно повторить.
Пробиотические комплексы РиоФлора разрабатывались с учетом различий микробных нарушений при различных патологических состояниях. Так, РиоФлора Баланс Нео специально разработан для использования при антибиотикассоциированной диарее. Штаммы пробиотика РиоФлора Баланс Нео подбирались с учетом патофизиологического процесса, развивающегося на фоне приема антибиотиков. Штаммы РиоФлора Баланс Нео подавляют рост и выделение токсина C. difficile, также подавляют рост представителей рода Shigella, рода SaLmoneLLa, грибы рода Candida (данная информация представлена в Product Master file и может быть предоставлена по запросу читателей).
Общепринятая практика совместного использования пробиотика и антибактериального препарата способствует снижению риска развития кишечных расстройств, вызванных приемом антибактериальных препаратов.
РиоФлора Баланс Нео
инновационный мультивидовый пробиотик направленного действия
• Снижает риск возникновения кишечных расстройств, связанных с приемом антибиотиков: вздутие живота, нарушения стула – запор, диарея.
• Ускоряет восстановление микрофлоры кишечника, нарушенной приемом антибиотиков.1
• Бактерии выживают в агрессивной среде ЖКТ -можно применять в капсуле и без нее.
• Может храниться при комнатной температуре.
Курс приема – от 10 ДНБЙ
О )=
2 капсулы 2 раза в день 2 упаковки* При приеме антибиотиков взрослым и детям с 3 лет
*2 упаковки по 20 капсул
Противопоказания: индивидуальная непереносимость компонентов (в т.ч. сои и лактозы), острый панкреатит. Свидетельство о гос. регистрации:
РиоФлора Баланс Нео № 1?и.77.99.11.003.Е.010820.06.12 от 29.06.2012 г.; РиоФлора Иммуно Нео № №.77.99.11.003.Е.010819.06.12 от29.06.2012 г.
1. Koning C.J. et al. The Effect of a Multispecies Probiotic on the Intestinal Microbiota and Bowel Movements in Healthy Volunteers Taking the Antibiotic Amoxycillin. Am J Gastroenterol. 2008;103:178-189.
Информация о клиническом эффекте пробиотиков в профилактике ААД широко освещена в литературе. По результатам метаанализов, отмечается польза от назначения пробиотиков, причем более существенная от комбинации пробиотических штаммов бактерий [24, 25].
Применение биологически активной добавки РиоФлора Баланс Нео на фоне антибиотикотерапии снижает риск развития кишечных расстройств на трех уровнях:
1) в просвете кишечника полезные бактерии препятствуют размножению патогенной микрофлоры;
2) нормализует баланс микрофлоры кишечника;
3) активирует иммунитет, увеличивает уровень иммуноглобулинов.
Кроме того, прием РиоФлора Баланс Нео оказывает широкий спектр положительных эффектов: способствует улучшению функционального состояния кишечника при диарее и запорах; поддерживает и восстанавливает полезную микрофлору кишечника, снижая риск развития диареи при приеме антибиотиков [26].
РиоФлора Иммуно Нео содержит комбинацию из 9 штаммов: Bifidobacterium lactis W51, B. lactis W52, B. longum W108, Lactobacillus acidophilus W22, L. paracasei W20, L. plantarum W21, L. salivarius W24, L. lactis W19, Streptococcus thermophilus W69. Каждая кишечнорастворимая капсула содержит 5 х 108 КОЕ/г пробиотических микроорганизмов, оказывающих иммуномодулирующее действие. Имеются данные о том, что S. thermophilus и L. acidophilus тормозили адгезию и инвазию Escherichia coli в клетках кишечного эпителия человека, усиливая барьерную функцию эпителия [23]. Действие пробиотического комплекса РиоФлора Иммуно Нео направлено на активизацию иммунитета за счет увеличения уровня иммуноглобули-
нов и нормализацию микрофлоры кишечника [26]. Таким образом, РиоФлора Баланс Нео и РиоФлора Иммуно Нео близки по составу, но содержат разные бактериальные штаммы. В этих двух продуктах только три одинаковых штамма. Комбинация пробиотических штаммов в данных продуктах была подобрана таким образом, чтобы штаммы оказывали синергетический и симбиотический эффекты. Оба пробиотических комплекса РиоФлора нормализуют состав кишечной микробиоты.
Комплексные мультиштаммовые пробиотики РиоФлора способны восполнить конкретные функции кишечной микрофлоры. Из важных характеристик данных БАД следует отметить целенаправленную селекцию штаммов и наличие специального матрикса, имитирующего биопленку кишечника, благодаря чему обеспечивается сохранение жизнеспособных микроорганизмов при прохождении через пищеварительный тракт.
В проведенных зарубежных исследованиях отмечается высокий уровень безопасности данных комплексных пробиотиков [23, 24, 25].
ААД – это не единственное осложнение антибиотикотерапии. Восполнение микробного экобиоценоза важно с первого дня приема антибактериальных препаратов. РиоФлора Баланс Нео – единственный пробиотик, имеющий узкоспециализированное показание (снижение риска развития кишечных расстройств, вызванных приемом антибактериальных препаратов) и оптимально подобранный набор штаммов. Применяется детьми с 3 лет и взрослыми с первого дня приема антибиотиков в течение 10-14 дней.
ЛИТЕРАТУРА
1. Gnoth MJ, Kunz С, Saffran Е, RudLoff S. Human milk oligosaccharides are minimally digested in vitro. J Nutr, 2000, 130: 3014-3020.
2. Walker WA. Role of Nutrients and Bacterial Colonisation in the Development of Intestinal Host Defence. J Paediatr Gastroenterol Nutr, 2000, 30 (2): S2-S7.
3. Василенко В.В. Дисбактериоз – синдром раздраженного кишечника: эссе-анализ проблемы. Рос. журн. гастроэнтерол., гепатол., коло-проктол, 2000, 6: 10-13.
4. Хавкин А.И. Микрофлора пищеварительного тракта. М., 2006: 415.
5. Таточенко В.К. Педиатру на каждый день. Справочник по лекарственной терапии. М., 1997: 94.
6. Куваева И.Б, Ладодо К.С. Микроэкологические и иммунные нарушения у детей. М.: Медицина, 1991: 440.
7. Sullivan A, Edlund C, Nord CE. Effect of antimicrobial agents on the ecological balance of human microflora. Lancet infect. Dis. 2001, 1 (2): 101-114.
8. Шендеров Б.А. Медицинская микробная экология и функциональное питание. М., Грант, 1998, (1): 286, (2): 412.
9. Bignardi GE. Risk factors for Clostridium difficile infection. Journal of Hospital Infection, 1998, 40:1-15.
10. Gopal Rao G, Mahankali Rao CS, Starke I. Clostridium difficile-associated diarrhoea in patients with community-acquired lower res-
piratory infection being treated with ievofloxa-cin compared with b – lactam-based therapy. Journal of Antimicrobial Chemotherapy, 2003, 51: 697-701.
11. McFarland LV, Surawicz CM, Stamm WE. Risk factors For Clostridium difficile carriage and C. Difficile- associated diarrhea in a cohort of hospitalized patients. Journal of Infectious Diseases, 1990, 162: 678-84.
12. Бельмер С.В. Антибиотик-ассоциированный дисбактериоз кишечника. РМЖ, 2004 (12): 148-151.
13. Нижевич А.А., Хасанов Р.Ш., Нуртдинова Р.А., Очилова Р.А., Логиновская В.В., Кольметьева Л.Р. Антибиотик-ассоциированный дисбактериоз кишечника у детей. Детская гастроэнтерология, 2005, 2: 3-6.
14. Turck D, Bernet JP, Marx J et al. Incidence and risk factors of oral antibiotic-associated diarrhea in an outpatient pediatric populations. J. Pediatr. Gastroenterol. Nutr, 2003, 37 (1): 22-26.
15. Болезни кишечника у детей. Под общ. ред. А.М. Запруднова. М.: Анахарсис, 2009: 280.
16. Детская гастроэнтерология: руководство для врачей. Под ред. Н.П. Шабалова. М.: МЕДпресс-информ, 2011: 736.
17. Bergogne-Berezin E. Treatment and prevention of antibiotic associated diarrhea. Int. J. Antimicrob. Agent, 2000, 16(4): 521-526.
18. Щербаков П.Л., Цветков П.М., Нечаева Л.В. Профилактика диареи, связанной с приемом антибиотиков у детей. Вопросы современной педиатрии, 2004, (3), 2.
19. Wistrom J, Norrby SR, Myhre EB et al. Frequency of antibiotic-associated diarrhea in 2462 antibiotic-treated hospitalized patients: a prospective study. J. Antimicrob. Chemother., 2001, 47 (1): 43-50.
20. Golledge CL, Carson CF, Oneill GL et al. Ciprofloxacin and Clostridium difficile – associated diarrhea. Journal of Antimicrobial Chemotherapy, 1992, 30: 141-147.
21. Acar JF. A comparison of side effects of levo-floxacin to other agents concerning the ecological and microbiological effects on normal human flora. Chemotherapy, 2001, 47 (3): 15-23.
22. Бабаян М.Л. Современные методы профилактики антибиотико-ассоциированных диарей у детей. РМЖ, 2005 (13), 18: 1206-07.
23. McFarland LV. Meta-analysis of probiotics for the prevention of antibiotic associated diarrhea and the treatment of Clostridium difficile disease. Am. J. Gastroenterol., 2006, 101 (4): 812-822.
24. D’Souza A, Rajkumar C, Cooke J, Bulpitt C. Probiotics in prevention of antibiotic-associated diarrhea: meta-analysis. BMJ, 2002, 324 (8): 1361.
25. Johnston BC, Supina AL, Ospina M et al. Probiotics for the prevention of pediatric antibiotic-associated diarrhea Cochrane Database Syst Rev. 2007, 2: CD004827.
26. Листок-вкладыш к БАД к пище РиоФлора Баланс.
Как восстановить флору кишечника и очистить кишечник после приема антибиотиков
Вот что вам нужно знать, чтобы восстановить здоровье кишечника, помочь своей естественной флоре и выбрать пищевые добавки для здоровья кишечника после антибиотиков.
Стать самым здоровым человеком может показаться непреодолимой задачей, особенно потому, что наши тела могут быть невероятно загадочными и сложными. Но многие люди не знают, что существуют простые, конкретные, изученные способы улучшить свое здоровье, и большинство из них связано с кишечником.
Это потому, что ваше тело полагается на полезные бактерии, которые регулируют пищеварительную систему, поддерживают иммунитет, производство серотонина и многое другое. Вместо того, чтобы выяснять, как избавиться от вредных кишечных бактерий, вы обнаружите, что восстановление кишечной флоры и устранение полезных бактерий важнее.
Содержание
В этой статье наших друзей из Jetson Probiotics исследуются преимущества пробиотиков для смягчения воздействия антибиотиков и другие способы поддержания здоровья кишечника, заботясь о кишечном микробиоме.
☝️ ОТКАЗ ОТ ОТВЕТСТВЕННОСТИ ☝Эта статья предназначена только для информационных целей. Он не предназначен для использования в качестве замены профессиональных медицинских рекомендаций, диагностики или лечения.
Что такое микробиом кишечника?
Зачем кишечнику нужны бактерии (Тед Эд)Микробиом кишечника живет в толстом кишечнике и является домом для самых разнообразных бактерий во всем организме. Это потому, что, в отличие от любой другой части тела, ваш пищеварительный тракт представляет собой открытую экосистему, которая больше подвержена влиянию внешней среды, чем любая другая часть тела.
Что это значит? Что ж, микробиом кишечника может быть сформирован такими вещами, как пол, возраст, географические и социально-экономические условия, диета и состояние здоровья. Это также означает, что микробиом кишечника каждого человека будет разным и на него будут влиять разные факторы.
Хорошие бактерии и здоровье кишечника
Но нам десятилетиями говорили, что все бактерии – зло, поэтому, если вы задаетесь вопросом: «Полезна ли для вас флора?» прямо сейчас, значит, вы не одиноки. Не волнуйтесь, это широко распространенное мнение – миф.Фактически, теперь мы знаем, что бактерии в подавляющем большинстве безвредны, некоторые из них полезны, а лишь некоторые из них вредны.
Чтобы ваш кишечник оставался счастливым и вы были здоровы, это зависит от микробного разнообразия. По сути, должно быть много разных типов микробов, живущих вместе. Когда этого не происходит, это приводит к дисбактериозу, при котором недостаточно разнообразия, и некоторые бактерии могут бесконтрольно расти.
Когда происходит дисбаланс между хорошими и плохими бактериями, микробиом может стать несчастливым, что имеет последствия для пищеварения, воспаления, слизистой оболочки кишечника и даже настроения и здоровья мозга.
Кишечные бактерии и здоровье иммунной системы
Что наиболее важно, захват вредных бактерий может резко повлиять на иммунитет и оставить место для развития инфекций, болезней и хронических заболеваний. Кишечник – это первая линия связи между внешней средой и иммунной системой. Эти двое работают вместе, чтобы взаимно регулировать реакцию нашего организма на вредные патогены.
Но когда иммунная система и кишечник работают вместе, все работает гладко. Это стимулирует рост полезных бактерий, что улучшает иммунитет и работу кишечника.Он вызывает более сильную реакцию на болезнетворные микроорганизмы, в то же время делая организм более устойчивым к естественным кишечным бактериям.
Как антибиотики вредят здоровью кишечника?
Восстановление здоровья кишечника начинается с понимания бактерий в вашем желудочно-кишечном тракте.Антибиотики прописываются почти половине населения Великобритании каждый год от обычных заболеваний и в больницах для лечения и предотвращения серьезных инфекций. Вот наиболее распространенные применения антибиотиков:
| ушные инфекции | Инфекции носовых пазух |
| инфекции грудной клетки | Инфекции горла |
| Инфекции мочевыводящих путей, мочевого пузыря и почек | Кожные и раневые инфекции |
| пневмония |
К сожалению, антибиотики не останавливаются на вредных бактериях и не лечат вирусные инфекции, которые часто почти невозможно отличить от бактериальных.Вместо этого антибиотики убивают и хорошие бактерии, а это плохо, потому что хорошие бактерии часто помогают вашему организму бороться с инфекцией.
Многие люди также испытывают легкие или тяжелые побочные эффекты антибиотиков, особенно если их иммунное здоровье уже нарушено, например, пациенты в больницах. Более того, антибиотики могут оставлять место для чрезвычайно вредных бактерий, таких как кишечная палочка , C.diff и сальмонелла, – инфекции, которые могут быть настолько серьезными, что потребуется госпитализация.
Общие побочные эффекты антибиотиков
- понос
- дрожжевые инфекции
- газ
- рвота
- тошнота
- запор
Несмотря на то, что антибиотики очень эффективны при лечении бактериальных инфекций, важно принять необходимые меры предосторожности, чтобы поддержать микробиом кишечника, потому что сохранение хороших бактерий так же важно, как и уничтожение плохих.
Как лучше всего восстановить здоровье кишечника?
Диета, богатая пребиотическими растительными продуктами, питает микробиом кишечника.Ни для кого не секрет, что здоровье кишечника не является обязательным условием для достижения общего состояния здоровья. Поддерживать уровень полезных бактерий в микробиоме кишечника можно разными способами, включая диету и использование пробиотиков.
Все начинается с диеты. Хорошие бактерии насыщаются клетчаткой и питательными веществами в растительной пище – это пребиотики – и они превращают эти вещества в питательные вещества, которые питают слизистую оболочку кишечника и поддерживают баланс кишечного биома.
С другой стороны, пробиотические добавки содержат миллиарды бактерий из одного или нескольких штаммов бактерий, которые в определенных, изученных дозах приносят пользу вашему здоровью. Вот некоторые из самых известных и хорошо изученных пробиотических бактерий и дрожжей, которые вы найдете в добавках:
| Бифидобактерии | Лактобациллы |
| Лактококк | Сахаромицеты |
☝️ Что сообщает Atlas Biomed: ☝️ Ученые-микробиомы из Atlas подчеркивают, что преимущества пробиотиков могут быть временными для некоторых людей и сохраняться только до тех пор, пока они принимают добавки.
Сколько времени нужно, чтобы снова заселить кишечник полезными бактериями?
На этот вопрос нет простого ответа, потому что он зависит от состояния вашего микробиома, качества вашей диеты, принимаемых вами лекарств, уровня физической активности и многого другого. Однако микробиом кишечника очень легко адаптируется и реагирует на положительный образ жизни.
Итак, если вы придерживаетесь диеты с большим количеством цельных продуктов, богатых клетчаткой (ученые называют это пребиотиками) и добавляете пробиотические продукты или добавки, вы можете ускорить восстановление биома кишечника.Кроме того, регулярные упражнения, особенно кардио, связаны с большим разнообразием кишечника.
Как восстановить здоровую флору кишечника
Пробиотики в целом безопасны, и иногда их даже рекомендуется принимать во время курса антибиотиков, за исключением госпитализированных пациентов и людей с ослабленной иммунной системой. После этого они особенно полезны для восстановления микробиома кишечника.
☝️ СОВЕТ Не существует такой вещи, как диета с чистым кишечником – ваш кишечник очищается естественным образом.Тем не менее, вы можете помочь кишечным бактериям сохранить здоровье с помощью пребиотической диеты, богатой растениями.
Какие пробиотики при побочных эффектах антибиотиков?
Пробиотики борются с воздействием антибиотиков на полезные кишечные бактерииОбычно организму требуется время, чтобы сбалансировать микробиом до здорового, разнообразного уровня бактерий. Фактически, исследования показывают, что восстановление после повреждений, нанесенных антибиотиками, занимает около 6 месяцев. И даже тогда организм может даже не вернуться в то состояние, в котором он находился до антибиотика.
Saccharomyces boulardii , пробиотические дрожжи, особенно хороши для предотвращения и облегчения диареи, связанной с антибиотиками, и диареи путешественников. Это также друг кишечных бактерий, поддерживающий полезные бактерии и предотвращающий воспаления.
Lactobacillus acidophilus , пробиотическая бактерия, наиболее известная тем, что содержится в йогурте, также полезна для кишечника. Исследования показывают, что он помогает лечить и предотвращать инфекции, а также снижает побочные эффекты антибиотиков для пищеварения.
Другие бактерии, которые помогают восстановиться после употребления антибиотиков, включают:
- L. casei
- L. Rhamnosus GG
- L. Plantarum 299v
- B. subtilis
- B. coagulans lactospore
- B. clausii
Каковы долгосрочные последствия нарушения здоровья кишечника?
Ваше тело не только более восприимчиво к инфекциям, ослабленному иммунитету и хроническим воспалениям, но мы также знаем, что несбалансированная микробиота может увеличить риск более поздних хронических заболеваний, таких как болезни сердца, диабет, даже болезни Альцгеймера и Паркинсона.
Микробиом кишечника – это самая разнообразная по бактериальному составу часть вашего тела, и на него влияют то, что вы едите, пьете, уровень вашей активности и лекарства, которые вы принимаете. Это может показаться немного сложным, но для восстановления кишечника не нужно много времени: хорошее питание, регулярные упражнения и некоторая помощь пробиотических бактерий.
Изменения микробиоты кишечника человека, вызванные антибиотиками, для наиболее часто назначаемых антибиотиков в учреждениях первичной медико-санитарной помощи в Великобритании: систематический обзор
Введение
В Великобритании в период с 2000 по 2014 год количество рецептов на антибиотики увеличилось с 14.От 3 до 19,7 установленных суточных доз (DDD) на 1000 жителей в день. С тех пор объем прописывания антибиотиков снизился, достигнув 18,7 DDD на 1000 жителей в день в 2016 г. (http://www.oecd.org/). Неправильное и чрезмерное использование противомикробных препаратов не только в медицинском, но и в ветеринарном и сельскохозяйственном секторах приводит к повышению устойчивости, что в глобальном масштабе ограничивает наши возможности по борьбе с инфекциями. Снижение потребления антибиотиков – ключевая цель решения этой проблемы, и Соединенное Королевство внедрило меры по управлению противомикробными препаратами в первичной медико-санитарной помощи1 и разработало 5-летний план действий по борьбе с устойчивостью к противомикробным препаратам.2
Данные, проанализированные из базы данных The Health Improvement Network (THIN), показали, что средний уровень назначения антибиотиков среди участвующих практик составлял 626 назначений антибиотиков на 1000 пациентов (543–699 IQR), 69% из которых могут быть связаны с системой организма и / или или клиническое состояние.3 Из этих назначений 46% были связаны с инфекциями дыхательных путей (ИРО) и 22,7% – с инфекциями мочеполовых путей. Около половины всех прописанных антибиотиков составляли пенициллин, из которых примерно 55% составлял амоксициллин; за этим следует 13% макролидов и 12% тетрациклина.3 Частота консультаций с терапевтом (GP) в Англии и Уэльсе показывает, что четверть населения будет посещать своего терапевта из-за ИРТ каждый год.4 Использование антибиотиков для лечения такой инфекции варьируется в зависимости от конкретного врача и страны, 4–6, но составляет 60% всех назначений антибиотиков в общей практике.7–9 Аналогичным образом, инфекции мочевыводящих путей (ИМП) часто наблюдаются в учреждениях первичной медико-санитарной помощи.10 Пациенты часто лечатся антибиотиками, даже если инфекция часто не подтверждается микробиологически.11 Чрезмерное использование антибиотиков при состояниях, которые не являются серьезными или когда лечение антибиотиками не подходит для болезни, привело к снижению их эффективности и появлению устойчивых бактерий.
Нормальная микробиота кишечника состоит из примерно 800–1000 различных видов бактерий и более 7000 различных штаммов.12 «Нормальный» определяется как виды-комменсалы, преимущественно и постоянно встречающиеся в кишечнике здорового человека. Состав микробиомов пищевода и желудка отличается от микробиомов толстой кишки.Существует большее разнообразие видов и их количество на грамм содержимого в толстой кишке, что отражает более высокий уровень pH.13 14 В ядре микробиома здоровых людей преобладают типы Firmicutes и Bacteroidetes (более 90%), за которыми следуют Verrucomicrobia и Actinobacteria.13 Некоторые важные функции здоровой микробиоты кишечника включают выработку витаминов, метаболизм питательных веществ, иммуномодуляцию и защиту от инфекций путем ингибирования колонизации кишечника патогенами. Исследования микробиомов кишечника, проведенные в разных странах, выявили различия в разнообразии, которые отражают различия в диете, географии, воздействиях в раннем возрасте и генетике.15 Возраст, диета, антибиотики, пробиотики и пребиотики – все это способствует формированию здоровой микробиоты кишечника, и это продолжается динамично на протяжении всей жизни.13 14 16
Эти различия приводят к дисбиозу микробиома, и все больше доказательств того, что изменения микробиома человека могут влиять насколько хорошо функционирует иммунная система и ее способность противостоять инфекции17 18; повышают риск развития болезни Паркинсона, рассеянного склероза и болезни Альцгеймера 19, риска депрессии, тревоги или психоза20; и косвенно влияют на здоровье в долгосрочной перспективе и риск ожирения и диабета.21 Появляется все больше доказательств того, что микробиом имеет решающее значение для риска инфекционных осложнений у онкологического пациента.22 Недавние исследования показали, что воздействие антибиотиков в детстве связано с повышенным риском развития ряда заболеваний, включая ожирение, диабет 1 и 2 типа, воспалительные заболевания кишечника, Болезнь Крона, целиакия, аутоиммунные заболевания, такие как аллергия, ювенильный идиопатический артрит и астма.23–26. Похоже, что эти эффекты наиболее выражены, если антибиотики потребляются в течение первых 2 лет жизни, и эффекты вполне могут быть кумулятивными.17 27 28 Это особенно важно для маленьких детей, когда микробиом взрослого еще не сформировался полностью 29 30 После прекращения лечения антибиотиками микробиом может обладать определенной степенью устойчивости, будучи способным вернуться к составу, аналогичному исходному один, но это плохо изучено и может занять месяцы или даже годы.17 31
Различия в представлениях о том, насколько безрисково лечение антибиотиками, могут частично объяснять огромные различия в темпах их использования от практикующего врача к практикующему в разных местах и в разных странах, но также и в рамках конкретной группы практикующих врачей, таких как терапевты.Необходимо четко понимать реальную стоимость наиболее часто назначаемых антибиотиков в первичной медико-санитарной помощи, включая различия между отдельными противомикробными препаратами в их воздействии на микробиом. Эта информация будет особенно полезна для управления противомикробными препаратами в первичной медико-санитарной помощи.
Aim
Это исследование было направлено на изучение вызванных антибиотиками изменений в микробиоте кишечника при применении наиболее часто назначаемых антибиотиков в учреждениях первичной медико-санитарной помощи в Великобритании: тех, которые назначаются при ИРО и ИМП.Нашим первичным результатом было определение любых вызванных антибиотиками изменений в составе микробиома кишечника, измеряемых (1) численностью и / или (2) разнообразием микробов, в то время как наш вторичный результат измерял время, необходимое для восстановления микробиома. состояние до антибиотика.
Методы
Был проведен систематический обзор литературы по исследованиям, в которых оценивалась связь между антибиотиками, обычно назначаемыми при ИМП и ИМП в первичной медико-санитарной помощи, и их влиянием на микробиом кишечника.В качестве основы для этого обзора использовались предпочтительные элементы отчетности для систематических обзоров и метаанализов (PRISMA) (см. Дополнительную онлайн-таблицу S1, контрольный список PRISMA) 32. Протокол исследования был зарегистрирован под номером PROSPERO CRD42017073750 (http: // www. .crd.york.ac.uk / ПРОСПЕРО).
Стратегия поиска
Электронные базы данных MEDLINE, EMBASE и AMED использовались для выявления релевантных статей до мая 2020 года на английском языке, доступных в виде полного текста. Комбинация поисковых запросов включала следующие ключевые слова: (антибактериальные средства ИЛИ бактериальные инфекции) И (микробиота ИЛИ микробиом).Стратегия была разработана для выявления исследований, проводимых в любой стране, по изучению вызванных антибиотиками изменений микробиоты кишечника человека; анализируется на индивидуальном или популяционном уровне, публикуется на любом языке (вставка 1). Списки ссылок включенных исследований и соответствующие обзоры были изучены вручную для выявления дополнительных подходящих исследований. Все отобранные рефераты и цитаты были экспортированы из научных баз данных в программу управления ссылками EndNote X9 (Thompson Reuters, Нью-Йорк, Нью-Йорк, США), дубликаты исключены.
Box 1Стратегия поиска
Anti-Bacterial Agents / ae, pd, tu
Bacterial Infections / dt, mi
Microbiota /
(Микробиом или микробиомы или микробиомы кишечника или кишечника или микробиота кишечника или микробиота) .mp
Люди /
1 или 2
3 или 4
6 и 7
5 и 8
Выбор исследования и право на участие критерии
Исследование соответствовало критериям обзора, если в нем сообщалось о количественных изменениях микробиоты кишечника, вызванных лечением антибиотиками, которые чаще всего назначаются для лечения ИРТ и ИМП в учреждениях первичной медико-санитарной помощи (таблица 1).ИРО включали инфекции верхних дыхательных путей (ИВПТ), включая простуду, ларингит, фарингит / тонзиллит, острый ринит, острый риносинусит и острый средний отит, а также инфекции нижних дыхательных путей (ИДПТ), включая острый бронхит, бронхиолит, пневмонию и трахеит. . Мы включили неосложненные и рецидивирующие инфекции мочевыводящих путей (ИМП и ИМП). Мы исключили исследования на животных или в больницах.
Таблица 1Критерии PICOS для включения и исключения исследований
Основным проявлением интереса в этом обзоре было влияние обычно назначаемых антибиотиков на микробиом кишечника на основе рекомендаций по рецептам, включенных в Национальный институт здравоохранения и качества ухода (NICE) руководящие принципы1 8 33–35 и о текущем использовании, как описано в национальных отчетах об использовании антибиотиков.1 34 Особый интерес представляют те антибиотики, которые обычно используются в первичной медико-санитарной помощи для лечения ИРО верхних и нижних отделов (амоксициллин, феноксиметилпенициллин, доксициклин, коамоксиклав, эритромицин, кларитромицин) и ИМП (триметоприм, нитрофурантоин, амоксициллин) .
Скрининг, извлечение данных и управление
Пять рецензентов (VW, KTE, EvdW, LD и AH) независимо проверяли результаты поиска и оценивали каждое потенциальное исследование в соответствии с критериями включения и исключения.Все решения записывались в электронную таблицу. Были получены полнотекстовые статьи для всех подходящих исследований, и три рецензента (VW, KTE, AH) независимо друг от друга проверили выбранные статьи во второй раз.
Следующие данные были извлечены из включенных исследований в электронную таблицу Excel одним рецензентом (KTE) и процентная доля, подтвержденная на точность другим (VW): автор, журнал, год публикации, дизайн исследования, страна исследования, количество участников , количество участников, представляющих интерес для этого обзора, возрастной диапазон, процент женщин-участников, другие критерии включения, критерии исключения, методы набора, период времени набора, тип образца, первичный результат, вторичный результат, использованный антибиотик (представляющий интерес для данного обзора) , любые другие использованные антибиотики, доза антибиотиков (антибиотика, представляющего интерес для этого обзора), временной ход (антибиотика, представляющего интерес для этого обзора), количество временных точек для сбора образцов, временные точки для каждого сбора образцов, метод тестирования, инфекция или состояние, общее заключение.Для этого обзора была разработана сводная таблица, которая включала идентификатор исследования, страну, дизайн, популяцию, условия, инфекцию, интересующий антибиотик, образец и анализ, первичный результат и основные результаты (таблица 2).
Таблица 2Сводка исследований, включенных в обзор
Оценка методологического качества
Систематическая ошибка отбора оценивалась с помощью контрольного списка Программы критических навыков оценки (CASP) (www.casp-uk.net). Каждый компонент исследований (т. Е. Соответствие дизайна исследования исследуемому вопросу, риск систематической ошибки выбора, измерение воздействия и оценка результатов) был оценен, и общая градация использовалась для создания диаграмм оценки качества на основе системы светофора. «низкий», «высокий» и «неясный» или «неприменимо», как рекомендовано Кокраном.36 Три составителя обзора (VW, KTE, EvdW) независимо друг от друга оценили риск систематической ошибки в исследованиях с двумя составителями обзора (KTE, VW), оценивающими все исследования, и расхождения были устранены на основе консенсуса между составителями обзора.
Синтез и анализ данных
Из-за недостаточного количества доступных исследований мы не смогли провести какой-либо анализ чувствительности для определения надежности результатов и качества исследований.36 Результаты обсуждаются описательно.
Участие пациентов и общественности
Это исследование было проведено без участия пациентов.
Характеристики исследования
Отбор проб
Образцы фекалий обычно считаются репрезентативными для кишечной микробиоты. В исследованиях, проведенных до 2000 года, использовались культивированные гомогенизированные образцы фекалий на неселективных и селективных средах для подсчета различных типов колоний. Некоторые изолированные чистые культуры для идентификации на уровне рода. Эффект антибиотика измеряли путем сравнения количества бактерий, присутствующих от каждого рода до обработки, с уменьшением, увеличением чрезмерного роста или размножения других бактерий.Однако известно, что многие типы кишечных бактерий, около 80%, не культивировались.67 В более поздних исследованиях преимущественно использовались более быстрые молекулярные методы.
Аналитические методы
Во всех исследованиях анализировались пробы фекалий либо культурально (17 исследований), либо молекулярными методами (13 исследований), в одном исследовании использовались оба метода. В восемнадцати исследованиях участвовали здоровые добровольцы, в четырех исследованиях изучались пациенты с респираторной инфекцией, в трех исследованиях пациенты страдали ИМП, в одном исследовании сообщалось о пациентах с инфекциями мочевыводящих путей и дыхательных путей, у одного пациента был синусит, в одном исследовании – пародонтит, в другом исследование основывалось на сообщениях о самооценке инфекций, а в двух исследованиях состояние здоровья участников не уточнялось.
Риск систематической ошибки
Риск систематической ошибки среди исследований оценивался с помощью контрольных списков CASP для случаев контроля, рандомизированных контролируемых испытаний (РКИ), других испытаний и когортных исследований (рис. 2). Было проведено 1 оценка случай-контроль, 15 когортных исследований и 15 испытаний. Все исследования адекватно излагали цели и гипотезы своих исследований, и эта часть оценки была оценена как «низкий» риск.
Рисунок 2Общий риск оценки систематической ошибки для тематических исследований (A), когортных исследований (B) и испытаний (C).
Случай – контроль
В наш обзор было включено одно исследование случай – контроль пациента с началом диареи, не связанной с инфекцией Clostridium , в течение 24 часов после введения антибиотика.49 Было показано, что это было связано с изменениями в разнообразие микробиоты кишечника. Что касается систематической ошибки, исследование имеет тенденцию к общему неясному риску, поскольку отсутствуют средства контроля, а в отчете подробно описывается только один пациент в клинических условиях с интересующим симптомом (рис. 2A).Однако они использовали очень надежные молекулярные методы для изучения этих временных изменений разнообразия микробиоты.
Когорты
В наш обзор было включено 15 когортных исследований. Оценка достоверности исследования рассматривается в вопросах 1–6 (рисунок 2B). В целом эти исследования были низкого риска. Надежность исследований, определяемая размером эффекта и тем, насколько точно он был оценен, рассматривается в вопросах 7–9 и имеет низкий или неясный риск.Существует больший неясный риск, когда речь идет о применимости результатов (вопросы 10–12), полезности для принятия клинических решений, часто размер популяции был слишком мал, чтобы экстраполировать результаты на большую популяцию в целом.
Испытания
Пятнадцать исследований, включенных в этот обзор, были испытаниями / РКИ, и общий риск был более неясным. Валидность исследований (Q1-6), рандомизация и маскировка назначения лечения в целом были низкого риска. Исходные характеристики исследования имели низкий или неясный риск, поскольку в большинстве исследований указывались возраст, пол и состояние здоровья, за некоторыми исключениями указывались индекс массы тела и этническая принадлежность.Последующее наблюдение за участниками исследования было низкого риска, при этом в большинстве исследований образцы берутся в течение 4 недель после введения антибиотика (хотя есть некоторые признаки того, что это должно быть дольше). Контроль вмешивающихся факторов (Q6) не был ясен в большинстве исследований. Величина лечебного эффекта (Q7) была хорошо известна, но точность (Q8) была неясной, в основном из-за небольшого размера популяции и отсутствия статистического анализа. Возможность переноса результатов на другие группы населения (Q9 и 11) представляла неясный риск.
Воздействие антибиотиков на кишечник
В проанализированных исследованиях использовались различные методологии для изучения воздействия антибиотиков на микробиоту кишечника. Они последовательно демонстрируют, что дисбактериоз развивается при приеме антибиотиков, что происходит быстро и приводит к потере разнообразия и сдвигу в численности кишечных микробов вверх или вниз. После лечения антибиотиками композиция обычно возвращается к аналогичному состоянию до обработки в течение нескольких недель, но не во всех случаях.Здесь мы описываем результаты более подробно для каждого интересующего антибиотика.
Амоксициллин
Десять исследований изучали влияние перорального амоксициллина на нормальную микрофлору кишечника и суммированы в таблице 3.37–46. Вкратце, введение амоксициллина приводит к увеличению или чрезмерному росту энтеробактерий (шесть исследований). Изменения в анаэробной популяции (включая Lactobacillus, Bifidobacterium и Bacteroides ) сильно различались между исследованиями: от отсутствия изменений до увеличения и / или уменьшения, а также изменений в разнообразии.Было два сообщения об изолировании Clostridium и Candida и два, в которых не наблюдалось никаких изменений в количестве. В восьми исследованиях проводилось более длительное наблюдение, и в большинстве из них сообщалось, что популяция вернулась к норме в течение 2–4 недель. В трех исследованиях сообщалось, что значительные изменения в разнообразии или численности микробиома все еще были очевидны в период от 42 дней до 6 месяцев после последней дозы антибиотика. Другими более долгосрочными эффектами были сохранение Candida через 6 недель, появление других аэробных или устойчивых грамотрицательных бактерий (виды не указаны) через 28 дней и стойкое снижение количества Lachnospiraceae через 6 месяцев без сходства в популяциях. обрабатывали.
Таблица 3Влияние амоксициллина на микрофлору желудочно-кишечного тракта
Christensson et al 42 провели культурально-зависимое рандомизированное исследование 84 субъектов с инфекциями нижних дыхательных путей, 38 из которых завершили лечение амоксициллином (остальные получали цефаклор и не будут будет обсуждаться далее здесь). Они показали, что количество энтеробактерий, анаэробных грамположительных лактобактерий, бифидобактерий и эубактерий и анаэробных бактерий значительно увеличилось в группе амоксициллина.Количество анаэробных кокков уменьшилось у 18 пациентов и увеличилось у 11 пациентов. Не было изменений в численности Enterococcus spp, Staphylococcus spp или Streptococcus spp. Четыре пациента были колонизированы Pseudomonas sp и пять – C. albicans . Хотя C. albican s также был выделен у двух пациентов до лечения и у трех пациентов через 6 недель после лечения. C. difficile был выделен у двух пациентов во время лечения.
Влияние амоксициллина на микрофлору кишечника пациентов с бронхитом оценивалось в рандомизированном исследовании Floor и др. .46 Анаэробная флора оставалась неизменной как во время, так и после терапии амоксициллином. Общее количество аэробных грамотрицательных палочек значительно увеличилось, и у 37,5% пациентов с недавно приобретенными бактериями основными идентифицированными видами были Klebsiella . Энтерококки были культивированы только у одного пациента. У трети пациентов были другие аэробные бактерии, отличные от исходного уровня на 21–28 дни.Обилие бактерий и грибков вернулось к исходному уровню через 21 день после лечения.
Mangin et al 41 изучали 18-месячных детей с острым бронхитом. Как общее количество бактерий, так и количество бифидобактерий были одинаковыми во время курса лечения антибиотиками. Однако изменения в Bifidobacterium на уровне видов показали снижение разнообразия. Лечение амоксициллином привело к полному исчезновению видов Bifidobacterium adolescentis , значительному снижению частоты встречаемости Bifidobacterium bifidum , но не повлияло на Bifidobacterium longum и Bifidobacterium pseudocatenulatum / Bifidulatumterium .Они не изучали более долгосрочные эффекты.
Монреаль и др. 38 использовали методы, основанные на культуре, для исследования популяций фекальных бактерий у 22 пациентов с ИРО, получавших амоксициллин. Bacteroides spp, Bifidobacterium spp и Lactobacillus spp были уменьшены при лечении антибиотиками. Однако это было временным явлением, и через 30 дней после окончания лечения уровни Bifidobacterium и Lactobacillu s вернулись к своим нормальным значениям. Бактероиды восстанавливались медленнее.
Ladirat et al. 45 изучали небольшое количество здоровых добровольцев с амоксициллином и пребиотиком, в частности, на общее количество бактерий и Bifidobacterium . Количество Bifidobacterium уменьшилось со временем из-за лечения амоксициллином, особенно в группе без пребиотика. Амоксициллин повлиял на численность и разнообразие Bifidiobacterium spp, и наблюдался чрезмерный рост Enterobacteriaceae.Наблюдения были очень индивидуально зависимыми. В период наблюдения (через 3 недели после прекращения лечения амоксициллином) уровни бифидобактерий в кале вернулись к исходным уровням.
Амоксициллин вводили случайным образом небольшому количеству здоровых добровольцев, а влияние на микрофлору кишечника (и ротоглотку) изучали Brismar et al. .43 В аэробной кишечной флоре наблюдалось незначительное снижение количества стрептококков и стафилококков. наблюдаемый.Разрастание видов Klebsiella наблюдалось у шести субъектов и видов Enterobacter у двух субъектов. Разрастания энтерококков или дрожжей не наблюдалось. В анаэробной микрофлоре уменьшилось только количество эубактерий. Не было колонизации C. difficile . Через две недели после введения амоксициллина микробиота вернулась к исходному уровню.
Другое исследование влияния амоксициллина на микрофлору кишечника здоровых добровольцев показало лишь небольшие изменения в аэробной микрофлоре фекалий.44 Все основные группы анаэробных бактерий не были затронуты амоксициллином, и не было колонизации C. difficile . Наблюдался чрезмерный рост Klebsiella spp у шести субъектов и Enterobacter у двух субъектов. Микрофлора кишечника нормализовалась через 2 недели после прекращения лечения.
Шесть здоровых добровольцев получали амоксициллин перорально в течение 5 дней, а их фекальную микробиоту исследовали с помощью амплификации гена 16S рРНК и градиентного гель-электрофореза до 60 дней.37 Профили доминирующего видового разнообразия сравнивались на основе сходства с процентным соотношением при первой выборке в диапазоне от 93% до 99%. В течение 5-дневного курса лечения амоксициллином эти проценты снизились в среднем до 73%, но между людьми наблюдались огромные различия. К 60 дню пять из шести испытуемых гелевых профилей вернулись к своему почти исходному составу. Образцы гелевых полос были исследованы более подробно для трех человек, и было показано, что они соответствуют Clostridium nexile , Ruminococcus Torques и β- Proteobacteria .
Abeles et al 40 изучали сожителей в течение 6 месяцев, когда одному давали антибиотик, а другому плацебо. Микробиота субъектов, принимавших амоксициллин, со временем становилась все более разнородной, хотя и не статистически значимой, поскольку аналогичные тенденции наблюдались и у субъектов, принимавших плацебо. Таксономический состав кишечника отличался после терапии амоксициллином. Lachnospiraceae были значительно уменьшены и оставались уменьшенными через 6 месяцев. Veillonellaceae, Bacteroidales и Porphyromonadaceae были значительно снижены в ответ на амоксициллин, тогда как Fusobacteriaceae были увеличены. Bifidobacteriales и Erysipelotrichaceae были первоначально уменьшены, а затем увеличены по сравнению с их соседями по дому, принимавшими плацебо.
Pallav et al. 39 изучали эффект лечения амоксициллином с пребиотиком и без него. У восьми субъектов, получавших только антибиотик, произошли существенные изменения микробиома, в первую очередь увеличение количества Escherichia / Shigella . В контрольной группе изменений численности не было. Изменения, связанные с приемом антибиотиков, сохранялись до конца исследования, через 42 дня после окончания терапии антибиотиками.
Амоксициллин с клавулановой кислотой
В семи исследованиях изучали влияние амоксициллина в комбинации с клавулановой кислотой на микробиоту кишечника.31 47–52 Они суммированы в таблице 4. Вкратце, комбинация амоксициллина с клавулановой кислотой вызывала легкое – умеренные изменения в составе микробиома, в основном увеличение количества энтеробактерий с различным воздействием на анаэробные бактерии Bifidobacterium sp, Lactobacillus sp и Bacteroides sp и общее снижение разнообразия.В одном исследовании сообщалось, что численность бактерий не нормализовалась через 2 месяца после прекращения лечения антибиотиками, а четыре сообщенных уровня были аналогичны исходному уровню в течение 35 дней.
Таблица 4Влияние амоксициллина с клавулановой кислотой на микрофлору желудочно-кишечного тракта.
Введение амоксициллина / клавулановой кислоты здоровым людям привело к увеличению количества энтерококков и штаммов Escherichia coli в аэробной микрофлоре, в то время как бифидобактерии, лактобациллы и клостридии значительно снизились.51 Количество анаэробных кокков и Bacteroides существенно не изменилось. C. difficile. штаммов были выделены у трех добровольцев. У всех добровольцев микрофлора нормализовалась через 35 дней.
Янг и Шмидт49 исследовали краткосрочное воздействие амоксициллина / клавулановой кислоты, назначенного пациенту-мужчине с острым синуситом, у которого развилась диарея, связанная с антибиотиками. Было показано, что основные группы бактерий частично восстановились через 14 дней после лечения антибиотиками, за исключением Bifidobacterium .Во время введения антибиотика не было обнаружено никаких последовательностей, соответствующих продуцирующему бутират Clostridium кластеру XIVa, но через 2 недели после прекращения приема антибиотиков этот кластер снова появился. В этом тематическом исследовании уменьшение этого кластера может быть связано с диареей, связанной с антибиотиками.
В одном из этапов исследования Engelbrektson et al. 50 наблюдались эффекты лечения пробиотиками одновременно с терапией антибиотиками на сообщества фекалий. Они проанализировали свои данные, измерив индивидуальные отклонения от исходного уровня после лечения, чтобы решить проблему индивидуальной вариабельности.Субъекты делятся на две категории: те, у кого стабильная исходная микробиота, и те, у которых она значительно различается. Данные по культивированию показали увеличение количества Bacteroides и Enterobacteriaceae, но отсутствие тенденции для Clostridium , Bifidobacterium и Lactobacillus . Группа антибиотиков (без пробиотика) имела значительное изменение количества бактерий по сравнению с исходным уровнем на 21 день.
Forssten et al 48 также изучали введение антибиотиков в комбинации с пробиотиком.Потребление комбинации пробиотиков в основном приводило к увеличению уровня фекалий видов, включенных в препарат. Антибиотик оказал лишь незначительное воздействие на Lactobacillus , Bifidobacterium , Bacteroides , Enterobacteriaceae и Clostridium .
Korpela et al. 31 изучали макролиды амоксициллин с клавулановой кислотой и пенициллином V и без них. Использование макролидов снизило численность актинобактерий и увеличило количество бактерий и протеобактерий.Группы пенициллина не имели отчетливо различного филового состава. Фирмикуты сократились. Эффект от использования макролидов был продолжительным и был связан с повышенным риском астмы и набором веса, связанным с приемом антибиотиков.
Двенадцать здоровых субъектов получали амоксициллин / клавуланат в течение 7 дней, а образцы их стула были проанализированы с использованием пиросеквенирования гена 16s рРНК52. Изменения, связанные с антибиотиками, включали снижение распространенности рода Roseburia и увеличение числа Escherichia , Parabacteroides и Энтеробактер .Изменения микробиоты вернулись к исходному уровню, но полностью не восстановились через 2 недели после лечения.
ПЦР в реальном времени с гель-электрофорезом в временном градиенте температуры (TTGE) показала, что в конце 5-дневного курса амоксициллин-клавулановой кислоты общие концентрации бактерий и бифидобактерий были значительно снижены у 18 здоровых добровольцев47. профили среднего процента сходства были значительно уменьшены, и количество различных видов Bifidobacterium на образец значительно уменьшилось.Через два месяца после воздействия антибиотика средний процент сходства не нормализовался.
Нитрофурантоин
В трех исследованиях изучалось влияние макрокристаллов нитрофурантоина на состав фекальной микробиоты.53–55 В двух исследованиях использовалось секвенирование гена 16S рРНК и в одном исследовании бактериальная культура, и они суммированы в таблице 2. Нитрофурантоин ингибирует бактериальную ДНК, РНК и клеточную стенку. синтез белка. Он используется в профилактических целях в качестве мочевого противоинфекционного средства против большинства грамположительных и грамотрицательных организмов, а также для длительного подавления инфекций.При пероральном применении большая часть нитрофурантоина быстро всасывается в тонком кишечнике и выводится в основном за счет клубочковой фильтрации почек в мочу, где он достигает более высоких и эффективных терапевтических концентраций. Лишь небольшое количество достигает толстой кишки, что может объяснить незначительное влияние на микрофлору кишечника.
В одном из исследований была изучена небольшая группа женщин (n = 7) с рецидивирующими ИМП, и оно показало, что нитрофурантоин не изменял ни энтеробактерии, ни энтерококки, ни дрожжи кишечной флоры во время лечения.55 Резистентных штаммов грамотрицательных аэробных бактерий обнаружено не было.
Stewardson et al. 53 пациентов с ИМП (n = 10) лечили макрокристаллами нитрофурантоина и показали, что это не было связано со статистически значимым глобальным воздействием на микробиоту кишечника (слабый эффект). Лечение нитрофурантоином было связано с увеличением доли рода Faecalibacterium и уменьшением доли Clostridium (Clostridiaceae) в конце лечения антибиотиками.В другом небольшом исследовании (n = 8) изучались неосложненные ИМП, и не было выявлено какого-либо значительного влияния лечения нитрофурантоином на фекальную микробиоту, кроме временного увеличения филума актинобактерий, в частности полезных видов Bifidobacterium 54. до уровней до антибиотиков через 31-43 дня после прекращения лечения антибиотиками, в то время как в другом исследовании не проводилось последующее тестирование.53 54
Доксициклин
В четырех исследованиях сообщалось о влиянии доксициклина на фекальную микробиоту, в одном исследовании использовалась субоптимальная дозировка 20 мг в течение 9 месяцев) у пациентов с пародонтитом57 и двое в обычной дозе 100-150 мг в течение 7-10 дней, хотя один также с пробиотиком 56 58 и другой в низкой дозе (40 мг в течение 16 недель) 59, как описано в таблице 2.Лечение доксициклином существенно не повлияло на подсчет общего количества анаэробных бактерий, кандида, кишечных бактерий, Staphylococcus или резистентных к доксициклину бактерий, выделенных в любой из периодов отбора проб, и не привело к развитию множественной устойчивости к антибиотикам57. 58 специально оценили влияние терапии доксициклином на состав и чувствительность кишечных бифидобактерий к антибиотикам у девяти субъектов, которые также принимали пробиотики, и сравнили их со взрослыми, потребляющими только пробиотики.Во время терапии доксициклином наблюдалось заметное снижение разнообразия популяций Bifidobacterium . Устойчивые к тетрациклину Изоляты Bifidobacterium чаще выявлялись в группе антибиотиков, чем в контрольной группе, что увеличивало пул устойчивых комменсальных бактерий в кишечнике.
В другом исследовании с участием 10 здоровых добровольцев доксициклин уменьшал количество Enterobacteriaceae, Enterococcus spp, E. coli и Streptococcus spp.56 За исключением Fusobacterium spp, который был элиминирован, количество анаэробных бактерий в фекалиях не зависело от доксициклина. 56 После введения доксициклина численность бактерий вернулась к уровню до антибиотика через 9 дней после прекращения лечения. 56 В четвертом исследовании также изучалась низкая доза в течение 16 недель.59 Наблюдалось 2 log уменьшения количества энтерококков и E. coli . Другие аэробные микроорганизмы, включая энтеробактерии, Candida spp, не были затронуты.Не было значительных изменений в количестве анаэробных лактобацилл, бифидобактерий, клостридий и Bacteroides во время введения доксициклина.59 Штаммов C. difficile не было выделено. Аэробная и анаэробная микрофлора была нормальной через 28 дней после прекращения лечения.59 Таким образом, доксициклин влияет на способность микроорганизмов вырабатывать белки. В субоптимальной дозировке он мало влияет на микробиоту кишечника, за исключением энтерококков и E.coli . При нормальной дозировке он заметно влияет на разнообразие популяций бифидобактерий в одном исследовании и элиминировал Fusobacterium sp в другом. Воздействие на популяции других кишечных бактерий кажется временным, и к 28 дням сообщалось о нормализации. Долгосрочные эффекты неизвестны.
Кларитромицин
Включены четыре статьи о влиянии кларитромицина. Трое из одного и того же научно-исследовательского института исследовали микрофлору кишечника здоровых добровольцев до, во время и после введения кларитромицина.Дизайн исследования был схожим во всех трех исследованиях и включал небольшое количество участников, 10 (смесь мужчин и женщин) в двух исследованиях60 62 и только 12 мужчин61, как описано в таблице 2. Дозировка и стратегия отбора фекалий и анализ также были схожими, 250 мг два раза в день в течение 7 дней, 59 500 мг два раза в день в течение 7 дней, 60 и 250 мг два раза в день в течение 10 дней, 62 взятия проб три раза во время и три-четыре раза после введения в течение до 35 дней. Субъектам только мужского пола вводили другой антибиотик с 6-недельным периодом вымывания; неясно, было ли это до или после введения кларитромицина.
Основным результатом более раннего исследования было снижение количества энтеробактерий и стрептококков. Lactobacilli, Bifidobacteria и Bacteroides были подавлены в анаэробной микрофлоре60.
Кларитромицин вызвал значительное снижение содержания E. coli в течение 7 дней лечения, но уровни вернулись к норме через 28 дней после окончания курса61. устойчивыми аэробными грамотрицательными палочками: Citrobacter , Klebsiella , Proteus и Pseudomonas .Общее количество анаэробных бактерий уменьшилось. Bifidobacteria и Bacteroides были значительно уменьшены, а Lactobacilli и Clostridia были подавлены, но это не было значительным. Не было обнаружено избыточного роста C. difficile или дрожжей. Микрофлора нормализовалась у всех испытуемых через 35 дней.
В последнем исследовании количество E. coli было значительно снижено, а у шести человек произошло разрастание Klebsiella , Citrobacter и Enterobacter spp.62 Общее количество анаэробных кишечных бактерий не изменилось, но количество лактобацилл и бифидобактерий было значительно снижено, что сохранялось на протяжении всего исследования. Не было значительного избыточного роста Candida spp, и ни один субъект не был колонизирован C. difficile .
Четвертое исследование, проведенное в другой группе на шести здоровых добровольцах, не показало изменений в численности Candida spp, Enterococcus spp или анаэробных бактерий.Не было новой колонизации C. difficile . Количество Enterobacteriaceae несколько снизилось. Сообщалось, что уровни вернулись к исходному к 21 дню после курса кларитромицина.
Подводя итог, все четыре исследования сообщили о снижении количества энтеробактерий, а три – о подавлении анаэробных бактерий после введения кларитромицина. Это снижение было временным для большинства видов, за исключением Lactobacilli и Bifidobacteria. Только в одном исследовании сообщалось о выделении C.albicans. 60 Не сообщалось о новой колонизации или чрезмерном росте C. difficile . Все сообщили о нормализации до исходного уровня в течение 28 дней после окончания лечения антибиотиками.
Феноксиметилпенициллин
Феноксиметилпенициллин не оказал большого влияния на микробиом кишечника, как показали два исследования, в которых изучалось его влияние на ротоглоточную и кишечную микрофлору здоровых добровольцев (таблица 2) .64 65 В очень раннем исследовании сообщалось об отсутствии эффекта феноксиметилпеницилла на обилие различных видов, составляющих аэробную и анаэробную флору фекальных проб.64 Более позднее исследование показало, что никаких значительных изменений в общей аэробной и анаэробной микрофлоре кишечника не наблюдалось, хотя три добровольца были вновь колонизированы Klebsiella sp, а один имел большое количество неферментативных грамотрицательных палочек. На количество стрептококков viridans, энтерококков и Bacillus не повлияло введение феноксиметилпенициллина, в то время как незначительные изменения были замечены в количестве E. coli .Средние значения видов Clostridium увеличились во время введения, в то время как количество видов Bacteroides не изменилось в течение периода исследования. Через 2 недели после отмены препаратов микрофлора нормализовалась.
Эритромицин
В раннем исследовании 66 было показано, что введение 500 мг эритромицина два раза в день в течение 7 дней 10 добровольцам привело к снижению численности как аэробной, так и анаэробной фекальной флоры. Кроме того, всех субъектов колонизировали потенциально патогенные устойчивые к эритромицину энтеробактерии, клостридии или дрожжи.66 Брисмар и его коллеги60 вводили эритромицин перорально в течение 7 дней 10 добровольцам и оценивали его влияние на бактерии толстой кишки. Они обнаружили уменьшение количества стрептококков, энтерококков и энтеробактерий во время приема, увеличение количества стафилококков и изменение анаэробных бактерий.
Обсуждение
Основные выводы
В этом систематическом обзоре изучалось использование наиболее часто назначаемых антибиотиков в первичной медико-санитарной помощи для лечения ИРТ и ИМП и их влияние на микробиоту кишечника.Во-первых, исследования показали, что антибиотики влияют на численность бактерий в кишечном сообществе, вызывая быстрое снижение уровня бактериального разнообразия и таксономического богатства, увеличение и уменьшение относительной численности определенных таксонов, что также приводит к дисбактериозу. как антибиотик и индивидуальные специфические эффекты хозяина.
Во-вторых, после прекращения лечения имелись некоторые, но скудные доказательства того, что кишечные бактерии проявляют устойчивость и способны в некоторой степени восстанавливаться до исходного состояния.Однако микробиота часто не восстанавливается полностью, что позволяет предположить, что некоторые антибиотики оказывают стойкое воздействие на определенные виды. Эти наблюдения подчеркивают важность ограничительного и правильного использования антибиотиков для предотвращения долгосрочных экологических нарушений местной микробиоты.
Сравнительные наблюдения
В других обзорах также сообщается и обобщается, как антибиотики изменяют численность и разнообразие кишечной микробиоты.68–70 Здесь мы сосредоточимся на тех антибиотиках, которые обычно назначаются врачами общей практики (ВОП) в первичной помощи.Часто врачи ненадлежащим образом назначают антибиотики при инфекциях, вызванных вирусами, или назначают антибиотики широкого спектра действия, когда следует использовать антибиотики для определенных бактерий. Они также могут прописать неправильную дозу или на неправильный период времени. Медицинские работники обеспокоены тем, что антибиотики используются слишком часто и неправильно, что способствует устойчивости к противомикробным препаратам, а с дополнительным нарушением микробиома также может иметь другие негативные (долгосрочные) последствия для здоровья, такие как метаболические и иммунные нарушения.71 72 Эти дополнительные эффекты будут в дальнейшем влиять на пациента и, возможно, на бремя первичной медико-санитарной помощи. Неправильное назначение связано со многими факторами, включая пациентов, которые настаивают на приеме антибиотиков, врачей общей практики, у которых нет времени, чтобы объяснить, почему антибиотики не нужны, тех, кто не знает, как распознать серьезную бактериальную инфекцию, или тех, кто слишком осторожен.
Количественная оценка воздействия антибактериальной терапии на кишечную флору является сложной задачей. Хотя в литературе описывается «нормальный», на самом деле это означает те комменсальные виды, которые постоянно и преимущественно встречаются в здоровом кишечнике человека.Исследования, оценивающие изменения флоры, было бы легче интерпретировать, если бы в каждом случае были установлены исходные популяции. Мы обнаружили отсутствие крупномасштабных испытаний (включая РКИ) и обсервационных исследований, а также неоднородность методологии и результатов. Неоднородность проявляется в несоответствии дозировки, продолжительности лечения и последующего наблюдения, выбора и спектра используемых антибиотиков, которые способствуют различным концентрациям в фекалиях. Состояние здоровья и возраст участника также имеют значение, в большинстве исследований четко не определены исходные характеристики, что вызывает проблемы при сравнении результатов.В большинстве исследований не сообщалось о побочных эффектах или каких-либо других факторах, которые могли бы повлиять на эффективность антибиотика, что, в свою очередь, могло бы повлиять на результат для микробиома. В исследованиях использовались различные методы, например, случайное распределение антибиотиков среди здоровых добровольцев или нерандомизированное лечение, при котором все здоровые субъекты в исследовании получали антибиотики, также некоторые участники исследований были скрыты от того, какое лечение они получали, а другие нет. Между исследованиями были различия в способах определения и измерения результатов, например, культивирование и молекулярные методы.Эти различные аналитические методы могут привести к различиям в наблюдаемых эффектах вмешательства. Ряд включенных исследований был проведен одной исследовательской группой, что может добавить дополнительную систематическую ошибку к результатам. Различные классы антибиотиков также по-разному влияют на микробиом, что затрудняет сравнение между исследованиями.
Состав кишечной микробиоты людей значительно варьируется от субъекта к субъекту. Группировка данных от нескольких лиц может привести к потере статистической значимости.В исследованиях не учитываются какие-либо мешающие факторы, такие как диета, возраст испытуемых, воздействие антибиотиков в детстве, географическое положение, стресс или прием пробиотических добавок, все из которых могут усложнить воздействие конкретных антибиотиков на профиль микробиома кишечника. Эти факторы могут меняться в течение жизни.
Сильные стороны и ограничения
Основная сила этого исследования заключается в том, что мы сосредоточили внимание на наиболее часто назначаемых антибиотиках в первичной медико-санитарной помощи и их влиянии на микробиоту кишечника.Информация о том, как эти обычно назначаемые антибиотики влияют на микробиом кишечника, может повлиять на принятие решения терапевтом при назначении антибиотиков. Кроме того, большое значение имеет неблагоприятное воздействие антибиотиков на микробиом кишечника, поскольку в случае его нарушения оно может быть связано с множеством заболеваний, включая восприимчивость к инфекциям, аутоиммунные заболевания (например, воспалительные заболевания кишечника), диабет, депрессию и ожирение. Основные ограничения этого обзора заключаются в том, что большинство включенных исследований были небольшими, не рандомизированными должным образом и не являлись крупными обсервационными исследованиями.Значительная неоднородность подвержена предубеждениям и смешивающим факторам.
Многие исследования, посвященные влиянию антибиотиков на микробиоту кишечника, ограничены в доступных методах анализа. Многие из них были выполнены с использованием кропотливой методологии, основанной на культуре, которая не позволяет анализировать большое количество образцов. В более ранних исследованиях, включенных в наш анализ, для изучения состава кишечной микробиоты использовались методы на основе посевов, что увеличивает риск систематической ошибки обнаружения.Недостатком использования культивирования является то, что, несмотря на использование специальных селективных сред и анаэробных условий инкубации, остается значительная часть микробиоты, примерно 80% 67, которая еще не была культивирована. Выбор питательной среды и обработка образцов также могут исказить данные.
Ограничения методов, основанных на культуре, можно в значительной степени преодолеть с помощью молекулярных подходов.73 Эти методы основаны на амплификации гена 16S рРНК и дают нам более широкий, менее предвзятый взгляд на бактериальный состав кишечника.Амплифицированные гены характеризуются такими методами, как полиморфизм длины концевых рестрикционных фрагментов, денатурирующий гель-электрофорез или электрофорез в температурном градиенте, глубокий метагеном и полноразмерное секвенирование, некоторые из которых используются в более поздних статьях нашего обзора. Эти биоинформатические методы также имеют ограничения в том, что их часто труднее понять и интерпретировать. Использование различных методов затрудняет сравнение результатов, и обобщение выводов является результатом такого разнообразия в определении и количественной оценке.
Состав кишечных бактерий почти восстанавливается после приема антибиотиков – ScienceDaily
Триллионы бактерий в кишечнике человека влияют на наше здоровье множеством способов, включая влияние на иммунные функции и обмен веществ. Считается, что богатая и разнообразная микробиота кишечника способствует укреплению здоровья, предоставляя человеку-хозяину множество возможностей для предотвращения хронических заболеваний. Напротив, плохое разнообразие экосистемы кишечника является характерной чертой хронических заболеваний, включая ожирение, диабет, астму и воспалительные заболевания кишечника.
Из-за того, что антибиотики в целом убивают бактерии, было высказано предположение, что повторное использование антибиотиков лишает людей богатой бактериальной среды кишечника и, таким образом, приводит к неблагоприятным последствиям для здоровья.
Международная группа исследователей во главе с Копенгагенским университетом и Центром диабета Стено в Копенгагене сообщает, что когда 3 антибиотика давали молодым здоровым мужчинам в течение 4 дней, это привело к почти полному уничтожению кишечных бактерий с последующим постепенным восстановлением большинства бактерий. видов в течение шести месяцев.
Однако по прошествии шести месяцев участникам исследования по-прежнему не хватало девяти общих полезных бактерий, и несколько новых потенциально нежелательных бактерий колонизировали кишечник. Результаты опубликованы сегодня в журнале « Nature Microbiology ».
«Мы показываем, что кишечное бактериальное сообщество здоровых взрослых людей устойчиво и способно восстанавливаться после кратковременного одновременного воздействия трех разных антибиотиков. Однако наши результаты также предполагают, что воздействие антибиотиков широкого спектра действия может уменьшить разнообразие кишечной бактериальной экосистемы. .Антибиотики могут быть благом для сохранения здоровья человека, но их следует использовать только на основании четких доказательств бактериальной причины инфекции », – объясняет руководитель исследования профессор Олуф Педерсен, Центр фундаментальных метаболических исследований Novo Nordisk.
Отсутствуют ли полезные кишечные микробы в западном мире из-за чрезмерного использования антибиотиков?
Исследование представляет собой четырехдневное вмешательство с использованием трех так называемых «крайних мер» антибиотиков широкого спектра действия у 12 взрослых здоровых мужчин. Метод с коктейлем из трех антибиотиков был разработан, чтобы имитировать реальное лечение в отделениях интенсивной терапии.
Кишечник – это резервуар сотен различных видов бактерий с генами устойчивости к антибиотикам. Это было подтверждено в исследовании, поскольку эти бактериальные гены были инициирующей силой, которая привела к пополнению запасов бактерий в кишечнике.
«В этом случае хорошо, что мы можем регенерировать нашу кишечную микробиоту, которая важна для нашего общего здоровья. Однако проблема связана с потенциально необратимой потерей полезных бактерий после многократного воздействия антибиотиков в течение нашей жизни.Есть свидетельства того, что западное население имеет значительно меньшее разнообразие кишечной микробиоты, чем коренные жители, живущие в определенных частях Африки и Амазонки. Одним из возможных объяснений этого может быть широкое использование антибиотиков при лечении инфекционных заболеваний », – говорит Олуф Педерсен.
История Источник:
Материалы предоставлены Копенгагенским университетом Факультет здравоохранения и медицинских наук . Примечание. Содержимое можно редактировать по стилю и длине.
Здоровье кишечника, антибиотики и дисбактериоз
Антибиотики и дисбактериоз
Антибиотики – потенциально спасающие жизнь лекарства, которые в свое время с готовностью прописывали «на всякий случай» для лечения состояний, при которых они не были нужны, например, простуды. 1 Назначение антибиотиков теперь более строго регулируется из-за растущей проблемы с резистентностью бактерий (при которой бактерии адаптируются, поэтому основные антибиотики больше не эффективны).
Также растет признание того, что некоторые антибиотики могут вызывать проблемы со здоровьем, особенно в кишечнике, и, как это ни парадоксально, увеличивать вашу восприимчивость к инфекциям. 2 Это проблема, когда используются антибиотики широкого спектра действия, которые вместо того, чтобы нацеливаться только на несколько типов бактерий, имеют метод разбрасывания, который убивает как «хорошие» бактерии, так и вредные. Это может привести к состоянию, известному как дисбактериоз кишечника.
Что такое дисбактериоз?
Дисбактериоз кишечника – это нарушение баланса пищеварительных бактерий, обычно обнаруживаемых в кишечнике. Ваш кишечник населен сложной популяцией бактерий, которые вместе называются микробиотой.Самые полезные пищеварительные бактерии – это штаммы лактобацилл и бифидобактерий. Они производят молочную кислоту, активируют иммунные клетки, стимулируют выработку антител и конкурируют за питательные вещества, чтобы помочь подавить рост менее полезных или вредных бактерий. Пробиотические бактерии также производят такие вещества, как короткоцепочечные жирные кислоты (например, ацетат), которые «питают» клетки слизистой оболочки кишечника и повышают целостность кишечного барьера, чтобы уменьшить проблемы, связанные с протекающим кишечником. 3
Ученые, использующие специальные зонды рДНК для определения того, какие виды бактерий присутствуют в кишечнике, обнаружили, что после лечения антибиотиками в балансе кишечной микробиоты происходят серьезные и долгосрочные изменения.Например, прием антибиотика ципрофлоксацина в течение пяти дней может изменить численность примерно одной трети видов кишечных бактерий. 4
Хотя микробиота обычно приходит в норму через месяц после прекращения лечения ципрофлоксацином, некоторые типы бактерий не восстанавливаются даже после этого относительно короткого курса антибиотиков. Другое исследование показало, что прием клиндамицина в течение семи дней значительно сокращает разнообразие присутствующих видов Bacteroides, и они не возвращаются к своему первоначальному балансу в течение двух лет после прекращения лечения клиндамицином. 5 Среди наиболее часто используемых антибиотиков пенициллина ампициллин и амоксициллин также вызывают стойкие изменения микробиоты кишечника, включая уменьшение количества видов Lactobacillus. 6
Почему дисбактериоз кишечника является проблемой?
Дисбактериоз кишечника может вызывать ряд пищеварительных симптомов, включая вздутие живота, метеоризм и диарею. Фактически, диарея является наиболее частым побочным эффектом со стороны кишечника, которым страдают от 5% до 35% людей, принимающих антибиотики. 7
Дисбиоз также увеличивает вероятность гастроэнтерита (пищевого отравления) бактериями, такими как сальмонелла, и может снизить иммунный ответ против вируса гриппа.Дисбактериоз кишечника также связан с долгосрочными кишечными проблемами, такими как дивертикулярная болезнь, синдром раздраженного кишечника 8 и воспалительное заболевание кишечника. Поскольку кишечные бактерии помогают активизировать иммунную систему, последние исследования показывают, что дисбактериоз кишечника также увеличивает риск проблем со здоровьем, влияющих на другие части тела, включая астму и аллергию, диабет 9 и артрит. 10
Как уменьшить дисбактериоз при приеме антибиотиков
Бывают случаи, когда антибиотики, несомненно, необходимы, и если ваш врач прописал их, вы всегда должны пройти полный курс.Один из наиболее эффективных способов уменьшить дисбактериоз во время и после курса антибиотиков – это принимать пробиотические добавки, чтобы восполнить уровень «хороших» бактерий. Недавний анализ результатов 31 исследования с участием 8672 человека подтвердил, что прием пробиотической добавки может предотвратить даже самую серьезную форму диареи, связанной с антибиотиками, вызванной чрезмерным ростом Clostridium difficile, у взрослых и детей. 11 Исследование также подтвердило, что пробиотики безопасны и эффективны при использовании вместе с антибиотиками у пациентов без иммунодефицита или тяжелого истощения.
Для общего состояния здоровья я обычно рекомендую принимать пробиотики, которые обеспечивают от 5 до 20 миллиардов пробиотических бактерий в день. Однако, если вы принимаете антибиотики, взрослым рекомендуется добавка, содержащая от 20 до 50 миллиардов пробиотических бактерий. Если сомневаетесь, поговорите со своим врачом и следуйте его советам.
Если вы хотите узнать больше о преимуществах сохранения здоровья кишечника, а также узнать больше о том, как можно улучшить его здоровье, выберите «Пищеварение» в меню «Ваше здоровье» выше.
Д-р Сара Брюэр – медицинский директор Healthspan, имеет ученую степень в области естественных наук, хирургии и медицины Кембриджского университета. Работая терапевтом и врачом в больнице, доктор Сара теперь имеет степень магистра медицины питания в Университете Суррея и специализируется на питании. Она также является отмеченным наградами писателем и писателем.
Узнайте больше на веб-сайте доктора Сары Брюэр или узнайте больше об экспертах Healthspan в области здравоохранения.
Восстановление после антибиотиков и многого другого
- Флора кишечника – это микроорганизмы, которые выстилают пищеварительный тракт, помогают переваривать пищу и играют важную роль во всем, от иммунной системы до вашего веса.
- Антибиотики, сахар и даже стресс могут нарушить баланс кишечной флоры и серьезно повлиять на здоровье пищеварительной системы.
- Небольшие шаги, такие как прием определенных штаммов пробиотиков, употребление пребиотических продуктов и сокращение потребления сахара, могут помочь восстановить здоровую флору кишечника как можно скорее.
Вы чувствуете, что ваше пищеварение не в порядке. Может быть, вам нужно пройти курс антибиотиков, вы чувствуете газообразование после еды или пережили дополнительный стресс и перешли на жирную пищу и успокаивающие сладости (эй, вы же человек).Теперь вы задаетесь вопросом, как восстановить здоровую флору кишечника. Хорошие новости: вы можете предпринять шаги, чтобы поддержать здоровье пищеварительной системы и сбалансировать микробиом кишечника. Продолжайте читать, чтобы узнать, как это сделать.
Что такое кишечная флора?
В вашей пищеварительной системе обитает целый мир микроорганизмов. Эта коллекция микроорганизмов – ваша кишечная флора, также известная как кишечная микробиота – сложная экосистема, состоящая примерно из 300-500 видов бактерий. Это почти в 10 раз больше клеток в организме человека. [1]
Наши знания о взаимодействии между здоровьем кишечника и общим здоровьем все еще находятся на начальной стадии. Мы знаем, что колонии полезных бактерий помогают вам переваривать и усваивать пищу, бороться с микробами, вызывающими заболевание, и даже вырабатывать большую часть серотонина, который помогает поддерживать хорошее настроение. [2] [3] [4]
Наука продолжает открывать способы, которыми кишечные бактерии напрямую связаны с вашим здоровьем. Мы знаем, что наличие сбалансированных популяций полезных кишечных бактерий и «плохих» бактерий – это нормально, а здоровый кишечник способен держать плохих парней под контролем.Но исследователи только сейчас начинают понимать, что происходит, когда другие факторы, такие как антибиотики, диета и стресс, склоняют чашу весов в неверном направлении.
Связано: Получите хорошее ощущение кишечника с помощью Bulletproof-детоксикации и добавок для здоровья кишечника
Как различные факторы образа жизни влияют на флору кишечника
Вот один из отличительных признаков здорового кишечника: процветающая популяция полезных микробов и их разнообразное сочетание. Эти хорошие парни поддерживают общее здоровье человека, но они также предотвращают распространение вредных микробов, то есть вредных бактерий, которые могут способствовать воспалению и изменению вашего веса.
Что это значит для вас? Будьте внимательны, когда имеете дело с факторами, которые могут повлиять на ваши здоровые бактерии. Некоторые факторы, такие как возраст и болезнь, мы не контролируем. Но вы можете предпринять позитивные шаги и с другими факторами, такими как то, что вы едите после приема антибиотиков, количество сахара в вашем рационе и то, как вы справляетесь со стрессом. Ниже мы подробно рассмотрим некоторые из них, а также общие советы по восстановлению микрофлоры кишечника. Как всегда, поддерживайте открытое общение со своим врачом.
Антибиотики атакуют все кишечные бактерии (даже самые полезные)
Антибиотики нацелены на всех бактерий – как хороших, так и плохих.Вы можете предпринять определенные действия, чтобы заменить полезные бактерии, пока вы принимаете антибиотики, и помочь восстановить их баланс после окончания курса.
В свое время врачи думали, что здоровое тело – это стерильное тело, и что наша иммунная система постоянно борется с микробами, с которыми мы контактируем. После изобретения антибиотиков были спасены миллионы жизней, поскольку люди были защищены от бактериальных инфекций.
Теперь медицинское сообщество понимает, что в вашем кишечнике обитает целый мир полезных организмов, и пока мы поддерживаем их баланс, мы будем оставаться здоровыми.К сожалению, это означает, что антибиотики представляют собой одну из самых больших угроз для здоровья кишечника.
Антибиотики убивают бактерии, вызывающие инфекцию, но они также убивают полезные кишечные бактерии и разнообразие микробов, которые вы хотите взрастить. В лучшем случае у вас могут быть газы и диарея в течение нескольких дней. В худшем случае это может стать настолько плохим, что баланс вашего микробиома изменится, и вы можете столкнуться с такими проблемами, как нарушение всасывания, изменения в пищеварении, разрастание кандиды (дрожжи) и даже изменения в вашем психическом здоровье.
Конечно, есть время и место для антибиотиков. При агрессивных инфекциях, хирургических вмешательствах и других случаях они необходимы вам, и нам повезло, что у нас есть доступ к лекарствам. Также лучше иметь несколько профилактических мер в заднем кармане, чтобы поддерживать здоровье кишечника, пока вы принимаете антибиотики. Так вы сможете быстрее восстановить равновесие, когда закончите.
Диета, стресс и плохой сон влияют на здоровье пищеварительной системы
Вы – то, что вы едите, по крайней мере, когда речь идет о кишечной флоре.Алкоголь и продукты с высокой степенью переработки могут негативно повлиять на здоровье кишечника, но мы собираемся сосредоточиться на одном из основных игроков: сахаре.
Диета с высоким содержанием сахара может накормить вредные бактерии в кишечнике, создавая оптимальную среду для процветания не очень хороших микробов. Это потому, что высокое потребление сахара, кажется, меняет баланс бактерий в кишечнике, увеличивая популяции микробов, которые способствуют воспалению и проницаемости кишечника (или «дырявому кишечнику»). [5]
Переход на искусственные подсластители ничем не лучше – исследования на грызунах показывают, что сахарин, сукралоза и аспартам вызывают изменения в микробиоте кишечника и способствуют дисбактериозу кишечника или дисбалансу микроорганизмов. [6]
А как насчет стресса и сна? Вот короткое и длинное:
- Стресс и здоровье кишечника : Психический стресс – от работы до новостей до семейной жизни – может мешать коммуникации между кишечником и мозгом, также известной как ось кишечник-мозг. Эта пропущенная связь способствует появлению таких симптомов, как тошнота, вздутие живота и даже здоровью кишечных бактерий.
- Сон и здоровье кишечника : Недосыпание (или хронический некачественный сон) может отрицательно изменить соотношение бактерий в кишечнике, увеличивая риск инсулинорезистентности, повышенной проницаемости кишечника и даже тяги к сахару.
Связанные: Избавьтесь от сахарной привычки с помощью этих пуленепробиваемых альтернативных подсластителей
Как восстановить здоровую флору кишечника
Вам не нужно сидеть сложа руки и просто ждать, пока ваше тело восстановится. Читайте дальше, чтобы узнать, как восстановить микрофлору кишечника, чтобы вы пришли в норму и почувствовали себя лучше с микробиомом кишечника Rockstar.
Принимайте пробиотики для восстановления микрофлоры кишечника
Пробиотики – это полезные кишечные бактерии, которые, среди прочего, поддерживают здоровое пищеварение, производят питательные вещества и избавляются от токсинов и патогенов.Диета, богатая пробиотиками (такими как кефир, квашеная капуста, чайный гриб и кимчи), может помочь хорошим микробам заселиться в вашем кишечнике и сдержать появление недружелюбных. Хед-ап:
Наличие гистамина в ферментированных продуктах означает, что некоторые варианты, такие как мисо и обычный йогурт, подходят не всем. Добавки с пробиотиками – суперэффективные способы включить эти полезные бактерии в свой рацион.
Вот и легкая победа: Bulletproof Unflavored Gut Health Collagen Protein покрывает все ваши основы.Он содержит пробиотики, а также пребиотики акации (подробнее о пребиотиках ниже), глицин и цинк карнозин для здоровой слизистой оболочки кишечника.
Что нужно знать о пробиотиках и антибиотиках
Каждая доза антибиотиков уничтожает большую часть бактерий по всему вашему телу, включая хороших парней. После этого хорошие и недружелюбные микробы медленно восстанавливаются, и, если все идет хорошо, они возвращаются в равновесие. Но на это нужно время, и они не всегда колонизируют в гармонии.
Чтобы один штамм кишечной флоры не захватил верх, принимайте пробиотические добавки во время приема антибиотиков. [7] [8] Дружественные пробиотические бактерии могут не колонизировать кишечник, но они все же могут помочь вам пройти курс лечения антибиотиками.
Если вы правильно рассчитаете дозировку пробиотиков, полезные бактерии, которые только что проходят, смогут делать свою работу и держать плохих парней под контролем. Некоторые из них даже выживут и смогут поддерживать баланс, пока следующая доза антибиотиков не уничтожит их.
- Время и тип имеют решающее значение : Обязательно принимайте пробиотики не менее чем за два часа до или после доз антибиотика. Кроме того, если вы чувствительны к пробиотикам, избегайте штаммов, которые могут генерировать гистамины, таких как Lactobacillus casei , Lactobacillus reuteri и Lactobacillus bulgaricus . [9] [10] Вместо этого выберите Lactobacillus plantarum, Bifdocaterium lactis, Bifdocaterium infantis и Bifidobacterium longum .Эти штаммы снижают уровень гистамина, уменьшают воспаление и улучшают пищеварение. [11] [12]
- Возьмите S. boulardii : S. boulardii – это полезные дрожжи, а не бактерии, поэтому антибиотики их не трогают. В нескольких исследованиях исследователи обнаружили, что S. boulardii предотвращает диарею, связанную с антибиотиками (AAD), когда они вводят его с антибиотиками. [13] [14] [15] [16]
Принимайте пребиотики для кормления полезных бактерий
Пробиотики необходимы, но для того, чтобы хорошие бактерии процветали, их нужно есть.Вот почему вам нужны пребиотики в своем рационе. Пребиотики – это соединения, которые питают полезные кишечные бактерии. Сытые, дружелюбные бактерии населяют слизистую оболочку кишечника, помогая поддерживать здоровый биом. Это помогает восстановить и сохранить целостность слизистой оболочки кишечника. [17]
Пребиотики можно получить из корня цикория, артишоков, лука-порея, цельного зерна и продуктов с высоким содержанием резистентного крахмала – типа крахмала, который сопротивляется перевариванию. [18] Он ферментирует пищеварительный тракт и питает полезные бактерии в кишечнике. [19] Источники устойчивого крахмала включают необжаренные кешью, сырые зеленые бананы, сырую муку из подорожника и сырой картофельный крахмал. У некоторых людей это может вызвать расстройство пищеварения, поэтому начните медленно и постепенно увеличивайте количество до нескольких столовых ложек.
Вот простой способ включить пребиотики в свой рацион: принимать добавки с пребиотиками. Bulletproof InnerFuel Prebiotic содержит разнообразную смесь пребиотиков растительного происхождения для поддержки здорового пищеварения. Он легко смешивается с горячими или холодными жидкостями, поэтому его можно легко добавлять в кофе, смузи и коктейли ежедневно.
Уменьшите потребление сахара
Диета с высоким содержанием рафинированного сахара, искусственных подсластителей и даже натуральных сахаров (включая фрукты!) Может нарушить баланс кишечной флоры, поэтому вам следует ограничить потребление сахара, особенно в отношении антибиотиков.
Без бактерий, которые могут держать их в страхе, у грибов есть возможность занять себя во время курса антибиотиков. Многие проблемы, которые возникают после приема антибиотиков, такие как диарея и инфекции на юге, можно приписать чрезмерному росту грибков, особенно дрожжей.Одним из проблемных штаммов грибка является Candida albicans, который особенно склонен к ссадине после приема антибиотиков. [20]
Кандида питается сахаром и простыми углеводами (например, хлебом и макаронами), которые организм быстро превращает в сахар. Кандида будет процветать, если она будет получать сахар из пищи, которую вы едите, а бактерии не будут сопротивляться. [21] Чтобы он не взял верх, сводите потребление сахара и углеводов к минимуму. Они не уйдут очень далеко, если у них не будет достаточного количества пищи.
Выпейте костный бульон или примите пептиды коллагена
Бактерии, выстилающие пищеварительный тракт, защищают мембраны, удерживающие внутреннее содержимое кишечника на своем месте. По мере того, как они изнашиваются, у грибов появляется шанс заселиться на их месте. Когда грибы растут, они выпускают гифы, тонкие нитевидные корни, которые впиваются в стенки кишечника. По сути, они прокалывают дыры в кишечнике, что позволяет частично переваренным частицам пищи выходить за пределы пищеварительного тракта и вызывать проблемы.
Итак, что вы можете сделать? Убедитесь, что вы едите продукты, поддерживающие крепкую соединительную ткань, например костный бульон и продукты, богатые коллагеном. Коллаген – это белок, который скрепляет ваши мембраны, и прием пептидов коллагена даст вашим клеткам все необходимые им аминокислоты, когда придет время сделать стенки кишечника более прочными и эластичными
Вы не можете производить коллаген без витамина С, поэтому рекомендуется увеличить потребление витамина С при добавлении гидролизованного коллагена.(Вот почему Bulletproof Collagen Protein также содержит витамин С.)
Связано: ваше полное руководство по пептидам коллагена
Ешьте много овощей
Когда большая часть бактерий уничтожается, они медленно восстанавливаются. Как и в случае с любым населением, конкурирующим за ресурсы, это своего рода гонка за повторное заселение. Пока это происходит, вы хотите кормить хороших парней и морить голодом плохих парней.
Нарезка сахара унесет вас далеко. Пока вы закрываете бар на вечеринке с дрожжами, почему бы не подать желанным гостям цельную еду? Кишечные микробы, которые помогают переваривать и усваивать пищу, любят овощи.Это имеет смысл, потому что они едят ту часть овощей, которую человек не расщепляет, и превращают эти порции в питательные вещества, которые иначе вы бы не получили.
Положите в тарелку цельные продукты, которые едят дружелюбные микробы, и еще больше хороших парней заселят ваш кишечник. В частности, ищите ярко окрашенные овощи (например, темную листовую зелень и яркие крестоцветные овощи). Помимо полезной для кишечника клетчатки, эти овощи являются источниками полифенолов – растительных антиоксидантов, которые могут помочь увеличить популяцию полезных кишечных бактерий. [22] Поговорим о большом побочном эффекте.
А чтобы получить дополнительную порцию полифенолов в вашем рационе, попробуйте Bulletproof Polyphenomenal – ежедневную антиоксидантную добавку, которая содержит разнообразную смесь полифенолов из ягод и растений, таких как гранат, черника и зеленый чай.
Читать далее: 6 научно обоснованных добавок для здоровья кишечника
Присоединяйтесь к более чем 1 миллиону поклонников
Подпишитесь на рассылку Bulletproof и получайте последние новости и обновления!
В эту статью добавлено новое содержание.
Сколько времени требуется для восстановления кишечной флоры после приема антибиотиков?
Но убийство плохих парней, ответственных за вашу инфекцию, означает, что вы также убиваете хорошую флору, которая имеет решающее значение для вашего здоровья. Если вы недавно прошли курс лечения антибиотиками и задаетесь вопросом, сколько времени потребуется, чтобы ваш микробиом вернулся в норму – или даже если это вообще возможно, – читайте дальше. “,
“изображение”: “https://mk0healthpathcouchnf.kinstacdn.com/wp-content/uploads/2020/03/Recover_Gut_Flora-HEADER.svg “,
“author”: {
“@type”: “Человек”,
“name”: “Александра Фалконер”
},
“publisher”: {
“@type”: “Организация”,
“name”: “healthpath.com”,
“logo”: {
“@type”: “ImageObject”,
“url”: “https://healthpath.com/wp-content/themes/healthpath/images/logo.svg”
}
},
“datePublished”: “2020-12-17”
}
Антибиотики убивают бактерии. В конце концов, это их работа. Именно так они спасли миллионы жизней за последние сто лет.
Но убийство плохих парней, ответственных за вашу инфекцию, означает, что вы также убиваете хорошую флору, которая имеет решающее значение для вашего здоровья.Если вы недавно прошли курс лечения антибиотиками и задаетесь вопросом, сколько времени потребуется, чтобы ваш микробиом вернулся в норму – или даже если это вообще возможно, – читайте дальше.
Содержание
Насколько сильно антибиотики повреждают нашу кишечную флору?
Почему так важно разнообразие?
Состав кишечных бактерий у большинства людей почти восстанавливается после приема антибиотиков.
Как я могу помочь своим кишечным бактериям восстановиться после приема антибиотиков?
Сколько времени нужно, чтобы восстановить хорошие бактерии после приема антибиотиков?
Могут ли кишечные бактерии некоторых людей вылечиться от антибиотиков примерно за шесть месяцев?
Ключевые выносы
Насколько сильно антибиотики повреждают нашу кишечную флору?
В нашем кишечнике около 100 триллионов бактерий, поэтому невозможно узнать точный состав микробиома человека до начала курса антибиотиков или после его окончания.Но современные тесты кишечника могут дать нам хорошее представление.
Исследования показали, что антибиотики могут уничтожать наши кишечные бактерии. Это означает, что раунд, который вы использовали для лечения инфекции носовых пазух, мог снизить микрофлору кишечника до одной десятой от предыдущего уровня. Не на одну десятую, а на одну десятую: это сокращение на 90 процентов (Источник: NCBI).
Урон, похоже, зависит от нескольких факторов.
1. Продолжительность и количество курсов
Многократные курсы антибиотиков, по-видимому, являются наиболее разрушительными (Источник: NCBI), а более высокие дозы антибиотиков, принимаемые в течение более длительного периода времени, имеют наибольшее влияние.Это может быть шокирующей новостью для многих людей, которые – часто в подростковом возрасте – месяцами принимали антибиотики, пытаясь вылечить угри.
Олуф Педерсен, главный научный сотрудник проекта 2018 года, который изучал влияние всего одного курса антибиотиков на микробиом, отметил, что большинство людей получат несколько циклов воздействия антибиотиков. «Обеспокоенность связана с потенциально необратимой потерей полезных бактерий после многократного воздействия антибиотиков в течение нашей жизни», – сказал он журналистам на сайте научных новостей ars TECHNICA (Источник: DX DOI).
2. Тип антибиотика
Если вы обратитесь к врачу с инфекцией, вы, скорее всего, вылечитесь с помощью антибиотика широкого спектра действия. Это потому, что, если ваш врач не возьмет образец и не отправит его в лабораторию для посева, он не знает, какой тип бактерий вызывает вашу инфекцию. Назначение антибиотика широкого спектра действия повышает вероятность того, что он подействует на вашу инфекцию, но кишечные бактерии пострадают сильнее.
Когда исследователи дали мышам цефалоспориновый антибиотик широкого спектра действия или комбинацию из трех антибиотиков (амоксициллин, висмут и метронидазол), оба антибиотика вызвали значительные изменения в микробном сообществе кишечника.
Мыши, получавшие антибиотик широкого спектра действия, не восстановили свое нормальное разнообразие, но другие мыши, получавшие комбинацию, содержащую амоксициллин, в основном, но не полностью, вернулись к уровням до лечения (Источник: IAI.ASM).
3. На каком этапе жизни вы их принимаете
Наши первые годы кажутся решающими для создания здорового микробиома на всю жизнь. Одно исследование обнаружило связь между приемом антибиотиков в первый год жизни и более поздними нейрокогнитивными проблемами, такими как СДВГ, депрессия и тревога (Источник: Wiley), а другие исследования показали, что чем больше курсов антибиотиков человек получает в детстве, тем выше их риск развития ювенильного ревматоидного артрита и воспалительного заболевания кишечника (Источник: NCBI).
Другие связывают воздействие антибиотиков в утробе матери и в раннем детстве (и последующее изменение микробного состава кишечника) с развитием астмы в более позднем возрасте (Источник: BMJ) и ожирением у детей, а также взрослых (Источник: Science Direct).
К началу
Почему так важно разнообразие?
В здоровом, разнообразном микробиоме кишечника резидентные микробы помогают защитить от вторжения патогенов, которые могут вызвать инфекцию или заболевание. Они работают вместе, используя разные методы подавления патогенов, например:
- производит антимикробных соединений , борющихся с вредными бактериями
- вытеснение патогенов и предотвращение их попадания «недвижимое» пространство в кишечник
- поддерживает слой слизи , выстилающий кишечник, так что патогены не могут достигать кишечных клеток и создают дом
- тренирует иммунную систему реагировать на патогены
Когда количество резидентных микроорганизмов кишечника уменьшается во время использования антибиотиков, эти защитные функции могут прекратиться.Вот тогда патогенные бактерии могут вторгнуться и нарушить баланс.
К началу
Состав кишечных бактерий у большинства людей почти восстанавливается после приема антибиотиков
Исследование выявило интересную стратегию, которую некоторые бактерии используют для восстановления после приема антибиотиков. Они используют гены устойчивости, которые ученые называют «резистомами», чтобы гарантировать, что они никогда не исчезнут.
После попытки уничтожить определенные виды бактерий с помощью антибиотиков, исследователи изучили микробиомы 12 здоровых мужчин в течение шести месяцев и задокументировали побочный ущерб.
Первоначальные изменения включали «расцвет» определенных типов потенциально вредных бактерий, а также исчезновение дружественных Bifidobacterium и видов, продуцирующих бутират. Однако исследователи утверждают, что микробиота кишечника субъектов восстановилась – «почти» до исходного уровня – в течение 1,5 месяцев.
Однако важно отметить, что девять общих видов, которые присутствовали у всех субъектов до лечения, оставались необнаруженными у большинства субъектов через 180 дней (Источник: DX DOI).
К началу
Как я могу помочь кишечным бактериям восстановиться после приема антибиотиков?
Не существует однозначного способа помочь кишечным бактериям восстановиться после приема антибиотиков. Реальность такова, что, хотя наука о микробиоме быстро развивается, мы все еще многого не знаем.
Есть кое-что, что мы знаем наверняка: здоровый микробиом – это все о разнообразии, и антибиотики определенно не способствуют этому. Вы можете позаботиться о своем здоровье кишечника и узнать о способах улучшения разнообразия своего микробиома в нашей Программе здоровья кишечника.
А пока давайте посмотрим, какие исследования могут рассказать нам о том, как увеличить это разнообразие, независимо от того, применяются ли антибиотики или нет.
1. Примите пробиотики
Клинические доказательства преимуществ приема пробиотиков во время и после применения антибиотиков сбивают с толку.
Некоторые исследования показали, что прием пробиотиков может снизить риск инвазии условно-патогенных микроорганизмов (Источник: NCBI) и диареи, связанной с антибиотиками (Источник: JAMA).Но вполне вероятно, что разные штаммы пробиотиков по-разному действуют на разных людей.
Доказано, что некоторые пробиотики выживают в желудочной кислоте и достигают кишечника, образуя защитный барьер от потенциально вредных бактерий. Culturelle – один из примеров.
Лучшее время для приема пробиотиков, если вы принимаете антибиотики, – это как минимум три часа друг от друга. Это дает пробиотикам наилучшие шансы на выживание (Источник: NCBI).
Saccharomyces Boulardii – это полезные дрожжи, которые могут помочь остановить распространение Candida (условно-патогенные дрожжи) после курса антибиотиков.Кандида обычно присутствует в небольших количествах у большинства людей, но при первой возможности она может взять верх и вызвать проблемы. Также было обнаружено, что Saccharomyces Boulardii сохраняет и восстанавливает кишечный барьер (Источник: NCBI). Что наиболее важно, поскольку это дрожжи, а не бактерии, антибиотики на них никак не влияют.
Интересно, что недавнее небольшое исследование показало, что пробиотики могут фактически препятствовать возвращению нативной микробиоты кишечника. Исходный микробиом кишечника группы людей, которые принимали пробиотики в течение 28 дней после приема антибиотиков, возвращался дольше по сравнению с группой, которая не принимала пробиотики (Источник: Cell).
В этом конкретном исследовании также изучалась польза так называемого «переливания аутологичной фекальной микробиоты» (aFMT), когда ученые восстанавливали бактерии, которые у участников были до антибиотиков, замораживая их старый стул (да, фекалии) и помещая их обратно в толстую кишку. когда курс закончился.
Звучит безумно? По словам ведущего исследователя, он вызывал «быстрое и почти полное выздоровление в течение нескольких дней после приема». Это доказательство преимуществ aFMT после приема антибиотиков побудило одну клинику в Великобритании предложить услугу замораживания стула людям, которые собираются пройти тяжелое лечение антибиотиками.
2. Максимально используйте пребиотики
Еще одна стратегия восстановления кишечной флоры после приема антибиотиков – убедиться, что вы хорошо ее кормите: продуктами, которые нравятся вашим кишечным клопам. Это означает употребление в пищу продуктов с высоким содержанием пребиотиков.
Пребиотики – это пища для бактерий в толстом кишечнике, потому что они не перевариваются «дальше» в тонком кишечнике. Пребиотические продукты обычно богаты клетчаткой и растительными полифенолами. Так что ешьте много фруктов, овощей, бобовых, орехов и цельнозерновых.
Вы также можете попробовать добавки с пребиотиками, такие как инулин: растительный сахар, который, как было обнаружено, снижает разрушающее разнообразие антибиотика ампициллина в бактериальных культурах (Источник: NCBI).
3. Ешьте как охотник-собиратель
Разнообразная, богатая клетчаткой диета – лучший выбор для увеличения разнообразия, которому могут угрожать антибиотики (Источник: NCBI).
В недавнем исследовании группа итальянских исследователей сравнила кишечные микробы молодых сельских жителей Буркина-Фасо, Африка, с микробами детей во Флоренции, Италия.Сельские жители, которые ели в основном просо и сорго (цельнозерновые), обладали гораздо большим микробным разнообразием, чем итальянцы, которые придерживались типичной западной диеты. Они обнаружили, что микробиоты в кишечнике итальянских детей адаптированы к белку, жирам и простым сахарам, а микробиом Буркина-Фасо предпочитает клетчатку (Источник: NCBI).
Один из исследователей, участвовавших в исследовании Буркина-Фасо, хотел узнать больше о роли клетчатки в нашем микробиоме, поэтому они продолжили исследование, в котором одна группа мышей скармливала много клетчатки, а другую – сладкую западную диету. .В то время как у мышей, получавших клетчатку, развился более разнообразный микробиом, разнообразие резко упало у мышей, соблюдающих диету, подобную западной. Интересно, что они также сообщили, что голодные по клетчатке мыши были злее, и с ними было труднее справиться! (Источник: NCBI).
4. Снижение стресса
Исследования показали, что стресс вызывает реакцию «бей или беги», которая высвобождает гормоны в различных частях вашего тела, что, в свою очередь, влияет на микробиом, уменьшая разнообразие (Источник: NCBI).Ситуация усугубляется тем, что измененная популяция кишечных микробов влияет на регуляцию нейротрансмиттеров, еще больше усиливая стресс (Источник: NCBI).
5. Упражнение
Упражнения изменяют состав вашего микробиома. Одно исследование показало, что упражнения могут обогатить разнообразие вашего микробиома, улучшая баланс определенных семейств бактерий, которые потенциально могут способствовать снижению веса (Источник: Хиндави).
Более того, исследователи пришли к выводу, что упражнения стимулируют рост бактерий, которые могут улучшить целостность кишечного барьера и защитить от желудочно-кишечных расстройств и рака толстой кишки.
Другая тактика поддержки здоровой микрофлоры кишечника:
К началу
Сколько времени нужно, чтобы восстановить хорошие бактерии после приема антибиотиков?
Похоже, что большинство семейств бактерий возвращаются к нормальному уровню примерно через два месяца после лечения (Источник: NCBI). Однако этот ответ основан на исследованиях, в которых изучается влияние одного краткосрочного курса антибиотиков. Мы должны помнить, что «большинство» семейств бактерий не означает все, и потерянные семейства могут играть ключевую роль в хрупкой экосистеме нашего кишечника (Источник: OUP), (Источник: ASM).
К началу
Могут ли кишечные бактерии некоторых людей вылечиться от антибиотиков примерно за шесть месяцев?
Некоторые исследования, опубликованные в 2018 году, показали, что нашей кишечной флоре потребовалось около шести месяцев, чтобы прийти в норму после приема антибиотиков (Источник: DX DOI). СМИ подхватили это, и поэтому многие люди сегодня думают, что вы вернете свою старую кишку. именно через шесть месяцев после приема антибиотиков. Однако это исследование – лишь одно из многих, и все они дали разные результаты.
Если вы чувствуете себя подавленным всей этой информацией, вы можете получить некоторую стратегическую помощь с нашей необязательной программой проверки симптомов.
Вполне возможно, что кишечные бактерии никогда не вернутся в норму. Но это не значит, что вы не можете предпринять шаги для увеличения своего разнообразия. Каждый может получить пользу от заботы о своем кишечнике, но если вы недавно принимали антибиотики, для этого есть еще более серьезная причина.
К началу
Ключевые выносы
- Иногда вам, возможно, придется принимать антибиотики.Если вы это сделаете, есть способы уменьшить повреждение кишечной флоры
- Основная проблема антибиотиков заключается в их способности резко сократить разнообразие вашего микробиома.
- Возможно, ваш микробиом вернется в норму в течение недель или месяцев
- Чтобы дать вашим кишечным клопам наилучший шанс, сделайте все возможное, чтобы увеличить их разнообразие
- Простые шаги включают потребление клетчатки, пребиотиков и уход за кишечником в целом
Наверх
Автор
Александра Фалконер MA (Dist) DipCNM mBANT – сертифицированный диетолог, специализирующийся на СРК и родственных состояниях.Выпускница Брайтонского колледжа натуропатической медицины, она стремится бороться с первопричинами хронических заболеваний и предоставлять функциональную медицину всем, кто в ней нуждается.
До своей естественной оздоровительной карьеры Алекс была журналистом и копирайтером. Она продолжает писать для журналов и медиа-агентств, и теперь объединяет свои две великие страсти – писательство и здоровье – создавая контент, который дает людям возможность отстаивать свое право на здоровое тело и разум.
Миноциклин и его влияние на микробный дисбактериоз кожи и желудочно-кишечного тракта у пациентов с угрями – Университет Джона Хопкинса
TY – JOUR
T1 – Миноциклин и его влияние на микробный дисбактериоз кожи и желудочно-кишечного тракта у пациентов с угрями 9000 –
Томпсон, Кэтрин Г.
AU – Rainer, Barbara M.
AU – Antonescu, Corina
AU – Florea, Liliana
AU – Mongodin, Emmanuel F.
AU – Kang, Sewon
AU – Chien, Anna L.
N1 – Информация о финансировании: Эта работа была частично поддержана грантом Американского общества акне и розацеа. Авторские права издателя: Авторские права © Корейская дерматологическая ассоциация и Корейское общество следственной дерматологииPY – 2020
Y1 – 2020
N2 – Общие сведения: Связь между акне и сопутствующими заболеваниями желудочно-кишечного тракта позволяет предположить, что микробный дисбактериоз и кишечная проницаемость могут способствовать воспалительным акне, что часто управляется пероральными антибиотиками.Цель: мы провели исследование случай-контроль для изучения микробиоты кожи и кишечника у 8 пациентов с акне до и после перорального приема миноциклина по сравнению с контрольной группой, соответствующей возрасту ± 5 лет, полу и расе. Методы: ДНК выделяли из образцов стула и мазков с кожи лица. Секвенирование области V3V4 бактериального гена 16S рРНК было выполнено с использованием Illumina MiSeq и проанализировано с использованием программного обеспечения QIIME / MetaStats 2.0. Результаты. Среди пациентов с угрями было 7 женщин и 1 мужчина в возрасте от 20 до 32 лет. Различия по Шеннону для разных типов кожи существенно не различались (p = 0.153) или кишечной (p <0,999) микробиоты пациентов с угревой сыпью до и после приема антибиотиков. Микробиота кишечника у пациентов с угрями до приема антибиотиков по сравнению с контрольной группой без прыщей была обеднена пробиотиками Lactobacillus iners (p = 0,001), Lactobacillus zeae (p = 0,001) и Bifidobacterium animalis (p = 0,026). После приема антибиотиков микробиота кишечника пациентов с угревой сыпью была обеднена Lactobacillus salivarius (p = 0,001), Bifidobacterium adolescentis (p = 0,002), Bifidobacterium pseudolongum (p = 0,010) и Bifidobacterium breve (p = 0.042), тогда как микробиота кожи была обогащена пробиотиками Bifidobacterium longum (p = 0,028) и Leuconostoc mesenteroides (p = 0,029) и обеднена Staphylococcus epidermidis (p = 0,009) и Prevotella nigrescens (p = 0,028). На уровне филума значительное обогащение Bacteroidetes в стуле пациентов с угревой сыпью после лечения антибиотиками (p = 0,033) привело к снижению соотношения Firmicutes к Bacteroidetes. Заключение: миноциклин вызывает значительные нарушения в микробиоте кожи и кишечника, включая многие виды пробиотиков, что подчеркивает потенциал более целенаправленных противомикробных методов лечения акне.
AB – Общие сведения: Связь между угрями и сопутствующими заболеваниями желудочно-кишечного тракта позволяет предположить, что микробный дисбактериоз и кишечная проницаемость могут способствовать воспалительным акне, заболеванию, которое часто лечится пероральными антибиотиками. Цель: мы провели исследование случай-контроль для изучения микробиоты кожи и кишечника у 8 пациентов с акне до и после перорального приема миноциклина по сравнению с контрольной группой, соответствующей возрасту ± 5 лет, полу и расе. Методы: ДНК выделяли из образцов стула и мазков с кожи лица.Секвенирование области V3V4 бактериального гена 16S рРНК было выполнено с использованием Illumina MiSeq и проанализировано с использованием программного обеспечения QIIME / MetaStats 2.0. Результаты. Среди пациентов с акне было 7 женщин и 1 мужчина в возрасте от 20 до 32 лет. Различия по Шеннону существенно не различались между микробиотой кожи (p = 0,153) или кишечника (p <0,999) пациентов с акне до и после приема антибиотиков. Микробиота кишечника у пациентов с угревой сыпью до приема антибиотиков по сравнению с контрольной группой без прыщей была обеднена пробиотиками Lactobacillus iners (p = 0.001), Lactobacillus zeae (p = 0,001) и Bifidobacterium animalis (p = 0,026). После приема антибиотиков микробиота кишечника пациентов с угревой сыпью была обеднена Lactobacillus salivarius (p = 0,001), Bifidobacterium adolescentis (p = 0,002), Bifidobacterium pseudolongum (p = 0,010) и Bifidobacterium breve (p = 0,042). обогащены пробиотиками Bifidobacterium longum (p = 0,028) и Leuconostoc mesenteroides (p = 0,029) и обеднены Staphylococcus epidermidis (p = 0,009) и Prevotella nigrescens (p = 0.028). На уровне филума значительное обогащение Bacteroidetes в стуле пациентов с угревой сыпью после лечения антибиотиками (p = 0,033) привело к снижению соотношения Firmicutes к Bacteroidetes. Заключение: миноциклин вызывает значительные нарушения в микробиоте кожи и кишечника, включая многие виды пробиотиков, что подчеркивает потенциал более целенаправленных противомикробных методов лечения акне.
кВт – Acne vulgaris
кВт – Bacteroidetes
кВт – Firmicutes
кВт – Microbiome
кВт – Миноциклин
кВт – Propionibacterium
UR – http: // www.scopus.com/inward/record.url?scp=85078871209&partnerID=8YFLogxK
UR – http://www.scopus.com/inward/citedby.url?scp=85078871209&partnerID=8YFLogxK
14. 1.21
DO – 10.5021 / ad.2020.32.1.21
M3 – Артикул
C2 – 33
5
AN – SCOPUS: 85078871209
VL – 32
SP – 21
EP – 30
–JO Annals Дерматология
JF – Annals of Dermatology
SN – 1013-9087
IS – 1
ER –
.