Энтерококки у грудничка в кале: Энтерококки в кале у ребенка: норма и причины повышения
что это, нужно ли лечить?
По результатам обследования на дисбактериоз могут быть обнаружены энтерококки в кале у ребенка.
Что это означает, есть ли причины для беспокойства и нужно ли что-то с этим делать – стоит узнать маме еще до рождения малыша.
Польза и вред энтерококков
Энтерококки – это мелкие микробы, имеющие округлую форму, не образовывающие капсулы и споры.
Не так давно они были выделены в отдельную группу, которая представлена грамположительными микробами 15 видов (ранее энтерококк причисляли к стрептококкам).
Наиболее распространены 2 вида: энтерококк фекальный и энтерококк фэциум (наиболее патогенным является первый из них, поскольку способен возбудить инфекционные заболевания мочевыделительной системы, органов малого таза и внутренней оболочки сердца).
Эти микробы – важная составляющая человеческой микрофлоры, отвечают за формирование иммунной системы ребенка.
Поселяются энтерококки в организме в первые дни жизни малыша, новорожденный получает их с материнским молоком или, если он находится на искусственном вскармливании, через руки матери, персонала родильного дома и воздушно-капельным путем.
В основном они дислоцируются в тонком и толстом кишечнике. Нормальное количество энтерококков для взрослого – 100 миллионов на грамм кала.
Такое высокое, на первый взгляд, содержание, является безобидным и необходимо для выполнения целого ряда функций: уничтожения патогенных микроорганизмов, синтеза витаминов, расщепления и переработки углеводистой пищи, усвоения сахара, повышения иммунитета.
Применяются штаммы энтерококков и в пищевой промышленности: для сквашивания молока, уничтожения патогенной микрофлоры в продуктах, гидролиза лактозы.
Используются они в производстве кисломолочной продукции и сыроварении. В медицинские препараты энтерококки добавляют для восстановления нормальной микрофлоры кишечника человека.
Однако количество энтерококков очень важно держать в норме и иногда контролировать, тем более у детей.
В то время, когда защитные силы организма снижены (в результате длительного лечения антибиотиками, перенесенного хирургического вмешательства, после употребления кортикостероидов), начинается развитие условно патогенных микроорганизмов, в том числе энтерококкового ряда.
Они способны приводить к развитию заболеваний, с трудом поддающихся лечению. Кроме того, патогенными энтерококки становятся в том случае, если попадают в места, не являющиеся типичными для их обитания (в почки или мочевыделительную систему).
В таких случаях микроорганизмы могут стать возбудителями патологий мочеполовой системы, дивертикулита толстой кишки, септического артрита, бактериемии, эндокардита, гастрита, энтерита и менингита.
Энтерококковые инфекции
В детском возрасте наиболее часто встречается резкое увеличение количества энтерококков, поскольку иммунитет ребенка еще не в состоянии подавлять их размножение.
Факторами, провоцирующими рост патогенной микрофлоры, могут стать такие причины, как:
- переохлаждение малыша;
- простудные заболевания;
- прием антибиотиков, подавляющих микрофлору, в том числе полезную;
- проведение исследований с помощью инвазивных методик.
Верный симптом того, что у ребенка повышены энтерококки – проявления диареи, однако точную картину даст лишь биохимический анализ кала ребенка.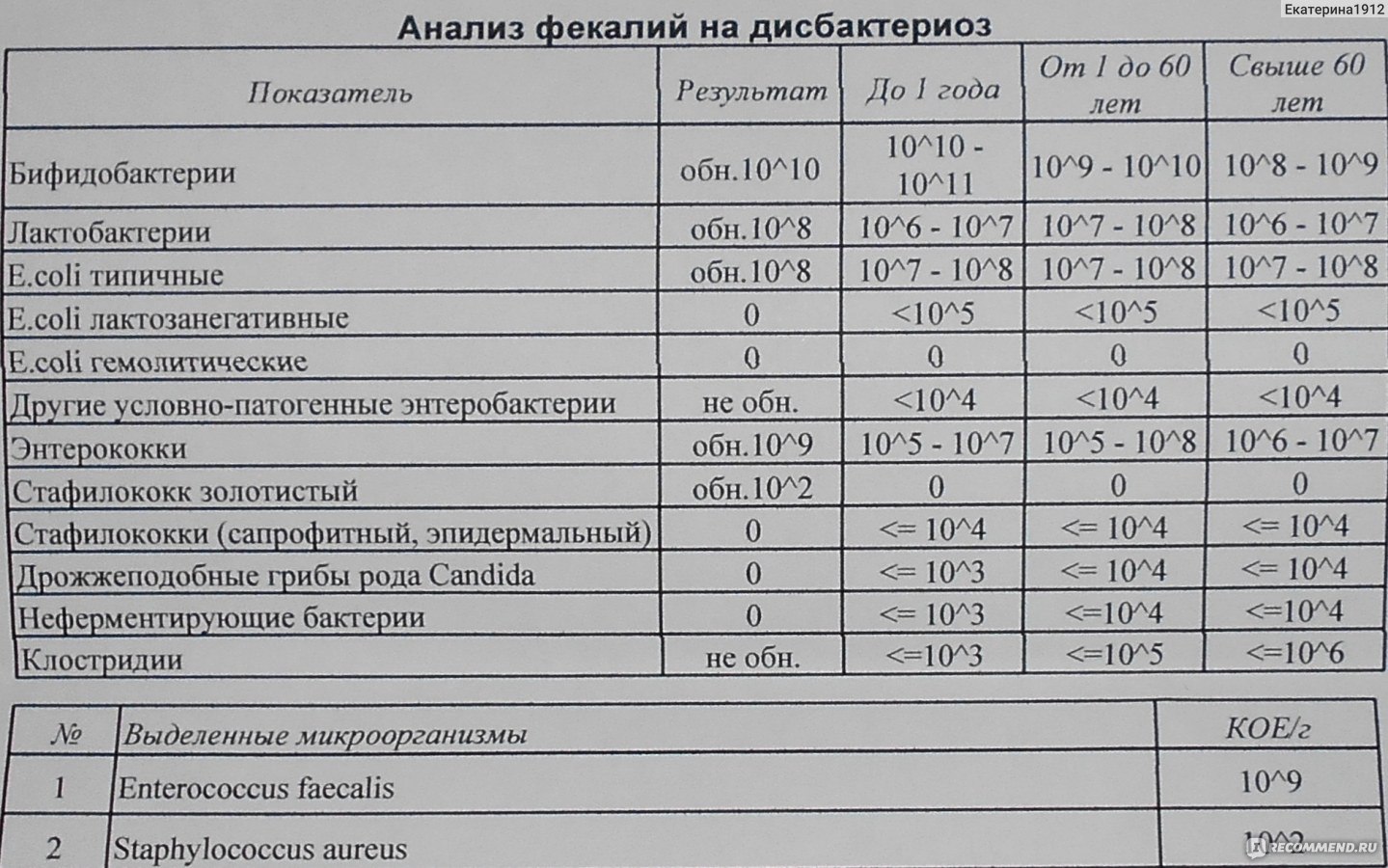
Получив на руки результаты анализов, можно увидеть, не превышено ли в кале у ребенка содержание микробов: нормальным у младенца до года принято считать количество от ста тысяч до десяти миллионов на грамм фекалий, у детей постарше – до ста миллионов.
Если число энтерококков меньше указанной нормы, то никакой причины для беспокойства нет, патологией это не является.
Высокое число микроорганизмов может свидетельствовать о воспалении органов брюшной полости и малого таза. У девочек неконтролируемый рост энтерококков часто свидетельствует о вульвовагинитах и вульвитах.
Однако чаще всего дети страдают от дисбактериоза, который является следствием увеличения патогенной микрофлоры.
Видео:
Типичными симптомами этого заболевания являются ухудшение аппетита, тошнота, метеоризм, расстройство стула, общая интоксикация организма.
Кал во время дисбактериоза, вызванного энтерококками, имеет кислый или гнилостный запах. Дети становятся непривычно вялыми, имеют плохой сон и не хотят играть.
Дети становятся непривычно вялыми, имеют плохой сон и не хотят играть.
Наиболее тяжело дисбактериоз переносится в грудном возрасте, когда организм не в состоянии регулировать баланс «хороших» и «плохих» микроорганизмов.
Энтерококки в кале у грудничка могут повышаться даже из-за небольших повреждений кожного покрова или слизистой.
Лечение в этом случае нужно начинать незамедлительно, в противном случае младенец рискует столкнуться с множеством заболеваний инфекционного характера.
Лечение и профилактика
Лечение инфекций, вызванных энтерококками, проводится под контролем врача. Для точной постановки диагноза одной копрограммы не всегда достаточно, например, при проявлении первых признаков заболеваний мочевыводящей системы обязательно берут на анализ мочу.
Диагноз считается подтвержденным, если количество энтерококков в ней выше ста тысяч микроорганизмов на грамм свежесобранного материала. Схема лечения и препараты зависят от возраста пациента.
Лечение инфекций, вызванных энтерококками, у детей старше года проводится антибиотиками (чаще «Ампициллином» в таблетированной форме) и сопровождается обязательным приемом витаминных комплексов.
Видео:
В случаях, когда лечение таблетками не принесло ожидаемого эффекта, доктора назначает внутримышечные инъекции.
Помимо этого, для обеспечения высокой эффективности лечения перед назначением препаратов проводится бакпосев, позволяющий точно определить вид энтерококка и, соответственно, подобрать антибиотик, к которому он восприимчив.
Легкая форма заболевания лечится с применением аминогликозидов (Сизомицин, Тобрамицин, Амикацин).
Помимо этого, терапия эхинококкоза проводится с применением свечей или таблеток, способных восстановить баланс микрофлоры (пробиотиков Ацилакт, Лактонорм, Бифидумбактерин, Бифиформ, Линекс), и иммуномодулирующих препаратов, направленных на восстановление защитных ресурсов организма. Длительность восстановительного периода обычно составляет не менее двух недель.
Снижение количества энтерококков в кале грудничка достигается посредством применения интести-бактериофагов, поскольку лечение антибиотиками может навредить крохе, иммунная система которого еще только формируется.
Бактериофаг в жидкой форме дают ребенку трижды в день перед едой; в тех случаях, когда напоить малыша не представляется возможным, практикуют клизменное введение.
Лечение длится в течение 5-6 дней. В тех случаях, когда анализы говорят об улучшении, но полное выздоровление еще не наступило, можно продлить курс на 2-3 дня.
Стоит отметить, что лечение бактериофагами уступает избавлению от энтерококков антибиотиками, однако для младенцев выбирают наиболее щадащий вариант.
Главной причиной роста энтерококков в кале детей является низкая иммунная защита, поэтому лучшей профилактикой может стать правильный режим питания и регулярные прогулки.
Видео:
Мамам грудничков нужно соблюдать время кормлений и их продолжительность, младенцам-искусственникам необходимо подобрать оптимальную смесь.
Появление любого из признаков развивающегося дисбактериоза, регулярные расстройства кишечника должны стать причиной посещения педиатра.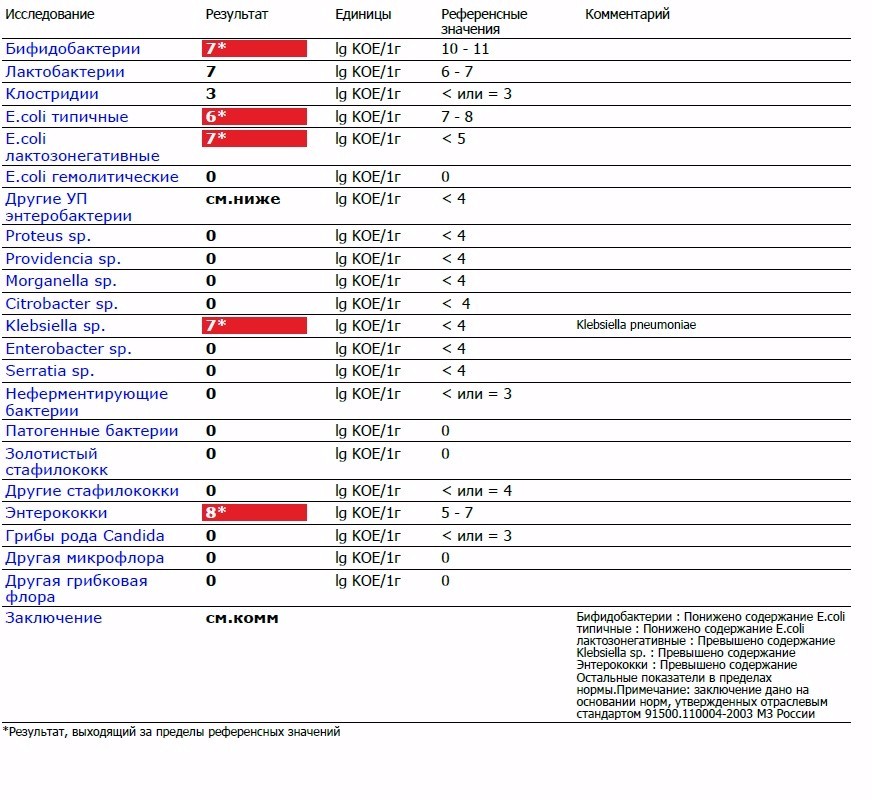
Энтерококки в фекалиях ребенка далеко не всегда являются поводом для беспокойства, поскольку в норме они помогают нормальному функционированию организма.
Небольшое превышение их количества легко исправляется с помощью корректировки питания.
Сдерживание же ускоренного роста энтерококков проводится с применением определенных медикаментов, правильно подобрать которые в состоянии только врач-педиатр.
Понравилась статья? Поделитесь:
Энтерококки в кале у грудничка
Новорожденный ребенок нуждается в постоянном динамическом наблюдении со стороны педиатра. В один месяц малышу назначают большое количество анализов, позволяющих оценить состояние здоровья малыша. В том числе врач может назначить сдать кал на дисбактериоз. По результатам анализов он может обнаружить, что в кале у ребенка повышены энтерококки.
Начиная с самого рождения, энтерококки заселяют микрофлору кишечника.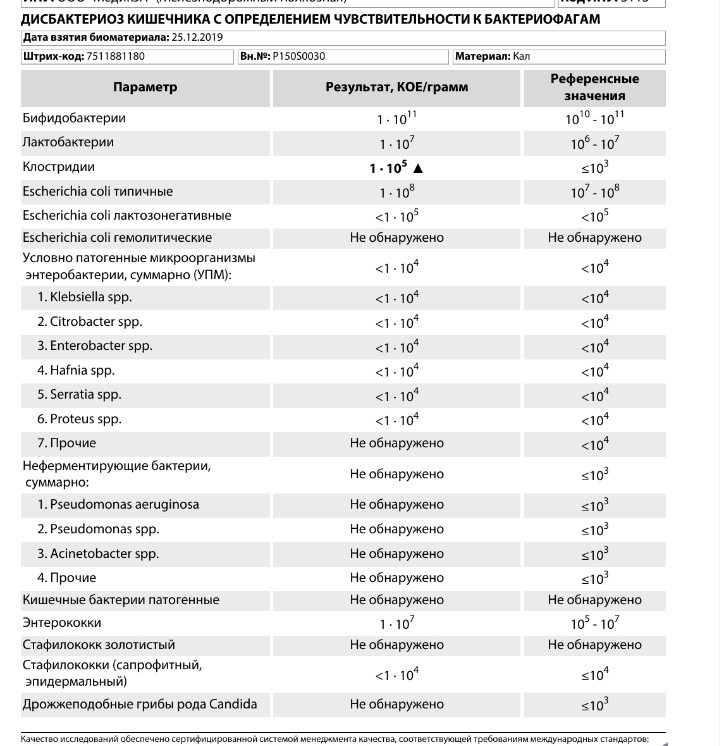 У ребенка в возрасте до одного года их количество составляет примерно 100 миллионов на один грамм фекалий. Первоначально они выполняют достаточно полезную функцию: способствуют усвоению сахара, синтезу витаминов, уничтожению условно-патогенных микроорганизмов. Однако превышение их количества требует пристального внимания, так как способны вызывать ряд серьезнейших заболеваний:
У ребенка в возрасте до одного года их количество составляет примерно 100 миллионов на один грамм фекалий. Первоначально они выполняют достаточно полезную функцию: способствуют усвоению сахара, синтезу витаминов, уничтожению условно-патогенных микроорганизмов. Однако превышение их количества требует пристального внимания, так как способны вызывать ряд серьезнейших заболеваний:
- менингит;
- дивертикулит;
- бактериемия;
- поражение мочеполовой системы;
- хронический энтерит;
- колит;
- хронический гастрит.
Энтерококки в кале у грудничка: нужно ли их лечить?
Энтерококки могут содержаться и в грудном молоке. Поэтому если малыш находится на грудном вскармливании, вполне возможно, что именно мама «заражает» его. В таком случае необходимо сдать грудное молоко в лабораторию для исследования. Грудное вскармливание при этом не прекращают.
Поскольку в столь раннем возрасте иммунная система малыша еще слабо развита и находится только на этапе формирования, то любое лечение, подразумевающее прием антибиотиков, может способствовать росту энтерококков. Поэтому важно не столько лечить у ребенка фекальный энтерококк, сколько восстанавливать микрофлору кишечника, чтобы обеспечить оптимальный уровень бифидо- и лактобактерий. В таком случае врач может назначить креон или бактериофаг. Однако следует помнить, что лечение можно начинать только при условии, что количество энтерококков в кале значительно превышает нормативные показатели. Если же их повышение некритично, то энтерококки у детей не нуждаются в лечении.
Поэтому важно не столько лечить у ребенка фекальный энтерококк, сколько восстанавливать микрофлору кишечника, чтобы обеспечить оптимальный уровень бифидо- и лактобактерий. В таком случае врач может назначить креон или бактериофаг. Однако следует помнить, что лечение можно начинать только при условии, что количество энтерококков в кале значительно превышает нормативные показатели. Если же их повышение некритично, то энтерококки у детей не нуждаются в лечении.
причины, норма у грудничка, лечение антибиотиками
Под энтерококками подразумевают род бактерий Enterococcacea, которые относятся к грамположительным коккам, относящиеся к подклассу лактобактерий. На сегодняшний день ученым известно около 15 видов энтерококков.
Эти бактерии обитают в теле и мужчин и женщин, их относят к условно-патогенной микрофлоре.
В самом кишечнике человеческого организма проживают такие виды энтерококков:
- Фекальный.

- Фэциум.
Эти разновидности бактерий образуют состав нормальной микрофлоры желудочно-кишечного тракта (ЖКТ). Эти же бактерии могут наносить и вред человеческому организму, а именно спровоцировать прогрессирование различных заболеваний (менингит, пищевые отравления, дисбактериоз и другие).
Патогенная активность именно фекального энтерококка и продуцирует развитие воспалительных процессов.
Энтерококки участвуют:
- в процессе переработки углеводов;
- в производстве витаминов;
- влияют на благоприятное создание местного иммунитета (непосредственно в кишечнике).
Для того чтобы царила полная гармония, необходимо достижение такого состояния взаимодействия, при котором количество кишечных палочек не будет превышать количество энтерококков. Нарушение этой гармонии приводит к развитию огромного ряда серьезных заболеваний.
Показатели нормы
В норме показатели энтерококков будут следующие:
- Для детей до одного года 105-107.

- Для более старшего возраста 105-108.
- Для взрослых показатель в пределах 105-108.
Причины появления энтерококков
Причины появления энтерококков в кале очень часто раскрываются через нарушения работы микрофлоры кишечника.
Это может быть вызвано:
- Достаточно длительным приемом антибактериальных препаратов.
- Заражением через кожные и слизистые повреждения. Это чаще всего может наблюдаться при проведении манипуляций в больничных учреждениях, при использовании недостаточно обработанных инструментов.
- Гормональным дисбалансом у женщин.
- У беременных женщин, как результат постоянных количественных изменений эстрогенов и андрогенов.
- Изменениями, происходящими через эндокринные процессы в организме.
Польза энтерококков для организма
Можно выделить такие важные функции энтерококка в организме:
- Расщепление и переработка углеродов.
- Укрепление иммунитета.

- Понижение кислотности желудка, общего смягчающего действия на него.
- Процесс уничтожения патогенных микроорганизмов.
- Синтез витаминов.
- Благотворное влияние на усвоение сахара.
Опасность энтерококков в организме
Опасность скрывается за целой цепочкой серьезных заболеваний. Важно следить за тем, чтобы показатели данного вида бактерий были в пределах нормы.
Полезные бактерии энтерококки становятся патогенными вследствие:
- затяжных болезненных процессов;
- перенесенных операций;
- приема препаратов антибиотиков и кортикостероидов
Патогенными энтерококки становятся и тогда, когда проникают в места нетипичного их обитания (например, попадание их в мочевыводящие пути или почки).
Заболевания, вызванные повышением энтерококков
Энтерококки могут вызвать такие заболевания:
- Дивертикулит толстой кишки – это болезненный процесс образования на стенках кишки различных образований.
 Зачастую они имеют мешковидную форму. Это заболевание нарушает процесс нормальной моторики кишечника.
Зачастую они имеют мешковидную форму. Это заболевание нарушает процесс нормальной моторики кишечника. - Различные патологии мочеполовой системы, несвоевременное лечение этих заболеваний может приобрести хроническую форму, которая будет проявляться периодическими рецидивами.
- Эндокардит. Это инфекционно-воспалительное заболевание сердца, может иметь как острый, так и хронический характер. Патогенные организмы поражают внутреннюю оболочку предсердий и желудочка, поражению подвергается также клапанный аппарат.
- Септический артрит — инфекционное поражение одного или нескольких суставов.
- Бактериемия — наличие патогенных бактерий в крови человека.
- Менингит представляет собой инфекционное воспаление оболочки спинного или головного мозга.
- Хронический гастрит – это поверхностное воспаление оболочки желудка
- Хронический энтерит. Длительно протекающее воспалительное заболевание тонкой кишки
Диагностика заболеваний, вызванных энтерококками
Общие лабораторные анализы и дополнительные:
- кровь;
- моча;
- анализ каловых масс.

С помощью последнего анализа можно точно подтвердить или отклонить вероятность подозрения инфекционной основы того или иного заболевания.
Лечение болезней, вызванных энтерококками
После проведения диагностирующих процедур, по изучению нарушения микрофлоры кишечника, а именно в случае наличия энтерококков, превышающих показатели нормы, актуальным будет лечение антибиотиками.
Для того чтобы определить к каким антибиотикам чувствителен штамм энтерококка, следует произвести посев. С помощью аминогликозидов осуществляется борьба с инфекциями, которые имеют легкую форму.
Микрофлора кишечника восстанавливается благодаря приему специальных терапевтических таблеток и свечей. Прием иммуномодуляторов способствует восстановлению и укреплению защитных сил организма.
Лечение взрослых и детей старшей возрастной категории
Лечение необязательно с применением щадящей терапии. Так как чаще всего причиной выступает ослабленный иммунитет, то все методы лечения должны быть направлены на повышение иммунных процессов организма.
Одним из вариантов лечения можно рассматривать:
- применение антипаразитарного прибора Паркес;
- лечение ампициллином и ванкомицином;
- использование бактериофага- происходит за счет полного поражения этим препаратом патогенных бактерий. Курс лечения в основном длится 5-6 дней, после чего в большинстве случаев диагностируется улучшение общего состояния;
- антибиотикотерапия (например, ампициллином), в основном длится в течение пяти дней, если есть положительная динамика, курс лечения максимально может продлиться до нескольких недель.
Лечение грудничка
Лечение обусловлено особенностью маленького организма, в лечении которого терапия антибиотиками абсолютно не приемлема. У грудного ребенка не достаточно сформирован иммунитет, а в такой ситуации прием антибиотиков существенно ухудшит состояние больного. Как выглядит кал грудничка, его нормы и отклонения читайте здесь.
В такой ситуации применяется щадящее лечение:
- с помощью бактериофагов;
- препарата Креон 1000, который и стабилизирует микрофлору малыша;
- восстановление режима грудного вскармливания;
- длительные и регулярные прогулки на свежем воздухе.

Если грудное вскармливание уже невозможно, то при подборе детской молочной смеси следует подобрать именно достаточно качественное питание, что будет соответствовать потребностям маленького организма.
Помимо терапии, снижающей количество патогенных бактерий, следует помнить о необходимости приема важных для организма витаминных комплексов.
Профилактика заболевания дисбактериоза
Профилактика очень важна как для взрослого, так и ребенка, а тем более грудничка. Родителям следует достаточно уделять внимания изменениям в настроении детей, что может свидетельствовать о начале негативной симптоматики.
Важно придерживаться не сложных, но очень важных правил, для профилактики этого заболевания:
- Правильный режим питания и регулярные прогулки на свежем воздухе будут положительно влиять на любой организм, как не имеющий достаточного иммунитета (грудничок), так и для уже взрослого человека.
- Обязательным правилом для мам грудных детей — соблюдение режима и общую продолжительность кормления младенца.

- Отказ от вредных привычек, существенно снижающих защитные силы организма.
- Регулярные занятия спортом и закаливание
Микрофлора кишечника, правильно функционирующая, это не всегда стабильное состояние человека. Превращение положительно настроенных бактерий, в связи с рядом причин, в патогенные вредители, может произойти за очень короткий промежуток времени.
Обращение к медицинскому специалисту и проведение необходимых диагностических процедур поможет не допустить усугубления ситуации.
Особое внимание следует уделить малышам грудного возраста, у которого иммунитет недостаточно сформированный, что делает грудничков наиболее беззащитными перед наплывом различных инфекций.
Здоровый и активный образ жизни не только укрепляет защитные силы организма, но и способствуют общему иммунитету к большинству различных инфекций. Правильное питание, как детей, так и взрослых станет основой здорового организма.
как вылечить, причины, симптомы, профилактика, консультация врача, последствия
Диагностика и лечение энтерококков у ребенка
Для обнаружения повышенного числа этих грамположительных микробов проводится копрограмма. В норме количество энтерококков в кале у ребенка колеблется в пределах 106—107 бактерий на 1 г. биологического материала.
В норме количество энтерококков в кале у ребенка колеблется в пределах 106—107 бактерий на 1 г. биологического материала.
Для постановки точного диагноза анализ кала не всегда является единственным маркером наличия расстройства. При выраженных признаках воспаления мочевыделительной системы показан анализ мочи. Диагноз устанавливается, если содержание энтерококков в моче у ребенка превышает сто тысяч микробных тел на 1 мл. свежевыпущенной жидкости.
Для эффективного лечения сначала определяют вид энтерококка, вызвавшего развитие инфекции. Больным показан прием жидкого интести-бактериофага. Этот антибактериальный препарат используют для терапии широкого круга болезней пищеварительного тракта, ассоциированных с деятельностью чувствительных микроорганизмов. Во избежание побочных эффектов у младенцев первые два дня лекарственное средство разводят кипяченой водой. При отсутствии негативной реакции по истечении этого срока бактериофаг можно принимать неразведенным.
Детям старше 3 лет перед употреблением препарата следует выпить раствор, состоящий из 0,5 стакана воды и половины чайной ложки соды.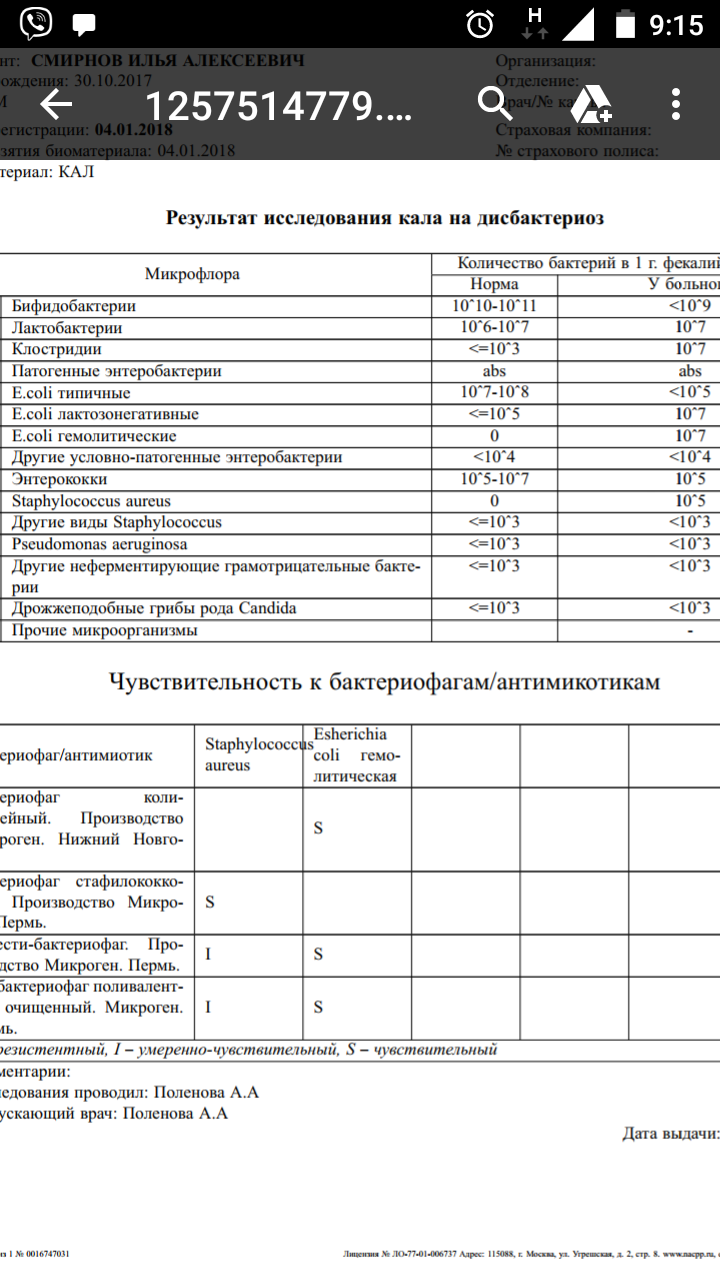
Антибиотики, конечно, намного лучше подавляют патогенную микрофлору, однако бактериофаги более безопасны для маленького ребенка. Именно это и служит определяющим фактором для педиатра при составлении конечной схемы лечения.
Профилактика, консультация педиатра по вопросу энтерококков у ребенка
Наличие инфекции сложно не заметить. Поэтому, как только у маленького пациента появились первые признаки болезни, нужно записаться на прием к педиатру. В ходе первой консультации врач оценивает состояние малыша на основании сведений анамнеза, физикального осмотра и медицинской документации.
Дальнейшая диагностика проводится с целью подтверждения микробной природы патологии и выбора оптимальной лечебной тактики. Своевременное обращение к доктору – залог эффективного подавления инфекции и нормализации кишечной микрофлоры.
Основными методы профилактики энтерококковых инфекций заключаются в раннем удалении мочевых, венозных катетеров (устанавливаются для проведения различных медицинских манипуляций) и иссечении некротических тканей. Кроме того, регулярное посещение профилактических обследований – надежный способ выявить болезнь на ранней стадии.
Кроме того, регулярное посещение профилактических обследований – надежный способ выявить болезнь на ранней стадии.
причины, повышены, понижены, нормы, лечение
Энтерококки – грамположительные микробы, представленные 15 различными видами. Есть непатогенные, полезные виды, условно-патогенные. Большое количество последних может привести к развитию различных заболеваний. Энтерококки имеют круглую форму. Они не могут образовывать вокруг себя капсул и спор.
Различают несколько групп: в 80-90% бактерии представлены Enterococcus faecalis, на втором месте находится Enterococcus faecium. Есть и другие, менее многочисленные виды.
Польза бактерии
Впервые наш организм сталкивается с энтерококками, когда они поступают к нам вместе с материнским молоком. Большая часть остается в тонком и толстом кишечнике.
Количество энтерококков зависит не только от особенностей организма, но и возраста. Чем взрослее человек, тем больше шансов на увеличенное количество бактерий в организме.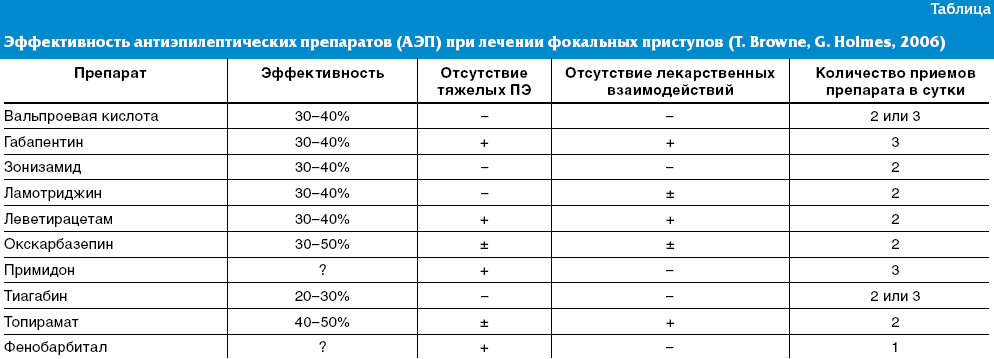
В норме на 1 гр. фекалий должно быть не больше 100 млн. бактерий. Если количественные характеристики не выше этой отметки, то:
- эффективно уничтожается условно-патогенная микрофлора;
- происходит быстрое усвоение и правильное распределение глюкозы по организму;
- синтезируются витамины;
- углеводы начинают расщепляться и перерабатываться;
- повышается иммунитет.
Некоторые непатогенные виды микробов используется в пищевой промышленности для сбраживания молока, уменьшения количество патогенных микроорганизмов в продуктах питания. Некоторые разновидности используются и в медицине. На их основе делают препараты, позволяющие эффективно бороться с дисбактериозом, кишечными инфекциями.
Опасность
Количество бактерий в количестве, превышающем норму, может привести к развитию болезней. Нарушение естественного баланса может привести к увеличению условно-патогенной микрофлоры.Патогенными они становятся при появлении в местах нетипичного обитания. Это могут быть почки, мочевыводящие пути и другие органы. Опасность скрывается за целой цепочкой серьезных заболеваний, важно следить за тем, чтобы показатели всегда были в норме.
Это могут быть почки, мочевыводящие пути и другие органы. Опасность скрывается за целой цепочкой серьезных заболеваний, важно следить за тем, чтобы показатели всегда были в норме.
Показатели нормы
При изучении каловых масс нормальным считается количество:
- для детей до 1 года – 106 – 107.
- для детей после 1 года – 107 – 108.
- для взрослых – 106 – 108.
Причины появления
У детей чаще всего причиной становится прием лекарственных средств, переохлаждение, повреждение целостности слизистой. Иногда в кале появляются бактерии при использовании инвазивных методов диагностики.
У взрослых причин для появления в кале энтерококков больше. Это может быть длительный прием антибиотиков, гормональный дисбаланс у женщин. Иногда наблюдается большое количество бактерий у беременных женщин в результате постоянных скачков эстрогенов и андрогенов.
Обычно заразиться энтерококками невозможно, поскольку они являются естественными обитателями нашего организма.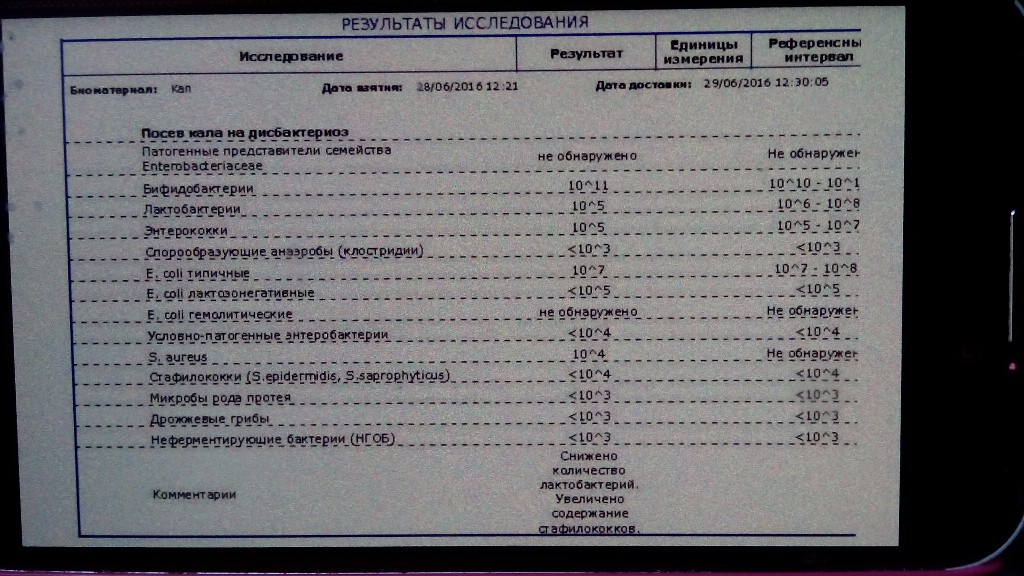 Их увеличение может быть связано с несоблюдением правил личной гигиены, снижением реактивности иммунитета.
Их увеличение может быть связано с несоблюдением правил личной гигиены, снижением реактивности иммунитета.
Последнее возможно из-за стрессов, наличия различных патологий инфекционного характера. Провоцирующими факторами выступают и чрезмерное увлечение алкогольными напитками, естественное старение человека.
Энтерококки в кале повышены
Бактерия может спровоцировать развитие серьезных проблем со здоровьем. К ним относится:
- Менингит. Инфекционное заболевание оболочки спинного или головного мозга.
- Дивертикулит. Болезненный процесс, связанный с образованием на стенках различных образований. Нарушает процессы нормальной моторики кишечника.
- Патологии мочеполовой системы. При отсутствии лечения могут появиться хронические формы, которые трудно поддаются лечению, становятся причинами рецидивов.
- Эндокардит. Заболевание сердца, которое может носить острый или хронический характер. Патогенная микрофлора поражает внутреннюю оболочку предсердий, желудочка, клапанного аппарата.
- Септический артрит. При нем происходит инфекционное поражение суставов.
- Гастрит. Характеризуется поверхностным воспалением оболочки желудка.
- Энтерит. Патология, которая в основном затрагивает здоровые клетки тонкой кишки.
В грудничковом возрасте предположить чрезмерное увеличение количества бактерий можно по различным симптомам. К ним относится выделение зловонного кала, диарея, вздутие живота. Ребенок может стать плаксивым, отказаться от еды.
У взрослых признаками увеличения патогенной микрофлоры являются не только симптомы, характерные для той или иной болезни, но и депрессия, слабость, повышенная утомляемость. У мужчин может страдать потенции.
Если понижены?
Иногда показатели снижены. Это может происходить по физиологическим причинам. Это не имеет диагностической информации. Резкий рост может спровоцировать серьезные воспалительные реакции.
Диагностика заболеваний, вызванных бактерией
Выявить причину болезни, спровоцированной увеличенным количеством энтерококков можно только с использованием лабораторных методов исследования.Кроме анализа кала может потребоваться исследования мочи, мазок. Последний применяется в большинстве случаев у женщин, поскольку бактерии у них нередко становятся причиной вагинитов и других воспалений половых путей.
Если энтерококки появились в большом количестве, то могут потребоваться и анализы крови для определения воспалительной реакции. Остальные методы диагностики подбираются с учетом специфики протекания патологии.
Лечение
За последние 30 лет энтерококки стали устойчивы практически ко всем известным классам антибиотиков. Несмотря на это подобные препараты являются одними из основных для лечения патологии.
Чтобы уменьшить риск развития резистентности используются комбинации различных противомикробных препаратов. Дополнительно проводится посев, чтобы определить степень чувствительности штамма энтерококка к тому или иному препарату.
Чаще всего при легком течении патологии применяются аминогликозиды. Дополнительно могут быть назначены иммуномодуляторы. Способствующие восстановлению защитных свойств организма.
Полезные энтерококки позволяют справляться с патогенной микрофлорой. Поэтому они продаются в форме специальных средств. Пробиотики предназначены для лечения дисбактериоза, восстановления нормальной микрофлоры ЖКТ.
Популярными и известными средствами являются Бифиформ, Линекс. Для создания таких препаратов чаще используют штаммы, которые были селекционированные для пищевой промышленности. Такие штаммы не рассчитаны на слишком длительный период нахождения в организме.
При слишком большом росте энтерококков применяется жидкий бактериофаг. Его можно давать детям первых месяцев жизни. Бактериофаг можно пить или использовать для клизмы.
В заключение отметим, что поддерживать нормальный рост микрофлоры в кишечнике просто, если соблюдать правильный режим питания, совершать прогулки на свежем воздухе.
Врачи напоминают, что вредные привычки снижают защитные силы организма. Поэтому рекомендуется отказаться от них, сделать упор на регулярных видах спорта и закаливания. Особое внимание уделяется грудничкам. У них иммунитет еще сформирован не до конца, поэтому нужно следить за их правильным питанием.
Анализ кала на дисбактериоз
Анализ кала на дисбактериоз
Представлены обобщенные сведения о традиционном микробиологическом анализе кала культурально-зависимым способом (бакпосевом).
О новых методиках анализа кишечной микробиоты информация ниже.
Анализ кала на дисбактериоз или Бактериологический посев (посев или бакпосев). Посев – это биологическое исследование испражнений, которое определяет состав и примерное количество микроорганизмов, обитающих в кишечнике человека. Для этого используется внесение частиц кала на разные питательные среды, на которых растут 3 группы микроорганизмов: нормальные (необходимы для переваривания пищи), условно-патогенные (способные при снижении естественной резистентности макроорганизма вызывать заболевания, для которых характерно отсутствие нозологической специфичности) и патогенные (болезнетворные). Указанное лабораторное исследование используется в медицинской практике с профилактической целью и при подозрении на инфекционное заболевание желудочно-кишечного тракта.
Данное исследование позволяет определить содержание бактерий в толстом кишечнике. В кишечнике человека содержится огромное количество бактерий, которые активно участвуют в переваривании и усвоении питательных веществ. Анализ кала на дисбактериоз назначается по большей части детям, в таких случаях, когда имеются следующие нарушения работы кишечника: диарея, запор, боли в животе, метеоризм, а также после длительного лечения антибиотиками (антибиотики помимо того, что борются с инфекциями, уничтожают и нормальные бактерии кишечника). Существую три группы бактерий кишечника – «нормальные» бактерии (бифидобактерии, лактобактерии и эшерихии) они активно участвуют в работе кишечника, условно-патогенные бактерии (энтерококки, стафилококки, клостридии, кандиды) при определенных обстоятельствах могут превратиться в патогенные бактерии и вызвать различные заболевания, и патогенные бактерии (шигелла, сальмонелла) которые при попадании в кишечник вызывают серьезные инфекционные заболевания кишечника.
Нормы анализа кала на дисбактериоз(КОЕ / г фекалий)
| Дети до 1 года | Дети старшего возраста | Взрослые |
Бифидобактерии | 1010 – 1011 | 109 – 1010 | 108 – 1010 |
Лактобактерии | 106 – 107 | 107 – 108 | 106 – 108 |
Эшерихии | 106 – 107 | 107 – 108 | 106 – 108 |
Бактероиды | 107 – 108 | 107 – 108 | 107 – 108 |
Пептострептококки | 103 – 105 | 105 – 106 | 105 – 106 |
Энтерококки | 105 – 107 | 105 – 108 | 105 – 108 |
Сапрофитные стафилококки | ≤104 | ≤104 | ≤104 |
Патогенные стафилококки | – | – | – |
Клостридии | ≤103 | ≤105 | ≤105 |
Кандида | ≤103 | ≤104 | ≤104 |
Патогенные энтеробактерии | – | – | – |
Бифидобактерии
Норма бифидобактерий
Дети до 1 года | 1010 – 1011 |
Дети старшего возраста | 109 – 1010 |
Взрослые | 108 – 1010 |
Около 95% всех бактерий в кишечнике – бифидобактерии. Бифидобактерии участвуют в производстве таких витаминов как В1, В2, В3, В5, В6, В12,К. Помогают всасыванию витамина D, при помощи специальных вырабатываемых ими веществ борются с «плохими» батериями, а также участвуют в усилении иммунитета.
Причины снижения количества бифидобактерий
- Медикаментозное лечение (антибиотики, нестероидные противовоспалительные средства (НПВС) такие как анальгин, аспирин, слабительные средства)
- Неправильное питание (избыток жиров или белков или углеводов, голодание, неправильный режим питания, искусственное вскармливание)
- Кишечные инфекции (дизентерия, сальмонеллез, вирусные инфекции)
- Ферментопатии (целиакия, лактазная недостаточность)
- Хронические заболевания ЖКТ (хронический гастрит, панкреатит, холецистит, язвенная болезнь желудка или двенадцатиперстной кишки)
- Иммунные заболевания (иммунные дефициты, аллергии)
- Смена климатических зон
- Стресс
Лактобактерии
Норма лактобактерий
Дети до 1 года | 106 – 107 |
Дети старшего возраста | 107 – 108 |
Взрослые | 106 – 108 |
Лактобактерии занимают около 4-6% от общей массы бактерий кишечника. Лактобактерии являются не менее полезными, чем бифидобактерии. Их роль в организме следующая: поддержка уровня pH в кишечнике, производство большого количества веществ (молочная кислота, уксусная кислота, перекись водорода, лактоцидин, ацидофилин), которые активно используются для уничтожения патогенных микроорганизмов, а также вырабатывают лактазу.
Причины снижения количества лактобактерий
- Медикаментозное лечение (антибиотики, нестероидные противовоспалительные средства (НПВС) такие как анальгин, аспирин, слабительные средства)
- Неправильное питание (избыток жиров или белков или углеводов, голодание, неправильный режим питания, искусственное вскармливание)
- Кишечные инфекции (дизентерия, сальмонеллез, вирусные инфекции)
- Хронические заболевания ЖКТ (хронический гастрит, панкреатит, холецистит, язвенная болезнь желудка или двенадцатиперстной кишки)
- Стресс
Эшерихии (E.coli типичные)
Норма эшерихий
Дети до 1 года | 107 – 108 |
Дети старшего возраста | 107 – 108 |
Взрослые | 107 – 108 |
Эшерихии появляются в организме человека с рождения и присутствуют в нем на протяжении всей жизни. Выполняют следующую роль в организме: участвуют в образовании витаминов группы В и витамина К, участвуют в переработке сахаров, вырабатывают антибиотикоподобные вещества (колицины) которые борются с патогенными организмами, усиливают иммунитет.
Причины снижения количества эшерихий
- Гельминтозы
- Лечение антибиотиками
- Неправильное питание (избыток жиров или белков или углеводов, голодание, неправильный режим питания, искусственное вскармливание)
- Кишечные инфекции (дизентерия, сальмонеллез, вирусные инфекции)
Бактероиды
Норма бактероидов в кале
Дети до 1 года | 107 – 108 |
Дети старшего возраста | 107 – 108 |
Взрослые | 107 – 108 |
Бактероиды участвуют в пищеварении, а именно в переработке жиров в организме. У детей до 6 месяцев в анализах кала не обнаруживаются, их можно обнаружить, начиная с возраста 8-9 месяцев.
Причины увеличения содержания бактероидов
- Жировая диета (употребление большого количества жиров в пищу)
- Лечение антибиотиками
- Кишечные инфекции (дизентерия, сальмонеллез, вирусные инфекции)
Причины снижения содержания бактероидов
- Лечение антибиотиками
- Кишечные инфекции (дизентерия, сальмонеллез, вирусные инфекции)
Пептострептококки
Нормальное количество в кале
Дети до 1 года | 103 – 105 |
Дети старшего возраста | 105 – 106 |
Взрослые | 105 – 106 |
В норме пептострептококки живут в толстом кишечнике, при увеличении их количества и попадании в любую другую область нашего организма, они вызывают воспалительные заболевания. Участвуют в переработке углеводов и молочных белков. Вырабатывают водород, который в кишечнике превращается в перекись водорода и помогает контролировать рН в кишечнике.
Причины увеличения содержания пептострептококков
- Употребление большого количества углеводов
- Кишечные инфекции
- Хронические заболевания ЖКТ
Энтерококки
Норма энтерококков
Дети до 1 года | 105 – 107 |
Дети старшего возраста | 105 – 108 |
Взрослые | 105 – 108 |
Энтерококки участвуют в переработке углеводов, в производстве витаминов, а также играют роль в создании местного иммунитета (в кишечнике). Количество энтерококков не должно превышать количество кишечных палочек, если их количество увеличивается, они могут вызвать ряд заболеваний.
Причины увеличения содержания энтерококков
- Снижение иммунитета, иммунные заболевания
- Пищевые аллергии
- Гельминтозы
- Лечение антибиотиками (в случае резистентности энтерококков к применяемому антибиотику)
- Неправильное питание
- Снижение количества кишечной палочки (эшерихии)
Стафилококки (сапрофитные стафилококки и патогенные стафилококки)
Норма сапрофитных стафилококков
Дети до 1 года | ≤104 |
Дети старшего возраста | ≤104 |
Взрослые | ≤104 |
Норма патогенных стафилококков
Дети до 1 года | – |
Дети старшего возраста | – |
Взрослые | – |
Стафилококки делятся на патогенные и непатогенные. К патогенным относятся: золотистый, гемолитический и плазмокоагулирующий, наиболее опасен золотистый. К непатогенным стафилококкам относятся негемолитический и эпидермальный.
Стафилококк не относится к нормальной микрофлоре кишечника, он попадает в организм из внешней среды вместе с пищей. Золотистый стафилококк, попадая в ЖКТ, обычно, вызывает токсические инфекции.
Причины появления стафилококка
Стафилококк может попасть в организм человека разными путями, начиная грязными руками, вместе с продуктами питания и заканчивая внутрибольничными инфекциями.
Клостридии
Норма клостридий
Дети до 1 года | ≤103 |
Дети старшего возраста | ≤105 |
Взрослые | ≤105 |
Клостридии участвуют в переработке белков, продуктом их переработки являются такие вещества как индол и скатол, которые по сути являются ядовитыми веществами, однако в небольших количествах эти вещества стимулируют перистальтику кишечника тем самым улучшая функцию эвакуации каловых масс. Однако при увеличении количества клостридий в кишечнике вырабатывается большее количество индола и скатола, что может привести к развитию такого заболевания как гнилостная диспепсия.
Причины увеличения количества клостридий
- Большое количество белка употребляемого в пищу
Кандида
Норма кандид
Дети до 1 года | ≤103 |
Дети старшего возраста | ≤104 |
Взрослые | ≤104 |
При увеличении количества кандид в кишечнике может развиться бродильная диспепсия, а также заметное увеличение количества кандид может спровоцировать развитие различных видов кандидоза.
Причины увеличения количества кандид
- Употребление большого количества углеводов в пищу
- Лечение антибиотиками (без применения в комплексе противогрибковых препаратов)
- Использование гормональных противозачаточных средств
- Беременность
- Сахарный диабет
- Стресс
Анализ кала на патогенную флору
Анализ кала на патогенную флору является тем же самым анализом кала на дисбактериоз. В бланке с результатами анализов он занимает место – Патогенные энтеробактерии. К группе патогенных энтеробактерий относят Сальмонеллу и Шигеллу как основных возбудителей инфекционных заболеваний кишечника.
Патогенные (болезнетворные) бактерии (pathogenic bacteria, греч. pathos — страдание и genes — порождающий, рождающийся; греч. bacterion — палочка) – бактерии, паразитирующие на других организмах и способные вызывать инфекционные заболевания человек, среди которых особое место занимают кишечные инфекции. Кишечные инфекции – целая группа заразных заболеваний, которые в первую очередь повреждают пищеварительный тракт. Заражение происходит при попадании возбудителя инфекции через рот, как правило, при употреблении зараженных пищевых продуктов и воды. Всего таких заболеваний более 30, в частности, к ним относятся: холера, брюшной тиф, ботулизм, сальмонеллез, дизентерия и т.п. Среди кишечных заболеваний самое безобидное — это пищевое отравление. Возбудителями кишечных инфекций могут быть как сами бактерии (сальмонеллез, брюшной тиф, холера), так и их токсины (ботулизм). Некоторые бактерии могут вызывать язвенную болезнь и рак желудка, а также хронический гастрит.
Сальмонелла
В норме сальмонеллы в результате анализа быть не должно!
Вызывает такое заболевание как сальмонеллез, которое проявляется сильным токсическим поражением кишечника. Основными переносчиками являются водоплавающие птицы.
Причины появления сальмонеллы
- Употребление плохо обработанного или сырого мяса
- Употребление плохо обработанных или сырых яиц
- Контакт с переносчиками
- Контакт с водой зараженной сальмонеллой
- Грязные руки
Шигелла
В норме шигеллы в результате анализа быть не должно!
Вызывает такое заболевание как дизентерия, которое также поражает кишечник и проявляется сильным токсическим поражением кишечника. Основными путями заражения являются молочные продукты, сырые овощи, зараженная вода, люди больные дизентерией.
Причины появления шигеллы
- Употребление или контакт с зараженной водой
- Употребление зараженных продуктов питания
- Контакт с людьми болеющими дизентерией
- Грязные руки и контакт с зараженными поверхностями (посуда, игрушки)
Часто задаваемые вопросы
Как правильно подготовиться к анализу?
Применение некоторых медикаментов может повлиять на результат анализа кала. Поэтому их применение необходимо приостановить или прекратить в период подготовки к сдаче анализа кала после консультации с вашим врачом.
- Отменить прием препаратов (после личной консультации Вашего лечащего врача). К препаратам, которые могут повлиять на результаты анализов кала, относятся следующие:
- Противодиарейные препараты (Смекта, Неосмектин, Полифан, Имодиум, Энтерол)
- Противогельминтные препараты (Немозол, Декарис, Вермокс, Гельминтокс)
- Антибиотики – любые виды
- Лечебные и очищающие клизмы
- Слабительные препараты (Бисакодил, Экстракт сенны, Форлакс, Порталак)
- НПВП – нестероидные противовоспалительные препараты (Аспирин, Парацетамол, Ибупрофен)
- Также нельзя использовать кал который был в контакте с чистящими или дезинфицирующими средствами, которые используются для чистки унитаза, водой или мочой.
Как правильно собрать кал для анализа?
- Помочитесь перед сбором материала, для того чтобы моча не попала в кал.
- Необходимо взять чистую, сухую ёмкость, куда будет проводиться дефекация.
- Из полученного материала необходимо взять 8-10 см3 (~2 чайные ложки). Кал забирается при помощи специальной «ложки» которая встроена в крышку специального контейнера, который вам должны выдать для сбора кала.
- Кал для анализа собирается из разных участков каловых масс (сверху, с боков, изнутри)
- Материал (кал) кладется в выданный вам контейнер, и плотно закрывается.
- Необходимо подписать контейнер (Ваше имя и фамилию, дату сбора анализа)
Как хранить кал перед отправкой в лабораторию?
Материал для анализа кала на дисбактериоз и на кишечную инфекцию необходимо доставить в лабораторию в максимально короткие сроки 30-40 минут (максимум 1,5 -2 часа). Чем больше времени прошло со времени сбора материала и момента доставки материала в лабораторию, тем менее достоверны будут анализы. Проблема в том, что большая часть бактерий кишечника являются анаэробными, то есть они живут в среде без кислорода, при контакте с ним умирают. Это может повлиять на достоверность результата. Поэтому хранить хоть какое либо время свыше рекомендуемых максимальных 2 часа, категорически не рекомендуется.
Примечание
Полный (максимально подробный и точный) микробиологический анализ кала (анализ микробиоты толстой кишки) невозможно провести культурально зависимым способом, т.к. не все бактерии можно выделить и культивировать в искусственных условиях. В общем, проблема с микробиомом состоит в том, что мы можем выращивать в лаборатории менее 5% видов микробов, остальные просто слишком привередливы. Сегодня используются более технологичные культурально-независимые методы анализа:
Обзор популярных методов анализа микробиоты
Современные анализы кишечной микробиоты проводятся культурально-независимыми способами, среди которых можно выделить два наиболее известных на сегодняшний день в России метода – метод газовой хроматографии масс-спектрометрии микробных маркеров и метагеномный анализ микробиоты с помощью секвенирования нуклеиновых кислот. Обе методики имеют свои преимущества и недостатки (стоимость, время), включая погрешности в самих результатах и ограничения в использовании, а поэтому они совершенствуются до сих пор. Но несмотря на определенные недочеты, указанные технологии при грамотном использовании все же являются мощным инструментарием на пути к достижению целей персонализированнной медицины.
Информация к разделу: Дисбактериоз
См. отдельно: Типичный анализ микробиома кишечника по образцам стула (метод метагеномики)
Будьте здоровы!
ССЫЛКИ К РАЗДЕЛУ О ПРЕПАРАТАХ ПРОБИОТИКАХ
- ПРОБИОТИКИ
- ДОМАШНИЕ ЗАКВАСКИ
- БИФИКАРДИО
- КОНЦЕНТРАТ БИФИДОБАКТЕРИЙ ЖИДКИЙ
- ПРОПИОНИКС
- ЙОДПРОПИОНИКС
- СЕЛЕНПРОПИОНИКС
- МИКРОЭЛЕМЕНТНЫЙ СОСТАВ
- ПРОБИОТИКИ С ПНЖК
- БИФИДОБАКТЕРИИ
- ПРОПИОНОВОКИСЛЫЕ БАКТЕРИИ
- ПРОБИОТИКИ И ПРЕБИОТИКИ
- СИНБИОТИКИ
- РОЛЬ МИКРОБИОМА В ТЕРАПИИ РАКА
- АНТИОКСИДАНТНЫЕ СВОЙСТВА
- АНТИОКСИДАНТНЫЕ ФЕРМЕНТЫ
- АНТИМУТАГЕННАЯ АКТИВНОСТЬ
- МИКРОФЛОРА КИШЕЧНОГО ТРАКТА
- МИКРОБИОМ ЧЕЛОВЕКА
- МИКРОФЛОРА И ФУНКЦИИ МОЗГА
- ПРОБИОТИКИ И ХОЛЕСТЕРИН
- ПРОБИОТИКИ ПРОТИВ ОЖИРЕНИЯ
- МИКРОФЛОРА И САХАРНЫЙ ДИАБЕТ
- ПРОБИОТИКИ и ИММУНИТЕТ
- МИКРОБИОМ И АУТОИММУННЫЕ БОЛЕЗНИ
- ПРОБИОТИКИ и ГРУДНЫЕ ДЕТИ
- ПРОБИОТИКИ, БЕРЕМЕННОСТЬ, РОДЫ
- ДИСБАКТЕРИОЗ
- ВИТАМИННЫЙ СИНТЕЗ
- АМИНОКИСЛОТНЫЙ СИНТЕЗ
- АНТИМИКРОБНЫЕ СВОЙСТВА
- СИНТЕЗ ЛЕТУЧИХ ЖИРНЫХ КИСЛОТ
- СИНТЕЗ БАКТЕРИОЦИНОВ
- ФУНКЦИОНАЛЬНОЕ ПИТАНИЕ
- АЛИМЕНТАРНЫЕ ЗАБОЛЕВАНИЯ
- ПРОБИОТИКИ ДЛЯ СПОРТСМЕНОВ
- ПРОИЗВОДСТВО ПРОБИОТИКОВ
- ЗАКВАСКИ ДЛЯ ПИЩЕВОЙ ПРОМЫШЛЕННОСТИ
- НОВОСТИ
Микрофлора кишечника у детей – почему это важно
Микрофлора (или микробиота, микробиом) – это комплекс микроорганизмов разных видов, живущих в симбиозе с человеческим организмом и помогающих ему. Бактерии присутствуют практически на каждом участке нашего тела: во рту, в легких, в носу, на коже. Их нет в желудке: там они не выживают из-за высокой кислотности. Зато в кишечнике присутствуют в большом количестве.
Кишечная микрофлора у детей: ее особенности и этапы формирования
Бактерии начинают заселять кишечник малыша с самого рождения и сопровождают человека до конца жизни. Ребенок появляется на свет со стерильной пищеварительной системой. В первородном кале микроорганизмов не обнаруживается. Эту фазу называют асептической.
Но по мере взаимодействия новорожденного с окружающей средой начинает формироваться микрофлора. Происходит это в несколько этапов:
• 2-ая фаза. Во время родов ребенок впервые встречается с бактериями. В его организм попадает микрофлора из половых органов и кишечника матери, в которой преобладают лактобациллы.
• Транзиторная фаза (первые дни жизни). На формирование микробиоты оказывает влияние несколько факторов: состояние здоровья роженицы, характер питания малыша (грудное или искусственное вскармливание), уровень микробного загрязнения окружающей обстановки. В этот период в организме новорожденного преобладают клостридии и коковая флора (энтерококки, микрококки). Позже их вытесняют энтеробактерии, бифидобактерии.
• Фаза трансплантации (первые 2-3 недели). Состав кишечной микробиоты подвержен колебаниям. Стабилизация наступает к концу первого месяца жизни. Доминирующей становится бифидофлора. Искусственное и смешанное вскармливание увеличивают трансплантационный период. При таком питании бифидофлора несколько угнетена.
К 4-7 годам отмечаются значительные изменения в микробиоценозе: уменьшается содержание лакто- и бифидобактерий, возрастает число граммположительных аспорогенных организмов. Формирование занимает несколько лет. Обычно только к 12-13 годам состав кишечной микрофлоры у детей становится таким же, как у взрослых.
Коротко о составе микробиоты
Нормальная микрофлора кишечника у детей состоит на 90% из молочнокислых микроорганизмов (бифидо- и лактобактерий) и на 10% из энтеробактерий. Но такое соотношение возможно только в том случае, если малыш доношен и здоров. Именно молочнокислые микроорганизмы вырабатывают молочную и уксусную кислоты, которые обеспечивают иммунную защиту от патогенных и гнилостных бактерий.
Отмечаются характерные особенности микрофлоры у детей, находящихся на грудном и искусственном вскармливании. Если младенец питается грудным молоком, преобладают бифидобактерии. При кормлении смесями – лактобактерии.
Состав сформированной кишечной микробиоты представлен 2-мя группами микроорганизмов:
• Облигатными (обязательными, основными). К ним относятся бифидо-, лакто-, пропионибактерии, энтерококки, кишечные палочки, бактериоды. Они абсолютно безопасны для организма.
• Факультативные (условно-патогенные). В эту группу входят клостридии, цитро-, энтеробактеры, клебсиеллы. Они могут мирно существовать в кишечнике, не давая о себе знать. Но при снижении местного иммунитета, ухудшении самочувствия человека способны вызвать воспалительный процесс.
Наличие патогенных микроорганизмов (золотистого стафилококка, холерного вибриона, дрожжевых грибков Кандида) всегда указывает на развитие заболевания. Обычно у здорового человека их нет. Бывают случаи обнаружения в кишечнике небольшого количества (0.01%) возбудителей инфекций, но при отсутствии проблем с иммунной защитой, это не приводит к возникновению патологий.
Роль микрофлоры для здоровья детей
Присутствие микроорганизмов необходимо. Нормальная флора кишечника оказывает благоприятное влияние на здоровье, ведь она:
• Препятствует размножению патогенных штаммов, что спасает от возникновения кишечных инфекций.
• Предотвращает развитие гнилостных процессов в толстой кишке, останавливает брожение. Это обеспечивает хорошее самочувствие.
• Завершает процесс переработки пищи, формируя нормальные каловые массы, легко покидающие пищевой тракт. Устраняет предпосылки для поноса или диареи.
• Способствует всасыванию многих полезных микроэлементов. При этом препятствует проникновению внутрь токсинов.
• Участвует в синтезе минералов, витаминов, ферментов.
• Укрепляет детский иммунитет, продуцируя иммуноглобулин А и стимулируя работу лимфоидной ткани, 80% которой присутствует в слизистой пищеварительной системы.
В 2016 году были опубликованы исследования западных микробиологов, которые пришли к интересным выводам. Оказывается, нормальная микробиота способствует крепкому сну. Мелатонин – гормон, отвечающий за его качество, вырабатывается не только мозгом, но и бактериями кишечника.
И это еще не все: польза нормофлоры огромна. Она может влиять как на самочувствие, так и на настроение. В частности, бороться с депрессией. Микроорганизмы способствуют снижению концентрации гормона стресса – кортизола, тем самым избавляют от тревожности.
Значимость отдельных бактерий
У каждого представителя облигатной группы свои задачи, решение которых позволяет поддерживать здоровье ребенка:
• Молочнокислые бактерии стимулируют синтез желудочного сока, способствуют быстрому усвоению микроэлементов, устраняют газообразование.
• Энтерококки, размножаясь в дрожжевой среде или лактозе, улучшают и ускоряют переваривание пищи.
• Бактероиды нейтрализуют желчь с помощью специального вещества, полученного в процессе брожения.
• Кишечная палочка синтезирует лактозу, участвует в выработке витаминов группы В, К. Она выделяет антисептик, способный уничтожить сальмонеллу.
Отсутствие обязательных микроорганизмов приведет к серьезным проблемам со здоровьем.
Чем грозит нарушение микрофлоры
При грамотном уходе за новорожденными, правильном питании малышей и ребят старшего возраста микробное сообщество находится в равновесии. Родители младенцев, не достигших 3-х месяцев, часто сталкиваются с возникающими у малышей коликами, метеоризмом, проблемами с дефекацией. Объясняется это недостатком полезных бактерий и нехваткой ферментов для переваривания молока.
Опасность представляют и нестерильные погремушки, пустышки, через которые вредоносные бактерии попадают в детский организм и начинают размножаться.
Нарушение микрофлоры кишечника у ребенка объясняется 2-мя факторами: проникновением патогенных или снижением полезных микроорганизмов. Причины этого бывают разные:
• Неправильный рацион кормящей мамы.
• Раннее введение искусственного прикорма.
• Инфекции.
• Применение некоторых лекарственных препаратов (противовоспалительных, антибиотиков).
• Плохая экологическая обстановка.
• Некоторые заболевания: анемия, рахит.
• Пребывание ребенка в стрессовой ситуации.
Все это может привести к дисбактериозу, то есть нарушению баланса патогенной и полезной микрофлорой. Он бывает транзиторным (наблюдается у малышей в первые дни жизни) и истинным. При грудном вскармливании транзиторный быстро проходит, так как молочнокислые бактерии вытесняют болезнетворных аналогов. Но может затянуться у недоношенных младенцев и тех, которым назначили антибиотики.
Истинный дисбактериоз разделяется на 2 вида. При компенсированном виде о нарушении микрофлоры свидетельствуют только анализы кала. Некомпенсированный дисбиоз сопровождается образованием газов, рвотой, вздутием живота.
Симптомы дисбактериоза
Медики выделяют 4 степени выраженности патологии. Каждая из них имеет характерные признаки:
1. Компенсированная. Проявляется появлением слизи в каловых массах, их необычным запахом, снижением аппетита.
2. Субкомпенсированная. Усиленное газообразование вызывает колики. Нарушается стул, возможно появление поносов или запоров. Ребенок ведет себя беспокойно: малыши часто срыгивают, взрослые ребята испытывают тошноту, чувствуют позывы рвоты.
3. Средняя. К присутствующим ранее симптомам добавляются повышенная температура, слабость, явно выраженное вздутие живота. Дети плачут, отказываются от еды.
4. Тяжелая. Характеризуется учащенными испражнениями (до 15 раз в сутки), сильными болями в животе, сухой кожей из-за обезвоживания, бледностью. Возможно развитие анемии, так как полезные микроэлементы не усваиваются. Лечится только в инфекционном отделении.
Также на любой стадии могут появляться покраснения (особенно в складках кожи), аллергия, молочница в ротовой полости. О дисбактериозе кишечника свидетельствует и диатез у малыша. Такое состояние не пройдет самостоятельно. Оно будет длиться до тех пор, пока не будет выявлена и устранена причина нарушения баланса патогенных и полезных микроорганизмов.
Помощь при дисбактериозе
Главная задача – восстановить сбалансированный биоценоз, то есть устранить вредоносные бактерии, уменьшить количество условно-патогенных и увеличить численность полезных микроорганизмов.
Следует придерживаться правил питания:
• Кормить ребенка только свежеприготовленными блюдами.
• Не допускать переедания, так как при этом замедляется процесс переваривания пищи.
• Придерживаться дробного питания – не менее 5 раз в день.
• Исключить или ограничить употребление соли.
Для улучшения микрофлоры кишечника ребенку назначают специальную диету. В рацион малышей на смешанном вскармливании добавляются кисломолочные продукты – желательно без красителей и ароматизаторов: простокваша, кефир. Для прикорма лучше выбирать смеси, обогащенные бифидобактериями, олигосахаридами, овощные пюре и каши без сахара.
Диета для детей старшего возраста предполагает ограничение животных белков, сахара, углеводов. Обязательно должны присутствовать хлеб грубого помола, крупы, овощи. Выбор продуктов во многом зависит от симптоматики. При запоре рекомендуют чернослив, овсянку, свеклу. При поносе – рисовые каши, пюре из цветной капусты, печеные яблоки. При метеоризме – паровые омлеты, легкие бульоны, запеченный картофель. Лучше отказаться от бобовых, сладостей, цельного молока. Способствуют восстановлению биоценоза геркулес и гречка.
Медикаментозное лечение
Фармакология предлагает много средств для устранения дисбактериоза разными способами. Обычно применяют:
• Пребиотики. Формируют благоприятные условия жизни для полезных бактерий. Доказали эффективность сироп «Лактусан», «Дюфалак» в виде суспензии. Назначенные после поноса или курсовой терапии антибиотиками, они способствуют заживлению слизистой кишечника, улучшают пищеварение.
• Пробиотики. Используются для заселения флоры, выступают аналогами полезных микроорганизмов. В составе может присутствовать один тип бактерий или несколько. Часто выписывают свечи «Лактобактерин», капсулы «Линекс», «Бифидумбактерин» в виде порошка.
• Симбиотики. Совмещают свойства про- и пребиотиков. Создают благоприятную среду и заселяют кишечник полезной флорой. Улучшают пищеварение, продуцируют фолиевую кислоту, пиридоксин, витамин К. В аптеках встречаются «Бифистим», «Максилак», а специально для детей с 4-хмесячного возраста создан «Максилак Бэби».
• Антибиотики. Назначаются при тяжелом протекании патологии. Устраняют патогенную микрофлору, хорошо справляются с грибами, стафилокками. Наиболее распространен «Метронидазол».
Все препараты назначает врач. Заниматься самолечением нельзя. Также доктор может выписать дополнительные средства. Детям, подверженным заболеваниям, назначается иммуномоделирующая терапия. При нарушении пищеварения – ферменты, при интоксикации – сорбенты. Для устранения кандидозного дисбактериоза используются «Флукозонал», «Нистатин» – препараты с противогрибковым эффектом. Также могут применяться антидиарейные, антигистаминные, спазмолитические средства.
Профилактика дисбактериоза
Нарушение микробной флоры лучше предупредить, чем потом устранять последствия. Причем заниматься профилактикой нужно задолго до рождения малыша. Все начинается с правильного режима дня и сбалансированного питания беременной женщины. Будущая мама должна избавиться от возможных очагов инфекции. Особенно часто они локализуются в мочевыводящих путях и ротовой полости.
После появления младенца на свет большое значение имеет раннее прикладывание к груди – в течение получаса с момента родов. Не следует быстро отказываться от естественного вскармливания. Введение прикормов должно быть своевременным. Они обязательно должны включать обогащенные бифидобактериями кисломолочные продукты. Выбирать нужно только качественные, желательно с коротким сроком годности, без ароматизаторов.
Профилактика для ребят старшего возраста заключается в правильном питании, в своевременном лечении болезней ЖКТ, так как они практически всегда нарушают состав кишечной флоры. Если был назначен курс антибактериальных препаратов, после него обязательно прохождение общеукрепляющей терапии.
Дисбактериоз свидетельствует о сбоях в организме детей. Его нельзя оставлять без внимания. Не допустить нарушений флоры позволят профилактические мероприятия. А своевременное и грамотное лечение восстановит биоценоз, если он все-таки пошатнулся.
границ | Enterococcus faecalis, выделенный из детских фекалий, подавляет токсигенные Clostridioides (Clostridium) difficile
Введение
Clostridioides (Clostridium) difficile – это грамположительная палочка, спорообразующая, анаэробная и токсин-продуцирующая бактерия. Инфекция C. difficile (CDI) является основной причиной диареи, связанной с антибиотиками (AAD) и внутрибольничной диареи, и ее проявления варьируются от легкой диареи до псевдомембранозного колита и смерти (1).В глобальном масштабе заболеваемость и тяжесть ИКД существенно выросли за последнее десятилетие, о чем свидетельствуют высокие показатели заболеваемости и смертности (1, 2).
Распространение C. difficile в медицинских учреждениях обычно связано с эндоспорами (3), которые обладают высокой устойчивостью к химическим веществам и экстремальным температурам и сохраняются в течение месяцев и даже лет. Было обнаружено, что окружающая среда вокруг пациентов с ИКД и толстый кишечник пациентов, получающих антибиотики широкого спектра действия, загрязнены спорами C.difficile . В отсутствие нормальной флоры и в соответствующих условиях споры созревают в вегетативные клетки кишечника, что в конечном итоге приводит к ИКД (2). Вегетативные клетки прикрепляются к эпителиальным клеткам и переносят токсины в клетки. Патогенез CDI опосредуется токсинами, такими как энтеротоксин (TcdA) и цитотоксин (TcdB), которые кодируются генами tcdA и tcdB соответственно (4). Эти токсины являются основными детерминантами вирулентности и проявляют как цитопатическое, так и цитотоксическое действие на клетки млекопитающих.В эпителиальных клетках кишечника эти эффекты опосредуются инактивацией ГТФаз семейства Rho, таких как Rho, Cdc42 и Rac, что приводит к нарушению и дезорганизации цитоскелета F-актина и плотным контактам, морфологическим изменениям и последующей гибели клеток (4, 5 ).
Ванкомицин и фидаксомицин обычно рекомендуются при ИКД. Однако о рецидиве инфекции сообщали до 24% пациентов в течение 2 месяцев после первого эпизода; риск рецидивов увеличивается (50–65%) после последующих эпизодов (5, 6).В странах Европы и Азии показатель устойчивости составляет более 60% (7). Следовательно, исследования с альтернативной профилактикой или лечением ИКД получили известность.
Пробиотики – это «живые микроорганизмы, которые при введении в адекватных количествах приносят пользу здоровью хозяина» (8). Систематические исследования показали, что некоторые пробиотические бактерии, особенно молочнокислые бактерии (LAB) и Bifidobacterium spp., Могут влиять на терапию CDI; В клинических испытаниях было показано, что пробиотики предотвращают AAD (17%) и предотвращают или лечат CDI 3% (9, 10).Пробиотики LAB приписывают различные противомикробные механизмы. К ним относятся конкуренция питательных веществ, предотвращение адгезии клеток слизистой оболочки и интернализация патогенов, таких как C. difficile (9, 11, 12). Более того, штаммы LAB могут продуцировать молочную кислоту и определенные антимикробные молекулы, такие как перекись водорода, жирные кислоты и бактериоцины, для проявления своей антимикробной активности (13, 14). Кроме того, гидролаза желчных солей (BSH), продуцируемая LAB для преобразования конъюгированной желчной кислоты в неконъюгированную желчную кислоту, может ингибировать прорастание спор C.difficile (10, 15).
Enterococcus spp. принадлежат к LAB (16) и продуцируют молочную кислоту и широкий спектр бактериоцинов (14, 16). Энтерококки повсеместно встречаются в виде микрофлоры в кишечной экосистеме животных и человека, особенно E. faecalis и E. faecium (17). Они также присутствуют в грудном молоке, вагинальных выделениях человека, ферментированных продуктах и молочных продуктах, в первую очередь из-за их устойчивости к экстремальным значениям pH, температуры и солености (16).В предыдущих исследованиях было показано, что пробиотические штаммы Enterococcus служат в качестве функциональных пищевых продуктов, которые смягчают или предотвращают диарею, вызванную патогенами пищевого происхождения, такими как Escherichia coli, C. perfringens и C. difficile (12, 18). . Хотя было показано, что E. faecium NM1015, E. faecalis NM815 и E. faecalis NM915 ингибируют C. difficile in vivo (12), в нескольких исследованиях изучались анти- C.difficile активность энтерококков. В этом исследовании мы идентифицировали подходящие штаммы энтерококков, которые обладают не только антибактериальной активностью против штаммов C. difficile , но также обладают пробиотическими свойствами. Далее мы оценили их защитный эффект на цитопатию C. difficile в клетках HT-29.
Материалы и методы
Сбор образцов кала и выделение LAB
образцов кала ( n = 38) грудных младенцев в больнице Сонгкланакаринд были собраны при необходимом одобрении комитетов по этике медицинского факультета Университета принца Сонгкла (REC.61-064-4-2). Младенцы включались в исследование в соответствии со следующими критериями: возраст <6 месяцев, получение исключительно грудного молока с преобладающими штаммами LAB, вагинальные роды, здоровые дети, матери без существующих или прошлых неблагоприятных заболеваний и доношенная беременность. Кал немедленно культивировали на агаре de Man Rogosa Sharpe (Merck Millipore, Дармштадт, Германия) при 37 ° C в течение 48 часов в анаэробных условиях. После инкубации каждую из выделенных колоний собирали и хранили при -80 ° C в бульоне BHI с 30% глицерином до тестирования.
Бактериальные штаммы и состояние культур
В этом исследовании использовались два контрольных штамма, C. difficile ATCC 630 (риботип 012) и ATCC 43255 (риботип 087), полученные из Американской коллекции типовых культур (АТСС). Два клинических изолята, C. difficile 17 и C. difficile 541, которые были идентифицированы с использованием MALDI-TOF MS / MS, были получены из лаборатории клинической микробиологии больницы Сонгкланагаринд. штаммов C. difficile культивировали на агаре с циклосерином, цефокситином и фруктозой (CCFA, Merck Millipore), и чашки с агаром инкубировали при 37 ° C в течение 48 часов в анаэробных условиях.Колонии переносили в тиогликолятный бульон (Merck Millipore) и инкубировали при 37 ° C в течение 18 часов. Штаммы C. difficile с различной морфологией, образованные подозреваемым энтерококком, до тестирования хранили при -80 ° C в тиогликолятном бульоне с 30% глицерином.
E. faecalis DMST 4736 был получен из Департамента медицинских наук Таиланда (DMST). Этот штамм культивировали на агаре BHI и инкубировали при 37 ° C в течение 18 часов. E. faecalis DMST 4736 хранили при -80 ° C в бульоне BHI с 30% глицерином до тестирования.
Скрининг фекальных изолятов на
C. difficileAgar well-diffusion assay использовали для тестирования ингибирующей активности выделенных колоний из образцов фекалий против токсигенного C. difficile в соответствии с Nigam et al. (19) с небольшими изменениями. Вкратце, ночные культуры токсигенных C. difficile ATCC43255 и ATCC 630 инокулировали на агаре BHI и вырезали из агара. Каждую лунку заполняли 50 мкл 1 × 10 8 КОЕ / мл отобранных изолятов.Планшеты инкубировали при 37 ° C в течение 48 ч в анаэробных условиях и проверяли на наличие зон ингибирования. Испытания проводились в двух экземплярах.
Идентификация бактерий
Бактерии были идентифицированы с помощью окрашивания по Граму, микроскопического исследования и активности каталазы, проведенных в соответствии с руководством Bergey (20), и подтверждены с помощью MALDI-Biotyper ® (Karlsruhe, Германия) в соответствии с инструкциями производителя. Кроме того, изоляты были идентифицированы путем амплификации их генов 16S рРНК с использованием универсальных праймеров 27F и 1492R (21) и секвенирования на 6 Applied Biosystems 3730xl (Macrogen, Корея).Последовательности были выровнены с базой данных NCBI с использованием инструмента поиска BLAST для установления сходства последовательностей (22).
Характеристика свойств пробиотиков
Выживание в условиях желудочно-кишечного тракта (ЖКТ)
Толерантность к низкому pH (pH 2,0, 3,0 и 4,0) и желчным солям проверяли в соответствии с процедурой, описанной Rodríguez et al. (23). Толерантность к моделированному пищеварению желудка и поджелудочной железы определялась с использованием описанного протокола, но с небольшими изменениями (24).Переносимость определяли путем смешивания 1 мл стимулированного желудочного (3 г / л, pH 2) или панкреатического сока (1 г / л, pH 8) с 0,5 мл бульона BHI, содержащего 10 8 КОЕ / мл бактериальных клеток. Смеси инкубировали при 37 ° C в течение 3 или 4 часов для желудочных или панкреатических состояний соответственно. Количество колоний на чашках BHI до и после инкубации со стимулированным желудочным и панкреатическим соками подсчитывали с использованием метода свободных чашек.
Уровень выживаемости (%) = [Конечный (Log КОЕ / мл) / Начальный (Log КОЕ / мл)] × 100Анализ гидрофобности клеточной поверхности
Гидрофобность изолятов определяли с помощью анализа экстракции ксилолом (25).Процент гидрофобности (H%) рассчитывали следующим образом:
H% = [(A0-A) / A0] × 100,, где A 0 и A – значения оптической плотности, измеренные до и после экстракции ксилолом.
Анализ адгезии клеток кишечника человека
Адгезионная способность пробиотических штаммов прикрепляться к эпителиальным клеткам кишечника способствует их колонизации и исключению патогенов при адгезии к эпителиальным клеткам кишечника. Адгезию бактериальных изолятов к клеткам аденокарциномы толстой кишки человека (клетки HT-29) измеряли, как описано Monteagudo-Mera et al.(24). Количество бактерий, прикрепившихся к клеткам HT-29, рассчитывали следующим образом:
% Адгезионная способность = (V1 × 100) / V0,, где V 0 – начальное количество жизнеспособных клеток, а V 1 – количество жизнеспособных клеток, прикрепившихся к клеткам HT-29 после инкубации.
Скрининг на бактериоцины
Бактериоцины измеряли модифицированным методом (22). Вкратце, бактерии (10 8 КОЕ / мл) центрифугировали (7000 × г в течение 10 мин), и pH супернатанта доводили до 6.5 с 1 н. NaOH. Нейтрализованные супернатанты инкубировали с или без 1 мг / мл протеиназы К при 30 ° C в течение 2 часов, а затем нагревали при 80 ° C в течение 10 минут для инактивации протеазы. Супернатанты фильтровали через мембранные фильтры 0,2 мкм. Аликвоты супернатантов наносили на соответствующие чашки с агаром BHI, которые предварительно покрывали ночной культурой патогенных индикаторных бактерий, и инкубировали в аэробных условиях при 37 ° C в течение 48 часов. В зависимости от того, продуцируют ли тестируемые бактерии бактериоцины, вокруг лунок, инкубированных с 1 мг / мл протеиназы K.Их сравнивали с лунками, которые не обрабатывали протеиназой К.
.Производство пероксида водорода (H
2 O 2 ) и активность гидролазы желчных солей (BSH)H 2 O 2 Производство выбранных изолятов (26) и их активности BSH (27) были протестированы в соответствии с описанными процедурами.
Оценка безопасности
Факторы вирулентности
Гены, кодирующие потенциальные факторы вирулентности, были обнаружены с использованием методов амплификации с помощью полимеразной цепной реакции (ПЦР).Праймеры показаны в дополнительной таблице 1. Фенотипические анализы, продукция желатиназы, гемолитическая активность и деградация муцина выполнялись, как сообщалось ранее (28).
Чувствительность к антибиотикам
Чувствительность к антибиотикамопределялась в соответствии с рекомендациями Института клинических и лабораторных стандартов (CLSI) 2019 г. (29). Антибиотики, выбранные для тестирования, включают ампициллин (10 мкг), пенициллин (10 мкг), имипенем (10 мкг), ванкомицин (30 мкг), гентамицин (10 мкг), эритромицин (15 мкг), тетрациклин (30 мкг) и ципрофлоксацин. (5 мкг).
Вирулентность в
Galleria mellonella МодельМодель G. mellonella была использована для определения токсичности предполагаемых пробиотических штаммов, как описано ранее (30). Вкратце, личинки были инфицированы через гемоцель последней левой ложной ноги с использованием стерилизованного инсулинового шприца с 10-мкл инокулята различных штаммов E. faecalis , содержащих 5 × 10 8 КОЕ / мл. E. faecalis DMST 4736 в качестве патогенного штамма и PBS также исследовали в тех же условиях, что и вирулентный контроль и неинфицированный контроль, соответственно.После инъекции личинок инкубировали в темноте при 37 ° C в течение 5 дней. Выживаемость личинок регистрировали каждый день.
Оценка потенциальной пробиотической активности против
C. difficile и его спорAgar Well-Diffusion Assay
Agar well-diffusion assay был использован для тестирования ингибирующей активности выделенных колоний из образцов фекалий против токсигенного C. difficile в соответствии с описанной процедурой (19) с небольшими изменениями.Вкратце, ночные культуры токсигенных штаммов C. difficile ( C. difficile ATCC630, ATCC43255, 17 и 541) суспендировали в бульоне BHI для достижения плотности клеток 1 × 10 8 КОЕ / мл и распределяли по чашки с агаром BHI. Из агара вырезали пять лунок (каждая диаметром 9 мм). Каждую лунку заполняли 50 мкл 1 × 10 8 КОЕ / мл выбранного изолята. Планшеты инкубировали при 37 ° C в течение 48 ч в анаэробных условиях и измеряли зоны ингибирования.Каждый тест проводился в трех экземплярах.
Очистка спор
Этот метод был модифицирован из (31). C. difficile выращивали на агаре BHI в течение ночи при 37 ° C. Единственную колонию из чашки с агаром BHI инокулировали в 10 мл бульона BHI с 0,5% дрожжевого экстракта и 0,1% L-цистеина (Merck Millipore, Дармштадт, Германия) и инкубировали при 37 ° C в течение ночи в анаэробных условиях и 1 мл культуру BHI субкультивировали в агар BHI с 0,1% L-цистеином и инкубировали при 37 ° C в анаэробном сосуде в течение 7 дней.После 7 дней инкубации при 37 ° C эффективность споруляции была подтверждена с помощью фазово-контрастной микроскопии и измерения термостойких КОЕ и споровых культур, собранных сразу или после инкубации в течение ночи при 4 ° C. Споры дважды промывали PBS; суспендирован в PBS, содержащем 125 мМ Трис, 200 мМ EDTA, 0,3 мг / мл протеиназы K (Amresco, США) и 1% саркозила; и инкубировали при осторожном встряхивании при 37 ° C в течение 2 часов. Споры центрифугировали (6500 × г, , 10 мин), осадок ресуспендировали в воде и промывали 10 раз.После окончательного суспендирования в воде споры подвергали термообработке (60 ° C, 20 мин) для уничтожения любых остаточных клеток. Супернатанты спор хранили при 4 ° C до тестирования. Для расчета КОЕ спор аликвоты серийно разводили в PBS и высевали на агар BHI с добавлением 0,1% таурохолата натрия (Merck Millipore). Планшеты инкубировали 48 ч перед подсчетом КОЕ.
Тест на подавление прорастания
Тест на всхожесть был проведен по методу, измененному по протоколу (32).Вкратце, 15 мкл суспензии спор (5 × 10 6 спор / мл) добавляли в 96-луночные планшеты, содержащие 135 мкл бульона BHI и 0,01% таурохолата, с или без 10 8 КОЕ / мл специфического E .faecalis и инкубировали в анаэробных условиях при 37 ° C в течение 30 мин. Прорастающие споры подсчитывали путем посева на колониеобразующие единицы (КОЕ) на агаре BHI, и процент прорастания рассчитывали следующим образом:
Процент прорастания = [КОЕ после анализа / исходное КОЕ] × 100.Тест ингибирования споруляции
Следуя Carlson et al., Было измерено ингибирование споруляции (32). Спорообразование оценивали на бульонных культурах. Лог-фазовые культуры C. difficile BHI были инокулированы в бульоне с триптозным дрожжевым экстрактом (3% триптозный и 2% дрожжевой экстракт) при начальной плотности 1 × 10 6 КОЕ / мл с 10 8 КОЕ / мл или без них. / мл штаммов E. faecalis . После 48 ч культивирования образцы анализировали на наличие вегетативных клеток и спор с помощью микроскопии.Рассчитывали процент споруляции.
% споруляции = [количество спор / (количество спор × количество вегетативных клеток] × 100Совместное культивирование пробиотиков и токсигенных
C. difficile с клетками HT-29Метод, описанный Valdes-Varela et al. был адаптирован для проверки влияния воздействия пробиотиков на цитопатические эффекты C. difficile на клетки HT-29. Шесть штаммов E. faecalis культивировали в бульоне BHI и инкубировали при 37 ° C в течение 18 часов в анаэробных условиях. Клетки E. faecalis дважды промывали PBS и ресуспендировали (10 8 КОЕ / мл) в среде для культивирования клеток HT-29 с добавлением токсигенных C. difficile , а затем инкубировали в течение 1 ч в анаэробных условиях при перемешивании ( 300 об / мин). Затем эти супернатанты непосредственно использовали для тестирования их цитотоксичности на монослоях HT-29; Клетки HT-29 высевали на 96-луночные планшеты для культивирования тканей (5 × 10 4 клеток на лунку). Планшеты инкубировали при 37 ° C в 5% CO 2 до образования конфлюэнтного монослоя.К клеткам HT-29 добавляли по 20 микролитров каждого супернатанта. Планшеты инкубировали в течение 24 ч при 37 ° C в 5% CO 2 . Затем клетки исследовали под инвертированным микроскопом на предмет морфологических изменений. На цитопатический эффект указывало более 50% клеток округлой формы.
Иммунофлуоресцентный анализ
Процедура была адаптирована из ранее описанного метода (33, 34). Вкратце, клетки HT-29, подвергнутые обработке различными супернатантами, анализировали с помощью конфокальной микроскопии.Для этого в лунки 8-луночного планшета засевали 300 мкл (2 × 10 6 клеток HT-29 / мл) и инкубировали в течение 20 ч для достижения конфлюэнтного состояния. Затем супернатант удаляли, и лунки заполняли одинаковым объемом каждого супернатанта, содержащего разные бактериальные штаммы, с токсигенной средой C. difficile или DMEM (отрицательный контроль). Инкубацию продолжали еще 24 часа. Затем супернатант удаляли из каждой лунки и клетки HT-29 фиксировали 300 мкл 3.7% формальдегида в течение 15 мин. Образцы трижды промывали PBS в течение 5 минут и повышали проницаемость с помощью PBS, содержащего 0,1% Triton X-100, в течение 15 минут. Сайты неспецифического связывания блокировали обработкой 1% BSA в течение 20 минут, и клетки снова промывали PBS. Зонд Phalloidin-Alexa-Fluor-488 (Invitrogen, США) в отношении F-актина добавляли в 100 мкл PBS (конечная концентрация 1:40), и образцы инкубировали в течение 1 ч при 4 ° C в темноте. После трехкратной промывки PBS ядра клеток HT-29 окрашивали DAPI (Sigma Chemical Co.) при разведении 1: 1000 (окончательное разведение в PBS) и инкубировали в течение 20 мин. Наконец, образцы были промыты и добавлено 50 мкл средств для фиксации против выцветания (Invitrogen) перед визуализацией под лазерным сканирующим конфокальным микроскопом сверхвысокого разрешения; SR-LSCM (ZEISS, Германия) с масляным объективом 63 × / 1,4.
Статистический анализ
Все анализы независимо выполняли трижды. Результаты выражены в виде среднего значения ± стандартное отклонение, а различия между группами оценивали с помощью теста Стьюдента t или одностороннего дисперсионного анализа (ANOVA) с использованием GraphPad Prism 5.Статистически значимым считалось значение p <0,05. Функция выживаемости Каплана-Мейера программного обеспечения Stata была применена для анализа выживаемости ( p <0,05).
Результаты
Выделение и скрининг бактерий, активных против
C. difficileВосемьдесят пять различных колоний LAB были собраны из фекалий 38 грудных детей. Из них девять выделенных штаммов проявили антимикробную активность против C. difficile ATCC 43355 и ATCC 630.
Идентификация активных изолятов
Первоначально девять изолятов в форме кокков были грамположительными, каталазонегативными, толерантными к 6,5% NaCl и продуцировали эскулин желчи. Эти фенотипические свойства указывали на то, что изоляты были энтерококками. Кроме того, последовательности 16S рРНК всех изолятов показали> 97% гомологию с E. faecalis . Более того, выравнивание последовательностей генов 16S РНК изолятов между собой не показало 100% идентичности, что позволяет предположить наличие различных штаммов.MALDI-TOF MS-анализ изолятов показал совпадение с штаммом E. faecalis CLB21560 с оценкой от 2,302 до 2,443, что позволяет предположить, что идентификация видов была надежной.
Характеристика пробиотических свойств
Выживание в условиях ЖКТ требует толерантности к кислому pH, пепсину, панкреатину и солям желчных кислот. Это важные свойства пробиотических штаммов. Данные о выживаемости девяти изолятов E. faecalis и контрольного пробиотического штамма [ Lactobacillus plantarum ATCC14917 (TISTR 877)] в условиях ЖКТ суммированы в таблице 1.Девять изолятов E. faecalis могли выжить после воздействия pH 2–4 в течение 2 часов; однако снижение процента выживаемости (от 67,25 ± 2,01% до 96,55 ± 1,52%) наблюдалось при pH 2. При том же pH полностью ингибировалось L. plantarum ATCC14917. Когда изоляты E. faecalis были имплантированы в пепсин (pH 2), его выживаемость (от 54,06 ± 1,72% до 36,94 ± 1,92%) была значительно выше, чем у L. plantarum ATCC14917 (нежизнеспособный). E. faecalis PK2502 показал самый высокий процент выживаемости (54.06 ± 1,72%), затем E. faecalis PK1801 (49,97 ± 1,47%) и E. faecalis PK2004 (46,55 ± 1,86%). Кроме того, все штаммов E. faecalis показали хорошую выживаемость (от 122,32 ± 1,12% до 119,97 ± 0,16%) в присутствии фермента поджелудочной железы в течение 4 часов. Хотя жизнеспособность штаммов E. faecalis и L. plantarum ATCC 14917 в среде, содержащей соли желчных кислот, снизилась через 4 часа, процент выживаемости каждого штамма E. faecalis в солях желчных кислот был значительно выше, чем у штаммов E. faecalis . Л.plantarum ATCC 14917 (от 75,68 ± 6,43% до 74,16 ± 5,14% по сравнению с 30,97 ± 0,37%).
Таблица 1 . Тест на переносимость штаммов E. faecalis в смоделированных условиях желудочно-кишечного тракта.
Гидрофобность девяти исследованных штаммов E. faecalis варьировала от 47,51 ± 3,02% до 85,00 ± 2,93%. Гидрофобность каждого штамма, кроме E. faecalis PK1202, была значительно выше, чем у L. plantarum ATCC 14917 (41.08 ± 0,89%) (рис. 1А). Анализ адгезии кишечных клеток человека проводили для подтверждения адгезии девяти штаммов E. faecalis к эпителиальным клеткам НТ-29 кишечника. Результаты показали, что девять штаммов E. faecalis более прочно прилипали к клеткам HT-29 по сравнению с L. plantarum ATCC 14917. E. faecalis PK1801 продемонстрировал самую высокую адгезивность (78,83 ± 4,16%) (Рисунок 1B) .
Рисунок 1 . Адгезия изолятов E. faecalis, и L.plantarum ATCC 14917 в линию клеток человека. (A) Адгезионная способность. (B) % гидрофобности. Планки погрешностей указывают на стандартное отклонение трех независимых экспериментов. * p <0,05.
Безопасность
изолятов E. faecalisПрофили чувствительности к антибиотикам штаммов E. faecalis приведены в таблице 2. Все девять штаммов были чувствительны к ампициллину, пенициллину, имипенему и ванкомицину, но были устойчивы к гентамицину (100%).Пять штаммов E. faecalis (PK1003, PK1301, PK2003, PK2004 и PK2502) были устойчивы к эритромицину (55,56%) и тетрациклину (66,67%), и только штаммов E. faecalis PK1801 были устойчивы к тетрациклину. Интересно, что ни один из выделенных штаммов не был устойчив к ванкомицину. ПЦР-анализ не обнаружил генов Van-A или Van-B . Более того, результаты ПЦР-скрининга на наличие генов вирулентности энтерококков показали, что эти штаммы несли разные генные паттерны (таблица 3).Гены cpd, cob, ccf и cad кодируют детерминанты половых феромонов, которые способствуют конъюгации бактерий. В то время как cpd и cob переносились некоторыми штаммами E. faecalis , ccf и cad не были обнаружены ни в одном из штаммов E. faecalis . Все девять штаммов несли генов efaAfs и gel E, которые участвуют в адгезии клеток и кодируют желатиназу соответственно.
Таблица 2 .Чувствительность к антибиотикам штаммов Enterococcus .
Таблица 3 . Резюме анализов полимеразной цепной реакции и фенотипического скрининга детерминант вирулентности.
Фенотипические анализы показали, что ни один из девяти штаммов E. faecalis не обладал детектируемой активностью желатиназы и не был способен разлагать муцин. Более того, три штамма E. faecalis , несущие esp , проявили гемолитическую активность на чашках с кровяным агаром.Поэтому эти штаммы были исключены как потенциальные пробиотики.
Вирулентность остальных шести штаммов была признана безопасной и подтверждена с помощью анализа уничтожения G. mellonella . Патогенный штамм E. faecalis ATCC 4736 может убить личинок G. mellonella (85%). Напротив, выживаемость личинок колебалась от 80 до 100%, когда им вводили шесть штаммов E. faecalis , даже при высоких дозах E. faecalis .Аналогичные результаты наблюдались с L. plantarum ATCC 14917. Эти данные свидетельствуют о том, что эти шесть штаммов E. faecalis были безопасны для использования в качестве потенциальных пробиотиков.
Бактериоцин-опосредованная антимикробная активность
E. faecalisВ первую очередь, шесть изолятов E. faecalis проявили антимикробную активность против C. difficile . Зоны ингибирования находились в диапазоне от 10,90 ± 0,10 до 14,00 ± 0,00 мм. Чтобы установить участие белковых агентов, бесклеточные супернатанты E.faecalis нейтрализовали до pH 7,2 и обрабатывали протеиназой K для переваривания растворимых белков в супернатанте. Четкая зона ингибирования не была обнаружена, что указывает на то, что ингибирующая активность штаммов E. faecalis против токсигенных C. difficile опосредована бактериоцинами. Кроме того, хотя активность BSH была обнаружена во всех штаммах E. faecalis , кроме PK1301 и PK1302, продукция H 2 O 2 не была обнаружена ни в одном из шести выбранных штаммов E.faecalis штаммов.
Потенциальный пробиотик
E. faecalis Активность против токсигенных Штаммов C. difficile , их образование спор и прорастаниеСущественным свойством пробиотика является его способность подавлять рост бактериальных патогенов. Отобранные шесть штаммов E. faecalis продемонстрировали сильную способность ингибировать четыре токсигенных штамма C. difficile , включая C. difficile ATCC 630, C. difficile ATCC 43255 и два клинических изолята ( C.difficile 17 и C. difficile 541) (Таблица 4). Чтобы установить пробиотическую природу шести штаммов E. faecalis , мы изучили их способность ингибировать споруляцию и образование спор в токсигенных штаммах C. difficile .
Таблица 4 . Ингибирование токсигенных штаммов C. difficile изолятами Enterococcus (мм).
Способность подавлять споруляцию была протестирована на шести штаммах E. faecalis и L.plantarum ATCC 14917. Процент образования спор штаммов C. difficile колебался от 44,20 ± 15,97% до 78,07 ± 7,30%. После обработки шестью штаммами E. faecalis и L. plantarum ATCC 14917 процент споруляции C. difficile значительно снизился (с 1,19 ± 2,06% до 13,89 ± 12,49%) по сравнению с необработанными ( Фигура 2).
Рисунок 2 . Процент спор C. difficile с обработкой или без обработки шестью E.faecalis и L. plantarum ATCC 14917.
Шесть отобранных штаммов E. faecalis и L. plantarum ATCC 14917 были проверены на их потенциальную пробиотическую активность против C. difficile путем изучения их способности ингибировать прорастание спор. Результаты показали, что воздействие токсигенных штаммов C. difficile на штаммы E. faecalis и L. plantarum ATCC 14917 привело к полному снижению их всхожести (0% -1.80 ± 2,17%) (таблица 5), что указывает на пробиотические свойства для всех шести штаммов E. faecalis .
Таблица 5 . Относительный процент прорастания токсигенного C difficile при обработке изолятов E. faecalis .
Влияние совместного культивирования изолированного
E. faecalis и токсигенного C. difficile на клетки HT-29Цитопатические эффекты токсигенного вещества C. difficile на клетки HT-29 оценивали с помощью анализа цитотоксичности.Результаты показали, что обработка клеток HT-29 бесклеточным супернатантом четырех штаммов C. difficile (ATCC 630, ATCC 43255 и клинические штаммы 17 и 541) приводила к изменениям морфологии клеток ( более 50% клеток были круглыми и сферическими), тогда как обработка бесклеточным супернатантом шести штаммов монокультуры E. faecalis и монокультуры L. plantarum ATCC 14917 вызывала только 5–10% ГТ. -29 клеток, чтобы иметь округлую морфологию, аналогичную отрицательному контролю (рис. 3).Более того, когда клетки HT-29 обрабатывали бесклеточными супернатантами E. faecalis , которые ранее инкубировали с клиническими C. difficile 541, они оставались стабильными, а процент округления клеток снижался по сравнению с HT-29. клетки, обработанные бесклеточным супернатантом четырех штаммов C. difficile . Однако, когда клетки HT-29 обрабатывали совместной культурой бесклеточного супернатанта из шести E. faecalis , инкубированных с C.difficile ATCC 630, ATCC 43255 и клинический C. difficile 17,> 50% округлены. Тем не менее, эти клеточные повреждения были меньше, чем наблюдаемые после обработки бесклеточным супернатантом монокультуры C. difficile (фиг. 3).
Рисунок 3 . Сравнение цитотоксических эффектов отдельных штаммов C. difficile , E. faecalis и совместного культивирования E. faecalis с C. difficile на клетках HT-29. (A) Монослойные клетки HT-29. (B – D) Клетки HT-29, обработанные бесклеточным супернатантом токсигенного штамма C. difficile и E. faecalis . (E, F) Клетки HT-29, обработанные бесклеточным супернатантом из совместной культуры E. faecalis и C. difficile .
Кроме того, для изучения клеточных событий, вызванных различными видами лечения, детекцию F -актина проводили с использованием иммунофлуоресцентного анализа.Результаты показали, что в то время как клетки HT-29 контрольной группы демонстрировали типичный цитоскелет F -актина, поглощенное ядро и связанные клетки (Фиг.4), клетки HT-29, обработанные бесклеточным супернатантом индивидуума Монокультура C. difficile показала потерю опосредованных цитоскелетом F -актина взаимосвязей между клетками, а также обнаружила конденсированные ядра, что указывает на начальную стадию апоптоза. Клетки HT-29 стали округлыми, и плотные контакты были нарушены.Изображения клеток HT-29, монокультурных с бесклеточным супернатантом шести E. faecalis или L. plantarum ATCC 14917, были аналогичны изображениям контрольной группы, а актин F- показал нормальную морфологию. Интенсивность окрашивания DAPI ядра этих клеток была сравнима с таковой для контроля, но меньше, чем у клеток HT-29, обработанных бесклеточным супернатантом индивидуума C. difficile .
Рисунок 4 . Иммунофлуоресцентные изображения, полученные с помощью конфокальной сканирующей лазерной микроскопии клеток HT-29 через 24 часа с бесклеточным супернатантом индивидуума C.difficile ATCC630, E. faecalis 1302 и L. plantarum ATCC 14917 и с бесклеточным супернатантом, полученным после инкубации E. faecalis с C. difficile ATCC630 и L. plantarum ATCC 14917 с C. difficile ATCC630. (A) DAPI-окрашенное ядро (синее, возбужденное при 405 нм). (B) F-актин, окрашенный зондом Phalloidin-Alexa-Fluor-488 (зеленый, возбуждение при 490 нм). (C) Комбинация ядра и окрашенного F-актина.
Конфокальные изображения клеток HT-29, обработанных бесклеточными супернатантами, полученные из совместной культуры E. faecalis PK1302 или L. plantarum ATCC 14917 с каждым из четырех токсигенных C. difficile , показали, что HT Клетки -29 были менее повреждены по сравнению с клетками HT-29, которые обрабатывали бесклеточным супернатантом отдельной монокультуры C. difficile . Некоторые части цитоскелета F -актина имели взаимосвязанную структуру, а клетки имели нормальную морфологию.Хотя ядра большинства клеток были аналогичны ядрам контрольной группы, некоторые ядра были конденсированными.
В целом, эти результаты свидетельствуют о том, что бесклеточные супернатанты E. faecalis снижали цитопатические эффекты C. difficile , противодействуя эффекту токсинов C. difficile .
Обсуждение
Пробиотики изучаются как альтернативный терапевтический вариант лечения и профилактики ИКД (9). Выбор подходящего пробиотика против ИКД очень важен.Это в основном связано с тем, что не все пробиотические препараты эффективны против ИКД (35, 36).
Различные штаммы потенциальных пробиотиков были выделены из фекалий человека и животных, особенно потому, что этот источник общепризнан как безопасный для употребления в пищу человеком (16, 37). Энтерококки, а именно E. faecium и E. faecalis , преимущественно присутствуют в нормальной флоре кишечного тракта теплокровных животных. Они приносят пользу своему хозяину для здоровья (17).Поэтому новые штаммы энтерококков из фекалий обычно проверяются на предмет потенциальных пробиотических свойств. Штаммы, выделенные из фекалий грудных детей, обладают более высокой способностью выживать при прохождении через желудочно-кишечный тракт по сравнению со штаммами, выделенными из молочной пищи. Они конкурируют с патогенными бактериями за питательные вещества и эффективно колонизируют ЖКТ (38). Более того, в нескольких исследованиях сообщалось о новых пробиотиках из фекалий грудных детей, поскольку в них преобладают бифидобактерии, лактобациллы, энтерококки и другие LAB (23, 39–41).В этом исследовании девять штаммов E. faecalis , PK1003, PK1201, PK1202, PK1301, PK1302, PK180, PK2003, PK2004 и PK2502, были выделены из фекалий грудных детей из-за их высокой толерантности к состояниям ЖКТ. Способность прикрепляться к слизистой оболочке кишечника – важное свойство потенциального пробиотика. Адгезия пробиотических бактерий к эпителиальным клеткам человека может служить важным механизмом для предотвращения колонизации патогенов и предотвращения удаления бактерий из толстой кишки через перистальтику (42, 43).Адгезия к ЖКТ в основном связана с гидрофобностью поверхности бактериальных клеток (44). Здесь все штаммов E. faecalis показали высокую гидрофобность, что позволяет предположить, что они были способны прикрепляться к эпителиальным клеткам кишечника.
E. faecalis обычно используется в качестве пищевого продукта и молочной закваски. Недавно они использовались в качестве пробиотиков для терапевтического лечения, и до сих пор не сообщалось о побочных эффектах (16). Однако около штаммов E. faecalis являются внутрибольничными патогенами.Следовательно, если пробиотик не объявлен «общепризнанным безопасным», его параметры безопасности должны быть определены перед использованием. Устойчивость к антибиотикам является критическим фактором, который необходимо оценивать для оценки безопасности энтерококков, и необходимо убедиться, что они не содержат приобретенных и передаваемых детерминант устойчивости к антибиотикам. В частности, устойчивость энтерококков к ванкомицину является серьезной проблемой для безопасности пробиотиков, поскольку она горизонтально передается другим штаммам (45).Интересно, что все изолированные штаммы были чувствительны к ванкомицину и не содержали генов устойчивости к ванкомицину Van-A и Van-B . Все штаммы несли по крайней мере один вирулентный детерминантный ген; однако наличие генов вирулентности не указывает на патогенные свойства. Из девяти штаммов шесть штаммов E. faecalis представили efaAfs и gel E; efaAfs участвуют в адгезии клеток бактериальных патогенов (28, 46), что, в свою очередь, важно для прилипания пробиотиков к клеткам кишечника. gel E кодирует желатиназу, которая гидролизует коллаген, казеин и гемоглобин (28, 46). Три штамма E. faecalis (PK2003, PK2004 и PK2502), несущие esp , проявили гемолитическую активность на чашках с кровяным агаром. Поэтому эти штаммы были исключены как потенциальные пробиотики. Вирулентность шести штаммов была также определена с использованием теста киллинга G. mellonella , который является полезной моделью для изучения инфекций патогенов человека, поскольку врожденная иммунная система G.mellonella похожа на личинок позвоночных (47). Шесть отобранных штаммов E. faecalis не уничтожили G. mellonella . Взятые вместе, эти результаты подтверждают тот факт, что все шесть штаммов E. faecalis могут быть использованы в качестве потенциальных пробиотических штаммов, которые были безопасными и удовлетворяли всем требованиям к пробиотическим свойствам.
Известно, что пробиотики действуют против ИКД через различные механизмы бактериального антагонизма, такие как конкуренция за адгезию к слизистой оболочке кишечника, продуцирование антимикробных молекул, модуляция воспаления кишечника, снижение токсичности, вызванной C.difficile и ингибирование спор C. difficile (48). Некоторые соединения, продуцируемые пробиотическими бактериями, такие как метаболиты, органические кислоты и бактериоцины, также могут способствовать антимикробной активности против энтеропатогенов (49). Enterococcus spp. может продуцировать энтероцины, такие как энтероцин A, энтероцин AS-48 и энтероцины L50A и L50B, которые могут образовывать поры в клеточной мембране, истощать трансмембранный потенциал и / или градиент pH, приводящий к утечке необходимых внутриклеточных молекул и лизису клеток (14, 16, 50).В этом исследовании бактериоцин был обнаружен во всех шести отобранных штаммах E. faecalis , которые могут ингибировать токсигенные C. difficile .
Споры C. difficile важны для передачи болезни. Они устойчивы к многочисленным воздействиям окружающей среды, включая низкий pH, тепло, радиацию и химические вещества (51). Кроме того, неспособность устранить спор C. difficile может привести к рецидиву ИКД в течение 2–3 месяцев (52). В настоящее время пробиотики используются в некоторых больницах для снижения уровня C.difficile у пациентов, которым вводят антибиотики (53). Результаты исследования Rätsep et al. (15) показали, что комбинация ксилита с L. plantarum inducia подавляет прорастание спор и рост в вегетативные токсин-продуцирующие клетки C. difficile , а также снижает колонизацию кишечника патогеном, что впоследствии снижает ИКД. ставки. Что касается ингибирования, шесть штаммов E. faecalis , идентифицированных в этом исследовании, также проявили значительное ингибирующее действие на образование спор и прорастание C.difficile . Почти все штаммов E. faecalis , выделенных в этом исследовании, продуцировали ферменты BSH, которые участвуют в ингибировании прорастания спор C. difficile (10, 54).
C. difficile продуцирует токсины, в основном энтеротоксин (TcdA) и / или цитотоксин (TcdB). Эти токсины разрушают актиновый цитоскелет и плотные контакты, что приводит к дезорганизации цитоскелета F-актина и плотных контактов кишечных эпителиальных клеток, морфологическим изменениям и последующей гибели клеток (4, 5).В предыдущем исследовании энтерококки показали свою эффективность в профилактике ААД (16). Было показано, что E. faecalis NM815, E. faecalis NM915 и E. faecium NM1015 ингибируют C. difficile (12). Аналогичным образом, наши результаты показали, что шесть штаммов E. faecalis были способны ингибировать C. difficile , продуцируя бактериоцин и / или BSH. В предыдущем отчете было обнаружено, что некоторые пробиотики ингибируют токсинов C. difficile , продуцируя протеазные белки, которые гидролизуют TcdA и TcdB и ингибируют их связывание с соответствующими рецепторами щеточной каймы кишечника (10, 54).Valdes-Varela et al. проверили бифидобактерии и лактобациллы, которые были способны противодействовать цитотоксическому действию C. difficile на монослой кишечного эпителия HT29 (34). Они показали, что Bifidobacterium longum и Bifidobacterium breve были способны снизить токсические эффекты патогена на клеточные линии HT-29, и округление было предотвращено, а микроструктура F -актина и плотные контакты между соседними клетками были сохранены. E. faecium и L.lactis также помогает защитить эпителиальные клетки от токсинов C. difficile (11). Аналогичным образом, результаты нашего исследования показали, что шесть E. faecalis могут секретировать антибактериальные агенты, которые снижают цитотоксические эффекты токсинов C. difficile и защищают клетки HT-29.
Заключение
Шесть штаммов E. faecalis были идентифицированы как потенциальные пробиотики для предотвращения или контроля колонизации C. difficile или ИКД.Было обнаружено, что они ингибируют токсикогенный эффект C. difficile за счет уменьшения токсического воздействия клостридией на клетки HT-29 и предотвращения образования и прорастания спор C. difficile . Однако необходимы дальнейшие исследований in vivo ингибирования C. difficile с использованием этих штаммов E. faecalis .
Заявление о доступности данных
Оригинальные материалы, представленные в исследовании, включены в статью / дополнительные материалы, дальнейшие запросы можно направлять соответствующим авторам.
Заявление об этике
Исследования с участием людей были рассмотрены и одобрены этическими комитетами медицинского факультета Университета принца Сонгкла. Письменное информированное согласие на участие в этом исследовании было предоставлено законным опекуном / ближайшими родственниками участников.
Авторские взносы
CR, AT и KS разработали и разработали эксперименты. CR, NI, PS и WC проводили эксперименты. CR и KS проанализировали данные. KS предоставил реагенты, материалы и инструменты для анализа.ЧР, А.А. и К.С. написали рукопись. Все авторы внесли свой вклад в статью и одобрили представленную версию.
Финансирование
Эта работа была поддержана медицинским факультетом Университета принца Сонгкла (номер гранта REC61-064-4-2). CR является стипендиатом медицинского факультета Университета принца Сонгкла.
Конфликт интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Благодарности
Авторы благодарны доктору Сурасаку Сангкхатхату за предоставление клеток HT-29 и хотели бы поблагодарить Центральную исследовательскую лабораторию медицинского факультета Университета принца Сонгкла за предоставление необходимых лабораторных инструментов.
Дополнительные материалы
Дополнительные материалы к этой статье можно найти в Интернете по адресу: https://www.frontiersin.org/articles/10.3389/fped.2020.572633/full#supplementary-material
Список литературы
1.Мартин Дж. С., Уилкокс М. Х. Инфекция Clostridium difficile : эпидемиология, диагностика и понимание передачи. Nat Rev Gastroenterol Hepatol. (2016) 13: 206–16. DOI: 10.1038 / nrgastro.2016.25
PubMed Аннотация | CrossRef Полный текст | Google Scholar
2. Чепиль Дж., Дроздз М., Питуч Х., Куиджпер Э. Дж., Перуки В., Миелимонка А. и др. Инфекция Clostridium difficile : обзор. евро J Clin Microbiol . (2019) 38: 1211–21. DOI: 10.1007 / s10096-019-03539-6
PubMed Аннотация | CrossRef Полный текст | Google Scholar
3.Бриттон Р.А., Янг В.Б. Взаимодействие между кишечной микробиотой и хозяином при устойчивости к колонизации Clostridium difficile . Trends Microbiol. (2012) 20: 313–9. DOI: 10.1016 / j.tim.2012.04.001
PubMed Аннотация | CrossRef Полный текст | Google Scholar
4. Рупник М., Уилкокс М.Х., Гердинг Д.Н. Clostridium difficile i Инфекция: новые разработки в эпидемиологии и патогенезе. Nat Rev Microbiol. (2009) 7: 526–36. DOI: 10.1038 / nrmicro2164
PubMed Аннотация | CrossRef Полный текст | Google Scholar
5.Кэрролл К.С., Бартлетт Дж. Дж. Биология Clostridium difficile : значение для эпидемиологии и диагностики. Annu Rev Microbiol. (2011) 65: 501–21. DOI: 10.1146 / annurev-micro-0-102824
PubMed Аннотация | CrossRef Полный текст | Google Scholar
6. Вишванатан В.К., Маллоцци М.Дж., Ведантам Г. Инфекция Clostridium difficile : обзор болезни и ее патогенеза, эпидемиологии и вмешательств. Кишечные микробы. (2010) 1: 234–42.DOI: 10.4161 / gmic.1.4.12706
PubMed Аннотация | CrossRef Полный текст | Google Scholar
8. Продовольственная и сельскохозяйственная организация Объединенных Наций / Всемирная организация здравоохранения. Руководство по оценке пробиотиков в пищевых продуктах . Продовольственная и сельскохозяйственная организация Объединенных Наций; Всемирная организация здравоохранения (2002 г.).
Google Scholar
9. McDonald LC, Gerding DN, Johnson S, Bakken JS, Carroll KC, Coffin SE, et al. Руководство по клинической практике для инфекции Clostridium difficile у взрослых и детей: обновление 2017 г., подготовленное Американским обществом инфекционных болезней (IDSA) и Обществом эпидемиологии здравоохранения Америки (SHEA). Clin Infect Dis. (2018) 66: e1–48. DOI: 10.1093 / cid / ciy149
PubMed Аннотация | CrossRef Полный текст | Google Scholar
10. Parkes GC, Sanderson JD, Whelan K. Механизмы и эффективность пробиотиков в профилактике Clostridium difficile -ассоциированной диареи. Lancet Infect Dis. (2009) 9: 237–44. DOI: 10.1016 / S1473-3099 (09) 70059-3
PubMed Аннотация | CrossRef Полный текст | Google Scholar
11. Доуделл П., Чанкамхаенгдеча С., Панбангред В., Джанвилисри Т., Арооннуал А.Пробиотическая активность Enterococcus faecium и Lactococcus lactis , выделенных из таиландских ферментированных колбас, и их защитное действие против Clostridium difficile . Пробиотики Antimicro . (2019) 12: 641–8. DOI: 10.1007 / s12602-019-09536-7
PubMed Аннотация | CrossRef Полный текст | Google Scholar
12. Мансур Н.М., Эльхатиб В.Ф., Абошанаб К.М., Бахр ММА. Ингибирование Clostridium difficile у мышей с использованием смеси потенциальных пробиотических штаммов Enterococcus faecalis NM815, E.faecalis NM915 и E. faecium NM1015: новые кандидаты для борьбы с инфекцией C. difficile (CDI). Пробиотики Антимикроб . (2017) 10: 511–22. DOI: 10.1007 / s12602-017-9285-7
PubMed Аннотация | CrossRef Полный текст | Google Scholar
13. Рацеп М., Наабер П., Кольялг С., Смидт И., Шкут Э. Влияние штаммов Lactobacillus plantarum на клинические изоляты Clostridium difficile in vitro . J Пробное здоровье .(2014) 2: 119. DOI: 10.4172 / 2329-8901.1000119
CrossRef Полный текст | Google Scholar
15. Рятсеп М., Кылйалг С., Сепп Э., Смидт И., Труусалу К., Сонгисепп Э. и др. Комбинация пробиотика и пребиотика может предотвратить прорастание спор Clostridium difficile и инфекцию. Анаэроб. (2017) 47: 94–103. DOI: 10.1016 / j.anaerobe.2017.03.019
PubMed Аннотация | CrossRef Полный текст | Google Scholar
16. Franz CMAP, Huch M, Abriouel H, Holzapfel W, Gálvez A.Энтерококки как пробиотики и их значение для безопасности пищевых продуктов. Int J Food Microbiol. (2011) 151: 125–40. DOI: 10.1016 / j.ijfoodmicro.2011.08.014
PubMed Аннотация | CrossRef Полный текст | Google Scholar
17. Девризе Л., Баэле М., Бутайе П. Род Enterococcus . В: М. Дворкин, С. Фалькоу, Э. Розенберг, К. Х. Шлейфер, Э. Стакебрандт, редакторы. Прокариоты: Том 4: Бактерии: Firmicutes, Cyanobacteria . Нью-Йорк, штат Нью-Йорк: Springer US (2006).п. 163–74.
Google Scholar
18. Chen C-C, Lai C-C, Huang H-L, Huang W-Y, Toh H-S, Weng T-C и др. Антимикробная активность видов Lactobacillus в отношении устойчивых к карбапенемам энтеробактерий. Front Microbiol. (2019) 10: 789. DOI: 10.3389 / fmicb.2019.00789
PubMed Аннотация | CrossRef Полный текст | Google Scholar
19. Нигам А., Кумар А., Айенгар М.Х.В., Бхола Н. Скрининг in vitro антибактериальной активности молочнокислых бактерий против общих кишечных патогенов. J Biomed Sci. (2012) 1: 2. DOI: 10.3823 / 1010
CrossRef Полный текст | Google Scholar
20. Павел Д.В. Bergeys Руководство по систематической бактериологии. Фирмы . 2-е изд. Дордрехт; Нью-Йорк, штат Нью-Йорк: Спрингер. (2009).
Google Scholar
21. Hongoh Y, Yuzawa H, Ohkuma M, Kudo T. Оценка праймеров и условий ПЦР для анализа генов 16S рРНК из естественной среды. FEMS Microbiol Lett. (2003) 221: 299–304.DOI: 10.1016 / S0378-1097 (03) 00218-0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
22. Хан С.К., Шин М.С., Пак Х.И., Ким С.И., Ли В.К. Скрининг бактериоцин-продуцирующих штаммов Enterococcus faecalis на антагонистическую активность против Clostridium perfringens . Корейский J Food Sci Anim Resour . (2014) 34: 614–21. DOI: 10.5851 / kosfa.2014.34.5.614
PubMed Аннотация | CrossRef Полный текст | Google Scholar
23.Родригес Э., Аркес Дж. Л., Родригес Р., Пейротен А., Ландете Дж. М., Медина М. Антимикробные свойства пробиотических штаммов, выделенных из младенцев, находящихся на грудном вскармливании. J Funct Foods. (2012) 4: 542–51. DOI: 10.1016 / j.jff.2012.02.015
CrossRef Полный текст | Google Scholar
24. Монтеагудо-Мера А., Родригес-Апарисио Л., Руа Дж., Мартинес-Бланко Х., Наваса Н., Гарсия-Арместо М. Р. и др. In vitro оценка физиологических пробиотических свойств различных штаммов молочнокислых бактерий молочного и человеческого происхождения. J Funct Foods. (2012) 4: 531–41. DOI: 10.1016 / j.jff.2012.02.014
CrossRef Полный текст | Google Scholar
25. Влкова Е., Рада В., Смехилова М., Киллер Дж. Автоагрегационная и коагрегационная способность бифидобактерий и клостридий. Folia Microbiol. (2008) 53: 263–9. DOI: 10.1007 / s12223-008-0040-z
PubMed Аннотация | CrossRef Полный текст | Google Scholar
26. Сонг Ю.Л., Като Н., Мацумиа Ю., Лю С.Х., Като Х., Ватанабе К. Идентификация и производство перекиси водорода фекальными и вагинальными лактобактериями, выделенными от японских женщин и новорожденных. J Clin Microbiol. (1999) 37: 3062–4. DOI: 10.1128 / JCM.37.9.3062-3064.1999
PubMed Аннотация | CrossRef Полный текст | Google Scholar
27. Ван З., Цзэн Х, Мо И, Смит К., Го И, Лин Дж. Идентификация и характеристика гидролазы желчных солей из Lactobacillus salivarius для разработки новых альтернатив стимуляторам роста антибиотиков. Appl Environ Microbiol. (2012) 78: 8795–802. DOI: 10.1128 / AEM.02519-12
PubMed Аннотация | CrossRef Полный текст | Google Scholar
28.Ревириего К., Итон Т., Мартин Р., Хименес Э., Фернандес Л., Гассон М.Дж. и др. Скрининг детерминант вирулентности в штаммах Enterococcus faecium , выделенных из грудного молока. Дж Hum Lact. (2005) 21: 131–7. DOI: 10.1177 / 08
405275394
PubMed Аннотация | CrossRef Полный текст | Google Scholar
29. CLSI. Методы тестирования антимикробной чувствительности анаэробных бактерий . 29 изд. Уэйн, Пенсильвания: Институт клинических и лабораторных стандартов (2019).
Google Scholar
30. Ян Х-Ф, Пан А-Дж, Ху Л-Ф, Лю И-И, Ченг Дж, Йе Й и др. Galleria mellonella как модель in vivo для оценки эффективности антимикробных агентов против инфекции Enterobacter cloacae . J Microbiol Immunol. (2017) 50: 55–61. DOI: 10.1016 / j.jmii.2014.11.011
PubMed Аннотация | CrossRef Полный текст | Google Scholar
31. Лоули Т.Д., Краучер Нью-Джерси, Ю. Л., Клэр С., Себайхия М., Гулдинг Д. и др.Протеомная и геномная характеристика высокоинфекционных спор Clostridium difficile 630. J Bacteriol. (2009) 191: 5377–86. DOI: 10.1128 / JB.00597-09
PubMed Аннотация | CrossRef Полный текст | Google Scholar
32. Carlson PE Jr, Kaiser AM, McColm SA, Bauer JM, Young VB, Aronoff DM, et al. Различия в прорастании клинических изолятов Clostridium difficile коррелируют с тяжестью заболевания. Анаэроб. (2015) 33: 64–70. DOI: 10.1016 / j.anaerobe.2015.02.003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
33. Джафари Н.В., Кюне С.А., Минтон Н.П., Аллан Э., Баджадж-Эллиотт М. Clostridium difficil e-опосредованные эффекты на эпителий кишечника человека: моделирование взаимодействий хозяин-патоген в камере вертикальной диффузии. Анаэроб. (2016) 37: 96–102. DOI: 10.1016 / j.anaerobe.2015.12.007
PubMed Аннотация | CrossRef Полный текст | Google Scholar
34. Valdes-Varela L, Alonso-Guervos M, Garcia-Suarez O, Gueimonde M, Ruas-Madiedo P.Скрининг бифидобактерий и лактобацилл, способных противодействовать цитотоксическому действию Clostridium difficile на монослой кишечного эпителия HT29. Front Microbiol. (2016) 7: 577. DOI: 10.3389 / fmicb.2016.00577
PubMed Аннотация | CrossRef Полный текст | Google Scholar
35. Аллен С.Дж., Уэрхэм К., Ван Д., Брэдли С., Хатчингс Н., Харрис В. и др. Lactobacilli и бифидобактерии в профилактике антибиотико-ассоциированной диареи и Clostridium difficile диареи у пожилых стационарных пациентов (PLACIDE): рандомизированное двойное слепое плацебо-контролируемое многоцентровое исследование. Ланцет. (2013) 382: 1249–57. DOI: 10.1016 / S0140-6736 (13) 61218-0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
36. Auclair J, Frappier M, Millette M. Lactobacillus acidophilus CL1285, Lactobacillus casei LBC80R и Lactobacillus rhamnosus CLR2 (Bio-K +): характеристика, производство, контроль конкретных механизмов действия и комбинация пробиотиков для первичной профилактики инфекции Clostridium difficile . Clin Infect Dis. (2015) 60 (Приложение 2): S135–43. DOI: 10.1093 / cid / civ179
PubMed Аннотация | CrossRef Полный текст | Google Scholar
38. Фернандес Л., Ланга С., Мартин В., Мальдонадо А., Хименес Е., Мартин Р. и др. Микробиота грудного молока: происхождение и потенциальная роль в здоровье и болезнях. Pharmacol Res. (2013) 69: 1–10. DOI: 10.1016 / j.phrs.2012.09.001
PubMed Аннотация | CrossRef Полный текст | Google Scholar
39. Халил Р., Махрус Х., Эль-Халафави К., Камали К., Фрэнк Дж., Эль Сода М.Оценка пробиотического потенциала молочнокислых бактерий, выделенных из фекалий грудных детей в Египте. Afr J Biotechnol. (2007) 6: 939–49.
Google Scholar
40. Механна Н.С., Вали И., Аттиа А.Е., Лотфи В., Тавил А.Е., Механна Н.С. Связь между пробиотическими свойствами изолятов, выделенных из грудного молока и стула младенцев. NutrFood Sci. (2016) 46: 294–305. DOI: 10.1108 / NFS-10-2014-0091
CrossRef Полный текст | Google Scholar
41.Panya M, Lulitanond V, Rattanachaikunsopon P, Srivoramas T., Chaiwong T. Выделение, идентификация и оценка новых пробиотических штаммов, выделенных из фекалий грудных детей. J Med Assoc Thai. (2016) 99 (Дополнение 1): S28–34.
PubMed Аннотация | Google Scholar
43. Джордж Керри Р., Патра Дж. К., Гауда С., Парк И., Шин Х. С., Дас Дж. Действие пробиотиков для здоровья человека: обзор. J Анал с пищевыми продуктами. (2018) 26: 927–39. DOI: 10.1016 / j.jfda.2018.01.002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
44. Монтеагудо-Мера А., Расталл Р.А., Гибсон Г.Р., Харалампопулос Д., Хатцифрагкоу А. Механизмы адгезии, опосредованные пробиотиками и пребиотиками, и их потенциальное влияние на здоровье человека. Appl Microbiol Biotechnol. (2019) 103: 6463–72. DOI: 10.1007 / s00253-019-09978-7
PubMed Аннотация | CrossRef Полный текст | Google Scholar
46. Лемпиайнен Х., Киннунен К., Мертанен А., фон Райт А.Распространенность факторов вирулентности среди изолятов кишечных энтерококков человека. Lett Appl Microbiol. (2005) 41: 341–4. DOI: 10.1111 / j.1472-765X.2005.01769.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
48. Goldstein EJC, Johnson SJ, Maziade PJ, Evans CT, Sniffen JC, Millette M, et al. Пробиотики и профилактика инфекции Clostridium difficile . Анаэроб. (2017) 45: 114–9. DOI: 10.1016 / j.anaerobe.2016.12.007
PubMed Аннотация | CrossRef Полный текст | Google Scholar
49.Халиги А., Бехдани Р., Кухестани С. Пробиотики: всесторонний обзор их классификации, механизма действия и роли в питании человека. В: В Рао, Л. Г. Рао, редакторы, Пробиотики и пребиотики в питании и здоровье человека . Риека: InTech (2016). п. 02. doi: 10.5772 / 63646
CrossRef Полный текст | Google Scholar
50. Вимонт А., Фернандес Б., Хаммами Р., Абабса А., Даба Н., Флисс И. Производит бактериоцин Enterococcus faecium LCW 44: потенциальный кандидат в пробиотики из сырого верблюжьего молока. Передняя микробиолия. (2017) 8: 865. DOI: 10.3389 / fmicb.2017.00865
PubMed Аннотация | CrossRef Полный текст | Google Scholar
51. Zhu D, Sorg JA, Sun X. Биология Clostridioides difficile: споруляция, прорастание и соответствующие методы лечения инфекции C. difficile . Front Cell Infect Microbiol. (2018) 8:29. DOI: 10.3389 / fcimb.2018.00029
PubMed Аннотация | CrossRef Полный текст | Google Scholar
53. McFarland LV, Ship N, Auclair J, Millette M.Первичная профилактика инфекций Clostridium difficile с помощью специального пробиотика, сочетающего штаммы Lactobacillus acidophilus, L. casei и L. rhamnosus : оценка доказательств. J Hosp Infect. (2018) 99: 443–52. DOI: 10.1016 / j.jhin.2018.04.017
PubMed Аннотация | CrossRef Полный текст | Google Scholar
54. Castagliuolo I, Riegler MF, Valenick L, LaMont JT, Pothoulakis C. Протеаза Saccharomyces boulardii подавляет эффекты Clostridium difficile токсинов A и B в слизистой оболочке толстой кишки человека. Infect Immun. (1999) 67: 302–7. DOI: 10.1128 / IAI.667.1.302-307.1999
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Enterococcus faecalis, выделенный из детских фекалий, подавляет токсикогенные Clostridioides (Clostridium) difficile
DOI: 10.3389 / fped.2020.572633. Электронная коллекция 2020.Принадлежности Расширять
Принадлежности
- 1 Отделение биомедицинских наук, медицинский факультет, Университет принца Сонгкла, Сонгкхла, Таиланд.
- 2 Кафедра педиатрии медицинского факультета Университета принца Сонгкла, Сонгкхла, Таиланд.
- 3 Отделение биохимии, факультет наук, Университет принца Сонгкла, Сонгкхла, Таиланд.
- 4 Клиническая микробиология, отделение патологии, медицинский факультет, Университет принца Сонгкла, Сонгкхла, Таиланд.
Элемент в буфере обмена
Chonticha Romyasamit et al.Фронт Педиатр. .
Бесплатная статья PMC Показать детали Показать вариантыПоказать варианты
Формат АннотацияPubMedPMID
DOI: 10.3389 / fped.2020.572633. Электронная коллекция 2020.Принадлежности
- 1 Отделение биомедицинских наук, медицинский факультет, Университет принца Сонгкла, Сонгкхла, Таиланд.
- 2 Кафедра педиатрии медицинского факультета Университета принца Сонгкла, Сонгкхла, Таиланд.
- 3 Отделение биохимии, факультет наук, Университет принца Сонгкла, Сонгкхла, Таиланд.
- 4 Клиническая микробиология, отделение патологии, медицинский факультет, Университет принца Сонгкла, Сонгкхла, Таиланд.
Элемент в буфере обмена
Полнотекстовые ссылки Опции CiteDisplayПоказать варианты
Формат АннотацияPubMedPMID
Абстрактный
Инфекция Clostridioides (Clostridium) difficile считается основной причиной диареи, связанной с антибиотиками, в больницах по всему миру.Пробиотики, особенно молочнокислые бактерии, являются наиболее часто используемым альтернативным лечением. Это исследование направлено на выявление потенциальных пробиотических штаммов энтерококков, которые действуют против штаммов C. difficile и оказывают защитное действие на клетки аденокарциномы толстой кишки (клетки HT-29). С этой целью были исследованы девять штаммов Enterococcus , выделенных из фекалий грудных детей. Посредством секвенирования 16s рРНК и MALDI-TOF они были идентифицированы как E. faecalis . Были оценены свойства пробиотиков, включая их жизнеспособность при моделировании состояния желудочно-кишечного тракта, способность к адгезии клеток и их безопасность.Все штаммы проявляли большую толерантность как к пепсину, так и к солям желчных кислот и более плотно прилипали к клеткам HT-29 по сравнению со стандартным пробиотическим штаммом Lactobacillus plantarum ATCC 14917. Результаты полимеразной цепной реакции (ПЦР) показали, что шесть из девяти штаммов несли по крайней мере один ген детерминанты вирулентности; однако ни один из них не проявлял фенотипов вирулентности или не нес переносимые гены устойчивости к антибиотикам. Эти штаммы не заразили Galleria mellonella по сравнению с патогенными E.faecalis ( p <0,05). Более того, их антибактериальная активность против C. difficile была исследована с использованием тестов на диффузию в агаре, образование спор и прорастание. Шесть безопасных штаммов ингибировали прорастание спор (100-98,20% ± 2,17%) и споруляцию, особенно у C. difficile ATCC 630, обработанных E. faecalis PK 1302. Кроме того, иммунофлуоресцентный анализ показал, что цитопатические эффекты C .difficile клеток HT-29 были восстановлены обработкой бесклеточным супернатантом E.faecalis штаммов. Эти штаммы предотвращали округление клеток HT-29 и сохраняли микроструктуру F -актина и плотные соединения между соседними клетками, что указывало на их способность снижать цитопатические эффекты клостридиумов. Таким образом, исследование выявило шесть изолятов E. faecalis , которые обладают активностью против C. difficile . Это могут быть многообещающие пробиотики с потенциальным применением для предотвращения колонизации C. difficile и лечения C.difficile .
Ключевые слова: Clostridioides (Clostridium) difficile; Enterococcus faecalis; кишечная клетка; пробиотики; споры.
Авторские права © 2020 Romyasamit, Thatrimontrichai, Aroonkesorn, Chanket, Ingviya, Saengsuwan и Singkhamanan.
Цифры
Рисунок 1
Адгезия E.faecalis изоляты…
Рисунок 1
Адгезия изолятов E. faecalis и L. plantarum ATCC 14917 к человеку…
Рисунок 1Адгезия изолятов E. faecalis и L. plantarum ATCC 14917 к линии клеток человека. (A) Адгезионная способность. (B) % гидрофобности. Планки погрешностей указывают на стандартное отклонение трех независимых экспериментов. * p <0,05.
Рисунок 2
Процент спор C. difficile …
Рисунок 2
Процент C.difficile с обработкой шестью или без нее E. faecalis…
фигура 2Процент спор C. difficile с обработкой или без обработки шестью штаммами E. faecalis и L. plantarum ATCC 14917.
Рисунок 3
Сравнение цитотоксических эффектов…
Рисунок 3
Сравнение цитотоксических эффектов индивидуума C.difficile , E. faecalis и…
Рисунок 3Сравнение цитотоксических эффектов отдельных штаммов C. difficile , E. faecalis и совместного культивирования E. faecalis с C. difficile на клетках HT-29. (A) монослойных клеток HT-29. (B – D) Клетки HT-29, обработанные бесклеточным супернатантом токсигенного C.difficile и E. faecalis . (E, F) Клетки HT-29, обработанные бесклеточным супернатантом из совместной культуры E. faecalis и C. difficile .
Рисунок 4
Иммунофлуоресцентные изображения, полученные конфокальным…
Рисунок 4
Иммунофлуоресцентные изображения, полученные методом конфокальной сканирующей лазерной микроскопии клеток HT-29 через 24…
Рисунок 4Иммунофлуоресцентные изображения, полученные с помощью конфокальной сканирующей лазерной микроскопии клеток HT-29 через 24 часа с бесклеточным супернатантом индивидуума C.difficile ATCC630, E. faecalis 1302 и L. plantarum ATCC 14917 и с бесклеточным супернатантом, полученным после инкубации E. faecalis с C. difficile ATCC630 и L. plantarum ATCC 14917 с C. difficile ATCC630. (A) DAPI-окрашенное ядро (синее, возбужденное при 405 нм). (B) F-актин, окрашенный зондом Phalloidin-Alexa-Fluor-488 (зеленый, возбуждение при 490 нм). (C) Комбинация ядра и окрашенного F-актина.
Похожие статьи
- Ингибирование Clostridium difficile у мышей с использованием смеси потенциальных штаммов пробиотиков Enterococcus faecalis NM815, E. faecalis NM915 и E. faecium NM1015: новые кандидаты для борьбы с инфекцией C. difficile (CDI).
Мансур Н.М., Эльхатиб В.Ф., Абошанаб К.М., Бахр ММА. Мансур Н.М. и др.Пробиотики, антимикробные белки. 2018 сентябрь; 10 (3): 511-522. DOI: 10.1007 / s12602-017-9285-7. Пробиотики, антимикробные белки. 2018. PMID: 28497217
- Ингибирование in vitro Clostridium difficile и Clostridium perfringens коммерческими пробиотическими штаммами.
Шостер А., Кокотович Б., Пермин А., Педерсен П.Д., Даль Белло Ф., Гуардабасси Л. Schoster A, et al.Анаэроб. 2013 Апрель; 20: 36-41. DOI: 10.1016 / j.anaerobe.2013.02.006. Epub 2013 5 марта. Анаэроб. 2013. PMID: 23471038
- Комбинация пробиотика и пребиотика может предотвратить прорастание спор Clostridium difficile и инфекцию.
Rätsep M, Kõljalg S, Sepp E, Smidt I, Truusalu K, Songisepp E, Stsepetova J, Naaber P, Mikelsaar RH, Mikelsaar M.Rätsep M, et al. Анаэроб. 2017 Октябрь; 47: 94-103. DOI: 10.1016 / j.anaerobe.2017.03.019. Epub 2017 29 апреля. Анаэроб. 2017 г. PMID: 28465256
- Нетоксигенный Clostridioides (ранее Clostridium) difficile для профилактики C. difficile инфекции: от скамейки к постели, обратно к скамье и обратно к постели.
Гердинг Д. Н., Самбол С. П., Джонсон С.Гердинг Д. Н. и др. Front Microbiol. 26 июля 2018 г .; 9: 1700. DOI: 10.3389 / fmicb.2018.01700. eCollection 2018. Front Microbiol. 2018. PMID: 30093897 Бесплатная статья PMC. Рассмотрение.
- Пробиотики для профилактики диареи, связанной с Clostridium difficile, у взрослых и детей.
Гольденберг Дж. З., Яп С., Литвин Л., Ло К. К., Бердсли Дж., Мертц Д., Джонстон BC. Гольденберг Дж. З. и др.Кокрановская база данных Syst Rev.19 декабря 2017 г .; 12 (12): CD006095. DOI: 10.1002 / 14651858.CD006095.pub4. Кокрановская база данных Syst Rev.2017. PMID: 2
- 53 Бесплатная статья PMC. Рассмотрение.
использованная литература
- Мартин Дж. С., Уилкокс М. Х. Инфекция Clostridium difficile: эпидемиология, диагностика и понимание передачи.Нат Рев Гастроэнтерол Гепатол. (2016) 13: 206–16. 10.1038 / nrgastro.2016.25 – DOI – PubMed
- Czepiel J, Drózdz M, Pituch H, Kuijper EJ, Perucki W, Mielimonka A, et al.. Инфекция Clostridium difficile: обзор. Eur J Clin Microbiol. (2019) 38: 1211–21. 10.1007 / s10096-019-03539-6 – DOI – ЧВК – PubMed
- Бриттон Р.А., Янг В.Б.Взаимодействие между кишечной микробиотой и хозяином при устойчивости к колонизации Clostridium difficile. Trends Microbiol. (2012) 20: 313–9. 10.1016 / j.tim.2012.04.001 – DOI – ЧВК – PubMed
- Рупник М., Уилкокс М.Х., Гердинг Д.Н.Инфекция Clostridium difficile: новые разработки в эпидемиологии и патогенезе. Nat Rev Microbiol. (2009) 7: 526–36. 10.1038 / nrmicro2164 – DOI – PubMed
- Кэрролл К.С., Бартлетт Дж. Дж.Биология Clostridium difficile: значение для эпидемиологии и диагностики. Annu Rev Microbiol. (2011) 65: 501–21. 10.1146 / annurev-micro-0-102824 – DOI – PubMed
Показать все 54 ссылки
Энтерококковая колонизация младенцев в отделении интенсивной терапии новорожденных: связанные предикторы, факторы риска и сезонные закономерности | BMC Infectious Diseases
Fanaro S, Chierici R, Guerrini P, Vigi V: Микрофлора кишечника в раннем младенчестве: состав и развитие. Acta Paediatr Suppl. 2003, 441: 48-55.
Google ученый
Маки Р.И., Сгир А., Гаскин Х.Р .: Микробная экология развития желудочно-кишечного тракта новорожденных. Am J Clin Nutr. 1999, 69 (Дополнение): 1035S-45S.
CAS PubMed Google ученый
Schwiertz A, Gruhl B, Löbnitz M, Michel P, Radke P, Blaut M: Развитие бактериального состава кишечника у госпитализированных недоношенных младенцев по сравнению с доношенными младенцами, находящимися на грудном вскармливании. Pediatr Res. 2003, 54: 393-99. 10.1203 / 01.PDR.0000078274.74607.7A.
Артикул PubMed Google ученый
Orrhage K, Nord CE: Факторы, контролирующие бактериальную колонизацию кишечника у младенцев, находящихся на грудном вскармливании. Acta Paediatr Suppl.1999, 430: 47-57.
Google ученый
Хайке М.М., Сам Д.Ф., Гилмор М.С.: Энтерококки с множественной лекарственной устойчивостью: природа проблемы и планы на будущее. Emerg Infect Dis. 1998, 4: 239-49.
CAS Статья PubMed PubMed Central Google ученый
Благородный CJ: Носительство стрептококков группы D в кишечнике человека. J Clin Pathol.1978, 31: 1182-86. 10.1136 / jcp.31.12.1182.
CAS Статья PubMed PubMed Central Google ученый
Мюррей Б.Е.: энтерококковые инфекции, устойчивые к ванкомицину. N Engl J Med. 2000, 342: 710-21. 10.1056 / NEJM200003093421007.
CAS Статья PubMed Google ученый
Маки Д.Г., Эггер В.А.: Энтерококковая бактериемия: клинические особенности, риск эндокардита и лечение.Медицина. 1988, 67: 248-69. 10.1097 / 00005792-198807000-00005.
CAS Статья PubMed Google ученый
Gewolb IH, Schwalbe RS, Taciak VL, Harrison TS, Panigrahi P: Микрофлора стула у младенцев с крайне низкой массой тела при рождении. Arch Dis Child Fetal Neonatal Ed. 1999, 80: F167-73.
CAS Статья PubMed PubMed Central Google ученый
Hendley JO, Hayden FG, Winther B: Еженедельная точечная распространенность Streptococcus pneumoniae, Hemophilus influenzae и Moraxella catarrhalis в верхних дыхательных путях здоровых маленьких детей: влияние респираторного заболевания и времени года. APMIS. 2005, 113: 213-20. 10.1111 / j.1600-0463.2005.apm1130310.x.
Артикул PubMed Google ученый
Huang YC, Chou YH, Su LH, Lien RL, Lin TY: Метициллин-резистентный Staphylococcus aureus и его связь с инфекцией среди младенцев, госпитализированных в отделения интенсивной терапии новорожденных.Педиатр. 2006, 118: 469-74. 10.1542 / peds.2006-0254.
Артикул Google ученый
Facklam R, Collins MD: Идентификация видов Enterococcus , выделенных от инфекций человека, с помощью стандартной тестовой схемы. J Clin Microbiol. 1989, 27: 731-4.
CAS PubMed PubMed Central Google ученый
Национальный комитет по клиническим лабораторным стандартам: Стандарты эффективности тестирования на чувствительность к противомикробным препаратам (приложение).Вилланова, П.А. 1999
Google ученый
Хименес Э., Фернандес Л., Марин М.Л., Мартин Р., Одриозола Дж. М., Нуэно-Палоп С., Нарбад А., Оливарес М., Хаус Дж., Родригес Дж. М.: Выделение комменсальных бактерий из пуповинной крови здоровых новорожденных. путем кесарева сечения. Curr Microbiol. 2005, 51: 270-4. 10.1007 / s00284-005-0020-3.
CAS Статья PubMed Google ученый
Martin R, Langa S, Reviriego C, Jimenez E, Marin ML, Xaus J, Fernandez L, Rodriguez JM: Грудное молоко является источником молочнокислых бактерий для кишечника младенца. J Pediatr. 2003, 143: 754-8. 10.1016 / j.jpeds.2003.09.028.
CAS Статья PubMed Google ученый
Heikkilä MP, Saris PEJ: Ингибирование Staphylococcus aureus комменсальными бактериями грудного молока. J Appl Microbiol. 2003, 95: 471-8. 10.1046 / j.1365-2672.2003.02002.x.
Артикул PubMed Google ученый
Hitti J, Riley DE, Krohn MA, Hillier SL, Agnew KJ, Krieger JN, Eschenbach DA: Цепная реакция бактериальной рибосомной РНК-полимеразы широкого спектра действия для выявления инфекции околоплодных вод у женщин при преждевременных родах. Clin Infect Dis. 1997, 24: 1229-32.
Артикул Google ученый
Bearfield C, Davenport ES, Sivapathasundaram V, Allaker RP: Возможная связь между инфекцией микроорганизмов околоплодных вод и микрофлорой рта. Br J Obstet Gynaecol. 2002, 109: 527-33.
Артикул Google ученый
Rescigno M, Urbano M, Valzasina B, Francolini M, Rotta B, Bonasio R, Granucci F, Kraehenbuhl JP, Ricciardi-Castagnoli P: Дендритные клетки экспрессируют белки плотных контактов и проникают в монослои эпителия кишечника, чтобы взять образцы бактерий.Nat Immunol. 2001, 4: 361-7. 10.1038 / 86373.
Артикул Google ученый
Мюррей Б.Э .: Жизнь и времена энтерококка. Clin Microbiol Rev.1990, 3: 82-90.
Артикул Google ученый
Reid KC, Cockerill FR, Patel R: Клинические и эпидемиологические особенности Enterococcus casseliflavus / flavescens и Enterococcus gallinarum бактериемия: отчет о 20 случаях.Clin Infect Dis. 2001, 32: 1540-6. 10.1086 / 320542.
CAS Статья PubMed Google ученый
Miedema CJ, Kerkhof M, Arends JP, Bergman KA, Kimpen JLL: Факторы риска колонизации энтерококками в отделении интенсивной терапии новорожденных. Clin Microbiol Infect. 2000, 6: 53-10.1046 / j.1469-0691.2000.00019.x.
CAS Статья PubMed Google ученый
Penders J, Thijs C, Vink C, Stelma FF, Snijders B, Kummeling I, van den Brandt PA, Stobberingh EE: Факторы, влияющие на состав кишечной микробиоты в раннем детстве. Педиатр. 2006, 118: 511-21. 10.1542 / peds.2005-2824.
Артикул Google ученый
Weinstein JW, Roe M, Towns M, Sanders L, Thorpe JJ, Corey GR, Saxton DJ: Устойчивые энтерококки: проспективное исследование распространенности, заболеваемости и факторов, связанных с колонизацией в университетской больнице.Инфекционный контроль Hosp Epidemiol. 1996, 17: 36-41.
CAS Статья PubMed Google ученый
Bischoff WE, Reynolds TM, Hall GO, Wenzel RP, Edmond MB: Молекулярная эпидемиология устойчивого к ванкомицину Enterococcus faecium в большой городской больнице в течение 5 лет. J Clin Microbiol. 1999, 37: 3912-6.
CAS PubMed PubMed Central Google ученый
Prellner K, Christensen P, Hovelius B, Rosen C: носоглоточное носительство бактерий у предрасположенных к отиту и не предрасположенных к отиту детей в детских садах. Acta Otolaryngologica. 1984, 98: 343-50.
CAS Статья Google ученый
Syrjänen RK, Kilpi TM, Kaijalainen TH, Herva EE, Takal AK: носоглоточное носительство Streptococcus pneumoniae у финских детей младше 2 лет. J Infect Dis.2001, 184: 451-9. 10.1086 / 322048.
Артикул PubMed Google ученый
Hoberman A, Paradise JL, Greenberg DP, Wald ER, Kearney DH, Colborn DK: Чувствительность пневмококковых изолятов к пенициллину, вызывающих острый средний отит у детей. Pediatr Infect Dis J. 2005, 24: 115-20. 10.1097 / 01.inf.0000151092.85759.6d.
Артикул PubMed Google ученый
Сеть детских инфекционных болезней по острым инфекциям дыхательных путей. [http://www.pid-ari.net/RL_WebWarn/Saisonberichte.htm]
Ферех М., Коенен С., Малхотра-Кумар С., Дворакова К., Хендркс Е., Суэтенс К., Гусенс Х., ESAC Project Группа: Европейский надзор за потреблением антимикробных препаратов (ESAC): использование антибиотиков в амбулаторных условиях в Европе. J Antimicrob Chemother. 2006, 58: 401-7. 10.1093 / jac / dkl188.
CAS Статья PubMed Google ученый
Детская энтерококковая инфекция: история болезни, патофизиология, эпидемиология
Автор
Мира Варман, доктор медицины Доцент кафедры педиатрии, отделение детских инфекционных заболеваний, Медицинский центр Университета Крейтон
Мира Варман, доктор медицины, является членом следующих медицинских обществ: Американской академии педиатрии, Американского общества микробиологии, инфекционного Общество болезней Америки, Общество детских инфекционных заболеваний, Общество эпидемиологии здравоохранения Америки
Раскрытие информации: выступить (d) в качестве докладчика или члена бюро докладчиков для: Pfizer, Sanofi
Получил исследовательский грант от: Merck; MedImmune; Регенрон; Пфайзер; Новартис; Саноф; GSK
Получал гонорары от фармацевтических компаний за выступления и преподавание; Получил грант / средства на исследования от фармацевтических компаний для проведения клинических исследований.
Соавтор (ы)
Арчана Чаттерджи, доктор медицины, доктор философии Профессор и заведующий кафедрой педиатрии, старший заместитель декана по развитию факультета Медицинской школы Сэнфорд, Университет Южной Дакоты
Арчана Чаттерджи, доктор медицинских наук, является членом следующих медицинских обществ : Американская академия педиатрии, Американское общество микробиологии, Общество инфекционных болезней Америки, Международное общество инфекционных заболеваний, Общество педиатрических инфекционных болезней, Общество педиатрических исследований
Раскрытие: Ничего не раскрывать.
Валид Абухаммур, MD, MBA, CIC, FAAP, FIDSA Профессор педиатрии, Колледж медицины человека Мичиганского государственного университета; Адъюнкт-профессор кафедры педиатрии Хашимитского университета, Иордания; Заведующий педиатрическими инфекционными заболеваниями педиатрического отделения детской больницы Аль-Джалила, ОАЭ
Валид Абухаммур, доктор медицины, магистр делового администрирования, CIC, FAAP, FIDSA является членом следующих медицинских обществ: Американская академия педиатрии, Международное общество инфекционных заболеваний, Международное общество инфекционных заболеваний, Иорданская медицинская ассоциация, Иорданское педиатрическое общество, Мичиганское общество инфекционных болезней, Медицинское общество штата Мичиган, Национальная арабско-американская медицинская ассоциация, Общество детских инфекционных болезней
Раскрытие: нечего раскрывать.
Специальная редакционная коллегия
Мэри Л. Виндл, PharmD Адъюнкт-профессор фармацевтического колледжа Медицинского центра Университета Небраски; Главный редактор Medscape Drug Reference
Раскрытие информации: нечего раскрывать.
Ларри Лютвик, доктор медицины, FACP , главный редактор, ID Cases; Модератор Программы мониторинга возникающих заболеваний; Адъюнкт-профессор медицины, Медицинский колледж Нижнего штата Нью-Йорка
Ларри Лютвик, доктор медицины, FACP является членом следующих медицинских обществ: Американской ассоциации развития науки, Американской ассоциации изучения заболеваний печени, Американской Колледж врачей, Американская федерация клинических исследований, Американское общество микробиологов, Американское общество инфекционных заболеваний, Общество инфекционных болезней Нью-Йорка, Международное общество инфекционных заболеваний, Нью-Йоркская академия наук, Общество практикующих врачей-терапевтов по делам ветеранов
Раскрытие: нечего раскрывать.
Главный редактор
Рассел Стил, доктор медицины Профессор-клиницист, Медицинский факультет Тулейнского университета; Врач, штатный врач, Ochsner Clinic Foundation
Рассел Стил, доктор медицинских наук, является членом следующих медицинских обществ: Американской академии педиатрии, Американской ассоциации иммунологов, Американского педиатрического общества, Американского общества микробиологии, Американского общества инфекционных болезней, Медицинского центра штата Луизиана. Общество, Общество детских инфекционных болезней, Общество педиатрических исследований, Южная медицинская ассоциация
Раскрытие: Ничего не раскрывать.
Дополнительные участники
Хосе Рафаэль Ромеро, доктор медицины Директор программы стипендий по педиатрическим инфекционным заболеваниям, доцент кафедры педиатрии Объединенного отделения детских инфекционных заболеваний, Университет Крейтон / Медицинский центр Университета Небраски
Хосе Рафаэль Ромеро, доктор медицины, является членом следующие медицинские общества: Американская академия педиатрии, Американское общество микробиологии, Американское общество инфекционных болезней, Нью-Йоркская академия наук, Общество педиатрических инфекционных болезней
Раскрытие: Ничего не разглашать.
Благодарности
Авторы и редакторы eMedicine выражают признательность предыдущему автору Уоррену Джонсону III, доктору медицины, за вклад в разработку и написание этой статьи.
Передача штаммов Enterococcus от матери и новорожденного во время родов | Журнал фундаментальных и прикладных наук Университета Бени-Суэф
Гиббонс Л., Белизан Дж. М., Лауэр Дж. А. (2010) Общее количество и стоимость дополнительно необходимого и ненужного кесарева сечения, выполняемого в год: чрезмерное использование как препятствие для всеобщего охвата.World Heal Rep Backgr Pap: 1–31
Osterman MJK, Martin JA (2014) Национальная статистика естественного движения населения сообщает о частоте первичного кесарева сечения в разбивке по штатам: результаты пересмотренного свидетельства о рождении, 2006–2012 гг., Стр. 63
Google ученый
Назнин Р., Бегум Р., Султана К. (1970) Тенденция роста числа случаев кесарева сечения в больнице третичного уровня за последние десять лет. J Bangladesh Coll Physitors Surg. https://doi.org/10.3329/jbcps.v29i3.9432
Артикул Google ученый
А TR. Тенденция к увеличению частоты кесарева сечения в Индии: данные NFHS-4. J Med Sci Clin Res 2017; 5: 26167–26176. DOI: https://doi.org/10.18535/jmscr/v5i8.31.
Gosalbes MJ, Llop S, Moya A (2013) Типы микробиоты мекония, в которой преобладают молочнокислые или кишечные бактерии, по-разному связаны с экземой у матери и респираторными проблемами у младенцев.Clin Exp Allergy 43: 198–211. https://doi.org/10.1111/cea.12063
Артикул PubMed CAS Google ученый
Fanaro S, Chierici R, Guerrini P, Vigi V (2003) Кишечная микрофлора в раннем младенчестве: состав и развитие, стр. 48–55
Google ученый
Mackie RI, Sghir A, Gaskins HR (1999) Микробная экология развития желудочно-кишечного тракта новорожденных.Am J Clin Nutr. https://doi.org/10.1093/ajcn/69.5.1035s
Артикул CAS Google ученый
Schwiertz A, Gruhl B, Löbnitz M, Michel P, Radke M, Blaut M (2003) Развитие бактериального состава кишечника у госпитализированных недоношенных младенцев по сравнению с доношенными младенцами, находящимися на грудном вскармливании. Pediatr Res. https://doi.org/10.1203/01.PDR.0000078274.74607.7A
Артикул Google ученый
Orrhage K, Nord CE (1999) Факторы, контролирующие бактериальную колонизацию кишечника у младенцев, находящихся на грудном вскармливании. Acta Paediatr Int J Paediatr Suppl. https://doi.org/10.1111/j.1651-2227.1999.tb01300.x
Артикул Google ученый
Hobbs AJ, Mannion CA, McDonald SW, Brockway M, Tough SC (2016) Влияние кесарева сечения на начало, продолжительность и трудности грудного вскармливания в первые четыре месяца после родов.BMC Беременность и роды. https://doi.org/10.1186/s12884-016-0876-1
Grönlund MM, Grzeskowiak Ł, Isolauri E, Salminen S (2011) Влияние микробиоты кишечника матери на колонизацию кишечника у младенца. Кишечные микробы 2: 226–233. https://doi.org/10.4161/gmic.2.4.16799
Артикул Google ученый
Houghteling PD, Walker WA (2015) Почему первоначальная бактериальная колонизация кишечника важна для здоровья младенцев и детей? J Pediatr Gastroenterol Nutr.https://doi.org/10.1097/MPG.0000000000000597
Артикул Google ученый
Ван С., Хибберд М.Л., Петтерссон С., Ли Ю.К. (2014) Enterococcus faecalis от здоровых младенцев модулирует воспаление через сигнальные пути MAPK. PLoS One. https://doi.org/10.1371/journal.pone.0097523
Артикул CAS Google ученый
Хайке М.М., Сам Д.Ф., Гилмор М.С. (1998) Энтерококки с множественной лекарственной устойчивостью: природа проблемы и планы на будущее.Emerg Infect Dis. https://doi.org/10.3201/eid0402.980211
Артикул CAS Google ученый
Noble CJ (1978) Носительство стрептококков группы D в кишечнике человека. J Clin Pathol. https://doi.org/10.1136/jcp.31.12.1182
Артикул CAS Google ученый
Belguesmia Y, Madi A, Sperandio D, Merieau A, Feuilloley M, Prévost H et al (2011) Новые сведения о безопасности бактериоцинов: пример энтероцина S37.Res Microbiol. https://doi.org/10.1016/j.resmic.2010.09.019
Артикул CAS Google ученый
Drider D, Rebuffat S (2011) Прокариотические антимикробные пептиды: от генов к приложениям. https://doi.org/10.1007/978-1-4419-7692-5_1
Глава Google ученый
Gewolb IH, Schwalbe RS, Taciak VL, Harrison TS, Panigrahi P (1999) Микрофлора стула у младенцев с крайне низкой массой тела при рождении.Arch Dis Child Fetal Neonatal Ed. https://doi.org/10.1136/fn.80.3.F167
Артикул CAS Google ученый
Hufnagel M, Liese C, Loescher C, Kunze M, Proempeler H, Berner R et al (2007) Энтерококковая колонизация младенцев в отделении интенсивной терапии новорожденных: связанные предикторы, факторы риска и сезонные закономерности. BMC Infect Dis 7: 107. https://doi.org/10.1186/1471-2334-7-107
Артикул PubMed PubMed Central Google ученый
Normann E, Fahlén A, Engstrand L, Lilja HE (2013) Микробные профили кишечника у крайне недоношенных детей с некротическим энтероколитом и без него. Acta Paediatr Int J Paediatr. https://doi.org/10.1111/apa.12059
Артикул Google ученый
Björkstén B, Sepp E, Julge K, Voor T, Mikelsaar M (2001) Развитие аллергии и микрофлора кишечника в течение первого года жизни. J Allergy Clin Immunol. https: // doi.org / 10.1067 / mai.2001.118130
Артикул Google ученый
Araújo TF, Lúcia C, Fortes DL (2013) Род энтерококков как пробиотик: проблемы безопасности. 56: 457–466
Pandey PK, Siddharth J, Verma P, Bavdekar A, Patole MS, Shouche YS и др. (2012) Краткое описание молекулярного типирования фекальной эукариотической микробиоты младенцев и их матерей. J Biosci 37: 221–226. https://doi.org/10.1007 / s12038-012-9197-3
Артикул PubMed Google ученый
Бхагват А., Нанданвар Ю.С., Варке Р., Аннапур США (2019) Оценка in vitro физиологических свойств штаммов энтерококков человеческого происхождения для возможного использования пробиотиков. Asian J Pharm Clin Res 12
Bhagwat A, Annapure US (2019) Оценка метаболического профиля штаммов Enterococcus человеческого происхождения in vitro. Дженет Eng Biotechnol 17:11.https://doi.org/10.1186/s43141-019-0009-0
Артикул PubMed PubMed Central Google ученый
Pascual LM, Daniele B, Pa C, T LB. Виды Lactobacillus, выделенные из влагалища: идентификация, выработка перекиси водорода и устойчивость к ноноксинолу-9 Contraception 2006; 73: 78–81. DOI: 10.1016 / j.contraception.2005.06.066.
Артикул CAS Google ученый
Chun J, Lee J-H, Jung Y (2007) EzTaxon: сетевой инструмент для идентификации прокариот на основе последовательностей гена 16S рибосомной РНК. Int J Syst Evol Microbiol 57: 2259–2261. https://doi.org/10.1099/ijs.0.64915-0
Артикул PubMed CAS Google ученый
Naser SM, Vancanneyt M, De Graef E, Devriese LA, Snauwaert C, Lefebvre K et al (2016) Enterococcus canintestini sp. nov., из фекалий здоровых собак: 2177–2182.https://doi.org/10.1099/ijs.0.63752-0
Артикул CAS Google ученый
Aslim B, Kilic E (2006) Некоторые пробиотические свойства вагинальных лактобацилл, выделенных от здоровых женщин. Jpn J Infect Dis 59: 249–253
PubMed Google ученый
Ботина С.Г., Суходолец В.В. (2006) Видообразование у бактерий: сравнение гена 16S рРНК близкородственных видов Enterococcus.42: 247–251. https://doi.org/10.1134/S1022795406030033
Артикул CAS Google ученый
Janda JM, Abbott SL (2007) MINIREVIEW 16S рРНК Секвенирование генов для идентификации бактерий в диагностической лаборатории: плюсы, опасности и подводные камни. 45: 2761–2764. https://doi.org/10.1128/JCM.01228-07
Артикул CAS Google ученый
Law-Brown J, Meyers PR (2003) Enterococcus phoeniculicola sp.nov., новый представитель энтерококков, выделенных из уропигиальной железы красноклювого обыкновенного обыкновенного Phoeniculus purpureus. Int J Syst Evol Microbiol 53: 683–685. https://doi.org/10.1099/ijs.0.02334-0
Артикул PubMed CAS Google ученый
Фишер К., Филлипс С. (2009) Экология, эпидемиология и вирулентность Enterococcus: 1749–1757. https://doi.org/10.1099/mic.0.026385-0
Артикул CAS Google ученый
Ниеми Р.М., Оллинкангас Т., Паулин Л., Павел С., Вандамм П., Каркман А. и др. (2016) Enterococcus rivorum sp. нов., из воды чистых ручьев: 2169–2173. https://doi.org/10.1099/ijs.0.038257-0
Артикул CAS Google ученый
Naser SM, Vancanneyt M, De Graef E, Devriese LA, Snauwaert C, Lefebvre K et al (2005) Enterococcus canintestini sp. nov., из фекалий здоровых собак. Int J Syst Evol Microbiol 55: 2177–2182.https://doi.org/10.1099/ijs.0.63752-0
Артикул PubMed CAS Google ученый
Tanasupawat S, Sukontasing S, Lee J (2016) Enterococcus thailandicus sp. nov., выделенный из ферментированной колбасы («мама») в Таиланде: 1630–1634. https://doi.org/10.1099/ijs.0.65535-0
Артикул CAS Google ученый
Round JL, O’Connell RM, Mazmanian SK (2010) Координация толерогенных иммунных ответов комменсальной микробиотой.J Autoimmun 34. https://doi.org/10.1016/j.jaut.2009.11.007
Артикул CAS Google ученый
Миками К., Кимура М., Такахаши Х (2012) Влияние материнских бифидобактерий на развитие кишечных бифидобактерий у младенцев. Фармацевтика 5: 629–642. https://doi.org/10.3390/ph%205060629
Артикул PubMed PubMed Central Google ученый
Lin H-C, Su B-H, Chen A-C, Lin T-W, Tsai C-H, Yeh T-F et al (2005) Пероральные пробиотики снижают частоту и тяжесть некротического энтероколита у младенцев с очень низкой массой тела при рождении. Педиатрия 115: 1–4
Статья Google ученый
Penders J, Thijs C, Vink C, Stelma FF, Snijders B, Kummeling I et al (2006) Факторы, влияющие на состав кишечной микробиоты в раннем младенчестве. Педиатрия 118: 511–521
Статья Google ученый
Саарела М., Криттенден Р. (2016) Кишечные бактерии и здоровая пища – европейская перспектива кишечные бактерии и здоровая пища – европейская перспектива. https://doi.org/10.1016/S0168-1605(02)00235-0
Артикул CAS Google ученый
Беликова (2004) Синергетическая активность селена и пробиотической бактерии Enterococcus faecium M-74 против выбранных мутагенов в анализе сальмонелл. Folia Microbiol (Praha) 49: 301–305
Статья CAS Google ученый
Are A, Aronsson L, Wang S, Greicius G, Yuan KL, Gustafsson JÅ et al (2008) Enterococcus faecalis от новорожденных детей регулируют эндогенную активность PPARγ и уровни IL-10 в эпителиальных клетках толстой кишки. Proc Natl Acad Sci U S A. https://doi.org/10.1073/pnas.0711734105
Артикул Google ученый
Franz CMAP, Huch M, Abriouel H, Holzapfel W, Gálvez A (2011) Энтерококки как пробиотики и их значение для безопасности пищевых продуктов.Int J Food Microbiol. https://doi.org/10.1016/j.ijfoodmicro.2011.08.014
Артикул CAS Google ученый
Аль-Атья А.К., Драйдер-Хадиуш К., Раваллек Р., Сильвайн А., Вачи А., Драйдер Д. (2015) Пробиотический потенциал штаммов Enterococcus faecalis, выделенных из мекония. Front Microbiol. https://doi.org/10.3389/fmicb.2015.00227
Enterococcus faecalis от здоровых младенцев модулирует воспаление с помощью сигнальных путей MAPK
Abstract
Колонизирующие комменсальные бактерии после рождения необходимы для правильного развития желудочно-кишечного тракта.Считается, что характер бактериальной колонизации в кишечнике новорожденных влияет на барьерную функцию кишечника и созревание иммунной системы. Исследования развития фекальной микробиоты у младенцев показали, что кишечник новорожденных сначала был колонизирован энтерококками, а затем другой микробиотой, такой как Bifidobacterium . Другие исследования показали, что младенцы, у которых развилась аллергия, реже колонизировались Enterococcus в течение первого месяца жизни по сравнению со здоровыми младенцами. Было проведено множество исследований, чтобы выяснить, как бифидобактерии или лактобациллы, некоторые из которых считаются пробиотиками, регулируют иммунитет кишечника младенцев.Однако меньшее количество исследований было посвящено энтерококкам. В нашем исследовании мы демонстрируем, что E. faecalis , выделенные от здоровых новорожденных, подавляют воспалительные реакции, активированные in vivo и in vitro . Мы обнаружили, что E. faecalis ослабляет секрецию провоспалительных цитокинов, особенно IL-8, через сигнальные пути JNK и p38. Это открытие пролило свет на то, как первый колонизатор, E.faecalis , регулирует воспалительные реакции в организме хозяина.
Образец цитирования: Ван С., Хибберд М.Л., Петтерссон С., Ли Ю.К. (2014) Enterococcus faecalis от здоровых младенцев модулирует воспаление через сигнальные пути MAPK. PLoS ONE 9 (5): e97523. https://doi.org/10.1371/journal.pone.0097523
Редактор: Лиза Ф.П. Нг, Сингапурская сеть иммунологии, Агентство науки, технологий и исследований (A * STAR), Сингапур
Поступила: января 2, 2014; Одобрена: 19 апреля 2014 г .; Опубликовано: 15 мая 2014 г.
Авторские права: © 2014 Wang et al.Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Финансирование: Работа поддержана Национальным исследовательским фондом EWI Incentive for Research and Innovation Scheme. Финансирующие организации не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: Авторы заявили, что конкурирующих интересов не существует.
Введение
Существенные разногласия существуют по поводу роли энтерококка, в частности, E.faecalis , для здоровья. Принимая во внимание, что в клинических условиях с пациентами с ослабленным иммунитетом, E.faecalis можно рассматривать как условно-патогенный микроорганизм [1], также было показано, что он оказывает благотворное влияние на здоровье. Недавнее исследование in vitro продемонстрировало, что E.faecalis ингибировал инфекцию C. jejuni MB 4185 при моделировании состояния слепой кишки бройлеров [2]. E.faecalis , выделенный от здорового взрослого человека, показал самую высокую пробиотическую активность по сравнению с более чем 70 изолятами других молочнокислых бактерий (LAB), включая лактобациллы и бифидобактерии [3]. Эти противоположные роли предполагают взаимодействие между бактериями и человеком-хозяином, которое зависит от контекста и, вероятно, динамично во времени.
До рождения кишечник стерилен, и после рождения бактерии начинают колонизировать.Кишечник новорожденных с наивной, но компетентной иммунной системой представляет собой ценный контекст для определения роли определенных бактерий в здоровье. Для правильного развития желудочно-кишечного тракта необходима своевременная колонизация после рождения [4]. Исследование показало, что приобретение микробиоты в младенчестве, вероятно, является определяющим фактором раннего иммунного программирования, последующего инфицирования и риска аллергии [5]. Среди микроорганизмов первой волны, обнаруживаемых в кале младенцев, энтерококки обычно обнаруживаются в первый день жизни [6], [7].Они постепенно уменьшаются с одновременным увеличением количества бифидобактерий , которые появляются в течение 2–3 дней у младенцев, вскармливаемых грудью [8]. Младенцы, у которых развились аллергии, были реже колонизированы Enterococcus в течение первого месяца жизни по сравнению со здоровыми младенцами [9]. Это означает, что Enterococcus может иметь большое влияние на развитие иммунной системы кишечника на самых ранних этапах жизни.
Известно, что на состав микробной флоры на раннем этапе жизни влияют несколько факторов, такие как способ родов и срок беременности.Недоношенные и младенцы, родившиеся с помощью кесарева сечения, демонстрируют отсроченную кишечную колонизацию с меньшим видовым разнообразием и более высокой распространенностью потенциально патогенных микроорганизмов [10], [11]. При недоношенных родах вероятность возникновения некротического энтероколита (НЭК) гораздо выше, чем при родах [12]. Интересно, что младенцы, у которых развился NEC, несут меньше E.faecalis [13]. Предыдущие исследования показали, что сывороточные концентрации ИЛ-8 были повышены в тяжелых случаях НЭК с момента его появления до первых 24 часов [14].IL-8 представляет собой хемокин, который стимулирует миграцию нейтрофилов из внутрисосудистых в интерстициальные сайты и может непосредственно активировать нейтрофилы и регулировать экспрессию молекул адгезии нейтрофилов [15] – [17]. Таким образом, IL-8 играет важную роль в младенческих инфекциях.
Также известно, что компоненты клеточной стенки из грамотрицательных, такие как липополисахариды, а также цитокины хозяина, такие как IL-1β и TNF-α, увеличивают секрецию IL-8 из IEC через активацию митоген-активируемой протеинкиназы ( МАПК) [18], [19].Выявлено как минимум три группы МАПК. К ним относятся киназы, регулируемые внеклеточными сигналами (ERK), c-JUN NH 2 -концевые киназы (JNK) и p38. Сообщалось, что P38 стабилизирует мРНК IL-8, и его уровень был повышен в собственной мышечной ткани толстой кишки как у мышей с колитом DSS, так и у пациентов с воспалительным заболеванием кишечника (ВЗК) [20]. Ингибитор p38 подавлял воспаление на модели DSS-индуцированного колита за счет снижения уровней IL-1β и TNF-α слизистой оболочки [21]. Ингибирование активации JNK коррелирует с подавлением индуцированной IL-1β секреции IL-8 в IECs [22].Исследование показало, что активация сигнального пути ERK в ответ на TNF-α в клетках HT-29 приводит к увеличению экспрессии IL-8 [23].
Были проведены обширные исследования, чтобы определить, как лактобациллы и бифидобактерии регулируют иммунитет кишечника младенца [24], [25]. Однако мало исследований было сосредоточено на E.faecalis , который является первым колонизатором в желудочно-кишечном тракте человека [6], [7]. Здесь мы демонстрируем, что E. faecalis , выделенный от новорожденных, может подавлять патоген-опосредованные воспалительные реакции в человеческих IEC, а также DSS-индуцированное воспаление на модели мышей. E. faecalis ослабляет секрецию провоспалительных цитокинов, особенно IL-8, различными путями. Эти бактерии подавляют JNK и p38, а также нарушают воспалительные реакции, регулируемые c-JUN. Эти данные проливают свет на функции первого колонизатора, E.faecalis , в защите кишечника младенцев.
Результаты
Выделение и идентификация бактерий из кишечника младенцев
Чтобы охарактеризовать ранние постнатальные кишечные LAB, мы собрали фекалии 16 здоровых младенцев в возрасте 3 дней и 1 месяца из Индонезии.В общей сложности 25 изолятов были размножены и подтверждены как LAB на основании продукции молочной кислоты, стержневой или кокковой формы и грамположительности. В зависимости от характера ферментации углеводов девять штаммов были отнесены к Lactobacillus и 16 штаммов как Enterococcus . Анализ последовательности 16S рДНК показал, что 8/9 лактобацилл были Lactobacillus casei и 13/16 энтерококков были Enterococcus faecalis (Таблица 1). Таким образом, мы обнаружили ограниченное разнообразие ранних колонизирующих видов у младенцев с L.casei и E. faecalis были видными ранними колонизаторами. Представлено филогенетическое дерево, построенное на основе метода расстояния между последовательностями (рис. 1). Из филогенетического дерева мы могли видеть, что некоторые энтерококки были ближе к лактобактериям, чем остальные энтерококки.
Enterococcus faecalis подавляет кишечную секрецию IL-8Затем мы исследовали, как эти ранние колонизирующие бактерии могут влиять на иммунитет кишечника и передачу сигналов эпителиальными клетками.Потенциальные противовоспалительные эффекты энтерококков и лактобацилл, выделенных для младенцев, были исследованы путем совместного культивирования с IEC, происходящими от колоректального рака (Caco-2, HT29 и HCT116). Супернатанты собирали для анализа IL-8 в качестве маркера воспаления кишечника [26]. Хотя некоторые лактобациллы подавляли секрецию IL-8 в клетках Caco-2, ни один из изолятов Lactobacillus не ослаблял значительно секрецию IL-8 во всех трех клеточных линиях (рис. S1A – C). Напротив, большинство изолятов Enterococcus подавляли продукцию IL-8 в клетках Caco-2 и HCT116 (рис. 2A, B).Поразительно, что четыре штамма, а именно EC1, EC3, EC15 и EC16, подавляли секрецию IL-8 во всех трех линиях (рис. 2 A – C, и снижение уровней IL-8 не было связано с апоптозом, индуцированным E.faecalis ( Рисунок S1D, E). Затем мы проверили кинетику подавления IL-8 этими четырьмя штаммами в клетках HCT116 (Рисунок 2D). Для каждого из этих изолятов степень подавления IL-8 зависела от бактериальной множественности инфекции ( MOI). изолятов E. faecalis подавляли секрецию IL-8 с 4 ч при MOI 100.Однако такой же уровень подавления наблюдался намного раньше при MOI 1000. Напротив, такое быстрое и надежное подавление IL-8 не наблюдалось с коммерческими пробиотическими штаммами, L. rhamnosus GG (L.gg) (рис. 2D). Salmonella typhimurium (Salm), известный патоген и стимулятор IL-8 [27], активировал секрецию IL-8 через 2 часа (рис. 2D). Эти данные предполагают, что раннее заселение E.faecalis оказывает сильное противовоспалительное действие, что оценивается с использованием экспрессии IL-8 в качестве маркера.
Рисунок 2. Секреция IL-8 в IEC.
СекрецияIL-8 в Caco-2 (A), HCT116 (B) и HT-29 (C) при обработке Enterococcus . Всего в клетки добавляли 10 7 КОЕ / мл бактерий на 6 ч. Супернатанты собирали для анализа цитокинов, как описано в разделе «Материалы и методы». (D) Клетки HCT116 совместно культивировали с E. faecalis (EC1, EC3, EC15, EC16) и L. rhamnosus GG (L.GG) и S. typhimurium (Salm) с множественной инфекцией. (MOI) 100 в течение 2, 4, 6 и 24 часов.Для получения представленных данных было проведено три независимых эксперимента. Данные были выражены как среднее значение ± стандартное отклонение. T-критерий Стьюдента использовался для статистического анализа, как описано в разделе «Материалы и методы». * р <0,05.
https://doi.org/10.1371/journal.pone.0097523.g002
Активный
E. faecalis Физиология не имеет решающего значения для подавления воспаления кишечникаЗатем мы исследовали, какие аспекты E. faecalis могут вызывать снижение секреции IL-8 в IEC.Чтобы проверить, является ли физиология интактных бактерий критической для подавления IL-8, мы подвергли клетки HCT116 живым бактериям или бактериям, которые были убиты ультрафиолетовым облучением (УФ) или физическим разрушением посредством обработки ультразвуком непосредственно перед использованием (рис. 3). В каждом случае мы обнаружили, что подавление IL-8 оставалось неизменным, что указывает на то, что активная бактериальная физиология не была критической для этой активности. Затем мы проверили, важен ли физический контакт между бактериальными мембранами и эпителиальными клетками.Физическое отделение живых бактерий от эпителиальных клеток с использованием полупроницаемой вставки клеточной культуры значительно облегчило супрессию IL-8 (рис. 3), указывая на то, что физический контакт между бактериями и эпителиальными клетками важен для этой активности. Кроме того, кондиционированная бактериями среда из одних только бактерий или из сокультив клеток млекопитающих не привела к явной супрессии IL-8 (Рисунок 3), что позволяет предположить, что эпителиальные клетки реагируют на плохо растворимый фактор (факторы), вероятно, присутствующий на внешней клеточной стенке Э.faecalis .
Рисунок 3. Секреция IL-8 в клетках HCT116.
Производство IL-8 в HCT116 с обработкой различной условной среды (CM) (из супернатанта сокультуры, из бактерий и из супернатанта клеток), клеточных вставок, убитых ультрафиолетом и обработанных ультразвуком бактерий. Целые живые бактерии использовали в качестве контроля, как описано в разделе «Материалы и методы». Было проведено три независимых эксперимента, и данные были выражены как среднее значение ± стандартное отклонение. T-критерий Стьюдента использовался для статистического анализа, как описано в разделе «Материалы и методы».* р <0,05.
https://doi.org/10.1371/journal.pone.0097523.g003
E. faecalis подавляет продукцию IL-8, индуцированную IL-1β, TNF-α и S. typhimuriumЗатем мы проверили способность E. faecalis регулировать продукцию IL-8, индуцированную IL-1β (2 нг / мл), TNF-α (200 нг / мл) и S. typhimurium (10 7 КОЕ / мл) в клетках Caco-2 и HCT116. Мы обнаружили, что E. faecalis EC16 подавляли продукцию IL-8, индуцированную IL-1β, TNF-α и S.typhimurium через 1 ч инкубации. Подавление продукции IL-8 внутри клеток наблюдалось через 30 минут обработки (фигура S2A, B). Это явление наблюдалось как в клетках HCT116 (фиг. 4A, B), так и в клетках Caco-2 (фиг. S2C). Интересно, что E. faecalis EC2 не может подавлять продукцию IL-8 ни внутри, ни за пределами IEC, что предполагает отличительную способность этих четырех штаммов E. faecalis (EC1, EC3, EC15, EC16) регулировать продукцию IL-8.
E.faecalis подавляет экспрессию TNF-α, индуцированную IL-1βВ дополнение к IL-8, мы протестировали потенциальную регуляцию TNF-α с помощью E. faecalis в клетках HCT116 и Caco-2. TNF-α является важным регулятором эпителиального воспаления. Уровни TNF-α повышены как при воспалительных заболеваниях кишечника человека, так и на моделях воспаления кишечника на животных [28] – [30]. Как и ожидалось, мы обнаружили, что секреция TNF-α клетками HCT116 (фиг. 4C) и Caco-2 (фиг. S2D) активируется IL-1β. Однако это увеличение секреции было ослаблено E.faecalis EC16. Интересно, что индукция ICAM1, IL-2, IL-5, IL-17 и INF-γ под действием IL-1β и S. typhimurium подавлялась с помощью EC16 в клетках Caco-2 (фигура S2D).
E. faecalis регулирует множественные иммунные сигнальные путиНаше открытие, что E.faecalis может подавлять экспрессию IL-8, побудило нас исследовать, могут ли эти бактерии регулировать другие пути передачи иммунных сигналов. Мы протестировали экспрессию иммунного гена четырьмя штаммами E.faecalis (EC1, EC3, EC15, EC16) с использованием анализа микрочипов кДНК. Возможные изменения экспрессии 406 иммунных сигнальных генов анализировали в клетках Caco-2 после 6 часов совместного культивирования с изолятами E. faecalis . Собранные данные с мембран массива были первоначально сканированы (рисунок S3A), и были получены графики вулканов для выявления статистически значимых изменений экспрессии генов (рисунок S3B). Неполный список генов, демонстрирующих статистически значимые изменения экспрессии (> 1.5-кратный) с помощью анализа микроматрицы кДНК представлен в таблице 2. Из данных микроматрицы мы обнаружили несколько сигнальных путей, которые могут быть вовлечены в противовоспалительные эффекты четырех штаммов E. faecalis . Используя анализ пути изобретательности, мы в основном определили передачу сигналов цитокинов (передача сигналов IL-1, IL-2, IL-6, IL-8 и IL-10), передачу сигналов SAPK / JNK, передачу сигналов P38 MAPK и передачу сигналов NF-κB, ответственных за передачу сигналов. ответы (рис. 5А). Вместе эти данные предполагают, что E. faecalis может одновременно изменять несколько иммуномодулирующих путей.
Рис. 5. Анализ IPA и ПЦР в реальном времени.
Анализ пути изобретательности (A) и ПЦР в реальном времени (B) на клетках HCT116, обработанных E.faecalis . Все пути и гены, показанные на фигуре, в значительной степени (p <0,05) регулировались в клетках HCT116 при обработке E. faecalis EC16 в течение 6 часов при MOI 100. Эксперименты проводились в 3 биологических повторностях.
https://doi.org/10.1371/journal.pone.0097523.g005
Из анализа микрочипов мы выбрали 46 генов для дальнейшего изучения с использованием TLDA.ID гена и зонды Taqman перечислены в таблице S1. Каждый из четырех изолятов E. faecalis продемонстрировал сходную картину регуляции иммунного гена в клетках Caco-2 и HCT116. Данные для генной регуляции изолятом EC16 представлены в качестве репрезентативного примера (рис. 5B). К нашему удивлению, мы обнаружили, что мРНК IL-8 не регулируется. Мы также обнаружили, что DUSP1, известная MAPK-фосфатаза, которая может ослаблять передачу сигналов MAPK, сильно активирована. Другие гены, участвующие в передаче сигналов MAPK, подавлялись в клетках Caco-2, а именно MAP3K7IP1, позитивный регулятор каскада киназ MAP [31]; MKNK1, мишень ERK и активатор CREB-опосредованной пролиферации и дифференцировки [32], и MAPKAPK2, мишень киназы p38 MAP, участвующей во многих клеточных процессах, включая воспалительные реакции (рисунок S4A).Другие члены семейства MAPK, такие как MAPK7 в клетках Caco-2, MAPK9 в клетках HCT116, также подавлялись E. faecalis (фиг. S4B, C). На основании приведенных выше данных мы предполагаем, что ранние колонизирующие клетки E. faecalis могут влиять на воспалительные реакции в организме хозяина, регулируя путь передачи сигналов MAPK. Кроме того, в соответствии с наблюдениями на микрочипе, результаты TLDA также показали, что NF-κB1 и IKBKB подавлялись E. faecalis как в клетках Caco-2, так и в клетках HCT116 (рисунок S4D, E), что позволяет предположить, что E.faecalis подавлял сигнальный путь NF-κB1 на уровне транскрипции.
E. faecalis подавляет активацию P38, P-JNK и C-JUNПоскольку факторы, регулирующие передачу сигналов MAPK, были изменены при воздействии E.faecalis , мы предположили, что эти бактерии могут ослаблять продукцию IL-8, по крайней мере частично, путем ингибирования путей MAPK. Чтобы проверить это, мы исследуем экспрессию и фосфорилирование MAPK с помощью иммуноблоттинга. В то время как p-JNK сильно и временно активировался IL-1β и S.typhimurium в клетках HCT116 в течение получаса обработки, E. faecalis подавлял эту активацию (фиг. 6A). В соответствии с этим открытием, cJUN, который находится ниже JNK, активировался IL-1β и S. typhimurium через один час, в то время как подавлялся E. faecalis EC16 (фиг. 6B). Точно так же присутствие фосфорилированного p38 увеличивалось при инкубации либо с IL-1β, либо с S. typhimurium в течение одного часа, что было устранено совместным культивированием с E.faecalis EC16 (Рисунок 6C). Следовательно, E. faecalis может ингибировать передачу сигналов JNK и p38 как одно из возможных средств подавления продукции IL-8. Напротив, фосфорилирование ERK не изменилось при обработке IL-1β, S. typhimurium и E. faecalis (фиг. S5), что позволяет предположить, что ERK не влияет на продукцию IL-8 в этих клетках. Эти данные предполагают, что E.faecalis может подавлять воспалительную передачу сигналов в IEC за счет снижения активации JNK и p38.
Рисунок 6. Экспрессия белка в экспрессии HCT116JNK (A) через 30 минут, экспрессии c-JUN (B) и P38 (C) через 1 час в HCT116 с обработкой 2 нг / мл IL-1β и 10 7 КОЕ / мл S. typhimurium, E. faecalis EC16, как описано в разделе «Материалы и методы».
Затем клетки лизировали и тестировали белки с помощью вестерн-блоттинга. Было проведено три независимых эксперимента.
https://doi.org/10.1371/journal.pone.0097523.g006
E.faecalis подавляют экспрессию IL-1β и TNF-α у мышей с колитом, индуцированным DSS, модельЧтобы изучить иммуномодулирующие эффекты E.faecalis in vivo , мы вызвали колит с помощью натриевой соли декстрансульфата (DSS) у мышей, а затем обработали их E.faecalis EC16 или Lactobacillus rhamnosus GG (L.gg). , хорошо изученный пробиотический штамм. Длина толстой кишки, которая является индикатором воспаления, была укорачена после лечения DSS. В соответствии с иммунорепрессивной ролью, как E.faecalis и L.gg значительно уменьшили это сокращение (рис. 7A). Кроме того, E.faecalis , а также L.gg предотвращали индуцированную DSS потерю веса у этих животных (фиг. 7B). IL-1β и TNF-α, которые были активированы DSS, значительно подавлялись EC16 и L.gg (рис. 7C, D)
Рисунок 7. Модель легкого колита, обработанного E.faecalis , DSS.
Длина толстой кишки (см) (A) и изменение веса мышей (B) с 1,5% DSS с обработкой EC16 и L.GG или без нее, как описано в разделе «Материалы и методы».ПЦР в реальном времени на экспрессию IL-1β (C) и TNF-α (D) в толстой кишке. В каждой группе по 6–8 мышей. Данные выражали как среднее значение ± стандартное отклонение. T-критерий Стьюдента использовался для статистического анализа, как описано в разделе «Материалы и методы». * p <0,05, ** P <0,01.
https://doi.org/10.1371/journal.pone.0097523.g007
Обсуждение
В этом исследовании мы описываем выделение и первичную характеристику штаммов E.faecalis , выделенных от здоровых новорожденных в Индонезии. E.faecalis представляли бактерии, наиболее часто выделяемые у детей, а выбранные изоляты обладали способностью сильно ингибировать маркеры воспаления в IEC. Отобранные изоляты с наиболее сильным противовоспалительным действием были охарактеризованы для определения потенциального механизма действия, и мы обнаружили, что пути MAPK регулируются. В частности, E. faecalis был способен ослаблять активацию JNK и p38, совпадающую со сниженной экспрессией IL-8 in vitro , а также IL-1β и TNF-α in vivo .
Энтерококки ранее были зарегистрированы среди обычных ранних колонизаторов у людей [6]. Таким образом, наше исследуемое население в Индонезии обеспечивает удивительную стабильность ранних колонизирующих бактерий. Поскольку на E.faecalis приходится 90-95% комменсальных энтерококков в кишечнике взрослого человека, обнаружение E.faecalis более заметного, чем следующий по значимости вид, E.faecium , не является неожиданным. В нашем исследовании L.casei были вторыми по частоте изолированными молочнокислыми бактериями у 3-дневных младенцев.Хотя когорта исследования невелика, насколько нам известно, это первое сообщение о lactobacillus среди ранних колонизаторов, что может отражать различия в окружающей среде для этой индонезийской когорты.
Ни один из изолятов лактобацилл не оказывал сильного иммуносупрессивного действия, как было определено по уровням экспрессии IL-8. С другой стороны, некоторые изоляты E.faecalis могут сильно ингибировать IL-8 в IEC. Наши предыдущие результаты показали, что E.faecalis может индуцировать противовоспалительный цитокин IL-10 в кишечном эпителии через PPAR-гамма [33].Взятые вместе, это может объяснить меньшую численность колонизации энтерококками [34] и высокую частоту НЭК у недоношенных детей [35]. Более того, младенцы, у которых развился НЭК, несут меньше E.faecalis [13], [36]. Следовательно, E.faecalis может обладать способностью модулировать и ослаблять воспалительные реакции, чтобы предотвратить воспалительные заболевания, такие как NEC, у младенцев. Интересно, что поведение трех линий IEC существенно различается в ответ на многие бактерии, что позволяет предположить, что, в отличие от стандартных анализов, использование одного IEC для характеристики может быть неадекватным.Противовоспалительные эффекты были подтверждены в системе in vivo . Этот результат согласуется с предыдущим исследованием, показывающим, что E.faecalis обладает большим защитным эффектом на модели экспериментального колита, вызванного DSS, у мышей [37]. На данном этапе неясно, почему только определенные изоляты E.faecalis в этом исследовании могут снижать продукцию IL-8 in vitro . Было бы интересно потенциально изучить эти другие изоляты на предмет их поведения на модели индуцированного DSS колита in vivo .
Интересно, что в то время как изолятов E.faecalis снижали уровень белка IL-8 внутри и вне клеток, уровень его мРНК повышался. Недавние исследования также показали, что MAPK может регулировать eIF4E [38], а сверхэкспрессия eIF4E связана с повышенной экспрессией IL-8 [39]. Следовательно, ингибирование пути MAPK может подавлять eIF4E, что приводит к снижению трансляции IL-8. В модели DSS-колита, а также у пациентов с воспалительным заболеванием кишечника (ВЗК) уровни p38 повышены в собственной мышечной ткани толстой кишки [20].При лечении ингибитором p38 уровни IL-1β и TNF-α слизистых оболочек снижались в модели колита DSS [21], что согласуется с тем, что мы обнаружили для лечения E.faecalis . Таким образом, явления, которые мы наблюдаем с E.faecalis , могут быть исключительно результатом ингибирования MAPK. С другой стороны, E.faecalis может влиять на другие пути, например, наши предыдущие результаты показали, что LAB может подавлять уровни мРНК TLR3, TLR9 и TRAF6 [40]. Следовательно, E.faecalis может подавлять пути TLR и дополнительно подавлять путь MAPK, а также опосредованную NFκB транскрипцию.
E.faecalis , как один из первых колонизаторов, может подавлять воспалительные реакции и формировать иммунную систему. Кишечник младенца обычно подвергается острому воспалению при воздействии грамотрицательных бактерий. Присутствие E. faecalis может помочь кишечнику поддерживать иммунный баланс в ответ на такие проблемы. Наш вывод о том, что E.faecalis работает так же хорошо, как признанные пробиотики, указывает на их потенциал в качестве пробиотика. Однако терапевтические эффекты должны быть тщательно изучены, так как E.faecalis также был зарегистрирован как условно-патогенный микроорганизм при госпитальных инфекциях. Поскольку мы обнаружили, что мертвые E.faecalis также обладают способностью подавлять секрецию IL-8, использование мертвых E.faecalis может снизить риск оппортунистической инфекции E.faecalis .
Материалы и методы
Культивирование и идентификация бактерий
Все бактериальные штаммы были изолированы от 16 здоровых младенцев в Индонезии. Это исследование рассмотрено и одобрено Наблюдательным советом Национального университета Сингапура (NUS IRB), разрешение No.NUS1469. Форма письменного согласия была получена от опекунов участников. Критерии включения включали естественные роды и грудное вскармливание. Критерии исключения включали прием антибиотиков за 2 недели до и в рамках исследования, получение пробиотиков / культурального молока за 2 месяца до и в ходе исследования.
Эти бактерии сначала окрашивали по Граму, затем тест-полоски API 50 CH для палочковидных бактерий и экспресс-тест ID 32 STREP для штаммов кокковой формы. Затем все штаммы бактерий культивировали и экстрагировали на ДНК.16S рДНК напрямую секвенировали с использованием праймера 1100 обратного 5V-GGGTTGCGCTCGTTG-3V для получения частичной последовательности 16S рДНК [41]. Вычисление филогенетического дерева было основано на методе расстояния между последовательностями и с использованием алгоритма Neighbor Joining (NJ) Сайто и Нея [42].
Культура клеток и инфекции
Caco-2, HT-29 и HCT116 были получены из Американской коллекции типовых культур (Манассас, Вирджиния) и поддерживались в среде, рекомендованной АТСС. Перед инфицированием клеток 1 × 10 5 клеток культивировали в стерильных 24-луночных планшетах с плоским дном (Nalge Nunc International, США) в течение 24 часов.Клетки Caco-2, HT-29 и HCT116 инкубировали в свежей среде без (контроль) или с бактериями при множественности инфекции (MOI) 100 в течение 6 часов. Супернатанты собирали для анализа ELISA (BD bioscience, Сан-Диего, Калифорния). и белки собирали для анализа вестерн-блоттингом.
Условная среда и вставки для ячеек
Супернатанты клеточных культур, полученные из IEC, бактерий и сокультуры бактерий и IEC, собирали стерильно, а затем к приготовленным культурам клеток добавляли условные среды.Затем собирали супернатант для анализа цитокинов. Для теста на вставку клеток клетки HCT116 высевали в лунки многолуночного планшета Transwell (США). В каждую вставку добавляли 100 мкл бактериальной суспензии. Для обработки бактериальных клеток ультразвуком к суспензиям добавляли ингибиторы протеаз. Затем бактериальные клетки разрушали обработкой ультразвуком (SANYO, Япония) на льду в течение 10 циклов с 30-секундными импульсами и 1-минутным отдыхом [43]. Клеточный дебрис осаждали и добавляли в культуру клеток, приготовленную, как описано выше.Другие бактериальные суспензии подвергали воздействию УФ-света в течение 5 минут [44], чтобы убедиться, что по крайней мере 99% бактерий были убиты, а затем совместно культивировали с клетками.
TNF-α, IL-1β и
S. typhimurium индуцировали секрецию цитокинов и продукцию белка200 нг / мл TNF-α (Preproteck, INC, Rocky Hill, NJ), 0,2 нг / мл IL-1β (Preproteck, INC, Rocky Hill, NJ) и S. typhimurium с MOI 100 были добавлены к Клетки Caco-2 и HCT116. Затем клетки инфицировали E.faecalis EC16 с или без TNF-α / IL-1β / S. typhimurium . Клетки без какой-либо обработки использовали в качестве контроля. Затем клетки культивировали при 37 ° C с 5% CO 2 в течение 30 минут, 1 час, 2 часа, 4 часа и 6 часов. Собирали супернатанты и определяли концентрацию IL-8 с помощью ELISA (BD bioscience, Сан-Диего, Калифорния). Другие цитокины, такие как INF-γ, TNF-α, IL-2, IL-5, IL-17 и ICAM-1, определяли с помощью анализа цитокинов (Bio-Rad, США). Белки собирали для анализа вестерн-блоттингом.
Анализ микрочипов
В соответствии с инструкциями производителя в этом исследовании (Superarray, США) было обнаружено 406 клонов кДНК, связанных с сигнальным путем иммунной системы человека. Исходные данные доступны на сайте Gene Expression Omnibus с регистрационным номером GSE56485. Сигналы анализировали с помощью Интернет-пакета GEArray Expression Analysis Suite (Supperarray, США). GeneSpring GX 7.3.1 и анализ пути изобретательности также использовались для анализа данных. Данные были исключены с плохими или отсутствующими флажками.В этом эксперименте для одной обработки делали 2-3 повтора. T-критерий Стьюдента применялся для контроля количества ложноположительных результатов ( P <0,05 считалось значимым), кластерный анализ был произведен с помощью программного обеспечения.
TaqMan Массив низкой плотности (TLDA)
РНК собирали с использованием набора для экстракции РНК (Roche, Швейцария). 48-луночный матричный массив Taqman с низкой плотностью был разработан для подмножества генов, которые дифференциально экспрессировались в экспериментах с набором, включая два эндогенных контроля 18 s и β-актин (Applied Biosystems, США).Идентификаторы генов и анализов ABI перечислены в таблице S1. Суммарная РНК 0,5 мкг была преобразована в кДНК с использованием набора для архивирования кДНК высокой емкости (Applied Biosystems, США) и 10 нг кДНК в 100 мкл универсальной мастер-смеси для ПЦР TaqMan (Applied Biosystems, США) была использована для каждого порта и запущена на ABI 7900. система (Applied Biosystems, США). Данные были проанализированы с использованием программного обеспечения SDS2.2, где настройки базового уровня и порогового значения были автоматически скорректированы.
Натрий-додецилсульфат-полиакриламидный гель-электрофорез (SDS-PAGE) и иммуноблоттинг
Электрофорез в геле с додецилсульфатом и полиакриламидным гелем проводили на 10% геле, используя 20 мкг на дорожку лизата цельных клеток.Электрофорез проводили при постоянном напряжении 75 В в течение приблизительно полутора часов, а затем переносили на нитроцеллюлозную мембрану 0,22 мкм (Biorad, США) при 85 В в течение 2 часов в холодной комнате. Затем мембрану блокировали в трис-буферном солевом растворе-твин (TBST), содержащем 5% обезжиренного молока, в течение по меньшей мере 1 часа. Затем специфические первичные антитела разводили и мембрану инкубировали в течение ночи при 4 ° C на орбитальном шейкере (Bellco, США). После промывания в мембрану добавляли соответствующие вторичные антитела, конъюгированные с пероксидазой хрена (HRP), разведенные в TBST, содержащем 5% обезжиренного молока, и инкубировали в течение 1 часа при комнатной температуре на орбитальном шейкере (Bellco, США).Затем осуществляли визуализацию иммуномеченных полос с использованием реагентов для обнаружения вестерн-блоттинга ECL Plus или набора для обнаружения вестерн-блоттинга ECL Advance (GE Healthcare, Великобритания) в соответствии с инструкциями производителя. Сигналы экспонировались на рентгеновской пленке (Koda, США).
Животные
Самцов мышей C57BL / 6 (возраст от 8 до 10 недель) содержали в Центре экспериментальной медицины SingHealth и содержали в коллективных клетках при температуре 22 ± 1 ° C при 12-часовом цикле свет / темнота (свет включается в 07:00). со свободным доступом к лабораторному корму и автоклавированной водопроводной воде.Эксперименты проводились во время световой фазы цикла. Экспериментальные процедуры были ранее одобрены Комитетом по этическому использованию животных SingHealth Institutional Animal Care and Use Committee (IACUC), где проводилось исследование, и проводились в соответствии с сингапурскими правилами защиты животных.
Модель легкого колита, индуцированного DSS, у мышей
самцов мышей C57BL / 6 ( n = 6–8 на группу) получали раствор фильтрованной воды, содержащий 1.5% -ный декстран-сульфат натрия (DSS) (TdB Consultancy AB, Упсала, Швеция) в течение 12-дневного периода. Через день пополняли всего 200 мл 1,5% раствора DSS. Общий объем раствора DSS, потребляемого на мышь, составлял примерно 4,4 мл / день. Никаких различий между экспериментальными группами не наблюдалось. На третий день лечения 1,5% DSS группу лечения кормили 10-7 КОЕ / 100 мл EC16 или 10-7 КОЕ / 100 мл L.GG с использованием иглы для желудочного зонда, соответственно. Контрольную группу кормили PBS. Животным были предоставлены 1.5% DSS до 12 дня. На 12 день животных умерщвляли, удаляли толстую кишку для измерения длины и замораживали в жидком азоте для будущего анализа.
Статистический анализ
Данные выражены как среднее ± стандартное отклонение. Достоверность различий определялась с помощью Т-критерия Стьюдента и дисперсионного анализа. Значения P <0,05 считались статистически значимыми.
Дополнительная информация
Рисунок S1.
Секреция IL-8 в Caco-2 (A), HT-29 (B) и HCT116 (C) при обработке Lactobacillus и анализе апоптоза в HCT116 (D, E). Общее количество 10 7 КОЕ / мл бактерий было добавлено в клетки на 6 часов. Супернатанты собирали для анализа цитокинов, как описано в разделе «Материалы и методы». Для получения представленных данных было проведено три независимых эксперимента. Данные были выражены как среднее значение ± стандартное отклонение. D. Анализ апоптоза в контроле HCT116. E. Анализ апоптоза в HCT116 с обработкой EC16. Один репрезентативный анализ был показан из трех независимых экспериментов.
https://doi.org/10.1371/journal.pone.0097523.s001
(TIF)
Рисунок S2.
Производство цитокинов в МЭК. Продукция IL-8 внутри клеток HCT116 (A, B), секреция IL-8 (C) и ICAM1, IL-2, IL-5, IL-17, IFN-γ и TNF-α в клетках Caco-2 (D ) с обработкой 2 нг / мл IL-1β и 10 7 КОЕ / мл S. typhimurium и E. faecalis (EC16 и EC2), как описано в разделе «Материалы и методы». Было сделано три повтора. Данные выражали как среднее значение ± стандартное отклонение.
https: // doi.org / 10.1371 / journal.pone.0097523.s002
(TIF)
Рисунок S3.
Экспрессия гена в клетках Caco-2 проверена с использованием микроматрицы кДНК. (A) Исходное фото EC16 после экспонирования. (B) График EC16 вулкана, полученный с использованием программного обеспечения Gene Spring. Красные точки представляют собой значительно измененные гены. Желтые точки обозначают гены, которые не регулируются в значительной степени. В качестве представления использовался только один из пяти наборов данных EC16.
https://doi.org/10.1371/journal.pone.0097523.s003
(TIF)
Рисунок S4.
ПЦР в реальном времени на E.faecalis обработанных клетках HCT116 (точка) и Caco2 (черный). Эксперименты проводились в 3-4 биологических повторностях и в 2 технических повторностях. Изменения складок> 1,5 и Т-тест с P <0,05 считали значимым изменением.
https://doi.org/10.1371/journal.pone.0097523.s004
(TIF)
Благодарности
Мы также благодарим Dr.Патрику Рейли из Национального онкологического центра Сингапура за критическое рассмотрение рукописи и его ценные предложения. Мы также благодарим доктора Себастьяна Потта за обсуждения во время исследования.
Вклад авторов
Задумал и спроектировал эксперименты: SW MLH SP YKL. Проведены эксперименты: SW. Проанализированы данные: SW. Предоставленные реагенты / материалы / инструменты для анализа: SW MLH SP YKL. Написал бумагу: SW YKL.
Ссылки
- 1. Пинхольт М., Остергард С., Арпи М., Бруун Н.Э., Шонхейдер Х.С. и др.. (2013) Заболеваемость, клинические характеристики и 30-дневная смертность от энтерококковой бактериемии в Дании, 2006–2009 годы: популяционное когортное исследование. Clin Microbiol Infect.
- 2. Робин Дж., Расшарт Дж., Мессенс В., Пасманс Ф., Хейндриккс М. (2012) Скрининг молочнокислых бактерий, способных ингибировать Campylobacter jejuni, при моделировании среды слепой кишки цыплят-бройлеров in vitro. Benef Microbes 3: 299–308.
- 3. Nueno-Palop C, Narbad A (2011) Оценка пробиотиков Enterococcus faecalis CP58, выделенных из кишечника человека.Int J Food Microbiol 145: 390–394.
- 4. Сюй Дж., Гордон Дж. И. (2003) Почитай своих симбионтов. Proc Natl Acad Sci U S A 100: 10452–10459.
- 5. Мадан Дж. К., Фарзан С.Ф., Хибберд П.Л., Карагас М.Р. (2012) Нормальные вариации микробиома новорожденных в зависимости от факторов окружающей среды, инфекции и аллергии. Curr Opin Pediatr 24: 753–759.
- 6. Orrhage K, Nord CE (1999) Факторы, контролирующие бактериальную колонизацию кишечника у младенцев, находящихся на грудном вскармливании.Acta Paediatr Suppl 88: 47–57.
- 7. Fanaro S, Chierici R, Guerrini P, Vigi V (2003) Микрофлора кишечника в раннем младенчестве: состав и развитие. Acta Paediatr Suppl 91: 48–55.
- 8. Исэки К. (1987) [Развитие кишечной флоры у новорожденных]. Хоккайдо Игаку Дзасси 62: 895–906.
- 9. Bjorksten B, Sepp E, Julge K, Voor T, Mikelsaar M (2001) Развитие аллергии и кишечная микрофлора в течение первого года жизни.J Allergy Clin Immunol 108: 516–520.
- 10. Швирц А., Грюль Б., Лобниц М., Мишель П., Радке М. и др. (2003) Развитие бактериального состава кишечника у госпитализированных недоношенных детей по сравнению с доношенными детьми, находящимися на грудном вскармливании. Pediatr Res. 54: 393–399.
- 11. Gewolb IH, Schwalbe RS, Taciak VL, Harrison TS, Panigrahi P (1999) Микрофлора стула у младенцев с крайне низкой массой тела при рождении. Arch Dis Child Fetal Neonatal Ed 80: F167–173.
- 12.Hufnagel M, Liese C, Loescher C, Kunze M, Proempeler H и др. (2007) Энтерококковая колонизация младенцев в отделении интенсивной терапии новорожденных: связанные предикторы, факторы риска и сезонные закономерности. BMC Infect Dis 7: 107
- 13. Normann E, Fahlen A, Engstrand L, Lilja HE (2013) Микробные профили кишечника у крайне недоношенных младенцев с некротическим энтероколитом и без него. Acta Paediatr 102: 129–136.
- 14. Edelson MB, Bagwell CE, Rozycki HJ (1999) Уровни и тяжесть циркулирующих провоспалительных цитокинов и их тяжесть при некротическом энтероколите.Педиатрия 103: 766–771.
- 15. Baggiolini M, Walz A, Kunkel SL (1989) Нейтрофилактивирующий пептид-1 / интерлейкин 8, новый цитокин, который активирует нейтрофилы. Дж. Клин Инвест 84: 1045–1049.
- 16. Djeu JY, Matsushima K, Oppenheim JJ, Shiotsuki K, Blanchard DK (1990) Функциональная активация нейтрофилов человека с помощью рекомбинантного полученного из моноцитов хемотаксического фактора нейтрофилов / IL-8. J Immunol 144: 2205–2210.
- 17. Huber AR, Kunkel SL, Todd RF 3rd, Weiss SJ (1991) Регулирование трансэндотелиальной миграции нейтрофилов эндогенным интерлейкином-8.Наука 254: 99–102.
- 18. Отте Дж. М., Карио Э., Подольский Д. К. (2004) Механизмы перекрестной гипореактивности к бактериальным лигандам Toll-подобных рецепторов в эпителиальных клетках кишечника. Гастроэнтерология 126: 1054–1070.
- 19. Jijon HB, Buret A, Hirota CL, Hollenberg MD, Beck PL (2012) Рецептор EGF и HER2 участвуют в TNF-альфа-зависимой активации MAPK и секреции IL-8 в эпителиальных клетках кишечника. Посредники Inflamm 2012: 207398.
- 20. Ихара Э., Бек П.Л., Чаппеллаз М., Вонг Дж., Медликотт С.А. и др.(2009) Митоген-активируемые протеинкиназные пути способствуют гиперсокращаемости и повышенной сенсибилизации Ca2 + при экспериментальном колите у мышей. Mol Pharmacol 75: 1031–1041.
- 21. Холленбах Э., Нойман М., Вьет М., Ресснер А., Мальфертайнер П. и др. (2004) Ингибирование передачи сигналов киназы p38 MAP и RICK / NF-kappaB подавляет воспалительное заболевание кишечника. FASEB J 18: 1550–1552.
- 22. Рафферти Б.Дж., Унгер Б.Л., Перей А.С., Таммариелло С.П., Павлидес С. и др.(2012) Новая роль Rho-ассоциированной киназы, ROCK, в ответах кишечных эпителиальных клеток, стимулированных IL-1. Cell Immunol 280: 148–155.
- 23. Jijon HB, Panenka WJ, Madsen KL, Parsons HG (2002) MAP-киназы вносят вклад в секрецию IL-8 эпителиальными клетками кишечника через посттранскрипционный механизм. Am J Physiol Cell Physiol 283: C31–41.
- 24. Perez-Cano FJ, Dong H, Yaqoob P (2010) Иммуномодулирующая активность in vitro Lactobacillus fermentum CECT5716 и Lactobacillus salivarius CECT5713: двух пробиотических штаммов, выделенных из грудного молока человека.Иммунобиология 215: 996–1004.
- 25. Шегрен Ю.М., Томичич С., Лундберг А., Ботчер М.Ф., Бьоркстен Б. и др. (2009) Влияние ранней микробиоты кишечника на созревание детских слизистых оболочек и системные иммунные ответы. Clin Exp Allergy 39: 1842–1851.
- 26. Каллиомаки М., Сатокари Р., Лахтеиноджа Х., Вахамико С., Гронлунд Дж. И др. (2012) Экспрессия микробиоты, Toll-подобных рецепторов и их регуляторов в слизистой оболочке тонкой кишки при целиакии. J Pediatr Gastroenterol Nutr 54: 727–732.
- 27. Carey CM, Kostrzynska M (2013) Молочнокислые бактерии и бифидобактерии ослабляют провоспалительный ответ в эпителиальных клетках кишечника, вызванный Salmonella enterica серовар Typhimurium. Может J Microbiol 59: 9–17.
- 28. Murch SH, Braegger CP, Walker-Smith JA, MacDonald TT (1993) Расположение фактора некроза опухоли альфа с помощью иммуногистохимии при хроническом воспалительном заболевании кишечника. Gut 34: 1705–1709.
- 29. Бриз Э.Дж., Мичи Калифорния, Николлс С.В., Марч С.Х., Уильямс С.Б. и др.(1994) Клетки, продуцирующие фактор некроза опухоли альфа в слизистой оболочке кишечника детей с воспалительным заболеванием кишечника. Гастроэнтерология 106: 1455–1466.
- 30. Braegger CP, Nicholls S, Murch SH, Stephens S, MacDonald TT (1992) Фактор некроза опухоли альфа в стуле как маркер воспаления кишечника. Ланцет 339: 89–91.
- 31. Wolf A, Beuerlein K, Eckart C, Weiser H, Dickkopf B и др. (2011) Идентификация и функциональная характеристика новых сайтов фосфорилирования в TAK1-связывающем белке (TAB) 1.PLoS One 6: e29256.
- 32. Чанг Ш., Ю К. Н., Ли Ю. С., Ан Г. Х., Бек Г. Р. Мл. И др. (2006) Повышенный уровень неорганического фосфата стимулирует передачу сигналов Akt-ERK1 / 2-Mnk1 в клетках легких человека. Am J Respir Cell Mol Biol 35: 528–539.
- 33. Are A, Aronsson L, Wang S, Greicius G, Lee YK и др. (2008) Enterococcus faecalis от новорожденных детей регулируют эндогенную активность PPARgamma и уровни IL-10 в эпителиальных клетках толстой кишки. Proc Natl Acad Sci U S A 105: 1943–1948.
- 34.Моровиц М.Дж., Денеф В.Дж., Костелло Е.К., Томас BC, Поройко В. и др. (2011) Штамм-разрешенный геномный анализ колонизации кишечных микробов у недоношенного ребенка. Proc Natl Acad Sci U S A 108: 1128–1133.
- 35. Lin HY, Chang JH, Chung MY, Lin HC (2013) Профилактика некротического энтероколита у недоношенных новорожденных с очень низкой массой тела: возможно ли это? J Formos Med Assoc.
- 36. Стюарт CJ, Marrs EC, Magorrian S, Nelson A, Lanyon C и др.(2012) Микробиота кишечника недоношенных: изменения, связанные с некротическим энтероколитом и инфекцией. Acta Paediatr 101: 1121–1127.
- 37. Chen LL, Wang XH, Cui Y, Lian GH, Zhang J и др. (2009) Терапевтические эффекты четырех штаммов пробиотиков при экспериментальном колите у мышей. World J Gastroenterol 15: 321–327.
- 38. Швейгерт М., Кайзер С., Брэдрик С.С., Громейер М. (2010) Регулирование фосфорилирования эукариотического фактора инициации 4E (eIF4E) митоген-активируемой протеинкиназой происходит посредством модуляции взаимодействия Mnk1-eIF4G.Mol Cell Biol 30: 5160–5167.
- 39. Zhou S, Wang GP, Liu C, Zhou M (2006) Фактор инициации эукариот 4E (eIF4E) и ангиогенез: прогностические маркеры рака груди. BMC Cancer 6: 231.
- 40. Ван С., Нг ЛХ, Чоу В.Л., Ли Ю.К. (2008) Кишечный энтерококк младенцев подавляет воспалительные реакции в клеточных линиях кишечника человека. World J Gastroenterol 14: 1067–1076.
- 41. Weisburg WG, Barns SM, Pelletier DA, Lane DJ (1991) амплификация рибосомной ДНК 16S для филогенетического исследования.J Bacteriol 173: 697–703.
- 42. Saitou N, Nei M (1987) Метод объединения соседей: новый метод реконструкции филогенетических деревьев. Mol Biol Evol 4: 406–425.
- 43. Шон В., Лим С., Бэ К.С., Бэк С., Ли В. (2005) Экспрессия интегринов альфа4 полиморфноядерными нейтрофилами человека в ответ на обработанные ультразвуком экстракты Enterococcus faecalis. Дж. Эндод 31: 369–372.
- 44. Коннер-Керр Т.А., Салливан П.К., Гайярд Дж., Франклин М.Э., Джонс Р.М. (1998) Влияние ультрафиолетового излучения на устойчивые к антибиотикам бактерии in vitro.Управление стомной раной 44: 50–56.
Инфекция E. Coli через пищу или воду | Детская больница CS Mott
Обзор темы
Что такое инфекция
E. coli ?E. coli ( Escherichia coli ) – это название микроба или бактерии, обитающей в пищеварительном тракте людей и животных.
Существует много типов E. coli , и большинство из них безвредны.Но некоторые могут вызвать кровавый понос. Некоторые штаммы бактерий E. coli могут также вызывать тяжелую анемию или почечную недостаточность, что может привести к смерти.
Другие штаммы E. coli могут вызывать инфекции мочевыводящих путей или другие инфекции.
Что вызывает кишечную инфекцию
E. coli ?Вы заразитесь E. coli при контакте с фекалиями или калом людей или животных. Это может произойти, если вы пьете воду или едите пищу, загрязненную фекалиями.
E. coli в продуктах питания
E. coli может попасть в мясо во время обработки. Если зараженное мясо не было приготовлено до 160 ° F (71 ° C), бактерии могут выжить и заразить вас, когда вы его съедите. Это наиболее распространенный способ заражения людей в США E. coli . Любая пища, контактировавшая с сырым мясом, также может заразиться.
Другие продукты, которые могут быть инфицированы E. coli , включают:
- Сырое молоко или молочные продукты.Бактерии могут передаваться из вымени коровы в молоко. Проверьте этикетки на молочных продуктах, чтобы убедиться, что они содержат слово «пастеризованные». Это означает, что пища была нагрета для уничтожения бактерий.
- Сырые фрукты и овощи, такие как салат, проростки люцерны, непастеризованный яблочный сидр или другие непастеризованные соки, контактировавшие с инфицированными фекалиями животных.
E. coli в воде
Фекалии человека или животных, инфицированные E.coli иногда попадает в озера, бассейны и водоемы. Люди могут заразиться, если загрязненный город или городское водоснабжение не было должным образом обработано хлором или когда люди случайно проглотили зараженную воду во время купания в озере, бассейне или оросительном канале.
E. coli при личном контакте
Бактерии также могут передаваться от одного человека к другому, обычно, когда инфицированный человек плохо моет руки после дефекации. E. coli может передаваться от рук инфицированного человека к другим людям или объектам.
Каковы симптомы?
Основными симптомами кишечной инфекции E. coli являются:
- Кровавая диарея.
- Спазмы желудка.
- Тошнота и рвота.
Некоторые люди не замечают никаких симптомов. У детей симптомы появляются чаще, чем у взрослых. Симптомы обычно появляются через 3-4 дня после контакта с E.coli .
Большинство людей поправляются примерно через неделю. Они часто не обращаются к врачу и не знают, что E. coli вызвала их проблемы.
Когда E. coli вызывает серьезные проблемы с кровью или почками, симптомы включают:
- Бледная кожа.
- Лихорадка.
- Слабость.
- Ушиб.
- Выделение лишь небольшого количества мочи.
Как работает
E.coli диагностирована кишечная инфекция?Ваш врач может заподозрить, что у вас инфекция E. coli , после того, как он или она задаст вам вопросы и сделает экзамен. Ваш стул, вероятно, будет проверен на E. coli .
Как лечится?
Инфекция E. coli обычно проходит сама по себе. Ваше основное лечение – устроиться поудобнее и пить воду глотками. При диарее организм теряет больше воды, чем обычно. Это может привести к обезвоживанию, что особенно опасно для младенцев и пожилых людей.Регулярные небольшие глотки воды помогут предотвратить обезвоживание.
Если у вас кровавый понос, который может быть вызван инфекцией E. coli , не принимайте лекарства от диареи или антибиотики. Эти лекарства могут замедлить процесс пищеварения, давая вашему организму больше времени для поглощения ядов, производимых E. coli . Вместо этого позвоните своему врачу.
У некоторых людей инфекция E. coli вызывает серьезные проблемы с кровью и почками. Этим людям может потребоваться переливание крови или диализ.Диализ – это лечение, которое помогает отфильтровывать продукты жизнедеятельности из крови, когда почки не работают должным образом.
Как предотвратить кишечную инфекцию
E. coli ?Продукты питания и вода, зараженные бактериями E. coli , выглядят и пахнут нормально. Но есть кое-что, что можно сделать, чтобы предотвратить заражение:
- Приготовьте говяжий фарш как минимум до 160 ° F (71 ° C).
- На кухне часто мойте руки горячей мыльной водой, особенно после прикосновения к сырому мясу.
- Вымойте все инструменты или кухонные поверхности, которые соприкасались с сырым мясом.
- Используйте только пастеризованное молоко, молочные и соковые продукты.
- Используйте только очищенную или хлорированную питьевую воду.
- Когда вы путешествуете в страны, где может быть небезопасная питьевая вода, не используйте лед и не пейте воду из-под крана. Избегайте сырых фруктов и овощей, кроме тех, с кожицы которых вы чистите сами.
- Часто мойте руки и всегда мойте их после посещения туалета или смены подгузников.
Симптомы
У детей чаще, чем у взрослых, развиваются симптомы инфекции E. coli . У большинства инфицированных людей будут:
- Сильные спазмы и болезненность желудка.
- Понос, сначала водянистый, но часто становящийся очень кровянистым.
- Тошнота и рвота.
Некоторые люди, инфицированные бактериями, не замечают никаких симптомов. Они могут передавать бактерии другим, даже не подозревая об этом.
Существует множество состояний с симптомами, аналогичными симптомам кишечной инфекции E. coli . Диагностика инфекции E. coli может быть осложнена тем, что большинство бактериальных инфекций, вызывающих диарею, сопровождаются высокой температурой. Если у вас нет лихорадки или у вас только умеренная температура, ваш врач может подозревать, что ваши симптомы вызваны чем-то другим, а не бактериями.
Кровавая диарея часто встречается в подтвержденных случаях кишечной инфекции E. coli , но бактерии также следует рассматривать как возможную причину некровавой диареи.
Для получения дополнительной информации о том, когда обращаться к врачу по поводу диареи без крови, см .:
Симптомы инфекции E. coli обычно проходят примерно через неделю без дальнейших проблем. Но серьезные проблемы с кровью и почками могут возникнуть в течение 2 недель после начала диареи. Эти проблемы могут вызывать почечную недостаточность, а иногда и длительную инвалидность или смерть у некоторых детей и пожилых людей.
Обследования и анализы
Медицинское обследование диареи, которая может быть вызвана болезнью E.coli обычно начинается с медицинского осмотра и сбора анамнеза.
Во время истории болезни ваш врач задаст вопросы о ваших симптомах, например:
- Когда началась диарея, как долго она длилась и как часто бывают испражнения?
- Есть ли кровь при диарее? Если да, то сколько?
- Были ли у вас озноб или жар?
- Были ли у вас спазмы в животе, тошнота или рвота?
- Вы чувствуете усталость или раздражительность?
- Вы упали в обморок или почувствовали головокружение?
Заражение E.coli легко спутать с другими заболеваниями с похожими симптомами, например с другими инфекционными заболеваниями.
Врач может заподозрить у вас инфекцию E. coli , если вы подверглись воздействию этих бактерий. Во время истории болезни ваш врач может спросить, были ли вы:
- Были в детском саду, школе, доме престарелых или другом учреждении по уходу за взрослыми.
- Недавно ел в ресторане.
- Потребляли недоваренное мясо или непастеризованное молоко, молочные продукты или соки.
- Общался с кем-либо с недавней или продолжающейся диареей.
- Недавно был в поездке.
- Недавно принимал антибиотики.
Во время медицинского осмотра врач обычно:
- Измеряет вашу температуру.
- Измерьте артериальное давление и определите частоту пульса.
- Посмотрите на свой цвет кожи, чтобы увидеть, не слишком ли вы бледны.
- Проверьте живот на нежность.
- Проведите ректальное исследование, чтобы узнать, есть ли у вас кровь в стуле.
Врачи, подозревающие инфекцию E. coli , заказывают культуру стула, которая обнаруживает штаммы E. coli . Поскольку бактерии могут покинуть организм всего за несколько дней, образец следует получить как можно скорее после появления симптомов.
Иногда используются другие тесты, когда диагноз неясен, но они еще не широко доступны.
Если у ребенка или пожилого человека диагностирована инфекция E. coli , за ним можно наблюдать на предмет развития серьезных проблем с кровью или почками.Для мониторинга необходимы анализы крови и мочи для измерения основных элементов крови и биологических жидкостей.
Обзор лечения
Лечение инфекций, вызывающих болезнетворных бактерий E. coli , включает лечение осложнений – в основном обезвоживания, вызванного диареей.
Если у вас развиваются симптомы серьезных проблем с кровью или почками, такие как анемия или почечная недостаточность, ваше лечение может включать:
- Тщательное регулирование потребления жидкости и основных минералов.
- Диализ, чтобы отфильтровать отходы из крови. Некоторым людям с почечной недостаточностью, вызванной инфекцией E. coli , требуется диализ.
- Переливание крови для лечения анемии путем введения дополнительных богатых кислородом красных кровяных телец.
Лекарства, которых следует избегать
Большинство людей выздоравливают от инфекций E. coli за 5–10 дней без лекарств. Антибиотики не рекомендуются. Сообщите своему врачу, если вы думаете, что у вас может быть E.coli и принимают антибиотики.
Лекарства от диареи, отпускаемые без рецепта или по рецепту, обычно не используются для лечения инфекции E. coli . Многие противодиарейные продукты замедляют скорость прохождения пищи и продуктов жизнедеятельности через кишечник. Это может дать организму больше времени для поглощения ядов, производимых бактериями, увеличивая риск таких осложнений, как серьезные проблемы с кровью и почками.
Избегайте этих продуктов без рецепта, если у вас есть или вы подозреваете, что у вас есть E.coli :
- Лоперамид. К ним относятся Имодиум, Маалокс и другие противодиарейные средства. Примечание: Следует избегать только тех продуктов, в состав которых входит лоперамид.
- Продукты, содержащие салицилаты. К ним относятся пепто-бисмол и аналогичные противодиарейные препараты на основе висмута, аспирин и ибупрофен (например, Адвил). Салицилаты могут усилить кровотечение из кишечника. Кроме того, салицилаты связаны с синдромом Рея, редким, но серьезным заболеванием у детей.
Лекарства от диареи, отпускаемые по рецепту, могут быть вредными при назначении человеку с инфекцией E. coli . Врач может прописать одно из этих лекарств, если он или она не знает, что E. coli вызвала диарею. Обязательно обсудите свои симптомы со своим врачом. Обмен информацией важен для постановки правильного диагноза вашего состояния.
Избегайте приема этих лекарств, отпускаемых по рецепту, если у вас есть или вы думаете, что у вас инфекция E. coli :
- Дифеноксин с атропином (Мотофен)
- Дифеноксилат с атропином (ломотил)
- Лоперамид (имодиум, отпускаемый по рецепту)
Домашнее лечение
Домашнее лечение инфекционных заболеваний E.coli состоит в том, чтобы чувствовать себя комфортно и предотвращать распространение бактерий. Если вы не инфицированы, примите меры для предотвращения заражения.
Если вы считаете, что вы или кто-то из ваших подопечных инфицированы E. coli , немедленно обратитесь к врачу. Не лечите симптомы диареи какими-либо лекарствами, отпускаемыми без рецепта или по рецепту.
Домашнее лечение диареи или кровавой диареи, вызванной инфекцией
E. coli- Не используйте противодиарейные препараты, отпускаемые без рецепта, если у вас диарея с кровью или без крови, которая, как вы подозреваете, может быть вызвана E.coli инфекция. Эти продукты включают Imodium и Maalox Anti-Diarrheal. Не принимайте другие лекарства, оставшиеся после перенесенной болезни.
- Часто делайте небольшие глотки воды или напитка для регидратации, чтобы восполнить потерю жидкости и предотвратить обезвоживание. Поскольку обезвоживание может быть более опасным для младенцев, позвоните своему врачу, если вы считаете, что у вашего ребенка может быть обезвоживание. Ваш желудок не может обрабатывать слишком много жидкости за один раз. Обратитесь за медицинской помощью, если у вас появятся признаки умеренного обезвоживания, в том числе:
- Появление сухости во рту.
- Глаза, которые не слезятся.
- Низкий диурез.
- Легкомысленность.
Особенно у детей и взрослых в возрасте 65 лет и старше обратите внимание на симптомы серьезных проблем с кровью и почками, такие как лихорадка, слабость, бледность кожи или выделение небольшого количества мочи. При появлении любого из этих симптомов немедленно обратитесь к врачу .
Советы по защите от заражения
E. coli через зараженную пищу и воду- Приготовьте говяжий фарш при температуре не менее 160 ° F (71 ° C).Говяжий фарш следует готовить до тех пор, пока не исчезнет весь розовый цвет, но не полагайтесь только на цвет. Проверяйте температуру термометром для мяса. Разрежьте ресторан и домашние гамбургеры, чтобы они были полностью приготовлены. Соки должны быть прозрачными или желтоватыми, без следов розового. Никогда не ешьте сырой или недоваренный говяжий фарш.
- При приготовлении пищи:
- Часто мойте руки горячей мыльной водой, особенно после работы с сырым мясом.
- Всегда мойте инструменты для приготовления пищи, разделочные доски, посуду, столешницы и посуду горячей мыльной водой сразу после того, как они соприкоснулись с сырым мясом.Не кладите приготовленное мясо обратно на тарелку, на которой находилось сырое мясо, если тарелка не была тщательно вымыта водой с мылом и высушена.
- Используйте отдельные разделочные доски для сырого мяса и других продуктов.
- Храните сырое мясо, птицу и морепродукты отдельно от овощей, фруктов, хлеба и других продуктов, которые уже были приготовлены для употребления в пищу.
- Используйте только пастеризованное молоко, молочные и соковые продукты. Проверьте этикетку продукта на наличие слова «пастеризованный».«Сок из концентрата такой же, как и пастеризованный.
- Используйте только очищенную (хлорированную) питьевую воду.
- Путешественникам в страны, где водоснабжение может быть небезопасным, следует быть особенно осторожными, чтобы не класть лед в напитки и не пить воду из-под крана. Вся употребляемая вода должна быть кипяченой или разлитой по бутылкам. Ешьте горячие блюда. Избегайте сырых фруктов и овощей, кроме тех, с кожицы которых вы чистите сами.
Советы по предотвращению передачи
E.coli бактерий- Часто мойте руки и всегда мойте их после дефекации или смены подгузников. Если в вашем доме несколько ванных комнат, ограничьте использование инфицированного человека только одной ванной.
- Тщательно утилизируйте загрязненные подгузники и стул. Если есть подозрение на инфекцию у маленького ребенка, используйте одноразовые подгузники вместо тканевых, пока болезнь не пройдет.
- Взрослые должны следить за тем, чтобы дети, страдающие диареей, тщательно мыли руки после посещения туалета.Дети, инфицированные E. coli , должны избегать контакта с другими детьми, особенно во время плавания.
- Вымойте ручки унитазов и раковин антибактериальным очистителем.
- Людям, у которых была диагностирована инфекция E. coli , не следует обращаться с едой или работать в детском саду или другом учреждении до тех пор, пока у них не будет отрицательного результата теста на бактерии в двух образцах стула. Если вы принимали какой-либо антибиотик, образец стула следует взять как минимум через 48 часов после приема последней дозы.
- Хлорированная вода в плавательных бассейнах и гидромассажных ваннах.
Список литературы
Консультации по другим работам
- Американская педиатрическая академия (2015). Диарея, вызванная Escherichia coli (включая гемолитико-уремический синдром). В DW Kimberlin et al., Eds., Red Book: 2015 Report of the Committee on Infectious Diseases, 30th ed., Pp. 343–347. Деревня Элк-Гроув, Иллинойс: Американская академия педиатрии.
- Procop GW, Cockerill F III (2001). Энтерит, вызываемый видами Escherichia coli и Shigella и Salmonella. В WR Wilson et al., Под ред., Current Diagnosis and Treatment in Infectious Diseases, pp. 548–556. Нью-Йорк: Макгроу-Хилл.
Кредиты
Текущий по состоянию на: 23 сентября 2020 г.
Автор: Healthwise Staff
Медицинский обзор:
E.Грегори Томпсон, врач-терапевт
Кэтлин Ромито, доктор медицины, семейная медицина
Адам Хусни, доктор медицины, семейная медицина
Элизабет Т. Руссо, врач-терапевт
В. Дэвид Колби IV, магистр, доктор медицинских наук, FRCPC – инфекционное заболевание
По состоянию на: 23 сентября 2020 г.
Автор: Здоровый персонал
Медицинское обозрение: E.Грегори Томпсон, врач-терапевт и Кэтлин Ромито, доктор медицины, семейная медицина и Адам Хусни, доктор медицины, семейная медицина, Элизабет Т. Руссо, врач-терапевт, и В. Дэвид Колби IV, магистр медицины, доктор медицинских наук, FRCPC – инфекционные заболевания
.


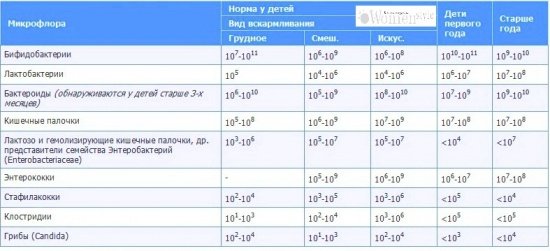
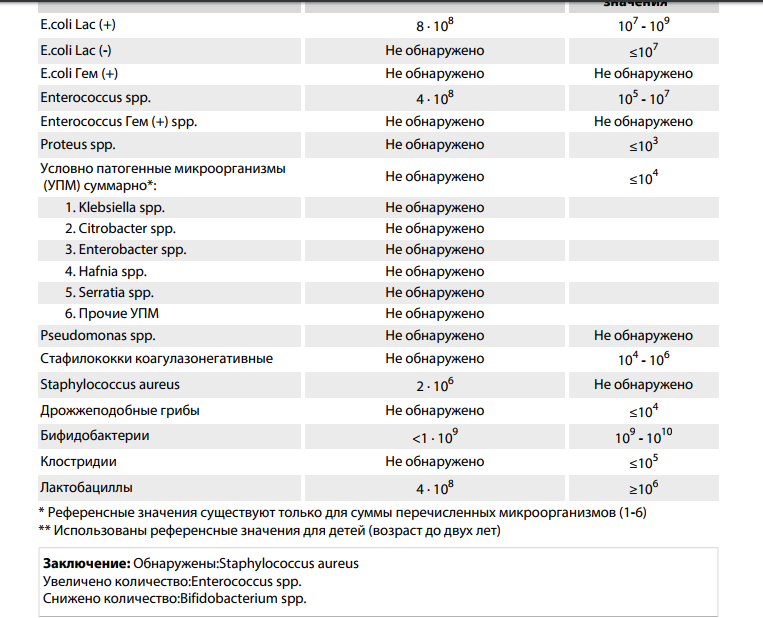
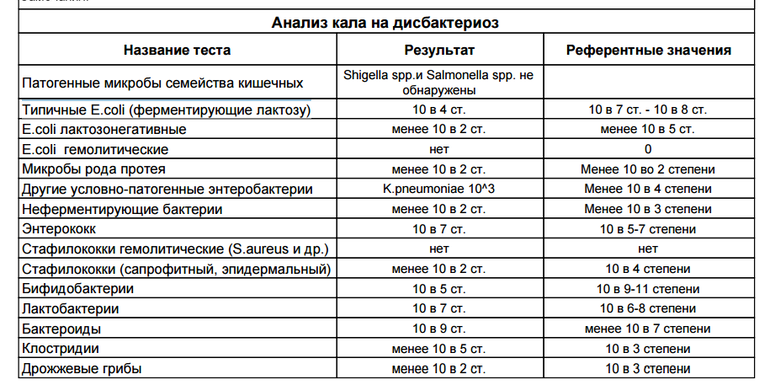 Зачастую они имеют мешковидную форму. Это заболевание нарушает процесс нормальной моторики кишечника.
Зачастую они имеют мешковидную форму. Это заболевание нарушает процесс нормальной моторики кишечника.