Эрадикация это в медицине: Эрадикация Нelicobacter pylori – пути достижения эффективности | Лоранская И.Д., Степанова Е.В., Ракитская Л.Г., Мамедова Л.Д.
Эрадикация Нelicobacter pylori – пути достижения эффективности | Лоранская И.Д., Степанова Е.В., Ракитская Л.Г., Мамедова Л.Д.
Представлены данные о хеликобактериозе, побочных эффектах эрадикационной терапии Нelicobacter (Н.) pylori, адъювантном варианте эрадикации.
Эрадикационная терапия не всегда является успешной, что сопряжено с растущей резистентностью штаммов Н. pylori к антибактериальным препаратам, а также с низкой комплаентностью пациентов, прекращением терапии из-за развития побочных эффектов. Использование пробиотических препаратов, в частности Lactobacillus (L.) reuteri, позволяет улучшить переносимость эрадикационной терапии, а также снизить количество и активность Н. pylori.
Применение штамма L. reuteri, обладающего выраженной антихеликобактерной активностью, в качестве адъюванта антихеликобактерной терапии представляется перспективным.
Н. pylori – неинвазивный микроб, колонизирующий преимущественно поверхностные слои слизистой оболочки (CO) желудка.
Попадая в желудок, бактерия продуцирует уреазу, которая расщепляет мочевину желудочного содержимого, вследствие чего образуются аммиак и СО2. Аммиак способствует защите микроба от соляной кислоты и вызывает повреждение СО желудка. Выделяя фермент муциназу, Н. pylori разрушает белок муцин, содержащийся в желудочной слизи, в результате чего создаются условия для проникновения бактерии через слой слизи и адгезии ее на эпителий СО желудка [4, 7].
Аммиак способствует защите микроба от соляной кислоты и вызывает повреждение СО желудка. Выделяя фермент муциназу, Н. pylori разрушает белок муцин, содержащийся в желудочной слизи, в результате чего создаются условия для проникновения бактерии через слой слизи и адгезии ее на эпителий СО желудка [4, 7].
В микробиоме желудка Н. pylori является «хозяином», хотя эффект его доминирования неясен [25]. Существует 196 штаммов Н. pylori [24]. Маркерами вирулентности Н. pylori могут служить такие гены, как cagА (способствующий индукции воспаления и секреции цитотоксичных веществ), vacА (продуцирующий вакуолизирующий цитотоксин), iceА (наиболее токсичен ice А1, способствующий адгезии Н. pylori на эпителиоцитах СО желудка) [5, 10].

Н. pylori-инфекция является наиболее частой причиной (60–75%) развития неатрофического антрального гастрита, который постепенно (в течение 15–18 лет) может эволюционировать в антральный атрофический хронический гастрит, распространяться в антрокардиальном направлении, поражая фундальный отдел желудка, а в части случаев вызывать развитие мультифокального атрофического хронического гастрита, появление в СО желудка очагов кишечной метаплазии, эпителиальной дисплазии, неоплазии (предрака). С Н. рylori ассоциированы язвенная болезнь, реже – рак желудка и МАLТ-лимфома желудка [10, 23].
Протеазы, высвобождающиеся полиморфноядерными лейкоцитами в ответ на инфекцию Н. pylori, разрушают эпителий желез СО желудка, что в конце концов ведет к развитию атрофии [6, 15]. Кроме того, инфекция Н. pylori способствует выработке антител, которые перекрестно реагируют с париетальными клетками и могут вызвать их атрофию. В свою очередь, ахлоргидрия способствует размножению бактерий в желудке, трансформирующих нитраты в нитриты и приводящих к образованию N-нитрозосоединений, обладающих канцерогенными свойствами.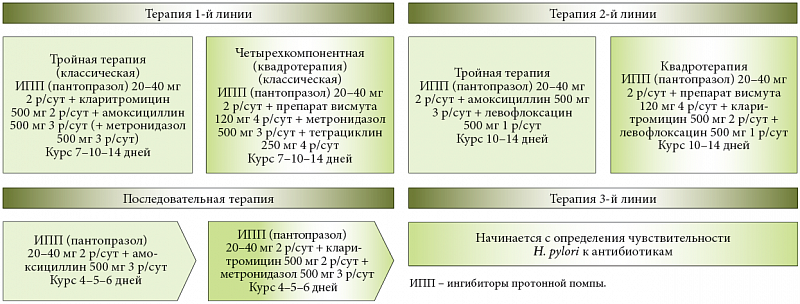 Под действием Н. pylori изменяется баланс между процессами пролиферации и апоптоза, в результате чего нарушается физиологическая регенерация СО желудка, увеличивается образование свободных радикалов, аммиака, оксида азота, также обладающих канцерогенными свойствами. При длительном существовании инфекции Н. pylori возможны мутации гена р53, обеспечивающего противоопухолевую защиту, в результате чего могут появляться эпителиальные клетки с поврежденной ДНК и прогрессировать явления дисплазии эпителия. Инфекция Н. pylori приводит к снижению содержания аскорбиновой кислоты, β-каротина, α-токоферола, обеспечивающих противоопухолевую защиту [6, 14]. В 1994 г. Международным агентством по изучению рака (IARC) Н. pylori отнесен к канцерогенам 1 класса («определенно доказанным»). Наличие инфекции Н. pylori повышает риск развития рака желудка в 4–20 раз [6, 19].
Под действием Н. pylori изменяется баланс между процессами пролиферации и апоптоза, в результате чего нарушается физиологическая регенерация СО желудка, увеличивается образование свободных радикалов, аммиака, оксида азота, также обладающих канцерогенными свойствами. При длительном существовании инфекции Н. pylori возможны мутации гена р53, обеспечивающего противоопухолевую защиту, в результате чего могут появляться эпителиальные клетки с поврежденной ДНК и прогрессировать явления дисплазии эпителия. Инфекция Н. pylori приводит к снижению содержания аскорбиновой кислоты, β-каротина, α-токоферола, обеспечивающих противоопухолевую защиту [6, 14]. В 1994 г. Международным агентством по изучению рака (IARC) Н. pylori отнесен к канцерогенам 1 класса («определенно доказанным»). Наличие инфекции Н. pylori повышает риск развития рака желудка в 4–20 раз [6, 19].
Известно, что некоторые популяции с высоким уровнем инфицирования Н. pylori (в странах Восточной Азии) имеют высокую заболеваемость раком желудка, тогда как другие высокоинфицированные (в странах Южной и Западной Африки) имеют низкую частоту развития рака. Этот феномен назван «африканской загадкой» и может быть объяснен разностью генотипов Н. pylori, особенно cagА и vacА [25].
Этот феномен назван «африканской загадкой» и может быть объяснен разностью генотипов Н. pylori, особенно cagА и vacА [25].
Основой лечения заболеваний, ассоциированных с Н. pylori, является эрадикация этой инфекции. Известно, что риск возникновения пептической язвы и рака желудка возрастает с повышением уровня инфицирования Н. pylori, следовательно, подавление Н. pylori-инфекции снижает риск этих заболеваний [20]. Кроме того, эрадикация Н. рylori признана наиболее перспективной стратегией снижения заболеваемости раком желудка [1, 21].
Последнее согласительное совещание «Маастрихт-4» (2010 г.) ограничило число применяемых схем эрадикации инфекции Н. pylori до 5:
– стандартная 3-компонентная терапия (ингибитор протонной помпы (ИПП) в стандартной дозе 2 р./сут + амоксициллин по 1000 мг 2 р./сут + кларитромицин 500 мг 2 р./сут в течение 7–14 дней;
– 4-компонентная терапия с препаратами висмута (ИПП в стандартной дозе 2 р.
– последовательная терапия (в течение первых 5 дней – ИПП в стандартной дозе 2 р./сут + амоксициллин по 1000 мг 2 р./сут, следующие 5 дней – ИПП в стандартной дозе 2 р./сут + кларитромицин 500 мг 2 р./сут + метронидазол 500 мг 3 р./сут;
– 4-компонентная терапия без препаратов висмута (ИПП в стандартной дозе 2 р./сут + амоксициллин 1000 мг 2 р./сут + кларитромицин 500 мг 2 р./сут + еще один антибактериальный препарат, например метронидазол 500 мг 3 р./сут) в течение 10–14 дней;
– 3-компонентная терапия с левофлоксацином (ИПП в стандартной дозе 2 р./сут + амоксициллин 1000 мг 2 р./сут + левофлоксацин 500 мг 2 р./сут) в течение 10–14 дней.
В зонах с низкой (<10%) резистентностью штаммов Н. pylori к кларитромицину (в России этот показатель составляет 7,6%) в качестве схемы первой линии назначают стандартную 3-компонентную терапию, последовательную или 4-компонентную терапию с препаратами висмута.
В зонах с высокой резистентностью к кларитромицину в качестве режимов эрадикации первой линии применяют 4-компонентные схемы с препаратами висмута, последовательную 4-компонентную терапию без препаратов висмута. В качестве терапии второй линии применяется 3-компонентная схема с левофлоксацином, а схема эрадикации третьей линии формируется с учетом результатов определения чувствительности Н. pylori к антибиотикам.
При наличии аллергии к пенициллину в зонах с низкой резистентностью к кларитромицину назначают схему с ИПП, кларитромицином и метронидазолом, в зонах с высокой резистентностью к кларитромицину – 4-компонентные схемы с препаратами висмута.
С целью повышения эффективности стандартной тройной терапии можно использовать следующие меры: назначение удвоенной (по сравнению со стандартной) дозы ИПП, увеличение продолжительности стандартной тройной терапии с 7 до 10–14 дней, добавление к стандартной тройной терапии висмута трикалия дицитрата, добавление к стандартной тройной терапии пробиотика Saсcharomyces boulardii и контроль за соблюдением пациентом режима приема лекарственных препаратов.
Контроль эрадикации следует проводить не ранее чем через 4 нед. после окончания терапии, используя для этого уреазный дыхательный тест (УДТ) или определение антигена в кале [6].
С открытием Н. pylori в 1983 г. австралийскими учеными B.J. Marshall и R. Warren и провозглашением стратегии на тотальную эрадикацию в соответствии с известным постулатом D.Y. Graham («хороший хеликобактер – это мертвый хеликобактер») этот процесс стал лавинообразно нарастать [10]. Однако эффективность эрадикации Н. pylori-инфекции в последние годы снизилась до 80% (а стандартная 3-компонентная схема эрадикации достигает успеха лишь у 70%) [11, 17, 28], в основном за счет увеличения резистентности штаммов Н. pylori к антибиотикам, а также нежелательных лекарственных реакций, которые приводят к низкой комплаентности, ухудшению качества жизни пациентов и самостоятельному прекращению лечения [27, 28].
Побочные эффекты лекарственных препаратов, используемых для эрадикации Н. pylori, приведены в таблице 1.
pylori, приведены в таблице 1.
В мире проведено более 30 исследований в период с 1993 по 2009 г., показавших общую устойчивость Н. pylori к амоксициллину, кларитромицину, метронидазолу, тетрациклину, фуразолидону, левофлоксацину. Уровни устойчивости Н. pylori к антибиотикам различны в разных странах. Частично это определяется географическими особенностями. В Европе наблюдается большая разница между южной и северной частями (например, устойчивость к кларитромицину у взрослого населения южно-европейских стран более 35%, что на 20% выше по сравнению с северными европейскими странами). В США устойчивость Н. pylori к кларитромицину составила 10–15%, к метронидазолу – 20–40%, а к амоксициллину отмечалась редко. В Китае за период с 2000 по 2009 г. уровень устойчивости Н. pylori к метронидазолу вырос с 12,8 до 56,6%, к кларитромицину – с 12,8 до 23,8%, тогда как к амоксициллину снизился с 2,1 до 0,3%. В Японии уровень устойчивости Н. pylori к кларитромицину возрос с 7 до 15,2%, к метронидазолу – до 69%, а к амоксициллину приблизился к 0%.
Главный механизм устойчивости Н. pylori – это точечные мутации бактериальной хромосомы, вследствие чего значительно изменяется фенотип бактерии. Другой предполагаемый механизм – снижение проницаемости бактериальной клетки к антибиотику. Нужно отметить, что Н. pylori заселяет труднодоступные для терапии участки СО. Первое препятствие для биодоступности антибиотика – кислота полости желудка (например, кларитромицин распадается под действием кислого желудочного содержимого и пепсина; повышение интрагастрального рН при помощи ИПП способствует положительному влиянию на эрадикацию Н. pylori). Второй барьер, который должен преодолеть антибиотик, – пристеночная слизь. Кроме того, антибактериальный препарат должен достичь высокой концентрации на достаточное время для уничтожения бактерии, где бы она ни находилась. Перспективна попытка преодолеть устойчивость Н. pylori к антибиотикам путем выявления генетических механизмов устойчивости Н. pylori [25].
Антибиотико-ассоциированная диарея (ААД) является одним из наиболее частых осложнений эрадикационной терапии, наблюдается у 5–39% пациентов в зависимости от популяции, типа антибиотика. Повышен риск развития ААД у пациентов старше 65 лет, при применении антибиотиков широкого спектра действия, у находящихся в условиях стационара [29]. Под термином «антибиотико-ассоциированная диарея» понимают необъяснимую другими причинами диарею, развившуюся в связи с приемом антибиотиков (во время их приема или в первые 2 мес., чаще в течение 2–3 нед. после окончания приема). Спектр клинических проявлений ААД широк: от легкой диареи до псевдомембранозного колита. Антибактериальные препараты способны разрушать нормальные колонии кишечной микрофлоры, изменять карбогидратный метаболизм и антимикробную активность кишки, приводя к осмотической диарее и к диарее, вызванной патогенными бактериями. Наибольший риск развития ААД наблюдается на фоне приема амоксициллина с клавулановой кислотой и цефиксима. Ампициллин, амоксициллин, клиндамицин, линкомицин, цефалоспорины II и III поколений – препараты, при приеме которых наиболее часто наблюдается ААД, ассоциированная с Clostridium difficile.
Повышен риск развития ААД у пациентов старше 65 лет, при применении антибиотиков широкого спектра действия, у находящихся в условиях стационара [29]. Под термином «антибиотико-ассоциированная диарея» понимают необъяснимую другими причинами диарею, развившуюся в связи с приемом антибиотиков (во время их приема или в первые 2 мес., чаще в течение 2–3 нед. после окончания приема). Спектр клинических проявлений ААД широк: от легкой диареи до псевдомембранозного колита. Антибактериальные препараты способны разрушать нормальные колонии кишечной микрофлоры, изменять карбогидратный метаболизм и антимикробную активность кишки, приводя к осмотической диарее и к диарее, вызванной патогенными бактериями. Наибольший риск развития ААД наблюдается на фоне приема амоксициллина с клавулановой кислотой и цефиксима. Ампициллин, амоксициллин, клиндамицин, линкомицин, цефалоспорины II и III поколений – препараты, при приеме которых наиболее часто наблюдается ААД, ассоциированная с Clostridium difficile.
Рост устойчивости Н. pylori к антибактериальным препаратам, увеличивающиеся сроки и побочные эффекты эрадикационной терапии свидетельствуют о необходимости разработки альтернативного метода лечения и способов профилактики [3, 12]. Ряд исследований показали, что пробиотики могут использоваться и усиливать эффект эрадикационной терапии, а также повысить комплаентность пациента. Предполагались следующие эффекты пробиотиков: улучшение переносимости антибактериальной терапии и уменьшение ее побочных эффектов, повышение уровня завершенности терапии, иммуномодулирующий, антибактериальный эффекты. Указывались возможные эффекты лактобацилл: усиление защитного барьера, снижение адгезии и ингибирование роста Н. pylori за счет выработки лактата, бактериоцинов; некоторые штаммы способны ингибировать уреазу Н. pylori [20, 28].
pylori к антибактериальным препаратам, увеличивающиеся сроки и побочные эффекты эрадикационной терапии свидетельствуют о необходимости разработки альтернативного метода лечения и способов профилактики [3, 12]. Ряд исследований показали, что пробиотики могут использоваться и усиливать эффект эрадикационной терапии, а также повысить комплаентность пациента. Предполагались следующие эффекты пробиотиков: улучшение переносимости антибактериальной терапии и уменьшение ее побочных эффектов, повышение уровня завершенности терапии, иммуномодулирующий, антибактериальный эффекты. Указывались возможные эффекты лактобацилл: усиление защитного барьера, снижение адгезии и ингибирование роста Н. pylori за счет выработки лактата, бактериоцинов; некоторые штаммы способны ингибировать уреазу Н. pylori [20, 28].
При проведении эрадикационной терапии Н. pylori с профилактической целью и в случае появления диареи назначают пробиотики. Точный механизм антидиарейного действия пробиотиков не установлен. Данные метаанализов исследований эффективности пробиотиков, проведенных в 2010–2011 гг., показали, что применение этой группы препаратов значительно ускоряет выздоровление пациентов при лечении диареи различного генеза, в т. ч. ААД [8, 29, 30].
Данные метаанализов исследований эффективности пробиотиков, проведенных в 2010–2011 гг., показали, что применение этой группы препаратов значительно ускоряет выздоровление пациентов при лечении диареи различного генеза, в т. ч. ААД [8, 29, 30].
В схемах эрадикации вместе с антибиотиками могут применяться пробиотики как средства адъювантной терапии, что отражено в Маастрихтском соглашении [6]. При условии кислотоустойчивости штамма (доказано для Saсcharomyces boulardii, Lactobacillus ramnosus GG, L. reuteri, Lactobacillus acidophilus) пробиотики могут оказывать прямое антагонистическое действие в отношении Н. pylori, конкурировать с ним за питательные вещества и рецепторы адгезии, вырабатывать метаболиты, подавляющие рост Н. pylori (летучие жирные кислоты, молочную кислоту, перекись водорода, пироглутамат). Многие штаммы пробиотических культур вырабатывают антибактериальные субстанции, ингибирующие рост других микроорганизмов; Lactobacilli и Bifidobacteria выделяют бактериоцины, которые способны ингибировать рост Н. pylori и уменьшить его адгезию к эпителиоцитам желудка. Кроме того, пробиотики играют важную роль в стабилизации барьерной функции желудка и уменьшают воспаление его СО [20].
pylori и уменьшить его адгезию к эпителиоцитам желудка. Кроме того, пробиотики играют важную роль в стабилизации барьерной функции желудка и уменьшают воспаление его СО [20].
Группа немецких исследователей выбрала штамм L. reuteri путем скрининга сотен штаммов Lactobacilli большой коллекции культур. Этот специфический штамм принадлежит к группе Lactobacillus fermentum. L. reuteri специфически коагрегирует с Н. pylori in vitro и в искусственном желудочном соке и не оказывает негативного влияния на другие бактерии симбиотической кишечной флоры. Специфические связи закрывают поверхностные структуры Н. pylori и уменьшают его подвижность, в результате чего связанный патоген не может присоединиться к СО желудка и выводится из него [3].
L. reuteri были обнаружены как в грудном молоке человека, так и в микрофлоре желудочно-кишечного тракта. Было доказано, что штаммы L. reuteri благоприятно влияют на здоровье, в т. ч. при коликах у младенцев, желудочных расстройствах у детей и пищевой непереносимости у недоношенных детей [16].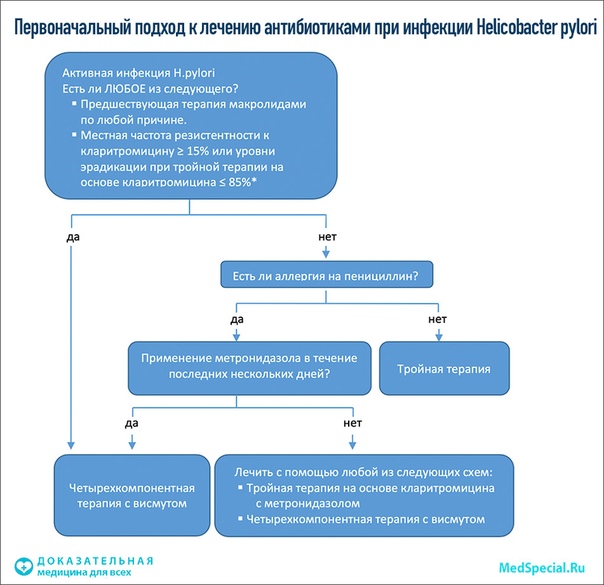
Микробиологи из Organobalance GmbH (Германия) создали оригинальный штамм L. reuteri DSMZ17648, а затем было начато его производство в концерне Lonza Group Ltd. (Швейцария) под названием Pylopass™. Данный штамм бактерий, имеющий статус GRAS (Generally Recognized AsSafe – абсолютно безопасный), одобрен Управлением по надзору за качеством пищевых продуктов и лекарственных средств США (FDA – Foodand Drug Administration). Технология производства этого штамма принципиально отличается от производства других пробиотиков – вместо лиофильной сушки используется сушка путем распыления лактобацилл, затем они подвергаются ферментации и инактивации, после которых выдерживают изменения условий окружающей среды, в т. ч. низкие рН, и остаются высокостабильными при хранении. Данный кислотоустойчивый штамм специально «обучен» распознавать поверхностные рецепторы Н. pylori и прикрепляться к ним, создавая так называемые ко-агрегаты, которые затем естественным путем выводятся из организма. Pylopass™ коагрегирует с Н. pylori, позволяя уменьшить общую бактериальную обсемененность желудка, что снижает риск развития гастрита, язвы желудка и двенадцатиперстной кишки. Pylopass™ связывается исключительно с Н. pylori и не влияет на другую микрофлору пищеварительного тракта [9].
Pylopass™ коагрегирует с Н. pylori, позволяя уменьшить общую бактериальную обсемененность желудка, что снижает риск развития гастрита, язвы желудка и двенадцатиперстной кишки. Pylopass™ связывается исключительно с Н. pylori и не влияет на другую микрофлору пищеварительного тракта [9].
H. Mehling et al. провели пилотное слепое плацебо-контролируемое исследование с участием 22 H. рylori-позитивных пациентов, у которых не было гастроинтестинальных симптомов, но они имели положительный результат С13 УДТ выше порога 12‰, что указывало на умеренно высокую колонизацию Н. pylori. Уровень обсеменения Н. pylori в динамике определялся с помощью С13 УДТ после 14 дней приема препарата, а также через 6, 12 и 24 нед. после окончания приема препарата. Всем пациентам назначалась L. reuteri DSMZ17648 Pylopass™ в суточной дозе 2х1010 КОЕ, контрольную группу составили Н. pylori-позитивные волонтеры, которые получали плацебо. В опытной группе наблюдалось значительное снижение концентрации Н. pylori в динамике (р<0,05). У пациентов не было отмечено нежелательных лекарственных эффектов в течение 14 дней приема плацебо или L. reuteri DSMZ17648 Pylopass™. Результаты исследования подтвердили потенциал Pylopass™ в качестве нового способа снижения нагрузки Н. pylori [9, 22].
pylori в динамике (р<0,05). У пациентов не было отмечено нежелательных лекарственных эффектов в течение 14 дней приема плацебо или L. reuteri DSMZ17648 Pylopass™. Результаты исследования подтвердили потенциал Pylopass™ в качестве нового способа снижения нагрузки Н. pylori [9, 22].
В 2014 г. C. Holz et al. опубликовали результаты углубленного пилотного плацебо-контролируемого исследования применения L. reuteri DSMZ17648 Pylopass™ у лиц, инфицированных Н. pylori и не имевших симптомов заболевания. Исследование 364 пациентов (из них 47 пар близнецов) показало существенное снижение уровня колонизации Н. pylori (подтвержденное С13 УДТ) после приема в течение 14 дней пищевой добавки с L. reuteri DSMZ 17648 (в ежедневной дозе 1 капсула – 2х1010 нежизнеспособных лиофилизированных клеток) [3]. С повышением уровня колонизации эффект уменьшения количества Н. pylori, вызванный приемом L. reuteri DSMZ17648 Pylopass™, оказывался сильнее. Этот эффект уменьшения количества Н. pylori продолжался и по окончании лечения. Потенциальный эффект плацебо был значительно ниже, чем действие L. reuteri DSMZ17648 Pylopass™. В ходе исследования не было зарегистрировано каких-либо изменений качества жизни, например, физической деятельности, питания или здоровья, о которых обследуемые сообщали в анкете. Никаких нежелательных лекарственных реакций не было отмечено ни в одной группе исследования [18].
Потенциальный эффект плацебо был значительно ниже, чем действие L. reuteri DSMZ17648 Pylopass™. В ходе исследования не было зарегистрировано каких-либо изменений качества жизни, например, физической деятельности, питания или здоровья, о которых обследуемые сообщали в анкете. Никаких нежелательных лекарственных реакций не было отмечено ни в одной группе исследования [18].
Противомикробное действие объяснялось не только прямым воздействием на Н. pylori, но и снижением его уреазной активности. Авторы предположили, что уничтожение или замедление роста количественных показателей инфицирования может использоваться в качестве средства профилактики, в т. ч. долговременной (т. к. снижение уровня обсемененности Н. pylori наблюдалось еще 4–6 нед. после лечения) [3]. Это исследование подтвердило, что даже лиофилизированные клетки L. reuteri обладают выраженной антихеликобактерной активностью, что существенно облегчает условия хранения и делает данный вид пробиотика чрезвычайно перспективным. У лиц, инфицированных Н. pylori, без абсолютных показаний к эрадикации (т. е. при отсутствии пептической язвы, рака и МАLТ-лимфомы желудка) назначение L. reuteri DSMZ17648 представляется обоснованным и эффективным [2].
У лиц, инфицированных Н. pylori, без абсолютных показаний к эрадикации (т. е. при отсутствии пептической язвы, рака и МАLТ-лимфомы желудка) назначение L. reuteri DSMZ17648 представляется обоснованным и эффективным [2].
В конце 2014 г. в России появился продукт L. reuteri DSMZ17648 Pylopass™ под названием ХЕЛИНОРМ® в капсулах по 200 мг. Один грамм этого средства содержит около 1 трлн специально обработанных микробных клеток. Продолжительность курса терапии продуктом ХЕЛИНОРМ® составляет 4 нед. В день достаточно принимать всего 1 капсулу, которую рекомендуется проглатывать, не вскрывая, во время еды, запивая небольшим количеством воды. Благодаря высокой безопасности ХЕЛИНОРМ® может назначаться детям старше 6 лет. ХЕЛИНОРМ® можно назначать в виде монотерапии или в комплексной схеме антихеликобактерного лечения для повышения его эффективности.
Пробиотики, как правило, считаются безопасными агентами для применения, а ряд штаммов уже получили признание для использования в клинической практике. Введение безопасных пробиотиков в качестве адъюванта антихеликобактерной терапии представляется весьма перспективным. Дальнейшие исследования механизмов прямых и косвенных эффектов влияния пробиотиков на Н. pylori могут помочь не только оптимизировать лечение, но и способствовать новому пониманию некоторых аспектов патогенеза «взаимоотношений» Н. pylori с человеком. Новый продукт ХЕЛИНОРМ® используется для альтернативного лечения, не увеличивает резистентность Н. pylori к антибиотикам и снижает уровень колонизации этим бактериальным агентом [9].
Введение безопасных пробиотиков в качестве адъюванта антихеликобактерной терапии представляется весьма перспективным. Дальнейшие исследования механизмов прямых и косвенных эффектов влияния пробиотиков на Н. pylori могут помочь не только оптимизировать лечение, но и способствовать новому пониманию некоторых аспектов патогенеза «взаимоотношений» Н. pylori с человеком. Новый продукт ХЕЛИНОРМ® используется для альтернативного лечения, не увеличивает резистентность Н. pylori к антибиотикам и снижает уровень колонизации этим бактериальным агентом [9].
.
Антихеликобактерная терапия | Клиника «Медлайн» в Кемерово
Helicobacter pylori — один из наиболее «популярных» микроорганизмов, широко изучаемый учеными из многих стран и известный как микроб. Попадание Helicobacter pylori в организм человека приводит к развитию язвенной болезни и гастрита, может способствовать формированию злокачественных новообразований желудка.
Установлено, что H. pylori выявляется приблизительно у 30-35% населения в детском возрасте и 50-85% — у взрослых. При наличии показаний врач-гастроэнтеролог назначает проведение эрадикационной антихеликобактерной терапии.
pylori выявляется приблизительно у 30-35% населения в детском возрасте и 50-85% — у взрослых. При наличии показаний врач-гастроэнтеролог назначает проведение эрадикационной антихеликобактерной терапии.
Источники и пути передачи возбудителя
Источником инфекции является человек. Жизнеспособные штаммы H.pylori выделены из содержимого желудка, двенадцатиперстной кишки, пищевода, фекалий людей с активным гастритом и язвенной болезнью. Наиболее изученным является контактный механизм передачи инфекции от больного человека или бактерионосителя орально-оральным или фекально-оральным путем. Возможен также механизм передачи инфекции через грязные руки.
Факторы передачи возбудителя
Наиболее вероятные факторы передачи — вода и пища. H.pylori способен выживать в охлажденной речной воде в течение нескольких дней. Имеются данные о возможности выживания H.pylori в зубном налете, слюне, рвотных массах и желудочном соке.
Группы риска
Факторами риска развития хеликобактерной инфекции являются: перенаселенность жилых помещений, общие кровати, отсутствие достаточного количества горячей воды. Здесь же – семьи, где есть заболевший, а также медицинский персонал гастроэнтерологических клиник (хирурги, эндоскописты, обслуживающий персонал), контингенты специнтернатов, психиатрических стационаров, детских домов.
Здесь же – семьи, где есть заболевший, а также медицинский персонал гастроэнтерологических клиник (хирурги, эндоскописты, обслуживающий персонал), контингенты специнтернатов, психиатрических стационаров, детских домов.
Диагностика хеликобактерной инфекции в клинике «Медлайн»
Диагностика Helicobacter pylori выполняется при помощи инвазивных и неинвазивных методик (инвазивные тесты (биопсия) и неинвазивные тесты) до лечения – первичная диагностика, и после проведения противохеликобактерной терапии — контроль эффективности выбранной схемы лечения.
Лечение хеликобактерной инфекции
Лечение хеликобактерной инфекции называется эрадикационной терапией. Основным принципом терапии является принцип эрадикации Н.pylori.
Эрадикация – полное уничтожение вегетативных и кокковых форм Н.pylori в желудке и двенадцатиперстной кишке человека.
Показания к проведению эрадикационной терапии:
- Язвенная болезнь желудка или 12-перстной кишки в стадии обострения или ремиссии, включая осложненную язвенную болезнь
- MALT-лимфома
- Атрофический гастрит
- Состояние после резекции желудка по поводу рака
- Ближайшим родственникам больных раком желудка – по желанию пациента (после подробной консультации врача)
Кроме того, проведение эрадикационной терапии целесообразно по следующим показаниям:
- Функциональная диспепсия
- Гастроэзофагеальная рефлюксная болень (ГЭРБ)
Требования, предъявляемые к антихеликобактерной терапии:
- Способность уничтожить бактерию Н.
 pylori как минимум в 80% случаев
pylori как минимум в 80% случаев - Не вызывать вынужденной отмены терапии врачом, вследствие побочных эффектов (допустимо менее чем в 5% случаев) или прекращения пациентом приёма лекарств по схеме, рекомендованной врачом
- Эффективность при продолжительности курса не более 7-14 дней
Принципы антихеликобактерной терапии:
- Использование многокомпонентных схем лечения — тройная терапия или квадротерапия
- Строгое соблюдение выбранной схемы лечения
- Прием выбранных лекарственных препаратов в определенных дозах и при определённой продолжительности терапии
- Учёт совместимости (синергизма) лекарственных препаратов
Эффективная эрадикация Helicobacter pylori: от теории к практике
Авторы: Ю.М. Степанов
Статья в формате PDF.
Cегодня Helicobacter pylori (НР) считается самой распространенной инфекцией человека и наиболее изученным ульцерогенным и канцерогенным фактором. Необходимость эрадикации НР уже не вызывает сомнений, хотя еще несколько лет назад она не считалась обязательной для всех носителей этой бактерии. Что касается непосредственно методов эрадикации, то они время от времени обновляются.
Наиболее распространена инфекция НР у жителей стран Азии и Африки (80-90%), а также Восточной Европы и Южной Америки (40-70% популяции). В экономически благополучных странах Европы и Северной Америки указанная инфекция диагностирована у 25-30% населения. Распространенность НР среди украинской популяции достигает 80%. Еще в 1994 г. Международное агентство по изучению рака, которое входит в структуру Всемирной организации здравоохранения, признало эту инфекцию канцерогеном 1-го порядка из-за ее эпидемиологической связи с аденокарциномой желудка и MALT-лимфомой (mucosa-associated lymphoid tissue lyphoma) желудка (Свинцицкий А. С., Соловьева Г. А., 2015; Ткач С. М., 2015).
С., Соловьева Г. А., 2015; Ткач С. М., 2015).
Инфекция Helicobacter pylori и канцерогенез
В Украине ежегодно рак желудка (РЖ) впервые диагностируется примерно у 13 тыс. пациентов, причем у 61,8% из них – в III и IV стадиях; в течение года умирают 58,1% больных с впервые диагностированным РЖ (Ткач С. М., 2015). Доказанными факторами риска развития РЖ являются НР-инфекция, высокое содержание соли в рационе, пернициозная анемия, аденоматозные полипы, хронический атрофический гастрит, воздействие облучения и перенесенная резекция желудка. Результаты проспективных исследований свидетельствуют, что у больных, инфицированных НР, риск развития РЖ повышен в 3-6 раз.
Инфекция НР – практически единственный неблагоприятный фактор, воздействие на который способно реально уменьшить риск развития некардиального РЖ. Модель последовательной смены гистологических изменений в слизистой желудка при инфекции НР была описана Р. Correa около 15 лет назад и в настоящее время является общепризнанной. Так, в течение 30 лет у 50% инфицированных Н. рylori разовьется атрофия слизистой оболочки желудка, у 40% – кишечная метаплазия, у 8% – дисплазия и у 1-2% – аденокарцинома желудка (Свинцицкий А. С., Соловьева Г. А., 2015; Ткач С. М., 2015).
Так, в течение 30 лет у 50% инфицированных Н. рylori разовьется атрофия слизистой оболочки желудка, у 40% – кишечная метаплазия, у 8% – дисплазия и у 1-2% – аденокарцинома желудка (Свинцицкий А. С., Соловьева Г. А., 2015; Ткач С. М., 2015).
Основную роль в канцерогенезе играют штаммы НР, которые продуцируют цитотоксин CagA и вакуолизирующий токсин VacA. Высокоиммуногенный белок CagA, пептидогликан и другие факторы патогенности НР повреждают клетки эпителия и межклеточные контакты, стимулируют пролиферацию и воспаление посредством активации выработки интерлейкина‑8. В результате длительного хронического воспаления, характерного для НР-ассоциированного гастрита, нарушается система клеточного обновления, изменяется соотношение процессов апоптоза и пролиферации в пользу последней. Слизистая желудка становится уязвимой к действию мутагенных и канцерогенных факторов, и эпителий желудка в результате атрофии замещается метапластическим, диспластическим и наконец неопластическим.
Эрадикация НР снижает риск развития РЖ (уровень доказательности ІА, сильная рекомендация). Исследования показывают, что эрадикационная терапия снижает риск развития в будущем РЖ на 34%. Массовая эрадикация НР на уровне популяции снижает этот риск на 25% вместе с риском развития атрофического гастрита и пептических язв. НР-ассоциированный гастрит (морфологически подтвержденный с участками атрофии слизистой желудка) считается предраковым состоянием, поэтому важно выявлять НР-инфекцию и проводить ее эрадикацию как можно раньше, до развития интраэпителиальной неоплазии.
Исследования показывают, что эрадикационная терапия снижает риск развития в будущем РЖ на 34%. Массовая эрадикация НР на уровне популяции снижает этот риск на 25% вместе с риском развития атрофического гастрита и пептических язв. НР-ассоциированный гастрит (морфологически подтвержденный с участками атрофии слизистой желудка) считается предраковым состоянием, поэтому важно выявлять НР-инфекцию и проводить ее эрадикацию как можно раньше, до развития интраэпителиальной неоплазии.
В 2012 г. в журнале Endoscopy были опубликованы Европейские рекомендации по ведению предраковых состояний и изменений в желудке (Guidelines for the Management of Precancerous Conditions and Lesions in the Stomach – MAPS), разработанные Европейским обществом по изучению НР, Европейским эндоскопическим обществом и Европейским обществом патологов. В этих рекомендациях указаны две принципиальные позиции:
• пациенты с хроническим атрофическим гастритом и кишечной метаплазией должны рассматриваться как группа высокого риска развития РЖ;
• у пациентов группы высокого риска необходимо предотвращать такие исходы, как развитие дисплазии высокой степени и инвазивный РЖ.
В группе пациентов с предраковыми изменениями слизистой оболочки желудка до начала лечения эффективность эрадикации НР для профилактики РЖ остается недостаточной, такие больные нуждаются в эндоскопическом наблюдении. В этой связи у пациентов с предраковыми состояниями необходимо проводить стратификацию риска, основанную на тяжести и распространенности процесса по системам OLGY и OLGYM.
Вместе с тем даже при наличии атрофии и кишечной метаплазии желудочного эпителия можно добиться регресса этих гистологических изменений, проводя адекватную антихеликобактерную терапию (АХБТ). Недавно проведенный метаанализ 16 клинических исследований (Kong Y. G., 2014) обнаружил, что эрадикация НР приводит к статистически значимому регрессу атрофии слизистой оболочки как в теле, так и в антральном отделе желудка. Что касается регресса кишечной метаплазии после эрадикации HР, то он отмечается только в антральном отделе, но не в теле желудка.
Современные схемы эрадикационной терапии в свете V Маастрихтского консенсуса
В конце 2016 года в журнале Gut была опубликована официальная версия консенсуса Маастрихт V, в котором были пересмотрены некоторые позиции по АХБТ. В разделе «Лечение» положение № 1 гласит, что резистентность НР к антибиотикам (АБ) в мире демонстрирует тенденцию к постоянному росту. Например, резистентность НР к кларитромицину составляет 30% в Италии и Японии, 40% – в Турции, но только около 15% в Швеции и на Тайване. На этом основании в тех регионах земного шара, где уровень устойчивости НР к кларитромицину превышает 15%, не следует использовать стандартную трехкомпонентную схему с кларитромицином без предварительного определения чувствительности к АБ. В регионах с высокой (>15%) резистентностью к кларитромицину рекомендуется проведение квадротерапии с включением в стандартную схему препаратов висмута или нитроимидазола. Продолжительность эрадикации при помощи тройной терапии с кларитромицином должна составлять 14 дней.
В разделе «Лечение» положение № 1 гласит, что резистентность НР к антибиотикам (АБ) в мире демонстрирует тенденцию к постоянному росту. Например, резистентность НР к кларитромицину составляет 30% в Италии и Японии, 40% – в Турции, но только около 15% в Швеции и на Тайване. На этом основании в тех регионах земного шара, где уровень устойчивости НР к кларитромицину превышает 15%, не следует использовать стандартную трехкомпонентную схему с кларитромицином без предварительного определения чувствительности к АБ. В регионах с высокой (>15%) резистентностью к кларитромицину рекомендуется проведение квадротерапии с включением в стандартную схему препаратов висмута или нитроимидазола. Продолжительность эрадикации при помощи тройной терапии с кларитромицином должна составлять 14 дней.
В качестве одного из подходов к преодолению кларитромицинрезистентности была предложена последовательная терапия – ингибитор протонной помпы (ИПП) + амоксициллин, затем ИПП + кларитромицин и метронидазол. Однако недавно проведенный метаанализ показал, что одновременный прием препаратов на 51% эффективнее последовательного (р=0,02). В предыдущем консенсусе в качестве второй линии препаратов рекомендовались левофлоксацин, препарат висмута, амоксициллин и эзомепразол. Тем не менее в новом консенсусе этот подход был отвергнут из-за возрастающей резистентности к фторхинолонам. Вместо левофлоксацина в четырехкомпонентных схемах с висмутом можно использовать тетрациклин или рифабутин (Malfertheiner P. et al., 2016).
Однако недавно проведенный метаанализ показал, что одновременный прием препаратов на 51% эффективнее последовательного (р=0,02). В предыдущем консенсусе в качестве второй линии препаратов рекомендовались левофлоксацин, препарат висмута, амоксициллин и эзомепразол. Тем не менее в новом консенсусе этот подход был отвергнут из-за возрастающей резистентности к фторхинолонам. Вместо левофлоксацина в четырехкомпонентных схемах с висмутом можно использовать тетрациклин или рифабутин (Malfertheiner P. et al., 2016).
Украинский хеликобактер и его антибиотикорезистентность
Принятые консенсусом рекомендации хоть и являются вполне универсальными, все же в каждом отдельном регионе их применение должно быть обдуманным. Например, уровень резистентности к метронидазолу в странах СНГ, в том числе и Украине, превышает 40%, что делает крайне проблематичным его использование в схемах АХБТ (Фадеенко Г. Д., Просоленко К. О., 2009). Привычное назначение эмпирической тройной терапии «по старинке» ИПП + кларитромицин + метронидазол приводит к неудовлетворительной эрадикации, экономическим потерям и развитию вторичной резистентности НР к обоим препаратам (Тумак И. М., Никишаев В. И. и соавт., 2012).
М., Никишаев В. И. и соавт., 2012).
Что касается устойчивости НР к кларитромицину, в большинстве публикаций говорится, что в Украине еще не превышен критический порог в 15-20% (Тумак И. М., Никишаев В. И. и соавт., 2012). По разным данным, нечувствительные к кларитромицину штаммы НР составляют от 3-6% (Радченко О. М., 2010) до 11,4% (Гончарук Л. М., Галицкая В. А., 2016). Уровень резистентности НР к кларитромицину выше в детской популяции, что объясняется широким назначением этого препарата педиатрами в случае респираторных инфекций. Например, в Польше резистентность НР к кларитромицину у детей и взрослых составляет 28 и 15% соответственно.
Низкая чувствительность НР к амоксициллину не связана с выработкой β-лактамаз и возможна только в результате мутаций pbp1Q-гена, который определяет способность белков связывать пенициллины. К счастью, такие мутации встречаются крайне редко, поэтому НР сохраняет практически 100% чувствительность к амоксициллину (Фадеенко Г. Д., Просоленко К.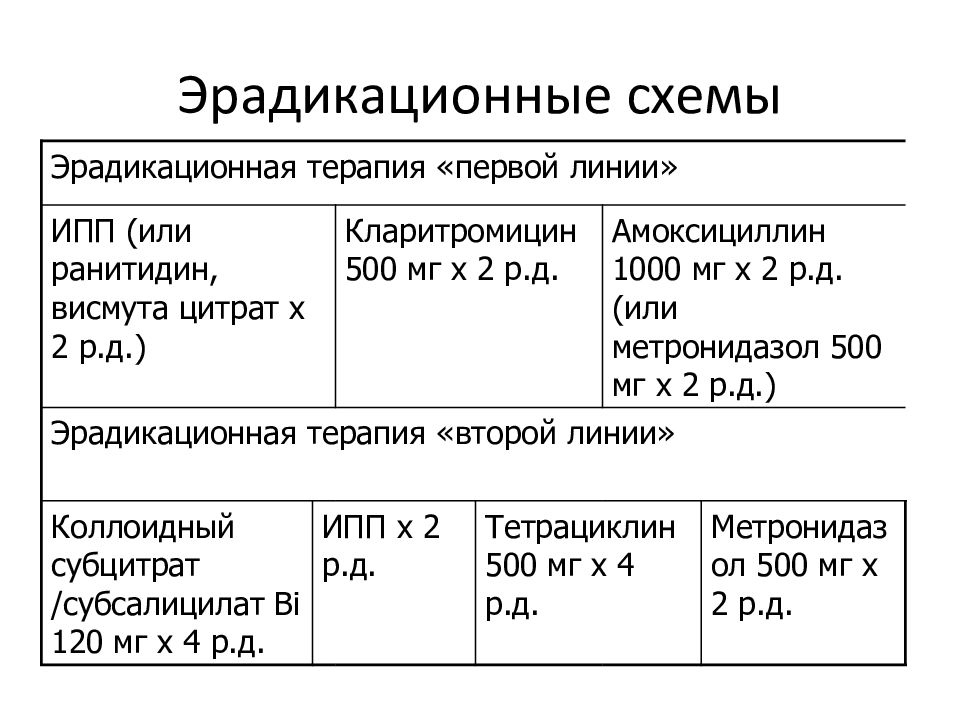 О., 2009).
О., 2009).
Таким образом, АХБТ показана всем пациентам с НР, не имеющим противопоказаний к ее проведению. Украина все еще остается регионом с низким уровнем резистентности НР к кларитромицину, поэтому для АХБТ у взрослых может применяться тройная схема ИПП + амоксициллин + кларитромицин с/без препарата висмута. Рекомендуемая продолжительность АХБТ – 14 дней.
Мнение эксперта
8-9 июня в г. Днепре проходила V научная сессия Института гастроэнтерологии НАМН Украины «Новітні технології в теоретичній та клінічній гастроентерології». Во время своего выступления в рамках научной программы директор ГУ «Институт гастроэнтерологии НАМН Украины», доктор медицинских наук, профессор Юрий Миронович Степанов рассказал о стратегиях в лечении кислотозависимых заболеваний.
– Сегодня известно, что HP является не только ульцерогенным, но и канцерогенным фактором. В связи с этим АХБТ следует проводить у всех инфицированных НР пациентов, не имеющих противопоказаний к такому лечению. Важно, что эрадикационная терапия полезна и должна быть назначена на любой стадии патологического процесса – воспаления, атрофии, гиперплазии, дисплазии.
Важно, что эрадикационная терапия полезна и должна быть назначена на любой стадии патологического процесса – воспаления, атрофии, гиперплазии, дисплазии.
В соответствии с новой системой оценки эффективности эрадикационной терапии она классифицируется как отличная (≥95%), хорошая (≥90%), приемлемая (85-89%) и неприемлемая (<85%). Чтобы обеспечить достаточный уровень эрадикации (≥85%), стандартной тройной терапии не всегда бывает достаточно. Пролонгация курса лечения повышает его эффективность на 3-6%. Однако подобный метод может привести к увеличению риска развития побочных эффектов от АХБТ, что, безусловно, снизит комплайенс и негативно повлияет на фармакоэкономические показатели.
В качестве одного из способов усиления АХБТ было предложено использовать двойные дозы ИПП. Это повышает эффективность АХБТ на 6-10%, но приводит к ситуации «off label» (в переводе с англ. – «вне инструкции»). Это означает, что двойная доза не рекомендована ни официальными рекомендательными документами, ни инструкцией, а значит, не может считаться безопасной. Поэтому сегодня в рутинной практике для усиления стандартной тройной схемы АХБТ можно использовать препараты висмута (повышают эффективность на 15-20% без негативных последствий) или пробиотики (повышают эффективность до 13%, а также снижает частоту развития нежелательных явлений от основных препаратов).
Поэтому сегодня в рутинной практике для усиления стандартной тройной схемы АХБТ можно использовать препараты висмута (повышают эффективность на 15-20% без негативных последствий) или пробиотики (повышают эффективность до 13%, а также снижает частоту развития нежелательных явлений от основных препаратов).
Назначая АХБТ в любой комбинации препаратов, важно помнить о создании благоприятного комплайенса. Необходимость принимать одновременно 4-6 препаратов может быть негативно воспринята пациентом. К счастью, на украинском рынке вновь доступен препарат Пилобакт Нео® – фиксированная комбинация омепразола 20 мг, кларитромицина 500 мг и амоксициллина 1000 мг. Собранные в одной упаковке все базисные препараты для тройной АХБТ удобны для приема, что значительно повышает приверженность пациента к лечению. В нашем институте препарат Пилобакт Нео® применяется достаточно широко, так как по соотношению цена/качество является оптимальной фиксированной комбинацией для базисной АХБТ.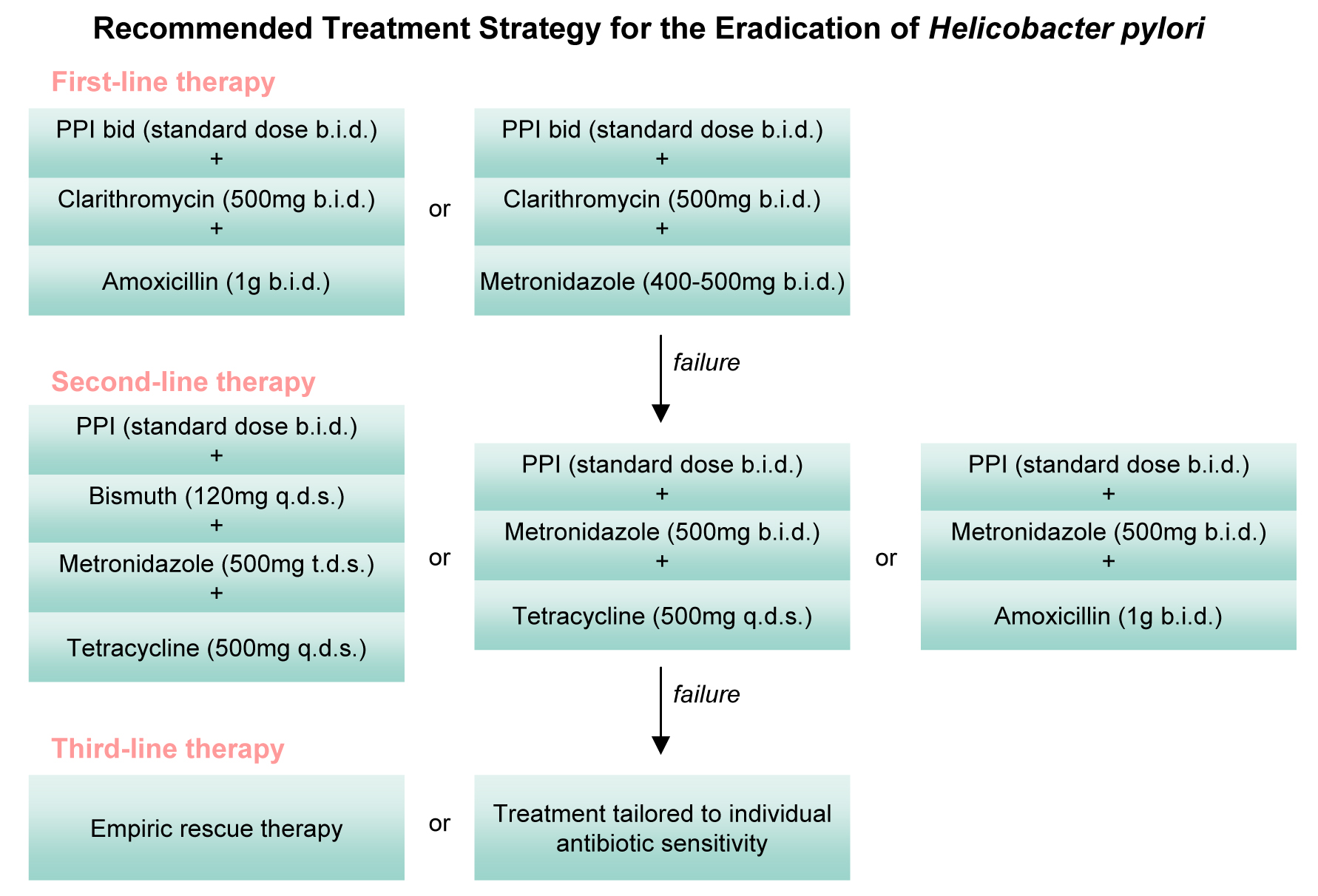
Подготовила Мария Маковецкая
Медична газета “Здоров’я України” № 17 (414) вересень 2017 p.
СТАТТІ ЗА ТЕМОЮ Гастроентерологія
10.07.2021 Гастроентерологія Педіатрія Терапія та сімейна медицина Інновації в дитячій гастроентерології та нутриціології в практиці педіатра і сімейного лікаря18-19 травня 2021 р. відбулася науково-практична конференція «Інновації в дитячій гастроентерології та нутриціології в практиці педіатра і сімейного лікаря. Читання ім. професора Ю.В. Бєлоусова», присвячена світлій пам’яті видатного українського вченого та лікаря, заслуженого діяча науки і техніки України, завідувача кафедри педіатричної гастроентерології та нутриціології Харківської медичної академії післядипломної освіти (ХМАПО), доктора медичних наук, професора Юрія Володимировича Бєлоусова….
відбулася науково-практична конференція «Інновації в дитячій гастроентерології та нутриціології в практиці педіатра і сімейного лікаря. Читання ім. професора Ю.В. Бєлоусова», присвячена світлій пам’яті видатного українського вченого та лікаря, заслуженого діяча науки і техніки України, завідувача кафедри педіатричної гастроентерології та нутриціології Харківської медичної академії післядипломної освіти (ХМАПО), доктора медичних наук, професора Юрія Володимировича Бєлоусова….
У цілому світі від депресивних розладів страждає близько 322 млн людей, що становить 4,4% населення світу. Незважаючи на те, що інтерес до розуміння механізмів виникнення та можливостей лікування патології у науковців та клініцистів не вщухає, кількість людей із депресією продовжує невпинно зростати, і не лише за рахунок глобального збільшення населення. Нещодавно дослідники почали ширше дивитися на патологію, інтегруючи концепцію цілісності людського організму. …
Незважаючи на те, що інтерес до розуміння механізмів виникнення та можливостей лікування патології у науковців та клініцистів не вщухає, кількість людей із депресією продовжує невпинно зростати, і не лише за рахунок глобального збільшення населення. Нещодавно дослідники почали ширше дивитися на патологію, інтегруючи концепцію цілісності людського організму. …
Горизонты и стандарты эрадикационной терапии инфекции H. Pylori
Владимир Трофимович Ивашкин, академик РАМН, доктор медицинских наук:
– А сейчас мы, уважаемые коллеги, мы переходим к следующему нашему разделу. И доцент Татьяна Львовна Лапина сделает сообщение «Горизонты и стандарты эрадикационной терапии инфекции H. Pylori». Это традиционная тематика, которая, тем не менее, не теряет своей актуальности и представляет большой интерес для большого круга врачей. Пожалуйста, Татьяна Львовна.
Татьяна Львовна Лапина, доцент, кандидат медицинских наук:
– Спасибо большое, Владимир Трофимович, Оксана Михайловна, уважаемая интернет-аудитория. Понятно, что развитие научных представлений идет по такой бесконечной спирали. И сейчас, с точки зрения эрадикационной терапии инфекции пилорического хеликобактера, мы, наверно, находимся на уровне более-менее горизонтальном вот этой спирали. То есть, действительно, в настоящий момент стандарты эрадикационной терапии инфекции пилорического хеликобактера во многом установлены и являются устоявшимися.
Если говорить о горизонтах эрадикационной терапии инфекции пилорического хелико актера, то, наверно, нужно говорить о двух сторонах этого вопроса, на которых я и попытаюсь остановиться в сегодняшнем коротком выступлении.
Первая сторона – это, конечно, повышение эффективности эрадикационной терапии, которая однозначно относится к повышению процента эрадикации в результате применения той или другой схемы эрадикации инфекции пилорического хеликобактера. И в данной ситуации, мне кажется, что вот наши горизонты во многом определяются не поиском чего-то радикально нового, а разумным и логичным использованием тех существующих схем эрадикационной терапии, тех существующих стандартных подходов к эрадикации, которые мы просто должны уметь очень логично, очень стройно применять по отношению к конкретному больному.
И наконец, вторая часть проблемы – это расширение области применения эрадикационной терапии, т.е. расширение показаний к эрадикации инфекции пилорического хеликобактера.
Я позволю себе начать со стандарта. Это рекомендации Российской гастроэнтерологической ассоциации по диагностике и лечению инфекции пилорического хеликобактера у взрослых, плод труда российских экспертов в этой области. И здесь перечислены препараты первой линии, второй линии, схемы, к которым должен обращаться врач общей практики, схемы, которые зафиксированы, в основном, как схемы для работы гастроэнтеролога. И я позволю себе, конечно, в первую очередь, остановиться на терапии выбора первой линии. Это стандартная эрадикационная тройная терапия.
Итак, ингибитор протонной помпы в стандартной дозе – два раза в сутки, Кларитромицин 500 миллиграмм два раза в сутки и Амоксициллин 1000 миллиграмм два раза в сутки. Продолжительность лечения минимальная – 7 дней, желательная – 10 или 14 дней. И, честно говоря, почему все равно остается большой интерес к этой схеме, хотя, наверно, это одна из самых изученных и самых по возрасту старых схем лечения эрадикации инфекции пилорического хеликобактера?
Во-первых, позволю себе сказать существует ряд исследований, на мой взгляд, очень серьезных, из разных регионов нашей страны, которые показывают, что резистентность пилорического хеликобактера к Кларитромицину не превышает те самые 18-20%, которые указаны австрийским консенсусом, как пороговые значения для того, чтобы отказаться от эмпирического назначения стандартной тройной терапии с Кларитромицином. Я не смогу в своем коротком выступлении остановиться на всех этих работах и вообще на сложности этой проблематики, но я позволю себе процитировать, например, работу Марины Федоровны Осипенко и соавторов из Новосибирска, которые в результате использования молекулярно-генетического метода определения штаммов, резистентных Кларитромицину, показали, что таких штаммов было обнаружено только 6%.
Другой регион России – это Нижний Новгород. Здесь тоже с помощью молекулярно-генетической методики очень близкие получены проценты частоты штаммов, резистентных Кларитромицину, без приема макролидов в анамнезе – те же самые 6,3%.
И если говорить о том, работает ли стандартная тройная терапия в клинической практике, то я должна сказать, что если мы посмотрим на сборник трудов последней российской гастроэнтерологической недели, то вот эта схема стандартной тройной терапии: ингибитор протонной помпы – Кларитромицин – Амоксициллин, – наверно, является все равно наиболее широко распространенной схемой.
И не вдаваясь в детали проведенных исследований, я позволю себе привести только два примера и показать, что авторы, которые в 2012 году опубликовали работу в тезисах российской гастроэнтерологической неделе и получили 100% эрадикации инфекции пилорического хеликобактера. Вот еще одна работа со стандартной тройной терапией, 84% эрадикации инфекции пилорического хеликобактера.
Если говорить о наших горизонтах, как мы можем еще усилить эффективность стандартной тройной терапии? Довести ее желательно вот до тех самых заветных, – понятно, что не до 100%, – ну хотя бы до 95-99%. Я позволю себе только одну часть вот этих мероприятий по повышению эффективности сегодня акцентировать, представить на ваше внимание. Это тоже фрагмент российских рекомендаций о диагностике и лечению инфекции пилорического хеликобактера. Для того, чтобы увеличить эффективность стандартной тройной терапии, нужно тщательно работать над комплаенсом пациента. Подробное инструктирование пациента и контроль за ним для обеспечения точного соблюдения назначенного режима приема лекарственных средств достоверно увеличивает процент эрадикации инфекции пилорического хеликобактера, полученных в результате применения стандартной тройной терапии с Кларитромицином.
Еще одна сторона вопроса эрадикационной терапии. Это, конечно, сторона, которая касается качества назначаемых лекарственных препаратов. И здесь очень большое значение имеет и качество антибактериальной терапии в составе эрадикационной схемы, и качество базисного препарата для эрадикационной схемы, то есть качество ингибитора протонной помпы. И мне, конечно, очень хотелось бы обратить внимание на достойные данные по оригинальному препарату Клацид компании Эббот, который действительно послужил основой тех самых схем эрадикационной терапии, в результате которых мы говорим о том, что стандартная тройная терапия на основе Кларитромицина все равно остается терапией №1 во многих регионах мира и в России.
И на этом слайде, и на последующем, я позволю себе привести сравнение генериков Кларитромицина по сравнению с оригинальным препаратом Клацид. И мы видим, что не все препараты – производные Клацида, могут отличаться тем заданным стандартом качества, которые характерны для оригинального препарата Кларитромицина компании Эббот. Например, содержание Кларитромицина в таблетке не должно по стандартным технологиям отличаться более чем на 5% от заявленного на упаковке. И вы видите, что по данному исследованию Найтингейл это достаточно много протестированных препаратов в 18 странах, 9% из протестированных дженериков не соответствовали спецификации Эббот по заявленному количеству действующего вещества.
Еще один очень важный параметр – содержание примесей в продукте, также отражает качество производственного процесса. Естественно, чем менее строгие требования к производственному процессу, тем более, скажем так, большее количество примесей может содержаться в препарате. По данным Найтингейл 19% из всех протестированных дженериков превышали установленную спецификацией компании Эббот 3% норму по содержанию примесей.
Но мне очень приятно сказать, что у нас появляется новый дженериковый препарат, препарат Рабепразол ОнТайм, и это как раз тот дженериковый препарат, генерический препарат, который соответствует требованиям по воспроизведению качества исходного оригинального препарата.
Почему мы говорим о рабепразоле? Потому что использование эффективного ингибитора протонной помпы тоже может увеличить процент эрадикации инфекции пилорического хеликобактера. Вот мета-анализ МакНиколь. И авторы этого мета-анализа достоверно показали, что схемы на основе рабепразола дают чуть больший процент эрадикации инфекции пилорического хеликобактера, чем схемы, основанные на других ингибиторах протонной помпы.
И вот вы видите, что в этом мета-анализе было 35 исследований, практически 6000 пациентов, процент эрадикации на Рабепразоле превышал 80% , на схемах на основе Омепразола Лансо-, Пантопразола был чуть ниже 80%. При этом я должна сказать, что рабепразол, в силу особенностей метаболизма, не зависит от генетического полиморфизма цитохрома Р450 CYP2C19. И даже у быстрых метаболизаторов ИПП схемы, основанные на Рабепразоле, дают стабильно высокий процент эрадикации. Это тоже один из результатов мета-анализа.
А вот и представления о биоэквивалентости препарата ОнТайм. Это препарат рабепразола. И вы видите, что по кривым биоэквивалентости очень серьезно поставлено было это исследование, это было исследование с перекрестным дизайном, и удалось четко показать соответствие биоэквивалентости препарата ОнТайм оригинальному Рабепразолу.
Какие еще схемы эрадикации инфекции пилорического инфекции хеликобактера доступны нам? Это схема квадротерапии, которая содержит ИПП, тетрациклин, Метронидазол и препарат висмута. Эта схема может использоваться, как альтернатива терапии первой линии, и эта схема может использоваться в случае, например, если терапия первой линии не привела к успешной эрадикации инфекции пилорического хеликобактера.
И в оставшееся мне время я позволю себе остановиться на второй части проблемы – на проблеме расширения области применения эрадикационной терапии. И должна сказать, что с точки зрения российских рекомендаций, рекомендаций российской гастроэнтерологической ассоциации, здесь дан карт-бланш в руки врачей. Хронический гастрит, вызванный инфекцией пилорического хеликобактера, в том числе атрофический гастрит, служит основанием для проведения эрадикационной терапии. То есть более широких показаний, можно сказать, и придумать нельзя.
Почему так важно говорить о том, что это положение является злободневным и актуальным? Потому что четвертый австрийский консенсус совершенно четко провозглашает эрадикационную терапию инфекции пилорического хеликобактера как меру активной профилактики рака желудка, аденокарциномы желудка. Посмотрите, пожалуйста, соответствующие приложения четвертого австрийского консенсуса. Инфекция пилорического хеликобактера – наиболее доказанный фактор риска рака желудка. Его элиминация служит самой многообещающей стратегией для снижения заболеваемости раком желудка.
Почему? Потому что пилорический хеликобактер вызывает в слизистой оболочке желудка каскад патоморфологических событий, в итоге которых развивается атрофический гастрит с кишечной метаплазией, который является предраковым заболеванием, по отношению к аденокарциноме желудка.
И вот соответствующее положение четвертого австрийского консенсуса. Гистопатологические изменения указывают на морфологическом уровне на то, что рак желудка редко развивается без хронического активного гастрита, причина активного хронического гастрита – пилорический хеликобактер. И объем поражения, и степень гастрита с атрофией кишечной метаплазии ассоциированы с раком желудка.
Что мы можем получить в результате проведения эрадикационной терапии инфекции пилорического хеликобактера? Мы можем, в первую очередь, ликвидировать хроническое активное воспаление в слизистой оболочке желудка, и можем замедлить, а некоторые авторы даже говорят об остановке прогрессирования, а некоторые авторы идут еще дальше – они говорят о регрессии атрофических изменений слизистой оболочки желудка. И понятно, что это и есть тот морфологический аспект, который говорит о том, что профилактика рака желудка действительно реально возможна в результате проведения эрадикационной терапии.
Почему авторы четвертого австрийского консенсуса, и мы вслед за ними, говорят о том, что эрадикация пилорического хеликобактера снижает риск рака желудка? Да потому, что есть целый ряд работ, которые свидетельствуют в пользу этого утверждения. Я позволю себе привести данные из систематического обзора. Это обзор целого ряда исследований, которые показали, что при проведении эрадикационной терапии частота случаев рака желудка реже, чем при отсутствии проведения эрадикационной терапии в соответствующей контрольной группе.
И вот выводом из этого систематического обзора является такое вот очень оптимистическое утверждение – эрадикация пилорического хеликобактера статистически снижает частоту рака желудка на одну треть. Согласитесь, это очень серьезное основание для того, чтобы нам в практике широко назначать эрадикационную терапию по имеющимся показаниям, в том числе для профилактики рака желудка.
Если мы говорим только о профилактической эрадикации пилорического хеликобактера, кому мы должны назначать это лечение? Я должна сказать, что российские рекомендации говорят очень широко о хроническом гастрите. С точки зрения четвертого австрийского консенсуса, может быть более детализированы эти показания. Давайте посмотрим на них. Итак, эрадикация пилорического хеликобактера для профилактики рака желудка должна быть рассмотрена в качестве показания у следующих групп пациентов:
– ближайшие родственники больных раком желудка;
– больные неоплазией желудка после эндоскопической резекции или субтотальной резекции;
И я должна сказать, что целый ряд работ, в первую очередь, проведенных в Японии, совершенно потрясающе дают результаты эрадикации инфекции пилорического хеликобактера у пациентов после эндоскопической резекции раннего рака желудка. Если проводится эрадикация инфекции пилорического хеликобактера после удаления рака желудка, карциномы желудка, то сам факт назначения эрадикационной терапии приводит к более благоприятному течению последующего наблюдения. У этих пациентов гораздо реже может развиться рак желудка в результате активного наблюдения, чем в той группе пациентов, у которых после эндоскопической резекции раннего рака желудка не проводили эрадикацию инфекции пилорического хеликобактера. Это обязательное показание для проведения эрадикационной терапии.
– больных гастритом. Каким гастритом? Выраженный пангастрит, гастрит с преимущественным поражением тела желудка, выраженная атрофия.
Итак, у нас есть ряд пациентов с инфекцией пилорического хеликобактера, которым мы можем назначить на длительный срок ИПП. В этом случае мы должны продумать сначала проведения эрадикационной терапии инфекции пилорического хеликобактера больным со значимыми внешними факторами риска рака желудка (курение, вредности в виде пыли, угля, кварца, цемента или работы в карьерах).
– Хеликобактер пилори – позитивные лица со страхом рака желудка после консультации врача и при отсутствии противопоказаний им может быть назначена эрадикация инфекции пилорического хеликобактера.
Благодарю за внимание, буду очень рада ответить на ваши вопросы.
Эрадикационная терапия H.pylori как основа профилактики рака желудка
Владимир Трофимович Ивашкин, академик РАМН, доктор медицинских наук:
– Сейчас у нас состоится симпозиум Российской гастроэнтерологической ассоциации. И в рамках этого симпозиума пройдет международный совет экспертов, и он будет посвящен обсуждению вопроса канцеропревенции, то есть первичной преимущественно, желательно, конечно, первичной профилактике рака органов пищеварительной системы. Удалось ли что-нибудь сделать Российской гастроэнтерологической ассоциации, которая уделяет очень много времени и усилий по, во-первых, образованию врачей, в первую очередь, и, во-вторых, по продвижению современных методов профилактики онкологических заболеваний в области органов пищеварения? И я должен ответить на этот вопрос в определенной степени утвердительно, положительно. Наиболее часто встречающиеся заболевания органов пищеварительной системы – это рак желудка и колоректальный рак. Раки других органов, пищевода, поджелудочной железы, печени и так далее, конечно, всех нас тревожат, и они все, безусловно, нас заставляют искать возможности их профилактики. Но все-таки наиболее распространенные формы злокачественных заболеваний в области гастроэнтерологии – это рак желудка и колоректальный рак, рак толстой кишки. И я должен сказать, что все-таки Россия в числе других экономически развитых стран, то есть экономически развитые европейские страны и североамериканские страны, сейчас вошла в тренд снижения заболеваемости раком желудка. Так, Татьяна Львовна?
Татьяна Львовна Лапина, доцент, кандидат медицинских наук:
– Да, абсолютно верно, я эту статистику, с вашего разрешения, покажу.
Ивашкин В.Т.:
– И вот Татьяна Львовна эту статистику… Разные могут быть причины, вернее, даже разные есть причины. В том числе, улучшение качества питания населения, улучшение гигиены питания, все более и более широкое внедрение в нашу практику холодильников, рефрижераторов, которые позволяют продукты… более разнообразное питание, большее содержание витаминов в рационе, большее содержание в рационе антиоксидантов. Это на таком, популяционном уровне. Это, безусловно, нельзя отрицать. Это социальный вклад в эту проблему. Но мы, безусловно, должны отметить заслугу гастроэнтерологов, которые сумели убедить врачебное сообщество в том, что очень важным кофактором развития рака желудка является инфекция Helicobacter pylori. И все более и более расширяющееся понимание этого фактора привело к двум, по крайней мере, очень значимым следствиям. Первое следствие – общее снижение заболеваемости раком желудка в российской популяции, постепенное, тренд. И второе – гораздо меньшая частота хирургических вмешательств у пациентов с неосложненными язвами двенадцатиперстной, главным образом, кишки и желудка, антрального отдела желудка. Это два очень важных фактора. И, таким образом, в декабре проводился экспертный совет на Каширском шоссе в онкологическом центре российском по канцеропревенции. Так что не все безнадежно, наоборот, при значительных усилиях, наших с вами, в том числе, усилиях, есть перспектива постепенного снижения заболеваемости раком желудка и других форм рака. Сейчас Татьяна Львовна, я думаю, подтвердит нам, что наши усилия заслуживают одобрения и продолжения.
Лапина Т.Л.:
– Да, Владимир Трофимович. Я действительно должна сказать, что в России на протяжении конца прошлого и начала нынешнего века наблюдается тенденция к снижению заболеваемости раком желудка. Но, тем не менее, актуальность профилактики рака желудка не должна ни у кого вызывать сомнения. Действительно, рак желудка по данным нашей статистики занимает твердое четвертое место по заболеваемости. И показатель заболеваемости, соответственно, в 2011 году составил 26,8 на 100 тысяч населения. В чем проблема? Проблема в том, что, к сожалению, показатель смертности рака желудка составляет 23,23 на 100 тысяч населения. И по смертности рак желудка занимает второе место и у мужчин, и у женщин. И это говорит о том, что вероятно мы недостаточно активно внедряем меры раннего выявления опухоли, потому что чем позже поставлен диагноз, тем, естественно, хуже прогноз. Высчитано, что кумулятивный риск умереть от злокачественного новообразования желудка у мужчин в России составляет 2,6%, у женщин – 1%. Итак, о чем мы должны говорить? Мы, конечно, должны говорить о том, что вообще является современно парадигмой, общепринятой в мире и, в том числе, в европейских странах о том, что инфекция пилорического хеликобактера – наиболее доказанный фактор риска рака желудка. И, соответственно, стратегия профилактики рака желудка должна подразумевать элиминацию этой инфекции. Я цитирую положение четвертого Маастрихтского консенсуса, который очень деликатно рекомендует стратегию screen-and-treat по отношению к инфекции пилорического хеликобактера в популяции, где рак желудка составляет проблему здравоохранения.
Я думаю, что наша статистика показывает, что рак желудка и есть проблема здравоохранения в нашей стране. Итак, screen-and-treat. Соответственно, нужно наладить скрининг инфекции пилорического хеликобактера и проводить лечение инфекции пилорического хеликобактера не просто у пациента с дуоденальной язвой, а у пациента, по сути дела, без каких-либо имеющихся жалоб. Посильна ли нам сейчас эта задача, для нашей огромной страны с высокой частотой инфекции пилорического хеликобактера в популяции, которая в некоторых регионах превышает показатели 90%? Конечно, это очень и очень сложный вопрос. Вот эти вопросы профилактики рака желудка заложены в рекомендациях Российской гастроэнтерологической ассоциации по диагностике и лечению инфекции пилорического хеликобактера у взрослых, потому что Российская гастроэнтерологическая ассоциация называет желательным проведение эрадикационной терапии у лиц, имеющих инфекцию пилорического хеликобактера и у лиц, имеющих хронических гастрит.
То есть по рекомендации Российской гастроэнтерологической ассоциации врач должен задуматься о проведении эрадикации у любого Helicobacter pylori-позитивного пациента. И мне действительно очень приятно сказать, Владимир Трофимович, что, наверное, из таких умозрительных представлений о том, что заниматься профилактикой новообразований хорошо, Российская гастроэнтерологическая ассоциация действительно идет очень быстро к внедрению чисто практических, ясных для врача общей практики мероприятий, направленных на профилактику рака желудка. И создание таких рекомендаций и публикация их в авторитетном «Российском журнале гастроэнтерологии, гепатологии и колопроктологии» – это заметный шаг к реальной профилактике рака желудка. Мы совершенно четко даем инструмент для проведения эрадикационной терапии. Мы называем в качестве терапии первой линии стандартную тройную терапию: ингибитор протонной помпы, кларитромицин, амоксициллин. И благодаря тому, что в России имеет место широкое признание значения солей висмута, в том числе, и висмута трикалия дицитрата и в гастроэнтерологии, и в эрадикационной терапии в качестве такого компонента, который может быть использован в квадротерапии, мы рекомендуем висмут трикалия дицитрат. Это квадротерапия как альтернативная первая линия лечения или вторая линия лечения при неудаче стандартной тройной терапии.
Речь идет о схеме: ингибитор протонной помпы, тетрациклин, метронидазол, висмут трикалия дицитрат. Мы можем усилить стандартную тройную терапию путем очень простых и понятных для любого практикующего врача мер. Мы можем, во-первых, назначать более длительные схемы лечения, и сейчас, в общем, ни для кого не является неожиданным, что врач назначает эрадикационную терапию на 10-14 дней, а не на 7 дней, как, скажем, было более принято лет десять назад. Мы можем увеличить дозу ингибитора протонной помпы, мы можем добавить Saccharomyces boulardii, но, в том числе, не является, опять же, неожиданным для практикующего врача то, что добавление к стандартной терапии препарата висмута также может добавить к проценту эрадикации инфекции пилорического хеликобактера. Четвертый Маастрихтский консенсус рекомендует нам совершенно определенные показания с точки зрения профилактики рака желудка для проведения эрадикационной терапии. Это ближайшие родственники больных раком желудка, это, скажем так, вариант третичной профилактики рака желудка у пациентов после эндоскопической резекции или субтотальной резекции желудка по поводу рака, это больные с гастритом, называется выраженный пангастрит, гастрит с преимущественным поражением тела желудка, наличие выраженной атрофии. Это больные, которым проводится лечение с подавлением желудочной кислотности продолжительностью более одного года, больным со значимыми внешними факторами риска рака желудка: курение, профессиональные вредности. И, наконец, просто желание пациента, его страх заболеть раком желудка.
Соответственно, Российская гастроэнтерологическая ассоциация в ряде регионов приветствует региональные программы по организованному скринингу рака желудка, которые основаны на выделении популяции риска среди лиц старше 45 лет по уровню сывороточного пепсиногена. И, конечно, мы делаем очень большую работу для того, чтобы каждый практический врач на своем рабочем месте понимал, что его задача – проведение оппортунистического скрининга инфекции пилорического хеликобактера. Итак, задача организованного скрининга – выявить больных гастритом. Тех самых больных гастритом, которые проименованы в четвертом Маастрихтском консенсусе: выраженный пангастрит, гастрит с преимущественным поражением тела желудка, выраженная атрофия. Для этого существуют простые инструменты. В первую очередь, это изучение сывороточных маркеров атрофии различных отделов желудка и очень простой сывороточный маркер пепсиноген 1. Снижение пепсиногена 1 достоверно, и это доказано работами и под руководством Владимира Трофимовича Ивашкина, и в разных регионах России, коррелирует со степенью атрофии тела желудка.
Немножко сложнее вопросы диагностики инфекции пилорического хеликобактера, потому что мы должны, с одной стороны, говорить о серологических методах выявления инфекции для проведения скрининговых манипуляций. И мы должны, конечно, хорошо понимать, что для диагностики лечения, излечения пациента от инфекции пилорического хеликобактера самое важное место занимает дыхательный тест с мочевиной, меченной углеродом С13. И это имеет принципиально большое значение, именно в этих двух направлениях, мне думается, надо развивать диагностику инфекции пилорического хеликобактера с точки зрения практического здравоохранения. Проблемы, которые стоят перед врачом общей практики, перед участковым терапевтом, который понимает, что такое проведение оппортунистического скрининга, действительно очень велики. В первую очередь, врач, к которому приходит пациент по любому показанию, должен задуматься о наличии у пациента инфекции пилорического хеликобактера и понять, когда он обязательно должен этого пациента направить на определение антител к инфекции пилорического хеликобактера и назначить ему такое лечение. Он должен проводить другие меры профилактики рака желудка.
Например, объяснить вред курения, добиться прекращения курения у пациента, добиться нормализации веса, знать профессиональные вредности, которые приводят к раку желудка. И, конечно, работать с изменением рациона питания, что тоже, в общем, достаточно сложно, и здесь нужно четко представлять, что необходимо изменить рацион питания на более здоровое с увеличением дозы свежих фруктов и овощей, молочных продуктов, цельнозерновых продуктов. При этом снизить содержание соли, маринада, алкоголя. Мне бы хотелось акцентировать внимание практикующих врачей на двух очень четких аспектах, которые в любом случае заставляют подумать о необходимости диагностики и лечения инфекции пилорического хеликобактера с точки зрения профилактики рака желудка. Это наличие ближайших родственников, больных раком желудка. Мы знаем, что семейный анамнез – фактор риска рака желудка, и мне бы хотелось остановиться на одном из последних исследований случай-контроль, это американская популяция. В качестве контролей были изучены 147 больных раком пищевода, 182 пациента аденокарциномы кардии и 285 пациентов дистальной аденокарциномы.
Это исследование, в том числе, достаточно интересно тем, что выявляет разные факторы риска для разных опухолей желудочно-кишечного тракта. И очень важно, что еще раз было доказано, что с высокой статистической показательностью семейный анамнез рака желудка связан с дистальной аденокарциномой, отношение шансов больше 2. И при раннем начале заболевания, диагноз установлен до 50 лет, отношение шансов, по сути дела, составляет 3. И еще один момент, на который любой практический врач, мне кажется, должен обратить внимание и подумать о проведении профилактической эрадикационной терапии. Это больные, которым проводится лечение с подавлением желудочной кислотности продолжительностью более 1 года. И таких пациентов достаточно много, потому что это пациенты с гастроэзофагеальной рефлюксной болезнью, которые очень часто встречаются в российской популяции, и пациенты, которые принимают ингибиторы протонной помпы для профилактики НПВС-гастропатии.
Здесь, наверное, нечего добавить к очередному положению четвертого Маастрихтского консенсуса, длительное лечение ингибитором протонной помпы Helicobacter pylori-позитивных лиц, ассоциировано с перемещением популяции, в основном, в тело желудка с развитием там активного гастрита и ускорением процесса потери специализированных желез, то есть к ускорению формирования атрофического гастрита тела желудка. И, безусловно, сейчас, конечно, нет четких данных о том, что лечение инфекции пилорического хеликобактера у таких пациентов снижает частоту рака желудка, но я думаю, что на практическом уровне мы очень хорошо понимаем, что так оно и должно быть. Вот, собственно, мне кажется, основное, что мы должны пропагандировать среди практикующих врачей, в первую очередь, среди врачей общей практики и участковых терапевтов с точки зрения повседневной работы по профилактике рака желудка. Спасибо.
Особенности национальной антихеликобактерной терапии: что может врач общей практики?
Со всей полнотой горькие плоды так называемого реформирования национального здравоохранения предстоит вкусить, вероятно, в будущем. Однако уже сегодня можно оценить некоторые очевидные последствия этого процесса. Вопервых, доступность медицинской помощи для основной массы населения резко снизилась. Особенно это касается квалифицированной помощи, оказываемой узкими специалистами, в том числе и гастроэнтерологами. Вовторых, как следствие этого, возросла нагрузка на врачейтерапевтов, именуемых в новаторском стиле семейными врачами, или врачами общей практики. При этом основной проблемой является расширение спектра курируемой патологии. В недавнем прошлом терапевт, предполагая у пациента наличие кардиологического (нефрологического, гастроэнтерологического) заболевания, имел возможность оперативно направить его к врачу того или иного профиля и в дальнейшем проводил и контролировал лечение в соответствии с полученными рекомендациями и назначениями. Сегодня же врач общей практики должен самостоятельно решать вопросы диагностики и лечения в сфере, где у него зачастую не хватает ни теоретической подготовки, ни практического опыта.
Что же необходимо для того, чтобы врач общей практики мог болееменее адекватно решать проблемы, которые раньше были прерогативой узкого специалиста? Мы убеждены, что прежде всего необходимо повысить информированность терапевта, предоставляя ему в доступной форме современные, ориентированные на практику данные по той или иной проблеме. Настоящая статья адресована исключительно врачам общей практики. Она представляет собой попытку объяснить, что такое хеликобактерная инфекция и почему с ней следует бороться.
Хеликобактерная инфекция — это инфекция, вызванная микроорганизмом Helicobacter pylori (Нр), который всего 30 лет назад открыли австралийские ученыеJ.R. Warren и B.J. Marshall. Обнаружив эти бактерии на слизистой оболочке желудка (СОЖ) пациентов с хроническим гастритом и эрозивноязвенными поражениями гастродуоденальной зоны, они предположили, что именно хеликобактер играет ведущую этиопатогенетическую роль в данной патологии. Среди многочисленных теорий о причинах и механизмах возникновения указанных заболеваний инфекционная была, пожалуй, наименее популярной. Считалось, что кислая среда желудка полностью исключает возможность жизни в нем какихлибо микроорганизмов. Последние, попадая в желудок, должны либо погибнуть, либо переместиться в кишечник, где условия их обитания более благоприятные. Доминировавшая в 80е годы прошлого века точка зрения указывала на приоритет агрессивного кислотнопептического фактора, то есть основных компонентов желудочного сока — соляной кислоты (HCl) и пепсинов. Тем самым постулировалась идея загребского хирурга Карла Шварца, сказавшего еще в 1910 году: «Нет кислоты — нет язвы».
Однако и кислотная концепция имела слабые места. Главной нерешенной проблемой было рецидивирующее течение язвенной болезни. Почему даже постоянный прием появившихся в нашем арсенале эффективных антисекреторных препаратов не предотвращал повторного возникновения (обострения) язв и эрозий гастродуоденальной зоны? Этот вопрос оставался без ответа.
Тем не менее на первых порах медицинский мир с настороженностью и недоверием отнесся к сообщению J.R. Warren и B.J. Marshall. Однако в последующие десятилетия были получены неоспоримые доказательства их правоты, и в 2005 году австралийским ученым была вручена Нобелевская премия по физиологии и медицине «За открытие бактерии Helicobacter pylori и ее роли в возникновении гастрита и пептических гастродуоденальных язв».
Что представляет собой этот микроорганизм? Helicobacter pylori — спиралевидная грамотрицательная бактерия, около 3 мкм в длину, диаметром около 0,5 мкм. Она обладает 4–6 жгутиками и способностью чрезвычайно быстро двигаться даже в густой слизи. Эта бактерия микроаэрофильна, то есть требует для своего развития наличия кислорода, но в концентрациях, значительно меньших атмосферной (именно в таком количестве кислород содержится в желудке). В неблагоприятных условиях, а также в зрелых или старых культурах Нр обладает способностью превращаться из спиралевидной в более устойчивую круглую или шарообразную (кокковидную) форму. Это благоприятствует ее выживанию и может являться важным фактором в распространении бактерии.
Путь инфицирования — фекальнооральный, как и при традиционных кишечных инфекциях. Поэтому хеликобактерная инфекция максимально распространена в странах с низким социальноэкономическим уровнем, где зачастую не соблюдаются санитарногигиенические нормы; инфицирование при этом нередко возникает в детском или молодом возрасте. Оно сопровождается неспецифическими симптомами острого гастроэнтерита, хотя может протекать и бессимптомно.
На начальном этапе после попадания в желудок Нр быстро двигается при помощи жгутиков в места скопления других бактерий данного вида (это обеспечивает быструю колонизацию слизистой) и достигает защитного слоя слизи. В принципе слизистобикарбонатный барьер (СББ), покрывающий практически всю поверхность СОЖ, достаточно устойчив к потенциальным повреждающим факторам, в том числе и к собственной соляной кислоте и пепсинам. Однако вырабатываемые бактерией ферменты муциназа, протеаза и липаза деполимеризуют (растворяют) белки этого барьера. В итоге соляная кислота и пепсины получают непосредственный доступ к оголенной слизистой желудка и начинают ее разъедать, вызывая химический ожог, воспаление и изъязвление. Сам же Нр, находясь в слое слизи, защищен от контакта с HCl.
Достигнув поверхности слизистой оболочки (эпителиальных клеток), бактерия фиксируется на них с помощью структурных компонентов своей наружной оболочки — липосахаридов и белков, которые обладают способностью адгезировать («прилипать») к желудочному эпителию. Закрепившись на поверхности слизистой, Нр начинает вырабатывать уреазу. Этот фермент является ключевым в жизнедеятельности бактерии. Уреаза расщепляет имеющуюся в желудочном содержимом мочевину, в результате чего образуется аммиак. Он нейтрализует соляную кислоту желудка и обеспечивает хеликобактеру локальное поддержание комфортного для него pH (около 6–7). Таким образом, вокруг микроорганизма возникает щелочное «облачко», представляющее собой своеобразный скафандр, который защищает Нр от кислотнопептического фактора. Одновременно с этим аммиак вызывает химическое раздражение и воспаление, а впоследствии и гибель клеток СОЖ. Кроме того, обусловленное аммиаком повышение рН в слизистой оболочке и слое защитной слизи поблизости от растущей колонии микроорганизмов по механизму отрицательной обратной связи сопровождается компенсаторным повышением секреции соляной кислоты и пепсина, с одновременным снижением секреции бикарбонатов. Это усугубляет повреждение слизистой оболочки (рис. 1).
Нр обладает способностью формировать биопленки, защищающие его от иммунного ответа хозяина и способствующие невосприимчивости к антибиотикотерапии, что также повышает выживаемость бактерии.
Зафиксировавшись на поверхности эпителия, Нр начинает выделять различные токсины (экзотоксины), которые усиливают повреждающий слизистую оболочку потенциал. Эндотоксины бактерии посредством специальной «инжекторной системы» впрыскиваются непосредственно внутрь эпителиальных клеток. Привлеченные воспалением лейкоциты вырабатывают различные медиаторы воспаления, что приводит к прогрессированию воспаления и изъязвления слизистой. Нр также вызывает окислительный стресс и запускает механизм программируемой клеточной смерти клеток эпителия желудка (апоптоз).
Итогом длительного действия разнообразных повреждающих факторов является изменение структуры клеток и нарушение клеточного обновления в СОЖ. Длительное персистирование инфекции в желудке закономерно приводит к атрофии его слизистой оболочки и нередко способствует формированию эрозий, язв и рака желудка (РЖ). Поэтому еще в 1994 году входящее в структуру Всемирной организации здравоохранения Международное агентство по изучению рака (IARC) признало хеликобактер канцерогеном первого порядка в отношении рака желудка.
Способность Hр колонизировать слизистую желудка, вызывая те или иные заболевания, зависит прежде всего от индивидуальных особенностей конкретного штамма бактерии (вирулентность и патогенность; рис. 2), а также состояния иммунитета организма хозяина. В нашей стране, к сожалению, ульцерогенные и канцерогенные штаммы распространены достаточно широко.
В заключение этой части добавим, что этиологическая роль хеликобактера доказана всеми 4 постулатами Коха. Таким образом, совершенно очевидно, что Нр — безусловный патоген, а не комменсал, как продолжают безосновательно считать некоторые наши коллеги.
Поэтому с конца прошлого века во всем мире растет интерес к вопросам диагностики и лечения хеликобактерной инфекции. Наиболее авторитетным документом на эту тему является Маастрихтский консенсус — рекомендации по диагностике Нр и лечению ассоциированных с ним заболеваний, разработанные специально созданной в 1987 году Европейской группой по изучению Helicobacter pylori. Первая редакция этого соглашения была опубликована в 1997 году. В дальнейшем, по мере накопления новой информации в сфере хеликобактериологии, раз в 4–5 лет рекомендации обновлялись, оперативно реагируя на появление новых данных относительно методов диагностики, а также целей, задач и принципов лечения хеликобактерной инфекции. Последняя, четвертая, версия была опубликована в мае 2012 года.
Занимаясь антихеликобактерной терапией (она же — эрадикационная, от слова «эрадикация» — искоренение, то есть полное уничтожение инфекции) с 1994 года, мы накопили достаточно большой опыт диагностики и лечения Нринфекции в юговосточном регионе Украины. Именно сквозь призму этого опыта мы изложим основные положения Маастрихтского консенсуса, стараясь сделать их понятными для негастроэнтерологов.
Хотя адекватных эпидемиологических исследований в Украине не проводилось, ориентировочная Нринфицированность взрослого населения нашей страны составляет 80 %. Кого же следует рассматривать в качестве кандидатов на эрадикационную терапию?
Прежде всего это Нрположительные пациенты с пептическими гастродуоденальными язвами. Тут впору вспомнить афористическое высказывание академика В.Х. Василенко: «Язвы заживают при лечении, без лечения и вопреки лечению». Однако успешная эрадикация решает проблему, с которой не позволял справиться даже постоянный прием антисекреторных препаратов, — она прекращает рецидивирование язвы, то есть фактически излечивает ее. Именно поэтому с появлением антихеликобактерной терапии отошло в прошлое определение язвенной болезни как «хронического, протекающего с периодическими обострениями» заболевания. Да и сам диагностический термин «язвенная болезнь» традиционно употребляется только на постсоветском пространстве. Его ограниченность связана с тем, что подобная формулировка диагноза всего лишь констатирует наличие патологического образования (язвы) соответствующей локализации без всякого указания на ведущие этиопатогенетические механизмы ее образования. Наши зарубежные коллеги в подобных случаях говорят о Нрпозитивной пептической язве желудка и/или двенадцатиперстной кишки. Эта формулировка представляется более удачной, так как сразу обозначает ведущие факторы язвообразования — хеликобактерную инфекцию и кислотнопептическую агрессию. Таким образом, на смену постулату К. Шварца «Нет кислоты — нет язвы» пришел обновленный доказательный тезис: «Нет хеликобактера и нет кислоты — нет язвы». Обращаем внимание на то, что в этом дуэте именно Нр, а не кислота занимает приоритетную позицию. Еще раз подчеркнем, что успешная эрадикационная терапия сегодня составляет основу адекватного лечения пептических гастродуоденальных язв, поскольку она способна избавить человека от заболевания, ранее считавшегося неизлечимым. Поэтому в лечении Нринфекции нуждаются не только пациенты с имеющейся сейчас язвой, но и те, у кого она была раньше («язвенная болезнь вне обострения» по прежним представлениям).
Совершенно очевидно, что антихеликобактерную терапию следует проводить и при осложненном течении язвенной болезни. Так, было показано, что успешная эрадикация у пациентов, перенесших язвенное кровотечение, в 5—10 раз снижает риск повторного кровотечения. Доказательства этого столь убедительны, что в современных Международных рекомендациях по ведению больных с эрозивноязвенными кровотечениями из верхних отделов ЖКТ 2010 года настоятельно рекомендуется назначать эрадикационную терапию сразу после перевода пациента на энтеральное питание. К сожалению, в Донецком центре по лечению больных с острым кровотечением в просвет пищеварительного канала эта тактика полностью игнорируется. Ни при стационарном лечении, ни в рекомендациях при выписке не учитывается Нрстатус пациента. Наш коллегахирург однажды пошутил: «Мы, хирурги, в микробов не верим — мы их никогда не видели». В связи с этим вспоминается персонаж Ильфа и Петрова — ничья бабушка. «Она, как известно, жгла на своей антресоли керосин, так как не доверяла электричеству». Итог недоверия был плачевен — «Воронья слободка» сгорела дотла…
Пользуясь удобным случаем, заметим, что медицина — это не только вера в свою правоту, но и знание доказательной информации, и вернемся к нашей теме.
Еще одна патология, в рамках профилактики и лечения которой следует проводить эрадикационную терапию, — эрозивноязвенные поражения гастродуоденальной зоны, индуцированные приемом нестероидных противовоспалительных препаратов (НПВП). С 1986 года для обозначения этой патологии существует термин «НПВПгастропатия». Патогенетические механизмы НПВПгастропатии отличаются от таковых при «классической» язвенной болезни (пептической язве). Вкратце напомним о них.
Ключевым объектом воздействия НПВП является фермент циклооксигеназа (ЦОГ), посредством которого запускаются ведущие механизмы воспалительных реакций. Однако ЦОГ существует в виде 2 изоферментов: ЦОГ1 и ЦОГ2. При определенном структурном сходстве они, тем не менее, реализуют разные (иногда противоположные) функции. Так, провоспалительные реакции «осуществляет» ЦОГ2. При посредстве же ЦОГ1 происходят различные физиологические процессы, в том числе и те, которые обеспечивают нормальную структуру и функцию уже упоминавшегося слизистобикарбонатного барьера желудка. Следовательно, для эффективного подавления воспаления необходима блокада ЦОГ2. Однако вследствие структурного сходства между двумя изоферментами одновременно в большей или меньшей степени блокируется также и ЦОГ1, что приводит к нарушению структуры СББ и снижению его защитной функции. В результате этого повышается уязвимость СОЖ при воздействии на нее агрессивных факторов, прежде всего соляной кислоты и пепсинов. Как следствие, в желудке возникают эрозии и/или язвы — чаще множественные, локализованные в желудке, с более высоким, чем у «классических» язв и эрозий, риском кровотечений. Зачастую эти эрозии и язвы не сопровождаются характерными клиническими симптомами, что также способствует их прогрессированию вплоть до осложнений. Наиболее эффективной стратегией профилактики НПВПгастропатии является одновременный прием антисекреторных препаратов, которые снижают повреждающий потенциал кислотнопептического фактора. Кроме того, если пациент, принимающий НПВП, имеет хеликобактерную инфекцию, для уменьшения суммарного повреждающего действия на СОЖ обязательно следует проводить эрадикационную терапию. Иными словами, если врач вынужден «наградить» больного одним фактором риска язвообразования — НПВП, он обязан избавить его от второго фактора риска — хеликобактера. Успешная эрадикация способна снизить риск развития НПВПгастропатии в 60 (!) раз. Особенно это актуально для лиц с пептическими язвами (прежде всего осложненными) и явлениями НПВПгастропатии в анамнезе.
Все сказанное в отношении НПВП в полной мере относится и к ацетилсалициловой кислоте (АСК). Сегодня АСК, используемая в минимальных дозах (75–100 мг), востребована прежде всего как препарат для профилактики кардио и цереброваскулярных тромбозов. Однако снижение агрегации тромбоцитов также реализуется посредством блокады ЦОГ1. Кроме того, АСК обладает дополнительной способностью повреждать СОЖ при непосредственном контакте с ней (т.е. не только ЦОГ1опосредованными механизмами). К тому же с антитромбоцитарной целью препарат, как правило, назначается неопределенно долго. Поэтому всех пациентов, принимающих АСК, следует тестировать на наличие у них Нр, а в случае Нрпозитивности проводить эрадикационную терапию.
Как уже было сказано, Нр, персистируя на слизистой оболочке желудка, вызывает ее хроническое воспаление, т.е. хронический гастрит (ХГ). Хронический неатрофический гастрит со временем трансформируется в атрофический гастрит. Атрофия СОЖ закономерно сопровождается ее метаплазией и дисплазией. Дисплазированный эпителий имеет высокий риск злокачественной трансформации. Именно поэтому Нр и рассматривается как потенциальный канцероген, способствующий возникновению рака желудка. Последовательность изменений в СОЖ от неатрофического гастрита до атрофического с метаплазией, дисплазией, приводящих в итоге к развитию у предрасположенных лиц РЖ, носит название каскада желудочного канцерогенеза, или каскада P. Correa (по фамилии впервые описавшего его ученого).
Пользуясь случаем, напомним нашим коллегам о том, что на сегодняшний день во всем мире хронический гастрит является не клиническим, а морфологическим диагнозом. Почему? Вопервых, потому, что ХГ не болит и болеть не может по определению, так как слизистая оболочка лишена чувствительной иннервации. Вовторых, доказать наличие ХГ (как неатрофического, так и атрофического) может только морфолог, которому для этого нужны взятые во время фиброгастроскопии биоптаты из различных (обязательно!) отделов желудка. Сам эндоскопист при этом может судить об атрофии СОЖ только по косвенным признакам. Что же касается эндоскопических признаков метаплазии и атрофии, то их попросту не существует. Абсолютно неадекватными являются столь популярные в 70е годы прошлого века попытки диагностировать ХГ при помощи рентгенологического исследования желудка или путем анализа желудочного сока.
Таким образом, если объединенные усилия эндоскописта и морфолога подтверждают наличие у пациента хронического атрофического гастрита на фоне Нринфекции, то такой пациент нуждается в антихеликобактерной терапии. Успешная эрадикация в данном случае позволит прервать упомянутый каскад и предотвратить развитие РЖ.
Как уже было сказано, взаимосвязь хеликобактерной инфекции и рака желудка на сегодняшний день четко доказана и не вызывает сомнений. В связи с этим эрадикация Нр рассматривается современной медициной как наиболее эффективная стратегия профилактики РЖ в популяциях с высоким риском этой патологии. Этот подход четко оговорен в последних редакциях Маастрихтского консенсуса. Той же точки зрения придерживаются и ведущие украинские специалисты, которые считают целесообразным проведение скрининга (выявления) Нрпозитивных лиц с последующим их лечением в масштабах всей страны. Это связано с тем, что в Украине РЖ занимает 3–4е место по распространенности и 2е — по смертности среди всей онкопатологии. Кто же имеет максимальный риск возникновения РЖ и в связи с этим нуждается в эрадикации Нр? Вопервых, это уже упомянутые лица с морфологически доказанным атрофическим гастритом. Вовторых, это родственники больных раком желудка первой степени родства (последняя описывает связь между родителями и детьми, а также родными братьями и сестрами). С чем это связано? Воспалительный ответ слизистой на Нринфекцию (как ведущий, так и не ведущий в итоге к РЖ) генетически предопределен. Поэтому вероятность того, что хеликобактер вызовет предраковые изменения, а затем и сам рак желудка у человека, чей ближайший родственник уже имеет это заболевание, достоверно выше, чем в общей популяции. Повышенный риск отмечен также у лиц, которые не являются ближайшими родственниками больного раком желудка, но, проживая совместно с ним, имеют более высокую вероятность инфицирования потенциально канцерогенным штаммом хеликобактера. Поэтому в случае Нрпозитивности им также следует проводить эрадикацию.
Антихеликобактерная терапия эффективна в рамках не только первичной, но и вторичной профилактики РЖ. Доказано, что его рецидив после комбинированного лечения (резекция желудка + химиотерапия) у Нрнегативных пациентов возникает достоверно реже, чем у Нрпозитивных.
Эрадикация в качестве первого лечебного вмешательства должна быть проведена Нрпозитивным больным с функциональной диспепсией. Именно она (а не хронический гастрит!) чаще всего и беспокоит пациента, жалующегося на периодические боль и/или дискомфорт в эпигастрии (тяжесть, переполнение после еды, патологически раннее насыщение), при обследовании которого мы не выявляем ничего, кроме упомянутого ХГ. Но поскольку функциональная диспепсия — патология исключения многочисленных органических заболеваний, попрежнему являющихся «предметом заботы» гастроэнтеролога, в данной статье, ориентированной на терапевтов, мы всего лишь ограничимся констатацией этого факта.
Многие исследователи пытаются рассматривать Нр как возможную причину различной внежелудочной патологии (дерматологические, неврологические, кардиологические заболевания). Однако на сегодняшний день считается доказанной взаимосвязь хеликобактерной инфекции только с иммунной тромбоцитопенией и идиопатической Feдефицитной анемией, которые ассоциированы с Нр в 40 и 50 % случаев соответственно. Эрадикационная терапия может оказаться полезной в том случае, если тщательное обследование пациента с указанной патологией не выявило других причин, способных объяснить ее наличие.
Таким образом, мы видим, что перечень заболеваний, для лечения или профилактики которых необходима антихеликобактерная терапия, достаточно велик. В связи с этим возникает вопрос: как правильно диагностировать наличие инфекции в организме?
Самым простым и доступным способом является определение антител класса IgG к хеликобактеру. Если человек контактировал с инфекцией, то его иммунная система отреагировала на это выработкой упомянутых антител. Поскольку самопроизвольная элиминация (удаление) хеликобактера из организма — явление крайне редкое, то наличие антител к инфекции можно считать доказательством присутствия самой инфекции в организме. Разумеется, при этом необходимо убедиться, что пациент не принимал препараты с антихеликобактерным эффектом, которые могли его излечить. Поэтому данный метод можно использовать в качестве скринингового для первичной диагностики Нринфекции. Однако определение антител не годится для контроля после лечения, поскольку даже в случае эффективной эрадикации инфекции антитела к ней могут сохраняться и, соответственно, определяться от нескольких месяцев до 2 лет (так называемый «серологический рубец»).
Более широкие диагностические возможности имеют уреазные тесты: дыхательный уреазный и уреазный с гастробиоптатом. Не вдаваясь в технические тонкости соответствующих методик, заметим, что их суть — в выявлении присутствующей в желудке уреазы, которая, как мы помним, является ключевым ферментом жизнедеятельности Нр. Дыхательный тест неинвазивен, более точен и выявляет присутствие уреазы в желудке по анализу выдыхаемого пациентом воздуха. Именно он рекомендован в качестве стандартного метода диагностики хеликобактерной инфекции — как до лечения, так и после (в качестве контроля). Однако он достаточно дорогой и не слишком доступен в национальной практике. Тест с гастробиоптатом определяет наличие уреазы в слизистой оболочке желудка, для чего, разумеется, нужен биоптат и, соответственно, фиброгастроскопия. Последняя позволяет провести осмотр слизистой верхних отделов ЖКТ, что чаще всего необходимо для диагностики Нрассоциированной патологии. Этот метод в наших условиях доступнее и зачастую дешевле дыхательного теста.
Для повышения информативности уреазных тестов следует соблюсти определенные условия, которые мы предлагаем рассмотреть на конкретных примерах. Предположим, эрадикация оказалась успешной и хеликобактер в желудке уже отсутствует. Но накопленная в слизистой за время его существования уреаза еще сохраняется, постепенно сходя на нет. Поэтому во избежание ложноположительного результата уреазный контрольный тест следует проводить не раньше чем через 1 мес. после окончания лечения. Обратная ситуация: лечение оказалось неэффективным, и хеликобактер попрежнему персистирует на слизистой оболочке желудка. Но препараты, с помощью которых мы с ним боролись, подавляют активность уреазы, в связи с чем она может не определяться. Направив пациента на контрольный тест сразу после окончания лечения, мы можем получить отрицательный результат, но он будет ложноотрицательным. Поэтому и в данном случае необходимо соблюсти тот же интервал в 1 мес. Если бактерия остается в желудке, за этот период ее уреаза восстановит свою активность и будет выявлена при контрольном уреазном тесте.
Достоинства и недостатки остальных диагностических методов мы обсуждать не будем, поскольку они, к сожалению, практически недоступны в нашей повседневной клинической практике.
Какой же должна быть антихеликобактерная терапия и почему? Попробуем, разобравшись в этом вопросе, сделать сложное простым или по крайней мере понятным.
Вернемся к модифицированному постулату Шварца: «Без H.pylori и без кислоты нет язвы». Два основных «виновника» обозначены четко. Логично предположить, что эрадикационные схемы должны работать в 2 направлениях: с одной стороны, подавлять солянокислую секрецию желудка, а с другой — обладать антибактериальной (антихеликобактерной) активностью.
Наиболее эффективными антисекреторными препаратами на сегодняшний день являются ингибиторы протонной помпы (ИПП). Они широко представлены в нашей практике: от первого препарата этой группы омепразола до представителя последней генерации эзомепразола. Все ИПП принципиально сходны по своей клинической эффективности, в связи с чем любой из них может быть использован в схемах эрадикационной терапии.
Антибактериальных препаратов с антихеликобактерной активностью достаточно много. Принципы их рационального использования оговорены Маастрихтским консенсусом. В соответствии с этими рекомендациями лечение Нринфекции предполагает несколько этапов. Первый этап — выбор стартовой терапии, или терапии первой линии. Она является трехкомпонентной (тройная терапия) и включает в себя ИПП и 2 антибактериальных препарата: амоксициллин + кларитромицин или амоксициллин + метронидазол; продолжительность лечения составляет 7–14 дней. В случае неэффективности терапии первой линии следует использовать терапию второй линии. Она представлена четырехкомпонентной схемой (квадротерапия) и включает в себя ИПП в сочетании с 3 антихеликобактерными препаратами: тетрациклином, метронидазолом и препаратом висмута. Что делать, если и квадротерапия не обеспечила эрадикацию? Наиболее эффективным в данном случае является выделение от пациента возбудителя и определение чувствительности этого штамма к конкретным антибиотикам. Это позволяет перейти от эмпирической антимикробной терапии к лечению инфекции при установленной чувствительности возбудителя. К сожалению, культуральные методы диагностики в нашей стране недоступны. Поэтому остается второй вариант: продолжить эмпирическое лечение, используя для этого терапию третьей линии, или «терапию спасения». Она включает в себя измененные дозы и режимы приема препаратов, использовавшихся на предыдущих этапах, а также другие антимикробные препараты — АП (чаще всего респираторные фторхинолоны и рифабутин). Таковы рекомендации последнего Маастрихтского консенсуса.
Однако какими бы обоснованными и авторитетными ни были международные рекомендации по любой антимикробной терапии, универсальными являются только принципы ее проведения, а не конкретные рекомендуемые схемы. Эффективность или неэффективность последних связана прежде всего с региональной устойчивостью микроорганизмов к антибиотикам. Так, в странах Северной Америки и Западной Европы, где эрадикация активно проводится уже со 2й половины 90х годов ХХ века, эффективность многих лечебных схем снижается, и это вынуждает исследователей рекомендовать новые режимы антихеликобактерной терапии. Однако в Украине ситуация совершенно иная, поскольку в национальную медицинскую практику широкое использование эрадикации пришло гораздо позднее. К тому же резистентность Нр широко варьирует не только в разных странах, но и в различных регионах одной и той же страны. Поэтому выбор конкретных схем эрадикации должен определяться исключительно региональными уровнями антибиотикорезистентности Нр.
На что же следует ориентироваться терапевту, выбирая тот или иной вариант стартовой антихеликобактерной терапии в Украине и, в частности, в ее юговосточном регионе?
Как мы видим, принципиально возможны 2 схемы: с кларитромицином и с метронидазолом. Какой из них отдать предпочтение? Согласно данным, изложенным в Приказе Минздрава Украины от 03.08.2012 № 600 «Про затвердження та впровадження медикотехнологічних документів зі стандартизації медичної допомоги при диспепсії», средние национальные показатели резистентности Нр к кларитромицину и метронидазолу составляют 6,7 и 26 % соответственно. Общеизвестно, что устойчивость микроорганизма к антибиотику растет пропорционально длительности его использования. Совершенно очевидно, что кларитромицин появился в нашей практике гораздо позднее метронидазола и схемы с его использованием обеспечивают более высокий уровень эрадикации. Именно поэтому в упомянутом Приказе № 600 кларитромицинкомпонентная тройная терапия официально рекомендована в качестве приоритетной. К тому же, как показывает наш личный опыт, в случае неудачи стартовой терапии эффективность метронидазолкомпонентной квадротерапии выше, если метронидазол в этой стартовой терапии не использовался.
Второй вопрос: какой должна быть оптимальная продолжительность терапии? У наших зарубежных коллег отчетливо прослеживается тенденция к увеличению продолжительности лечения с 7 до 10–12, а затем и до 14 дней. К сожалению, это неизбежно приводит не только к удорожанию лечения, но и к росту побочных эффектов, наиболее частыми из которых являются антибиотикоассоциированная диарея (ААД) и аллергические реакции. К тому же, согласно Маастрихтскому консенсусу, удлинение лечения с 7 до 14 дней повышает частоту успешной эрадикации всего лишь на 5 %. Как показывает наш опыт, тройная кларитромицинкомпонентная терапия и сегодня способна обеспечить высокий уровень эрадикации (более 90 %) при 7дневном курсе. В своей практике мы используем другие способы повышения эффективности антихеликобактерной терапии: удвоение доз ИПП (согласно Маастрихтскому консенсусу, это повышает эрадикацию в среднем на 8 %) и включение в схему лечения пробиотика, содержащего большое количество лактобактерий. Последний не только улучшает переносимость антибиотиков, предотвращая тем самым ААД, но и обладает собственным антагонизмом по отношению к Нр.
Если врач общей практики, преодолев скепсис и недоверие, осознает необходимость проведения антихеликобактерной терапии, он в силу дефицита опыта наверняка столкнется с проблемой выбора оптимальной схемы лечения с учетом адекватных комбинаций препаратов, их дозировок, продолжительности курса лечения. Эта проблема успешно решается путем использования фиксированных комбинаций для эрадикации хеликобактера. Кроме того, схема приема комбинированного препарата понятнее пациенту, что, в свою очередь, повышает его приверженность терапии и способствует полному соблюдению предписаний врача. Немаловажно, что фиксированный препарат дешевле «набора» из отдельных препаратов. Кроме того, не секрет, что зачастую этот «набор», составленный по рекомендациям сотрудников аптечной сети, претерпевает существенные изменения (другие дозировки, оставляющее желать лучшего качество лекарственного средства и т.д.). И последнее: в случае неудачи эрадикационной терапии, проведенной самостоятельно подобранными препаратами, вопрос о том, какой из них «не сработал», остается без ответа. Фиксированные препараты помогают успешно решать эти проблемы.
Сегодня на фармацевтическом рынке Украины есть 3 комбинированных препарата, формально соответствующих требованиям к стандартной тройной терапии: Пилобакт Нео (ИПП [омепразол] + амоксициллин + кларитромицин), бетаклатинол (ИПП [пантопразол] + амоксициллин + кларитромицин) и орнистат (ИПП [рабепразол] + амоксициллин + орнидазол). В проведенном нами сравнительном исследовании их эффективности максимальный уровень эрадикации — 91,7 % — продемонстрировал Пилобакт Нео. Эффективность орнистата составила 73,3 %. Этот результат вполне ожидаем, поскольку орнистат содержит компонент, являющийся производным метронидазола, распространенность устойчивых штаммов Нр к которому встречается в Украине примерно в 4 раза чаще, чем к кларитромицину. Самый скромный результат — 61,7 % успешной эрадикации — оказался у бетаклатинола. Последнее вызывает вопрос хотя бы потому, что формально Пилобакт Нео и бетаклатинол являются аналогичными кларитромицинкомпонентными комбинациями для проведения тройной терапии. Ответ, очевидно, следует искать в ненадлежащем качестве некоторых генерических препаратов, попадающих на национальный фармацевтический рынок. Добавим, что продолжительность приема всех препаратов составила 7 дней. Именно данное обстоятельство позволяет нам утверждать, что стандартная 7дневная кларитромицинкомпонентная терапия в юговосточном регионе Украины продолжает сохранять высокую эффективность, и это делает неактуальным широкое использование альтернативных схем эрадикации. Аналогичной точки зрения придерживается один из ведущих украинских специалистов по вопросам диагностики и лечения Нрассоциированной патологии профессор С.М. Ткач. Он рекомендует строго следовать положениям Маастрихтского консенсуса IV, прежде всего относительно показаний к эрадикации, методов диагностики Нр и контроля эффективности лечения. Что касается самого лечения, то с учетом относительно невысокой резистентности к кларитромицину стандартную кларитромицинкомпонентную терапию 1й линии в Украине вряд ли стоит менять. При этом следует рассматривать проведение стандартной терапии в течение 10 и 14 дней, а также ее комбинацию с пробиотиками как возможные пути повышения эффективности эрадикационного лечения.
В связи с этим нам представляется уместным привести отдельные положения Декларации по борьбе с антимикробной резистентностью, которая была принята 16 сентября 2000 года на Всемирном дне резистентности в Торонто (Канада):
— антимикробные препараты — это невосстановимые ресурсы;
— резистентность коррелирует с клинической неэффективностью;
— резистентность создается человеком, и только человек может решить эту проблему;
— антибиотики — это социальные препараты;
— избыточное применение АП населением, неправильные представления и недооценка проблемы резистентности врачами и фармацевтами, назначающими АП, ведут к распространению резистентности.
Совершенно очевидно, что преждевременный переход на активное использование «терапии спасения» как раз и является примером нерационального использования антибактериальных ресурсов.
В заключение хотелось бы еще раз акцентировать внимание коллегтерапевтов на наиболее важных аспектах антихеликобактерного лечения.
1. Круг патологии, при которой с позиций доказательной медицины следует проводить эрадикационную терапию, достаточно широк и распространен в популяции. Нередко Нрассоциированные заболевания представляют собой междисциплинарную проблему. В связи с этим, а также с уменьшением доступности квалифицированной гастроэнтерологической помощи стандартную антихеликобактерную терапию, очевидно, должны назначать и врачи общей практики (терапевты).
2. Эффективная фиксированная комбинация позволяет избежать врачебных ошибок, самыми частыми из которых являются выбор неоптимальных комбинаций, дозировок и продолжительности лечения. В условиях, когда антихеликобактерная терапия назначается врачом общей практики (терапевтом), а не более опытным в данном вопросе гастроэнтерологом, это особенно важно.
3. Из всех имеющихся на рынке фиксированных комбинаций для эрадикации в юговосточном регионе Украины, по нашим данным, максимально эффективен Пилобакт Нео, который при 7дневном приеме в комбинации с пробиотиком обеспечивал успешную эрадикацию без клинически значимых побочных эффектов в 91,7 % случаев.
4. Оценка эффективности антихеликобактерной терапии требует обязательного проведения контроля эрадикации не ранее чем через 1 мес. после окончания приема как ИПП, так и антибиотиков.
5. Широкое использование новых эрадикационных схем/препаратов на сегодняшний день в Украине следует признать нерациональным и нецелесообразным.
6. В национальной практике в качестве возможных путей повышения эффективности эрадикации следует рассматривать удвоение доз ИПП, удлинение антихеликобактерной терапии до 10–14 дней и ее комбинацию с определенными пробиотиками.
СХЕМЫ ЭРАДИКАЦИИ ШТАММОВ HELICOBACTER PYLORI, РЕЗИСТЕНТНЫХ К МЕТРОНИДАЗОЛУ У ДЕТЕЙ | Щербаков
1. Щербаков П.Л. Поражения верхних отделов пищеварительного тракта у детей (клинико-эндоскопические исследования). Автореф. дис…. докт. мед. наук. М. 1997. 34 с.
2. Schwarz K. Ueber penetrierende Magen und Jejunalgeschwunde. Beitr. Klin. Chir. 1910; 67: 96-128.
3. Marshall B.J., Warren J.R. Unindencifield curved bacilli in the stomach of patient with gastritis and peptic ulceration. Lancet. 1984; 1: 1311.
4. Satoh K., Kimura K., Takimoto T., Kihira K. A follow up study of atrophic gastritis and intestinal metaplasia after eradication of Helicobacter pylori. Helicobacter. 1998; 3 (4): 236-240.
5. Eradication of Helicobacter pylori normalizes elevated mucosal levels of epidermal growth factor and its receptor. Am. J. Gastroenterol. 1999; 94 (10): 2885–2889.
6. Ganga-Zandzou P.S., Michaud L., Vincent P. еt al. http://www3.infotrieve.com/medline/infotrieve/results.asp?search+simplesearch+view1+nmed98-99+25+0+wAAA+(‘Helicobacter’):TANatural outcome of Helicobacter pylori infection in asymptomatic children: a two-year follow up study. Pediatrics. 1999; 104 (2): 216–221.
7. Nawaz A., Mohammed I., Ahsan K. et al. Clostridium difficult colitis associated with treatment of Helicobacter pylori infection. Am. J. Gastroenterol. 1998; 93(7): 1175–1176.
8. Sёoderlin M.K., Alasaarela E.,; Hakala M. Reactive arthritis induced by Clostridium difficult enteritis as a complication of Helicobacter pylori eradication. Clin. Rheumatol. 1999; 18 (4): 337–338.
9. http://www3.infotrieve.com/medline/infotrieve/results.asp?search+simplesearch+view1+nmed98-99+25+0+wAAA+(‘Adamsson+I’):AUAdamsson I.., Nord C.E., Lundquist P. et al. Comparative effects of omeprazole, amoxycillin plus metronidazole versus omeprazole, clarithromycin plus metronidazole on the oral, gastric and intestinal microflora in Helicobacter pylori-infected patients. J. Antimicrob. Chemother. 1999; 44 (5): 629–640.
10. Mahony D.E., Lim-Morrison S., Bryden L. et al. Antimicrobial activities of synthetic bismuth compounds against Clostridium difficile. Antimicrob. Agents. Chemother. 1999; 43 (3): 582–588.
11. Лыкова Е.А., Сидоренко С.В., Бондаренко В.М. и др. Антибактериальная терапия и коррекция микроэкологических нарушений при хеликобактериозе у детей. Диагностика и лечение. 1996; 12: 75–77.
12. Мазурин А.В. Болезни органов пищеварения. М.: Медицина. 1984. С. 254–333.
13. Аруин Л.И., Григорьев П.Я., Исаков В.А., Яковенко Э.П. Хронический гастрит. Амстердам. 1993. 362 с.
14. Zala G., Wirth H.P., Bauer S. et al. Eradication of metronidazole-resistant Helicobacter pylori: is omeprazole/amoxicillin a therapeutic alternative? Schweiz. Med. Wochenschr. 1994; 124 (31–32): 1385–1390.
15. Sieber C.C.; Frei R.; Beglinger C. et al. Helicobacter pylori resistance against metronidazole in Switzerland: implications for eradication therapy? Schweiz. Med. Wochenschr. 1994; 124 (31–32): 1381–1384.
16. Hudson N., Brydon W.G., Eastwood M.A. et al. Successful Helicobacter pylori eradication incorporating a one week antibiotic regimen. Aliment. Pharmacol. Ther. 1995; 9 (1): 47.
17. Holton J., Vaira D., Menegatti M. The susceptibility of Helicobacter pylori to the rifamycin, rifaximin. Antimicrob. Chemother. 1995; 35 (4): 545–549.
1800–99 | Оспа | 1806: Президент Томас Джефферсон упоминает об «искоренении» оспы в своем письме Эдварду Дженнеру |
Туберкулез | 1888: Чарльз В. Чапин призывает искоренить туберкулез | |
Бешенство | 1896: Бешенство ликвидировано в Англии | |
1900–49 | Желтая лихорадка | 1901: Желтая лихорадка ликвидирована в Гаване, Куба |
Анкилостомоз | 1907: Фонд Рокфеллера создает Санитарную комиссию по искоренению анкилостомы в США | |
Желтая лихорадка | 1915: Фонд Рокфеллера создает Комиссию по желтой лихорадке для искоренения болезни | |
Туберкулез | 1917: Решение об элиминации туберкулеза крупного рогатого скота в США | |
Анкилостомоз | 1922: Кампания Фонда Рокфеллера по борьбе с анкилостомами начинает постепенно сворачиваться из-за ограниченного успеха | |
Желтая лихорадка | 1923: Желтая лихорадка снова появляется в Бразилии после почти годичного отсутствия | |
Желтая лихорадка | 1928–29: Дополнительные вспышки желтой лихорадки в Бразилии | |
Желтая лихорадка | 1934: Предложение об исключении Aedes aegypti из Бразилии | |
Туберкулез | 1937: W.Х. Фрост сообщает, что туберкулез человека ликвидируется в США и других странах | |
Малярия | 1941: Anopheles gambiae исключено из Бразилии | |
Желтая лихорадка | 1943: Боливия стала первой страной, провозгласившей ликвидацию Aedes aegypti | |
Малярия | 1945: Anopheles gambiae исключено из Египта | |
Желтая лихорадка | 1947: ПАОЗ принимает предложение по ликвидации Aedes aegypti из Америки | |
1950–99 | Оспа | 1950: Панамериканская санитарная конференция утверждает цель ликвидации оспы в Северной и Южной Америке |
Рыскание | 1950: Панамериканская санитарная конференция одобрила цель устранения фрамбезии в Северной и Южной Америке | |
Малярия | 1951: ликвидация малярии на Сардинии | |
Рыскание | 1954: ВОЗ объявляет цель искоренить фрамбезию | |
Малярия | 1955: Восьмая сессия Всемирной ассамблеи здравоохранения приняла цель глобальной ликвидации малярии | |
Оспа | 1958: Одиннадцатая сессия Всемирной ассамблеи здравоохранения приняла цель глобальной ликвидации оспы | |
Оспа | 1966: Девятнадцатая сессия Всемирной ассамблеи здравоохранения приняла цель активизировать ликвидацию оспы к 1976 году | |
Малярия | 1969: ВОЗ меняет политику ликвидации малярии на политику борьбы с малярией | |
Оспа | 1970: Оспа ликвидирована в Северной и Южной Америке | |
Малярия | 1975: Европа объявлена свободной от малярии | |
Оспа | 1977: Оспа ликвидирована во всем мире | |
Корь | 1978: США объявляют цель ликвидировать корь к 1982 году | |
Оспа | 1980: ВОЗ объявляет о глобальной ликвидации оспы | |
Дракункулез | 1980: Индия начинает национальную программу ликвидации дракункулеза | |
Полиомиелит | 1985: ПАОЗ ставит цель ликвидации полиомиелита в Северной и Южной Америке к 1990 году | |
Корь | 1985: Европа ставит цель элиминации кори к 2000 году | |
Дракункулез | 1986: тридцать девятая сессия Всемирной ассамблеи здравоохранения объявляет цель ликвидации дракункулеза | |
Полиомиелит | 1988: Сорок первая сессия Всемирной ассамблеи здравоохранения объявляет цель глобальной ликвидации полиомиелита к 2000 г. | |
Дракункулез | 1988: Африканский регион ВОЗ поставил цель ликвидации дранкункулеза в Африке к 1995 году | |
Дракункулез | 1991: Сорок четвертая сессия Всемирной ассамблеи здравоохранения объявляет цель глобальной ликвидации дракункулеза к 1995 году | |
Полиомиелит | 1991: Последний случай местного дикого вируса полиомиелита в Американском регионе ВОЗ | |
Онхоцеркоз | 1991: ПАОЗ принимает решение ликвидировать заболеваемость онхоцеркозом в Американском регионе ВОЗ к 2007 г. | |
Полиомиелит | 1994: Регион Американского региона ВОЗ сертифицировал отсутствие полиомиелита | |
Корь | 1994: ПАОЗ устанавливает цель по элиминации кори в Американском регионе ВОЗ к 2000 г. | |
Полиомиелит | 1997: Последний случай местного дикого вируса полиомиелита в Западно-Тихоокеанском регионе ВОЗ | |
Корь | 1997: Регион Восточного Средиземноморья ВОЗ устанавливает цель по элиминации кори к 2010 году | |
Полиомиелит | 1998: Последний случай местного дикого вируса полиомиелита в Европейском регионе ВОЗ | |
2000–10 | Полиомиелит | 2000: Всемирная организация здравоохранения (Западно-Тихоокеанский регион) сертифицировала отсутствие полиомиелита |
Полиомиелит | 2002: Европейский регион ВОЗ сертифицировал отсутствие полиомиелита | |
Корь | 2002: Прекращение передачи местного вируса кори в Американском регионе ВОЗ | |
Корь | 2003: Западно-Тихоокеанский регион ВОЗ устанавливает цель по элиминации кори к 2012 году | |
Корь | 2005: Европейский регион ВОЗ установил цель по элиминации кори к 2010 г. | |
Корь | 2008 г .: Африканский регион ВОЗ устанавливает цель до элиминации кори |
Что нужно, чтобы искоренить болезнь?
Искоренение болезней – это святой Грааль для чиновников здравоохранения, поскольку искоренение болезней и улучшение здоровья в конечном итоге приносит пользу экосистемам на глобальном уровне.Такие инициативы, как One Health, поддерживаемые Центрами по контролю и профилактике заболеваний (CDC), направлены на интеграцию факторов здоровья человека, здоровья животных и окружающей среды при решении вопросов профилактики, лечения и искоренения болезней. One Health учитывает влияние изменения климата, увеличения присутствия людей в ранее незаселенных местах, усиления взаимодействия людей и животных и глобальной миграции людей и животных на распространение болезней. На сегодняшний день Всемирная организация здравоохранения (ВОЗ) объявила об официальном искоренении только двух болезней: оспы, вызываемой вирусом натуральной оспы (VARV), и чумы крупного рогатого скота, вызываемой вирусом чумы крупного рогатого скота (RPV).Оспа была древним заболеванием, которое на протяжении всей истории человечества вызывало эпидемии, унесшие 300-500 миллионов смертей (примерно 10% всех смертей) в 20 веке. Чума крупного рогатого скота была смертельным заболеванием крупного рогатого скота, которое приводило к гибели стад крупного рогатого скота по всей Европе и Африке с 18 по 20 века, пока целенаправленная глобальная кампания не привела к ее искоренению.
Волдыри от оспы на руке (NCP 10520), Национальный музей здоровья и медицины. Источник: https://www.flickr.com/photos/9
Коровы, убитые чумой крупного рогатого скота в Южной Африке, 1896 г.Источник: https://upload.wikimedia.org/wikipedia/commons/3/36/Rinderpest_1896-CN.jpg
Искоренение: определения определяют успех
Искоренение может быть сложно концептуально. Антрополог по инфекционным заболеваниям Томас Эйден Кокберн определил искоренение болезни как «исчезновение патогена, вызывающего болезнь». Согласно этому определению, оспа и чума крупного рогатого скота не искоренены. Образцы обоих вирусов все еще существуют в мире: в Соединенных Штатах и России есть запасы VARV, надежно хранящиеся, в то время как образцы RPV остаются на многих объектах по всему миру.Вымирание потребует уничтожения этих запасов – сложная тема, включающая геополитику и культурные нормы, а также микробиологию.Другое определение искоренения, широко принятое многими организациями, включая ВОЗ, – это «постоянное сокращение до нуля случаев инфекции, вызываемой конкретным возбудителем, в результате целенаправленных усилий». Последний зарегистрированный случай оспы произошел в Сомали в 1977 году, а последний зарегистрированный случай чумы крупного рогатого скота – в Кении в 2001 году.С тех пор официальные лица здравоохранения свернули эти кампании по ликвидации, и новых инфекций обнаружено не было, что привело к объявлениям об искоренении оспы в 1980 году и чумы крупного рогатого скота в 2011 году. Однако попытки искоренить другие болезни имели ограниченный успех. Такие организации, как ВОЗ и Chan Zuckerberg Biohub, перешли на использование термина «ликвидация болезни» с менее строгим и более достижимым определением, чем искоренение, чтобы повысить доверие к глобальным инициативам в области здравоохранения.Ликвидация болезни не требует постоянного сокращения заболеваемости во всем мире до нуля, а, скорее, снижения заболеваемости до нуля в определенной географической области. Одним из примеров этой разницы может быть ликвидация холеры в таких странах, как Перу, несмотря на то, что Vibrio cholera не искоренены во всем мире.
Контрольный список микробиолога для искоренения болезней
Чтобы определить, можно ли искоренить болезнь, учитывайте научные данные, политический климат и экономику.Ориентируясь на научные критерии, ученые и представители общественного здравоохранения могут изучить кампании по искоренению оспы и чумы крупного рогатого скота. Обе эти болезни обладали особыми характеристиками, которые облегчили их искоренение.# 1: Легко ли диагностировать или распознать болезнь?
Больной полиомиелитом проходит реабилитацию. Источник: https://flic.kr/p/KxE3q6 Симптомы заболевания – это один из способов быстро диагностировать наличие заболевания на уровне отдельного человека или сообщества.Кампания по искоренению оспы выиграла от характерных язв и высыпаний, вызванных VARV-инфекцией. Эти отчетливые симптомы позволили медицинским работникам во всем мире легко и эффективно диагностировать пациентов и отслеживать эпидемиологию болезней в своих сообществах. В качестве другого примера полиомиелит, вызванный полиовирусом (ПВ), вызывает характерный паралич с быстрым началом у подгруппы пациентов, который использовался в качестве маркера активной передачи инфекции в сообществе.Чем изощреннее методы диагностики болезней, тем меньше вероятность того, что болезнь будет искоренена.Малярия, болезнь, которую необходимо ликвидировать, исторически требовала квалифицированных медицинских специалистов, способных интерпретировать мазки крови пациентов для выявления инфицированных людей. Отсутствие квалифицированных паразитологов в эндемичных районах оказалось одной из причин неудач кампании 1950-х годов по искоренению малярии.
# 2: Есть нечеловеческий резервуар или переносчик (или оба)?
Патогены, вызывающие болезни, иногда могут инфицировать несколько видов, пересекая филогенетические границы.В этих случаях патоген существует у вида, который служит «резервуаром» для будущих инфекций других видов. Рассмотрим SARS, вызванный коронавирусом SARS (SARS-CoV). Хотя вирус был способен инфицировать людей и вызывать тяжелые заболевания, люди не были первоначальным хозяином для этого вируса. Подозревается, что резервуаром SARS-CoV, кроме человека, являются летучие мыши, поскольку у летучих мышей были обнаружены вирусы, которые имеют поразительное сходство с SARS-CoV. Хотя успешные стратегии сдерживания устранили передачу атипичной пневмонии среди людей, постоянное наличие резервуара для животных означает, что атипичная пневмония еще не является искорененной болезнью.Другие патогены не только способны инфицировать несколько видов, но и приспособились к использованию одного вида хозяина в качестве «вектора» для передачи другому виду хозяина. Многие членистоногие являются переносчиками болезней человека и практически не проявляют симптомов от патогенов, вызывающих патологию у людей. Например, лихорадка денге, вызываемая флавивирусом денге (DENV), передается людям через комаров-переносчиков. Даже если болезни будут ликвидированы в человеческих популяциях, их присутствие в нечеловеческих резервуарах или переносчиках делает возможным повторное заражение и дальнейшее распространение.
Поскольку вирус натуральной оспы поражает только людей, он был хорошей целью для искоренения. Передачу от человека к человеку можно остановить с помощью целевых кампаний вакцинации. Точно так же полиовирус, который также поражает только людей, был ликвидирован в 193 странах. Поскольку передача полиомиелита дикого типа ограничена Афганистаном, Нигерией и Пакистаном, официальное объявление о ликвидации уже не за горами. Напротив, желтая лихорадка, вызванная вирусом желтой лихорадки (YFV), возвращается.В Нигерии усилия по вакцинации против YFV остановили передачу и привели к снижению заболеваемости до нуля в 1996 году. К сожалению, снижение показателей вакцинации, наряду с существованием членистоногих-переносчиков и резервуаров приматов, вызвали вспышку желтой лихорадки в сентябре 2017 года. с тех пор сезонные вспышки желтой лихорадки.
# 3: Ограничено ли заболевание географически?
Нет никаких сомнений в том, что оспа затронула мировое сообщество. Многие из болезней, которые были искоренены (оспа и чума крупного рогатого скота) или которые были намечены для ликвидации ВОЗ, такие как полиомиелит, малярия, корь и краснуха, присутствуют во многих странах.Однако по мере того, как болезнь приближается к искоренению, заболеваемость становится все более ограниченной географически. Это явление имеет множество эффектов.По мере того как болезнь становится более географически ограниченной, в регионах с нулевой заболеваемостью наблюдается плато выгод от кампаний по искоренению без изменения социальных, политических и экономических издержек. Это может привести к тому, что страны, которые больше не страдают от болезни, сократят свою поддержку. Эта проблема препятствовала искоренению оспы, и полиомиелит сталкивается с аналогичным препятствием.
Одним из положительных преимуществ более ограниченной географии является возможность сузить фокус кампании на этих регионах. Некоторые болезни, такие как дракункулез (дракункулез) или фрамбезия, никогда не были широко распространены в географическом плане. Таким образом, ВОЗ и другие организации создали целевые кампании, которые поставили эти болезни на грань искоренения.
# 4: Есть ли вакцина? Есть ли другие альтернативы, препятствующие передаче?
Вакцины спасли бесчисленное количество жизней и предотвратили невыразимые страдания.Стратегии ликвидации оспы и чумы крупного рогатого скота основывались на вакцинах, и большинство текущих кампаний по ликвидации болезней включают стратегии вакцинации. Эти кампании, кажется, подчеркивают необходимость вакцины и могут даже предполагать, что вакцины имеют решающее значение для искоренения. Но действительно ли необходима вакцина, чтобы свести к нулю передачу болезней? Дракункулез, вероятно, будет искоренен в ближайшем будущем. Это вызвано попаданием в организм личинок Dracunculus medinensis из загрязненных источников воды.Через год после заражения у пациентов появляются мучительно болезненные волдыри на ступнях и ногах. Пациенты ищут облегчения, замачивая волдыри в источниках воды, таких как реки и пруды, вызывая появление взрослого червя, который выпускает в воду инфекционные личинки. Нет доступных терапевтических средств или вакцин от дракункулеза.
Жизненный цикл Dracunculus medinensis. Источник: https://www.cdc.gov/parasites/images/guineaworm/Dracunculiasis_LifeCycle_3.jpg
Каким образом болезнь дракункулеза близка к искоренению без вакцины? Именно здесь вступают в игру творческие стратегии сдерживания инфекционных заболеваний. Центр Картера в сотрудничестве с ЮНИСЕФ распространил системы фильтрации воды и активизировал усилия по обеспечению питьевой водой пострадавших общин. Медицинские работники также не позволяют пациентам входить в источники воды, вместо этого оборачивая взрослую нематоду вокруг палки и медленно и методично вытаскивая ее. Просвещение населения и выявление инфицированных людей привело к снижению заболеваемости с 3.5 миллионов в 1986 году до 53 случаев в 2019 году. Если дракункулез будет искоренен, кампания станет первой, кто сделает это без вакцины, что свидетельствует о том, что есть несколько способов искоренить болезнь, которые не зависят от вакцины.
Ликвидация болезней: путь вперед
Мы не можем забывать, что искоренение болезни зависит не только от научного контекста. Ликвидация оспы и чумы крупного рогатого скота потребовала усилий политического, экономического и социального образования, которые привели к их успеху.Глобальная координация и отслеживание вспышек болезней требует сотрудничества на международном уровне. Без политической поддержки глобальные кампании в области здравоохранения не могут быть успешными. Без экономической поддержки невозможно эффективно мобилизовать важнейшие ресурсы.Одним из наиболее вызывающих беспокойство событий последнего времени является растущее недоверие к науке, о чем свидетельствует рост настроений против вакцинации. Завоевание и поддержание общественного доверия к науке и глобальным инициативам в области здравоохранения станет краеугольным камнем кампаний по искоренению.Ликвидация оспы была прообразом для будущих кампаний по искоренению и дала ценные уроки, такие как необходимость политических и бюрократических рамок для поддержки усилий по вакцинации и необходимость иметь четкие, измеримые, универсальные цели для отслеживания прогресса в любом конкретном регионе. Станет ли искоренение болезни нормой или оспа и чума крупного рогатого скота останутся исключительными? Время покажет.
Всегда ли лучший путь – искоренение болезней?
Сара Горман из Гарвардского университета обсуждает подводные камни усилий по искоренению болезней.
Макфадден Дж. (2010) Убить убийцу: что дальше с оспой? PLoS Pathog 6 (1): e1000727. doi: 10.1371 / journal.ppat.1000727Нет никаких сомнений в том, что искоренение оспы, разрушительной болезни, уносящей миллионы жизней, было одним из величайших достижений медицины века. В 1980 году Всемирная ассамблея здравоохранения торжественно провозгласила искоренение болезни. Ликвидация оспы требовала чрезвычайно целенаправленного эпиднадзора, а также использования стратегии, называемой «кольцевой вакцинацией», при которой каждый, кто мог заразиться оспой, был немедленно вакцинирован.Почему оказалось возможным искоренить оспу? Во-первых, оспу легко и быстро распознать из-за характерной сыпи, связанной с болезнью. Во-вторых, оспа может передаваться только от человека. Отсутствие резервуара для животных значительно упрощает борьбу с болезнью.
Успех кампаний по искоренению оспы привел к постоянным призывам к искоренению других инфекционных заболеваний с 1980 года. К сожалению, искоренение болезни может быть трудным и даже невозможным в случае многих инфекционных заболеваний, и очень важно учитывать особенности каждой болезни, чтобы прийти к правильному выводу о том, является ли стремление к искоренению болезни лучшим подходом.Во-первых, важно четко понимать, что означает «искоренение». Ликвидация относится к целенаправленным усилиям по снижению до нуля случаев инфекционных заболеваний во всем мире. Это не то же самое, что вымирание, полное уничтожение всех возбудителей болезней или переносчиков болезней. Ликвидация, третья концепция, включает полное отсутствие болезни в определенной популяции в определенный момент времени. Таким образом, искоренение болезни определяет особую стратегию борьбы с инфекционными заболеваниями; существуют другие варианты, которые в некоторых обстоятельствах могут быть более желательными.
Может ли стремление искоренить болезнь когда-либо быть вредным? Это может быть в случае некоторых заболеваний, которые нелегко поддаются полному искоренению. Заявление об искоренении логически завершает профилактические мероприятия, сокращает усилия по обучению медицинских работников распознаванию и лечению искорененного заболевания и останавливает исследования болезни и ее причин. Когда кампании по искоренению болезни показывают некоторый успех, финансовая поддержка борьбы с этой болезнью резко падает.Поэтому широкое распространение информации об усилиях по искоренению без подтверждения успеха может оказаться вредным. В этих случаях самоуспокоенность может преждевременно заменить столь необходимую бдительность. Если есть разумная вероятность рецидива болезни или если пожизненный иммунитет против болезни невозможен, то попытка искоренения может оказаться катастрофической, поскольку в случае повторного появления инфраструктуры для контроля болезни не будет. Выявление оставшихся случаев заболевания, находящегося на грани искоренения, может быть невероятно дорогостоящим и отвлекать государственные деньги в странах с ограниченными ресурсами на удовлетворение более насущных потребностей.
Другая потенциальная проблема, связанная с усилиями по искоренению болезней, заключается в том, что в качестве вертикального подхода они могут истощать ресурсы из горизонтальных подходов, таких как создание потенциала и укрепление системы здравоохранения. Некоторые выступают за более «диагональный» подход, при котором используются вмешательства по конкретным заболеваниям для улучшения общей системы здравоохранения. Третьи утверждали, что вертикальные подходы, которые лечат одно заболевание за раз, могут отвлекать ресурсы от первичной медико-санитарной помощи и способствовать дисбалансу в местных медицинских услугах.Вертикальные схемы могут также привести к непропорциональной зависимости от международных НПО, что может привести к ослаблению местных систем здравоохранения.
Малярия является прекрасным примером того, как бушуют споры о том, будут ли успешными усилия по искоренению. Существует четыре вида одноклеточных паразитов, вызывающих малярию, наиболее распространенными из которых являются P. falciparum и P. vivax . P. falciparum является наиболее смертоносным, а P. vivax является наиболее распространенным.Эти два вида затрудняют создание единой надежной вакцины. Еще больше осложняет разработку вакцины против малярии способность паразитов мутировать, так что даже заражение малярией не дает пожизненного иммунитета. Кроме того, малярия поражает животных-переносчиков (комаров). Совершенно очевидно, что полностью искоренить малярию будет огромной проблемой и, возможно, даже невозможным. Начиная с 1955 года, была предпринята глобальная попытка искоренить малярию после того, как стало известно, что опрыскивание домов ДДТ является дешевым и эффективным способом уничтожения комаров.Инициатива оказалась успешной в ликвидации малярии в странах с умеренным климатом и сезонной передачей малярии. Тем не менее, в некоторых странах, таких как Индия и Шри-Ланка, произошло резкое сокращение случаев заболевания малярией только для того, чтобы увидеть резкий рост, когда усилия неизбежно прекратились. Положение дел в Индии и Шри-Ланке демонстрирует некоторые негативные последствия кампаний по искоренению, которые не были доведены до конца. Проект был заброшен из-за широко распространенной лекарственной устойчивости, устойчивости к доступным инсектицидам и неустойчивого финансирования со стороны стран-доноров.Эта неудача была пагубной, потому что оставленные попытки борьбы с переносчиками привели к появлению тяжелых устойчивых штаммов, которые было гораздо труднее лечить.
Недавно снова начались дискуссии об искоренении малярии. В настоящее время у таких агентств, как Фонд Гейтса, имеется значительная политическая воля и финансирование усилий по искоренению малярии. Инициатива по программе исследований по искоренению малярии, частично финансируемая Фондом Гейтса, привела к значительному прогрессу в определении того, что необходимо сделать для достижения искоренения.Даже в этом случае сторонники искоренения малярии признают, что для достижения этой цели потребуется не менее 40 лет. Неясно, как долго продержится нынешняя политическая воля и финансирование. Есть опасения, что политическая воля может ослабнуть перед лицом предполагаемых ежегодных затрат в 5 миллиардов долларов на поддержание усилий по искоренению.
Искоренение болезни, несомненно, может стать невероятно важным триумфом общественного здравоохранения, как это видно на примере оспы. Но когда следует применять эту стратегию и когда лучше всего избегать рисков, связанных с усилиями по искоренению, которые могут потерпеть неудачу? Необходимо принимать во внимание многочисленные научные, социальные и экономические факторы, связанные с данным заболеванием.Может ли микроб, связанный с этим заболеванием, сохраняться и размножаться у нечеловеческих видов? Придает ли естественное заболевание или иммунизация пожизненный иммунитет или может произойти повторное инфицирование? Является ли наблюдение за заболеванием относительно простым или длительные инкубационные периоды и скрытая инфекция затрудняют выявление каждого последнего случая заболевания? Приемлемы ли вмешательства, связанные с искоренением болезни, включая карантин, для сообществ во всем мире? Превышает ли чистая выгода от искоренения затраты на усилия по искоренению? Предложения по искоренению болезней должны быть тщательно взвешены с учетом потенциального риска.Программы искоренения болезней не должны представляться как дальновидные, идеалистические цели, они должны быть четко определены в контексте биологических и экономических аспектов конкретной болезни и проблем, которые она представляет.
Автор заявляет об отсутствии конкурирующих интересов.
Разница между искоренением и уничтожением
В области общественного здравоохранения такие термины, как «искоренение» и «устранение», являются обычными. Однако среднему читателю эти два слова могут показаться идентичными.
Итак, в чем разница в словарном запасе? А что на самом деле означают эти фразы?
Как вы, наверное, догадались, устранение болезни и искоренение болезни подразумевают избавление от болезни. Но один термин применяется на местном уровне, а другой – в глобальном масштабе:
Ликвидация
- Если болезнь ликвидирована, ее передача перестает быть активной в определенной области, например в стране. Если спросят, ВОЗ может принять официальное решение о том, свободна ли страна от этой болезни.
- Страна, желающая получить это признание, должна добровольно запросить его через официальный процесс подачи заявок. После запроса генеральный директор ВОЗ принимает окончательное решение. Они выдают свидетельство об элиминации, если страна вне всяких разумных сомнений докажет, что перерыв в передаче болезни длился не менее трех лет подряд.
Ликвидация
- Если болезнь ликвидирована, ее передача во всем мире прекратится, и не останется ни одного случая.Это делает ненужными дальнейшие меры вмешательства.
- Пока мы добились искоренения только оспы. ВОЗ объявила о прекращении заражения оспой в 1980 году. CDC назвал это событие «крупнейшим достижением международного общественного здравоохранения».
Как устраняются и искореняются болезни?
Локальный контроль заболеваний обычно является первым шагом. Это означает, что эксперты прилагают целенаправленные и постоянные усилия для снижения показателей новых инфекций, смертей и текущих инфекций в одном регионе.Это может быть город, штат или даже страна.
Если специалисты могут контролировать болезнь до такой степени, что дальнейшая передача в этом районе невозможна, ее ликвидируют. После нескольких лет исключения страны, скорее всего, обратятся в ВОЗ для сертификации.
Хотя это повод отметить, но продолжение этого события не гарантируется.
В конце сентября казалось, что Соединенные Штаты потеряют статус элиминации кори. К счастью, страна едва ли избежала этой проблемы после того, как подтвердила, что некоторые недавние случаи были доставлены из-за границы.
Это не означает, что США в чистом виде от кори. Сохранение случаев заболевания в ближайшие годы может стоить стране статуса страны, свободной от кори. Это потенциальное событие еще больше отдалит искоренение болезни.
Организации надеются, что многие другие болезни вскоре получат сертификат о ликвидации.
Например, полиомиелит эндемичен только в трех странах. Тем не менее, многие другие страны все еще испытывают вспышки или находятся под угрозой их возникновения.Филиппины недавно попали в заголовки газет после того, как объявили о первых новых пациентах с полиомиелитом за два десятилетия.
К сожалению, несмотря на успешные усилия, не всегда удается искоренить болезнь.
Доктор Стивен Дж. Глакман, медицинский директор Penn Global Medicine, упомянул малярию как случай этого. Он сказал:
«Вы не можете полностью избавиться от малярии, потому что переносимые комарами паразиты, передающие болезнь, могут развить лекарственную устойчивость. Но вы можете контролировать это с помощью стратегий здравоохранения и профилактики, таких как агрессивная борьба с комарами, надкроватные сетки и противомалярийные препараты.”
Passport Health поможет вам избежать заражения малярией во время путешествий. Для получения конкретных рекомендаций и расходных материалов для вашего пункта назначения позвоните нам по телефону или запишитесь на прием онлайн и поговорите с медсестрой в путешествии.
Помогла ли эта статья вам понять разницу между контролем, элиминацией и искоренением болезней? Знаете ли вы, что до сих пор искоренена только одна болезнь? Сообщите нам об этом в комментариях ниже или через Facebook и Twitter.
Написано для Паспорта здоровья Кэтрин Мейкл.Кэтрин – писатель-исследователь и гордая американка британского происхождения в первом поколении, живущая во Флориде, где она родилась и выросла. У нее страсть к путешествиям и любовь к письму, которые идут рука об руку.
Контроль и ликвидация – Приоритеты борьбы с болезнями в развивающихся странах
В этом разделе мы применяем рассуждения, разработанные ранее, для проведения эмпирического анализа трех последних программ ликвидации – оспы и двух текущих программ – полиомиелита и дракункулеза.
Оспа
Как отмечалось ранее, искоренение оспы было достигнуто в октябре 1977 г., через 11 лет после начала усиленной программы. После проведения строгой процедуры сертификации ВАЗ объявил о ликвидации оспы в 1980 году.
Феннер и другие (1988) оценили ежегодные выгоды от ликвидации оспы для развивающихся и промышленно развитых стран (см.). Эти совокупные оценки, полученные путем пропорционального распределения оценок выгод от ликвидации оспы для Индии и Соединенных Штатов для всех развивающихся и промышленно развитых стран, соответственно, предполагают, что развивающиеся страны выиграли от ликвидации оспы больше, чем промышленно развитые страны.В качественном отношении вырисовывается непротиворечивая картина: искоренение оспы было не только огромным капиталовложением для всего мира; это также была инвестиция, которая принесла пользу каждой стране, как богатой, так и бедной.
Таблица 62.1
Выгоды и затраты на ликвидацию оспы (в миллионах долларов США) .
Когда начались усилия по искоренению оспы, оспа больше не была эндемической в большинстве промышленно развитых стран. Тем не менее, этим странам необходимо было поддерживать иммунитет населения перед угрозой возможного завоза из эндемичных стран.Они выиграют от искоренения не только за счет прекращения вакцинации и связанных с ней затрат, но и за счет возможности уменьшить количество карантинных инспекторов в портах въезда и избежать затрат на лечение, связанных с побочными эффектами этой живой вакцины.
Все еще эндемичные страны также сократят расходы на вакцинацию, хотя большинство из них вакцинируют лишь сравнительно небольшую часть своего населения. Большим преимуществом для них было предотвращение потерь от болезней, включая огромное количество погибших.Ряд развивающихся стран уделяют профилактике оспы высокий приоритет, о чем свидетельствует число стран, которым удалось прервать передачу инфекции без международной помощи. В этот список входит Китай, который не был членом ВОЗ на момент начала усилий по ликвидации.
Действительно, как показано на рисунке, на все еще эндемичные страны пришлось примерно две трети затрат на ликвидацию посевов в размере 298 миллионов долларов США. Остаток пополнился международными источниками. Если последние затраты интерпретировать как дополнительные затраты на достижение ликвидации, то соотношение выгод и затрат при глобальной ликвидации оспы превышает 450: 1, что является исключительно высоким показателем.Даже с учетом затрат эндемичных стран, выгода от искоренения превысила затраты на необычно большую сумму.
Бриллиант (1985) подсчитал, что ежегодные затраты на кампанию по искоренению оспы в Индии составляют около 17 миллионов долларов США в год, включая косвенные затраты (потеря производительности, вызванная побочными реакциями на вакцинацию) и альтернативные издержки (медицинские работники отвлекаются от других программ. ). Эти затраты составляли лишь часть годовой выгоды от искоренения для Индии, которая, по расчетам Бриллианта, составила 150 миллионов долларов США.Оценки пользы Феннера и других (1988) намного больше, а у Рамайи (1976) меньше, но все три исследования делают один и тот же (качественный) вывод: искоренение оспы было хорошим вложением для Индии. Basu, Ježek, and Ward (1979, 312) представляют оценки, идентичные оценкам Рамая (1976), но без указания авторства.
Первоначально Индия решила провести программу по оспе всего через месяц после того, как ВАЗ проголосовала за искоренение болезни во всем мире в 1959 году. Однако эта попытка провалилась, в основном по административным причинам (Basu, Ježek, and Ward 1979; Brilliant 1985; Fenner и др. 1988 г.).По сути, у Индии был экономический стимул для борьбы с оспой самостоятельно (Brilliant 1985, 33), но не хватало организационного потенциала и эффективной стратегии для достижения этой цели. Однако обратите внимание, что у Индии были другие приоритеты в области здравоохранения, включая планирование семьи. По словам Бриллианта (1985, 33), «для индийских специалистов по планированию здравоохранения, которые тогда были заняты чрезвычайными ситуациями и конкурирующими политическими требованиями к скудным ресурсам, долгосрочные выгоды от искоренения болезней не были большим стимулом. Планировщики здравоохранения чувствительны к ближайшим политическим реалиям, и преимущества искоренения оспы будут реализованы только в будущем, когда ежегодные расходы на оспу в размере 3 миллионов долларов можно будет использовать для решения других проблем со здоровьем.В то же время, однако, затраты на выделение стольких скудных ресурсов на одну программу, а не на удовлетворение многих медицинских потребностей были высоки “.
дает оценку преимуществ ликвидации оспы для Соединенных Штатов. Общая выгода от ликвидации оспы для Соединенных Штатов Штаты примерно того же порядка, что и Индия, но разбивка другая. В то время как Индия выиграла в основном от предотвращенных инфекций, Соединенные Штаты выиграли в основном от избежания вакцинации. К тому времени, когда была запущена программа ликвидации, Соединенные Штаты уже прекратили распространение оспы передачи, но вакцинация была дорогостоящей как с экономической точки зрения, так и с точки зрения здоровья человека (небольшое количество людей ежегодно умирало от инфекций, вызванных живой вакциной).Защита нации от завезенных инфекций потребовала дополнительных затрат.
Таблица 62.2
Преимущества ликвидации оспы для Соединенных Штатов, 1968 год (Миллионы долларов США) .
Что касается здоровья, то ликвидация оспы спасла миллионы жизней; с экономической точки зрения, это принесло выгоду, во много раз превышающую затраты. Трудно определить еще одну инвестицию, которая принесла сравнимую прибыль и принесла пользу каждой стране. Одна из причин, по которой экономические показатели искоренения оспы были столь благоприятными, заключается в том, что у всех стран были сильные стимулы для того, чтобы присоединиться к искоренению болезни.Чтобы добиться искоренения, потребовались огромные организационные усилия, но при относительно небольших дополнительных затратах. Призрак глобального терроризма недавно заставил некоторые страны подготовиться к возможному нападению оспы путем создания запасов вакцины. Хотя такие действия снижают эффективность искоренения, экономические показатели остаются благоприятными.
Оспа, однако, была особым случаем. Многие признаки болезни и вакцины способствовали искоренению. Вакцина была термостойкой, и для защиты человека на срок от 5 до 10 лет требовалась всего одна доза.Вакцинация была легко проведена и защищена сразу после применения. У каждого инфицированного человека наблюдалась типичная, легко распознаваемая сыпь, что позволяло проводить точное наблюдение без использования лабораторной диагностики. Заболевание распространяется медленно, так что передачу можно было легко остановить, изолировав пациента и вакцинировав контактных лиц в этом районе.
Полиомиелит
Программа ликвидации полиомиелита, начатая ВАЗ в 1988 году, достигла значительного прогресса (CDC 2003a, 2003b, 2003c, 2004a, 2004c, 2004e, 2004g, 2005).Заболеваемость паралитическим полиомиелитом у детей снизилась более чем на 99 процентов, с примерно 1000 случаев в день во всем мире в 1988 году до менее 4 случаев в день в 2003 году. Число эндемичных по полиомиелиту стран также уменьшилось со 125 в 1988 году до всего 6 к 2003 г. (Афганистан, Арабская Республика Египет, Индия, Нигер, Нигерия и Пакистан). Это похвальное сокращение явилось результатом повторяющихся кампаний вакцинации легко вводимой оральной полиовакциной в целые регионы, страны и большие группы населения.
В 2004 г., однако, иммунизация против полиомиелита в северной Нигерии была приостановлена на длительный период из-за опасений зараженных вакцин, что привело к развитию эпидемий по всей стране. Болезнь распространилась также на 10 других африканских стран, а также на Саудовскую Аравию, Йемен и Индонезию. Передача снова была восстановлена в нескольких африканских странах (Буркина-Фасо, Центральноафриканская Республика, Чад, Кот-д’Ивуар и Судан). Предпринимаются героические усилия по борьбе с этими вспышками с помощью широкомасштабной иммунизации, но в таких странах, как эта, где службы здравоохранения испытывают стресс, а инфраструктура здравоохранения, связи и транспорта являются слабыми, передачу болезней трудно остановить.Тем временем другие страны во всем мире, которые кажутся свободными от полиомиелита, продолжают свои программы вакцинации, но им становится все труднее поддерживать импульс интереса, усилий и финансирования.
Трудности поддержания надежных систем эпиднадзора во всех развивающихся странах наглядно продемонстрировали обнаружение полиомиелита в Судане в мае 2004 г., более чем через три года после того, как был зарегистрирован последний случай заболевания (CDC 2005). Тем временем образцы от 75 до 90 процентов таких случаев обрабатывались в лаборатории, и меры по надзору за случаями острого вялого паралича были полностью удовлетворительными.Сначала считалось, что суданские случаи были вызваны импортом из Нигерии, и, действительно, некоторые случаи так и были. Однако из более подробных лабораторных исследований было определено, что дикий вирус типа 1 циркулировал необнаруженным более трех лет, а вирус типа 3 – почти пять лет.
Очевидно, что прекращение продолжающейся передачи дикого полиовируса само по себе является сложной задачей, успех которой ни в коем случае нельзя считать бесспорным. Проблемным открытием с момента начала глобальной программы искоренения стало обнаружение того, что люди с определенными иммунологическими расстройствами выделяют вирус вакцины против полиомиелита в течение многих месяцев или лет, таким образом, служа резервуаром для этого вируса.Вирус, в свою очередь, может вернуться в нейровирулентную форму, которая способна вызывать вспышки заболевания (Bellmunt and others 1999). Такие люди могут быть полностью бессимптомными, и их невозможно идентифицировать, кроме как с помощью фекальных культур. Более того, не известно никакого лечения, которое могло бы остановить их распространение вируса. Они представляют собой практически непреодолимую проблему для нынешних усилий по ликвидации полиомиелита.
Программе еще больше мешает инструмент, который обеспечил такой успех – оральная полиовакцина (ОПВ).В условиях ограниченных ресурсов полиомиелит лучше всего контролировать с помощью недорогой, живой и легко вводимой пероральной вакцины. Живая вакцина выводится из организма и может заразить других чувствительных контактов. Способность ОПВ иммунизировать других людей косвенно делает ее идеальной вакциной для достижения высокого уровня популяционного иммунитета, особенно для наиболее труднодоступных групп населения с низким социально-экономическим статусом. Однако выделенный вирус иногда возвращается в патологическое состояние, вызывая не только случаи, но и вспышки паралитического полиомиелита, связанного с вакцинацией, который может возникнуть только через несколько месяцев или даже лет после введения вакцины (Kew and others 2004).К сожалению, альтернативная инактивированная вакцина против полиомиелита (ИПВ) не сразу становится вариантом во многих странах, не в последнюю очередь потому, что глобальные производственные мощности не могут удовлетворить спрос. Другие проблемы включают текущую разницу в стоимости между ОПВ и ИПВ, повышенную сложность введения вакцины шприцем и иглой и необходимость достижения более высоких показателей охвата ИПВ, поскольку она не передается от человека к человеку, как ОПВ.
К сожалению, если прекратить использование ОПВ при отсутствии альтернативного иммунитета, полиовирусы, скорее всего, будут циркулировать тихо (Eichner and Dietz 1996) и появиться снова.Предварительные результаты модели, представленной ВОЗ, указывают на более чем 60-процентную вероятность вспышки в течение двух лет после возможного прекращения приема ОПВ во всем мире (ВОЗ, 2004 г.) из-за постоянной циркуляции необнаруженных вирусов живых вакцин, которые могут рецидивировать. Вспышки уже наблюдались в нескольких регионах, где сокращение использования живой вакцины оставило карманы восприимчивых людей, которые в конечном итоге подверглись воздействию патогенных вирусов вакцинного происхождения (Kew and others 2002). Такая вспышка может произойти с катастрофической скоростью, потому что вирус полиомиелита гораздо более заразен, чем вирус оспы.В развивающихся странах практически все случаи полиомиелита имели место среди лиц младше пяти лет, причем пожилые люди были защищены естественным иммунитетом, имевшим место ранее в результате инфицирования. Следовательно, в течение пяти лет после прекращения вакцинации уровень иммунитета населения в развивающихся странах будет не лучше, чем он был до введения вакцинации. С учетом этого кажется сомнительным, что всех министров здравоохранения можно убедить призвать к прекращению вакцинации против полиомиелита в масштабах всей страны, учитывая неопределенность обнаружения вирусов в столь многих отдаленных и недоступных регионах мира.
По определению, ликвидация подразумевает удостоверение прекращения передачи вируса и отсутствия резервуаров, чтобы можно было прекратить контрольные вмешательства. Как отмечалось ранее в этой главе, только по этой причине искоренение приносит дивиденды. Хотя прекращение передачи вируса дикого полиомиелита теоретически возможно, препятствия на пути к достижению и поддержанию этой цели огромны. В настоящее время трудно предвидеть будущее, которое не предусматривает продолжения программы вакцинации, возможно, с использованием ИПВ в странах, которые могут позволить себе существенные дополнительные расходы, и с использованием ОПВ во всех других странах.
Инициатива по ликвидации полиомиелита, как и в случае оспы, должна была опираться в первую очередь на добровольные пожертвования как в ВОЗ, так и на двусторонней основе. Особенно важную роль сыграли Фонд Ротари Интернэшнл и Фонд Билла и Мелинды Гейтс. С 1988 по 2004 год на эти усилия было потрачено более 3 миллиардов долларов США (ВОЗ, 2003).
Каковы экономические аспекты ликвидации полиомиелита? Барт, Фулдс и Патриарка (1996) разработали первый глобальный анализ затрат и выгод от ликвидации полиомиелита, начиная с затрат, понесенных с 1986 года, когда Панамериканская организация здравоохранения предприняла региональные усилия по ликвидации полиомиелита, и до 2040 года.Они предположили, что ликвидация будет достигнута в 2005 году с использованием ОПВ, и что вакцинация прекратится после того, как ликвидация будет сертифицирована. Выгоды (например, затраты со скидкой 6%) отражают предотвращенные расходы на неотложную помощь и предотвращенные расходы на вакцинацию после сертификации. Их анализ показал, что эта инициатива окупится к 2007 году и принесет миру более 13 миллиардов долларов к 2040 году – обнадеживающий результат, но он был основан на предположении, что все вакцинации внезапно прекратятся в 2005 году.
Хан и Эрет (2003) разработали аналогичный анализ, но представили детализацию по регионам. Они оценили затраты и медицинские расходы, которых удалось избежать при иммунизации и ликвидации полиомиелита в период с 1970 по 2050 год, исходя из предположения, что вакцинация может быть прекращена после 2010 года. Как показано, Хан и Эрет подсчитали, что иммунизация и ликвидация полиомиелита в целом повлекут за собой отрицательные чистые затраты с Европой. и Америка экономит больше всего, а другие регионы несут положительную чистую стоимость. По сравнению с другими медицинскими мероприятиями, эти затраты для развивающихся стран могут быть сравнительно рентабельными.Однако Хан и Эрет отмечают, что стоимость сэкономленного года жизни с поправкой на инвалидность (DALY) высока для развивающихся стран (см.). Как они объясняют (Хан и Эрет 2003, 705), «это означает, что без финансовой поддержки со стороны развитых стран мира многие развивающиеся страны не выбрали бы меры вмешательства против полиомиелита для осуществления. С точки зрения развитых стран, оказание поддержки поскольку программа по полиомиелиту не просто помогает бедным и обездоленным, она фактически представляет собой хорошее экономическое вложение.”
Таблица 62.3
Чистые затраты на иммунизацию и ликвидацию полиомиелита (в миллионах долларов США) .
К сожалению, оба этих исследования затрат и выгод имеют существенные ограничения. Во-первых, оба показывают, что ликвидация является экономически привлекательной, если одно из них включает все затраты и выгоды от начала этой программы. Поскольку искоренение еще не достигнуто, этот подход сочетает ретроспективную оценку и перспективный анализ (исторические расходы и выгоды не учитываются и поэтому не имеют отношения к текущей ситуации).Во-вторых, в обоих исследованиях рассчитываются выгоды и затраты относительно мира без иммунизации. Лучшим подходом было бы рассчитать чистую выгоду от искоренения по сравнению с альтернативой оптимальной программы борьбы. Выбор не между бездействием и искоренением. Это между оптимальным уровнем контроля и искоренения. Наконец, в обоих исследованиях предполагается, что вакцинация может быть прекращена в 2005 или 2010 годах. Как объяснялось ранее, такая возможность крайне маловероятна.
В более позднем анализе, проведенном Сангруджи, Касерес и Кочи (2004), рассчитываются затраты на 15 лет после достижения цели сертификации ликвидации в 2005 году для трех различных сценариев: продолжение использования ОПВ, прекращение приема ОПВ с дополнительным использованием убитых или инактивированная вакцина против полиомиелита и отказ от ОПВ с помощью универсальной ИПВ.показывает свои результаты.
Таблица 62.4
Затраты на ликвидацию полиомиелита (в миллионах долларов США) .
Соответствующие затраты для стран со средним и высоким уровнем дохода одинаковы для всех трех сценариев, отражая предположение, что страны с высоким уровнем дохода перейдут на ИПВ к 2005 году, а страны со средним уровнем дохода сделают это в период с 2006 по 2008 год. сценарии различаются только для стран с низкими доходами. В первом сценарии ожидается, что эти страны продолжат плановую иммунизацию с использованием ОПВ; во втором – иммунизация прекращается в 2011 году, после чего следует система эпиднадзора и ответных мер.В третьем сценарии страны с низкими доходами присоединяются к другим и переходят на ИПВ в период между 2008 и 2010 годами. Из этих трех сценариев второй наиболее близок к стратегии после ликвидации полиомиелита 2005 года, которую в настоящее время поддерживает руководство программы ликвидации полиомиелита.
К сожалению, и этот анализ недостаточен. Во-первых, прерывание передачи произойдет не раньше 2006 г., а на сертификацию уйдет еще три года. Следовательно, анализ затрат после ликвидации должен начаться не раньше 2009 г., и до этого времени необходимо будет нести расходы на продолжение иммунизации.Во-вторых, анализ предполагает, что способность поставлять ИПВ превышает текущие оценки. Не очевидно, что этот сценарий осуществим или, если бы это было так, если бы затраты на увеличение производства были адекватно отражены в расчетах. В-третьих, что наиболее важно, это указывает на то, что только страны с низким уровнем доходов получат выгоду от ликвидации полиомиелита в течение этого 15-летнего периода – и все же таблица не включает какую-либо оценку риска, которому эти страны могут нести возможную вспышку.
Хотя этот анализ предполагает, что прекращение использования ОПВ сулит наибольший возврат к искоренению, он предполагает, что циркулирующие полиовирусы вакцинного происхождения могут быть сдержаны, если и когда они появятся.Однако подготовка к этой возможности потребует гораздо более эффективной глобальной системы эпиднадзора, чем существует сейчас, обслуживания лабораторной инфраструктуры и запасов ОПВ. Кроме того, борьба со вспышками с помощью ОПВ без риска возврата вирусов к вирулентности будет чрезвычайно сложной в условиях растущей доли лиц, не имевших иммунологического статуса. Использование ОПВ в этом сценарии вполне может привести к тому, что полиомиелит снова станет эндемическим. В любом случае ориентировочная стоимость любой из стратегий превышает 20 миллиардов долларов.
Таким образом, экономические показатели ликвидации полиомиелита не столь благоприятны, как пришли к выводу Барт, Фулдс и Патриарка (1996) или Хан и Эрет (2003). Оба исследования предполагают, что вакцинация может быть прекращена без использования ИПВ в качестве замены где-либо, оба исключают затраты на поддержание способности реагирования, и ни одно из них не учитывает реальную угрозу возрождения. Сангруджи, Касерес и Кочи (2004) принимают во внимание два из этих соображений, но их анализ рассчитывает только затраты на 15 лет, игнорируя как риск повторного появления, так и преимущества искоренения.Таким образом, каждое исследование дает лишь частичное представление об экономических аспектах ликвидации полиомиелита и не рассматривает в достаточной мере фундаментальную трудность (неспособность) прекращения вакцинации и поддержания ликвидации.
В заключение, несмотря на то, что некоторые считали экономику ликвидации полиомиелита благоприятной (Aylward and others 2003), она гораздо менее благоприятна, чем экономика ликвидации оспы, даже если предположить, что вакцинация от полиомиелита может быть прекращена.
Дракункулез
Дракункулез, или болезнь дракункулеза, представляет собой нематодную инфекцию, которая контролируется не вакцинацией, а просвещением пострадавшего населения, снабжением водой, свободной от нематод, через колодцы или фильтрацию, а также лечением больных.Это не глобальное заболевание, оно встречается только в сельских районах нескольких очень бедных тропических стран. Последнее отличие особенно важно с экономической точки зрения. Это означает, что международное финансирование программы ликвидации дракункулеза должно в большей степени полагаться на помощь в целях развития, а не на собственные интересы стран-доноров.
К настоящему времени программа ликвидации привела к снижению числа случаев дракункулеза на 99 процентов по сравнению с уровнем 1986 года (Carter Center 2004).География распространения болезни также сократилась с 20 до 12 стран. Хотя это достижение важно, искоренение остается недостижимым много лет после 1995 года, года, который ВАЗ установил для искоренения в 1991 году (Cairncross, Muller, and Zagaria 2002, 232).
Было опубликовано только одно исследование рентабельности программы ликвидации дракункулеза (Kim, Tandon, and Ruiz-Tiben, 1997), и оно, к сожалению, имеет ряд недостатков. Во-первых, как указывалось ранее, необходимо сравнить затраты на ликвидацию с затратами, связанными с альтернативной программой оптимального контроля.Во-вторых, анализ затрат и выгод применяется к периоду 1987–1998 годов и, таким образом, является ретроспективным. Анализ может показать, принесли ли ранее потраченные деньги выгоду, превышающую затраты (да), но он не может показать, стоило ли заниматься искоренением в то время, когда проводилось это исследование. Наконец, он не принимает во внимание инвестиционное решение об искоренении – главную причину достижения цели искоренения в первую очередь.
Это последнее упущение особенно актуально для анализа программы ликвидации в Судане в рамках исследования.В исследовании прогнозировалось, что к 1998 году инфекции прекратятся повсюду, кроме Судана. (Понятно, что это предсказание было неверным, хотя Судан является самой большой проблемой для программы, в основном из-за продолжающейся гражданской войны, которая ограничивает доступ к эндемичным районам; см. Hopkins and others 2002.) Затем рассчитывается чистая приведенная стоимость ликвидации. болезнь есть. Результаты не обнадеживают. Они показывают, что искоренение является привлекательным только в том случае, если болезнь удастся ликвидировать в Судане в течение пяти лет.Однако этот анализ игнорирует дивиденды, которые искоренение посевов принесет Судану. Он также игнорирует наиболее важную особенность искоренения – то, что если бы болезнь была сертифицирована как ликвидированная из ее последнего оплота, она принесла бы пользу всем потенциально уязвимым странам. Таким образом, экономические аспекты ликвидации дракункулеза в Судане, если именно здесь болезнь сделает свой последний рубеж, будут гораздо более привлекательными, чем предполагает этот анализ.
Книги по медицине и здравоохранению @ Amazon.com
Новые фармацевтические подходы к контролю за образованием инфекционной биопленки на медицинских устройствахПо мере роста использования имплантированных медицинских устройств исследователи обнаружили, что неосыпающиеся поверхности медицинских устройств часто представляют собой идеальные субстраты для колонизации микробами, образующими биопленку. В результате частота заболеваний, связанных с биопленкой, среди пациентов с имплантированными устройствами также выросла. В ответ в этой книге рассматриваются новые и появляющиеся фармацевтические подходы к предотвращению или искоренению образования инфекционных биопленок на медицинских устройствах.Он также исследует биопленочные инфекции, не связанные с устройством. Более того, книга предлагает самое современное понимание структуры, состава, организации и деятельности биопленок.
Искоренение и предотвращение биопленки разделен на три части:
В части 1, «Развитие и характеристика биопленки», исследуется, что вызывает образование биопленок и почему биопленки образуются на поверхности медицинских устройств, а также на тканях и органах человека
Часть 2, «Инфекции, связанные с биопленкой в различных органах человека (хронические инфекции, не связанные с устройствами)», посвящена последним исследованиям в области фармацевтики и доставки лекарств, посвященных инфекциям, связанным с биопленкой, которые развиваются на глазах, во рту, кожных ранах, и легкие
Часть 3, «Носители доставки лекарств для искоренения образования биопленки на медицинских устройствах», объясняет фармацевтические подходы, такие как носители доставки лекарств на основе липидов и полимеров для искоренения инфекции биопленок на медицинских устройствах; она заканчивается обсуждением нового низкомолекулярного контроля образования бактериальной биопленки.
Эта книга, охватывающая образование биопленок, заболевания, связанные с образованием биопленок на медицинских устройствах и органах человека, а также фармацевтические решения, является важным справочным материалом для исследователи в фармацевтической промышленности и индустрии медицинского оборудования, а также клиницисты, которые лечат пациентов с помощью медицинских устройств.
Новые фармацевтические подходы к контролю за образованием инфекционной биопленки на медицинских устройствахПо мере роста использования имплантированных медицинских устройств исследователи обнаружили, что неосыпающиеся поверхности медицинских устройств часто представляют собой идеальные субстраты для колонизации микробами, образующими биопленку. В результате частота заболеваний, связанных с биопленкой, среди пациентов с имплантированными устройствами также выросла. В ответ в этой книге рассматриваются новые и появляющиеся фармацевтические подходы к предотвращению или искоренению образования инфекционных биопленок на медицинских устройствах.Он также исследует биопленочные инфекции, не связанные с устройством. Более того, книга предлагает самое современное понимание структуры, состава, организации и деятельности биопленок.
Искоренение и предотвращение биопленки разделен на три части:
В части 1, «Развитие и характеристика биопленки», исследуется, что вызывает образование биопленок и почему биопленки образуются на поверхности медицинских устройств, а также на тканях и органах человека
Часть 2, «Инфекции, связанные с биопленкой в различных органах человека (хронические инфекции, не связанные с устройствами)», посвящена последним исследованиям в области фармацевтики и доставки лекарств, посвященных инфекциям, связанным с биопленкой, которые развиваются на глазах, во рту, кожных ранах, и легкие
Часть 3, «Носители доставки лекарств для искоренения образования биопленки на медицинских устройствах», объясняет фармацевтические подходы, такие как носители доставки лекарств на основе липидов и полимеров для искоренения инфекции биопленок на медицинских устройствах; она заканчивается обсуждением нового низкомолекулярного контроля образования бактериальной биопленки.
Эта книга, охватывающая образование биопленок, заболевания, связанные с образованием биопленок на медицинских устройствах и органах человека, а также фармацевтические решения, является важным справочным материалом для исследователи в фармацевтической промышленности и индустрии медицинского оборудования, а также клиницисты, которые лечат пациентов с помощью медицинских устройств.
Об авторе
ТАМИЛВАНАН ШУНМУГАПЕРУМАЛ, доктор философии , работает на кафедре фармацевтических технологий Международного медицинского университета в Куала-Лумпуре, Малайзия. Его текущее исследование направлено на использование потенциала носителей для доставки лекарств на основе липидов и полимеров для искоренения инфекционного образования биопленок, связанного как с медицинскими устройствами, так и с человеческими органами.
Искоренение и ликвидация малярии: взгляды на то, как воплотить мечту в реальность | BMC Medicine
Gething PW, Elyazar IR, Moyes CL, Smith DL, Battle KE, Guerra CA и др. Карта мира по малярии, которой давно не уделялось внимания: эндемичность Plasmodium vivax в 2010 г. PLoS Negl Trop Dis. 2012; 6: e1814.
PubMed PubMed Central Google Scholar
Алонсо П.Л., Браун Г., Аревало-Эррера М., Бинка Ф., Читнис К., Коллинз Ф. и др. Программа исследований в поддержку искоренения малярии. PLoS Med. 2011; 8: e1000406.
PubMed PubMed Central Google Scholar
Всемирная организация здравоохранения. Всемирный доклад о малярии, 2014 г. http://www.who.int/malaria/publications/world_malaria_report_2014/en/.
Всемирная организация здравоохранения и Глобальная программа борьбы с малярией. Прогресс на пути к ликвидации в Шри-Ланке. Женева: Всемирная организация здравоохранения; 2012.
Google Scholar
Абейасингх Р.Р., Галаппати Г.Н., Смит Гуйе К., Кан Дж. Г., Фичем Р. Г.. Контроль и ликвидация малярии в Шри-Ланке: документирование прогресса и факторов успеха в условиях конфликта.PLoS One. 2012; 7: e43162.
CAS PubMed PubMed Central Google Scholar
Всемирная организация здравоохранения. Глобальная техническая стратегия борьбы с малярией (2016-2030 гг.). http://www.who.int/malaria/areas/global_technical_strategy/draft_strategy/en/.
Всемирная организация здравоохранения. Партнерство по борьбе с малярией: Глобальный план действий по борьбе с малярией. http://www.rollbackmalaria.org/microsites/gmap/
RBM. Действия и инвестиции Партнерства «Обратить вспять малярию» для победы над малярией 2016-2030: (AIM) для мира, свободного от малярии. Женева: ВОЗ; 2015г. В консультации.
Google Scholar
UNCTAD. Экономическое развитие в Африке: отчет 2014: стимулирование инвестиций для преобразующего роста в Африке. Нью-Йорк и Женева: Организация Объединенных Наций; 2014.
Google Scholar
Всемирный банк. Перспективы мировой экономики. Таблица прогнозов. Перспективы мировой экономики (2015). http://www.worldbank.org/en/publication/global-economic-prospects/summary-table
Всемирная организация здравоохранения. От борьбы с малярией к ликвидации малярии: руководство по планированию сценария ликвидации. 2014. http://who.int/malaria/publications/atoz/9789241507028/en/
Глобальная группа медицинских наук UCSF. http://globalhealthsciences.ucsf.edu/global-health-group.
Малярия ВОЗ. Консультативный комитет по политике и Секретариат. Консультативный комитет ВОЗ по политике в отношении малярии: выводы и рекомендации шестого совещания, проводимого два раза в год (сентябрь 2014 г.). Малар Дж. 2015; 14: 107.
Google Scholar
Моша Дж. Ф., Стеррок Х. Дж., Гринвуд Б., Сазерленд С. Дж., Гадалла Н. Б., Атвал С. и др. Горячая точка или нет: сравнение методов пространственной статистики для прогнозирования предполагаемых малярийных инфекций.Малар Дж. 2014; 13:53.
PubMed PubMed Central Google Scholar
Линдблэйд К.А., Стейнхардт Л., Сэмюэлс А., Качур С.П., Слуцкер Л. Скрытая угроза: бессимптомная паразитемия и передача малярии. Эксперт Rev Anti Infect Ther. 2013; 11: 623–39.
CAS PubMed Google Scholar
Хойер С., Нгуон С., Ким С., Хабиб Н., Хим Н., Сум С. и др.Целенаправленный скрининг и лечение (FSAT): основанная на ПЦР стратегия для выявления носителей малярийных паразитов и сдерживания лекарственно-устойчивых P. falciparum, Пайлин, Камбоджа. PLoS One. 2012; 7: e45797.
CAS PubMed PubMed Central Google Scholar
Hsiang MS, Greenhouse B, Rosenthal PJ. Тестирование на предмет выявления малярии в точках наблюдения с использованием LAMP, петлевой изотермической амплификации. J Infect Dis. 2014; 210: 1167–9.
PubMed Google Scholar
Вакали А., Пацула Е., Спанакос Г., Данис К., Вассалу Е., Тегос Н. и др. Малярия в Греции, 1975–2010 гг. Euro Surveill 2012, 17: pii: 20322.
Chiodini PL. Диагностика малярии: настоящее и будущее. Паразитология. 2014; 141: 1873–9.
PubMed Google Scholar
Лесли Т., Михаил А., Майан I, Кандилл Б., Анвар М., Бахташ С.Х. и др. Экспресс-диагностические тесты для улучшения лечения малярии и других лихорадочных заболеваний: рандомизированное исследование эффективности пациентов в клиниках первичной медико-санитарной помощи в Афганистане.BMJ. 2014; 348: g3730.
PubMed PubMed Central Google Scholar
Титье К., Хокинс К., клерк С., Эбелс К., МакГрей С., Круддер С. и др. Существенная роль технологий обнаружения инфекций в элиминации и искоренении малярии. Trends Parasitol. 2014. 30: 259–66.
PubMed Google Scholar
Ансах Е.К., Нарх-Бана С., Эпокор М., Аканпигбиам С., Квартей А.А., Гьяпонг Дж. И др.Экспресс-тестирование на малярию в условиях, где доступна микроскопия, и в периферийных клиниках, где доступно только предварительное лечение: рандомизированное контролируемое исследование в Гане. BMJ. 2010; 340: c930.
PubMed PubMed Central Google Scholar
Wong J, Hamel MJ, Drakeley CJ, Kariuki S, Shi YP, Lal AA, et al. Серологические маркеры для мониторинга исторических изменений интенсивности передачи малярии в высокоэндемичном регионе Западной Кении, 1994-2009 гг.Малар Дж. 2014; 13: 451.
PubMed PubMed Central Google Scholar
Kattenberg JH, Ochodo EA, Boer KR, Schallig HD, Mens PF, Leeflang MM. Систематический обзор и метаанализ: экспресс-тесты в сравнении с гистологией плаценты, микроскопией и ПЦР для выявления малярии у беременных. Малар Дж. 2011; 10: 321.
PubMed PubMed Central Google Scholar
Чендлер К.И., Уитти С.Дж., Ансах Э.К. Каким образом экспресс-тесты для диагностики малярии могут раскрыть свой потенциал? Качественное исследование клинических испытаний в медицинских учреждениях Ганы. Малар Дж. 2010; 9: 95.
PubMed PubMed Central Google Scholar
Мод Р.Дж., Понтаворнпиньо В., Сараламба С., Агуас Р., Йунг С., Дондорп А.М. и др. Последний выживший человек – самый стойкий: он ликвидирует в Камбодже устойчивую к артемизинину малярию. Малар Дж.2009; 8:31.
PubMed PubMed Central Google Scholar
Коренромп Э.Л., Уильямс Б.Г., Гоус Э, краситель С, снег RW. Измерение тенденций детской смертности от малярии в Африке: оценка прогресса в достижении целей на основе вербального вскрытия. Lancet Infect Dis. 2003. 3: 349–58.
PubMed Google Scholar
Packard RM. Истоки устойчивости к противомалярийным препаратам.N Engl J Med. 2014; 371: 397–9.
CAS PubMed Google Scholar
Hien TT, White NJ. Цинхаосу. Ланцет. 1993; 341: 603–8.
CAS PubMed Google Scholar
Ностен Ф., ван Вугт М, Прайс Р, Люксембург С., Туэй К.Л., Брокман А. и др. Эффекты комбинации артесунат-мефлохин на заболеваемость малярией Plasmodium falciparum и резистентность к мефлохину в западном Таиланде: проспективное исследование.Ланцет. 2000; 356: 297–302.
CAS PubMed Google Scholar
Dondorp AM, Nosten F, Yi P, Das D, Phyo AP, Tarning J, et al. Устойчивость к артемизинину при малярии, вызванной Plasmodium falciparum. N Engl J Med. 2009. 361: 455–67.
CAS PubMed PubMed Central Google Scholar
Ariey F, Witkowski B, Amaratunga C, Beghain J, Langlois AC, Khim N, et al.Молекулярный маркер малярии, вызванной устойчивостью к артемизинину Plasmodium falciparum. Природа. 2014; 505: 50–5.
PubMed Google Scholar
Эшли Э.А., Дорда М., Фэрхерст Р.М., Амаратунга С., Лим П., Суон С. и др. Распространение устойчивости к артемизинину при малярии, вызванной Plasmodium falciparum. N Engl J Med. 2014; 371: 411–23.
PubMed PubMed Central Google Scholar
Tun KM, Imwong M, Lwin KM, Win AA, Hlaing TM, Hlaing T, et al.Распространение резистентного к артемизинину Plasmodium falciparum в Мьянме: поперечный обзор молекулярного маркера K13. Lancet Infect Dis. 2015; 15: 415–21.
CAS PubMed PubMed Central Google Scholar
Spring MD, Lin JT, Manning JE, Vanachayangkul P, Somethy S, Bun R, et al. Дигидроартемизинин-пиперахиновая недостаточность, связанная с тройным мутантом, включая kelch23 C580Y, в Камбодже: наблюдательное когортное исследование.Lancet Infect Dis. 2015; 15: 683–91.
CAS PubMed Google Scholar
Всемирная сеть по противомалярийной устойчивости DPSG. Влияние режимов дозирования на противомалярийную эффективность дигидроартемизинин-пиперахина: объединенный анализ индивидуальных данных пациента. PLoS Med. 2013; 10: e1001564. обсуждение e1001564.
Google Scholar
Newton PN, Green MD, Fernandez FM.Влияние некачественных лекарств на «развивающийся» мир. Trends Pharmacol Sci. 2010; 31: 99–101.
CAS PubMed PubMed Central Google Scholar
Всемирная организация здравоохранения. Экстренное реагирование на резистентность к артемизинину в субрегионе Большого Меконга. Региональные рамки действий на 2013-2015 гг. http://www.who.int/malaria/publications/atoz/9789241505321/en/. По состоянию на ноябрь 2014 г.
Feachem RG, Phillips AA, Hwang J, Cotter C, Wielgosz B, Greenwood BM, et al.Уменьшение карты малярии: успехи и перспективы. Ланцет. 2010; 376: 1566–78.
PubMed PubMed Central Google Scholar
Трапеция JF. Воздействие устойчивости к хлорохину на здоровье населения в Африке. Am J Trop Med Hyg. 2001; 64: 12–7.
CAS PubMed Google Scholar
Трапе Дж. Ф., Писон Дж., Презиози М. П., Энель С., Дезгре дю Лу А, Делоне В. и др.Влияние устойчивости к хлорохину на смертность от малярии. C R Acad Sci III. 1998. 321: 689–97.
CAS PubMed Google Scholar
Phyo AP, Nkhoma S, Stepniewska K, Ashley EA, Nair S, McGready R, et al. Появление устойчивой к артемизинину малярии на западной границе Таиланда: продольное исследование. Ланцет. 2012; 379: 1960–6.
PubMed PubMed Central Google Scholar
Gamo FJ. Устойчивость к противомалярийным препаратам: новые варианты лечения Plasmodium. Drug Discov Today Technol. 2014; 11: 81–8.
PubMed Google Scholar
Sturrock HJ, Hsiang MS, Cohen JM, Smith DL, Greenhouse B, Bousema T, et al. Противодействие бессимптомным малярийным инфекциям: активное наблюдение в области контроля и ликвидации. PLoS Med. 2013; 10: e1001467.
PubMed PubMed Central Google Scholar
Имвонг М., Ханчана С., Маллерет Б., Рения Л., Дэй Н.П., Дондорп А. и др. Высокопроизводительные сверхчувствительные молекулярные методы для количественного определения малярийных паразитемий низкой плотности. J Clin Microbiol. 2014; 52: 3303–9.
CAS PubMed PubMed Central Google Scholar
Ньюби Дж., Хван Дж., Койта К., Чен И., Гринвуд Б., фон Зайдляйн Л. и др. Обзор массового управления лекарствами от малярии и его оперативных проблем. Am J Trop Med Hyg.2015.
Пуаро Э., Скарбински Дж., Синклер Д., Качур С.П., Слуцкер Л., Хван Дж. Массовое введение лекарств от малярии. Кокрановская база данных Syst Rev.2013; 12: CD008846.
PubMed Google Scholar
Белый NJ. Примахин для предотвращения передачи малярии falciparum. Lancet Infect Dis. 2013; 13: 175–81.
CAS PubMed Google Scholar
Nosten F, Уайт, штат Нью-Джерси. Комбинированное лечение малярии falciparum на основе артемизинина. Am J Trop Med Hyg. 2007; 77 Дополнение 6: 181–92.
CAS PubMed Google Scholar
Maude RJ, Socheat D, Nguon C, Saroth P, Dara P, Li G, et al. Оптимизация стратегий элиминации малярии Plasmodium falciparum в Камбодже: примахин, массовое введение лекарств и устойчивость к артемизинину. PLoS One. 2012; 7: e37166.
CAS PubMed PubMed Central Google Scholar
Howes RE, Piel FB, Patil AP, Nyangiri OA, Gething PW, Dewi M и др. Распространенность дефицита G6PD и оценки затронутого населения в эндемичных по малярии странах: карта на основе геостатистической модели. PLoS Med. 2012; 9: e1001339.
CAS PubMed PubMed Central Google Scholar
Baird JK. Токсичность примахина препятствует эффективному терапевтическому лечению эндемической малярии. Int J Parasitol. 2012; 42: 1049–54.
CAS PubMed Google Scholar
Battle KE, Karhunen MS, Bhatt S, Gething PW, Howes RE, Golding N, et al. Географические вариации рецидива Plasmodium vivax. Малар Дж. 2014; 13: 144.
PubMed PubMed Central Google Scholar
Дуглас Н.М., Ностен Ф., Эшли Э.А., Фаифун Л., ван Вугт М., Сингхасиванон П. и др. Рецидив Plasmodium vivax после малярии falciparum и смешанных видов: факторы риска и влияние антималярийной кинетики.Clin Infect Dis. 2011; 52: 612–20.
PubMed PubMed Central Google Scholar
Сутанто И., Тьяджоно Б., Басри Х., Тейлор В.Р., Путри Ф.А., Мейлия Р.А. и др. Рандомизированное открытое испытание примахина против рецидива малярии vivax в Индонезии. Антимикробные агенты Chemother. 2013; 57: 1128–35.
CAS PubMed PubMed Central Google Scholar
Ансти Н.М., Дуглас Н.М., Поеспопроджо Дж. Р., Прайс РН.Plasmodium vivax: клинический спектр, факторы риска и патогенез. Adv Parasitol. 2012; 80: 151–201.
PubMed Google Scholar
Джон Г.К., Дуглас Н.М., фон Зайдляйн Л., Ностен Ф., Бэрд Дж. К., Уайт Нью-Джерси и др. Примахин радикальное лечение Plasmodium vivax: критический обзор литературы. Малар Дж. 2012; 11: 280.
PubMed PubMed Central Google Scholar
фон Зайдляйн Л., Оберн С., Эспино Ф., Шанкс Д., Ченг К., Маккарти Дж. И др. Обзор ключевых пробелов в знаниях по выявлению дефицита глюкозо-6-фосфатдегидрогеназы в отношении безопасного клинического применения схем лечения 8-аминохинолином: отчет семинара. Малар Дж. 2013; 12: 112.
Google Scholar
Льянос-Куентас А., Ласерда М.В., Руангвирают Р., Крудсуд С., Гупта С.К., Кочар С.К. и др. Тафенохин плюс хлорохин для лечения и профилактики рецидивов малярии Plasmodium vivax (ДЕТЕКТИВ): многоцентровое двойное слепое рандомизированное исследование выбора дозы фазы 2b.Ланцет. 2014; 383: 1049–58.
CAS PubMed Google Scholar
Беннетт Дж. У., Пибус Б. С., Ядава А., Тош Д., Соуза Дж. К., Маккарти В. Ф. и др. Примахиновая недостаточность и цитохром P-450 2D6 при малярии, вызванной Plasmodium vivax. N Engl J Med. 2013; 369: 1381–2.
CAS PubMed Google Scholar
МакГриди Р., Ли SJ, Wiladphaingern J, Эшли Е.А., Райкен М.Дж., Боэль М. и др.Побочные эффекты малярии falciparum и vivax и безопасность противомалярийного лечения на ранних сроках беременности: популяционное исследование. Lancet Infect Dis. 2012; 12: 388–96.
CAS PubMed PubMed Central Google Scholar
Стаут Дж. А., Слауи М., Хеппнер Д. Г., Момин П., Кестер К. Э., Десмонс П. и др. Предварительная оценка рекомбинантной белковой вакцины на основе циркумспорозоитов против малярии, вызванной Plasmodium falciparum. RTS, S Группа оценки вакцины против малярии.N Engl J Med. 1997; 336: 86–91.
CAS PubMed Google Scholar
Кестер К.Е., Каммингс Дж. Ф., Офори-Аньянам О., Окенхаус К. Ф., Кшич Ю., Морис П. и др. Рандомизированное двойное слепое испытание фазы 2a вакцин против малярии falciparum RTS, S / AS01B и RTS, S / AS02A у взрослых, ранее не инфицированных малярией: безопасность, эффективность и иммунологические факторы защиты. J Infect Dis. 2009; 200: 337–46.
CAS PubMed Google Scholar
Абдулла С., Оберхольцер Р., Джума О, Кубходжа С., Мачера Ф., Мемби С. и др. Безопасность и иммуногенность вакцины против малярии RTS, S / AS02D у младенцев. N Engl J Med. 2008; 359: 2533–44.
CAS PubMed Google Scholar
Alonso PL, Sacarlal J, Aponte JJ, Leach A, Macete E, Milman J, et al. Эффективность вакцины RTS, S / AS02A против инфекции и болезни Plasmodium falciparum у детей раннего возраста в Африке: рандомизированное контролируемое исследование.Ланцет. 2004; 364: 1411–20.
CAS PubMed Google Scholar
Апонте Дж. Дж., Эйд П., Реном М., Мандомандо I, Бассат К., Сакарлал Дж. И др. Безопасность вакцины-кандидата от малярии RTS, S / AS02D для младенцев, живущих в высокоэндемичной зоне Мозамбика: двойное слепое рандомизированное контролируемое исследование фазы I / IIb. Ланцет. 2007; 370: 1543–51.
CAS PubMed Google Scholar
Асанте К.П., Абдулла С., Агнанджи С., Лаймо Дж., Векеманс Дж., Соулануджингар С. и др. Безопасность и эффективность вакцины-кандидата против малярии RTS, S / AS01E, вводимой с вакцинами расширенной программы иммунизации: наблюдение в течение 19 месяцев рандомизированного открытого исследования фазы 2. Lancet Infect Dis. 2011; 11: 741–9.
CAS PubMed Google Scholar
Bejon P, Lusingu J, Olotu A, Leach A, Lievens M, Vekemans J, et al. Эффективность вакцины RTS, S / AS01E против малярии у детей от 5 до 17 месяцев.N Engl J Med. 2008; 359: 2521–32.
CAS PubMed PubMed Central Google Scholar
Agnandji ST, Lell B, Soulanoudjingar SS, Fernandes JF, Abossolo BP, Conzelmann C, et al. Первые результаты фазы 3 испытания вакцины против малярии RTS, S / AS01 у африканских детей. N Engl J Med. 2011; 365: 1863–75.
PubMed Google Scholar
RTS, S Clinical Trials Partnership, Agnandji ST, Lell B, Fernandes JF, Abossolo BP, Methogo BG, et al.Испытание фазы 3 вакцины против малярии RTS, S / AS01 у африканских младенцев. N Engl J Med. 2012; 367: 2284–95.
Google Scholar
Alonso PL, Sacarlal J, Aponte JJ, Leach A, Macete E, Aide P и др. Продолжительность защиты с помощью вакцины против малярии RTS, S / AS02A в профилактике болезни Plasmodium falciparum у детей Мозамбика: расширенное наблюдение за рандомизированным контролируемым исследованием, проводимое слепым методом. Ланцет. 2005; 366: 2012–8.
CAS PubMed Google Scholar
Олоту А., Лусингу Дж., Лич А., Ливенс М., Векеманс Дж., Мшам С. и др. Эффективность вакцины против малярии RTS, S / AS01E и исследовательский анализ титров антител против циркумспорозоитов и защиты у детей в возрасте 5–17 месяцев в Кении и Танзании: рандомизированное контролируемое исследование. Lancet Infect Dis. 2011; 11: 102–9.
CAS PubMed PubMed Central Google Scholar
Rts S. Партнерство по клиническим исследованиям. Эффективность и безопасность вакцины против малярии RTS, S / AS01 в течение 18 месяцев после вакцинации: рандомизированное контролируемое испытание фазы 3 у детей и младенцев в 11 африканских центрах.PLoS Med. 2014; 11: e1001685.
Google Scholar
Ndungu FM, Mwacharo J, Kimani D, Kai O, Moris P, Jongert E, et al. Статистическое взаимодействие между Т-клетками, специфичными для циркумспорозоитного белка, и реакциями антител и риском клинических эпизодов малярии после вакцинации RTS, S / AS01E. PLoS One. 2012; 7: e52870.
CAS PubMed PubMed Central Google Scholar
Олоту А., Морис П., Мвачаро Дж., Векеманс Дж., Кимани Д., Янссенс М. и др. Циркумспорозоит-специфические Т-клеточные ответы у детей, вакцинированных RTS, S / AS01E, и защита от клинической малярии P. falciparum. PLoS One. 2011; 6: e25786.
CAS PubMed PubMed Central Google Scholar
Warimwe GM, Fletcher HA, Olotu A, Agnandji ST, Hill AV, Marsh K, et al. Отношение моноцитов к лимфоцитам периферической крови при включении в исследование позволяет прогнозировать эффективность RTS.S вакцина против малярии: анализ объединенных данных клинических испытаний фазы II. BMC Med. 2013; 11: 184.
PubMed PubMed Central Google Scholar
White MT, Bejon P, Olotu A, Griffin JT, Bojang K, Lusingu J, et al. Комбинированный анализ иммуногенности, кинетики антител и эффективности вакцины из испытаний фазы 2 RTS. S вакцина против малярии. BMC Med. 2014; 12: 117.
PubMed PubMed Central Google Scholar
White MT, Bejon P, Olotu A, Griffin JT, Riley EM, Kester KE, et al. Взаимосвязь между RTS, S-вакцинами-индуцированными антителами, CD4 (+) Т-клеточными ответами и защитой от инфекции Plasmodium falciparum. PLoS One. 2013; 8: e61395.
CAS PubMed PubMed Central Google Scholar
RTS, S Clinical Trial Partnership. Эффективность и безопасность вакцины против малярии RTS, S / AS01 с бустерной дозой или без нее у младенцев и детей в Африке: окончательные результаты фазы 3, индивидуально рандомизированного, контролируемого исследования.Ланцет. 2015. DOI: 10.1016 / S0140-6736 (15) 60721-8.
Ричардс Дж. С., Бисон Дж. Г.. Будущее вакцин против малярии на стадии крови. Immunol Cell Biol. 2009; 87: 377–90.
CAS PubMed Google Scholar
Всемирная организация здравоохранения. Таблицы прогресса вакцины против малярии во всем мире. http://www.who.int/immunization/research/development/Rainbow_tables/en/
Bejon P, Mwacharo J, Kai O, Mwangi T., Milligan P, Todryk S, et al.Рандомизированное испытание фазы 2b кандидатных вакцин против малярии FP9 ME-TRAP и MVA ME-TRAP среди детей в Кении. Клинические испытания PLoS. 2006; 1: с29.
PubMed PubMed Central Google Scholar
Эвер К.Дж., О’Хара Г.А., Дункан С.Дж., Коллинз К.А., Шихи С.Х., Рейес-Сандовал А. и др. Защитный CD8 + Т-клеточный иммунитет к малярии человека, индуцированный иммунизацией против аденовируса шимпанзе – MVA. Nat Commun. 2013; 4: 2836.
PubMed PubMed Central Google Scholar
Гентон Б., Бетуэла И., Фельгер И., Аль-Яман Ф., Андерс Р.Ф., Саул А. и др. Рекомбинантная вакцина против малярии на стадии крови снижает плотность Plasmodium falciparum и оказывает избирательное давление на популяции паразитов в испытаниях фазы 1-2b в Папуа-Новой Гвинее. J Infect Dis. 2002; 185: 820–7.
PubMed Google Scholar
Thera MA, Doumbo OK, Coulibaly D, Laurens MB, Ouattara A, Kone AK, et al. Полевые испытания для оценки вакцины против малярии на стадии крови.N Engl J Med. 2011; 365: 1004–13.
CAS PubMed PubMed Central Google Scholar
Дрю Д.Р., Ходдер А.Н., Уилсон Д.В., Фоли М., Мюллер И., Сиба П.М. и др. Определение антигенного разнообразия апикального мембранного антигена 1 Plasmodium falciparum и требований к мультиаллельной вакцине против малярии. PLoS One. 2012; 7: e51023.
CAS PubMed PubMed Central Google Scholar
Dutta S, Dlugosz LS, Drew DR, Ge X, Ababacar D, Rovira YI, et al. Преодоление антигенного разнообразия путем повышения иммуногенности консервативных эпитопов на антигене-1 апикальной мембраны-кандидата в вакцину против малярии. PLoS Pathog. 2013; 9: e1003840.
PubMed PubMed Central Google Scholar
Terheggen U, Drew DR, Hodder AN, Cross NJ, Mugyenyi CK, Barry AE, et al. Ограниченное антигенное разнообразие антигена 1 апикальной мембраны Plasmodium falciparum поддерживает разработку эффективных мультиаллельных вакцин.BMC Med. 2014; 12: 183.
PubMed PubMed Central Google Scholar
Sirima SB, Cousens S, Druilhe P. Защита от малярии с помощью вакцины-кандидата MSP3. N Engl J Med. 2011; 365: 1062–4.
CAS PubMed Google Scholar
Wright GJ, Rayner JC. Инвазия эритроцитов Plasmodium falciparum: сочетание функции с уклонением от иммунитета. PLoS Pathog.2014; 10: e1003943.
PubMed PubMed Central Google Scholar
Persson KE, McCallum FJ, Reiling L, Lister NA, Stubbs J, Cowman AF, et al. Вариации в использовании путей инвазии эритроцитов Plasmodium falciparum опосредуют уклонение от ингибирующих антител человека. J Clin Invest. 2008. 118: 342–51.
CAS PubMed Google Scholar
Ричардс Дж. С., Арумугам Т. У., Рейлинг Л., Целитель Дж., Ходдер А. Н., Фаукс Ф. Дж. И др.Идентификация и приоритизация мерозоитных антигенов как мишеней защитного иммунитета человека к малярии, вызванной Plasmodium falciparum, для разработки вакцин и биомаркеров. J Immunol. 2013; 191: 795–809.
CAS PubMed PubMed Central Google Scholar
Wu Y, Ellis RD, Shaffer D, Fontes E, Malkin EM, Mahanty S, et al. Фаза 1 испытания вакцин-кандидатов, блокирующих передачу малярии, Pfs25 и Pvs25, содержащих монтанид ISA 51.PLoS One. 2008; 3: e2636.
PubMed PubMed Central Google Scholar
Miura K, Takashima E, Deng B, Tullo G, Diouf A, Moretz SE и др. Функциональное сравнение вакцин-кандидатов, блокирующих передачу Plasmodium falciparum, с помощью стандартного анализа с мембранным питанием. Infect Immun. 2013; 81: 4377–82.
CAS PubMed PubMed Central Google Scholar
Outchkourov NS, Roeffen W, Kaan A, Jansen J, Luty A, Schuiffel D, et al. Правильно свернутый белок Pfs48 / 45 Plasmodium falciparum вызывает у мышей иммунитет, блокирующий передачу малярии. Proc Natl Acad Sci U S. A. 2008; 105: 4301–5.
CAS PubMed PubMed Central Google Scholar
Seder RA, Chang LJ, Enama ME, Zephir KL, Sarwar UN, Gordon IJ, et al. Защита от малярии путем внутривенной иммунизации нереплицирующейся спорозоитной вакциной.Наука. 2013; 341: 1359–65.
CAS PubMed Google Scholar
Эррера С., Бонело А., Перлаза Б.Л., Фернандес О.Л., Виктория Л., Ленис А.М. и др. Безопасность и выявление гуморальных и клеточных ответов у добровольцев из Колумбии, ранее не инфицированных малярией, с помощью синтетической вакцины на основе циркумспорозоитного белка Plasmodium vivax. Am J Trop Med Hyg. 2005; 73 Дополнение 5: 3–9.
CAS PubMed Google Scholar
Эррера С., Фернандес О.Л., Вера О., Карденас В., Рамирес О., Паласиос Р. и др. Испытание фазы I безопасности и иммуногенности длинных синтетических пептидов, полученных из Plasmodium vivax CS, с адъювантом монтанидом ISA 720 или монтанидом ISA 51. Am J Trop Med Hyg. 2011; 84 Приложение 2: 12–20.
CAS PubMed PubMed Central Google Scholar
Малкин Е.М., Дурбин А.П., Димерт Д.Д., Саттабонгкот Дж., Ву И, Миура К. и др. Испытание фазы 1 вакцины против Pvs25H: вакцины, блокирующей передачу от малярии Plasmodium vivax.Вакцина. 2005; 23: 3131–8.
CAS PubMed Google Scholar
Beeson JG, Crabb BS. На пути к вакцине против малярии Plasmodium vivax. PLoS Med. 2007; 4: e350.
PubMed PubMed Central Google Scholar
Каттс Дж. К., Пауэлл Р., Агиус П. А., Бисон Дж. Г., Симпсон Дж. А., Фаукс Ф. Дж. Иммунологические маркеры воздействия Plasmodium vivax и иммунитета: систематический обзор и метаанализ.BMC Med. 2014; 12: 150.
PubMed PubMed Central Google Scholar
Коул-Тобиан Дж. Л., Мишон П., Биазор М., Ричардс Дж. С., Бисон Дж. Г., Мюллер И. и др. Штамм-специфические антитела к связывающему белку даффи коррелируют с защитой от инфекции гомологичными по сравнению с гетерологичными штаммами плазмодия vivax у детей Папуа-Новой Гвинеи. Infect Immun. 2009; 77: 4009–17.
CAS PubMed PubMed Central Google Scholar
Фаукс Ф. Дж., Симпсон Дж. А., Бисон Дж. Г.. Последствия лицензирования частично эффективной вакцины против малярии для оценки вакцин второго поколения. BMC Med. 2013; 11: 232.
PubMed PubMed Central Google Scholar
Байер Дж. К., Китинг Дж., Гитуре Дж. И., Макдональд МБ, Импоинвил, Делавэр, Новак Р.Дж. Комплексная борьба с переносчиками малярии. Малар Дж. 2008; 7 Приложение 1: S4.
PubMed Google Scholar
Badolo A, Traore A, Jones CM, Sanou A, Flood L, Guelbeogo WM и др. Три года мониторинга устойчивости к инсектицидам у Anopheles gambiae в Буркина-Фасо: устойчивость растет? Малар Дж. 2012; 11: 232.
PubMed PubMed Central Google Scholar
Mulamba C, Riveron JM, Ibrahim SS, Irving H, Barnes KG, Mukwaya LG, et al. Широко распространенная устойчивость к пиретроиду и ДДТ у основного переносчика малярии Anopheles funestus в Восточной Африке обусловлена механизмами метаболической устойчивости.PLoS One. 2014; 9: e110058.
PubMed PubMed Central Google Scholar
Хемингуэй Дж. Роль борьбы с переносчиками инфекции в прекращении передачи малярии: угрозы и возможности. Philos Trans R Soc Lond B Biol Sci. 2014; 369: 20130431.
PubMed PubMed Central Google Scholar
Уилсон А.Л., Чен-Хасси В., Логан Дж. Г., Линдси СВ. Эффективны ли местные репелленты от насекомых против малярии в эндемичных популяциях? Систематический обзор и метаанализ.Малар Дж. 2014; 13: 446.
PubMed PubMed Central Google Scholar
Алфей Л. Генетический контроль комаров. Анну Рев Энтомол. 2014; 59: 205–24.
CAS PubMed Google Scholar
Берт А. Наследственные стратегии борьбы с насекомыми-переносчиками болезней. Philos Trans R Soc Lond B Biol Sci. 2014; 369: 20130432.
PubMed PubMed Central Google Scholar
Всемирная организация здравоохранения. Ликвидация малярии. Полевое руководство для стран с низкой и средней эндемичностью. http://www.who.int/malaria/publications/atoz/9789241596084/en/
Марш К. Приоритеты исследований в области ликвидации малярии. Ланцет. 2010; 376: 1626–7.
PubMed Google Scholar
Kinfu Y, Dal Poz MR, Mercer H, Evans DB.

 pylori как минимум в 80% случаев
pylori как минимум в 80% случаев