Эрадикация хеликобактер пилори схема: Клинические рекомендации Российской гастроэнтерологической ассоциации по диагностике и лечению инфекции Helicobacter pylori у взрослых | Ивашкин
Нelicobacter pylori (НP) как ведущий этиологический фактор канцерогенеза в ЖКТи развитии аутоиммунных процессов. Роль эрадикации в комплексной терапии.
Обзор литературы
Нelicobacter pylori (НP) – один из самых распространенных возбудителей в мире. Частота встречаемости HP-ассоциированной инфекции зависит от социально-экономической обстановки в стране, так, в развивающихся странах данный показатель достигает 70% у населения с 10-летнего возраста. В России данный показатель среди взрослого населения составляет 80% при монодиагностике и 100% при полидиагностике.
НР – грамотрицательная спиралевидная бактерия с жгутиками, образующая защитный гликокаликс вокруг бактериальной клетки. После проникновения в организм HP, продуцируя фосфолипазу, повреждает эпителиальную клетку и проникает внутрь, образуя адгезивный бактериальный слой на эпителиоцитах. Под действием ферментов усиливается воспалительная реакция и продукция провоспалительных агентов.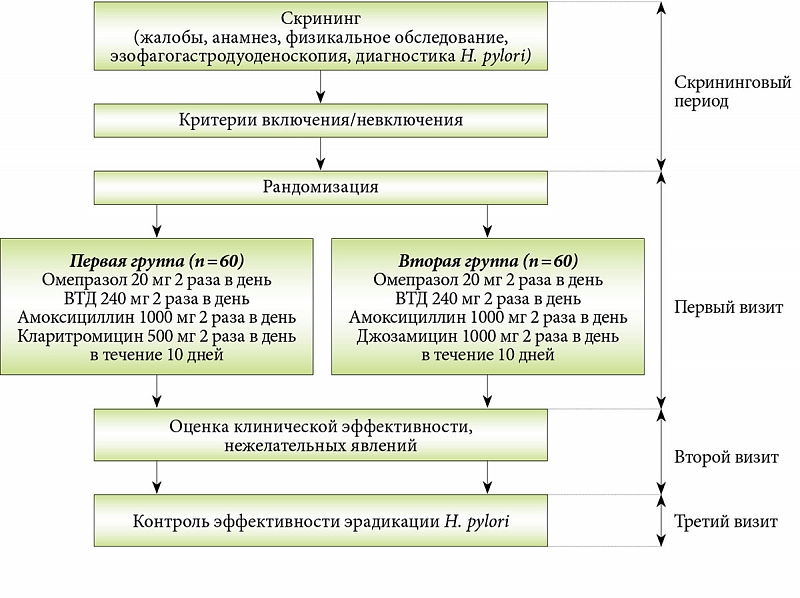
В настоящее время по результатам анализа обзоров иностранной литературы для диагностики HР применяют инвазивные (эндоскопические) и неинвазивные методы. Рекомендации по применению, специфичность и чувствительность методов в диагностике HP указаны в таблице 1.
Таблица 1
| № п/п | Методы | Специфичность | Чувствительность | Рекомендации по применению | Стоимость и сложность выполнения |
|---|---|---|---|---|---|
| Инвазивные (эндоскопические): | |||||
| 1 | Эндоскопическая гистология | > 95% | > 95% | Является золотым стандартом в диагностике HР. Необходимо 3 образца из угла, большой кривизны и привратника. Чувствительность метода зависит от времени после проведения терапии | Дорогой, сложный |
| 2 | Гистологический тест на уреазу | > 95% | > 90% | Результат известен в течение 1-24 часов. Прием эрадикационной терапии снижает чувствительность и специфичность до 25% Прием эрадикационной терапии снижает чувствительность и специфичность до 25% |
Дешевый, сложный |
| 3 | Культуральный посев гистологического материала | 100% | 75-90% | Зависит от приема блокаторов протонной помпы. Рекомендован при резистентности HР к антибиотикам | Дорогой, сложный |
| 4 | ПЦР гистологического материала | 100% | 61-96% | Может применяться для типирования микроорганизма и определения вирулентности. Неэффективен при мутантных антибиотикорезистентных формах | Дешевый, сложный |
| Неинвазивные: | |||||
| 1 | Уровень антител IG в крови | 79-90% | 76-85% | Не рекомендован после эрадикации НР. Чувствительность появляется на 21 день после инвазии бактерии и сохраняется длительно после эрадикации | Дешевый, простой |
| 2 | Уреазный дыхательный тест | > 95% | > 95% | Предпочтителен у детей и беременных. Рекомендован до терапии, 28 дней после терапии антибиотиками и препаратами висмута и 7-14 дней после терапии блокатарами протонной помпы Рекомендован до терапии, 28 дней после терапии антибиотиками и препаратами висмута и 7-14 дней после терапии блокатарами протонной помпы | Дорогой, простой |
| 3 | Выявление антигенов HР в кале – До терапии – Поликлональный – Монокланальный – После терапии – Поликлональный – Моноклональный |
93% 97% 92% 97% |
91% 96% 86% 95% |
Альтернативный дыхательному тесту. Рекомендован в качестве скринингового теста до терапии и после терапии, а также совместно с дыхательным тестом | Дешевый, простой |
Показания для диагностики HР подразделяются на основные, или установленные, и относительные, или спорные.
Основными показаниями для диагностики HР являются:
- активно прогрессирующая язва желудка или 12-перстной кишки;
- документально подтвержденная язвенная болезнь без проведенной эрадикационной терапии;
- зрелоклеточные MALT-лимфомы желудка;
- состояние после эндоскопической резекции ранней стадии рака желудка;
- неисследованная диспепсия.

Относительными или спорными показаниями для диагностики HР являются:
- неязвенная диспепсия;
- ГЭРБ;
- НПВС-ассоциированная диспепсия;
- высокий популяционный риск рака желудка;
- железодефицитная анемия неясной этиологии.
Эрадикационная терапия HР включает несколько схем, которые подразделяются на 2 линии. При инфекции HР, диагностированной впервые, эрадикационная терапия проводится по первой линии, и показания для ее проведения подразделяются на абсолютные и относительные.
Показания для эрадикационной терапии HР первой линии:
Абсолютные:
- MALT-лимфома желудочно-кишечного тракта;
- состояние после эндоскопической резекции ранней стадии рака желудка;
- необследованная диспепсия у лиц моложе 55 лет, некупируемая 4-недельным курсом ингибиторов протонной помпы и 4-недельным курсом антацидов.

Относительные:
- ГЭРБ;
- НПВС-ассоциированная диспепсия;
- высокий популяционный риск рака желудка;
- железодефицитная анемия неясной этиологии.
Эрадикационная терапия HР 1-й линии:
| Категории пациентов | Препараты и дозы |
|---|---|
| Пациент без аллергии к пенициллинам и не применявший ранее макролиды |
Омепразол 20 мг 2 раза в день Кларитромицин 500 мг 2 раза в день Амоксициллин 1000 мг 2 раза в день В течение 10-14 дней |
| Пациент с аллергией к пенициллинам, не применявший ранее макролиды, с наличием противопоказаний к проведению квадротерапии |
Омепразол 20 мг 2 раза в день Кларитромицин 500 мг 2 раза в день Метронидазол 500 мг 2 раза в день В течение 10-14 дней |
Эрадикационная терапия H.pylori 2-й линии – квадротерапия, используется как терапия спасения при резистентном течении:
- Препарат висмута 525 мг 4 раза в день
- Метронидазол 250 мг 4 раза в день
- Тетрациклин 500 мг 4 раза в день
- Омепразол 20 мг 2 раза в день
- В течение 10-14 дней
Влияние эрадикации на положительный эффект в лечении МАLТ-лимфом ЖКТ, рака желудка, ИТП и ЖДА
1.
2. ИТП. Взаимосвязь между хеликобактерной инфекцией (ХИ) и ИТП заподозрена благодаря исследованиям, показавшим рост числа тромбоцитов после эрадикации ХИ. Однако существует и альтернативное объяснение этого эффекта, такое как эрадикация бактерий, отличных от H pylori, или иммуномодулирующий эффект этой терапии сам по себе. Более того, последние данные показывают, что эффект от такой терапии наблюдается независимо от результатов эрадикационной терапии. При этом тромбоцитарный ответ на противо-хеликобактерную терапию получен у 49.6%.
Однако существует и альтернативное объяснение этого эффекта, такое как эрадикация бактерий, отличных от H pylori, или иммуномодулирующий эффект этой терапии сам по себе. Более того, последние данные показывают, что эффект от такой терапии наблюдается независимо от результатов эрадикационной терапии. При этом тромбоцитарный ответ на противо-хеликобактерную терапию получен у 49.6%.
3. Железодефицитная анемия. Множество исследований говорят о потенциальной связи необъяснимой другими причинами ЖДА и наличия инфекции H. Pylori у пациента, основываясь на возможном развитии пангастрита с последующей ахлоргидрией, снижением секреции аскорбиновой кислоты и уменьшением всасывания железа. Другие объясняют связь этого эффекта и ЖДА возможностью оккультных кровопотерь из эрозий на слизистой и секвестрацией и утилизацией железа этим микроорганизмом. Несмотря на явную взаимосвязь, до сих пор не обнаружено улучшения течения анемии при лечении железосодержащими препаратами с сопроводительной терапией антибиотиками.
Для снижения частоты рецидивов НР рекомендована после эрадикационной терапии смена зубных щеток, санация полости рта (удаление зубного камня). Нет единого мнения относительно проведения диагностики и эрадикации в случае обнаружения НР у лиц, имеющих тесный контакт с пациентом, которому была проведена эрадикация. По нашему мнению диагностика НР должна проводиться у всех тесно контактирующих лиц. Целесообразность эрадикации НР зависит от показаний, указанных выше. Возможным неблагоприятным эффектом эрадикации является аллергия на антибиотикотерапию и развитие клостридиального колита в течение 4-6-недельного срока после эрадикации.
Эрадикационная терапия НР статистически достоверно в 50-80% приводит к регрессу МАLТ-лимфом ЖКТ и к 49.6% ремиссий при ИТП, не влияет на риск возникновения аденокарцином, нет достоверных данных о влиянии на течение ЖДА.
Подготовила А. Федулова,
Литература:
- Киушкин А.А.
 , Садоков В.М. Значение операционных характеристик теста при выборе метода диагностики инфекции Н.pylori. Экспериментальная и клиническая гастроэнтерология, 2002, №4.
, Садоков В.М. Значение операционных характеристик теста при выборе метода диагностики инфекции Н.pylori. Экспериментальная и клиническая гастроэнтерология, 2002, №4. - Корниенко Е.А. и соавт. Хелпил-тест, Хелик-тест и аммиачный дыхательный тест в диагностике инфекции Н.pylori. Клиническая лабораторная диагностика, 2000, №1, С.41-43.
- Логинов А.С., Васильев Ю.В., Зеленикин С.А., Касьяненко В.И. Сравнительные данные применения некоторых современных методов исследования в диагностике Helicobacter pylori. Российский Гастроэнтерологический журнал, 1993, №2.
- Donald M. A. and Roberto S. Does Helicobacter pylori Eradication Therapy Result in a Platelet Count Improvement in Adults with Immune Thrombocytopenic Purpura Regardless of H pylori Infection? ASH Evidence-based Review 2008 Hematology 2008.
- Fontham E.T., Ruiz В., Perez A. et al. Determinants of Helicobacter pylori infection and chronic gastritis. Am. J. Gastroenterol., 1995, Vol. 90(7), pp.
 1094-101.
1094-101. - Harsch А., Hahn Е.G., Konturek P.C. Pseudomembranous colitis after eradication of Helicobacter pylori infectionwith a triple therapy. Med Sci Monit, 2001; 7(4).
- Momynaliev K., Smirnova O., Kudryavtseva L. European Journal of Clinical Microbiology& Infectious Diseases, Volume 22, Number 9 / sept 2003, pp.573-574.
- Kolk H., Maaroos H. Do dyspeptic patients under the age of 45 need to be investigated? 6-th United Europian Gastoenterology Week, 18-23 October 1997, Abstracts-on-disk, p.58 1404.
- Suerbaum S., M.D., and Michetti P., M.D. Helicobacter pylori Infection. Volume 347:1175-1186. The New English Journal of Medicine, October 10, 2002, Number 15.
- William D. Chey, M.D., F.A.C.G., A.G.A.F., F.A.C.P., Benjamin C.Y. Wong, M.D., Ph.D., F.A.C.G., F.A.C.P. American College of Gastroenterology Guideline on the Management of Helicobacter pylori Infection and the Practice Parameters Committee of the American College of Gastroenterology.
 American Journal of Gastroenterology, 2007, 102:1808-1825.
American Journal of Gastroenterology, 2007, 102:1808-1825.
ФАРМАТЕКА » Гибридная схема эрадикационной терапии инфекции Helicobacter pylori: систематизация литературных данных
Снижение эффективности стандартных схем эрадикационной терапии (ЭТ) инфекции Helicobacter pylori, коррелирующее с ростом антибиотикорезистентности микроорганизма, обусловливает целесообразность разработки и комплексного изучения альтернативных вариантов ЭТ. Гибридная схема ЭТ, предложенная в 2011 г. китайскими исследователями и успешно апробированная в ряде стран Азии, Европы и Ближнего Востока, привлекла к себе широкое внимание мирового гастроэнтерологического сообщества благодаря сочетанию высокой эффективности и приемлемой безопасности. В настоящем обзоре систематизированы литературные данные о гибридной схеме ЭТ, включая вопросы ее эффективности, безопасности, переносимости и текущего места в качестве метода профилактики и лечения H. pylori-ассоциированных заболеваний.
Введение
На настоящий момент инфекция Helicobacter pylori является одной из наиболее распространенных патогенных инфекций человека, ассоциированной с развитием ряда заболеваний гастродуоденальной зоны [1–3].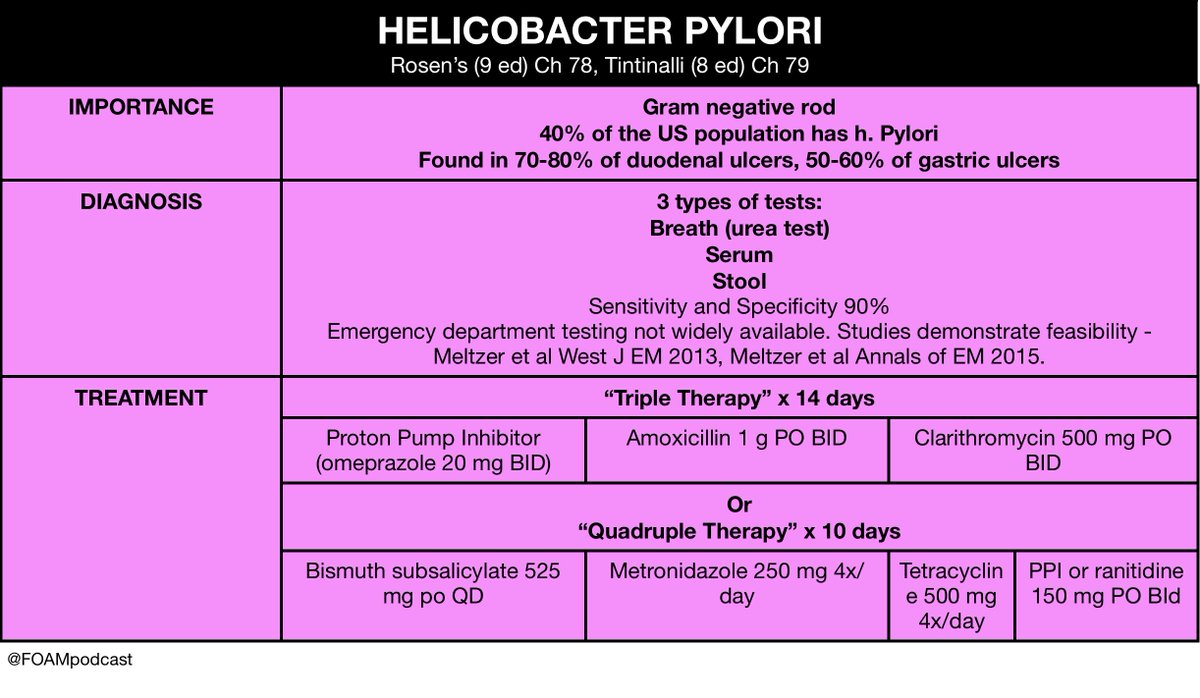 Согласно современным международным консенсусным рекомендациям (Маастихт-V, 2015; Киотский консенсус, 2015; Торонтский консенсус, 2016), базисным методом профилактики и лечения H. pylori-ассоциированных заболеваний является эрадикационная терапия (ЭТ), включающая ингибитор протонной помпы (ИПП) в сочетании с несколькими антибактериальными препаратами [4–6]. Однако сегодняшний этап изучения инфекции H. pylori связан с негативным трендом снижения эффективности классических схем ЭТ, что коррелирует с ростом резистентных к антибиотикам штаммов микроорганизма в популяции [1, 2, 4, 7]. Этот вызов современной медицине обусловливает целесообразность дальнейшего поиска, разработки и комплексного изучения альтернативных вариантов ЭТ.
Согласно современным международным консенсусным рекомендациям (Маастихт-V, 2015; Киотский консенсус, 2015; Торонтский консенсус, 2016), базисным методом профилактики и лечения H. pylori-ассоциированных заболеваний является эрадикационная терапия (ЭТ), включающая ингибитор протонной помпы (ИПП) в сочетании с несколькими антибактериальными препаратами [4–6]. Однако сегодняшний этап изучения инфекции H. pylori связан с негативным трендом снижения эффективности классических схем ЭТ, что коррелирует с ростом резистентных к антибиотикам штаммов микроорганизма в популяции [1, 2, 4, 7]. Этот вызов современной медицине обусловливает целесообразность дальнейшего поиска, разработки и комплексного изучения альтернативных вариантов ЭТ.
Гибридная схема ЭТ, предложенная в 2011 г. P.I. Hsu и соавт. [8] и успешно апробированная в ряде стран Азии, Европы и Ближнего Востока, привлекла к себе широкое внимание мирового гастроэнтерологического сообщества благодаря сочетанию высокой эффективности и приемлемой безопасности.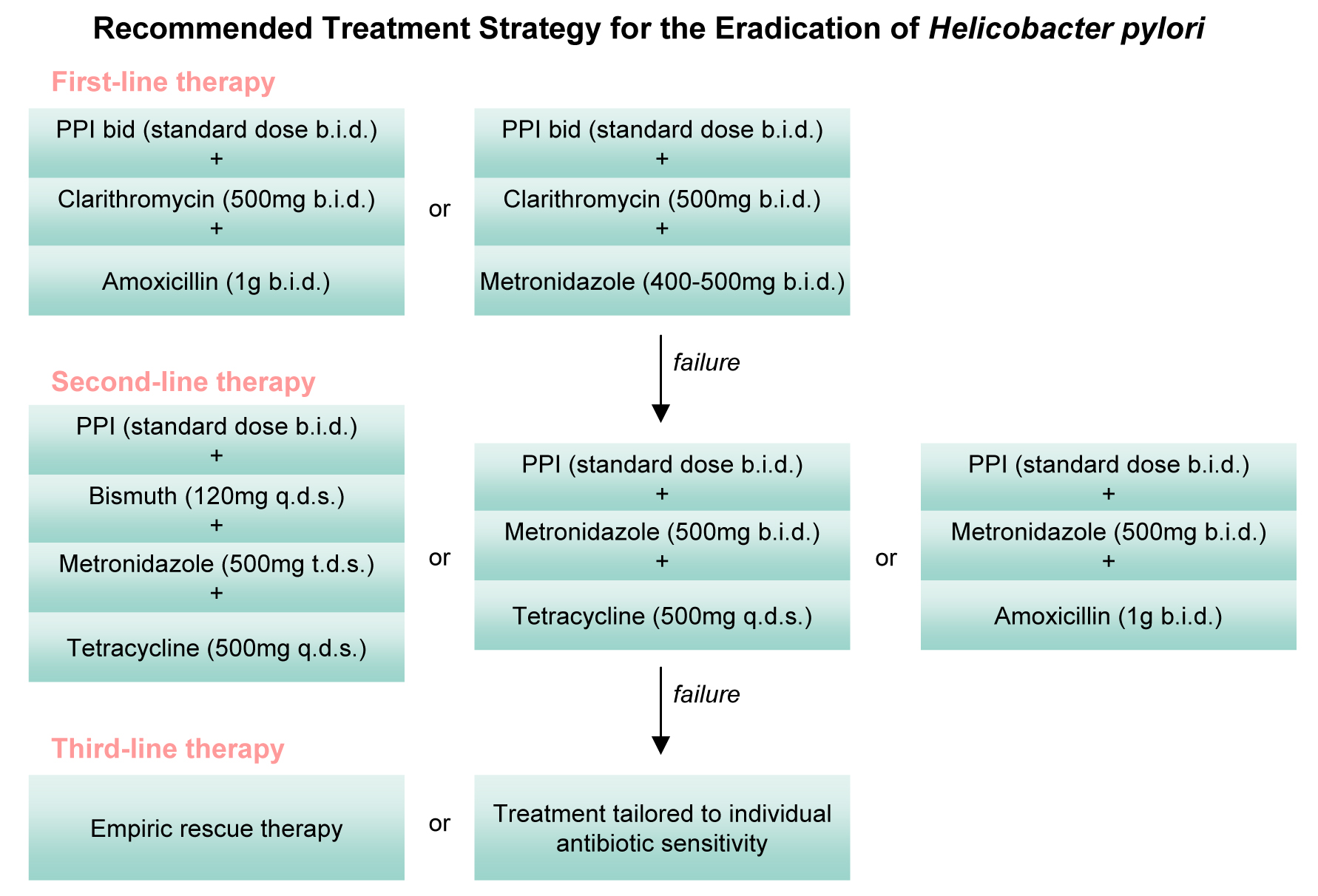 В настоящем обзоре систематизированы литературные данные о гибридной схеме ЭТ, включая вопросы ее эффективности, безопасности, переносимости и текущего места в качестве метода профилактики и лечения H. pylori-ассоциированных заболеваний.
В настоящем обзоре систематизированы литературные данные о гибридной схеме ЭТ, включая вопросы ее эффективности, безопасности, переносимости и текущего места в качестве метода профилактики и лечения H. pylori-ассоциированных заболеваний.
Состав и механизм действия гибридной схемы ЭТ
Гибридная схема ЭТ представляет собой комплексный 14-дневный четырехкомпонентный протокол антихеликобактерного лечения без препаратов висмута и состоит из двух этапов: проведения двойной терапии в течение первых 7 дней (ИПП и амоксициллин) с переходом на четырехкомпонентную терапию в последующие 7 дней (ИПП, амоксициллин, кларитромицин и метронидазол/тинидазол). Разовые дозировки лекарственных средств не отличаются от таковых при использовании классических схем ЭТ: ИПП в стандартной дозе, амоксициллин 1 г, кларитромицин 0,5 г и метронидазол/тинидазол 0,5 г. Все препараты принимают 2 раза в сутки [8–10].
Таким образом, гибридная схема ЭТ представляет собой сочетание двух других схем ЭТ: двухкомпонентная терапия на первом этапе аналогична последовательной терапии, а четырехкомпонентная терапия на втором этапе соответствует «одномоментной» схеме. В целом гибридная терапия основана на оптимизации последовательной схемы ЭТ: пролонгирован курс ЭТ с 10 до 14 дней, а второй этап ЭТ дополнен амоксициллином [8, 11].
В целом гибридная терапия основана на оптимизации последовательной схемы ЭТ: пролонгирован курс ЭТ с 10 до 14 дней, а второй этап ЭТ дополнен амоксициллином [8, 11].
В рамках гибридной схемы ЭТ применяется сразу три антибактериальных препарата с различным альтерирующим действием на клетки H. pylori. Механизм воздействия амоксициллина на Н. pylori заключается в ингибировании процессов синтеза в мембране бактериальной клетки пенициллинсвязывающих белков – ферментов, осуществляющих завершающие стадии биосинтеза основного компонента клеточной стенки микроорганизма – пептидогликана, что приводит к нарушению роста и гибели бактерии [1, 12]. Кларитромицин ингибирует синтез белка бактериальной рибосомы, что приводит к образованию неполноценных белковых молекул и гибели микроорганизма [12]. Механизм действия метронидазола/тинидазола реализуется посредством повреждения ДНК бактериальной клетки. Проникая внутрь клетки, NO2-группа препарата восстанавливается в форму гидроксиламинового производного, вызывая повреждение ДНК и гибель микроорганизма [2, 13].
Механизм комплексного антихеликобактерного действия гибридной терапии аналогичен последовательной терапии. В течение первого этапа применения протокола уничтожаются кларитромицин-резистентные штаммы H. pylori и бóльшая часть бактерий на поверхности слизистой оболочки, а в течение второго этапа – прочие, в т.ч. в глубине желудочных ямок, и адгезированные на эпителии (с учетом действия кларитромицина на биопленки и высокой способности проникновения в ткани) [13–15]. Помимо этого амоксицилин в первые 7 дней применения протокола приводит к значительному снижению бактериальной нагрузки и редукции образования в бактериальной клетке трансмембранных эффлюксных каналов для выведения антибиотиков, что значительно повышает эффективность последующего применения кларитромицина и метронидазола/тинидазола [15–17].
Эффективность гибридной схемы ЭТ
Согласно последнему систематическому обзору, опубликованному в 2016 г., включившем 12 исследований из различных регионов мира (Тайвань, Китай, Иран, Южная Корея, Испания, Италия), уровень эрадикации при использовании гибридной схемы ЭТ составил 77,6–97,4%, по данным анализа intention-to-treat (ITT, «все включенные пациенты»), и 82,6–99,1%, по данным анализа per-protocol (PP, «по протоколу»). Систематизация данных различных исследований показывает, что средний уровень эрадикации при применении гибридной схемы ЭТ составляет 85,1 (ITT) и 91,2% (PP) [18].
Систематизация данных различных исследований показывает, что средний уровень эрадикации при применении гибридной схемы ЭТ составляет 85,1 (ITT) и 91,2% (PP) [18].
В целом эффективность гибридной терапии имеет существенные региональные отличия и требует дальнейшей валидации в различных популяциях. При ранжировании схем ЭТ по эффективности, предложенной специалистами Европейской группы по изучению Н. pylori (EHSG – European Helicobacter Study Group) [19], можно отметить, что гибридная схема ЭТ в подавляющем большинстве исследований продемонстрировала приемлемую (85–89%), высокую (90–95%) и очень высокую (≥95%) эффективность при анализе PP (см. таблицу).
Эффективность ниже приемлемой, показанная в нескольких работах, по всей видимости, может быть ассоциирована с высоким уровнем полирезистентности к антибиотикам в исследуемых регионах. Согласно консенсусу Маастрихт-V (2015), двойная резистентность к кларитромицину и метронидазолу (>15%) снижает эффективность всех висмутнесодержащих схем ЭТ, включая гибридную схему ЭТ [4]. При анализе исследований эффективности гибридной схемы ЭТ, в которых оценивалась антибиотикорезистентность Н. pylori, показано, что эффективность ЭТ в отсутствие резистентности к кларитромицину и метронидазолу составляет 98,5%, при наличии изолированной резистентности к метронидазолу или кларитромицину – 92,9–97,6%, а при двойной резистентности к кларитромицину и метронидазолу – 80,0% [18].
При анализе исследований эффективности гибридной схемы ЭТ, в которых оценивалась антибиотикорезистентность Н. pylori, показано, что эффективность ЭТ в отсутствие резистентности к кларитромицину и метронидазолу составляет 98,5%, при наличии изолированной резистентности к метронидазолу или кларитромицину – 92,9–97,6%, а при двойной резистентности к кларитромицину и метронидазолу – 80,0% [18].
Другим актуальным аспектом, потенциально оказывающим влияние на эффективность гибридной схемы ЭТ, является длительность протокола лечения. В исследовании, проведенном в Иране, показано, что сокращение курса терапии до 10 дней приводит к редукции эффективности примерно на 10% [20]. Однако в работе, выполненной на Тайване и в Китае, оценивающей эффективность 10-, 12- и 14-дневного курсов гибридной ЭТ, были продемонстрированы примерно эквивалентные результаты, превышающие 90% (анализ PP) [21]. Аналогично в несравнительных работах, проведенных в Южной Корее и Испании, были показаны приемлемые уровни эрадикации Н. pylori при применении 10-дневной гибридной схемы ЭТ, превышающие 85% (анализ PP) [22, 23]. Таким образом, выявленные региональные отличия при оценке эффективности более коротких курсов гибридной схемы ЭТ могут быть ассоциированы с различным паттерном резистентности к антибиотикам в исследуемых регионах.
pylori при применении 10-дневной гибридной схемы ЭТ, превышающие 85% (анализ PP) [22, 23]. Таким образом, выявленные региональные отличия при оценке эффективности более коротких курсов гибридной схемы ЭТ могут быть ассоциированы с различным паттерном резистентности к антибиотикам в исследуемых регионах.
Безопасность и переносимость гибридной схемы ЭТ
Общая частота регистрации побочных эффектов на фоне применения гибридной схемы ЭТ составила 14,5–67,5%. При систематизации данных различных исследований общий показатель частоты побочных эффектов составил 32,9% [18]. Побочные эффекты включали изменения вкусового восприятия, боль/дискомфорт в животе, тошноту, рвоту, диарею, головокружение, головную боль и другие жалобы, большинство из которых были легкой или умеренной степени выраженности (не влияющие или незначительно влияющие на повседневную деятельность). Лишь в 2,5% случаев выраженность побочных эффектов оказывала заметное влияние на ежедневную активность пациента и приводила к прекращению курса ЭТ. В свою очередь общий показатель переносимости протокола лечения составил 96,6% [18]. Таким образом, гибридная схема ЭТ продемонстрировала приемлемый профиль безопасности, сопоставимый с другими четырехкомпонентными протоколами антихеликобактерного лечения без препаратов висмута.
В свою очередь общий показатель переносимости протокола лечения составил 96,6% [18]. Таким образом, гибридная схема ЭТ продемонстрировала приемлемый профиль безопасности, сопоставимый с другими четырехкомпонентными протоколами антихеликобактерного лечения без препаратов висмута.
Сравнение гибридной терапии с другими режимами ЭТ
Классическая тройная терапия. В исследовании, проведенном в Испании, сравнивалась эффективность 10-дневной гибридной терапии по сравнению с 10-дневной классической тройной терапией. По результатам исследования эффективность гибридной терапии была значительно выше классической тройной терапии (ITT – 90,8 против 70,0%; р=0,002; PP – 93,9 против 72,4%; р=0,001). Отмечена хорошая переносимость обоих режимов (98,5 против 99,6%), в то время как общая частота развития побочных эффектов при использовании гибридной терапии была значительно выше (67,5 против 45,0%; р=0,012) [22].
Последовательная терапия. Эффек-тивность гибридной и последовательной терапии сравнивали в шести исследованиях. По результатам работ, проведенных на Тайване, Китае [8, 24, 25] и Иране [26], уровень эрадикации при использовании гибридной схемы ЭТ был значительно выше по сравнению с последовательной терапией. В двух исследованиях, проведенных в Италии [27, 28], эффективность последовательной терапии была незначительно выше. Подобный результат был также получен в исследовании, проведенном в Корее [29]. Систематизация данных показала, что уровень эффективности при применении гибридной терапии составил 87,8 (ITT) и 93,0% (РР), а при использовании последовательной терапии – 83,8 (ITT) и 86,6% (PP) [18]. В целом определено, что среди населения Азии эффективность гибридной терапии выше, тогда как среди населения Италии последовательная терапия более приемлемой. Показатель переносимости и профиль безопасности анализируемых схем ЭТ между группами существенно не различались.
По результатам работ, проведенных на Тайване, Китае [8, 24, 25] и Иране [26], уровень эрадикации при использовании гибридной схемы ЭТ был значительно выше по сравнению с последовательной терапией. В двух исследованиях, проведенных в Италии [27, 28], эффективность последовательной терапии была незначительно выше. Подобный результат был также получен в исследовании, проведенном в Корее [29]. Систематизация данных показала, что уровень эффективности при применении гибридной терапии составил 87,8 (ITT) и 93,0% (РР), а при использовании последовательной терапии – 83,8 (ITT) и 86,6% (PP) [18]. В целом определено, что среди населения Азии эффективность гибридной терапии выше, тогда как среди населения Италии последовательная терапия более приемлемой. Показатель переносимости и профиль безопасности анализируемых схем ЭТ между группами существенно не различались.
«Одномоментная» терапия. Эффек-тивность гибридной и «одномоментной» терапии сравнивалась в пяти исследованиях. В исследовании, проведенном в Италии [28], при анализе PP уровень эрадикации на фоне применения 14-дневной гибридной терапии был значительно выше по сравнению с 5-дневной «одномоментной» терапией (без существенной разницы при анализе ITT). Однако в другом исследовании, проведенном в Италии [27], никаких существенных различий выявлено не было. По результатам исследования, проведенного в Испании и Италии [30], уровень эрадикации на фоне применения 14-дневного курса гибридной терапии был ниже по сравнению с 14-дневной «одномоментной» схемой ЭТ (анализ PP), в то время как существенного различия при анализе ITT выявлено не было. Аналогичные результаты были получены в двух других исследованиях [22, 23]. Объединенный анализ данных показал, что уровень эрадикации при использовании гибридной терапии составил 84,1% (ITT), 91,4 (РР) и 84,6 (ITT), 91,5% (РР) при применении «одномоментной» терапии. Таким образом, эффективность гибридной и «одномоментной» терапии фактически эквивалентная, однако переносимость и безопасность гибридной терапии несколько лучше – частота развития выраженных побочных эффектов примерно на 2,5% ниже [18].
Однако в другом исследовании, проведенном в Италии [27], никаких существенных различий выявлено не было. По результатам исследования, проведенного в Испании и Италии [30], уровень эрадикации на фоне применения 14-дневного курса гибридной терапии был ниже по сравнению с 14-дневной «одномоментной» схемой ЭТ (анализ PP), в то время как существенного различия при анализе ITT выявлено не было. Аналогичные результаты были получены в двух других исследованиях [22, 23]. Объединенный анализ данных показал, что уровень эрадикации при использовании гибридной терапии составил 84,1% (ITT), 91,4 (РР) и 84,6 (ITT), 91,5% (РР) при применении «одномоментной» терапии. Таким образом, эффективность гибридной и «одномоментной» терапии фактически эквивалентная, однако переносимость и безопасность гибридной терапии несколько лучше – частота развития выраженных побочных эффектов примерно на 2,5% ниже [18].
Заключение
Таким образом, гибридная терапия – одна из наиболее перспективных схем ЭТ. Комплексное и последовательное действие нескольких антибактериальных препаратов, входящих в состав данного протокола лечения, обусловливает высокую эффективность эрадикации. Тем не менее эффективность и приемлемая безопасность, продемонстрированные в ряде стран Азии, Европы и Ближнего Востока, требуют дальнейшей валидации в других регионах мира.
Тем не менее эффективность и приемлемая безопасность, продемонстрированные в ряде стран Азии, Европы и Ближнего Востока, требуют дальнейшей валидации в других регионах мира.
1. Маев И.В., Самсонов А.А., Андреев Д.Н. Инфекция Helicobacter pylori. М., 2016. 2. Morgan D.R., Crowe S.E. Helicobacter pylori infection. In: Sleisenger and Fordtran’s Gastrointestinal and Liver Disease: Pathophysiology, Diagnosis, Management/edited by M. Feldman, L.S. Friedman, L.J. Brandt. 10th ed. 2015. 3. Руководство по внутренней медицине / Под ред. Г.П. Арутюнова, А.И. Мартынова, А.А. Спасского. М., 2015. 4. Malfertheiner P., Megraud F., O’Morain C.A., et al. Management of Helicobacter pylori infection-the Maastricht V/Florence Consensus Report. Gut. 2017;66(1):6–30. 5. Sugano K., Tack J., Kuipers E.J., et al. Kyoto global consensus report on Helicobacter pylori gastritis. Gut. 2015;64(9):1353–67. 6. Fallone C.A., Chiba N., van Zanten S.V., et al. The Toronto Consensus for the Treatment of Helicobacter pylori Infection in Adults. 7. Маев И.В., Кучерявый Ю.А., Андреев Д.Н., Баркалова Е.В. Эрадикационная терапия инфекции Helicobacter pylori: обзор мировых тенденций. Тер. архив. 2014;3:94–9. 8. Hsu P.I., Wu D.C., Wu J.Y., Graham D.Y. Modified sequential Helicobacter pylori therapy: Proton pump inhibitor and amoxicillin for 14 days with clarithromycin and metronidazole added as a quadruple (hybrid) therapy for the final 7 days. Helicobacter. 2011;16:139–45. 9. Molina-Infante J., Gisbert J.P. Optimizing clarithromycin-containing therapy for Heli-cobacter pylori in the era of antibiotic resistance. World J. Gastroenterol. 2014;20:10338–47. 10. Graham D.Y., Lee Y.C., Wu M.S. Rational Helicobacter pylori therapy: Evidence-based medicine rather than medicine-based evidence. Clin. Gastroenterol. Hepatol. 2014;12:177–86.e3. 11. Rimbara E., Fischbach L.A., Graham D.Y. Optimal therapy for Helicobacter pylori infections. Nat. Rev. Gastroenterol. Hepatol. 12. Самсонов А.А. Антибиотики схем эрадикации Helicobacter pylori. Чем мы ограничены в выборе препаратов? Рос. журн. гастроэнтерологии, гепатологии, колопроктологии. 2008;4:63–8. 13. Самсонов А.А., Андреев Д.Н., Гречушников В.Б., Айвазова Р.А. Резистентность Helicobacter pylori к компонентам эрадикационной терапии и пути ее преодоления. Фарматека. 2015;2:26–30. 14. Кучерявый Ю.А., Андреев Д.Н., Баркалова Е.В. Клинико-молекулярные аспекты резистентности Helicobacter pylori к антибактериальным препаратам. Мед. совет. 2013;10:11–5. 15. Gisbert J.P., Calvet X., O’Connor J.P., Mégraud F., O’Morain C.A. The sequential therapy regimen for Helicobacter pylori eradication. Expert Opin Pharmacother.2010;11:905–18. 16. Vaira D., Zullo A., Hassan C., Fiorini G., Vakil N. Sequential therapy for Helicobacter pylori eradication:The time is now! Therap. Adv. Gastroenterol. 2009;2:317–22. 17. Zullo A., De Francesco V., Hassan C., Morini S., Vaira D. 18. Song Z.Q., Liu J., Zhou L.Y. Hybrid Therapy Regimen for Helicobacter Pylori Eradication. Chin. Med. J. (Engl). 2016;129(8):992–99. 19. Graham D.Y., Lu H., Yamaoka Y. A report card to grade Helicobacter pylori therapy. Helicobacter. 2007;12:275–78. 20. Metanat H.A., Valizadeh S.M., Fakheri H., Maleki I., Taghvaei T., Hosseini V., et al. Comparison between 10- and 14-day hybrid regimens for Helicobacter pylorieradication: a randomized clinical trial. Helicobacter. 2015;20:299–304. 21. Wu J.Y., Hsu P.I., Wu D.C., Graham D.Y., Wang W.M. Feasibility of shortening 14-day hybrid therapy while maintaining an excellent Helicobacter pylori eradication rate. Helicobacter. 2014;19:207–13. 22. Cuadrado-Lavín A., Salcines-Caviedes J.R., Diaz-Perez A., Carrascosa M.F., Ochagavía M., Fernandez-Forcelledo J.L., et al. First-line eradication rates comparing two shortened non-bismuth quadruple regimens against Helicobacter pylori:An open-label, randomized, multicentre clinical trial. 23. Heo J., Jeon S.W., Jung J.T., Kwon J.G., Lee D.W., Kim H.S., et al. Concomitant and hybrid therapy for Helicobacter pylori infection:A randomized clinical trial. J. Gastroenterol. Hepatol. 2015;30:1361–66. 24. Chen K.Y., Lin T.J., Lin C.L., Lee H.C., Wang C.K., Wu D.C. Hybrid vs sequential therapy for eradication of Helicobacter pylori in Taiwan: A prospective randomized trial. World J. Gastroenterol. 2015;21:10435–42. 25. Hsu P.I., Wu D.C., Wu J.Y., Graham D.Y. Is there a benefit to extending the duration of Helicobacter pylori sequential therapy to 14 days? Helicobacter. 2011;16:146–52. 26. Sardarian H., Fakheri H., Hosseini V., Taghvaei T., Maleki I., Mokhtare M. Comparison of hybrid and sequential therapies for Helicobacter pylori eradication in Iran: A prospective randomized trial. Helicobacter. 2013;18:129–34. 27. Zullo A., Scaccianoce G., De Francesco V., Ruggiero V., D’Ambrosio P., Castorani L. 28. De Francesco V., Hassan C., Ridola L., Giorgio F., Ierardi E., Zullo A. Sequential, concomitant and hybrid first-line therapies for Helicobacter pylori eradication:A prospective randomized study. J. Med. Microbiol. 2014;63(Pt. 5):748–52. 29. Oh D.H., Lee D.H., Kang K.K., Park Y.S., Shin C.M., Kim N., et al. Efficacy of hybrid therapy as first-line regimen for Helicobacter pylori infection compared with sequential therapy. J. Gastroenterol. Hepatol. 2014;29:1171–76. 30. Molina-Infante J., Romano M., Fernandez-Bermejo M., Federico A., Gravina A.G., Pozzati L., et al. Optimized nonbismuth quadruple therapies cure most patients with Helicobacter pylori infection in populations with high rates of antibiotic resistance. Gastroenterology. 2013;145:121–28. Gastroenterology. 2016;151(1):51–69.e14
Gastroenterology. 2016;151(1):51–69.e14 2011;8:79–88.
2011;8:79–88. The sequential therapy regimen for Helicobacter pylori eradication:A pooled-data analysis. Gut. 2007;56:1353–57.
The sequential therapy regimen for Helicobacter pylori eradication:A pooled-data analysis. Gut. 2007;56:1353–57. J. Antimicrob. Chemother. 2015;70:2376–81.
J. Antimicrob. Chemother. 2015;70:2376–81. , et al. Concomitant, sequential, and hybrid therapy for H pylori eradication: A pilot study. Clin. Res. Hepatol. Gastroenterol. 2013;37:647–50.
, et al. Concomitant, sequential, and hybrid therapy for H pylori eradication: A pilot study. Clin. Res. Hepatol. Gastroenterol. 2013;37:647–50.
Д.Н. Андреев – к.м.н., ассистент кафедры пропедевтики внутренних болезней и гастроэнтерологии, науч. сотр. лаборатории функциональных методов исследования в гастроэнтерологии ФГБОУ ВО МГМСУ им. А.И. Евдокимова Минздрава России, Москва; e-mail: [email protected]
сотр. лаборатории функциональных методов исследования в гастроэнтерологии ФГБОУ ВО МГМСУ им. А.И. Евдокимова Минздрава России, Москва; e-mail: [email protected]
СОВРЕМЕННОЕ РАЗВИТИЕ СХЕМ ЭРАДИКАЦИИ HELICOBACTER PYLORI | Поздеева
1. Валеева Ю. В. Обнаружение Helicobacter pylori при хронических заболеваниях желчевыводящих путей : специальность 03.02.03 «Микробиология» : диссертация на соискание ученой степени кандидата медицинских наук / Валеева Юлия Владимировна ; Казанский государственный медицинский университет. – Уфа, 2011. – 123 с. : 24 ил. –Библиогр.: с. 120–123. – Место защиты: Башкирский государственный медицинский университет.
2. Динамика резистентности штаммов Helicobacter pylori к антибиотикам у городского населения в России в 1996-1998 гг. / Л. В. Кудрявцева, В. А. Исаков, П. Л. Щербаков [и др.] // Ивашкин В. Т. Helicobacter pylori: революция в гастроэнтерологии / В. Т. Ивашкин, Ф. Мегро, Т. Л. Лапина. – Москва, Триада-Х, 1999. – С. 191–196.
Т. Helicobacter pylori: революция в гастроэнтерологии / В. Т. Ивашкин, Ф. Мегро, Т. Л. Лапина. – Москва, Триада-Х, 1999. – С. 191–196.
3. Кудрявцева Л. В. Резистентность H. pylori к амоксициллину, кларитромицину и метронидазолу в России и ее клиническое значение / Л. В. Кудрявцева, В. А. Исаков // Материалы II Международного симпозиума «Диагностика и лечение заболеваний, ассоциированных с Helicobacter pylori». – Москва, 1999. – С. 17–18.
4. Кудрявцева Л. В. Резистентность H. pylori к метронидазолу, кларитромицину и амоксициллину в Москве, Санкт-Петербурге и Абакане в 2001 г. / Л. В. Кудрявцева, В. А. Исаков, И. О. Иваников // Педиатрия. – 2002. – № 2. – С. 61–63.
5. Старостин Б. Д. Опыт использования двухэтапной антихеликобактерной терапии / Б. Д. Старостин // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. – 2008. – № 5(S32). – С. 38.
– 2008. – № 5(S32). – С. 38.
6. Хавкин А. И. Роль пробиотической терапии при инфекции Helicobacter pylori у детей / А. И. Хавкин, С. Ф. Блат // Детские инфекции. – 2007. – № 4. – С. 53–58.
7. Эрадикационная терапия, включающая пробиотики: консенсус эффективности и безопасности / Е. И. Ткаченко, Е. Б. Авалуева, Ю. П. Успенский [и др.] // Клиническое питание. – 2005. – № 1. – С. 14–20.
Эрадикационная терапия Helicobacter pylori в условиях растущей антибиотикорезистентности
89
СУЧАСНА ГАСТРОЕНТЕРОЛОГІЯ
|
№ 4 (84) • 2015
ОГЛЯДИ
Г. Д. Фадєєнко, К. О. Ситник
ДУ «Національний інститут терапії імені Л. Т. Малої НАМН України», Харків
Ерадикаційна терапія Helicobacter pylori
в умовах зростаючої антибіотикорезистентності
Наведено дані щодо антибіотикорезистентності Helicobacter pylori до препаратів, які входять до схем
ерадикаційної терапії, та ролі препаратів вісмуту в терапії інфекції H. pylori.
Ключові слова: антибіотикорезистентність, H. pylori, препарати вісмуту.
G. D. Fadieienko, K. O. Sytnyk
SI «L.T. Mala National Therapy Institute of NAMS of Ukraine», Kharkiv
Eradication therapy of Helicobacter pylori
under conditions of growing antibiotic resistance
The article presents data on antibiotic resistance of H. pylori. The data reveal the role of bismuth preparations in the
treatment of infections H. pylori.
Key words: antibiotic resistance, H. pylori, bismuth preparations.
Список литературы
1. Bland M. V., Ismail S., Heinemann J. A., Keenan J. I. The action
of bismuth against Helicobacter pylori mimics but is not
caused by intracellular iron deprivation // Antimicrob. Agents
Chemother. — 2004. — Vol. 48 (6). — P. 1983 — 1988.
2. Castro-Fernández M., Vargas-Romero J. Infection with Heli-
cobacter pylori. Prevalence, research and impact of antibi-
otic resistance // Rev. Esp. Enferm. Dig. — 2009. —
Vol. 101 (11). — P. 743 — 756.
3. Cun S., Li H., Ge R. et al. A histidine-rich and cysteine-rich
metal-binding domain at the C terminus of heat shock pro-
tein A from Helicobacter pylori: implication for nickel
homeostasis and bismuth susceptibility // J. Biol. Chem. —
2008. — Vol. 283 (22). — P. 15142 — 15151.
4. De Francesco V., Giorgio F., Hassan C. et al. Worldwide H. pylo-
ri antibiotic resistance: a systematic review // J. Gastrointestin.
Liver Dis. — 2010. — Vol. 19 (4). — P. 409 — 414.
5. De Francesco V., Ierardi E., Hassan C., Zullo A. Helicobacter
pylori therapy: Present and future // World J. Gastrointest.
Pharmacol. Ther. — 2012. — N 3 (4). — P. 68 — 73.
6. Fischbach L., Evans E. L. Meta-analysis: the effect of antibiotic
resistance status on the efficacy of triple and quadruple first-
line therapies for Helicobacter pylori // Aliment. Pharmacol.
Ther. — 2007. — Vol. 26 (3). — P. 343 — 357.
7. Ge R., Chen Z., Zhou Q. The actions of bismuth in the treat-
ment of Helicobacter pylori infections: an update // Metallo-
mics. — 2012. — N 4 (3). — P. 239 — 243.
8. Georgopoulos S. D., Papastergiou V., Karatapanis S. Helico-
bacter pylori eradication therapies in the era of increasing
antibiotic resistance: A paradigm shift to improved efficacy //
Gastroenterol. Res. Pract. — 2012. — N 2012. — P. 757 — 926.
9. Glupczynski Y., Megraud F., Lopez-Brea M. et al. European
multicentre survey of in vitro antimicrobial resistance in Heli-
cobacter pylori // Eur. J. Clin. Microbiol. Infect. Dis. — 2001. —
Vol. 20. — P. 820 — 823.
10. Iwanczak F., Iwanczak B. Treatment of Helicobacter pylori
infection in the aspect of increasing antibiotic resistance //
Adv. Clin. Exp. Med. — 2012. — Vol. 21 (5). — P. 671 — 680.
11. Malfertheiner P., Megraud F., O’Morain C. et al. European Heli-
cobacter Study Group. Management of Helicobacter pylori
infection: the Maastricht IV. Florence Consensus Report //
Gut. — 2012. — Vol. 61 (7). — P. 646 — 664.
12. Megraud F. Antimicrobial Resistance and Approaches to
Treatment // Sutton P., Mitchell H. M., eds. Helicobacter pylori
in the 21 st Century. Wallingford, UK: CABI. — N 2010.
13. Megraud F. H. pylori antibiotic resistance. — P. prevalence,
importance, and advances in testing // Gut. — 2004. —
Vol. 53. — P. 1374 — 1384.
14. Megraud F., Coenen S., Versporten A. et al. Helicobacter
pylori resistance to antibiotics in Europe and its relationship
to antibiotic consumption // Gut. — 2013. — Vol. 62 (1). —
P. 34 — 42.
15. Pajares García J. M., Pajares-Villarroya R., Gisbert J. P. Helico-
bacter pylori infection: antibiotic resistance // Rev Esp Enferm
Dig. — 2007. — Vol. 99 (2). — P. 63 — 70.
16. Perez Aldana L., Kato M., Nakagawa S. et al. The relationship
between consumption of antimicrobial agents and the preva-
lence of primary Helicobacter pylori resistance // Helico-
bacter. — 2002. — N 7. — P. 306 — 309.
17. Peura D. A., Crowe S. E. Helicobacter pylori // Feldman M.,
Friedman L. S., Brandt L. J., eds. Sleisenger & Fordtran’s Gastro-
intestinal and Liver Disease. — 9th ed. Philadelphia, Pa: Saun-
ders Elsevier, 2010. — Ch. 50.
18. Sun Q., Liang X., Zheng Q. et al. High efficacy of 14-ay triple
therapy-based, bismuth-containing quadruple therapy for
initial Helicobacter pylori eradication // Helicobacter. —
2010. — Vol. 15 (3). — P. 233 — 238.
19. Tepes B., O’Connor A., Gisbert J., O’Morain C. Treatment of
Helicobacter pylori infection 2012 // Helicobacter. — 2012. —
Vol. 17 (suppl. 1). — P. 36 — 42.
20. Wu W., Yang Y., Sun G. Recent Insights into Antibiotic Resis-
tance in Helicobacter pylori Eradication // Gastroenterol Res
Pract. — 2012. — N 2012. — P. 723183.
21. Yoon J. H., Baik G. H., Kim Y. S. et al. Comparison of the Eradi-
cation Rate between 1st and 2nd Week Bismuth-Containing
Quadruple Rescue Therapies for Helicobacter pylori Eradica-
tion // Gut Liver. — 2012. — N 6 (4). — P. 434 — 439.
Контактна інформація
Фадєєнко Галина Дмитрівна, д. мед. н., проф., директор Національного інституту терапії ім. Л. Т. Малої НАМН України
61039, м. Харків, просп. Постишева, 2а. Тел. (57) 373-90-32. Е-mail: [email protected]
Стаття надійшла до редакції 11 червня 2015 р.
Gastro 4_2015.indd 89 09.09.2015 14:09:20
Что предлагает медицина для борьбы с Helicobacter pylori
Хеликобактерная инфекция является одной из потенциальных причин развития гастрита и язвенной болезни желудка. Роль инфекционного фактора в развитии данных заболеваний была клинически доказана. Любая терапия воспалительного процесса в области желудка окажется неэффективной без использования средств, губительно воздействующих на данный микроорганизм. Консервативная медицина использует различные схемы эрадикации хеликобактер пилори, при этом каждая схема имеет свои особенности, преимущества и недостатки.
Что такое эрадикация
Эрадикация helicobacter pylori объединяет несколько стандартных лечебных режимов, направленных на подавление жизнедеятельности данного микроорганизма. После уничтожения хеликобактерной инфекции, в слизистой оболочке желудка создаются благоприятные условия для купирования воспалительного процесса и заживление эрозивно-язвенных очагов. Любая из схем эрадикации helicobacter pylori может быть использована в том случае, если оно соответствует таким критериям:
- Эффективность терапии составляет не менее 80% при повторном обследовании пациента. На эффективность указывает исчезновение воспалительного процесса и полное заживление эрозивно-язвенных очагов.
- Продолжительность схемы эрадикации составляет не более 14 дней.
- Используемые препараты обладают низкой токсичностью и вызывают побочные эффекты не более чем в 15% случаев.
- Простой режим приёма препаратов. Человек, проходящий схему эрадикации не должен обладать специализированными навыками.
Говоря о том, что это такое эрадикация, нельзя не упомянуть, что этот процесс даже с возможностями современной медицины является продолжительным и не всегда обеспечивает нужный результат.
Разновидности схем
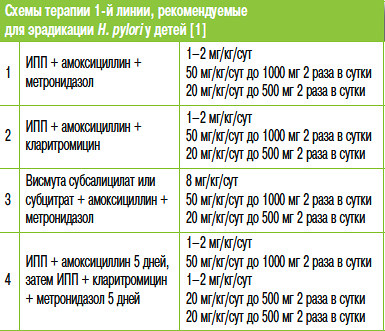
Для лечения хеликобактерной инфекции используются препараты 1 и 2 линии, при этом каждая схема может иметь трехкомпонентный или четырехкомпонентный состав.
Первая линия
Трехкомпонентная схема лечения при эрадикации хеликобактер пилори, включает прием таких медикаментов:
- Один из ингибиторов протонного насоса в стандартной дозировке (Пантопразол, Лансопразол, Омепразол, Рабепразол, Эзомепразол).
- Метронидазол или Амоксициллин.
- Кларитромицин.
Эффективность трехкомпонентной схемы эрадикации может быть усилена за счёт увеличения её продолжительности до 10-14 дней.
Вторая линия
В данном случае используется четырехкомпонентная схема эрадикации хеликобактерной инфекции .Данная схема включает такие препараты:
- Тетрациклин.
- Субсалицилат висмута.
- Метронидазол.
- Одно из наименований ингибиторов протонной помпы в стандартной дозировке (продолжительность терапии более 10 дней).
Выбор схемы эрадикационной терапии при хеликобактер пилори проводится индивидуально, на основании результатов медицинского обследования.
Несмотря на то, что традиционная медицина продолжает использовать стандартные методики эрадикации хеликобактерной инфекции, этот вариант лечения продолжает находиться под сомнением, так как антибактериальные средства не только частично уничтожают бактерию, но и провоцируют ряд побочных реакций.
Полноценной альтернативой стандартным схемам лечения хеликобактерной инфекции, является метапребиотик Стимбифид Плюс, который помогает ускорить процесс эрадикации бактериальной инфекции, восстановить структуру слизистой оболочки желудка и побороть воспалительный процесс. Биодобавка одинаково эффективна при гастрите как с повышенной, так и со сниженной кислотностью.
Стандартная эрадикационная терапия хеликобактерной инфекции основана на внешнем воздействии на бактерию. Клинически доказано, что этот метод лечения является тупиковым и не гарантирует полное уничтожение микроорганизма. Принципиально новым способом является так называемое эндогенное воздействие на хеликобактер пилори посредством увеличения популяции собственной микробиоты желудка. Инновационный путь эрадикации был успешно испытан на людях-добровольцах. Метапребиотик Стимбифид Плюс помогает избавиться от хеликобактерной инфекции посредством таких механизмов:
- Прямой механизм. Компоненты метапребиотика создают неблагоприятные условия для поддержания жизнедеятельности хеликобактер пилори.
- Косвенный механизм. Угнетение популяции хеликобактерной инфекции достигается за счет увеличения количества собственной микрофлоры желудка.
Биодобавка одинаково эффективна как при остром, так и при хроническом течении воспалительного процесса в области желудка. Продолжительность терапии метапребиотиком Стимбифид Плюс составляет от 12 до 28 дней. В ходе клинических испытаний, спустя 30 дней после начала приёма метапребиотика, был проведён контрольный анализ на определение хеликобактерной инфекции. В 100% случаев отмечалась полная эрадикация бактерии.
Метапребиотик используется в качестве монотерапии, при этом отсутствует необходимость в дополнительном приёме препаратов из стандартных схем эрадикации. Важно помнить, что хеликобактерная инфекция является одним из потенциальных факторов развития не только гастрита и язвенной болезни желудка, но и онкологии данного органа.
Своевременная эрадикация бактериальной инфекции помогает снизить риск до минимума. При использовании стандартных методик, эрадикация хеликобактер пилори + схема лечения должна регулярно согласовываться с лечащим врачом. Используя метапребиотик Стимбифид Плюс, человек может самостоятельно проводить терапию в домашних условиях, принимая только одно средство.
К основным преимуществам использования метапребиотика Стимбифид Плюс при гастрите, ассоциированном с хеликобактер пилори можно отнести:
- Биодобавка может быть одинаково использована для взрослых, так и детей, старшей 3-х лет.
- В отличие от антибиотиков, Стимбифид Плюс уничтожает хеликобактерную инфекцию, активизирует рост нормальной микрофлоры в желудке и не вызывает побочные реакции.
/ Доктор Стимбифид
Поделиться в соцсетях:
Новый метод эрадикационной терапии Helicobacter pylori | Старостин
1. Libanio D, Azevedo LF. Analysis of the Cochrane Review: Helicobacter pylori Eradication for the Prevention of Gastric Neoplasia. Cochrane Database Syst. Rev.- 2015; 7: CD 005583.
2. Yi-Chia Lee et al. Association Between Helicobacter pylori Eradication and Gastric Cancer Incidence: A Systematic Review and Meta-analysis // Gastroenterology.- 2016; 1-11. DOI: 10.1053/j.gastro.2016.01.028.
3. Шапошников А. В. Колоректальный рак. Канцерогенез и онкопревенция: пособие для врачей. – Москва, 2015.- с. 160.
4. Sugano K, et al. Kyoto global consensus report on Helicobacter pylori gastritis // Gut.- 2015; 64: 1-15. DOI: 10.1136/ gutjnl-2015-309252.
5. Malfertheiner P, et al. Current concepts in the management of Helicobacter pylori infection: the Maastricht III Consensus Report // Gut.- 2007; 56 (6): 772-781. DOI: 10.1136/gut.2006.101634.
6. Chey W. D., Wong B. C.Y. American College of Gastroenterology Guideline on the Management of Helicobacter pylori Infection // Am. J. Gastroenterol.- 2007; 102 (8): 18081825. DOI: 10.1111/j.1572-0241.2007.01393.x.
7. Graham DY. Helicobacter pylori Update: Gastric Cancer, Reliable Therapy, and Possible Benefits // Gastroenterology.- 2015; 148: 719-731. DOI: http://dx.doi. org/10.1053/j.gastro.2015.01.040.
8. Yuan Y, et al. Optimum duration of regimens for Helicobacter pylori eradication (Review) // The Cochrane Library.-2013, Issue 12. DOI: 10.1002/14651858.CD008337.pub2.
9. Старостин Б. Д. Под редакцией проф. Ткаченко Е. И. Повышение эффективности эрадикации Helicobacter pylori при Н.р.-ассоциированных заболеваниях. Практические рекомендации и схемы терапии.- СПб.: Инфо Ол, 2015.-52 с.: ил.
10. Chang Liu, Zhuo-Yang Zhang, Ke Dong, Xiao-Kui Guo. Adhesion and immunomodulatory effects of Bidobacterium lactis HN 019 on intestinal epithelial cells INT-407 // WJG.- 2010; 16 (18): 2283-2290. DOI:10.3748/wjg. v16.i18.2283.
11. Achmed M, et al. Impact of consumption of different levels of Bifidobacterium lactis HN019 on the intestinalmicroflora of elderly human subjects // J. Nutr. Health Aging.- 2007; 11 (1): 26-31.
12. Technical Memorandum. TM 58-2e. Danisco. Bifidobacterium lactis HN 019 – a probiotic witH proven efficacy.
13. Bernini LJ, Simao AN, Alfieri DF, et al. Beneficial effects of Bifidobacterium lactis on lipid profile and cytokines in patients with metabolic syndrome: A randomized trial. Effects of probiotics on metabolic syndrome // Nutrition.- 2016; 32 (6): 716-9. DOI: 10.1016/j. nut.2015.11.001.
14. Sachdeva A, Rawat S, Nagpal J. Effcacy of fermented milk and whey proteins in Helicobacter pylori eradication: A review // WJG.- 2014; 20 (3): 724-737. DOI: 10.3748/wjg.v20.i3.724.
15. Ammons M. C. and Copie V. Lactoferrin: A bioinspired, anti-biofilm therapeutic //Biofouling.- 2013; 29 (4): 443-455. DOI: 10.1080/08927014.2013.773317.
16. Fulgione Andrea, et al. Lactoferrin Adsorbed onto Biomimetic Hydroxyapatite Nanocrystals Controlling – In Vivo – the Helicobacter pylori Infection // PLOS one.- 2016; Jule 6: 1-16. DOI:10.1371/journal.pone.0158646.
17. Sachdeva A & Nagpal J. Meta-analysis: efficacy of bovine lactoferrin in Helicobacter pylori eradication // Aliment Pharmacol Ther.- 2008; 29: 720-730. DOI:10.1111/ j.1365-2036.2009.03934.x.
18. Lebros-Pantoflickova D, Corthesy-Theulaz I, and Blum L. Helicobacter pylori and Probiotics // J. Nutr. – 2007; 137: 812S-818S.
19. Calvet X, Garcia N, Lopez T, et al. A meta-analysis of short versus long therapy with a proton pump inhibitor, clarithromycin and either metronidazole or amoxycillin for treating Helicobacter pylori infection // Aliment. Pharmacol. Ther.- 2000; 14: 603-9.
20. Ford A, Moayyedi P. How can the current strategies for Helicobacter pylori eradication therapy be improved? //Can. J. Gastroenterol.- 2003; 17 (Suppl. B): 36B-40B.
21. Peter Malfertheiner, Francis Megraud, Colm A O’Morain, John Atherton, Anthony T R Axon, Franco Bazzoli, Gian Franco Gensini, Javier P Gisbert, David Y Graham, Theodore Rokkas, Emad M El-Omar, Ernst J Kuipers, The European Helicobacter Study Group (EHSG). Management of Helicobacter pylori infection – the Maastricht IV / Florence Consensus Report // Gut.- 2012; 61: 646-664. DOI:10.1136/gutjnl-2012-302084.
22. Villoria A. Acid-related diseases: are higher doses of proton pump inhibitors more effective in the treatment of Helicobacter pylori infection? // Gastroenterol Hepatol.-2008; 31: 546-7.
23. Sheu B-S, Wu J-J, Lo C-Y, et al. Impact of supplement with Lactobacillus- and Bifidobacterium-containing yogurt on triple therapy for Helicobacter pylori eradication // Aliment. Pharmacol. Ther.- 2002; 16: 1669-1675. DOI: 10.1046/j.1365-2036.2002.01335.x.
24. Medeiros Jose A, and Pereira Marta-Isabel. The use of Probiotics in Helicobacter pylori Eradication Therapy // J. Clin. Gastroenterol.- 2013; 47 (1): 1-5. DOI: 10.1097/ MCG.0b013e3182702dbc.
25. Emara Mohamed Y, et al. Emerging Role of Probiotics in the Management of Helicobacter Pylori Infection: Histopathologic Perspectives // Helicobacter.- 2016; 21: 3-10. DOI: 10.1111/hel.12237.
26. Cosme Angel, et al. Antimicrobial Susceptibility-Guided Therapy Versus Empirical Concomitant Therapy for Eradication of Helicobacter pylori in a Region with High Rate of Clarithromycin Resistance // Helico-bacter.-2016; 21 (1): 29-34. DOI: 10.1111/ hel.12231.
27. Zhou Liya, et al. Tailored versus Triple plus Bismuth or Concomitant Therapy as Initial Helicobacter pylori Treatment: A Randomized Trial // Helicobacter.- 2016; 21 (2): 91-99. DOI: 10.1111/hel.12242.
28. Chen Han, et al. Tailored Therapy Versus Empiric Chosen Treatment for Helicobacter pylori Eradication // Medicine.-2016; 95 (7): 1-10. DOI: 10.1097/MD.0000000000002750.
29. McFarland LV, Huang Y, Wang L and Malfertheiner P. Systematic review and meta-analysis: Multi-strain probiotics as adjunct therapy for Helicobacter pylori eradication and prevention of adverse events //UEG journal.-2016; 4 (4): 546-561. DOI: 10.1177/2050640615617358.
30. Manfredi M, et al. Helicobacter pylori Infection in Clinical Practice: Probiotics and a Combination of Probiotics + Lactoferrin Improve Compliance, But Not Eradication, in Sequential Therapy // Helicobacter.- 2012; 17 (4): 254-263. DOI: 10.1111/j.1523-5378.2012.00944.x.
31. Tong JL, Ran ZH, Shen J, et al. Meta-analysis: the effect of supplementation with probiotics on eradication rates and adverse events during Helicobacter pylori eradication therapy // Aliment. Pharmacol. Ther. – 2007; 25: 155-68. DOI: 10.1111/j.1365-2036.2006.03179.x.
32. Sachdeva A, Nagpal J. Effect of fermented milk-based probiotic preparations on H. pylori eradication: a systematic review and meta-analysis of randomized-controlled trials //Eur. J. Gastroenterol. Hepatol.- 2009; 1: 45-53. DOI: 10.1097/MEG.0b013e-32830d0eff.
33. Szajewska H, Horvath A, Piwowarczyk A. Meta-analysis: the effects of Saccharomyces boulardii supplementation on Helicobacter pylori eradication rates and side effects during treatment // Aliment Pharmacol Ther.- 2010; 32: 1069-79. DOI: 10.1111/j.1365-2036.2010.04457.x.
34. Bumjo Oh, Bong-Soo Kim, Ji Won Kim, et al. The Effect of Probiotics on Gut Microbiota during the Helicobacter pylori Eradication: Randomized Controlled Trial // Helico-bacter.-2016;21 (3): 165-174. DOI: 10.1111/ hel.12270.
35. Min-Min Zhang, Wei Qian, Ying-Yi Qin, Jia He, Yu-Hao Zhou. Probiotics in Helicobacter pylori eradication therapy: A systematic review and meta-analysis // WJG.- 2015; 21 (14): 4345-4357. DOI: 10.3748/wjg.v21.i14.4345.
36. Старостин Б. Д., Старостина Г. А. Флоролакт при проведении антихеликобактерного режима // Гастроэнтерология Санкт-Петербурга. – 2013; 1: 15-18.
37. P Malfertheiner, F Megraud, CA O’Morain, JP Gisbert, EJ Kuipers, AT Axon, F Bazzoli, A Gasbarrini, J Atherton, DY Graham, R Hunt, P Moayyedi, T Rokkas, M Rugge, M Selgrad, S Suerbaum, K Sugano, EM El-Omar, on behalf of the European Helicobacter and Microbiota Study Group and Consensus panel // Gut.-2017; 66: 6-30. DOI:10.1136/ gutjnl-2016-312288.
38. O’Connor A, Fishback W, G’isbert J, O’Morain C. Treatment of Helicobacter pylori infection 2016 // Helicobacter.- 2016; 21 (Suppl. 1): 55-61. DOI: 10.1111/hel.12342.
39. De Witte C, Sczulz C, Smet A, Malthertheiner P. Other Helicobacter and gastric microbiota // Helicobacter.- 2016; 21 (Suppl. 1): 62-68. DOI: 10.1111/hel.12343.
Лечение хеликобактериоза у больных сахарным диабетом 2 типа в сочетании с хронической гастродуоденальной патологией | Федорченко
Основным постулатом лечения патологии, ассоциированной с инфекцией Helicobacter pylori (HP), является принцип эрадикации возбудителя. В соответствии с международным консенсусом Маастрихт V (2015), Киотским консенсусом (2015), рекомендациями Российской гастроэнтерологической ассоциации по диагностике и лечению HP у взрослых (2012) регламентированы стандарты антихеликобактерной терапии [1, 2]. Однако, как свидетельствуют многочисленные отечественные и зарубежные исследования, за последнее десятилетие эффективность классических схем первой и второй линии эрадикации упала [3]. Это связано с рядом проблем, главные из которых: рост резистентности НР к метронидазолу и кларитромицину; побочные действия ингибиторов протонной помпы и антибактериальных препаратов [4].
Одной из новых схем эрадикационной терапии является последовательная схема (5 дней ингибитор протонной помпы (ИПП) + амоксициллин, далее 5 дней ИПП + кларитромицин + тинидазол/метронидазол). Эта схема в настоящее время – одна из самых изучаемых схем эрадикации во всем мире, что продиктовано высокими цифрами эффективности такой терапии [5]. В рамках консенсуса Маастрихт V данный протокол эрадикации регламентирован в качестве альтернативы схемы первой линии [2]. Данный консенсус рекомендует также для оптимизации лечения и увеличения эффективности эрадикации пролонгировать лечение схемами первой линии до 14 дней.
Для больных сахарным диабетом 2 типа (СД2) с хроническими гастродуоденальными заболеваниями (ГДЗ) также актуально стоит вопрос об эрадикации HP, т.к. доказана высокая степень инфицирования этих пациентов, от 70 до 90% [6]. Однако исследования, в которых изучались схемы эрадикации HP у больных СД с ГДЗ, в нашей стране и за рубежом, единичны [7, 8]. В частности, в доступной литературе нами не найдены работы по использованию последовательной схемы у данных пациентов.
Актуальной является проблема переносимости больными эрадикационной терапии, ее влияния, положительного или отрицательного, на качество жизни пациентов, на состояние микробиоты кишечника. Это особенно важно с учетом модификации схем эрадикации, увеличения длительности лечения и числа антибактериальных препаратов в этих схемах.
ЦЕЛЬ
Цель исследования состояла в изучении эффективности и последствий тройной и оптимизированной последовательной схем антихеликобактерной терапии больных СД2 в сочетании с ГДЗ.
МЕТОДЫ
Дизайн исследования
В открытое сравнительное контролируемое исследование по принципу случайной выборки были включены 118 пациентов, страдающих различными ГДЗ и инфицированные HP, из них у 54 имелся достоверно установленный СД2. 64 пациента с ГДЗ, но не имевшие СД2, составили группу сравнения. ГДЗ были диагностированы согласно имеющимся стандартам обследования с привлечением специальных методов: эзофагогастродуоденоскопии (ЭГДС), взятия биопсии слизистой желудка и двенадцатиперстной кишки с гистологическим исследованием. Инфицированность HP определяли уреазным тестом (в биоптатах минимум из двух мест – тела и антрума желудка) и методом иммуноферментного анализа (ИФА) с моноклональными антителами для выявления антигенов возбудителя в кале. Причем последний метод был обязателен для контроля за эрадикацией, который осуществляли через 1 мес после окончания лечения.
Все пациенты были разделены на 4 группы: в 1-ю группу вошли больные без СД2, которые получали стандартную тройную схему эрадикации HP. Во 2-ю группу – больные СД2, получавшие также тройную терапию. В 3-ю группу вошли больные без СД2 и в 4-ю – с СД2, которым была назначена оптимизированная последовательная схема эрадикации НР. 1-я и 3-я группы расценивались как контрольные по отношению к больным СД2. В табл. 1 представлена сравнительная характеристика всех 4 групп по результатам рандомизации.
Таблица 1. Исходная характеристика больных СД2 и контрольных групп, получавших тройную и последовательную антихеликобактерную терапию
Признак | Тройная терапия | Последовательная терапия | Р1–2 | Р3–4 | Р1–3 | Р2–4 | ||
1 группа контроль, n=34 | 2 группа СД2, n=26 | 3 группа контроль, n=30 | 4 группа СД2, n=28 | |||||
Возраст, лет | 52,4±6,3 | 54,6±4,2 | 47,3±5,2 | 52,3±4,1 | 0,458 | 0,438 | 0,265 | 0,722 |
Пол мужчины, n (%) женщины, n (%) | 14 (41,2) 20 (58,8) | 10 (38,5) 16 (61,5) | 8 (26,7) 22 (73,3) | 11 (39,3) 17 (60,7) | 0,376 0,621 | 0,321 0,458 | 0,244 0,332 | 0,558 0,416 |
ИМТ, кг/м² | 27,5±3,2 | 29,5±2,8 | 26,4±2,1 | 30,2±3,1 | 0,578 | 0,345 | 0,389 | 0,421 |
Болезни, абс. (%) НЭр. гастрит Эр. гастрит ЯБ | 11 (32,4) 16 (47,1) 7 (20,6) | 8 (30,8) 12 (46,1) 6 (23,1) | 13 (43,3) 13 (43,3) 4 (13,4) | 9 (32,1) 13 (46,4) 6 (21,4) | 0,434 0,786 0,146 | 0,465 0,278 0,277 | 0,433 0,465 0,132 | 0,211 0,390 0,178 |
Ср. длительность болезни, лет | 16,4±4.2 | 14,2±3,6 | 14,2±3,6 | 15,8±4,2 | 0,389 | 0,567 | 0,234 | 0,543 |
Сопут. болезни, абс. (%) ГЭРБ ПБЗ ИБС ГБ | 14 (41,2) 16 (47,1) 8 (23,5) 15 (44,1) | 13 (59,1) 12 (54,5) 10 (45,5) 20 (90,9) | 11 (36,7) 11 (36,7) 5 (16,7) 10 (33,3) | 10 (55,5) 8 (44,4) 12 (66,7) 23 (82,1) | 0,089 0,768 0,034 0,007 | 0,078 0,422 0,021 0,012 | 0,099 0,322 0,235 0,562 | 0,121 0,237 0,267 0,711 |
Исходная оценка НР, абс. (%) Уреазный тест ИФА в кале | 27 (79,4) 7 (20,6) | 18 (69,2) 8 (30,8) | 23 (76,7) 7 (23,3) | 18 (64,3) 10 (35,7) | 0,534 0,711 | 0,347 0,544 | 0,356 0,566 | 0,558 0,497 |
Примечания: ГЭРБ – гастроэзофагеальная рефлюксная болезнь, НЭр. – неэрозивный, Эр. – эрозивный, ЯБ – язвенная болезнь, ПБЗ – панкреатобилиарные заболевания, ИБС – ишемическая болезнь сердца, ГБ – гипертоническая болезнь.
Как видно из табл. 1, пациенты 4 групп достоверно не различались между собой по таким показателям, как возраст, распределение по полу, индексу массы тела (ИМТ), длительности заболевания, распределению по частоте ГДЗ, по методам оценки HP, что делало их максимально однородными за исключением отсутствия или наличия СД2. Единственное различие между группами контроля и группами СД2 было в частоте кардиальной патологии, которая в большей степени встречалась у больных СД2. Но это не могло повлиять на дальнейший ход исследования.
В задачи работы входило определение клинико-эндоскопической и лабораторной эффективности эрадикационных схем. Для оценки клинической эффективности использовали методику оценки гастроэнтерологических жалоб по системе GSRS (Gastrointestinal Simptom Rating Scale), разработанную I.Wiklund [9]. Русскоязычная версия опросника GSRS была создана исследователями Межнационального Центра исследования качества жизни (г. Санкт-Петербург) [10]. Суть методики заключалась в опросе больных по 5 шкалам: DS – диарейный синдром, IS – диспептический, CS – констипационный, AP – абдоминальных болей, RS – рефлюксный. За каждый синдром можно получить максимум от 14 до 28 баллов в зависимости от частоты симптомов. Для общей оценки жалоб баллы разных шкал суммировались.
Одна из задач нашего исследования состояла в изучении влияния эрадикационных схем на микробиоту тонкого кишечника, на синдром избыточного бактериального роста (СИБР) в тонком кишечнике. Последний встречается довольно часто у больных СД2 [7]. Для выявления СИБР использовали результаты водородного теста с лактулозой, который проводили исходно и через 1 мес после окончания лечения. Водородный тест признан наиболее информативным для оценки наличия СИБР в кишечнике. В качестве прибора для проведения водородного теста применяли «Гастролайзер» (Великобритания), а сама методика не отличалась от стандартной [11].
Критерии соответствия
Из обследования были исключены лица, страдающие тяжелыми декомпенсированными заболеваниями сердца, легких, печени, поджелудочной железы, кишечника. От всех пациентов было получено письменное согласие на обследование и лечение, согласно приказу Минздрава РФ № 173/1 от 25 июля 2012 г. «Об информированном добровольном согласии на медицинскую помощь».
Условия проведения
Все пациенты были жителями г. Хабаровска, наблюдались у гастроэнтеролога в ГБУЗ Городская поликлиника №16, у эндокринолога в «Центре эндокринологического здоровья» г. Хабаровска. На базе этих учреждений проводились обследование и лечение больных.
Продолжительность исследования
Исследование проводилось на протяжении 2 лет. Каждый обследованный перед началом исследованияв течение 2 нед не принимал ингибиторы протонной помпы (ИПП) и минимум 6 мес – антибиотики. После постановки диагноза ГДЗ и выявления инфекции НР пациентам назначалась одна из схем антихеликобактерной терапии согласно дизайну исследования. Для определения эндоскопической эффективности лечения, по его окончанию проводили ЭГДС с оценкой состояния слизистой желудка и двенадцатиперстной кишки. Следует отметить, что больные, помимо эрадикационной терапии, получали антацидную и антисекреторную терапию (только тем ИПП, который был назначен первоначально) до 1 мес. Проведение водородного теста с определением СИБР осуществляли исходно и через 1 мес после окончания антихеликобактерной терапии.
Описание медицинского вмешательства
Стандартная тройная схема антихеликобактерной терапии включала в себя: омепразол 40 мг/сут + кларитромицин 1 г/сут + амоксициллин 2 г/сут в течение 10 дней. Последовательная схема эрадикации НР была представлена выше, дозировки препаратов такие же, как в тройной схеме + метронидазол – 1 г/сут. Оптимизация данной схемы состояла в увеличении продолжительности лечения: ИПП + амоксициллин 7 дней, далее: ИПП + кларитромицин + метронидазол еще 7 дней. Кроме того, вместо омепразола в данной схеме использовался рабепразол, так как, согласно положению 10 рабочей группы 3 Маастрихта V, этот ИПП признан наименее подверженным влиянию генотипа CYP2C19 и метаболизирующимся преимущественно в результате неферментативного процесса [2].
Основной исход исследования
Лабораторной эффективностью эрадикационных схем считались отрицательные результаты ИФА на антигены HP в кале через 1 мес после окончания лечения.
Дополнительные исходы исследования
Клиническую эффективность лечения оценивали по достоверному снижению показателя GSRS по отношению к исходному через 1 мес от начала терапии ГДЗ. Эндоскопическая эффективность определялась исчезновением эндоскопических признаков заболевания по данным ЭГДС также через 1 мес от начала лечения.
Этическая экспертиза
На представленное исследование получено заключение экспертной комиссии по вопросам медицинской этики ФГБОУ ВО ДВГМУ (Положение об этическом комитете при научно-плановой комиссии ДВГМУ от 08.01.2014 г., утверждено ректором В.П.Молочным): проведенное научное исследование соответствует общепринятым нормам морали, требованию соблюдения прав, интересов и личного достоинства лиц, принимавших участие в исследовании.
Статистический анализ
Результаты исследования обработаны с помощью пакета прикладных программ Statisticа 10, Excel 2014. Абсолютные величины сравнивали с расчетом средних значений, ошибки средних, с использованием критерия Стьюдента. Для относительных величин применяли точный критерий Фишера. Различия считались статистически значимыми при достигнутом уровне p<0,05.
РЕЗУЛЬТАТЫ
Результаты тройной схемы антихеликобактерной терапии больных СД в сравнении с контрольной 1-й группой представлены в табл. 2.
Таблица 2. Результаты лечения тройной антихеликобактерной схемой больных СД2 и контрольной группы
Признак | Контроль (группа 1) n=34 | Больные СД2 (группа 2) n=26 | ||
исходно | после лечения | исходно | после лечения | |
Больных с НР, абс. (%) | 34 (100) | 11 (32,4)* | 26 (100) | 9 (34,6)* |
Больных с ремиссией по данным ЭГДС, абс. (%) | – | 24 (70,6) | – | 16 (61,5) |
Общий GSPS, баллы | 56,7±4,3 | 38,1±2,3* | 79,6±4,1 | 54,6±3,2* |
Синдромы GSPS, баллы DS (диарейный) IS (диспепсический) CS (констипационный) AP (абдоминальных болей) RS (рефлюксный) | 14,4±2,4 17,6±2,1 8,2±1,8 6,8±1,1 14,2±1,3 | 10,4±1,1 10,7±1,3* 14,8±1,8* 3,1±0,4* 4,1±1,1* | 7,9±1,2 26,6±2,1 13,1±1,3 13,2±1,6 20,8±1,6 | 14,3±1,1* 11,6±2,1* 12,2±2,4 4,2±1,1* 8,3±1,4* |
СИБР, абс. (%) | 15 (44,1) | 10 (29,4) | 18 (69,2) | 13 (50) |
Примечания: ____ – достоверность различий в исходных показателях между группами, p<0,05, * – достоверность различий с исходными показателями в каждой группе, p<0,05.
Следует отметить, что исходно у больных СД2 был достоверно выше общий балл GSRS, чем у пациентов без СД2, а значит, более выраженная клиническая картина ГДЗ. У больных СД2 клинически достоверно чаще встречались диспептический, рефлюксный, синдромы абдоминальных болей, чем в контрольной группе. В свою очередь, диарейный синдром достоверно чаще наблюдался в группе контроля. Запоры наблюдались примерно с одинаковой частотой в обеих группах.
Через 1 мес лечения, в том числе антихеликобактерного, в группе без СД2 достоверно с исходным уменьшились проявления диспептического, рефлюксного синдромов, синдрома абдоминальных болей, но чаще стал наблюдаться констипационный синдром. По синдрому диареи существенных изменений не произошло. В целом общий средний балл GSRS стал достоверно меньше. В группе СД2 на фоне терапии также произошло значимое уменьшение проявлений диспептического, рефлюксного и болевого синдромов, но чаще стала наблюдаться у больных диарея. Общий балл гастроэнтерологических жалоб все же достоверно снизился с 79,6 до 54,6 (p<0,05).
При проведении ЭГДС после завершения лечения оказалось, что в группе 1 в 70,6%, а в группе 2 – в 61,5% случаев имела место положительная динамика в виде заживления язв и эрозий, улучшения гистологической картины со стороны слизистой желудка и двенадцатиперстной кишки. Эффективность эрадикации НР при тройной антихеликобактерной терапии установлена следующая: в группе 1, у больных без СД – 67,6%, а в группе 2, у пациентов с СД2 – 65,3% (p>0,05).
Исследование показало, что исходно СИБР достоверно чаще встречался во 2-й группе с СД2 по сравнению с контрольной группой 1. При этом схема тройной терапии привела к уменьшению числа больных с СИБР в обеих группах, но снижение это не было достоверно значимым.
В табл. 3 представлены результаты лечения пациентов с ГДЗ оптимизированной последовательной схемой антихеликобактерной терапии.
Таблица 3. Результаты лечения оптимизированной последовательной антихеликобактерной схемой больных СД2 и контрольной группы
Признак | Контроль (группа 3) n=30 | Больные СД2 (группа 4) n=28 | ||
исходно | после лечения | исходно | после лечения | |
Больных с НР, абс. (%) | 30 (100) | 3 (10)* | 18 (100) | 4 (14,2)* |
Больных с ремиссией по данным ЭГДС, абс. (%) | 28 (93,3) | 23 (82,1) | ||
Общий GSPS, баллы | 57,2±3,8 | 30,2±2,4* | 76,4±2,5 | 38,6±2,4* |
Синдромы GSPS, баллы DS (диарейный) IS (диспепсический) CS (констипационный) AP (абдоминальных болей) RS (рефлюксный) | 13,6±1,4 18,2±1,2 7,8±1,3 7,2±1,4 9,8±1,2 | 4,4±1,1* 7,8±1,4* 6,3±1,2 3,1±0,6* 3,6±1,2* | 9,4±1,2 25,2±2,6 10,8±2,2 12,8±1,3 18,2±1,8 | 3,1±1,1* 11,1±1,3* 7,9±2,1 5,2±1,3* 8,4±1,4* |
СИБР, абс. (%) | 14 (46,7) | 6 (20)* | 22 (78,5) | 6 (21,4)* |
Примечания: ____ – достоверность различий в исходных показателях между группами, p<0,05, * – достоверность различий с исходными показателями в каждой группе, p<0,05.
Как видно из табл. 3, исходная клиническая картина, по общему среднему баллу GSRS, была достоверно более выражена в группе 4 с СД2, по сравнению с контрольной группой 3. У больных СД2 достоверно чаще наблюдались диспептический, болевой, рефлюксный синдромы и реже диарейный. На фоне лечения с использованием последовательной схемы в группе 3 достоверно уменьшились проявления диарейного, диспептического, болевого и рефлюксного синдромов. Такие же положительные изменения произошли в группе 4 больных с СД2, также с достоверной значимостью.
В ходе лечения эндоскопическая ремиссия была достигнута у 93,3% больных 3-й группы и у 82,1% пациентов 4-й группы. Эффективная эрадикация H.pylori на фоне оптимизированной последовательной схемы имела место у 90% пациентов 3-й группы и у 85,7% больных 4-й группы.
Исходно СИБР в тонком кишечнике, как и в случае с тройной схемой лечения, достоверно чаще наблюдали в группе 4 с СД2 по сравнению с группой контроля 3. Но, в отличие от результатов лечения тройной терапией, при данной схеме как в группе 3, так и в группе 4 имело место достоверное снижение числа больных с СИБР по окончанию терапии.
ОБСУЖДЕНИЕ
Таким образом, результаты нашего исследования позволили сравнить эффективность тройной и оптимизированной последовательной схем антихеликобактерной терапии больных с ГДЗ при наличии СД2 и без него. Следует отметить, что, согласно рекомендациям, посвященным проблеме хеликобактериоза, задача лечения заключается в более 80% эрадикации возбудителя, оптимальным считается от 85 до 90% [1]. Однако, как свидетельствуют многочисленные отечественные и зарубежные исследования, за последнее десятилетие эффективность классических схем первой и второй линии упала и редко превышает необходимый процент [3]. Как показали наши исследования (рис. 1), в группе тройной терапии как у больных СД2, так и без диабета процент эрадикации НР не достигал и 70%.
Рис. 1. Сравнение эффективности эрадикации НР при назначении тройной и оптимизированной последовательной схем терапии.
Для больных с СД2 он был ниже, чем в контрольной группе, хотя и недостоверно. В группе пациентов, получающих оптимизированную последовательную терапию, получен больший эффект эрадикации HP: у пациентов без СД2 – 90%, а с СД2 – 85,7%. Различия с тройной схемой лечения были достоверны: для больных без СД2 – p=0,035 и для больных с СД2 – р=0,044.
Обе схемы лечения во всех группах привели к уменьшению клинической картины ГДЗ, но в большей степени это наблюдалось в группах оптимизированной последовательной терапии. Для больных СД2 ΔGSRS (уменьшение общей суммы баллов) при тройной терапии составил 25,1±3,2 балла (p<0,05), ΔGSRS при последовательной терапии – 38,4±2,5 балла (p<0,05).
Эндоскопическая ремиссия также была в большем проценте случаев получена во всех группах последовательной терапии по отношению к тройной терапии.
Об эффективности последовательной схемы можно судить по серии клинических исследований, осуществленных в разных странах мира. Так, в Италии и Испании в период с 2003 по 2007 гг. были проведены исследования, включавшие более 100 человек каждое, уровень эрадикации НР достигал при этом 91–95% [12]. В исследовании Y.S.Kim и соавт. (2011), проведенном в Южной Корее, эффективность 10-дневной последовательной схемы составила 92,6% по сравнению с 85% 14-дневной тройной схемой с одинаковыми побочными явлениями [13]. Метаанализ, который включал 36 рандомизированных контролируемых исследований, смог продемонстрировать преимущества последовательной схемы, ее более высокую эффективность (84,1%) по сравнению с классическим протоколом тройной терапии (75,1%) [14]. Но следует отметить, что все перечисленные исследования не касались лиц, страдающих СД2.
По рекомендациям Российской гастроэнтерологической ассоциации (2012), последовательная схема утверждена в качестве альтернативной и высокоэффективной, эффект которой мало зависит от резистентности к кларитромицину. А значит, может применяться в районах, где эта резистентность высока, или не исследована. В этих рекомендациях отмечено, что последовательная схема лечения является многообещающей, и применительно к России требует проведения собственных исследований для уточнения ее места в терапии инфекции НР [1].
Интерес представляют данные по влиянию эрадикационной терапии на СИРБ в тонком кишечнике, который исходно имел место у 44–46% больных ГДЗ без СД (в зависимости от группы) и у 69–78% больных СД2. В нашем исследовании только оптимизированная последовательная схема терапии позволила достоверно уменьшить число больных с СИБР в обеих группах.
Исходя из анализа полученных результатов исследования, можно заключить, что использование оптимизированной последовательной схемы лечения больных с хеликобактериозом и ГДЗ имеет существенные преимущества перед классической тройной терапией. Это касается как пациентов без сопутствующего СД, так и с СД2. Для последней группы данные результаты особо значимы, т.к. ранее таких исследований не проводили. В рамках консенсуса Маастрихт V протокол последовательной схемы регламентируется как терапия первой линии, особенно в регионах с высокой резистентностью HP к кларитромицину [2]. Но так как в Хабаровском крае исследований по изучению данной резистентности не проводилось, последовательная схема приобретает особую актуальность.
ВЫВОДЫ
Применение у больных СД2 в сочетании с ГДЗ в качестве антихеликобактерной терапии оптимизированной последовательной схемы позволило повысить эффективность эрадикации НР по сравнению с тройной схемой терапии с 65,3 до 85,7%.
Использование оптимизированной последовательной схемы эрадикации у больных СД2 с ГДЗ имеет преимущества перед тройной схемой по степени уменьшения клинической картины и получения эндоскопической ремиссии у больных.
Назначение оптимизированной последовательной схемы терапии больным СД2 с ГДЗ, в отличие от тройной схемы терапии, позволяет достоверно уменьшить число больных с сопутствующим СИБР в кишечнике.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Финансирование работы. Финансирование за счет средств бюджета ГБУЗ Городская поликлиника № 16, г. Хабаровск, частное финансирование Федорченко Ю.Л., Мартынюк М.В.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией данной статьи.
Участие авторов. Федорченко Ю.Л. концепция, дизайн исследования, анализ данных, написание статьи; Мартынюк М.В. – сбор материала, обработка, анализ данных, написание статьи.
Лечение инфекции Helicobacter pylori: прошлое, настоящее и будущее
World J Gastrointest Pathophysiol. 2014 15 ноября; 5 (4): 392–399.
Василиос Папастергиу, Стилианос Каратапанис, Отделение внутренней медицины, Общая больница Родоса, 85100 Родос, Греция
Сотириос Д. Георгопулос, Отделение гастроэнтерологии, Афинский медицинский центр, Больница П. Фалирон, 17562 Афины, Греция
Вклад авторов: Папастергиу Вирджин участвовал в разработке концепции и дизайна статьи; Георгопулос С.Д. участвовал в написании статьи, критически отредактировав ее на предмет важного интеллектуального содержания; Каратапанис С. участвовал в окончательном утверждении версии, которая будет опубликована.Для корреспонденции: Стилианос Каратапанис, MD, PhD, Отделение внутренней медицины, Общая больница Родоса, ул. Калопетрас 10, 85100 Родос, Греция. rg.teneto@raklyts
Телефон: + 30-224-1080456 Факс: + 30-224-1066410
Получено 12 февраля 2014 г .; Пересмотрено 15 апреля 2014 г .; Принято 17 июля 2014 г.
Copyright © 2014 Baishideng Publishing Group Inc. Все права защищены. Эта статья цитируется в других статьях PMC.Аннотация
Helicobacter pylori ( H.pylori ) является основным патогеном человека, вызывающим значительную заболеваемость и смертность. Однако после десятилетий усилий лечение H. pylori остается проблемой для врачей, поскольку не существует универсально эффективной схемы. Из-за растущей распространенности устойчивости к противомикробным препаратам, в основном к кларитромицину, эффективность стандартных тройных терапий снизилась до неприемлемо низких уровней в большинстве регионов мира. Новые схемы, специально опробованные для улучшения терапевтического результата против антибиотикорезистентного H.pylori , в настоящее время рекомендуются в качестве вариантов эмпирического лечения первой линии, обеспечивающих высокую эффективность (по имеющимся данным,> 90% при анализе намерения лечить) даже в условиях высокой резистентности к кларитромицину. К ним относятся четырехкратная висмутовая, сопутствующая, последовательная и гибридная терапия. Из-за быстрого развития резистентности к хинолонам схемы на основе левофлоксацина следует зарезервировать как варианты второй линии / спасения. Было предложено дополнительное использование пробиотиков для повышения скорости эрадикации и уменьшения побочных эффектов, связанных с лечением.В настоящее время доступны методы молекулярного тестирования для характеристики терапевтической восприимчивости H. pylori , включая генотипическое определение устойчивости к макролидам и оценку статуса цитохрома P450 2C19, который, как известно, влияет на метаболизм ингибиторов протонной помпы. В будущем использование этих методов может позволить неинвазивно адаптировать терапию для лечения инфекции H. pylori без культивирования.
Ключевые слова: Helicobacter pylori , устойчивость к антибиотикам, четырехкратный висмут, сопутствующий, последовательный, пробиотики
Основной совет: Увеличение распространенности устойчивости к макролидам во всем мире привело к неэффективности стандартных методов лечения Helicobacter pylori ( H.pylori ) инфекция. Четырехкратная, сопутствующая, последовательная и гибридная терапия висмутом теперь рекомендуются в качестве эмпирических методов лечения первой линии, обеспечивающих повышенную эффективность в условиях высокой резистентности к кларитромицину. Поскольку резистентность к хинолонам быстро растет, левофлоксацин следует предпочтительно использовать в терапии второй линии / терапии неотложной помощи. Появляется все больше доказательств того, что добавление дополнительных пробиотиков улучшает терапевтический результат и переносимость. Генотипическая характеристика восприимчивости H. pylori к терапии может позволить разработать индивидуальный терапевтический подход в будущем.
ВВЕДЕНИЕ
Лечение инфекции Helicobacter pylori ( H. pylori ) имеет первостепенное значение для лечения распространенных желудочно-кишечных заболеваний, включая язвенную болезнь, рак желудка и функциональную диспепсию [1-3]. Более того, внепищеварительные расстройства теперь включены в качестве показаний для искоренения H. pylori : идиопатическая тромбоцитопеническая пурпура, дефицит витамина B12 и необъяснимая железодефицитная анемия [4]. В отличие от других бактериальных инфекций, при лечении которых обычно проводят тесты на чувствительность, культивирование H.pylori широко не доступен и требует проведения эндоскопии, которая не переносится всеми пациентами и имеет ряд ограничений, включая тот факт, что чувствительность in vitro и не всегда гарантирует искоренение in vivo [5]. Таким образом, схемы лечения H. pylori обычно назначались эмпирически при условии, что они были предварительно протестированы и в достаточной степени адаптированы с учетом различных параметров (, т.е. .; лечебная доза, продолжительность, интервалы дозирования и т. Д. .) для оптимизации скорости излечения и минимизации побочных эффектов. Однако оптимальное лечение для уничтожения H. pylori еще предстоит определить, поскольку ни один из режимов не является универсальным. Повышение во всем мире устойчивости к основным антибиотикам, главным образом к кларитромицину (CAM), но также к метронидазолу (MNZ) и левофлоксацину, является основным фактором, определяющим неэффективность лечения инфекции H. pylori [6,7]. В недавнем систематическом обзоре сообщалось, что глобальная заболеваемость устойчивостью к САМ составляет 17.2% в диапазоне от 11,1% в Европе до 29,3% в Америке, тогда как, согласно тому же анализу, континентальные уровни устойчивости к MNZ составили 17% и 44,1% соответственно [8]. Потребление антибиотиков при инфекциях, отличных от H. pylori , является причиной значительного увеличения показателей устойчивости к антибиотикам H. pylori [9,10]. Действительно, различные национальные стратегии использования антибиотиков в значительной степени отражают географическое распределение устойчивости H. pylori : сообщалось, что устойчивость к САМ значительно выше в странах Южной Европы (достигая 49% в некоторых районах Испании) по сравнению с Северной Европой ( e.g ., только 1% в Нидерландах), где политика в отношении использования антибиотиков более строгая [9]. В дополнение к развитию устойчивости к антибиотикам, ряд факторов, связанных как с хозяином, так и с патогеном, может отрицательно влиять на эффективность схем уничтожения H. pylori (таблица) [11,12].
Таблица 1
Факторы, которые, как сообщается, отрицательно влияют на исход лечения инфекции Helicobacter pylori
| Связанные с патогенами | Связанные с хозяином |
| Развитие устойчивости к антибиотикам | Несоблюдение режима лечения |
| Высокая бактериальная нагрузка в желудке | Неязвенная диспепсия |
| Защитный эффект слизистой оболочки желудка | Курение |
| Внутриклеточное расположение многих бактерий | Статус CYP2C19 ( быстрый метаболизатор) |
| CagA отрицательный | |
| Наличие покоящихся коккоидных форм (не чувствительных к антибиотикам) | |
| Гетерорезистентный статус (сосуществование штаммов, чувствительных и устойчивых к одному и тому же антибиотику) |
Несмотря на десятилетия усилий, лечение H.pylori остается сложной проблемой как для исследователей, так и для практикующих врачей. В настоящей статье мы стремимся предоставить всесторонний обзор перспектив эрадикации H. pylori в прошлом, настоящем и будущем.
ТРОЙНАЯ ТЕРАПИЯ НА ОСНОВЕ КЛАРИТРОМИЦИНА: СНИЖЕНИЕ КЛИНИЧЕСКОГО СТАНДАРТА
Исторически первая по-настоящему эффективная терапия инфекции H. pylori , включающая висмут, тетрациклин и MNZ, была предложена в 1990 году [13].Несколько лет спустя использование CAM в тройной терапии, предложенное Bazzoli et al [14], стало началом тройных схем на основе CAM, которые впоследствии стали золотым стандартом в лечении H. pylori . В исследованиях, проведенных в 90-х годах, стандартные тройные терапии (STT) включали ингибитор протонной помпы (PPI) два раза в день , CAM 500 мг два раза в день и амоксициллин 1000 мг два раза в день или 500 мг MNZ (или 400 мг в Англии) все эти препараты вводились в течение 7–14 дней и обеспечивали стабильно хорошие результаты, дающие> 80% успеха эрадикации и даже> 90% достижимости [15,16].Благодаря этой высокой эффективности и относительной простоте, оптимальному профилю безопасности и приверженности крупных фармацевтических компаний, эти схемы были широко приняты национальными экспертными комиссиями и согласованными рекомендациями во всем мире в качестве стандарта лечения первой линии для эрадикации H. pylori [ 17-20]. Однако рост распространенности устойчивости к САМ привел к значительному снижению эффективности стандартных схем лечения. Это снижение эффективности уже было очевидно в метаанализах, опубликованных в начале 2000-х годов, что привело к значительным изменениям в парадигме лечения инфекции.Они включали в себя введение концепции кумулятивной эффективности лечения (требующей от пациента соблюдения большего количества курсов лечения; таким образом, большее количество побочных эффектов и распространение вторичной устойчивости к антибиотикам), а затем введение местного порогового значения (15-20%) устойчивости к САМ, при которой САМ не следует использовать эмпирически [17,18]. Снижение эффективности стандартных методов лечения против САМ-устойчивых штаммов было хорошо задокументировано на метааналитической основе: в метаанализе Фишбаха и Эванса успех тройной терапии снизился на 66.2% (95% ДИ: 58,2–74,2%), когда штаммы H. pylori были устойчивыми, и восприимчивы к САМ [7]. Соответственно, более свежий анализ Venerito et al [21] показал аналогичные результаты: включая данные о чувствительности к противомикробным препаратам из 4 рандомизированных клинических испытаний (РКИ), стандартные тройные методы лечения успешно уничтожили 88% CAM-чувствительных, но только 14% CAM-устойчивых H. pylori штаммов (разница рисков = 0,75, 95% ДИ: 0,63–0,87). Если используется MNZ, наличие устойчивости к MNZ также может повлиять на терапевтический результат [22], хотя, как правило, это считается менее важным клинически.Это связано с тем, что устойчивость к MNZ можно в значительной степени преодолеть путем увеличения дозы и увеличения продолжительности лечения [23]. Наконец, устойчивость H. pylori к амоксициллину является исключительной и, как правило, не имеет клинического значения. В свете увеличения количества данных, подтверждающих субоптимальную эффективность (<70%) в большинстве европейских стран, недавний консенсусный доклад Маастрихт IV / Флоренции окончательно вытеснил стандартные схемы лечения в качестве эмпирического золотого стандарта для искоренения H. pylori [4].Вместо этого при использовании традиционных тройных схем следует учитывать местный характер резистентности (таким образом, они используются только в тех областях, в которых резистентность к САМ составляет <20%) или полагаться на тестирование на чувствительность при условии наличия культуры перед лечением (, т.е. ., используется в качестве индивидуализированного лечения).
ТЕКУЩИЕ ТЕРАПИИ ИНФЕКЦИИ H. PYLORI
Новые схемы, специально опробованные для улучшения терапевтического результата против устойчивых к антибиотикам штаммов H. pylori , теперь рекомендуются в качестве вариантов эмпирического лечения первой линии, обеспечивающих повышенную эффективность (по сообщениям> 90% при анализе намерения лечить) в условиях высокой устойчивости к САМ.Эти схемы сведены в Табл.
Таблица 2
Текущие схемы лечения инфекции Helicobacter pylori
| Лечение | Схема |
| Висмутсодержащая четырехкомпонентная терапия | A PPI (стандартная доза, два раза в день ), висмут (стандартная доза, 4 раза в день, ), тетрациклин (500 мг, 4 раза в день, ) и метронидазол (500 мг, 4 раза в день, ) в течение 10-14 дней |
| Последовательная терапия | A 5-дневная двойная терапия с ИПП (стандартная доза, два раза в день, ) и амоксициллин (1 г, два раза в день, ) с последующей 5-дневной тройной терапией с ИПП (стандартная доза, два раза в день, ), кларитромицином (500 мг, два раза в день, ) и метронидазол (500 мг, два раза в день, ) |
| Сопутствующая терапия | А ИПП (стандартная доза, два раза в день, ), кларитромицин (500 мг, два раза в день, ), амоксициллин (1 г, два раза в день, ) и метрони дазол (500 мг, два раза в день, ) в течение 7-10 дней |
| Гибридная терапия | Семидневная двойная терапия с ИПП (стандартная доза, два раза в день, ) и амоксициллином (1 г, два раза в день, ) с последующим с помощью 7-дневной четырехкратной терапии с ИПП (стандартная доза, два раза в день, ), амоксициллином (1 г, два раза в день, ), кларитромицином (500 мг, два раза в день, ) и метронидазолом (500 мг, два раза в день, ) |
| Тройная терапия на основе левофлоксацина | ИПП (стандартная доза, два раза в день, ), левофлоксацин (500 мг, два раза в день, ) и амоксициллин (1 г, два раза в день, ) в течение 10 дней |
БИСМУТОВАЯ КВАДРАПИЯ
Квадратная терапия висмутом (BQT) в настоящее время представляет собой предпочтительный вариант лечения первой линии для областей с высокой (≥ 20%) частотой резистентности к САМ, но также является ценным вариантом лечения второй линии, когда схема на основе САМ ранее была неэффективной.Он работает независимо от CAM, достигая> 90% эрадикации при наличии устойчивости к CAM, тогда как применение высокой дозы MNZ (1500-1600 мг / сут) и увеличенной (10-14 дней) продолжительности лечения позволяет минимизировать влияние на устойчивость к MNZ. , обеспечивая уровень эрадикации> 85% даже в регионах с высокой устойчивостью к этому препарату [24]. Доступна удобная для пациента монокапсула (содержащая висмут, MNZ и тетрациклин) (Pylera ® , Aptalis, Mont St Hilaire, QC, Канада), обеспечивающая уровень эрадикации от назначенного лечения 86% и 80% в двух крупных РКИ, проведенных в Северной Америке и Европе соответственно [25-27].Напротив, уровень эрадикации ITT с помощью BQT составил только 77,8% в недавнем метаанализе ( против 77% для STT), ставя под сомнение как эффективность, так и превосходство BQT над STT [28]. Однако следует признать значительную степень неоднородности исследований, особенно в отношении дозирования MNZ. Эффективность второй линии BQT также была подтверждена на метааналитической основе (30 исследований), показывающих в среднем 77% эффективность второй линии (ITT) после неэффективности STT [29]. В многоцентровом исследовании, проведенном в Испании, эффективность третьей линии BQT после двух предыдущих неудачных попыток эрадикации с помощью тройной терапии, содержащей САМ и левофлоксацин, составила 65% (ITT).Недоступность солей висмута или тетрациклина в некоторых странах, а также потенциальная токсичность висмута являются основными ограничениями. Однако при включении 4763 пациентов не было выявлено различий в переносимости между группами, не получавшими висмута, и группами, содержащими висмут, за исключением того, что темный стул более распространен в более поздних случаях [31].
ПОСЛЕДОВАТЕЛЬНАЯ ТЕРАПИЯ
В последовательной терапии используются те же антибиотики, что и в STT, но вводимые последовательно. Было высказано предположение, что начальный курс амоксициллина разрушает стенку бактериальной клетки, предотвращая развитие каналов оттока, переносящих САМ из бактерий [32].Хотя в первоначальных РКИ [33] (большинство из них проводилось в Италии) и более ранних метаанализах последовательная терапия явно превосходила STT [эрадикация ITT 91,7% (95% ДИ: 90% -93%) против 76,7% ( 95% ДИ: 75% -79%) для STT] [34], более свежие данные из Южной Америки, Ирана и Южной Кореи показали более низкие уровни эрадикации (<80%) [35-37]. Несмотря на то, что эта последовательная терапия, по-видимому, достаточно эффективна против монорезистентных штаммов CAM, будучи способной уничтожить 72,8% из них, ее эффективность против штаммов с двойной устойчивостью (CAM и MNZ) составила всего 37% (диапазон: 16.От 2% до 60,7%) при оценке 8 исследований с данными о чувствительности к антибиотикам [38]. Критически важно, что последовательная терапия не превосходила ни 14-дневную тройную терапию (RR = 1, 95% ДИ: 0,94–1,06), ни терапию на основе висмута (RR = 0,99, 95% ДИ: 0,94–1,05) в обширной оценка 46 РКИ [38].
НЕВИСМУТОВАЯ КВАДРУПНАЯ (СОПРОВОЖДАЮЩАЯ) ТЕРАПИЯ
Четырехкратная «сопутствующая» терапия без висмута – еще один действенный вариант лечения первой линии для областей с высокой частотой резистентности к САМ [39,40].В 19 исследованиях (2070 пациентов) общий уровень эрадикации при сопутствующей терапии составил 88% (95% ДИ: 85-91%) и 91%, когда были исключены 3 отдаленных исследования с изначально короткой продолжительностью лечения (3-5 дней) [41 ]. Действительно, для успеха сопутствующей терапии необходима продолжительность лечения не менее 7 дней [42], тогда как экстра-пролонгирование лечения до 14 дней в сочетании с высокой дозой ИПП (омепразол 40 мг × 2) может еще больше ускорить выздоровление. частота до> 95%, как показало многоцентровое исследование не меньшей эффективности [43].Повышенная эффективность против штаммов H. pylori с двойной устойчивостью была предложена в качестве основного преимущества сопутствующей терапии по сравнению с последовательной терапией [44], хотя эти две схемы показали одинаковые результаты при сравнении с 338 пациентами в стране с высокой устойчивостью к антибиотикам (Испания). ) [45]. Действительно, при оценке 106 пациентов с помощью теста на предрасположенность к лечению сопутствующая терапия уничтожила только 55% штаммов с двойной устойчивостью против 100% и 91% с устойчивостью к CAM и MNZ соответственно [46].Таким образом, обе схемы, по-видимому, подвержены пагубному влиянию двойной резистентности, выполняя их сравнительно (с эффективностью около 81% каждый) при объединении данных 6 сравнительных РКИ [38].
ГИБРИДНАЯ ТЕРАПИЯ
Двухэтапный комбинированный (гибридный) режим, предложенный Hsu et al [47], является еще одним ценным вариантом лечения, конкурирующим как с последовательным, так и с сопутствующим лечением. При оценке данных 2 РКИ гибридная терапия показала незначительные, хотя и незначительные результаты, по сравнению с последовательной терапией (86.6% ( против 81%) [38], и по сравнению с сопутствующей терапией в сравнительном исследовании, в котором, что интересно, меньше нежелательных явлений произошло в группе, получавшей гибридный режим [43]. Необходимы дополнительные данные, чтобы сделать окончательные выводы об эффективности и переносимости гибридной терапии.
ТЕРАПИИ НА ОСНОВЕ ЛЕВОФЛОКСАЦИНА
Для преодоления возрастающей резистентности к CAM левофлоксацин, хинолон широкого спектра действия, использовался в качестве замены CAM в тройных или последовательных схемах лечения, достигая скорости излечения> 90%, и даже> 95% возможно при условии что местная резистентность к левофлоксацину низкая (<10%) [48,49].Однако левофлоксацин также сталкивается с клинически значимыми проблемами устойчивости к антибиотикам, поскольку устойчивость к хинолонам в настоящее время превышает 40% в Америке, 20% в Европе и 10% в Азии [8]. Из-за быстрого развития вторичной резистентности к хинолонам применение левофлоксацина в качестве первого ряда обычно не рекомендуется, а препарат резервируется для использования в схемах второго ряда / экстренной помощи после неудачи схемы на основе CAM и / или MNZ [50 ]. Хорошая (частота излечения 81–87%) эффективность тройной терапии левофлоксацином (ЛТТ) второй линии была подтверждена в двух метаанализах, опубликованных в 2006 г., оба показали лучшие результаты с ЛТТ по сравнению с БКВ второй линии [51 , 52].Соответственно, эффективность ЛТТ второй линии составила 88,7% в более позднем метаанализе, включая РКИ до октября 2010 г. [53]. Важно отметить, что использование LTT после неэффективности последовательного или сопутствующего режима, как сообщается, обеспечивает до 97,8% совокупной терапевтической эффективности [54]. Использование других хинолоновых агентов, таких как моксифлоксацин и ситафлоксацин, показало многообещающие результаты [55,56], хотя нет никаких доказательств, подтверждающих какое-либо терапевтическое преимущество перед левофлоксацином.
ПЕРСПЕКТИВЫ НА БУДУЩЕЕ
Дополнительные пробиотики
Несмотря на то, что были предприняты различные попытки восстановить эффективность стандартных методов лечения, таких как увеличение дозы ИПП или продление продолжительности лечения, ни один не был доказан на уровне, позволяющем преодолеть сегодняшнюю устойчивость к противомикробным препаратам.Подход, который вызывает растущий интерес, заключается в использовании пробиотиков в сочетании со схемами уничтожения H. pylori [57]. Ожидаемая польза двоякая: усиление эрадикации и улучшение переносимости за счет предотвращения возникновения побочных эффектов, связанных с лечением. Патогенетическая основа возможного благоприятного действия пробиотиков на эрадикацию H. pylori еще предстоит выяснить, хотя были выдвинуты некоторые гипотезы, включая прочность слизистого барьера, конкуренцию за адгезию и иммуномодулирующие механизмы [58].В последние годы в различных исследованиях пробиотики использовались в дополнение к стандартным или новым схемам лечения, что дало противоречивые результаты [59–62]. Несмотря на то, что были оценены различные одно- или мультиштаммовые соединения, в настоящее время имеются доказательства в поддержку использования Saccharomyces boulardi (OR = 1,13; 95% ДИ: 1,05–1,21) или Lactobacillus spp . (OR = 1,78; 95% ДИ: 1,2–2,6) добавление добавок к стандартной тройной терапии [63,64]. В самом последнем анализе, оценивающем влияние добавок, содержащих Lactobacillus и Bifidobacterium, объединенное отношение шансов (ITT) с добавлением пробиотиков составило 2.066 (95% ДИ: 1,398–3,055) для эрадикации и 0,305 (95% ДИ: 0,117–0,793) для частоты полных побочных эффектов [65]. Интересно, что с точки зрения предотвращения побочных эффектов использование пробиотиков может быть актуальным только для некоторой части пациентов, особенно у пациентов с рецидивирующей инфекцией или в анамнезе с желудочно-кишечными побочными эффектами, связанными с антибиотиками [57]. Ожидаются дополнительные данные, чтобы прояснить роль, стандартизировать схемы лечения и оценить экономическую эффективность пробиотиков в лечении H.pylori инфекция.
Бескультуральное, неинвазивное определение чувствительности к антибиотикам H. pylori
Критически важно, что даже новые методы лечения, описанные выше, в некоторой степени (хотя и в меньшей по сравнению с традиционными методами лечения) подвержены влиянию устойчивости к антибиотикам; уровни эрадикации> 95% встречаются нечасто, и даже> 90% оспариваются в некоторых исследованиях [35,66,67]. Кроме того, возможно, что в будущем эффективность эмпирических методов лечения будет еще больше снижаться, поскольку во всем мире постоянно растет устойчивость к основным антибиотикам.Для поддержания высокой терапевтической эффективности оптимальным подходом представляется индивидуализированное лечение H. pylori при поражении f , основанное на предварительном тестировании чувствительности. Это предотвратит повторное лечение пациента эмпирическим лечением, которое увеличивает риск побочных эффектов и способствует развитию вторичной резистентности. Однако, как уже упоминалось, современные средства выполнения эндоскопии и посева H. pylori являются инвазивными, не отражают на 100% чувствительность in vivo и требуют много времени, поскольку для посева требуется 3-10 дней и тестирование чувствительности ( e.g ., Etest, AB bioMerieux, Solna, Sweden) потребуется дополнительно 3-4 дня. Эти ограничения препятствуют систематическому использованию культуры H. pylori , которая в настоящее время рекомендуется только для случаев, по крайней мере, с двумя эмпирическими неудачами лечения. Общеклассовая устойчивость к макролидам является результатом точечных мутаций в трех соседних нуклеотидных положениях ( A2143G, A2142G и A2142C ) в петле пептидилтрансферазы гена 23SrRNA [68,69]. Эти три точечные мутации составляют 90% случаев первичной устойчивости к САМ в западных странах.В последние годы были разработаны методы молекулярного тестирования этих мутаций, включая стандартную полимеразную цепную реакцию (ПЦР) и другие методы на основе ПЦР, включая полиморфизм длины рестрикционных фрагментов ПЦР, иммуноферментный анализ ПЦР-ДНК, анализ лигирования олигонуклеотидов ПЦР и линию ПЦР. зондовый анализ, а также анализ ПЦР в реальном времени, который представляет собой мощный шаг вперед по сравнению с базовой ПЦР [70–72]. Эти методы могут предложить быстрые и высокоточные результаты при генотипическом обнаружении устойчивости к САМ, включая определение статуса гетерорезистентности ( i.e ., сосуществование штаммов, чувствительных и устойчивых к одному и тому же антибиотику), как известно, является причиной значительного числа неудач лечения [73,74]. Эти методы могут применяться непосредственно к образцам биопсии желудка или использоваться в сочетании с малоинвазивными методами (, например, ., Чистка ротовой полости или промывание желудка) или неинвазивно с использованием образцов кала [75–77]. Важно отметить, что генотипическое определение устойчивости к САМ также возможно с помощью флуоресцентной гибридизации in-situ, которая также может применяться к образцам, залитым парафином [78,79].Также возможно определение устойчивости к левофлоксацину на основе обнаружения мутации gyrA [80]. Два азиатских исследования предоставили данные о потенциальной полезности индивидуализированного терапевтического подхода, основанного на молекулярном обнаружении устойчивости H. pylori к САМ. Специально подобранное лечение с использованием простого режима ИПП / МНЗ успешно ликвидировало патоген у 94,3% () против (71,4%) при использовании стандартного эмпирического лечения [77]. В более крупном исследовании (218 пациентов) CAM заменяли MNZ в тройном режиме, если был обнаружен устойчивый к CAM штамм.Показатели эрадикации составили 91,2% в специально подобранной группе против 79,1% и 75,9% при использовании эмпирических тройных терапий на основе MNZ и CAM ( n = 308 в каждой контрольной группе) соответственно ( P <0,001) [81] .
Фармакогеномика
Известно, что генетическая изменчивость активности цитохрома P450 (CYP) 2C19 (CYP2C19) влияет на уровни ИПП в плазме и, таким образом, на лечение инфекции H. pylori [82,83]. Различают три различных генотипа: быстрый, средний и слабый метаболизаторы.Предварительные данные о потенциальном использовании фармакогеномики были предоставлены в РКИ с 300 H. pylori -позитивными пациентами, рандомизированными либо на стандартную схему лечения в течение 1 недели, либо на индивидуальную терапию на основе статуса восприимчивости к CYP2C19 и CAM, оцененного с помощью генетического тестирования [84 ]. Показатели искоренения ITT были значительно выше в специально подобранной группе (96% против 70%) без увеличения окончательных затрат на одного пациента для успешной ликвидации. В будущем должны быть решены как практические, так и логистические вопросы, прежде чем молекулярный подход может быть широко принят в качестве подлинной основы для индивидуализации H.pylori эрадикационная терапия.
ЗАКЛЮЧЕНИЕ
На протяжении более десяти лет тройные схемы были стандартом лечения инфекции H. pylori . Однако в последние годы рост распространенности резистентности к макролидам привел к значительному снижению эффективности этих схем, что привело к необходимости проведения дополнительных курсов лечения для искоренения патогена. Чтобы поддерживать высокую терапевтическую эффективность, схемы с улучшенной эффективностью против антибиотикоустойчивых H.pylori в настоящее время рекомендуются в качестве предпочтительных препаратов первой линии. Сопутствующие и последовательные схемы в настоящее время являются наиболее подтвержденными терапевтическими вариантами первой линии. Гибридная терапия – еще одна эффективная альтернатива на основе КАМ и соответствующий конкурент обоим этим методам лечения. BQT также является действенным средством лечения при высокой резистентности к САМ, но также является эффективным режимом второго ряда, когда схема, основанная на САМ, не дает результатов. Из-за быстрого развития резистентности к хинолонам схемы на основе левофлоксацина в настоящее время следует зарезервировать как варианты лечения второй или более линий.В то время как усилия по совершенствованию эмпирических методов лечения продолжаются, области генотипического выявления чувствительности к противомикробным препаратам H. pylori и фармакогеномики открывают новые захватывающие перспективы. Это гарантирует 100% терапевтическую эффективность: быстро, без посева и неинвазивно.
Сноски
P- Рецензент: Ding SZ, Im SH, Velin D, Zhu YL S- Редактор: Wen LL L- Редактор: A E- Editor: Wang CH
Ссылки
1. Moayyedi P, Hunt RH. Значение Helicobacter pylori для общественного здравоохранения.Helicobacter. 2004; 9 Дополнение 1: 67–72. [PubMed] [Google Scholar] 2. Мальфертхайнер П., Чан Ф. К., Макколл К. Э. Язвенная болезнь. Ланцет. 2009; 374: 1449–1461. [PubMed] [Google Scholar] 3. Kuipers EJ. Helicobacter pylori, риск и лечение сопутствующих заболеваний: гастрита, язвенной болезни, атрофического гастрита и рака желудка. Алимент Pharmacol Ther. 1997; 11 Дополнение 1: 71–88. [PubMed] [Google Scholar] 4. Мальфертхайнер П., Мегроуд Ф., О’Морайн К.А., Атертон Дж., Аксон А.Т., Баццоли Ф., Дженсини Г.Ф., Гисберт Дж. П., Грэм Д. Ю., Роккас Т. и др.Управление инфекцией Helicobacter pylori – Маастрихтский отчет IV / Флорентийский консенсусный доклад. Кишечник. 2012. 61: 646–664. [PubMed] [Google Scholar] 5. Gisbert JP. Необходим ли посев перед лечением первой линии инфекции Helicobacter pylori? Intern Med. 2011; 50: 2717; ответ автора 2719–2720. [PubMed] [Google Scholar] 7. Fischbach L, Evans EL. Мета-анализ: влияние статуса устойчивости к антибиотикам на эффективность тройной и четверной терапии первой линии для Helicobacter pylori. Алимент Pharmacol Ther.2007. 26: 343–357. [PubMed] [Google Scholar] 8. Де Франческо В., Джорджио Ф., Хассан С., Манес Дж., Ваннелла Л., Панелла С., Иерарди Е., Зулло А. Всемирная устойчивость к антибиотикам H. pylori: систематический обзор. J Gastrointestin Liver Dis. 2010; 19: 409–414. [PubMed] [Google Scholar] 9. Megraud F, Coenen S, Versporten A, Kist M, Lopez-Brea M, Hirschl AM, Andersen LP, Goossens H, Glupczynski Y. Устойчивость Helicobacter pylori к антибиотикам в Европе и ее связь с потреблением антибиотиков. Кишечник. 2013; 62: 34–42.[PubMed] [Google Scholar] 10. Боянова Л., Илиева Дж., Гергова Г., Давидков Л., Спасова З., Камбуров В., Кацаров Н., Митов И. Многочисленные факторы риска устойчивости к антибиотикам Helicobacter pylori, выявленные в расширенном анамнезе: болгарское исследование. J Med Microbiol. 2012; 61: 85–93. [PubMed] [Google Scholar] 11. Георгопулос С.Д., Ладас С.Д., Каратапанис С., Ментис А., Спилиади С., Артикис В., Раптис С.А. Факторы, которые могут повлиять на исход лечения тройной эрадикационной терапии Helicobacter pylori омепразолом, амоксициллином и кларитромицином.Dig Dis Sci. 2000. 45: 63–67. [PubMed] [Google Scholar] 12. Ян JC, Лин CJ. Генотипы CYP2C19 в фармакокинетике / фармакодинамике терапии инфекции Helicobacter pylori на основе ингибиторов протонной помпы. Мнение эксперта Drug Metab Toxicol. 2010; 6: 29–41. [PubMed] [Google Scholar] 13. Джордж Л.Л., Бороди Т.Дж., Эндрюс П., Дивайн М., Мур-Джонс Д., Уолтон М., Брандл С. Лечение язвы двенадцатиперстной кишки после искоренения Helicobacter pylori. Med J Aust. 1990; 153: 145–149. [PubMed] [Google Scholar] 14. Баццоли Ф., Поццато П.Терапия инфекции H. pylori. J. Physiol Pharmacol. 1997; 48 Дополнение 4: 39–46. [PubMed] [Google Scholar] 15. Современные европейские концепции лечения инфекции Helicobacter pylori. Маастрихтский консенсусный доклад. Европейская группа по изучению Helicobacter Pylori. Кишечник. 1997; 41: 8–13. [Бесплатная статья PMC] [PubMed] [Google Scholar] 16. Линд Т., Вельдхуйзен ван Зантен С., Унге П., Спиллер Р., Байердорфер Э., О’Морайн С., Бардхан К.Д., Брадетт М., Чиба Н., Врангстад М. и др. Ликвидация Helicobacter pylori с использованием однонедельной тройной терапии, сочетающей омепразол с двумя противомикробными препаратами: исследование MACH I.Helicobacter. 1996; 1: 138–144. [PubMed] [Google Scholar] 17. Мальфертхайнер П., Мегро Ф., О’Морайн С., Хангин А.П., Джонс Р., Аксон А., Грэм Д.Ю., Титгат Г. Современные концепции управления инфекцией Helicobacter pylori – Консенсусный доклад Маастрихта 2-2000. Алимент Pharmacol Ther. 2002; 16: 167–180. [PubMed] [Google Scholar] 18. Мальфертхайнер П., Мегроуд Ф., О’Морайн С., Баццоли Ф., Эль-Омар Э., Грэм Д., Хант Р., Роккас Т., Вакил Н., Кейперс Э. Современные концепции лечения инфекции Helicobacter pylori: Маастрихтский консенсусный отчет III.Кишечник. 2007; 56: 772–781. [Бесплатная статья PMC] [PubMed] [Google Scholar] 19. Чей В.Д., Вонг BC. Руководство Американского колледжа гастроэнтерологии по лечению инфекции Helicobacter pylori. Am J Gastroenterol. 2007; 102: 1808–1825. [PubMed] [Google Scholar] 20. Фок К.М., Кателарис П., Сугано К., Энг Т.Л., Хант Р., Талли, штат Нью-Джерси, Лам С.К., Сяо С.Д., Тан Х.Дж., Ву С.Й. и др. Второе Азиатско-Тихоокеанское согласованное руководство по инфекции Helicobacter pylori. J Gastroenterol Hepatol. 2009; 24: 1587–1600. [PubMed] [Google Scholar] 21.Venerito M, Krieger T., Ecker T., Leandro G, Malfertheiner P. Мета-анализ четырехкратной терапии висмутом по сравнению с тройной терапией кларитромицином для эмпирического первичного лечения инфекции Helicobacter pylori. Пищеварение. 2013; 88: 33–45. [PubMed] [Google Scholar] 22. Хубен М. Х., ван де Бик Д., Хенсен Э. Ф., де Крен А. Дж., Раус Э. А., Титгат Г. Н.. Систематический обзор эрадикационной терапии Helicobacter pylori – влияние устойчивости к противомикробным препаратам на уровень эрадикации. Алимент Pharmacol Ther. 1999; 13: 1047–1055. [PubMed] [Google Scholar] 23.Грэм Д. Ю., Куреши В. А.. Инфекция H. pylori, резистентная к антибиотикам, и ее лечение. Curr Pharm Des. 2000; 6: 1537–1544. [PubMed] [Google Scholar] 24. Фишбах Л.А., ван Зантен С., Дикасон Дж. Мета-анализ: эффективность, побочные эффекты и приверженность, связанные с четырехкомпонентной терапией против Helicobacter pylori первой линии. Алимент Pharmacol Ther. 2004. 20: 1071–1082. [PubMed] [Google Scholar] 25. де Бур WA, ван Эттен RJ, Schneeberger PM, Tytgat GN. Одно лекарство от инфекции Helicobacter pylori: первые результаты с новой тройной монокапсулой висмута.Am J Gastroenterol. 2000; 95: 641–645. [PubMed] [Google Scholar] 26. Laine L, Hunt R, El-Zimaity H, Nguyen B, Osato M, Spénard J. Четырехкратная терапия на основе висмута с использованием одной капсулы бисскальцитрата висмута, метронидазола и тетрациклина с омепразолом по сравнению с омепразолом, амоксициллином и кларитромицином для эрадикации Helicobacter pylori у пациентов с язвой двенадцатиперстной кишки: проспективное рандомизированное многоцентровое исследование в Северной Америке. Am J Gastroenterol. 2003. 98: 562–567. [PubMed] [Google Scholar] 27.Malfertheiner P, Bazzoli F, Delchier JC, Celiñski K, Giguère M, Rivière M, Mégraud F. Эрадикация Helicobacter pylori с помощью капсулы, содержащей субцитрат висмута калия, метронидазол и тетрациклин, назначенные с омепразолом по сравнению с открытой терапией на основе омепразола и открытой терапии на основе трипразола. -метка, не неполноценность, испытание фазы 3. Ланцет. 2011; 377: 905–913. [PubMed] [Google Scholar] 28. Лютер Дж., Хиггинс П.Д., Шенфельд П.С., Моайеди П., Вакил Н., Чей В.Д. Эмпирическая четырехкратная и тройная терапия для первичного лечения инфекции Helicobacter pylori: систематический обзор и метаанализ эффективности и переносимости.Am J Gastroenterol. 2010; 105: 65–73. [PubMed] [Google Scholar] 30. Гисберт Дж. П., Перес-Айса А., Родриго Л., Молина-Инфанте Дж., Модолелл I, Бермехо Ф., Кастро-Фернандес М., Антон Р., Сакристан Б., Косме А. и др. Спасательная терапия третьей линии с использованием висмутсодержащего четырехкратного режима после неэффективности двух курсов лечения (кларитромицином и левофлоксацином) инфекции H. pylori. Dig Dis Sci. 2014; 59: 383–389. [PubMed] [Google Scholar] 31. Ford AC, Malfertheiner P, Giguere M, Santana J, Khan M, Moayyedi P. Неблагоприятные события с солями висмута для ликвидации Helicobacter pylori: систематический обзор и метаанализ.Мир Дж. Гастроэнтерол. 2008; 14: 7361–7370. [Бесплатная статья PMC] [PubMed] [Google Scholar] 32. Уэббер М.А., Пиддок Л.Дж. Важность оттокных насосов в устойчивости бактерий к антибиотикам. J Antimicrob Chemother. 2003; 51: 9–11. [PubMed] [Google Scholar] 33. Зулло А., Вайра Д., Вакил Н., Хассан С., Гатта Л., Риччи С., Де Франческо В., Менегатти М., Тампьери А., Перна Ф. и др. Высокие показатели эрадикации Helicobacter pylori при новом последовательном лечении. Алимент Pharmacol Ther. 2003. 17: 719–726. [PubMed] [Google Scholar] 34.Gisbert JP, Calvet X, O’Connor A, Mégraud F, O’Morain CA. Последовательная терапия для эрадикации Helicobacter pylori: критический обзор. J Clin Gastroenterol. 2010. 44: 313–325. [PubMed] [Google Scholar] 35. Гринберг Е.Р., Андерсон Г.Л., Морган Д.Р., Торрес Дж., Чей В.Д., Браво Л.Е., Домингес Р.Л., Ферреччио С., Эрреро Р., Ласкано-Понсе ЕС и др. 14-дневная тройная, 5-дневная сопутствующая и 10-дневная последовательная терапия инфекции Helicobacter pylori в семи странах Латинской Америки: рандомизированное исследование. Ланцет. 2011; 378: 507–514.[Бесплатная статья PMC] [PubMed] [Google Scholar] 36. Lim JH, Lee DH, Choi C, Lee ST, Kim N, Jeong SH, Kim JW, Hwang JH, Park YS, Lee SH и др. Клинические результаты двухнедельной последовательной и сопутствующей терапии для эрадикации Helicobacter pylori: рандомизированное пилотное исследование. Helicobacter. 2013. 18: 180–186. [PubMed] [Google Scholar] 37. Сардарян Х., Факери Х., Хоссейни В., Тагваеи Т., Малеки И., Мохтаре М. Сравнение гибридной и последовательной терапии для ликвидации Helicobacter pylori в Иране: проспективное рандомизированное исследование.Helicobacter. 2013. 18: 129–134. [PubMed] [Google Scholar] 38. Гатта Л., Вакил Н., Вайра Д., Скарпигнато С. Глобальные показатели эрадикации инфекции Helicobacter pylori: систематический обзор и метаанализ последовательной терапии. BMJ. 2013; 347: f4587. [Бесплатная статья PMC] [PubMed] [Google Scholar] 39. Georgopoulos S, Papastergiou V, Xirouchakis E, Laoudi F, Lisgos P, Spiliadi C, Papantoniou N, Karatapanis S. Четырехкратная «сопутствующая» терапия без висмута по сравнению со стандартной тройной терапией продолжительностью 10 дней для первой линии H.pylori: рандомизированное исследование. J Clin Gastroenterol. 2013; 47: 228–232. [PubMed] [Google Scholar] 40. Georgopoulos S, Papastergiou V, Xirouchakis E, Laudi F, Papantoniou N, Lisgos P, Spiliadi C, Fragou P, Skorda L., Karatapanis S. Оценка «сопутствующей» терапии с четырьмя препаратами, тремя антибиотиками и невисмутом в качестве первой режим эрадикации Helicobacter pylori в Греции. Helicobacter. 2012; 17: 49–53. [PubMed] [Google Scholar] 41. Gisbert JP, Calvet X. Обновленная информация о четверной (сопутствующей) терапии без висмута для искоренения Helicobacter pylori.Clin Exp Gastroenterol. 2012; 5: 23–34. [Бесплатная статья PMC] [PubMed] [Google Scholar] 42. Essa AS, Kramer JR, Graham DY, Treiber G. Мета-анализ: «сопутствующая терапия» с четырьмя лекарствами, тремя антибиотиками, без висмута по сравнению с тройной терапией для эрадикации Helicobacter pylori. Helicobacter. 2009. 14: 109–118. [Бесплатная статья PMC] [PubMed] [Google Scholar] 43. Молина-Инфанте Дж., Романо М., Фернандес-Бермехо М., Федерико А., Гравина А.Г., Поццати Л., Гарсия-Абадиа Е., Винагре-Родригес Г., Мартинес-Алькала С., Эрнандес-Алонсо М. и др.Оптимизированная четырехкомпонентная терапия без висмута излечивает большинство пациентов с инфекцией Helicobacter pylori в популяциях с высокими показателями устойчивости к антибиотикам. Гастроэнтерология. 2013; 145: 121–128.e1. [PubMed] [Google Scholar] 44. Wu DC, Hsu PI, Wu JY, Opekun AR, Kuo CH, Wu IC, Wang SS, Chen A, Hung WC, Graham DY. Последовательная и сопутствующая терапия четырьмя препаратами одинаково эффективна для искоренения инфекции H.pylori. Clin Gastroenterol Hepatol. 2010; 8: 36–41.e1. [Бесплатная статья PMC] [PubMed] [Google Scholar] 45.McNicholl AG, Marin AC, Molina-Infante J, Castro M, Barrio J, Ducons J, Calvet X, de la Coba C, Montoro M, Bory F и др. Рандомизированное клиническое испытание, сравнивающее последовательную и сопутствующую терапию эрадикации Helicobacter pylori в рутинной клинической практике. Кишечник. 2014; 63: 244–249. [PubMed] [Google Scholar] 46. Георгопулос SD, Xirouchakis E, Martinez-Gonzalez B, Sgouras DN, Spiliadi C, Mentis AF, Laoudi F. Клиническая оценка десятидневного режима с эзомепразолом, метронидазолом, амоксициллином и кларитромицином для эрадикации Helicromycinum с высоким содержанием кларитромицина из хеликобактера пилы. область сопротивления.Helicobacter. 2013; 18: 459–467. [PubMed] [Google Scholar] 47. Сюй П.И., Ву, округ Колумбия, Ву Дж.Й., Грэм Д.Ю. Модифицированная последовательная терапия Helicobacter pylori: ингибитор протонной помпы и амоксициллин в течение 14 дней с добавлением кларитромицина и метронидазола в качестве четверной (гибридной) терапии в течение последних 7 дней. Helicobacter. 2011; 16: 139–145. [Бесплатная статья PMC] [PubMed] [Google Scholar] 48. Романо М., Куомо А., Гравина А.Г., Миранда А., Айовен М.Р., Тисо А., Сика М., Рокко А., Салерно Р., Мармо Р. и др. Сравнение эмпирической терапии, содержащей левофлоксацин, и содержащей кларитромицин, для эрадикации Helicobacter pylori: рандомизированное исследование.Кишечник. 2010; 59: 1465–1470. [PubMed] [Google Scholar] 49. Бернинг М., Краш С., Мильке С. Должны ли хинолоны занимать первое место в терапии Helicobacter pylori? Therap Adv Гастроэнтерол. 2011; 4: 103–114. [Бесплатная статья PMC] [PubMed] [Google Scholar] 50. Каротерс Дж. Дж., Брюс М. Г., Хеннесси Т. В., Бенслер М., Моррис Дж. М., Reasonover А. Л., Херлбурт Д. А., Паркинсон А. Дж., Коулман Дж. М., МакМахон Б. Дж.. Взаимосвязь между предыдущим применением фторхинолонов и устойчивостью к левофлоксацину при инфекции Helicobacter pylori. Clin Infect Dis. 2007; 44: e5 – e8.[PubMed] [Google Scholar] 51. Гисберт Дж. П., Морена Ф. Систематический обзор и метаанализ: схемы спасения на основе левофлоксацина после неэффективности лечения Helicobacter pylori. Алимент Pharmacol Ther. 2006; 23: 35–44. [PubMed] [Google Scholar] 52. Саад Р.Дж., Шенфельд П., Ким Х.М., Чей В.Д. Тройная терапия на основе левофлоксацина в сравнении с четырехкратной терапией на основе висмута при персистирующей инфекции Helicobacter pylori: метаанализ. Am J Gastroenterol. 2006; 101: 488–496. [PubMed] [Google Scholar] 53. Ди Каро С., Фини Л., Дауд И., Гриззи Ф., Гасбаррини А., Де Лоренцо А., Ди Ренцо Л., Маккартни С., Блум С.Схемы на основе левофлоксацина / амоксициллина в сравнении с четырехкратной терапией для эрадикации Helicobacter pylori у препаратов второй линии. Мир Дж. Гастроэнтерол. 2012; 18: 5669–5678. [Бесплатная статья PMC] [PubMed] [Google Scholar] 54. Gisbert JP, Molina-Infante J, Marin AC, Vinagre G, Barrio J, McNicholl AG. Тройная спасательная терапия второй линии с левофлоксацином после неэффективности четырехкратного «последовательного» или «сопутствующего» лечения без висмута для искоренения инфекции H. pylori. Сканд Дж Гастроэнтерол. 2013. 48: 652–656. [PubMed] [Google Scholar] 55.Мураками К., Окимото Т., Кодама М., Танахаши Дж., Фудзиока Т., Икеда Ф., Мураока Х., Такигава М., Сайка Т., Хасегава М. и др. Активность ситафлоксацина в отношении изолятов Helicobacter pylori, в том числе с мутациями gyrA. Антимикробные агенты Chemother. 2009; 53: 3097–3099. [Бесплатная статья PMC] [PubMed] [Google Scholar] 56. Wenzhen Y, Kehu Y, Bin M, Yumin L, Quanlin G, Donghai W, Lijuan Y. Тройная терапия на основе моксифлоксацина по сравнению с тройной терапией на основе кларитромицина для лечения первой линии инфекции Helicobacter pylori: метаанализ рандомизированных контролируемых исследований .Intern Med. 2009. 48: 2069–2076. [PubMed] [Google Scholar] 57. Вильгельм С.М., Джонсон Дж. Л., Кале-Прадхан ПБ. Лечение клопов с помощью клопов: роль пробиотиков в качестве дополнительной терапии Helicobacter pylori. Энн Фармакотер. 2011; 45: 960–966. [PubMed] [Google Scholar] 58. Лесброс-Пантофликова Д, Кортези-Теулаз I, Блюм АЛ. Helicobacter pylori и пробиотики. J Nutr. 2007; 137: 812С – 818С. [PubMed] [Google Scholar] 59. Du YQ, Su T, Fan JG, Lu YX, Zheng P, Li XH, Guo CY, Xu P, Gong YF, Li ZS. Адъювантные пробиотики улучшают эрадикационный эффект тройной терапии инфекции Helicobacter pylori.Мир Дж. Гастроэнтерол. 2012. 18: 6302–6307. [Бесплатная статья PMC] [PubMed] [Google Scholar] 60. Efrati C, Nicolini G, Cannaviello C, O’Sed NP, Valabrega S. Эрадикация Helicobacter pylori: последовательная терапия и добавление Lactobacillus reuteri. Мир Дж. Гастроэнтерол. 2012. 18: 6250–6254. [Бесплатная статья PMC] [PubMed] [Google Scholar] 61. Манфреди М., Биззарри Б., Саккеро Р.И., Маккари С., Калабрезе Л., Фаббиан Ф, Де’Анджелис Г.Л. Инфекция Helicobacter pylori в клинической практике: пробиотики и комбинация пробиотиков + лактоферрин улучшают соблюдение режима последовательной терапии, но не искоренение.Helicobacter. 2012; 17: 254–263. [PubMed] [Google Scholar] 62. Shavakhi A, Tabesh E, Yaghoutkar A, Hashemi H, Tabesh F, Khodadoostan M, Minakari M, Shavakhi S., Gholamrezaei A. Влияние многопозиционного пробиотического соединения на висмутсодержащую четырехкомпонентную терапию для инфекции Helicobacter pylori: рандомизированный тройной плацебо-контролируемый -слепое исследование. Helicobacter. 2013. 18: 280–284. [PubMed] [Google Scholar] 63. Szajewska H, Horvath A, Piwowarczyk A. Мета-анализ: влияние добавок Saccharomyces boulardii на скорость эрадикации Helicobacter pylori и побочные эффекты во время лечения.Алимент Pharmacol Ther. 2010. 32: 1069–1079. [PubMed] [Google Scholar] 64. Zou J, Dong J, Yu X. Мета-анализ: Lactobacillus, содержащий четверную терапию по сравнению со стандартной тройной терапией первой линии для эрадикации Helicobacter pylori. Helicobacter. 2009. 14: 97–107. [PubMed] [Google Scholar] 65. Ван Чж, Гао Цюй, Фан Цзюй. Мета-анализ эффективности и безопасности препаратов пробиотических соединений, содержащих лактобактерии и бифидобактерии, в эрадикационной терапии Helicobacter pylori. J Clin Gastroenterol.2013; 47: 25–32. [PubMed] [Google Scholar] 66. Лиу Дж.М., Чен С.К., Чен М.Дж., Чен С.К., Чанг Си.Й., Фанг Й.Дж., Ли Дж.Й., Хсу С.Дж., Ло Дж.К., Чанг У.Х. и др. Последовательная и тройная терапия для лечения первой линии Helicobacter pylori: многоцентровое открытое рандомизированное исследование. Ланцет. 2013; 381: 205–213. [PubMed] [Google Scholar] 67. Вакил Н., Вайра Д. Лечение инфекции H. pylori: новые проблемы с устойчивостью к противомикробным препаратам. J Clin Gastroenterol. 2013; 47: 383–388. [PubMed] [Google Scholar] 68. Тейлор Д.Е., Ге З., Пурыч Д., Ло Т, Хирацука К.Клонирование и анализ последовательности двух копий гена 23S рРНК из Helicobacter pylori и ассоциация устойчивости к кларитромицину с мутациями 23S рРНК. Антимикробные агенты Chemother. 1997; 41: 2621–2628. [Бесплатная статья PMC] [PubMed] [Google Scholar] 69. Версалович Дж., Шортридж Д., Киблер К., Гриффи М. В., Бейер Дж., Фламм Р.К., Танака С.К., Грэм Д.Ю., Go MF. Мутации в 23S рРНК связаны с устойчивостью Helicobacter pylori к кларитромицину. Антимикробные агенты Chemother. 1996. 40: 477–480. [Бесплатная статья PMC] [PubMed] [Google Scholar] 70.Lehours P, Siffré E, Mégraud F. Мультиплексная ПЦР DPO в качестве альтернативы тестированию на культуру и чувствительность для выявления Helicobacter pylori и его устойчивости к кларитромицину. BMC Gastroenterol. 2011; 11: 112. [Бесплатная статья PMC] [PubMed] [Google Scholar] 71. Mégraud F, Lehours P. Обнаружение Helicobacter pylori и тестирование на чувствительность к противомикробным препаратам. Clin Microbiol Rev.2007; 20: 280–322. [Бесплатная статья PMC] [PubMed] [Google Scholar] 72. Schabereiter-Gurtner C, Hirschl AM, Dragosics B, Hufnagl P, Puz S, Kovách Z, Rotter M, Makristathis A.Новый анализ ПЦР в реальном времени для выявления инфекции Helicobacter pylori и одновременное определение чувствительности к кларитромицину в образцах стула и биопсии. J Clin Microbiol. 2004. 42: 4512–4518. [Бесплатная статья PMC] [PubMed] [Google Scholar] 73. De Francesco V, Zullo A, Ierardi E, Giorgio F, Perna F, Hassan C, Morini S, Panella C, Vaira D. Фенотипическая и генотипическая устойчивость к кларитромицину Helicobacter pylori и терапевтический результат: преимущества и ограничения. J Antimicrob Chemother. 2010. 65: 327–332. [PubMed] [Google Scholar] 74.Rimbara E, Fischbach LA, Graham DY. Оптимальная терапия инфекций Helicobacter pylori. Нат Рев Гастроэнтерол Гепатол. 2011; 8: 79–88. [PubMed] [Google Scholar] 75. Баба С., Оиси Й., Ватанабе Й., Оикава Р., Морита Р., Йошида Ю., Хираиси Т., Маэхата Т., Нагасе И., Фукуда Ю. и др. Молекулярный тест на устойчивость к антибиотикам у Helicobacter pylori на основе промывки желудка. Пищеварение. 2011; 84: 299–305. [PubMed] [Google Scholar] 76. Грэм Д.Ю., Кудо М., Редди Р., Опекун А.Р. Практичный быстрый, малоинвазивный, надежный неэндоскопический метод получения Helicobacter pylori для посева.Helicobacter. 2005; 10: 1–3. [PubMed] [Google Scholar] 77. Кавай Т., Ямагиши Т., Яги К., Катаока М., Каваками К., Софуни А., Итои Т., Сакаи Ю., Мориясу Ф., Осака Ю. и др. Индивидуальная эрадикационная терапия, основанная на чувствительности фекалий к кларитромицину Helicobacter pylori. J Gastroenterol Hepatol. 2008; 23 Приложение 2: S171 – S174. [PubMed] [Google Scholar] 78. Моррис JM, Reasonover AL, Брюс MG, Bruden DL, McMahon BJ, Sacco FD, Berg DE, Parkinson AJ. Оценка seaFAST, быстрого флуоресцентного теста гибридизации in situ, для обнаружения Helicobacter pylori и устойчивости к кларитромицину в парафиновых биопсийных срезах.J Clin Microbiol. 2005; 43: 3494–3496. [Бесплатная статья PMC] [PubMed] [Google Scholar] 79. Йилмаз О., Демирай Э., Тюмер С., Алтунгёз О., Йорукоглу К., Сойтюрк М., Симшек И. Обнаружение Helicobacter pylori и определение чувствительности к кларитромицину с использованием фиксированных формалином, залитых парафином образцов биопсии желудка с помощью флуоресцентной гибридизации in situ. Helicobacter. 2007; 12: 136–141. [PubMed] [Google Scholar] 80. Cambau E, Allerheiligen V, Coulon C, Corbel C, Lascols C, Deforges L, Soussy CJ, Delchier JC, Megraud F.Оценка нового теста, генотип HelicoDR, для молекулярного определения устойчивости к антибиотикам у Helicobacter pylori. J Clin Microbiol. 2009. 47: 3600–3607. [Бесплатная статья PMC] [PubMed] [Google Scholar] 81. Ли HJ, Kim JI, Cheung DY, Kim TH, Jun EJ, Oh JH, Chung WC, Kim BW, Kim SS, Park SH и др. Ликвидация Helicobacter pylori в соответствии с точечными мутациями 23S рибосомальной РНК, связанными с устойчивостью к кларитромицину. J Infect Dis. 2013; 208: 1123–1130. [PubMed] [Google Scholar] 82. Фурута Т., Шираи Н., Такашима М., Сяо Ф., Ханаи Х., Сугимура Х., Охаши К., Ишизаки Т., Канеко Э.Влияние генотипических различий в CYP2C19 на частоту излечения от инфекции Helicobacter pylori тройной терапией ингибитором протонной помпы, амоксициллином и кларитромицином. Clin Pharmacol Ther. 2001; 69: 158–168. [PubMed] [Google Scholar] 83. Sim SC, Risinger C, Dahl ML, Aklillu E, Christensen M, Bertilsson L, Ingelman-Sundberg M. Распространенный новый вариант гена CYP2C19 вызывает сверхбыстрый метаболизм лекарства, имеющий отношение к реакции лекарства на ингибиторы протонной помпы и антидепрессанты. Clin Pharmacol Ther. 2006. 79: 103–113.[PubMed] [Google Scholar] 84. Фурута Т., Шираи Н., Кодайра М., Сугимото М., Ногаки А., Курияма С., Иваидзуми М., Ямаде М., Теракава И., Охаши К. и др. Индивидуальный подход на основе фармакогеномики по сравнению со стандартным терапевтическим режимом для эрадикации H. pylori. Clin Pharmacol Ther. 2007. 81: 521–528. [PubMed] [Google Scholar]Лечение инфекции Helicobacter pylori: прошлое, настоящее и будущее
World J Gastrointest Pathophysiol. 2014 15 ноября; 5 (4): 392–399.
Василиос Папастергиу, Стилианос Каратапанис, Отделение внутренней медицины, Общая больница Родоса, 85100 Родос, Греция
Сотириос Д. Георгопулос, Отделение гастроэнтерологии, Athens Medical, P.Больница Фалирон, 17562 Афины, Греция
Вклад авторов: Папастергю V участвовал в разработке концепции и дизайна статьи; Георгопулос С.Д. участвовал в написании статьи, критически отредактировав ее на предмет важного интеллектуального содержания; Каратапанис С. участвовал в окончательном утверждении версии, которая будет опубликована.Для корреспонденции: Стилианос Каратапанис, MD, PhD, Отделение внутренней медицины, Общая больница Родоса, ул. Калопетрас 10, 85100 Родос, Греция. rg.teneto @ raklyts
Телефон: + 30-224-1080456 Факс: + 30-224-1066410
Поступила в редакцию 12 февраля 2014 г .; Пересмотрено 15 апреля 2014 г .; Принято 17 июля 2014 г.
Copyright © 2014 Baishideng Publishing Group Inc. Все права защищены. Эта статья цитируется в других статьях PMC.Abstract
Helicobacter pylori ( H. pylori ) – основной патоген человека, связанный со значительной заболеваемостью и смертностью. Однако после десятилетий усилий лечение H.pylori остается проблемой для врачей, поскольку не существует универсально эффективной схемы лечения. Из-за растущей распространенности устойчивости к противомикробным препаратам, в основном к кларитромицину, эффективность стандартных тройных терапий снизилась до неприемлемо низких уровней в большинстве регионов мира. Новые схемы, специально опробованные для улучшения терапевтического результата против устойчивых к антибиотикам штаммов H. pylori , теперь рекомендуются в качестве вариантов эмпирического лечения первой линии, обеспечивающих высокую эффективность (по сообщениям,> 90% при анализе намерений лечения) даже при высокой устойчивости к кларитромицину. настройки.К ним относятся четырехкратная висмутовая, сопутствующая, последовательная и гибридная терапия. Из-за быстрого развития резистентности к хинолонам схемы на основе левофлоксацина следует зарезервировать как варианты второй линии / спасения. Было предложено дополнительное использование пробиотиков для повышения скорости эрадикации и уменьшения побочных эффектов, связанных с лечением. В настоящее время доступны методы молекулярного тестирования для характеристики терапевтической восприимчивости H. pylori , включая генотипическое определение устойчивости к макролидам и оценку статуса цитохрома P450 2C19, который, как известно, влияет на метаболизм ингибиторов протонной помпы.В будущем использование этих методов может позволить неинвазивно адаптировать терапию для лечения инфекции H. pylori без культивирования.
Ключевые слова: Helicobacter pylori , устойчивость к антибиотикам, четырехкратный висмут, сопутствующий, последовательный, пробиотики
Основной совет: Увеличение распространенности устойчивости к макролидам во всем мире привело к неэффективности стандартных методов лечения Helicobacter pylori ( H.pylori ) инфекция. Четырехкратная, сопутствующая, последовательная и гибридная терапия висмутом теперь рекомендуются в качестве эмпирических методов лечения первой линии, обеспечивающих повышенную эффективность в условиях высокой резистентности к кларитромицину. Поскольку резистентность к хинолонам быстро растет, левофлоксацин следует предпочтительно использовать в терапии второй линии / терапии неотложной помощи. Появляется все больше доказательств того, что добавление дополнительных пробиотиков улучшает терапевтический результат и переносимость. Генотипическая характеристика восприимчивости H. pylori к терапии может позволить разработать индивидуальный терапевтический подход в будущем.
ВВЕДЕНИЕ
Лечение инфекции Helicobacter pylori ( H. pylori ) имеет первостепенное значение для лечения распространенных желудочно-кишечных заболеваний, включая язвенную болезнь, рак желудка и функциональную диспепсию [1-3]. Более того, внепищеварительные расстройства теперь включены в качестве показаний для искоренения H. pylori : идиопатическая тромбоцитопеническая пурпура, дефицит витамина B12 и необъяснимая железодефицитная анемия [4]. В отличие от других бактериальных инфекций, при лечении которых обычно проводят тесты на чувствительность, культивирование H.pylori широко не доступен и требует проведения эндоскопии, которая не переносится всеми пациентами и имеет ряд ограничений, включая тот факт, что чувствительность in vitro и не всегда гарантирует искоренение in vivo [5]. Таким образом, схемы лечения H. pylori обычно назначались эмпирически при условии, что они были предварительно протестированы и в достаточной степени адаптированы с учетом различных параметров (, т.е. .; лечебная доза, продолжительность, интервалы дозирования и т. Д. .) для оптимизации скорости излечения и минимизации побочных эффектов. Однако оптимальное лечение для уничтожения H. pylori еще предстоит определить, поскольку ни один из режимов не является универсальным. Повышение во всем мире устойчивости к основным антибиотикам, главным образом к кларитромицину (CAM), но также к метронидазолу (MNZ) и левофлоксацину, является основным фактором, определяющим неэффективность лечения инфекции H. pylori [6,7]. В недавнем систематическом обзоре сообщалось, что глобальная заболеваемость устойчивостью к САМ составляет 17.2% в диапазоне от 11,1% в Европе до 29,3% в Америке, тогда как, согласно тому же анализу, континентальные уровни устойчивости к MNZ составили 17% и 44,1% соответственно [8]. Потребление антибиотиков при инфекциях, отличных от H. pylori , является причиной значительного увеличения показателей устойчивости к антибиотикам H. pylori [9,10]. Действительно, различные национальные стратегии использования антибиотиков в значительной степени отражают географическое распределение устойчивости H. pylori : сообщалось, что устойчивость к САМ значительно выше в странах Южной Европы (достигая 49% в некоторых районах Испании) по сравнению с Северной Европой ( e.g ., только 1% в Нидерландах), где политика в отношении использования антибиотиков более строгая [9]. В дополнение к развитию устойчивости к антибиотикам, ряд факторов, связанных как с хозяином, так и с патогеном, может отрицательно влиять на эффективность схем уничтожения H. pylori (таблица) [11,12].
Таблица 1
Факторы, которые, как сообщается, отрицательно влияют на исход лечения инфекции Helicobacter pylori
| Связанные с патогенами | Связанные с хозяином |
| Развитие устойчивости к антибиотикам | Несоблюдение режима лечения |
| Высокая бактериальная нагрузка в желудке | Неязвенная диспепсия |
| Защитный эффект слизистой оболочки желудка | Курение |
| Внутриклеточное расположение многих бактерий | Статус CYP2C19 ( быстрый метаболизатор) |
| CagA отрицательный | |
| Наличие покоящихся коккоидных форм (не чувствительных к антибиотикам) | |
| Гетерорезистентный статус (сосуществование штаммов, чувствительных и устойчивых к одному и тому же антибиотику) |
Несмотря на десятилетия усилий, лечение H.pylori остается сложной проблемой как для исследователей, так и для практикующих врачей. В настоящей статье мы стремимся предоставить всесторонний обзор перспектив эрадикации H. pylori
в прошлом, настоящем и будущем.ТРОЙНАЯ ТЕРАПИЯ НА ОСНОВЕ КЛАРИТРОМИЦИНА: СНИЖЕНИЕ КЛИНИЧЕСКОГО СТАНДАРТА
Исторически первая по-настоящему эффективная терапия инфекции H. pylori
, включающая висмут, тетрациклин и MNZ, была предложена в 1990 году [13].Несколько лет спустя использование CAM в тройной терапии, предложенное Bazzoli et al [14], стало началом тройных схем на основе CAM, которые впоследствии стали золотым стандартом в лечении H. pylori . В исследованиях, проведенных в 90-х годах, стандартные тройные терапии (STT) включали ингибитор протонной помпы (PPI) два раза в день , CAM 500 мг два раза в день и амоксициллин 1000 мг два раза в день или 500 мг MNZ (или 400 мг в Англии) все эти препараты вводились в течение 7–14 дней и обеспечивали стабильно хорошие результаты, дающие> 80% успеха эрадикации и даже> 90% достижимости [15,16].Благодаря этой высокой эффективности и относительной простоте, оптимальному профилю безопасности и приверженности крупных фармацевтических компаний, эти схемы были широко приняты национальными экспертными комиссиями и согласованными рекомендациями во всем мире в качестве стандарта лечения первой линии для эрадикации H. pylori [ 17-20]. Однако рост распространенности устойчивости к САМ привел к значительному снижению эффективности стандартных схем лечения. Это снижение эффективности уже было очевидно в метаанализах, опубликованных в начале 2000-х годов, что привело к значительным изменениям в парадигме лечения инфекции.Они включали в себя введение концепции кумулятивной эффективности лечения (требующей от пациента соблюдения большего количества курсов лечения; таким образом, большее количество побочных эффектов и распространение вторичной устойчивости к антибиотикам), а затем введение местного порогового значения (15-20%) устойчивости к САМ, при которой САМ не следует использовать эмпирически [17,18]. Снижение эффективности стандартных методов лечения против САМ-устойчивых штаммов было хорошо задокументировано на метааналитической основе: в метаанализе Фишбаха и Эванса успех тройной терапии снизился на 66.2% (95% ДИ: 58,2–74,2%), когда штаммы H. pylori были устойчивыми, и восприимчивы к САМ [7]. Соответственно, более свежий анализ Venerito et al [21] показал аналогичные результаты: включая данные о чувствительности к противомикробным препаратам из 4 рандомизированных клинических испытаний (РКИ), стандартные тройные методы лечения успешно уничтожили 88% CAM-чувствительных, но только 14% CAM-устойчивых H. pylori штаммов (разница рисков = 0,75, 95% ДИ: 0,63–0,87). Если используется MNZ, наличие устойчивости к MNZ также может повлиять на терапевтический результат [22], хотя, как правило, это считается менее важным клинически.Это связано с тем, что устойчивость к MNZ можно в значительной степени преодолеть путем увеличения дозы и увеличения продолжительности лечения [23]. Наконец, устойчивость H. pylori к амоксициллину является исключительной и, как правило, не имеет клинического значения. В свете увеличения количества данных, подтверждающих субоптимальную эффективность (<70%) в большинстве европейских стран, недавний консенсусный доклад Маастрихт IV / Флоренции окончательно вытеснил стандартные схемы лечения в качестве эмпирического золотого стандарта для искоренения H. pylori [4].Вместо этого при использовании традиционных тройных схем следует учитывать местный характер резистентности (таким образом, они используются только в тех областях, в которых резистентность к САМ составляет <20%) или полагаться на тестирование на чувствительность при условии наличия культуры перед лечением (, т.е. ., используется в качестве индивидуализированного лечения).ТЕКУЩИЕ ТЕРАПИИ ИНФЕКЦИИ H. PYLORI
Новые схемы, специально опробованные для улучшения терапевтического результата против устойчивых к антибиотикам штаммов H. pylori , теперь рекомендуются в качестве вариантов эмпирического лечения первой линии, обеспечивающих повышенную эффективность (по сообщениям> 90% при анализе намерения лечить) в условиях высокой устойчивости к САМ.Эти схемы сведены в Табл.
Таблица 2
Текущие схемы лечения инфекции Helicobacter pylori
| Лечение | Схема |
| Висмутсодержащая четырехкомпонентная терапия | A PPI (стандартная доза, два раза в день ), висмут (стандартная доза, 4 раза в день, ), тетрациклин (500 мг, 4 раза в день, ) и метронидазол (500 мг, 4 раза в день, ) в течение 10-14 дней |
| Последовательная терапия | A 5-дневная двойная терапия с ИПП (стандартная доза, два раза в день, ) и амоксициллин (1 г, два раза в день, ) с последующей 5-дневной тройной терапией с ИПП (стандартная доза, два раза в день, ), кларитромицином (500 мг, два раза в день, ) и метронидазол (500 мг, два раза в день, ) |
| Сопутствующая терапия | А ИПП (стандартная доза, два раза в день, ), кларитромицин (500 мг, два раза в день, ), амоксициллин (1 г, два раза в день, ) и метрони дазол (500 мг, два раза в день, ) в течение 7-10 дней |
| Гибридная терапия | Семидневная двойная терапия с ИПП (стандартная доза, два раза в день, ) и амоксициллином (1 г, два раза в день, ) с последующим с помощью 7-дневной четырехкратной терапии с ИПП (стандартная доза, два раза в день, ), амоксициллином (1 г, два раза в день, ), кларитромицином (500 мг, два раза в день, ) и метронидазолом (500 мг, два раза в день, ) |
| Тройная терапия на основе левофлоксацина | ИПП (стандартная доза, два раза в день, ), левофлоксацин (500 мг, два раза в день, ) и амоксициллин (1 г, два раза в день, ) в течение 10 дней |
БИСМУТОВАЯ КВАДРАПИЯ
Квадратная терапия висмутом (BQT) в настоящее время представляет собой предпочтительный вариант лечения первой линии для областей с высокой (≥ 20%) частотой резистентности к САМ, но также является ценным вариантом лечения второй линии, когда схема на основе САМ ранее была неэффективной.Он работает независимо от CAM, достигая> 90% эрадикации при наличии устойчивости к CAM, тогда как применение высокой дозы MNZ (1500-1600 мг / сут) и увеличенной (10-14 дней) продолжительности лечения позволяет минимизировать влияние на устойчивость к MNZ. , обеспечивая уровень эрадикации> 85% даже в регионах с высокой устойчивостью к этому препарату [24]. Доступна удобная для пациента монокапсула (содержащая висмут, MNZ и тетрациклин) (Pylera ® , Aptalis, Mont St Hilaire, QC, Канада), обеспечивающая уровень эрадикации от назначенного лечения 86% и 80% в двух крупных РКИ, проведенных в Северной Америке и Европе соответственно [25-27].Напротив, уровень эрадикации ITT с помощью BQT составил только 77,8% в недавнем метаанализе ( против 77% для STT), ставя под сомнение как эффективность, так и превосходство BQT над STT [28]. Однако следует признать значительную степень неоднородности исследований, особенно в отношении дозирования MNZ. Эффективность второй линии BQT также была подтверждена на метааналитической основе (30 исследований), показывающих в среднем 77% эффективность второй линии (ITT) после неэффективности STT [29]. В многоцентровом исследовании, проведенном в Испании, эффективность третьей линии BQT после двух предыдущих неудачных попыток эрадикации с помощью тройной терапии, содержащей САМ и левофлоксацин, составила 65% (ITT).Недоступность солей висмута или тетрациклина в некоторых странах, а также потенциальная токсичность висмута являются основными ограничениями. Однако при включении 4763 пациентов не было выявлено различий в переносимости между группами, не получавшими висмута, и группами, содержащими висмут, за исключением того, что темный стул более распространен в более поздних случаях [31].
ПОСЛЕДОВАТЕЛЬНАЯ ТЕРАПИЯ
В последовательной терапии используются те же антибиотики, что и в STT, но вводимые последовательно. Было высказано предположение, что начальный курс амоксициллина разрушает стенку бактериальной клетки, предотвращая развитие каналов оттока, переносящих САМ из бактерий [32].Хотя в первоначальных РКИ [33] (большинство из них проводилось в Италии) и более ранних метаанализах последовательная терапия явно превосходила STT [эрадикация ITT 91,7% (95% ДИ: 90% -93%) против 76,7% ( 95% ДИ: 75% -79%) для STT] [34], более свежие данные из Южной Америки, Ирана и Южной Кореи показали более низкие уровни эрадикации (<80%) [35-37]. Несмотря на то, что эта последовательная терапия, по-видимому, достаточно эффективна против монорезистентных штаммов CAM, будучи способной уничтожить 72,8% из них, ее эффективность против штаммов с двойной устойчивостью (CAM и MNZ) составила всего 37% (диапазон: 16.От 2% до 60,7%) при оценке 8 исследований с данными о чувствительности к антибиотикам [38]. Критически важно, что последовательная терапия не превосходила ни 14-дневную тройную терапию (RR = 1, 95% ДИ: 0,94–1,06), ни терапию на основе висмута (RR = 0,99, 95% ДИ: 0,94–1,05) в обширной оценка 46 РКИ [38].
НЕВИСМУТОВАЯ КВАДРУПНАЯ (СОПРОВОЖДАЮЩАЯ) ТЕРАПИЯ
Четырехкратная «сопутствующая» терапия без висмута – еще один действенный вариант лечения первой линии для областей с высокой частотой резистентности к САМ [39,40].В 19 исследованиях (2070 пациентов) общий уровень эрадикации при сопутствующей терапии составил 88% (95% ДИ: 85-91%) и 91%, когда были исключены 3 отдаленных исследования с изначально короткой продолжительностью лечения (3-5 дней) [41 ]. Действительно, для успеха сопутствующей терапии необходима продолжительность лечения не менее 7 дней [42], тогда как экстра-пролонгирование лечения до 14 дней в сочетании с высокой дозой ИПП (омепразол 40 мг × 2) может еще больше ускорить выздоровление. частота до> 95%, как показало многоцентровое исследование не меньшей эффективности [43].Повышенная эффективность против штаммов H. pylori с двойной устойчивостью была предложена в качестве основного преимущества сопутствующей терапии по сравнению с последовательной терапией [44], хотя эти две схемы показали одинаковые результаты при сравнении с 338 пациентами в стране с высокой устойчивостью к антибиотикам (Испания). ) [45]. Действительно, при оценке 106 пациентов с помощью теста на предрасположенность к лечению сопутствующая терапия уничтожила только 55% штаммов с двойной устойчивостью против 100% и 91% с устойчивостью к CAM и MNZ соответственно [46].Таким образом, обе схемы, по-видимому, подвержены пагубному влиянию двойной резистентности, выполняя их сравнительно (с эффективностью около 81% каждый) при объединении данных 6 сравнительных РКИ [38].
ГИБРИДНАЯ ТЕРАПИЯ
Двухэтапный комбинированный (гибридный) режим, предложенный Hsu et al [47], является еще одним ценным вариантом лечения, конкурирующим как с последовательным, так и с сопутствующим лечением. При оценке данных 2 РКИ гибридная терапия показала незначительные, хотя и незначительные результаты, по сравнению с последовательной терапией (86.6% ( против 81%) [38], и по сравнению с сопутствующей терапией в сравнительном исследовании, в котором, что интересно, меньше нежелательных явлений произошло в группе, получавшей гибридный режим [43]. Необходимы дополнительные данные, чтобы сделать окончательные выводы об эффективности и переносимости гибридной терапии.
ТЕРАПИИ НА ОСНОВЕ ЛЕВОФЛОКСАЦИНА
Для преодоления возрастающей резистентности к CAM левофлоксацин, хинолон широкого спектра действия, использовался в качестве замены CAM в тройных или последовательных схемах лечения, достигая скорости излечения> 90%, и даже> 95% возможно при условии что местная резистентность к левофлоксацину низкая (<10%) [48,49].Однако левофлоксацин также сталкивается с клинически значимыми проблемами устойчивости к антибиотикам, поскольку устойчивость к хинолонам в настоящее время превышает 40% в Америке, 20% в Европе и 10% в Азии [8]. Из-за быстрого развития вторичной резистентности к хинолонам применение левофлоксацина в качестве первого ряда обычно не рекомендуется, а препарат резервируется для использования в схемах второго ряда / экстренной помощи после неудачи схемы на основе CAM и / или MNZ [50 ]. Хорошая (частота излечения 81–87%) эффективность тройной терапии левофлоксацином (ЛТТ) второй линии была подтверждена в двух метаанализах, опубликованных в 2006 г., оба показали лучшие результаты с ЛТТ по сравнению с БКВ второй линии [51 , 52].Соответственно, эффективность ЛТТ второй линии составила 88,7% в более позднем метаанализе, включая РКИ до октября 2010 г. [53]. Важно отметить, что использование LTT после неэффективности последовательного или сопутствующего режима, как сообщается, обеспечивает до 97,8% совокупной терапевтической эффективности [54]. Использование других хинолоновых агентов, таких как моксифлоксацин и ситафлоксацин, показало многообещающие результаты [55,56], хотя нет никаких доказательств, подтверждающих какое-либо терапевтическое преимущество перед левофлоксацином.
ПЕРСПЕКТИВЫ НА БУДУЩЕЕ
Дополнительные пробиотики
Несмотря на то, что были предприняты различные попытки восстановить эффективность стандартных методов лечения, таких как увеличение дозы ИПП или продление продолжительности лечения, ни один не был доказан на уровне, позволяющем преодолеть сегодняшнюю устойчивость к противомикробным препаратам.Подход, который вызывает растущий интерес, заключается в использовании пробиотиков в сочетании со схемами уничтожения H. pylori [57]. Ожидаемая польза двоякая: усиление эрадикации и улучшение переносимости за счет предотвращения возникновения побочных эффектов, связанных с лечением. Патогенетическая основа возможного благоприятного действия пробиотиков на эрадикацию H. pylori еще предстоит выяснить, хотя были выдвинуты некоторые гипотезы, включая прочность слизистого барьера, конкуренцию за адгезию и иммуномодулирующие механизмы [58].В последние годы в различных исследованиях пробиотики использовались в дополнение к стандартным или новым схемам лечения, что дало противоречивые результаты [59–62]. Несмотря на то, что были оценены различные одно- или мультиштаммовые соединения, в настоящее время имеются доказательства в поддержку использования Saccharomyces boulardi (OR = 1,13; 95% ДИ: 1,05–1,21) или Lactobacillus spp . (OR = 1,78; 95% ДИ: 1,2–2,6) добавление добавок к стандартной тройной терапии [63,64]. В самом последнем анализе, оценивающем влияние добавок, содержащих Lactobacillus и Bifidobacterium, объединенное отношение шансов (ITT) с добавлением пробиотиков составило 2.066 (95% ДИ: 1,398–3,055) для эрадикации и 0,305 (95% ДИ: 0,117–0,793) для частоты полных побочных эффектов [65]. Интересно, что с точки зрения предотвращения побочных эффектов использование пробиотиков может быть актуальным только для некоторой части пациентов, особенно у пациентов с рецидивирующей инфекцией или в анамнезе с желудочно-кишечными побочными эффектами, связанными с антибиотиками [57]. Ожидаются дополнительные данные, чтобы прояснить роль, стандартизировать схемы лечения и оценить экономическую эффективность пробиотиков в лечении H.pylori инфекция.
Бескультуральное, неинвазивное определение чувствительности к антибиотикам H. pylori
Критически важно, что даже новые методы лечения, описанные выше, в некоторой степени (хотя и в меньшей по сравнению с традиционными методами лечения) подвержены влиянию устойчивости к антибиотикам; уровни эрадикации> 95% встречаются нечасто, и даже> 90% оспариваются в некоторых исследованиях [35,66,67]. Кроме того, возможно, что в будущем эффективность эмпирических методов лечения будет еще больше снижаться, поскольку во всем мире постоянно растет устойчивость к основным антибиотикам.Для поддержания высокой терапевтической эффективности оптимальным подходом представляется индивидуализированное лечение H. pylori при поражении f , основанное на предварительном тестировании чувствительности. Это предотвратит повторное лечение пациента эмпирическим лечением, которое увеличивает риск побочных эффектов и способствует развитию вторичной резистентности. Однако, как уже упоминалось, современные средства выполнения эндоскопии и посева H. pylori являются инвазивными, не отражают на 100% чувствительность in vivo и требуют много времени, поскольку для посева требуется 3-10 дней и тестирование чувствительности ( e.g ., Etest, AB bioMerieux, Solna, Sweden) потребуется дополнительно 3-4 дня. Эти ограничения препятствуют систематическому использованию культуры H. pylori , которая в настоящее время рекомендуется только для случаев, по крайней мере, с двумя эмпирическими неудачами лечения. Общеклассовая устойчивость к макролидам является результатом точечных мутаций в трех соседних нуклеотидных положениях ( A2143G, A2142G и A2142C ) в петле пептидилтрансферазы гена 23SrRNA [68,69]. Эти три точечные мутации составляют 90% случаев первичной устойчивости к САМ в западных странах.В последние годы были разработаны методы молекулярного тестирования этих мутаций, включая стандартную полимеразную цепную реакцию (ПЦР) и другие методы на основе ПЦР, включая полиморфизм длины рестрикционных фрагментов ПЦР, иммуноферментный анализ ПЦР-ДНК, анализ лигирования олигонуклеотидов ПЦР и линию ПЦР. зондовый анализ, а также анализ ПЦР в реальном времени, который представляет собой мощный шаг вперед по сравнению с базовой ПЦР [70–72]. Эти методы могут предложить быстрые и высокоточные результаты при генотипическом обнаружении устойчивости к САМ, включая определение статуса гетерорезистентности ( i.e ., сосуществование штаммов, чувствительных и устойчивых к одному и тому же антибиотику), как известно, является причиной значительного числа неудач лечения [73,74]. Эти методы могут применяться непосредственно к образцам биопсии желудка или использоваться в сочетании с малоинвазивными методами (, например, ., Чистка ротовой полости или промывание желудка) или неинвазивно с использованием образцов кала [75–77]. Важно отметить, что генотипическое определение устойчивости к САМ также возможно с помощью флуоресцентной гибридизации in-situ, которая также может применяться к образцам, залитым парафином [78,79].Также возможно определение устойчивости к левофлоксацину на основе обнаружения мутации gyrA [80]. Два азиатских исследования предоставили данные о потенциальной полезности индивидуализированного терапевтического подхода, основанного на молекулярном обнаружении устойчивости H. pylori к САМ. Специально подобранное лечение с использованием простого режима ИПП / МНЗ успешно ликвидировало патоген у 94,3% () против (71,4%) при использовании стандартного эмпирического лечения [77]. В более крупном исследовании (218 пациентов) CAM заменяли MNZ в тройном режиме, если был обнаружен устойчивый к CAM штамм.Показатели эрадикации составили 91,2% в специально подобранной группе против 79,1% и 75,9% при использовании эмпирических тройных терапий на основе MNZ и CAM ( n = 308 в каждой контрольной группе) соответственно ( P <0,001) [81] .
Фармакогеномика
Известно, что генетическая изменчивость активности цитохрома P450 (CYP) 2C19 (CYP2C19) влияет на уровни ИПП в плазме и, таким образом, на лечение инфекции H. pylori [82,83]. Различают три различных генотипа: быстрый, средний и слабый метаболизаторы.Предварительные данные о потенциальном использовании фармакогеномики были предоставлены в РКИ с 300 H. pylori -позитивными пациентами, рандомизированными либо на стандартную схему лечения в течение 1 недели, либо на индивидуальную терапию на основе статуса восприимчивости к CYP2C19 и CAM, оцененного с помощью генетического тестирования [84 ]. Показатели искоренения ITT были значительно выше в специально подобранной группе (96% против 70%) без увеличения окончательных затрат на одного пациента для успешной ликвидации. В будущем должны быть решены как практические, так и логистические вопросы, прежде чем молекулярный подход может быть широко принят в качестве подлинной основы для индивидуализации H.pylori эрадикационная терапия.
ЗАКЛЮЧЕНИЕ
На протяжении более десяти лет тройные схемы были стандартом лечения инфекции H. pylori . Однако в последние годы рост распространенности резистентности к макролидам привел к значительному снижению эффективности этих схем, что привело к необходимости проведения дополнительных курсов лечения для искоренения патогена. Чтобы поддерживать высокую терапевтическую эффективность, схемы с улучшенной эффективностью против антибиотикоустойчивых H.pylori в настоящее время рекомендуются в качестве предпочтительных препаратов первой линии. Сопутствующие и последовательные схемы в настоящее время являются наиболее подтвержденными терапевтическими вариантами первой линии. Гибридная терапия – еще одна эффективная альтернатива на основе КАМ и соответствующий конкурент обоим этим методам лечения. BQT также является действенным средством лечения при высокой резистентности к САМ, но также является эффективным режимом второго ряда, когда схема, основанная на САМ, не дает результатов. Из-за быстрого развития резистентности к хинолонам схемы на основе левофлоксацина в настоящее время следует зарезервировать как варианты лечения второй или более линий.В то время как усилия по совершенствованию эмпирических методов лечения продолжаются, области генотипического выявления чувствительности к противомикробным препаратам H. pylori и фармакогеномики открывают новые захватывающие перспективы. Это гарантирует 100% терапевтическую эффективность: быстро, без посева и неинвазивно.
Сноски
P- Рецензент: Ding SZ, Im SH, Velin D, Zhu YL S- Редактор: Wen LL L- Редактор: A E- Editor: Wang CH
Ссылки
1. Moayyedi P, Hunt RH. Значение Helicobacter pylori для общественного здравоохранения.Helicobacter. 2004; 9 Дополнение 1: 67–72. [PubMed] [Google Scholar] 2. Мальфертхайнер П., Чан Ф. К., Макколл К. Э. Язвенная болезнь. Ланцет. 2009; 374: 1449–1461. [PubMed] [Google Scholar] 3. Kuipers EJ. Helicobacter pylori, риск и лечение сопутствующих заболеваний: гастрита, язвенной болезни, атрофического гастрита и рака желудка. Алимент Pharmacol Ther. 1997; 11 Дополнение 1: 71–88. [PubMed] [Google Scholar] 4. Мальфертхайнер П., Мегроуд Ф., О’Морайн К.А., Атертон Дж., Аксон А.Т., Баццоли Ф., Дженсини Г.Ф., Гисберт Дж. П., Грэм Д. Ю., Роккас Т. и др.Управление инфекцией Helicobacter pylori – Маастрихтский отчет IV / Флорентийский консенсусный доклад. Кишечник. 2012. 61: 646–664. [PubMed] [Google Scholar] 5. Gisbert JP. Необходим ли посев перед лечением первой линии инфекции Helicobacter pylori? Intern Med. 2011; 50: 2717; ответ автора 2719–2720. [PubMed] [Google Scholar] 7. Fischbach L, Evans EL. Мета-анализ: влияние статуса устойчивости к антибиотикам на эффективность тройной и четверной терапии первой линии для Helicobacter pylori. Алимент Pharmacol Ther.2007. 26: 343–357. [PubMed] [Google Scholar] 8. Де Франческо В., Джорджио Ф., Хассан С., Манес Дж., Ваннелла Л., Панелла С., Иерарди Е., Зулло А. Всемирная устойчивость к антибиотикам H. pylori: систематический обзор. J Gastrointestin Liver Dis. 2010; 19: 409–414. [PubMed] [Google Scholar] 9. Megraud F, Coenen S, Versporten A, Kist M, Lopez-Brea M, Hirschl AM, Andersen LP, Goossens H, Glupczynski Y. Устойчивость Helicobacter pylori к антибиотикам в Европе и ее связь с потреблением антибиотиков. Кишечник. 2013; 62: 34–42.[PubMed] [Google Scholar] 10. Боянова Л., Илиева Дж., Гергова Г., Давидков Л., Спасова З., Камбуров В., Кацаров Н., Митов И. Многочисленные факторы риска устойчивости к антибиотикам Helicobacter pylori, выявленные в расширенном анамнезе: болгарское исследование. J Med Microbiol. 2012; 61: 85–93. [PubMed] [Google Scholar] 11. Георгопулос С.Д., Ладас С.Д., Каратапанис С., Ментис А., Спилиади С., Артикис В., Раптис С.А. Факторы, которые могут повлиять на исход лечения тройной эрадикационной терапии Helicobacter pylori омепразолом, амоксициллином и кларитромицином.Dig Dis Sci. 2000. 45: 63–67. [PubMed] [Google Scholar] 12. Ян JC, Лин CJ. Генотипы CYP2C19 в фармакокинетике / фармакодинамике терапии инфекции Helicobacter pylori на основе ингибиторов протонной помпы. Мнение эксперта Drug Metab Toxicol. 2010; 6: 29–41. [PubMed] [Google Scholar] 13. Джордж Л.Л., Бороди Т.Дж., Эндрюс П., Дивайн М., Мур-Джонс Д., Уолтон М., Брандл С. Лечение язвы двенадцатиперстной кишки после искоренения Helicobacter pylori. Med J Aust. 1990; 153: 145–149. [PubMed] [Google Scholar] 14. Баццоли Ф., Поццато П.Терапия инфекции H. pylori. J. Physiol Pharmacol. 1997; 48 Дополнение 4: 39–46. [PubMed] [Google Scholar] 15. Современные европейские концепции лечения инфекции Helicobacter pylori. Маастрихтский консенсусный доклад. Европейская группа по изучению Helicobacter Pylori. Кишечник. 1997; 41: 8–13. [Бесплатная статья PMC] [PubMed] [Google Scholar] 16. Линд Т., Вельдхуйзен ван Зантен С., Унге П., Спиллер Р., Байердорфер Э., О’Морайн С., Бардхан К.Д., Брадетт М., Чиба Н., Врангстад М. и др. Ликвидация Helicobacter pylori с использованием однонедельной тройной терапии, сочетающей омепразол с двумя противомикробными препаратами: исследование MACH I.Helicobacter. 1996; 1: 138–144. [PubMed] [Google Scholar] 17. Мальфертхайнер П., Мегро Ф., О’Морайн С., Хангин А.П., Джонс Р., Аксон А., Грэм Д.Ю., Титгат Г. Современные концепции управления инфекцией Helicobacter pylori – Консенсусный доклад Маастрихта 2-2000. Алимент Pharmacol Ther. 2002; 16: 167–180. [PubMed] [Google Scholar] 18. Мальфертхайнер П., Мегроуд Ф., О’Морайн С., Баццоли Ф., Эль-Омар Э., Грэм Д., Хант Р., Роккас Т., Вакил Н., Кейперс Э. Современные концепции лечения инфекции Helicobacter pylori: Маастрихтский консенсусный отчет III.Кишечник. 2007; 56: 772–781. [Бесплатная статья PMC] [PubMed] [Google Scholar] 19. Чей В.Д., Вонг BC. Руководство Американского колледжа гастроэнтерологии по лечению инфекции Helicobacter pylori. Am J Gastroenterol. 2007; 102: 1808–1825. [PubMed] [Google Scholar] 20. Фок К.М., Кателарис П., Сугано К., Энг Т.Л., Хант Р., Талли, штат Нью-Джерси, Лам С.К., Сяо С.Д., Тан Х.Дж., Ву С.Й. и др. Второе Азиатско-Тихоокеанское согласованное руководство по инфекции Helicobacter pylori. J Gastroenterol Hepatol. 2009; 24: 1587–1600. [PubMed] [Google Scholar] 21.Venerito M, Krieger T., Ecker T., Leandro G, Malfertheiner P. Мета-анализ четырехкратной терапии висмутом по сравнению с тройной терапией кларитромицином для эмпирического первичного лечения инфекции Helicobacter pylori. Пищеварение. 2013; 88: 33–45. [PubMed] [Google Scholar] 22. Хубен М. Х., ван де Бик Д., Хенсен Э. Ф., де Крен А. Дж., Раус Э. А., Титгат Г. Н.. Систематический обзор эрадикационной терапии Helicobacter pylori – влияние устойчивости к противомикробным препаратам на уровень эрадикации. Алимент Pharmacol Ther. 1999; 13: 1047–1055. [PubMed] [Google Scholar] 23.Грэм Д. Ю., Куреши В. А.. Инфекция H. pylori, резистентная к антибиотикам, и ее лечение. Curr Pharm Des. 2000; 6: 1537–1544. [PubMed] [Google Scholar] 24. Фишбах Л.А., ван Зантен С., Дикасон Дж. Мета-анализ: эффективность, побочные эффекты и приверженность, связанные с четырехкомпонентной терапией против Helicobacter pylori первой линии. Алимент Pharmacol Ther. 2004. 20: 1071–1082. [PubMed] [Google Scholar] 25. де Бур WA, ван Эттен RJ, Schneeberger PM, Tytgat GN. Одно лекарство от инфекции Helicobacter pylori: первые результаты с новой тройной монокапсулой висмута.Am J Gastroenterol. 2000; 95: 641–645. [PubMed] [Google Scholar] 26. Laine L, Hunt R, El-Zimaity H, Nguyen B, Osato M, Spénard J. Четырехкратная терапия на основе висмута с использованием одной капсулы бисскальцитрата висмута, метронидазола и тетрациклина с омепразолом по сравнению с омепразолом, амоксициллином и кларитромицином для эрадикации Helicobacter pylori у пациентов с язвой двенадцатиперстной кишки: проспективное рандомизированное многоцентровое исследование в Северной Америке. Am J Gastroenterol. 2003. 98: 562–567. [PubMed] [Google Scholar] 27.Malfertheiner P, Bazzoli F, Delchier JC, Celiñski K, Giguère M, Rivière M, Mégraud F. Эрадикация Helicobacter pylori с помощью капсулы, содержащей субцитрат висмута калия, метронидазол и тетрациклин, назначенные с омепразолом по сравнению с открытой терапией на основе омепразола и открытой терапии на основе трипразола. -метка, не неполноценность, испытание фазы 3. Ланцет. 2011; 377: 905–913. [PubMed] [Google Scholar] 28. Лютер Дж., Хиггинс П.Д., Шенфельд П.С., Моайеди П., Вакил Н., Чей В.Д. Эмпирическая четырехкратная и тройная терапия для первичного лечения инфекции Helicobacter pylori: систематический обзор и метаанализ эффективности и переносимости.Am J Gastroenterol. 2010; 105: 65–73. [PubMed] [Google Scholar] 30. Гисберт Дж. П., Перес-Айса А., Родриго Л., Молина-Инфанте Дж., Модолелл I, Бермехо Ф., Кастро-Фернандес М., Антон Р., Сакристан Б., Косме А. и др. Спасательная терапия третьей линии с использованием висмутсодержащего четырехкратного режима после неэффективности двух курсов лечения (кларитромицином и левофлоксацином) инфекции H. pylori. Dig Dis Sci. 2014; 59: 383–389. [PubMed] [Google Scholar] 31. Ford AC, Malfertheiner P, Giguere M, Santana J, Khan M, Moayyedi P. Неблагоприятные события с солями висмута для ликвидации Helicobacter pylori: систематический обзор и метаанализ.Мир Дж. Гастроэнтерол. 2008; 14: 7361–7370. [Бесплатная статья PMC] [PubMed] [Google Scholar] 32. Уэббер М.А., Пиддок Л.Дж. Важность оттокных насосов в устойчивости бактерий к антибиотикам. J Antimicrob Chemother. 2003; 51: 9–11. [PubMed] [Google Scholar] 33. Зулло А., Вайра Д., Вакил Н., Хассан С., Гатта Л., Риччи С., Де Франческо В., Менегатти М., Тампьери А., Перна Ф. и др. Высокие показатели эрадикации Helicobacter pylori при новом последовательном лечении. Алимент Pharmacol Ther. 2003. 17: 719–726. [PubMed] [Google Scholar] 34.Gisbert JP, Calvet X, O’Connor A, Mégraud F, O’Morain CA. Последовательная терапия для эрадикации Helicobacter pylori: критический обзор. J Clin Gastroenterol. 2010. 44: 313–325. [PubMed] [Google Scholar] 35. Гринберг Е.Р., Андерсон Г.Л., Морган Д.Р., Торрес Дж., Чей В.Д., Браво Л.Е., Домингес Р.Л., Ферреччио С., Эрреро Р., Ласкано-Понсе ЕС и др. 14-дневная тройная, 5-дневная сопутствующая и 10-дневная последовательная терапия инфекции Helicobacter pylori в семи странах Латинской Америки: рандомизированное исследование. Ланцет. 2011; 378: 507–514.[Бесплатная статья PMC] [PubMed] [Google Scholar] 36. Lim JH, Lee DH, Choi C, Lee ST, Kim N, Jeong SH, Kim JW, Hwang JH, Park YS, Lee SH и др. Клинические результаты двухнедельной последовательной и сопутствующей терапии для эрадикации Helicobacter pylori: рандомизированное пилотное исследование. Helicobacter. 2013. 18: 180–186. [PubMed] [Google Scholar] 37. Сардарян Х., Факери Х., Хоссейни В., Тагваеи Т., Малеки И., Мохтаре М. Сравнение гибридной и последовательной терапии для ликвидации Helicobacter pylori в Иране: проспективное рандомизированное исследование.Helicobacter. 2013. 18: 129–134. [PubMed] [Google Scholar] 38. Гатта Л., Вакил Н., Вайра Д., Скарпигнато С. Глобальные показатели эрадикации инфекции Helicobacter pylori: систематический обзор и метаанализ последовательной терапии. BMJ. 2013; 347: f4587. [Бесплатная статья PMC] [PubMed] [Google Scholar] 39. Georgopoulos S, Papastergiou V, Xirouchakis E, Laoudi F, Lisgos P, Spiliadi C, Papantoniou N, Karatapanis S. Четырехкратная «сопутствующая» терапия без висмута по сравнению со стандартной тройной терапией продолжительностью 10 дней для первой линии H.pylori: рандомизированное исследование. J Clin Gastroenterol. 2013; 47: 228–232. [PubMed] [Google Scholar] 40. Georgopoulos S, Papastergiou V, Xirouchakis E, Laudi F, Papantoniou N, Lisgos P, Spiliadi C, Fragou P, Skorda L., Karatapanis S. Оценка «сопутствующей» терапии с четырьмя препаратами, тремя антибиотиками и невисмутом в качестве первой режим эрадикации Helicobacter pylori в Греции. Helicobacter. 2012; 17: 49–53. [PubMed] [Google Scholar] 41. Gisbert JP, Calvet X. Обновленная информация о четверной (сопутствующей) терапии без висмута для искоренения Helicobacter pylori.Clin Exp Gastroenterol. 2012; 5: 23–34. [Бесплатная статья PMC] [PubMed] [Google Scholar] 42. Essa AS, Kramer JR, Graham DY, Treiber G. Мета-анализ: «сопутствующая терапия» с четырьмя лекарствами, тремя антибиотиками, без висмута по сравнению с тройной терапией для эрадикации Helicobacter pylori. Helicobacter. 2009. 14: 109–118. [Бесплатная статья PMC] [PubMed] [Google Scholar] 43. Молина-Инфанте Дж., Романо М., Фернандес-Бермехо М., Федерико А., Гравина А.Г., Поццати Л., Гарсия-Абадиа Е., Винагре-Родригес Г., Мартинес-Алькала С., Эрнандес-Алонсо М. и др.Оптимизированная четырехкомпонентная терапия без висмута излечивает большинство пациентов с инфекцией Helicobacter pylori в популяциях с высокими показателями устойчивости к антибиотикам. Гастроэнтерология. 2013; 145: 121–128.e1. [PubMed] [Google Scholar] 44. Wu DC, Hsu PI, Wu JY, Opekun AR, Kuo CH, Wu IC, Wang SS, Chen A, Hung WC, Graham DY. Последовательная и сопутствующая терапия четырьмя препаратами одинаково эффективна для искоренения инфекции H.pylori. Clin Gastroenterol Hepatol. 2010; 8: 36–41.e1. [Бесплатная статья PMC] [PubMed] [Google Scholar] 45.McNicholl AG, Marin AC, Molina-Infante J, Castro M, Barrio J, Ducons J, Calvet X, de la Coba C, Montoro M, Bory F и др. Рандомизированное клиническое испытание, сравнивающее последовательную и сопутствующую терапию эрадикации Helicobacter pylori в рутинной клинической практике. Кишечник. 2014; 63: 244–249. [PubMed] [Google Scholar] 46. Георгопулос SD, Xirouchakis E, Martinez-Gonzalez B, Sgouras DN, Spiliadi C, Mentis AF, Laoudi F. Клиническая оценка десятидневного режима с эзомепразолом, метронидазолом, амоксициллином и кларитромицином для эрадикации Helicromycinum с высоким содержанием кларитромицина из хеликобактера пилы. область сопротивления.Helicobacter. 2013; 18: 459–467. [PubMed] [Google Scholar] 47. Сюй П.И., Ву, округ Колумбия, Ву Дж.Й., Грэм Д.Ю. Модифицированная последовательная терапия Helicobacter pylori: ингибитор протонной помпы и амоксициллин в течение 14 дней с добавлением кларитромицина и метронидазола в качестве четверной (гибридной) терапии в течение последних 7 дней. Helicobacter. 2011; 16: 139–145. [Бесплатная статья PMC] [PubMed] [Google Scholar] 48. Романо М., Куомо А., Гравина А.Г., Миранда А., Айовен М.Р., Тисо А., Сика М., Рокко А., Салерно Р., Мармо Р. и др. Сравнение эмпирической терапии, содержащей левофлоксацин, и содержащей кларитромицин, для эрадикации Helicobacter pylori: рандомизированное исследование.Кишечник. 2010; 59: 1465–1470. [PubMed] [Google Scholar] 49. Бернинг М., Краш С., Мильке С. Должны ли хинолоны занимать первое место в терапии Helicobacter pylori? Therap Adv Гастроэнтерол. 2011; 4: 103–114. [Бесплатная статья PMC] [PubMed] [Google Scholar] 50. Каротерс Дж. Дж., Брюс М. Г., Хеннесси Т. В., Бенслер М., Моррис Дж. М., Reasonover А. Л., Херлбурт Д. А., Паркинсон А. Дж., Коулман Дж. М., МакМахон Б. Дж.. Взаимосвязь между предыдущим применением фторхинолонов и устойчивостью к левофлоксацину при инфекции Helicobacter pylori. Clin Infect Dis. 2007; 44: e5 – e8.[PubMed] [Google Scholar] 51. Гисберт Дж. П., Морена Ф. Систематический обзор и метаанализ: схемы спасения на основе левофлоксацина после неэффективности лечения Helicobacter pylori. Алимент Pharmacol Ther. 2006; 23: 35–44. [PubMed] [Google Scholar] 52. Саад Р.Дж., Шенфельд П., Ким Х.М., Чей В.Д. Тройная терапия на основе левофлоксацина в сравнении с четырехкратной терапией на основе висмута при персистирующей инфекции Helicobacter pylori: метаанализ. Am J Gastroenterol. 2006; 101: 488–496. [PubMed] [Google Scholar] 53. Ди Каро С., Фини Л., Дауд И., Гриззи Ф., Гасбаррини А., Де Лоренцо А., Ди Ренцо Л., Маккартни С., Блум С.Схемы на основе левофлоксацина / амоксициллина в сравнении с четырехкратной терапией для эрадикации Helicobacter pylori у препаратов второй линии. Мир Дж. Гастроэнтерол. 2012; 18: 5669–5678. [Бесплатная статья PMC] [PubMed] [Google Scholar] 54. Gisbert JP, Molina-Infante J, Marin AC, Vinagre G, Barrio J, McNicholl AG. Тройная спасательная терапия второй линии с левофлоксацином после неэффективности четырехкратного «последовательного» или «сопутствующего» лечения без висмута для искоренения инфекции H. pylori. Сканд Дж Гастроэнтерол. 2013. 48: 652–656. [PubMed] [Google Scholar] 55.Мураками К., Окимото Т., Кодама М., Танахаши Дж., Фудзиока Т., Икеда Ф., Мураока Х., Такигава М., Сайка Т., Хасегава М. и др. Активность ситафлоксацина в отношении изолятов Helicobacter pylori, в том числе с мутациями gyrA. Антимикробные агенты Chemother. 2009; 53: 3097–3099. [Бесплатная статья PMC] [PubMed] [Google Scholar] 56. Wenzhen Y, Kehu Y, Bin M, Yumin L, Quanlin G, Donghai W, Lijuan Y. Тройная терапия на основе моксифлоксацина по сравнению с тройной терапией на основе кларитромицина для лечения первой линии инфекции Helicobacter pylori: метаанализ рандомизированных контролируемых исследований .Intern Med. 2009. 48: 2069–2076. [PubMed] [Google Scholar] 57. Вильгельм С.М., Джонсон Дж. Л., Кале-Прадхан ПБ. Лечение клопов с помощью клопов: роль пробиотиков в качестве дополнительной терапии Helicobacter pylori. Энн Фармакотер. 2011; 45: 960–966. [PubMed] [Google Scholar] 58. Лесброс-Пантофликова Д, Кортези-Теулаз I, Блюм АЛ. Helicobacter pylori и пробиотики. J Nutr. 2007; 137: 812С – 818С. [PubMed] [Google Scholar] 59. Du YQ, Su T, Fan JG, Lu YX, Zheng P, Li XH, Guo CY, Xu P, Gong YF, Li ZS. Адъювантные пробиотики улучшают эрадикационный эффект тройной терапии инфекции Helicobacter pylori.Мир Дж. Гастроэнтерол. 2012. 18: 6302–6307. [Бесплатная статья PMC] [PubMed] [Google Scholar] 60. Efrati C, Nicolini G, Cannaviello C, O’Sed NP, Valabrega S. Эрадикация Helicobacter pylori: последовательная терапия и добавление Lactobacillus reuteri. Мир Дж. Гастроэнтерол. 2012. 18: 6250–6254. [Бесплатная статья PMC] [PubMed] [Google Scholar] 61. Манфреди М., Биззарри Б., Саккеро Р.И., Маккари С., Калабрезе Л., Фаббиан Ф, Де’Анджелис Г.Л. Инфекция Helicobacter pylori в клинической практике: пробиотики и комбинация пробиотиков + лактоферрин улучшают соблюдение режима последовательной терапии, но не искоренение.Helicobacter. 2012; 17: 254–263. [PubMed] [Google Scholar] 62. Shavakhi A, Tabesh E, Yaghoutkar A, Hashemi H, Tabesh F, Khodadoostan M, Minakari M, Shavakhi S., Gholamrezaei A. Влияние многопозиционного пробиотического соединения на висмутсодержащую четырехкомпонентную терапию для инфекции Helicobacter pylori: рандомизированный тройной плацебо-контролируемый -слепое исследование. Helicobacter. 2013. 18: 280–284. [PubMed] [Google Scholar] 63. Szajewska H, Horvath A, Piwowarczyk A. Мета-анализ: влияние добавок Saccharomyces boulardii на скорость эрадикации Helicobacter pylori и побочные эффекты во время лечения.Алимент Pharmacol Ther. 2010. 32: 1069–1079. [PubMed] [Google Scholar] 64. Zou J, Dong J, Yu X. Мета-анализ: Lactobacillus, содержащий четверную терапию по сравнению со стандартной тройной терапией первой линии для эрадикации Helicobacter pylori. Helicobacter. 2009. 14: 97–107. [PubMed] [Google Scholar] 65. Ван Чж, Гао Цюй, Фан Цзюй. Мета-анализ эффективности и безопасности препаратов пробиотических соединений, содержащих лактобактерии и бифидобактерии, в эрадикационной терапии Helicobacter pylori. J Clin Gastroenterol.2013; 47: 25–32. [PubMed] [Google Scholar] 66. Лиу Дж.М., Чен С.К., Чен М.Дж., Чен С.К., Чанг Си.Й., Фанг Й.Дж., Ли Дж.Й., Хсу С.Дж., Ло Дж.К., Чанг У.Х. и др. Последовательная и тройная терапия для лечения первой линии Helicobacter pylori: многоцентровое открытое рандомизированное исследование. Ланцет. 2013; 381: 205–213. [PubMed] [Google Scholar] 67. Вакил Н., Вайра Д. Лечение инфекции H. pylori: новые проблемы с устойчивостью к противомикробным препаратам. J Clin Gastroenterol. 2013; 47: 383–388. [PubMed] [Google Scholar] 68. Тейлор Д.Е., Ге З., Пурыч Д., Ло Т, Хирацука К.Клонирование и анализ последовательности двух копий гена 23S рРНК из Helicobacter pylori и ассоциация устойчивости к кларитромицину с мутациями 23S рРНК. Антимикробные агенты Chemother. 1997; 41: 2621–2628. [Бесплатная статья PMC] [PubMed] [Google Scholar] 69. Версалович Дж., Шортридж Д., Киблер К., Гриффи М. В., Бейер Дж., Фламм Р.К., Танака С.К., Грэм Д.Ю., Go MF. Мутации в 23S рРНК связаны с устойчивостью Helicobacter pylori к кларитромицину. Антимикробные агенты Chemother. 1996. 40: 477–480. [Бесплатная статья PMC] [PubMed] [Google Scholar] 70.Lehours P, Siffré E, Mégraud F. Мультиплексная ПЦР DPO в качестве альтернативы тестированию на культуру и чувствительность для выявления Helicobacter pylori и его устойчивости к кларитромицину. BMC Gastroenterol. 2011; 11: 112. [Бесплатная статья PMC] [PubMed] [Google Scholar] 71. Mégraud F, Lehours P. Обнаружение Helicobacter pylori и тестирование на чувствительность к противомикробным препаратам. Clin Microbiol Rev.2007; 20: 280–322. [Бесплатная статья PMC] [PubMed] [Google Scholar] 72. Schabereiter-Gurtner C, Hirschl AM, Dragosics B, Hufnagl P, Puz S, Kovách Z, Rotter M, Makristathis A.Новый анализ ПЦР в реальном времени для выявления инфекции Helicobacter pylori и одновременное определение чувствительности к кларитромицину в образцах стула и биопсии. J Clin Microbiol. 2004. 42: 4512–4518. [Бесплатная статья PMC] [PubMed] [Google Scholar] 73. De Francesco V, Zullo A, Ierardi E, Giorgio F, Perna F, Hassan C, Morini S, Panella C, Vaira D. Фенотипическая и генотипическая устойчивость к кларитромицину Helicobacter pylori и терапевтический результат: преимущества и ограничения. J Antimicrob Chemother. 2010. 65: 327–332. [PubMed] [Google Scholar] 74.Rimbara E, Fischbach LA, Graham DY. Оптимальная терапия инфекций Helicobacter pylori. Нат Рев Гастроэнтерол Гепатол. 2011; 8: 79–88. [PubMed] [Google Scholar] 75. Баба С., Оиси Й., Ватанабе Й., Оикава Р., Морита Р., Йошида Ю., Хираиси Т., Маэхата Т., Нагасе И., Фукуда Ю. и др. Молекулярный тест на устойчивость к антибиотикам у Helicobacter pylori на основе промывки желудка. Пищеварение. 2011; 84: 299–305. [PubMed] [Google Scholar] 76. Грэм Д.Ю., Кудо М., Редди Р., Опекун А.Р. Практичный быстрый, малоинвазивный, надежный неэндоскопический метод получения Helicobacter pylori для посева.Helicobacter. 2005; 10: 1–3. [PubMed] [Google Scholar] 77. Кавай Т., Ямагиши Т., Яги К., Катаока М., Каваками К., Софуни А., Итои Т., Сакаи Ю., Мориясу Ф., Осака Ю. и др. Индивидуальная эрадикационная терапия, основанная на чувствительности фекалий к кларитромицину Helicobacter pylori. J Gastroenterol Hepatol. 2008; 23 Приложение 2: S171 – S174. [PubMed] [Google Scholar] 78. Моррис JM, Reasonover AL, Брюс MG, Bruden DL, McMahon BJ, Sacco FD, Berg DE, Parkinson AJ. Оценка seaFAST, быстрого флуоресцентного теста гибридизации in situ, для обнаружения Helicobacter pylori и устойчивости к кларитромицину в парафиновых биопсийных срезах.J Clin Microbiol. 2005; 43: 3494–3496. [Бесплатная статья PMC] [PubMed] [Google Scholar] 79. Йилмаз О., Демирай Э., Тюмер С., Алтунгёз О., Йорукоглу К., Сойтюрк М., Симшек И. Обнаружение Helicobacter pylori и определение чувствительности к кларитромицину с использованием фиксированных формалином, залитых парафином образцов биопсии желудка с помощью флуоресцентной гибридизации in situ. Helicobacter. 2007; 12: 136–141. [PubMed] [Google Scholar] 80. Cambau E, Allerheiligen V, Coulon C, Corbel C, Lascols C, Deforges L, Soussy CJ, Delchier JC, Megraud F.Оценка нового теста, генотип HelicoDR, для молекулярного определения устойчивости к антибиотикам у Helicobacter pylori. J Clin Microbiol. 2009. 47: 3600–3607. [Бесплатная статья PMC] [PubMed] [Google Scholar] 81. Ли HJ, Kim JI, Cheung DY, Kim TH, Jun EJ, Oh JH, Chung WC, Kim BW, Kim SS, Park SH и др. Ликвидация Helicobacter pylori в соответствии с точечными мутациями 23S рибосомальной РНК, связанными с устойчивостью к кларитромицину. J Infect Dis. 2013; 208: 1123–1130. [PubMed] [Google Scholar] 82. Фурута Т., Шираи Н., Такашима М., Сяо Ф., Ханаи Х., Сугимура Х., Охаши К., Ишизаки Т., Канеко Э.Влияние генотипических различий в CYP2C19 на частоту излечения от инфекции Helicobacter pylori тройной терапией ингибитором протонной помпы, амоксициллином и кларитромицином. Clin Pharmacol Ther. 2001; 69: 158–168. [PubMed] [Google Scholar] 83. Sim SC, Risinger C, Dahl ML, Aklillu E, Christensen M, Bertilsson L, Ingelman-Sundberg M. Распространенный новый вариант гена CYP2C19 вызывает сверхбыстрый метаболизм лекарства, имеющий отношение к реакции лекарства на ингибиторы протонной помпы и антидепрессанты. Clin Pharmacol Ther. 2006. 79: 103–113.[PubMed] [Google Scholar] 84. Фурута Т., Шираи Н., Кодайра М., Сугимото М., Ногаки А., Курияма С., Иваидзуми М., Ямаде М., Теракава И., Охаши К. и др. Индивидуальный подход на основе фармакогеномики по сравнению со стандартным терапевтическим режимом для эрадикации H. pylori. Clin Pharmacol Ther. 2007. 81: 521–528. [PubMed] [Google Scholar]Лечение инфекции Helicobacter pylori: прошлое, настоящее и будущее
World J Gastrointest Pathophysiol. 2014 15 ноября; 5 (4): 392–399.
Василиос Папастергиу, Стилианос Каратапанис, Отделение внутренней медицины, Общая больница Родоса, 85100 Родос, Греция
Сотириос Д. Георгопулос, Отделение гастроэнтерологии, Athens Medical, P.Больница Фалирон, 17562 Афины, Греция
Вклад авторов: Папастергю V участвовал в разработке концепции и дизайна статьи; Георгопулос С.Д. участвовал в написании статьи, критически отредактировав ее на предмет важного интеллектуального содержания; Каратапанис С. участвовал в окончательном утверждении версии, которая будет опубликована.Для корреспонденции: Стилианос Каратапанис, MD, PhD, Отделение внутренней медицины, Общая больница Родоса, ул. Калопетрас 10, 85100 Родос, Греция. rg.teneto @ raklyts
Телефон: + 30-224-1080456 Факс: + 30-224-1066410
Поступила в редакцию 12 февраля 2014 г .; Пересмотрено 15 апреля 2014 г .; Принято 17 июля 2014 г.
Copyright © 2014 Baishideng Publishing Group Inc. Все права защищены. Эта статья цитируется в других статьях PMC.Abstract
Helicobacter pylori ( H. pylori ) – основной патоген человека, связанный со значительной заболеваемостью и смертностью. Однако после десятилетий усилий лечение H.pylori остается проблемой для врачей, поскольку не существует универсально эффективной схемы лечения. Из-за растущей распространенности устойчивости к противомикробным препаратам, в основном к кларитромицину, эффективность стандартных тройных терапий снизилась до неприемлемо низких уровней в большинстве регионов мира. Новые схемы, специально опробованные для улучшения терапевтического результата против устойчивых к антибиотикам штаммов H. pylori , теперь рекомендуются в качестве вариантов эмпирического лечения первой линии, обеспечивающих высокую эффективность (по сообщениям,> 90% при анализе намерений лечения) даже при высокой устойчивости к кларитромицину. настройки.К ним относятся четырехкратная висмутовая, сопутствующая, последовательная и гибридная терапия. Из-за быстрого развития резистентности к хинолонам схемы на основе левофлоксацина следует зарезервировать как варианты второй линии / спасения. Было предложено дополнительное использование пробиотиков для повышения скорости эрадикации и уменьшения побочных эффектов, связанных с лечением. В настоящее время доступны методы молекулярного тестирования для характеристики терапевтической восприимчивости H. pylori , включая генотипическое определение устойчивости к макролидам и оценку статуса цитохрома P450 2C19, который, как известно, влияет на метаболизм ингибиторов протонной помпы.В будущем использование этих методов может позволить неинвазивно адаптировать терапию для лечения инфекции H. pylori без культивирования.
Ключевые слова: Helicobacter pylori , устойчивость к антибиотикам, четырехкратный висмут, сопутствующий, последовательный, пробиотики
Основной совет: Увеличение распространенности устойчивости к макролидам во всем мире привело к неэффективности стандартных методов лечения Helicobacter pylori ( H.pylori ) инфекция. Четырехкратная, сопутствующая, последовательная и гибридная терапия висмутом теперь рекомендуются в качестве эмпирических методов лечения первой линии, обеспечивающих повышенную эффективность в условиях высокой резистентности к кларитромицину. Поскольку резистентность к хинолонам быстро растет, левофлоксацин следует предпочтительно использовать в терапии второй линии / терапии неотложной помощи. Появляется все больше доказательств того, что добавление дополнительных пробиотиков улучшает терапевтический результат и переносимость. Генотипическая характеристика восприимчивости H. pylori к терапии может позволить разработать индивидуальный терапевтический подход в будущем.
ВВЕДЕНИЕ
Лечение инфекции Helicobacter pylori ( H. pylori ) имеет первостепенное значение для лечения распространенных желудочно-кишечных заболеваний, включая язвенную болезнь, рак желудка и функциональную диспепсию [1-3]. Более того, внепищеварительные расстройства теперь включены в качестве показаний для искоренения H. pylori : идиопатическая тромбоцитопеническая пурпура, дефицит витамина B12 и необъяснимая железодефицитная анемия [4]. В отличие от других бактериальных инфекций, при лечении которых обычно проводят тесты на чувствительность, культивирование H.pylori широко не доступен и требует проведения эндоскопии, которая не переносится всеми пациентами и имеет ряд ограничений, включая тот факт, что чувствительность in vitro и не всегда гарантирует искоренение in vivo [5]. Таким образом, схемы лечения H. pylori обычно назначались эмпирически при условии, что они были предварительно протестированы и в достаточной степени адаптированы с учетом различных параметров (, т.е. .; лечебная доза, продолжительность, интервалы дозирования и т. Д. .) для оптимизации скорости излечения и минимизации побочных эффектов. Однако оптимальное лечение для уничтожения H. pylori еще предстоит определить, поскольку ни один из режимов не является универсальным. Повышение во всем мире устойчивости к основным антибиотикам, главным образом к кларитромицину (CAM), но также к метронидазолу (MNZ) и левофлоксацину, является основным фактором, определяющим неэффективность лечения инфекции H. pylori [6,7]. В недавнем систематическом обзоре сообщалось, что глобальная заболеваемость устойчивостью к САМ составляет 17.2% в диапазоне от 11,1% в Европе до 29,3% в Америке, тогда как, согласно тому же анализу, континентальные уровни устойчивости к MNZ составили 17% и 44,1% соответственно [8]. Потребление антибиотиков при инфекциях, отличных от H. pylori , является причиной значительного увеличения показателей устойчивости к антибиотикам H. pylori [9,10]. Действительно, различные национальные стратегии использования антибиотиков в значительной степени отражают географическое распределение устойчивости H. pylori : сообщалось, что устойчивость к САМ значительно выше в странах Южной Европы (достигая 49% в некоторых районах Испании) по сравнению с Северной Европой ( e.g ., только 1% в Нидерландах), где политика в отношении использования антибиотиков более строгая [9]. В дополнение к развитию устойчивости к антибиотикам, ряд факторов, связанных как с хозяином, так и с патогеном, может отрицательно влиять на эффективность схем уничтожения H. pylori (таблица) [11,12].
Таблица 1
Факторы, которые, как сообщается, отрицательно влияют на исход лечения инфекции Helicobacter pylori
| Связанные с патогенами | Связанные с хозяином |
| Развитие устойчивости к антибиотикам | Несоблюдение режима лечения |
| Высокая бактериальная нагрузка в желудке | Неязвенная диспепсия |
| Защитный эффект слизистой оболочки желудка | Курение |
| Внутриклеточное расположение многих бактерий | Статус CYP2C19 ( быстрый метаболизатор) |
| CagA отрицательный | |
| Наличие покоящихся коккоидных форм (не чувствительных к антибиотикам) | |
| Гетерорезистентный статус (сосуществование штаммов, чувствительных и устойчивых к одному и тому же антибиотику) |
Несмотря на десятилетия усилий, лечение H.pylori остается сложной проблемой как для исследователей, так и для практикующих врачей. В настоящей статье мы стремимся предоставить всесторонний обзор перспектив эрадикации H. pylori
в прошлом, настоящем и будущем.ТРОЙНАЯ ТЕРАПИЯ НА ОСНОВЕ КЛАРИТРОМИЦИНА: СНИЖЕНИЕ КЛИНИЧЕСКОГО СТАНДАРТА
Исторически первая по-настоящему эффективная терапия инфекции H. pylori
, включающая висмут, тетрациклин и MNZ, была предложена в 1990 году [13].Несколько лет спустя использование CAM в тройной терапии, предложенное Bazzoli et al [14], стало началом тройных схем на основе CAM, которые впоследствии стали золотым стандартом в лечении H. pylori . В исследованиях, проведенных в 90-х годах, стандартные тройные терапии (STT) включали ингибитор протонной помпы (PPI) два раза в день , CAM 500 мг два раза в день и амоксициллин 1000 мг два раза в день или 500 мг MNZ (или 400 мг в Англии) все эти препараты вводились в течение 7–14 дней и обеспечивали стабильно хорошие результаты, дающие> 80% успеха эрадикации и даже> 90% достижимости [15,16].Благодаря этой высокой эффективности и относительной простоте, оптимальному профилю безопасности и приверженности крупных фармацевтических компаний, эти схемы были широко приняты национальными экспертными комиссиями и согласованными рекомендациями во всем мире в качестве стандарта лечения первой линии для эрадикации H. pylori [ 17-20]. Однако рост распространенности устойчивости к САМ привел к значительному снижению эффективности стандартных схем лечения. Это снижение эффективности уже было очевидно в метаанализах, опубликованных в начале 2000-х годов, что привело к значительным изменениям в парадигме лечения инфекции.Они включали в себя введение концепции кумулятивной эффективности лечения (требующей от пациента соблюдения большего количества курсов лечения; таким образом, большее количество побочных эффектов и распространение вторичной устойчивости к антибиотикам), а затем введение местного порогового значения (15-20%) устойчивости к САМ, при которой САМ не следует использовать эмпирически [17,18]. Снижение эффективности стандартных методов лечения против САМ-устойчивых штаммов было хорошо задокументировано на метааналитической основе: в метаанализе Фишбаха и Эванса успех тройной терапии снизился на 66.2% (95% ДИ: 58,2–74,2%), когда штаммы H. pylori были устойчивыми, и восприимчивы к САМ [7]. Соответственно, более свежий анализ Venerito et al [21] показал аналогичные результаты: включая данные о чувствительности к противомикробным препаратам из 4 рандомизированных клинических испытаний (РКИ), стандартные тройные методы лечения успешно уничтожили 88% CAM-чувствительных, но только 14% CAM-устойчивых H. pylori штаммов (разница рисков = 0,75, 95% ДИ: 0,63–0,87). Если используется MNZ, наличие устойчивости к MNZ также может повлиять на терапевтический результат [22], хотя, как правило, это считается менее важным клинически.Это связано с тем, что устойчивость к MNZ можно в значительной степени преодолеть путем увеличения дозы и увеличения продолжительности лечения [23]. Наконец, устойчивость H. pylori к амоксициллину является исключительной и, как правило, не имеет клинического значения. В свете увеличения количества данных, подтверждающих субоптимальную эффективность (<70%) в большинстве европейских стран, недавний консенсусный доклад Маастрихт IV / Флоренции окончательно вытеснил стандартные схемы лечения в качестве эмпирического золотого стандарта для искоренения H. pylori [4].Вместо этого при использовании традиционных тройных схем следует учитывать местный характер резистентности (таким образом, они используются только в тех областях, в которых резистентность к САМ составляет <20%) или полагаться на тестирование на чувствительность при условии наличия культуры перед лечением (, т.е. ., используется в качестве индивидуализированного лечения).ТЕКУЩИЕ ТЕРАПИИ ИНФЕКЦИИ H. PYLORI
Новые схемы, специально опробованные для улучшения терапевтического результата против устойчивых к антибиотикам штаммов H. pylori , теперь рекомендуются в качестве вариантов эмпирического лечения первой линии, обеспечивающих повышенную эффективность (по сообщениям> 90% при анализе намерения лечить) в условиях высокой устойчивости к САМ.Эти схемы сведены в Табл.
Таблица 2
Текущие схемы лечения инфекции Helicobacter pylori
| Лечение | Схема |
| Висмутсодержащая четырехкомпонентная терапия | A PPI (стандартная доза, два раза в день ), висмут (стандартная доза, 4 раза в день, ), тетрациклин (500 мг, 4 раза в день, ) и метронидазол (500 мг, 4 раза в день, ) в течение 10-14 дней |
| Последовательная терапия | A 5-дневная двойная терапия с ИПП (стандартная доза, два раза в день, ) и амоксициллин (1 г, два раза в день, ) с последующей 5-дневной тройной терапией с ИПП (стандартная доза, два раза в день, ), кларитромицином (500 мг, два раза в день, ) и метронидазол (500 мг, два раза в день, ) |
| Сопутствующая терапия | А ИПП (стандартная доза, два раза в день, ), кларитромицин (500 мг, два раза в день, ), амоксициллин (1 г, два раза в день, ) и метрони дазол (500 мг, два раза в день, ) в течение 7-10 дней |
| Гибридная терапия | Семидневная двойная терапия с ИПП (стандартная доза, два раза в день, ) и амоксициллином (1 г, два раза в день, ) с последующим с помощью 7-дневной четырехкратной терапии с ИПП (стандартная доза, два раза в день, ), амоксициллином (1 г, два раза в день, ), кларитромицином (500 мг, два раза в день, ) и метронидазолом (500 мг, два раза в день, ) |
| Тройная терапия на основе левофлоксацина | ИПП (стандартная доза, два раза в день, ), левофлоксацин (500 мг, два раза в день, ) и амоксициллин (1 г, два раза в день, ) в течение 10 дней |
БИСМУТОВАЯ КВАДРАПИЯ
Квадратная терапия висмутом (BQT) в настоящее время представляет собой предпочтительный вариант лечения первой линии для областей с высокой (≥ 20%) частотой резистентности к САМ, но также является ценным вариантом лечения второй линии, когда схема на основе САМ ранее была неэффективной.Он работает независимо от CAM, достигая> 90% эрадикации при наличии устойчивости к CAM, тогда как применение высокой дозы MNZ (1500-1600 мг / сут) и увеличенной (10-14 дней) продолжительности лечения позволяет минимизировать влияние на устойчивость к MNZ. , обеспечивая уровень эрадикации> 85% даже в регионах с высокой устойчивостью к этому препарату [24]. Доступна удобная для пациента монокапсула (содержащая висмут, MNZ и тетрациклин) (Pylera ® , Aptalis, Mont St Hilaire, QC, Канада), обеспечивающая уровень эрадикации от назначенного лечения 86% и 80% в двух крупных РКИ, проведенных в Северной Америке и Европе соответственно [25-27].Напротив, уровень эрадикации ITT с помощью BQT составил только 77,8% в недавнем метаанализе ( против 77% для STT), ставя под сомнение как эффективность, так и превосходство BQT над STT [28]. Однако следует признать значительную степень неоднородности исследований, особенно в отношении дозирования MNZ. Эффективность второй линии BQT также была подтверждена на метааналитической основе (30 исследований), показывающих в среднем 77% эффективность второй линии (ITT) после неэффективности STT [29]. В многоцентровом исследовании, проведенном в Испании, эффективность третьей линии BQT после двух предыдущих неудачных попыток эрадикации с помощью тройной терапии, содержащей САМ и левофлоксацин, составила 65% (ITT).Недоступность солей висмута или тетрациклина в некоторых странах, а также потенциальная токсичность висмута являются основными ограничениями. Однако при включении 4763 пациентов не было выявлено различий в переносимости между группами, не получавшими висмута, и группами, содержащими висмут, за исключением того, что темный стул более распространен в более поздних случаях [31].
ПОСЛЕДОВАТЕЛЬНАЯ ТЕРАПИЯ
В последовательной терапии используются те же антибиотики, что и в STT, но вводимые последовательно. Было высказано предположение, что начальный курс амоксициллина разрушает стенку бактериальной клетки, предотвращая развитие каналов оттока, переносящих САМ из бактерий [32].Хотя в первоначальных РКИ [33] (большинство из них проводилось в Италии) и более ранних метаанализах последовательная терапия явно превосходила STT [эрадикация ITT 91,7% (95% ДИ: 90% -93%) против 76,7% ( 95% ДИ: 75% -79%) для STT] [34], более свежие данные из Южной Америки, Ирана и Южной Кореи показали более низкие уровни эрадикации (<80%) [35-37]. Несмотря на то, что эта последовательная терапия, по-видимому, достаточно эффективна против монорезистентных штаммов CAM, будучи способной уничтожить 72,8% из них, ее эффективность против штаммов с двойной устойчивостью (CAM и MNZ) составила всего 37% (диапазон: 16.От 2% до 60,7%) при оценке 8 исследований с данными о чувствительности к антибиотикам [38]. Критически важно, что последовательная терапия не превосходила ни 14-дневную тройную терапию (RR = 1, 95% ДИ: 0,94–1,06), ни терапию на основе висмута (RR = 0,99, 95% ДИ: 0,94–1,05) в обширной оценка 46 РКИ [38].
НЕВИСМУТОВАЯ КВАДРУПНАЯ (СОПРОВОЖДАЮЩАЯ) ТЕРАПИЯ
Четырехкратная «сопутствующая» терапия без висмута – еще один действенный вариант лечения первой линии для областей с высокой частотой резистентности к САМ [39,40].В 19 исследованиях (2070 пациентов) общий уровень эрадикации при сопутствующей терапии составил 88% (95% ДИ: 85-91%) и 91%, когда были исключены 3 отдаленных исследования с изначально короткой продолжительностью лечения (3-5 дней) [41 ]. Действительно, для успеха сопутствующей терапии необходима продолжительность лечения не менее 7 дней [42], тогда как экстра-пролонгирование лечения до 14 дней в сочетании с высокой дозой ИПП (омепразол 40 мг × 2) может еще больше ускорить выздоровление. частота до> 95%, как показало многоцентровое исследование не меньшей эффективности [43].Повышенная эффективность против штаммов H. pylori с двойной устойчивостью была предложена в качестве основного преимущества сопутствующей терапии по сравнению с последовательной терапией [44], хотя эти две схемы показали одинаковые результаты при сравнении с 338 пациентами в стране с высокой устойчивостью к антибиотикам (Испания). ) [45]. Действительно, при оценке 106 пациентов с помощью теста на предрасположенность к лечению сопутствующая терапия уничтожила только 55% штаммов с двойной устойчивостью против 100% и 91% с устойчивостью к CAM и MNZ соответственно [46].Таким образом, обе схемы, по-видимому, подвержены пагубному влиянию двойной резистентности, выполняя их сравнительно (с эффективностью около 81% каждый) при объединении данных 6 сравнительных РКИ [38].
ГИБРИДНАЯ ТЕРАПИЯ
Двухэтапный комбинированный (гибридный) режим, предложенный Hsu et al [47], является еще одним ценным вариантом лечения, конкурирующим как с последовательным, так и с сопутствующим лечением. При оценке данных 2 РКИ гибридная терапия показала незначительные, хотя и незначительные результаты, по сравнению с последовательной терапией (86.6% ( против 81%) [38], и по сравнению с сопутствующей терапией в сравнительном исследовании, в котором, что интересно, меньше нежелательных явлений произошло в группе, получавшей гибридный режим [43]. Необходимы дополнительные данные, чтобы сделать окончательные выводы об эффективности и переносимости гибридной терапии.
ТЕРАПИИ НА ОСНОВЕ ЛЕВОФЛОКСАЦИНА
Для преодоления возрастающей резистентности к CAM левофлоксацин, хинолон широкого спектра действия, использовался в качестве замены CAM в тройных или последовательных схемах лечения, достигая скорости излечения> 90%, и даже> 95% возможно при условии что местная резистентность к левофлоксацину низкая (<10%) [48,49].Однако левофлоксацин также сталкивается с клинически значимыми проблемами устойчивости к антибиотикам, поскольку устойчивость к хинолонам в настоящее время превышает 40% в Америке, 20% в Европе и 10% в Азии [8]. Из-за быстрого развития вторичной резистентности к хинолонам применение левофлоксацина в качестве первого ряда обычно не рекомендуется, а препарат резервируется для использования в схемах второго ряда / экстренной помощи после неудачи схемы на основе CAM и / или MNZ [50 ]. Хорошая (частота излечения 81–87%) эффективность тройной терапии левофлоксацином (ЛТТ) второй линии была подтверждена в двух метаанализах, опубликованных в 2006 г., оба показали лучшие результаты с ЛТТ по сравнению с БКВ второй линии [51 , 52].Соответственно, эффективность ЛТТ второй линии составила 88,7% в более позднем метаанализе, включая РКИ до октября 2010 г. [53]. Важно отметить, что использование LTT после неэффективности последовательного или сопутствующего режима, как сообщается, обеспечивает до 97,8% совокупной терапевтической эффективности [54]. Использование других хинолоновых агентов, таких как моксифлоксацин и ситафлоксацин, показало многообещающие результаты [55,56], хотя нет никаких доказательств, подтверждающих какое-либо терапевтическое преимущество перед левофлоксацином.
ПЕРСПЕКТИВЫ НА БУДУЩЕЕ
Дополнительные пробиотики
Несмотря на то, что были предприняты различные попытки восстановить эффективность стандартных методов лечения, таких как увеличение дозы ИПП или продление продолжительности лечения, ни один не был доказан на уровне, позволяющем преодолеть сегодняшнюю устойчивость к противомикробным препаратам.Подход, который вызывает растущий интерес, заключается в использовании пробиотиков в сочетании со схемами уничтожения H. pylori [57]. Ожидаемая польза двоякая: усиление эрадикации и улучшение переносимости за счет предотвращения возникновения побочных эффектов, связанных с лечением. Патогенетическая основа возможного благоприятного действия пробиотиков на эрадикацию H. pylori еще предстоит выяснить, хотя были выдвинуты некоторые гипотезы, включая прочность слизистого барьера, конкуренцию за адгезию и иммуномодулирующие механизмы [58].В последние годы в различных исследованиях пробиотики использовались в дополнение к стандартным или новым схемам лечения, что дало противоречивые результаты [59–62]. Несмотря на то, что были оценены различные одно- или мультиштаммовые соединения, в настоящее время имеются доказательства в поддержку использования Saccharomyces boulardi (OR = 1,13; 95% ДИ: 1,05–1,21) или Lactobacillus spp . (OR = 1,78; 95% ДИ: 1,2–2,6) добавление добавок к стандартной тройной терапии [63,64]. В самом последнем анализе, оценивающем влияние добавок, содержащих Lactobacillus и Bifidobacterium, объединенное отношение шансов (ITT) с добавлением пробиотиков составило 2.066 (95% ДИ: 1,398–3,055) для эрадикации и 0,305 (95% ДИ: 0,117–0,793) для частоты полных побочных эффектов [65]. Интересно, что с точки зрения предотвращения побочных эффектов использование пробиотиков может быть актуальным только для некоторой части пациентов, особенно у пациентов с рецидивирующей инфекцией или в анамнезе с желудочно-кишечными побочными эффектами, связанными с антибиотиками [57]. Ожидаются дополнительные данные, чтобы прояснить роль, стандартизировать схемы лечения и оценить экономическую эффективность пробиотиков в лечении H.pylori инфекция.
Бескультуральное, неинвазивное определение чувствительности к антибиотикам H. pylori
Критически важно, что даже новые методы лечения, описанные выше, в некоторой степени (хотя и в меньшей по сравнению с традиционными методами лечения) подвержены влиянию устойчивости к антибиотикам; уровни эрадикации> 95% встречаются нечасто, и даже> 90% оспариваются в некоторых исследованиях [35,66,67]. Кроме того, возможно, что в будущем эффективность эмпирических методов лечения будет еще больше снижаться, поскольку во всем мире постоянно растет устойчивость к основным антибиотикам.Для поддержания высокой терапевтической эффективности оптимальным подходом представляется индивидуализированное лечение H. pylori при поражении f , основанное на предварительном тестировании чувствительности. Это предотвратит повторное лечение пациента эмпирическим лечением, которое увеличивает риск побочных эффектов и способствует развитию вторичной резистентности. Однако, как уже упоминалось, современные средства выполнения эндоскопии и посева H. pylori являются инвазивными, не отражают на 100% чувствительность in vivo и требуют много времени, поскольку для посева требуется 3-10 дней и тестирование чувствительности ( e.g ., Etest, AB bioMerieux, Solna, Sweden) потребуется дополнительно 3-4 дня. Эти ограничения препятствуют систематическому использованию культуры H. pylori , которая в настоящее время рекомендуется только для случаев, по крайней мере, с двумя эмпирическими неудачами лечения. Общеклассовая устойчивость к макролидам является результатом точечных мутаций в трех соседних нуклеотидных положениях ( A2143G, A2142G и A2142C ) в петле пептидилтрансферазы гена 23SrRNA [68,69]. Эти три точечные мутации составляют 90% случаев первичной устойчивости к САМ в западных странах.В последние годы были разработаны методы молекулярного тестирования этих мутаций, включая стандартную полимеразную цепную реакцию (ПЦР) и другие методы на основе ПЦР, включая полиморфизм длины рестрикционных фрагментов ПЦР, иммуноферментный анализ ПЦР-ДНК, анализ лигирования олигонуклеотидов ПЦР и линию ПЦР. зондовый анализ, а также анализ ПЦР в реальном времени, который представляет собой мощный шаг вперед по сравнению с базовой ПЦР [70–72]. Эти методы могут предложить быстрые и высокоточные результаты при генотипическом обнаружении устойчивости к САМ, включая определение статуса гетерорезистентности ( i.e ., сосуществование штаммов, чувствительных и устойчивых к одному и тому же антибиотику), как известно, является причиной значительного числа неудач лечения [73,74]. Эти методы могут применяться непосредственно к образцам биопсии желудка или использоваться в сочетании с малоинвазивными методами (, например, ., Чистка ротовой полости или промывание желудка) или неинвазивно с использованием образцов кала [75–77]. Важно отметить, что генотипическое определение устойчивости к САМ также возможно с помощью флуоресцентной гибридизации in-situ, которая также может применяться к образцам, залитым парафином [78,79].Также возможно определение устойчивости к левофлоксацину на основе обнаружения мутации gyrA [80]. Два азиатских исследования предоставили данные о потенциальной полезности индивидуализированного терапевтического подхода, основанного на молекулярном обнаружении устойчивости H. pylori к САМ. Специально подобранное лечение с использованием простого режима ИПП / МНЗ успешно ликвидировало патоген у 94,3% () против (71,4%) при использовании стандартного эмпирического лечения [77]. В более крупном исследовании (218 пациентов) CAM заменяли MNZ в тройном режиме, если был обнаружен устойчивый к CAM штамм.Показатели эрадикации составили 91,2% в специально подобранной группе против 79,1% и 75,9% при использовании эмпирических тройных терапий на основе MNZ и CAM ( n = 308 в каждой контрольной группе) соответственно ( P <0,001) [81] .
Фармакогеномика
Известно, что генетическая изменчивость активности цитохрома P450 (CYP) 2C19 (CYP2C19) влияет на уровни ИПП в плазме и, таким образом, на лечение инфекции H. pylori [82,83]. Различают три различных генотипа: быстрый, средний и слабый метаболизаторы.Предварительные данные о потенциальном использовании фармакогеномики были предоставлены в РКИ с 300 H. pylori -позитивными пациентами, рандомизированными либо на стандартную схему лечения в течение 1 недели, либо на индивидуальную терапию на основе статуса восприимчивости к CYP2C19 и CAM, оцененного с помощью генетического тестирования [84 ]. Показатели искоренения ITT были значительно выше в специально подобранной группе (96% против 70%) без увеличения окончательных затрат на одного пациента для успешной ликвидации. В будущем должны быть решены как практические, так и логистические вопросы, прежде чем молекулярный подход может быть широко принят в качестве подлинной основы для индивидуализации H.pylori эрадикационная терапия.
ЗАКЛЮЧЕНИЕ
На протяжении более десяти лет тройные схемы были стандартом лечения инфекции H. pylori . Однако в последние годы рост распространенности резистентности к макролидам привел к значительному снижению эффективности этих схем, что привело к необходимости проведения дополнительных курсов лечения для искоренения патогена. Чтобы поддерживать высокую терапевтическую эффективность, схемы с улучшенной эффективностью против антибиотикоустойчивых H.pylori в настоящее время рекомендуются в качестве предпочтительных препаратов первой линии. Сопутствующие и последовательные схемы в настоящее время являются наиболее подтвержденными терапевтическими вариантами первой линии. Гибридная терапия – еще одна эффективная альтернатива на основе КАМ и соответствующий конкурент обоим этим методам лечения. BQT также является действенным средством лечения при высокой резистентности к САМ, но также является эффективным режимом второго ряда, когда схема, основанная на САМ, не дает результатов. Из-за быстрого развития резистентности к хинолонам схемы на основе левофлоксацина в настоящее время следует зарезервировать как варианты лечения второй или более линий.В то время как усилия по совершенствованию эмпирических методов лечения продолжаются, области генотипического выявления чувствительности к противомикробным препаратам H. pylori и фармакогеномики открывают новые захватывающие перспективы. Это гарантирует 100% терапевтическую эффективность: быстро, без посева и неинвазивно.
Сноски
P- Рецензент: Ding SZ, Im SH, Velin D, Zhu YL S- Редактор: Wen LL L- Редактор: A E- Editor: Wang CH
Ссылки
1. Moayyedi P, Hunt RH. Значение Helicobacter pylori для общественного здравоохранения.Helicobacter. 2004; 9 Дополнение 1: 67–72. [PubMed] [Google Scholar] 2. Мальфертхайнер П., Чан Ф. К., Макколл К. Э. Язвенная болезнь. Ланцет. 2009; 374: 1449–1461. [PubMed] [Google Scholar] 3. Kuipers EJ. Helicobacter pylori, риск и лечение сопутствующих заболеваний: гастрита, язвенной болезни, атрофического гастрита и рака желудка. Алимент Pharmacol Ther. 1997; 11 Дополнение 1: 71–88. [PubMed] [Google Scholar] 4. Мальфертхайнер П., Мегроуд Ф., О’Морайн К.А., Атертон Дж., Аксон А.Т., Баццоли Ф., Дженсини Г.Ф., Гисберт Дж. П., Грэм Д. Ю., Роккас Т. и др.Управление инфекцией Helicobacter pylori – Маастрихтский отчет IV / Флорентийский консенсусный доклад. Кишечник. 2012. 61: 646–664. [PubMed] [Google Scholar] 5. Gisbert JP. Необходим ли посев перед лечением первой линии инфекции Helicobacter pylori? Intern Med. 2011; 50: 2717; ответ автора 2719–2720. [PubMed] [Google Scholar] 7. Fischbach L, Evans EL. Мета-анализ: влияние статуса устойчивости к антибиотикам на эффективность тройной и четверной терапии первой линии для Helicobacter pylori. Алимент Pharmacol Ther.2007. 26: 343–357. [PubMed] [Google Scholar] 8. Де Франческо В., Джорджио Ф., Хассан С., Манес Дж., Ваннелла Л., Панелла С., Иерарди Е., Зулло А. Всемирная устойчивость к антибиотикам H. pylori: систематический обзор. J Gastrointestin Liver Dis. 2010; 19: 409–414. [PubMed] [Google Scholar] 9. Megraud F, Coenen S, Versporten A, Kist M, Lopez-Brea M, Hirschl AM, Andersen LP, Goossens H, Glupczynski Y. Устойчивость Helicobacter pylori к антибиотикам в Европе и ее связь с потреблением антибиотиков. Кишечник. 2013; 62: 34–42.[PubMed] [Google Scholar] 10. Боянова Л., Илиева Дж., Гергова Г., Давидков Л., Спасова З., Камбуров В., Кацаров Н., Митов И. Многочисленные факторы риска устойчивости к антибиотикам Helicobacter pylori, выявленные в расширенном анамнезе: болгарское исследование. J Med Microbiol. 2012; 61: 85–93. [PubMed] [Google Scholar] 11. Георгопулос С.Д., Ладас С.Д., Каратапанис С., Ментис А., Спилиади С., Артикис В., Раптис С.А. Факторы, которые могут повлиять на исход лечения тройной эрадикационной терапии Helicobacter pylori омепразолом, амоксициллином и кларитромицином.Dig Dis Sci. 2000. 45: 63–67. [PubMed] [Google Scholar] 12. Ян JC, Лин CJ. Генотипы CYP2C19 в фармакокинетике / фармакодинамике терапии инфекции Helicobacter pylori на основе ингибиторов протонной помпы. Мнение эксперта Drug Metab Toxicol. 2010; 6: 29–41. [PubMed] [Google Scholar] 13. Джордж Л.Л., Бороди Т.Дж., Эндрюс П., Дивайн М., Мур-Джонс Д., Уолтон М., Брандл С. Лечение язвы двенадцатиперстной кишки после искоренения Helicobacter pylori. Med J Aust. 1990; 153: 145–149. [PubMed] [Google Scholar] 14. Баццоли Ф., Поццато П.Терапия инфекции H. pylori. J. Physiol Pharmacol. 1997; 48 Дополнение 4: 39–46. [PubMed] [Google Scholar] 15. Современные европейские концепции лечения инфекции Helicobacter pylori. Маастрихтский консенсусный доклад. Европейская группа по изучению Helicobacter Pylori. Кишечник. 1997; 41: 8–13. [Бесплатная статья PMC] [PubMed] [Google Scholar] 16. Линд Т., Вельдхуйзен ван Зантен С., Унге П., Спиллер Р., Байердорфер Э., О’Морайн С., Бардхан К.Д., Брадетт М., Чиба Н., Врангстад М. и др. Ликвидация Helicobacter pylori с использованием однонедельной тройной терапии, сочетающей омепразол с двумя противомикробными препаратами: исследование MACH I.Helicobacter. 1996; 1: 138–144. [PubMed] [Google Scholar] 17. Мальфертхайнер П., Мегро Ф., О’Морайн С., Хангин А.П., Джонс Р., Аксон А., Грэм Д.Ю., Титгат Г. Современные концепции управления инфекцией Helicobacter pylori – Консенсусный доклад Маастрихта 2-2000. Алимент Pharmacol Ther. 2002; 16: 167–180. [PubMed] [Google Scholar] 18. Мальфертхайнер П., Мегроуд Ф., О’Морайн С., Баццоли Ф., Эль-Омар Э., Грэм Д., Хант Р., Роккас Т., Вакил Н., Кейперс Э. Современные концепции лечения инфекции Helicobacter pylori: Маастрихтский консенсусный отчет III.Кишечник. 2007; 56: 772–781. [Бесплатная статья PMC] [PubMed] [Google Scholar] 19. Чей В.Д., Вонг BC. Руководство Американского колледжа гастроэнтерологии по лечению инфекции Helicobacter pylori. Am J Gastroenterol. 2007; 102: 1808–1825. [PubMed] [Google Scholar] 20. Фок К.М., Кателарис П., Сугано К., Энг Т.Л., Хант Р., Талли, штат Нью-Джерси, Лам С.К., Сяо С.Д., Тан Х.Дж., Ву С.Й. и др. Второе Азиатско-Тихоокеанское согласованное руководство по инфекции Helicobacter pylori. J Gastroenterol Hepatol. 2009; 24: 1587–1600. [PubMed] [Google Scholar] 21.Venerito M, Krieger T., Ecker T., Leandro G, Malfertheiner P. Мета-анализ четырехкратной терапии висмутом по сравнению с тройной терапией кларитромицином для эмпирического первичного лечения инфекции Helicobacter pylori. Пищеварение. 2013; 88: 33–45. [PubMed] [Google Scholar] 22. Хубен М. Х., ван де Бик Д., Хенсен Э. Ф., де Крен А. Дж., Раус Э. А., Титгат Г. Н.. Систематический обзор эрадикационной терапии Helicobacter pylori – влияние устойчивости к противомикробным препаратам на уровень эрадикации. Алимент Pharmacol Ther. 1999; 13: 1047–1055. [PubMed] [Google Scholar] 23.Грэм Д. Ю., Куреши В. А.. Инфекция H. pylori, резистентная к антибиотикам, и ее лечение. Curr Pharm Des. 2000; 6: 1537–1544. [PubMed] [Google Scholar] 24. Фишбах Л.А., ван Зантен С., Дикасон Дж. Мета-анализ: эффективность, побочные эффекты и приверженность, связанные с четырехкомпонентной терапией против Helicobacter pylori первой линии. Алимент Pharmacol Ther. 2004. 20: 1071–1082. [PubMed] [Google Scholar] 25. де Бур WA, ван Эттен RJ, Schneeberger PM, Tytgat GN. Одно лекарство от инфекции Helicobacter pylori: первые результаты с новой тройной монокапсулой висмута.Am J Gastroenterol. 2000; 95: 641–645. [PubMed] [Google Scholar] 26. Laine L, Hunt R, El-Zimaity H, Nguyen B, Osato M, Spénard J. Четырехкратная терапия на основе висмута с использованием одной капсулы бисскальцитрата висмута, метронидазола и тетрациклина с омепразолом по сравнению с омепразолом, амоксициллином и кларитромицином для эрадикации Helicobacter pylori у пациентов с язвой двенадцатиперстной кишки: проспективное рандомизированное многоцентровое исследование в Северной Америке. Am J Gastroenterol. 2003. 98: 562–567. [PubMed] [Google Scholar] 27.Malfertheiner P, Bazzoli F, Delchier JC, Celiñski K, Giguère M, Rivière M, Mégraud F. Эрадикация Helicobacter pylori с помощью капсулы, содержащей субцитрат висмута калия, метронидазол и тетрациклин, назначенные с омепразолом по сравнению с открытой терапией на основе омепразола и открытой терапии на основе трипразола. -метка, не неполноценность, испытание фазы 3. Ланцет. 2011; 377: 905–913. [PubMed] [Google Scholar] 28. Лютер Дж., Хиггинс П.Д., Шенфельд П.С., Моайеди П., Вакил Н., Чей В.Д. Эмпирическая четырехкратная и тройная терапия для первичного лечения инфекции Helicobacter pylori: систематический обзор и метаанализ эффективности и переносимости.Am J Gastroenterol. 2010; 105: 65–73. [PubMed] [Google Scholar] 30. Гисберт Дж. П., Перес-Айса А., Родриго Л., Молина-Инфанте Дж., Модолелл I, Бермехо Ф., Кастро-Фернандес М., Антон Р., Сакристан Б., Косме А. и др. Спасательная терапия третьей линии с использованием висмутсодержащего четырехкратного режима после неэффективности двух курсов лечения (кларитромицином и левофлоксацином) инфекции H. pylori. Dig Dis Sci. 2014; 59: 383–389. [PubMed] [Google Scholar] 31. Ford AC, Malfertheiner P, Giguere M, Santana J, Khan M, Moayyedi P. Неблагоприятные события с солями висмута для ликвидации Helicobacter pylori: систематический обзор и метаанализ.Мир Дж. Гастроэнтерол. 2008; 14: 7361–7370. [Бесплатная статья PMC] [PubMed] [Google Scholar] 32. Уэббер М.А., Пиддок Л.Дж. Важность оттокных насосов в устойчивости бактерий к антибиотикам. J Antimicrob Chemother. 2003; 51: 9–11. [PubMed] [Google Scholar] 33. Зулло А., Вайра Д., Вакил Н., Хассан С., Гатта Л., Риччи С., Де Франческо В., Менегатти М., Тампьери А., Перна Ф. и др. Высокие показатели эрадикации Helicobacter pylori при новом последовательном лечении. Алимент Pharmacol Ther. 2003. 17: 719–726. [PubMed] [Google Scholar] 34.Gisbert JP, Calvet X, O’Connor A, Mégraud F, O’Morain CA. Последовательная терапия для эрадикации Helicobacter pylori: критический обзор. J Clin Gastroenterol. 2010. 44: 313–325. [PubMed] [Google Scholar] 35. Гринберг Е.Р., Андерсон Г.Л., Морган Д.Р., Торрес Дж., Чей В.Д., Браво Л.Е., Домингес Р.Л., Ферреччио С., Эрреро Р., Ласкано-Понсе ЕС и др. 14-дневная тройная, 5-дневная сопутствующая и 10-дневная последовательная терапия инфекции Helicobacter pylori в семи странах Латинской Америки: рандомизированное исследование. Ланцет. 2011; 378: 507–514.[Бесплатная статья PMC] [PubMed] [Google Scholar] 36. Lim JH, Lee DH, Choi C, Lee ST, Kim N, Jeong SH, Kim JW, Hwang JH, Park YS, Lee SH и др. Клинические результаты двухнедельной последовательной и сопутствующей терапии для эрадикации Helicobacter pylori: рандомизированное пилотное исследование. Helicobacter. 2013. 18: 180–186. [PubMed] [Google Scholar] 37. Сардарян Х., Факери Х., Хоссейни В., Тагваеи Т., Малеки И., Мохтаре М. Сравнение гибридной и последовательной терапии для ликвидации Helicobacter pylori в Иране: проспективное рандомизированное исследование.Helicobacter. 2013. 18: 129–134. [PubMed] [Google Scholar] 38. Гатта Л., Вакил Н., Вайра Д., Скарпигнато С. Глобальные показатели эрадикации инфекции Helicobacter pylori: систематический обзор и метаанализ последовательной терапии. BMJ. 2013; 347: f4587. [Бесплатная статья PMC] [PubMed] [Google Scholar] 39. Georgopoulos S, Papastergiou V, Xirouchakis E, Laoudi F, Lisgos P, Spiliadi C, Papantoniou N, Karatapanis S. Четырехкратная «сопутствующая» терапия без висмута по сравнению со стандартной тройной терапией продолжительностью 10 дней для первой линии H.pylori: рандомизированное исследование. J Clin Gastroenterol. 2013; 47: 228–232. [PubMed] [Google Scholar] 40. Georgopoulos S, Papastergiou V, Xirouchakis E, Laudi F, Papantoniou N, Lisgos P, Spiliadi C, Fragou P, Skorda L., Karatapanis S. Оценка «сопутствующей» терапии с четырьмя препаратами, тремя антибиотиками и невисмутом в качестве первой режим эрадикации Helicobacter pylori в Греции. Helicobacter. 2012; 17: 49–53. [PubMed] [Google Scholar] 41. Gisbert JP, Calvet X. Обновленная информация о четверной (сопутствующей) терапии без висмута для искоренения Helicobacter pylori.Clin Exp Gastroenterol. 2012; 5: 23–34. [Бесплатная статья PMC] [PubMed] [Google Scholar] 42. Essa AS, Kramer JR, Graham DY, Treiber G. Мета-анализ: «сопутствующая терапия» с четырьмя лекарствами, тремя антибиотиками, без висмута по сравнению с тройной терапией для эрадикации Helicobacter pylori. Helicobacter. 2009. 14: 109–118. [Бесплатная статья PMC] [PubMed] [Google Scholar] 43. Молина-Инфанте Дж., Романо М., Фернандес-Бермехо М., Федерико А., Гравина А.Г., Поццати Л., Гарсия-Абадиа Е., Винагре-Родригес Г., Мартинес-Алькала С., Эрнандес-Алонсо М. и др.Оптимизированная четырехкомпонентная терапия без висмута излечивает большинство пациентов с инфекцией Helicobacter pylori в популяциях с высокими показателями устойчивости к антибиотикам. Гастроэнтерология. 2013; 145: 121–128.e1. [PubMed] [Google Scholar] 44. Wu DC, Hsu PI, Wu JY, Opekun AR, Kuo CH, Wu IC, Wang SS, Chen A, Hung WC, Graham DY. Последовательная и сопутствующая терапия четырьмя препаратами одинаково эффективна для искоренения инфекции H.pylori. Clin Gastroenterol Hepatol. 2010; 8: 36–41.e1. [Бесплатная статья PMC] [PubMed] [Google Scholar] 45.McNicholl AG, Marin AC, Molina-Infante J, Castro M, Barrio J, Ducons J, Calvet X, de la Coba C, Montoro M, Bory F и др. Рандомизированное клиническое испытание, сравнивающее последовательную и сопутствующую терапию эрадикации Helicobacter pylori в рутинной клинической практике. Кишечник. 2014; 63: 244–249. [PubMed] [Google Scholar] 46. Георгопулос SD, Xirouchakis E, Martinez-Gonzalez B, Sgouras DN, Spiliadi C, Mentis AF, Laoudi F. Клиническая оценка десятидневного режима с эзомепразолом, метронидазолом, амоксициллином и кларитромицином для эрадикации Helicromycinum с высоким содержанием кларитромицина из хеликобактера пилы. область сопротивления.Helicobacter. 2013; 18: 459–467. [PubMed] [Google Scholar] 47. Сюй П.И., Ву, округ Колумбия, Ву Дж.Й., Грэм Д.Ю. Модифицированная последовательная терапия Helicobacter pylori: ингибитор протонной помпы и амоксициллин в течение 14 дней с добавлением кларитромицина и метронидазола в качестве четверной (гибридной) терапии в течение последних 7 дней. Helicobacter. 2011; 16: 139–145. [Бесплатная статья PMC] [PubMed] [Google Scholar] 48. Романо М., Куомо А., Гравина А.Г., Миранда А., Айовен М.Р., Тисо А., Сика М., Рокко А., Салерно Р., Мармо Р. и др. Сравнение эмпирической терапии, содержащей левофлоксацин, и содержащей кларитромицин, для эрадикации Helicobacter pylori: рандомизированное исследование.Кишечник. 2010; 59: 1465–1470. [PubMed] [Google Scholar] 49. Бернинг М., Краш С., Мильке С. Должны ли хинолоны занимать первое место в терапии Helicobacter pylori? Therap Adv Гастроэнтерол. 2011; 4: 103–114. [Бесплатная статья PMC] [PubMed] [Google Scholar] 50. Каротерс Дж. Дж., Брюс М. Г., Хеннесси Т. В., Бенслер М., Моррис Дж. М., Reasonover А. Л., Херлбурт Д. А., Паркинсон А. Дж., Коулман Дж. М., МакМахон Б. Дж.. Взаимосвязь между предыдущим применением фторхинолонов и устойчивостью к левофлоксацину при инфекции Helicobacter pylori. Clin Infect Dis. 2007; 44: e5 – e8.[PubMed] [Google Scholar] 51. Гисберт Дж. П., Морена Ф. Систематический обзор и метаанализ: схемы спасения на основе левофлоксацина после неэффективности лечения Helicobacter pylori. Алимент Pharmacol Ther. 2006; 23: 35–44. [PubMed] [Google Scholar] 52. Саад Р.Дж., Шенфельд П., Ким Х.М., Чей В.Д. Тройная терапия на основе левофлоксацина в сравнении с четырехкратной терапией на основе висмута при персистирующей инфекции Helicobacter pylori: метаанализ. Am J Gastroenterol. 2006; 101: 488–496. [PubMed] [Google Scholar] 53. Ди Каро С., Фини Л., Дауд И., Гриззи Ф., Гасбаррини А., Де Лоренцо А., Ди Ренцо Л., Маккартни С., Блум С.Схемы на основе левофлоксацина / амоксициллина в сравнении с четырехкратной терапией для эрадикации Helicobacter pylori у препаратов второй линии. Мир Дж. Гастроэнтерол. 2012; 18: 5669–5678. [Бесплатная статья PMC] [PubMed] [Google Scholar] 54. Gisbert JP, Molina-Infante J, Marin AC, Vinagre G, Barrio J, McNicholl AG. Тройная спасательная терапия второй линии с левофлоксацином после неэффективности четырехкратного «последовательного» или «сопутствующего» лечения без висмута для искоренения инфекции H. pylori. Сканд Дж Гастроэнтерол. 2013. 48: 652–656. [PubMed] [Google Scholar] 55.Мураками К., Окимото Т., Кодама М., Танахаши Дж., Фудзиока Т., Икеда Ф., Мураока Х., Такигава М., Сайка Т., Хасегава М. и др. Активность ситафлоксацина в отношении изолятов Helicobacter pylori, в том числе с мутациями gyrA. Антимикробные агенты Chemother. 2009; 53: 3097–3099. [Бесплатная статья PMC] [PubMed] [Google Scholar] 56. Wenzhen Y, Kehu Y, Bin M, Yumin L, Quanlin G, Donghai W, Lijuan Y. Тройная терапия на основе моксифлоксацина по сравнению с тройной терапией на основе кларитромицина для лечения первой линии инфекции Helicobacter pylori: метаанализ рандомизированных контролируемых исследований .Intern Med. 2009. 48: 2069–2076. [PubMed] [Google Scholar] 57. Вильгельм С.М., Джонсон Дж. Л., Кале-Прадхан ПБ. Лечение клопов с помощью клопов: роль пробиотиков в качестве дополнительной терапии Helicobacter pylori. Энн Фармакотер. 2011; 45: 960–966. [PubMed] [Google Scholar] 58. Лесброс-Пантофликова Д, Кортези-Теулаз I, Блюм АЛ. Helicobacter pylori и пробиотики. J Nutr. 2007; 137: 812С – 818С. [PubMed] [Google Scholar] 59. Du YQ, Su T, Fan JG, Lu YX, Zheng P, Li XH, Guo CY, Xu P, Gong YF, Li ZS. Адъювантные пробиотики улучшают эрадикационный эффект тройной терапии инфекции Helicobacter pylori.Мир Дж. Гастроэнтерол. 2012. 18: 6302–6307. [Бесплатная статья PMC] [PubMed] [Google Scholar] 60. Efrati C, Nicolini G, Cannaviello C, O’Sed NP, Valabrega S. Эрадикация Helicobacter pylori: последовательная терапия и добавление Lactobacillus reuteri. Мир Дж. Гастроэнтерол. 2012. 18: 6250–6254. [Бесплатная статья PMC] [PubMed] [Google Scholar] 61. Манфреди М., Биззарри Б., Саккеро Р.И., Маккари С., Калабрезе Л., Фаббиан Ф, Де’Анджелис Г.Л. Инфекция Helicobacter pylori в клинической практике: пробиотики и комбинация пробиотиков + лактоферрин улучшают соблюдение режима последовательной терапии, но не искоренение.Helicobacter. 2012; 17: 254–263. [PubMed] [Google Scholar] 62. Shavakhi A, Tabesh E, Yaghoutkar A, Hashemi H, Tabesh F, Khodadoostan M, Minakari M, Shavakhi S., Gholamrezaei A. Влияние многопозиционного пробиотического соединения на висмутсодержащую четырехкомпонентную терапию для инфекции Helicobacter pylori: рандомизированный тройной плацебо-контролируемый -слепое исследование. Helicobacter. 2013. 18: 280–284. [PubMed] [Google Scholar] 63. Szajewska H, Horvath A, Piwowarczyk A. Мета-анализ: влияние добавок Saccharomyces boulardii на скорость эрадикации Helicobacter pylori и побочные эффекты во время лечения.Алимент Pharmacol Ther. 2010. 32: 1069–1079. [PubMed] [Google Scholar] 64. Zou J, Dong J, Yu X. Мета-анализ: Lactobacillus, содержащий четверную терапию по сравнению со стандартной тройной терапией первой линии для эрадикации Helicobacter pylori. Helicobacter. 2009. 14: 97–107. [PubMed] [Google Scholar] 65. Ван Чж, Гао Цюй, Фан Цзюй. Мета-анализ эффективности и безопасности препаратов пробиотических соединений, содержащих лактобактерии и бифидобактерии, в эрадикационной терапии Helicobacter pylori. J Clin Gastroenterol.2013; 47: 25–32. [PubMed] [Google Scholar] 66. Лиу Дж.М., Чен С.К., Чен М.Дж., Чен С.К., Чанг Си.Й., Фанг Й.Дж., Ли Дж.Й., Хсу С.Дж., Ло Дж.К., Чанг У.Х. и др. Последовательная и тройная терапия для лечения первой линии Helicobacter pylori: многоцентровое открытое рандомизированное исследование. Ланцет. 2013; 381: 205–213. [PubMed] [Google Scholar] 67. Вакил Н., Вайра Д. Лечение инфекции H. pylori: новые проблемы с устойчивостью к противомикробным препаратам. J Clin Gastroenterol. 2013; 47: 383–388. [PubMed] [Google Scholar] 68. Тейлор Д.Е., Ге З., Пурыч Д., Ло Т, Хирацука К.Клонирование и анализ последовательности двух копий гена 23S рРНК из Helicobacter pylori и ассоциация устойчивости к кларитромицину с мутациями 23S рРНК. Антимикробные агенты Chemother. 1997; 41: 2621–2628. [Бесплатная статья PMC] [PubMed] [Google Scholar] 69. Версалович Дж., Шортридж Д., Киблер К., Гриффи М. В., Бейер Дж., Фламм Р.К., Танака С.К., Грэм Д.Ю., Go MF. Мутации в 23S рРНК связаны с устойчивостью Helicobacter pylori к кларитромицину. Антимикробные агенты Chemother. 1996. 40: 477–480. [Бесплатная статья PMC] [PubMed] [Google Scholar] 70.Lehours P, Siffré E, Mégraud F. Мультиплексная ПЦР DPO в качестве альтернативы тестированию на культуру и чувствительность для выявления Helicobacter pylori и его устойчивости к кларитромицину. BMC Gastroenterol. 2011; 11: 112. [Бесплатная статья PMC] [PubMed] [Google Scholar] 71. Mégraud F, Lehours P. Обнаружение Helicobacter pylori и тестирование на чувствительность к противомикробным препаратам. Clin Microbiol Rev.2007; 20: 280–322. [Бесплатная статья PMC] [PubMed] [Google Scholar] 72. Schabereiter-Gurtner C, Hirschl AM, Dragosics B, Hufnagl P, Puz S, Kovách Z, Rotter M, Makristathis A.Новый анализ ПЦР в реальном времени для выявления инфекции Helicobacter pylori и одновременное определение чувствительности к кларитромицину в образцах стула и биопсии. J Clin Microbiol. 2004. 42: 4512–4518. [Бесплатная статья PMC] [PubMed] [Google Scholar] 73. De Francesco V, Zullo A, Ierardi E, Giorgio F, Perna F, Hassan C, Morini S, Panella C, Vaira D. Фенотипическая и генотипическая устойчивость к кларитромицину Helicobacter pylori и терапевтический результат: преимущества и ограничения. J Antimicrob Chemother. 2010. 65: 327–332. [PubMed] [Google Scholar] 74.Rimbara E, Fischbach LA, Graham DY. Оптимальная терапия инфекций Helicobacter pylori. Нат Рев Гастроэнтерол Гепатол. 2011; 8: 79–88. [PubMed] [Google Scholar] 75. Баба С., Оиси Й., Ватанабе Й., Оикава Р., Морита Р., Йошида Ю., Хираиси Т., Маэхата Т., Нагасе И., Фукуда Ю. и др. Молекулярный тест на устойчивость к антибиотикам у Helicobacter pylori на основе промывки желудка. Пищеварение. 2011; 84: 299–305. [PubMed] [Google Scholar] 76. Грэм Д.Ю., Кудо М., Редди Р., Опекун А.Р. Практичный быстрый, малоинвазивный, надежный неэндоскопический метод получения Helicobacter pylori для посева.Helicobacter. 2005; 10: 1–3. [PubMed] [Google Scholar] 77. Кавай Т., Ямагиши Т., Яги К., Катаока М., Каваками К., Софуни А., Итои Т., Сакаи Ю., Мориясу Ф., Осака Ю. и др. Индивидуальная эрадикационная терапия, основанная на чувствительности фекалий к кларитромицину Helicobacter pylori. J Gastroenterol Hepatol. 2008; 23 Приложение 2: S171 – S174. [PubMed] [Google Scholar] 78. Моррис JM, Reasonover AL, Брюс MG, Bruden DL, McMahon BJ, Sacco FD, Berg DE, Parkinson AJ. Оценка seaFAST, быстрого флуоресцентного теста гибридизации in situ, для обнаружения Helicobacter pylori и устойчивости к кларитромицину в парафиновых биопсийных срезах.J Clin Microbiol. 2005; 43: 3494–3496. [Бесплатная статья PMC] [PubMed] [Google Scholar] 79. Йилмаз О., Демирай Э., Тюмер С., Алтунгёз О., Йорукоглу К., Сойтюрк М., Симшек И. Обнаружение Helicobacter pylori и определение чувствительности к кларитромицину с использованием фиксированных формалином, залитых парафином образцов биопсии желудка с помощью флуоресцентной гибридизации in situ. Helicobacter. 2007; 12: 136–141. [PubMed] [Google Scholar] 80. Cambau E, Allerheiligen V, Coulon C, Corbel C, Lascols C, Deforges L, Soussy CJ, Delchier JC, Megraud F.Оценка нового теста, генотип HelicoDR, для молекулярного определения устойчивости к антибиотикам у Helicobacter pylori. J Clin Microbiol. 2009. 47: 3600–3607. [Бесплатная статья PMC] [PubMed] [Google Scholar] 81. Ли HJ, Kim JI, Cheung DY, Kim TH, Jun EJ, Oh JH, Chung WC, Kim BW, Kim SS, Park SH и др. Ликвидация Helicobacter pylori в соответствии с точечными мутациями 23S рибосомальной РНК, связанными с устойчивостью к кларитромицину. J Infect Dis. 2013; 208: 1123–1130. [PubMed] [Google Scholar] 82. Фурута Т., Шираи Н., Такашима М., Сяо Ф., Ханаи Х., Сугимура Х., Охаши К., Ишизаки Т., Канеко Э.Влияние генотипических различий в CYP2C19 на частоту излечения от инфекции Helicobacter pylori тройной терапией ингибитором протонной помпы, амоксициллином и кларитромицином. Clin Pharmacol Ther. 2001; 69: 158–168. [PubMed] [Google Scholar] 83. Sim SC, Risinger C, Dahl ML, Aklillu E, Christensen M, Bertilsson L, Ingelman-Sundberg M. Распространенный новый вариант гена CYP2C19 вызывает сверхбыстрый метаболизм лекарства, имеющий отношение к реакции лекарства на ингибиторы протонной помпы и антидепрессанты. Clin Pharmacol Ther. 2006. 79: 103–113.[PubMed] [Google Scholar] 84. Фурута Т., Шираи Н., Кодайра М., Сугимото М., Ногаки А., Курияма С., Иваидзуми М., Ямаде М., Теракава И., Охаши К. и др. Индивидуальный подход на основе фармакогеномики по сравнению со стандартным терапевтическим режимом для эрадикации H. pylori. Clin Pharmacol Ther. 2007. 81: 521–528. [PubMed] [Google Scholar]Что входит в тройную терапию для искоренения инфекции Helicobacter pylori?
Flores-Treviño S, Mendoza-Olazarán S, Bocanegra-Ibarias P, Maldonado-Garza HJ, Garza-González E.Лекарственная устойчивость Helicobacter pylori: изменения в терапии и проблемы. Эксперт Рев Гастроэнтерол Гепатол . 2018 5 июля. [Medline].
[Рекомендации] Чей В.Д., Леонтиадис Г.И., Хауден К.В., Мосс С.Ф. Клинические рекомендации ACG: Лечение инфекции Helicobacter pylori. Ам Дж. Гастроэнтерол . 2017 Февраль 112 (2): 212-239. [Медлайн].
О’Коннор А., Молина-Инфанте Дж., Гисберт Дж. П., О’Морайн С. Лечение инфекции Helicobacter pylori 2013. Хеликобактер . 2013 Сентябрь 18 Дополнение 1: 58-65. [Медлайн].
Malfertheiner P, Megraud F, O’Morain CA, Gisbert JP, Kuipers EJ, Axon AT et. al. Управление инфекцией Helicobacter pylori – Маастрихт V / Флорентийский консенсусный доклад. Кишечник . 2017 Январь 66 (1): 6-30. [Медлайн].
Chey WD, Вонг, Британская Колумбия. Руководство Американского колледжа гастроэнтерологии по лечению инфекции Helicobacter pylori. Ам Дж. Гастроэнтерол .2007 августа 102 (8): 1808-25. [Медлайн].
Санчес-Дельгадо Дж., Гарсия-Иглесиас П., Кастро-Фернандес М., Бори Ф, Баренис М., Буханда Л. Тройная терапия эзомепразолом, амоксициллином и метронидазолом в высоких дозах в течение десяти дней позволяет достичь высоких показателей эрадикации Helicobacter pylori. Алимент Фармакол Тер . 2012 июл. 36 (2): 190-6. [Медлайн].
Nishizawa T., Maekawa T., Watanabe N, Harada N, Hosoda Y, Yoshinaga M и др. Кларитромицин по сравнению с метронидазолом в качестве первой линии эрадикации Helicobacter pylori: многоцентровое проспективное рандомизированное контролируемое исследование в Японии. Дж Клин Гастроэнтерол . 2015 июл. 49 (6): 468-71. [Медлайн].
Malfertheiner P, Mégraud F, O’Morain C, Bell D, Bianchi Porro G, Deltenre M и др. Современные европейские концепции лечения инфекции Helicobacter pylori – Маастрихтский консенсусный доклад. Европейская группа изучения Helicobacter Pylori (EHPSG). Eur J Гастроэнтерол Hepatol . 1997 9 января (1): 1-2. [Медлайн].
Yuan Y, Ford AC, Khan KJ, Gisbert JP, Forman D, Leontiadis GI, et al.Оптимальная продолжительность схем эрадикации Helicobacter pylori. Кокрановская база данных Syst Rev . 2013 г. 11 декабря. CD008337. [Медлайн].
Nyssen OP, McNicholl AG, Megraud F, Savarino V, Oderda G, Fallone CA и др. Последовательная и стандартная тройная терапия первой линии для эрадикации Helicobacter pylori. Кокрановская база данных Syst Rev . 2016, 28 июня. CD009034. [Медлайн].
Liou JM, Fang YJ, Chen CC, Bair MJ, Chang CY, Lee YC et.al. Сопутствующая четырехкратная терапия висмутом и трехкратная 14-дневная терапия в качестве первой линии лечения Helicobacter pylori: многоцентровое открытое рандомизированное исследование. Ланцет . 2016, 12 ноября. 388 (10058): 2355-2365. [Медлайн].
Zullo A, De Francesco V, Hassan C, Ridola L, Repici A, Bruzzese V, et al. Модифицированные схемы последовательной терапии для эрадикации Helicobacter pylori: систематический обзор. Dig Liver Dis . 2013 Январь 45 (1): 18-22. [Медлайн].
Зулло А., Хассан С., Ридола Л., Де Франческо V, Вайра Д.Стандартные тройные и последовательные методы лечения для эрадикации Helicobacter pylori: обновленная информация. Eur J Intern Med . 2013 24 января (1): 16-9. [Медлайн].
Uygun A, Kadayifci A, Yesilova Z, Safali M, Ilgan S, Karaeren N. Сравнение последовательного и стандартного трехкомпонентного режима для эрадикации Helicobacter pylori: 14-дневное, открытое, рандомизированное, проспективное, параллельное исследование у взрослых пациентов с неязвенной диспепсией. Клин Тер . 2008 30 марта (3): 528-34.[Медлайн].
Qian J, Ye F, Zhang J, Yang YM, Tu HM, Jiang Q, et al. Тройная и последовательная терапия, содержащая левофлоксацин, или стандартная последовательная терапия в качестве лечения первой линии для эрадикации Helicobacter pylori в Китае. Хеликобактер . 2012 г., 17 (6): 478-85. [Медлайн].
Liou JM, Chen CC, Chang CY, Chen MJ, Fang YJ, Lee JY и др. Эффективность последовательной терапии на основе генотипической резистентности в лечении третьей линии рефрактерной инфекции Helicobacter pylori: многоцентровое клиническое испытание. J Антимикробный препарат Chemother . 2013 Февраль 68 (2): 450-6. [Медлайн].
Лиу Дж.М., Чен С.К., Чен М.Дж., Чен С.К., Чанг С.Й., Фанг Ю.Дж. Последовательная и тройная терапия для лечения первой линии Helicobacter pylori: многоцентровое открытое рандомизированное исследование. Ланцет . 2013 19 января. 381 (9862): 205-13. [Медлайн].
Manfredi M, Bizzarri B, de’Angelis GL. Инфекция Helicobacter pylori: последовательная терапия с последующей тройной терапией, содержащей левофлоксацин, обеспечивает хорошую кумулятивную скорость эрадикации. Хеликобактер . 2012 17 августа (4): 246-53. [Медлайн].
Molina-Infante J, Pazos-Pacheco C, Vinagre-Rodriguez G, Perez-Gallardo B, Dueñas-Sadornil C, Hernandez-Alonso M. Четверная (сопутствующая) терапия без висмута: эмпирическая и индивидуализированная эффективность по сравнению со стандартной тройной терапией кларитромицином – чувствительность к Helicobacter pylori и против последовательной терапии устойчивых к кларитромицину штаммов. Хеликобактер . 2012 17 августа (4): 269-76. [Медлайн].
Kongchayanun C, Vilaichone RK, Pornthisarn B, Amornsawadwattana S, Mahachai V. Пилотные исследования для определения оптимальной продолжительности сопутствующей эрадикационной терапии Helicobacter pylori в Таиланде. Хеликобактер . 2012 17 августа (4): 282-5. [Медлайн].
Georgopoulos S, Papastergiou V, Xirouchakis E, Laoudi F, Lisgos P, Spiliadi C. Четырехкратная «сопутствующая» терапия без висмута по сравнению со стандартной тройной терапией продолжительностью 10 дней для первой линии H.pylori: рандомизированное исследование. Дж Клин Гастроэнтерол . 2013 Март 47 (3): 228-32. [Медлайн].
Ким С.И., Ли С.В., Хён Дж.Дж., Юнг С.В., Ку Дж.С., Йим Х.Дж. Сравнительное исследование скорости эрадикации Helicobacter pylori с 5-дневной четырехкратной «сопутствующей» терапией и 7-дневной стандартной тройной терапией. Дж Клин Гастроэнтерол . 2013 Январь 47 (1): 21-4. [Медлайн].
Янаи А., Сакамото К., Аканума М., Огура К., Маэда С. Четырехкратная терапия без висмута для эрадикации Helicobacter pylori первой линии: рандомизированное исследование в Японии. Мир J Gastrointest Pharmacol Ther . 2012 фев 6. 3 (1): 1-6. [Медлайн].
Molina-Infante J, Lucendo AJ, Angueira T., Rodriguez-Tellez M, Perez-Aisa A, Balboa A, et al. Оптимизированная эмпирическая тройная и сопутствующая терапия для эрадикации Helicobacter pylori в клинической практике: исследование OPTRICON. Алимент Фармакол Тер . 2015 Март 41 (6): 581-9. [Медлайн].
Sardarian H, Fakheri H, Hosseini V, Taghvaei T., Maleki I, Mokhtare M.Сравнение гибридных и последовательных методов лечения эрадикации Helicobacter pylori в Иране: проспективное рандомизированное исследование. Хеликобактер . 2013 Апрель 18 (2): 129-34. [Медлайн].
Hsu PI, Kao SS, Wu DC, Chen WC, Peng NJ, Yu HC, et al. Рандомизированное контролируемое исследование, сравнивающее обратную гибридную терапию и стандартную тройную терапию для инфекции Helicobacter pylori. Медицина (Балтимор) . 2015 декабрь 94 (48): e2104. [Медлайн].
Tay CY, Windsor HM, Thirriot F, Lu W, Conway C, Perkins TT.Ликвидация Helicobacter pylori в Западной Австралии с использованием новых комбинаций четырехкомпонентной терапии. Алимент Фармакол Тер . 2012 декабря 36 (11-12): 1076-83. [Медлайн].
Graham DY, Canaan Y, Maher J, Wiener G, Hulten KG, Kalfus IN. Тройная терапия на основе рифабутина (RHB-105) для ликвидации Helicobacter pylori : двойное слепое рандомизированное контролируемое исследование. Энн Интерн Мед. 2020 16 июня. 172 (12): 795-802. [Медлайн].
Kuo CH, Hsu PI, Kuo FC, Wang SS, Hu HM, Liu CJ.Сравнение 10-дневной четырехкратной терапии висмутом с высокими дозами метронидазола или левофлоксацина с терапией второй линии Helicobacter pylori: рандомизированное контролируемое исследование. J Антимикробный препарат Chemother . 2013 Январь 68 (1): 222-8. [Медлайн].
Salazar CO, Cardenas VM, Reddy RK, Dominguez DC, Snyder LK, Graham DY. Более 95% успеха с 14-дневной четырехкратной висмутовой терапией против Helicobacter pylori: пилотное исследование на латиноамериканцах в США. Хеликобактер . 2012 Октябрь.17 (5): 382-90. [Медлайн].
Xie Y, Zhu Z, Wang J, Zhang L, Zhang Z, Lu H и др. Десятидневная четырехкратная терапия, включающая низкие дозы рабепразола, висмута, амоксициллина и тетрациклина, является эффективным и безопасным препаратом первой линии для лечения инфекции Helicobacter pylori в популяции с высокой устойчивостью к антибиотикам: проспективное многоцентровое рандомизированное клиническое исследование с параллельным контролем в Китае. Противомикробные агенты Chemother . 18 июня 2018 г. [Medline].[Полный текст].
Yagbasan A, Coşkun DÖ, Özbakir Ö, Deniz K, Gürsoy Ş, Yücesoy M. Проспективное рандомизированное исследование, сравнивающее 7-дневную и 14-дневную четырехкратную терапию в качестве лечения первой линии при инфекции Helicobacter pylori у пациентов с функциональной диспепсией. Нигер Дж. Клин Практик . 2018 21 января (1): 54-58. [Медлайн].
Шах А., Джавид Г., Заргар С.А., Тели Ф., Хан Б.А., Йатату Г.Н. Безопасность и эффективность однонедельной тройной терапии на основе левофлоксацина в качестве первой линии лечения язвенной болезни, связанной с Helicobacter pylori, в Кашмире, Индия. Индийский Дж. Гастроэнтерол . 2013 января, 32 (1): 32-6. [Медлайн].
Peedikayil MC, Альшайбани FI, Алхенизан AH. Терапия первой линии на основе левофлоксацина в сравнении со стандартной терапией первой линии для эрадикации Helicobacter pylori: метаанализ рандомизированных контролируемых исследований. PLoS Один . 2014 21 января. 9 (1): e85620. [Медлайн].
Куадрадо-Лавин А., Сальсинес-Кавьедес Дж. Р., Карраскоса М. Ф., Дирссен-Сотос Т., Кобо М., Кампос М. Р. и др.Левофлоксацин по сравнению с кларитромицином в 10-дневной тройной схеме терапии для эрадикации Helicobacter pylori первой линии: простое слепое рандомизированное клиническое испытание. J Антимикробный препарат Chemother . 2012 Сентябрь 67 (9): 2254-9. [Медлайн].
Kale-Pradhan PB, Mihaescu A, Wilhelm SM. Последовательная терапия фторхинолоном Helicobacter pylori: метаанализ. Фармакотерапия . 2015 авг. 35 (8): 719-30. [Медлайн].
Федерико А., Нардоне Г., Гравина А.Г., Йовене М.Р., Миранда А., сравнить D.Эффективность 5-дневной сопутствующей терапии, содержащей левофлоксацин, в эрадикации инфекции Helicobacter pylori. Гастроэнтерология . 2012 июл. 143 (1): 55-61.e1; quize e13-4. [Медлайн].
Fu W, Song Z, Zhou L, Xue Y, Ding Y, Suo B и др. Рандомизированное клиническое испытание: эзомепразол, висмут, левофлоксацин и амоксициллин или цефуроксим в качестве схем первой линии эрадикации инфекции Helicobacter pylori. Dig Dis Sci . 2017 июн.62 (6): 1580-1589. [Медлайн].
Su J, Zhou X, Chen H, Hao B, Zhang W., Zhang G. Эффективность четырехкратной терапии висмутом 1-й линии с левофлоксацином или кларитромицином для искоренения инфекции Helicobacter pylori: 1 неделя, открытая , рандомизированное исследование. Медицина (Балтимор) . 2017 Февраль 96 (7): e5859. [Медлайн].
Malfertheiner P, Megraud F, O’Morain CA, Atherton J, Axon AT, Bazzoli F. Управление инфекцией Helicobacter pylori – Маастрихтский отчет IV / Флорентийский консенсус. Кишечник . 2012 май. 61 (5): 646-64. [Медлайн].
Liang X, Xu X, Zheng Q, Zhang W, Sun Q, Liu W. Эффективность висмутсодержащей четырехкомпонентной терапии при инфекциях Helicobacter pylori, устойчивых к кларитромицину, метронидазолу и фторхинолонам, в проспективном исследовании. Клин Гастроэнтерол Гепатол . 2013 июл.11 (7): 802-7.e1. [Медлайн].
Соквала А., Шах М.В., Девани С., Йонга Г. Эрадикация Helicobacter pylori: рандомизированное сравнительное исследование 7-дневной и 14-дневной тройной терапии. S Afr Med J . 2012 июн 102 (6, часть 2): 368-71. [Медлайн].
Целик М., Йигит М. Эффективность левофлоксацин-содержащей последовательной терапии с висмутом или без него в эрадикации Helicobacter Pylori при неязвенной диспепсии. Acta Gastroenterol Belg . 2017 янв-март. 80 (1): 39-42. [Медлайн].
Эрадикация Helicobacter pylori в Мексике с использованием схемы на основе левофлоксацина по сравнению со стандартной тройной терапией: результаты открытого рандомизированного исследования фазы IIIb без меньшей эффективности
Резюме
Введение и цели
Helicobacter pylori ( H.pylori ) остается основной причиной ряда гастродуоденальных заболеваний. Несмотря на то, что для изменения связанной с ней заболеваемости и смертности использовались несколько схем лечения антибиотиками, распространенность этой бактериальной инфекции по-прежнему непропорционально высока во всем мире, в основном из-за устойчивости к антибиотикам. Чтобы оценить эффективность и безопасность 2 10-дневных тройных схем эрадикации H. pylori , мы оценили кларитромицин 500 мг, лансопразол 30 мг и амоксициллин 1 г, все 2 раза в день (стандартная тройная терапия или CLA, группа 1) по сравнению с .пантопразол 80 мг, левофлоксацин 500 мг и азитромицин 500 мг, все 1 раз (PLA, группа 2). Оба режима сравнивали у пациентов, не получавших лечения.
Материалы и методы
Открытое рандомизированное исследование IIIb фазы без меньшей эффективности, в котором сравнивали CLA и PLA, было проведено в течение 10-дневного периода в период с июня 2012 г. по март 2014 г. Исключение было подтверждено с помощью 13 C. -дыхательная проба на мочевину. Биопсии желудка тестировали на наличие флуоресценции гибридизации in situ (FISH) и устойчивости к кларитромицину перед введением любого антибиотика.Результаты эффективности и безопасности были проанализированы в соответствии с методологическим подходом не меньшей эффективности.
Результаты
Из 227 H. pylori положительных субъектов, которые были рандомизированы, 194 были окончательно проанализированы согласно протоколу. Уровень эрадикации в группе 2 составил 63% и не уступал уровню эрадикации в группе 1, равному 58,5% (верхний предел 95% ДИ: 0,11608; ниже границы не меньшей эффективности: 0,1200). Устойчивость к кларитромицину FISH была обнаружена в 28,2% случаев. Неблагоприятные события, все незначительные и купированные самостоятельно, были значительно выше в группе 1, чем в группе 2 (86 vs.65,4%; р = 0,001).
Выводы
Первая линия Эрадикация H. pylori с помощью комбинированной терапии пантопразолом / левофлоксацином / азитромицином так же эффективна, как и стандартная тройная терапия, с лучшей переносимостью и более легким дозированием. При выборе антибиотиков для лечения эрадикации Helicobacter pylori
необходимо учитывать устойчивость к кларитромицину.Идентификатор ClinicalTrials.gov NCT02726269.
Результат
Введение и объект
Инфекция от Helicobacter pylori ( H.pylori ) представляют собой важный этиологический фактор в числовом выражении гастродуоденалов. A pesar de haberse utilizado múltiples esquemas antibióticos para modificar su morbimortalidad asociada, la prevalencia de esta infacción bacteriana continúa siendo desproporcionadamente alta en todo el mundo, debido mainmente a la resistena antibiada. Эффект от оценки эффективности не ниже и 2 режимов тройной терапии по 10 дней для лечения H.pylori comparemos Claritromicina 500 мг, лансопразол 30 мг y амоксицилина 1 г, 2 veces al día (тройная терапия с CLA, группа 1) по сравнению с пантопразолом 80 мг, levofloxacina 500 мг y 500 мг de azitromicina, 1 vez al día (PLA , группа 2). Los 2 regímenes fueron compareos en pacientes previamente no tratados.
Материал и методы
Entre junio del 2012 y marzo del 2014 se llevó a cabo un estudio abierto de fase iiib aleatorizado y de no inferioridad que сравнения CLA и PLA en un periodo de 10 días.La erradicación se verificó con pruebas de aliento con 13 C-мочевина. Las biopsias gástricas se analizaron para resistencia a Claritromicina por hibridación fluorescente in situ, anterior a la administración de cualquier antibiótico. Los resultados de eficacia y seguridad fueron analizados siguiendo la metodología de no inferioridad.
Resultados
De los 227 sujetos positivos a H. pylori que fueron aleatorizados, finalmente se analizaron 194 por protocolo solamente.La tasa de erradicación del grupo 2 fue del 63%, не ниже уровня a la tasa de erradicación del grupo 1 del 58,5% (límite superior IC 95% = 0,11608; margen de no inferioridad = 0,1200). La resistencia a la Claritromicina оценивается fue del 28,2%. Los eventos adversos fueron importantamente mayores en el grupo 1 que en el grupo 2 (86% против 65,4%, p = 0,001).
Заключения
La erradicación de H. pylori en primera línea con terapia combinada de pantoprazol / levofloxacina / azitromicina resulta tan efectiva como con la terapia triple estándar, aunque con mejor unclerabilidación.La resistencia a la Claritromicina debe Thinkrarse en los tratamientos de erradicación del H. pylori .
Идентификатор ClinicalTrials.gov: NCT02726269.
Ключевые слова
Helicobacter pylori
Кларитромицин
Левофлоксацин
Ингибиторы протонной помпы
Palabras clave
Helicobacter pylori
Helicobacter pylori
9vromitombommed )© 2018 Опубликовано Masson Doyma México S.A. от имени Asociación Mexicana de Gastroenterología.
Рекомендуемые статьи
Цитирующие статьи
10-дневная против 14-дневной сопутствующей PAMC как стратегия лечения первой линии для искоренения инфекции H. Pylori – Просмотр полного текста
В Греции, в то время как эффективность 10-дневной Недавно была разработана сопутствующая схема PAMC, и, насколько нам известно, прямого сравнения, оценивающего время лечения (10 против 14 дней) той же терапевтической схемы, не проводилось.Мы решили провести рандомизированное двойное слепое контролируемое клиническое исследование, сравнивающее 10-дневную и 14-дневную сопутствующие терапевтические схемы PAMC в качестве стратегии лечения первой линии для искоренения инфекции H. pylori в стране с повышенной двойной устойчивостью к кларитромицину и метронидазол (там, где нет висмута). Первичной конечной точкой нашего исследования будет эффективность лечения (первичная и вторичная резистентность к антибиотикам), а вторичной конечной точкой – соблюдение пациентом режима лечения и безопасность.
Это открытое проспективное рандомизированное исследование будет проводиться в больнице с фондом паевых взносов армии (NIMTS) в Афинах, Греция, и будет проводиться отделением гастроэнтерологии больницы. Письменное информированное согласие будет получено от всех участников перед зачислением. Исследование должно быть предварительно одобрено институциональным наблюдательным советом больницы.
Вмешательства Врач будет нанят для получения демографических данных и истории болезни пациентов.Используя запечатанные конверты, подходящие пациенты будут случайным образом разделены на две группы, а научный сотрудник назначит терапию в соответствии с назначениями лечения, хранящимися в конвертах. В первой группе пациенты будут назначены на 10-дневную сопутствующую терапию PAMC (40 мг эзомепразола два раза в день, 500 мг кларитромицина два раза в день, 1 г амоксициллина два раза в день и 500 мг метронидазола два раза в день). Во второй группе пациентам будет назначена такая же сопутствующая терапия PAMC в течение 14 дней. Каждый конверт будет содержать точные письменные инструкции относительно графика лечения, дозировки и времени приема лекарств, а дальнейшие инструкции будут доступны, если необходимо, по телефону.
Последующее наблюдение и результат Для подтверждения соответствия всем пациентам будет предложено принести оставшиеся лекарства через 5 дней после окончания лечения, где мы подсчитаем оставшиеся их таблетки. Пациенты с комплаентностью <80% будут исключены из исследования согласно анализу протокола (PP). Пациенты также будут опрошены по причинам, связанным с пропущенными дозами схем, а также с возникновением любых новых или ухудшившихся заболеваний, которые побудили их обратиться за медицинской помощью.Нежелательные явления будут классифицированы как незначительные или серьезные, а в последнем случае лечение будет прекращено.
Через четыре недели после периода лечения (без введения ИПП или каких-либо антибиотиков) мы подтвердим эрадикацию H. pylori с помощью C13-UBT сотрудником, который не будет знать о группе эрадикации каждого пациента. В случае неэффективности лечения будет проведена повторная эндоскопия с забором образцов биопсии (два из антрального отдела и два из тела желудка).Образцы биопсии будут культивированы, и будет определена чувствительность к антибиотикам для амоксициллина, тетрациклина, кларитромицина, метронидазола и левофлоксацина с помощью теста на разведение в агаре в соответствии со стандартным европейским протоколом14,15. Микробиолог, который будет проводить разведение в агаре. тест будет слепым к лечению. Если эрадикационная терапия первой линии не дает результатов, будет назначена терапия второй линии в зависимости от чувствительности к антибиотикам.
Статистический анализ. В этом исследовании клинически значимая разница в эрадикации между двумя группами составит 15%.Чтобы достичь 80% мощности для обнаружения этой разницы, наряду с альфа-уровнем 0,05 и соотношением распределения 1: 1, мы рассчитали необходимую выборку из 364 пациентов. Поскольку это удобный клинический образец, исследование будет прекращено либо по достижении этого числа пациентов, либо по ограничению сроков исследования. Будут сравниваться исходные характеристики и оцениваться разница наблюдаемых показателей эрадикации между исследуемыми группами. Результаты этого исследования будут проанализированы в отношении намерения лечить (ITT) и популяции PP.В ITT-анализ будут включены все рандомизированные пациенты, которые приняли хотя бы одну дозу исследуемого лекарства (независимо от соблюдения режима лечения). Пациенты, чей статус инфекции будет неизвестен после лечения, будут считаться пациентами, не прошедшими лечение, для целей ITT-анализа. В PP-анализ будут включены пациенты с соблюдением не менее 80% (исключая пациентов с неизвестным статусом H. pylori после терапии и пациентов с серьезными нарушениями протокола).
(PDF) Ликвидация инфекции Helicobacter Pylori: прошлое, настоящее и будущее
• Страница 8 из 10 •
ISSN: 2469-584XBaryshnikova et al.J Clin Gastroenterol Treat 2016, 2: 011
35. Жебрун А.Б., Александрова В.А., Гончарова Л.Б., Ткаченко Е.И. (2002)
Диагностика, профилактика и лечение заболеваний, ассоциированных с H. pylori:
Рекомендации для врачей. Санкт-Петербург 15-18.
36. Megraud F (2007) Helicobacter pylori и устойчивость к антибиотикам. Gut 56: 1502.
37. О’Коннор А., Вайра Д., Гисберт Дж. П., О’Морайн С. (2014) Лечение инфекции Helicobacter
pylori 2014.Helicobacter 19 Дополнение 1: 38-45.
38. Махачай В. Ратаначу-эк Т., Мьинт Т., Питтаянон Р., Ямаока Ю., Учида Т.,
et al. (2014) Структура устойчивости к антибиотикам инфекции Helicobacter pylori в странах Южной и Юго-Восточной Азии
. Helicobacter 1: 146.
39. Аларкон Т., Саез С., Мерчан Б., Рубио Б., Гомес де Олеа Ф. и др. (2014)
Устойчивость к противомикробным препаратам Helicobacter pylori и ее связь с
потреблением антибиотиков.Helicobacter 1: 146.
40. Мартинес-Гонсалес Б., Пападакос К., Псарракос П., Рома Е., Панайоту Дж.,
Сгурас Д. Н., Ментис А.Ф. Высокий уровень устойчивости к калритромицину у клинических изолятов Helicobacter
pylori, полученных от детей в греции: ретроспективное исследование,
2000–2013. Helicobacter 1: 148.
41. Martins GM, Lima KS, Cota BDCV, Sanches BSV, Moretzsohn LD, et al.
(2014) Молекулярное определение устойчивости к кларитромицину и фторхинолонам
при инфекции Helicobacter pylori, непосредственно при биопсии желудка, у городского населения Бразилии
.Helicobacter 1: 150.
42. Mandkhai B, Munkhdelger Y, Bira N, Sarantuya J (2014) Устойчивые к лекарствам штаммы H.
pylori, выделенные в Монголии. Helicobacter 1: 151.
43. Сиавоши Ф., Хоссейни Ф., Шахреза С., Халили Самани С., Афшар Б. (2014)
Повышение уровня устойчивости изолятов H. pylori через 5 лет. Helicobacter
1: 153.
44. Camargo MC, García A, Riquelme A, Otero W, Camargo CA, et al. (2014)
Проблема устойчивости Helicobacter pylori к антибиотикам: систематический обзор
в Латинской Америке.Am J Gastroenterol 109: 485-495.
45. Сян Дж., Селваратнам С., Тейлор С., Йео Дж., Тан Ю. М. и др. (2013) Повышение первичной устойчивости к антибиотикам на
и этнические различия в показателях искоренения
инфекции Helicobacter pylori в Новой Зеландии – новый взгляд на старого врага. N
Z Med J 126: 64-76.
46. Ан Б., Мун Б.С., Ким Х., Лим Х.С., Ли Ю.С. и др. (2013) Устойчивость к антибиотикам
у штаммов Helicobacter pylori и ее влияние на H.pylori в едином центре
в Корее. Энн Лаб Мед 33: 415-419.
47. Ли Дж. У., Ким Н., Ким Дж. М., Нам Р. Х., Чанг Х и др. (2013) Распространенность
первичной и вторичной устойчивости к противомикробным препаратам Helicobacter pylori в
Корее с 2003 по 2012 год. Helicobacter 18: 206-214.
48. Векенс К., Вандебош С., Де Бел А., Урбен Д., Мана Ф (2013) Первичная
устойчивость к противомикробным препаратам Helicobacter pylori в Бельгии.Acta Clin Belg 68:
183-187.
49. Селград М., Мейссле Дж., Борншейн Дж., Кандульски А., Лангнер С. и др. (2013)
Чувствительность к антибиотикам Helicobacter pylori в центральной Германии и ее взаимосвязь
с количеством методов эрадикационной терапии. Eur J Gastroenterol
Hepatol 25: 1257-1260.
50. О’Коннор А., Танеике И., Нами А., Фицджеральд Н., Райан Б. и др. (2013)
Показатели устойчивости Helicobacter pylori к левоксацину, тетрациклину и рифабутину
среди ирландских изолятов в справочном центре.Ir J Med Sci 182: 693-635.
51. Су П, Ли Й, Ли Х, Чжан Дж, Линь Л. и др. (2013) Устойчивость к антибиотикам
Helicobacter pylori, выделенных в юго-восточном прибрежном регионе Китая.
Helicobacter 18: 274-279.
52. Де Франческо В., Джорджио Ф., Хассан К., Манес Дж., Ваннелла Л. и др. (2010)
Устойчивость к антибиотикам H. pylori во всем мире: систематический обзор. J Gastrointestin
Liver Dis 19: 409-414.
53.Успенский Ю.П., Суворов А.Н., Барышникова Н.В. (2011) Инфекция Helicobacter pylori
в клинической практике. Санкт-Петербург: ИнформМед 462-554.
54. Валлв М., Вергара М., Гисберт Дж. П., Кальвет X (2002). Однократная и двойная доза
ингибитора протонной помпы в тройной терапии для эрадикации Helicobacter pylori: метаанализ
. Aliment Pharmacol Ther 16: 1149-1156.
55. Ван Ч., Ма М.Х., Чжоу Х.С., Йен З.С., Ян Ч.В. и др. (2010) Высокодозные
по сравнению с ингибиторами протонной помпы в невысоких дозах после эндоскопического лечения у
пациентов с кровоточащей язвенной болезнью: систематический обзор и метаанализ
рандомизированных контролируемых исследований.Arch Intern Med 170: 751-758.
56. Паолузи П., Якопини Ф., Криспино П., Нарди Ф., Белла А. и др. (2006) 2-недельная
тройная терапия инфекции Helicobacter pylori лучше, чем 1 неделя в клинической практике
: большое проспективное одноцентровое рандомизированное исследование. Helicobacter
11: 562-568.
57. Катичич М., Тичак М., Прскало М. Ликвидация инфекции Helicobacter pylori
с двумя тройными режимами терапии по 7, 10 и 14 дней: четырехлетний опыт.
Helicobacter 11: 386.
58. Кальвет X, Гарсия Н., Лопес Т., Гисберт Дж. П., Джене Э и др. (2000) Метаанализ
краткосрочной и длительной терапии ингибитором протонной помпы, кларитромицином и
метронидазолом или амоксициллином для лечения инфекции Helicobacter pylori.
Aliment Pharmacol Ther 14: 603–609.
59. Симаненков В.И., Ткаченко Е.И., Захарова Н.В. (2008) Протоколы диагностики
и лечения инфекции H. pylori.Санкт-Петербург 3-32.
60. Ди Марио Ф., Кавалларо Л.Г., Скарпиньято С. (2006) «Спасательные» терапии для лечения
инфекции Helicobacter pylori. Dig Dis 24: 113-130.
61. Gisbert JP, Romano M, Molina-Infante J, Lucendo AJ, Medina E, et al. (2015)
Двухнедельная высокодозная терапия ингибитором протонной помпы, тройная терапия моксиноксацином Helicobacter
pylori после неэффективности стандартной тройной или невисмутовой четырехкратной терапии
. Dig Liver Dis 47: 108-113.
62. Фурута Т., Сугимото М., Кодаира С., Нишино М., Ямаде М. и др. (2014)
Схемы экстренной помощи третьей линии на основе ситаноксацина при инфекции Helicobacter pylori
в Японии. J Gastroenterol Hepatol 29: 487-493.
63. Лазебник Л.Б., Бордин Д.С. (2013) Ведение пациентов с Helicobacter
pylori-ассоциированными заболеваниями в обычной клинической практике. Промежуточные результаты программы мониторинга
. Эксп Клин Гастроэнтерол 5: 93-101.
64. Захарова Н.В. (2004) Эволюция взглядов на проблему искоренения H. pylori.
Consilium medicum 6: 9-11.
65. Успенский Ю.П., Барышникова Н.В. (2012) Использование нитрофуранов в эрадикации
схем лечения первой линии. Российский медицинский журнал 25: 1-4.
66. Гасбаррини А., Лауритано Е.С., Ниста ЕС, Канделли М., Габриелли М. и др. (2006)
Схемы на основе рифаксимина для ликвидации Helicobacter pylori: пилотное исследование.
Dig Dis 24: 195-200.
67. Чиккаглион А.Ф., Челлини Л., Гросси Л., Манзоли Л., Марцио Л. (2015) Тройная и
четырехместная терапия доксициклином и висмутом для лечения первой линии инфекции Helicobacter pylori
: пилотное исследование. Helicobacter 20: 390-396.
68. Олокоба А.Б., Обатеру О.А., Боджувое М.О. (2013) Эрадикационная терапия Helicobacter pylori
: обзор текущих тенденций. Niger Med J 54: 1-4.
69. Парфенов А.И., Ручкина И.Н. (2008) Раздражение кишечника (рекомендации
для врачей).Москва, 3-34.
70. Лазебник Л.Б., Ткаченко Е.И., Абдулхаков Р.А., Бордин Д.С., Гриневич В.Б. и др.
(2013) Стандарт диагностики и лечения кислотозависимых заболеваний и H.
pylori-ассоциированных заболеваний 1: 20.
71. Malfertheiner P (2010) Инфекция: висмут улучшает тройную терапию на основе ИПП
для H эрадикация y pylori. Нат Рев Гастроэнтерол Гепатол 7: 538-539.
72. Ciccaglione AF, Cellini L, Grossi L, Marzio L (2012) Четверная терапия с использованием
моксиноксацина и висмута для лечения первой линии Helicobacter pylori.Мир
J Gastroenterol 18: 4386-4390.
73. Гадир М.Р., Шафаги А., Ираникха А., Пакдин А., Джукар Ф. и др. (2011)
Фуразолидон, амоксициллин и омепразол с висмутом или без него для эрадикации
Helicobacter pylori при язвенной болезни. Turk J Gastroenterol 22: 1-5.
74. Farkas R, Pronai L, Tulassay Z, Selmeci L (2005) Взаимосвязь между
эрадикацией Helicobacter pylori и активностью супероксиддисмутазы
слизистой оболочки желудка.Anticancer Res 25: 4763-4767.
75. Аруин Л.И., Кононов А.В., Мозгово С.И. (2009) [Международная классификация хронического гастрита
: что принимать, а в чем есть сомнения]. Арх Патол 71:
11-18.
76. Вакил Н., Вайра Д. (2008) Последовательная терапия Helicobacter pylori: время до
рассмотреть возможность перехода? JAMA 300: 1346-1347.
77. О’Коннор А., Гисберт Дж., О’Морайн С. (2009) Лечение инфекции Helicobacter pylori
.Helicobacter 14 Дополнение 1: 46-51.
78. Ким Дж. С., Парк С. М., Ким Б. В. (2015) Последовательная или сопутствующая терапия для искоренения инфекции Helicobacter pylori
: систематический обзор и анализ мета-
. J Gastroenterol Hepatol 30: 1338-1345.
79. Ким С.И., Пак Д.К., Квон К.А., Ким К.О., Ким Ю.Дж. и др. (2014) [Десятидневная сопутствующая терапия
превосходит десятидневную последовательную терапию для эрадикации Helicobacter
pylori].Корейский журнал J Gastroenterol 64: 260-267.
80. Ли Х. Дж., Ким Дж. И., Ли Дж. С., Джун ЭДЖ, О Дж. Х. и др. (2015). Сопутствующая терапия
обеспечила лучший уровень эрадикации Helicobacter pylori среди различных терапевтических стратегий
. World J Gastroenterol 21: 351-359.
81. Метанат Х.А., Вализаде С.М., Факери Х., Малеки И., Тагваеи Т. и др. (2015)
Сравнение 10- и 14-дневных гибридных схем для эрадикации Helicobacter
pylori: рандомизированное клиническое испытание.Helicobacter 20: 299-304.
82. Куадрадо-Лавин А., Сальсинес-Кавьедес Дж. Р., Диас-Перес А., Карраскоса М. Ф.,
Очагавиа М. и др. (2015) Показатели эрадикации первой линии сравнивают две укороченные четырехкомпонентные схемы без висмута
против Helicobacter pylori: открытое рандомизированное многоцентровое клиническое исследование
.



 , Садоков В.М. Значение операционных характеристик теста при выборе метода диагностики инфекции Н.pylori. Экспериментальная и клиническая гастроэнтерология, 2002, №4.
, Садоков В.М. Значение операционных характеристик теста при выборе метода диагностики инфекции Н.pylori. Экспериментальная и клиническая гастроэнтерология, 2002, №4. 1094-101.
1094-101. American Journal of Gastroenterology, 2007, 102:1808-1825.
American Journal of Gastroenterology, 2007, 102:1808-1825.