Эрадикация возбудителя это: Что такое эрадикация – схема лечения
Эрадикация – что это такое, цели и задачи терапии, использование медикаментов и народных рецептов, диета
ВрачмедикПоиск Найти
ВКонтакте- Обследования и анализы
- МРТ
- Анализ крови
- Анализ мочи
- УЗИ
- Флюорография
- Здоровье от А до Я
- Гинекология
- Ревматология
- Проктология
- Онкология
- Гастроэнтерология
- Неврология
- Урология
- Отоларингология
- Дерматология
- Маммология
- Терапия
- Флебология
- Травматология
- Эндокринология
- Хирургия
- Пульмонология
Бактерия helicobacter pylori, эрадикация хеликобактер пилори
В последнее время словосочетание «Хеликобактер пилори» у всех на слуху – о данной бактерии слышно в рекламах фармацевтических препаратов, можно прочитать на форумах и т.д. Многие даже знают, что хеликобактер – причина большого количества желудочных проблем. Как именно влияет на наш организм эта бактерия?
Что такое Хеликобактер?
Еще около двух десятков лет тому назад лечение гастритов и язвенной болезни желудка основывалось на эмпирических данных, в большинстве своем оно было симптоматическим.
Настоящим прорывом в медицине стало повторное открытие в 1981 году микроорганизма Helicobacter pylori (HP), находящегося в слизистой желудка пациентов с хроническим антральным гастритом. Английский ученый Барри Маршал и австралийский патолог Робин Уоррен не только выделили хеликобактерии в отдельный от кампилобактера род, но и доказали их медицинское значение, за что в 2005 году получили Нобелевскую премию. Это открытие вошло в первые ряды ведущих медицинских достижений ХХ века, а эрадикация Helicobacter pylori (полное уничтожение бактерии) стала золотым стандартом лечения хеликобактер-ассоциированных патологий ЖКТ.
Доказано, что H. Pylori вызывает гастриты примерно у 30% населения, является причиной более чем 95% всех гастро-дуоденальных язв и в 65% случаев становится триггером развития рака желудка. В данный момент ведутся исследования по поводу роли хеликобактера в развитии неспецифического язвенного колита (болезни Крона), идиопатической хронической крапивницы, заболеваний печени и желчевыводящих путей.
Формы микроорганизма
 Хеликобактериальные заболевания относятся к кампилобактериозам, а сам микроорганизм выделен в отдельный род. Микробиология H. Pylori следующая: это грамотрицательная спиралевидная бактерия, до 3 мкм длиной и 0,5 мкм в диаметре. Она имеет 4–6 жгутиков и может довольно быстро передвигаться в густых питательных средах. Особенностью бактерии является то, что она микроаэрофильна, т.е. для ее нормального развития и существования необходимо небольшое количество кислорода, гораздо меньшее, чем в воздухе. HP вырабатывает окислительные ферменты, способна формировать защитную биопленку, спасающую от антител и агрессивной желудочной среды.
Хеликобактериальные заболевания относятся к кампилобактериозам, а сам микроорганизм выделен в отдельный род. Микробиология H. Pylori следующая: это грамотрицательная спиралевидная бактерия, до 3 мкм длиной и 0,5 мкм в диаметре. Она имеет 4–6 жгутиков и может довольно быстро передвигаться в густых питательных средах. Особенностью бактерии является то, что она микроаэрофильна, т.е. для ее нормального развития и существования необходимо небольшое количество кислорода, гораздо меньшее, чем в воздухе. HP вырабатывает окислительные ферменты, способна формировать защитную биопленку, спасающую от антител и агрессивной желудочной среды.
В неблагоприятных условиях хеликобактер пилори меняет спиралевидную форму на круглую, изменяя при этом также строение клеточной стенки, вследствие чего иммунная система человека не может узнать известный ранее микроорганизм. Такое явление называется бактериальной мимикрией.
Круглую форму невозможно культивировать в лабораторных условиях. Ее обнаруживают после антибиотикотерапии или по мере «старения» выращенных на питательных средах культур. Круглая форма более устойчива к антибактериальным препаратам, чем спиралевидная, она также обладает большей вирулентностью и канцерогенностью.
Причины хеликобактериоза и пути заражения
 Эпидемиология хеликобактерной инфекции довольна проста. Возбудитель – это антропоноз, т.е. вызывает заболевания только у людей. Бактерия передается через слизь и слюну. Заражение чаще всего происходит при очень тесных контактах, например, через поцелуи, общие столовые приборы, посуду, предметы гигиены. Исследования показывают, что патогенный микроорганизм может передаваться также фекально-оральным способом, но случается это реже, так как хеликобактер не может долго жить вне организма человека. Встречаются случаи передачи инфекции при эндоскопии, когда обследование проводится плохо стерилизованным прибором. Рост случаев передачи возбудителя отмечается в весенний и осенний период, что, связано с сезонными обострениями хронических гастродуоденальных патологий.
Эпидемиология хеликобактерной инфекции довольна проста. Возбудитель – это антропоноз, т.е. вызывает заболевания только у людей. Бактерия передается через слизь и слюну. Заражение чаще всего происходит при очень тесных контактах, например, через поцелуи, общие столовые приборы, посуду, предметы гигиены. Исследования показывают, что патогенный микроорганизм может передаваться также фекально-оральным способом, но случается это реже, так как хеликобактер не может долго жить вне организма человека. Встречаются случаи передачи инфекции при эндоскопии, когда обследование проводится плохо стерилизованным прибором. Рост случаев передачи возбудителя отмечается в весенний и осенний период, что, связано с сезонными обострениями хронических гастродуоденальных патологий.
Источник хеликобактериоза – больной как острой, так и бессимптомной формами болезни. Чаще всего это люди старше 60 лет. В группе риска также находятся лица с состояниями дефицита иммунитета. Бактерия продуцирует цитотоксины, которые проникают сквозь слизисто-бикарбонатный желудочный барьер и разрушают слизистую оболочку.
В большинстве случаев НР-инфекций клинические симптомы отсутствуют и патологические повреждения слизистой минимальны. Появление явных признаков заболевания происходит при развитии значительных нарушений иммунной защиты. При этом отмечается возникновение острого гастрита с выраженной воспалительной реакцией, которая затем переходит в хронический процесс.
Инфицирование H. pylori и повреждение слизистой верхнего отдела тонкого кишечника возможно только при наличии участков метаплазии желудочного эпителия. Доказана прямая связь между хроническим хеликобактериальным гастритом, возникновением язвенной болезни и даже раком желудка.
Симптомы хеликобактериоза
В зависимости от клинико-патологических особенностей заражения Helicobacter pylori появляются определенные симптомы, на основе которых ставится диагноз и назначается лечение. Инкубационный период составляет от нескольких суток до недели. Клинические проявления заболеваний, вызванных хеликобактером, не отличаются от других патологий ЖКТ.
По интенсивности симптоматики выделяют следующие формы HP-ассоциированных заболеваний:

- Бессимптомная – при хорошем иммунитете бактерия не вызывает дискомфорт и болевые ощущения, нарушения функций ЖКТ не особо заметны. Однако многолетнее течение латентного хеликобактериоза может в итоге привести к раку желудка.
- Острый гастрит или гастродуоденит. Большинство пациентов при этом жалуются на слабость, усталость, дискомфорт и боли в эпигастральной области, тошноту, изжогу, рвоту, запор или диарею, изменения аппетита. Часто проявляются также признаки вегето-сосудистой дистонии.
- Хронический антральный гастрит либо дуоденит. Во время обострения хронического процесса также доминируют диспепсический, интоксикационный и болевой синдромы.
- Язва желудка и/или двенадцатиперстной кишки. Клиническое течение болезни более тяжелое, связано с более глубоким поражением слизистой органов. Обострения случаются чаще, обычно возникают при иммунодефицитных состояниях, курении, алкоголизме, наркомании и других провоцирующих факторах. Язвенная болезнь довольно часто осложняется желудочными кровотечениями, перфорацией слизистой, пенетрацией в другие органы, рубцовыми деформациями.
- Другие, редко встречающиеся формы (хеликобактер-ассоциированный эзофагит, колит, энтерит, проктит). Обострения редких форм сопровождаются дисфагией (расстройством глотания), метеоризмом, запорами, диареей.
Даже когда человек является носителем хеликобактера, то есть инфекция протекает бессимптомно, это не следует оставлять без внимания. При благоприятных условиях, на фоне тяжелого иммунодефицита заболевание может перейти в манифестную форму.
При своевременной диагностике и адекватном лечении прогноз для жизни пациента в основном благоприятный. Летальные случаи возможны при запущенных и тяжелых осложнениях язвенной болезни.
Диагностика заболеваний
Для подтверждения клинического диагноза пользуются следующими методами диагностики Helicobacter pylori:
- бактериологическое исследование мазков-отпечатков и выявление бактерий с помощью иммунофлюоресценции или темнопольной микроскопии,
- культуральное выделение возбудителя,
- полимеразная цепная реакция (ПЦР) кала,
- биопсия тканей слизистой желудка и двенадцатиперстной кишки,
- серологические исследования биологического материала больного (крови, слюны), позволяющие обнаружить антитела к хеликобактеру,
- уреазный аэротест, при котором определенное содержание аммиака в выдыхаемом воздухе означает наличие НР у пациента.
Эффективным является изотопный анализ, основанный на определении в моче и выдыхаемом воздухе меченых изотопов мочевины.
Как бороться с НР-инфекциями?
Избавиться от бактерии следует в любом случае, поэтому эрадикационная терапия хеликобактер пилори назначается не только пациентам с острыми и хроническими формами болезни, но и носителям с бессимптомным течением.
Медикаментозное лечение
Эрадикация хеликобактер пилори основана на этиотропной (направленной на устранение причины) и патогенетической (предназначенной для коррекции функциональных нарушений) терапии. Для прямого воздействия на возбудителя при антральном гастрите назначают лекарства, способные убить бактерию, такие как Метронидазол или Тинидазол. При желудочных и дуоденальных язвах прописывают производные висмута, например, Вис-Нол, Гастро-норм, Де-Нол, Улькавис. Медикаменты для этиотропной терапии относятся к препаратам первой линии.
Вторую линию составляют патогенетические лекарственные средства. Характер течения язвенной болезни довольно длительный, с периодическими обострениями и высокой частотой рецидивов. Поэтому для патогенетического лечения с целью коррекции нарушенных функций поврежденных органов и нормализации обмена веществ показано применение ингибиторов протонной помпы (Омепразол, Нексиум) и Н2-гистаминорецепторов (Ранитидин, Фамотидин).

Медикаментозная терапия хеликобактера наиболее эффективна при назначении схемы лечения, которая также направлена на предотвращение рецидивов. При легком течении болезни может быть рекомендована тройная терапия – комбинация из трех препаратов, например, Де-Нола, Омепразола, Метронидазола. Показанием к назначению квадротерапии являются хронические и дефектные формы болезни. При этом используют комбинации следующих групп медикаментов:
- коллоидные субцитраты висмута – Де-Нол, Вис-Нол и др.,
- ингибиторы протонной помпы – Пантопразол, Омепразол,
- антибиотики и противопротозойные фармпрепараты – Метронидазол, Фазижин,
- макролиды – Аугментин, Кларитромицин.
Из противомикробных препаратов широкого спектра действия заменить макролиды способен Амоксициллин, но высокая чувствительность к его компонентам может стать причиной аллергии и, следовательно, противопоказанием.
Во время и после лечения обязателен контроль состояния кишечной микрофлоры для профилактики дисбактериоза.
Эффективным является назначение курса восстановительной терапии, включающего пробиотики (Бифи-форм), прокинетики (Домперидон), витаминные комплексы.
Использование монотерапии или неполноценных схем эрадикации ведет к быстрому развитию у H.pylori резистентности к антибиотикам и отсутствию терапевтического эффекта.
Народная медицина и Хеликобактер
Наряду с традиционной медикаментозной терапией, широко пользуется успехом лечение заболеваний ЖКТ и избавление от хеликобактера народными средствами. Но так как компоненты, используемые в рецептах домашней медицины, оказывают в основном симптоматическое действие, их лучше комбинировать с фармпрепаратами и применять только по рекомендации лечащего врача. При этом обязательно учитываются:
- возраст пациента – ребенку могут быть противопоказаны некоторые средства, подходящие для лечения взрослых,
- наиболее выраженные симптомы,
- секреторная функция желудка – она может быть нормальной, повышенной или сниженной,
- особенности клинического течения и стадия заболевания.
В дополнение к основной терапии, лечить НР-ассоциированные болезни ЖКТ можно с помощью отваров из цветков ромашки и календулы, средств на основе коры дуба, семян льна, алоэ, прополиса, таких трав, как зверобой и шалфей.
Диета при лечении хеликобактерной инфекции
Правильное, сбалансированное питание пациента – залог успеха терапии. Диета при хеликобактерных инфекциях направлена на смягчение болевых ощущений в области ЖКТ и повышение эффективности лечения. Чтобы предотвратить дальнейшее раздражение и повреждение слизистой желудка и двенадцатиперстной кишки, из рациона следует исключить продукты, стимулирующие выработку желудочного сока: копчености, пряности, жареные, жирные и соленые блюда, черный хлеб, богатые клетчаткой фрукты и овощи, кофе, алкоголь.

Пациентам рекомендована обволакивающая слизистую оболочку пища, слабо стимулирующая секреторную функцию желудка, например, перетертые супы из круп и овощей, отварная рыба, паровые котлеты, молоко, яйца, белые сухарики, некрепкий чай, щелочная вода без газа.
Соблюдение лечебного диетического питания в комплексе с терапевтическими мероприятиями приведет к более быстрому улучшению состояния пациента.
Профилактика хеликобактериоза
В качестве меры предосторожности, чтобы минимизировать риски заражения НР-инфекцией, следует должным образом соблюдать правила гигиены – не пользоваться общей посудой, тщательно мыть руки перед приемом пищи, использовать индивидуальные гигиенические средства. Профилактика заболеваний, вызванных хеликобактером, включает в себя корректировку способа жизни. Важно избегать физических и психических перегрузок, проводить санацию очагов возможной инфекции, рационально питаться.
Кроме того, при выявлении данной инфекции в семейном кругу, целесообразно провести эрадикацию всем членам семьи. Через 2–3 месяца после успешной терапии хеликобактериоза желательно снова пройти исследование, например, дыхательный тест, в качестве профилактики повторного инфицирования.
 Загрузка…
Загрузка…Что такое эрадикационная терапия?
Эрадикационная терапия назначается для борьбы с таким уникальным и недавно изученным микроорганизмом, как бактерия Хеликобактер Пилори. Согласно исследованиями последних десятилетий, именно она в большинстве случаев связана с развитием у людей язвенного заболевания. Если раньше считалось, что проблема заключается только в неправильном питании, режиме отдыха и активности, частого употребления спиртных напитков, плохой экологической ситуации, то сейчас ученые и врачи установили, что спровоцировать развитие язвы желудка может именно эта бактерия. Терапия эрадикационного типа представляет собой комплекс стандартных процедур, которые помогут устранить этот микроорганизм и восстановить работу органов пищеварения.
Диагностика заболевания
Прежде чем приступать к эрадикационной терапии, необходимо выяснить, вызвана ли язвенная болезнь именно наличием микроорганизма хеликобактер пилори. Только после этого можно начинать применять эрадикацонные схемы. Особенно это касается подростков, т. к. большое количество антибиотиков может навредить здоровью. Основная цель при диагностировании — это выяснить причины, почему симптомы проявились, а также определить наличие этой бактерии.
Если у ребенка имеются боли абдоминального характера, тесты для выявления бактерии не рекомендуется осуществлять. Такие тесты необходимо провести тем людям, у которых в анамнезе есть пометки о раке желудка его родственников. Кроме того, тесты назначаются при анемии рефрактерального железодефицитного типа (но при условии исключения других факторов, которые спровоцировали это заболевание). Несмотря на многочисленные исследования, пока не найдены подтверждения того, что этот микроорганизм может вызывать пародонтит, отит, синдром резкой детской смертности, низкий рост, аллергические реакции пищевого характера. Однако, подозрения все же имеются, так что дальнейшие исследования проводятся.
Сама же методика тестирования будет зависеть от некоторых факторов. Обязательно необходимо сделать биопсию желудка (точнее, его антральной зоны). В дальнейшем проводится анализ гистологического типа. Первоначальный диагноз основывается на положительном результате этого исследования, на положительном ответе при тесте на уреазу. В качестве альтернативного варианта можно использовать культурное обследование, но результат тоже будет положительным.
Если применять неинвазивные методики, то подойдет дыхательный С-уреазный тест. Этот вариант является надежным для выявления того, состоялась ли эрадиация бактерии. В качестве еще одного неинвазивного метода можно использовать анализ кала на иммуноферменты. Он тоже является надежным и точным. А вот те тесты, которые основываются на поиске антител к этой бактерии в крови, сыворотке, слюне или моче, наоборот, не считаются такими надежными.
Показаниями к проведению эрадикацонной терапии является наличие язвенной болезни, которая вызвана инфицированием микроорганизма хеликобактер пилори. Если такого заболевания у пациента нет, но все тесты, биопсия и исследования выявили наличие такой инфекции, то проведение эрадиационной терапии не является обязательным, однако, все же ее можно применить.
Комплексная терапия
Микроорганизм хеликобактер пилори был открыт еще в 1983 году Уореном Р. и Маршаллном Б. Именно они определили, что эта бактерия является возбудителем язвенного заболевания, которое развивается в кишечнике и желудке. Для борьбы с этой бактерией разработаны специальные схема эрадикации.
Сейчас нет никаких сомнений в том, что наличие язв в желудке и кишечнике связано именно с активностью этой инфекции на слизистых оболочках. Для лечения подбирается комплексная терапия, которая помогает полностью освободиться от влияния инфекции, а само количество бактерий сводится к минимуму. Благодаря этому рецидивы заболевания практически не появляются, но для того потребуется пройти не 1 курс лечения. Сейчас проводятся исследования, которые указывают на связь такой бактерии с прочими болезнями органов пищеварения, анемией, респираторными, аллергическими болезнями.
Маастрихтский консенсус — это известный международный документ, которые регулирует применение эрадикационной терапии. Это соглашение известно всем гастроэнтерологам.
На данный момент регулирование диагностики и лечения всех заболеваний, которые могут быть вызваны микроорганизмом хеликобактер пилори, осуществляется благодаря уже 4 консенсусу. Он принят в 2010 году. В странах Европы и Америки, где постоянно велись разработки препаратов против этого микроорганизма, наблюдается спад в появлении язвенных болезней и гастрита у населения. То же касается и рака желудка.
Эрадикационная терапия основывается на том, что комбинируются различные препараты. Ингибиторы помпы помогают блокировать некоторые ферменты, что приводит к проблемам энергетического баланса микроба. Повышается уровень кислотности в желудке, и создаются прекрасные условия для действия антибиотиков. Соли висмута накапливаются в микроорганизме, а потом мешают работе его системы ферментов. В итоге такое действие помогает иммунитету справиться с инфекцией.
Наиболее часто применяемой считается группа антибиотиков, которые тоже применяются при эрадикации. Микроорганизм постоянно становится устойчивым к препаратам, которые содержат именно антибиотики, так что эффективность эрадикации из-за этого падает. Эта проблема становится актуальной каждое десятилетие. Такая тенденция связана с появлением на фармацевтическом рынке препаратов низкого качества, постоянным самолечением, неправильной дозировкой и комбинацией медикаментов, сокращением курса лечения.
Схема эрадикационной терапии
Схемы эрадикационной терапии направлены на достижение ряда целей.
Сейчас выделяют 2 основные методики. При маастрихтской схеме лечебные процедуры должны подчиняться некоторым требованиям. Во-первых, они должны быть экономичными.
Вся схема подчиняется этому принципу и отличается своей экономичностью. Во-вторых, поддерживать эрадикацию требуется на высоком уровне, причем, всегда. В-третьих, такая схема отличается своей простотой и комфортностью, так что она очень удобна для людей. Кроме того, при использовании именно этой схемы будет полностью отсутствовать воздействие штаммов бактерии хеликобактер пилори, которые стали резистентными к процедурам (точнее, к их частоте проведения).
Еще одним плюсом считается то, что побочные эффекты практически не появляются, зато такая терапия будет воздействовать не только на микроорганизм, но и на язвенные процессы.
Чтобы достичь желаемого результата, в ходе схемы постоянно проводится совершенствование и коррекция процедур и решений, которые признаны на международной конференции. Сейчас разработана 3- и 4-компонентные методики, которые помогают бороться с микроорганизмом.
Трехкомпонентная терапия эрадикационного типа
Тройная терапия хеликобактер имеет 2 типа. Во-первых, она может проходить с упором на использование препаратов, которые содержат висмут. Во-вторых, в основе будут лежать ингибиторы протонной помпы для клеток париетльного типа. В первом случае лечение язвенного заболевания включает использование висмута, который будет назначаться в форме галлата, субцитрата или субсалицилата коллоидного типа. Дозировка составляет не более 120 мг. Кроме того, врачи назначают больному метронидазол. Дозировка составляет не более 250 мг. Этот препарат можно заменить тинидазолом. Дополнительно применяется тетрациклин, но его необходимо использовать только строго по 0,5 г. Все эти медикаменты применяются не менее 4 раз в день, учитывая дозировку. Курс составит примерно неделю.
Во втором случае врачи назначают омепразол по 20 мг. К нему нужно добавить метронидазол. Последний применяется трижды в день по 0,4 г. Назначается и еще один препарат из группы антибиотиков — кларитромицин. Его используют по 250 мг 2 раза за сутки. Можно использовать амоксициллин (1 г дважды в утки), кларитромицин (2 раза в день по 0,5 г) и пантопразол (по 40 мг). Когда назначаются ингибиторы протонной помпмы, то их необходимо использовать дважды в день. Врач может заменить пантропразол ланопропазолом. В таком случае доза составит 0,3 г 2 раза в день. Такая терапия продолжается неделю.
В 85 % всех случаев терапия против хеликобактер пилори является успешной.
Однако, это совсем не означает, что микроорганизм будет полностью уничтожен. Когда человек принимает препараты антибактериальной группы, то количество бактерий быстро уменьшается, что покажут взятые материалы для анализа. После того как терапия будет окончена, численность микроорганизмов может быстро восстановиться, так что потребуется еще один курс приема медикаментов.
Четырехкомпонентная терапия эрадикационная терапия
Если 3-компонентная схема не дала положительного результата, то необходимо приступить к методике, которая включает 4 компонента. Обязательно в этом случае назначается висмут. Его необходимо использовать 4 раза в день по 120 мг. Кроме этого, схема подразумевает применение пары антибиотиков. К примеру, можно совместить тетрациклин с метранидазолом или тетрациклин с тинидазолом. Все средства придется принимать по 4 раза в сутки.
Дозировка для тинидазола и метронидазола составляет 0,25 г, а для тетрациклина — 0,5 г. Предусмотрено применение медикаментов, которые относятся к группе ингибиторов протонной помпы. Для данной схемы можно применять пантропразол (0,04 г), омепразол (0,02 г) или лансопразол (0,03 г). Необходимо выбрать одно из этих средств. Прием назначается 2 раза в сутки. В целом курс эрадикации составляет примерно неделю.
Когда производится выбор препаратов из группы антибиотиков, обязательно необходимо учесть статистические данные по резистентности микроорганизма хеликобактер пилори к различным веществам. Менее устойчивой эта бактерия является к тетрациклину и амоксициллину. Иногда к кларитромицину резко возрастает устойчивость бактерии.
Практически отсутствует чувствительность к метронидазолу. Новые исследования показали, что в терапии против хеликобактер пилори необходимо применять новые разработанные препараты. К примеру, подойдут левофлоксацин или рифабутин. Чтобы язвы и эрозии на слизистых оболочках желудка начали быстрее заживать, можно применять цетраксат или софалькон.
Эрадикационная терапия язвенной болезни является иногда практически единственным вариантом, который поможет уничтожить микроорганизм и устранить влияние хеликобактер пилори на слизистые и мышечные слои желудка. Очень часто человек думает, что язва вызвана неблагоприятными факторами для организма и его пищеварительных процессов, а на самом деле виной появления язв в желудке практически всегда считается именно этот микроорганизм. Эрадикационные мероприятия помогут нивелировать влияние этой инфекции.
Если не лечить заболевание и игнорировать эти микроорганизмы, то в дальнейшем они вызовут не только язвы, но и колит, гастрит и прочие болезни органов желудочно-кишечного тракта.
Эволюция в эрадикационной терапии НР-ассоциированных заболеваний. Выход за рамки стандартов? | Успенский Ю.П., Фоминых Ю.А., Иванов С.В., Менакер И.О.
Статья посвящена эрадикационной терапии НР-ассоциированных заболеваний
ВведениеОдним из наиболее «популярных» в гастроэнтерологии микроорганизмов, своего рода «притчей во языцех», является Helicobacter pylori. Установлено, что H. pylori выявляется приблизительно у 30–35% населения в детском возрасте и у 50–85% во взрослой популяции [1–5]. В то же время необходимо отметить, что H. pylori-ассоциированные заболевания развиваются не чаще 10–20% случаев [6]. Это наблюдение объясняется тем, что популяция H. pylori отличается крайне высокой генетической гетерогенностью, а ее штаммы значительно отличаются по вирулентности, следовательно, не все из них способны вызвать клинические проявления заболеваний [7]. Следует сказать, что даже инфицирование цитопатогенными штаммами отнюдь не означает фатальной неизбежности развития заболевания, существенное значение принадлежит особенностям макроорганизма, реализации других патогенетических факторов. Тем не менее уверенно доказано, что данный микроорганизм увеличивает риск развития язвенной болезни (ЯБ) и гастрита, является канцерогеном первого порядка и может способствовать формированию новообразований желудка (MALT-лимфома, аденокарцинома). И, несмотря на то, что микробная теория развития поражений гастродуоденальной области как уникальная и единственная не выдерживает критики с позиций классического учения о развитии болезни (в отношении H. pylori не выполняются такие постулаты Коха, как 100% инфицированность заболевших, отсутствие развития заболевания при заражении микробной культурой в эксперименте), суждения о протективной роли бактерии также остаются бездоказательными. Вполне обоснованным является высказывание одного из ведущих хеликобактериологов мира Д. Грэхема: «Хороший хеликобактер – мертвый хеликобактер» (разумеется, в рамках применения данной максимы у больных и в группах лиц повышенного риска, а не у всей человеческой популяции в целом). Таким образом, клиническая и научная составляющие диктуют необходимость проведения эрадикационной терапии.
Принято подразделять показания к проведению эрадикационной терапии на абсолютные и относительные (табл. 1). Традиционно в клинической практике используются стандартные схемы антихеликобактерной терапии (АХБТ), в состав которых входят ингибиторы протонной помпы (ИПП) и антибактериальные препараты.
![Таблица 1. Показания к проведению эрадикационной терапии [8] Таблица 1. Показания к проведению эрадикационной терапии [8]](/800/600/https/www.rmj.ru/upload/medialibrary/3fd/3fd0ad022dc3b0cf931fb1513d29baa0.png)
Как известно, эрадикацию инфекции H. pylori более 80% принято считать успешной. Зачастую данного положительного и эффективного результата практикующим врачам удается достичь не после первого и порой даже не после второго курса АХБТ. По-прежнему существует ряд проблем, приводящих к снижению эффективности АХБТ. К основным причинам, способствующим уменьшению процента успешной эрадикации, относятся:
1. Рост резистентности H. pylori к антибиотикам.
2. Побочные эффекты ИПП и антибактериальных препаратов.
3. Низкий уровень комплаентности и нежелание пациента принимать антибиотики.
Отмечено, что повышение резистентности H. pylori к антибиотикам приводит к катастрофическому уменьшению эффективности эрадикации – с 80–90% до 30–60% [9]. Одним из основных факторов, оказывающих негативное влияние на успех АХБТ, является характерная для многих стран тенденция к росту резистентности микроорганизма к кларитромицину – важнейшему компоненту стандартной тройной схемы эрадикации 1-й линии. Рекомендации III Маастрихтского консенсуса предписывают использование кларитромицина в схемах эрадикационной терапии 1-й линии, если резистентность H. pylori к этому антибиотику в данном регионе не превышает 15–20% [10]. Суммируя результаты 20 европейских исследований, в которых проведена оценка результатов стандартной тройной терапии 1-й линии, включавшей ИПП, амоксициллин и кларитромицин у 2751 пациента, можно заключить, что в случае чувствительности штаммов эрадикация достигается в среднем у 87,8%, а при устойчивости к кларитромицину – только у 18,3% пациентов [11], а по данным некоторых авторов, в условиях резистентности к кларитромицину процент эрадикации снижается даже до 14,3% [12]. В рекомендациях IV Маастрихтского консенсуса определено, что для регионов с высокой и низкой резистентностью H. pylori к кларитромицину рекомендованы разные схемы терапии как 1-й, так и 2-й линии (табл. 2).
![Таблица 2. Схемы, рекомендуемые для эрадикации H. pylori [8] Таблица 2. Схемы, рекомендуемые для эрадикации H. pylori [8]](/800/600/https/www.rmj.ru/upload/medialibrary/f47/f47b812d5868f2ce991d61b437b2f3dd.png)
Резистентность H. pylori к антибиотикам в России также активно изучается. В большинстве отечественных исследований прослеживается тенденция к росту резистентности микроорганизма к кларитромицину, что согласуется с известными общемировыми данными (табл. 3).
![Таблица 3. Результаты исследований по оценке резистентности H. pylori в России [13, 14] Таблица 3. Результаты исследований по оценке резистентности H. pylori в России [13, 14]](/800/600/https/www.rmj.ru/upload/medialibrary/2ce/2ceba0fa37a0d517b8d1d997c5b638ed.png)
В связи с нарастающей устойчивостью H. pylori к кларитромицину и другим антибиотикам, а также с наличием риска развития резистентности к новым антибактериальным препаратам, использующимся в лечении хеликобактериоза, поиск и разработка новых схем терапии очень актуальны.
Одним из наиболее перспективных направлений оптимизации схем эрадикационной терапии является дополнительное использование в ее составе пробиотиков, возможность применения которых указана в общепринятых стандартах лечения инфекции H.pylori: IV Маастрихтское соглашение, рекомендации Российской гастроэнтерологической ассоциации по диагностике и лечению H. pylori у взрослых (2013), V Московское соглашение – Стандарты диагностики и лечения кислотозависимых и ассоциированных с Helicobacter pylori заболеваний (2013) [8, 15–17].
Дополнительное к стандартной эрадикационной терапии назначение пробиотиков повышает комплаентность, снижает частоту и выраженность побочных эффектов (дисбиоз кишечника, антибиотик-ассоциированная диарея), повышает эффективность эрадикации бактерии за счет прямого антагонистического влияния на H. pylori и повышения иммунного ответа организма человека [18–21].
В последнее время особое значение стало придаваться поиску принципиально нового решения по оптимизации эрадикационной терапии. Группой немецких исследователей был разработан препарат на основе инактивированных клеток пробиотических бактерий Lactobacillus reuteri DSMZ 17648 (Pylopass™), выделенных и переработанных биотехнологическим путем. Важно подчеркнуть, что Lactobacillus reuteri DSMZ 17648 – специально подобранный штамм лактобацилл, обладающий уникальной способностью специфично связываться с H. pylori и образовывать коагрегаты, не влияя на другие бактерии и нормальную кишечную флору. Данное специфическое связывание снижает подвижность Helicobacter, а агрегаты патогенов перестают связываться со слизистой ЖКТ и «вымываются» из желудка, что в результате приводит к уменьшению колонизации H. pylori в слизистой оболочке желудка, снижая риск развития гастрита и ЯБ [21, 22]. Исследования эффективности препарата показали, что имеет место снижение уровня H. pylori после 2х-недельного курса приема по данным дыхательного уреазного теста. В качестве критерия оценки эффективности элиминации H. pylori использовался мочевинный дыхательный тест (МДТ): нагрузка H. pylori после 2 нед. приема Pylopass™. Установлено, что на фоне приема плацебо отмечено изменение МДТ на 3% по сравнению с исходным, а при использовании Pylopass – на 16% по сравнению с исходным [21, 23].
В России данный продукт зарегистрирован под торговым названием Хелинорм, является инновационным безрецептурным антихеликобактерным средством с принципиально новым механизмом действия [21].
Цель исследования: изучить эффективность и безопасность использования продукта Хелинорм, назначаемого с целью терапии пациентов с HP-ассоциированной ЯБ двенадцатиперстной кишки (ДПК).
Задачи исследования:
Выявить влияние продукта Хелинорм в составе комплексной эрадикационной терапии на:
– клиническую картину заболевания;
– эндоскопическую картину;
– обсемененность HP-инфекцией;
– качество жизни пациентов, принимающих Хелинорм;
– обосновать назначение Хелинорма в составе комплексной терапии.
Материал и методы
Тип исследования – проспективное когортное открытое сравнительное рандомизированное. Для распределения пациентов по группам была использована фиксированная блоковая рандомизация с переменным размером блока (Randomly Mixed Permuted Blocks). Выбор данного метода рандомизации был обусловлен необходимостью обеспечения одинакового размера групп сравнения – 1:1:1 (в процессе процедуры рандомизации использовался простой генератор случайных чисел).
В исследование включались пациенты с ЯБ ДПК, ассоциированной с инфекцией H. pylori. Согласно критериям включения, представленным ниже, пациенты имели либо ЯБ ДПК в фазе рецидива язвообразования, либо рубцовую деформацию луковицы ДПК, на фоне эрозивного бульбита или иных эндоскопических проявлений воспалительного процесса в слизистой оболочке.
Критерии включения:
– подписание информированного согласия;
– отсутствие психических расстройств и интеллектуально-мнестических нарушений;
– наличие ЯБ ДПК, ассоциированной с инфекцией H. pylori, в фазе обострения на момент включения в исследование;
– отсутствие других острых заболеваний на момент включения в исследование.
Критерии исключения:
– наличие тяжелых органических заболеваний органов пищеварения или их осложнений, например, ЯБ (признаки кровотечения из ЖКТ, перфорация, пенетрация, стеноз пилородуоденальной зоны, малигнизация), органических поражений кишечника (опухоли, дивертикулез), ОКИ, воспалительных заболеваний кишечника (болезнь Крона, язвенный колит и пр.) на момент включения в исследование;
– наличие выраженной сопутствующей патологии: недостаточность кровообращения, ХОБЛ с проявлениями дыхательной недостаточности, хроническая почечная недостаточность, хронические гепатиты различной этиологии, хроническая печеночная недостаточность;
– целиакия;
– системные заболевания соединительной ткани;
– прием стероидных препаратов;
– наличие аллергических реакций или непереносимость компонентов препарата;
– злоупотребление алкоголем;
– беременность или кормление грудью;
– невозможность или нежелание дать информированное согласие на участие в исследовании или на выполнение требований исследования;
– психические заболевания, в т. ч. ранее перенесенные, которые, по мнению исследователя, делают неприемлемым участие пациента в исследовании;
– наркомания в течение 1 года до включения в исследование;
– тяжелые судорожные расстройства в анамнезе;
– пациенты, склонные к отказу от исследования и выполнению предписаний врача;
– пациенты, участвующие в других клинических испытаниях.
В исследование были включены 60 пациентов (средний возраст – 36 лет), которые были разделены на 3 сходные по возрастному и гендерному составу группы по 20 человек.
Пациенты группы 1 (группа активного контроля) принимали следующую терапию в течение 10 дней:
– омепразол 20 мг 2 р./сут;
– кларитромицин 500 мг 2 р./сут;
– амоксициллин 1000 мг 2 р./сут;
– Де-нол 240 мг 2 р./сут.
Режим дозирования на протяжении всего периода терапии был неизменным.
Пациенты группы 2 (группа активного контроля) принимали эрадикационную терапию в течение 10 дней:
– омепразол 20 мг 2 р./сут;
– кларитромицин 500 мг 2 р./сут;
– амоксициллин 1000 мг 2 р./сут.
Режим дозирования на протяжении всего периода терапии также был неизменным.
Пациенты группы 3 (основная группа) принимали эрадикационную терапию в течение 10 дней:
– омепразол 20 мг 2 р./сут;
– кларитромицин 500 мг 2 р./сут;
– амоксициллин 1000 мг 2 р./сут;
– продукт Хелинорм по 1 капсуле 2 р./сут во время еды в течение 28 дней (начало приема исследуемого препарата, таким образом, совпадало с основным стартом терапии с применением стандартного эрадикационного комплекса и продолжалось еще 18 дней после окончания базисного курса).
В течение периода лечения проводилось динамическое наблюдение за пациентами. По окончании курса терапии всем пациентам были повторно проведены клиническое обследование, стандартизированный опрос, оценка качества жизни. Через 2 мес. от начала наблюдения пациентам выполнялось эндоскопическое исследование верхних отделов пищеварительного тракта с забором гистологического материала и уреазным тестом. Дизайн исследования представлен в таблице 4.

Конечными точками исследования были следующие: частота жалоб пациентов, частота положительных тестов на H. pylori, частота эндоскопических и гистологических изменений по данным ФГДС, значения показателей по шкалам качества жизни опросника SF-36.
Анализ полученных в результате исследования данных был проведен с помощью пакета статистических программ SPSS 17.0 (SPSS Inс., США) с использованием методов параметрической и непараметрической статистики [24–26]. Определение типа распределения данных проводилось с использованием критериев Шапиро – Уилка и Колмогорова – Смирнова. Так как фактические данные имели распределение, отличное от нормального, для статистического описания средних тенденций вариационных была использована медиана.
Для сравнения количественных признаков в динамике использовался парный критерий Вилкоксона (в зависимости от типа распределения данных). Сравнение групп наблюдения проводилось с помощью непараметрического дисперсионного анализа (критерий Краскела – Уоллиса).
Для сравнения качественных признаков в динамике использовался критерий Мак-Нимара, для сравнения частоты исходов в группах наблюдения – критерий χ2 Пирсона и его вариации (поправка Йейтса на непрерывность и точный критерий Фишера).
Уровень статистической значимости p<0,05 считался достаточным для отклонения нулевой статистической гипотезы и вывода о статистической значимости различий данных, полученных в исследовании. При проведении множественных сравнений для коррекции критического уровня статистической значимости использовалась поправка Бонферрони.
Результаты исследования
Все пациенты завершили исследование в соответствии с протоколом.
Оценка жалоб пациентов
У включенных в исследование пациентов на момент начала наблюдения наиболее распространенными жалобами были боли в животе, отрыжка, тошнота, чувство горечи во рту, урчание в животе и вздутие живота. Динамика частоты гастроинтестинальных жалоб после курса терапии представлена в таблице 5.
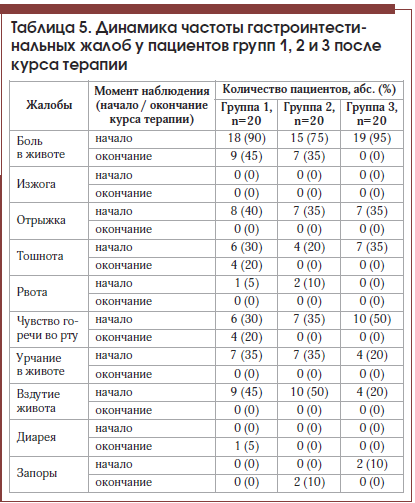
Среди жалоб наибольший интерес представлял болевой синдром как наиболее существенно влиявший на качество жизни пациентов.
При сравнении момента окончания наблюдения и момента начала терапии во всех 3-х группах наблюдалось статистически значимое уменьшение частоты встречаемости болей в животе: уровень статистической значимости составил 0,004, 0,008 и <0,001 для групп 1, 2 и 3 соответственно.
При попарном сравнении групп между собой в отношении снижения частоты встречаемости болевого синдрома статистически значимые различия были выявлены между группами 3 и 1 (χ2=12,554, p< 0,001) и между группами 3 и 2 (χ2 = 11,165, p=0,001), в то время как между группами 1 и 2 статистических различий выявлено не было (χ2=0,036, p=0,849).
Оценка качества жизни пациентов
После курса терапии статистически значимое улучшение качества жизни наблюдалось у пациентов группы 2 по шкалам GH, VT и MH и у пациентов группы 3 по шкалам GH, BP, VT и MH, в то время как у пациентов группы 1 статистически значимого изменения качества жизни не наблюдалось ни по одной из шкал. Динамика показателей качества жизни пациентов представлена в таблице 6 и на рисунках 1–3.



Сравнение динамики показателей шкал качества жизни выявило статистически значимые различия между группами только в отношении шкалы «интенсивность боли» BP (χ2=2,920, p=0,012). Близкими к статистически значимым оказались различия между группами и в отношении шкалы жизненной активности VT (χ2=5,942, p=0,051). Попарные межгрупповые сравнения значения показателя качества жизни по шкале «интенсивность боли» показали статистически значимые различия между группами 3 и 1 (U=111,5, p=0,015) и между группами 3 и 2 (U=106,0, p=0,010), в то время как группы 1 и 2 статистически не различались (U=179,5, p=0,583).
Оценка данных ФГДС
По данным ФГДС у всех включенных в исследование пациентов был диагностирован хронический H. pylori-ассоциированный гастродуоденит. У 7 (12%) пациентов имелась рубцовая деформация луковицы ДПК, у 13 (22%) пациентов имелись эрозии в луковице ДПК, у всех пациентов отмечались отечность и гиперемия слизистой ДПК.
У 22 (37%) пациентов была выявлена язва ДПК, у 14 (23%) пациентов имелся эрозивный бульбит, у остальных 24 (40%) пациентов имел место катаральный дуоденит.
На фоне проводимой терапии во всех группах пациентов отмечено улучшение эндоскопической картины – язвенный дефект зарубцевался у всех пациентов, имевших язву ДПК на момент начала наблюдения, у пациентов с эрозивным дуоденитом имевшиеся эрозии на фоне терапии эпителизировались.
При этом гиперемия и отечность слизистой оболочки желудка и ДПК сохранялись у 5 (25%) пациентов группы 1, 2 (10%) пациентов группы 2 и у 2 (10%) пациентов группы 3.
Оценка результатов гистологического метода диагностики H. pylori и уреазного теста
На момент начала исследования положительный результат гистологического исследования для диагностики H. pylori и положительный уреазный тест были выявлены у всех включенных в исследование пациентов (согласно критериям включения в исследование).
После курса лечения во всех 3-х группах отмечено статистически значимое снижение частоты выявления положительного итога диагностики H. pylori по результатам как гистологического исследования, так и уреазного теста (табл. 7, рис. 4). Тем не менее в группе, получавшей Хелинорм, после окончания курса терапии только у 1 пациента гистологическое исследование показало наличие H. pylori, в противоположность 6 и 3 пациентам групп активного контроля с добавлением Де-Нола и просто эрадикационной терапии соответственно.
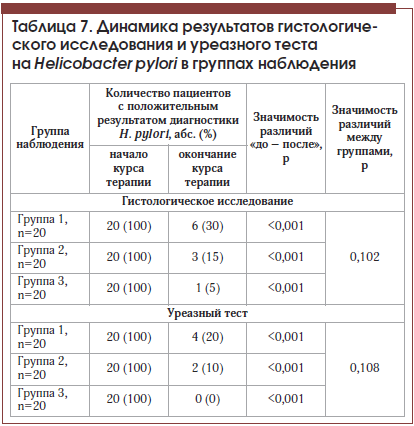
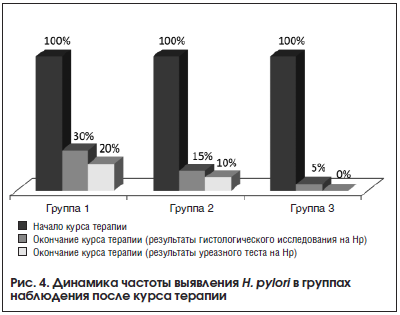
Как видно из полученных данных, у включенных в исследование пациентов результаты выявления H. pylori при использовании гистологического метода и уреазного теста не имели существенных расхождений.
Обсуждение результатов
По результатам анализа исследовательских данных, после курса эрадикационной терапии положительная клиническая динамика наблюдалась во всех 3-х группах пациентов, но при этом болевой синдром достоверно более эффективно элиминировался у пациентов группы 3, получавших исследуемый Хелинорм в дополнение к эрадикационной терапии. Также обратило на себя внимание отсутствие нежелательных явлений в группе исследуемого продукта Хелинорм, что позволяет сделать благоприятное заключение в отношении профиля его безопасности.
После использования продукта Хелинорм в комплексе с эрадикационной терапией отмечено более выраженное улучшение качества жизни по сравнению с обычно используемыми схемами эрадикации H. pylori, в первую очередь улучшение качества жизни пациентов было связано со снижением выраженности болевого синдрома.
Элиминация H. pylori по данным обоих использованных тестов (гистологического и уреазного) была более эффективной в группе пациентов, принимавших Хелинорм (95 и 100% соответственно), при этом эндоскопическая динамика была сходной во всех 3-х группах наблюдения.
Полученные результаты позволяют предположить, что включение продукта Хелинорм в стандартную эрадикационную схему лечения может повысить эффективность терапии Helicobacter pylori-ассоциированных заболеваний. По эффективности такая комбинация сравнима с группой, получавшей эрадикационную терапию + Де-Нол, а благоприятный профиль безопасности средства Хелинорм выгодно выделяет продукт среди препаратов для борьбы с H. pylori.
Заключение
Прием продукта Хелинорм вместе со стандартной эрадикационной терапией:
– повышает эффективность эрадикации H. pylori на 10%;
– оказывает положительное влияние на клиническую картину заболевания Helicobacter pylori-ассоциированной ЯБ ДПК и, в частности, способствует купированию абдоминального болевого синдрома;
– имеет хорошую переносимость и безопасность;
– улучшает показатели качества жизни, что свидетельствует о высокой медико-экономической эффективности данного подхода к лечению.
Таким образом, Хелинорм может быть рекомендован для применения у пациентов с Helicobacter pylori-ассоциированными заболеваниями.
Рекомендуемая схема приема продукта Хелинорм – по 1 капсуле 2 р./сут в течение 28 дней, на фоне эрадикационной терапии.
.
Эрадикационная терапия язвенной болезни, гастрита у детей: показания, схемы. Эрадикационная терапия
Открытая в 1982-м австралийцами Б. Маршаллом и Р. Уорреном инфекция Helicobacter pylori является виновницей язвенных болезней различных участков желудка и кишечника. Для борьбы с ней международным медицинским сообществом разработаны различные схемы эрадикационной терапии.
Опасный сосед
В настоящее время не подлежит сомнению высокая степень ассоциации пептических язв с жизнедеятельностью хеликобактер пилори в слизистой желудка. Для лечения используется комплексная эрадикационная терапия – это действия, направленные на полное освобождение от инфекции, которые сводят к минимуму вероятность рецидивирования язв.
В последующие за открытием Н. pylori годы появились сообщения о том, что эта бактерия является этиологическим фактором целого ряда других заболеваний: хронического активного антрального гастрита (типа В), атрофического гастрита (типа А), некардиального рака, MALT-лимфомы, идиопатической железодефицитной анемии, идиопатической тромбоцитопенической пурпуры и анемии, обусловленной дефицитом витамина В12. Продолжается изучение взаимосвязи спиралевидной бактерии с аллергическими, респираторными и другими внежелудочными заболеваниями.
Эрадикационная терапия у детей
Необходимость эрадикации инфекции H. pylori у детей показана в многочисленных клинических исследованиях и их метаанализах, которые послужили основой для составления и регулярного обновления международного согласительного документа, хорошо известного практикующим гастроэнтерологам как Маастрихтский консенсус. В настоящее время вопросы диагностики и лечения хеликобактер-ассоциированных заболеваний регламентируются уже четвертым Маастрихтским консенсусом, принятым в 2010 году.
В развитых странах Европы, Америки и в Австралии, где с момента открытия этиологической роли Н. pylori систематически разрабатывались и внедрялись в практику методы диагностики и лечения данной инфекции, отмечен спад заболеваемости язвенной болезнью и хроническим гастритом. Кроме того, в этих государствах впервые за десятилетия наметилась тенденция к снижению заболеваемости раком желудка, чему также способствует эрадикационная терапия.
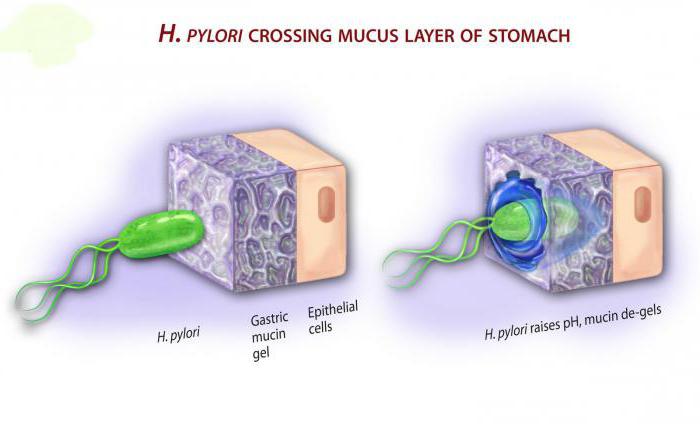
Загадочная бактерия
На основании результатов многочисленных рандомизированных плацебо и сравнительных исследований определена эффективность пробиотических средств при различных клинических ситуациях, в том числе и при хеликобактерной инфекции у детей. Однако, несмотря на некоторые достижения в понимании действия пробиотиков на бактерию H. pylori, ее тонкие механизмы остаются малоизученными.
Основным ингибирующим и бактерицидным фактором Lactobacillus является молочная кислота, которую они производят в больших количествах. Молочная кислота ингибирует активность уреазы H. pylori и, как предполагают, оказывает свое антимикробное действие за счет снижения рН в пространстве люмена желудка. Однако было установлено, что молочная кислота, которая производится клетками слизистой желудка (СОШ), способствует росту колонии H. pylori. Кроме молочной кислоты лактобактерии и некоторые другие пробиотические штаммы продуцируют антибактериальные пептиды.
Комплексная терапия
Концепция эрадикационной терапии базируется на комбинировании препаратов. ИПП (ингибиторы протонной помпы) блокируют фермент уреазу и накопление энергии внутри H. pylori, а также повышают pH на слизистой желудка, создавая условия для действия антибактериальных препаратов. Соли висмута, скапливаясь в бактерии, мешают ферментной системе патогена, позволяя иммунной системе ребенка эффективнее справляться с «вторженцем». Наконец, самой разнородной является группа антибактериальных препаратов.
Эрадикационная терапия при язвенной болезни у детей (как и при гастрите) часто предполагает использование нитроимидазолов, макролидов, лактамов, тетрациклина и нитрофуранов. Хеликобактер вырабатывает устойчивость именно к антибактериальным компонентам, что снижает эффективность эрадикационной терапии. И актуальность этой проблемы растет с каждым десятилетием.
Резистентность к антибиотикам
Выработка устойчивости к антибиотикам – общая черта, присущая всем патогенным микроорганизмам. Это эволюционный механизм, который обеспечивает их выживание в изменяющихся условиях. Резистентность Н. pylori подразделяют на:
- Первичную (следствие предшествующего лечения).
- Вторичную (приобретенная мутация микроорганизма, которую «подстегивает» эрадикационная терапия).
Причины устойчивости к лечению
В числе главных причин формирования приобретенной резистентности H. pylori ученые называют:
- Рост назначений антибактериальных препаратов этих же групп по другим показаниям.
- Бесконтрольное самолечение антибиотиками в странах, где они продаются без рецепта.
- Неадекватно назначенная эрадикационная терапия гастрита или язвы (назначение низких доз антибиотиков, сокращение курсов лечения, неправильная комбинация в схеме препаратов).
- Несоблюдение предписаний врача пациентами.
- Появление на фармацевтических рынках препаратов низкого качества.
В результате всего перечисленного рост резистентности H. pylori сокращает и без того ограниченное количество антибиотиков, активных в отношении данного микроорганизма.
Проблема антибиотикорезистентности особенно актуальна для детей, которым показана эрадикационная терапия язвенной болезни. Чаще всего они инфицируются первично резистентными микроорганизмами от родителей и близких родственников.
Кроме того, в детской популяции особенно распространено необоснованное применение антибиотиков для лечения других заболеваний, чаще всего респираторных инфекций, что также способствует селекции первично устойчивых штаммов. Нарушение режима эрадикационной терапии, как и у взрослых, приводит к формированию вторичной резистентности. Развитие устойчивости патогенна также связано с мутациями разных генов хеликобактерии.

Диагностика
Эрадикационная терапия у подростков начинается после всеобъемлющей диагностики. Первичной целью обследования ребенка, у которого наблюдаются гастроинтестинальные симптомы, является определение причины возникновения этих симптомов, а не только наличия H. pylori. При этом проведение тестов на выявление хеликобактера не рекомендуется у детей с функциональной абдоминальной болью. Можно рассмотреть целесообразность проведения тестов на выявление патогена:
- у пациентов, в семейном анамнезе которых есть рак желудка у родственника первой степени родства;
- при рефрактерной железодефицитной анемии (если исключены другие причины заболевания).
Не хватает достаточных практических доказательств причастности H. pylori к среднему отиту, инфекциям ВДП, пародонтиту, пищевой аллергии, синдрому внезапной детской смерти, идиопатической тромбоцитопенической пурпуре, низкому росту. Но подозрения есть.
Диагностические тесты
Эрадикационная терапия при язвенной болезни и гастрите определяется диагностическими тестами. Методика тестирования зависит от многих факторов:
- Для диагностики хеликобактера при проведении эзофагогастродуоденоскопии рекомендуется провести биопсию антрального отдела желудка для дальнейшего гистологического анализа.
- Рекомендуется, чтобы первоначальный диагноз H. pylori был основан на следующих данных: положительное гистологическое исследование и положительный тест на уреазу (как альтернатива – положительные результаты культурального исследования).
- C-уреазный дыхательный тест является надежным неинвазивным методом для определения того, состоялась ли эрадикация H. pylori.
- Иммуноферментный анализ кала также является надежным неинвазивным тестом для определения того, состоялась ли эрадикация бактерии.
- Тесты, основанные на выявлении антител к хеликобактерии в сыворотке, цельной крови, мочи и слюне, наоборот, надежными не являются.
Показания
Какие нужны показания к эрадикационной терапии:
- При наличии язвенной болезни и инфицировании хеликобактером.
- Если язвенной болезни нет, а инфекцию H. pylori выявили по результатам исследования образцов, взятых с помощью биопсии, эрадикация возбудителя необязательна, но возможна.
Кстати, применительно к детям не рекомендуется применять принцип «диагностируй и лечи», необходима определенная осторожность.
Эпидемиология
Определение уровня резистентности в отдельно взятой стране, регионе или популяции – сложная задача, требующая больших материальных и человеческих ресурсов. Еще сложнее сравнивать данные, полученные в разных странах из-за различий в методологии исследований. Например, по материалам длительных исследований в Европе (2003-2011 гг.), устойчивость патогена к «Кларитромицину» составляла от 2 до 64 % в разных странах. По данным российских авторов, резистентность к «Кларитромицину» варьируется от 5,3 до 39 %.
Из препаратов, которые применяются в схемах эрадикации, наименьшую устойчивость к резистентности формирует амоксициллин, а наибольшую – «Метронидазол». Продолжает расти устойчивость Н. pylori к препарату «Кларитромицин».
Проблемы использования «Метронидазола» и «Фуразолидона»
Эрадикационная терапия раньше часто проводилась вышеуказанными препаратами. Однако рост приспосабливаемости бактерий к «Метронидазолу» резко снизил эффективность схем лечения с его использованием. «Метронидазол» по этой причине во многих странах сегодня исключен из схем лечения.
Альтернативой «Метронидазолу» стали препараты нитрофуранового ряда, в частности «Фуразолидон». Эффективность эрадикации на его основе в комбинации с висмутом составляет 86 %. Однако «Фуразолидон» токсичен – в детской терапии во многих клиниках он не используется. К числу недостатков «Фуразолидона» относятся гепато-, нейро- и гематотоксичность, подавление микрофлоры, неудовлетворительные органолептические свойства. Для достижения требуемой концентрации действующего вещества в организме данный препарат приходится принимать четыре раза в день. Эти качества «Фуразолидона» значительно снижают полезное действие всей схемы лечения и, как следствие, эффективность эрадикации.
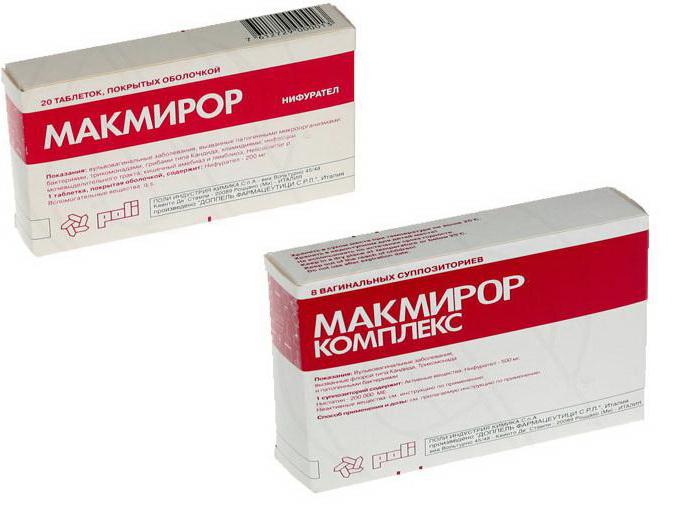
Препарат нового поколения
Многие лаборатории фармацевтических фирм разрабатывают менее токсичные, но эффективные против хеликобактера лекарства. Настоящим прорывом стал препарат «Макмирор», содержащий в качестве действующего вещества нифуратель. Современная альтернатива «Фуразолидону» разработана и синтезирована научно-исследовательской компанией Polichem (Италия). «Макмирор» обладает широким спектром антибактериального, противогрибкового и антипротозойного действия. Эрадикационная терапия для детей стала более безопасной.
Использование «Макмирора» позволяет усовершенствовать существующие схемы эрадикации хеликобактера у детей, повысить их эффективность и безопасность. «Нифуратель» включен в обновленные протоколы лечения H. pylori – ассоциированного хронического гастрита, гастродуоденита и язвенной болезни у детей.
Использование препарата «Макмирор» сопровождается высоким комплайенсом, так как благодаря двенадцатичасовому периоду полувыведения он может назначаться два раза в сутки. Применяется у детей с шестилетнего возраста, суточная доза при лечении лямблиоза и в схемах эрадикации хеликобактера – 30 мг в сутки на килограмм массы ребенка.
Схемы эрадикационной терапии
Примеры терапии первой линии. Однонедельные тройные схемы с препаратом висмута:
- Коллоидный субцитрат висмута (КСВ) дополняется «Амоксициллином» («Рокситромицином») или «Кларитромицином» («Азитромицином») плюс «Нифуратель» («Фуразолидон»).
- Во второй схеме «Нифуратель» заменяется «Фамотидином» («Ранитидином»), остальные препараты те же.
Однонедельные тройные схемы с ингибиторами протонной помпы:
- «Омепразол» («Пантопразол») дополняется амоксициллином или «Кларитромицином» плюс «Нифуратель» («Фуразолидон»).
- То же самое, но «Нифуратель» заменяется на КСВ.
В качестве лечения второй линии применяется эрадикационная терапия с четырьмя компонентами: КСВ работает вместе с «Омепразолом» («Пантопразолом»), «Амоксициллином» (или «Кларитромицином») и «Нифурателем» («Фуразолидоном»).
Дозы
Протоколами также регламентируются дозы препаратов, которые следует использовать в эрадикационных схемах у детей (ежесуточно на килограмм веса):
- КСВ – 48 мг (максимум 480 мг в сутки).
- «Кларитромицин» – 7,5 мг (максимум 500 мг).
- «Амоксициллин» – 25 мг (максимум 1 г).
- «Рокситромицин» – 10 мг (максимум 1 г).
- «Фуразолидон» – 10 мг.
- «Нифуратель» – 15 мг.
- «Омепразол» – 0,5-0,8 мг (максимум 40 мг).
- «Пантопразол» – 20-40 мг (без учета веса).
- «Ранитидин» – 2-8 мг (максимум 300 мг).
- «Фамотидин» – 1-2 мг (максимум 40 мг).
Особенности лечения
Какое лечение следует применять в той или иной ситуации:
- Детям, инфицированным H. pylori и имеющим в семейном анамнезе рак желудка у родственника первой степени родства, можно назначить эрадикационную терапию.
- Рекомендовано в разных регионах проводить надзор за распространенностью антибиотикорезистентных штаммов Helicobacter.
- В регионах/популяциях, в которых распространенность резистентности Helicobacter к «Кларитромицину» высока (> 20 %), рекомендуется перед началом тройной терапии, предусматривающей применение «Кларитромицина», определять чувствительность к этому антибиотику.
- Рекомендуемая продолжительность тройной терапии – 7-14 суток. При рассмотрении этого вопроса следует учесть расходы, приверженность к лечению и побочные эффекты.
- Для оценки результатов проведенной эрадикационной терапии рекомендуется применить надежные неинвазивные тесты спустя 4-8 недель после лечения.
Если не помогло
В случае неэффективности лечения рекомендуется следующие подходы:
- Эзофагогастродуоденоскопия с последующим культивированием и определением чувствительности к антибиотикам, включая альтернативные, если это не было сделано перед лечением.
- Флуоресцентная гибридизация in situ (FISH) для определения резистентности к «Кларитромицину» с применением образцов, взятых при первой биопсии и залитых в парафин, если определение чувствительности к этому антибиотику не проводилось перед лечением.
- Модификация лечения: добавить антибиотик, назначить другой антибиотик, добавить препарат висмута и/или повысить дозу, и/или увеличить продолжительность терапии.
Вывод
Эрадикационная терапия – это действенное (порой единственное) средство борьбы с опаснейшей бактерией Helicobacter pylori, способной спровоцировать язвы, гастриты, колиты и прочие болезни ЖКТ.
Что такое патоген? 4 типа и пути распространения болезни
Патоген – это организм, вызывающий болезнь.
Естественно, ваше тело полно микробов. Однако эти микробы вызывают проблему только в том случае, если ваша иммунная система ослаблена или им удается проникнуть в обычно стерильную часть вашего тела.
Патогены разные и могут вызывать заболевание при попадании в организм.
Все, что патогену необходимо для процветания и выживания, – это хозяин. Как только патоген обосновывается в организме хозяина, ему удается избежать иммунных реакций организма и использовать ресурсы организма для репликации, прежде чем покинуть организм и распространиться на нового хозяина.
Патогены могут передаваться несколькими путями в зависимости от типа. Они могут распространяться при контакте с кожей, жидкостями организма, частицами в воздухе, контакте с фекалиями и прикосновением к поверхности, к которой прикасается инфицированный человек.
Существуют разные типы патогенов, но мы сосредоточимся на четырех наиболее распространенных типах: вирусах, бактериях, грибах и паразитах.
Вирусы
Вирусы состоят из фрагмента генетического кода, такого как ДНК или РНК, и защищены белковой оболочкой.После заражения вирусы проникают в клетки-хозяева вашего тела. Затем они используют компоненты клетки-хозяина для репликации, производя больше вирусов.
После завершения цикла репликации эти новые вирусы высвобождаются из клетки-хозяина. Обычно это повреждает или уничтожает инфицированные клетки.
Некоторые вирусы могут какое-то время бездействовать, прежде чем снова размножаться. Когда это происходит, кажется, что человек излечился от вирусной инфекции, но снова заболевает.
Антибиотики не убивают вирусы и поэтому неэффективны при лечении вирусных инфекций.Иногда можно использовать противовирусные препараты, в зависимости от вируса.
Бактерии
Бактерии – это микроорганизмы, состоящие из одной клетки. Они очень разнообразны, имеют множество форм и особенностей и способны жить практически в любой среде, в том числе внутри и на вашем теле. Не все бактерии вызывают инфекции. Те, что могут, называются патогенными бактериями.
Ваше тело может быть более подвержено бактериальным инфекциям, когда ваша иммунная система подвергается опасности из-за вируса.Болезненное состояние, вызванное вирусом, позволяет нормально безвредным бактериям становиться патогенными.
Антибиотики используются для лечения бактериальных инфекций. Некоторые штаммы бактерий стали устойчивыми к антибиотикам, что затрудняет их лечение. По данным Всемирной организации здравоохранения (ВОЗ), это может произойти естественным путем, но также и из-за чрезмерного использования антибиотиков.
Грибы
На Земле существуют миллионы различных видов грибов. Известно, что около 300 человек вызывают болезни.Грибы можно найти практически повсюду в окружающей среде, в том числе в помещении, на открытом воздухе и на коже человека. Они вызывают инфекцию, когда разрастаются.
Клетки грибов содержат ядро и другие компоненты, защищенные мембраной и толстой клеточной стенкой. Их структура может затруднить убийство.
Некоторые новые штаммы грибковых инфекций, такие как Candida aurus, оказались особенно опасными, что побудило к дальнейшим исследованиям грибковых инфекций.
Паразиты
Паразиты – это организмы, которые ведут себя как крошечные животные, живут внутри или на хозяине и питаются от хозяина или за счет него.Хотя паразитарные инфекции чаще встречаются в тропических и субтропических регионах, они могут возникать где угодно.
Три основных типа паразитов могут вызывать заболевания у человека. К ним относятся:
- простейших, которые представляют собой одноклеточные организмы, которые могут жить и размножаться в вашем теле
- гельминтов, которые представляют собой более крупные многоклеточные организмы, которые могут жить внутри или вне вашего тела и обычно известны как черви
- эктопаразиты, которые представляют собой многоклеточные организмы, которые живут или питаются вашей кожей, включая некоторых насекомых, таких как клещи и комары
Они могут распространяться несколькими путями, в том числе через загрязненную почву, воду, пищу и кровь. как при половом контакте, так и при укусах насекомых.
.Ликвидацияпатогенов – это … Что такое искоренение патогенов?
Ликвидация инфекционных заболеваний – Ликвидация – это сокращение распространенности инфекционного заболевания среди населения хозяев во всем мире до нуля [1]. Иногда его путают с элиминацией, которая описывает снижение распространенности инфекционного заболевания в регионе…… Wikipedia
Патоген – Патоген (греч. Πάθος пафос, страдание, страсть и γἰγνομαι (γεν) gignomai (gen), который я рождаю) или инфекционный агент, в просторечии, микроб или микроорганизм, такой как вирус, бактерия, прион, или грибок, вызывающий заболевание…… Wikipedia
Ликвидация полиомиелита – Глобальная ликвидация полиомиелита – это усилия общественного здравоохранения по ликвидации всех случаев инфекции полиомиелита (полиомиелита).Глобальные усилия, начатые в 1988 году и возглавляемые Всемирной организацией здравоохранения, ЮНИСЕФ и Фондом Ротари, сократили…… Wikipedia
Внезапная смерть дуба – acutie Oak Decline 240px Зараза на зараженном дубе Научная классификация Домен: Царство эукариот: Chromalveolata… Википедия
болезнь растений – ▪ патология растений Введение нарушение нормального состояния растения, которое нарушает или изменяет его жизненно важные функции.Болезни подвержены все виды растений, как дикие, так и культивируемые. Хотя каждый вид…… Universalium
Инфекционное заболевание – Классификация и внешние источники На электронной микрофотографии, окрашенной в ложный цвет, виден малярийный спорозоит, мигрирующий через эпителий средней кишки. МКБ 10… Википедия
Oidium mangiferae – O. mangiferae, поражающий листья манго Научная классификация Царство… Википедия
Вакцина – Для использования в других целях, см Вакцина (значения).Вакцина – это биологический препарат, повышающий иммунитет к определенному заболеванию. Вакцина обычно содержит агент, напоминающий болезнетворный микроорганизм, и часто производится из…… Wikipedia
Язвы цитрусовых – Xanthomonas axonopodis Научная классификация Царство: Бактерии Тип: Proteobacteria Класс: Гамма-защита… Википедия
CIA, транснациональная здравоохранение и экономическая деятельность – В этой статье рассматривается деятельность U.S. Центральное разведывательное управление занималось вопросами выживания людей, уделяя особое внимание болезням и основным потребностям, таким как вода и сельское хозяйство. TOC Деятельность ЦРУ в этой области включает подготовку Национального…… Wikipedia
болезнь животных – ▪ нечеловеческий Введение нарушение нормального состояния животного, которое нарушает или изменяет его жизненно важные функции. Обеспокоенность болезнями, поражающими животных, восходит к самым ранним контактам человека с животными и находит свое отражение…… Universalium
Физиология и патология врожденного иммунного ответа против патогенов
Клетки врожденной иммунной системы выполняют несколько функций, которые необходимы для защиты от патогенов. Некоторые клетки образуют физические барьеры, препятствующие инфекциям. Некоторые типы клеток экспрессируют различные PRR, которые распознают PAMP и DAMP, которые отвечают, продуцируя воспалительные цитокины для уничтожения микробов или инфицированных клеток. Эти клетки включают немиелоидные клетки, миелоидные клетки и некоторые лимфоидные клетки.
2.1. Немиелоидные клетки
Немиелоидные клетки включают эпителиальные клетки, фибробласты и т.д., которые в основном образуют барьер между внутренней и внешней средой. Эти клетки вырабатывают антимикробные вещества, препятствующие проникновению патогенов [1, 2]. Эти противомикробные вещества называются антимикробными пептидами (АМП), и они являются важными компонентами врожденного иммунного ответа, которые вносят вклад в первую линию защиты от инфекций [7]. У человека AMP подразделяются на три основных семейства: дефенсины (α и β), кателицидин и статины.AMP обладают широким спектром антимикробной активности, выполняя свои функции за счет электростатических взаимодействий между их положительным зарядом и отрицательным зарядом, который определенные патогены имеют на своей клеточной стенке. AMP опосредуют воспалительный ответ, обеспечивая высвобождение цитокинов, пролиферацию клеток, ангиогенез, заживление ран и хемотаксис [8]. В настоящее время продемонстрирована их синергетическая активность с антибиотиками, применяемыми в клинике. Таким образом, их исследование эффективных адъювантов в борьбе с бактериальными инфекциями продолжает изучаться [9].
2.2. Миелоидные клетки
Миелоидные клетки включают моноциты, макрофаги, дендритные клетки (ДК), нейтрофилы, эозинофилы, базофилы, тучные клетки и тромбоциты. Все эти клетки обладают специализированными функциями защиты от вторжения патогенов [2, 10].
2.2.1. Моноциты
Моноциты – это клетки, которые развиваются в костном мозге, и они попадают в кровоток для циркуляции в течение примерно 72 часов, а затем эмигрируют в различные ткани, где они дифференцируются в макрофаги или DC.Они представляют собой основной тип мононуклеарных фагоцитов, обнаруживаемых в крови, и являются членами семейства миелоидных клеток [11]. У человека моноциты подразделяются на классические и неклассические в зависимости от их поверхностной экспрессии кластера дифференцировки (CD) -14 и CD16. Классические моноциты с фенотипом CD14 + CD16 – считаются воспалительными клетками, составляющими более 92% от общего числа моноцитов. Напротив, неклассические моноциты с фенотипом CD14 + CD16 + могут устранять дебрис из сосудистой системы и производить низкие уровни провоспалительных цитокинов, а также высокие уровни противовоспалительных факторов.Несколько исследований показали, что обе субпопуляции находятся в условиях воспалительного процесса; воспалительная реакция – это постепенный процесс, который начинается с основного появления классических моноцитов, а через несколько дней появляются неклассические моноциты [12]. Среди основных функций моноцитов – их участие во врожденном иммунном ответе против патогенов и во время воспалительных процессов, при которых моноциты крови мигрируют к месту инфекции, где происходит процесс, и они созревают в макрофаги или ДК, чтобы участвовать в качестве фагоцитов, как переваривание патогенов или клеточного мусора [13].Кроме того, моноциты представляют собой антигенпрезентирующие клетки (APC), известные своим участием в антигенной презентации через главный комплекс гистосовместимости (MHC) к Т-клеткам, также участвуя в активации адаптивного иммунного ответа [14].
2.2.2. Макрофаги
Моноциты – это клетки-предшественники, которые продуцируются в костном мозге, которые мобилизуются в кровоток, а затем дифференцируются в макрофаги в месте воспаления [15]. Макрофаги представляют собой очень гетерогенную популяцию клеток, таких как эффекторные клетки врожденной иммунной системы, которые играют важную роль в защите и воспалении хозяина.В целом макрофаги можно разделить на две популяции: резидентные и воспалительные макрофаги [16]. Резидентные макрофаги обнаруживаются почти во всех тканях и способствуют их развитию, а также иммунологическому надзору, гомеостазу и восстановлению тканей [17, 18]. С другой стороны, воспалительные макрофаги происходят из циркулирующих моноцитов и быстро инфильтрируют ткани, поврежденные травмой или инфекцией. В ответ на несколько сигналов из микроокружения макрофаги могут активироваться и принимать различные функции: макрофаги M1 (классически активированные макрофаги) и макрофаги M2 (альтернативно активированные макрофаги) [19, 20].Макрофаги M1 выполняют провоспалительные функции и участвуют в защите хозяина от патогенов и опухолевых клеток [21], и считается, что они способствуют иммунному ответу Th2. Когда макрофаги M1 активируются интерфероном (IFN) -γ, колониестимулирующим фактором гранулоцитарных макрофагов (GM-CSF) или другими лигандами Toll-подобного рецептора, эти макрофаги продуцируют провоспалительные цитокины, такие как интерлейкин (IL) -1β, IL- 12, фактор некроза опухоли (TNF) -α, хемокин (мотив C – C) лиганд (CCL) -15, CCL20, хемокин с мотивом CXC (CXC) -8-11 и CXCL13 и реактивируют разновидности азота и кислорода [22] , увеличивают опосредованный комплементом фагоцитоз, поскольку их основная цель – убить внутриклеточные патогены.Напротив, макрофаги M2 связаны с ремоделированием тканей и прогрессированием опухоли и обладают иммунорегуляторным эффектом. Макрофаги M2 экспрессируют IL-10, антагонист рецептора IL-1, хемокины (например, CCL22 и CCL17), рецепторы трансформирующего фактора роста (TGF) -β, маннозу и рецепторы галактозы и обладают эффективной фагоцитарной активностью. Считается, что макрофаги M2 способствуют иммунному ответу Th3 и противодействуют воспалительному ответу и его медиаторам [23, 24].
Макрофаги обладают широким спектром поверхностных рецепторов, что дает им способность распознавать широкий спектр эндогенных / экзогенных лигандов для адекватного ответа, что имеет решающее значение для этих клеток.Эти рецепторы включают Toll-подобные рецепторы (TLR), NOD-подобные рецепторы, семейство гена, индуцируемого ретиноевой кислотой (RIG) -I, лектины и рецепторы скавенджеров, которые распознают PAMP, DAMP, чужеродные вещества и мертвые или поврежденные клетки [25 –27]. Во время воспалительного ответа патогенов макрофаги, активированные воспалительным фенотипом, продуцируют несколько медиаторов воспаления, таких как TNF-α, IL-1, IL-6 и INF-γ, которые участвуют в активации микробицидных механизмов, способствующих развитию патогена. устранение.Воспалительная реакция макрофагов состоит в основном из четырех стадий: (1) распознавание инфекционного агента через PRR макрофагов; (2) рекрутирование и размножение макрофагов в инфицированной ткани in situ; (3) устранение возбудителя инфекции; и (4) преобразование в макрофаги M2 для восстановления поврежденной ткани [28].
2.2.3. Дендритные клетки
Моноциты циркулируют в крови, костном мозге и селезенке [29, 30] и представляют собой эффекторные иммунные клетки, снабженные хемокинами и рецепторами адгезии, которые опосредуют миграцию клеток из крови в ткани во время инфекции.Моноциты продуцируют воспалительные цитокины и фагоциты, как клетки, так и токсичные молекулы. Моноциты могут дифференцироваться в воспалительные DC во время воспаления. Миграция в ткани и дифференцировка в воспалительные ДК зависят от воспалительной среды и PRR [31]. Эти PRR, включая семейство TLR, способны распознавать PAMP на поверхности бактерий, вирусов, грибов и паразитов [29].
DC представляют собой важное звено между врожденным и адаптивным иммунитетом [2]. ДК представляют собой гетерогенную популяцию антигенпрезентирующих клеток, которые имеют решающее значение для инициации и поляризации иммунного ответа.Хотя все DC способны захватывать, обрабатывать и представлять антигены Т-клеткам, подтипы DC различаются по происхождению, расположению, паттернам миграции и специализированным иммунологическим ролям [32]. В основном существуют два подтипа DC: классические DC и плазмацитоидные DC. Классические ДК – это клетки, специализирующиеся на процессинге и презентации антигенов, с высокой фагоцитарной активностью как незрелые клетки и высокой способностью продуцировать цитокины как зрелые клетки [26]. Классические CD представляют собой высоко мигрирующие клетки, которые могут перемещаться из тканей в зоны Т-клеток и В-клеток лимфоидных органов.Классические DC регулируют ответы Т-клеток как в стабильном состоянии, так и во время инфекции. Обычно они недолговечны и заменяются предшественниками, передающимися с кровью [33, 34]. С другой стороны, плазмоцитоидные ДК отличаются от классических ДК тем, что они относительно долгоживущие [35]. Плазмацитоидные ДК присутствуют в костном мозге и во всех периферических органах, и они специализируются на ответной реакции на вирусную инфекцию с помощью массивной продукции интерферонов типа I (IFN). Однако они также могут действовать как антигенпрезентирующие клетки и контролировать Т-клеточные ответы [36].
2.2.4. Нейтрофилы
У человека около 100 миллиардов нейтрофилов попадают в кровоток каждый день [37]. Нейтрофилы происходят из гемопоэтических стволовых клеток в ответ как на внеклеточные стимулы, так и на внутриклеточные регуляторы. Они происходят из линии миелоидных клеток при образовании гранулоцитов. Гранулопоэз, происходящий в костном мозге, начинается, когда миелобласты нейтрофилов (MB) развиваются в промиелоцитах (PM), характеризующихся округлым ядром и присутствием азурофильных гранул.Впоследствии они созревают в миелоциты со специфическими гранулами, созревая в метамиелоциты (ММ), клетки, состоящие из ядра с почечной формой. Метамиелоциты созревают до оболочек клеток (CB) и в сегментированных клетках (CS), также известных как полиморфно-ядерные клетки (PMN). Затем из их сегментированного ядра вызываются PMN, которые в конечном итоге попадают в кровоток [38, 39]. Нейтрофилы играют важную роль в разрешении микробных инфекций. После того, как патогены прорываются через эпителиальные барьеры, нейтрофилы становятся первой линией клеток защиты для врожденного иммунного ответа, которые привлекаются из кровотока к месту инфекции.Нейтрофилы пересекают кровеносные сосуды и мигрируют к очагу инфекции с помощью хемотаксических факторов и цитокинов, которые вырабатываются как воспалительные сигналы при повреждении тканей, вызванном вторжением патогенов. Нейтрофилы достигают места инфекции и инициируют процесс фагоцитоза за счет распознавания PAMP их рецепторами, такими как TLR. Нейтрофилы проявляют свое противомикробное действие за счет высвобождения активных форм кислорода и цитотоксических компонентов, содержащихся в их гранулах, таких как AMP [40].Точно так же нейтрофилы, использующие механизм, называемый внеклеточными ловушками (NET), состоящий из волокон ДНК, которые образуются и высвобождаются во внеклеточное пространство, используются врожденной иммунной системой для уничтожения и устранения патогенов [41]. Однако исследования показали, что сети нейтрофилов участвуют в развитии нескольких патологий [42–44]. Наконец, нейтрофилы могут также регулировать адаптивный иммунный ответ, поскольку они опосредуют подавление пролиферации Т-клеток, а также их активности. Нейтрофилы также могут стимулировать и активировать В-лимфоциты селезенки [45].
2.2.5. Эозинофилы
Эозинофилы продуцируются в костном мозге из плюрипотентных стволовых клеток, которые сначала дифференцируются в предшественников базофилов и эозинофилов, а затем дифференцируются в эозинофильную линию [46]. IL-3, IL-5 и GM-CSF особенно важны в регуляции развития эозинофилов [47–50]. Из этих трех цитокинов IL-5 является наиболее специфичным для эозинофильного клона и отвечает за избирательную дифференцировку [51] и высвобождение эозинофилов из костного мозга в периферическое кровообращение [52].IL-5 играет решающую роль в продукции эозинофилов, поскольку избыточная продукция [53, 54] и нейтрализация [55-57] этого цитокина связаны со значительным увеличением или уменьшением эозинофилии, соответственно.
Эозинофилы – это многофункциональные лейкоциты, участвующие в патогенезе многих воспалительных процессов [58], включая паразитарные гельминтозы и аллергические заболевания [59–61]. В базовых условиях большинство эозинофилов попадает в желудочно-кишечный тракт, где они обычно находятся в собственной пластинке, производство которой не зависит от продукции лимфоцитов [62].Рекрутирование желудочно-кишечных эозинофилов регулируется конститутивной экспрессией эотаксина-1 [63], хемокина, участвующего в индуцированных аллергенами ответах эозинофилов [64].
В ответ на несколько стимулов, таких как иммуноглобулины, цитокины и система комплемента, эозинофилы активируются и рекрутируются из кровотока к месту воспаления [65]. Доставка эозинофилов в участки воспаления включает различные цитокины, происходящие из иммунного ответа Th3, такие как IL-4, IL-5 и IL-13 [66, 67], молекулы адгезии (например,g., β1, β2 и β7 интегрины) [68] и хемокины (например, эотаксины) [69]. Оказавшись в очаге воспаления, эозинофилы могут модулировать иммунный ответ за счет секреции нескольких провоспалительных медиаторов, таких как IL-2, IL-6. IL-8, TGF-α / β, GM-CSF, TNF-α, INF-γ, а также хемокины и липидные медиаторы, такие как фактор активации тромбоцитов (PAF) и лейкотриен (LT) -C4 [70], которые оказывают провоспалительное действие в виде положительной регуляции систем адгезии, модуляции клеточного транспорта, активации и регуляции проницаемости сосудов, секреции слизи и сокращения гладких мышц.Кроме того, эозинофилы могут служить эффекторными клетками, которые могут вызывать повреждение тканей за счет высвобождения различных катионных белков из своих цитотоксических гранул, основного основного белка (MBP), катионного белка эозинофилов (ECP), пероксидазы эозинофилов (EPO) и нейротоксинов. из эозинофилов (EDN) [59]. Эти белки очень важны, потому что они напрямую связаны с эффекторными функциями эозинофилов. Например, ECP участвует в подавлении пролиферативных ответов Т-клеток, а синтез иммуноглобулинов В-клетками вызывает дегрануляцию тучных клеток и стимуляцию секреции слизи в дыхательных путях, а также продукцию гликозаминогликанов фибробластами человека [71], в то время как ЭПО связан с образованием активных форм кислорода и активных метаболитов азота.Эти молекулы способствуют окислительному стрессу и последующей гибели клеток в результате апоптоза и некроза [72–74].
В дополнение к множественному эффекторному действию эозинофилов, эти клетки могут инициировать антиген-специфические иммунные ответы, действуя как APC [75, 76], поскольку они могут обрабатывать и представлять различные бактериальные [77], вирусные [78], и паразитарные [79] антигены. Хотя исследования продемонстрировали прямую связь эозинофилов с паразитарными гельминтными инфекциями, была подтверждена гипотеза, что эозинофилы являются классическими эффекторными клетками в защите хозяина [80].Несколько исследований также показали, что отсутствие эозинофилов при заражении паразитическими гельминтами защищает хозяина [81], так что эозинофилы могут влиять на иммунный ответ таким образом, чтобы поддерживать хроническую инфекцию и обеспечивать выживание паразита в хозяине [82–84].
2.2.6. Базофилы
Базофилы – это клетки, происходящие из миелоидных гематопоэтических предшественников в костном мозге, и они фенотипически и функционально отличаются от других лейкоцитов, включая тучные клетки, поскольку тучные клетки находятся в тканях, в то время как базофилы находятся в кровообращении и могут быть задействованы в ткани [85–89].Базофилы обладают способностью связывать врожденный и адаптивный иммунитет, включая способность индуцировать и распространять иммунные ответы Th3 [90]. Базофилы важны при всех аллергических заболеваниях, включая анафилаксию, аллергический ринит, астму, крапивницу и пищевую аллергию. Базофилы быстро высвобождают гистамин и синтезируют LTC4, после чего иммуноглобулин (Ig) -E связывается с их рецептором FcεRI и впоследствии продуцирует цитокины Th3, такие как IL-4 и IL-13 [91–95], вызывая клинические симптомы немедленной гиперчувствительности, что также способствует реакции гиперчувствительности замедленного действия [96–99].Роль базофилов в защитном иммунитете против гельминтов хорошо известна [96, 100]. Однако в последнее время базофилы также участвуют в инициации иммунных ответов против бактериальной респираторной инфекции [101].
2.2.7. Тучные клетки
Тучные клетки представляют собой гранулированные тканевые резидентные клетки из гематопоэтических клеток-предшественников CD34 + [102, 103]. Тучные клетки циркулируют как незрелые клетки и мигрируют в васкуляризированные ткани, где они завершают свою дифференцировку.Тучные клетки вместе с дендритными клетками представляют собой первые иммунные клетки, которые взаимодействуют с антигенами, патогенами и токсинами окружающей среды. Поэтому их можно считать «сторожами» врожденной иммунной системы [104]. Тучные клетки активируются опасными стимулами, на которые они реагируют, быстро высвобождая широкий спектр медиаторов, как предварительно сформированных, так и вновь продуцируемых. Некоторые из этих медиаторов (например, гистамин, TNF-α, фактор роста эндотелия сосудов, VEGF) способствуют локальной сосудистой проницаемости и отеку в месте воспаления [105], в то время как хемокины (например,g., IL-8 / CXCL8, эотаксин) индуцируют рекрутирование других иммунных клеток [106], таких как нейтрофилы, естественные киллерные (NK) клетки и эозинофилы. Важно отметить, что тучные клетки также могут участвовать в защите от патогенов с помощью различных механизмов, таких как фагоцитоз, высвобождение антимикробных пептидов или образование внеклеточных ловушек, подобных тем, которые описаны в нейтрофилах [107, 108]. Тучные клетки обнаруживают эти вторгающиеся патогены через PRR, такие как TLR [109]. Исследования показали, что бактериальные и вирусные белки могут активировать тучные клетки через специфические рецепторы [110, 111].
Тучные клетки экспрессируют высокоаффинный рецептор IgE (FcεRI) [90, 112]. Поперечное сшивание FcεRI комплексами IgE-антигенов и / или аллергенов индуцирует активацию тучных клеток и быстрое высвобождение провоспалительных медиаторов посредством дегрануляции. Благодаря этому свойству, наряду с циркулирующими базофилами, тучные клетки известны в первую очередь как эффекторные клетки для IgE-опосредованных (Th3-подобных) ответов [113], ответвление адаптивной иммунной системы против заражения гельминтами [114] и как первичный эффектор. клетки в реакциях гиперчувствительности [115].В дополнение к их функциям как эффекторные клетки, недавние данные свидетельствуют о том, что тучные клетки способны модулировать как врожденный, так и адаптивный иммунный ответ, действуя как иммуномодулирующие клетки [116, 117].
2.2.8. Тромбоциты
Тромбоциты – это фрагменты цитоплазмы (диаметром от 1 до 4 мкм), образующиеся в результате фрагментации мегакариоцитов, которые представляют собой клетки костного мозга. Тромбоциты – это безъядерные органеллы, которые обладают функциональными характеристиками, такими как полноценная клетка, поскольку они обладают цитоскелетом, митохондриями, остатками Гольджи и эндоплазматическим ретикулумом, участвующим в синтезе ферментов, хранением ионов кальция, а также хранящими гранулами [118, 119].Эти запасающие гранулы представляют собой δ-гранулы [120], α-гранулы и лизосомальные гранулы [121], которые играют важную роль в гомеостазе, воспалении, заживлении ран и взаимодействиях между клеткой и матрицей. Во время воспалительной реакции тромбоциты могут активироваться через свои рецепторы, которые действуют как молекулы адгезии, которые взаимодействуют с поврежденным эндотелием, другими тромбоцитами и лейкоцитами, играя важную роль в процессе свертывания крови для восстановления поврежденного кровеносного сосуда и восстановления его целостности [122–12]. 124].
2.3. Лимфоидные клетки
Лимфоидные клетки включают NK-клетки, естественные Т-клетки-киллеры (NKT) и врожденные лимфоидные клетки (ILC). ILC представляют собой новое семейство гематопоэтических эффекторов, которые выполняют защитную роль в врожденных иммунных ответах на инфекционные микроорганизмы, в формировании лимфоидной ткани, в ремоделировании ткани после повреждения, вызванного травмой или инфекцией, и в гомеостазе тканевых стромальных клеток [125].
2.3.1. Врожденные лимфоидные клетки (ILC)
ILC представляют собой врожденную версию хелперных и цитотоксических Т-клеток как части врожденной иммунной системы, которые играют важную роль в раннем иммунном ответе [126, 127].Все члены семейства ILC характеризуются классической морфологией лимфоидных клеток и экспрессией IL-7Ra (CD127) и CD161, но им не хватает экспрессии молекул клеточной поверхности, которые характерны для других типов иммунных клеток, таких как Т-клетки (CD3, TCRαβ и TCRδ), B-клетки (CD19), NK-клетки (CD16 и CD94), миелоидные клетки (CD1a, CD14 и CD123), гранулоциты (FcεR1α и CD123), гемопоэтические стволовые клетки (CD34) и дендритные клетки плазмацитоидов (BDCA2). и CD123), поэтому их определяют как клетки, которые не экспрессируют маркеры клонов (Lin-) [128].ILC можно разделить на три группы на основании их фенотипических и функциональных характеристик: Группа 1 (ILC1) включает клетки, которые обладают способностью продуцировать IFN-γ в качестве своего основного эффекторного цитокина и экспрессировать фактор транскрипции T-bet. Прототипом этой группы является клетка NK. Группа 2 (ILC2) – это клетки, которым для своего развития необходим IL-17. Эти клетки характеризуются продуцированием цитокинов, связанным с иммунным ответом Th3, в ответ на стимуляцию IL-25, IL-33 и стромальным лимфопоэтином тимуса (TSLP) и демонстрируют фенотип GATA3 и RORα для своего развития и функции.Группа 3 (ILC3) включает подтипы клеток, которые продуцируют IL-17 и / или IL-22 и IFN-γ, и эти клетки зависят от фактора транскрипции RORγt для своего развития и функционирования [129]. Недавние исследования выявили различные функции клеток ILC: (1) ILC способствуют защите хозяина от инфекций и регулируют взаимодействия с микробиотой; (2) а также координировать заживление ран и восстановление тканей и (3) в других обстоятельствах ИЛК могут способствовать воспалению и прогрессированию опухоли [130]. ILC плохо представлены в лимфоидных тканях, но обнаружено, что они важны в паренхиматозных тканях, особенно на поверхностях слизистых оболочек.Следовательно, подтипы ИЛК играют важную роль во врожденном иммунном ответе на вирусы, бактерии, грибки, внутриклеточных и внеклеточных паразитов в этом типе ткани, и они быстро активируются цитокинами и факторами роста [125, 131].
2.3.2. Естественные клетки-киллеры
NK-клетки происходят из лимфоидных предшественников клеток. Однако они не опосредуют обычный адаптивный иммунный ответ, поскольку у них отсутствуют антиген-специфические рецепторы, такие как Т- и В-лимфоциты [132].Ранее считалось, что развитие NK-клеток у человека происходит исключительно в костном мозге. Однако недавние исследования показали, что NK-клетки также развиваются во вторичных лимфоидных органах [133]. Доминирующая популяция NK-клеток в кровообращении имеет фенотип CD56 dim CD16 + , соответствующий его конечной стадии созревания, тогда как NK-клетки с фенотипом CD56 bright считаются относительно незрелыми клетками [134]. NK-клетки являются важными эффекторными лимфоидными клетками врожденной иммунной системы, поскольку они представляют собой ключевой элемент в быстром распознавании и гибели как инфицированных, так и онкогенных клеток, что может вызвать нарушение целостности тканей хозяина.NK-клетки идентифицируют клетки-мишени (клетки, которые имеют некоторые повреждения) посредством сложных комбинаций сигналов от активации или ингибирования рецепторов, которые взаимодействуют с лигандами, которые экспрессируются на поверхности стрессированных или нормальных клеток соответственно [135]. Решение об устранении или не устранении этих клеток зависит от результата баланса между положительными (активация) и отрицательными (ингибирование) сигналами. Кроме того, активация NK-клеток регулируется посредством сотрудничества с другими иммунными клетками, включая DC [136], что позволяет NK-клеткам приобретать мощную цитотоксическую активность, способность продуцировать цитокины, такие как IFN-γ, и вносить вклад в адаптивный иммунный ответ. запуском опосредованного Т-клетками ответа [137].
2.3.3. Природные киллерные Т-клетки
NKT-клетки составляют небольшую субпопуляцию лимфоцитов, которые характеризуются экспрессией маркеров линии NK-клеток, а также рецепторов линии αβ T. NKT-клетки развиваются в тимусе и имеют того же общего лимфоидного предшественника, что и обычные Т-клетки, но их фенотипические и функциональные характеристики отличаются от Т-клеток [138]. В периферической крови человека идентифицированы четыре субпопуляции NKT-клеток: CD4 + , CD8 αβ + , CD8 αα + и двойные отрицательные (CD4 – CD8 – ), которые различаются по цитокину. профиль секреции и экспрессия хемокиновых рецепторов, интегринов и рецепторов NK [140].Кроме того, NKT-клетки распознают гликолипидные антигены, которые представлены молекулами CD1d, MHC-подобными молекулами, которые конститутивно экспрессируются антигенпредставляющими клетками, такими как DC, B-клетки и макрофаги. NKT-клетки также обладают способностью реагировать на клетки, участвующие во врожденном иммунитете, с минимальным участием Т-клеточного рецептора (TCR), и клетки памяти через часть TCR, что делает их способными быть мостом между врожденным и адаптивным иммунитетом. ответ [141].
.Определение

