Эрозивный рефлюкс эзофагит симптомы: Причины эрозивного эзофагита, симптомы, факторы риска — клиника «Добробут»
Эрозивный рефлюкс-эзофагит – симптомы, причины, методы лечения
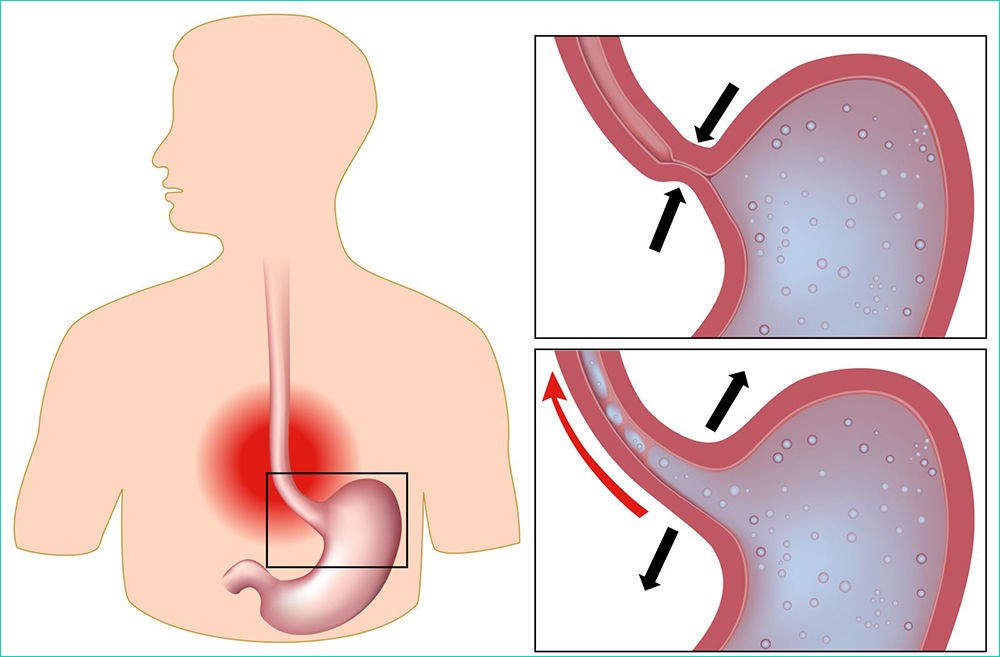
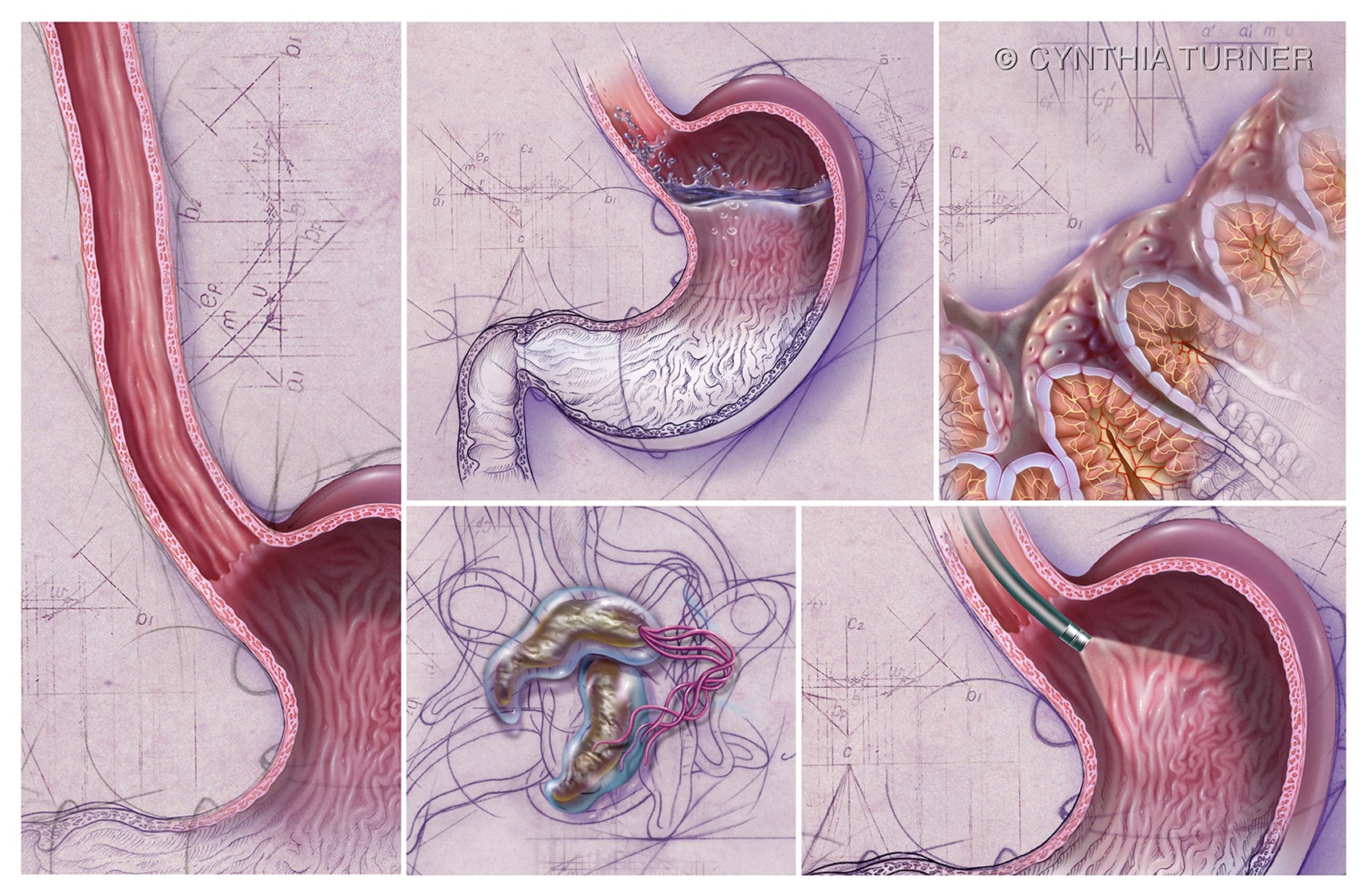
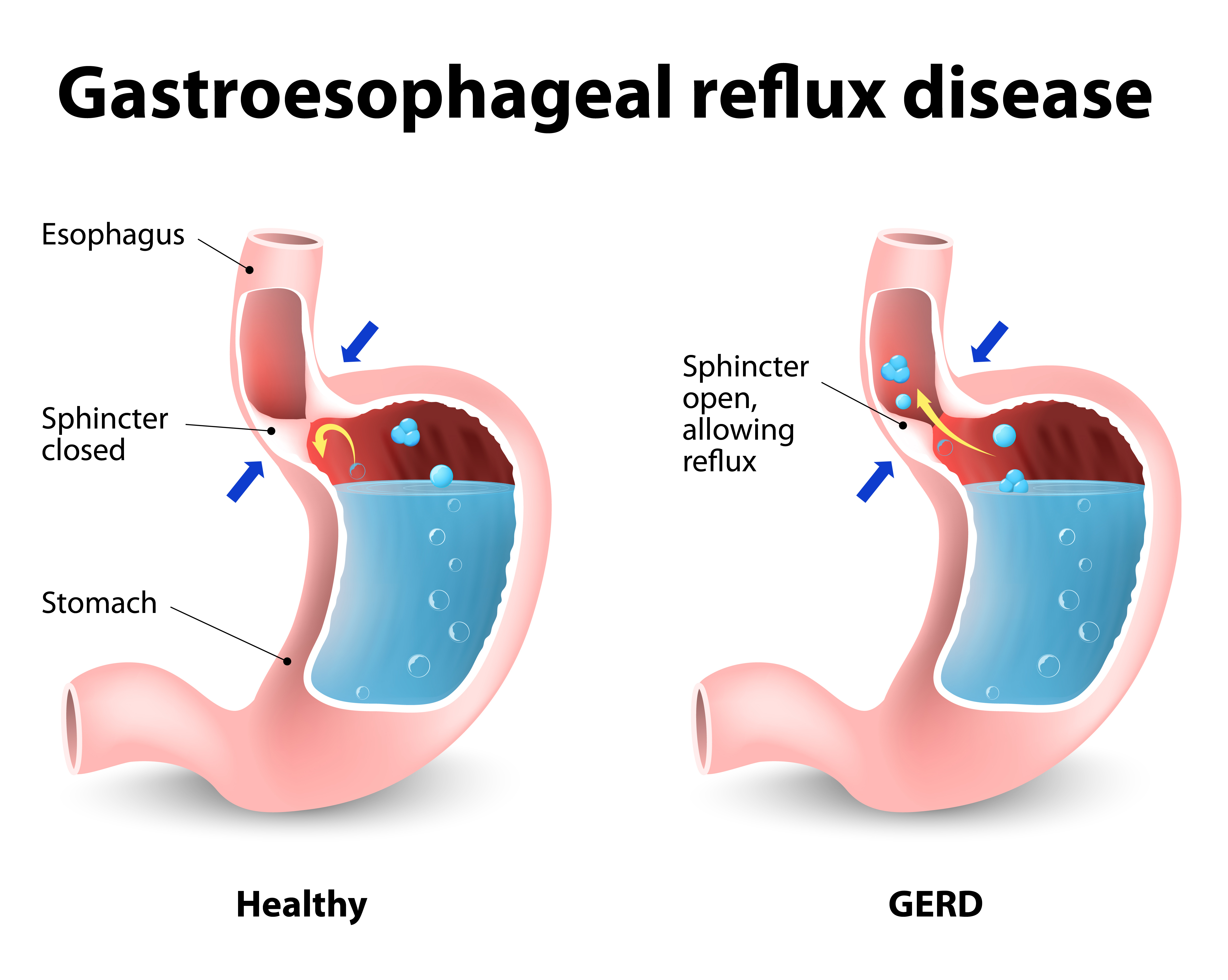
Эрозивный рефлюкс-эзофагит — одна из форм воспалительного заболевания слизистой пищеводного канала. Патология развивается в результате периодического заброса секрета желудка в нижний отдел пищевода. Под агрессивным действием соляной кислоты и ферментов, содержащихся в желудочном соке, верхние слои слизистой пищеводной трубки воспаляются и опухают. При дальнейшем воздействии на них содержимого желудка на стенках образуются эрозии и язвы, а после — рубцы.
Эрозивный рефлюкс выражается частыми обострениями, которые приносят больному дискомфорт. Симптомы сильнее проявляются после еды, приема медпрепаратов, особенно из салициловой группы. Участки, подвергнувшиеся эрозии, не способны полноценно функционировать. А если лечение болезни отсутствует и не соблюдаются рекомендации по диетическому питанию, то в пищеводе могут возникнуть язвенные заболевания.
Как подтверждают статистические данные медицинских учреждений Москвы, наиболее часто эрозивный рефлюкс возникает в нижней части пищевода, самой близкой к желудку.
Причины эрозивного эзофагита
Основной причиной, из-за которой развивается эрозивный рефлюксный эзофагит, считается нарушение функции пищевого сфинктера. Он представляет собой мышечное кольцо, которое расположено на границе пищевода и желудка. В норме сфинктер помогает пище двигаться вниз из пищевода к желудку и не позволяет пищевому комку передвигаться в обратном направлении. Если тонус мышц ослабевает, то регулярно происходит обратный заброс, вызывающий рефлюксный эзофагит.
Нарушение работы сфинктера может быть врожденным или возникнувшим по ряду причин. Ими могут быть:
- Длительные стрессовые ситуации.
- Вредные привычки, в том числе курение и злоупотребление алкоголем.
- Избыточный вес и ожирение.
- Частое употребление напитков, содержащих кофеин в большом количестве.
- Прием целого ряда медикаментов, предназначенных для лечения дыхательной и сердечнососудистой системы, седативных препаратов, снотворного.

На работу пищеводного сфинктера оказывает влияние повышенное давление в брюшине. Оно может быть связано с беременностью, поднятием тяжестей, длительным кашлем и другими причинами. Причиной рефлюкса с признаками эрозии становится грыжа пищевого отверстия диафрагмы, некоторые заболевания пищевого тракта, например, гастрит или язвенная болезнь желудка.
Но чаще всего к появлению эрозивного рефлюкс-эзофагита приводит неправильная система питания и вредные привычки, в их числе:
- Нарушения режима и характера питания.
- Чрезмерное употребление острой и жирной пищи.
- Ношение тесной одежды, а также другие факторы или их сочетание.
Симптомы болезни
Характерными признаками эрозивного рефлюкс-эзофагита являются боли за грудиной, часто отдающие в плечо или область сердца. Такая локация часто напоминает сердечные боли при стенокардии, поэтому стоит присмотреться и к другим симптомам. Ими являются:
- Постоянная изжога, частая отрыжка, навязчивая икота.

- Неприятный кислый или горький привкус во рту.
- Обильное выделение слюны и ночной кашель, спровоцированный срыгиванием во время сна.
- Режущая боль при проглатывании пищи. Пища как бы застревает «под ложечкой»
Часто такие симптомы усиливаются после еды, при наклонах вперед или когда больной ложиться.
Лечение эрозивного рефлюкса
ООО “Клиника
профессора Горбакова”
Лечение больных эрозивным эзофагитом современный взгляд на проблему | Морозов
1. Vakil N, van Zanten SV, Kahrilas P et al. The Montreal definition and classification of gas-troesophageal reflux disease: a global evidence-based consensus. American Journal of Gastroenterology, 2006, 101(8): 1900–1943.
2. Shaheen N J, Hansen R A, Morgan D Ret al. The burden of gastrointestinal and liver diseases, 2006.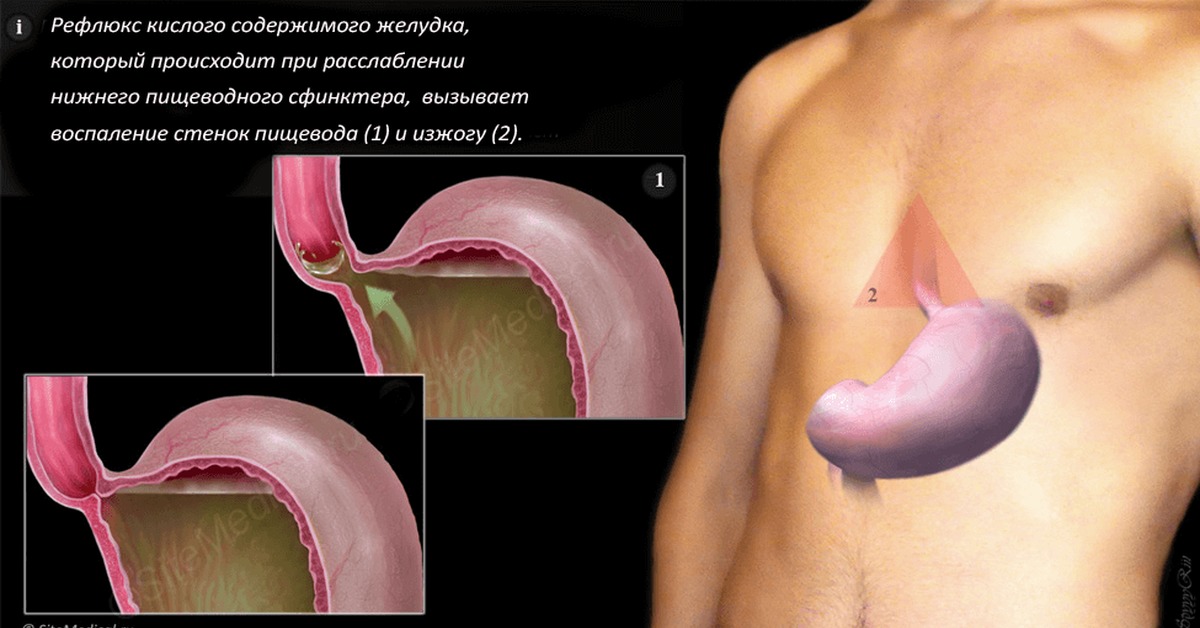 American Journal of Gastroenterology, 2006, 101(9): 2128–2138.
American Journal of Gastroenterology, 2006, 101(9): 2128–2138.
3. Dent J, El-Serag H B, Wallander M A, Johansson S. Epidemiology of gastro-oesophageal reflux disease: a systematic review. Gut, 2005, 54(5): 710–717.
4. Blot WJ. Esophageal cancer trends and risk factors. Seminars in Oncology, 1994: 21(4): 403–410.
6. El-Serag HB. Time trends of gastroesophageal reflux disease: a systematic review. Clinical Gastroenterology and Hepatology, 2007, 5(1): 17–26.
7. Engel L S, Chow WH, Vaughan TL et al. Population attributable risks of esophageal and gastric cancers. Journal of the National Cancer Institute, 2003, 95(18): 1404–1413.
Engel L S, Chow WH, Vaughan TL et al. Population attributable risks of esophageal and gastric cancers. Journal of the National Cancer Institute, 2003, 95(18): 1404–1413.
8. Sontag SJ, Sonnenberg A, Schnell TG et al. The long-term natural history of gastroesophageal reflux disease. Journal of Clinical Gastroenterology, 2006, 40(5): 398–404.
9. Agrawal A, Castell D. GERD is chronic but not progressive. Journal of Clinical Gastroenterology, 2006, 40(5): 374–375.
10. Bardhan KD, Royston C, Nayyar AK. Reflux rising! An essay on witnessing a disease in evolution. Dig Liver Dis, 2006, 38: 163-168.
11. ass R, Ofman J. Gastroesophageal reflux disease–should we adopt a new conceptual framework? Am J Gastroenterol, 2002, 97: 1901-1909.
12. Nwokediuko SC. Current trends in the management of gastroesophageal reflux disease: a review. ISRN Gastroenterol, 2012, 2012: 391631. doi: 10.5402/2012/391631.
13. Морозов С.В., Кучерявый Ю.А. Гастроэзофагеальная рефлюксная болезнь: формы заболевания и особенности их лечения. Лечебное дело (журнал), 2015, 4: 21-30.
14. Исаков В.А., Морозов С.В., Ставраки Е.С., Комаров Р.С. Анализ Распространенности Изжоги: национальное эпидемиологическое исследование взрослого городского населения (АРИАДНА). Экспериментальная и клиническая гастроэнтерология, 2008, 1: 20-30.
15. Mandel KG, Daggy BP, Brodie DA, Jacoby HI. Review article: alginate-raft formations in the treatment of heartburn and acid reflux. Aliment Pharmacol Ther, 2000, 14: 669-690.
Aliment Pharmacol Ther, 2000, 14: 669-690.
17. Washington N. Antacids and Anti-Reflux Agents. Boca Raton, FL, USA: CRC Press Inc., 1991: 127.
18. ones R, Lydeard S. Prevalence of symptoms of dyspepsia in the community. Lancet, 1989, 1: 47-51.
19. Vatier J, Celice-Pingaud C, Farinotti R. A com-puterized artificial stomach model to assess sodium alginate-induced pH gradient. Int J Pharmaceut, 1998, 163: 225-9.
20. night LC, Maurer AH, Ammar IA et al. Use of 111In-labeled alginate to study the pH dependence of alginic acid anti-esophageal refux barrier.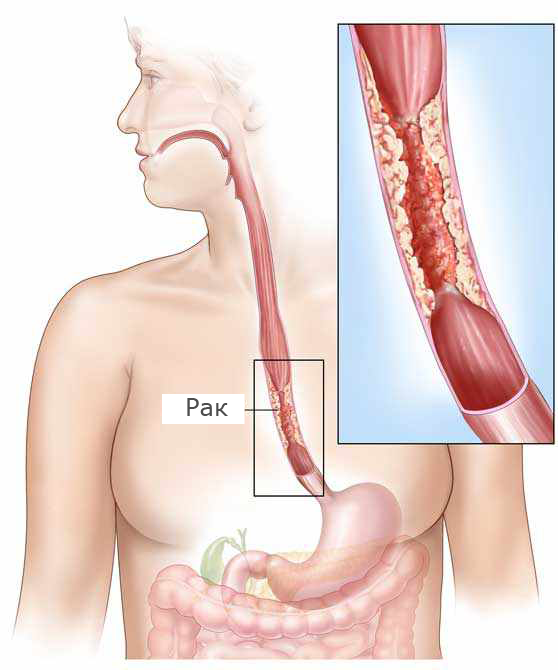
21. May HA, Wilson CG, Hardy JG. Monitoring radiolabeled antacid preparations in the stomach. Inter J Pharmaceutics, 1984, 19: 169-76.
22. Malmud LS, Charles ND, Littlefield J, et al. The mode of action of alginic acid compound in the reduction of gastroesophageal reflux. J Nuc Med, 1979, 20: 1023-8.
23. Goodall JS, Orwin JM, Imrie MJ. A combined pH and X-ray study of liquid alginate/antacid formulation using a novel X-ray contrast medium. Acta Therapeutica, 1977, 3: 141-53.
24. Washington N, Parker MA, Steele RJC, et al. Time to onset of action of sodium alginate, ranitidine, omeprazole and water based on oesophageal pH. Gastroenterology, 1999, 116: A350(Abstract).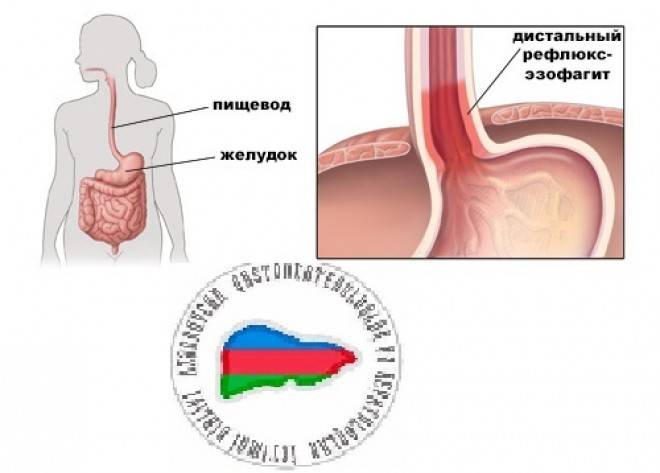
25. Uzan M, Uzan S, Surean C, Richard-Berthe C. Heartburn and regurgitation in pregnancy. Efficacy and innocuousness of treatment with Gaviscon suspension. Rev Fr Gynecol Obst, 1988, 83: 569-72.
26. Lang GD, Dougall A. Comparative study of Algicon suspension and magnesium trisilicate mixture in the treatment of reflux dyspepsia of pregnancy. Br J Clin Pract, 1990, 66: 48-51.
27. Modlin IM, Hunt RH, Malfertheiner P et al. Diagnosis and Management of Non-Erosive Reflux Disease – The Vevey NERD Consensus Group. Digestion, 2009, 80: 74–88.
29. Kim YS, Kim TH, Choi CS et al. Effect of ito-pride, a new prokinetic, in patients with mild GERD: A pilot study. World J Gastroenterol, 2005, 11(27): 4210-4214.
30. Ndraha S. Combination of PPI with a prokinetic drug in GERD. Acta Med Indones-Indones J Intern Med, 2011, 43 (4): 233-236.
31. Manzotti ME, Catalano HN, Serrano FA et al. Prokinetic drug utility in the treatment of gas-troesophageal reflux esophagitis: a systematic review of randomized controlled trials. Open Med, 2007, 1(3): 171-80.
32. Jones DB, Howden CW, Burget DW, et al. Acid suppression in duodenal ulcer: a meta-analysis to define optimal dosing with antisecretory drugs. Gut, 1987, 28: 1120–1127.
33. Khan M, Santana J, Donnellan C, et al. Medical treatments in the short term management of reflux oesophagitis. Cochrane Database Syst Rev, 2007, 2: CD003244.
Khan M, Santana J, Donnellan C, et al. Medical treatments in the short term management of reflux oesophagitis. Cochrane Database Syst Rev, 2007, 2: CD003244.
34. Исаков В.А. Ингибиторы протонного насоса: их свойства и применение в гастроэнтерологии. М.: ИКЦ «Академкнига», 2001. 304 с.
35. Kahrilas PJ, Shaheen NJ, Vaezi MF, et al. American Gastroenterological Association Medical Position Statement on the management of gastroesophageal reflux disease. Gastroenterology, 2008, 135: 1383–1391.
36. Katz PO, Gerson LB, Vela MF. Guidelines for the diagnosis and management of gastroesophageal reflux disease. Am J Gastroenterol, 2013, 108: 308–328.
37. Bell NJ, Hunt RH. Role of gastric acid suppression in the treatment of gastro-oesophageal reflux disease. Gut, 1992 Jan, 33(1): 118-24.
Gut, 1992 Jan, 33(1): 118-24.
38. Lind T, Rydberg L, Kyleback A, et al. Esomeprazole provides improved acid control vs omeprazole In patients with symptoms of gastro-oesophageal reflux disease. Aliment Pharmacol Ther, 2000, 14: 861–7.
39. Rohss K, Hasselgren G, Hedenstrom H. Effect of esomeprazole 40 mg vs omeprazole 40 mg on 24-hour intragastric pH in patients with symptoms of gastroesophageal reflux disease. Dig Dis Sci, 2002, 47: 954–8
40. Wilder-Smith CH, Rohss K, Nilsson-Pieschl C, et al. Esomeprazole 40 mg provides improved intragastric acid control as compared with lansoprazole 30 mg and rabeprazole 20 mg in healthy volunteers. Digestion, 2003, 68: 184–8.
41. Miner PJr, Katz PO, Chen Y, et al. Gastric acid control with esomeprazole, lansoprazole, omeprazole, pantoprazole, and rabeprazole: a five-way crossover study. Am J Gastroenterol, 2003, 98: 2616–20.
Gastric acid control with esomeprazole, lansoprazole, omeprazole, pantoprazole, and rabeprazole: a five-way crossover study. Am J Gastroenterol, 2003, 98: 2616–20.
42. Rohss K, Lind T, Wilder-Smith C. Esomeprazole 40 mg provides more effective intragastric acid control than lansoprazole 30 mg, omeprazole 20 mg, pantoprazole 40 mg and rabeprazole 20 mg in patients with gastro-oesophageal reflux symptoms. Eur J Clin Pharmacol, 2004, 60: 531–9.
43. Miehlke S, Madisch A, Kirsch C, et al. Intragastric acidity during treatment with esomeprazole 40 mg twice daily or pantoprazole 40 mg twice daily – a randomized, two-way crossover study. Aliment Pharmacol Ther, 2005, 21: 963–7
44. Johnson DA, Stacy T, Ryan M, et al. A comparison of esomeprazole and lansoprazole for control of intragastric pH in patients with symptoms of gastro-oesophageal reflux disease. Aliment Pharmacol Ther, 2005, 22: 129–34
Aliment Pharmacol Ther, 2005, 22: 129–34
45. Simon B, Muller P, Pascu O, et al. Intra-oeso phageal pH profiles and pharmacokinetics of pantoprazole and esomeprazole: a crossover study in patients with gastro-oesophageal reflux disease. Eur J Gastroenterol Hepatol, 2003, 15: 791–9.
46. Морозов С.В., Исаков В.А., Цодикова О.М. Влияние эзомепразола и рабепразола на закисление пищевода у больных гастроэзофагеальной рефлюксной болезнью, интенсивно метаболизирующих ингибиторы протонного насоса. Терапевтический архив, 2005, 2: 21-25
47. Kalaitzakis E, Björnsson E. A review of esomeprazole in the treatment of gastroesophageal reflux disease (GERD). Therapeutics and Clinical Risk Management, 2007, 3(4): 653-663.
48. Vakil N, Fennerty MB. Direct comparative trials of the efficacy of proton pump inhibitors in the management of gastro-oesophageal reflux disease and peptic ulcer disease. Aliment Pharmacol Ther, 2003, 18(6): 559-68.
Vakil N, Fennerty MB. Direct comparative trials of the efficacy of proton pump inhibitors in the management of gastro-oesophageal reflux disease and peptic ulcer disease. Aliment Pharmacol Ther, 2003, 18(6): 559-68.
49. Li MJ, Li Q, Sun M, Liu LQ. Comparative effectiveness and acceptability of the FDA-licensed proton pump inhibitors for erosive esophagitis: A PRISMA-compliant network meta-analysis. Medicine (Baltimore), 2017, 96(39): e8120. doi: 10.1097/MD.0000000000008120. PubMed PMID: 28953640.
50. Kukulka M, Eisenberg C, Nudurupati S. Comparator pH study to evaluate the singledose pharmacodynamics of dual delayedrelease dexlansoprazole 60mg and delayedrelease esomeprazole 40 mg. Clin Exp Gastroenterol, 2011, 4: 213–20.
51. DeVault KR, Castell DO. Updated guidelines for the diagnosis and treatment of gastroesophageal reflux disease. Am J Gastroenterol, 2005, 100: 190–200
Am J Gastroenterol, 2005, 100: 190–200
52. Moayyedi P, Talley NJ. Gastro-oesophageal reflux disease. Lancet, 2006, 367: 2086–100.
53. Johnson DA, Benjamin SB, Vakil NB, et al. Esomeprazole once daily for 6 months is effective therapy for maintaining healed erosive esophagitis and for controlling gastroesophageal reflux disease symptoms: a randomized, double-blind, placebo-controlled study of efficacy and safety. Am J Gastroenterol, 2001, 96: 27–34.
54. Lauritsen K, Deviere J, Bigard MA, et al. Esomeprazole 20 mg and lansoprazole 15 mg in maintaining healed reflux oesophagitis: Metropole study results. Aliment Pharmacol Ther, 2003, 17: 333–41.
55. Labenz J, Armstrong D, Lauritsen K, et al.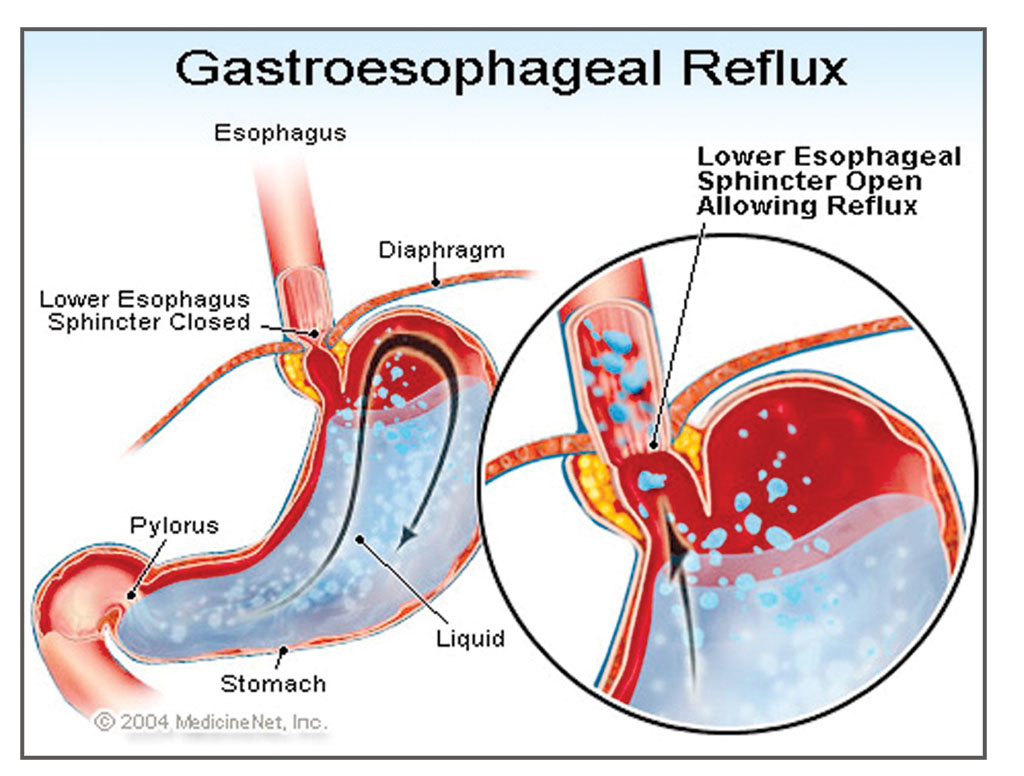 Esomeprazole 20 mg vs pantoprazole 20 mg for maintenance therapy of healed erosive oesophagitis: results from the EXPO study. Aliment Pharmacol Ther, 2005, 22: 803–11.
Esomeprazole 20 mg vs pantoprazole 20 mg for maintenance therapy of healed erosive oesophagitis: results from the EXPO study. Aliment Pharmacol Ther, 2005, 22: 803–11.
56. Devault KR, Johanson JF, Johnson DA, et al. Maintenance of healed erosive esophagitis: a randomized six-month comparison of esomeprazole twenty milligrams with lansoprazole fifteen milligrams. Clin Gastroenterol Hepatol, 2006, 4: 852–9.
57. Park JH, H Park, Lee DH et al. A randomized, double blinded, clinical trial to assess the efficacy and cost effectiveness of omeprazole compared to rabeprazole in the maintenance therapy of patients with gastroesophageal reflux disease. J Neurogastroenterol Motil, 2013, 19(2): 219–226.
58. Bertilsson L. Geographical/interracial differences in polymorphic drug oxidation: current state of knowledge of cytochromes P450 (CYP) 2D6 and 2C19. Clin Pharmacokinet, 1995, 29: 192- 209.
Clin Pharmacokinet, 1995, 29: 192- 209.
59. Sjöstedt S, Befrits R, Sylvan A, et al Daily treatment with esomeprazole is superior to that taken on-demand for maintenance of healed erosive oesophagitis. Aliment Pharmacol Ther, 2005, 22(3): 183-91.
60. Freedberg DE, Kim LS, Yang YX. The risks and benefits of long-term use of proton pump inhibitors: expert review and best practice advice from the American Gastroenterological Association. Gastroenterology, 2017, 152(4): 706- 715.
61. Lazarus B, Chen Y, Wilson FP, et al. Proton Pump Inhibitor Use and the Risk of Chronic Kidney Disease. JAMA Intern Med, 2016, 176: 238–246.
62. Xie Y, Bowe B, Li T, et al. Proton pump inhibitors and risk of incident CKD and progression to ESRD.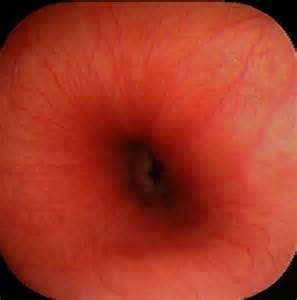 J Am Soc Nephrol, 2016, 27: 3153-316.
J Am Soc Nephrol, 2016, 27: 3153-316.
63. Badiola N, Alcalde V, Pujol A, et al. The protonpump inhibitor lansoprazole enhances amyloid beta production. PLoS One, 2013, 8: e58837.
64. Haenisch B, von Holt K, Wiese B, et al. Risk of dementia in elderly patients with the use of proton pump inhibitors. Eur Arch Psychiatry Clin Neurosci, 2015, 265: 419–428.
65. Gomm W, von Holt K, Thome F, et al. Association of Proton Pump Inhibitors With Risk of Dementia: A Pharmacoepidemiological Claims Data Analysis. JAMA Neurol, 2016, 73: 410–416.
66. Yang YX, Lewis JD, Epstein S, et al. Long-term proton pump inhibitor therapy and risk of hip fracture. JAMA, 2006, 296: 2947–2953.
67. Targownik LE, Leslie WD, Davison KS, et al. The relationship between proton pump inhibitor use and longitudinal change in bone mineral density: a population-based study from the Canadian Multicentre Osteoporosis Study (CaMos). Am J Gastroenterol, 2012, 107: 1361–1369.
Targownik LE, Leslie WD, Davison KS, et al. The relationship between proton pump inhibitor use and longitudinal change in bone mineral density: a population-based study from the Canadian Multicentre Osteoporosis Study (CaMos). Am J Gastroenterol, 2012, 107: 1361–1369.
68. Maggio M, Lauretani F, Ceda GP, et al. Use of proton pump inhibitors is associated with lower trabecular bone density in older individuals. Bone, 2013, 57: 437–442.
69. Targownik L, Luo Y, Goertzen A, et al. Comparing Bone Structure and Bone Metabolism Between Long-Term Proton Pump Inhibitor Users and Non-Users. Gastroenterology, 2015, 148: S-153.
70. Bhatt DL, Cryer BL, Contant CF, et al. Clopidogrel with or without omeprazole in coronary artery disease. N Engl J Med, 2010, 363: 1909–1917.
71. Ghebremariam YT, LePendu P, Lee JC, et al. Unexpected effect of proton pump inhibitors: elevation of the cardiovascular risk factor asymmetric dimethylarginine. Circulation, 2013, 128: 845–853.
72. Shah NH, LePendu P, Bauer-Mehren A, et al. Proton Pump Inhibitor Usage and the Risk of Myocardial Infarction in the General Population. PLoS One, 2015, 10: e0124653.
73. Rosen R, Hu L, Amirault J, et al. 16S community profiling identifies proton pump inhibitor related differences in gastric, lung, and oro-pharyngeal microflora. J Pediatr, 2015, 166: 917–923.
74. Lambert AA, Lam JO, Paik JJ, et al. Risk of community acquired pneumonia with outpatient proton-pump inhibitor therapy: a systematic review and meta-analysis.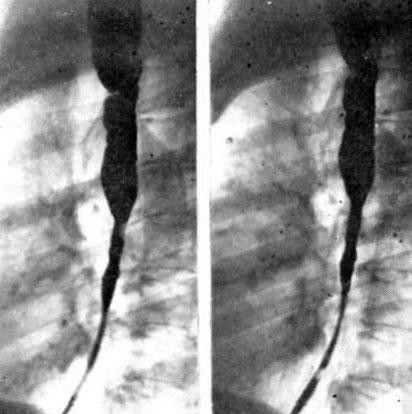 PLoS One, 2015, 10: e0128004.
PLoS One, 2015, 10: e0128004.
75. Scheiman JM, Devereaux PJ, Herlitz J, et al. Prevention of peptic ulcers with esomeprazole in patients at risk of ulcer development treated with low-dose acetylsalicylic acid: a rand-omized, controlled trial (OBERON). Heart, 2011, 97: 797–802.
76. Estborn L, Joelson S. Frequency and time to onset of community-acquired respiratory tract infections in patients receiving esomeprazole: a retrospective analysis of patient-level data in placebo-controlled studies. Aliment Pharmacol Ther, 2015, 42: 607–613.
77. O’Connell MB, Madden DM, Murray AM, et al. Effects of proton pump inhibitors on calcium carbonate absorption in women: a randomized crossover trial. American Journal of Medicine, 2005, 118: 778–781.
78. Ivanovich P, Fellows H, Rich C. The absorption of calcium carbonate. Ann Intern Med, 1967, 66: 917–923.
Ivanovich P, Fellows H, Rich C. The absorption of calcium carbonate. Ann Intern Med, 1967, 66: 917–923.
79. Serfaty-Lacrosniere C, Wood RJ, Voytko D, et al. Hypochlorhydria from short-term omeprazole treatment does not inhibit intestinal absorption of calcium, phosphorus, magnesium or zinc from food in humans. Journal of the American College of Nutrition, 1995, 14: 364–368.
80. Stewart CA, Termanini B, Sutliff VE, et al. Iron absorption in patients with Zollinger-Ellison syndrome treated with long-term gastric acid antisecretory therapy. Alimentary Pharmacology & Therapeutics, 1998, 12: 83–98.
81. Epstein M, McGrath S, Law F. Proton-pump inhibitors and hypomagnesemic hypoparathyroidism. N Engl J Med, 2006, 355: 1834–1836.
82. Lam JR, Schneider JL, Zhao W, et al. Proton pump inhibitor and histamine 2 receptor antagonist use and vitamin B12 deficiency. JAMA, 2013, 310: 2435–2442.
Lam JR, Schneider JL, Zhao W, et al. Proton pump inhibitor and histamine 2 receptor antagonist use and vitamin B12 deficiency. JAMA, 2013, 310: 2435–2442.
Лечение больных эрозивным эзофагитом современный взгляд на проблему Текст научной статьи по специальности «Клиническая медицина»
10.21518/2079-701X-2018-6-96-103
С.В. МОРОЗОВ1, к.м.н., Ю.А. КУЧЕРЯВЫЙ2, к.м.н., В.С. КРОПОЧЕВ1
1 Федеральный исследовательский центр питания и биотехнологии, Москва
2 Московский государственный медико-стоматологический университет им. А.И. Евдокимова Минздрава России
ЛЕЧЕНИЕ БОЛЬНЫХ ЭРОЗИВНЫМ ЭЗОФАГИТОМ
СОВРЕМЕННЫЙ ВЗГЛЯД НА ПРОБЛЕМУ
Гастроэзофагеальная рефлюксная болезнь – одно из наиболее широко встречающихся заболеваний гастроэнтерологического профиля. Выделяют несколько форм заболеваний, в том числе неэрозивную форму, эрозивный эзофагит, пищевод Барретта. В статье представлен обзор средств, использующихся для лечения эрозивной формы ГЭРБ и длительной поддерживающей терапии с позиций доказательной медицины. Основными целями лечения эрозивного эзофагита являются заживление повреждений слизистой оболочки пищевода, обеспечение длительной ремиссии заболевания, нормализация качества жизни больных. В настоящее время основой терапии эрозивного эзофагита являются ингибиторы протонной помпы (ИПП). Эти препараты используются на всех этапах лечения как для купирования симптомов, так и для заживления повреждений слизистой оболочки пищевода, а также в составе длительной поддерживающей терапии. Ввиду необходимости длительного использования ИПП закономерно возникают вопросы об их безопасности. В публикациях последних лет отмечена возможность увеличения рисков развития хронической болезни почек, инфаркта миокарда, пневмоний, развития дефицита кальция, магния, железа, витамина В12.
Выделяют несколько форм заболеваний, в том числе неэрозивную форму, эрозивный эзофагит, пищевод Барретта. В статье представлен обзор средств, использующихся для лечения эрозивной формы ГЭРБ и длительной поддерживающей терапии с позиций доказательной медицины. Основными целями лечения эрозивного эзофагита являются заживление повреждений слизистой оболочки пищевода, обеспечение длительной ремиссии заболевания, нормализация качества жизни больных. В настоящее время основой терапии эрозивного эзофагита являются ингибиторы протонной помпы (ИПП). Эти препараты используются на всех этапах лечения как для купирования симптомов, так и для заживления повреждений слизистой оболочки пищевода, а также в составе длительной поддерживающей терапии. Ввиду необходимости длительного использования ИПП закономерно возникают вопросы об их безопасности. В публикациях последних лет отмечена возможность увеличения рисков развития хронической болезни почек, инфаркта миокарда, пневмоний, развития дефицита кальция, магния, железа, витамина В12. В то же время анализ исследований, лежащих в основе наличия рисков длительного использования ИПП, выявляет ряд существенных недостатков, уменьшающих их доказательную ценность. В настоящей работе приведены данные о наиболее часто обсуждаемых рисках и их критическая оценка. Ключевые слова: гастроэзофагеальная рефлюксная болезнь, лечение, эрозивный эзофагит, ингибиторы протонной помпы, декслансопразол.
В то же время анализ исследований, лежащих в основе наличия рисков длительного использования ИПП, выявляет ряд существенных недостатков, уменьшающих их доказательную ценность. В настоящей работе приведены данные о наиболее часто обсуждаемых рисках и их критическая оценка. Ключевые слова: гастроэзофагеальная рефлюксная болезнь, лечение, эрозивный эзофагит, ингибиторы протонной помпы, декслансопразол.
S.V. MOROZOV1, PhD in medicine, Yu.A. KUCHERYAVY2, PhD in medicine, V.S. KROPOCHEV1.
1 Federal Research Center for Nutrition and Biotechnology, Moscow
2 Yevdokimov Moscow State University of Medicine and Dentistry of the Ministry of Health of Russia TREATMENT OF PATIENTS WITH EROSIVE ESOPHAGITIS. A MODERN VIEW ON THE PROBLEM
Gastroesophageal reflux disease is one of the most common diseases of the gastroenterological profile. There are several forms of illness, including non-erosive forms, erosive esophagitis, Barrett esophagus. The article provides an overview of the drugs used to treat the erosive form of GERD and long-term supportive therapy from the perspective of evidence-based medicine. The main objectives of the treatment of erosive esophagitis are to heal esophagus mucosa lesions, achieve long-term remissions, and normalize the patients’ life quality. The proton pump inhibitors (PPIs) have steadily become the mainstay in treatment of erosive esophagitis. These drugs are used at all stages of treatment, both for the relief of symptoms and healing of oesophagus mucosa lesions, and as the long-term supportive therapy. Due to the need for long-term use of IPI, their safety are open to question. The recent publications reported an increased risk of chronic kidney disease, myocardial infarction, pneumonia, calcium, magnesium, iron, vitamin B12 deficiency. At the same time, the analysis of studies underlying the risks of long-term PPI use detected some significant disadvantages that reduce their evidence-based value.
There are several forms of illness, including non-erosive forms, erosive esophagitis, Barrett esophagus. The article provides an overview of the drugs used to treat the erosive form of GERD and long-term supportive therapy from the perspective of evidence-based medicine. The main objectives of the treatment of erosive esophagitis are to heal esophagus mucosa lesions, achieve long-term remissions, and normalize the patients’ life quality. The proton pump inhibitors (PPIs) have steadily become the mainstay in treatment of erosive esophagitis. These drugs are used at all stages of treatment, both for the relief of symptoms and healing of oesophagus mucosa lesions, and as the long-term supportive therapy. Due to the need for long-term use of IPI, their safety are open to question. The recent publications reported an increased risk of chronic kidney disease, myocardial infarction, pneumonia, calcium, magnesium, iron, vitamin B12 deficiency. At the same time, the analysis of studies underlying the risks of long-term PPI use detected some significant disadvantages that reduce their evidence-based value. This paper provides data on the most frequently discussed risks and critical assessment of them.
This paper provides data on the most frequently discussed risks and critical assessment of them.
Keywords: gastroesophageal reflux disease, treatment, erosive esophagitis, proton pump inhibitors, dexlansoprazole.
ВВЕДЕНИЕ
Гастроэзофагеальная рефлюксная болезнь (ГЭРБ) -состояние, характеризующееся развитием значимо беспокоящих пациента симптомов вследствие рефлюкса желудочного содержимого. Является одним из наиболее распространенных заболеваний органов пищеварения в большинстве стран мира [1]. Данные популяционных исследований свидетельствуют о наличии тенденции к росту частоты встречаемости проявлений этого заболевания во всем мире [2-6]. Наличие симптомов ГЭРБ, таких как изжога и отрыжка кислым, существенно ухудшает качество жизни больных и сопряжено с экономическими затратами, связанными с утратой трудоспособности, высокой стоимостью диагностики и лечения [2, 4, 7].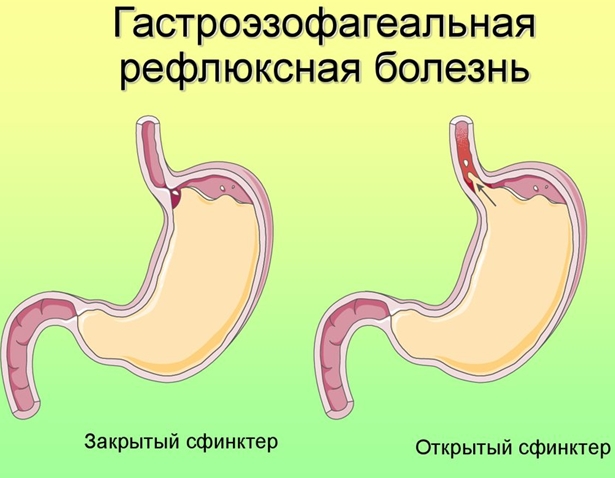
Спектр осложнений заболевания – пептические стриктуры пищевода, кровотечения из эрозий и язв, формирование аденокарциномы пищевода – обусловливают необходимость своевременной диагностики и качественного лечения ГЭРБ [4, 7].
Долгое время неэрозивная форма ГЭРБ рассматривалась как «начальное» проявление заболевания, а эрозивная или язвенная формы рефлюкс-эзофагита с его осложнениями – в качестве «развернутой» стадии заболевания. Результаты наблюдений, имеющихся в настоящее время, позволяют считать, что эрозивная форма (ЭЭ) и неэрозивная форма ГЭРБ (НЭРБ) не имеют тенденции к самостоятельной трансформации одна в другую и могут существовать независимо друг от друга [8-10]. Более того, ряд авторов предлагает выделять третью самостоятельную
форму заболевания – пищевод Барретта [11], возникающую не только на фоне ЭЭ, но и на фоне НЭРБ, а также в ряде случаев протекая без типичных симптомов ГЭРБ.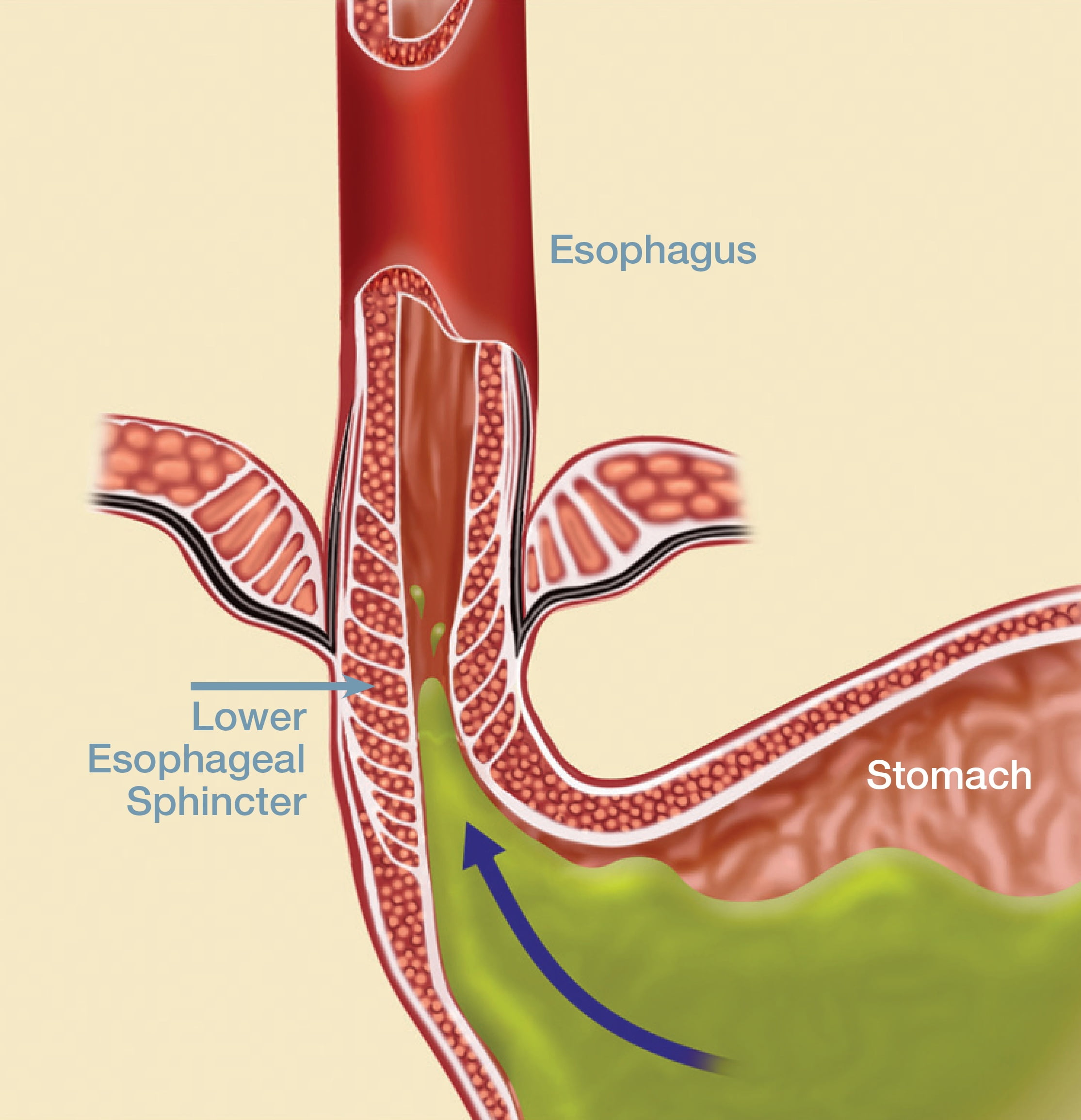 Вероятно, такая особенность течения заболевания обусловлена совокупностью факторов: генетическими особенностями пациентов, их образом жизни, а также комплексным влиянием окружающей среды, которые в совокупности определяют баланс между защитными свойствами слизистой оболочки пищевода и активностью повреждающих факторов [12].
Вероятно, такая особенность течения заболевания обусловлена совокупностью факторов: генетическими особенностями пациентов, их образом жизни, а также комплексным влиянием окружающей среды, которые в совокупности определяют баланс между защитными свойствами слизистой оболочки пищевода и активностью повреждающих факторов [12].
Целями терапии при любых проявлениях ГЭРБ являются: быстрое и эффективное устранение симптомов заболевания, обеспечение заживления повреждений слизистой оболочки, обеспечение длительной ремиссии заболевания, улучшение качества жизни пациентов, снижение риска осложнений [1].
Достижение этих целей возможно при использовании ряда подходов. Одним из них является модификация образа жизни и диеты. Современные диетологические рекомендации включают коррекцию рационов больных с ограничением использования жиров, в особенности животного происхождения, отказ от употребления алкоголя, уменьшение общей калорийности рациона, увеличение квоты пищевых волокон в рационе больных. Используется дробное питание небольшими по объему порциями, последний прием пищи рекомендуют проводить не менее чем за два часа до сна. Эффективность модификации образа жизни и диеты не была оценена в сравнительных исследованиях у больных эрозивным эзо-фагитом. Имеются лишь отдельные исследования по оценке эффективности диетологических подходов у больных неэрозивной формой ГЭРБ [13, 50].
Используется дробное питание небольшими по объему порциями, последний прием пищи рекомендуют проводить не менее чем за два часа до сна. Эффективность модификации образа жизни и диеты не была оценена в сравнительных исследованиях у больных эрозивным эзо-фагитом. Имеются лишь отдельные исследования по оценке эффективности диетологических подходов у больных неэрозивной формой ГЭРБ [13, 50].
Для фармакологической коррекции проявлений ГЭРБ используется несколько групп лекарственных средств.
Антациды и алгинаты
Данные, полученные в ходе исследования распространенности изжоги среди взрослых пациентов, посещающих участкового врача-терапевта (АРИАДНА), свидетельствует о том, что 80% респондентов, испытывающих данный симптом, принимают антацидные препараты или алгинаты [14]. Данные анализа фармацевтического рынка свидетельствуют об аналогичной тенденции и в США: продажи безрецептурных средств (включая антациды и алгинаты) превышают 1,2 млрд долл. в год [15]. Популярность этих средств, сохраняющаяся по настоящее время, легко объяснима. Действительно, как препараты из группы антаци-дов, так и алгинаты или их комбинации позволяют добиться быстрого купирования изжоги. Результаты исследований показывают, что начало их действия отмечается в пределах 3-7 минут [16-17]. Кроме того, в большинстве стран мира эти средства отпускаются без рецепта, что делает их наиболее доступным способом, помогающим пациентам облегчить симптомы ГЭРБ до визита к врачу для получения адекватной медицинской помощи [18]. Общим недостатком этих средств является небольшая длительность действия: от 20 до 60 минут для антацидов и до 4 часов для алгинатов, что предполагает необходи-
в год [15]. Популярность этих средств, сохраняющаяся по настоящее время, легко объяснима. Действительно, как препараты из группы антаци-дов, так и алгинаты или их комбинации позволяют добиться быстрого купирования изжоги. Результаты исследований показывают, что начало их действия отмечается в пределах 3-7 минут [16-17]. Кроме того, в большинстве стран мира эти средства отпускаются без рецепта, что делает их наиболее доступным способом, помогающим пациентам облегчить симптомы ГЭРБ до визита к врачу для получения адекватной медицинской помощи [18]. Общим недостатком этих средств является небольшая длительность действия: от 20 до 60 минут для антацидов и до 4 часов для алгинатов, что предполагает необходи-
мость их повторного использования при выраженных и упорных симптомах [15, 17]. Небольшая по длительности эффективность обусловлена особенностями механизма действия: для антацидов – это нейтрализация некоторого количества уже имеющейся в желудке кислоты, в то время как для алгинатов дополнительно – создание флотирующей взвеси с нейтральным уровнем рН на поверхности желудочного содержимого, предположительно оказывающего протективное воздействие на слизистую оболочку пищевода в случае рефлюкса [19]. К сожалению, исследования in vivo с использованием сцинтиграфии и эндоскопических исследований не подтвердили возможность адгезии этой взвеси к слизистой оболочке пищевода и также продемонстрировали кратковременность (20-60 мин для антацидов и 1-3 часа для алгинатов) ее нахождения в желудке [27, 20-23]. Следует отметить, что эффективность этих средств наиболее выражена после приема пищи [24]. Исходя из этих фактов, вероятно, сферой их современного использования является симптоматическое использование для быстрого купирования изжоги или боли за грудиной, возникающих после приема пищи у тех пациентов, которые испытывают симптомы редко (менее 1 раза в неделю) [3]. Отсутствие системного действия и низкая вероятность побочных действий также обусловливают возможность симптоматического использования этих средств при возникновении изжоги у беременных [25, 26].
К сожалению, исследования in vivo с использованием сцинтиграфии и эндоскопических исследований не подтвердили возможность адгезии этой взвеси к слизистой оболочке пищевода и также продемонстрировали кратковременность (20-60 мин для антацидов и 1-3 часа для алгинатов) ее нахождения в желудке [27, 20-23]. Следует отметить, что эффективность этих средств наиболее выражена после приема пищи [24]. Исходя из этих фактов, вероятно, сферой их современного использования является симптоматическое использование для быстрого купирования изжоги или боли за грудиной, возникающих после приема пищи у тех пациентов, которые испытывают симптомы редко (менее 1 раза в неделю) [3]. Отсутствие системного действия и низкая вероятность побочных действий также обусловливают возможность симптоматического использования этих средств при возникновении изжоги у беременных [25, 26].
Прокинетики
К этой группе средств относятся цизаприд, метокло-прамид, домперидон, тегасерод, итоприд. Фармакологическое действие этих препаратов заключается в усилении антропилорической моторики, приводящей к ускоренной эвакуации желудочного содержимого, повышении тонуса нижнего пищеводного сфинктера и тем самым уменьшению количества гастроэзофагеальных рефлюк-сов и времени контакта желудочного содержимого со слизистой пищевода [27]. Использование ряда из этих средств ограничено ввиду имеющихся побочных действий (цизаприд, тегасерод). Использование препаратов этой группы для лечения НЭРБ широко обсуждается [27, 28]. Действительно, увеличение тонуса нижнего пищеводного сфинктера и ускорение эвакуации из желудка могло бы существенно улучшить эффективность лечения ГЭРБ. Несмотря на то что имеющиеся данные свидетельствуют о возможности достижения этих эффектов, по крайней мере, при использовании некоторых препаратов этой группы [29], до настоящего времени масштабных исследований, подтверждающих эффективность препаратов этой группы, не получено. Небольшие по численности включенных пациентов работы оценивали эффективность прокинетиков в купировании симптомов заболевания при НЭРБ, однако в полной мере оценить результаты не представляется возможным, поскольку ввиду отсутствия верификации диагноза в эти работы могли быть включены пациенты с наличием функциональной диспепсии [30].
Фармакологическое действие этих препаратов заключается в усилении антропилорической моторики, приводящей к ускоренной эвакуации желудочного содержимого, повышении тонуса нижнего пищеводного сфинктера и тем самым уменьшению количества гастроэзофагеальных рефлюк-сов и времени контакта желудочного содержимого со слизистой пищевода [27]. Использование ряда из этих средств ограничено ввиду имеющихся побочных действий (цизаприд, тегасерод). Использование препаратов этой группы для лечения НЭРБ широко обсуждается [27, 28]. Действительно, увеличение тонуса нижнего пищеводного сфинктера и ускорение эвакуации из желудка могло бы существенно улучшить эффективность лечения ГЭРБ. Несмотря на то что имеющиеся данные свидетельствуют о возможности достижения этих эффектов, по крайней мере, при использовании некоторых препаратов этой группы [29], до настоящего времени масштабных исследований, подтверждающих эффективность препаратов этой группы, не получено. Небольшие по численности включенных пациентов работы оценивали эффективность прокинетиков в купировании симптомов заболевания при НЭРБ, однако в полной мере оценить результаты не представляется возможным, поскольку ввиду отсутствия верификации диагноза в эти работы могли быть включены пациенты с наличием функциональной диспепсии [30]. В метаанализе работ, посвященных эффективности прокинетиков в устранении симптомов ГЭРБ, как в виде монотерапии, так и в комбинации с антисекре-
В метаанализе работ, посвященных эффективности прокинетиков в устранении симптомов ГЭРБ, как в виде монотерапии, так и в комбинации с антисекре-
торными средствами отношение шансов наличия положительного эффекта составило 1,7 (95%ДИ 1,37-2,12) по сравнению с плацебо. При этом увеличение вероятности купирования симптомов варьировало от 18% до 41% (NN1 3-6) [31], что позволило авторам сделать вывод об умеренной силе доказательной базы в отношении купирования симптомов ГЭРБ при помощи этих средств.
Антисекреторные средства
Антисекреторные средства – препараты выбора для фармакологической терапии ГЭРБ. Выделяют 2 класса кис-лотоснижающих препаратов: блокаторы Н2-рецепторов гистамина и ингибиторы протонной помпы (ИПП). Различием в действии этих двух групп препаратов является воздействие их на разные уровни выработки кислоты. Блокаторы Н2-рецепторов гистамина (БН2РГ) – цимети-дин, ранитидин, фамотидин, низатидин и роксатидин -частично влияют на выработку соляной кислоты, угнетая лишь стимулирующие влияния гистамина, в то время как ингибиторы протонного насоса влияют на общий конечный этап ее секреции, что и обуславливает их большую эффективность. Скорость наступления эффекта после приема однократной дозы препаратов этой группы составляет 1-3 часа, продолжительность антисекреторного действия для БН2РГ относительно небольшая, в среднем по классу составляя 8-10 часов, кроме того, для всех представителей этой группы лекарственных средств характерно последовательное снижение эффективности при длительном приеме за счет синдрома «усталости рецепторов» [32, 33].
Скорость наступления эффекта после приема однократной дозы препаратов этой группы составляет 1-3 часа, продолжительность антисекреторного действия для БН2РГ относительно небольшая, в среднем по классу составляя 8-10 часов, кроме того, для всех представителей этой группы лекарственных средств характерно последовательное снижение эффективности при длительном приеме за счет синдрома «усталости рецепторов» [32, 33].
Все имеющиеся в настоящее время ИПП (омепразол, лансопразол, пантопразол, рабепразол, эзомепразол, дек-слансопразол) необратимо блокируют общий конечный этап выработки кислоты – Н+К+-АТФазу за счет образования ковалентной связи с ней. Скорость наступления эффекта при однократном приеме стандартной разовой дозы составляет в среднем около 2 часов, при этом продолжительность действия, варьируя между отдельными представителями данного класса лекарственных средств, а также в связи с генетическими особенностями пациентов может достигать 72 часов [34].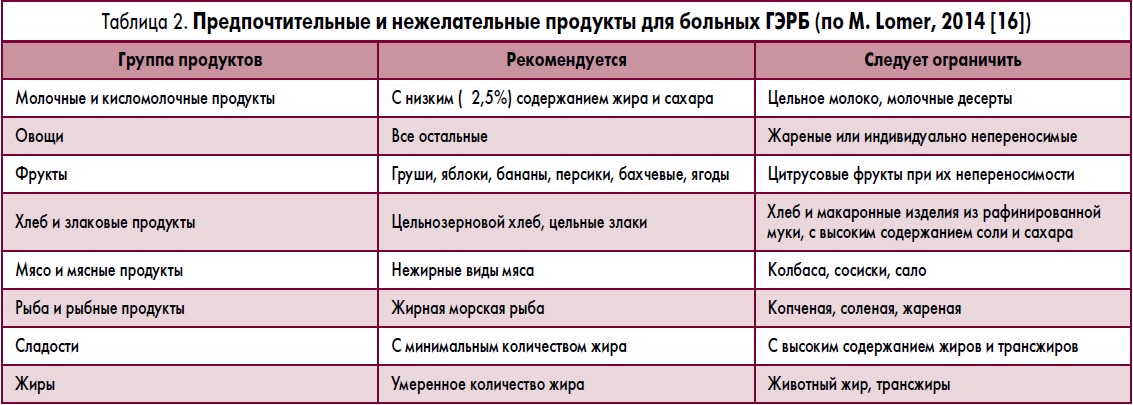
Возможности современной терапии неэрозивной формы ГЭРБ были рассмотрены нами в одной из предыдущих работ [13]. В настоящей публикации рассмотрены современные аспекты лечения рефлюкс-эзофагита (эрозивной формы ГЭРБ).
В соответствии с современными рекомендациями основой терапии данной формы заболевания является использование ИПП [35, 36]. При этом основными целями их назначения являются достижение заживления повреждения слизистой оболочки пищевода в возможно короткие сроки и удержание ремиссии заболевания на максимально длительный срок, при этом должна быть обеспечена безопасность пациентов в течение всего периода лечения.
ЗАЖИВЛЕНИЕ ЭРОЗИВНОГО ЭЗОФАГИТА
Широкое внедрение в клиническую практику ИПП позволило не только достаточно эффективно влиять на
симптомы ГЭРБ, но и обеспечивать заживление эрозий пищевода. На основании наблюдений за больными ГЭРБ, получавшими омепразол, Н. Белл с соавт. выявили закономерность, что заживление эрозий пищевода к контрольному сроку 8 нед. происходит в 80-90% случаев, если удается поддержать рН в пищеводе > 4 не менее 16-22 часов на протяжении суток [37]. Действительно, обеспечить надежную кислотосупрессию на столь длительный срок в настоящее время возможно лишь с использованием ИПП, даже несмотря на появление новых представителей БН2РГ, обладающих лучшим, по сравнению с предыдущими представителями этого класса, фармакокинетическим профилем.
На основании наблюдений за больными ГЭРБ, получавшими омепразол, Н. Белл с соавт. выявили закономерность, что заживление эрозий пищевода к контрольному сроку 8 нед. происходит в 80-90% случаев, если удается поддержать рН в пищеводе > 4 не менее 16-22 часов на протяжении суток [37]. Действительно, обеспечить надежную кислотосупрессию на столь длительный срок в настоящее время возможно лишь с использованием ИПП, даже несмотря на появление новых представителей БН2РГ, обладающих лучшим, по сравнению с предыдущими представителями этого класса, фармакокинетическим профилем.
К настоящему времени опубликовано большое число работ, в которых оценены эффекты различных ИПП на подавление желудочной секреции в прямых и непрямых исследованиях. Их результаты свидетельствуют о том, что доля времени суток с pH>4 при использовании ИПП в течение 5 дней колеблется от 43,7% (омепразол 20 мг 1 р/ сут) до 85,4% (эзомепразол 40 мг 2 р/сут), тем самым обеспечивая предпосылки для нормализации кислотности в пищеводе [38-44].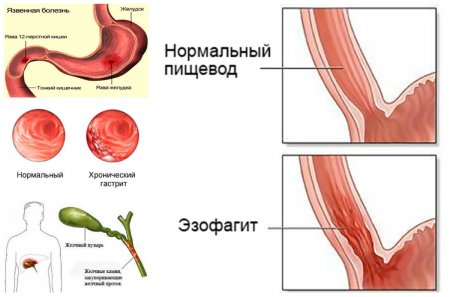 Действительно, при оценке эффекта различных ИПП на уровне закисления в нижней трети пищевода оказывается, что к 5-7-му дню лечения удается снизить долю времени с рН менее 4 с исходных 20% до 1-3% [45-46]. Очевидно, что этим обусловлена эффективность ИПП в отношении заживления ЭЭ в контрольные сроки. Анализ данных исследований эффективности различных ИПП в заживлении ЭЭ к контрольному сроку 4 нед. в среднем составляет 72% (от 47,5% при использовании лансопразола 30 мг 1 р/сут до 81,7% при использовании эзомепразола в дозе 40 мг 1 р/сут), а к контрольному сроку 8 недель – 91% (от 77,5% при использовании лансопразола 30 мг 1 р/сут до 95,5% при использовании панто-празола 40 мг 1 р/сут) [47]. Различия, получаемые в различных исследованиях, могут быть обусловлены вариабельным соотношением «тяжелых» стадий эзофагита (с вовлечением большей части окружности пищевода в воспалительный процесс), а также генетическими особенностями пациентов, вошедших в исследование (что может оказывать влияние на скорость метаболизма ИПП и, соответственно, эффективность терапии).
Действительно, при оценке эффекта различных ИПП на уровне закисления в нижней трети пищевода оказывается, что к 5-7-му дню лечения удается снизить долю времени с рН менее 4 с исходных 20% до 1-3% [45-46]. Очевидно, что этим обусловлена эффективность ИПП в отношении заживления ЭЭ в контрольные сроки. Анализ данных исследований эффективности различных ИПП в заживлении ЭЭ к контрольному сроку 4 нед. в среднем составляет 72% (от 47,5% при использовании лансопразола 30 мг 1 р/сут до 81,7% при использовании эзомепразола в дозе 40 мг 1 р/сут), а к контрольному сроку 8 недель – 91% (от 77,5% при использовании лансопразола 30 мг 1 р/сут до 95,5% при использовании панто-празола 40 мг 1 р/сут) [47]. Различия, получаемые в различных исследованиях, могут быть обусловлены вариабельным соотношением «тяжелых» стадий эзофагита (с вовлечением большей части окружности пищевода в воспалительный процесс), а также генетическими особенностями пациентов, вошедших в исследование (что может оказывать влияние на скорость метаболизма ИПП и, соответственно, эффективность терапии). Тем не менее результаты двух метаанализов свидетельствуют о том, что эзомепразол 40 мг 1 р/сут превосходит все остальные представители ИПН (омепразол, лансопразол, пантопразол, рабе-празол, декслансопразол) в эффективности заживления эрозий в пищеводе к контрольному сроку 8 нед. [47, 48]. Эффективность эзомепразола 40 мг в отношении обеспечения заживления эрозий пищевода к контрольному сроку 4 нед. также оказалась выше по сравнению с другими ИПП, однако данные нескольких исследований свидетельствуют о недостоверных различиях в его эффективности в этой контрольной точке по сравнению с эффектом декслансопразола 60 мг/сут [49]. Упомянутые ограничения связаны с небольшим количеством накопленных данных о сравнительной клинической эффективности декслансо-празола, поскольку данный препарат был одобрен к использованию FDA лишь в 2009 г. В то же время улучшен-
Тем не менее результаты двух метаанализов свидетельствуют о том, что эзомепразол 40 мг 1 р/сут превосходит все остальные представители ИПН (омепразол, лансопразол, пантопразол, рабе-празол, декслансопразол) в эффективности заживления эрозий в пищеводе к контрольному сроку 8 нед. [47, 48]. Эффективность эзомепразола 40 мг в отношении обеспечения заживления эрозий пищевода к контрольному сроку 4 нед. также оказалась выше по сравнению с другими ИПП, однако данные нескольких исследований свидетельствуют о недостоверных различиях в его эффективности в этой контрольной точке по сравнению с эффектом декслансопразола 60 мг/сут [49]. Упомянутые ограничения связаны с небольшим количеством накопленных данных о сравнительной клинической эффективности декслансо-празола, поскольку данный препарат был одобрен к использованию FDA лишь в 2009 г. В то же время улучшен-
ный фармакокинетический профиль этого лекарственного средства за счет двойного высвобождения препарата в кишечнике обеспечивает наиболее полное угнетение желудочной секреции с максимальными значениями рН в желудке по сравнению с другими ИПП, что позволяет предполагать у него значительный потенциал [50]. Кроме того, декслансопразол не требует обязательного приема за 30 минут до еды, что увеличивает удобство и, как следствие, возможную приверженность к лечению, поэтому у ряда пациентов декслансопразол может стать средством выбора в лечении ЭЭ.
ПОДДЕРЖАНИЕ РЕМИССИИ ЭРОЗИВНОГО ЭЗОФАГИТА
Заживление повреждений слизистой пищевода у больных эрозивным эзофагитом является лишь первоочередной задачей. Естественное течение заболевания характеризуется возвратом исходной эндоскопической картины при отсутствии поддерживающей терапии в 80% случаев через 6-12 месяцев [51, 52]. Соответственно, больные эрозивной формой ГЭРБ требуют длительной, зачастую пожизненной антисекреторной терапии [47, 52]. Выбор режима поддерживающего лечения зачастую представляет непростую задачу, поскольку выбор представлен использованием стандартной дозы использовавшегося для заживления повреждений слизистой оболочки пищевода лекарственного средства, половины стандартной дозы его же или другого препарата для поддержания ремиссии. Эффективность различных ИПП в поддержании ремиссии ЭЭ была оценена в ряде работ. Так, в исследовании D.A. Johnson и соавт. было показано, что при использовании эзомепразола 40 мг в сутки ремиссия ЭЭ через 6 месяцев наблюдения обеспечивается у 93,6%
Рисунок. Сравнительная эффективность различных пред-
ставителей ИПН в удержании ремиссии эрозивного эзофагита по данным сравнительных исследований [54-56]
Результаты исследований по оценке ИПН в удержании ремиссии эрозивного эзофагита
Lauritsen et al , 2003 N=1224 p<0,0001
90
Labenz et al , 2003 N=2776 p<0,0001
Devault et al , 2006 N=1026 p<0,0007
85
75
ï 70
87
84,5
83
74
74,9
75,9
эзо20 лан15
эзо20 панто20
эзо20 лан15
больных, при использовании этого же препарата в дозе 20 мг – у 93,2%, в то время как при использовании дозы 10 мг – лишь у 57,1% больных [53]. В ходе сравнительных исследований эзомепразола 20 мг/сут в сравнении с другими ИПП выявлена большая его эффективность в удержании ремиссии в контрольные сроки 6 месяцев (рис.).
В одном из исследований была показана возможность поддержания ремиссии ЭЭ в течение 42 нед. у более чем 90% больных при использовании рабепразола 10 мг/сут или омепразола 10 мг/сут [57]. Однако данные этого исследования невозможно экстраполировать на европейскую популяцию, поскольку исследование было выполнено с участием корейских пациентов, среди которых распространенность генотипа, обусловливающего медленный метаболизм ИПН и, соответственно, большую эффективность ИПН, выше [58].
Одним из возможных вариантов поддерживающего лечения у больных эрозивной формой ГЭРБ является терапия «по требованию», когда пациент принимает препарат лишь тогда, когда у него возникают симптомы, обусловленные рефлюксом (чаще всего изжога и отрыжка кислым). Однако эффективность такого лечения оказалась гораздо ниже в поддержании эрозивного эзофагита по сравнению с длительным постоянным приемом ИПП в поддерживающих дозах.
При оценке количества пациентов, у которых наблюдалась ремиссия заболевания через 6 месяцев, отсутствие эрозий пищевода в группе, получавшей эзомепра-зол 20 мг в режиме «по требованию» (n = 234), составило 58%, в то время как у тех пациентов, которые принимали препарат постоянно (n = 243), не было признаков эрозивного эзофагита значительно чаще – у 81% [59].
ОЦЕНКА БЕЗОПАСНОСТИ ДЛИТЕЛЬНОГО ИСПОЛЬЗОВАНИЯ ИПП
Длительное использование ИПП является необходимостью при ряде заболеваний, в том числе и при эрозивной ГЭРБ. Соответственно, аспекты, связанные с безопасностью применения этой группы средств, становятся весьма актуальными. В последние годы появились многочисленные высказывания и гипотезы, предполагающие разнообразные и даже якобы серьезные риски нежелательных явлений при длительном применении ИПП. В частности, обсуждались такие потенциальные осложнения длительной терапии ИПН, как гипергастринемия, карциноид, атрофический гастрит, кишечная метаплазия и рак желудка; ахлоргидрия и снижение бактерицидно-сти желудочного сока, приводящие, в свою очередь, к повышению риска бактериальных кишечных инфекций, возникновению аспирационной пневмонии, мальабсорб-ции жиров, минералов и витаминов. В таблице 1 приведены наиболее часто обсуждаемые возможные риски при длительном использовании ИПП [60].
Действительно, данные двух исследований, опубликованные в 2016 г., свидетельствуют о том, что использование ИПП может провоцировать развитие хронической болезни почек (ХБП), причем вне связи с острым интер-
80
стициальным нефритом [61, 62]. В первом из них были исследованы две когорты пациентов: в одну вошли 10 482 пациента, которые находились под наблюдением; вторую составили данные о 249 751 больном, полученные в ходе ретроспективного анализа. Анализ возможных факторов риска развития ХБП выявил, что одним из них является использование ИПН, причем риск в первой когорте составил 50%, а во второй – 17%.
В другом исследовании анализировалась частота выявления ХБП у больных, получавших длительно ИПП (173 321 человек) или Н2БРГ (20 270 человек) за период наблюдения 5 лет. Авторы включали пациентов с нормальным уровнем клубочковой фильтрации исходно и диагностировали наличие ХБП в том случае, если уровень клубоч-ковой фильтрации снижался до уровня менее чем 60 мл/ мин/1,73 м2. Авторы выявили абсолютный годовой избыточный риск развития ХБП у лиц, принимающих ИПН 1,8%.
Детальный анализ результатов обоих этих исследований свидетельствует о том, что, скорее всего, они были обусловлены ошибкой планирования исследования, поскольку не учитывалась исходная тяжесть сопутствующей патологии у лиц, включенных в исследование (например, сахарного диабета).типа для разрушения БА. В исследованиях на мышах был показано, что ИПП могут блокировать работу этих ферментов, что может приводить к накоплению БА в головном мозге животных [63]. Опубликованные недавно результаты исследования, в ходе которого были обследо-
ваны 3 327 пациентов старше 75 лет, свидетельствовали, что частота встречаемости деменции (как на фоне болезни Альцгеймера, так и без нее) выше на 38% среди тех из них, кто принимал ингибиторы протонного насоса [64]. В дальнейшем был проведен ретроспективный анализ данных страховых компаний в отношении лиц старше 75 лет (включивший данные более половины лиц этой возрастной группы в Германии), в ходе которого было выявлено, что риск развития деменции выше на 44% среди тех, кто постоянно употреблял ИПП, по сравнению с теми, кто не использовал препараты этой группы [65]. Среди тех, кто использовал ИПП периодически, риск развития деменции был выше на 16% по сравнению с теми, кто ИПП не использовал. Казалось бы, эти результаты могут четко свидетельствовать о возможном риске использования ИПП? Однако следует обратить внимание на то, что пациенты, начинающие лечение ИПП, в особенности в пожилом возрасте, имеют большой спектр сопутствующей патологии. В цитируемых исследованиях у пациентов, которым были назначены антисекреторные средства, частота выявления депрессивных расстройств, нарушений мозгового кровообращения в анамнезе была поразительно высока. И кроме того, эти больные чаще получали одновременно несколько лекарственных препаратов. Все это могло в значительной мере отразиться на результатах исследования и не позволяет в полной мере соотнести риски развития деменции с приемом ИПП [60].
Переломы костей
Возможность развития переломов костей при приеме ИПП широко дискутируется практически со времени регистрации первого препарата этой группы. Потенциально такая связь может существовать за счет сниже-
Таблица. Возможные риски длительного использования ИПП [цит. по 60]
Возможное побочное действие Относительный риск Источник оценки риска Источник оценки частоты НЯ Абсолютный оценочный риск
Хроническая болезнь почек Рост на 10-20% Lazarus et al Lazarus et al 0,1-0,3% на пациента в год
Деменция Увеличение на 4-80% Haenisch et al Haenisch et al 0,07-1,5% на пациента в год
Переломы трубчатых костей Рост от 30% до х 4 раза Yang et al Yang et al 0,1-0,5% на пациента в год
Инфаркт миокарда Нет взаимосвязи по данным РКИ
Синдром избыточного бактериального роста в тонкой кишке Увеличение риска в 2-8 раз Lo et al Нет данных Невозможно оценить
Инфекции Campilobacter и Salmonella Увеличение риска в 2-6 раз Bavishi et al Crim et al 0,2-0,3% на пациента в год
Спонтанный бактериальный перитонит Увеличение риска от 50% до х3 раз Xu et al Fernandez et al От 3 до 16% на пациента в год
Инфекция С. dificile От отсутствия риска -до 3-кратного увеличения риска Furuya et al Lessa et al 0-0,09% на пациента в год
Пневмония Нет взаимосвязи по данным РКИ
Дефицит микронутриентов Увеличение риска на 60-70% Lam et al Bailey et al 0,3-0,4% на пациента в год
Опухоли желудочно-кишечного тракта Нет ассоциации по данным РКИ
ния кислотопродукции в желудке и связанной с ней мальабсорбцией кальция, за счет гастрин-индуцирован-ной гиперпаратиреоидной гиперплазии, а также за счет угнетения вакуолярной АТФазы остеокластов. Данные риски были отмечены во многих [66], но не во всех [67] исследованиях. Минерализация костной ткани может зависеть от множества причин, которые не всегда могут быть учтены в ходе одной работы. В последнее время стали доступны новые методы исследования костной ткани, такие как, например, объемная компьютерная абсорбциоденситометрия. В одном из исследований было показано, что использование ИПП может обусловить уменьшение минерализации трабекулярной части шейки бедра [68], однако другие работы в принципе отрицают возможное влияние длительного приема ИПП на минерализацию костей [67, 69]. В соответствии с имеющейся в настоящее время доказательной базой контролировать минеральную плотность костной ткани у больных, получающих ИПП, необходимости нет [60].
Риски инфаркта миокарда
Около десяти лет назад активно обсуждалась возможность ИПП увеличивать риски инфаркта миокарда (ИМ) за счет конкуренции за пути метаболизма с антиангинальны-ми средствами. Например, клопидогрел требует для активации участия ферментов цитохрома Р450 CYP2C19. Эта же изоформа цитохрома активно участвует в метаболизме ИПП. Предполагалось, что при назначении ИПП, анти-агрегантный эффект клопидогрела снижается. В специально проведенном исследовании COGENT с участием 3 761 больного, получавших комбинацию клопидогрела с омепразолом или клопидогрел-плацебо, было показано, что частота инфарктов миокарда в группе, принимавшей оба препарата, была меньше, чем в группе плацебо (4,9% против 5,7%) [70]. В дальнейшем была выдвинута другая теория, что ИПП могут угнетать NO-синтазу сосудов, тем самым обусловливая большую вероятность спазма [71]. Однако частота развития ИМ у пациентов, принимающих ИПП, оказалась почему-то выше в подгруппе с исходно низкими рисками ИМ (повышение риска на 9-16%) [72]. В то время как логичнее было бы предположить более высокие риски ИМ у лиц с исходно более высокими шансами его развития. Очевидно, что требуется дополнительное изучение этого вопроса в дальнейших исследованиях, поскольку многие из значимых аспектов в упоминавшихся исследованиях учтены не были.
Пневмонии
Увеличение риска развития внебольничных пневмоний (ВБП) было теоретически обосновано уменьшением барьерной функции желудка за счет угнетения кислотопродукции при применении ИПП и возможности контаминации сапрофитной микрофлорой верхних дыхательных путей [74, 75]. Интересно, что риски развития ВБП были выше у тех пациентов, которые начали принимать ИПП недавно, чем у тех, которые использовали эти средства длительно. Вероятно, это можно объяснить тем, что ИПП были назначены именно тем больным, у которых в
недавнем прошлом были диагностированы острые ситуации (например, в ходе текущей госпитализации) или же эти средства были выписаны по поводу ранних симптомов воспаления легких. В исследовании OBERON были рандомизированы 2 426 пациентов, получавшие ИПП или плацебо в течение 26 нед. для предотвращения язво-образования. Анализ данных этого исследование свидетельствует, что риски ВБП оказались статистически сопоставимыми в основной (0,9%) и контрольной (1,9%) группах [75]. При ретроспективном анализе данных 24 исследований, в которых пациенты получали ИПП или плацебо, также не было выявлено существенных различий по рискам развития ВБП в обеих группах [76].
Риск дефицита микронутриенов
Кислота желудочного сока играет существенную роль в регуляции обмена железа, кальция, магния, витамина В12. В ряде исследований было показано, что использование ИПП может обусловить дефицитные состояния по этим микронутриентам. Так, массивное подавление кислотопродукции может нарушить всасывания кальция. В то же время это не относится к водорастворимым солям кальция, содержащимся, например, в молоке и сыре [77, 78]. Кроме того, как выяснилось, использование слегка закисленной пищи полностью предотвращает эту проблему [79].
Использование ИПП более 6 лет не было ассоциировано с уменьшением общих запасов железа в организме пациентов и не приводило к развитию железодефицит-ной анемии [80]. Эти данные свидетельствуют об отсутствии необходимости профилактически восполнять запасы железа дополнительным назначением препаратом железа или биодобавок при длительном приеме ИПП.
Было зарегистрировано несколько случаев развития гипомагниемии у больных, принимавших ИПП [81]. Редкая частота таких случаев на фоне широкого распространения ИПП позволяет рассматривать данный феномен как случаи идиосинкразии.
Возможность развития дефицита витамина В12 у больных, длительно принимающих ИПП, теоретически обоснована необходимостью участия кислоты желудочного сока для его усвоения. В ряде исследований была продемонстрирована возможность увеличения рисков развития В12-дефицитных состояний в 2-4 раза при приеме ИПП в сравнении с теми, кто не получал эти средства [82]. Однако в настоящее время нет доказательной базы, обусловливающей необходимость восполнения дефицита витамина В12 у пациентов, получающих ИПП.
ЗАКЛЮЧЕНИЕ
Эрозивная форма ГЭРБ является одной из наиболее изученных и в то же время зачастую недооцениваемой в широкой клинической практике. Риски рецидивов после отмены терапии создают впечатление «неизлечимости» болезни по мнению пациента и вследствие этого более низкую приверженность к назначаемым в последующем препаратам. Как и многие другие хронические заболева-
ния, эрозивная форма ГЭРБ требует длительной и постоянной терапии с использованием ИПП. Для поддержания ремиссии заболевания могут быть использованы более низкие дозы ИПП, чем для ее достижения в соответствии с инструкциями к используемому препарату (например, декслансопразол 60 мг назначается для индукции клини-ко-эндоскопической ремиссии, а доза 30 мг используется для длительной ежедневной поддерживающей терапии).
В случае любого назначения ИПП следует оценивать баланс возможной пользы и потенциальных рисков. В случае эрозивного эзофагита риски, связанные с отказом от наиболее эффективных средств для достижения ремиссии заболевания и ее поддержания, очевидны -они заключаются как в возможности образования более глубоких повреждений слизистой оболочки пищевода (язв), так и в развитии таких осложнений, как малигниза-ция и стриктуры. Существенное снижение качества жизни у пациента, продолжающего испытывать симптомы заболевания, также обосновывает необходимость выбора наиболее эффективных лекарственных средств, способных быстро и эффективно эти симптомы купировать. Следует учитывать возможные риски длительного исполь-
зования ИПП, в особенности у пациентов, получающих несколько препаратов одновременно. Тем не менее в соответствии с текущими рекомендациями нет необходимости специальным образом контролировать минеральную плотность костной ткани, концентрации креатинина, магния или витамина В12 сыворотки крови при длительном использовании ИПП. Потребление пищевых веществ выше норм физиологической потребностей также не считается обоснованным [60].
И наконец, выбор препарата ИПП для обеспечения адекватного лечения больного эрозивной формой ГЭРБ, в соответствии с современными стандартами, остается за врачом, который должен учитывать целый ряд аспектов. При этом, по нашему мнению, предпочтение должно отдаваться использованию современных препаратов (оптимально – стереоизомерам ИПП), обеспечивающих максимальный эффект в короткие сроки, обладающие хорошим профилем безопасности и удобные для использования пациентом.
Конфликт интересов: авторы заявляют об отсутствии конфликта интересов в ходе написания данной статьи.
ЛИТЕРАТУРА
1. Vakil N,van Zanten SV, Kahrilas P et al The Montreal definition and classification of gastroesophageal reflux disease: a global evidence-based consensus. American Journal of Gastroenterology, 2006, 101(8): 1900-1943.
2. Shaheen N J, Hansen R A, Morgan D Ret al. The burden of gastrointestinal and liver diseases, 2006. American Journal of Gastroenterology, 2006, 101(9): 2128-2138.
3. Dent J, El-Serag H B, Wallander M A, Johansson S. Epidemiology of gastro-oesophageal reflux disease: a systematic review. Gut, 2005, 54(5): 710-717.
4. Blot WJ. Esophageal cancer trends and risk factors. Seminars in Oncology, 1994: 21(4): 403-410.
5. Wahlqvist P, Reilly MC, Barkun A. Systematic review: the impact of gastro-oesophageal reflux disease on work productivity. Alimentary Pharmacology and Therapeutics, 2006, 24(2): 259-272.
6. El-Serag HB. Time trends of gastroesophageal reflux disease: a systematic review. Clinical Gastroenterology and Hepatology, 2007, 5(1): 17-26.
7. Engel L S, Chow WH, Vaughan TL et al. Population attributable risks of esophageal and gastric cancers. Journal of the National Cancer Institute, 2003, 95(18): 1404-1413.
8. Sontag SJ, Sonnenberg A, Schnell TG et al. The long-term natural history of gastroesophageal reflux disease. Journal of Clinical Gastroenterology, 2006, 40(5): 398-404.
9. Agrawal A, Castell D. GERD is chronic but not progressive. Journal of Clinical Gastroenterology. 2006, 40(5): 374-375.
10. Bardhan KD, Royston C, Nayyar AK. Reflux rising! An essay on witnessing a disease in evolution. Dig Liver Dis, 2006, 38: 163-168.
11. ass R, Ofman J. Gastroesophageal reflux disease-should we adopt a new conceptual framework? Am J Gastroenterol, 2002, 97: 1901-1909.
12. Nwokediuko SC. Current trends in the management of gastroesophageal reflux disease: a review. ISRN Gastroenterol, 2012, 2012: 391631. doi: 10.5402/2012/391631.
13. Морозов С.В., Кучерявый Ю.А. Гастроэзофаге-альная рефлюксная болезнь: формы заболевания и особенности их лечения. Лечебное дело (журнал), 2015, 4: 21-30. Morozov SV, Kucheryavy YuA. Gastroesophageal reflux disease: the forms of the disease and the features of its treatment. Lechebnoe Delo (Journal), 2015, 4: 21-30.
14. Исаков В.А., Морозов С.В., Ставраки Е.С., Комаров Р.С. Анализ Распространенности Изжоги: нАциональное эпидемиологическое исследование взрослого городского нАселения (АРИАДНА). Экспериментальная и клиническая гастроэнтерология, 2008, 1: 20-30./ Isakov VA, Morozov SV, Stavraky ES, Komarov RS. Heartburn prevalence analysis: National Epidemiological Study of Urban Adult Population (ARIADNA). Eksperimentalnaya i Klinicheskaya Gastroenterologiya, 2008, 1: 20-30.
15. Mandel KG, Daggy BP, Brodie DA, Jacoby HI. Review article: alginate-raft formations in the treatment of heartburn and acid reflux. Aliment Pharmacol Ther, 2000, 14: 669-690.
16. Ritschel WA. Antacids and Other Drugs in GI Diseases. Hamilton, IL, USA: Drug Intelligence Publications, Inc., 1984.
17. Washington N. Antacids and Anti-Reflux Agents. Boca Raton, FL, USA: CRC Press Inc., 1991: 127.
18. ones R, Lydeard S. Prevalence of symptoms of dyspepsia in the community. Lancet, 1989, 1: 47-51.
19. Vatier J, Celice-Pingaud C, Farinotti R. A computerized artificial stomach model to assess sodium alginate-induced pH gradient. Int J Pharmaceut, 1998, 163: 225-9.
20. night LC, Maurer AH, Ammar IA et al. Use of 111In-labeled alginate to study the pH dependence of alginic acid anti-esophageal refux barrier. Int J Rad Appl Instrum (B), 1988, 15: 563-71.
21. May HA, Wilson CG, Hardy JG. Monitoring radiolabeled antacid preparations in the stomach. Inter J Pharmaceutics, 1984, 19: 169-76.
22. Malmud LS, Charles ND, Littlefield J, et al. The mode of action of alginic acid compound in the reduction of gastroesophageal reflux. J Nuc Med, 1979, 20: 1023-8.
23. Goodall JS, Orwin JM, Imrie MJ. A combined pH and X-ray study of liquid alginate/antacid formulation using a novel X-ray contrast medium. Acta Therapeutica, 1977, 3: 141-53.
24. Washington N, Parker MA, Steele RJC, et al. Time to onset of action of sodium alginate, ranitidine, omeprazole and water based on oesophageal pH. Gastroenterology, 1999, 116: A350(Abstract).
25. Uzan M, Uzan S, Surean C, Richard-Berthe C. Heartburn and regurgitation in pregnancy. Efficacy and innocuousness of treatment with Gaviscon suspension. Rev Fr Gynecol Obst, 1988, 83: 569-72.
26. Lang GD, Dougall A. Comparative study of Algicon suspension and magnesium trisilicate mixture in the treatment of reflux dyspepsia of pregnancy. Br J Clin Pract, 1990, 66: 48-51.
27. Modlin IM, Hunt RH, Malfertheiner P et al. Diagnosis and Management of Non-Erosive Reflux Disease – The Vevey NERD Consensus Group. Digestion, 2009, 80: 74-88.
28. Langen ML, van Zanten SV. Does the evidence show that prokinetic agents are effective in healing esophagitis and improving symptoms of GERD? Open Medicine, 2007, 1(3): 181-3.
29. Kim YS, Kim TH, Choi CS et al. Effect of ito-pride, a new prokinetic, in patients with mild GERD: A pilot study. World J Gastroenterol, 2005, 11(27): 4210-4214.
30. Ndraha S. Combination of PPI with a prokinetic drug in GERD. Acta Med Indones-Indones J Intern Med, 2011, 43 (4): 233-236.
31. Manzotti ME, Catalano HN, Serrano FA et al. Prokinetic drug utility in the treatment of gas-troesophageal reflux esophagitis: a systematic review of randomized controlled trials. Open Med, 2007, 1(3): 171-80.
32. Jones DB, Howden CW, Burget DW, et al. Acid suppression in duodenal ulcer: a meta-analysis to define optimal dosing with antisecretory drugs. Gut, 1987, 28: 1120-1127.
33. Khan M, Santana J, Donnellan C, et al. Medical treatments in the short term management of reflux oesophagitis. Cochrane Database Syst Rev, 2007, 2: CD003244.
34. Исаков В.А. Ингибиторы протонного насоса: их свойства и применение в гастроэнтерологии. М.: ИКЦ «Академкнига», 2001. 304 с./ Isakov VA. Proton pump inhibitors: properties and application in gastroenterology. M.: IKC Akademkniga, 2001. 304 p.
35. Kahrilas PJ, Shaheen NJ, Vaezi MF, et al. American Gastroenterological Association Medical Position Statement on the management of gastroesophageal reflux disease. Gastroenterology, 2008, 135: 1383-1391.
36. Katz PO, Gerson LB, Vela MF. Guidelines for the diagnosis and management of gastroesopha-geal reflux disease. Am J Gastroenterol, 2013, 108: 308-328.
37. Bell NJ, Hunt RH. Role of gastric acid suppression in the treatment of gastro-oesophageal reflux disease. Gut, 1992 Jan, 33(1): 118-24.
38. Lind T, Rydberg L, Kyleback A, et al. Esomeprazole provides improved acid control vs omeprazole In patients with symptoms of gastro-oesophageal reflux disease. Aliment Pharmacol Ther, 2000, 14: 861-7.
39. Rohss K, Hasselgren G, Hedenstrom H. Effect of esomeprazole 40 mg vs omeprazole 40 mg on 24-hour intragastric pH in patients with symptoms of gastroesophageal reflux disease. Dig Dis Sci, 2002, 47: 954-8
40. Wilder-Smith CH, Rohss K, Nilsson-Pieschl C, et al. Esomeprazole 40 mg provides improved intragastric acid control as compared with lan-soprazole 30 mg and rabeprazole 20 mg in healthy volunteers. Digestion, 2003, 68: 184-8.
41. Miner PJr, Katz PO, Chen Y, et al. Gastric acid control with esomeprazole, lansoprazole, ome-prazole, pantoprazole, and rabeprazole: a five-way crossover study. Am J Gastroenterol, 2003, 98: 2616-20.
42. Rohss K, Lind T, Wilder-Smith C. Esomeprazole 40 mg provides more effective intragastric acid control than lansoprazole 30 mg, omeprazole 20 mg, pantoprazole 40 mg and rabeprazole 20 mg in patients with gastro-oesophageal reflux symptoms. Eur J Clin Pharmacol, 2004, 60: 531-9.
43. Miehlke S, Madisch A, Kirsch C, et al. Intragastric acidity during treatment with esomeprazole 40 mg twice daily or pantopra-zole 40 mg twice daily – a randomized, two-way crossover study. Aliment Pharmacol Ther, 2005, 21: 963-7
44. Johnson DA, Stacy T, Ryan M, et al. A comparison of esomeprazole and lansoprazole for control of intragastric pH in patients with symptoms of gastro-oesophageal reflux disease. Aliment Pharmacol Ther, 2005, 22: 129-34
45. Simon B, Muller P, Pascu O, et al. Intra-oesopha-geal pH profiles and pharmacokinetics of panto-prazole and esomeprazole: a crossover study in patients with gastro-oesophageal reflux disease. Eur J Gastroenterol Hepatol, 2003, 15: 791-9.
46. Морозов С.В., Исаков В.А., Цодикова О.М. Влияние эзомепразола и рабепразола на закисление пищевода у больных гастроэзо-фагеальной рефлюксной болезнью, интенсивно метаболизирующих ингибиторы протонного насоса. Терапевтический архив, 2005, 2: 21-25./ Morozov SV, Isakov VA, Tsodikova OM. Effect of esomeprazole and rabeprazole on esophageal acid exposure in patients with gas-troesophageal reflux disease, intensively metabolizing proton pump inhibitors. TerapevticheskiyArkhiv, 2005, 2: 21-25.
47. Kalaitzakis E, Bjornsson E. A review of esome-prazole in the treatment of gastroesophageal reflux disease (GERD). Therapeutics and Clinical Risk Management, 2007, 3(4): 653-663.
48. Vakil N, Fennerty MB. Direct comparative trials of the efficacy of proton pump inhibitors in the management of gastro-oesophageal reflux disease and peptic ulcer disease. Aliment Pharmacol Ther, 2003, 18(6): 559-68.
49. Li MJ, Li 0, Sun M, Liu LQ. Comparative effectiveness and acceptability of the FDA-licensed proton pump inhibitors for erosive esophagitis: A PRISMA-compliant network meta-analysis. Medicine (Baltimore), 2017, 96(39): e8120. doi: 10.1097/MD.0000000000008120. PubMed PMID:28953640.
50. Kukulka M, Eisenberg C, Nudurupati S. Comparator pH study to evaluate the singledose pharmacodynamics of dual delayed-release dexlansoprazole 60mg and delayed-release esomeprazole 40 mg. Clin Exp Gastroenterol, 2011, 4: 213-20.
51. DeVault KR, Castell DO. Updated guidelines for the diagnosis and treatment of gastroesophageal reflux disease. Am J Gastroenterol, 2005, 100: 190-200
52. Moayyedi P, Talley NJ. Gastro-oesophageal reflux disease. Lancet, 2006, 367: 2086-100.
53. Johnson DA, Benjamin SB, Vakil NB, et al. Esomeprazole once daily for 6 months is effective therapy for maintaining healed erosive esophagitis and for controlling gastroesophage-al reflux disease symptoms: a randomized, double-blind, placebo-controlled study of efficacy and safety. Am J Gastroenterol, 2001, 96: 27-34.
54. Lauritsen K, Deviere J, Bigard MA, et al. Esomeprazole 20 mg and lansoprazole 15 mg in maintaining healed reflux oesophagitis: Metropole study results. Aliment Pharmacol Ther, 2003, 17: 333-41.
55. Labenz J, Armstrong D, Lauritsen K, et al. Esomeprazole 20 mg vs pantoprazole 20 mg for maintenance therapy of healed erosive oesophagitis: results from the EXPO study. Aliment Pharmacol Ther, 2005, 22: 803-11.
56. Devault KR, Johanson JF, Johnson DA, et al. Maintenance of healed erosive esophagitis: a randomized six-month comparison of esome-prazole twenty milligrams with lansoprazole fifteen milligrams. Clin Gastroenterol Hepatol. 2006, 4: 852-9.
57. Park JH, H Park, Lee DH et al. A randomized, double blinded, clinical trial to assess the efficacy and cost effectiveness of omeprazole compared to rabeprazole in the maintenance therapy of patients with gastroesophageal reflux disease. J Neurogastroenterol Motil, 2013, 19(2): 219-226.
58. Bertilsson L. Geographical/interracial differences in polymorphic drug oxidation: current state of knowledge of cytochromes P450 (CYP) 2D6 and 2C19. Clin Pharmacokinet, 1995, 29: 192209.
59. Sjöstedt S, Befrits R, Sylvan A, et al Daily treatment with esomeprazole is superior to that taken on-demand for maintenance of healed erosive oesophagitis. Aliment Pharmacol Ther. 2005, 22(3): 183-91.
60. Freedberg DE, Kim LS, Yang YX. The risks and benefits of long-term use of proton pump inhibitors: expert review and best practice advice from the American Gastroenterological Association. Gastroenterology, 2017, 152(4): 706715.
61. Lazarus B, Chen Y, Wilson FP, et al. Proton Pump Inhibitor Use and the Risk of Chronic Kidney Disease. JAMA Intern Med, 2016, 176: 238-246.
62. Xie Y, Bowe B, Li T, et al. Proton pump inhibitors and risk of incident CKD and progression to ESRD. J Am Soc Nephrol, 2016, 27: 3153-316.
63. Badiola N, Alcalde V, Pujol A, et al. The protonpump inhibitor lansoprazole enhances amyloid beta production. PLoS One, 2013, 8: e58837.
64. Haenisch B, von Holt K, Wiese B, et al. Risk of dementia in elderly patients with the use of proton pump inhibitors. Eur Arch Psychiatry Clin Neurosci, 2015, 265: 419-428.
65. Gomm W, von Holt K, Thome F, et al. Association of Proton Pump Inhibitors With Risk of Dementia: A Pharmacoepidemiological
Claims Data Analysis. JAMA Neurol, 2016, 73: 410-416.
66. Yang YX, Lewis JD, Epstein S, et al. Long-term proton pump inhibitor therapy and risk of hip fracture. JAMA, 2006, 296: 2947-2953.
67. Targownik LE, Leslie WD, Davison KS, et al. The relationship between proton pump inhibitor use and longitudinal change in bone mineral density: a population-based study from the Canadian Multicentre Osteoporosis Study (CaMos). Am J Gastroenterol, 2012, 107: 1361-1369.
68. Maggio M, Lauretani F, Ceda GP, et al. Use of proton pump inhibitors is associated with lower trabecular bone density in older individuals. Bone, 2013, 57: 437-442.
69. Targownik L, Luo Y, Goertzen A, et al. Comparing Bone Structure and Bone Metabolism Between Long-Term Proton Pump Inhibitor Users and Non-Users. Gastroenterology, 2015, 148: S-153.
70. Bhatt DL, Cryer BL, Contant CF, et al. Clopidogrel with or without omeprazole in coronary artery disease. N Engl J Med, 2010, 363: 1909-1917.
71. Ghebremariam YT, LePendu P, Lee JC, et al. Unexpected effect of proton pump inhibitors: elevation of the cardiovascular risk factor asymmetric dimethylarginine. Circulation, 2013, 128: 845-853.
72. Shah NH, LePendu P, Bauer-Mehren A, et al. Proton Pump Inhibitor Usage and the Risk of Myocardial Infarction in the General Population. PLoS One, 2015, 10: e0124653.
73. Rosen R, Hu L, Amirault J, et al. 16S community profiling identifies proton pump inhibitor related differences in gastric, lung, and oro-pharyngeal microflora. J Pediatr, 2015, 166: 917-923.
74. Lambert AA, Lam JO, Paik JJ, et al. Risk of community acquired pneumonia with outpatient proton-pump inhibitor therapy: a systematic review and meta-analysis. PLoS One, 2015, 10: e0128004.
75. Scheiman JM, Devereaux PJ, Herlitz J, et al. Prevention of peptic ulcers with esomeprazole in patients at risk of ulcer development treated with low-dose acetylsalicylic acid: a randomized, controlled trial (OBERON). Heart, 2011, 97: 797-802.
76. Estborn L, Joelson S. Frequency and time to onset of community-acquired respiratory tract infections in patients receiving esomeprazole: a retrospective analysis of patient-level data in placebo-controlled studies. Aliment Pharmacol Ther, 2015, 42: 607-613.
77. O’Connell MB, Madden DM, Murray AM, et al. Effects of proton pump inhibitors on calcium carbonate absorption in women: a randomized crossover trial. American Journal of Medicine, 2005, 118: 778-781.
78. Ivanovich P, Fellows H, Rich C. The absorption of calcium carbonate. Ann Intern Med, 1967, 66: 917-923.
79. Serfaty-Lacrosniere C, Wood RJ, Voytko D, et al. Hypochlorhydria from short-term omeprazole treatment does not inhibit intestinal absorption of calcium, phosphorus, magnesium or zinc from food in humans. Journal of the American College of Nutrition, 1995, 14: 364-368.
80. Stewart CA, Termanini B, Sutliff VE, et al. Iron absorption in patients with Zollinger-Ellison syndrome treated with long-term gastric acid antisecretory therapy. Alimentary Pharmacology & Therapeutics, 1998, 12: 83-98.
81. Epstein M, McGrath S, Law F. Proton-pump inhibitors and hypomagnesemic hypoparathy-roidism. N Engl J Med, 2006, 355: 1834-1836.
82. Lam JR, Schneider JL, Zhao W, et al. Proton pump inhibitor and histamine 2 receptor antagonist use and vitamin B12 deficiency. JAMA, 2013, 310: 2435-2442.
Осложнения гастроэзофагеальной рефлюксной болезни, их лечение и профилактика
Под пищеводом Барретта подразумевают состояние, при котором вследствие длительно существующего гастроэзофагеального рефлюкса происходит замена плоского неороговевающего эпителия, характерного для слизистой оболочки дистального отдела пищевода, на метаплазированный желудочный или кишечный. По определению ведущих экспертов Американской гастроэнтерологической ассоциации, пищевод Барретта — это «сегмент цилиндрического метапластического эпителия дистального отдела пищевода, имеющего предраковый потенциал. Эпителий кишечного типа в сегменте метаплазии имеет наибольший предраковый потенциал и требует диагностики» [17]
Пищевод Барретта чаще встречается у мужчин европеоидной расы. У лиц африканского происхождения данная патология наблюдается значительно реже. Распространенность увеличивается с возрастом. К факторам риска развития заболевания относится длительный анамнез ГЭРБ, наличие сопутствующей грыжи пищеводного отверстия диафрагмы и ее размеры, курение, употребление алкоголя и ожирение [4]. Так, анамнез ГЭРБ более 5–7 лет в 3 раза повышает риск развития пищевода Барретта и аденокарциномы. Грыжа пищеводного отверстия диафрагмы определяется у 64,4–96% больных с пищеводом Барретта. Причем степень тяжести грыжи коррелирует с уровнем неопластической прогрессии ПБ. При сочетании симптомов рефлюкса и курения риск пищевода Барретта повышается до 51,4 (относительный риск [ОР] 51,4; 95% доверительный интервал [ДИ] 14,1–188). Более высокий риск пищевода Барретта имеют люди с ожирением и симптомами рефлюкса (ОР 34,4; 95% ДИ 6,3–188) по сравнению с наличием только рефлюкса (ОР 9,3; 95% ДИ 1,4–62,2) или только ожирения (ОР 0,7; 95% ДИ 0,2–2,4). Ожирение признано независимым предиктором прогрессирования данного заболевания. Это связано не только с тем, что ожирение абдоминального типа чисто механически увеличивает степень внутрибрюшного и внутрижелудочного давления, но и за счет того, что жировая ткань является активным эндокринным органом, продуцирующим факторы воспалительного ответа [2]. По мере увеличения индекса массы тела прогрессивно увеличивается риск развития аденокарциномы пищевода с 1,52 (95% ДИ 1,147–2,009) у лиц с избыточной массой тела до 2,78 (95% ДИ 1,850–4,164) при морбидном ожирении. К дополнительным факторам риска развития аденокарциномы относят наличие длинного сегмента кишечной метаплазии в пищеводе (более 8 см), дуоденогастроэзофагеальный рефлюкс, семейный анамнез и сопутствующие язвы и стриктуры пищевода. Воздействие соляной кислоты на слизистую оболочку пищевода приводит к развитию воспаления и в дальнейшем — к изъязвлению слизистой оболочки. Процесс репарации слизистой оболочки сопровождается увеличением количества стволовых клеток. В условиях низкого рН Согласно современным представлениям патогенетические механизмы развития ПБ с последующей возможной неопластической трансформацией могут быть представлены следующим образом. В ответ на повреждение слизистой оболочки пищевода в результате импульсного воздействия желчи и соляной кислоты развивается клеточный ответ, заключающийся в мутации гена-супрессора опухолевого роста р53, изменении продукции ряда сигнальных молекул (TGF-бета, протеинкиназа С), появлении нестабильности хромосом. Возможны эпимутации, заключающиеся в метилировании ДНК и приводящие к изменению состояния активности генов, контролирующих клеточную пролиферацию. В конечном итоге развивается повреждение ДНК, приводящее к ускорению пролиферации и замедлению апоптоза [3, 5, 6, 14]. Клинические проявления ПБ не специфичны и могут напоминать классические симптомы ГЭРБ с характерной для данного заболевания изжогой, дискомфортом за грудиной после еды и натощак, а также возможным развитием дисфагии. Однако у ряда пациентов с ПБ изжога носит невыраженный характер, а иногда полностью отсутствует, что обусловлено низкой чувствительностью метаплазированного эпителия к действию рефлюктанта. Указание в анамнезе на наличие выраженной клиники пищеводного рефлюкса с последующим развитием мнимого благополучия может указывать на формирование ПБ у больного с рефлюкс-эзофагитом и послужить поводом к незамедлительному обследованию пациента, особенно если этот пациент — мужчина с длительным (более 5 лет) анамнезом ГЭРБ. Пищевод Барретта может развиваться также у пациентов без предшествующего анамнеза ГЭРБ [3, 7, 8]. Рентгенологическое исследование не является основным в диагностике ПБ. К косвенным признакам, позволяющим заподозрить ПБ, является картина выраженного пищеводного рефлюкса в сочетании с грыжей пищеводного отверстия диафрагмы, высокими и протяженными стриктурами пищевода, а также наличием его изъязвления. Золотым стандартом диагностики ПБ является эндоскопическое исследование с последующим гистологическим исследование биоптатов. Эндоскопическая картина характеризуется наличием очагов гиперемии («языков пламени») на фоне жемчужно белого эпителия пищевода. Стандартом эндоскопической диагностики ПБ остаются созданные в 2005 году Пражские критерии, которые предполагают два главных аспекта — обозначение длины циркулярного сегмента метаплазии (С-критерий) и обозначение длины максимального по протяженности сегмента метаплазии (М-критерий) (G. Tytgat, P. Sharma, 2005), необходимые для составления правильного лечения и определения динамики на фоне проводимого лечения. Для повышения точности эндоскопической диагностики используются методы хромоэндоскопии с окраской слизистой оболочки 2% раствором Люголя, метиленовым синим, индигокармином, а также 1% раствором уксусной кислоты. Метод хромоскопического усиления позволяет с точностью до 80% выделить участки метапластической дегенерации эпителия. Биопсийный материал для последующего гистологического исследования берется из четырех квадрантов по окружности пищевода каждые 2 см, начиная от границы зоны метаплазии, а также из участка выше визуально определяемой границы метаплазии, так как именно там наиболее часто локализируются очаги дисплазии и фокусы аденокарциномы [1, 7]. Диагноз ПБ верифицируется в случае обнаружения специализированного цилиндрического эпителия хотя бы в одном из биоптатов, взятом из любого участка слизистой оболочки грудного отдела пищевода, так как именно на фоне кишечной метаплазии выявляются все случаи тяжелой дисплазии эпителия и аденокарциномы пищевода. К факультативному предраковому состоянию относят неполную (толстокишечную) метаплазию, основу которой составляют бокаловидные клетки [9, 15]. Маркером повышенного риска развития аденокарциномы у пациентов с ПБ является слабая и тяжелая дисплазия эпителия [4, 5]. Морфологическими признаками дисплазии при ПБ являются укрупнение ядер, изменение ядерно-цитоплазматического соотношения, нарастание клеточного и ядерного полиморфизма, митотическая активность. В последнее время в диагностике и скрининге ПБ все чаще используются современные эндоскопические технологии, позволяющие более точно выявлять участки слизистой оболочки пищевода с различными стадиями неопластической прогрессии и выполнять прицельный забор биопсийного материала для морфологического исследования: эндоскопическое ультразвуковое исследование, оптическая когерентная томография (ОКТ), конфокальная лазерная эндомикроскопия, узкоспектральная эндоскопическая методика (Narrow band imaging). Чувствительность последнего метода в диагностике кишечной метаплазии и дисплазии высокой степени составляет 97% и 100%, специфичность — 87%. Современные оптические эндоскопические методики ОКТ позволяют в реальном масштабе времени выполнять прижизненную «оптическую» биопсию стенки пищевода с визуализацией слоев и прицельной биопсией подозрительных участков слизистой оболочки. Корреляционный анализ данных ОКТ и морфологического исследования позволяет отметить высокую разрешающую способность метода в дифференциальной диагностике ПБ и аденокарциномы пищевода[16]. Метод конфокальной лазерной эндомикроскопии позволяет получать в режиме реального времени in vivo гистологические изображения, т.е. осуществлять «виртуальную биопсию» слизистой оболочки в ходе рутинной эндоскопии [4]. Залогом успешной профилактики развития и прогрессирования ПБ является своевременная диагностика и адекватное лечение эрозивных рефлюкс-эзофагитов. Патогенетическое влияние на течение ГЭРБ оказывают ингибиторы протонной помпы (ИПП). Препараты этой группы обеспечивают контроль симптомов рефлюкса, удерживая рН >4, способствуют заживлению эрозий пищевода и поддержанию ремиссии, препятствуют прогрессированию дисплазии эпителия пищевода, а также необходимы для обеспечения заживления слизистой оболочки после эндоскопического лечения. Прием ИПП приводит к уменьшению степени расширения межклеточных пространств, через которые происходит усиленное проникновение ионов водорода в толщину стенки пищевода, тем самым оказывая прямое патогенетическое воздействие на слизистую оболочку. При ПБ назначение ИПП более чем на 60% уменьшает риск прогресси-рования дисплазии высокой степени, поэтому целесообразно использование препаратов этой группы в качестве факторов для первичной хемопревенции аденокарциномы пищевода (ОР 0,43; ДИ 95% 0,21–0,83). Длительность приема ИПП у больных с ПБ без морфологических признаков дисплазии эпителия должна осуществляться не менее 8–12 недель, при дисплазии низкой степени — непрерывно. Согласно рекомендациям Американской гастроэнтерологической ассоциации по ведению больных с пищеводом Барретта при наличии дисплазии высокой степени рекомендовано эндоскопическое лечение (а не наблюдение). Используются методы термической, ультразвуковой, химической абляции мета- и дисплазированного эпителия, фотодинамическая терапия, а также эндоскопическая резекция слизистой оболочки (Gasteroenterology. 2011. Vol. 140. P. 1084–1091). Высокая эффективность лечения ПБ с высокой степенью дисплазии с использованием эндоскопических методик достигается у 70–80% пациентов. В случаях, когда эндоскопическая хирургия не показана или ее проведение невозможно в силу различных причин либо отказа пациента, используется тактика контрольной эндоскопии с биопсией. Пациентам с высокой степенью дисплазии целесо-образно активное наблюдение каждые 3 месяца, лицам с низкой степенью дисплазии — 1 раз в год. Пациенты с ПБ без дисплазии должны подвергаться эндоскопическому обследованию каждые 3–5 лет. Стриктуры пищевода Вторым по частоте встречаемости осложнений ГЭРБ являются стриктуры пищевода. Согласно статистическим данным они формируются у 7–23% больных, Стриктуры развиваются вследствие длительно существующего эрозивно-язвенного поражения слизистой оболочки пищевода. В местах их заживления формируются рубцы, приводящие к сужению его просвета [12, 13]. Определенную роль в образовании стриктур пищевода в последнее время отводят нестероидным противовоспалительным препаратам (НПВП). По данным ряда исследований типа «случай–контроль» у лиц, принимающих НПВП, имеется повышенный риск развития пептических стриктур пищевода. При этом доказано, что препараты этой группы не инициируют рефлюксную болезнь и не влияют на тонус нижнего пищеводного сфинктера, адекватная функция которого играет ведущую роль в патогенезе ГЭРБ. Имеются предположения, что НПВП и аспирин могут обладать местным раздражающим действием у пациентов с рефлюксной болезнью, вызывая усиление воспаления и формирование стриктуры. Как правило, данные препараты чаще принимают пациенты пожилого возраста, и именно у них чаще встречаются эрозивные формы ГЭРБ, что частично может объяснить случайную взаимосвязь повышенного риска формирования стриктур у лиц, принимающих НПВП. Стриктуры образуются у больных с длительным анамнезом ГЭРБ. В течение многих месяцев и лет больные предъявляют жалобы на изжогу, иногда в сочетании с кислой отрыжкой, однако данному симптому не придается серьезного значения и не проводится адекватная терапия. Со временем при сужении просвета пищевода до 2 см в клинической картине начинает превалировать дисфагия — нарушение глотания при прохождении твердой и жидкой пищи, боль при глотании. В тяжелых случаях при выраженном сужении просвета пищевода развивается регургитация непереваренной пищей (рвота после приема пищи), значительное снижение массы тела, анемический синдром, общая слабость как следствие недостаточности питания. Диагностика стриктур пищевода осуществляется с помощью рентгенологического и эндоскопического методов исследования. При рентгеноскопии определяются верхний уровень рубцового стеноза, степень сужения пищевода и протяженность стриктуры, состояние желудка и двенадцатиперстной кишки. Кроме того, рентгенологическое исследование позволяет выявить пищеводно-респираторные свищи и дивертикулы, при которых эндоскопическое исследование и вмешательство следует проводить с особой осторожностью во избежание возникновения серьезных осложнений. Преимуществом эндоскопического метода диагностики является не только оценка локализации и степени выраженности стеноза, но и возможность непосредственной оценки состояния слизистой оболочки в зоне сужения и выявления пищевода Барретта, а также забора биопсийного материала для морфологического исследования с целью верификации рубцовых стриктур не рефлюксной природы. По локализации стриктуры разделяются на высокие (вход в пищевод, шейный отдел пищевода), средние (аортальные, бифуркационные), низкие (эпифренальные, кардиальные) и комбинированные (пищевод и желудок). Для стриктур в исходе длительного течения рефлюксной болезни характерным является формирование единичного сужения в нижней трети пищевода, при гистологическом исследовании выявляется картина пищевода Барретта. В то же время, при других заболеваниях, сопровождающихся формированием стриктур, в частности, эозинофильном эзофагите, наблюдаются множественные циркулярные сужения в верхней и средней трети пищевода, иногда в дистальном отделе пищевода. Циркулярные стриктуры могут сочетаться с эрозиями в виде вертикальных борозд на фоне отека и гиперемии. При гистологическом исследовании выявляется выраженная эозинофильная инфильтрация (более 15 эозинофилов в поле зрения). Лечение ГЭРБ-ассоциированных стриктур заключается, прежде всего, в своевременной диагностике и адекватном лечении рефлюкс-эзофагита, что является основой профилактики формирования и прогрессирования стриктуры. При назначении ИПП в адекватных терапевтических дозах и длительной кислотной супрессии возможно частичное обратное развитие сформировавшейся стриктуры. По результатам крупного мета-анализа (Edwards S.J. et al., 2009) суммарные результаты сравнения различных режимов терапии у больных с тяжелым эрозивным эзофагитом продемонстрировали преимущества эзомепразола в дозе 40 мг над препаратами группы омепразола, лансопразола и пантопразола в эффективности лечения эзофагитов высоких градаций (C и D стадий по Лос-Анджелесской классификации) в течение как 4, так и 8 недель. Длительность лечения эрозивной рефлюксной болезни должна составлять не менее 8 недель. Согласно исследованиям J. Tao и соавторов (2007), в котором оценивалась динамика ширины межклеточных пространств плоского эпителия в пищеводе на фоне терапии эзомепразолом в дозе 40 мг в сутки, показано, что лишь у 83,3% больных с эрозивным рефлюкс-эзофагитом и у 85,5% больных неэрозивной ГЭРБ происходит нормализация межклеточных пространств к окончанию 8-недельного курса терапии. При этом лишь у тех пациентов, у которых нормализовались межклеточные пространства в плоском эпителии в пищеводе, имелся 100% контроль симптомов заболевания. При клинически значимых симптомах дисфагии и непроходимости пищевода применяются малоинвазивные хирургические вмешательства — бужирование, баллонная дилатация либо установка стентов. После проведения данных хирургических вмешательств, дающих достаточный клинический эффект, обязательным является назначение ИПП. В случае низкой эффективности консервативного лечения и малоинвазивных хирургических методик проводится объемное хирургическое вмешательство — резекция пораженного сегмента пищевода с последующей пластикой желудка (по Льюису или Гэрлоку). При ГЭРБ-ассоциированных стриктурах пищевода прогноз относительно благоприятный при условии адекватной терапии этого заболевания. В случае постоянной поддерживающей антисекреторной терапии стриктуры крайне редко рецидивируют, и пациенты в большинстве случаев могут полностью вернуться к привычному образу жизни. Язвы пищевода Язвы пищевода наблюдаются у 2–7% больных с рефлюксной болезнью, у 34% больных они сопровождаются кровотечением, у 3% больных течение болезни осложняется перфорацией чаще всего в средостение с развитием медиастинита. Основной вклад в формирование язв пищевода вносит ГЭРБ (около 65%), 20% составляют лекарственные поражения пищевода. Вирусные (ВИЧ-ассоциированные, герпетические, цитомегаловирусные) и кандидозные язвы встречаются в 8% и 3% случаев соответственно. В случае выявления кандидозных язв требуется проведение специфической этиотропной терапии в сочетании с симптоматическим лечением антацидными препаратами. Для лечения ГЭРБ-ассоциированных язв проводится патогенетическое лечение с использованием ИПП (омепразол 20 мг, лансопразол 30 мг, пантопразол 40 мг, рабепразол 20 мг или эзомепразол 20 мг) 1–2 раза в сутки за 30 минут до приема пищи. Длительность основного курса терапии составляет не менее 8 недель. При обнаружении пищевода Барретта целесообразен непрерывный прием поддерживающей дозы ИПП. В качестве дополнительного лечения могут быть назначены современные прокинетики. С симптоматической целью — антациды и альгинаты. Таким образом, залогом успешного лечения и профилактики осложнений ГЭРБ является их ранняя диагностика и своевременное лечение рефлюксной болезни. При адекватном подходе, при назначении современных антисекреторных лекарственных средств возможно замедление прогрессирования заболевания, обратное частичное развитие сформировавшихся морфологических изменений слизистой оболочки пищевода, обеспечение стойкой клинической ремиссии ГЭРБ и улучшение качества жизни пациентов. Литература 1. Ахметов Т.В., Петров С.В., Бурмистров М.В. и др. Современная морфологическая оценка пищевода Барретта и рака пищевода // Практическая медицина. – 2008. – №26. – С. 6–8. 2. Болезни пищевода / Под ред. В.Т. Ивашкина, А.С. Трухманова. – М.: Триада-Х, 2000. – 179 с. 3. Васильев Ю.В. Пищевод Барретта: этиопатогенез, диагностика, лечение больных // Трудный пациент. – 2006. – Т. 4, №7. – С. 29–37. 4. Коломацкая П.Б. Пищевод Барретта. Эпидемиология, экология, патогенез, морфологическая характеристика, возможности эндоскопической диагностики // Вестник РНЦРР МЗ РФ. – 2011. – №11. 5. Тер-Ованесов М.Д. Пищевод Барретта: этиология, патогенез, современные подходы к лечению (обзор) // Мед. альманах. – 2011. – №5 (18).Полный список литературы, включающий 17 пунктов, находится в редакции.
Гастроэзофагеальная рефлюксная болезнь. Лечение в Клиническом центре Сеченовского Университета
Что такое рефлюкс эзофагит — описание, симптомы и лечение
Рефлюкс эзофагит или не очень удачный перевод англоязычного термина гастроэзофагеальная рефлюксная болезнь(ГЭРБ), это состояние которое возникает у человека когда разрушается антирефлюксный аппарат кардии.
Причины и факторы риска
В норме у здорового взрослого человека и у детей от 1 года, существует целая система, предотвращающая заброс кислого желудочного содержимого в пищевод, основную роль в которой играет связочный аппарат и тонус так называемого нижнего пищеводного сфинкетра. В результате кислое желудочное содержимое и желчь из 12 перстной кишки попадают в пищевод, но в целом ряде случаев возникают состояния когда существующая в норме природная чернильница непроливайка разрушается из-за повышения внутрибрюшного давления, нарушения эвакуации из желудка, переполнения желудка и возникает ситуация когда пищеводно-желудочный переход оказывается не эффективным и желудочное содержимое или желчь обжигают нижнюю треть пищевода. В результате человек начинает ощущать изжогу, а слизистая пищевода повреждается. На ней сначала возникает воспаление (катаральный эзофагаит), оно же прогрессируя, может привести к язвам пищевода (эрозивный эзофагит), которые постепенно заживая могут превратиться в его рубцовое сужение или даже в «пищевод Барретта» причина которого является изменение эпителия. Которое может стать раком пищевода.
Симптомы и диагностика РЭ
Таким образом за счет разрушение естественной непроливашки, постепенно формируется все более тяжелый рефлюкс эзофагит, и возникающая дисфагия (3-4 ст.) требующие хирургического лечения. Основным симптомами рефлюкс эзофагита в первую очередь является изжога. Мучительная изжога связанная с горизонтальным положением тела, (особенно после еды) с наклоном туловища, является основной причиной рефлюкс эзофагита. Помимо того, что обжигается сам пищевод, желудочное содержимое и желчь могут забрасывая в легкие, бронхи, раздражать голосовые связки, и даже полость среднего уха вследствие образуются так называемые внепищеводные симптомы, и нередко такой больной достаточно долго наблюдается ЛОР врачами, по поводу мало объяснимой охриплости голоса. У такого больного развивается хронический бронхит, а в тяжелых случаях даже может развиться бронхиальная астма, связанная с хроническим аспирационным синдромом на фоне постоянного заброса желудочного содержимого в дыхательные пути. Надо подчеркнуть, что на фоне всеобщего переедания и ожирения число больных с рефлюкс все более увеличивается, на сегодняшний день это основное заболевание пищевода с которым сталкиваются врачи. Большинство этих пациентов лечат терапевты, их лечение в первую очередь требует соблюдение не сложных, но обязательных диетических правил, назначение антисекреторных препаратов снижающие агрессивность желудочного сока, прокинетиков – препаратов улучшающие моторику верхних отделов ЖКТ, препаратов увеличивающих тонус нижнего пищеводного сфинктера. Лишь 10 % процентов больных требуют хирургического лечения. Показаниями к операции являются тяжелые осложнения рефлюкс эзофагита такие как эрозийный язвенный рефлюкс эзофагит, формирующая пептическая стриктура пищевода, и пищевод Барретта. В этих случаях больным имеет смысл выполнить антирефлюксную операцию, восстановить чернильницу непроливайку которая была разрушена за счет образования этого заболевания.
Диагностика
Для того чтобы диагностировать РЭ обычно выполняют ЭГДС, на которой становится видна эрозивная, покрытая нередко язвами поверхность нижней трети пищевода выполняют эзофагоманометрию которая свидетельствует о снижении пропульсивной моторики и тонуса нижнего пищеводного сфинктера, но главным исследованием мы считаем рентгенографию пищевода с барием, которая позволяет зарегистрировать не только рефлюкс контраста в пищевод но увидеть рефлюкс в плоть до дыхательных путей, выявить нередко сопутсвующий этому заболеванию ГПОД, оценить тонус пищевода, и увидеть пропульсивную моторику пищевода, и выявить есть ли рубцовые структуры пищевода. Нередко длительное существующая изжога может в какой то момент смениться ощущениями дисфагии, когда больной ощущает, что пища застревает за грудиной. Это признак формирования рубцового сужения пищевода. Нередким осложнением подобного РЭ говорит о внепищеводных проявлениях резестентные к терапии аритмии сердца, которые связаны с раздражением прилежащего рядом к пищеводу сердца.
Лечение
Мы выполняем, данные операции лапароскопически, формируя симметричную чернильницу по методу академика А.Ф. Черноусова который являет основоположником антирефлюксных операций в нашей стране, и имеет наибольший опыт повторных операций в мире, но нам приходится оперировать пациентов и из традиционного лапаротомного доступа. Как правило это повторные антирефлюксные операции после неудачно сделанных так называемых «фундопликаций» в других лечебных учреждениях.
Распространенность эрозивного эзофагита и пептических стриктур пищевода у жителей Ленинградской области
Интерес к гастроэзофагеальной рефлюксной болезни (ГЭРБ) определяется ее исключительно широкой распространенностью среди населения экономически развитых стран, включая Россию [3—6, 10, 11, 25].
Частота выявления ГЭРБ у представителей различных популяционных групп колеблется от 4,8—7,1% (Юго-Восточная Азия) до 20,0—27,0% (отдельные географические зоны США и Великобритании). Промежуточное положение по уровню заболеваемости занимают страны Европы [9—11, 16, 17, 19, 21, 22, 26].
Распространенность ГЭРБ в России по результатам исследования АРИАДНА, проведенного в 2006 г. в 11 крупных городах, составила 12,9% среди женщин и 13,5% среди мужчин. Близкие показатели отмечены и при многоцентровом исследовании МЭГРЕ, осуществленном в 2006—2007 гг. в 6 мегаполисах: распространенность заболевания среди лиц мужского пола составила 12,5%, среди женщин — 13,9% [3, 4].
Эрозивный эзофагит — наиболее частое пищеводное проявление ГЭРБ. Этот синдром отмечается у 20—40% больных ГЭРБ. У представителей различных этнических групп Северной Америки ассоциированный с гастроэзофагеальным рефлюксом эзофагит составляет 23%. При наличии симптомов диспепсии эрозивное повреждение слизистой пищевода выявляется у 43,4% жителей Канады. В Швеции распространенность эрозивного рефлюкс-эзофагита составляет 15,5%, в Нидерландах — 14%, в Италии — 11,8—14,8%. У японцев эрозивный эзофагит при эндоскопическом исследовании отмечается в 7,1—16% наблюдений [7, 12, 14, 18, 23—25, 27].
Частота развития пептических стриктур при ГЭРБ неизвестна, поскольку отсутствуют работы, посвященные ее эпидемиологии. В исследованиях, посвященных клиническим вопросам проблемы, обычно приводятся ориентировочные данные — 1—5% всех пациентов с рефлюкс-эзофагитом [8, 13, 20].
Данные о распространенности эрозивного эзофагита в России немногочисленны и противоречивы. В отдельных работах частота выявления эзофагита при эндоскопическом исследовании варьирует от 2,6 до 13%. Частота пептических стриктур у россиян практически не исследована [1, 2, 5, 6, 15].
Отмеченные соображения явились основанием для изучения распространенности эрозивного эзофагита и пептических стриктур у представителей относительно однородной по этническому составу и культурным особенностям популяции.
Материал и методы
В период с 2007 по 2013 г. в Ленинградской областной клинической больнице было проведено 34 903 эндоскопических исследования верхних отделов пищеварительного тракта. Процедуры выполняли жителям Ленинградской области с симптомами желудочной диспепсии. Осмотр осуществлял один коллектив врачей по стандартному протоколу.
Возрастной и половой состав больных представлен в табл. 1.
Таблица 1. Демографические показатели у больных с эрозивным эзофагитом
Тяжесть эндоскопических изменений оценивали по Лос-Анджелесской классификации эрозивного эзофагита. Преобладали легкие и среднетяжелые проявления заболевания (табл. 2).
Таблица 2. Частота и степень тяжести эрозивного эзофагита в зависимости от пола больных
Изменения степени A и B отмечали в 1590 наблюдениях (93,5% пациентов с эзофагитом и 4,6% общего числа прошедших эндоскопическое исследование пищевода), степени C и D — в 121 наблюдении (6,0% и 0,3% соответственно).
У 64 больных при эндоскопическом осмотре были выявлены пептические стриктуры пищевода (3,7% пациентов с эзофагитом и 0,2% обследованных). В 36 наблюдениях (56,3% больных со стриктурами и 2,1% больных с эзофагитом) осложнение встретилось у мужчин, в 28 (43,7 и 1,6% соответственно) — у женщин. Пик заболеваемости как у мужчин, так и у женщин отмечался в возрастном интервале от 61 года до 75 лет (табл. 3).
Таблица 3. Демографические показатели у больных с пептическими стриктурами
Степень сужения пищевода при пептических стриктурах оценивали по классификации Ю.И. Галлингера и Э.А. Годжелло (1999 г.) (табл. 4).
Таблица 4. Частота и степень сужения пищевода при пептических стриктурах в зависимости от пола больных
Чаще пептическое сужение развилось на фоне эзофагита степени D. Эзофагит степени С отмечался у 15 (23,4%) мужчин и у 15 (23,4%) женщин, эзофагит степени D — соответственно в 21 (32,8%) и 13 (20,4%) наблюдениях.
Таким образом, эрозивный эзофагит — это частое проявление гастроэзофагеальной рефлюксной болезни. У представителей относительно однородной по этническому и культурному составу популяции россиян (жителей Ленинградской области) его распространенность составляет 4,9%. У мужчин эрозивные повреждения слизистой пищевода встречаются почти в полтора раза чаще, чем у женщин. Пик заболеваемости отмечается в возрасте от 46 до 60 лет. Преобладают легкие и среднетяжелые формы заболевания.
Распространенность пептических стриктур пищевода у россиян составляет 0,2%. Это осложнение развивается у 3,7% страдающих эрозивным эзофагитом на фоне тяжелых изменений слизистой пищевода (степени C и D). Среди больных с пептическими стриктурами преобладают мужчины. Чаще рефлюкс-ассоциированные рубцовые сужения пищевода как у мужчин, так и у женщин отмечаются в возрастной группе от 61 года до 75 лет.
Представленные данные о распространенности эрозивного эзофагита и пептических стриктур пищевода у жителей России уступают показателям в большинстве европейских популяций, однако являются настораживающими и требуют более пристального внимания к проблеме гастроэзофагеальной рефлюксной болезни.
Эзофагит причины, симптомы, лечение эзофагита в Санкт-Петербурге
Эзофагит-это заболевание пищевода, при возникновении, которого воспалительный процесс охватывает его стенки и внутреннюю слизистую оболочку. Если заболевание прогрессирует, поражаются более глубокие слои. Эзофагит может носить как острый, так и хронический характер. Обычно развитие заболевания провоцируется раздражающим химическим, термическим, токсическим или пептическим (при недостаточности кардии и рефлюкс-эзофагите) воздействием на слизистую оболочку пищевода, в редких случаях — бактериальным или токсико-аллергическим поражением. Эзофагит может принимать разные морфологические формы. В наибольшей степени пациент страдает при флегмонозном эзофагите, который развивается вследствие повреждения слизистой пищевода при проглатывании инородных тел, попытке его извлечения.
Причины возникновения эзофагита
- желудочно-пищеводный рефлюкс,
- инфекции,
- болезни (эзофагит может стать последствием гастрита, гастреодуоденита, невроза и так далее)
- химический ожог (случайный или преднамеренный)
- физическое повреждение
Симптомы эзофагита
Эзофагит проявляет себя дисфагией, ощущением дискомфорта, жжением и болью за грудиной, которая возникает или усиливается при глотании, ощущением “кома” в горле. Различают рефлюкс-эзофагит, причиной которого служит дуоденогастроэзофагеальный рефлюкс, эрозивный, геморрагический эзофагит и ещё несколько морфологических форм эзофагита. Характерные признаки рефлюкс-эзофагита:
- изжога;
- отрыжка кислым или горечью.
Признаки эрозивного и геморрагического эзофагита:
- кровавая рвота;
- выделение крови с калом.
Как лечить эзофагит
В первую очередь врач устанавливает причину возникновения болезни. Лечение заболевания проводится комплексно, учитывая его этиологию. Больным эзофагитом назначают щадящую диету, при которой запрещается потребление острой пищи, алкоголя, слишком горячей или холодной пищи, ограничивается потребление молочных продуктов. Питание должно быть дробным, рекомендуется употребление в пищу слизистых супов, жидких каш, кисломолочных продуктов. Помимо рационального диетического питания врачи-гастроэнтерологи назначают антибиотики широкого спектра воздействия, для того, чтобы остановить воспаление и ограничить дальнейшее развитие заболевания, и антацидные препараты, для нейтрализации избытка соляной кислоты желудка, антисекреторные препараты, для снижения повреждающего воздействия, которое оказывает кислотное содержимое желудка на слизистую пищевода, прокинетики для стимуляции моторики желудка, тонкой кишки и пищевода. В тяжёлых случаях требуется оперативное вмешательство. При наличии нагноения проводится вскрытие и дренирование гнойника. Кроме нагноения показаниями к операции служат неэффективность консервативного лечения, опасность малигнезации, осложнения, частые пневмании в анамнезе больного. Чаще всего при эзофагите назначают фундопликацию по Ниссену.
Эзофагит имеет очень неприятные последствия, поэтому при возникновении первых симптомов этого опасного заболевания необходимо обратиться к врачу гастроэнтерологу. Своевременно оказанная медицинская помощь убережёт Вас от серьёзных неприятностей.
Чтобы избавиться от кмней в почках, нужно препринять ряд мер. Прежде всего при желчекаменной болезни следует придерживаться четкого плана питания и следить за весом.
Запишитесь на консультацию
Когда перезвонить и что Вас беспокоит? (по желанию):
Нажимая кнопку Отправить Вы даёте согласие на обработку своих персональных данных.
Причины и методы лечения эрозивного эзофагита
Эрозивный эзофагит – это тип эзофагита, при котором поражается пищевод. Эзофагит – это воспаление, раздражение или отек слизистой оболочки пищевода, которая является трубкой, идущей от горла к желудку.
Джордж Дойл / Stockbyte / Getty ImagesСимптомы
Исследования показывают, что наиболее частыми симптомами эзофагита являются изжога, боль в груди и дисфагия (дискомфорт при глотании).Взаимодействие с другими людьми
Другие симптомы эзофагита могут включать:
- Затруднения при глотании
- Ощущение, будто что-то застряло в горле
- Чувство жжения в пищеводе
- Кровотечение, проявляющееся кровью в рвоте или стуле (стул становится черным или дегтеобразным)
Причины и факторы риска
Выстилка пищевода чувствительна, поэтому она уязвима для раздражения и отека.
Несколько факторов могут способствовать повышенному риску развития эзофагита:
- Рефлюкс желудочной кислоты: Регулярное поступление желудочной кислоты в пищевод является наиболее частой причиной эзофагита.Рефлюкс в основном наблюдается при гастроэзофагеальной рефлюксной болезни (ГЭРБ), которая возникает, когда мышца на конце пищевода не закрывается должным образом. Другие триггеры рефлюкса включают беременность, ожирение, курение, алкоголь, напитки с кофеином, жирную или острую пищу.
- Чрезмерная рвота: Кислота, содержащаяся в рвоте, может раздражать пищевод, а чрезмерная рвота может привести к воспалению.
- Таблетки застревают: Если таблетка застревает в пищеводе, это может вызвать ожог слизистой оболочки.Обычно это происходит, когда для запивания таблетки используется недостаточно воды или другой жидкости. Однако это может также произойти, когда пищевод сужен из-за рубцов или стриктур, или если нарушение моторики не позволяет мышцам пищевода правильно сокращаться для продвижения содержимого в желудочно-кишечный тракт.
- Инфекции: К ним относятся инфекции, вызываемые вирусами (такими как герпес и цитомегаловирус), грибами (например, инфекциями Candida) и бактериями. Инфекции чаще развиваются у людей, иммунная система которых ослаблена такими заболеваниями, как ВИЧ / СПИД.
- Травма от химикатов: При проглатывании сильнодействующих химикатов, таких как очистители канализации, травма пищевода может быть очень серьезной и даже опасной для жизни.
- Лучевая травма: Лучевая терапия в области груди или шеи в рамках лечения рака может вызвать эзофагит.
Диагностика
Ваш врач проведет тщательный медицинский осмотр, а также изучит вашу историю болезни, прежде чем приступить к диагностическому тесту.
Эти тесты включают:
- Эндоскопия: в этой процедуре используется эндоскоп, гибкая трубка с источником света и камерой на конце, чтобы обеспечить прямой обзор пищевода.
- Рентгеновские лучи бария: эти рентгеновские лучи сделаны вместе с проглатываемым раствором бария. Этот специальный краситель покрывает слизистую оболочку пищевода и становится белым на рентгеновском снимке, что помогает получить четкое изображение пищевода.
- Биопсия воспаленной ткани
- Культура пищевода
Процедуры
Лечение эзофагита зависит от причины и может включать:
- Лекарства, снижающие кислотность, такие как ингибиторы протонной помпы (ИПП) или блокаторы h3, если причиной ГЭРБ является
- Антибиотики, если причиной является инфекция
- Стероидный препарат для уменьшения воспаления
- Обезболивающее
Во время лечения ваш врач также расскажет вам о том, как изменить образ жизни, чтобы облегчить дискомфорт при эзофагите.
Что делатьЕшьте пять или шесть небольших приемов пищи в течение дня вместо трех больших.
Ешьте мягкую пищу, например пудинги, яблочное пюре, супы и кремы.
Ешьте небольшие кусочки и тщательно пережевывайте, прежде чем пытаться проглотить.
Пейте напитки через трубочку.
Поднимите изголовье кровати на 8-10 дюймов или спите на клиновидной подушке, чтобы содержимое желудка не попадало в пищевод во время сна.
Острые продукты
Кислые пищевые продукты и напитки, такие как соки цитрусовых и другие соки, а также продукты на основе томатов
Твердые продукты, которые могут вызвать боль в пищеводе при проглатывании, например орехи и сырые овощи
Табак
Спирт
Жирная пища
Кофеин
Шоколад
Прогноз
Независимо от того, вызван ли ваш эзофагит рефлюксной болезнью или инфекцией, оба обычно хорошо поддаются лечению.Однако, если причиной является кислотный рефлюкс, лечение может потребоваться длительное время.
Осложнения
Вам следует позвонить своему врачу, если произойдет одно из следующих событий:
- Ваши симптомы не исчезнут после начального лечения. Рубцевание пищевода может привести к его стриктуре (сужению или стягиванию). Это сужение может вызвать постоянные трудности с глотанием, что может потребовать дополнительного лечения.
- Вы не можете есть или пить из-за боли.Если вы не можете пить жидкость, может возникнуть опасное для жизни обезвоживание.
- Внезапно усиливающаяся боль в груди, одышка или жар. Это может означать, что в пищеводе образовалась глубокая эрозия или отверстие, и вам следует немедленно позвонить своему врачу. Отверстие может кровоточить и позволить бактериям из пищеварительного тракта проникнуть в грудную полость и вызвать серьезную инфекцию, которая может быть опасной для жизни.
Эзофагит | Johns Hopkins Medicine
Причины эзофагита
Вот некоторые возможные причины раздражения и воспаления:
Желудочная кислота в пищевом тракте.Если у вас гастроэзофагеальная рефлюксная болезнь (ГЭРБ), желудочная кислота просачивается обратно в пищевод. Если это происходит регулярно, это может вызвать эзофагит.
Хроническая рвота
Лекарства, такие как аспирин или другие противовоспалительные препараты
Медицинские процедуры, такие как лучевая терапия
Инфекции, ослабляющие вашу иммунную систему
Аллергия, часто на продукты питания
Эзофагит может иметь серьезные последствия, влияющие на качество вашей жизни.Если не лечить, эзофагит может перерасти в состояние, называемое пищеводом Барретта. Это может увеличить риск рака пищевода.
Симптомы
При эзофагите могут наблюдаться следующие симптомы:
Факторы риска
Вы можете подвергаться риску развития эзофагита, не связанного с инфекцией, если вы:
Беременны
Дым
Страдают ожирением
Пожилой человек
Употреблять много алкоголя, кофе, шоколада, жирной или острой пищи
Используйте определенные лекарства, в том числе НПВП, обезболивающие, нитраты и бета-адреноблокаторы
Имеют травму спинного мозга
Проходили лучевую терапию опухолей грудной клетки
Проглотите лекарство с небольшим количеством воды, иначе таблетка застрянет в горле
Склеродермия, аутоиммунное заболевание
Есть много аллергий, особенно на определенные продукты
Диагностика
Чтобы поставить диагноз, ваш лечащий врач может сделать следующее:
Изучите историю болезни и проведите медицинский осмотр.
Заказать верхнюю серию GI. Этот тест состоит из рентгеновских снимков пищевода и желудка, когда вы глотаете бариевую жидкость, на которых видны все проблемные области.
Заказать эндоскопию. Это амбулаторная процедура, при которой гастроэнтеролог использует крошечную камеру на тонкой гибкой трубке, чтобы заглянуть внутрь пищевода на предмет признаков эзофагита.
Проведите pH-тест пищевода на кислотность желудочного сока.Гастроэнтеролог вставит датчики или тонкие провода во время эндоскопии для сбора информации в течение 1-3 дней. Это может помочь вашему лечащему врачу узнать о кислоте желудочного сока, которая может появляться в пищеводе.
Лечение
Лечение эзофагита зависит от причины. Возможные варианты лечения:
Терапия. Это нужно для поиска причины вашего эзофагита.
A Препараты, блокирующие СИД
Дополнительные лекарственные средства. Ваш лечащий врач может назначить лекарства для укрепления нижнего сфинктера пищевода. Это удерживает кислоту в желудке.
Избегание определенных продуктов. Это необходимо, если у вас аллергия на эзофагит.
Расширение. Растяжение пищевода проводится во время эндоскопии.
Изменение образа жизни. Если ваш эзофагит вызван ГЭРБ, ваш лечащий врач может предложить следующие рекомендации:
Поднимите изголовье кровати так, чтобы во время сна голова находилась немного выше ног.
Измените свои привычки в еде, чтобы уменьшить кислотность или раздражение пищевода. Это может означать переход на мягкую диету на некоторое время и отказ от острой пищи, цитрусовых, шоколада, жирной пищи и кофеина.
Бросьте курить.
Избегайте или ограничьте употребление алкоголя.
Поддерживайте здоровый вес.
Станьте более активными.
Хирургия. Ваш лечащий врач может порекомендовать операцию, если у вас кровотечение или сужение пищевода. Его также можно рекомендовать, если необходимо контролировать распространение предраковых клеток.
Осложнения
Проблемы, которые могут возникнуть при эзофагите, включают:
Жизнь с эзофагитом
Эзофагит может вернуться, если вы не измените свой образ жизни.Жить с этим заболеванием означает следовать рекомендациям врача по изменению образа жизни и использованию лекарств.
Когда звонить поставщику медицинских услуг
Обратитесь к своему врачу, если симптомы вернутся.
Эзофагит у детей | Бостонская детская больница
Эзофагит – это воспаление слизистой оболочки пищевода, мышечной трубки, соединяющей глотку (глотку) с желудком. У детей это обычно результат гастроэзофагеальной рефлюксной болезни (ГЭРБ), эозинофильного эзофагита, инфекции или проглатывания едких веществ (таких как чистящие средства или аккумуляторная кислота).Со временем эзофагит может привести к нарушению моторики, сужению пищевода или предраковым изменениям пищевода (пищевод Барретта).
Каковы симптомы эзофагита?
Эзофагит – это воспаление слизистой оболочки пищевода. Это может привести к появлению различных симптомов у детей, в том числе:
- изжога
- боль в груди
- кашляет
- Дисфагия (затруднение глотания)
- Боль при глотании
- еда застревает
- пересечение кривых роста
- избегание текстур пищи
При отсутствии лечения эзофагит может вызвать осложнения, такие как:
- кровотечение
- Хронические респираторные заболевания
- Неспособность процветать
- Стриктуры пищевода, сужение пищевода, затрудняющее глотание
- пищевод Барретта, предраковое состояние, вызванное длительным воспалением пищевода, таким как ГЭРБ
Что вызывает эзофагит?
Эзофагит – это воспаление, которое обычно возникает, когда пищевод вашего ребенка подвергается воздействию раздражающих веществ, будь то едкие продукты, пищевые аллергены или их собственная желудочная кислота.Вероятность развития эзофагита у вашего ребенка выше, если у него:
- ГЭРБ, сопровождающаяся хронической регургитацией желудочной кислоты
- эозинофильный эзофагит, аллергическая реакция, которая может вызвать воспаление
- пищевая аллергия
- проглотил едкие вещества, такие как некоторые бытовые чистящие средства и батареи
- принимал внутрь определенные лекарства, включая вдыхаемые или проглоченные стероиды, доксициклин, тетрациклин, препараты железа или нестероидные противовоспалительные препараты
- нарушение иммунитета
- инфекций, чаще всего связанных с Candida (дрожжевые грибки) или вирусом простого герпеса
Как диагностируется эзофагит?
Врач вашего ребенка проведет медицинский осмотр и спросит вас и вашего ребенка о любых симптомах.Они также могут порекомендовать определенные тесты для оценки пищевода, в том числе:
Как лечится эзофагит?
Лечение эзофагита зависит от причины, но может включать:
- Ингибиторы протонной помпы или другие лекарства для лечения ГЭРБ
- Удаление аллергенов или лекарств для лечения эозинофильного эзофагита
- оральные стероиды
- антибиотики, противовирусные или противогрибковые средства для лечения некоторых инфекций
Как мы лечим эзофагит
Гастроэнтерологи Бостонской детской больницы имеют опыт диагностики и лечения пациентов с воспалением пищевода.Есть разные способы справиться с этим воспалением в зависимости от причины и симптомов. Ваша медицинская бригада разработает лучший план лечения в зависимости от причины и симптомов.
Экстраэзофагеальные симптомы у лиц с эрозивным эзофагитом и без него: исследование случай – контроль в Албании | BMC Gastroenterology
Вакил Н., ван Зантен С.В., Карилас П., Дент Дж., Джонс Р. Группа глобального консенсуса. Монреальское определение и классификация гастроэзофагеальной рефлюксной болезни: глобальный консенсус, основанный на фактических данных.Am J Gastroenterol. 2006. 101 (8): 1900–20.
Артикул Google Scholar
Katz PO, Gerson LB, Vela MF. Рекомендации по диагностике и лечению гастроэзофагеальной рефлюксной болезни. Am J Gastroenterol. 2013; 108: 308–28.
Артикул Google Scholar
Poelmans J, Tack J. Экстраэзофагеальные проявления гастроэзофагеального рефлюкса. Кишечник. 2005. 54 (10): 1492–149.
CAS Статья Google Scholar
Ясперсен Д., Кулиг М., Лабенз Дж., Леодольтер А., Линд Т., Мейер-Сабеллек В. и др. Распространенность экстраэзофагеальных проявлений при гастроэзофагеальной рефлюксной болезни: анализ, основанный на исследовании ProGERD. Алимент Pharmacol Ther. 2003; 17: 1515–20.
CAS Статья Google Scholar
Reimer C, Bytzer P. Опрос населения для оценки тревожных симптомов гастроэзофагеальной рефлюксной болезни.Сканд Дж Гастроэнтерол. 2009; 44: 394–400.
Артикул Google Scholar
Дент Дж., Эль-Сераг Х.Б., Валландер М.А., Йоханссон С. Эпидемиология гастроэзофагеальной рефлюксной болезни: систематический обзор. Кишечник. 2005; 54: 710–7.
CAS Статья Google Scholar
Richter JE. Гастроэзофагеальная рефлюксная болезнь. Лучшие Практики Рес Клин Гастроэнтерол. 2007; 21: 609–31.
Артикул Google Scholar
Bresadola V, Adani GL, Londero F, Leo AC, Cherchi V, Lorenzinet D, et al. Неэрозионные и неосложненные эрозивные рефлюксные болезни: различие в патофизиологической и симптоматической картинах. Мир J Gastrointest Pathophysiol. 2011; 2 (3): 42–8.
Артикул Google Scholar
Oh JH, Choi MG, Park JM, Lim CH, Cho YK, Lee IS, et al.Клиническая характеристика гастроэзофагеальной рефлюксной болезни у пациентов с симптомами гортани, направленных в гастроэнтерологию. Dis Esophagus. 2013; 26: 465–9.
Артикул Google Scholar
Куфман Я.А., Белафский П.С., Бах К.К., Даниэль Э., Постма Г.Н. Распространенность эзофагита у пациентов с подтвержденным pH ларингофарингеальным рефлюксом. Ларингоскоп. 2002; 112: 1606–9.
CAS Статья Google Scholar
Села Л., Края Б., Хоти К., Точи Э., Муджа Х., Бурацери Г. Характеристики образа жизни и гастроэзофагеальная рефлюксная болезнь: популяционное исследование в Албании. Гастроэнтерол Рес Прак. 2013; 2013: 1–7.
Артикул Google Scholar
Mone I, Kraja B, Bregu A, Duraj V, Sadiku E, Burazeri G. Приверженность преимущественно средиземноморской диете снижает риск гастроэзофагеальной рефлюксной болезни: перекрестное исследование в странах Юго-Восточной Европы Население.Dis Esophagus. 2016; 29: 794–800.
CAS Статья Google Scholar
Kraja B, Burazeri G, Prifti S. Антропометрические показатели и гастроэзофагеальная рефлюксная болезнь у взрослого населения в Тиране, Албания. Med Arh. 2008. 62: 139–41.
PubMed Google Scholar
Гарсия-Компеан Д., Гонсалес М.В., Галиндо Г., Мар Д.А., Тревиньо Д.Л., Мартинес Р. и др. Распространенность гастроэзофагеальной рефлюксной болезни у пациентов с экстраэзофагеальными симптомами, направленными из практики отоларингологии, аллергии и кардиологии: проспективное исследование.Dig Dis. 2000. 18: 178–82.
CAS Статья Google Scholar
Ирвин Р.С., Рихтер Дж. Э. Гастроэзофагеальный рефлюкс и хронический кашель. Am J Gastroenterol. 2000; 95: S9-14.
CAS Статья Google Scholar
Fouad YM, Katz PO, Hatlebakk JG, Castell DO. Неэффективная моторика пищевода: наиболее частое нарушение моторики у пациентов с респираторными симптомами, связанными с ГЭРБ.Am J Gastroenterol. 1999; 94: 1464–7.
CAS Статья Google Scholar
Смит С.Ф., ван Леувен Дж. А., Матус-Влиген Л. М., Девризе П. П., Семин А., Тан Дж. И др. Гастрофарингеальный и гастроэзофагеальный рефлюкс в виде шара и охриплости. Arch Otolaryngol Head Neck Surg. 2000. 126 (7): 827–30.
CAS Статья Google Scholar
Райха И., Хиетанен Э., Суреандер Л.Симптомы гастроэзофагеальной рефлюксной болезни у пожилых людей. Возраст Старение. 1991; 5: 365–70.
Артикул Google Scholar
Irwin RS, Madison JM. Анатомический диагностический протокол при оценке хронического кашля со специфической ссылкой на гастроэзофагеальную рефлюксную болезнь. Am J Med. 2000; 10: 126S-S130.
Артикул Google Scholar
Kao SS, Chen WC, Hsu PI, Lu CL, Lai KH, Tsai FW, et al.Частота гастроэзофагеальных и экстрагастроэзофагеальных симптомов у пациентов с легким эрозивным эзофагитом, тяжелым эрозивным эзофагитом и пищеводом Барретта на Тайване. Гастроэнтерол Рес Прак. 2013; 2013: 1–6. https://doi.org/10.1155/2013/480325.
Артикул Google Scholar
Poelmans J, Feenstra L, Demedts I., Rutgeerts P, Tack J. Результаты эндоскопии верхних отделов желудочно-кишечного тракта у пациентов с подозрением на хронические симптомы уха, носа и горла, связанные с рефлюксом.Am J Gastroenterol. 2004; 99: 1419–26.
Артикул Google Scholar
Broderick R, Fuchs K-H, Breithaupt W., Varga G, Schulz T., Babic B, et al. Клиническая картина гастроэзофагеальной рефлюксной болезни: проспективное исследование разнообразия симптомов и модификации анкетирования. Dig Dis. 2020; 38: 188–95.
Артикул Google Scholar
Эль-Сераг HB, Зонненберг А.Коморбидное возникновение заболевания гортани или легких с эзофагитом у ветеранов вооруженных сил США. Гастроэнтерология. 1997. 113: 755–60.
CAS Статья Google Scholar
Руигомес А., Валландер М.А., Йоханссон С., Гарсия Родригес Л.А., Граффнер Х., Дент Дж. Естественная история гастроэзофагеальной рефлюксной болезни, диагностированной в общей врачебной практике Великобритании. Алимент Pharmacol Ther. 2004. 20: 751–60.
CAS Статья Google Scholar
Саварино Е., Тутуиан Р., Зентилин П., Дульбекко П., Поль Д., Маработто Е. и др. Характеристики эпизодов рефлюкса и ассоциация симптомов у пациентов с эрозивным эзофагитом и неэрозивной рефлюксной болезнью: исследование с использованием комбинированной терапии импеданс-pH. Am J Gastroenterol. 2010. 105 (5): 1053–61.
Артикул Google Scholar
Фраццони М., Де Микели Э., Саварино В. Различные модели воздействия кислоты пищевода отличают осложненную рефлюксную болезнь от эрозивного рефлюкс-эзофагита или неэрозивной рефлюксной болезни.Алимент Pharmacol Ther. 2003. 18: 1091–8.
CAS Статья Google Scholar
Фельдман М., Фридман Л.С., Брандт Л.Дж., редакторы. Заболевания желудочно-кишечного тракта и печени Слейзенгера и Фордтрана: патофизиология, диагностика, лечение. 9 изд. Филадельфия, Пенсильвания: Сондерс; 2010.
Google Scholar
Ли А.Л., Гольдштейн Р.С. Гастроэзофагеальная рефлюксная болезнь при ХОБЛ: ссылки и риски.Int J Chron Obstruct Pulmon Dis. 2015; 10: 1935–49.
Артикул Google Scholar
Камолз Т., Веланович В. Психологические и эмоциональные аспекты гастроэзофагеальной рефлюксной болезни. Dis Esophagus. 2002; 15: 199–203.
CAS Статья Google Scholar
Hartono JL, Qua CS, Goh KL. Неэрозивная рефлюксная болезнь (НЭРБ), симптоматическая и бессимптомная эрозивная рефлюксная болезнь (ЭРБ): от гиперчувствительности к гипочувствительности пищевода.Dig Dis Sci. 2011. 56 (1): 90–6.
Артикул Google Scholar
Доре М.П., Марагкудакис Э., Фрейли К., Педрони А., Тадеу В., Реалди Г. и др. Диета, образ жизни и пол при гастроэзофагеальной рефлюксной болезни. Dig Dis Sci. 2008; 53: 2027–32.
Артикул Google Scholar
Choi JY, Jung HK, Song EM, Shim KN, Jung SA. Детерминанты симптомов гастроэзофагеальной рефлюксной болезни: неэрозивная рефлюксная болезнь, симптоматическая и тихая эрозивная рефлюксная болезнь.Eur J Gastroenterol Hepatol. 2013; 25: 764–71.
Артикул Google Scholar
Мотидзуки Н., Фудзита Т., Кобаяши М., Ямадзаки Ю., Терао С., Сануки Т. и др. Факторы, связанные с проявлением симптомов эрозивного эзофагита у субъектов медицинского осмотра: проспективное многоцентровое когортное исследование. PLoS ONE. 2018; 13 (5): e0196848.
Артикул Google Scholar
Chang CH, Wu CP, Wang JD, Lee SW, Chang CS, Yeh HZ, Ko CW, Lien HC. Употребление алкоголя и чая связано с бессимптомным эрозивным эзофагитом у тайваньских мужчин. PLoS ONE. 2017; 12 (3): e0173230.
Артикул Google Scholar
Gyawali CP, Kahrilas PJ, Savarino E, Zerbib F, Mion F, Smout AJPM, et al. Современный диагноз ГЭРБ: Лионский консенсус. Кишечник. 2018; 67: 1351–62.
Артикул Google Scholar
Richter JE. Гастроэзофагеальная рефлюксная болезнь и астма: эти два понятия напрямую связаны. Am J Med. 2000; 108: 153S-S158.
Артикул Google Scholar
Ding H, Shi C, Xu X, Yu L. Хронический кашель, вызванный лекарствами, и возможный механизм действия. Ann Palliat Med. 2020; 9 (5): 3562–70.
Артикул Google Scholar
Эозинофильный эзофагит: имитация гастроэзофагеальной рефлюксной болезни – От редакции
1.Деллон ES, Дженсен ET, Мартин CF, Шахин, штат Нью-Джерси, Каппельман MD. Распространенность эозинофильного эзофагита в США. Клин Гастроэнтерол Гепатол . 2014; 12 (4): 589–596 ….
2. Putnam PE. Эозинофильный эзофагит у детей: клинические проявления. Gastrointest Endosc Clin N Am . 2008. 18 (1): 11–23.
3. Lucendo AJ, Санчес-Касалилья М. Эозинофильный эзофагит у взрослых и детей: важные различия и сходства для понимания клиницистом. Эксперт Рев Клин Иммунол . 2012. 8 (8): 733–745.
4. Деллон ES, Гонсалвес Н, Хирано I, Фурута GT, Liacouras CA, Кацка Д.А. Клинические рекомендации ACG: научно-обоснованный подход к диагностике и лечению эозинофилии пищевода и эозинофильного эзофагита. Ам Дж. Гастроэнтерол . 2003. 108 (5): 679–192.
5. Коникофф М.Р., Ноэль Р.Дж., Бланшар С, и другие. Рандомизированное двойное слепое плацебо-контролируемое исследование флутиказона пропионата при детском эозинофильном эзофагите. Гастроэнтерология . 2006. 131 (5): 1381–1391.
6. Александр Ж.А., Юнг К.В., Арора А.С., и другие. Проглоченный флутиказон улучшает гистологический, но не симптоматический ответ у взрослых с эозинофильным эзофагитом. Клин Гастроэнтерол Гепатол . 2012; 10 (7): 742–749.e1.
7. Dellon ES, Кацка Д.А., Коллинз MH, Хамдани М, Гупта СК, Хирано I; МП-101-06 Следователи.Пероральная суспензия будесонида улучшает симптоматические, эндоскопические и гистологические параметры по сравнению с плацебо у пациентов с эозинофильным эзофагитом. Гастроэнтерология . 2017; 152 (4): 776–786.e5.
8. Lucendo AJ, Ариас Б, Гонсалес-Сервера Дж., и другие. Эмпирическая диета с исключением 6 продуктов питания вызвала и поддерживала длительную ремиссию у пациентов с эозинофильным эзофагитом у взрослых: проспективное исследование пищевой причины заболевания. J Allergy Clin Immunol . 2013. 131 (3): 797–804.
9. Догерти М., Рунге TM, Элури С, Dellon ES. Расширение пищевода методом бужирования или баллона для лечения эозинофильного эзофагита: систематический обзор и метаанализ. Гастроинтест Эндоск . 2017; 86 (4): 581–591.
Эндоскопический кампус – Рефлюкс-эзофагит: классификация Лос-Анджелеса
Гастроэзофагеальная рефлюксная болезнь с эндоскопически идентифицируемыми поражениями (эрозии, стриктура, пищевод Барретта) определяется как эрозивная гастроэзофагеальная рефлюксная болезнь (ГЭРБ).Менее 50% пациентов с типичными симптомами ГЭРБ имеют эндоскопически распознаваемые поражения слизистой оболочки (1) .
Диагноз эрозивного рефлюкс-эзофагита устанавливается при наличии пятнистых, полосатых или круглых и сливных эпителиальных дефектов (эрозий) на слизистой оболочке дистального отдела пищевода. Почти все руководства по диагностике и лечению рефлюксной болезни рекомендуют классифицировать рефлюкс-эзофагит эндоскопически (2) . Из-за простоты использования и очень незначительной индивидуальной вариабельности в оценке следует использовать классификацию Лос-Анджелеса (3) .Немецкое руководство также рекомендует документировать другие результаты эндоскопии (стеноз, язва, кольцо Шацки, метаплазия и т. Д.) И наличие грыжи пищеводного отверстия диафрагмы. Напротив, эритема, грануляция, нечеткое соединение между областью слизистой оболочки плоского эпителия и цилиндрическим эпителием, повышенная маркировка сосудов в дистальном отделе пищевода, отек и приподнятые складки слизистой оболочки не являются надежными признаками и поэтому не должны использоваться при диагностике рефлюкса. болезнь (2) .
Степень имеющегося рефлюкс-эзофагита предполагает различные виды терапии (в зависимости от степени симптомов). Легкие случаи рефлюкс-эзофагита (Лос-Анджелес A / B) следует лечить ингибитором протонной помпы (ИПП) в стандартной дозировке в течение примерно 4 недель, в то время как пациенты с тяжелыми случаями (Лос-Анджелес C / D) должны получать 8 недель лечения. ИПП в стандартной дозировке.
Схема
Рефлюкс-эзофагит легкой степени – LA степень A + B
LA степень A: одна или несколько эрозий, ограниченных складкой (-ями) слизистой оболочки и размером не более 5 мм.
LA степень B: одна или несколько эрозий, ограниченных складками слизистой оболочки и размером более 5 мм (как вторичные находки на левом нижнем изображении, рубцовые изменения слизистой оболочки могут быть отмечены как признаки хронического рецидивирующего рефлюкса эзофагит).
Тяжелый рефлюкс-эзофагит – LA степень C + D
LA степень C: эрозии, распространяющиеся на складки слизистой оболочки, но менее чем на три четверти окружности.
LA степень D: сливные эрозии, охватывающие более трех четвертей окружности (круглые дефекты).
Список литературы
- Фасс Р., Офман Дж. Дж. Гастроэзофагеальная рефлюксная болезнь – следует ли принять новую концептуальную основу? Am J Gastroenterol 2002; 97 (8): 1901-9.
- Koop H, Fuchs KH, Labenz J, Lynen Jansen P, Messmann H, Miehlke S, Schepp W, Wenzl TG, und die Mitarbeiter der Leitliniengruppe.S2k-Leitlinie: Gastroösophageale Refluxkrankkheit unter Federführung der Deutschen Gesellschaft für Gastroenterologie, Verdauungs- und Stoffwechselkrankheiten. З Гастроэнтерол 2014; 52 (11): 1299-1346.
- Армстронг Д. Эндоскопическая оценка гастроэзофагеальной рефлюксной болезни. Йельский журнал биол. Медицины, 1999; 72 (2-3): 93-100.
Проспективное многоцентровое когортное исследование
Аннотация
Фон
Мы стремились выяснить факторы, связанные с проявлением симптомов эрозивного эзофагита (ЭЭ) у субъектов, проходящих медицинские осмотры.
Методы
Мы использовали исходные данные от 7,552 субъектов, прошедших эндоскопию верхних отделов тканей, для проверки состояния здоровья в проспективном многоцентровом когортном исследовании. Участников попросили заполнить анкету с подробным описанием симптомов в верхней части живота и образа жизни. Основываясь на частоте изжоги и / или кислотной регургитации, субъекты EE были разделены на следующие три группы: (1) не менее одного дня в неделю (симптоматическое EE [sEE]), (2) менее одного дня в неделю (легкая симптоматический EE [msEE]) и (3) никогда (бессимптомный EE [aEE]).Постпрандиальный дистресс-синдром (PDS) и эпигастральный болевой синдром (EPS) определяли в соответствии с критериями Rome III.
Результаты
Из 1262 (16,7%) субъектов (мужчины 83,8%, средний возраст 52,6 года) с EE доли sEE, msEE и aEE составили 15,0%, 37,2% и 47,9% соответственно. Группа sEE продемонстрировала значимые ассоциации с перекрывающимися EPS (OR: 58,4, 95% CI: 25,2–160,0), перекрывающимися PDS (OR: 9,96, 95% CI: 3,91–26,8), тяжелой грыжей пищеводного отверстия диафрагмы (OR: 2,43, 95% CI). : 1.43–4,05), высокий уровень стресса (OR: 2,20, 95% CI: 1,43–3,40), атрофический гастрит (OR: 1,57, 95% CI: 1,03–2,36) и Лос-Анджелес (LA) степени B или хуже ( OR: 1,72, 95% ДИ: 1,12–2,60) в многомерном анализе.
Выводы
Примерно одна шестая часть субъектов EE имела симптомы. Многофакторная этиология, включая факторы, не связанные с секрецией желудочного сока, была связана с проявлением симптомов у субъектов с ЭЭ.
Образец цитирования: Mochizuki N, Fujita T, Kobayashi M, Yamazaki Y, Terao S, Sanuki T, et al.(2018) Факторы, связанные с проявлением симптомов эрозивного эзофагита у субъектов медицинского осмотра: проспективное многоцентровое когортное исследование. PLoS ONE 13 (5): e0196848. https://doi.org/10.1371/journal.pone.0196848
Редактор: Джон Грин, Университетская больница Лландо, СОЕДИНЕННОЕ КОРОЛЕВСТВО
Поступила: 18 ноября 2017 г .; Принята к печати: 20 апреля 2018 г .; Опубликован: 3 мая 2018 г.
Авторские права: © 2018 Mochizuki et al.Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Доступность данных: Все соответствующие данные находятся в документе и его файлах с вспомогательной информацией.
Финансирование: Это исследование финансировалось за счет грантов, предоставленных NPO-Corporation, Центром исследований и образования в области гастроинтестинальной медицины и Японским обществом оценки и укрепления здоровья (Т.F.). Финансирующие организации не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: Авторы заявили об отсутствии конкурирующих интересов.
Введение
Гастроэзофагеальная рефлюксная болезнь (ГЭРБ) – это заболевание, которое развивается, когда рефлюкс содержимого желудка вызывает неприятные симптомы и / или осложнения [1]. ГЭРБ распространена во всем мире [2], а распространенность ГЭРБ в Японии растет с конца 1990-х годов [3,4].
ГЭРБ делится на две группы согласно данным эндоскопии: (1) эрозивный эзофагит (ЭЭ) и (2) неэрозивная гастроэзофагеальная рефлюксная болезнь (НЭРБ). Распространенность ЭЭ составляет 15,5% среди взрослого населения Швеции [5] и 12,4% среди пациентов из Испании, перенесших эндоскопию верхних отделов желудочно-кишечного тракта [6]. В Азии, включая Японию, распространенность ЭЭ колеблется от 4,5% до 15,7% [3, 7]. Симптомы ГЭРБ не всегда связаны с наличием или отсутствием эзофагита, часто встречается бессимптомный ЭЭ.В исследовании взрослого населения Швеции 37% случаев ЭЭ протекали бессимптомно [5]. Общенациональное исследование ГЭРБ в Японии показало, что 210 из 600 (35%) пациентов с ЭЭ не имели симптомов [8]. Аналогичным образом, недавние исследования из других азиатских стран, проведенные с участием субъектов, проходящих медицинские осмотры, показали, что примерно половина или более пациентов с ЭЭ не имеют симптомов [9–11]. Симптоматика у пациентов с ЭЭ имеет клиническое значение, поскольку симптомы ГЭРБ снижают качество жизни пациентов (КЖ) [12,13].Однако факторы, связанные с проявлением симптомов ЭЭ, полностью не выяснены.
Настоящее исследование было направлено на проспективное изучение распространенности ЭЭ в большой популяции, проходящей медицинские осмотры в 7 учреждениях, и определение факторов, связанных с проявлением симптомов ЭЭ, которые снижают качество жизни пациентов.
Материалы и методы
Субъектов
Это исследование было основано на исходных данных (n = 8 889) исследования заболеваний верхних отделов желудочно-кишечного тракта (UGID), которое в настоящее время проводится в Японии.Исследование UGID – это проспективное многоцентровое когортное исследование, целью которого является изучение распространенности и естественного течения ЭЭ, НЭРБ и функциональной диспепсии (ФД). В исследовании UGID субъекты в возрасте 18 лет и старше, прошедшие эндоскопию верхних отделов тканей для обследования состояния здоровья в 7 учреждениях, будут находиться под наблюдением до 5 лет. В эту исследуемую группу вошли 7 552 субъекта, включенных в исследование в период с апреля 2013 г. по март 2015 г. Применялись следующие критерии исключения: лечение ингибитором протонной помпы (ИПП) или антагонистом рецепторов гистамина 2 типа (h3RA) (n = 597), неполные данные для эндоскопических результатов (n = 59), симптомов рефлюкса или опросника симптомов диспепсии (n = 79), курения (n = 25), употребления алкоголя (n = 24), кифоза (n = 112) и тревожности, связанной с состоянием Инвентарные (STAI) признаки (n = 441).Это исследование было проведено в соответствии с Хельсинкской декларацией и поправками к ней (UMIN-CTR ID: 000022504). Протокол исследования был одобрен комитетом по этике в каждом учреждении (этические комитеты больницы Второго Красного Креста Киото, Христианской больницы Йодогава, больницы Красного Креста Фукуи, Центральной городской больницы Какогава, Медицинского центра Кита-харима, больницы Сайсейкай Накацу и отеля Okura Kobe. Клиника). Письменное информированное согласие было получено от всех испытуемых. Все авторы имели доступ к данным исследования, а также просмотрели и одобрили окончательную рукопись.
Анкета
Испытуемых попросили заполнить анкету о симптомах со стороны верхних отделов брюшной полости (симптомы рефлюкса, диспепсические симптомы), росте, массе тела, курении (никогда, бывший курильщик, курильщик в настоящее время), потреблении алкоголя (нет, ≤20 г / день, 20–60 г / день или> 60 г / день), недостаток сна (да, нет), недостаток физических упражнений (да, нет), нерегулярное время приема пищи (да, нет), высокий уровень стресса (да, нет), чувство подавленности (да, нет) и кифоз. Для симптомов рефлюкса исследовали частоту изжоги и / или кислотной регургитации за последние 3 месяца (т.е., никогда, менее одного дня в месяц, одного дня в месяц, двух-трех дней в месяц, одного дня в неделю, более одного дня в неделю или каждый день). Для диспептических симптомов постпрандиального дистресс-синдрома (ПДС) изучали частоту надоедливого послеобеденного насыщения и / или раннего насыщения за последние 3 месяца (т. Е. Никогда, менее одного дня в месяц, одного дня в месяц, двух-трех дней в месяц, один день в неделю, более одного дня в неделю или каждый день). Для диспептических симптомов болевого синдрома в эпигастрии (EPS) исследовали частоту боли в эпигастрии и / или жжения в эпигастрии за последние 3 месяца (т.е., никогда, менее одного дня в месяц, одного дня в месяц, двух-трех дней в месяц, одного дня в неделю, более одного дня в неделю или каждый день). Кроме того, испытуемых спрашивали, возникли ли симптомы диспепсии более 6 месяцев назад. Наличие или отсутствие «недостатка сна», «недостатка физических упражнений», «нерегулярного времени приема пищи», «переживания высокого уровня стресса» и «ощущения депрессии» исследовалось без включения объективных определений в этот опросный лист, составленный самими пациентами.Кифоз оценивали с помощью следующего вопроса. «Касается ли ваша голова стены затылком, когда вы стоите, касаясь стены пятками?» Возможные ответы: «Да, легко», «Да, но не легко» или «Нет». Субъекты, ответившие «Нет», были определены как положительные на кифоз, как это было диагностировано с помощью анкеты.
Тревога оценивалась по шкале STAI [14]. Список STAI (черт) состоит из двадцати вопросов, и более высокие баллы указывают на более сильную тревогу. Высокий балл по шкале STAI был определен как ≥44 у мужчин и ≥45 у женщин.
Лекарства, которые были прописаны испытуемым, были исследованы с помощью опросника для проверки состояния здоровья, используемого в каждом учреждении. В этом исследовании использовались ИПП (присутствие, отсутствие), h3RA (присутствие, отсутствие), другие гастромукопротекторные средства (присутствие, отсутствие), нестероидные противовоспалительные препараты (НПВП) (присутствие, отсутствие), аспирин в низких дозах. (присутствие, отсутствие), антагонисты кальция (Са) (присутствие, отсутствие), блокаторы рецепторов ангиотензина II (БРА) (присутствие, отсутствие), статины (присутствие, отсутствие), пероральные противодиабетические средства (присутствие, отсутствие) и бисфосфонат (присутствие , отсутствие).
Результаты эндоскопии
EE был диагностирован на основании наличия эндоскопически определяемых разрывов слизистой оболочки и классифицирован в соответствии с классификацией Лос-Анджелеса (Лос-Анджелес). Наличие эндоскопической слизистой оболочки Барретта определялось длиной более 10 мм эндоскопического столбчатого эпителия, который диагностировали с использованием палисадных сосудов в качестве ориентира для пищеводно-желудочного перехода [15]. Грыжа пищеводного отверстия диафрагмы диагностирована на основании проксимального смещения пищеводно-желудочного перехода более чем на 2 см выше диафрагмального отверстия.Тяжесть грыжи пищеводного отверстия диафрагмы классифицировалась по длине смещения пищеводно-желудочного перехода; 2–4 см считались легкими, а более 4 см – тяжелыми. Атрофический гастрит был диагностирован эндоскопически, и эндоскопическая степень атрофической слизистой оболочки была оценена в соответствии с классификацией Кимуры-Такемото от C-1 до O-3 [16]. Субъекты с атрофической слизистой оболочкой (классифицированные как C-2, C-3, O-1, O-2 и O-3) были определены как положительные по атрофическому гастриту.
Определения симптоматической EE, легкой симптоматической EE, бессимптомной EE, NERD и контрольной группы
Субъекты EE, у которых не было ни пептических язв, ни хирургических вмешательств на верхних отделах желудочно-кишечного тракта в анамнезе, были классифицированы в одну из трех групп в зависимости от частоты симптомов рефлюкса: группа симптоматического EE (sEE) (субъекты с изжогой и / или кислотной регургитацией, происходящей в по крайней мере один день в неделю), группу с легким симптоматическим EE (MSEE) (пациенты с изжогой и / или кислотной регургитацией, возникающие менее одного дня в неделю) или группу с бессимптомным EE (aEE) (пациенты без изжоги или кислотной регургитации).Субъекты с изжогой и / или кислотной регургитацией, происходящей, по крайней мере, один день в неделю, без ЭЭ, пептических язв или каких-либо хирургических вмешательств на верхних отделах желудочно-кишечного тракта в анамнезе, были определены как пациенты с НЭРБ. В качестве контрольной группы были определены пациенты без изжоги, кислотной регургитации, беспокоящего переполнения после приема пищи, раннего насыщения, боли в эпигастрии или жжения в эпигастрии, а также без ЭЭ, пептической язвы, злокачественных новообразований верхних отделов желудочно-кишечного тракта или в анамнезе.
Определения FD, PDS и EPS
Группа FD была определена как субъекты, которые испытали PDS и / или EPS в соответствии с критериями Rome III [17].ПДС был определен как «беспокоящее ощущение полноты после еды» и / или «раннее насыщение», происходящие не менее двух дней в неделю в течение последних 3 месяцев, с появлением симптомов 6 месяцев назад, а ЭПС – как «боль в эпигастрии» или «жжение в эпигастрии». «возникающие не реже одного раза в неделю в течение последних 3 месяцев, с появлением симптомов 6 месяцев назад.
В этом исследовании пациенты с ГЭРБ не были исключены из группы FD.
Статистический анализ
Все статистические анализы проводились с использованием JMP версии 10 (Институт SAS, Кэри, Северная Каролина, США).Сравнения между субъектами с EE и контрольной группой, а также между субъектами с sEE и субъектами с msEE плюс aEE были выполнены с помощью теста χ 2 (или точного критерия Фишера, если применимо) для категориальных переменных и критерия Стьюдента . t -тест для непрерывных переменных. Категориальные переменные, включая возраст, пол, текущий статус курения, потребление алкоголя ≥20 г / день, и переменные со значениями P менее 0,2 (согласно критерию χ 2 ) были использованы для анализа множественной логистической регрессии, и П <0.05 считался статистически значимым.
Результаты
Распространенность и факторы, связанные с EE
Из 7,552 испытуемых 1262 человека (16,7%) (1058 мужчин и 204 женщины, средний возраст ± стандартное отклонение: 52,6 ± 9,4 года) имели ЭЭ. Большинство случаев EE были легкой степени тяжести (степень A – 79,7%, степень B – 18,0%) (таблица 1).
На рис. 1 показано распределение распространенности ЭЭ по возрасту и полу. Во всех возрастах у мужчин ЭЭ диагностировали чаще, чем у женщин (22.2% у мужчин против 7,3% у женщин, P <0,0001), хотя разница была менее выражена у пожилых людей (12,9% у мужчин старше 70 лет против 8,9% у женщин старше 70 лет, P = 0,2497).
Сравнение клинических характеристик субъектов с ЭЭ и контрольной группы показано в Таблице 2. Пол, индекс массы тела (ИМТ), курение в настоящее время, потребление алкоголя ≥20 г / день, нехватка физических упражнений, нерегулярное время приема пищи, уровни стресса, чувство депрессии, оценка STAI, грыжа пищеводного отверстия диафрагмы, эндоскопическая слизистая оболочка Барретта ≥10 мм, атрофический гастрит, а также использование антагонистов Са, БРА и пероральных гипогликемических средств значительно различались между группой EE и контрольной группой.
Результаты многомерного анализа факторов, связанных с ЭЭ, показали, что возраст 40-59 лет (эталон: ≤39 лет) (OR 1,44, 95% ДИ 1,12–1,88), возраст ≥60 лет (эталон: ≤39 лет) (OR 1,49, 95% CI 1,10–2,03), мужской пол (OR 2,32, 95% CI 1,93–2,80), ИМТ ≥25 кг / м 2 (OR 1,87, 95% CI 1,60–2,19), текущий статус курения (OR 1,34, 95% CI 1,12–1,61), потребление алкоголя ≥20 г / день (OR 1,57, 95% CI 1,34–1,84), высокий уровень стресса (OR 1,40, 95% CI 1.17–1,68), грыжа пищеводного отверстия диафрагмы (OR 2,41, 95% ДИ 2,08–2,79), эндоскопическая слизистая оболочка Баррета ≥10 мм (OR 2,62, 95% ДИ 1,71–4,04), атрофический гастрит (OR 0,40, 95% ДИ 0,34–0,47) , и использование низких доз аспирина (OR 0,38, 95% CI 0,17–0,76) значительно различались между группой EE и контрольной группой (Таблица 3).
Поскольку в возрастном распределении распространенности эрозивного эзофагита наблюдались гендерные различия, мы провели многомерный анализ факторов, связанных с ЭЭ, стратифицированных по полу.Как показано в таблице S1, отношение шансов для EE увеличивалось по мере увеличения возрастной группы у женщин. Напротив, эта взаимосвязь между возрастом и ЭЭ не наблюдалась у мужчин, хотя отношение шансов было значительно выше для группы 40–59 лет, чем для группы ≤39 лет.
Кроме того, мы провели многомерный анализ факторов, связанных с ЭЭ в подгруппе субъектов, стратифицированных по наличию грыжи пищеводного отверстия диафрагмы и / или эндоскопической слизистой оболочки Баррета.Как показано в таблице S2, факторы, связанные с ЭЭ, были одинаковыми независимо от стратификации субъектов исследования.
Кроме того, мы сравнили клинические характеристики субъектов EE и контрольной группы, включая субъектов с отсутствующими значениями STAI, с помощью двумерного анализа. Как показано в таблице S3, те же факторы, которые были значимыми в таблице 2, значительно различались между двумя группами, и доля субъектов с отсутствующими значениями STAI среди субъектов EE существенно не отличалась от таковой среди контрольных лиц (4.4% (58/1320) против 5,5% (189/3443), P = 0,1270). Кроме того, был проведен множественный логистический регрессионный анализ факторов, связанных с EE, по сравнению с контрольной группой с использованием трех категорий баллов STAI (высокий балл STAI, нормальный и низкий балл STAI и отсутствующий балл STAI). Как показано в таблице S4, факторы, связанные с EE, были одинаковыми независимо от включения субъектов с отсутствующими значениями STAI, и отсутствующий балл STAI не был значимым фактором.
Факторы, связанные с симптоматической ЭЭ по сравнению с легкой симптоматической и бессимптомной ЭЭ
Среди 1262 субъектов EE пропорция субъектов с sEE, msEE и aEE составляла 15.0% (n = 189), 37,2% (n = 469) и 47,9% (n = 604) соответственно. В таблице 4 показано сравнение клинических характеристик трех групп ЭЭ. Потребление алкоголя ≥20 г / день, недостаток сна, высокий уровень стресса, чувство депрессии, оценка STAI, EE ≥LA степени B, грыжа пищеводного отверстия диафрагмы тяжелой степени, атрофический гастрит и перекрывающиеся FD (PDS и EPS) значительно различались между группа sEE и группа msEE плюс aEE (таблицы 4 и S5).
В многомерном анализе факторов, связанных с sEE, по сравнению с msEE плюс aEE, перекрывающиеся EPS (OR 58.4, 95% ДИ 25,2–160,0), перекрывающиеся PDS (ОШ 9,96, 95% ДИ 3,91–26,8), грыжа пищеводного отверстия диафрагмы тяжелой степени (ОШ 2,43, 95% ДИ 1,43–4,05), высокий уровень стресса (ОШ 2,20 , 95% ДИ 1,43–3,40), ЭЭ ≥LA степени B (ОШ 1,72, 95% ДИ 1,12–2,60) и атрофический гастрит (ОШ 1,57, 95% ДИ 1,03–2,36) были определены как значимые факторы (таблица 5).
Обсуждение
Результаты настоящего исследования показали, что распространенность ЭЭ у субъектов, проходящих медицинские осмотры, составляла 16,7%, а в большинстве случаев ЭЭ (97.7%) были легкими – степень A или B. В Японии распространенность ГЭРБ увеличивается с конца 1990-х годов [3,4]. Одна из возможных причин этого изменения – увеличение секреции кислоты желудочного сока в популяции Японии, независимо от инфекции Helicobacter pylori [18]. Поскольку сообщалось, что потребление жиров с пищей стимулирует секрецию желудочной кислоты у мышей [19], хронологическое увеличение секреции желудочной кислоты у японцев может быть связано с увеличением потребления жиров [20]. Кроме того, поскольку H .Инфекция pylori обратно пропорциональна распространенности ГЭРБ [3], уменьшению H . pylori уровень инфицирования среди населения Японии считается одним из объяснений этого изменения.
Кроме отсутствия H . pylori , выявлены множественные факторы риска ЭЭ, включая пожилой возраст, мужской пол, ИМТ, курение, употребление алкоголя, отсутствие атрофии желудка, эндоскопическое исследование слизистой оболочки Баррета или грыжу пищеводного отверстия диафрагмы [6,21–26].В соответствии с предыдущими исследованиями, эти факторы также были значительно связаны с ЭЭ по сравнению с контрольной группой в этом исследовании. Кроме того, в этом исследовании высокий уровень стресса был значительным фактором риска, связанным с ЭЭ, что согласуется с сообщенной ассоциацией между психологическими факторами и ГЭРБ [27]. Использование низких доз аспирина было значимым профилактическим фактором, связанным с ЭЭ в многофакторном анализе, хотя он не был идентифицирован как значимый фактор в двумерном анализе.Поскольку в этом исследовании участвовало несколько пользователей, принимавших низкие дозы аспирина, в анализе могла существовать случайная статистическая погрешность. Сообщалось о связи между сахарным диабетом и ГЭРБ [28]. К сожалению, поскольку в этом исследовании не изучались значения глюкозы в крови натощак и гемоглобина A1c, мы не проводили статистический анализ с использованием сахарного диабета в качестве объясняющей переменной. Использование пероральных гипогликемических средств было значительным фактором риска, связанным с ЭЭ в двумерном анализе, но не было значимым фактором в многофакторном анализе.
Поскольку это снижает качество жизни пациента, проявление симптомов ЭЭ имеет клиническое значение. Хотя патогенез проявления симптомов рефлюкса при ГЭРБ до конца не изучен, стимуляция сенсорных нервов посредством прямого контакта с рефлюксной кислотой желудочного сока является основным фактором. Кроме того, в проявление симптомов рефлюкса могут быть вовлечены другие факторы, включая висцеральную гиперчувствительность пищевода, аномальное сопротивление ткани или устойчивое сокращение пищевода [29]. Это исследование показало, что распространенность sEE у субъектов EE составляла 15.0% и примерно половина (47,9%) субъектов EE не имели симптомов. В предыдущих исследованиях распространенность sEE у субъектов EE колебалась от 11,3% до 66,4% [9–11, 30], что, вероятно, зависит от различий в определениях sEE и исследуемых популяций.
Значимые независимые предикторы sEE в этом исследовании включали EE более высокой степени (≥LA степень B), тяжелую грыжу пищеводного отверстия диафрагмы, атрофический гастрит, высокий уровень стресса, перекрывающиеся EPS и перекрывающиеся PDS. Тяжесть эзофагита и грыжи пищеводного отверстия диафрагмы была связана с воздействием на пищевод рефлюксной кислоты желудочного сока, что предполагает, что ингибирование кислоты важно для лечения симптомов рефлюкса.
Переживание высокого уровня стресса считается психологическим фактором. В двумерном анализе в этом исследовании другие факторы, связанные с психологическим стрессом, включая недосыпание, чувство депрессии и баллы по шкале STAI, были статистически значимыми факторами риска, связанными с sEE. Предыдущие исследования также показали, что психологические факторы, такие как тревога, депрессия и симптомы соматизации, являются факторами риска, связанными с sEE [9–11].
Диспептические симптомы чаще встречаются у пациентов с частой ГЭРБ по сравнению с прерывистой ГЭРБ, и они влияют на качество жизни пациента [31].В соответствии с предыдущими исследованиями [10,11], в этом исследовании FD была значительным фактором риска, связанным с sEE. EPS показала более сильную связь с sEE, чем PDS, что также согласуется с предыдущим исследованием [10]. Известно, что пациенты с диспепсией подвержены риску развития ГЭРБ [31]. Кроме того, сообщается, что специфические симптомы диспепсии связаны с плохой реакцией на ИПП у пациентов с ГЭРБ [32]. Чтобы лучше контролировать симптомы рефлюкса ЭЭ, необходимы дальнейшие патофизиологические исследования наложения ГЭРБ и ФД.
Атрофический гастрит, который в основном вызывается H . Инфекция pylori приводит к пониженной кислотности желудочного сока и отрицательно связана с ЭЭ. Эта отрицательная связь также наблюдалась в этом исследовании. Интересно, однако, что наличие атрофического гастрита также было фактором риска, связанным с sEE в этом исследовании. Положительная связь между H . pylori Инфекция и sEE была описана в предыдущем исследовании, проведенном в Китае [30].Хроническое воспаление слизистой оболочки при атрофическом гастрите может приводить к нарушениям моторики и чувствительности гастродуоденальной зоны [33], а также к проявлению симптомов рефлюкса.
Одной из сильных сторон этого исследования было использование большого каталога данных проспективного многоцентрового когортного исследования. Размер и полнота этой базы данных позволили нам определить предикторы ЭЭ и факторы, связанные с проявлением симптомов при ЭЭ, с поправкой на потенциальные искажающие факторы. Тем не менее у этого исследования есть несколько ограничений.Во-первых, большинство субъектов ЭЭ в этом исследовании были людьми, прошедшими обследование, а не пациентами. Кроме того, тяжесть симптомов рефлюкса не измерялась, хотя частота симптомов измерялась подробно. Анкета для самооценки повседневной жизни без объективного определения была простой, и поэтому ее могло быть недостаточно для оценки данных или для сравнения с другими исследованиями по той же теме. Субъекты, получавшие антидепрессанты или транквилизаторы, не были исключены из этого исследования, хотя эти препараты могли повлиять на их восприятие уровня стресса.Кроме того, статус H . Инфекция pylori биологически не оценивалась, хотя эндоскопический атрофический гастрит ассоциировался с H . Была оценена инфекция pylori .
В заключение, примерно у одной шестой испытуемых с ЭЭ в нашей популяции были симптомы. Факторы, связанные с симптоматической картиной ЭЭ, включали перекрывающиеся ЭПС, перекрывающиеся ПДС, высокий уровень стресса, тяжелую грыжу пищеводного отверстия диафрагмы, атрофический гастрит и степень ЛА B или хуже.Многофакторная этиология, включая факторы, не связанные с секрецией желудочного сока, была связана с симптоматической картиной ЭЭ. Естественная история проявления симптомов ЭЭ будет изучена в наших последующих исследованиях.
Благодарности
Мы благодарны г-же Хару Хаманака за ее преданную секретарскую помощь. Мы благодарим г-на Масаки Ашиду, г-на Такахиде Кудо и г-на Такаши Окамото за их помощь в статистическом анализе. Мы благодарим госпожу Джунко Отани за помощь в создании базы данных.Мы благодарим г-на Такахиро Ханасаки за его помощь. Мы благодарим доктора Киёси Ашиду за полезные предложения для этого исследования. Мы благодарим доктора Кеничи Нисиодзи, доктора Май Камагути, доктора Хидеказу Мукаи, доктора Ацуши Сугахара, доктора Акихико Ватанабе, доктора Саори Мацуи и доктора Нобуюки Мацуки за их помощь в сборе данных.
Ссылки
- 1. Вакил Н., ван Зантен С.В., Карирас П., Дент Дж., Джонс Р.; Global Consensus Group. Монреальское определение и классификация гастроэзофагеальной рефлюксной болезни: глобальный консенсус, основанный на фактических данных.Am J Gastroenterol. 2006; 101: 1900–1920. pmid: 16928254
- 2. Эль-Сераг HB, Sweet S, Winchester CC, Dent J. Обновление эпидемиологии гастроэзофагеальной рефлюксной болезни: систематический обзор. Кишечник. 2014; 63: 871–880. pmid: 23853213
- 3. Fujiwara Y, Arakawa T. Эпидемиология и клинические характеристики ГЭРБ у населения Японии. J Gastroenterol. 2009; 44: 518–534. pmid: 19365600
- 4. Ивакири К., Киношита Ю., Хабу И., Осима Т., Манабе Н., Фудзивара Ю. и др.Гастроэзофагеальная рефлюксная болезнь 2015. J Gastroenterol. 2016; 51: 751–767. pmid: 27325300
- 5. Ронкайнен Дж., Аро П., Сторскрубб Т., Йоханссон С.Е., Линд Т., Боллинг-Стернвальд Э. и др. Высокая распространенность симптомов гастроэзофагеального рефлюкса и эзофагита с симптомами или без них среди взрослого населения Швеции в целом: отчет об исследовании Kalixanda. Сканд Дж Гастроэнтерол. 2005. 40: 275–285. pmid: 15932168
- 6. Пике Н., Понсе М., Гарригес В., Родриго Л., Кальво Ф., де Аргила С. М. и др.Распространенность тяжелого эзофагита в Испании. Результаты исследования PRESS (Факторы распространенности и риска эзофагита в Испании: перекрестное исследование). United European Gastroenterol J. 2016; 4: 229–235. pmid: 27087951
- 7. Юнг HK. Эпидемиология гастроэзофагеальной рефлюксной болезни в Азии: систематический обзор. J Neurogastroenterol Motil. 2011; 17: 14–27. pmid: 21369488
- 8. Охара С., Козу Т., Кавано Т., Кусано М. Национальное эпидемиологическое исследование по поводу изжоги и рефлюкс-эзофагита на японском языке (на японском языке).Nihon Shokakibyo Gakkai Zasshi. 2005; 102: 1010–1024. pmid: 16124707
- 9. Лей В.Й., Ю ХК, Вэнь Ш., Лю Т.Т., Йи СН, Ван СС и др. Факторы прогнозирования тихого рефлюкса у пациентов с эрозивным эзофагитом. Dig Liver Dis. 2015; 47: 24–29. pmid: 25308612
- 10. Ли Д., Ли КДж, Ким К.М., Лим СК. Распространенность бессимптомного эрозивного эзофагита и факторы, связанные с проявлением симптомов эрозивного эзофагита. Сканд Дж Гастроэнтерол. 2013; 48: 906–912 pmid: 23834193
- 11.Чой Дж.Й., Юнг Х.К., Сон Э.М., Шим К.Н., Юнг С.А. Детерминанты симптомов гастроэзофагеальной рефлюксной болезни: неэрозивная рефлюксная болезнь, симптоматическая и тихая эрозивная рефлюксная болезнь. Eur J Gastroenterol Hepatol. 2013; 25: 764–771. pmid: 23459104
- 12. Ронкайнен Дж., Аро П., Сторскрубб Т., Линд Т., Боллинг-Стерневальд Э., Юнгард О. и др. Симптомы гастроэзофагеального рефлюкса и качество жизни, связанное со здоровьем, среди взрослого населения в целом – исследование Kalixanda. Алимент Pharmacol Ther.2006; 23: 1725–1733 pmid: 16817916
- 13. Хонго М., Киношита Ю., Симозума К., Кумагаи Ю., Савада М., Нии М. Психометрическая проверка японского перевода опросника «Качество жизни при рефлюксе и диспепсии» у пациентов с изжогой. J Gastroenterol. 2007; 42: 807–815 pmid: 17940833
- 14. Джулиан LJ. Показатели тревожности: опросник состояния-черты тревожности (STAI), опросник Бека (BAI) и больничная шкала тревожности и депрессии (HADS-A).Уход и исследования артрита (Хобокен). 2011; 63 (Приложение 11): S467 – S472.
- 15. Мацузаки Дж., Сузуки Х., Асакура К., Сайто Й., Хирата К., Такебаяши Т. и др. Этиологическое различие между ультракоротким и короткосегментным пищеводом Барретта. J Gastroenterol. 2011. 46: 332–338. pmid: 21132333
- 16. Кимура К., Такемото Т. Эндоскопическое распознавание атрофической границы и ее значение при хроническом гастрите. Эндоскопия 1969; 1: 87–97
- 17. Tack J, Tally NJ, Camilleri M, Holtmann G, Hu P, Malagelada JR и др.Функциональные гастродуоденальные расстройства. Гастроэнтерология. 2006; 130: 1466–1479 pmid: 16678560
- 18. Kinoshita Y, Kawanami C, Kishi K, Nakata H, Seino Y, Chiba T. Helicobacter pylori – независимое хронологическое изменение секреции желудочной кислоты у японцев. Кишечник. 1997. 41: 452–458. pmid: 9391241
- 19. Саки-Сальсес М., Даудл В.Е., Рейтер Дж. Ф., Торговец Дж. Л. Диета с высоким содержанием жиров регулирует секрецию гастрина и кислоты через первичные реснички. FASEB J. 2012; 26: 3127–3139. pmid: 22516298
- 20.Иидзима К., Коике Т., Абэ Й., Охара С., Симосегава Т. Хронологическое увеличение секреции желудочной кислоты с 1995 по 2014 год у молодых здоровых японских добровольцев в возрасте до 40 лет. Tohoku J Exp Med. 2016; 239: 237–241. pmid: 27440759
- 21. Мисима I, Адачи К., Арима Н., Амано К., Такашима Т., Моритани М. и др. Распространенность эндоскопически отрицательной и положительной гастроэзофагеальной рефлюксной болезни у японцев. Сканд Дж Гастроэнтерол. 2005; 40: 1005–1009. pmid: 16211699
- 22.Ким Н, Ли С.В., Чо С.И., Пак К.Г., Ян Ч., Ким Х.С. и др. Распространенность и факторы риска эрозивного эзофагита и неэрозивной рефлюксной болезни: общенациональное многоцентровое проспективное исследование в Корее. Алимент Pharmacol Ther. 2008. 27: 173–185. pmid: 17973646
- 23. Менон С., Джаясена Х., Найтингейл П., Труджилл, штат Нью-Джерси. Влияние возраста и пола на результаты эндоскопии гастроэзофагеальной рефлюксной болезни: исследование базы данных эндоскопии. Eur J Gastroenterol Hepatol. 2011; 23: 389–395.pmid: 21448069
- 24. Гунджи Т., Сато Х., Иидзима К., Фудзибаяши К., Окумура М., Сасабе Н. и др. Факторы риска эрозивного эзофагита: поперечное исследование большого числа японских мужчин. J Gastroenterol. 2011; 46: 448–455. pmid: 21229366
- 25. Минацуки К., Ямамичи Н., Шимамото Т., Какимото Х., Такахаши Ю., Фудзиширо М. и др. Фоновые факторы рефлюкс-эзофагита и неэрозивной рефлюксной болезни: перекрестное исследование с участием 10 837 субъектов в Японии.PLoS One. 2013; 8: e69891. pmid: 23922844
- 26. Мацузаки Дж., Сузуки Х., Кобаякава М., Инадоми Дж. М., Такаяма М., Макино К. и др. Ассоциация области висцерального жира, курения и употребления алкоголя с рефлюкс-эзофагитом и пищеводом Барретта в Японии. PLoS One. 2015; 10: e0133865. pmid: 26225858
- 27. Dent J, El-Serag HB, Wallander MA, Johansson S. Эпидемиология гастроэзофагеальной рефлюксной болезни: систематический обзор. Кишечник. 2005; 54: 710–717. pmid: 15831922
- 28.Sun XM, Tan JC, Zhu Y, Lin L. Связь между сахарным диабетом и гастроэзофагеальной рефлюксной болезнью: метаанализ. Мир Дж. Гастроэнтерол. 2015; 21: 3085–3092. pmid: 25780309
- 29. Моайеди П., Талли, штат Нью-Джерси. Гастроэзофагеальная рефлюксная болезнь. Ланцет. 2006; 367: 2086–2100. pmid: 16798392
- 30. Пэн С., Цуй И, Сяо ИЛ, Сюн Л.С., Ху П.Дж., Ли СиДжей и др. Распространенность эрозивного эзофагита и пищевода Барретта среди взрослого населения Китая. Эндоскопия.2009; 41: 1011–1017. pmid: 19967617
- 31. Gerson LB, Kahrilas PJ, Fass R. Понимание симптомов диспепсии, связанных с гастроэзофагеальной рефлюксной болезнью. Clin Gastroenterol Hepatol. 2011; 9: 824–833. pmid: 21699806
- 32. Д’Алессандро А., Зито Ф. П., Пеше М., Андреоцци П., Эффективность Е, Карджолли М. и др. Специфические симптомы диспепсии связаны с плохим ответом на терапию у пациентов с гастроэзофагеальной рефлюксной болезнью. United European Gastroenterol J. 2017; 5: 54–59.pmid: 28405322
- 33. Сузуки Х., Моайеди П. Инфекция Helicobacter pylori при функциональной диспепсии. Нат Рев Гастроэнтерол Гепатол.