Фаза ремиссии: Характеристика фазы ремиссии при впервые выявленном инсулинзависимом сахарном диабете | Смирнова
что это? Стабилизации и прогрессирование болезни
Ремиссия – это такой период в ходе лечения хронического заболевания, при котором происходит частичное или полное исчезновение признаков болезни. Ремиссию нельзя назвать полным излечением, поскольку остается некоторый риск рецидива, то есть повторного возникновения болезни.
В процессе лечения онкологических заболеваний различают несколько видов ремиссий:
-
Полная (радикальная) или полный ответ. По итогам лечения у пациента не проявляются признаки болезни, ни с помощью лабораторных анализов, ни помощью специальных инструментальных методов обследования в течении 4х недель. Факт полной ремиссии можно подтвердить, если признаки заболевания не проявляются минимум в течении пяти лет.
-
Неполная (частичная) ремиссии (частичный ответ). В этом случае обнаруживается уменьшение объема опухоли на 50% или более в течении 4х недель, выявляется наличие атипичных клеток, но симптоматика отсутствует.

В случае солидных опухолей – при наличии частичной ремиссии (частичного ответа), как правило, продолжают лечение по назначенной ранее схеме до тех пор, пока наблюдается положительная динамика.
Также онкологи говорят о стабилизации или прогрессировании болезни. Что это?
Стабилизация – отсутствие изменений, незначительный рост или небольшое уменьшение опухоли без появления дополнительных очагов. Эти изменения нельзя достоверно отнести к увеличению опухоли, ни к ее частичному регрессу. Стабилизация приводит к замедлению опухолевого роста, улучшает качество и продлевает длительность жизни, поэтому данный результат лечения считается положительным, как и частичный ответ
Прогрессированием болезни принято считать появление нового очага опухоли после любого радикального лечения (хирургического, лучевого, лекарственного), либо увеличение размеров опухоли более, чем на 25% по результатам инструментальных методов диагностики (УЗИ, КТ, МРТ). Опухолевая прогрессия может быть установлена и гистологическими методами (онкогематологические заболевания). В этом случае врач при микроскопическом исследовании биоматериала обнаруживает изменения клеточных структур, увеличение скорости деления клеток, а это сигнал увеличения потенциала злокачественности.
Опухолевая прогрессия может быть установлена и гистологическими методами (онкогематологические заболевания). В этом случае врач при микроскопическом исследовании биоматериала обнаруживает изменения клеточных структур, увеличение скорости деления клеток, а это сигнал увеличения потенциала злокачественности.
Ремиссия — что это такое (в медицине) простыми словами
Обновлено 4 января 2021- Ремиссия — это…
- Виды ремиссии при онкологии
- Сколько она длится
- Как контролируют процесс
Здравствуйте, уважаемые читатели блога KtoNaNovenkogo.ru. Все мы болеем, и это неизбежно. Острые заболевания отличаются тем, что они имеют тот или иной исход.
Возьмем, к примеру, краснуху – это острое заболевание, которым чаще болеют дошколята.
Не ошибусь, если скажу, что большинство читателей уже испытали на себе не слишком приятные симптомы болезни и давно забыли о ней, поскольку наступило выздоровление.
Хронические болезни характеризуются сменой периодов: обострений и ремиссий.
Ремиссия — это…
Термин «ремиссия» происходит от латинского слова «remissio». Говоря о ремиссии в медицинском понятии, мы имеем в виду определенный период в течение заболевания.
Если говорить простыми словами, это такое время, в которое наблюдается ослабление и полное исчезновение признаков патологии (что это такое?).
Ремиссия – это слово, которое медики часто используют при описании онкологии. Оно обозначает, что после лечения у пациента отсутствуют симптомы рака.
Однако этот этап нельзя считать полноценным избавлением от болезни, полной гарантии на исчезновение раковых клеток доктор не дает.
Опухоль может рассосаться частично. Оставшиеся атипичные клетки способны спровоцировать повторное развитие онкологии. Причиной рецидива (что это такое?) может послужить внешний или внутренний фактор, а также сочетание тех и других.
Виды ремиссии при онкологии
Продолжим тему онкологических заболеваний и определим характер уменьшения признаков рака. В медицинской практике различают следующие разновидности ремиссий:
В медицинской практике различают следующие разновидности ремиссий:
- радикальная или полная. Редкое явление. Точно обозначить отступление патологии можно только при отсутствии симптомов болезни на протяжении не менее чем 5-ти лет. В таком случае врачи подтверждают факт пожизненной ремиссии;
- частичная или неполная. Картина наблюдается при отсутствии проявлений, но с наличием нескольких атипичных клеток. Продлить период ремиссии можно, следуя всем врачебным рекомендациям;
- спонтанная. Явление изучено плохо – информации у науки в отношении спонтанной ремиссии немного.
Так, терапия четвертой стадии рака может неожиданно привести к полному исчезновению проявлений и самого опухолевого процесса. Больной выздоравливает по неясным для пациента и врачей причинам.
Полная ремиссия – конечная цель любого лечения. Однако нередки случаи ведения полноценной жизни и при частичной ремиссии.
Существуют определенные виды опухолей, которые не способны полностью рассосаться (рак яичников, хронический лейкоз и пр. ). В таких случаях проще относиться к онкологии, как к сахарному диабету или болезни сердца: считать рак не единовременным событием, а постоянным состоянием здоровья.
). В таких случаях проще относиться к онкологии, как к сахарному диабету или болезни сердца: считать рак не единовременным событием, а постоянным состоянием здоровья.
Сколько длится ремиссия
Продолжительность ремиссии вариативная. Если она протекает на протяжении нескольких дней, говорят о нестойкой ремиссии. Когда же больной «отдыхает от болезни» в течение нескольких лет, отмечают стойкую ремиссию.
Длительность описываемого состояния зависит от качества проводимого лечения, течения самой патологии, ее стадии, сопротивляемости организма пациента и общего состояния здоровья человека.
Как контролируют процесс ремиссии
Уяснив, что такое ремиссия в медицине, возникает новый вопрос: можно ли этот процесс контролировать? Эта непростая задача возложена на плечи медиков, которые заняты назначением профилактических действий и контролем над их выполнением.
В процессе поддержания состояния ремиссии больному:
- прописывают специальные лекарственные средства и антибиотики, которые улучшают общее состояние пациента, уменьшают интенсивность ярких признаков болезни;
- назначают специальную профилактику, которая направлена на укрепление здоровья и иммунитета, чтобы организм больного был готов продолжить борьбу с хронической патологией;
- рекомендуют выполнять специальные действия, которые не только укрепят иммунную систему, но и поспособствуют рассасыванию опухоли.

Речь идет об отказе от сигарет, алкогольных напитков, соблюдении режима дня, организации регулярного и сбалансированного питания и пр.
Пациенту предстоит регулярно посещать доктора, который станет проводить обследования и поможет обозначить период ремиссии. Если состояние больного долгое время стабильно, велика вероятность того, что хроническое заболевание со временем отступит, и иммунитет сможет восстановиться.
Ремиссия – понятие воодушевляющее. Однако временное отсутствие признаков патологии, особенно если речь идет о раке, не должно стать для больного билетом в разгульную жизнь. Самое время отнестись к своему здоровью внимательнее!
На этом у меня пока все. Доброго здоровья, друзья!
Автор статьи: Кристина Чехова
Удачи вам! До скорых встреч на страницах блога KtoNaNovenkogo.ruДиагностика и лечение болезни Крона Санкт-Петербург
Болезнь Крона – это хроническое рецидивирующее заболевание, характеризующееся наличием воспаления и поражения желудочно-кишечного тракта, которое может наблюдаться на всем его протяжении от ротовой полости до заднего прохода, при этом здоровые участки чередуются с поврежденными. Чаще всего воспалительный процесс поражает конечный отдел тонкой кишки и толстую кишку. Заболевание распространяется на все слои стенки кишки и может протекать по-разному с преобладанием воспаления, признаков кишечной непроходимости или поражения ануса и прямой кишки.
Чаще всего воспалительный процесс поражает конечный отдел тонкой кишки и толстую кишку. Заболевание распространяется на все слои стенки кишки и может протекать по-разному с преобладанием воспаления, признаков кишечной непроходимости или поражения ануса и прямой кишки.
Основные симптомы
Симптомы проявления болезни разделяют на кишечные и некишечные. Почти у всех заболевших в начале заболевания наблюдаются:
- общая слабость, утомляемость;
- лихорадка;
- потеря веса;
- диарея, в том числе с кровью;
- боли в животе.
Иногда диагностика заболевания затрудняется при наличии неявно выраженных симптомов и локализации воспалительных процессов только в тонкой кишке.
Механизм развития заболевания
Причины возникновения болезни Крона окончательно не выяснены. Предположительными факторами, вызывающими и способствующими воспалению, являются наследственность, иммунные нарушения, инфекционные заболевания.
Когда необходимо обратиться к врачу?
При длительной диарее, появлении крови в стуле, общей слабости, болях в животе обязательно нужна консультация гастроэнтеролога для исключения болезни Крона.
При ухудшении состояния и появлении признаков обострения, а особенно при резком ухудшении состояния, необходимо незамедлительно обратиться к врачу за помощью, так как течение болезни Крона может сопровождаться внезапным ухудшением и развитием тяжелой атаки с возникновением опасных для жизни осложнений.
Осложнения
Длительное воспаление приводит к фиброзу и образованию стриктур (сужений) кишечника, свищей, патологических соединений пораженного участка кишки с другими органами или кожей.
Обострение заболевания и тяжелая атака может сопровождаться:
- кишечным кровотечением;
- кишечной непроходимостью;
- абсцессом;
- перфорацией (прободением) стенки кишечника.
Ремиссия язвенной болезни – восстановление больных после язвы желудка в Москве
Язва желудка — хроническая патология, для которой характерно наличие язвенных дефектов в желудочных стенках — является рецидивирующим заболеванием. Во время стадии ремиссии рекомендуется проводить ряд реабилитационных мероприятий, направленных на устранение возникших симптомов и профилактику возможного рецидива.
Во время стадии ремиссии рекомендуется проводить ряд реабилитационных мероприятий, направленных на устранение возникших симптомов и профилактику возможного рецидива.
Симптомы язвенной болезни
Симптоматика зависит от локализации и размеров язвы в желудке, а также от индивидуальных особенностей больного: его общего состояния, возраста и др.
Основным симптомом язвенной болезни является боль, которая проявляется самым различным образом:
- поздняя, ранняя, ночная;
- с сезонным обострением: усиливается осенью и весной;
- переменная: появляется и исчезает;
- различная по характеру: от легкой до нестерпимой, от колющей до тупой;
- в различных отделах тела: как правило, в левой части грудной клетки, левой руке, в спине, в области малого таза, правого подреберья, в пояснице.
Кроме того, могут проявляться следующие симптомы:
- изжога, тошнота, рвота, отрыжка;
- запоры;
- чувство тяжести в животе;
- слабый аппетит;
- быстрое насыщение;
- ощущение вздутия в брюшной полости.

Реабилитация язвы желудка — это комплекс лекарственных мер, направленных на уничтожение вредоносных бактерий хеликобактер пилори, уменьшение кислотности желудка, профилактику возможных осложнений и лечение симптомов болезни во время ремиссии. В этот период требуется защитить желудок от возможных проявлений заболевания в будущем и устранить все текущие симптомы.
К методам лечения желудочной язвы относятся:
- терапия антибиотиками;
- применение антисекреторных препаратов;
- применение лекарственных препаратов, повышающих защиту слизистой оболочки, и прочих препаратов;
- строгая диета.
Лекарственная терапия и диета назначаются индивидуально в каждом отдельном случае, с учетом особенностей пациента, расположения язвы в желудке, ее размера, общего состояния больного и прочих факторов. Лечение проходит под строгим контролем терапевта, но при необходимости в нем принимают участие врачи других направлений.
При заболеваниях желудка важно не только составить правильную диету и обеспечить выполнение всех требований к режиму питания, но и грамотно подойти к составлению лекарственной терапии.
Кроме того, важно регулярно проводить осмотр больного, чтобы оценивать эффективность программы восстановления и при необходимости скорректировать ее.
В «Благополучии» работает высококвалифицированный персонал: от поваров, способных приготовить именно те блюда, которые показаны пациенту, до медицинского персонала, способного провести диагностику и обеспечить качественную лекарственную терапию, сделав восстановление пациента наиболее эффективным.
Хронический пиелонефрит
Развитие хронического пиелонефрита связывают в основном с переходом острого пиелонефрита в хроническую стадию, рецидивами острого пиелонефрита, обусловленными нарушениями проходимости мочевых путей или наличием какого-то заболевания в них. Нередко своим происхождением хронический пиелонефрит обязан детскому периоду. У молодых женщин он может быть связан с «дефлорационным циститом», беременностью.Большое значение в его развитии имеют снижение иммунного статуса и неспецифическая резистентность.
Различают фазы активного и латентного воспаления. Морфологически в почках наблюдаются полиморфность и очаговость. Воспаление распространяется по интерстициальной ткани почки. Пути распространения микроорганизмов в почку — гематогенный и уриногенный. При уриногенном распространении инфекции воспалительный процесс проходит четыре стадии — катаральную, гнойную, фиброзную и язвенную. Фиброзная и язвенная стадии характеризуются разрастанием фиброзной ткани в межуточном веществе мозгового слоя почки, дистрофией эпителия почечных канальцев, появлением аналогичных изменений в околопочечной клетчатке, возникновением педункулита.
Симптомы.
Проявления хронического пиелонефрита зачастую скудные и проявляются в периоды обострений. Многие авторы отмечают волнообразность его клинического течения. В активной фазе воспалительного процесса течение идентично острому пиелонефриту. В стадии ремиссии жалобы могут быть на головную боль, слабость, снижение аппетита и быструю утомляемость. Могут быть ноющие боли в реберно-позвоночном углу, дизурия. Постепенно развивается артериальная гипертензия.
Могут быть ноющие боли в реберно-позвоночном углу, дизурия. Постепенно развивается артериальная гипертензия.
Диагностика.
Грамотная постановка диагноза основывается на жалобах, клинической картине заболевания. Важно выявить из анамнеза наличие дизурии, почечных колик, значительные повышения температуры тела. Существенную роль играют лабораторные, бактериологические исследования. Обнаруживаются пиурия, бактериурия. Если обычными методами исследования пиурия не выявляется, используют методы Нечипоренко (количество лейкоцитов в 1 мл мочи) и другие, обнаружение клеток Штернгаймера-Мальбина, активных лейкоцитов.
В связи с поражением в основном канальцевого аппарата при хроническом пиелонефрите наблюдаются полиурия, гипоизостенурия. Достаточно широко применяются изотопная ренография, динамическая нефросцинтиграфия. Ультразвуковые признаки хронического пиелонефрита в стадии ремиссии не демонстративны. Лишь в активной стадии наблюдается некоторое увеличение размеров почки, снижение эхогенности почечных пирамидок, признаки отека параненефральной клетчатки.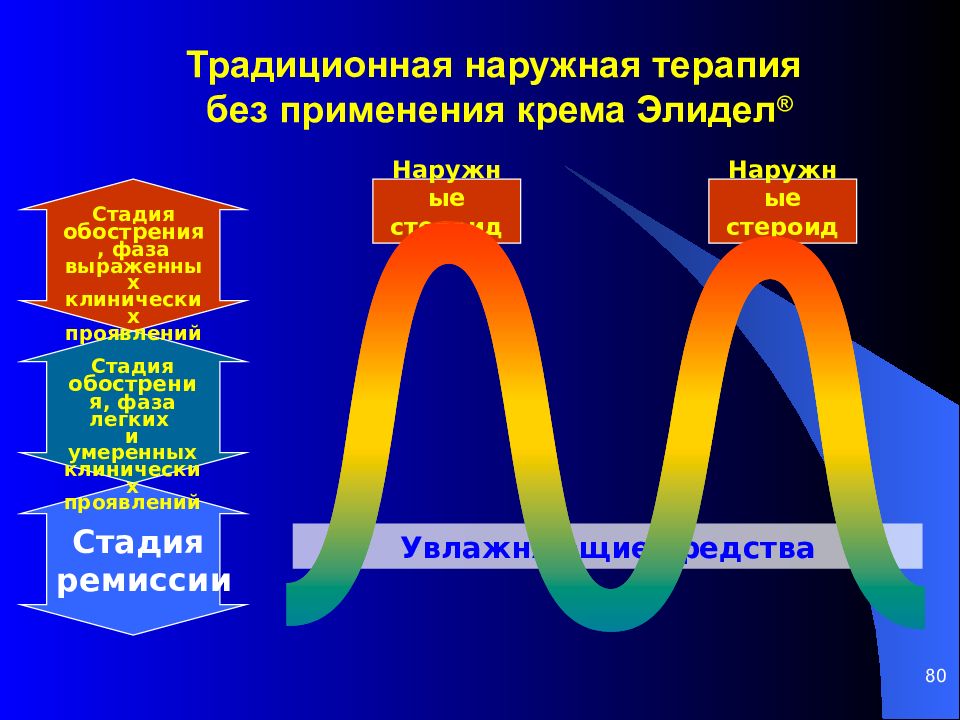 УЗ исследованием можно также обнаружить признаки сморщенной почки.
УЗ исследованием можно также обнаружить признаки сморщенной почки.
При экскреторной урографии обнаруживаются органические изменения (деформация чашечно-лоханочной системы в виде раздвинутых шеек чашечек, сглаженности сосочков почки, булавовидной чашечки и т.д.) и функциональные (снижение тонуса лоханки и интенсивности выделения контрастного вещества).
При пиелонефритически сморщенной почке рентгенологически определяется симптом «вянущего цветка», описанный в 1956 году Момбертом.
В некоторых ситуациях для определения состояния почечного кровообращения применяют почечную артериографию. Ангиографические симптомы — «симптом обгорелого дерева», сужение и деформация сосудов.
Исходом хронического пиелонефрита могут быть пионефроз (обычно при наличии обструктивных факторов) и сморщивание почки (при удовлетворительном оттоке мочи по мочевым путям).
Обратившись в наши медицинские клиники к врачу урологу, Вы можете получить подробную консультацию, провести полный комплекс диагностических мероприятий и получить все необходимые рекомендации по профилактике и лечению.
Как протекает рассеянный склероз
Выше уже было сказано, что чаще всего встречается ремиттирующее течение болезни — чередование фазы обострения и фазы ремиссии. В фазе ремиссии симптомы болезни могут проходить полностью или частично и она может быть разной по длительности у разных пациентов.Однако после обострения симптомы болезни проходят не полностью. Ограничения, которые человек испытывает в моменты обострения, накапливаются, в дальнейшем могут возникать следующие обострения и также проходить не полностью. А с какого-то времени болезнь может прогрессировать вовсе без выраженных обострений. Это называется вторично-прогрессирующим течением.
Кроме того, есть достаточно редкий вариант первично-прогрессирующего рассеянного склероза, когда нельзя выделить четкие обострения, а симптомы болезни прогрессируют с течением времени.
И отдельно хочется отметить так называемый клинически-изолированный синдром (КИС) как вариант течения рассеянного склероза. С ним можно столкнуться в начале болезни. Напомним, что для постановки диагноза РС, врач должен увидеть распространенность болезни во времени — то есть, должно быть хотя бы два эпизода каких-то нарушений, вызванных болезнью. КИС — это такое состояние, когда симптомы болезни возникают впервые и, выполнив МРТ, врач наблюдает один или несколько очагов и предполагает, что у человека РС. Как быть? Здесь может помочь спинномозговая пункция. Считается, что при наличии антител рассеянный склероз разовьется в 80% случаев. Если начать в этот момент прием препаратов, которые изменяют течение РС (ПИТРС), то можно улучшить исход этого заболевания.
С ним можно столкнуться в начале болезни. Напомним, что для постановки диагноза РС, врач должен увидеть распространенность болезни во времени — то есть, должно быть хотя бы два эпизода каких-то нарушений, вызванных болезнью. КИС — это такое состояние, когда симптомы болезни возникают впервые и, выполнив МРТ, врач наблюдает один или несколько очагов и предполагает, что у человека РС. Как быть? Здесь может помочь спинномозговая пункция. Считается, что при наличии антител рассеянный склероз разовьется в 80% случаев. Если начать в этот момент прием препаратов, которые изменяют течение РС (ПИТРС), то можно улучшить исход этого заболевания.
В любом случае главная цель как врача, так и пациента — улучшить качество жизни, то есть, сохранить работоспособность, активный образ жизни. Именно на это направлены все усилия, против играет только время. Поэтому крайне важно увеличивать информативность, понимание природы этой болезни, что с ней делать и к кому обращаться.
Лечение хронической обструктивной болезни легких (ХОБЛ) легкой и средней степени тяжести в фазе ремиссии с ЛСН не выше I стадии
Лечение хронической обструктивной болезни легких (ХОБЛ) легкой и средней степени тяжести в фазе ремиссии с ЛСН не выше I стадии Мы заботимся о наших гостях и принимаем меры по борьбе с распространением вируса COVID-19. Мы заботимся о безопасности наших гостей.
Подробнее
Мы заботимся о безопасности наших гостей.
ПодробнееПрограммы санаториев предлагают комплекс мер, позволяющий продлить период ремиссии (период отсутствия обострений). Методами лечения профилактики являются: электрофорез, магнитотерапия, ультразвук, массаж грудной клетки, лазеро- и аэротерапия. В совокупности с правильным питанием, нормализованным распорядком дня, умеренными физическими нагрузками лечение позволяет значительно улучшить качество жизни больного.
Методами лечения профилактики являются: электрофорез, магнитотерапия, ультразвук, массаж грудной клетки, лазеро- и аэротерапия. В совокупности с правильным питанием, нормализованным распорядком дня, умеренными физическими нагрузками лечение позволяет значительно улучшить качество жизни больного.
Противопоказания
- Все заболевания в острой стадии, хронические заболевания в стадии обострения и осложненные острогнойными процессами
- Острые инфекционные заболевания.
- Злокачественные новообразования.
- Все заболевания и состояния, требующие стационарного лечения.
- Часто повторяющиеся и обильные эпизоды кровохарканья, интоксикационный синдром, астения, выпот в плевральную полость, пневмоторакс.
- Все формы туберкулеза в активной стадии.
- Дыхательная недостаточность выше II-й степени.
- Бронхиальная астма тяжелого и средней тяжести течения, неконролируемая адекватной базисной терапией.

Результаты лечения
Влажный, чистый воздух курорта Красная Пахра способствует скорейшему выздоровлению пациентов с ХОБЛ. В сочетании с комплексным лечением, терапия даёт потрясающий результат: восстанавливается воздушный поток в дыхательных путях, проходит кашель и дышать становится намного легче.Последствия отсутствия лечения
Запущенная болезнь, может привести к серьёзным последствиям, таким как, эмфизема лёгких, бронхоэктазия, нарушение ритма сердца, дыхательная недостаточность, лёгочное сердце. Хроническая обструктивная болезнь легких (ХОБЛ) – заболевание легких, при котором происходит ограничение воздушного потока в дыхательных путях. В результате этого появляется затрудненное дыхание и кашель. В большинстве случаев хроническая осбтруктивная болезнь возникает из-за курения, как активного, так и пассивного. Другими причинами ХОБЛ становятся инфекционные заболевания дыхательных путей, наследственная предрасположенность и воздействие вредных веществ, скапливающихся в воздухе.
В большинстве случаев хроническая осбтруктивная болезнь возникает из-за курения, как активного, так и пассивного. Другими причинами ХОБЛ становятся инфекционные заболевания дыхательных путей, наследственная предрасположенность и воздействие вредных веществ, скапливающихся в воздухе.
Фаза ремиссии у детей с диабетом 1 типа: новое понимание и новые биомаркеры – FullText – Исследование гормонов в педиатрии 2017, Vol. 88, № 5
Аннотация
Диабет 1 типа (T1D) – это метаболическое заболевание неизвестной этиологии, которое возникает в результате аутоиммунного разрушения β-клеток. Клиническое начало с классическими симптомами гипергликемии гораздо чаще встречается у детей и молодых людей, когда остается менее 30% β-клеток.Введение экзогенного инсулина – единственное лечение для пациентов. Однако из-за нарушения регуляции глюкозы постепенно развиваются тяжелые осложнения. В последнее время во всем мире зарегистрировано увеличение заболеваемости СД1, особенно у детей. Вскоре после постановки диагноза пациенты с СД1 часто испытывают частичную ремиссию, называемую «фазой медового месяца», которая длится несколько месяцев при незначительной потребности в экзогенном инсулине. На этой стадии оставшиеся β-клетки все еще способны продуцировать достаточно инсулина, чтобы уменьшить введение экзогенного инсулина.Восстановление иммунологической толерантности к аутоантигенам β-клеток может объяснить попытку регенерации в этой фазе ремиссии. Этот мини-обзор посвящен фазе ремиссии у детей с СД1. Понимание этого периода и обнаружение тех периферических биомаркеров, которые являются признаками иммунорегуляции или регенерации островков, могут способствовать выявлению пациентов с лучшим гликемическим прогнозом и более низким риском вторичных осложнений. Эта фаза ремиссии может стать хорошей контрольной точкой для назначения будущих иммунотерапевтических препаратов.
Однако из-за нарушения регуляции глюкозы постепенно развиваются тяжелые осложнения. В последнее время во всем мире зарегистрировано увеличение заболеваемости СД1, особенно у детей. Вскоре после постановки диагноза пациенты с СД1 часто испытывают частичную ремиссию, называемую «фазой медового месяца», которая длится несколько месяцев при незначительной потребности в экзогенном инсулине. На этой стадии оставшиеся β-клетки все еще способны продуцировать достаточно инсулина, чтобы уменьшить введение экзогенного инсулина.Восстановление иммунологической толерантности к аутоантигенам β-клеток может объяснить попытку регенерации в этой фазе ремиссии. Этот мини-обзор посвящен фазе ремиссии у детей с СД1. Понимание этого периода и обнаружение тех периферических биомаркеров, которые являются признаками иммунорегуляции или регенерации островков, могут способствовать выявлению пациентов с лучшим гликемическим прогнозом и более низким риском вторичных осложнений. Эта фаза ремиссии может стать хорошей контрольной точкой для назначения будущих иммунотерапевтических препаратов.
© 2017 S. Karger AG, Базель
Диабет 1 типа и аутоиммунитет
Диабет 1 типа (T1D) – это метаболическое заболевание, вызываемое разрушением иммунной системой продуцирующих инсулин β-клеток. Это наиболее частое эндокринное заболевание у детей и подростков [1], хотя оно может появиться в любом возрасте. СД1 предшествует длительный бессимптомный период (преддиабет), при котором теряется иммунологическая толерантность к β-клеткам.Клинические симптомы заболевания возникают после значительного уменьшения массы β-клеток. Аутоантитела к островковым клеткам можно обнаружить в сыворотке крови субъектов на доклинической стадии СД1. В экспериментальной модели T1D у мышей с диабетом без ожирения (NOD) антитела и Т-клеточные ответы коррелировали с аутоиммунной реакцией на островки и с инфильтрацией островков, инсулитом [2]. Аутоантитела островковых клеток являются биомаркерами аутоиммунного процесса и отражают атаку на компоненты островков. Некоторые из этих компонентов не включают β-клетки (инсулин, ZnT8 [переносчик цинка 8], IGRP [белок, специфичный для островков каталитической субъединицы глюкозо-6-фосфатазы]), в то время как другие имеют более широкую нейроэндокринную экспрессию (GAD [глутаминовая кислота декарбоксилаза], IA-2 [островковый антиген 2], S100β) или нейрональная экспрессия (GFAP, глиальный фибриллярный кислый белок), аспект, подтвержденный экспериментальными моделями заболевания [3]. Обычно первыми появляются те, которые реагируют на инсулин, и их распространенность выше у маленьких детей.
Некоторые из этих компонентов не включают β-клетки (инсулин, ZnT8 [переносчик цинка 8], IGRP [белок, специфичный для островков каталитической субъединицы глюкозо-6-фосфатазы]), в то время как другие имеют более широкую нейроэндокринную экспрессию (GAD [глутаминовая кислота декарбоксилаза], IA-2 [островковый антиген 2], S100β) или нейрональная экспрессия (GFAP, глиальный фибриллярный кислый белок), аспект, подтвержденный экспериментальными моделями заболевания [3]. Обычно первыми появляются те, которые реагируют на инсулин, и их распространенность выше у маленьких детей.
Причина СД1 неизвестна, хотя известно, что генетические факторы и факторы окружающей среды повышают риск его развития. Факторы генетической предрасположенности в основном определяются генами HLA, в частности гаплотипами HLA класса II DRB1 * 03: 01-DQB1 * 02: 01 (DR3-DQ2) и DRB1 * 04: 01-DQB1 * 03: 02 (DR4-DQ8), которые приводят к сильной восприимчивости [4]. Эти гены кодируют белки, обнаруженные на поверхности клетки, и связаны с важными иммунологическими функциями, такими как презентация антигена. Факторы окружающей среды также участвуют в развитии СД1, и большинство из них могут действовать в детстве (например,g., перинатальные факторы, инфекции, диета и стрессовые события).
Факторы окружающей среды также участвуют в развитии СД1, и большинство из них могут действовать в детстве (например,g., перинатальные факторы, инфекции, диета и стрессовые события).
Клинические симптомы болезни возникают после значительного уменьшения массы β-клеток. Изменения, наблюдаемые в поджелудочной железе у пациентов с СД1, подтверждают, что иммунная система атакует β-клетки. Однако пациенты сохраняют некоторую способность регенерировать β-клетки до нескольких десятилетий после клинического начала [5], хотя аутоиммунный ответ разрушает новые β-клетки по мере их регенерации (Рис. 1). Прекращение аутоиммунитета будет ключом к успешной регенеративной терапии.Вскоре после начала СД1 может быть обнаружена временная или частичная стадия спонтанной ремиссии, также известная как фаза медового месяца. Во время этой фазы потребность в экзогенном инсулине снижается до менее 50% от начального уровня – и в некоторых случаях может быть достигнута даже независимость от инсулина – при сохранении почти нормального гликемического контроля. После этого пациенты будут нуждаться в лечении инсулином на всю жизнь, и в большинстве случаев будут возникать вторичные осложнения. Фаза частичной ремиссии может наблюдаться у детей, подростков и взрослых с одинаковыми симптомами и особенностями обмена веществ.В этом обзоре мы сосредоточимся на стадии ремиссии СД1 у детей.
После этого пациенты будут нуждаться в лечении инсулином на всю жизнь, и в большинстве случаев будут возникать вторичные осложнения. Фаза частичной ремиссии может наблюдаться у детей, подростков и взрослых с одинаковыми симптомами и особенностями обмена веществ.В этом обзоре мы сосредоточимся на стадии ремиссии СД1 у детей.
Рис. 1.
Естественная история СД1 и предлагаемая последовательность фазы ремиссии, связанная с массой β-клеток.
СД1 и детство
СД1 у детей особенно актуален, поскольку заболевание влияет на качество жизни пациентов и их семей, увеличивая риск вторичных осложнений в долгосрочной перспективе. Недавние исследования детского СД1 показывают некоторые эпидемиологические изменения, которые указывают на быстрое увеличение с возрастом заболеваемости примерно на 3–4% [6, 7].Различий в заболеваемости мальчиков и девочек не описано. Кроме того, возраст постановки диагноза обычно увеличивается, особенно у детей в возрасте от 0 до 4 лет. Эти изменения в генетически стабильной популяции отражают новые активные факторы окружающей среды, которые увеличивают риск аутоиммунных заболеваний, включая СД1.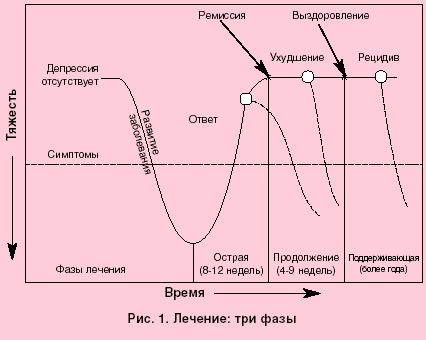 Это основа гигиенической гипотезы, которая утверждает, что отсутствие ряда инфекций в раннем детстве (глисты, вирусы и другие микробы) ухудшает созревание иммунной системы, тем самым влияя на репертуар лимфоцитов, изменяя иммунорегуляцию и повышая риск T1D [8].Фактически, перинатальное воздействие окружающей среды имеет решающее значение для сенсибилизации к аутоантигенам β-клеток и для развития специфической генной сигнатуры в аутореактивных Т-лимфоцитах CD4 + [9]. В целом эти данные предполагают, что СД1 является следствием многоступенчатого процесса, инициированного на ранних этапах жизни.
Это основа гигиенической гипотезы, которая утверждает, что отсутствие ряда инфекций в раннем детстве (глисты, вирусы и другие микробы) ухудшает созревание иммунной системы, тем самым влияя на репертуар лимфоцитов, изменяя иммунорегуляцию и повышая риск T1D [8].Фактически, перинатальное воздействие окружающей среды имеет решающее значение для сенсибилизации к аутоантигенам β-клеток и для развития специфической генной сигнатуры в аутореактивных Т-лимфоцитах CD4 + [9]. В целом эти данные предполагают, что СД1 является следствием многоступенчатого процесса, инициированного на ранних этапах жизни.
Детям с ранними признаками и клиническими симптомами СД1 следует диагностировать как можно скорее, чтобы избежать диабетического кетоацидоза, наиболее частой причины смерти в начале СД1. Более молодой возраст и кетоацидоз на момент постановки диагноза были связаны с более низкими уровнями стимулированного С-пептида через 1 год после начала СД1, что отражает более низкую остаточную функцию β-клеток у этих пациентов.Кроме того, сообщалось о более быстрой потере функции β-клеток у самых маленьких детей по сравнению с более старшими возрастными группами. Следовательно, это может означать быстрое и более обширное разрушение β-клеток или снижение способности регенерировать β-клетки у очень маленьких детей [10].
Детский T1D демонстрирует определенные отличия по сравнению с взрослыми: бессимптомный период обычно короче, остаточная функция β-клеток ниже, антиинсулиновые антитела встречаются чаще, а ассоциация с типами HLA высокого риска выше [11] .Кроме того, начало СД1 в возрасте до 7 лет связано с более медленным интеллектуальным развитием и когнитивными проблемами, вероятно, из-за вторичных осложнений, таких как гипер- и гипогликемия, которые могут повлиять на развитие мозга [12, 13].
Фаза ремиссии у детей с СД1
Особенно интересным этапом естественного течения СД1 является фаза частичной спонтанной ремиссии. Эта фаза начинается через несколько недель после начала инсулинотерапии. На этом этапе потребность пациента в экзогенном инсулине снижается на 50%, и сохраняется почти нормальный метаболический контроль.В некоторых случаях может быть достигнута даже временная инсулиновая независимость. Нет единого мнения в отношении клинического определения фазы ремиссии, и были предложены различные интерпретации. Его можно определить как потребность в инсулине <0,5 единиц / кг массы тела в день и HbA1c <7%, но недавно была предложена новая формула, сочетающая оба значения: «HbA1c с поправкой на дозу инсулина» (IDDAA1c), определяемый как HbA1c. (%) + 4 × (доза инсулина в единицах / кг / 24 ч), что предполагает, что значение <9 указывает на частичную ремиссию.Это определение хорошо коррелирует со стимулированным С-пептидом> 300 пмоль / л и было подтверждено в крупных когортных исследованиях [14-16]. Мы твердо убеждены в том, что по нескольким причинам критерии IDDAA1c должны быть стандартом для определения фазы ремиссии СД1: (1) он учитывает дозы инсулина и метаболический контроль; (2) он показывает хорошую корреляцию с уровнями С-пептида; (3) он был подтвержден на больших когортах детей и подростков с СД1 [16]; (4) он был рекомендован Международным обществом педиатрического и подросткового диабета (ISPAD) [17].Согласно этому новому определению, фаза ремиссии T1D может быть предсказана у 61% через 3 месяца, у 44% через 6 месяцев и у 18% через 12 месяцев. Ранее определение этой стадии варьировалось в зависимости от дозы инсулина (от 0,3 до 0,5 МЕ / кг / день), которую разные авторы считали необходимой для правильного метаболического контроля, и в соответствии с уровнями HbA1c (6,5–7,0–7,5%). или 48–53–58 ммоль / моль), что свидетельствует о правильном метаболическом контроле [14]. Однако точное определение фазы медового месяца вызвало большую неопределенность.
Распространенность фазы ремиссии при СД1, выявленная в различных исследованиях, широко варьируется (30–80%), что частично отражает использование этих разных определений. Фаза медового месяца присутствует почти у 80% детей [18, 19] и предполагает некоторую оставшуюся функцию β-клеток после начала лечения инсулином и, вероятно, отражает попытку регенерации островков в благоприятных иммуномодулирующих условиях [20].
Было обнаружено, что несколько клинических и метаболических факторов влияют на частоту и продолжительность периода ремиссии, который частично зависит от восстановления функции β-клеток [21].Продолжительность этой стадии варьируется от недель до лет, в среднем 7 месяцев, и обычно она дольше у пациентов старше 5 лет [19]. В настоящее время прогнозирующая роль этой фазы неизвестна. Дети с умеренным / тяжелым диабетическим кетоацидозом при диагнозе СД1 с меньшей вероятностью войдут в фазу частичной ремиссии, а их фаза медового месяца короче [22]. Частичная ремиссия у детей младше 2 лет встречается редко, что указывает на более прогрессивное и быстрое разрушение β-клеток и меньшую остаточную секрецию инсулина на момент постановки диагноза [18].Наблюдательное исследование показало, что у мужчин с СД1 вероятность частичной ремиссии выше, чем у женщин (73 против 53%), а также в течение более длительного периода времени [23]; однако эти результаты не были воспроизведены. Также было высказано предположение, что тип лечения инсулином может влиять на продолжительность этой фазы. Было показано, что строгий гликемический контроль с помощью базального болюса [24] или инсулиновой помпы [25] продлевает фазу медового месяца.
Остаточная функция β-клеток может быть оценена путем измерения уровня С-пептида в сыворотке.Конверсия проинсулина приводит к эквимолярной продукции С-пептида и инсулина. Следовательно, С-пептид можно использовать для определения секреции эндогенного инсулина даже после начала инсулиновой терапии [26]. Концентрацию С-пептида можно оценить в базальном состоянии или стимулировать после внутривенной инъекции глюкагона или после стандартизированной смешанной еды [27]. Последний метод является наиболее широко используемым в клинических исследованиях и интервенционных исследованиях для мониторинга изменений функции β-клеток у пациентов с СД1, хотя необходимо достичь соглашения о стандартизации этого теста.Другими предлагаемыми биомаркерами функции β-клеток у человека являются уровни проинсулина в сыворотке или медиаторы стресса β-клеток, такие как соотношение проинсулин / С-пептид и измерение белка теплового шока 90 (Hsp90) [28].
Патогенетические механизмы, лежащие в основе частичной ремиссии СД1, недостаточно описаны. Было высказано предположение, что это, вероятно, связано с частичным восстановлением β-клеток с улучшенной выработкой эндогенного инсулина и изменениями периферической инсулинорезистентности из-за покоя β-клеток после начала терапии инсулином [14].Однако недавние исследования показали, что это объяснение кажется неполным [20, 29]. В настоящее время предполагается, что фаза медового месяца происходит из-за временного восстановления адаптивной иммунной толерантности, но не хватает надежных биомаркеров, которые могут отражать снижение аутоиммунной агрессии, позволяя репликацию β-клеток [30]. В этом сценарии будет увеличиваться секреция эндогенного инсулина, хотя уменьшение островковой глюкотоксической среды, благоприятное начало терапии инсулином, может способствовать улучшению функции оставшихся β-клеток.Основные черты этого интересного этапа суммированы в таблице 1. Однако необходимы дальнейшие исследования, чтобы определить метаболическое и иммунологическое значение фазы ремиссии СД1, особенно у детей.
Таблица 1.
Основные признаки фазы частичной ремиссии (медового месяца) у детей
Побочные повреждения фазы ремиссии T1D и новые предложенные биомаркеры
Благодаря попытке регенерации островков и местной иммунорегуляции, новые клетки, продуцирующие инсулин может возникнуть в фазе спонтанной ремиссии.Однако регенерация β-клеток может иметь двойную роль, то есть увеличивать выработку эндогенного инсулина, но способствовать высвобождению аутоантигенов, тем самым сохраняя порочный круг регенерации и аутоиммунитета, который хорошо соответствует предполагаемой рецидивирующей ремиттирующей природе СД1. Эти новые эпитопы могут усиливать аутоиммунную атаку, приводя к побочным повреждениям, которые уравновешивают иммунный ответ на разрушение β-клеток и окончательное отсутствие иммунологической толерантности к себе.
Фаза ремиссии вызвала большой интерес как возможная контрольная точка для терапевтических вмешательств при СД1, направленных на сохранение оставшихся β-клеток, а также на выявление субъектов с незначительным риском долгосрочных осложнений, связанных с диабетом.По этой причине на данном этапе необходимы биомаркеры. Некоторые метаболические биомаркеры учитывались при некоторых терапевтических вмешательствах [31]. Следовательно, необходимы надежные и специфические биомаркеры спонтанной ремиссии для выявления субъектов риска, для лучшего мониторинга этой стадии и для выполнения будущих иммунных вмешательств.
Известные факторы предрасположенности к развитию СД1 в основном генетические; следовательно, также могут быть гены предрасположенности к вступлению в фазу медового месяца.Недавнее исследование показало, что аллель рецептора простагландина EP4 (PTGER4) может быть связан с модуляцией ремиссии у пациентов с T1D [32]. Интересно, что это фактор риска других аутоиммунных заболеваний, таких как ревматоидный артрит или рассеянный склероз. Рецептор PTGER4 – один из 4 рецепторов простагландина E 2 – активирует регуляторные Т-лимфоциты [33] и подавляет аутоиммунный ответ в модели мышей NOD [34, 35]. Следовательно, это может быть вызвано противовоспалительным и иммуностимулирующим механизмом, который объяснит более длительную фазу медового месяца.
Помимо генетических маркеров для субъектов риска, существует интерес к определению иммунологических биомаркеров этой временной ремиссии, которая включает восстановление толерантности к β-клеткам. Эти биомаркеры могут быть полезны не только для подтверждения стадии метаболизма, но и в качестве репортеров иммунологического статуса в фазе ремиссии, которая может быть оптимальной стадией для иммунного вмешательства. Это было продемонстрировано эффективностью ритуксимаба (моноклонального антитела против CD20) в продлении стадии до 2 лет [36] и абатацепта (моноклонального антитела, которое блокирует костимулирующие молекулы CD80 и CD86, необходимые для активации Т-клеток). в снижении снижения функции β-клеток у пациентов с СД1 [37].Эти исследования противоречивы, так как они представляют собой иммунотерапию со значительными побочными эффектами, но демонстрируют эффект ингибирования аутоиммунитета на восстановление β-клеток и выработку эндогенного инсулина.
В связи с этим в настоящее время изучаются периферические биомаркеры, которые показывают иммунные нарушения во время фазы ремиссии. Полный иммунный фенотип этой стадии не идентифицирован, но новые данные указывают на интересные изменения. Поскольку T1D является заболеванием, опосредованным Т-клетками, ожидается, что различные субпопуляции Т-клеток будут модулировать аутоиммунную реакцию, что приведет к частичной ремиссии заболевания.Математическая модель предсказала, что начало T1D вызвано преобладанием Т-эффекторных лимфоцитов над Т-регуляторными лимфоцитами и что переход к фазе медового месяца со временем может быть вызван инверсией частот этих подгрупп [38]. В соответствии с этими результатами, количество островковых антиген-специфических клеток, продуцирующих IL-10 – важная клеточная субпопуляция при T1D – снижается в периферической крови у пациентов с T1D во время фазы ремиссии. Пациенты с большим количеством островковых продуцирующих IL-10 клеток на момент постановки диагноза были связаны с хорошим контролем уровня глюкозы.Следовательно, предполагается, что эти клетки могут предсказывать хорошие клинические исходы с помощью специфической регуляторной реакции [39, 40]. Интересно, что преобладающий профиль цитокинов IL-10 (и низкая секреция IFN-γ) в мононуклеарных клетках периферической крови наблюдался у 1 пациента с T1D с полной ремиссией, с сообщенной функцией β-клеток [41]. Более того, низкие концентрации IFN-γ в сыворотке крови в начале клинического проявления СД1 обеспечивают сильную положительную прогностическую ценность для частичной ремиссии [42]. Роль иммунорегуляторных факторов в фазе медового месяца также можно наблюдать по изменению частоты субпопуляций Т-клеток в периферической крови: CD4 + CD45R0 + Т-лимфоцитов памяти, активированных Т-регуляторных лимфоцитов и CD4 + CD25 + CD127 высокий (косвенно связанный с иммунорегуляцией) [43].Эти изменения тесно связаны с продолжительностью частичной ремиссии, контролем уровня глюкозы, толерантностью и функцией β-клеток. Другой признак Т-лимфоцитов, связанный с частичной ремиссией, – это повышенный апоптоз CD4 + CD25 высокий Т-лимфоцитов из периферической крови у пациентов с СД1 во время фазы ремиссии [44], предложенный в качестве меры ремиссии, связанной с подавляющим потенциалом этих лимфоцитов. клетки. Возможные предлагаемые новые биомаркеры для этой стадии СД1 представлены в таблице 2.
Таблица 2.
Предлагаемые новые биомаркеры для выявления стадии ремиссии
Эти данные предполагают, что стадия медового месяца является следствием генетической предрасположенности и иммунологических изменений, которые имеют место в микросреде островков, но проявляются на периферии, в основном в с точки зрения иммунорегуляторных субпопуляций Т-клеток и цитокинов. Однако необходимы дальнейшие исследования для определения надежных биомаркеров для клинического использования. Успех инновационных методов иммунотерапии в предотвращении и даже реверсии T1D будет зависеть от применения биомаркеров иммунорегуляции и регенерации, которые отражают терапевтическую эффективность в клинических испытаниях [45].Некоторые из вышеупомянутых биомаркеров (соотношение Т-клеток CD4 + к Т-клеткам CD8 + , IFN-γ и IL-6) уже используются в иммуноинтервенциях при T1D человека, таких как исследования по профилактике заболеваний и трансплантация островков, а также маркеры риска развития СД1 [46]. Однако существует много препятствий при внедрении иммунных биомаркеров, поскольку аутореактивные реакции в периферической крови редки или требуют манипуляций ex vivo. Инфильтрирующие островки клетки или системные признаки иммунорегуляции могут быть легко получены в экспериментальной модели болезни NOD, но требуют подтверждения для применения в терапии пациентов с СД1 из-за значительных различий как в врожденном, так и в адаптивном иммунитете [47].
Клинические перспективы: сила фазы ремиссии
Остается важный вопрос: можно ли продлить фазу ремиссии на длительный период времени или навсегда? Продолжительная фаза медового месяца (т.е. продолжающаяся несколько лет) и даже полная ремиссия СД1 описаны как необычные явления, особенно у детей [16, 48]. Хотя иммунологические изменения во время ремиссии плохо охарактеризованы [49], продление этой стадии может принести пользу пациентам с СД1, поскольку остаточная функция β-клеток связана со снижением долгосрочных и острых осложнений [50].Более того, фаза частичной ремиссии, по-видимому, является оптимальной стадией для внесения изменений в диету, иммунотерапию, регенеративную медицину или инновационные стратегии, направленные на сохранение и увеличение массы β-клеток у пациентов с T1D . Считается, что T1D может рецидивировать во время фазы медового месяца после восстановления самотолерантности, тем самым подавляя аутоиммунное разрушение. Это позволит восстановить массу β-клеток и увеличить секрецию эндогенного инсулина [51]. Результаты, полученные с экспериментальной моделью мышей NOD, показывают, что изменения в диете на этой стадии сохраняют массу β-клеток [52], что предполагает терапевтический потенциал в этой контрольной точке.Таким образом, фаза ремиссии представляет большой иммунологический и метаболический интерес, и ее характеристика может помочь идентифицировать пациентов с лучшим гликемическим контролем в будущем [39, 49] и меньшим количеством вторичных осложнений. Более того, эта стадия также может быть хорошей фазой для иммуномодуляции [53, 54].
Немногие исследования охарактеризовали эту стадию болезни, и еще меньше исследований изучали ее у детей. Поэтому его механизмы действия остаются неизвестными. Однако недавние результаты [39] указывают на иммунологические прогностические различия у пациентов, вступающих в эту стадию, которые могут коррелировать с развитием заболевания.Наша группа провела первое исследование транскриптома поджелудочной железы человека и островков диабетиков [55]. Одним из этих пациентов был 16-летний мальчик, умерший через 9 месяцев после начала заболевания. В поджелудочной железе этого мальчика наблюдались признаки иммунорегуляции, повышенная экспрессия регенерирующих генов и изменения воспаления и экспрессии генов врожденного иммунитета, что свидетельствовало о ремиттирующе-повторяющейся обратной связи [30]. Материнский микрохимеризм или наличие клеток материнского происхождения в поджелудочной железе у пациентов с СД1 может повлиять на частичную ремиссию; эти клетки обогащены инсулин-положительной фракцией и могут способствовать не только восстановлению тканей, но также аутоиммунитету или иммунорегуляции [56].Было бы интересно определить, коррелируют ли эти клетки с продолжительностью фазы ремиссии.
Предварительные данные указывают на необходимость изучения воспалительных, метаболических, иммунологических и регенеративных молекул, чтобы лучше понять и охарактеризовать спонтанную ремиссию СД1 у детей. Было бы большим клиническим подспорьем определить новые биомаркеры этой фазы, которые коррелируют с регенерацией β-клеток и индукцией иммунотолерантности, так как это облегчило бы иммуномониторинг будущих терапий, вводимых на этой стадии.С одной стороны, как и при других аутоиммунных заболеваниях, идентификация возможных изменений в субпопуляциях лейкоцитов [57, 58] во время ремиссии T1D может представлять собой надежный и простой биомаркер, отражающий клеточный иммунный процесс частичной ремиссии. С другой стороны, определение роли определенных молекул, связанных с аутоиммунитетом, воспалением, регенерацией и иммунорегуляцией во время фазы медового месяца, поможет понять механизмы, задействованные в этой фазе, и составить точные маркеры основного процесса.
Эта стадия частичной ремиссии болезни может помочь нам понять механизмы, с помощью которых β-клетки способны частично останавливать свое разрушение, хотя, возможно, уже поздно для иммуноинтервенции, направленной на обращение T1D. В идеале иммуно-вмешательство следует начинать на пресимптоматической стадии. Необходимы дальнейшие исследования, чтобы определить полезность фазы ремиссии как прогностического потенциала в развитии болезни и ее силу как возможный этап для применения будущих методов лечения.Таким образом, фаза медового месяца является этапом частичного восстановления массы β-клеток и обеспечивает интересную основу для разработки подходов к лечению СД1.
Благодарности
Авторы благодарны г-же Деборе Каллелл-Янг за ее помощь с грамматикой английского языка.
Заявление о раскрытии информации
У авторов нет финансовых конфликтов интересов, связанных с этой работой.
Источники финансирования
Наша работа в этой области финансировалась за счет гранта правительства Испании (FIS PI15 / 00198) и софинансировалась Европейскими фондами регионального развития (FEDER) Fundació La Marató de TV3 (28 / 201632-10) и программой CERCA / Generalitat de Catalunya.CIBER диабета и ассоциированных заболеваний обмена веществ (CIBERDEM) – это инициатива Instituto de Salud Carlos III. Наша работа была поддержана позитивными обсуждениями в сети A FACTT (Cost Action BM1305: www.afactt.eu). COST поддерживается Рамочной программой ЕС Horizon 2020.
Список литературы
- Stanescu DE, Lord K, Lipman TH: Эпидемиология диабета 1 типа у детей.Endocrinol Metab Clin North Am 2012; 41: 679–694.
- Tisch R, Yang XD, Singer SM, Liblau RS, Fugger L, McDevitt HO: Иммунный ответ на декарбоксилазу глутаминовой кислоты коррелирует с инсулитом у мышей с диабетом без ожирения. Nature 1993; 366: 72–75.
- Winer S, Tsui H, Lau A, Song A, Li X, Cheung RK, Sampson A, Afifiyan F, Elford A, Jackowski G, Becker DJ, Santamaria P, Ohashi P, Dosch HM: Аутоиммунное разрушение островков при спонтанном диабете 1 типа не является эксклюзивом для бета-клеток.Nat Med 2003; 9: 198–205.
- Ван Л., Ван Ф. С., Гершвин М. Е.: Аутоиммунные заболевания человека: всестороннее обновление. J Intern Med 2015; 278: 369–395.
- Мейер Дж. Дж., Бхушан А., Батлер А. Е., Рицца Р. А., Батлер П. К.: Устойчивый апоптоз бета-клеток у пациентов с давним диабетом 1 типа: косвенные доказательства регенерации островков? Диабетология 2005; 48: 2221–2228.
- Группа проекта DIAMOND: Заболеваемость и тенденции развития детского диабета 1 типа во всем мире, 1990–1999 гг. Диабет Мед 2006; 23: 857–866.
- Паттерсон С.К., Дьюрус Е., Розенбауэр Дж., Синек О, Ной А., Шобер Е., Парслоу Р.С., Йонер Дж., Свенссон Дж., Кастелл С., Бингли П.Дж., Шенле Е., Ярош-Чобот П., Урбонайте Б., Роте Ю., Кшисник С., Ionescu-Tirgoviste C, Weets I, Kocova M, Stipancic G, Samardzic M, de Beaufort CE, Green A, Dahlquist GG, Soltész G: Тенденции заболеваемости диабетом 1 типа в Европе в 1989–2008 гг. время в темпах увеличения.Диабетология 2012; 55: 2142–2147.
- Кондрашова А., Hyoty H: Роль вирусов и других микробов в патогенезе диабета 1 типа. Int Rev Immunol 2014; 33: 284–295.
- Heninger AK, Eugster A, Kuehn D, Buettner F, Kuhn M, Lindner A, Dietz S, Jergens S, Wilhelm C, Beyerlein A, Ziegler AG, Bonifacio E: дивергентная популяция аутоантиген-чувствительных CD4 + Т-клеток у младенцев до бета-клеточный аутоиммунитет.Sci Transl Med 2017; 9: eaaf8848.
- Мортенсен Х. Б., Свифт PGF, Холл Р. У., Хугард П., Хансен Л., Бьорндален Х., Де Бофор С. Е., Книп М.; Группа исследования детского диабета Hvidoere: многонациональное исследование у детей и подростков с впервые диагностированным диабетом типа 1: связь возраста, кетоацидоза, статуса HLA и аутоантител с остаточной функцией бета-клеток и гликемическим контролем через 12 месяцев после постановки диагноза.Педиатр Диабет 2010; 11: 218–226.
- Карьялайнен Дж., Салмела П., Илонен Дж., Сурсель Х. М., Книп М.: Сравнение детского и взрослого сахарного диабета I типа. N Engl J Med 1989; 320: 881–886.
- Ferguson SC, Blane A, Wardlaw J, Frier BM, Perros P, McCrimmon RJ, Deary IJ: Влияние раннего возраста диабета 1 типа на структуру мозга и когнитивные функции.Уход за диабетом 2005; 28: 1431–1437.
- Cato MA, Mauras N, Mazaika P, Kollman C, Cheng P, Aye T., Ambrosino J, Beck RW, Ruedy KJ, Reiss AL, Tansey M, White NH, Hershey T: продольная оценка когнитивных функций у маленьких детей с типом 1 сахарный диабет старше 18 месяцев. J Int Neuropsychol Soc 2016; 22: 293–302.
- Мортенсен Х. Б., Хугард П., Свифт П., Хансен Л., Холл Р. У., Хои Х., Бьорндален Х., де Бофор С., Кьярелли Ф., Данне Т., Шенле Э. Дж., Аман Дж; Исследовательская группа Хвидоэре по детскому диабету: новое определение периода частичной ремиссии у детей и подростков с диабетом 1 типа.Уход за диабетом 2009; 32: 1384–1390.
- Макс Андерсен М.Л., Хугард П., Порксен С., Нильсен Л. Б., Фредхейм С., Свенссон Дж., Томсен Дж., Викре-Йоргенсен Дж., Хертель Т., Петерсен Дж. С., Хансен Л., Мортенсен Г. Б. Определение частичной ремиссии: проверка на основе дозы инсулина. скорректированный HbA1c (IDAA1C) у 129 датских детей с впервые возникшим диабетом 1 типа.Педиатр Диабет 2014; 15: 469–476.
- Nagl K, Hermann JM, Plamper M, Schroder C, Dost A, Kordonouri O, Rami-Merhar B, Holl RW: Факторы, способствующие частичной ремиссии при диабете 1 типа: анализ, основанный на дозе инсулина HbA1c у 3657 детей и подростков из Германии и Австрии.Педиатр Диабет 2016, Epub впереди печати.
- Купер Дж. Дж., Халлер М. Дж., Зиглер А. Г., Книп М., Людвигссон Дж., Крейг М. Е.; Международное общество педиатрического и подросткового диабета: Консенсусные рекомендации ISPAD по клинической практике, 2014 г. Фазы диабета 1 типа у детей и подростков.Педиатр Диабет 2014; 15 (приложение 20): 18–25.
- Мухаммад Б.Дж., Свифт PGF, Раймонд Н.Т., Бота Дж.Л.: Фаза частичной ремиссии диабета у детей младше 10 лет. Арч Дис Детство 1999; 80: 367–369.
- Абдул-Расул М., Хабиб Х., Аль-Хоули М.: «Фаза медового месяца» у детей с сахарным диабетом 1 типа: частота, продолжительность и влияющие факторы.Педиатр Диабет 2006; 7: 101–107.
- Али Х., Готлиб П. Фаза медового месяца: пересечение метаболизма и иммунологии. Curr Opin Endocrinol Diabetes Obes 2009; 16: 286–292.
- Lombardo F, Valenzise M, Wasniewska M, Messina MF, Ruggeri C, Arrigo T., De Luca F: Двухлетняя проспективная оценка факторов, влияющих на частоту и продолжительность медового месяца у детей с инсулинозависимым сахарным диабетом: ключевая роль возраста в диагноз.Диабет Нутр Метаб 2002; 15: 246–251.
- Neylon OM, White M, O´Connell MA, Cameron FJ: Фаза частичной ремиссии HbA1c с корректировкой по дозе инсулина в педиатрической популяции – когда закончился медовый месяц? Диабет Мед 2013; 30: 627–628.
- Книп М., Пуукка Р., Каар М.Л., Акерблом Х.К .: Фаза ремиссии, эндогенная секреция инсулина и метаболический контроль у детей с диабетом.Acta Diabetol Lat 1982; 19: 243–251.
- Влияние интенсивной терапии на остаточную функцию бета-клеток у пациентов с диабетом 1 типа в исследовании контроля и осложнений диабета. Рандомизированное контролируемое исследование. Исследовательская группа по контролю диабета и его осложнениям.Ann Intern Med 1998; 128: 517–523.
- Thrailkill KM, Moreau CS, Swearingen C, Rettiganti M, Edwards K, Morales AE, Kemp SF, Frindik JP, Fowlkes JL: Помповая инсулиновая терапия, начатая во время постановки диагноза: влияние на гликемический контроль и функцию бета-клеток поджелудочной железы при типе 1 сахарный диабет.Диабет Технол Тер 2011; 13: 1023–1030.
- Джонс А.Г., Хаттерсли А.Т.: Клиническая полезность измерения С-пептида при лечении пациентов с диабетом. Диабет Мед 2013; 30: 803–817.
- Cernea S, Raz I, Herold KC, Hirshberg B., Roep BO, Schatz DA, Fleming GA, Pozzilli P, Little R, Schloot NC, Leslie RD, Skyler JS, Palmer JP; Семинар D-Cure: Проблемы в разработке конечных точек для интервенционных исследований диабета 1 типа.Diabetes Metab Res Rev 2009; 25: 694–704.
- Watkins RA, Evans-Molina C, Terrell JK, Day KH, Guindon L, Restrepo IA, Mirmira RG, Blum JS, DiMeglio LA: проинсулин и белок теплового шока 90 как биомаркеры бета-клеточного стресса в раннем периоде после появления типа 1 сахарный диабет.Transl Res 2016; 168: 96–106.e101.
- Krogvold L, Skog O, Sundström G, Edwin B, Buanes T, Hanssen KF, Ludvigsson J, Grabherr M, Korsgren O, Dahl-Jørgensen K: Функция изолированных островков поджелудочной железы у пациентов в начале диабета 1 типа: секреция инсулина может быть восстанавливается через несколько дней в недиабетогенной среде in vitro: результаты исследования DiViD.Диабет 2015; 64: 2506–2512.
- фон Херрат М., Санда С., Херольд К.: Диабет 1 типа как ремиттирующее заболевание? Nat Rev Immunol 2007; 7: 988–994.
- Insel RA, Dunne JL, Atkinson MA, Chiang JL, Dabelea D, Gottlieb PA, Greenbaum CJ, Herold KC, Krischer JP, Lernmark A, Ratner RE, Rewers MJ, Schatz DA, Skyler JS, Sosenko JM, Ziegler AG: предварительная стадия диабет 1 типа: научное заявление JDRF, Эндокринного общества и Американской диабетической ассоциации.Уход за диабетом 2015; 38: 1964–1974.
- Moosavi M, Séguin J, Polychronakos C: Влияние локусов риска аутоиммунитета на фазу медового месяца при диабете 1 типа. Педиатр Диабет 2016, Epub впереди печати.
- Барателли Ф, Линь И, Чжу Л., Ян С.К., Хойз-Вурч Н, Зенг Г., Реккамп К., Дохадвала М., Шарма С., Дубинетт С.М.: Простагландин Е2 индуцирует экспрессию гена FOXP3 и функцию Т-регуляторных клеток в CD4 + Т-клетках человека .J Immunol 2005; 175: 1483–1490.
- Hancock WW, Polanski M, Zhang J, Blogg N, Weiner HL: Подавление инсулита у мышей с диабетом без ожирения (NOD) пероральным введением инсулина связано с селективной экспрессией интерлейкина-4 и -10, трансформирующих фактор роста-бета, и простагландин-E.Am J Pathol 1995; 147: 1193–1199.
- Pujol-Autonell I, Ampudia RM, Planas R, Marin-Gallen S, Carrascal J, Sanchez A, Marin A, Puig-Domingo M, Pujol-Borrell R, Verdaguer J, Vives-Pi M: эффероцитоз оказывает подавляющее действие на дендритные клетки через производство простагландина E2 в контексте аутоиммунитета.PLoS One 2013; 8: e63296.
- Куродзуми А., Окада Ю., Арао Т., Миядзаки Ю., Йошикава М., Торимото К., Кубо С., Накаямада С., Танака Ю.: Защитный эффект ритуксимаба на поджелудочную железу при остром диабете типа 1 в период медового месяца: отчет о клиническом случае. Endocrinol Diabetes Metab Case Rep 2016; 2016: 160020.
- Орбан Т., Банди Б., Беккер Д. Д., ДиМеллио Л. А., Гительман С. Е., Голанд Р., Готлиб П. А., Гринбаум С. Джей, Маркс Дж. Б., Монзави Р., Моран А., Пикман М., Раскин П., Рассел В. Е., Шатц Д., Уэрретт Д. К., Уилсон Д. М. , Krischer JP, Skyler JS: Модуляция костимуляции абатацептом у пациентов с недавно начавшимся диабетом 1 типа: наблюдение через 1 год после прекращения лечения.Уход за диабетом 2014; 37: 1069–1075.
- Джабери-Доураки М., Пьетропаоло М., Хадра А.: Модель континуума авидности Т-клеток: понимание аутореактивных и регуляторных реакций Т-клеток при диабете 1 типа. J Theor Biol 2015; 383: 93–105.
- Санда С., Роеп Б.О., фон Херрат М.: островковые антиген-специфические иммунные ответы IL-10 +, но не клетки CD4 + CD25 + FoxP3 + при диагностике, предсказывают гликемический контроль при диабете 1 типа.Clin Immunol 2008; 127: 138–143.
- Arif S, Tree TI, Astill TP, Tremble JM, Bishop AJ, Dayan CM, Roep BO, Peakman M: Аутореактивные Т-клеточные ответы демонстрируют провоспалительную поляризацию при диабете, но регуляторный фенотип в состоянии здоровья. J Clin Invest 2004; 113: 451–463.
- Каргес Б., Дуринович-Белло I., Хайнце Э., Дебатин К.М., Бем Б., Каргес В.: Иммунологические механизмы, связанные с длительной ремиссией диабета типа 1 человека.Diabetes Metab Res Rev 2006; 22: 184–189.
- Ализаде Б.З., Ханифи-Могхаддам П., Эрлай П., ван дер Слик А.Р., Колб Х., Хараджитсингх А.В., Перейра Ариас А.М., Ронкайнен М., Книп М., Бонфанти Р., Бонифачо Э., Девендра Д., Уилкин Т., Гипхарт М.Дж., Келеман Б.П., Нолсо Р., Мандруп Поулсен Т., Шлут, Северная Каролина, Роэп Б.О. Исследовательская группа DIABMARKER: Ассоциация генотипов гамма-интерферона и интерлейкина 10 и сывороточных уровней с частичной клинической ремиссией при диабете 1 типа.Clin Exp Immunol 2006; 145: 480–484.
- Мойя Р., Робертсон Х. К., Пейн Д., Нарсале А., Козиол Дж.; Исследовательская группа TrialNet по диабету 1 типа, Дэвис Дж. Д.: пилотное исследование, показывающее связь между частотой подмножеств клеток памяти CD4 (+) при постановке диагноза и продолжительностью частичной ремиссии при диабете 1 типа.Clin Immunol 2016; 166–167: 72–80.
- Глизич-Милосавлевич С., Ваукау Дж., Джайлвала П., Яна С., Кху Х. Дж., Альбертц Х., Вудлифф Дж., Коппен М., Алемзаде Р., Хагопиан В., Гош С. У пациентов с диабетом типа 1 из группы риска и недавно возникшего повышенный апоптоз у фракция CD4 + CD25 + (высокий уровень) Т-клеток.PLoS One 2007; 2: e146.
- Рекерс Н.В., фон Херрат М.Г., Уэсли Дж. Д.: Иммунотерапия и иммунные биомаркеры при диабете 1 типа: партнерство для достижения успеха. Clin Immunol 2015; 161: 37–43.
- Thorsen SU, Pipper CB, Eising S, Skogstrand K, Hougaard DM, Svensson J, Pociot F: Уровни адипонектина, интерлейкина-10 и интерлейкина-12 у новорожденных связаны с риском развития диабета 1 типа в детстве и подростковом возрасте: общенациональный Дэн Иш исследование случай-контроль.Clin Immunol 2017; 174: 18–23.
- Mestas J, Hughes CC: О мышах, а не о людях: различия между иммунологией мыши и человека. J Immunol 2004; 172: 2731–2738.
- Поццилли П., Манфрини С., Баззетти Р., Лампетер Э, Леув И.Д., Яфуско Д., Приско М., Ионеску-Тырговиште С., Колускова С., Линн Т., Людвигссон Дж., Мадачи Л., Мрозикевич А.С., Мрозикевич П.М., Подар Й. Vialettes B, Visalli N, Yilmaz T, Browne PD: Исследование уровня глюкозы в ремиссии (GETREM) при диабете 1 типа: европейское многоцентровое исследование.Клиническая практика диабета, 2005; 68: 258–264.
- Cutfield SW, Derraik JGB, Reed PW, Hofman PL, Jefferies C, Cutfield WS: Ранние маркеры гликемического контроля у детей с сахарным диабетом 1 типа. PLoS One 2011; 6: e25251.
- Стеффес М.В., Сибли С., Джексон М., Томас В.: Функция бета-клеток и развитие связанных с диабетом осложнений в исследовании контроля и осложнений диабета.Уход за диабетом 2003; 26: 832–836.
- Акирав Э., Кушнер Дж., Герольд К.К .: Бета-клеточная масса и диабет 1 типа: идет, идет, уходит? 2008; 57: 2883–2888.
- Kagohashi Y, Otani H: Диета с низким соотношением n-6 / n-3 незаменимых жирных кислот, начатая сразу после начала явного диабета, продлевает выживаемость мышей NOD модели диабета 1 типа.Congenit Anom 2010; 50: 226–231.
- Chatenoud L, Warncke K, Ziegler A-G: Клинические иммунологические вмешательства для лечения диабета 1 типа. Cold Spring Harb Perspect Med 2012; 2: a007716.
- Gu W, Hu J, Wang W, Li L, Tang W, Sun S, Cui W, Ye L, Zhang Y, Hong J, Zhu D, Ning G: Диабетический кетоацидоз на момент постановки диагноза влияет на полную ремиссию после лечения трансплантацией гемопоэтических стволовых клеток. у подростков с сахарным диабетом 1 типа.Уход за диабетом 2012; 35: 1413–1419.
- Planas R, Carrillo J, Sanchez A, Ruiz de Villa MC, Nuñez F, Verdaguer J, James RFL, Pujol-Borrell R, Vives-Pi M: Профили экспрессии генов поджелудочной железы человека и очищенных островков при диабете 1 типа: новые результаты при клиническом начале и при длительном диабете.Clin Exp Immunol 2010; 159: 23–44.
- Йе Дж, Вивес-Пи М., Гиллеспи К.М.: Материнский микрохимеризм: повышен в инсулино-положительном компартменте поджелудочной железы диабета 1 типа, но не в инфильтрирующих иммунных клетках или реплицирующихся островковых клетках. PLoS One 2014; 9: e86985.
- Appay V, van Lier RAW, Sallusto F, Roederer M: Фенотип и функция субпопуляций человеческих Т-лимфоцитов: консенсус и проблемы.Cytometry A 2008; 73: 975–983.
- Maecker HT, McCoy JP, Nussenblatt R: Стандартизация иммунофенотипирования для проекта иммунологии человека. Нат Рев Иммунол 2012; 12: 191–200.
Автор Контакты
Marta Vives-Pi
Отделение иммунологии, Немецкий научно-исследовательский институт Триас-и-Пухоль
Carretera Canyet s / n
ES – 08916 Бадалона (Испания)
Электронная почта mvives @ igtp.кошка
Подробности статьи / публикации
Предварительный просмотр первой страницы
Поступила: 23 марта 2017 г.
Принята: 20 июня 2017 г.
Опубликована онлайн: 3 августа 2017 г.
Дата выпуска: ноябрь 2017 г.
Количество страниц для печати: 9
Количество рисунков: 1
Количество столов: 2
ISSN: 1663-2818 (печатный)
eISSN: 1663-2826 (онлайн)
Для дополнительной информации: https: // www.karger.com/HRP
Авторские права / Дозировка препарата / Заявление об ограничении ответственности
Авторские права: Все права защищены. Никакая часть данной публикации не может быть переведена на другие языки, воспроизведена или использована в любой форме или любыми средствами, электронными или механическими, включая фотокопирование, запись, микрокопирование, или с помощью какой-либо системы хранения и поиска информации, без письменного разрешения издателя. .
Дозировка лекарства: авторы и издатель приложили все усилия, чтобы гарантировать, что выбор и дозировка лекарства, указанные в этом тексте, соответствуют текущим рекомендациям и практике на момент публикации.Тем не менее, ввиду продолжающихся исследований, изменений в правительственных постановлениях и постоянного потока информации, касающейся лекарственной терапии и реакций на них, читателю настоятельно рекомендуется проверять листок-вкладыш для каждого препарата на предмет любых изменений показаний и дозировки, а также дополнительных предупреждений. и меры предосторожности. Это особенно важно, когда рекомендованным агентом является новый и / или редко применяемый препарат.
Отказ от ответственности: утверждения, мнения и данные, содержащиеся в этой публикации, принадлежат исключительно отдельным авторам и соавторам, а не издателям и редакторам.Появление в публикации рекламы и / или ссылок на продукты не является гарантией, одобрением или одобрением рекламируемых продуктов или услуг или их эффективности, качества или безопасности. Издатель и редактор (-ы) не несут ответственности за любой ущерб, причиненный людям или имуществу в результате любых идей, методов, инструкций или продуктов, упомянутых в контенте или рекламе.
границ | Фаза ремиссии при диабете 1 типа: роль ректификации гипергликемии в иммунной модуляции
Введение
Сахарный диабет 1 типа (СД1) – это аутоиммунное Т-клеточное повреждение β-клеток поджелудочной железы, ведущее к абсолютному дефициту эндогенного инсулина.Из-за необратимости ухудшения функции β-клеток необходимо непрерывное лечение экзогенным инсулином (1). Восстановить функцию β-клеток пациента и стать инсулино-независимым – это высшая цель, которую ученые преследовали на протяжении десятилетий. Фактически, первичной конечной точкой интервенционного исследования СД1 является защита функции β-клеток. Было испробовано много попыток и стратегий; некоторые достигли значительного прогресса в иммунотерапии, но лечение СД1 по-прежнему остается сложной задачей (2).
В процессе болезни у некоторых пациентов бывает особый период с временным восстановлением функции β-клеток, который называется фазой ремиссии или «периодом медового месяца» (3).Концепция «фазы ремиссии» была впервые описана Jackson et al. (4). Они наблюдали быстрое снижение потребности в экзогенном инсулине у детей с диабетом после регулярного лечения инсулином, и в этот период частым явлением был гипогликемический шок. В 1944 г. Браш (5) дал более конкретное описание этого явления. Эксперименты на животных также доказали, что гипергликемия является основным фактором, способствующим развитию диабета, а ранняя коррекция гипергликемии способствует восстановлению функции островков (6, 7).Несколько последующих исследований подтвердили, что лечение инсулином приводит к сохранению остаточной функции β-клеток (8, 9).
Фаза ремиссии – это короткая «стадия клинического излечения», которая представляет собой достойную человеческую модель для изучения защиты β-клеток и иммунной модуляции. Углубленные исследования механизмов этого периода могут заложить основу для подавления аутоиммунного ответа и даже для достижения клинического излечения от СД1. Фундаментальным патофизиологическим изменением фазы ремиссии является временное восстановление функции β-клеток (10).Точные механизмы все еще не определены, но одним из общепризнанных механизмов является то, что коррекция «глюкотоксичности» с помощью экзогенной инсулиновой терапии приводит к покою β-клеток. Недавние данные свидетельствуют о том, что устранение гипергликемии может защищать функцию β-клеток другими путями, такими как индукция иммунной модуляции (11, 12). Последнее исследование показало, что фаза ремиссии сопровождалась изменениями частоты регуляторных Т-клеток (T reg), CD25 + CD127 hi клеток, Т-клеток памяти, Th2-клеток, субпопуляций B-клеток, нейтрофилов и др. иммунные клетки (13).Помимо иммунных клеток, к фазе ремиссии могут быть связаны различные клеточные воспалительные факторы и молекулы, связанные с иммунитетом. В этом обзоре будут обсуждаться возможные механизмы иммунной модуляции фазы ремиссии с точки зрения клеточного, воспалительного и молекулярного уровней, а основное внимание будет уделено гликометаболизму в иммунных клетках.
Иммунные клетки
Подмножества Т-клеток
Частота некоторых субпопуляций Т-клеток тесно связана с фазой ремиссии, и эта корреляция может частично объясняться хорошим гликемическим контролем.Moya et al. (14) обнаружили, что высокая частота активированных Treg-клеток (aTreg), CD45RO + Т-клеток памяти и CD25 + CD127 hi клеток у пациентов с СД1 имеет положительную корреляцию с продолжительностью фазы ремиссии, и эти корреляции существовали только при условии удовлетворительного гликемического контроля. Исследование, проведенное в 2018 году, также показало, что фаза ремиссии сопровождалась динамическими изменениями в Treg-клетках, подмножествах Th2- и Tc1-клеток (13), с уменьшением количества Treg-клеток и увеличением Th2 и Tc1-клеток в конце фазы ремиссии.Недавнее исследование, в котором изучались различные субпопуляции иммунных клеток и клеточные молекулы у детей с впервые поставленным диагнозом СД1, показало, что уровень Т-клеток, регулирующих память (mTreg), снижался после появления клинических симптомов, а количество клеток aTreg и Th27 значительно повышалось в первый год от начала заболевания (часто наступает фаза ремиссии) (15). Было также отмечено, что mTregs положительно коррелируют с С-пептидом у пациентов с СД1 (16). Свидетельства очевидных динамических изменений Treg на разных стадиях фазы ремиссии предполагают, что иммунный ответ во время фазы ремиссии, скорее всего, был связан с частотой и функцией Treg.
Treg-клетки (CD4 + CD25 + Т-клетки) играют решающую роль в индукции и поддержании периферической толерантности (17-19). Было обнаружено, что дисфункция Treg-клеток является одним из ключевых патогенеза аутоиммунного диабета (20, 21). Есть одно исследование, которое показало, что присутствие Tregs в преобладании Teff является основной причиной фазы ремиссии (22). Принимая во внимание решающую роль метаболизма глюкозы в функции Т-клеток, ожидалось, что выпрямление гипергликемии может быть триггером доминирования Treg в фазе ремиссии.
Еще в 2008 году Maciver et al. (23) обнаружили, что энергия, поставляемая глюкозой, необходима Т-клеткам для поддержания роста, пролиферации и иммунной активности. Т-клетки не могут продуцировать соответствующие цитокины, такие как IFN-γ, для оказания иммунного эффекта без адекватного поглощения глюкозы (23). Это говорит о том, что иммунная функция Т-клеток требует нормального состояния метаболизма глюкозы. Treg-клетки также участвовали в метаболизме глюкозы в многочисленных исследованиях (24, 25). Недавнее исследование показало, что процессы роста и дифференцировки Treg и Th27 в значительной степени зависят от гликолиза и аэробного фосфорилирования (26).В этом отношении, хотя прямых доказательств нет, рационально сделать вывод, что быстрое устранение гипергликемии на начальной стадии СД1 может помочь восстановить нарушенную функцию Treg-клеток и подавить иммунный ответ, который характеризуется фазой ремиссии. Действительно, в исследовании Moya R частые изменения aTreg, CD25 + CD127 hi клеток и клеток памяти CD45RO + коррелировали с лучшим контролем уровня глюкозы в крови (14), что может служить косвенным доказательством того, что это гипотеза.
Помимо Treg, о других подгруппах Т-клеток в фазе ремиссии меньше сообщается. В ранее упомянутом исследовании Мойя показал, что частота клеток CD25 + CD127 hi значимо коррелировала с частотой aTregs. Таким образом, можно предположить, что хороший гликемический контроль может также восстановить функцию клеток CD25 + CD127 hi , которые способствуют развитию клеток Tr1 через сигнальные пути CD44 и CD44v6 (14). Было также продемонстрировано, что Tr1 и Т-клетки памяти подавляют аутореактивное воспаление (27, 28), но их роль в фазе ремиссии до сих пор не сообщалась.
Подмножества B-клеток
Недавние исследования показали, что В-лимфоциты также играют незаменимую роль в патогенезе аутоиммунного диабета (29, 30). Исследование показало, что изменение частоты B-клеток маргинальной зоны (MZB), фолликулярных B-клеток (FoB) и других субпопуляций B-клеток было связано с TIDM, а регуляторные B-клетки (Breg) обладают иммуномодулирующим действием (30). Ограниченные сообщения показали, что фаза ремиссии сопровождалась изменением частоты B-клеток (13, 15).Было также показано, что метаболизм глюкозы играет важную роль в нормальном функционировании В-клеток. Следовательно, можно предположить, что устранение гипергликемии во время фазы ремиссии влияет на частоту B-клеток.
Исследования взаимосвязи между субпопуляциями В-клеток и фазой ремиссии проводятся редко. В 2018 году Фитас и др. (13) обнаружили, что абсолютное количество и относительная частота В-клеток значительно снизились во время течения заболевания по сравнению с начальной стадией и достигли самого низкого уровня в фазе ремиссии.Недавнее исследование показало, что количество клеток Breg значительно увеличилось во время фазы ремиссии (15). Кроме того, исследование показало, что применение ритуксимаба, моноклонального антитела к CD20, может увеличить продолжительность фазы ремиссии до 2 лет (31). Эти объединенные результаты свидетельствуют о том, что В-лимфоциты участвуют в патогенезе фазы ремиссии.
Среди всех субпопуляций B-клеток субпопуляция Breg с иммуномодулирующими эффектами является горячей точкой для исследований. Исследование на животных показало, что субпопуляции Breg, которые секретируют IL-10 (CD1d hi CD5 + , B10), могут эффективно ингибировать пролиферацию эффекторных Т-клеток и снижать снижение функции β-клеток за счет секретного IL-10 (32). .Клетки Breg были увеличены на ранней стадии восстановления СД1 (15), а подгруппа B10 положительно коррелировала с уровнем С-пептида натощак и отрицательно коррелировала с HbA1c пациентов с СД1 (30). Данные свидетельствуют о том, что субпопуляции B-клеток участвуют в процессе фазы ремиссии. Кроме того, сообщалось, что клетки B10 могут снижать опосредованное Т-клетками отторжение трансплантата островковых клеток, способствуя развитию Treg-клеток и ингибируя провоспалительную активность Th2-клеток (33). Учитывая эту ситуацию, очень важно исследовать эффекты и механизмы, возможные для субпопуляций B10-клеток в фазе ремиссии.
В настоящее время исследования метаболизма глюкозы и иммунных клеток в основном сосредоточены на Т-клетках и макрофагах. Исследования взаимосвязи между В-клетками и метаболизмом глюкозы проводятся редко. Исследование in vitro показало, что фактор активации B-лимфоцитов, липополисахарид и рецептор B-клеток быстро ускоряют захват глюкозы и гликолиз, что обеспечивает быструю энергию для пролиферации клеток (34). Кроме того, Кодзима и др. (35) сообщили, что индуцируемые гипоксией факторы играют роль в повышении регуляции гликолиза во время развития В-клеток.Кроме того, индуцируемый гипоксией фактор-1α играет решающую роль в размножении клеток B10 и экспрессии IL-10 (36). Предполагается, что регуляция энергетического метаболизма В-клеток имеет важное значение для его развития и функционирования. Следовательно, устранение гипергликемии может влиять на нормальную функцию субпопуляций B-клеток и участвовать в процессе иммуномодуляции фазы ремиссии. Однако соответствующих исследований пока нет.
Другие иммунные клетки
Помимо Т и В-клеток, другие иммунные клетки, такие как естественные киллеры (NK), моноциты и нейтрофилы, также могут участвовать в фазе ремиссии СД1.Fitas et al. (13) сообщили, что количество нейтрофилов и NK-клеток было значительно снижено в начале TIDM и начало восстанавливаться в период ремиссии, а низкий процент NK-клеток и высокий процент нейтрофилов положительно коррелировали с продолжительностью фазы ремиссии. . Количество мононуклеарных клеток также уменьшилось после начала СД1 и достигло надира в первый год (15). Эти изменения иммунных клеток в периферической крови предполагают активную экстравазацию к тканям-мишеням, вероятно, способствуя подавлению аутоиммунного ответа (16).
Цитокины
Роль провоспалительных и противовоспалительных цитокинов в патогенезе СД1 известна давно. Многочисленные цитокины были протестированы как возможные биомаркеры фазы ремиссии. Команда Хвидоэре обнаружила, что Th2-связанные хемокины CCL5 снижались у пациентов с ремиссией и положительно коррелировали с HbA1c, тогда как CCL3 увеличивались у этих пациентов, но отрицательно коррелировали с С-пептидом (37). Кроме того, у пациентов во время фазы ремиссии снижались уровни IFN-γ и TGF-β, а высокие уровни IL-10 сопровождались хорошим гликемическим контролем (15, 38, 39).Однако сообщалось о некоторых противоречивых результатах, и было показано, что провоспалительный ИЛ-6 повышен в фазе ремиссии, при этом продемонстрирована положительная корреляция с гликемическим контролем (40). Когда разные цитокины были взяты вместе и определены пациенты в соответствии с несколькими цитокинами, то есть пациенты с низким ответом, которые не обнаружили никаких противовоспалительных (IL-4, IL-10 и IL-13) и провоспалительных факторов (TNF). -α) и пациентов с высоким ответом, по крайней мере, с одним обнаруженным цитокином, было обнаружено, что пациенты с низким ответом имели более высокие уровни С-пептида и более длительную ремиссию, чем пациенты с высоким ответом (13), что предполагает подавление провоспалительного процесса в фазе ремиссии.
Метаболизм глюкозы вовлечен в паттерн изменения цитокинов. Растворимый рецептор интерлейкина-7 (ИЛ-7) α (sCD127), экспрессируемый на поверхности Т-клеток, в сочетании с ИЛ-7 оказывает антагонистическое действие на сигнальный путь ИЛ-7 и пролиферацию Т-клеток, опосредованную ИЛ-7 ( 41). Стоит отметить, что гипергликемия привела к образованию гликозилированной формы sCD127, которая оказалась неэффективной в качестве антагониста IL-7, а гликозилированный sCD127 был обнаружен у пациентов с TIDM (42), что предоставило новые доказательства того, что гипергликемия регулирует иммунную сеть, воздействуя на иммунные молекулы. .
Иммунные молекулы
Роль ингибирующих иммунных молекул, таких как CTLA4, имеет решающее значение в патогенезе TIDM. В последнее время внимание в области запрограммированной гибели клеток-1 (PD-1), трансмембранного гликопротеина, принадлежащего к семейству CD28 / CTLA4, которое действует как важная иммуносупрессивная молекула, которая экспрессируется в основном на активированных Т- или В-клетках, вновь привлекает внимание. СД1, а также в онкологии (43). Было показано, что инфильтрация аутоиммунного островкового воспаления и островковых антиген-реактивных Т-клеток усиливается, когда PD-1 или PD-L1 блокируются (44).PD-1 / PD-L1 в качестве терапевтической мишени может эффективно ингибировать аутоиммунный Т-клеточный ответ у мышей с диабетом без ожирения и обратного диабета (23). Широкое применение терапии антителами PD-1 / PD-L1 является эпохальным событием в области онкологии, но их побочные эффекты в качестве индуцированного ингибитором PD-1 СД1 побудили нас изучить роль PD-1 / PD- L1 при СД1 и его возможное участие в фазе ремиссии. Примечательно, что экспрессия PD-L1 на β-клетках может облегчить аутоиммунные атаки и противостоять разрушению, опосредованному T-клетками (45, 46), что делает PD-L1 потенциальным биомаркером для распознавания β-клеток, которые сопротивляются иммунной атаке.В этом смысле представляет особый интерес изучить, может ли экспрессия PD-1 / PD-L1 иммунных клеток и β-клеток быть предиктором возникновения и продолжительности фазы ремиссии.
Иммуногенность островковых β-клеток
Исследование показало, что некоторые β-клетки могут выжить долгое время без иммунной атаки за счет снижения экспрессии связанных с диабетом антигенов IGRP, Chga, Gad1 и Ins1 / Ins2 (46). Это говорит о том, что изменения антигенности β-клеток играют важную роль в процессе иммунной деструкции.Влияние глюкозы в крови на иммуногенность β-клеток давно задокументировано, а гипергликемическая среда может стимулировать экспрессию антигена (47–49). Новое исследование показало, что резидентные макрофаги в островках могут поглощать β-внутриклеточные инсулинсодержащие гранулы через его филоподиальные и представлять пептиды инсулина инсулино-реактивным Т-клеткам, а презентация антигена увеличивалась после стимуляции высоким содержанием глюкозы у мышей с диабетом без ожирения ( 50). Skowera et al. (51) показали, что экспрессия сигнальных эпитопов клеточно-специфического проинсулиногена (ИПП) увеличивалась при длительных гипергликемических концентрациях, что приводило к усилению гибели клеток CD8 + Т-клетками, специфичным для ИПП, и ускорению гибели β-клеток.Соответственно, после лечения инсулином наблюдалось значительное снижение экспрессии аутоантигенов β-клеток (52, 53). В совокупности считается, что коррекция «глюкотоксичности» во время фазы ремиссии может подавлять иммунный ответ за счет снижения иммуногенности β-клеток.
Обсуждение
Таким образом, пациенты в фазе ремиссии сопровождались изменениями частоты различных клеток и иммунных молекул, включая увеличение aTreg, Th27, Breg и нейтрофильных клеток в различной степени, снижение B-клеток, NK-клеток, IFN-γ и снижение иммуногенности β-клеток, отчасти из-за устранения гипергликемии.Между тем, продолжительность фазы ремиссии также связана с различными клетками и молекулами, такими как aTreg, CD25 + CD127 hi клетки, CD45RO + клетки памяти, нейтрофилы и IL-10, которые положительно коррелируют. , а также NK-клетки и некоторые воспалительные молекулы (IL-4, IL-10, IL-13 и TNF-γ), которые имеют отрицательную корреляцию (Таблица 1). Возникновение фазы ремиссии зависит от иммунной модуляции, а также от покоя β-клеток, и устранение гипергликемии, вероятно, является основной причиной этого иммунного изменения.Хотя точные механизмы не ясны, можно предположить, что контроль гипергликемии важен не только для покоя β-клеток, но также имеет жизненно важное влияние на различные иммунные компоненты. Лучшим способом вмешательства при СД1 может быть сочетание строгого гликемического контроля с иммунным вмешательством для защиты функций β-клеток как можно раньше и как можно дольше.
Таблица 1 . Иммунологические изменения на разных стадиях фазы ремиссии.
Несмотря на то, что существует несколько опубликованных исследований фазы ремиссии СД1 (54, 55), обзоры, посвященные механизмам иммуномодуляции путем ректификации гипергликемии, отсутствуют.Наш обзор имеет определенную силу в предоставлении всестороннего обзора и новых доказательств взаимодействия между метаболизмом глюкозы и иммунной регуляцией по множеству аспектов, таких как иммунные клетки, воспалительные цитокины, биомолекулы и антигенность клеток. Следует подчеркнуть важность иммунного гликометаболизма в патогенезе фазы ремиссии.
Авторские взносы
Рукопись написанаRT. TZ внесла свой вклад в раздел цитокинов и иммунных молекул. CW просмотрел часть ссылок.XL предоставил идеи. ZZ отполировал статью.
Финансирование
Эта работа была поддержана Национальной программой ключевых исследований и разработок Китая (гранты № 2016YFC1305000, 2016YFC1305001 и 2017YFC1309604) и Фондом естественных наук провинции Хунань, Китай (грант № 2019JJ40419).
Конфликт интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Список литературы
1. Ли Х, Ченг Дж., Чжоу З. Пересмотр нескольких моделей прогрессирования потери функции β-клеток при диабете 1 типа: значение для профилактики и лечения. Дж Диабет . (2016) 8: 460–9. DOI: 10.1111 / 1753-0407.12376
PubMed Аннотация | CrossRef Полный текст | Google Scholar
2. Аткинсон М.А., Роэп Б.О., Посгай А., Уиллер DCS, Пикман М. Проблема модуляции аутоиммунитета β-клеток при диабете 1 типа. Ланцет Диабет Эндокринол. (2019) 7: 52–64. DOI: 10.1016 / S2213-8587 (18) 30112-8
PubMed Аннотация | CrossRef Полный текст | Google Scholar
3. Чжун Т., Тан Р., Гонг С., Ли Дж., Ли Х, Чжоу З. Фаза ремиссии при диабете 1 типа: изменение эпидемиологии, определений и возникающих иммунометаболических механизмов. Diabetes Metab Res Rev. . (2019) 2019: e3207. DOI: 10.1002 / dmrr.3207
CrossRef Полный текст | Google Scholar
4. Джексон Р.Л., Бойд Д.Д., Смит Т.Е. Стабилизация диабетического ребенка. Proc Soc Exp Biol Med Soc Exp Biol Med. (1940) 157: 610–4.
Google Scholar
5. Кисть JM. Первоначальная стабилизация у ребенка-диабетика. Am J Dis Child. (1944) 67: 429–44. DOI: 10.1001 / archpedi.1944.02020060002001
CrossRef Полный текст | Google Scholar
6. Лучший чемпион, Campbell J, Haist RE. Влияние экстрактов передней доли гипофиза на содержание инсулина в поджелудочной железе. J Physiol. (1939) 97: 200–6. DOI: 10.1113 / jphysiol.1939.sp003799
PubMed Аннотация | CrossRef Полный текст | Google Scholar
7. Лукенс ФДВ, Дохан ФК. Морфологическое и функциональное восстановление островков поджелудочной железы у кошек с диабетом, получавших инсулин. Наука . (1940) 92: 222–3. DOI: 10.1126 / science.92.2384.222
PubMed Аннотация | CrossRef Полный текст | Google Scholar
9. Shah SC, Malone JI, Simpson NE. Рандомизированное исследование интенсивной инсулинотерапии при впервые выявленном инсулинозависимом сахарном диабете. N Engl J Med. (1989) 320: 550–4. DOI: 10.1056 / NEJM1983200902
PubMed Аннотация | CrossRef Полный текст | Google Scholar
10. Чобот А., Стомпор Дж., Шида К., Соколовска М., Дея Дж., Поланска Дж. И др. Фаза ремиссии у детей с диагнозом диабет 1 типа в 2012–2013 гг. В Силезии, Польша: обсервационное исследование. Детский диабет . (2019) 20: 286–92. DOI: 10.1111 / pedi.12824
PubMed Аннотация | CrossRef Полный текст | Google Scholar
11.Фонолледа М., Мурильо М., Васкес Ф., Бел Дж., Вивес-Пи М. Фаза ремиссии при педиатрическом диабете 1 типа: новое понимание и новые биомаркеры. Hormone Res Paediatr. (2017) 88: 307–15. DOI: 10.1159 / 000479030
PubMed Аннотация | CrossRef Полный текст | Google Scholar
13. Фитас А.Л., Мартинс С., Боррего Л.М., Лопес Л., Йорнс А., Лензен С. и др. Структура иммунных клеток и цитокинов у детей с сахарным диабетом 1 типа, находящихся в фазе ремиссии: продольное исследование. Детский диабет. (2018) 19: 963–71. DOI: 10.1111 / pedi.12671
PubMed Аннотация | CrossRef Полный текст | Google Scholar
14. Моя Р., Робертсон Х. К., Пейн Д., Нарсейл А., Козиол Дж., Дэвис Дж. Д.. Пилотное исследование, показывающее связь между частотой подмножеств клеток памяти CD4 (+) при постановке диагноза и продолжительностью частичной ремиссии при диабете 1 типа. Clin Immunol. (2016) 166–167: 72–80. DOI: 10.1016 / j.clim.2016.04.012
PubMed Аннотация | CrossRef Полный текст | Google Scholar
15.Вильяльба А., Фонолледа М., Мурильо М., Родригес-Фернандес С., Ампудиа Р.М., Перна-Баррулл Д. и др. При частичной ремиссии и ранних стадиях детского диабета 1 типа наблюдаются иммунорегуляторные изменения. Пилотное исследование. Transl Res. (2019) 210: 8–25. DOI: 10.1016 / j.trsl.2019.03.002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
16. Орас А., Пит А., Гизе Т., Тиллманн В., Уибо Р. Исследование 51 подтипа иммунных клеток периферической крови у недавно диагностированных молодых пациентов с диабетом 1 типа. Clin Exp Immunol. (2019) 198: 57–70. DOI: 10.1111 / cei.13332
PubMed Аннотация | CrossRef Полный текст | Google Scholar
17. Мбонге Дж. С., Роусон Дж., Гарсия П. А., Гонсалес Н., Кобб Дж., Кандил Ф. и др. Обращение вспять впервые возникшего диабета типа 1 с помощью пероральной комбинированной терапии на основе сальмонелл, опосредованной регуляторными Т-клетками у мышей NOD. Front Immunol. (2019) 10: 320. DOI: 10.3389 / fimmu.2019.00320
PubMed Аннотация | CrossRef Полный текст | Google Scholar
18.Ли З, Ши Х, Лю Дж, Шао Ф, Хуанг Дж, Чжоу З и др. Артесунат предотвращает диабет 1 типа у мышей NOD в основном за счет индукции защитных Т-клеток, продуцирующих ИЛ-4, и регуляторных Т-клеток. FASEB J. (2019) 33: 8241–8. DOI: 10.1096 / fj.201
6RPubMed Аннотация | CrossRef Полный текст | Google Scholar
19. Виисанен Т., Газали А.М., Ихантола Е.Л., Экман И., Нанто-Салонен К., Вейола Р. и др. Компартмент регуляторных Т-клеток FOXP3 + изменяется у детей с впервые диагностированным диабетом типа 1, но не у детей из группы риска с положительной реакцией на антитела. Front Immunol. (2019) 10:19. DOI: 10.3389 / fimmu.2019.00019
CrossRef Полный текст | Google Scholar
20. Паттерсон С.Дж., Пезенакер А.М., Ван А.Ю., Гиллис Дж., Моджибиан М., Моришита К. и др. Продукция хемокинов регуляторных Т-клеток опосредует привлечение и подавление патогенных Т-клеток. J Clin Invest. (2016) 126: 1039–51. DOI: 10.1172 / JCI83987
PubMed Аннотация | CrossRef Полный текст | Google Scholar
21. Аттиас М., Аль-Обода Т., Пичкирилло, Калифорния.Механизмы развития и функционирования клеток FoxP3 (+) treg человека при здоровье и болезнях. Клин Эксперимент Иммунол . (2019) 197: 36–51. DOI: 10.1111 / cei.13290
PubMed Аннотация | CrossRef Полный текст | Google Scholar
22. Джабери-Дураки М., Пьетропаоло М., Хадра А. Модель континуума авидности Т-клеток: понимание аутореактивных и регуляторных Т-клеточных ответов при диабете 1 типа. J. Theor Biol. (2015) 383: 93–105. DOI: 10.1016 / j.jtbi.2015.07.032
PubMed Аннотация | CrossRef Полный текст | Google Scholar
23.Maciver NJ, Jacobs SR, Wieman HL, Wofford JA, Coloff JL, Rathmell JC. Метаболизм глюкозы в лимфоцитах – это регулируемый процесс, оказывающий значительное влияние на функцию и выживаемость иммунных клеток. J Leukocyte Biol. (2008) 84: 949–57. DOI: 10.1189 / jlb.0108024
PubMed Аннотация | CrossRef Полный текст | Google Scholar
24. Анжелин А., Гиль-де-Гомес Л., Дахия С., Цзяо Дж., Го Л., Левин М. Х. и др. Foxp3 перепрограммирует метаболизм Т-клеток для функционирования в средах с низким содержанием глюкозы и высоким содержанием лактата. Cell Metab. (2017) 25: 1282–93.e7. DOI: 10.1016 / j.cmet.2016.12.018
PubMed Аннотация | CrossRef Полный текст | Google Scholar
26. Клакстон Д., Петраска А., Моран Б., Флетчер Дж. М.. Дифференциальная регуляция treg и Th27 клеток человека путем синтеза жирных кислот и гликолиза. Front Immunol. (2019) 10: 115. DOI: 10.3389 / fimmu.2019.00115
PubMed Аннотация | CrossRef Полный текст | Google Scholar
27. Яо Й., Вент-Шмидт Дж., МакГео М.Д., Вонг М., Хоффман Х.М., Штайнер Т.С. и др.Клетки Tr1, но не регуляторные Т-клетки Foxp3 +, подавляют активацию воспаления NLRP3 посредством IL-10-зависимого механизма. Дж. Иммунол . (2015) 195: 488–97. DOI: 10.4049 / jimmunol.1403225
CrossRef Полный текст | Google Scholar
28. Guarda G, Dostert C, Staehli F, Cabalzar K, Castillo R, Tardivel A, et al. Т-клетки подавляют врожденный иммунный ответ за счет ингибирования инфламмасом NLRP1 и NLRP3. Природа . (2009) 460: 269–73. DOI: 10.1038 / nature08100
PubMed Аннотация | CrossRef Полный текст | Google Scholar
29.Хабиб Т., Лонг С.А., Самуэльс П.Л., Брахмандам А., Татум М., Функ А. и др. Динамические иммунные фенотипы В- и Т-хелперов отмечают различные стадии прогрессирования СД1. Диабет . (2019) 68: 1240–50. DOI: 10.2337 / db18-1081
PubMed Аннотация | CrossRef Полный текст | Google Scholar
30. Дэн Ц., Сян И, Тан Т., Рен З, Цао Ц, Хуанг Дж. И др. Измененные субпопуляции периферических B-лимфоцитов при диабете 1 типа и латентном аутоиммунном диабете у взрослых. Уход за диабетом. (2016) 39: 434–40.DOI: 10.2337 / dc15-1765
PubMed Аннотация | CrossRef Полный текст | Google Scholar
31. Куродзуми А., Окада Ю., Арао Т., Миядзаки Ю., Йошикава М., Торимото К. и др. Защитный эффект поджелудочной железы ритуксимаба при остром диабете 1 типа в период медового месяца: клинический случай. Эндокринол, метаболизм диабета, отчет (2016) 2016: 160020. DOI: 10.1530 / EDM-16-0020
PubMed Аннотация | CrossRef Полный текст | Google Scholar
33. Цинь И, Чжан М., Цзян Р.М., Ву Цюй, Сюй Си, Чен Х и др.Клетки B10 играют роль в иммунной модуляции про- и противовоспалительных иммунных ответов при отторжении островкового аллотрансплантата мыши. Cell Immunol. (2016) 310: 184–92. DOI: 10.1016 / j.cellimm.2016.09.010
PubMed Аннотация | CrossRef Полный текст | Google Scholar
35. Кодзима Х., Кобаяси А., Сакураи Д., Канно Й., Хасе Х., Такахаши Р. и др. Требование стадии дифференцировки в гликолитическом пути, регулируемом гипоксией, индуцируемым фактором-1α, во время развития В-клеток мышей в костном мозге. Дж. Иммунол . (2010) 184: 154–63. DOI: 10.4049 / jimmunol.0800167
PubMed Аннотация | CrossRef Полный текст | Google Scholar
36. Мэн Х, Гротч Б., Ло И, Кнауп К.Х., Визенер М.С., Чен ХХ и др. Индуцируемый гипоксией фактор-1α является критическим фактором транскрипции для В-клеток, продуцирующих ИЛ-10, при аутоиммунном заболевании. Nat Commun. (2018) 9: 251. DOI: 10.1038 / s41467-017-02683-x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
37.Пфлегер С., Каас А., Хансен Л., Ализаде Б., Хугард П., Холл Р. и др. Связь циркулирующих концентраций лигандов хемокинового рецептора CCR5 с С-пептидом, проинсулином и HbA1c и прогрессированием заболевания при диабете 1 типа. Клин Иммунол . (2008) 128: 57–65. DOI: 10.1016 / j.clim.2008.03.458
PubMed Аннотация | CrossRef Полный текст | Google Scholar
38. Ализаде Б.З., Ханифи-Могхаддам П., Эрлай П., ван дер Слик А.Р., Колб Х., Хараджитсингх А.В. и др. Связь генотипов интерферона-гамма и интерлейкина 10 и сывороточных уровней с частичной клинической ремиссией при диабете 1 типа. Клин Эксперимент Иммунол . (2006) 145: 480–4. DOI: 10.1016 / j.clim.2006.04.465
PubMed Аннотация | CrossRef Полный текст | Google Scholar
39. Каргес Б., Дуринович-Белло И., Хайнце Э., Дебатин К.М., Бём Б., Каргес В. Иммунологические механизмы, связанные с длительной ремиссией диабета типа 1 человека. Diabetes Metab Res Rev. . (2006) 22: 184–9. DOI: 10.1002 / dmrr.600
PubMed Аннотация | CrossRef Полный текст | Google Scholar
40. Пфлегер С., Мортенсен Х.Б., Хансен Л., Гердер С., Роэп Б.О., Хои Х. и др.Связь IL-1ra и адипонектина с С-пептидом и ремиссия у пациентов с диабетом 1 типа. Диабет . (2008) 57: 929–37. DOI: 10.2337 / db07-1697
PubMed Аннотация | CrossRef Полный текст | Google Scholar
41. Монти П., Скирполи М., Маффи П., Гидоли Н., Де Таддео Ф., Бертуцци Ф. и др. Трансплантация островков у пациентов с аутоиммунным диабетом индуцирует гомеостатические цитокины, которые увеличивают аутореактивные Т-клетки памяти. Дж. Клин Инвест . (2008) 118: 1806–14.DOI: 10.1172 / JCI35197
PubMed Аннотация | CrossRef Полный текст | Google Scholar
42. Монти П., Бригатти С., Красманн М., Циглер А.Г., Бонифачо Э. Концентрация и активность растворимой формы рецептора интерлейкина-7 α при диабете 1 типа определяет взаимодействие между гипергликемией и иммунной функцией. Диабет . (2013) 62: 2500–8. DOI: 10.2337 / db12-1726
PubMed Аннотация | CrossRef Полный текст | Google Scholar
43. Паукен К.Е., Дженкинс М.К., Азума М., Файф БТ.PD-1, но не PD-L1, экспрессируемый реактивными по отношению к островкам CD4 + Т-клетками, подавляет инфильтрацию поджелудочной железы во время диабета 1 типа. Диабет . (2013) 62: 2859–69. DOI: 10.2337 / db12-1475
CrossRef Полный текст | Google Scholar
44. Ансари М.Дж., Салама А.Д., Читнис Т., Смит Р.Н., Ягита Х., Акиба Х. и др. Путь запрограммированной смерти-1 (PD-1) регулирует аутоиммунный диабет у мышей без ожирения (NOD). J Exp Med . (2003) 198: 63–9. DOI: 10.1084 / jem.20022125
PubMed Аннотация | CrossRef Полный текст | Google Scholar
45.Colli ML, Hill JLE, Marroqui L, Chaffey J, Dos Santos RS, Leete P и др. PDL1 экспрессируется в островках у людей с диабетом 1 типа и активируется интерферонами-α и -γ посредством индукции IRF1. EBioMedicine . (2018) 36: 367–75. DOI: 10.1016 / j.ebiom.2018.09.040
PubMed Аннотация | CrossRef Полный текст | Google Scholar
46. Руи Дж., Дэн С., Арази А., Пердигото А.Л., Лю З., Херольд К.С. Бета-клетки, которые сопротивляются иммунологической атаке, развиваются во время прогрессирования аутоиммунного диабета у мышей NOD. Cell Metab. (2017) 25: 727–38. DOI: 10.1016 / j.cmet.2017.01.005
PubMed Аннотация | CrossRef Полный текст | Google Scholar
47. Buschard K, Brogren CH, Ropke C, Rygaard J. Экспрессия антигена бета-клеток поджелудочной железы зависит от их функционального состояния, как показано с помощью специфического крысиного моноклонального антитела IC2. APMIS: Acta Pathologica, Microbiologica, et Immunologica Scandinavica . (1988) 96: 342–6. DOI: 10.1111 / j.1699-0463.1988.tb05313.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
48.Бьорк Э., Кампе О., Карлссон Ф.А., Пайплеерс Д.Г., Андерссон А., Хеллерстром С. и др. Глюкозная регуляция аутоантигена GAD65 в островках поджелудочной железы человека. Дж Клин Эндокринол Метаб . (1992) 75: 1574–6. DOI: 10.1210 / jcem.75.6.1464667
PubMed Аннотация | CrossRef Полный текст | Google Scholar
49. Hagopian WA, Karlsen AE, Petersen JS, Teague J, Gervassi A, Jiang J, et al. Регулирование экспрессии аутоантигена диабета декарбоксилазы глутаминовой кислоты в высокоочищенных изолированных островках Macaca nemestrina. Эндокринол . (1993) 132: 2674–81. DOI: 10.1210 / endo.132.6.8504767
PubMed Аннотация | CrossRef Полный текст | Google Scholar
50. Zinselmeyer BH, Vomund AN, Saunders BT, Johnson MW, Carrero JA, Unanue ER. Резидентные макрофаги в островках поджелудочной железы мышей постоянно исследуют свою местную среду, захватывая гранулы бета-клеток и частицы крови. Диабетология . (2018) 61: 1374–83. DOI: 10.1007 / s00125-018-4592-4
PubMed Аннотация | CrossRef Полный текст | Google Scholar
51.Сковера А., Эллис Р. Дж., Варела-Кальвино Р., Ариф С., Хуанг Г. К., Ван-Кринкс С. и др. ЦТЛ нацелены на уничтожение бета-клеток у пациентов с диабетом 1 типа посредством распознавания регулируемого глюкозой эпитопа препроинсулина. Дж. Клин Инвест . (2008) 118: 3390–402. DOI: 10.1172 / jci35449
PubMed Аннотация | CrossRef Полный текст | Google Scholar
52. Браун Р.Дж., Ротер К.И. Влияние покоя бета-клеток на функцию бета-клеток: обзор клинических и доклинических данных. Детский диабет .(2008) 9: 14–22. DOI: 10.1111 / j.1399-5448.2007.00272.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
53. Марре М.Л., Джеймс Э.А., Пиганелли Д.Д. Бета-клеточный стресс ER и последствия для иммуногенности при диабете 1 типа. Биология развития передней клетки . (2015) 3:67. DOI: 10.3389 / fcell.2015.00067
PubMed Аннотация | CrossRef Полный текст | Google Scholar
54. Четан М. Р., Чарльтон М. Х., Томпсон К., Диас Р. П., Эндрюс Р. К., Нарендран П.«Медовый месяц» диабета 1 типа у мужчин, которые занимаются спортом, в пять раз дольше: исследование случай-контроль. Диабетическая медицина . (2019) 36: 127–8. DOI: 10.1111 / dme.13802
PubMed Аннотация | CrossRef Полный текст | Google Scholar
55. Моосави М., Сегин Дж., Полихронакос С. Влияние локусов аутоиммунного риска на фазу медового месяца при диабете 1 типа. Детский диабет . (2017) 18: 459–62. DOI: 10.1111 / pedi.12421
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Что на самом деле означает ремиссия рака?
Если вам поставили диагноз «рак», вы, вероятно, надеетесь услышать от врача слово «ремиссия».«Это знаменует собой важный поворот в вашем уходе и долгосрочном здоровье. Но это сложнее, чем просто лечить.
Существует два типа ремиссии:
- Частичная ремиссия означает, что рак все еще существует, но ваша опухоль уменьшилась – или при таких формах рака, как лейкемия, у вас меньше рака по всему телу. Некоторые врачи советуют пациентам рассматривать свой рак как «хронический», как болезнь сердца. Это то, что вам нужно будет проверить.Если у вас частичная ремиссия, это может означать, что вы можете сделать перерыв в лечении до тех пор, пока рак не начнет снова расти.
- Полная ремиссия означает, что анализы, медицинские осмотры и сканирование показывают, что все признаки рака исчезли. Некоторые врачи также называют полную ремиссию «отсутствием признаков заболевания (NED)». Это не значит, что вы излечились.
Продолжение
Для обоих типов ремиссии уменьшение или отсутствие признаков рака должно длиться не менее одного месяца.
Врачи не могут знать, что все раковые клетки в вашем теле исчезли, поэтому многие врачи не используют слово «вылечены». Если раковые клетки действительно возвращаются, это обычно происходит в течение 5 лет после первого диагноза и лечения.
Что такое «рецидив»
Некоторые раковые клетки могут оставаться незамеченными в организме в течение многих лет после лечения. Если рак возвращается после ремиссии, это называется «рецидивом». Рак может повториться в том же месте, где он был первоначально диагностирован, или он может повториться в другой части тела.Беспокоиться о том, что это случится с вами, – это нормально. Все ситуации индивидуальны, и невозможно предсказать, что произойдет.
Ваш врач или медицинский центр будут продолжать проверять наличие признаков рака или проблем со здоровьем, связанных с вашим лечением. Очень важно пройти все рекомендованные обследования, даже если у вас нет симптомов. Последующее наблюдение может включать медицинские осмотры, анализы крови и визуализационные тесты.
Что такое фаза медового месяца при диабете 1 типа?
После того, как вам поставили диагноз диабета 1 типа – в детстве или во взрослом возрасте – вы можете вступить в период, когда ваши симптомы улучшатся.Вы можете слышать, как ваш врач назвал это «фазой медового месяца».
Как и настоящий медовый месяц, диабетическая версия не длится вечно. Но пока вы в нем, вам может быть легче контролировать уровень сахара в крови.
Как начинается фаза медового месяца
При диабете 1 типа ваша иммунная система – защита организма от микробов – дает осечку. Он разрушает
бета-клеток в поджелудочной железе, которые вырабатывают инсулин – гормон, который помогает вашему телу накапливать сахар для получения энергии.
Без бета-клеток ваш запас инсулина падает, а уровень сахара в крови повышается.Чтобы добиться нужного уровня сахара в крови, вам нужно вводить инсулин через инъекцию или через помпу.
У большинства людей с диабетом 1 типа после постановки диагноза есть период времени, когда оставшиеся бета-клетки могут выкачивать достаточно инсулина, чтобы контролировать уровень сахара в крови. Это фаза медового месяца. Пока это длится, вам может не понадобиться принимать такое количество инсулина.
Причины этого?
По мере того как ваша иммунная система разрушает бета-клетки и они выделяют меньше инсулина, уровень сахара в крови повышается.Обычно симптомы диабета 1 типа начинаются, когда у вас остается только 30% бета-клеток. Это может быть, когда вам впервые поставят диагноз и вы начнете принимать инсулин.
Около 60% людей с диабетом 1 типа вступают в фазу медового месяца вскоре после постановки диагноза. В этот период ваша поджелудочная железа продолжает производить новые бета-клетки, а старые умирают. Эти бета-клетки вырабатывают достаточно инсулина, чтобы контролировать уровень сахара в крови.
Частичная ремиссия по сравнению с полной ремиссией
Уровень сахара в крови должен быть стабильнее во время фазы медового месяца.У вас будет меньше качелей вверх и вниз. И вы можете снизить дозу инсулина.
Большинство людей, вступающих в фазу медового месяца, находятся в «частичной ремиссии», что означает, что вам все еще нужно принимать инсулин, чтобы контролировать уровень сахара в крови.
У очень небольшого количества людей наступает «полная ремиссия». Они могут перестать принимать инсулин или другие лекарства от диабета, потому что их поджелудочная железа вырабатывает достаточно инсулина для удовлетворения потребностей их организма.
Как долго это длится?
Фаза медового месяца обычно начинается примерно через 3 месяца после начала лечения диабета 1 типа.Это может длиться от 1 месяца до 13 лет. Продолжительность медового месяца у каждого человека разная.
По прошествии времени и гибели большего количества бета-клеток поджелудочная железа вырабатывает меньше инсулина. Когда станет труднее контролировать уровень сахара в крови, вам нужно будет увеличить дозу инсулина.
Что делать во время медового месяца?
Фаза медового месяца не означает, что вы излечились или что у вас никогда не было диабета. Даже если у вас нормальный уровень сахара в крови, вашему организму все равно нужен инсулин.И ваша поджелудочная железа может быть не в состоянии вырабатывать его в достаточном количестве, чтобы контролировать уровень сахара в крови.
Трудно предсказать, сколько инсулина вырабатывает поджелудочная железа во время фазы медового месяца. В результате уровень сахара в крови может колебаться вверх и вниз.
Вам нужно будет проверять уровень сахара в крови несколько раз в день. Ваш врач скажет вам, как часто проводить анализы. Они могут посоветовать вам скорректировать дозу инсулина в зависимости от уровня сахара в крови, вашего рациона и того, сколько вы тренируетесь.
Влияет ли фаза медового месяца на ваш диабет в будущем?
Фаза медового месяца улучшает контроль сахара в крови в краткосрочной перспективе.Это также может снизить ваши шансы получить в будущем осложнения диабета, такие как:
Можно ли продлить фазу медового месяца?
Вы можете кое-что сделать, чтобы остаться в фазе медового месяца на более длительное время. Регулярные тренировки могут помочь. В одном исследовании период медового месяца длился в пять раз дольше у людей, которые занимались спортом после того, как им поставили диагноз.
Витамин D также может замедлять повреждение поджелудочной железы, хотя это не было доказано. Чем меньше повреждений, тем дольше медовый месяц.
Есть надежда, что однажды у нас появятся лекарства, которые не позволят иммунным клеткам атаковать поджелудочную железу. В ходе клинических испытаний исследователи изучают способы сбросить иммунный ответ и остановить медовый месяц.
Частичная ремиссия (фаза медового месяца) при сахарном диабете 1 типа
Частичная ремиссия (фаза медового месяца) при сахарном диабете 1 типа
Стр. 1-20 (20)
DOI: 10.2174 / 9781681084459117040004Автор (ы): Сасигарн А.Боуденское отделение эндокринологии, отделение педиатрии, Национальная детская больница / Государственный университет Огайо, штат Огайо 43205, США.
Место работы:
Абстрактные
Фаза частичной ремиссии («медовый месяц») при диабете 1 типа (СД1) – это характеризуется снижением потребности в экзогенном инсулине, которое начинается вскоре после начало инсулинотерапии у впервые диагностированных лиц.В некоторых случаях инсулин Требуемая доза значительно снижена до почти полного отсутствия при сохранении близкой к норме гликемический контроль. Результаты исследования контроля диабета и его осложнений указывают на то, что что сохранение остаточной функции β-клеток связано не только с уменьшением долгосрочные клинические микрососудистые и макрососудистые осложнения, а также уменьшение острых такие осложнения, как гипогликемия или диабетический кетоацидоз. Был недавний возобновился интерес к частичной ремиссии, потому что она предлагает уникальную возможность для фармакологическое вмешательство, направленное на полное прекращение дальнейшего процесса разрушения β-клетки, или лучше всего для регенерации β-клеток и, таким образом, сохранения эндогенного инсулина секреция.В этом обзоре обобщены текущие знания о частичной ремиссии при СД1, а также о том, как для определения частичной ремиссии по клиническим критериям и измерениям С-пептида, обзоры факторов, связанных с частичной ремиссией, и предоставляет обновленную информацию о вмешательствах для сохранить функцию β-клеток, чтобы способствовать или продлить фазу частичной ремиссии.
Ключевые слова:
Сахарный диабет 1 типа, детский диабет, частичная ремиссия, β-клетки, Cпептид.
Частичная клиническая ремиссия сахарного диабета 1 типа у детей: клиническое применение и проблемы с определениями
ВВЕДЕНИЕ
Был проведен поиск литературы для выявления публикаций, посвященных фазе медового месяца у детей с сахарным диабетом 1 типа (СД1).Поиск в Medline, EMBASE и Ovid проводился с использованием следующих поисковых терминов: «клиническая ремиссия», «частичная ремиссия», «частичная клиническая ремиссия», «фаза медового месяца», «С-пептид», «диабет 1 типа», «дети». , «детский диабет 1 типа» и «педиатрический диабет 1 типа». Девять статей были исключены из-за нечеткого определения частичной клинической ремиссии.
ОБЗОР И ОПРЕДЕЛЕНИЕ ЧАСТИЧНОЙ КЛИНИЧЕСКОЙ РЕМИССИИ У ДЕТЕЙ С САХАРНЫМ ДИАБЕТОМ 1 ТИПА
Ключевым ограничением раннего ведения СД1 является отсутствие единой стратегии предотвращения ранней дисгликемии у лиц, не отправляющих денежные переводы; это дети и подростки, не прошедшие фазу медового месяца или фазу частичной клинической ремиссии (ПЦР) заболевания. 1-4 СД1 – это заболевание стойкой гипергликемии, возникающее в результате аутоиммунного разрушения β-клеток поджелудочной железы. 5,6 ПЦР часто следует за диагнозом СД1, и эта фаза отмечена повышенной функциональностью выживших β-клеток с повышенной выработкой эндогенного инсулина. 4,7 ПЦР обычно длится 3–12 месяцев; 8 Однако недавние исследования показали доказательства продукции С-пептида и, следовательно, остаточной функции β-клеток через> 5 лет после постановки диагноза СД1. 9 С-пептид секретируется с инсулином из β-клеток поджелудочной железы и представляет собой суррогатный маркер остаточной функции β-клеток. В физиологических концентрациях С-пептид действует, улучшая как кровоток микрососудов, так и функцию эндотелия микрососудов за счет высвобождения эндотелиального оксида азота. 10 После постановки диагноза СД1 концентрация С-пептида в сыворотке сначала экспоненциально падает, а затем наступает стабильная фаза снижения, которая может длиться несколько лет. 9 Наличие остаточной эндогенной секреции инсулина у пациентов с СД1 связано со снижением риска тяжелой гипогликемии, 11,12 развития диабетической ретинопатии, 13 увеличения естественного роста у детей препубертатного возраста, 14 и улучшение долгосрочного гликемического контроля. 2,15 Эти результаты были недавно подтверждены продолжительным исследованием, в котором сообщалось о значительном снижении риска хронических микрососудистых осложнений при 7-летнем наблюдении у молодых людей, перенесших ПЦР. 2
Хотя отправители денежных переводов имеют общее долгосрочное прогностическое преимущество по сравнению с лицами, не отправляющими денежные переводы, эта дихотомия редко принимается во внимание на ранней стадии лечения диабета, поскольку не существует конкретной стратегии предотвращения ранней дисгликемии у лиц, не отправляющих денежные переводы, что является ключевым фактором. ограничение раннего ведения СД1 у детей. 1-4 Исследования в этой области в первую очередь были сосредоточены на увеличении продолжительности ПЦР у отправителей. Обзор этих исследований показал различные выводы из-за тяжелого профиля побочных эффектов некоторых агентов, 16-20 недостаточных доз других экспериментальных агентов, 21,22 и, что более важно, нестандартизации схем инсулина. 16,17,21,22 во время этих вмешательств, что ослабило эффект экспериментальных агентов.Иммуномодулирующий подход является многообещающим, но испытанные схемы не имеют достаточной пользы, чтобы оправдать риск. 16,17 Трансплантация аутологичных гемопоэтических стволовых клеток, 19 Подход, который останавливает аутоиммунное разрушение целевой ткани и восстанавливает толерантность, имеет огромный потенциал у тщательно отобранных пациентов, у которых он привел к ремиссии в течение> 3,5 лет в лучшие случаи. Однако его эффект основан на существовании функциональных β-клеток и поэтому не будет эффективен у лиц, не отправляющих деньги. 23 Что еще более важно, его многочисленные побочные эффекты, включая алопецию, фебрильную нейтропению, тошноту, de novo аутоиммунитет, инфекции и смерть, 20 ограничили его широкое распространение. С другой стороны, добавка витамина D безопасна и может замедлить прогрессирование СД1, 21,22 , но в существующих исследованиях есть предостережения, препятствующие широкому применению этой рекомендации. В настоящее время проводится рандомизированное контрольное исследование, в котором оценивается влияние приема умеренно высоких доз витамина D на продолжительность ПЦР; его результаты будут опубликованы в 2021 году. 24 Поэтому крайне важно понимать уникальные недостатки лиц, не получающих денежные переводы, чтобы гарантировать, что они защищены от метаболических нарушений на ранней стадии и сопутствующих долгосрочных осложнений СД1.
Распространенность без ремиссии у детей с сахарным диабетом 1 типа
Введение в 2009 г. золотого стандарта определения ПЦР – HbA1c с поправкой на дозу инсулина (IDAA1c) – позволило достичь консенсуса по оценке ПЦР. 8 Согласно последним исследованиям, распространенность ПЦР у детей и подростков составляет примерно 50%. 2,4,25,26 Это означает, что значительная часть детей и подростков с диагнозом СД1 не будет проходить ПЦР. 1,27-29
Механизмы отсутствия ремиссии
Молекулярные механизмы, лежащие в основе ремиссии или отсутствия ремиссии, полностью не охарактеризованы; однако определенные факторы играют ключевую роль, включая повышенный уровень β-клеток, неблагоприятный профиль цитокинов 30 , повышенную концентрацию глюкагона 31 , 32 и роль иммунных медиаторов и генетических маркеров.Повышенная деформация β-клеток характеризуется плохой переработкой проинсулина, поскольку было показано, что у детей мужского пола с избыточным весом, которые с большей вероятностью претерпевают ремиссию, улучшается переработка проинсулина. 30 Кроме того, сообщается, что ремиттеры обладают отличительным цитокиновым профилем с меньшим повреждающим действием на β-клетки. 31 Ремиттеры также имеют более низкую концентрацию глюкагона, открытие, которое согласуется с предположением о том, что производство глюкагона подавляется внутриостровковой выработкой и высвобождением инсулина. 32 В исследовании, предполагающем ключевую роль иммунных механизмов в ПЦР 33 , сообщается о значительно более низких концентрациях IFN-γ у ремиттеров по сравнению с теми, кто не ремитирует, и в контроле. Более высокая частота CD4 + CD25 + CD127 hi клеток, нерегулирующего подмножества Т-клеток памяти Т-клеток, коррелировала с более медленной скоростью прогрессирования СД1, 34,35 подтверждая гипотезу защитного роль иммунных медиаторов для ПЦР. Moya et al. 35 сообщил, что комбинация частоты клеток CD4 + CD25 + CD127 hi с гликемическими маркерами во время диагностики TIDM может служить в качестве предиктора продолжительности ПЦР.В аналогичном исследовании сообщается, что самые высокие уровни апоптоза Т-клеток CD4 + CD25 + hi наблюдаются у субъектов либо с впервые возникшим СД1, либо с повышенным количеством аутоантител, связанных с диабетом. 36 Другое исследование показало, что увеличение количества островковых антиген-специфичных IL-10-продуцирующих клеток у субъектов с впервые возникшим TIDM коррелировало с улучшением гликемического контроля, в то время как повышенная экспрессия FoxP3 у аналогичных субъектов предсказывала худший результат. 37 Генетическое исследование 38 показало, что уровень циркулирующей микроРНК has-miR-197-3p через 3 месяца после постановки диагноза СД1 был надежным предиктором остаточной функции β-клеток через 1 год после постановки диагноза. .Таким образом, совокупность генетических, иммунных, гормональных и воспалительных факторов позволяет прогнозировать возникновение и продолжительность ремиссии или отсутствия ремиссии.
Недостатки единственного внимания к детерминантам ремиссии за счет отсутствия ремиссии
Решение сосредоточить этот обзор на детерминантах клинической отсутствия ремиссии было основано на настоятельной необходимости смены парадигмы в подходе к ведению детей с впервые возникшим СД1. Четкая характеристика отсутствия ремиссии как сущности позволит клиницистам принять меры для обеспечения оптимального гликемического контроля на очень раннем этапе заболевания у лиц, не получающих ремиссию, 3 , таким образом предотвращая раннюю дисгликемию.Этот новый подход, основанный на модели прогнозирования отсутствия ремиссии, окажет значительное влияние на осложнения диабета, учитывая высокую распространенность отсутствия ремиссии (> 50%) как у детей, так и у взрослых. 1,27,29,39 Прогностическая модель также улучшит отбор кандидатов для испытаний по сохранению β-клеток, а также для исследований, посвященных продромальной фазе СД1, таких как исследование TrialNet по диабету 1 типа. 40
Недавнее исследование 204 детей и подростков младше 18 лет с впервые возникшим СД1 изучало распространенность и ключевые показатели отсутствия ремиссии и сообщило, что показатель распространенности неремиссии составляет 57.8%. 41 Это исследование также продемонстрировало, что основными предикторами отсутствия ремиссии в этой популяции были уровень бикарбоната сыворотки <15 мг / дл, более молодой возраст на момент постановки диагноза, увеличение количества аутоантител, связанных с диабетом, и женский пол. 41 Напротив, мужской пол и пожилой возраст были связаны со снижением риска отсутствия ремиссии. Одно исследование показало, что ремиссия чаще возникала у более молодых пациентов; 42 Однако другие опубликованные исследования сообщили об обратном. 4,8,25,41,43-45 25-гидроксивитамин D в сыворотке не повлиял на риск отсутствия ремиссии. Это исследование дополнительно количественно оценило гликемические издержки отсутствия ремиссии, продемонстрировав продолжительный период значительного повышения уровня HbA1c в течение 3–18 месяцев после постановки диагноза у лиц, не получающих ремитент, по сравнению с лицами, отправляющими ремитент 25 (рис. 1).
МОНИТОРИНГ РЕМИССИИ И НЕРЕМИССИИ
Несмотря на принятие IDAA1c в качестве маркера золотого стандарта для ПЦР, нет единого мнения о простом и удобном для пользователя инструменте для обнаружения и мониторинга ПЦР у детей и подростков. 4,26,41 Это ограничило применение IDAA1c в качестве универсального инструмента для мониторинга ПЦР у детей с впервые возникшим СД1. Таким образом, следующей задачей в профилактике дисгликемии на ранней стадии у детей с СД1 была разработка простого и удобного инструмента для мониторинга ремиссии и отсутствия ремиссии, чтобы обеспечить установление и поддержание интенсивного гликемического контроля у этих пациентов, особенно у этих пациентов. лица, не получающие денежные переводы, у которых отсутствует связанная с медовым месяцем эндогенная защита от ранней дисгликемии и сопутствующих долгосрочных осложнений. 1,11-13,27-29,46
Недостатки маркера золотого стандарта для обнаружения частичной клинической ремиссии: HbA1c с корректировкой по дозе инсулина
Формула IDAA1c выражается как HbA1c (%) + (4-кратная общая суточная доза инсулина [TDDI] [единицы / кг / 24 часа]). Эта формула, объединяющая как HbA1c, так и TDDI, была подтверждена в нескольких когортных исследованиях; 4,7 однако этот суррогатный маркер концентрации С-пептида в сыворотке подвергся критике за его многочисленные недостатки. 4 Первым серьезным недостатком является то, что возраст, который является основным определяющим фактором ПЦР, не включен в формулу. 8 Во-вторых, IDAA1c недооценивает ПЦР у детей младшего возраста, которые часто имеют более низкие концентрации C-пептида в сыворотке из-за их меньшей массы β-клеток поджелудочной железы, поскольку формула для IDAA1c была получена с использованием более высокого порогового значения C-пептида 300 пмоль / л. вместо 200 пмоль / л, подтвержденных исследованием по борьбе с диабетом и осложнениями. 3,8 В-третьих, IDAA1c недооценивает частоту ПЦР у пожилых, полных европейских женщин с инсулинорезистентностью, 4 , поскольку IDAA1c не может различить чувствительность к инсулину и секрецию инсулина. 4 IDAA1c также имеет низкую чувствительность к риску гипогликемии у пациентов с впервые диагностированным СД1. 3 и многоэтапный подход к расчету IDAA1c представляет собой серьезное препятствие для его принятия занятыми клиницистами, что ограничивает его широкое использование в эндокринных клиниках. . Последний недостаток этой формулы заключается в том, что IDAA1c не может быть распространен на всех детей с СД1, поскольку он был получен из когорты европейских и японских субъектов, у которых характеристики диабета заметно отличаются от характеристик общего населения США. 3,47 Плохая генерализация IDAA1c была недавно продемонстрирована в США в ретроспективном исследовании, в котором IDAA1c использовался для сравнения гликемических и сердечно-сосудистых параметров у 80 афроамериканцев, 216 испаноязычных и 631 неиспаноязычных белых (NHW) молодых людей < 19 лет с СД1. 48 Авторы сообщили, что молодые афроамериканцы и латиноамериканцы имели более высокие средние значения HbA1c и ИМТ и более низкую частоту ремиссии по сравнению с молодыми людьми из NHW. 48 Удивительно, но это исследование не обнаружило статистически или клинически значимых различий в параметрах липидов между группами в первые 3 года заболевания, несмотря на постоянно более высокий уровень HbA1c у молодежи из этнических меньшинств, что позволяет предположить, что IDDA1c недооценивает ПЦР у этих молодых людей в США. , аналогично недооценке ПЦР у полных европейских женщин. 4 Другими словами, большинство молодых афроамериканцев и латиноамериканцев, отнесенных к категории лиц, не отправляющих денежные переводы, были ложноотрицательными. 47 Эта недооценка ПЦР усугубляется тем фактом, что у молодых людей из этнических меньшинств США с СД1 средний HbA1c на 0,4% выше, чем у молодых людей из NHW при той же средней концентрации глюкозы. 49,50 У них также наблюдается более быстрый рост траектории HbA1c с момента постановки диагноза. 51 В результате этих недостатков в настоящее время предлагается разработать значение IDAA1c для этнических групп для этнических меньшинств в США, 47 , и провести дополнительные исследования, чтобы прояснить полезность и эффективность IDAA1c в повседневной клинической практике. . 4 В частности, необходимо определить возрастные, половые и демографические пределы IDAA1c для определения ПЦР на основе серийного определения концентрации С-пептида в сыворотке, чтобы гарантировать, что частота ложноотрицательных результатов по текущему критерию составляет сокращены, и что все отправители точно идентифицированы. 4,47,52,53
Сравнение HbA1c с скорректированной дозой инсулина с другими маркерами частичной клинической ремиссии
Сравнение IDAA1c с более ранними определениями ПЦР, 26-30,47,54,55 , такими как HbA1c ≤7.5%, TDDI ≤0,5 единиц / кг / день, 54 или комбинации параметров, таких как HbA1c ≤7,5% и TDDI ≤0,5 единиц / кг / день, 55 показали, что хотя IDAA1c имеет более сильную корреляцию со стимулированным Концентрация С-пептида по сравнению с предыдущими определениями, 8 IDAA1c менее чувствительна, чем TDDI <0,5 единиц / кг / день для раннего обнаружения ПЦР, но более специфична для обнаружения ПЦР между 6 и 12 месяцами. 8 Кроме того, использование либо TDDI ≤0,5 единиц / кг / день, либо HbA1c <7.Было обнаружено, что 5% изолированно переоценивают распространенность ПЦР, хотя использование комбинации TDDI ≤0,5 единиц / кг / день и HbA1c <7,5% занижает оценку ПЦР. 8 Недавно бельгийская группа, сославшись на вышеупомянутые недостатки IDAA1c, разработала новый инструмент для обнаружения ПЦР, названный HbA1c с корректировкой гликемической мишени, 26 , который имеет чувствительность 72% для обнаружения ПЦР на основе Определение IDAA1c.
Учитывая недостатки IDAA1c и недостатки других определений, недавнее исследование сравнило IDAA1c с новым, простым и удобным для пользователя определением PCR: TDDI <0.3 единицы / кг / сутки. 25,56 Это сравнение было основано на гипотезе о том, что TDDI <0,3 единиц / кг / день может находиться в промежуточном положении между потенциалом обнаружения TDDI ≤0,5 единиц / кг / день 54 и комбинацией HbA1c < 7,5% и TDDI ≤0,5 единиц / кг / день. 55 Основанием для этого исследования было то, что эндокринологи, которые обычно рассчитывают TDDI во время регулярных посещений клиники, сочли бы применение TDDI <0,3 единиц / кг / день более практичным и удобным для раннего выявления и мониторинга ремиссии или отсутствия ремиссии. - ремиссии, чем IDAA1c, что обеспечило бы большее признание клиницистами.Результаты этого исследования, которое проводилось в популяции США, показали, что TDDI <0,3 единиц / кг / день и IDAA1c ≤9 выявляют аналогичную долю пациентов, начавших ПЦР: 40,2% против 42,2%, соответственно, причем оба критерия показывают пик. распространенность ремиссии через 6–12 месяцев и аналогичная продольная картина HbA1c в первые 3 года болезни (рис. 1). В частности, на Рисунке 1 показано, что, когда ПЦР определялась критерием IDAA1c ≤9, среднее значение HbA1c было одинаковым при диагностике между отправителями и лицами, не отправляющими денежные переводы; после этого уровень HbA1c стал значительно ниже у отправителей через 3–18 месяцев и после этого оставался незначительно ниже у отправителей.Когда ПЦР определялась с помощью TDDI <0,3 единиц / кг / день, уровень HbA1c оказался значительно ниже у пациентов с ремитентом при постановке диагноза и через 3 месяца, а затем стал незначительно ниже у лиц с ремитентом до 15 месяца, когда средние значения HbA1c стали аналогичными. между группами. В этом исследовании сделан вывод о том, что при прямом сравнении критерий TDDI <0,3 единиц / кг / день не уступает IDAA1c, поскольку оба критерия показали аналогичную чувствительность и специфичность для обнаружения ПЦР у детей. Однако TDDI <0.3 единицы / кг / день имели то преимущество, что они были легкодоступным инструментом для быстрого обнаружения и мониторинга ПЦР в загруженных условиях клиники. Таким образом, внедрение в клиническую практику рутинного применения TDDI <0,3 единиц / кг / день должно улучшить наблюдение как за ремиссией, так и без ремиссии, чтобы обеспечить поддержание эугликемии у детей, которым требуются дозы инсулина> 0,3 единицы / кг / день. 25
КЛИНИЧЕСКИЕ ПОСЛЕДСТВИЯ НЕРЕМИССИИ
Следующей задачей при характеристике ПЦР у детей и подростков является предоставление объективных доказательств пагубных сердечно-сосудистых эффектов отсутствия ремиссии на ранней стадии СД1, особенно в течение первых 5 лет.Такая демонстрация может стать основой для рекомендаций по раннему выявлению и мониторингу ПЦР у детей для предотвращения долгосрочных микрососудистых и макрососудистых осложнений, которые начинаются в первые несколько лет болезни. 57 Это особенно важно, потому что о ранних изменениях липидного профиля между отправителями и лицами, не отправляющими денежные переводы, ранее не сообщалось. 52
Патобиология ранней фазы дислипидемии у детей с сахарным диабетом 1 типа: необходимость стратификации пациентов по истории частичной клинической ремиссии при исследовании различий в липидном профиле
Несмотря на отчет о защитной роли С-пептида в сосудистой сети у ремиттеров, проведенных в исследовании Diabetes Control and Complications Trial, 15 до недавнего времени не было данных о характеристике дислипидемии на ранней стадии у ремиттеров и не ремиттеров. 52 Обзор текущей литературы по дислипидемии у детей и подростков с СД1 не выявил единого мнения по липидному типу, и считается, что отсутствие стратификации субъектов по истории ПЦР могло искажать эти результаты. 58-61 В то время как одно продолжительное исследование показало, что 25% молодых людей с СД1 имеют прогрессирующую и стойкую дислипидемию и повышенную жесткость артерий, 58 другое исследование у детей и подростков с плохо контролируемым СД1 выявило положительную связь между повышенной жесткостью артерий и общей ригидностью. холестерин, холестерин липопротеидов низкой плотности (ЛПНП) и HbA1c. 59 Напротив, продольное ретроспективное когортное исследование в аналогичной популяции с СД1 показало, что изменения показателей HbA1c и ИМТ z оказали минимальное влияние на холестерин ЛПНП и холестерин липопротеинов невысокой плотности. 60 Кроме того, в то время как в некоторых исследованиях сообщалось о значительной взаимосвязи между плохим гликемическим контролем и дислипидемией при СД1, в других исследованиях 58,60 сообщалось о противоречивом характере корреляции липидов и HbA1c, 62 или об отсутствии корреляции вообще. 63
Однако ни в одном из вышеупомянутых исследований не изучались различия липидных профилей в зависимости от состояния ремиссии пациентов, за исключением Redondo et al., 48 , результаты которых были искажены недооценкой ПЦР IDAA1c у молодых людей из числа этнических меньшинств. 47 Стратификация детей и подростков с впервые возникшим СД1 по статусу ПЦР имеет фундаментальное значение для обеспечения значимых сравнений между группами для уменьшения несоответствий в результатах липидного обмена, особенно концентрации холестерина ЛПНП, в предыдущих исследованиях. 58-61 Например, возможно, что исследование, в котором сообщалось о прогрессирующей и стойкой дислипидемии 58 , могло содержать более высокую долю лиц, не принимающих ремитенты, в то время как исследование, в котором сообщалось только об умеренном влиянии HbA1c и ИМТ на параметры липидов 60 могла иметь более высокую долю отправителей денежных средств. Тот факт, что лица, не принимающие ремитенты, составляют> 50% детей и подростков с впервые возникшим СД1 27,29 , делает критически важным стратификацию субъектов на основе истории ПЦР во всех исследованиях концентраций циркулирующих липидов у пациентов с СД1.
Кроме того, характеристика дислипидемии ранней фазы при СД1, в частности изменений холестерина ЛПНП, на основе стратификации с помощью ПЦР является обязательной, поскольку атеросклероз возникает в детстве и раннем подростковом возрасте, 64,65 и дислипидемия является основным фактором увеличения риск сердечно-сосудистых заболеваний у пациентов с СД1. 64,65 Такой акцент может прояснить возможную роль отсутствия ремиссии как немодифицируемого фактора риска дислипидемии при СД1.
Первым шагом к решению этой проблемы стало недавнее продольное ретроспективное когортное исследование 123 детей и подростков с 5-летним СД1. 66 Средний возраст испытуемых составлял 11,9 ± 2,9 года, а когорта состояла из 55 мужчин и 68 женщин. Было 44 отправителя и 79 отправителей. Временной график 4–5 лет после постановки диагноза был выбран в соответствии с рекомендацией Американской диабетической ассоциации (ADA) для начала скрининга на осложнения диабета у детей либо в начале полового созревания, либо через 4–5 лет после постановки диагноза, 67 , потому что это было Ранее считалось, что риск дислипидемии в препубертатном возрасте минимален.В это исследование не включались дети с дислипидемией или семейным анамнезом липидных аномалий. Результаты показали, что дети и подростки, которые прошли ПЦР, имели значительно более низкий средний холестерин ЛПНП через 4–5 лет после постановки диагноза СД1 по сравнению с их сверстниками, которые не проходили ПЦР 52 после контроля возраста, полового созревания, гликемического контроля и ожирения. Значительно более низкий уровень ЛПНП у лиц, отправляющих ремитент, был довольно поразительным, поскольку большая часть лиц, отправлявших ремитент, находилась в пубертатном периоде через 4–5 лет после постановки диагноза СД1, по сравнению с лицами, не получавшими ремитент.Это связано с тем, что в предыдущем отчете указывалось, что у подростков полового возраста с СД1 был повышен уровень холестерина ЛПНП по сравнению со здоровыми сверстниками, 63 , и это было связано с тем фактом, что у детей с СД1 не наблюдается обычной картины снижения холестерина ЛПНП в период полового созревания. 63 Таким образом, это исследование прояснило предыдущий отчет, продемонстрировав, что у лиц, перешедших в период полового созревания, были такие же средние концентрации холестерина ЛПНП, что и у детей и подростков без диабета, открытие, о котором ранее не сообщалось.В этом отчете представлены важные и объективные доказательства ранней защиты сердечно-сосудистой системы с помощью ПЦР. Необходимы более масштабные исследования для подтверждения этих различий в липидных фракциях между отправителями и лицами, не отправляющими денежные переводы.
ВЫВОДЫ И ПРЕДЛАГАЕМЫЕ ИЗМЕНЕНИЯ В РУКОВОДСТВАХ ПО МОНИТОРИНГУ ЛИПИДОВ МЕЖДУНАРОДНОГО ОБЩЕСТВА ПО ДИАБЕТУ ПЕДИАТРИИ И ПОДРОСТКОВ (ISPAD) И АМЕРИКАНСКОЙ АССОЦИАЦИИ ДИАБЕТОВ (ADA)
В этом обзоре литературы подробно описываются новые разработки в клиническом применении периода медового месяца СД1, акцентируя внимание на отсутствии ремиссии как на конкретной клинической сущности с более плохим долгосрочным прогнозом, чем частичная ремиссия.Автор надеется продвинуться в этой области, представив стратегии прогнозирования и мониторинга отсутствия ремиссии, а также обоснование начала липидного мониторинга во время диагностики СД1 у детей и подростков. В этом обзоре обобщены генетические, иммунные, воспалительные и биохимические маркеры, которые могут предсказывать ремиссию и отсутствие ремиссии. Он также охарактеризовал первую клиническую прогностическую модель, посвященную отсутствию ремиссии у детей с впервые возникшим СД1, которая основана на легко доступных клинических параметрах на момент постановки диагноза СД1, таких как возраст, пол, ИМТ, pH тела, число диабетиков. -ассоциированные аутоантитела и бикарбонат сыворотки.Он также рассмотрел исследование, показывающее, что TDDI <0,3 единиц / кг / день не уступает маркеру золотого стандарта ПЦР, IDAA1c ≤9. Наконец, в нем были рассмотрены результаты 5-летнего лонгитюдного исследования, показывающего доказательства дислипидемии на ранней стадии у лиц, не принимающих ремитенты, у которых был значительно повышен уровень холестерина ЛПНП по сравнению с лицами, принимающими ремитенты, после поправки на смешанные переменные. Хотя необходимы более масштабные исследования для подтверждения этих ранних результатов, отчетливая картина ранних изменений холестерина ЛПНП в этом недавнем исследовании 52 может объяснить дихотомию в распространенности долгосрочных осложнений СД1 между лицами, отправляющими и не отправляющими денежные переводы. 15 Значительно повышенный уровень холестерина ЛПНП у лиц, не ремиссирующих по направлению, является веским аргументом в пользу целевого мониторинга липидов при СД1, поскольку предполагает, что отсутствие ремиссии может быть немодифицируемым фактором риска сердечно-сосудистых заболеваний при СД1. Точно так же раннее расхождение в концентрации холестерина ЛПНП в сыворотке у этих педиатрических субъектов с СД1 поддерживает модификацию текущих руководящих принципов Международного общества педиатрического и подросткового диабета (ISPAD) 68 и ADA 67 , чтобы рекомендовать начало липидной терапии. мониторинг во время постановки диагноза СД1, независимо от возраста ребенка, с использованием подхода, аналогичного действующим руководящим принципам для сахарного диабета 2 типа. 68 Это обеспечит раннее выявление гиперхолестеринемии у лиц, не получающих денежные переводы, которые можно было бы устранить с помощью раннего терапевтического и диетического вмешательства в сочетании с постоянным мониторингом липидов.
В заключение, принятие следующих мер может способствовать улучшению долгосрочного сердечно-сосудистого здоровья детей и подростков с диабетом в зрелом возрасте: внедрение прогностической модели для выявления отсутствия ремиссии; использование TDDI <0,3 единиц / кг / день для более удобного отслеживания ремиссии или отсутствия ремиссии; и введение целевого мониторинга липидов во время постановки диагноза у всех детей с впервые диагностированным СД1.Необходимы более масштабные исследования с участием пациентов разных национальностей, чтобы подтвердить возможность обобщения этих показателей.
Фаза частичной ремиссии диабета у детей младше 10 лет
Несмотря на острое клиническое начало, инсулинозависимый сахарный диабет 1 типа (ИЗСД) развивается как кульминация длительной доклинической фазы прогрессирующего разрушения клеток островков поджелудочной железы1. Диагностика большая часть недавно диагностированных детей и взрослых с IDDM переходят в фазу частичной ремиссии 2, характеризующейся продолжением секреции эндогенного инсулина, снижением потребности в экзогенном инсулине и хорошим метаболическим контролем.3-5
Возобновился интерес к ремиссии или спонтанному восстановлению β-клеток, поскольку это имеет важные последствия с точки зрения потенциального фармакологического вмешательства и иммуномодуляции.6 Более того, было высказано предположение, что госпитализация детей в момент постановки диагноза (и с перерывами в дальнейшем) должна инициировать интенсивное внутривенное введение инсулина может вызвать более длительную фазу ремиссии. 8 Это предположение связано с гипотезой о том, что введение инсулина до постановки клинического диагноза может предотвратить или отсрочить начало IDDM.9 Также считается, что у детей дошкольного возраста с диабетом реже, чем у детей старшего возраста, наблюдается полная или частичная ремиссия, 10 11, основанный на предположении, что у детей младшего возраста больше шансов заболеть кетоацидозом, и считается, что у них чаще наблюдается недостаточность β-клеток с более агрессивным аутоиммунным заболеванием. 13
Целью нашего исследования было оценить частоту частичной ремиссии у детей младшего возраста, в частности, из-за возможности поддерживать фазу ремиссии и, таким образом, достичь лучшего долгосрочного метаболического контроля.
Исследуемая популяция и методы
Мы рассмотрели записи о 110 детях с диагнозом ИЗСД в возрасте до 10 лет в период 1981–1991 годов, которые были зарегистрированы в Регистре диабета Лестершира. Мы извлекли данные за первые два года после постановки диагноза через 1, 3, 6, 12, 18 и 24 месяца, записали рост, вес, потребность в инсулине, концентрации гликированного гемоглобина (HbA 1 ), продолжительность истории симптомов, этническую принадлежность. происхождение (особенно дети индийского субконтинентального происхождения из Южной Азии), длительность госпитализации и наличие диабетического кетоацидоза (ДКА) на момент постановки диагноза.
Мы определили частичную ремиссию как потребность в инсулине <0,5 Ед / кг / день, а ДКА как pH крови <7,25.
СТАТИСТИКА
Мы проанализировали данные, используя статистический программный пакет SAS, вычисляя пропорции, средние значения, точные тесты Фишера и критерии независимости χ 2 в зависимости от ситуации. Программное обеспечение анализа доверительных интервалов (CIA) использовалось для оценки 95% доверительных интервалов для пропорций и их различий14.
Мы сравнили различия в потребностях в инсулине между подгруппами за период исследования методом суммарных измерений.Для каждого ребенка мы рассчитали площадь под кривой потребности в инсулине с течением времени, используя правило трапеции, и стандартизировали результат путем деления на период исследования.15 Затем мы сравнили эти итоговые показатели, используя критерий Стьюдента t или критерий Манна-Уитни U протестируйте при необходимости.
Результаты
Из 110 пациентов, потенциально доступных для исследования, мы включили 95 (86,3%). Мы исключили 15 детей, потому что больничные записи не были доступны для шести, четверо переехали из Лестершира, а пятеро переехали в Лестершир после постановки диагноза.Все 95 пациентов получали инсулин при постановке диагноза и продолжают это делать.
Таблица 1 описывает исходные характеристики и подгруппы пациентов при поступлении и суммирует результаты ремиссии. В течение первых 24 месяцев у 41 пациента отмечен период частичной ремиссии. Мы наблюдали аналогичные показатели ремиссии у пациентов в возрасте 2–3, 4–5, 6–7 и 8–9 лет на момент постановки диагноза. Ни у одного из пяти детей в возрасте до 2 лет на момент постановки диагноза не наблюдалось частичной ремиссии (трое из них были госпитализированы с ДКА).У большего количества мальчиков, чем у девочек, и у более белых, чем у детей из Южной Азии, наблюдалась частичная ремиссия, но различия не были значительными (пол: χ 2 = 0,896 1 df, p = 0,33; этническая принадлежность: точный критерий Фишера (двусторонний), p = 0,34) .
Таблица 1Характеристики пациентов, детали ремиссии и 95% доверительный интервал (ДИ) различий
У меньшего числа детей с ДКА и госпитализированных было ремиссии, чем у детей, поступивших без ДКА или не госпитализированных, но эти различия не были значимыми (χ 2 = 3.02 2 df, p = 0,22).
Через три месяца после постановки диагноза у 29 участников когорты наблюдалась ремиссия (около одной трети детей младше 5 лет на момент постановки диагноза и детей в возрасте 5–9 лет). К 12 месяцам эти показатели упали до 4 из 36 и 11 из 64 в младшей и старшей возрастных группах соответственно; к 24 месяцам эти цифры упали до 1 и 6 соответственно. В течение двух лет средняя потребность в инсулине была меньше у лиц в возрасте 5–9 лет по сравнению с более молодой возрастной группой, но различия не были значительными (p = 0.13), а средняя потребность в инсулине у мальчиков была на ~ 8% ниже, чем у девочек (несущественно, p = 0,14). Для детей с любым периодом ремиссии потребности в инсулине были значительно ниже с момента первого сбора данных в течение одного месяца до 24 месяцев по сравнению с детьми, у которых не было ремиссии (рис. 1; p <0,01).
фигура 1Средняя потребность в инсулине с течением времени с 95% доверительным интервалом (CL) по наблюдаемой частичной ремиссии.
Данных о гликированном гемоглобине было недостаточно, чтобы связать это с возрастными группами и дозировкой инсулина.
Обсуждение
Мы обнаружили статистически схожие проценты детей с частичной ремиссией в двухлетних возрастных группах от 2 до 10 лет. Однако через два года после постановки диагноза потребность в экзогенном инсулине существенно не различалась между группами в зависимости от предыдущей ремиссии, возраста, этнической принадлежности, пола, госпитализации при постановке диагноза и первоначального ДКА. Ни один ребенок, которому поставлен диагноз в возрасте до 2 лет, не был переведен, и их доза инсулина за эти два года была выше, чем у детей старшего возраста.
Оценки частоты ремиссии при ИЗСД сильно различаются, отчасти из-за использования разных определений. Дрэш описал большую когорту в возрастной группе 0–15 лет, используя то же определение (доза инсулина <0,5 Ед / кг / день), и обнаружил, что у 70% случаев ремиссия происходит частично, и что ремиссия чаще встречается у детей старшего возраста, у мальчиков и у пациентов, не страдающих тяжелым кетоацидозом.10 Он, как и мы, отметил более низкую (10%) потребность в инсулине у мальчиков.
В другой большой когорте (с использованием того же определения) частота ремиссии через три месяца составила 59%, а через год – 36%, при этом период ремиссии был идентичным у детей с диагнозом <5, 5–10 или 10–15 лет. возраст.16
Применяя другое определение – снижение потребности в инсулине как минимум на 33% от дозы при выписке из больницы – более ранние небольшие исследования в Великобритании указывали на 15-40% ремиссий в различных возрастных группах.17 18
Основная критика этих клинических определений заключается в том, что они не оценивают физиологическую основу ремиссии, а именно эндогенную секрецию инсулина, или результат с точки зрения гликозилированного гемоглобина. Agner и др. показали, что концентрации C-пептида были выше, а концентрации гликозилированного гемоглобина были ниже у трети их пациентов в возрасте до 16 лет, у которых была ремиссия.4 К сожалению, в нашей когорте измерения гликированного гемоглобина в первые 12 месяцев после постановки диагноза были недостаточными для предоставления достоверных данных, но мы отмечаем, что в группе детей с ремиттирующими заболеваниями потребность в инсулине была значительно ниже в течение первых недель после постановки диагноза (рис. с клинически превосходным гликемическим контролем. Это важно, потому что недавние данные крупных многоцентровых исследований показывают, что хороший контроль диабета, достигнутый вскоре после постановки диагноза, с большей вероятностью будет устойчивым (T Danne, неопубликованные данные, 1998).19 Часто наблюдается обратное: плохой контроль на ранних стадиях диабета с большей вероятностью будет связан с продолжением неудовлетворительного контроля после этого.
Обширные клинические, генетические и биохимические исследования первых месяцев диабета после его клинического проявления в Финляндии показали, что у детей в возрасте до 2 лет ДКА более вероятен, частичная ремиссия встречается редко, а концентрации С-пептида в сыворотке крови выше. низкий.13 Наше открытие об отсутствии ремиссии и более высоких потребностях в инсулине у младенцев <2 лет согласуется с этим.Интенсивность деструкции β-клеток связана с генетическими детерминантами, в частности с гетерозиготностью HLA DR3 / DR412 или DQB1 0302/0201.20 Таким образом, сохранение остаточной функции β-клеток и частичная ремиссия могут различаться между разными генетическими подгруппами в разных странах.21
Возможно, более важное клиническое значение для Великобритании и других стран имеет тот факт, что уход за детьми с впервые диагностированным ИЗСД смещается в сторону ведения на дому и в общине22. 23 Таким образом, предположение о том, что интенсивное лечение инсулином в начале заболевания может продлить и углубить фазу ремиссии8, вызывает определенное беспокойство, особенно потому, что недавние данные исследования контроля диабета и осложнений (DCCT), как правило, подтверждают эту идею.19 Наши результаты не вносят вклад в эту важную дискуссию отчасти потому, что мы не смогли документально подтвердить связь между дозой инсулина, остаточной функцией β-клеток и метаболическим контролем. Таким образом, еще предстоит выяснить, будет ли экзогенный инсулин перед началом, 9 или интенсивное лечение инсулином после него, 7 8 24 может заметно сохранить функцию β-клеток и изменить долгосрочные клинические результаты у детей с диабетом.
Мы показали, что у детей, получающих традиционную инсулиновую терапию и часто находящихся на начальном этапе вне больницы, более 40% дошкольников и детей старшего возраста переходят в переходную фазу частичной ремиссии.Это более высокий показатель, чем в некоторых отчетах, но значительно ниже, чем в других, и будет важно проспективно проверить, являются ли различия результатом генетических или патофизиологических различий, или же более интенсивное лечение инсулином при постановке диагноза может продлить фазу ремиссии. .
Фаза частичной ремиссии должна отражаться в концентрациях гликозилированного гемоглобина, близких к норме, и тщательный мониторинг этих концентраций в течение первых двух лет после постановки диагноза может дать полезную информацию об успехе или неудаче лечения диабета у детей.
Таким образом, мы делаем вывод, что «период медового месяца» с продолжающейся секрецией эндогенного инсулина продолжает предоставлять окно возможностей для оценки лечения инсулином и потенциальных новых методов лечения в попытке сохранить функцию β-клеток поджелудочной железы и установить образец оптимального метаболизма.




