Фовеолярная гиперплазия: , / 2014, , . , … –
Фовеолярная гиперплазия – Вопрос гастроэнтерологу
Если вы не нашли нужной информации среди ответов на этот вопрос, или же ваша проблема немного отличается от представленной, попробуйте задать дополнительный вопрос врачу на этой же странице, если он будет по теме основного вопроса. Вы также можете задать новый вопрос, и через некоторое время наши врачи на него ответят. Это бесплатно. Также можете поискать нужную информацию в похожих вопросах на этой странице или через страницу поиска по сайту. Мы будем очень благодарны, если Вы порекомендуете нас своим друзьям в социальных сетях.Медпортал 03online.com осуществляет медконсультации в режиме переписки с врачами на сайте. Здесь вы получаете ответы от реальных практикующих специалистов в своей области. В настоящий момент на сайте можно получить консультацию по 70 направлениям: специалиста COVID-19, аллерголога, анестезиолога-реаниматолога, венеролога, гастроэнтеролога, гематолога, генетика, гепатолога, гериатра, гинеколога, гомеопата, дерматолога, детского гастроэнтеролога, детского гинеколога, детского дерматолога, детского инфекциониста, детского кардиолога, детского лора, детского невролога, детского нефролога, детского офтальмолога, детского психолога, детского пульмонолога, детского ревматолога, детского уролога, детского хирурга, детского эндокринолога, дефектолога, диетолога, иммунолога, инфекциониста, кардиолога, клинического психолога, косметолога, логопеда, лора, маммолога, медицинского юриста, нарколога, невропатолога, нейрохирурга, неонатолога, нефролога, нутрициолога, онколога, онкоуролога, ортопеда-травматолога, офтальмолога, паразитолога, педиатра, пластического хирурга, проктолога, психиатра, психолога, пульмонолога, ревматолога, рентгенолога, репродуктолога, сексолога-андролога, стоматолога, трихолога, уролога, фармацевта, физиотерапевта, фитотерапевта, флеболога, фтизиатра, хирурга, эндокринолога.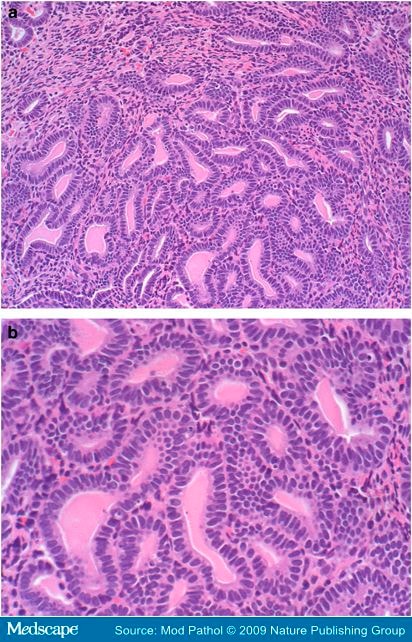
Мы отвечаем на 97.23% вопросов.
Оставайтесь с нами и будьте здоровы!
Фокальная гиперплазия фовеолярная – Вопрос гастроэнтерологу
Если вы не нашли нужной информации среди ответов на этот вопрос, или же ваша проблема немного отличается от представленной, попробуйте задать дополнительный вопрос врачу на этой же странице, если он будет по теме основного вопроса. Вы также можете задать новый вопрос, и через некоторое время наши врачи на него ответят. Это бесплатно. Также можете поискать нужную информацию в похожих вопросах на этой странице или через страницу поиска по сайту. Мы будем очень благодарны, если Вы порекомендуете нас своим друзьям в социальных сетях.Медпортал 03online.com осуществляет медконсультации в режиме переписки с врачами на сайте. Здесь вы получаете ответы от реальных практикующих специалистов в своей области. В настоящий момент на сайте можно получить консультацию по 70 направлениям: специалиста COVID-19, аллерголога, анестезиолога-реаниматолога, венеролога, гастроэнтеролога, гематолога, генетика, гепатолога, гериатра, гинеколога, гомеопата, дерматолога, детского гастроэнтеролога, детского гинеколога, детского дерматолога, детского инфекциониста, детского кардиолога, детского лора, детского невролога, детского нефролога, детского офтальмолога, детского психолога, детского пульмонолога, детского ревматолога, детского уролога, детского хирурга, детского эндокринолога, дефектолога, диетолога, иммунолога, инфекциониста, кардиолога, клинического психолога, косметолога, логопеда, лора, маммолога, медицинского юриста, нарколога, невропатолога, нейрохирурга, неонатолога, нефролога, нутрициолога, онколога, онкоуролога, ортопеда-травматолога, офтальмолога, паразитолога, педиатра, пластического хирурга, проктолога, психиатра, психолога, пульмонолога, ревматолога, рентгенолога, репродуктолога, сексолога-андролога, стоматолога, трихолога, уролога, фармацевта, физиотерапевта, фитотерапевта, флеболога, фтизиатра, хирурга, эндокринолога.
Мы отвечаем на 97.23% вопросов.
Оставайтесь с нами и будьте здоровы!
Оценка поражения антрального и фундального отделов желудка при хроническом гастродуодените у детей
Kharkiv National Medical University Repository
Learn MorePlease use this identifier to cite or link to this item: http://repo.knmu.edu.ua/handle/123456789/4273
| Title: | Оценка поражения антрального и фундального отделов желудка при хроническом гастродуодените у детей |
| Authors: | Гаргин, Виталий Витальевич Долгая, Оксана Владимировна |
| Keywords: | гастрит Helicobacter Pylori |
| Issue Date: | 2013 |
| Citation: | Гаргин В.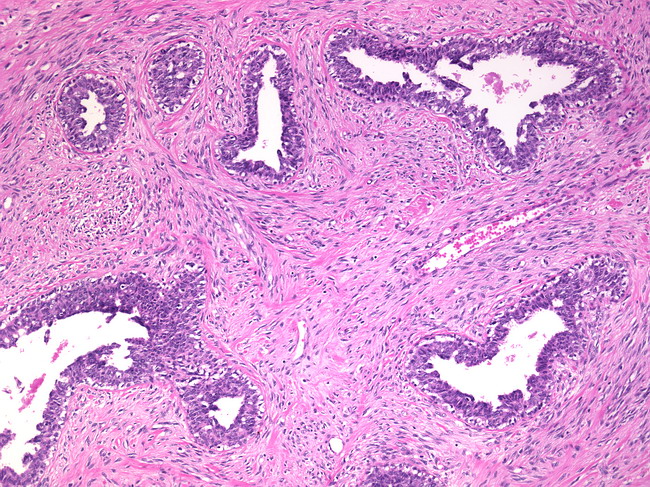 В Оценка поражения антрального и фундального отделов желудка при хроническом гастродуодените у детей / В. В. Гаргин, О. В. Долгая // Актуальні питання педіатрії, акушерства та гінекології. – 2013. – № 2. – С. 62–64. В Оценка поражения антрального и фундального отделов желудка при хроническом гастродуодените у детей / В. В. Гаргин, О. В. Долгая // Актуальні питання педіатрії, акушерства та гінекології. – 2013. – № 2. – С. 62–64. |
| Abstract: | Представлены результаты изучения патологии желудка у детей в возрасте от 7 до14 лет с клиническими проявлениями гастродуоденита. Для исследования были использованы биоптаты слизистой оболочки антрального отдела и тела желудка. Морфологические заключения представлены в соответствии с Сиднейско-Хьюстонской классификацией хронических гастритов. У большинства детей обнаружен хронический начальный атрофический гастрит. В пилороантральном отделе у каждого второго пациента отмечалась фовеолярная гиперплазия. Helicobacter Pylori-ассоциированными были все хронические умеренно выраженные атрофические антральные гастриты. Секреторная активность была низкой, а мукоид незрелым как в поверхностно-ямочном, так и в эпителии пилорических желез, количество которых уменьшалось.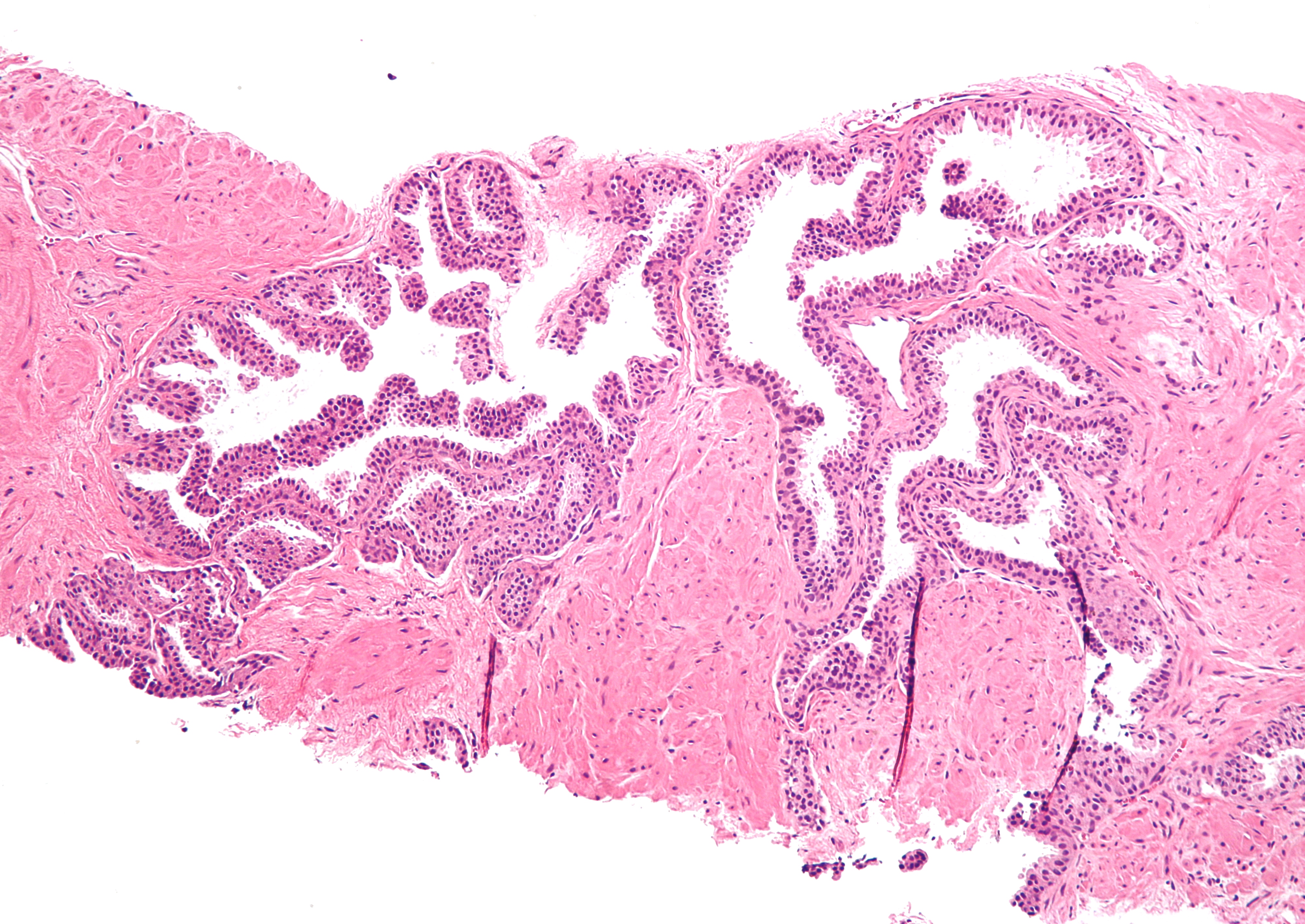 Сопоставление патогистологических изменений слизистой оболочки антрального и фундального отделов желудка у одних и тех же больных показало, что наиболее выраженные морфологические изменения отмечались в антральном отделе и ассоциировались с Helicobacter Pylori. Распространение их колонизации на тело желудка так же вызывало дистрофические изменения в поверхностно-ямочном эпителии, но менее выраженные. Таким образом, у детей с гастродуоденальной патологией отмечается нарушение слизеобразования, ведущее к снижению защитных свойств поверхностно-ямочного эпителия слизистой оболочки желудка. Хронический активный гастрит наблюдался у всех пациентов с Helicobacter Pylori. Представленные H. pylori-ассоциированные хронические активные гастриты характеризовались преобладанием изменений в антральном отделе; случаев с преобладанием изменений в фундальном отделе нами выявлено не было среди ассоциированных с H. Pylori инфекцией. Сопоставление патогистологических изменений слизистой оболочки антрального и фундального отделов желудка у одних и тех же больных показало, что наиболее выраженные морфологические изменения отмечались в антральном отделе и ассоциировались с Helicobacter Pylori. Распространение их колонизации на тело желудка так же вызывало дистрофические изменения в поверхностно-ямочном эпителии, но менее выраженные. Таким образом, у детей с гастродуоденальной патологией отмечается нарушение слизеобразования, ведущее к снижению защитных свойств поверхностно-ямочного эпителия слизистой оболочки желудка. Хронический активный гастрит наблюдался у всех пациентов с Helicobacter Pylori. Представленные H. pylori-ассоциированные хронические активные гастриты характеризовались преобладанием изменений в антральном отделе; случаев с преобладанием изменений в фундальном отделе нами выявлено не было среди ассоциированных с H. Pylori инфекцией. |
| URI: | http://repo.knmu.edu.ua/handle/123456789/4273 |
| Appears in Collections: | Наукові праці.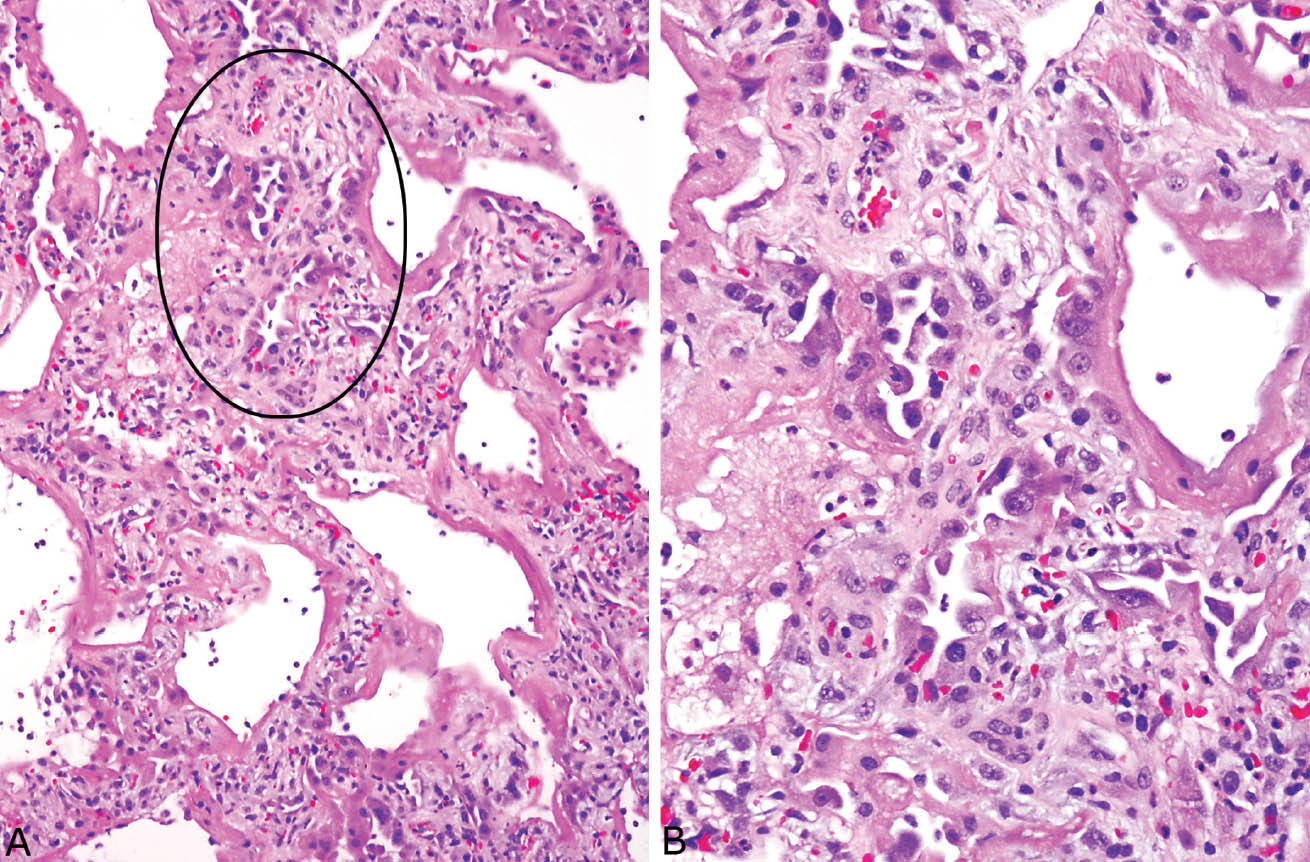 Кафедра патологічної анатомії Кафедра патологічної анатомії |
Items in DSpace are protected by copyright, with all rights reserved, unless otherwise indicated.
Фовеолярная гиперплазия и кишечная метаплазия
Вопрос:
Здравствуйте, доктор. Около месяца мучили боли в районе желудка. Обратился к гастроэнтерологу. Сдал анализы крови (норма), кала (норма), УЗИ брюшной полости (не выявлено патологий), видеоколоноскопия (органической патологии не выявлено), ФГДС (хронический гастрит, дуоденопатия, НР++).
Назначены «Улькавис» по 2 шт. 2 раза в день, «Нольпаза» 20 мг 2 раза в день, «Необутин 200» 3 раза в день. Дробное питание и диета. Сказали, приходить повторно колоноскопию через год и меньше нервничать. Какое-то время поболело и прошло. Через три месяца по своей инициативе сходил на ФГДС с биопсией (платно, без направления). Врач сказал, что он ничего криминального не видит и взял 1 кусочек биопсии из антрума по малой кривизне. Спустя неделю пришёл результат биопсии: хронический гастрит без атрофии желёз умеренной выраженности и незначительной активности, очаговая фовеолярная гиперплазия и кишечная метаплазия (до 10% биоптата). НP (-).
НP (-).
Меня напрягают слова «фовеолярная гиперплазия» и «кишечная метаплазия». Нужно ли сейчас идти к врачу в свете новых обстоятельств или через год, как она велела. Соблюдаю диету, ничего не болит. Спасибо.
Ответ:
Приветствую!
Наличие кишечной метаплазии признак неблагополучия в слизистой желудка. Если это тонкокишечная метаплазия (полная), то это функциональные нарушения, онкологический риск составляет около 8%. Если это толстокишечная метаплазия (неполная), то риск выше – до 34%. Поэтому в гистологическом отчёте нужно требовать от морфолога указывать форму кишечной метаплазии. В данном случае, мы всем пациентам рекомендую выполнить так называемый гистологический паспорт желудка: мультифокальную биопсию слизистой желудка по OLGA/OLGIM, биопсия из 3 зон желудка, 5-12 фрагментов. По специальным таблицам формируется интегральная оценка рисков развития не кардиального рака желудка, и по протоколу MAPS II от 6 марта 2019 года определяется кратность наблюдения за таким желудком. При толстокишечной метаплазии мы рекомендуем нативную хромоскопию с метиленовым синим, который накапливается в изменённых клетках. С этих окрашенных участков и надо брать биопсию.
При толстокишечной метаплазии мы рекомендуем нативную хромоскопию с метиленовым синим, который накапливается в изменённых клетках. С этих окрашенных участков и надо брать биопсию.
Приезжайте к нам в институт пластической хирургии и косметологии на консультацию и выполнение хромоскопии и биопсии OLGA/OLGIM.
Версия для печати
ПОРАЖЕНИЯ СЛИЗИСТОЙ ОБОЛОЧКИ ЖЕЛУДКА У БОЛЬНЫХ С АКРОМЕГАЛИЕЙ.
Терещенко С. Г., руководитель отделения эндоскопии, д. м. н.
Лукина Е. М., старший научный сотрудник отделения эндоскопии, к. м. н.
Титаева А. А., младший научный сотрудник отделения эндоскопии
Иловайская И. А., старший научный сотрудник отделения терапевтической эндокринологии, к. м. н.
Корсакова Н. А., старший научный сотрудник патологоанатомического отделения, к. м. н.
ГУ МОНИКИ им.М.Ф. Владимирского
г. Москва
Среди известных гипоталамо-гипофизарных нарушений акромегалия занимает особое место в связи с сохраняющимся диссонансом между относительной легкостью диагностики заболевания и существующей трудностью его адекватного лечения.
Проанализированы результаты эндоскопического исследования желудка у 96 больных с акромегалией. Больные были в возрасте от 26 до 78 лет, в среднем возраст составил 55,5±2,3 года.
По возрастным группам больные распределились следующим образом: 15-29 лет – 1 человек, 30-44 года – 16, 45-59 лет – 45, 60-74 года – 30, 75 лет и старше – 4 больных. Мужчин было 30, женщин – 66. 55 больных госпитализировались один раз, 21 – дважды, 15 – трижды, четыре госпитализации было у 2 больных, пять – у 2, шесть – у 1 пациента. В среднем число госпитализаций составило 1,7±0,2.
Период наблюдения: в течение 1 года наблюдали 68 больных, в течение 2 лет наблюдалось 8 больных, в течение 3 лет – 5 больных, в течении 4 лет наблюдалось 10 больных. Среднее время наблюдения составило – 1,7±0,1 год.
В процессе обследования 92 больным выполнено 140 исследований желудка. Взято 155 биоптатов из различных отделов, в зависимости от найденной эндоскопически патологии, которые подвергнуты патоморфологическому исследованию.
Обследование верхнего отдела пищеварительного тракта имело свои особенности, обусловленные изменениями языка и глотки, заключающиеся в увеличении размеров данных структур, и связанных с этим трудностями проведения исследования.
Исследования выявило следующую патологию. Гастрит выявлен у всех больных, при этом у 7 пациентов обнаружены эрозии, у 9 – «полные» эрозии желудка, у 1 больного ксантома.
Полиповидные образования желудка выявлены у 26 больных. При анализе данных гистологического исследования выявлена следующая верификация: гиперплазия покровно-ямочного эпителия – 16(61,2%) пациентов, фовеолярная гиперплазия – у 4(15,4%), гиперпластический полип – у 6(23,4%) пациентов. Полиповидные образования локализовались преимущественно в дистальных отделах желудка: в теле желудка – у 8, в антральном отделе – у 17, множественные полипы тела желудка – у 1 больного.
Полиповидные образования локализовались преимущественно в дистальных отделах желудка: в теле желудка – у 8, в антральном отделе – у 17, множественные полипы тела желудка – у 1 больного.
Размеры полиповидных образований оказались следующими: у 14 больных размер полиповидного образования был до 0,5 см, у 12 от 0,6 см до 1,0 см, у 2 больных – от 1,1 до 1,5 см, у одного больного – множественные полипы желудка.
Ввиду того, что больные акромегалией проходят ежегодное обследование в стационаре, было исследовано, как меняются гистологически гиперпластические очаги у данных больных, для того чтобы выявить наиболее рациональную тактику ведения пациентов с акромегалией и сопутствующими заболеваниями желудка. Результаты оказались следующими: у трех больных в течение одного года полиповидные образования из фовеолярной гиперплазии преобразовались в гиперпластический полип. У остальных больных, у которых были обнаружены гиперпластические полипы, за время наблюдения изменения структуры образований обнаружено не было.
Параллельно было исследовано, коррелируется ли наличие Helicobacter pylory в биоптатах данных больных с наличием полиповидных образований, так как было отмечено, что у большинства больных акромегалией желудок обсеменен данной бактерией.
Оценка биопсийного материала желудка на наличие Helicobacter pylori y 61 больного с акромегалией показала следующее: отсутствие микроорганизма – у 18(29%) пациентов, 1 степень обсемененности выявлена у 10(16,3%), 2 степень – у 10(16,3%), 3 степень – у 23(38,4%) больных.
У 23 больных при наличии полиповидных образований: Helicobacter pylori отсутствовал у 5(21,7%) больных, 1 степень обсемененности имела место у 3(13%), 2 степень – у 3(13%), 3 степень – у 12 больных (52,3%).
У 9 больных, имеющих «полные» эрозии желудка, 1 степень обсемененности имела место у 3 (33,3%), 2 степень – у 1 (11,2%), 3 степень – 12 больных (55,5%).
Проанализировав результаты данного исследования, можно прийти к выводу, что у больных с акромегалией, ввиду системного поражения организма, имеет место большая вероятность сопутствующей патологии желудка, заключающаяся в различных гиперпластических процессах, обусловленных основным заболеванием.
Клинические особенности и роль НР у пожилых больных с язвенной болезнью | Звенигородская Л.А., Бондаренко Е.Ю., Морозов И.А., Чикунова Б.З.
Несмотря на предложенные программы профилактики и раннего выявления язвенной болезни желудка (ЯБЖ) и двенадцатиперстной кишки (ЯБДПК), появлению новых лекарственных препаратов и методов лечения в последние годы отмечается тенденция к увеличению заболеваемости ЯБЖ и гастроэзофагеальной рефлюксной болезни (ГЭРБ) по сравнению c ЯБДПК, особенно у пожилых больных.
ЯБЖ и ЯБДПК у пожилых больных и лиц старческого возраста отличаются рядом особенностей. Это касается не только клинических и морфофункциональных, но и этиологических аспектов.
Основными факторами, определяющими особенности клинического течения ЯБ у пожилых лиц, является исходное состояние слизистой оболочки желудка (СОЖ) и слизистой оболочки двенадцатиперстной кишки (СОДПК), ишемические гастропатии [3,5,7], на фоне которых развиваются эрозивно–язвенные поражения гастродуоденальной зоны.
Наиболее часто у пожилых больных ЯБ развивается на фоне выраженной дистрофии и атрофии СОЖ, СОДПК [4,7]. При гистологическом исследовании СОЖ и СОДПК определяется уменьшение числа слизеобразующих клеток, выраженные изменения сосудов микроциркуляторного русла собственной пластинки СОЖ, пропитывание СОЖ, СОДПК эритроцитами, обеднение клеточными элементами собственной пластинки СОЖ, участки склероза и фиброза (рис. 1–3).
Возрастные особенности, выраженные дистрофические и атрофические изменения СОЖ и СОДПК, наличие сопутствующих конкурирующих заболеваний меняют не только клиническое течение ЯБ, но и расстановку этиологических акцентов ульцерогенеза у этой категории больных.
Настоящее сообщение подтверждает патогенетическую и клиническую неоднородность ЯБ у пожилых лиц, обязывает клинициста выделять основные патогенетические механизмы возникновения ЯБЖ или ЯБДПК, определять дифференцированный подход к лекарственной терапии, исключать шаблонные схемы лечения [3,7,9].
Констатируя наличие язвенного дефекта в СОЖ и СОДПК у пожилых лиц, объяснить его возникновение с позиций общеизвестных и достаточно хорошо изученных патогенетических механизмов не всегда возможно.
Ряд исследователей считают, что язвы и эрозии у пожилых лиц связаны с нарушением кровообращения в СОЖ и основными факторами агрессии являются гипоксия и связанные с ней трофические нарушения в СОЖ и СОДПК [4,5,6,7,9], изменения в сосудах микроциркуляторного русла и метаболические нарушения. Кислотно–пептический фактор и пилорический хеликобактер (НР) имеют второстепенное значение [4,5].
Материалы и методы
Нами было обследовано 512 больных с ЯБЖ и ЯБДПК в возрасте от 54 до 73 лет.
Дизайн обследования:
1. Детализация жалоб, анамнеза, выявление сопутствующих сердечно–сосудистых заболеваний (ишемической болезнью сердца (ИБС), гипертонической болезнью (ГБ), церебральный атеросклероз, атеросклероз сосудов нижних конечностей, хронической ишемической болезнью органов пищеварения (ХИБОП).
2. Объективное обследование больного.
3. Исследование клинических и биохимических анализов крови, включая показатели липидного спектра крови, показатели перекисного окисления липидов (ПОЛ) в сыворотке крови по конечному продукту пероксидации – малоновому альдегиду (МДА) [1], вязкости венозной и артериальной крови и плазмы [7,10,11,12], агрегационной способности тромбоцитов [9], коагулограммы.
4. ЭГДС с биопсией СОЖ или 12–перстной кишки. (Сопоставление эндоскопической и морфологической картины, составление картограммы желудка).
5. Гистологическое исследование СОЖ, выявление НР (уреазный тест, цитологический метод, дыхательный тест).
6. Рентгенологическое исследование пищевода, желудка и 12–перстной кишки.
7. Исследование кислотообразующей функции желудка (Д/час НCl + 24–часовая рН–метрия).
8. Холтеровское ЭКГ–мониторирование.
9. Оценка гистологических данных при исследовании СОЖ при терапии Н2–блокаторами рецепторов гистамина и ингибиторов протонной помпы (ИПП).
Результаты и обсуждение. У большинства пожилых больных выявлялось от 2 до 9 конкурирующих заболеваний. Наиболее часто встречалась ИБС (62,7%). В связи с тем, что у пожилых больных с ЯБЖ боли чаще всего локализовались в левой половине грудной клетки или за грудиной, требовалось проводить дифференциальную диагностику болевого синдрома. Дифференциальная диагностика загрудинных болей порой была затруднена из–за наличия перехлестных синдромов и нередко требовала проведения Холтеровского мониторирования (табл. 1).
У большинства больных с ЯБЖ и ЯБДПК имелся синдром язвенной диспепсии (ЯД) (табл. 2).
Синдром неязвенной диспепсии (НЯД) встречается у пожилых лиц в 64% случаев. Явления НЯД у этих больных, по–видимому, объясняются снижением цифр желудочной секреции, нарушениями моторики желудка и двенадцатиперстной кишки, выраженными атрофическими изменениями СОЖ и СОДПК.
При рентгенологическом исследовании у 33% больных была выявлена ГПОД; у 51% – наличие гастроэзофагеального рефлюкса и у 11% – нарушение эвакуаторной функции желудка.
У 79% больных методом внутрижелудочной рН–метрии выявлено снижение кислотообразующей функции желудка до 2,5±0,3 (I – 1,21–2,0) (табл. 3).
У пожилых лиц при обострении ЯБЖ Нр выявляется в 22% случаев (1 степень обсемененности). У 58% в период обострения ЯБЖ НР не выявлялся. Обострение ЯБЖ у этой категории больных не всегда совпадало с наличием НР–инфекции. У 20% больных выявлен НР вне обострения ЯБЖ и ЯБДПК.
При изучении процессов ПОЛ отмечалось значительное повышение процессов свободнорадикального окисления липидов (СПОЛ). Содержание МДА у лиц контрольной группы составляло 10,2±0,2 нмоль/л, а у лиц с ЯБЖ – 13,8±0,5 нмоль/л (при норме 10,2±0,2 нмоль/л).
Показатели свертывающей системы крови свидетельствовали о синдроме гиперкоагуляции. Так, константа свертывания (КС) у пожилых лиц с ЯБ составила 19,28±1 (при норме 34,0±2,2). Отмечалось повышение вязкости венозной крови и плазмы (табл. 4).
У 38% больных отмечено увеличение агрегационной способности тромбоцитов от 56,4 до 79,3%.
 Показатели липидного спектра крови свидетельствовали о выраженной дислипидемии у всех больных с ЯБ, протекающей на фоне ИБС.
Показатели липидного спектра крови свидетельствовали о выраженной дислипидемии у всех больных с ЯБ, протекающей на фоне ИБС.В большинстве случаев отмечалось 2–3–кратное повышение общего содержания липидов, а липопротеидов низкой плотности (ЛПНП) – более чем в 3 раза по сравнению с контрольной крупой.
Придерживаясь Маастрихтовских соглашений в случаях выявления НР, терапия ЯБ у пожилых лиц проводилась согласно предложенным рекомендациям (табл. 5).
На фоне проводимой терапии мы отметили следующие морфологические изменения СОЖ и СОЖПК у пожилых больных за 15 лет (период с 1990 по 2005 г.):
Динамика морфологических изменений СОЖ и ДПК у пожилых больных (1990–2000 гг.)
НР– 89 биопсий
• Хроническая язва желудка – 18 больных
• Хронический неактивный умеренно выраженный гастрит – 76 больных
• Фовеолярная гиперплазия – 10 больных
• Эрозии – 23 больных
• Гиперплазиогенные полипы – 4 больных
• Кишечная метаплазия 1 типа – 11 больных
• Кишечная метаплазия 2 типа – 8 больных
• Эзофагит – 12 больных
• ЯБДПК – 8 больных
• Рак желудка – 2 больных
Основная терапия – блокаторы Н2–рецепторов гистамина+периодически ИПП
Динамика морфологических изменений СОЖ и ДПК у пожилых больных (2000–2005 гг.
 )
)НР– 176 биопсий
• Хроническая язва желудка – 39 больных
• Хронический неактивный умеренно выраженный гастрит – 132 больных
• Гиперплазиогенные полипы – 53 больных (рис. 4)
• Эрозии – 54 больных
• Фовеолярная гиперплазия – 63 больных (рис. 5)
• Тубулярная аденома – 5 больных (рис. 6)
• Кишечная метаплазия 1 типа – 26 больных (рис. 7)
• Кишечная метаплазия 2 типа – 18 больных (рис. 8)
• Эзофагит – 44 больных
• ЯБДПК – 12 больных
• Рак желудка – 11 больных
• Лимфома – 2 больных
• Пищевод Барретта – 3 больных
• Основная терапия – ИПП 20мг/сут. от 3 до 5 лет получали 113 человек
Динамика морфологических изменений СОЖ и ДПК у пожилых больных (2000–2005 гг.)
НР+ 37 биопсий
• Хроническая язва желудка – 5 больных
• Хронический неактивный умеренно выраженный гастрит – 32 больных (из них НР+++ – 2 больных)
• Хронический гастрит с выраженной активностью – 3 больных
• Фовеолярная гиперплазия – 1 больной
• Эрозии – 3 больных
• Гиперплазиогенные полипы – 0
• Кишечная метаплазия 1 типа – 2 больных
• ЯБДПК – 2 больных
Нами отмечено, что на фоне длительного приема ИПП у больных пожилого возраста в слизистой оболочке желудка значительно чаще наблюдается процесс фовеолярной гиперплазии, характеризующийся удлинением желудочных ямок и образованием высоких валиков поверхностного эпителия, а в ряде случаев – формированием гиперплазмиогенных полипов.
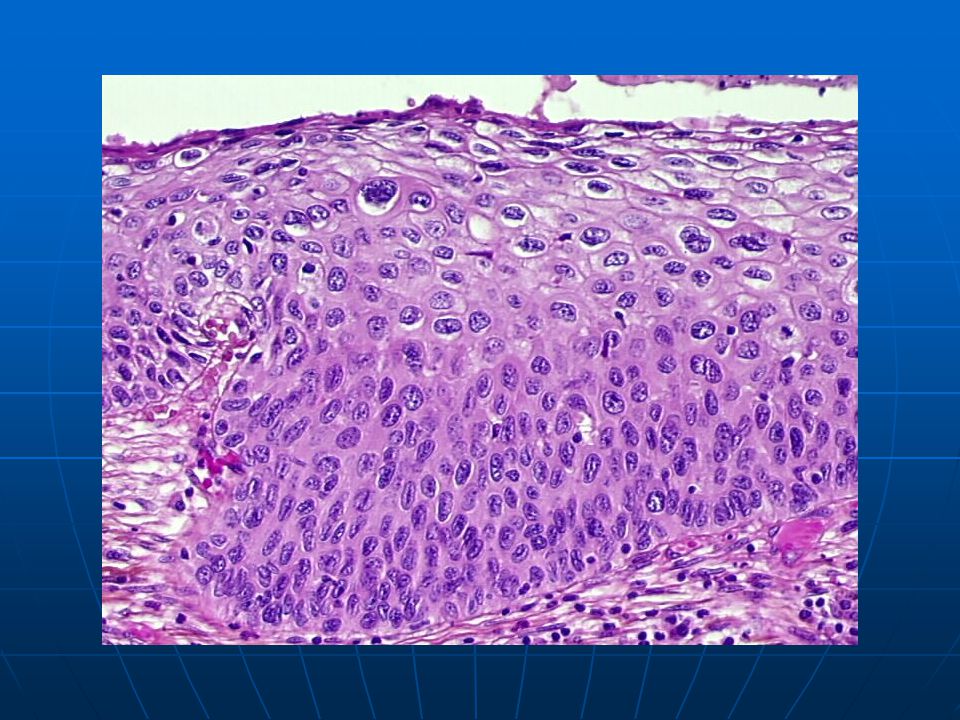 Скорее всего, причину развития этих гиперпластических процессов следует искать в механизмах регуляции постоянства клеточного состава СОЖ, связанных с регуляцией кислой секреции. Механизмы эти представлены контурами обратной связи, построенными на принципах паракринной регуляции. В них принимают участие такие известные кишечные гормоны, как гастрин, соматостатин, гистамин. Активность гастринпродуцирующих G–клеток желудка, расположенных в антральном отделе, регулируется уровнем кислотности желудочного сока. Повышение кислотности подавляет синтез и высвобождение гастрина, а снижение кислотности желудочного сока ведет к стимуляции продукции гастрина. Как известно, гастрин, с одной стороны, является активатором желудочной секреции, но, с другой стороны, он обладает трофическим действием на эпителий желудочно–кишечного тракта. Длительное подавление кислоты в желудке ведет к постоянному росту секреции гастрина, и факт этот хорошо известен [13]. В результате усиливается трофическое действие гастрина на эпителий желудка, что приводит к развитию в нем гиперпластических процессов.
Скорее всего, причину развития этих гиперпластических процессов следует искать в механизмах регуляции постоянства клеточного состава СОЖ, связанных с регуляцией кислой секреции. Механизмы эти представлены контурами обратной связи, построенными на принципах паракринной регуляции. В них принимают участие такие известные кишечные гормоны, как гастрин, соматостатин, гистамин. Активность гастринпродуцирующих G–клеток желудка, расположенных в антральном отделе, регулируется уровнем кислотности желудочного сока. Повышение кислотности подавляет синтез и высвобождение гастрина, а снижение кислотности желудочного сока ведет к стимуляции продукции гастрина. Как известно, гастрин, с одной стороны, является активатором желудочной секреции, но, с другой стороны, он обладает трофическим действием на эпителий желудочно–кишечного тракта. Длительное подавление кислоты в желудке ведет к постоянному росту секреции гастрина, и факт этот хорошо известен [13]. В результате усиливается трофическое действие гастрина на эпителий желудка, что приводит к развитию в нем гиперпластических процессов. В научной литературе имеются данные о возникновении полипов на слизистой оболочке желудка на фоне длительной поддерживающей терапии омепразолом [14]. Причем в отсутствие НР они развиваются достоверно чаще, чем у инфицированных [15]. Считается, однако, что эти процессы не обладают предраковым потенциалом [16], но требуют динамического наблюдения в дальнейшем.
В научной литературе имеются данные о возникновении полипов на слизистой оболочке желудка на фоне длительной поддерживающей терапии омепразолом [14]. Причем в отсутствие НР они развиваются достоверно чаще, чем у инфицированных [15]. Считается, однако, что эти процессы не обладают предраковым потенциалом [16], но требуют динамического наблюдения в дальнейшем.Заключение. Таким образом, основные клинические особенности ЯБ у пожилых больных могут быть представлены в виде следующих положений:
1. Частое поражение желудка (язва желудка –73%, язва 12–перстной кишки – 27%).
2. Чаще болеют мужчины, чем женщины (в 3,5 раза).
3. Манифестация заболевания и обострений в виде желудочного кровотечения – 52%.
4. Наклонность к частым и длительным обострениям – 76%.
5. Атипичный болевой синдром или его отсутствие – 78%.
6. Сочетание с ГЭРБ– 32%.
7. Сочетание с ИБС – 62,7%.
8. Отсутствие сезонности обострений – 82%.
И при назначении лекарственной терапии необходимо помнить особенности течения язвенной болезни у пожилых больных, этиопатогенез возникновения язвенного дефекта и тот факт, что на фоне длительного приема ИПП у больных пожилого возраста в слизистой оболочке желудка значительно чаще наблюдается процесс фовеолярной гиперплазии. Все вышеперечисленное приводит к необходимости разработки программы по лечению язвенной болезни у пожилых больных, учитывая данные особенности.
Литература
1. Андреева Л.И., Кожемякин Л.А., Кликун А.Ф. Лабораторное дело. 1988. №11 с.41–46.
2. Балуда В.П., Гольберг Е.Д. Лабораторные методы исследование гомеостаза. Томск, 1980. с.222–230.
3. Кузнецов М.Р., Звенигородская Л.А., Самсонова Н.Г. Сердечнососудистая хирургия. 1999 №4. с. 35–38.
4. Логинов А.С., Звенигородская Л.А. Особенности язвенной болезни у лиц с сопутствующей ишемической болезнью сердца. Тер. Архив. 1998 №2 с.9–13.
5. Логинов А.С., Звенигородская Л.А. Российский. Гастроэнтерологический журнал. 1995 №3 с.1–7.
Логинов А.С., Звенигородская Л.А. Российский. Гастроэнтерологический журнал. 1995 №3 с.1–7.
6. Погромов А.П., Маленевич А.В. Российский. Гастроэнтерологический журнал. 1995 №1 с.3–5.
7. Савельев В.С., Петухов В.А., Кузнецов М.Р. особенности висцерального кровообращения при хронической ишемической болезни огранов кровообращения и дислипидемии Грудная и сердечнососудистая хирургия. 1999 № 4 с.40–45.
8. Томпсон Г.Б. Руководство по гиперлипидемии. М, 1991. с. 105–115.
9. Циммерман Я.С. Клиническая медицина. 1992 №3 с.65–67.
10. Gamett W.Din. Cardiol. 1994 V. 17. P. 3–10.
11. Gotto A.M. Circulation. 1995 V.92. P. 646–652.
12. Smith H.T., Okubaitis L.A. et al. Hypertension. 1995. V.6. P. 375–382.
13. Schenk B., Kuipers E., Klikenberg–Knol EC et al. Hypergastrinemia during long–term omeprazole therapy: influence of vagal nerve function, gastric emptying and Helicobacter pylori infacion. //Aliment Pharmacol Ther. 1998.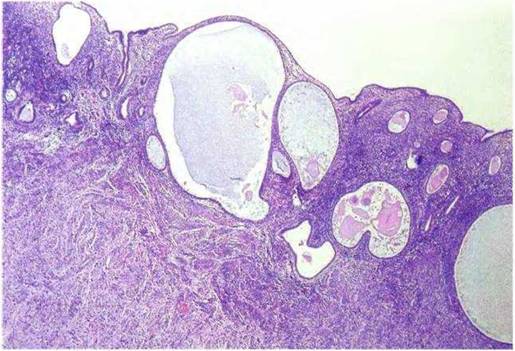 V.12.p.605–12.
V.12.p.605–12.
14. El–Zimaiti HTM, Jackson FW, Graham DY /Fundic gland polyps developing during omeprazole therapy.//Am.J.Gastroentrol 1997.v.92.p 1858–60.
15. Cats A., Schenk B., Bloemena E. Et al. /parietal cell protrucion and fundic glad cysts during omeprazole maintenance treatment.//Hum Pathol. 2000.v.31.N.6.p.684–90.
16. Proton pump inhibitor relabeling for cancer risk not warranted.//FDC Pink 1996.Nov.11. v.58.p.1–2.
.
Порекомендуйте статью вашим коллегам
Фовеолярная гиперплазия желудка: что это такое, лечение
При фовеолярной гиперплазии желудка количество клеток органа увеличивается, в результате чего слизистая оболочка утолщается, а со временем на ней появляются полипы. В случае возникновения симптомов заболевания необходимо незамедлительно обратиться к врачу и пройти обследование. Если диагноз подтвердится, начинать лечение нужно будет как можно быстрее.
Этиология заболевания
Фовеолярная гиперплазия не появляется сама по себе. Этому способствует воздействие ряда неблагоприятных факторов. Чаще всего патология развивается из-за неправильного питания и употребления продуктов, которые содержат канцерогены.
Также к развитию гиперплазии могут привести следующие факторы:
- хронические заболевания желудка – гастрит и язва;
- гормональный дисбаланс в организме;
- наследственные факторы;
- нарушенная микрофлора желудка, наличие бактерии Хеликобактер Пилори;
- чрезмерное потребление алкоголя;
- частые стрессовые ситуации;
- проблемы в функционировании нервной системы;
- продолжительный прием НПВП для лечения других заболеваний.
Что это такое – очаговая фовеолярная гиперплазия желудка? Это патология, при которой наблюдается чрезмерное деление желудочных клеток. Может страдать вся слизистая оболочка, эпителий или ткани органа или только отдельные очаги.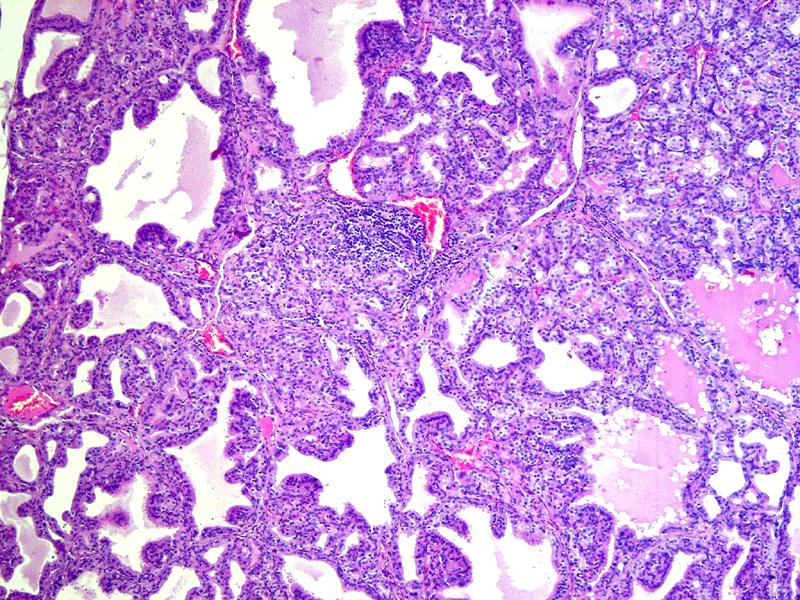 Если вовремя не лечить заболевание, в структуре клеток могут произойти изменения, они станут атипичными. В результате могут развиться злокачественные опухоли.
Если вовремя не лечить заболевание, в структуре клеток могут произойти изменения, они станут атипичными. В результате могут развиться злокачественные опухоли.
Механизм развития патологии
Развитие заболевания происходит в результате чрезмерного деления клеток. В норме процесс их деления является жизненно необходимым для нормального функционирования организма. Однако при воздействии определенных факторов они начинают делиться бесконтрольно, что приводит к разрастанию слизистой оболочки желудка.
При визуализации органа пищеварительной системы заметны деформации складок и увеличение их длины. Также внешние изменения касаются и желудочных ямок. Обычно на начальных стадиях патология обнаруживается случайно при плановом эндоскопическом обследовании.
Клинические проявления
Фовеолярная гиперплазия слизистой желудка опасна тем, что на начальных стадиях протекает бессимптомно и никак не дает о себе знать. А первые признаки заболевания появляются слишком поздно, уже может быть запущен онкологический процесс.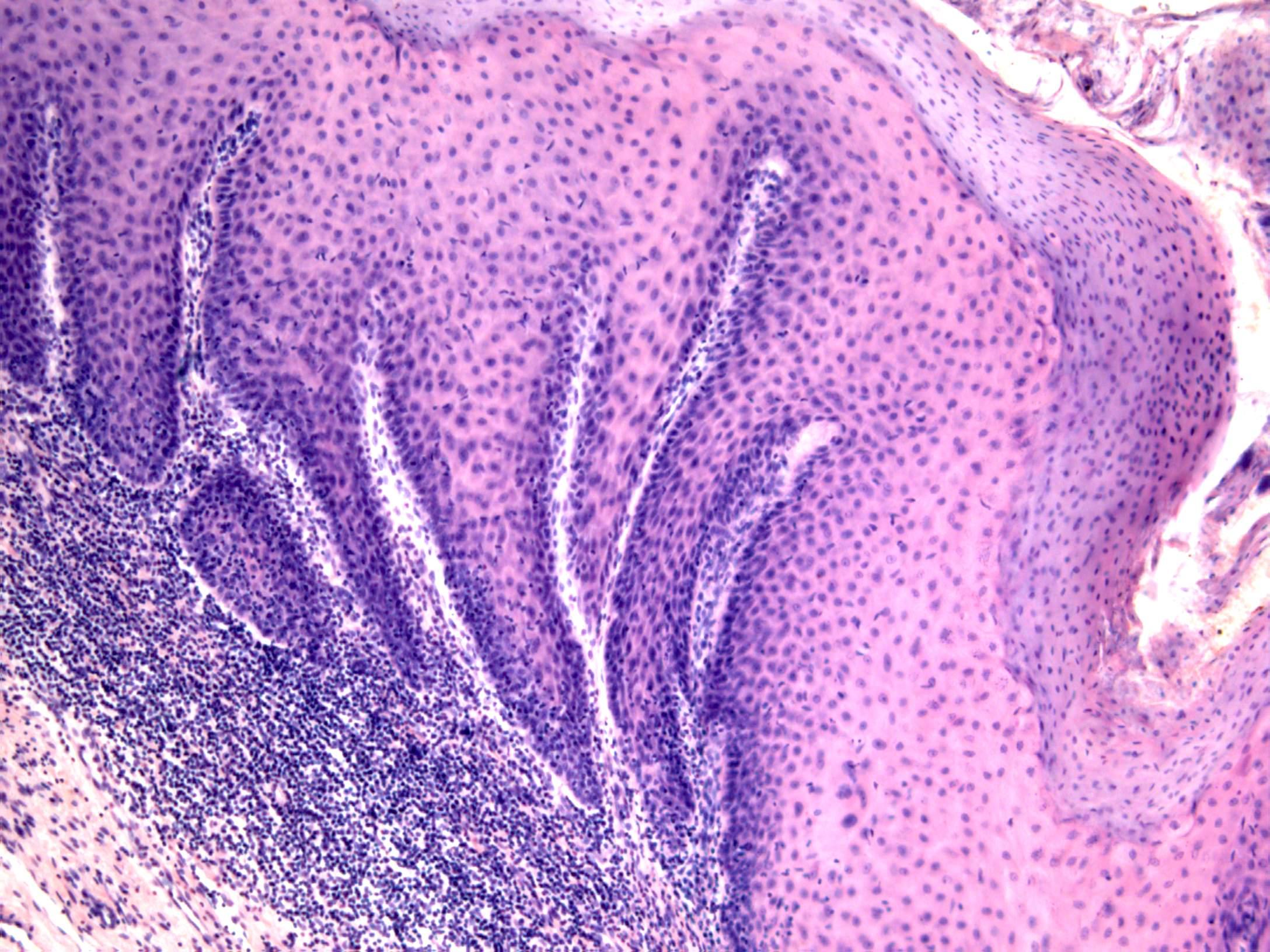
Притом для гиперплазии нет специфических симптомов. Она протекает так же, как многие другие заболевания желудка. О гиперплазии могут свидетельствовать следующие признаки:
- Выраженная боль в области живота. Она может быть временной, проявляться периодически, но в остальное время не беспокоить пациента. Но некоторых больных мучают постоянные нестерпимые боли, при которых наблюдается непроизвольное сокращение мышц живота.
- Нарушение пищеварения. Процесс переваривания и усвоения пищи может быть расстроен, из-за этого продукты начинают бродить. От этого может измениться консистенция каловых масс, появится метеоризм. Также возможен плохой аппетит и отрыжка с гнойным запахом.
- Тошнота, которая нередко переходит в рвоту.
- Бледность кожного покрова.
- Общее ухудшение самочувствия. Возможна слабость, головные боли, ломота в суставах.
- Повышение температуры тела до субфебрильных значений.
Одним из первых признаков заболевания может быть боль в ночное время.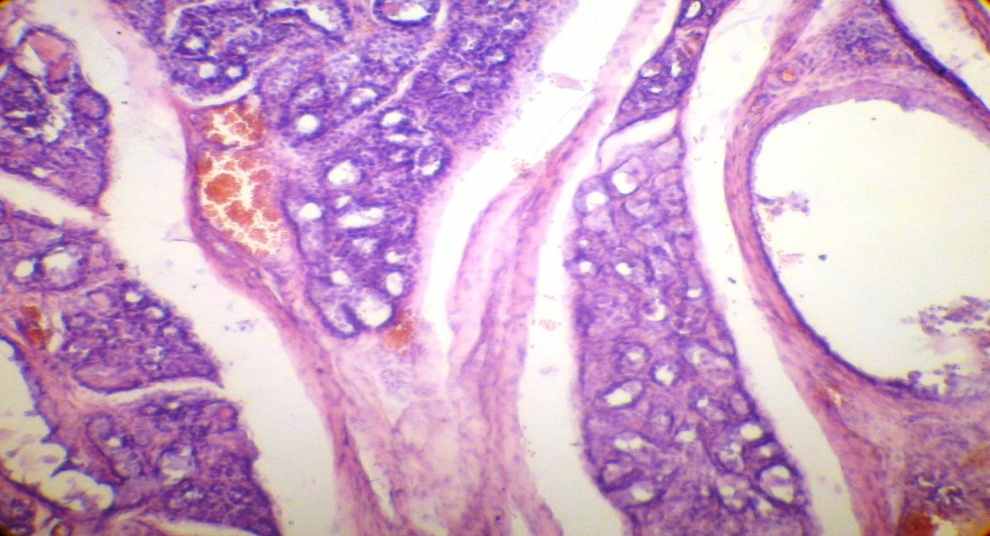 В особенности она может быть сильной, если человек не соблюдает режим приема пищи и кушает перед сном.
В особенности она может быть сильной, если человек не соблюдает режим приема пищи и кушает перед сном.
Диагностика
Если появились вышеперечисленные симптомы, необходимо отправиться на прием к гастроэнтерологу. Врач осмотрит пациента, расспросит его жалобы, назначит необходимые методы диагностики. Только после установки точного диагноза будет подобрана наиболее адекватная схема терапии.
Но в большинстве случае патологию выявляют случайно. Она протекает почти бессимптомно, поэтому обнаруживают ее либо при плановом осмотре, либо при подозрении на другие заболевания. Для постановки правильного диагноза назначаются следующие методы диагностики:
- ФГДС. Это самый эффективный способ обнаружить патологический процесс. Заключается во введении в желудок специального прибора с камерой на конце. Это позволяет специалисту увидеть наглядно стенки органа, определить степень его поражения. Посредством ФГДС можно оценить степень распространения патологического процесса, так как фовеолярная гиперплазия может затрагивать антральный отдел желудка, а также участки, которые относятся к кардии, телу и дну пищеварительного органа.
 Также во время ФГДС может быть проведена биопсия. Врач захватывает часть ткани слизистой желудка, которая в дальнейшем отправляется на гистологический анализ. Такая процедура позволяет определить, не начался ли злокачественный процесс в желудке.
Также во время ФГДС может быть проведена биопсия. Врач захватывает часть ткани слизистой желудка, которая в дальнейшем отправляется на гистологический анализ. Такая процедура позволяет определить, не начался ли злокачественный процесс в желудке. - Рентген. Больной выпивает специальное контрастное вещество. Через пару минут делают снимок желудка. Во время такой процедуры возможно определить степень деформации желудочных складок. Если есть полипы, определяются их форма и размеры.
- УЗИ. Определить непосредственно гиперплазию желудка при помощи такого метода невозможно. Однако УЗИ назначают в качестве дополнительного диагностического метода, чтобы определить первопричину патологического процесса.
Дополнительно могут быть назначены и другие диагностические мероприятия – общий анализ крови, мочи, кала.
Методы терапии
Лечение фовеолярной гиперплазии желудка должно быть комплексным. Обязательно назначаются медикаментозные препараты, которые можно совмещать с народными методами.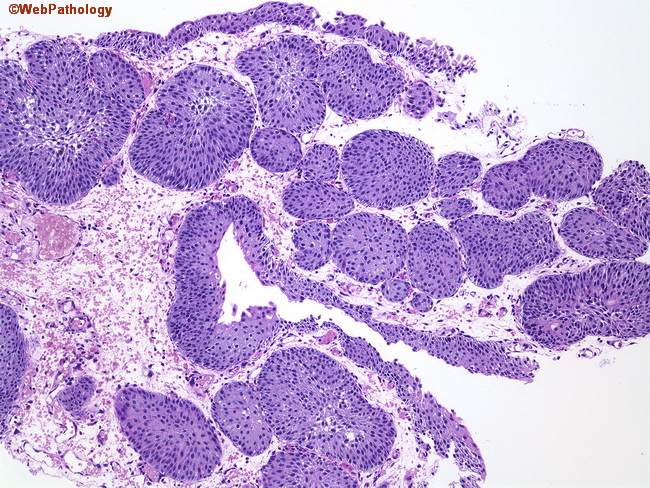 Также необходимо скорректировать питание. А если имеются полипы, может потребоваться их хирургическое удаление. Особенности лечения зависят от выраженности деформации желудочных складок.
Также необходимо скорректировать питание. А если имеются полипы, может потребоваться их хирургическое удаление. Особенности лечения зависят от выраженности деформации желудочных складок.
Медикаментозное
Как лечить фовеолярную гиперплазию желудка, определяет лечащий врач. На время терапии больной должен отказаться от других лекарств. В частности, гиперплазия нередко вызывается из-за приема НПВП. Поэтому такие препараты нужно обязательно исключить.
Если заболевание развилось из-за Хеликобактер Пилори, для ее уничтожения назначаются следующие лекарства:
- Антибиотики. Уничтожают вредоносную бактерию. Но вместе с тем могут негативно повлиять на микрофлору ЖКТ. Поэтому после курса антибиотиков необходимо обязательно пропить пробиотики и пребиотики.
- Препараты для уменьшения выработки желудочной кислоты. Повышенная кислотность также может быть одной из причин проблем с желудком.
- Средства с висмутом. Они являются противоязвенными и обладают бактерицидными свойствами в отношении Хеликобактер Пилори.

Если обнаружены наросты, врач проводит дополнительные исследования на злокачественность. Если онкологии нет, и новообразования небольшие по размеру, хирургическое вмешательство не назначается. Однако пациент должен будет регулярно проводить ФГДС, чтобы контролировать нарост. Если со временем его размер увеличится, может быть назначена операция.
Также хирургическое вмешательство может потребоваться в случае неэффективности проводимой медикаментозной терапии. Операция может быть открытой или эндоскопической в зависимости от особенностей протекания заболевания.
Народные способы лечения
При гиперплазии эпителия желудка фовеолярного типа можно использовать и средства народной медицины. Но использовать их можно только после предварительной консультации с лечащим врачом. Для эпителиальной ткани желудка полезны следующие средства:
- Отвар ромашки и перечной мяты. Необходимо взять по 1 ч.л. сырья, залить 500 мл кипятка. Проварить 15 минут на медленном огне.
 Затем процедить. Принимать, предварительно разбавив водой 1:3. Добавлять сахар и прочие подсластители не рекомендуется.
Затем процедить. Принимать, предварительно разбавив водой 1:3. Добавлять сахар и прочие подсластители не рекомендуется. - Имбирный чай. Для его приготовления необходимо вскипятить 0,5 л воды. Добавить корень имбиря длиной 4 см. Проварить 1 минуту, снять с огня. Добавить сок половины лимона и стручок кардамона. Принимать желательно без сахара. Для улучшения вкуса чая можно добавить немного меда, но уже в охлажденный напиток.
- Настой из корней петрушки. Чтобы его приготовить, необходимо 1 ст.л. измельченного сырья залить 200 мл крутого кипятка. Настаивать до остывания, затем процедить. Принимать по 1 ст.л. трижды в день до приема пищи.
Консультация с лечащим врачом является обязательной. Дело в том, что некоторые растения могут вызывать аллергические реакции и имеют ряд противопоказаний. Поэтому их использование может быть не рекомендованным для некоторых пациентов.
Роль питания в лечении патологии
При гиперплазии желудка особую роль необходимо уделить питанию.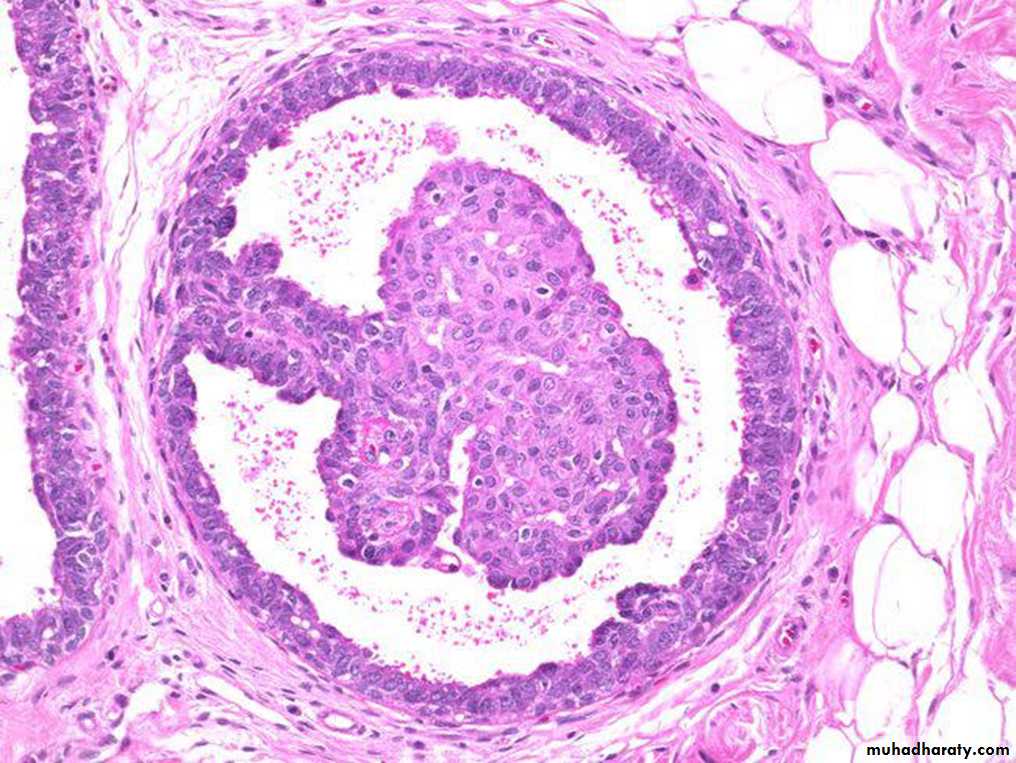 В большинстве случаев заболевание развивается в результате неправильного питания. Обязательно необходимо скорректировать рацион, в противном случае проводимая терапия может не дать никакого результата.
В большинстве случаев заболевание развивается в результате неправильного питания. Обязательно необходимо скорректировать рацион, в противном случае проводимая терапия может не дать никакого результата.
Пациентам с любой формой гиперплазии, в том числе и очаговой, необходимо соблюдать следующие правила приема пищи:
- Принимать пищу нужно небольшими порциями – не более 200 г за раз. Кушать часто – до 5-6 раз в сутки.
- Употреблять только такие продукты, которые не раздражают слизистую желудка. В рацион полезно включить любые каши, нежирные сорта мяса и рыбы, фрукты и овощи.
- Готовить пищу желательно на пару, запекать в духовке, варить или тушить.
- Употреблять можно только теплую еду. Слишком холодная или горячая пища может негативно повлиять на состояние слизистой оболочки.
- Исключить из рациона жареную, острую, копченую, маринованную пищу. Такие блюда раздражают слизистую желудка, поэтому могут замедлить выздоровление.
Если у человека диагностирована гиперплазия, он должен быть готов к тому, что ему придется в течение последующей жизни соблюдать диету по вышеперечисленным правилам.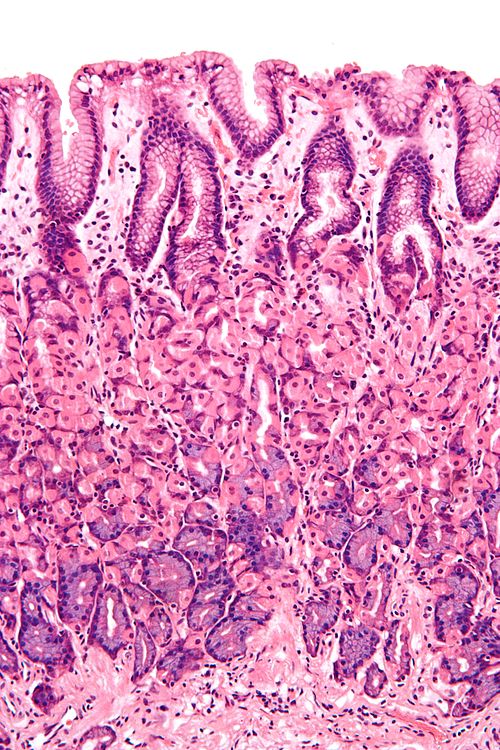 Это поможет предотвратить развитие рецидива в дальнейшем.
Это поможет предотвратить развитие рецидива в дальнейшем.
Возможные осложнения и прогноз
Если вовремя не лечить гиперплазию желудка, клетки могут переродиться и стать атипичными. В результате может начаться онкологический процесс. На ранних стадиях его можно вылечить, что обеспечит пятилетнюю выживаемость пациента. А если обнаружить рак желудка на 3-4 стадии, будет наблюдаться высокая вероятность смертельного исхода в течение 1 года.
Но фовеолярная гиперплазия очень редко перерождается в рак. Чаще наблюдаются другие осложнения заболевания. В частности, на слизистой могут образовываться полипы. Также может нарушиться процесс пищеварения, из-за чего в дальнейшем могут развиться другие заболевания пищеварительной системы.
Гиперплазия хорошо подается лечению даже в случае запущенных процессов. Но на ранних стадиях она лечится легче и быстрее.
Меры профилактики
Для профилактики развития гиперплазии необходимо следить за своим питанием. Нужно обязательно соблюдать режим приема пищи, кушать в одно и то же время.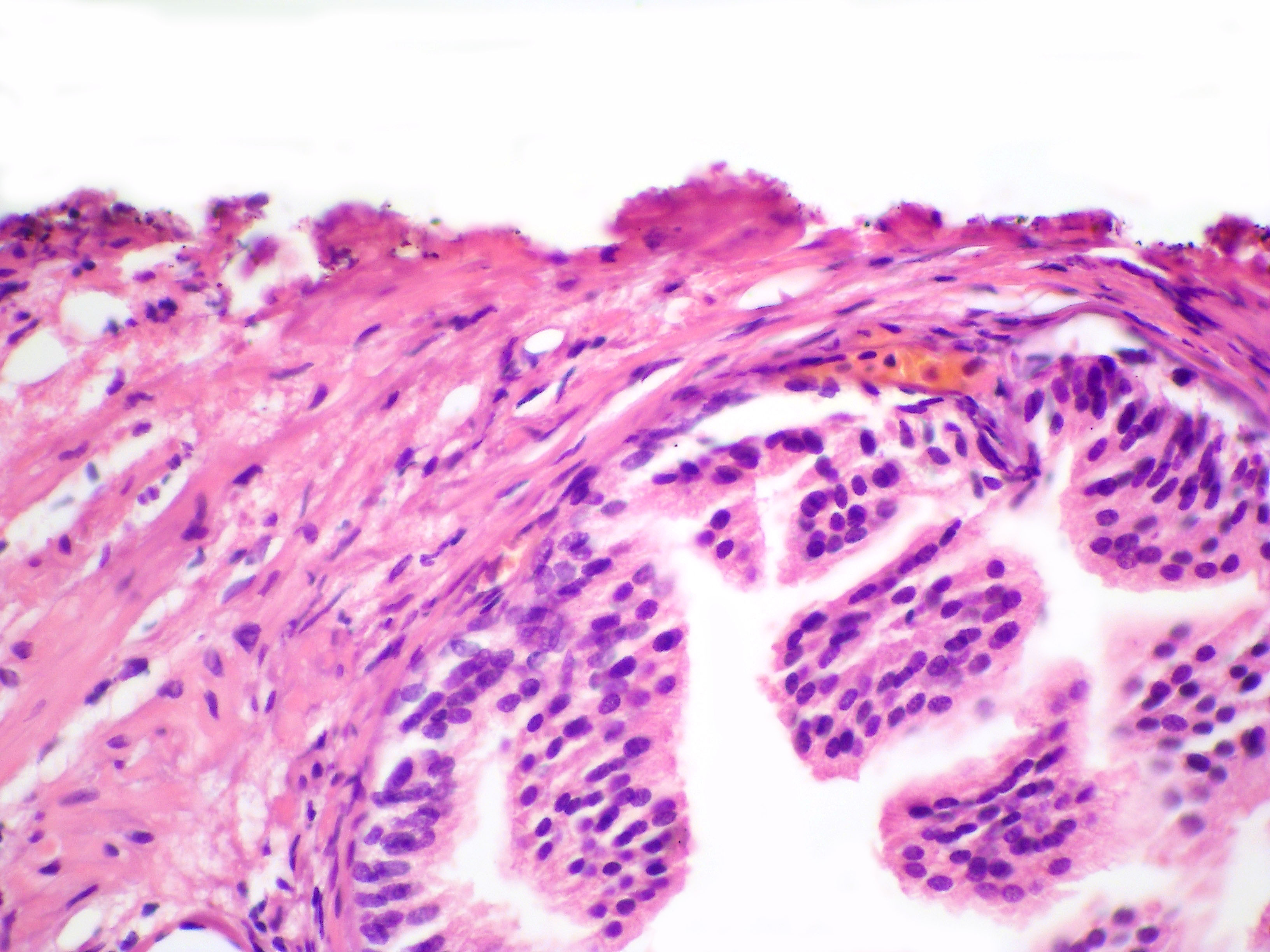 Рацион должен быть богатым и сбалансированным. По минимуму употреблять алкоголь и газированные напитки.
Рацион должен быть богатым и сбалансированным. По минимуму употреблять алкоголь и газированные напитки.
Также необходимо лечить любые другие заболевания желудка, строго следуя схеме лечения, назначенной врачом. Не допускать их хронизации, так как хронические патологии также могут стать причиной гиперплазии. Также в профилактических целях заболевания необходимо вести активный образ жизни и избегать стрессовых ситуаций.
Реактивная гастропатия | MyPathologyReport.ca
Эта статья поможет вам прочитать и понять отчет о патологии реактивной гастропатии.
, Джейсон Вассерман, доктор медицинских наук, FRCPC, рассмотрено нашими партнерами-пациентами 18 сентября 2020 г.
Факты:
- Реактивная гастропатия – это незлокачественное изменение желудка.
- Это означает, что клетки, выстилающие внутреннюю часть желудка, были повреждены веществами, которые обычно не встречаются в желудке.
- Причины включают рефлюкс желчи, нестероидные противовоспалительные препараты, алкоголь и курение.
- Другое название этого состояния – химическая гастропатия.
Функция и анатомия желудка
Желудок – часть пищеварительной системы. Это полый орган, расположенный посередине живота, чуть ниже ребер. Пища, которую мы едим, проходит изо рта в желудок по длинной трубке, называемой пищеводом. Попадая в желудок, он смешивается и расщепляется.Когда это будет завершено, переваренная пища переместится в тонкий кишечник. Желудок специально разработан, чтобы растягиваться, когда мы едим обильно, и сжиматься, когда он пустой.
Желудок делится на четыре части: кардия, дно, тело и привратник. Первая часть желудка, кардия, соединяется с пищеводом. Последняя часть желудка, привратник, соединяется с тонкой кишкой. Когда пища выходит из желудка и попадает в тонкий кишечник, она смешивается с жидкостями из печени (желчь) и поджелудочной железы (секреция поджелудочной железы), которые способствуют пищеварению.
Внутренняя поверхность желудка выстлана специализированными фовеолярными клетками. Фовеолярные клетки образуют барьер, называемый эпителием. Фовеолярные клетки производят вещество, называемое слизью, которое защищает ткань от сильных кислот, вырабатываемых внутри желудка. Под эпителием находится тонкий слой ткани, называемый собственной пластинкой. Патологи используют слово слизистая оболочка для описания эпителия и собственной пластинки вместе.
Клетки внутри желудка соединяются вместе, образуя длинные тонкие структуры, называемые железами.Эти железы простираются вниз от поверхности в собственную пластинку. Специализированные клетки у основания желез вырабатывают кислоту, которая наполняет желудок, и ферменты, которые помогают расщеплять пищу.
Что такое реактивная гастропатия?
Реактивная гастропатия – это незлокачественное изменение желудка. Это означает, что клетки, выстилающие внутреннюю часть желудка, были повреждены веществами, которые обычно не встречаются в желудке. Вещества повреждают фовеолярные клетки и не позволяют им производить слизь, необходимую для защиты желудка от кислоты.
Повреждение вызывает боль в животе, которая часто усиливается после еды. Если не лечить, реактивная гастропатия может привести к язве или кровотечению в желудке.
Другое название этого состояния – химическая гастропатия.
Что вызывает реактивную гастропатию?
Вещества, вызывающие реактивную гастропатию, могут поступать как изнутри тела, так и извне. Наиболее частой причиной реактивной гастропатии является перемещение желчи или секреции поджелудочной железы в желудок из тонкой кишки.Это называется рефлюксом. Другие причины включают алкоголь и нестероидные противовоспалительные препараты (НПВП). Также было показано, что курение вызывает реактивную гастропатию.
Как патологоанатомы ставят этот диагноз?
Диагноз реактивного гастрита ставится после того, как патолог исследует образец ткани изнутри желудка под микроскопом. Образец ткани удаляется в ходе процедуры, называемой биопсией. Биопсия обычно выполняется после того, как пациенту вводят успокоительное и в желудок вводят камеру, называемую эндоскопом.
Патологоанатомы ищут следующие признаки, чтобы поставить этот диагноз:
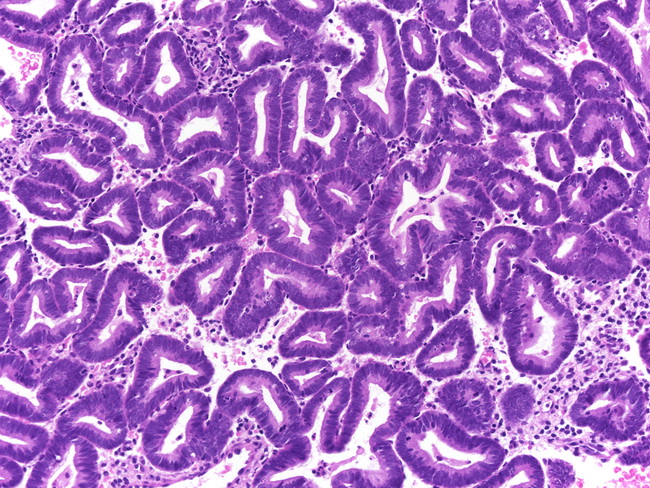
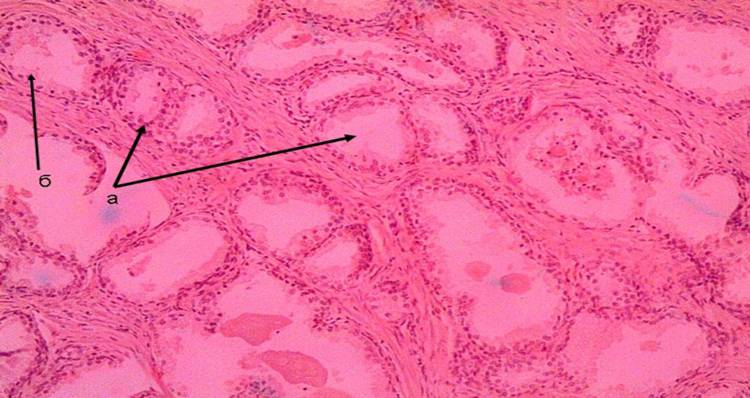
- Фовеолярная гиперплазия – Гиперплазия – это слово, которым патологи называют увеличенное количество клеток. Фовеолярная гиперплазия означает, что на внутренней поверхности желудка имеется повышенное количество фовеолярных клеток. Увеличенное количество клеток заставляет железы выглядеть скрученными. Патологи иногда описывают эти железы как имеющие вид «штопор». Также можно увидеть небольшие пальцеобразные выступы ткани, называемые ворсинками.
- Истощение муцина – Нормальные фовеолярные клетки полны муцина, который они выделяют для образования слизи. Истощение муцина означает, что фовеолярные клетки на внутренней поверхности желудка содержат меньше муцина, чем нормальные здоровые клетки.
- Эрозия – Эрозия – это слово, которое патологи используют для описания травмы, которая повреждает клетки на поверхности ткани. В желудке эрозия означает потерю фовеолярных клеток.
- Кишечная метаплазия – Кишечная метаплазия означает, что нормальный эпителий желудка заменен эпителием того типа, который обычно находится в тонкой кишке.Желудок подвергается этому изменению, чтобы защитить себя от желчи и секретов поджелудочной железы, попадающих в желудок из тонкой кишки.
Фовеолярная гиперплазия кардии желудка: распространенность и ассоциации
Цели: В антральном отделе и теле желудка фовеолярная гиперплазия является признаком реактивного гастрита, вызванного, например, дуоденогастральным рефлюксом желчи и применением нестероидных противовоспалительных препаратов (НПВП).Целью этого исследования было изучить возникновение и клиническую значимость фовеолярной гиперплазии желудка.
Методы: Исследуемая популяция была взята из последовательной серии из 1698 пациентов, отправленных на эндоскопию верхних отделов желудочно-кишечного тракта. Были включены только случаи без хронического гастрита или пищевода Барретта. Окончательная популяция исследования состояла из 307 пациентов.
Полученные результаты: Фовеолярная гиперплазия наблюдалась в слизистой оболочке сердца желудка у 31 (10%) пациента с гистологически нормальной слизистой оболочкой желудка, но ни у одного из них не было эндоскопически заметных гиперпластических полипов. По сравнению с пациентами без сердечной гиперплазии желудка, у пациентов с гиперплазией чаще наблюдались хроническое воспаление и полная кишечная метаплазия в биоптатах соединения (48% против 77% и 9% против 26% соответственно).Логистический регрессионный анализ показал, что хроническое воспаление сердца (отношение шансов (OR), 3,2; 95% доверительный интервал (CI), от 1,3 до 7,8) и кишечная метаплазия полного типа (OR, 2,8; 95% CI, от 1,1 до 7,1) были независимые факторы риска сердечной фовеолярной гиперплазии. В однофакторном анализе эндоскопический эрозивный эзофагит (гастроэзофагеальная рефлюксная болезнь с положительным результатом эндоскопии) и прием НПВП не были связаны с наличием фовеолярной гиперплазии.
Выводы: Фовеолярная гиперплазия слизистой оболочки сердца желудка возникает у пациентов с гистологически нормальными желудками, не связанными с гастритом, и может развиваться как следствие хронического воспаления, ограниченного гастроэзофагеальным переходом («юнктит»).Это не связано напрямую с положительной по результатам эндоскопии гастроэзофагеальной рефлюксной болезнью или применением НПВП.
Воспаление и фовеолярная гиперплазия уменьшаются дополнительным диетическим глутамином во время инфекции Helicobacter pylori у мышей | Журнал питания
Абстрактные
Мы недавно показали, что L-Gln защищает культивируемые клетки желудка от гибели клеток, вызванной аммиаком, и предсказали, что Gln может также защищать во время инфекции Helicobacter pylori in vivo.Таким образом, цель этого исследования состояла в том, чтобы проверить, защищает ли дополнительный диетический Gln от патологии, ассоциированной с H. pylori . Для этого мышей C57BL / 6 кормили очищенной диетой, состоящей из 20,3% белка (1,9% Gln), 66% углеводов и 5% жира или 25,3% белка (5% дополнительного L-Gln; 6,9% общего Gln) 61. % углеводов и 5% жиров. После 2-недельного периода кормления мышей делили на фиктивные (неинфицированные) группы или группы, инфицированные H. pylori . Еженедельно регистрировали массу тела и потребление пищи.Гистопатологию тканей, колонизацию H. pylori , сывороточный IgG, а также экспрессию мРНК про- и противовоспалительных цитокинов определяли через 6, 12 и 20 недель после инфицирования (wkPI). Воспаление, противовоспалительный цитокин и экспрессия мРНК интерлейкина-1 β были значительно выше через 6 недель у мышей, инфицированных H. pylori , получавших дополнительный Gln, по сравнению с мышами, получавшими контрольную диету. Однако через 20 недель после первого дня воспаление и фовеолярная гиперплазия были значительно ниже у H.pylori -инфицированных мышей, получавших дополнительный Gln, по сравнению с мышами, получавшими контрольную диету. Прирост массы тела, потребление пищи, колонизация H. pylori и сывороточный IgG не различались у мышей, инфицированных H. pylori , получавших дополнительный Gln, по сравнению с контрольной диетой. Наши данные демонстрируют, что мыши, инфицированные H. pylori , получавшие дополнительный Gln, снизили патологию, ассоциированную с H. pylori , in vivo, что сопровождается благоприятными изменениями иммунного ответа на H.pylori на ранней стадии заражения. Таким образом, добавление Gln может быть альтернативной терапией для уменьшения патологии, ассоциированной с H. pylori .
Введение
Helicobacter pylori – это грамотрицательные бактерии спиралевидной формы, заражающие более половины населения мира. Они высвобождают многочисленные цитотоксины, в том числе аммиак, вакуолизирующий цитотоксин А, липополисахарид и белки острова патогенности цитотоксин-ассоциированного гена, которые являются основными факторами риска развития пептических (желудочных) и верхних язв тонкой кишки (двенадцатиперстной кишки).Кроме того, H. pylori был определен ВОЗ как канцероген группы 1 и как таковой значительно увеличивает риск развития рака желудка у инфицированных лиц (1,2). Примерно 5,5% глобального бремени рака связано с инфекцией H. pylori (2), и ежегодно регистрируется более 900 000 новых случаев рака желудка. Рак желудка также является второй по частоте причиной смерти от рака во всем мире (3). Несмотря на широкое использование лечения антибиотиками для уничтожения H.pylori , который уменьшает вызванное H. pylori воспаление (гастрит), которое способствует развитию рака, распространенность рака желудка остается высокой в Северной Америке среди иммигрантов из некоторых регионов Центральной и Южной Америки и Дальнего Востока, а также в различных географических точках в некоторые развивающиеся страны (3,4). Текущие рекомендации по лечению рекомендуют тройную терапию первой линии в течение 7–10 дней с ингибитором протонной помпы и комбинацией кларитомицина, амоксициллина, тетрациклина или метронидазола (4).Схемы лечения для эрадикации H. pylori были недавно пересмотрены, и сообщалось, что их эффективность снижается в значительной степени из-за лекарственно-устойчивых штаммов H. pylori (4). Проблемы с лекарственной устойчивостью, стоимостью, побочными эффектами лечения и соблюдением режима лечения ухудшают стратегии массового лечения, и эрадикационная терапия не рекомендуется для пациентов с инфекцией H. pylori , у которых отсутствуют симптомы или имеется диспепсия без язвенной болезни (4). Таким образом, высок интерес к разработке вакцины (5), а также диетических подходов, которые уменьшают воспаление, связанное с инфекцией, и поражения слизистой оболочки, указывающие на предраковый каскад.С этой целью исследуются новые альтернативные подходы с использованием пробиотиков (6), чеснока (7), сульффорофана (8) и рисовой жидкости (9).
Недавно мы показали, что l-глутамин (Gln) защищает клетки слизистой оболочки желудка крыс от гибели клеток, вызванной аммиаком, и предположили, что он может защитить от повреждения слизистой оболочки во время инфекции H. pylori in vivo (10). Аммиак высвобождается с помощью H. pylori для выживания и отрицательно влияет на целостность слизистой оболочки, вызывая гибель клеток (10,11), подавляет восстановление после повреждения (12) и опосредует процессинг окклюдина в плотных контактах, разрушая барьер слизистой оболочки (13).Считается, что нарушение целостности слизистой оболочки приводит к хроническому воспалению, которое вызывает дальнейшее нарушение барьера, повреждение слизистой оболочки и воспаление. Воспаление во время инфекции H. pylori приводит к выработке многочисленных цитокинов и хемокинов, которые не только поддерживают воспалительную среду, но и способствуют прогрессированию рака.
Поверхностный гастрит с последующим атрофическим гастритом, метаплазией, дисплазией и карциномой были признаны Correa et al. (14) как путь во время H.pylori , которая приводит к прогрессированию рака. Хроническая инфекция H. pylori мышей с адаптированным к мышам человеческим штаммом H. pylori Sydney (SS1) 6 приводит к гиперпластическому гастриту, моделирующему ранние события в прогрессировании рака у человека (14,15). Это хорошая модель для проверки эффективности диетического вмешательства при патологии, вызванной H. pylori , которая может иметь отношение к заболеванию человека. Таким образом, наше исследование было разработано для оценки роли Gln в снижении уровня H.pylori на модели мышей SS1. Вторая цель этого исследования состояла в том, чтобы проверить, поддерживает ли диетический Gln иммунный ответ, связанный с T-хелпером (T H ) 2, а не смещенный T H 1, на H. pylori , который, как было показано, ограничить повреждение слизистой оболочки и патологий, связанных с H. pylori , при наличии инфекции.
Материалы и методы
Животные.
Животные, использованные для этого исследования, содержались в соответствии с руководящими принципами Комитета по животным в Медицинском центре Бет Исраэль Дьяконисса и Массачусетского технологического института, а также руководящими принципами, подготовленными комитетом по уходу и использованию лабораторных животных NRC.Исследования также проводились с одобрения комитета IACUC в каждом учреждении в соответствии с утвержденными протоколами. Мыши C57BL / 6 (самки), не содержащие Helicobacter spp, Citrobacter rodentium , Salmonella spp, эндопаразитов и антитела к вирусным патогенам, были получены в возрасте 8 недель от Taconic Farms. Мышей содержали в клетках с микроизолятором в учреждении, аккредитованном AAALAC.
Экспериментальные диеты.
По прибытии в помещение для животных 105 мышей случайным образом разделили на 2 диетические группы.Первая группа, состоящая из 45 мышей, получала диету для грызунов AIN-76A (16,17), которая была контрольной диетой. Вторая группа, состоящая из 60 мышей, получала диету для грызунов AIN-76A с добавлением 5% l-Gln. Диета с Gln поддерживала энергетический баланс на уровне 16,3 кДж / г, но белок был увеличен на 5% до 25,3 г / 100 г за счет добавления l-Gln, а уровень углеводов был снижен на 5% до 61,0 г / 100 г за счет снижения содержания сахарозы. Жир в обеих диетах был постоянным и составлял 5 г / 100 г. Очищенные компоненты, используемые для приготовления каждой диеты, были идентичными, так что единственная разница заключалась в процентном содержании L-Gln, которое составляло ~ 1.9 г / 100 г в контрольной диете и 6,9 г / 100 г в диете Gln. Диета Gln также содержала светло-желтый краситель, так что ее можно было легко идентифицировать как тестируемую диету. Все диеты были произведены Research Diets. Массу тела, прирост массы тела и потребление пищи рассчитывали еженедельно, от 2 недель до заражения до 20 недель после заражения (wkPI).
Бактерии.
SS1, используемый для оральной инокуляции, выращивали в бульоне Brucella при 37 ° C в микроаэробных условиях в 5% фетальной сыворотке теленка, как описано Lee et al.(15). Бактерии собирали через 48 часов роста, ресуспендировали в PBS и оценивали с помощью окрашивания по Граму и фазовой микроскопии на чистоту, морфологию и подвижность. Кроме того, бактерии были протестированы на уреазную, каталазную и оксидазную активность.
Экспериментальная инфекция.
После 2-недельного периода уравновешивания рациона мыши в каждой группе диеты были либо ложно инфицированы (не инфицированы), либо инфицированы H. pylori . Что касается контрольной диеты, 15 мышей были ложно инфицированы (UCont), а 30 мышей были инфицированы H.pylori (HPCont). Для диеты Gln 20 мышей были ложно инфицированы (UGln), а 40 мышей были инфицированы H. pylori (HPGln). Измерения массы тела и количество корма, потребляемого на клетку (5 мышей на клетку), определяли еженедельно. Ткани антрального отдела и тела были взяты через 6, 12 и 20 недель на дюйм для количественного культивирования, ELISA, количественной ПЦР и ПЦР в реальном времени, гистопатологической оценки и иммуноцитохимии. Количество мышей, используемых в каждую экспериментальную временную точку, было следующим: 4–5 UCont, 5–7 UGln и 10 HPCont были использованы на 6, 12 и 20 неделях, а 10, 12 и 15 HPGln были использованы на 6, 12 и 20 недель на дюйм соответственно.Несколько исходных мышей умерли после кровотечения, получив в ходе эксперимента титры H. pylori .
Количественная культура.
ДНКэкстрагировали из тела желудка с использованием реагента TRI (Sigma Aldrich), а колонизацию H. pylori количественно оценивали с помощью флуорогенного ПЦР-анализа в реальном времени (18).
ELISA-анализ для измерения постинфекционных антител IgG2c (T
H 1-like) и IgG1 (T H 2-like) антител в сыворотке.Образцы сыворотки были собраны у мышей в каждой диетической группе при 6, 12 и 20 неделях на дюйм и хранили при -20 ° C до использования. Методы ELISA с использованием белков внешней мембраны из H. pylori были описаны ранее (19,20) и были выполнены без изменений.
Анализ RT-PCR в реальном времени для экспрессии мРНК цитокинов в тканях желудка.
Суммарная РНК была извлечена из корпуса с использованием реагента TRI, а затем преобразована в кДНК с использованием набора High Capacity cDNA Archive (Applied Biosystems).Коммерчески доступные праймеры и смесь зондов для провоспалительных и противовоспалительных цитокинов были приобретены в Applied Biosystems. Экспрессию каждого целевого гена нормализовали по глицеральдегид-3-фосфатдегидрогеназе (GAPDH), и результаты рассчитывали по методу – ΔΔ C T (21, 22).
Гистопатологическая оценка.
Исследуемые ткани состояли из двух срезов, взятых по малой кривизне, начиная с плоскоколонного перехода и заканчивая гастродуоденальным переходом.Ткани желудка фиксировали 10% нейтральным забуференным формалином, заливали парафином, делали срезы и затем окрашивали гематоксилином и эозином. Гистопатология желудка оценивалась с использованием парадигмы, разработанной Rogers et al. (23).
Иммуноцитохимия-парафиновые срезы.
Парафиновые срезы готовили стандартными методами, как описано выше. Для иммуноокрашивания срезы депарафинизировали, а затем гидратировали. Демаскирование антигена проводили с использованием цитратного буфера, а затем активность эндогенной пероксидазы блокировали с использованием 3% H 2 O 2 , а эндогенный авидин-биотин блокировали с использованием набора для блокирования (Vector).Окрашивание антител проводили с использованием анти-Ki67, маркера ядерной пролиферации (NeoMarkers). Экспрессию антител визуализировали после инкубации с диаминобензадином, содержащим 3% H 2 O 2 , а затем ткани контрастировали с использованием гематоксилина. Изображения были получены с помощью микроскопа Nikon TE300, оснащенного камерой CCD Hamamatsu Orca, и данные о пролиферации были получены путем подсчета количества положительных клеток на область слизистой оболочки тела с использованием программного обеспечения IP lab (Scanalytics).
Статистический анализ.
Результаты выражены как средние значения ± стандартная ошибка среднего. Все данные были проанализированы с использованием двухфакторного дисперсионного анализа в течение определенного периода времени (диета × инфекция в каждый момент времени) и для сравнения различий в лечении диетой с течением времени у неинфицированных или инфицированных H. pylori мышей (время × диета в пределах инфекции). группа). Единственным исключением были данные о пролиферации при 12 неделях на дюйм, которые были проанализированы с помощью двухфакторного дисперсионного анализа по рангам из-за неравных дисперсий. Различия между средними значениями определялись с помощью теста Стьюдента-Ньюмана-Кеулса и считались значимыми при P <0.05. Все статистические анализы были выполнены с использованием программного обеспечения Sigma Stat (Systat Software).
Результаты
Масса тела, прибавка в весе и прием пищи.
Масса тела мышейHPGln была значительно ниже, чем у мышей во всех других группах, при 20 неделях на дюйм (таблица 1). Этот результат может быть обусловлен, по крайней мере частично, значительно более низкой начальной массой тела мышей HPGln (таблица 1). Прирост массы тела, однако, не отличался у неинфицированных мышей по сравнению с инфицированными мышами или у мышей, получавших контрольную диету по сравнению с диетой с добавлением Gln, при 6, 12 или 20 неделях после инъекции (таблица 1).Поскольку масса тела, прирост массы тела или потребление пищи не различались по HPCont по сравнению с мышами HPGln при 12 нед. Однако отсутствие строгого режима парного кормления является потенциальным недостатком исследования. Расчетное потребление Gln у мышей UGln и HPGln составило 6,39 г · кг -1 · сут -1 и 6,47 г · кг -1 · сут -1 , соответственно.
ТАБЛИЦА 1Масса тела, увеличение массы тела и потребление пищи у неинфицированных и человек H.pylori -инфицированные мыши в возрасте 20 недель / л, получавшие контрольную диету или диету с добавлением Gln 1
| Лечение . | Масса тела 0 недель ИП 2 . | Масса тела 20 недель / дюйм . | Увеличение массы тела . | Прием пищи . | |||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| г | |||||||||||
| UCont | 19.63 ± 0,26 а | 34,52 ± 2,46 а | 16,72 ± 2,49 | 3,01 ± 0,17 a | |||||||
| UGln | 19,29 ± 0,22 | 14,91 ± 0,93 | 2,78 ± 0,07 b | | ||||||||
| HPCont | 19,50 ± 0,18 a | 33,76 ± 0,55 a | 15,92 ± 0,66 | 15,92 ± 0,66 | 2,77 b | 18.99 ± 0,15 b | 29,79 ± 1,12 b | 12,65 ± 1,27 | 2,73 ± 0,20 b | ||
| Лечение . | Масса тела 0 недель ИП 2 . | Масса тела 20 недель / дюйм . | Увеличение массы тела . | Прием пищи . | |||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| г | |||||||||||
| UCont | 19.63 ± 0,26 а | 34,52 ± 2,46 а | 16,72 ± 2,49 | 3,01 ± 0,17 a | |||||||
| UGln | 19,29 ± 0,22 | 14,91 ± 0,93 | 2,78 ± 0,07 b | | ||||||||
| HPCont | 19,50 ± 0,18 a | 33,76 ± 0,55 a | 15,92 ± 0,66 | 15,92 ± 0,66 | 2,77 b | 18.99 ± 0,15 b | 29,79 ± 1,12 b | 12,65 ± 1,27 | 2,73 ± 0,20 b | ||
Масса тела, прирост массы тела и потребление пищи у неинфицированных и человек H. pylori -инфицированные мыши в возрасте 20 недель / л, получавшие контрольную диету или диету с добавлением Gln 1
| Лечение . | Масса тела 0 недель ИП 2 . | Масса тела 20 недель / дюйм . | Увеличение массы тела . | Прием пищи . | |||||
|---|---|---|---|---|---|---|---|---|---|
| г | |||||||||
| UCont | 19,63 ± 0,26 а | 34,52 ± 2,46 а | 16,72 | UGln | 19,29 ± 0,22 a | 32,31 ± 1,13 a | 14.91 ± 0,93 | 2,78 ± 0,07 b | |
| HPCont | 19,50 ± 0,18 a | 33,76 ± 0,55 a | 15,92 ± 0,66 | 15,92 ± 0,66 | 2,77 b 0,09 | 18,99 ± 0,15 b | 29,79 ± 1,12 b | 12,65 ± 1,27 | 2,73 ± 0,20 b |
| Лечение . | Масса тела 0 недель ИП 2 . | Масса тела 20 недель / дюйм . | Увеличение массы тела . | Прием пищи . | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| г | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| UCont | 19,63 ± 0,26 а | 34,52 ± 2,46 а | 16,72 | UGln | 19.29 ± 0,22 a | 32,31 ± 1,13 a | 14,91 ± 0,93 | 2,78 ± 0,07 b | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| HPCont | 19,50 ± 0,18 a | 2,77 ± 0,09 b | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| HPGln | 18,99 ± 0,15 b | 29,79 ± 1,12 b | 12,65 ± 1,23 | H.pylori колонизация.||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| . | 6 недель / дюйм . | 12 недель / дюйм . | 20 недель / дюйм . | |||||
|---|---|---|---|---|---|---|---|---|
| T H 1 цитокин | Отношение к GAPDH 2 | |||||||
| Интерферон- γ | HP89 ± 0,27 a | 34,90 ± 0,68 b | 36,31 ± 0,44 c | |||||
| HPGln | 32,32 ± 0,44 a | 34,47 ± 0,47 b | ||||||
| Фактор некроза опухоли- α | ||||||||
| HPCont | 36,35 ± 0,12 a | 37,93 ± 0.29 b | 38,41 ± 0,26 b | |||||
| HPGln | 36,75 ± 0,26 a | 37,88 ± 0,23 b | 38,36 ± 0,23 b | 38,36 ± 0,19 b | ||||
| HPCont | 38,28 ± 0,22 a | 39,92 ± 0,29 b | 40,47 ± 0,24 b | HP10 ± 0,20 a * | 39,78 ± 0,22 b | 40,07 ± 0,20 b | ||
| T H 2 цитокин | 9028 | |||||||
| HPCont | 30,13 ± 0,35 | 30,43 ± 0,38 | 30,63 ± 0,17 | |||||
| HPGln | 31,16 ± 0,27 * | 30.72 ± 0,19 | 31,23 ± 0,18 | |||||
| ИЛ-10 | ||||||||
| HPCont | 34,61 ± 0,26 a | 35,92 ± 0,17 б | ||||||
| HPGln | 35,66 ± 0,28 * | 35,30 ± 0,14 * | 35,43 ± 0,16 | |||||
| TGF β | 64 ± 0,12 а | 38,27 ± 0,06 б | 38,64 ± 0,18 b | |||||
| HPGln | 38,07 ± 0,14 ab * | 37,75 ± 0,15 * | 37,75 ± 0,15 б | |||||
| . | 6 недель / дюйм . | 12 недель / дюйм . | 20 недель / дюйм . | |||||
|---|---|---|---|---|---|---|---|---|
| T H 1 цитокин | Отношение к GAPDH 2 | |||||||
| Интерферон- γ | HP89 ± 0,27 a | 34,90 ± 0,68 b | 36,31 ± 0,44 c | |||||
| HPGln | 32,32 ± 0,44 a | 34,47 ± 0,47 b | ||||||
| Фактор некроза опухоли- α | ||||||||
| HPCont | 36,35 ± 0,12 a | 37,93 ± 0.29 b | 38,41 ± 0,26 b | |||||
| HPGln | 36,75 ± 0,26 a | 37,88 ± 0,23 b | 38,36 ± 0,23 b | 38,36 ± 0,19 b | ||||
| HPCont | 38,28 ± 0,22 a | 39,92 ± 0,29 b | 40,47 ± 0,24 b | HP10 ± 0,20 a * | 39,78 ± 0,22 b | 40,07 ± 0,20 b | ||
| T H 2 цитокин | 9028 | |||||||
| HPCont | 30,13 ± 0,35 | 30,43 ± 0,38 | 30,63 ± 0,17 | |||||
| HPGln | 31,16 ± 0,27 * | 30.72 ± 0,19 | 31,23 ± 0,18 | |||||
| ИЛ-10 | ||||||||
| HPCont | 34,61 ± 0,26 a | 35,92 ± 0,17 б | ||||||
| HPGln | 35,66 ± 0,28 * | 35,30 ± 0,14 * | 35,43 ± 0,16 | |||||
| TGF β | 64 ± 0,12 а | 38,27 ± 0,06 б | 38,64 ± 0,18 b | |||||
| HPGln | 38,07 ± 0,14 ab * | 37,75 ± 0,15 * | 37,75 ± 0,15 b | |||||
Tissue T H 1 и T H 2 Экспрессия мРНК цитокина у мышей, инфицированных H. pylori , на 6, 12 и 20 неделях, получавших контрольную диету или диету с добавлением Gln 1
| . | 6 недель / дюйм . | 12 недель / дюйм . | 20 недель / дюйм . | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| T H 1 цитокин | Отношение к GAPDH 2 | ||||||||||
| Интерферон- γ | 34,90 ± 0,68 б | 36,31 ± 0.44 c | |||||||||
| HPGln | 32,32 ± 0,44 a | 34,47 ± 0,47 b | 35,62 ± 0,34 b | ||||||||
| 9028 9028 | 9028 9028 | ||||||||||
| HPCont | 36,35 ± 0,12 a | 37,93 ± 0,29 b | 38,41 ± 0,26 b | ||||||||
| HPGln | 36.75 ± 0,26 a | 37,88 ± 0,23 b | 38,36 ± 0,19 b | ||||||||
| IL-1 β | |||||||||||
| 39,92 ± 0,29 b | 40,47 ± 0,24 b | ||||||||||
| HPGln | 39,10 ± 0,20 a * | 39,78 ± 0,22 | 07 ± 0.20 b|||||||||
| T H 2 цитокин | |||||||||||
| IL-4 | |||||||||||
| 30,63 ± 0,17 | |||||||||||
| HPGln | 31,16 ± 0,27 * | 30,72 ± 0,19 | 31,23 ± 0,18 | ||||||||
| IL-10 | 61 ± 0,26 а | 35,92 ± 0,17 b | 35,68 ± 0,15 b | ||||||||
| HPGln | 35,66 ± 0,28 * | 35,30 ± 0,14 * | 35,30 ± 0,14 * | β | |||||||
| HPCont | 37,64 ± 0,12 a | 38,27 ± 0,06 b | 38,64 ± 0,18 b | 38,64 ± 0,18 b | 07 ± 0,14 ab * | 37,75 ± 0,15 a * | 38,30 ± 0,15 b | ||||
| . | 6 недель / дюйм . | 12 недель / дюйм . | 20 недель / дюйм . | |||||
|---|---|---|---|---|---|---|---|---|
| T H 1 цитокин | Отношение к GAPDH 2 | |||||||
| Интерферон- γ | HP89 ± 0,27 a | 34,90 ± 0,68 b | 36,31 ± 0,44 c | |||||
| HPGln | 32,32 ± 0,44 a | 34,47 ± 0,47 b | ||||||
| Фактор некроза опухоли- α | ||||||||
| HPCont | 36,35 ± 0,12 a | 37,93 ± 0.29 b | 38,41 ± 0,26 b | |||||
| HPGln | 36,75 ± 0,26 a | 37,88 ± 0,23 b | 38,36 ± 0,23 b | 38,36 ± 0,19 b | ||||
| HPCont | 38,28 ± 0,22 a | 39,92 ± 0,29 b | 40,47 ± 0,24 b | HP10 ± 0,20 a * | 39,78 ± 0,22 b | 40,07 ± 0,20 b | ||
| T H 2 цитокин | 9028 | |||||||
| HPCont | 30,13 ± 0,35 | 30,43 ± 0,38 | 30,63 ± 0,17 | |||||
| HPGln | 31,16 ± 0,27 * | 30.72 ± 0,19 | 31,23 ± 0,18 | |||||
| ИЛ-10 | ||||||||
| HPCont | 34,61 ± 0,26 a | 35,92 ± 0,17 б | ||||||
| HPGln | 35,66 ± 0,28 * | 35,30 ± 0,14 * | 35,43 ± 0,16 | |||||
| TGF β | 64 ± 0,12 а | 38,27 ± 0,06 б | 38,64 ± 0,18 b | |||||
| HPGln | 38,07 ± 0,14 ab * | 37,75 ± 0,15 * | 37,75 ± 0,15 b | |||||
Гистопатология.
Все мыши, инфицированные H. pylori , имели четко установленные гистопатологические изменения в желудке, включая воспаление, гиперплазию и атрофию, независимо от диетического лечения.Однако мыши HPGln и HPCont различались двумя важными способами. Во-первых, воспаление было значительно сильнее при 6 неделях и ниже при 20 неделях в HPGln по сравнению с мышами HPCont. Кроме того, высокий уровень воспаления на 6-й неделе у мышей HPGln не увеличивался далее. Напротив, воспаление значительно увеличилось с 6 до 12 нед. У всех мышей, инфицированных H. pylori , воспаление было наиболее выраженным в подслизистой оболочке и собственной пластинке, окружающей основание желудочных желез (рис.2). Воспаление было диффузным у мышей HPCont на 6-й неделе (фиг. 2A, B) и 12-й нед. Это контрастирует с диффузной картиной воспаления, обнаруживаемой у мышей HPGln во все моменты времени (рис. 2C, D и G, H). Во-вторых, средние гистологические баллы для фовеолярной гиперплазии у мышей HPGln были снижены на 12 нед. Гиперпластические железы были значительно длиннее у мышей HPCont (рис.3A) по сравнению с мышами HPGln (фиг. 3B) при 20 нед. Дополнительный диетический Gln не влиял на гистопатологические показатели атрофии или метаплазии у мышей, инфицированных H. pylori (данные не показаны).
РИСУНОК 2
Количество и организация воспалительных клеток в HPGln по сравнению с мышами HPCont на 6 и 20 неделях на дюйм. Данные представлены в таблице 3. ( A , B ) HPCont при 6 нед. ( C , D ) HPGln при 6 нед. / Дюйм. ( E , F ) HPCont при 20 нед. / Дюйм.( G , H ) HPGln при 20 нед. Стрелки, воспалительные клетки; EM, внешняя мышца; I – зона с высокой концентрацией воспалительных клеток; L – просвет желудка; LP, lamina propria; MM, muscularis mucosa; SM, подслизистая основа. Полоса в G представляет собой увеличение для A , C , E и G и составляет 500 мкм м. Полоса в H представляет собой увеличение для B , D , G и H и составляет 100 мкм м.
РИСУНОК 2
Количество и организация воспалительных клеток в HPGln по сравнению с мышами HPCont на 6 и 20 неделях на дюйм. Данные представлены в таблице 3. ( A , B ) HPCont при 6 нед. ( C , D ) HPGln при 6 нед. / Дюйм. ( E , F ) HPCont при 20 нед. / Дюйм. ( G , H ) HPGln при 20 нед. Стрелки, воспалительные клетки; EM, внешняя мышца; I – зона с высокой концентрацией воспалительных клеток; L – просвет желудка; LP, lamina propria; MM, muscularis mucosa; SM, подслизистая основа.Полоса в G представляет собой увеличение для A , C , E и G и составляет 500 мкм м. Полоса в H представляет собой увеличение для B , D , G и H и составляет 100 мкм м.
РИСУНОК 3
Длина желудочных ямок в HPCont по сравнению с мышами HPGln при 20 нед. Данные представлены в таблице 3. ( A ) Желудочные ямки (PIT) от мыши HPCont при 20 нед.( B ) Желудочные ямки (PIT) мыши HPGln при 20 нед. Полоса в B представляет собой увеличение для A и B и составляет 100 мкм м.
РИСУНОК 3
Длина желудочных ямок при HPCont по сравнению с мышами HPGln при 20 нед. Данные представлены в таблице 3. ( A ) Желудочные ямки (PIT) от мыши HPCont при 20 нед. ( B ) Желудочные ямки (PIT) мыши HPGln при 20 нед. Полоса в B представляет увеличение для A и B и составляет 100 мкм м.
ТАБЛИЦА 3Показатели гистологии воспаления и гиперплазии у инфицированных H. pylori мышей в 6, 12 и 20 неделях после инъекции, получавших контрольную диету или диету с добавлением Gln 1
| . | 6 недель / дюйм . | 12 недель / дюйм . | 20 недель / дюйм . | ||||||
|---|---|---|---|---|---|---|---|---|---|
| Воспаление | Гистологический балл | ||||||||
| HPCont | 0.50 ± 0,11 a | 1,45 ± 0,12 b | 2,00 ± 0,13 c | ||||||
| HPGln | 1,10 ± 0,19 a * | 1,38 ± 0,09 b * | |||||||
| Гиперплазия | |||||||||
| HPCont | 0,00 ± 0,00 a | 1,25 ± 0,24 b | b | 1,55 b | 1,55 b | 1,55 b 0.15 ± 0,11 a | 0,96 ± 0,16 b | 0,93 ± 0,17 b * | |
| . | 6 недель / дюйм . | 12 недель / дюйм . | 20 недель / дюйм . | ||||
|---|---|---|---|---|---|---|---|
| Воспаление | Оценка гистологии | ||||||
| HPCont | 0,50 ± 0,11 a | 1.45 ± 0,12 b | 2,00 ± 0,13 c | ||||
| HPGln | 1,10 ± 0,19 a * | 1,38 ± 0,09 ab | 1,57 | 1,57 ± 0,11 | |||
| HPCont | 0,00 ± 0,00 a | 1,25 ± 0,24 b | 1,55 ± 0,22 b | ||||
| HP | 15 ± 0,11 a | 0,96 ± 0,16 b | 0,93 ± 0,17 b * | ||||
Гистологические оценки воспаления и гиперплазии у мышей , инфицированных H. pylori, , в возрасте 6, 12 лет и 20 недель / нед на контрольной диете или рационе с добавлением Gln 1
| . | 6 недель / дюйм . | 12 недель / дюйм . | 20 недель / дюйм . | ||||||
|---|---|---|---|---|---|---|---|---|---|
| Воспаление | Гистологический балл | ||||||||
| HPCont | 0.50 ± 0,11 a | 1,45 ± 0,12 b | 2,00 ± 0,13 c | ||||||
| HPGln | 1,10 ± 0,19 a * | 1,38 ± 0,09 b * | |||||||
| Гиперплазия | |||||||||
| HPCont | 0,00 ± 0,00 a | 1,25 ± 0,24 b | b | 1,55 b | 1,55 b | 1,55 b 0.15 ± 0,11 a | 0,96 ± 0,16 b | 0,93 ± 0,17 b * | |
| . | 6 недель / дюйм . | 12 недель / дюйм . | 20 недель / дюйм . | ||||
|---|---|---|---|---|---|---|---|
| Воспаление | Оценка гистологии | ||||||
| HPCont | 0,50 ± 0,11 a | 1.45 ± 0,12 b | 2,00 ± 0,13 c | ||||
| HPGln | 1,10 ± 0,19 a * | 1,38 ± 0,09 ab | 1,57 | 1,57 ± 0,11 | |||
| HPCont | 0,00 ± 0,00 a | 1,25 ± 0,24 b | 1,55 ± 0,22 b | ||||
| HP | 15 ± 0,11 a | 0,96 ± 0,16 b | 0,93 ± 0,17 b * | ||||
Распространение.
Количество пролиферирующих клеток на область не различалось в тканях через 6 недель после инъекции независимо от режима диеты (Таблица 4) и содержало Ki-67-положительные клетки в узкой зоне на стыке желудочной ямки и железы ( Дополнительный Рис. 1). A , B ). Через 12 и 20 недель количество пролиферирующих клеток значительно увеличилось у H.pylori по сравнению с неинфицированными мышами, и никакого эффекта от лечения диетой не наблюдалось (таблица 4). На 12 неделе ИП были области с высокой плотностью иммунопозитивных клеток Ki-67 в теле около чешуйчато-столбчатого перехода (дополнительный рисунок 1 C , D ) и около антрального отдела (дополнительный рисунок 1 E). , F ). В тех же тканях в промежуточных областях тела было меньше пролиферирующих клеток (дополнительный рис. 1 C , F ). H.pylori -инфицированные мыши имели наивысшую среднюю плотность иммунопозитивных клеток Ki-67 при 20 нед. / дюйм независимо от диеты (таблица 4). В этот момент времени иммуноположительные клетки Ki-67 были обнаружены по всей длине слизистой оболочки тела от поверхности до основания желудочных желез (дополнительный рис. 1 G , H ). Двойное иммуноокрашивание срезов из групп HPCont или HPGln при 20 нед.п.н. с помощью Ki-67 и анти-CD-3, антитела, которое связывается с рецептором Т-клеток на всех Т-клетках, подтвердило, что пролиферирующие клетки, которые мы подсчитали в анализе не были быстро пролиферирующими Т-клетками (данные не показаны).
ТАБЛИЦА 4Влияние контрольной диеты или диеты с добавлением глн на пролиферацию у неинфицированных или инфицированных H. pylori мышей в 6, 12 и 20 недель ИП 1
| Лечение . | 6 недель / дюйм . | 12 недель PI 2 . | 20 недель / дюйм . |
|---|---|---|---|
| Ki-67, ячеек / мкм м 2 | |||
| UCont | 1.49 ± 0,19 ab | 1,92 ± 0,26 a | 1,16 ± 0,10 b |
| UGln | 1,56 ± 0,22 ab | 1,84 ± 0,40 a | |
| HPCont | 1,93 ± 0,21 a | 3,14 ± 0,32 b * | 4,63 ± 0,53 c * |
| HPGln | 4,63 ± 0,5305 ± 0,59 b *4,63 ± 0,38 b * |
| Лечение . | 6 недель / дюйм . | 12 недель PI 2 . | 20 недель / дюйм . | |||
|---|---|---|---|---|---|---|
| Ki-67, ячеек / μ m 2 | ||||||
| UCont | 1,49 ± 0,19 ab 1 288 | 90.92 ± 0,26 а1,16 ± 0,10 b | ||||
| UGln | 1,56 ± 0,22 ab | 1,84 ± 0,40 a | 1,12 ± 0,12 9028 9028 9028 9028 | 1,93 ± 0,21 a | 3,14 ± 0,32 b * | 4,63 ± 0,53 c * |
| HPGln | 1,79 ± 0,15 a | 4,05 ± 0,59 | 4,05 b63 ± 0,38 b * |
Влияние контроля или диеты с добавлением Gln на пролиферацию у неинфицированных или инфицированных H. pylori мышей на 6, 12 и 20 неделях ИП 1
| Лечение . | 6 недель / дюйм . | 12 недель PI 2 . | 20 недель / дюйм . |
|---|---|---|---|
| Ki-67, ячеек / мкм м 2 | |||
| UCont | 1.49 ± 0,19 ab | 1,92 ± 0,26 a | 1,16 ± 0,10 b |
| UGln | 1,56 ± 0,22 ab | 1,84 ± 0,40 a | |
| HPCont | 1,93 ± 0,21 a | 3,14 ± 0,32 b * | 4,63 ± 0,53 c * |
| HPGln | 4,63 ± 0,5305 ± 0,59 b *4,63 ± 0,38 b * |
| Лечение . | 6 недель / дюйм . | 12 недель PI 2 . | 20 недель / дюйм . | |||
|---|---|---|---|---|---|---|
| Ki-67, ячеек / μ m 2 | ||||||
| UCont | 1,49 ± 0,19 ab 1 288 | 90.92 ± 0,26 а1,16 ± 0,10 b | ||||
| UGln | 1,56 ± 0,22 ab | 1,84 ± 0,40 a | 1,12 ± 0,12 9028 9028 9028 9028 | 1,93 ± 0,21 a | 3,14 ± 0,32 b * | 4,63 ± 0,53 c * |
| HPGln | 1,79 ± 0,15 a | 4,05 ± 0,59 | 4,05 b63 ± 0,38 б * |
Обсуждение
В этом исследовании мы демонстрируем роль дополнительного диетического Gln в защите от патологии, связанной с H. pylori . Фактически, мы показываем, что добавление 5% дополнительного Gln не только ограничивает воспаление и гиперплазию поверхностных клеток желудка на 20 нед / с, но и модулирует иммунный ответ на H. pylori на ранней стадии инфекции, увеличивая IL-1 β и воспаление при поддерживает защитный цитокиновый ответ, связанный с T H 2.Ранее сообщалось о роли Gln в защите слизистой оболочки желудка при образовании язв, вызванных стрессом, индометацином и аспирином, и считалось, что он обеспечивает защиту за счет буферной обратной диффузии кислоты и индуцированного кислотой повреждения слизистой оболочки (24–27). Хотя это также может быть средством защиты на ранней стадии инфекции H. pylori , до наступления атрофии и ахлоргидрии, наши данные предполагают, что Gln также модулирует воспалительный ответ на H. pylori и влияет на физиологию эпителиальных клеток желудка на всем протяжении течение инфекции.
Хотя транспорт и метаболизм Gln широко изучены в кишечнике, где Gln является основным источником энергии для энтероцитов и иммунных клеток (28,29), мало что известно о транспорте или использовании Gln в слизистой оболочке желудка. Недавнее исследование показало, что париетальные клетки желудка используют LAT2–4F2hc Gln транспортер для облегчения экструзии H + во время секреции кислоты (30). Однако транспорт и метаболизм Gln в поверхностных клетках желудка, которые относятся к типу клеток, которые напрямую взаимодействуют с поглощенным Gln из просвета желудка, не были изучены, поэтому неясно, возникали ли эффекты пищевого Gln, которые мы описываем здесь, из просвета желудка. , системного кровообращения или того и другого.Другие исследования предполагают, что уровни сывороточного Gln будут выше у мышей, если в рацион будет добавлено 5% диетического Gln; Недавно было показано, что такая же концентрация Gln, скармливаемого крысам, увеличивает уровень Gln в крови на 35% за 2 недели (31). Эпителиальные клетки в группах с диетой Gln будут подвергаться воздействию значительно более высоких уровней Gln на базолатеральной поверхности, а уровни Gln будут значительно выше в собственной пластинке, где находятся воспалительные и другие клетки соединительной ткани. Из просвета Gln может влиять не только на поверхностные клетки, но и на метаболизм и рост H.pylori (см. ниже). В целом, Gln может, таким образом, влиять на множество путей одновременно, что приводит к защите, которую мы демонстрируем в этом отчете.
Мы показали, что добавка 5% диетического Gln, скармливаемого мышам, инфицированным H. pylori , первоначально (через 6 недель), способствовала усилению воспаления, которое было связано с высокими уровнями провоспалительного IL-1 β . Хотя мало что известно о том, как IL-1 β влияет на поверхностные эпителиальные клетки желудка, было показано, что сам по себе IL-1 β влияет на целостность монослоев кишечных клеток, разрушая плотные контакты (32,33).IL-1 β также индуцирует секрецию IL-8 в раковых клетках MKN желудка и усиливает хемотаксис нейтрофилов (34), предполагая, что повышенная экспрессия IL-1 β , которую мы показали здесь у мышей HPGln, может иметь отношение к поддержание целостности барьера и привлечение иммунных клеток к слизистой оболочке. Gln также увеличивает передачу сигналов митоген-активируемой протеинкиназы, как и H. pylori , предполагая, что Gln сам по себе или в комбинации с H. pylori может также увеличивать экспрессию хемокина IL-8 / CXC и воспаление у мышей, получавших Gln с или без H.pylori . В отличие от этих предсказанных эффектов Gln и IL-1 β , мы показали, что воспаление значительно уменьшилось в целом у мышей, получавших Gln, через 20 недель после первого дня, и гиперплазия не развивалась в той же степени, как у мышей, получавших контрольную диету, что позволяет предположить что нарушение слизистого барьера и рекрутирование иммунных клеток скорее уменьшаются, чем облегчаются, с помощью Gln. Одним из потенциальных факторов, способствующих этому результату, может быть ранняя экспрессия IL-10 у мышей HPGln, которая, как недавно было показано, уравновешивает повреждающие эффекты как IL-1 β , так и IL-8 в кишечных клетках IPEC-1, инфицированных энтеротоксигенным веществом. Escherichia coli K88 (35).Важные защитные механизмы также могут быть индуцированы Gln во время инфекции H. pylori , включая пути детоксикации аргиназы и аммиака (10) и экспрессию белка теплового шока (36). Gln также модулирует воспаление путем ингибирования экспрессии ICAM, VCAM и E-селектина на эндотелиальных клетках сосудов и значительно снижает экспрессию IL-8 в модели колита, индуцированного 2,4,6-тринитробензолсульфоновой кислотой, регулируя ядерный фактор κ – усилитель легкой цепи активации активированных В-клеток (37).Хотя мало что известно об этих путях в желудке, наши данные предполагают, что существует баланс повреждающих и защитных механизмов, стимулируемых Gln, которые в целом являются защитными против H. pylori -индуцированной патологии в слизистой оболочке желудка. Возможно, эта защита была бы даже лучше, если бы уровень добавок Gln был увеличен. Чтобы поддержать это мнение, Накамура и др. (38) недавно показали, что Gln дозозависимо (0–20% в рационе) уменьшает эрозии, изъязвления и отеки у H.pylori – инфицированные монгольские песчанки. Поскольку мы показываем здесь, что воспаление не было значительно усилено в тканях мышей UGln с течением времени, одного только диетического Gln недостаточно, чтобы вызвать воспаление желудка в отсутствие других факторов.
Наши результаты, которые демонстрируют уменьшение фовеолярной гиперплазии с помощью 5% дополнительного пищевого Gln, были неожиданными. В то время как инфекция H. pylori увеличивала гиперплазию и пролиферацию клеток одновременно в группе HPCont, мы обнаружили, что пролиферация клеток также была высокой у мышей HPGln, несмотря на значительное общее снижение гиперплазии на 20 нед.Гиперплазия может возникать из-за блокады, вызванной H. pylori экспрессируемого белка p27 kip1 (39), который регулирует развитие клеточного цикла, а также за счет повышения уровня гастрина (18,40) в результате атрофии париетальных клеток и снижения кислотности секреция. Мы показываем, что атрофия у мышей HPCont идентична по сравнению с мышами HPGln и, одновременно, что скорость пролиферации клеток также одинакова при каждом лечении диетой. Таким образом, неясно, как можно уменьшить гиперплазию, если апоптоз значительно не возрастет при использовании диеты, содержащей Gln.Альтернативно, Gln может способствовать поддержанию экспрессии белка p27 kip1 , других промежуточных продуктов клеточного цикла или других аспектов контроля поверхностного клеточного цикла в присутствии высокого содержания гастрина, так что гиперплазия снижается. Хотя исследования этих интересных возможностей выходят за рамки данного исследования, они заслуживают дальнейшего изучения и важны для понимания защитных эффектов Gln на физиологию клеток желудка.
Метаболизм Gln происходит не только в тканях, но и в бактериях H.pylori , как известно, быстро метаболизирует Gln с образованием аммиака для защиты от кислоты желудочного сока (41). Первоначально мы беспокоились о том, что рост и колонизация H. pylori будут усилены при диете, содержащей Gln, а патология, связанная с H. pylori , будет более серьезной при таком режиме питания. Наше исследование ясно показывает, что это не так, поскольку диета не повлияла на уровень колонизации H. pylori от 6 до 20 недель / дюйм. Аналогично, H.pylori -специфические титры IgG не различались у мышей HPCont и HPGln от 6 до 20 нед.
В заключение, результаты, представленные здесь, демонстрируют, что диета с добавлением 5% Gln значительно снижает воспаление и фовеолярную гиперплазию у мышей, инфицированных H. pylori . Эта защита, обеспечиваемая Gln, может быть усилена, если механизмы, управляющие ответом, будут лучше выяснены.В этой работе были определены многие другие важные параметры, включая данные, демонстрирующие, что 5% дополнительный диетический Gln в отсутствие H. pylori не вызывает воспалительной реакции в желудке. Кроме того, неинфицированные мыши, получавшие дополнительный Gln, хорошо переносили диету и имели сходную массу тела, прибавку в весе, профиль цитокинов, гистологический внешний вид и скорость пролиферации клеток по сравнению с мышами, получавшими контрольную диету. В целом, наши результаты предполагают, что диетические добавки Gln следует рассматривать в дальнейшем как альтернативную стратегию для ограничения воспаления и патологии слизистых оболочек во время H.pylori инфекция.
Цитированная литература
1.Локхед
P
,Эль-Омар
EM
.Рак желудка
.руб. Med Bull.
2008
;85
:87
–100
.2.Паркин
DM
.Глобальное бремя рака, связанного с инфекциями, для здоровья в 2002 г.
.Int J Cancer.
2006
;118
:3030
–44
.3.Parkin
DM
,Bray
F
,Ferlay
J
,Pisani
P
.Глобальная статистика рака, 2002 г.
.CA Cancer J Clin.
2005
;55
:74
–108
.4.Вакил
N
,Megraud
F
.Эрадикационная терапия против Helicobacter pylori 9000 3.
Гастроэнтерология.
2007
;133
:985
–1001
. 5.Blanchard
TG
,Eisenberg
JC
,Matsumoto
Y
.Удаление инфекции Helicobacter pylori посредством иммунизации: сайт активации Т-клеток способствует эффективности вакцины
.Вакцина.
2004
;22
:888
–97
.6.Lesbros-Pantoflickova
D
,Corthesy-Theulaz
I
,Blum
AL
.Helicobacter pylori и пробиотики
.J Nutr.
2007
;137
:S812
–8
.7.Гейл
MH
,You
W-C
.Факторное испытание, включающее добавки чеснока, оценивает эффект в уменьшении предраковых поражений желудка
.J Nutr.
2006
;136
:S813
–5
.8.Fahey
JW
,Haristoy
X
,Dolan
PM
,Kensler
TW
,Scholtus
I
,000000,000, StephensalЛоневски
А
.Сульфофан подавляет внеклеточные, внутриклеточные и устойчивые к антибиотикам штаммы Helicobacter pylori и предотвращает индуцированные бензо [a] пиреном опухоли желудка
.Proc Natl Acad Sci USA.
2002
;99
:7610
–5
.9.Ishizone
S
,Maruta
F
,Suzuki
K
,Miyagawa
S
,Takeuchi
M
,000
000 Kanaya
Hayama
M
,Kawakami
Y
и др.In vivo бактерицидная активность японской рисовой жидкости против H. pylori у монгольской песчанки модели
.Int J Med Sci.
2007
;4
:203
–8
.10.Накамура
E
,Hagen
SJ
.Роль глутамина и аргиназы в защите от вызванной аммиаком гибели клеток эпителия желудка
.Am J Physiol Gastrointest Liver Physiol.
2002
;283
:G1264
–75
.11.Suzuki
H
,Yanaka
A
,Shibahara
T
,Matsui
H
,Nakahara
A
,000
000 Танк
Momoi
T
,Uchiyama
Y
.Апоптоз, индуцированный аммиаком, ускоряется при более высоком pH в поверхностных клетках желудка
.Am J Physiol Gastrointest Liver Physiol.
2002
;283
:G986
–95
.12.Suzuki
H
,Yanaka
A
,Muto
H
.Просветной аммиак замедляет восстановление поврежденной слизистой оболочки желудка морской свинки in vitro
.Am J Physiol Gastrointest Liver Physiol.
2000
;279
:G107
–17
. 13.Lytton
SD
,Fischer
W
,Nagel
W
,Haas
R
,Beck
FX
.Производство аммония с помощью Helicobacter pylori опосредует процессинг окклюдина и разрушение плотных контактов в клетках Caco-2
.Микробиология.
2005
;151
:3267
–76
. 14.Correa
P
,Houghton
J
.Канцерогенез Helicobacter pylori
.Гастроэнтерология.
2007
;133
:659
–72
.15.Lee
A
,O’Rourke
J
,DeUngria
MC
,Robertson
B
,Daskalopoulos
G
,G
Стандартизированная модель мыши инфекции Helicobacter pylori : введение штамма Sydney
.Гастроэнтерология.
1997
;112
:1386
–97
. 16.АИН
.Отчет специального комитета Американского института питания по стандартам исследований питания
.J Nutr.
1977
;107
:1340
–8
. 17.АИН
.Второй отчет специального комитета по стандартам для исследований в области питания
.J Nutr.
1980
;110
:1726
. 18.Fox
JG
,Wang
TC
,Robers
AB
,Poutahidis
T
,Ge
Z
,Taylor
000 CA
9000 DanglerИзраиль
DA
,Кришна
США
и др.Хозяин и микробные составляющие влияют на Helicobacter pylori -индуцированный рак в мышиной модели гипергастринемии
.Гастроэнтерология.
2003
;124
:1879
–90
.19.Pronovost
AD
,Rose
SL
,Pawlak
JW
,Robin
H
,Schneider
R
.Оценка нового иммунодиагностического анализа для обнаружения антител Helicobacter pylori : корреляция с гистопатологическими и микробиологическими результатами
.J Clin Microbiol.
1994
;32
:46
–50
.20.Whary
MT
,Morgan
TJ
,Dangler
C
,Gaudes
KJ
,Taylor
NS
,Fox
JХронический активный гепатит, индуцированный Helicobacter hepaticus у мышей A / JCr, связан с иммунным ответом, опосредованным клетками Th2
.Infect Immun.
1998
;66
:3142
–8
,21.Ливак
KJ
,Schmittgen
TD
.Анализ данных относительной экспрессии генов с использованием количественной ПЦР в реальном времени и метода 2 – ΔΔ CT
.Методы.
2001
;25
:402
–8
.22.Takaishi
S
,Cui
G
,Frederick
DM
,Carlson
JE
,Houghton
J
,9000 Dock
Ge
Z
,Whary
MT
и др.Синергетическое ингибирующее действие антагонистов рецепторов гастрина и гистамина на рак желудка, индуцированный Helicobacter
.Гастроэнтерология.
2005
;128
:1965
–83
. 23.Rogers
AB
,Taylor
NS
,Whary
MT
,Stefanich
ED
,Wang
TC
,Fox JG
.Helicobacter pylori , но с низким содержанием соли, вызывает интраэпителиальную неоплазию желудка у мышей B6129
.Cancer Res.
2005
;65
:10709
–15
. 24.Окабе
S
,Ohtsu
K
,Takeuchi
K
,Takagi
K
.Влияние L-глутамина на индуцированные индометацином поражения желудка у крыс
.Jpn J Pharmacol.
1974
;24
:169
–71
. 25.Окабе
S
,Honda
K
,Takeuchi
K
,Takagi
K
.Ингибирующее действие L-глутамина на раздражение желудка и обратную диффузию желудочной кислоты в аспирин у крыс
.Am J Dig Dis.
1975
;20
:626
–31
. 26.Окабе
S
,Takeuchi
K
,Nakamura
K
,Takagi
K
.Ингибирующее действие l-глутамина на вызванные аспирином поражения желудка у крыс
.J Pharm Pharmacol.
1974
;26
:605
–11
. 27.Okabe
S
,Takeuchi
K
,Takata
Y
,Nagunuma
T
,Takagi
K
.Влияние l-глутамина на различные поражения желудка у крыс и морских свинок
.Пищеварение.
1976
;14
:325
–31
. 28.Newsholme
P
.Почему метаболизм l-глутамина важен для клеток иммунной системы в состоянии здоровья, после травм, хирургических вмешательств или инфекций?
J Nutr.
2001
;131
:S2515
–22
. 29.Трости
PJ
,Burrin
DG
.Глютамин и кишечник
.J Nutr.
2001
;131
:S2505
–8
.30.Кирхгоф
П
.Переносчик аминокислот, участвующий в секреции кислоты желудочного сока
.Pflugers Arch.
2006
;451
:738
–48
. 31.Vicario
M
,Amat
C
,Rivero
M
,Moreto
M
,Pelegri
C
.Пищевой глутамин влияет на функции слизистых оболочек у крыс с легким DSS-индуцированным колитом
.J Nutr.
2007
;137
:1931
–7
.32.Аль-Сади
RM
,млн лет назад
TY
.IL-1 β вызывает увеличение проницаемости плотного соединения кишечного эпителия
.J Immunol.
2007
;178
:4641
–9
. 33.Аль-Сади
RM
,Ye
D
,Dokladny
K
,Ma
TY
.Механизм индуцированного IL1 β увеличения проницаемости кишечных эпителиальных соединений
.J Immunol.
2008
;180
:5653
–61
. 34.Ямада
H
,Такеши
Y
,Okabe
S
.Механизм Helicobacter pylori стимуляции продукции IL-8 в линии эпителиальных клеток желудка (MKN 28): роль митоген-активируемой протеинкиназы и IL1 β
.Biochem Pharmacol.
2001
;61
:1595
–604
.35.Roselli
M
,Finamore
S
,Britti
MS
,Konstantinova
SR
,Smidt
H
,de Vos
.Новый штамм свиней Lactobacillus sobrius защищает клетки кишечника от энтеротоксигенной инфекции Escherichia coli K88 и предотвращает повреждение мембранного барьера
.J Nutr.
2007
;137
:2709
–16
.36.Wischmeyer
PE
,Musch
MM
,Madonna
MB
,Thisted
R
,Chang
EB
.Глутамин защищает эпителиальные клетки кишечника: роль индуцибельного HSP70
.Am J Physiol.
1997
;272
:G879
–84
.37.Zhou
Z
,Connell
MC
,MacEwan
DJ
.TNFR1-индуцированная NF-kB, но не активация ERK, p38MAPK или JNK, опосредует TNF-индуцированную экспрессию ICAM-1 и VCAM-1 на эндотелиальных клетках
.Cell Signal.
2007
;19
:1238
–48
,38.Накамура
E
,Hayashi
S
,Amagase
K
,Okabe
S
,Endo
T
,Kakuchi
Профилактическое действие глутамина и марзулена против Helicobacter pylori -связанных заболеваний желудка у монгольских песчанок
.Jpn Pharmacol Ther.
2007
;35
:479
–88
.39.Кузушита
N
,Роджерс
AB
,Monti
NA
,Whary
MT
,Park
MJ
,000 H0003,
Aswad
,Aswad
Koff
A
,Eguchi
H
и др.p27 kip1 дефицит придает восприимчивость к желудочному канцерогенезу у мышей, инфицированных Helicobacter pylori
.Гастроэнтерология.
2005
;129
:1544
–56
.40.Peek
RM
,Wirth HP, Moss
SF
,Ян
M
,Абдалла
AM
,Tham
KT
,000
000
000
000 Zhang
,000
000 Zhang LH
,Modlin
IM
и др.Helicobacter pylori изменяет события клеточного цикла желудочного эпителия и секрецию гастрина у монгольских песчанок
.Гастроэнтерология.
2000
;118
:48
–59
.41.Mendz
GL
,Hazell
SL
.Утилизация аминокислот Helicobacter pylori
.Int J Biochem Cell Biol.
1995
;27
:1085
–93
.Сокращения
GAPDH
глицеральдегид-3-фосфатдегидрогеназа
HPCont
Helicobacter pylori -инфицированные мыши, получавшие контрольную диету
-HPGln
pylori с добавками Helic
IL
SS1
Helicobacter pylori Sydney штамм 1
T H
TGF β
трансформирующий фактор роста-
9 β
9 β
неинфицированные мыши, получавшие контрольную диетуUGln
неинфицированные мыши, получавшие диету с добавками Gln
wkPI
Заметки автора
© 2009 Американский институт питания
Определение
Альтернативные / исторические названия
Критерии диагностики
Роберт В. Роуз, доктор медицины Исходное сообщение: 9 сентября 2009 г. Дифференциальная диагностика
Клинический
СпискиГастрит / гастропатия
Библиография
|
Неправильный диагноз гипертрофической гастропатии
Гипертрофическая гастропатия – редкое идиопатическое гиперпролиферативное заболевание, которое может проявляться как болезнь Менетрие (БД), характеризующаяся фовеолярной гиперплазией дна желудка и тела. Это часто сопровождается серьезной потерей белков плазмы (включая альбумин) из измененной слизистой оболочки желудка.Заболевание протекает в двух формах: детская форма, вызванная цитомегаловирусной инфекцией, и взрослая форма, связанная со сверхэкспрессией трансформирующего фактора роста-альфа (TGF- α ). Наиболее частые симптомы включают боль в эпигастрии с ощущением полноты и рвоты и генерализованный периферический отек с гипоальбуминемией. Мы представляем случай 75-летней женщины с болью в эпигастрии и рвотой. Эндоскопия верхних отделов желудочно-кишечного тракта и компьютерная томография выявили неправильную складку слизистой оболочки тела и антрального отдела и утолщение стенки желудка соответственно.Хотя эндоскопическая биопсия слизистой оболочки желудка была неспецифической, пациенту была выполнена частичная резекция желудка из-за клинико-рентгенологического подозрения на карциному. По гистопатологическим данным, случай был описан как гипертрофическая гастропатия, соответствующая MD. Хотя существует сильное клиническое и радиологическое подозрение на злокачественное новообразование гипертрофированной слизистой оболочки желудка, MD должен быть одним из важных дифференциальных диагнозов.
1. Введение
Гипертрофическая гастропатия определяется тремя основными состояниями, а именно., (a) болезнь Менетрие – гиперплазия фовеолярного слоя, (b) синдром Золлингера-Эллисона (ZES) – гиперплазия железистого слоя и (c) комбинированная фовеолярно-железистая гиперплазия [1]. Болезнь Менетрие (БМ) – редкое заболевание, впервые описанное французским патологом Пьером Менетрие в 1888 году [2]. Это необычная приобретенная гипертрофическая гастропатия, приводящая к расширению секретирующих слизь желудочных ям (фовеола) наряду с атрофией желудочных желез, вырабатывающих кислоту и пепсиноген.Из-за этих изменений заболевание характеризуется огромным расширением слизистой оболочки желудка, секрецией густой слизи, потерей белка и гипохлоргидрией [3]. Заболевание чаще встречается у мужчин (3: 1) и в возрасте от четвертого до шестого десятилетия [4]. Заболевание протекает в двух формах: детская форма, вызванная цитомегаловирусной инфекцией, и взрослая форма, связанная со сверхэкспрессией трансформирующего фактора роста-альфа (TGF- α ) [5].
2. Изучение клинического случая
75-летняя женщина из отдаленной холмистой местности, домохозяйка по роду занятий, обратилась с жалобами на боль в эпигастрии и тошноту, то периодически появляющуюся и прекращающуюся в течение 5 месяцев.Пациент также имел в анамнезе периодическую отечность нижней конечности. Не было соответствующей семейной или прошлой медицинской или хирургической истории. Общий вид пациента был удовлетворительным. Все жизненно важные функции были в пределах нормы, лимфаденопатии не было. При системном обследовании у нее был вздутый живот без гепатоспленомегалии или асцита. Все параметры крови, а именно, общий анализ крови, случайный уровень сахара в крови, тест функции почек, тест функции печени и уровень электролитов сыворотки были в пределах нормы.Альбумин сыворотки был в пределах нормы (40 г / л). Стул на скрытую кровь отрицательный. Серологические тесты на ВИЧ, HBsAg и HCV также были нормальными. Ультрасонография (УЗИ) брюшной полости показала утолщение стенки желудка с сужением просвета. Эндоскопия верхних отделов желудочно-кишечного тракта (UGI) показала экзофитный рост в теле желудка с твердым основанием. Компьютерная томография с контрастным усилением (КЭКТ) брюшной полости также показала утолщение стенки желудка на теле и пилорическом конце, доходящем до первой части двенадцатиперстной кишки, и была предложена карцинома желудка (рис. 1).Была проведена эндоскопическая биопсия и зарегистрирован хронический гастрит без признаков H. pylori . В связи с рентгенологическим подозрением на рак желудка пациенту была выполнена диагностическая лапаротомия с частичной гастрэктомией. В целом образец состоял из части желудка длиной 12 см с прикрепленным к нему сальником. На поверхности слизистой оболочки были обнаружены множественные полиповидные поражения, охватывающие область тела желудка (рис. 2 (а)). Еще одно одиночное полиповидное поражение также было идентифицировано при измерении дистального конца.На разрезе поражение представляло собой утолщенные серо-белые и блестящие складки слизистой оболочки, которые не выходили за пределы подслизистой оболочки (рис. 2 (b)). Гистологически срезы показали гипертрофированную слизистую оболочку желудка с фовеолярной гиперплазией типа штопора с удлинением и извилистостью, а также атрофией подлежащих желез желудка. Некоторые железы кистозно расширены. Собственная пластинка была отечной и инфильтрирована хроническими воспалительными клеточными инфильтратами, состоящими из лимфоцитов, плазматических клеток и эозинофилов.Признаков атипии не было (рис. 3). Сообщалось о случае гипертрофической гастропатии, соответствующей MD. В настоящее время при наблюдении через 20 месяцев состояние здоровья хорошее.
3. Обсуждение
В 1888 году Менетрие описал термины «полиаденомы полипеукс», эквивалентные множественным гиперпластическим полипам, и «полиаденомы en nappe», при которых болезнь Менетрие ограничена в настоящее время. Он также известен как гипертрофическая или гиперпластическая гастропатия, гигантский гипертрофический гастрит и гигантская гипертрофия морщин желудка [6].Это редкое идиопатическое гиперпролиферативное заболевание фовеолярного эпителия слизистой оболочки дна и тела желудка, связанное с гипопротеинемией и отеком [7].
MD – чрезвычайно редкое заболевание, и в литературе описано всего несколько сотен случаев [3, 8]. Чаще всего он поражает взрослых в возрасте от четвертого до шестого десятилетия с мужским пристрастием (3: 1), что, однако, отличается от настоящего случая [4]. Взрослая форма связана со сверхэкспрессией трансформирующего фактора роста-альфа (TGF- α ), тогда как детская форма связана с инфекцией цитомегаловирусом [5].В данном случае в нашей больнице не было подходящего теста на цитомегаловирус. Морфологические клеточные изменения также не были обнаружены в гистологическом срезе резецированного препарата, что указывает на инфекцию цитомегаловирусом. Причем возраст пациента в этом случае составил 75 лет.
Клинически болезнь коварна с прогрессирующим клиническим течением и обычно проявляется желудочно-кишечными симптомами, периферическими отеками и гигантскими желудочными складками. Наиболее частые желудочно-кишечные симптомы включают боль в эпигастрии, анорексию, потерю веса и рвоту, которые аналогичны симптомам в данном исследовании.Аномальная потеря кишечного белка проявляется гипоальбуминемией и генерализованным периферическим отеком [7]. Для диагностики MD гипоальбуминемия считается краеугольным камнем, но, как и в других исследованиях, в нашем случае уровни альбумина были в пределах нормы, несмотря на наличие периферических отеков [9].
Радиологические исследования включают проглатывание бария из верхних отделов желудочно-кишечного тракта с последующим прохождением через тонкую кишку или сканирование КЭКТ, которое часто показывает диффузное утолщение стенки желудка, часто не затрагивая антральный отдел, в отличие от нашего исследования, в котором сканирование КЭКТ и эндоскопия УГИ выявили нерегулярную слизистую оболочку. складка и утолщение стенки желудка с вовлечением тела и антрального отдела [7].УЗИ брюшной полости также показало аналогичные результаты. При различных радиологических модальностях окончательный диагноз нельзя поставить с уверенностью, и следует исключить гиперпластический гастрит, злокачественное новообразование желудка, синдром желудочного полипоза и ЗЭС [3].
В данном случае эндоскопическая щипковая биопсия не смогла установить диагноз. Поскольку для точной диагностики некоторых из этих заболеваний, включая БМ, требуется исследование очень толстой слизистой оболочки желудка, вместо стандартной биопсии с помощью щипцов рекомендуется использовать большие сеточные биопсии, которые захватывают всю толщину слизистой оболочки [10].Sanchez et al. [11] сообщили о случае MD, в котором диагноз был поставлен с помощью инвазивной лапароскопической биопсии на всю толщину после неудачных попыток множественных эндоскопических исследований с защемлением. Несколько исследований показали ассоциацию H. pylori с MD [12, 13], и многие авторы предположили, что H. pylori играет важную роль в процессе патогенеза MD [14]. Однако, как и в нашем случае, Azer et al. и несколько других исследований сообщили о гипертрофической гастропатии или MD без очевидных признаков H.pylori [9, 15, 16].
Образец гастрэктомии в данном случае имел множественный полиповидный рост с утолщенными серо-белыми и блестящими складками слизистой оболочки, которые не выходили за пределы подслизистой оболочки. Юношеский полипоз и другие полипозные синдромы иногда затрагивают желудок и могут имитировать БМ, которые можно дифференцировать на основании семейного анамнеза, проявлений за пределами желудка, генетического тестирования, внешнего вида при эндоскопии и гистологического исследования [3]. В серии случаев из 48 пациентов, проведенной Rich et al.для оценки возможной БМ у 3 был диагностирован ювенильный полипоз, у 1 – синдром Кронкхита-Канады и у 4 – другие гамартоматозные полипы или синдром нехарактерного полипоза [3].
Гистологический диагноз БМ основан на признаках значительного увеличения высоты слизисто-клеточного компартмента слизистой оболочки желудка с гигантской гиперплазией фовеолярного слоя, с полипоподобными образованиями и необычно глубокой извитой и часто кистозно расширенной ямкой по длине. с уменьшенными железами, как в нашем случае [4].Гистологический дифференциальный диагноз включает глубокий полипозный гастрит и хронический активный гиперпластический, лимфоцитарный или аллергический гастроэнтерит [7]. Отсутствие воспалительных клеток является ключом к дифференциации MD от лимфоцитарного или аллергического гипертрофического гастрита и инфекции Helicobacter pylori . Диффузное утолщение фовеол извилистым гиперпластическим эпителием является ключом к дифференциации БМ от локализованных изменений преимущественно у основания желез при глубоком полипозе гастрита [17, 18].Гистологически MD отличается от гиперпластических полипов и ювенильных полипов сохранением тканевой архитектуры и параллельностью желудочных желез, а также наличием выступающих гладких мышечных волокон собственной пластинки [10]. Гиперпластические полипы и ювенильные полипы будут выглядеть более неорганизованными и отечными. Другой гистологический дифференциальный диагноз также включает ЗЭС, которая характеризуется утолщением слизистой оболочки тела желудка размером до 5-8 мм [18] из-за гиперплазии париетальных клеток, которая также распространяется на основание желез в зонах. обычно занимают главные клетки.Фовеолярный отсек не расширен [10].
Медикаментозное лечение болезни включает ингибиторы протонной помпы, диету с высоким содержанием белка, искоренение H. pylori [14], цетуксимаб (моноклональные антитела) [19] и высвобождение октреотида длительного действия [16]. Однако гастрэктомия – это хорошо зарекомендовавший себя метод лечения гипертрофической гастропатии или БМ из-за высокой частоты неудач медикаментозного лечения и риска злокачественной трансформации [15]. В нашем случае, хотя эндоскопическая биопсия желудка была выполнена, диагноз установить не удалось, и пациенту была выполнена частичная гастрэктомия из-за клинико-радиологического подозрения на карциному.
4. Заключение
Гипертрофическая гастропатия – редкое идиопатическое гиперпролиферативное заболевание, которое может проявляться как MD, характеризующееся фовеолярной гиперплазией дна и тела желудка, связанной с желудочно-кишечными симптомами, гипопротеинемией и отеком. Несмотря на наличие сильного клинического и радиологического подозрения на злокачественное новообразование, MD должен быть одним из дифференциалов гипертрофированной слизистой оболочки желудка с H. pylori или гипоальбуминемией или без нее.
Доступность данных
Н / Д
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов в отношении публикации этой статьи.
Идиопатическая фокальная фовеолярная гиперплазия у младенцев.
Блэкшоу А.Дж., Levision DA (1986) Эозинофильные инфильтраты желудочно-кишечного тракта. J Clin Pathol 39: 1–7
Google ученый
Levision DA Roy CC, Brochu P, Gregoire H, Morin CL, Weber AM (1981) Болезнь Менетрие у детей: отчет пациента и обзор шестнадцати других случаев. Гастроэнтерология 80: 1042–1047
Google ученый
Katz ME, Blocker SH, McAlister WH (1985) Фокальная фовеолярная гиперплазия, проявляющаяся в виде антрально-пилорического образования у грудного ребенка. Педиатр Радиол 15: 136–137
Google ученый
Леонидас JC, Битти EC, Веннер HA (1973) Болезнь Менетрие и цитомегаловирусная инфекция в детстве. Ам Дж. Дис Чайлд 126: 806–808
Google ученый
Маркус П., Верп М.С. (1993) Болезнь Менетрие у ребенка от кровного брака.Am J Med Genet 47: 1231–1232
Google ученый
McAlister WH, Katz ME, Perlman JM, Tack ED (1988) Сонография фокальной фовеолярной гиперплазии, вызывающей обструкцию желудка у младенца. Педиатр Радиол 18: 79–81
Google ученый
Меркадо-Дин М.Г., Бертон Е.М., Броули А.В., Хатли Р. (1994) Вызванная простагландином фовеолярная гиперплазия, имитирующая стеноз привратника у младенца с цианотической болезнью сердца.Педиатр Радиол 24: 45–46
Google ученый
Mezoff AG, Hyams JS (1995) Радиологический случай месяца. Arch Pediatr Adolesc Med 149: 1169–1170
Google ученый
Пелед Н., Даган О., Бабин П., Сильвер М.М., Баркер Г., Хеллманн Дж. И др. (1992) Обструкция выходного отверстия желудка, вызванная терапией простагландинами у новорожденных. N Engl J Med 327: 505–510
Google ученый
Sanna CM, Loriga P, Dessi E, Frau G, Congiu G, Corrias A, et al (1991) Гиперпластический полип желудка, имитирующий гипертрофический стеноз привратника. J Pediatr Gastroenterol Nutr 13: 204–208
Google ученый
Сейдман Э. (1995) Эозинофильный гастроэнтерит. В: Roy CC, Silverman A, Alagille D (eds) Детская клиническая гастроэнтерология. Ежегодник Мосби, Сент-Луис, стр. 384–387
Google ученый
Spry CJF (1984) Эозинофильный гастроэнтерит. В: Bouchier IAD, Allan RN, Hodgson HJF (eds) Учебник гастроэнтерологии. Balliere Tindall, London, pp 596–598
. Google ученый
Sundt TM, Compton CC, Malt RA (1988) Болезнь Менетрие – трехвалентная гастропатия. Энн Сург 208: 694–701
Google ученый
Talley NJ, Shorter RG, Philips SF, Zinsmeister AR (1990) Эозинофильный гастроэнтерит: клинико-патологическое исследование пациентов с заболеванием слизистой оболочки, мышечного слоя и субсерозных тканей.Кишечник 31: 54–58
Google ученый
Whitington PF, Whitington GL (1988) Эозинофильная гастроэнтеропатия в детстве. J Pediatr Gastroenterol Nutr 7: 379–385
Google ученый
Дисплазия фовеолярного типа в пищеводе Барретта
Vizcaino AP, Moreno V, Lambert R, et al . Временные тренды заболеваемости обоими основными гистологическими типами карцином пищевода в отдельных странах, 1973–1995 гг. Int J Cancer 2002; 99 : 860–868.
CAS Статья PubMed Google ученый
Девеса СС, Блот В. Дж., Фраумени-младший Дж. Ф. Изменения в структуре заболеваемости раком пищевода и желудка в США. Cancer 1998; 83 : 2049–2053.
CAS Статья Google ученый
Боттервек А.А., Схоутен Л.Дж., Воловикс А., и др. .Тенденции заболеваемости аденокарциномой пищевода и кардии желудка в десяти странах Европы. Int J Epidemiol 2000; 4 : 645–654.
Артикул Google ученый
Лорд Р.В., Закон М.Г., Уорд Р.Л., и др. . Рост заболеваемости аденокарциномой пищевода у мужчин в Австралии. J Gastroenterol Hepatol 1998; 4 : 356–362.
Артикул Google ученый
Шахин, штат Нью-Джерси.Достижения в области пищевода Барретта и аденокарциномы пищевода. Гастроэнтерология 2005; 128 : 1554–1566.
Артикул PubMed Google ученый
Паулл А., Трир Дж. С., Далтон Мэриленд, и др. . Гистологический спектр пищевода Барретта. N Engl J Med 1976; 295 : 476–480.
CAS Статья PubMed Google ученый
Скиннер Д. Б., Вальтер Британская Колумбия, Ридделл Р. Х., и др. .Пищевод Барретта. Сравнение доброкачественных и злокачественных заболеваний. Ann Surg 1983; 198 : 554–565.
CAS Статья PubMed PubMed Central Google ученый
Гамильтон С.Р., Смит Р.Р. Связь между столбчатой эпителиальной дисплазией и инвазивной аденокарциномой, возникающей в пищеводе Барретта. Am J Clin Pathol 1987; 87 : 301–312.
CAS Статья PubMed Google ученый
Spechler SJ, Goyal RK.Столбчатый пищевод, кишечная метаплазия и Норман Барретт. Гастроэнтерология 1996; 110 : 614–621.
CAS Статья PubMed Google ученый
Такубо К., Аида Дж., Наомото Ю., и др. . Фон кардиального, а не кишечного типа в образцах эндоскопической резекции мелкой аденокарциномы Барретта. Хум Патол 2009 г .; 40 : 65–74.
Артикул Google ученый
Кларк GW, Smyrk TC, Burdiles P, et al .Является ли метаплазия Барретта источником аденокарциномы кардии? Arch Surg 1994; 129 : 609–614.
CAS Статья Google ученый
Cameron AJ, Souto EO, Smyrk TC. Малые аденокарциномы пищеводно-желудочного перехода: связь с кишечной метаплазией и дисплазией. Am J Gastroenterol 2002; 97 : 1375–1380.
Артикул PubMed Google ученый
Cameron AJ, Lomboy CT, Pera M, et al .Аденокарцинома пищеводно-желудочного перехода и пищевода Барретта. Гастроэнтерология 1995; 109 : 1541–1546.
CAS Статья PubMed Google ученый
Нунобе С., Наканиши Ю., Танигучи Х., и др. . Два различных пути туморогенеза аденокарцином пищеводно-желудочного перехода, связанных или не связанных с кишечной метаплазией. Pathol Int 2007; 57 : 315–321.
CAS Статья PubMed Google ученый
Chandrasoma P, Wickramasinghe K, Ma Y, et al . Является ли кишечная метаплазия необходимым предшественником аденокарциномы дистального отдела пищевода, желудочно-пищеводного перехода и кардии желудка? Dis Esophagus 2007; 20 : 36–41.
CAS Статья Google ученый
Шмидт Х.Г., Ридделл Р.Х., Вальтер Б., и др. .Дисплазия пищевода Барретта. J Cancer Red Clin Oncol 1985; 110 : 145–152.
CAS Статья Google ученый
Ридделл Р. Х., Одзе РД. Определение пищевода Барретта: время переосмыслить: мертва ли кишечная метаплазия? Am J Gastroenterol 2009; 104 : 2588–2594.
Артикул Google ученый
Steininger H, Pfofe DA, Müller H, et al .Экспрессия CDX2 и MUC2 в слизистой оболочке Барретта. Pathol Res Pract 2005; 201 : 573–577.
CAS Статья PubMed Google ученый
Groisman GM, Amar M, Meir A. Экспрессия кишечного маркера Cdx2 в столбчатом пищеводе с кишечной метаплазией (Барретта) и без нее. Mod Pathol 2004; 17 : 1282–1288.
CAS Статья Google ученый
Phillips RW, Fierson Jr HF, Москалюк, Калифорния.Cdx2 как маркер эпителиальной дифференцировки кишечника в пищеводе. Am J Surg Pathol 2003; 27 : 1442–1447.
Артикул Google ученый
Shi XY, Bhagwandeen B, Leong AS. CDX2 и виллин являются полезными маркерами кишечной метаплазии при диагностике пищевода Барретта. Am J Clin Pathol 2008; 129 : 571–577.
Артикул PubMed Google ученый
Лю В., Хан Х., Одзе Р. Д., и др. .Метапластический цилиндрический эпителий пищевода без бокаловидных клеток показывает аномалии содержания ДНК, аналогичные эпителию, содержащему бокаловидные клетки. Am J Gastroenterol 2009; 104 : 816–824.
CAS Статья PubMed PubMed Central Google ученый
Хан Х.П., Блаунт П.Л., Аюб К., и др. . Дифференциация кишечника в метапластическом столбчатом эпителии без оболочек пищевода. Am J Surg Pathol 2009; 33 : 1006–1015.
Артикул PubMed PubMed Central Google ученый
Ван К.К., Самплинер Р.Е., Комитет параметров практики Американского колледжа гастроэнтерологии. Обновленное руководство 2008 г. по диагностике, наблюдению и терапии пищевода Барретта. Am J Gastroenterol 2008; 103 : 788–797.
Артикул Google ученый
Одзе РД.Обновленная информация о диагностике и лечении пищевода Барретта и связанных с ним неопластических предшественников. Arch Pathol Lab Med 2008; 132 : 1577–1585.
PubMed Google ученый
Янтисс РК, Одзе РД. Предшественники новообразований верхних отделов желудочно-кишечного тракта. Diag Histopathol 2008; 14 : 437–451.
Артикул Google ученый
Одзе РД.Диагностика и классификация дисплазии пищевода Барретта. J Clin Pathol 2006; 59 : 1029–1038.
CAS Статья PubMed PubMed Central Google ученый
Park do Y, Srivastava A, Kim GH, et al. . Аденоматозная и фовеолярная дисплазия желудка: различные паттерны экспрессии муцина и фоновая кишечная метаплазия. Am J Surg Pathol 2008; 32 : 524–533.
Артикул PubMed Google ученый
Ракер-Шмидт Р.Л., Санчес Калифорния, Блаунт П.Л., и др. . Неденоматозная дисплазия в пищеводе Барретта: клиническое, патологическое и проточно-цитометрическое исследование содержания ДНК. Am J Surg Pathol 2009; 33 : 886–893.
Артикул PubMed PubMed Central Google ученый
Йонезава С., Накамура А., Хориноути М., и др. .Экспрессия нескольких типов муцина связана с биологическим поведением новообразований поджелудочной железы. J Hepatobilation Pancreat Surg 2002; 9 : 328–341.
Артикул PubMed PubMed Central Google ученый
Ban S, Naitoh Y, Mino-Kenudson M, et al. . Внутрипротоковое папиллярное муцинозное новообразование (IPMN) поджелудочной железы: его гистопатологические различия между двумя основными типами. Am J Surg Pathol 2006; 30 : 1561–1569.
Артикул PubMed Google ученый
Катаби Н, Климстра Д.С. Внутрипротоковые папиллярные муцинозные новообразования поджелудочной железы: клинико-патологические особенности и диагностические подходы. J Clin Pathol 2008; 61 : 1303–1313.
CAS Статья PubMed Google ученый
Whiteman DC, Sadeghi S, Pandeya N, и др. .Комбинированные эффекты ожирения, кислотного рефлюкса и курения на риск аденокарциномы пищевода. Гут 2008; 57 : 173–180.
CAS Статья Google ученый
Hamilton SR, Aaltonen LA, (ред.). Классификация опухолей Всемирной организации здравоохранения. Патология и генетика опухолей пищеварительной системы . IARC Press: Lyon, 2000.
Google ученый
Монтгомери Э., Броннер М.П., Голдблюм Дж. Р., и др. .Воспроизводимость диагноза дисплазии пищевода Барретта: подтверждение. Хум Патол 2001; 32 : 368–378.
CAS Статья PubMed Google ученый
Махаджан Д., Беннетт А.Е., Лю X, и др. . Степень дисплазии желудочного фовеолярного типа в пищеводе Барретта. Mod Pathol 2010; 23 : 1–11.
Артикул PubMed Google ученый
Такубо К., Аида Дж., Савабе М., и др. .Нормальная анатомия пищеводно-желудочного перехода: гистопатологический взгляд и его корреляция с эндоскопией. Best Pract Res Clin Gastroenterol 2008; 22 : 569–583.
Артикул PubMed Google ученый
Такубо К., Сасадзима К., Ямасита К., и др. . Двойная мышечная оболочка пищевода Барретта. Хум Патол 1991; 22 : 1158–1161.
CAS Статья PubMed Google ученый
Льюис Дж. Т., Ван К. К., Абрахам СК.Дупликация Muscularis mucosae и мышечно-фиброзная аномалия при эндоскопических резекциях слизистой оболочки пищевода Барретта: значение для стадирования аденокарциномы. Am J Surg Pathol 2008; 32 : 566–571.
Артикул PubMed Google ученый
ДеНарди Ф.Г., Ридделл Р.Х. Нормальный пищевод. Am J Surg Pathol 1991; 15 : 296–309.
CAS Статья PubMed Google ученый
Астхана Н., Мандич Д., Лигато С.Полиповидная дисплазия пищевода фовеолярного фенотипа желудка с очаговой внутрислизистой карциномой, связанной с пищеводом Барретта. Am J Surg Pathol 2008; 32 : 1581–1585.
Артикул PubMed Google ученый
Kushima R, Vieth M, Mukaisho K, et al . Аденома пилорической железы, возникающая в пищеводе Барретта, с иммуногистохимической и молекулярно-цитогенетической оценкой муцина. Virchows Arch 2005; 446 : 537–541.
CAS Статья PubMed Google ученый
Leedham SJ, Preston SL, McDonald SA, и др. . Индивидуальная генетическая гетерогенность крипт и происхождение метапластического железистого эпителия в пищеводе Барретта человека. Гут 2008; 57 : 1041–1048.
CAS Статья PubMed PubMed Central Google ученый
Сарози Г., Браун Г., Джайсвал К., и др. .Клетки-предшественники костного мозга вносят вклад в регенерацию пищевода и метаплазию в модели пищевода Барретта на крысах. Dis Esophagus 2008; 21 : 43–50.
CAS Статья PubMed Google ученый
Zhang HY, Spechler SJ, Souza RF. Аденокарцинома пищевода, возникающая в пищеводе Барретта. Cancer Lett 2009; 275 : 170–177.
CAS Статья PubMed Google ученый
Келти С.Дж., Гоф, доктор медицины, Ван Вик К., и др. .Пищевод Барретта: кишечная метаплазия не является существенным фактором риска рака.

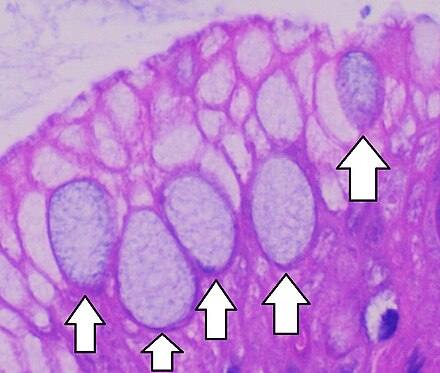 Также во время ФГДС может быть проведена биопсия. Врач захватывает часть ткани слизистой желудка, которая в дальнейшем отправляется на гистологический анализ. Такая процедура позволяет определить, не начался ли злокачественный процесс в желудке.
Также во время ФГДС может быть проведена биопсия. Врач захватывает часть ткани слизистой желудка, которая в дальнейшем отправляется на гистологический анализ. Такая процедура позволяет определить, не начался ли злокачественный процесс в желудке.
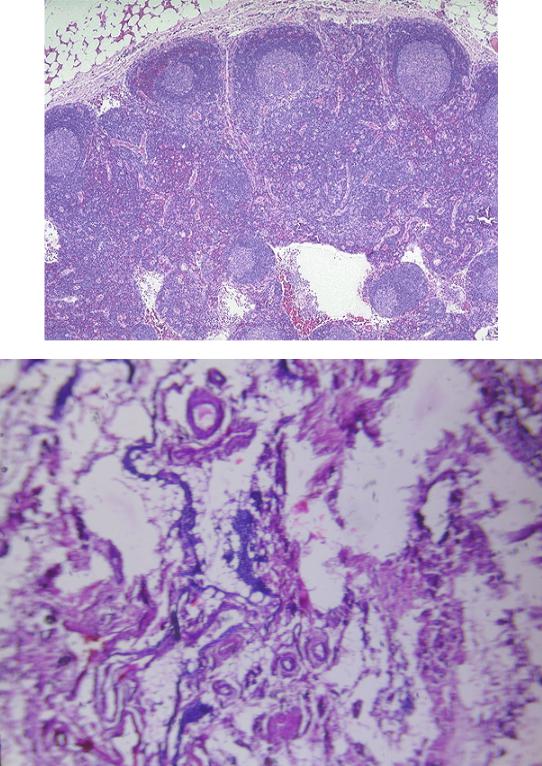 Затем процедить. Принимать, предварительно разбавив водой 1:3. Добавлять сахар и прочие подсластители не рекомендуется.
Затем процедить. Принимать, предварительно разбавив водой 1:3. Добавлять сахар и прочие подсластители не рекомендуется.