Где находится купол слепой кишки: Образование купола слепой кишки с основанием в подвздошной кишке ближе к губе БЗ.
Ответы
подозрение на новообразование в брюшной полостиАрхивная запись
Добрый день! 06.04.10 я проходила процедуру колонскопии, врач описал следующее, осмотрены: прямая кишка, сигмовидный, низходящий, восходящий отделы ободочной кишки, слепая кишка. В куполе слепой кишки, на 0,5 см латеральнее устья червеобразного отростка визуализируется сдавление стенки кишки образованием извне овальной формы 1,0-0,8 см при инструментальной пальпации плотной консистенции, не смещается относительно стенки кишки,однако перистальтические волны в зоне сдавления прослеживаются. Слизистая оболочка над образованием не изменена, подвижная, не фиксирована с подлежащим слоем. Баугиниевазаслонка эластичная, сомкнута. В остальных отделах толстой кишки стенки эластичны, слизистая розовая, гладкая, блестящая, сосудистый рисунок отчетливый. Тонус сохранен на всем протяжении. Заключение: эндоскопическая картина более характерна для сдавления образованием извне с фиксацией стенки слепой кишки, однако нельзя полностью исключить неэпиталиального образования купола слепой кишки.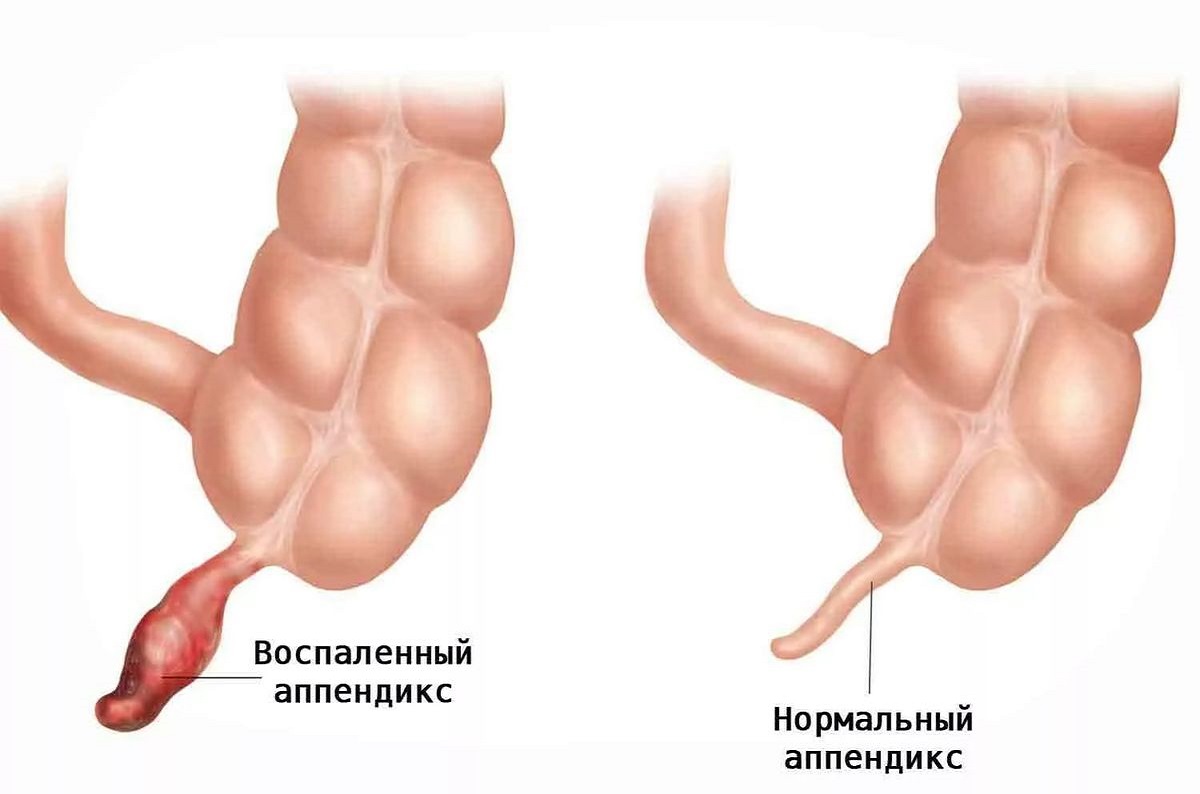
Пожалуйста подскажите, можно ли мне сдать кровь на онкомаркеры и на какие нужно сдавать, для определения, если ли у меня в организме онкологические изменения? Или что Вы мне посоветуете, может быть есть еще какие-нибудь анализы на определения наличия инародного образования внутри? Боли и дискомфорт до сих пор дают о себе знать. Хочется все-таки узнать, есть ли на самом деле это образование и что с ним делать дальше.
 Ведь под нож просто так никто не положит, но и такое бездействие отоже не приведет ни к чему хорошему. Заранее благодарю!
Ведь под нож просто так никто не положит, но и такое бездействие отоже не приведет ни к чему хорошему. Заранее благодарю!Жалобы на данный момент
на сегодняшний день сохраняются неприятные ощущения в правом нижнем боку, в районе аппендикса. боли непонятной этиологии, тянущие иногда ноющие отдающие в спину в области креста со смещением в право. появление связать ни с чем не могу. самостоятельно нащупываю уплотнение внизу живота в области аппендикса, при нажатии проявляется тянущая боль, так же боль внезапно возникает при хотьбе и в положении сидя, а также бывает и в положении лежа. складывается впечатление, что внутри что-то есть как бы чувство распирания с тянущей болью.
Прошедшие обследования
Колоноскопия, 2 раза УЗИ органов малого таза и КТ брюшной полости и органов малого таза. КТ: исследование проведено по стандартной методике, щагом томографа 7мм после предварительного контрастирования кишечника. Стенки толстой кишки не утолщены, просвет не деформирован, патологических объемных образований в просвете кишки достоверно не определяется. Купол слепой кишки расположен в малом тазу. Прилежит к дну матки и верхней стенке мочевого пузыря справа. Тело матки до 58*51мм, с четкими контурами, однородной структуры, полость матки да 13мм. Правый яичник до 24*20мм, левый до 26*18мм, структура однородная. Мочевой пузырь обычной формы, стенки не утолщены, содержимое гомогенное. Тазовая клетчатка дифференцирована. Увеличенных лимфоузлов не определяется. В дугласовом простнастве определяется незначительное кол-во свободной жидкости. Заключение: КТ данных за объемный процесс в брюшной полости и в полости малого таза не получено.
КТ: исследование проведено по стандартной методике, щагом томографа 7мм после предварительного контрастирования кишечника. Стенки толстой кишки не утолщены, просвет не деформирован, патологических объемных образований в просвете кишки достоверно не определяется. Купол слепой кишки расположен в малом тазу. Прилежит к дну матки и верхней стенке мочевого пузыря справа. Тело матки до 58*51мм, с четкими контурами, однородной структуры, полость матки да 13мм. Правый яичник до 24*20мм, левый до 26*18мм, структура однородная. Мочевой пузырь обычной формы, стенки не утолщены, содержимое гомогенное. Тазовая клетчатка дифференцирована. Увеличенных лимфоузлов не определяется. В дугласовом простнастве определяется незначительное кол-во свободной жидкости. Заключение: КТ данных за объемный процесс в брюшной полости и в полости малого таза не получено.
Данные биопсии и гистологии
не брались, т. к. при колоноскопии обнаруженной новообразование находилось вне купола кишки.
к. при колоноскопии обнаруженной новообразование находилось вне купола кишки.
в больнице на основании проведенных исследований поставили диагноз, что новобразование не было выявлено и лапараскопию делать не стали.
Инородное тело в куполе слепой кишки
Инородное тело толстой кишки — нечастая ситуация в хирургии. По данным литературы, только 3% инородных тел, попавших в желудочно-кишечный тракт антеградно, фиксируются в толстой кишке. В такой ситуации возможны осложнения: перфорация, кровотечение, возникновение инфильтрата [1]. Частота осложнений во многом зависит от размера и формы инородного тела, характера материала. Кроме того, извлечение инородного тела может быть технически затруднено [2].
Пациент Е., 49 лет, поступил в экстренном порядке в отделение хирургии Челябинской областной клинической больницы с жалобами на боли внизу живота, преимущественно справа. Был осмотрен хирургом, госпитализирован с предварительным диагнозом: частичная спаечная кишечная непроходимость.
 На фоне лечения болевой синдром купирован. После выписки практически сразу отметил появление болей внизу живота, которые локализовались в правой подвздошной области, чувство вздутия, переполнения, после отхождения газов болевой синдром уменьшался. За 2 нед похудел на 8 кг. При госпитализации общее состояние больного средней степени тяжести. Температура 37,0 °С. При визуальном осмотре живот не вздут, мягкий, болезненный в правой подвздошной области. Симптомы раздражения брюшины отрицательны. При лабораторном обследовании отмечен лейкоцитоз 10,88·109.г/л, палочкоядрный сдвиг до 15%, СОЭ — 15 мм/ч. При ультразвуковом исследовании брюшной полости в правой подвздошно-паховой области обращает на себя внимание участок кишки протяженностью 42 мм диаметром до 15 мм, с неравномерно утолщенными стенками, жидкостным содержимым, без признаков перистальтики. По данным мультиспиральной компьютерной томографии, в правой подвздошной области в проекции слепой кишки и проксимальных отделов восходящей ободочной кишки визуализируется линейная металлическая структура — инородное тело протяженностью до 50 мм (рис.
На фоне лечения болевой синдром купирован. После выписки практически сразу отметил появление болей внизу живота, которые локализовались в правой подвздошной области, чувство вздутия, переполнения, после отхождения газов болевой синдром уменьшался. За 2 нед похудел на 8 кг. При госпитализации общее состояние больного средней степени тяжести. Температура 37,0 °С. При визуальном осмотре живот не вздут, мягкий, болезненный в правой подвздошной области. Симптомы раздражения брюшины отрицательны. При лабораторном обследовании отмечен лейкоцитоз 10,88·109.г/л, палочкоядрный сдвиг до 15%, СОЭ — 15 мм/ч. При ультразвуковом исследовании брюшной полости в правой подвздошно-паховой области обращает на себя внимание участок кишки протяженностью 42 мм диаметром до 15 мм, с неравномерно утолщенными стенками, жидкостным содержимым, без признаков перистальтики. По данным мультиспиральной компьютерной томографии, в правой подвздошной области в проекции слепой кишки и проксимальных отделов восходящей ободочной кишки визуализируется линейная металлическая структура — инородное тело протяженностью до 50 мм (рис.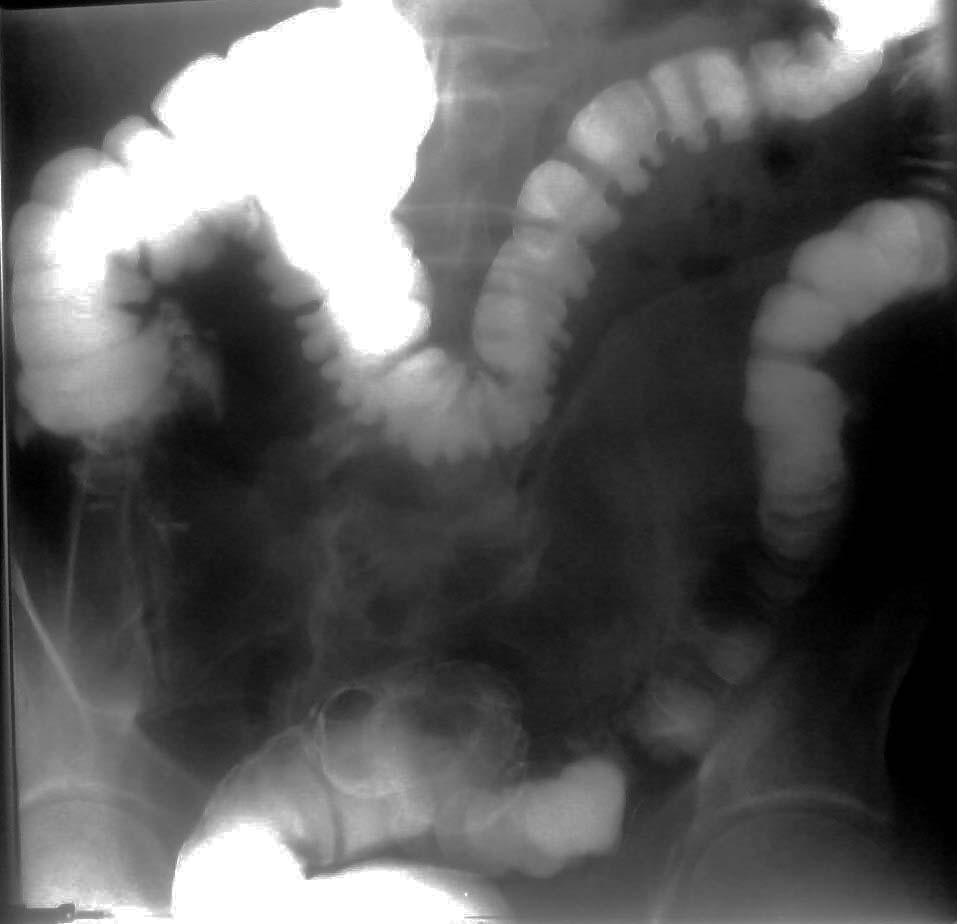 1). Инфильтративных изменений в брюшной полости не выявлено. Выставлены показания к колоноскопии. Пациент подготовлен к исследованию лаважирующим препаратом на основе полиэтиленгликоля в два этапа. Видеоколоноскопия выполнена в условиях анестезиологического пособия (внутривенное введение пропофола), с инсуффляцией в просвет кишки углекислого газа. В куполе слепой кишки между складками, под баугиниевой заслонкой визуализировано металлическое инородное тело (швейная игла), длиной 45 мм, диаметром 2 мм (рис. 2, 3). Игла захвачена петлей за ушко, развернута параллельно стенке кишки в просвете и при интенсивной инсуффляции углекислого газа медленно извлечена под постоянным визуальным контролем. При повторном эндоскопическом осмотре данных за механическое повреждение слизистой толстой кишки не выявлено.
1). Инфильтративных изменений в брюшной полости не выявлено. Выставлены показания к колоноскопии. Пациент подготовлен к исследованию лаважирующим препаратом на основе полиэтиленгликоля в два этапа. Видеоколоноскопия выполнена в условиях анестезиологического пособия (внутривенное введение пропофола), с инсуффляцией в просвет кишки углекислого газа. В куполе слепой кишки между складками, под баугиниевой заслонкой визуализировано металлическое инородное тело (швейная игла), длиной 45 мм, диаметром 2 мм (рис. 2, 3). Игла захвачена петлей за ушко, развернута параллельно стенке кишки в просвете и при интенсивной инсуффляции углекислого газа медленно извлечена под постоянным визуальным контролем. При повторном эндоскопическом осмотре данных за механическое повреждение слизистой толстой кишки не выявлено.Рис. 1. МСКТ брюшной полости пациента Е.
Рис. 2. Инородное тело в куполе слепой кишки пациента Е. (колоноскопия).
Рис. 3. Инородное тело — швейная игла в просвете толстой кишки пациента Е. (колоноскопия).
(колоноскопия).
После пробуждения пациент отметил отсутствие болевого синдрома, выписан на 5-е сутки. Объяснить, как данный предмет попал в желудочно-кишечный тракт, больной не смог.
Особенность представленного клинического случая в том, что тонкий, острый металлический предмет значительного размера беспрепятственно преодолел большую часть желудочно-кишечного тракта и клинически ярко себя показал в куполе слепой кишки (рис. 4). Современные эндоскопические технологии (видеоколоноскопия, анестезиологическое пособие, использование углекислого газа) позволили извлечь сложное инородное тело из начальных отделов толстой кишки без осложнений.
Рис. 4. Инородное тело — швейная игла после извлечения.
Авторы заявляют об отсутствии конфликта интересов.
H. Kashida. Техника выполнения колоноскопии, Перевод с английского
Полный текст статьи:
Для того, чтобы правильно выполнить диагностический этап и провести эндоскопическое лечение, необходимы навыки свободного владения колоноскопом. Достаточно быстрое и безболезненное введение колоноскопа является крайне необходимым не только для правильной диагностики, но и для последующей тактики лечения. Представленная техника проведения колоноскопии заключается в методе выпрямления и подтягивания.
Достаточно быстрое и безболезненное введение колоноскопа является крайне необходимым не только для правильной диагностики, но и для последующей тактики лечения. Представленная техника проведения колоноскопии заключается в методе выпрямления и подтягивания.
Наша методика основывается на выполнении исследования одним врачом, без дополнительного пособия и без использования рентгенологического контроля. В повседневной практике мы используем эндоскоп с функцией увеличения. Он, по сравнению с обычным эндоскопом, несколько толще по диаметру и более ригидный. Из-за этого в некоторых случаях могут возникать сложности в его проведении. Практически во всех случаях мы используем эндоскопы средней длины. Седация обычно для выполнения исследования не требуется. Среднее время проведения эндос¬копа в купол слепой кишки составляет 5-10 минут. В некоторых случаях – 2-3 минуты.
В качестве подготовки накануне исследования вечером назначаем таблетированные формы слабительных. Утром в день исследования пациенты принимают 2 литра полэтиленгликоля и 20 мл электролитного раствора. Непосредственно перед употреблением раствора в него добавляется пеногаситель для предотвращения образования пузырьков в просвете толстой кишки.
Непосредственно перед употреблением раствора в него добавляется пеногаситель для предотвращения образования пузырьков в просвете толстой кишки.
Для премедикации используем спазмолитики (Скополамин – 10-20 мг). В некоторых случаях, когда есть противопоказания к использованию скополамина (сердечная патология, глаукома, гипертрофия простаты) используем Глюкогон. Использование спазмолитиков крайне важно не только для правильного выполнения методики, но и для тщательной диагностики новообразований. Обычно не требуется использования седативных и обезболивающих средств. В некоторых сложных случаях используем седацию с сохранением сознания пациента. Для седации приме-няем Бензодиазепин в дозировке до 5 мг. Анальгин используем крайне редко в очень сложных случаях как дополнение к седации (35 мг).
Для проведения колоноскопии стараемся максимально подтянуть, присборить и распрямить кишку. При этом важно помнить о необходимости сохранения оси толстой кишки. Ость толстой кишки – это линия, которая соединяет прямую кишку с областью перехода сигмовидной кишки в нисходящую кишку, далее – к селезёночному, к печёночному изгибу, и куполу слепой кишки. В процессе проведения колоноскопа рекомендуем как можно меньше отклоняться от этой оси, не создавать изгибов.
В процессе проведения колоноскопа рекомендуем как можно меньше отклоняться от этой оси, не создавать изгибов.
ОСНОВНЫЕ ПРАВИЛА ВЫПОЛНЕНИЯ КОЛОНОСКОПИИ
Присборить (укоротить) кишку. Избегать проталкивания колоноскопа при продвижении, постоянно выполняя подтягивающие движения.
Избегать чрезмерной инсуфляции воздуха. При этом необходимо достаточно часто аспирировать воздух из просвета толстой кишки.
Несоблюдение этих правил создает следующие трудности: растягивается и «перекручивается» кишка; чрезмерное продвижение эндоскопа и избыточная подача воздуха приводят к появлению болевого синдрома.
Не убирать правую руку с рабочей части эндоскопа. Дистальный конец эндоскопа следует изгибать только левой рукой. Не стоит управлять винтами одновременно правой и левой рукой: левая рука – на винтах, правая рука – на рабочей части эндоскопа. Только левой рукой достаточно сложно выполнять повороты эндоскопа вправо-влево, но при этом достаточно свободно можно выполнять эти движения непосредственно движением рабочей части эн¬доскопа.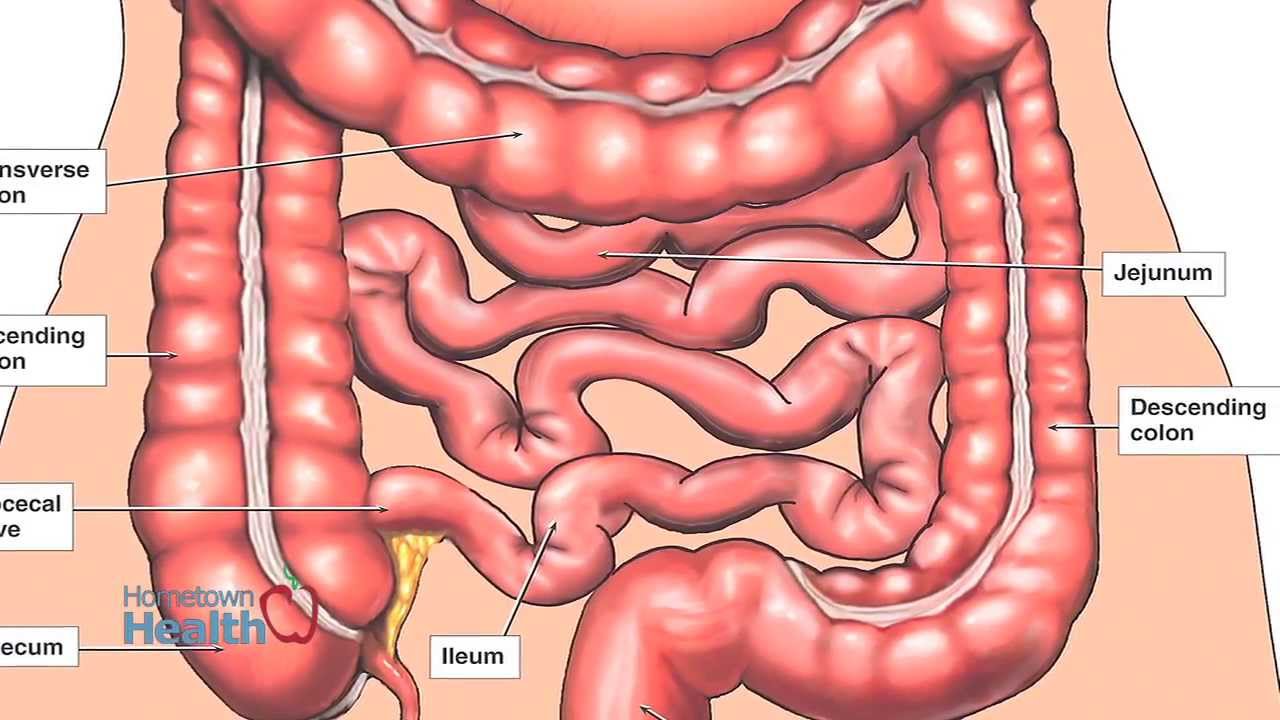 Правильное управление винтами очень важно при выполнении эндоскопических операций, так как правая рука управляет инструментами.
Правильное управление винтами очень важно при выполнении эндоскопических операций, так как правая рука управляет инструментами.
Избегать формирования петель: когда кишка присборена, она не образует дополнительных петель и дистальный конец эндоскопа будет двигаться в соответствии с движениями его рабочей части. В случае растяжения кишки дополнительными петлями продвижение рабочей части не приведёт к продвижению дистального конца эндоскопа. Наоборот, дистальный конец продвинется назад. Это так называемое «парадоксальное движение» за счёт удлинения петель кишки. При чрезмерном растяжении кишки у пациента возникают сильные болевые ощущения.
Продвижение эндоскопа через углы толстой кишки может привести к тому, что углы станут более острыми, из-за чего прохождение данного участка становится еще более затруднительным. Наоборот, подтягивание эндоскопа «на себя» в данной ситуации «собирает» дистальную часть толстой кишки, сглаживая угол, что облегчает продвижение эндоскопа.
Не следует продвигать эндоскоп вперед, если конец аппарата упирается в стенку кишки (изображение принимает вид размытого красного пятна). Необходимо подтянуть аппарат на себя (визуализировать складки кишки) для обнаружения просвета. Лишь после этого можно продолжить продвижение вперед. Даже если просвета не видно, то по расположению складок его ход можно предугадать.
Необходимо подтянуть аппарат на себя (визуализировать складки кишки) для обнаружения просвета. Лишь после этого можно продолжить продвижение вперед. Даже если просвета не видно, то по расположению складок его ход можно предугадать.
ПАССИВНОЕ ПРОДВИЖЕНИЕ
Возможно проведение эндоскопа вперед без применения физических усилий. При присборивании кишки и подтягивании эндоскопа на себя кишка собирается в складки, укорачивается, и дистальный конец эндоскопа продвигается вперед. Это так называемое «парадоксальное движение».
При аспирации воздуха из просвета кишки она сжимается, укорачивается, получается эффект продвижения эндоскопа вперед. Следует учитывать, что при чрезмерной инсуфляции воздуха в просвет кишка растягивается и удлиняется.
ЗАКЛЮЧЕНИЕ
1. Не следует чрезмерно проталкивать эндоскоп вперед, особенно если чувствуется сопротивление или не виден просвет кишки.
2. Очень важно чаще подтягивать эндоскоп на себя.
Это актуально даже при четко визуализируемом просвете кишки. Это способствует присбориванию кишки, препятствует образованию петель и облегчает продвижение эндоскопа.
Это способствует присбориванию кишки, препятствует образованию петель и облегчает продвижение эндоскопа.
3. Избегайте чрезмерной инсуфляции воздуха в просвет кишки. Чаще аспирируйте воздух.
Организация рабочего места
Пациент лежит на левом боку. Врач стоит справа от пациента с выпрямленной спиной. Экран монитора находится спереди врача на уровне глаз. Правая рука на рабочей части эндоскопа на расстоянии 20-30 см от ануса. Если держать руку ближе, то возникают трудности при вращении рабочей части.
Специфическая техника проведения колоноскопа по отделам толстой кишки
Ректосигмоидный отдел. Обычно ректосигмоидный отдел находится в левой части экрана. Для того, чтобы пройти ректосигмоидный изгиб, нужно несколько согнуть дистальный конец эндоскопа кверху и ротировать его влево. Но не следует активно проталкивать эндоскоп в область угла. Нужно несколько подтянуть эндоскоп на себя, в результате чего ректосигмоидный угол станет более тупым. После этого станет виден просвет кишки в правой части экрана. После аккуратной ротации эндоскопа вправо возможно легко пройти в сигмовидную кишку без продвижения вперёд аппарата. Часть эндоскопа при этом лежит на кушетке. При прохождении ректосигмоидного отдела не следует использовать чрезмерное усилие для проведения эндоскопа вперёд, так как при этом формируется либо удлиняется петля в сигмовидной кишке.
После аккуратной ротации эндоскопа вправо возможно легко пройти в сигмовидную кишку без продвижения вперёд аппарата. Часть эндоскопа при этом лежит на кушетке. При прохождении ректосигмоидного отдела не следует использовать чрезмерное усилие для проведения эндоскопа вперёд, так как при этом формируется либо удлиняется петля в сигмовидной кишке.
Успех колоноскопического исследования определяется проведением эндоскопа в ректосигмоидном отделе.
Считается, что наиболее сложным этапом колоноскопии является проведение эндоскопа в области перехода сигмовидной кишки в нисходящий отдел. Продвижение эндоскопа на значительном протяжении вправо приводит к формированию более острого угла в данном участке. Поэтому крайне важным моментом является подтягивание и укорачивание сигмовидной кишки с самого начала. Если удаётся укоротить, подтянуть и присборить сигмовидную кишку, то угол перехода сигмовидной кишки в нисходящий отдел сглаживается. Этот этап называется «подтягиванием по часовой стрелке». В тех случаях, когда сигмовидная кишка сильно удлинена и её подтянуть очень сложно, следует выполнить подтягивание с ротацией вправо до того, как достигнут переход сигмовидной кишки в нисходящий отдел. Кроме того, при долихосигме можно использовать приём ручного пособия ассистентом. При этом медсестра надавливает рукой на область чуть ниже пупка или слева в области предполагаемого перехода сигмовидной кишки в нисходящую. Этот приём позволяет предотвратить чрезмерное растяжение сигмовидной кишки. Ещё одним моментом, который может помочь, является изменение положения тела пациента. В положении пациента на левом боку переход сигмовидной кишки в нисходящую находится под достаточно острым углом. Если положить пациента на правый бок или на спину, то изменится конфигурация данного перехода, то есть сформируется более сглаженный угол.
В тех случаях, когда сигмовидная кишка сильно удлинена и её подтянуть очень сложно, следует выполнить подтягивание с ротацией вправо до того, как достигнут переход сигмовидной кишки в нисходящий отдел. Кроме того, при долихосигме можно использовать приём ручного пособия ассистентом. При этом медсестра надавливает рукой на область чуть ниже пупка или слева в области предполагаемого перехода сигмовидной кишки в нисходящую. Этот приём позволяет предотвратить чрезмерное растяжение сигмовидной кишки. Ещё одним моментом, который может помочь, является изменение положения тела пациента. В положении пациента на левом боку переход сигмовидной кишки в нисходящую находится под достаточно острым углом. Если положить пациента на правый бок или на спину, то изменится конфигурация данного перехода, то есть сформируется более сглаженный угол.
Если не удаётся присборить кишку с самого начала, то начните её присборивать со средних отделов. Если и это не помогает и сигмовидная кишка чрезмерно удлиняется, можно провести эндоскоп с некоторым усилием. Уже после этого выполнить присборивание, после того как прошли изгиб. Но последний вариант не очень предпочтителен, так как возникает болевой синдром и повышается риск перфорации сигмовидной кишки. Часть специалистов предпочитают формировать альфа-петлю. Но это также не идеальный вариант, так как усиливается болевая реакция. Формирование петли может произойти спонтанно, но как только это произошло, её тут же стоит расправить. После устранения альфа-петли можно спокойно про-водить эндоскоп в нисходящую ободочную кишку. Для этого нужно повернуть эндоскоп направо и подтянуть. Некоторые специалисты называют это устранение альфа-петли «подтягиванием с поворотом вправо». Но этот приём достаточно сложен для выполнения. Подтягивание и поворот эндоскопа вправо способствуют продвижению и в нисходящем отделе.
Уже после этого выполнить присборивание, после того как прошли изгиб. Но последний вариант не очень предпочтителен, так как возникает болевой синдром и повышается риск перфорации сигмовидной кишки. Часть специалистов предпочитают формировать альфа-петлю. Но это также не идеальный вариант, так как усиливается болевая реакция. Формирование петли может произойти спонтанно, но как только это произошло, её тут же стоит расправить. После устранения альфа-петли можно спокойно про-водить эндоскоп в нисходящую ободочную кишку. Для этого нужно повернуть эндоскоп направо и подтянуть. Некоторые специалисты называют это устранение альфа-петли «подтягиванием с поворотом вправо». Но этот приём достаточно сложен для выполнения. Подтягивание и поворот эндоскопа вправо способствуют продвижению и в нисходящем отделе.
В некоторых случаях проведение эндоскопа через селезёночный угол крайне затруднительно, так как формируется петля в виде «трости». Этот феномен заключается в том, что при попытках продвижения дистального конца эндоскопа он не продвигается в проксимальные отделы кишки, при этом происходит растяжение кишки и растяжение её в сторону диафрагмы. Или же наоборот, другая часть эндоскопа растягивает сигмовидную кишку. Ситуация сложна тем, что не происходит продвижение эндоскопа и возни-кает боль. В этом случае нужно попросить пациента сделать глубокий вдох (при этом диафрагма опускается вниз) и надавить на селезёночный угол, что выпрямит сформировавшуюся петлю. Или же медсестра оказывает ручное пособие – надавливание на область селезёночного изгиба и сигмовидной кишки справа налево. В области селезёночного угла медсестра может надавливать одним пальцем. Если эти приёмы не помогают, можно попросить пациента изменить положение на левом боку. Селезёночный из¬гиб острый, а при повороте направо или на спину угол сглаживается. Если и этот приём не срабатывает, то можно попросить пациента при его изменён¬ном положении сделать глубокий вдох.
Или же наоборот, другая часть эндоскопа растягивает сигмовидную кишку. Ситуация сложна тем, что не происходит продвижение эндоскопа и возни-кает боль. В этом случае нужно попросить пациента сделать глубокий вдох (при этом диафрагма опускается вниз) и надавить на селезёночный угол, что выпрямит сформировавшуюся петлю. Или же медсестра оказывает ручное пособие – надавливание на область селезёночного изгиба и сигмовидной кишки справа налево. В области селезёночного угла медсестра может надавливать одним пальцем. Если эти приёмы не помогают, можно попросить пациента изменить положение на левом боку. Селезёночный из¬гиб острый, а при повороте направо или на спину угол сглаживается. Если и этот приём не срабатывает, то можно попросить пациента при его изменён¬ном положении сделать глубокий вдох.
Просвет поперечно-ободочной кишки обычно хорошо визуализируется. Если чрезмерно продвигать эндоскоп в поперечно-ободочной кишке, то она растягивается и опускает в область малого таза, при этом эндоскоп не продвигается вперед и растягивает сигмовидную кишку. При прохождении данного участка необходимо подтягивать эндоскоп на себя для того, чтобы приподнять среднюю часть поперечно-ободочной кишки. Обнаружив просвет кишки, дистальным концом эндоскопа нужно зацепиться за складку, немного сгибая большой винт кверху и ротируя рабочую часть эндоскопа влево. После успешного подтягивания и распрямления поперечно-ободочной кишки виден ее просвет справа. Далее появится угол печеночного изгиба. Нельзя продвигать эндоскоп в область печеночного угла. Напротив, для того, чтобы увидеть просвет восходящей ободочной кишки, необходимо опять выполнить подтягивающие движения в области печеночного угла. При этом просвет восходящей кишки будет в спавшемся состоянии. Далее следует проводить эндоскоп аккуратно, избегая проталкивания. Обычно для этого требуется несколько загнуть дистальный конец эндоскопа кверху и повернуть рабочую часть эндоскопа вправо, по часовой стрелке, слегка подтянуть. При этом дистальный конец самопроизвольно пройдет печеночный изгиб. Это движение подтягивания и ротации является крайне важным для успешного проведения эндоскопа. Также для прохождения этого участка может помочь изменение положения тела пациента налево или руч¬ное пособие медсестры в околопупочной области или в области сигмовидной кишки справа налево, так как при прохождении печеночного угла сигмовидная кишка растягивается. После прохождения данного участка следует аспирировать воздух из просвета кишки, что приведет к спонтанному продвижению эндоскопа в слепую кишку, то есть в просвете восходящей кишки нет необходимости чрезмерно продвигать эндоскоп вперед. Для того, чтобы успешно провести эндоскоп через печеночный угол, нужно попросить пациента лечь на спину.
При прохождении данного участка необходимо подтягивать эндоскоп на себя для того, чтобы приподнять среднюю часть поперечно-ободочной кишки. Обнаружив просвет кишки, дистальным концом эндоскопа нужно зацепиться за складку, немного сгибая большой винт кверху и ротируя рабочую часть эндоскопа влево. После успешного подтягивания и распрямления поперечно-ободочной кишки виден ее просвет справа. Далее появится угол печеночного изгиба. Нельзя продвигать эндоскоп в область печеночного угла. Напротив, для того, чтобы увидеть просвет восходящей ободочной кишки, необходимо опять выполнить подтягивающие движения в области печеночного угла. При этом просвет восходящей кишки будет в спавшемся состоянии. Далее следует проводить эндоскоп аккуратно, избегая проталкивания. Обычно для этого требуется несколько загнуть дистальный конец эндоскопа кверху и повернуть рабочую часть эндоскопа вправо, по часовой стрелке, слегка подтянуть. При этом дистальный конец самопроизвольно пройдет печеночный изгиб. Это движение подтягивания и ротации является крайне важным для успешного проведения эндоскопа. Также для прохождения этого участка может помочь изменение положения тела пациента налево или руч¬ное пособие медсестры в околопупочной области или в области сигмовидной кишки справа налево, так как при прохождении печеночного угла сигмовидная кишка растягивается. После прохождения данного участка следует аспирировать воздух из просвета кишки, что приведет к спонтанному продвижению эндоскопа в слепую кишку, то есть в просвете восходящей кишки нет необходимости чрезмерно продвигать эндоскоп вперед. Для того, чтобы успешно провести эндоскоп через печеночный угол, нужно попросить пациента лечь на спину.
Осмотр всей толстой кишки проводится в положении пациента лежа на спине.
Идеальное расстояние от ануса (по эндоскопу):
- Переход сигмовидной кишки в нисходящую – 25-30 см
- Селезеночный угол – 40 см
- Печеночный угол – 60 см
- Слепая кишка – 70-80 см
Если дистальный конец эндоскопа находится в области перехода сигмовидной кишки в нисходящую, а длина проведенного аппарата 60 см, значит сигмовидная кишка перерастянута. Перед дальнейшим продвижением эндоскопа кишку нужно присборить. После успешного проведения эндоскопа в слепую кишку, кишка принимает форму «7».
Характеристики эндоскопа
Используется эндоскоп с увеличением, который несколько толще по диаметру и более гибкий. Если неосторожно выполнять манипуляцию, пациент испытывает боль. В некоторых случаях могут возникать сложности при проведении этого типа эндоскопа через область перехода сигмовидной кишки в нисходящую, при этом он легче проходит поперечно-ободочную кишку.
Более тонкий и мягкий эндоскоп приводит к меньшему появлению болевой реакции и легче проходит через область перехода сигмовидной кишки в нисходящую, но при этом высок риск формирования альфа-петли.
Есть эндоскопы с изменяющейся жесткостью, которую можно изменять в процессе исследования: на начальных этапах – более мягкий, смена на жест¬кий режим – при прохождении селезёночного угла. Также уровень жесткости можно изменять в зависимости от особенностей анатомии толстой кишки пациента или предпочтений врача.
Н. Kashida
Showa University Northern Yokohama Hospital, Digestive Center, Yokohama, Japan
строение, отношение к брюшине, топография червеобразного отростка. Кровоснабжение, иннервация слепой кишки и червеобразного отростка.
Слепая кишка, caecum, расположена в правой подвздошной ямке и представляет собой начальную расширенную часть толстой кишки ниже места впадения подвздошной кишки в толстую (рис. 214). Задней поверхностью слепая кишка лежит на подвздошной и большой поясничной мышцах, а передняя ее поверхность прилежит к передней брюшной стенке. Брюшиной слепая кишка покрыта со всех сторон (интраперитонеальное положение), однако брыжейки не имеет. Положение слепой кишки у взрослых очень вариабельно. Она может находиться выше уровня верхней передней подвздошной ости или довольно низко — у входа в малый таз. Длина слепой кишки 6—8 см, поперечник достигает 7,0—7,5 см. На ее заднемедиальной поверхности внизу сходятся в одной точке ленты ободочной кишки.
В этом месте отходит червеобразный отросток (аппендикс),
appendix vermiformis, который представляет собой вырост слепой кишки длиной 2—20 см (в среднем 8,6 см), поперечник его равен 0,5—1,0 см. Червеобразный отросток покрыт брюшиной со всех сторон (расположен интраперитонеально) и имеет брыжейку.
С практической точки зрения очень важно знание проекции основания червеобразного отростка на переднюю стенку брюшной полости. Основание червеобразного отростка проецируется на переднюю брюшную стенку на границе между наружной и средней третями линии, соединяющей правую верхнюю переднюю подвздошную ость и пупок (точка Мак-Бернея). Однако такое положение червеобразного отростка встречается редко. Чаще всего основание червеобразного отростка проецируется на границе между наружной и средней третями линии, соединяющей правую и левую верхние передние подвздошные ости (толчка Ланца).
Расположение отростка зависит от его длины и места положения слепой кишки. В основном червеобразный отросток расположен в правой подвздошной ямке, но может находиться выше или ниже. Направление червеобразного отростка может быть нисходящим (40—45 %), латеральным (17—20%) или восходящим (13%). При восходящем положении червеобразный от-ростйк нередко располагается позади слепой кишки.
Переход подвздошной кишки в слепую — илеоцекальное отверстие, ostium ileocaecale, представляет собой расположенную почти горизонтально щель, ограниченную сверху и снизу двумя вдающимися в полость слепой кишки складками, образующими илеоцекальный клапан, valva ileocaecalis (баугиниева заслонка). Спереди и сзади складки (заслонки) клапана сходятся и образуют уздечку илеоцекального клапана, frenulum valvae ileocaecalis [iledlisj. В толще складок клапана находится покрытый слизистой оболочкой круговой слой мускулатуры. Илеоцекальный клапан, имеющий вид воронки, узкой частью обращенной в просвет слепой кишки, свободно пропускает пищевую массу из тонкой кишки в толстую. При повышении давления в слепой кишке складки илеоцекального клапана смыкаются и доступ из толстой кишки в тонкую невозможен. Несколько ниже илеоцекального клапана на внутренней поверхности слепой кишки имеется отверстие червеобразного отростка (аппендикса), ostium appendicis vermiformis, возле которого нередко видна полулунной формы складочка слизистой оболочки.
Описание видов медицинской помощи
Вид операции зависит от того, в каком отделе кишечника находится опухоль. Хирургическое лечение рака прямой кишки представляет особые технические и функциональные сложности, поэтому будет обсуждаться отдельно.Целью хирургической операции является удаление сегмента ободочной кишки с опухолью, а также лимфатических узлов, в которые происходит отток лимфы от пораженной части кишки. Из-за того, что раковые клетки могут распространяться по лимфатическим протокам и попадать в лимфатические узлы, их тоже нужно удалять, чтобы снизить риск повторного появления рака. Кроме того, тщательно изучив удаленные лимфатические узлы, патологоанатом может дать ценную информацию для определения стадии опухоли. Стадирование опухоли необходимо для определения нужно ли проводить дополнительное лечение, например, химиотерапию.
Хирургическое удаление (резекция) части кишечника называется колэктомия. Для удаления опухолей, располагающихся в правой половине ободочной кишки выполняют операцию правосторонняя гемиколэктомия, а для опухолей в левой половине ободочной кишки – левосторонняя гемиколэктомия. При расположении опухоли в сигмовидной кишке выполняют резекцию сигмовидной кишки. Обычно, при стандартной резекции ободочной кишки удаляют 30-40 см кишечника, хотя длина удаленного сегмента может быть разной в зависимости от роста пациента и его веса.
-Дистальная резекция сигмовидной кишки заключается в резекции дистальных двух третей сигмовидной кишки и верхней трети прямой кишки с перевязкой сигмовидных и верхнепрямокишечных сосудов. Восстановление толстой кишки осуществляют путём формирования сигморектального анастомоза. Сегментарная резекция сигмовидной кишки — резекция средней части сигмовидной кишки с перевязкой сигмовидных сосудов и формированием анастомоза.
-Левосторонняя гемиколэктомия предусматривает удаление левой половины ободочной кишки (сигмовидной, нисходящей и дистальной половины поперечной ободочной кишки) с перевязкой и пересечением нижних брыжеечных сосудов и формированием трансверзоректального анастомоза. Резекция поперечной ободочной кишки предполагает перевязку и пересечение средней ободочной артерии у её основания и формирование анастомоза.
-Правосторонняя гемиколэктомия заключается в удалении слепой кишки с дистальной частью подвздошной кишки (10—15 см), восходящей ободочной и проксимальной трети поперечной ободочной кишки с перевязкой и пересечением подвздошно-ободочных сосудов, правой ободочной артерии и правой ветви средней ободочной артерии. Восстановление кишечной непрерывности осуществляют путём формирования илеотрансверзоанастомоза. –
-Субтотальная резекция ободочной кишки — удаление всей ободочной кишки, за исключением самой дистальной части сигмовидной кишки, с формированием илеосигмоидного анастомоза. При этом пересекают все основные сосуды, питающие ободочную кишку.
Возврат к списку
Нейроэндокринная опухоль червеобразного отростка
Авторы: Д.Л. Табидзе, В.В. Панов, В.Я. Саидов и др.
Нейроэндокринные опухоли (НЭО) представляют собой редко встречающиеся новообразования, интерес к которым не ослабевает с 1902 г., когда они были выделены в отдельную группу немецким патологоанатомом Обендорфером [1].
В литературе и клинической практике в качестве определения для НЭО желудочно-кишечного тракта (ЖКТ) до сих пор используют несколько синонимов. Обендорфер для обозначения интестинальных опухолей с менее агрессивным, чем у аденокарцином, клиническим течением предложил название «карциноид» [1]. В 2000 г. его заменили определением «эндокринная опухоль» (ВОЗ). В настоящее время термин «карциноид» применяют только для нейроэндокринных новообразований легких. Наиболее распространенные в современной литературе термины «нейроэндокринная опухоль» и «нейроэндокринная карцинома» базируются на том факте, что у всех эндокринных (нейроэндокринных) клеток есть общие иммунофенотипические особенности [2].
По результатам проведенного в США в течение 1973-2004 гг. анализа заболеваемости у более 35 тыс. пациентов с разными НЭО, зарегистрированными в базе данных SEER по кодам ICD-0-3, выяснилось много нового. Авторы работы отметили достоверный рост заболеваемости с 1,09 на 100 тыс. населения в 1973 г. до 5,25 случая на 100 тыс. населения в 2004 г. Анализ показал статистически значимое увеличение заболеваемости за весь период для всех локализаций первичной опухоли. Возможно, это связано с постепенным улучшением качества диагностики, особенно эндоскопического обследования, что позволило более подробно документировать НЭО различной локализации.
Не было выявлено значимых различий в заболеваемости мужчин и женщин. У последних более часто отмечалась склонность к возникновению первичной НЭО в легких, желудке, аппендиксе или слепой кишке, тогда как у мужчин чаще поражались тимус, двенадцатиперстная кишка, поджелудочная железа, тощая, подвздошная или прямая кишка. Однако локализация первичной опухоли значительно отличалась в зависимости от возраста пациента [3].
К сожалению, на сегодняшний день в Украине нет статистических данных по заболеваемости НЭО, поэтому анализ результатов лечения этих больных и разработка диагностического алгоритма вызывают определенные трудности.
Клинически НЭО червеобразного отростка может быть как функционирующей, так и не функционирующей – эти опухоли составляют 15-30% случаев [4-6]. Функционирующие НЭО проявляются карциноидным синдромом.
Надо отметить, что цианоз или покраснение кожи лица и шеи часто является первым, а иногда единственным симптомом заболевания. Эту «маску» у женщин чаще всего принимают за климактерические приливы, особенно если учесть, что частота заболеваемости НЭО увеличивается после 50 лет. Также жалобы могут расцениваться как вегетативные реакции при неврозах или нейроциркуляторной дистонии, что отодвигает сроки распознавания заболевания [4-6].
Абдоминальные проявления (схваткообразные боли в животе, тошнота, рвота, диарея) напрямую обусловлены влиянием на моторику ЖКТ серотонина, однако конкурирующими причинами могут быть ишемия кишки, раздражение брыжейки, явления непроходимости, как и в случае с нефункционирующей НЭО. Физикальное обследование на поздних стадиях заболевания может выявить наличие пальпируемой опухоли в брюшной полости, изменения периферических регионарных лимфоузлов [4-6].
Необходимо особо остановиться на сердечно-сосудистой симптоматике карциноидного синдрома, которая характеризуется тахикардией, болями в области сердца, повышением артериального давления (АД). Эти жалобы очень часто встречаются в повседневной практике терапевта и кардиолога, и на рутинном приеме достаточно трудно заподозрить у пациента карциноидную опухоль, а не более частую и известную клиницистам сердечно-сосудистую патологию.
Высокие концентрации циркулирующих биологически активных аминов и пептидных гормонов не могут не затронуть функции высшей нервной деятельности, и, действительно, у пациентов с НЭО часто фиксируются расстройства нервно-психического статуса [4-6].
Тяжелым проявлением НЭО является карциноидный криз. Он характеризуется интенсивно выраженными признаками: нарушениями ЦНС вплоть до потери сознания и комы, сердечно-сосудистыми расстройствами, включающими аритмии, артериальную гипертензию или гипотензию [4-6].
НЭО червеобразного отростка среди всех НЭО занимает особое место. Частота постановки этого диагноза составляет 0,15 случая на 100 тыс. населения в год. Болеют преимущественно женщины. Средний возраст больных – 40-50 лет. НЭО червеобразного отростка выявляются, как правило, случайно, во время аппендэктомии (каждый 3-5-й случай на 1 тыс. аппендэктомий). Пятилетняя выживаемость при местнораспространенном новообразовании составляет 85-100%, при распространенной форме – 25% [7].
Исходя из этих данных можно сделать вывод: НЭО червеобразного отростка размерами менее 1 см, без распространения в мезоаппендикулярную область, с четкими контурами, даже после простой аппендэктомии не рецидивируют, в то время как в отношении опухолей более 2 см, с инвазией в мезоаппендикулярную область, существует большой риск развития рецидивов после простой аппендэктомии – требуется проводить правостороннюю гемиколэктомию [7].
Мы приводим клинический случай больной в возрасте 65 лет с диагнозом «НЭО червеобразного отростка». В клинике выполнено хирургическое лечение данной пациентки. Больная была социально адаптирована.
Клинический случай
Пациентка Л., 65 лет, поступила в проктологическое отделение КУ «ХГКБ им. Е.Е. Карабелеша» 19.12.2014 г. с жалобами на боли в правой подвздошной области (в проекции слепой кишки), запоры – в течение 3-4 дней, приливы c гиперемией кожи лица и шеи 2 раза в неделю.
Anamnesis morbi: В 2007 г. пациентка находилась на лечении в гастротерапевтическом отделении; по данным эпикриза, при пальпации в правой подвздошной области выявлялась плотноэластической консистенции слепая кишка, а по данным УЗИ органов брюшной полости (ОБП), в правой подвздошной области – гипоэхогенное образование 3,3×1,3 см.
Из вышесказанного можно сделать вывод, что на то время НЭО имела место и медленно развивалась.
Со слов пациентки, 2-3 раза в неделю у нее наблюдались «приливы» с гиперемией кожи лица, которые она связывала с последствием перенесенной в 1994 г. операции (надвлагалищной ампутации матки с придатками).
Пациентка не обращалась к докторам вплоть до появления у нее в 2014 г. выделений из влагалища. Гинеколог направила больную на УЗИ органов малого таза (ОМТ), где в проекции червеобразного отростка был выявлен фрагмент кишки размером 3,9×1,9 см с утолщенными стенками, частичной потерей физиологической слоистости, пузырьками воздуха в просвете. Вероятнее всего, описанное образование является мукоцеле червеобразного отростка.
После УЗИ пациентку проконсультировал хирург, который исключил острый аппендицит и направил больную на консультацию к проктологу.
На осмотре у проктолога 11.12.2014 г.: в проекции аппендикса на УЗИ ОБП выявлены патологические изменения (см. описание выше). По данным фиброколоноскопии 10.12.2014 г. – за илеоцекальным клапаном нечетко определяется локальное выпячивание стенки за счет сдавливания извне. Слизистая в области площадки устья червеобразного отростка не изменена.
В анамнезе – экстирпация матки с придатками по поводу миомы 20 лет назад и холецистэктомия. Жалобы на приливы в течение 20 лет, боли в правой подвздошной области примерно 1 год. Общий анализ крови: Hb – 130 г/л, СОЭ – 7 мм/ч. В правой подвздошной области пальпируется плотное, умеренно болезненное образование, бугристое, ограниченно подвижное, размерами 4,0×5,0 см. Можно предположить наличие патологии червеобразного отростка, включая НЭО. Показано: осмотр через 1 нед; при сохранении жалоб – оперативное лечение.
18.12.2014 г. Пациентка обратилась повторно с теми же жалобами. Показана госпитализация, оперативное лечение после дообследования с повторным УЗИ ОБП – осмотр тканей вокруг подвздошных сосудов, мочеточника, забрюшинного пространства.
19.12.2014 г. Госпитализирована в проктологическое отделение для дообследования и оперативного лечения с диагнозом: «Объемное образование правой подвздошной области; НЭО червеобразного отростка?».
В anamnesis vitae обращает на себя внимание тот факт, что менопауза у пациентки имеет место 20 лет. Сестра и мать умерли от рака грудной железы.
При поступлении: масса тела – 59 кг, рост – 155 см. Общее состояние удовлетворительное. АД 120/80 мм рт. ст. Пульс 70 уд/мин. Кожа и видимые слизистые бледно-розового цвета, без высыпаний, чистые. Периферические лимфатические узлы не пальпируются.
Status localis: В правой подвздошной области при глубокой пальпации определяется бугристая опухоль 4×5 см малоподвижная, с нечеткими контурами, плотной консистенции.
Клинический диагноз: объемное образование правой подвздошной области; НЭО червеобразного отростка?
Лабораторно-инструментальные исследования провели по стандарту. Из особенностей нужно отметить следующие.
УЗИ ОБП совместно с лечащим врачом от 22.12.2014 г. В проекции правой подвздошной области выявлено новообразование овальной формы с неровным контуром размерами до 3,5×1,5 см низкой эхогенности и умеренной локальной болезненности, вероятно, расположенное вне просвета кишечника (детализация затруднена).
Данные клинико-инструментального обследования не позволяют произвести 100% верификацию заболевания. Показано оперативное лечение, объем которого будет определен после ревизии ОБП.
После подготовки пациентке 24.12.2014 г. выполнена операция – резекция илеоцекального угла кишечника с илеоасцендоанастомозом «конец в конец», рассечение спаек.
В брюшной полости массивный плоскостной спаечный процесс. При ревизии выявлено опухолевидное образование в илеоцекальном углу кишечника, точнее, в его брыжейке при отсутствии червеобразного отростка с деформацией купола слепой кишки в месте его основания. Опухоль бугристая, костной плотности размерами 5,0×1,5 см, интимно сращена с брыжейкой терминального отдела подвздошной кишки. Сам отросток визуально не определяется, расположен за слепой и восходящей кишкой в брыжейке. Выделить его из сращения без нарушения кровоснабжения подвздошной кишки нельзя. Состояние расценено как хронический аппендикулярный инфильтрат с оссификацией червеобразного отростка. В отношении НЭО отростка есть большие сомнения. Из-за нарушения проходимости в илеоцекальном клапане и наличия до конца неясной этиологии измененного червеобразного отростка была выполнена резекция илеоцекального угла кишечника с удалением 15 см подвздошной кишки и ее брыжейки, слепой и восходящей кишки с перевязкой подвздошно-ободочных сосудов и наложением асцендоилеоанастомоза конец в конец. Проходимость анастомоза хорошая.
Перитонизация. Произведены туалет брюшной полости и послойное ушивание раны наглухо.
Макропрепарат (описание). 1. Илеоцекальный угол: 7 см подвздошной кишки, 6 см слепой – с червеобразным отростком. Червеобразный отросток представляет собой конгломерат, спаянный с брыжейкой толстой кишки, на разрезе с участком костной плотности, на разрезе просвет облитерирован, стенка неравномерно утолщена, с участками кальциноза. В подлежащей жировой ткани – округлое образование без границ диаметром 1,5 см. Остальные стенки толстой кишки и тонкой кишки без особенностей + прилежащая жировая клетчатка.
2. Серо-желтый фрагмент 2×1,5 см, на разрезе среди жировой клетчатки отмечается белесоватый фрагмент размером 1 см в диаметре – лимфоузел (?) (рис. 1).
Гистологическое исследование материала № 1896 от 25.12.2014 г.: Злокачественный карциноид червеобразного отростка с ростом опухоли в прилежащую жировую ткань, участки кальциноза. № 1894,4 – Контрольные полоски без признаков опухолевого роста. № 1895,2 – Лимфатичеcкий узел с метастазом злокачественного карциноида.
Для решения вопроса о тактике дальнейшего лечения пациентки произведено иммуногистохимическое исследование гистопрепаратов в ООД (маркеры хромогранин А и синаптофизин, маркер пролиферации Ki-67).
Иммуногистохимическое исследование материала № 11 от 26.01.2015 г.: Chromogranin A (SP 6) – положительная реакция, synaptophysin (SP 11) – положительная реакция, Ki-67 (SP 6) – менее 2%.
С учетом морфологической картины и результатов иммуногистохимического исследования опухолевая ткань соответствует НЭО червеобразного отростка с низким потенциалом злокачественности G1.
На 12-е сутки сняты швы. Заживление первичным натяжением. Пациентка выписана в удовлетворительном состоянии. Больной даны рекомендации по дальнейшему наблюдению (специальное лечение не показано).
Заключение
НЭО червеобразного отростка занимают первое место по частоте (80%) среди всех НЭО ЖКТ.
Первичные карциноиды клинически проявляются лишь в 5-10% случаев, при метастазах в печень карциноидный синдром отмечается у 40-45% (до 95%) пациентов, в 50% случаев при поражении гонад, в 20% – при локализации в поджелудочной железе, у 20-30% больных с илеоеюнальной локализацией опухоли, у 5% – с карциноидом легких.
Предварительный диагноз НЭО может быть поставлен на основании клинической картины и обычного гистологического исследования, а окончательная верификация проводится при помощи иммуногистохимического исследования.
При постановке диагноза, выборе алгоритма лечения нужно руководствоваться Клиническими рекомендациями ESMO по диагностике, лечению и наблюдению пациентов при нейроэндокринных гастроэнтеропанкреатических опухолях.
В обязательном порядке нужно проводить лекции для врачей по НЭО для большей онконастороженности при данной патологии.
В Украине существует много проблем, связанных с диагностикой и лечением НЭО. Прежде всего это отсутствие национального регистра по учету НЭО или хотя бы приблизительных данных о распространенности патологии. В настоящее время нейроэндокринный рак включен в общую статистику злокачественных новообразований по органной принадлежности. Другими словами, в национальном регистре злокачественных опухолей нет диагноза «нейроэндокринная опухоль». Такое положение препятствует распространению знаний о НЭО среди врачей-онкологов в регионах. Также отсутствуют образовательные программы по патоморфологической, рентгенологической диагностике и терапии НЭО. Большинство патологоанатомических и биохимических лабораторий не располагают возможностями для диагностики НЭО, поэтому об опыте лечения вообще говорить не приходится. Новые препараты, эффективность которых при НЭО была доказана в международных клинических исследованиях, длительное время проходят регистрацию в Украине, что также ограничивает возможности терапии НЭО на современном уровне.
Литература
1. Obendorfer S. Karzinoide tumoren des Dunndarms // Frankf. Z. Pathol. 1907. Vol. 1. P. 425-429.
2. Niederle M.B., Hackl M., Kaserer K. et al. Gastroenteropancreatic neuroendocrine tumours: the current incidence and staging based on the WHO and European Neuroendocrine Tumour Society
classification: an analysis based on prospectively collected parameters. Endocr Relat Cancer 2010; 17: 909-918.
3. Yao J.-C. One hundred years after «carcinoid»: epidemiology of and prognostic factors for neuroendocrine tumors in 35,825 cases in the United States / J.-C. Yao, M. Hassan, A. Phan et al. // J Clin Oncol 2008. – 26. – P. 3063-3072.
4. Barakat M.T. Neuroendocrine tumors. / M.T. Barakat, K. Meeran, S.R. Bloom // Endocrin. Relat. Cancer. – 2004. – 11. – P. 1-18.
5. Jensen R.T. Carcinoid Tumors and the Carcinoid Syndrome / R.T. Jensen, J.M. Doherty // Cancer: Principles and Practice of Oncology. – 2000. – Ch. 38.6.
6. Kulke M.H. Neuroendocrine tumours: clinical presentation and management of localized disease /
M.H. Kulke // Cancer Treat. Rev. – 2003. – Vol. 29. – P. 363-370.
7. ENETS Consensus Guidelines for the Management of Patients with Neuroendocrine Neoplasms from the Jejuno-Ileum and the Appendix Including Goblet Cell Carcinomas – Р. 143-152.
СТАТТІ ЗА ТЕМОЮ Ендокринологія
08.09.2021 Ендокринологія Цукровий діабет та артеріальна гіпертензіяЗа даними Всесвітньої організації охорони здоров’я, артеріальна гіпертензія (АГ) та цукровий діабет (ЦД) 2 типу є одними з провідних чинників серцево-судинного ризику. За останні 30 років поширеність АГ зменшилася до 1/4 населення світу, але захворюваність на ЦД зросла з 4,7 до 8,5%, і прогноз на майбутнє свідчить про подальший драматичний приріст….
08.09.2021 Ендокринологія Фізіологічна роль та перспективи клінічного застосування R-енантіомера α-ліпоєвої кислотиАльфа-ліпоєва кислота (АЛК) вперше була виділена в 1951 році як кофермент у циклі Кребса [1]. Це сполучення належить до ліпоамідів, функціонує як кофактор у мультиферментних комплексах, котрі каталізують окислювальне декарбоксилювання α-кислот, як-от піровиноградна й α-кетоглутарова кислоти [2, 3], і є потужним природним антиоксидантом. Згодом було встановлено, що синтетична АЛК існує в R‑ та S-енантіометричних структурних формах у співвідношенні 50:50, при цьому лише R-форма є важливим ендогенним кофактором у біологічних системах [4, 5]….
08.09.2021 Ендокринологія Селенодефіцит і патологія щитоподібної залози: зв’язок, яким не можна нехтуватиСелен – есенціальний мікроелемент, що має надзвичайно важливу роль у забезпеченні фізіологічних процесів людського організму; він необхідний для синтезу низки функціональних білків (селенопротеїнів), через які реалізує антиоксидантні, протизапальні, протипухлинні й інші властивості. Селен був уперше описаний у 1817 р.; свою красиву назву отримав на честь місяця (із грецької – Σελήνη), за однією з версій, завдяки своєму сірому кольору з металевим блиском. Щитоподібна залоза (ЩЗ) – орган з найбільшою концентрацією селену на 1 г тканини, що опосередковано відображає значення цього мікроелемента для нормальної роботи ЩЗ. У цьому огляді підсумовано сучасні знання щодо ролі селену у функціонуванні ЩЗ і ефективності прийому його добавок у лікуванні захворювань ЩЗ….
08.09.2021 Ендокринологія Субклінічний гіпотиреоз і предіабетПід час чергової сесії науково-освітнього проєкту «Школа ендокринолога», що відбулася 9-12 червня, учасники заходу мали змогу спостерігати за діалогом експертів, присвяченим питанню сполучення і взаємовпливу субклінічного гіпотиреозу та предіабету. В обговоренні взяли участь завідувачка кафедри ендокринології Івано-Франківського національного медичного університету, доктор медичних наук, професор Надія Василівна Скрипник і завідувачка кафедри внутрішньої медицини № 1 Тернопільського національного медичного університету ім. І. Я. Горбачевського, доктор медичних наук, професор Надія Василівна Пасєчко….
Рак слепой кишки | Цены и отзывы в Ихилов
Рассчитать стоимость леченияКаковы преимущества лечения в израильской клинике Ихилов Комплекс?
- Узконаправленная лучевая терапия. Благодаря современному оборудованию, которым располагает клиника установка TrueBeam «Новалис»), здесь проводятся безопасные и эффективные сеансы лучевой терапии. Современные линейные ускорители дают возможность воздействовать на опухоль прицельно, уничтожая раковые клетки;
- Эффективное обезболивание. Когда пациенты обращается в клинику на поздних стадиях болезни, нередко им приходится терпеть сильные и мучительные боли. В клинике Ихилов Комплекс пациенты сразу же получают надежные препараты, которые избавляют их даже от очень сильной боли;
- Малоинвазивная хирургия. Хирурги проводят операции по удалению рака слепой кишки максимально бережно. Иногда после вмешательства даже не требуется формировать колостому – выход на брюшине для опорожнения кишечника.
Лечение рака слепой кишки в клинике Ихилов Комплекс: весь потенциал израильской медицины
- Химиотерапия применяется для того, чтобы подавить рост злокачественных клеток. Пациенту назначают сочетание нескольких препаратов, которые неплохо переносятся и эффективно справляются со своей задачей. На раннем этапе болезни может заменить ослабленным пациентам хирургическое вмешательство;
- Лучевая терапия применяется до и после операции: сначала для сдерживания роста опухоли, а затем – для уничтожения остаточных раковых клеток. Лучевая терапия с новейшими линейными ускорителями требует не более 15 минут в день и не оказывает негативного влияния на здоровые органы и ткани;
- Хирургическое лечение является основным видом борьбы с раком слепой кишки. На ранних стадиях болезни доктора могут провести лапароскопическое удаление опухоли без образования колостомы – выхода для каловых масс на брюшной стенке. Доктора иссекают поврежденный участок кишечника налаживая анастомоз – обходной путь для содержимого кишечника.
При более серьезных поражениях удаляется не только слепая кишка, но и части тонкого и толстого кишечника, создается колостома.
Получить цены в клинике
Диагностика рака слепой кишки в клинике Ихилов Комплекс: главное не упустить время
На ранних стадиях рак слепой кишки имеет крайне яркий симптом – кровь в кале. Из-за потери крови у человека может развиться анемия, а растущая опухоль приведет к болям в нижней части живота, общей интоксикации, метастазам. При этом для диагностики рака слепой кишки в клинике Ихилов Комплекс нужно всего несколько дней.
Первый день. Визит в клинику
Пациент, который прибывает в Израиль, прежде всего проходит первичный осмотр. Доктор опрашивает больного, отдает на перевод медицинские документы и стекла биопсии (если проба была взята на родине) на проверку. В этот же день пациент получает список диагностических процедур, которые нужны для постановки диагноза.
Второй день. Полное обследование
При подозрении на рак слепой кишки чаще всего назначаются некоторые из следующих исследований:
- Ультразвуковое исследование. Помогает отличить рак слепой кишки от других возможных патологий, а также дает возможность выяснить локализацию новообразования;
- Колоноскопия. Исследование кишечника при помощи специального гибкого прибора с камерой на конце. Колоноскопия проводится под обезболиванием и может сопровождаться биопсией или удалением доброкачественных новообразований;
- Ирригоскопия. Рентгенологический метод исследования кишечника, перед которым пациент выпивает рентгеноконтрастное вещество. Жидкость обволакивает кишечник и дает возможность рассмотреть на снимке все структурные изменения слизистой;
- МРТ или КТ. Подобные современные исследования дают возможность оценить общее состояние организма, а также выявить все возможные патологии, в том числе метастазы;
- ПЭТ КТ. Этот современный метод сканирования тела позволяет обнаружить малейшие изменения в нормальной структуре органов и тканей. Подобное исследование незаменимо при поиске метастазов.
Третий день. Подбор методов лечения
Предлагая пациенту терапию, доктора всегда оценивают общее состояние больного, стадию его болезни, сопутствующие хронические заболевания. Если необходимо, пациента может проконсультировать любой узкий специалист, а решение о лучшем способе лечения всегда принимается коллегиально.
Цены на лечение рака слепой кишки
Полная стоимость лечения рака слепой кишки определяется по результатам диагностики. Ведь только после обследования можно сказать, какие потребуются методы лечения, насколько объемной будет хирургическая операция и вообще потребуется ли она.
Вполне определенным является лишь тот факт, что стоимость медицинских услуг в израильских клиниках традиционно ниже, чем в больницах США и Европы. Иногда разница в стоимости лечения может достигать 50%.
Сообщите мне цены- 5
- 4
- 3
- 2
- 1
Аденокарцимома толстой кишки типа DOME / GALT: описание случая, обзор литературы и единая фенотипическая категоризация
Лимфоидная ткань, ассоциированная со слизистой оболочкой (MALT) в кишечнике, называется лимфоидной тканью, ассоциированной с кишечником (GALT). Он состоит из изолированных и агрегированных лимфоидных фолликулов [16].
Дискретные лимфоидные агрегаты образуют куполообразные массы, которые выпирают в просвет кишечника [5].
Эпителий, связанный с фолликулами (FAE), покрывает агрегированные лимфоидные фолликулы.Такой эпителий представляет собой одноклеточный слой, состоящий из энтероцитов и специализированных эпителиальных микроскладок, так называемых «М-клеток», и лишен бокаловидных и энтероэндокринных клеток [16].
Считается, что очень небольшое количество CRC происходит от M-ячейки. В 1999 году Де Петрис описал куполообразное возвышение слизистой оболочки, соответствующее небольшой подслизистой аденокарциноме, состоящей из расширенных злокачественных желез, выстланных столбчатым эпителием с эозинофильной цитоплазмой и гиперхроматическими ядрами на заметном лимфоидном фоне [1].
Де Петрис предположил, что DC является злокачественным аналогом лимфогландулярного комплекса и может представлять собой предшественник LELC ввиду ассоциированной с опухолью лимфоидной стромы и наличия менее дифференцированных областей [1].
Есть три аргумента в пользу связи между лимфогландулярным комплексом и DC, таким образом подтверждая концепцию, что эта опухоль может происходить из М-клеток FAE.
Во-первых, злокачественный эпителий такой опухоли находится в тесной взаимосвязи с заметной лимфоидной тканью, демонстрирующей характерную организацию GALT [5].
Во-вторых, есть наблюдение, что DC, как и в FAE, не имеет бокаловидных клеток [2].
Наконец, существует морфологическое сходство между неопластическими изменениями, наблюдаемыми в экспериментальных моделях на крысах, и морфологией DC, наблюдаемой в зарегистрированных случаях заболевания людей [2].
В этом отношении исследования опухолей толстой кишки у экспериментальных крыс, получавших канцероген, показали значительную связь между локализацией лимфоидных агрегатов, локализацией неполиповидных опухолей сидячего типа и ранним появлением злокачественных желез внутри агрегатов [17, 18 ].
Что касается гистологических и диагностических признаков, DC демонстрируют совокупность морфологических признаков, отличных от выраженного лимфоидного компонента, которые присутствуют в различных вариациях (Таблица 2), что объясняет некоторую неоднородность.
О наличии инфильтрирующих опухоль лимфоцитов сообщается в половине случаев ДК (Таблица 2).
Несмотря на то, что М-клетки обычно содержат многочисленные межклеточные лимфоциты, это может быть не всегда: соответственно количество лимфоцитов связано с состоянием зрелости этих клеток [2, 19].
Ранее ассоциированная аденома была описана почти в половине случаев карциномы DC и GALT (Таблица 2).
Объяснение отсутствия аденоматозного компонента может заключаться в том, что некоторые из этих опухолей возникают из подслизистой FAE или из грыжи желез в подслизистой основе, обычно в UC, как описано одним из нас [12, 14].
Если присутствует, аденоматозная трансформация, в свою очередь, может быть вызвана самими лимфоидными фолликулами в слизистой / подслизистой оболочке толстой кишки [20].
Присутствие аденокарциномы обычного типа, наблюдаемое в некоторых DC, могло бы объяснить относительную редкость DC как сущности, при которой компонент DC уничтожается чрезмерным ростом карциномы обычного типа [3].
Единственное различие между DC и GALT-карциномой – это уникальные особенности цитоархитектуры, описанные Де Петрисом. Доказательства кистозно-расширенных желез и цитологические особенности, типичные для ДК, описаны Rubio только в одном случае GALT-карциномы в 2002 году [15].
Медуллярная карцинома и лимфоэпителиомоподобная карцинома несколько отличается от DC и GALT-карциномы. В цитоархитектурных особенностях они демонстрируют недифференцированные признаки высокой степени [10], и у них отсутствуют типичные цитологические признаки DC.
Медуллярный фенотип связан с MSI-H CRC [10], и, соответственно, этот вариант помимо внутриопухолевых [1] показывает сдвигающиеся края и яркие перитуморальные лимфоидные инфильтраты.
Наиболее важными морфологическими признаками, служащими диагностически полезными маркерами MSI-H-CRC, возникающего спорадически и в контексте синдрома Линча, являются лимфоцитарная инфильтрация, секреция муцина и плохая дифференцировка [13].
Паттерны лимфоцитарной инфильтрации в MSI-H CRC включают узловатую или крона-подобную перитумуральную лимфоцитарную реакцию и присутствие инфильтрирующих опухоль лимфоцитов (TIL) [13].
Стромальный лимфоидный компонент, связанный с карциномой DC и GALT, организованный с помощью лимфоидных фолликулов и зародышевых центров, отличается от лимфоидных инфильтратов, встречающихся при медуллярной карциноме, лимфоэпителиомоподобной карциноме и в MSI-H CRC; скорее всего, они представляют собой остатки ранее существовавших лимфоидных узелков, а не адаптивного иммунного ответа [2], что объясняет гистологическую гетерогенность и разницу в статусе микросателлитов.
Поскольку любой вид лимфоцитарной инфильтрации (перитуморальная воспалительная реакция, TIL и реакция Крона) при CRC считается положительным прогностическим фактором [21], неудивительно, что нет сообщений о рецидивах или связанных с раком смертей от DC или GALT-карцинома.
Произошла ошибка при настройке вашего пользовательского файла cookie
Произошла ошибка при настройке вашего пользовательского файла cookieЭтот сайт использует файлы cookie для повышения производительности.Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Возможность дифференциации колоректального рака от нормального и воспалительного утолщения стенки толстой кишки с помощью анализа текстуры КТ
Одобрение этики
Это исследование было проведено в соответствии с Хельсинкской декларацией и одобрено Комитетом по этике больницы Ренджи Шанхайского университета Цзяо Тонг . Все участники подписали формы информированного согласия.
Отбор пациентов
Это ретроспективное исследование было одобрено местным наблюдательным советом учреждения (IRB), и для этого ретроспективного исследования требовалось письменное информированное согласие пациента.Чтобы включить пациентов с подозрением на поражение толстой кишки на многофазную КТ с контрастным усилением, мы сначала выполнили компьютеризированный поиск в библиотеке истории болезни пациентов с января 2014 года по октябрь 2018 года. Мы последовательно включили 96, 82 и 163 пациента с гистологически подтвержденными CD, UC и CRC. , соответственно. Гистологический результат в этих случаях был получен при эндоскопической биопсии или хирургической резекции. Во-вторых, мы исключили 24 из 96 пациентов с БК, 23 из 82 пациентов с ЯК и 51 из 163 пациентов с КРР из этого исследования из-за предоперационной лучевой терапии или химиотерапии (n = 32), сердечной недостаточности (n = 17), ревматических заболеваний (n = 26). ), отсутствие CT (n = 15), только неусиленный CT (n = 3) или только однофазный усиленный CT (n = 5).Наконец, мы исключили еще 14 пациентов с БК без поражения толстой кишки и 9 пациентов с артефактами движения на КТ-изображениях. Критерии включения были следующими: (1) все пациенты с гистологически подтвержденной CD, UC или CRC; и (2) все пациенты с полными данными КТ (PCP, AP и PVP) и клинической информацией. Критерии исключения были следующими: (1) пациенты без расширенных КТ-сканирований или с качеством КТ-изображения, не отвечающим требованиям; и (2) пациенты, которые получали предоперационное лечение или страдали другими заболеваниями, которые могут повлиять на анализ изображения.Многофазные КТ-изображения были отдельно проанализированы двумя опытными радиологами (J. Z., Q. F.) с 24 и 15 годами опыта в диагностической визуализации желудочно-кишечного тракта. В результате этого обзора было 58 пациентов с CD с поражением толстой кишки, 55 пациентов с UC и 107 пациентов с CRC. Таким образом, всего было 113 пациентов с IBD и 107 CRC. В качестве контрольной группы мы также включили 96 пациентов с симптомами пищеварительной системы, которые были направлены на многофазную компьютерную томографию брюшной полости с усилением, но не имели никаких отклонений от нормы.Схема рабочего процесса этого исследования в отношении выбора пациентов показана на рис. 4. Клиническая информация об этих пациентах приведена в таблице 6.
Рисунок 4Схема рабочего процесса скрининга пациентов.
Таблица 6 Клиническая и гистопатологическая информация о пациентах с CRC и IBD.Протокол КТ
КТ брюшной полости с многофазным контрастным усилением была выполнена на двух КТ-сканерах: (1) 64-канальный мультидетекторный компьютерный томограф (Discovery CT750 HD или Lightspeed VCT, GE Healthcare, Милуоки, США) и (2) 128 -канальный мультидетекторный компьютерный томограф (определение SOMATOM AS +, Siemens Healthcare, Эрланген, Германия).В соответствии с инструкциями по КТ брюшной полости в нашем отделении, все пациенты получали жидкую диету и проходили слабительную подготовку за 24 часа до КТ исследования. С учетом переносимости пациента через задний проход осторожно вводили от 1 до 1,5 л теплой воды (30 ° C ~ 40 ° C) с последующими тремя последовательными сканированиями КТ (со всеми тремя включенными фазами), когда пациент находился в положении лежа на спине. PCP CT была проведена на всей брюшной полости от купола диафрагмы до лонного сочленения. После компьютерной томографии PCP последовательно выполнялись КТ-сканирование AP и PVP с одинаковым охватом.Эти два КТ-сканирования с контрастным усилением были выполнены через 35 и 60 секунд, соответственно, после автоматической инъекции 75–150 мл (1,5 мл / кг) неионогенного йодированного контрастного вещества (370 иопамидол, Shanghai Bracco Sine Pharmaceutical China) через антекубитальный канал. вену со скоростью 3,5 мл / с. Параметры сканирования для PCP CT: 120 кВ, 200–350 мА; поле зрения 40–50 см; толщина среза 1,2 мм или 1,25 мм; интервал 1,2 мм или 1,25 мм; матрица, 512 × 512; время вращения трубки 0,6-0,8 с; шаг, 1–1.375: 1; и ядро реконструкции, стандартный алгоритм. После реконструкции изображения отображались с толщиной поперечного сечения 1,0 мм и разрешением в плоскости 0,60 × 0,60 мм. Полученные изображения компьютерной томографии были просмотрены через наш институциональный сервер системы архивирования изображений и связи.
Выбор изображения
Чтобы выбрать типичные изображения для ТА из каждого КТ-сканирования, трехфазные КТ-изображения толстой кишки каждого пациента последовательно просматривали от прямой кишки до илеоцекального соединения по ходу толстой кишки.Когда были локализованы поражения CRC или аномальное утолщение толстой кишки, были определены три репрезентативных аксиальных изображения каждого КТ-сканирования. Репрезентативные изображения на трех КТ (PCP, AP и PVP) были определены в одном и том же поперечном сечении. Для CRC первое осевое изображение было получено в середине опухоли, избегая некроза или кровеносных сосудов. Второе и третье изображения были сделаны по средней линии между средней и верхней границей и между средней и нижней границей опухоли, соответственно.Для пациентов с ВЗК (ЯК и БК) и нормальных участников были выбраны три осевых изображения толстой кишки в восходящей, поперечной и нисходящей ободочной кишке (включая сигмовидную кишку) на основании следующих критериев: (а) толщина утолщенной стенки толстой кишки. или высыпания были более 5 мм; (б) было предпочтительным асимметричное или локализованное утолщение толстой кишки; и (c) утолщенная стенка толстой кишки содержала поражения у пациентов с ВЗК. КТ-изображения были просмотрены, и репрезентативные изображения были выбраны двумя предыдущими радиологами желудочно-кишечного тракта (J.Z., Q.F.) вместе, и любые разногласия разрешались путем консенсуса. Каждое из трех выбранных осевых изображений толстой кишки было анонимным и экспортировано из системы архивации изображений и коммуникации.
TA и классификация на основе TA
Выбранные одноосевые КТ-изображения толстой кишки (формат DICOM) были преобразованы в изображения в формате растрового изображения и сегментированы поражения с помощью программного обеспечения MaZda 4.6 (http://www.eletel.p.lodz.pl/ программы / мазда /). Каждое изображение было вручную сформировано и измерено двумя независимыми рентгенологами (читатели A и B, которые имели 3 года и 5 лет опыта диагностики соответственно) для определения внешнего края утолщенной стенки или поражения толстой кишки и сохранено как ROI. для дальнейшего ТА (рис.5 CRC в AP (a), IBD в AP (b) и NTC в AP (c)). Двое врачей-рентгенологов не знали о патологических результатах этих пациентов. Контур был слегка нарисован внутри утолщенной стенки толстой кишки (для пациентов с ВЗК и нормальных участников) или границ опухоли, чтобы устранить объемные эффекты соседнего периколонического жира или газа. Принимая во внимание, что у некоторых пациентов или участников может быть трудно идентифицировать границы толстой кишки при неулучшенном КТ-сканировании, для определения контура можно использовать соответствующие улучшенные изображения.Каждый считыватель записывал пиксели, содержащиеся в каждой контурной области интереса, и максимальную толщину утолщенной стенки толстой кишки или опухоли (показания A1 и B). Читатель A снова очертил ROI через 4 недели, чтобы исследовать внутреннюю согласованность наблюдателя (чтение A2). Полученные контуры по показаниям A1, A2 и B были проанализированы на текстуру независимым рецензентом.
Рисунок 5Обозначение области интереса (ROI) в артериальной фазе. ( a ) для рака толстой кишки, ( b ) для язвенного колита, ( c ) для нормальной утолщенной стенки толстой кишки.
До TA шкала серого для каждой контурной области интереса была нормализована с динамическим ограничением µ ± 3δ (µ, среднее; δ, стандартное отклонение), чтобы минимизировать эффекты изменения контраста и яркости, которые в противном случае могли бы размыть реальную текстуру 32 . После нормализации характеристики текстуры были рассчитаны с использованием методов обработки изображений, включая гистограмму серого, длину прогона и матрицу совместной встречаемости, абсолютный градиент, авторегрессионную модель и вейвлет-преобразование (см. Дополнительную таблицу C).Чтобы определить, какие особенности текстуры были наиболее полезны для отличия CRC, воспалительных поражений IBD и NTC от контроля, ранее вычисленные особенности текстуры были дополнительно извлечены с помощью коэффициента Фишера, POE + ACC и коэффициента MI 31 . Программа B11 (http://www.eletel.p.lodz.pl/programy/cost/projekt_cost.html), которая изучает данные для уменьшения размерности вектора и увеличения дискриминирующего значения, использовалась для статистической оценки признаков. В программе B11 мы использовали три разных подхода: (i) PCA; (ii) LDA; (iii) NDA.Характеристики, извлеченные из PCA, LDA, были дополнительно классифицированы классификатором k-NN, а функции, извлеченные из NDA, были классифицированы классификатором ANN, соответственно. Ошибочная классификация векторов данных с помощью k-NN и ANN для дифференциации CRC, поражений IBD и NTC изучалась отдельно для изображений PCP, AP и PVP.
Для проверки согласованности внутри (считыватели A1 и A2) и между наблюдателями (считыватели A1 и B) при выборе функций текстуры были проанализированы характеристики текстуры, выбранные с использованием следующих методов для каждого считывателя, и воспроизводимость этих функций: среднее значение и дисперсия гистограммы уровня серого, второй угловой момент, энтропия, общая энтропия, разница в дисперсии, разница в энтропии из матрицы совместного появления и разница в длине серии и шкале серого из матрицы длин серий.Определения характеристик текстуры приведены в дополнительной таблице D.
Визуальная классификация
Все КТ-изображения каждого пациента были просмотрены двумя лечащими радиологами желудочно-кишечного тракта (читатели C и D) с опытом работы 12 и 10 лет и двумя молодыми резидентами ( читатели E и F) со стажем работы 3 и 4 года соответственно. Читатели не имели доступа к информации о пациентах, включая патологические результаты и результаты ТА. При визуальном анализе читатели устанавливают оптимальное окно и уровень в соответствии с визуальной обратной связью, чтобы обеспечить достаточную видимость поражения.Каждый раз пересматривался один этап сканирования. Две недели спустя следующая фаза сканирования была пересмотрена, чтобы избежать эффектов памяти. Читатели независимо друг от друга ставили диагноз CRC, IBD или NTC в основном на основании характера утолщения стенки толстой кишки и характеристик увеличения контрастности поражения. MCR визуализации для каждого рентгенолога желудочно-кишечного тракта был рассчитан в соответствии со следующим уравнением:
$$ {\ rm {MCR}} \, (\%) = \ left (1- \ frac {Number \, of \, cases \ , с \, правильно \, диагностикой} {Число \, из \, всех \, случаев} \ right) \ times 100 \% $$
Статистический анализ
Количество пикселей в области интереса и толщина толстой кишки стены выражены как среднее ± стандартное отклонение.Наш анализ ограничивался средними значениями на уровне пациента для каждой особенности и для каждого набора контуров (A1, A2 и B). Различия в измерениях между показаниями (A1, A2 и B) на одних и тех же изображениях анализировали с помощью дисперсионного анализа (ANOVA). Согласование между наблюдателями (A1, A2) и между наблюдателями (A1, B) между пикселями области интереса и сеансами измерения толщины оценивалось с помощью ICC. ICC 0–20, 20–40, 40–60, 60–80 и 80–100 указывает на плохое, удовлетворительное, умеренное, существенное и очень хорошее согласие, соответственно.Повторяемость текстурных особенностей в пределах (A1 против A2) и между (A1 против B) читателей оценивалась с помощью коэффициента конкордантности (Rc) и отображалась графически с использованием метода Бланда-Альтмана. Rc <0,90, 0,90–95, 0,95–0,99 и> 0,99 указывает на плохое, умеренное, существенное и почти полное совпадение, соответственно. U-тесты Манна-Уитни были выполнены для сравнения MCR для дифференциации CRC, IBD и NTC на каждой фазе сканирования CT между CTTA и визуальным анализом. Статистический анализ проводился с использованием программного обеспечения SPSS (версия 22.0), а значения p менее 0,05 считались указанием на значимые различия. Возможность классификации рассчитанных характеристик текстуры оценивалась анализом кривой ROC с использованием программного обеспечения MedCalc (Vision 19.1.7, MedCalc Software, Ltd., Остенде, Бельгия).
Этическое разрешение
Все процедуры, выполненные в исследованиях с участием людей, соответствовали этическим стандартам институционального и / или национального исследовательского комитета, а также Хельсинкской декларации 1964 года и более поздним поправкам к ней или сопоставимым этическим стандартам.
Информированное согласие
Информированное согласие было получено от всех отдельных участников, включенных в исследование.
Червеобразный отросток – обзор
Лимфоидные структуры
Сообщающаяся сеть лимфатических сосудов, необходимая для распространения лимфомиелоидных клеток, развивается на ранней стадии роста плода. Лимфатические сосуды у людей начинают дифференцироваться на 35–42 днях беременности (Yoffey and Courtice, 1970). В кишечнике плода человека скопления лимфоцитов, которые могут представлять собой ранние пятна Пейера (PP), могут быть обнаружены под микроскопом между 100 и 110 днями беременности (Spencer et al., 1986; Спенсер и др., 1987; Ogra, 2010), а PP можно макроскопически увидеть на 200-й день беременности (Cornes, 1965). Отдельные первичные В-клеточные фолликулы, Т-клеточные зоны с высокими эндотелиальными венулами, область купола и связанный с фолликулом эпителий наблюдаются в кишечнике плода человека примерно на 130–140 дней беременности (Spencer et al., 1997). Агрегации лимфоцитов появляются в червеобразном отростке примерно через 120 дней беременности (Malas et al., 2004).
Антигены класса I главного комплекса гистосовместимости (MHC) (HLA-A-B) экспрессируются на эпителиальных клетках кишечника человека в период от 120 до 140 дней беременности (самый ранний изученный срок) (Rognum et al., 1992; Russell et al., 1990a). Венулы высокого эндотелия экспрессируют молекулы межклеточной адгезии и молекулы адгезии сосудистых клеток (Dohan et al., 1993), а PP-лимфоциты, как сообщается, экспрессируют HLA-DR (MacDonald et al., 1988). В тканях желудочно-кишечного тракта плода человека экспрессируются небольшие количества HLA-DR, в основном из клеток с морфологией дендритных клеток (MacDonald et al., 1988; Oliver et al., 1988), но значительная экспрессия HLA-DR происходит только после рождения в нормальные новорожденные (Rognum et al., 1992; Russell et al., 1990a). Рецептор Fc для иммуноглобулина G (IgG) был обнаружен вдоль кишечника плода человека и, как полагают, играет роль в поглощении и транспортировке IgG из околоплодных вод (Shah et al., 2003) и в иммунном надзоре, а также индукция оральной толерантности (Israel et al., 1997).
В легком плода человека организованные лимфоидные агрегаты, называемые бронх-ассоциированной лимфоидной тканью (BALT), присутствуют лишь изредка до рождения в отсутствие какой-либо идентифицируемой основной инфекции.У нормальных плодов нечеткие лимфоидные агрегаты наблюдаются на 110-й день беременности, с четко выраженными агрегатами на 140-й день беременности (Gould and Isaacson, 1993). Однако, в отличие от кишечника, развитие BALT в значительной степени зависит от инфекции или антигенного стимула и в природе не присутствует в жизни плода (Gould and Isaacson, 1993).
Выступающие и невыступающие карциномы толстой кишки, происходящие из кишечной лимфоидной ткани
Реферат
Предпосылки: Карциномы толстой кишки, возникающие в кишечной лимфоидной ткани (GALTC), называются куполообразными карциномами (DC) из-за их выступающего фенотипа.В литературе описано только 8 случаев GALTC. История болезни: у пациентки 53 лет, у которой в семейной родословной были рак толстой кишки, рак шейки матки и опухоль головного мозга, развилась карцинома с кольцом-печаткой в слепой кишке, а через 10 лет – рак эндометрия. В то время как бессимптомное течение, бляшкообразное выпячивание в толстой кишке было обнаружено при наблюдательной колоноскопии. Гистология показала выступающий GALTC. Хирургический образец показал четыре дополнительных карциномы: 2 GALTC (невыступающие) и 2 карциномы в лимфоидной слизистой оболочке толстой кишки (LFCMC).Заключение: поскольку аденомы не могли быть обнаружены ни ранее, ни в образце колэктомии, предполагается, что GALTC у этого пациента могли следовать пути GALT-карциномы.
Около половины лимфоцитов иммунной системы обнаруживается в лимфоидных тканях, связанных со слизистой оболочкой (MALT) (1). MALT располагается на поверхности всех тканей, наиболее известным его представителем является лимфоидная ткань, ассоциированная с кишечником (GALT).
Слизистая оболочка толстой кишки (CRM) может быть разделена на две количественно, структурно и функционально разнородные фракции.Одна фракция охватывает подавляющее большинство CRM и не связана с лимфоидной тканью (LT). Мы будем называть ее фракцией без GALT. Он построен из слизи, производящей бокаловидные клетки и столбчатые клетки с регулярными микроворсинками, покрытыми гликокаликсом, внеклеточным гликопротеином. Функция этой огромной фракции слизистой оболочки – защищать подлежащие структуры и активно поглощать жидкости, витамины и некоторые питательные вещества. Другая фракция, микроскопически малая, связана с LT; она будет называться фракцией GALT.Эта крошечная фракция покрыта одним слоем клеток с широкими впячиваниями, которые увеличиваются на поверхности клетки, образуя интраэпителиальные карманы. Эти микроскладки дали название клетке, а именно M-клетка (1). Иногда присутствуют бокаловидные клетки, продуцирующие слизь. Функция М-клеток заключается в абсорбции люминальных антигенов, макромолекул и микроорганизмов через клатрин-опосредованный эндоцитоз (2) и их транспортировка в нижележащую коллекцию индигенных в кишечнике, независимых от тимуса LT для немедленной иммунологической обработки.Созвездие M-клеток-LT строит лимфо-эпителиальный иммунологический блок перекрестного взаимодействия, ретрансляционный комплекс для распознавания антиген-кишечник.
Почти все колоректальные карциномы (CRC), третий по частоте рак в мире (3), развиваются во фракции, свободной от GALT. Напротив, CRC, возникающие во фракции GALT, очень редки. В 1999 г. де Петрис и др. (4) сообщил о первом случае рака толстой кишки, возникшем во фракции GALT. Из-за его выступающей формы эти авторы предложили назвать этот новый фенотип карциномы толстой кишки, куполообразной карциномой (DC).С тех пор в литературе было зарегистрировано еще 7 случаев ДК (5-8) (Таблица I).
Недавно в этой больнице был диагностирован случай ДК.
История болезни
Семейный анамнез: Дед пациентки умер от рака толстой кишки в возрасте 50 лет, ее мать умерла от рака шейки матки в возрасте 56 лет, как и одна тетя в возрасте 50 лет и вторая тетя от опухоли головного мозга, когда она была молодой. Из 6 братьев и сестер один брат в 41 год и сестра в 43 года умерли от рака толстой кишки.
Пациентка, женщина 53 лет (2009 г.).В связи с семейным происхождением она периодически проходила клинические обследования. В 1992 году на рентгеновском снимке обнаружена опухоль слепой кишки. Была проведена илео-слепая резекция, гистология показала рак с печаткой. Десять лет спустя (2002 г.) была выполнена гистеро-сальпингоофорэктомия по поводу рака эндометрия.
В начале 2009 года при бессимптомном обследовании при колоноскопии было обнаружено хорошо очерченное бляшкообразное выступание с ровной поверхностью на 2 см дистальнее подвздошно-ободочной кишки. анастомоз.Остальная часть толстой и прямой кишки была в норме. Выполнена мукозэктомия выступающего очага поражения. Образец мукозэктомии показал центрально расположенный бляшкообразный выступ размером 3 мм × 8 мм. Гистологическое исследование выявило четко очерченный ЛП с зародышевыми центрами; он был покрыт кубовидным или столбчатым эпителием, частично пропитанным лимфоцитами. Аденоматозных структур ни сверху, ни сбоку не обнаружено. Внутри организованной LT была обнаружена железисто-образующая аденокарцинома (рисунок 1).При микроскопии под большим увеличением были обнаружены плеоморфные опухолевые клетки с незаметным ядрышком. Множественные срезы доказали, что опухоль иссечена локально. Поражение было диагностировано как DC (4-8).
Рисунок 1.Низкое увеличение GALTC (выступающий фенотип) (H&E × 2).
Фигура 2.Отсутствие иммунореактивности MLh2 в GALTC (выступающий фенотип, MLh2, × 2).
Таблица I.В литературе опубликованы случаи купольного колоректального рака.
Дополнительные срезы были иммуногистохимически заражены MLh2 (BD Biosciences, Сан-Диего, США), MSh3, MUC1, MUC2, Actin SM (Leica Microsystems AB, Bromma, Швеция), Ki-67 (клон MIB1), MNF 116, ламинином 5 ( Dako Cytomation, Glostrup, Дания), M30 (Peviva, Bromma, Швеция), p53 (BD Products, Franklin Lakes, США), p21 WAF1 (Oncogen Science, Чикаго, США) и гистохимически окрашивали альциановым синим (pH 2.5), ПАС и ПАС-Д.
Изучение белков репарации ошибочного спаривания показало, что в то время как MSh3 экспрессировался нормально (фиг. 2), MLh2 не экспрессировался (фиг. 3). Опухоль была сильно пролиферирующей, экспрессировала MUC-1, но не MUC-2 или MUC-5AC. p53 экспрессировался в 7% опухолевых клеток, в то время как окрашивание p21 WAF1 было отрицательным. M30 показал лишь минимальный апоптоз. Актин SM показал, что опухоль проникла через muscularis mucosae . Окрашивание альциановым синим, PAS и PAS-D показало отсутствие сиаломуцинов и гликопротеинов в опухолевых клетках.
Впоследствии была выполнена колэктомия. Образец имел длину 50 см. Примерно в 15 см от проксимальной линии резекции, невыступающая слизистая оболочка размером 3 × 7 мм. обнаружено поражение. Гистология показала GALTC (невыступающий фенотип) с ранней инвазией в подслизистую основу (рис. 4). Сверху аденоматозных компонентов не обнаружено. На нескольких срезах из области предыдущей эндоскопической мукозэктомии не было обнаружено остатков опухоли.
Рисунок 3.GALTC показывает высокую пролиферацию клеток (фенотип выступающих, Ki-67, клон MIB1, × 2).
Из остатка образца было случайным образом отобрано 20 новых блоков (длиной около 4 см) из явно нормальной слизистой оболочки толстой кишки. Гистологически выявлено 3 новых синхронно растущих аденокарциномы невыступающего фенотипа; один был GALTC, а остальные два не были GALTC.
Аденоматозные компоненты не были обнаружены гистологически ни в одной из 3 карцином, ни в остаточном образце.
Всего из хирургического образца было извлечено 14 лимфатических узлов; ни у кого не было метастатических отложений.Послеоперационный период прошел без происшествий. Через восемь месяцев после операции пациент чувствует себя хорошо.
Обсуждение
Несмотря на то, что CRC является третьим по частоте раковым заболеванием в мире, карциномы, развивающиеся на слизистой оболочке GALT, встречаются редко. Фактически, это 9-й случай DC, о котором сообщалось ранее. Из 9 случаев DC, показанных в Таблице I, семейная родословная была известна в 5, и особенно 2 произошли у пациентов с синдромом Линча.
Синдром Линча запускается мутацией зародышевой линии в одном из двух генов-супрессоров опухолевой репарации несоответствия ДНК (MMR): MSh3 или MLh2 , и гораздо реже MSH6 (который сильно связан с раком эндометрия).После инактивации аллеля дикого типа белки MMR больше не будут экспрессироваться, что приведет к неспособности исправить несоответствия ДНК, возникающие как спонтанные ошибки во время репликации ДНК (9). В своих ранних отчетах Линч ссылался на семейный синдром рака (CFS) (10), а позже (11) он ввел термин HPNCC, подчеркивая наследственную предрасположенность к CRC при отсутствии широко распространенного полипоза. Боланд и Тронкейл назвали эту генетическую черту Синдром Линча (12).
Рисунок 4.GALTC с инвазией в подслизистую основу (стрелка), обнаруженный в образце колэктомии (невыступающий фенотип, MNF116, × 2).
В литературе HNPCC и синдром Линча в основном использовались как синонимы, но сегодня многие авторы отдают предпочтение термину синдром Линча, поскольку HNPCC неточен и потенциально вводит в заблуждение фенотипа заболевания (9, 13, 14). Фактически, термин HNPCC подразумевает отсутствие колоректальных полипов, что не так, поскольку пациенты Lynch могут иметь такое же количество полипов, что и население в целом. Кроме того, термин HNPCC не учитывает более широкий спектр ассоциированных новообразований, таких как карциномы эндометрия, желудка, тонкой кишки, яичников, пазухи и кожи.Что еще более важно, HNPCC по-разному применялась к двум перекрывающимся группам пациентов, отвечающим Амстердамским критериям, и тем, у которых наблюдались клинико-патологические и молекулярные особенности с очевидной мутацией зародышевой линии в гене MMR. Эта путаница, по крайней мере, частично объясняется ассоциацией HNPCC с Амстердамскими критериями до демонстрации молекулярно-генетической основы заболевания (9, 13, 14).
Из 5 синхронно сосуществующих карцином, обнаруженных у пациента с синдромом Линча, описанных здесь, 3 были GALTC, а оставшиеся 2 карциномы без GALT.Из 3 GALTC один имел выступающий фенотип (DC), тогда как оставшиеся два имели невыступающий фенотип. Оставшиеся 2 новообразования без GALT были невыступающими карциномами. Полное подавление иммунореактивности MLh2 и нормальная экспрессия MSh3 соответствовали преобладающему дефициту несоответствия ДНК, обнаруженному у пациентов с синдромом Линча (9, 13, 14).
de Petris et al. (4) предложил термин DC, сообщая о случае выпирающего GALTC. Другие авторы, представленные в таблице I, использовали тот же термин (DC) для определения GALTC в целом (5-8).Однако мы продемонстрировали, что GALTC может проявляться не только как GALT-DC, но и как GALT-не выступающий. При сообщении архитектурного профиля GALTC в гистологических срезах следует учитывать наличие выступающих или невыступающих фенотипов.
GALTC толстой кишки является редкой опухолью. Несмотря на эндоскопическое удаление тысяч небольших полиповидных и неполиповидных поражений толстой кишки в программах наблюдения в Японии, Франции, Германии, Швеции и США (15), мы обнаружили GALTC только у одного пациента, описанного здесь.
Подавляющее большинство CRC развивается в слизистой оболочке, свободной от GALT, через последовательность аденома-карцинома (16-18). Поскольку аденомы не были обнаружены ни ранее, ни в образце колэктомии, предполагается, что GALTCs у этого пациента могли следовать по пути GALT – карцинома.
Задача будущего – раскрыть последовательность микроскопических / молекулярных изменений, происходящих, скорее всего, в М-клетках, которые предшествовали развитию эпителиальных новообразований в GALT.
Это первый случай в литературе, демонстрирующий множественные синхронно растущие GALTC, как выступающие (DC), так и невыступающие, у пациента с синдромом Линча.
- Получено 22 апреля 2010 г.
- Исправление получено 25 мая 2010 г.
- Принято 3 июня 2010 г.
- Copyright © 2010 Международный институт противораковых исследований (доктор Джон Г. Делинассиос), Все права защищены
Какие из них наиболее опасны для вас? – Клиника Кливленда
Вы прошли колоноскопию и получили довольно запутанный отчет.
Клиника Кливленда – некоммерческий академический медицинский центр. Реклама на нашем сайте помогает поддерживать нашу миссию. Мы не поддерживаем продукты или услуги, не принадлежащие Cleveland Clinic. Политика
Что означают все эти длинные слова? И какие полипы с наибольшей вероятностью могут привести к колоректальному раку?
«Мы часто не можем сказать, какие полипы плохие, по их глазам. Мы должны удалить их, а затем изучить образцы под микроскопом », – говорит колоректальный хирург Джеймс Черч, доктор медицины.
Здесь он объясняет, как полипы различаются по форме, размеру и характеру роста.
На что указывает форма полипа
Полипы – уплотнения на гладкой поверхности толстой или прямой кишки – все чаще встречаются после 40 лет. Врачи находят и удаляют полипы во время колоноскопии.
- Около 85 процентов полипов «сидячие»: куполообразные, без ножки.
- Около 13 процентов полипов имеют «ножку», свисая со стенки толстой кишки на стебле, как вишня на стебле.
- Около 2 процентов предраковых поражений плоские.
Несмотря на то, что полипы на сидячих местах можно легко поймать, очень большие полипы на сидячих местах необходимо удалять по частям.
Полипы на ножке легче обнаружить, и их можно удалить одним куском. «Голова – это то место, где может быть предрак, поэтому, захватив стебель, мы без сомнения знаем, что он исчез», – говорит он.
Плоские полипы удалить сложнее всего. «Они могут быть довольно незаметными, и их легко пропустить», – говорит д-р.Церковь.
Почему размер полипа имеет значение
«Чем меньше полип, тем меньше вероятность того, что он приведет к раку», – отмечает он.
Полипы варьируются от «миниатюрных» размеров менее 5 миллиметров до «гигантских» размеров более 30 миллиметров.
«Маленький полип размером всего со спичечную головку», – говорит он. «Большой полип может быть почти такого же размера, как большой палец среднего человека».
Полипы размером более 20 миллиметров имеют 10-процентную вероятность развития рака.
Что такое дисплазия
Первое, что врачи исследуют под микроскопом, – это то, как выглядят клетки полипа. «Предраковые клетки выглядят дико», – говорит доктор Черч. «Это безумие называется дисплазией».
Диспластические клетки больше не могут контролировать свой рост. Они выглядят более неорганизованными и имеют более крупные и темные центры, чем нормальные клетки.
Клетки с дисплазией низкой степени не слишком отличаются от нормальных клеток. «Но клетки с дисплазией высокой степени выглядят очень дико, как раковые клетки», – говорит он.
«Когда полип показывает дисплазию высокой степени, мы рады избавиться от него, потому что рак не за горами».
Аденомы и зубчатые полипы
Семьдесят пять процентов случаев рака толстой кишки возникают из-за полипов, называемых аденомами, которые возникают из железистых клеток в слизистой оболочке толстой кишки.
«Аденомы часто более розовые, отчетливые и на стеблях, и их довольно легко удалить», – говорит д-р Черч.
Двадцать пять процентов рака толстой кишки возникают из-за зубчатых полипов, которые под микроскопом выглядят как зубья пилы.
«Зубчатые полипы тонкие, бледные и без особой формы. Их легко пропустить во время колоноскопии ».
Аденомы ворсинок и канальцев
Ряд «крипт», напоминающих крошечные лунки, покрытые клетками, образуют выстилку толстой кишки. Крипты полипа под микроскопом могут выглядеть «трубчатыми» или «ворсинчатыми»:
- В трубчатых аденомах крипты расположены нормально и выглядят как крошечные пробирки, зажатые в слизистой оболочке толстой кишки.
- В ворсинчатых аденомах крипты неупорядочены и напоминают листья папоротника, что свидетельствует о более быстром росте.
Изменения ворсинок вызывают большее беспокойство. «Чем больше полип, тем больше вероятность того, что мы увидим дисплазию высокой степени и изменения ворсинок», – отмечает доктор Черч.
«Хотя не все полипы превращаются в рак, все виды рака начинаются как полипы. Это означает, что мы должны удалить их все. ”
Посещение колоноскопии позволит вашим врачам делать именно это.
Все о раке толстой кишки | OncoLink
Что такое толстая кишка?
Ободочная кишка – самая длинная часть толстой кишки, также известная как толстая кишка.Толстый кишечник – последняя часть пищеварительного тракта. Толстый кишечник – это трубка длиной от 5 до 6 футов. Первые 5 футов составляют толстую кишку. Ободочная кишка состоит из четырех различных частей: восходящей ободочной кишки, поперечной ободочной кишки, нисходящей ободочной кишки и сигмовидной кишки. Ободочная кишка соединяется с прямой кишкой и, наконец, заканчивается анусом.
К тому времени, когда пища достигает толстой кишки (примерно через 3-8 часов после еды), питательные вещества усваиваются. Остается жидкие отходы.Функция толстой кишки – превращать жидкие отходы в твердый стул. Он делает это за счет поглощения воды. Стул может находиться в толстой кишке от 10 часов до нескольких дней, прежде чем выйти через задний проход.
Что такое рак толстой кишки?
Рак – это неконтролируемый рост клеток, который может привести к образованию опухоли. Рак толстой кишки – это злокачественная опухоль, которая растет в стенке толстой кишки. Большинство опухолей толстой кишки возникают, когда нормальная ткань в стенке толстой кишки образует аденоматозный полип или предраковый рост, который выходит из стенки толстой кишки.По мере увеличения полипа образуется опухоль. Этот процесс может занять много лет, что дает время для раннего выявления с помощью скрининговых тестов.
Что вызывает рак толстой кишки и подвержен ли я риску?
Рак толстой кишки – четвертый по распространенности тип рака как у мужчин, так и у женщин в Соединенных Штатах. Ежегодно в Соединенных Штатах будет диагностироваться около 104 000 случаев рака толстой кишки. Афроамериканцы, особенно афроамериканские мужчины, подвергаются повышенному риску. Риск рака толстой кишки также повышается после 50 лет, но с каждым годом все больше случаев регистрируется у лиц моложе 50 лет.Рак толстой кишки чаще встречается в возрасте 55-74 лет, при этом средний возраст на момент постановки диагноза составляет 67 лет.
Определенные факторы подвергают людей более высокому риску. Лица с личным или семейным анамнезом рака толстой кишки, полипов или наследственных синдромов рака толстой кишки (например, FAP и синдром HNPCC / Lynch), а также лица с язвенным колитом или болезнью Крона относятся к группе более высокого риска и могут потребовать обследования на более ранний возраст, чем у населения в целом. У человека, у которого есть один родственник первой степени родства (родитель, брат, сестра или ребенок) с раком толстой кишки, в 2–3 раза больше шансов заболеть раком толстой кишки, чем у человека, у которого нет больного родственника.
Это не означает, что люди без семейного анамнеза не подвергаются риску. Исследования случаев рака толстой кишки показали, что факторы образа жизни могут подвергать человека более высокому риску. Эти факторы включают: диету с высоким содержанием жиров и красного мяса и низким содержанием фруктов и овощей, высокое потребление калорий, низкий уровень физической активности и ожирение. Кроме того, курение и чрезмерное употребление алкоголя могут играть роль в развитии рака толстой кишки. Несмотря на то, что вы избегаете всех этих факторов, у некоторых людей все равно развивается рак толстой кишки.Благодаря скринингу и раннему выявлению таких пациентов в большинстве случаев можно эффективно вылечить.
Как предотвратить рак толстой кишки?
Диета с низким содержанием жиров, высоким содержанием фруктов и овощей и низким содержанием красного мяса, а также регулярные физические упражнения и поддержание здоровой массы тела могут помочь предотвратить рак толстой кишки. Также важно не курить или бросить курить, если вы уже курите. Ограничение употребления алкоголя может быть полезным.
Химиопрофилактика определяется как «использование химического соединения для предотвращения, подавления или обращения вспять образования рака.«В настоящее время проводятся исследования, в которых рассматриваются витамины A, E, D и C, фолиевая кислота, кальций, селен, аспирин, ингибиторы ЦОГ-2, статины (традиционно используемые для снижения холестерина) и заместительная гормональная терапия как потенциальные химиопрофилактические препараты агенты, которые могут предотвратить или обратить вспять образование полипов и рака толстой кишки. Эти исследования были безрезультатными, поэтому нельзя дать конкретные рекомендации для населения в целом. Некоторые из этих агентов продолжают проходить клинические испытания.
Какие скрининговые тесты используются для выявления рака толстой кишки?
Когда начинать обследование на рак толстой кишки, по-прежнему ведутся споры. Американское онкологическое общество рекомендует, чтобы скрининг для лиц со средним риском начинался в возрасте 45 лет. Недавно Рабочая группа США по профилактике также предложила изменить руководящие принципы, чтобы начать скрининг в 45 лет. Этот вопрос продолжает пересматриваться. Имейте в виду, что страховка может не покрывать скрининг, начиная с 45 лет. Важно поговорить со своим поставщиком медицинских услуг и страховой компанией перед назначением скринингового теста.
Существует множество различных типов скрининговых тестов на рак толстой кишки. Некоторые из этих тестов ищут ДНК-доказательства рака в стуле. Другие – визуальный осмотр толстой и прямой кишки с помощью ректороманоскопии или колоноскопии. Вы можете узнать больше о различных типах тестов, доступных на OncoLink. Поговорите со своим лечащим врачом о вариантах скрининга и о том, как часто вам нужно будет проходить эти тесты.
Лица с семейным или личным анамнезом рака толстой кишки, воспалительного заболевания кишечника или генетических синдромов, таких как FAP или HPNCC, должны проходить скрининг чаще.Ваш лечащий врач посоветует вам, когда начинать обследование, а также как часто вам нужно будет проходить обследование.
Каковы признаки рака толстой кишки?
На ранних стадиях рака толстой кишки симптомы могут отсутствовать. Вот почему важно делать скрининговые тесты, даже если вы чувствуете себя хорошо. По мере того как полип перерастает в опухоль, он может кровоточить или закупорить толстую кишку, вызывая симптомы. Эти симптомы включают:
- Кровотечение из прямой кишки.
- Кровь в стуле или туалете после дефекации.
- Изменение формы стула (то есть истончение).
- Спастические боли внизу живота.
- Ощущение потребности в дефекации, хотя на самом деле в этом нет необходимости.
Эти симптомы также могут быть вызваны другими состояниями, кроме рака. Если вы испытываете эти симптомы, вам следует обратиться к врачу.
Как диагностируется рак толстой кишки?
Как только рак толстой кишки обнаружен, необходимы дальнейшие тесты для определения степени опухоли.Тесты, используемые для определения распространения опухоли, – это компьютерная томография, МРТ, ПЭТ / КТ и анализы крови. Позитронно-эмиссионная томография (ПЭТ) позволяет оценить состояние всего тела и выявить активные опухоли в организме. Злокачественные опухоли имеют повышенную скорость гликолиза, о чем свидетельствует повышенное поглощение маркера глюкозы. ПЭТ / КТ используется для оценки потенциально резектабельных метастазов в легких и печени. Уровень карциноэмбрионального антигена (CEA) является маркером рака толстой кишки, обнаруженного в крови. Этот маркер повышен в 95% случаев рака толстой кишки.
Как определяется стадия рака толстой кишки?
После этих тестов определяется этап, который помогает определить необходимое лечение. Рак толстой кишки чаще всего диагностируется с помощью «системы TNM». Система стадирования TNM оценивает степень первичного t umor, n odal вовлечения (описывает, есть ли рак в лимфатических узлах) и отдаленных m etastases (если рак распространился на другие органы). Об этом сообщается в вашем отчете о патологии – вы можете попросить копию этого отчета для своих личных файлов.Система постановки очень сложная. Вся промежуточная система описана в конце этой статьи. Несмотря на свою сложность, система стадирования помогает поставщикам медицинских услуг определять степень рака и, в свою очередь, принимать решения о лечении рака пациента. Стадия рака или степень заболевания основывается на информации, собранной с помощью различных тестов, проводимых во время диагностики и лечения рака.
Как лечится рак толстой кишки?
Хирургия
Хирургия является наиболее распространенным методом лечения рака толстой кишки.Если рак ограничен полипом, вы можете пройти полипэктомию (удаление полипа) или местное иссечение, при котором также удаляется небольшое количество окружающей ткани.
Если опухоль проникает в стенку кишечника или окружающие ткани, вам потребуется частичная резекция. Это удаление рака и части кишечника. Лимфатические узлы также будут удалены, чтобы определить, распространился ли на них рак. После удаления опухоли два конца оставшейся толстой кишки повторно соединяются, обеспечивая нормальную работу кишечника.В некоторых случаях невозможно восстановить соединение толстой кишки, и требуется колостома (отверстие в брюшной стенке, через которое проходит стул). Это может быть временное или постоянное.
Химиотерапия
Несмотря на то, что у большинства пациентов опухоль полностью удалена хирургическим путем, у многих людей разовьется рецидив без дальнейшего лечения. Чтобы снизить вероятность рецидива, назначают химиотерапию. Тип химиотерапии, используемой для лечения рака толстой кишки, также может зависеть от способности пациента переносить интенсивную химиотерапию, а также от расположения опухоли в толстой кишке и стадии опухоли.Ваша опухоль может быть проверена на наличие определенных маркеров, называемых микросателлитной нестабильностью (MSI-H) и стабильностью (MSS). Этот тест может указать на чувствительность к определенным методам лечения рака толстой кишки.
Обычно при лечении рака толстой кишки используются фторурацил, оксалиплатин, иринотекан, лейковорин, бевацизумаб, трифлуридин / типирацил, капецитабин и зив-афлиберцепт. Эти препараты используются как при начальной химиотерапии, так и при лечении рецидивов / метастатических заболеваний. .
Таргетная терапия также используется при лечении рецидивирующих или метастатических типов рака толстой кишки. Эти методы лечения часто используются в сочетании с ранее упомянутыми химиотерапевтическими препаратами для борьбы со специфическими аномалиями, обнаруженными в раковых клетках. Эти аномалии способствуют росту, распространению и прогрессированию рака. Ваш лечащий врач проверит вашу опухоль, чтобы определить, присутствует ли конкретная цель.
Одной из таких мишеней является рецептор эпидермального фактора роста (EGFR).EGFR аномально сверхэкспрессируется при многих видах рака (включая рак толстой и прямой кишки), поэтому ингибирование EGFR может привести к снижению роста опухолевых клеток и снижению продукции других факторов, ответственных за метастазирование (распространение опухоли). Панитумумаб, рамуцирумаб и цетуксимаб представляют собой моноклональные антитела, которые ингибируют связывание эпидермального фактора роста с EGFR, что препятствует действию эпидермального фактора роста, замедляя рост рака. Эти агенты обычно используются для пациентов, у которых тип опухоли считается “KRAS дикого типа”.Это означает, что в белке KRAS нет мутации. Опухоли KRAS дикого типа также можно лечить цетуксимабом и панитумумабом. Регорафениб и рамуцирумаб – это препараты, нацеленные на фактор роста эндотелия сосудов (VEGF). Вемурафениб и энкорафениб могут нацеливаться на клетки, положительные по мутации BRAF V600E. Трастузумаб, пертузумаб, лапатиниб и фам-тратузумаб deruxtecan-nxki могут использоваться при раке толстой кишки с мутациями HER2, WRAS и BRAF.
Иммунотерапия также используется при лечении некоторых видов рака толстой кишки.Иммунотерапия – это метод лечения рака, который использует собственные возможности организма для выявления и уничтожения раковых клеток. Препараты иммунотерапии, которые в настоящее время используются для лечения рака толстой кишки, включают ипилимумаб, ниволумаб и пембролизумаб.
Рекомендации по лечению пациентов с метастатическим поражением зависят от того, подходит ли пациенту для интенсивной терапии. Варианты химиотерапии для пациентов с метастатическим поражением зависят от того, какое лечение они получали изначально.Перед стандартной терапией может быть рекомендовано участие в клинических испытаниях.
Лучевая терапия
Рак толстой кишки обычно не лечится с помощью лучевой терапии. Если рак проник в другой орган или прикрепился к брюшной стенке, лучевая терапия может быть вариантом лечения. Одна из причин ограниченной роли радиации заключается в том, что это местное лечение, обычно направленное на «цель». После того, как рак толстой кишки был удален хирургическим путем, не очень легко определить «мишень» или зону высокого риска рецидива заболевания.Кроме того, если рак распространился на другие органы, химиотерапия (а не лучевая терапия) может достичь отдаленных областей распространения опухолевых клеток.
Интервенционная радиология
Интервенционные радиологи (IR) – это специалисты, которые используют радиологические методы, такие как компьютерная томография, для доступа к участкам тела и лечения заболеваний без традиционного хирургического вмешательства. Эти методы иногда называют «малоинвазивными». В некоторых случаях эти поставщики услуг могут помочь пациентам с раком толстой кишки, который распространился (метастазировал) в печень или легкие.Методы, используемые в настоящее время этими специалистами, включают: биопсию под контролем КТ, химиоэмболизацию, радиочастотную абляцию и радиоэмболизацию. Проникая в кровеносные сосуды пациента, врач может продеть катетер и лечить непосредственно опухоль.
Радиочастотная абляция (РЧА) – это местное лечение, которое убивает опухолевые клетки с помощью тепла, сохраняя при этом здоровую ткань печени или легких. Когда опухоль слишком велика или находится в месте, не поддающемся РЧА, эмболизация может использоваться для прекращения кровоснабжения опухоли, доставки излучения к опухоли (так называемая радиоэмболизация) или сочетания этой техники с химиотерапией для доставки противоракового лекарства. непосредственно к опухоли (химиоэмболизация , ).
Некоторым пациентам может быть полезно установить инфузионный насос для введения химиотерапии непосредственно в печень. Врачи-терапевты также могут выполнять паллиативные процедуры, такие как установка стента для снятия обструкции, лечение определенных типов боли, введение центральных катетеров или лечение тромбов.
Клинические испытания
Существуют клинические исследования для большинства типов рака и каждой стадии заболевания. Клинические испытания предназначены для определения ценности конкретных методов лечения.Испытания часто предназначены для лечения определенной стадии рака либо в качестве первой предлагаемой формы лечения, либо в качестве варианта лечения после того, как другие методы лечения не сработали. Их можно использовать для оценки лекарств или методов лечения для предотвращения рака, его более раннего выявления или помощи в борьбе с побочными эффектами. Клинические испытания чрезвычайно важны для углубления наших знаний о болезнях. Именно благодаря клиническим испытаниям мы знаем, что делаем сегодня, и в настоящее время проходят испытания многие новые захватывающие методы лечения.Поговорите со своим врачом об участии в клинических испытаниях в вашем районе. Вы также можете изучить открытые в настоящее время клинические испытания с помощью службы сопоставления клинических испытаний OncoLink.
Последующее наблюдение и выживание
После завершения лечения за вами будут внимательно следить на предмет рецидива. Рекомендации по последующему уходу зависят от начальной стадии рака толстой кишки. При стадиях II-IV вы должны проходить осмотры у вашего лечащего врача каждые 3-6 месяцев в течение 2 лет, а затем каждые 6 месяцев в течение 2-5 лет.Повторную колоноскопию следует проводить через 1 год после лечения, затем через три года, а затем снова каждые 5 лет. Если первоначальная колоноскопия показывает аденому, колоноскопию следует повторить через 1 год. Пациентам с I, II или III стадией заболевания обычное ПЭТ или КТ не рекомендуется. Для пациентов со стадией II / III. Для пациентов с болезнью IV стадии рекомендуется проводить компьютерную томографию грудной клетки, брюшной полости и таза каждые 6-12 месяцев в течение 5 лет. КТ грудной клетки, брюшной полости и таза рекомендуется проводить каждые 3-6 месяцев в течение 2 лет, а затем каждые 6-12 месяцев в течение 5 лет.
Страх рецидива, отношения и сексуальное здоровье, долгосрочное лечение стомы и проблем с внешним видом тела, финансовые последствия лечения рака, проблемы с трудоустройством и стратегии выживания – общие эмоциональные и практические проблемы, с которыми сталкиваются выжившие после рака толстой кишки. Ваша медицинская бригада может найти ресурсы для поддержки и решения этих проблем, с которыми сталкиваются во время и после рака.
Борьба с раком – относительно новое направление в онкологической помощи. В одних только США почти 17 миллионов человек, выживших после рака, необходимо помочь пациентам перейти от активного лечения к выживанию.Что будет дальше, как вернуться к нормальной жизни, что нужно знать и делать, чтобы жить здоровой жизнью в будущем? План ухода за выжившими может стать первым шагом в обучении тому, как вести себя в жизни после рака, и помочь вам грамотно общаться с вашими поставщиками медицинских услуг. Создайте план ухода за выжившими сегодня на OncoLink.
Ресурсы для получения дополнительной информации
Альянс рака толстой кишки – Альянс рака толстой кишки выражает голос выживших в борьбе с колоректальным раком посредством поддержки пациентов, обучения, исследований и защиты интересов.
Борьба с колоректальным раком – Обеспечивает защиту, обучение и поддержку.
The Colon Club – Содействует обучению и повышению осведомленности интересными и нестандартными способами.
Американское общество хирургов толстой и прямой кишки – Общество хирургов толстой и прямой кишки и других хирургов, занимающихся лечением пациентов с заболеваниями и расстройствами, поражающими толстую, прямую и анус.
Приложение: Полная стадия рака толстой кишки
Американский объединенный комитет по раку (2017)
T (опухоль) | Описание | |||||
|---|---|---|---|---|---|---|
TX | как первичная опухоль. | |||||
T0 | Нет признаков первичной опухоли. | |||||
T1s | Карцинома in situ, внутрислизистая карцинома (поражение собственной пластинки без распространения через мышечные слизистые оболочки). | |||||
T1 | Опухоль проникает в подслизистую оболочку (через слизистую мышечную, но не в собственную мышечную). | |||||
T2 | Опухоль поражает собственную мышечную мышцу. | |||||
T3 | Опухоль проникает через собственную мышцу в периколоректальные ткани. | |||||
T4 | Опухоль проникает в висцеральную периотонию или проникает в соседний орган или структуру или прилипает к ним. | |||||
T4a | Опухоль проникает через висцеральную брюшину (включая грубую перфорацию кишечника через опухоль и непрерывную инвазию опухоли через области воспаления на поверхность висцеральной брюшины. |
Опухоль непосредственно вторгается в соседние органы или структуры или прилипает к ним. |
N (регионарные лимфатические узлы) | Описание |
|---|---|
92 NX оценен. | |
N0 | Нет метастазов в регионарные лимфатические узлы. |
N1 | От одного до трех региональных лимфатических узлов положительные (опухоль в лимфатических узлах размером ≥0,2 мм) или любое количество опухолевых отложений, и все идентифицируемые лимфатические узлы отрицательны. |
N1a | Один региональный лимфатический узел положительный. |
N1b | Два или три регионарных лимфатических узла положительны. |
N1c | Нет положительных результатов в регионарных лимфатических узлах, но есть отложения опухоли в суберозе, брыжейке, неперитонеализированных периколичественных или периректальных / мезоректальных тканях. |
N2 | Четыре или более региональных узла положительны. |
N2a | От четырех до шести региональных лимфатических узлов положительные. |
N2b | Семь или более регионарных лимфатических узлов положительны. |
M (отдаленные метастазы) | Описание |
|---|---|
M0 | Нет удаленных метастазов нет признаков опухоли в отдаленных участках или органах. |
M1 | Обнаружены метастазы в один или несколько отдаленных участков или органов или перитонеальные метастазы. |
M1a | Выявлен метастаз в один участок или орган без перитонеальных метастазов. |
M1b | Метастазы в два или более места или органы идентифицируются без перитонеальных метастазов. |
M1c | Метастазы на поверхность брюшины идентифицируются отдельно или вместе с метастазами в другом месте или органе. |
Группировка стадий | T | N | M | |||
|---|---|---|---|---|---|---|
0 | ||||||
I | T1, T2 | N0 | M0 | |||
IIA | T3 | T3 IIB | T4a | N0 | M0 | |
IIC | T4b | 3 | N048 | T1-T2 T1 | N1 / N1c N2a | M0 M0 |
IIIB | T3-T4a T2-T3 T1-T2 9c4000 N0492 | |||||
IIIC | T4a T3-T4a T4b | 000 N2a 0003 M0 | ||||
IVA | Любой T | Любой N | M1a | |||
IVB 9492 | IVB | 9049|||||
IVC | Любой T | Любой N | M1c |
