Хеликобактер фото: причины появления, симптомы заболевания, диагностика и способы лечения
что это такое, откуда берется, как передается
Возможности определения инфекции Хеликобактер пилори при гастроскопии:
Стандартная гастроскопия обязательно должна включать в себя определение инфекции Хеликобактер Пилори в желудке — уреазный тест. Без данного анализа Ваше лечение может быть невозможным. Кроме того, очень важно, проведение уреазного теста с помощью качественных реактивов, с полным соблюдением методики. Хорошие клиники, как правило, закупают готовые стандартные наборы европейских производителей.
При проведении исследования желудка один из самых распространённых хеликобактер дополнительных тестов является определение наличия в желудке бактерии Хеликобактер пилори (Helicobacter pylori). По первым буквам латинского названия этой бактерии тест на нее часто называют HP-тест. Также используется название «уреазный тест». Это название происходит от способности хеликобактера выделять фермент уреазу. Этот фермент во время теста расщепляет мочевину и в результате изменения кислотности среды меняется окраска теста на ярко красный.
Значение хеликобактера тяжело переоценить. Это бактерия открыта ещё в 80-е годы австралийскими учеными, в 2005 году за это открытие они получили Нобелевскую премию, а значит и всеобщее окончательное признание.
На данный момент доказано, что хеликобактер является основной причиной гастрита, язвенной болезни желудка и двенадцатиперстной кишки, рака желудка. Также признается немаловажная роль хеликобактерной инфекции в возникновении панкреатита, холецистита.
При проведения эндоскопического исследования (гастроскопии) для проведения уреазного теста в желудке из антрального отдела и тела желудка необходимо взять 2 фрагмента слизистой оболочки из антрального отдела и тела желудка и поместить в специальный реактив. По изменению окраски — делается вывод о наличии (окраска становится красной — тест положительный) или отсутствии хеликобактерной инфекции (окраска не изменилась — тест отрицательный).
То что взятие кусочков слизистой проводится биопсийными щипцами и они входят в контакт с кровью(возможность заражения гепатитом, ВИЧ) необходимо учитывать пациенту при выборе медицинского учреждения для гастроскопии с уреазным тестом. Щипцы должны быть в достаточном количестве и проходить стерилизацию после каждого пациента качественными дезинфицирующими препаратами. Кроме того, при некачественной обработке частицы слизистой с хеликобактером могут переноситься от одного пациента к другому.
Щипцы должны быть в достаточном количестве и проходить стерилизацию после каждого пациента качественными дезинфицирующими препаратами. Кроме того, при некачественной обработке частицы слизистой с хеликобактером могут переноситься от одного пациента к другому.
На точность определения Хеликобактерной инфекции сильно влияет прием антибиотиков, кислотоснижающих препаратов (омез, париет, нексиум, ранитидин, фамотидин), препаратов висмута (ДЕ-НОЛ). Рекомендуется не принимать их в течении минимум 2х недель перед гастроскопией.
Кроме того при гастроскопии с местной анестезией часто удаётся взять 1 фрагмент слизистой желудка, как правило из-за рвотного рефлекса, что снижает точность определения хеликобактера. Поэтому, и еще по целому ряду причин, мы рекомендуем проходить гастроскопию в медикаментозном сне.
Эта коварная бактерия Хеликобактер пилори. Онкология
Вас часто беспокоят боли в животе, тошнота, чувство тяжести после еды и отрыжка? Возможно, в вашем желудочно-кишечном тракте поселился маленький, но очень агрессивный враг – бактерия Хеликобактер пилори.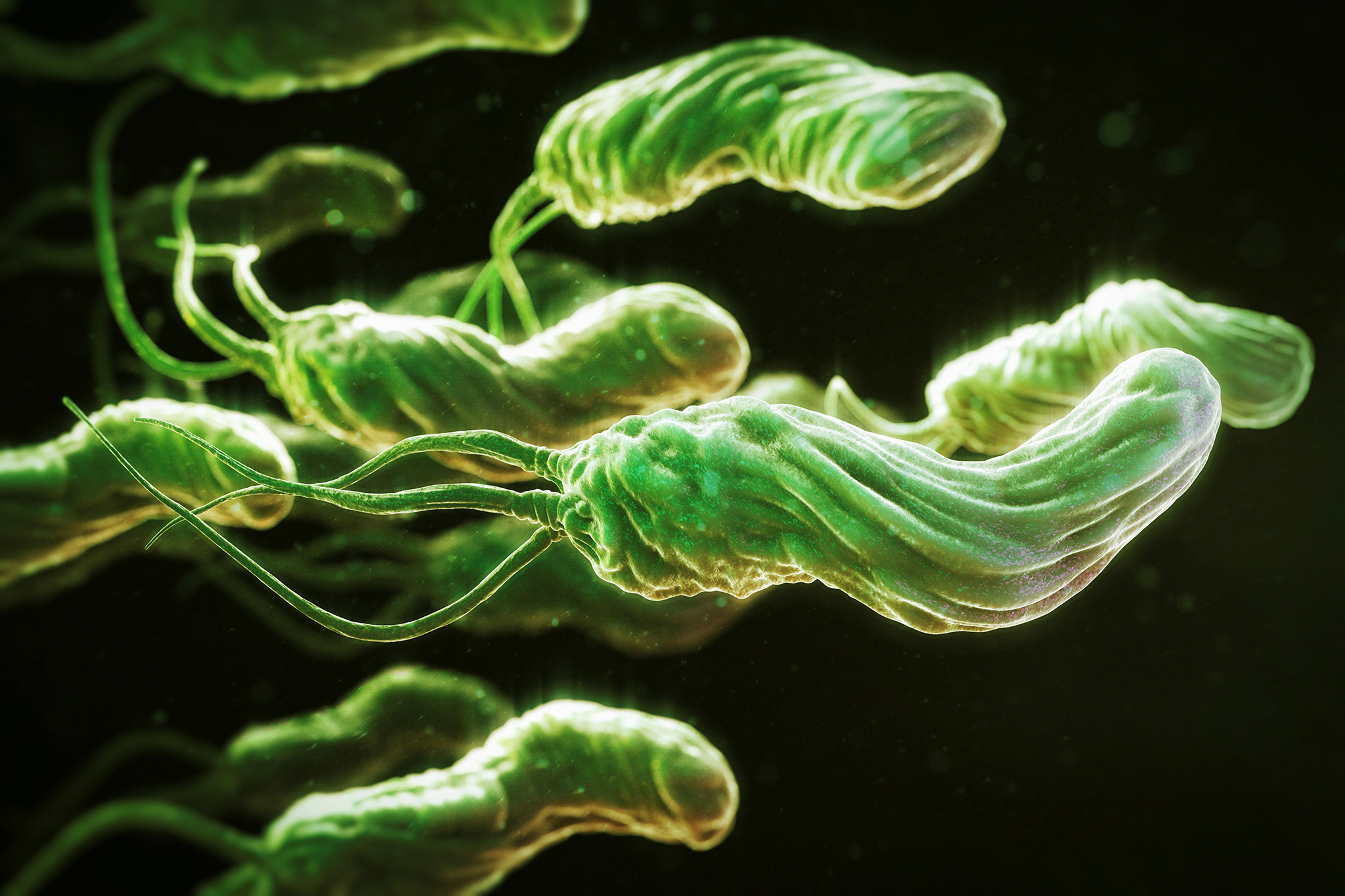 Helicobacter pylori – это особый вид патогенных бактерий, которые инфицируют желудок и двенадцатиперстную кишку. Эти микроорганизмы являются паразитами, продуцирующими большое количество токсинов, повреждающих слизистую оболочку внутренних органов. Подобные повреждения приводят к воспалениям и развитию гастрита, язвы и впоследствии даже к раку. Хеликобактер пилори хитра и коварна. Большинство из известных на сегодняшний день микроорганизмов не могут выжить в кислой среде желудка, но для этой бактерии такая среда наоборот является предпочтительной. Хеликобактер пилори имеет спиралевидную форму и снабжена несколькими жгутиками, которые помогают ей передвигаться по стенкам внутренних органов. Она отлично умеет приспосабливаться к любым условиям, везде чувствует себя «как рыба в воде», требует совсем мало кислорода и при необходимости может даже изменить форму – стать шарообразной или овальной. Впервые хеликобактер пилори была исследована двумя австралийскими учеными – Робином Уорреном и Барри Маршаллом, которые за это открытие в 2005 году были удостоены Нобелевской премии.
Helicobacter pylori – это особый вид патогенных бактерий, которые инфицируют желудок и двенадцатиперстную кишку. Эти микроорганизмы являются паразитами, продуцирующими большое количество токсинов, повреждающих слизистую оболочку внутренних органов. Подобные повреждения приводят к воспалениям и развитию гастрита, язвы и впоследствии даже к раку. Хеликобактер пилори хитра и коварна. Большинство из известных на сегодняшний день микроорганизмов не могут выжить в кислой среде желудка, но для этой бактерии такая среда наоборот является предпочтительной. Хеликобактер пилори имеет спиралевидную форму и снабжена несколькими жгутиками, которые помогают ей передвигаться по стенкам внутренних органов. Она отлично умеет приспосабливаться к любым условиям, везде чувствует себя «как рыба в воде», требует совсем мало кислорода и при необходимости может даже изменить форму – стать шарообразной или овальной. Впервые хеликобактер пилори была исследована двумя австралийскими учеными – Робином Уорреном и Барри Маршаллом, которые за это открытие в 2005 году были удостоены Нобелевской премии.
Вот ведь язва!
Хеликобактер пилори передается во время контактов с зараженным человеком. Использование одной посуды и предметов гигиены часто приводят к тому, что все члены семьи становятся инфицированными одним штаммом этой бактерии. Загрязненные руки, слюна, мокрота, выделяющаяся при кашле, – все это тоже служит путями передачи хеликобактер пилори. Врачи утверждают, что пристанищем для уживчивой заразы служит желудочно-кишечный тракт не менее 70% людей, живущих на нашей планете. Попав в желудок и комфортно там разместившись, бактерия начинает свою «подрывную» деятельность: она начинает активно вырабатывать уреазу – вещество, которое раздражает слизистую. В попытке защититься от агрессора желудок в свою очередь увеличивает выработку соляной кислоты и пепсина. От этого хеликобактер пилори становится хорошо, так как кислая среда для нее – дом родной, а нам становится плохо, ведь желудок начинает разъедать свои же стенки, оповещая об этом болью. Иногда иммунная система организма справляется с агрессором, в противном случае врач ставит диагноз «гастрит» или «язва». В процессе своей жизнедеятельности бактерия расщепляет слизь, которая защищает желудок, и на эти оголенные участки прямиком попадает агрессивный желудочный сок с содержанием пищеварительных ферментов. Кроме того, хеликобактер пилори выделяет особые токсины, которые способы вызвать иммунное воспаление и вызвать отторжение слизистой желудка. В некоторых случаях агрессивная бактерия наоборот провоцирует снижение выработки желудком соляной кислоты, что тоже вредно и приводит к атрофическому гастриту с поражением функции пищеварительной системы.
От этого хеликобактер пилори становится хорошо, так как кислая среда для нее – дом родной, а нам становится плохо, ведь желудок начинает разъедать свои же стенки, оповещая об этом болью. Иногда иммунная система организма справляется с агрессором, в противном случае врач ставит диагноз «гастрит» или «язва». В процессе своей жизнедеятельности бактерия расщепляет слизь, которая защищает желудок, и на эти оголенные участки прямиком попадает агрессивный желудочный сок с содержанием пищеварительных ферментов. Кроме того, хеликобактер пилори выделяет особые токсины, которые способы вызвать иммунное воспаление и вызвать отторжение слизистой желудка. В некоторых случаях агрессивная бактерия наоборот провоцирует снижение выработки желудком соляной кислоты, что тоже вредно и приводит к атрофическому гастриту с поражением функции пищеварительной системы.
Гастрит и язва – болезни XX века
По мнению гастроэнтерологов, гастрит и язвенная болезнь желудка и двенадцатиперстной кишки – это бич современных людей, которые не мыслят свою жизнь без нескольких мясных блюд в день.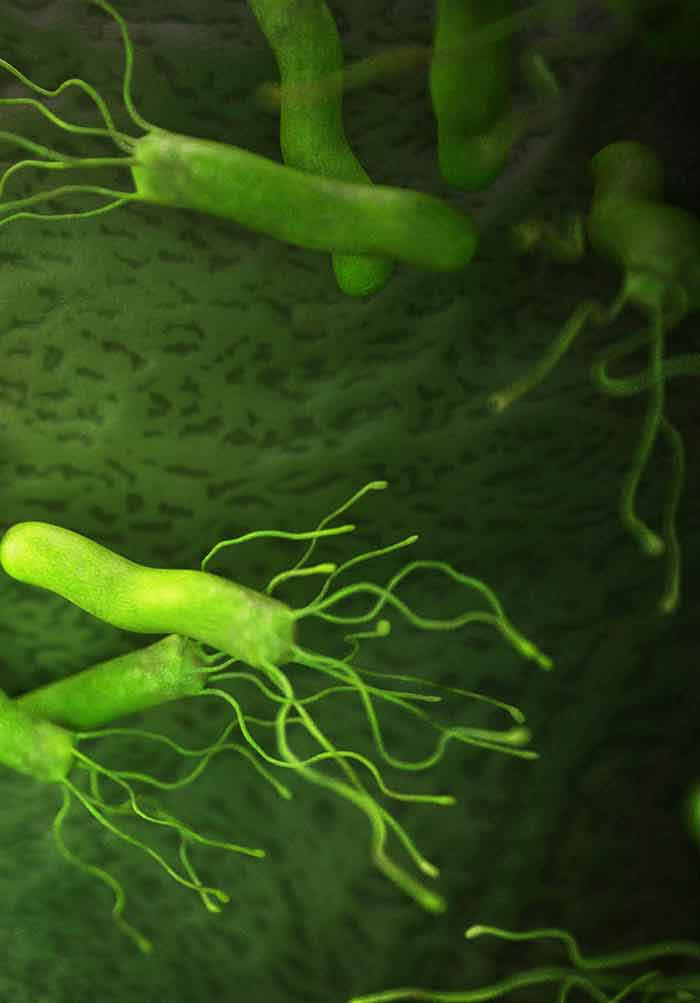
- боли в разных отделах живота и за грудиной после употребления пищи;
- частая отрыжка – внезапное попадание в полость рта содержимого желудка с характерным звуком, кислым привкусом и запахом тухлых яиц;
- дисфагия – трудности при глотании еды и напитков;
- тошнота и ощущения давления в подложечной области;
- рвота;
- частый метеоризм и урчание в животе;
- нарушение аппетита и потеря веса без видимой причины;
- изменения в работе кишечника – запоры, длящиеся свыше 48 часов, и частые поносы;
- появление крови в каловых или рвотных массах.

Не стоит бояться неприятных ощущений во время диагностики и лечения – за последние десятилетия медицина шагнула далеко вперед и современные клиники оборудованы новейшей аппаратурой, которая позволяет проводить исследования с минимальным дискомфортом для пациента. Уже во время первичной консультации опытный гастроэнтеролог может установить предварительный диагноз и дать толковые советы по пищевому поведению. Лечение хеликобактериоза предусматривает проведение комплексной терапии, направленной на уничтожения вредоносной бактерии в желудке.
Редакция благодарит специалистов центра ОН КЛИНИК за помощь в подготовке материалаИсточники
- Li XW., Xia B., Guo Q., Jin X., Yu Y., Zhao ZG., Wang XF., Wang YF., Zhang YZ. [The clinical characteristics and prognostic analysis of gastric mucosa-associated lymphoid tissue lymphoma of 103 cases]. // Zhonghua Xue Ye Xue Za Zhi – 2012 – Vol33 – N10 – p.805-9; PMID:23384898
симптомы и причины / Полезное
Бактерия хеликобактер: симптомы и причины
Боли в животе, тошнота, отрыжка воздухом — всё это может говорить о том, что в организме поселилась опасная, вредоносная бактерия хеликобактер, лечение которой должно быть серьёзным и основательным.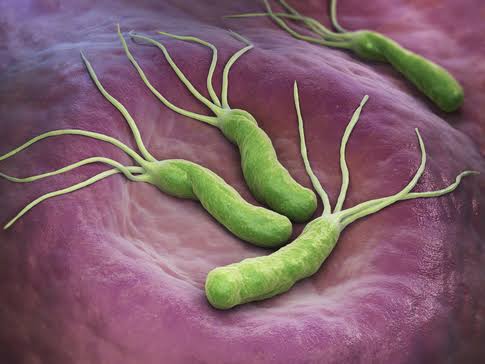 Хеликобактер пилори — очень опасный патогенный микроорганизм, который может привести к язвенной болезни желудка и ДПК, гастриту и другим опасным для пищеварительной системы заболеваниям.
Хеликобактер пилори — очень опасный патогенный микроорганизм, который может привести к язвенной болезни желудка и ДПК, гастриту и другим опасным для пищеварительной системы заболеваниям.
Хеликобактерия впервые была обнаружена только 30 лет назад. Медицинские исследования, проведенные с того времени, доказали, что гастрит может иметь инфекционную этиологию. Также, согласно исследованиям этой бактерии, учеными было доказано, что по статистике 75% случаев заболевания раком желудка в развитых странах вызваны именно хеликобактерий. В развивающихся странах этот показатель ещё более пугающий: 90% больных раком желудка заполучили болезнь, благодаря Helicobacter pylori.
Таким образом, стоит указать на особую роль ранней диагностики гастрита и язвы желудка. Именно своевременное обращение к врачу может спасти здоровье и жизнь.
Что собой представляет бактерия хеликобактер?
Хеликобактерия является особенным видом патогенных микроорганизмов. Она представляет собой опасную бактерию, которая инфицирует двенадцатиперстную кишку и желудок человека. Сам по себе микроорганизм является паразитом, который производит токсические вещества, повреждающие слизистые оболочки органов. Именно повреждения слизистой и приводят к язвенной болезни, гастриту и другим опасным недугам.
Сам по себе микроорганизм является паразитом, который производит токсические вещества, повреждающие слизистые оболочки органов. Именно повреждения слизистой и приводят к язвенной болезни, гастриту и другим опасным недугам.
Долгое время считалось, что ни один из организмов не способен выжить в кислой желудочной среде. Но это не касается хеликобактер. Бактерия, напротив, отлично существует в кислой среде, которая для неё является предпочтительнее любого другого обиталища. Helicobacter pylori обладает формой в виде спирали и жгутиками. Такая структура микроорганизма позволяет ему передвигаться по слизистым внутренних органов и наносить непоправимый вред их целостности.
Хеликобактерия может приспособиться практически к любой среде обитания. Объясняется это тем, что данный организм практически не требует кислорода. А ещё одной отличительной особенностью Helicobacter pylori является её умение изменять собственную форму и становиться овальной или круглой.
Российские ученые пришли к решению ввести специальный термин — хеликобактериоз.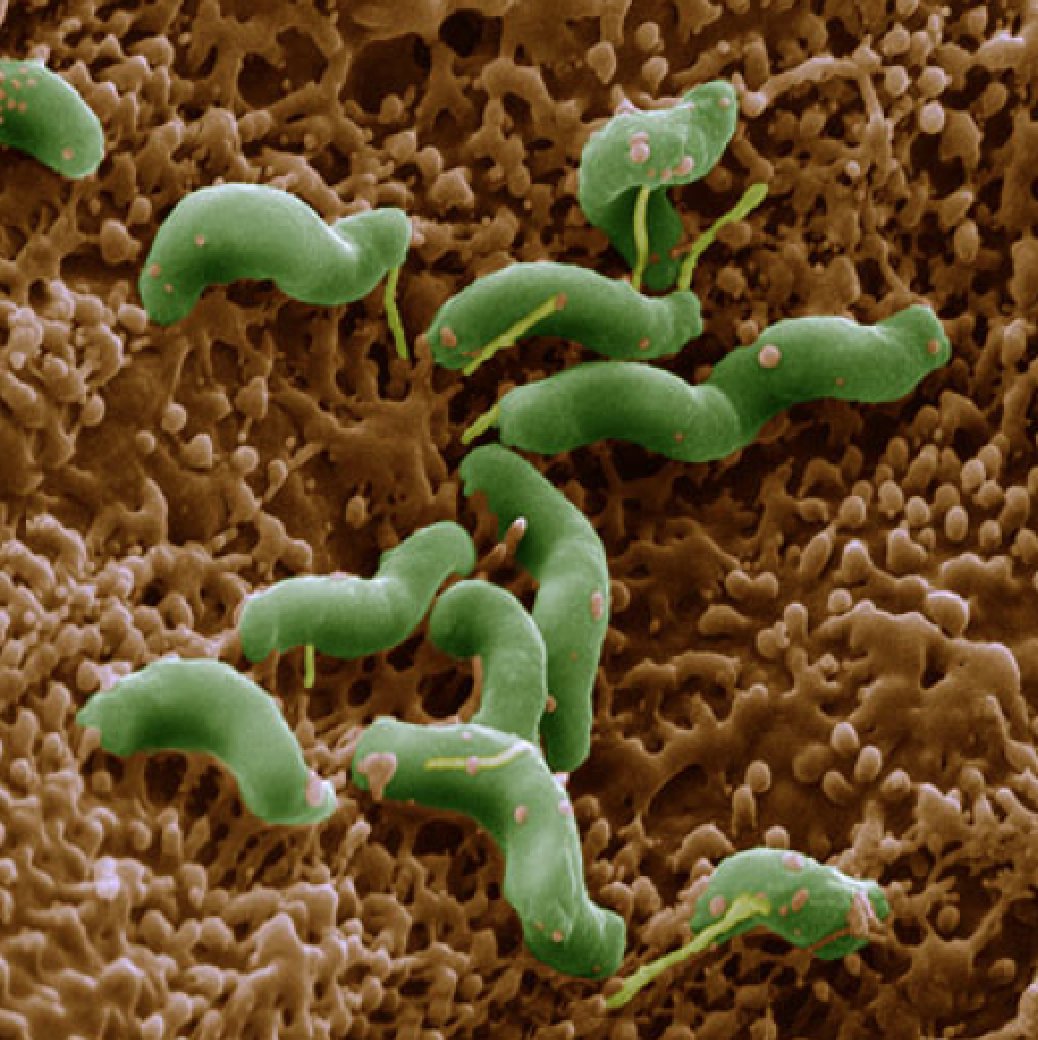 Обозначает он все процессы, которые начинают происходить в организме сразу после внедрения в него этого патогенного микроорганизма. А вот западные ученые провели исследования карт больных и пришли к выводу, что возникновению инфицирования подвержены около 60-65% населения всей Земли. Так, хеликобактерия — самое распространенное инфекционное заболевание человечества после герпеса, который является вирусным недугом.
Обозначает он все процессы, которые начинают происходить в организме сразу после внедрения в него этого патогенного микроорганизма. А вот западные ученые провели исследования карт больных и пришли к выводу, что возникновению инфицирования подвержены около 60-65% населения всей Земли. Так, хеликобактерия — самое распространенное инфекционное заболевание человечества после герпеса, который является вирусным недугом.
Что происходит в организме
Как только хеликобактерия попадает в организм человека, она сразу опускается в желудок, где и обитает всё оставшееся время. Для того чтобы не погибнуть от желудочного сока, состав которого достаточно агрессивен, хеликобактер выделяет специальные ферменты, которые окружат её оболочкой и обезвреживают кислоту. Спиралевидные усики, которые имеет хеликобактерия, позволяют ей пробурить слой слизистой и пробраться к клеткам пристеночных тканей, которые обычно скрыты от кислоты.
Именно пристеночные клетки тканей становятся основным питанием хеликобактер. Патогенный микроорганизм поедает их и отравляет окружающую среду продуктами своей жизнедеятельности. При этом в организме просыпаются те клетки крови, которые реагируют на хеликобактерии и стремятся их уничтожить (нейтрофилы). Однако, уничтожая патогенный микроорганизм, нейтрофилы уничтожают и клетки слизистой, к которым уже прикоснулась хеликобактер.
Патогенный микроорганизм поедает их и отравляет окружающую среду продуктами своей жизнедеятельности. При этом в организме просыпаются те клетки крови, которые реагируют на хеликобактерии и стремятся их уничтожить (нейтрофилы). Однако, уничтожая патогенный микроорганизм, нейтрофилы уничтожают и клетки слизистой, к которым уже прикоснулась хеликобактер.
После того, как слой слизистой оболочки нарушен, соляная кислота начинает активно воздействовать на ткани. Так развивается воспалительный процесс и возникает язва. Локализация язв чаще всего похожая. Объясняется это тем, что сама хеликобактерия очень любит два отдела желудка – луковицу и пилорический.
Причины заражения хеликобактер пилори
Хеликобактерии не могут существовать на воздухе, при активном его поступлении эти патогенные организмы погибают. Передаются они в основном через слизь и слюну человека. Таким образом, чаще всего заражение происходит следующими путями:
- Пользование общей посудой;
- Пользование одними средствами личной гигиены;
- Поцелуи;
- От матери к ребенку.

Так, в группе риска могут оказаться друзья, семья и сожители больного.
В целом заражению способствуют низкий уровень жизни и пренебрежение правилами гигиены. Очень часто хеликобактериоз встречается у людей, живущих в коммунальных квартирах и общежитиях, детдомах, а также у медицинских работников. Стоит отметить то, что в странах третьего мира заболевание встречается значительно чаще, чем в развитых государствах. В России в последние годы стали отмечать заболеваемость гастритом и язвой вследствие влияния хеликобактерии и у людей из обеспеченных слоёв населения.
Обезопасить себя можно ,и лучше позаботиться о профилактике заранее, чем страдать от недуга и искать пути борьбы с хеликобактер экстренно.
Симптоматика
Наличие хеликобактерии в организме человека не говорит о том, что он обязательно заболеет язвой. Но возникновение этого недуга вполне возможно в случае, если у пациента имеются предрасполагающие факторы такие как:
- неправильное питание;
- алкоголизм;
- курение;
- стрессы.

А вот хронический гастрит — возникает при заражении хеликобактерией почти в 100% случаев. Именно хроническое воспаление желудка является основным проявлением Helicobacter pylori. При этом у пациента возникает следующая симптоматика:
Боли в желудке. Локализация симптома может меняться и переходить в область расположения двенадцатиперстной кишки. Боли бывают острыми, ноющими, тупыми. Человек может испытывать ощущение распирания. Дискомфорт может возникать при длительном голодании, натощак или после приема пищи.
Изжога. Это ощущение практически невозможно спутать с каким-либо другим дискомфортом. Человек ощущает жжение в подложечной области, жгучие ощущения в пищеводе и даже гортани. При этом может появиться боль в груди, которую часто путают с сердечными болями. Также не редко у пациентов появляется неприятный кислый или гнилостный привкус.
Отрыжка. Этот симптом практически всегда возникает наряду с изжогой. Отрыжка может иметь горький или кислый привкус. В некоторых случаях наблюдается частая отрыжка воздухом, усиливающаяся после приема еды.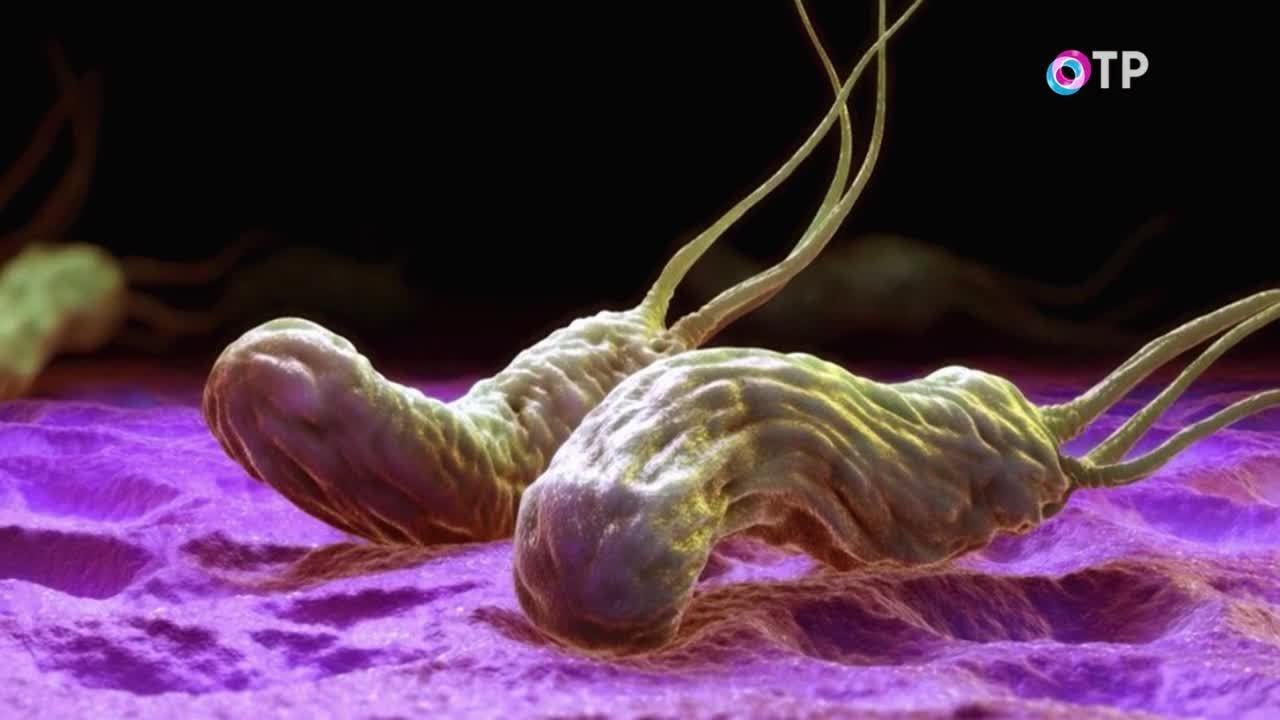
Тошнота. Этот симптом часто возникает вместе с голодными болями. Человека может тошнить натощак или спустя 3 часа после последнего приема пищи. Если слизистая желудка сильно травмирована, тошнота может сменяться рвотой со сгустками крови.
Расстройство кишечника. Диарея встречается достаточно редко, но и этот симптом также может говорить о наличие в желудке и дпк человека хеликобактерии. В каловых массах может быть явная кровь в виде сгустков или вкраплений.
При сильном обсеменении организма хеликобактериями, может возникнуть и ряд нетипичных симптомов, которые говорят о значительном заражении и прогресировании болезни:
Снижение аппетита до полного его отсутствия.
Резкое снижение массы тела, не являющееся нормой.
Сухость во рту и привкус металла.
Неприятный запах изо рта при отсутствии кариеса.
Появление заед в уголках рта.
Таковы симптомы хеликобактер, которые требуют незамедлительного лечения. При появлении хотя бы одного из них необходимо оптимально быстро обратиться за врачебной помощью и приступить к диагностике.
Диагностика
От случая к случаю хеликобактерия может проявлять себя по-разному. Так, у разных пациентов могут быть разные симптомы. Для того чтобы определить наличие патогенного микроорганизма в желудке человека предусмотрены специальные тесты. Больным показаны специальные анализы на хеликобактер — уреазный и цитологический. Они помогают выявить бактерию.
Эта коварная бактерия Хеликобактер пилори – Авиценна
Вас часто беспокоят боли в животе, тошнота, чувство тяжести после еды и отрыжка? Возможно, в вашем желудочно-кишечном тракте поселился маленький, но очень агрессивный враг – бактерия Хеликобактер пилори.
Хеликобактер пилори (Helicobacter pylori) на сегодняшний день является одной из самых распространенных инфекций человека. Заражение чаще происходит внутри семьи или других тесно общающихся групп, так как инфекция распространяется при использовании одной и той же посуды, несоблюдении правил гигиены, скученности проживания.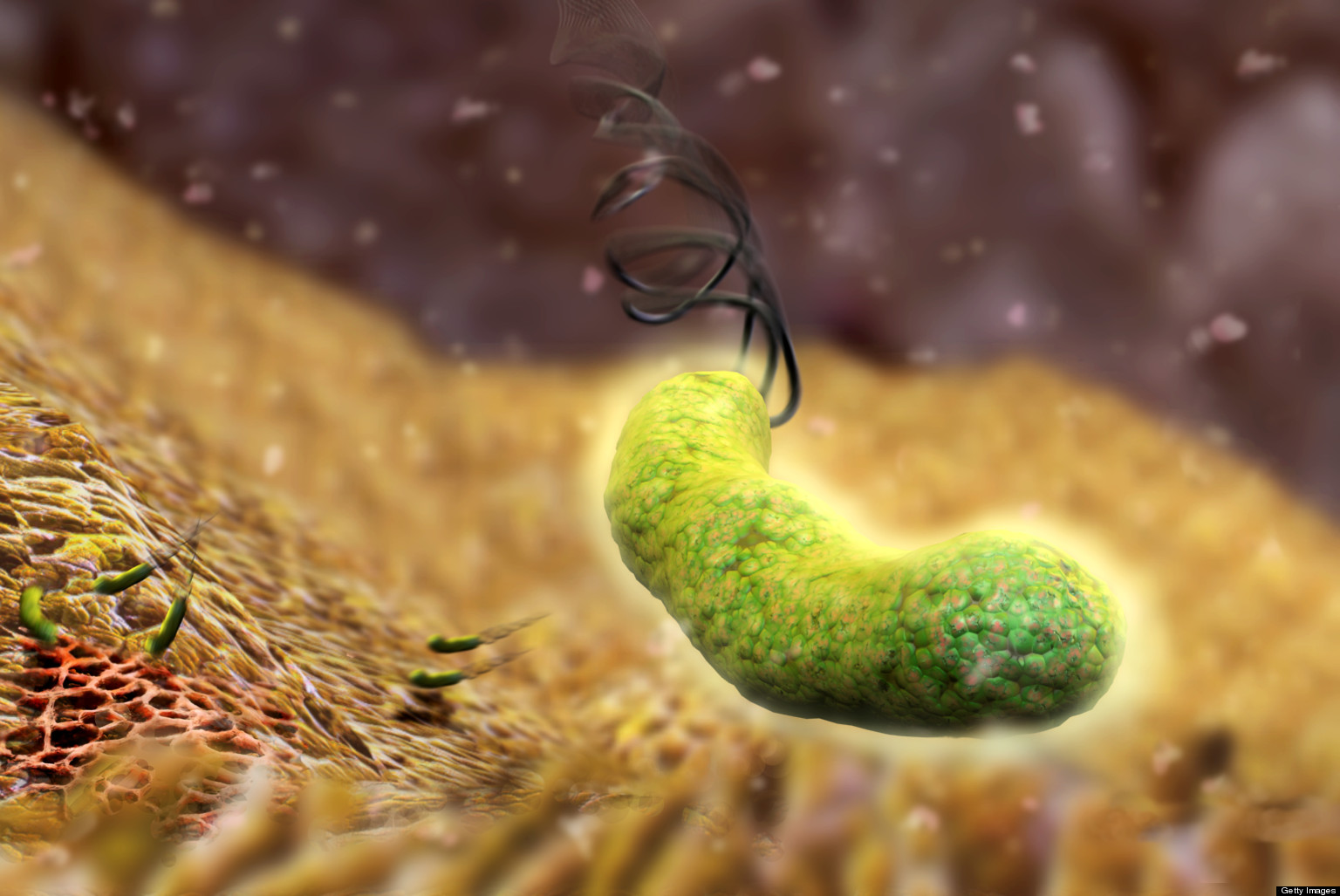 Часто инфекция передается от матери к ребенку (через слюну, попавшую на соску, ложку и другие предметы). Заразиться инфекцией хеликобактер пилори можно даже при поцелуе.
Часто инфекция передается от матери к ребенку (через слюну, попавшую на соску, ложку и другие предметы). Заразиться инфекцией хеликобактер пилори можно даже при поцелуе.
Анализ на хеликобактер пилори (Helicobacter pylori) показан всем, кто жалуется на болезненные ощущения и дискомфорт в области желудка. Поскольку хеликобактерная инфекция провоцирует развитие многих поражений слизистой оболочки желудка и двенадцатиперстной кишки, ее своевременное обнаружение и ликвидация позволяет избежать развития серьезнейших нарушений здоровья, вплоть до онкологических заболеваний.
С момента открытия Н.pylori прошло около 30-ти лет. За этот небольшой период времени было разработано большое количество методов диагностики, позволяющих выявлять и идентифицировать этот микроорганизм. Развитие и усовершенствование этих методов помогло в получении ценной информации об этой инфекции, что позволило разработать наиболее эффективные схемы антихеликобактерной (эрадикационной) терапии и меры профилактики хеликобактерной инфекции.
Кроме того, уже доказан тот факт, что длительное пребывание H. pylori в слизистой оболочке желудка приводит к развитию атрофического гастрита, а в последующем и к возникновению онкологических заболеваний (рака желудка). Поэтому понятно стремление большинства гастроэнтерологов провести при выявлении данного возбудителя эффективную антибактериальную терапию.
Остаются сложным вопрос подбора эффективной эрадикационой терапии. Существует много различных методик. Этой проблеме посвящены многие исследования и доклады ведущих специалистов в этой области.
Для получения грамотной консультации по этому вопросу необходимо провести полноценное обследование, включающее эндоскопическое (фиброгастроскопию с забором материала для определения H. pylori) и выполнение достоверных серологических или других исследований для определения H. pylori.
При проведении эрадикационной терапии (терапии, направленной на уничтожение Helicobacter pylori) важно соблюдать назначенные дозировки препаратов, кратность приемов лекарств и длительность назначенного курса. Несоблюдение в полном объеме назначений гастроэнтеролога приведет к значительному снижению результативности терапии, а в ряде случаев и к неудачным результатам.
Несоблюдение в полном объеме назначений гастроэнтеролога приведет к значительному снижению результативности терапии, а в ряде случаев и к неудачным результатам.
Ваши проблемы можно решить, надо только объединить Ваши усилия и желание Вашего гастроэнтеролога помочь Вам!
В клинике «Авиценна» принимает новый высококвалифицированный врач — гастроэнтеролог, кандидат медицинских наук по специальности «Внутренние болезни» — Максимова Елена Владимировна.
Записаться к врачу можно по телефонам:
- +7 (978) 833 22 16
- +7 (978) 833 22 09
Прием идет по адресу: отделение «Авиценна», ул. Гагарина, 17
ХЕЛИКОБАКТЕР ПИЛОРИ: методы диагностики | Медицинский центр “Вита”
«Беспокоят боли в области живота, тошнота, отрыжка, тяжесть на желудке… Хочу узнать причину расстройств, но боюсь делать ФГДС. Какие варианты обследования еще могут быть?» Часто пациенты обращаются к нам с таким вопросом.
Хеликобактер Пилори – спиралевидная бактерия, способная инфицировать слизистую оболочку желудка и двенадцатиперстной кишки. Важность выявления Helicobacter pylori возросла после того, как была обнаружена тесная связь между присутствием бактерии в организме и подтвержденными желудочно-кишечными заболеваниями желудка и двенадцатиперстной кишки, такими как: гастрит, язвенная болезнь, рак желудка.
Многие не решаются делать тест на Хеликобактер Пилори, думая, что это возможно только во время процедуры ФГДС. В клинике ВИТА для диагностики инфицирования H. pylori пациентов с симптомами желудочно-кишечных заболеваний можно выбрать разные методы исследования:
1. Уреазный тест – это быстрый диагностический метод для обнаружения бактерий Helicobacter pylori в образце биоптата, полученном во время проведения процедуры ФГДС. Готовность результата в течение трех минут.
2. Анализ крови методом ИФА позволяет выявить суммарные антитела (IgA, IgM, IgG) к антигену CagA Helicobacter pylori в крови человека. Рекомендуется для эпидемиологического скрининга крови, диагностики заболеваний желудка и двенадцатиперстной кишки как составная часть комплексного обследования пациентов.
3. Анализ кала – экспресс-тест для выявления антигенов H. pylori . Это лабораторный иммунохроматографический тест, позволяющий диагностировать инфицирование H. Pylori в течение 20 мин. Точность экспресс-теста > 92% в сравнении с другими методами.
4. Анализ кала методом ПЦР – один из самых чувствительных методов выявления H. pylori. Это метод молекулярной диагностики, позволяющий выявлять в биологическом материале (кале) фрагменты генетического материала (ДНК) возбудителя инфекции, причем присутствие любых форм H. pylori.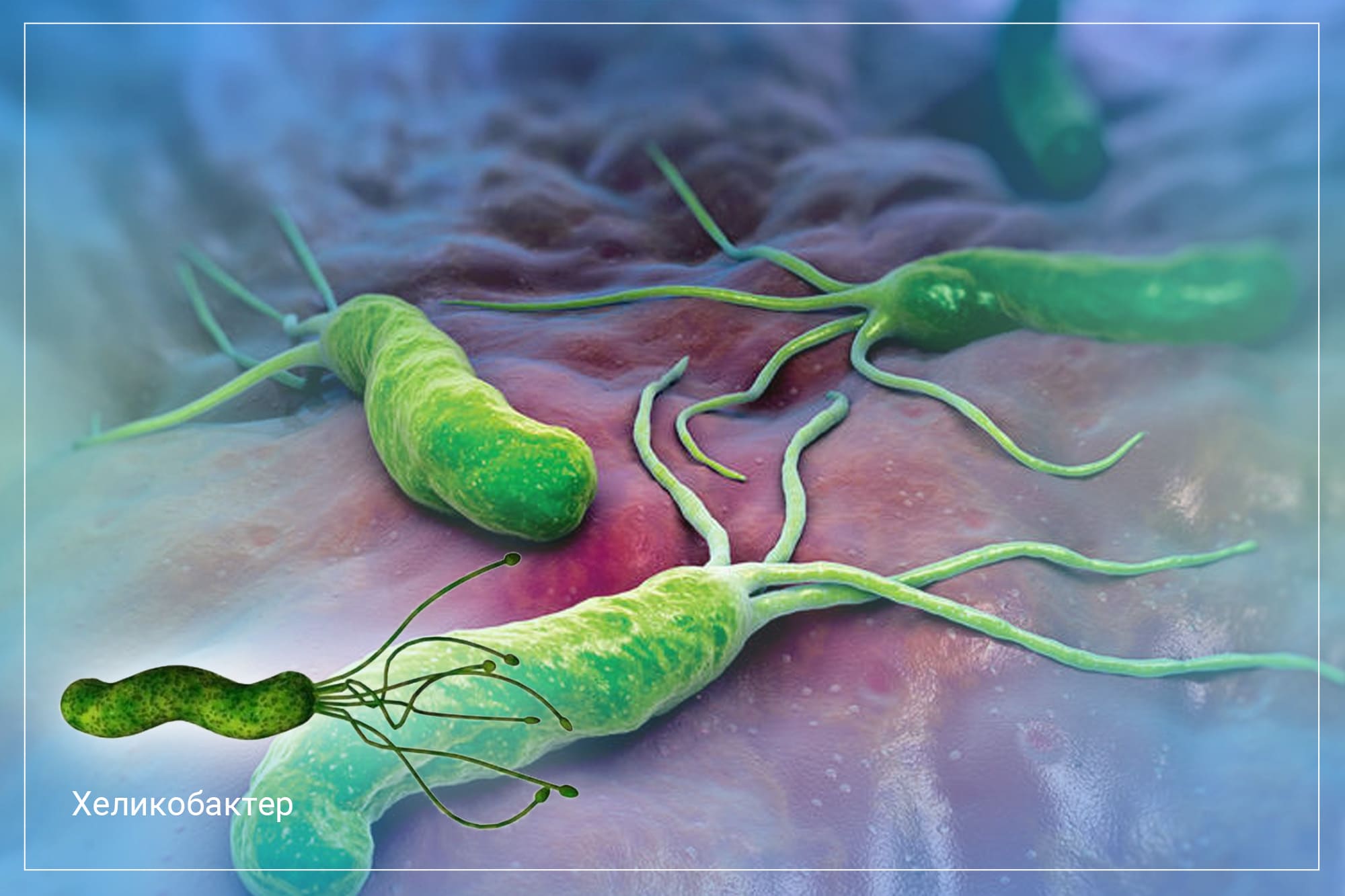 Чувствительность метода ПЦР – 85-98 %.
Чувствительность метода ПЦР – 85-98 %.
Как правильно подготовиться к исследованию?
- Исследование рекомендуется проводить до начала приема антибиотиков и других антибактериальных химиотерапевтических препаратов.
- Исключить прием слабительных препаратов, введение ректальных свечей, масел, ограничить (по согласованию с врачом) прием медикаментов, влияющих на работу кишечника, и препаратов, влияющих на окраску кала, в течение 72 часов до сбора кала.
- Не курить в течение 30 минут до исследования.
Пройти лабораторное обследование можно в любом из наших центров.
в Вологде:
ул. М.И. Ульяновой, 3,
ул. Карла Маркса, 80,
ул. Ленинградская, 136,
ул. Беляева, 1а,
ул. Ярославская, 23,
(8172) 26-44-26
в Череповце:
пр-т Победы, 111,
Шекснинский пр-т, 11,
ул. Комарова, 7,
пр-т Победы, 113/19,
(8202) 28-11-22
в Шексне:
ул.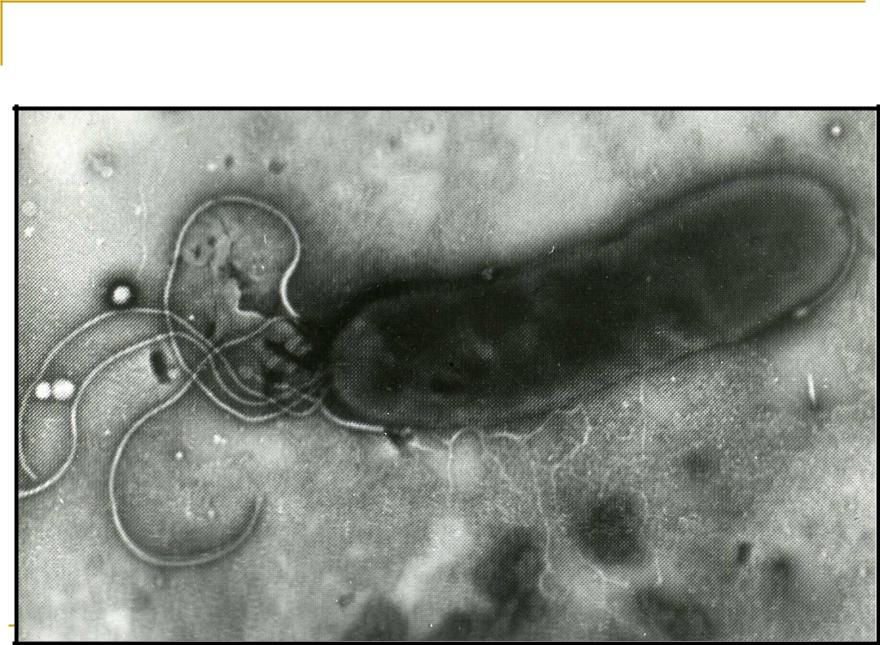 Шекснинская, 5, тел.: (81751) 2-11-57
Шекснинская, 5, тел.: (81751) 2-11-57
в Вельске:
ул. Дзержинского, 123, тел.: (81836) 604-30
в Котласе:
пр-т Мира, 21, тел.: (81837) 21-301
Helicobacter pylori, IgG (количественно): исследования в лаборатории KDLmed
Выявление иммуноглобулинов класса G (IgG) к Helicobacter pylori в сыворотке крови, используемое для диагностики антрального и фундального гастрита, язвы желудка и двенадцатиперстной кишки, а также для контроля за их лечением.
Синонимы русские
Хеликобактер, иммуноглобулины класса G, IgG-антитела.
Синонимы английские
Helicobacter pylori Antibody, IgG; Anti-Helicobacter pylori antibody, IgG (quantitative).
Метод исследования
Твердофазный хемилюминесцентный иммуноферментный анализ («сэндвич»-метод).
Какой биоматериал можно использовать для исследования?
Венозную кровь.
Как правильно подготовиться к исследованию?
Не курить в течение 30 минут до сдачи крови.
Общая информация об исследовании
Инфицирование H. pylori сопровождается развитием местного и системного иммунного ответа. Вслед за транзиторным увеличением титра иммуноглобулинов класса М (IgM) следует продолжительное и значительное нарастание IgG-, а также IgA-антител в сыворотке крови. Определение концентрации иммуноглобулинов (серологическое исследование) применяют в диагностике хеликобактериоза. IgG обнаруживаются в 95-100 % случаев инфицирования H. pylori, IgA – в 68-80 %, а IgM – лишь в 15-20 %. Поэтому для подтверждения инфицирования H. pylori определяют концентрацию IgG в сыворотке крови. Этот анализ имеет ряд преимуществ перед другими лабораторными методами выявления хеликобактера.
Определение IgG в крови не требует эндоскопического исследования, поэтому является более безопасным способом диагностики. Так как чувствительность теста сопоставима с чувствительностью большинства инвазивных анализов (быстрый уреазный тест, гистологическое исследование), он оказывается особенно полезным, когда выполнение эндоскопии не планируется. Следует, однако, отметить, что тест не выявляет непосредственно микроорганизм и зависит от особенностей иммунного ответа пациента. Так, например, иммунный ответ пожилых людей характеризуется пониженной выработкой специфических антител (любых, в том числе к H. pylori), что необходимо учитывать, если получен отрицательный результат анализа при клинических признаках диспепсии. Кроме того, иммунный ответ подавляется при приеме некоторых цитостатических препаратов.
Анализ на IgG может быть с максимальным успехом применен для диагностики первичного инфицирования H. pylori (например, при обследовании молодого пациента с впервые возникшими признаками диспепсии). В этой ситуации высокий титр IgG позволяет заподозрить активную инфекцию. Также положительный результат анализа у пациента (с признаками диспепсии в анамнезе или без них), не получавшего терапию, будет указывать на хеликобактериоз.
Интерпретация положительного результата анализа в случае, если была проведена терапия (или если антибиотики, обладающие активностью против H. pylori, были применены в других целях), имеет некоторые особенности. Уровень IgG остается высоким в течение длительного времени после полной гибели микроорганизма (около половины пациентов, вылечившихся от H. pylori, будут иметь высокие титры IgG еще 1-1,5 года). В результате положительный результат анализа у пациента, принимавшего антибиотики, не позволяет дифференцировать активную инфекцию и инфекцию в анамнезе и требует проведения дополнительных лабораторных исследований.
По этой же причине, исследование на IgG не является основным тестом для диагностики эффективности терапии. Однако оно может быть применено с этой целью, если титр антител на момент начала болезни сравнивается с титром после окончания лечения. Считается, что снижение концентрации IgG на 20-25 % в течение 6 месяцев косвенно указывает на гибель микроорганизма. В то же время, если эта концентрация не снижается, это не означает неэффективность терапии. Отсутствие IgG-антител при повторном анализе свидетельствует об успешности лечения и избавлении от микроорганизма.
Количество IgG к H. pylori также является одним из компонентов, по которому судят о состоянии слизистой оболочки желудка (это так называемая серологическая биопсия).
Для чего используется исследование?
Для диагностики заболеваний, вызванных H. pylori, и контроля за их лечением:
- антрального и фундального гастрита;
- язвы двенадцатиперстной кишки или желудка.
Когда назначается исследование?
- При обследовании пациента с впервые возникшими признаками диспепсии (первичное инфицирование H. pylori), особенно если эндоскопия не планируется.
- При обследовании пациента с указанием на диспепсию в анамнезе, если не назначалась терапия H. pylori (или если антибиотики, активные против H. pylori, не использовались по другому поводу).
- При первичной диагностике хеликобактериоза и через 6 месяцев после окончания курса его терапии.
Что означают результаты?
Референсные значения
Результат: отрицательно.
Концентрация: 0 — 0,9.
Причины положительного результата
- Активная инфекция H. pylori:
a) снижение титра антител на 20-25 % в течение в течение 6 месяцев после окончания антибактериальной терапии косвенно указывает на гибель микроорганизма;
b) отсутствие тенденции к снижению IgG не говорит о неэффективности терапии.
- инфекция H. pylori в анамнезе.
Причины отрицательного результата:
- отсутствие инфекции H. pylori;
- гибель микроорганизма после курса антибиотикотерапии;
- неправильное взятие биоматериала для исследования.
Что может влиять на результат?
Иммунный ответ пожилых людей, а также пациентов, получающих иммуносупрессивную терапию, характеризуется пониженной выработкой специфических антител, в том числе к H. pylori, что приводит к большему числу ложноотрицательных реакций теста в этой группе пациентов.
Важные замечания
- Положительный результат исследования следует интерпретировать с учетом дополнительных данных (в частности, нужно учитывать эрадикационную терапию или прием антибиотиков, активных в отношении H. pylori, в других целях).
Также рекомендуется
Кто назначает исследование?
Гастроэнтеролог, педиатр, врач общей практики, инфекционист.
Литература
- Glupczynski Y. Microbiological and serological diagnostic tests for Helicobacter pylori: an overview. Br Med Bull. 1998;54(1):175-86.
- Mark Feldman, MD; Byron Cryer, MD; Edward Lee, MD; Walter L. Peterson, MD. Role of Seroconversion in Confirming Cure ofHelicobacter pylori Infection. JAMA. 1998;280(4):363-365. doi:10.1001/jama.280.4.363
- Athanasios Makristathis, Alexander M. Hirschl, Philippe Lehours, Francis Mégraud,. Diagnosis of Helicobacter pylori Infection. Helicobacter. Volume 9, Issue Supplement s1, pages 7–14, August 2004.
- Chernecky C. C. Laboratory Tests and Diagnostic Procedures / С.С. Chernecky, В.J. Berger; 5th ed. – Saunder Elsevier, 2008.
Анализы и тесты на Хеликобактер пилори
Стоимость
ЭГДС диагностическая (эзофагогастродуоденоскопия без наркоза)
Биопсия желудка с помощью эндоскопии
Уреазный экспресс-тест на Helicopter Pylori
Анестезия
Анестезия аппликационная
Хеликбактериоз по современным данным, провоцирует развитие серьезных поражений слизистых оболочек, вызывая множество заболеваний желудочно-кишечного тракта, включая развитие рака желудка. Именно поэтому при наличии жалоб в этой области, неправильно проводить лечение самостоятельно с помощью безрецептурных препаратов. Необходимо проконсультироваться с гастроэнтерологом и пройти тест на хеликобактериоз. Он может быть инвазивным (биопсия при гастроскопии) и неинвазивным (определение продуктов жизнедеятельности бактерии в выдыхаемом воздухе, моче, кале, слюне). Только врач может определить, какой тест или их комбинация в вашем случае даст ему необходимую информацию для проведения эффективного лечения заболевания.
Уреазный дыхательный тестХеликобактер пилори разлагает мочевину на аммиак и углекислый газ. Основываясь на этом факте, обследование на концентрацию аммиака в выдыхаемом воздухе, позволяет определить наличие бактерий в вашем организме. Проконсультируйтесь заранее с персоналом клиники о подготовке к тесту, который проводит на приеме гастроэнтеролог. Уреазный дыхательный тест абсолютно безвреден и достаточно достоверен – 80-85% и используется для первичной диагностики, а также для контроля хода антихеликобактерной терапии и проверки эффективности уже проведенной терапии.
Гистологический тест на Helicobacter pylori.Cамым надёжным и информативным методом диагностики хеликобактерной инфекции остаётся биопсия, производимая во время гастроскопии желудка и двенадцатиперстной кишки. Взятую при биопсии ткань слизистой подвергают быстрому тестированию на наличие уреазы и антигенов H. pylori, гистологическому исследованию, а также исследованию с помощью культивации бактерии в специальной среде для ее выделения. Это исследование дает 100%-достоверную информацию, позволяя также количественно оценить бактерии, и провести анализ чувствительности бактерии к различным антибиотикам для выбора самого эффективного.
Иммунологическое исследование на Helicobacter pyloriДеятельность хеликобактер пилори вызывает имунную реакцию организма, проявляющуюся в выработке антител на бактерию. К иммунологическим исследованиям относится определение бактериальных антител в слюне, моче, крови, кале. Самым простым, недорогим, доступным является тест определения антител в крови. Точность диагноза составляет порядка 80%. К сожалению, он пригоден лишь для постановки диагноза, но не подходит для оценки эффективности лечения.
Поделиться в соц. сетях:
ВРАЧИ ОТДЕЛЕНИЯ Анализы на Хеликобактер пилори
УраковаЯна Чингизовна
Врач – эндоскопист. Кандидат медицинских наук. Высшей квалификационной категории.
Helicobacter Pylori у детей
Что такое H. pylori (Helicobacter pylori) у детей?
H. pylori (Helicobacter pylori, произносится как Hel-ee-koh-BAK-ter Pie-LORE-ee ) представляет собой спиралевидный микроб (бактерии), поражающий желудок.
Как сказать
Hel-ee-koh-BAK-ter
Py-LOHR-ee
Он может повредить ткани желудка вашего ребенка и первую часть тонкой кишки (двенадцатиперстную кишку).Это может вызвать покраснение и отек (воспаление). Это также может вызвать болезненные язвы, называемые пептическими язвами, в верхних отделах пищеварительного тракта.
Что вызывает инфекцию H. pylori у ребенка?
Эксперты в области здравоохранения не знают наверняка, как распространяется инфекция H. pylori. Они считают, что микробы могут передаваться от человека к человеку через рот.
Ваш ребенок также может контактировать с бактериями, если он:
- Принимает пищу, которая не была очищена или приготовлена небезопасным способом
- Пьет воду, зараженную бактериями
- Плохо моет руки после туалета
Большинство людей впервые сталкиваются с бактериями в детстве.
Какие дети подвержены риску заражения H. pylori?
Большинство людей впервые заражаются бактериями в детстве. Но взрослые тоже могут это получить.
Эксперты не уверены, передается ли инфекция H. pylori по наследству. Чаще встречается там, где люди живут в многолюдных или нечистых условиях. Это может затронуть до 75% детей в развивающихся странах. Реже встречается в США
.Каковы симптомы инфекции H. pylori у ребенка?
У большинства людей есть кодек H.pylori в течение многих лет, не зная об этом, потому что у них нет никаких симптомов. Эксперты не знают почему.
После заражения H. pylori у вашего ребенка может развиться воспаление слизистой оболочки желудка. Это называется гастритом. Но у большинства людей никогда не бывает симптомов или проблем, связанных с инфекцией.
Когда симптомы действительно возникают, они могут включать боль в животе, которая может:
- Быть тупой, жгучей болью
- Происходит через 2–3 часа после еды
- Приходи и уходи на несколько дней или недель
- Происходит посреди ночи, когда желудок вашего ребенка пуст
- Получите облегчение после еды или приема антацидов
Другие симптомы могут включать:
- Потеря веса
- Потеря аппетита
- Отек или вздутие живота
- отрыжка
- Расстройство желудка или тошнота
- Рвота
H.pylori могут выглядеть как другие заболевания. Всегда обращайтесь к врачу вашего ребенка для постановки диагноза.
Как диагностируется инфекция H. pylori у ребенка?
Лечащий врач вашего ребенка изучит историю болезни и проведет медицинский осмотр. Провайдер также может заказать другие тесты, в том числе:
- Культура стула. Позволяет найти в пищеварительном тракте вашего ребенка патологические бактерии, которые могут вызвать диарею и другие проблемы.Небольшой образец стула собирается и отправляется в лабораторию.
- Дыхательные пробы . Эти тесты проверяют, есть ли углерод после того, как ваш ребенок выпьет специальную жидкость. Если углерод обнаружен, это означает, что присутствует H. pylori.
- EGD или верхняя эндоскопия. Этот тест исследует слизистую оболочку пищевода (пищевода), желудка и первую часть тонкой кишки (двенадцатиперстную кишку). Для этого используется тонкая трубка с подсветкой или эндоскоп.На одном конце трубки есть камера. Трубка вводится ребенку в рот и горло. Затем он попадает в пищевод, желудок и двенадцатиперстную кишку. Воспитатель вашего ребенка может видеть эти органы изнутри. При необходимости берется небольшой образец ткани или биопсия. Образец ткани можно проверить на наличие признаков инфекции или бактерий H. pylori.
Как лечится инфекция H. pylori у ребенка?
Лечение будет зависеть от симптомов, возраста и общего состояния вашего ребенка.Это также будет зависеть от степени тяжести состояния.
Лечение вашего ребенка может включать антибиотики для уничтожения бактерий.
Ваш ребенок также может принимать лекарства, препятствующие выработке желудочного сока. К ним относятся:
- х3-блокаторов. Они уменьшают количество кислоты, которую производит желудок, блокируя гормон гистамин. Гистамин помогает вырабатывать кислоту.
- Ингибиторы протонной помпы. Помогают предотвратить образование кислоты в желудке.Они делают это, останавливая работу кислотного насоса желудка.
- Протекторы слизистой оболочки желудка . Они защищают слизистую оболочку желудка от кислоты. Они также помогают убивать бактерии.
Каковы возможные осложнения инфекции H. pylori у ребенка?
Очень тяжелая язва может истощить слизистую оболочку желудка вашего ребенка. Это также может вызвать такие проблемы, как:
- Кровотечение при износе кровеносного сосуда
- Отверстие (перфорация) в стенке желудка
- Закупорка, когда язва находится в месте, которое препятствует выходу пищи из желудка
- Рак желудка
Что я могу сделать, чтобы предотвратить появление H.pylori у моего ребенка?
Эксперты в области здравоохранения не знают наверняка, как бактерии H. pylori передаются от человека к человеку. Но хорошие привычки в отношении здоровья или соблюдение личной гигиены могут помочь обезопасить вашего ребенка. Эти привычки включают в себя обеспечение того, чтобы ваш ребенок:
- Моет руки водой с мылом. Вашему ребенку очень важно делать это после посещения туалета и перед едой.
- Принимает пищу, которая была очищена и приготовлена безопасным способом
- Пьет безопасную и чистую воду
Когда мне следует позвонить поставщику медицинских услуг для моего ребенка?
Позвоните своему ребенку, лечащему врачу, если у вашего ребенка:- Регулярная боль в животе (брюшной полости)
- Непрекращающаяся рвота
- Кровь в рвоте
Основные сведения о H.pylori у детей
- H. pylori – спиралевидный микроб (бактерии). Он поражает желудок и первую часть тонкой кишки (двенадцатиперстную кишку).
- Это вызывает воспаление. Это также может вызвать открытые язвы, называемые пептическими язвами, в верхних отделах пищеварительного тракта.
- У большинства людей с H. pylori не будет никаких симптомов или язвы. Но это основная причина язв.
- Это может быть передано через небезопасную пищу или питьевую воду.Он также может передаваться от человека к человеку через рот.
- Хорошие привычки в отношении здоровья или соблюдение гигиены могут помочь защитить вашего ребенка.
Следующие шаги
Советы, которые помогут вам получить максимальную пользу от посещения лечащего врача вашего ребенка:
- Знайте причину визита и то, что вы хотите.
- Перед визитом запишите вопросы, на которые хотите получить ответы.
- Во время посещения запишите название нового диагноза и любые новые лекарства, методы лечения или тесты.Также запишите все новые инструкции, которые ваш врач дает вашему ребенку.
- Узнайте, почему прописано новое лекарство или лечение и как они помогут вашему ребенку. Также знайте, какие бывают побочные эффекты.
- Спросите, можно ли вылечить состояние вашего ребенка другими способами.
- Знайте, почему рекомендуется тест или процедура и что могут означать результаты.
- Знайте, чего ожидать, если ваш ребенок не принимает лекарство, не проходит обследование или процедуру.
- Если вашему ребенку назначен повторный прием, запишите дату, время и цель этого визита.
- Узнайте, как можно связаться с лечащим врачом вашего ребенка в нерабочее время. Это важно, если ваш ребенок заболел и у вас есть вопросы или вам нужен совет.
Helicobacter Pylori – микробиология, инфекция и лечение
Микробиология, инфекции и лечение
Обзор
Все жгутиковые бактерии обладают тонкими продолговатыми плетевидными структурами, известными как жгутики (flagellum-singular).Используя эти структуры, бактерии (а также другие эукариотические клетки, такие как простейшие) могут свободно плавать в своей среде в поисках пищи или в более благоприятной среде.
В зависимости от вида бактерий количество и расположение жгутиков может варьироваться. Например, в то время как у однообразных бактерий один полярный жгутик, у амфитрихов – один жгутик на полярных концах клетки, в то время как у лофотриховных бактерий есть несколько жгутиков на одном или обоих полярных концах.
Helicobacter pylori, член Helicobacter, является хорошим примером жгутиковых бактерий. Используя жгутики, бактерии способны перемещаться и колонизировать слизистую оболочку желудочно-кишечного тракта у людей, вызывая желудочно-кишечные заболевания.
Классификация H. Pylori
- Домен: Eubacteria – включает ряд бактерий, у которых нет четко выраженной ядерной мембраны. Таким образом, Eubacteria состоит из прокариотических организмов.
- Царство: Бактерии – одноклеточные прокариоты
- Тип: Протеобактерии – Включают все грамотрицательные бактерии
- Класс: Эпсилонпротеобактерии – состоят из грамотрицательных организмов, которые могут быть найдены живущими в глубоких водах или в морских глубинах. кишечник животных
- Семейство: Helocobacteraceas – грамотрицательные бактерии, которые характеризуются своей спиральной формой
- Род: Helicobacter – Этот род состоит из грамотрицательных бактерий, которые являются микроаэрофильными по природе и имеют спиралевидную форму. форма.Они часто встречаются в желудочно-кишечном тракте таких животных, как собаки и мыши, а также людей.
- Виды: H. pylori
Микробиология H. pylori
Морфология (и ультраструктура)
H. pylori имеет спиралевидную форму, напоминающую штопор. У них также есть разветвленные / нити из 5-7 жгутиков, прикрепленных к одному концу бактерий (на одном полярном конце). Эта форма (спиральная или s-образная) похожа на многие другие бактерии, классифицируемые как Helicobacter, и, как было показано, играет важную роль в облегчении движения бактерий в окружающей среде.
В слизистой оболочке желудка высокая вязкость, что может вызвать проблемы с моторикой организма. Однако, используя пучок из 5-7 жгутиков и пользуясь преимуществом его формы, H. Pylori может быстро перемещаться из одного места в другое.
* Являясь бактерией, H. Pylori содержит в своей цитоплазме нуклеоидный материал и рибосомы, которые не находятся внутри мембраны (характерно для прокариот). Клетка также имеет две мембраны (внутреннюю и внешнюю), разделенные периплазмой (гелеобразной матрицей).
* . Для изучения структуры бактерий используются более мощные микроскопы, фазово-контрастный микроскоп и конфокальный микроскоп. может помочь выявить общую морфологию H.пилори.
Строение жгутика
Все хеликобактеры используют жгутики как средство перемещения из одного места в другое в своей среде. Жгутики покрыты оболочкой, защищающей их клетки и структуры. Помимо оболочки, жгутики состоят из нескольких частей, которые позволяют им эффективно работать.
К ним относятся:
- Базальное тело – по сравнению с другими частями базальное тело является наиболее сложной структурой, которая служит якорем для жгутика.Таким образом, он соединяет жгутик с клеточной стенкой (и плазматической мембраной) бактерий. Поэтому его сложность играет важную роль в обеспечении того, чтобы жгутик всегда прикреплялся к телу бактерий. Он состоит из концентрических колец на разных слоях клеточной стенки, а также из белкового стержня, что делает его сложным.
- Филамент – это самая внешняя часть жгутика (хвостовидная), состоящая из флагеллина (глобулярный белок).
- Крючок – это часть, которая соединяет филамент с базальным телом.
* Жгутики действуют как пропеллеры. Таким образом, они вращаются против часовой стрелки, чтобы продвигать бактерии в заданном направлении.
Было показано, что когда условия меняются и становятся вредными, H. pylori меняет свою форму со спиральной на сферическую (кокковидную).
Согласно ряду исследований, бактерии нельзя было культивировать после того, как они трансформировались (в кокковидные), и они не вернутся к своей нормальной форме, когда они будут помещены в благоприятные условия.
С другой стороны, было показано, что они трансформируются в кокковидную форму по мере старения, что показывает, что это преобразование служит не только для защиты организмов.
См. Страницу о ресничках и жгутиках
Экология
Helicobacter pylori был впервые обнаружен и изолирован в слое желудочной слизи в конце 1970-х – начале 1980-х годов Барри Дж. Маршаллом и Дж. Робином Уорреном.
Этот, а также различные другие организмы, наблюдаемые в желудочно-кишечной системе, помогли открыть новую эру в микробиологии желудка и медицинской помощи.В то время как другие виды, принадлежащие к роду Helicobacter, обитают в слизистой оболочке желудка таких животных, как собаки и мыши, исследования показали, что H. Pylori предпочитает антральный отдел желудка человека.
В ходе гистологического исследования, проведенного в 1979 году, Уоррен заметил, что H. pylori присутствует в слое слизи, покрывающей ткань, а не в слизистой оболочке желудка. У здоровых людей с нормально функционирующим желудочно-кишечным трактом H. pylori ограничивается этой частью тела (антральная поверхность желудка), где они живут и выживают, не причиняя значительного вреда хозяину.
* Жгутики, используемые для плавания, и способность секретировать фермент уреазу позволяют бактериям выживать на антральной поверхности.
Выживание в антральной поверхности желудка
Из-за кислой природы желудка (из-за производства соляной кислоты) было широко распространено мнение, что ни один микроорганизм не может выжить в этой среде.
Это изменилось с открытием спиральных организмов в слое желудочной слизи.Согласно дальнейшим исследованиям, стало очевидно, что, как и другие организмы, H. pylori обладает униполярными жгутиками, которые позволяют бактериям быстро плавать через вязкую слизь. Эта характеристика позволяет организму перемещаться из одного места в другое в антральном отделе желудка и, при необходимости, в более благоприятные области.
Было обнаружено, что H. pylori не только обладает жгутиками для движения, но и секретирует большое количество фермента уреазы. Используя этот фермент, бактерии могут эффективно расщеплять эндогенную мочевину до аммиака (а также бикарбоната, который является основанием), создавая тем самым благоприятные условия для выживания.Преобразуя мочевину в аммиак, H. pylori вызывает повышение уровня pH в окружающей среде (до более высокого pH), тем самым защищая бактерии от кислой природы среды желудка.
* Производство фермента уреазы во многом зависит от уровня pH. Когда уровень pH вокруг бактерий низкий, активируются каналы на мембране бактериальной клетки, что, в свою очередь, стимулирует выработку фермента.
Было показано, что помимо производства аммиака, который увеличивает уровень pH вокруг бактерий, фермент оказывает токсическое действие на клетки желудочного эпителия.Таким образом, он способствует инфекции и, таким образом, стимулирует иммунный ответ.
Чтобы выжить в условиях желудочно-кишечного тракта, H. pylori также производит ряд других продуктов, которые либо защищают бактерии от фагоцитов, либо разрушают другие компоненты окружающей среды. Например, бактерии могут секретировать супероксиддисмутазу, которая защищает их от действий фагоцитов, которые поглощают и убивают вторгшиеся микроорганизмы.
Кроме того, такие ферменты, как гликосульфатаза, используются для расщепления и разложения таких соединений, как муцин, и других компонентов в окружающей их области.Используя такие адгезины, как BabA, H. pylori может прикрепляться и, таким образом, оставаться прикрепленными к поверхности желудка (клеткам желудочного эпителия). Это может стимулировать выработку иммунных клеток (цитокинов) на участке, что приводит к разрушению и гибели эпителиальных клеток.
В некоторых случаях было показано, что бактерии живут в эпителиальных клетках (через эндоцитозы), что затрудняет полное уничтожение бактерий у некоторых пациентов.
Для разных штаммов бактерий существуют разные факторы вирулентности.Например, среди некоторых штаммов исследования связывают присутствие цитотоксин-ассоциированного гена A (CagA) с высокой продукцией провоспалительных цитокинов в слизистой оболочке желудка.
Его присутствие связывают с высоким риском развития язвенной болезни, а также рака желудка. Было показано, что около половины штаммов способны продуцировать цитотоксин, который способен вызывать вакуолизацию и гибель эпителиальных клеток и, таким образом, усиливать инфекцию слизистой оболочки желудка.
Это варьируется от страны к стране, а также от молодежи и взрослых.Например, было показано, что уровень инфицирования в развивающихся странах выше, чем в развитых.
* H. pylori поражает около половины населения мира.
* Они могут быть инвазивными и жить как межклеточные факультативные организмы (организмы, которые могут переключаться на анаэробное дыхание в отсутствие кислорода).
Размножение и жизненный цикл
H. Pylori размножается и размножается за счет бинарного деления, как и большинство бактерий.Во время бинарного деления бактериальные хромосомы реплицируются по мере увеличения клетки. Затем следует деление хромосомы и образование перегородки, которая в конечном итоге делит клетку на две части.
Две половины хромосомы в конечном итоге разделяются, и когда клетка делится на две, это позволяет каждой дочерней клетке оставаться с хромосомами и другими компонентами клетки (цитоплазма, рибосома и т. Д.). Этот процесс создает две дочерние клетки.
* Во время бинарного деления фермент геликаза разрывает связи, удерживающие вместе нуклеотидные основания, чтобы распаковать молекулу.Другие белки, такие как ДНК-полимераза, затем играют важную роль в добавлении новых нуклеотидов, чтобы построить двухцепочечную молекулу ДНК для каждой из дочерних клеток.
Как уже упоминалось, бактерии населяют часть слизистой оболочки желудка, где они живут и размножаются. Это может происходить вне клеток (эпителиальных клеток) слизистой оболочки желудка или внутри клеток (как инвазивные организмы). По мере роста и размножения они могут выделяться вместе с фекалиями в окружающую среду (источники воды и т. Д.).
При проглатывании зараженной пищи, воды и т. Д. Бактерии могут проникать в организм человека (фекально-оральный путь), позволяя им проходить по пищеводу к слизистой оболочке желудка, где продолжается жизненный цикл. Благодаря этому способу размножения и жизненного цикла бактерии могут продолжать процветать, передаваясь от одного хозяина к другому.
* В некоторых случаях также выявлялась орально-оральная передача. Хороший пример этого – женщины в развивающихся странах и странах третьего мира, которые предварительно готовят пищу для младенцев.
Инфекция и продолжительность жизни
Кроме людей, исследования не выявили каких-либо других существенных резервуаров H. pylori. Это привело к выводу, что люди являются основным и идеальным хозяином для бактерий. У других животных (собак и т. Д.) Идентифицированные организмы напоминают только H. pylori, и, следовательно, известно, что они вызывают не-H. Pylori-инфекции.
Хотя было показано, что H. pylori инфицирует более 50 процентов населения мира, у большинства инфицированных нет симптомов, связанных с инфекцией.Однако в других случаях бактерии были связаны с инфекциями, требующими лечения.
Поскольку H. pylori производит ферменты и другие продукты для защиты от условий окружающей среды, он влияет на защитную слизь в этой области желудка. Это позволяет кислоте легко контактировать с чувствительной подкладкой и вызывать раздражение.
Продолжающееся раздражение слизистой оболочки в конечном итоге вызывает язвы (язвы двенадцатиперстной кишки и желудка). Без лечения инфекция может привести к гастриту, язвенной болезни или раку желудка.
Некоторые из симптомов, связанных с язвенной болезнью, включают:
- Грызущая боль
- Плохой аппетит
- Рвота
- Потеря веса
- Стул темный
- Вздутие живота
* H. pylori отвечает за 70 до 80 процентов язв желудка, а также до 90 процентов всех язв двенадцатиперстной кишки.
Лечение
Полное уничтожение бактерий из среды желудка оказалось трудным, потому что нелегко получить высокие концентрации препарата в слое слизи.По этой причине отказ от потенциально загрязненной воды и пищи, а также соблюдение правил гигиены (тщательное мытье продуктов перед употреблением, а также мытье рук с мыльной водой и т. Д.) Оказались одними из лучших стратегий предотвращения заражения H. pylori.
Для лечения этих инфекций используется комбинация лекарств (субсалицилат висмута, тетрациклин и метронидазол). Хотя лечение доказало свою эффективность, оно также может приводить к таким побочным эффектам, как легкая диарея.
Помимо антибиотиков, инфекции также можно лечить с помощью ингибиторов протонной помпы, которые подавляют выработку кислоты в области желудка.
Устойчивость к антибиотикам
Хотя лечение в большинстве случаев оказывается успешным, неэффективность терапии первой линии выявляется примерно в 20 процентах случаев. Эта устойчивость к антибиотикам объясняется тем, что H. pylori может быть инвазивным и продолжать размножаться в эпителиальных клетках.Показано, что некоторые штаммы (мутанты) устойчивы к лечению.
Микроскопия Helicobacter Pylori
Образцы для микроскопии можно получить непосредственно от хозяина с помощью эндоскопии. Полученные ткани можно обрабатывать с помощью автоматизированного процессора тканей. Здесь ткани, зафиксированные в парафине, срезают с помощью микротона, чтобы получить небольшие срезы (толщиной 4 микрометра) для окрашивания.
Перед окрашиванием гематоксилолом и эозином срезы необходимо депарафинизировать.
Здесь окрашивание H&E включает:
- Окрашивание гематоксилолом в течение примерно 5 минут
- Полоскание 1-процентным кислотным спиртом в течение примерно 2 секунд
- Промывание водопроводной водой
- Противодействие окрашиванию эозином в течение 5 минут
- Стирка предметное стекло с водой
* Помимо окрашивания H&E, для окрашивания бактерий также используются красители Giesma и другие специальные красители.
Подробнее об окрашивании клеток
Наблюдение: При просмотре под микроскопом H.pylori может иметь форму стержня или спирали. Поскольку бактерии не удерживают первичное пятно (характерное для грамотрицательных бактерий), они будут иметь красноватый / пурпурный цвет (цвет встречного пятна).
См. Также: Rhizobium Species
Вернуться к бактериям под микроскопом
Вернуться на страницу Proteobacteria
Вернуться на главную страницу Prokaryotes
Вернуться от Helicobacter Pylori к MicroscopeMaster Home
сообщить об этом объявлении
Список литературы
Брюс Э.Данн, Хартли Коэн и Мартин Дж. Блазер. (1997). Helicobacter pylori. Обзоры клинической микробиологии. Авторское право © 1997, Американское общество микробиологии.
Сильвия Чапарро. (2004). Helicobacter pylori.
Виджая Д., Чандрашекар Н., Нагарантнамма Т., Шиварудраппа А.С. (2012). Простое пятно на Helicobacter Pylori.
Яджи Мнена Э, Нна Эммануэль и Эга РАИ. (2017). Оценка надежности ПЦР, микробиологических и гистологических методов обнаружения Helicobacter pylori при биопсии желудка.Журналы iMedPub.
Д. Скотт, Д. Уикс, К. Мельчерс, Г. Сакс. (1998). Жизнь и смерть Helicobacter pylori.
Ya-Hui Wang, Jiunn-Jong Wu и Huan-Yao Lei (2009). Когда Helicobacter pylori проникает в клетки и размножается в них. : Http://www.tandfonline.com/loi/kaup20.
Ссылки
https://www.ncbi.nlm.nih.gov/books/NBK2452/
https://microbeonline.com/bacterial-flagella-structure-importance-and -examples-of-flagellated-бактерии /
https: // www.ncbi.nlm.nih.gov/books/NBK2423/
Новый подход к определению того, как канцерогенные бактерии находят свои цели
Художественное изображение Helicobacter pylori, канцерогена, который может вызывать определенные виды рака.
Getty Images
Грамотрицательные бактерии Helicobacter pylori (H. pylori) колонизируют желудки большинства населения мира. Хотя у большинства людей могут никогда не возникнуть серьезные осложнения из-за патогена H.pylori повышают риск развития некоторых видов рака желудка, а также других заболеваний, таких как язвенная болезнь и гастрит.
В настоящее время инфекций H. pylori поддаются лечению с помощью коктейля из антибиотиков, но быстрое появление устойчивости к антибиотикам у H. pylori вызывает серьезную озабоченность. Чтобы противостоять этим угрозам, Пушкар Леле, доцент кафедры химического машиностроения Арти Макферрина Техасского университета A&M, исследовал, как H.pylori помещают их идеальную среду в желудок хозяина.
Подвижные бактерии, такие как H. pylori , плавают, вращая нитевидные придатки, называемые жгутиками. Они ориентируются, воспринимая химические сигналы в окружающей их среде – процесс, известный как хемотаксис. Внутриклеточный сигнальный путь – сеть хемотаксиса – помогает навигации, контролируя направление вращения жгутиков. Текущее понимание того, как работает сеть хемотаксиса, основано на исследованиях Escherichia coli (E.coli) , которая является модельной системой для бактериального хемотаксиса и подвижности. Сеть хемотаксиса в E. coli модулирует вероятность вращения по часовой стрелке в жгутиках, вращающихся против часовой стрелки, чтобы помочь клетке мигрировать в благоприятную химическую среду. Как сеть хемотаксиса модулирует функции жгутиков у H. pylori , неизвестно.
Популярные методы, использующие зонды для изучения хемотаксической функции бактерий, не работают в H.pylori . Это создает значительные проблемы в понимании функций жгутиков у этого вида. Чтобы преодолеть эти проблемы, группа Леле впервые применила новый беззондовый подход к изучению функций жгутиков у H. pylori .
В их подходе использовался тот факт, что клетки плавают по кругу по часовой стрелке возле стеклянных поверхностей, когда их жгутики вращаются против часовой стрелки, и против часовой стрелки, когда их жгутики вращаются по часовой стрелке. В статье, опубликованной в eLife , Леле и его исследовательская группа использовали этот подход, чтобы сообщить о вероятности вращения по часовой стрелке в H.pylori впервые. Джиот Антани, докторант в группе Леле, провел эксперименты, которые в дальнейшем показали, что сеть хемотаксиса H. pylori модулирует жгутиковые функции аналогично таковой у E. coli .
Леле сказал, что сходство в форме контроля над жгутиками у двух видов бактерий интригует, учитывая, что они различаются по многим ключевым аспектам. В то время как H. coli предпочитают желудок, E. coli обнаруживаются в нижних отделах желудочно-кишечного тракта.Физические характеристики H. pylori таковы, что они движутся вперед и назад, в отличие от E. coli , которые бегут вперед, а затем падают. В результате, модуляция вероятностей вращения жгутиков по часовой стрелке, которая очень хорошо подходит для E. coli , по прогнозам, вызовет ошибки в хемотаксисе у H. pylori .
Леле предсказывает, что будущая работа с их новым подходом покажет, как H. pylori достигнет своих целей, несмотря на ошибки, и как можно разработать диетические вмешательства для подавления хемотаксиса.
Это исследование было поддержано грантом High Impact High Risk Awards, предоставленным Научно-исследовательским институтом профилактики рака Техаса.
Helicobacter pylori Stock Фото 4378-4429: Superstock
.Детали
Номер изображения: 4378-4429
Права управляемого
Кредит: The Science Picture Company / Science Picture Co
Разрешение модели : Нет
Права собственности: Нет
Детали: 5370 x 3580px | 17.9 дюймов x 11,93 дюйма | 57.67MB | 300 точек на дюйм
ЛИЦЕНЗИРОВАНИЕ EASY RM
250 долларов США
Издательское дело / образование
$ 400
Прямой маркетинг – внутреннее использование
$ 1600
Продлить лицензию
Для индивидуальных тарифных планов со скидкой, без водяных знаков или пакетов изображений для частных лиц или корпораций нажмите кнопку
НУЖНЫ ДОПОЛНИТЕЛЬНЫЕ ОПЦИИ ниже.
В поисках материалов для подписки посетите наш дочерний сайт PURESTOCK .
Добавить в корзину Нужны дополнительные параметры?
×
Свяжитесь с нами
Мы здесь, чтобы помочь! Свяжитесь с нами, если вам нужны более гибкие варианты лицензирования.
Позвоните нам по телефону 866-236-0087
. Представители доступны с 9:00 до 18:00 EST.
Ключевые слова
Пожалуйста, свяжитесь с
Продажи и исследования SuperStock
Эл. Почта: [email protected]
Телефон: 1-866-236-0087
Helicobacter и желудочная лимфома MALT
По-видимому, за последние 20 лет ни в одной другой области гастроэнтерологии не было такого значительного прогресса, как в области злокачественных лимфом желудка.Эти достижения можно резюмировать следующим образом:
Лимфомы сегодня обнаруживаются гораздо чаще на ранней стадии
Помимо лимфом высокой степени злокачественности все чаще диагностируются лимфомы низкой степени
Новые, улучшенные гистологическая классификация этих лимфом была разработана
Значительный прогресс был достигнут в нашем понимании патогенеза лимфомы.
Самый большой прорыв был достигнут в результате исследования связи между инфекцией желудка, вызванной Helicobacter pylori , и лимфомой желудка, которое показало, что:
Лимфоидная ткань, связанная со слизистой оболочкой (MALT) желудка, всегда является последствием инфекция H. pylori
Приобретенный MALT является предпосылкой для потенциального развития лимфомы MALT
Более чем в 90% случаев лимфома MALT связана с инфекцией H. pylori
Prior H pylori инфекция, следовательно, является состоянием перед лимфомой MALT
В экспериментах на животных лимфомы MALT могут быть вызваны инфекцией H. pylori
Удаление H pylori само по себе может привести к полной ремиссии MALT-лимфомы .
Однако еще предстоит ответить на многочисленные вопросы:
Какие дополнительные факторы необходимы для преобразования реактивной пролиферации лимфоцитов в лимфому MALT?
Почему некоторые лимфомы низкой степени регрессируют после эрадикации H. pylori , а другие – нет?
Какие продукты H pylori или Т-лимфоцитов влияют на пролиферацию клеток лимфомы и через какие рецепторы на опухолевых клетках?
Продолжается ли полная ремиссия после эрадикации H. pylori и насколько высока частота местных рецидивов?
Существуют ли антиген-чувствительные опухоли, кроме MALT-лимфомы желудка?
СИТУАЦИЯ ДО
ГОДА ПИЛОРИДо начала 1980-х лимфома желудка классифицировалась в соответствии с эндоскопической классификацией, предложенной Палмером в 1950 году. 1 В то время лимфомы, которые патологоанатомы могли исследовать, были, по большей части, большими развитыми опухолями с инфильтрацией всех слоев стенки желудка, инфильтрацией соседних тканей и поражением регионарных лимфатических узлов.
Лимфомы, обнаруженные в биопсийном материале, часто ошибочно диагностировались как карциномы, и для дальнейшей диагностики часто рекомендовали резекцию желудка. Гистологическая классификация была просто и недифференцированной: «лимфосаркома».
Три вехи в 1983 и 1984 годах ознаменовали конец этого неудовлетворительного состояния и начало положительного развития. Исааксон и Райт разработали MALT-концепцию лимфомы желудка, 2 Уоррен и Маршалл описали H. pylori , 3 и из Японии пришли – по аналогии с ранними карциномами – первые сообщения о ранних лимфомах желудка с ограничением инфильтрации до слизистая и подслизистая. 4 В последующие годы процент ранних лимфом среди лимфом желудка быстро увеличивался.Цифра для материалов из Вены за период 1974–78 гг. Составляла 21,7%, 5 в Токио между 1977 и 1986 гг., 40,9%, 6 и в нашем собственном материале между 1983 и 1989 гг., 49,6%.
На момент постановки диагноза ранние лимфомы желудка уже имеют относительно большой диаметр, не отличающийся от диаметра прогрессирующих лимфом. 7 Их можно распознать макроскопически по ряду совпадающих данных – утолщенным складкам, эрозиям и изъязвлениям. 2, 8 Как и в случае ранней карциномы желудка, эти поражения подвергаются злокачественному циклу, 9 заживают и снова появляются, в результате чего видна разнообразная картина, включая утолщенные складки, эрозии, язвы, шрамы и регенеративную слизистую оболочку. .
Тот факт, что ранние лимфомы уже имеют относительно большой диаметр – в среднем около 8 см – на момент постановки диагноза, мог побудить нас подозревать, что на поверхности слизистой оболочки должен присутствовать фактор, стимулирующий рост.
Распознавание ранней лимфомы было шагом вперед, о чем свидетельствуют следующие данные: глубина инфильтрации коррелирует с поражением регионарных лимфатических узлов и степенью злокачественности опухоли 10 ; чем глубже инфильтрация, тем больше случаев поражения лимфатических узлов и тем больше случаев злокачественных новообразований высокой степени. Поэтому логичен тот факт, что глубина инфильтрации является основным прогностическим фактором в случаях лимфомы желудка. 11
Достижения в ранней эндоскопически-биоптической диагностике также отражаются в изменении относительных пропорций лимфом низкой и высокой степени злокачественности. В то время как ранее преобладание диагностированных лимфом было высокой степени злокачественности, 12 в 1990-е годы был обнаружен более высокий процент лимфом низкой степени злокачественности – процент лимфом низкой степени злокачественности в нашем материале от 351 пациента в период 1993–1998 годов составлял 77,2. %.
В конце 1980-х годов Исааксон и его коллеги предложили первую хорошую гистологическую классификацию. 13 Поскольку местом происхождения опухоли является перифолликулярная маргинальная клетка, в пересмотренной европейско-американской классификации лимфоидных новообразований 14 и в новой классификации опухолей пищеварительной системы ВОЗ 15 лимфома также называется лимфомой. маргинальная В-клеточная лимфома. Первичные Т-клеточные лимфомы желудка встречаются очень редко. Из 220 хирургических образцов лимфомы желудка только два были Т-клеточными лимфомами. 10
Решающим достижением в диагностике злокачественных лимфом желудка низкой степени злокачественности на основе биопсии стало установление следующих гистологических критериев Исааксоном и его коллегами 16, 17 :
Замена желудочных желез однородными инфильтратами, содержащими центроцитоидные клетки (см. рис 3)
Явное свидетельство лимфоидной деструкции желудочных желез фовеол (рис. 1 и 2).
Частичное разрушение желудочной железы инфильтратами MALT-лимфомы низкой степени злокачественности (иммуногистохимия с антителом к CD 20).
Рисунок 2Множественные поражения лимфоэпителием при лимфоме низкой степени злокачественности MALT (иммуногистохимия с использованием антител к панцитокератину).
Диагноз MALT лимфомы желудка низкой степени злокачественности следует ставить только в том случае, если доказан инвазивный и деструктивный рост опухоли.То есть, когда ямки и / или железы частично или почти полностью разрушаются лимфоидными клетками.
Для точного гистологического диагноза лимфомы желудка MALT после первой диагностической работы часто необходимо провести проблемно-ориентированное эндоскопически-биоптическое исследование с дополнительной целью обнаружения возможной фокальной трансформации в лимфому высокой степени злокачественности. Для такого исследования необходимо получить не менее 15 образцов биопсии из любого эндоскопически подозрительного поражения. 18
ОТКРЫТИЕ СВЯЗИ МЕЖДУ
H PYLORI , СОЛОДОМ И ЛИМФОМАМИ СОЛАПути исследования H pylori и желудочного MALT-лимфомы впервые пересеклись в 1988 году с признанием того, что причиной приобретенного желудочного MALT является хроническая инфекция, вызванная H pylori . 19, 20 Первым фрагментом головоломки, который помог прояснить эту связь, было эпидемиологическое исследование, которое показало зависимость заболеваемости MALT-лимфомой от частоты инфицирования H. pylori . 21 Вторая причина заключалась в том, что ранние лимфомы, как приобретенный MALT, локализуются в основном в антральном отделе желудка. 7
Анализ хирургических образцов лимфомы желудка MALT показал гастрит H. pylori в 92,0–98,3%. 10, 22 Кроме того, исследование случай-контроль, проведенное Parsonnet и соавторами 23 , показало статистически значимо более высокую частоту инфицирования H pylori среди пациентов с MALT-лимфомой задолго до развития лимфомы.Это доказательство того факта, что гастрит H pylori является заболеванием, предшествующим лимфоме MALT. Наконец, эксперименты на животных показали, что пожизненное инфицирование мышей H felis приводило к развитию лимфомы желудочного MALT в 26% случаев. 24, 25 В другом исследовании группа Адриана Ли трансплантировала клетки лимфомы желудка подкожно или внутрибрюшинно молодым мышам. Только у животных, инфицированных H. pylori , развились лимфомы; контрольные животные, не инфицированные H pylori , не инфицировались.Однако лимфомы располагались не в местах подкожной или внутрибрюшинной трансплантации, а в желудке животных. 26 В течение длительного периода наблюдения некоторые из этих лимфом претерпели трансформацию из лимфом низкой степени злокачественности в лимфомы высокой степени. 27
Напротив, у другой линии мышей пожизненное инфицирование H felis привело к тяжелой форме гастрита с атрофией, но без лимфом. Экспериментальная индукция лимфомы желудка у мышей BALB / C также возможна с использованием H heilmannii , но показатели различаются – от 14% до 89%, в зависимости от хозяина инфекции. 28
Эти эксперименты на животных показывают, что факторы, необходимые для индукции развития лимфомы желудка при приобретенном MALT, вероятно, следует искать среди различных бактериальных факторов и факторов хозяина.
В этом контексте интересно отметить, что у пациентов с гастритом H heilmannii , по-видимому, лимфома MALT развивается чаще, чем у пациентов с гастритом H. pylori : в нашем материале с 1988 по 1998 год восемь лимфом MALT среди 543 пациентов с H heilmannii гастрит (1.47%) по сравнению с 1745 лимфомами MALT среди 263 680 пациентов с гастритом H. pylori (0,66%). Как и в случае с мышами BALB / C в экспериментах на животных, проведенных группой, возглавляемой Адрианом Ли, гастрит H heilmannii был более низкой степени тяжести и менее активен, чем гастрит H. pylori . 29 В пользу этой связи с более легкой формой гастрита говорит тот факт, что согласованное контрольное исследование всех материалов показало, что у пациентов с MALT-лимфомой желудка гастрит имеет более низкую степень по сравнению с другими заболеваниями, вызванными H pylori . , и нет никакой разницы между оценкой желудка в антральном отделе и теле. 30
Что касается инфекции слизистой оболочки желудка H heilmannii , дальнейшие исследования с тех пор показали, что существует несколько типов H heilmannii , которые могут передаваться различными домашними животными (собаками, кошками, свиньями) и могут также проявляться в виде инфекции. смешанная инфекция слизистой оболочки желудка. 31
Таким образом, возможно, что специальные антигены, происходящие непосредственно от тех штаммов Helicobacter , которые являются слабопатогенными, или косвенно через Т-лимфоциты, приводят к положительному отбору опухолевых клеток через рецептор антигена.Это подтверждается исследованием, показывающим, что В-клетки лимфомы MALT-типа представляют собой гипермутированные лимфоциты постгерминального центра, прошедшие отбор на антиген. 32 Кроме того, сообщалось, что изменения гена супрессора р53 участвуют в развитии и трансформации лимфом MALT; частичная инактивация приводит к развитию лимфом MALT низкой степени, а полная инактивация – к лимфомам MALT высокой степени. 33
Молекулярно-генетические исследования MALT-лимфомы желудка, доступные в настоящее время, еще не раскрывают всей картины, и необходимы дальнейшие исследования.Поэтапное приобретение генетических аномалий можно разделить на ранние и более поздние молекулярные события. Ранние молекулярные события в эволюции MALT-лимфомы желудка включают трисомию 3 (33% желудочных MALT-лимфом), но это событие, по-видимому, не играет важной роли в прогрессировании. 34 Транслокация хромосомы t (11; 18) (q21; q21) также является ранней, частой и специфической аберрацией при лимфомах MALT низкой степени злокачественности. 35– 37 Эта транслокация, по-видимому, отсутствует при лимфомах желудка высокой степени злокачественности, что позволяет предположить, что лимфомы MALT низкой степени злокачественности, положительные по транслокации t (11; 18) (q21; 21), могут представлять подгруппу прогрессирования в запущенная лимфома.Другим молекулярным событием на ранней стадии лимфомагенеза является сверхэкспрессия белка Bcl-2. Следовательно, ингибирование апоптоза, по-видимому, участвует в лимфомагенезе. 38 Экспрессия белка p53 обратно коррелирует с экспрессией Bcl-2 и чаще встречается при лимфомах желудка высокой степени злокачественности. Следовательно, мутации гена p 53 могут быть связаны с гистологической трансформацией лимфомы низкой или высокой степени злокачественности. 38– 40
H PYLORI УДАЛЕНИЕ ЛИМФОМЫ СЛОДАОткрытие полной ремиссии MALT-лимфомы низкой степени злокачественности было инициировано попытками улучшить эндоскопически-биоптический дифференциальный диагноз между реактивными лимфатическими инфильтратами и инфильтратами MALT-лимфомы низкой степени злокачественности.Мы выдвинули гипотезу, что реактивные лимфатические инфильтраты должны исчезнуть, но инфильтраты лимфомы сохранятся в ответ на эрадикацию H. pylori . 41
К нашему большому удивлению, наш первый анализ 32 пациентов, изученных в 1992 г., показал, что лимфомы MALT также могут исчезнуть: у шести из 10 пациентов с лимфомами MALT низкой степени злокачественности последующее наблюдение выявило регресс лимфомы. Двое из этих шести пациентов были подвергнуты резекции желудка; в обоих случаях мы обнаружили пустую собственную пластинку с небольшими остатками агрегатов Т-лимфоцитов, что указывает на регресс опухоли – картина, однажды наблюдаемая только после успешной химиотерапии или лучевой терапии лимфомы желудка MALT (см. рис. 3).
Рисунок 3Полная ремиссия лимфомы MALT низкой степени после эрадикации H. pylori с типичной картиной пустой собственной пластинки.
В 1993 г. Уотерспун и его коллеги 42 сообщили о регрессе низкосортных лимфом MALT желудка у пяти из шести пациентов. Та же группа исследовала поведение пролиферации опухолевых клеток из лимфом MALT низкой и высокой степени злокачественности в культурах клеток с H pylori и без них, а также с Т-лимфоцитами и без них.Было обнаружено, что клетки лимфомы MALT низкой степени злокачественности пролиферируют только тогда, когда культуральная среда содержит как H pylori , так и Т-лимфоциты, но не при отсутствии H pylori или Т-лимфоцитов. Напротив, на пролиферацию клеток лимфомы высокой степени злокачественности не влияло отсутствие H. pylori или Т-лимфоцитов. 43
Немецкое исследование MALT-лимфомы
Ободренные этими первоначальными результатами, мы начали изучать лечение низкосортных лимфом желудка MALT, состоящее исключительно из эрадикации H pylori .Мы уже опубликовали ряд отчетов о первоначальных результатах, а также результатах последующих обследований. 44– 46 Мы завершили это исследование после того, как мы включили 120 пациентов, которые все еще остаются под наблюдением.
Мы принимали только пациентов с гистологически однозначным диагнозом лимфомы MALT. Мы также выполнили рекомендацию Isaacson и Norton о том, что лимфому MALT следует диагностировать только тогда, когда результаты эндоскопии совместимы с лимфомой MALT. 47 Контрольные эндоскопические и биопсийные исследования были выполнены после эрадикации H. pylori , сначала с интервалом в два месяца, а затем, после достижения полной ремиссии, с интервалом в шесть месяцев. Пациентам с частичной ремиссией и без изменений в опухолях рекомендовалось хирургическое лечение, лучевая терапия или химиотерапия.
Результаты, полученные после среднего периода наблюдения в 48 месяцев, были следующими: полная ремиссия 81%, частичная ремиссия 9% и отсутствие ответа на лечение 10%.
Из 12 пациентов, не ответивших на лечение, двое умерли от лимфомы, а девять были прооперированы. Обработка хирургических образцов выявила одну Т-клеточную лимфому, пять вторичных лимфом высокой степени злокачественности и три лимфомы низкой степени злокачественности. Двое пациентов прошли химиотерапию.
Из 11 пациентов с частичной ремиссией после эрадикации H. pylori , один с тех пор умер от инсульта, шесть были прооперированы, двое получили химиотерапию, а у остальных двоих заболевание стабильно без прогрессирования, и они все еще находятся под наблюдением. .
На основании эндоскопического внешнего вида невозможно предсказать, приведет ли эрадикация H pylori к ремиссии лимфомы. Диаметр опухоли не дает никаких указаний на ее ремиссию. Пациент с самой большой лимфомой MALT, имеющей диаметр 10 см, в настоящее время находится в полной ремиссии в течение семи лет после ликвидации H pylori .
Это контрастирует с глубиной инфильтрации: только в случае ранних лимфом с инфильтрацией слизистой и подслизистой оболочки можно ожидать полной ремиссии у большого процента пациентов.Вот почему эндоскопическое ультразвуковое исследование имеет большое значение для определения стадии перед лечением. Мы никогда не наблюдали полной ремиссии лимфом, инфильтрирующих собственную мышечную и серозную оболочки. 48 Однако в одном исследовании также сообщается о полной ремиссии глубоко инфильтрирующих лимфом. 49
Хорошим маркером для прогноза ремиссии лимфомы после эрадикации H. pylori , по-видимому, является определение t (11; 18). В то время как все пациенты, у которых не было никаких доказательств этой транслокации после эрадикации H. pylori , показали полную ремиссию, 75% из тех, у которых был обнаружен t (11; 18), не имели ремиссии. 50, 51
Гистологическая диагностика полной ремиссии по биопсийному материалу остается большой проблемой. Гистологическое исследование 15 хирургических образцов не отвечающих на лечение пациентов и пациентов с частичной ремиссией показало неопределенность диагноза регресса на основе биопсии: в случаях регресса лимфомы в плоскости слизистой оболочки мы обнаружили остаточную лимфому в более глубоких слоях. стенки желудка. Даже если участки лимфомы обнаруживаются на слизистой оболочке хирургического образца, гистологический диагноз лимфомы, тем не менее, может оставаться неопределенным; во всех 15 хирургических образцах после эрадикации H pylori мы не смогли обнаружить наиболее важный критерий диагностики лимфомы MALT – лимфоэпителиальные поражения.
Полимеразная цепная реакция (ПЦР), проведенная на перегруппировке VDJ тяжелой цепи иммуноглобулина, не может помочь нам решить эту дилемму. При первичном диагнозе лимфомы до лечения ПЦР была положительной только в 71% случаев. С другой стороны, ПЦР оставалась положительной у 45% пациентов с полной эндоскопической, эндосонографической и гистологической ремиссией. 52
Подобные результаты были получены другими авторами. 53, 54 Чтобы найти источник моноклональных В-клеток, мы провели исследования ПЦР после микродиссекции поверхностных участков и базальных лимфатических агрегатов в слизистой оболочке.Было обнаружено, что источник моноклональных В-клеток находится в основном в базальных лимфатических агрегатах. 52 Дальнейшее обследование этих пациентов должно будет показать, могут ли эти моноклональные клетки привести к рецидиву, и может ли это произойти только после повторного инфицирования H. pylori или также у H pylori отрицательных пациентов.
Из 97 наших пациентов с полной ремиссией лимфомы четверо с тех пор умерли. Причины смерти – инфаркт миокарда, инсульт и артериальная эмболия.На данный момент мы диагностировали девять рецидивов, в том числе одну лимфому высокой степени в носу и восемь рецидивирующих поражений низкой степени, одно после повторного инфицирования H pylori , при котором эрадикационная терапия H pylori снова привела к полной ремиссии лимфомы. Один пациент перенес операцию, а один получил лучевую терапию. У остальных пяти пациентов эндоскопический вид оставался нормальным; последующие гистологические исследования лимфомы не выявили.
Результаты дальнейших контрольных обследований должны будут определить, имеет ли какое-либо значение гистологический результат в очаге крошечной лимфомы и / или положительный результат ПЦР после полной ремиссии лимфомы, можно ли классифицировать любой из этих случаев как «стабильное заболевание» в «фаза покоя» 55 или могут ли эти клетки вызывать рецидив.
У трех пациентов с полной ремиссией лимфомы мы диагностировали рак желудка на ранней стадии через 4–6 лет после эрадикации H. pylori . Все три вида рака ограничивались слизистой оболочкой, имели диаметр 4–5 мм и успешно лечились с помощью эндоскопической резекции слизистой оболочки.
Результаты других исследований
При обзоре литературы и обобщении результатов лечения MALT лимфомы желудка на разных стадиях с эрадикацией H. pylori 42, 44, 45, 49, 56– 70 мы обнаружили полное частота ремиссии составляет от 35% до 100% (см. таблицу 1).
Стол 1Результаты лечения MALT лимфомы желудка эрадикацией H pylori
Лимфомы, возникающие при гастрите H heilmannii , также можно вылечить с помощью эрадикационной терапии. 71 Даже в отдельных случаях лимфомы MALT высокой степени эрадикация H. pylori может привести к полной ремиссии опухоли. 72– 77 Эрадикация H. pylori даже привела к регрессу лимфомы, локализованной не в желудке.Об этом сообщалось для случаев регресса лимфомы слюнной железы, 78 лимфомы двенадцатиперстной кишки, 79 лимфомы IPSID, 80 и лимфомы прямой кишки. 81
ЗАКЛЮЧЕНИЕ
Наше исследование и результаты, представленные в литературе, подтверждают, что гастрит H pylori и H heilmannii является заболеванием, предшествующим лимфоме MALT, и что эрадикационная терапия Helicobacter может привести к полной ремиссии примерно в 80% случаев низкой степени злокачественности. лимфома, но может произойти около 5% рецидивов в год.Даже в отдельных случаях MALT-лимфомы высокой степени и лимфом двенадцатиперстной кишки, тонкой кишки, прямой кишки и слюнных желез эрадикация Helicobacter может привести к полной ремиссии опухоли.
Следует, однако, отметить, что диагноз полной ремиссии является неопределенным, и что, несмотря на эндоскопически, эндосонографически и гистологически диагностированную полную ремиссию, моноклональные В-клетки все еще обнаруживаются в слизистой оболочке желудка у 45% этих пациентов.Необходимы дальнейшие исследования, чтобы показать важность этой моноклональности В-клеток. Также требует прояснения вопрос, следует ли ожидать дальнейшей регрессии этих моноклональных клеток с течением времени, имеем ли мы дело с непролиферативным, стабильным заболеванием в дремлющей фазе или существует опасность рецидива.
До тех пор, пока не будут даны ответы на эти вопросы и пока недоступны долгосрочные результаты, охватывающие период наблюдения более пяти лет, эрадикация Helicobacter в качестве единственного лечения лимфомы MALT остается экспериментальной и должна ограничиваться исследованиями, в которых регулярно проводятся Могут быть выполнены эндоскопические и биоптические контрольные обследования.
Тем не менее, настоящие результаты уже подтверждают название обзора Питера Исааксона: «Желудочная лимфома MALT: от концепции до лечения». 82
РЕЗЮМЕ
За последние 20 лет огромные успехи были достигнуты в области MALT-лимфом желудка. До начала 1980-х годов эта лимфома диагностировалась почти только на поздней стадии и по большей части как очень злокачественное поражение. Только после публикации Исааксоном концепции MALT-лимфомы в 1983 году стало возможным диагностировать ранние стадии этой лимфомы.
Наши текущие знания о связи между инфекцией H pylori и лимфомами MALT были начаты с открытия, что лимфатическая ткань, связанная со слизистой оболочкой (MALT) желудка, всегда является следствием инфекции H. pylori .
На основе этих открытий была разработана гипотеза о том, что дифференциальный диагноз MALT-лимфомы и реактивных лимфатических инфильтратов в биопсийном материале можно улучшить, удалив H. pylori .Эта гипотеза утверждала, что реактивный инфильтрат должен исчезнуть после эрадикации H pylori , но инфильтраты лимфомы должны сохраниться. Однако исследования, основанные на этих соображениях, показали, что MALT-лимфома низкой степени злокачественности на ранней стадии с инфильтрацией слизистой и подслизистой оболочки также зажила после эрадикационной терапии H. pylori .
Это побудило нас в 1994 году начать исследование по лечению лимфомы низкой степени злокачественности с помощью только эрадикации H. pylori .После обследования 120 пациентов мы прекратили это исследование. Результатом была полная ремиссия 81%, частичная ремиссия 9% и отсутствие ответа на лечение 10%. Сопоставимые исследования, проведенные в Европе и Японии, дали аналогичные результаты (частота полной ремиссии от 35% до 93%).
Анализ наших собственных случаев показал, что результаты эндоскопии не могут быть использованы для получения прогноза ремиссии после эрадикации H. pylori . Большее значение имеет глубина проникновения лимфомы.Только для лимфом, инфильтрирующих слизистую и подслизистую, но не инфильтрирующих более глубокие слои стенки, мы смогли достичь полной ремиссии.
ПЦР для диагностики и последующего наблюдения за ремиссией не является надежным: при первичном диагнозе она показывает моноклональность в 71% лимфом, но также в 45% случаев с полной ремиссией. Источником этой моноклональности являются стойкие базальные агрегаты лимфоцитов. У девяти наших пациентов с полной ремиссией был обнаружен рецидив лимфомы: лимфома слизистой носа высокой степени злокачественности у одного и местный рецидив у восьми.Эти последние, однако, были диагностированы только на основании гистологического исследования, при этом эндоскопический вид был нормальным. Остается ответить на вопрос, были ли эти рецидивы просто непролиферативной «фазой покоя» моноклональных В-клеток. Отчеты о клинических случаях, опубликованные в последние годы, показали, что лимфомы высокой степени злокачественности также могут пройти полную ремиссию после лечения H. pylori .
ССЫЛКИ
- ↵
Палмер Е .Саркома желудка. Am J Dig Dis 1950; 17: 186–95.
- ↵
Исааксон PG , Райт DH. Злокачественная лимфома из лимфоидной ткани, связанной со слизистой оболочкой: отличительный тип В-клеточной лимфомы. Рак 1983; 52: 1410–16.
- ↵
Уоррен Дж. Р. , Маршалл Б.Дж. Неопознанные изогнутые бациллы на эпителии желудка при активном хроническом гастрите. Lancet1983; 330: 1273–5.
- ↵
Мураяма Х , Кикучи М., Эймото Т., и др. .Ранняя лимфома сосуществует с реактивной лимфоидной гиперплазией желудка. Acta Pathol Jpn 1984; 34: 679–86.
- ↵
Радашкевич Т. , Драгошич Б., Бауэр П. Злокачественные лимфомы желудочно-кишечного тракта лимфоидной ткани, связанной со слизистой оболочкой: факторы, влияющие на прогноз. Гастроэнтерология 1992; 102: 1628–38.
- ↵
Mohri N . Первичные неходжкинские лимфомы желудка в Японии.Арка Вирха A1987; 411: 295–8.
- ↵
Stolte M , Eidt S. Диагностика ранней лимфомы желудка. Z Gastroenterol1991; 29: 6–10.
- ↵
Weismüller J , Seifert E, Goronzy R, Stolte M. Das maligne Lymphom des Magens — Fortschritte in der Frühdiagnostik. Schweiz Rundschau Med (Praxis) 1986; 75: 1531–2.
- ↵
Eidt S , Stolte M.Доказательства злокачественного цикла при ранней лимфоме желудка. Эндоскопия, 1994; 26: 295–8.
- ↵
Eidt S , Stolte M, Fischer R. Гастрит Helicobacter pylori и неходжкинская лимфома желудка. Дж. Клин Патол, 1994; 47: 436–9.
- ↵
Dragosics B , Bauer P, Radaszkiewicz T. Первичные неходжкинские лимфомы желудочно-кишечного тракта. Ретроспективное клинико-патологическое исследование 150 случаев.Cancer 1985; 55: 1060–73.
- ↵
Cogliatti SB , Schmid U, Schumacher U, и др. . Первичная B-клеточная лимфома желудка: клинико-патологическое исследование 145 пациентов. Гастроэнтерология, 1991; 101: 1159–70.
- ↵
Исааксон PG , Спенсер Дж. Райт DH. Классификация первичных лимфом кишечника. Lancet 1988; 2: 1148–9.
- ↵
Harris NL , Jaffe ES, Stein H, и др. .Пересмотренная европейско-американская классификация лимфоидных новообразований. Предложение международной группы по изучению лимфомы. Blood1994; 84: 1361–92.
- ↵
Hamilton SR , Aaltonen LA, ред. Опухоли пищеварительной системы. Классификация опухолей Всемирной организации здравоохранения . Лион: ARCPress, 2000.
. - ↵
Isaacson PG , Spencer J. Злокачественная лимфома слизистой лимфоидной ткани.Гистопатология 1987; 11: 445–62
- ↵
Исааксон PG , Нортон AJ. Экстранодальные лимфомы . Эдингбург: Черчилль Ливингстон, 1994.
- ↵
De Jong D , Boot J, van Heerde P, et al . Гистологическая оценка лимфомы желудка: критерии до лечения и клиническая значимость. Гастроэнтерология 1997; 112: 1466–74.
- ↵
Wyatt JI , Rathbone BJ.Иммунный ответ слизистой оболочки желудка на Campylobacter pylori. Scand J Gastroenterol 1988; 23 (прил. 142): 44–9.
- ↵
Stolte M , Eidt S. Лимфоидные фолликулы в слизистой оболочке антрального отдела: иммунный ответ на Campylobacter pylori. Дж. Клин Патол, 1989; 42: 1269–71.
- ↵
Doglioni C , Wotherspoon AC, Moschinie A, и др. . Высокая частота первичной лимфомы желудка на северо-востоке Италии.Lancet1992; 339: 1175–6.
- ↵
Wotherspoon AC , Ortiz-Hidalgo C, Falzon MR, и др. . Helicobacter pylori-ассоциированный гастрит и первичная B-клеточная лимфома желудка. Lancet1991; 338: 1175–6.
- ↵
Парсонне Дж. , Хансен С., Родригес Л., и др. . Инфекция Helicobacter pylori и лимфома желудка. N Engl J Med1994; 330: 1267–71.
- ↵
Энно А. , О’Рурк Дж., Ли А., и др. .MALToma-подобные поражения желудка, возникшие в результате длительной инфекции Helicobacter у мышей. Ам Дж. Гастроэнтерол, 1994; 89: 1357.
- ↵
Энно А , О’Рурк Дж., Хоулетт CR, и др. . MALToma-подобные поражения слизистой оболочки желудка мышей после длительного инфицирования Helicobacter felis: модель лимфомы желудка Helicobacter pylori на мышах. Am J Pathol, 1995; 147: 217–22.
- ↵
Энно А , О’Рурк Дж., Хоулетт CR, и др. .Реанимация от мыши к мыши низкосортной лимфомы MALT, вызванной длительной инфекцией Helicobacter. Предварительное исследование пересаженных опухолей. Гастроэнтерология 1996; 110: A536.
- ↵
Энно А , О’Рурк Дж., Брей С., и др. . Антиген-зависимое прогрессирование лимфомы, ассоциированной со слизистой оболочкой лимфоидной ткани (MALT), в желудке. Влияние антимикробной терапии на лимфому желудка MALT у мышей. Am J Pathol 1998; 152: 1625–32.
- ↵
О’Рурк Дж. Л. , Энно А., Диксон М. Ф., и др. . В-клеточные лимфомы желудка, индуцированные у одной линии мышей различными изолятами Helicobacter heilmannii. Сходства и различия. Gut1995; 37 (приложение 1): A7.
- ↵
Stolte M , Wellens E, Bethke B, и др. . Helicobacter heilmannii (ранее Gastrospirillum hominis) гастрит: инфекция, передающаяся от животных? Scand J Gastroenterol1994; 29: 1061–4.
- ↵
Meining A , Stolte M, Hatz R, и др. . Различная степень и распространение гастрита при заболеваниях, ассоциированных с Helicobacter pylori. Вирхов Arch2997; 431: 11–15.
- ↵
Trebesius K , Adler K, Vieth M, et al . Специфическое обнаружение и распространенность Helicobacter heilmannii-подобных организмов в слизистой оболочке желудка человека с помощью флуоресцентной гибридизации in situ и частичного секвенирования 16S рибосомной ДНК.J Clin Microbiol2001; 39: 1510–16.
- ↵
Qin Y , Greiner A, Trunk MJF, и др. . Соматическая гипермутация при B-клеточной лимфоме, ассоциированной со слизистой оболочкой, низкой степени злокачественности. Blood1995; 86: 3528–34.
- ↵
Du M , Peng H, Singh N, и др. . Накопление аномалий р53 связано с прогрессированием лимфомы лимфоидной ткани, связанной со слизистой оболочкой.Blood1992; 339: 745–7.
- ↵
Hoeve MA , Gisbertz IAM, Schoutten HC, и др. . MALT-лимфома низкой степени злокачественности, MALT-лимфома высокой степени и диффузная большая B-клеточная лимфома имеют разную частоту трисомии. Leukemia 1999; 13: 799–807.
- ↵
Ott G , Katzenberger T, Greiner A, et al . Транслокация хромосомы t (11; 18) (q21; q21) является частой и специфической аберрацией при низкоуровневой, но не высокой злокачественной неходжкинской лимфоме типа лимфоидной ткани, ассоциированной со слизистой оболочкой (MALT).Cancer Res1997; 57: 3944–8.
Агаки Т. , Мотеги М., Тамура А, и др. . Новый ген, MALT1 в 18q21, участвует в t (11,18) (q21; q21), обнаруживаемом в B-клеточной лимфоме низкой степени злокачественности лимфоидной ткани, ассоциированной со слизистой оболочкой. Онкоген1999; 18: 5785–94.
- ↵
Dierlamm J , Baens M, Wlodarska I, et al . Ген ингибитора апоптоза AP12 и новый ген 18q, MLT, рекуррентно реаранжируются в t (11; 18) (q21; q21), ассоциированном с лимфомой лимфоидной ткани, ассоциированной со слизистой оболочкой.Blood1999; 93: 3601–9.
- ↵
Охаши С. , Сгава К., Окамура С., и др. . Клинико-патологическое исследование лимфомы лимфоидной ткани, связанной со слизистой оболочкой желудка. Cancer2000; 88: 2210–19.
Fa YS , Ризкалла К., Энгель Дж. Интерстициальная делеция 8 (q23; q21) при диффузной большой B-клеточной лимфоме желудка. Cancer Genet Cytogenet1999; 115: 28–31.
- ↵
Ferreri AJ , Cordio S, Paro S, и др. .Терапевтическое лечение первичных лимфом желудка высокой степени злокачественности I-II стадии. Онкология, 1999; 56: 274–82.
- ↵
Столте М . Helicobacter pylori и MALT-лимфома. Lancet1992; 339: 745–7.
- ↵
Wotherspoon AC , Doglioni C, Diss TC, и др. . Регресс первичной низкосортной B-клеточной лимфомы желудка слизисто-ассоциированного лимфоидного типа после эрадикации Helicobacter pylori.Lancet1993; 342: 575–7.
- ↵
Hussell T , Isaacson PG, Crabtree JE, Spencer J. Ответ клеток низкосортной B-клеточной лимфомы желудка ассоциированной со слизистой оболочкой лимфоидной ткани на Helicobacter pylori. Lancet1993; 342: 571–4.
- ↵
Bayerdörffer E , Neubauer A, Rudolph B, et al . Группа исследования лимфомы MALT. Регресс первичной лимфомы желудка слизисто-ассоциированного тканевого типа после лечения инфекции Helicobacter pylori.Lancet1995; 345: 1591–4.
- ↵
Neubauer A , Thiede C, Morgner A, и др. . Лечение инфекции Helicobacter pylori и продолжительность ремиссии лимфомы лимфоидной ткани, ассоциированной со слизистой оболочкой желудка низкой степени. J Natl Cancer Inst 1997; 89: 1350–5.
- ↵
Morgner A , Bayerdörffer E, Neubauer A, и др. . MALT-лимфома желудка и ее связь с инфекцией Helicobacter pylori: лечение и патогенез заболевания.Micros Res Tech3000; 48: 349–56.
- ↵
Исааксон PG , Нортон AJ. Экстранодальные лимфомы . Эдинбург: Черчилль Ливингстон, 1994.
- ↵
Sackmann M , Morgner A, Rudolph B, et al . Регресс лимфомы желудка MALT после эрадикации Helicobacter pylori прогнозируется с помощью эндосонографического определения стадии. Группа изучения лимфомы MALT. Гастроэнтерология 1997; 113: 1087–90.
- ↵
Steinbach G , Ford R, Glober G, и др. . Лечение антибиотиками лимфомы желудка из лимфоидной ткани, связанной со слизистой оболочкой. Ann Intern Med, 1999; 131: 88–95.
- ↵
Alpen B , Neubauer A, Dirlamm J, et al . Транслокация t (11; 18) отсутствует в ранней В-клеточной лимфоме маргинальной зоны желудка MALT-типа, отвечающей на эрадикацию инфекции Helicobacter pylori.Blood2000; 95: 4012–15.
- ↵
Liu H , Ruskone-Formeshaux A, Lavergue-Slove A, и др. . Устойчивость t (11; 18) лимфомы лимфоидной ткани, ассоциированной со слизистой оболочкой желудка, к эрадикационной терапии Helicobacter pylori. Lancet2001; 357: 39–40.
- ↵
Thiede C , Wündisch T, Alpen B, и др. . Длительное сохранение моноклональных В-клеток после излечения от инфекции Helicobacter pylori и полная гистологическая ремиссия в B-клеточной лимфоме, ассоциированной со слизистой оболочкой желудка.Дж. Клин Онкол, 2001; 19: 1600–9.
- ↵
Savio A , Franzin G, Wotherspoon AC, и др. . Диагностика и последующее наблюдение после лечения Helicobacter pylori-положительной лимфомы желудка из слизистой лимфоидной ткани: гистология, полимеразная цепная реакция или и то, и другое? Blood1996; 87: 1255–60.
- ↵
Aiello A , Giardini R, Tondini C, и др. . Анализ клональности на основе ПЦР: надежный метод диагностики и последующего наблюдения за консервативно леченными B-клеточными MALT-лимфомами желудка? Гистопатология 1999; 34: 326–30.
- ↵
Isaacson PG , Diss TC, Wotherspoon AC, и др. . Долгосрочное наблюдение за MALT-лимфомой желудка, леченной эрадикацией H. pylori с помощью антибиотиков. Гастроэнтерология, 1999; 117: 750–1.
- ↵
Savio A , Franzin G, Wotherspoon AC, и др. . Диагностика и последующее наблюдение после лечения Helicobacter pylori-положительной лимфомы желудка из лимфоидной ткани, связанной со слизистой оболочкой; гистология, полимеразная цепная реакция или и то, и другое? Blood1996; 87: 1255–60.
- ↵
Roggero E , Zucca E, Pinotti G, и др. . Ликвидация инфекции Helicobacter pylori при первичной лимфоме желудка низкой степени злокачественности из лимфоидной ткани слизистой оболочки. Ann Intern Med, 1995; 122: 767–79.
Fischbach W , Kolve ME, Engemann R, et al . Неожиданный успех эрадикации Helicobacter pylori при лимфоме низкой степени злокачественности. Гастроэнтерология 1996; 110: A512.
Montalban C , Manzanal A, Boixeda D, et al . Эрадикация Helicobacter pylori для лечения MALT-лимфомы низкой степени злокачественности: последующее наблюдение вместе с последовательными молекулярными исследованиями. Энн Онкол 1997; 8 (приложение 2).
Pinotti G , Zucca E, Roggero E, и др. . Клинические особенности, лечение и исходы у 93 пациентов с MALT-лимфомой низкой степени злокачественности.Лимфома Лейка 1997; 26: 527–37.
Nobre-Leitao C , Lage P, Cravo M, и др. . Лечение MALT-лимфомы желудка с помощью эрадикации Helicobacter pylori: исследование, контролируемое эндоскопической ультрасонографией: Am J Gastroenterol1998; 93: 732–6.
Като Т. , и др. . Регресс желудочной лимфомы MALT низкой степени злокачественности после эрадикации Helicobacter pylori.Кишечник желудка 1999; 34: 1345–52.
Накамура Т. , и др. . Изменения эндоскопических, рентгенографических и патологических данных MALT-лимфомы желудка после лечения инфекции H. pylori. Кишечник желудка 1999; 34: 1353–66.
Suzuki T , и др. . Клинико-патологические особенности лимфомы MALT. Желудок и кишечник 1999; 34: 1367–79.
Oda I , и др. .Эндоскопическая оценка эрадикации Helicobacter pylori. Кишечник желудка 1999; 34: 1381–8.
Yamashita H , и др. . Гистологические особенности низкосортной лимфомы MALT, демонстрирующие полную регрессию после эрадикации Helicobacter pylori, и время прогнозирования ее эффективности – ценность клинического типирования, основанного на результатах эндосонографии. Желудок и кишечник 1999; 34: 1389–96.
Suekane H , и др. .Клинический курс и практические рекомендации после искоренения Helicobacter pylori – ценность клинического типирования, основанного на результатах эндосонографии. Кишечник желудка 1999; 34: 1397–409.
Thiede C , Wündisch T, Neubauer B, et al . Ликвидация Helicobacter pylori и стабильность выбросов в B-клеточных лимфомах желудка низкой степени злокачественности из лимфоидной ткани, ассоциированной со слизистой оболочкой: результаты продолжающегося многоцентрового исследования. Cancer Res2000; 156: 125–33.
Fischbach W , Dragosics B, Kolve-Goebeler ME, и др. . Первичная В-клеточная лимфома желудка: результаты проспективного многоцентрового исследования. Гастроэнтерология 2000; 119: 1191–202.
- ↵
Ruskoné-Fourmestaux A , Lavergne A, Aegerter PH, и др. . Факторы прогнозирования регресса MALT-лимфомы желудка после лечения анти-Helicobacter pylori.Gut2001; 48: 297–303.
- ↵
Morgner A , Lehn N, Andersen LP, и др. . Связанная с Helicobacter heilmannii первичная желудочная лимфома MALT низкой степени злокачественности: полная ремиссия после излечения инфекции. Гастроэнтерология 2000; 118: 821–8.
- ↵
Ng WW , Lam CP, Chau WK, и др. . Регресс лимфомы лимфоидной ткани, ассоциированной со слизистой оболочкой желудка высокой степени злокачественности, вызванной Helicobacter pylori, после трехкратной антибактериальной терапии.Гастроинтест Endosc2000; 51: 93–6.
Morgner A , Miehlke S, Fischbach W, и др. . Полная ремиссия первичной B-клеточной лимфомы желудка высокой степени злокачественности после излечения от инфекции Helicobacter pylori. Дж. Клин Онкол, 2001; 19: 2041–8.
Falco-Jover G , Martinez-Egea A, Sanchez CJ, и др. . Регресс первичной B-клеточной лимфоидной ткани слизистой оболочки желудка (MALT) после эрадикации Helicobacter pylori.Ред. Эсп Энферм Dig1999; 91: 541–8.
Сеймур JF , Андерсон Р.П., Татхал П.С. Регресс лимфомы желудка на фоне терапии инфекции Helicobacter pylori. Энн Интерн Мед 1997; 127: 247.
Chen LT , Cheng AL, Shyu Ly, et al . Антихеликобактерная терапия при лимфоидной лимфоме желудка, ассоциированной со слизистой оболочкой, высокой степени злокачественности. Proc Am Soc Clin Oncol 1998; 17: 289A.
- ↵
Roggero E , Copie-Bergman C, Traulle C, и др. . Регресс В-клеточной лимфомы желудка высокой степени злокачественности после ликвидации инфекции Helicobacter pylori. Энн Онкол, 1999; 10: 67.
- ↵
Alkan S , Karcher DS, Newman MA, Cohen P. Регрессия MALT лимфомы слюнной железы после лечения Helicobacter pylori. Lancet1996; 348: 269.
- ↵
Nagashima R , Takeda H, Maeda K, et al .Регресс лимфомы лимфоидной ткани, связанной со слизистой двенадцатиперстной кишки, после эрадикации Helicobacter pylori. Гастроэнтерология 1996; 111: 1674–8.
- ↵
Fischbach W , Tacke W, Greiner A, и др. . Регресс иммунопролиферативного заболевания тонкого кишечника после эрадикации Helicobacter pylori. Lancet1997; 349: 31–2.
- ↵
Мацумото Т , Лида М., Симидзу М.Регресс лимфомы прямой кишки, связанной со слизистой оболочкой, после эрадикации Helicobacter pylori. Lancet1997; 350: 115–16.
- ↵
Исааксон PG . Желудочная лимфома MALT: от концепции до лечения. Энн Онкол, 1999; 10: 637–45.
Регулярно ешьте грецкие орехи, чтобы уменьшить негативные последствия инфекции H. pylori: Исследование | Здоровье
Новое исследование с использованием моделей мышей, распространенное в Журнале клинической биохимии и питания, рекомендует, чтобы регулярное потребление грецких орехов могло быть многообещающим средством для уменьшения негативных результатов, связанных с Helicobacter pylori (H.pylori), широко распространенной бактериальной инфекции, поражающей большую часть населения мира.
Используя модели мышей, исследователи из Исследовательского центра профилактики рака CHA в Корее обнаружили предварительные доказательства того, что диета, богатая грецкими орехами, может помочь защитить от негативных последствий, связанных с инфекцией H. pylori. В частности, исследование показало, что экстракты грецкого ореха, полученные из цельных грецких орехов, могут помочь создать защитные белки и противовоспалительные действия в кишечнике, которые могут защитить от H.pylori и приводит к раку у мышей. Исследование было поддержано Комиссией по орехам Калифорнии.
Распространенность H. pylori наиболее распространена в развивающихся странах, поскольку она, как правило, связана с социально-экономическим статусом и гигиеническими условиями и, как считается, передается от человека к человеку или даже через пищу и воду. Инфекция H. pylori является основной причиной язв желудка и тонкого кишечника, а также рака желудка и язвенной болезни. Хотя лечение в настоящее время доступно, существуют опасения по поводу растущей устойчивости бактерий к антибиотикам.
Из-за возрастающих проблем, связанных с устойчивостью к антибиотикам, исследователи изучали диетические и другие небактериальные подходы для улучшения воздействия инфекции H. pylori, как в этом новом исследовании.
Это не первый случай, когда грецкие орехи связывают со снижением риска развития рака желудочно-кишечного тракта у мышей. Два других исследования на животных, опубликованные в журнале Cancer Prevention Research and Nutrients, показали, что грецкие орехи в рационе могут подавлять развитие опухоли толстой кишки, изменяя кишечные бактерии, а также подавлять прогрессирование колоректального рака путем подавления ангиогенеза – развития новых кровеносных сосудов, которые облегчают рост кишечных бактерий. раковые клетки.
Исследования на животных важны для получения исходной информации и могут быть использованы в качестве основы для будущих исследований на людях. Основываясь на имеющихся данных, включая это исследование грецких орехов, диетические подходы к уменьшению симптомов инфекции H. pylori, таких как воспаление, представляются целесообразными для изучения в хорошо спланированном клиническом исследовании для подтверждения результатов.
Эта история была опубликована из ленты информационного агентства без изменений в тексте. Изменился только заголовок.Влияние инфекции Helicobacter pylori и различных компонентов H. pylori на пролиферацию и апоптоз эпителиальных клеток и фибробластов желудка
В течение H . pylori у человека, бактерии прикрепляются к эпителиальным клеткам желудка, вызывая дестабилизацию эпителиального барьера желудка, что приводит к развитию воспалительной реакции, связанной с инфильтрацией иммунокомпетентных клеток в ответ на ИЛ-6, ИЛ-8 и потенциально ИЛ-33 [50–51].Использование опытной модели H . Инфекция pylori у морских свинок позволяет нам изучить типичный результат H . pylori [52–53], главным образом потому, что морские свинки – единственные лабораторные животные, у которых структура желудка напоминает структуру человеческого органа. Более того, морские свинки склонны к развитию воспаления в ответ на секрецию IL-8, IL-6 и IL-33 эпителиальными и иммунокомпетентными клетками желудка [42, 53–54]. В нашем исследовании мы использовали модель in vivo экспериментальной морской свинки H . pylori и in vitro клеточных моделей первичных эпителиальных клеток желудка и фибробластов морских свинок, обработанных H . pylori или его растворимые компоненты для оценки эффекта H . pylori и разные H . pylori , влияющих на пролиферацию и апоптоз эпителиальных клеток и фибробластов желудка, а также на подвижность и прорегенеративный потенциал этих клеток.
Исследование на животных – реакция на экспериментальный
H . pylori инфекцияВ нашей модели статус H . pylori Инфекция через 7 и 28 дней инокуляции была подтверждена гистологическими, молекулярными и серологическими методами, как описано ранее [33]. Для гистологического анализа мы применили несколько принципов Сиднейской системы – классификации гастрита, введенной в 1990 г. и обновленной в 1995 г. [55]. Слизистая оболочка желудка морских свинок инокулирована H . pylori был колонизирован этими бактериями, как показано окрашиванием тканей по Гимзе и Вартин-Старри, которые использовались для визуализации HLO (рис. 1A). В желудочной ткани инфицированных, но не контрольных животных, последовательности cagA и ureC были обнаружены с помощью ПЦР как продукт из 294 пар оснований (п.н.) и продукт из 298 п.о. соответственно (рис. 1B) . В предыдущем исследовании на том же виде мы показали, что заражение морских свинок H . pylori сопровождалось усилением экспрессии муцина 5 (MUC5AC) и отложением детерминант Льюиса в слизистой оболочке желудка, особенно через 7 дней после инокуляции, что коррелировало с усиленной колонизацией тканей желудка бактериями [44]. Инфицированные животные ответили на бактерии производством анти- H . pylori IgM и IgG. Уровень анти- H . pylori IgM в образцах сыворотки животных было выше через 7 дней, чем через 28 дней после инокуляции, что указывает на острую инфекцию, тогда как животные через 28 дней после инокуляции показали более высокий уровень анти- H . pylori IgG, чем через 7 дней после инокуляции (рис. 1C i, ii) . Аналогично концентрация H . pylori антигенов в образцах стула животных было выше через 28 дней, чем через 7 дней после инокуляции, что подтвердило персистентность инфекции (рис. 1C iii). Гистопатологический анализ срезов ткани желудка, окрашенных гематоксилином и эозином, показал воспаление в ткани желудка в H . pylori -инфицированных животных (рис. 2A i). Инфекция сопровождалась значительной инфильтрацией гранулоцитов (Ly-6G-положительные клетки) в течение 7–28 дней после инокуляции, которая была сильнее через 28 дней (степень 3), чем через 7 дней (степень 2). (Рис. 2B i, II). Воспалительная реакция стала хронической через 28 дней после инокуляции, о чем свидетельствует инфильтрация лимфоцитов, которые располагались в основном в подслизистой оболочке (степень 3) (рис. 2A i). Однако через 7 дней после инокуляции было обнаружено большее количество CD4 + Т-лимфоцитов, чем CD8 + Т-лимфоцитов, тогда как через 28 дней после инокуляции количество CD8 + Т-лимфоцитов было выше, чем количество CD4 + Т-клеток (Рис. 2C i, ii и Рис 2D i, ii, соответственно) .Эти результаты указывают на вовлечение различных субпопуляций Т-лимфоцитов в течение инфекции. Ранее в vitro клеточных культур проводили с лимфоцитами из мезентериальных лимфатических узлов H . pylori -инфицированные морские свинки в присутствии растворимого H . pylori , лимфоциты, особенно CD4-положительные Т-клетки, интенсивно пролиферировали, что указывает на доминирование этой популяции лимфоцитов у инфицированных морских свинок через четыре недели после заражения [42].В том же исследовании мы проанализировали уровни мРНК для цитокинов, происходящих из моноцитов, таких как интерлейкин (IL) -8, IL-1α и интерферон гамма (IFN-γ), а также для цитокинов, полученных из лимфоцитов, включая трансформирующий фактор роста бета (TGF -β), в культурах клеток лейкоцитов, полученных из контрольных лимфатических узлов брыжейки, и H . pylori -инфицированные морские свинки [42]. В моноцитах как неинфицированных, так и инфицированных животных была обнаружена мРНК IL-8, тогда как мРНК для IL-1β была обнаружена только в моноцитах неинфицированных животных.МРНК TGF-β была обнаружена в лимфоцитах контроля и H . pylori -инфицированные морские свинки. Интересно, что значительно повышенный уровень мРНК для IFN-γ был обнаружен в лимфоцитах из H . pylori инфицировали по сравнению с неинфицированными животными и размножались в культурах клеток только в ответ на H . pylori , но не только в среде для культивирования клеток [42]. Эти результаты были совместимы с исследованием Kronsteiner et al.[56], которые показали, что H . Инфекция pylori у морских свинок вызвала преобладающий системный ответ, характеризующийся повышенным количеством T CD4-положительных лимфоцитов. Наши предварительные результаты на морских свинках через 60 дней после инокуляции H . pylori подтвердил сохранение хронической воспалительной реакции (неопубликованные данные). Ткань желудка неинфицированных животных не показала признаков усиленного воспаления (фиг. 2). Наши наблюдения из настоящего исследования развития воспалительного процесса в ответ на H . pylori соответствуют результатам, полученным другими группами, которые изучали развитие воспалительной реакции в слизистой оболочке желудка H . pylori -инфицированные морские свинки [33, 57–58]. Sjoredn et al. [59] выявили массивную инфильтрацию мононуклеарных клеток и эозинофилов в слизистой оболочке желудка морских свинок через 3 недели после инокуляции H . пилори . Sun et al. [60] показали H . pylori – индуцированный гастрит у монгольских песчанок, который был связан с дефектами желудочного барьера, распространяющимися из антрального отдела в тело с течением времени.
Рис. 1. Гистологическая, серологическая и молекулярная оценка H . pylori на экспериментальной модели морской свинки.
(A) Репрезентативные изображения срезов ткани желудка, полученные от морских свинок, неинфицированных или инфицированных H . pylori через 7 и 28 дней после инокуляции, окрашивают методом Гимзы и Вартина-Старри и визуализируют в световом микроскопе (YS100, Nikon, Япония). Красные стрелки и квадраты указывают местонахождение Helicobacter -подобных организмов (HLO). (B) Электрофоретическое разделение ureC и cagA H . pylori продукты амплификации гена с помощью полимеразной цепной реакции (ПЦР) образцов ткани желудка, выделенных из неинфицированных или H . pylori инфицированных морских свинок через 7 дней после инокуляции. Образцы обрабатывали в 1,4% агарозном геле в присутствии маркера размером (M) 100 п.н. и контролей: (C [+] – положительный контроль – H . ДНК pylori , выделенная из H . pylori суспензия при плотности 1х10 8 КОЕ / мл, C [-] – отрицательный контроль, реакционная смесь без ДНК). ( i ) Отсутствие продуктов амплификации генов cagA и ureC в образцах ткани желудка, выделенных от контрольных животных. ( ii ) Наличие ДНК (продуктов амплификации) для CagA (ген cagA – 298 п.н.) и UreC (амплификация гена ureC – 294 п.н.) в образцах ткани желудка, выделенных от животных, инфицированных H . пилори . (C) Серологические методы определения сывороточного уровня анти- H . pylori IgM ( i ), анти- H . pylori IgG ( ii ) и H . pylori антигенов ( iii ) в образцах стула морских свинок, не инфицированных или инфицированных H . pylori через 7 и 28 дней после инокуляции. Были исследованы пять животных на группу для контроля и 5 животных на группу для инфицированных животных (через 7 и 28 дней после инокуляции, 5 + 5).Результаты представлены в виде средних значений четырех независимых экспериментов, проведенных в трех экземплярах для каждого экспериментального варианта. Статистический анализ проводился с помощью непараметрического критерия Краскела-Уоллиса. Статистическая значимость * P <0,05, ** P <0,01, *** P <0,001 была получена для H . pylori инфицированных животных (через 7 и 28 дней после инокуляции) против контрольных животных; Н . pylori инфицированных животных через 7 дней против животных через 28 дней после последней инокуляции.
https://doi.org/10.1371/journal.pone.0220636.g001
Рис. 2. Инфильтрация слизистой оболочки желудка морской свинки воспалительными клетками в ответ на H . pylori инфекция.
(A) Репрезентативные изображения окрашивания гематоксилином и эозином (H&E) ткани желудка морских свинок, неинфицированных (n = 5) или инфицированных экспериментально H . pylori через 7 дней (n = 5) и 28 дней после инокуляции (n = 5) сфотографировали в световом микроскопе (YS100 Nikon, Япония).Желтые квадраты показывают инфильтрацию воспалительных клеток. (B) Репрезентативные изображения нейтрофилов (маркер Ly-6G, FITC – зеленый) в ткани желудка неинфицированных (n = 5) и H . pylori инфицированных животных (через 7 и 28 дней после инокуляции, n = 5 + 5). Ядра клеток контрастировали DAPI (синий). Срезы тканей фотографировали в конфокальном микроскопе (LeicaTCS SP) при длинах волн: возбуждение FITC 495 нм и испускание 519 нм; DAPI возбуждение 345 нм и излучение 455 нм. (C) Репрезентативные изображения лимфоцитов CD4 + (FITC – зеленый) в ткани желудка неинфицированных (n = 5) и H . pylori инфицированных животных (через 7 и 28 дней после инокуляции, n = 5 + 5). Ядра клеток контрастировали DAPI (синий). Срезы тканей фотографировали в конфокальном микроскопе (LeicaTCS SP) при длинах волн: возбуждение FITC 495 нм и испускание 519 нм; DAPI возбуждение 345 нм и излучение 455 нм. (D) Репрезентативные изображения лимфоцитов CD8 + (FITC – зеленый) в ткани желудка неинфицированных (n = 5) и H . pylori инфицированных животных (через 7 и 28 дней после инокуляции, n = 5 + 5). Ядра клеток контрастировали DAPI (синий). Срезы тканей фотографировали в конфокальном микроскопе (LeicaTCS SP) при длинах волн: возбуждение FITC 495 нм и испускание 519 нм; DAPI возбуждение 345 нм и излучение 455 нм. (i) Интенсивность флуоресценции Ly6G, CD4 + и CD8 + положительных клеток в ткани желудка неинфицированных (n = 5) и H . pylori инфицированных животных (7 и 28 дней после инокуляции, n = 5 + 5), измеренные в программе Image J версии 1.48v (Национальный институт здоровья, США). Результаты представлены в виде средних значений четырех независимых экспериментов, проведенных в трех экземплярах для каждого экспериментального варианта. Статистический анализ проводился с помощью непараметрического критерия Краскела-Уоллиса. Статистическая значимость * P <0,05, ** P <0,01, *** P <0,001 была получена для H . pylori инфицированных животных (через 7 и 28 дней после инокуляции) против контрольных животных; Н . pylori инфицированных животных через 7 дней против животных через 28 дней после последней инокуляции.
https://doi.org/10.1371/journal.pone.0220636.g002
Важно отметить, что окислительный стресс, вызванный H . pylori компонентов или эндогенных факторов могут вносить вклад в патофизиологические и гистопатологические изменения, включая аутофагию и апоптоз, приводящие к гастриту и даже развитию рака [61]. В нашем исследовании модель H . pylori -индуцированная воспалительная реакция в слизистой оболочке желудка инфицированных животных была связана с увеличением окислительного стресса, более значимо через 7 дней, чем через 28 дней после инокуляции, что мы оценили путем мониторинга перекисного окисления липидов в ткани желудка (обнаружение 4HNE) ( Фиг.3A) и концентрация MPO (Фиг.3B). Самый высокий уровень 4HNE наблюдался у животных, инфицированных H . pylori через 7 дней после инокуляции и оставался на повышенном уровне через 28 дней, хотя он был ниже, чем через 7 дней после инокуляции. Это может указывать на инициирование антиоксидантного ответа хозяина. Повышенная концентрация МПО была обнаружена в желудочной ткани инфицированных животных. Он был выше через 28, чем через 7 дней после инокуляции, что соответствовало увеличению количества гранулоцитов в эпителии желудка в ходе инфекции.
Рис. 3. Обнаружение 4HNE, MPO и MMP-9 в ткани желудка H . pylori инфицированных морских свинок.
(A) Оценка окислительного стресса в ткани желудка морских свинок, неинфицированных или инфицированных H . pylori через 7 и 28 дней после инокуляции в зависимости от присутствия 4-гидроксиноненала (4HNE). ( i ) Интенсивность флуоресценции 4HNE в ткани желудка, измеренная с использованием программного обеспечения Image J версии 1.48v (Национальный институт здоровья, США). (ii) Репрезентативные изображения 4HNE в ткани желудка, визуализированные в конфокальном микроскопе (LeicaTCS SP) при длинах волн: возбуждение FITC 495 нм и излучение 519 нм; DAPI возбуждение 345 нм и излучение 455 нм. (B) Уровень миелопероксидазы (МПО) в гомогенатах ткани желудка морских свинок, неинфицированных или инфицированных H . pylori через 7 и 28 дней после инокуляции. (C) Уровень металлопротеиназы (MMP-9) в гомогенатах ткани желудка (i) или сыворотке (ii) морских свинок, неинфицированных или инфицированных H . pylori через 7 и 28 дней после инокуляции. Были исследованы пять животных в группе для контроля и по 5 животных в группе для инфицированных особей (через 7 и 28 дней после инокуляции, n = 5 + 5). Результаты представлены в виде средних значений с диапазоном из четырех независимых экспериментов, выполненных в трех экземплярах для каждого экспериментального варианта. Статистический анализ проводился с помощью непараметрического критерия Краскела-Уоллиса. Статистическая значимость * P <0,05, ** P <0,01, *** P <0,001 была получена для H . pylori инфицированных животных (через 7 и 28 дней после инокуляции) против контрольных животных; Н . pylori инфицированных животных через 7 дней против животных через 28 дней после последней инокуляции.
https://doi.org/10.1371/journal.pone.0220636.g003
Из-за инфильтрации слизистой оболочки желудка нейтрофилами в течение H . pylori , мы оценили локальную и системную концентрации MMP-9 (рис. 3C). Эта матриксная металлопротеиназа доставляется в основном активированными гранулоцитами, ферментативная активность которых и секреция активных форм кислорода усиливают окислительный стресс в воспалительной среде, а также эпителиальными и эндотелиальными клетками в ответ на различные стимулы [62–63]. В нашем предыдущем исследовании (неопубликованные данные) мы показали корреляцию между повышенной концентрацией ММП-9 в сыворотке крови и H . pylori инфекция у взрослых пациентов с гастритом или ишемической болезнью сердца.В этом исследовании концентрацию MMP-9 оценивали в гомогенатах ткани желудка или в сыворотке H . pylori -инфицированные или неинфицированные морские свинки (рис. 3C i, ii). Он был значительно выше в ткани желудка инфицированных животных через 7 дней после инокуляции, чем у неинфицированных животных, и увеличивался еще через 28 дней после инокуляции. С другой стороны, уровень ММР-9 в сыворотке инфицированных животных значительно увеличился через 28 дней, тогда как через 7 дней он оставался на уровне контроля (неинфицированные животные) (рис. 3C ii). Наши результаты показывают, что уровень MMP-9 увеличивался сначала локально, а затем системно. MMP-9 катализирует нормальный оборот макромолекул внеклеточного матрикса (ECM) и может играть важную роль в процессах репарации. Это также подтвержденный проапоптотический фактор и регулятор клеточного цикла [64].
У человека, H . Инфекция pylori может изменять морфологию эпителиальных клеток, вызывая нарушение плотных контактов, индукцию продукции цитокинов, пролиферацию эпителиальных клеток и увеличение гибели эпителиальных клеток через апоптоз [65–66].В нашем исследовании мы использовали тест TUNEL, чтобы показать скорость апоптоза в слизистой оболочке желудка исследуемых животных. Наши результаты показали повышенное количество клеток, подвергающихся апоптозу, в слизистой оболочке желудка морских свинок, инфицированных H . pylori по сравнению с неинфицированными животными. Через 7 дней в желудочной ткани инфицированных животных было обнаружено больше апоптотических клеток, чем через 28 дней после инфицирования (рис. 4A i, ii), , что было совместимо с повышенной экспрессией антиапоптотического белка Bcl-xL в ткани желудка. через 28 дней (Рис. 4B i, ii) .Наше наблюдение апоптоза клеток в анализе TUNEL было дополнительно подтверждено обнаружением повышенного уровня расщепленной проапоптотической каспазы 3, который был более выраженным через 7 дней, чем через 28 дней (рис. 4C i, ii) . Тяжесть апоптотических изменений в ткани желудка может быть ответом на сильное воспаление, особенно во время острой фазы инфекции (в нашем исследовании, через 7 дней после последней инокуляции), чтобы защитить эпителий желудка от неблагоприятных последствий воспалительной реакции.Запрограммированная гибель клеток может уменьшить микробную инфекцию, отделить инфицированные клетки от неинфицированных и предупредить иммунную систему хозяина об опасных сигналах и повышении уровня медиаторов воспаления [67]. Апоптотические клетки могут индуцировать выработку противовоспалительных медиаторов, таких как трансформирующий фактор роста (TGF), простагландин E2 и фактор активации тромбоцитов макрофагами [68]. Многие факторы, включая инфекционные агенты и их компоненты, а также сигнальные белки нескольких сигнальных путей, активируемых во время процесса воспаления, участвуют в регуляции апоптоза клеток.Обычно клиренс апоптотических клеток макрофагами и эпителиальными клетками подавляет воспалительную реакцию; однако H . pylori демонстрируют способность снижать фагоцитарную активность нейтрофилов и макрофагов с использованием различных стратегий [19–20, 69]. Это нарушение может приводить к нарушению клиренса апоптотических клеток и удлинению воспалительного ответа, что впервые было показано при заболеваниях легких [70]. Bimczok et al. [71] выявили, что эпителиальные клетки претерпевают апоптоз в ответ на живые H . pylori не элиминировались мононуклеарными фагоцитами желудка человека, даже несмотря на то, что они находились под влиянием TNF-α, высвобождаемого макрофагами и высоко экспрессируемого в H . pylor- инфицированной слизистой оболочки желудка по сравнению с контрольными клетками [71]. В настоящем исследовании интенсивная инфильтрация слизистой оболочки желудка H . pylori -инфицированные лимфоцитами животные могут указывать на их роль в апоптозе эпителиальных клеток желудка, что также предполагалось другими авторами [72–73].
Рис. 4. Интенсивность апоптоза и пролиферации в ткани желудка морских свинок, инфицированных H . пилори .
(A) Уровень апоптоза оценивали в ткани желудка морских свинок, неинфицированных или инфицированных H . pylori через 7 и 28 дней после инокуляции. (i) Интенсивность флуоресценции апоптотических клеток, обнаруженных в ткани желудка с помощью анализа TUNEL и окрашенных DAPI, измеряли с использованием программного обеспечения Image J версии 1.48v (Национальный институт здоровья, США). (ii) Репрезентативные изображения срезов ткани желудка, окрашенных с помощью анализа TUNEL, контрастированных с помощью DAPI и сфотографированных в флуоресцентном микроскопе (Axio Scope A1, Zeiss, Германия) при длинах волн: 550 нм (возбуждение) и 590 нм (излучение) для TUNEL и 345 нм (возбуждение), 455 нм (излучение) для DAPI. (B) Уровень интенсивности антиапоптотического действия Bcl-xL в ткани желудка морских свинок, неинфицированных или инфицированных H . pylori через 7 и 28 дней после инокуляции. (i) Интенсивность флуоресценции Bcl-xL в ткани желудка измеряли с использованием программного обеспечения Image J версии 1.48v (Национальный институт здравоохранения, США). (ii) Репрезентативные изображения Bcl-xL в ткани желудка, сфотографированные в конфокальном микроскопе (LeicaTCS SP). DAPI использовали для окрашивания ядер. (C) Уровень интенсивности расщепленной проапоптотической каспазы 3 (CC3) в ткани желудка морских свинок, неинфицированных или инфицированных H . pylori через 7 и 28 дней после инокуляции. (i) Интенсивность флуоресценции CC3 в ткани желудка измеряли с использованием программного обеспечения Image J версии 1.48v (Национальный институт здравоохранения, США). (ii) Репрезентативные изображения CC3 в ткани желудка, сфотографированные в конфокальном микроскопе (LeicaTCS SP). DAPI использовали для окрашивания ядер. (D) Уровень Ki-67 (маркер пролиферации) в ткани желудка морских свинок, неинфицированных или инфицированных H . pylori через 7 и 28 дней после инокуляции. (i) Клеточная пролиферация, выраженная как индекс мечения (LI%), указывающий на долю Ki-67-положительных клеток (коричневые меченые клетки) ко всем эпителиальным клеткам, подсчитанную с использованием программы Image J. (ii) Репрезентативные изображения ткани желудка, окрашенные на Ki67. Черные стрелки показывают положительные по Ki-67 клетки. Были исследованы пять животных в группе для контроля и 10 животных в группе для инфицированных особей (n = 5 + 5).Результаты представлены в виде средних значений четырех независимых экспериментов, проведенных в трех экземплярах для каждого экспериментального варианта. Статистический анализ проводился с использованием непараметрических критериев U Манна-Уитни и Крускала-Уоллиса. Статистическая значимость * P <0,05, ** P <0,01, *** P <0,001 была получена для H . pylori инфицированных животных (через 7 и 28 дней после инокуляции) против контрольных животных; Н . pylori инфицированных животных через 7 дней против животных через 28 дней после последней инокуляции.
https://doi.org/10.1371/journal.pone.0220636.g004
Потеря эпителиальных клеток в ткани желудка в течение H . Инфекция pylori требует усиления пролиферативной активности эпителиальных клеток желудка. В этом исследовании белок Ki-67 был маркером пролиферации клеток в ткани желудка контрольных или инфицированных животных. Наши результаты показали, что эпителиальные клетки пролиферируют более интенсивно в хронической фазе инфекции, что свидетельствует о прорегенеративном потенциале этих клеток (рис. 4C i, ii) .Однако повышенная активность пролиферации эпителиальных клеток желудка в ответ на H . pylori может увеличивать риск мутаций, которые могут иметь отношение к развитию рака желудка [74].
Клеточное исследование – реакция на растворимые компоненты
H . пилориН . pylori бактерии являются источником множества растворимых или связанных с клеточной поверхностью вирулентных факторов, которые, связываясь с клетками-хозяевами, влияют на развитие болезни [22,75–76].Мы использовали первичные эпителиальные клетки желудка и фибробласты для изучения in vitro эффектов хорошо охарактеризованного H . pylori антигенов, таких как GE, CagA, UreA и LPS, при условии барьера эпителиальных клеток. Важно отметить, что оба типа клеток, использованных в экспериментах, были получены от морской свинки, что сделало модель более подходящей для модели in vivo для H . pylori , использованная в этом исследовании. Фибробласты, присутствующие в субэпителиальной слизистой оболочке, могут быть нацелены на H . pylori соединений, которые проникают через эпителиальные поражения или переносятся туда через эпителий [77]. Кроме того, фибробласты участвуют в процессе заживления ран и воспаления, отвечая на провоспалительные цитокины [78–79]. Наши результаты показали значительное увеличение 4HNE из-за перекисного окисления липидов в первичных эпителиальных клетках желудка, а также в фибробластах в ответ на стимуляцию H . pylori компоненты (рис. 5A i, ii и рис 5B i, ii) .Интересно, что уровень 4HNE в эпителиальных клетках желудка при стимуляции H . pylori LPS был почти таким же интенсивным, как и ответ на E . coli эндотоксин (положительный контроль). Более того, повышенное количество 4HNE в эпителиальных клетках желудка и фибробластах стимулировалось H . pylori LPS происходило параллельно с высвобождением MMP-9 в супернатанты культур (фиг. 5C i, ii), , что также может потенциально отражаться in vivo .Однако не было значительного различия в концентрации MMP-9 между неинфицированными клетками и клетками, обработанными GE, CagA или UreA. Это может означать, что in vivo в течение H . pylori , MMP-9 может доставляться иммунокомпетентными клетками, инфильтрирующими слизистую оболочку желудка, особенно гранулоцитами.
Рис. 5. Детерминанты окислительного стресса в первичных эпителиальных клетках желудка и фибробластах морских свинок.
Оценка окислительного стресса, основанная на продукции 4HNE, оцененной в первичных эпителиальных клетках желудка ( A) и фибробластах ( B), не леченных или обработанных в течение 24 часов H . pylori антигены: экстракт глициновой кислоты (GE) (10 мкг / мл), белок цитотоксин-ассоциированного гена A (CagA) (1 мкг / мл), субъединица уреазы A (Ure A) (5 мкг / мл) и H . pylori (Hp) или E . coli (Ec) липополисахарид (LPS) (25 нг / мл). (i) Интенсивность флуоресценции 4HNE в эпителиальных клетках или фибробластах, измеренная с использованием программного обеспечения Image J версии 1.48v (Национальный институт здравоохранения, США). (ii) Репрезентативные изображения первичных эпителиальных клеток желудка и фибробластов, окрашенные на 4HNE и сфотографированные в флуоресцентном микроскопе (Axio Scope A1, Zeiss, Германия).DAPI использовали для окрашивания ядер. Желтые стрелки показывают локализацию 4HNE в клетках. (C) Продукция MMP-9 первичными эпителиальными клетками желудка (i) и фибробластами (ii) в ответ на H . pylori соединений, обнаруженных с помощью анализа ELISA. Результаты представлены в виде средних значений четырех независимых экспериментов, проведенных в трех экземплярах для каждого экспериментального варианта. Статистический анализ проводился с использованием непараметрического U-критерия Манна-Уитни со значимостью * P <0.05, ** P <0,01, *** P <0,001 получено для нестимулированных клеток по сравнению с клеток, обработанных H . pylori антигенов.
https://doi.org/10.1371/journal.pone.0220636.g005
Наши результаты, полученные с помощью анализа TUNEL, показали повышенное количество первичных эпителиальных клеток желудка (Рис. 6A, i, ii) и фибробластов (Рис. 6B i, ii) претерпевают апоптоз в ответ на лечение GE, CagA, UreA или LPS H . pylori , а ЛПС показал самую сильную проапоптотическую активность, аналогичную E . coli LPS. В культурах, обработанных H . pylori LPS или стандартный E . coli LPS, апоптоз был необратим, что подтверждается конденсацией хроматина и распадом ядер клеток при окрашивании DAPI (фиг. 6A iii, iv и фиг. 6B, iii, iv). В подтверждение нашего наблюдения, что H . pylori Компоненты активировали апоптоз обоих типов клеток, что было обнаружено с помощью окрашивания TUNEL, мы проанализировали расщепленную проапоптотическую каспазу 3 (CC3) и Bax, а также антиапоптотическую экспрессию Bcl-xL и Bcl-2 в клетках.Как показано на рис. , рис. 7A i, ii, и , рис. 7B, i, ii, , экспрессия антиапоптотического Bcl-xL снижалась, тогда как экспрессия проапоптотического CC3 увеличивалась в эпителиальных клетках желудка и фибробластах, обработанных H. . pylori компонентов. Поскольку эпителиальные клетки желудка и фибробласты стимулируются с помощью H . pylori LPS высвобождает значительное количество MMP-9 в культуральную среду, и этот фермент является общепризнанным индуктором апоптоза клеток [64], мы изучили его роль в H . pylori -индуцированная регуляция выживаемости клеток. Добавление экзогенного ММР-9 к культурам эпителиальных клеток желудка и фибробластов, которое проводили с H . pylori , что привело к более интенсивной продукции CC3, снижению экспрессии антиапоптотического Bcl-xL ( Рис. 8A и 8B) и антиапоптотического белка Bcl-2, а также к повышенной экспрессии проапоптотического Bax белок (Фиг.9A и 9B) . Pierzchalski et al. [80] предложил жить только H . pylori бактерий были способны вызывать каспазо-3-зависимый апоптоз в эпителиальных клетках желудка. Наши результаты показали не только необратимый апоптоз эпителиальных клеток желудка и фибробластов при воздействии H . pylori LPS, но также сниженная пролиферативная активность клеток, измеренная в анализе восстановления МТТ и радиоактивном анализе (Фиг.10A и 1B ), и уменьшенная миграция клеток в анализе царапин, предполагая его роль в том, что клетки не могут восстанавливать повреждение. (Рис. 11A и 11B).
Рис. 6. Определение интенсивности апоптоза в эпителиальных клетках желудка и фибробластах, обработанных H . pylori компонентов.
Апоптоз клеток, оцениваемый с помощью анализа TUNEL, и ядерное окрашивание с помощью DAPI оценивали в культурах клеток первичных эпителиальных клеток желудка (A) и фибробластов ( B) , нестимулированных или стимулированных в течение 24 часов бактериальными антигенами: экстракт глициновой кислоты ( GE) (10 мкг / мл), белок цитотоксин-ассоциированного гена A (CagA) (1 мкг / мл), субъединица уреазы A (Ure A) (5 мкг / мл) и H . pylori (Hp) или E . coli (Ec) липополисахарид (LPS) (25 нг / мл). (i) Интенсивность флуоресценции первичных эпителиальных клеток и фибробластов, окрашенных в анализе TUNEL и подсчитанных с использованием программного обеспечения Image J версии 1.48v (Национальный институт здравоохранения, США). (ii) Репрезентативные изображения первичных эпителиальных клеток или фибробластов, окрашенных в анализе TUNEL (красные ядра), сфотографированные в флуоресцентном микроскопе (Axio Scope A1, Zeiss, Германия) при длинах волн: 550 нм (возбуждение) и 590 нм (эмиссия) . (iii) Процент первичных эпителиальных клеток и фибробластов, окрашенных DAPI и указывающих на повреждение ДНК. (iv) Типичные изображения первичных эпителиальных клеток и фибробластов, окрашенных DAPI (синие ядра) и сфотографированных в флуоресцентном микроскопе (Axio Scope A1, Zeiss, Германия) при длинах волн: 345 нм (возбуждение), 455 нм (излучение). Желтые стрелки показывают распад хроматина. Результаты представлены в виде средних значений четырех независимых экспериментов, проведенных в трех экземплярах для каждого экспериментального варианта.Статистический анализ проводили в непараметрическом U-тесте Манна-Уитни со значимостью для * P <0,05, ** P <0,01, *** P <0,001, полученных для нестимулированных клеток по сравнению с клеток, обработанных H . pylori антигенов.
https://doi.org/10.1371/journal.pone.0220636.g006
Рис. 7. Bcl-xL и CC3 в эпителиальных клетках желудка и фибробластах, обработанных H . pylori компонентов.
Уровень антиапоптотического Bcl-xL и расщепленной проапоптотической каспазы 3 (CC3) в клеточных культурах первичных эпителиальных клеток желудка (A) и фибробластов (B) , нестимулированных или стимулированных в течение 24 часов бактериальными антигенами: глицином ацидный экстракт (GE) (10 мкг / мл), белок цитотоксин-ассоциированного гена A (CagA) (1 мкг / мл), субъединица уреазы A (Ure A) (5 мкг / мл), H . pylori (л.с.) и E . coli (Ec) липополисахарид (LPS) (25 нг / мл). Уровень интенсивности Bcl-xL (i) и CC3 (iii) в первичных эпителиальных клетках и фибробластах измеряли с использованием программного обеспечения Image J версии 1.48v (Национальный институт здравоохранения, США). Репрезентативные изображения первичных эпителиальных клеток и фибробластов, окрашенных на Bcl-xL (ii) и CC3 (iv) и сфотографированных в конфокальном микроскопе (LeicaTCS SP).DAPI использовали для окрашивания ядер и фаллоидин для окрашивания цитоскелета. Результаты представлены в виде средних значений четырех независимых экспериментов, проведенных в трех экземплярах для каждого экспериментального варианта. Статистический анализ проводили в непараметрическом U-тесте Манна-Уитни со значимостью для * P <0,05, ** P <0,01, *** P <0,001, полученных для нестимулированных клеток по сравнению с клеток, обработанных H . pylori антигенов.
https: // doi.org / 10.1371 / journal.pone.0220636.g007
Рис. 8. Bcl-xL и CC3 в клетках желудка при воздействии H . pylori компонентов и / или металлопротеиназы (ММП) -9.
Уровень антиапоптотического Bcl-xL и расщепленной проапоптотической каспазы 3 (CC3) в клеточных культурах первичных эпителиальных клеток желудка (A) и фибробластов (B) , нестимулированных или стимулированных в течение 24 часов с помощью экстракта глициновой кислоты (GE) (10 мкг / мл), MMP-9 (1 U– 7,5 нг / мл), MMP-9 (10 U– 75 нг / мл), MMP-9 (1 U– 7.5 нг / мл) + GE (10 мкг / мл) и MMP-9 (10 U– 75 нг / мл) + GE (10 мкг / мл). Уровень интенсивности Bcl-xL (i) и CC3 (iii) в первичных эпителиальных клетках и фибробластах измеряли с использованием программного обеспечения Image J версии 1.48v (Национальный институт здравоохранения, США). Репрезентативные изображения первичных эпителиальных клеток и фибробластов, окрашенных на Bcl-xL (ii) и CC3 (iv) и сфотографированных в конфокальном микроскопе (LeicaTCS SP). DAPI использовали для окрашивания ядер и фаллоидин для окрашивания цитоскелета.Результаты представлены в виде средних значений четырех независимых экспериментов, проведенных в трех экземплярах для каждого экспериментального варианта. Статистический анализ проводили в непараметрическом U-критерии Манна-Уитни со значимостью * P <0,05, ** P <0,01, *** P <0,001, полученными для нестимулированных клеток по сравнению с клеток, обработанных H . pylori антигенов.
https://doi.org/10.1371/journal.pone.0220636.g008
Рис. 9. Bax и Bcl -2 в клетках желудка, подвергнутых воздействию H . pylori компонентов и / или металлопротеиназы (MMP-9).
Уровень проапоптотического Bax и антиапоптотического Bcl-2 в клеточных культурах первичных эпителиальных клеток желудка (A) и фибробластов (B) , нестимулированных или стимулированных в течение 24 часов: мкг / мл), MMP-9 (1 U– 7,5 нг / мл), MMP-9 (10 U– 75 нг / мл), MMP-9 (1 U– 7,5 нг / мл) + GE (10 мкг / мл ) и MMP-9 (10 U– 75 нг / мл) + GE (10 мкг / мл). Уровень интенсивности Bax (i) и Bcl-2 (iii) в первичных эпителиальных клетках и фибробластах измеряли с использованием программного обеспечения Image J версии 1.48v (Национальный институт здоровья, США). Репрезентативные изображения первичных эпителиальных клеток и фибробластов, окрашенных на Bax (ii) и Bcl-2 (iv) и сфотографированных в конфокальном микроскопе (LeicaTCS SP). DAPI использовали для окрашивания ядер и фаллоидин для окрашивания цитоскелета. Результаты представлены в виде средних значений четырех независимых экспериментов, проведенных в трех экземплярах для каждого экспериментального варианта. Статистический анализ проводился с использованием непараметрического U-критерия Манна-Уитни со значимостью * P <0.05, ** P <0,01, *** P <0,001 получено для нестимулированных клеток по сравнению с клеток, обработанных H . pylori антигенов.
https://doi.org/10.1371/journal.pone.0220636.g009
Рис. 10. Общий рост эпителиальных клеток желудка и фибробластов, подвергшихся воздействию H . pylori компонентов.
Общий рост первичных эпителиальных клеток желудка ( A) и фибробластов ( B) нестимулированных или стимулированных бактериальными антигенами: экстракт глициновой кислоты (GE) (10 мкг / мл), белок гена A, ассоциированного с цитотоксином (CagA) (1 мкг / мл), субъединица уреазы A (Ure A) (5 мкг / мл) и H . pylori (Hp) или E . coli (Ec) липополисахарид (LPS) (25 нг / мл), обнаруженный на основе включения ( 3 H) -тимидина в клеточную ДНК (i) или анализа восстановления МТТ (ii). (i) Пролиферация первичных эпителиальных клеток желудка или фибробластов показана в виде графика, представляющего индекс стимуляции (SI), рассчитанный путем деления количеств радиоактивности (имп / мин / мин) для культур клеток в присутствии стимула на подсчеты для контрольные культуры клеток только в культуральной среде.Результаты представлены в виде среднего значения с диапазоном. Приведены результаты шести независимых экспериментов, проведенных в трех экземплярах для каждого варианта эксперимента. (ii) Восстановление соли МТТ первичными эпителиальными клетками и фибробластами показано в виде графика, представляющего средний процент клеток (нестимулированных и стимулированных антигенами H . pylori ), способных снижать МТТ. Данные представляют собой средние значения четырех независимых экспериментов, выполненных в трех экземплярах для каждого экспериментального варианта.Статистический анализ проводили в непараметрическом U-тесте Манна-Уитни со значимостью для * P <0,05, ** P <0,01, *** P <0,001, полученных для нестимулированных клеток по сравнению с клеток, обработанных H . pylori антигенов.
https://doi.org/10.1371/journal.pone.0220636.g010
Рис. 11. Эффективность миграции эпителиальных клеток желудка и фибробластов, подвергшихся воздействию H . pylori компонентов.
Миграция первичных эпителиальных клеток желудка (A) и фибробластов (B) , нестимулированных или обработанных: экстракт глициновой кислоты (GE) (10 мкг / мл), белок цитотоксин-ассоциированного гена A (CagA) (1 мкг / мл), субъединица уреазы A (Ure A) (5 мкг / мл), H . pylori (Hp) или E . coli (Ec) липополисахарид (LPS) (25 нг / мл) и обнаружен в анализе царапин. (i) Миграция первичных эпителиальных клеток и фибробластов показана в виде графика, представляющего слияние раны [%] (средний размер раны в зависимости от времени). Результаты представлены в виде средних значений четырех независимых экспериментов, проведенных в трех экземплярах для каждого экспериментального варианта. Статистический анализ проводился с использованием непараметрического U-критерия Манна-Уитни со значимостью * P <0.05, ** P <0,01, *** P <0,001 получено для нестимулированных клеток по сравнению с клеток, обработанных H . pylori антигенов (в зависимости от используемых стимуляторов). (ii) Фазово-контрастные микроскопические изображения царапин. Снимки были сделаны в указанные моменты времени, и степень закрытия раны показана для каждого варианта лечения (красные стрелки). Показаны репрезентативные изображения каждой временной точки для обоих типов клеток.
https: // doi.org / 10.1371 / journal.pone.0220636.g011
Ранее было показано, что патогенные эффекты H . pylori LPS были связаны с усилением экспрессии провоспалительных цитокинов слизистой оболочки желудка, избыточной продукцией оксида азота, снижением продукции регуляторных цитокинов и прекращением прогрессирования клеточного цикла и пролиферации клеток [45, 81–82]. Ли и др. [83] заметили, что LPS регулирует проапоптотическую экспрессию MMP-9 посредством передачи сигналов Toll-like (TLR) 4 / NF-κB, и Cho et al.[84] сообщили об индукции генов, связанных с апоптозом, в клетках карциномы человека с помощью H . pylori токсин VacA [83–84]. Этот токсин в основном секретируется H . pylori в желудочную среду; однако он также экспонируется на поверхности бактериальных клеток и присутствует в мембранных везикулах [76]. Ранее мы показали, что пролиферация лимфоцитов периферической крови человека ингибируется в присутствии антигенного комплекса из H . pylori G27 VacA + CagA-, но не из мутантного штамма G27 VacA-CagA- [85]. В настоящем исследовании эпителиальные клетки желудка и фибробласты стимулировались экстрактом глициновой кислоты из H . pylori CCUG 17874 VacA + CagA + штамм. Следовательно, возможно, что VacA может быть ответственным за определенные эффекты, продемонстрированные в этом исследовании. Однако необходимы дальнейшие исследования, чтобы выяснить участие VacA в регуляции MMP-9, а также в пролиферации и апоптозе эпителиальных клеток желудка.
В заключение, результаты, полученные с использованием модели in vivo морских свинок, экспериментально инфицированных H . pylori и in vitro клеточных моделей первичных эпителиальных клеток желудка морской свинки и фибробластов показали, что в течение H . pylori , растворимые факторы вирулентности этих бактерий, присутствующие в нише колонизации, могут вызывать апоптоз клеток и ингибирование пролиферации клеток в связи с воспалительным ответом и повышенным окислительным стрессом.Утрата клеток влияет на целостность и защитную функцию эпителиального барьера желудка. Н . pylori Компоненты потенциально могут проникать через желудочный барьер в базальную мембрану, где они могут влиять на прорегенеративную функцию фибробластов, поддерживая воспалительную реакцию и развитие патологических эффектов. Преодолевая барьеры из желудочной ткани, H . Компоненты pylori также могут влиять на иммунные клетки. Однако результаты клеточных экспериментов in vitro , в которых используются рекомбинантные белки, следует интерпретировать с осторожностью.Неясно, идентичны ли вызываемые ими эффекты эффектам, вызываемым живыми бактериями.
Наша группа и другие авторы ранее показали, что около H . pylori Компоненты , включая CagA или LPS, обладают отрицательными иммуномодулирующими свойствами, которые могут способствовать выживанию бактерий и длительной инфекции, что увеличивает риск язвенной болезни и развития рака [20, 23,43, 85–89]. Стоит подчеркнуть, что эффекты индивидуальные H . pylori компоненты могут быть разными. Следовательно, учитывая островную природу H . pylori , следует предположить, что соотношение между отдельными компонентами может иметь значительное влияние на их эффекты в месте колонизации. Сохранение воспалительной реакции вместе с одновременным увеличением скорости пролиферации эпителиальных клеток желудка может представлять риск неопластических изменений, особенно в воспалительной среде, вызванной H . pylori [90]. Транслокация H . pylori Соединения через пищеварительный тракт потенциально могут вызывать системные эффекты у хозяина в ответ на H . pylori инфекция.
.


