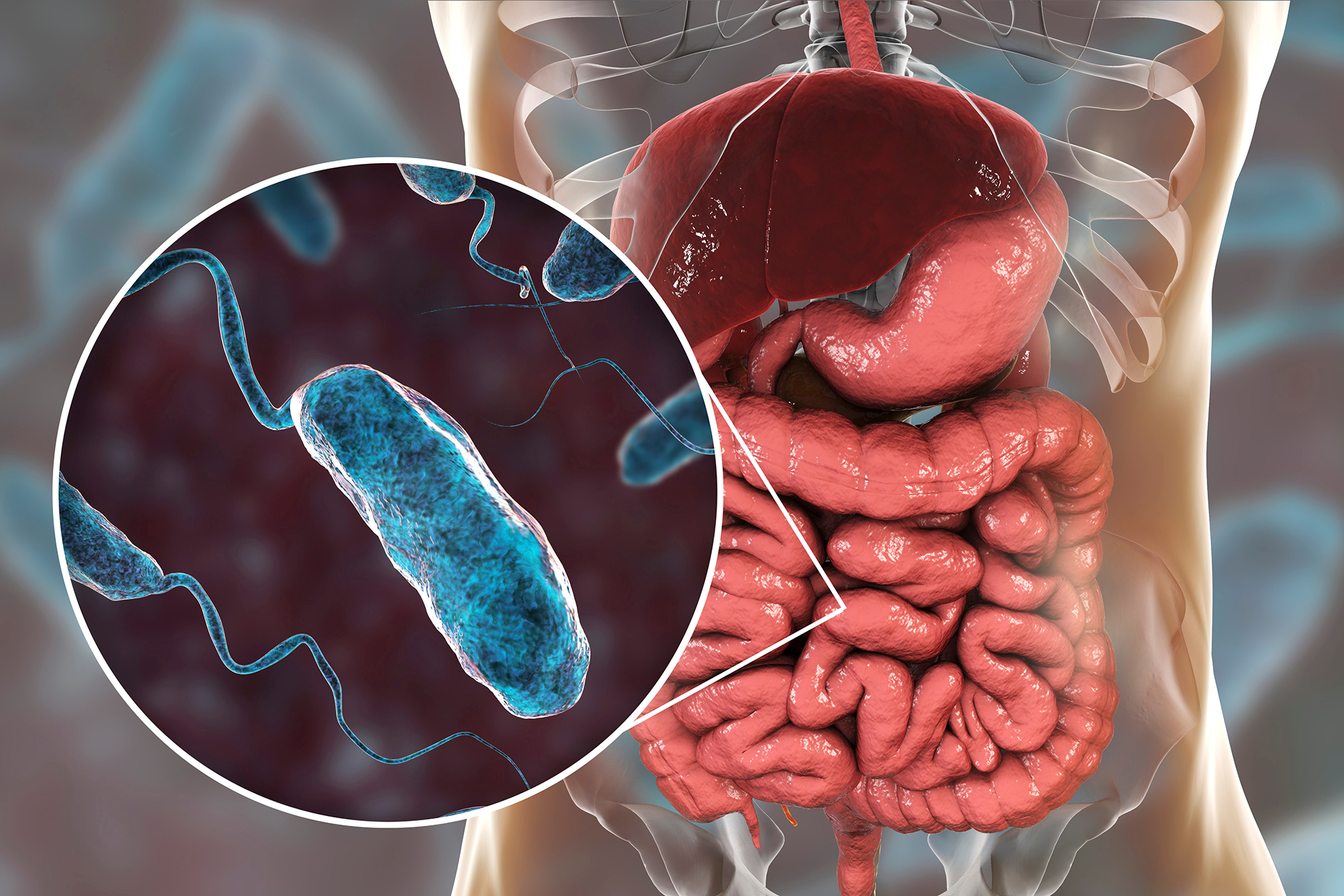
Инфекция в кишечнике: Кишечная инфекция
Кишечные инфекции
Среди многочисленных инфекционных болезней человека значительное место занимают кишечные инфекции (КИ). Практически каждый человек на земле за свою жизнь переболевает этими заболеваниями.
Что представляют собой кишечные инфекции?
Кишечные инфекции – это целая группа заразных заболеваний, которые повреждают, в первую очередь, пищеварительный тракт.
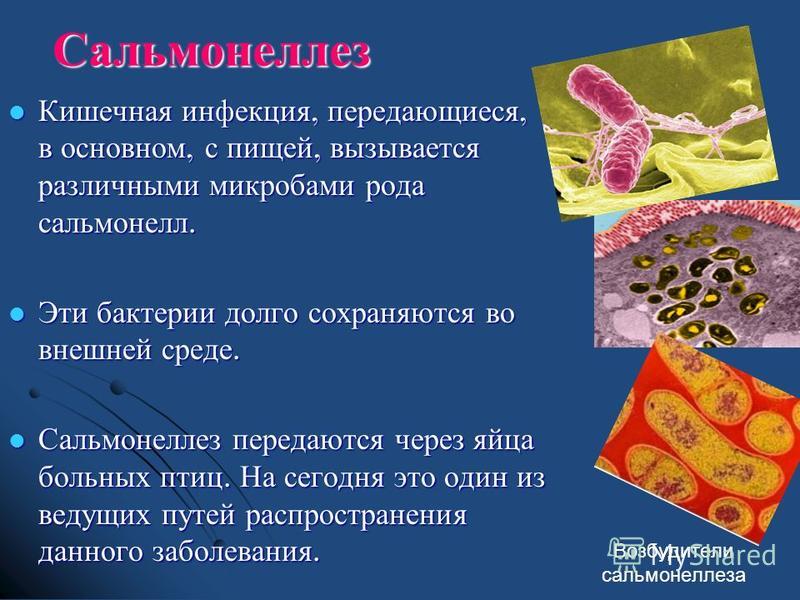
Всего таких заболеваний более 30. Самое «безобидное» из них – так называемое пищевое отравление, а самые опасные – холера, брюшной тиф, ботулизм, сальмонеллез, бруцеллез, дизентерия и др.
Пути заражения КИ
Возбудителями кишечных инфекций могут быть: бактерии (сальмонеллез, брюшной тиф, холера), их токсины (ботулизм), а также вирусы (энтеровирус, ротавирус) и т.д.
От больных и носителей инфекции микробы выделяются во внешнюю среду с испражнениями, рвотными массами, иногда с мочой. Практически все возбудители кишечных инфекций чрезвычайно живучи. Они способны подолгу существовать в почве, воде и даже на различных предметах.
В организм здорового человека возбудители кишечной инфекции попадают через рот:вместе с пищей, водой или из-за грязных рук. Например, дизентерия может начаться, если попить парное (некипяченое) молоко или поесть сделанную из него простоквашу, творог или сметану. Кишечную палочку можно «съесть» вместе с некачественным кефиром или йогуртом. Стафилококковая инфекция комфортно себя чувствует в испорченных тортах с кремом. Возбудители сальмонеллеза (а их известно около 400 видов) попадают к человеку через любые зараженные продукты: куриное мясо и яйца, вареную колбасу, сосиски, плохо промытые или вымытые грязной водой овощи и зелень.
Изо рта микробы попадают в желудок, а затем в кишечник, где начинают усиленно размножаться. После попадания микробов в организм наступает бессимптомный инкубационный период, продолжающийся, в большинстве случаев, 6-48 часов.
После попадания микробов в организм наступает бессимптомный инкубационный период, продолжающийся, в большинстве случаев, 6-48 часов.
Симптомы заболевания
В самом начале заболевания человека беспокоит слабость, вялость, снижение аппетита, головная боль, повышение температуры – симптомы, напоминающие обычное ОРЗ. Однако через некоторое время возникает тошнота, появляются схваткообразные боли в животе, понос с примесью слизи, гноя или крови (например, при дизентерии). Может беспокоить жажда и озноб.
Симптомы заболевания вызывают как сами микробы, так и выделяемые ими токсины. Кишечные инфекции могут протекать в виде острого гастрита (с рвотой с болями под ложечкой), энтерита (с поносом), гастроэнтерита (с рвотой и поносом), колита (с кровью в экскрементах и нарушением стула), энтероколита (с поражением всего кишечника).
Одно из самых неприятных последствий, возникающих при кишечных инфекциях, – обезвоживание организма вследствие рвоты и/или поноса. Результатом резкого обезвоживания могут стать почечная недостаточность и другие тяжелые осложнения, в частности, дегидратационный (связанный с потерей жидкости) шок.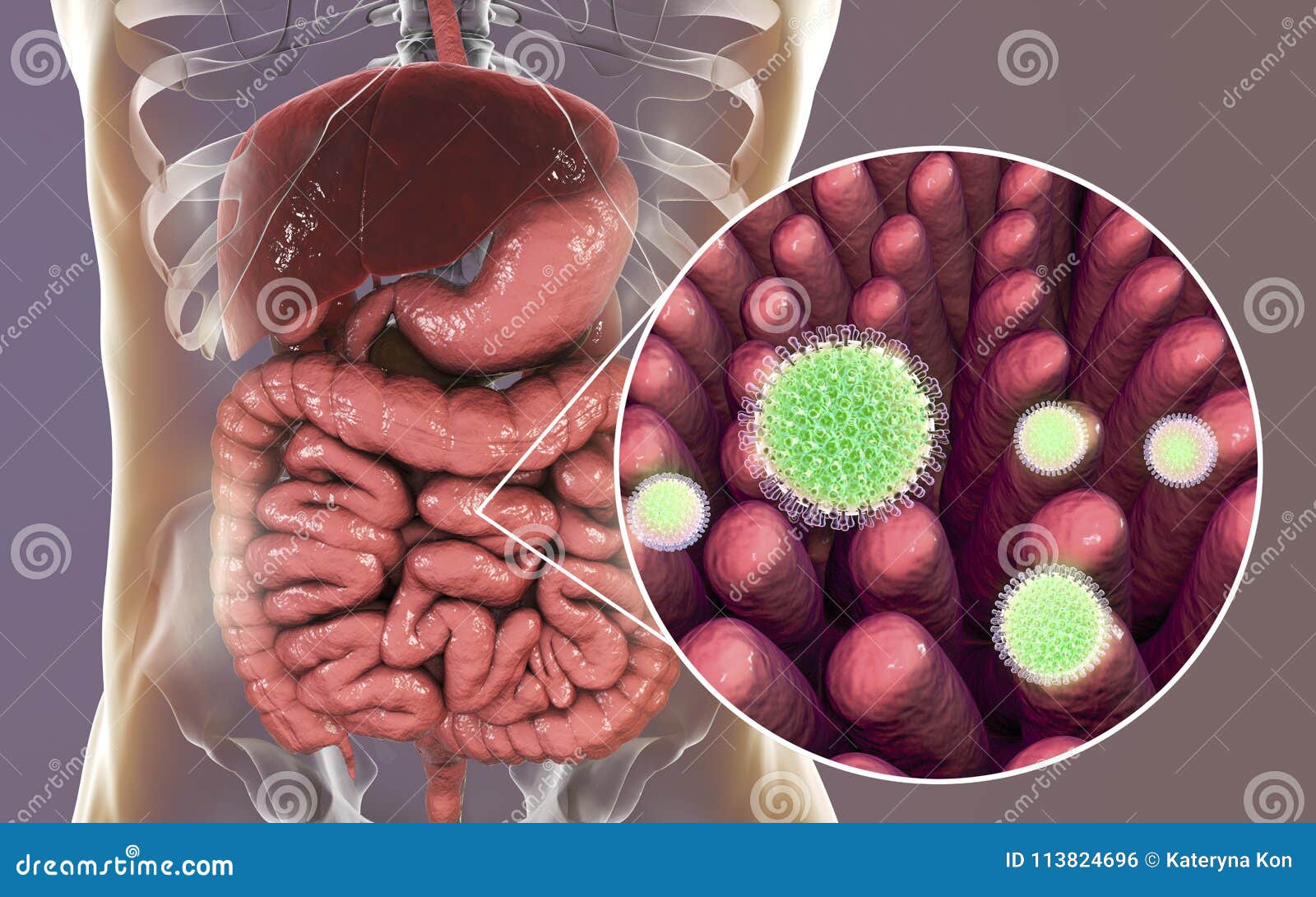
Диагностика и лечение КИ
Очень важно отличить кишечную инфекцию от других заболеваний со сходными симптомами: небактериального пищевого отравления (например, лекарствами), острого аппендицита, инфаркта миокарда, пневмонии, внематочной беременности и т.д.
При появлении симптомов, напоминающих острую кишечную инфекцию, необходимо обратиться к инфекционисту. Для того, чтобы правильно поставить диагноз, врач назначает бактериологическое исследование кала или рвотных масс. Дополнительно могут применяться серологические методы диагностики (для выявления антител к возбудителям инфекции).
Лечение кишечных инфекций является комплексным и включает в себя: борьбу с микробными ядами, самими микробами, а также с обезвоживанием организма. Кроме того, больные должны соблюдать правильную диету и с помощью специальных препаратов восстанавливать нормальную микрофлору кишечника.
Меры профилактики и защиты
Кишечными инфекциями можно заболеть в любое время года. Но особенно резко возрастает их количество в летний период в связи с пренебрежениями мерами безопасности и небрежным отношением самих граждан к своему здоровью.
Чтобы уберечься от заболеваний кишечными инфекциями нужно соблюдать следующие правила:
- Не использовать сырую воду из открытых водоемов (река, пруд, ручей и т.д.), ее можно употреблять только после кипячения.
- Не использовать воду из источников, предназначенных для технических нужд.
- Водопроводную воду пить только после кипячения.
- Молочные продукты, купленные у частных владельцев, должны подвергаться термической обработке (молоко обязательно кипятить!), а лучше всего не покупать в неустановленных местах.
- Творог «домашнего» изготовления подвергать термической обработке, готовить из него оладьи, сырники, вареники и т.п.
- Хранить продукты питания в холоде, не допуская соприкосновения сырых и готовых продуктов и не более срока, указанного на этикетке.
- Фрукты, овощи, ягоды, цитрусовые перед употреблением тщательно мыть проточной водой, а лучше кипяченой. Хорошо промывать овощи для салатов после их очистки.

- Следить за чистотой рук! Обязательно мыть их перед приготовлением и приемом пищи, перед кормлением ребенка, после посещения туалета, прихода с улицы или работы.
- Не употреблять скоропортящиеся продукты, такие как вареная колбаса, салаты, винегреты, студни, кремовые изделия, которые более часа хранились вне холодильника.
Соблюдая эти простые правила, можно защитить себя и своих близких от угрозы возникновения кишечных инфекций.
Автор: Шаранова О.А. – зам.главного врача ГССМП
Редактор: Арский Ю.М.
Художественное оформление: Бибова Е.Г.
Ответственный за выпуск: Тарашкевич И.И.
Опасность острых кишечных инфекций в жаркий период
Вы знали, что острые кишечные инфекции наиболее опасны в жаркий период?
Елена Николаевна Абрамова, заведующая отделением кишечных инфекций ИКБ № 1, расскажет об особенностях течения этих заболеваний, и как можно избежать заражения данными инфекциями.
Острые кишечные инфекции (ОКИ) – это заболевания желудочно-кишечного тракта, вызываемые различными бактериями, вирусами или простейшими паразитами, и которые сопровождаются интоксикацией, болями в животе, жидким стулом и рвотой. К таким инфекциям относятся: дизентерия, сальмонеллезы, брюшной тиф, холера, иерсиниозы, пищевые токсикоинфекции и вирусные диареи (ротавирусная и норовирусная инфекции).
ОКИ имеют значительное распространение в летне-осенний период. Заболеваемость увеличивается в связи с повышенным употреблением овощей, фруктов и других продуктов, которые иногда забываем или недостаточно тщательно моем. Летом мы чаще пьем некипяченую воду, открывается купальный и пляжный сезон. Не стоит забывать, что инфекция может передаться через воду в водоемах.
Ввиду повышенной температуры воздуха летом, повышается риск порчи различных продуктов. Заражение людей ОКИ происходит при попадании возбудителя в организм человека через рот, а именно, при приеме в пищу продуктов питания, инфицированных возбудителями инфекции, употреблении воды из неизвестных источников и не подвергавшейся обеззараживанию.
Нельзя употреблять в пищу еду с истекшим сроком годности или скоропортящиеся продукты, которые длительное время хранились не в холодильнике.
Необходимо соблюдать правила личной гигиены. Достаточно помыть руки, чтобы избежать инфицирования через рукопожатия и различные предметы обихода, т.к. микроорганизмы весьма устойчивы к внешней среде. Перед приготовлением еды и приемом пищи руки тоже нужно помыть.
На кухне должна соблюдаться идеальная чистота. При разделке различных видов продуктов используйте отдельные ножи и доски. Тщательно мойте все поверхности и предохраняйте кухню и продукты от насекомых, грызунов и других животных. Своевременно удаляйте пищевые отходы.
Соблюдайте правила приготовления и хранения продуктов. После остывания приготовленной еды, храните ее в закрытой посуде с температурой не выше 5°С, но не долго. Пищу для детей лучше не подвергать хранению и употреблять сразу.
Пищу для детей лучше не подвергать хранению и употреблять сразу.
Клиническая картина кишечных инфекций зависит от возбудителя заболевания. Инкубационный период варьирует от нескольких часов при пищевой токсикоинфекции до нескольких дней при сальмонеллёзе и дизентерии. Основные симптомы, на которые необходимо обратить внимание: общая вялость, слабость, плохой аппетит. Чуть позже наступает рвота, диарея, боли в животе, возможна высокая температура, озноб. Наряду с поражением кишечника могут отмечаться изменения со стороны верхних дыхательных путей. С рвотой и жидким стулом организм обезвоживается, что представляет опасность для работы сердечно-сосудистой системы и почек.
При возникновении симптомов острой кишечной инфекции необходимо немедленно обратиться за медицинской помощью. Проявления кишечных инфекций могут быть схожи с симптомами острой хирургической патологии, например аппендицит или острый панкреатит – правильный диагноз может поставить только врач.
| Профилактика кишечных инфекций
Наибольший подъем заболеваемости кишечными инфекциями наблюдается в летне-осенний период, что связано с массовыми выездами на дачи, употреблением овощей и фруктов, расширением уличной торговли скоропортящимися продуктами, купанием в открытых водоемах. Возбудители острых кишечных инфекций могут находиться на поверхностях различных предметов, овощах, ягодах, фруктах. К кишечным инфекциям относятся дизентерия, сальмонеллез, брюшной тиф, паратифы А и Б, холера, гастроэнтерит, пищевые токсикоинфекции, вирусный гепатит А, вирусные кишечные инфекции (аденовирус, ротавирус, норовирус, астро вирус и т. д.). Основными проявлениями заболевания кишечными инфекциями, на которые следует обращать внимание, являются слабость, вялость, плохой аппетит, диарея, рвота, боли в животе, повышение температуры и появление озноба. Для всех этих заболеваний характерным является проникновение возбудителей через рот и размножение их в кишечнике человека, откуда они с выделениями вновь попадают во внешнюю среду: почву, воду, на различные предметы и продукты питания. Возбудители кишечных инфекций обладают высокой устойчивостью во внешней среде, сохраняя свои болезнетворные свойства в течение от нескольких дней до нескольких недель и даже месяцев. Еще более устойчивы во внешней среде патогенная кишечная палочка, возбудители брюшного тифа, вирусного гепатита, вирусы. В передаче возбудителей могут участвовать несколько основных факторов: вода, пищевые продукты, почва, предметы обихода, живые переносчики (например, насекомые) и т.д. В пищевых продуктах возбудители кишечных инфекций не только сохраняются, но и активно размножаются, не меняя при этом внешнего вида и вкуса продукта. Источником заражения кишечными инфекциями является человек – больной или бактерионоситель (практически здоровый человек, в организме которого находятся возбудители кишечных инфекций). Восприимчивость людей к кишечным инфекциям довольно высокая. Особенно подвержены им дети. В условиях несоблюдения мер общественной и личной гигиены кишечные инфекции проявляют высокую контагиозность, могут быстро распространяться среди окружающих больного (бактерионосителя) лиц и вызывать массовые заболевания людей. Опасность заражения кишечными инфекциями представляют продукты (блюда из них), употребляемые в холодном виде, без тепловой обработки, т.к. микробы в ней не только хорошо сохраняются, но и размножаются. В этом плане большую опасность представляют собой кремово- кондитерские изделия, салаты, винегреты, молоко, масло, другие пищевые продукты (особенно те, которые не подлежат термической обработке). Одним из факторов заражения и распространения кишечных инфекций является вода. Опасность заражения кишечными инфекциями представляет употребление для питья, мытья посуды, рук, овощей и фруктов воды открытых водоемов, талой воды. Заражение может произойти при купании в открытых водоемах. К заражению кишечными инфекциями может привести употребление воды из колодца, если колодец неправильно построен или неправильно используется. Через воду могут распространяться холера, брюшной тиф, дизентерия, сальмонеллезы, вирусный гепатит “А” (или болезнь Боткина) и др. Предметы домашнего обихода тоже могут содержать возбудителей различных заболеваний, особенно если в семье есть больной (или носитель) какого- либо заболевания. Это посуда, через которую могут передаваться кишечные инфекции, игрушки для детей, полотенца. Профилактика кишечных инфекций включает простые правила гигиены:
Несвоевременное обращение за медицинской помощью может отрицательно сказаться на здоровье и привести к заражению окружающих. Все мы обязаны заботиться о своем здоровье. При обнаружении у себя того, или иного инфекционного заболевания необходимо срочно обратиться к врачу. Не занимайтесь самолечением! Многие заболевания, например – дизентерия и сальмонеллез, в результате самолечения могут приобрести хронический характер. По данным сайта www.rospotrebnadzor.ru |
Мирнинская центральная районная больница | Кишечные инфекции
Самыми распространенными кишечными инфекциями являются дизентерия, сальмонеллез, холера, ротавирус, энтеровирус, а также пищевая токсикоинфекция, которая спровоцирована стафилококком. Болезни этой группы достаточно распространены и уступают по количеству случаев заражения лишь респираторным заболеваниям. Основная масса заболевших – это дети от года до шести лет.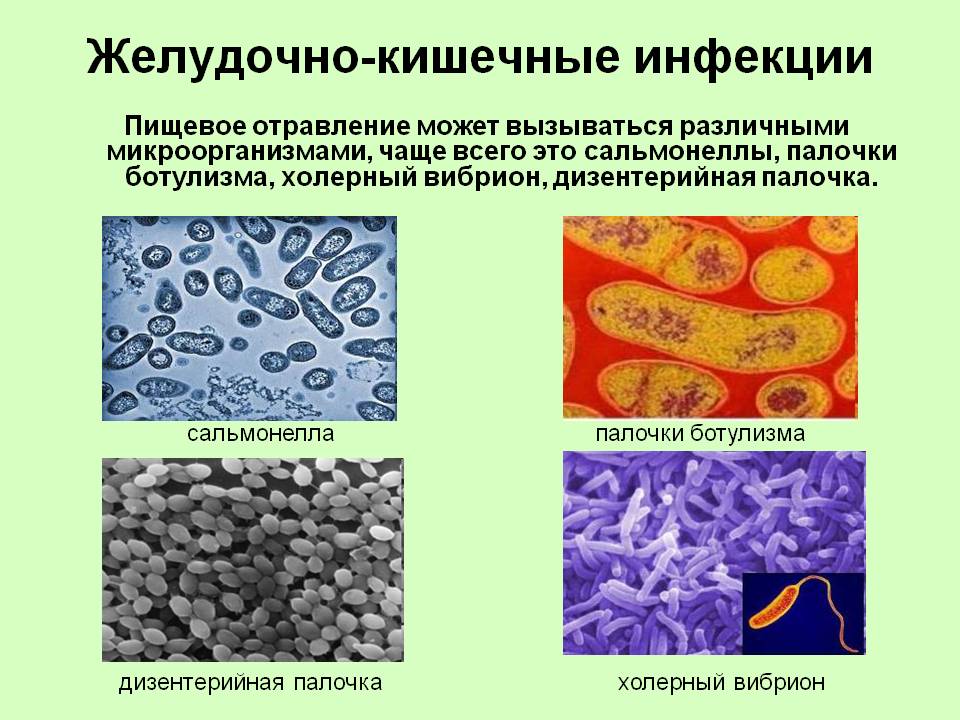
Основными проявлениями заболевания кишечными инфекциями, на которые следует обращать внимание, являются слабость, вялость, плохой аппетит, диарея, рвота, боли в животе, повышение температуры и появление озноба. При острых кишечных инфекциях вирусной этиологии наряду с поражениями кишечника отмечаются изменения со стороны верхних дыхательных путей: неба, дужек, язычка – при ротавирусной инфекции; трахеобронхит – при аденовирусной инфекции.
Для всех этих заболеваний характерным является проникновение возбудителей через рот и размножение их в кишечнике человека, откуда они с выделениями вновь попадают во внешнюю среду: почву, воду, на различные предметы и продукты питания.
Заразиться кишечной инфекцией можно повсюду – в общественном транспорте, магазине, различных организациях и детских коллективах. От нее практически не застрахован никто. У беременных женщин и детей младшего возраста болезнь протекает особенно тяжело, из-за сниженного иммунитета, в группу риска также входят люди преклонного возраста.
Переносчиками кишечных инфекций часто становятся насекомые – в основном мухи. Они переносят болезнетворные микроорганизмы на лапках. В профилактических целях нужно защищать жилище от этих назойливых насекомых.
Симптоматика болезней
Как только возбудитель попадает в организм человека, он считается переносчиком инфекции. Еще несколько дней человек может даже не подозревать, что он болен, и продолжать общаться со многими людьми. Инкубационный период может быть от пары часов до нескольких недель, все зависит от типа возбудителя и иммунитета человека.
После инкубационного периода развивается острая фаза болезни, которая проявляется такими симптомами:
1. Со стороны желудочно-кишечного тракта возникает ряд патологических изменений – тошнота, неукротимая рвота, боль в желудке и животе, водянистая диарея, иногда с вкраплениями крови и слизи.
2. Со стороны центральной нервной системы – головокружение, боль, поднятие температуры, иногда судороги и спутанность сознания.
В особо тяжких случаях, при заражении определенным возбудителем, быстро возникает обезвоживание. Слизистые больного становятся сухими, кожа приобретает синюшный оттенок и ощущается сильная слабость.
Чтобы не допустить обезвоживания, которое представляет опасность для жизни, необходимо часто, но малыми порциями, отпаивать больного человека. В качестве питья можно давать воду, чаи, компоты, морсы и отвары трав.
Профилактика кишечных инфекций включает простые правила гигиены:
– обязательное тщательное мытье рук с мылом перед приготовлением, приемом пищи и после посящения туалета;
– воду для питья употреблять кипяченную, бутилированную или из питьевого фонтанчика с системой доочистки водопроводной воды;
– овощи и фрукты, в том числе цитрусовые и бананы употреблять только после мытья их чистой водой и ошпаривания кипятком;
– разливное молоко употреблять после кипячения;
– творог, приготовленный из сырого молока или развесной, лучше употреблять только в виде блюд с термической обработкой;
– все пищевые продукты следует хранить в чистой закрывающейся посуде;
– скоропортящиеся продукты сохранять в холодильниках в пределах допустимых сроков хранения;
– обязательны соблюдение чистоты в жилище, частое проветривание, ежедневное проведение влажной уборки;
– купаться в открытых водоемах в летний период года можно только в специально отведенных местах;
– на вокзалах, в аэропортах, местах массового отдыха при питье бутилированной, газированной воды использовать только одноразовые стаканчики.
Профилактика кишечных инфекций
03 июля 2020 г.
Месячник профилактики кишечных инфекций
В рамках месячника будут оформлены тематические уголки здоровья, в холле поликлиники проведение радиобесед и демонстрация видеороликов, распространение печатной продукции памятки, буклеты, брошюры.
Профилактика кишечных инфекций
Острые кишечные инфекции (ОКИ) – это большая группа инфекционных заболеваний человека, вызываемых патогенными и условно-патогенными бактериями, вирусами и простейшими. К основным кишечным инфекциям относятся: дизентерия, сальмонеллез (читай ниже), холера, энтеровирусная и ротавирусная инфекция, пищевая токсикоинфекция, вызванная стафилококком и др. По частоте распространения среди всех болезней человека они уступают лишь ОРВИ. Более 60% всех случаев заболеваний кишечными инфекциями приходятся на детский возраст.
Каковы причины возникновения кишечных инфекций? Источником возбудителя острой кишечной инфекции может быть больной человек или бактерионоситель, а также животные, насекомые (мухи).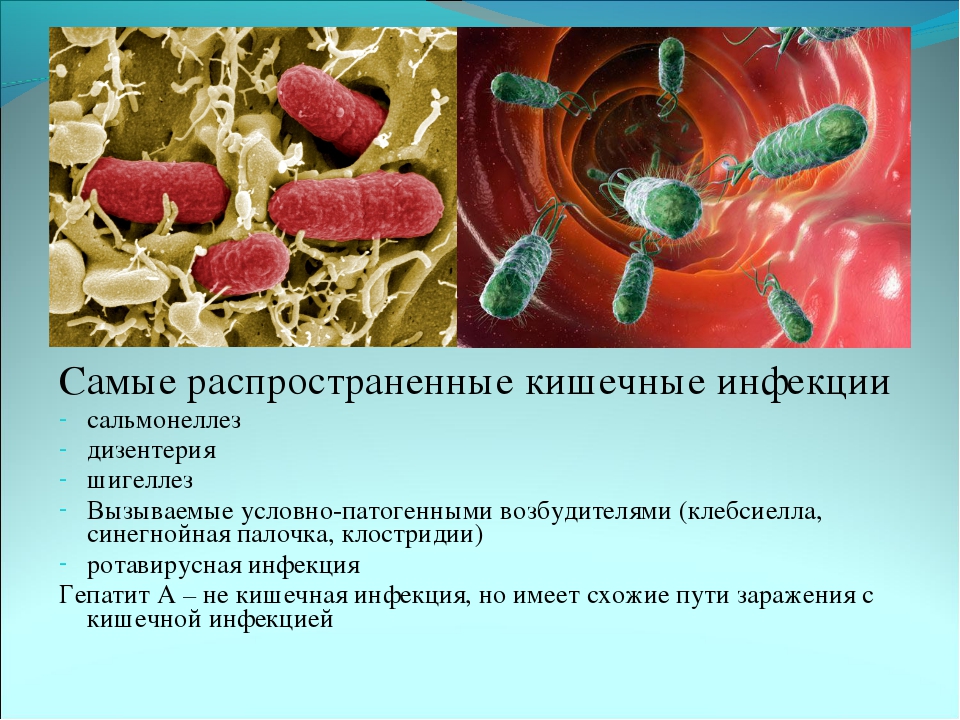 Возбудители кишечных инфекций могут находиться на грязных руках, немытых овощах и фруктах, в некипяченой воде. Благоприятной средой для размножения микробов являются молочные продукты, изделия из вареного мяса, паштеты и т.д.
Возбудители кишечных инфекций могут находиться на грязных руках, немытых овощах и фруктах, в некипяченой воде. Благоприятной средой для размножения микробов являются молочные продукты, изделия из вареного мяса, паштеты и т.д.
Как проявляется заболевание?
Возбудители кишечных инфекций вызывают:
- Поражение желудочно-кишечного тракта (боли в животе, понос, тошнота, рвота).
- Интоксикацию (повышение температуры тела, головная боль, слабость).
Клиническая картина зависит от вида возбудителя, количества попавших патогенных агентов и состояния иммунной системы человека. В тяжелых случаях развивается обезвоживание организма (сухость кожи и слизистых оболочек, жажда).
Каковы основные меры профилактики?
- Тщательно мойте овощи и фрукты, употребляемые в пищу в сыром виде (желательно щеткой с мылом с последующим ополаскиванием кипятком).
- Мойте руки с мылом перед приготовлением еды и после каждого перерыва в процессе готовки (и обязательно – после разделки сырых рыбы, мяса или птицы), а так же перед приемом пищи, после прогулок, игр с животными.

- Подвергайте продукты термической обработке. Сырые птица, мясо и молоко часто обсеменены патогенными микроорганизмами. В процессе варки (жарки) возбудители уничтожаются.
Обратите внимание! Замороженное мясо, рыба и птица должны тщательно оттаиваться перед кулинарной обработкой.
- Избегайте контакта между сырыми и готовыми пищевыми продуктами (в том числе не используйте одну и ту же доску и нож для разделывания сырых и готовых мясных, рыбных продуктов и овощей).
- Храните все скоропортящиеся продукты и готовую пищу в холодильнике – холод замедляет размножение попавших в продукты микробов.
- Содержите кухню в чистоте.
- Защищайте от мух продукты питания.
Выполнение этих несложных советов
поможет избежать заболевания острой кишечной инфекцией
и сохранит Ваше здоровье и здоровье Ваших близких!
Вирусные кишечные инфекции – как не попасть в зону риска
Среда, 2 Ноября 2016
С конца сентября текущего года в городе Когалыме отмечается рост заболеваемости кишечными инфекциями вирусной этиологии. Страдают преимущественно дети дошкольного возраста. В октябре в городе на карантин было закрыто два детских сада по причине высокой заболеваемости детей норовирусной инфекцией (общее число заболевших составило 57 человек, из них 52 – дети).
Страдают преимущественно дети дошкольного возраста. В октябре в городе на карантин было закрыто два детских сада по причине высокой заболеваемости детей норовирусной инфекцией (общее число заболевших составило 57 человек, из них 52 – дети).
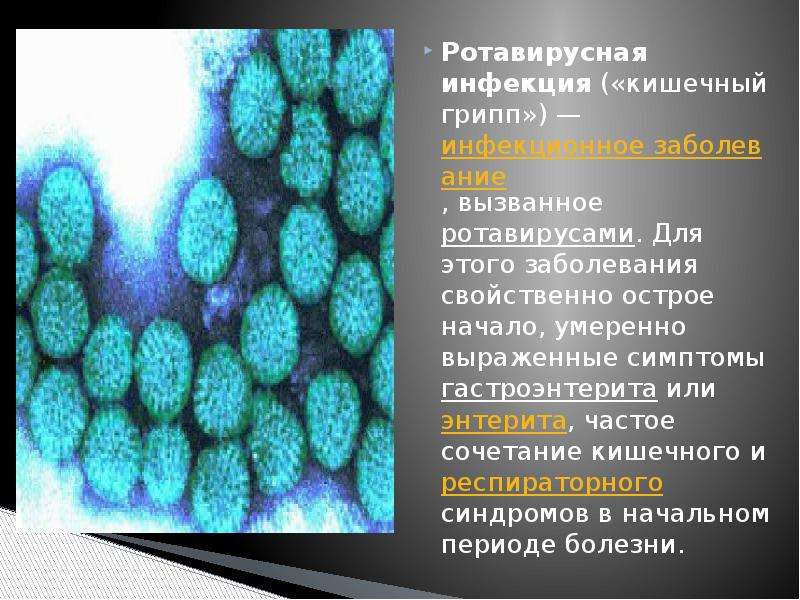
Вирусные кишечные инфекции – группа различных острых инфекционных заболеваний, для которых характерны признаки общей интоксикации, нарушение работы желудка и тонкого кишечника, а также поражение других органов и системы (например, дыхательных путей при аденовирусных заболеваниях). Эти инфекции вызываются после попадания в организм человека различных патогенных вирусов.
По данным Всемирной организации здравоохранения, на долю вирусных кишечных инфекций приходится 70% всех острых кишечных инфекций, в то время, как число кишечных инфекций бактериальной этиологии составляет не более 30%. Наиболее часто желудочно-кишечные нарушения наблюдаются при заболеваниях, вызванных ротавирусами. На втором месте – норовирусы. Ротавирус является причиной 20-60% острых кишечных инфекций у детей, а заболеваемость норовирусной инфекцией занимает второе место в структуре всех кишечных инфекций и составляет порядка 25% случаев. Реже диареи вызываются аденовирусами, астровирусами, реовирусами и энтеровирусами. Данные вирусы устойчивы к различным физико-химическим воздействиям и внешней среде – эфиру, органическим растворителям, кислотам, действию хлорсодержащих дезсредств. Также они хорошо сохраняются при низких температурах, даже при замораживании.
Ротавирус является причиной 20-60% острых кишечных инфекций у детей, а заболеваемость норовирусной инфекцией занимает второе место в структуре всех кишечных инфекций и составляет порядка 25% случаев. Реже диареи вызываются аденовирусами, астровирусами, реовирусами и энтеровирусами. Данные вирусы устойчивы к различным физико-химическим воздействиям и внешней среде – эфиру, органическим растворителям, кислотам, действию хлорсодержащих дезсредств. Также они хорошо сохраняются при низких температурах, даже при замораживании.
Источником вирусных диарей является больной человек или бессимптомный носитель. Чаще всего заражение происходит фекально-оральный путём, когда патогенные вирусы проникают в организм с пищей, водой и через грязные руки. Основная масса вирусов выделяется у больного со стулом. В 1 г фекалий может находиться до 10 млрд вирусов, а для заражения требуется менее 10 вирусных частиц. Также возможен и воздушно-капельный путь распространения, например, при аденовирусной инфекции, или же через посуду и предметы общего пользования.
Для ротавирусной и норовирусной инфекций характерна осеннее – зимняя сезонность, так как они более устойчивы во внешней среде при низких температурах. Единичные случаи заболеваний регистрируются и в летний период. Болеют преимущественно дети раннего возраста. Среди подростков старше 11 лет заболеваемость значительно снижается и снова возрастает в возрастной группе от 60 лет и старше. Большинство пациентов переносят инфекцию неоднократно, так как иммунитет к этим вирусам нестойкий.
Период инкубации при вирусных диареях колеблется от нескольких часов до 7 суток. Ротавирусная и норовирусная инфекции проявляются у подавляющего большинства пациентов в течение первых суток. Заболевание начинается остро, с подъёма температуры до 37,5-38°C, при более тяжёлых формах – до 39°C и выше, может наблюдаться лихорадочная реакция. Отмечается интоксикационный синдром, сопровождающийся слабостью, вялостью, снижением аппетита. В дальнейшем возникают симптомы поражения желудочно-кишечного тракта – тошнота, повторная рвота, диарея, боли в животе. Характерен обильный пенистый стул желтоватого или зеленоватого цвета, водянистый (до 10-12 раз в сутки). В начальном периоде заболевания ротавирусной инфекцией могут быть воспалительные изменения со стороны верхних дыхательных путей – покраснение горла, покашливание, насморк. Длится заболевание от 3 до 5 дней.
Характерен обильный пенистый стул желтоватого или зеленоватого цвета, водянистый (до 10-12 раз в сутки). В начальном периоде заболевания ротавирусной инфекцией могут быть воспалительные изменения со стороны верхних дыхательных путей – покраснение горла, покашливание, насморк. Длится заболевание от 3 до 5 дней.
В основе лечения вирусных кишечных инфекций лежит нормализация недостаточности ферментов желудочно-кишечного тракта. Также важную роль играет диета – пища должна обладать механически щадящими свойствами (из-за воспалительного процесса в кишечнике) и содержать как можно меньше жиров, кроме этого необходимо увеличить потребление кисломолочных продуктов, чтобы сократить риск развития дисбактериоза. Противовирусное лечение проводится аналогично лечению острых респираторных вирусных инфекций. Для этого назначается комплекс противовирусных и общеукрепляющих средств.
Из средств специфической профилактики данных заболеваний разработана только вакцина против ротавирусной инфекции. К мерам неспецифической профилактики можно отнести десять «золотых» правил, введённых экспертами Всемирной Организации Здравоохранения:
К мерам неспецифической профилактики можно отнести десять «золотых» правил, введённых экспертами Всемирной Организации Здравоохранения:
1. Выбор безопасных пищевых продуктов. Определённые продукты, которые потребляются сырыми (зелень, овощи, фрукты), требуют тщательной мойки. Не употребляйте продукты с истекшим сроком годности. Не покупайте продукты питания в не установленных местах.
2. Правильное приготовление пищи. Многие сырые продукты, главным образом, птица, мясо и сырое молоко, часто обсеменены патогенными микроорганизмами. В процессе приготовления (варки, жарки) микроорганизмы уничтожаются. Помните, что температура во всех частях пищевого продукта должна достигнуть 70°С. Тщательно прожаривайте или проваривайте продукты, особенно мясо, птицу, яйца и морские продукты.
3. Употребление приготовленной пищи без промедления. Не оставляйте приготовленную пищу при комнатной температуре более чем на 2 часа, пищу для детей лучше вообще не подвергать хранению. Охлаждайте без задержки все приготовленные и скоропортящиеся пищевые продукты (желательно ниже 5°С). Держите приготовленные блюда горячими (выше 60°С) вплоть до сервировки. Не храните пищу долго, даже в холодильнике. Не размораживайте продукты при комнатной температуре.
Охлаждайте без задержки все приготовленные и скоропортящиеся пищевые продукты (желательно ниже 5°С). Держите приготовленные блюда горячими (выше 60°С) вплоть до сервировки. Не храните пищу долго, даже в холодильнике. Не размораживайте продукты при комнатной температуре.
4. Правильное хранение пищевых продуктов. Если Вы приготовили пищу впрок или хотите после употребления сохранить оставшуюся её часть, имейте в виду, что она должна храниться либо горячей (около или выше 60°С), либо холодной (около или ниже 10°С). Это исключительно важное правило, особенно если Вы намерены хранить пищу более 4-5 часов.
5. Тщательная термическая обработка приготовленной заранее пищи. Это наилучшая мера защиты от микроорганизмов, которые могли размножиться в пище в процессе хранения (правильное хранение угнетает рост микробов, но не уничтожает их). Ещё раз, перед едой, тщательно прогрейте пищу (температура в её толще должна быть не менее 70°С).
6. Избежание контакта между сырыми и готовыми пищевыми продуктами. Правильно приготовленная пища может быть загрязнена путём соприкосновения с сырыми продуктами. Нельзя использовать один и тот же разделочный инвентарь (доска, нож и др.) для приготовления сырой и готовой пищи.
Избежание контакта между сырыми и готовыми пищевыми продуктами. Правильно приготовленная пища может быть загрязнена путём соприкосновения с сырыми продуктами. Нельзя использовать один и тот же разделочный инвентарь (доска, нож и др.) для приготовления сырой и готовой пищи.
7. Частое и тщательное мытьё рук. Тщательно мойте руки перед приготовлением еды и после каждого перерыва в процессе готовки -особенно, если Вы перепеленали ребёнка или были в туалете. После разделки сырых продуктов, таких как рыба, мясо или птица, опять вымойте руки, прежде чем приступить к обработке других продуктов. Если у Вас имеется инфицированная царапина (ранка) на руке, то обязательно перевяжите её или наложите пластырь прежде, чем приступить к приготовлению пищи. Помните, что домашние животные являются частыми носителями опасных микроорганизмов, которые могут попасть в пищу через Ваши руки.
8. Содержание кухни в идеальной чистоте. Так как пища легко загрязняется, то любая поверхность, используемая для её приготовления, должна быть абсолютно чистой. Полотенца для протирания посуды должны меняться каждый день. Предохраняйте кухню и продукты от насекомых, грызунов и других животных.
Полотенца для протирания посуды должны меняться каждый день. Предохраняйте кухню и продукты от насекомых, грызунов и других животных.
9. Хранение пищи, защищённой от насекомых, грызунов и других животных. Животные часто являются переносчиками патогенных микроорганизмов, которые вызывают пищевые отравления. Для надёжной защиты продуктов храните их в плотно закрывающихся банках (контейнерах).
10. Использование только кипячёной воды для питья и готовки. Чистая вода исключительно важна как для питья, так и для приготовления пищи. Если у Вас есть сомнения в отношении качества воды, то прокипятите её перед добавлением к пищевым продуктам или перед использованием, или возьмите бутилированную воду.
БУДЬТЕ ЗДОРОВЫ!
Ю.С. Корепанова, врач-эпидемиолог
14.04.2021 Кишечные инфекции: симптомы и профилактика
Эпидемиологическая служба ТОГБУЗ «ГКБ №3 г. Тамбова» напоминает о мерах профилактики кишечных инфекций.
Тамбова» напоминает о мерах профилактики кишечных инфекций.
К кишечным инфекциям относятся дизентерия, сальмонеллез, брюшной тиф, паратифы А и Б, холера, гастроэнтерит, пищевые токсикоинфекции, вирусный гепатит А, вирусные кишечные инфекции: аденовирус, ротавирус, норовирус, астро-вирус и другие. Основными проявлениями заболевания являются – слабость, вялость, плохой аппетит, диарея, рвота, боли в животе, повышение температуры и появление озноба. При острых кишечных инфекциях вирусной этиологии наряду с поражениями кишечника отмечаются изменения со стороны верхних дыхательных путей.
Источники заражения
Для всех этих заболеваний характерным является проникновение возбудителей через рот и размножение их в кишечнике человека. Возбудители кишечных инфекций обладают высокой устойчивостью во внешней среде. Наиболее устойчивы патогенная кишечная палочка, возбудители брюшного тифа, вирусного гепатита, вирусы. В передаче возбудителей могут участвовать несколько основных факторов: вода, пищевые продукты, почва, предметы обихода, насекомые. В пищевых продуктах возбудители кишечных инфекций не только сохраняются, но и активно размножаются, не меняя при этом внешнего вида и вкуса продукта. Но при действии высокой температуры, например, при кипячении, возбудители погибают.
В пищевых продуктах возбудители кишечных инфекций не только сохраняются, но и активно размножаются, не меняя при этом внешнего вида и вкуса продукта. Но при действии высокой температуры, например, при кипячении, возбудители погибают.
Источником заражения кишечными инфекциями является человек. Восприимчивость людей к кишечным инфекциям довольно высокая. Особенно подвержены им дети.
Заразиться можно при употреблении неправильно приготовленной или испорченной пищи. Одним из факторов заражения является вода. Заразиться можно при употреблении непригодной для питья и промывки фруктов и овощей воды. Заражение может произойти при купании в открытых водоёмах. К заражению кишечными инфекциями может привести употребление воды из колодца, если колодец неправильно построен или неправильно используется. Через воду могут распространяться холера, брюшной тиф, дизентерия, сальмонеллезы, вирусный гепатит “А” (или болезнь Боткина) и другие.
Предметы домашнего обихода – посуда, игрушки, полотенца – тоже могут содержать возбудителей различных заболеваний, особенно если в семье есть заболевший кишечной инфекцией.
Профилактика
Необходимо соблюдать ряд правил:
– обязательно тщательно мыть руки с мылом перед приготовлением, приёмом пищи и после туалета;
– воду для питья употреблять только кипячённую, бутилированную или из питьевого фонтанчика с системой доочистки водопроводной воды;
– овощи и фрукты, в том числе цитрусовые и бананы употреблять только после мытья их чистой водой и ошпаривания кипятком;
– разливное молоко употреблять после кипячения;
– творог, приготовленный из сырого молока или развесной, лучше употреблять только в виде блюд с термической обработкой;
– все пищевые продукты следует хранить в чистой закрывающейся посуде;
– скоропортящиеся продукты надо сохранять в холодильниках в пределах допустимых сроков хранения;
– важно соблюдать чистоту в жилище, часто проветривать, ежедневно проводить влажную уборку;
– купаться в открытых водоёмах в летний период года можно только в специально отведённых местах;
– на вокзалах, в аэропортах, местах массового отдыха при питье бутилированной, газированной воды использовать только одноразовые стаканчики.
При обнаружении у себя того, или иного признака инфекционного заболевания необходимо срочно обратиться к врачу. Не занимайтесь самолечением! Многие заболевания, например, дизентерия и сальмонеллез, в результате самолечения могут приобрести хронический характер.
Симптомы, причины, диагностика, лечение, хирургия
Что такое дивертикулит?
Дивертикулит – это инфекция или воспаление мешочков, которые могут образовываться в кишечнике. Эти мешочки называются дивертикулами.
Пакеты в целом безвредны. Они могут появиться в любом месте вашего кишечника. Если они у вас есть, это называется дивертикулезом. Если они инфицированы или воспаляются, у вас дивертикулит.
Иногда дивертикулит незначительный.Но это также может быть серьезным, с обширной инфекцией или перфорацией (ваш врач назовет это разрывом) кишечника.
Симптомы дивертикулита
Вы можете иметь мешочки и не знать об этом. Дивертикулы обычно безболезненны и вызывают незначительные симптомы, если таковые имеются. Но вы можете заметить:
Но вы можете заметить:
- Спазмы в левой части живота, которые проходят после выхода газов или дефекации
- Ярко-красная кровь в фекалиях
Симптомы дивертикулита более заметны и включают сильную боль в животе и высокая температура.
Дивертикулит может быть острым или хроническим. При острой форме у вас может быть один или несколько тяжелых приступов инфекции и воспаления. При хроническом дивертикулите воспаление и инфекция могут уменьшиться, но никогда не исчезнут полностью. Со временем воспаление может привести к непроходимости кишечника, что может вызвать запор, жидкий стул, диарею, вздутие живота и боли в животе. Если непроходимость продолжается, боль и болезненность в животе усиливаются, и вы можете почувствовать тошноту или рвоту.
Причины дивертикулита
Мешочки в кишечнике воспаляются или заражаются, когда они разрываются или закупориваются фекалиями.
Ваши шансы заболеть дивертикулитом повышаются с возрастом. Чаще встречается у людей старше 40 лет. К другим факторам риска относятся:
К другим факторам риска относятся:
- Избыточный вес
- Курение сигарет
- Недостаточная физическая нагрузка
- Употребление большого количества жира и красного мяса, но не большого количества клетчатки
- Принятие определенных видов наркотиков, в том числе стероиды, опиоиды и нестероидные противовоспалительные средства, такие как ибупрофен или напроксен
Осложнения дивертикулита
Если его не лечить, дивертикулит может привести к серьезным осложнениям, требующим хирургического вмешательства:
- Абсцессы, скопление гноя из инфекция может образоваться вокруг инфицированных дивертикулов.Если они пройдут через стенку кишечника, можно заразиться перитонитом. Эта инфекция может быть смертельной. Вам срочно понадобится лечение.
- Перфорация или разрыв стенки кишечника может привести к абсцессам и инфекции из-за попадания отходов в брюшную полость.
- Рубцы могут привести к стриктуре или закупорке кишечника.

- Свищи могут развиться, если инфицированный дивертикул достигает соседнего органа и образует соединение.Чаще всего это происходит между толстой кишкой и мочевым пузырем. Это может привести к инфекции почек. Свищи также могут образовываться между толстой кишкой и кожей или влагалищем.
Если у вас сильное кровотечение, вам может потребоваться переливание крови.
Диагноз дивертикулита
Симптомы дивертикулита могут быть похожи на другие проблемы. Ваш врач сузит круг вопросов, исключив другие проблемы. Они начнут с медицинского осмотра. Женщины тоже могут пройти обследование органов малого таза.Затем ваш врач может назначить один или несколько тестов, в том числе:
- Анализы крови, мочи и стула для выявления инфекции
- КТ-сканирование для поиска воспаленных или инфицированных дивертикулов
- Тест ферментов печени для исключения проблем с печенью
Лечение дивертикулита
Если дивертикулит протекает в легкой форме, врач порекомендует покой и жидкую диету на время заживления кишечника.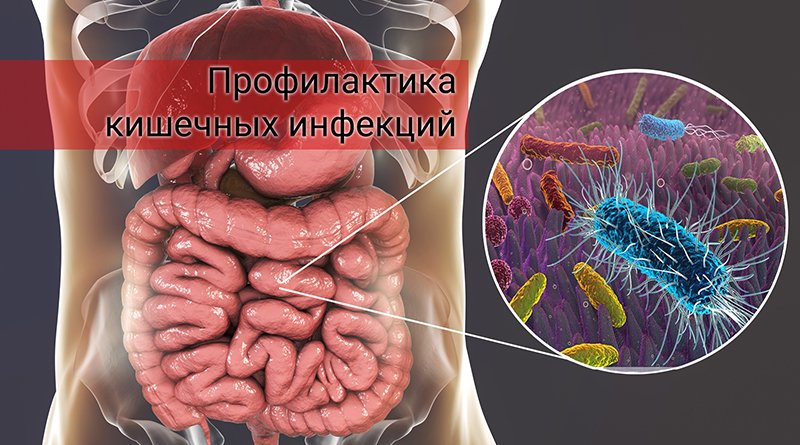 Они также могут прописать вам антибиотики для лечения инфекции.
Они также могут прописать вам антибиотики для лечения инфекции.
В более тяжелых случаях вам, возможно, придется оставаться в больнице и принимать внутривенные антибиотики (вводимые в вены).Если у вас абсцесс брюшной полости, врач его осушит. Если у вас разрыв кишечника или перитонит, вам потребуется операция.
Когда вы выздоровеете, ваш врач может сделать вам колоноскопию, чтобы исключить рак толстой кишки.
Дивертикулез и дивертикулит и их осложнения можно предотвратить, если есть много клетчатки, пить много воды и регулярно заниматься спортом.
Возможная кишечная инфекция и фекально-оральная передача SARS-CoV-2
Фер, А. Р. и Перлман, С. Коронавирусы: обзор их репликации и патогенеза. Methods Mol. Биол. 1282 , 1–23 (2015).
CAS PubMed PubMed Central Google Scholar
Цуй, Дж., Ли, Ф. и Ши, З. Происхождение и эволюция патогенных коронавирусов. Nat. Rev. Microbiol. 17 , 181–192 (2019).
Nat. Rev. Microbiol. 17 , 181–192 (2019).
CAS PubMed PubMed Central Google Scholar
Zhou, P. et al. Вспышка пневмонии, связанная с новым коронавирусом, вероятно, происхождения летучих мышей. Природа 579 , 270–273 (2020).
CAS PubMed PubMed Central Google Scholar
ВОЗ. Информационная панель ВОЗ по коронавирусной болезни (COVID-19). ВОЗ https://covid19.who.int/ (2020).
Lan, J. et al. Структура спайкового домена, связывающего рецептор SARS-CoV-2, связанного с рецептором ACE2. Природа 581 , 215–220 (2020).
CAS PubMed PubMed Central Google Scholar
Blanco-Melo, D. et al. Несбалансированная реакция хозяина на SARS-CoV-2 способствует развитию COVID-19. Ячейка 181 , 1036–1045. e9 (2020).
e9 (2020).
CAS PubMed PubMed Central Google Scholar
Channappanavar, R.и другие. Нарушение регуляции интерферона I типа и воспалительные реакции моноцитов-макрофагов вызывают летальную пневмонию у мышей, инфицированных SARS-CoV. Клеточный микроб-хозяин 19 , 181–193 (2016).
CAS PubMed PubMed Central Google Scholar
Kindler, E. et al. Эффективная репликация нового бета-коронавируса человека EMC на первичном эпителии человека подчеркивает его зоонозный потенциал. мБио 4 , e00611-12 (2013).
PubMed PubMed Central Google Scholar
Mehta, P. et al. COVID-19: рассмотрите синдромы цитокинового шторма и иммуносупрессию. Ланцет 395 , 1033–1034 (2020).
CAS PubMed PubMed Central Google Scholar

Ву, З. и МакГуган, Дж. М. Характеристики и важные уроки вспышки коронавирусного заболевания 2019 г. (COVID-19) в Китае: краткое изложение отчета Китайского центра по контролю и профилактике заболеваний о 72314 случаях. JAMA 323 , 1239–1242 (2020).
CAS Google Scholar
Guan, W. J. et al. Клиническая характеристика коронавирусной болезни 2019 в Китае. N. Engl. J. Med. 382 , 1708–1720 (2020).
CAS PubMed PubMed Central Google Scholar
Chen, N. et al. Эпидемиологические и клинические характеристики 99 случаев новой коронавирусной пневмонии 2019 г. в Ухане, Китай: описательное исследование. Ланцет 395 , 507–513 (2020).
CAS PubMed PubMed Central Google Scholar
Liang, W. et al. Можно недооценить диарею: недостающее звено в новом коронавирусе 2019 года.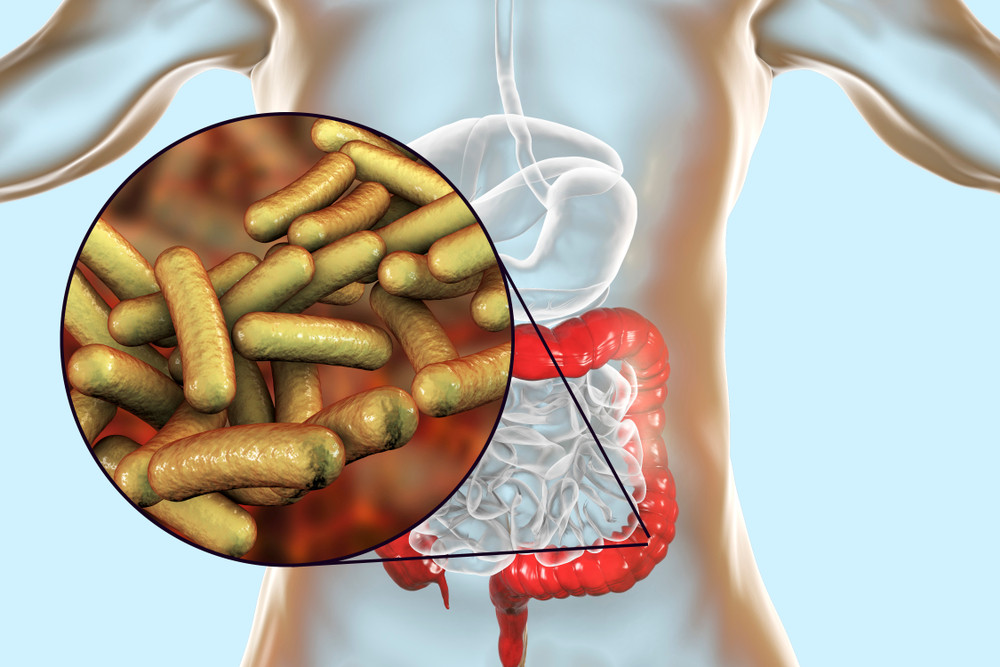 Кишечник 69 , 1141–1143 (2020).
Кишечник 69 , 1141–1143 (2020).
CAS Google Scholar
Qi, F., Qian, S., Zhang, S. & Zhang, Z. Секвенирование одноклеточной РНК 13 тканей человека позволяет идентифицировать типы клеток и рецепторы коронавирусов человека. Biochem. Биофиз. Res. Commun. 526 , 135–140 (2020).
CAS PubMed PubMed Central Google Scholar
Cheung, K. S. et al. Желудочно-кишечные проявления инфекции SARS-CoV-2 и вирусная нагрузка в образцах кала из гонконгской когорты: систематический обзор и метаанализ. Гастроэнтерология 159 , 81–95 (2020).
CAS Google Scholar
Zhou, F. et al. Клиническое течение и факторы риска смертности взрослых пациентов с COVID-19 в Ухане, Китай: ретроспективное когортное исследование. Ланцет 395 , 1054–1062 (2020).
CAS PubMed PubMed Central Google Scholar
Ferm, S. et al. Анализ желудочно-кишечных и печеночных проявлений инфекции SARS-CoV-2 у 892 пациентов в Квинсе, штат Нью-Йорк. Clin. Гастроэнтерол.Гепатол. 18 , 2378–2379.e1 (2020).
CAS PubMed PubMed Central Google Scholar
Díaz, L.A. et al. Профили симптомов и факторы риска госпитализации у пациентов с SARS-CoV-2 и COVID-19: большая когорта из Южной Америки. Гастроэнтерология 159 , 1148–1150 (2020).
Google Scholar
Aghemo, A. et al. Поражение пищеварительной системы COVID-19 и клинические результаты в крупной академической больнице в Милане, Италия. Clin. Гастроэнтерол. Гепатол. 18 , 2366–2368.e3 (2020).
CAS PubMed PubMed Central Google Scholar

Remes-Troche, J. M. et al. Начальные желудочно-кишечные проявления у пациентов с SARS-CoV-2 у 112 пациентов из Веракруса (Юго-Восточная Мексика). Гастроэнтерология 159 , 1179–1181 (2020).
CAS Google Scholar
Hajifathalian, K. et al. Желудочно-кишечные и печеночные проявления нового коронавирусного заболевания 2019 года в большой когорте инфицированных пациентов из Нью-Йорка: клинические последствия. Гастроэнтерология 159 , 1137–1140.e2 (2020).
CAS Google Scholar
Redd, W. D. et al. Распространенность и характеристики желудочно-кишечных симптомов у пациентов с тяжелым острым респираторным синдромом, инфицированным коронавирусом 2, в США: многоцентровое когортное исследование. Гастроэнтерология 159 , 765–767.e2 (2020).
CAS Google Scholar

Jin, X. et al. Эпидемиологическая, клиническая и вирусологическая характеристика 74 случаев заболевания коронавирусом 2019 г. (COVID-19) с желудочно-кишечными симптомами. Кишечник 69 , 1002–1009 (2020).
CAS Google Scholar
Чен, А.и другие. Специфичны ли желудочно-кишечные симптомы для инфекции COVID-19? Проспективное исследование случай-контроль из США. Гастроэнтерология 159 , 1161–1163.e2 (2020).
CAS Google Scholar
Lin, L. et al. Желудочно-кишечные симптомы 95 случаев инфекции SARS-CoV-2. Кишечник 69 , 997–1001 (2020).
CAS Google Scholar
Sun, Y. et al. Эпидемиологические и клинические предикторы COVID-19. Clin. Заразить. Дис. 71 , 786–792 (2020).
CAS Google Scholar

Papa, A. et al. Желудочно-кишечные симптомы и сопутствующие заболевания пищеварительной системы в итальянской когорте пациентов с COVID-19. Eur. Rev. Med. Pharmacol. Sci. 24 , 7506–7511 (2020).
CAS Google Scholar
Wan, Y. et al. Поражение кишечника у госпитализированных пациентов с COVID-19 за пределами Ухани. Ланцет Гастроэнтерол. Гепатол. 5 , 534–535 (2020).
PubMed PubMed Central Google Scholar
Cholankeril, G. et al. Высокая распространенность сопутствующих желудочно-кишечных проявлений у пациентов с тяжелым острым респираторным синдромом, коронавирусом 2: ранний опыт из Калифорнии. Гастроэнтерология 159 , 775–777 (2020).
CAS Google Scholar
Sultan, S. et al. Институт AGA экспресс-анализ желудочно-кишечных и печеночных проявлений COVID-19, мета-анализ международных данных и рекомендации по консультативному ведению пациентов с COVID-19. Гастроэнтерология 159 , 320–334.e27 (2020).
Гастроэнтерология 159 , 320–334.e27 (2020).
CAS PubMed PubMed Central Google Scholar
Лю, Дж., Цуй, М., Ян, Т. и Яо, П. Корреляция между желудочно-кишечными симптомами и тяжестью заболевания у пациентов с COVID-19: систематический обзор и метаанализ. BMJ Open Gastroenterol. 7 , e000437 (2020).
PubMed PubMed Central Google Scholar
Нобель, Ю. Р. и др. Желудочно-кишечные симптомы и коронавирусное заболевание 2019: исследование случай-контроль из США. Гастроэнтерология 159 , 373–375.e2 (2020).
CAS PubMed PubMed Central Google Scholar
Hung, I. F. et al. Тройная комбинация интерферона бета-1b, лопинавира-ритонавира и рибавирина в лечении пациентов, госпитализированных с COVID-19: открытое рандомизированное исследование фазы 2. Ланцет 395 , 1695–1704 (2020).
Ланцет 395 , 1695–1704 (2020).
CAS PubMed PubMed Central Google Scholar
Song, Y. et al. Диарея, вызванная SARS-CoV-2, как начальный симптом у пациента с COVID-19. Кишечник 69 , 1143–1144 (2020).
CAS Google Scholar
Wang, D. et al. Клинические характеристики 138 госпитализированных пациентов с пневмонией, инфицированной новым коронавирусом 2019 г., в Ухане, Китай. JAMA 323 , 1061–1069 (2020).
CAS PubMed PubMed Central Google Scholar
Zumla, A., Hui, D. S. & Perlman, S. Ближневосточный респираторный синдром. Ланцет 386 , 995–1007 (2015).
PubMed PubMed Central Google Scholar
Wootton, S.H. et al. Обнаружение вируса гриппа Nh2N1 в недыхательных местах у детей. Детская инфекция. Дис. J. 33 , 95–96 (2014).
Детская инфекция. Дис. J. 33 , 95–96 (2014).
Google Scholar
Yuen, K. Y. et al. Клинические особенности и быстрая вирусная диагностика заболеваний человека, связанных с вирусом птичьего гриппа A H5N1. Lancet 351 , 467–471 (1998).
CAS PubMed PubMed Central Google Scholar
Leung, W. K. et al. Поражение кишечника тяжелой формой коронавирусной инфекции, связанной с острым респираторным синдромом. Гастроэнтерология 125 , 1011–1017 (2003).
PubMed PubMed Central Google Scholar
Peiris, J. S. et al. Клиническое прогрессирование и вирусная нагрузка при вспышке коронавирус-ассоциированной пневмонии SARS: проспективное исследование. Ланцет 361 , 1767–1772 (2003).
CAS PubMed PubMed Central Google Scholar

Shi, X. et al. Коронавирус, связанный с тяжелым острым респираторным синдромом, выявляется в тканях кишечника смертельных случаев. Am. J. Gastroenterol. 100 , 169–176 (2005).
PubMed PubMed Central Google Scholar
Arabi, Y. M. et al. Ближневосточный респираторный синдром. N. Engl. J. Med. 376 , 584–594 (2017).
PubMed PubMed Central Google Scholar
Corman, V. M. et al. Выделение вируса и ответ антител у 37 пациентов с коронавирусной инфекцией ближневосточного респираторного синдрома. Clin. Заразить. Дис. 62 , 477–483 (2016).
CAS PubMed PubMed Central Google Scholar
Chotpitayasunondh, T. et al. Болезнь человека от гриппа A (H5N1), Таиланд, 2004 г. Emerg. Заразить. Дис. 11 , 201–209 (2005).
PubMed PubMed Central Google Scholar
Hien, T. T. et al.Птичий грипп A (H5N1) у 10 пациентов во Вьетнаме. N. Engl. J. Med. 350 , 1179–1188 (2004).
CAS Google Scholar
Beigel, J.H. et al. Инфекция птичьего гриппа A (H5N1) у людей. N. Engl. J. Med. 353 , 1374–1385 (2005).
PubMed PubMed Central Google Scholar
Хамберд, Дж., Гуан, Ю. и Вебстер, Р. Г. Сравнение репликации вирусов гриппа А у китайских кольцевидных фазанов и чукарских куропаток. J. Virol. 80 , 2151–2161 (2006).
CAS PubMed PubMed Central Google Scholar
Александр Д. Дж. Обзор эпидемиологии птичьего гриппа. Vaccine 25 , 5637–5644 (2007).
CAS PubMed PubMed Central Google Scholar
Кёрнер, Р. В., Маджути, М., Альказар, М. А. и Махабир, Э. О мышах и людях: модели коронавируса MHV и мыши как трансляционный подход к пониманию SARS-CoV-2. Вирусы 12 , 880 (2020).
Google Scholar
Саиф Л. Дж. И Юнг К. Сравнительный патогенез респираторных коронавирусов крупного рогатого скота и свиней у животных-хозяев и SARS-CoV-2 у людей. J. Clin. Microbiol. 58 , e01355–20 (2020).
CAS PubMed PubMed Central Google Scholar
DuPont, H. L. Острая инфекционная диарея у иммунокомпетентных взрослых. N. Engl. J. Med. 370 , 1532–1540 (2014).
CAS PubMed PubMed Central Google Scholar
Wang, J. et al. Инфекция, вызванная вирусом респираторного гриппа, вызывает поражение иммунной системы кишечника из-за опосредованного микробиотой воспаления, зависимого от клеток Th27. J. Exp. Med. 211 , 2397–2410 (2014).
J. Exp. Med. 211 , 2397–2410 (2014).
CAS PubMed PubMed Central Google Scholar
Crawford, S.E. et al. Ротавирусная инфекция. Nat. Преподобный Дис. Prim. 3 , 17083 (2017).
PubMed PubMed Central Google Scholar
Гласс Р. И., Парашар У. Д. и Эстес М. К. Норовирусный гастроэнтерит. N. Engl. J. Med. 361 , 1776–1785 (2009).
CAS PubMed PubMed Central Google Scholar
Lundgren, O. et al. Роль кишечной нервной системы в секреции жидкости и электролитов при ротавирусной диарее. Наука 287 , 491–495 (2000).
CAS PubMed PubMed Central Google Scholar
Hung, I. F. et al. Вирусные нагрузки в клинических образцах и проявления SARS. Emerg. Заразить. Дис. 10 , 1550–1557 (2004).
Emerg. Заразить. Дис. 10 , 1550–1557 (2004).
CAS PubMed PubMed Central Google Scholar
To, K. F. et al. Тканевый и клеточный тропизм коронавируса, связанный с тяжелым острым респираторным синдромом: исследование in-situ гибридизации смертельных случаев. J. Pathol. 202 , 157–163 (2004).
CAS PubMed PubMed Central Google Scholar
Lang, Z.-W. и другие. Клинико-патологическое исследование трех случаев тяжелого острого респираторного синдрома (SARS). Патология 35 , 526–531 (2003).
PubMed PubMed Central Google Scholar
Xiao, F. et al. Доказательства желудочно-кишечной инфекции SARS-CoV-2. Гастроэнтерология 158 , 1831–1833.e3 (2020).
CAS PubMed PubMed Central Google Scholar

Qian, Q. et al. Прямое свидетельство активной репликации SARS-CoV-2 в кишечнике. Clin. Заразить. Дис. https://doi.org/10.1093/cid/ciaa925 (2020).
Артикул PubMed PubMed Central Google Scholar
Hassan, E. & Baldridge, M. T. Встречи норовируса в кишечнике: многогранные взаимодействия и исходы болезней. Mucosal Immunol. 12 , 1259–1267 (2019).
CAS PubMed PubMed Central Google Scholar
Effenberger, M. et al. Калпротектин в фекалиях указывает на воспаление кишечника при COVID-19. Кишечник 69 , 1543–1544 (2020).
CAS PubMed PubMed Central Google Scholar
Park, S. K. et al. Обнаружение SARS-CoV-2 в образцах кала пациентов с бессимптомным и легким COVID-19 в Корее. Clin. Гастроэнтерол. Гепатол. https://doi. org/10.1016/j.cgh.2020.06.005 (2020).
org/10.1016/j.cgh.2020.06.005 (2020).
Артикул PubMed PubMed Central Google Scholar
Hashimoto, T. et al. ACE2 связывает аминокислотное недоедание с микробной экологией и воспалением кишечника. Природа 487 , 477–481 (2012).
CAS PubMed PubMed Central Google Scholar
Tao, W. et al. Анализ микробиоты кишечника у пациентов с COVID-19 и ее корреляция с воспалительным фактором IL-18. Med. Microecol. 5 , 100023 (2020).
PubMed PubMed Central Google Scholar
Gu, S. et al. Изменения микробиоты кишечника у пациентов с коронавирусной болезнью 2019 или гриппом h2N1. Clin. Заразить. Дис. https://doi.org/10.1093/cid/ciaa709 (2020).
Артикул PubMed PubMed Central Google Scholar
Hoffmann, M. et al. Вход в клетки SARS-CoV-2 зависит от ACE2 и TMPRSS2 и блокируется клинически доказанным ингибитором протеазы. Ячейка 181 , 271–280.e8 (2020).
CAS PubMed PubMed Central Google Scholar
Zhang, H. et al. Пищеварительная система – это потенциальный путь распространения COVID-19: анализ паттерна одноклеточной коэкспрессии ключевых белков в процессе проникновения вируса. Кишечник 69 , 1010–1018 (2020).
CAS Google Scholar
Stanifer, M. L. et al. Критическая роль интерферона типа III в контроле инфекции SARS-CoV-2 в эпителиальных клетках кишечника человека. Cell Rep. 32 , 107863 (2020).
CAS PubMed PubMed Central Google Scholar
Hamming, I. et al. Распределение в тканях белка ACE2, функционального рецептора коронавируса SARS. Первый шаг к пониманию патогенеза SARS. J. Pathol. 203 , 631–637 (2004).
Первый шаг к пониманию патогенеза SARS. J. Pathol. 203 , 631–637 (2004).
CAS PubMed PubMed Central Google Scholar
То, К. Ф. и Ло, А.W. Изучение патогенеза тяжелого острого респираторного синдрома (SARS): распределение в тканях коронавируса (SARS-CoV) и его предполагаемого рецептора, ангиотензинпревращающего фермента 2 (ACE2). J. Pathol. 203 , 740–743 (2004).
CAS PubMed PubMed Central Google Scholar
Lin, W. et al. Связь между обнаруживаемой РНК SARS-COV-2 в анальных мазках и тяжестью заболевания у пациентов с коронавирусной болезнью 2019. J. Med. Virol. 93 , 794–802 (2021).
CAS PubMed PubMed Central Google Scholar
Ling, Y. et al. Устойчивость и клиренс вирусной РНК у пациентов, прошедших реабилитацию с новым коронавирусным заболеванием 2019 г. Подбородок. Med. J. 133 , 1039–1043 (2020).
Подбородок. Med. J. 133 , 1039–1043 (2020).
PubMed PubMed Central Google Scholar
Kujawski, S.A. et al. Клинические и вирусологические характеристики первых 12 пациентов с коронавирусной болезнью 2019 г. (COVID-19) в США. Nat. Med. 26 , 861–868 (2020).
Google Scholar
Lo, I. L. et al. Оценка выделения РНК SARS-CoV-2 в клинических образцах и клинических характеристиках 10 пациентов с COVID-19 в Макао. Внутр. J. Biol. Sci. 16 , 1698–1707 (2020).
CAS PubMed PubMed Central Google Scholar
Young, B.E. et al. Эпидемиологические особенности и клиническое течение пациентов, инфицированных SARS-CoV-2, в Сингапуре. JAMA 323 , 1488–1494 (2020).
CAS PubMed PubMed Central Google Scholar

Hua, C.Z. et al. Эпидемиологические особенности и вирусное выделение у детей с инфекцией SARS-CoV-2. J. Med. Virol. 92 , 2804–2812 (2020).
CAS PubMed PubMed Central Google Scholar
Han, M. S. et al. Нагрузка вирусной РНК у детей с легкими и бессимптомными симптомами COVID-19, Сеул. Emerg. Заразить. Дис. J. 26 , 2497–2499 (2020).
CAS Google Scholar
Xu, Y. et al. Характеристики детской инфекции SARS-CoV-2 и потенциальные доказательства стойкого фекального выделения вируса. Nat. Med. 26 , 502–505 (2020).
CAS PubMed PubMed Central Google Scholar
Liu, P. et al. Динамическое наблюдение за выделением и нейтрализацией антител SARS-CoV-2 у детей с COVID-19. Emerg. Микробы заражают. 9 , 1254–1258 (2020).
CAS PubMed PubMed Central Google Scholar
Cai, J. et al. Серия случаев заболевания детей новой коронавирусной инфекцией 2019 г .: клинико-эпидемиологические особенности. Clin. Заразить. Дис. 71 , 1547–1551 (2020).
CAS Google Scholar
Xing, Y.H. et al. Длительное выделение вируса с фекалиями у педиатрических пациентов с коронавирусной болезнью 2019. J. Microbiol. Иммунол. Заразить. 53 , 473–480 (2020).
CAS PubMed PubMed Central Google Scholar
Wu, Y. et al. Длительное присутствие вирусной РНК SARS-CoV-2 в образцах фекалий. Ланцет Гастроэнтерол. Гепатол. 5 , 434–435 (2020).
PubMed PubMed Central Google Scholar
Chen, Y. et al. Наличие РНК SARS-CoV-2 в кале пациентов с COVID-19. J. Med. Virol. 92 , 833–840 (2020).
J. Med. Virol. 92 , 833–840 (2020).
CAS PubMed PubMed Central Google Scholar
Kim, S.E. et al. Кинетика вирусной нагрузки инфекции SARS-CoV-2 в слюне у корейских пациентов: проспективное многоцентровое сравнительное исследование. J. Korean Med. Sci. 35 , e287 (2020).
CAS PubMed PubMed Central Google Scholar
Zheng, S. et al. Динамика вирусной нагрузки и тяжесть заболевания у пациентов, инфицированных SARS-CoV-2, в провинции Чжэцзян, Китай, январь-март 2020 г .: ретроспективное когортное исследование. BMJ 369 , m1443 (2020).
PubMed PubMed Central Google Scholar
Walsh, K. A. et al. Обнаружение SARS-CoV-2, вирусная нагрузка и инфекционность в течение инфекции. J. Infect. 81 , 357–371 (2020).
CAS PubMed PubMed Central Google Scholar
Wölfel, R. et al. Вирусологическая оценка госпитализированных пациентов с COVID-2019. Природа 581 , 465–469 (2020).
Google Scholar
Zhang, Y. et al. Выделение 2019-nCoV из образца кала лабораторно подтвержденного случая коронавирусной болезни 2019 (COVID-19). China CDC Wkly. 2 , 123–124 (2020).
Google Scholar
Wang, W. et al. Обнаружение SARS-CoV-2 в различных типах клинических образцов. JAMA 323 , 1843–1844 (2020).
CAS PubMed PubMed Central Google Scholar
Xiao, F. et al. Инфекционный SARS-CoV-2 в кале больного тяжелой формой COVID-19. Emerg. Заразить. Дис. 26 , 1920–1922 (2020).
CAS PubMed PubMed Central Google Scholar
Zhou, J. et al. Заражение органоидов кишечника летучих мышей и человека SARS-CoV-2. Nat. Med. 26 , 1077–1083 (2020).
CAS Google Scholar
Han, Y. et al. Идентификация ингибиторов SARS-CoV-2 с использованием органоидов легких и толстой кишки. Природа 589 , 270–275 (2021).
CAS Google Scholar
Lucas, C. et al. Продольный анализ выявляет иммунологические перебои в работе при тяжелой форме COVID-19. Природа 584 , 463–469 (2020).
CAS PubMed PubMed Central Google Scholar
Huang, C. et al. Клинические особенности пациентов, инфицированных новым коронавирусом 2019 г., в Ухане, Китай. Ланцет 395 , 497–506 (2020).
CAS PubMed PubMed Central Google Scholar

Xu, Z. et al.Патологические данные COVID-19, связанные с синдромом острого респираторного дистресс-синдрома. Ланцет Респир. Med. 8 , 420–422 (2020).
CAS PubMed PubMed Central Google Scholar
Magro, F. et al. Сравнение различных гистологических индексов при оценке активности ЯК и их точности в отношении результатов эндоскопии и уровней кальпротектина в фекалиях. Кишечник 68 , 594–603 (2019).
CAS Google Scholar
Джеффри В., Голдсон А. Дж., Дейнти Дж. Р., Чиппа М. и Соболевски А. Передача сигналов IL-6 регулирует гомеостаз крипт тонкой кишки. J. Immunol. 199 , 304–311 (2017).
CAS Google Scholar
Гривенников С.В. и др. IL-6 и Stat3 необходимы для выживания эпителиальных клеток кишечника и развития рака, связанного с колитом. Cancer Cell 15 , 103–113 (2009).
Cancer Cell 15 , 103–113 (2009).
CAS PubMed PubMed Central Google Scholar
Dann, S. M. et al. ИЛ-6-зависимая защита слизистой оболочки предотвращает создание микробной ниши для прикрепления / удаления образующих поражения кишечных бактериальных патогенов. J. Immunol. 180 , 6816–6826 (2008).
CAS Google Scholar
Xu, X. et al. Эффективное лечение тяжелых пациентов с COVID-19 с помощью тоцилизумаба. Proc. Natl Acad. Sci. США 117 , 10970–10975 (2020).
CAS PubMed PubMed Central Google Scholar
Luo, P. et al. Лечение тоцилизумабом при COVID-19: опыт единого центра. J. Med. Virol. 92 , 814–818 (2020).
CAS Google Scholar
Stone, J. H. et al. Эффективность тоцилизумаба у пациентов, госпитализированных с covid-19. N. Engl. J. Med. 383 , 2333–2344 (2020).
H. et al. Эффективность тоцилизумаба у пациентов, госпитализированных с covid-19. N. Engl. J. Med. 383 , 2333–2344 (2020).
CAS Google Scholar
Salama, C. et al. Тоцилизумаб у пациентов, госпитализированных с пневмонией, вызванной covid-19. N. Engl. J. Med. 384 , 20–30 (2021 г.).
CAS Google Scholar
Hermine, O. et al. Эффект тоцилизумаба по сравнению с обычным уходом у взрослых, госпитализированных с COVID-19 и умеренной или тяжелой пневмонией: рандомизированное клиническое исследование. JAMA Intern. Med. 181 , 32–40 (2021 г.).
CAS Google Scholar
Zhu, S. et al. Инфламмасома Nlrp9b ограничивает ротавирусную инфекцию в эпителиальных клетках кишечника. Природа 546 , 667–670 (2017).
CAS PubMed PubMed Central Google Scholar

Elinav, E. et al. Инфламмасома NLRP6 регулирует микробную экологию толстой кишки и риск колита. Ячейка 145 , 745–757 (2011).
CAS PubMed PubMed Central Google Scholar
Wang, P. et al. Nlrp6 регулирует врожденный противовирусный иммунитет кишечника. Наука 350 , 826–830 (2015).
CAS PubMed PubMed Central Google Scholar
Хуанг, К. Дж. И др. Цитокиновый шторм, связанный с интерфероном-гамма, у пациентов с ОРВИ. J. Med. Virol. 75 , 185–194 (2005).
CAS Google Scholar
Yang, Y. et al. Резкое повышение IP-10, MCP-3 и IL-1ra во время инфекции SARS-CoV-2 связано с тяжестью заболевания и летальным исходом. Препринт на medRxiv https://doi.org/10.1101/2020.03.02.20029975 (2020).
Артикул PubMed PubMed Central Google Scholar

Pu, Q. et al. Взаимодействие инфламмасом, аутофагии и некодирующих РНК: новые горизонты для лекарств. Precis. Clin. Med. 2 , 166–182 (2019).
PubMed PubMed Central Google Scholar
Siegmund, B. et al. Нейтрализация интерлейкина-18 снижает тяжесть мышиного колита и продукцию кишечного IFN-гамма и TNF-альфа. Am. J. Physiol. Regul. Интегр. Комп. Physiol. 281 , R1264 – R1273 (2001).
CAS PubMed PubMed Central Google Scholar
Monteleone, G. et al. Экспрессия биоактивного IL-18 повышается при болезни Крона. J. Immunol. 163 , 143–147 (1999).
CAS PubMed PubMed Central Google Scholar
Pizarro, T. T. et al. IL-18, новый иммунорегуляторный цитокин, активируется при болезни Крона: экспрессия и локализация в клетках слизистой оболочки кишечника. J. Immunol. 162 , 6829–6835 (1999).
J. Immunol. 162 , 6829–6835 (1999).
CAS PubMed PubMed Central Google Scholar
Nold, M. F. et al. IL-37 – фундаментальный ингибитор врожденного иммунитета. Nat. Иммунол. 11 , 1014–1022 (2010).
CAS PubMed PubMed Central Google Scholar
Gabay, C. et al. Открытое многоцентровое клиническое исследование фазы II с увеличением дозы по безопасности и эффективности тадекинига альфа (IL-18BP) при болезни Стилла у взрослых. Ann. Реум. Дис. 77 , 840–847 (2018).
CAS PubMed PubMed Central Google Scholar
Йилдиз, С., Мазель-Санчес, Б., Кандасами, М., Маникассами, Б. и Шмолке, М. Инфекция вируса гриппа А влияет на динамику системной микробиоты и вызывает количественный дисбактериоз кишечника. Микробиом 6 , 9 (2018).
PubMed PubMed Central Google Scholar
Ханада, С., Пирзаде, М., Карвер, К. Ю. и Денг, Дж. С. Изменения микробиома, вызванные респираторной вирусной инфекцией, и вторичная бактериальная пневмония. Фронт. Иммунол. 9 , 2640 (2018).
PubMed PubMed Central Google Scholar
Zuo, T. et al. Изменения микробиоты кишечника пациентов с COVID-19 во время госпитализации. Гастроэнтерология 159 , 944–955.e8 (2020).
CAS PubMed PubMed Central Google Scholar
Гева-Заторский Н. и др. Изучение микробиоты кишечника человека на наличие иммуномодулирующих организмов. Ячейка 168 , 928–943.e11 (2017).
CAS PubMed PubMed Central Google Scholar
Zhang, W. & Zhu, S. Метаболиты кишечника: сделать сирот усыновленными. Precis.Clin. Med. 2 , 87–89 (2019).
& Zhu, S. Метаболиты кишечника: сделать сирот усыновленными. Precis.Clin. Med. 2 , 87–89 (2019).
Google Scholar
Билотта, А. Дж. И Конг, Ю. Регуляция метаболитов кишечной микробиоты защитных сил организма хозяина на поверхности слизистой оболочки: значение для точной медицины. Precis. Clin. Med. 2 , 110–119 (2019).
PubMed PubMed Central Google Scholar
Haase, S., Haghikia, A., Уилк, Н., Мюллер, Д. Н. и Линкер, Р. А. Влияние метаболитов микробиома на иммунную регуляцию и аутоиммунитет. Иммунология 154 , 230–238 (2018).
CAS PubMed PubMed Central Google Scholar
Antunes, K. H. et al. Ацетат, полученный из микробиоты, защищает от респираторно-синцитиального вируса за счет интерферонового ответа GPR43-типа 1. Nat. Commun. 10 , 3273 (2019).
Commun. 10 , 3273 (2019).
PubMed PubMed Central Google Scholar
Trompette, A. et al. Пищевые волокна обеспечивают защиту от гриппа, формируя Ly6c –, патрулируя гемопоэз моноцитов и метаболизм Т-клеток CD8 + . Иммунитет 48 , 992–1005.e8 (2018).
CAS PubMed PubMed Central Google Scholar
Чу, Х.и другие. Сравнительный тропизм, кинетика репликации и профили повреждения клеток SARS-CoV-2 и SARS-CoV с последствиями для клинических проявлений, трансмиссивности и лабораторных исследований COVID-19: обсервационное исследование. Ланцетный микроб 1 , e14 – e23 (2020).
CAS PubMed PubMed Central Google Scholar
Zang, R. et al. TMPRSS2 и TMPRSS4 способствуют инфицированию SARS-CoV-2 энтероцитов тонкого кишечника человека. Sci. Иммунол. 5 , eabc3582 (2020).
Sci. Иммунол. 5 , eabc3582 (2020).
CAS PubMed PubMed Central Google Scholar
Lamers, M. M. et al. SARS-CoV-2 продуктивно инфицирует энтероциты кишечника человека. Наука 369 , 50–54 (2020).
CAS Google Scholar
Ding, S. et al. Дефицит STAG2 вызывает ответы интерферона через путь cGAS-STING и ограничивает вирусную инфекцию. Nat. Commun. 9 , 1485 (2018).
PubMed PubMed Central Google Scholar
Lau, S. K. et al. Коронавирусоподобный вирус тяжелого острого респираторного синдрома у китайских подковоносов. Proc. Natl Acad. Sci. США 102 , 14040–14045 (2005).
CAS PubMed PubMed Central Google Scholar
Ge, X. Y. et al. Выделение и характеристика коронавируса, похожего на SARS у летучих мышей, который использует рецептор ACE2. Природа 503 , 535–538 (2013).
Природа 503 , 535–538 (2013).
CAS PubMed PubMed Central Google Scholar
Wan, Y., Shang, J., Graham, R., Baric, RS & Li, F. Распознавание рецепторов новым коронавирусом из Ухани: анализ, основанный на десятилетних структурных исследованиях коронавируса SARS . Дж.Virol. 94 , e00127–20 (2020).
PubMed PubMed Central Google Scholar
Sun, S.H. et al. Мышиная модель инфекции и патогенеза SARS-CoV-2. Клеточный микроб-хозяин 28 , 124–133.e4 (2020).
CAS PubMed PubMed Central Google Scholar
Kim, Y. I. et al. Инфекция и быстрое распространение SARS-CoV-2 у хорьков. Cell Host Microbe 27 , 704–709.e2 (2020).
CAS PubMed PubMed Central Google Scholar

Munster, V.J. et al. Респираторное заболевание у макак-резусов, зараженных SARS-CoV-2. Природа 585 , 268–272 (2020).
CAS PubMed PubMed Central Google Scholar
Deng, W.и другие. Первичное воздействие SARS-CoV-2 защищает макак-резус от повторного заражения. Наука 369 , 818–823 (2020).
CAS PubMed PubMed Central Google Scholar
Sia, S. F. et al. Патогенез и передача SARS-CoV-2 у золотистых хомяков. Природа 583 , 834–838 (2020).
CAS PubMed PubMed Central Google Scholar
Bao, L. et al. Патогенность SARS-CoV-2 у трансгенных мышей hACE2. Природа 583 , 830–833 (2020).
CAS PubMed PubMed Central Google Scholar

Shi, J. et al. Восприимчивость хорьков, кошек, собак и других домашних животных к коронавирусу SARS 2. Science 368 , 1016–1020 (2020).
CAS PubMed PubMed Central Google Scholar
Hassan, A.O. et al. Модель инфекции SARS-CoV-2 на мышах демонстрирует защиту за счет нейтрализующих антител. Ячейка 182 , 744–753.e4 (2020).
CAS PubMed PubMed Central Google Scholar
Richard, M. et al. SARS-CoV-2 передается через контакт и по воздуху между хорьками. Nat. Commun. 11 , 3496 (2020).
CAS PubMed PubMed Central Google Scholar
Chan, J. F. et al. Моделирование клинических и патологических проявлений коронавирусной болезни 2019 (COVID-19) в модели золотого сирийского хомяка: последствия для патогенеза и передачи заболевания. Clin. Заразить. Дис. 71 , 2428–2446 (2020).
Clin. Заразить. Дис. 71 , 2428–2446 (2020).
CAS PubMed PubMed Central Google Scholar
Zhou, J. et al. Кишечный тракт человека служит альтернативным путем заражения коронавирусом ближневосточного респираторного синдрома. Sci. Adv. 3 , eaao4966 (2017).
PubMed PubMed Central Google Scholar
Rockx, B. et al. Сравнительный патогенез COVID-19, MERS и SARS на нечеловеческой модели приматов. Наука 368 , 1012–1015 (2020).
CAS PubMed PubMed Central Google Scholar
Jiao, L. et al.Желудочно-кишечный тракт является альтернативным путем заражения SARS-CoV-2 на модели приматов, отличных от человека. Гастроэнтерология https://doi.org/10.1053/j.gastro.2020.12.001 (2020).
Артикул PubMed PubMed Central Google Scholar

Конрад К., Роггенбак Д. и Лаасс М. В. Диагностика и классификация язвенного колита. Аутоиммун. Ред. 13 , 463–466 (2014).
CAS PubMed PubMed Central Google Scholar
CDC. Как распространяется COVID-19. CDC https://www.cdc.gov/coronavirus/2019-ncov/about/transmission.html (2020).
Offord, C. Как распространяется COVID-19. Ученый https://www.the-scientist.com/news-opinion/how-covid-19-is-spread-67143 (2020).
Правительство Гонконга. Группа ВОЗ по гигиене окружающей среды сообщает о Сямэньских садах. Правительство Гонконга https://www.info.gov.hk/gia/general/200305/16/0516114.htm (2003).
Kang, M. et al. Вероятное свидетельство передачи SARS-CoV-2 фекальным аэрозолем в многоэтажном доме. Ann. Int. Med. 173 , 974–980 (2020).
PubMed PubMed Central Google Scholar
Бушман, Ф. Д., Маккормик, К. и Шерилл-Микс, С. Вирусные структуры ограничивают способы передачи. Nat. Microbiol. 4 , 1778–1780 (2019).
CAS PubMed PubMed Central Google Scholar
Hirose, R. et al. Механизм персистенции РНК вируса гриппа человека и выживания вирионов в кале: слизь защищает вирионы от кислоты и пищеварительных соков. J. Infect. Дис. 216 , 105–109 (2017).
CAS PubMed PubMed Central Google Scholar
Kalantzi, L. et al. Характеристика содержимого верхних отделов желудочно-кишечного тракта человека в условиях, имитирующих исследования биодоступности / биоэквивалентности. Pharm. Res. 23 , 165–176 (2006).
CAS PubMed PubMed Central Google Scholar
Джантратид, Э., Янссен, Н., Реппас, К. и Дрессман, Дж. Б. Среда для растворения, имитирующая условия в проксимальном отделе желудочно-кишечного тракта человека: обновленная информация. Pharm. Res. 25 , 1663–1676 (2008).
CAS PubMed PubMed Central Google Scholar
Chan, K.H. et al. Факторы, влияющие на стабильность и инфекционность SARS-CoV-2. J. Hosp. Заразить. 106 , 226–231 (2020).
PubMed PubMed Central Google Scholar
Wurtzer, S. et al. Оценка воздействия блокировки на динамику SARS-CoV-2 посредством количественной оценки вирусного генома в сточных водах Парижа. Препринт на medRxiv https://doi.org/10.1101/2020.04.12.20062679 (2020).
Артикул Google Scholar
Wu, F. et al. Титры SARS-CoV-2 в сточных водах выше, чем ожидалось от клинически подтвержденных случаев. mСистемы 5 , e00614-20 (2020).
PubMed PubMed Central Google Scholar
Немудрый А. и др. Временное обнаружение и филогенетическая оценка SARS-CoV-2 в городских сточных водах. Cell Rep. Med. 1 , 100098 (2020).
PubMed PubMed Central Google Scholar
Ahmed, W. et al. Первое подтвержденное обнаружение SARS-CoV-2 в неочищенных сточных водах в Австралии: доказательство концепции надзора за сточными водами COVID-19 в сообществе. Sci. Всего. Environ. 728 , 138764 (2020).
CAS PubMed PubMed Central Google Scholar
Pang, X. et al. Загрязнение пищевых продуктов холодовой цепью как возможная причина возрождения COVID-19 в Пекине. Natl Sci.Ред. 7 , 1864–1864 (2020).
Google Scholar
Gou, W. et al. Микробиота кишечника может лежать в основе предрасположенности здоровых людей к COVID-19. Препринт на medRxiv https://doi.org/10.1101/2020.04.22.20076091 (2020).
Артикул Google Scholar
Фагарасан, С. и Хонджо, Т. Синтез кишечного IgA: регуляция передовых защитных сил организма. Nat. Rev. Immunol. 3 , 63–72 (2003).
CAS PubMed PubMed Central Google Scholar
Gutzeit, C., Magri, G. & Cerutti, A. Производство IgA в кишечнике и его роль во взаимодействии хозяина и микроба. Immunol. Ред. 260 , 76–85 (2014).
CAS PubMed PubMed Central Google Scholar
Tao, W. et al. Повторно обнаруживаемые положительные тесты на РНК SARS-CoV-2 у пациентов, вылечившихся от COVID-19 с кишечной инфекцией. Protein Cell https://doi.org/10.1007/s13238-020-00778-8 (2020).
Артикул PubMed PubMed Central Google Scholar
Sterlin, D. et al. IgA доминирует в раннем нейтрализующем ответе антител на SARS-CoV-2. Sci. Пер. Med. 13 , eabd2223 (2021 г.).
CAS PubMed PubMed Central Google Scholar
Ma, H. et al. Сывороточные ответы IgA, IgM и IgG при COVID-19. Cell Mol. Иммунол. 17 , 773–775 (2020).
PubMed PubMed Central Google Scholar
Zhang, Z. et al. Возможная роль аберрантного иммунного ответа слизистой оболочки на SARS-CoV-2 в патогенезе IgA-нефропатии.Препринт на medRxiv https://doi.org/10.1101/2020.12.11.20247668 (2020).
Артикул PubMed PubMed Central Google Scholar
Механ А., Венкатеш А. и Гириш М. COVID-19: следует ли уделять больше внимания стратегиям оральной вакцинации? Ther. Adv. Вакцины Immunother. 8 , 2515135520946503 (2020).
CAS PubMed PubMed Central Google Scholar
Морено-Фиеррос, Л., Гарсия-Сильва, И. и Росалес-Мендоза, С. Разработка вакцин против SARS-CoV-2: следует ли сосредоточить внимание на иммунитете слизистых оболочек? Мнение эксперта. Биол. Ther. 20 , 831–836 (2020).
CAS PubMed PubMed Central Google Scholar
Lu, X. et al. Инфекция SARS-CoV-2 у детей. N. Engl. J. Med. 382 , 1663–1665 (2020).
PubMed PubMed Central Google Scholar
Факири К. Э., Насих Х., Саб И. А., Дрейсс Г. и Бускрауи М. Эпидемиология и клинические особенности коронавирусной болезни 2019 у детей Марокко. Indian Pediatr. 57 , 808–810 (2020).
PubMed PubMed Central Google Scholar
de Ceano-Vivas, M. et al. Инфекция SARS-CoV-2 у амбулаторных и госпитализированных испанских детей. Arch. Дис. Ребенок. 105 , 808–809 (2020).
PubMed PubMed Central Google Scholar
Mahmoudi, S. et al. Коронавирусное заболевание 2019 (COVID-19) у детей: исследование в детской больнице Ирана. Заражение. Устойчивость к наркотикам. 13 , 2649–2655 (2020).
CAS PubMed PubMed Central Google Scholar
Группа реагирования CDC на COVID-19. Коронавирусная болезнь 2019 у детей – США, 12 февраля – 2 апреля 2020 г. MMWR Morb. Смертный. Wkly. Реп. 69 , 422–426 (2020).
Google Scholar
Parri, N., Lenge, M. & Buonsenso, D. Дети с COVID-19 в педиатрических отделениях неотложной помощи в Италии. N. Engl. J. Med. 383 , 187–190 (2020).
CAS Google Scholar
Кишечная инфекция вызывает симптомы болезни Паркинсона у мышей Pink1 – / –
Джонсон, М. Э., Стечер, Б., Лабри, В., Брундин, Л. и Брундин, П. Триггеры, посредники и отягощающие факторы: новое определение патогенеза болезни Паркинсона. Тенденции Neurosci . 42 , 4–13 (2019).
CAS PubMed Google Scholar
Каннаркат, Г. Т., Босс, Дж. М. и Танси, М. Г. Роль врожденного и адаптивного иммунитета при болезни Паркинсона. Дж. Паркинсона Дис. . 3 , 493–514 (2013).
PubMed PubMed Central Google Scholar
Фаррер, М. Дж. Генетика болезни Паркинсона: сдвиги парадигмы и перспективы на будущее. Nat. Ред. Genet . 7 , 306–318 (2006).
CAS PubMed Google Scholar
Нарендра, Д., Танака, А., Суен, Д. Ф. и Юл, Р. Дж. Паркин избирательно задействуется в поврежденных митохондриях и способствует их аутофагии. J. Cell Biol . 183 , 795–803 (2008).
CAS PubMed PubMed Central Google Scholar
Аллен, Г. Ф., Тот, Р., Джеймс, Дж. И Гэнли, И. Г. Потеря железа запускает PINK1 / паркин-независимую митофагию. EMBO Rep . 14 , 1127–1135 (2013).
CAS PubMed PubMed Central Google Scholar
Kageyama, Y. et al. Паркин-независимая митофагия требует Drp1 и поддерживает целостность сердца и мозга млекопитающих. EMBO J . 33 , 2798–2813 (2014).
CAS PubMed PubMed Central Google Scholar
McWilliams, T. G. et al. Фосфорилирование паркина по серину 65 необходимо для его активации in vivo . Открыть Биол . 8 , https://doi.org/10.1098 / рсоб.180108 (2018).
CAS PubMed PubMed Central Google Scholar
McWilliams, T. G. et al. Базальная митофагия происходит независимо от pink1 в тканях мышей с высокой метаболической потребностью. Ячейка Метаб . 27 , 439–449.e5 (2018).
CAS PubMed PubMed Central Google Scholar
Matheoud, D. et al. Белки PINK1 и Parkin, связанные с болезнью Паркинсона, подавляют презентацию митохондриального антигена. Ячейка 166 , 314–327 (2016).
CAS Google Scholar
Houser, M.C. & Tansey, M.G. Ось кишечник-мозг: является ли воспаление кишечника скрытой движущей силой патогенеза болезни Паркинсона? NPJ Паркинсона Дис. . 3 , 3 (2017).
PubMed PubMed Central Google Scholar
Oliveras-Salvá, M., Ван Ромпей, А.С., Химан, Б., Ван ден Хауте, К. и Бэкеландт, В. Модели грызунов с потерей функции для паркина и PINK1. Дж. Паркинсона Дис. . 1 , 229–251 (2011).
PubMed Google Scholar
Мюллер, С.Н., Джонс, С.М., Смит, С.М., Хит, В.Р. и Карбон, Франция. Быстрая активация цитотоксических Т-лимфоцитов происходит в дренирующих лимфатических узлах после кожной инфекции вируса простого герпеса в результате ранней презентации антигена и не наличие вируса. J. Exp. Мед . 195 , 651–656 (2002).
CAS PubMed PubMed Central Google Scholar
Танака А., Леунг П. С. и Гершвин М. Е. Экологические основы первичного билиарного холангита. Exp. Биол. Med. (Мэйвуд) 243 , 184–189 (2018).
CAS Google Scholar
Манди, Р., Макдональд, Т.T., Dougan, G., Frankel, G. & Wiles, S. Citrobacter rodentium мышей и человека. Cell. Микробиол . 7 , 1697–1706 (2005).
CAS PubMed Google Scholar
Sliter, D. A. et al. Паркин и PINK1 смягчают воспаление, вызванное STING. Природа 561 , 258–262 (2018).
ADS CAS Google Scholar
Ghaem-Maghami, M. et al. Интимин-специфические иммунные ответы предотвращают бактериальную колонизацию прикрепляющимся патогеном Citrobacter rodentium . Заражение. Иммунный . 69 , 5597–5605 (2001).
CAS PubMed PubMed Central Google Scholar
Nishimura, M. et al. Двойные функции фракталкина / лиганда CX3C 1 в транспортировке перфорина + / гранзима B + цитотоксических эффекторных лимфоцитов, которые определяются экспрессией CX3CR1. Дж. Иммунол . 168 , 6173–6180 (2002).
CAS PubMed Google Scholar
Nishiyori, A. et al. Локализация фракталкина и мРНК CX3CR1 в головном мозге крысы: играет ли фракталкин роль в передаче сигналов от нейрона к микроглии? FEBS Lett . 429 , 167–172 (1998).
CAS PubMed Google Scholar
Cebrián, C. et al. Экспрессия MHC-I делает катехоламинергические нейроны восприимчивыми к Т-клеточной дегенерации. Nat. Коммуна . 5 , 3633 (2014).
ADS PubMed PubMed Central Google Scholar
Kageyama, S. et al. Сильный цитолитический ответ клона CD8 + CTL на несколько пептидов из одного и того же белка в ассоциации с аллогенной молекулой MHC I класса. Дж.Иммунол . 166 , 3028–3034 (2001).
CAS PubMed Google Scholar
Dave, K. D. et al. Фенотипическая характеристика моделей болезни Паркинсона на крысах с рецессивным нокаутом гена. Neurobiol. Dis . 70 , 190–203 (2014).
CAS PubMed Google Scholar
Мацуура, К., Кабуто, Х., Макино, Х. и Огава, Н.Полюс-тест – полезный метод оценки двигательного расстройства у мышей, вызванного истощением дофамина в полосатом теле. J. Neurosci. Методы 73 , 45–48 (1997).
CAS PubMed Google Scholar
Kelm-Nelson, C.A. et al. Характеристика двигательной недостаточности с ранним началом у Pink1 – / – Модель болезни Паркинсона на мышах. Мозг Рес . 1680 , 1–12 (2018).
CAS PubMed Google Scholar
Kitada, T. et al. Нарушение высвобождения дофамина и синаптической пластичности в полосатом теле мышей с дефицитом PINK1. Proc. Natl Acad. Sci. США 104 , 11441–11446 (2007).
ADS CAS PubMed Google Scholar
Sommer, A. et al. Лимфоциты Th27 вызывают гибель нейрональных клеток в модели болезни Паркинсона на основе ИПСК человека. Стволовые клетки клеток . 23 , 123–131.e6 (2018).
CAS PubMed Google Scholar
Sulzer, D. et al. Т-клетки пациентов с болезнью Паркинсона распознают пептиды α-синуклеина. Природа 546 , 656–661 (2017).
ADS CAS PubMed PubMed Central Google Scholar
Holmqvist, S. et al.Прямые доказательства того, что патология Паркинсона распространилась из желудочно-кишечного тракта в мозг у крыс. Acta Neuropathol . 128 , 805–820 (2014).
PubMed Google Scholar
Fasano, C., Thibault, D. & Trudeau, L.E. Культура постнатальных мезэнцефальных дофаминовых нейронов на монослое астроцитов. Curr. Protoc. Neurosci . 44 , 3.21.1–3.21.19 (2008).
PubMed Google Scholar
Gundersen, H. J. et al. Новые стереологические инструменты: дезектор, фракционатор, нуклеатор и точечные выборки перехватов и их использование в патологических исследованиях и диагностике. APMIS 96 , 857–881 (1988).
CAS PubMed Google Scholar
Dutz, JP, Tsomides, TJ, Kageyama, S., Rasmussen, MH & Eisen, HN Клон цитотоксических Т-лимфоцитов может распознавать один и тот же природный собственный пептид в ассоциации с собственным и чужеродным белком MHC класса I. . Мол. Иммунол . 31 , 967–975 (1994).
CAS PubMed Google Scholar
Кишечная инфекция связана с нарушением врожденного иммунитета легких к вторичной респираторной инфекции | Открытый форум по инфекционным болезням
Аннотация
Общие сведения
Пневмония и диарея являются одними из основных причин смерти во всем мире, и эпидемиологические исследования показали, что диарея связана с повышенным риском последующей пневмонии.Наша цель состояла в том, чтобы определить влияние кишечной инфекции на врожденный иммунный ответ в легких.
Методы
Используя мышиную модель кишечной инфекции, вызванной Salmonella enterica сероваром Typhimurium ( S . Typhimurium [ ST ]), мы исследовали связь между желудочно-кишечными инфекциями и ответами врожденного иммунитета легких на бактериальную ( Klebsiella Klebsiella) ) испытание.
Результаты
Мы обнаружили изменения в частоте клеток врожденного иммунитета в легких инфицированных кишечником мышей по сравнению с неинфицированными мышами.При последующем заражении K. pneumoniae, мы обнаружили, что мыши с предшествующей кишечной инфекцией имеют более высокую бактериальную нагрузку в легких и воспаление, повышенную маргинацию нейтрофилов и внеклеточные ловушки нейтрофилов, но более низкое общее количество нейтрофилов по сравнению с мышами без предшествующей кишечной инфекции. Общее количество дендритных клеток, врожденных Т-клеток и естественных клеток-киллеров не различалось у мышей с предшествующей кишечной инфекцией и без нее.
Выводы
В совокупности эти результаты предполагают, что кишечная инфекция влияет на врожденные иммунные реакции легких, в первую очередь на характеристики нейтрофилов, потенциально приводя к повышенной восприимчивости к вторичной пневмонии.
Диарея и пневмония являются одними из основных причин смерти во всем мире. Только у детей от этих болезней ежегодно умирает около 1,4 миллиона человек, причем большинство этих смертей приходится на страны с низким и средним уровнем дохода [1]. Эпидемиологические исследования показали, что дети подвергаются повышенному риску пневмонии после эпизода диареи [2, 3]. Однако иммунологические механизмы повышенной восприимчивости к таким вторичным респираторным инфекциям изучены недостаточно.
Хотя желудочно-кишечные и дыхательные пути имеют разную среду и функции, появляются новые данные, показывающие перекрестные помехи между этими двумя участками слизистой оболочки при хронических воспалительных заболеваниях, таких как воспалительное заболевание кишечника (ВЗК) и астма [4]. Кроме того, появляются новые доказательства того, что кишечная микробиота играет роль в защите хозяина от бактериальной пневмонии [5]. Желудочно-кишечный тракт и дыхательные пути имеют одинаковое эмбриональное происхождение и имеют общие компоненты иммунной системы слизистой оболочки, такие как эпителиальный барьер, подслизистая лимфоидная ткань, выработка IgA и дефенсинов, а также наличие врожденных лимфоцитов и дендритных клеток [6].Примечательно, что некоторые врожденные лейкоциты, такие как связанные со слизистой оболочкой инвариантные Т (MAIT) клетки, инвариантные естественные киллеры T (iNKT), гамма-дельта T (γδ T) клетки, дендритные клетки (DC) и нейтрофилы, обладают способностью к циркулируют между тканями и играют важную роль в иммунитете дыхательных путей и кишечника [7, 8].
Salmonella enterica подвид 1 серовар Typhimurium ( ST ) является основной причиной энтероколита человека. У мышей серовар Typhimurium обычно не вызывает воспаления кишечника или развития диареи [9]; тем не менее, предварительно обработанная стрептомицином мышиная модель диареи Salmonella [10] стала отличным инструментом для изучения взаимодействий патоген-хозяин в слизистой оболочке кишечника.Без предварительной обработки стрептомицином пероральное инфицирование ST приводит к энтеропатии только у 5% всех животных, но после лечения однократной дозой стрептомицина у инфицированных животных развивается выраженное воспаление слизистой оболочки уже через 4-8 часов после заражения [10, 11] . Кроме того, время течения заболевания, гистопатология, паттерны цитокиновой реакции инфицированной слизистой оболочки и факторы вирулентности патогена, вызывающие заболевание, практически идентичны для мышей, предварительно обработанных стрептомицином, и моделей болезни у коров и приматов [12]. .
В целом, предварительная обработка мышей стрептомицином делает их восприимчивыми к сероварному колиту Typhimurium, который очень похож на воспалительные реакции, наблюдаемые в толстой кишке человека. Поэтому в этом исследовании мы изучаем влияние кишечной инфекции на иммунный ответ в легких мышей, используя эту установленную модель кишечной инфекции [10]. Мы обнаружили, что мыши, инфицированные S. Typhimurium, имеют повышенную восприимчивость к респираторной инфекции Klebsiella pneumoniae ( KP ) по сравнению с мышами без предшествующей кишечной инфекции.Предшествующая кишечная инфекция модулировала эффекторные клетки врожденного иммунитета в легких, что способствовало нарушению регуляции респираторного иммунитета и увеличению бактериальной нагрузки KP .
МЕТОДЫ
Мыши и прививки
Самки мышей дикого типа C57BL / 6J в возрасте от шести до 8 недель были получены из Jackson Laboratories. Всех животных содержали, и эксперименты проводили в соответствии с рекомендациями Университета штата Юта и Институционального комитета по уходу и использованию животных (протокол 17-01011).Животных содержали при постоянной температуре (25 ° C) с неограниченным доступом к пеллетной диете и воде в комнате с 12-часовым циклом свет / темнота. За всеми животными ежедневно наблюдали, и инфицированных животных оценивали по признакам тяжести клинического заболевания [13]. Животных умерщвляли с соблюдением этических норм, используя CO 2 .
Для экспериментов всех мышей предварительно обрабатывали стрептомицином, как описано ранее [10]. Вкратце, воду и пищу удаляли за 4 часа до введения 7 через желудочный зонд.5 мг стрептомицина в 100 мкл HBSS. После этого животным давали воду и корм ad libitum. Через 20 часов после обработки стрептомицином воду и корм снова удаляли в течение 4 часов перед тем, как мышам вводили через зонд 10 4 КОЕ ST (100 мкл суспензии в фосфатно-солевом буфере [PBS]) или обрабатывали стерильным PBS ( контроль). После этого немедленно предложили питьевую воду и пищу ad libitum. Через шесть дней после заражения мышей умерщвляли и легкие удаляли для анализа.
Для экспериментов с заражением KP , через 6 дней после инфицирования ST , мышей, анестезированных изофлураном, интраназально инокулировали высоким инокулятом ~ 10 10 КОЕ KP в объеме 50 мкл. Инокулированных мышей забивали через 18 часов для подсчета бактериальной нагрузки и иммунной оценки (подробности бактериальных штаммов и обоснования дозировки доступны в дополнительных методах).
Гистология легких
После смерти мышей в легкие через трахею вводили 10% нейтральный забуференный формалин, фиксировали в формалине в течение ночи, обезвоживали в 70% этиловом спирте и заливали парафином; Срезы размером 4 мкм окрашивались гематоксилином и эозином и анализировались сертифицированным анатомическим патологом (А.Х.Г.). Перед гистопатологическим анализом образцы слепили.
Оценка внеклеточной ловушки нейтрофилов в легких
Залитые парафином легкие мыши разрезали на микротоме до толщины 8 мкм. Срезы депарафинизировали и регидратировали с использованием ксилола и промывок с уменьшающейся концентрацией этанола. Вызванный нагреванием эпитопный антиген срезов легкого обрабатывали в термическом процессоре 2100 Retriever (Electron Microscopy Sciences), содержащем раствор цитратного буфера с pH 6,0.Срезы инкубировали в течение 10 минут с 0,1% Triton-X-100 и блокировали 10% ослиной сывороткой в течение 1 часа при комнатной температуре (RT). Антитела к цитруллинированному гистону h4 (Abcam) и миелопероксидазе (MPO; R&D Systems) инкубировали при разведении 1: 100 в 10% ослиной сыворотке в течение ночи при 4 ° C. После промывки срезов PBS вторичные кроличьи и козьи антитела, конъюгированные с Alexa Fluor 488 или Alexa Fluor 546, соответственно, вместе с окрашиванием ядер DAPI, инкубировали на срезах в течение 90 минут при 4 ° C.Срезы были промыты и покровные стекла приклеены водной монтажной средой (Dako, S3025). Изображения были получены на конфокальном лазерном сканирующем микроскопе Olympus FV3000. Программное обеспечение FluoView (Olympus) и ImageJ Fiji (NIH) использовалось для обработки и анализа изображений. Мы количественно оценили образование внеклеточной ловушки нейтрофилов (NET) на изображениях, используя стандартизированную сетку [14]. Вкратце, мы разместили стандартизированную сетку на случайно выбранных полевых изображениях высокой мощности (n = 5 полевых изображений / образец). Подсчитывалось количество раз, когда любая NET пересекала линию сетки.
Изоляция мононуклеарных клеток легких
Для переваривания легких и приготовления одноклеточных суспензий легкие перфузировали с использованием 5 мл PBS, собирали в асептических условиях у мертвых мышей и хранили в RPMI с 10% фетальной бычьей сывороткой (FBS). Легкие диссоциировали с использованием набора для диссоциации легких мышей (Miltenyi Biotec) и диссоциатора softMACS (Miltenyi Biotec). Затем клетки пропускали через сито для клеток 70 мкм и промывали. Эритроциты лизировали буфером для лизиса эритроцитов.Затем мононуклеарные клетки легких дважды промывали.
Количественное определение бактериальной нагрузки
Бактериальную нагрузку КП определяли путем посева 10-кратных серийных разведений гомогенатов легких на чашки с агаром MacConkey (Sigma-Aldrich). Планшеты инкубировали при 37 ° C в течение ночи перед определением бактериальных КОЕ подсчетом колоний.
Количественное определение воспаления мышей
Гомогенаты легких фильтровали через сетчатые фильтры для клеток 70 мкм и центрифугировали при 300 × g в течение 5 минут.Супернатанты хранили при –80 ° C для анализа содержания цитокинов. Уровни цитокинов в легких оценивали по образцам супернатанта с помощью набора LEGENDplex (панель 13-plex для мышей по воспалению, BioLegend) в соответствии с инструкциями производителя. Уровни цитокинов определяли с помощью проточного цитометра FACSCanto II (BD Biosciences), а анализы выполняли с использованием программного обеспечения для анализа данных LEGENDplex (BioLegend).
Окрашивание поверхности одноклеточных суспензий легких тетрамером и антителами
От каждого животного были приготовлены аликвоты 1–2 миллиона клеток и окрашены фиксируемым красителем для определения жизнеспособности eFluor 780 (eBioscience) в течение 15 минут при комнатной температуре для исключения мертвых клеток, промыты PBS + 2% FBS и инкубированы с CD16 / CD32 антимыши. Fc-блокирующие антитела (BD) в течение 20 минут при 4 ° C.Затем клетки окрашивали в течение 30 минут конъюгированными с флуоресценцией антителами либо при комнатной температуре, либо при 4 ° C (подробно описано в дополнительных методах). Всего с помощью проточного цитометра BD Fortessa было собрано 10 6 стробированных событий на образец, а результаты проанализированы с помощью программного обеспечения FlowJo 10.4.2.
Статистический анализ
Для статистического анализа использовалось программное обеспечениеGraphPad Prism 8. Тест Манна-Уитни U использовали для сравнения между неинфицированными и инфицированными ST группами, а также между мышами с предшествующей кишечной инфекцией и без нее.Результаты были представлены как среднее значение ± стандартное отклонение, P <0,05 считалось статистически значимым.
РЕЗУЛЬТАТЫ
Мыши с предшествующей инфекцией кишечника
ST имеют повышенную бактериальную нагрузку в легких, показатель заболеваемости и восприимчивость к респираторным заболеваниям KP ИнфекцияЧтобы проверить, увеличивает ли предшествующая кишечная инфекция восприимчивость к респираторной инфекции KP , мы оценили выживаемость, потерю массы тела, показатель болезни и бактериальную нагрузку в легких после заражения KP (рис. 1A).По сравнению с инфицированными ST- мышами, у которых уровень выживаемости составлял 90–100%, и мышами, инфицированными K. pneumonia , которые имели коэффициент выживаемости 60–80%, мышами с предшествующим ST кишечным кишечником. Коэффициент выживаемости инфекции составлял 0–30% через 120 часов после инфицирования KP (рис. 1B). Интересно, что хотя не было статистически значимых различий в потере массы тела между мышами с заражением ST и без заражения KP (дополнительный рисунок 1), мыши с предшествующей кишечной инфекцией имели более высокий балл заболеваемости (рисунок 1C).Эта система оценки болезни включала сгорбленную позу, взъерошенный мех, снижение подвижности и изменение частоты дыхания и качества дыхания (рис. 1С). Следует отметить, что мыши с кишечной инфекцией только ST не показали потери веса и имели более низкие показатели заболеваемости. Когда бактериальная нагрузка оценивалась через 18 и 33 часа после инфицирования KP , мы обнаружили значительно более высокую бактериальную нагрузку в легких у мышей с предшествующей кишечной инфекцией по сравнению с мышами без предшествующей кишечной инфекции (рис. 1D).Мыши с предшествующей кишечной инфекцией также показали значительно более высокую бактериальную нагрузку в легких через 33 часа по сравнению с 18 часами (рис. 1D). Нам не удалось выделить ST из гомогенатов легких мышей с кишечной инфекцией. Кроме того, в подгруппе животных мы выполнили метагеномное секвенирование следующего поколения (дополнительные методы) и наблюдали присутствие ST в образцах стула и KP в жидкости бронхоальвеолярного лаважа (БАЛ) (дополнительная таблица 1).
Рисунок 1.
Мыши с предшествующей кишечной инфекцией Salmonella enterica серовара Typhimurium ( S . Typhimurium [ ST ]) имеют повышенную восприимчивость к респираторной инфекции Klebsiella pneumoniae ( KP ). A, Хронология этого исследования. B, кривые выживания Каплана-Мейера для мышей, инфицированных ST кишечной инфекцией (S), только инфекцией KP (K), и мышей с предшествующей кишечной инфекцией ST и зараженных инфекцией KP (S + K) .Статистический анализ проводился с использованием лог-рангового критерия (Mantel-Cox) ( P = 0,07) и лог-рангового критерия значимой тенденции ( P = 0,02). C, графики оценки заболеваемости, где данные представляют кумулятивные результаты 2 независимых экспериментов (n = 4–6 для S, n = 11 для K и n = 10 для S + K) и среднее значение ± стандартное отклонение. * P <.05. Статистический анализ проводился с использованием теста Краскела-Уоллиса с последующим тестом множественного сравнения Данна. D, KP бактериальная нагрузка, определенная в легких через 18 часов после инфицирования KP в группах K и S + K.Данные представляют собой совокупные результаты 3 независимых экспериментов (n = 16 для K и n = 19 для S + K). Бактериальная нагрузка легких также определялась через 33 часа в обеих группах (n = 4 для каждой группы, n = 1 эксперимент). Данные представляют собой среднее значение ± стандартное отклонение, а статистическая значимость была определена с использованием критерия Манна-Уитни. * P <0,05; ** P <0,01.
Рисунок 1.
Мыши с предшествующей кишечной инфекцией Salmonella enterica серовара Typhimurium ( S . Typhimurium [ ST ]) имеют повышенную восприимчивость к респираторной инфекции Klebsiella pneumoniae ( KP ).A, Хронология этого исследования. B, кривые выживания Каплана-Мейера для мышей, инфицированных ST кишечной инфекцией (S), только инфекцией KP (K), и мышей с предшествующей кишечной инфекцией ST и зараженных инфекцией KP (S + K) . Статистический анализ проводился с использованием лог-рангового критерия (Mantel-Cox) ( P = 0,07) и лог-рангового критерия значимой тенденции ( P = 0,02). C, графики оценки заболеваемости, где данные представляют кумулятивные результаты 2 независимых экспериментов (n = 4–6 для S, n = 11 для K и n = 10 для S + K) и среднее значение ± стандартное отклонение.* P <.05. Статистический анализ проводился с использованием теста Краскела-Уоллиса с последующим тестом множественного сравнения Данна. D, KP бактериальная нагрузка, определенная в легких через 18 часов после инфицирования KP в группах K и S + K. Данные представляют собой совокупные результаты 3 независимых экспериментов (n = 16 для K и n = 19 для S + K). Бактериальная нагрузка легких также определялась через 33 часа в обеих группах (n = 4 для каждой группы, n = 1 эксперимент). Данные представляют собой среднее значение ± стандартное отклонение, а статистическая значимость была определена с использованием критерия Манна-Уитни.* P <0,05; ** P <0,01.
Мыши с предшествующей инфекцией
ST Кишечник усилили воспаление легких, вызванное последующим респираторным заболеванием KP ИнфекцияЗатем мы исследовали степень воспаления легких с помощью гистологического анализа срезов тканей всех 4 групп мышей. Гистопатологический анализ выявил смешанные интерстициальные воспалительные консолидации у мышей с респираторной инфекцией KP и повышенное образование микроабцессов пикнотическими нейтрофилами у мышей, коинфицированных ST и KP (фигура 2A; дополнительная таблица 2).Неинфицированные мыши и мыши с кишечной инфекцией показали нормальную гистологию альвеолярного и интерстициального легких (рис. 2А). После заражения респираторной инфекцией KP у мышей с предшествующей кишечной инфекцией ST также наблюдалась выраженная внутрисосудистая кластеризация полиморфноядерных нейтрофилов (PMN) с увеличенной границей, образованием некротических кластеров и экстравазией (фигура 2B; дополнительная фигура 2). Внутрисосудистая кластеризация нейтрофилов заметно отсутствовала в других группах лечения.Кроме того, срезы легких мышей с кишечной инфекцией и мышей с кишечной и респираторной инфекциями показали рассеянные микротромбы в сосудах размером с капилляр, тогда как мыши с респираторной инфекцией KP (без предшествующей кишечной инфекции) не показали образования микротромбов (дополнительный рисунок 3) .
Рисунок 2.
Мыши с предшествующей кишечной инфекцией Salmonella enterica серовара Typhimurium ( S . Typhimurium [ ST ]) увеличили воспаление легких в результате последующей респираторной инфекции Klebsiella pneumoniae ( KP ), характеризуемой микропроцессом. , пикнотические кластеры нейтрофилов и маргинальность по сравнению с группами без предшествующей кишечной инфекции.А. Репрезентативные изображения (увеличение 400 ×, масштабная линейка = 20 мкм) срезов легких, окрашенных гематоксилином и эозином (H&E). На вставках показано цифровое увеличение исходного изображения. У неинфицированных мышей и мышей только с кишечной инфекцией (S) черные стрелки показывают нормальную паренхиму легких. У мышей только с респираторной инфекцией (K) наблюдаются смешанные интерстициальные воспалительные уплотнения, а черная стрелка показывает нормальные нейтрофилы. У мышей с предшествующей кишечной инфекцией ST и зараженных KP-инфекцией (S + K) микроабцессы обведены кружками, а черные стрелки выделяют скопления пикнотических нейтрофилов.B: репрезентативные изображения (H&E, увеличение 400 ×, масштабная линейка = 20 мкм) срезов легких S + K-инфицированных мышей. Сосуды легких у мышей, инфицированных S + K, демонстрируют нейтрофилы (слева, черные стрелки), края и кластеры (в центре), некротические кластеры (справа, зеленая стрелка) и экстравазация (справа, черная стрелка). Данные представляют собой совокупные результаты 2 независимых экспериментов (n = 2 для UI, n = 10 для группы S, n = 9 для группы K и n = 8 для группы S + K).
Рисунок 2.
Мыши с предшествующим Salmonella enterica сероваром Typhimurium ( S .Кишечная инфекция Typhimurium [ ST ]) усилила воспаление легких в результате последующей респираторной инфекции Klebsiella pneumoniae ( KP ), характеризующейся микроабцессом, пикнотическими кластерами нейтрофилов и маргинализацией, по сравнению с пациентами без предшествующей кишечной инфекции. А. Репрезентативные изображения (увеличение 400 ×, масштабная линейка = 20 мкм) срезов легких, окрашенных гематоксилином и эозином (H&E). На вставках показано цифровое увеличение исходного изображения. У неинфицированных мышей и мышей только с кишечной инфекцией (S) черные стрелки показывают нормальную паренхиму легких.У мышей только с респираторной инфекцией (K) наблюдаются смешанные интерстициальные воспалительные уплотнения, а черная стрелка показывает нормальные нейтрофилы. У мышей с предшествующей кишечной инфекцией ST и зараженных KP-инфекцией (S + K) микроабцессы обведены кружками, а черные стрелки выделяют скопления пикнотических нейтрофилов. B: репрезентативные изображения (H&E, увеличение 400 ×, масштабная линейка = 20 мкм) срезов легких S + K-инфицированных мышей. Сосуды легких у мышей, инфицированных S + K, демонстрируют нейтрофилы (слева, черные стрелки), края и кластеры (в центре), некротические кластеры (справа, зеленая стрелка) и экстравазация (справа, черная стрелка).Данные представляют собой совокупные результаты 2 независимых экспериментов (n = 2 для UI, n = 10 для группы S, n = 9 для группы K и n = 8 для группы S + K).
Мыши с предшествующей инфекцией кишечника
ST изменили профили цитокинов легких после заражения КПТонкий баланс между провоспалительными и противовоспалительными цитокинами имеет решающее значение для сдерживания патогенов и поддержания восстановления тканей и гомеостаза в легких [11]. Предыдущие исследования показали важность цитокинов, таких как интерферон (IFN) -γ, в привлечении нейтрофилов в легочную ткань [15, 16].Мы исследовали, влияет ли кишечная инфекция на продукцию цитокинов в гомогенатах легких и влияет ли предшествующая кишечная инфекция на этот цитокиновый ответ на интраназальное введение КП . Наши результаты показывают, что по сравнению с неинфицированной контрольной группой, ST -инфицированные мыши имели значительно более высокие уровни в легких IFN-γ, моноцитарного хемоаттрактантного белка-1 и интерлейкина (IL) -1β (рис. 3A – C). Хотя Thy1-экспрессирующие естественные клетки-киллеры (NK) [17] и клетки NKp46 + ILC3 [17] обычно считаются источниками IFN-γ, появляется все больше свидетельств того, что нейтрофилы являются важным клеточным источником IFN-γ. γ во время врожденной фазы колита, индуцированного ST [18].Возможно, что большое количество примированных нейтрофилов попадает в легкие после кишечной инфекции, способствует выработке цитокинов и увеличивает вероятность опосредованной нейтрофилами патологии или образования NET при вторичной инфекции [8]. Кроме того, после заражения KP мыши с предшествующей кишечной инфекцией имели более высокие уровни IFN-γ и более низкие уровни продукции цитокинов гранулоцитарно-макрофагального колониестимулирующего фактора (GM-CSF) в гомогенатах легких по сравнению с мышами без предшествующей кишечной инфекции (фиг. 3A и D).Уровни IL-23, IL-1α, фактора некроза опухоли (TNF) α, IL-12p70, IL-10, IL-6, IL-27, IL-17A и IFN-β существенно не различались между мышами с и без предшествующей кишечной инфекции (дополнительный рисунок 4).
Рисунок 3.
Мыши с предшествующей кишечной инфекцией Salmonella enterica серовара Typhimurium ( S . Typhimurium [ ST ]) изменили профили цитокинов в легких и изменили цитокиновые реакции на респираторную инфекцию Klebsiella (Klebsiella ) Klebsiella 9214e (Klebsiella 9214e). по сравнению с пациентами без предшествующей кишечной инфекции.Уровни воспалительных цитокинов легких (A) интерферон-γ (минимальный предел обнаружения [MDL] = 2,44 пг / мл), (B) моноцитарный хемоаттрактантный белок – 1 (MDL = 2,44 пг / мл), (C) интерлейкин-1β (MDL) = 2,44 пг / мл), и (D) гранулоцитарно-макрофагальный колониестимулирующий фактор (MDL = 2,44 пг / мл) оценивали через 18 часов после контрольного заражения KP с помощью 13-сплетенного анализа воспаления на мышах LEGENDplex на основе гранул. Данные представляют 1 эксперимент для неинфицированных мышей (n = 6) и мышей, инфицированных ST (n = 6), и совокупные результаты 3 независимых экспериментов для групп K (n = 18) и S + K (n = 19).Планки погрешностей представляют собой среднее значение ± стандартное отклонение, а значимость определялась с помощью тестов Манна-Уитни.
Рисунок 3.
Мыши с предшествующей кишечной инфекцией Salmonella enterica серовара Typhimurium ( S . Typhimurium [ ST ]) изменили профили цитокинов в легких и ответили цитокинами на респираторную Klebsiella 14 (pneumoniae) инфекции по сравнению с пациентами, у которых кишечная инфекция ранее отсутствовала. Уровни воспалительных цитокинов легких (А), интерферона-γ (минимальный предел обнаружения [MDL] = 2.44 пг / мл), (B) моноцитарный хемоаттрактантный белок – 1 (MDL = 2,44 пг / мл), (C) интерлейкин-1β (MDL = 2,44 пг / мл) и (D) гранулоцитарно-макрофагальный колониестимулирующий фактор ( MDL = 2,44 пг / мл) оценивали через 18 часов после контрольного заражения KP с помощью 13-сплетенного анализа воспаления на мышах LEGENDplex на основе гранул. Данные представляют 1 эксперимент для неинфицированных мышей (n = 6) и мышей, инфицированных ST (n = 6), и совокупные результаты 3 независимых экспериментов для групп K (n = 18) и S + K (n = 19).Планки погрешностей представляют собой среднее значение ± стандартное отклонение, а значимость определялась с помощью тестов Манна-Уитни.
Мыши с предшествующей инфекцией кишечника
ST имеют меньшее количество нейтрофилов в легких после заражения KPЗатем мы исследовали влияние кишечной инфекции на врожденные клеточные ответы в легких, а также ее влияние на такие ответы на респираторную инфекцию KP . Мы проанализировали изменения в основных врожденных лейкоцитах легких (плазматические дендритные клетки [pDC], дендритные клетки, полученные из моноцитов [moDC], CD103 + DC, нейтрофилы, альвеолярные макрофаги [AMs] и интерстициальные макрофаги [IMs]) до и после Заражение KP у мышей, инфицированных ST (стратегия стробирования на дополнительной фигуре 5A).В соответствии с предыдущими исследованиями [19], мы наблюдали быстрое и устойчивое рекрутирование нейтрофилов в легкие через 18 часов после инфицирования KP по сравнению с неинфицированным контролем. Интересно, что мыши с предшествующей кишечной инфекцией ST имели значительно более низкие частоты и общее количество нейтрофилов легких после заражения KP по сравнению с мышами, инфицированными только KP (фиг. 4A). Кроме того, результаты показали, что частота pDC увеличилась, а moDC снизилась в легких ST инфицированных кишечником мышей по сравнению с неинфицированными контрольными мышами (фиг. 4B и C).После интраназального заражения KP мы обнаружили заметное увеличение частоты pDC и значительно более низкую частоту moDC у мышей с предшествующей кишечной инфекцией ST по сравнению с мышами без предшествующей кишечной инфекции (рис. 4B и C). Не наблюдали значительных различий в частотах CD103 + DC (фиг. 4D) между KP -инфицированными мышами с предшествующей кишечной инфекцией ST и без нее. Общее количество pDC, moDC, CD103 + DC, AM и IM не различались у мышей с предшествующей кишечной инфекцией по сравнению с мышами без предшествующей кишечной инфекции ST (рисунок 4; дополнительный рисунок 6).Мы также обнаружили более высокое количество нейтрофилов, pDC и IM и меньшее количество CD103 + DC у мышей с кишечной инфекцией только ST по сравнению с неинфицированными мышами (рисунок 4; дополнительный рисунок 6).
Рисунок 4.
Мыши с предшествующей кишечной инфекцией Salmonella enterica серовара Typhimurium ( S . Typhimurium [ ST ]) изменили частоту врожденных типов клеток в легких и изменили врожденные клеточные реакции легких на респираторные Klebsiella pneumoniae ( КП ) инфекция.Процентные частоты, общее количество и репрезентативные графики сортировки активируемых флуоресценцией клеток: (A) нейтрофилов, (B) плазмоцитоидных дендритных клеток легких (pDC), (C) моноцитарных дендритных клеток (moDC), (D) CD103 + дендритных клеток показаны на неинфицированных мышах (UI), ST -инфицированных мышах (S), KP -инфицированных мышах (K), а также ST и KP- инфицированных мышах (S + K). Данные представляют собой совокупные результаты 5 независимых экспериментов (n = 22 для UI, n = 24 для S, n = 25 для K и n = 22 для S + K).Планки погрешностей представляют собой среднее значение ± стандартное отклонение, и статистически значимая разница между UI и S или между K и S + K была определена с использованием тестов Манна-Уитни.
Рисунок 4.
Мыши с предшествующей кишечной инфекцией Salmonella enterica серовара Typhimurium ( S . Typhimurium [ ST ]) изменили частоту врожденных типов клеток в легких и изменили врожденные клеточные реакции легких на респираторные Klebsiella pneumoniae ( KP ) инфекция.Процентные частоты, общее количество и репрезентативные графики сортировки активируемых флуоресценцией клеток: (A) нейтрофилов, (B) плазмоцитоидных дендритных клеток легких (pDC), (C) моноцитарных дендритных клеток (moDC), (D) CD103 + дендритных клеток показаны на неинфицированных мышах (UI), ST -инфицированных мышах (S), KP -инфицированных мышах (K), а также ST и KP- инфицированных мышах (S + K). Данные представляют собой совокупные результаты 5 независимых экспериментов (n = 22 для UI, n = 24 для S, n = 25 для K и n = 22 для S + K).Планки погрешностей представляют собой среднее значение ± стандартное отклонение, и статистически значимая разница между UI и S или между K и S + K была определена с использованием тестов Манна-Уитни.
Мы также исследовали врожденные Т-клетки, включая клетки MAIT, клетки iNKT, γδ Т-клетки и естественные клетки-киллеры, поскольку они, как известно, играют важную роль в бактериальных инфекциях (стратегия стробирования на дополнительном рисунке 5B) [7]. Не наблюдалось различий в процентных частотах или общем количестве iNKT-клеток, MAIT, γδ T-клеток или NK-клеток между мышами с предшествующей кишечной инфекцией и без нее (рис. 5).Кроме того, когда общий анализ крови оценивался с помощью анализатора Hemavet, не наблюдалось значительных различий в циркулирующих нейтрофилах, лимфоцитах, моноцитах, эозинофилах, базофилах или тромбоцитах между мышами с предшествующей кишечной инфекцией и без нее (дополнительный рисунок 7).
Рисунок 5.
Мыши с предшествующей кишечной инфекцией Salmonella enterica серовара Typhimurium ( S . Typhimurium [ ST ]) не имеют различий в инвариантных Т-естественных киллерах (iNKT), инвариантных Т-лимфоцитах, связанных со слизистой оболочкой. рецептор (TCR) γδ или естественные клетки-киллеры (NK) и имеют повышенное образование нейтрофильных внеклеточных ловушек (NET) в легких в результате последующей респираторной инфекции Klebsiella pneumoniae ( KP ) по сравнению с теми, у кого не было предшествующей кишечной инфекции.Процентные частоты, общее количество и типичные графики сортировки активируемых флуоресценцией клеток для (A) клеток iNKT, (B) клеток MAIT, (C) клеток TCR γδ и (D) клеток NK показаны у неинфицированных мышей (UI), Мыши, инфицированные ST (S), мыши , инфицированные KP (K), и мыши, инфицированные как ST , так и KP (S + K). Данные представляют собой совокупные результаты 5 независимых экспериментов (n = 22 для UI, n = 24 для S, n = 25 для K и n = 22 для S + K). Планки погрешностей представляют собой среднее значение ± стандартное отклонение, и статистически значимые различия между UI и S или между K и S + K были определены с использованием тестов Манна-Уитни.E. Используя конфокальную микроскопию, образование NET было оценено во всех 4 группах, и изображения были сделаны при 60-кратном увеличении. Голубая флуоресценция = ядерная ДНК; зеленая флуоресценция = цитруллинированный гистон h4; красная флуоресценция = миелопероксидаза. NET выделены желтыми стрелками на вышележащих изображениях. F, гистограмма, показывающая количество СЕТЕЙ, пересекающих линии сетки на поле высокой мощности. Односторонний дисперсионный анализ с апостериорным тестом Тьюки. *** P <0,001.
Рисунок 5.
Мыши с предшествующим Salmonella enterica сероваром Typhimurium ( S .Typhimurium [ ST ]) кишечной инфекции не имеют различий в инвариантных естественных киллерах T (iNKT), связанных со слизистой оболочкой инвариантных T, T-клеточных рецепторах (TCR) γδ или естественных киллерах (NK) и имеют повышенную внеклеточную ловушку нейтрофилов ( NET) в легких в результате последующей респираторной инфекции Klebsiella pneumoniae ( KP ) по сравнению с инфекциями без предшествующей кишечной инфекции. Процентные частоты, общее количество и типичные графики сортировки активируемых флуоресценцией клеток для (A) клеток iNKT, (B) клеток MAIT, (C) клеток TCR γδ и (D) клеток NK показаны у неинфицированных мышей (UI), Мыши, инфицированные ST (S), мыши , инфицированные KP (K), и мыши, инфицированные как ST , так и KP (S + K).Данные представляют собой совокупные результаты 5 независимых экспериментов (n = 22 для UI, n = 24 для S, n = 25 для K и n = 22 для S + K). Планки погрешностей представляют собой среднее значение ± стандартное отклонение, и статистически значимые различия между UI и S или между K и S + K были определены с использованием тестов Манна-Уитни. E. Используя конфокальную микроскопию, образование NET было оценено во всех 4 группах, и изображения были сделаны при 60-кратном увеличении. Голубая флуоресценция = ядерная ДНК; зеленая флуоресценция = цитруллинированный гистон h4; красная флуоресценция = миелопероксидаза.NET выделены желтыми стрелками на вышележащих изображениях. F, гистограмма, показывающая количество СЕТЕЙ, пересекающих линии сетки на поле высокой мощности. Односторонний дисперсионный анализ с апостериорным тестом Тьюки. *** P <0,001.
Мыши с предшествующей инфекцией кишечника
ST демонстрируют широко распространенный нетоз легких после заражения КПНедавние исследования показали, что чрезмерное образование NET играет роль в патоген-ассоциированном повреждении легких, в том числе на моделях бактериальной пневмонии [20–23].Наш гистопатологический анализ выявил скопления пикнотических нейтрофилов и образование тромбов у мышей с предшествующей кишечной инфекцией (Рисунок 2; Дополнительный Рисунок 3). Известно, что нейтрофилы составляют ключевой клеточный компонент тромбов и участвуют в тромбозах, высвобождая NET [24]. Более того, мы обнаружили более высокие уровни IFN-γ у мышей с предшествующей кишечной инфекцией по сравнению с мышами без предшествующей кишечной инфекции (Рисунок 3), а IFN-γ может способствовать образованию NET нейтрофилами [25].Поэтому мы определили, была ли предшествующая кишечная инфекция ST связана с повышенным образованием NET в легких после интраназального введения KP . Мы исследовали цитруллинированные гистоны и МПО в тканях легких каждой экспериментальной группы методом иммунофлуоресценции. Мы обнаружили значительно большее количество NET ( P = 0,0006) у мышей с предшествующей кишечной инфекцией ST по сравнению с мышами без предшествующей кишечной инфекции (рис. 5 E и F), о чем свидетельствует присутствие внеклеточной ДНК, наложенной на цитруллинированный гистон h4 и МПО (рис. 5Е).Легкие с ложной инфекцией не показали какого-либо окрашивания на цитруллинированный гистон h4 или МПО. Мы обнаружили минимальные или отсутствующие NET в тканях легких мышей в неинфицированной контрольной группе, группе только с кишечной инфекцией ST или в группе, инфицированной только KP-, и не было существенной разницы между этими группами (рис. 5F).
ОБСУЖДЕНИЕ
Мы обнаружили, что бактериальная кишечная инфекция у мышей отрицательно влияет на иммунитет легких, повышая восприимчивость к вторичной респираторной инфекции.Мы показываем, что мыши с предшествующей кишечной инфекцией ST имеют более высокую бактериальную нагрузку в легких и показатели заболеваемости после последующего заражения KP по сравнению с мышами без предшествующей инфекции ST . Это открытие было связано с изменениями врожденных клеточных ответов, в первую очередь нейтрофилов, которые были уменьшены в паренхиме, скопления в сосудистой сети легких и связаны с повышенным образованием NET у пациентов с вторичной инфекцией. Поскольку нейтрофилы необходимы для выведения из легких бактериальных инфекций, таких как KP [9], возможно, что кишечная инфекция нарушает набор и функцию нейтрофильных ответов легких против KP , что приводит к неспособности избавиться от легочной бактериальной инфекции. тем самым ухудшается функция легких.
В дополнение к эпидемиологическим исследованиям, показывающим более высокую восприимчивость к легочным инфекциям после кишечной инфекции у детей [2, 3] и что кишечные заболевания часто связаны с легочными заболеваниями [26], иммунологические перекрестные помехи оси легкие-кишечник не очень хороши. понял. В контексте ВЗК было высказано предположение, что воспаление кишечника и повышенные уровни цитокинов создают условия, благоприятные для маргинализации нейтрофилов на эндотелии легких [27]. Когда легкое сталкивается с вторичным инсультом, рекрутирование, активация и экстравазация нейтрофилов могут опосредовать повреждение легочной ткани и респираторные заболевания, вызванные ВЗК [8, 28].Наши знания о том, как кишечная инфекция влияет на набор, экстравазацию и функцию нейтрофилов в тканях за пределами кишечника, ограничены. Исследования показали, что GM-CSF играет важную роль в накоплении нейтрофилов [29, 30], а GM-CSF оказывает защитное действие на доклинических моделях связанного с пневмонией поражения легких [31]. Мы обнаружили значительно более низкий ответ GM-CSF легких на инфекцию KP у мышей с предшествующей кишечной инфекцией, что может снизить способность легких рекрутировать циркулирующие нейтрофилы, что приводит к повышенной восприимчивости к инфекции.В соответствии с этим мы также обнаружили повышенное образование NET и микротромбоз у мышей, инфицированных KP , у мышей с предшествующей кишечной инфекцией ST по сравнению с мышами без предшествующей кишечной инфекции. Вероятно, что NET и факторы, связанные с NET, включая гистоны и протеазы гранул, опосредуют повреждение сосудов и тканей и вносят вклад в микротромбоз [14, 32–34]. Активация NETosis, регулируемого процесса гибели клеток, приводящего к образованию NET, также вызывает изменения в морфологии нейтрофилов, включая разрыв клеточной мембраны и гибель нейтрофилов [35].Мы предполагаем, что предшествующая кишечная инфекция вызывает образование NET, что способствует снижению количества жизнеспособных нейтрофилов в легких. Необходимы дальнейшие исследования, изучающие механизмы, управляющие активацией нейтрофилов и образованием NET в легких после кишечной инфекции.
Нетрадиционные Т-лимфоциты, включая клетки MAIT, и NKT-клетки и γδ-Т-клетки, обладают свойствами самонаведения тканей и участвуют в защите от респираторных бактериальных инфекций [7].Здесь мы не обнаружили различий в частотах или количестве этих клеток между тестируемыми группами. Аналогичным образом, за исключением IFN-γ, мы не обнаружили никаких различий в цитокинах, которые участвуют в защите легких от бактериальных патогенов, включая IL-17A [36], TNF-α [37] и IL-10 [38]. Сообщалось о защитной [39] и пагубной [40] роли IFN-γ при бактериальных инфекциях, и мы обнаружили значительное увеличение продукции IFN-γ в легких у мышей с кишечной инфекцией. Многочисленные исследования показали, что IFN-γ, продуцируемый активированными CD4 + и CD8 + Т-клетками и NK-клетками, играет важную роль в защитном иммунитете против Salmonella [41, 42].Хотя мы не наблюдали различий в количестве NK-клеток у мышей с предшествующей кишечной инфекцией и без нее, возможно, что активированные Т-клетки, отвечающие на консервативные микробные эпитопы, рекрутируются на ранней стадии в легкие после кишечной инфекции и являются основным источником продукции IFN-γ. . Однако важность активации Т-клеток и продукции IFN-γ в нашей модели коинфекции неясна и требует дальнейшего изучения. О модуляции респираторных DC во время инфицирования KP сообщалось ранее Hackstein et al.[43]. Хотя мы не наблюдали различий в общем количестве DC, мы наблюдали более высокие частоты pDC в легких мышей с предшествующей кишечной инфекцией, и это может быть связано с ролью респираторных pDC в восстановлении тканей [44]. С другой стороны, накопление pDC в легких после кишечной инфекции может быть вовлечено в инициирование воспаления и антиген-специфических Т-клеточных ответов [45]. Более того, частота moDC, которые могут способствовать контролю вторичной респираторной инфекции KP , была снижена у мышей с предшествующей кишечной инфекцией [46].Необходимы дальнейшие исследования для изучения функциональной роли pDC и moDC при бактериальной пневмонии после кишечной инфекции.
У нашего исследования есть несколько ограничений. Во-первых, мы не учли эффект существовавшей ранее кишечной микробиоты; тем не менее, все мыши были приобретены из одного источника и перед заражением их содержали в одном помещении. Во-вторых, мы не оценивали сывороточные уровни IL-6, TNF-α, IFN-γ и фактора роста эндотелия сосудов [27] или нейтрофильных хемокинов, таких как хемокин, происходящий из кератиноцитов (KC), воспалительный белок макрофагов 2, рецептор CXC. 2 и лиганд 5 CXC [47], что могло бы улучшить наше понимание переноса нейтрофилов в легкие после воспаления кишечника.В-третьих, мы не исследовали роль врожденных лимфоидных клеток, которые, как было показано, рекрутируются из кишечника в легкие в ответ на воспаление [48]. В-четвертых, мы не тестировали влияние более низких / градуированных доз контрольного заражения KP на мышей с предшествующей кишечной инфекцией. Наконец, мы подчеркиваем, что в нашем исследовании отсутствуют эксперименты, направленные на определение механизмов, ведущих к усилению патологии легких после кишечной инфекции. Мы предполагаем, что при вторичных инфекциях реакция нейтрофилов и выработка NET требуют точного баланса: недостаточная активность может привести к риску увеличения репликации и инвазии патогенов, тогда как чрезмерная активность может привести к чрезмерному воспалению и повреждению тканей.Необходимы будущие эксперименты, изучающие эффект истощения нейтрофилов и действие ингибиторов NET и агентов, разрушающих NET, таких как ДНКаза.
В заключение, настоящее исследование демонстрирует, что кишечная инфекция отрицательно влияет на иммунитет легких. Этот отчет открывает потенциальные возможности для изучения перекрестных иммунологических помех между легкими и кишечником во время кишечной инфекции. Хотя эпидемиологические исследования продемонстрировали эту ассоциацию легких и кишечника, мы приводим здесь новые данные о том, что кишечная инфекция модулирует нейтрофильные и цитокиновые реакции в легких, что приводит к повышенной восприимчивости к вторичной пневмонии.Эти данные могут помочь в усилиях по профилактике и лечению респираторных инфекций у людей с кишечной инфекцией или воспалением.
Дополнительные данные
Дополнительные материалы доступны на Открытом форуме по инфекционным заболеваниям в Интернете. Состоящие из данных, предоставленных авторами для удобства читателя, размещенные материалы не копируются и являются исключительной ответственностью авторов, поэтому вопросы или комментарии следует адресовать соответствующему автору.
Благодарности
Мы хотели бы поблагодарить Коула Андерсона, Майкла Грейвса, Александру Хейткамп и Мелани Преттман за их техническую помощь.
Финансовая поддержка. Эта работа была частично поддержана грантом W81XWH-17-1-0109 Министерства обороны (для D.T.L.) и Национальными институтами здравоохранения (R01HD0
для C.C.Y. и R01AI130378 для D.T.L.). Эта работа была поддержана Центром проточной цитометрии Университета штата Юта, а также Национальным институтом рака (номер премии 5P30CA042014-24) и учреждением для животных CMC.
Возможный конфликт интересов. C.C.Y. является автором патента США (патент № 10 232 023 B2) Университета штата Юта на использование пептидов, ингибирующих NET, для «лечения и профилактики воспалительных заболеваний», эксклюзивную лицензию на который имеет PEEL Therapeutics, Inc. Все авторы подали форму ICMJE для раскрытия информации о потенциальных конфликтах интересов. Выявлены конфликты, которые редакция считает относящимися к содержанию рукописи.
Вклад авторов. S.T. и D.T.L. разработал и руководил проектом. S.T., O.J. и M.J.C. провели эксперименты. D.T.L., A.H.G., K.J.W. и C.C.Y. способствовал анализу данных. S.T. и D.T.L. написал газету. P.H.S. и К. провели метагеномное секвенирование следующего поколения. T.W. проанализированы данные метагеномного секвенирования. Все авторы обсудили результаты и прокомментировали рукопись.
Согласие пациента. Исследование не включает факторы, требующие согласия пациента.
Список литературы
1.Liu
L
,Oza
S
,Hogan
D
и др.Глобальные, региональные и национальные причины смертности детей в возрасте до 5 лет в 2000-15 годах: обновленный систематический анализ с последствиями для целей устойчивого развития
.Ланцет
2016
;388
:3027
–35
. 2.Leung
DT
,Das
SK
,Malek
MA
и др.Сопутствующая пневмония у детей в возрасте до 5 лет, поступающих в диарейную больницу в Дакке, Бангладеш
.Am J Trop Med Hyg
2015
;93
:831
–5
.3.Schmidt
WP
,Cairncross
S
,Barreto
ML
и др.Недавние диарейные заболевания и риск инфекций нижних дыхательных путей у детей в возрасте до 5 лет
.Int J Epidemiol
2009
;38
:766
–72
.4.Tulic
MK
,Piche
T
,Verhasselt
V
.Перекрестный разговор легких и кишечника: доказательства, механизмы и последствия для воспалительных заболеваний слизистых оболочек
.Clin Exp Allergy
2016
;46
:519
–28
. 5.Schuijt
TJ
,Lankelma
JM
,Scicluna
BP
и др.Микробиота кишечника играет защитную роль в защите хозяина от пневмококковой пневмонии
.Кишечник
2016
;65
:575
–83
.6.Budden
KF
,Gellatly
SL
,Wood
DLA
и др.Возникающие патогенные связи между микробиотой и осью кишечник – легкие
.Nat Rev Microbiol
2017
;15
:55
–63
.7.Иванов
S
,Paget
C
,Trottein
F
.Роль нетрадиционных Т-лимфоцитов в респираторных инфекциях: случай пневмококка
.PLoS Pathog
2014
;10
:e1004300
.8.Mateer
SW
,Maltby
S
,Marks
E
и др.Возможные механизмы регуляции легочной патологии при воспалительном заболевании кишечника
.J Leukoc Biol
2015
;98
:727
–37
.9.Xiong
H
,Carter
RA
,Leiner
IM
и др. Различный вклад нейтрофилов и моноцитов CCR2 + в легочный клиренс различных штаммов Klebsiella pneumoniae. Инфекция Иммун2015
; 83: 3418–27.10.Barthel
M
,Hapfelmeier
S
,Quintanilla-Martínez
L
и др.Предварительная обработка мышей стрептомицином дает модель Salmonella enterica серовара Typhimurium colitis, которая позволяет анализировать как патоген, так и хозяин
.Infect Immun
2003
;71
:2839
–58
. 11.Altmeyer
M
,Barthel
M
,Eberhard
M
и др.Отсутствие поли (АДФ-рибоза) полимеразы 1 задерживает начало Salmonella enterica серовара Typhimurium-индуцированного воспаления кишечника
.Infect Immun
2010
;78
:3420
–31
.12.Kaiser
P
,Hardt
WD
.Salmonella typhimurium диарея: переключение эпителия слизистой оболочки с гомеостаза на защиту
.Curr Opin Immunol
2011
;23
:456
–63
. 13.Burkholder
T
,Foltz
C
,Karlsson
E
и др.Оценка здоровья экспериментальных лабораторных мышей
.Curr Protoc Mouse Biol
2012
;2
:145
–65
. 14.Йост
CC
,Schwertz
H
,Cody
MJ
и др.Неонатальный фактор ингибирования NET и родственные пептиды ингибируют образование внеклеточной ловушки нейтрофилов
.J Clin Invest
2016
;126
:3783
–98
.15.Yamada
M
,Gomez
JC
,Chugh
PE
и др.Продукция интерферона-γ нейтрофилами при бактериальной пневмонии у мышей
.Am J Respir Crit Care Med
2011
;183
:1391
–401
.16.Печоус
РД
.С такими друзьями: сложная роль нейтрофилов в прогрессировании тяжелой пневмонии
.Front Cell Infect Microbiol
2017
;7
:160
. 17.Kupz
A
,Scott
TA
,Belz
GT
и др.Вклад Thy1 + NK-клеток в выработку защитного IFN-γ при заражении Salmonella typhimurium
.Proc Natl Acad Sci U S A
2013
;110
:2252
–7
. 18.Spees
AM
,Kingsbury
DD
,Wangdi
T
и др.Нейтрофилы являются источником гамма-интерферона во время острой болезни Salmonella enterica серовар Typhimurium colitis
.Infect Immun
2014
;82
:1692
–7
. 19.Zhang
S
,Kingsley
RA
,Santos
RL
и др.Молекулярный патогенез Salmonella enterica диарея, индуцированная Typhimurium серотипа
.Infect Immun
2003
;71
:1
–12
.20.Narasaraju
T
,Yang
E
,Samy
RP
и др.Избыточные нейтрофилы и внеклеточные ловушки нейтрофилов способствуют острому поражению легких при гриппозном пневмоните
.Am J Pathol
2011
;179
:199
–210
. 21.Porto
BN
,Stein
RT
.Внеклеточные ловушки нейтрофилов при легочных заболеваниях: слишком много хорошего?
Фронт Иммунол
2016
;7
:311
.22.Lefrançais
E
,Mallavia
B
,Zhuo
H
,Calfee
CS
,Looney
MR
.Неадаптивная роль внеклеточных ловушек нейтрофилов в патоген-индуцированном повреждении легких
.JCI Insight
2018
;3
:e98178
. 23.Пулавендран
S
,Прашанти
M
,Рамачандран
A
и др.Производство внеклеточных ловушек нейтрофилов способствует патогенезу туляремии Francisella
.Frontiers Immunol
2020
;11
. 24.фон Брюля
ML
,Stark
K
,Steinhart
A
и др.Моноциты, нейтрофилы и тромбоциты взаимодействуют, чтобы инициировать и распространять венозный тромбоз у мышей in vivo
.J Exp Med
2012
;209
:819
–35
.25.Bertin
FR
,Rys
RN
,Mathieu
C
и др.Естественные клетки-киллеры индуцируют образование внеклеточной ловушки нейтрофилов при венозном тромбозе
.J Thromb Haemost
2019
;17
:403
–14
. 26.Kelly
MG
,Frizelle
FA
,Thornley
PT
и др.Воспалительное заболевание кишечника и легких: есть ли связь между хирургическим вмешательством и бронхоэктазами?
Int J Colorectal Dis
2006
;21
:754
–7
.27.Scaldaferri
F
,Vetrano
S
,Sans
M
и др.VEGF-A связывает ангиогенез и воспаление в патогенезе воспалительного заболевания кишечника
.2009
;136
:585
–95.e5
. 28.Margraf
A
,Ley
K
,Zarbock
A
.Рекрутмент нейтрофилов: от модельных систем до тканеспецифичных паттернов
.Trends Immunol
2019
;40
:613
–34
,29.Khajah
M
,Millen
B
,Cara
DC
и др.Гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF): хемоаттрактивный агент для лейкоцитов мышей in vivo
.J Leukoc Biol
2011
;89
:945
–53
.30.Laan
M
,Prause
O
,Miyamoto
M
и др.Роль GM-CSF в накоплении нейтрофилов в дыхательных путях, вызванном IL-17 и TNF-alpha
.Eur Respir J
2003
;21
:387
–93
. 31.Quinton
LJ
.GM-CSF: двойная доза защиты при пневмонии
.Am J Physiol Lung Cell Mol Physiol
2012
;302
:L445–6
.32.Cheng
OZ
,Palaniyar
N
.Балансировка NET: проблема воспалительных заболеваний легких
.Фронт Иммунол
2013
;4
:1
.33.Мартинод
К
,Вагнер
DD
.Тромбоз: запутался в СЕТИ
.Кровь
2014
;123
:2768
–76
. 34.Fuchs
TA
,Brill
A
,Wagner
DD
.Влияние внеклеточной ловушки нейтрофилов (NET) на тромбоз глубоких вен
.Артериосклер Тромб Васк Биол
2012
;32
:1777
–83
.35.Бринкманн
В
,Зихлинский
А
.Самоубийство с пользой: почему нейтрофилы умирают, образуя NET
.Nat Rev Microbiol
2007
;5
:577
–82
.36.Simonian
PL
,Roark
CL
,Wehrmann
F
и др.Т-клетки, экспрессирующие IL-17A, необходимы для бактериального клиренса в мышиной модели гиперчувствительного пневмонита
.J Immunol
2009
;182
:6540
–9
0,37.Skerrett
SJ
,Martin
TR
,Chi
EY
и др.Роль рецептора TNF типа 1 в воспалении легких после вдыхания эндотоксина или Pseudomonas aeruginosa
.Am J Physiol
1999
;276
:L715
–27
0,38.Канг
MJ
,Ян
AR
,Park
JY
и др.IL-10 защищает мышей от инфекции легких, вызванной Acinetobacter baumannii , и способствует бактериальному клиренсу, регулируя STAT3-опосредованную экспрессию MARCO в макрофагах
.Фронт Иммунол
2020
;11
:270
.39.Moore
TA
,Perry
ML
,Getsoian
AG
, et al.Дивергентная роль гамма-интерферона в мышиной модели легочной инфекции по сравнению с системной Klebsiella pneumoniae
.Infect Immun
2002
;70
:6310
–8
.40.Schultz
MJ
,Rijneveld
AW
,Speelman
P
и др.Эндогенный гамма-интерферон снижает бактериальный клиренс из легких во время Pseudomonas aeruginosa пневмонии
.евро Cytokine Netw
2001
;12
:39
–44
.41.Mittrücker
H-W
,Köhler
A
,Kaufmann
SHE
.Характеристика ответа мышиных Т-лимфоцитов на инфицирование сероваром Typhimurium Salmonella enterica
.Infect Immun
2002
;70
:199
–203
.42.Равиндран
R
,McSorley
SJ
.Отслеживание динамики активации Т-клеток в ответ на инфекцию Salmonella
.Иммунология
2005
;114
:450
–8
. 43.Hackstein
H
,Kranz
S
,Lippitsch
A
и др.Модуляция респираторных дендритных клеток при инфицировании Klebsiella pneumonia
.Respir Res
2013
;14
:91
.44.Грегорио
J
,Меллер
S
,Конрад
C
и др.Плазмацитоидные дендритные клетки ощущают повреждение кожи и способствуют заживлению ран с помощью интерферонов типа I
.J Exp Med
2010
;207
:2921
–30
.45.Takagi
H
,Fukaya
T
,Eizumi
K
и др.Плазмацитоидные дендритные клетки имеют решающее значение для инициирования воспаления и Т-клеточного иммунитета in vivo
.Иммунитет
2011
;35
:958
–71
. 46.Бибер
К
,Аутенриет
SE
.Развитие дендритных клеток при инфекции
.Мол Иммунол
2020
;121
:111
–7
. 47.Tateda
K
,Moore
TA
,Newstead
МВт
и др.Хемокин-зависимое рекрутирование нейтрофилов в мышиной модели Legionella pneumonia: потенциальная роль нейтрофилов как иммунорегуляторных клеток
.Infect Immun
2001
;69
:2017
–24
.48.Mjösberg
J
,Rao
A
.Воспаление легких из кишечника
.Наука
2018
;359
:36
–7
.© Автор (ы) 2021. Опубликовано Oxford University Press от имени Общества инфекционных болезней Америки.
Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution-NonCommercial-NoDerivs (http: // creativecommons.org / licenses / by-nc-nd / 4.0 /), который разрешает некоммерческое воспроизведение и распространение работы на любом носителе, при условии, что оригинальная работа не была изменена или преобразована каким-либо образом, и что работа правильно процитирована . По вопросам коммерческого повторного использования обращайтесь по адресу [email protected].Постинфекционный СРК – О СРК
Синдром раздраженного кишечника (СРК) – одно из наиболее распространенных желудочно-кишечных (ЖКТ) расстройств. В этой большой группе больных есть небольшая подгруппа, у которых симптомы СРК начинаются внезапно.Это происходит после того, что кажется приступом инфекции желудка и кишечника (гастроэнтерит), и называется постинфекционным СРК (ИП-СРК).
В то время как большинство людей полностью выздоравливают после первоначальной болезни, некоторые нет. PI-IBS кажется необычным после инфекции желудочно-кишечного тракта, вызванной вирусом. Возбудитель инфекции обычно бактериальный.
PI-IBS был впервые обнаружен во время Второй мировой войны у солдат, возвращавшихся в Соединенное Королевство. У них развились симптомы СРК после бактериальной дизентерии.
Совсем недавно был описан PI-IBS после инфекций, вызванных рядом бактерий, включая Campylobacter, Salmonella и Shigella. Бактериальные инфекции обычно передаются при употреблении зараженной пищи или воды либо при контакте с инфицированными людьми или животными.
Насколько распространен PI-IBS?
От 6 до 17% людей с СРК, у которых ранее было нормальное опорожнение кишечника, считают, что их болезнь началась внезапно в связи с инфекционным заболеванием. Хотя оценки различаются, исследования показывают, что около 10% людей, страдающих бактериальным гастроэнтеритом, заболевают СРК.
Большинство зарегистрированных случаев относятся к подтипу СРК с преобладанием диареи (СРК-Д) или смешанным (СРК-М) (чередование диареи и запора). Реже регистрируется подтип СРК с преобладанием запора (СРК-З).
Кто получает PI-IBS?
Факторы риска для PI-IBS включают:
- Продолжительность и тяжесть начального заболевания
- Характеристики инфицированного человека, такие как психологические факторы, пол и возраст
- Способность бактерий производить токсин
Недавние данные свидетельствуют о том, что здесь также может быть генетический фактор.Самые сильные факторы риска связаны с продолжительностью и тяжестью первоначального заболевания. Более длительное и тяжелое начальное заболевание приводит к большему риску развития PI-IBS.
Несколько исследований показывают, что психологические факторы, такие как хронический стресс или беспокойство, а также неблагоприятные жизненные события в месяцы, предшествующие инфицированию, увеличивают риск примерно в два раза.
PI-IBS чаще отмечается у женщин, хотя пол, по-видимому, не влияет на иммунную систему в кишечнике и ее реакцию на инфекцию.
Campylobacter jejuni – это вид бактерий, которые обычно вызывают гастроэнтерит. Исследования показали, что он производит токсин, который может нарушить работу кишечника. В этих исследованиях люди старше 60 лет имели примерно 1/3 риска развития PI-IBS по сравнению с людьми в возрасте 19–29 лет. Рвота во время начальной болезни (один из способов избавления организма от вредных микробов) также снижает риск PI-IBS примерно на 50%.
Что вызывает PI-IBS?
Воспаление – это один из способов реакции организма на нежелательные микробы.Это часть сложного иммунного ответа. Иммунная система должна включаться и выключаться в нужное время, чтобы бороться с инфекцией и не причинять вреда. Задержка выключения нормального воспалительного ответа после первоначальной инфекции может быть одной из причин PI-IBS. Незначительное воспаление может сохраняться годами. Эти воспалительные изменения при СРК очень малозаметны и обычно не обнаруживаются.
Изменения нервов, выстилающих кишечник, также могут быть важным фактором. Инфекция может вызвать повреждение нервов, отвечающих за моторику и чувствительность кишечника.Это может привести к изменению дефекации и ненормальному осознанию боли в желудочно-кишечном тракте.
Существуют ли какие-либо методы лечения PI-IBS?
Специального лечения PI-IBS не существует. Тактика при PI-IBS, как и при других типах IBS, зависит от тяжести отдельных симптомов и основных симптомов.
Узнайте больше о вариантах лечения СРК
Следует обратить внимание на факторы диеты или образа жизни, которые, по-видимому, ухудшают симптомы. Это также относится к любым психологическим проблемам, которые могут возникнуть, например, к хроническому стрессу.Ваш врач или другой поставщик медицинских услуг может порекомендовать лекарства, которые помогут контролировать ваши симптомы.
Для разработки дополнительных методов лечения необходимы дополнительные исследования. В настоящее время изучаются исследования, направленные на устранение основных причин PI-IBS.
Каковы перспективы восстановления в PI-IBS?
Исследования показывают, что около 50% пациентов с PI-IBS выздоравливают без специального лечения, хотя это может занять несколько лет. Сосуществование тяжелой нелеченной тревоги или депрессии может снизить шансы на выздоровление.В целом, хотя симптомы могут сохраняться годами, перспективы улучшения обнадеживают.
Источник: адаптировано из публикации IFFGD № 210 Робина Спиллера, доктора медицины, профессора гастроэнтерологии, Университетская больница, Ноттингем, Соединенное Королевство.
Инфекция толстой кишки: все, что вам нужно знать об этом
Инфекция – одна из причин воспаления толстой кишки. (Источник: File Photo / Getty Images / Thinkstock)Кишечные инфекции продолжают вызывать беспокойство у многих пациентов и их семей.Согласно исследованию, опубликованному в июне 2019 года в журнале Journal of Family Medicine and Primary Care , в такой развивающейся стране, как Индия, кишечные паразитарные инфекции остаются важной проблемой общественного здравоохранения. «Инфекция остается основной причиной заболеваемости и смертности, особенно среди детей. Предполагается, что распространенность высока в развивающихся странах, вероятно, из-за плохих санитарных условий и неправильной практики личной гигиены ».
Инфекция толстой кишки
Колит – хроническое заболевание пищеварительной системы, характеризующееся воспалением внутренней оболочки толстой кишки, длинного, спиралевидного, похожего на трубку органа, также известного как толстый кишечник, который, как известно, удаляет воду и соль из переваренной пищи.Когда организм готов к дефекации, отходы сбрасываются в прямую кишку. По данным Национального центра биотехнологической информации (NCBI), «толстая кишка является обычным местом заражения гетерогенной группы бактериальных патогенов».
Согласно доктору Вивеку Вию, директору больницы Фортис, Нойда; Мемориальный исследовательский институт Фортис, Гуруграм; Институт сердца Fortis Escorts, Охла-роуд, «Инфекция толстой кишки или колит – это широкий термин, включающий любую инфекцию (бактериальную, вирусную, амебную и т. Д.) Толстой кишки.Это может произойти из-за негигиеничной еды, воды и т. Д. »
Симптомы
Симптомы воспаления толстой кишки, среди прочего, включают диарею с кровью или без нее, боль в животе и спазмы, лихорадку, тошноту, усталость, потерю веса и вздутие живота.
Причины воспаления толстой кишки
Инфекция – одна из причин воспаления толстой кишки. Колит может быть вызван вирусами, бактериями и паразитами. Инфекционным колитом можно заразиться из-за загрязненной воды, болезней пищевого происхождения или плохой гигиены.
Другие причины включают воспалительное заболевание кишечника (ВЗК), ишемический колит, диарею и боль в животе.
Профилактика
Также может возникать спонтанно у некоторых пациентов со сниженным иммунитетом. Это можно предотвратить, обеспечив потребление гигиеничной пищи и чистой воды. «Пациенты со сниженным иммунитетом должны регулярно контактировать со своим врачом», – посоветовал доктор Видж.
Обнаружение
Некоторые распространенные тесты на колит включают рентген толстой кишки, анализ кала на кровь и гной, ректороманоскопию и колоноскопию.Дополнительные анализы включают посев стула и анализы крови, в том числе биохимические анализы крови.
Лечение
Согласно NCBI, «заболевание толстой кишки обычно проявляется в виде отдельных синдромов, и для врачей важно распознать возбудителей, потому что специфическое лечение очень эффективно».
Лечение зависит от причины колита. Во многих случаях требуется немного больше, чем симптоматическая помощь, включая прозрачные жидкости для отдыха кишечника и лекарства для контроля боли.Пациенты с острым заболеванием часто нуждаются в внутривенном введении жидкости среди других вмешательств.
В то время как инфекция толстой кишки, вызванная диареей и колитом, потенциально может потребовать антибиотиков, в зависимости от причины, вирусные инфекции требуют жидкости и времени. Некоторые бактериальные инфекции, такие как сальмонелла, не нуждаются в антибактериальной терапии, поскольку организм может избавиться от инфекции самостоятельно. Другие бактериальные инфекции, такие как Clostridium difficile, требуют лечения антибиотиками.
Воспалительное заболевание кишечника (ВЗК)
Лекарства часто используются для борьбы с ВЗК.Первоначально могут использоваться противовоспалительные препараты, а при необходимости могут быть добавлены препараты, подавляющие иммунную систему. В тяжелых случаях возможно хирургическое вмешательство, включая удаление толстой и тонкой кишки.
Ишемический колит
Жидкости внутривенно вводятся для отдыха кишечника и предотвращения обезвоживания. Если не восстанавливается достаточное кровоснабжение, может потребоваться операция по удалению частей кишечника, которые потеряли кровоснабжение.
Диарея и боли в животе
Начальное лечение в домашних условиях может включать в себя жидкую диету в течение 24 часов и отдых.Если симптомы проходят быстро, дальнейший уход не требуется.
Кишечная инфекция: 3 распространенные причины и 2 варианта лечения
Ничего хорошего от кишечной инфекции не бывает. Вот как позаботиться о себе при ударе.
Кишечные инфекции, как правило, поражаются в самые худшие времена.Пять лет назад мы с мужем и двумя детьми путешествовали от одного хорватского острова к другому, когда это случилось – мучительные судороги сдвинули меня вдвое, а пот стекал по каждой щели. Меня перешло от легкой тошноты к желанию умереть в течение нескольких минут – все из-за кишечной инфекции, которую я развил после употребления в пищу плохого тунца 12 часов назад.
Неважно, вызваны ли они пищевым заболеванием, как у меня, паразитом или бактериями, полученными вами от своих детей, кишечные инфекции опасны.Они вызывают воспаление желудочно-кишечного тракта (то есть желудка и тонкой кишки). Их наиболее тревожный побочный эффект: обезвоживание. Вот что вам нужно знать о кишечных инфекциях: от распознавания ключей, необходимых для диагностики вашего заболевания, до изучения способов лечения и предотвращения его распространения.
Каковы наиболее распространенные признаки и симптомы желудочно-кишечных расстройств?
Признак номер один того, что вы заразились кишечной инфекцией? Понос.«Большинство инфекций желудочно-кишечного тракта вызываются вирусами, которые проявляются в виде кратковременной водянистой диареи», – говорит доктор Дэниел Фридберг, доктор медицинских наук, доцент медицинского центра Колумбийского университета. «Дизентерия (кровавый понос) чаще вызывается бактериями». Другие симптомы включают тошноту, рвоту, судороги, а иногда и лихорадку.
Сколько времени нужно, чтобы преодолеть кишечную инфекцию?
Это зависит от того, каким типом кишечной инфекции вы страдаете. В то время как с некоторыми заболеваниями, такими как пищевое заболевание, можно справиться в течение 24 часов, для преодоления других, например некоторых паразитов, могут потребоваться месяцы.
Какие антибиотики лечат кишечную инфекцию?
В некоторых случаях время и большое количество жидкости – единственное лечение кишечной инфекции. Для других, таких как бактериальные инфекции или паразиты, могут помочь антибиотики. По словам Фридберга, наиболее часто назначаемые лекарства для лечения кишечных инфекций включают фторхинолоны и метриндазол, азитромицин и триметерприм-сульфаметоксазол. «Но это полностью зависит от организма, и используются самые разные лекарства, в том числе и антипаразитарные.”
Распространенные типы кишечных инфекций
Есть три основных типа кишечных инфекций.
- Норовирус. Эта группа вирусов вызывает гастроэнтерит (т.е. воспаление желудка или кишечника), который приводит к спазмам, тошноте, рвоте и диарее. По данным Центров по контролю за заболеваниями (CDC), норовирус вызывает от 19 до 21 миллиона заболеваний ежегодно. По их оценкам, «человек заразится норовирусом примерно 5 раз в течение жизни.«Если у вас когда-либо была такая кишечная инфекция, вы знаете, что один раз – это слишком много! Норовирус также может вызвать пищевое заболевание, если микробы попали в продукт. Он очень заразен: более 80 процентов вспышек происходит зимой (то есть с ноября по апрель).
- Бактериальные инфекции пищевого происхождения. По данным CDC, 48 миллионов человек ежегодно заболевают болезнями пищевого происхождения. Они также утверждают, что выявлено более 250 из этих заболеваний.«Большинство из них – инфекции, вызываемые различными бактериями, вирусами и паразитами», – говорится в сообщении CDC. Один из наиболее распространенных типов болезней пищевого происхождения, Clostridium perfringens, ежегодно вызывает около миллиона случаев пищевого отравления. Эта бактерия, обычно встречающаяся в сыром мясе и птице, может быстро размножаться и создавать токсины в кишечнике. По данным CDC, его часто получают от «говядины, птицы, подливок, сушеных или полуфабрикатов». Хорошая новость: симптомы появляются быстро и длятся менее 24 часов.Кроме того, у вас вряд ли возникнет рвота или поднимется температура, и это не заразно. Наш старый друг сальмонелла – еще одно заболевание пищевого происхождения, которое может привести к кишечной инфекции. По данным CDC, сальмонелла ежегодно вызывает около 1,1 миллиона заболеваний в США. Симптомы включают диарею, лихорадку и спазмы в животе, которые появляются через 12-72 часа после заражения. На выздоровление требуется от 4 до 7 дней. Шигелла и кишечная палочка – это еще два типа бактерий, которые могут вызывать кишечную инфекцию.Как и в случае с Clostridium perfingens и сальмонеллой, они часто заражаются при употреблении недостаточно приготовленной пищи (например, птицы, говядины, молочных продуктов или яиц). Они также могут передаваться после тесного контакта с зараженным животным или его водой.
- Кишечные паразиты. Еще одна частая причина кишечной инфекции, которую часто принимают за пищевое отравление. По данным CDC, «лямблиоз является наиболее часто диагностируемым кишечным паразитарным заболеванием в Соединенных Штатах и среди путешественников с хронической диареей.Оно может длиться от одной до двух недель или дольше и включает такие симптомы, как газы, жирный стул, спазмы в животе, тошнота, рвота и диарея. Они появляются через 7-10 дней после заражения. Лямблиоз часто встречается в воде (например, в бассейне или озере) и заражается после попадания внутрь. Cryptosporidium – еще один распространенный паразит, который обычно распространяется таким же образом.
Что есть (и чего избегать) при кишечной инфекции
Ваша первая линия защиты при кишечной инфекции: пейте много жидкости, чтобы избежать обезвоживания.Затем постепенно попробуйте мягкую диету, известную как BRAT (бананы, рис, яблочное пюре и тосты), – рекомендует Фридберг. Однако избегайте молочных продуктов, поскольку большинство заболеваний, вызывающих инфекционную диарею, вызывают мальабсорбцию лактозы. «Точные продукты питания, вероятно, не имеют решающего значения, – говорит он, – но следует избегать алкоголя, молочных продуктов, очень жирной пищи и продуктов, которые могут способствовать развитию диареи».
Заразна ли кишечная инфекция?
Зависит от типа.Как упоминалось ранее, некоторые инфекции, такие как норовирус, очень заразны. Другие, такие как болезни пищевого происхождения, легко передаются от инфицированных продуктов, но вряд ли передаются от одного человека к другому (если, например, вам не удалось натереть сырого цыпленка о руки или рот друга). Тем не менее, говорит Фридберг, «большинство инфекций ЖКТ заразны и передаются при случайном проглатывании фекального материала. Однако контакт с потенциальным патогеном не является синонимом инфекции.Другими словами, заразитесь ли вы кишечной инфекцией, зависит от того, сколько инфицированных организмов вы проглотили (ужасно!), А также от того, насколько вы были здоровы, когда проглотили их.
Как предотвратить кишечную инфекцию
Лучший способ не заболеть: вымыть руки! Также тщательно промывайте фрукты и овощи и тщательно готовьте птицу, мясо, устриц и других моллюсков. После приготовления храните пищу при правильной температуре (140 ° F или выше, или 40 ° F или ниже), чтобы предотвратить рост спор бактерий, которые могли выжить в процессе приготовления.Охладите пищу до 40 ° F или ниже в течение двух часов после приготовления и разогрейте как минимум до 165 ° F.
Также очищайте и дезинфицируйте загрязненные поверхности (например, туалеты, столешницы, пульты от телевизора и дверные ручки). Еще одна вещь: снимите и постирайте одежду или простыни сразу после их загрязнения.
Кишечная инфекция: домашние средства
«Оральная регидратация – безусловно, самое важное домашнее средство», – говорит доктор Фридберг. Повысьте уровень электролитов, потерянных при диарее и рвоте, добавив столовую ложку сахара и половину чайной ложки соли в один литр воды.Затем выпейте. «Когда люди умирают от инфекционной диареи (обычно в развивающихся странах), этот рецепт спасает жизни», – говорит он. =
Насколько распространены кишечные инфекции?
Очень хорошо, – говорит доктор Фридберг. «Здоровый человек может ожидать заражения кишечной инфекцией – обычно легкой, обычно вирусной – каждые несколько лет». Отлично, чего стоит ждать!
Для чтения по теме посетите эти сообщения:
Эта статья изначально была опубликована в 2018 году.

 При острых кишечных инфекциях вирусной этиологии наряду с поражениями кишечника отмечаются изменения со стороны верхних дыхательных путей: неба, дужек, язычка – при ротавирусной инфекции; трахеобронхит – при аденовирусной инфекции.
При острых кишечных инфекциях вирусной этиологии наряду с поражениями кишечника отмечаются изменения со стороны верхних дыхательных путей: неба, дужек, язычка – при ротавирусной инфекции; трахеобронхит – при аденовирусной инфекции. Но при действии высокой температуры, например – при кипячении, возбудители кишечных инфекций погибают.
Но при действии высокой температуры, например – при кипячении, возбудители кишечных инфекций погибают.