Как нормализовать микрофлору кишечника народными средствами: Восстанавливаем микрофлору кишечника народными средствами
Восстанавливаем микрофлору кишечника народными средствами
Простудные заболевания, антибиотики, некачественная еда – вот и причина дисбактериоза.
Но есть очень эффективная процедура, которая вполне может быть проведена в домашних условиях.
Надо сказать, что флора, живущая в кишечнике каждого человека, очень чутка и ранима, навредить ей очень легко. Повредить или даже уничтожить флору кишечника может множество факторов. И если уничтожить микроорганизмы, живущие в кишечники очень просто, то их восстановление может занять продолжительное время.
Ученые утверждают, что микроорганизмы в кишечнике неоднородны, всего в желудочно-кишечном тракте могут проживать до пятисот видов разнообразных крохотных организмов. Повредить микроорганизмам могут самые разные причины и факторы.
Во-первых, уничтожить флору кишечника могут различные врожденные болезни, которые приводят к недостатку (или переизбытку) фермента.
Во-вторых, флора может быть уничтожена вследствие принятия медикаментозных средств (например антибиотиков), а также из-за неправильного питания, различных инфекций и излишка алкогольных напитков.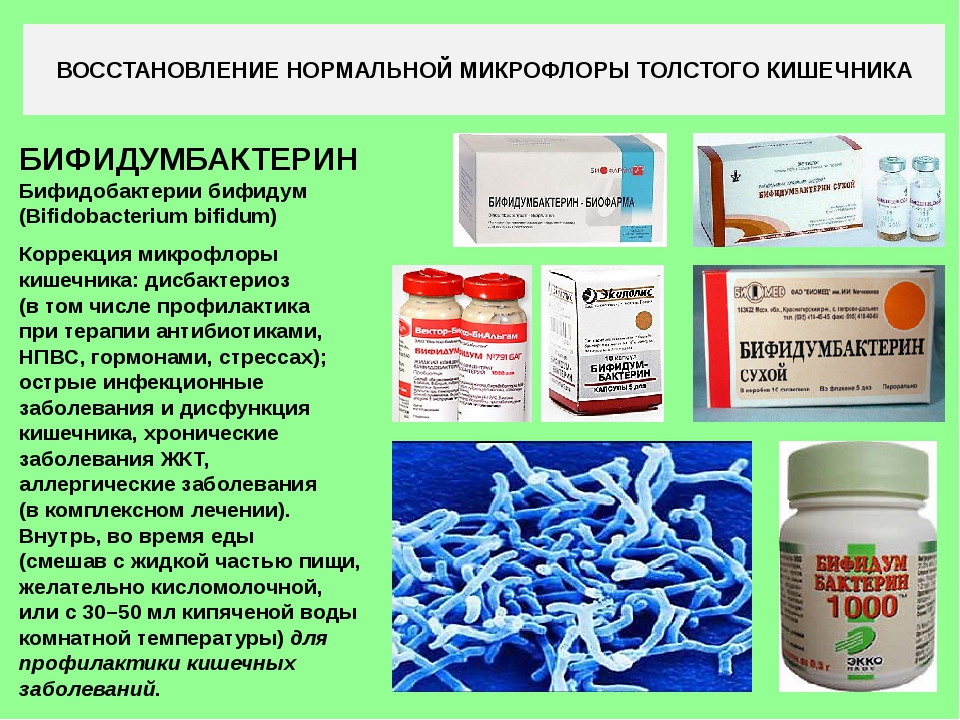
Кроме того, радиация всех видов (включая рентгеновские лучи) могут убивать флору кишечника.
Поэтому восстановление микрофлоры кишечника народными средствами крайне важно, так как от этого зависит здоровье человека. Благо, существует огромное количество лекарственных трав, которые помогут решить эту проблему.
• Так, в частности, для того чтобы быстро восстановить микрофлору кишечника, можно сделать сладкую и полезную смесь. Изготавливается такая смесь из меда, кураги и чернослива. Твердые ингредиенты необходимо размельчить с помощью блендера или мясорубки, а после смешать их с медом. Употреблять такую смесь надо по одной столовой ложке в день.
• Восстановление микрофлоры кишечника народными средствами можно проводить с помощью классических круп. К примеру, очень помогают каши из геркулеса или гречки, съеденные за завтраком. Не будет лишним добавить к каше качественный чернослив.
Также восстановлению микрофлоры очень хорошо помогает компот из сухофруктов.
К обеду добавляйте винегрет или любой другой салат из свеклы. Пейте чай с добавлением кусочка лимона, ежедневно съедайте 2 зубчика чеснока для уничтожения злотворных бактерий.
Пейте чай с добавлением кусочка лимона, ежедневно съедайте 2 зубчика чеснока для уничтожения злотворных бактерий.
• Конечно же, оптимальным вариантом будет употреблять различные кисломолочные продукты, такие как кефир и творог. Есть их можно без ограничений, так как эти продукты приносят организму исключительно пользу. Достаточно большой эффективностью отличается прием кумыса или ряженки (до двух стаканов в сутки).
• Восстановление микрофлоры кишечника народными средствами можно осуществлять с помощью корней кровохлебки. Для этого нужно 200 граммов корня кровохлебки залить стаканом воды и оставить вариться на медленном огне 15-20 минут. Получившийся отвар нужно принимать внутрь пять-шесть раз в день по одной столовой ложке. Подобное лечение нужно проводить как минимум месяц.
• Также можно приготовить отличный рецепт из четырех чайных ложек семян укропа. Семена укропа нужно залить стаканом кипятка и оставить настаиваться в течение двух часов. После этого полученный настой следует принимать каждые два часа.
• Подорожник с корнем аира – отличный способ восстановить флору кишечника. Как и в предыдущих случаях, 2 ч ложки смеси лекарственных трав заливают кипятком и настаивают полчаса, после чего принимают в течение десяти дней по 50 миллилитров за полчаса перед каждым приемом пищи.
• Восстановление микрофлоры кишечника после антибиотиков брагой. Это самый что ни на есть народный рецепт.
В пол-литра теплой воды добавляете по 1 ст ложке меда и сахара и примерно 2 г дрожжей. Все тщательно перемешиваете и оставляете бродить на пАру часов в теплое место. Дольше не стоит, иначе получится хмельная брага. Выпить следует сразу все за раз залпом. Выпивать по времени ровно между приемами пищи. Это получится 2 кружки в день. Этим средством вы сразу поселяете в кишечник бродильные микроорганизмы, тем самым восстанавливаете его нормальную работу.
• Еще запомните – все кислые ягоды, типа клюквы, и плоды шиповника – это очень хорошее лекарство для восстановления микрофлоры кишечника. Ешьте их ежедневно и у вас все будет хорошо.
Ешьте их ежедневно и у вас все будет хорошо.
• Уже ни для кого не секрет, что тыквенные семечки хорошо очищают кишечник от паразитов. Усильте их действие таким рецептом: в равных количествах измельчите в блендере тыквенные семечки, семечки от подсолнуха и грецкие орехи. 2 ст ложки получившегося порошка размешиваете в половине стакана кипяченой воды и выпиваете. Курс приема 2 раза в день 10 дней.
Стоит отметить, что восстановление флоры кишечника – процедура, которая требует терпения и кропотливой работы.
Для полного излечения нужно принимать целебные травы как минимум десять дней, и при этом нельзя игнорировать диету.
По материалам сайта “ПроЗдоровье”
Перед применением посоветуйтесь с врачом об отсутствии у вас противопоказаний.
____________________
Нашли ошибку или опечатку в тексте выше? Выделите слово или фразу с ошибкой и нажмите Shift + Enter или сюда.
Как восстановить микрофлору кишечника • Причины, симптомы и признаки нарушения микрофлоры
Миллиарды полезных бактерий, живущих в ЖКТ человека, делают незаметную, но нужную работу. От чего возникает дисбактериоз и можно ли восстановить микрофлору кишечника?
От чего возникает дисбактериоз и можно ли восстановить микрофлору кишечника?
«Миллиарды» – это не преувеличение, а преуменьшение. Биологи подсчитали, что в кишечнике здорового человека проживает примерно 50 триллионов микроорганизмов. Хотя человек может жить с нарушениями микрофлоры ЖКТ или даже при полном ее отсутствии, это считается отклонением от нормы. Также нежелателен дисбаланс между разными микроорганизмами или преобладание патогенных видов. Поэтому важно поддерживать здоровье кишечника и его обитателей – и речь здесь не столько о лечении, сколько о правильном питании и образе жизни.
Что такое микрофлора кишечника
Микрофлора кишечника – это совокупность всех микроорганизмов, которые живут в ЖКТ здорового человека. При этом в желудке их намного меньше, поскольку кислая среда неблагоприятна для большинства бактерий. Большая часть микрофлоры сосредоточена в тонком и толстом кишечнике. В основном это – лактобациллы, бифидобактерии и бактероиды.
Причины нарушения микрофлоры кишечника
В очень редких случаях микрофлора кишечника исчезает полностью. Гораздо чаще врачи сталкиваются с уменьшением количества нужных видов микроорганизмов и ростом патогенной флоры. Произойти это может по нескольким причинам:
- пищевое или химическое отравление;
- хронические заболевания ЖКТ;
- инфекционное заболевание;
- лечение антибиотиками или иными подавляющими микрофлору препаратами.
Это состояние врачи называют дисбактериозом или дисбиозом кишечника. Важно понимать, что это не самостоятельная болезнь, а синдром. Поэтому правильнее лечить первопричину, а не сам дисбактериоз.
Симптомы и признаки нарушения микрофлоры кишечника
Даже сегодня микрофлора кишечника изучена недостаточно. Например, ученые до сих пор не могут ответить на вопрос: почему нарушение ее состава у одних людей протекает тяжело, а у других – бессимптомно и без ухудшения самочувствия. Так или иначе, предположить нарушение микрофлоры ЖКТ можно по следующим клиническим проявлениям:
Например, ученые до сих пор не могут ответить на вопрос: почему нарушение ее состава у одних людей протекает тяжело, а у других – бессимптомно и без ухудшения самочувствия. Так или иначе, предположить нарушение микрофлоры ЖКТ можно по следующим клиническим проявлениям:
- боль или чувство распирания в животе;
- диарея и/или метеоризм;
- ухудшение аппетита.
Диагностировать нарушение микрофлоры кишечника сложно, поскольку у каждого человека она уникальна. Поэтому врач будет в первую очередь искать причину дисбактериоза, а именно – заболевание, которое могло к этому привести.
Как восстановить микрофлору кишечника народными средствами
К сожалению, достоверных исследований, которые бы показали действенность альтернативной медицины в данном случае, нет. Нормализовать микрофлору кишечника можно лишь опосредованно: улучшая качество жизни. Речь идет не только о правильном питании, но и о физических активностях, отказе от вредных привычек и др.
Восстановление микрофлоры после антибиотиков
После приема некоторых лекарств (в частности, антибиотиков) в микрофлоре кишечника может наблюдаться дисбаланс. Например, место убитых лекарствами лактобактерий могут занять грибковые культуры или протеи, на которых антибиотики не действуют. Непосредственного лечения, позволяющего быстро восстановить микрофлору кишечника, современная медицина предложить не может. Чаще всего микрофлора приходит в норму самостоятельно, через некоторое время после отмены антибиотиков. Как долго придется ждать? Как правило, несколько недель. По результатам анализов врач дополнительно может назначить средства, подавляющие патогенную флору (например, противогрибковые препараты).
К сожалению, широко рекламируемые пробиотики и препараты с лакто– и бифидобактериями не имеют доказанной эффективности. Проблема в том, что полезные микроорганизмы невозможно доставить туда, где они нужны, живыми. Так, двенадцатиперстная кишка человека содержит агрессивные пищеварительные ферменты, которые убивают большинство микроорганизмов. Поэтому до кишечника «полезные бактерии в капсулах» просто не доходят.
Проблема в том, что полезные микроорганизмы невозможно доставить туда, где они нужны, живыми. Так, двенадцатиперстная кишка человека содержит агрессивные пищеварительные ферменты, которые убивают большинство микроорганизмов. Поэтому до кишечника «полезные бактерии в капсулах» просто не доходят.
Какие продукты восстанавливают микрофлору кишечника
Важно понимать, что какими бы полезными не были продукты, в кишечник они попадают в полностью переваренном состоянии. И однозначно говорить, например, что кефир улучшает микрофлору за счет содержания полезных бактерий, не совсем верно. Поэтому после отравления, диареи или иного расстройства ЖКТ необходимо, в первую очередь, снизить нагрузку на организм, придерживаясь определенной диеты.
Вот пример лечебного питания, назначаемого при заболеваниях кишечника:
| Можно | Нельзя |
|---|---|
| Сухари из белого хлеба (без добавления сахара, соли и специй) | Сдобные мучные изделия, черный хлеб, пирожные |
| Супы на обезжиренном бульоне или овощном отваре | Наваристые мясные бульоны, грибные супы |
| Нежирные сорта мяса и птицы в виде отварных и паровых блюд | Жирное мясо и рыбу, жареные блюда, колбасы, соленая рыба и икра |
| Каши на воде (рис, греча, овсянка, манка) | Перловка, макароны, бобовые |
| Творог и кисломолочные продукты | Цельное молоко и сливки |
| Свежие или печеные фрукты без кожуры (в том числе в виде пюре) | Фрукты и овощи, содержащие много грубой клетчатки (капуста, морковь, груши, абрикосы) |
| Кисели, желе, отвар шиповника, разбавленные ягодные соки | Газированные напитки, алкоголь, кофе |
Несмотря на то, что сырые фрукты и овощи надо вводить в меню аккуратно, полностью отказываться от них нельзя. Помимо содержания необходимых витаминов, клетчатка стимулирует перистальтику, что может уберечь от запора. А вот отвары лечебных трав без рекомендации врача принимать не стоит.
Помимо содержания необходимых витаминов, клетчатка стимулирует перистальтику, что может уберечь от запора. А вот отвары лечебных трав без рекомендации врача принимать не стоит.
Читайте также:
Идеи для быстрого и здорового перекуса
Как правильно выбрать хороший мед
Кролик с овощами: рецепт для пароварки
Проверенные рецепты для восстановление микрофлоры кишечника | top news
Восстановление микрофлоры кишечника народными средствами – очень эффективная процедура, которая вполне может быть проведена в домашних условиях. Надо сказать, что флора, живущая в кишечнике каждого человека, очень чутка и ранима, навредить ей очень легко. Повредить или даже уничтожить флору кишечника может множество факторов.
И если уничтожить микроорганизмы, живущие в кишечники очень просто, то их восстановление может занять продолжительное время.
Ученые утверждают, что микроорганизмы в кишечники не однородны, всего в желудочно-кишечном тракте могут проживать до пятисот видов разнообразных крохотных организмов.
Повредить микроорганизмам могут самые разные причины и факторы. Во-первых, уничтожить флору кишечника могут различные врожденные болезни, которые приводят к недостатку (или переизбытку) фермента. Во-вторых, флора может быть уничтожена вследствие принятия медикаментозных средств (например антибиотиков), а также из-за неправильного питания, различных инфекций и излишка алкогольных напитков. Кроме того радиация всех видов (включая рентгеновские лучи) могут убивать флору кишечника.
Поэтому восстановление микрофлоры кишечника народными средствами крайне важно, так как от этого зависит здоровье человека. Благо существует огромное количество лекарственных трав, которые помогут решить эту проблему.
💥 Так в частности для того, чтобы быстро восстановить микрофлору кишечника можно сделать сладкую и полезную смесь. Изготавливается такая смесь из меда, кураги и чернослива. Твердые ингредиенты необходимо размельчить с помощью блендера или мясорубки, а после смешать их с медом. Употреблять такую смесь надо по одной столовой ложке в день.
Употреблять такую смесь надо по одной столовой ложке в день.
💥 Восстановление микрофлоры кишечника народными средствами можно проводить с помощью классических круп. К примеру, очень помогают каши из геркулеса или гречки, съеденные за завтраком. Не будет лишним добавить к каше качественный чернослив. Также восстановлению микрофлоры очень хорошо помогает компот из сухофруктов. К обеду добавляйте винегрет или любой другой салат из свеклы. Пейте чай с добавлением кусочка лимона, ежедневно съедайте 2 зубчика чеснока для уничтожения злотворных бактерий.
💥 Конечно же, оптимальным вариантом будет употреблять различные кисломолочные продукты, такие как кефир и творог. Есть их можно без ограничений, так как эти продукты приносят организму исключительно пользу. Достаточно большой эффективностью отличается прием кумыса или ряженки (до двух стаканов в сутки).
💥 Восстановление микрофлоры кишечника народными средствами можно осуществлять с помощью корней кровохлебки. Для этого нужно 200 граммов корня кровохлебки залить стаканом воды и оставить вариться на медленном огне 15-20 минут. Получившийся отвар нужно принимать внутрь пять-шесть раз в день по одной столовой ложке. Подобное лечение нужно проводить как минимум месяц.
Для этого нужно 200 граммов корня кровохлебки залить стаканом воды и оставить вариться на медленном огне 15-20 минут. Получившийся отвар нужно принимать внутрь пять-шесть раз в день по одной столовой ложке. Подобное лечение нужно проводить как минимум месяц.
💥 Также можно приготовить отличный рецепт из четырех чайных ложек семян укропа. Семена укропа нужно залить стаканом кипятка и оставить настаиваться в течение двух часов. После этого полученный настой следует принимать каждые два часа.
💥 Подорожник с корнем аира – отличный способ восстановить флору кишечника. Как и в предыдущих случаях, 2 ч ложки смеси лекарственных трав заливают кипятком и настаивают полчаса, после чего принимают в течение десяти дней по 50 миллилитров за полчаса перед каждым приемом пищи.
💥 Восстановление микрофлоры кишечника после антибиотиков брагой. Это самый, что ни на есть народный рецепт. В поллитра теплой воды добавляете по 1 ст ложке меда и сахара и примерно 2 г дрожжей. Все тщательно перемешиваете и оставляете бродить на пАру часов в теплое место. Дольше не стоит, иначе получится хмельная брага. Выпить следует сразу все за раз залпом. Выпивать по времени ровно между приемами пищи. Это получится 2 кружки в день. Этим средством вы сразу поселяете в кишечник бродильные микроорганизмы, тем самым восстанавливаете его нормальную работу.
Все тщательно перемешиваете и оставляете бродить на пАру часов в теплое место. Дольше не стоит, иначе получится хмельная брага. Выпить следует сразу все за раз залпом. Выпивать по времени ровно между приемами пищи. Это получится 2 кружки в день. Этим средством вы сразу поселяете в кишечник бродильные микроорганизмы, тем самым восстанавливаете его нормальную работу.
💥 Еще запомните – все кислые ягоды, типа клюквы, и плоды шиповника – это очень хорошее лекарство для восстановления микрофлоры кишечника. Ешьте их ежедневно и у вас все будет хорошо.
💥 Уже ни для кого не секрет, что тыквенные семечки хорошо очищают кишечник от паразитов. Усильте их действие таким рецептом: в равных количествах измельчите в блендере тыквенные семечки, семечки от подсолнуха и грецкие орехи. 2 ст ложки получившегося порошка размешиваете в половине стакана кипяченой воды и выпиваете. Курс приема 2 раза в день 10 дней.
Стоит отметить, что восстановление флоры кишечника процедура, которая требует терпения и кропотливой работы. Для полного излечения нужно принимать целебные травы как минимум десять дней и при этом нельзя игнорировать диету.
Для полного излечения нужно принимать целебные травы как минимум десять дней и при этом нельзя игнорировать диету.
Очень полезно проводить один два раза в неделю разгрузочные дни, в которые вы будете употреблять только свежие яблоки и сырую морковь, так можно и язву вылечить.
Восстановлением микрофлоры кишечника займутся народные средства
Бактерии помогают усваивать питательные вещества, способствуют пищеварению и защищают от вредных микроорганизмов. Однако этот микромир очень хрупок и легко может быть поврежден.
Дисбактериоз проявляется себя у курильщиков, злоупотребляющих алкоголем людей, у пациентов, пьющих антибактериальные или просто сильные лекарства, во время облучения, например рентгеновского.
Кстати, у чрезмерно чистоплотных людей, увлекающихся антибактериальными средствами также может возникнуть нарушение микрофлоры кишечника. При неправильном очищении кишечника могут быть уничтожены и полезные бактерии. К дисбактериозу могут привести и нарушения сна.
У человека с дисбактериозом меняется цвет кожи, он быстрее устает, быстро раздражается, сильнее подвержен различным заболеваниям.
Рецепты восстановления микрофлоры кишечника
Нужно смешать мед, измельченные курагу и чернослив, и потреблять смесь по столовой ложке в день.
Также эффективны гречневые и геркулесовые каши. В них можно добавить сухофрукты. Также микрофлору восстанавливает компот из сухофруктов.
В обед следует употреблять больше салатов. Особенно эффективен салат из свеклы или винегрет. Для борьбы с плохими бактериями следует ежедневно съедать немного чеснока.
Очень помогают травяные сборы. Зверобой, ромашку, мелиссу и льняные семена смешивают и заливают половиной литра кипятка. Состав настаивается час, и принимается до еды по полстакана.
Также для нормального пищеварения измельченный корень девясила заливают холодной водой и настаивают. На следующий день готовое лекарство пьют по 50 миллилитров до еды.
Для борьбы с вредными бактериями в кишечнике измельченный чеснок заливают оливковым или льняным маслом. Состав настаивается 3 дня, после чего потребляется утром по чайной ложке.
Привести в порядок кишечник поможет простокваша, в которую нужно измельчить 2 чесночных зубчика и свежую черемшу. Лекарство пьют перед сном каждый день.
В восстановлении микрофлоры кишечника помогут фрукты и овощи, а также – кисломолочные продукты. Следует есть меньше жирной, острой, кислой и мучной пищи.
Но при серьезных проблемах с пищеварением лучше обратиться к гастроэнтерологу, который назначит лечение и посоветует наиболее эффективные рецепты.
Кефир улучшает микрофлору кишечника. Научное доказательство
Подпись к фото,Доктор Майкл Мозли выяснил, что же на самом деле влияет на наши кишки
Может ли пища, которую мы употребляем, улучшить состояние нашего кишечника? Доктор Майкл Мозли решил разобраться, какие продукты и напитки эффективнее улучшают микрофлору.
Кишечный микробиом – то есть тот разнообразный набор бактерий, который населяет наши кишки, – стал в последнее время популярной научной темой.
Практически каждый день можно наткнуться на заголовок, утверждающий, что микробиом, оказывается, воздействует на наше здоровье каким-то новым, еще более удивительным образом – будь то похудение, настроение или же наша способность сопротивляться инфекциям.
Поэтому неудивительно, что супермаркеты и магазины здоровой пищи, учитывая этот возросший интерес к нашей внутренней экосистеме, стали продавать разнообразные пищевые продукты и биологически активные добавки, содержащие живые микрокультуры – пробиотики, которые якобы могут улучшить здоровье наших кишок. Но так ли это на самом деле?
Чтобы это выяснить программа “Верьте мне, я доктор!” (“Trust me, I’m A Doctor”) решила провести эксперимент в шотландском городе Инвернесс с помощью местного отделения Национальной службы здравоохранения (NHS Highland) и 30 добровольцев и ученых, собранных со всей страны.
Три группы
Автор фото, Science Photo Library
Подпись к фото,Одна из важнейших молочнокислых бактерий – Lactobacillus casei, которую можно обнаружить как у нас во рту, так и в кишках
Мы разделили наших добровольцев на три группы и попросили каждую из них в отдельности испробовать на себе в течение четырех недель какой-нибудь один способ из тех, которые вроде бы должны улучшать наш микробиом.
Первая наша группа стала пить продающийся в продуктовых магазинах пробиотический напиток из разряда тех, которые, как правило, содержат одну или две бифидобактерии, способных пережить путешествие через кислотную среду в желудке и попасть непосредственно в кишки.
Вторая группа перешла на кефир, производящийся методом обычного брожения и содержащий набор бактерий и дрожжей.
Третья группа должна была есть еду, богатую инулином – природным полисахаридом, являющимся биологически активной добавкой, пребиотиком.
Пребиотики – это вещества, которые питают “хорошие” бактерии, уже живущие в нашем кишечнике, а инулин содержится в таких продуктах, как топинамбур (земляная груша), корень цикория, лук, чеснок и лук-порей.
Стакан кефира вместо?
Автор фото, iStock
Подпись к фото,Земляная груша является полезным пребиотиком
В конце своего эксперимента мы обнаружили удивительную вещь.
У группы, которая пила пробиотический напиток, немного прибавилось бактерии, которая хорошо влияет на поддержание веса – Lachnospiraceae, хотя эти изменения были статистически незначимы.
Две другие группы продемонстрировали более заметные изменения.
Группа, употреблявшая пищу, богатую пребиотиком, серьезно нарастила присутствие в кишечнике того типа бактерии, которая хорошо влияет на состояние нашего кишечника, – этот же результат показывали исследования других ученых.
Однако самое большое изменение произошло у той группы, которая пила кефир.
У добровольцев из этой группы резко выросла колония лактобактерий, которые, как мы знаем, оказывают положительное воздействие на наш кишечник и помогают в таких случаях, как непереносимость лактозы и диарея туриста (понос, который может возникнуть у человека при смене климата, воды и еды – то есть при столкновении с непривычными микробами).
“Ферментированные [подвергнутые процессу брожения] продукты в своей основе довольно кислые, поэтому эти микробы должны были эволюционировать с тем, чтобы приспособиться к подобного рода обстановке и выдерживать кислотную среду, – поясняет доктор Пол Коттер из научно-исследовательского центра Teagasc в городе Корк, который помогал нам в наших изысканиях. – Именно поэтому они проходят сквозь желудок и могут повлиять на формирование среды в кишечнике”.
Автор фото, iStock
Подпись к фото,Да, в Британии продается кефир, хотя и не на каждом шагу
Где брать?
Мы решили продолжить изучение ферментированных продуктов и напитков, чтобы понять, на чем именно следует остановить свой выбор, если вы хотите улучшить свою кишечную среду.
С помощью доктора Коттера и ученых Роухэмптонского университета мы отобрали целый ряд приготовленных дома или купленных в магазине продуктов и напитков, подвергнутых процессу брожения, и отослали их в лабораторию.
Разница получилась колоссальная: тогда как многие продукты, изготовленные дома или же сделанные традиционным методом брожения, действительно содержали большое количество бактерий, некоторые промышленно произведенные продукты почти никаких полезных бактерий не содержали.
“Обычно коммерческие продукты должны проходить процесс пастеризации уже после приготовления, чтобы их обезопасить и продлить срок годности, а это убивает бактерии, но с приготовленными в домашних условиях этого не случается”, – поясняет доктор Коттер.
Так что, если вы хотите улучшить работу кишечника и пополнить свой микробиом благотворными бактериями, то лучше всего покупать те продукты, которые приготовлены традиционным способом или же вовсе делать их самим.
Микрофлора кишечника и ее восстановление
Человек является воплощением того, что он употребляет в пищу. Разнообразие рациона, образ жизни, сфера деятельности, качество жизни – все это определяет “живность”, которая живет в кишечнике. Эти крохотные организмы помогают пище перевариться, предварительно расщепляя ее и подготавливая к всасыванию в стенки желудочно-кишечного тракта.
Поэтому нарушить эту хрупкую систему взаимной работы организма и бактерий могут даже самые невзрачные факторы. Труднее потом восстановить здоровую микрофлору, чем навредить.
Именно поэтому так важно знать всевозможные средства и приемы, как восстановить микрофлору кишечника в домашних условиях, применяя простые натуральные продукты и травы.
Что может навредить нормальной работе кишечника
В кишечнике может жить, питаться и размножаться множество различных видов бактерий, отвечающих за свой “фронт работ” над пищей. Некоторые ученые насчитывают около 500 видов, другие исчисляют тысячами.
Ребенок уже в первые годы жизни в период болезней начинает принимать массу медикаментов, без которых сегодня невозможно излечиться.
Постоянное влияние лекарственных препаратов, особенно антибиотиков, разрушает полезную микрофлору кишечника напрочь, что требует принятие мер по возобновлению работы ЖКТ и насыщению кишечника полезными бактериями, искоренив патогенные организмы.
Как убрать живот в зависимости от его типа?
Также уничтожают полезные бактерии алкогольные напитки, неправильное питание, наличие инфекций. Ферменты в кишечнике погибают под воздействием загрязненных продуктов и воды, при наличии врожденных болезней, если человек является носителем инфекций.
Также губительно влияет окружающая среда, экология, множественное влияние рентгеновского излучения не на пользу полезной микрофлоре в кишечнике.
Как восстановить микрофлору кишечника без приема медицинских препаратов, помогут народные средства и рецепты, которые мы далее рассмотрим подробнее.
Кортизоловый живот: почему появляется и как избавится от стрессового жира?
Как восстановить флору кишечника народными средствами
Рецепт №1
И сладкая и полезная смесь из чернослива, кураги и меда сможет наладить работу в кишечнике. Компоненты измельчаются ножом, в мясорубке или в блендере. Соединить измельченную курагу и чернослив, залить медом (жидким) и перемешать.
В день принимать по одной столовой ложке такой смеси. Не ждите, что в первый же день все наладиться, только после некоторого продолжительно времени, прием этой сладкой смесь поможет восстановить микрофлору.
Рецепт №2
Нечего выдумывать велосипед заново, даже обычные крупы помогут решить проблему с кишечником. Прием геркулесовой каши в жидком виде натощак или гречневой крупы за завтраком может постепенно приводить в норму всю работу ЖКТ, включая желудок.
К кашам полезно добавлять курагу или чернослив, яблоки. Запивать можно узваром, он также поддерживает жизнедеятельность полезных бактерий в норме. Обед разнообразить можно свеклой, которая не только помогает налаживать работу кишечника, еще и токсины и шлаки выводит без проблем и трудностей.
Топ 15 продуктов богатых клетчаткой
Каждый день съедайте пару зубчиков чеснока и пейте чай с лимоном. Чеснок избавит кишечник от вредных микроорганизмов, паразитов.
Рецепт №3
Употребляйте если не постоянно, хоть несколько раз в неделю кисломолочные продукты на основе натурального молока, простыми словами, кислое молоко и творог. Также можно пить ряженку, 2 стакана в день будут полезными для кишечника.
Рецепт №4
Как восстановить микрофлору кишечника народными средствами используя корни кровохлебки лекарственной, расскажут даже наши бабушки. Корень кровохлебки (200 г) залить одним стаканом кипяченой воды, варить смесь 20 минут (на медленном огне). Отвар из корня остудить и процедить. Принимать до 6 раз за сутки по столовой ложке. Употреблять не менее месяца.
Рецепт №5
Маленьким деткам, если вздувается животик, готовят мамы отвар из семян укропа. Этот древний как мир рецепт пользуется уважением и является эффективным средством. Семена укропа (4 маленьких ложечки) залить кипятком (1 стакан) и настаивать 2 часа. Процедить и принимать через каждые 2 часа по ложке.
Рецепт №6
Смесь подорожника и корня аира отлично помогает при болях и для восстановления микрофлоры кишечника. Измельчить корень аира и подорожник, залить кипяченой водой, настоять около 30 минут. На протяжении 10 дней принимать по 50 мл, обязательно за 30 минут до приема пищи.
Диета Аткинса: 4 фазы до стройного тела
Рецепт №7
Возобновляем микрофлору брагой. На пол-литра теплой воды необходима 1 ложка меда и сахара, плюс 2 г дрожжей. Все ингредиенты смешать, оставить в теплом и темном месте, чтобы бродили – на 2 часа. Если дольше выдержать, то брага станет хмельной. Рассчитывать время ровно, между приемами пищи.
Рецепт №8
Использовать полезно для кишечника все кислые сорта ягод: клюкву, например, или шиповник. Ежедневное применение отвара из плодов шиповника насытит кишечник здоровьем.
Как нормолизовать микрофлору кишнчника и добиться идеального тела?
Рецепт №9
Очистить кишечник от паразитов помогут тыквенные семечки. Семечки измельчить в блендере или кофемолке, в таком же объеме измельчите семечки подсолнуха и грецкие орехи. 2 ложки смеси из семечек и орехов залейте стаканом воды (кипяченой) и пейте. 2 раза в день принимать на протяжении 10 дней.
Употреблять нездоровую пищу и восстанавливать микрофлору кишечника себе дороже, поэтому строго следуйте режиму приема средства для восстановления работы кишечника, питайтесь только полезными продуктами и не забывайте, что курс лечения должен быть не менее 10 дней.
Препараты зеленой аптеки от дисбактериоза
Содержание
Около 70 % населения мира имеют дисбактериоз — нарушение баланса микрофлоры кишечника, которое приводит к сбою его деятельности.
В норме основу кишечного биоценоза человека составляют «полезные» бактерии, которые защищают организм от инфекций и помогают пищеварению. Дефицит таких бактерий и чрезмерный рост патогенных микроорганизмов вызывают дисбактериоз.
Дисбактериоз не возникает как самостоятельное заболевание, а является следствием болезней ЖКТ, стрессов, инфекций, приема антибиотиков или неправильного питания.
Для восстановления сбалансированной микробиологической среды кишечника пациентам назначают специальную диету, антисептические средства, пробиотики и витамины. Медикаментозное лечение обычно сочетают с фитопрепаратами.
Благодаря мощным противовоспалительным и спазмолитическим свойствам травяные сборы в виде чаев, настоев, отваров подавляют гнилостные процессы в кишечнике, снимают воспаление слизистой и устраняют симптомы дисбактериоза:
- метеоризм,
- запор или диарею,
- урчание и боли в животе,
- неприятный привкус во рту,
- тошноту, снижение аппетита.
Подобранные специалистом растительные средства позволяют уменьшить медикаментозную нагрузку на больного, ведь останавливают развитие патогенной микрофлоры в кишечнике, создают условия для размножения «дружественных» бактерий и не раздражают желудок. А минимальный перечень противопоказаний и польза для иммунитета позволяют применять лекарственные травы даже детям от шести месяцев.
Лекарственные растения для восстановления микрофлоры кишечника
Иммунитет человека во многом зависит от здоровья ЖКТ. Проявления дисбактериоза — вздутие, колики, нерегулярный стул — истощают организм и могут свидетельствовать о серьезных заболеваниях пищеварительной системы.
Народная медицина предлагает немало лекарственных растений, которые борются с патогенной микрофлорой кишечника, уменьшают газообразование и помогают восстановить комфортное пищеварение. К ним относятся:
- фенхель,
- тмин,
- аир,
- полынь горькая,
- ромашка,
- тысячелистник,
- анис,
- мята,
- укроп и др.
Высокая эффективность трав в борьбе с дисбактериозом объясняется наличием в их составе эфирных масел, фитонцидов, флавоноидов, горьких и дубильных веществ, которые обеспечивают антибактериальный, ветрогонный эффект, снимают спазмы и улучшают моторику кишечника.
О полезных лекарственных растениях и сборах от дисбактериоза рассказываем далее.
Тысячелистник
Растение содержит сесквитерпены, флавоноиды, горькие, дубильные вещества, благодаря которым:
- обладает мощным антисептическим, противогрибковым и бактерицидным действием;
- нормализует моторику ЖКТ и уменьшает проявления метеоризма;
- блокирует спастические боли в кишечнике;
- активизирует выделение желудочного сока и усиливает аппетит;
- увеличивает желчеотделение.
Чтобы приготовить целебный настой от дисбактериоза, 1 ст. л. травы тысячелистника смешайте с 1 ч. л. травы полыни горькой, залейте 300 мл кипятка и настаивайте в течение 20 минут. Принимайте по 1 ст. л. 2–3 раза в день за 15 минут до еды.
Как заварить настой из тысячелистника и ромашки против дисбактериоза, читайте в нашем материале.
Крапива
Богатая на витамины, органические кислоты и гликозиды крапива — эффективное растительное средство от дисбактериоза, поскольку:
- нормализует липидный обмен и кислотность желудка;
- оказывает противовоспалительное и регенеративное действие — заживляет ранки на слизистой органов пищеварения;
- активизирует выделение желчи;
- укрепляет иммунную систему.
Листья крапивы применяют при запорах, геморрое, диарее, заболеваниях печени.
Для стимуляции обмена веществ в ЖКТ и смягчения стула готовят отвар из крапивы и крушины. Для этого 2 ч. л. листьев крапивы смешивают с 1 ч. л. коры крушины, заливают 500 мл кипятка и держат на слабом огне 10 минут. Отвар настаивают в течение 20 минут и принимают по 100 мл три раза в день до еды.
Аир
Благодаря полезным биологически активным веществам — эфирным маслам и горькому гликозиду акорину — настои из корневища аира:
- устраняют гнилостные процессы в кишечнике;
- уменьшают газообразование;
- усиливают рефлекторное выделение желудочного сока;
- возбуждают окончания вкусовых рецепторов и повышают аппетит;
- снимают спазмы кишечника;
- усиливают желчную функцию печени.
Для облегчения симптомов дисбактериоза 1 ст. л. корневищ растения поместите в эмалированную посуду, залейте стаканом кипятка и, накрыв крышкой, держите на водяной бане 15 минут. Дайте остыть.Принимайте настой три раза в день по ¼ стакана за 15 минут до еды.
Аир часто входит в состав желудочных сборов, ведь корневища растения — один из самых эффективных фитопрепаратов против метеоризма.
Какие травяные настои и отвары от дисбактериоза можно пить детям?
Дисбактериоз — один из самых распространенных диагнозов у детей до года. Среди причин развития патогенной микрофлоры у новорожденных:
- физиологическая незрелость моторной функции кишечника;
- позднее прикладывание к груди;
- искусственное вскармливание;
- раннее введение прикорма, употребление аллергенов;
- прием лекарств.
Симптомы дисбактериоза у грудных детей:
- боль в животе (ребенок может надрывно плакать, поджимать, напрягать ножки)
- частые срыгивания, отрыжка;
- частый стул: зеленого цвета, с непереваренными остатками пищи и резким кислым запахом;
- повышенное газообразование;
- белый налет на языке;
- неприятный запах изо рта;
- снижение аппетита, плохой набор веса;
- высыпания на коже;
- вялость, плохой сон.
Проявления дисбактериоза можно спутать с симптомами инфекционного заболевания или отравления, поэтому сначала рекомендуют выяснить и устранить первопричину расстройства пищеварения у малыша.
Содержание микрофлоры детского организма в нормальном состоянии является чрезвычайно важной задачей. Это способствует качественному перевариванию пищи, синтезу необходимых витаминов и формированию иммунной системы.
К наиболее эффективным лекарственным растениям от дисбактериоза у детей относятся:
- Тмин. Самое популярное средство от повышенного газообразования. Тминную водичку рекомендуют даже малышам. Плоды тмина имеют сильное бактерицидное, обезболивающее и ветрогонное эффект, нормализуют работу всего ЖКТ.
- Фенхель. Эффективное и безопасное природное средство при коликах у детей. Улучшает моторику кишечника, способствует быстрому и безболезненному выведению газов. Обладает секретолитическим, спазмолитическим, ветрогонным, противомикробным действием.
- Ромашка. Растительное средство мягкого действия, которое эффективно снимает воспаление и спазмы кишечника, уменьшает вздутие, устраняет отрыжку. Цветы ромашки имеют противомикробный эффект, благодаря чему подавляют развитие патогенной флоры ЖКТ.
- Укроп. Регулирует моторную деятельность кишечника, избавляет от метеоризма и спазмов. Повышает секрецию желудочных желез, улучшает аппетит.
Под наблюдением врача настои на основе этих растений можно применять даже детям от шести месяцев.
Если дисбактериоз сопровождают вздутие и метеоризм, облегчить страдания малыша может легкий массаж животика по часовой стрелке, использование газоотводной трубки или выкладывание на живот.
Если ребенок на грудном вскармливании, хотим напомнить, что натуральный фиточай «Лактафитол» от компании «Лектравы» — средство, которое не только повышает лактацию у мамы, но и из-за обогащения грудного молока полезными веществами налаживает работу ЖКТ малыша.
Это возможно благодаря карвону в плодах тмина и аниса, которые входят в состав препарата. Получая эти вещества вместе с грудным молоком, малыш чувствует облегчение при спазмах и коликах.
Дисбактериоз у беременных: можно ли лечиться травами?
Беременность может стать серьезным испытанием для организма будущей мамы.
Уже в первые дни после зачатия тело активно меняется, в нем вырабатываются различные гормоны, важные для сохранения и полноценного развития плода. В некоторых случаях этот процесс существенно снижает иммунитет, вследствие чего может развиться дисбактериоз.
Поскольку бактериальная флора мамы — фундамент для формирования микрофлоры малыша, лечение следует начать уже при первых симптомах недомогания.
Лекарственные растения для лечения дисбактериоза у беременных должны назначаться с особой осторожностью: только врачом и только тогда, когда польза для матери превышает потенциальный риск для плода.
Чтобы облегчить проявления метеоризма, спастической боли в животе и нормализовать стул, будущим мамам рекомендуют чаи, настои, отвары из ромашки и мяты перечной. Эти растения обладают стойким противомикробным действием, поддерживают иммунитет и являются эффективным успокаивающим средством.
Для приготовления полезного травяного настоя смешайте 1 ч. л. цветков ромашки с 1 ч. л. листья мяты перечной. Залейте 250 мл кипятка и дайте настояться в течение 15 минут. Беременным женщинам такой настой рекомендуется принимать раз в трое суток.
Здоровье органов пищеварения — гарантия отличного самочувствия и крепкого иммунитета! Поэтому прислушивайтесь к собственному телу и не откладывайте визит к врачу, когда неприятные ощущения в желудке мешают вашему комфорту.
Текущий рейтинг: 4.16 из 5. Количество голосов: 184
Микробиота кишечника, потенциальная новая мишень для китайских лекарственных трав при лечении сахарного диабета
Микробиота кишечника, как важный фактор, влияющий на здоровье хозяина, играет значительную роль в возникновении и развитии сахарного диабета (СД), и механизм может быть связаны с избытком эндотоксинов, измененными короткоцепочечными жирными кислотами (SCFA) и нарушением метаболизма желчных кислот. Традиционная китайская медицина (ТКМ) имеет долгую историю лечения СД, но ее механизм не очень ясен.Недавние исследования показали, что китайская фитотерапия может улучшить метаболизм глюкозы за счет ремоделирования микробиоты кишечника, что открывает новые возможности для дальнейших исследований механизмов гипогликемии. В этом обзоре представлен недавний прогресс китайских трав, экстрактов трав и препаратов на основе трав в лечении СД посредством регулирования микробиоты кишечника и обобщены основные задействованные механизмы, а именно противовоспалительные и антиоксидантные эффекты, защита кишечного барьера и ингибирование липотоксичности.Кроме того, предлагаются некоторые предложения по улучшению.
1. Введение
Сахарный диабет (СД) – серьезная проблема для здоровья, которая угрожает людям во всем мире. В 2017 году Международная федерация диабета (IDF) выпустила восьмое издание «Карты диабета IDF», которая показала, что примерно 425 миллионов взрослых (20-79 лет) во всем мире страдают СД, и это число может достигнуть 629 миллионов. к 2045 году. В Китае примерно 114,4 миллиона человек (20-79 лет) живут с DM; таким образом, Китай занимает первое место в мире (http: // www.diabatlas.org). В последние несколько лет люди постепенно осознали, что функция метаболизма человека определяется не только нами, но и тесно связана с нашим «вторым геномом» – кишечной микробиотой, которая открыла еще одну дверь для лучшего понимания DM. [1–3]. Чтобы найти лучший лечебный эффект от СД, были разработаны и постепенно внедрены в клиническую практику множество пробиотических, пребиотических и синбиотических препаратов [4].
Традиционная китайская медицина (ТКМ) лечит СД более 2000 лет.В последние годы накопление доказательств подтвердило, что традиционная китайская медицина может улучшить СД с помощью различных молекулярных механизмов [5], а ремоделирование кишечной микробиоты является важным направлением исследований [6]. Помимо специфических изменений в некоторых кишечных бактериях после приема лекарственных трав, исследователи также обращают внимание на то, как улучшенная микробиота кишечника влияет на метаболизм хозяина. В этом обзоре мы обобщаем соответствующую литературу, пытаемся выделить несколько основных путей, связывающих кишечную микробиоту и гликометаболизм, а затем предлагаем возможные будущие направления, которые могут улучшить ограничения текущих исследований.
Был проведен поиск литературы с использованием баз данных PubMed, CNKI, Chinese Biomedical Literature, Wanfang и VIP. Ключевые слова для поиска включали «диабет», «кишечная микробиота», «кишечная микрофлора», «кишечная флора», «кишечная микрофлора», «традиционная китайская медицина», «фитотерапия» и «травы». Мы также провели поиск связанные ссылки.
2. Взаимосвязь между DM и кишечной микробиотой
Кишечная микробиота не только влияет на кишечник, но также оказывает глубокое влияние на метаболическую функцию хозяина через различные механизмы [1].В последние десятилетия накопленные данные свидетельствуют о тесной связи между сахарным диабетом и микробиотой кишечника. Два когортных исследования с участием людей в Китае и Европе показали, что в микробиоте кишечника пациентов с сахарным диабетом 2 типа (СД2) наблюдаются композиционные и функциональные изменения. Например, количество бутират-продуцирующих бактерий Roseburia и Faecalibacterium prausnitzii было ниже [7, 8]. Кроме того, исследование, основанное на китайской популяции хань, показало, что по сравнению со здоровыми людьми, люди с сахарным диабетом 1 типа (СД1) имели совершенно другую микробиоту кишечника, а численность Bacteroides положительно коррелировала с аутоантителами [9].
Как нарушенная микробиота кишечника влияет на углеводный обмен в организме хозяина? Согласно текущим исследованиям, причины могут быть связаны со следующими факторами: (1) липополисахариды (ЛПС): ЛПС являются жизненно важным компонентом внешней мембраны грамотрицательных бактерий, в то время как они могут вызывать легкое воспаление, связанное с СД, когда чрезмерное попадание ЛПС в кровоток [10]; (2) короткоцепочечные жирные кислоты (SCFAs): SCFAs, в основном включающие уксусную кислоту, пропионовую кислоту и масляную кислоту, являются основными продуктами ферментации, производимыми из неперевариваемой клетчатки и полисахаридов, а снижение уровня SCFA может нарушить метаболический гомеостаз хозяина, поскольку они связаны с энергетическим обменом, секрецией GLP-1 и целостностью слизистой оболочки кишечника [11]; (3) желчные кислоты (ЖК): ЖК продуцируются деградацией холестерина и метаболизируются микробиотой кишечника, а нарушенный метаболизм ЖК может влиять на экспрессию рецепторов желчных кислот в кишечнике, а затем нарушать соответствующие пути метаболизма глюкозы [12]; (4) проницаемость кишечника: нарушенная микробиота кишечника может нарушить белки плотных контактов кишечника, повысить проницаемость кишечника и привести к постоянной утечке ЛПС, что, в свою очередь, вызывает системное воспаление низкой степени [13]; (5) сбор энергии: кишечная микробиота, связанная с ожирением, более эффективно использует энергию, получаемую с пищей, что приводит к энергетической перегрузке в организме хозяина, что является важной основой для возникновения инсулинорезистентности и СД2 [14]; (6) кишечная иммунная система: микробиота кишечника имеет решающее значение для развития и модуляции иммунной системы слизистой оболочки кишечника, а дисфункциональное взаимодействие между микробиотой кишечника и иммунной системой связано с возникновением СД1 [15].И наоборот, улучшенная микробиота кишечника может регулировать один или несколько из указанных выше путей, оказывая комплексное терапевтическое воздействие на СД.
3. Доказательства китайских лекарственных трав для лечения СД путем регулирования кишечной микробиоты
3.1. Травы и экстракты трав
Folium Mori для лечения Xiaoke (название DM в TCM) зарегистрировано в Compendium of Materia Medica [16], и его гипогликемический эффект был подтвержден в экспериментах на животных [ 17] и клинические испытания [18].Скармливание диабетическим крысам диеты, содержащей 20% силы Folium Mori в течение 8 недель, может подавить сигнальный путь неэстерифицированных жирных кислот (NEFA) и уменьшить гипергликемию. В то же время доля Bacteroidetes в кишечных бактериях восстанавливается после обработки Folium Mori [19]. Другое исследование подтвердило, что Folium Mori может способствовать производству SCFAs и регулировать метаболизм стероидов и ЖК [20]. В дополнение к Folium Mori , Dendrobium Candidum может облегчить окислительный стресс в печени [21], а Rhizoma Dioscoreae способствует снижению уровня глюкозы в крови пациентов с СД 2 типа [22].Их подробности приведены в таблице 1.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Сокращения .NEFA: неэтерифицированная жирная кислота; Ж / Б: Firmicutes / Bacteroidetes; GLP-2: глюкагоноподобный пептид-2; GLP-1: глюкагоноподобный пептид-1; SCFA: жирные кислоты с короткой цепью; N / A: не применимо. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Берберин является основным биологически активным алкалоидом некоторых теплозащитных трав, таких как Coptis chinensis [23]. Недавние исследования показали, что берберин является отличным модулятором кишечной микробиоты у животных и людей с СД. Например, он может способствовать пролиферации Bifidobacterium и Lactobacillus , подавлять рост Escherichia coli, и снижать уровни ЛПС в кишечнике, тем самым снимая хроническое системное воспаление [24].Кроме того, поврежденная слизистая оболочка кишечника и иммунный барьер также могут быть восстановлены с помощью берберина, который способствует предотвращению попадания кишечных эндотоксинов в кровь и поддержанию метаболического гомеостаза хозяина [25, 26]. Кроме того, многие другие фитохимические вещества, такие как реин [27], белок облепихи [28], алкиламиды Zanthoxylum [29] и полифенолы из Fructus MoriL . [30], также обладают гипогликемическим эффектом, регулируя микробиоту кишечника (Таблица 1).
Кроме того, полисахариды, извлеченные из лекарственных растений, также являются потенциальными пребиотиками. Qixing Nie и его коллеги [31] подтвердили, что полисахариды из семян Plantago asiatica L. могут снижать массу тела, снижать уровень глюкозы в крови и восстанавливать поврежденную функцию почек у крыс с диабетом. Кроме того, он также может увеличить количество бактерий, таких как Bacteroides vulgatus , Lactobacillus fermentum , Prevotella loescheii и Bacteroides ovatus , и способствовать производству SCFA.Более того, полисахариды экстрагированы из Ganoderma atrum [32], Maydis stigma [33], Radix Pseudostellariae [34], Morus nigra [35] и Momordica charantia L ). ферментированный Lactobacillus plantarum NCU116 [36], также может лечить СД, регулируя кишечную микроэкологию (Таблица 1).
3.2. Препараты на травах
Формула TCM представляет собой комбинацию нескольких трав, и совместимость трав является ключом к синергетической терапевтической роли [37].Xiexin Tang, включающий три травы: Rhei Rhizome , Scutellaria radix и Coptidis rhizome , демонстрирует идеальные противовоспалительные, гипогликемические и гиполипидемические эффекты у крыс с T2DM. Кроме того, Xiexin Tang может увеличить количество некоторых противовоспалительных бактерий, таких как Adlercreutzia, Alloprevotella, , и концентрацию SCFAs в кале. Корреляционный анализ предполагает, что увеличение количества кишечных бактерий может быть прямым регулятором метаболической функции [38].Помимо экспериментов на животных, соответствующие доказательства также подтверждаются клиническими рандомизированными контролируемыми исследованиями. Классическая формула Gegen Qinlian Decoction и современная травяная формула AMC обладают значительными гипогликемическими эффектами, а структура кишечной микробиоты оптимизируется после 12 недель приема. Например, уровни Faecalibacterium , бактерии с противовоспалительным действием, значительно увеличиваются двумя формулами; бактерии, продуцирующие SCFA, Roseburia и Blautia , также стимулируются после обработки AMC [39, 40].Кроме того, гипогликемический эффект отвара Gegen Qinlian (эксперимент на животных) [41], отвара Huanglian Jiedu [42, 43], смеси Qijian [44], отвара Banxia Xiexin [45] и трех инновационных препаратов на основе трав [46–48] также способствует регулированию микробиоты кишечника, и их подробности перечислены в таблице 2.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Сокращения .SCFA: жирные кислоты с короткой цепью; GLP-1: глюкагоноподобный пептид-1; GLP-2: глюкагоноподобный пептид-2; ЛПС: липополисахариды; N / A: не применимо. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
3.3. Резюме
Согласно существующей литературе, эффекты противодиабетических лекарственных трав на кишечную микробиоту имеют следующие правила: (1) регулирование структуры микробиоты путем увеличения микробного разнообразия и уменьшения соотношения Firmicutes / Bacteroidetes (F / B); (2) увеличение противовоспалительных бактерий, таких как Bifidobacterium , Lactobacillus , Akkermansia, и Faecalibacterium ; (3) увеличение количества SCFAs, продуцирующих бактерии, таких как Roseburia и Eubacterium , и стимулирование концентрации SCFAs в кишечнике; (4) снижение численности патогенных бактерий, таких как Escherichia coli и Enterococcus .Эти изменения микробиоты кишечника могут вызвать серию цепных реакций, которые затем могут улучшить метаболизм глюкозы в организме хозяина. Конкретные механизмы обсуждаются ниже.
4. Механизмы лечения СД китайскими лекарственными препаратами с помощью регуляции кишечной микробиоты
4.1. Противовоспалительный эффект
Хроническое воспаление средней степени тяжести признано характеристикой некоторых метаболических заболеваний, таких как сахарный диабет и ожирение, и состояние микробиоты кишечника тесно связано с этим типом воспаления [49]. Lactobacillus , пробиотики, широко используемые в различных областях, обладают функцией уменьшения воспаления, связанного с метаболизмом, как у крыс, получавших СТЗ [50], так и у людей с СД [51]. Bifidobacterium может также снижать высвобождение провоспалительных цитокинов, восстанавливая баланс между регуляторными Т-клетками (Treg) и В-лимфоцитами и обращая процесс транслокации бактерий из кишечника в ткани [52, 53]. Как мы уже представили выше, китайские лечебные травы берберин [24], белок облепихи [28], Zanthoxylum алкиламиды [29], полисахариды Radix Pseudostellariae [34], отвар Gegen Qinlian [39, 41] и так же все промоторы пролиферации Lactobacillus и Bifidobacterium , что может быть важной причиной того, что они проявляют лучший терапевтический эффект.Помимо стимулирования роста пробиотиков, уменьшение побочных эффектов LPS также может ослабить воспалительную реакцию. Нарушение микробиоты может повысить уровень ЛПС в кишечнике, а затем усугубить воспалительное повреждение кишечного эпителия. Когда чрезмерное количество ЛПС попадает в кровь через поврежденную слизистую кишечника, может возникнуть системное воспаление слабой степени [54]. В вышеперечисленных лечебных травах отвар Gegen Qinlian [41] и отвар Banxia Xiexin [45] могут уменьшить утечку LPS и уменьшить воспалительные факторы в сыворотке; Отвар Huanglian Jiedu [42] может подавлять экспрессию LPS-связанных воспалительных белков и улучшать барьерную функцию слизистой оболочки кишечника.
Вместе взятые, увеличение количества противовоспалительных бактерий, снижение выработки и утечки ЛПС и подавление воспалительных факторов, связанных с ЛПС, являются ключевыми звеньями противовоспалительного действия традиционной китайской медицины.
4.2. Антиоксидантный эффект
Окислительный стресс играет важную роль в патологическом процессе СД и не только разрушает клетки островка β и сигнальные пути инсулина, но также может способствовать серьезным осложнениям, таким как диабетическое сердечно-сосудистое заболевание и диабетическая нефропатия [55] .Недавние исследования показывают, что некоторые кишечные бактерии обладают антиоксидантной активностью. Во-первых, пробиотики снижают уровень окислительного стресса кишечника за счет собственных антиоксидаз и метаболитов антиоксидантов; с другой стороны, они также могут активировать антиоксидантную систему хозяина и улучшать окислительный стресс различными путями [56]. Здоровая кишечная микробиота является основой для поддержания окислительно-восстановительного гомеостаза, в то время как неупорядоченный состав микробиоты может индуцировать образование активных форм кислорода (АФК) в эпителиальном эпителии кишечника, вызывая повреждения кишечника или даже системные заболевания [57, 58].В последние годы исследователи подтвердили, что некоторые про- и пребиотики могут улучшить состояние окислительного стресса [59]. Точно так же вышеупомянутые гипогликемические ТКМ, такие как Dendrobium Candidum [21], полифенолы из Fructus Mori L . [30], и некоторые полисахариды трав [31, 32, 34–36] также обладают антиоксидантной активностью. В диабетическом состоянии энтерогенный эндотоксин не только является источником воспаления, но и может вызывать окислительный стресс в некоторых органах, таких как поджелудочная железа [60] и печень [61].Регулируя микробиоту кишечника и восстанавливая барьер слизистой оболочки кишечника, лекарственные травы могут уменьшить повреждение эндотоксином и избежать ряда проблем, вызванных им. Кроме того, накапливающиеся данные показывают, что некоторые бактерии, такие как Lactobacillus , Bifidobacterium и Akkermansia , а также бактериальный метаболит бутират, также обладают потенциальными антиоксидантными свойствами [56, 62–64]; как указано выше, их увеличению может способствовать множество лекарственных трав.
Таким образом, некоторые лекарственные травы, особенно полисахариды трав, могут играть антиоксидантную роль, способствуя росту пробиотиков и ингибируя повреждение энтерогенными эндотоксинами.
4.3. Защита кишечного барьера
В 1986 году исследователи уже наблюдали повышенную кишечную проницаемость у пациентов с диабетом [65], а в последние годы люди были обеспокоены «второй атакой» на организм, вызванной повреждением кишечного барьера. В физиологическом состоянии слизистая оболочка кишечника поглощает питательные вещества и предотвращает проникновение патогенных бактерий или эндотоксинов в кровь. Однако под влиянием диеты с высоким содержанием жиров, воспалительной стимуляции, окислительного стресса и других факторов структура и функция слизистой оболочки кишечника могут быть нарушены, что может привести к повреждению кишечника и системным заболеваниям, таким как сахарный диабет [66].Несмотря на то, что кишечный барьер играет важную роль для здоровья, существует лишь несколько препаратов, направленных на его устранение [67]. Регулируя микробный состав и увеличивая количество SCFA, некоторые растительные лекарственные средства могут улучшить барьерную функцию кишечника и подавить повреждение LPS. В частности, адгезивно-инвазивный вирус Escherichia coli может вызвать воспалительную реакцию и нарушить гомеостаз слизистой оболочки [68]. Напротив, Akkermansia и Lactobacillus могут восстанавливать целостность кишечного эпителия за счет снижения провоспалительных цитокинов [69, 70], а Bifidobacterium может поддерживать здоровье кишечника, способствуя секреции глюкагоноподобного пептида-2 (GLP- 2) [71]; SCFAs, как топливо для слизистой оболочки кишечника, не только обеспечивают энергией эпителиальные клетки [72], но также способствуют сборке плотных контактов [73].Как упоминалось выше, берберин [24–26] может эффективно регулировать микробиоту кишечника, улучшать проницаемость кишечника путем ингибирования сигнального пути TLR4 / MyD88 / NF-kB и увеличивать секрецию GLP-2. Составной препарат, содержащий фруктоолигосахарид лопуха GF13 и Lactobacillus plantarum Sc 52 [47], может значительно стимулировать продукцию SCFA и восстанавливать нарушенный кишечный барьер, что может быть потенциальным пребиотическим продуктом для лечения DM.
Короче говоря, поврежденный кишечный барьер – это скрытые убийцы метаболического гомеостаза, и лекарственные травы могут улучшить это патологическое состояние, уменьшая количество патогенных бактерий, увеличивая количество защитных бактерий слизистой оболочки и способствуя выработке SCFAs.
4.4. Ингибирование липотоксичности
Липотоксичность относится к дисфункции или гибели клеток, вызванной избыточным накоплением липидов в нежировых тканях [74], что не только еще больше усугубляет прогрессирование СД [75, 76], но также приводит к диабетическим осложнениям, таким как кардиомиопатия [77] и ангиопатия [78]. Недавние исследования показывают, что микробиота кишечника играет множество фундаментальных ролей в поддержании метаболического гомеостаза липидов и может быть потенциальной мишенью для улучшения дислипидемии [79].Прежде всего, регулирование микробного соотношения кишечника является эффективным подходом. В целом, у людей с ожирением соотношение Firmicutes / Bacteroidetes (F / B) выше, чем у людей с нормальным весом [80, 81]. После обработки реином [27], полифенолами из Fructus Mori L . [30] и полисахариды Morus nigra [35], наблюдается более низкое соотношение F / B. Кроме того, растительные лекарственные средства, такие как Zanthoxylum алкиламиды [29], полисахариды из семян Plantago asiatica L.[31], а ферментированный Momordica charantia L . [36] может подавлять липотоксичность, способствуя выработке метаболитов кишечной микробиоты ацетата и бутирата. В частности, ацетат может регулировать экспрессию генов, связанных с бежевым адипогенезом, в белой жировой ткани, тем самым способствуя выделению тепла [82]. Бутират полезен для усиления митохондриальной функции скелетных мышц и бурого жира, а также для увеличения расхода энергии [83]. Кроме того, у лиц с абдоминальным ожирением липополисахаридсвязывающий белок (LBP) сыворотки и NEFA сильно коррелируют, что позволяет предположить, что LPS также приводят к нарушению липидного обмена [84].Как обсуждалось выше, некоторые лекарственные травы могут подавлять ЛПС, регулируя микробиоту. Наконец, бактериальные метаболиты БА могут модулировать системный метаболизм липидов через ядерный фарнезоидный X-рецептор (FXR) и рецептор 5, связанный с G-белком (GPR5) [85], и могут быть потенциально значимой мишенью для лекарственных трав, в то время как соответствующие доказательства отсутствуют, и необходимы дальнейшие исследования.
В целом, TCM снижает липотоксичность в основном за счет снижения соотношения F / B, регулирования микробных метаболитов ацетата, бутирата и уменьшения повреждения LPS.
4.5. Резюме
Таким образом, лекарственные травы могут оказывать множество полезных терапевтических эффектов на СД, регулируя микробиоту кишечника, а противовоспалительные и антиоксидантные эффекты, защита кишечного барьера и ингибирование липотоксичности являются основными механизмами. Более того, стимулирование секреции GLP-1 и ингибирование глюконеогенеза в печени также может быть связано с регуляцией микробиоты. Помимо восстановления функции островков и улучшения инсулинорезистентности, эти механизмы также способствуют предотвращению развития осложнений, связанных с диабетом.Одним словом, действие лекарственных средств на травах на микробиоту кишечника является всеобъемлющим и далеко идущим (рис. 1).
5. Обсуждение и перспективы на будущее
Данные многочисленных исследований подтверждают важную роль кишечной микробиоты в процессе лечения СД традиционной китайской медициной, но у большого числа видов бактерий, которые могут оказывать наиболее важные эффекты? Необходимо обратить внимание на ключевую микробиоту. Хотя на видов Lactobacillus приходится всего 0 видов.От 01 до 0,06 для всех видов бактерий, он играет важную роль в защите эпителиального барьера, продуцирует антипатогенные соединения и регулирует иммунитет [86]. Недавно накопленные данные свидетельствуют о том, что штаммы пробиотиков Lactobacillus могут играть вспомогательную роль в лечении СД [87], в то время как другие исследования показывают, что численность Lactobacillus положительно коррелирует с уровнем глюкозы в крови [8, 88], поэтому Перекрестная связь между Lactobacillus и метаболизмом глюкозы требует дальнейшего изучения.Бифидобактерии являются одними из доминирующих представителей желудочно-кишечного тракта грудного ребенка [89], и избирательное увеличение количества бифидобактерий может улучшить СД, вызванное высоким содержанием жиров, и метаболическую эндотоксемию у мышей [90]. Akkermansia muciniphila считается полезным микробом следующего поколения, который может активировать сигнальные пути Toll-подобного рецептора 2 и способствовать выработке IL-10, тем самым играя защитную роль для барьера слизистой оболочки кишечника [91]. Roseburia обладает высокой способностью продуцировать бутират, который может обеспечивать энергией эпителиальные клетки кишечника и подавлять высвобождение провоспалительных цитокинов [92].Обычно численность Bifidobacterium , Akkermansia, и Roseburia отрицательно коррелирует с уровнем глюкозы в крови [91–93]. Как показано выше, большая часть TCM может способствовать росту этих полезных бактерий, которые затем вызывают многоцелевые терапевтические эффекты для лечения DM.
Однако мы должны признать, что на микробиоту кишечника может влиять множество факторов [94]. Чтобы лучше использовать TCM, необходимо обсудить его в реальном мире, а не только в лаборатории.Среди факторов, влияющих на микробиоту взрослого человека, факторы питания могут составлять до 57% изменений микробиоты кишечника [95], и в последнее время диета, нацеленная на микробиоту кишечника для лечения СД, стала предметом всеобщего беспокойства [96]. Липин Чжао и его коллеги [97] обнаружили, что диета, богатая клетчаткой, может оптимизировать микробиоту кишечника, производить больше SCFA и помочь более эффективно контролировать уровень глюкозы в крови, что представляет собой новый экологический подход к управлению СД2. Кроме того, влияние диеты на микробиоту может быть связано с эффективностью лечебных трав.Кишечные бактерии могут преобразовывать химические вещества трав в различные биоактивные вещества, тем самым способствуя лучшему всасыванию и использованию [98], в то время как нарушенная микробиота может в некоторой степени влиять на нормальный метаболизм лекарств [99]. Итак, мы предполагаем, что микробиота кишечника, сформированная здоровым питанием, повысит эффективность традиционной китайской медицины, но эта гипотеза требует дальнейшего изучения.
Дальнейшие перспективы могут включать, но не ограничиваются следующими направлениями: прежде всего, должны применяться более совершенные технические средства, такие как метагеномное секвенирование и стерилизация животных, чтобы лучше выявить взаимосвязь между TCM и микробиотой кишечника.Кроме того, текущие исследования в основном сосредоточены на кишечных бактериях, LPS и SCFA, а дальнейшие исследования могут быть нацелены на кишечные грибы и другие бактериальные метаболиты, такие как BA. Кроме того, результаты исследований на мышах / крысах трудно применить в клинической практике напрямую, и срочно необходимы исследования микробиоты кишечника человека. И последнее и самое важное: больше внимания следует переключить от механизма к применению. С одной стороны, вводить новшества и улучшать традиционную китайскую медицину в направлении индивидуализированной целевой терапии; с другой стороны, попытайтесь объединить лекарственные травы с пробиотиками, пробиотиками или здоровой пищей и разработать новые и более эффективные составные препараты.
6. Заключение
Китайские лекарственные травы, применяемые для лечения СД, тесно связаны с регулированием микробиоты кишечника, а оптимизированная микробиота кишечника улучшает метаболизм глюкозы у хозяев, в основном за счет противовоспалительного и антиоксидантного действия, защищая кишечный барьер. и подавление липотоксичности. На следующем этапе необходимо провести дополнительные исследования микробиоты человека и принять индивидуализацию, точность и междисциплинарную интеграцию в качестве целей развития.Короче говоря, микробиота кишечника дает новую возможность выяснить механизм TCM при лечении DM; в то же время фитотерапия – это кладезь потенциальных пребиотиков и требует более глубокого изучения.
Disclosure
Boxun Zhang и Rensong Yue являются соавторами.
Конфликт интересов
Авторы заявляют, что нет никаких конфликтов интересов относительно публикации этой статьи.
Вклад авторов
Все авторы несли ответственность за дизайн исследования. Boxun Zhang и Rensong Yue внесли равный вклад в эту работу. Документ подготовили Boxun Zhang и Rensong Yue . Юань Чен , Маойи Ян и Сяоин Хуан участвовали в поиске литературы; Jiacheng Shui , Yuliang Peng, и Jiawei Chin контролировали исследование; все авторы одобрили итоговую статью.
Благодарности
Работа поддержана Национальным фондом естественных наук Китая (№81774279) и ключевой научно-исследовательский проект провинции Сычуань (№ 2018SZ0068).
Обзор новых взглядов на патогенез и лечение диабета 2 типа
Резюме
Травяные лекарственные средства (ТМ) являются основным подмножеством комплементарной и альтернативной медицины. Они веками использовались для эффективного клинического лечения сахарного диабета 2 типа (СД2). Однако связанные лежащие в основе механизмы еще предстоит выяснить. Было обнаружено, что микробиота участвует в патогенезе и лечении СД2.Взаимодействие между кишечной микробиотой и хозяином происходит в основном на слизистой оболочке желудочно-кишечного тракта. Движения хозяина влияют на состав и численность кишечной микробиоты, тогда как кишечная микробиота, в свою очередь, модулирует метаболическую и иммунологическую активность хозяина. Дисбактериоз кишечника, индуцированное эндотоксином метаболическое воспаление, нарушение иммунного ответа, бактериальные компоненты и метаболиты, а также снижение продукции короткоцепочечных жирных кислот считаются важными патогенными механизмами, лежащими в основе СД2.Взаимодействие между кишечной микробиотой и ТМ во время лечения СД2 было изучено на людях, животных и исследованиях in vitro, . ТМ регулируют состав полезных и вредных бактерий и уменьшают воспаление, вызванное кишечной микробиотой. Кроме того, метаболизм кишечной микробиоты модулирует биотрансформацию ТМ. В этом обзоре мы обобщили результаты таких исследований с целью улучшить наше понимание патогенеза и потенциальных терапевтических механизмов ТМ при СД2, а также предоставить новые сведения о конкретных целевых методах лечения на основе ТМ и открытии новых лекарств.
Ключевые слова: фитопрепараты, сахарный диабет 2 типа, кишечная микробиота, бактериальные метаболиты, терапевтические механизмы
Введение
Сахарный диабет (СД) – широко распространенное хроническое заболевание, связанное со значительными проблемами здравоохранения во всем мире. По данным Международной федерации диабета (IDF), в 2017 г. от СД страдали около 425 миллионов взрослых, и ожидается, что к 2045 году их число увеличится до 629 миллионов (Cho et al., 2018). Распространенность СД варьируется между развивающимися и развитыми странами и, по оценкам, вырастет в этих странах на 69 и 20% с 2010 по 2030 год, соответственно (Shaw et al., 2010). Длительный СД может привести к множественным осложнениям и сопутствующим заболеваниям, поражающим глаза, почки, сердечно-сосудистую и нервную системы (Inzucchi et al., 2012). По имеющимся данным, уровень смертности взрослых пациентов с СД в два-четыре раза выше, чем у взрослых без диабета (Gerrits et al., 2015). Сахарный диабет 2 типа (СД2) – один из основных типов СД. Он характеризуется гипергликемией в результате прогрессирующей дисфункции β-клеток на фоне инсулинорезистентности (Американская диабетическая ассоциация, 2019).Кроме того, на СД2 приходится более 90% всех пациентов с диабетом, что приводит к общественной пандемии (Chatterjee et al., 2017). Распространенность СД2 заметно выросла с годами, что стало причиной значительного глобального бремени смертности и инвалидности (Zheng et al., 2017). Ожирение является наиболее значительным фактором риска развития СД2. К другим факторам риска относятся диета с низким содержанием клетчатки и нездоровый образ жизни, в том числе малоподвижный образ жизни, курение и употребление алкоголя (Wu et al., 2014; Kautzky-Willer et al., 2016).Существуют различные терапевтические подходы к лечению СД2, такие как управление образом жизни (Schellenberg et al., 2013) (обучение и поддержка самоуправления, диетотерапия, физическая активность, планирование диеты и психосоциальная помощь), пероральные препараты (Qaseem et al., 2017) (метформин, сульфонилмочевины, тиазолидиндионы, ингибиторы α-глюкозидов, ингибиторы дипептидилпептидазы-4 и натрий-зависимый переносчик глюкозы 2), инъекционные препараты (Tran et al., 2015) (инсулин и глюкагоноподобный пептид-1), хирургия (Maleckas et al., 2015), а также дополнительные и альтернативные лекарства (Nahas and Moher, 2009).
С ростом значения дополнительной и альтернативной медицины в соответствии с рекомендациями Всемирной организации здравоохранения (ВОЗ) (Zhang Q. et al., 2019) применение и исследования альтернативных лекарств для лечения СД2 заметно увеличились в последние годы (Al-Eidi et al., 2016; Pang et al., 2019). Как один из важнейших видов альтернативной медицины, фитотерапия (ТМ) имеет тысячелетнюю историю и включает систематические медицинские теории, основанные на длительных периодах фенотипических и персонализированных клинических испытаний (Li and Weng, 2017).По оценкам ВОЗ, 70–80% населения, проживающего в развивающихся странах, рассматривают ТМ как метод первичной медико-санитарной помощи, в то время как исследования ТМ все еще находятся на предварительной стадии и требуют дальнейших исследований механизмов эффективности (Ekor, 2014). В течение последних двух десятилетий HM играл активную роль в лечении DM и доказал свою ценность для предотвращения прогрессирования заболевания как в европейских, так и в азиатских странах (Banjari et al., 2019). Согласно мировой этноботанической информации, для борьбы с сахарным диабетом было применено около 800 трав (Alarcon-Aguilara et al., 1998). Большое количество клинических испытаний и испытаний на животных продемонстрировали эффект различных форм ТМ, таких как использование отдельных трав и их экстрактов (Pang et al., 2015; Mirfeizi et al., 2016), отваров лечебных трав (Zhang et al., 2011; Ryuk et al., 2017) и китайских патентованных лекарств (Pang et al., 2017; Chen et al., 2019). Помимо установления эффективности ТМ против СД2, исследования также были направлены на определение их терапевтических механизмов с использованием современной науки и технологий; однако эти механизмы еще предстоит выяснить.
Кишечник представляет собой крупнейший пищеварительный и иммунный орган человеческого тела, в котором обитают триллионы микробов. Микробы, населяющие кишечник, также известные как кишечная микробиота, составляют сложное экологическое сообщество и сильно влияют на здоровье хозяина (Lozupone et al., 2012). В настоящее время все большее число исследователей уделяют внимание роли микробиоты кишечника в лечении заболеваний и лекарственной терапии, включая взаимодействие микробиоты кишечника, СД2 и ТМ. Новые взгляды, основанные на микробиоте кишечника, предоставили интересное понимание механизма действия ТМ при лечении СД2.
Здесь мы стремимся предоставить обзор взаимосвязи между микробиотой кишечника, хозяином и СД2 с патологической точки зрения, включая изменения микробиоты кишечника и то, как они взаимодействуют с хозяином при СД2. Затем мы описываем взаимодействие микробиоты кишечника, хозяина и ТМ при лечении СД2, что облегчает понимание потенциальных терапевтических механизмов ТМ. Наконец, мы резюмируем и обсуждаем терапевтическую стратегию HM, основанную на микробиоте кишечника, и представляем наши перспективы.
Хозяин, кишечная микробиота и СД2: патогенез
Взаимодействие между кишечной микробиотой и хозяином
Кишечник человека представляет собой сложную экосистему. Микробиота и хозяин разделяют обширную платформу для межклеточной передачи сигналов и защиты от потенциальных патогенов (Sekirov et al., 2010). У здоровых людей около 3,8 × 10 13 бактерий колонизируют кишечник, которые вместе кодируют более трех миллионов генов (Qin et al., 2010). Классификация бактерий по филогенетическому разнообразию вариабельных нуклеотидных последовательностей малых субъединичных оперонов рибосомной РНК или генов 16S рРНК позволяет анализировать огромное микробное сообщество.Разнообразие совокупностей организмов может давать основную единицу на функциональном уровне, и отклонения от этого ядра связаны с разными физиологическими состояниями (Turnbaugh et al., 2009).
Анализ микробиома показал, что прогрессирование болезни связано с изменениями в фекальном микробиоме. Исследования на животных моделях показали, что разные ответы, основанные на генотипах хозяина, могут способствовать развитию фенотипов метаболических нарушений, связанных с изменениями микробиоты кишечника (Miranda-Ribera et al., 2019; Ван Дж. Х. и др., 2019). У здоровых людей большинство кишечных бактерий можно разделить на пять типов: Firmicutes, Bacteroidetes, Actinobacteria, Proteobacteria и Verrucomicrobia (Tremaroli and Backhed, 2012). Все эти микробы экспрессируют гены продукции короткоцепочечных жирных кислот (SCFA) (Krautkramer et al., 2016), лиганды для рецепторов, связанных с G-белком (GPCR) (Cohen et al., 2017), нейротрансмиттеров (Asano et al. ., 2012) и других метаболитов.В свою очередь, метаболиты генетически и эпигенетически влияют на ответы хозяина (Sharkey et al., 2018). Что касается хозяев, как внутренние, так и внешние факторы влияют на бактериальный состав кишечника. В результате родов при рождении, вскармливания младенцев, генетики, инфекций, лекарств и диеты внутренняя среда хозяина часто меняется, что приводит к соответствующим изменениям микробиоты кишечника (Wen and Duffy, 2017). По сути, жизненные движения хозяина влияют на численность кишечной микробиоты, тогда как кишечная микробиота контролирует метаболическое физиологическое состояние и иммунологические функции хозяина с помощью ряда механизмов, регулируемых генами.
Большинство взаимодействий между хозяином и микробиотой кишечника происходит на желудочно-кишечном барьере, который состоит из двух частей: бактериального барьера и барьера слизистой оболочки. Оба имеют решающее значение для предотвращения проникновения комменсальных бактерий, патогенов и пищевых антигенов из просвета в ткань кишечника и системный кровоток хозяина (Sorini et al., 2019). Бактериальный барьер является первой линией защиты от проникновения содержимого просвета и выполняет множество биологических функций. Микробиота кишечника различается по продольной оси кишечника.Таким образом, различные бактерии заселяют разные места кишечника. Из-за радиального градиента кислорода микробы, проживающие на слизистой оболочке толстой кишки, обладают более высокой толерантностью к кислороду и экспрессией каталазы по сравнению с просветными или ассоциированными со стулом бактериями (Albenberg et al., 2014). Что касается слизистого барьера, эпителий кишечника содержит большую поверхность, выстланную монослоем эпителиальных клеток кишечника (IEC) (Wu et al., 2019). Они создают барьеры слизистой оболочки, включая физические и химические барьеры, для поддержания симбиотических отношений между кишечной микробиотой и хозяином (Okumura and Takeda, 2017).После нарушения кишечного барьера некоторые физиологические функции кишечника будут нарушены, что может вызвать круговые реакции кишечного дисбактериоза, воспаления, ферментативных механизмов и нарушений иммунного ответа.
Как кишечная микробиота влияет на T2DM
Кишечный дисбиоз
Дисбиоз характеризуется потерей полезных микроорганизмов, увеличением количества потенциально вредных микробов и / или потерей общего микробного разнообразия (Olesen and Alm, 2016).Ожирение и полиметаболические нарушения приводят к дисбалансу кишечной микробиоты, что считается характерным признаком СД2. Дисбактериоз кишечника приводит к транслокации бактериальных метаболитов, таких как триметиламин (ТМА), медиаторов метаболической дисрегуляции и патоген-ассоциированных молекулярных паттернов (PAMP) (Tilg et al., 2020). Bacteroidetes и Firmicutes являются двумя доминирующими бактериальными типами микробиоты кишечника пациентов с СД2. Интересно, что соотношение Bacteroidetes и Firmicutes положительно и значительно коррелировало с концентрациями глюкозы в плазме во многих предыдущих исследованиях (Turnbaugh et al., 2009; Ларсен и др., 2010; Schwiertz et al., 2010). Содержание Bacteroidetes увеличивается с потерей веса и низкокалорийной диетой, что способствует выздоровлению от СД2 (Ley et al., 2006). У пациентов с СД2 увеличивается количество продуцирующих липополисахариды Escherichia coli (тип Proteobacteria ). Они способствуют усилению системного воспаления кишечника (Qin et al., 2012). Напротив, Akkermansia muciniphila и Faecalibacterium prausnitzii представляют собой очень распространенные кишечные микробы человека у здоровых людей, и их пониженные уровни связаны с воспалением и изменениями метаболических процессов, участвующих в развитии СД2 (Verhoog et al., 2019). Недавно было установлено значение Akkermansia muciniphila для поддержания целостности желудочно-кишечного тракта. Его метаболиты влияют на ряд факторов транскрипции и генов, участвующих в метаболизме липидов в клетках, что имеет решающее значение для прецессии метаболического синдрома и СД2. Akkermansia muciniphila и его метаболит пропионат модулируют экспрессию Fiaf, GPR43, гистоновых деацетилаз (HDAC) и рецептора гамма, активируемого пролифератором пероксисом (PPAR гамма), и они играют важную роль в регуляции функции фактора транскрипции, клеточного цикла , липолиз и насыщение (Lukovac et al., 2014). Дисбиоз кишечника изменяет микробиом, повышая регуляцию мембранного транспорта сахаров и аминокислот с разветвленной цепью, а также подавляя биосинтез бутирата (Luca et al., 2019). Обогащенные микробные гены, сопоставленные с передачей сигналов окислительного стресса, предполагают прямую связь между измененным составом микробиоты и воспалительным состоянием у пациентов с СД2 (Tilg et al., 2020). Разрыв кишечного барьера, вызванный дисбактериозом, приводит к местному и системному воспалению, которое имеет отношение к развитию СД2 (Belizario et al., 2018).
Метаболическое воспаление, вызванное эндотоксинами
СД2 в определенной степени является воспалительным заболеванием, и несколько воспалительных молекул указывают на развитие СД2 (Zhou W. Y. et al., 2019). Микробиота модулирует экспрессию PPAR в кишечных эпителиальных и иммуномодулирующих клетках и изменяет воспалительные реакции хозяина (Hasan et al., 2019). Между тем, гомеостатический дисбаланс или нарушение способствует перемещению эндотоксинов, таких как липополисахарид (ЛПС), в кровоток, что приводит к усилению системного и кишечного воспаления и проницаемости стенок желудочно-кишечного тракта.При диабете микробиота кишечника вносит свой вклад в патофизиологическую регуляцию эндотоксемии и увеличивает проницаемость кишечника из-за нарушения функции белков плотного соединения, таких как оккуладин и ZO-1 (Cani et al., 2007b, 2008). Это увеличивает уровни ЛПС в плазме, что вызывает легкое воспаление в кровообращении и, в конечном итоге, инсулинорезистентность (ИР) (Cani et al., 2007a). Как корецептор дифференцировочного антигена моноцитов CD14 + , TLR4 опосредует различные воспалительные каскады, вызванные LPS, и развитие врожденного иммунного ответа, который состоит из рецепторов распознавания (PRR), антимикробных пептидов и секретируемого IgA (Creely et al., 2007; Джиалал и Раджамани, 2014). Хроническое воспаление средней степени тяжести следует за активацией провоспалительных путей, что способствует ожирению, ИР, снижению уровня β-клеток поджелудочной железы и, в конечном итоге, СД2 (Lew et al., 2019). LPS является одним из PAMP, которые распознаются PRR, включая Toll-подобные рецепторы (TLR) и Nod-подобные рецепторы (NLR). Взаимодействие между PRR и LPS индуцирует продукцию цитокинов и интерферона. В свою очередь, они запускают провоспалительные сигнальные каскады в периферических тканях человека (Zhao C.и др., 2019). Воспаление способствует окислительному состоянию, что увеличивает обогащение аэротолерантных типов. Это также увеличивает производство концевых акцепторов электронов для факультативных анаэробов. Это означает, что воспалительное состояние способствует серьезности дисбактериоза кишечника, что способствует разрушению бактериального барьера (Winter et al., 2013).
Снижение продукции короткоцепочечных жирных кислот
SCFAs являются побочными продуктами анаэробной микробной ферментации непереваренной пищи в толстой кишке (Wisniewski et al., 2019). Они могут модулировать энергетический гомеостаз хозяина посредством взаимодействия между хемосенсорными энтероэндокринными клетками, которые принадлежат эпителиальным клеткам и могут сами поставлять энергию (Kuwahara, 2014). Имеются данные о том, что SCFAs увеличивают массу β-клеток поджелудочной железы и секрецию инсулина, снижают секрецию глюкагона и регулируют метаболизм глюкозы (Mandaliya and Seshadri, 2019b). Дисбактериоз кишечника может изменить соотношение анаэробных и аэробных бактерий, что напрямую приводит к снижению уровня SCFA. SCFAs, включая пропионат, бутират и ацетат, могут запускать локальное высвобождение пептида YY (PYY) и GLP1.Рецепторы SCFA сильно экспрессируются на L-клетках, продуцирующих GLP1, в дистальных отделах подвздошной кишки и толстой кишки (Mandaliya and Seshadri, 2019a). Пропионат является субстратом для глюконеогенеза, который защищает хозяина от ожирения, вызванного диетой, и непереносимости глюкозы (Ohira et al., 2017). Бутират, SCFA, ферментированный микробиотой, является энергетическим субстратом для колоноцитов, который снижает проницаемость кишечного барьера, способствуя высвобождению GLP-2 и увеличивая секрецию слизи (Sonnenburg and Backhed, 2016). Бутират может подавлять аномально увеличенную пролиферацию эпителиальных клеток толстой кишки при диабете, воздействуя на HMGB1 (Wang S.Ю. и др., 2019). Кроме того, как ингибитор гистондеацетилазы (HDAC), бутират может способствовать дифференцировке, пролиферации, функции β-клеток и улучшению инсулина, который имеет тесную связь с диабетом (Khan and Jena, 2015). Исследователи также продемонстрировали, что бутират и пропионат активируют кишечный глюконеогенез (IGN) посредством цАМФ-зависимого механизма и нейронной цепи кишечник-мозг с участием рецептора жирных кислот FFARS, который оказывает метаболическое влияние на контроль глюкозы у мышей (De Vadder et al., 2016 ).Что касается ацетата, обнаружено, что повышенное производство этого SCFA способствует увеличению секреции инсулина, стимулированной глюкозой, за счет активации парасимпатической нервной системы (Perry et al., 2016).
Таким образом, из-за дисбактериоза кишечника эндотоксин-опосредованное стимулирование метаболического воспаления и снижение уровней SCFA являются двумя основными механизмами, лежащими в основе взаимодействия между микробиотой кишечника и хозяином при СД2 (2).
T2DM регулирует численность определенных кишечных бактерий, чтобы уменьшить количество продуцирующих слизь видов и нескольких бактерий, продуцирующих короткоцепочечные жирные кислоты (SCFA).Затем эти бактерии продуцируют ЛПС, который может разрушить барьерную функцию кишечника и просачиваться во внутреннюю среду через окклюдин и ZO-1, что приводит к воспалительному статусу. Низкие циркулирующие уровни SCFA могут способствовать нарушению сытости у хозяина и снижению чувствительности к инсулину или секреции через GPR. Нарушение углеводного обмена может вызвать нарушение кишечного барьера, что приводит к более тяжелому дисбактериозу кишечника. При стимуляции LPS IECs секретируют провоспалительные цитокины MCP-1, TNF-α, IL-18 и IL-6.Врожденные иммунные клетки, такие как макрофаги и DC, используют рецепторы распознавания образов для присоединения к патогенам или токсинам, таким как LPS, что приводит к активации воспалительного каскада.
Метаболическая дисфункция, вызванная бактериальными компонентами и метаболитами
Во время переваривания пищи метаболизм ксенобиотиков и жизненные движения хозяина активируют серию событий через ферментативные пути для функционирования в сочетании с кишечником (Tremaroli and Backhed, 2012). Бактериальные компоненты способствуют производству многих биоактивных типов молекул, таких как желчные кислоты и адипокины, которые необходимы для взаимосвязанных путей гликолиза, цикла трикарбоновых кислот / Кребса, окислительного фосфорилирования (OXPHOS) и метаболизма аминокислот и жирных кислот (Belizario et al. ., 2018). Желчные кислоты – это молекулы, вырабатываемые из холестерина микробиотой нижних отделов тонкой и толстой кишки. Сообщается, что они подавляют ожирение, вызванное диетой, и предотвращают развитие ИР путем активации рецептора желчных кислот (фарнезоид-рецептор, FXR) и мембранного рецептора G-белка TGR5, что указывает на их влияние на энергетический гомеостаз (Gastaldelli et al., 2010; Gerard and Видаль, 2019). Способность метаболизировать естественный антагонист FXR тауро-b-мюрихоловую кислоту является важным шагом на пути к нарушению толерантности к глюкозе и инсулину (Lazar et al., 2019). Жировая ткань обычно считается активным органом, выполняющим ключевые метаболические и эндокринные функции, секретируя биоактивные пептиды и белки, называемые адипокинами, которые играют решающую роль в метаболизме хозяина. Под влиянием кишечной микробиоты он высвобождает воспалительные адипокины, такие как белок, связывающий жирные кислоты 4 (FABP-4), белок, стимулирующий ацилирование (ASP), ретинол-связывающий белок 4 (RBP4), липокалин-2 (LCN2) и хемерин. и т. д., которые связаны с усилением воспаления, ожирением, инсулинорезистентностью и, в конечном итоге, с СД2 (Lee et al., 2019) ().
Метаболическая дисфункция, вызванная бактериальными компонентами и метаболитами, серия ферментативных реакций, приводящих к инсулинорезистентности.
Взаимодействие микробиоты кишечника и лекарственных растений во время лечения СД2
ТМ регулируют состав полезных и вредных бактерий
Существенное различие между составом микробиоты кишечника пациентов с СД2 и здоровых людей было обнаружено еще в 2010 году. из Bacteroidetes до Firmicutes и группы Bacteroides-Prevotella до C.coccoides-E. rectale были тесно связаны с концентрацией глюкозы в крови; кроме того, представители бетапротеобактерий были высоко обогащены у пациентов с СД2 (Ларсен и др., 2010). В связи с растущими данными исследований дисбаланс полезных и вредных бактерий считается важным для патогенеза СД2. SCFAs, включая бутират, пропионат и ацетат, связаны с уменьшением ожирения и СД2 (Ju et al., 2019). Бутират SCFA особенно полезен для лечения СД2 за счет повышения чувствительности к инсулину и улучшения функции митохондрий (Gao et al., 2009). Увеличение количества SCFA-продуцирующих и особенно бутират-продуцирующих бактерий и снижение количества условно-патогенных микроорганизмов являются ключевыми механизмами, лежащими в основе лечения СД2 (Zhang B. et al., 2019).
Ревень – это многолетнее растение, используемое для терапии воспалительных заболеваний, включая острый панкреатит и гастроэнтерит, а также диабета и его осложнений в сочетании с другими травами (Li et al., 2004; Zhou et al., 2016; Cao et al., 2017). Антрахинон, содержащий свободные антрахиноны и гликозиды, является одним из его основных компонентов (Arvindekar et al., 2015). Недавнее исследование на животных показало, что терапевтический механизм очищенного антрахинон-гликозидного препарата из ревеня (RAGP) для лечения СД2 включает улучшение дисбактериоза кишечника за счет обогащения пробиотиком Lactobacillus и бактериями, продуцирующими короткоцепочечные жирные кислоты, и снижением численности бактерий. группа Lachnospiraceae NK4A136 и бактерии-продуценты ЛПС Desulfovibrio (Cui et al., 2019).
Водный экстракт Caulis Spatholobi (WECS) эффективно поддерживал гомеостаз глюкозы в крови и снижал инсулинорезистентность в исследовании с использованием модели мышей с ожирением, вызванным диетой (DIO).Он улучшил не только лабораторные показатели, связанные с диабетом, но и дисбактериоз микробиоты, в основном за счет увеличения количества родов бактерий, связанных с ожирением и диабетом, включая Parabacteroides, Bacteroidetes, Anaerotruncus и Bifidobacterium (Zhang C. et al. др., 2019).
Xiexin Tang (XXT) – это китайская травяная формула, обычно применяемая для лечения диабета. В исследовании in vivo XXT заметно изменил микробиоту кишечника крыс с СД2.Он увеличивал количество SCFA-продуцирующих и противовоспалительных бактерий, таких как Adlercreutzia, Alloprevotella, Barnesiella , [ Eubacterium ] Ventriosum группа, Blautia, Lachnospiraceae UCG-001BB, Papillibacter и группа в разной степени. Изменения состава кишечной микробиоты соответствовали уменьшению гипергликемии у крыс с СД2, нарушению липидного обмена и воспалительной активности (Wei et al., 2018).
Отвар Хуан-Лянь-Цзе-Ду (HLJDD), известная китайская травяная формула, происходящая из династии Тан, широко применялась в лечении СД2 в течение тысяч лет (Zhang et al., 2014). Несмотря на его клинический гипогликемический эффект, основной механизм неясен. Недавно исследование на животных показало, что HLJDD улучшает уровень глюкозы в крови и восстанавливает дисрегулируемый состав микробиоты. Улучшение индуцированной HLJDD гипергликемии было в основном связано с увеличением численности бактерий, продуцирующих SCFA, таких как Adlercreutzia, Porphyromonadaceae (включая Parabacteroides ), Lachnospiraceae (включая Blautia ) и уменьшение количества патогенных бактерий. бактерии, такие как Corynebacteriaceae (включая Corynebacterium ), Staphylococcaceae (включая Staphylococcus ) и Aerococcaceae (включая Corynebacterium и Facklamia al.) ( Facklamia al.), 2018).
Помимо экспериментов на животных, постепенно накапливаются клинические исследования, изучающие и проверяющие микробные механизмы кишечника, лежащие в основе гипогликемического эффекта ТМ при лечении СД2. В основном они сосредоточены на изменении состава микробиоты кишечника. Клиническое испытание антидиабетических эффектов традиционной китайской травяной формулы под названием отвар Gegen Qinlian (GQD) обнаружило корреляцию между увеличением количества полезной микробиоты кишечника и ее клинической эффективностью, включая уровень глюкозы в крови и функцию островковых β-клеток. .Кроме того, бактерии, продуцирующие бутират Faecalibacterium prausnitzii , были значительно обогащены в кале пациентов с СД2 после 12 недель вмешательства (Xu et al., 2015). Рандомизированное клиническое испытание эффективности специально разработанной китайской травяной смеси под названием AMC для лечения СД2 с гиперлипидемией показало, что AMC значительно улучшил уровни глюкозы и липидов в крови и улучшил уровни HOMA-IR и триглицеридов с большей эффективностью, чем метформин. Исследование подтвердило, что эти эффекты были связаны с бактериями, продуцирующими бутират, такими как Faecalibacterium spp.и Blautia (Tong et al., 2018) ().
Таблица 1
HM регулирует состав микробиоты кишечника.
| HM | Экстракт или натуральные травы | Субъект | Индексы терапевтического эффекта | Обогащенная микробиота кишечника 78 | Сниженная микробиота кишечника||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Ревень | Очищенный экстракт (антрахинон-гликозид) | Крысы с диабетом 2-го типа | FBG, GSP, уровень инсулина и чувствительность, GLP-1 | Lactobacillus N | 9124 Lactobacillus N 9124 Lactobacillus Cui et al., 2019||||||||
| Caulis Spatholobi | Водный экстракт | Мыши с ожирением, вызванные диетой | Масса тела, масса жировых органов, содержание жира в организме, потребление кислорода, концентрация норадреналина, толерантность к глюкозе, чувствительность к инсулину, профиль липидов, TNF-α , IL-6, IL-1β | Parabacteroides, Bacteroidetes, Anaerotruncus, Bifidobacterium | – b | Zhang CH et al., 2019 | ||||||
| Натуральные травы 2 диабетические крысы | Масса тела, FBG, липидный профиль, уровень инсулина и чувствительность, TNF-α, IL-6, CRP, резистин | Adlercreutzia, Alloprevotella, Barnesiella , [ Eubacterium ] Blauriosum group, группа Ventauriosum Lachnospiraceae UCG-001, Papillibacter, Prevotellaceae NK3B31 группа | – | Wei et al., 2018 | ||||||||
| Отвар Huang Lian Jie Du | Натуральные травы | Крысы с диабетом 2 типа | Масса тела, FBG, толерантность к глюкозе, липидный профиль, уровень инсулина и чувствительность, IL-1β, IL-6, CRP, MDA , SOD, GSH-Px, ALT, AST, TBA, TBIL, DBIL | Adlercreutzia, Porphyromonadaceae, Lachnospiraceae | Corynebacteriaceae, Staphylococcaceae, Corynebacteriaceae, Staphylococcaceae, Corynebacteriaceae | Натуральные травы | Пациенты с СД2 | HbA1c, FBG, 2h-PBG, уровень и чувствительность к инсулину, ИМТ, липидный профиль, окружность талии и бедер | Faecalibacterium prausnitzii | – | Xu et al., 2015 | |
| AMC | Натуральные травы | Пациенты с T2DM | HbA1c, FBG, 2h-PBG, уровень инсулина и чувствительность, профиль липидов, ИМТ, масса тела, окружность талии и бедра | Faecalibacterium spp, Blautia | – | Tong et al., 2018 |
HMs уменьшают воспаление, вызванное кишечной микробиотой и иммунитетом хозяина
Патогенез T2DM тесно связан с воспалительным состоянием низкой степени и активацией иммунный ответ хозяина, также называемый продолжающимся цитокин-индуцированным острофазовым ответом (Pickup, 2004; Donath and Shoelson, 2011).В патогенезе СД2 ЛПС, выделяемый грамотрицательными бактериями, попадает в энтерогепатическую циркуляцию из-за кишечного микроэкологического нарушения, которое может инициировать иммунный ответ в жировой ткани. Активируется экспрессия TLR, и высвобождаются провоспалительные адипоцитокины, такие как IL-1, IL-6 и TNF-α, что приводит к воспалительному состоянию слабой степени (Creely et al., 2007). Т-клетки, как критический эффектор клеточно-опосредованного иммунитета, имеют решающее значение для развития СД2 и связанного с ним воспаления.Метаболизм Т-клеток тесно связан с инсулином и его нисходящей передачей сигналов через рецептор инсулина, а отсутствие рецепторов инсулина на Т-клетках может ингибировать гликолиз (Tsai et al., 2018). Кроме того, накопление доказательств связывает CD4 + Т-лимфоцитов с ожирением и инсулинорезистентностью, которые являются основными факторами риска СД2 (Xia et al., 2017). Подтипы CD4 + Т-клеток, включая клетки Th2 и Th3, могут продуцировать большое количество провоспалительных цитокинов после их активации для регулирования воспалительных процессов (Kahn et al., 2006; Рафаэль и др., 2015). По мере накопления доказательств того, что микробиота кишечника играет значительную роль в иммунитете хозяина и последующем воспалении, постепенно появляются связанные с ней механизмы ТМ в лечении СД2. Терапевтические механизмы, лежащие в основе их эффективности, связаны с кишечным противовоспалительным действием и иммуномодуляцией.
Scutellaria Radix (SR) и Coptidis Rhizome (CR) – хорошо известные травы, применяемые для лечения диабета на протяжении тысячелетий, и продемонстрировали гипогликемические эффекты как в клинических испытаниях, так и в базовых экспериментах (Zhang et al., 2018; Ран и др., 2019). Комбинация SR и CR (SC) проявляла антидиабетическую активность через сигнальный путь TLR4, участвующий в противовоспалительной регуляции и регуляции микробиоты кишечника. Введение SC на мышиной модели T2DM KK-Ay было связано со значительным снижением уровней белка LPS, IL-6, TNF-α, TLR4 и MyD88 и улучшением содержания глюкозы, инсулина и липидов в крови; кроме того, Lactobacillus Кишечник считался возможным целевым пробиотиком (Zhang C.H. et al., 2019).
Potentilla disolor Bunge (PDB) – многолетнее растение, обычно используемое в качестве антидиабетического средства. В исследовании на животных его гипогликемический эффект был тесно связан с регуляцией кишечной эндотоксемии и воспаления. По сравнению с контрольными мышами, мыши T2D, получавшие PDB, показали значительное снижение уровней TNF-α, IL-1β и IL-6 в сыворотке и LPS в кале и сыворотке. Кроме того, численность Bacteroidales_S24-7_group увеличилась после введения PDB, что сопровождалось уменьшением численности Helicobacteraceae (Han et al., 2019).
Dendrobium – это HM, клинически используемый для лечения T2DM и его осложнений, а полифенолы dendrobium являются его основными составляющими, которые оказывают различные фармакологические эффекты (Paudel et al., 2018). Исследование эффектов богатого полифенолами экстракта Dendrobium loddigesii (DJP) у мышей с диабетом выявило противовоспалительную активность DJP для лечения СД2 за счет снижения экспрессии IL-6 и TNF-α, что коррелировало с модуляция кишечной микробиоты, включая увеличение соотношения Bacteroidetes до Firmicutes и численность Prevotella / Akkermansia и снижение численности S24-7 / Rikenella / Escherichia coli ., 2018) ().
Метаболизм, опосредованный кишечной микробиотой, модулирует биотрансформацию ТМ
Клиническое применение ТМ для лечения СД2 широко распространено во всем мире. Однако до сих пор существует огромный пробел с точки зрения одобрения Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США и открытия новых лекарств из-за низкой биодоступности и биологической активности ТМ после перорального приема (Kesarwani et al., 2013). В последние годы ученые обнаружили, что микробиота кишечника критически влияет на биотрансформацию гипогликемических ТМ, превращая полярные и бедные липофильные соединения в менее полярные и более липофильные соединения и улучшая скорость их перорального всасывания при лечении СД2.В частности, микробиомы кишечника кодируют различные ферменты, которые могут метаболизировать ТМ, изменять структуру исходных химических веществ и производить новые соединения (Koppel et al., 2017). После метаболизма микробиомов кишечника биодоступность и биоактивность вновь продуцируемых химических соединений отличаются от таковых у исходных химикатов ТМ, а соединения с более высокой биодоступностью и биоактивностью могут легко абсорбироваться кишечником и оказывать терапевтическое действие на хозяина. В процессе биотрансформации ТМ штамм кишечных бактерий может трансформировать различные химические соединения.Между тем, соединение также может быть преобразовано синергическим действием различных бактерий.
Берберин (BBR) является типичным компонентом широко используемого гипогликемического HM CR (Wang J. et al., 2019). Многочисленные исследования продемонстрировали гипогликемические эффекты BBR при СД2 (Zhang et al., 2010; Liang et al., 2019). Однако, как изохинолиновый алкалоид с плохой растворимостью в воде, BBR плохо всасывается эпителиальными клетками кишечника, что приводит к его чрезвычайно низкой биодоступности (Liu et al., 2016). Недавние исследования показали, что микробиота кишечника играет важную роль в биотрансформации BBR и его антидиабетических эффектах. В кишечнике хозяина кишечная микробиота превращает BBR в более легко усваиваемый, но неактивный метаболит, дигидроберберин (dhBBR), посредством катализа нитроредуктаз. После абсорбции dhBBR тканью стенки кишечника он немедленно окисляется до BBR и оказывает фармакологическое действие в кровообращении (Feng et al., 2015).
Женьшень – это HM, который применялся для лечения СД2 в течение тысяч лет.Положительные эффекты женьшеня в клинических испытаниях включают улучшение контроля уровня глюкозы в крови и чувствительности к инсулину у пациентов с СД2 (Gui et al., 2016). Гинзенозиды, основные активные компоненты женьшеня, оказывают гипогликемическое действие у крыс с диабетом 2 типа, включая снижение уровня глюкозы в крови, модуляцию инсулиновой реакции и уменьшение массы тела (Tian et al., 2018). Метаболизм микробиоты кишечника оказывает заметное влияние на фармакологические эффекты гинсенозидов. Гинсенозид Rb1, антидиабетический агент, относящийся к тетрациклическим тритерпеноидным сапонинам, имеет низкую биодоступность (Yu et al., 2018; Чжоу П. и др., 2019). Однако после катализа β-глюкозидаз, продуцируемых кишечными бактериями, гинсенозид Rb1 может метаболизироваться до более биологически активных соединений, таких как гинзенозид 20 (S) -Rg3 и соединение K (Jung et al., 2012; Quan et al., 2012; Ким, 2013). Гинсенозиды Re и Rg1 также трансформируются в новые метаболиты, такие как редкие гинзенозиды Rd, GypXVII, Rg2 и протопанаксатриол, которые обладают более высокой биологической и фармакологической активностью (Yu et al., 2017).
Куркумин, один из основных активных компонентов куркумы HM, обладает рядом фармакологических свойств, включая антидиабетические, противовоспалительные и антиоксидантные эффекты, и защищает от диабета и его осложнений (Nabavi et al., 2015; Парсаманеш и др., 2018). Однако, как полифенольное соединение, низкая биодоступность куркумина при пероральном приеме представляет собой большой барьер на пути к его клинической эффективности (Lopresti, 2018). Микробиота кишечника была определена как ключевой момент в биотрансформации куркумина. Куркумин может метаболизироваться посредством метаболизма кишечной бактерии человека Blautia sp . MRG-PMF1 превращается в деметилкуркумин и бисдеметилкуркумин в результате реакции расщепления метиларилового эфира (Burapan et al., 2017).Кроме того, в эксперименте по инкубации человеческих фекалий in vitro были обнаружены три метаболита, тетрагидрокуркумин (THC), дигидроферуловая кислота (DFA) и метаболит, предварительно идентифицированный как 1- (4-гидрокси-3-метоксифенил) -2-пропанол. в смеси, содержащей куркумин, после ферментации фекалий человека (Tan et al., 2015). Бактерия Escherichia coli из фекалий человека была обнаружена при микробной биотрансформации куркумина. Посредством двухступенчатого восстановления с помощью уникального фермента, очищенного от Escherichia coli , который был назван «НАДФН-зависимый куркумин / дигидрокуркумин редуктаза», куркумин может быть преобразован в дигидрокуркумин в качестве промежуточного метаболита и тетрагидрокуркумин в качестве конечного продукта (Hassaninasab et al. ., 2011).
Кверцитрин – это биофлавоноид, присутствующий в различных антидиабетических ТМ, таких как Mori Folium, Bupleurum Radix и боярышник, который положительно влияет на метаболизм углеводов и антиоксидантную активность во время лечения диабета (Babujanarthanam et al., 2010, 2011). Однако из-за его относительно низкой биодоступности ключевые факторы, опосредующие его полезные эффекты, и лежащий в основе механизм остаются неуловимыми. Эксперимент in vivo , инкубирующий кверцетин с кишечными бактериями человека, показал, что продуцируются метаболиты с более высокой биоактивностью, включая кверцетин, 3,4-дигидроксифенилуксусную кислоту и 4-гидроксибензойную кислоту. Fusobacterium K-60 была обнаружена как основная бактерия, которая трансформировала кверцитрин в кверцетин (Kim et al., 1999).
Обсуждение и перспективы
В последние годы постоянно исследуются механизмы изменений микробиоты кишечника, связанных с СД2. Дисбактериоз кишечника, индуцированное эндотоксинами метаболическое воспаление, нарушение иммунного ответа, бактериальные компоненты и метаболиты, а также снижение продукции SCFAs тесно связаны с патогенезом T2DM и представляют собой механизм взаимодействия микробиоты кишечника с хозяином.Однако исследования гипогликемических эффектов ТМ на кишечную микробиоту находятся только в зачаточном состоянии. Наш анализ соответствующих клинических исследований показал, что большинство из них просто анализировали модуляцию состава микробиоты кишечника ТМ, тогда как основные механизмы, включая режим взаимодействия флор с ТМ, затронутые пути хозяина и терапевтические мишени, изучались редко. Таким образом, мы считаем, что с точки зрения микробиоты кишечника исследование терапевтических механизмов гипогликемических ТМ имеет большой потенциал.
ТМ является основным компонентом системы традиционной китайской медицины (ТКМ) и считается «основой всех других лекарств» (An et al., 2019). На протяжении тысячелетий это не было научно признано, потому что эта система и ее теория полностью отличаются от современной науки. Ядром системы традиционной китайской медицины является баланс и дисбаланс Инь и Ян, которые сложно количественно оценить и охарактеризовать, тогда как современная наука фокусируется на объективных и поддающихся количественной оценке свидетельствах. Хотя назначения нескольких комбинаций ТМ, основанные на теории ТКМ, достигли заметной клинической эффективности, плохое знание их механизмов сильно ограничило прогресс в ТКМ и ТМ.Однако исследования взаимодействия между микробиотой кишечника и ТМ представляют научные доказательства полезности ТКМ и ТМ и рациональной совместимости, что значительно повышает оптимизм в отношении их использования в клинической практике. В рецептах TCM несколько комбинаций HM проявляют синергетические или антагонистические эффекты, чтобы получить лучшую эффективность или снизить токсичность и побочные эффекты. Например, для лечения T2DM, CR и SR обычно комбинируются для снижения уровня глюкозы в крови, потому что, согласно теории TCM, они оба имеют горький вкус и могут бороться с высоким содержанием сахара.Как бы неясна эта теория, микробиота кишечника может быть прекрасным объяснением того, почему основные компоненты CR и SR, а именно берберин и байкалин, могут улучшить дисбаланс кишечного микробиома у хозяина, увеличить численность различных бактерий, продуцирующих SCFA, и уменьшить количество вредных бактерий (Zhang et al., 2015; Ju et al., 2019). Однако антагонизм между CR и SR в кишечнике также существует. В эксперименте in vitro с использованием суспензий фекалий крыс CR снижал биодоступность антрахинонов за счет ингибирования превращения конъюгированных антрахинонов в свободные антрахиноны, опосредованного микробиотой кишечника, тогда как SR противостоял CR, ингибируя глюкуронирование антрахинонов в кишечнике (Yan et al. ., 2015).
Изучение взаимодействия кишечной микробиоты-хозяина-HM также предлагает новые взгляды на прецизионную терапию HM и открытие лекарств. Метформин повсеместно признан антидиабетическим средством первой линии для лечения СД2 и улучшает бактериальный дисбактериоз кишечника. Было подтверждено, что одним из терапевтических эффектов метформина при СД2 является продукция SCFA, а также увеличение численности Escarianha (Forslund et al., 2015). Метформин оказывает антигипергликемический эффект за счет увеличения содержания желчной кислоты гкурсодезоксихолевой кислоты в кишечнике за счет уменьшения численности видов B.fragilis и его гидролазной активностью желчных солей (Sun et al., 2018). Однако менее известно, что происхождение метформина можно проследить до традиционного европейского HM, а именно Galega officinalis (также известного как козья рута) (Bailey, 2017). Этот классический и успешный пример демонстрирует, что травы очень ценны для медицины и вносят значительный вклад в открытие лекарств. В связи с возросшим в последнее время интересом и накоплением научных данных о ТМ, их фармакологическом действии и связанных с ними механизмах, открытие и разработка новых лекарств на основе ТМ, как ожидается, станет важной тенденцией будущего.В качестве определенной мишени микробиота кишечника может быть направлением для точно направленной терапии ТМ и открытия новых лекарств с использованием экстрактов из природных ТМ.
Кроме того, многие травы Китайской фармакопеи, обогащенные клетчаткой и растительными веществами, также присутствуют в нашем ежедневном рационе и называются растительными пищевыми добавками (Di Giorgi Gerevini et al., 2005). Например, Momordica charantia и китайский ямс являются обычными продуктами в ежедневном рационе, а также используются в качестве HM для лечения диабета и регулирования микробиоты кишечника (Li et al., 2017; Wang et al., 2017). Диета тесно связана с СД2, а микробиота кишечника считается пересечением диеты и болезни (Sonnenburg and Backhed, 2016). Кроме того, многочисленные исследования подтвердили, что ежедневный распорядок дня важен для лечения диабета (Nie et al., 2019). Таким образом, изучение растительных продуктов, регулирующих флору, может помочь в разработке гипогликемических пищевых добавок и лекарств для достижения цели: «Пусть пища будет лекарством, а лекарства – пищей.”
Глубокие последствия для диеты и болезней
Abstract
Микробиом кишечника играет важную роль в здоровье человека и влияет на развитие хронических заболеваний, начиная от метаболических заболеваний и заканчивая желудочно-кишечными расстройствами и колоректальным раком. Эти состояния, которые все чаще встречаются в западных обществах, требуют лечения. Режимы питания и факторы окружающей среды оказывают сильное влияние на формирование микробиоты кишечника в режиме реального времени. Разнообразные популяции кишечных бактерий опосредуют свое благотворное действие посредством ферментации пищевых волокон с образованием короткоцепочечных жирных кислот, эндогенных сигналов, играющих важную роль в гомеостазе липидов и уменьшении воспаления.Недавний прогресс показывает, что исходный микробный профиль человека является ключевым фактором при прогнозировании его реакции на вмешательство с использованием живых пробиотиков. Микробиота кишечника сложна, и ее сложно охарактеризовать. Энтеротипы были предложены с использованием таких показателей, как разнообразие альфа-видов, отношение Firmicutes к типу Bacteroidetes и относительная численность полезных родов (например, Bifidobacterium , Akkermansia ) по сравнению с факультативными анаэробами ( E. coli ), pro -воспалительный Ruminococcus , или небактериальные микробы.Состав микробиоты и относительные популяции видов бактерий связаны с физиологическим здоровьем по разным направлениям. Мы рассматриваем роль качества диеты, потребления углеводов, ферментируемых FODMAP и пребиотических волокон в поддержании здоровой микрофлоры кишечника. Обсуждаются последствия для различных состояний, включая ожирение, диабет, синдром раздраженного кишечника, воспалительные заболевания кишечника, депрессию и сердечно-сосудистые заболевания.
Ключевые слова: кишечная микробиота, питание, привычные диеты, западная диета, ожирение, кардиометаболические факторы риска, хронические заболевания, желудочно-кишечные расстройства, пребиотики и пробиотики
1.Введение в кишечную микробиоту и заболевания
Кишечный микробиом недавно был вовлечен в множество хронических заболеваний, начиная от воспалительного заболевания кишечника (ВЗК), диабета 2 типа (СД2) и сердечно-сосудистых заболеваний (ССЗ) до колоректального рака [1,2 , 3]. Сообщество из ~ 200 распространенных бактерий, вирусов и грибов, населяющих желудочно-кишечный тракт (ЖКТ) человека, обеспечивает хозяину уникальные метаболические функции и имеет фундаментальное значение для здоровья и болезней [4,5]. Микробиом относится к коллективным геномам всех микроорганизмов, населяющих окружающую среду.В то время как выделение и культивирование каждого отдельного вида является сложной задачей, передовой метод анализа последовательностей, метагеномика, позволил реконструировать виды микробов и их функции по совокупному содержанию нуклеотидов, содержащихся в образце стула. Анализ метагеномного секвенирования с дробовиком обнаружил 1952 неклассифицированных вида бактерий в микробиоме кишечника человека в дополнение к 553 бактериям, ранее культивированным из кишечника [6]. Центральный вопрос в медицине касается природы взаимосвязи между здоровьем человека и микробиотой кишечника, которая относится к сообществу самих микроорганизмов, относительной численности популяций отдельных видов и их функциям.
Метагеномика и анализ данных о близнецах показали, что факторы окружающей среды, такие как диета и совместное проживание в семье, значительно перевешивают наследственный генетический вклад в состав и функцию кишечной микробиоты [7]. По аналогии со статистикой генетической наследственности Rothschild et al. построили индекс ассоциации микробиома. Наблюдаются значительные ассоциации между микробиомом кишечника и фенотипами хозяина по индексу массы тела (ИМТ) (25%), соотношению талии и бедер (24%), уровням глюкозы натощак (22%), гликемическому статусу (25%), высокому уровню уровень холестерина липопротеинов плотности (ЛПВП) (36%) и ежемесячное потребление лактозы (36%) [7].По сравнению с ИМТ соотношение талии и бедер является антропометрическим показателем центрального ожирения и более сильным предиктором диастолического и систолического артериального давления, общего холестерина / ЛПВП и триглицеридов [8], а также смерти от сердечно-сосудистых заболеваний [9].
Западная диета оказывает глубокое влияние на разнообразие и популяции микробных видов, составляющих флору кишечника [10]. В США проживает самое большое количество иммигрантов в мире, у многих из которых после иммиграции развиваются метаболические заболевания. Более ранние эпидемиологические данные показали, что в течение 15 лет после эмиграции в США возможно четырехкратное увеличение риска ожирения.S. по сравнению с популяциями, остающимися в стране их рождения [11]. В недавнем поперечном и продольном исследовании когорты азиатских американцев из нескольких поколений было показано, что эмиграция в США снижает разнообразие и функцию кишечных микробов [12]. Альфа-разнообразие измерялось с помощью энтропии Шеннона, количественного индекса, который учитывает численность и равномерность видов, обитающих в хозяине, в отличие от видового богатства, которое представляет собой количество присутствующих видов. В рамках типа грамотрицательных Bacteroidetes бактериальные штаммы из рода Prevotella , ферменты которых разрушают растительную клетчатку, были вытеснены доминантными штаммами из рода Bacteroides в зависимости от времени, проведенного человеком в U.S. Отношение Bacteroides к Prevotella увеличилось в 10 раз, что коррелирует со временем в десятилетиях, проведенных в США. До этого исследования метагеномика выявила три группы вариаций в кишечнике человека, которые называются энтеротипами [ 13]. Первый энтеротип с высоким содержанием Bacteroides и низким содержанием Prevotella, обнаружен у лиц, длительно соблюдающих западную диету с высоким содержанием животного белка, питательного холина и насыщенных жиров [14]. Второй энтеротип с высоким содержанием Prevotella и низким содержанием Bacteroides связан с растительной диетой, богатой клетчаткой, простыми сахарами и соединениями растительного происхождения.Третий потенциальный энтеротип, хотя и менее отчетливый, был обнаружен в несколько более высокой популяции рода Ruminococcus внутри филума Firmicutes. Обогащенный Ruminococcus связан с синдромом раздраженного кишечника (СРК) [15], а временное цветение провоспалительного Ruminococcus было связано с активными обострениями ВЗК [16]. R. gnavus , распространенный микроб кишечника, который размножается при ВЗК, секретирует уникальный олигосахарид L-рамнозы, который индуцирует фактор некроза опухоли альфа (TNFα), главный провоспалительный цитокин [17].
2. Микробиота, иммунный ответ и диета при ВЗК
ВЗК – хроническое заболевание ЖКТ, характеризующееся сверхактивным иммунным ответом на микробиом кишечника. ВЗК – серьезное изнурительное состояние, которое влияет на рост и развитие детей, увеличивает риск колоректального рака и может привести к опасным для жизни осложнениям [18]. Существует две формы ВЗК, болезнь Крона и язвенный колит, которые различаются воспаленными участками кишечника. Обычно анаэробные микробы в кишечнике получают свои питательные вещества в результате ферментации неперевариваемых олигосахаридов и других углеводов, не попадающих в проксимальный отдел пищеварения [19].При ВЗК акцепторы респираторных электронов, образующиеся как побочный продукт воспалительной реакции хозяина, становятся факторами стресса окружающей среды, которые поддерживают рост бактерий [20]. Нарушение приводит к окислительному стрессу для хозяина и микробиома, что приводит к дисбактериозу кишечника в виде снижения богатства сообщества и распространения факультативных анаэробных Enterobacteriaceae и прикрепившихся инвазивных штаммов Escherichia coli [16,20,21]. Медикаментозная терапия ВЗК традиционно включала иммунодепрессанты в виде кортикостероидов, антиметаболитов или антител против TNF, часто с дополнительным назначением антибиотиков [22].Альтернативным лечением, которое назначают преимущественно детям, является определенная формула энтерального питания. Преимущество диетической терапии состоит в том, что она устраняет необходимость в иммуносупрессии, и считается, что она работает за счет изменения состава кишечной микробиоты.
Продольное исследование, включающее метагеномный анализ, было проведено с участием 90 детей, начавших лечение по поводу болезни Крона [22]. Симптомы желудочно-кишечного тракта, воспаление слизистой оболочки и микробные сообщества сравнивались при диетической и анти-TNF терапии и применении антибиотиков по сравнению со здоровыми детьми.Сообщества микробов разделены на два кластера по составу. Сообщество дисбиотиков, связанное с активным заболеванием, характеризовалось повышенным представительством грибов, увеличением количества бактерий, ферментирующих лактозу (Streptococcus, Lactobacillus, Klebsiella ), и присутствием ДНК человека в стуле (из эпителиальных клеток и лейкоцитов). У пациентов с болезнью Крона также снизилась относительная численность Prevotella и увеличилась на Escherichia по сравнению со здоровыми детьми.Лечение антибиотиками в течение последних шести месяцев было тесно связано с микробным дисбиозом [22], что согласуется с более ранними выводами о том, что пероральные антибиотики от прыщей являются фактором риска для нового начала болезни Крона [23]. Обработка антибиотиками способствовала обогащению грибов, таких как Candida и Saccharomyces [22]. С другой стороны, лечение энтеральным питанием [24] или терапией антителами уменьшало воспаление и заметно улучшало микробиоту кишечника. Относительные популяции грибов сократились в течение одной недели после приема определенной диетической формулы, в которой отсутствовала клетчатка [22].Поскольку определенная формула была эффективна для восстановления здоровой микробиоты, вполне вероятно, что более общая пероральная диета с правильным питанием может восстановить внутрипросветную среду [25,26,27].
3. Микробные метаболиты и короткоцепочечные жирные кислоты
3.1. Активация рецептора SCFA
Короткоцепочечные жирные кислоты (SCFA) привлекли значительное внимание из-за их роли в здоровье человека [28]. Облигатные анаэробные бактерии (филы Firmicutes и Bacteroidetes) кодируют множество ферментов для гидролиза сложных углеводов (цепочек молекул сахара), не усваиваемых хозяином, таких как резистентный крахмал и клетчатка.Некоторые роды, такие как Lactobacillus и Bifidobacterium , специализируются на ферментации олигосахаридов с использованием галактоолигосахаридов (GOS), фруктоолигосахаридов (FOS) и полисахарида инулина [29]. Углеводная ферментация анаэробами обеспечивает хозяина важными SCFA, такими как ацетат, пропионат и бутират [30]. Для SCFAs было идентифицировано несколько рецепторов, таких как рецептор свободных жирных кислот 3 (FFAR3 или GPR41) и рецептор ниацина 1 (GPR109A) [31]. GPR41 и GPR109A представляют собой рецепторы, связанные с G-белком (GPCR), обнаруженные на эпителиальных клетках кишечника, иммунных клетках и адипоцитах.Как эндогенные агонисты в передаче сигнала GPCR, SCFAs оказывают сильное влияние на физиологические процессы [32,33] независимо от доставки калорий хозяину в виде молекул углерода [34]. GPR41 связан с повышенным расходом энергии, экспрессией гормона лептина и снижением потребления пищи [31,35]. Аналогично активности ниацина, бутират активирует GPR109A для подавления воспаления толстой кишки и развития рака толстой кишки [36]. Ниацин является известным агентом, снижающим уровень липидов: GPR109A ингибирует гидролиз (липолиз) триглицеридов в адипоцитах, снижая уровень триглицеридов и липопротеинов низкой плотности (ЛПНП) в крови для снижения атерогенной активности.Ацетат и пропионат активируют рецептор GPR43 клеточной поверхности, чтобы вызвать хемотаксис нейтрофилов. GPR43 действует против липолиза и участвует в ВЗК, но противоречивые результаты, полученные на мышах, оставляют сомнения относительно того, какой из агонистов или антагонистов лучше всего лечит колит [35]. Растет интерес к использованию GPR41 и GPR43 в качестве мишеней для лечения хронических воспалительных заболеваний, астмы, артрита и ожирения [37]. Еще предстоит проделать большую работу для создания соответствующих моделей болезней, необходимых для изучения этих состояний.
Эпителиальные клетки толстой кишки (колоноциты) являются контрольным переключателем, отделяющим микробный гомеостаз от дисбактериоза кишечника [38]. Известно, что антибиотики истощают микробы, которые ферментируют важные SCFA, такие как бутират, которые обычно отвечают за поддержание микробного гомеостаза [24,39]. Недостаток бутирата подавляет метаболические сигналы в кишечнике. Бета-окисление митохондрий в колоноцитах прекращается, что приводит к переносу кислорода, который свободно диффундирует через клеточные мембраны из крови в просвет желудочно-кишечного тракта.Затем кислород в толстой кишке позволяет патогенным факультативным анаэробам, таким как E. coli [40], вытеснить доброкачественные облигатные анаэробы, характерные для здорового кишечника [41,42]. Микробный гомеостаз обычно поддерживается гамма-рецептором, активируемым пролифератором пероксисом (PPAR-γ). PPAR-γ представляет собой ядерный рецептор, активируемый бутиратом и другими лигандами, обнаружен в адипоцитах и колоноцитах и отвечает за активацию генов, участвующих в метаболизме глюкозы и липидов. Отсутствие передачи сигналов бутирата приводит к высвобождению нитратных акцепторов электронов в толстую кишку, которые факультативные анаэробы также могут использовать для клеточного дыхания, расщепляя углеводы на углекислый газ, а не ферментируя их [20].Факультативные анаэробы, включая протеобактерии, могут дополнительно влиять на питание, катаболизируя SCFAs, присутствующие в просвете [38]. Метаболическое перепрограммирование колоноцитов аналогично перепрограммированию макрофагов, которые становятся поляризованными в сторону анаэробного гликолиза в ответ на провоспалительные сигналы. При язвенном колите чрезмерная репарация эпителия приводит к снижению синтеза PPAR-γ, что снижает бета-окисление и увеличивает оксигенацию колоноцитов. Воспаление слизистых оболочек у пациентов с колитом увеличивается у Proteobacteria, основного типа грамотрицательных бактерий, но уменьшается у грамположительных Firmicutes.Однако лечение агонистом PPAR-γ может улучшить микробный баланс [43].
3.2. Фекальные биомаркеры и СРК
Фекальные биомаркеры, такие как воспалительные белки, антимикробные пептиды и уровни SCFA, становятся неинвазивным инструментом скрининга для оценки и диагностики различных состояний здоровья [44]. У пациентов с ВЗК более низкие уровни ацетата, пропионата и бутирата в кале и более высокие уровни молочной и пировиноградной кислот, чем у здоровых людей [45]. Учитывая взаимосвязь между продуктами бактериальной ферментации и атеросклерозом, текущие исследования направлены на характеристику фекальной микробиоты и сигнатур SCFA людей с высоким уровнем липидов в крови [46].Высокий уровень изомасляной кислоты может быть одним из таких биомаркеров гиперхолестеринемии. Колоноскопия – это инвазивное обследование, на которое в США полагаются как на периодический скрининг на колоректальный рак [18], но во многих странах ежегодно проводится скрининг с использованием неинвазивного иммунохимического теста кала, который ищет микроскопическую кровь в стуле [47]. . В настоящее время предпринимаются попытки идентифицировать новые микробные биомаркеры колоректального рака, учитывая, что он связан с повышенным уровнем в кале F.nucleatum , промотор туморогенеза [3].
В отличие от структурных нарушений, таких как ВЗК, СРК представляет собой функциональное расстройство и совокупность симптомов ЖКТ, наблюдаемых при отсутствии макроскопических признаков воспаления. Несмотря на поражение 10–15% населения и возможность низкого качества жизни, его этиология неясна, а текущее лекарственное лечение в значительной степени неэффективно [48]. После исключения всех остальных патологий диагноз традиционно основывается на критериях симптомов, характеристиках стула и опросниках [49].Римские критерии устанавливают классификации для четырех подтипов: СРК с преобладающей диареей (СРК-Д), СРК с преобладающим запором (СРК-З) и СРК со смешанным или чередующимся типом кишечника (СРК-М) в зависимости от того,> 25% дефекации относятся к мягкому или твердому типу стула или к обеим категориям, соответственно, за которыми следует неклассифицированный СРК (СРК-Н) [50]. В течение некоторого времени было известно, что у пациентов с СРК наблюдается меньшее микробное разнообразие по сравнению со здоровыми субъектами [51], см. Также ссылки 6–9 в [51].Воспалительные белки, такие как человеческий β-дефенсин 2, бактерицид, были идентифицированы как полезный фекальный биомаркер при СРК и ВЗК [48,51,52]. Наконец, разница концентраций в двух SCFAs, пропионовой минус масляной кислоте, оказалась положительной для всех четырех подтипов СРК, но отрицательной у здоровых людей [53].
3.3. Leaky Gut
Было обнаружено, что повышенные уровни интерлейкина 6, провоспалительного пептидного цитокина и липополисахаридного (ЛПС) эндотоксина, маркера грамотрицательной бактериальной транслокации, повышены в субпопуляции пациентов с СРК-Д с проницаемость тонкого кишечника, аналогичная той, что наблюдается при целиакии [54].Предполагается, что психологический стресс может усугубить воспалительное состояние, позволяя переносить вредные бактериальные продукты через эпителий кишечника. Известный как «проницаемый кишечник», нарушенный эпителиальный барьер позволяет токсинам и антигенам из просвета желудочно-кишечного тракта попадать в кровоток. Здоровая кишечная флора важна для поддержания кишечного барьера. Увеличивая экспрессию белков плотного соединения клеток, полезные пробиотики, такие как Lactobacillus и Bifidobacterium , могут ограничивать развитие аутоиммунных заболеваний у генетически предрасположенных лиц [55] и жировой болезни печени у лиц с ожирением [56].При алкогольной болезни печени употребление алкоголя вызывает проницаемость кишечника за счет снижения экспрессии REG3, бактерицидного белка, обычно отвечающего за ограничение колонизации слизистой оболочки просветными бактериями [57].
3.4. Взаимодействие кишечник-мозг
В последнее десятилетие было обнаружено, что кишечная и центральная нервные системы связаны через двунаправленную коммуникационную сеть, называемую осью кишечник-мозг. Связь между кишечником и мозгом нарушается в случаях СРК и микробного дисбиоза [58], в первом случае это приводит к изменениям перистальтики и секреции кишечника и вызывает висцеральную гиперчувствительность (гипералгезию) [59].Рецидивирующие боли в животе – отличительная черта СРК. Расстройство аутистического спектра, которое часто связано с запорами, было связано с дисбактериозом кишечника в виде повышенного соотношения Firmicutes / Bacteroidetes и высокого уровня факультативных анаэробов Escherichia / Shigella и грибов рода Candida [60,61] . Предполагается, что повышенная проницаемость кишечника способствует патогенезу аутизма за счет увеличения системных метаболитов, которые изменяют нейроиммунную и нейроэндокринную системы, влияя, таким образом, на мозг и развитие нервной системы [61,62,63].
В прошлом веке кетогенная диета (КД) использовалась для лечения рефрактерной эпилепсии в детских больницах [64], что позволило снизить частоту приступов на 50% [65]. КД ограничивает количество потребляемых углеводов, чтобы создать состояние кетоза, в котором организм полагается на кетоновые тела для получения энергии, а не на глюкозу. В настоящее время в клинических исследованиях изучается использование КД для лечения неврологических состояний, включая аутизм, болезнь Альцгеймера и болезнь Паркинсона, с многообещающими результатами, полученными для небольших групп [66].Первоначально предполагалось, что механизм действия является результатом нормализации аберрантного энергетического метаболизма, связанного с этими нарушениями, но теперь в центре внимания оказывается роль микробиоты кишечника. Недавнее сравнение мышей, получавших традиционное выращивание KD, с мышами, получавшими антибиотики или выращенными без микробов, показало, что изменения в микробиоте кишечника необходимы для воспроизведения противосудорожных эффектов KD [67]. Наблюдалось, что после KD популяции анаэробных родов Akkermansia и Parabacteroides пополняются.Более того, повышенные уровни ингибирующего нейромедиатора γ-аминомасляной кислоты (ГАМК) были обнаружены в профилях метаболитов гиппокампа мозга мышей, получавших KD, и, как было обнаружено, зависели от микробиоты. ГАМК является основным средством снижения связи между клетками мозга, а возбудимость нейронов усиливается при неврологических состояниях, таких как эпилепсия, тревога и болезнь Альцгеймера [66,68]. Помимо диетического вмешательства, эти и другие наблюдения показывают, что добавки с пребиотиками или пробиотиками могут быть использованы для улучшения когнитивных симптомов, связанных с неврологическими состояниями, от аутизма до болезни Альцгеймера и Паркинсона [69,70], что дает начало понятию «психобиотики» [71 , 72].
Трансплантация фекальной микробиоты (FMT) – еще один терапевтический вариант, который включает приживление микробов от здорового донора [73]. В исследовании с участием 18 аутичных детей восьминедельный курс FMT привел к улучшению поведения и снижению на 80% симптомов желудочно-кишечного тракта и боли в животе, связанных с аутизмом [74]. Результаты оставались улучшенными при оценке через восемь недель после окончания лечения, что подтверждает гипотезу о том, что микробиота кишечника, по крайней мере, частично ответственна за симптомы аутизма.Анализ состава микробиоты показал, что FMT увеличивал общее бактериальное разнообразие и количество ферментативных Bifidobacterium и Prevotella у аутичных людей даже после прекращения лечения. В других клинических исследованиях FMT продемонстрировал 90% успешность лечения рецидивирующей инфекции Clostridioides difficile , частоту клинической ремиссии до 78% при лечении ВЗК, а также разрешение или улучшение симптомов у 70% пациентов с СРК [75] .В настоящее время растет интерес к применению FMT при других расстройствах, от болезни Паркинсона до метаболического синдрома [75,76]. Было показано, что у пациентов с метаболическим синдромом FMT улучшает чувствительность к инсулину у пациентов со сниженным исходным микробным разнообразием, но эффекты не сохраняются в долгосрочной перспективе [77].
Другие линии клинических данных о взаимодействии кишечника и мозга показывают, что микробиота кишечника влияет на центральную нервную систему путем изменения высвобождения нейроэндокринных гормонов и активности нейротрансмиттеров.Нарушения передачи сигналов рецептора ГАМК вызывают тревогу и депрессию, а полезные бактерии Lactobacillus и Bifidobacterium превращают глутамат аминокислоты в ГАМК [78,79]. Метагеномный анализ фламандской когорты из 1054 человек показал, что производящие бутират Faecalibacterium и Coprococcus связаны с более высоким качеством жизни и улучшением психического здоровья, а Dialister и Coprococcus истощаются в случаях депрессии [79].Для улучшения когнитивных симптомов, связанных с клинической депрессией и тревогой, клинически вводили полезные пробиотические штаммы B. longum и L. helveticus с многообещающими результатами [72,80]. В исследовании, сравнивающем молодых и средних мышей, было обнаружено, что пищевые добавки с пребиотиком инулином увеличивают Bifidobacterium и Akkermansia, уменьшают нейровоспаление и тревожность, а также улучшают познавательные способности у мышей среднего возраста [81]. Тот факт, что изменения микробиоты кишечника могут способствовать облегчению когнитивных симптомов, может служить одной из оснований для наблюдаемой взаимосвязи между качеством диеты и состоянием психического здоровья [82].
4. Микробиота кишечника и метаболический синдром
4.1. Ожирение, микробное разнообразие и добавка SCFA
Появляются четкие связи между микробиомом и его влиянием на метаболизм хозяина, что имеет глубокие последствия для здоровья человека, учитывая рост ожирения и метаболического синдрома в западном обществе [83]. Исследование четырех пар близнецов, не согласующихся с ожирением, проведенное Ridaura et al. выявили различия в их микробиоте [84], при этом у худых людей наблюдалось увеличение бактериальной ферментации SCFA и трансформации желчных кислот.Чтобы показать, что продукция SCFA является трансмиссивной, фекальную микробиоту человека трансплантировали худым и тучным мышам. Мышей с ожирением также содержали вместе с мышами с низким содержанием жира в течение 10 дней, что препятствовало увеличению веса из-за вторжения в их микробиом определенных представителей Bacteroidetes при введении диеты с низким содержанием жиров. Такие результаты подчеркивают роль факторов окружающей среды в формировании микробиоты кишечника и развитии ожирения.
Исследование микробиоты человека и мыши коррелировало ожирение с различиями в относительной численности двух доминирующих бактериальных подразделений и показало, что люди с ожирением имеют повышенную способность получать энергию из рациона [85].По сравнению с поджарыми мышами и людьми, тучные люди имеют повышенное относительное количество Firmicutes и пониженное количество Bacteroidetes. Наблюдение, что уменьшение микробного разнообразия увеличивает сбор калорий, также подтверждается метагеномным анализом, сравнивающим микробиоты, принадлежащие однояйцевым и разнояйцевым близнецам и их матерям [86]. Более поздняя работа продемонстрировала, что люди с низким количеством микробных генов имеют более выраженное системное воспаление, ожирение, инсулинорезистентность и дислипидемию [87].Лица с низким количеством генов со временем набирали больше веса и доминировали в родах Bacteroides и Ruminococcus , в то время как 36 родов, включая Faecalibacterium , Bifidobacterium , Lactobacillus и Akkermansia, были значительно связаны с генами Akkermansia худощавые люди. В аналогичном исследовании с участием 49 человек с избыточным весом или ожирением было обнаружено, что соблюдение диеты с ограничением калорий в течение шести недель частично восстанавливает богатство микробных генов [88].
В исследованиях на людях и грызунах один вид типа Verrucomicrobia обратно коррелирует с ожирением и СД2: Akkermansia muciniphila , колонизатор слизи, который может использовать муцин в качестве единственного источника углерода и азота во время ограничения калорийности. Было показано, что лечение мышей пробиотическим штаммом A. muciniphila или его пребиотиком FOS обращает вспять увеличение веса, вызванное диетой с высоким содержанием жиров и резистентность к инсулину, увеличивает кишечные эндоканнабиноиды, контролирующие воспаление и барьер кишечника, и противодействует вызванному диетой уменьшению слизи. толщина слоя [89].Было обнаружено, что у мышей, получавших диету с высоким содержанием жиров и сахарозы, экстракт клюквы, богатый полифенолами, защищал от метаболического синдрома и воспаления кишечника за счет увеличения относительного содержания Akkermansia [90]. У людей уровни A. muciniphila на исходном уровне и после шестинедельной диеты с ограничением калорий обратно коррелировали с глюкозой натощак, соотношением талии и бедер и триглицеридами в плазме [91]. Недавнее пилотное исследование было проведено на добровольцах с избыточной массой тела или ожирением, резистентных к инсулину.Было обнаружено, что ежедневный пероральный прием 10 10 клеток A. muciniphila улучшает чувствительность к инсулину, снижает инсулинемию и снижает массу тела в течение трехмесячного периода [92]. Такие успешные исследования показывают, что A. muciniphila может найти применение в качестве пробиотика следующего поколения для борьбы с метаболическим синдромом [93].
Операция обходного желудочного анастомоза (RYGB) по Ру является одним из наиболее эффективных методов лечения патологического ожирения и СД2. RYGB снижает ожирение, улучшает метаболизм глюкозы, увеличивает расход энергии в состоянии покоя и приводит к быстрой и устойчивой потере веса, но эти эффекты нельзя просто объяснить снижением потребления и всасывания пищи [94,95].Было обнаружено, что у пациентов после обходного желудочного анастомоза количество Firmicutes снижается [96]. Prevotella увеличивается через три месяца после операции по сравнению с лицами с ожирением, тогда как Faecalibacterium prausnitzii ниже у пациентов с диабетом и отрицательно коррелирует с маркерами воспаления низкой степени [97]. На модели мышей было показано, что RYGB реструктурирует микробиоту посредством быстрого и устойчивого увеличения относительной численности Akkermansia ниже места операции в кишечнике [94].
Jiao et al. исследовали эффекты перорального введения доз SCFAs уксусной, пропионовой и масляной кислоты свиньям-отъемышам [98]. Наблюдалось, что введение SCFA снижает уровни триглицеридов, общего холестерина и инсулина в сыворотке при одновременном повышении концентрации гормона лептина в сыворотке. Примечательно, что исследование показало, что SCFAs уменьшают отложение жира, ингибируя потребление корма, уменьшая липогенез и усиливая липолиз. Другое исследование 12 мужчин, подвергшихся инфузии толстой кишки, показало, что получение клизмы, содержащей SCFAs, может увеличить окисление жиров натощак и расход энергии в состоянии покоя [99].При здоровом питании бактериальная ферментация клетчатки в SCFAs способствует микробному разнообразию и является одним из механизмов, с помощью которого высокое потребление клетчатки препятствует увеличению веса [100,101], даже перевешивая наследственный вклад в ожирение [102].
Метаболические эффекты бутирата были измерены в исследовании мышей, получавших диету с высоким содержанием жиров (60% калорий из сала) [103]. Было показано, что пероральное, но не внутривенное введение бутирата воздействует на цепь кишечника и мозга через блуждающий нерв, уменьшая потребление пищи и предотвращая вызванное диетой ожирение, гиперинсулинемию, гипертриглицеридемию и жировую болезнь печени.Интересно, что бутират также способствовал окислению жиров и активировал коричневую жировую ткань. Обнаружение того, что бутират улучшает энергетический обмен, не вызывая каких-либо побочных эффектов, предполагает, что пероральный прием добавок может быть многообещающей стратегией в борьбе с кардиометаболическим заболеванием [104]. Далее было показано, что бутират изменяет микробиоту кишечника независимо от блуждающего нерва [103]. Конкретные роды внутри подкласса Erysipelotrichia были значительно увеличены, в результате чего относительная численность типа Firmicutes с 26% до 32% по сравнению с контролем, в то время как тип Bacteroidetes снизился с 71% до 66%.Отношение Firmicutes к Bacteroidetes увеличивалось на 21% после введения бутирата. Учитывая, что Firmicutes обычно коррелируют с менее благоприятным метаболическим профилем [105], похоже, что определенные виды Erysipelotrichia полезны для энергетического метаболизма хозяина.
4.2. Микробиота при диабете
И ожирение, и диабет характеризуются инсулинорезистентностью и слабым воспалением. Исследование на мышах Cani et al. указывает на бактериальный ЛПС как на причинный фактор инсулинорезистентности, ожирения и диабета [106].Циклы кормления и голодания повышали или понижали уровни ЛПС в плазме соответственно, а у мышей, получавших четырехнедельную диету с высоким содержанием жиров, наблюдалась метаболическая эндотоксемия, которая увеличивала долю грамотрицательных бактерий в кишечнике, повышая концентрацию ЛПС в плазме в несколько раз. от двух до трех. Эндотоксемия также может быть вызвана подкожным введением ЛПС в течение четырех недель, что приводит к увеличению веса и увеличению гипергликемии натощак и гиперинсулинемии. ЛПС вызывает воспаление в адипоцитах за счет активации передачи сигналов толл-подобного рецептора 4 [107].Таким образом, пребиотики, улучшающие микробиоту кишечника и снижающие проницаемость кишечника, потенциально могут использоваться в клинической практике для лечения диабета [108,109]. В рандомизированных контролируемых исследованиях сообщалось об улучшении показателей гликемии и сердечно-сосудистых маркеров у пациентов с СД2, принимавших резистентный крахмал, резистентный декстрин или инулин [110].
Потребление пищевых волокон оказывает положительное влияние на метаболизм, включая повышенное чувство насыщения, снижение набора веса и снижение уровня глюкозы и холестерина в крови, что способствует снижению риска сердечно-сосудистых заболеваний и СД2 [111,112,113].Клетчатка исторически классифицируется как растворимая или нерастворимая, но стенки растительных клеток часто содержат и то, и другое, и это различие не всегда предсказывает физиологическую функцию [114]. Может оказаться более полезным разделить волокна на четыре категории в зависимости от того, легко ли они ферментируются и образуют ли вязкий сшитый гель [115]. Нерастворимая клетчатка (пшеничные отруби) плохо ферментируется и не меняет вязкость. Растворимая невязкая клетчатка (инулин, декстрин пшеницы, резистентный крахмал) легко ферментируется.И наоборот, вязкие гелеобразующие волокна могут быть ферментируемыми (β-глюкан) или нет (псиллиум). Улучшение метаболизма может быть вызвано тремя факторами: микробной ферментацией растворимой клетчатки в SCFAs [33,95,100], замедленным всасыванием питательных веществ и повышенным уровнем холестерина / глюкозы из-за образования вязкого геля [115,116], а также способностью нерастворимой клетчатки снижать инсулинорезистентность за счет препятствует всасыванию белка [112]. Было обнаружено, что у обычных крыс диета с высоким содержанием жиров снижает образование бутирата и увеличивает содержание холестерина и триглицеридов в печени по сравнению с крысами, получавшими диету с низким содержанием жиров, но эти эффекты можно частично обратить, добавив ферментируемые пищевые волокна к диете с высоким содержанием жиров. [117].В 12-недельном исследовании на мышах добавление к рациону с высоким содержанием жиров 10% ферментируемых волокон льняного семени резко увеличивало производство бутирата, расход энергии и уровни Bifidobacterium и Akkermansia , одновременно сдерживая увеличение веса [118]. В отличие от западной диеты, ежедневное употребление клетчатки, фруктов и овощей способствует альфа-разнообразию видов бактерий в кишечнике [12,102,119,120,121].
Suez et al. исследовали влияние некалорийных искусственных подсластителей (НАС) на толерантность к глюкозе [122].Коммерческие составы сахарина, сукралозы или аспартама добавляли в питьевую воду худых мышей на 11 недель. 10% -ные растворы НАС были значительно ниже известных токсичных доз на 1 кг массы тела. В то время как у мышей, употребляющих воду, глюкозу или сахарозу, были сходные кривые толерантности к глюкозе, во всех трех группах, потреблявших НАС, развивалась непереносимость глюкозы, которую можно было обратить вспять после лечения антибиотиками. Также было показано, что НАС вызывает изменения в микробиоте кишечника, ранее наблюдавшиеся при СД2; в частности, чрезмерное представительство грамотрицательных Bacteroides и недостаточное представительство грамположительных Clostridiales.Бактериальные таксоны были обогащены метаболическими путями, участвующими в деградации гликанов, что способствовало повышению способности к сбору энергии [85]. Наконец, Suez et al. оценили долгосрочное потребление НАС в клиническом исследовании питания с использованием опросника по частоте приема пищи, предоставленного 381 человеку, не страдающему диабетом. Были обнаружены значительные положительные корреляции между потреблением НАС и показателями метаболического синдрома, включая увеличение веса, соотношение талии и бедер, уровень глюкозы в крови натощак и гемоглобин A1c [122].
Связь между потреблением NAS у мышей и изменениями в микробиоте кишечника подтверждает идею о том, что люди могут иметь индивидуальную реакцию на пищевые компоненты на основе существующих или приобретенных различий в их микробиоте. Исследование 800 здоровых израильтян с предиабетом показало высокую межличностную вариабельность их постпрандиальных реакций глюкозы на одни и те же продукты, что можно объяснить различиями в микробиоте кишечника и другими факторами [123]. Алгоритм машинного обучения был разработан Zeevi et al.и обнаружено, что он позволяет точно прогнозировать персонализированную гликемическую реакцию на реальную пищу, используя информацию о параметрах крови, диетических привычках, антропометрических показателях, физической активности и микробиоте кишечника. Затем 26 новых участников были набраны для рандомизированного контролируемого исследования. Было обнаружено, что алгоритм позволяет выбрать индивидуальную диету, которая успешно снижает гликемический ответ после еды для каждого человека [123]. Аналогичное исследование американцев со Среднего Запада предсказало гликемические реакции с учетом численности Prevotella и Bacteroides [124].Такие исследования подчеркивают важность индивидуальных микробных профилей в разработке терапевтических вмешательств, имеющих большое потенциальное значение для развивающейся области персонализированного питания [125].
Наконец, лекарства от диабета связаны с положительными изменениями в микробиоте кишечника. Метагеномный анализ 345 китайских добровольцев показал, что у диабетиков наблюдается снижение количества бактерий, продуцирующих бутират, и увеличение количества условно-патогенных микроорганизмов по сравнению со здоровыми людьми [126]. Недавно было проведено четырехмесячное плацебо-контролируемое исследование с участием 40 пациентов с впервые диагностированным СД2 [127].У лиц, получавших золотой стандарт лекарственного средства от СД2, метформин, наблюдались быстрые изменения в составе микробиома кишечника. Во всей когорте наблюдалась отрицательная ассоциация между уровнем гемоглобина A1c в крови и B. adolescentis , видом, скорость репликации которого увеличивалась метформином. Передача образцов фекалий до и после лечения метформином мышам, лишенным микробов, показала, что улучшение толерантности к глюкозе может быть результатом исключительно измененной метформином микробиоты. На химическом уровне противодиабетические эффекты были приписаны увеличению микробной продукции SCFAs и изменениям, наблюдаемым в бактериальной экспрессии металлсвязывающих белков [127].
В исследовании на грызунах у мышей, получавших диету с высоким содержанием жиров, содержащую жирное сало, была снижена экспрессия котранспортера глюкозы-1 натрия (SGLT1) [128]. SGLT1 обычно необходим для здорового восприятия глюкозы в верхних отделах тонкой кишки, чтобы снизить выработку эндогенной глюкозы печенью. Наблюдалось, что лечение метформином восстанавливает экспрессию SGLT1 и увеличивает поглощение глюкозы в кишечнике. Метформин также увеличивал количество бактерий Lactobacillus в верхнем отделе тонкой кишки.Антидиабетический эффект передавался при трансплантации фекалий, показывая, что кишечная микробиота восстанавливает экспрессию SGLT1 и чувствительность к глюкозе у нелеченных крыс с ожирением. Перед лечением у мышей, потребляющих диету с высоким содержанием жиров, было пониженное количество грамположительных типов Actinobacteria, в то время как уровень Proteobacteria и род Escherichia были увеличены по сравнению с контрольной группой, потреблявшей обычную пищу. Молекулярная связь с экспрессией SGLT1 неизвестна, но вполне вероятно, что микробные метаболиты, такие как SCFAs, активируют чувствительность к глюкозе.Метагеномный анализ голландской когорты подтвердил, что концентрации SCFA выше у людей, принимающих метформин, по сравнению с диабетиками, не принимающими метформин [120]. Анализ колумбийского сообщества показал, что у потребителей метформина были более высокие уровни продуцирующих SCFA A. muciniphila , B. bifidum и Prevotella [129].
Некоторые пациенты не могут переносить метформин из-за неблагоприятных эффектов со стороны ЖКТ, включая боль в животе, вздутие живота, тошноту и диарею. Недавно было проведено небольшое клиническое исследование на лицах, не страдающих диабетом, которое подтвердило, что метформин изменяет микробиоту кишечника независимо от гликемического статуса [130].Интересно, что численность бактерий 12 родов на исходном уровне предсказывала, будут ли здоровые люди испытывать неблагоприятные эффекты со стороны желудочно-кишечного тракта при лечении метформином. Это наблюдение дает представление о том, как микробиота кишечника, сформированная диетой, может опосредовать индивидуальные терапевтические реакции на лекарство. Наконец, лекарство от диабета акарбоза представляет собой минимально абсорбируемый ингибитор глюкоамилазы, который предотвращает переваривание крахмала человеком. В исследовании на мышах наблюдали за мышами, получавшими акарбозу, которые получали либо диету с высоким содержанием крахмала в западном стиле, либо диету с высоким содержанием клетчатки, богатую растительными полисахаридами [131].Аналогично лечению метформином, высоких доз акарбозы было достаточно, чтобы изменить таксоны кишечных бактерий и увеличить производство бутирата даже у тех, кто потреблял диету с высоким содержанием крахмала, но бактериальный состав быстро восстановился после прекращения лечения акарбозой. В целом эти исследования показывают, что изменения в микробном сообществе кишечника вносят значительный вклад в механизм действия антигипергликемических средств.
4.3. Диетический холин и атеросклероз
Метаболомический анализ был использован для мониторинга 2000 метаболитов, присутствующих в плазме крови пациентов, проходящих кардиологическое обследование, с целью выявления потенциальных предикторов сердечно-сосудистых событий [132].Было обнаружено, что три небольшие молекулы предсказывают риск сердечно-сосудистых заболеваний: холин, триметиламин N -оксид (ТМАО) и бетаин. Каждый из них представляет собой метаболиты фосфатидилхолина, диетического липида, который в больших количествах содержится в яичном желтке, печени и других продуктах животного происхождения с высоким содержанием жира. Холин, также называемый лецитином, является важным питательным веществом, которое продается как пищевая добавка. Гидролиз фосфатидилхолина высвобождает холин, который метаболизируется кишечными микробами в газ триметиламин (ТМА), который печень, в свою очередь, превращает в ТМАО.Было обнаружено, что у мышей, получавших радиоактивно меченый фосфатидилхолин, повышенный уровень ТМАО в крови способствует большему развитию артериальных бляшек [132]. В другом исследовании предрасположенность к атеросклерозу могла передаваться от предрасположенных к атерогенности линий мышей к устойчивым к атерогенному признакам посредством трансплантации микробов слепой кишки [133].
Национальные институты здравоохранения профинансировали два проспективных клинических исследования ТМАО [134]. В первом исследовании, провокации фосфатидилхолином, наблюдалось повышение уровня ТМАО в плазме после употребления двух яиц, отслеживаемых с помощью меченного изотопом фосфатидилхолина.Генерацию ТМАО можно подавить, назначив недельный курс антибиотиков для уменьшения кишечных бактерий. Через месяц после отмены антибиотиков поколение TMAO вернулось в ходе контрольного теста с холином. Во второй когорте из 4007 взрослых, проходящих кардиологическое обследование, участники с наивысшим квартилем уровней ТМАО в плазме натощак имели значительно повышенный риск серьезного неблагоприятного события сердечно-сосудистых заболеваний в течение трехлетнего периода наблюдения (отношение рисков 2,5 относительно нижний квартиль).Другое исследование пациентов со стабильной ишемической болезнью сердца обнаружило четырехкратное увеличение пятилетнего риска смертности от всех причин для тех, кто находится в наивысшем квартиле ТМАО [135]. Атерогенность метаболита холина ТМАО помогает объяснить корреляцию, существующую между сердечно-сосудистыми заболеваниями и чрезмерным потреблением продуктов животного происхождения [136]. С другой стороны, причинно-следственная связь между диетическим холестерином и сердечно-сосудистыми заболеваниями не была продемонстрирована, и ее будет трудно доказать, учитывая тот факт, что холестеринсодержащие продукты также содержат много насыщенных жиров, за исключением яиц и креветок [137].Долгосрочное исследование с участием 29 615 участников недавно показало, что потребление яиц с желтком повышает риск сердечно-сосудистых заболеваний в зависимости от дозы [138], причем каждая половина потребляемого в день яйца увеличивает абсолютный риск на 1,1%, а общую смертность на 1,9. %. Один яичный желток содержит 120 мг холина.
Было показано, что структурный аналог холина и натурального продукта, содержащийся в некоторых пищевых продуктах, 3,3-диметил-1-бутанол (DMB), снижает уровень ТМАО за счет нелетального ингибирования ТМА-лиазы [139], что дает доверие к понятию «лекарство от микробиома».В исследовании мышей, получавших западную диету, DMB снижал ТМАО в плазме и предотвращал сердечную дисфункцию, воспаление и фиброз, но не влиял на массу тела и дислипидемию [140]. В настоящее время предпринимаются попытки определить потенциал различных видов бактерий к образованию ТМА и разработать новые стратегии лечения для сдерживания пролиферации продуцентов ТМА [141]. L-карнитин – еще один триметиламин, который содержится в красном мясе и продается как пищевая добавка. Подобно холину, исследования на грызунах и людях показывают, что карнитин увеличивает уровень ТМАО в плазме, ускоряет атеросклероз и увеличивает риск сердечно-сосудистых заболеваний [142].Интересно, что сравнение тестов с провокацией карнитином у обычных всеядных и веганов / вегетарианцев показывает, что всеядные животные обладают микробиотой, способной генерировать в 20 раз более высокие уровни ТМАО [142,143].
Связь между ТМАО и сердечно-сосудистыми заболеваниями имеет важное значение для потребления мяса, учитывая, что говядина и свинина содержат 100 мг холина на 100 г порции (телятина: 400 мг). Не отстают рыба и курица с 70–80 мг холина на порцию. Некоторые исследования наблюдали умеренное увеличение относительного риска смертности от сердечно-сосудистых заболеваний (от 26% до 34%) для самого высокого квантиля потребления необработанного красного мяса или как переработанного, так и необработанного красного мяса [144,145].Однако сравнительная оценка риска с использованием национального опроса не обнаружила значительного вклада только в необработанное красное мясо [146], а более ранний метаанализ рассчитал, что его отношение относительного риска на 100 г порции составляет 1,00 (95% доверительный интервал: 0.81–1.23) [147]. Вполне вероятно, что качество сравниваемой диеты является смешивающей переменной, способствующей разногласиям в выводах о влиянии мяса на сердечно-сосудистые заболевания [148].
Улучшение здоровья сердечно-сосудистой системы было связано со степенью приверженности средиземноморской диете, которая ограничивает потребление красного мяса и молочных продуктов с упором на растительную пищу и полезные жиры [149,150,151].Относительное снижение риска сердечно-сосудистых заболеваний, полученное для лиц с наивысшим квантилем приверженности средиземноморской диете, с учетом всех диетических компонентов вместе взятых, согласно метаанализу, составляет около 30% или даже до 45% для высоких группы риска [152]. Микробиом недавно был оценен De Filippis et al. у 123 итальянцев, обычно соблюдающих всеядные, вегетарианские или веганские диеты [153]. Чтобы оценить их приверженность средиземноморской диете, люди были стратифицированы по диетическому индексу из 11 пищевых единиц.Люди, потребляющие диеты на основе овощей, более строго придерживались средиземноморской диеты, у них было больше Prevotella и бактерий, разлагающих клетчатку, а также были более высокие уровни SCFAs в фекалиях. С другой стороны, всеядные животные имели более высокое соотношение Firmicutes и Bacteroidetes в кишечнике и повышенное содержание ТМАО в моче [153].
В научном сообществе также ведутся споры о том, насколько красное мясо повышает риск колоректального рака, еще одного заболевания, широко распространенного в западном обществе [154,155].Недавно было показано, что кишечная микробиота, связанная с колоректальным раком, имеет увеличение генов, связанных с ТМА-лиазой и катаболизмом белков, в то время как пути деградации углеводов микробами были истощены [156, 157]. Диетический холин не коррелирует с заболеваемостью раком, в то время как бетаин, донор метильной группы, связан со снижением риска колоректального рака [158]. Опять же, общее качество диеты, вероятно, является важным фактором. Исследование с использованием модели рака полипоза на мышах показало, что диета с высоким содержанием клетчатки увеличивает количество бактерий, продуцирующих SCFA, а также экспрессию бутиратного рецептора GPR109A, подавляя канцерогенез толстой кишки [159].Исследование случай-контроль, проведенное в Китае, обнаружило обратную связь между потреблением растительной клетчатки и колоректальным раком (отношение шансов Q4 к Q1: 0,51; 95% доверительный интервал: 0,31–0,85) [160]. Сильные ассоциации также наблюдались для общего потребления растворимых и нерастворимых волокон, но не для фруктовых, соевых или зерновых волокон. Сравнительная оценка риска показала, что на неоптимальные уровни потребления пищевых продуктов приходится 38% новых случаев колоректального рака [161]. Недавно было показано, что чрезмерный рост микробов соответствует экологическим постулатам Коха [162] о причинности заболевания колоректальным раком.Было обнаружено, что онкогенез у мышей вызывает не конкретный патоген, а замкнутая в матриксе экосистема бактерий или биопленка, извлеченная из пациентов с опухолями [163].
5. Вмешательства микробов
5.1. Пробиотики
Пробиотики определяются как «живые микроорганизмы, которые при введении в адекватных количествах приносят пользу здоровью хозяина» [164]. Пробиотики доступны без рецепта или по рецепту и содержат микроорганизмы, подобные комменсальным бактериям, обнаруживаемым в кишечнике, чаще всего продуцирующим молочную кислоту Bifidobacterium и Lactobacillus spp.В целом, существуют клинические данные в поддержку использования пробиотиков для лечения острой инфекционной диареи, диареи, связанной с антибиотиками, диареи, связанной с C. difficile, , язвенного колита и синдрома раздраженного кишечника, но не для лечения острого панкреатита или болезни Крона. [165, 166, 167, 168, 169, 170]. Обычно назначаемые антибиотики несут в себе риск заражения C. difficile , который может вызвать серьезные осложнения и имеет ориентировочную стоимость лечения в размере 24 205 долларов США на пациента.Поэтому одновременное назначение пробиотиков, которые снижают риск заражения C. difficile , было предложено в качестве профилактического средства при назначении антибиотиков [171]. Клинические исследования пробиотиков являются видоспецифичными, а часто и штаммоспецифичными, при этом отдельные бактерии исследуются на предмет отдельных болезненных состояний [172]. Пробиотические бактерии потенциально могут принести пользу здоровью за счет нормализации нарушенной микробиоты и перистальтики кишечника, конкурентного исключения патогенов и увеличения продукции SCFA [173, 174, 175].
Различные виды пробиотиков были изучены для облегчения симптомов желудочно-кишечного тракта, хотя не всегда ясно, какие виды или штаммы наиболее полезны [176]. Более ранняя работа показала, что соотношение Firmicutes к Bacteroidetes было повышено у 62 пациентов с СРК по сравнению с 46 контрольными субъектами в Хельсинки, Финляндия [177]. Удивительно, но обе группы доминировали в относительной численности Firmicutes (90% и 83% соответственно), что оставляло сомнения в репрезентативности или общем состоянии здоровья небольшой когорты (64% было оценено для голландской когорты из 1135 человек [120]. ). Bifidobacterium был одним из родов строго анаэробных грамположительных актинобактерий, количество которых было заметно снижено (16–47%) у пациентов с диагнозом СРК-М, СРК-Д или СРК-З по сравнению со здоровым контролем [177]. Другие исследования подтвердили, что добавление пробиотиков к бифидобактериям приводит к умеренному улучшению симптомов со стороны ЖКТ у пациентов с СРК и ВЗК [167, 178]. Корреляция микробных профилей со здоровьем кишечника более сложна для других видов. Внутри филы Firmicutes было обнаружено, что Streptococcus уменьшается при IBS-C, но увеличивается при IBS-D, тогда как Allisonella уменьшается при IBS-C и IBS-D, но увеличивается при IBS-M [15].Род внутри Bacteroidetes, такой как Prevotella и Bacteroides , может быть увеличен или уменьшен при СРК [15, 177]. Было отмечено, что существует сильная положительная связь между IBS и избыточным бактериальным ростом в тонком кишечнике (SIBO) [179]. Это привело к первоначальной идее лечения этого состояния антибиотиками, но реакция пациентов сильно различается, и симптомы со стороны желудочно-кишечного тракта могут даже ухудшиться. Недавнее воздействие антибиотиков на самом деле положительно коррелирует с развитием СИБР [180].Симптомы СИБР и желудочно-кишечного тракта усиливаются у здоровых людей, которые переходят на диету с высоким содержанием сахара и низким содержанием клетчатки всего на семь дней, что приводит к снижению микробного разнообразия тонкого кишечника и увеличению проницаемости эпителия [180].
Одна из проблем рынка пробиотиков заключается в том, что коммерческие продукты, если не поступают заявления о конкретных заболеваниях, плохо регулируются. Торговые марки пробиотиков производятся по брендам, а не по штаммам бактерий, и их составы или протоколы производства могут со временем меняться, что существенно влияет на эффективность [181].В частности, было показано, что штаммы одного и того же рода или вида могут оказывать существенно различное воздействие на хозяина, различаясь своей способностью расти и выживать в кишечной среде, прикрепляться к эпителиальным клеткам кишечника и подавлять инвазию патогенов [182,183]. После выделения E. coli Nissle 1917 из стула солдата Первой мировой войны, который не заразился дизентерией, непатогенные штаммы E. coli получили некоторое признание в качестве пробиотиков. Э.coli уникален тем, что полагается на моносахаридные и дисахаридные питательные вещества, расщепляемые из сложных углеводов строгими анаэробными видами бактерий [184]. Полезные штаммы E. coli использовались для лечения пациентов, страдающих инфекционными заболеваниями, вероятно, из-за их способности вытеснять кишечные патогены за питательные вещества [40]. Однако недавние исследования на мышах дают повод для осторожности. Соколонизация E. coli O157: H7, печально известного патогена пищевого происхождения, с непатогенным штаммом E.coli у мышей, лишенных микробов, фактически увеличивало вирулентность патогена и продукцию токсинов Шига, которые кодируются генами вирусных профагов, до 12 раз [185]. В другом исследовании было обнаружено, что пробиотик E. coli Nissle 1917 претерпел геномную адаптацию в ответ на селективное и зависящее от диеты давление хозяина в течение пяти недель [186]. в генах, которые влияют на адгезию кишечника и использование углеводов и компонентов муцина в качестве источников углеродной энергии.У мышей, которые ранее подвергались воздействию антибиотиков, штаммы E. coli приобрели мутации, ответственные за устойчивость к антибиотикам [186]. Такие исследования подчеркивают центрально важную роль, которую горизонтальный обмен генами играет в эволюции кишечных бактерий [187].
Несколько видов Lactobacillus и Bifidobacterium теперь стали основными продуктами в области пробиотиков. Известные коммерческие составы с несколькими штаммами были подвергнуты клиническим исследованиям, включая Visbiome ® (ранее VSL # 3) [188], BIO-25 [189] и Ther-Biotic ® Complete [190].Visbiome ® содержит несколько штаммов хорошо известных видов пробиотиков L. plantarum DSM24730, Streptococcus thermophilus DSM24731, B. breve DSM24732, L. paracasei DSM24733ru, L. subsp. Delb. bulgaricus DSM24734, L. acidophilus DSM24735, B. longum DSM24736 и B. infantis DSM24737. Лактобациллы и бифидобактерии, подобные этим, были тщательно протестированы на их противовоспалительное действие при колите, а также на их благотворное влияние на перистальтику кишечника, особенно при лечении запоров [173,191,192,193].В то время как E. coli продуцирует ЛПС, было показано, что B. breve снижает индуцированное ЛПС отщепление эпителиальных клеток, которое наблюдается у пациентов с рецидивом ВЗК [194]. Популяции Lactobacillus уменьшаются в потреблении алкоголя и ожирении, вызванном диетой с высоким содержанием жиров [55,195]. Было показано, что добавление пробиотического штамма L. rhamnosus GG снижает чрезмерный рост микробов, восстанавливает целостность слизистой оболочки, уменьшает транслокацию микробов и облегчает повреждение печени, вызванное алкоголем [55,196].Наконец, использование пробиотиков было предложено в качестве альтернативы или дополнения к лечению антибиотиками [197]. В случае энтерогеморрагической E. coli O157: H7 антибиотики неэффективны из-за выделения дополнительного токсина. Было обнаружено, что пробиотики L. acidophilus R0052 и L. rhamnosus R0011 предотвращают повреждение эпителия за счет снижения адгезии E. coli O157: H7, а также энтеропатогенной E. coli O127: H6 [198].
Клиническое исследование здоровых взрослых, получавших пробиотик L.paracasei DG показал, что изменения, наблюдаемые в основной микробиоте кишечника, могут зависеть от исходного микробного профиля человека [199]. Участники исследования с низкими исходными уровнями бутирата в кале испытали четырехкратное увеличение продукции бутирата и снижение на 55% Ruminococcus , члена класса Clostridia, ответственного за разложение устойчивого крахмала. С другой стороны, у людей с высокими начальными уровнями бутирата выработка бутирата снизилась на 49%, а у шести родов Clostridia, включая Faecalibacterium , противовоспалительный продуцент бутирата, полезный для психического здоровья [79].Другие исследования подтверждают, что первоначальный микробный состав кала пациента может помочь предсказать его реакцию на пробиотическое вмешательство [189], предполагая, что однажды станет возможным оптимизировать дозу бактериальных штаммов, вводимых индивидууму [200]. Также было показано, что микробиом человека влияет на выработку бутирата при добавлении в рацион ферментируемого устойчивого крахмала, в соответствии с которым бактериальные таксоны усиливаются [201]. Учитывая взаимосвязь между микробиомом и метаболическим заболеванием, текущие исследования изучают пробиотические вмешательства в качестве адъювантной терапии для улучшения кардиометаболических профилей [202, 203].Положительные результаты были получены при использовании мультиштаммового препарата Ecologic ® Barrier для T2D [204]. Ранее было показано, что у крыс Ecologic ® Barrier улучшает поведение, связанное с депрессией, независимо от употребления диеты западного типа с высоким содержанием жиров [205]. Ecologic ® Barrier содержит следующие штаммы: Bifidobacterium bifidum W23, B. lactis W52, Lactobacillus acidophilus W37, L. brevis W63, L.casei W56, L. salivarius W24, Lactococcus lactis W19 и Lc. lactis W58. Наконец, было обнаружено, что два штамма L. gasseri , выделенные из кишечника человека и грудного молока, снижают массу висцерального жира у взрослых с ожирением, но эффекты уменьшались после прекращения лечения SBT2055, что указывает на необходимость постоянного снабжения пробиотиками [206, 207]. ].
5.2. Пребиотики
В некоторых клинических исследованиях пробиотик вводят в сочетании с пребиотическим соединением, которое способствует росту бактерий, вместе называемым синбиотиком.Требования к пребиотику заключаются в том, что он не переваривается в верхних отделах желудочно-кишечного тракта, может ферментироваться кишечной микробиотой, избирательно стимулирует рост и разнообразие полезных бактерий и положительно влияет на здоровье хозяина [208, 209]. Пребиотики включают FOS, GOS и полиоловые сахарные спирты, используемые в качестве питательных подсластителей [193, 210]. Инулин представляет собой растворимую клетчатку и фруктан, или полимер фруктозы переменной длины, который не переваривается человеком и оказывает минимальное влияние на уровень глюкозы в крови [211].Считается, что инулин является наиболее эффективным в стимулировании роста многих видов пробиотиков [193]. Инулин был испытан в качестве успешного синбиотического лечения язвенного колита [191, 211]. Совсем недавно было обнаружено, что добавки бутирата и инулина снижают диастолическое артериальное давление, уровень сахара в крови натощак и соотношение талии и бедер у пациентов с СД2 [104].
Многочисленные исследования показывают, что значительную пользу для здоровья можно получить только от приема пребиотиков [110,193,211]. Было показано, что пребиотики, такие как GOS и FOS, улучшают микробные профили за счет увеличения бифидобактерий и уменьшения E.coli [193, 212]. Сводку клинических испытаний пребиотиков см. В таблице 5 в ссылке [193]. В двойном слепом рандомизированном контролируемом исследовании двух отдельных когорт в Канаде, 16 недель приема добавок инулина, обогащенного ФОС (8 г / день), снизили жировые отложения, триглицериды в сыворотке и интерлейкин 6 у детей с избыточным весом или ожирением по сравнению с детьми, получавшими изокалорийная доза мальтодекстрина плацебо [213]. Бифидобактерии в образцах фекалий увеличились с 6% до 10% от средней численности бактерий при лечении пребиотиками, в то время как Firmicutes снизилась с 69% до 63%, а Ruminococcus – с 2.От 3% до 1,4%. В исследовании на животных у крыс, получавших диету с высоким содержанием жиров и сахарозы вместе с ФОС, наблюдалась нормализация инсулинорезистентности, уровней лептина, дислипидемии и кишечной микробиоты [214]. Более того, пребиотик ФОС ограничивал повреждение коленного сустава в этой модели остеоартрита, вызванной диетой, до уровней, приближающихся к уровням, полученным при умеренных аэробных упражнениях. Эффекты пребиотической терапии также зависят от исходного микробного профиля человека. В исследовании, сравнивающем ФОС, сорго и арабиноксилан, одинаково высокая продукция SCFA наблюдалась у добровольцев, микробиота которых преобладала у использующих клетчатку Prevotella , но у людей с преобладанием Bacteroides были разные уровни SCFA в ответ на каждое волокно [215].
Учитывая взаимосвязь между микробиотой кишечника и воспалением, в настоящее время проводятся исследования по изучению воздействия противовоспалительных омега-3 полиненасыщенных жирных кислот (ПНЖК) на разнообразие микробов. Известно, что западная диета с высоким содержанием животного белка увеличивает соотношение омега-6 и омега-3 ПНЖК в 10 раз, вызывая воспалительный ответ, опосредованный гормоноподобными эйкозаноидами в организме [149, 216]. Омега-3 ПНЖК докозагексаеновая кислота (DHA) и эйкозапентаеновая кислота (EPA), однако, снимают воспаление и обладают противоколоректальной активностью против рака, см. Ссылки 4–6 в [217].Исследования на людях показывают, что пищевые добавки с EPA и DHA увеличивают кишечное изобилие Bifidobacterium и Lactobacillus , уменьшая при этом Faecalibacterium [217, 218]. Противоречивые результаты были получены в отношении влияния омега-3 жирных кислот на соотношение типов Firmicutes и Bacteroidetes. Наконец, недавно был проведен метаболомный анализ 876 взрослых близнецов женского пола. После внесения поправки на потребление пищевых волокон было обнаружено, что потребление и уровни циркулирующих омега-3 жирных кислот в значительной степени коррелируют с микробным альфа-разнообразием, измеренным с помощью индекса Шеннона [219].
6. Значение для диеты и питания
6.1. Диетические и другие ковариаты микробиома
Метагеномный анализ был проведен среди 1135 участников из голландской популяции с использованием глубокого секвенирования [120]. Данные секвенирования позволили выявить ассоциации микробиоты со 126 различными факторами окружающей среды, включая диету, болезни и использование лекарств. Более высокое потребление общих углеводов было наиболее тесно связано с уменьшением разнообразия микробиома: бифидобактерии увеличились, а роды Lactobacillus, Streptococcus, и Roseburia уменьшились.Индекс разнообразия Шеннона снизился в соответствии с уровнями потребления общих углеводов, за которыми следовали сахаросодержащие напитки, хлеб, пиво, пикантные закуски и, в меньшей степени, общие жиры, бобовые и бобовые. Разнообразие также уменьшилось у людей, сообщивших о СРК, а использование антибиотиков было связано с уменьшением у двух видов Bifidobacterium . С другой стороны, микробное разнообразие увеличивалось за счет употребления фруктов, кофе, овощей и красного вина и, в меньшей степени, завтрака и чаепития.Употребление красного вина было связано с увеличением численности F. prausnitzii [120], противовоспалительного вида, связанного с постным типом микробиоты с высоким содержанием пищи [87]. Кофе, чай и красное вино содержат много полифенолов, соединений, связанных с пребиотической и бифидогенной активностью, см. Ссылки 19–21 в ссылке [120]. В недавнем метаанализе было обнаружено, что употребление до трех чашек кофе в день снижает общую смертность и смертность от сердечно-сосудистых заболеваний в зависимости от дозы, независимо от содержания кофеина [220].
Аналогичный анализ на уровне популяции бельгийской когорты из 1106 человек по 69 ковариатам [221] показал, что бристольская шкала стула, индикатор времени прохождения через кишечник, и использование лекарств имеют наибольшее объяснительное значение для вариаций микробиома. Было обнаружено общее бактериальное богатство 664 родов, но различия между индивидуумами возникли в основном из-за различий в относительной численности 14 основных родов. В соответствии с ранее охарактеризованными энтеротипами [13], бактериальные таксоны с наибольшим разбросом по численности были Prevotella , Bacteroides и Ruminococcaceae. Prevotella коррелировал с более мягким стулом, в то время как Ruminococcaceae был доминирующим семейством в стуле твердого типа. Общее видовое богатство снижается с более коротким временем прохождения через кишечник и увеличивается количество основных видов, вероятно, потому, что во избежание вымывания отбираются определенные бактерии с потенциалом быстрого роста или высокой степенью прилипания к слизистой оболочке [221, 222]. Другими факторами, которые оказались ковариатами микробиома, были недавнее курение, а также использование антибиотиков, осмотических слабительных, лекарств от ВЗК и антидепрессантов [221].В недавнем исследовании на мышах шесть дней лечения безрецептурным слабительным полиэтиленгликолем оказали долгосрочное воздействие на кишечник [223]. Бактериальное семейство S24-7 перешло от 50% общего микробного обилия к явному исчезновению, в то время как семейство Bacteroidaceae, также относящееся к отряду Bacteroidales, испытало рост микробного обилия с 20% до 60%. Осмотический стресс разрушает слизистый барьер и заставляет иммунную систему вырабатывать длительный ответ антител против комменсальных бактерий [223].Недавно у 758 корейских мужчин были собраны образцы фекалий, чтобы изучить влияние курения сигарет на микробиом [224]. Хотя между бывшими курильщиками и теми, кто никогда не курил, различий не наблюдалось, у нынешних курильщиков была повышенная доля Bacteroidetes и сниженные уровни Firmicutes и Proteobacteria.
Заметные диетические коварианты в исследовании населения Бельгии включали потребление фруктов, алкоголя, мяса, соевых продуктов и газированных напитков, а также предпочтение темного шоколада [221].Удивительно, но способ рождения и история грудного вскармливания не были связаны с составом микробиоты взрослого человека, а домашние животные предсказывали только минимальную долю вариации микробиома [221]. Более раннее исследование показало, что домашние собаки в первую очередь изменяют микробиоту кожи своего хозяина, а не микробиоту кишечника [225]. Более доминирующими факторами, влияющими на микробиом, являются урбанизация открытых территорий, усиление замкнутости зданий и уборка, каждая из которых снижает общее микробное разнообразие, переходя от грамположительных (например,g., Actinobacteria) грамотрицательным и потенциально патогенным видам [226, 227, 228].
В соответствии с бельгийскими [221] и другими исследованиями [7,120], более ранний анализ когорты голландского населения показал, что бактериальные таксоны могут объяснять ИМТ и липиды крови независимо от возраста, пола и генетики хозяина [229]. Богатство видов отрицательно коррелировало как с ИМТ, так и с триглицеридами, и положительно коррелировало с защитными уровнями холестерина ЛПВП [120, 229]. Однако значимой корреляции между микробиотой кишечника и уровнями ЛПНП или общего холестерина не наблюдается [7,120,221,229].Примечательно отсутствие корреляции между ЛПНП в плазме и микробиомом, учитывая, что последний связан с метаболическим заболеванием. Несмотря на то, что в течение последних трех десятилетий ЛПНП в плазме использовались в качестве основной мишени в гиполипидемической терапии, последние данные свидетельствуют о том, что уровни триглицеридов, ЛПВП и аполипопротеина В в крови могут быть более полезными предикторами сердечно-сосудистых заболеваний [230, 231, 232, 233, 234, 235]. Многие факторы затрудняют взаимосвязь между концентрацией ЛПНП в плазме и ССЗ. В то время как каждый третий человек является гиперреагирующим на пищевой холестерин, соотношение ЛПНП и ЛПВП минимально изменяется, когда другие, особенно пожилые люди, потребляют дополнительно 100 мг / день [236].Для людей с аналогичными концентрациями ЛПНП преобладание мелких плотных частиц ЛПНП (sdLDL) увеличивает риск сердечно-сосудистых заболеваний [236], как и более высокая доля ковалентно модифицированных частиц ЛПНП, известных как липопротеин (а) [237]. Широко назначаемые статины эффективны для снижения концентрации ЛПНП и в некоторой степени аполипопротеина B, но они не уменьшают долю sdLDL и, как было обнаружено, повышают уровень липопротеинов (а) в плазме до 20%, способствуя тому, что было названо « остаточный риск ССЗ [238 239].Отсутствие связи между концентрацией ЛПНП в плазме и микробиомом неудивительно, учитывая эти смешивающие факторы.
6.2. FODMAP и здоровье кишечника
Ферментируемые олигосахариды (фруктаны, GOS), дисахариды (лактоза), моносахариды (фруктоза) и полиолы (сорбитол, ксилит) называются FODMAP [240]. При употреблении диетических FODMAP вода попадает в тонкий и толстый кишечник, вызывая растяжение просвета. Затем при ферментации FODMAP кишечными бактериями и дрожжами образуется водород или метан.Было показано, что ограничение FODMAP в рационе помогает облегчить функциональные симптомы со стороны желудочно-кишечного тракта у пациентов с СРК (вздутие живота, боль в животе, диарея), но не сообщалось об эффектах воспаления кишечника при ВЗК [27, 240]. Пшеница, рожь и ячмень содержат фруктаны и поставляют большую часть FODMAP, содержащихся в западной диете. Двойной слепой перекрестный тест был проведен среди 59 взрослых, которые сами сообщили о чувствительности к глютену без глютена (NCGS), которые ранее соблюдали безглютеновую диету в течение как минимум шести месяцев [241].Участники выполнили три семидневных испытания, в которых потребляли батончик мюсли, содержащий либо ФОС, пшеничный глютен, либо плацебо, с количеством фруктана / глютена, равным количеству фруктана / глютена, содержащемуся в четырех ломтиках пшеничного сэндвич-хлеба. Показатели симптомов СРК ухудшились при введении фруктана ( P = 0,04), тогда как симптомы фактически немного улучшились по сравнению с плацебо при потреблении глютена ( P = 0,55). Вывод о том, что фруктаны, а не глютен ответственны за симптомы со стороны желудочно-кишечного тракта у самоидентифицированных пациентов с NCGS, также подтверждается перекрестным испытанием, в котором 37 субъектов с NCGS и IBS следовали диете с низким содержанием FODMAP, прежде чем перейти на диету с высоким или низким содержанием. глютеновая диета [242].Независимо от источника симптомов, NCGS и IBS, по крайней мере, имеют частично совпадающие черты и не являются полностью отдельными сущностями [243].
Долгосрочное внедрение диеты с низким содержанием FODMAP проблематично из-за ограничения здоровой растительной пищи и того факта, что FODMAP являются пребиотиками, поддерживающими микробиоту кишечника. Яблоки, груши и косточковые фрукты богаты фруктозой и другими FODMAP. Бобовые и зернобобовые также содержат большое количество FODMAP, как и некоторые овощи, включая лук, чеснок и цветную капусту.При правильном назначении квалифицированным диетологом элиминационная диета FODMAP должна быть процессом, а не жесткой исключающей диетой. Начальная фаза выведения длится 2–6 недель, чтобы контролировать симптомы со стороны желудочно-кишечного тракта. На этапе испытания определенные продукты питания или типы FODMAP повторно вводятся по одному и в возрастающих количествах. Пациенту предлагается вести подробный дневник питания, чтобы он мог узнать, какие FODMAP лучше всего переносятся и которые в конечном итоге могут быть включены в заключительную фазу интеграции диеты.Во время этого процесса могут возникнуть две клинические проблемы: симптомы пациента могут не реагировать, или они действительно реагируют, и тогда пациент становится неохотно повторно вводить FODMAP [244]. Хотя долгосрочные исследования отсутствуют, соблюдение диеты с низким содержанием FODMAP снижает разнообразие и качество потребляемых компонентов питания [245], а разнообразие здорового питания связано с более разнообразной микробиотой и лучшими результатами для здоровья [246]. Кратковременное ограничение FODMAP нарушает микробиоту кишечника всего за 2-3 недели, уменьшая общую численность бактерий и популяцию Bifidobacterium , увеличивая при этом соотношение Firmicutes и Bacteroidetes [247, 248].
6.3. Кетогенная диета
КД и низкоуглеводные диеты стали популярным и эффективным средством похудания и могут улучшить показатели сердечно-сосудистых заболеваний крови в краткосрочной перспективе [249, 250]. Однако 20-летние исследования с участием большой проспективной когорты показывают, что качество диеты и источник белков и жиров могут в конечном итоге определять результаты для здоровья при низкоуглеводных (40% калорийности) диетах [251, 252]. В исследовании, проведенном де Конингом и соавторами, было обнаружено, что высокое потребление белков и жиров на растительной основе снижает коэффициент риска (HR) для СД2 до 0.78, тогда как высокое потребление животных белков и жиров увеличивает риск (ОР 1,37) [251]. Было замечено, что поправка на потребление красного и переработанного мяса снижает связь с животными источниками (HR: 1,11). В строгом кетодействе запрещается употребление подземных овощей и бобовых с высоким содержанием чистых углеводов, а также большинства фруктов, чтобы ограничить общее потребление углеводов до 50 г / день. Ограничение углеводов на растительной основе может иметь значительное влияние на микробиоту кишечника, учитывая, что клетчатка и пребиотики необходимы для разнообразия бактерий [65,119,208].Уменьшение количества клетчатки также может способствовать запору, частому побочному эффекту КД.
На модели противосудорожных мышей было показано, что KD снижает альфа-разнообразие кишечных бактерий, одновременно повышая относительную численность A. muciniphila , но KD наблюдали только в течение трех недель [67]. Более продолжительное исследование 10 пациентов с рассеянным склерозом показало, что общее количество и разнообразие бактерий снизилось в краткосрочной перспективе, но восстановилось в течение 12–24 недель лечения КД [253]. Akkermansia первоначально увеличивалось, но затем снижалось в течение длительного периода KD, и количество бактерий-пионеров неуклонно снижалось [253].Бактерии-пионеры, такие как Bifidobacterium и Clostridium , первыми колонизируют новорожденных и пациентов, выздоравливающих после курса лечения антибиотиками. Двадцать детей с рефрактерной эпилепсией недавно лечились КД в течение шести месяцев [254]. Лечение снизило альфа-разнообразие и уменьшило соотношение Firmicutes / Bacteroidetes. У 10 детей, которые не ответили на лечение (уменьшение припадков <50%), относительное количество Ruminococcaceae и Clostridia увеличилось, что позволяет предположить, что определенные бактерии могут служить биомаркером эффективности или потенциальной терапевтической мишенью [254].Такие изменения микробиоты кишечника, связанные с длительным течением КБ, предполагают важность правильно сбалансированной и высококачественной диеты [65].
6.4. Роль потребления углеводов
Потребление избыточных углеводов в рамках западной диеты с высоким содержанием рафинированного зерна, крахмала и добавленного сахара отрицательно влияет на микробиоту кишечника. Первая связь между микробиомом и метаболическим здоровьем была отмечена в 1970 году, когда Международный фонд исследований сахара обнаружил, что диета с высоким содержанием сахара приводит к повышению уровня триглицеридов в сыворотке у обычных крыс, но не у крыс, свободных от микробов [255].В современном голландском исследовании населения крупнейшим диетическим предиктором низкого бактериального разнообразия кишечника было общее потребление углеводов, за которым следовали уровни потребления пива, хлеба и газированных напитков [120]. Исследование 178 пожилых людей, проведенное Claesson et al. обнаружили, что пациенты, проживающие в интернатных учреждениях, придерживаются диеты с более высоким содержанием жиров и меньшим содержанием клетчатки, чем пожилые люди, проживающие в их районе [246]. Разнообразие рациона оценивалось с использованием индекса разнообразия здоровой пищи, который различает здоровую и нездоровую пищу во всех пищевых группах, и было обнаружено, что он положительно коррелирует с разнообразием кишечных бактерий.Индивидуальная микробиота сгруппирована на основе длительного ухода или статуса проживания в сообществе, и состав микробиоты значительно коррелирует с маркерами слабости, сопутствующей патологии и воспаления [246]. В то время как исследования ожирения традиционно сравнивали диеты с низким и высоким содержанием жиров, исследование на крысах показало, что диета с низким содержанием жиров и высоким содержанием сахарозы приводит к снижению бактериального разнообразия, увеличению количества Firmicutes: Bacteroidetes, появлению Ruminococcaceae, воспалению кишечника, изменению блуждающего нерва и головного мозга. общение и ожирение, аналогичные изокалорийной диете с высоким содержанием жиров и сахарозы [105].
Диеты с высоким содержанием углеводов и сахара коррелируют с повышенным содержанием грибов Candida и метаногена Methanobrevibacter , родов из разных сфер жизни, которые отрицательно коррелируют с потреблением аминокислот, белка и жирных кислот [256]. Methanobrevibacter smithii является наиболее распространенным археоном в кишечнике человека и может составлять до 10% всех анаэробов у здоровых взрослых. На модели мышей было показано, что M. smithii увеличивает ожирение хозяина, направляя Bacteroides thetaiotaomicron на ферментацию растительных полисахаридов (фруктанов) в рационе до ацетата SCFA [257].Бактериальная ферментация непереваренных пищевых полисахаридов в SCFAs, по оценкам, составляет от 5 до 10% суточного потребления калорий в типичной диете [258]. Повышенный уровень M. smithii также был выявлен у пациентов с СРК, особенно с СРК-З, у которых газообразный метан задерживает транзит через кишечник [259]. M. smithii количество копий обратно коррелировало с частотой стула ( R = -0,42).
Candida – преобладающие виды грибов, способные колонизировать кишечник.В целом микобиом менее стабилен, чем микробиом [260]. В то время как структура популяции бактерий в первую очередь связана с длительной диетой [14,246], Candida может сильно варьироваться во времени в ответ на недавнее потребление углеводов, использование антибиотиков и источники окружающей среды [22]. В исследовании 98 здоровых добровольцев, проведенном Hoffmann et al., Candida положительно коррелировал с долгосрочным потреблением общих углеводов и сахара и был сильно связан с недавним потреблением углеводов [256].В отличие от Candida и Methanobrevibacter наблюдалось, что популяции бактерий сильнее связаны с долгосрочными диетическими привычками, чем с недавним потреблением пищи. Prevotella и Ruminococcus увеличивались при потреблении углеводов и уменьшались при приеме продуктов животного происхождения, в то время как для Bacteroides наблюдался обратный эффект [256]. Была предложена модель синтрофии, в которой метаногенез поддерживает метаболизм Ruminococcus , а Candida разлагает крахмал до простых сахаров, обеспечивая ферментацию субстрата Prevotella .
Исследования образцов кала выявили Candida у 63% пациентов, при этом 11% показали избыточный рост Candida [261]. Чрезмерный рост может привести к инвазивной системной грибковой инфекции у онкологических больных или лиц с ослабленным иммунитетом, что приводит к высокому уровню смертности. В модели химиотерапии мышей наблюдали, что инфекция C. albicans вызывает дисбактериоз слизистой оболочки, что позволяет Stenotrophomonas , Alphaproteobacteria и ферментирующему молочную кислоту Enterococcus размножаться, в то время как разнообразие бактерий снижается [262].Лечение антибиотиками также является сильным фактором риска системного кандидоза. В анализах роста клеток показано, что SCFAs и молочная кислота обладают фунгистатическим, но не фунгицидным действием, что позволяет предположить, что здоровый микробиом предотвращает чрезмерный рост Candida [263]. Молочная кислота отвечает за антимикробную активность лактобацилл по отношению к патогенам. Кроме того, было показано, что полезный пробиотический штамм L. rhamnosus GG несет экзополисахарид, который препятствует росту Candida , образованию гиф и адгезии в кишечнике [264].
Чрезмерное потребление сахара или крахмала может привести к дисбактериозу Candida . Кандидоз в основном приписывают C. albicans , виду, который обладает внутренней устойчивостью к фунгистатическому эффекту SCFAs. Интересно, что устойчивость к SCFA зависит от присутствия мономерной глюкозы в питательной среде; темпы роста замедляются, когда дисахарид мальтоза используется в качестве источника питательных веществ [263]. В исследовании с участием 120 человек с хроническим разрастанием Candida в кишечнике диета вылечила 85% пациентов через три месяца после традиционной противогрибковой терапии по сравнению с 42% пациентов, получавших только нистатин [261].Пациенты из диетической группы избегали продуктов с высоким содержанием простых сахаров и крахмала, вяленого и жирного мяса, молока и молочных продуктов, а также алкоголя.
Идея сокращения содержания крахмала и сахара для улучшения здоровья кишечника восходит к 1920-м годам, когда гастроэнтеролог Сидней Хаас начал лечить пациентов с глютеновой болезнью, используя специфическую углеводную диету (SCD) [265]. Позднее биохимик Элейн Готтшалл популяризировал SCD как диету для уменьшения чрезмерного роста микробов, создав словарь легальных / незаконных продуктов и ингредиентов [266, 267].В диете запрещены зерновые (пшеница, ячмень, овес, рис, кукуруза), картофель, обработанное мясо, добавленные сахара и дисахариды (лактоза, сахароза), но разрешены свежие (не консервированные) фрукты, овощи и соки, не полученные из концентрата [268 ]. SCD ограничивает молочные продукты сливочным маслом, яйцами и выдержанными сырами с минимальным содержанием лактозы. Пиво, сладкое вино, ликеры и слизистые волокна ограничены, как и добавки и консерванты, такие как мальтодекстрин, пектин, гуар / камедь и FOS. Сахарные спирты запрещены, а мед является рекомендуемым подсластителем при SCD.Сначала соблюдается строгий трехмесячный период, чтобы разморозить разрастающиеся бактерии и дрожжи, после чего можно выборочно вносить бобовые. В отличие от диетической стратегии с низким содержанием FODMAP, SCD задумана как долгосрочная исключающая диета. В то время как отказ от FODMAP может улучшить симптомы СРК в краткосрочной перспективе, сообщалось о случаях клинической ремиссии без лекарств у пациентов с ВЗК после ВСС с полным исчезновением воспаления слизистой оболочки у некоторых пациентов с болезнью Крона [27, 269].
Искусственные пищевые ингредиенты связаны с дисбактериозом кишечника.Мальтодекстрин, полисахарид, полученный в результате гидролиза крахмала, является распространенной пищевой добавкой, которая позволяет прикрепленным инвазивным штаммам E. coli прикрепляться к эпителиальным клеткам кишечника и расти в биопленку, что способствует дисбактериозу кишечника и воспалению кишечника [21]. Полисорбат-80, эмульгатор, используемый в обработанных пищевых продуктах, усиливает транслокацию патогенных штаммов E. coli через колоноциты [21]. В исследовании на мышах, проведенном Chassaing et al., Низкие (0,1–1,0%) массовые концентрации эмульгаторов полисорбата-80 и карбоксиметилцеллюлозы вызывали легкое воспаление, ожирение и дисгликемию у мышей дикого типа и способствовали стойкому колиту у мышей, предрасположенных к беспорядок [270].Фекальные трансплантаты мышам, свободным от микробов, показали, что за это ответственны изменения микробиоты. Эмульгаторы уменьшили микробное разнообразие и уровни полезных для здоровья Bacteroidales, одновременно увеличивая муколитические Ruminococcus gnavus и провоспалительные Proteobacteria. Уменьшение толщины слизи также наблюдалось у мышей, получавших эмульгатор, наряду с посягательством бактерий на обычно стерильный внутренний слой слизи [270]. Посягательство микробиоты связано с ВЗК и метаболическим синдромом.У людей среднее бактериально-эпителиальное расстояние между ближайшими бактериями обратно пропорционально ИМТ, уровням глюкозы натощак и гемоглобину A1c [271]. Такие наблюдения указывают на то, что потребление обработанных пищевых продуктов является одним из факторов, усиливающих глобальную эпидемию ожирения [272].
6.5. Прерывистое голодание
Чрезмерное потребление калорий приводит к тому, что жир откладывается в белой жировой ткани, в то время как расход энергии на окисление жира происходит преимущественно за счет термогенеза коричневой жировой ткани.Таким образом, превращение белых адипоцитов, известное как beiging, является многообещающей стратегией лечения метаболических заболеваний. Недавно Ли и др. смогли избирательно индуцировать образование белой жировой ткани у мышей, используя естественную стратегию прерывистого голодания [273]. Мыши, которым был назначен режим голодания через день, имели такое же кумулятивное потребление пищи, что и контрольная группа ad libitum, но испытали сдвиг в микробиоте кишечника, увеличение содержания ацетата и лактата в продуктах ферментации и изменение вызванного диетой ожирения.Транспорт ацетата и лактата через мембрану адипоцитов управляется переносчиком монокарбоксилата 1, экспрессия которого, как было обнаружено, повышается в бежевых клетках. Beiging не наблюдался у мышей, свободных от микробов, но мог быть восстановлен после фекальной трансплантации кишечной микробиоты [273]. Предыдущее исследование на мышах продемонстрировало, что воздействие холода активирует образование белого жира и увеличивает чувствительность к инсулину за счет изменений в микробиоме [274]. Эти наблюдения показывают существование оси микробиота-бежевый жир.В другой работе Panda et al. обнаружили, что ожирение, вызванное диетой, снижает суточные циклические колебания микробиоты мышей [275]. Ограничение кормления восьмичасовым окном каждый день частично восстановило циркадные колебания, включая снижение численности Lactobacillus , наблюдаемое во время фазы кормления. Прерывистое голодание, более длительное многодневное голодание и диеты, имитирующие голодание, показали, что улучшают барьерную функцию кишечника, увеличивают микробное разнообразие, усиливают антиоксидантные микробные пути и даже обращают вспять воспаление кишечника на моделях ВЗК [276, 277, 278].
8. Выводы и дальнейшие направления исследований
Последние десять лет исследований начали выявлять всеобъемлющую роль кишечного микробиома в здоровье человека. Определенные виды Bifidobacterium , Akkermansia и Lactobacillus полезны для человека-хозяина и включены во многие пробиотические препараты, но такие роды, как Bacteroides и Ruminococcus , имеют отрицательные последствия для здоровья.Использование антибиотиков и современная санитария способствовали уменьшению разнообразия микробиома человека [287]. Разнообразие основных микробов и соотношение Firmicutes и Bacteroidetes являются общими показателями здоровья и могут меняться с возрастом, хотя межличностные различия велики, а качество диеты и факторы окружающей среды играют доминирующую роль [246 297 298 299]. В будущих исследованиях необходимо будет охарактеризовать изменения в бактериальном составе, сопровождающие различные болезненные состояния, и соответствующие паттерны экспрессии в генах как микроба, так и хозяина [296 300].Увеличение возраста связано с окислительным стрессом и провоспалительным состоянием, а улучшение микробиоты, как было показано, увеличивает продолжительность жизни на животных моделях старения, хотя исследования старения людей отсутствуют [81, 278, 301, 302]. Пребиотики и пищевые волокна увеличивают относительное количество полезных анаэробных бактерий, усиливают ферментацию бутирата и имеют благоприятные метаболические эффекты. Пропионат, с другой стороны, представляет собой SCFA, используемый в качестве пищевого консерванта, который недавно был связан с инсулинорезистентностью при потреблении в обычных концентрациях [303].Наконец, сообщается об отрицательных результатах для ацетата, продуцируемого кишечной микробиотой. Было обнаружено, что у крыс, получавших диету с высоким содержанием жиров, повышенное производство ацетата способствует ожирению и метаболическому синдрому [304]. В аналогичной модели на крысах инфузия толстой кишки с резистентным крахмалом и экзогенным ацетатом задерживала развитие ожирения и инсулинорезистентности и защищала слизистый барьер [305]. Было обнаружено, что такие виды, как Faecalibacterium и Roseburia , позволяют превращать ацетат в бутират, повышая уровни бутирата в сыворотке и кале.
В то время как наши знания о комменсальных и патогенных бактериях значительно расширились, будущие исследования потребуют дальнейшего изучения роли небактериальных микробов в кишечнике человека, включая вирусы, эукариоты, дрожжи и археи [256,306,307]. Было показано, что вирусы, паразитирующие по отношению к бактериям, известные как бактериофаги, со временем сосуществуют с видами бактерий, на которых они охотятся. Поедание фагов также может приводить к каскадному воздействию на другие виды, включая цветение нецелевых бактерий [308].Аномальный кишечный виром был обнаружен у пациентов с ВЗК, у которых увеличение количества бактериофагов способствует снижению бактериального разнообразия и дисбактериоза кишечника [309]. Наиболее распространенный эукариот в кишечнике человека, Blastocystis , представляет собой одноклеточный гетероконтный протист, который колонизирует значительную часть людей в промышленно развитых (0,5–30%) и развивающихся (30–76%) странах [310]. Было высказано предположение, что Blastocystis может охотиться на виды бактерий в кишечнике в своей амебоидной форме [306] и может вносить вклад в патогенез СРК [311].В исследовании на мышах, проведенном Ясоном и соавторами, инфекция патогенным подтипом Blastocystis (ST7) наблюдалась в снижении кишечных уровней полезных Bifidobacterium и Lactobacillus при увеличении содержания E. coli , что, по всей видимости, соответствует критерию Коха. постулируют, что инфицирование здорового человека приводит к заболеванию [312]. Однако у бессимптомных людей непатогенный Blastocystis положительно коррелирует с микробным разнообразием и обратно – с ИМТ, уровнем калпротектина в кале, болезнью Крона и колоректальным раком [313].Как род, виды Blastocystis имеют невероятно разные геномы. Процент белков, уникальных для каждого подтипа, колеблется от 6% до 20%, а ортологичные белки имеют медианную идентичность аминокислотной последовательности только 60% [314].
Диета и статус питания являются важными детерминантами здоровья человека. Попытки охарактеризовать взаимосвязь между диетой и здоровьем перешли от изучения эффектов отдельных питательных веществ к изучению роли моделей питания и конкретных диет [149, 150, 151].Роль диеты в формировании кишечной микробиоты, метаболизма хозяина и липидного гомеостаза меняет наше представление о шагах, которые человек может предпринять, чтобы улучшить свое системное здоровье [10, 315]. Корреляции между микробным разнообразием по 60 различным диетическим ковариатам показывают важность высококачественного сбалансированного питания [120], подтверждая мнение о том, что добавление отдельных питательных веществ к пище не заменяет здоровую диету [316]. Наблюдения за тем, что отдельные продукты питания стимулируют рост определенных бактериальных таксонов, позволяют предположить, что кишечные бактерии действительно могут определять наши пищевые предпочтения, аппетит и чувство сытости [221, 317].Влияя на метаболизм и воспаление, диета и питание могут перевешивать генетические и экологические факторы в определении результатов для здоровья хронических западных состояний, таких как диабет, ожирение, СРК, ВЗК, колоректальный рак и депрессия [1,2,318].
Остается один вопрос исследования: что представляет собой оптимальный микробиом, способствующий укреплению здоровья, и как люди с другой исходной микробиотой могут получить такую микрофлору. При характеристике эубиоза и дисбактериоза кишечника воздействие определенных видов микробов не может рассматриваться просто изолированно, что дает начало понятию экологических постулатов Коха о причинно-следственной связи заболеваний [162].Изменения консистенции стула и содержания воды затрудняют количественную оценку абсолютной микробной нагрузки, и необходимы новые методы для выявления патологических маркеров [319]. В то время как образцы фекалий обычно считаются репрезентативными для микробных сообществ толстой кишки, необходимы дальнейшие исследования, чтобы охарактеризовать различные микробные сообщества, встречающиеся по длине желудочно-кишечного тракта [320]. Исследование пяти срезов кишечника свиней показало преобладание Lactobacillus в тонком кишечнике и Prevotella в толстой кишке, что свидетельствует о том, что быстрое использование простых углеводов стимулирует микробную конкуренцию в верхнем отделе кишечника, в то время как ферментация полисахаридов остается в основном для толстая кишка [321].
Индивидуальные вариации микробиоты кишечника могут объяснить различия в результатах, которые часто наблюдаются при изменении образа жизни, и почему универсальные диеты не всегда эффективны [83,125,201]. Влияние типа диеты на относительную численность микробных популяций может быть сложным и трудно воспроизводимым в различных клинических исследованиях, отчасти из-за количества отдельных видов, вовлеченных в каждый тип и род [142]. Было показано, что индивидуумы обладают высоко персонализированной реакцией микробиома на различные продукты питания в зависимости от их предшествующего анамнеза диетического разнообразия [322].Быстрые изменения микробиоты кишечника возможны при принятии новой диетической стратегии, такой как соблюдение исключительно растительной или животной диеты [323]. Микробные маркеры даже были предложены в качестве объективного средства измерения соблюдения определенного режима питания для более точной корреляции полученных результатов для здоровья [150]. В совокупности микробы кодируют в 150 раз больше генов, чем геном человека [5]. Было показано, что ферменты кишечных бактерий в основных таксономических группах метаболизируют 176 обычных пероральных препаратов, что позволяет предположить, что различия в микробиоте кишечника могут формировать индивидуальные реакции на лекарственную терапию [324].В конечном итоге, определение полного ландшафта взаимодействия хозяина и микробиоты позволит достичь прогресса в персонализированной медицине, точном питании [125, 325] и разработке пробиотиков следующего поколения, адаптированных к индивидууму [326].
Роль микробиоты кишечника в питании и здоровье
- Ана М. Вальдес, доцент1 2,
- Йенс Вальтер, председатель CAIP по вопросам питания, микробов и здоровья желудочно-кишечного тракта4,
- Эран Сигал, профессор4,
- Тим Спектор , профессор5
- 1 Медицинский факультет Ноттингемского университета, Городская больница, Ноттингем NG5 1PB, Великобритания
- 2 Ноттингемский биомедицинский исследовательский центр NIHR, Ноттингем, Великобритания 60 наук о сельском хозяйстве, пищевых продуктах и питании и Департамент биологических наук, Университет Альберты, Эдмонтон, Канада
- 4 Департамент компьютерных наук и прикладной математики, Институт науки Вейцмана, Реховот, Израиль
- 5 Департамент исследований близнецов и генетической эпидемиологии, Королевский колледж Лондона, Лондон, Великобритания
- Для корреспонденции: T D Spector tim.spector {at} kcl.ac.uk
Ана М. Вальдес и его коллеги обсуждают стратегии регулирования кишечной микробиоты с помощью диеты и пробиотиков
Микробиом относится к коллективным геномам микроорганизмов в конкретной среде и микробиоте. это сообщество самих микроорганизмов (вставка 1). Приблизительно 100 триллионов микроорганизмов (большинство из них – бактерии, но также вирусы, грибы и простейшие) существуют в желудочно-кишечном тракте человека12 – микробиом сейчас лучше всего рассматривать как виртуальный орган тела.Геном человека состоит примерно из 23 000 генов, тогда как микробиом кодирует более трех миллионов генов, производящих тысячи метаболитов, которые заменяют многие функции хозяина 13, следовательно, влияя на приспособленность, фенотип и здоровье хозяина.2
Вставка 1 ГлоссарийМикробиом – коллективные геномы микроорганизмов в определенной среде
Микробиота – сообщество самих микроорганизмов
– мера разнообразия микробиоты 9 сколько разных видов и, в зависимости от показателей разнообразия, насколько равномерно они распределены в сообществе.Низкое разнообразие считается маркером дисбактериоза (микробного дисбаланса) в кишечнике и обнаруживается при аутоиммунных заболеваниях, ожирении и кардиометаболических состояниях, а также у пожилых людей
Оперативная таксономическая единица – определение, используемое для классификации групп близкородственных организмов. Последовательности ДНК могут быть сгруппированы в соответствии с их сходством друг с другом, и рабочие таксономические единицы определяются на основе порога сходства (обычно 97% сходства), установленного исследователем
Колоноциты – эпителиальные клетки толстой кишки
Животные без микробов – животные, в которых или на них не живут микроорганизмы
Короткоцепочечные жирные кислоты – жирные кислоты с двумя-шестью атомами углерода, которые образуются в результате бактериальной ферментации пищевых волокон
Изучение микробиоты кишечника
Исследования с близнецами показали, что, хотя существует наследственный компонент микробиоты кишечника, факторы окружающей среды, связанные с диетой, лекарствами и антропометрическими показателями, являются более крупными детерминантами состава микробиоты.45
Кишечные микробы играют ключевую роль во многих аспектах здоровья человека, включая иммунные6, метаболические5 и нейроповеденческие особенности (рис. 1) .78 Различные уровни доказательств подтверждают роль кишечной микробиоты в здоровье человека, полученные на животных моделях910 и исследованиях на людях 4111213
Рис. 1Схематическое изображение роли микробиоты кишечника в здоровье и болезнях с некоторыми примерами входов и выходов. ССЗ = сердечно-сосудистые заболевания; IPA = индолепропионовая кислота; ЛПС = липополисахарид; SCFA = жирные кислоты с короткой цепью; ТМАО = N-оксид триметиламина
Модели на животных могут помочь идентифицировать кишечные микробы и механизмы, хотя степень, в которой результаты передаются людям, неизвестна.На людях обсервационные исследования могут показать перекрестные ассоциации между микробами и характеристиками здоровья, но ограничены невозможностью измерить причинно-следственные связи. Самый убедительный уровень доказательств получен в интервенционных клинических исследованиях, в частности, в рандомизированных контролируемых исследованиях.
Состав кишечной микробиоты обычно количественно определяется с использованием методов, основанных на ДНК, таких как секвенирование следующего поколения генов рибосомной РНК 16S или полногеномное секвенирование с дробовиком, что также позволяет сделать вывод о функциях микробиоты.1415 Продукты метаболизма микробиоты теперь можно измерить в кале и сыворотке с помощью метаболомных методов.16
Что делает кишечная микробиота?
Микробиота кишечника обеспечивает необходимые возможности для ферментации неперевариваемых субстратов, таких как пищевые волокна и эндогенная кишечная слизь. Эта ферментация поддерживает рост специальных микробов, которые производят короткоцепочечные жирные кислоты (SCFA) и газы.17 Основными производимыми SCFA являются ацетат, пропионат и бутират.
Бутират является основным источником энергии для колоноцитов человека, может вызывать апоптоз клеток рака толстой кишки и активировать глюконеогенез в кишечнике, оказывая благотворное влияние на глюкозный и энергетический гомеостаз.18 Бутират необходим эпителиальным клеткам для потребления большого количества кислорода через β окисление, вызывая состояние гипоксии, которое поддерживает кислородный баланс в кишечнике, предотвращая дисбактериоз кишечной микробиоты.19
Пропионат переносится в печень, где он регулирует глюконеогенез и передачу сигналов насыщения через взаимодействие с рецепторами жирных кислот кишечника 18 Ацетат – самый обильные SCFA и важный метаболит для роста других бактерий – достигает периферических тканей, где он используется в метаболизме холестерина и липогенезе, и может играть роль в центральной регуляции аппетита.20 Рандомизированные контролируемые испытания показали, что более высокая продукция SCFAs коррелирует с меньшим ожирением, вызванным диетой21, и со снижением инсулинорезистентности22. Бутират и пропионат, но не ацетат, по-видимому, контролируют гормоны кишечника и снижают аппетит и потребление пищи у мышей.21 ферменты участвуют в метаболизме желчных кислот, генерируя неконъюгированные и вторичные желчные кислоты, которые действуют как сигнальные молекулы и регуляторы метаболизма, влияя на важные пути хозяина.23
Другие специфические продукты кишечной микробиоты напрямую влияют на здоровье человека.Примеры включают триметиламин и индолепропионовую кислоту. Производство триметиламина из пищевого фосфатидилхолина и карнитина (из мяса и молочных продуктов) зависит от микробиоты кишечника, и, следовательно, его количество в крови варьируется у разных людей. Триметиламин окисляется в печени до N-оксида триметиламина, что положительно связано с повышенным риском атеросклероза и серьезных сердечно-сосудистых событий.24 Индолепропионовая кислота сильно коррелирует с потреблением пищевых волокон25 и обладает мощной активностью улавливания радикалов in vitro, 26 что кажется для снижения риска заболеваемости диабетом 2 типа.25
Микробиота кишечника и ожирение
Микробиота кишечника, по-видимому, играет роль в развитии и прогрессировании ожирения. Большинство исследований с участием людей с избыточным весом и ожирением показывают, что дисбактериоз отличается меньшим разнообразием. 31-39 Мыши без микробов, которые получают фекальные микробы от людей с ожирением, набирают больше веса, чем мыши, которые получают микробы от людей со здоровым весом.4 Крупное исследование близнецов в Великобритании показало, что род Christensenella редко встречается у людей с избыточным весом и когда давать мышам, не содержащим микробов, предотвращать увеличение веса.4 Этот и другие микробы, такие как Akkermansia , коррелируют с более низкими отложениями висцерального жира.12 Хотя большая часть подтверждающих данных получена на моделях на мышах, долгосрочное увеличение веса (более 10 лет) у людей коррелирует с низким разнообразием микробиоты, и эта связь усугубляется низким потреблением пищевых волокон.28
Дисбиоз кишечной микробиоты, вероятно, способствует ожирению, вызванному диетой, и метаболическим осложнениям за счет различных механизмов, включая иммунную дисрегуляцию, изменение регуляции энергии, изменение регуляции гормонов кишечника и провоспалительные механизмы (такие как липополисахаридные эндотоксины, проникающие через кишечник). барьер и вход в портал кровообращения 2930; рис 1 ) .
Разнообразие микробиоты и здоровье
Более низкое бактериальное разнообразие воспроизводимо наблюдается у людей с воспалительным заболеванием кишечника, 31 псориатическим артритом, 32 диабетом 1 типа, 33 атопической экземой, 34 глютеновой болезнью, 35 ожирением, 36 диабетом 2 типа, 37 и артериальным жесткость, 38, чем у здоровых людей. У курильщиков с болезнью Крона разнообразие кишечного микробиома еще ниже.39 Связь между сниженным разнообразием и заболеванием указывает на то, что богатая видами кишечная экосистема более устойчива к воздействиям окружающей среды, поскольку функционально связанные микробы в нетронутой экосистеме могут компенсировать функцию других отсутствующих разновидность.Следовательно, разнообразие, по-видимому, в целом является хорошим показателем «здорового кишечника». 4041 Но недавние интервенционные исследования показывают, что значительное увеличение количества пищевых волокон может временно уменьшить разнообразие, поскольку микробы, переваривающие клетчатку, становятся специфически обогащенными, что приводит к изменению состава и, за счет конкурентных взаимодействий, сокращение разнообразия.22
Функциональная роль микробиома кишечника у людей была показана с помощью трансплантации фекальной микробиоты.42 Эта процедура эффективна в случаях тяжелой резистентной к лекарствам инфекции Clostridium difficile и в настоящее время обычно используется для этого по всему миру.43 Для других патологий трансплантация фекалий еще не является клинической практикой, но была изучена.44 Например, пересадка фекалий от худощавого здорового донора (аллогенного) реципиентам с метаболическим синдромом привела к лучшей чувствительности к инсулину, сопровождаемой измененным составом микробиоты, чем при использовании аутологичные фекалии.45
Влияние пищи и лекарств на микробиоту кишечника
Конкретные продукты и режим питания могут влиять на численность различных типов бактерий в кишечнике, что, в свою очередь, может влиять на здоровье (таблица 1).
Таблица 1Примеры продуктов питания, питательных веществ и режимов питания, которые влияют на здоровье человека в связи с их влиянием на микробиоту кишечника
Высокоинтенсивные подсластители обычно используются в качестве альтернативы сахару, поскольку они во много раз слаще сахара при минимальном количестве калорий. Несмотря на то, что регулирующие органы «в целом признаны безопасными», некоторые исследования на животных показали, что эти заменители сахара могут оказывать негативное воздействие на микробиоту кишечника.46 Было показано, что сукралоза, аспартам и сахарин нарушают баланс и разнообразие микробиоты кишечника.46 Крысы, получавшие сукралозу в течение 12 недель, имели значительно более высокие доли Bacteroides , Clostridia и общее количество аэробных бактерий в кишечнике, а также значительно более высокий pH фекалий, чем у крыс, получавших сукралозу в течение шести месяцев. экспрессия в кишечнике бактериальных провоспалительных генов и нарушенных метаболитов фекалий.48
Пищевые добавки, такие как эмульгаторы, которые повсеместно присутствуют в обработанных пищевых продуктах, также влияют на микробиоту кишечника животных.49 Мыши, получавшие относительно низкие концентрации двух обычно используемых эмульгаторов – карбоксиметилцеллюлозы и полисорбат-80, – показали снижение микробного разнообразия по сравнению с мышами, которым не давали эмульгаторы. Bacteroidales и Verrucomicrobia были уменьшены, а протеобактерии, способствующие воспалению, связанные со слизью, были обогащены .49
Другие области, вызывающие беспокойство, включают побочные эффекты популярных ограничительных диет на здоровье кишечника. К ним относятся некоторые строгие веганские диеты, сыроедение или диеты «чистого питания», диеты без глютена и диеты с низким содержанием FODMAP (ферментируемых олигосахаридов, дисахаридов, моносахаридов и полиолов), используемые для лечения синдрома раздраженного кишечника.
Некоторые считают веганов более здоровыми, чем всеядные. Исследование 15 веганов и 16 оминворов выявило поразительные различия в сывороточных метаболитах, генерируемых кишечными микробами, но очень скромные различия в кишечных бактериальных сообществах.50 Эксперимент с контролируемым кормлением 10 человек всеядных животных, рандомизированных для получения диеты с высоким содержанием жиров и низким содержанием клетчатки или с низким содержанием жира и высоким содержанием клетчатки в течение 10 дней было обнаружено очень скромное влияние на состав микробиома кишечника и отсутствие разницы в производстве короткоцепочечных жирных кислот.Вместе эти данные подтверждают большую роль диеты, влияющей на метаболом, полученный из бактерий, чем только на краткосрочное бактериальное сообщество50.
Исследования на животных и in vitro показывают, что безглютеновый хлеб снижает дисбактериоз микробиоты, наблюдаемый у людей с чувствительностью к глютену или глютеновой болезнью. 5152 Но большинство людей, избегающих глютена, не страдают глютеновой болезнью или непереносимостью, а недавнее крупное обсервационное исследование показало повышенный риск сердечных заболеваний у тех, кто избегает глютена, возможно, из-за снижения потребления цельного зерна.53 Одно исследование показало, что у 21 здорового человека профиль кишечной микробиоты существенно различается после четырех недель безглютеновой диеты. У большинства людей наблюдалась более низкая численность нескольких ключевых полезных видов микробов.54
Диета с низким содержанием FODMAP была показана в шести рандомизированных контролируемых испытаниях для уменьшения симптомов синдрома раздраженного кишечника.5556 Это связано с уменьшением доли Bifidobacterium у пациентов. с синдромом раздраженного кишечника, и реакцию на эту диету можно предсказать по бактериальному профилю фекалий.57 Диеты с низким содержанием FODMAP приводят к глубоким изменениям микробиоты и метаболома, продолжительность и клиническая значимость которых пока неизвестны.5859
Помимо диеты, лекарственные препараты являются ключевым модулятором состава микробиоты кишечника. Крупное голландско-бельгийское популяционное исследование показало, что лекарственные препараты (включая осмотические слабительные, прогестерон, ингибиторы TNF-α и рупатадин) обладают наибольшей объяснительной силой в отношении состава микробиоты (10% вариабельности в сообществе) 13. ингибиторы протонной помпы на микробное сообщество, что может объяснить более высокую частоту желудочно-кишечных инфекций у людей, принимающих эти препараты.60 Очевидно, что антибиотики действуют на кишечные микробы, и домашнему скоту обычно дают низкие дозы для увеличения их роста и веса. Большая часть антибиотиков во многих странах используется в сельском хозяйстве, особенно в интенсивном разведении птицы и говядины.61 Несколько наблюдательных исследований на людях, а также многие исследования на грызунах указали на ожирение антибиотиков у людей даже в крошечных дозах, обнаруживаемых в пище. 61 Но люди имеют очень разные ответы на антибиотики, и интервенционные исследования не показали последовательных метаболических последствий.62 Пестициды и другие химические вещества обычно распыляются на пищевые продукты, но, хотя уровни могут быть высокими, убедительных доказательств их вреда для здоровья кишечника и воздействия органических продуктов питания в настоящее время нет.63
Недостаточно клинических данных, чтобы сделать четкие выводы или рекомендации. для тех или иных диетических предпочтений на основе микробиоты кишечника. Но будущие исследования пищевых добавок, лекарств, а также безопасности и эффективности диетических модификаций должны учитывать эти достижения и их влияние на микробиоту кишечника.Это становится очевидным для пациентов с раком, получавших иммунохимиотерапию, реципиентов костного мозга и пациентов с аутоиммунными нарушениями на биопрепаратах, у которых небольшие изменения в их микробиоте могут вызвать серьезные изменения в их реакции.64 Более того, эксперименты на животных показали защитные эффекты фитоэстрогенов. на рак груди зависят от наличия кишечных микробов (таких как Clostridium saccharogumia , Eggerthella lenta, Blautia producta, и Lactonifactor longoviformis ), которые могут преобразовывать изофлавоны в биологически активные соединения.65
Во вставке 2 обобщены наши текущие знания о взаимодействиях между микробиотой кишечника, питанием и здоровьем человека.
Вставка 2 Консенсус и неопределенностиЧто мы знаем
Добавки с пробиотиками оказывают несколько благотворных эффектов на здоровье человека
Микробы в нашем кишечнике влияют на энергетический метаболизм человека 222324252627282930313260334343534 сильное влияние на состав микробиоты кишечника
Состав микробиоты влияет на реакцию на химиотерапию и иммунотерапию96
Состав микробиома определяет реакцию глюкозы на пищевые продукты и может использоваться для персонализации диеты94
Потребление пищевых волокон влияет на состав микробиоты кишечника и связано к лучшему здоровью 8687104
Чего мы не знаем
Лучше ли натуральные пробиотики в пище, чем пробиотические добавки? Стоит ли принимать их в профилактических целях?
Могут ли микробы влиять на выбор пищи и аппетит?
Влияют ли низкие дозы антибиотиков в пище на здоровье человека?
Как пестициды, содержащиеся в пище, влияют на микробиом кишечника? Органические продукты лучше для кишечной микробиоты?
Следует ли проверять все новые лекарства и пищевые химикаты на микробиоте кишечника?
Управление микробиотой кишечника с помощью диеты
Изменения микробиоты кишечника могут произойти в течение нескольких дней после смены диеты; заметные различия были обнаружены после того, как афроамериканцы и сельские африканцы сменили диету всего на две недели.66 Увеличение численности известных бактерий, продуцирующих бутират, у афроамериканцев, потребляющих сельскую африканскую диету, привело к увеличению производства бутирата в 2,5 раза и снижению синтеза вторичной желчной кислоты66. пять дней.67 Но здоровая микробиота устойчива к временным изменениям в результате диетических вмешательств, что означает, что гомеостатические реакции восстанавливают исходный состав сообщества, как недавно было показано в случае хлеба 68
Пребиотические продукты и пищевые волокна
Большинство национальных властей определяют диетические волокна как съедобные углеводные полимеры с тремя или более мономерными единицами, которые устойчивы к эндогенным пищеварительным ферментам и, таким образом, не подвергаются гидролизу и не всасываются в тонком кишечнике.69 Подмножество источников пищевых волокон является ферментируемым, что означает, что они служат субстратами для роста микробов в дистальном отделе кишечника.70 Некоторые неперевариваемые углеводы называются «пребиотиками», которые определяются как пищевые компоненты или ингредиенты, которые не усваиваются организмом человека, но специально или выборочно питают полезные микроорганизмы толстой кишки (вставка 3) .71 Концепция пребиотиков подвергалась критике за то, что она плохо определена и излишне узка, 72 и некоторые ученые предпочитают термин «углеводы, доступные микробиоте» 11. которые по существу эквивалентны ферментируемым пищевым волокнам в том смысле, что они становятся доступными в качестве субстратов для роста кишечных микробов, которые обладают необходимой ферментативной способностью для их использования.70
Box 3 Что такое пребиотики и пробиотики?Количество белка, насыщенных и ненасыщенных жиров, углеводов и пищевых волокон в рационе влияет на численность различных типов бактерий в кишечнике. Микробиоту также можно изменить, добавляя в пищу живые микроорганизмы или голодая.
Пробиотики – это живые бактерии и дрожжи, которые при введении в жизнеспособной форме и в достаточных количествах полезны для здоровья человека.Обычно их добавляют в йогурты или принимают в качестве пищевых добавок.
Пребиотики определяются как субстрат, который избирательно используется микроорганизмами-хозяевами, принося пользу для здоровья. Хотя все соединения, которые считаются пребиотиками, являются углеводами, доступными для микробиоты, или ферментируемыми пищевыми волокнами, обратное неверно. Концепция пребиотиков является предметом текущих дебатов70
Синбиотики содержат смесь пребиотиков и пробиотиков
Было показано, что потребление резистентных крахмалов обогащает определенные группы бактерий ( Bifidobacterium adolescentis, occus brom. Eubacterium rectale ) у некоторых людей.7475 Обогащенные таксоны различаются в зависимости от типа устойчивых крахмалов и других пищевых волокон 75, что указывает на то, что сдвиги зависят от химической структуры углеводов и ферментативной способности микробов получать к ним доступ. Микробы также должны «прилипать» к субстрату и выдерживать условия, возникающие в результате ферментации (например, низкий pH) .76
Влияние доступных микробиоте углеводов на состав микробиома желудочно-кишечного тракта может быть значительным, при этом определенные виды обогащаются и составляют больше более 30% фекальной микробиоты.7577 Таким образом, углеводы, доступные для микробиоты, обеспечивают потенциальную стратегию улучшения полезных меньшинств микробиома. Эти изменения продолжаются только до тех пор, пока потребляются углеводы, и они очень индивидуальны, что обеспечивает основу для индивидуальных подходов. Многие краткосрочные испытания кормления очищенными пищевыми волокнами или даже диетами на основе цельных растений либо не влияют на разнообразие микробиоты, либо уменьшают его, 22 но все же могут иметь клинические преимущества, потенциально за счет метаболитов, таких как жирные кислоты с небольшой цепью.2267
Низкое потребление клетчатки снижает производство низкоцепочечных жирных кислот и сдвигает метаболизм микробиоты желудочно-кишечного тракта в сторону использования менее благоприятных питательных веществ 78, что приводит к выработке потенциально вредных метаболитов.7980 Убедительные доказательства показывают, что западная диета с низким содержанием клетчатки разрушает слизистый барьер толстой кишки. , вызывая вторжение микробиоты, что приводит к восприимчивости к патогенам81 и воспалению, 82 обеспечивая потенциальный механизм связи западной диеты с хроническими заболеваниями.Два недавних исследования показали, что пагубное влияние диеты с высоким содержанием жиров на проницаемость слизистого слоя и метаболические функции можно предотвратить путем диетического введения инулина.8384 В целом, эти результаты, вместе с ролью бутирата в предотвращении вызванного кислородом дисбиоза кишечной микробиоты, 19 представляют собой убедительный аргумент в пользу увеличения потребления пищевых волокон для поддержания неповрежденной барьерной функции слизистой оболочки кишечника.85
Значительные данные наблюдений показывают, что потребление клетчатки полезно для здоровья человека.Два недавних метаанализа выявили четкую связь между диетической клетчаткой и пользой для здоровья при широком спектре патологий8687, а недавнее интервенционное исследование показало, что пищевые волокна значительно снижают инсулинорезистентность у пациентов с диабетом 2 типа, с четкой связью с изменениями в микробиоте. и полезные метаболиты (такие как бутират) .45
Пробиотические продукты питания
Пробиотики – это живые микроорганизмы, которые при введении в адекватных количествах приносят пользу здоровью хозяина).88 Пробиотики (в основном виды Bifidobacterium и Lactobacillus ) могут быть включены в различные продукты, включая пищевые продукты, пищевые добавки или лекарства.
Есть опасения, что большинство микробных добавок не могут прижиться в кишечнике и не могут оказать влияние на местное сообщество.8990 Но пробиотики могут влиять на здоровье независимо от микробиоты кишечника через прямое воздействие на хозяина; например, посредством иммуномодуляции или производства биологически активных соединений.Терапевтический эффект пробиотических добавок изучался при широком спектре заболеваний.
Мы провели поиск в Кокрановской библиотеке систематических обзоров на предмет «пробиотик *», что дало 39 исследований, и выполнили поиск в Medline по запросу «систематический обзор» или «метаанализ» и «пробиотик *», в результате чего было получено 31 исследование. Мы включили информацию о систематических обзорах рандомизированных контролируемых исследований, опубликованных за последние пять лет, в которых основным лечением были пробиотики (а не пищевые добавки в целом). Только исследования, которые были сосредоточены на сравнении пробиотиков с контрольной группой, которые содержали по крайней мере несколько рандомизированных контролируемых испытаний среднего или высокого качества по оценке авторов систематического обзора, в результате которых было подготовлено в общей сложности 22 систематических обзора (таблица 2 ). .Анализ 313 исследований и 46 826 участников продемонстрировал убедительные доказательства положительного воздействия пробиотических добавок в профилактике диареи, некротизирующего энтероколита, острых инфекций верхних дыхательных путей, обострений легких у детей с муковисцидозом и экземы у детей. Пробиотики также улучшают кардиометаболические параметры и снижают концентрацию С-реактивного белка в сыворотке крови у пациентов с диабетом 2 типа. Важно отметить, что исследования не были однородными и не обязательно соответствовали типу или дозе пробиотических добавок, а также продолжительности вмешательства, что ограничивает точные рекомендации.Новые области лечения пробиотиками включают использование новых микробов и их комбинаций, сочетание пробиотиков и пребиотиков (синбиотиков) 91 и индивидуальные подходы, основанные на профилях микробов-кандидатов при воспалении, раке, метаболизме липидов или ожирении.92 Стабильное приживление пробиотика Bifidobacterium longum , например, было показано, что он зависит от индивидуальных особенностей микробиоты кишечника, что дает обоснование для персонализации применения пробиотиков.93
Таблица 2Резюме систематических обзоров, анализирующих роль пробиотиков в клинических исходах
Персонализированное питание и будущие направления
Учитывая различия в микробиоте кишечника у разных людей, может потребоваться адаптация оптимальной диеты человека к его микробиоте кишечника.Зееви и др. 94 получили многомерный профиль микробиоты у 900 человек и отслеживали потребление пищи, постоянный уровень глюкозы в крови и физическую активность в течение одной недели. Исследователи разработали алгоритм машинного обучения для прогнозирования персонализированных ответов глюкозы после еды на основе клинических данных и данных микробиома кишечника и показали, что он позволяет получать значительно более высокие прогнозы, чем такие подходы, как подсчет углеводов или оценка гликемического индекса. В последующем двойном слепом рандомизированном перекрестном исследовании с 26 участниками персонализированные диетические вмешательства, основанные на алгоритме, успешно нормализовали уровень глюкозы в крови.94
Исследование реакции на хлеб68 с использованием рандомизированного перекрестного испытания однонедельных диетических вмешательств показало значительную межличностную вариабельность гликемической реакции на разные виды хлеба. Тип хлеба, который вызвал более низкий гликемический ответ у каждого человека, можно было предсказать, основываясь исключительно на данных микробиома, собранных до вмешательства.68 Необходимо провести гораздо больше исследований, чтобы установить, являются ли такие персонализированные подходы осуществимыми, устойчивыми и имеют положительный эффект. по клиническим исходам.
Выводы
Мы вступаем в эпоху, когда мы можем все больше изменять здоровье с помощью еды и измерять воздействие с помощью наших микробов или метаболитов. Клетчатка является ключевым питательным веществом для здорового микробиома, и на нее не обращали внимания, пока бушевали дебаты о сахаре и жирах. Нельзя больше игнорировать неблагоприятное воздействие на микробиом лекарств и обработанных пищевых ингредиентов. Учитывая текущие пробелы в знаниях, нам нужны клинические доказательства, которые могут быть применены в клинической практике, в идеале с помощью рандомизированных контролируемых исследований, в которых используются согласованные матрицы пребиотиков или пробиотиков или трансплантация фекальной микробиоты для оценки изменений в составе микробиоты кишечника и в результатах для здоровья.
Ключевые сообщения
Микробиота кишечника влияет на многие области здоровья человека от врожденного иммунитета до аппетита и энергетического метаболизма
Нацеливание на микробиом кишечника с помощью пробиотиков или пищевых волокон приносит пользу здоровью человека и потенциально может снизить ожирение
Лекарства, пищевые ингредиенты, антибиотики и пестициды могут оказывать неблагоприятное воздействие на микробиоту кишечника
Микробиоту следует рассматривать как ключевой аспект в питании; медицинское сообщество должно адаптировать свое образование и сообщения общественного здравоохранения
Потребление клетчатки связано с положительными эффектами в нескольких контекстах
Сноски
Участники и источники: AMV изучает молекулярные основы старения и сложных заболеваний и недавно исследовали роль состава кишечного микробиома на кардиометаболические нарушения.JW изучал и широко освещал микробную экологию кишечной микробиоты, ее роль в здоровье хозяина и то, как она может регулироваться диетой. ES возглавляет многопрофильную лабораторию вычислительных биологов и ученых-экспериментаторов, специализирующуюся на питании, генетике, микробиоме и их влиянии на здоровье и болезни. Его цель – разработать индивидуальное питание и медицину. TDS возглавляет регистр TwinsUK и британский проект кишечника в качестве главы многопрофильной группы, изучающей генетические, диетические и образ жизни, определяющие состав микробиома кишечника человека и его связь с распространенными заболеваниями.Все авторы внесли свой вклад, прочитали и одобрили окончательную версию.
Конкурирующие интересы: Мы прочитали и поняли политику BMJ в отношении конкурирующих интересов и заявляем следующее: AMV и TS являются консультантами Zoe Global. Компания JW получила финансирование исследований из промышленных источников, занимающихся производством и маркетингом пребиотиков и пищевых волокон, и является совладельцем Synbiotics Solutions, разработчика синбиотических продуктов. ES является консультантом DayTwo Inc. AMV финансируется Ноттингемским центром биомедицинских исследований NIHR.JW поддерживается через программу Campus Alberta Innovates и гранты Канадского института медицинских исследований (CIHR), Совета естественных и инженерных исследований Канады (NSERC), JPI HDHL и Канадского фонда инноваций. ES поддерживается Центром генома человека Crown; Фонд Эльзы Кроенер Фрезениус; Дональд Л. Шварц, Шерман-Окс, Калифорния; Джек Н. Халперн, Нью-Йорк, штат Нью-Йорк; Лиза Стейнберг, Канада; и гранты, финансируемые Европейским исследовательским советом и Израильским научным фондом.TwinsUK финансировался Wellcome Trust; Седьмая рамочная программа Европейского сообщества (FP7 / 2007-2013). Исследование также получило поддержку от Национального института исследований в области здравоохранения (NIHR), Центра клинических исследований BioResource и Центра биомедицинских исследований, базирующегося в Фонде NHS Гая и Сент-Томаса, и Королевского колледжа Лондона. TDS – старший следователь NIHR.
Провенанс и экспертная оценка: Введен в эксплуатацию; внешняя экспертная оценка.
Эта статья является одной из серии, заказанной BMJ .Плата за открытый доступ к серии финансировалась Swiss Re, которая не участвовала в вводе в эксплуатацию или экспертной оценке статей. BMJ благодарит консультантов серии, Ниту Форухи и Дариуша Мозаффариан, за ценные советы и рекомендации по выбору тем в серии.
Это статья в открытом доступе, распространяемая в соответствии с некоммерческой лицензией Creative Commons Attribution (CC BY-NC 4.0), которая разрешает другим распространять, ремикшировать, адаптировать, использовать эту работу в некоммерческих целях и лицензировать свои производные работы на разных условиях при условии, что оригинальная работа правильно процитирована и используется в некоммерческих целях.См. Http://creativecommons.org/licenses/by-nc/4.0/.
Микробиота кишечника и здоровье хозяина: новый клинический рубеж
Введение
Представьте себе сценарий: ученый на конференции заявляет, что обнаружил новый орган в человеческом теле. Он сравним с иммунной системой, поскольку состоит из набора клеток, содержит в 100 раз больше генов, чем хозяин, специфичен для хозяина, содержит наследуемые компоненты, может быть изменен диетой, хирургическим вмешательством или антибиотиками. , а в его отсутствие затрагиваются почти все аспекты физиологии хозяина.Хотя это может показаться надуманным, это нынешняя ситуация, в которой мы находимся. Теперь мы понимаем, что человеческая микробиота – это недооцененная система, которая вносит значительный вклад в биологию и развитие человека. Более того, есть убедительные доказательства того, что у людей совместно эволюционировала потребность в своей микробиоте.1
В последнее десятилетие, отчасти из-за наблюдательных исследований с высоким разрешением с использованием технологий секвенирования следующего поколения и профилирования метаболитов (см. Вставку 1), микробиота кишечника стал ассоциироваться с укреплением здоровья и инициированием или поддержанием различных желудочно-кишечных и не-желудочно-кишечных заболеваний.Вступая в постметагеномную эру, нам необходимо отойти от простых наблюдений, чтобы определить, что является просто корреляциями, а что – причинными связями, и сосредоточить усилия и ресурсы на последних. Эта постметагеномная эра начинает предоставлять новые терапевтические цели, основанные на лучшем понимании того, как микробиота взаимодействует с физиологией хозяина. В конечном итоге мы стремимся интегрировать микробиоту человека в какую-либо форму персонализированного здравоохранения и, лучше понимая ее роль, лечить болезни человека более эффективно и целенаправленно.Обладая более полным пониманием процесса болезни, мы сможем более точно разделить различные болезненные состояния и определить, является ли микробиота кишечника потенциальной терапевтической мишенью, которую мы можем модулировать для лечения конкретных заболеваний.
Box 1Краткий учебник по микробиологии (см. Также Lepage
et al ) 4Дисбиоз
Нарушение или дисбаланс в биологической системе, например, изменение типов и количества бактерий в кишечнике, которые может привести к развитию различных заболеваний, таких как ВЗК.
Инфламмасомы
Недавно обнаруженные мультибелковые комплексы, которые участвуют в широком спектре воспалительных процессов, включая запрограммированную гибель клеток (пироптоз), в ответ на распознавание микробных сигналов и сигналов опасности.
Липополисахарид (ЛПС)
Основной компонент внешней мембраны грамотрицательных бактерий; эндотоксин. Теперь он рассматривается как причина воспаления и связан с возникновением определенных заболеваний.
Липотейхоевая кислота
Основной компонент внешней мембраны грамположительных бактерий; эндотоксин. Теперь он рассматривается как причина воспаления и связан с возникновением определенных заболеваний.
Метабоном / метаболом
Профиль химических веществ в ткани или образце, например, в метабономе мочи. Этот профиль представляет собой моментальный снимок того, какие химические вещества присутствуют в образце.
Метагеномика
Метод, который позволяет нам создавать каталоги того, что могут делать бактерии, на основе имеющихся у них генов.
Микробиом
Коллекция различных микробов и их функций или генов, обнаруженных в окружающей среде обитания. Различные части тела имеют разные микробиомы, например, микробиом кожи отличается от микробиома кишечника, но все они являются частью микробиома человека.
Микробиота
Типы организмов, которые присутствуют в окружающей среде обитания, будь то бактерии, вирусы или эукариоты.
‘ Omic ’ methods
Термин, который описывает набор методов, таких как геномика, метабономика, метагеномика и т. Д., Которые мы используем для изучения взаимодействия между бактериями в кишечнике и хозяином.
Pathobiont
Комменсальный организм, который может вызывать заболевание при изменении определенных генетических условий или условий окружающей среды у хозяина.
Phenome
Набор измеримых характеристик, которые определяют человека.
Этот обзор дает столь необходимую обновленную информацию о текущем понимании микробиоты кишечника при заболеваниях желудочно-кишечного тракта и нарушениях обмена веществ, а также дает представление о том, как это может повлиять на клиническую практику. Рассмотрены доказательства профилактического и терапевтического эффекта различных способов регулирования микробиоты кишечника, таких как пробиотики, пребиотики, антибиотики и трансплантация фекальной микробиоты (FMT) (см. Вставку 2).
Вставка 2Возможные методы лечения, направленные на модуляцию микробиоты кишечника
Пробиотики : Живые микроорганизмы, которые при введении в адекватных количествах приносят пользу здоровью хозяина.107, 108 Примеры включают штаммы родов Bifidobacterium и Lactobacillus . Пробиотики могут иметь множественные взаимодействия с хозяином, 109 включая конкурентное ингибирование других микробов, влияние на барьерную функцию слизистой оболочки и взаимодействие с антигенпредставляющими дендритными клетками.72
Пребиотики: Селективно ферментированный ингредиент, который приводит к определенным изменениям в составе и / или активности микробиоты желудочно-кишечного тракта, тем самым принося пользу (я) здоровью хозяина.110 Пребиотики обычно представляют собой неперевариваемые углеводы, олигосахариды или короткие полисахариды, из которых наиболее интенсивно изучаются инулин, олигофруктоза, галактофруктоза, галактоолигосахариды и ксилоолигосахариды.
Трансплантация фекальной микробиоты: Введение кишечных бактерий от здорового донора в пациента путем переноса инфузии пробы фекалий через назогастральный зонд, назодуоденальный зонд, ректальную клизму или биопсийный канал колоноскопа.111
Текущее понимание микробиоты кишечника
За последнее десятилетие в рамках нескольких крупномасштабных проектов, например, проекта микробиома человека, исследовалась микробиота различных ниш тела, включая кожу, а также ротовую полость. вагинальные и носовые полости. 2 Хотя некоторые из них относительно легкодоступны, ЖКТ остается сложной средой для отбора проб и описания. В настоящее время большая часть исследований сосредоточена на микробиоте кишечника, поскольку именно здесь обнаруживается наибольшая плотность и количество бактерий, причем большинство данных получают из образцов фекалий и, в меньшей степени, из биопсий слизистой оболочки.Хотя получить свежие пробы фекалий относительно легко, информация, полученная на их основе, не дает полной картины кишечника. Из ряда ограниченных исследований мы знаем, что тонкий кишечник содержит совсем другое количество и состав бактерий, с гораздо более динамичным изменением по сравнению с толстой кишкой.3 Микробиота толстой кишки в значительной степени определяется эффективным разложением сложных неперевариваемых углеводов, но это тонкой кишки определяется его способностью к быстрому импорту и преобразованию относительно небольших углеводов, а также быстрой адаптацией к общей доступности питательных веществ.Хотя фекалии не являются идеальным показателем для желудочно-кишечного тракта, они дают представление о разнообразии в толстой кишке. Кроме того, большая часть данных поступает из исследований в Северной Америке и Европе и очень мало исследований в Азии, Африке или Южной Америке. Следовательно, у нас есть несколько предвзятый взгляд на микробиоту кишечника.
Столь быстрый рост интереса к микробиому также был вызван применением многоатомных технологий; мы отсылаем читателя к Lepage и др. 4 для более подробного объяснения этого (см. также вставку 1).
Что мы знаем о микробиоте кишечника?
Принимая во внимание указанные выше ограничения, желудочно-кишечный тракт часто рассматривается как система двух типов (Firmicutes и Bacteroidetes), хотя следует отметить, что представители по крайней мере 10 различных типов также могут иметь важный функциональный вклад (см. Вставку 3). . Мы также очень сосредоточены на бактериях, когда смотрим на микробиоту кишечника; только несколько работ посвящены вирусному компоненту (или вирому) и микроэукариотам (простейшим и грибам).Когда анализируется микробиота кишечника относительно больших групп людей (например, более 100), можно видеть, что соотношение Firmicutes: Bacteroidetes не одинаково у всех людей. В настоящее время мы не знаем значения нахождения на обоих концах этого континуума, тем более что большой сдвиг в относительной численности группы организмов приводит к умеренному изменению численности бактерий. Однако есть свидетельства того, что истощение одного вида, например Faecalibacterium prausnitzii, , принадлежащего типу Firmicutes, было связано с ВЗК.5 Но в научной литературе мы видим контраргументы в пользу любого участия этого вида в ВЗК.6 Это несоответствие подчеркивает нынешний уровень понимания. Мы знаем, что микробиота кишечника важна для правильного функционирования и развития хозяина, но мы не уверены, какие виды являются ключевыми и является ли функция микробиоты более важной, чем функция любого отдельного члена сообщества. Но это слишком упрощенная точка зрения. В некоторых случаях различия штаммов внутри вида могут быть различием между патогеном / патобионтом и пробиотиком: например, Escherichia coli ассоциирована с ВЗК и колоректальным раком (CRC) 7, 8, но E.coli используется в качестве пробиотика.
Вставка 3Праймер по таксономике
Для классификации бактерий мы приняли систему Линнея, которая включает иерархии, в которые помещен организм.
Например, люди классифицируются на уровне видов как Homo sapiens , которые являются представителями рода Homo , семейства Hominidae , отряда приматов, класса Mammalia, типа Chordata и, наконец, царства Eukaryota. По мере продвижения по разным таксономическим уровням, от вида к царству, все большее количество организмов становится ассоциированным друг с другом.
В жизни существует три царства: Бактерии, Археи и Эукариоты, причем большинство бактериоподобных (или прокариот) классифицируются как Бактерии и Археи. Например, кишечный комменсал и иногда патогенный вид Escherichia coli встречается в царстве бактерий; тип Proteobacteria; класс Gammaproteobacteria; отряд Enterobacteriales; семейство Enterobacteriaceae и, наконец, род Escherichia . Таким образом, когда мы ссылаемся на тип или тип, мы обычно описываем очень большие коллекции родственных организмов.
В толстом кишечнике здоровых взрослых людей двумя наиболее доминирующими типами являются Firmicutes (состоящие в основном из грамположительных клостридий) и Bacteroidetes (состоящие в основном из грамотрицательных бактерий, таких как вид Bacteroides fragilis ).
Фактически, пять типов представляют большинство бактерий, составляющих микробиоту кишечника. В толстом кишечнике каждого человека насчитывается около 160 видов9, и очень немногие из них являются общими для неродственных особей.Напротив, функции, обеспечиваемые этими видами, по-видимому, обнаруживаются в желудочно-кишечном тракте каждого человека, и это наблюдение приводит нас к выводу, что функция важнее, чем идентичность вида, обеспечивающего ее. Тем не менее, различия в микробиоте кишечника могут иметь значение, потому что они могут привести к различиям в эффективности функции. Например, хотя способность синтезировать короткоцепочечные жирные кислоты (SCFA) обнаружена у всех людей 10, их количество может варьироваться.
Диетическое регулирование микробиоты кишечника
Метаболическая активность микробиоты кишечника
Углеводная ферментация – это основная деятельность микробиоты кишечника человека, которая способствует экономии энергии и углерода в толстой кишке.Доминирующие и преобладающие виды кишечных бактерий, включая продуценты SCFA, по-видимому, играют решающую роль в начальной деградации сложных полисахаридов растительного происхождения11, сотрудничая с видами, специализирующимися на ферментации олигосахаридов (например, бифидобактерии), для высвобождения SCFA и газов, которые являются также используется в качестве источников углерода и энергии другими более специализированными бактериями (например, восстанавливающими ацетогенами, сульфатредуцирующими бактериями и метаногенами) .12 Эффективное преобразование сложных неперевариваемых пищевых углеводов в SCFA служит микробным сообществам перекрестного питания и хозяину, при этом 10% наши ежедневные потребности в энергии, обусловленные ферментацией толстой кишки.Бутират и пропионат могут регулировать физиологию кишечника и иммунную функцию, в то время как ацетат действует как субстрат для липогенеза и глюконеогенеза.13 Недавно были определены ключевые роли этих метаболитов в регуляции иммунной функции на периферии, направляя соответствующий иммунный ответ, пероральную переносимость и разрешение. воспаления, а также для регулирования воспалительного процесса в жировой ткани, главном воспалительном органе при ожирении14. В толстой кишке большая часть этого углеводного брожения происходит в проксимальном отделе толстой кишки, по крайней мере, у людей, соблюдающих диету западного стиля.По мере того как углеводы истощаются по мере того, как пищеварение перемещается в дистальном направлении, микробиота кишечника переключается на другие субстраты, особенно на белок или аминокислоты. Ферментация аминокислот, помимо выделения полезных SCFAs, производит ряд потенциально вредных соединений. Некоторые из них могут играть роль в заболеваниях кишечника, таких как рак толстой кишки или ВЗК. Исследования на животных моделях и in vitro показывают, что такие соединения, как аммиак, фенолы, p -крезол, некоторые амины и сероводород, играют важную роль в инициации или прогрессировании дырявого кишечника, воспаления, повреждения ДНК и прогрессирования рака.15 Напротив, пищевые волокна или потребление растительной пищи, по-видимому, препятствуют этому, что подчеркивает важность поддержания ферментации углеводов микробиомом кишечника.16 Признание ферментации углеводов в качестве основной деятельности микробиоты кишечника обеспечивает научную основу для рационального проектирования функциональные продукты питания, направленные на улучшение здоровья кишечника, а также на воздействие на деятельность микробиоты, связанную с системной физиологией хозяина, посредством недавно признанных осей взаимодействия между царством, таких как ось кишечник: печень, ось кишечник: мозг и ось кишечник: мозг: кожа.17
Три «П» для здоровья кишечника: пробиотики, пребиотики и полифенолы
Существует ряд диетических стратегий для изменения состава или метаболической / иммунологической активности микробиоты кишечника человека: пробиотики, пребиотики и полифенолы являются одними из самых хорошо установлено.18
Существует множество примеров положительных результатов с различными штаммами пробиотиков в отношении ряда болезненных состояний на животных моделях, однако данные о людях неоднозначны.Частично это может быть связано с плохим дизайном исследования и неправильным выбором штамма. Однако существует также постоянное непонимание самой природы пробиотиков, которые нельзя рассматривать как «класс» биоактивных веществ, поддающийся традиционным оценкам эффективности, таким как метаанализ (если не ограничивается одним штаммом), поскольку они все являются уникальными живыми организмами, и их полезные для здоровья свойства зависят от штамма. Редко когда пробиотические штаммы отбирались с учетом конкретных механизмов воздействия; это привело к противоречивым наблюдениям и нанесло ущерб репутации этой области науки.Есть несколько исключений, в первую очередь работа Джонса и др. , которые выбрали гидролизующий желчные соли штамм Lactobacillus reuteri , чтобы изучить его способность снижать уровень холестерина у людей с гиперхолестеринемией. В двух хорошо обоснованных, рандомизированных, плацебо-контролируемых и двойных слепых исследованиях они продемонстрировали, что прием этого штамма значительно снижает уровень общего холестерина и холестерина липопротеинов низкой плотности (ЛПНП). Более того, они предложили лежащий в основе новый механизм, связанный со снижением всасывания жира из кишечника19 через ядерный рецептор фарнезоидного рецептора X (FXR).20
Пребиотики представляют собой особый тип пищевых волокон, которые при ферментации опосредуют измеримые изменения в составе микробиоты кишечника, обычно увеличение относительной численности бактерий, считающихся полезными, таких как бифидобактерии или некоторые продуценты бутирата. Как и в случае с пробиотиками, несмотря на убедительные и воспроизводимые результаты исследований на животных, показывающие эффективность в профилактике или лечении многих заболеваний (например, ВЗК, СРК, рак толстой кишки, ожирение, диабет 2 типа (СД2) и сердечно-сосудистые заболевания), данные о людях остаются неоднозначными. .С пребиотиками было проведено меньше хорошо обоснованных или хорошо спланированных клинических исследований по сравнению с пробиотиками, и могут возникнуть проблемы с дозой пребиотиков. В исследованиях на людях пребиотики используются редко, если вообще используются. В исследованиях на животных показано, что пребиотик эффективен: обычно 10% от веса рациона, что у людей соответствует примерно 50 г в день.18 Однако по мере того, как мы узнаем больше об экологии кишечной микробиоты, становится все больше. Понятно, что концепция пребиотиков проникла в основную ткань микробиоты кишечника, поскольку сообщество прежде всего сахаролитических и ферментативных микробов эволюционировало, чтобы работать в партнерстве с пищеварительной системой своего хозяина, чтобы получать энергию и углерод из сложных полисахаридов растений, которые в противном случае терялись бы с фекалиями.
Полифенолы представляют собой разнообразный класс вторичных метаболитов растений, часто связанных с цветом, вкусом и защитными механизмами фруктов и овощей. Они давно изучаются как наиболее вероятный класс соединений, присутствующих в цельных растительных продуктах, способных влиять на физиологические процессы, защищающие от хронических заболеваний, связанных с диетой. Микробиота кишечника играет решающую роль в превращении пищевых полифенолов в усваиваемые биологически активные вещества, воздействуя на примерно 95% пищевых полифенолов, которые достигают толстой кишки.21 Недавние исследования показывают, что диетическое вмешательство с использованием экстрактов полифенолов, в первую очередь деалкоголизированного экстракта полифенолов красного вина и флаванолов, полученных из какао, изменяет микробиоту кишечника человека в сторону более «благоприятного для здоровья профиля» за счет увеличения относительного количества бифидобактерий и лактобацилл. Эти данные снова повышают вероятность того, что определенные функциональные продукты питания задействованы в основных экологических процессах, регулирующих структуру и функции сообщества кишечного микробиома, что способствует здоровью кишечной микробиоты и ее хозяина.22
Заболевания, связанные с ожирением, и микробиота кишечника
Начиная примерно с 2004 г., основные исследования Гордона и др. продемонстрировали потенциальную связь между микробиомом кишечника и развитием фенотипа ожирения. Увеличение относительной численности Firmicutes и пропорциональное уменьшение Bacteroidetes были связаны с микробиотой мышей с ожирением, 23 что было подтверждено в исследовании диетических вмешательств на людях, демонстрирующем, что потеря веса у лиц с ожирением (индекс массы тела, ИМТ> 30) сопровождалась увеличением относительной численности Bacteroidetes.24 Тем не менее, основываясь на большинстве исследований на людях, связанное с ожирением снижение соотношения Bacteroidetes к Firmicutes (B: F) остается спорным. 24, 25 Это, вероятно, связано с неоднородностью среди людей в отношении генотипа и образа жизни. Недавние исследования выявили, что диета, особенно жиры, является сильным модулятором микробиоты, особенно у инбредных и стандартизованных по возрасту лабораторных животных. Источники вариабельности микробиоты в основном ограничиваются используемыми экспериментальными диетами, и появляется все больше свидетельств того, что высокое потребление жиров, а не ожирение как таковое, оказывает прямое влияние на микробиоту и связанные клинические параметры.26 Однако у людей микробиом подвергается воздействию принципиально разных факторов окружающей среды у тучных и худых людей, которые выходят за рамки одного только ИМТ, включая диету26 и гормональные факторы хозяина. воспаление, гиперлипидемия, гипертония, непереносимость глюкозы и диабет отражают сложные взаимодействия этих множественных генетических, поведенческих и экологических факторов28. Наконец, точность ИМТ как индикатора ожирения ограничена; Фактически, 25% людей с ожирением могут считаться метаболически «здоровыми» (т.е. с нормальным метаболизмом липидов и глюкозы).29 Таким образом, связь микробного состава желудочно-кишечного тракта напрямую и исключительно с ожирением у людей будет оставаться сложной задачей из-за различных смешивающих факторов в гетерогенной популяции.
Эта сложность привела к переходу от лечения ожирения как единственного фенотипа к попыткам сопоставления микробных сигнатур с отдельными или множественными признаками, связанными с (развитием) метаболических синдромов, таких как СД2. Недавно было проведено два (мета) полногеномных исследования ассоциации с 345 китайцами30 и 145 европейскими женщинами.31 В обоих исследованиях созданные de novo кластеры генов на уровне метагеномного вида использовались в качестве дискриминантных маркеров, которые с помощью математического моделирования могли лучше различать пациентов и контрольную группу с более высокой специфичностью, чем аналогичный анализ, основанный либо на вариации генома человека, либо на других известных факторах риска. такие как ИМТ и окружность талии. На функциональном уровне мембранные переносчики и гены, связанные с окислительным стрессом, были обогащены микробиотой пациентов 31, в то время как биосинтез бутирата был снижен.30 Хотя в обоих исследованиях было обнаружено большое сходство в функциях, кодируемых микробными генами, наиболее дискриминантные метагеномные кластеры генов на уровне видов различались между когортами ( Akkermansia не внесла вклад в классификацию в европейской когорте, тогда как Lactobacillus не показала никакого вклада в Китайское исследование населения), что указывает на то, что диагностические биомаркеры могут быть специфичными для исследуемой популяции.
В другом метагеномном исследовании наблюдали бимодальное распределение богатства микробных генов у лиц с ожирением, разделяя людей на высокое или низкое количество генов (HGC и LGC).32 человека с HGC характеризовались более высокой распространенностью предполагаемых противовоспалительных видов, таких как F. prausnitzii , и повышенным производственным потенциалом органических кислот (включая бутират). Напротив, люди с LGC показали более высокое относительное количество потенциально провоспалительных Bacteroides spp и генов, участвующих в реакции на окислительный стресс. Примечательно, что только биохимические переменные, связанные с ожирением, такие как инсулинорезистентность, значительно коррелировали с количеством генов, тогда как вес и ИМТ – нет, что подчеркивает неадекватность ИМТ как индикатора «ожирения и связанных с ним метаболических нарушений» (OAMD).33 В сопроводительном документе показано, что вмешательство по снижению веса, вызванное диетой, значительно увеличило богатство генов у лиц с LGC, что было связано с улучшенным метаболическим статусом. привычки и структура микробиоты кишечника.31 Это также предполагает, что постоянное регулирование микробиоты может быть достигнуто с помощью диеты.
Большинство исследований с участием микробиома были исключительно коррелятивными, но недавно была установлена причинная связь между гомеостазом глюкозы в организме хозяина и микробным составом кишечника.FMT от худых доноров к людям с метаболическим синдромом значительно повысил их чувствительность к инсулину.33 Трансплантат вызывал увеличение концентрации бутирата в фекалиях, микробного разнообразия и относительного количества бактерий, связанных с продуцирующим бутират Roseburia Кишечник .
Вместе эти исследования дают совокупность доказательств того, что микробиом играет роль в энергетическом гомеостазе хозяина, а также в установлении и развитии OAMD, хотя точные механизмы остаются неясными.Предыдущие противоречивые данные могут быть отнесены к разным подходам, 35 а также неоднородности генотипа, образа жизни и диеты людей в сочетании со сложной этиологией OAMD. Тем не менее, вырисовывается более четкая картина. Считается, что кишечник людей с ОАМД содержит микробиом, связанный с воспалением, с более низким потенциалом производства бутирата и уменьшенным разнообразием бактерий и / или богатством генов. Хотя основной причиной OAMD является избыточное потребление калорий по сравнению с расходами, различия в микробной экологии кишечника могут быть важным медиатором и новой терапевтической целью или биомаркером для прогнозирования метаболической дисфункции / ожирения в более позднем возрасте.
Заболевание печени и микробиота кишечника
Печень получает 70% своего кровоснабжения из кишечника через воротную вену, поэтому она постоянно подвергается воздействию кишечных факторов, включая бактериальные компоненты, эндотоксины (липополисахарид, флагеллин и липотейхоевую кислоту) и пептидогликаны. Множественные клетки печени, включая клетки Купфера, синусоидальные клетки, билиарные эпителиальные клетки и гепатоциты, экспрессируют рецепторы врожденного иммунитета, известные как рецепторы распознавания патогенов, которые реагируют на постоянный приток этих продуктов микробного происхождения из кишечника.36 В настоящее время признано, что микробиота кишечника и хронические заболевания печени тесно связаны. Характеризуя природу дисбактериоза кишечника, целостность кишечного барьера и механизмы иммунного ответа печени на факторы, происходящие из кишечника, потенциально имеют отношение к разработке новых методов лечения хронических заболеваний печени.37 Более того, область передачи сигналов желчной кислоты открыла новые горизонты. концепция оси кишечник: печень как активная и строго регулируемая.38
Неалкогольная жировая болезнь печени
Патофизиология НАЖБП является многофакторной, с сильным генетическим и экологическим вкладом.Последние данные показывают, что дисбактериоз кишечной микробиоты может приводить к развитию связанной с ожирением неалкогольной жировой болезни печени (НАЖБП), а у пациентов с НАЖБП наблюдается избыточный бактериальный рост в тонком кишечнике и повышенная кишечная проницаемость39. стеатогепатит (НАСГ) и избыточный бактериальный рост в тонком кишечнике наблюдались у людей после кишечного обхода и, что интересно, регрессия стеатоза печени после лечения метронидазолом, предполагая возможную роль кишечных бактерий в НАЖБП.40 Нарушение инфламмасом мышей (см. Вставку 1) связано с увеличением Bacteroidetes и уменьшением Firmicutes и приводит к тяжелому стеатозу печени и воспалению.41 Анализ фекальной микробиоты пациентов с НАЖБП и НАСГ дал разные результаты из-за значительного различия демографические данные пациента, тяжесть заболевания печени и методология. Более низкая доля Ruminococcaceae была отмечена у пациентов с НАСГ по сравнению со здоровыми предметами42, а исследование, охарактеризовавшее кишечную микробиоту детей с НАСГ, ожирением и здоровыми людьми контрольной группы, показало, что у пациентов с НАСГ доля Escherichia была выше по сравнению с другими группами. .43 Пациенты с НАЖБП также имеют повышенную проницаемость кишечника, что позволяет предположить, что перенос бактерий или продуктов микробного происхождения в портальный кровоток вносит свой вклад в патогенез.39
Алкогольная болезнь печени
Поскольку не у всех алкоголиков развивается повреждение печени, оказывается, что хроническое злоупотребление алкоголем является необходимо, но недостаточно, чтобы вызвать дисфункцию печени. Многочисленные исследования на животных моделях и наблюдательные исследования показывают, что кишечные бактериальные продукты, такие как эндотоксин, могут опосредовать воспаление и действовать как кофакторы для развития связанного с алкоголем поражения печени.44 Уровни эндотоксина в сыворотке повышены у людей и крыс с алкогольным заболеванием печени, а моноциты алкоголиков ориентированы на выработку цитокинов после воздействия эндотоксина. Алкоголь вызывает избыточный бактериальный рост в кишечнике у людей, и количество бактерий было значительно выше в аспирате тощей кишки от пациентов с хроническим злоупотреблением алкоголем по сравнению с контрольной группой, с аналогичными результатами у пациентов с алкогольным циррозом.45 Степень избыточного роста коррелирует с тяжестью цирроза.Мыши-модели Tsukamoto-French, получавшие алкоголь внутрижелудочно в течение 3 недель, показали повышенную относительную численность Bacteroidetes и Akkermansia spp и снижение Lactobacillus , Leuconostoc , Lactococcus и a Pediococcus, в то время как контрольные мыши имели преобладание. Firmicutes.46 У пациентов с алкогольной болезнью печени также наблюдается повышенная проницаемость кишечника, что позволяет бактериям и бактериальным продуктам перемещаться в печень.47
Аутоиммунные заболевания печени
К ним относятся первичный склерозирующий холангит (ПСХ), первичный билиарный цирроз (ПБЦ) и аутоиммунный гепатит, и они составляют не менее 5% всех хронических заболеваний печени. Они считаются аутоиммунными состояниями, но ожидается, что микробиота кишечника имеет отношение к патогенезу, особенно потому, что (A) PSC связан с ВЗК и аберрантным отслеживанием лимфоцитов, и (B) значимые оси кишечника: печени существуют посредством передачи сигналов желчной кислоты. У пациентов с ПСХ развивается отдельная форма ВЗК, поэтому понимание взаимосвязи между ПСХ и ВЗК имеет важное значение для раскрытия патогенеза ПСХ, который остается в значительной степени неопределенным.Однако вполне вероятно, что у генетически предрасположенных людей кишечные бактерии могут вызывать аномальный или неадекватный иммунный ответ, который в конечном итоге приводит к повреждению печени и фиброзу. Недавно было показано, что пациенты с ПСХ имеют отчетливую кишечную микробиоту. Анализ микробиоты биопсии толстой кишки показал, что у пациентов с ПСХ-ВЗК и ВЗК наблюдалось снижение численности Prevotella и Roseburia (продуцент бутирата) по сравнению с контрольной группой.48, 49 У пациентов с ПСХ-ВЗК практически отсутствовали. Bacteroides по сравнению с пациентами с ВЗК и контрольными пациентами, а также значительное увеличение у Escherichia , Lachnospiraceae и Megasphaera .Рандомизированные контролируемые испытания (РКИ) по изучению антибиотикотерапии при ПСХ показали, что они превосходят их в улучшении биохимических суррогатных маркеров и гистологических параметров активности заболевания по сравнению с одной урсодезоксихолевой кислотой.50 В недавней серии проспективных педиатрических случаев было показано, что пероральный ванкомицин нормализует или значительно улучшают функциональные тесты печени.51 Существуют доказательства того, что целостность слизистой оболочки нарушена у пациентов с ПСХ, что подтверждает традиционную гипотезу дырявого кишечника о том, что продукты микробного происхождения перемещаются в печень и желчевыводящие пути, чтобы вызвать воспалительную реакцию.52 Также было продемонстрировано, что плотные соединения гепатоцитов были нарушены у пациентов с ПСХ, а введение непатогенной E. coli в портальную циркуляцию вызывало портальный фиброз на животных моделях.53 Эти данные в совокупности предполагают, что бактериальные антигены перемещаются через протекающую и возможно воспаление стенки кишечника в портальную и билиарную системы, чтобы вызвать аномальный иммунный ответ и внести свой вклад в патогенез ПСХ.
ПБХ – хроническое холестатическое заболевание печени с неясной этиологией.Обычно считается, что это аутоиммунное заболевание, вызванное факторами окружающей среды у людей с генетической предрасположенностью. До сих пор не проводилось исследований, непосредственно характеризующих микробиоту кишечника у пациентов, но молекулярная мимикрия была предложена в качестве предлагаемого механизма развития аутоиммунитета при ПБЦ, когда сывороточные антитела пациентов перекрестно реагируют с консервативным бактериальным компонентом комплекса пируватдегидрогеназы E2 ( PDC-E2) гомологов видов E. coli , Novosphingobium aromaticivorans, Mycobacterium и Lactobacillus .Следовательно, было высказано предположение, что эти бактерии (возможного происхождения из ЖКТ) могут инициировать молекулярную мимикрию и развитие ПБЦ у генетически восприимчивых хозяев.54
Модуляция микробиоты как средство лечения заболеваний печени за счет уменьшения бактериальной транслокации и воспаления печени.55 Недавний метаанализ показал, что пробиотики могут снижать аминотрансферазы печени, общий холестерин, фактор некроза опухоли α и улучшать инсулинорезистентность у пациентов с НАЖБП.56 Недавнее исследование пациентов с циррозом и асцитом показало, что пробиотик VSL # 3 значительно снижает портальную гипертензию. 57 В другом исследовании оценивалась роль FMT в модулировании заболевания печени путем передачи фенотипа НАЖБП от мышей со стеатозом печени мышам без микробов. .58 Остается потребность в подробных описательных и интервенционных исследованиях, сфокусированных на разнообразии бактерий и механизмах, связывающих дисбактериоз кишечника с воспалительным, метаболическим и аутоиммунным / билиарным поражением печени.
ВЗК и микробиота кишечника
Ранние исследования участия бактерий в патогенезе ВЗК были сосредоточены на выявлении потенциального виновника, который может инициировать воспалительный каскад, типичный для ВЗК.Было предложено множество организмов: Mycobacterium avium subsp paratuberculosis и ряд протеобактерий, включая энтерогепатические Helicobacter , не jejuni / coli Campylobacter и адгезивные и инвазивные E. coli . Акцент недавно сместился с осознанием того, что микробиота кишечника в целом изменяется при ВЗК. Концепция измененной микробиоты кишечника или дисбактериоза, возможно, является наиболее значительным событием в исследованиях ВЗК за последнее десятилетие.Окончательное изменение нормальной микробиоты кишечника с нарушением мутуализма между хозяином и микробами, вероятно, является определяющим событием в развитии ВЗК.59
Об изменениях микробиоты кишечника неоднократно сообщалось у пациентов с ВЗК, причем определенные изменения явно связаны с болезнью Крона. Болезнь (БК) или ЯК: наиболее устойчивым изменением является снижение количества Firmicutes.60 Это уравновешивается сообщениями о повышенных уровнях представителей типа Bacteroidetes 61, хотя также сообщалось о снижении количества Bacteroidetes.62 Есть предположение, что может произойти пространственная реорганизация видов Bacteroides у пациентов с ВЗК, при этом Bacteroides fragilis отвечает за большую долю бактериальной массы у пациентов с ВЗК по сравнению с контрольной группой.63
Уменьшение количества бактерий. Вид Firmicutes F. prausnitzii был хорошо задокументирован у пациентов с CD, особенно с подвздошной CD, хотя увеличение F. prausnitzii было показано в педиатрической когорте, что свидетельствует о более динамичной роли вида, который заслуживает дальнейшее изучение.64 Другие исследования также продемонстрировали снижение разнообразия Firmicutes, при этом у пациентов с ВЗК выявляется меньшее количество составляющих видов по сравнению с контролем.65 Изменения в двух доминирующих типах, Firmicutes и Bacteroidetes, сочетаются с увеличением численности представителей типа Proteobacteria. , которые все чаще обнаруживают ключевую роль в ВЗК.66 Исследования показали сдвиг в сторону увеличения количества видов, принадлежащих к этому типу, предполагая роль агрессора в инициации хронического воспаления у пациентов с ВЗК.67 Более конкретно, повышенное количество E. coli, включая патогенные варианты, было зарегистрировано в подвздошной CD.68 Метагеном IBD содержит на 25% меньше генов, чем здоровый кишечник, с метапротеомными исследованиями, показывающими коррелятивное снижение белков и функциональных путей. 69 В частности, было показано, что БК подвздошной кишки связана с изменениями бактериального углеводного метаболизма и взаимодействия бактерий-хозяин, а также с ферментами, секретируемыми хозяином человека.69 от 231 субъекта и еще 11 метагеномов.70 Это исследование выявило обогащение микробных путей толерантности к окислительному стрессу, уклонения от иммунитета и поглощения метаболитов хозяином, с соответствующим истощением биосинтеза SCFA и типичного кишечного метаболизма углеводов и процессов биосинтеза аминокислот. Интересно, что аналогичные микробные метаболические сдвиги наблюдались при других воспалительных состояниях, таких как T2D, 30, что указывает на общий микробный ответ ядра кишечника на хроническое воспаление и активацию иммунной системы. Кроме того, недавняя работа предполагает роль вирусов в ВЗК со значительным распространением бактериофага Caudovirales у пациентов.71
Модуляция микробиоты как терапия при ВЗК
В нескольких клинических испытаниях изучали подход к модуляции микробиоты у пациентов с ВЗК, многие из которых предшествовали эре «омиков». Такие испытания служат «доказательством концепции» важности роли кишечной микробиоты в ВЗК, но объединение индивидуальных подходов со сложной многофакторной природой ВЗК остается проблемой, особенно в отношении различных фенотипов и генотипов заболевания и различные «фазы» болезненного процесса: например, профилактика, поддержание ремиссии, лечение рецидивов.
Язвенный колит
Что касается исследования пробиотиков, одним из крупнейших клинических испытаний ВЗК было использование E. coli Nissle 1917 для поддержания ремиссии при ЯК. Пациенты (n = 327) были отнесены к двойному слепому испытанию с двойной фиксацией для получения либо пробиотика, либо месалазина.72 Оба лечения были сочтены эквивалентными в отношении рецидива. E. coli Nissle в настоящее время считается эффективной альтернативой 5-аминосалицилату для поддержания ремиссии при ЯК.73 Есть два опубликованных клинических испытания многопрофильного пробиотика VSL # 3 в условиях легких и умеренных обострений ЯК.74 Оба демонстрируют, что высокие дозы улучшают показатели активности заболевания, но являются ли такие улучшения клинически значимыми для пациентов, особенно по сравнению с другие варианты лечения, еще предстоит уточнить. Альтернативный подход – трансплантация всей микробиоты кишечника от здорового донора: FMT. При ВЗК недавний систематический обзор и метаанализ показали, что из девяти когортных исследований, восьми тематических исследований и одного рандомизированного контролируемого исследования в целом 45% (54/119) достигли клинической ремиссии.Когда были проанализированы только когортные исследования, в 36% была достигнута клиническая ремиссия. 75 После этого метаанализа два рандомизированных контролируемых исследования в ЯК показали противоречивые результаты. Одно испытание, в котором две фекальные трансплантаты были сделаны через верхний отдел желудочно-кишечного тракта, не показало различий в клинической или эндоскопической ремиссии между группой фекальных трансплантатов и контрольной группой (с аутологичным стулом) .76 Второе испытание, в котором пациенты с ЯК были рандомизированные на еженедельные фекальные клизмы от здоровых доноров или клизмы с плацебо в течение 6 недель, продемонстрировали ремиссию у большего процента пациентов, получавших FMT, по сравнению с контрольной группой (получавшей водную клизму).77 Остались без ответа вопросы относительно способа доставки, частоты доставки и оптимальных характеристик донора / хозяина.
Болезнь Крона
Антибиотики демонстрируют эффективность в определенных группах пациентов с CD, но некоторые антибиотики могут быть вредными, показывая сложное взаимодействие между хозяином и микробиотой. У пациентов, которым была сделана резекция по поводу БК, снижается частота эндоскопических и клинических рецидивов, когда метронидазол или орнидазол используются в качестве профилактической терапии.78 В нескольких исследованиях оценивалась конкретная роль антимикобактериальной терапии в лечении БК, но общие результаты неутешительны. Нет клинически значимой доказательной базы для использования пробиотиков при БК и с точки зрения пребиотиков, хотя открытое испытание фруктоолигосахарида при БК показало многообещающие, 79 и последующее рандомизированное плацебо-контролируемое исследование фруктоолигосахарида не подтвердило любая клиническая польза. 80
Паучит
Восстановительная проктоколэктомия с анастомозом подвздошно-мешочек анального канала – операция выбора для пациентов с ЯК, требующих хирургического вмешательства.Паучит встречается у 50% пациентов, хотя это серьезная клиническая проблема только для 10%. Антибиотики используются в качестве первичной терапии; если один антибиотик не помогает, можно использовать двойные антибиотики, применяемые в течение более длительных периодов времени, или антибиотики, адаптированные к микробиоте отдельного пациента. VSL # 3 снижал риск начала заболевания и поддерживал ремиссию, вызванную антибиотиками при поучите.81 Метаанализ показал, что VSL # 3 значительно снижает частоту клинических рецидивов для поддержания ремиссии у пациентов с поучитом.82
CRC и микробиота кишечника
Многие исследования микробиома были сосредоточены на раковых заболеваниях, связанных с колитом83, или на доклинических моделях грызунов.84 Несмотря на это, появляется все больше свидетельств того, что микробиота толстой кишки играет важную роль в причине спорадических CRC85. временная стабильность и повышенное разнообразие были продемонстрированы для фекальной микробиоты субъектов с установленным CRC и полипозом, 86 а теперь метагеномные и метатранскриптомные исследования выявили индивидуализированный онкогенный микробиом и конкретные виды бактерий, которые выборочно колонизируют участки опухоли и опухоли.87
Для объяснения этих наблюдений появилось несколько конкурирующих теорий микробной регуляции CRC (рис. 1). Гипотеза краеугольного патогена88 и гипотеза альфа-клопа утверждают, что некоторые члены микробиоты с низким содержанием (например, энтеротоксигенный B. fragilis ) обладают уникальными признаками вирулентности, которые являются проонкогенными и модифицируют микробиом и, в свою очередь, способствуют иммунному иммунитету слизистых оболочек. ответы и изменения эпителиальных клеток толстой кишки.89 Tjalsma et al 90 также предложили модель «водитель-пассажир» для CRC: первый удар местных кишечных бактерий («бактериальных драйверов»), которые вызывают повреждение ДНК, которое способствует развитию CRC. инициация.Во-вторых, онкогенез вызывает изменения кишечной ниши, которые способствуют размножению условно-патогенных бактерий («бактериальных пассажиров»). Например, CRC имеют повышенное обогащение условно-патогенными микроорганизмами и полимикробными грамотрицательными анаэробными бактериями91, но пока не ясно, получают ли эти условно-патогенные микроорганизмы только пользу от микросреды CRC или влияют на прогрессирование заболевания. Однако полипы толстой кишки демонстрируют более высокое бактериальное разнообразие и богатство по сравнению с контрольными пациентами, с более высокой численностью Proteobacteria слизистой оболочки и более низкой численностью Bacteroidetes.92 Это частично может быть объяснено защитными стратегиями слизистой оболочки, разработанными для управления комменсальной микробиотой. Например, экспрессия α-дефенсина значительно увеличивается в аденомах, что приводит к повышенной антибактериальной активности по сравнению с нормальной слизистой.93
Рисунок 1Предлагаемые механизмы микробиома кишечника при этиологии рака толстой кишки.
В настоящее время в исследованиях на людях задействовано небольшое количество пациентов, что свидетельствует о неоднородности выборки, ограниченном фенотипировании опухолей и онкологических данных.Несмотря на это, небольшое количество специфических патобионтов в настоящее время связано с аденомами и CRC, включая Streptococcus gallolyticus , 94 Enterococcus faecalis 95 и B. fragilis. 84 E. coli также сверхэкспрессируется на слизистой оболочке CRC; он экспрессирует гены, которые придают свойства, относящиеся к онкологической трансформации, включая транслокацию М-клеток, ангиогенез и генотоксичность.96 Обогащение Fusobacterium nucleatum также было идентифицировано в аденоме по сравнению с прилегающей нормальной тканью, и его больше в стуле от CRC и случаев аденомы, чем в здоровых контролирует. F. nucleatum fadA, уникальный адгезин, позволяет ему прилипать к эпителиальным клеткам человека и вторгаться в них, вызывая воспалительный ответ97 и стимулируя пролиферацию клеток.98 Новые механизмы от ранее несвязанных бактерий также описываются для объяснения того, как бактериальные белки нацелены на пролиферирующие стволовые клетки-предшественники. Например, было показано, что AvrA, патогенный продукт Salmonella , активирует сигналы β-катенина и усиливает онкогенез толстой кишки.99
Работа также была сосредоточена на метаболической функции микробиома кишечника и взаимодействиях микробиома с пищей в этиологии CRC.Вполне вероятно, что для этого решающее значение имеет метаболизм клетчатки. Метагеномные анализы неизменно выявляли снижение продуцентов бутирата у пациентов с CRC100, что было воспроизведено на животных.101 Микробиом также играет важную роль в метаболизме сульфата посредством ассимиляционного восстановления сульфата с образованием цистеина и метионина и диссимиляции. сульфатное восстановление с образованием сероводорода (H 2 S). H 2 S, вероятно, способствует развитию CRC, поскольку детоксикация H 2 S в толстой кишке также снижается у пациентов с CRC; он также вызывает гиперпролиферацию слизистой оболочки толстой кишки.102 Существуют также доказательства того, что различия в генотипе хозяина, которые влияют на углеводный ландшафт дистального отдела кишечника, взаимодействуют с диетой, изменяя состав и функцию резидентных микробов в зависимости от диеты.103 Следовательно, возможно, что пациенты генетически предрасположены к CRC имеют модифицированный метаболически активный микробиом, который определяется их генами, их семейным окружением и диетическими привычками. Есть и другие свидетельства глобальных исследований риска рака, что микробиом играет важную роль в риске рака.
У афроамериканцев в толстой кишке преобладают Bacteroides , тогда как у африканцев Prevotella более многочисленны. 104 Афроамериканцы, которые подвержены высокому риску CRC, могли развить CRC-микробиоту, сформированную диетическими привычками и воздействием окружающей среды. Критически важно, что экспрессия Ki67 слизистой оболочки (биомаркер риска рака) может уменьшаться или увеличиваться в течение 2 недель либо диетического вмешательства с высоким содержанием клетчатки (> 50 г / день) у афроамериканцев, либо западного питания с высоким содержанием жиров и белков с низким содержанием клетчатки у африканцев. .Это краткосрочное вмешательство приводит к реципрокным изменениям в сетевых структурах совместного возникновения микробиома просвета, которые подавляют межиндивидуальные различия в экспрессии микробных генов. В частности, диета на основе животных увеличивает количество устойчивых к желчи микроорганизмов ( Alistipes , Bilophila и Bacteroides ) и снижает уровни Firmicutes, которые метаболизируют полисахариды пищевых растений ( Roseburia , Eubacterium и Eubacterium. Ruminococcus bromii ).105, 106
Выводы
За последнее десятилетие интерес к микробиому человека значительно возрос. Существенным фактором стало осознание того, что комменсальные микроорганизмы, составляющие микробиоту человека, не просто пассажиры в хозяине, но также могут управлять некоторыми функциями хозяина. У стерильных грызунов мы видим драматическое влияние, которое удаление микробиоты оказывает почти на все аспекты способности хозяина нормально функционировать. В этом обзоре выделены некоторые ключевые области заболеваний, в которых микробиота и ее микробиом, как считается, играют не только взаимосвязанную, но и ключевую модулирующую роль (таблица 1).Лучше понимая механизмы и вклад микробиоты в эти заболевания, мы надеемся разработать новые терапевтические средства и стратегии для модуляции микробиоты для лечения или предотвращения болезни. Кроме того, в некоторых случаях можно использовать микробиом для обнаружения заболеваний, связанных с кишечником, до того, как это удастся с помощью традиционной диагностики. В будущем мы надеемся использовать эту информацию для более точной стратификации пациентов и для более эффективного лечения. Ряд доказательств также указывает на то, что микробиота кишечника является фактором окружающей среды в метаболизме лекарств, например, инактивация сердечного лекарственного препарата дигоксина Eggerthella lenta в кишечнике.Таким образом, если мы хотим реализовать видение персонализированной революции в области здравоохранения, мы должны изучить, как микробиом согласуется с этим понятием.
Таблица 1Ключевые выводы о влиянии микробиоты кишечника на заболевания ЖКТ и печени
Благодарности
Этот обзор был заказан группой экспертов по кишечной микробиоте для здоровья Британского общества гастроэнтерологов.
Нормализация микробиоты у пациентов после лечения поражений толстой кишки | Микробиом
Сигель Р.Л., Миллер К.Д., Джемаль А.Статистика рака, 2016. CA: Cancer J Clin. 2016; 66: 7–30.
Google Scholar
Хаггар Ф.А., Боуши Р.П. Эпидемиология колоректального рака: заболеваемость, смертность, выживаемость и факторы риска. Clin Colon Rectal Surg. 2009; 22: 191–7.
Артикул PubMed PubMed Central Google Scholar
Хеллингер, Мэриленд, Сантьяго, Калифорния. Повторная операция по поводу рецидива колоректального рака.Clin Colon Rectal Surg. 2006; 19: 228–36.
Артикул PubMed PubMed Central Google Scholar
Ryuk JP, Choi G-S, Park JS, Kim HJ, Park SY, Yoon GS, Jun SH, Kwon YC. Факторы прогнозирования и прогноз рецидива колоректального рака в течение 2 лет после лечебной резекции. Ann Surg Treat Res. 2014; 86: 143–51.
Артикул PubMed PubMed Central Google Scholar
Howlader N, Noone AM, Krapcho M, Miller D, Bishop K, Kosary CL, Yu M, Ruhl J, Tatalovich Z, Mariotto A, Lewis DR, Chen HS, Feuer EJ, Cronin KA, (ред.) .Обзор статистики рака SEER, 1975-2014, Национальный институт рака. Bethesda, MD. https://seer.cancer.gov/csr/1975_2014/.
Goodwin AC, Destefano Shields CE, Wu S, Huso DL, Wu X, Murray-Stewart TR, Hacker-Prietz A, Rabizadeh S, Woster PM, Sears CL, Casero RA. Катаболизм полиаминов способствует индуцированному энтеротоксигенным Bacteroides fragilis онкогенезу толстой кишки. Proc Natl Acad Sci USA. 2011; 108: 15354–9.
CAS Статья PubMed PubMed Central Google Scholar
Abed J, Emgård JEM, Zamir G, Faroja M, Almogy G, Grenov A, Sol A, Naor R, Pikarsky E, Atlan KA, Mellul A, Chaushu S, Manson AL, Earl AM, Ou N, Бреннан CA, Гарретт WS, Бахрах Г.Fap2 опосредует обогащение колоректальной аденокарциномы Fusobacterium nucleatum путем связывания с экспрессируемым опухолью Gal-GalNAc. Клеточный микроб-хозяин. 2016; 20: 215–25.
CAS Статья PubMed PubMed Central Google Scholar
Артур JC, Gharaibeh RZ, Mühlbauer M, Perez-Chanona E, Uronis JM, McCafferty J, Fodor AA, Jobin C. Геномный анализ микробов показывает важную роль воспаления в вызванном бактериями колоректальном раке.Nature Commun. 2014; 5: 4724.
CAS Статья Google Scholar
Kostic AD, Chun E, Robertson L, Glickman JN, Gallini CA, Michaud M, Clancy TE, Chung DC, Lochhead P, Hold GL, El-Omar EM, Brenner D, Fuchs CS, Meyerson M, Garrett WS. Fusobacterium nucleatum усиливает онкогенез кишечника и модулирует иммунное к опухоли микроокружение. Клеточный микроб-хозяин. 2013; 14: 207–15.
CAS Статья PubMed PubMed Central Google Scholar
Wu S, Rhee K-J, Albesiano E, Rabizadeh S, Wu X, Yen H-R, Huso DL, Brancati FL, Wick E, McAllister F, Housseau F, Pardoll DM, Sears CL.Комменсал толстой кишки человека способствует онкогенезу толстой кишки за счет активации Т-хелперных ответов Т-клеток 17-го типа. Nature Med. 2009; 15: 1016–22.
CAS Статья PubMed PubMed Central Google Scholar
Zackular JP, Baxter NT, Chen GY, Schloss PD. Манипуляции с микробиотой кишечника выявляют роль в онкогенезе толстой кишки. мСфера. 2016; 1: 1–12.
Артикул Google Scholar
Zackular JP, Baxter NT, Iverson KD, Sadler WD, Petrosino JF, Chen GY, Schloss PD.Микробиом кишечника модулирует онкогенез толстой кишки. mBio. 2013; 4: e00692—00613.
Артикул Google Scholar
Baxter NT, Zackular JP, Chen GY, Schloss PD. Структура микробиома кишечника после колонизации человеческими фекалиями определяет опухолевую нагрузку на толстую кишку. Микробиом. 2014; 2:20.
Артикул PubMed PubMed Central Google Scholar
Флинн К.Дж., Baxter NT, Schloss PD.Метаболическая и общественная синергия оральных бактерий при колоректальном раке. мСфера. 2016; 1: 1–6.
Артикул Google Scholar
Ван Т., Цай Г, Цю Й, Фей Н, Чжан М., Панг Х, Цзя В., Цай С., Чжао Л. Структурная сегрегация кишечной микробиоты между пациентами с колоректальным раком и здоровыми добровольцами. ISME J. 2012; 6: 320–9.
CAS Статья PubMed Google Scholar
Chen H-M, Yu Y-N, Wang J-L, Lin Y-W, Kong X, Yang C-Q, Yang L, Liu Z-J, Yuan Y-Z, Liu F, Wu J-X, Zhong L, Fang D-C, Zou W, Fang J-Y.Снижение потребления пищевых волокон и структурные изменения микробиоты кишечника у пациентов с прогрессирующей колоректальной аденомой. Am J Clin Nutr. 2013; 97: 1044–52.
CAS Статья PubMed Google Scholar
Chen W, Liu F, Ling Z, Tong X, Xiang C. Человеческая микробиота, связанная с просветом кишечника и слизистой оболочкой, у пациентов с колоректальным раком. PloS One. 2012; e39743: 7.
Google Scholar
Шен XJ, Rawls JF, Randall T., Burcal L, Mpande CN, Jenkins N, Jovov B., Abdo Z, Sandler RS, Keku TO.Молекулярная характеристика бактерий, прикрепленных к слизистой оболочке, и ассоциации с колоректальными аденомами. Кишечные микробы. 2010; 1: 138–47.
Артикул PubMed PubMed Central Google Scholar
Kostic AD, Gevers D, Pedamallu CS, Michaud M, Duke F, Earl AM, Ojesina AI, Jung J, Bass AJ, Tabernero J, Baselga J, Liu C, Shivdasani RA, Ogino S, Birren BW, Huttenhower C, Garrett WS, Meyerson M. Геномный анализ выявляет ассоциацию Fusobacterium с колоректальной карциномой.Genome Res. 2012; 22: 292–8.
CAS Статья PubMed PubMed Central Google Scholar
Фэн Кью, Лян С, Цзя Х, Штадлмайр А, Тан Л, Лан З, Чжан Д, Ся Х, Сюй Х, Цзе З, Су Л, Ли Х, Ли Х, Ли Дж, Сяо Л, Huber-Schönauer U, Niederseer D, Xu X, Al-Aama JY, Yang H, Wang J, Kristiansen K, Arumugam M, Tilg H, Datz C, Wang J. Развитие микробиома кишечника вдоль последовательности колоректальной аденомы-карциномы. Nat Commun. 2015; 6: 6528.
CAS Статья PubMed Google Scholar
Dejea CM, Wick EC, Hechenbleikner EM, White JR, Mark Welch JL, Rossetti BJ, Peterson SN, Snesrud EC, Borisy GG, Lazarev M, Stein E, Vadivelu J, Roslani AC, Malik AA, Wanyiri JW , Goh KL, Thevambiga I, Fu K, Wan F, Llosa N, Housseau F, Romans K, Wu X, McAllister FM, Wu S, Vogelstein B, Kinzler KW, Pardoll DM, Sears CL. Организация микробиоты – отличительная черта проксимального колоректального рака.Proc Natl Acad Sci USA. 2014; 111: 18321–6.
CAS Статья PubMed PubMed Central Google Scholar
Мима К., Сукава Ю., Нишихара Р., Цянь З.Р., Ямаути М., Инамура К., Ким С.А., Масуда А., Новак Дж. А., Ношо К., Костич А.Д., Гианнакис М., Ватанабэ Х., Буллман С., Милнер Д.А., Harris CC, Giovannucci E, Garraway LA, Freeman GJ, Dranoff G, Chan AT, Garrett WS, Huttenhower C, Fuchs CS, Ogino S. Fusobacterium nucleatum и Т-клетки в колоректальной карциноме.JAMA Oncol. 2015; 1: 653–61.
Артикул PubMed PubMed Central Google Scholar
Артур Дж. К., Перес-Чанона Е., Мюльбауэр М., Томкович С., Уронис Дж. М., Фан Т. Дж., Кэмпбелл Б. Дж., Абуджамель Т., Доган Б., Роджерс А. Б., Родс Дж. М., Стинци А., Симпсон К. В., Хансен Дж. Дж., Кек TO, Fodor AA, Jobin C. Воспаление кишечника нацелено на вызывающую рак активность микробиоты. Наука (Нью-Йорк). 2012; 338: 120–3.
CAS Статья Google Scholar
Baxter NT, Ruffin MT, Rogers MAM, Schloss PD.Модель на основе микробиоты повышает чувствительность иммунохимического теста кала для выявления поражений толстой кишки. Genome Med. 2016; 8:37.
Артикул PubMed PubMed Central Google Scholar
Целлер Дж., Тэп Дж., Войт А.Ю., Сунагава С., Культима Дж. Р., Костя П. И., Амиот А., Бём Дж., Брунетти Ф., Хаберманн Н., Херког Р., Кох М., Лучиани А., Менде Д. Р., Шнайдер М. А., Schrotz-King P, Tournigand C, Tran Van Nhieu J, Yamada T, Zimmermann J, Benes V, Kloor M, Ulrich CM, Knebel Doeberitz Mvon, Sobhani I, Bork P.Возможности фекальной микробиоты для ранней диагностики колоректального рака. Mol Syst Biol. 2014; 10: 766.
Артикул PubMed PubMed Central Google Scholar
Zackular JP, Rogers MAM, Ruffin MT, Schloss PD. Микробиом кишечника человека как инструмент скрининга колоректального рака. Cancer Prev Res (Филадельфия). 2014; 7: 1112–21.
CAS Статья Google Scholar
O’Brien CL, Allison GE, Grimpen F, Pavli P.Влияние подготовки кишечника к колоноскопии на микробиоту кишечника. PloS ONE. 2013; e62815: 8.
Google Scholar
Kozich JJ, Westcott SL, Baxter NT, Highlander SK, Schloss PD. Разработка стратегии двухиндексного секвенирования и конвейера курации для анализа данных последовательности ампликонов на платформе секвенирования MiSeq Illumina. Appl Environ Microbiol. 2013; 79: 5112–20.
CAS Статья PubMed PubMed Central Google Scholar
Pruesse E, Quast C, Knittel K, Fuchs BM, Ludwig W, Peplies J, Glöckner FO, SILV A.Комплексный онлайн-ресурс для проверенных и согласованных данных о последовательностях рибосомных РНК, совместимых с ARB. Nucleic Acids Res. 2007; 35: 7188–96.
CAS Статья PubMed PubMed Central Google Scholar
Edgar RC, Haas BJ, Clemente JC, Quince C, Knight R. UCHIME улучшает чувствительность и скорость обнаружения химер. Биоинформатика. (Оксфорд, Англия). 2011; 27: 2194–200.
CAS Статья Google Scholar
Ван К., Гаррити ГМ, Тидже Дж. М., Коул Дж. Р.Наивный байесовский классификатор для быстрого отнесения последовательностей рРНК к новой бактериальной таксономии. Appl Environ Microbiol. 2007; 73: 5261–7.
CAS Статья PubMed PubMed Central Google Scholar
Schloss PD, Westcott SL. Оценка и совершенствование методов, используемых в операционных подходах на основе таксономических единиц для анализа последовательности гена 16S рРНК. Appl Environ Microbiol. 2011; 77: 3219–26.
CAS Статья PubMed PubMed Central Google Scholar
Брейман Л.Случайные леса. Mach Learn. 2001; 45: 5–32.
Артикул Google Scholar
Андерсон MJ, Уолш DCI. ПЕРМАНОВА, ANOSIM и тест Мантеля перед лицом неоднородных дисперсий: какую нулевую гипотезу вы проверяете? Ecol Monogr. 2013; 83: 557–74.
Артикул Google Scholar
Бенджамини Ю., Хохберг Ю. Контроль уровня ложного обнаружения: практичный и эффективный подход к множественному тестированию.J Royal Stat Soc Ser B Methodol. 1995; 57: 289–300.
Google Scholar
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie.Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie.Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
.