Кишечная палочка виды: Все о кишечной палочке | Domestos
Все о кишечной палочке | Domestos
Причины передачи кишечной палочки, причины и каналы ее распространения, а также методы профилактики.
- На главную
- Здоровье и Гигиена
- Все о кишечной палочке
Кишечная палочка – это бактерия, которая может причинить вред вашему здоровью. Если вы узнаете о способах уничтожения и профилактики кишечной палочки, вы сможете снизить риск заражения и не допустить ее распространения.
Мы поможем вам разобраться с такими вопросами, как «кишечная палочка: причины», «как передается кишечная палочка?» и расскажем, каким образом Domestos может помочь убить вредоносные бактерии, живущие в вашем туалете, и предотвратить распространение заболевания. Давайте рассмотрим подробнее, что представляет собой эта бактерия.
Кишечная палочка: симптомы
Кишечная палочка — это палочковидная бактерия, которая обитает в кишечнике человека и имеет множество разновидностей. Большинство из них — это безвредные микроорганизмы, но есть и такие, которые влекут за собой серьезные проблемы со здоровьем. Кишечная палочка возникает из-за несоблюдения гигиены и чистоты, поэтому использование хлоросодержащих моющих средств, таких как Domestos, необходимо.
Кишечная палочка возникает из-за несоблюдения гигиены и чистоты, поэтому использование хлоросодержащих моющих средств, таких как Domestos, необходимо.
Перед тем, как ответить на вопросы «откуда берется кишечная палочка?» и «как передается кишечная палочка?», нужно упомянуть симптомы, появляющиеся при заражении, такие как рвота, спазмы желудка и температура.
Кишечная палочка: причины
Одним из первых шагов по профилактике кишечной палочки в вашем доме должен стать ответ на вопрос «как передается кишечная палочка?» Для этого существует несколько основных причин:
Зараженная еда:
Зараженные бактерии можно обнаружить в мясе крупного рогатого скота, включая говядину и баранину, так как бактерии кишечной палочки могут находиться в кишечнике животных. Кроме того, может быть заражена и фермерская продукция: зелень, фрукты и овощи.
Зараженная вода:
Подхватить кишечную палочку очень просто, выпив воды из зараженного источника.

Все описанные выше причины и являются ответом на вопрос «откуда возникает кишечная палочка?» А теперь перейдем к самому важному – профилактике кишечной палочки в вашем доме.
Кишечная палочка передается?
Присутствие безвредных разновидностей кишечной палочки является нормой для микрофлоры кишечника человека. Такие бактерии полезны для здоровья, так как препятствуют появлению других болезнетворных бактерий в кишечнике. Однако при нарушении работы пищеварительного тракта безвредная норма кишечной палочки может увеличиться и тогда необходима консультация доктора.
К сожалению, кишечная палочка заразна и тем самым еще более опасна. Кишечная палочка передается от человека к человеку воздушно-капельным и половым путем. Помимо прямого контакта с зараженным человеком, инфекция может передаваться путем употребления некачественной еды или загрязненной воды.
Кишечная палочка: профилактика с помощью личной гигиены
Чтобы остановить распространение кишечной палочки, нужно обязательно мыть руки:
После обращения с животными
После любого контакта с зараженным человеком
Перед и после приготовления еды
После замены подгузников, грязной одежды или постельного белья
После использования туалета
После уборки
Кишечная палочка: профилактика дома
Теперь перейдем к домашней уборке – важной части профилактики кишечной палочки. Следуйте этим простым советам, чтобы защитить свой дом:
Следуйте этим простым советам, чтобы защитить свой дом:
Тщательно убирайте ванную комнату и туалет – пользуйтесь хлорсодержащими чистящими средствами при уборке раковин, сантехники и всех твердых поверхностей. Особое внимание стоит уделить туалету, так как он – один из основных источников распространения кишечной палочки. Использование Domestos поможет убить все вредоносные бактерии в вашем туалете и ванной. Такое чистящее средство сэкономит ваше время, а также позаботится о вашем здоровье. Однако, перед использованием любого нового средства, не забудьте его протестировать и внимательно читайте инструкцию.
Вытирайте все ручки в доме, чтобы не допустить распространения бактерий.
Протирайте стиральную машину после стирки грязной одежды и постельного белья.
Когда дело касается дезинфекции вашего дома, хлорсодержащие чистящие средства становятся основным способом поддержания гигиены. Многочисленные исследования не раз показывали эффективность геля Domestos, содержащего хлор, в уничтожении вредных бактерий и в борьбе по предотвращению кишечных инфекций.
Не стоит забывать и про использование туалетных блоков, которые помогут поддержать гигиеническую чистоту и предотвратить распространение бактерий. Туалетные блоки Domestos идеально встраиваются под ободок унитаза, плотно прилегая в самом критичном, с точки зрения грязи и микробов, месте.
Максимальный эффект защиты вашего туалета может быть достигнут благодаря совместному использованию чистящего геля и туалетных блоков Domestos. Результат – чистый и опрятный туалет 24/7*!
*Защита от загрязнений (благоприятной среды для микробов) 24 часа в сутки, 7 дней в неделю при использовании согласно инструкции. По результатам инструментальных тестов Unilever, Италия, 2016
E. coli – это бактерия, обычно обнаруживаемая в нижних отделах кишечника теплокровных организмов.
Обзор
Бактерия Escherichia coli (E. coli), продуцирующая шигатоксин часто обнаруживается в кишечнике людей и теплокровных животных. Большинство штаммов E. coli безвредны. Однако некоторые штаммы, такие как энтерогеморрагическая E. coli (STEC), могут вызывать тяжелые болезни пищевого происхождения. Эта бактерия передается человеку, главным образом, при потреблении зараженных пищевых продуктов, таких как сырые или не прошедшие достаточную тепловую обработку продукты из мясного фарша, сырое молоко и загрязненные сырые овощи и ростки.
coli (STEC), могут вызывать тяжелые болезни пищевого происхождения. Эта бактерия передается человеку, главным образом, при потреблении зараженных пищевых продуктов, таких как сырые или не прошедшие достаточную тепловую обработку продукты из мясного фарша, сырое молоко и загрязненные сырые овощи и ростки.
STEC производит токсины, известные как шига токсины, названные так из-за их сходства с токсинами, производимыми Shigella dysenteriae. Количество бактерий STEC может увеличиваться при температуре от 7°C до 50°С (оптимальная температура 37°С). Количество некоторых бактерий STEC может расти в кислых продуктах с показателем pH вплоть до 4,4, а также в продуктах с минимальной активностью воды (aw) на уровне 0,95.
Бактерии погибают при тщательной тепловой обработке пищевых продуктов – до тех пор, пока все части продуктов не достигнут температуры 70°С или выше. Наиболее значимым для общественного здравоохранения серотипом STEC является E. Coli O157:H7; однако возбудителями спорадических случаев и вспышек заболеваний часто являются и другие серотипы.
Симптомы
Симптомы болезней, вызываемых бактериями STEC, включают абдоминальные спазмы и диарею, которая в некоторых случаях может переходить в кровавую диарею (геморрагический колит). Возможны также лихорадка и рвота. Инкубационный период длится от 3 до 8 дней, при средней продолжительности 3-4 дня. Большинство пациентов выздоравливает в течение 10 дней, но у незначительного числа пациентов (особенно детей раннего возраста и пожилых людей) инфекция может приводить к развитию такой представляющей угрозу для жизни болезни, как гемолитический уремический синдром (ГУС). Для ГУС характерны острая почечная недостаточность, гемолитическая анемия и тромбоцитопения (низкий уровень тромбоцитов в крови).
Люди, страдающие от кровавой диареи или тяжелых абдоминальных спазмов, должны обращаться за медицинской помощью. Антибиотики не являются составной частью лечения пациентов с болезнью, вызванной STEC, и могут повышать риск развития ГУС.
По оценкам, ГУС может развиваться у 10 % пациентов с инфекцией STEC, а коэффициент летальности составляет от 3 до 5 %. Во всем мире ГУС является самой распространенной причиной острой почечной недостаточности у детей раннего возраста. Он может приводить к неврологическим осложнениям (таким как конвульсии, инсульт и кома) у 25 % пациентов и к хроническим заболеваниям почек, обычно нетяжелым, примерно у 50 % выживших пациентов.
Во всем мире ГУС является самой распространенной причиной острой почечной недостаточности у детей раннего возраста. Он может приводить к неврологическим осложнениям (таким как конвульсии, инсульт и кома) у 25 % пациентов и к хроническим заболеваниям почек, обычно нетяжелым, примерно у 50 % выживших пациентов.
Источники и передача инфекции
Имеющаяся о STEC информация относится, в основном, к серотипу O157:H7, так как с биохимической точки зрения его можно легко дифференцировать от других штаммов E. coli. Резервуаром этого патогенного микроорганизма является, в основном, крупный рогатый скот. Кроме того, значительными резервуарами считаются другие жвачные животные (такие как овцы, козы и олени), обнаруживаются и другие инфицированные млекопитающие (такие как свиньи, лошади, кролики, собаки, кошки) и птицы (такие как куры и индейки).
E. coli O157:H7 передается человеку, главным образом, в результате потребления в пищу зараженных пищевых продуктов, таких как сырые или не прошедшие достаточную тепловую обработку продукты из мясного фарша и сырое молоко. Загрязнение фекалиями воды и других пищевых продуктов, а также перекрестное загрязнение во время приготовления пищи (через продукты из говядины и другого мяса, загрязненные рабочие поверхности и кухонные принадлежности) также могут приводить к инфицированию. Примеры пищевых продуктов, явившихся причиной вспышек E. coli O157:H7, включают не прошедшие надлежащую тепловую обработку гамбургеры, копченую салями, непастеризованный свежевыжатый яблочный сок, йогурт и сыр, приготовленный из сырого молока.
Загрязнение фекалиями воды и других пищевых продуктов, а также перекрестное загрязнение во время приготовления пищи (через продукты из говядины и другого мяса, загрязненные рабочие поверхности и кухонные принадлежности) также могут приводить к инфицированию. Примеры пищевых продуктов, явившихся причиной вспышек E. coli O157:H7, включают не прошедшие надлежащую тепловую обработку гамбургеры, копченую салями, непастеризованный свежевыжатый яблочный сок, йогурт и сыр, приготовленный из сырого молока.
Все большее число вспышек болезни связано с потреблением в пищу фруктов и овощей (включая ростки, шпинат, латук, капусту и салат), заражение которых может происходить в результате контакта с фекалиями домашних или диких животных на какой-либо стадии их выращивания или обработки. Бактерии STEC обнаруживаются также в водоемах, (таких как пруды и реки), колодцах и поилках для скота. Они могут оставаться жизнеспособными в течение нескольких месяцев в навозе и осадочных отложениях на дне поилок. Так же была зарегистрирована передача инфекции как через зараженную питьевую воду, так и через воды для рекреационного использования.
Так же была зарегистрирована передача инфекции как через зараженную питьевую воду, так и через воды для рекреационного использования.
Близкие контакты людей являются одним из основных путей передачи инфекции (орально-фекальный путь заражения). Были зарегистрированы бессимптомные носители, то есть лица, у которых не проявляются клинические симптомы болезни, но которые способны инфицировать других людей. Период выделения бактерий STEC у взрослых людей длится примерно одну неделю или менее, а у детей этот период может быть более длительным. В числе значительных факторов риска инфицирования STEC отмечается также посещение ферм и других мест содержания сельскохозяйственных животных, где возможен прямой контакт с ними.
Профилактика
Для профилактики инфекции необходимо соблюдать контрольные меры на всех стадиях продовольственной цепи – от производства сельскохозяйственной продукции на фермах до переработки, обработки и приготовления пищевых продуктов как на коммерческих предприятиях, так и в домашних условиях.
В промышленных условиях
Число случаев заболевания можно уменьшить благодаря проведению разнообразных стратегий по снижению риска в отношении мясного фарша (например, обследование животных перед убоем для предотвращения попадания большого количества патогенных микроорганизмов в места для убоя скота). Надлежащая практика убоя скота и соблюдение гигиены снижают уровень загрязнения туш фекалиями, но не гарантируют отсутствия бактерий STEC в продуктах. Для сведения к минимуму микробиологического заражения крайне важно проводить обучение гигиеническим навыкам при обращении с пищевыми продуктами среди работников ферм, скотобоен и предприятий по производству пищевых продуктов. Единственным эффективным способом уничтожения бактерий STEC в пищевых продуктах является бактерицидная обработка, такая как нагревание (например, тепловая обработка или пастеризация) или облучение.
В домашних условиях
Меры для профилактики инфекции E. coli O157:H7 схожи с мерами, рекомендуемыми для профилактики других болезней пищевого происхождения.
Пятью важнейшими принципами обеспечения более безопасных пищевых продуктов являются:
Эти рекомендации необходимо выполнять во всех случаях, особенно рекомендацию в отношении “надлежащей тепловой обработки продуктов”, при которой температура в середине продуктов достигает, по меньшей мере, 70°C. Необходимо тщательно мыть фрукты и овощи, особенно если они употребляются в пищу в сыром виде. По возможности овощи и фрукты следует чистить. Уязвимым группам населения (таким как дети и пожилые люди) следует избегать потребления в пищу сырых или не прошедших надлежащую тепловую обработку мясных продуктов, сырого молока и продуктов, приготовленных из сырого молока.
Настоятельно рекомендуется регулярное мытье рук, в частности перед приготовлением пищи, едой и после посещения туалета, особенно для людей, ухаживающих за детьми раннего возраста, пожилыми людьми и людьми с ослабленным иммунитетом, так как бактерия может передаваться не только через пищевые продукты, воду и при прямых контактах с животными, но и от человека человеку.
Некоторое количество инфекций STEC возникает в результате контакта с водами для рекреационного использования. Поэтому, важно также защищать такие водоемы, равно как и источники питьевой воды, от попадания в них экскрементов животных.
Производители фруктов и овощей
Публикация ВОЗ «Пять важнейших принципов выращивания более безопасных фруктов и овощей», предназначаемая для сельскохозяйственных работников, выращивающих свежие фрукты и овощи для себя, своих семей и для продажи на местных рынках, содержит основные практические методики для предотвращения микробного загрязнения свежей продукции во время посадки, выращивания, сбора урожая и хранения.
Пятью важнейшими принципами выращивания более безопасных фруктов и овощей являются:
- Соблюдение надлежащей личной гигиены.
- Защита полей от загрязнения фекалиями животных.
- Использование обработанных фекальных отходов.
- Оценка рисков, связанных с использованием ирригационной воды, и управление этими рисками.
- Содержание оборудования и помещений для сбора и хранения урожая в чистоте и сухости.
Деятельность ВОЗ
ВОЗ проводит научные оценки для контроля пищевых продуктов на присутствие STEC. Эти оценки служат основанием для международных стандартов на пищевые продукты, руководящих принципов и рекомендаций, разрабатываемых Комиссией Кодекс Алиментариус.
В отношении профилактики ВОЗ разработала глобальную стратегию для уменьшения бремени болезней пищевого происхождения. ВОЗ разработала информационное сообщение “Пять основных правил для обеспечения более безопасных пищевых продуктов”. Эти пять правил и связанные с ними учебные пособия являются материалами для стран, которые легко использовать, воспроизводить и адаптировать к различным целевым аудиториям.
ВОЗ способствует укреплению систем безопасности пищевых продуктов путем продвижения надлежащей практики производства и просвещения розничных торговцев и потребителей в отношении надлежащего обращения с пищевыми продуктами и предотвращения их загрязнения.
Во время вспышек E. coli, таких как вспышки, имевшие место в Европе в 2011 году, ВОЗ осуществляет поддержку координации в области обмена информацией и сотрудничества с помощью Международных медико-санитарных правил и в рамках Международной сети органов по безопасности пищевых продуктов (ИНФОСАН) во все мире; ВОЗ осуществляет тесное сотрудничество с национальными органами здравоохранения и международными партнерами, обеспечение технической помощи и предоставление последней информации о вспышках болезни.
что такое, как берут анализ и где можно сдать?
В нашем организме живут миллионы бактерий — их общий вес составляет около двух килограммов. Кишечная палочка занимает среди них далеко не последнее место. Эта бактерия может долгое время помогать человеку в формировании микрофлоры и пищеварении, а может в один момент превратиться в серьезную медицинскую проблему. В нашей статье мы расскажем о способах выявления кишечной палочки.
Эта бактерия может долгое время помогать человеку в формировании микрофлоры и пищеварении, а может в один момент превратиться в серьезную медицинскую проблему. В нашей статье мы расскажем о способах выявления кишечной палочки.
Кишечная палочка: две стороны одной медали
Кишечная палочка, или Escherichia coli (Эшерихия коли) — это палочковидная бактерия, которая обитает в кишечнике человека и некоторых животных. Существует более сотни разновидностей этой палочки. Большинство из них совершенно безвредны, но некоторые могут вызвать серьезные заболевания.
Кстати
Один из редких видов кишечной палочки — штамм О141:Н4 — стал знаменит из-за эпидемии в Европе в 2011 году. Тогда в странах Европы и северной Америки за период с мая по июнь заболело примерно 4 000 человек, из них 43 человека погибло.
У здорового человека Escherichia coli живет в толстом кишечнике. Ее количество обычно составляет 104–1010 КОЕ в 1 мл содержимого.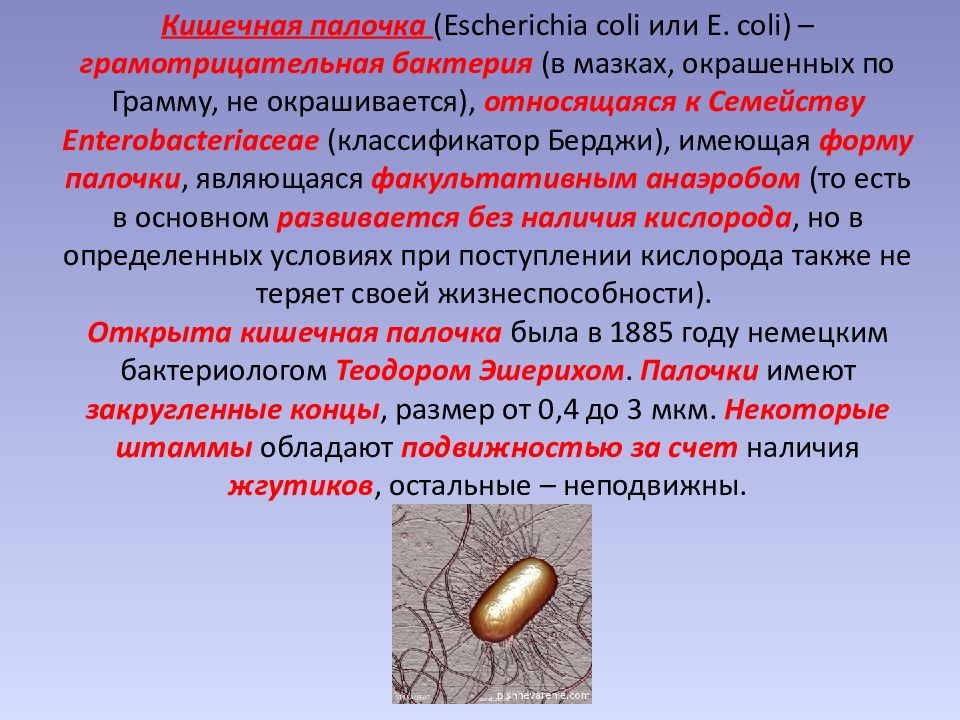 В кишечнике эта бактерия участвует в переваривании пищи, синтезирует нужные нам витамины, а также производит органические кислоты. Эти кислоты создают благоприятную среду для развития лакто- и бифидобактерий.
В кишечнике эта бактерия участвует в переваривании пищи, синтезирует нужные нам витамины, а также производит органические кислоты. Эти кислоты создают благоприятную среду для развития лакто- и бифидобактерий.
У организма человека есть различные механизмы, которые помогают контролировать количество бактерий и ограничивать места их «обитания». Но если механизм дает сбой, могут возникнуть как легкие проходящие расстройства, так и действительно серьезные заболевания, иногда с летальным исходом. Из-за кишечной палочки могут развиваться различные заболевания: от диареи до тяжелого менингита и коли-сепсиса. Обнаружение бактерии в любых органах, кроме толстого кишечника, уже говорит о развитии нарушений.
Чаще всего кишечная палочка попадает в другие органы при нарушении гигиены или при снижении иммунитета. Попадая в женскую половую систему, она вызывает кольпит, аднексит, другие воспалительные заболевания. Особенно опасно заражение при беременности и после родов. Это может вызвать внутриутробную инфекцию у ребенка и стать причиной послеродового эндометрита у матери. Мужчин эта опасность тоже не обходит стороной. Кишечная палочка, попавшая в уретру, может вызвать уретрит, простатит, воспаление придатков и яичек.
Мужчин эта опасность тоже не обходит стороной. Кишечная палочка, попавшая в уретру, может вызвать уретрит, простатит, воспаление придатков и яичек.
Кроме этого, нормальная кишечная палочка может мутировать и становиться действительно опасной. Некоторые виды этой бактерии, например O157:H7, O104:h5, O121 и O104:h31, выделяют сильные токсины. Они могут вызвать гемолитико-уремический синдром, перитонит, пневмонию, пищевые отравления.
Чаще всего мутировавшая кишечная палочка попадает в организм вместе с продуктами питания, такими как немытые овощи, плохо обработанное мясо, молоко. Но в некоторых случаях такие штаммы могут образоваться внутри организма в результате мутаций и обмена генами.
Когда может быть назначен анализ
Патогенная кишечная палочка нередко вызывает диарею. Обычно эшерихиозом страдают дети младшего возраста и люди, путешествующие в страны с низким уровнем гигиены (так называемая диарея путешественников). Вовремя проведенный анализ позволит выявить кишечную палочку и начать лечение.
Некоторые опасные штаммы кишечной палочки могут вызвать гемолитико-уремический синдром (ГУС). Это тяжелое состояние, при котором в мелких сосудах образуется большое количество тромбов, собственные эритроциты разрушаются и возникает полиорганная недостаточность — тяжелая стресс-реакция организма. При любом подозрении на ГУС обязательно проводят анализ на энтеропатогенные (опасные) эшерихии.
Обычный бактериологический анализ, который проводят при воспалительных заболеваниях органов половой системы, послеродовых эндометритах и других, — также может показать наличие кишечной палочки.
Еще одним показанием к проведению исследования является дисбактериоз. Изменение состава микрофлоры кишечника может привести к проблемам с пищеварением, к урчанию и болям в животе. Нарушение образования витаминов и повышенное всасывание токсинов приводит к слабости, утомляемости и другим неспецифическим симптомам.
Какие типы анализов назначают при подозрении на патологический процесс
Кишечную палочку можно обнаружить в кале, в моче, в мазках с поверхности половых органов или из ран, при посеве промывных вод. Также во время исследований она может быть обнаружена в ране, в легких.
Также во время исследований она может быть обнаружена в ране, в легких.
Основным методом анализа для обнаружения кишечной палочки является бактериологический посев. Для этого небольшое количество материала помещают в питательную среду, на которой бактерии очень хорошо размножаются. Результат подсчитывают через несколько дней по количеству образовавшихся колоний. Единица измерения — КОЕ/мл, то есть количество бактерий, из которых при исследовании выросли колонии, в миллилитре материала.
На выращенных колониях проводят тест с чувствительностью к антибиотикам или бактериофагам. Для этого в чашку Петри помещают микробы и выкладывают на ее поверхность диски, содержащие определенный антибиотик. Если антибиотик действует, рядом с диском образуется «пустое» кольцо, в котором роста микроорганизмов нет. Так же поступают и с бактериофагами.
Кроме ручного способа существует и полуавтоматический метод исследования чувствительности. Для этого микроб «засевают» не на чашки Петри, а на специальные кассеты, уже содержащие определенный набор антибиотиков. После эти кассеты помещают в анализатор.
После эти кассеты помещают в анализатор.
Также существует метод ПЦР-диагностики. Он позволяет сказать, присутствует ли в материале патогенная кишечная палочка. Но ни количество бактерий, ни их чувствительность к лекарственным препаратам этот метод не покажет.
Другие методы, которые не подразумевают выделение чистой культуры кишечной палочки, могут сказать о заражении только косвенно. Например, в общем анализе мочи могут обнаружить бактерии в виде палочек. Но для того чтобы определить их вид придется сдавать дополнительно бактериологический посев. Похожая ситуация и с копрограммой. Анализ может дать представление о состоянии желудка и кишечника, но не позволяет выявить конкретные бактерии.
Общий анализ крови позволяет выявить характерные для воспалительных заболеваний сдвиги. Но они могут быть вызваны не только эшерихиозом, но и дизентерией, пневмонией или любым другим воспалительным заболеванием.
Как сдавать биоматериал для анализа на кишечную палочку
Любое бактериологическое исследование нужно проводить до начала лечения антибиотиками. В противном случае можно получить ложноотрицательный результат.
В противном случае можно получить ложноотрицательный результат.
Анализ кала на кишечную палочку собирается в стерильную пробирку с транспортной средой. Для этого нужно заранее подготовить судно или другую емкость, тщательно вымыть ее и ополоснуть кипятком. В эту емкость собирается кал после естественной дефекации. Из специальной пробирки с транспортной средой нужно достать аппликатор, погрузить его в несколько участков собранного биоматериала и снова убрать в пробирку, плотно закрыв крышку. Если в собранном материале присутствуют кишечные палочки, бактериологический анализ это покажет.
Знаете ли вы, что…
кишечная палочка попадает в организм ребенка в первые же дни его жизни. Уже через 40 часов после рождения кишечник малыша заселен нормальной микрофлорой, в том числе и кишечной палочкой. Такое «сожительство» будет продолжаться всю его жизнь.
Анализ мочи на бактериологическое исследование тоже собирают в специальную стерильную емкость.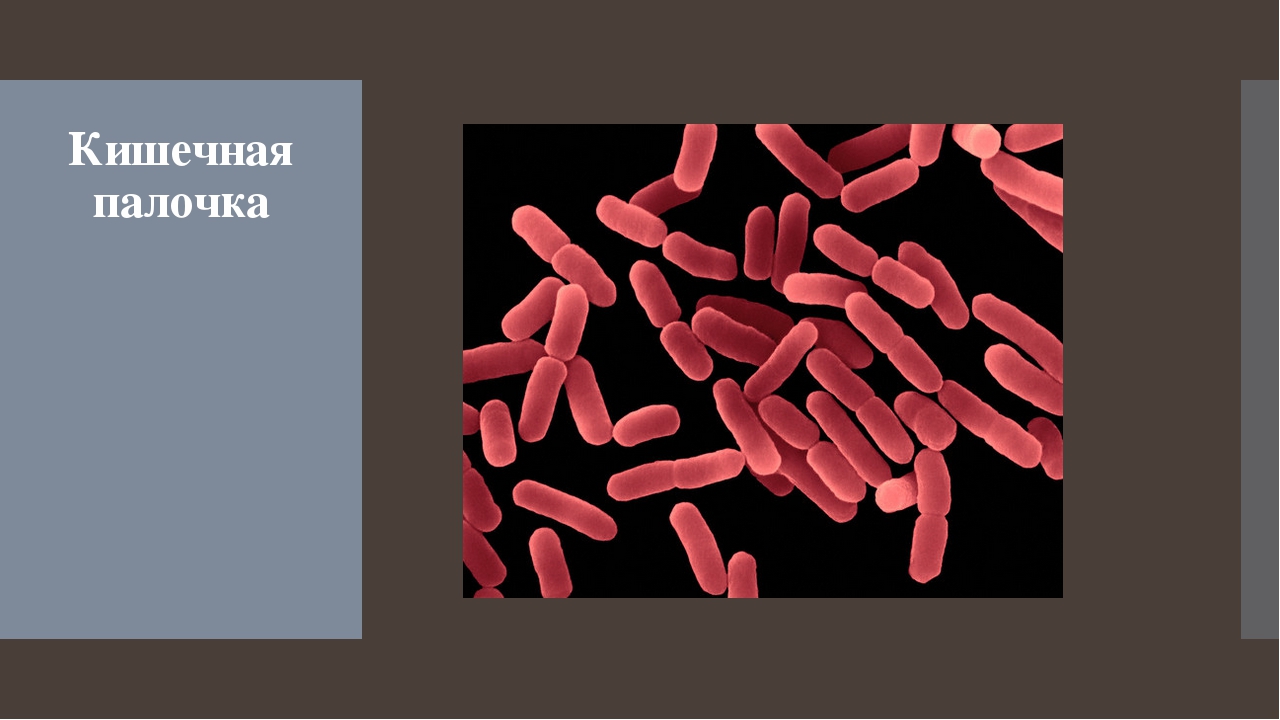 Собрать материал можно в любое время суток. Перед этим обязательно нужно принять душ, чтобы в емкость не попали бактерии с поверхности кожи. Чем скорее получится доставить материал в лабораторию, тем лучше.
Собрать материал можно в любое время суток. Перед этим обязательно нужно принять душ, чтобы в емкость не попали бактерии с поверхности кожи. Чем скорее получится доставить материал в лабораторию, тем лучше.
Мазки и соскобы урогенитального тракта при подозрении на уретрит, вагинит и любые другие мочеполовые заболевания, вызванные кишечной палочкой, забирают сразу в лаборатории или на приеме врача. Специальной щеточкой делается соскоб из уретры, со стенок влагалища или с шейки матки. Это не очень приятная процедура, но без нее не обойтись.
В каком виде и когда выдаются результаты
Быстрый анализ, который позволяет выявить в материале ДНК кишечной палочки, проводится за 1–2 рабочих дня. Результат бактериологического анализа на кишечную палочку придется ждать дольше — от 5 до 7 дней. За это время выращивается культура клеток, определяется их вид, проводится анализ на чувствительность к антибиотикам и бактериофагам.
В норме кишечной палочки не должно быть нигде, кроме толстого кишечника. То есть если вы сдаете мочу или мазок, то лучший результат — это отрицательное заключение. Если речь идет о содержимом кишечника, то здесь не должно обнаруживаться энтеропатогенных кишечных палочек, таких как O157:H7. В некоторых лабораториях проводят быстрый ПЦР-тест на целую группу таких бактерий.
То есть если вы сдаете мочу или мазок, то лучший результат — это отрицательное заключение. Если речь идет о содержимом кишечника, то здесь не должно обнаруживаться энтеропатогенных кишечных палочек, таких как O157:H7. В некоторых лабораториях проводят быстрый ПЦР-тест на целую группу таких бактерий.
При определении чувствительности к антибиотикам или бактериофагам выдается бланк, на котором напротив каждого наименования написана степень влияния препарата на рост бактерии. По такому бланку врач за несколько минут подберет наиболее эффективный для конкретного случая антибиотик.
Где можно сдать анализ на кишечную палочку
Анализ на эшерихиоз можно сдать как в обычной поликлинике, так и в частной лаборатории. Желательно заранее уточнить, какой метод исследования при этом используется.
Бактериологические исследования лучше проводить в клиниках и лабораториях, оснащенных автоматическими и полуавтоматическими анализаторами. Это исключает человеческий фактор, позволяет проводить исследование с широким перечнем антибиотиков и бактериофагов. Такие оснащенные лаборатории имеют как современные государственные больницы, занимающиеся лечением инфекционных болезней, так и частные медицинские центры.
Такие оснащенные лаборатории имеют как современные государственные больницы, занимающиеся лечением инфекционных болезней, так и частные медицинские центры.
Также стоит обратить внимание на время проведения исследования. Для бактериологического исследования это не менее пяти дней. Раньше бактерия просто не успеет вырасти в достаточном для анализа количестве. Время больше 7–10 дней говорит о том, что исследование будет проводиться в сторонней лаборатории. Это существенный недостаток, поскольку речь идет о транспортировке биоматериала, что нежелательно: чем раньше был доставлен материал, тем более достоверным будет результат.
Так как с результатами исследования еще придется идти к врачу для назначения лечения, не стоит выбирать неизвестные лаборатории по принципу «ближе к телу». Врач может просто не поверить полученным результатам и отправить сдавать анализ заново в свою больницу или в лабораторный центр, которому он доверяет. А это повлечет дополнительные временные и денежные траты.
Кишечная палочка — неотъемлемая часть микрофлоры кишечника. Пока она находится под контролем организма, ее клетки помогают синтезировать витамины, переваривать пищу, создавать благоприятную среду для жизни других полезных микробов. Но любое нарушение этого равновесия грозит патологиями вплоть до серьезных воспалительных заболеваний. К счастью, медицина помогает нам вовремя выявить отклонения от нормы и приять соответствующие меры.
Кишечная палочка (E.coli)
СТАЙЛАБ предлагает тест-системы для определения кишечной палочки (E. coli) в пробах продуктов и окружающей среды микробиологическими методами, с помощью ПЦР в реальном времени, а также методом латекс-агглютинации.
Кишечная палочка (Escherichia coli) – это факультативно-анаэробная грамотрицательная подвижная палочковидная бактерия, входящая в состав нормальной микрофлоры кишечника большинства теплокровных животных, в том числе, и человека.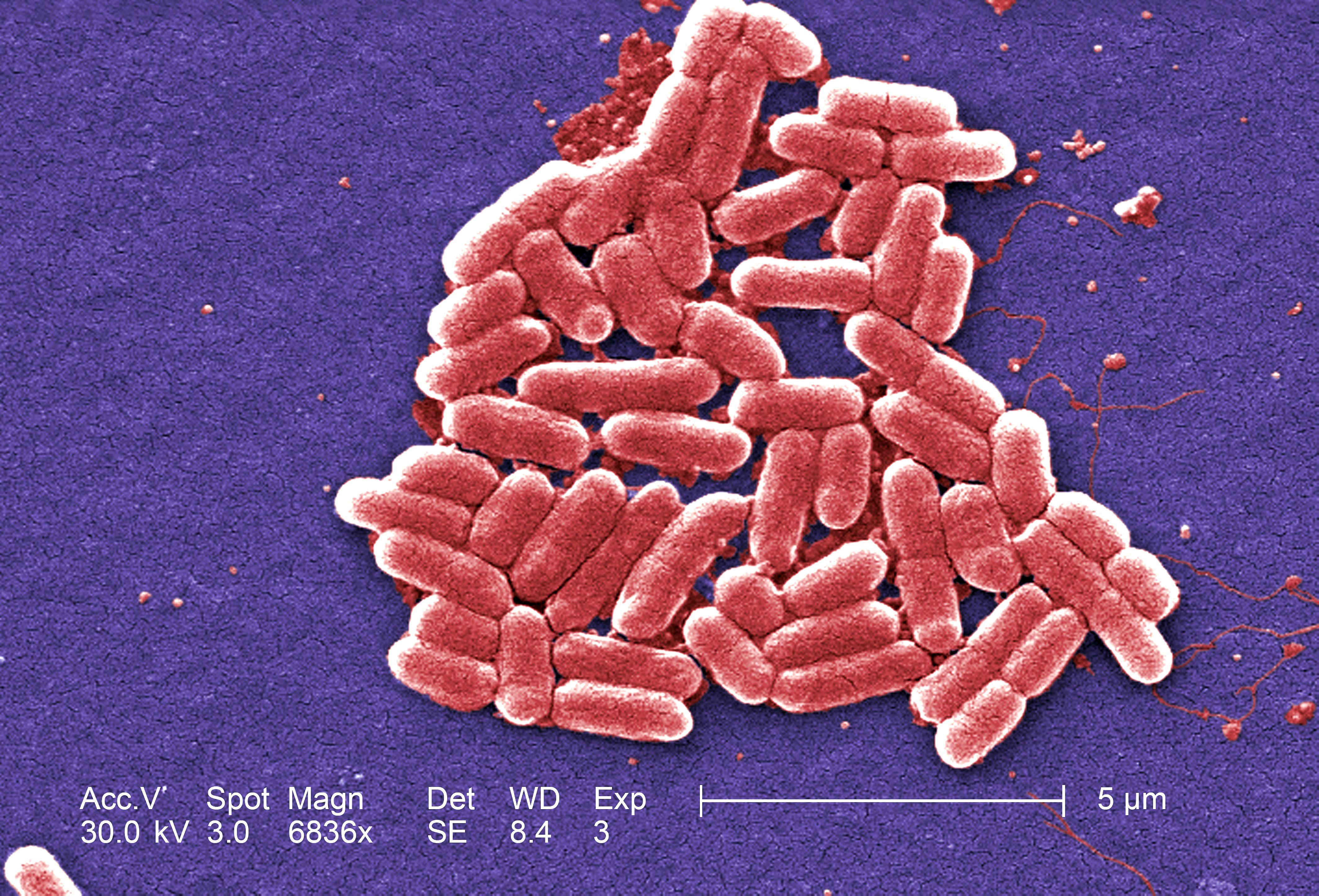 Существует множество серотипов кишечной палочки, большинство из которых безвредно или даже полезно для носителя. Бактерии, входящие в состав микрофлоры, препятствуют размножению других бактерий, в том числе, патогенных. Кроме того, кишечная палочка вырабатывает витамин К. Однако некоторые серотипы E. coli могут вызывать тяжелые заболевания. Морфологически безвредные и патогенные кишечные палочки не различаются, потому для определения патогенности микроорганизма необходимо проанализировать его антигены.
Существует множество серотипов кишечной палочки, большинство из которых безвредно или даже полезно для носителя. Бактерии, входящие в состав микрофлоры, препятствуют размножению других бактерий, в том числе, патогенных. Кроме того, кишечная палочка вырабатывает витамин К. Однако некоторые серотипы E. coli могут вызывать тяжелые заболевания. Морфологически безвредные и патогенные кишечные палочки не различаются, потому для определения патогенности микроорганизма необходимо проанализировать его антигены.
Бактерии кишечной палочки могут относиться к различным серогруппам: обладать различными антигенами. Серогруппа – это группа бактерий, обладающих общим антигеном; она может включать более одного серотипа, вида или рода. Для E. coli наиболее известными являются серогруппы энтеропатогенной кишечной палочки O26, O55, O86, O111, O114, O119, O125, O126, O127, O128, O142 и O158. К этим же группам могут относиться и другие типы патогенной кишечной палочки.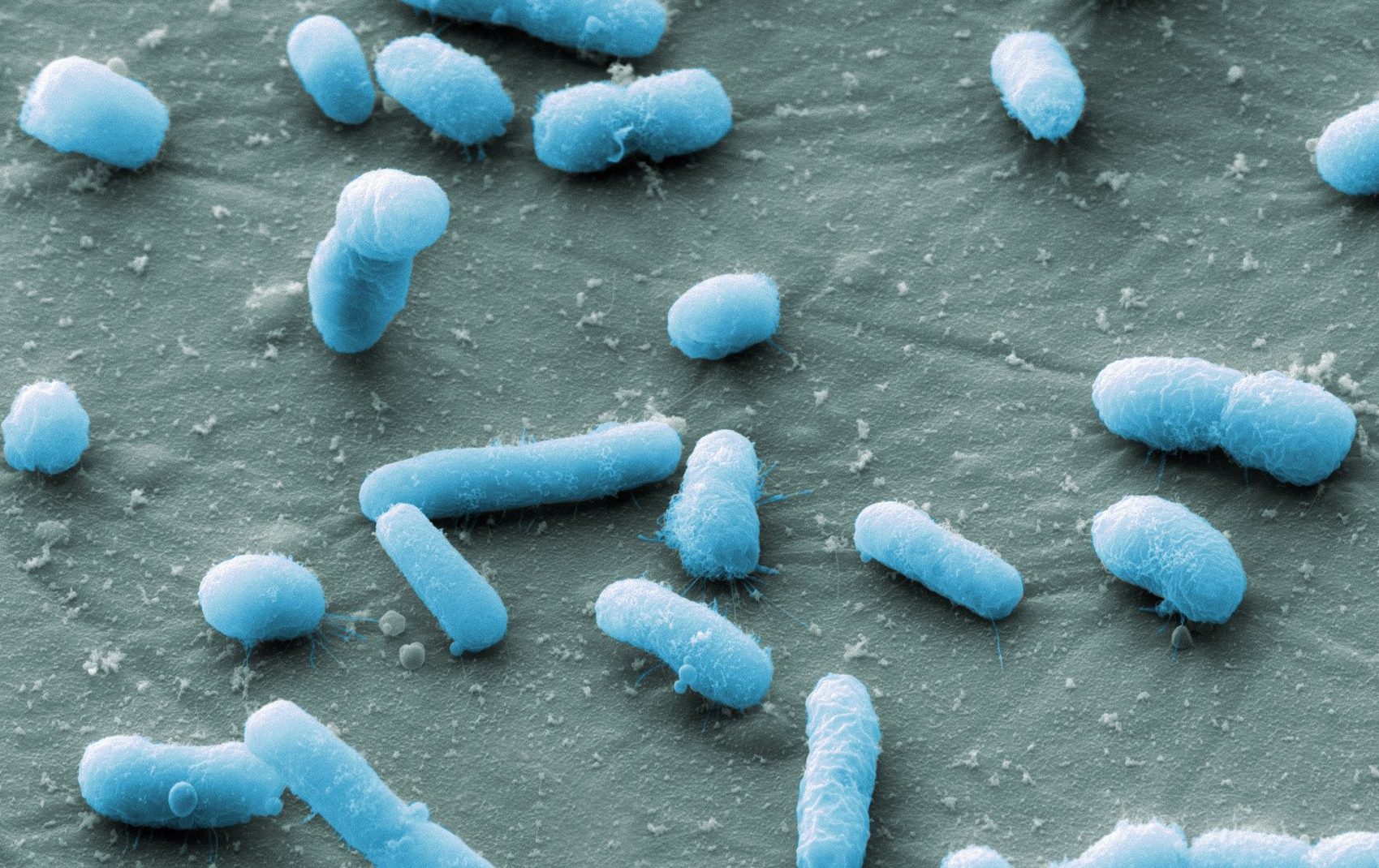 Например, у DAEC выявлены серогруппы O86, O127, O142 и O158.
Например, у DAEC выявлены серогруппы O86, O127, O142 и O158.
Выделяют шесть типов патогенных кишечных палочек.
- Энтерогеморрагическая кишечная палочка (EHEC, используются также сокращения STEC – от «шигатоксин-продуцирующая E. coli и VTEC – «веротоксин-продуцирующая E.Coli). Эти бактерии вырабатывают два токсина, которые называют веротоксинами, или шигаподобными (шигеллоподобными) токсинами. EHEC вызывает заболевания, по симптоматике сходные с дизентерией и сопровождающиеся геморрагической диареей. В тяжелых случаях может развиваться гемолитико-уремический синдром (ГУС). К EHEC относятся серотипы кишечной палочки O104:h5, O157:H7 и некоторые другие.
- Энтеротоксигенная кишечная палочка (ETEC) вырабатывает термолабильный и термостабильный токсины, последний из которых похож на токсин холерного вибриона. Для заболеваний, вызываемых этой бактерией, характерна водянистая диарея, повышенная температура и, в некоторых случаях, тошнота.
- Энтероинвазивная кишечная палочка (EIEC) вызывает заболевания, похожие на бактериальную дизентерию.
 Эти бактерии проникают в клетки эпителия кишечника и размножаются в них.
Эти бактерии проникают в клетки эпителия кишечника и размножаются в них. - Энтеропатогенная кишечная палочка (EPEC) чаще вызывает диарею у детей, чем у взрослых. Механизм ее действия отличается от ETEC и EIEC: эти бактерии прикрепляются к клеткам эпителия кишечника, но не проникают в них. Заболевания, вызванные EPEC, могут продолжаться до 2 недель.
- Энтероагрегативная кишечная палочка (EAEC) также вызывает заболевания, в основном, у детей. Бактерии прикрепляются к эпителию кишечника и выделяют токсины.
- Диффузно-адгезивная кишечная палочка (DAEC) вызывает легкую диарею у детей, особенно возрастом до 2х лет. Однако этот микроорганизм обнаруживали и у здоровых детей, а также у здоровых взрослых.
Кишечная палочка способна вызывать не только энтериты и токсикоинфекции, но и менингиты новорожденных, респираторные инфекции, инфекции мочевыводящих путей и бактериемию – общее поражение организма, вызванное бактериями, проникшими в кровь.
E. coli относится к наиболее изученным организмам. Геном одного из штаммов этих бактерий был полностью секвенирован в 1997 году. Кишечную палочку используют в генетических и микробиологических экспериментах, а также при изучении видообразования. Кроме того, с помощью этих бактерий синтезируют различные белки, в частности, аналог инсулина человека, некоторые ферменты и др. Их применяют также для получения вакцин. Ведутся исследования по использованию кишечной палочки для получения топлива.
coli относится к наиболее изученным организмам. Геном одного из штаммов этих бактерий был полностью секвенирован в 1997 году. Кишечную палочку используют в генетических и микробиологических экспериментах, а также при изучении видообразования. Кроме того, с помощью этих бактерий синтезируют различные белки, в частности, аналог инсулина человека, некоторые ферменты и др. Их применяют также для получения вакцин. Ведутся исследования по использованию кишечной палочки для получения топлива.
В Российской Федерации и странах Таможенного Союза содержание кишечной палочки в пищевых продуктах ограничено ТР ТС 021/2011 «О безопасности пищевой продукции», ТР ТС 033/2013 «О безопасности молока и молочной продукции» и другими техническими регламентами. С актуальной законодательной информацией можно ознакомиться на сайте compact24.com.
Для определения кишечной палочки в пробах используют как микробиологические методы (селективные среды, тест-подложки), так и определение ДНК с помощью ПЦР. В качестве экспресс-тестов применяют простой и быстрый метод латекс-агглютинации.
В качестве экспресс-тестов применяют простой и быстрый метод латекс-агглютинации.
Литература
- О.К. Поздеев. Медицинская микробиология. Москва, ГЭОТАР-МЕД, 2001.
- Официальный сайт CDC.
- Germani Y, Bégaud E, Duval P, Le Bouguénec C. Prevalence of enteropathogenic, enteroaggregative, and diffusely adherent Escherichia coli among isolates from children with diarrhea in new Caledonia. J Infect Dis. 1996 Nov;174(5):1124-6.
- Mansan-Almeida R, Pereira AL, Giugliano LG. Diffusely adherent Escherichia coli strains isolated from children and adults constitute two different populations. BMC Microbiol. 2013 Feb 1;13:22.
- Isabel C. A. Scaletsky, Sandra H. Fabbricotti, Rozane L. B. Carvalho, Claudia R. Nunes, Helcio S. Maranhão, Mauro B. Morais, and Ulysses Fagundes-Neto Diffusely Adherent Escherichia coli as a Cause of Acute Diarrhea in Young Children in Northeast Brazil: a Case-Control Study. J Clin Microbiol. 2002 Feb; 40(2): 645–648.

общее микробное число
Публикации в СМИ
Эшерихиозы — группа инфекционных болезней, вызываемых патогенными серотипами кишечной палочки, протекающих с интоксикацией, лихорадкой, преимущественным поражением ЖКТ, реже — мочевыводящих, желчевыводящих путей, других органов или с развитием сепсиса, наблюдают чаще у детей раннего возраста.
Этиология и патогенез. Большинство инфекций вызывает Escherichia coli. Кишечная палочка — типичный представитель нормальной аэробной микрофлоры толстой кишки. Патогенные свойства контролируются плазмидами и связаны со способностью Escherichia coli выделять токсины, их способностью к адгезии и инвазии в клетки слизистой оболочки кишечника. Морфологические различия между патогенными и непатогенными кишечными палочками отсутствуют. Их дифференцировка основана на различиях в структуре поверхностных Аг, среди которых выделяют липополисахаридные (О-), жгутиковые (Н-) и капсульные, полисахаридные Аг (К-Аг).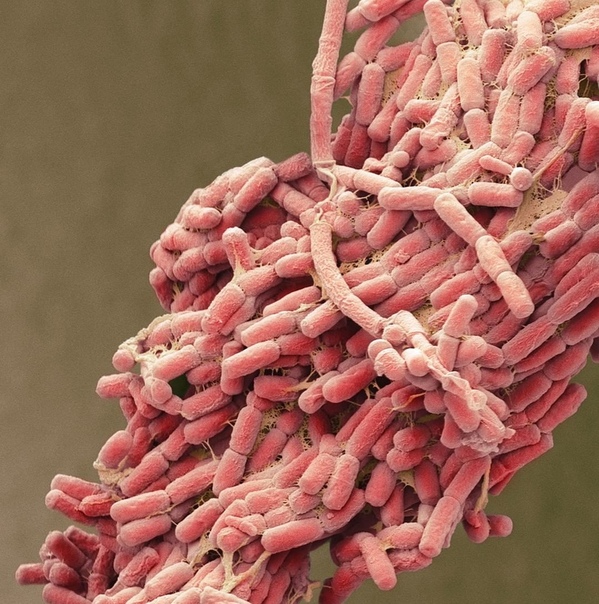 Серовары, ответственные за развитие восходящей инфекции мочевыводящих путей и внекишечные поражения, имеют К-Аг. По структуре О- и Н-Аг выделяют пять основных групп диареегенных эшерихий.
Серовары, ответственные за развитие восходящей инфекции мочевыводящих путей и внекишечные поражения, имеют К-Аг. По структуре О- и Н-Аг выделяют пять основных групп диареегенных эшерихий.
• Энтеропатогенная группа представлена сероварами О18, О26, О44, О55, О86, O111ab, О112, О114, О119, О125ac, О127, О128ab, О142, О158, не продуцирующими энтеротоксин и не обладающими инвазивными свойствами. Основные возбудители диарей у детей. Патогенез поражений обусловлен адгезией бактерии на эпителии кишечника и повреждением микроворсинок, но не инвазией в клетки. Практически все серотипы имеют плазмиду, кодирующую синтез фактора адгезивности энтеропатогенных Escherichia coli; незначительную группу бактерий, лишённых фактора адгезивности, предложено выделить в отдельную подгруппу. Бактерии экспрессируют ген еае, обусловливающий выделение продуктов, изменяющих архитектонику слизистой оболочки кишечника.
• Энтероинвазивная группа представлена сероварами О28ac, О29, О112ac, О115, О124, О135, О136, О143, О144, О152, О164, О167. Обладают инвазивными свойствами и вызывают развитие воспалительных изменений в слизистой оболочке толстой кишки. По морфологическим и культуральным свойствам сходны с шигеллами и вызывают диарею, напоминающую шигеллёзы. Подобно шигеллам, энтероинвазивные кишечные палочки способны проникать и размножаться в клетках эпителия кишечника, что обусловлено наличием плазмиды, кодирующей синтез определённых поверхностных белков, схожих (но не идентичных) с аналогичными белками шигелл (могут давать перекрёстные реакции).
Обладают инвазивными свойствами и вызывают развитие воспалительных изменений в слизистой оболочке толстой кишки. По морфологическим и культуральным свойствам сходны с шигеллами и вызывают диарею, напоминающую шигеллёзы. Подобно шигеллам, энтероинвазивные кишечные палочки способны проникать и размножаться в клетках эпителия кишечника, что обусловлено наличием плазмиды, кодирующей синтез определённых поверхностных белков, схожих (но не идентичных) с аналогичными белками шигелл (могут давать перекрёстные реакции).
• Энтеротоксигенная группа представлена сероварами О6, О8, O11, О15, О20, О25, О27, О63, О78, О80, О85, О114, О115, О126, О128ac, О139, О148, О153, О159, О166, О167. Основные возбудители диарей путешественников и детских диарей в развивающихся странах. Факторы патогенности — ворсинки или фимбриальные факторы, облегчающие адгезию на эпителии, способствующие колонизации нижних отделов тонкой кишки и определяющие способность к образованию термолабильного и/или термостабильного энтеротоксинов.
• Энтерогеморрагическая группа представлена сероварами О26, О111, О157. Образуют цитотоксин (образование кодирует ген, переносимый бактериофагом), шигаподобный токсин 1 (веротоксин 1), аналогичный токсину Shigella dysentheriae типа 1, и шигаподобный цитотоксин 2 (веротоксин 2). Ещё один фактор патогенности — плазмиды, кодирующие образование фимбрий, облегчающих адгезию бактерий на эпителии.
• Энтероадгезивные (энтероаггрегативные) кишечные палочки не образуют цитотоксины, не инвазируют в клетки эпителия и не имеют плазмидный фактор адгезии, присутствующий у энтеропатогенных эшерихий.
Эпидемиология
• Механизм распространения диареегенных эшерихий — фекально-оральный. Наиболее часто человек заражается при употреблении загрязнённой пищи и воды. В стационарах и закрытых коллективах для всех типов большее значение имеет контактный путь передачи. В странах с умеренным климатом большинство случаев заражения, в т. ч. вызванных энтерогеморрагической кишечной палочкой, наблюдают в тёплый сезон. В тропиках, где доминируют инфекции, вызванные энтеротоксигенной и энтеропатогенной кишечными палочками, пик заболеваемости наблюдают в сезоны дождей. Поскольку эшерихии обитают в кишечнике большого числа животных, то установить природный резервуар патогенных типов не представляется возможным. Установлен факт циркуляции энтерогеморрагической кишечной палочки О157:Н7 у крупного рогатого скота
ч. вызванных энтерогеморрагической кишечной палочкой, наблюдают в тёплый сезон. В тропиках, где доминируют инфекции, вызванные энтеротоксигенной и энтеропатогенной кишечными палочками, пик заболеваемости наблюдают в сезоны дождей. Поскольку эшерихии обитают в кишечнике большого числа животных, то установить природный резервуар патогенных типов не представляется возможным. Установлен факт циркуляции энтерогеморрагической кишечной палочки О157:Н7 у крупного рогатого скота
• Инфекции мочевыводящих путей. Возбудители обычно происходят из микрофлоры кишечника. Определённую роль играют анатомические и физиологические аномалии, затрудняющие нормальную эвакуацию мочи, например стенозы мочеиспускательного канала или пузырно-мочеточниковый рефлюкс. Часто риск развития поражений зависит от возраста и пола: среди новорождённых и детей первых 3 мес жизни они преобладают у мальчиков, в подростковый период — у девочек
• Бактериемия. Ранее Escherichia coli редко выделяли из крови пациентов и подобные случаи рассматривали как казуистику. Однако они постепенно вытеснили грамположительные бактерии и на сегодняшний день составляют основную причину бактериемий у детей и взрослых. У новорождённых источник инфекции обычно остаётся неизвестным, но у 15–20% эшерихиозы обусловлены манипуляциями на мочевыводящих путях. Факторы риска — преждевременные роды, преждевременные разрывы плодного пузыря, заболевания у беременных в III триместре, родовые травмы, гипоксии и низкая масса плода. Более поздние поражения обусловлены недостаточным функционированием защитных факторов и снижением содержания лактоферрина и трансферрина в сыворотке (последние связывают железо, способствующее размножению Escherichia coli). Риск развития поражений возрастает при наличии сопутствующей патологии, при проведении инвазивных урологических процедур или после оперативных вмешательств
Однако они постепенно вытеснили грамположительные бактерии и на сегодняшний день составляют основную причину бактериемий у детей и взрослых. У новорождённых источник инфекции обычно остаётся неизвестным, но у 15–20% эшерихиозы обусловлены манипуляциями на мочевыводящих путях. Факторы риска — преждевременные роды, преждевременные разрывы плодного пузыря, заболевания у беременных в III триместре, родовые травмы, гипоксии и низкая масса плода. Более поздние поражения обусловлены недостаточным функционированием защитных факторов и снижением содержания лактоферрина и трансферрина в сыворотке (последние связывают железо, способствующее размножению Escherichia coli). Риск развития поражений возрастает при наличии сопутствующей патологии, при проведении инвазивных урологических процедур или после оперативных вмешательств
• Менингит. Escherichia coli — частый возбудитель менингитов у новорождённых (1:1 000, чаще у мальчиков). У взрослых менингит наблюдают редко (обычно после травмы или трепанации черепа).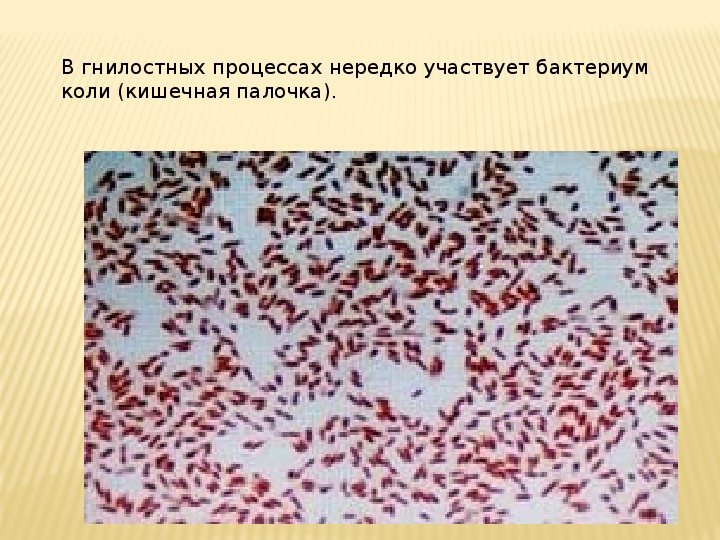 В большинстве случаев менингиты — осложнения бактериемии и развиваются у 10–40% новорождённых с подобной патологией. Основная группа риска — новорождённые со сниженной массой тела (менее 2 500 г).
В большинстве случаев менингиты — осложнения бактериемии и развиваются у 10–40% новорождённых с подобной патологией. Основная группа риска — новорождённые со сниженной массой тела (менее 2 500 г).
Клиническая картина
• Кишечные инфекции (коли-инфекция)
•• Энтеропатогенные эшерихии вызывают развитие воспалительного процесса преимущественно в тонкой кишке с развитием симптоматики острой диареи у детей первого года жизни, в т.ч. у новорождённых. Эшерихии ответственны за развитие вспышек диарейных заболеваний в родовспомогательных учреждениях. Поражения характеризуются выраженными болями в животе, рвотой, водянистым стулом без примеси крови.
•• Энтероинвазивные кишечные палочки. Поражения (преимущественно дистальный колит) характеризуются выраженными болями в животе, профузной диареей с примесью крови. На инвазивность микроорганизмов указывает большое количество полиморфноклеточных нейрофилов в испражнениях.
•• Энтеротоксигенные кишечные палочки вызывают развитие холероподобных форм кишечных инфекций у взрослых и детей.
•• Энтерогеморрагические эшерихии вызывают диарею с примесью крови (геморрагический колит) при полном отсутствии лейкоцитов в испражнениях и признаков лихорадки, гемолитико-уремический синдром и тромбоцитопеническую пурпуру.
•• Энтероадгезивные (энтероаггрегативные) эшерихии. Согласно имеющимся единичным описаниям, клиника поражений аналогична симптомокомплексу сравнительно умеренных шигеллёзов.
•• При всех клинических вариантах коли-инфекции наблюдают синдром интоксикации, соответствующий аналогичным проявлениям при бактериальных кишечных инфекциях, его выраженность определяет тяжесть состояния больного.
• Инфекции мочевыводящих путей — полиморфная группа поражений, включающая бессимптомную бактериурию, циститы и острый пиелонефрит. Клинически проявляются дизурией, частыми позывами на мочеиспускание, болями в боковых и нижних отделах живота, лихорадкой, реже тошнотой и рвотой.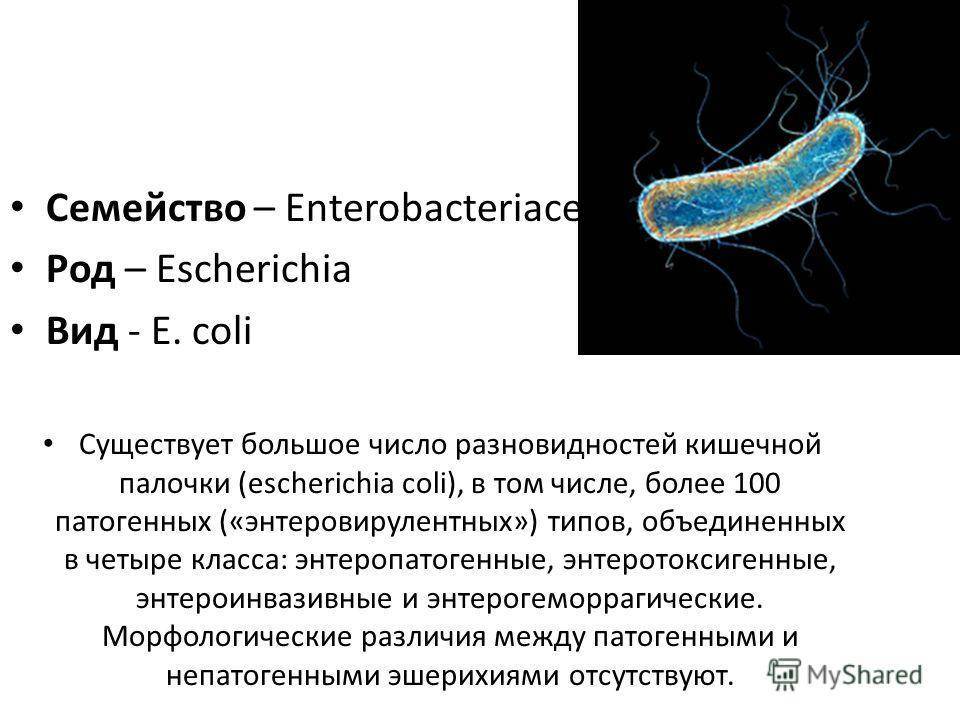 Уропатогенные эшерихии вызывают более 30% госпитальных поражений, обычно происходят из микрофлоры кишечника.
Уропатогенные эшерихии вызывают более 30% госпитальных поражений, обычно происходят из микрофлоры кишечника.
• Клинически бактериемии, вызванные Escherichia coli, не имеют особых патогномоничных признаков. У новорождённых наиболее часто отмечают нарушения терморегуляции, анорексию, респираторный дистресс-синдром, апноэ, рвоту, диарею, желтуху, увеличение печени и селезёнки. У взрослых — лихорадку, спутанность сознания, судороги, артериальную гипотензию, олиго- и анурию, респираторный дистресс-синдром.
• Менингит. Клинические проявления: лихорадка, сонливость, рвота, диарея, респираторный дистресс-синдром, желтуха и менингеальные симптомы. Летальность достигает 12% у новорождённых, родившихся после физиологических родов, и 35% у новорождённых, относящихся к группе риска. У 20–50% выживших отмечают остаточные неврологические расстройства.
• Инфекции респираторного тракта (пневмония, плеврит, абсцесс лёгкого). Возбудители могут относиться как к патогенным, так и непатогенными штаммам кишечной палочки. Практически всегда носят оппортунистический характер и развиваются лишь у пациентов с иммунодефицитными состояниями.
Возбудители могут относиться как к патогенным, так и непатогенными штаммам кишечной палочки. Практически всегда носят оппортунистический характер и развиваются лишь у пациентов с иммунодефицитными состояниями.
• У новорождённых (в первую очередь, недоношенных) и детей первых месяцев жизни возможно развитие коли-бациллярного сепсиса с симптоматикой инфекционно-токсического шока или множественных очагов воспаления в различных органах (пневмония, менингит, инфекция мочевыводящих путей, эндокардит, артрит, остеомиелит и т.д.). Прогноз болезни, даже при современных методах лечения, серьёзный (летальность — 50–85%).
Методы исследования • Выделение возбудителя и его токсинов •• Материал для исследования — кал, рвотные массы, промывные воды желудка, при внекишечной локализации — кровь, ликвор, моча, мокрота. Бактериологический анализ основан на определении антигенных свойств •• Идентификация диареегенных типов. У энтеротоксических кишечных палочек выявляют токсины — термостабильный на мышатах-сосунках; термолабильный на культурах клеток Y1 надпочечников. Энтероинвазивные эшерихии определяют по развитию конъюнктивита у морских свинок при внесении бактерий в конъюнктивальный мешок (тест Серени) или по способности инвазировать клетки HeLa и НЕр-2. Энтерогеморрагические кишечные палочки идентифицируют посевом на среды с сорбитом •• Энтеротоксин энтеротоксигенных эшерихий обнаруживают в реакциях коагглютинации и преципитации в агаре •• Токсин энтерогеморрагических кишечных палочек выявляют методом ИФА • Серологические методы обычно не проводят из-за большого числа перекрёстных реакций с Аг различных серотипов Escherichia coli • Идентификацию возбудителя также можно проводить с помощью ПЦР.
У энтеротоксических кишечных палочек выявляют токсины — термостабильный на мышатах-сосунках; термолабильный на культурах клеток Y1 надпочечников. Энтероинвазивные эшерихии определяют по развитию конъюнктивита у морских свинок при внесении бактерий в конъюнктивальный мешок (тест Серени) или по способности инвазировать клетки HeLa и НЕр-2. Энтерогеморрагические кишечные палочки идентифицируют посевом на среды с сорбитом •• Энтеротоксин энтеротоксигенных эшерихий обнаруживают в реакциях коагглютинации и преципитации в агаре •• Токсин энтерогеморрагических кишечных палочек выявляют методом ИФА • Серологические методы обычно не проводят из-за большого числа перекрёстных реакций с Аг различных серотипов Escherichia coli • Идентификацию возбудителя также можно проводить с помощью ПЦР.
Лечение
• Диета — механически и термически адекватно обработанная пища
• Госпитализация по клиническим показаниям
• Этиотропная терапия — ампициллин, карбенициллин, цефалоспорины II и III поколений, ко-тримоксазол или сочетание одного из препаратов с аминогликозидами •• При менингитах — ампициллин и аминогликозиды •• При почечной недостаточности аминогликозиды заменяют цефалоспоринами III поколения (например, цефотаксимом или цефтриаксоном) •• При диссеминированных формах антибактериальные средства вводят парентерально •• Применение антибиотиков не снижает частоту развития гемолитико-уремического синдрома при эшерихиозах, вызванных Escherichia coli O157:H7
• Патогенетическая терапия: регидратация при обезвоживании, ГК и адреномиметические средства при инфекционно-токсическом шоке, гемотрансфузии при анемии и тромбоцитопении и т. п.
п.
Осложнения. Специфическое осложнение эшерихиозов, вызванных энтерогеморрагической кишечной палочкой, — гемолитико-уремический синдром (синдром Гассера), регистрируемый у 5–10% заболевших. Симптомы: микроангиопатическая гемолитическая анемия, тромбоцитопения и ОПН. Синдром проявляется чаще всего к концу первой недели с момента возникновения первых симптомов дисфункции кишечника. У взрослых пациентов возможно развитие тромботической тромбоцитопенической пурпуры и инфекционно-токсического шока.
Профилактика
• Больные с коли-инфекцией подлежат немедленной и обязательной изоляции (диссеминированные формы эшерихиозов представляют меньшую эпидемическую опасность)
• Санитарный контроль медицинского персонала детских и реанимационных отделений, а также родовспомогательных учреждений
• После изоляции заболевшего в отделении проводят заключительную дезинфекцию.
МКБ-10 • A04 Другие бактериальные кишечные инфекции
симптомы, лечение, диагностика в Европейском Медицинском Центре
Цистит – это воспалительное заболевание стенок мочевого пузыря. Цистит чаще возникает у женщин, чем у мужчин.
Цистит чаще возникает у женщин, чем у мужчин.
Самая частая причина цистита (до 80%) – это бактерия Escherichia coli (кишечная палочка), которая поражает слизистую мочевого пузыря и мочеиспускательного канала. Кишечная палочка является составляющей нормальной флоры кишечника, однако вирулентные типы этой бактерии попадают в мочевой пузырь через мочеиспускательный канал и вызывают местное воспаление. Также причиной цистита может стать внутрибольничная инфекция, особенно у пациентов с уретральным катетером.
Цистит: факторы риска
-
Использование женщинами тампонов в качестве средств личной гигиены.
-
Риск заболеть циститом повышается при использовании вагинальных диафрагм в качестве контрацепции.
-
Если мочевой пузырь не опорожняется полностью, то остаточная моча – это хорошая питательная среда для размножения бактерий.
-
Сексуальная активность.

-
Различные заболевания почек или мочевого пузыря.
-
Во время менопаузы, когда из-за недостатка женских половых гормонов снижается количество продуцируемой слизи во влагалище, которая выполняет барьерную функцию, бактерии чаще попадают в мочеиспускательный канал. Таким образом, женщины, находящиеся на заместительной гормональной терапии, имеют меньший риск заболеть циститом.
-
Анатомически наружное отверстие уретры у женщины расположено ближе к анусу, чем у мужчин – это еще одна причина легкого заброса бактерий из прямой кишки в мочеиспускательный канал.
Если цистит возникает у мужчины, то это, как правило, потенциально более серьезная проблема, чем у женщины, так как причинами могут быть такие заболевания, как инфекция предстательной железы, рак, инфравезикальная обструкция, увеличение предстательной железы – гиперплазия. Также в группе повышенного риска возникновения цистита находятся мужчины, имеющие однополые сексуальные отношения.
Симптомы цистита
-
примесь крови в моче,
-
темная, насыщенная по цвету моча,
-
сильный запах мочи,
-
боль над лоном,
-
боль в животе,
-
боль в области поясницы,
-
учащенное мочеиспускание,
-
жжение при мочеиспускании,
-
пожилые пациенты могут ощущать слабость и повышение температуры тела и не отмечать при этом других симптомов.
Другие заболевания, имеющие те же симптомы, что и цистит:
-
уретрит (воспаление мочеиспускательного канала),
-
уретральный синдром,
-
некоторые бактериальные инфекции,
-
простатит (воспаление предстательной железы у мужчин),
-
кандидоз (молочница).

Диагностика цистита
Доктор проведет с вами подробную беседу, сделает осмотр и назначит анализ мочи. Бактериологический посев мочи с определением антибиотикограммы назначается дополнительно, чтобы точно определить наличие и тип бактерии в моче. Если бактерии в моче обнаруживаются, то доктор назначает специфические антибиотики, воздействующие на эти бактерии.
Часто проводятся дополнительные проверки на наличие заболеваний, передающихся половым путем, так как многие из них могут иметь симптоматику, схожую с циститом.
Пациентам, у которых цистит повторяется неоднократно, требуется более детальное обследование, которое включает в себя: УЗИ мочевой системы и цистоскопию.
Лечение цистита
Любой цистит, который продолжается больше 3 дней, требует лечения и наблюдения у врача. Большинство пациентов отмечают улучшение уже в первые дни лечения правильно подобранными антибиотиками.
Пожилые пациенты, пациенты, страдающие сахарным диабетом, а также пациенты со сниженным иммунитетом, имеют высокие риски восходящей инфекции – поражения почек и других осложнений. Поэтому лечение таких больных нужно начинать незамедлительно.
Поэтому лечение таких больных нужно начинать незамедлительно.
Профилактика цистита
-
гигиена после половых контактов,
-
во время мочеиспускания старайтесь полностью опорожнять мочевой пузырь,
-
если вы чувствуете, что хотите в туалет, не терпите и не откладывайте мочеиспускание,
-
избегайте ношения узких и давящих брюк,
-
носите хлопковое нижнее белье,
-
во время полового акта контролируйте количество любрикации, если ее не достаточно, используйте искусственные любриканты,
-
опорожняйте мочевой пузырь сразу после полового акта.
Дисбактериоз кишечника – Клиника Здоровье 365 г. Екатеринбург
Микробиоцеоз – это сообщество микроорганизмов, обитающих на территориально ограниченном участке с однородными условиями жизни. Бактерии нормальной кишечной флоры живут, прикрепляясь к кишечной стенке и образуя пленку, покрывающую кишечник изнутри. Через эту пленку происходит все всасывание в кишечнике. Бактерии нормальной кишечной микрофлоры обеспечивают по совокупности 50 – 80% всего пищеварения, а также выполняют защитные функции, нейтрализуют действие чужеродных и гнилостных бактерий. Бифидобактерии. Это основные представители нормальной кишечной микрофлоры, количество которых в кишечнике должно быть 95 – 99%. Бифидобактерии выполняют важную работу по расщеплению, перевариванию и всасыванию различных компонентов пищи, например, углеводов; они сами синтезируют витамины, а также способствуют усвоению их из пищи. При участии бифидобактерий происходит всасывание в кишечнике железа, кальция и других важных микроэлементов; нейтрализуют различные токсические вещества. В бланке анализа указывается титр бифидобактерий, который должен быть не меньше 107 – 108. Существенное снижение количества бифидобактерий – признак выраженного дисбактериоза.
Через эту пленку происходит все всасывание в кишечнике. Бактерии нормальной кишечной микрофлоры обеспечивают по совокупности 50 – 80% всего пищеварения, а также выполняют защитные функции, нейтрализуют действие чужеродных и гнилостных бактерий. Бифидобактерии. Это основные представители нормальной кишечной микрофлоры, количество которых в кишечнике должно быть 95 – 99%. Бифидобактерии выполняют важную работу по расщеплению, перевариванию и всасыванию различных компонентов пищи, например, углеводов; они сами синтезируют витамины, а также способствуют усвоению их из пищи. При участии бифидобактерий происходит всасывание в кишечнике железа, кальция и других важных микроэлементов; нейтрализуют различные токсические вещества. В бланке анализа указывается титр бифидобактерий, который должен быть не меньше 107 – 108. Существенное снижение количества бифидобактерий – признак выраженного дисбактериоза.
Лактобактерии (лактобациллы, молочнокислые микробы, молочнокислые стрептококки).
Второй по представительству (5% в совокупности микроорганизмов кишечника) и по значимости представитель нормальной флоры. Лактобактерии или молочнокислые микробы вырабатывают молочную кислоту – важнейший компонент для нормальной работы кишечника. В результатах исследования их количество должно быть не меньше 106 – 107. Дефицит лактобактерий может привести к развитию аллергических заболеваний, запоров, лактазной недостаточности.
Кишечная палочка с нормальной ферментативной активностью (эшерихии).
Третий представитель нормальной флоры. Количество кишечной палочки среди других бактерий не превышает 1%, но роль ее очень важна. Во-первых, кишечная палочка является главным конкурентом условно-патогенной флоры, препятствуя заселению чужеродными микробами кишечной стенки; во-вторых, кишечная палочка забирает из просвета кишечника кислород, который является ядом для бифидобактерий и лактобактерий. Снижение общего количества кишечной палочки может быть признаком присутствия в кишечнике небактериальных паразитов (глистов, простейших, которые также нуждаются в кислороде, обделяя им кишечную палочку). Кишечная палочка со сниженной ферментативной активностью. Это неполноценная кишечная палочка, которая не представляет никакого вреда, но при этом не выполняет своих полезных функций. Присутствие данного показателя в анализе является признаком начинающегося дисбактериоза, а также как и снижение общего количества может быть косвенным признаком присутствия в кишечнике глистов или простейших.
Кишечная палочка со сниженной ферментативной активностью. Это неполноценная кишечная палочка, которая не представляет никакого вреда, но при этом не выполняет своих полезных функций. Присутствие данного показателя в анализе является признаком начинающегося дисбактериоза, а также как и снижение общего количества может быть косвенным признаком присутствия в кишечнике глистов или простейших.
В некоторых анализах описываются бактероиды, роль которых неясна, но известно, что это – не вредные бактерии, обычно их количество не имеет практического значения. Все остальные показатели микрофлоры являются условно-патогенной флорой. Они становятся патогенными (нарушающими нормальные функции кишечника) при определенных условиях: повышение их абсолютного количества или снижении функции иммунной системы.
Условно-патогенная флора – это лактозонегативные энтеробактерии (клебсиелла, протей, цитробактеры, энтеробактеры, гафнии, серрации), гемолизирующая кишечная палочка и различные кокки (энтерококки, эпидермальные или сапрофитные стафилококки, золотистый стафилококк). Кроме того, к условно-патогенным относятся клостридии, которые высеваются не во всех лабораториях. Условно-патогенная флора внедряется, конкурируя с полезными бактериями, в микробную пленку кишечника, заселяет кишечную стенку и вызывает нарушения работы всего желудочно-кишечного тракта. Дисбактериоз кишечника с повышенным содержанием условно-патогенной флоры может сопровождаться аллергическими кожными реакциями, нарушениями стула (запоры, поносы, зелень и слизь в кале), болями в животе, вздутиями живота, срыгиваниями, рвотами.
Кроме того, к условно-патогенным относятся клостридии, которые высеваются не во всех лабораториях. Условно-патогенная флора внедряется, конкурируя с полезными бактериями, в микробную пленку кишечника, заселяет кишечную стенку и вызывает нарушения работы всего желудочно-кишечного тракта. Дисбактериоз кишечника с повышенным содержанием условно-патогенной флоры может сопровождаться аллергическими кожными реакциями, нарушениями стула (запоры, поносы, зелень и слизь в кале), болями в животе, вздутиями живота, срыгиваниями, рвотами.
Кокковые формы в общей сумме микробов.
Самыми безобидными представителями условно-патогенной флоры являются энтерококки. Они наиболее часто встречаются в кишечнике у здоровых людей, их количество до 106 – 107 не представляет угрозы здоровью. Если количество превышает 25% (более 107), это чаще всего связано со снижением нормальной флоры. Эпидермальный (или сапрофитный) стафилококк (S. epidermidis, S. saprophyticus). Эти виды стафилококков могут вызывать нарушения, но их количество до 104 является допустимым. Золотистый стафилококк (S. aureus). Один из самых неприятных (наряду с гемолизирующей кишечной палочкой, протеем и клебсиеллой) представителей условно-патогенной флоры. Даже небольшие его количества могут вызвать выраженные клинические проявления, особенно у детей первых месяцев жизни. Поэтому обычно в нормах, приведенных в бланке анализа, указывается, что его быть не должно (на самом деле допустимы количества, не превышающие 103). Патогенность золотистого стафилококка напрямую зависит от состояния нормальной флоры: чем больше бифидобактерий, лактобактерий и нормальной кишечной палочки, тем меньше вреда от стафилококка. Гемолизирующая кишечная палочка. Является представителем лактозонегативных энтеробактерий, но выделяется отдельно в связи с распространенностью и значимостью. В норме должна отсутствовать. К данному микробу применимо практически все, сказанное про золотистый стафилококк.
saprophyticus). Эти виды стафилококков могут вызывать нарушения, но их количество до 104 является допустимым. Золотистый стафилококк (S. aureus). Один из самых неприятных (наряду с гемолизирующей кишечной палочкой, протеем и клебсиеллой) представителей условно-патогенной флоры. Даже небольшие его количества могут вызвать выраженные клинические проявления, особенно у детей первых месяцев жизни. Поэтому обычно в нормах, приведенных в бланке анализа, указывается, что его быть не должно (на самом деле допустимы количества, не превышающие 103). Патогенность золотистого стафилококка напрямую зависит от состояния нормальной флоры: чем больше бифидобактерий, лактобактерий и нормальной кишечной палочки, тем меньше вреда от стафилококка. Гемолизирующая кишечная палочка. Является представителем лактозонегативных энтеробактерий, но выделяется отдельно в связи с распространенностью и значимостью. В норме должна отсутствовать. К данному микробу применимо практически все, сказанное про золотистый стафилококк.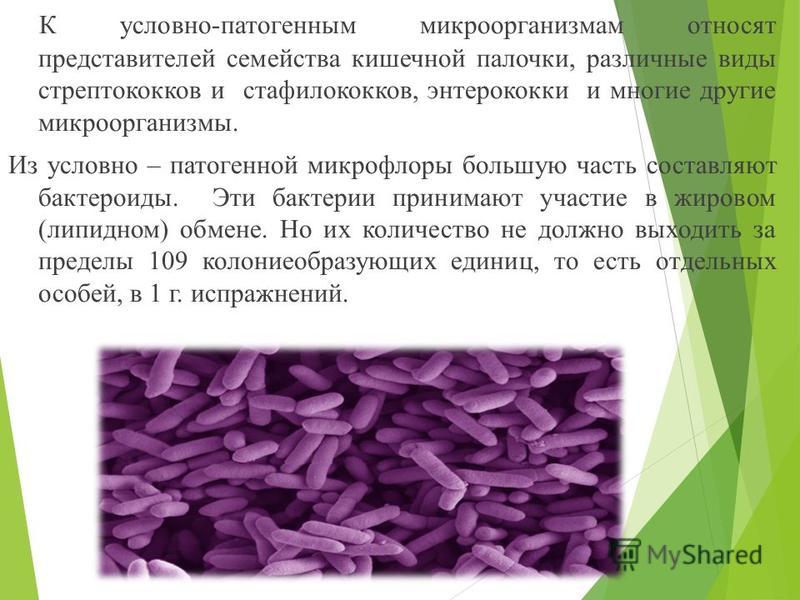 То есть, она может вызывать аллергические и кишечные проблемы, очень распространена в окружающей среде (правда, практически никогда не встречается в грудном молоке), вызывает проблемы у ослабленных детей, требует иммунокоррекции. Следует отметить, что термин “гемолизирующая” не означает, что имеется какое-то влияние на кровь. Лактозонегативные энтеробактерии. Большая группа условно-патогенных бактерий большей или меньшей степени патогенности. Их количество не должно превышать (в титрах: 103 – 106 ). Наиболее неприятными бактериями из этой группы являются протей (чаще всего с ними связаны запоры) и клебсиеллы (являются прямыми антагонистами (конкурентами) лактобактерий, что приводит к развитию аллергии и запоров, а также к проявлениям лактазной недостаточности). Часто в бланке анализа указывается общее количество лактозонегативных энтеробактерий (наиболее информативно процентное соотношение), а затем идет расшифровка: клебсиеллы, протей, хафнии, серрации, энтеробактерии и цитробактерии.
То есть, она может вызывать аллергические и кишечные проблемы, очень распространена в окружающей среде (правда, практически никогда не встречается в грудном молоке), вызывает проблемы у ослабленных детей, требует иммунокоррекции. Следует отметить, что термин “гемолизирующая” не означает, что имеется какое-то влияние на кровь. Лактозонегативные энтеробактерии. Большая группа условно-патогенных бактерий большей или меньшей степени патогенности. Их количество не должно превышать (в титрах: 103 – 106 ). Наиболее неприятными бактериями из этой группы являются протей (чаще всего с ними связаны запоры) и клебсиеллы (являются прямыми антагонистами (конкурентами) лактобактерий, что приводит к развитию аллергии и запоров, а также к проявлениям лактазной недостаточности). Часто в бланке анализа указывается общее количество лактозонегативных энтеробактерий (наиболее информативно процентное соотношение), а затем идет расшифровка: клебсиеллы, протей, хафнии, серрации, энтеробактерии и цитробактерии. Обычно какие-то количества этих бактерий постоянно живут в кишечнике, не вызывая проблем. В нормах могут быть указаны цифры от 104 до 105, являющиеся допустимыми.
Обычно какие-то количества этих бактерий постоянно живут в кишечнике, не вызывая проблем. В нормах могут быть указаны цифры от 104 до 105, являющиеся допустимыми.
Грибы рода Candida.
Допустимо присутствие до 103. Повышение этого параметра может быть после применения антибиотиков. Если количество грибов повышено, а количество нормальной кишечной флоры резко снижено, при этом отмечается кандидоз (молочница) видимых слизистых оболочек (ротовая полость, половые органы) – это проявления системного кандидоза, то есть имеется инфицирование грибами кишечника. Если же количество грибов в анализе на дисбактериоз увеличено, но нет снижения нормальной кишечной флоры, это свидетельствует о том, что грибы живут на коже вокруг заднего прохода, а не в кишечнике, в этом случае достаточно наружной терапии с использованием противогрибковых мазей или кремов.
Клостридии. Допустимое количество до 105.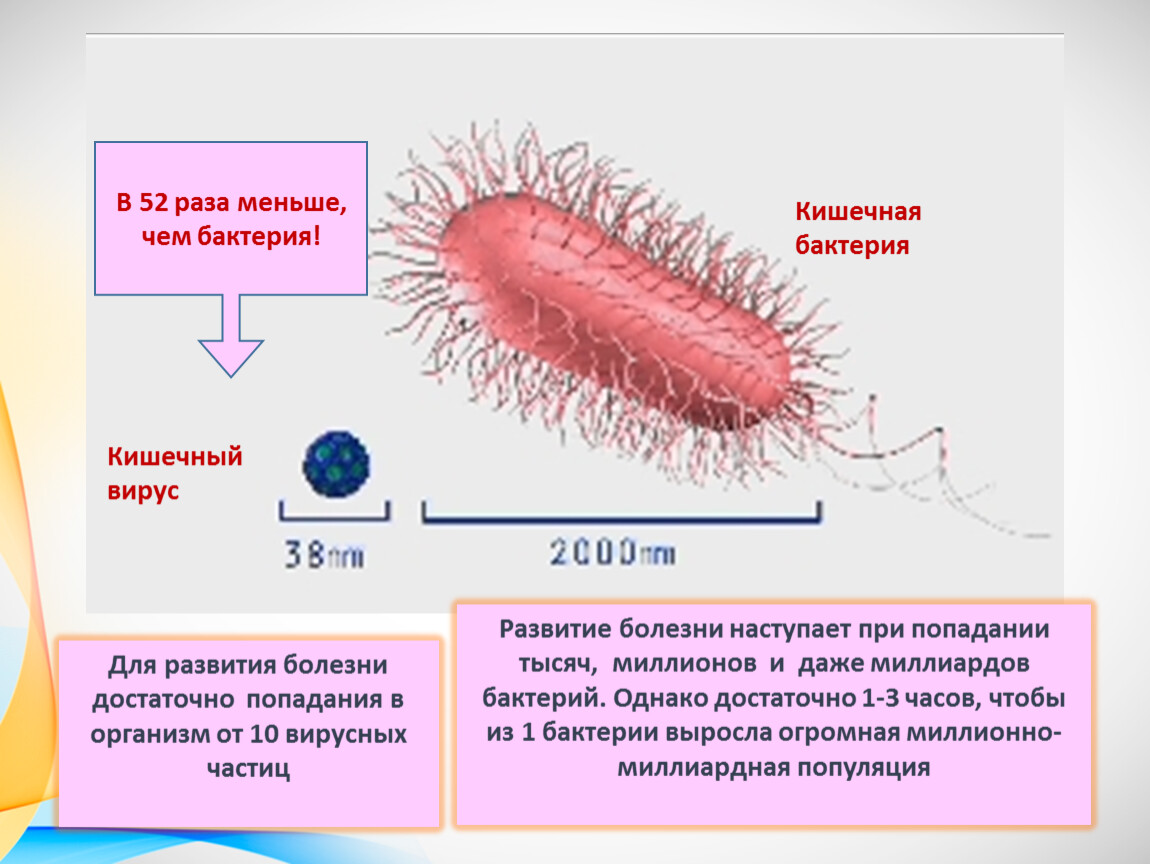 Проявляют патогенность обычно в комплексе с другой условно-патогенной флорой, редко изолированно вызывают проблемы (чаще всего – разжижение стула, понос). Их количество зависит от функции местного иммунитета кишечника.
Проявляют патогенность обычно в комплексе с другой условно-патогенной флорой, редко изолированно вызывают проблемы (чаще всего – разжижение стула, понос). Их количество зависит от функции местного иммунитета кишечника.
Прочие микроорганизмы.
В данном параметре описываются редко встречающиеся виды бактерий, самым опасным из которых является синегнойная палочка (Pseudomonas aerugenosa). Чаще всего, микроорганизмы, описанные в этой позиции, не имеют практического значения. Термин “abs” обозначает отсутствие данного микроорганизма, также употребляется “не обнаружено”.
Кишечная палочка
E. coli – грамотрицательная, факультативная анаэробная палочка, которая является частью нормальной кишечной флоры и легко растет в большинстве питательных сред. E. coli классифицируется на от 150 до 200 серотипов или серогрупп на основе соматических (O), капсульных (K) и жгутиковых (H) антигенов. Только штаммы ограниченного числа серогрупп являются патогенными и классифицируются по категориям или патотипам на основе продуцирования факторов вирулентности. Наиболее важными категориями сельскохозяйственных животных являются энтеротоксигенные E.coli (ETEC), энтеропатогенный E. coli (EPEC), веротоксигенный E. coli (VTEC) и внекишечный патогенный E. coli (ExPEC). ExPEC состоят из септицемической E. coli (SEPEC), некротоксической E. coli (NTEC), патогенной для птиц E. coli (APEC) и несептицемической внекишечной E. coli . Определенные серогруппы O связаны с конкретными проявлениями болезни у каждого вида животных.
Наиболее важными категориями сельскохозяйственных животных являются энтеротоксигенные E.coli (ETEC), энтеропатогенный E. coli (EPEC), веротоксигенный E. coli (VTEC) и внекишечный патогенный E. coli (ExPEC). ExPEC состоят из септицемической E. coli (SEPEC), некротоксической E. coli (NTEC), патогенной для птиц E. coli (APEC) и несептицемической внекишечной E. coli . Определенные серогруппы O связаны с конкретными проявлениями болезни у каждого вида животных.
ETEC
ETEC является наиболее частой причиной E.coli диарея у сельскохозяйственных животных. Эти штаммы продуцируют одну или несколько фимбриальных адгезий и энтеротоксины. Наиболее важными фимбриальными адгезинами ETEC у свиней являются F4 (K88), F5 (K99), F6 (987P), F41 и F18 (F107). Описаны три варианта F4 (K88): ab, ac и ad. Наиболее часто встречающийся вариант – ac. Были описаны два варианта F18, ab и ac. Вариант F18ac чаще всего ассоциируется с ETEC. Изоляты, продуцирующие адгезин F4 (K88) или F18, и некоторые изоляты, продуцирующие F6, демонстрируют гемолиз на кровяном агаре.Все остальные ETEC от свиней негемолитические. Наиболее важными фимбриальными адгезинами ETEC у жвачных животных являются F5 (K99), F41 и F17. Колонии этих изолятов часто бывают более слизистыми и редко демонстрируют гемолиз на кровяном агаре. Энтеротоксины, продуцируемые ETEC, могут быть термостабильными (STa или STb) или термолабильными (LT), а дополнительный термостабильный энтеротоксин, энтероагрегант E. coli энтеротоксин 1 (EAST1), недавно был обнаружен на изолятах ETEC от свиней ( Ямамото и Накадзава, 1997).Наиболее важные патотипы, то есть комбинации факторов вирулентности, перечислены в таблицах ниже.
Были описаны два варианта F18, ab и ac. Вариант F18ac чаще всего ассоциируется с ETEC. Изоляты, продуцирующие адгезин F4 (K88) или F18, и некоторые изоляты, продуцирующие F6, демонстрируют гемолиз на кровяном агаре.Все остальные ETEC от свиней негемолитические. Наиболее важными фимбриальными адгезинами ETEC у жвачных животных являются F5 (K99), F41 и F17. Колонии этих изолятов часто бывают более слизистыми и редко демонстрируют гемолиз на кровяном агаре. Энтеротоксины, продуцируемые ETEC, могут быть термостабильными (STa или STb) или термолабильными (LT), а дополнительный термостабильный энтеротоксин, энтероагрегант E. coli энтеротоксин 1 (EAST1), недавно был обнаружен на изолятах ETEC от свиней ( Ямамото и Накадзава, 1997).Наиболее важные патотипы, то есть комбинации факторов вирулентности, перечислены в таблицах ниже.
EPEC
EPEC обычно ассоциируется с диареей после отъема у свиней.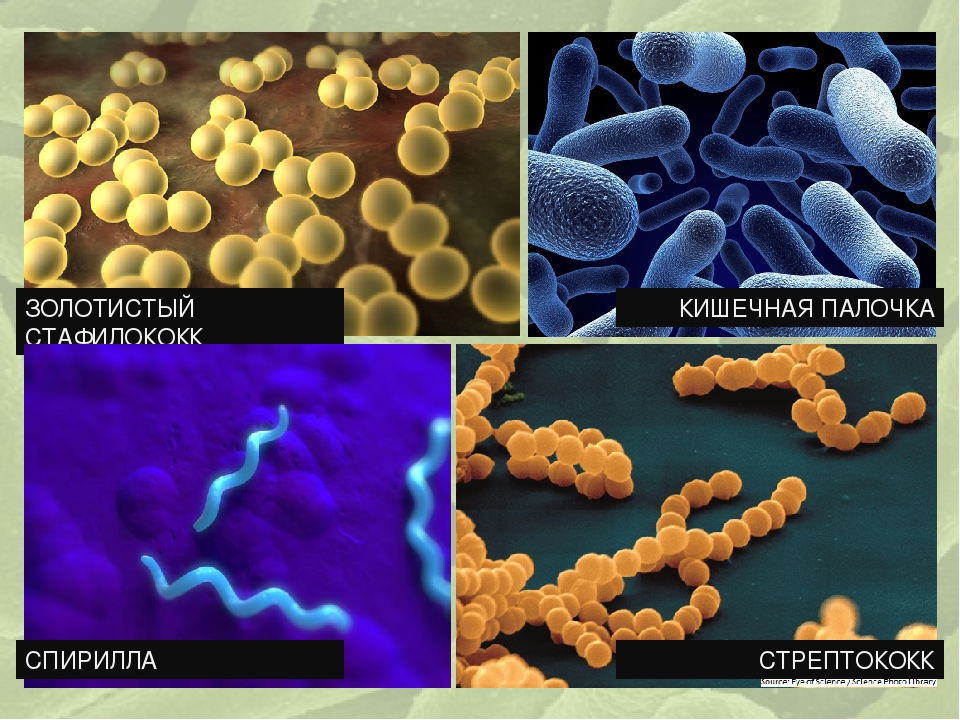 ЕРЕС свиньи плотно прикрепляется к мембране эпителиальных клеток кишечника с помощью бактериального белка внешней мембраны, называемого интимином, или фактором присоединения ЕРЕС (eae). eae взаимодействует с бактериальным рецептором Tir, который продуцируется бактериями и перемещается в мембрану клетки-хозяина бактериальными белками Esp.EPEC свиней, связанный с диареей после отъема, часто принадлежит к серогруппам O45 и O103.
ЕРЕС свиньи плотно прикрепляется к мембране эпителиальных клеток кишечника с помощью бактериального белка внешней мембраны, называемого интимином, или фактором присоединения ЕРЕС (eae). eae взаимодействует с бактериальным рецептором Tir, который продуцируется бактериями и перемещается в мембрану клетки-хозяина бактериальными белками Esp.EPEC свиней, связанный с диареей после отъема, часто принадлежит к серогруппам O45 и O103.
VTEC
Изоляты VTEC от телят продуцируют веротоксин (VT), также называемый шига-подобным токсином (SLT) или шига-токсином (Stx). Эти изоляты продуцируют два разных типа токсинов: VT1 (Stx1) и VT2 (Stx2). Они также крепко прикрепляются к мембране кишечных эпителиальных клеток посредством фактора интимина, или eae, как наблюдается в EPEC. Изоляты VTEC от телят обычно принадлежат к серогруппам O5, O26, O103, O111 и O118 (Fairbrother, 1999a).
org/cet”> VTEC от свиней в основном относятся к серогруппам O138, O139 и O141. Эти изоляты являются гемолитическими на кровяном агаре (Gannon et al., 1988) и продуцируют вариант VT2, называемый VTe (Stx2e). Они не прилипают к эпителию слизистой оболочки, как это наблюдается для EPEC. С другой стороны, многие из этих штаммов продуцируют фимбриальный адгезин F18ab, ранее известный как F107. VTEC от свиней может также продуцировать классические термостабильные (STa, STb) и термолабильные (LT) энтеротоксины и фимбриальный адгезин F4 ETEC (Mainil, 1999).ExPEC
SEPEC и несептикемический внекишечный E. coli обычно обладают системой усвоения железа аэробактина, сопротивляются бактерицидным эффектам комплемента в сыворотке и фагоцитозу, принадлежат к ограниченному числу серогрупп (Blanco et al., 1996) , и часто продуцируют фимбриальные адгезины F17 (Lintermans et al., 1988), CS31A (Girardeau et al. , 1988) (Korth et al., 1991) или P (Brito et al., 1999), S, F165 (Maiti et al., 1994) (Harel et al., 1995) или семейства AFA (Wegmann). Они часто продуцируют колицин V, цитотоксические некротические факторы (CNF) 1 или 2 и токсин, расширяющий цито летальный исход (CDT) (Johnson and Lior, 1988).
, 1988) (Korth et al., 1991) или P (Brito et al., 1999), S, F165 (Maiti et al., 1994) (Harel et al., 1995) или семейства AFA (Wegmann). Они часто продуцируют колицин V, цитотоксические некротические факторы (CNF) 1 или 2 и токсин, расширяющий цито летальный исход (CDT) (Johnson and Lior, 1988).
APEC обычно обладают системой усвоения железа аэробактином, противостоят бактерицидным эффектам комплемента в сыворотке и фагоцитозу, принадлежат к ограниченному количеству серогрупп, в основном O1, O2 и O78, и часто продуцируют фимбриальный адгезин F1. Большинство APEC производят чувствительный к температуре гемагглютинин (Tsh). APEC серогрупп O1 и O2 и некоторые нетипируемые изоляты обладают капсулой K1.APEC, в основном серогрупп O1 и O18, может обладать P-фимбриальным адгезином F11.
Важные категории, патотипы и серогруппы Escherichia coli , вызывающие заболевание свиней.
| Заболевание | Категория | Патотипы | Серогруппы |
| Кишечный колибактериоз | |||
| Неонатальная диарея | ETEC | STa: F41 (K99) , STa: F6 (987P), LT: STb: EAST1: F4ac (K88ac), LT: STb: STa: EAST1: F4ac (K88ac), | O8, O9, O20, O45, O64, O101, O138, O141, O147, O149, O157 |
| Диарея после отъема | ETEC | LT: STb: EAST1: F4ac (K88ac), LT: STb: STa: EAST1: F4ac (K88ac), STa: STb, STa: STb: F18ac, STa: F18ac, LT: STb, STb | O8, O138, O139, O141, O147, O149, O157, O?: K48 |
| EPEC | Eae, Tir, EspA, EspB, EspD, EspC ( энтеротоксин) | O45, O103 | |
| Отечная болезнь | VTEC | VT2e (Stx2e): F18ab, a -гемолизин | O138, O139, O141 |
| Extrai кишечного колибактериоза | |||
| Колисептикемия / полисерозит | SEPEC | Аэробактин, F165-1 (фимбриальное семейство P), F165-2 (фимбриальное семейство S), CNF1 или 2, CDT | 8O , O9, O11, O15, O17, O18, O20, O45, 060, O78, O83, O93, O101, O112, O115, O116 |
| ETEC | LT: STb: F4 (K88), LT: STb: STa: F4 (K88) | O8, O138, O139, O141, O147, O149, O157 | |
| Инфекция мочеполовых путей | UPEC | P, S, аэробактин, CNF1 | O1, O4, O6, O18 |
| Заболевание | Категория | Патотипы | Серогруппы |
| Кишечный колибациллез | |||
| Неонатальная диарея | ETEC | STa: F41 (K99) | O8, O9, O20, O64, O101 |
| Геморрагическая диарея | VTEC | Eae: VT1 (Stx1) и / или VT2 (Stx2) | O5, O8, O20, O26, O103, O111, O118, O118, O145 |
| Внекишечный колибактериоз | |||
| Колисептикемия | SEPEC | P: CNF1F17: CNF2: CDT | O8, O9, O15, O26, O35, O8645, O1078, O1078 O115, O117, O137 |
| Мастит | Эндотоксины, CNF | Разнообразные |
| Заболевание | Категория | Факторы вирулентности | Серогруппы |
| Внекишечный колибактериоз | |||
| Колисептикемия | APEC | Аэробактин, F11 (тип 1 семейство), K1, Tsh, | O1, O2, O8, O15, O18, O35, O78, O88, O109, 0115 |
| Целлюлит | APEC | F1- и P-фимбрии, K1 | O2, O25, O71, O78 |
E.coli
Обзор
Escherichia coli ( E. coli ) – бактерия, которая обычно встречается в кишечнике людей и теплокровных животных. Большинство штаммов E. coli безвредны. Однако некоторые штаммы, такие как продуцирующая токсин шига E. coli (STEC), могут вызывать тяжелые заболевания пищевого происхождения. Он передается людям в первую очередь через употребление зараженных пищевых продуктов, таких как сырые или недоваренные мясные продукты, сырое молоко и зараженные сырые овощи и проростки.
Большинство штаммов E. coli безвредны. Однако некоторые штаммы, такие как продуцирующая токсин шига E. coli (STEC), могут вызывать тяжелые заболевания пищевого происхождения. Он передается людям в первую очередь через употребление зараженных пищевых продуктов, таких как сырые или недоваренные мясные продукты, сырое молоко и зараженные сырые овощи и проростки.
STEC производит токсины, известные как шига-токсины из-за их сходства с токсинами, продуцируемыми Shigella dysenteriae. STEC может расти в диапазоне температур от 7 ° C до 50 ° C, при оптимальной температуре 37 ° C. Некоторые STEC могут расти в кислых продуктах питания до pH 4,4 и в продуктах с минимальной активностью воды ( W ) 0,95.
STEC разрушается при тщательном приготовлении пищи до тех пор, пока все части не достигнут температуры 70 ° C или выше. E. coli O157: H7 – наиболее важный серотип STEC с точки зрения общественного здравоохранения; однако другие серотипы часто участвовали в спорадических случаях и вспышках.
Симптомы
Симптомы заболеваний, вызванных STEC, включают спазмы в животе и диарею, которые в некоторых случаях могут переходить в кровавую диарею (геморрагический колит). Также могут возникать жар и рвота. Инкубационный период может составлять от 3 до 8 дней, в среднем от 3 до 4 дней. Большинство пациентов выздоравливают в течение 10 дней, но у небольшой части пациентов (особенно маленьких детей и пожилых) инфекция может привести к опасному для жизни заболеванию, например, гемолитико-уремическому синдрому (ГУС).ГУС характеризуется острой почечной недостаточностью, гемолитической анемией и тромбоцитопенией (низкий уровень тромбоцитов).
Подсчитано, что у 10% пациентов с инфекцией STEC может развиться ГУС, а летальность составляет от 3 до 5%. В целом ГУС является наиболее частой причиной острой почечной недостаточности у детей раннего возраста. Это может вызвать неврологические осложнения (такие как судороги, инсульт и кома) у 25% пациентов с ГУС и хронические почечные осложнения, обычно легкие, примерно у 50% выживших.
Людям, у которых наблюдается кровавый понос или сильные спазмы в животе, следует обратиться за медицинской помощью. Антибиотики не являются частью лечения пациентов с заболеванием STEC и могут повысить риск последующего ГУС.
Источники и передача
Большая часть доступной информации о STEC относится к серотипу O157: H7, поскольку биохимически он легко дифференцируется от других штаммов E. coli . Резервуаром этого патогена является, в основном, крупный рогатый скот.Кроме того, другие жвачные животные, такие как овцы, козы, олени, считаются значительными резервуарами, в то время как другие млекопитающие (например, свиньи, лошади, кролики, собаки и кошки) и птицы (например, куры и индейки) были обнаружены инфицированными.
E. coli O157: H7 передается человеку в основном через употребление зараженных пищевых продуктов, таких как сырые или недоваренные мясные продукты и сырое молоко. Фекальное загрязнение воды и других пищевых продуктов, а также перекрестное заражение во время приготовления пищи (говядиной и другими мясными продуктами, загрязненными поверхностями и кухонной утварью) также могут привести к заражению. Примеры пищевых продуктов, вызывающих вспышки E. coli O157: H7, включают недоваренные гамбургеры, сушеную салями, непастеризованный яблочный сидр свежего отжима, йогурт и сыр из сырого молока.
Примеры пищевых продуктов, вызывающих вспышки E. coli O157: H7, включают недоваренные гамбургеры, сушеную салями, непастеризованный яблочный сидр свежего отжима, йогурт и сыр из сырого молока.
Растущее число вспышек связано с потреблением фруктов и овощей (включая проростки, шпинат, салат, салат из капусты), причем заражение может быть связано с контактом с фекалиями домашних или диких животных на определенном этапе во время выращивания или обработки.STEC также был изолирован из водоемов (таких как пруды и ручьи), колодцев и желобов, и было обнаружено, что он выживает в течение нескольких месяцев в навозе и отложениях в водоемах. Сообщалось о передаче через воду как из загрязненной питьевой воды, так и из рекреационных вод.
Контакт между людьми – важный путь передачи орально-фекальным путем. Сообщалось о бессимптомном состоянии носительства, когда люди не проявляют клинических признаков заболевания, но способны инфицировать других.Продолжительность выведения STEC составляет около 1 недели или меньше у взрослых, но может быть дольше у детей. Посещение ферм и других мест, где население может напрямую контактировать с сельскохозяйственными животными, также было определено как важный фактор риска заражения STEC.
Посещение ферм и других мест, где население может напрямую контактировать с сельскохозяйственными животными, также было определено как важный фактор риска заражения STEC.
Профилактика
Профилактика инфекции требует мер контроля на всех этапах пищевой цепочки, от сельскохозяйственного производства на ферме до обработки, производства и приготовления пищевых продуктов как на коммерческих предприятиях, так и на домашних кухнях.
Промышленность
Число случаев заболевания можно снизить с помощью различных стратегий смягчения последствий для говяжьего фарша (например, скрининга животных перед убоем для уменьшения попадания большого количества патогенов в среду убоя). Надлежащая гигиеническая практика забоя снижает загрязнение туш фекалиями, но не гарантирует отсутствие STEC в продуктах.
Для сведения микробиологического заражения к минимуму необходимо просвещение рабочих на фермах, скотобойнях и тех, кто занимается производством пищевых продуктов, по вопросам гигиенического обращения с пищевыми продуктами. Единственный эффективный метод устранения STEC из пищевых продуктов – это введение бактерицидной обработки, такой как нагревание (например, приготовление пищи или пастеризация) или облучение.
Единственный эффективный метод устранения STEC из пищевых продуктов – это введение бактерицидной обработки, такой как нагревание (например, приготовление пищи или пастеризация) или облучение.
Домашнее хозяйство
Профилактические меры для инфекции E. coli O157: H7 аналогичны мерам, рекомендованным для других болезней пищевого происхождения. Базовая практика надлежащей гигиены пищевых продуктов, как описано в документе ВОЗ « Пять ключей к более безопасным продуктам питания », может предотвратить передачу патогенов, вызывающих многие болезни пищевого происхождения, а также защитить от болезней пищевого происхождения, вызываемых STEC.
Пять ключей к более безопасному питанию:
- Содержать в чистоте.
- Разделить сырое и приготовленное.
- Тщательно готовьте.
- Храните пищу при безопасной температуре.
- Используйте безопасную воду и сырье.
Такие рекомендации следует выполнять во всех случаях, особенно «тщательно готовить», чтобы центр блюда достиг температуры не менее 70 ° C. Обязательно тщательно мойте фрукты и овощи, особенно если их едят в сыром виде.По возможности овощи и фрукты следует очистить от кожуры. Уязвимые группы населения (например, маленькие дети и пожилые люди) должны избегать употребления сырых или недоваренных мясных продуктов, сырого молока и продуктов из сырого молока.
Обязательно тщательно мойте фрукты и овощи, особенно если их едят в сыром виде.По возможности овощи и фрукты следует очистить от кожуры. Уязвимые группы населения (например, маленькие дети и пожилые люди) должны избегать употребления сырых или недоваренных мясных продуктов, сырого молока и продуктов из сырого молока.
Настоятельно рекомендуется регулярное мытье рук, особенно перед приготовлением пищи или употреблением в пищу и после контакта с туалетом, особенно для людей, которые заботятся о маленьких детях, пожилых людях или лицах с ослабленным иммунитетом, поскольку бактерия может передаваться от человека к человеку, а также через еда, вода и прямой контакт с животными.
Ряд инфекций STEC был вызван контактом с рекреационной водой. Следовательно, также важно защитить такие водные территории, а также источники питьевой воды от отходов животноводства (4).
Производители фруктов и овощей
Программа ВОЗ « Пять ключей к выращиванию более безопасных фруктов и овощей » предоставляет сельским работникам, выращивающим свежие фрукты и овощи для себя, своих семей и для продажи на местных рынках, основные методы предотвращения микробного заражения свежих продуктов во время посадки, выращивания и сбора урожая. и хранение.
и хранение.
Пять ключей к выращиванию более безопасных фруктов и овощей:
- Соблюдайте правила личной гигиены.
- Защищайте поля от заражения фекалиями животных.
- Используйте очищенные фекальные отходы.
- Оценка и управление рисками, связанными с поливной водой.
- Следите за чистотой и сухостью инвентаря для сбора урожая и хранения.
Ответ ВОЗ
ВОЗ предоставляет научные оценки для контроля STEC в пищевых продуктах.Эти оценки служат основой для международных пищевых стандартов, руководств и рекомендаций, разработанных Комиссией Codex Alimentarius.
ВОЗ способствует укреплению систем безопасности пищевых продуктов, продвигая передовую производственную практику и обучая розничных торговцев и потребителей правильному обращению с пищевыми продуктами и предотвращению загрязнения.
Во время вспышек E. coli , например, в Европе в 2011 году, ВОЗ поддерживает координацию обмена информацией и сотрудничества через Международные медико-санитарные правила и Международную сеть органов по безопасности пищевых продуктов (INFOSAN) во всем мире. ВОЗ тесно сотрудничает с национальными органами здравоохранения и международными партнерами, предоставляя техническую помощь и последнюю информацию о вспышках.
ВОЗ тесно сотрудничает с национальными органами здравоохранения и международными партнерами, предоставляя техническую помощь и последнюю информацию о вспышках.
Escherichia coli O157: инфекция H7 (E. coli O157) и гемолитико-уремический синдром (HUS)
Escherichia coli ( E. coli ) – это вид бактерий, который обычно обитает в кишечнике здоровых людей и животных. Идентифицировано более 700 серотипов E. coli .Большинство разновидностей кишечной палочки безвредны или вызывают относительно кратковременную диарею, но некоторые штаммы могут вызывать сильные спазмы в животе, кровавую диарею и рвоту.
Шига-токсин-продуцент
E. coli (STEC) Шига-токсин-продуцент E. coli (STEC)
может также называться продуцирующей вероцитотоксин E. coli (VTEC) или энтерогеморрагической E. coli (EHEC). Штаммы STEC могут вызывать серьезные заболевания у людей, вырабатывая токсины, которые могут серьезно повредить слизистую оболочку кишечника и почек. Заражение штаммами STEC может привести к серьезным осложнениям, таким как гемолитико-уремический синдром (ГУС), который иногда заканчивается летальным исходом.
Заражение штаммами STEC может привести к серьезным осложнениям, таким как гемолитико-уремический синдром (ГУС), который иногда заканчивается летальным исходом.
- Escherichia coli O157: H7 ( E. coli O157)
Информационные бюллетени, симптомы, продолжительность заболевания, осложнения и информация о передаче E. coli O157: H7. - Не-O157: H7 Вырабатывающий токсин шига E. coli
Хотя Э.coli O157: H7 является наиболее часто определяемым типом STEC в США, существует множество других типов шига-токсина E. coli , вызывающих заболевания, иногда называемых «не-O157 STEC».
Подробнее о STEC
Другие формы
E. coli , вызывающие диарейные заболевания- Энтеротоксигенный E. coli (ETEC), продуцирующий другой токсин, является основной бактериальной причиной диареи в развивающихся странах.

- Энтеропатогенный E. coli (EPEC) вызывает стойкую диарею (продолжительностью 2 недели и более). Он передается людям через зараженную воду или контакт с инфицированными животными и широко распространен в развивающихся странах.
- Здоровье
Информация для поставщика медицинских услуг по E. coli и HUS
Требуемая отчетная информация, клинические характеристики, лаборатория диагностика, лечение и многое другое. - CDC: E. coli (Escherichia coli)
Подробнее о E. coli от CDC.
Escherichia coli – обзор
Общие характеристики
Escherichia coli является членом семейства Enterobacteriaceae, которое включает грамотрицательные, факультативно анаэробные палочковидные бактерии (обладающие как ферментативным, так и респираторным метаболизмом), которые не производят фермент оксидазу.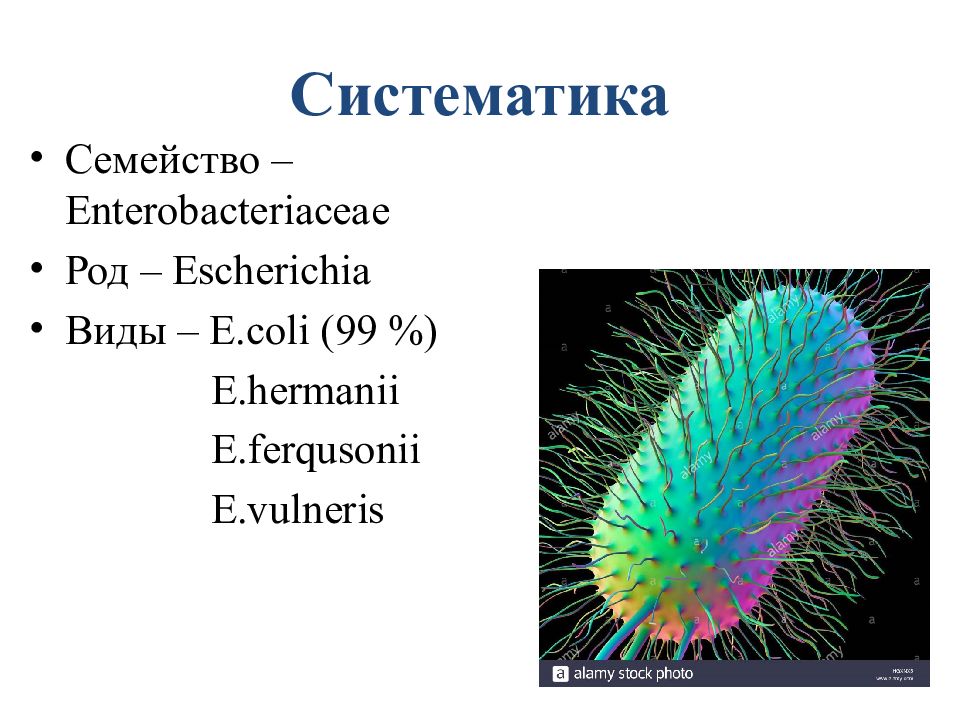 Клетки Escherichia coli обычно имеют ширину 1,1–1,5 мкм, длину 2–6 мкм и представляют собой отдельные прямые стержни. Они могут быть подвижными или неподвижными, и когда они подвижны, образуют латеральные, а не полярные жгутики. Помимо жгутиков, многие штаммы продуцируют другие придатки, такие как фимбрии или пили, которые представляют собой белковые структуры (или придатки или волокна), которые выступают наружу от бактериальной поверхности и играют роль в прикреплении к поверхностям, включая другие клетки или ткани хозяина.
Клетки Escherichia coli обычно имеют ширину 1,1–1,5 мкм, длину 2–6 мкм и представляют собой отдельные прямые стержни. Они могут быть подвижными или неподвижными, и когда они подвижны, образуют латеральные, а не полярные жгутики. Помимо жгутиков, многие штаммы продуцируют другие придатки, такие как фимбрии или пили, которые представляют собой белковые структуры (или придатки или волокна), которые выступают наружу от бактериальной поверхности и играют роль в прикреплении к поверхностям, включая другие клетки или ткани хозяина.
Escherichia coli имеет штамм-специфичные O-липополисахаридные антигены на своей клеточной стенке (в настоящее время распознаются по крайней мере 188 O-антигены) и антигены жгутиков или H, если они присутствуют (распознаются по крайней мере 53 H-типа).Существует также множество различных капсульных полисахаридных (K) антигенов. Escherichia coli серотипированы на основе комбинации антигенов O, H и K, хотя обычно перечислены только типы O и H, например, E. coli O157: H7. Серотипирование E. coli вместе с геномом, вирулентностью и типированием фага является полезным эпидемиологическим инструментом. Полногеномное секвенирование – это метод, который все чаще используется для типирования E. coli и идентификации генов вирулентности.Непатогенные последовательности генома E. coli состоят из 4,6 миллиона оснований, в то время как патогенные изоляты имеют более крупные геномы, составляющие около 5,4 миллиона оснований. Такая геномная информация обеспечивает основу для понимания взаимосвязей между различными патогенными группами E. coli , способности изолятов вызывать заболевание и способности передавать генетический материал, который может привести к появлению новых или более вирулентных типов E. Coli .
coli O157: H7. Серотипирование E. coli вместе с геномом, вирулентностью и типированием фага является полезным эпидемиологическим инструментом. Полногеномное секвенирование – это метод, который все чаще используется для типирования E. coli и идентификации генов вирулентности.Непатогенные последовательности генома E. coli состоят из 4,6 миллиона оснований, в то время как патогенные изоляты имеют более крупные геномы, составляющие около 5,4 миллиона оснований. Такая геномная информация обеспечивает основу для понимания взаимосвязей между различными патогенными группами E. coli , способности изолятов вызывать заболевание и способности передавать генетический материал, который может привести к появлению новых или более вирулентных типов E. Coli .
Escherichia coli тесно связана с Shigella spp., хотя Shigella имеет тенденцию быть менее биохимически активным, чем большинство штаммов E. coli . Shigella и E. coli могут рассматриваться как принадлежащие к одному роду на основании генетического родства, но исторически они оставались отдельными, чтобы не допустить путаницы в медицинском диагнозе.
Shigella и E. coli могут рассматриваться как принадлежащие к одному роду на основании генетического родства, но исторически они оставались отдельными, чтобы не допустить путаницы в медицинском диагнозе.
Escherichia – обзор | ScienceDirect Topics
Таксономия
Escherichia coli таксономически отнесена к роду Escherichia (названному в честь его первооткрывателя Теодора Эшериха), семейству Enterobacteriaceae, отряд Enterobacteriales, класс Gammaproteobacteria, тип Proteobacteria, тип Proteobacteria.В настоящее время род Escherichia включает пять признанных видов: E. albetii, E. coli (типовой вид), E. fergusonii, E. hermanii и E. vulneris . Два бывших вида Escherichia , E. adecarboxylata, и E. blattae, были реклассифицированы как Leclercia adecarboxylata и Shimwellia blattae, соответственно.
На основе его поверхностных антигенов (т. Е. Соматического O-антигена и жгутикового H-антигена) E.coli можно разделить на> 190 серогрупп (серотипов), при этом серотип изолята E. coli определяется конкретной комбинацией O- и H-антигенов (например, O157: H7). Во многих случаях О-антиген (который составляет часть липополисахаридного слоя) «маскируется» термолабильной кислой полисахаридной капсулой (К-антигеном). Определенные серогруппы часто связаны с определенными клиническими синдромами, но некоторые из них могут быть связаны более чем с одной категорией E.coli .
Е. Соматического O-антигена и жгутикового H-антигена) E.coli можно разделить на> 190 серогрупп (серотипов), при этом серотип изолята E. coli определяется конкретной комбинацией O- и H-антигенов (например, O157: H7). Во многих случаях О-антиген (который составляет часть липополисахаридного слоя) «маскируется» термолабильной кислой полисахаридной капсулой (К-антигеном). Определенные серогруппы часто связаны с определенными клиническими синдромами, но некоторые из них могут быть связаны более чем с одной категорией E.coli .
Используя методы генотипирования, E. coli можно разделить на шесть филогенетических групп (A, B1, B2, D, E и Shigella). Несмотря на тесную связь с другими членами E. coli, и, возможно, представляющими клоны E. coli, филогенетическая группа Shigella продолжает рассматриваться как отдельный род Shigella (который включает виды S . dysenteriae , S. flexneri , S.boydii , S. sonnei ) по историческим соображениям.
sonnei ) по историческим соображениям.
В соответствии с патогенным потенциалом E. coli делится на непатогенные и патогенные группы. Хотя непатогенная кишечная палочка существует как комменсал в кишечнике теплокровных животных, иногда она может быть вовлечена в оппортунистические инфекции. Патогенная кишечная палочка вызывает у людей три основных типа заболеваний: инфекция мочевыводящих путей (ИМП, которая иногда может переходить в гемолитико-уремический синдром или ГУС), инфекции крови и центральной нервной системы (сепсис / менингит) и желудочно-кишечные заболевания.
Благодаря уникальному взаимодействию с эукариотическими клетками, механизму адгезии / колонизации, продукции токсинов / факторов вирулентности и клиническим профилям заболевания, патогенные штаммы E. coli далее разделяются на десять патотипов: энтеротоксигенные E. coli (ETEC), энтеропатогенный E. coli (EPEC), энтерогеморрагический E. coli (EHEC), энтероагрегантный E. coli (EAEC), энтероагрегант, продуцирующий шига-токсин E. coli (STEAEC ), энтероинвазивный E.coli (EIEC), диффузно прилипающая E. coli (DAEC), адгезивная инвазивная E. coli (AIEC), уропатогенная E. coli (UPEC) и связанная с менингитом E. coli (MAEC) ( Таблица 1). В совокупности ETEC, EPEC, EHEC, EAEC, STEAEC, EIEC и DAEC известны как диареи E. coli , в то время как AIEC является кишечным патогеном, вызывающим болезнь Крона, одним из симптомов которой может быть диарея.
coli (EHEC), энтероагрегантный E. coli (EAEC), энтероагрегант, продуцирующий шига-токсин E. coli (STEAEC ), энтероинвазивный E.coli (EIEC), диффузно прилипающая E. coli (DAEC), адгезивная инвазивная E. coli (AIEC), уропатогенная E. coli (UPEC) и связанная с менингитом E. coli (MAEC) ( Таблица 1). В совокупности ETEC, EPEC, EHEC, EAEC, STEAEC, EIEC и DAEC известны как диареи E. coli , в то время как AIEC является кишечным патогеном, вызывающим болезнь Крона, одним из симптомов которой может быть диарея.
Таблица 1. Классификация и характеристика E.coli патотипы
| Категория | Серогруппы a | Токсин | Адгезин | Клиническое заболевание |
|---|---|---|---|---|
| Энтеротоксигенный | ||||
| Термолабильный энтеротоксин (LT), термостабильный энтеротоксин (ST), Цитолизин A (ClyA) | Факторы колонизации (CF), адгезин, связанный с A / E свиней (Paa) | Острая водянистая диарея (<5 лет) диарея путешественников | ||
| Энтеропатогенные (EPEC) | O26, O55, O86, O111, O111, O111 O119, O125, O126, O127, O128, O142, O158 | – | Интимин, пили, образующие пучки (BFP) Paa, LPF, Iha, EhaA | Детская диарея |
| Энтерогеморрагический 60, OHEC , O111, O157 | Stx | Intimin, Paa, Tox в B (ToxB), E. coli фактор адгезии (Efa) -1, LPF, аутоагглютинирующий адгезин STEC (Saa), иммуноглобулин-связывающий белок E. coli (EibG), ген A, кодирующий аутотранспортер EHEC (EhaA), белок A внешней мембраны (OmpA), Iha coli фактор адгезии (Efa) -1, LPF, аутоагглютинирующий адгезин STEC (Saa), иммуноглобулин-связывающий белок E. coli (EibG), ген A, кодирующий аутотранспортер EHEC (EhaA), белок A внешней мембраны (OmpA), Iha | Пищевое отравление (геморрагический колит или кровавая диарея, HUS) | |
| Энтероагрегант (EAEC) | O3, O15, O44, O77, O126 | EAEC термостабильный энтеротоксин 1 (EAST1), энтеротоксин Shigella (энтеротоксин Shigella) 1, гемолизин E (HlyE) | Фимбрии совокупной адгезии (AAF) (I, II, III, Hda), локусы токсигенной инвазии A (Tia) | Диарея путешественников, детская диарея |
| Шига-токсин, продуцирующий энтеротоксин-токсин (STEAEC) | O114 | Stx | AAF, IrgA гомолог адгезин (Iha) | Пищевое отравление |
| Энтероинвазивный (EIEC) | O28ac, O29, O112ac, O124, O131416, O143, O143, O143, O143 , О167 | ШЭТ1 / 2 | – | 9 0636 Шигеллез|
| Диффузно прилипающий (DAEC) | O86, O127, O142, O158 (выделенный от детей и содержащий гены Afa / Dr) | – | афимбриальный (Afa) или фимбриальный (Dr) адгезин | Острая диареа (& lt; 5 лет) |
| Адгезивно-инвазивный (AIEC) | O6, O25, O83 | – | Пили типа 1, длинные полярные фимбрии (LPF) | Болезнь Крона с хроническим трансмуральным, сегментарным и обычно гранулематозным воспалением кишечника |
| Уропатогенные (UPEC) | O1, O2, O4, O6, O7, O8, O16, O18, O25, O75, O78, O114, O142, O164, O157 | α-гемолизин, цитозинтоксический некротик фактор 1 | P fimbriae (кодируется pap ), S fimbriae (кодируется sfa ), спайки Afa (кодируется afa ) | Бессимптомная бактериурия, цистит, пиелонефрит | O1, O2, O18, O45, O83 | – | P фимбриальный адгезин, S фимбриальный адгезин | Лихорадка, раздражительность, судороги |
Источники : Clements A, Young JC, N, Франкель Г. Стратегии заражения кишечными патогенными Escherichia coli . Кишечные микробы. 2012; 3: 71–87; Тоцика М. и др. Уропатогенная инфекция мочевыводящих путей, опосредованная Escherichia coli . Текущие цели в отношении лекарственных средств, 2012 г .; 13: 1386–99; Смит EJ, Томпсон AP, О’Дрисколл A, Кларк DJ. Патогенез адгезивно-инвазивной Escherichia coli . Будущая микробиология 2013; 8: 1289–300.
Стратегии заражения кишечными патогенными Escherichia coli . Кишечные микробы. 2012; 3: 71–87; Тоцика М. и др. Уропатогенная инфекция мочевыводящих путей, опосредованная Escherichia coli . Текущие цели в отношении лекарственных средств, 2012 г .; 13: 1386–99; Смит EJ, Томпсон AP, О’Дрисколл A, Кларк DJ. Патогенез адгезивно-инвазивной Escherichia coli . Будущая микробиология 2013; 8: 1289–300.
Интересно, что в то время как некоторые диареи E. coli предпочитают редко колонизированную тонкую кишку в качестве предпочтительного места заражения (ETEC, EPEC), другие применяют свои патогенные стратегии на уровне слизистой оболочки толстой кишки (EIEC, EHEC и, возможно, EAEC). , в более интимной близости к энтероциту, чем непатогенная флора.Кроме того, в то время как EHEC, EPEC и EIEC полагаются на систему секреции типа 3 (T3SS) для транслокации бактериальных белков (известных как эффекторы) непосредственно в эукариотическую клетку-хозяин, чтобы нарушить процессы в клетке-хозяине, ETEC, EAEC, STEAEC, DAEC и AIEC являются патотипы, не связанные с T3SS, которые обладают сравнительно простыми и эффективными молекулярными механизмами вирулентности, требующими эффективных факторов колонизации с последующей секрецией токсинов, которые впоследствии попадают в клетку-хозяин.
Краткий обзор Escherichia coli O157: H7 и его плазмиды O157
J Microbiol Biotechnol.Авторская рукопись; доступно в PMC 2013 6 мая.
Опубликован в окончательной редакции как:
J Microbiol Biotechnol. 2010 Янв; 20 (1): 5–14.
PMCID: PMC3645889
NIHMSID: NIHMS464337
Джи Юн Лим
1 Кафедра микробиологии, молекулярной биологии и биохимии, Университет Айдахо, Москва, Айдахо 83844, США
Группа передовых кадров и исследований в области медицины (BK21), Медицинский факультет Университета Конкук, Сеул 143-701, КореяКэролайн Дж.Ховде
1 Кафедра микробиологии, молекулярной биологии и биохимии, Университет Айдахо, Москва, Айдахо 83844, США
1 Кафедра микробиологии, молекулярной биологии и биохимии, Университет Айдахо, Москва, Айдахо 83844, США
2 Группа передовых кадров и исследований в области медицины (BK21), Медицинский факультет Университета Конкук, Сеул 143-701, Корея
См. Другие статьи в PMC, в которых цитируется опубликованная статья.
Другие статьи в PMC, в которых цитируется опубликованная статья.Abstract
Энтерогеморрагический Escherichia coli O157: H7 – основной патоген пищевого происхождения, вызывающий тяжелые заболевания людей во всем мире. Здоровый крупный рогатый скот является резервуаром E. coli O157: H7, а корма для крупного рогатого скота и свежие продукты, загрязненные бычьими отходами, являются наиболее частыми источниками вспышек заболеваний в Соединенных Штатах . E. coli O157: H7 также хорошо выживает в окружающей среде. Для способности вызывать болезни человека, колонизировать желудочно-кишечный тракт крупного рогатого скота и выживать в окружающей среде требуется E.coli O157: H7 адаптироваться к самым разным условиям. Были идентифицированы три основных фактора вирулентности E. coli O157: H7, включая токсины Шига, продукты острова патогенности, называемые локусом сглаживания энтероцитов, и продукты F-подобной плазмиды pO157. Среди этих факторов вирулентности роль pO157 изучена меньше всего. В этом обзоре представлен обзор платы E. coli O157: H7 с акцентом на pO157.
В этом обзоре представлен обзор платы E. coli O157: H7 с акцентом на pO157.
Ключевые слова: E.coli O157: H7, pO157
Escherichia coli O157: H7Escherichia coli
Escherichia coli ( E. coli ) представляет собой грамотрицательный палочковидный факультативный бактериальный ана. Этот микроорганизм был впервые описан Теодором Эшерихом в 1885 году. Большинство штаммов E. coli безвредно колонизируют желудочно-кишечный тракт людей и животных как нормальная флора. Однако есть некоторые штаммы, которые превратились в патогенные E.coli путем приобретения факторов вирулентности через плазмиды, транспозоны, бактериофаги и / или острова патогенности. Эти патогенные E. coli можно разделить на категории на основе серогрупп, механизмов патогенности, клинических симптомов или факторов вирулентности [33, 47]. Среди них энтерогеморрагическая E. coli (EHEC) определяется как патогенные штаммы E. coli , которые продуцируют токсины Шига (Stxs) и вызывают геморрагический колит (HC) и опасные для жизни последствия гемолитико-уремического синдрома (HUS) у людей. .Некоторые серотипы в EHEC часто связаны с заболеваниями человека, такими как O26: h21, O91: h31, O111: H8, O157: NM и O157: H7 [44, 51]. E. coli O157: H7 – наиболее часто выделяемый серотип EHEC у больных в Соединенных Штатах, Японии и Соединенном Королевстве, и он является предметом настоящего обзора.
coli , которые продуцируют токсины Шига (Stxs) и вызывают геморрагический колит (HC) и опасные для жизни последствия гемолитико-уремического синдрома (HUS) у людей. .Некоторые серотипы в EHEC часто связаны с заболеваниями человека, такими как O26: h21, O91: h31, O111: H8, O157: NM и O157: H7 [44, 51]. E. coli O157: H7 – наиболее часто выделяемый серотип EHEC у больных в Соединенных Штатах, Японии и Соединенном Королевстве, и он является предметом настоящего обзора.
История
Серотип EHEC O157: H7 был впервые признан в 1982 г. как патоген человека, связанный со вспышками кровавой диареи в Орегоне и Мичигане, США [57, 71], а также был связан со спорадическими случаями ГУС в 1983 г. [34] .С тех пор в Соединенных Штатах было зарегистрировано множество вспышек, связанных с EHEC, и E. coli O157: H7 стала одним из наиболее важных патогенов пищевого происхождения.
Распространенность и экономические затраты
Центры по контролю и профилактике заболеваний (CDC) подсчитали, что инфекции E. coli O157: H7 вызывают 73 000 заболеваний, 2200 госпитализаций и 60 смертей ежегодно в Соединенных Штатах [43]. Согласно данным эпиднадзора за вспышками от CDC, E.coli O157: число случаев инфицирования H7 уменьшается после пика в 1999 году. Однако крупные вспышки и спорадические случаи продолжают иметь место. Ежегодная стоимость болезни, вызванной инфекциями E. coli O157: H7, составила 405 миллионов долларов, включая потерю производительности, медицинское обслуживание и преждевременную смерть [21]. Высокая стоимость болезни требует дополнительных усилий по борьбе с этим возбудителем.
coli O157: H7 вызывают 73 000 заболеваний, 2200 госпитализаций и 60 смертей ежегодно в Соединенных Штатах [43]. Согласно данным эпиднадзора за вспышками от CDC, E.coli O157: число случаев инфицирования H7 уменьшается после пика в 1999 году. Однако крупные вспышки и спорадические случаи продолжают иметь место. Ежегодная стоимость болезни, вызванной инфекциями E. coli O157: H7, составила 405 миллионов долларов, включая потерю производительности, медицинское обслуживание и преждевременную смерть [21]. Высокая стоимость болезни требует дополнительных усилий по борьбе с этим возбудителем.
Выделение и идентификация
E. coli O157: H7 экспрессирует соматический (O) антиген 157 и антиген жгутиков (H) 7. E. coli O157: H7 имеет уникальные особенности отсроченной ферментации D-сорбита (> 24 ч) и неспособности продуцировать β-глюкуронидазу, которая может гидролизовать синтетическую молекулу, 4-метил-умбеллиферил-D-глюкуронид (MUG) [ 68]. Таким образом, агар Sorbitol MacConkey (SMAC) с добавлением MUG был использован для обнаружения E. coli O157: H7. Для повышения селективности в отношении E. coli O157: H7, цефиксим, теллурит калия и ванкомицин были добавлены в чашки с агаром SMAC для подавления другой грамотрицательной флоры.Серотипы O157 и H7 могут быть дополнительно подтверждены коммерчески доступным анализом латексной агглютинации.
Таким образом, агар Sorbitol MacConkey (SMAC) с добавлением MUG был использован для обнаружения E. coli O157: H7. Для повышения селективности в отношении E. coli O157: H7, цефиксим, теллурит калия и ванкомицин были добавлены в чашки с агаром SMAC для подавления другой грамотрицательной флоры.Серотипы O157 и H7 могут быть дополнительно подтверждены коммерчески доступным анализом латексной агглютинации.
Геномная организация
Размер хромосомы E. coli O157: H7 составляет 5,5 Мб. Этот геном включает последовательность из 4,1 млн п.н., консервативную во всех штаммах E. coli . Остальные специфичны для E. coli O157: H7 [53]. Кроме того, сравнение генома E. coli O157: H7 с непатогенным E. coli K12 показывает, что 0.53 МБ ДНК отсутствуют для E. coli O157: H7, что позволяет предположить, что уменьшение генома также сыграло роль в эволюции E. coli O157: H7 [17, 53]. Большинство последовательностей ДНК E. coli O157: H7 (1,4 МБ) представляют собой горизонтально переносимые чужеродные ДНК, такие как профаг и профагоподобные элементы. E. coli O157: H7 содержит 463 фаг-ассоциированных гена по сравнению с 29 в E. coli K-12 [72]. Изменение содержания G + C является одним из признаков того, что геномная область была получена путем горизонтального переноса, и Putonti et al. [55] подсчитал, что по крайней мере 53 различных вида внесли вклад в эти уникальные последовательности в E. coli O157: H7. Связанные с вирулентностью гены между двумя секвенированными штаммами E. coli O157: H7 почти идентичны (99%). Очевидно, как приобретение, так и потеря ДНК сыграли важную роль в эволюции патогенеза E. coli O157: H7.
coli O157: H7 (1,4 МБ) представляют собой горизонтально переносимые чужеродные ДНК, такие как профаг и профагоподобные элементы. E. coli O157: H7 содержит 463 фаг-ассоциированных гена по сравнению с 29 в E. coli K-12 [72]. Изменение содержания G + C является одним из признаков того, что геномная область была получена путем горизонтального переноса, и Putonti et al. [55] подсчитал, что по крайней мере 53 различных вида внесли вклад в эти уникальные последовательности в E. coli O157: H7. Связанные с вирулентностью гены между двумя секвенированными штаммами E. coli O157: H7 почти идентичны (99%). Очевидно, как приобретение, так и потеря ДНК сыграли важную роль в эволюции патогенеза E. coli O157: H7.
Evolution
Несколько сравнительных и эпидемиологических исследований показывают, что E. coli O157: H7, возможно, произошли от нетоксигенного и менее вирулентного штамма E.coli O55: H7 [72].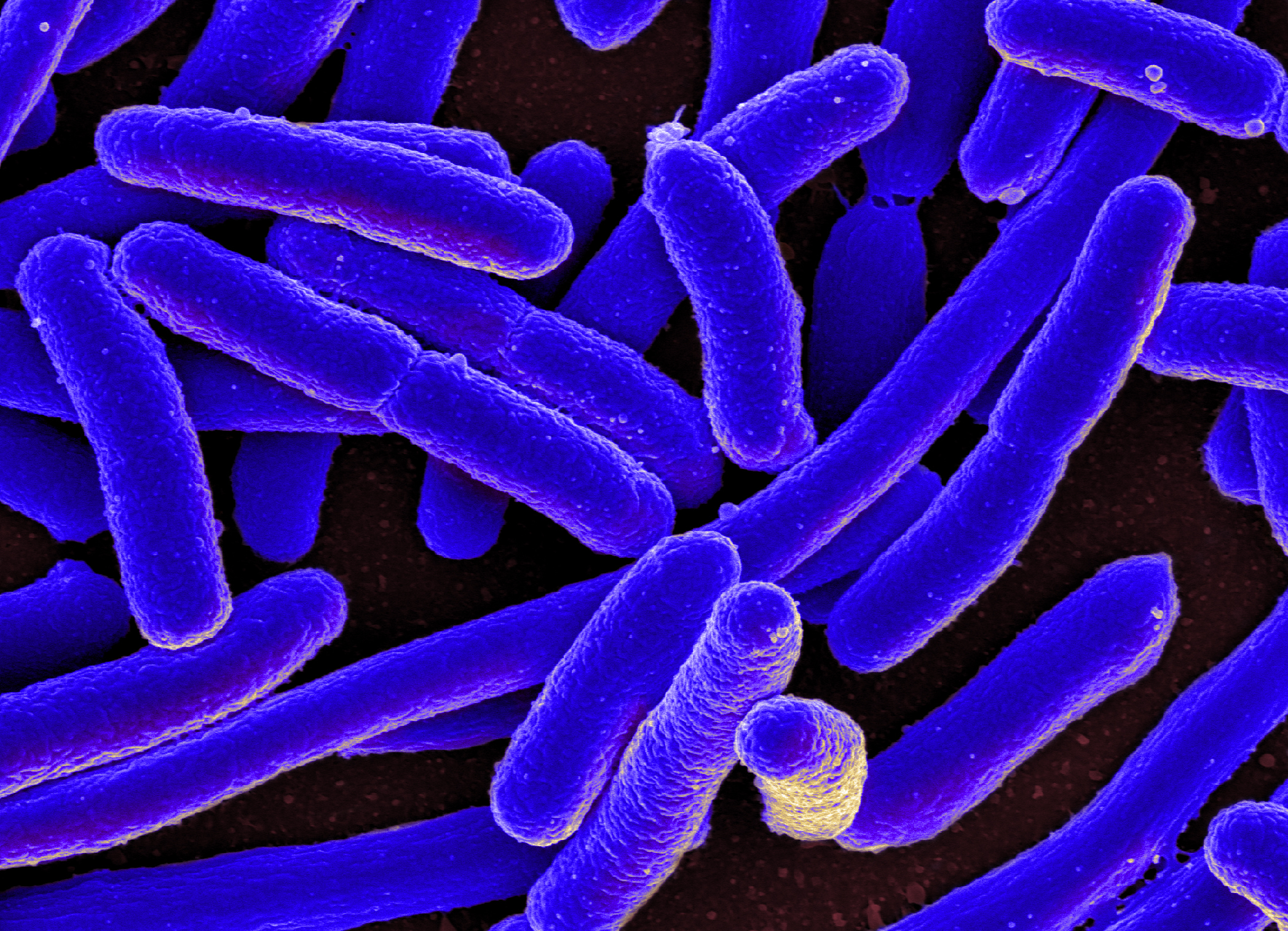 E. coli O15: H7 возник в результате четырех последовательных событий; (i) приобретение stx2-содержащего бактериофага, (ii) приобретение pO157 и области rfb , (iii) приобретение stx1-содержащего бактериофага и (iv) потеря способности ферментировать D-сорбитол и потеря активности бета-глюкуронидазы (ГУД).
E. coli O15: H7 возник в результате четырех последовательных событий; (i) приобретение stx2-содержащего бактериофага, (ii) приобретение pO157 и области rfb , (iii) приобретение stx1-содержащего бактериофага и (iv) потеря способности ферментировать D-сорбитол и потеря активности бета-глюкуронидазы (ГУД).
Резервуар для животных
Крупный рогатый скот является основным резервуаром E. coli O157: H7, и этот резервуарный хозяин обычно бессимптомен при переносе этого микроорганизма.У молодых телят этого серотипа наблюдаются редкие случаи диарейного заболевания. Доля выпаса скота в любой момент времени варьируется. Было обнаружено, что овцы, козы, свиньи и индейки выделяют E. coli O157: H7 с фекалиями.
Молекулярное подтипирование
Для улучшения понимания эпидемиологии вспышек E. coli O157: H7 были разработаны различные методы молекулярного подтипирования. Эти методы включают гель-электрофорез в импульсном поле (PFGE), полиморфизмы длины рестрикционных фрагментов (RFLP), полиморфизмы длины амплифицированных фрагментов (AFLP) и фаговое типирование [65, 73]. Среди них метод PFGE был стандартизирован CDC и успешно применяется для распознавания связанных со вспышкой, спорадических или неродственных инфекций с 1993 г. [3].
Среди них метод PFGE был стандартизирован CDC и успешно применяется для распознавания связанных со вспышкой, спорадических или неродственных инфекций с 1993 г. [3].
Инфекция
E. coli O157: Инфекция H7 – серьезная проблема общественного здравоохранения в Северной Америке, Европе и других регионах мира. Хотя общее число случаев заражения E. coli O157: H7 ниже, чем у других кишечных патогенов, таких как Salmonella или Campylobacter spp., болезни, вызванные E. coli O157: H7, показали гораздо более высокие показатели госпитализации и летальности [43]. Инфекция человека, вызванная E. coli O157: H7, может иметь широкий клинический спектр – от бессимптомных случаев до смерти. Большинство случаев начинаются с диареи без крови и проходят самостоятельно без дальнейших осложнений. Однако у некоторых пациентов кровавый понос или ГК прогрессируют через 1-3 дня. У 5–10% пациентов с ГК заболевание может прогрессировать до опасных для жизни последствий, ГУС или тромбоцитопенической пурпуры (ТТП) [1].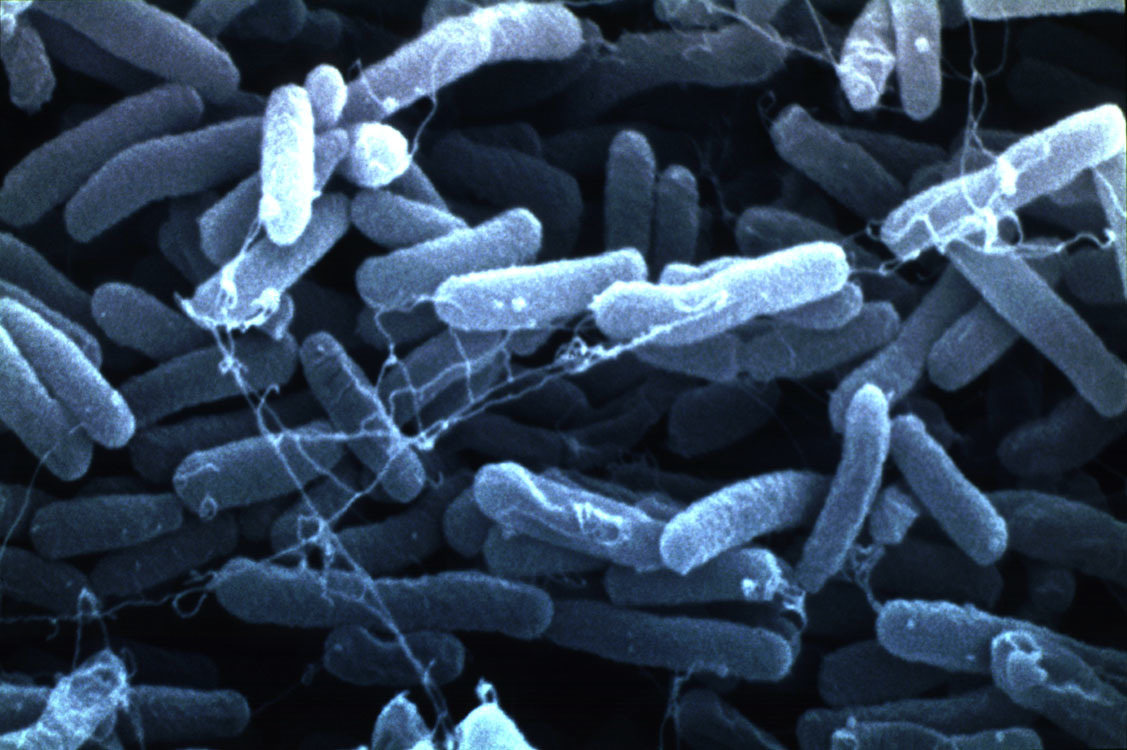 E. coli O157: H7 – наиболее частая причина ГУС в Соединенных Штатах. Дети и пожилые люди подвержены повышенному риску серьезных клинических симптомов, таких как ГУС.
E. coli O157: H7 – наиболее частая причина ГУС в Соединенных Штатах. Дети и пожилые люди подвержены повышенному риску серьезных клинических симптомов, таких как ГУС.
Было изучено несколько терапевтических стратегий, включая использование антибиотиков и вакцинацию. Однако специфического лечения инфекции E. coli O157: H7 не существует, и использование антибиотиков может быть противопоказано. Таким образом, лечение в основном является поддерживающим, чтобы ограничить продолжительность симптомов и предотвратить системные осложнения.Учитывая этот статус, необходимы высокоэффективные меры по профилактике и контролю инфекций E. coli O157: H7 и борьбы с ними.
Передача
В Соединенных Штатах наиболее частый путь передачи инфекций E. coli O157: H7 – через потребление зараженных продуктов питания и воды [56]. Однако он также может передаваться напрямую от человека к человеку, особенно в детских дошкольных учреждениях, и от животного к человеку. Были зарегистрированы случаи заражения людей, посещавших контактные зоопарки, молочные фермы или лагеря, где ранее пасся крупный рогатый скот [28, 31].Недавно сообщалось о возможной передаче инфекции воздушным путем в зараженном здании, где находится экспонат с животными [70]. Из 350 вспышек, о которых было сообщено в CDC с 1982 по 2002 гг., Пути передачи были определены через пищевые (52%), неизвестные (21%), от человека к человеку (14%), через воду (9%) и при контакте с животными ( 3%) [56]. Модель передачи E. coli O157: H7, обновленная по диаграмме Gansheroff и O’Brien [23], показана на. Эти различные пути передачи можно объяснить очень низкой инфекционной дозой (~ 50 КОЕ) E.coli O157: H7.
Были зарегистрированы случаи заражения людей, посещавших контактные зоопарки, молочные фермы или лагеря, где ранее пасся крупный рогатый скот [28, 31].Недавно сообщалось о возможной передаче инфекции воздушным путем в зараженном здании, где находится экспонат с животными [70]. Из 350 вспышек, о которых было сообщено в CDC с 1982 по 2002 гг., Пути передачи были определены через пищевые (52%), неизвестные (21%), от человека к человеку (14%), через воду (9%) и при контакте с животными ( 3%) [56]. Модель передачи E. coli O157: H7, обновленная по диаграмме Gansheroff и O’Brien [23], показана на. Эти различные пути передачи можно объяснить очень низкой инфекционной дозой (~ 50 КОЕ) E.coli O157: H7.
Передача E. coli O157: H7.
Здоровый крупный рогатый скот является основным резервуаром E. coli O157: H7 и временно переносит этот микроорганизм без симптомов. Загрязненные продукты из крупного рогатого скота и зерновые культуры являются преобладающими источниками инфекций среди людей.
Крупный рогатый скот является естественным резервуаром E. coli O157: H7. От 1% до 50% здорового крупного рогатого скота в любой момент времени переносят и выделяют E. coli O157: H7 с фекалиями [13, 18, 27].Загрязненный говяжий фарш является наиболее частым переносчиком вспышек E. coli O157: H7. Продукты из говядины могут быть заражены во время убоя, а в процессе измельчения говядины патогенные микроорганизмы могут переноситься с поверхности мяса внутрь. Таким образом, если говяжий фарш приготовлен не полностью, бактерии могут выжить. Кроме того, существует множество загрязненных пищевых продуктов, кроме говяжьего фарша, которые были связаны с случаев заражения E. coli O157: H7, включая непастеризованное молоко, питьевую воду, салями, вяленое мясо говядины и свежие продукты, такие как салат, редис. ростки, свежий шпинат и яблочный сидр.Самая крупная вспышка была связана с заражением проростков редиса (1996 г.) в Осаке, Япония, где у 7 966 человек были диагностированы подтвержденные инфекции [45]. Эпидемиологические исследования показывают, что эти пищевые продукты были заражены фекалиями крупного рогатого скота. Таким образом, предотвращение заражения крупного рогатого скота E. coli O157: H7 может быть одним из наиболее важных методов борьбы. Для борьбы с E. coli O157: H7 на ферме было предложено усовершенствовать методы содержания крупного рогатого скота, выявить подавляющие корма, иммунизацию, использовать кормовые добавки и использовать пробиотические культуры.
Эпидемиологические исследования показывают, что эти пищевые продукты были заражены фекалиями крупного рогатого скота. Таким образом, предотвращение заражения крупного рогатого скота E. coli O157: H7 может быть одним из наиболее важных методов борьбы. Для борьбы с E. coli O157: H7 на ферме было предложено усовершенствовать методы содержания крупного рогатого скота, выявить подавляющие корма, иммунизацию, использовать кормовые добавки и использовать пробиотические культуры.
Кислотостойкость
E. coli O157: H7 Кислотостойкость (AR) – это способность бактерий защищаться от чрезвычайно низкого pH ( coli O157: H7, что делает эту бактерию очень заразной.
coli O157: H7, что делает эту бактерию очень заразной.
В различных исследованиях сообщалось об AR штаммов E. coli O157: H7 [5, 12]. Эти исследования определили три эффективных системы AR. Первая система AR требует альтернативного сигма-фактора RpoS и репрессии глюкозы. Мутант rpoS из E. coli O157: H7 выделялся в меньших количествах у экспериментально инфицированных мышей и телят.Вторая система AR требует добавления аргинина во время воздействия кислой среды. Об аргининдекарбоксилазе ( adiA ) и регуляторе adiA ( cysB ) сообщалось во второй системе AR. Третья система AR требует глутамата для защиты в условиях низкого pH. Основные компоненты этой системы AR включают два изофермента глутаматдекарбоксилазы ( gadA или gadB) и предполагаемый антипортер глутамата γ-аминомасляной кислоты ( gadC ).В то время как только одна из двух глутаматдекарбоксилаз необходима для защиты при pH 2,5, оба изофермента глутаматдекарбоксилазы необходимы при pH 2,0. Предыдущие результаты показали, что глутамат-зависимый АР является наиболее эффективной защитой при pH 2,0 в сложной среде. E. coli O157: H7 обладает тремя перекрывающимися системами AR, но контроль и требования к активности AR различны в каждой системе AR.
Предыдущие результаты показали, что глутамат-зависимый АР является наиболее эффективной защитой при pH 2,0 в сложной среде. E. coli O157: H7 обладает тремя перекрывающимися системами AR, но контроль и требования к активности AR различны в каждой системе AR.
Помимо этих трех систем AR, несколько белков, участвующих в AR E.coli O157: H7. Эти белки включают шаперон HdeA, белок, связанный с РНК-полимеразой SspA, и ДНК-связывающий белок Dps. Более того, было показано, что изменения в мембране клеточной стенки или продукции толстой кишки связаны с успешным AR. Таким образом, E. coli O157: H7 использует различные системы AR, основанные на типе естественной кислой среды.
Колонизация крупного рогатого скота
E. coli O157: H7 естественным образом колонизирует желудочно-кишечный тракт крупного рогатого скота и слизистую оболочку, насыщенную лимфоидными фолликулами, в конечной части прямой кишки, называемой слизистой оболочкой прямой кишки (RAJ), известной как основное место. колонизации крупного рогатого скота [39, 48].
колонизации крупного рогатого скота [39, 48].
Три различных паттерна носительства E. coli O157: H7 у крупного рогатого скота были описаны ранее [14, 39, 58]. Во-первых, животные могут быть временно положительными в культуре в течение коротких периодов в несколько дней и считаются пассивными шеддерами и, вероятно, не колонизируются на слизистой оболочке RAJ. Во-вторых, крупный рогатый скот может колонизироваться и выделять бактерии в среднем в течение 1 месяца и обычно не дольше 2 месяцев. В-третьих, несколько редких животных колонизируются в течение длительного времени и выделяют бактерии от 3 до 12 месяцев или дольше.Эта уникальная ситуация, в которой у нескольких животных развивается длительная колонизация (> 2 месяцев) E. coli O157: H7, вероятно, связана с бактериальной ассоциацией на слизистой оболочке RAJ; однако это может быть связано с уникальной колонизацией бактериями определенного участка (а) в дополнение к слизистой оболочке RAJ.
Возраст, диета и иммунитет отдельных особей крупного рогатого скота также потенциально могут влиять на колонизацию бактерий. Cray and Moon [14] сообщили, что телята выделяют E. coli на O157: H7 дольше, чем взрослый крупный рогатый скот при таком же уровне E.coli O157: H7.
Cray and Moon [14] сообщили, что телята выделяют E. coli на O157: H7 дольше, чем взрослый крупный рогатый скот при таком же уровне E.coli O157: H7.
Снижение уровня носительства E. coli O157: H7 у крупного рогатого скота как основного источника инфекции E. coli O157: H7 могло бы сыграть ключевую роль в снижении риска заражения человека. Понимание факторов колонизации E. coli O157: H7 будет необходимо для разработки эффективных стратегий снижения или предотвращения носительства E. coli O157: H7 у крупного рогатого скота.
Экологическое выживание
E.coli O157: H7 может выживать и сохраняться в различных средах, таких как почва, вода и пища, а также в резервуарах для животных (). E. coli O157: H7, как было показано, выживает в течение года в почве, обработанной навозом, и в течение 21 месяца в необработанном навозе, который не подвергался компостированию [30]. Компостирование навоза эффективно для уничтожения E. coli O157: H7, если температура поддерживается выше 50 ° C в течение 6 дней. E. coli O157: H7 может долгое время выживать в воде, особенно при низких температурах.Отложения в водоемах, загрязненные фекалиями крупного рогатого скота, могут служить долгосрочным (> 8 месяцев) резервуаром для E. coli O157: H7, а выжившие бактерии в загрязненных желобах являются источником инфекции [38]. Баркер и др. . [2] показали, что E. coli O157: H7 выживает и реплицируется в Acanthamoeba polyphaga. A. polyphaga – обычное простейшее в окружающей среде, широко распространенное в почве, воде и фекалиях. Таким образом, это может быть эффективный трансмиссионный автомобиль E.coli O157: H7 в этих средах.
coli O157: H7, если температура поддерживается выше 50 ° C в течение 6 дней. E. coli O157: H7 может долгое время выживать в воде, особенно при низких температурах.Отложения в водоемах, загрязненные фекалиями крупного рогатого скота, могут служить долгосрочным (> 8 месяцев) резервуаром для E. coli O157: H7, а выжившие бактерии в загрязненных желобах являются источником инфекции [38]. Баркер и др. . [2] показали, что E. coli O157: H7 выживает и реплицируется в Acanthamoeba polyphaga. A. polyphaga – обычное простейшее в окружающей среде, широко распространенное в почве, воде и фекалиях. Таким образом, это может быть эффективный трансмиссионный автомобиль E.coli O157: H7 в этих средах.
Экологическая схема E. coli O157: H7.
Желудочно-кишечный тракт.
Чтобы выжить в разнообразных средах, E. coli O157: H7 требует способности адаптироваться к колебаниям или резким изменениям температуры, pH и осмолярности, которые обычно встречаются в природе. Например, продукция экзополисахаридов (EPS) E. coli O157: H7 связана с устойчивостью к теплу и кислоте, а изменение липидного состава мембран вызвано тепловым стрессом [77].
Например, продукция экзополисахаридов (EPS) E. coli O157: H7 связана с устойчивостью к теплу и кислоте, а изменение липидного состава мембран вызвано тепловым стрессом [77].
Эти экологические адаптации E. coli O157: H7 играют важную роль в сохранении и распространении этого микроорганизма на фермах и в увеличивающейся передаче от крупного рогатого скота к крупному рогатому скоту. Кроме того, способность выживать за пределами резервуара-хозяина увеличивает риск того, что патоген может заразить посевы и произвести через заражение коровьим навозом, орошение зараженной водой или прямой контакт с инфицированными животными [42].
Основные факторы вирулентности
Определение факторов и механизмов вирулентности E.coli O157: Патогенез H7 был предметом многочисленных исследований (). Производство Stx считается важным, но не единственно ответственным за заболевание. Кроме того, E. coli O157: H7, ассоциированная с тяжелым заболеванием человека, должна колонизировать слизистую кишечника, а наличие pO157 также коррелирует со способностью вызывать заболевание. Каждый из этих аспектов описан ниже.
Каждый из этих аспектов описан ниже.
Факторы вирулентности E. coli O157: H7.
Shiga Toxins (Stxs)
Stx – мощный цитотоксин, кодируемый бактериофагом.Stx расширяется из одной транскрипционной единицы и вызывает повреждение множества типов клеток [29]. Stx можно разделить на две группы, называемые Stx1 и Stx2, но они не генерируют перекрестно-реактивные антитела, гомологичные по аминокислотным последовательностям на 56%. Stx1 идентичен Stx из Shigella dysenteriae I, но с одной аминокислотной разницей. Вирулентные изоляты E. coli O157: H7 могут экспрессировать только Stx1, только Stx2 или оба токсина. Известно, что Stx2 более токсичен и чаще ассоциируется с HC или HUS при инфекциях человека, чем штаммы Stx1 [6, 50].
Stx имеет консервативную структуру, состоящую из одной ферментативно активной субъединицы А (А1) и пяти идентичных рецептор-связывающих субъединиц В (В5). Субъединица B5 связывается со специфическими рецепторами хозяина – глоботриаозилцерамидом (Gb3) или глоботетраозилцерамидом (Gb4) [47]. После связывания Stx (A1B5) с клеткой-хозяином субъединица A интернализуется в цитоплазму. Al ингибирует синтез белка путем специфического удаления одного остатка аденина из 28S рРНК 60S субъединицы рибосомы [59]. Подробные механизмы транслокации Stx в различные ткани до конца не изучены.
После связывания Stx (A1B5) с клеткой-хозяином субъединица A интернализуется в цитоплазму. Al ингибирует синтез белка путем специфического удаления одного остатка аденина из 28S рРНК 60S субъединицы рибосомы [59]. Подробные механизмы транслокации Stx в различные ткани до конца не изучены.
Локус отрастания энтероцитов
E. coli O157: H7 колонизирует слизистую оболочку кишечника и вызывает характерное гистопатологическое поражение, называемое прикрепляющимися и размывающими (A / E) очагами. Поражение A / E характеризуется стиранием микроворсинок и прикреплением бактерий к мембране эпителиальной клетки. Прикрепленные бактерии стимулируют накопление актина в клетке-хозяине, что приводит к возвышению пьедестала прикрепления [11]. Генетические исследования показали, что гены, ответственные за поражения A / E, отображаются в 13-м регионе, который был обозначен как локус сглаживания энтероцитов (LEE).LEE E. coli O157: H7 также консервативен в EPEC, и хорошо известно, что присутствие LEE сильно связано с заболеванием [24]. LEE E. coli O157: H7 имеет размер 43 т.п.н. и содержит дополнительную последовательность профага в 7,5 т.п.н. по сравнению со штаммами EPEC. Роль этой дополнительной последовательности четко не определена. LEE состоит по крайней мере из 41 различных генов, организованных в три основных региона; (i) система секреции типа III (TTSS), которая экспортирует эффективные молекулы; (ii) адгезия под названием интимин и его транслоцированный рецептор Tir, который транслоцируется в мембрану клетки-хозяина с помощью TTSS; и (iii) несколько секретируемых белков (Esp) как часть TTSS, которые важны для модификации передачи сигнала клетки-хозяина во время образования повреждений A / E [15, 52].Недавно также были идентифицированы эффекторы, не кодируемые LEE, и выяснение их роли еще больше расширит понимание патологических явлений при инфекциях E. coli O157: H7 [16].
LEE E. coli O157: H7 имеет размер 43 т.п.н. и содержит дополнительную последовательность профага в 7,5 т.п.н. по сравнению со штаммами EPEC. Роль этой дополнительной последовательности четко не определена. LEE состоит по крайней мере из 41 различных генов, организованных в три основных региона; (i) система секреции типа III (TTSS), которая экспортирует эффективные молекулы; (ii) адгезия под названием интимин и его транслоцированный рецептор Tir, который транслоцируется в мембрану клетки-хозяина с помощью TTSS; и (iii) несколько секретируемых белков (Esp) как часть TTSS, которые важны для модификации передачи сигнала клетки-хозяина во время образования повреждений A / E [15, 52].Недавно также были идентифицированы эффекторы, не кодируемые LEE, и выяснение их роли еще больше расширит понимание патологических явлений при инфекциях E. coli O157: H7 [16].
Плазмида O157 (pO157)
В дополнение к Stxs и LEE, которые оба хромосомно кодируются, все клинические изоляты E. coli O157: H7 обладают предполагаемой плазмидой вирулентности, называемой pO157.
coli O157: H7 обладают предполагаемой плазмидой вирулентности, называемой pO157.
Плазмида O157 (pO157)
Плазмиды
Плазмида представляет собой внехромосомную ДНК, которая способна реплицироваться независимо от хромосомной ДНК.Плазмиды – это мобильные элементы, которые обеспечивают различные полезные свойства хозяина, такие как устойчивость к антибиотикам и тяжелым металлам, выработка токсинов и других факторов вирулентности, биотрансформация углеводородов и симбиотическая азотфиксация [22]. Кодируемые плазмидой гены необходимы для полного патогенеза многих энтеропатогенных бактерий, включая видов Shigella , Yersinia , Salmonella и видов E. coli .
pO157
E.coli O157: H7 содержит высококонсервативную плазмиду, названную pO157. PO157 представляет собой неконъюгативную F-подобную плазмиду с размером диапазона от 92 до 104 т.п.н. Полная последовательность pO157 в двух разных изолятах вспышки была опубликована [10, 41].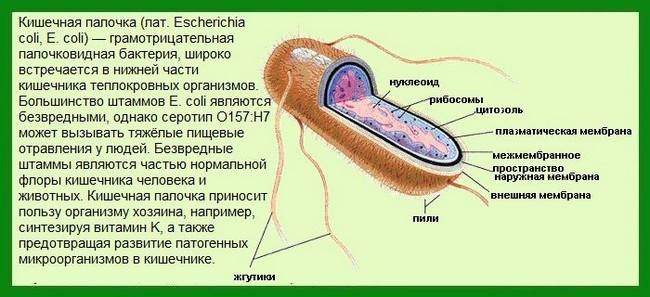 PO157 показывает динамическую структуру и включает различные мобильные генетические элементы, такие как транспозоны, профаги, инсерционные последовательности (IS) и части других плазмид. Гетерогенный состав pO157 может ограничивать совместные ответы на функциональные области pO157.Среди них IS или остатки IS часто связаны с сегментами, относящимися к вирулентности, которые аналогичны составам большой плазмиды вирулентности в Shigella spp. [10, 41]. Эти результаты показывают, что фактический pO157 образуется в результате интеграции фрагментов из эволюционно различных видов в F-подобную плазмиду, и, таким образом, факторы вирулентности или предполагаемые факторы вирулентности на разных сегментах pO157 могут иметь разное происхождение. Полная последовательность pO157 выявляет 100 открытых рамок считывания (ORF) [10].Среди них 43 ORF показали достаточное сходство с известными белками, предполагая функции, а 22 ORF не имели убедительного сходства с какими-либо известными белками.
PO157 показывает динамическую структуру и включает различные мобильные генетические элементы, такие как транспозоны, профаги, инсерционные последовательности (IS) и части других плазмид. Гетерогенный состав pO157 может ограничивать совместные ответы на функциональные области pO157.Среди них IS или остатки IS часто связаны с сегментами, относящимися к вирулентности, которые аналогичны составам большой плазмиды вирулентности в Shigella spp. [10, 41]. Эти результаты показывают, что фактический pO157 образуется в результате интеграции фрагментов из эволюционно различных видов в F-подобную плазмиду, и, таким образом, факторы вирулентности или предполагаемые факторы вирулентности на разных сегментах pO157 могут иметь разное происхождение. Полная последовательность pO157 выявляет 100 открытых рамок считывания (ORF) [10].Среди них 43 ORF показали достаточное сходство с известными белками, предполагая функции, а 22 ORF не имели убедительного сходства с какими-либо известными белками.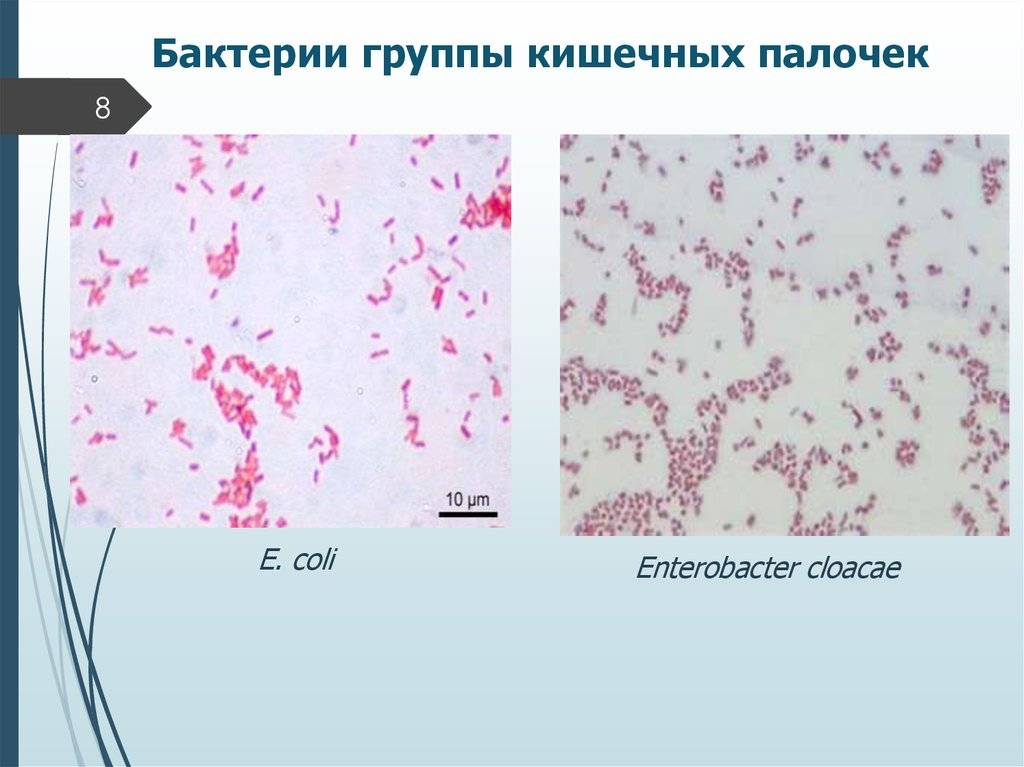 Тридцать пять белков предположительно участвуют в патогенезе инфекций E. coli O157: H7, но из них только 19 генов были ранее охарактеризованы, включая гемолизин ( ehxA ) [63], каталазу-пероксидазу ( katP ) [9], устройство системы секреции типа II ( etp ) [62], сериновая протеаза ( espP ) [8], предполагаемый адгезин ( toxB ) [67], металлопротеаза цинка (s tcE ) [37] и консервативный фрагмент eae ( ecf ) [75].Однако биологическое значение pO157 в патогенезе до конца не изучено.
Тридцать пять белков предположительно участвуют в патогенезе инфекций E. coli O157: H7, но из них только 19 генов были ранее охарактеризованы, включая гемолизин ( ehxA ) [63], каталазу-пероксидазу ( katP ) [9], устройство системы секреции типа II ( etp ) [62], сериновая протеаза ( espP ) [8], предполагаемый адгезин ( toxB ) [67], металлопротеаза цинка (s tcE ) [37] и консервативный фрагмент eae ( ecf ) [75].Однако биологическое значение pO157 в патогенезе до конца не изучено.
Гемолизин (
ehx ) Гемолизин был первым описанным фактором вирулентности pO157 [4, 61]. Оперон гемолизина ( ehxCABD ) может быть чужеродным по происхождению, потому что он имеет другой процент G + C и использование кодонов, чем окружающее генетическое содержимое. Фрагмент размером 3,4 т.п.н. кодирует гены, необходимые для синтеза и транспорта гемолизина, и эта область была использована в качестве диагностического зонда для E. coli O157: H7 и часто изоляты EHEC. Несколько исследований показали, что гемолизин является высококонсервативным среди различных серотипов EHEC, таких как O157: H7, O111: H8 и O8: h29, но не известно, обладают ли они идентичными биологическими активностями [7].
coli O157: H7 и часто изоляты EHEC. Несколько исследований показали, что гемолизин является высококонсервативным среди различных серотипов EHEC, таких как O157: H7, O111: H8 и O8: h29, но не известно, обладают ли они идентичными биологическими активностями [7].
Каталаза-пероксидаза (
katP ) Ген активности каталазы-пероксидазы ( katP ) был идентифицирован из pO157 [9]. Этот ген имеет размер 2,2 т.п.н. и очень гомологичен бактериальной бифункциональной каталазе-пероксидазе.Активность фермента KatP E. coli O157: H7 была показана как во фракциях цитоплазмы, так и во фракциях периплазмы. N-концевая сигнальная последовательность предполагает, что этот фермент транспортируется через цитоплазматическую мембрану. Ген katP был обнаружен во всех штаммах E. coli O157: H7, но не обнаружен в штаммах EPEC, ETEC, EIEC и EAggEC. Этот фермент может помочь E. coli O157: H7 колонизировать кишечник хозяина за счет снижения окислительного стресса и использования побочного продукта кислорода в условиях пониженного или дефицитного кислорода в кишечнике хозяина.
Система секреции типа II (T2SS) (
etp )pO157 кодирует 13 ORF с именами от etpC до etpO , которые показывают высокое сходство с T2SS грамотрицательных бактерий [62]. Эти гены расположены рядом с локусом гемолизина. Инсерционный элемент, подобный IS911, был обнаружен далеко от генов etp и ehx . Подобно гену katP , гены etp также были обнаружены во всех штаммах E. coli O157: H7, некоторые в штаммах EHEC, отличных от O157, и не обнаружены в штаммах EPEC, ETEC, EIEC и EAggEC.Этот T2SS подобен пути секреции пуллуланазы ( pulO ) Klebsiella oxytoca , но его функция не идентифицирована.
Сериновая протеаза (
espP ) EspP представляет собой кодируемую pO157 сериновую протеазу типа V, которая, как известно, расщепляет пепсин A и фактор свертывания крови V человека [8]. Этот внеклеточный фермент подобен нескольким секретируемым или поверхностно связанным белкам, включая PssA в EHEC O26: H-, EspC в EPEC и протеазу IgA1 у видов Neisseria [69].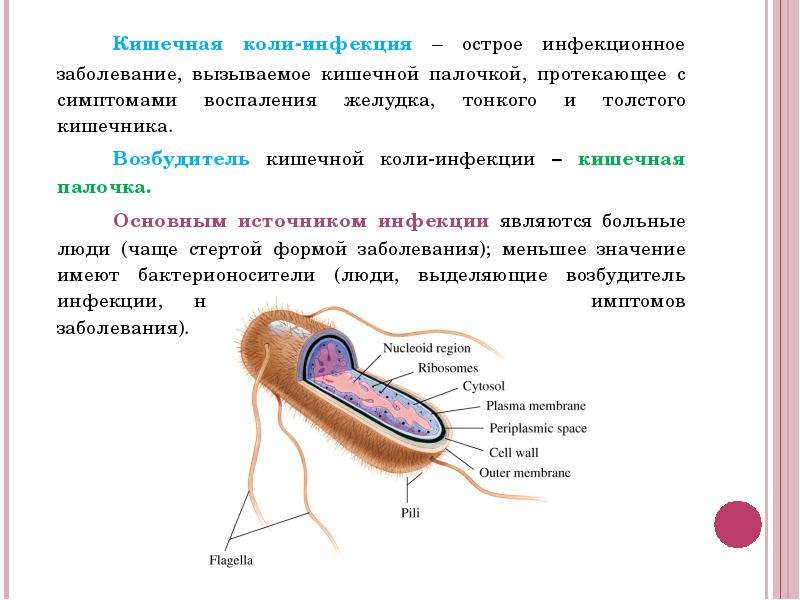 Недавно Dziva et al . [19] сообщили, что EspP влияет на колонизацию кишечника телят и прилипание к первичным кишечным эпителиальным клеткам крупного рогатого скота. Более того, деградация человеческого фактора свертывания V через EspP может способствовать кровоизлиянию в слизистую оболочку, наблюдаемому у пациентов с HC.
Недавно Dziva et al . [19] сообщили, что EspP влияет на колонизацию кишечника телят и прилипание к первичным кишечным эпителиальным клеткам крупного рогатого скота. Более того, деградация человеческого фактора свертывания V через EspP может способствовать кровоизлиянию в слизистую оболочку, наблюдаемому у пациентов с HC.
Металлопротеаза (
stcE ) Металлопротеиназа, StcE, кодируется на pO157 и специфически расщепляет ингибитор C1-эстеразы [37]. Ингибитор С1-эстеразы является регулятором множества протеолитических каскадов, связанных с путями воспаления, такими как классический комплемент, внутренняя коагуляция и контактная активация.StcE секретируется через T2SS, кодируемый на pO157, и регулируется регулятором, кодируемым LEE ( ler ) [20, 37]. Grys и др. . [25] продемонстрировали, что StcE может способствовать тесной адгезии E. coli O157: H7 к клеткам Hep2 in vitro . Ген stcE был обнаружен все в E. coli O157: H7, некоторые – в серотипе EPEC O55: H7, и он не обнаружен в других диареи E. coli .
coli O157: H7, некоторые – в серотипе EPEC O55: H7, и он не обнаружен в других диареи E. coli .
Предполагаемая адгезия (
toxB ) Ген toxB кодируется в последовательности 9.Размером 5 т.п.н., и его предсказанный продукт показывает 20% сходство с токсином B Clostridium difficile [41]. Недавние исследования показали, что ToxB способствует прикреплению E. coli O157: H7 к клеткам Caco-2 за счет увеличения секреции TTSS [67]. Более того, сравнение последовательностей показало, что ToxB имеет 28% идентичности аминокислот и 47% сходства с предсказанным продуктом efa-1 / lifA , другого гена вирулентности, часто обнаруживаемого на хромосоме EPEC и не-O157 EHEC. изоляты [46].Присутствие гена efa-1 / lifA , как известно, ингибирует активацию желудочно-кишечных лимфоцитов человека и мыши, и, следовательно, ToxB может участвовать в ингибировании лимфоцитов хозяина [36]. Однако мутация генов toxB и efa-1 не влияла на колонизацию кишечника у телят или овец [66].
Положительные по гену Eae консервативные фрагменты (
ecf ) Недавно мы сообщили, что pO157 кодирует оперон ecf ( ecf1 – 4 ), температура которого регулируется внутренне изогнутой ДНК [76]. ecf1 и ecf2 кодируют предполагаемую полисахаридную деацетилазу и LPS α-1, 7- N -ацетилглюкозаминтрансферазу, соответственно, и оба являются уникальными для pO157 [32]. ecf3 показывает сходство с предполагаемым белком внешней мембраны в E. coli K1, ассоциированным с бактериальной инвазией [49]. ecf4 , также называемый msbB2 , кодирует вторую копию липид А миристоилтрансферазы [35, 76]. Двойной мутант, несущий делеции в ecf4 и его хромосомную копию lpxM из E.coli O157: H7 имеет измененную структуру липида А и состав мембранных жирных кислот, а также демонстрирует пониженную стойкость в желудочно-кишечном тракте крупного рогатого скота [76]. Однако единственный мутант ecf4 не показал значительных различий по сравнению с E. coli дикого типа O157: H7.
coli дикого типа O157: H7.
Патогенез pO157
После первого сообщения о том, что pO157 необходим для экспрессии фимбрий и адгезии к эпителиальным клеткам, несколько исследований сообщили о противоречивых результатах о роли pO157 в прикреплении к эпителиальным клеткам [74]. Исследования pO157 in vivo на животных моделях, включая мыши, кролика и гнобиотических поросят, также показали противоречивые результаты. Однако исследования in vivo имеют ограничения, поскольку не существует подходящей модели на животных, воспроизводящей все аспекты болезни. Следовательно, точная роль pO157 в патогенезе E. coli O157: H7 все еще требует определения.
Таблица 1
Резюме исследований патогенеза pO157 in vitro и in vivo .
| Год | Цель | Патогенез | Эффект | |||
|---|---|---|---|---|---|---|
| In vitro | 1987 | Целая плазмида | эпигелий | Клетки фимбрии | ||
| 1990 | Целая плазмида | Адгезия к эпителиальным клеткам | Да | |||
| 1993 | Целая плазмида | Производство пилли | Нет | |||
| Адгезия к эпителиальным клеткам | Да | |||||
| 2005 | Ген stcE на pO157 | Прилипание к эпителиальным клеткам | Да | |||
| Да | ||||||
20070 | Приверженность t o Первичные эпителиальные клетки кишечника крупного рогатого скота | Да | ||||
| In vivo | 1987 | Целая плазмида | Прикрепление и удаление очагов поражения у гнотобиотических поросят | Нет | ||
| 1990 | Целая плазма мыши | Нет | ||||
| 1993 | Целая плазмида | Клинические симптомы у кролика | Нет | |||
| 2006 | Вся плазмида | Колонизация крупного рогатого скота | Да | Плазмида | ||
| 2007 | Полная крупного рогатого скота | Да | ||||
| 2007 | Ген espP на pO157 | Колонизация телят | Да |
Недавно мы показали, что pO157 влияет на эффективность E. coli O157: H7 колонизация здорового крупного рогатого скота и выживание в кислых условиях [40, 64]. Изогенный мутант E. coli O157: H7 ΔpO157 более устойчив к кислой синтетической желудочной жидкости крупного рогатого скота и желчи, чем дикий тип [40]. Эта повышенная кислотная устойчивость мутанта ΔpO157 обусловлена повышенной экспрессией глутаматдекарбоксилазы (GAD). Механизм регуляции gad с помощью pO157 неизвестен, но, вероятно, это связано с регуляцией pO157 хромосомных генов. In vivo , мутант ΔpO157 выживает при прохождении через желудочно-кишечный тракт крупного рогатого скота лучше, чем дикий тип, но не колонизирует слизистую оболочку RAJ крупного рогатого скота так, как дикий тип [40, 64].
coli O157: H7 колонизация здорового крупного рогатого скота и выживание в кислых условиях [40, 64]. Изогенный мутант E. coli O157: H7 ΔpO157 более устойчив к кислой синтетической желудочной жидкости крупного рогатого скота и желчи, чем дикий тип [40]. Эта повышенная кислотная устойчивость мутанта ΔpO157 обусловлена повышенной экспрессией глутаматдекарбоксилазы (GAD). Механизм регуляции gad с помощью pO157 неизвестен, но, вероятно, это связано с регуляцией pO157 хромосомных генов. In vivo , мутант ΔpO157 выживает при прохождении через желудочно-кишечный тракт крупного рогатого скота лучше, чем дикий тип, но не колонизирует слизистую оболочку RAJ крупного рогатого скота так, как дикий тип [40, 64].
pO157-подобные плазмиды в EHEC
Большие плазмиды, похожие на pO157, обнаружены в большинстве изолятов EHEC, отличных от O157, но не во всех изолятах от человека, и размер варьируется от 70 до 200 т.п.н. [26]. Эти плазмиды обычно несут оперон гемолизина ( ehx ), но гены etpC-O , katP и espP обнаруживаются менее чем в 50% изолятов [11]. Сообщается, что некоторые из этих плазмид EHEC-гемолизин участвуют в адгезии, но некоторые нет.Эпидемиологические данные свидетельствуют о более сильной корреляции присутствия этой плазмиды EHEC-гемолизин с развитием HUS, а не с диареей. Помимо плазмид pO157 или EHEC-гемолизин, в изолятах E. coli O157: H7 был обнаружен ряд других плазмид размером от 2 до 87 т.п.н. Однако не было обнаружено корреляции с наличием какой-либо из этих плазмид и клиническим заболеванием.
Сообщается, что некоторые из этих плазмид EHEC-гемолизин участвуют в адгезии, но некоторые нет.Эпидемиологические данные свидетельствуют о более сильной корреляции присутствия этой плазмиды EHEC-гемолизин с развитием HUS, а не с диареей. Помимо плазмид pO157 или EHEC-гемолизин, в изолятах E. coli O157: H7 был обнаружен ряд других плазмид размером от 2 до 87 т.п.н. Однако не было обнаружено корреляции с наличием какой-либо из этих плазмид и клиническим заболеванием.
Заключительные замечания
Этот обзор посвящен серотипу E.coli O157: H7 и его плазмида размером 92 т.п.н. E. coli O157: H7 вызывает тяжелые заболевания людей во всем мире. Три основных фактора вирулентности включают токсины Шига, продукты острова патогенности, называемые локусом сглаживания энтероцитов, и продукты F-подобной плазмиды pO157. Этот патоген хорошо выживает в различных средах, от своего бесшумного резервуара в здоровом рогатом скоте до окружающей среды на ферме. Гены, кодируемые pO157, влияют на прикрепление бактерий к эукариотическим клеткам, колонизацию крупного рогатого скота и устойчивость к кислотам. Дальнейшее изучение механизмов патогенеза и устойчивости E. coli O157: H7 в окружающей среде приведет к эффективным вмешательствам для предотвращения болезней человека.
Дальнейшее изучение механизмов патогенеза и устойчивости E. coli O157: H7 в окружающей среде приведет к эффективным вмешательствам для предотвращения болезней человека.
Ссылки
1. Банатвала Н., Гриффин П.М., Грин К.Д., Барретт Т.Дж., Бибб В.Ф., Грин Дж. Х., Уэллс Дж. Национальное проспективное исследование гемолитико-уремического синдрома США: микробиологические, серологические, клинические и эпидемиологические данные. J Infect Dis. 2001; 183: 1063–1070. [PubMed] [Google Scholar] 2. Баркер Дж, Хамфри Т.Дж., Браун М.В.Выживание Escherichia coli O157 в почвенных простейших: последствия для болезней. FEMS Microbiol Lett. 1999; 173: 291–295. [PubMed] [Google Scholar] 3. Барретт Т.Дж., Лиор Х., Грин Дж. Х., Кахрия Р., Уэллс Дж. Г., Белл Б. П., Грин К. Д., Льюис Дж., Гриффин П. М.. Лабораторное исследование мультистатной пищевой вспышки Escherichia coli O157: H7 с использованием гель-электрофореза в импульсном поле и фагового типирования. J Clin Microbiol. 1994; 32: 3013–3017. [Бесплатная статья PMC] [PubMed] [Google Scholar] 4.Бауэр М.Э., Велч Р.А.. Характеристика токсина RTX от энтерогеморрагической Escherichia coli O157: H7. Заражение иммунной. 1996. 64: 167–175. [Бесплатная статья PMC] [PubMed] [Google Scholar] 6. Бурлин П., МакИвен С.А., Бурлин-Петцольд Ф., Уилсон Дж.Б., Джонсон Р.П., Джайлз К.Л. Связь между факторами вирулентности Escherichia coli , продуцирующей токсин шига , и заболеванием человека. J Clin Microbiol. 1999; 37: 497–503. [Бесплатная статья PMC] [PubMed] [Google Scholar] 7. Brashears MM, Galyean ML, Loneragan GH, Mann JE, Killinger-Mann K.Распространенность Escherichia coli O157: H7 и продуктивность мясного откорма крупного рогатого скота, получавшего микробиалы прямого кормления Lactobacillus . J Food Prot. 2003. 66: 748–754. [PubMed] [Google Scholar] 8. Брундер В., Шмидт Х., Карч Х. EspP, новая внеклеточная сериновая протеаза энтерогеморрагической Escherichia coli O157: H7 расщепляет человеческий фактор свертывания крови V.
1994; 32: 3013–3017. [Бесплатная статья PMC] [PubMed] [Google Scholar] 4.Бауэр М.Э., Велч Р.А.. Характеристика токсина RTX от энтерогеморрагической Escherichia coli O157: H7. Заражение иммунной. 1996. 64: 167–175. [Бесплатная статья PMC] [PubMed] [Google Scholar] 6. Бурлин П., МакИвен С.А., Бурлин-Петцольд Ф., Уилсон Дж.Б., Джонсон Р.П., Джайлз К.Л. Связь между факторами вирулентности Escherichia coli , продуцирующей токсин шига , и заболеванием человека. J Clin Microbiol. 1999; 37: 497–503. [Бесплатная статья PMC] [PubMed] [Google Scholar] 7. Brashears MM, Galyean ML, Loneragan GH, Mann JE, Killinger-Mann K.Распространенность Escherichia coli O157: H7 и продуктивность мясного откорма крупного рогатого скота, получавшего микробиалы прямого кормления Lactobacillus . J Food Prot. 2003. 66: 748–754. [PubMed] [Google Scholar] 8. Брундер В., Шмидт Х., Карч Х. EspP, новая внеклеточная сериновая протеаза энтерогеморрагической Escherichia coli O157: H7 расщепляет человеческий фактор свертывания крови V. Mol Microbiol. 1997; 24: 767–778. [PubMed] [Google Scholar] 9. Брундер В., Шмидт Х., Карч Х. KatP, новая каталаза-пероксидаза, кодируемая большой плазмидой энтерогеморрагической Escherichia coli 0157: H7.Микробиология. 1996. 142: 3305–3315. [PubMed] [Google Scholar] 10. Берланд В., Шао Ю., Перна Н. Т., Планкетт Г., София Х. Дж., Блаттнер Фр. Полная последовательность ДНК и анализ большой плазмиды вирулентности Escherichia coli O157: H7. Nucl Acids Res. 1998. 26: 4196–4204. [Бесплатная статья PMC] [PubMed] [Google Scholar] 11. Caprioli A, Morabito S, Brugère H, Oswald E. Enterohaemorrhagic Escherichia coli : Новые проблемы вирулентности и способов передачи. Vet Res. 2005; 36: 289–311.[PubMed] [Google Scholar] 12. Кастани-Корнет член парламента, Пенфаунд Т.А., Смит Д., Эллиотт Дж. Ф., Фостер Дж. У. Контроль кислотостойкости Escherichia coli . J Bacteriol. 1999; 181: 3525–3535. [Бесплатная статья PMC] [PubMed] [Google Scholar] 13. Чо С., Бендер Дж.
Mol Microbiol. 1997; 24: 767–778. [PubMed] [Google Scholar] 9. Брундер В., Шмидт Х., Карч Х. KatP, новая каталаза-пероксидаза, кодируемая большой плазмидой энтерогеморрагической Escherichia coli 0157: H7.Микробиология. 1996. 142: 3305–3315. [PubMed] [Google Scholar] 10. Берланд В., Шао Ю., Перна Н. Т., Планкетт Г., София Х. Дж., Блаттнер Фр. Полная последовательность ДНК и анализ большой плазмиды вирулентности Escherichia coli O157: H7. Nucl Acids Res. 1998. 26: 4196–4204. [Бесплатная статья PMC] [PubMed] [Google Scholar] 11. Caprioli A, Morabito S, Brugère H, Oswald E. Enterohaemorrhagic Escherichia coli : Новые проблемы вирулентности и способов передачи. Vet Res. 2005; 36: 289–311.[PubMed] [Google Scholar] 12. Кастани-Корнет член парламента, Пенфаунд Т.А., Смит Д., Эллиотт Дж. Ф., Фостер Дж. У. Контроль кислотостойкости Escherichia coli . J Bacteriol. 1999; 181: 3525–3535. [Бесплатная статья PMC] [PubMed] [Google Scholar] 13. Чо С., Бендер Дж. Б., Диез-Гонсалес Ф., Фосслер С. П., Хедберг С. В., Канини Дж. Б., Рюгг П. Л., Варник Л. Д., Уэллс С. Распространенность и характеристика изолятов Escherichia coli O157 с молочных ферм Миннесоты и окружных ярмарок. J Food Prot. 2006; 69: 252–259. [PubMed] [Google Scholar] 14.Cray WC, Jr, Moon HW. Экспериментальное заражение телят и взрослого крупного рогатого скота Escherichia coli O157: H7. Appl Environ Microbiol. 1995; 61: 1586–1590. [Бесплатная статья PMC] [PubMed] [Google Scholar] 15. Delahay RM, Frankel G, Knutton S. Интимные взаимодействия энтеропатогенных Escherichia coli на поверхности клетки-хозяина. Curr Opin Infect Dis. 2001. 14: 559–565. [PubMed] [Google Scholar] 16. Дэн В., Пуэнте Дж. Л., Грюнхайд С., Ли Ю., Валланс Б. А., Васкес А. и др. Рассекающая вирулентность: систематический и функциональный анализ острова патогенности.Proc Natl Acad Sci USA. 2004. 101: 3597–3602. [Бесплатная статья PMC] [PubMed] [Google Scholar] 17. Добриндт Ю., Агерер Ф., Михаэлис К., Янка А., Бухризер С., Самуэльсон М. и др. Анализ пластичности генома патогенных и комменсальных изолятов Escherichia coli с использованием массивов ДНК. J Bacteriol. 2003; 185: 1831–1840. [Бесплатная статья PMC] [PubMed] [Google Scholar] 18. Данн Дж. Р., Кин Дж. Э., Томпсон Р. А.. Распространенность Shiga-toxigenic Escherichia coli O157: H7 у взрослого молочного скота. J Am Vet Med Assoc.2004. 224: 1151–1158. [PubMed] [Google Scholar] 19. Дзива Ф., Махаджан А., Кэмерон П., Карри С., МакКендрик И.Дж., Уоллис Т.С., Смит Д.Г., Стивенс М.П. EspP, сериновая протеаза энтерогеморрагической Escherichia coli O157: H7, секретируемая типом V, влияет на колонизацию кишечника телят и адгезию к первичным кишечным эпителиальным клеткам крупного рогатого скота. FEMS Microbiol Lett. 2007. 271: 258–264. [PubMed] [Google Scholar] 20. Эллиотт С.Дж., Сперандио В., Хирон Д.А., Шин С., Меллис Д.Л., Уэйнрайт Л., Хатчесон С.В., МакДэниел Т.К., Капер Дж.Б.Регулятор, кодируемый локусом сглаживания энтероцитов (LEE), контролирует экспрессию как LEE-, так и не-LEE-кодируемых факторов вирулентности в энтеропатогенных и энтерогеморрагических Escherichia coli . Заражение иммунной. 2000. 68: 6115–6126. [Бесплатная статья PMC] [PubMed] [Google Scholar] 21. Frenzen PD, Drake A, Angulo FJ. Экономическая стоимость болезни, вызванной инфекциями, вызванными Escherichia coli, O157 в США. J Food Prot. 2005; 68: 2623–2630. [PubMed] [Google Scholar] 22. Фрост Л.С., Леплае Р., Саммерс А.О., Туссен А.Мобильные генетические элементы: агенты эволюции открытого исходного кода. Nat Rev Microbiol. 2005; 3: 722–732. [PubMed] [Google Scholar] 23. Ганшеров Л.Дж., О’Брайен А.Д. Escherichia coli O157: H7 у мясного скота, отправленного на убой в США: более высокие показатели распространенности, чем предполагалось ранее. Proc Natl Acad Sci USA. 2000; 97: 2959–2961. [Бесплатная статья PMC] [PubMed] [Google Scholar] 24. Гриффин PM, Tauxe RV. Эпидемиология инфекций, вызванных Escherichia coli O157: H7, другими энтерогеморрагическими E.coli и связанный с ним гемолитико-уремический синдром. Epidemiol Rev.1991; 13: 60–98. [PubMed] [Google Scholar] 25. Грис Т.Э., Сигель М.Б., Lathem WW, Велч Р.А. Протеаза StcE способствует тесному прилипанию энтерогеморрагической Escherichia coli O157: H7 к клеткам-хозяевам. Заражение иммунной. 2005. 73: 1295–1303. [Бесплатная статья PMC] [PubMed] [Google Scholar] 26. Хейлз Б.А., Харт Калифорния, Батт Р.М., Сондерс-младший. Большие плазмиды, обнаруженные в энтерогеморрагической и энтеропатогенной Escherichia coli , составляют родственную серию репликонов Inc F-IIA, дефектных по переносу.Плазмида. 1992; 28: 183–193. [PubMed] [Google Scholar] 27. Хэнкок Д.Д., Бессер Т.Э., Райс Д.Х., Херриотт Д.Э., Тарр П.И. Продольное исследование Escherichia coli O157 в четырнадцати стадах крупного рогатого скота. Epidemiol Infect. 1997. 118: 193–195. [Бесплатная статья PMC] [PubMed] [Google Scholar] 28. Heuvelink AE, van Heerwaarden C, Zwartkruis-Nahuis JT, van Oosterom R, Edink K, van Duynhoven YT, de Boer E. Escherichia coli O157 Инфекция, связанная с контактным зоопарком. Epidemiol Infect. 2002; 129: 295–302.[Бесплатная статья PMC] [PubMed] [Google Scholar] 29. Яцевич М.С., Ачесон Д.В., Binion DG, West GA, Lincicome LL, Fiocchi C, Keusch GT. Ответы эндотелиальных клеток микрососудов кишечника человека на токсины Shiga 1 и 2 и патогенез геморрагического колита. Заражение иммунной. 1999; 67: 1439–1444. [Бесплатная статья PMC] [PubMed] [Google Scholar] 31. Джонсон Р.П., Уилсон Дж. Б., Мишель П., Ран К., Ренвик С. А., Джайлз К. Л., Спика Дж. С.. Заражение человека веротоксигенной Escherichia coli связано с воздействием на фермы и сельскую среду.В: Стюарт К.С., Флинтс Х.Дж., редакторы. Escherichia coli O157 у сельскохозяйственных животных. CABI Publishing; Уоллингфорд, Великобритания: 1999. С. 147–168. [Google Scholar] 32. Канюк Н.А., Виноградов Э., Ли Дж., Монтейро М.А., Уитфилд С. Хромосомные и плазмидные ферменты необходимы для сборки центрального олигосахарида типа R 3 в липополисахариде Escherichia coli O157: H7. J Biol Chem. 2004; 279: 31237–31250. [PubMed] [Google Scholar] 33. Капер Дж. Б., Натаро Дж. П., Мобли Х.Л. Патогенный Escherichia coli .Nat Rev Microbiol. 2004; 2: 123–140. [PubMed] [Google Scholar] 34. Кармали М.А., Стил Б.Т., Петрик М., Лим С. Спорадические случаи гемолитико-уремического синдрома, связанные с фекальным цитотоксином и производящим цитотоксин Escherichia coli в стуле. Ланцет. 1983; 1: 619–620. [PubMed] [Google Scholar] 35. Kim SH, Jia W, Bishop RE, Gyles C. Гомолог msbB, содержащийся в плазмиде pO157, кодирует ацилтрансферазу, участвующую в биосинтезе липида A в Escherichia coli O157: H7. Заражение иммунной. 2004. 72: 1174–1180.[Бесплатная статья PMC] [PubMed] [Google Scholar] 36. Klapproth JMA, I, Scaletsky CA, McNamara BP, Lai LC, Malstrom C, James SP, Donnenberg MS. Большой токсин из патогенных штаммов Escherichia coli , подавляющий активацию лимфоцитов. Заражение иммунной. 2000. 68: 2148–2155. [Бесплатная статья PMC] [PubMed] [Google Scholar] 37. Lathem WW, Grys TE, Witowski SE, Torres AG, Kaper JB, Tarr PI, Welch RA. StcE, металлопротеиназа, секретируемая Escherichia coli O157: H7, специфически расщепляет ингибитор C1-эстеразы.Mol Microbiol. 2002. 45: 277–288. [PubMed] [Google Scholar] 38. LeJeune JT, Besser TE, Hancock DD. Поилки для крупного рогатого скота как резервуары для Escherichia coli O157. Appl Environ Microbiol. 2001; 67: 3053–3057. [Бесплатная статья PMC] [PubMed] [Google Scholar] 39. Лим Дж.Й., Ли Дж., Шенг Х., Бессер Т.Э., Поттер К., Ховде С.Дж. Escherichia coli O157: Колонизация H7 в прямой кишке крупного рогатого скота с длительным культивированием. Appl Environ Microbiol. 2007. 73: 1380–1382. [Бесплатная статья PMC] [PubMed] [Google Scholar] 40.Лим Дж.Й., Шенг Х., Со К.С., Пак Й.Х., Ховде СиДжей. Характеристика мутанта с делецией O157 плазмиды Escherichia coli O157: H7, его выживаемость и устойчивость у крупного рогатого скота. Appl Environ Microbiol. 2007. 73: 2037–2047. [Бесплатная статья PMC] [PubMed] [Google Scholar] 41. Макино К., Исии К., Ясунага Т., Хаттори М., Йокояма К., Юцудо С.Х. и др. Полные нуклеотидные последовательности плазмид размером 93 т.п.н. и 3,3 т.п.н. энтерогеморрагической Escherichia coli O157: H7, полученной из очага Сакаи. ДНК Res.1998; 5: 1–9. [PubMed] [Google Scholar] 42. Мауле А. Выживание вероцитотоксигенных Escherichia coli O157 в почве, воде и на поверхностях. Symp Ser Soc Appl Microbiol. 2000; 29: 71С – 78С. [PubMed] [Google Scholar] 43. Мид П.С., Слуцкер Л., Дитц В., Маккейг Л.Ф., Брези Дж.С., Шапиро С., Гриффин П.М., Токс Р.В. Заболевания и смерть, связанные с пищевыми продуктами в США. Emerg Infect Dis. 1999; 5: 607–625. [Бесплатная статья PMC] [PubMed] [Google Scholar] 44. Мелтон-Селса АР, Дарнелл СК, О’Брайен А.Д. Активация Shiga-подобных токсинов кишечной слизью мышей и человека коррелирует с вирулентностью энтерогеморрагических изолятов Escherichia coli O91: h31 у перорально инфицированных мышей, получавших стрептомицин.Заражение иммунной. 1996; 64: 1569–1576. [Бесплатная статья PMC] [PubMed] [Google Scholar] 45. Мичино Х., Араки К., Минами С., Такая С., Сакаи Н., Миядзаки М., Оно А., Янагава Х. Массовая вспышка Escherichia coli O157: инфекция H7 у школьников в городе Сакаи, Япония, связанная с потреблением белого редиса ростки. Am J Epidemiol. 1999; 150: 787–796. [PubMed] [Google Scholar] 46. Морабито С., Тоццоли Р., Освальд Э., Каприоли А. Мозаичный остров патогенности, состоящий из локуса сглаживания энтероцитов и острова патогенности Escherichia coli O157: H7 часто присутствует в прикреплении и удалении E.coli . Заражение иммунной. 2003. 71: 3343–3348. [Бесплатная статья PMC] [PubMed] [Google Scholar] 48. Naylor SW, Low JC, Besser TE, Mahajan A, Gunn GJ, Pearce MC, McKendrick IJ, Smith DGE, Gally DL. Плотная слизистая оболочка лимфоидного фолликула в конце прямой кишки является основным местом колонизации энтерогеморрагической Escherichia coli O157: H7 в коровьем хозяине. Заражение иммунной. 2003. 71: 1505–1512. [Бесплатная статья PMC] [PubMed] [Google Scholar] 49. Orndorff PE, Wang Y, Huang SH, Wass CA, Stins MF, Kim KS.Локус гена yijP способствует инвазии Escherichia coli K1 в эндотелиальные клетки микрососудов головного мозга. Заражение иммунной. 1999; 67: 4751–4756. [Бесплатная статья PMC] [PubMed] [Google Scholar] 50. Острофф С.М., Тарр П.И., Нил М.А., Льюис Дж. Х., Харгретт-Бин Н., Кобаяши Дж. М.. Генотипы токсинов и плазмидные профили как детерминанты системных осложнений при инфекциях Escherichia coli O157: H7. J Infect Dis. 1989; 160: 994–998. [PubMed] [Google Scholar] 51. Патон А.В., Патон Дж. Прямое обнаружение токсикогенных штаммов Shiga Escherichia coli , принадлежащих к серогруппам O111, O157 и O113, с помощью мультиплексной ПЦР.J Clin Microbiol. 1999; 37: 3362–3365. [Бесплатная статья PMC] [PubMed] [Google Scholar] 52. Perna NT, Mayhew GF, Posfai G, Elliott S, Donnenberg MS, Kaper JB, Blattner FR. Молекулярная эволюция острова патогенности от энтерогеморрагической Escherichia coli O157: H7. Заражение иммунной. 1998; 66: 3810–3817. [Бесплатная статья PMC] [PubMed] [Google Scholar] 53. Perna NT, Plunkett G, Burland V, Mau B, Glasner JD, Rose DJ и др. Последовательность генома энтерогеморрагической Escherichia coli O157: H7.Природа. 2001; 409: 529–533. [PubMed] [Google Scholar] 54. Петерсон В.Л., Макковяк П.А., Барнетт С.С., Марлинг-Кейсон М., Хейли М.Л. Бактерицидный барьер желудка человека: механизмы действия, относительная антибактериальная активность и влияние питания. J Infect Dis. 1989; 159: 979–983. [PubMed] [Google Scholar] 55. Putonti C, Luo Y, Katili C, Chumakov S, Fox GE, Graur D, Fofanov Y. Вычислительный инструмент для геномной идентификации регионов с необычными композиционными свойствами и его использование в обнаружении горизонтально перенесенных последовательностей.Mol Biol Evol. 2006; 23: 1863–1868. [PubMed] [Google Scholar] 56. Ранжел Дж. М., Спарлинг П. Х., Кроу К., Гриффин П. М., Свердлов Д. Л.. Эпидемиология Escherichia coli O157: вспышки H7, США, 1982–2002 гг. Emerg Infect Dis. 2005; 11: 603–609. [Бесплатная статья PMC] [PubMed] [Google Scholar] 57. Райли Л.В., Ремис Р.С., Хелгерсон С.Д., Макги Х.Б., Уэллс Дж.Г., Дэвис Б.Р. и др. Геморрагический колит, связанный с редким серотипом Escherichia coli . N Engl J Med. 1983; 308: 681–685. [PubMed] [Google Scholar] 58.Сандерсон М.В., Бессер Т.Э., Гей Дж.М., Гей CC, Хэнкок Д.Д. Фекал Escherichia coli O157: Характер выделения H7 у телят с пероральной прививкой. Vet Microbiol. 1999; 69: 199–205. [PubMed] [Google Scholar] 59. Саксена С.К., О’Брайен А.Д., Акерман Э.Дж. Токсин шига, вариант шига-подобного токсина II и рицин представляют собой односайтовые РНК N -гликозидазы 28S РНК при микроинъекции в ооциты Xenopus . J Biol Chem. 1989; 264: 596–601. [PubMed] [Google Scholar] 60. Шлех В.Ф., III, Чейз Д.П., Бэдли А.Модель пищевой инфекции Listeria monocytogenes у крыс Sprague-Dawley с использованием инокуляции желудка: развитие и влияние кислотности желудочного сока на инфекционную дозу. Int J Food Microbiol. 1993; 18: 15–24. [PubMed] [Google Scholar] 61. Schmidt H, Beutin L, Karch H. Молекулярный анализ кодируемого плазмидой гемолизина Escherichia coli O157: штамм H7 EDL 933. Infect Immun. 1995; 63: 1055–1061. [Бесплатная статья PMC] [PubMed] [Google Scholar] 62. Schmidt H, Henkel B, Karch H. Кластер генов, тесно связанный с оперонами пути секреции типа II грамотрицательных бактерий, расположен на большой плазмиде энтерогеморрагических штаммов Escherichia coli O157.FEMS Microbiol Lett. 1997. 148: 265–272. [PubMed] [Google Scholar] 63. Шмидт Х., Карч Х., Бойтин Л. Большие плазмиды энтерогеморрагических штаммов Escherichia coli O157 кодируют гемолизины, которые предположительно являются членами семейства альфа-гемолизинов E. coli . FEMS Microbiol Lett. 1994; 117: 189–196. [PubMed] [Google Scholar] 64. Шенг Х., Лим Дж.Й., Кнехт Х.Д., Ли Дж., Ховде С.Дж. Роль факторов вирулентности Escherichia coli O157: H7 в колонизации терминальной слизистой оболочки прямой кишки крупного рогатого скота.Заражение иммунной. 2006; 74: 4685–4693. [Бесплатная статья PMC] [PubMed] [Google Scholar] 65. Шима К., Йошии Н., Акиба М., Нисимура К., Накадзава М., Ямасаки С. Сравнение ПЦР – ПДРФ и PFGE для определения клональности энтерогеморрагических штаммов Escherichia coli . FEMS Microbiol Lett. 2006; 257: 124–131. [PubMed] [Google Scholar] 66. Стивенс МП, Роу А.Дж., Влисиду И., Ван Димен П.М., Ла Раджионе Р.М., Лучший А, Вудворд М.Дж., Галли Д.Л., Уоллис Т.С. Мутация toxB и усеченная версия гена efa -1 в Escherichia coli O157: H7 влияет на экспрессию и секрецию локуса белков, кодируемых удалением энтероцитов, но не на колонизацию кишечника у телят или овец.Заражение иммунной. 2004. 72: 5402–5411. [Бесплатная статья PMC] [PubMed] [Google Scholar] 67. Tatsuno I, Horie M, Abe H, Miki T, Makino K, Shinagawa H, Taguchi H, Kamiya S, Hayashi T. Ген toxB на pO157 энтерогеморрагической Escherichia coli O157: H7 требуется для полного прикрепления эпителиальных клеток . Заражение иммунной. 2001; 69: 6660–6669. [Бесплатная статья PMC] [PubMed] [Google Scholar] 68. Томпсон Дж. С., Ходж Д. С., Борчик А. А.. Экспресс-биохимический тест для выявления вероцитотоксин-положительных штаммов Escherichia coli серотипа O157.J Clin Microbiol. 1990; 28: 2165–2168. [Бесплатная статья PMC] [PubMed] [Google Scholar] 69. ван Димен П.М., Дзива Ф., Стивенс МП, Уоллис Т.С. Идентификация энтерогеморрагической Escherichia coli O26: H-гены, необходимые для колонизации кишечника у телят. Заражение иммунной. 2005; 73: 1735–1743. [Бесплатная статья PMC] [PubMed] [Google Scholar] 70. Варма Дж. К., Грин К. Д., Реллер М. Е., Делонг С. М., Троттье Дж., Новицки С.Ф. и др. Вспышка инфекции Escherichia coli O157 в результате контакта с зараженным зданием.ДЖАМА. 2003. 290: 2709–2712. [PubMed] [Google Scholar] 71. Уэллс Дж. Г., Дэвис Б. Р., Ваксмут И. К., Райли Л. В., Ремис Р. С., Соколов Р., Моррис Г. К.. Лабораторное исследование вспышек геморрагического колита, связанного с редким серотипом Escherichia coli . J Clin Microbiol. 1983; 18: 512–520. [Бесплатная статья PMC] [PubMed] [Google Scholar] 72. Вик Л. М., Ци В., Лачер Д. В., Уиттам Т. С.. Эволюция геномного содержания при ступенчатом появлении Escherichia coli O157: H7. J Bacteriol. 2005; 187: 1783–1791.[Бесплатная статья PMC] [PubMed] [Google Scholar] 73. Уиллшоу Г.А., Смит Х.Р., Чести Т., Уолл П.Г., Роу Б. Цитотоксин-продуцент Vero Escherichia coli Вспышки O157 в Англии и Уэльсе, 1995: фенотипические методы и генотипическое определение подтипов. Emerg Infect Dis. 1997; 3: 561–565. [Бесплатная статья PMC] [PubMed] [Google Scholar] 75. Юн Дж.В., Лим Дж.Й., Пак Й.Х., Ховде СиДжей. Участие оперона Escherichia coli O157: H7 (pO157) ecf и активности миристоилтрансферазы липида А в выживаемости бактерий в желудочно-кишечном тракте крупного рогатого скота и устойчивости бактерий в поилках фермы.Заражение иммунной. 2005. 73: 2367–2378. [Бесплатная статья PMC] [PubMed] [Google Scholar] 76. Юн Дж. В., Миннич С. А., Ан Дж. С., Пак Ю. Х., Пащинский А., Ховде С. Дж.. Терморегуляция оперона Escherichia coli O157: H7 pO157 ecf и липида Активность миристоилтрансферазы А включает в себя изогнутую по своей природе ДНК. Mol Microbiol. 2004. 51: 419–435. [PubMed] [Google Scholar] 77. Юк Х.Г., Маршалл Д.Л. Адаптация Escherichia coli O157: H7 к pH изменяет липидный состав мембран, секрецию веротоксина и устойчивость к симулированной кислоте желудочного сока.Appl Environ Microbiol. 2004. 70: 3500–3505. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Б., Диез-Гонсалес Ф., Фосслер С. П., Хедберг С. В., Канини Дж. Б., Рюгг П. Л., Варник Л. Д., Уэллс С. Распространенность и характеристика изолятов Escherichia coli O157 с молочных ферм Миннесоты и окружных ярмарок. J Food Prot. 2006; 69: 252–259. [PubMed] [Google Scholar] 14.Cray WC, Jr, Moon HW. Экспериментальное заражение телят и взрослого крупного рогатого скота Escherichia coli O157: H7. Appl Environ Microbiol. 1995; 61: 1586–1590. [Бесплатная статья PMC] [PubMed] [Google Scholar] 15. Delahay RM, Frankel G, Knutton S. Интимные взаимодействия энтеропатогенных Escherichia coli на поверхности клетки-хозяина. Curr Opin Infect Dis. 2001. 14: 559–565. [PubMed] [Google Scholar] 16. Дэн В., Пуэнте Дж. Л., Грюнхайд С., Ли Ю., Валланс Б. А., Васкес А. и др. Рассекающая вирулентность: систематический и функциональный анализ острова патогенности.Proc Natl Acad Sci USA. 2004. 101: 3597–3602. [Бесплатная статья PMC] [PubMed] [Google Scholar] 17. Добриндт Ю., Агерер Ф., Михаэлис К., Янка А., Бухризер С., Самуэльсон М. и др. Анализ пластичности генома патогенных и комменсальных изолятов Escherichia coli с использованием массивов ДНК. J Bacteriol. 2003; 185: 1831–1840. [Бесплатная статья PMC] [PubMed] [Google Scholar] 18. Данн Дж. Р., Кин Дж. Э., Томпсон Р. А.. Распространенность Shiga-toxigenic Escherichia coli O157: H7 у взрослого молочного скота. J Am Vet Med Assoc.2004. 224: 1151–1158. [PubMed] [Google Scholar] 19. Дзива Ф., Махаджан А., Кэмерон П., Карри С., МакКендрик И.Дж., Уоллис Т.С., Смит Д.Г., Стивенс М.П. EspP, сериновая протеаза энтерогеморрагической Escherichia coli O157: H7, секретируемая типом V, влияет на колонизацию кишечника телят и адгезию к первичным кишечным эпителиальным клеткам крупного рогатого скота. FEMS Microbiol Lett. 2007. 271: 258–264. [PubMed] [Google Scholar] 20. Эллиотт С.Дж., Сперандио В., Хирон Д.А., Шин С., Меллис Д.Л., Уэйнрайт Л., Хатчесон С.В., МакДэниел Т.К., Капер Дж.Б.Регулятор, кодируемый локусом сглаживания энтероцитов (LEE), контролирует экспрессию как LEE-, так и не-LEE-кодируемых факторов вирулентности в энтеропатогенных и энтерогеморрагических Escherichia coli . Заражение иммунной. 2000. 68: 6115–6126. [Бесплатная статья PMC] [PubMed] [Google Scholar] 21. Frenzen PD, Drake A, Angulo FJ. Экономическая стоимость болезни, вызванной инфекциями, вызванными Escherichia coli, O157 в США. J Food Prot. 2005; 68: 2623–2630. [PubMed] [Google Scholar] 22. Фрост Л.С., Леплае Р., Саммерс А.О., Туссен А.Мобильные генетические элементы: агенты эволюции открытого исходного кода. Nat Rev Microbiol. 2005; 3: 722–732. [PubMed] [Google Scholar] 23. Ганшеров Л.Дж., О’Брайен А.Д. Escherichia coli O157: H7 у мясного скота, отправленного на убой в США: более высокие показатели распространенности, чем предполагалось ранее. Proc Natl Acad Sci USA. 2000; 97: 2959–2961. [Бесплатная статья PMC] [PubMed] [Google Scholar] 24. Гриффин PM, Tauxe RV. Эпидемиология инфекций, вызванных Escherichia coli O157: H7, другими энтерогеморрагическими E.coli и связанный с ним гемолитико-уремический синдром. Epidemiol Rev.1991; 13: 60–98. [PubMed] [Google Scholar] 25. Грис Т.Э., Сигель М.Б., Lathem WW, Велч Р.А. Протеаза StcE способствует тесному прилипанию энтерогеморрагической Escherichia coli O157: H7 к клеткам-хозяевам. Заражение иммунной. 2005. 73: 1295–1303. [Бесплатная статья PMC] [PubMed] [Google Scholar] 26. Хейлз Б.А., Харт Калифорния, Батт Р.М., Сондерс-младший. Большие плазмиды, обнаруженные в энтерогеморрагической и энтеропатогенной Escherichia coli , составляют родственную серию репликонов Inc F-IIA, дефектных по переносу.Плазмида. 1992; 28: 183–193. [PubMed] [Google Scholar] 27. Хэнкок Д.Д., Бессер Т.Э., Райс Д.Х., Херриотт Д.Э., Тарр П.И. Продольное исследование Escherichia coli O157 в четырнадцати стадах крупного рогатого скота. Epidemiol Infect. 1997. 118: 193–195. [Бесплатная статья PMC] [PubMed] [Google Scholar] 28. Heuvelink AE, van Heerwaarden C, Zwartkruis-Nahuis JT, van Oosterom R, Edink K, van Duynhoven YT, de Boer E. Escherichia coli O157 Инфекция, связанная с контактным зоопарком. Epidemiol Infect. 2002; 129: 295–302.[Бесплатная статья PMC] [PubMed] [Google Scholar] 29. Яцевич М.С., Ачесон Д.В., Binion DG, West GA, Lincicome LL, Fiocchi C, Keusch GT. Ответы эндотелиальных клеток микрососудов кишечника человека на токсины Shiga 1 и 2 и патогенез геморрагического колита. Заражение иммунной. 1999; 67: 1439–1444. [Бесплатная статья PMC] [PubMed] [Google Scholar] 31. Джонсон Р.П., Уилсон Дж. Б., Мишель П., Ран К., Ренвик С. А., Джайлз К. Л., Спика Дж. С.. Заражение человека веротоксигенной Escherichia coli связано с воздействием на фермы и сельскую среду.В: Стюарт К.С., Флинтс Х.Дж., редакторы. Escherichia coli O157 у сельскохозяйственных животных. CABI Publishing; Уоллингфорд, Великобритания: 1999. С. 147–168. [Google Scholar] 32. Канюк Н.А., Виноградов Э., Ли Дж., Монтейро М.А., Уитфилд С. Хромосомные и плазмидные ферменты необходимы для сборки центрального олигосахарида типа R 3 в липополисахариде Escherichia coli O157: H7. J Biol Chem. 2004; 279: 31237–31250. [PubMed] [Google Scholar] 33. Капер Дж. Б., Натаро Дж. П., Мобли Х.Л. Патогенный Escherichia coli .Nat Rev Microbiol. 2004; 2: 123–140. [PubMed] [Google Scholar] 34. Кармали М.А., Стил Б.Т., Петрик М., Лим С. Спорадические случаи гемолитико-уремического синдрома, связанные с фекальным цитотоксином и производящим цитотоксин Escherichia coli в стуле. Ланцет. 1983; 1: 619–620. [PubMed] [Google Scholar] 35. Kim SH, Jia W, Bishop RE, Gyles C. Гомолог msbB, содержащийся в плазмиде pO157, кодирует ацилтрансферазу, участвующую в биосинтезе липида A в Escherichia coli O157: H7. Заражение иммунной. 2004. 72: 1174–1180.[Бесплатная статья PMC] [PubMed] [Google Scholar] 36. Klapproth JMA, I, Scaletsky CA, McNamara BP, Lai LC, Malstrom C, James SP, Donnenberg MS. Большой токсин из патогенных штаммов Escherichia coli , подавляющий активацию лимфоцитов. Заражение иммунной. 2000. 68: 2148–2155. [Бесплатная статья PMC] [PubMed] [Google Scholar] 37. Lathem WW, Grys TE, Witowski SE, Torres AG, Kaper JB, Tarr PI, Welch RA. StcE, металлопротеиназа, секретируемая Escherichia coli O157: H7, специфически расщепляет ингибитор C1-эстеразы.Mol Microbiol. 2002. 45: 277–288. [PubMed] [Google Scholar] 38. LeJeune JT, Besser TE, Hancock DD. Поилки для крупного рогатого скота как резервуары для Escherichia coli O157. Appl Environ Microbiol. 2001; 67: 3053–3057. [Бесплатная статья PMC] [PubMed] [Google Scholar] 39. Лим Дж.Й., Ли Дж., Шенг Х., Бессер Т.Э., Поттер К., Ховде С.Дж. Escherichia coli O157: Колонизация H7 в прямой кишке крупного рогатого скота с длительным культивированием. Appl Environ Microbiol. 2007. 73: 1380–1382. [Бесплатная статья PMC] [PubMed] [Google Scholar] 40.Лим Дж.Й., Шенг Х., Со К.С., Пак Й.Х., Ховде СиДжей. Характеристика мутанта с делецией O157 плазмиды Escherichia coli O157: H7, его выживаемость и устойчивость у крупного рогатого скота. Appl Environ Microbiol. 2007. 73: 2037–2047. [Бесплатная статья PMC] [PubMed] [Google Scholar] 41. Макино К., Исии К., Ясунага Т., Хаттори М., Йокояма К., Юцудо С.Х. и др. Полные нуклеотидные последовательности плазмид размером 93 т.п.н. и 3,3 т.п.н. энтерогеморрагической Escherichia coli O157: H7, полученной из очага Сакаи. ДНК Res.1998; 5: 1–9. [PubMed] [Google Scholar] 42. Мауле А. Выживание вероцитотоксигенных Escherichia coli O157 в почве, воде и на поверхностях. Symp Ser Soc Appl Microbiol. 2000; 29: 71С – 78С. [PubMed] [Google Scholar] 43. Мид П.С., Слуцкер Л., Дитц В., Маккейг Л.Ф., Брези Дж.С., Шапиро С., Гриффин П.М., Токс Р.В. Заболевания и смерть, связанные с пищевыми продуктами в США. Emerg Infect Dis. 1999; 5: 607–625. [Бесплатная статья PMC] [PubMed] [Google Scholar] 44. Мелтон-Селса АР, Дарнелл СК, О’Брайен А.Д. Активация Shiga-подобных токсинов кишечной слизью мышей и человека коррелирует с вирулентностью энтерогеморрагических изолятов Escherichia coli O91: h31 у перорально инфицированных мышей, получавших стрептомицин.Заражение иммунной. 1996; 64: 1569–1576. [Бесплатная статья PMC] [PubMed] [Google Scholar] 45. Мичино Х., Араки К., Минами С., Такая С., Сакаи Н., Миядзаки М., Оно А., Янагава Х. Массовая вспышка Escherichia coli O157: инфекция H7 у школьников в городе Сакаи, Япония, связанная с потреблением белого редиса ростки. Am J Epidemiol. 1999; 150: 787–796. [PubMed] [Google Scholar] 46. Морабито С., Тоццоли Р., Освальд Э., Каприоли А. Мозаичный остров патогенности, состоящий из локуса сглаживания энтероцитов и острова патогенности Escherichia coli O157: H7 часто присутствует в прикреплении и удалении E.coli . Заражение иммунной. 2003. 71: 3343–3348. [Бесплатная статья PMC] [PubMed] [Google Scholar] 48. Naylor SW, Low JC, Besser TE, Mahajan A, Gunn GJ, Pearce MC, McKendrick IJ, Smith DGE, Gally DL. Плотная слизистая оболочка лимфоидного фолликула в конце прямой кишки является основным местом колонизации энтерогеморрагической Escherichia coli O157: H7 в коровьем хозяине. Заражение иммунной. 2003. 71: 1505–1512. [Бесплатная статья PMC] [PubMed] [Google Scholar] 49. Orndorff PE, Wang Y, Huang SH, Wass CA, Stins MF, Kim KS.Локус гена yijP способствует инвазии Escherichia coli K1 в эндотелиальные клетки микрососудов головного мозга. Заражение иммунной. 1999; 67: 4751–4756. [Бесплатная статья PMC] [PubMed] [Google Scholar] 50. Острофф С.М., Тарр П.И., Нил М.А., Льюис Дж. Х., Харгретт-Бин Н., Кобаяши Дж. М.. Генотипы токсинов и плазмидные профили как детерминанты системных осложнений при инфекциях Escherichia coli O157: H7. J Infect Dis. 1989; 160: 994–998. [PubMed] [Google Scholar] 51. Патон А.В., Патон Дж. Прямое обнаружение токсикогенных штаммов Shiga Escherichia coli , принадлежащих к серогруппам O111, O157 и O113, с помощью мультиплексной ПЦР.J Clin Microbiol. 1999; 37: 3362–3365. [Бесплатная статья PMC] [PubMed] [Google Scholar] 52. Perna NT, Mayhew GF, Posfai G, Elliott S, Donnenberg MS, Kaper JB, Blattner FR. Молекулярная эволюция острова патогенности от энтерогеморрагической Escherichia coli O157: H7. Заражение иммунной. 1998; 66: 3810–3817. [Бесплатная статья PMC] [PubMed] [Google Scholar] 53. Perna NT, Plunkett G, Burland V, Mau B, Glasner JD, Rose DJ и др. Последовательность генома энтерогеморрагической Escherichia coli O157: H7.Природа. 2001; 409: 529–533. [PubMed] [Google Scholar] 54. Петерсон В.Л., Макковяк П.А., Барнетт С.С., Марлинг-Кейсон М., Хейли М.Л. Бактерицидный барьер желудка человека: механизмы действия, относительная антибактериальная активность и влияние питания. J Infect Dis. 1989; 159: 979–983. [PubMed] [Google Scholar] 55. Putonti C, Luo Y, Katili C, Chumakov S, Fox GE, Graur D, Fofanov Y. Вычислительный инструмент для геномной идентификации регионов с необычными композиционными свойствами и его использование в обнаружении горизонтально перенесенных последовательностей.Mol Biol Evol. 2006; 23: 1863–1868. [PubMed] [Google Scholar] 56. Ранжел Дж. М., Спарлинг П. Х., Кроу К., Гриффин П. М., Свердлов Д. Л.. Эпидемиология Escherichia coli O157: вспышки H7, США, 1982–2002 гг. Emerg Infect Dis. 2005; 11: 603–609. [Бесплатная статья PMC] [PubMed] [Google Scholar] 57. Райли Л.В., Ремис Р.С., Хелгерсон С.Д., Макги Х.Б., Уэллс Дж.Г., Дэвис Б.Р. и др. Геморрагический колит, связанный с редким серотипом Escherichia coli . N Engl J Med. 1983; 308: 681–685. [PubMed] [Google Scholar] 58.Сандерсон М.В., Бессер Т.Э., Гей Дж.М., Гей CC, Хэнкок Д.Д. Фекал Escherichia coli O157: Характер выделения H7 у телят с пероральной прививкой. Vet Microbiol. 1999; 69: 199–205. [PubMed] [Google Scholar] 59. Саксена С.К., О’Брайен А.Д., Акерман Э.Дж. Токсин шига, вариант шига-подобного токсина II и рицин представляют собой односайтовые РНК N -гликозидазы 28S РНК при микроинъекции в ооциты Xenopus . J Biol Chem. 1989; 264: 596–601. [PubMed] [Google Scholar] 60. Шлех В.Ф., III, Чейз Д.П., Бэдли А.Модель пищевой инфекции Listeria monocytogenes у крыс Sprague-Dawley с использованием инокуляции желудка: развитие и влияние кислотности желудочного сока на инфекционную дозу. Int J Food Microbiol. 1993; 18: 15–24. [PubMed] [Google Scholar] 61. Schmidt H, Beutin L, Karch H. Молекулярный анализ кодируемого плазмидой гемолизина Escherichia coli O157: штамм H7 EDL 933. Infect Immun. 1995; 63: 1055–1061. [Бесплатная статья PMC] [PubMed] [Google Scholar] 62. Schmidt H, Henkel B, Karch H. Кластер генов, тесно связанный с оперонами пути секреции типа II грамотрицательных бактерий, расположен на большой плазмиде энтерогеморрагических штаммов Escherichia coli O157.FEMS Microbiol Lett. 1997. 148: 265–272. [PubMed] [Google Scholar] 63. Шмидт Х., Карч Х., Бойтин Л. Большие плазмиды энтерогеморрагических штаммов Escherichia coli O157 кодируют гемолизины, которые предположительно являются членами семейства альфа-гемолизинов E. coli . FEMS Microbiol Lett. 1994; 117: 189–196. [PubMed] [Google Scholar] 64. Шенг Х., Лим Дж.Й., Кнехт Х.Д., Ли Дж., Ховде С.Дж. Роль факторов вирулентности Escherichia coli O157: H7 в колонизации терминальной слизистой оболочки прямой кишки крупного рогатого скота.Заражение иммунной. 2006; 74: 4685–4693. [Бесплатная статья PMC] [PubMed] [Google Scholar] 65. Шима К., Йошии Н., Акиба М., Нисимура К., Накадзава М., Ямасаки С. Сравнение ПЦР – ПДРФ и PFGE для определения клональности энтерогеморрагических штаммов Escherichia coli . FEMS Microbiol Lett. 2006; 257: 124–131. [PubMed] [Google Scholar] 66. Стивенс МП, Роу А.Дж., Влисиду И., Ван Димен П.М., Ла Раджионе Р.М., Лучший А, Вудворд М.Дж., Галли Д.Л., Уоллис Т.С. Мутация toxB и усеченная версия гена efa -1 в Escherichia coli O157: H7 влияет на экспрессию и секрецию локуса белков, кодируемых удалением энтероцитов, но не на колонизацию кишечника у телят или овец.Заражение иммунной. 2004. 72: 5402–5411. [Бесплатная статья PMC] [PubMed] [Google Scholar] 67. Tatsuno I, Horie M, Abe H, Miki T, Makino K, Shinagawa H, Taguchi H, Kamiya S, Hayashi T. Ген toxB на pO157 энтерогеморрагической Escherichia coli O157: H7 требуется для полного прикрепления эпителиальных клеток . Заражение иммунной. 2001; 69: 6660–6669. [Бесплатная статья PMC] [PubMed] [Google Scholar] 68. Томпсон Дж. С., Ходж Д. С., Борчик А. А.. Экспресс-биохимический тест для выявления вероцитотоксин-положительных штаммов Escherichia coli серотипа O157.J Clin Microbiol. 1990; 28: 2165–2168. [Бесплатная статья PMC] [PubMed] [Google Scholar] 69. ван Димен П.М., Дзива Ф., Стивенс МП, Уоллис Т.С. Идентификация энтерогеморрагической Escherichia coli O26: H-гены, необходимые для колонизации кишечника у телят. Заражение иммунной. 2005; 73: 1735–1743. [Бесплатная статья PMC] [PubMed] [Google Scholar] 70. Варма Дж. К., Грин К. Д., Реллер М. Е., Делонг С. М., Троттье Дж., Новицки С.Ф. и др. Вспышка инфекции Escherichia coli O157 в результате контакта с зараженным зданием.ДЖАМА. 2003. 290: 2709–2712. [PubMed] [Google Scholar] 71. Уэллс Дж. Г., Дэвис Б. Р., Ваксмут И. К., Райли Л. В., Ремис Р. С., Соколов Р., Моррис Г. К.. Лабораторное исследование вспышек геморрагического колита, связанного с редким серотипом Escherichia coli . J Clin Microbiol. 1983; 18: 512–520. [Бесплатная статья PMC] [PubMed] [Google Scholar] 72. Вик Л. М., Ци В., Лачер Д. В., Уиттам Т. С.. Эволюция геномного содержания при ступенчатом появлении Escherichia coli O157: H7. J Bacteriol. 2005; 187: 1783–1791.[Бесплатная статья PMC] [PubMed] [Google Scholar] 73. Уиллшоу Г.А., Смит Х.Р., Чести Т., Уолл П.Г., Роу Б. Цитотоксин-продуцент Vero Escherichia coli Вспышки O157 в Англии и Уэльсе, 1995: фенотипические методы и генотипическое определение подтипов. Emerg Infect Dis. 1997; 3: 561–565. [Бесплатная статья PMC] [PubMed] [Google Scholar] 75. Юн Дж.В., Лим Дж.Й., Пак Й.Х., Ховде СиДжей. Участие оперона Escherichia coli O157: H7 (pO157) ecf и активности миристоилтрансферазы липида А в выживаемости бактерий в желудочно-кишечном тракте крупного рогатого скота и устойчивости бактерий в поилках фермы.Заражение иммунной. 2005. 73: 2367–2378. [Бесплатная статья PMC] [PubMed] [Google Scholar] 76. Юн Дж. В., Миннич С. А., Ан Дж. С., Пак Ю. Х., Пащинский А., Ховде С. Дж.. Терморегуляция оперона Escherichia coli O157: H7 pO157 ecf и липида Активность миристоилтрансферазы А включает в себя изогнутую по своей природе ДНК. Mol Microbiol. 2004. 51: 419–435. [PubMed] [Google Scholar] 77. Юк Х.Г., Маршалл Д.Л. Адаптация Escherichia coli O157: H7 к pH изменяет липидный состав мембран, секрецию веротоксина и устойчивость к симулированной кислоте желудочного сока.Appl Environ Microbiol. 2004. 70: 3500–3505. [Бесплатная статья PMC] [PubMed] [Google Scholar]Escherichia coli
Где классифицируется кишечная палочка?
Кишечная палочка Классификация
Домен: бактерии Царство: Бактерии Тип: Протеобактерии Класс: Гамма-протеобактерии Заказ: Энтеробактерии Семья : Энтеробактерии Род : Эшерихия Виды : Escherichia coli (E.coli) | Где я подхожу? Фото из паблика Домен Извлекаются из Wikimedia Commons |
Пояснение к классификации:
Домен и Королевство: Escherichia coli подходит для область и царство бактерий так как члены этой группы – одноклеточные микроорганизмы.
Тип:
Escherichia coli соответствует типу Протеобактерии, потому что члены этой группы Грамотрицательный (G-) бактерия с наружной мембранойc
состоит в основном из липополисахаридов.Класс :
Escherichia coli вписывается в класс Гамма-протеобактерии, потому что члены этой группыфакультативно анаэробная G-бактерия.
Заказ:
Escherichia coli вписывается в заказ Энтеробактерии, потому что представители этой группы имеют палочковидную форму факультативно анаэробные G-бактерии.Семья :
Escherichia coli вписывается в семейство Enterobacteriaceae, потому что члены этой группы подвижны через перитрихозные жгутики, хорошо растущие при 37 o ° C, Оксидаза отрицательный, положительный по каталазе и снижает содержание нитратов.Род :
Escherichia coli относится к роду Эшерихия (названная в честь человека, открывшего эту род, Теодор Эшерих), потому что члены этой группы в основном условно-патогенная флора, кишечная (колонизируют в кишечном тракте млекопитающих).Разновидность: Escherichia coli – один из пяти видов, признанных Род Escherichia.Что делает кишечную палочку уникальной, так это биохимическая активность: ферментирует лактозу, обладает лизиндекарбоксилаза, отрицательный результат Фогуса-Проскауэра, производит индол, на нитратах не растет, и не производит H 2 S.
* Запутались?
Большая часть этого будет объяснено в других разделах.

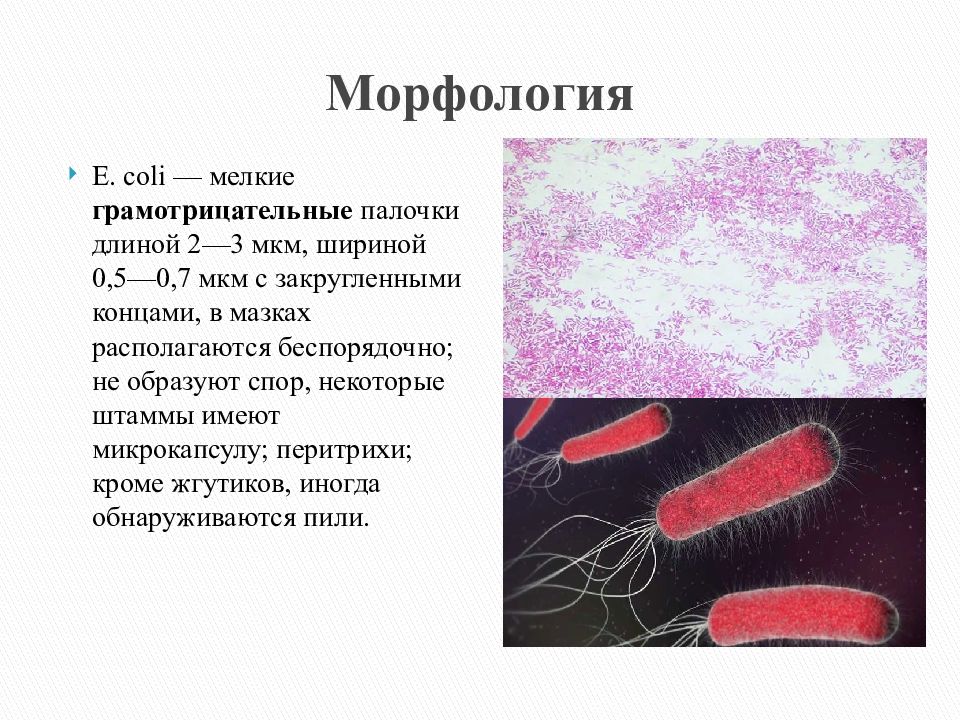 Эти бактерии проникают в клетки эпителия кишечника и размножаются в них.
Эти бактерии проникают в клетки эпителия кишечника и размножаются в них.