Кишечный дисбактериоз: Дисбактериоз кишечника – симптомы, диагностика, лечение — медцентр Аксис (Зеленоград)
Дисбактериоз кишечника
Практически все пространство желудочно-кишечного тракта занято десятками видов микроорганизмов (бактерий). Их можно разделить на две большие группы: микроорганизмы, которые приносят человеческому организму только пользу (нормальная флора кишечника) и «недружественные» микроорганизмы (условно-патогенная флора кишечника). При кишечных инфекциях появляются и «вражеские» бактерии; возбудители этих инфекций постоянно живут только у лиц — бактерионосителей. Организм человека, перенесшего инфекцию, настолько привыкает к таким микробам, что они остаются у него жить. При попадании в другой организм они вызывают заболевание — дисбактериоз кишечника.
Дисбактериоз кишечника — изменение нормальной кишечной микрофлоры, включая качественные и количественные ее параметры, а также место ее обитания. Изменение нормального состава микрофлоры кишечника приводит к функциональным нарушениям во всех отделах желудочно-кишечного тракта.
Основные симптомы недостаточности пищеварения:
- Боли различного характера
- Расстройство стула с преобладанием поноса
- Метеоризм. Вздутие живота и урчание усиливается во вторую половину дня и ночью, характерны отрыжка и неприятный привкус во рту
- Непереносимость определенных пищевых продуктов (чаще всего — молока). После его употребления у больных появляется диарея, испражнения становятся жидкими, объемными, пенистыми. Больных беспокоят вздутие и боль в животе, иногда тошнота и рвота
Для дисбактериоза кишечника характерен дефицит витамина РР, сопровождающийся раздражительностью, неуравновешенностью, подавленностью настроения, конфликтностью, слюнотечением и др. Дефицит витамина В2 проявляется выпадением волос, изменением ногтей, заедами, стоматитом, дерматитом крыльев носа. Для дефицита витаминов B1 и В6 типичны головная боль, слабость, атония кишечника, дистрофические изменения в миокарде, нарушения со стороны периферической нервной системы.
На фоне дисбактериоза нередко развиваются аллергические реакции, которые проявляются либо пищевой идиосинкразией, либо общими аллергическими реакциями (крапивницей, отеком Квинке, бронхоспазмом, полиартралгией, снижением АД). Поражение кишечника характеризуется схваткообразной, реже ноющей тупой болью в животе, урчанием, вздутием и переливанием, а также императивными позывами на опорожнение кишечника. Появляется частый жидкий стул, нередко с примесью непереваренной пищи, реже — крови.
О дисбактериозе рассказывает педиатр «ЕвроМед клиники»
Дисбактериоз — история о плохих и хороших бактериях
Дисбактериоз — одна из наиболее часто обсуждаемых проблем со здоровьем, особенно, среди детей. Педиатр «ЕвроМед клиники»Елена Сергеевна Кочеткова рассказывает нашим читателям, что известно о дисбактериозе в свете современных знаний.
Дисбактериоз – микроэкологические нарушения в желудочно-кишечном тракте.Это клиническая совокупность нарушений в макроорганизме (то есть в человеке), вызванные изменением количественных соотношений, состава и свойств микрофлоры. Дисбактериоз определяется, по сути, по результату анализа — посева кала на известные и возможные для исследования микроорганизмы толстого кишечника. В последнее время чаще говорят о дисбиозе, это нарушение функционирования и механизмов взаимодействия организма человека, его микрофлоры и окружающей среды. Почему это важно? Согласно результатам последних исследований, микрофлора заселяет практически все поверхности, все слизистые оболочки и полости тела. Конечно, большая часть живет в толстом и тонком кишечнике, но при этом 80–90% не культивируются (то есть невозможно вырастить и изучить) вне тела человека, и как следствие, о них мы практически ничего не знаем. На одну клетку человека приходится примерно 10 микробных, причем вся микрофлора несет в 150 раз больше генетической информации, чем человек. Представьте: на одну единицу «человек-информации» приходится 150 единиц «микробы-информации»! Только в таком соотношении мы можем функционировать, полноценно жить.
Как известно, у человека 4 группы крови, точно так выделены 3 энтеротипа микробиоценоза человека. Каждому человеку в рамках своего энтеротипа присуща своя микробная ассоциация. Энтеротип неизменен, но количество и качество поддерживающих бактерий зависит от питания, заболеваний, использования лекарств, окружающей среды.
Что же делает микрофлора в нашем теле?
- противостоит болезнетворным бактериям и сдерживает рост условно-патогенных бактерий
- участвует в синтезе и всасывании многих витаминов
- разрушает и выводит токсины
- вырабатывает вещества, участвующие в обмене холестерина, жирных кислот, липопротеидов, оксалатов, стероидных гормонов
- участвует в формировании как местного, так и системного иммунитета. По сути, кишечник и находящиеся в нем бактерии являются самым большим иммунным органом человека
- участвует в переваривании многих пищевых ингредиентов
- питает, поддерживает работу клеток кишечной стенки
Это далеко не все, только основные направления работы нашей микрофлоры.Не зря 20% поступающих пищевых ингредиентов и 10% вырабатываемой организмом энергии идет на поддержание нашей микрофлоры.
Симптомы
Как проявляется дисбиоз хорошо известно всем:
- диспептический синдром: поносы, запоры, метеоризм, повышенное газообразование, отрыжка, боли в животе
- аллергические реакции: кожные высыпания, бронхиальная астма, насморк, непереносимость некоторых пищевых продуктов
- частые простудные заболевания, как правило, протекающие длительно и волнообразно
- синдром мальабсорбции — нарушение всасывания, как следствие: гиповитаминоз, анемия, неврологические расстройства, задержка роста и развития
- хроническая интоксикация, как следствие: недомогание, плохой аппетит, головные боли, субфебрильная температура
Хотя, как упоминалось выше, кишечная микробиота индивидуальна и в целом постоянна, она не существует как нечто неизменное, представляя собой динамически меняющуюся смесь микробов, индивидуальных для каждого человека. К факторам, влияющим на становление кишечной микробиоты, у младенцев относят:
К факторам, влияющим на становление кишечной микробиоты, у младенцев относят:
- наличие у мамы любых инфекций: хронических урогенитальных и других, даже вне обострения, острых (ОРЗ и др.), прием лекарств, нерациональное питание
- роды путем кесарева сечения
- позднее (не в родовом зале) прикладывание к груди. Млечные ходы молочной железы заселены лакто- и бифидобактериями, даже если новорожденный высосет 3–5 мл молозива он получит первой «хорошую» семейную микрофлору, а не больничную, вероятнее всего, вредную
- гипоксия нервной системы любой степени тяжести
- долгое нахождение в родильном доме
- раздельное нахождение мамы и младенца в роддоме
- искусственное вскармливание
- применение антибиотиков и некоторых других лекарств
- раннее введение прикормов и прекращение грудного вскармливания
- нерациональное питание
Какие анализы можно сдать для выявления дисбиоза:
- Кал на дисбиоз.
 До 3 месяцев идет активное заселение кишечника, микрофлора меняется каждый день, анализ будет готов через 7–10 дней, значит, говорит о прошлом состоянии, не о сегодняшнем. Можно по нему назначать какое-либо лечение? Нет, поэтому до 3 месяцев не рекомендуют проводить это исследование. Но после 3 месяцев микрофлора становится более или менее постоянной, и если исследование проводилось не один, а 2–3 раза, то можно более уверенно говорить об устойчивом нахождении каких-либо «нежелательных» нам бактерий.
До 3 месяцев идет активное заселение кишечника, микрофлора меняется каждый день, анализ будет готов через 7–10 дней, значит, говорит о прошлом состоянии, не о сегодняшнем. Можно по нему назначать какое-либо лечение? Нет, поэтому до 3 месяцев не рекомендуют проводить это исследование. Но после 3 месяцев микрофлора становится более или менее постоянной, и если исследование проводилось не один, а 2–3 раза, то можно более уверенно говорить об устойчивом нахождении каких-либо «нежелательных» нам бактерий. - Копрограмма – показывает нарушения характера пищеварения: своевременно ли и в достаточном ли количестве выделяется желчь и секрет поджелудочной железы.
- Газо-жидкостная хроматография и молекулярно-генетическое исследование фекалий показывают истинное состояние микрофлоры, ее полный количественный и качественный состав (в том числе тонко-кишечный и тот, который невозможно вырастить вне человека), энтеротип человека. Проводится в нескольких НИИ в мире, в широком применении будет только в ближайшие 5–10 лет.

Можем ли мы как то повлиять на количество и качество микробиоты? Даже учитывая, что мы, на сегодняшний день, не знаем большинства «наших» бактерий, но все же можем многое сделать, особенно, для младенца. У всех детей первого полугодия 98-99 % микрофлоры — это бифидо- и лактобактерии, значит, надо обеспечить их достаточное количество и качество их жизнедеятельности. Задача эта очень сложная. Почему? Эти бактерии очень нежные, могут жить и хорошо работать в определенных условиях. Например, при наличии лактазной недостаточности в кишечнике неблагоприятная среда, а бифидо- и лактобактерии не могут ни жить, ни работать в такой среде. С введением прикормов изменяется характер пищи, требуются другие бактерии, происходит заселение кишечника новыми видами. Кстати тут сразу встает вопрос: когда вводить прикорм, какой? Есть определенные рекомендации, даже национальная программа вскармливания по рекомендациям ВОЗ (Всемирная организация здравоохранения), но решение принимается в каждом случае индивидуально!
Получается, мы живем в океане микробов, и только так мы можем жить.Если мы хотим жить долго и здорово, мы должны заботиться о них. Лечение — это одно, а постоянное поддержание здоровья — это другое. Нет никакой волшебной таблетки, никаким однократным курсом лечения с дисбиозом не справиться! Курсы биопрепаратов (разные, в разное время, разные детям и взрослым), рациональное питание, иногда в помощь лекарственные препараты, и всё — только по рекомендации врача!
симптомы у взрослых, лечение по низким ценам в СПБ, отзывы
Дисбактериоз — состояние организма, характеризующееся микробным дисбалансом на теле или внутри него (чаще всего в кишечнике). Сам по себе болезнью не является (в МКБ-10 понятие “дисбактериоз” не определено), но часто выступает как симптом другого заболевания. Это очень распространенное состояние, встречающееся примерно у 90 % взрослых (в равной степени у мужчин и женщин) и 95 % детей. Для кишечника выделяется 4 степени дисбактериоза:
- 1 степень. Пациенты отмечают дискомфорт только при смене привычной диеты или употреблении новых продуктов.
 После возвращения к обычному образу питанию баланс микрофлоры восстанавливается и симптоматика исчезает.
После возвращения к обычному образу питанию баланс микрофлоры восстанавливается и симптоматика исчезает. - 2 степень. Количества производимых ферментов недостаточно для нормального пищеварения. Симптомы включают в себя вздутие живота, диарею или запоры, периодическую тошноту.
- 3 степень. Кишечная стенка реагирует на присутствие патогенной микрофлоры хроническим воспалительным процессом. Состояние требует медицинской помощи.
- 4 степень. К воспалению кишечной стенки добавляются проблемы всасывания — развивается дефицит витаминов, микроэлементов и питательных веществ во всеми сопутствующими симптомами. Защитные свойства нормальной микрофлоры теряются и возникает гроза тяжелых кишечных инфекций и отравлений.
Причины появления дисбактериоза
Существует множество предпосылок к появлению дисбактериоза:
- хронические патологии желудочно-кишечного тракта;
- длительный прием антибиотиков;
- неполноценная диета;
- пожилой возраст;
- гормонотерапия;
- лечение онкологических заболеваний;
- хронический стресс;
- частые кишечные инфекции;
- метаболические нарушения.

Дисбактериоз кишечника у женщин также может появиться после беременности, родов или аборта.
Симптомы дисбактериоза
На ранних этапах дисбактериоз кишечника может проявляться множеством признаков, но особое внимание следует обратить на:
- отрыжку;
- тошноту;
- постоянное урчание в животе;
- метеоризм;
- периодические ноющие или режущие боли;
- нарушения консистенции стула;
- сухость кожи;
- неприятные привкусы во рту и горечь;
- расстройства сна.
Диагностика дисбактериоза
Подтверждение состояния дисбактериоза выполняется исключительно опытным специалистом с использованием специальной аппаратуры. Обследование на наличие дисбактериоза включает в себя:
- анализ крови;
- анализ мочи;
- специфические ПЦР-тесты;
- физикальные обследования кожи.
Диета при дисбактериозе
Когда дисбактериоз вызван погрешностями режима питания, на помощь приходит диета, соблюдение которой должно быть неукоснительным. Так, при дисбактериозе запрещены:
Так, при дисбактериозе запрещены:
- блюда острым вкусом и обилием приправ;
- алкогольные напитки;
- жирная, жареная пища;
- необработанные фрукты и овощи;
- некоторые злаки и бобовые;
- белый хлеб и дрожжевая выпечка.
Диетологи при дисбактериозе рекомендуют употреблять только вареную и тушеную еду, а также блюда, приготовленные на пару. Сами приемы пищи должны быть дробными, 5-6 раз в день.
Лечение дисбактериоза
Если дисбактериоз спровоцирован применением антибиотиков или перенесенной острой кишечной инфекцией, то при своевременной диагностике и правильной коррекции этого состояния можно добиться полного восстановления равновесия кишечной микрофлоры. Если же дисбактериоз является следствием хронического заболевания, то избавиться от него нельзя, не устранив его причину, но периодически проводить терапию, направленную на нормализацию микрофлоры кишечника просто необходимо, так как изменения микрофлоры могут приводить и поддерживать обострения основного заболевания.
Лечение хронического дисбактериоза у взрослых зависит от причин и симптомов и назначается комплексно. Стандартная схема лечения включает меры, направленные на:
- устранение избыточности патогенных микроорганизмов;
- восстановление нормальной микрофлоры;
- улучшение процесса пищеварения;
- нормализацию моторики кишечника;
- стимулирование реактивности организма.
Врачи из клиники Долголетие в Санкт-Петербурге имеют огромный опыт лечения дисбактериоза кишечника и провоцирующих его болезней. Специалисты подберут индивидуальный план лечения. Записаться на прием можно на сайте (круглосуточно), и у администратора по телефону. Для удобства наших пациентов прием осуществляется и в выходные дни.
ᐈ Диагностика и лечение дисбактериоза кишечника в Санкт-Петербурге
Дисбактериоз кишечника – очень распространенная и при этом недостаточно оцениваемая в современном обществе проблема. Дисбаланс кишечной флоры отмечается почти у 90% людей, но в большинстве случаев он протекает малосимптомно и остается не диагностированным. А это негативно сказывается на качестве пищеварения и становится предпосылкой для развития и рецидивирования нарушений и заболеваний. Поэтому выявление и лечение дисбактериоза кишечника – это путь к общему оздоровлению организма.
Дисбактериоз – это болезнь или вариант нормы?
Дисбактериозом (дисбиозом) называют стойкие нарушения кишечной микрофлоры, со значительным изменением баланса между количеством и активностью условно-патогенных и полезных для человека микроорганизмов. В результате просвет кишечника становится местом обитания большого количества бактерий и грибов, которые нарушают работу желудочно-кишечного тракта и способны негативно влиять на состояние всего организма.
Следует понимать, что речь идет не о воздействии конкретного болезнетворного микроорганизма (как при кишечных инфекциях). Дисбактериоз – это системное нарушение нормального состояния кишечника. Негативное влияние оказывает и увеличение количества условно-патогенных микроорганизмов, и недостаток полезных бактерий-помощников.
Человеческий организм в норме не является стерильным. На поверхности нашей кожи, в кишечнике и в большинстве других полых органов обитает большое количество микроорганизмов. Некоторые из них нейтральны для человека, другие при определенных условиях и снижении иммунитета способны проявлять агрессию. Такая флора называется условно-патогенной, в норме она малоактивна и не представляет опасности. Лечиться для полного избавления от нее не надо.
В просвете кишечника обитают и полезные для нашего организма бактерии: лактобактерии, бифидобактерии, энтеробактерии и др. Они выполняют много функций:
- участвуют в окончательном переваривании пищи;
- синтезируют некоторые витамины;
- поддерживают необходимую кислотность в просвете кишечника;
- влияют на моторику пищеварительного тракта;
- регулируют обмен холестерина;
- способствуют образованию необходимых антител;
- контролируют количество и активность условно-патогенной флоры, подавляя рост гноеродных и гнилостных бактерий.
Уже развившийся дисбактериоз толстой кишки или тонкого кишечника иногда постепенно самостоятельно нейтрализуется, но чаще всего он принимает затяжное течение. Такое состояние не является физиологическим (естественным) для человека. Это требующая коррекции патология, хотя ее и не приравнивают к самостоятельным заболеваниям.
Почему такое развивается
У взрослых дисбактериоз всегда является вторичным, речь идет о нарушении баланса уже существующей в кишечнике микрофлоры. А вот у детей первых месяцев жизни желудочно-кишечный тракт еще только заселяется микроорганизмами, этот процесс может происходить неравномерно, с временным преобладанием условно-патогенных бактерий и грибов. Такой дисбактериоз у грудного ребенка называют первичным.
Полезная микрофлора кишечника чувствительна к разнообразным поступающим извне веществам, к ферментному балансу в пищеварительном тракте и к составу пищи. Поэтому причин для развития дисбактериоза достаточно много:
- Прием антибактериальных средств, кишечных антисептиков, препаратов с широким антимикробным действием. Причем значение имеют и назначенные врачом лечебные курсы, и бессистемное самолечение.
- Несбалансированное питание, с малым количеством клетчатки и сложных углеводов, с избытком жареного жирного красного мяса и простых углеводов.
- Злоупотребление слабительными средствами и клизмами. Часто повторяющиеся кишечные инфекции, синдром раздраженного кишечника, хроническая диарея другого происхождения
- Частый прием сорбентов.
- Хронические заболевания кишечника и других органов пищеварения.
- Эндокринные заболевания.
- Лучевая терапия, химиотерапия, некоторые другие методы лечения с цитостатическим эффектом.
Усугубляют ситуацию хронические стрессы, недосыпание, гиподинамия, вредные привычки и многие другие факторы. Они действуют опосредованно, ухудшая работу кишечника и иммунной системы, что в итоге негативно сказывается на составе кишечной флоры и ухудшает саморегуляцию. Грамотное лечение дисбактериоза должно учитывать все эти моменты.
Основные проявления
Дисбаланс кишечной микрофлоры в первую очередь отражается на качестве пищеварения, поэтому самое частое проявление заболевания – это кишечное расстройство. Но дисбактериоз приводит и к другим нарушениям, что, к сожалению, не всегда принимается во внимание при подборе схемы лечения.
Самые частые симптомы и признаки дисбактериоза:
- Нарушения работы ЖКТ. Людей с дисбиозом кишечника могут беспокоить урчание и периодический дискомфорт в животе, метеоризм, отрыжка, кишечные расстройства (запоры, поносы или их чередование). Такие признаки могут иметь различную интенсивность, возникать периодически или беспокоить основную часть времени. Наиболее яркую и дискомфортную симптоматику обычно дает дисбактериоз тонкой кишки.
- Неприятный запах изо рта, необычный привкус.
- Признаки гиповитаминоза, а иногда и анемии. Это связано с нарушением процесса переваривания и усвоения питательных веществ, со снижением синтеза витаминов группы В полезной кишечной микрофлорой, со повторяющейся диареей (поносом).
- Ухудшение состояния кожи и волос, склонность к дерматитам.
Анализ на дисбактериоз желательно также сдавать людям с частыми аллергическими реакциями, аутоиммунными заболеваниями, атопическим дерматитом, резистентной (устойчивой к лечению) бронхиальной астмой и псориазом. Дело в том, что дисбаланс кишечной флоры меняет реактивность иммунной системы, что может поддерживать симптомы заболеваний с аллергической и смешанной природой.
Как выявить дисбактериоз
План комплексного обследования при дисбиозе кишечника включает:
-
Микробиологический анализ кала. Это базовое исследование, позволяющее оценить состав кишечной микрофлоры. По назначению врача одновременно определяется чувствительность микроорганизмов к противомикробным препаратам и бактериофагам.
-
Копрологическое исследование для оценки качества переваривания пищи.
-
УЗИ органов брюшной полости. Относится к вспомогательным методам, используется для выявления структурных изменений органов ЖКТ.
-
Общеклиническая лабораторная диагностика (общие анализы крови и мочи, биохимический анализ крови). Позволяет определить наличие и выраженность воспалительных реакций, выявить анемию, оценить функциональное состояние печени, поджелудочной железы, почек.
-
Эндоскопическое исследование: ФГДС, ФКС. Позволяет осмотреть поверхность слизистой оболочки органов пищеварения, взять биопсию для гистологического исследования измененных тканей, провести исследование причин дисбактериоза. Использование эндоскопии значительно повышает качество диагностики заболеваний ЖКТ.
Существуют также лабораторные тесты для выявления патологических метаболитов и веществ, выделяемых патогенными бактериями. Но в повседневной клинической практике они используются редко.
Принципы лечения
Грамотно подобранная терапия дисбактериоза направлена не только на коррекцию основных симптомов и выявленных нарушений. Первостепенная задача лечения – восстановление физиологического баланса микрофлоры. Для этого необходимо подавить активность патогенных бактерий и грибов, заселить ЖКТ полезными бактериями и создать условия для их размножения.
Лечение дисбактериоза подбирается индивидуально и обычно включает:
- Соблюдение диеты для улучшения процесса переваривания, обеспечения организма необходимыми веществами.
- Препараты для подавления патогенной флоры, с учетом чувствительности к ним выделенных микроорганизмов. Это могут быть антибиотики, противомикробные средства, бактериофаги.
- Эубиотики – средства, которые содержат специально выведенные штаммы жизнеспособных полезных бактерий и вещества для их питания и роста.
- Энтеросорбенты, осаждающие на своей поверхности бактериальные токсины и часть патогенных микроорганизмов. Их применение – это симптоматическая терапия, позволяющая снизить уровень эндогенной интоксикации, уменьшить выраженность диареи и метеоризма.
- Противодиарейные средства.
Могут использоваться также витаминные комплексы, ферментные препараты, противоаллергические средства. Если же дисбактериоз развивается на фоне хронических заболеваний ЖКТ, подбирают лечение для их перевода в фазу стойкой ремиссии.
Куда обращаться
Лечить в СПб дисбактериоз кишечника могут врачи нескольких специальностей. Но все же профильным специалистом для этой патологии является гастроэнтеролог. Такой врач может рекомендовать необходимую схему обследования, грамотно оценить состояние всего желудочно-кишечного тракта, составить оптимальную программу лечения и дальнейшего восстановления. При выборе специалиста необходимо учитывать также профиль и возможности медицинского учреждения, по возможности отдавая предпочтение современным специализированным клиникам.
ICLINIC – это многопрофильный центр в г. Санкт-Петербург, ориентированный на достоверную диагностику и результативное лечение различных заболеваний органов пищеварения. В нашей клинике для обследования пациентов используется только современное высококлассное оборудование и прогрессивные диагностические программы, широко применяются эндоскопические методики.
Прием пациентов в ICLINIC ведут высококвалифицированные врачи различных специальностей, в штате имеется и сертифицированный опытный гастроэнтеролог. Лечение подбирается индивидуально, с учетом результатов обследования и современных клинических рекомендаций. Мы используем проверенные методики и результативные терапевтические схемы, добиваясь улучшения состояния даже у пациентов с тяжелыми и осложненными формами заболеваний.
Мы рекомендуем:
Прием врача-гастроэнтеролога
ФКС
ФКС с консультацией ведущего специалиста
Тест на вероятность рака желудка
Ваш возраст более 45 лет?
Да Нет
У Ваших родственников были онкологические заболевания?
Да Нет
У Вас есть хронические заболеваний желудочно-кишечного тракта:
– хронический гастрит,
– язвенная болезнь,
– хронический колит и другие воспалительные заболевания кишечника,
– болезнь Крона,
– неспецифический язвенный колит,
– выявленные ранее полипы желудка и кишечника,
– выявленные подслизистые эпителиальные образования желудочно-кишечного тракта?
Да Нет
Вы переносили операции на желудке и кишечнике?
Да Нет
У Вас есть рубцово-спаечные изменения желудочно-кишечного тракта?
Да Нет
Вы курите (более 1 сигареты в день)?
Да Нет
Вы допускаете погрешности в диете (низкое потребление овощей и фруктов, высокое потребление мяса и животных жиров)?
Да Нет
У Вас есть хотя-бы один из перечисленных симптомов:
– лишний вес,
– затруднения при глотании,
– раздражительность,
– бледность кожи,
– боли за грудиной,
– немотивированная слабость,
– нарушение сна,
– снижение аппетита,
– неприятный запах изо рта,
– отрыжка,
– тошнота и/или рвота,
– чувство тяжести в животе,
– изменение стула (запоры и/или поносы),
– следы крови в стуле,
– боли в животе.
Да Нет
Запишитесь на прием
В чем преимущества ICLINIC?Высочайший уровень специалистов: среди них доктора медицинских наук и члены мировых врачебных сообществ, а средний стаж врачей клиники – 16 лет безупречной работы.
Современное экспертное оборудование: диагностические аппараты медицинского центра выпущены в 2017 году ведущими мировыми производителями (Pentax и другими того же уровня).
Безупречная точность эндоскопической диагностики благодаря высокому разрешению изображения в 1,25 млн.пикселей.
Уникальные технологии ранней диагностики рака, среди которых i-scan – виртуальная хромоэндоскопия. С помощью данной технологии можно распознать даже самые мелкие, начальные опухолевые изменения.
Все для комфорта пациента: эффективное обезболивание, включая общий наркоз; тонкие эндоскопы менее 10мм в диаметре; быстрое и точное проведение манипуляций.
Безопасность: автоматизированная дезинфекция оборудования с контролем качества, мониторинг жизненно важных функций пациента в процессе исследований.
Узкая специализация: медцентр занимается заболеваниями пищеварительной системы, постоянно совершенствуясь именно в своей отрасли. Наши специалисты постоянно проходят повышение квалификации, участвуют в международных конференциях, тренингах и семинарах в России и Европе.
Удобное расположение: Петроградский район Санкт-Петербурга расположен недалеко от ценра. Сюда удобно добираться как на машине, так и на общественном транспорте. Совсем рядом с клиникой находится станция метро Чкаловская, также недалеко от медицинского центра станции СПб Спортивная, Петроградская и Горьковская.
Наш профессионализм всегда на страже вашего здоровья.
Дисбактериоз кишечника: чем может быть чревато нарушение природного баланса микрофлоры и как его устранить?
Человеческий организм населяет множество бактерий. При этом количество клеток микроорганизмов, функционирующих в теле, в несколько раз превышает численность наших собственных. Важная роль микроорганизмов в гармоничной работе желудочно-кишечного тракта давно известна и не вызывает сомнений. Интересно, что желудочно-кишечный тракт населяет около 500 различных видов микроорганизмов, общая масса которых достигает 1,5 кг. Микрофлора взрослого здорового человека состоит в основном из бактероидов, бифидобактерий, эубактерий, клостридий, стрептококков, кишечной палочки и лактобацилл. При этом их численность приближается к суммарному количеству всех человеческих клеток! Однако часто в силу различных внешних и внутренних факторов видовой и количественный состав микробиоценоза кишечника может страдать, и это часто «аукается» нам множеством неприятных симптомов, таких как вздутие, тяжесть в области живота, метеоризм, тошнота, диарея или запор. О том, как формируется микробиоценоз кишечника и как восстановить его гармоничное состояние в случае дисбактериоза, и пойдет речь далее.
Примечательно, что до рождения желудочно-кишечный тракт ребенка не населен бактериями, а колонизация кишечника начинается уже после прохождения по родовым путям и контакта с микроорганизмами организма матери. В результате дети, будто по наследству получают это сложное сообщество, состоящее из бифидобактерий, лактобацилл, энтеробактерий, клостридий и грамположительных кокков. Поэтому состав кишечной микрофлоры ребенка достаточно индивидуален и формируется в первые дни жизни. Важнейшим фактором образования нормальной микрофлоры является естественное вскармливание, поскольку материнское молоко содержит ряд веществ–пребиотиков, которые способствуют заселению кишечника определенными видами микроорганизмов. После этого состав микрофлоры подвергается изменениям в результате воздействия факторов окружающей среды, важнейшими из которых являются питание.
Нормальная микрофлора выполняет ряд важных задач: защищает организм от заселения болезнетворными микроорганизмами, обладает иммуномодулирующими свойствами, выполняет синтетическую, трофическую, детоксикационную и ферментативную функции.
Нормальная микрофлора толстого кишечника участвует в процессе пищеварения, помогая расщеплять сложные полисахариды, которые не перевариваются в тонком кишечнике (ксиланы, пектин, микрополисахариды, гликопротеин), продукты метаболизма белков, липидов и непереваренные азотсодержащие соединения.
Это происходит посредством ферментации нерасщепленных ранее компонентов пищи. Так, в результате расщепления углеводов образуются определенные конечные продукты, оказывающие положительное влияние на метаболизм — например такие, как молочная кислота и короткоцепочечные жирные кислоты.
Образование этих кислот приводит к снижению уровня рН среды кишечного содержимого и, как результат, к угнетению размножения гнилостных, патогенных микроорганизмов, тем самым обеспечивая стабильность состава кишечной микрофлоры. Благодаря продукции молочной и уксусной кислот нормальная микрофлора участвует в минеральном обмене, способствуя усилению процессов всасывания в стенке кишечника ионов кальция и железа1.
Кроме того, жирные кислоты используются клетками слизистой оболочки кишечника в качестве дополнительного источника энергии. Это способствует улучшению функционирования ее как защитного барьера. Кроме того, некоторые углеводы способны выборочно стимулировать размножение полезных для здоровья человека бактерий в толстом кишечнике1,2.
Если что-то пошло не так
Нарушение количественного и видового состава микробиоценоза кишечника принято называть дисбактериозом или дисбиозом кишечника. Среди основных причин, которые могут нарушить эту гармонию, можно выделить нерациональное питание, функциональные нарушения работы желудочно-кишечного тракта, стресс, ослабление иммунной защиты организма, инфекционные заболевания, резкую смену климатических условий проживания, применение антибиотиков и пр.
Как правило, дисбактериоз является вторичным состоянием, вызванным заболеванием или нарушением в работе пищеварительной системы. При этом его развитие замыкает порочный круг, разорвать который необходимо как для успешного лечения основного заболевания, так и для ликвидации его последствий2.
Как восстановить баланс?
При борьбе с последствиями дисбактериоза важно уделить внимание восстановлению собственной микрофлоры кишечника во всем ее природном многообразии, а также поддержать здоровье кишечника, обеспечив условия для стимуляции регенерации клеток его слизистой оболочки, способствуя таким образом восстановлению нормальной работы кишечника, а значит, и устранению неприятных симптомов.
В этом контексте перспективным направлением для коррекции нарушений микробиоценоза кишечника представляется воздействие на болезнетворную микрофлору продуктами метаболизма нормальных микроорганизмов. Такие средства обладают свойствами благоприятно влиять на состояние микробиоценоза, улучшая жизнедеятельность полезных бактерий и создавая для них максимально комфортные условия. Они способны оказывать прямое воздействие на метаболическую активность клеток или опосредованно влиять на регуляцию функционирования микробиоценоза, благодаря чему проявляют выраженный терапевтический эффект при многих заболеваниях пищеварительного тракта, сопровождающихся дисбактериозом3.
Одним из таких препаратов является ХИЛАК ФОРТЕ, который содержит концентрат продуктов обмена веществ Escherichia coli, DSM 4087, Enterococcus faecalis, DSM 4086 , Lactobacillus acidophilus, DSM 4149, Lactobacillus helveticus , DSM 4183. Данное лекарственное средство нормализует состояние кишечной флоры и водно-электролитный баланс в просвете кишечника4, а также способствуют сохранению физиологической функции слизистой оболочки кишечника и восстановлению его нормальной флоры4.
Кроме того, благодаря тому, что ХИЛАК ФОРТЕ содержит биосинтетическую молочную кислоту и ее буферные соли, нормализуется кислотность в кишечнике4. На фоне ускорения развития нормальных симбионтов кишечника под действием препарата нормализуется естественный синтез витаминов группы B и K5. Летучие кислоты жирного ряда, содержащиеся в препарате ХИЛАК ФОРТЕ, обеспечивают восстановление микрофлоры кишечника при инфекционных заболеваниях желудочно-кишечного тракта, стимулируют регенерацию эпителиальных клеток кишечной стенки, восстанавливают нарушенный водно-электролитный баланс в просвете кишки5.
Благодаря упомянутым выше эффектам препарат ХИЛАК ФОРТЕ показан при различных расстройствах пищеварения, таких как метеоризм, диарея, запор. Он также рекомендован во время и после терапии с применением антибиотиков и сульфаниламидных препаратов и ряде других нарушений со стороны желудочно-кишечного тракта.
Пресс-служба «Еженедельника АПТЕКА»
Статья подготовлена и размещена при поддержке ООО «Тева Украина»
Хилак фортеЦікава інформація для Вас:
Правила сбора испражнений при исследовании микрофлоры кишечника (дисбактериоз)
Уважаемые пациенты, соблюдение рекомендаций положительно влияет на точность и достоверность результата. Если вы принимаете какие-то лекарственные препараты, следует проконсультироваться с врачом по поводу целесообразности проведения исследования на фоне приёма препаратов или возможности отмены приёма препарата перед исследованием.
1. Сбор кала необходимо проводить до начала антимикробной терапии или не ранее, чем через 10-15 дней после прекращения лечения. Все обследуемые пациенты за 3-4 дней до взятия пробы должны находиться на диете, исключающие приём продуктов, усиливающих процессы брожения в кишечнике и молочно-кислые продукты, а также алкоголь и бактерийные препараты-пробиотики (содержащие бифидобактерии, кишечные палочки и другие живые микроорганизма). За 3-4 дня до исследования необходимо отменить приём слабительных препаратов, касторового и вазелинового масла, прекратить введение ректальных свечей . Кал, полученный после клизмы, а также после приёма барии: (при рентгеновском обследовании) для исследования не используется.
2. Для исследования необходим утренний кал после естественной дефекации которой собирают в чистый стерильный одноразовый контейнер с завинчивающейся крышкой и ложечкой До сбора анализа помочитесь в унитаз т.к. в пробу не должна попадать моча. Не рекомендуется собирать материал из унитаза. При использовании судна (горшка), его предварительно хорошо промыть с мылом и губкой, ополаскивают многократно водопроводной водой, а потом обдают кипятком и остужают, Рекомендуется собирать испражнения на чистую поверхность, в качестве которой может, использован чистый новый лист (пакет) из полиэтилена или бумаги. У детей до года кал собирают на тканевую пеленку, проглаженную утюгом. Материал в памперсах не принимается. .
3. Испражнения берут из разных мест, не касаясь стенок горшка, преимущественно из средней порции ложечкой, вмонтированной в крышку контейнера, в количестве ½ от объема контейнера. Не наполняйте доверху. Тщательно закройте крышку.
4. Проба доставляется в лабораторию в течении 2 часов с момента сбора анализа, при невозможности быстрой доставки, допустимо хранение в холодильнике не более 4-х часов (температура 8-10 о). Не допускается замораживание. На контейнере необходимо указать фамилию, инициалы, дату рождения, дату и время сбора материала, запись должна быть сделана разборчивым почерком.
Важно! Несоблюдение инструкции приводит к некорректным результатам исследования!
Срок выполнения исследования от 5 до 7 суток (в зависимости от выделенных микроорганизмов).
Признаки и причины дисбактериоза – сеть клиник НИАРМЕДИК
Симптомы дисбактериоза кишечника
Симптомы дисбактериоза кишечника у взрослых и детей аналогичны признакам различных заболеваний желудочно-кишечного тракта, которые сопровождаются следующими проявлениями:
- отрыжкой;
- тошнотой;
- изжогой;
- вздутием живота;
- поносами;
- запорами;
- неприятным привкусом во рту;
- неприятным запахом изо рта;
- болями в животе;
- аллергическими реакциямидаже на безобидные продукты питания;
- субфибрильной температурой.
При дисбактериозе в первую очередьпод удар попадаетпроцесс пищеварения. Пищу в кишечнике сначала расщепляют бактерии, а уже потом она всасывается в кровь. Без содействияполезных микробовчеловеческий организм не может полноценно усвоить необходимые питательные вещества. Поэтому и появляются такие признаки дисбактериоза кишечника как тошнота, рвота, жидкий стул и т.п.
Диагностика дисбактериоза
Для определения наличия и характера дисбактериоза кишечника необходимо сдать анализ, чтобы выяснить, какие именно микроорганизмы и в каком количестве населяют кишечник. Применяются следующие методы диагностики:
- Бактериологическое исследование. Результат данного анализа готовится восемь дней – именно столько времени в среднем нужно для того, чтобы бактерии выросли в специальных питательных средах и стали доступны для выявления. Качество результатов зависит от соблюдения сроков доставки, от качества материала и особенностей и трудностей культивирования отдельных видов бактерий.
- Метод обследования метаболитов микрофлоры, основанный на определении летучих жирных кислот, выделяемых микробами в процессе своего развития. Способ отличается высокой чувствительностью и очень прост в определении микробов, а также позволяет получить результат уже в течение нескольких часов.
Необходимо учитывать, что состав микрофлоры кишечника у каждого человека индивидуален. Это зависит от возраста, рациона питания, и даже от времени года. Потому одних лишь анализов для установления диагноза недостаточно. Обычно требуется дополнительное обследование для выявления причин дисбактериоза.
На сегодняшний день не существует ни одного способа диагностики, который позволил бы уверенно говорить о наличии кишечного дисбактериоза. Симптомы, приписываемые этому заболеванию, обычно являются проявлениями какого-либо основного заболевания. Малоинформативным является даже широко распространенный анализ на дисбактериоз у детей. Копроскопия не дает совсем никакой информации о микроорганизмах в кишечнике, только выявить наличие паразитов в некоторых случаях.
Лечение дисбактериоза
В сети клиник НИАРМЕДИК в большинстве случаев проводят комплексное лечение дисбактериоза кишечника у взрослых и детей, так как заболевание часто связано с нарушением моторики кишечника, синдромом раздраженного кишечника, а также психоэмоциональными нарушениями. Выбор методовлечения зависит от того, как протекает заболевание, на фоне которого проявляется кишечный дисбактериоз, а также от преобладающих симптомов.
Эффективные мероприятия по лечению дисбактериоза обычно направлены на то, чтобы:
- изменить образ жизни,
- соблюдать диету.
Огромное значение в терапии дисбактериоза имеет пересмотр образа жизни и правильное питание. Пациентам рекомендуется:
- избегать работы, требующей большой физической нагрузки;
- избегать психоэмоциональных потрясений и стрессовых ситуаций;
- дозировать регулярную физическую нагрузку – это оказывает положительное влияние на нервную систему и позволяет избавиться от депрессии.
Основные принципы питания при дисбактериозе
- кишечник должен быть максимально защищен от механического, химического и термического воздействия пищи;
- еда должна быть полноценной и разнообразной;
- пища должна содержать все необходимые витамины и микроэлементы;
- питаться следует по определенному графику в строго определенные часы;
- последний прием пищи должен быть не позднее, чем за три часа до сна;
- кушать следует медленно, хорошо пережевывая пищу, не отвлекаясь на чтение, разговоры или просмотр телевизора;
- соблюдать рекомендации врача по употреблению или же исключения из рациона тех или иных продуктов;
- устранить избыточное размножение вредных микроорганизмов в кишечнике.
Лечение антибиотиками должно осуществляться исключительно по показаниям врача. Антибактериальные препараты применяются только при сильном дисбактериозе с угрозой попадания микробов из кишечника в кровь и развитии сепсиса.
В остальных случаях лечение начинают с кишечных антисептиков, которые назначаются на 10-14 дней. Данные препараты оказывают более мягкое воздействие, не нарушают нормальную микрофлору, и при этом значительно снижают количество болезнетворных бактерий. Если антисептики не дали эффекта, могут назначить антибиотики.
Имплантировать нормальную кишечную микрофлору
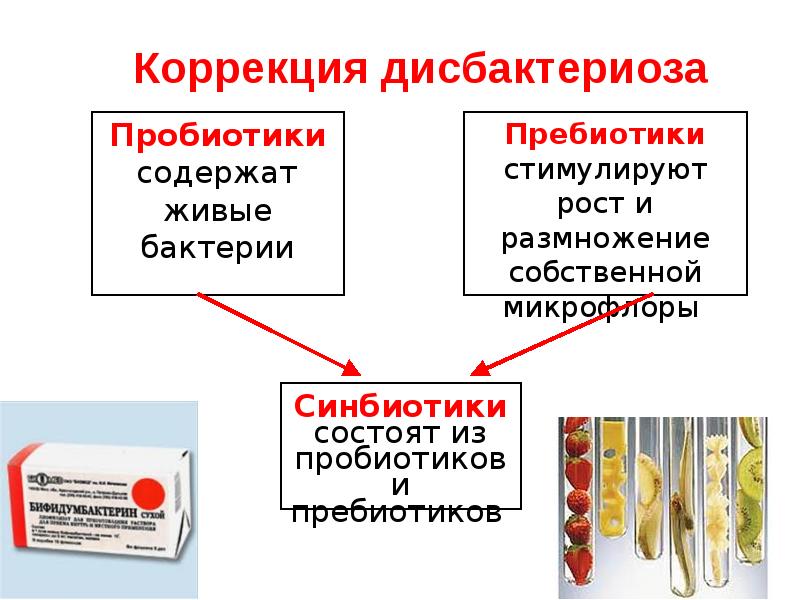
Для восстановления микрофлоры применяются пробиотики – препараты, которые содержат представителей нормальной флоры кишечника и пребиотики – лекарства, облегчающие их выживание и размножение в кишечнике.
Самые изученные и полезные бактерии для кишечника – это бифидо и лактобактерии. Пробиотики применяются регулярно, длительно (в течение 1-2-х месяцев) и дозировано.
Повысить иммунитет для создания естественной микрофлоры кишечника
Пациентам со сниженным иммунитетом могут назначить иммуностимуляторы и витамины в дополнение к диете.
Также могут применяться адсорбенты – препараты, которые обладают вяжущим и обволакивающим действием, а также впитывают растворы токсинов.
Профилактика дисбактериоза кишечника
Профилактика дисбактериоза состоит из лечения антибактериальными средствами, обязательного общеукрепляющего лечения и полноценного питания для ослабленных пациентов.
границ | NLR и воспалительные заболевания, связанные с дисбактериозом кишечника: движущие силы или препятствия?
Введение
Здоровый кишечник человека заселен несколькими микроорганизмами, включая грибы, вирусы и бактерии, принадлежащие к разным семействам (1). Исследования микробиома кишечника показывают большое количество бактерий из семейств Bacteroidaceae, Prevotellaceae, Rikenellaceae и Ruminococcaceae в толстой кишке (2). С другой стороны, тонкий кишечник в основном заселен бактериями из семейств Lactobacillaceae и Enterobacteriaceae (3).В последние годы секвенирующий анализ гена 16S рРНК выявил связь между микробиотой кишечника и воспалительными заболеваниями (4). Изменения в составе кишечной микробиоты, процесс, называемый дисбактериозом, играют ключевую роль в патогенезе воспалительных заболеваний, таких как ревматоидный артрит (5), атеросклероз (6), язвенный колит, болезнь Крона (7) и сахарный диабет. типа 1 и 2 (8, 9). Соответственно, модуляция микробиоты кишечника пребиотиками и пробиотиками в качестве профилактических или терапевтических стратегий для смягчения патогенеза воспалительных заболеваний все чаще исследуется (10).
Рецепторы врожденного иммунитета, также называемые рецепторами распознавания образов (PRR), экспрессируются несколькими клетками и участвуют в распознавании микробных продуктов или эндогенных собственных молекул. PRR являются ключевыми компонентами патогенеза воспалительных и аутоиммунных заболеваний (11, 12). Толл-подобные рецепторы (TLR) и NOD-подобные рецепторы (NLR) относятся к основным семействам, составляющим суперсемейство PRR (13). В процессе дисбактериоза увеличенное количество патобионтных бактерий модулирует экспрессию и активацию TLR, что приводит к провоспалительной реакции в кишечнике и вне кишечника (14, 15).С другой стороны, NLR имеют либо положительные, либо вредные эффекты, которые зависят от антимикробных факторов и провоспалительного цитокинового профиля после активации микробиоты кишечника. В этом мини-обзоре подчеркивается различная роль NLR в метаболических и воспалительных заболеваниях, связанных с дисбактериозом кишечника.
Дисбактериоз кишечника при воспалительных заболеваниях
Микробиота кишечника в гомеостазе напрямую связана со здоровьем хозяина. Кишечная микробиота влияет на метаболизм хозяина (16), иммунную систему (17, 18), микробицидные механизмы кишечника (19) и поддерживает кишечный барьер (20).Многие исследования показывают, что факторы окружающей среды, такие как использование антибиотиков (21, 22), диета (23) и стресс (24), могут изменить микробиоту кишечника, увеличивая количество патобионтических бактерий за счет комменсальных бактерий, процесс, известный как дисбиоз ( 25). Дисбактериоз кишечника способствует развитию ряда аутоиммунных, воспалительных и метаболических заболеваний, таких как ревматоидный артрит (РА), воспалительные заболевания кишечника (ВЗК) и сахарный диабет (26, 27). Однако во многих случаях, например, при ВЗК, еще не известно, является ли дисбактериоз причиной или следствием заболевания (28, 29).Точная роль микробиоты кишечника в патогенезе РА также полностью не изучена. Однако у мышей без микробов (GF) наблюдается задержка развития RA по сравнению с контрольной группой (30). На ранних стадиях РА было зарегистрировано уменьшение количества некоторых комменсальных бактерий, таких как бактерии, принадлежащие к роду Bifidobacteria и Bacteroides , и увеличение количества Escherichia coli и Proteus mirabilis (31, 32). . Кроме того, у пациентов с РА наблюдается повышение уровня Prevotella copri , а также анти- P.copri IgA и IgG, что позволяет предположить, что эти бактерии могут вносить вклад в патогенез РА (33).
Воспалительные заболевания кишечника, такие как болезнь Крона (БК) и язвенный колит (ЯК), поражают около 3 миллионов человек в Европе и США, причем высокая и ускоренная заболеваемость наблюдается в развивающихся странах (34, 35). Хотя этиология все еще не ясна, генетическая предрасположенность и факторы окружающей среды, такие как диета и использование антибиотиков, являются триггерами этих заболеваний, которые в основном характеризуются хроническим воспалением кишечника (34, 36).Кроме того, нарушение эпителиального барьера и дисбактериоз кишечника широко сообщается у пациентов и в экспериментальных моделях желудочно-кишечных инфекций (37, 38), включая пациентов с ВЗК (39, 40). Метагеномный анализ 16S рРНК показал, что микробиота, присутствующая в кале мышей с ЯК, сильно отличается от микробиоты в кале здоровых мышей, в основном увеличением видов филума Verrucomicrobia и уменьшением Tenericutes у мышей с колитом, что коррелирует с с более высоким показателем заболевания (41, 42).Увеличение количества энтеробактерий наблюдается в образцах кала пациентов с CD (43). Численность Escherichia и Shigella также увеличивается в этом состоянии по сравнению со здоровыми людьми. Кроме того, сообщалось о сокращении количества родов Roseburia, Coprococcus и Ruminococcus , которые являются важными продуцентами бутирата (44, 45). Анализ биопсии толстой кишки у пациентов с ВЗК также показывает снижение Firmicutes и увеличение Bacteroidetes (46), а у пациентов с ВЗК наблюдается повышенное производство биопленок штаммами Enterococcus по сравнению со штаммами из контрольной группы (47).
Несбалансированная микробиота кишечника и изменения барьерной функции кишечника также тесно связаны с патогенезом сахарного диабета (СД) (48). СД включает группу метаболических заболеваний, характеризующихся в основном хронической гипергликемией, возникающей в результате нарушения секреции и / или функциональности инсулина (49). При диабете 1 типа (T1D), также называемом аутоиммунным диабетом, присутствуют аутоантитела, и аутореактивные лимфоциты опосредуют разрушение β-клеток поджелудочной железы, что приводит к полному дефициту инсулина (50).Влияние микробиоты на развитие T1D было продемонстрировано на мышах с дефицитом Myd88 и диабетом без ожирения (NOD), выращенных в условиях, свободных от патогенов (SPF) или микробов (GF). Принимая во внимание, что мыши SPF NOD.Myd88 – / – защищены от T1D, у мышей в условиях GF развивается T1D, показывая, что защитные эффекты Myd88 зависят от присутствия микробиоты кишечника (51). В этом контексте многие исследования показали различия в составе микробиоты между диабетиками и недиабетическими пациентами, предполагая, что эти изменения связаны с развитием и тяжестью СД1 (52, 53).Исследования бактериального протеома показывают высокое обогащение белками Clostridium и Bacteroides у детей с СД1, тогда как контрольная группа демонстрирует большее обогащение белками Bifidobacterium (54). Кроме того, снижение количества видов, продуцирующих лактат и бутират, таких как B. adolescentis , связано с аутоиммунитетом T1D (55).
В моделях диабета 2 типа (T2D) дисбиоз кишечника усугубляет воспалительный процесс, увеличивает проницаемость кишечника, а также изменяет метаболизм короткоцепочечных жирных кислот, которые важны для инсулинорезистентности (56), в дополнение к ускорению развития ожирение, ретинопатия и нефропатия (57).У пациентов с СД2 чрезмерное потребление углеводов и белков связано с дисбалансом микробиоты кишечника, с увеличением рода Clostridium и уменьшением количества Bifidobacterium spp. и Lactobacillus , помимо непереносимости глюкозы (58). Более того, в экспериментальных моделях СД2 введение бактерий рода Bifidobacterium улучшает толерантность к глюкозе и придает защитную роль в развитии СД2 (59, 60).Точно так же прием Bacteroides acidifaciens снижает инсулинорезистентность и даже предотвращает ожирение (61).
Рецепторы врожденного иммунитета, такие как NLR, играют решающую роль в защите кишечного барьера от различных микроорганизмов из окружающей среды. Эти рецепторы также модулируют микробный состав кишечника, что связано с развитием воспалительных заболеваний (62).
Защитная роль NLR в гомеостазе кишечной микробиоты и ВЗК
Компоненты врожденной иммунной системы являются первым барьером против инфекций и распознают гибель клеток, вызывая быстрый иммунный ответ за счет распознавания патоген-ассоциированного молекулярного паттерна (PAMP) и ассоциированного с повреждением молекулярного паттерна (DAMP), соответственно (63).NLR являются частью множества рецепторов врожденного иммунитета, расположенных во внутриклеточной среде, и инициируют воспалительные процессы. NOD1 и NOD2, центральные члены NLR, в основном распознают бактериальный пептидогликан и, таким образом, индуцируют транскрипцию генов NF-kB и митоген-активируемых протеинкиназ (MAPK), активируя экспрессию провоспалительных факторов различными клетками (13).
Рецептор NOD1 обнаруживает гамма-D-глутамил-мезо-диаминопимелиновую кислоту (γ iE-DAP), пептид, обнаруживаемый в основном в грамотрицательных бактериях, но также и в группах грамположительных бактерий, таких как Listeria spp.и Bacillus spp (64–66). В отсутствие NOD1 происходит размножение некоторых кишечных бактерий, таких как Clostridiales , Bacteroides spp., Сегментированные нитчатые бактерии (SFB) и Enterobacteriaceae. Рецептор NOD2 обнаруживает мурамилдипептид (MDP), присутствующий в бактериальном пептидогликане, и является наиболее важным рецептором в контроле гомеостаза кишечника (67). Этот рецептор контролирует комменсальную микробиоту и устранение патогенных бактерий в кишечных криптах, сводя к минимуму риск воспаления кишечника и колоректального рака (68–70).Интересно, что экспрессия NOD2 зависит от присутствия кишечных комменсальных бактерий, что указывает на положительную обратную связь. Дефицит NOD2 нарушает это гомеостатическое взаимодействие, что приводит к дисбактериозу кишечника и повышенной восприимчивости к ВЗК (69).
Другие NLR также играют важную роль в гомеостазе кишечника. Активация семейства NOD-подобных рецепторов – пиринового домена, содержащего 6 (NLRP6), посредством олигомеризации и сборки белков с комплексом инфламмасом – активирует каспазу-1 и приводит к синтезу IL-1β и IL-18 в эпителии кишечника (71 ).Дефицит NLRP6 в эпителиальных клетках толстой кишки мышей снижает уровень IL-18, способствует дисбактериозу кишечника и увеличивает риск колита (72, 73). IL-18, секретируемый эпителиальными клетками, стимулирует барьерную функцию и регенерацию эпителиальных клеток (73). Кроме того, сама комменсальная микробиота активирует инфламмасому NLRP6, что приводит к выработке слизи бокаловидными клетками и антимикробными пептидами, поддерживая здоровый состав кишечной микробиоты (74).
NLRP3, другой тип NLR, высоко экспрессируется в моноцитарной линии (75) и способствует большей продукции IL-1β по сравнению с IL-18, что приводит к изменениям в составе кишечной микробиоты (76).В нормальных условиях у мышей с дефицитом NLRP3 наблюдается дисбиоз кишечника, связанный с чрезмерным ростом Prevotellaceae и Bacteroidetes (77), тогда как соотношение между Firmicutes и Bacterioidetes уменьшается (78). В отличие от других NLR, NLRP12 обладает противовоспалительным действием, ингибируя канонический и неканонический NF-κB; снижение выработки воспалительных цитокинов, хемокинов и онкогенных факторов (79–82) и контроль инфекции грамотрицательными бактериями (83). Дефицит NLRP12 на модели колита, индуцированного декстрансульфатом натрия (DSS), способствует воспалению толстой кишки, снижает разнообразие кишечной микробиоты и увеличивает количество колитогенных бактерий, таких как семейство Erysipelotrichaceae, что свидетельствует о защитной роли NLRP12 при ВЗК (84).
Расходящиеся роли NLR и AIM2 в развитии T1D
В последние несколько лет несколько линий доказательств продемонстрировали, что члены семейства NLR участвуют в патогенезе T1D. Недавно мы сообщили, что мыши, лишенные NOD2, но не NOD1, устойчивы к индуцированному стрептозотоцином (STZ) T1D и неспособны вызывать иммунный ответ Th2 и Th27 в лимфатических узлах поджелудочной железы (PLN) и поджелудочной железе. Интересно, что у мышей с диабетом наблюдаются изменения в составе микробиоты кишечника, и это связано с транслокацией микробиоты кишечника в PLN (рис. 1).Когда эти мыши подвергаются лечению антибиотиками широкого спектра действия до инъекций STZ, у них не развиваются признаки СД1, такие как гипергликемия. Кроме того, введение лиганда NOD2, MDP, способствует развитию STZ-индуцированного T1D у мышей дикого типа (WT), которым вводили антибиотики и инъецировали STZ. Наши результаты демонстрируют, что распознавание микробиоты кишечника NOD2 в PLN запускает провоспалительный ответ, который индуцирует патогенный иммунный ответ клеток Th2 и Th27, тем самым внося вклад в патогенез STZ-индуцированного T1D (Таблица 1) (85).
Рисунок 1 . Экспрессия и дифференциальные функции NLR в развитии диабета 1 типа. Повышенная экспрессия AIM2 была обнаружена в слизистой оболочке кишечника мышей с преддиабетическим состоянием, и его активация вызывает высвобождение IL-18, что, в свою очередь, способствует продукции RegIIIγ. Этот механизм ослабляет дисбактериоз кишечника, усиливает барьер кишечника и ослабляет ответ лимфоцитов Th2 и Tc1 против продуцирующих инсулин β-клеток, что в конечном итоге защищает от T1D. С другой стороны, NOD2 распознает перемещенный мурамилдипептид (MDP) из дисбиотической микробиоты и способствует активации лимфоцитов Th2 и Th27 при T1D.Наконец, у мышей с диабетом наблюдалась повышающая регуляция экспрессии NLRP3 в PLN, которая активируется в макрофагах путем распознавания митохондриальной ДНК (мДНК), приводит к продукции IL-1β и стимулирует образование патогенных лимфоцитов Th27 и Th2, что приводит к началу T1D.
Таблица 1 . Резюме экспериментальных исследований роли NLR в T1D.
STZ-инъецированные мыши WT демонстрируют увеличение различных групп бактерий в кишечной микробиоте, таких как семейство Bacteroidaceae и род Bacteroides , которые были связаны с повышенной восприимчивостью к T1D у людей (91, 92).Эти результаты повторяют то, что было обнаружено у пациентов с сахарным диабетом 1 типа, при этом тип Bacteroidetes, семейство Bacteroidaceae и род Bacteroides чаще встречаются у детей с положительной реакцией на антитела, чем у сверстников с отрицательной реакцией на антитела (55). Другое важное наблюдение, обнаруженное среди пациентов с диабетом 1 типа, – снижение разнообразия микробиоты, связанное со снижением относительной численности Bifidobacterium, Roseburia, Faecalibacterium и Lachnospira (91).Эти данные показывают, что дисбактериоз кишечника, наблюдаемый у пациентов с диабетом 1 типа, может действовать как триггер окружающей среды в развитии заболевания, и что стратегии, нацеленные на блокировку передачи сигналов NOD2, появляются в качестве потенциальных методов лечения СД1. Аналогичные результаты были получены на модели спонтанных мышей T1D. Мыши NOD.NOD2 – / – без совместного проживания демонстрируют снижение частоты СД1 и снижение CD4 + IFN-γ + / CD8 + IFN-γ + (Th2 / Tc1) и CD4 + IL-17 + / CD8 + IL-17 + (Th27 / Tc17) Т-клетки в PLN, что указывает на то, что активация NOD2 регулирует развитие T1D, изменяя состав микробиоты кишечника и модулируя адаптивный иммунный ответ ( 86).
Другие исследования также показали, что NLRP3 необходим для патогенеза СД1. Дефицит NLRP3 у мышей NOD защищает от T1D, подавляя экспрессию хемокинов и хемокиновых рецепторов, участвующих в миграции иммунных клеток к островкам поджелудочной железы. Дефицит NLRP3 у мышей NOD снижает экспрессию CCR5 и CXRC3 на Т-клетках, а также экспрессию генов CCL5 и CXCL10 в ткани поджелудочной железы, и эти процессы происходят зависимым от IRF1 образом (87). Кроме того, наша исследовательская группа продемонстрировала, что активация инфламмасомы NLRP3 митохондриальной ДНК (мДНК) способствует высвобождению IL-1β макрофагами, способствуя образованию патогенных клеток Th27 / Th2 в PLN и чувствительности к T1D в модели STZ-индуцированного T1D (рис. , Таблица 1) (88).Соответственно, ассоциативное исследование в северо-восточной части Бразилии выявило два однонуклеотидных полиморфизма (SNP) в NLRP3, rs10754558 и rs358294199, которые связаны с T1D у людей, что позволяет предположить, что вариации NLRP3 могут быть предрасполагающим генетическим фактором для развитие аутоиммунного СД1 (89).
Другой рецептор врожденного иммунитета, который приводит к сборке инфламмасом при его активации, – это датчик ДНК, отсутствующий в меланоме 2 (AIM2) (93, 94). Активация AIM2 участвует в аутоиммунных и воспалительных заболеваниях (95).В модели STZ T1D AIM2 высоко экспрессируется в подвздошной кишке на ранних стадиях заболевания. Интересно, что AIM2 – / – STZ-инъецированные мыши обнаруживают повышенную частоту T1D, повышенную кишечную проницаемость и бактериальную транслокацию в PLN, что приводит к провоспалительному ответу, опосредованному клетками Th2 и Tc1. Когда микробиота кишечника истощается коктейлем антибиотиков широкого спектра действия перед инъекциями STZ, повышенная чувствительность к T1D, наблюдаемая у мышей AIM2 – / – , исчезает (Таблица 1).Эффекты, индуцируемые активацией AIM2 in vivo , опосредуются высвобождением IL-18, который способствует регенерации продукции III гамма (RegIIIγ) островкового происхождения, таким образом смягчая изменения микробиоты кишечника и усиливая барьерную функцию кишечника. Вместе наши данные показывают, что активация AIM2 ограничивает дисбактериоз кишечной микробиоты, кишечную проницаемость и транслокацию в PLN, уменьшая провоспалительный ответ и обеспечивая защиту от T1D (90).
Роль NLR в ожирении, СД2 и сопутствующих заболеваниях
Дисбактериоз кишечника может приводить к повышенной проницаемости кишечного барьера, что приводит к системному воспалению низкой степени и метаболическим нарушениям, таким как ожирение, СД2 и ишемический инсульт (96, 97).Рецепторы врожденного иммунитета играют роль в системном воспалении, вызванном ожирением. У мышей, получавших диету с высоким содержанием жиров (HFD), наблюдается усиление воспаления толстой кишки и эндотоксемии из-за повышенной кишечной проницаемости слизистой оболочки толстой кишки (98). Кроме того, наблюдается усиление передачи сигналов TLR4 в толстой кишке и активация NF-κB (98). Однако самки мышей, лишенные TLR4, демонстрируют более высокий риск развития ожирения, но также обладают большей защитой от инсулинорезистентности, возможно, из-за отсутствия передачи сигналов TLR4 в органах, важных для метаболического гомеостаза (99).Кроме того, другие исследования показали, что дисбактериоз кишечника способствует состоянию метаболической эндотоксемии при ожирении, что приводит к накоплению ЛПС в крови, мета воспламенению и инсулинорезистентности через путь CD14 / TLR4 (100–102).
T2D – это хроническое метаболическое воспалительное состояние и самый распространенный тип диабета у взрослых во всем мире (103). Это заболевание инициируется обострением дисфункции поджелудочной железы, когда выработка инсулина β-панкреатическими клетками не успевает за увеличением периферической инсулинорезистентности (104, 105).Системное воспаление слабой степени сопровождает диабет с высокими уровнями в сыворотке крови C-реактивного белка (CRP), фактора некроза опухоли (TNF-α), хемопривлекающего моноциты белка-1 (MCP-1) и IL-1β (106, 107 ). Кроме того, ожирение, старение и другие состояния, способствующие хроническому воспалению слабой степени, связаны с повышенным риском развития СД2 (108–110). Системно высокие сывороточные концентрации IL-6, IL-1β и TNF-α увеличивают инсулинорезистентность и вызывают эндотелиальную дисфункцию, стимулируя сосудистую систему к развитию заболеваний, связанных с диабетом, включая системную артериальную гипертензию (111).Между тем, повышение уровня IL-1β, IL-6 и IL-8 в поджелудочной железе снижает экспрессию гена инсулина в β-клетках поджелудочной железы, что способствует повышению инсулинорезистентности (112).
Точный баланс между активацией врожденных рецепторов NOD1 и NOD2 имеет решающее значение для поддержания периферической инсулинорезистентности. Прямая активация рецепторов NOD1 посредством внутрибрюшинного введения лиганда NOD1 у мышей WT приводит к увеличению периферической инсулинорезистентности в течение 6 часов (113). В этом же исследовании активация NOD1 вызывала небольшое увеличение циркулирующих провоспалительных цитокинов.Кроме того, более высокие концентрации медиаторов воспаления наблюдаются в культурах фибробластов 3T3-L1, дифференцированных в адипоциты и подвергнутых воздействию лигандов NOD1 в течение 18 часов (113). Воспаление периферических тканей, особенно жировой ткани (114), является отличительной чертой СД2 и напрямую способствует его патогенезу через дисфункцию жировой ткани и последующие осложнения энергетического гомеостаза и промежуточного метаболизма (115). В этом контексте мыши NOD1 / NOD2 с двойным нокаутом защищены от периферической инсулинорезистентности и периферического воспаления, наблюдаемых в модели T2D, вызванной ожирением (HFD) (113).
NOD2 – это рецептор врожденного иммунитета, который распознает пептидогликан в клеточной стенке бактерий и, следовательно, представляет собой важное звено между микробиотой кишечника и иммунитетом (116). Следовательно, профиль активации NOD2 может быть важным при метаболических заболеваниях с ответвлениями иммунной системы и, следовательно, может представлять собой связь между микробиотой кишечника и этими заболеваниями. Дефицит NOD2 у мышей способствует большему перемещению бактерий из кишечника (116). В модели HFD мыши с дефицитом NOD2 проявляют большую периферическую резистентность к инсулину, воспаление висцеральной жировой ткани и более высокое содержание бактериальной ДНК в печени (117).HFD увеличивает соотношение Firmicutes к Bacteriodetes, а у мышей NOD2 – / – , подвергнутых HFD, обнаруживается дисбактериоз, представленный увеличением количества бактерий Helicobacter и семейства Peptococcaceae и уменьшением количества бактерий рода Clostridium по сравнению с Мыши WT, получавшие HFD (117). Трансплантация фекалий от мышей с ожирением мышам с худым GF увеличивает общую массу тела и массу жировой ткани. В качестве альтернативы трансплантация фекалий от тощих мышей мышам GF с ожирением снижает массу жировой ткани (118).В этой последней экспериментальной установке наблюдается увеличение количества типов Bacteriodetes в кишечнике, что связано с производством метаболитов микробиоты с модулирующими свойствами хозяина, в частности: SCFAs (118). Интересно, что адекватное потребление пищевых волокон способствует секреции SCFAs кишечной микробиотой. Кроме того, активация рецептора GPR43 у мышей с помощью SCFAs в макрофагах M2 жировой ткани приводит к повышенной метаболической активности и способствует поддержанию и гомеостазу здоровой жировой ткани, улучшая метаболическое здоровье (119).
Заключительные замечания
Различные категории NLR модулируют вызванные дисбактериозом кишечника внекишечные и кишечные воспалительные заболевания. Эффекты NLR разнообразны и могут быть как защитными, так и вредными, в зависимости от иммунологического контекста. В кишечнике NLR регулируют состав и транслокацию микробиоты кишечника, влияя на секрецию слизи и продукцию антимикробных пептидов, тем самым играя ключевую роль в защите от воспалительных заболеваний кишечника, таких как язвенный колит и болезнь Крона.Альтернативно, NLR также активируются микробными PAMP (кишечная микробиота) или эндогенными DAMP (компонентами мертвых или умирающих клеток), которые действуют как отрицательные или положительные регуляторы врожденного и адаптивного иммунного ответа и способствуют восприимчивости или устойчивости к метаболическим заболеваниям, таким как как ожирение, диабет 1, 2 типа и их сопутствующие заболевания. Таким образом, фармакологическая модуляция этих рецепторов может представлять новые терапевтические стратегии для этих воспалительных и метаболических заболеваний.
Авторские взносы
JE-O, JL, ÍP, JG и GM в равной степени внесли свой вклад в написание рукописи. JS и RT предоставили научную помощь и критически отредактировали ее. DC координировал и рецензировал рукопись. Все авторы одобрили подачу и публикацию.
Финансирование
Это исследование было поддержано грантами Исследовательского фонда Сан-Паулу (FAPESP) (номера процессов: 2012 / 10395-0; 2018 / 14815-0).
Конфликт интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Список литературы
5. Чжан X, Чжан Д., Цзя Х., Фэн К., Ван Д., Лян Д. и др. Микробиомы полости рта и кишечника нарушаются при ревматоидном артрите и частично нормализуются после лечения. Nat Med. (2015) 21: 895–905. DOI: 10,1038 / нм.3914
PubMed Аннотация | CrossRef Полный текст | Google Scholar
6. Карлссон Ф. Х., Фак Ф., Нукау И., Тремароли В., Фагерберг Б., Петранович Д. и др. Симптоматический атеросклероз связан с измененным метагеномом кишечника. Nat Commun. (2012) 3: 1245. DOI: 10.1038 / ncomms2266
PubMed Аннотация | CrossRef Полный текст | Google Scholar
7. Tamboli CP, Neut C, Desreumaux P, Colombel JF. Дисбактериоз при воспалительном заболевании кишечника. Gut. (2004) 53: 1–4. DOI: 10.1136 / gut.53.1.1
CrossRef Полный текст | Google Scholar
8. Тай Н, Вонг Ф.С., Вэнь Л. Роль кишечной микробиоты в развитии сахарного диабета 1-го, 2-го типа и ожирения. Rev Endocr Metab Disord. (2015) 16: 55–65. DOI: 10.1007 / s11154-015-9309-0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
14. Ли Х, Ватанабе К., Кимура И. Дисбиоз кишечной микробиоты стимулирует и подразумевает новые терапевтические стратегии для лечения сахарного диабета и связанных с ним метаболических заболеваний. Front Immunol. (2017) 8: 1882. DOI: 10.3389 / fimmu.2017.01882
PubMed Аннотация | CrossRef Полный текст | Google Scholar
15. Frosali S, Pagliari D, Gambassi G, Landolfi R, Pandolfi F, Cianci R.Как сложное взаимодействие между толл-подобными рецепторами, микробиотой и кишечным иммунитетом может влиять на патологию желудочно-кишечного тракта. J Immunol Res. (2015) 2015: 489821. DOI: 10.1155 / 2015/489821
PubMed Аннотация | CrossRef Полный текст | Google Scholar
16. Роуленд И., Гибсон Дж., Хейнкен А., Скотт К., Суонн Дж., Тиле И. и др. Функции кишечной микробиоты: метаболизм питательных веществ и других компонентов пищи. Eur J Nutr. (2018) 57: 1–24. DOI: 10.1007 / s00394-017-1445-8
CrossRef Полный текст | Google Scholar
18.Лазар В., Диту Л.М., Пиркалабиру Г.Г., Георге И., Курутиу С., Холбан А.М. и др. Аспекты взаимодействия микробиоты кишечника и иммунной системы при инфекционных заболеваниях, иммунопатологии и раке. Front Immunol. (2018) 9: 1–1830. DOI: 10.3389 / fimmu.2018.01830
PubMed Аннотация | CrossRef Полный текст | Google Scholar
21. Зарринпар А., Шаикс А., Сюй З.З., Чанг М.В., Мароц, Калифорния, Сагательян А. и др. Вызванное антибиотиками истощение микробиома изменяет метаболический гомеостаз, влияя на передачу сигналов в кишечнике и метаболизм в толстой кишке. Nat Commun. (2018) 9: 2872. DOI: 10.1038 / s41467-018-05336-9
PubMed Аннотация | CrossRef Полный текст
22. Ким Х.Дж., Ли Ш., Хонг С.Дж. Вызванный антибиотиками дисбиоз кишечной микробиоты усугубляет атопический дерматит у мышей из-за измененных короткоцепочечных жирных кислот. Allergy Asthma Immunol Res. (2020) 12: 137–48. DOI: 10.4168 / aair.2020.12.1.137
PubMed Аннотация | CrossRef Полный текст | Google Scholar
23. Алоу М.Т., Лагье Дж., Рауль Д.Влияние диеты на микробиоту кишечника и дисбактериоз, связанный с нарушением питания. Hum Microbiome J. (2016) 1: 3–11. DOI: 10.1016 / j.humic.2016.09.001
CrossRef Полный текст | Google Scholar
24. Карл Дж. П., Хэтч А. М., Арчидиаконо С. М., Пирс С. К., Пантоха-Фелисиано И. Г., Доэрти Л. А. и др. Влияние психологических, экологических и физических стрессоров на микробиоту кишечника. Front Microbiol. (2018) 9: 2013. DOI: 10.3389 / fmicb.2018.02013
PubMed Аннотация | CrossRef Полный текст | Google Scholar
29.Бутто Л.Ф., Халлер Д. Дисбиоз при воспалении кишечника: причина или следствие. Int J Med Microbiol. (2016) 306: 302–9. DOI: 10.1016 / j.ijmm.2016.02.010
CrossRef Полный текст | Google Scholar
31. Ваахтовуо Дж., Мунукка Э., Коркеамаки М., Лууккайнен Р., Тойванен П. Фекальная микробиота при раннем ревматоидном артрите. J Rheumatol. (2008) 35: 1500–5.
Google Scholar
32. Ньюкирк М.М., Збар А., Барон М., Манжес АР. Отчетливые паттерны бактериальной колонизации подтипов Escherichia coli связаны со статусом ревматоидного фактора при раннем воспалительном артрите. Ревматология. (2010) 49: 1311–6. DOI: 10.1093 / ревматология / keq088
PubMed Аннотация | CrossRef Полный текст | Google Scholar
33. Пианта А., Арвикар С., Стрле К., Дроуин Е.Е., Ван К., Костелло С.Е. и др. Доказательства иммунной значимости кишечного микроба prevotella copri у пациентов с ревматоидным артритом. Arthritis Rheumatol. (2017) 69: 964–75. DOI: 10.1002 / art.40003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
34.Ni J, Wu GD, Albenberg L, Tomov VT. Микробиота кишечника и ВЗК: причинная связь или корреляция? Nat Publ Gr. (2017) 14: 573–84. DOI: 10.1038 / nrgastro.2017.88
CrossRef Полный текст | Google Scholar
35. Соавторы G 2017 IBD. Глобальное, региональное и национальное бремя воспалительных заболеваний кишечника в 195 странах и территориях, 1990-2017 гг .: систематический анализ для исследования глобального бремени болезней, 2017 г. Lancet Gastroenterol Hepatol. (2020) 5: 17–30.DOI: 10.1016 / S2468-1253 (19) 30333-4
CrossRef Полный текст | Google Scholar
36. Маттос BRR, Гарсиа MPG, Ногейра Дж.Б., Пайатто Л.Н., Альбукерке К.Г., Соуза К.Л. и др. Воспалительное заболевание кишечника: обзор иммунных механизмов и биологических методов лечения. Медиаторы воспаления. (2015) 2015: 493012. DOI: 10.1155 / 2015/493012
PubMed Аннотация | CrossRef Полный текст | Google Scholar
37. Битти Дж. К., Акирман С. В., Мотта Дж. П., Муиз С., Воркентин М. Л., Харрисон Дж. Дж. И др.Giardia duodenalis вызывает патогенный дисбиоз биопленок кишечной микробиоты человека. Int J Parasitol. (2017) 47: 311–26. DOI: 10.1016 / j.ijpara.2016.11.010
PubMed Аннотация | CrossRef Полный текст | Google Scholar
38. Yu LCH, Shih YA, Wu LL, Lin YD, Kuo W.T., Peng WH, et al. Кишечный дисбактериоз способствует развитию устойчивых к антибиотикам бактериальных инфекций: системного распространения устойчивых и комменсальных бактерий через эпителиальный трансцитоз. Am J Physiol Gastrointest Liver Physiol. (2014) 307: G824–35. DOI: 10.1152 / ajpgi.00070.2014
PubMed Аннотация | CrossRef Полный текст | Google Scholar
39. Пророк-Хамон М., Фрисвелл М.К., Алсвид А., Робертс К.Л., Сонг Ф., Фланаган П.К. и др. Связанные со слизистой оболочкой толстой кишки диффузно адгезивные afaC + Escherichia coli , экспрессирующие lpfA и pks, увеличиваются при воспалительном заболевании кишечника и раке толстой кишки. Gut. (2014) 63: 761–70. DOI: 10.1136 / gutjnl-2013-304739
PubMed Аннотация | CrossRef Полный текст | Google Scholar
41.Саманта А.К., Торок В.А., Перси Нью-Джерси, Абимослех С.М., Ховарт Г.С. Микробный дактилоскопический анализ позволяет выявлять уникальные бактериальные сообщества в фекальной микробиоте крыс с экспериментально вызванным колитом. J Microbiol. (2012) 50: 218–25. DOI: 10.1007 / s12275-012-1362-8
PubMed Аннотация | CrossRef Полный текст | Google Scholar
42. Нагалингам Н.А., Као Дж.Й., Янг В.Б. Микробная экология кишечника мышей, связанная с развитием колита, индуцированного декстран-сульфатом натрия. Воспаление кишечника. (2011) 17: 917–26. DOI: 10.1002 / ibd.21462
PubMed Аннотация | CrossRef Полный текст | Google Scholar
43. Сексик П., Риготтье-Гойс Л., Грамет Г., Сутрен М., Почарт П., Марто П. и др. Изменения доминирующих фекальных бактериальных групп у пациентов с болезнью Крона толстой кишки. Gut. (2003) 52: 237–42. DOI: 10.1136 / gut.52.2.237
PubMed Аннотация | CrossRef Полный текст | Google Scholar
44. Чен Л., Ван В., Чжоу Р., Нг С.К., Ли Дж., Хуанг М. и др.Характеристики фекальной и слизистой микробиоты у китайских пациентов с воспалительным заболеванием кишечника. Медицина. (2014) 93: e51. DOI: 10.1097 / MD.0000000000000051
PubMed Аннотация | CrossRef Полный текст | Google Scholar
45. Ковальска-Дуплага К., Госевски Т., Капуста П., Срока-Олексяк А., Ведрихович А., Печарковский С. и др. Различия в микробиоме кишечника здоровых детей и пациентов с впервые диагностированной болезнью Крона. Sci Rep. (2019) 9: 18880. DOI: 10.1038 / s41598-019-55290-9
PubMed Аннотация | CrossRef Полный текст | Google Scholar
46. Уокер А. В., Сандерсон Дж. Д., Черчер С., Паркс Г. С., Хадспит Б. Н., Реймент Н. и др. Высокопроизводительный анализ библиотеки клонов микробиоты, связанной со слизистой оболочкой, выявляет дисбактериоз и различия между воспаленными и невоспаленными участками кишечника при воспалительном заболевании кишечника. BMC Microbiol. (2011) 11: 7. DOI: 10.1186 / 1471-2180-11-7
PubMed Аннотация | CrossRef Полный текст | Google Scholar
47.Golinska E, Tomusiak A, Gosiewski T, Wiecek G, Machul A, Mikolajczyk D, et al. Факторы вирулентности штаммов Enterococcus , выделенных от пациентов с воспалительным заболеванием кишечника. World J Gastroenterol. (2013) 19: 3562–72. DOI: 10.3748 / wjg.v19.i23.3562
PubMed Аннотация | CrossRef Полный текст | Google Scholar
48. Лу Дж., Ма К.Л., Руань XZ. Дисбиоз микробиоты кишечника способствует развитию сахарного диабета. Инфекционные микробы Dis. (2019) 1: 43–8.DOI: 10.1097 / IM9.0000000000000011
CrossRef Полный текст | Google Scholar
51. Вен Л., Лей Р. Е., Волчков П. Ю., Странджес П. Б., Аванесян Л., Стоунбрейкер А. С. и др. Врожденный иммунитет и микробиота кишечника в развитии диабета 1 типа. Природа. (2008) 455: 1109–13. DOI: 10.1038 / nature07336
PubMed Аннотация | CrossRef Полный текст | Google Scholar
53. Джамшиди П., Хасанзаде С., Тахвилдари А., Фарси Ю., Арбаби М., Мота Дж. Ф. и др. Есть ли связь между микробиотой кишечника и диабетом 1 типа? Систематический обзор. Gut Pathog. (2019) 11:49. DOI: 10.1186 / s13099-019-0332-7
PubMed Аннотация | CrossRef Полный текст | Google Scholar
54. Пинто Э., Ансельмо М., Калха М., Ботрилл А., Дуарте И., Эндрю П. У. и др. Кишечный протеом детей с диабетом и контрольной группы обогащен различными микробными белками и белками хозяина. Микробиология. (2017) 163: 161–74. DOI: 10.1099 / mic.0.000412
PubMed Аннотация | CrossRef Полный текст | Google Scholar
55.де Гоффау М.С., Луопаярви К., Книп М., Илонен Дж., Руохтула Т., Харконен Т. и др. Состав фекальной микробиоты у детей с бета-клеточным аутоиммунитетом и без него различается. Диабет. (2013) 62: 1238–44. DOI: 10.2337 / db12-0526
PubMed Аннотация | CrossRef Полный текст | Google Scholar
56. Сиркана А., Фрамарин Л., Леоне Н., Беррутти М., Кастеллино Ф., Паренте Р. и др. Изменение микробиоты кишечника при диабете 2 типа: просто совпадение? Curr Diab Rep.9 (2018) 18:98.DOI: 10.1007 / s11892-018-1057-6
PubMed Аннотация | CrossRef Полный текст | Google Scholar
57. Фернандес Р., Виана С.Д., Нунес С., Рейс Ф. Диабетический дисбактериоз кишечной микробиоты как воспаление и состояние иммунного старения, которое способствует прогрессированию ретинопатии и нефропатии. Biochim Biophys Acta Mol Basis Dis. (2019) 1865: 1876–97. DOI: 10.1016 / j.bbadis.2018.09.032
PubMed Аннотация | CrossRef Полный текст | Google Scholar
58. Ямагути Ю., Адачи К., Сугияма Т., Симозато А., Эби М., Огасавара Н. и др.Связь кишечной микробиоты с метаболическими маркерами и диетическими привычками у пациентов с сахарным диабетом 2 типа. Пищеварение. (2016) 94: 66–72. DOI: 10.1159 / 000447690
PubMed Аннотация | CrossRef Полный текст | Google Scholar
59. Ле ТКС, Хосака Т., Нгуен Т.Т., Кассу А., Данг Т.О., Тран HB и др. Виды Bifidobacterium снижают уровень глюкозы в сыворотке, увеличивают экспрессию сигнальных белков инсулина и улучшают профиль адипокина у мышей с диабетом. Biomed Res. (2015) 36: 63–70.DOI: 10.2220 / биомедры.36.63
PubMed Аннотация | CrossRef Полный текст | Google Scholar
60. Кикучи К., Бен Отман М., Сакамото К. Стерилизованные бифидобактерии подавляли накопление жира и уровень глюкозы в крови. Biochem Biophys Res Commun. (2018) 501: 1041–7. DOI: 10.1016 / j.bbrc.2018.05.105
PubMed Аннотация | CrossRef Полный текст | Google Scholar
61. Ян Дж.Й., Ли Ю.С., Ким Й., Ли Ш., Рю С., Фукуда С. и др. Комменсал кишечника Bacteroides acidifaciens предотвращает ожирение и улучшает чувствительность к инсулину у мышей. Mucosal Immunol. (2017) 10: 104–16. DOI: 10,1038 / mi.2016.42
PubMed Аннотация | CrossRef Полный текст | Google Scholar
63. Даолин Т., Руи К., Койн С.Б., Цех Х.Дж., Лотце М.Т. PAMP и DAMP: сигнальные 0, которые стимулируют аутофагию и иммунитет. Immunol Rev. (2012) 249: 158–75. DOI: 10.1111 / j.1600-065X.2012.01146.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
64. Жирардин С.Е., Травассос Л.Х., Эрве М., Блано Д., Бонека И.Г., Филпотт Д.Д. и др.Требования к молекулам пептидогликана, позволяющие обнаруживать их с помощью Nod1 и Nod2. J Biol Chem. (2003) 278: 41702–8. DOI: 10.1074 / jbc.M307198200
PubMed Аннотация | CrossRef Полный текст | Google Scholar
65. Girardin SE, Boneca IG, Carneiro LAM, Antignac A, Jéhanno M, Viala J, et al. Nod1 обнаруживает уникальный муропептид из грамотрицательного бактериального пептидогликана. Наука. (2003) 300: 1584–7. DOI: 10.1126 / science.1084677
PubMed Аннотация | CrossRef Полный текст | Google Scholar
66.Чамайлард М., Хашимото М., Хори Й., Масумото Дж., Цю С., Сааб Л. и др. Существенная роль NOD1 в распознавании хозяином бактериального пептидогликана, содержащего диаминопимелиновую кислоту. Nat Immunol. (2003) 4: 702–7. DOI: 10.1038 / ni945
PubMed Аннотация | CrossRef Полный текст | Google Scholar
67. Инохара Н., Огура Ю., Фонтальба А., Гутьеррес О., Понс Ф., Креспо Дж. И др. Распознавание хозяином бактериального мурамилдипептида, опосредованного NOD2: последствия для болезни Крона. J Biol Chem. (2003) 278: 5509–12. DOI: 10.1074 / jbc.C200673200
PubMed Аннотация | CrossRef Полный текст | Google Scholar
68. Рехман А., Сина С., Гаврилова О., Хеслер Р., Отт С., Бейнс Дж. Ф. и др. Nod2 необходим для временного развития кишечных микробных сообществ. Gut. (2011) 60: 1354–62. DOI: 10.1136 / gut.2010.216259
PubMed Аннотация | CrossRef Полный текст | Google Scholar
69. Петницки-Оквейя Т., Хрнцир Т., Лю Ю.Дж., Бисвас А., Худкович Т., Тласкалова-Хогенова Х. и др.Nod2 необходим для регуляции комменсальной микробиоты в кишечнике. Proc Natl Acad Sci USA. (2009) 106: 15813–8. DOI: 10.1073 / pnas.0
2106
PubMed Аннотация | CrossRef Полный текст | Google Scholar
70. Кутюрье-Майяр А., Секер Т., Рехман А., Норманд С., Де Арканджелис А., Хеслер Р. и др. NOD2-опосредованный дисбиоз предрасполагает мышей к трансмиссивному колиту и колоректальному раку. J Clin Invest. (2013) 123: 700–11. DOI: 10.1172 / JCI62236
PubMed Аннотация | CrossRef Полный текст | Google Scholar
72.Леви М., Таисс К.А., Зееви Д., Дохналова Л., Зильберман-Шапира Г., Махди Дж. А. и др. Метаболиты, модулируемые микробиотой, формируют микроокружение кишечника, регулируя передачу сигналов воспаления NLRP6. Cell. (2015) 163: 1428–43. DOI: 10.1016 / j.cell.2015.10.048
PubMed Аннотация | CrossRef Полный текст | Google Scholar
73. Элинав Э., Стровиг Т., Кау А.Л., Энао-Мехиа Дж., Тайс, Калифорния, Бут CJ и др. Инфламмасома NLRP6 регулирует микробную экологию толстой кишки и риск колита. Cell. (2011) 145: 745–57. DOI: 10.1016 / j.cell.2011.04.022
PubMed Аннотация | CrossRef Полный текст | Google Scholar
74. Wlodarska M, Thaiss CA, Nowarski R, Henao-Mejia J, Zhang JP, Brown EM, et al. Инфламмасома NLRP6 регулирует взаимодействие хозяина и микробов толстой кишки, регулируя секрецию слизи бокаловидными клетками. Cell. (2014) 156: 1045–59. DOI: 10.1016 / j.cell.2014.01.026
PubMed Аннотация | CrossRef Полный текст | Google Scholar
75.Awad F, Assrawi E, Jumeau C, Georgin-Lavialle S, Cobret L, Duquesnoy P и др. Влияние поляризации человеческих моноцитов и макрофагов на экспрессию NLR и активацию инфламмасомы NLRP3. PLoS ONE. (2017) 12: e0175336. DOI: 10.1371 / journal.pone.0175336
PubMed Аннотация | CrossRef Полный текст | Google Scholar
76. Яо Х, Чжан Ц., Син И, Сюэ Г, Чжан Ц., Пан Ф и др. Ремоделирование кишечной микробиоты гиперактивным NLRP3 побуждает регуляторные Т-клетки поддерживать гомеостаз. Nat Commun. (2017) 8: 1–17. DOI: 10.1038 / s41467-017-01917-2
PubMed Аннотация | CrossRef Полный текст | Google Scholar
77. Хенао-Мейджиа Дж., Элинав Э., Джин С., Хао Л., Мехал В.З., Стровиг Т. и др. Инфламмасомный дисбиоз регулирует прогрессирование НАЖБП и ожирения. Природа. (2012) 482: 179–85. DOI: 10.1038 / nature10809
PubMed Аннотация | CrossRef Полный текст | Google Scholar
79. Уильямс К.Л., Лич Дж. Д., Дункан Дж. А., Рид В., Раллабанди П., Мур С. и др.Белок CATERPILLER Monarch-1 является антагонистом toll-подобных рецепторов, фактора некроза опухоли α- и провоспалительных сигналов, индуцированных Mycobacterium tuberculosis. J Biol Chem. (2005) 280: 39914–24. DOI: 10.1074 / jbc.M502820200
PubMed Аннотация | CrossRef Полный текст | Google Scholar
80. Лич Дж. Д., Уильямс К. Л., Мур С. Б., Артур Дж. К., Дэвис Б. К., налоговый инспектор Д. Д. и др. Передний край: monarch-1 подавляет неканоническую активацию NF-κB и p52-зависимую экспрессию хемокинов в моноцитах. J Immunol. (2007) 178: 1256–60. DOI: 10.4049 / jimmunol.178.3.1256
PubMed Аннотация | CrossRef Полный текст | Google Scholar
81. Аллен И.С., Уилсон Дж. Э., Шнайдер М., Лич Дж. Д., Робертс Р. А., Артур Дж. К. и др. NLRP12 подавляет воспаление толстой кишки и онкогенез за счет негативной регуляции неканонической передачи сигналов NF-κB. Иммунитет. (2012) 36: 742–54. DOI: 10.1016 / j.immuni.2012.03.012
PubMed Аннотация | CrossRef Полный текст | Google Scholar
82.Заки М.Х., Фогель П., Малиредди Р.КС., Боди-Малапель М., Ананд П.К., Бертин Дж. И др. NOD-подобный рецептор NLRP12 ослабляет воспаление толстой кишки и онкогенез. Cancer Cell. (2011) 20: 649–60. DOI: 10.1016 / j.ccr.2011.10.022
PubMed Аннотация | CrossRef Полный текст | Google Scholar
83. Владимер Г.И., Венг Д., Пакетт С.В.М., Ваная С.К., Ратинам ВАК, Ауне М.Х. и др. Инфламмасома NLRP12 распознает yersinia pestis. Иммунитет. (2012) 37: 96–107. DOI: 10.1016 / j.иммунитет.2012.07.006
PubMed Аннотация | CrossRef Полный текст | Google Scholar
84. Chen L, Wilson JE, Koenigsknecht MJ, Chou WC, Montgomery SA, Truax AD, et al. NLRP12 ослабляет воспаление толстой кишки, поддерживая микробное разнообразие толстой кишки и способствуя защитному росту комменсальных бактерий. Nat Immunol. (2017) 18: 541–51. DOI: 10.1038 / ni.3690
CrossRef Полный текст | Google Scholar
85. Коста FRC, Francozo MCS, de Oliveira GG, Ignacio A, Castoldi A, Zamboni DS, et al.Транслокация кишечной микробиоты в лимфатические узлы поджелудочной железы запускает активацию NOD2 и способствует возникновению T1D. J Exp Med. (2016) 213: 1223–39. DOI: 10.1084 / jem.20150744
PubMed Аннотация | CrossRef Полный текст | Google Scholar
86. Ли YY, Пирсон JA, Chao C, Peng J, Zhang X, Zhou Z и др. Нуклеотид-связывающий домен олигомеризации, содержащий белок 2 (Nod2), модулирует восприимчивость к TIDM микробиотой кишечника. J Аутоиммун. (2017) 82: 85–95. DOI: 10.1016 / j.jaut.2017.05.007
PubMed Аннотация | CrossRef Полный текст | Google Scholar
87. Ху Ц., Дин Х, Ли Й, Пирсон Дж. А., Чжан Х, Флавелл Р. А. и др. Дефицит NLRP3 защищает от диабета 1 типа за счет регуляции хемотаксиса островков поджелудочной железы. Proc Natl Acad Sci USA. (2015) 112: 11318–23. DOI: 10.1073 / pnas.1513509112
PubMed Аннотация | CrossRef Полный текст | Google Scholar
88. Карлос Д., Коста, Франция, Перейра, Калифорния, Роча, Ф.А., Яочите, JNU, Оливейра, Г.Г. и др.Митохондриальная ДНК активирует инфламмасому NLRP3 и предрасполагает к диабету 1 типа на мышиной модели. Front Immunol. (2017) 8: 164. DOI: 10.3389 / fimmu.2017.00164
PubMed Аннотация | CrossRef Полный текст | Google Scholar
89. Pontillo A, Brandao L, Guimaraes R, Segat L, Araujo J, Crovella S. Два SNP в гене NLRP3 участвуют в предрасположенности к диабету 1 типа и целиакии в педиатрической популяции из северо-востока Бразилии. Аутоиммунитет. (2010) 43: 583–9.DOI: 10.3109 / 080 0432 PubMed Аннотация | CrossRef Полный текст | Google Scholar 90. Лейте Дж. А., Пессенда Дж., Герра-Гомес ИК, де Сантана АКМ, Андре Перейра С., Рибейро Кампос Коста Ф и др. ДНК-сенсор AIM2 защищает от индуцированного стрептозотоцином диабета 1 типа, регулируя гомеостаз кишечника через путь IL-18. Ячейки. (2020) 9: 959. DOI: 10.3390 / Cell
PubMed Аннотация | CrossRef Полный текст | Google Scholar
91.Murri M, Leiva I., Gomez-Zumaquero JM, Tinahones FJ, Cardona F, Soriguer F и др. Микробиота кишечника у детей с диабетом 1 типа отличается от таковой у здоровых детей: исследование случай-контроль. BMC Med. (2013) 11:46. DOI: 10.1186 / 1741-7015-11-46
PubMed Аннотация | CrossRef Полный текст | Google Scholar
92. Паттерсон Е., Маркес Т.М., О’Салливан О., Фицджеральд П., Фицджеральд Г.Ф., Коттер П.Д. и др. Стрептозотоцин-индуцированный диабет типа 1 у крыс Sprague-Dawley связан с изменением состава кишечной микробиоты и уменьшением разнообразия. Микробиология. (2015) 161: 182–93. DOI: 10.1099 / mic.0.082610-0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
93. Хорнунг В., Аблассер А., Шаррел-Деннис М., Бауэрнфейнд Ф., Хорват Г., Кэффри Д. Р. и др. AIM2 распознает цитозольную дцДНК и формирует воспаление, активирующее каспазу-1, с ASC. Природа. (2009) 458: 514–8. DOI: 10.1038 / nature07725
PubMed Аннотация | CrossRef Полный текст | Google Scholar
94. Ратинам ВАК, Цзян Цз., Ваггонер С.Н., Шарма С., Коул Л. Е., Ваггонер Л. и др.Инфламмасома AIM2 необходима для защиты хозяина от цитозольных бактерий и ДНК-вирусов. Nat Immunol. (2010) 11: 395–402. DOI: 10.1038 / ni.1864
PubMed Аннотация | CrossRef Полный текст | Google Scholar
95. Ман С.М., Карки Р., Каннеганти Т-Д. Инфламмасома AIM2 при инфекции, раке и аутоиммунитете: роль в распознавании ДНК, воспалении и врожденном иммунитете. Eur J Immunol. (2016) 46: 269–80. DOI: 10.1002 / eji.201545839
PubMed Аннотация | CrossRef Полный текст | Google Scholar
96.Ямасиро К., Танака Р., Урабе Т., Уэно Ю., Ямаширо Ю., Номото К. и др. Дисбактериоз кишечника связан с метаболизмом и системным воспалением у пациентов с ишемическим инсультом. PLoS ONE. (2017) 12: e0171521. DOI: 10.1371 / journal.pone.0171521
CrossRef Полный текст | Google Scholar
97. Pasini E, Corsetti G, Assanelli D, Testa C, Romano C, Dioguardi FS, et al. Влияние хронических упражнений на микробиоту кишечника и кишечный барьер у человека с диабетом 2 типа. Minerva Med. (2019) 110: 3–11. DOI: 10.23736 / S0026-4806.18.05589-1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
98. Ким К.А., Гу В, Ли И.А., Джон Э.Х., Ким Д.Х. Микробиота кишечника, вызванная диетой с высоким содержанием жиров, усугубляет воспаление и ожирение у мышей через сигнальный путь TLR4. PLoS ONE. (2012) 7: e47713. DOI: 10.1371 / journal.pone.0047713
PubMed Аннотация | CrossRef Полный текст | Google Scholar
99. Ши Х., Кокоева М.В., Иноуэ К., Цамели И., Инь Х., Флиер Дж. С..TLR4 связывает врожденный иммунитет и резистентность к инсулину, вызванную жирными кислотами. J Clin Invest. (2006) 116: 3015–25. DOI: 10.1172 / JCI28898
PubMed Аннотация | CrossRef Полный текст | Google Scholar
100. Кани П.Д., Амар Дж., Иглесиас М.А., Погги М., Кнауф С., Бастелика Д. и др. Метаболическая эндотоксемия вызывает ожирение и инсулинорезистентность. Диабет. (2007) 56: 1761–72. DOI: 10.2337 / db06-1491
PubMed Аннотация | CrossRef Полный текст | Google Scholar
101.Поджи М., Бастелика Д., Гуаль П., Иглесиас М.А., Гремо Т., Кнауф С. и др. Мыши C3H / HeJ, несущие мутацию toll-подобного рецептора 4, защищены от развития инсулинорезистентности в белой жировой ткани в ответ на диету с высоким содержанием жиров. Diabetologia. (2007) 50: 1267–76. DOI: 10.1007 / s00125-007-0654-8
PubMed Аннотация | CrossRef Полный текст | Google Scholar
102. Луч Э., Кузен Б., Гариду Л., Серино М., Вагет А., Барро С. и др. Метаболическая эндотоксемия напрямую увеличивает пролиферацию предшественников адипоцитов в начале метаболических заболеваний через CD14-зависимый механизм. Mol Metab. (2013) 2: 281–91. DOI: 10.1016 / j.molmet.2013.06.005
PubMed Аннотация | CrossRef Полный текст | Google Scholar
103. Пайпер М.С., Саад Р.Дж. Сахарный диабет и Cclon. Curr Treat Options Гастроэнтерол. (2017) 15: 460–74. DOI: 10.1007 / s11938-017-0151-1
CrossRef Полный текст | Google Scholar
104. Аларкон С., Боланд Б. Б., Учизоно Ю., Мур П. С., Петерсон Б., Раджан С. и др. Адаптивная пластичность β-клеток поджелудочной железы при ожирении увеличивает выработку инсулина, но отрицательно влияет на секреторную функцию. Диабет. (2016) 65: 438–50. DOI: 10.2337 / db15-0792
PubMed Аннотация | CrossRef Полный текст | Google Scholar
106. Рандерия С.Н., Томсон Г.Дж., Нелл Т.А., Робертс Т., Преториус Э. Воспалительные цитокины при сахарном диабете 2 типа как способствующие гиперкоагуляции и аномальное образование тромбов. Cardiovasc Diabetol. (2019) 18:72. DOI: 10.1186 / s12933-019-0870-9
PubMed Аннотация | CrossRef Полный текст | Google Scholar
107.Hotamisligil GS, Arner P, Caro JF, Atkinson RL, Spiegelman BM. Повышенная экспрессия фактора некроза опухоли-α в жировой ткани при ожирении и инсулинорезистентности человека. J Clin Invest. (1995) 95: 2409–15. DOI: 10.1172 / JCI117936
PubMed Аннотация | CrossRef Полный текст | Google Scholar
108. Ян С.Т., Цзя Дж.Х., Лв XF, Шао Ю.Х., Инь С.Н., Чжан XG и др. Гликемический контроль и комплексный контроль метаболических факторов риска у пожилых людей с диабетом 2 типа. Exp Gerontol. (2019) 127: 110713. DOI: 10.1016 / j.exger.2019.110713
PubMed Аннотация | CrossRef Полный текст | Google Scholar
109. Маскаринек Г., Садакане А., Сугияма Х., Бреннер А., Тацукава Ю., Грант Е. Диабет 2 типа, ожирение и риск рака груди среди японских женщин из когорты выживших после атомной бомбы. Cancer Epidemiol. (2019) 60: 179–84. DOI: 10.1016 / j.canep.2019.04.009
PubMed Аннотация | CrossRef Полный текст | Google Scholar
110. Ли С., Лейси М.Э., Янкович М., Корреа А., Ву WC.Связь между фенотипами ожирения и инсулинорезистентностью и риском диабета 2 типа у афроамериканцев: исследование сердца Джексона. J Clin Transl Endocrinol. (2020) 19: 100210. DOI: 10.1016 / j.jcte.2019.100210
PubMed Аннотация | CrossRef Полный текст | Google Scholar
112. Hotamisligil GkS, Peraldi P, Budavari A, Ellis R, White MF, Spiegelman BM. IRS-1-опосредованное ингибирование активности тирозинкиназы рецептора инсулина при резистентности к инсулину, индуцированной TNF-альфа и ожирением. Наука. (1996) 271: 665–70. DOI: 10.1126 / science.271.5249.665
PubMed Аннотация | CrossRef Полный текст | Google Scholar
113. Шерцер Дж. Д., Тамракар А. К., Магальяйнс Дж. Г., Перейра С., Билан П. Дж., Фуллертон М. Д. и др. Активаторы NOD1 связывают врожденный иммунитет с инсулинорезистентностью. Диабет. (2011) 60: 2206–15. DOI: 10.2337 / db11-0004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
114. Rakotoarivelo V, Lacraz G, Mayhue M, Brown C, Rottembourg D, Fradette J, et al.Профили воспалительных цитокинов во висцеральной и подкожной жировой ткани у пациентов с ожирением, перенесших бариатрическую операцию, показывают отсутствие корреляции с ожирением или диабетом. EBioMedicine. (2018) 30: 237–47. DOI: 10.1016 / j.ebiom.2018.03.004
CrossRef Полный текст | Google Scholar
116. de Souza PR, Guimarães FR, Sales-Campos H, Bonfá G, Nardini V, Chica JEL, et al. Отсутствие рецептора NOD2 предрасполагает к воспалению кишечника из-за нарушения регуляции иммунного ответа у хозяев, которые не могут контролировать дисбактериоз кишечника. Иммунобиология. (2018) 223: 577–85. DOI: 10.1016 / j.imbio.2018.07.003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
117. Дену Е., Лольмед К., Гариду Л., Поми С., Чабо С., Лау Т.С. и др. Нарушение восприятия пептидогликана NOD 2 способствует воспалению, дисбактериозу и инсулинорезистентности, вызванному диетой. EMBO Mol Med. (2015) 7: 259–74. DOI: 10.15252 / emmm.201404169
PubMed Аннотация | CrossRef Полный текст | Google Scholar
118.Muegge BD, Kuczynski J, Knights D, Clemente JC, González A, Fontana L, et al. Диета способствует сближению функций микробиома кишечника в филогенезе млекопитающих и в организме человека. Наука. (2011) 332: 970–4. DOI: 10.1126 / science.1198719
PubMed Аннотация | CrossRef Полный текст | Google Scholar
119. Накадзима А., Накатани А., Хасегава С., Ирие Дж., Одзава К., Цудзимото Г. и др. Рецептор короткоцепочечных жирных кислот GPR43 регулирует воспалительные сигналы в макрофагах М2-типа жировой ткани. PLoS ONE. (2017) 12: e0179696. DOI: 10.1371 / journal.pone.0179696
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Диагностика, лечение и направление будущих исследований у собак с дисбактериозом кишечника
Диагностика, лечение и направление будущих исследований у собак с дисбактериозом кишечника
11 сентября 2020 г.Как диагностировать дисбактериоз кишечника у собак?
У пациента с дисбактериозом кишечника может быть снижение аппетита, диарея, рвота или множество других клинических признаков.Также они могут протекать бессимптомно. Следует помнить, что у пациентов с симптомами дисбактериоза кишечника часто наблюдается сопутствующее желудочно-кишечное заболевание (ВЗК, энтеропатия, реагирующая на диету, или другое заболевание). Для диагностики в настоящее время существует доступный тест стула, предоставленный лабораторией A&M GI Техаса, который называется индексом дисбактериоза. Этот тест кала оценивает секвенирование 16s рРНК бактерий. В исследовании, опубликованном в 2017 году 1 , они подтвердили тест, используя образцы 95 здоровых собак как нормальную популяцию и 106 собак с хронической энтеропатией как популяцию с заболеванием.Отрицательный показатель указывает на нормальную микробиоту, а положительный показатель – на дисбактериоз. Результаты сомнительны, если значение находится в диапазоне от 0 до 2. В будущих исследованиях рекомендуется рассмотреть оценку секвенирования ДНК и РНК следующего поколения для оценки полного генома кишечной микробиоты. Мы подозреваем, что более ценным, чем оценка присутствующих бактерий, было бы использование метаболомики или профилирования иммунной системы для оценки функции нормальной микробиоты и функции у пациентов с дисбактериозом.В настоящее время мы проводим исследования, чтобы выяснить это.
Как лечить дисбактериоз кишечника у собак?
Каждый пациент индивидуален, и не существует универсального протокола лечения для каждого пациента. Лечение обычно включает комбинацию изменения диеты, пищеварительных ферментов, бактериальных пробиотиков и иногда включает добавление антибиотиков (обычно тилозин или метронидазол) на короткий период времени или добавление дрожжевого пробиотика, такого как Saccharomyces boulardii.
Какая диета лучше всего подходит для создания здорового микробиома?
В идеале диета должна состоять из цельных продуктов с минимальным количеством обработанной пищи или без нее. Ингредиенты должны быть высококачественными, в идеале, по возможности, органическими, чтобы минимизировать количество пестицидов. В диете не должно быть глютена, а также минимальное количество консервантов и других добавок. Диета должна содержать повышенное количество пребиотической клетчатки. Диетические пребиотики определяются как селективно ферментированные ингредиенты, которые приводят к определенным изменениям в составе и / или активности микробиоты желудочно-кишечного тракта, тем самым принося пользу (я) здоровью хозяина.Некоторые примеры высококачественных пребиотиков включают тыкву, свеклу, картофель, яблоки и хикаму. Диета может содержать пробиотики, но это не обязательно.
Какие пробиотики лучше всего подходят для собак?
На рынке есть множество вариантов пробиотиков. Рекомендуется использовать пробиотики, которые прошли тестирование и проверку качества и эффективности, по крайней мере, третьей стороной.
Существует минимальное регулирование или надзор в отношении эффективности, безопасности и контроля качества производства.Как правило, регулирование сосредоточено на законности любых заявлений о состоянии здоровья. По этим причинам следует проявлять осторожность при использовании безрецептурных пробиотиков, не прошедших клинических испытаний. Есть несколько пробиотиков, которые были клинически изучены на собаках и могут быть полезны пациентам с дисбактериозом кишечника. Их оценивали у пациентов с воспалительным заболеванием кишечника (ВЗК), хронической диареей и другими болезненными состояниями. Visbiome является одним из примеров, и этот продукт состоит из 8 бактериальных штаммов и был протестирован в более чем 70 клинических испытаниях на людях.Этот пробиотик хорошо переносится собаками и был протестирован и признан эффективным у пациентов с ВЗК в нескольких клинических испытаниях на собаках 2,3 . Proviable Forte – еще один изученный продукт. Он содержит 7 полезных бактериальных штаммов и, как было показано, в сочетании с Saccharomyces boulardii помогает улучшить желудочно-кишечные симптомы, связанные с приемом антибиотиков, у собак. 4 Saccharomyces boulardii – это дрожжевой пробиотик, который показан для лечения острых и хронических энтеропатий у людей.На рынке есть множество продуктов, содержащих этот дрожжевой пробиотик. В двойном слепом плацебо-контролируемом исследовании на собаках с ВЗК было обнаружено, что Saccharomyces boulardii является эффективным средством лечения собак с хроническими энтеропатиями. 5
В этом исследовании исследователи обследовали 13 собак с подтвержденной биопсией ВЗК. Собаки получали либо Saccharomyces boulardii, либо плацебо. Индекс клинической активности, частота стула, консистенция стула и оценка состояния тела значительно улучшились у собак с хронической энтеропатией, получавших S.boulardii по сравнению с плацебо.
Симптомы детоксикации во время терапии
Когда пациенты проходят лечение от дисбактериоза кишечника, есть симптомы, которые владельцы могут заметить, когда пациент проходит детоксикацию их желудочно-кишечного тракта:
- PU / PD (повышенное потребление воды и мочеиспускание)
- Повышенное метеоризм
- Увеличение производства табуретов
- Мягкий стул или диарея
Каковы показания для трансплантации FMT (трансплантации фекальной микробиоты)?
Пересадка фекальной микробиоты – это лечение дисбактериоза кишечника, но она не может быть терапией первой линии.Он показан для лечения инфекции Clostridium dificile у людей. Было опубликовано исследование по оценке использования FMT у щенков с парвовирусной инфекцией. 6 В этом исследовании они показали, что лечение FMT было связано с более быстрым исчезновением диареи и более коротким временем госпитализации по сравнению со стандартным лечением. Уровень смертности также был ниже у щенков, получавших FMT. Если ветеринар рассматривает возможность лечения пациента с FMT, первым шагом является поиск подходящего донора.При скрининге донорского стула на паразитов рекомендуется тестировать на энтеропатогены: гены C. difficile, парвовирус, Clostridium perfringens cpe и netF, C. jejuni, фекальные культуры (Salmonella и Campylobacter), прямой мазок фекалий, фекальные яйца и паразиты, фекалии. Giardia & Cryptosporidium, а также проведение теста на индекс дисбактериоза.
Что такое программа по устранению кишечного дисбактериоза Ethos Discovery?
В Ethos Discovery в настоящее время проводится наша программа по лечению дисбактериоза кишечника с активными клиническими испытаниями.У нас есть длинный список потенциальных клинических испытаний, которые мы будем проводить, в зависимости от финансирования и результатов первоначальных клинических испытаний. Вот список некоторых вопросов, на которые мы предлагаем ответить в ходе наших клинических испытаний:
- Как измерить дисбактериоз кишечника у собак и кошек?
- Индекс дисбактериоза против секвенирования следующего поколения против метаболомики или профилирования иммунной системы. Что является идеальным тестом – анализ стула, сывороточный биомаркер или комбинация тестов?
- Дисбактериоз кишечника и его связь с системным заболеванием.
В настоящее время мы обследуем пациентов с остеосаркомой, гемангиосаркомой и планируем обследовать пациентов с лимфомой, меланомой, IMHA, ИТП, сахарным диабетом, атопией, идиопатической эпилепсией и другими системными заболеваниями.
- Дисбактериоз кишечника вызывает или способствует развитию системного заболевания?
- Способствует ли выращивание здорового микробиома долголетию?
- Терапевтические испытания?
- Как правильно лечить дисбактериоз?
- Какая диета лучше всего способствует здоровому микробиому?
- Улучшает ли лечение дисбактериоза исходы у онкологических больных и пациентов с другими заболеваниями?
- Можно ли использовать собак в качестве модели для изучения болезней человека? В сотрудничестве с педиатрическими онкологами мы проводим оценку возможности использования саркомы собак в качестве модели детской саркомы человека.
Артикулы:
- Alshawaqfeh, M., Wajid, B., Minamoto, Y., Markel, M., Lidbury, J., Steiner, J., Serpedin, E., Suchodolski, J., 2017. Индекс дисбиоза для оценки микробного изменения в образцах кала собак с хронической воспалительной энтеропатией. FEMS Microbiology Ecology .. doi: 10.1093 / femsec / fix136
- White, R., Atherly, T., Guard, B., Rossi, G., Wang, C., Mosher, C., Webb, C., Hill, S., Ackermann, M., Sciabarra, P. , Алленспах, К., Suchodolski, J., Jergens, A.E., 2017. Рандомизированное контролируемое испытание по оценке влияния мультиштаммового пробиотика на микробиоту слизистой оболочки при идиопатическом воспалительном заболевании кишечника у собак. Кишечные микробы .. doi: 10.1080 / 194
.2017.1334754 - Росси, Г., Пенго, Г., Калдин, М., Палумбо Пиччонелло, А., Штайнер, Дж. М., Коэн, Н. Д., Йергенс, А. Э., Суходольски, Дж. С., 2014. Сравнение микробиологических, гистологических и иммуномодулирующих параметров в Ответ на лечение либо комбинированной терапией преднизоном и метронидазолом, либо пробиотиками штаммов VSL # 3 у собак с идиопатическим воспалительным заболеванием кишечника.PLoS ONE .. doi: 10.1371 / journal.pone.0094699
- Whittemore, J.C., Moyers, T.D., Price, J.M., 2019. Рандомизированное контролируемое перекрестное испытание профилактики желудочно-кишечных симптомов, вызванных антибиотиками, с использованием смеси синбиотиков на здоровых исследовательских собаках. Журнал внутренней ветеринарной медицины. Doi: 10.1111 / jvim.15553
- Д’Анджело, С., Фракасси, Ф., Брешиани, Ф., Галуппи, Р., Диана, А., Линта, Н., Беттини, Г., Морини, М., Пьетра, М., 2018. Эффект Saccharomyces boulardii у собак с хроническими энтеропатиями: двойное слепое плацебо-контролируемое исследование.Ветеринарная запись .. doi: 10.1136 / vr.104241
- Pereira GQ, Gomes LA, Santos IS, Alfieri AF, Weese JS, Costa MC. Трансплантация фекальной микробиоты щенкам с парвовирусной инфекцией собак. J Vet Intern Med . 2018; 32 (2): 707-711. DOI: 10.1111 / jvim.15072
Связь между кишечной микробиотой и патогенезом ревматоидного артрита
Характеристика и понимание кишечной микробиоты в последнее время расширились, что представляет собой широкую область исследований, особенно в области аутоиммунных заболеваний.Микробиота кишечника является основным источником микробов, которые могут оказывать как полезные, так и патогенные эффекты на здоровье человека. Роль кишечного микробиома как посредника воспаления выяснилась совсем недавно. Было обнаружено, что микробиота различается у субъектов с ранним ревматоидным артритом по сравнению с контрольной группой, и это открытие привело к этому исследованию как возможный аутоиммунный процесс. Исследования кишечной микробиоты показали, что ревматоидный артрит характеризуется увеличением и / или уменьшением бактериальных групп по сравнению с контролем.В этом обзоре мы представляем доказательства связи дисбактериоза кишечника с аутоиммунными механизмами, участвующими в развитии ревматоидного артрита.
1. Введение
Ревматоидный артрит (РА) – это системное, воспалительное и хроническое заболевание, характеризующееся стойким иммунным ответом, который приводит к воспалению и разрушению суставов. Эти этиопатогенные механизмы сложны и включают взаимодействие между врожденным и приобретенным иммунным ответом, включая антигенпрезентирующие клетки (APC), образование аутореактивных Т-клеток и производство аутоантител, направленных против их собственных клеточных структур, таких как ревматоидный фактор (RF) и антицитруллинированные белковые антитела (ACPA).Эти антитела часто присутствуют в крови задолго до появления каких-либо признаков воспаления суставов, что позволяет предположить, что запуск аутоиммунитета может происходить на разных участках суставов, например, в желудочно-кишечном тракте или дыхательных путях [1]. Эпидемиологические исследования предполагают, что ревматоидный артрит является результатом сложных взаимодействий между генами, экологическими и гормональными факторами и иммунной системой [2, 3].
Существует генетическая предрасположенность к ревматоидному артриту, обусловленная тенденцией к семейной агрегации, конкордантностью между монозиготными близнецами и ассоциацией с некоторыми антигенами гистосовместимости [4, 5].Оценки наследственности предполагают 60–70% генетических факторов риска, ответственных за развитие ревматоидного артрита [6]. Исследования генов-кандидатов или полногеномные ассоциации выявили различные локусы риска, связанные с этиологией ревматоидного артрита. В настоящее время при этом заболевании около 100 описанных генов связаны с восприимчивостью, защитой, тяжестью, активностью и ответом на лечение [6]. Полиморфизм лейкоцитарного антигена человека (HLA) является наиболее важным генетическим фактором риска. HLA – важная часть иммунной системы, запускающая Т-клетки иммунной системы для выработки антител.Ассоциации РА с аллелями HLA-DRB1 наблюдались во всех расовых и этнических популяциях [7, 8]. Общий эпитоп (SE), мотив последовательности из 5 аминокислот в положениях 70–74 цепи HLA – DR β , является наиболее значимым генетическим фактором риска ревматоидного артрита [9]. Некоторые аллели SE, такие как HLA-DRB10401, по-видимому, представляют более высокий риск, чем другие; кроме того, наличие двух аллелей SE и, в частности, HLA-DRB10401 / 0404 создает высокий риск развития заболевания, а также влияет на тяжесть заболевания [10].Аллели SE связаны с ACPA-положительным ревматоидным артритом, но относительно слабо связаны с ACPA-отрицательным ревматоидным артритом [8]. Аллели SE могут вносить вклад в генетическую предрасположенность к ревматоидному артриту, вызывая иммунную дисрегуляцию (контролирующую как специфичность, так и количество продукции ACPA) или преждевременное старение иммунитета [10].
У генетически предрасположенных к болезням людей последующие триггеры окружающей среды могут вызывать развитие ревматоидного артрита. Бактериальные и вирусные компоненты являются привлекательным источником антигенов, способных вызывать ревматоидный артрит, и поэтому наиболее исследованы как потенциальные возбудители [3].Однако на сегодняшний день нет убедительных доказательств причинной связи микроорганизма с ревматоидным артритом.
В последние годы характеристики и понимание этой кишечной микробиоты расширились и составляют широкую область исследований, особенно в области аутоиммунных заболеваний. Микробиота кишечника является основным источником микробов, которые могут оказывать как полезные, так и патогенные эффекты на здоровье человека [11]. Вдохновленный исследованиями, которые показывают изменения в составе кишечной микробиоты при аутоиммунных заболеваниях, таких как ревматоидный артрит, возобновился интерес к изучению микроорганизмов как потенциальных кандидатов в развитии аутоиммунитета [11–14].
Результаты, подтверждающие идею о том, что начало аутоиммунитета может быть связано с желудочно-кишечным трактом, заключаются в следующем: (1) микробный состав у субъектов с ранним ревматоидным артритом отличается от контрольной группы, с уменьшением количества определенных бактерий, принадлежащих к семейству Bifidobacterium и Bacteroides [15, 16] и заметное увеличение числа видов, принадлежащих к роду Prevotella [17]. (2) В моделях на мышах парентеральная инъекция фрагментов клеточной стенки различных кишечных бактерий является артритогенной [17], и в этой модели артрит не развивается при разведении в стерильных условиях; в противном случае он проявляется при интродукции кишечных бактерий [18].(3) Было показано, что диета влияет на уровень воспалительной активности [19]. (4) Некоторые препараты, используемые для лечения ревматоидного артрита, обладают антимикробным действием (хлорохин, сульфасалазин, миноциклин и рокситромицин) [20–23]. (5) Измененный микробиом был частично восстановлен до нормального состояния у пациентов, показавших клиническое улучшение после назначения модифицирующих течение заболевания противоревматических препаратов [5, 18]. Таким образом, различия в составе кишечной микробиоты и функции иммунной системы могут определять, у каких пациентов развивается болезнь.
В настоящее время прилагаются большие усилия для изучения субъектов с ревматоидным артритом на доклинической стадии. Осведомленность о механизмах, запускающих аутоиммунный процесс, а также о механизмах, участвующих в переходе от доклинической фазы к клинической, может помочь разработать стратегии вмешательства, которые позволят предотвратить или лечить этот процесс на очень ранних стадиях заболевания. Некоторые публикации предполагают, что раннее лечение ревматоидного артрита приводит к лучшим долгосрочным результатам и, возможно, к увеличению частоты ремиссии без лекарств [24].Концепция профилактики – это новая область исследований в области ревматологии, в которой изменения микробиоты могут быть новым способом модуляции болезни.
2. Иммунопатогенез ревматоидного артрита
Понимание сложных молекулярных процессов, которые играют роль в патогенезе ревматоидного артрита, все еще остается сложной задачей. Восприимчивые люди под влиянием генетических факторов и факторов окружающей среды с потерей иммунологической толерантности к аутоантигенам запускают аутоиммунные явления и образование аутоантител [25].Это отсутствие иммунологической толерантности представляет собой первый шаг к аутоиммунитету. Нарушение регуляции иммунной системы характеризуется наличием аутоантител и аутореактивных Т-клеток. Несоответствующее образование аутореактивных В-клеток – наиболее очевидное изменение иммунной системы у этих пациентов; их обнаруживают задолго до появления болезни. Наиболее важными являются RF и ACPA, которые распознают разные белки в цитруллинированной форме [26]. Наряду с повышенной продукцией аутоантител уровень провоспалительных цитокинов повышается в синовиальной оболочке сустава пациентов с ревматоидным артритом.Суставы пациентов с РА представляют собой сложные ткани, в которые вовлечены врожденные и адаптивные иммунные клетки наряду с резидентными клетками суставов, такими как синовиоциты и хондроциты [27].
Было выявлено несколько типов клеток, которые вносят вклад в патогенетический контекст ревматоидного артрита. В ревматоидном синовиуме дендритные клетки обнаруживаются в основном в лимфоцитарных агрегатах и периферических сосудах, что позволяет предположить, что они происходят из периферической крови. Аллели MHC экспрессируются APC, которые обрабатывают внеклеточные пептиды до CD4 + Т-клеток, управляя секрецией провоспалительных цитокинов, которые стимулируют В-клетки продуцировать антитела [25].У пациентов с этим заболеванием наблюдается нарушение функции циркулирующих регуляторных Т-клеток (Treg) и увеличение количества Т-хелперных 17 (Th27) клеток в плазме и синовиальной жидкости [28]. Произведенный из макрофагов и дендритных клеток трансформирующий фактор роста β и интерлейкин-1 β , 6, 21 и 23 обеспечивают среду, которая поддерживает дифференцировку Th27 и подавляет дифференцировку регуляторных Т-клеток, тем самым смещая гомеостаз Т-клеток в сторону воспаления. [29].
Посттрансляционные модификации (ПТМ) имеют решающее значение для функции и антигенности белков.Три ПТМ, в первую очередь участвующих в ревматоидном артрите, – это гликозилирование, карбамилирование и цитруллинирование [25]. Цитруллинирование происходит в результате превращения аргинина в цитруллин ферментом пептидиларгининдезиминазой (PAD), и это основная критическая посттранскрипционная модификация, связанная с распознаванием аутоантигена при ревматоидном артрите [25]. Цитруллин может изменять структуру белка и генерировать новые эпитопы, связанные с производством ACPA. ACPA, присутствующие у пациентов с ревматоидным артритом, демонстрируют различные тонкие специфичности и степени перекрестной реактивности с различными цитруллинированными и / или посттрансляционно модифицированными пептидами / белками, включая фибриноген, фибронектин, α -енолазу, коллаген типа II и гистоны [30].
Таблица 1 суммирует соответствующие аспекты развития этого заболевания. Доклинический ревматоидный артрит включает период, в течение которого аутоиммунитет выявляется до начала воспаления и / или повреждения клинически очевидной ткани, генетические факторы и факторы риска окружающей среды взаимодействуют, вероятно, последовательно, чтобы инициировать и распространять развитие аутоиммунитета, что в конечном итоге приводит к обнаружению воспаление и поражение тканей [24, 31]. Причастен ли какой-либо другой фактор риска к возникновению и / или распространению заболевания, он до сих пор неизвестен.
Фаза инициации заболевания (взаимодействие между генетико-гормональными факторами окружающей среды) Доклинический RA Клинический RA Гормональные факторы Факторы окружающей среды Иммунологические изменения Иммунологические изменения Общий эпитоп, PTPN22, STAT4, CTLA4, TRAF1, PADI4, FCRL3, ДНК-метилирование
метилирует
метилированный гистон
: Женщина 4: 1
Артрит улучшился во время беременности, но рецидив в послеродовом периодеМикробиота полости рта, легких и кишечника
Курение
Кремнеземная пыль
Ожирение
ДиетаНеадекватный ответ на пептиды
Увеличение аутореактивных Т-клеток и В-клеток
Расширение изотипа антител использование и переключение классов
Изменения в сетях растворимых цитокинов и хемокинов
Изменения Th27-клеток и соотношения Th27 / регуляторных Т-клетокПовышение регуляции сигнальных молекул
Иммуноопосредованное воспаление ткани
Изменения аутоантител, такие как гликозилирование
Клеточная экспансияКлинические проявления Наличие аутоантител (РФ, ACPA)
Неспецифические симптомыАртрит
Эрозии костей
Системные симптомы
Избегайте контакта с кремнеземом
Здоровое питание
Поддержание адекватного веса
Модификации микробиоты?Раннее использование ритуксимаба или абатацепта в исследованиях
Модификации микробиоты?Противовоспалительные
Биологические и небиологические препараты, модифицирующие заболевание
ГлюкокортикоидыРеакция ACPA может быть важна для перехода от доклинической фазы к клинической стадии ревматоидного артрита.Анализ репертуара ACPA до постановки диагноза у пациентов с ревматоидным артритом показал, что этот иммунный ответ начинается очень ограниченным образом и распространяется до нескольких месяцев или даже лет (распространение эпитопа, от одного первоначально распознанного эпитопа к реактивности на множество различных эпитопов) до постановки диагноза. ревматоидного артрита [10, 24, 32, 33]. Распространение эпитопа в сторону большего количества цитруллинированных, совместимо с возможностью того, что один антиген (но не всегда один и тот же) ответственен за запуск иммунного ответа [16, 32].Соколове и др. [33] сообщили, что ранее идентифицированные аутоантитела были нацелены против различных лигандов врожденного иммунного ответа, включая цитруллинированные гистоны, фибриноген и бигликан. Со временем титры ACPA и разнообразие эпитопов ACPA увеличиваются, особенно до начала артрита. ACPA могут быть изотипами IgG, IgA или IgM с измененным статусом гликозилирования, что обеспечивает усиление связывания Fc-рецептора и цитруллинированного антигена [34]. Сами по себе ACPA могут быть патогенными, активируя макрофаги или остеокласты посредством образования иммунных комплексов и взаимодействия с Fc-рецептором, или, возможно, связывая цитруллинированный виментин мембраной, способствуя, таким образом, потере костной массы [34].
С момента первоначального описания антител как цитруллинированных антигенов в субпопуляции пациентов с ревматоидным артритом стало ясно, что цитруллинированные эпитопы большого числа аутоантигенов, а также антигены, полученные из микроорганизмов, могут распознаваться высокоспецифичными антителами против ревматоидного артрита [ 30]. Изменения в определенных участках слизистой оболочки предполагают, что микробные факторы могут влиять на иммунный ответ слизистой оболочки, что также играет важную роль в раннем патогенезе ревматоидного артрита [35].Изменения композиционного разнообразия и уровней численности микробиоты, то есть дисбиоз, могут вызывать несколько типов аутоиммунных и воспалительных заболеваний из-за дисбаланса субпопуляций Т-клеток, таких как клетки Th2, Th3, Th27 и Treg [27].
Дисбиоз в одном или нескольких участках слизистой оболочки приводит к иммунным изменениям и нарушению самотолерантности к цитруллинированным аутоантигенам [35]. Поверхности слизистой оболочки тела, такие как дыхательные пути и желудочно-кишечный тракт, выполняют сложные задачи, поскольку они должны (1) оставаться толерантными к безвредным экологическим, пищевым и микробным антигенам для обеспечения функции органов и (2) устанавливать эффективные иммунные ответы против вторжения патогенов [36].Ткани легких и кишечника содержат иммунологические клетки, способные инициировать иммунный ответ; привлекательной возможностью является то, что запуск Т-клеточного иммунитета к цитруллинированным аутоантигенам может происходить в слизистых оболочках после презентации неоантигенов APC [1, 31]. В участке слизистой оболочки могут существовать возможные роли цитруллинированных микробных антигенов и молекулярной мимикрии, сигналов Toll-подобных рецепторов (TLR) и других врожденных иммунных активаторов и сигналов опасности [35]. Бактериальная флора, ассоциированная со слизистой оболочкой, курение или частицы окружающей среды (кремнеземная пыль) действуют на иммунные клетки (нейтрофилы, дендритные клетки и макрофаги) в качестве молекулярных структур, связанных с патогенами, и повреждают их, что приводит к возникновению воспаления, увеличению количества циркулирующих цитокинов и хемокинов вместе с производство аутоантигенов.Цитруллинированные антигены процессируются и представляются APC Т-клеткам, которые активируются и, в свою очередь, активируют В-клетки, что приводит к продукции аутоантител [31]. Аутоантигены при ревматоидном артрите не являются тканеспецифичными или органоспецифичными, но содержат большой набор посттрансляционных модифицированных белков [31]. Курение и другие стимулы могут инициировать цитруллинирование за счет активации PAD, образования лимфоидных структур, которые могут усиливать презентацию антигена, а также продукцию Т- и В-клеток [31].Возможные механизмы, с помощью которых сигаретный дым (CS) способствует ревматоидному артриту, включают высвобождение внутриклеточных белков из активированных или поврежденных реактивными окислительными веществами клеток, усиление аутореактивной функции B-клеток и изменение (а) многих клеточных сигнальных путей, участвующих в клеточной активации (b) ) антиген-презентирующие клетки, ослабленные сигаретным дымом, (в) регуляторные функции Т-клеток и (г) активация Т-клеток антигенами, обнаруженными в сигаретном дыме [37].
3. Микробиота и иммунная система
Воздействие микробов в желудочно-кишечном тракте и дыхательных путях является ключевыми детерминантами общего иммунного тонуса на этих слизистых барьерах и представляет собой главную цель для будущих стратегий вмешательства [36].Кишечник – это проход для различных антигенов окружающей среды в виде пищи или инфекционных агентов. Кишечная микробиота – фактор, влияющий на метаболический гомеостаз и иммунную систему [5]; это место замечательного взаимодействия между микроорганизмами и человеческим телом. Микроорганизмы устанавливают симбиотические отношения с эпителиальной и лимфоидной тканью [12, 25]. Кишечные бактерии синтезируют и изменяют множество соединений, влияющих на физиологию и иммунитет. Однако не все взаимодействия хозяина и микробиоты способствуют укреплению здоровья, особенно виды резидентных бактерий, по-видимому, активируют иммунную систему, что приводит к воспалительным заболеваниям [38, 39].Разнообразная и сбалансированная микробиота необходима для развития соответствующего иммунного ответа [40].
Преимущества, обеспечиваемые кишечной микробиотой хозяину, зависят от сложных взаимодействий с клетками хозяина [41]. Исследования на стерильных животных и гнотобиотических животных, колонизированных определенными бактериями, предоставили прямые доказательства решающей роли микробиоты в развитии и поддержании иммунной системы хозяина [41] и сохранении ее функций, таких как созревание лимфоидной ткани кишечника, секреция иммуноглобулина А. и производство важных антимикробных пептидов [42].У мышей axenic наблюдали скудный рост лимфоидной ткани и изменения в Т-клетках и субпопуляциях развития В-лимфоцитов; в некоторых случаях у этих мышей не развивались заболевания, характерные для обычных субъектов, вероятно, из-за дефектов адаптивной иммунной системы в отсутствие микробиоты, а не из-за отсутствия микроорганизмов как таковых. Консервированные молекулярные паттерны, выраженные на поверхности симбиотических бактерий или секретируемые в кишечнике, могут взаимодействовать с рецепторами распознавания паттернов (PRR), которые экспрессируются на эпителиальных и лимфоидных клетках или внутри них, чтобы инициировать трансдукцию и транскрипцию сигналов от набора молекул. которые опосредуют защиту хозяина или метаболическую активность в кишечнике [40].
Было показано, что кишечная комменсальная микробиота модулирует Т-клеточные и Treg-ответы, которые необходимы для эффективной защиты хозяина от патогенов, в то же время обходя аутоиммунные реакции и другие иммунопатологические последствия [43]. В качестве первой линии защиты хозяина от патогенов врожденные иммунные ответы основываются на семействе рецепторов, известных как PRR, включая TLR и рецепторы, подобные домену олигомеризации, связывающим нуклеотиды (NLR). TLR являются ключевыми рецепторами врожденного иммунитета для восприятия патоген-ассоциированных молекулярных паттернов (PAMP), которые представляют собой специфическую патогенную «молекулярную сигнатуру».«После обнаружения микробных PAMPs, TLR позволяют инициировать воспалительные реакции и в конечном итоге устранять патогенных захватчиков [43]. Компоненты грамположительных и грамотрицательных бактерий взаимодействуют с TLR, опосредуя как врожденный, так и адаптивный иммунитет, а также другие клеточные функции слизистого барьера [40]. Эпителиальные клетки имеют TLR на своей клеточной мембране, что позволяет распознавать PAMP и активировать опосредованную белком MyD88 передачу сигналов, которая заканчивается индукцией воспалительного ответа и выработкой провоспалительных цитокинов, таких как фактор некроза опухоли альфа (TNF- α ), интерлейкин-6 или интерлейкин-1 β .Клетки врожденного иммунного ответа собственной пластинки постоянно исследуют содержимое просвета кишечника на предмет чужеродных антигенов и составляют еще один защитный механизм [28]. Поскольку комменсальные бактерии различаются по своей способности стимулировать рецепторы врожденного иммунитета (TLR и NLR), характер высвобождаемых химических медиаторов значительно варьируется, определяя провоспалительные или противовоспалительные реакции. Липополисахарид грамотрицательных бактерий связывается с TLR-4, тогда как пептидогликан и другие компоненты клеточной стенки грамположительных бактерий передают сигнал через путь TLR-2, вызывая иммунный ответ [11].Грамположительные анаэробные бактерии содержат большее количество полисахаридов и пептидогликанов, которые могут действовать как антигенные раздражители.
После взаимодействия с антигеном дендритные клетки играют важную роль в дифференцировке незрелых лимфоцитов CD4 + в клетки Th2, Th27 или Th3. На дифференцировку Т-хелперных клеток, по-видимому, сильно влияет кишечная микробиота [11, 16, 42]. Дендритные клетки действуют как APC, отображая заряженные пептиды в своих молекулах MHC класса II.Презентация этих молекул В-клеткам или рецепторам Т-клеток сенсибилизирует эти клетки, чтобы инициировать адаптивный иммунный ответ [28]. При ревматоидном артрите дендритные клетки могут участвовать в поддержании воспалительного процесса, регулируя антигенную презентацию, и тогда презентация антигена или артритогенных антигенов будет ненормально продлена, что может способствовать сохранению воспаления. Макрофаги и дендритные клетки постоянно обнаруживают антигены просвета кишечника и оценивают наличие вредоносных антигенов.Антигены представлены молекулами MHC II и взаимодействуют с В-клетками или рецепторами Т-клеток, чтобы вызвать адаптивные иммунные ответы. В зависимости от микробного антигена затем создается специфическая цитозиновая среда, чтобы влиять на специфический тип дифференцировки Т-хелперных клеток. В то время как Т-хелперные клетки (Th2) типа 1 развиваются в ответ на внутриклеточные патогены и продуцируют интерферон, как Т-хелперные клетки (Th3) типа 2, так и клетки Th27 стимулируются внеклеточными микроорганизмами. Клетки Th27 вносят вклад в защиту от внеклеточных патогенов за счет продукции IL-17 и IL-22, которые вызывают изменение класса иммуноглобулинов в B-лимфоцитах и продукцию Reg3g эпителиальными клетками, соответственно [14].Иммунный ответ, генерируемый эффекторными Т-клетками, регулируется субпопуляцией, известной как регуляторные Treg-клетки. Кишечные Treg-клетки играют важную роль в поддержании иммунной толерантности к диетическим антигенам и микробиоте кишечника [44]. Клетки Treg сохраняют толерантность к аутоантигенам и устраняют аутоиммунитет. CD4 + CD25 + Treg-клетки являются клетками-супрессорами, которые экспрессируют фактор транскрипции Foxp3, и незаменимы для поддержания иммунной самотолерантности и гомеостаза путем подавления аберрантного или чрезмерного иммунного ответа. Lactobacillus и Bifidobacterium infantis оказывают противовоспалительное действие за счет индукции CD4 + CD25 + FoxP3 + Treg клеток [11]. Bacteroides fragilis полисахарид A действует как иммуномодулятор и стимулирует CD4 + Treg-клетки посредством интерлейкин-2-зависимого механизма для производства IL-10 [11].
Принимая во внимание тот факт, что дендритные клетки играют фундаментальную роль в создании иммунного ответа, было высказано предположение, что комменсальные бактерии влияют на функцию и дифференцировку дендритных клеток, модулируя таким образом иммунный ответ [11, 23].Таким образом, дисбактериоз кишечника может вызывать артрит, влияя на дифференциацию подгрупп Т-клеток. Он также влияет на степень экспрессии Toll-подобных рецепторов антигенпрезентирующих клеток и может вносить вклад в дисбаланс соотношения Th27 / Treg-клеток. С развитием клеток Th27, активацией местных воспалительных каскадов с повреждением тканей и у предрасположенных людей этот местный иммунный ответ может привести к системному аутоиммунитету с самореактивными клетками Th27.
Микробиота оказывает наиболее заметное влияние со стороны окружающей среды на дифференцировку клеток Th27.В последнее время большое внимание уделяется сегментированным нитчатым бактериям (SFB) из-за их способности индуцировать продукцию и активацию клеток Th27 в кишечнике с секрецией интерлейкина-17 [23, 27]. SFB включают группу грамположительных бактерий, связанных с Clostridia, которые плотно прилегают к бляшкам Пейера в тонком кишечнике и могут стимулировать иммунный ответ, индуцируя секрецию IgA и активируя B-клетки. Эти бактерии необходимы для развития аутоиммунитета на мышиной модели артрита K / BxN [45], а использование антибиотиков предотвращает развитие артрита [13, 30, 31].Исследования на мышах показали, что индукция клеток T FH и Th27 предшествует началу артрита, что указывает на роль обоих типов клеток. Моноколонизация с помощью SFB усиливает продукцию аутоантител и ускоряет прогрессирование заболевания за счет образования клеток Th27, хотя индуцированный микробиотой клеточно-зависимый процесс T FH также может спровоцировать заболевание [44]. Teng et al. [46] продемонстрировали, что SFB запускают аутоиммунный артрит, индуцируя дифференцировку и миграцию Т-фолликулярных вспомогательных клеток кишечника (T FH ) в системные лимфоидные участки, что приводит к увеличению продукции аутоантител и обострению артрита.Напротив, Block et al. [45, 47] подтвердили роль микробиоты кишечника в дифференцировке клеток T FH и формировании зародышевого центра. Истощение кишечной микробиоты у мышей антибиотиками снижает количество клеток T FH и уровни продукции антител. Они пришли к выводу, что кишечная микробиота регулирует развитие артрита через T FH независимо от клеток Th27.
4. Дисбиоз при ревматоидном артрите
Важность кишечного микробиома в аутоиммунных заболеваниях, связанных с ревматоидным артритом, была связана как с моделями мышей, так и с заболеваниями человека.Изменения микробиоты связаны с риском и тяжестью заболевания. В частности, с ним связаны три участка, в основном легкие, слизистая оболочка полости рта и желудочно-кишечный тракт. Тем не менее, еще предстоит проверить место (а) инициации первоначального иммунного ответа. В то время как точные механизмы, которые увеличивают риск для каждого из них, полностью не изучены, вполне вероятно, что местный тканевой стресс приводит к посттрансляционной модификации пептидов с последующим образованием антител, выступающих в качестве общего механизма [48].
Нарушения дыхательных путей и цитруллинирование легочной ткани обнаруживаются как у пациентов с ревматоидным артритом, так и у лиц из группы риска. Это позволяет предположить, что легкое является возможным местом генерации аутоиммунитета [49]. Доказательства ранней роли адаптивного иммунитета и иммунной активации в легких этих пациентов получены из протеомного исследования, в котором были описаны два общих цитруллинированных пептида виментина в бронхиальной ткани у пациентов с ранним ревматоидным артритом и синовиальной ткани пациентов с установленным заболеванием. некоторые ключи к разгадке иммунного процесса, инициированного в легких [25].Слизистая оболочка легких как причина аутоиммунного процесса основана на следующих наблюдениях: ACPA представлены в мокроте ACPA-положительных пациентов без артрита; есть микроскопические и макроскопические изменения в легких при раннем ревматоидном артрите и у нелеченных ACPA-положительных пациентов; легочные изменения были продемонстрированы при компьютерной томографии с высоким разрешением у субъектов без заболевания, но с положительным ACPA; образцы легочной биопсии от пациентов с положительным ACPA с установленной AR предполагают, что ACPA продуцируются локально.Однако точные молекулярные механизмы, которые могут быть ответственны за запуск иммунитета в слизистой оболочке легких, относительно не исследованы. Известно, что воздействие на легкие вредных агентов, включая дым, может вызвать повышенную экспрессию и активацию ЗПА [1]. Была выдвинута гипотеза, что цитруллинированные белки могут стать аутоантигеном и тем самым вызвать ответ иммунной системы у людей с генетической предрасположенностью к ревматоидному артриту.
Курение и пародонтит способствуют цитруллинированию белка и выработке ACPA [50].Внимание к деснам основано на заболевании пародонта, которое чаще встречается у пациентов с ревматоидным артритом или связано с его активностью. Было высказано предположение, что пародонтальные патогены вызывают системное воспаление или распространяются на пораженные ткани. Действительно, повышенный специфический IgG к патогенам пародонта, включая Prevotella intermedia и Porphyromonas gingivalis , был зарегистрирован при РА [51]. Присутствие P. intermedia и P. gingivalis в поддесневой зубной бляшке, а также в синовиальной жидкости подтверждает роль микробиоты в инициировании или поддержании хронического воспаления [52].Поперечные исследования выявили корреляцию между RA и более высокими титрами сывороточных антител против предполагаемых патогенов пародонта, таких как P. gingivalis , Prevotella melaninogenica и Tannerella forsythia [53]. Оральная инокуляция P. gingivalis и Prevotella nigrescens усугубляла тяжесть артрита в экспериментальной мышиной модели, направляя иммунный путь в сторону продукции IL-17 и генерации ответа Th27 [54].Эффекты двух бактерий расходились в том, что P. nigrescens , в отличие от P. gingivalis , подавлял цитокины типа 2, защищающие суставы, включая IL-4. P. gingivalis экспрессирует фермент с амидезиминазной активностью, который превращает С-концевой аргинин в цитруллин, аналогичный тому, который участвует в этиологии ревматоидного артрита. Цитруллинирование бактериальных и человеческих белков с помощью PAD может выявить скрытые эпитопы, что приведет к потере толерантности у генетически предрасположенных людей.Считается, что возникающий иммунный ответ вместе с эндогенным цитруллинированием продуцирует ACPA [4]. Тот факт, что курение тесно связано с наличием пародонтита и инфекции, вызванной P. gingivalis , дает косвенные доказательства в пользу этой гипотезы. Однако недавние эпидемиологические данные не продемонстрировали четкой взаимосвязи между пародонтитом и ревматоидным артритом [1].
Недавно микробиота кишечника была предложена в качестве незаменимого фактора окружающей среды в прогрессировании ревматоидного артрита [5, 18, 27, 55–57].Беннике и др. [43] идентифицировали 21 цитруллинированный пептид в ткани толстой кишки как пациентов с ревматоидным артритом, так и контрольной группы, которые ранее были обнаружены в ткани легких и синовиальной жидкости пациентов с РА. Три цитруллинированных белка (цитруллинированный виментин, фибриноген-альфа и актин) являются известными мишенями для ACPA, подтверждая, что слизистая оболочка толстой кишки может быть потенциальным местом нарушения иммунной толерантности к цитруллинированным эпитопам. Цитруллинированный виментин был обнаружен с повышенным содержанием в ткани толстой кишки этих пациентов по сравнению с контрольной группой, что может указывать на то, что первоначальный запуск ревматоидного артрита не ограничивается только конкретным местом в организме, но может иметь место во многих других местах [43].Таким образом, это исследование поддерживает гипотезу о том, что слизистая оболочка толстой кишки может служить местом нарушения иммунной толерантности к цитруллинированным белкам, вызывая выработку ACPA у пациентов с ослабленной иммунной системой.
5. Кишечная микробиота при ревматоидном артрите
Потенциальная роль кишечной микробиоты в этиопатогенезе ревматоидного артрита подтверждается исследованиями на животных моделях, исследованиями кишечной микробиомы и косвенно влиянием диеты и пробиотиков на степень воспалительного процесса. деятельность.Патофизиологические механизмы, с помощью которых микробиота кишечника связана с артритом, вероятно, многофакторны; предлагаемые механизмы включают активацию антигенпрезентирующих клеток посредством воздействия на TLR или NLR, способность производить цитруллинизацию пептидов посредством ферментативного действия, антигенную мимикрию, изменения проницаемости слизистой оболочки кишечника, контроль иммунной системы хозяина (запуск дифференцировки Т-клеток) и усиление воспаления слизистой оболочки, опосредованного Т-хелпером 17.
Несмотря на существование моделей на животных, хорошо известно, что не существует модели на животных, которая полностью представляла бы ревматоидный артрит [58].Однако модели артрита на мышах показали, что они вызывают эрозивный полиартрит при внутрибрюшинной инъекции фрагментов клеточной стенки Streptococcus pyogenes , Lactobacillus casei и Eubacterium aerofaciens [59–61]. Артритогенность бактериальных структур зависит от видов бактерий, и примечательно, что даже бактерии из нормальной кишечной микробиоты вызывают экспериментальный артрит у животных [17]. У мышей-гнотобиотиков не развивается артрит, и введения SFB достаточно для реинтеграции клеток Th27 из собственной пластинки, увеличения выработки аутоантител и быстрого развития деструктивного артрита [62].Лечение антибиотиками предотвращает и подавляет фенотип, сходный с ревматоидным артритом, на нескольких моделях мышей [4, 18, 28], а у генетически предрасположенных мышей дисбиоз увеличивает чувствительность к артриту за счет активации аутореактивных Т-клеток в кишечнике [63].
Роль кишечной микробиоты в патогенезе артрита была продемонстрирована индукцией / обострением артрита на экспериментальных мышах [55, 64–66]. Исследования на мышах-гнотобиотиках показали, что нарушения в кишечной микробиоте могут вызывать выработку провоспалительных цитокинов, интерлейкина-17 и повышение уровня клеток Th27 даже во внекишечных тканях [11].Затем клетки Th27 мигрируют в периферическую лимфоидную ткань и секретируют IL-17, который, в свою очередь, действует непосредственно на B-клетки и индуцирует системную дифференцировку B-клеток и продукцию антител [67]. В конечном итоге это может привести к развитию аутоиммунного заболевания за счет распознавания молекулярных паттернов кишечной микробиоты [67]. Мыши с нокаутом по антагонисту рецептора IL-1 (IL-1Ra), у которых спонтанно развивается аутоиммунный Т-клеточный артрит, не заболевают при выращивании в среде, свободной от микробов. Однако колонизация пригородной Lactobacillus bifidus вызывает быстрое начало заболевания, тяжесть и заболеваемость, сравнимые с артритом, наблюдаемым у мышей. L. bifidus запускает артрит в этой модели, способствуя дисбалансу гомеостаза Treg-Th27 клеток и опосредованному посредством передачи сигналов Toll-подобного рецептора (TLR2-TLR4) [28, 65]. Лю и др. [64] обнаружили, что род Lactobacillus был значительно более распространен у мышей, чувствительных к коллаген-индуцированному артриту (CIA-) до начала артрита, чем у устойчивых к CIA мышей. Примечательно, что стерилизованные мыши с микробиотой от чувствительных к CIA мышей показали более высокую частоту индукции артрита, чем мыши с микробиотой от устойчивых к CIA мышей.Моноколонизация свободных от микробов мышей K / BxN с помощью SFB была достаточной для стимулирования продукции аутоантител и патогенных клеток Th27, а также для запуска артрита [66]. Системный дефицит стерильных животных отражает потерю клеток Th27 из собственной пластинки кишечника. Введение одного вида резидентных кишечных нитчатых бактерий восстановило компартмент клеток Th27 в собственной пластинке; производство аутоантител и артрит возникли быстро. Таким образом, один комменсальный микроб, благодаря своей способности стимулировать конкретную субпопуляцию Т-хелперных клеток, может привести к аутоиммунному заболеванию [66].Эти результаты свидетельствуют о том, что комменсальные бактерии могут вызывать аутоиммунный артрит, вызывая ответ Th27 в кишечнике. Таким образом, состав кишечной микробиоты играет ключевую роль в балансе между воспалительными Th-клетками и супрессивными Treg-клетками для поддержания иммунной толерантности в здоровых условиях [27].
Взаимодействие между генетическими факторами хозяина, такими как MHC и кишечная микробиота, и его влияние на развитие ревматоидного артрита трудно изучать на людях из-за высокой вариабельности генетических факторов и диеты [11].Исследования, проведенные Gomez et al. [68] представили первую демонстрацию того, что гены HLA и кишечная среда взаимодействуют, чтобы влиять на восприимчивость к артриту. Это исследование показало различия в фекальном микробиоме трансгенных мышей HLA-DRB10401, чувствительных к ревматоидному артриту, по сравнению с мышами DRB10402, устойчивыми к развитию ревматоидного артрита. В частности, самки мышей DRB10401 имели микробный состав, значительно отличающийся от самок DRB10402, и это приводило к увеличению кишечной проницаемости и транскриптов цитокинов типа Th27 у мышей DRB10401.Анализ показал, что кишечная флора мышей, чувствительных к артриту, имела большее количество Clostridium sp. Бактерии DRB10402, устойчивые к артриту, пополнились семействами Porphyromonadaceae и Bifidobacteriaceae [68]. Последний организм связан с противовоспалительным ответом иммунной системы слизистой оболочки кишечника за счет подавления пролиферации Т-клеток и продукции провоспалительных цитокинов, а также за счет ингибирования ядерного фактора kB.Результаты показывают различие в микробном составе кишечника между двумя штаммами, предполагая, что гены MHC могут прямо или косвенно участвовать в определении микробного состава кишечника и взаимодействия между кишечными комменсалами [13, 18]. Кроме того, они продемонстрировали, что дисбактериоза недостаточно, поскольку он требует генетической предрасположенности хозяина из-за невозможности индукции воспалительного ответа у диких животных даже с проартритогенной кишечной флорой [13, 28].
Несколько исследований, пытающихся связать воспаление слизистой оболочки кишечника и суставов, отслеживались в течение последних десятилетий. Eerola et al. [69] сообщили, что фекальный профиль жирных кислот бактериальных клеток значительно отличался у субъектов с ревматоидным артритом, в основном анаэробными бактериями, по сравнению с контрольной группой. Они поддерживают идею о том, что ревматоидный артрит представляет собой состояние хронического воспаления, которое может быть мотивировано или усугублено чрезмерным ростом патогенных бактерий или отсутствием обычных иммуномодулирующих бактерий [5, 16, 18, 57, 70].Vaahtovuo et al. [16] также описали различия в фекальном разнообразии у лиц с ревматоидным артритом по сравнению с пациентами с фибромиалгией, характеризующимися более низким бунди-бактериями, Bacteroides-Porphyromonas-Prevotella , подгруппой Bacteroides fragilis и группой Eubacterium rectale-Clostridium cocco. у пациентов с ревматоидным артритом [6]. С другой стороны, Newkirk et al. [71] выявили различия в типах колонизации патогеном E. coli среди субъектов с ревматоидным артритом, RF-положительные пациенты чаще колонизировались бактериями E.coli , филогенетическая группа D, тогда как RF-отрицательные пациенты чаще были колонизированы E. coli , филогенетическая группа B2, и у этих людей также были более низкие оценки суставов и маркеры воспаления, но более высокие ответы антител IgA к E. coli .
Наблюдение за различиями микробиоты кишечника у субъектов с ранним ревматоидным артритом по сравнению с контрольной группой возобновило интерес к изучению кишечной микробиоты как возможного места происхождения аутоиммунных процессов; исследования микробиоты кишечника показывают, что ревматоидный артрит характеризуется увеличением и / или уменьшением бактериальных групп по сравнению с контролем [5, 18, 55–57].Высокопроизводительное секвенирование образцов стула в 5 исследованиях пациентов с РА показало дисбактериоз кишечника [5, 18, 55, 57, 63], а в 2 исследованиях сообщалось о чрезмерном расширении Prevotella sp. у пациентов с ранним РА, особенно P. copri (Таблица 2) . Различия между бактериями, о которых сообщалось в исследованиях, могут зависеть от времени течения заболевания (то есть раннего по сравнению с установленным), субъектов, включенных в контрольные группы (здоровые или родственники первой степени), полученного лечения и географического положения, поскольку исследования не показывают такой же закономерности.
Автор (год публикации) Дизайн Включенные испытуемые Используемый метод Результаты в группе RA по сравнению с контрольной группой 8 Shine al. [70] Случай-контроль 25 пациентов с РА по сравнению с контрольной группой Оценка количества бактерий в фекальной культуре Значительно более высокая частота носительства Clostridium perfringens в популяции с РА по сравнению с контрольной группой (88% против 48%, ).Количество колиформных бактерий также было выше Eerola et al. [69] Случай-контроль 74 ранний RA, ранее не получавший лечения, и 91 контрольная группа без RA Газожидкостная хроматография бактериальных CFA Вариации в CFA-профиле RA по сравнению с контролем, вероятно, вызванные анаэробными бактериями Vaahtovuo et al. [16] Случай-контроль 50 человек с РА и 50 человек с фибромиалгией Проточная цитометрия, гибридизация 16S рРНК и окрашивание ДНК У пациентов с РА было значительно меньше бифидобактерий и бактерий Bacteroides-Porphyromonas- Prevotella группа, Bacteroides fragilis подгруппа и Eubacterium rectale – Clostridium coccoides группа Toivanen et al.[57] Случай-контроль 25 пациентов с ранним РА, не получавших лечения, и 23 контрольных пациента, страдающих невоспалительной болью 16S рибосомная ДНК У пациентов с ранним РА было значительно меньше бактерий, принадлежащих к Bacteroides , Prevotella и Porphyromonas , чем контрольные (4,7% против 9,5%,). Количество бактерий, принадлежащих к группе Bacteroides-Prevotella-Porphyromonas , в среднем у пациентов с РА составляло лишь половину от контрольной группы Scher et al.[18] Поперечное сечение 44 человека с РА, ранее не получавших лечения, 26 пациентов с РА, 16 пациентов с псориатическим артритом и 28 здоровых людей из контрольной группы 16S рибосомная ДНК Увеличение Prevotella copri (75% по сравнению с 21,4 %) численность и уменьшение Bacteroides Liu et al. [56] Случай-контроль 15 человек с ранним РА и 15 здоровых людей из контрольной группы Количественная ПЦР в реальном времени Фекальная микробиота пациентов с РА содержала значительно больше Lactobacillus (10.62 ± 1,72 копий / г), чем в контрольной группе (8,93 ± 1,60 копий / г) Zhang et al. [5] Когорта 77 не получавших лечения лиц с РА и 80 неродственных здоровых людей из контрольной группы; 17 человек с РА, не получавших лечения, в паре с 17 здоровыми родственниками; и 21 образец от пациентов, получавших DMARD, с RA Метагеномное секвенирование с дробовиком и исследование метагеномной ассоциации Кишечник RA был обогащен грамположительными бактериями и истощен от грамотрицательных бактерий, в том числе около Proteobacteria и грамотрицательных. Firmicutes семейства Veillonellaceae.Обогащенные RA MLG сформировали большой кластер, включающий Clostridium asparagiforme , Gordonibacter pamelaeae , Eggerthella lenta и Lachnospiraceae. Наблюдалась тенденция к увеличению численности P. copri в зависимости от продолжительности РА в первый год Maeda et al. [63] Поперечное сечение 25 человек, ранее не получавших лечения, с ранними пациентами с РА и 23 здоровых человека в контрольной группе Глубокое секвенирование на основе 16S рРНК Субпопуляция пациентов с ранним РА содержала кишечную микробиоту, в которой преобладали Prevotella copri Chen et al.[55] Случай-контроль 40 Субъектов с РА, прошедших лечение 16S рибосомная ДНК Повышенное количество считываний из филума актинобактерий в группе RA (0,45 против 0,04%) 32 контроля (15 родственников 1 степени с AR и 17 здоровых субъектов) Уменьшение Faecalibacterium и распространение Collinsella aerofaciens и Eggerthella lenta MLG: группы метагеномных связей. Toivanen et al. [57] сравнили фекальную микробиоту 25 пациентов с ранним RA с микробиотой пациентов с невоспалительной болью, используя олигонуклеотидный зонд против 16S РНК. У пациентов с ранним РА было значительно меньше бактерий, принадлежащих к полу: Bacteroides sp., Prevotella sp. И Porphyromonas sp. В другом исследовании Scher et al. [18] сообщили, что люди с ранним РА более склонны к носительству Prevotella copri по сравнению с контрольной группой.Кроме того, они продемонстрировали, что пероральное введение P. copri увеличивало местный воспалительный ответ на мышиной модели колита. Следовательно, P. copri изменит кишечную проницаемость. Такое увеличение может привести к проникновению бактерий и / или их компонентов по всему телу; это один из предложенных механизмов, связывающих дисбактериоз с патогенезом артрита. Интересно, что относительная численность P. copri обнаружила отрицательную корреляцию с наличием общего эпитопа, что позволяет предположить, что состав микробиома кишечника человека также может частично зависеть от генома хозяина, и предполагает наличие дисбактериоза до появления клинических проявлений. фенотип.
В соответствии с этими результатами Maeda et al. [63] наблюдали, что P. copri было в изобилии в кишечной микробиоте у японских пациентов с ранним РА, не получавших медикаментозного лечения. Они определили, что P. copri per se обладает высокой способностью индуцировать цитокины, связанные с клетками Th27, такие как IL-6 и IL-23. Увеличенная Prevotella sp. изобилие связано с усиленным Т-хелпером 17-опосредованного воспаления слизистой оболочки, что соответствует заметной способности Prevotella sp.в управлении иммунным ответом Th27 in vitro [51]. В другом исследовании Pianta et al. [72] определили, что подгруппы пациентов с ревматоидным артритом имеют дифференциальную иммунную реактивность IgG или IgA с P. copri. Как у пациентов с впервые начавшимся ревматоидным артритом, так и у пациентов с хроническим артритом, подгруппа имела ответы антител IgA либо на Pc-p27, либо на весь организм, которые коррелировали с ответами цитокинов Th27 и частыми ACPA. Во второй подгруппе присутствовали антитела IgG P. copri , которые были связаны с ДНК Prevotella в синовиальной жидкости, P.copri -специфические ответы Th2 и менее частые ACPA. Пациенты с РА имели IgA, IgG или не имели специфических антител, что указывает на то, что у каждого отдельного пациента могут развиваться разные иммунные ответы на P. copri , что, в свою очередь, может иметь значение для риска и исходов заболевания.
Молекулярная мимикрия из-за сходства последовательностей чужеродных и собственных пептидов является одним из таких механизмов, которые, как известно, приводят к перекрестной активации аутореактивных Т- или В-клеток, происходящих от патогенов.Эти Т- и В-клетки могут перекрестно реагировать с эпитопами хозяина, что приводит к аутоиммунитету [67]. В недавней работе Pianta et al. [73] описали два белка, происходящие из общих типов кишечных бактерий, которые могут вызывать иммунные ответы у пациентов с РА. N -Ацетилглюкозамин-6-сульфатаза (GNS) и филамин A (FLNA) были идентифицированы как аутоантигены, которые вызывают ответ как Т-, так и В-клеток, более чем у 50% пациентов с РА, но не у здоровых людей из контрольной группы или пациентов с другие ревматические заболевания.Представленный HLA-DR пептид GNS имеет заметную гомологию последовательностей с эпитопами сульфатазных белков Prevotella sp. и Parabacteroides sp., тогда как представленный HLA-DR пептид FLNA имеет гомологию с эпитопами из белков Prevotella sp. и Butyricimonas sp., другой кишечный комменсал. Ответы Т-клеток на соответствующие микробные и собственные пептиды сильно коррелировали. Это исследование предоставляет доказательства того, что Т-клеточные эпитопы родственного отряда кишечных микробов, в частности Prevotella sp., могут перекрестно реагировать с аутоэпитопами высокоэкспрессированных белков в суставах, особенно у пациентов с аллелями SE.
Кроме того, Prevotella sp. может быть не единственным видом, участвующим в воспалительном заболевании. Zhang et al. [5] использовали метагеномную технологию секвенирования для анализа образцов фекалий, зубов и слюны от большой группы пациентов с РА, а также от здоровых людей. Анализ дифференциально представленных групп метагеномного сцепления выявил значительные различия микробиома между пациентами с РА и здоровыми людьми в контрольной группе не только в фекалиях, но также в образцах слюны и зубов.Они продемонстрировали, что грамположительные бактерии обогащают микробиоту по сравнению с небольшим количеством грамотрицательных бактерий и, кроме того, что дисбактериоз связан с маркерами воспаления и клинической активностью ревматоидного артрита. Кроме того, они также обнаружили изменения в окислительно-восстановительной среде, транспорте и метаболизме железа, серы и цинка в микробиоте пациентов с РА, что указывает на то, что измененный микробиом может играть важную роль в патогенезе РА. Примечательно, что измененный микробиом был частично восстановлен до нормального состояния (микробиома здорового контроля) у пациентов, у которых отмечалось клиническое улучшение после назначения модифицирующих болезнь противоревматических препаратов.Примечательно, что P. copri у индивидуумов, пораженных RA, продемонстрировал тенденцию к увеличению относительной численности в первый год, что согласуется с его увеличением в раннем RA. Многие виды Prevotella были обогащены слюной субъектов с РА по сравнению с контрольной группой. Заметным исключением был Prevotella intermedia , который был обогащен в контрольной группе. Однако в образцах зубного налета картина была совсем другой, и большинство Prevotella sp. присутствовали в более высоких пропорциях у здоровых субъектов.
Chen et al. [55] сообщили, что бактерии, принадлежащие к типу Actinobacteria , играют значительную роль в патогенезе ревматоидного артрита, Collinsella sp. и Eggerthella sp. предсказал его присутствие, и дисбактериоз в кишечном микробиоме частично восстанавливается после лечения модифицирующими болезнь противоревматическими препаратами, аналогично результатам, полученным в предыдущем исследовании. Потенциальная ассоциация P. copri , о которой сообщалось ранее, с новым дебютом нелеченного RA и DR4 не наблюдалась в этой когорте пациентов с RA (в отличие от предыдущих исследований, все пациенты в настоящем исследовании в настоящее время находились на схеме лечения).Они показали, что снижение микробного разнообразия кишечника у пациентов с РА связано с продолжительностью заболевания после корректировки различных препаратов, используемых для лечения. Collinsella sp. может способствовать развитию ревматоидного артрита посредством молекулярной мимикрии, поскольку он представляет последовательности, общие с DRB10401. Роль RA-ассоциированных бактерий Collinsella sp. был подтвержден с использованием линии эпителиальных клеток человека и гуманизированной мышиной модели артрита. Collinsella sp.повышенная тяжесть заболевания в гуманизированной модели мыши. Один из механизмов, с помощью которого Collinsella вносит вклад в патогенез заболевания, заключается в увеличении проницаемости кишечника, о чем свидетельствует более низкая экспрессия белков плотных контактов. Кроме того, Collinsella влияет на продукцию IL-17A эпителием [55].
Хотя исследования пациентов с ревматоидным артритом показывают корреляцию между Prevotella sp. По своему патогенезу другие исследования предполагают, что он может считаться полезным бактериальным видом, а не патогенным [74, 75].Коллекции культур в настоящее время включают около 40 различных видов Prevotella , большинство из которых представляют собой пероральные изоляты, а три из них обнаружены в кишечнике (обычно более многочисленны P. copri ). Существенно различающиеся репертуары геномных генов штаммов в пределах Prevotella sp. и между хозяевами, вероятно, лежат в основе некоторых различий, наблюдаемых в ответах на уровне рода на диету и состояние здоровья у разных людей [75]. Недавнее комплексное исследование, сравнивающее несколько видов бактерий, предполагает, что принадлежность к определенному типу не предсказывает иммунологические свойства, подчеркивая важность характеристики свойств на уровне видов.Marietta et al. [76] оценили способность 2 видов Prevotella sp. для профилактики и лечения артрита у мышей HLA-DQ8. Было показано, что способность модулировать иммунный ответ у штаммов Prevotella различалась. Обработка P. histicola подавляла развитие артрита путем модуляции иммунного ответа (регуляция дендритных клеток и генерация Treg-клеток), что приводило к подавлению ответов Th27 и снижению воспалительных цитокинов (IL-2, IL-17 и некроз опухолей). фактор).Напротив, введение P. melaninogenica не показало значительных изменений в уровнях цитокинов, предотвращающих развитие артрита. Способность P. histicola модулировать была подтверждена с использованием модели мышей DBA / 1, демонстрируя, что у мышей, получавших P. histicola , развился более умеренный артрит по сравнению с контролем. Очевидно, что единичный штамм Prevotella sp. могут действовать так, как это было истолковано как положительное или отрицательное, в зависимости от контекста.Это может объяснить, почему Prevotella sp. изобилует здоровой микробиотой и предполагает, что только определенные штаммы могут проявлять патогенные свойства.
У пациентов с впервые возникшим РА, изобилие Prevotella в кишечнике происходило за счет Bacteroides fragilis , организма, который важен для функции Treg [18, 72]. Фактически, высокие уровни P. copri и аналогичных видов связаны с низким уровнем полезных микробов, которые, как полагают, подавляют иммунную систему и метаболизируют витамины в формах, всасываемых в кровоток [17].При обсуждении возможных механизмов, посредством которых диета может влиять на ревматоидный артрит, следует учитывать влияние кишечной флоры [77–79]. Диета, богатая белками и животными жирами, связана с присутствием Bacteroides sp. в то время как диета, богатая углеводами, связана с присутствием Prevotella sp. [80]. Исследования показали, что средиземноморская или веганская диета снижает воспалительную активность, улучшает физическую функцию и улучшает жизненный тонус [19]. Однако в некоторых других исследованиях обнаруживаются преимущества без достижения значительного улучшения сводных индексов для измерения активности заболевания [81, 82].Тем не менее, в этих исследованиях не было определено, действительно ли улучшение при ревматоидном артрите было связано с изменением состава кишечной флоры.
Пробиотики – это живые организмы, которые могут принести пользу здоровью хозяина. Пробиотики в основном оказывают свое положительное действие с помощью следующих трех методов: антимикробное действие, повышение целостности слизистого барьера и иммуномодуляция [83]. Исследования [84–86], оценивающие взаимосвязь между добавлением пробиотиков и уровнем активности РА, не показали убедительных результатов (Таблица 3).Улучшения в пробиотических вмешательствах не были достаточно очевидными, чтобы продемонстрировать эффективность лечения пациентов с РА, из-за ограниченного количества исследований. Необходимо провести более продуманные исследования, чтобы определить лучшие виды, облегчающие РА, и оптимизировать метод приема и дозы пробиотиков [83].
Автор (год публикации) Дизайн Население и вмешательство Результаты и др. [89] Клиническое испытание Группа Lactobacillus (). Группа плацебо () Не было статистически значимых различий в: CRP, СОЭ, IL-6, IL-10, IL-12 и HAQ Pineda et al. [86] Клиническое испытание 15 субъектов Lactobacillus rhamnosus GR-1 и Lactobacillus reuteri RC-14, введенные в течение 3 месяцев, по сравнению с 14 субъектами в контрольной группе Пробиотики статистически не улучшили процент ответа ACR 20 (20 % против 7%) Alipour et al.[84] Клиническое испытание 22 пациента с Lactobacillus casei по сравнению с 24 пациентами с плацебо Статистически значимое снижение уровня СРБ, количества воспаленных и болезненных суставов и DAS-28 Vaghef-Mehrabany et al. . [85] Клиническое испытание 22 пациента с Lactobacillus casei по сравнению с 24 пациентами с плацебо (мальтодекстрин) Статистически значимое снижение уровня TNF- α , IL-6 и IL-12, количество воспаленных и болезненные суставы и в DAS-28 CRP: C-реактивный белок; DAS28: показатель активности заболевания – 28; ИЛ: интерлейкин; СОЭ: скорость оседания эритроцитов; ACR: Американский колледж ревматологии. Наконец, доказательства того, что кишечная микробиота стимулирует развитие артрита, получены на экспериментальных моделях на мышах. У людей эта ассоциация основана на различиях между микробиомом в группах сравнения, которые не обязательно отражают его причинную связь. Результаты у людей позволяют предположить, что дисбактериоз является значимым этиологическим агентом, способствующим прогрессированию ревматоидного артрита, или, что еще важнее, воспаление, вызванное некоторыми микроорганизмами, такими как P. copri , вероятно, может способствовать поддержанию артрита.Для того чтобы предсказать роль кишечной микробиоты в патогенезе ревматоидного артрита, все же необходимо точное представление о потенциале этого вида, его экологии и взаимодействии с другими микробами и / или хозяевами. Кроме того, хотя слизистая оболочка кишечника, вероятно, имеет самый высокий потенциал для взаимодействия хозяина и микроба, все слизистые оболочки имеют резидентную микробиоту и динамически реагируют на ее присутствие с помощью иммунной модуляции. Грамотрицательные бактерии могут вызвать инфекции в любой части тела; Среди наиболее распространенных типов – оральный, стоматологический, плевропульмонарный, внутрибрюшной, слизистой оболочки половых органов, кожи и мягких тканей.Другими словами, это не означает, что все пациенты с ревматоидным артритом должны иметь дисбактериоз в одном месте.
6. Микробиота как возможный механизм профилактики ревматоидного артрита
Текущие исследовательские проекты сосредоточены на профилактике с помощью биологических препаратов, которые ингибируют образование антител или активируют Т-клетки [87]. Недавние открытия показали, что дисбактериоз кишечника является важным шагом в нашем понимании ревматоидного артрита. Тем не менее, нет исследований, демонстрирующих антиген или антигены, запускающие аутоиммунный процесс.Логические признаки указывают на дисбактериоз слизистой оболочки как привлекательное место для выяснения путей аутоиммунитета, особенно механизмов, которые вызывают потерю иммунной толерантности, и конкретных механизмов, с помощью которых человек эволюционирует от доклинического к клиническому заболеванию.
Было показано, что микробиота кишечника играет роль в ревматоидном артрите, хотя механизм этой связи остается неясным. Понимание этих механизмов имеет решающее значение для повышения эффективности лечения и индивидуального ведения пациентов [67].Пластичность микробиома может позволить специфические или систематические манипуляции с определенной кишечной микробиотой, связанной с болезнями хозяина [88], предполагая, что в будущем эта манипуляция может изменить терапевтические стратегии у субъектов с ревматоидным артритом.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов в отношении публикации этой статьи.
Благодарности
Авторы благодарят Глорию Меркадо за ее полезные комментарии во время подготовки этой рукописи.
О дисбактериозе кишечника – Ethos Veterinary Health
О дисбактериозе кишечника
15 июня 2020 г.Что такое микробиом желудочно-кишечного тракта (ЖКТ)?
Термин «микробиом желудочно-кишечного тракта» относится к геному всей микробиоты (бактерий, грибов и других микроорганизмов), обитающих в желудочно-кишечном тракте. Большинство этих микробов обитает в толстой кишке. Большинство организмов – бактерии, но микробиом также состоит из генов грибов, вирусов и архей, которые обычно населяют желудочно-кишечный тракт всех животных.Всего существует около 100 триллионов организмов. У среднего человека вес этих микроорганизмов составляет ~ 5 фунтов! Существует от 500 до 1000 различных видов, которые обычно населяют желудочно-кишечный тракт. Хотя каждый человек имеет уникальный состав микробиома, в целом микробиом собак и людей очень похож. Мы разделяем ~ 20% нашего микробиома с домашними животными и членами семьи, которые живут в нашем доме. В дополнение к огромному количеству организмов, живущих в нашем желудочно-кишечном тракте, каждый из этих организмов имеет свой собственный геном.В совокупности существует более 3 миллионов генов, которые возникают из этой микробиоты. Это примерно в 130 раз больше генома человека и в 160 раз больше генома собаки!
Какова функция микробиома?
Микробиота играет огромную роль в переваривании и усвоении питательных веществ. Эти организмы также активно участвуют в работе иммунной системы. Примерно 70% клеток иммунной системы организма находятся в кишечном тракте.Нормальный микробиом важен для иммунной толерантности, чтобы не развивались иммуноопосредованные заболевания. Нормальный микробиом также важен для защиты от инфекционных заболеваний. Микроорганизмы, обитающие в желудочно-кишечном тракте, производят более 1000 метаболитов, включая полезные короткоцепочечные жирные кислоты, витамин K, B12, тиамин, рибофлавин и многие другие. Микробиом принимает непосредственное участие в метаболизме многих лекарств.
Что такое дисбактериоз кишечника и каковы его возможные последствия?
- Дисбактериоз кишечника определяется как дисбаланс между типами микроорганизмов в желудочно-кишечном тракте.Это может быть связано с чрезмерным ростом потенциальных патогенов, уменьшением количества комменсальных организмов, уменьшением общей численности организмов или любой комбинацией этих сценариев. Когда возникает дисбактериоз, он приводит к воспалению из-за выработки провоспалительных цитокинов. Это может привести к множеству различных хронических заболеваний. Некоторые из болезней, которые были связаны с дисбактериозом у людей и в моделях исследований на грызунах, включают:
- Аллергия
- Болезнь Альцгеймера (диабет 3 типа)
- Беспокойство
- Астма
- Аутоиммунные заболевания (ревматоидный артрит и др.)
- Рак (колоректальный, рак груди, рак поджелудочной железы, лимфома и др.)
- Хронические рецидивирующие ИМП
- Колит
- Деменция
- Депрессия (большое депрессивное расстройство)
- Сахарный диабет
- Болезнь сердца
- Гепатит
- Раздраженное заболевание кишечника (ВЗК)
- Метаболический синдром
- Мигрень
- Ожирение
- Остеоартроз
- Панкреатит
- Болезнь Паркинсона
- Заболевания пародонта
- Судорожные расстройства
- Кожные заболевания (розацеа, псориаз, экзема)
Это обширный, но не исчерпывающий список.Связь с некоторыми из этих заболеваний – всего лишь ассоциация, но в сфере дисбактериоза появляется все больше и больше исследований, и многие исследования теперь начинают показывать доказательства того, что дисбактериоз кишечника является причиной некоторых из этих заболеваний.
Каковы некоторые причины дисбактериоза кишечника?
Использование антибиотиков – основная причина дисбактериоза кишечника. К сожалению, все антибиотики могут вызывать дисбактериоз, поскольку они убивают комменсальную флору в дополнение к потенциальным патогенам.Диета является основным фактором здорового микробиома, и мы обсудим это более подробно в следующей статье. Некоторые диетические компоненты, которые могут вызвать дисбактериоз, включают сахар, пищевые добавки и обработанные пищевые ингредиенты.
Пестициды в продуктах питания и в окружающей среде могут вызывать дисбактериоз. Кесарево сечение также может привести к дисбактериозу, хотя это не такая большая проблема для собак, как у людей, из-за относительной редкости родов с кесаревым сечением у собак. У детей наблюдается повышенная ассоциация с астмой и атопией у детей, рожденных посредством кесарева сечения.Было доказано, что плохая гигиена полости рта является причиной дисбактериоза, а также высокого уровня стресса и беспокойства.
Заболевания желудочно-кишечного тракта могут возникать одновременно с дисбактериозом кишечника
Дисбактериоз кишечника может возникать при отсутствии очевидного кишечного заболевания. Однако чаще всего дисбактериоз сочетается с кишечным заболеванием. В этих случаях трудно определить, вызвал ли дисбактериоз кишечное заболевание или дисбактериоз развился из-за кишечного заболевания.
Вот список кишечных заболеваний, которые были связаны с дисбактериозом кишечника:
- Хронические энтеропатии
- Адаптация к еде
- Чувствительность к антибиотикам
- Воспалительное заболевание кишечника (ВЗК)
- Острая диарея, вызванная различными причинами, как инфекционная, так и неинфекционная
- Кишечный застой и другие нарушения моторики
- Снижение выделения желудочного сока
- Прием препаратов, подавляющих кислотность (h3-блокаторы, ингибиторы протонной помпы)
- Внешнесекреторная недостаточность поджелудочной железы
Ethos Discovery Research
Дисбактериоз кишечника – это изменение состава и / или численности нормальных бактерий, обнаруживаемых в желудочно-кишечном тракте (микробиота).Было высказано предположение, что состояния кишечного дисбиоза существуют и могут, возможно, коррелировать с болезненными процессами, которые влияют на здоровье кишечника и других органов и заболеваний, таких как рак и иммуноопосредованные заболевания. Влияние дисбактериоза кишечника на прогрессирование различных заболеваний в настоящее время отсутствует как в медицине, так и в ветеринарии. Ethos Discovery теперь спрашивает, как влияет дисбактериоз кишечника на различные заболевания, не связанные с желудочно-кишечным трактом, у ветеринарных пациентов.
В этой программе мы сначала определим, связан ли дисбактериоз с отдаленными заболеваниями, а затем воспользуемся этим в качестве отправной точки для:
- Разработка новых анализов крови для диагностики дисбактериоза.
- Разработайте новые диеты и другие методы лечения клинически важного дисбактериоза.
Эта статья была первоначально опубликована на нашем дочернем сайте: Ethos Discovery под заголовком «О дисбактериозе кишечника и почему он является приоритетом для Ethos Discovery». Чтобы узнать больше об Ethos Discovery, посетите этот веб-сайт.
Дисбиоз кишечника и обнаружение «живых кишечных бактерий» в крови японских пациентов с диабетом 2 типа
Реферат
ЦЕЛЬ Растущее количество доказательств указывает на то, что микробиота кишечника является важным модификатором ожирения и диабета.Однако до сих пор нет информации о кишечной микробиоте и «живых кишечных бактериях» в системном кровотоке японских пациентов с диабетом 2 типа. Дизайн и методы исследования. параметры, включая маркеры воспаления. Мы также проанализировали наличие кишечных бактерий в образцах крови.
РЕЗУЛЬТАТЫ Подсчет группы Clostridium coccoides , кластера Atopobium и Prevotella (облигатных анаэробов) был значительно ниже ( P <0,05), в то время как общее количество Lactobacillus ) были значительно выше ( P < 0,05) в образцах кала больных диабетом, чем в образцах контрольной группы. В частности, количество подгрупп Lactobacillus reuteri и Lactobacillus plantarum было значительно выше ( P <0.05). Кишечные бактерии были обнаружены в крови у пациентов с диабетом значительно чаще, чем у контрольных субъектов (28% против 4%, P < 0,01), и большинство этих бактерий были грамположительными.
ВЫВОДЫ Это первое сообщение о дисбактериозе кишечника у японских пациентов с диабетом 2 типа по оценке с помощью RT-qPCR. Большое количество кишечных бактерий в кровообращении предполагает перемещение бактерий из кишечника в кровоток.
Введение
Микробиота кишечника необходима для иммунной системы хозяина (1), пищеварения, включая расщепление сложных углеводов, таких как пищевые волокна, и производство органических кислот для поддержания соответствующей среды pH в кишечнике (2) .Изучение микробиоты кишечника быстро прогрессирует, и без преувеличения можно сказать, что внедрение культурально-независимых подходов, основанных на анализе 16S рРНК, привело к смене парадигмы в этой области (2,3). Помимо своего физиологического значения, дисбактериоз кишечника связан с ожирением из-за увеличения доступности богатых калориями продуктов, таких как западная диета (4–6). Вместе с предыдущими данными появилась новая информация о патофизиологической роли микробиоты кишечника и крови в развитии атеросклероза (7–9).Важная концепция роли кишечной микробиоты в инсулинорезистентности была впервые описана Кани и его коллегами (4,10–13). В серии исследований эти исследователи продемонстрировали, что кишечные грамотрицательные бактерии продуцируют липополисахарид (ЛПС), который является хорошо известной провоспалительной молекулой, может перемещаться в кровоток из дырявого кишечника и вызывать метаболическую эндотоксемию, которая связана с ожирением. (4). Более конкретно, диета с высоким содержанием жиров усиливает разрушение белков плотных контактов в кишечнике, таких как zonula occludens-1 и окклюдин, которые участвуют в барьерной функции кишечника на моделях мышей (13).Этот эффект напрямую зависит от микробиоты кишечника, поскольку лечение антибиотиками устраняет индуцированную диетой проницаемость кишечника (4). Вышеупомянутые исследования показывают, что дисбактериоз кишечника и связанная с ним повышенная проницаемость кишечника могут служить факторами окружающей среды для развития ожирения до развития диабета. Хотя данные, полученные на мышах, убедительны, функциональные связи между микробиотой кишечника человека и заболеванием менее понятны из-за различных смешивающих факторов, включая возраст, пол, диету, генетику и расу (14,15).
В Японии оценочное число пациентов с диабетом 2 типа увеличилось до 10,7 миллиона, что является шестым по величине таким населением в мире (16). Однако исследований состава кишечной микробиоты у японских пациентов с диабетом 2 типа на людях не проводилось. Японская диета сильно отличается от западной диеты, и известно, что на микробиоту кишечника влияет тип пищи (6), что позволяет предположить, что микробиота кишечника у японских пациентов с диабетом 2 типа может отличаться от таковой у западных людей.Поэтому важно исследовать состав микробиоты кишечника у японских пациентов с диабетом 2 типа.
Интересно, что Amar et al. (17) сообщили, что диета с высоким содержанием жиров индуцирует бактериальную транслокацию из кишечника в кровоток у людей путем обнаружения бактериальной геномной ДНК, кодирующей 16S рРНК. Однако пока нет доказательств того, что «живые бактерии» перемещаются из кишечника в системный кровоток.
В текущем исследовании мы проанализировали состав микробиоты фекального кишечника и уровни кишечных бактерий в плазме у 50 японских пациентов с диабетом 2 типа и 50 контрольных субъектов путем обнаружения 16S рРНК.Мы также исследовали взаимосвязь между различными клиническими параметрами, приемом пищи и микробиотой кишечника, чтобы определить клиническое значение микробиоты кишечника у японских пациентов с диабетом 2 типа.
Дизайн и методы исследования
Объекты исследования
Мы набрали японских пациентов с диабетом 2 типа, которые регулярно посещали амбулаторную клинику университетской больницы Дзюнтендо в период с 2011 по 2012 год, и 50 пациентов согласились принять участие в исследовании. Мы также набрали контрольных субъектов, которые регулярно посещали амбулаторную клинику университетской больницы Джунтендо для лечения гипертонии, дислипидемии или заболевания щитовидной железы, состояние которых находилось под хорошим контролем, или которые посещали университетскую больницу Джунтендо для плановых медицинских осмотров в период с 2011 по 2012 год.Пятьдесят контрольных субъектов с уровнем HbA 1c <6,0% (42 ммоль / моль) согласились участвовать. Из исследования были исключены пациенты со следующими состояниями: 1 ) пролиферативная ретинопатия; 2 ) возраст ≥80 лет; 3 ) серьезное заболевание печени (уровень аспартатаминотрансферазы и / или аланинаминотрансферазы> 100 МЕ / л) или серьезное заболевание почек (уровень креатинина сыворотки> 2,0 мг / дл; 4 ) острая сердечная недостаточность; 5 ) злокачественная опухоль; 6 ) воспалительное заболевание кишечника; и 7 ) история лечения антибиотиками в течение 3 месяцев после участия в исследовании.Протокол исследования был одобрен Комитетом по этике Университета Джунтендо, и письменное информированное согласие было получено от каждого пациента перед включением в исследование.
Определение количества бактерий с помощью обратной транскрипции, направленной на 16S рРНК – количественная ПЦР
После включения в исследование участников попросили предоставить свежие образцы фекалий. Образцы фекалий помещали непосредственно в две пробирки (∼1,0 г / пробирка) участники или сотрудники больницы; одна пробирка содержала 2 мл РНК позже (раствор для стабилизации РНК; Ambion, Остин, Техас), а другая была пуста.Образцы помещали в холодильник при 4 ° C (для анализа фекальной микробиоты) или в морозильную камеру при -20 ° C (для анализа концентрации органических кислот в фекалиях и pH фекалий) в течение 30 минут после выделения. Образцы крови были взяты после ночного голодания в течение 5 дней после сдачи образцов кала. Один миллилитр крови добавляли к 2 мл бактериального реагента RNAprotect (Qiagen, Hilden, Германия) сразу после сбора. Образцы хранили при -80 ° C. Образцы кала и крови при температуре −20 ° C были доставлены в Центральный институт микробиологических исследований им. Якульта.
Для количественной оценки бактерий, присутствующих в образцах, мы экстрагировали фракции общей РНК из фекалий и крови ранее описанным методом (18–21) и исследовали состав кишечной микробиоты и уровни кишечных бактерий в плазме с использованием 16S рРНК- прицельная RT – количественная ПЦР (qPCR) с использованием Yakult Intestinal Flora-SCAN. Три серийных разведения образца экстрагированной РНК использовали для бактериальной рРНК-целевой ОТ-кПЦР (18–21), а значения порогового цикла в линейном диапазоне анализа применяли к стандартной кривой для получения соответствующего количества бактериальных клеток в каждый образец нуклеиновой кислоты.Затем эти данные были использованы для определения количества бактерий в образце. Специфичность анализа RT-qPCR с использованием праймеров, специфичных для группы, рода или вида, определяли, как описано ранее (18–21). Последовательности праймеров перечислены в дополнительной таблице 1.
Измерение органических кислот и pH
Концентрации органических кислот в кале и сыворотке определяли с использованием методов, описанных ранее (21) с небольшими изменениями. Вкратце, замороженный образец гомогенизировали в четырех объемах 0.15 моль / л хлорной кислоты и выдерживают при 4 ° C в течение 12 часов. Суспензию центрифугировали при 20 400 × g при 4 ° C в течение 10 мин. Затем полученный супернатант пропускали через фильтр с размером пор 0,45 мкм (Millipore Japan, Токио, Япония). Образец анализировали на наличие органических кислот с помощью системы высокоэффективной жидкостной хроматографии (детектор проводимости 432; Waters Co., Милфорд, Массачусетс), и pH в кале анализировали с помощью pH / термометра IQ 150 (IQ Scientific Instruments, Inc., Карловы Вары, Калифорния).
Биохимические анализы
Образцы крови были получены после ночного голодания. Липиды сыворотки (общий холестерин [T-CHO], холестерин HDL [HDL-C], холестерин LDL и триглицерид [TG]), уровень глюкозы в крови натощак и HbA 1c измеряли стандартными методами. Уровни в плазме высокочувствительного С-реактивного белка (hs-CRP), интерлейкина-6 (IL-6) и фактора некроза опухоли (TNF) -α были измерены с помощью латексной нефелометрии, иммунохемилюминесцентного иммуноферментного анализа и ELISA в частном порядке. лаборатории (SRL Laboratory, Токио, Япония) соответственно.Уровень LPS-связывающего белка (LBP) в плазме измеряли с помощью набора для ELISA LBP человека (Hycult Biotech, Нидерланды).
Опросник по диетическому питанию
Оригинальный опросник по анамнезу диеты (DHQ) был разработан Sasaki et al. (22) в 1998 г., и его справедливость была подтверждена. Однако на ответ требуется около 45–60 минут. В этом исследовании мы использовали краткий тип самоуправляемого DHQ (BDHQ) (23), потому что BDHQ требует всего ∼15–20 минут, чтобы ответить. Действительность BDHQ также подтверждается, как описано ранее (23).Анкета была заполнена, когда участники посетили больницу, чтобы сдать образцы крови. Это четырехстраничная структурированная анкета для самостоятельного заполнения, в которой оцениваются пищевые привычки за предыдущий месяц. Большинство продуктов питания и напитков были выбраны из списка продуктов, которые очень часто потребляются в Японии, с использованием списка продуктов, который с некоторыми изменениями использовался в Национальном обследовании здоровья и питания Японии. В дополнение к BDHQ участники предоставили дополнительную письменную информацию о частоте употребления определенных продуктов, которые, как известно, влияют на микробиоту кишечника, таких как йогурт и пищевые добавки.
Статистический анализ
Все статистические анализы проводились с использованием пакета статистического программного обеспечения JMP, версия 10.0.2 (Институт SAS, Кэри, Северная Каролина). Данные были выражены как среднее значение ± стандартное отклонение для данных с нормальным распределением и медиана (межквартильный размах) для данных с асимметричным распределением. Для анализа данных использовался тест Манна-Уитни U . Корреляционный анализ Спирмена использовался для определения связи между количеством фекальных бактерий / органических кислот, LBP и клиническими параметрами.Степень обнаружения анализировалась с помощью теста прямой вероятности Фишера. P <0,05 считали статистически значимым.
Результаты
ИМТ и уровень глюкозы в крови натощак, HbA 1c и уровни ТГ были значительно выше в группе диабета 2 типа, чем в контрольной группе, в то время как уровни T-CHO и HDL-C были значительно ниже в группе 2. группу диабета по сравнению с контрольной группой. Кроме того, hs-CRP и IL-6 (представляющие маркеры воспаления) были значительно выше в группе диабета 2 типа, чем в контрольной группе.Не было значительных различий в возрасте и уровне TNF-α между двумя группами (Таблица 1).
Таблица 1Характеристики субъектов исследования
Расчетное общее потребление энергии согласно опроснику BDHQ составило 1,662 ± 569 и 1749 ± 521 ккал / день в группе диабета 2 типа и контрольной группе, соответственно. Отношение потребления углеводов к общему потреблению энергии составило 56,1 ± 7,9% в группе диабета и 53,9 ± 6,6% в контрольной группе, в то время как соотношение потребления жиров было 26.8 ± 5,7% и 28,6 ± 5,1% соответственно, а соотношение потребления белка составило 17,1 ± 3,5% и 17,5 ± 3,0% соответственно. Не было значительных различий в потреблении общей энергии, углеводов, жиров и белков между двумя группами. Количество участников, употреблявших йогурт не реже одного раза в неделю, было одинаковым в двух группах (группа диабета 32 участника; контрольная группа 30 участников).
Количество фекальных бактерий существенно не различалось между двумя группами (таблица 2).Однако среди облигатных анаэробов количество группы Clostridium coccoides , кластера Atopobium и Prevotella было значительно ниже ( P < 0,05), а общее количество Lactobacillus среди факультативных анаэробов было значительно ниже. выше ( P < 0,05) в группе диабета по сравнению с контрольной группой. Подгруппы Lactobacillus reuteri и Lactobacillus plantarum были особенно значительно выше ( P <0.05).
Таблица 2Сравнение количества бактерий, органических кислот и pH между контрольными субъектами и пациентами с диабетом 2 типа
Известно, что метформин и ингибиторы α-глюкозидазы влияют на желудочно-кишечную систему. Таким образом, мы исследовали разницу в микробиоте кишечника у пациентов с диабетом, принимавших и не принимавших метформин и ингибиторы α-глюкозидазы. Уровни Enterobacteriaceae (7,5 ± 0,9 [ n = 18] против 6,7 ± 1,1 log 10 клеток / г [ n = 31], P <0.05) и Staphylococcus (4,9 ± 0,9 [ n = 17] против 4,4 ± 0,9 log 10 клеток / г [ n = 30], P <0,05) были значительно выше у пациентов, получавших метформин. Уровень Bifidobacterium (9,7 ± 0,6 [ n = 9] против 9,1 ± 0,8 log 10 клеток / г [ n = 41], P <0,05), всего Lactobacillus (8,3 ± 1,1 [ n = 9] против 6,7 ± 1,4 log 10 клеток / г [ n = 41], P <0.01), Lactobacillus gasseri (7,7 ± 1,1 [ n = 9] по сравнению с 5,8 ± 1,6 log 10 клеток / г [ n = 39], P <0,01) и Enterococcus ( 7,8 ± 1,2 [ n = 9] против 6,3 ± 1,2 log 10 клеток / г [ n = 41], P <0,01) были значительно выше у пациентов, получавших ингибиторы α-глюкозидазы.
Концентрации в кале общих органических кислот ( P < 0,05), уксусной кислоты ( P < 0.01) и пропионовой кислоты ( P < 0,05) были значительно ниже в группе диабета, чем в контрольной группе (таблица 2). Концентрация изовалериановой кислоты в кале была значительно выше ( P < 0,05) в группе диабета, чем в контрольной группе, но концентрации других органических кислот в кале и значения pH существенно не различались между двумя группами. С другой стороны, не наблюдалось разницы между концентрацией органических кислот в крови в группе диабета и в контрольной группе.
Затем мы исследовали связи между различными клиническими параметрами (перечисленными в таблице 1), продуктами питания в BDHQ и фекальными бактериями с низким содержанием в группе диабета. Как показано в таблице 3, количество C. coccoides в кале отрицательно коррелировало с уровнями hs-CRP ( r = -0,387), потреблением энергии ( r = -0,332), потреблением насыщенных жирных кислот ( r = -0,313) и ИМТ ( r = -0,312). Кроме того, количество фекалий кластера Atopobium отрицательно коррелировало с уровнем hs-CRP ( r = -0.392) и ИМТ ( r = -0,321), и положительно с HDL-C ( r = 0,353). Напротив, количество Prevotella не коррелировало с клиническими параметрами или продуктами питания в BDHQ. Общее количество Lactobacillus , которое было выше в группе диабета, не коррелировало с клиническими параметрами или продуктами питания, перечисленными в BDHQ.
Таблица 3Корреляция между количеством бактерий в кале, органическими кислотами и различными клиническими параметрами у пациентов с диабетом 2 типа
В таблице 3 также обобщены ассоциации между различными клиническими параметрами, продуктами питания, перечисленными в BDHQ, и органическими кислотами в фекалиях, измененными при типе 2 пациенты с диабетом.Общее количество органических кислот в фекалиях отрицательно коррелировало с потреблением насыщенных жирных кислот ( r = -0,325) и общим потреблением жиров ( r = -0,324) и положительно с потреблением углеводов ( r = 0,281) у пациентов с диабетом 2 типа. . Уровень уксусной кислоты в кале отрицательно коррелировал с потреблением насыщенных жирных кислот ( r = -0,364), общим потреблением жиров ( r = -0,327) и продолжительностью диабета ( r = -0,301) и положительно с потреблением углеводов. ( r = 0.356). Как и уксусная кислота, уровень пропионовой кислоты в кале отрицательно коррелировал с продолжительностью диабета ( r = -0,349) и потреблением насыщенных жирных кислот ( r = -0,311). Высокий уровень изовалериановой кислоты в кале у пациентов с диабетом 2 типа не коррелировал с клиническими параметрами или продуктами питания, перечисленными в BDHQ.
В таблице 4 показана скорость обнаружения рРНК кишечных бактерий в образцах крови. Бактерии были обнаружены у 14 из 50 субъектов в группе диабета, по сравнению только с 2 из 50 субъектов в контрольной группе (28% vs.4%, P < 0,01). Частота обнаружения каждой бактерии в группе диабета 2 типа составляла 14% в группе C. coccoides , 14% в группе Atopobium , 4% в подгруппе Clostridium leptum , 2% в группе Streptococcus группе и 2% в группе Enterobacteriaceae , а уровень обнаружения в контрольной группе составил 2% в группе C. coccoides и 2% в группе Streptococcus . Количество видов бактерий, обнаруженных в образцах крови, было ограниченным, и большинство из них были грамположительными анаэробными бактериями, которые, как известно, являются частью комменсальной кишечной флоры, за исключением грамотрицательных бактерий Enterobacteriaceae .Уровни LBP в сыворотке, которые, как известно, играют роль в LPS-опосредованном воспалительном ответе (24), были значительно выше в группе диабета, чем в контрольной группе (12,1 ± 3,7 против 10,5 ± 3,0 мкг / мл, P < 0,05). Более того, в группе диабета уровень LBP показал положительную корреляцию с ИМТ ( r = 0,499, P <0,01), HbA 1c ( r = 0,356, P <0,05), hs- CRP ( r = 0,724, P <0.01), TNF- ( r = 0,313, P <0,05) и IL-6 ( r = 0,595, P <0,01).
Таблица 4Количество бактерий в образцах крови и уровни LBP
Выводы
Основными результатами настоящего исследования были дисбактериоз кишечника и наличие живых бактерий в крови японских пациентов с диабетом 2 типа. Amar et al. (17) ранее сообщали, что концентрация бактериальных генов в крови (с использованием бактериальной 16S рДНК) может предсказать начало диабета, что впервые указывает на клиническое значение микробиоты крови в развитии диабета 2 типа.Однако анализ бактериальной 16S рДНК не может различить, живы или мертвые бактерии-мишени в кишечнике и крови. По этой причине в текущем исследовании мы использовали RT-qPCR, который может обнаруживать живые бактерии как в кишечнике, так и в крови, поскольку в этом методе используются специфические праймеры, нацеленные на молекулы бактериальной РНК (18). Используя эту технологию, мы определили наличие дисбактериоза кишечника и возможную бактериальную транслокацию из кишечника в кровь у японских пациентов с диабетом 2 типа.
Недавно Larsen et al.(25) идентифицировали наличие дисбактериоза кишечника у датских пациентов с диабетом 2 типа с помощью пиросеквенирования с использованием тегов и количественной ПЦР. Кроме того, Qin et al. (26) сообщили о дисбактериозе кишечника у китайских пациентов с сахарным диабетом 2 типа в исследовании ассоциации на уровне всего метагенома. Методы, использованные в двух вышеупомянутых исследованиях, отличались от методов, использованных в нашем исследовании, и, вероятно, объясняют различия в результатах трех исследований. Однако мы подтвердили некоторые аналогичные результаты у японских пациентов с диабетом 2 типа.Кроме того, количество каловых масс в группе C. coccoides было значительно ниже у пациентов с диабетом 2 типа, что согласуется с результатами Qin et al. (26). Кроме того, общее количество Lactobacillus в кале было значительно выше у пациентов с диабетом 2 типа, что согласуется с данными, представленными Larsen et al. (25) Причина высокого количества Lactobacillus , пробиотика, в настоящее время не ясна. Поскольку наш метод не позволяет различить врожденные бактерии и бактерии, происходящие из таких продуктов, как йогурт, мы подсчитали количество участников, которые потребляли йогурт, но не обнаружили значительной разницы между двумя группами.Эти результаты предполагают, что высокое количество Lactobacillus в кале отражает высокий уровень врожденных бактерий у пациентов с диабетом 2 типа. Необходимы дальнейшие исследования для изучения роли Lactobacillus при диабете 2 типа.
Сложные углеводы, такие как пищевые волокна, метаболизируются микробиотой толстой кишки до олигосахаридов и моносахаридов и ферментируются до короткоцепочечных жирных кислот, таких как масляная кислота, уксусная кислота и пропионовая кислота (2). Масляная кислота обеспечивает энергией эпителиальные клетки толстой кишки (27).Кроме того, сообщалось, что короткоцепочечные жирные кислоты стимулируют секрецию GLP-1 через рецептор, связанный с G-белком (FFAR2) (28). Таким образом, органические кислоты, продуцируемые кишечной флорой, тесно связаны с получением энергии из рациона и гомеостазом глюкозы инкретиновым гормоном. Интересно, что в нашем исследовании концентрации в кале общей органической кислоты, уксусной кислоты и пропионовой кислоты у пациентов с диабетом 2 типа были значительно ниже, чем у контрольных субъектов, а концентрации в кале уксусной кислоты и пропионовой кислоты отрицательно коррелировали с длительность диабета.Кроме того, органические кислоты в кале способствуют элиминации Escherichia coli O -157 (29). Принимая во внимание эту роль органических кислот в кале и наши результаты, низкий уровень органических кислот в кале может быть вредным, вызывая ухудшение гликемического контроля за счет снижения секреции инкретинового гормона после еды и повышения восприимчивости к инфекции у пациентов с диабетом 2 типа (28). , 30).
Наши данные показали, что уровень общих органических кислот в кале тесно коррелирует с потреблением углеводов и отрицательно с общим потреблением жиров и насыщенных жирных кислот.Кроме того, уровни LBP в плазме были значительно выше у пациентов с диабетом 2 типа. Известно, что LBP увеличивается при ожирении и отражает уровень LPS, части стенки грамотрицательных анаэробных бактерий, и связывается с важными рецепторами распознавания структуры клеточной поверхности, называемыми Toll-подобным рецептором (TLR) -4 (31). В группе диабета уровень LBP показал положительную корреляцию с клиническими маркерами, такими как BMI, HbA 1c , hs-CRP, TNF-α и IL-6. Эти результаты частично согласуются с гипотезой Cani et al.(4,13), что диета с высоким содержанием жиров вызывает дисбактериоз кишечника и впоследствии приводит к инсулинорезистентности через LPS-зависимый механизм. В текущем исследовании, хотя высокий уровень бактерий был обнаружен в образцах крови пациентов с диабетом 2 типа, большинство обнаруженных бактерий были грамположительными анаэробными бактериями, которые, как известно, являются частью комменсальной флоры кишечника. В экспериментах на мышах пища с высоким содержанием жиров увеличивала транслокацию живых грамотрицательных бактерий через слизистую кишечника в кровь и брыжеечную жировую ткань, что, в свою очередь, было связано с воспалением слабой степени (32).В одном исследовании (17) среди бактерий, обнаруженных в крови пациентов с диабетом 2 типа,> 90% бактериальной ДНК принадлежало к филуму грамотрицательных бактерий Proteobacteria . Однако в этом исследовании мы обнаружили повышенный уровень LBP без повышенного уровня грамотрицательных бактерий из кишечника. Возможно, это связано с повышенным уровнем бактерий в других местах, например, в полости рта.
Клиническое значение грамположительной бактериальной транслокации у пациентов с диабетом 2 типа остается неизвестным.В этом отношении важно взаимодействие между липотейхоевой кислотой (LTA) и TLR-2 в продукции цитокинов. LTA, грамположительный компонент бактериальной стенки, связывается с TLR-2 (33). Недавние исследования (34,35) показали, что LTA усиливает экспрессию IL-6 в различных клетках, а наше исследование продемонстрировало наличие высоких уровней IL-6 у пациентов с диабетом 2 типа. Вместе взятые, необходимы дальнейшие исследования для определения значимости транслокации грамположительных бактерий в системном воспалении, выявленном у пациентов с ожирением и диабетом 2 типа.
Текущее исследование имеет определенные ограничения. Во-первых, у контрольных субъектов не проводился пероральный тест на толерантность к глюкозе, чтобы полностью исключить наличие диабета. Следовательно, контрольные субъекты в нашем исследовании нельзя с уверенностью отнести к контрольным субъектам, не страдающим диабетом. Однако уровни HbA 1c у всех испытуемых не превышали 6,0% (42 ммоль / моль). Во-вторых, мы не смогли подтвердить причинно-следственную связь между дисбиозом кишечника и бактериальной транслокацией, потому что наше исследование было кросс-секционным по дизайну.В-третьих, поскольку пациенты с диабетом 2 типа имели избыточный вес или страдали ожирением, нельзя исключать, что дисбактериоз кишечника и бактериальная транслокация были вызваны ожирением. В связи с этим мы разделили пациентов с диабетом на две группы: группу с ожирением (ИМТ ≥25 кг / м 2 ) и группу без ожирения (ИМТ <25 кг / м 2 ). Не было значительных различий в частоте обнаружения бактерий крови. Эти данные подтверждают идею о том, что ожирение не было основной причиной различий. В-четвертых, в нашем исследовании была небольшая выборка.
Хотя эти ограничения следует принимать во внимание, наши результаты могут дать новое понимание патофизиологических механизмов диабета 2 типа. Необходимы дальнейшие крупномасштабные исследования микробиоты кишечника и крови у японских пациентов с диабетом 2 типа.
В заключение, наши результаты продемонстрировали дисбактериоз кишечника и возможную бактериальную транслокацию крови у пациентов с диабетом 2 типа. Следующим шагом в этом протоколе исследования является проведение интервенционных исследований, чтобы выяснить, может ли улучшение дисбактериоза кишечника путем изменения образа жизни или введения пробиотиков снизить уровни маркеров кровообращения и скорость бактериальной транслокации с улучшением гликемического контроля.
Информация о статье
Благодарности. Авторы благодарят Норикацу Юки, Акиру Такахаши и Юкико Кадо из Центрального института микробиологических исследований Якульт, которые помогли с анализом собранных образцов. Авторы также благодарят Джо Мацуока, биостатиста из Центра клинических исследований Высшей школы медицины Университета Джунтендо, который дал советы по статистическому анализу.
Двойственность интересов. А.К. получил гонорары за лекции от Kissei Pharma, Sanofi и Takeda Pharmaceutical Co.Ю.Т. получил гонорары за лекции от Takeda Pharmaceutical Co., MSD, Boehringer Ingelheim, Sanofi, Eli Lilly, Novartis Pharmaceuticals и Kissei Pharma. Т. получил гонорары за лекции от MSD, Takeda Pharmaceutical Co. и Eli Lilly. Ю.Ф. получил гонорары за лекции от Novartis Pharmaceuticals и Eli Lilly и исследовательские фонды от Novartis Pharmaceuticals, MSD и Takeda Pharmaceutical Co. T.H. получил гонорары за лекции от MSD, Eli Lilly, Takeda Pharmaceutical Co., Novartis Pharmaceuticals, Dainippon Sumitomo, Novo Nordisk Pharma, Sanofi и Daiichi Sankyo, а также получил средства на исследования от MSD, Eli Lilly, Takeda Pharmaceutical Co., Kowa, Mochida, Sanwakagaku, Novo Nordisk Pharma, Kissei Pharma, Novartis, Boehringer Ingelheim, Tanabe Mitsubishi, Dainippon Sumitomo, Telmo, Sanofi Aventis, Roche, Ono и Daiichi Sankyo. С.Н. и Ю.Ю. получили средства на исследования от Yakult Honsha Co. Ltd. H.W. получил гонорары за лекции от Boehringer Ingelheim, Sanofi, Ono Pharmaceutical Co., Novo Nordisk Pharma, Novartis Pharmaceuticals, Eli Lilly, Sanwakagaku Kenkyusho, Daiichi Sankyo Inc., Takeda Pharmaceutical Co., MSD, Dainippon Sumitomo Pharmaceuticals и Kowa Co.и фонды исследований от Boehringer Ingelheim, Pfizer, Mochida Pharmaceutical Co., Sanofi, Novo Nordisk Pharma, Novartis Pharmaceuticals, Sanwakagaku Kenkyusho, Terumo Corporation, Eli Lilly, Mitsubishi Tanabe Pharma, Daiichi Sankyo Inc., Takeda Pharmaceutical Co., MSD, Shionogi. , Dainippon Sumitomo Pharma, Kissei Pharma и AstraZeneca. О других потенциальных конфликтах интересов, относящихся к этой статье, не сообщалось.
Авторские взносы. J.S. и А.К. исследовал данные, участвовал в сборе данных, анализировал данные, участвовал в обсуждении, а также написал и отредактировал рукопись.F.I., T.Y., H.G., H.A., K.K., M.K., T.S., T.O., Y.T., Y.S., R.Y., T.M., Y.F. и H.F. участвовали в сборе данных и внесли свой вклад в обсуждение. К.Н., Т.Т. и Т.А. разработал исследование, проанализировал данные и отредактировал рукопись. T.H. разработал исследование и внес свой вклад в обсуждение. С.Н. участвовал в обсуждении. Ю.Ю. разработал исследование, участвовал в обсуждении и отредактировал рукопись. H.W. исследовал данные, участвовал в сборе данных, участвовал в обсуждении и редактировал рукопись.А.К. является гарантом этой работы и, как таковой, имеет полный доступ ко всем данным в исследовании и берет на себя ответственность за целостность данных и точность анализа данных.
Предварительная презентация. Части этого исследования были представлены в виде тезисов на 73-й научной сессии Американской диабетической ассоциации, Чикаго, Иллинойс, 21–25 июня 2013 г.
- Получено 2 декабря 2013 г.
- Принято 28 марта 2014 г.
- © 2014 Американская диабетическая ассоциация.Читатели могут использовать эту статью при условии, что произведение правильно процитировано, используется в образовательных целях, а не для получения прибыли, и если работа не изменена.
Дисбактериоз кишечника у детей с синдромом короткой кишки связан с нарушением исхода | Microbiome
Предпосылки
Детская кишечная недостаточность (IF) определяется как неспособность желудочно-кишечного тракта поддерживать адекватный рост, гидратацию и гомеостаз электролитов у детей без парентерального питания (PN).Синдром короткой кишки (SBS) – наиболее частая причина детской IF. Состояние вызвано массивной резекцией тонкой кишки из-за некротического энтероколита (НЭК) или заворота, а также врожденных пороков развития, таких как гастрошизис и атрезия тощей кишки. СБС новорожденных – заболевание с высокой заболеваемостью и смертностью [1]. Медицинское руководство SBS направлено на обеспечение полного энтерального / перорального кормления и отлучение от PN.
Кишечная микробиота, по-видимому, является основным фактором в определении успешного клинического исхода SBS, определяемого как независимость от лечения PN и кишечной адаптации.Изменения в микробиоте могут привести к серьезным осложнениям, таким как избыточный бактериальный рост в тонкой кишке (SBBO) и воспаление слизистой оболочки кишечника, что может предотвратить отлучение от ПП за счет нарушения абсорбционных функций кишечника [2,3]. При SBBO у детей рекомендовано длительное лечение люминальными / пероральными антибиотиками [4,5]. Большинство случаев SBS возникает у новорожденных в период, когда стерильный кишечник в норме заселен бактериями, достигая микробного профиля, характерного для желудочно-кишечного тракта взрослых, примерно в возрасте от 2 до 4 лет [6].Нарушение сбалансированного микробного сообщества кишечника, то есть дисбактериоз, с повышенным относительным содержанием факультативных анаэробных Enterobacteriaceae в толстой кишке, наблюдается при воспалительном заболевании кишечника (ВЗК) на моделях мышей, у людей с болезнью Крона и у людей. НЭК у недоношенных детей [7,8].
На сегодняшний день нет сообщений о картировании кишечной микробиоты у детей с SBS. Здесь мы представляем первый отчет о микробном профиле у детей с SBS с использованием секвенирования гена 16S рРНК на платформе Illumina MiSeq.
Методы
Пациенты
Это исследование было одобрено региональным комитетом по этике медицинских исследований в Упсале (Dnr2012 / 002). Информированное письменное согласие на сбор образцов и последующие анализы было получено от родителей. Характеристики исследуемой группы и соответствующих здоровых братьев и сестер представлены в таблице 1. В исследование включены 11 детей в возрасте от 1,5 до 7 лет с диагнозом IF / SBS в неонатальном периоде, из которых двое относятся к группе тройняшек (2A и 3А) (таблица 1).Все дети, кроме одного, родились недоношенными. Ребенку 1А, 8А и 13А была проведена процедура удлинения кишечника с серийной поперечной энтеропластикой (STEP) [9]. Пятеро детей не были отлучены от ПП на момент исследования. Семь здоровых братьев и сестер служили контролем. Дети, получавшие ПП, получали пероральный и / или энтеральный прием смеси безлактозного гидролизованного белка и соответствующее возрасту потребление твердой пищи со снижением содержания дисахаридов в соответствии с таблицей 1.
Таблица 1 Характеристики исследуемой группы и соответствующих здоровых братьев и сестерСбор данных и статистический анализ
Образцы фекалий собирали и хранили при -80 ° C до анализа.ДНК экстрагировали из каждого образца фекалий с помощью набора для выделения ультрачистой фекальной ДНК (MoBio, Naxo Ltd, Тарту, Эстония) в соответствии с инструкциями производителя.
Библиотеки секвенированияполучали путем амплификации области V3-V4 гена 16S рРНК с использованием праймеров 341f-805r, описанных Hugerth et al . [10]. После начальной амплификации была проведена вторая ПЦР для присоединения адаптеров Illumina, а также штрих-кодов, которые позволяют мультиплексировать. Образцы были секвенированы с использованием IlluminaMiSeq, что дало в общей сложности 10 136 440 считываний 2 × 300 пар оснований со средним значением 307 165 считываний на образец.Последовательности праймеров были обрезаны, а считывания парных концов, произведенные инструментом для секвенирования, были объединены с использованием SeqPrep версии 1.1 (https://github.com/jstjohn/SeqPrep) с параметрами по умолчанию и затем обработаны с помощью конвейера QIIME 1.8.0 ( Количественное понимание микробной экологии) [11]. Объединенные чтения были случайным образом разбиты на подвыборку до равной глубины 151 610 считываний на выборку, что было минимальным числом считываний среди выборок. Используя алгоритм UCLUST [12], встроенный в конвейер QIIME, последовательности были сгруппированы с 97% идентичностью по справочной базе данных Greengenes, что дало 4216 OTU (операционных таксономических единиц) [11].Для каждого образца; количество не-одноэлементных OTU, а также наиболее доминирующих OTU с соответствующим описанием представлено в дополнительных данных (Дополнительный файл 1). Индексы разнообразия Шеннона были рассчитаны для детей с SBS, получавших и не принимавших PN, и проверены на значимость с помощью критерия суммы рангов Вилкоксона. Используя конвейер QIIME, были получены невзвешенные расстояния UniFrac, которые использовались для исследования бета-разнообразия путем построения координат PCA. Подробные сведения о праймерах гена 16S рРНК, условиях амплификации и штрих-кодах образцов показаны в дополнительных данных (дополнительный файл 2).
Результаты
На рисунке 1 показано, что индекс разнообразия Шеннона значительно снижен у детей с SBS, все еще получающих PN, по сравнению с детьми, отлученными от PN. Ни у одного из детей, получавших ПП, не осталось ICV.
Рисунок 1Индекс разнообразия Шеннона у детей с SBS, все еще получающих PN, по сравнению с детьми, отлученными от PN.
У детей, все еще получающих PN, четверо из пяти (1A, 3A, 8A и 9A) были обследованы на предмет нескольких эпизодов подозрения на SBBO, также во время взятия пробы кала (Таблица 1).Их лечили пероральным метронидазолом, триметоприм-сульфаметоксазолом, гентамицином или амоксициллин-клавулановой кислотой. У этих пациентов Enterobacteriacae были наиболее многочисленным таксономическим семейством и полностью доминировали в микробном сообществе этих детей (рис. 2). У оставшегося пациента в этой группе (12A), все еще принимавшего PN и с пониженным индексом разнообразия Шеннона, было обнаружено относительное преобладание Lactobacillaceae , за которым следовали Enterobacteriacae. В целом, высокая относительная численность Enterobacteriacae была связана с SBS у 6 из 11 пациентов (1A, 3A, 8A, 9A, 11A и 12A). У оставшихся пяти пациентов с SBS, все без PN (2A, 4A, 13A, 16A и 18A), наблюдался более разнообразный состав микробиоты и более равномерное распределение таксономических семейств. Однако ни один из детей SBS, кроме одного (2А), не достиг показателей разнообразия Шеннона на том же уровне, что и контрольная группа (таблица 1). У одного из детей, все еще получающих PN (1A), верхняя и нижняя эндоскопия с биопсией выявила макроскопическое и гистопатологическое острое воспаление в желудке, двенадцатиперстной кишке, тонкой кишке и проксимальном отделе толстой кишки.У ребенка 3А, также получавшего ПП, верхняя эндоскопия с биопсией показала атрофию ворсинок тонкой кишки.
Рисунок 2Микробные сообщества у детей с SBS, получавших PN (1A, 3A, 8A, 9A, 12A), детей с SBS, отлученных от PN (2A, 4A, 11A, 13A, 16A, 18A) и братьев и сестер (2C1, 2C2, 11C1, 11C2, 12C, 13C1, 13C2). На рисунке показана относительная численность 19 наиболее распространенных таксономических семейств, на которую приходится не менее 84% численности во всех выборках.
На рисунке 3 представлены индексы разнообразия Шеннона, а на рисунке 4 – невзвешенные расстояния UniFrac у детей с SBS на PN (1A, 3A, 8A, 9A, 12A), дети SBS, отлученные от PN (2A, 4A, 11A, 13A). , 16A, 18A) и братьев и сестер (2C1, 2C2, 11C1, 11C2, 12C, 13C1, 13C2).
Рисунок 3Индекс разнообразия Шеннона у детей с SBS, получавших PN (1A, 3A, 8A, 9A, 12A), детей с SBS, отлученных от PN (2A, 4A, 11A, 13A, 16A, 18A) и братьев и сестер (2C1 , 2C2, 11C1, 11C2, 12C, 13C1, 13C2).
Рис. 4График PCoA, описывающий невзвешенное расстояние UniFrac между образцами. Попарные расстояния между всеми образцами проецируются на двумерное пространство, где ось PC1 описывает наивысшую степень вариации. Таким образом, считается, что образцы, которые сгруппированы близко друг к другу, имеют большую долю филогенетического дерева по сравнению с образцами, которые более разделены.
У нас была уникальная возможность изучить тройню, представляющую все три группы. Ребенок 2А и ребенок 3А были тройняшками мужского пола, рожденными на 23 неделе беременности. Оба мальчика в неонатальном периоде перенесли НЭК, что привело к резекции тонкой кишки (таблица 1). Третий тройняшек (2С2) остался здоровым. У ребенка 2А было резецировано только 2 см тонкой кишки, однако после обширной НЭК у него развился ИФ, и он стал зависимым от ПП. Во время лечения ПН у него не было признаков СББО. Его приучили к полноценному пероральному вскармливанию и без антибиотиков за 3 месяца до забора фекалий.Его кишечное бактериальное разнообразие было таким же, как у его здорового брата (SDI 4, 67 и 4, 97, соответственно).
Ребенок 12A лечился антибиотиками только в течение первых 2 недель постнатального периода, у него не было признаков SBBO, и отлучение от PN продвигалось, но медленно. В соответствии с нашими предыдущими результатами, ее фекальное бактериальное разнообразие показало, что Lactobacillacae являются наиболее относительно многочисленным таксономическим семейством (рис. 2) [13]. Мы смогли обнаружить Clostridium difficile у двух из десяти пациентов с SBS (пациенты 2A и 11A) и в очень низкой относительной численности (данные не показаны).
Выводы
Тенденция SBBO и воспаления кишечника к задержке или предотвращению отлучения от PN у этих детей с SBS, по-видимому, связана с микробным дисбиозом в кишечном тракте. Этот результат согласуется с предыдущим исследованием, показывающим, что введение PN независимо связано с SBBO [14]. Влияние PN на изменение профиля из-за голодания микробиома маловероятно, поскольку нарушение всасывания при пероральном / энтеральном питании является основной проблемой при SBS.В целом наблюдаемые изменения микробиоты у детей с SBS, скорее всего, являются как причиной, так и следствием болезненного статуса ребенка. Ограничением исследования является небольшая исследовательская группа, и смешанные факторы, которые могут повлиять на результаты, – это возраст, длина кишечника и лечение антибиотиками. Тем не менее, когорта в настоящем исследовании представляет детей с SBS в клинической практике.
В нашем центре мы лечим SBBO пероральными антибиотиками в соответствии с рекомендациями других центров [4-6].Однако наиболее вероятно, что антибиотики в дальнейшем будут способствовать развитию дисбактериоза у этих детей. У детей с SBS нормальная колонизация нарушается из-за раннего и частого использования антибиотиков, а уменьшение бактериального разнообразия позволяет потенциальным патогенным бактериям расширяться. Было высказано предположение, что антибиотики снижают резистентность к колонизации против Enterobacteriacae , таких как Escherichia coli и Salmonella enterica , за счет повышения воспалительного тонуса слизистой оболочки кишечника [15].Чаще всего пробиотики используются для изменения кишечной микробиоты при SBS; однако существуют противоречивые данные и сообщения о пробиотической септицемии [16].
Общее снижение бактериального разнообразия у наших детей с SBS согласуется с дисбактериозом кишечника у пациентов с IBD, младенцев с NEC, а также было описано в модели SBS у поросят [7,8,17,18]. Кроме того, у детей с рецидивирующей диареей, ассоциированной с C. difficile-, наблюдается снижение калового разнообразия с уменьшением на Bacteriodetes и Firmicutes [19].У этих детей успешность трансплантации фекальной микробиоты (FMT) превышает 90%. Такое лечение также успешно использовалось в качестве дополнения к лечению ВЗК [19,20]. Следовательно, FMT может оказаться альтернативой лечения в тщательно отобранных случаях SBS с дисбактериозом. Однако, поскольку дети с SBS часто уязвимы из-за своего первоначального состояния здоровья, необходимо учитывать трудности и риски FMT. Хотя случаи серьезных побочных эффектов редки, одним из таких рисков является заражение донором, когда бессимптомные микроорганизмы, не вызывающие проблем у здорового донора, могут вызвать реакцию у реципиента.Кроме того, массовое появление новой микробиоты может также вызвать аутоиммунное заболевание, а также развитие бактерий и септический шок. Также следует проявлять особую осторожность при приеме FMT, если у пациента есть какие-либо признаки иммунодефицита [21].
Это первый отчет, описывающий микробный профиль кишечника у детей с SBS с использованием секвенирования следующего поколения. Мы наблюдали выраженный микробный дисбактериоз у детей с SBS, все еще получающих PN, по сравнению с детьми, отлученными от PN с повышенным относительным количеством протеобактерий, большинство из которых длительное время лечились антибиотиками.Наши результаты показывают, что дисбактериоз кишечника у детей с SBS связан с ухудшением исхода с длительной зависимостью от PN. В будущих исследованиях необходимо найти новые стратегии лечения дисбактериоза кишечника у этих детей.
Дисбактериоз кишечника | Справка врача
Пребиотики – это субстраты, которые избирательно используются микроорганизмами-хозяевами и могут принести пользу здоровью хозяина. 19 Они представляют собой неперевариваемые, ферментируемые или неферментируемые волокна, в основном растительные волокна (например, инулин, некрахмальные полисахариды, дисахариды, олигосахариды, полисахариды).Пребиотики ферментируются микробиотой толстой кишки до метаболитов (например, короткоцепочечных жирных кислот), 20 , которые поддерживают здоровье с помощью ряда различных механизмов (например, обладая противовоспалительными свойствами, снижая pH кишечника для предотвращения роста патогенных микробов). 21-23 Растворимые пищевые волокна (например, псиллиум, целлюлоза, пектин) обладают водосвязывающими свойствами, улучшая консистенцию фекалий, увеличивая толщину слоев кишечной слизи и оказывая благотворное влияние на пролиферацию эпителиальных клеток.Также было показано, что псиллиум обладает свойствами связывания желчных кислот 24 и может оказывать благоприятное воздействие на пациентов с секреторной диареей из-за мальабсорбции желчных кислот. Большинство коммерчески доступных диет для желудочно-кишечного тракта содержат большое количество клетчатки, и несколько исследований показали улучшение показателей кала после приема клетчатки. 25,26
Пробиотики – это живые микроорганизмы, вводимые перорально, которые при введении в адекватных количествах приносят пользу здоровью хозяина. 27 Пробиотики не вызывают серьезных изменений в резидентной микробиоте, но имеют штамм-специфические механизмы действия (например, ингибирование патогенной инвазии, 28,29 модулирование иммунной системы хозяина, усиление барьерной функции кишечника). 30 Пробиотик следует выбирать на основе доказанной эффективности в научных исследованиях. Некоторые коммерчески доступные пробиотики показали положительный терапевтический эффект при различных заболеваниях желудочно-кишечного тракта у животных. Например, исследования показали повышенную регуляцию белков плотного соединения кишечника в эпителиальном барьере у собак с воспалительным заболеванием кишечника, более плотный характер стула у кошек из приютов с неосложненной диареей, 31 и снижение содержания энтеротоксигенных Clostridium perfringens в кале и ускоренную нормализацию кишечника.

 Это клиническая совокупность нарушений в макроорганизме (то есть в человеке), вызванные изменением количественных соотношений, состава и свойств микрофлоры. Дисбактериоз определяется, по сути, по результату анализа — посева кала на известные и возможные для исследования микроорганизмы толстого кишечника. В последнее время чаще говорят о дисбиозе, это нарушение функционирования и механизмов взаимодействия организма человека, его микрофлоры и окружающей среды. Почему это важно? Согласно результатам последних исследований, микрофлора заселяет практически все поверхности, все слизистые оболочки и полости тела. Конечно, большая часть живет в толстом и тонком кишечнике, но при этом 80–90% не культивируются (то есть невозможно вырастить и изучить) вне тела человека, и как следствие, о них мы практически ничего не знаем. На одну клетку человека приходится примерно 10 микробных, причем вся микрофлора несет в 150 раз больше генетической информации, чем человек. Представьте: на одну единицу «человек-информации» приходится 150 единиц «микробы-информации»! Только в таком соотношении мы можем функционировать, полноценно жить.
Это клиническая совокупность нарушений в макроорганизме (то есть в человеке), вызванные изменением количественных соотношений, состава и свойств микрофлоры. Дисбактериоз определяется, по сути, по результату анализа — посева кала на известные и возможные для исследования микроорганизмы толстого кишечника. В последнее время чаще говорят о дисбиозе, это нарушение функционирования и механизмов взаимодействия организма человека, его микрофлоры и окружающей среды. Почему это важно? Согласно результатам последних исследований, микрофлора заселяет практически все поверхности, все слизистые оболочки и полости тела. Конечно, большая часть живет в толстом и тонком кишечнике, но при этом 80–90% не культивируются (то есть невозможно вырастить и изучить) вне тела человека, и как следствие, о них мы практически ничего не знаем. На одну клетку человека приходится примерно 10 микробных, причем вся микрофлора несет в 150 раз больше генетической информации, чем человек. Представьте: на одну единицу «человек-информации» приходится 150 единиц «микробы-информации»! Только в таком соотношении мы можем функционировать, полноценно жить. Как известно, у человека 4 группы крови, точно так выделены 3 энтеротипа микробиоценоза человека. Каждому человеку в рамках своего энтеротипа присуща своя микробная ассоциация. Энтеротип неизменен, но количество и качество поддерживающих бактерий зависит от питания, заболеваний, использования лекарств, окружающей среды.
Как известно, у человека 4 группы крови, точно так выделены 3 энтеротипа микробиоценоза человека. Каждому человеку в рамках своего энтеротипа присуща своя микробная ассоциация. Энтеротип неизменен, но количество и качество поддерживающих бактерий зависит от питания, заболеваний, использования лекарств, окружающей среды.
 Не зря 20% поступающих пищевых ингредиентов и 10% вырабатываемой организмом энергии идет на поддержание нашей микрофлоры.
Не зря 20% поступающих пищевых ингредиентов и 10% вырабатываемой организмом энергии идет на поддержание нашей микрофлоры.
 До 3 месяцев идет активное заселение кишечника, микрофлора меняется каждый день, анализ будет готов через 7–10 дней, значит, говорит о прошлом состоянии, не о сегодняшнем. Можно по нему назначать какое-либо лечение? Нет, поэтому до 3 месяцев не рекомендуют проводить это исследование. Но после 3 месяцев микрофлора становится более или менее постоянной, и если исследование проводилось не один, а 2–3 раза, то можно более уверенно говорить об устойчивом нахождении каких-либо «нежелательных» нам бактерий.
До 3 месяцев идет активное заселение кишечника, микрофлора меняется каждый день, анализ будет готов через 7–10 дней, значит, говорит о прошлом состоянии, не о сегодняшнем. Можно по нему назначать какое-либо лечение? Нет, поэтому до 3 месяцев не рекомендуют проводить это исследование. Но после 3 месяцев микрофлора становится более или менее постоянной, и если исследование проводилось не один, а 2–3 раза, то можно более уверенно говорить об устойчивом нахождении каких-либо «нежелательных» нам бактерий.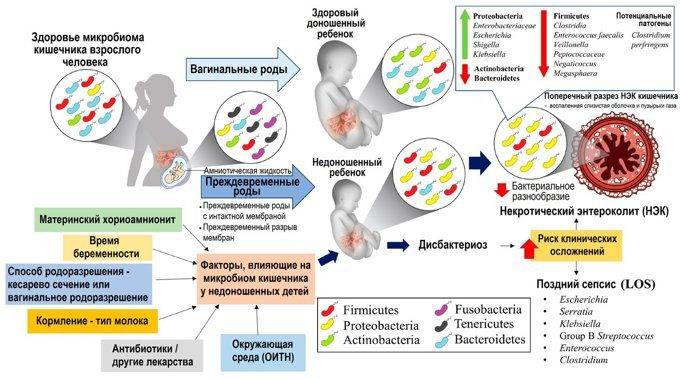
 Если мы хотим жить долго и здорово, мы должны заботиться о них. Лечение — это одно, а постоянное поддержание здоровья — это другое. Нет никакой волшебной таблетки, никаким однократным курсом лечения с дисбиозом не справиться! Курсы биопрепаратов (разные, в разное время, разные детям и взрослым), рациональное питание, иногда в помощь лекарственные препараты, и всё — только по рекомендации врача!
Если мы хотим жить долго и здорово, мы должны заботиться о них. Лечение — это одно, а постоянное поддержание здоровья — это другое. Нет никакой волшебной таблетки, никаким однократным курсом лечения с дисбиозом не справиться! Курсы биопрепаратов (разные, в разное время, разные детям и взрослым), рациональное питание, иногда в помощь лекарственные препараты, и всё — только по рекомендации врача!
 После возвращения к обычному образу питанию баланс микрофлоры восстанавливается и симптоматика исчезает.
После возвращения к обычному образу питанию баланс микрофлоры восстанавливается и симптоматика исчезает.