Кровь на брюшной тиф: как сдается, как подготовиться, сколько стоит и где можно сдать?
Сдать анализ на брюшной тиф
Метод определения РПГА с применением комплексного сальмонеллёзного, Vi- и O9 – группового сальмонеллёзного диагностикума с обработкой унитиолом в одной из реакций.
Исследуемый материал Сыворотка крови
Доступен выезд на дом
Онлайн-регистрация Серологический тест, использующийся в диагностике брюшного тифа. Брюшной тиф – тяжёлое системное инфекционное заболевание, характеризующееся длительной нарастающей лихорадкой, болезненностью живота, потерей аппетита, явлениями общей интоксикации, устойчивой бактериемией.
 Рецидивы брюшного тифа с возобновлением симптоматики после улучшения состояния возможны (8 – 12%). От 2 до 5% переболевших становятся хроническими носителями. Клиническая диагностика брюшного тифа может быть затруднена. Безусловным лабораторным подтверждением диагноза служит выделение брюшнотифозных бацилл при серийных посевах крови (начиная с первой недели болезни) или кала – на второй неделе (см. тест №.457). Выявляемость возбудителя микробиологическими методами зависит от концентрации возбудителя в материале и влияния терапии антибиотиками. Ко второй неделе становятся положительными результаты серологических агглютинационных тестов, к числу которых относится и РПГА-тест на антитела к S. typhi. Серологические тесты уступают по специфичности бактериологическим методам, поскольку положительная реакция в них может быть обусловлена перенесённой ранее инфекцией и в некоторых случаях – перекрёстными реакциями с другими видами сальмонелл. Информативным является повторное исследование с интервалом 5 дней для наблюдения роста титров, которым характеризуется острая инфекция.
Рецидивы брюшного тифа с возобновлением симптоматики после улучшения состояния возможны (8 – 12%). От 2 до 5% переболевших становятся хроническими носителями. Клиническая диагностика брюшного тифа может быть затруднена. Безусловным лабораторным подтверждением диагноза служит выделение брюшнотифозных бацилл при серийных посевах крови (начиная с первой недели болезни) или кала – на второй неделе (см. тест №.457). Выявляемость возбудителя микробиологическими методами зависит от концентрации возбудителя в материале и влияния терапии антибиотиками. Ко второй неделе становятся положительными результаты серологических агглютинационных тестов, к числу которых относится и РПГА-тест на антитела к S. typhi. Серологические тесты уступают по специфичности бактериологическим методам, поскольку положительная реакция в них может быть обусловлена перенесённой ранее инфекцией и в некоторых случаях – перекрёстными реакциями с другими видами сальмонелл. Информативным является повторное исследование с интервалом 5 дней для наблюдения роста титров, которым характеризуется острая инфекция.
Литература
- World Health Organization: Background document: the diagnosis, treatment, and prevention of typhoid fever. Geneva, Switzerland: 2003.
- http://www.who.int/vaccines-documents/DocsPDF03/www740.pdf
- Инфекционные болезни у детей. Ред. Д. Марри. М. Практика, 2006. 928 с.
- Нормативные документы МЗ.
Серологические исследования – анализы на брюшной тиф, бруцеллёз и краснуху
directions
Серология – наука, изучающая свойства сыворотки крови. Говоря о серологии, чаще всего подразумевают, что это раздел иммунологии, изучающий то, как взаимодействуют антитела сыворотки с антигенами. Серологические исследования представляют собой базовый анализ крови. По нему можно распознать наличие вирусных, инфекционных и микробных заболеваний, в том числе и болезней, возникновение которых обусловлено нарушениями иммунной системы человека.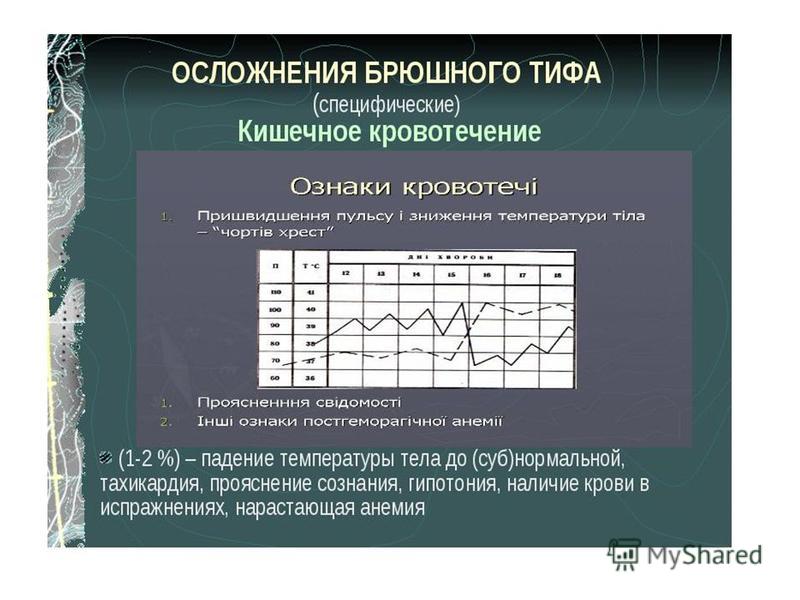
Врачи-специалисты
Медицинская сестра
Медицинская сестра эндоскопического кабинета
Врач-терапевт
Результат в течение 25 минут, с момента сдачи биоматериала
Наши клиники в Санкт-Петербурге
Медицентр Юго-ЗападПр.
 Маршала Жукова 28к2
Маршала Жукова 28к2Кировский район
- Автово
- Проспект Ветеранов
- Ленинский проспект
Получить подробную информацию и записаться на прием Вы можете по телефону +7 (812) 640-55-25
Серологическое исследование – это информативный показатель для установления причины возникновения болезни легионеров, атипичных пневмоний, миокардитов, вирусных гепатитов (например, гепатит Е). Они имеют огромное значение в постановке точного диагноза при возникновении аутоиммунных заболеваний, при беременности. По ним можно судить о наличии TORCH- инфекций, сифилиса и других заболеваний, передающихся половым путём.
По ним можно судить о наличии TORCH- инфекций, сифилиса и других заболеваний, передающихся половым путём.
Какие исследования проводятся у нас?
Брюшной тиф – тяжёлая острая кишечная инфекция, при которой происходит поражение лимфатической системы нижнего отдела тонкой кишки. Симптомы возникновения заболевания: слабость, бледность кожи, снижение аппетита, запоры, высокая температура, характерная бледно-розовая сыпь. После прохождения лечения болезнь может снова атаковать человека, так как носит циклический характер.
Бруцеллёз – инфекция, попадающая в организм человека через больных животных. Поражает множество органов и систем человеческого организма. Симптомы: упадок сил и слабость, боль в костях, высокая температура тела, усиленная потливость, боли в животе, нарушение сна.
Краснуха
– вирусное заболевание, в основном возникающее у детей. Оно является очень опасным во время беременности. При заражении краснухой могут возникнуть серьёзные врождённые пороки. У плода поражается сердечно-сосудистая система, глаза и слух.Как сдать анализ?
Никакой специальной подготовки к проведению анализа не требуется. Взятие крови происходит из вены, натощак.
Методы серологических исследований:
- Реакция непрямой гемагглютинации. При попадании антигена в кровь эритроциты способны концентрировать его на своей поверхности и затем склеиваться, образуя осадок. Это происходит при взаимодействии со специфическими антителами. Данный метод исследования очень информативен и в некоторых случаях используется для подтверждения результатов ИФА.
- Реакция иммунофлюоресценции является непрямым вариантом исследования и проводится в несколько этапов. Сначала выявляют необходимое антитело в комплексе антиген.

- Иммуноферментный анализ(ИФА) основан на своеобразном взаимодействии антигена с антителом. Обязательным условием проведения исследования является закрепление антитела или антигена на твёрдых планшетах. После этого при помощи специальной ферментной метки обнаруживаются комплексы антиген. ИФА имеет несколько преимуществ перед другими серологическими методами исследования:
- высокая чувствительность реакции;
- универсальные реагенты;
- автоматизированный учёт результатов реакции.
Оценка результатов происходит с помощью специальных измерительных приборов.
1328,1345,1274,820,1262,845
Вахтин Дмитрий Сергеевич 12. 03.2021
15:43
03.2021
15:43 medi-center.ru
Мучился с ангинами и с простудами каждый месяц, пил антибиотики которые давали временный эффект, попал на приём к ЛОРу в Медицентр на Поликарпова Аиде Фаталиевне , которая направила на анализы и поставила правильный диагноз, хронический тонзиллит, миндалины пришлось удалить, живу полгода и радуюсь жизни, за полгода никаких ангин, первый раз за зиму не заболел простудой
Смерткин Алексей Сергеевич 11.02.2021 19:40medi-center.ru
Хочу выразить благодарность врачу Саранчину Александру за качественный осмотр и рекомендации в лечении. Успехов Вам, Александр и профессионально развития.
Жданова Анна Михайловна 25. 11.2020
14:32
11.2020
14:32 medi-center.ru
Хочу выразить огромную благодарность врачу терапевту Дерешовскому Александру Сергеевичу. На 28 неделе беременности не обошла стороной и нас эта зараза под названием COVID-19. В день вызова врача пришёл Александр Сергеевич, посмотрел, послушал, взял мазки на ковид, назначил грамотное лечение. И самое главное всегда со мной был на связи, и утром , и днём, и вечером. Зараза отступила. Спасибо Вам, Александр Сергеевич, за Ваш труд в столь не простое для всех время. Здоровья Вам и Вашим близким!????
Ефремова Елена 07.11.2020 17:21medi-center.ru
Сердечно благодарим доктора Попову К. Е. за высокий профессионализм, внимательность и отзывчивость при домашнем визите и рекомендациях по лечению. Спасибо Вам большое!
Е. за высокий профессионализм, внимательность и отзывчивость при домашнем визите и рекомендациях по лечению. Спасибо Вам большое!
добрый день! хочу сердечно поблагодарить гастроэнтеролога Банникову Татьяну Петровну за профессиональный прием. Я обратилась с болью, думая, что у меня проблемы с желчным пузырем, даже принимала соотвествующие лекарства, но после опроса симптоматики и осмотра мне был поставлен другой диагноз и назначено соотвествующее лечение. Очень чуткий и внимательный доктор! Спасибо! Ваше имя: Валентина. Дата события: 25 апреля Специализация врача: Гастроэнтеролог Банникова Т.П. Обследование: первичный прием с жалобами на боль в боку.
Хотелось бы поблагодарить клинику МедиЦентр на Маршала Жукова 28.Все очень вежливые.
Была 12.01.2020г
В особенности благодарю врача гениколога Ашота Оганисян
Провел беседу, осмотор на кресле, и УЗИ. К моей проблеме отнёсся ответственно.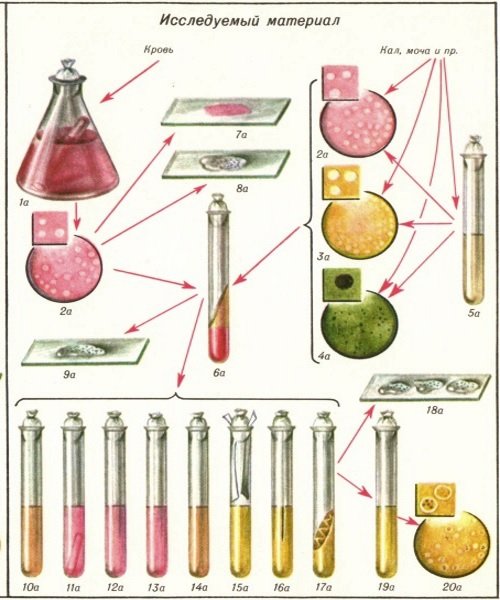 Хороший врач. Спасибо, буду обращаться.
Целикова Ольга
Хороший врач. Спасибо, буду обращаться.
Целикова Ольга
Брюшной тиф (антитела к Salmonella typhi (РПГА-тест)
Брюшной тиф – острое инфекционное заболевание с циклическим течением с фекально-оральным механизмом передачи. Инкубационный период длится в среднем 9-14 дней. Выраженность клинических проявлений инфекции варьирует, характеризуется поражением кишечника и лимфатических узлов, бактериемией, выраженной интоксикацией, увеличением печени и селезёнки, розеолёзной сыпью. При отсутствии лечения заболевание потенциально опасно для жизни в связи с возможностью развития ряда осложнений, включая кишечное кровотечение или перфорацию кишки вследствие некроза пейеровой бляшки.
Возбудитель брюшного тифа – Salmonella typhi (S. typhi), грамотрицательная подвижная палочка рода Salmonella семейства Enterobacteriaceae
Источник инфекции – больной человек или бактерионоситель. Бактерия начинает выделяться с калом с первых дней заболевания. С этого момента человек считается опасным для окружающих. На 3-4 неделе болезни выделение бактерий происходит в более активной форме с испражнениями, мочой, потом; также бактерии можно обнаружить в грудном молоке и носоглотке. После выздоровления выделение бактерий обычно прекращается. Бактерионосительство может быть острым, хроническим или транзиторным. Но в отличие от других острых кишечных инфекций, после перенесенного заболевания брюшного тифа в 2-5% случаев может формироваться хроническое бактерионосительство (более 3-х месяцев), которое сопровождается выделением возбудителя (с фекалиями и мочой) и наличием в сыворотке крови иммуноглобулинов (антител) к Vi-антигену возбудителя. Последний признак считают индикатором хронической формы инфекции или бессимптомного носительства. Носительство может быть кратковременным или продлиться всю жизнь. Бактерионосители опасны, как источники инфекции.
Бактерия начинает выделяться с калом с первых дней заболевания. С этого момента человек считается опасным для окружающих. На 3-4 неделе болезни выделение бактерий происходит в более активной форме с испражнениями, мочой, потом; также бактерии можно обнаружить в грудном молоке и носоглотке. После выздоровления выделение бактерий обычно прекращается. Бактерионосительство может быть острым, хроническим или транзиторным. Но в отличие от других острых кишечных инфекций, после перенесенного заболевания брюшного тифа в 2-5% случаев может формироваться хроническое бактерионосительство (более 3-х месяцев), которое сопровождается выделением возбудителя (с фекалиями и мочой) и наличием в сыворотке крови иммуноглобулинов (антител) к Vi-антигену возбудителя. Последний признак считают индикатором хронической формы инфекции или бессимптомного носительства. Носительство может быть кратковременным или продлиться всю жизнь. Бактерионосители опасны, как источники инфекции.
Бактерии Salmonella typhi умеренно устойчивы во внешней среде – в почве и воде могут сохраняться до 1-5 месяцев, в испражнениях – до 25 дней, на белье – до 2 недель, на пищевых продуктах – от нескольких дней до недель. Особенно опасно купаться в водоемах, которые могут быть заражены сточными водами. Самый высокий риск заражения связан с молочными и мясными продуктами, в них бактерия при температуре +18 С начинает активно размножаться. При нагревании возбудитель достаточно быстро погибает, дезинфицирующие растворы в обычных концентрациях действуют на него губительно.
Особенно опасно купаться в водоемах, которые могут быть заражены сточными водами. Самый высокий риск заражения связан с молочными и мясными продуктами, в них бактерия при температуре +18 С начинает активно размножаться. При нагревании возбудитель достаточно быстро погибает, дезинфицирующие растворы в обычных концентрациях действуют на него губительно.
К антигенной структуре Salmonella typhi относятся:
• термостабильный соматический О-антиген,
• термолабильный жгутиковый Н-антиген,
• термолабильный соматический Vi-антиген и др.
Безусловным лабораторным подтверждением диагноза служит выделение брюшнотифозных бацилл микробиологическим методом при серийных посевах крови (начиная с первой недели болезни) или кала – на второй неделе. Выявление возбудителя микробиологическими методами зависит от концентрации возбудителя в материале и влияния терапии антибиотиками.
В настоящее время наибольшее распространение получил серологический метод исследования, к числу которых относится исследование крови на антитела к Salmonella typhi с помощью реакции пассивной гемагглютинации (РПГА-тест), результат которой бывает положительным ко второй неделе заболевания.
Показания к назначению:
• для диагностики острой инфекции,
• дифференциальной диагностики у длительно лихорадящих
• обследования реконвалесцентов (выздоравливающих)
Референсные значения:
«отрицательный» – отсутствие антител к антигенам Salmonella typhi
Интерпретация результатов:
положительный
• наличие инфицирования S. typhi
отрицательный результат
• отсутствие инфицирования S. typhi
Возможны ложноположительные перекрёстные реакции с другими типами сальмонелл.
Необходимо воздержаться от приема пищи в течение 2-3 часов.
Анализ АТ к salmonella typhi (брюшной тиф) – сдать по цене 450 руб. в Москве
Стоимость забора биоматериалаНастоящим уведомляем Вас о том, что с 01 марта 2016 года Лаборатория «Литех» изменяет порядок и стоимость забора биоматериала. Прейскурант
*Цены у Партнеров могут отличаться.
|
Сдать анализ на брюшной тиф необходимо при появлении следующих симптомов:
- лихорадка,
- слабость,
- боли в животе,
- тошнота, рвота,
- понос,
- потеря аппетита.
Тест выявляет Salmonella typhi. Данный возбудитель проникает в организм человека фекально-оральным путем (через употребление в пищу зараженных продуктов и воды или грязные руки).
Сальмонелла через слизистую оболочку кишечника попадает в селезенку, печень и лимфатические узлы, затем — в кровь. Без лечения рассматриваемое инфекционное заболевание может привести к опасным для жизни последствиям:
- кишечному кровотечению,
- перфорации тонкой кишки.
Для того чтобы избежать осложнений, необходимо своевременно обратиться к врачу. Он направит на анализы, по результатам которых поставит диагноз и назначит необходимое лечение.
Он направит на анализы, по результатам которых поставит диагноз и назначит необходимое лечение.
Сдать анализ на брюшной тиф — в Литех
Сдать анализ для диагностики брюшного тифа можно в одном из медицинских офисов Литех. В качестве метода обнаружения применяют РПГА (реакцию пассивной гемагглютинации). Сотрудники лаборатории берут у пациента анализ крови, исследуют сыворотку на наличие антител.
Для точной расшифровки следует обратиться к специалисту.
Цену на анализ крови на брюшной тиф и график приема уточняйте предварительно.
Положительный результат может свидетельствовать о:
- остром течении заболевания,
- уже перенесенной инфекции,
- носительстве.
В некоторых случаях возможны ложноположительные показатели.
Отрицательный ответ сообщает о:
- отсутствии болезни,
- ранней форме,
- прошествии значительного времени после выздоровления.
Анализ крови на брюшной тиф в СПб
Описание
Брюшной тиф – серьезное заболевание, поражающее кишечник, его лимфоузлы и т. д. Инфицирование происходит через алиментарный (пищевой) путь и имеет инкубационный период около 2-х недель. Болезнь характеризуется увеличением печени и селезенки, интоксикацией, экзантемой, высокой температурой, изменением сознания. В тяжелых случаях – галлюцинациями и заторможенной реакцией.
д. Инфицирование происходит через алиментарный (пищевой) путь и имеет инкубационный период около 2-х недель. Болезнь характеризуется увеличением печени и селезенки, интоксикацией, экзантемой, высокой температурой, изменением сознания. В тяжелых случаях – галлюцинациями и заторможенной реакцией.
Своевременная сдача анализа на брюшной тиф и грамотная терапия позволят избежать осложнений – кровотечения кишок и перфорации кишок (из-за отмирания пейеровой бляшки). Рецидивы заболевания случаются у 8-12% инфицированных, хроническими носителями остаются 2-5% проходивших лечение.
Всем, кто сдает анализ на брюшной тиф для санкнижки, важно знать, сколько он действителен. Сотрудник проходит обследование на тиф при устройстве на работу в первый раз или при переходе на новое место работы.
Как берут анализ на брюшной тиф
При обнаружении характерных симптомов (недомогание, лихорадка неясной причины заражения, боли в области живота, потеря аппетита и др. ) заболевания необходимо обратиться к лечащему врачу, который подскажет, как правильно сдавать анализ крови на брюшной тиф. Венозную кровь берут в утренние часы на голодный желудок из области сгиба локтя. Для получения точного результата исследование проводят повторно через 5 дней.
) заболевания необходимо обратиться к лечащему врачу, который подскажет, как правильно сдавать анализ крови на брюшной тиф. Венозную кровь берут в утренние часы на голодный желудок из области сгиба локтя. Для получения точного результата исследование проводят повторно через 5 дней.
Метод анализа
РПГА (реакция пассивной гемагглютинации) – метод выполнения анализа на брюшной тиф.
Где можно сдать анализ на брюшной тиф в СПб?
Планируете пройти исследование на тиф? Рекомендуем обратиться в медцентр «ЭкспрессМедСервис» в СПб. Позвоните по телефонам, указанным на сайте учреждения, и наши администраторы предоставят всю необходимую информацию, включая цену анализа на тиф и сроки его готовности.Подготовка
Специальной подготовки не требуется. Сдавать кровь из вены для анализа на брюшной тиф необходимо утром в промежуток времени с 8 до 11 часов. До этого следует поголодать около 8-14 часов и воздержаться от курения 4 часа. Рекомендуется выпить один-два стакана воды без газа, чтобы получить требуемый объем крови. Это поможет уменьшить вязкость биоматериала и избежать формирования сгустков в пробирке. За день до сдачи тестового образца следует сохранять эмоциональное и физическое спокойствие.
До этого следует поголодать около 8-14 часов и воздержаться от курения 4 часа. Рекомендуется выпить один-два стакана воды без газа, чтобы получить требуемый объем крови. Это поможет уменьшить вязкость биоматериала и избежать формирования сгустков в пробирке. За день до сдачи тестового образца следует сохранять эмоциональное и физическое спокойствие.
Определение антител к сальмонелле тифи (Salmonella typhi) в крови (на брюшной тиф методом РНГА) – Серологические исследования крови
Брюшной тиф является антропонозной кишечной инфекцией, вызываемыми бактериями рода Salmonella (брюшной тиф – S. Typhi).По формам течения инфекционного процесса различают манифестные формы течения заболеваний и субманифестные (бессимптомные формы). Манифестные формы характеризуются циклическим течением с выраженной интоксикацией, лихорадкой, бактериемией, розеолезной сыпью на кожных покровах туловища, гепато- и спленомегалией, язвенным поражением тонкой кишки. На первой неделе заболевания отмечается запор на фоне длительной лихорадки, на второй неделе – может возникнуть диарея.
Источником инфекции при брюшном тифе является человек: бактерионоситель, больной брюшным тифом.
Доминирующим механизмом передачи является фекально-оральный, реализуемый пищевым, водным и контактно-бытовым путями передачи возбудителя.
Брюшной тиф могут проявляться острым и хроническим бактерионосительством, которые подразделяются на следующие категории:
- острые бактерионосители: лица, переболевшие брюшным тифом, у которых клиническое выздоровление наступает раньше, чем бактериологическое очищение организма от возбудителя, который может выделяться из мочи и кала до 3 месяцев после перенесенного заболевания;
- хронические бактерионосители: лица, выделяющие возбудителя более 3 месяцев после перенесенного заболевания, в том числе на протяжении всей жизни. Они составляют не менее 3-5% среди переболевших лиц.Выделение возбудителя хроническими носителями может иметь дискретный характер (возбудитель выделяется не постоянно), что затрудняет их выявление;
- транзиторные бактерионосители: лица, у которых при бактериологическом исследовании кала возбудитель был выделен однократно при отсутствии клинических проявлений или соответствующего диагноза в анамнезе. Наличие бактерий в пробах желчи или мочи исключает транзиторный характер носительства. Такое носительство может возникать при попадании возбудителей брюшного тифа в кишечник невосприимчивого к инфекции человека (вакцинированного против брюшного тифа или вследствие перенесенной болезни), либо при заражении малой, субинфекционной дозой возбудителя.
Лабораторная диагностика сальмонеллеза в Санкт-Петербурге
Сальмонеллы – группа возбудителей, который вызывают такие кишечные инфекции, как тифы, паратифы и, собственно, сальмонеллез. Отличия заключаются в подвиде бактерии, которая проникла в организм пациента. Это влияет на клиническую картину, особенности диагностики, выбор метода лечения и эпидемиологические действия. Рассмотрим особенности возбудителей и заболеваний, которые они вызывают.
S. paratyphi вызывает паратифы, они различаются по типу заболевания и делятся на А, В и С. Salmonellatyphi вызывает брюшной тиф. Эти инфекционные заболевания сопровождаются циркуляцией возбудителя в крови, высокой температурой тела, реакцией лимфатических узлов и токсическими проявлениями. Сальмонеллы вызывают сальмонеллез, который протекает несколько легче чем тифы и паратифы. Эти патологии трудно отличить, основываясь лишь на клинических явлениях – для этого используются лабораторные методы исследования. Их объединяет то, что они тропны к пищеварительному тракту и большинство симптомов наблюдается именно со стороны этих органов.
Эпидемиологические особенности патологий
Важным моментом при постановке диагноза являются особенности проникновения возбудителя в организм. В зависимости от этого различают несколько типов инфекций. К примеру, бактерии, которые приводят к развитию тифа и паратифов, являются антропонозными – передача инфекции наблюдается от людей, которые болеют и являются носителями. Сальмонеллез и некоторые паратифы являются зооантропонозами – инфекциями, которые общие и для животных. и для людей.
Строение сальмонелл позволяет им переживать условия внешней среды и продолжать свой жизненный цикл в воде, почве. Чтобы уничтожить их, необходимо использовать дезинфектанты и другие агрессивные вещества. В сточные воды и землю бактерии поступают, в основном, с испражнениями, поэтому путь передачи называется фекально-оральным. Кроме кала и мочи, значительное количество бактерий содержит слюна пациента, из чего также можно сделать выводы о передаче заболевания.
Когда необходимо пройти диагностику?Анализы необходимо сдать тем, кто работает на пищевом производстве, посещает детский коллектив или работает в нем. Это нужно для того, чтобы исключить факт носительства бактерии. Пищевая промышленность опасна в эпидемиологическом плане, так как возбудитель превосходно чувствует себя на питательных средах, которые используются в производстве готовых блюд или продуктов. Детские коллективы также имеют свою особенность – в детском возрасте не так серьезно соблюдаются гигиенические меры, чаще наблюдается некачественное мытье рук, контакт грязных поверхностей со слизистой рта. Особенно важна диагностика и для беременных. В остальных случаях, анализы проводятся при наличии следующих симптомов:
- острое повышение температуры;
- нарастающая интоксикация, которая проявляется слабостью, головной болью, ломотой в костях и суставах;
- боль в животе, которая имеет спастический характер, локализуется вокруг пупочного кольца и в месте, где сходятся реберные дуги;
- тошнота, за которой следует неоднократная рвота;
- диарея, при которой может наблюдаться зеленоватый оттенок каловых масс и их неприятный запах;
- бледность кожных покровов;
- сухость слизистых;
- мелкопятнистая сыпь красного цвета, которая постепенно становится более бледной.
Наблюдаются различные формы и особенности течения заболеваний, поэтому симптомы могут несколько отличаться. Как правило, при подозрительной клинической картине пациенты обращаются к врачу, а он направляет их на сдачу анализов. Лабораторная диагностика используется и ретроспективно – после выздоровления, для определения иммунологической картины, а также для выявления устойчивых форм патологии.
перейти к анализам
Виды исследований при данных инфекционных заболеванияхЛабораторная диагностика брюшного тифа
Начало диагностики – забор материала. Биологические жидкости и ткани необходимо правильно собрать, в зависимости от фазы развития болезни. Лучше сделать это до начала приема антибактериальной терапии.
Постановка диагноза “брюшной тиф” происходит такими методами:
Бактериологическая диагностика.
Данные методы актуальны для ранней постановки диагноза. Возбудителя можно выявить в крови, тканях костного мозга, дуоденальном содержимом, в каловых массах и в моче. Посев палочек тифа дает точную информацию для постановки диагноза.
Метод гемокультуры
Для исследования берется кровь пациента, 10 мл, венозная. Посев производится на специфические питательные среды. В некоторых случаях, часть крови используется для посева, а сыворотка – для серологического анализа. Ожидается рост культур, которые идентифицирует с помощью макро- и микроскопического исследования.
Метод миелокультуры
На определенных стадиях патологического процесса можно выделять возбудитель из костного мозга – для этого проводится стернальная пункция и забор небольшого количества материала. Это безопасно и безболезненно, так как проходит на фоне анестезии. Посев происходит на питательные среды. Особенность метода – большая чувствительность. Методика обладает диагностической точностью даже при стертых формах болезни, которые невозможно определить методом гемокультуры.
Метод биликультуры
Забор желчи происходит путем зондирования 12-перстной кишки. Сеются 3 порции кишечного содержимого. Особенность методики – эффективность при поиске носителей или устойчивых форм болезни у носителей.
Исследование розеолокультур
Материал находится в элементах сыпи – это прозрачная жидкость в центре розеолы. Используется при негативном ответе на другие методы исследования и при наличии характерной сыпи. Для забора крови необходимо обработать кожу и скарифицировать её острием скальпеля. Содержимое элемента сыпи наносится на питательную среду, как и в остальных случаях.
Метод уринокультуры
Определение культур в моче больше направлено на поиск бактерионосителей, чем пациентов с активной формой болезни. Мочу собирают после тщательного туалета, а еще лучше с помощью катетера. В остальном, исследование происходит также, как и в случае с остальным биологическим материалом.
Анализ копрокультуры
Методика используется не так часто, так как в каловых массах возбудитель появляется через время после заболевания. Исследование используется для здоровых лиц и носителей.
Для выявления тифозных микроорганизмов может использоваться исследование воды.
Для того, чтобы идентифицировать сам микроорганизм используется специальный метод окраски – он позволяет увидеть под микроскопом типичные палочки, красного цвета, которые на концах имеют закругленные образования. Исследуют её форму, размеры, биохимические свойства и идентифицируют вид микроорганизма. Производится также фаготипирование, то есть определение конкретного вида возбудителя.
Серологические методы
Используются для определения носительства или наличия патологического процесса. В диагностике тифа используется реакция Видаля, а также РИГА. Еще один серологический метод – иммуноферментный анализ.
Реакция Видаля позволяет выделить возбудитель из сыворотки крови. Реакция специфическая, начиная с 7-10 дня болезни. Особенность брюшного тифа – разные скорости повышения тех или иных типов антигенов. Определение всех антигенов позволяет правильно диагностировать процесс. Реакция имеет специфические особенности в плане забора материала и постановки исследования, поэтому её точность зависит от условий лаборатории.
Реакция гемагглютинации широко используется для диагностики тифа и паратифа. Особенно важна методика для определения носительства бактерий. Достоверность реакции подтверждается выделением чистой культуры микроорганизмов. Для носителей используются методики исследования мочи, желчи или каловых масс.
Серологические пробы более достоверны, если использовать методику парных сывороток и отслеживать динамическое изменение количества антител. Также, определение вида антител позволяет сказать, какая стадия процесса происходит в организме.
Аллергопроба при тифе основана на воздействии тифина, который обладает аллергеном. Он вызывает реакцию, если в организме есть антитела к нему. Реакция сопровождается небольшим местным отеком, покраснением. Проба используется для реконвалесцентов и необходима в ретроспективном плане.
Диагностика сальмонеллеза происходит с помощью таких процедур:
Бактериологическое исследование каловых масс используется наряду с аналогичным исследованием рвотных масс, мочи, желчи, промывных вод желудка. Посев производится на питательные среды, в которых созданы наиболее благоприятные условия для роста культур. Такие реактивы создаются на основе биохимических свойств возбудителя. Если в исследуемом материале есть культура сальмонелл, в благоприятных условиях она даст рост на среде. Исследователь ждет необходимое количество дней (от 7 до 10) и осматривает реактивы. Сальмонеллы отличаются характерным ростом, который дает основания для постановки диагноза.
Копрограмма при сальмонеллезе – один из наиболее быстрых методов постановки диагноза. Макроскопическое исследование дает основания заподозрить патологические изменения слизистой пищеварительного тракта. Об этом говорят непереваренные частицы клетчатки, воспалительные клетки, выделения слизи и крови вместе с калом, крахмальные зерна. Это говорит о том, что нарушена пищеварительная функция и многие компоненты пищи не расщепляются до своих единиц. Такие изменения вместе с клиническими данными позволяют поставить диагноз и начать лечение. Сбор каловых масс нельзя проводить после приема слабительных препаратов.
Для постановки полимеразно-цепной реакции используется кровь пациента. Современные методы диагностики позволяют обнаружить частицы генетического материала и составить из них фрагмент нуклеиновой кислоты. Полученный образец сопоставляют с таковым у искомого возбудителя и при их совпадении ставят диагноз. Метод обладает высокой чувствительностью, он является точным основанием для постановки диагноза.
Серологические методы диагностики основаны на поиске антител в крови пациента. Если в организме находятся антитела, они создадут иммунокомплекс вместе с антигеном, который добавляют к биологическому материалу. Если реакция произошла, её повторяют через время, чтобы увидеть динамическую картину заболевания. Это называется методом парных сывороток, определяется нарастание титра антител. Различают виды антител, которые есть в острой стадии, у носителей, у пациентов с реконвалесцентной формой патологии. Среди серологических методов – иммуноферментный анализ, реакции гемагглютинации, иммунофлюоресцентные методики. Они различаются добавлением дополнительных реактивов, прицельным изучением эритроцитов.
Каждый из методов диагностики используется при определенных обстоятельствах – в зависимости от состояния пациента, дня с начала болезни, а также для разных целей диагностики. Это важно и для назначения лекарственной тактики, и для получения эпидемиологических данных.
Острые кишечные инфекции опасны тем, что приводят к интоксикации и быстрому обезвоживанию. Вместе с жидкостью из организма выводятся полезные минералы, соли и другие вещества. За короткий срок может наступить критическое состояние организма, ведь потеря влаги происходит также за счет высокой температуры, частого дыхания, потоотделения и других процессов. Особенно опасно это для тех, кто имеет ослабленный иммунитет, для детей. Поэтому, своевременная и качественная диагностика настолько важна, ведь именно на её основе можно назначить необходимое лечение, которое приведет к положительному результату.
Количественное определение бактерий в крови больных брюшным тифом и взаимосвязь между количеством и клиническими характеристиками, трансмиссивностью и устойчивостью к антибиотикам
J Clin Microbiol. 1998 Jun; 36 (6): 1683–1687.
, 1, 2, 3 , 2 , 4 , 1, 3 , 2 , 1, 2, 3 и 1 3, *Джон Уэйн
Отдел клинических исследований Wellcome Trust 1 и Отдел микробиологии, 2 Центр тропических болезней, Больница Чо Куан, Хошимин, и Больница Донг Тап, Цао Лань, Dong Thap, 4 Vietnam, и Центр тропической медицины, Департамент клинической медицины Наффилда, Оксфордский университет, Оксфорд, Соединенное Королевство 3
To Song Diep
Wellcome Trust Clinical Research Unit 1 и Департамент микробиологии, 2 Центр тропических болезней, Больница Чо Куан, Хошимин, и Больница Донг Тхап, Као Лань, Донг Тхап, 4 Вьетнам, и Центр тропической медицины, Департамент клинической медицины Наффилда, О. xford University, Oxford, United Kingdom 3
Vo Anh Ho
Wellcome Trust Clinical Research Unit 1 и Департамент микробиологии, 2 Центр тропических болезней, Больница Чо Куан, Хошимин и Донг Тап Госпиталь, Као Лань, Донг Тхап, 4 Вьетнам, и Центр тропической медицины, Кафедра клинической медицины Наффилда, Оксфордский университет, Оксфорд, Соединенное Королевство 3
Аманда М.Walsh
Wellcome Trust Clinical Research Unit 1 и Департамент микробиологии, 2 Центр тропических болезней, Больница Чо Куан, Хошимин, и Больница Донг Тхап, Као Лань, Донг Тхап, 4 Вьетнам, и Центр тропической медицины, Департамент клинической медицины Наффилда, Оксфордский университет, Оксфорд, Соединенное Королевство 3
Нгуен Тхи Туйет Хоа
Wellcome Trust Отдел клинических исследований 1 и Департамент микробиологии, 2 Центр тропических болезней, Больница Чо Куан, Хошимин, и больница Донг Тхап, Као Лань, Донг Тхап, 4 Вьетнам, и Центр тропической медицины, Кафедра клинической медицины Наффилда, Оксфордский университет, Оксфорд, Соединенное Королевство 3
Кристофер М.Parry
Wellcome Trust Отдел клинических исследований 1 и Департамент микробиологии, 2 Центр тропических болезней, Больница Чо Куан, Хошимин, и Больница Донг Тхап, Као Лань, Донг Тап, 4 Вьетнам, и Центр тропической медицины, Кафедра клинической медицины Наффилда, Оксфордский университет, Оксфорд, Соединенное Королевство 3
Николас Дж. Уайт
Wellcome Trust Отдел клинических исследований 1 и Департамент микробиологии, 2 Центр тропических болезней, Больница Чо Куан, Хошимин, и Больница Донг Тхап, Као Лань, Донг Тхап, 4 Вьетнам, и Центр тропической медицины, Кафедра клинической медицины Наффилда, Оксфордский университет, Оксфорд, Великобритания 3
Wellcome Доверьте отдел клинических исследований 1 и отдел микробиологии, 2 Центр тропических болезней, больница Чо Куан, Хошимин, ан. d Больница Донг Тхап, Као Лань, Донг Тхап, 4 Вьетнам, и Центр тропической медицины, Кафедра клинической медицины Наффилда, Оксфордский университет, Оксфорд, Соединенное Королевство 3
* Автор, отвечающий за переписку.Почтовый адрес: Отдел клинических исследований Wellcome Trust, Центр тропических болезней, Больница Чо Куан, Хошимин, Вьетнам. Телефон: 84 88 353954. Факс: 84 88 353904. Электронная почта: [email protected].Поступило 30 декабря 1997 г .; Изменения запрошены 8 февраля 1998 г .; Принято 3 марта 1998 г.
Copyright © 1998, Американское общество микробиологов. Эта статья цитируется в других статьях в PMC.Abstract
Salmonella typhi была выделена из 369 и Salmonella paratyphi A был выделен у 6 из 515 вьетнамских пациентов с подозрением на кишечную лихорадку.По сравнению с традиционным культивированием крови в бульоне, прямой посев на лейкоцитарную пленку имел диагностическую чувствительность 99,5% (95% доверительный интервал [ДИ] от 97,1 до 100%). Количество бактерий в крови оценивали методом наливной чашки. Среднее количество S. typhi в крови составляло 1 КОЕ / мл (диапазон от <0,3 до 387 КОЕ / мл), из которых в среднем 63% (95% ДИ, от 58 до 67%) были внутриклеточными. Среднее количество бактерий на инфицированный лейкоцит составляло 1,3 (межквартильный размах [IQR], 0,7–2,4) КОЕ / клетку ( n = 81).У детей (<15 лет; n = 115) среднее количество бактерий в крови было выше, чем у взрослых ( n = 262): 1,5 (диапазон от <0,3 до 387) против 0,6 (диапазон от <0,3 до 17,7) КОЕ / мл ( P = 0,008), а пациенты, которые выделяли S. typhi с фекалиями, имели более высокие бактериемии, чем те, кто этого не делал: в среднем 3 (диапазон от <0,3 до 32) против 1 (диапазон от <0,3 до 68 ) КОЕ / мл ( P = 0,02). Количество бактерий в крови снижалось с увеличением продолжительности болезни ( P = 0.002) и были выше при инфекциях, вызванных S. typhi с множественной лекарственной устойчивостью (1,3 [диапазон от <0,3 до 387] КОЕ / мл; n = 313), чем при инфекциях, вызванных чувствительными к антибиотикам S. typhi (0,5 [диапазон от <0,3 до 32] КОЕ / мл; n = 62) ( P = 0,006). В многофакторном анализе это оказалось независимой ассоциацией, предполагающей связь между устойчивостью к антибиотикам и вирулентностью у S. typhi.
Брюшной тиф – это длительное заболевание, характеризующееся бактериемией, вызванной Salmonella typhi , высокоразвитым грамотрицательным бактериальным паразитом, поражающим только людей.Несмотря на бактериологическое сходство между S. typhi и другими энтеробактериями, клиническая картина брюшного тифа обычно отличается и во многих отношениях отличается от таковой при других септицемиях, вызываемых грамотрицательными микроорганизмами. В целом, пациенты с брюшным тифом менее тяжелы, и тяжесть брюшного тифа обычно отражает локализацию инфекции на пятнах Пейера и последующее изъязвление кишечника, а не фульминантную сепсис. Информации о количестве бактерий в крови и их связи с болезненным состоянием мало (17).При стандартном культивировании в бульоне сальмонеллы были обнаружены в крови от 30 до 90% пациентов с клинически подозреваемыми случаями кишечной лихорадки, а доля больных брюшным тифом с положительными культурами крови уменьшается с увеличением продолжительности болезни (3, 5, 20 , 21). Объем взятой крови и лабораторные методы, используемые для выделения, также являются важными факторами, определяющими выход при посеве крови (3–6, 10, 13, 17, 18, 20, 24). S. typhi способен выживать и воспроизводиться внутри моноцитарных фагоцитов, а при брюшном тифе S.typhi , как сообщается, ограничивается фракцией моноцитов-тромбоцитов крови (5, 17, 18, 24). Чтобы исследовать взаимосвязь между количеством бактерий в крови и клиническими и лабораторными признаками брюшного тифа, мы выполнили количественные бактериологические культуры для большой группы пациентов с неосложненной кишечной лихорадкой.
МАТЕРИАЛЫ И МЕТОДЫ
Пациенты.
Взрослые и дети, госпитализированные с подозрением на неосложненный брюшной тиф, изучались в течение 3-летнего периода в двух разных учреждениях во Вьетнаме: Центре тропических болезней, Хошимин, инфекционной больнице и больнице Дружбы, Цао Лань. Город, большая провинциальная больница в провинции Донг Тхап в дельте Меконга.Эти пациенты были набраны для проспективных исследований краткосрочного курса фторхинолоновой терапии на основании клинических подозрений или положительного посева крови. Критериями клинического диагноза брюшного тифа обычно служили лихорадка в течение ≥6 дней без явного очага инфекции, отрицательный мазок крови на малярию и дискомфорт в животе при изменении привычек кишечника. В некоторых случаях замкнутое или апатичное поведение пациентов при лихорадке также было диагностическим признаком.Пациенты с тяжелым или осложненным брюшным тифом (за исключением тех, у кого в анамнезе была только мелена) и те, кто уже получал эффективное лечение антибиотиками (т. Е. Антибиотиками, активными против S. typhi ), не были включены в эти исследования. Перед началом лечения брали кровь для стандартных лабораторных анализов и посева, как описано ниже, и, когда это было возможно, не откладывая начало лечения, культивировали образец кала на Salmonella . Полностью информированное согласие на забор крови было получено от всех пациентов.Это исследование было одобрено научным и этическим комитетами участвующих учреждений.
Лабораторные методы.
В обоих центрах использовались одинаковые лабораторные методы. У каждого пациента в асептических условиях брали от пяти до десяти миллилитров венозной крови и вносили в 50 мл бульона для инфузии мозга и сердца (Oxoid, Basingstoke, Великобритания), содержащего 0,05% полианэтолесульфоната натрия (Sigma, Poole, Великобритания). Поддерживали минимальное соотношение кровь-бульон от 1 до 10.Бульоны для культур крови инкубировали в течение 7 дней, а субкультивирование проводили через 24 часа и через 7 дней. Все флаконы также проверяли ежедневно, и если флакон показывал видимые признаки роста, проводили пересев на агар с овечьей кровью. Культивирование стула проводили после обогащения пробы массой 1 г в 10 мл селенитного бульона в течение 24 ч. Затем пять микролитров из верхней части бульона высевали на агар XLD (Oxoid). Бактериальные изоляты были идентифицированы стандартными биохимическими тестами (глюкоза, ферментация лактозы и образование газа, выработка индола и H 2 S, утилизация цитрата, подвижность и способность расщеплять мочевину) и агглютинация с Salmonella 09- и Vi-специфичными. антисыворотки (Wellcome Diagnostics, Дартфорд, Великобритания).Чувствительность дисков к антибиотикам определяли с использованием модификации метода Bauer et al. (1). Организмы, устойчивые к хлорамфениколу, ампициллину, триметоприму и сульфаметоксазолу, но чувствительные к офлоксацину и цефтриаксону, были описаны как устойчивые к множеству лекарственных препаратов.
Количественные культуры.
Венозная кровь для количественного посева и культивирования в бульоне была взята перед введением противомикробных препаратов от брюшного тифа. Кровь (от 3 до 9 мл у взрослых и от 1,5 до 6 мл у детей) собирали в стерильную гепаринизированную пробирку и немедленно отправляли в лабораторию.Количественные посевы цельной крови (QBC) проводили методом заливки на чашках. Вкратце, три отмеренные аликвоты крови (обычно 1 мл; 0,5 мл для маленьких детей) смешивали с 19 мл расплавленного (50 ° C) колумбийского агара (Unipath, Бейзингсток, Соединенное Королевство) в стерильной чашке Петри и оставляли для застывания. , а затем инкубировали при 37 ° C. Через 2-4 дня колонии подсчитывали и записывали как КОЕ на миллилитр. Для идентификации с поверхности агара собирали до пяти колоний. После повторной инкубации в течение 24 часов были выполнены стандартные биохимические тесты и агглютинация со специфической антисывороткой.Планшеты отбрасывали как отрицательные, если через 4 дня инкубации не было видно колоний.
Для определения количества внутрилейкоцитарных КОЕ в образцах крови были выполнены количественные посевы лейкоцитов периферической крови. Это исследование проводилось на случайно выбранной подгруппе пациентов. Гепаринизированную цельную кровь (2,5 или 5 мл), взятую одновременно с QBC, центрифугировали при 2700 × г в течение 10 мин. Плазму осторожно удаляли стерильной пластиковой пипеткой, и 0.1 мл, включая слой лейкоцитов, аспирировали стерильным шприцем на 1 мл. Количественные культуры были выполнены на этом 0,1-миллилитровом образце путем смешивания его с 19 мл расплавленного колумбийского агара, выливания смеси в виде чашки с агаром и инкубации в течение до 4 дней. Фагоциты периферической крови, содержащие более одной бактерии, будут производить одну колонию в твердой культуральной среде. Таким образом, для образцов цельной крови и лейкоцитов результаты выражались в КОЕ на миллилитр. Чтобы точно определить количество внутриклеточных бактерий на инфицированный фагоцит, секунда 0.Отбирали 1 мл образца лейкоцитов и лейкоциты лизировали путем инкубации с 0,1 мл 0,1% дигитонина (Sigma) в течение 10 мин при 37 ° C. Это должно было высвободить внутриклеточные бактерии. Затем количественные культуры были выполнены на этом образце так же, как и для первого образца, то есть путем смешивания с 19 мл расплавленного агара Колумбия, выливания смеси в виде чашки с агаром и инкубации при 37 ° C в течение до 4 дней. . Чтобы исключить возможность того, что локализация бактерий в лейкоцитарной пленке была артефактом этапа центрифугирования, в 10 мл крови здорового добровольца засевали 10 4 КОЕ из S.typhi и сразу центрифугировали при 2700 × g в течение 10 мин. Объем 0,1 мл лейкоцитарной пленки и 0,1 мл слоя эритроцитов собирали стерильными шприцами объемом 1 мл, смешивали с 19 мл расплавленного агара Columbia и давали возможность застыть, как описано выше. Бактериальные колонии подсчитывали через 4 дня инкубации при 37 ° C.
Расчет количества бактерий.
Число бактерий S. typhi на миллилитр крови (QBC) оценивали по количеству КОЕ на каждой разливочной пластине.Минимальный объем цельной крови, используемой для количественных методов от одного пациента, составлял 1,5 мл для маленьких детей и 3 мл для взрослых и детей старшего возраста. Это дает нижний предел обнаружения 0,7 или 0,3 КОЕ на мл соответственно. При сообщении количества бактерий в образцах лейкоцитарной пленки и лизированной лейкоцитарной пленки знаменателем был объем цельной крови, из которой был взят лейкоцит. У пациентов с положительной культурой в бульоне, но отрицательной по QBC, количественное значение оценивали по общему объему посевной крови: 0.От 7 до 1,0 КОЕ / мл из 1,5 мл крови и от 0,3 до 1,0 КОЕ / мл из 3 мл крови. Жизнеспособные бактерии в образце лейкоцитарной пленки объемом 0,1 мл считались внутрилейкоцитарными, а организмы в оставшейся части крови считались находящимися в плазме. Поэтому количество внеклеточных бактерий рассчитывали по следующей формуле: (КОЕ / мл цельной крови) – (КОЕ / мл лейкоцитарной пленки). Среднее количество жизнеспособных бактерий на инфицированный лейкоцит рассчитывали по следующей формуле: количество лизированных лейкоцитов (в бактериях на миллилитр) / количество нелизированных лейкоцитов (в инфицированных клетках на миллилитр).
Статистический анализ.
SPSS for Windows (SPSS Benelux Inc., Gorinchem, Нидерланды) версии 6 использовался для всех статистических анализов. Коэффициенты частичной корреляции были рассчитаны для связи между непрерывными переменными и количеством бактерий. Различия в количестве бактерий между группами, определяемыми дихотомическими переменными, проверяли с помощью U-критерия Манна-Уитни. Потенциально мешающие переменные (место и / или возраст) контролировались, и все данные с нестандартным распределением ранжировались до того, как были выполнены корреляционные тесты для ранжированных данных.Взаимодействия оценивались с помощью многомерного анализа.
РЕЗУЛЬТАТЫ
Посев крови в бульоне был проведен у 515 взрослых и детей с подозрением на кишечную лихорадку в период с марта 1993 г. по март 1996 г. (таблица). Все пациенты получали лечение офлоксацином перорально (общая доза от 60 до 135 мг / кг массы тела в течение 2–5 дней), как сообщалось в других источниках (4, 22), и все выздоровели. Возбудители кишечной лихорадки выделены от 375 (72,8%) пациентов: S. typhi от 369 пациентов и Salmonella paratyphi A от 6 пациентов.У двух пациентов QBC на чашке для заливки был положительным, но посевы крови в бульоне были отрицательными. Salmonella derby была выделена из крови одного пациента, и этот пациент был признан отрицательным по возбудителям кишечной лихорадки и исключен из анализа. Большинство изолятов S. typhi (313; 80%) обладали множественной лекарственной устойчивостью, то есть устойчивы к хлорамфениколу, триметоприм-сульфаметоксазолу и ампициллину. Подсчет бактерий как в цельной крови, так и в лейкоцитарной пленке был проведен у 187 пациентов.Эти пациенты имели клинические параметры при поступлении, аналогичные таковым у 188 пациентов с кишечной лихорадкой, которым проводился только QBC цельной крови. Одновременно были взяты образцы цельной крови, лейкоцитарной пленки и лизированной лейкоцитарной пленки у подгруппы из 81 пациента. Эти пациенты имели немного более короткую продолжительность болезни перед госпитализацией, т. Е. В среднем составляли 7 (диапазон от 2 до 33) дней по сравнению со средним значением в 9 (диапазон от 2 до 33) дней в целом, но во всех других отношениях их клинические проявления были похожи.
ТАБЛИЦА 1
Клинические и лабораторные параметры для пациентов с подозрением на кишечную лихорадку
| Переменная | Значение для: | |
|---|---|---|
| Все включенные пациенты ( n = 514) | Пациенты с положительным посевом крови ( n = 375) | |
| Возраст (лет) a | 12,9 (9) 14 (9,5) | |
| Продолжительность предшествующей лихорадки (дни) b | 9 (от 7 до 12; от 2 до 33) | 10 (от 7 до 13; от 2 до 33) |
| Температура (° C) а | 39.3 (1.0) | 39.1 (1.0) |
| Гепатомегалия c | 337 из 511 (66) | 237 из 375 (64) |
| Melena c | (4)14 из 374 (4) | |
| Рвота c | 91 из 508 (18) | 69 из 378 (18) |
| Боль в животе c | 32161 | (509)106 из 378 (62) |
| Диарея c | 325 из 506 (64) | 234 из 378 (62) |
| Желтуха a | 5 из 90 5122 9025 460 из 378 (1.1) | |
| Пиковая температура (° C) a | 39,7 (0,9) | 39,7 (0,9) |
| Пятна розы c | 18 из 482 (4) | 17 из 378 ( 5) |
| Количество лейкоцитов / мкл a | 7,300 (3,402) | 7,629 (3,121) |
| Гематокрит (%) a | 33,2 (4,960) 9024 | |
| Число тромбоцитов / мкл a | 180 000 (89 000) | 196 615 (84 795) |
Прямое нанесение на лейкоцитарную пленку.
Прямой посев лейкоцитов был проведен у 192 пациентов со случаями кишечной лихорадки с положительной культурой на бульоне: 190 из 191 S. typhi и 1 из 1 S. paratyphi A культуры были положительными, чувствительность 99,5% ( 95% доверительный интервал [ДИ], от 97,1 до 100%). Хотя точное время образования колоний из культур лейкоцитов не регистрировалось, подсчет обычно был возможен после инкубации в течение ночи. Существенного загрязнения не произошло.
Количественные результаты культивирования.
Среднее количество S. typhi в цельной крови пациентов с неосложненной кишечной лихорадкой ( n = 375) составляло 1 КОЕ / мл (межквартильный диапазон [IQR], <0,3–5; диапазон, <0,3–387) (Инжир. ). В среднем 37,5% (95% ДИ, от 32,9 до 42,1%) КОЕ были получены от организмов, распределенных в слоях эритроцитов и плазмы ( n = 187), а оставшиеся 62,5% жизнеспособных бактерий были сконцентрированы в лейкоцитарной пленке. слой. Среднее количество бактерий на инфицированный лейкоцит составляло 1.3 (IQR, от 0,7 до 2,4) КОЕ / клетку ( n = 81). У детей младше 15 лет ( n = 115) показатели цельной крови были выше, чем у взрослых ( n = 262): в среднем 1,5 (IQR, <0,3 - 6,0; диапазон, <0,3 - 387) по сравнению с медиана 0,6 (IQR, <0,3–2,8; диапазон, <1,3–17,7) КОЕ / мл ( P = 0,008). Количество внеклеточных бактерий также было выше у детей младше 15 лет, чем у взрослых: в среднем 1,5 (диапазон от 0 до 93) против медианы 0,6 (диапазон от 0 до 17.7) ( P = 0,005). Когда в кровь здорового добровольца засевали S. typhi , концентрация организмов, культивируемых из слоя эритроцитов, была такой же, как и в слое лейкоцитарной пленки. Бактерии из плазменного слоя не культивировались. Таким образом, клетки S. typhi не концентрировались в лейкоцитной пленке в результате центрифугирования.
Распределение количества бактерий в крови при остром брюшном тифе.
Устойчивость к антибиотикам и количество бактерий в крови.
Количество QBC было выше у пациентов, инфицированных множественной лекарственной устойчивостью S. typhi ( n = 313), чем у пациентов, инфицированных более чувствительными изолятами ( n = 62): в среднем 1,3 (диапазон, 0 до 387) по сравнению со средним значением 0,5 (диапазон от 0 до 32) КОЕ / мл ( P = 0,006) (рис.). Пациенты, инфицированные штаммами с множественной лекарственной устойчивостью, как правило, были моложе пациентов, инфицированных более чувствительными штаммами: в среднем 10 (IQR, от 6 до 15) по сравнению со средним значением 13 (IQR, от 7 до 24) лет ( P = 0.02). Продолжительность предшествующего заболевания также была немного короче при инфекциях штаммами с множественной лекарственной устойчивостью: в среднем 9 (IQR, от 6 до 12) по сравнению со средним значением в 10 (IQR, от 6 до 15) дней ( P = 0,07). В многофакторном анализе продолжительность предшествующего заболевания, возраст пациента и множественная лекарственная устойчивость изолированного S. typhi были связаны независимо с количеством бактерий в крови ( P = 0,04, P = 0,003 и P = 0,02 соответственно).Связь между количеством бактерий в крови и множественной лекарственной устойчивостью оказалась устойчивой и не могла быть объяснена смешивающими факторами.
Подсчет бактерий в крови пациентов, инфицированных чувствительными к антибиотикам и множественной лекарственной устойчивостью S. typhi . •, медиана; полоски указывают IQR. Каждый кружок представляет одного пациента.
Продолжительность болезни.
С увеличением продолжительности болезни наблюдалось снижение количества бактерий в цельной крови. Средний показатель цельной крови был равен 1.7 (диапазон от <0,2 до 387) КОЕ / мл на первой неделе болезни, 1 (диапазон от 0,2 до 68) КОЕ / мл на второй неделе, 1 (диапазон от <0,2 до 23) КОЕ / мл на третьей неделю и 0,3 (диапазон от <0,2 до 19) КОЕ / мл на четвертой неделе болезни ( P <0,001). Это оставалось статистически значимым, когда и возраст, и местонахождение контролировались в анализе частичной корреляции ( P = 0,002). Аналогичные тенденции наблюдались для внутриклеточного ( P = 0,06) и внеклеточного ( P = 0.03) в счет. Доля внеклеточных организмов также снижалась с увеличением продолжительности заболевания, но при множественном регрессионном анализе, учитывающем возраст и множественную лекарственную устойчивость, эта тенденция не достигла статистической значимости ( P = 0,058).
Каловые культуры.
S. typhi был выделен из 24 из 167 образцов стула пациентов. Среднее количество бактерий в крови у пациентов с положительными культурами стула было значительно выше, чем у пациентов с отрицательными культурами: 3 (IQR, 0.От 7 до 7,3) КОЕ / мл по сравнению с 1 (IQR, <0,3 до 3,0) КОЕ / мл ( P = 0,02). Относительный риск носительства стула у пациентов с инфекциями, вызванными множественной лекарственной устойчивостью S. typhi , по сравнению с таковым для пациентов с инфекциями, вызванными полностью чувствительными S. typhi , составлял 3,0 (95% ДИ от 0,75 до 12,3) ( P = 0,15).
ОБСУЖДЕНИЕ
Кишечная лихорадка – это характерный клинический синдром, который клинически и патологически отличается от других сепсисов, вызываемых грамотрицательными бактериями.Заболевание имеет подострое начало и хроническое течение при отсутствии лечения, но оно редко вызывает эндотоксический шок и несет значительно меньшую смертность, чем другие сепсисы, вызванные грамотрицательными бактериями (6, 12, 15, 16, 23). Несмотря на эти различия, уровни бактериемии у пациентов с неосложненным брюшным тифом (среднее количество 1 КОЕ / мл; смертность <1%) (27) аналогичны уровням бактериемии, вызванной другими энтеробактериями (смертность от 10 до 50%) (6 , 16, 27). Приблизительно у 50% пациентов с брюшным тифом с положительными культурами крови уровень крови составляет менее 1 КОЕ / мл, а у 10% - более 50 КОЕ / мл.Таким образом, патологические различия между сепсисом, вызываемым возбудителями кишечной лихорадки, и сепсисом, вызываемым другими энтеробактериями, нельзя объяснить различиями в количестве микроорганизмов, циркулирующих в крови. В предыдущем исследовании 25 пациентов с брюшным тифом, о котором сообщил Батлер и др., Количество бактерий в крови было выше: у пяти пациентов количество более 100 КОЕ / мл (3). В этой серии небольшой объем (0,1 мл) крови высевали непосредственно на агар, содержащий желчь, который мог высвободить внутриклеточные организмы.Пациенты также были тяжелее (у троих были кишечные кровотечения, двое умерли). Однако перфорация кишечника и кровотечение обычно являются признаками поздней стадии брюшного тифа и связаны с более низкими диагностическими результатами при посеве крови (5, 17). В настоящее исследование не были включены тяжелобольные пациенты, составляющие менее 5% всех случаев в этой области (хотя у 14 из 374 пациентов были признаки кровотечения из верхних отделов желудочно-кишечного тракта). Диапазон количества бактерий в крови в этом большом исследовании брюшного тифа аналогичен таковым в гораздо меньших исследованиях, о которых ранее сообщали Rubin et al., используя, во-первых, метод полуколичественной гибридизации ДНК (19) и, во-вторых, прямые культуры (18).
С точки зрения внутренней токсичности разница между энтеробактериями незначительна. Очищенный эндотоксин S. typhi аналогичен по цитотоксичности и способности индуцировать высвобождение провоспалительных цитокинов с таковым из Escherichia coli (26). Однако сепсис, вызванный грамотрицательными бактериями, часто возникает внезапно, тогда как подострое прогрессирование брюшного тифа может способствовать развитию толерантности к эндотоксинам (11, 14).Сальмонеллы, в том числе S. typhi , развили механизмы подавления воспалительной реакции, предположительно для облегчения устойчивости и передачи (7). Как и при других тяжелых бактериальных инфекциях, более высокие бактериемии чаще обнаруживались у детей с брюшным тифом и были связаны с более высокими пиковыми температурами. Это может отражать более низкий фоновый иммунитет. Принципиальное различие между системной инфекцией сальмонеллами и другими энтеробактериями заключается в том, что две трети бактерий в системе кровообращения находятся внутри фагоцитарных клеток, где они остаются жизнеспособными.Таким образом, количество внеклеточных организмов в кровотоке у пациентов с брюшным тифом обычно ниже, чем у пациентов с другими системными инфекциями.
Концентрация бацилл брюшного тифа в лейкоцитарной пленке (предположительно в моноцитах и полиморфно-ядерных лейкоцитах) означает, что прямое высевание этого клеточного слоя представляет собой альтернативный и более быстрый метод диагностики, чем посев на бульоне из цельной крови. Колонии обычно проявлялись после инкубации в течение ночи. В этом исследовании среднее количество организмов на одну фагоцитарную клетку составляло 1.3, цифра, идентичная приведенной Rubin et al. (18). Лизинг фагоцитарных клеток увеличивал абсолютное количество идентифицированных КОЕ, но не повышал чувствительность процедуры. В целом, культура лейкоцитной пленки была такой же чувствительной, как и культура на бульоне из цельной крови, и позволяла раньше идентифицировать организм и тестировать чувствительность к противомикробным препаратам. Загрязнение в этом исследовании было редким. Культивирование баффи может быть особенно полезно для маленьких детей, которые склонны к более высоким уровням бактериемии, так как это позволяет взять меньший общий объем крови.Плазма одного и того же образца может использоваться как для биохимических, так и для серологических тестов.
В этом исследовании количество бактерий в крови снижалось с увеличением продолжительности болезни. Снижение диагностической чувствительности посева крови с увеличением продолжительности болезни при брюшном тифе было хорошо известно на протяжении всего столетия. В 1907 году обзор литературы показал, что 89% посевов крови были положительными на первой неделе брюшного тифа, 73% были положительными на второй, 60% были положительными на третьей и только 26% были положительными на четвертой и четвертой неделе. последующие недели (5).Современные среды для культивирования крови содержат полианэтолесульфонат натрия (Liquoid) и могут лучше выращивать меньшее количество бактерий, чем те, которые использовались ранее (8, 9), но тенденция в этом большом исследовании была той же. Уменьшение количества бактерий в крови совпадает с увеличением риска язвы и кровотечений в тонкой кишке, поскольку тифоидные бациллы концентрируются в пятнах Пейера, а участки некроза образуются в стенке кишечника.
В других исследованиях, в которых множественная лекарственная устойчивость была связана с тяжестью брюшного тифа, эта связь была приписана неправильному начальному лечению и, следовательно, дальнейшему прогрессированию заболевания и последующему обращению в больницу (2, 25).В этом исследовании у пациентов с брюшным тифом, вызванным штаммами с множественной лекарственной устойчивостью, в крови было больше бактерий S. typhi , чем у пациентов, инфицированных чувствительными к антибиотикам организмами. У них также была немного меньшая продолжительность предшествующего заболевания, поэтому предыдущее лечение неэффективными противомикробными препаратами вряд ли объяснит более высокий уровень бактериемии в этой группе. Хотя нельзя однозначно исключить неэффективное предыдущее лечение, поскольку многие пациенты не уверены в том, какие лекарства они получали, фторхинолоны были антибиотиками, которые с наибольшей вероятностью назначались вне больницы в местах проведения исследования (22a), и они должны были быть столь же эффективными против лекарственно-устойчивые и чувствительные бактерии.Кроме того, фторхинолоны обычно стерилизуют кровь у пациентов с брюшным тифом в течение 2 дней, поэтому маловероятно, что были проведены серьезные курсы лечения антибиотиками. Пациенты с инфекциями, вызываемыми бактериями с множественной лекарственной устойчивостью, как правило, были моложе, но в многофакторном анализе лекарственная устойчивость была независимо связана с более высокими бактериемиями. Это предполагает, что фенотип множественной лекарственной устойчивости может быть связан с вирулентностью у S. typhi . Множественная устойчивость у S.typhi кодируется генами, содержащимися в больших переносимых плазмидах. Неизвестно, несут ли эти плазмиды другие гены вирулентности или сами механизмы устойчивости каким-то образом повышают выживаемость и размножение бактерий in vivo.
Посевы кала при однократном приеме дали положительный результат на S. typhi у 14,3% из 167 пациентов. Носительство S. typhi в стуле было связано со значительно более высоким содержанием бактерий в крови. Поскольку множественная лекарственная устойчивость также была положительно связана с количеством бактерий в крови, пациенты, инфицированные мультирезистентными бактериями, с большей вероятностью выделяли организмы со стулом, хотя эта разница не достигла статистической значимости.Если исследования с участием большего числа пациентов подтвердят это наблюдение, то связь лекарственной устойчивости с увеличением бактериемии, а также повышенным потенциалом передачи может дать правдоподобное объяснение недавнему очень быстрому распространению бацилл брюшного тифа с множественной лекарственной устойчивостью в южной части Вьетнама.
БЛАГОДАРНОСТИ
Мы очень благодарны директорам и персоналу провинциальной больницы Донг Тап и Центра тропических болезней в Хошимине.Мы особенно благодарны отделам микробиологии обоих учреждений за их помощь и Джули Симпсон за советы по статистике.
Это исследование было поддержано британским фондом Wellcome Trust.
СПИСОК ЛИТЕРАТУРЫ
1. Бауэр А. В., Кирби В. М., Шерис Дж. С., Терк М. Определение чувствительности к антибиотикам с помощью стандартизированного метода с одним диском. Am J Clin Pathol. 1978; 45: 493–496. [PubMed] [Google Scholar] 2. Бхутта З. А., Нагви С. Х., Раззак Р. А., Фаруки Б. Дж. Брюшной тиф с множественной лекарственной устойчивостью у детей: презентация и клинические особенности.Rev Infect Dis. 1991; 13: 832–836. [PubMed] [Google Scholar] 3. Батлер Т., Белл В. Р., Левин Дж., Линь Н. Н., Арнольд К. Брюшной тиф; исследования свертывания крови, бактериемии и эндотоксемии. Arch Intern Med. 1978; 138: 407–410. [PubMed] [Google Scholar] 4. Chinh N T, Solomon T, Thong M X, Ly N T, Hoa N T T, Wain J, Diep T. S, Smith M D, Day N P J, Phi L T, Parry C. M, White N J. Короткие курсы офлоксацина для лечения кишечной лихорадки. Trans R Soc Trop Med Hyg. 1997. 91: 347–349. [PubMed] [Google Scholar] 5.Коулман В., Бакстон Б. Х. Бактериология крови при брюшном тифе: анализ 1602 случаев. Am J Med Sci. 1907; 133: 896–903. [Google Scholar] 6. DuPont HL, Spink W. W. Инфекции, вызванные грамотрицательными микроорганизмами: анализ 860 пациентов с бактериемией в медицинском центре Университета Миннесоты, 1958–1966. Медицина. 1969; 48: 307–332. [PubMed] [Google Scholar] 7. Эйзенштейн Т. К., Аль-Рамади Б. К., Хуанг Д. Иммунитет и иммуносупрессия, индуцированные ослабленной Salmonella : роль оксида азота.В: Кабельо Ф, редактор. Биология сальмонеллы. Нью-Йорк, Нью-Йорк: Plenum Press; 1993. С. 265–276. [Google Scholar] 9. Эскамилла Дж., Сантьяго Л. Т., Сангаланг Р. П., Раноа С. П., Кросс Дж. Х. Сравнительное исследование трех систем культивирования крови для выделения кишечной лихорадки Salmonella . Юго-Восточная Азия J Trop Med Public Health. 1984. 15: 161–166. [PubMed] [Google Scholar] 10. Фостер В. Д. Лабораторная диагностика брюшного тифа. Ланцет. 1975; II: 80. [PubMed] [Google Scholar] 11. Грейсман С. Э., Вудворд С. Л.Исследования in vivo роли печени в эндотоксиновой лихорадке и толерантности. J Clin Invest. 1970; 49: 37а – 38а. [Google Scholar] 12. Холл В. Х., Голд Д. Шок, связанный с бактериемией. Arch Intern Med. 1955; 96: 403–412. [PubMed] [Google Scholar] 13. Хоффман С.Л., Пенджаби Н.Х., Рокхилл Р.К., Сутомо А., Риваи А.Р., Пулунгсих С.П. Дуоденальный посев на нити-капсулу в сравнении с культурами костного мозга, крови и ректальных мазков для диагностики брюшного тифа и паратифа. J Infect Dis. 1984. 149: 157–161. [PubMed] [Google Scholar] 14.Хорник Р. Б., Грейсман С. Е., Вудворд Т. Е., Дюпон Н. Л., Докинз А. Т., Снайдер М. Дж. Брюшной тиф: патогенез и иммунологический контроль. N Engl J Med. 1970; 283: 686–691. и 739–746. [PubMed] [Google Scholar] 15. Kluge R M, DuPont H L. Факторы, влияющие на смертность пациентов с бактериемией. Surg Gynecol Obstet. 1973; 137: 137–267. [PubMed] [Google Scholar] 16. Крегер Б. Э., Крейвен Д. Э. Грамотрицательная бактериемия. III. Переоценка этиологии, эпидемиологии и экологии у 612 пациентов. Am J Med. 1980. 68: 332–343.[PubMed] [Google Scholar] 17. Паркер М. Т. Сальмонелла. В: Уилсон Дж., Майлз А., Паркер М. Т., редакторы. Принципы бактериологии, вирусологии и иммунитета Топли и Вильсона. 7-е изд. Лондон, Англия: Эдвард Арнольд; 1983. С. 332–355. [Google Scholar] 18. Rubin FA, McWhirter PD, Burr D, Punjabi NH, Lane E, Kumala S, Sudarmono P, Pulungsih SP, Lesmana M, Tjaniadi P, Sukri N, Hoffman S.L. Быстрая диагностика брюшного тифа путем идентификации Salmonella typhi в 18 часов сбора образцов путем культивирования фракции мононуклеарных клеток и тромбоцитов крови.J Clin Microbiol. 1990; 28: 825–827. [Бесплатная статья PMC] [PubMed] [Google Scholar] 19. Rubin FA, McWhirter PD, Punjabi NH, Lane E, Sudarmono P, Pulungsih SP, Lesmana M, Kumala S, Kopecko DJ, Hoffman S.L. Использование зонда ДНК для обнаружения Salmonella typhi в крови пациентов с брюшным тифом . J Clin Microbiol. 1989; 27: 1112–1114. [Бесплатная статья PMC] [PubMed] [Google Scholar] 21. Стюарт М. Д., Пуллен Р. Л. Брюшной тиф: клинический анализ трехсот шестидесяти случаев. Arch Intern Med. 1946; 78: 629–661.[PubMed] [Google Scholar] 22. Vinh H, Wain J, Hanh V T N, Nga C N, Chinh M T, Bethell D, Hoa N T T, Diep T. S, Dung N M, White N J. Двух или трехдневное лечение офлоксацином неосложненного брюшного тифа с множественной лекарственной устойчивостью у детей. Антимикробные агенты Chemother. 1996; 40: 958–961. [Бесплатная статья PMC] [PubMed] [Google Scholar]22a. Уэйн, Дж. И К. М. Парри. Неопубликованное наблюдение.
23. Уолш А. Л., Смит М. Д., Вутиеканун В., Супуттамонгкол Ю., Чаовагуль В., Дэнс Д. А. Б, Ангус Б., Уайт Н. Дж.Прогностическое значение количественной бактериемии при септическом мелиоидозе. Clin Infect Dis. 1995; 21: 1498–1500. [PubMed] [Google Scholar] 24. Уотсон К. Выделение Salmonella typhi из кровотока. J Lab Clin Med. 1955. 46: 128–134. [PubMed] [Google Scholar] 25. Уайт Н. Дж., Пэрри С. М. Лечение брюшного тифа. Curr Opin Infect Dis. 1996; 9: 298–302. [Google Scholar] 26. Уилсон Б. М., Северн А., Рэпсон Н. Т., Чана Дж., Хопкинс П. Удобная система цельной крови для изучения регуляции высвобождения фактора некроза опухоли бактериальным липополисахаридом.J Immunol Methods. 1991; 139: 233–240. [PubMed] [Google Scholar]Количественное определение бактерий в крови пациентов с брюшным тифом и взаимосвязь между количеством и клиническими характеристиками, трансмиссивностью и устойчивостью к антибиотикам
J Clin Microbiol. 1998 Jun; 36 (6): 1683–1687.
, 1, 2, 3 , 2 , 4 , 1, 3 , 2 , 1, 2, 3 и 1 3, *Джон Уэйн
Отдел клинических исследований Wellcome Trust 1 и Отдел микробиологии, 2 Центр тропических болезней, Больница Чо Куан, Хошимин, и Больница Донг Тап, Цао Лань, Dong Thap, 4 Vietnam, и Центр тропической медицины, Департамент клинической медицины Наффилда, Оксфордский университет, Оксфорд, Соединенное Королевство 3
To Song Diep
Wellcome Trust Clinical Research Unit 1 и Департамент микробиологии, 2 Центр тропических болезней, Больница Чо Куан, Хошимин, и Больница Донг Тхап, Као Лань, Донг Тхап, 4 Вьетнам, и Центр тропической медицины, Департамент клинической медицины Наффилда, О. xford University, Oxford, United Kingdom 3
Vo Anh Ho
Wellcome Trust Clinical Research Unit 1 и Департамент микробиологии, 2 Центр тропических болезней, Больница Чо Куан, Хошимин и Донг Тап Госпиталь, Као Лань, Донг Тхап, 4 Вьетнам, и Центр тропической медицины, Кафедра клинической медицины Наффилда, Оксфордский университет, Оксфорд, Соединенное Королевство 3
Аманда М.Walsh
Wellcome Trust Clinical Research Unit 1 и Департамент микробиологии, 2 Центр тропических болезней, Больница Чо Куан, Хошимин, и Больница Донг Тхап, Као Лань, Донг Тхап, 4 Вьетнам, и Центр тропической медицины, Департамент клинической медицины Наффилда, Оксфордский университет, Оксфорд, Соединенное Королевство 3
Нгуен Тхи Туйет Хоа
Wellcome Trust Отдел клинических исследований 1 и Департамент микробиологии, 2 Центр тропических болезней, Больница Чо Куан, Хошимин, и больница Донг Тхап, Као Лань, Донг Тхап, 4 Вьетнам, и Центр тропической медицины, Кафедра клинической медицины Наффилда, Оксфордский университет, Оксфорд, Соединенное Королевство 3
Кристофер М.Parry
Wellcome Trust Отдел клинических исследований 1 и Департамент микробиологии, 2 Центр тропических болезней, Больница Чо Куан, Хошимин, и Больница Донг Тхап, Као Лань, Донг Тап, 4 Вьетнам, и Центр тропической медицины, Кафедра клинической медицины Наффилда, Оксфордский университет, Оксфорд, Соединенное Королевство 3
Николас Дж. Уайт
Wellcome Trust Отдел клинических исследований 1 и Департамент микробиологии, 2 Центр тропических болезней, Больница Чо Куан, Хошимин, и Больница Донг Тхап, Као Лань, Донг Тхап, 4 Вьетнам, и Центр тропической медицины, Кафедра клинической медицины Наффилда, Оксфордский университет, Оксфорд, Великобритания 3
Wellcome Доверьте отдел клинических исследований 1 и отдел микробиологии, 2 Центр тропических болезней, больница Чо Куан, Хошимин, ан. d Больница Донг Тхап, Као Лань, Донг Тхап, 4 Вьетнам, и Центр тропической медицины, Кафедра клинической медицины Наффилда, Оксфордский университет, Оксфорд, Соединенное Королевство 3
* Автор, отвечающий за переписку.Почтовый адрес: Отдел клинических исследований Wellcome Trust, Центр тропических болезней, Больница Чо Куан, Хошимин, Вьетнам. Телефон: 84 88 353954. Факс: 84 88 353904. Электронная почта: [email protected].Поступило 30 декабря 1997 г .; Изменения запрошены 8 февраля 1998 г .; Принято 3 марта 1998 г.
Copyright © 1998, Американское общество микробиологов. Эта статья цитируется в других статьях в PMC.Abstract
Salmonella typhi была выделена из 369 и Salmonella paratyphi A был выделен у 6 из 515 вьетнамских пациентов с подозрением на кишечную лихорадку.По сравнению с традиционным культивированием крови в бульоне, прямой посев на лейкоцитарную пленку имел диагностическую чувствительность 99,5% (95% доверительный интервал [ДИ] от 97,1 до 100%). Количество бактерий в крови оценивали методом наливной чашки. Среднее количество S. typhi в крови составляло 1 КОЕ / мл (диапазон от <0,3 до 387 КОЕ / мл), из которых в среднем 63% (95% ДИ, от 58 до 67%) были внутриклеточными. Среднее количество бактерий на инфицированный лейкоцит составляло 1,3 (межквартильный размах [IQR], 0,7–2,4) КОЕ / клетку ( n = 81).У детей (<15 лет; n = 115) среднее количество бактерий в крови было выше, чем у взрослых ( n = 262): 1,5 (диапазон от <0,3 до 387) против 0,6 (диапазон от <0,3 до 17,7) КОЕ / мл ( P = 0,008), а пациенты, которые выделяли S. typhi с фекалиями, имели более высокие бактериемии, чем те, кто этого не делал: в среднем 3 (диапазон от <0,3 до 32) против 1 (диапазон от <0,3 до 68 ) КОЕ / мл ( P = 0,02). Количество бактерий в крови снижалось с увеличением продолжительности болезни ( P = 0.002) и были выше при инфекциях, вызванных S. typhi с множественной лекарственной устойчивостью (1,3 [диапазон от <0,3 до 387] КОЕ / мл; n = 313), чем при инфекциях, вызванных чувствительными к антибиотикам S. typhi (0,5 [диапазон от <0,3 до 32] КОЕ / мл; n = 62) ( P = 0,006). В многофакторном анализе это оказалось независимой ассоциацией, предполагающей связь между устойчивостью к антибиотикам и вирулентностью у S. typhi.
Брюшной тиф – это длительное заболевание, характеризующееся бактериемией, вызванной Salmonella typhi , высокоразвитым грамотрицательным бактериальным паразитом, поражающим только людей.Несмотря на бактериологическое сходство между S. typhi и другими энтеробактериями, клиническая картина брюшного тифа обычно отличается и во многих отношениях отличается от таковой при других септицемиях, вызываемых грамотрицательными микроорганизмами. В целом, пациенты с брюшным тифом менее тяжелы, и тяжесть брюшного тифа обычно отражает локализацию инфекции на пятнах Пейера и последующее изъязвление кишечника, а не фульминантную сепсис. Информации о количестве бактерий в крови и их связи с болезненным состоянием мало (17).При стандартном культивировании в бульоне сальмонеллы были обнаружены в крови от 30 до 90% пациентов с клинически подозреваемыми случаями кишечной лихорадки, а доля больных брюшным тифом с положительными культурами крови уменьшается с увеличением продолжительности болезни (3, 5, 20 , 21). Объем взятой крови и лабораторные методы, используемые для выделения, также являются важными факторами, определяющими выход при посеве крови (3–6, 10, 13, 17, 18, 20, 24). S. typhi способен выживать и воспроизводиться внутри моноцитарных фагоцитов, а при брюшном тифе S.typhi , как сообщается, ограничивается фракцией моноцитов-тромбоцитов крови (5, 17, 18, 24). Чтобы исследовать взаимосвязь между количеством бактерий в крови и клиническими и лабораторными признаками брюшного тифа, мы выполнили количественные бактериологические культуры для большой группы пациентов с неосложненной кишечной лихорадкой.
МАТЕРИАЛЫ И МЕТОДЫ
Пациенты.
Взрослые и дети, госпитализированные с подозрением на неосложненный брюшной тиф, изучались в течение 3-летнего периода в двух разных учреждениях во Вьетнаме: Центре тропических болезней, Хошимин, инфекционной больнице и больнице Дружбы, Цао Лань. Город, большая провинциальная больница в провинции Донг Тхап в дельте Меконга.Эти пациенты были набраны для проспективных исследований краткосрочного курса фторхинолоновой терапии на основании клинических подозрений или положительного посева крови. Критериями клинического диагноза брюшного тифа обычно служили лихорадка в течение ≥6 дней без явного очага инфекции, отрицательный мазок крови на малярию и дискомфорт в животе при изменении привычек кишечника. В некоторых случаях замкнутое или апатичное поведение пациентов при лихорадке также было диагностическим признаком.Пациенты с тяжелым или осложненным брюшным тифом (за исключением тех, у кого в анамнезе была только мелена) и те, кто уже получал эффективное лечение антибиотиками (т. Е. Антибиотиками, активными против S. typhi ), не были включены в эти исследования. Перед началом лечения брали кровь для стандартных лабораторных анализов и посева, как описано ниже, и, когда это было возможно, не откладывая начало лечения, культивировали образец кала на Salmonella . Полностью информированное согласие на забор крови было получено от всех пациентов.Это исследование было одобрено научным и этическим комитетами участвующих учреждений.
Лабораторные методы.
В обоих центрах использовались одинаковые лабораторные методы. У каждого пациента в асептических условиях брали от пяти до десяти миллилитров венозной крови и вносили в 50 мл бульона для инфузии мозга и сердца (Oxoid, Basingstoke, Великобритания), содержащего 0,05% полианэтолесульфоната натрия (Sigma, Poole, Великобритания). Поддерживали минимальное соотношение кровь-бульон от 1 до 10.Бульоны для культур крови инкубировали в течение 7 дней, а субкультивирование проводили через 24 часа и через 7 дней. Все флаконы также проверяли ежедневно, и если флакон показывал видимые признаки роста, проводили пересев на агар с овечьей кровью. Культивирование стула проводили после обогащения пробы массой 1 г в 10 мл селенитного бульона в течение 24 ч. Затем пять микролитров из верхней части бульона высевали на агар XLD (Oxoid). Бактериальные изоляты были идентифицированы стандартными биохимическими тестами (глюкоза, ферментация лактозы и образование газа, выработка индола и H 2 S, утилизация цитрата, подвижность и способность расщеплять мочевину) и агглютинация с Salmonella 09- и Vi-специфичными. антисыворотки (Wellcome Diagnostics, Дартфорд, Великобритания).Чувствительность дисков к антибиотикам определяли с использованием модификации метода Bauer et al. (1). Организмы, устойчивые к хлорамфениколу, ампициллину, триметоприму и сульфаметоксазолу, но чувствительные к офлоксацину и цефтриаксону, были описаны как устойчивые к множеству лекарственных препаратов.
Количественные культуры.
Венозная кровь для количественного посева и культивирования в бульоне была взята перед введением противомикробных препаратов от брюшного тифа. Кровь (от 3 до 9 мл у взрослых и от 1,5 до 6 мл у детей) собирали в стерильную гепаринизированную пробирку и немедленно отправляли в лабораторию.Количественные посевы цельной крови (QBC) проводили методом заливки на чашках. Вкратце, три отмеренные аликвоты крови (обычно 1 мл; 0,5 мл для маленьких детей) смешивали с 19 мл расплавленного (50 ° C) колумбийского агара (Unipath, Бейзингсток, Соединенное Королевство) в стерильной чашке Петри и оставляли для застывания. , а затем инкубировали при 37 ° C. Через 2-4 дня колонии подсчитывали и записывали как КОЕ на миллилитр. Для идентификации с поверхности агара собирали до пяти колоний. После повторной инкубации в течение 24 часов были выполнены стандартные биохимические тесты и агглютинация со специфической антисывороткой.Планшеты отбрасывали как отрицательные, если через 4 дня инкубации не было видно колоний.
Для определения количества внутрилейкоцитарных КОЕ в образцах крови были выполнены количественные посевы лейкоцитов периферической крови. Это исследование проводилось на случайно выбранной подгруппе пациентов. Гепаринизированную цельную кровь (2,5 или 5 мл), взятую одновременно с QBC, центрифугировали при 2700 × г в течение 10 мин. Плазму осторожно удаляли стерильной пластиковой пипеткой, и 0.1 мл, включая слой лейкоцитов, аспирировали стерильным шприцем на 1 мл. Количественные культуры были выполнены на этом 0,1-миллилитровом образце путем смешивания его с 19 мл расплавленного колумбийского агара, выливания смеси в виде чашки с агаром и инкубации в течение до 4 дней. Фагоциты периферической крови, содержащие более одной бактерии, будут производить одну колонию в твердой культуральной среде. Таким образом, для образцов цельной крови и лейкоцитов результаты выражались в КОЕ на миллилитр. Чтобы точно определить количество внутриклеточных бактерий на инфицированный фагоцит, секунда 0.Отбирали 1 мл образца лейкоцитов и лейкоциты лизировали путем инкубации с 0,1 мл 0,1% дигитонина (Sigma) в течение 10 мин при 37 ° C. Это должно было высвободить внутриклеточные бактерии. Затем количественные культуры были выполнены на этом образце так же, как и для первого образца, то есть путем смешивания с 19 мл расплавленного агара Колумбия, выливания смеси в виде чашки с агаром и инкубации при 37 ° C в течение до 4 дней. . Чтобы исключить возможность того, что локализация бактерий в лейкоцитарной пленке была артефактом этапа центрифугирования, в 10 мл крови здорового добровольца засевали 10 4 КОЕ из S.typhi и сразу центрифугировали при 2700 × g в течение 10 мин. Объем 0,1 мл лейкоцитарной пленки и 0,1 мл слоя эритроцитов собирали стерильными шприцами объемом 1 мл, смешивали с 19 мл расплавленного агара Columbia и давали возможность застыть, как описано выше. Бактериальные колонии подсчитывали через 4 дня инкубации при 37 ° C.
Расчет количества бактерий.
Число бактерий S. typhi на миллилитр крови (QBC) оценивали по количеству КОЕ на каждой разливочной пластине.Минимальный объем цельной крови, используемой для количественных методов от одного пациента, составлял 1,5 мл для маленьких детей и 3 мл для взрослых и детей старшего возраста. Это дает нижний предел обнаружения 0,7 или 0,3 КОЕ на мл соответственно. При сообщении количества бактерий в образцах лейкоцитарной пленки и лизированной лейкоцитарной пленки знаменателем был объем цельной крови, из которой был взят лейкоцит. У пациентов с положительной культурой в бульоне, но отрицательной по QBC, количественное значение оценивали по общему объему посевной крови: 0.От 7 до 1,0 КОЕ / мл из 1,5 мл крови и от 0,3 до 1,0 КОЕ / мл из 3 мл крови. Жизнеспособные бактерии в образце лейкоцитарной пленки объемом 0,1 мл считались внутрилейкоцитарными, а организмы в оставшейся части крови считались находящимися в плазме. Поэтому количество внеклеточных бактерий рассчитывали по следующей формуле: (КОЕ / мл цельной крови) – (КОЕ / мл лейкоцитарной пленки). Среднее количество жизнеспособных бактерий на инфицированный лейкоцит рассчитывали по следующей формуле: количество лизированных лейкоцитов (в бактериях на миллилитр) / количество нелизированных лейкоцитов (в инфицированных клетках на миллилитр).
Статистический анализ.
SPSS for Windows (SPSS Benelux Inc., Gorinchem, Нидерланды) версии 6 использовался для всех статистических анализов. Коэффициенты частичной корреляции были рассчитаны для связи между непрерывными переменными и количеством бактерий. Различия в количестве бактерий между группами, определяемыми дихотомическими переменными, проверяли с помощью U-критерия Манна-Уитни. Потенциально мешающие переменные (место и / или возраст) контролировались, и все данные с нестандартным распределением ранжировались до того, как были выполнены корреляционные тесты для ранжированных данных.Взаимодействия оценивались с помощью многомерного анализа.
РЕЗУЛЬТАТЫ
Посев крови в бульоне был проведен у 515 взрослых и детей с подозрением на кишечную лихорадку в период с марта 1993 г. по март 1996 г. (таблица). Все пациенты получали лечение офлоксацином перорально (общая доза от 60 до 135 мг / кг массы тела в течение 2–5 дней), как сообщалось в других источниках (4, 22), и все выздоровели. Возбудители кишечной лихорадки выделены от 375 (72,8%) пациентов: S. typhi от 369 пациентов и Salmonella paratyphi A от 6 пациентов.У двух пациентов QBC на чашке для заливки был положительным, но посевы крови в бульоне были отрицательными. Salmonella derby была выделена из крови одного пациента, и этот пациент был признан отрицательным по возбудителям кишечной лихорадки и исключен из анализа. Большинство изолятов S. typhi (313; 80%) обладали множественной лекарственной устойчивостью, то есть устойчивы к хлорамфениколу, триметоприм-сульфаметоксазолу и ампициллину. Подсчет бактерий как в цельной крови, так и в лейкоцитарной пленке был проведен у 187 пациентов.Эти пациенты имели клинические параметры при поступлении, аналогичные таковым у 188 пациентов с кишечной лихорадкой, которым проводился только QBC цельной крови. Одновременно были взяты образцы цельной крови, лейкоцитарной пленки и лизированной лейкоцитарной пленки у подгруппы из 81 пациента. Эти пациенты имели немного более короткую продолжительность болезни перед госпитализацией, т. Е. В среднем составляли 7 (диапазон от 2 до 33) дней по сравнению со средним значением в 9 (диапазон от 2 до 33) дней в целом, но во всех других отношениях их клинические проявления были похожи.
ТАБЛИЦА 1
Клинические и лабораторные параметры для пациентов с подозрением на кишечную лихорадку
| Переменная | Значение для: | |
|---|---|---|
| Все включенные пациенты ( n = 514) | Пациенты с положительным посевом крови ( n = 375) | |
| Возраст (лет) a | 12,9 (9) 14 (9,5) | |
| Продолжительность предшествующей лихорадки (дни) b | 9 (от 7 до 12; от 2 до 33) | 10 (от 7 до 13; от 2 до 33) |
| Температура (° C) а | 39.3 (1.0) | 39.1 (1.0) |
| Гепатомегалия c | 337 из 511 (66) | 237 из 375 (64) |
| Melena c | (4)14 из 374 (4) | |
| Рвота c | 91 из 508 (18) | 69 из 378 (18) |
| Боль в животе c | 32161 | (509)106 из 378 (62) |
| Диарея c | 325 из 506 (64) | 234 из 378 (62) |
| Желтуха a | 5 из 90 5122 9025 460 из 378 (1.1) | |
| Пиковая температура (° C) a | 39,7 (0,9) | 39,7 (0,9) |
| Пятна розы c | 18 из 482 (4) | 17 из 378 ( 5) |
| Количество лейкоцитов / мкл a | 7,300 (3,402) | 7,629 (3,121) |
| Гематокрит (%) a | 33,2 (4,960) 9024 | |
| Число тромбоцитов / мкл a | 180 000 (89 000) | 196 615 (84 795) |
Прямое нанесение на лейкоцитарную пленку.
Прямой посев лейкоцитов был проведен у 192 пациентов со случаями кишечной лихорадки с положительной культурой на бульоне: 190 из 191 S. typhi и 1 из 1 S. paratyphi A культуры были положительными, чувствительность 99,5% ( 95% доверительный интервал [ДИ], от 97,1 до 100%). Хотя точное время образования колоний из культур лейкоцитов не регистрировалось, подсчет обычно был возможен после инкубации в течение ночи. Существенного загрязнения не произошло.
Количественные результаты культивирования.
Среднее количество S. typhi в цельной крови пациентов с неосложненной кишечной лихорадкой ( n = 375) составляло 1 КОЕ / мл (межквартильный диапазон [IQR], <0,3–5; диапазон, <0,3–387) (Инжир. ). В среднем 37,5% (95% ДИ, от 32,9 до 42,1%) КОЕ были получены от организмов, распределенных в слоях эритроцитов и плазмы ( n = 187), а оставшиеся 62,5% жизнеспособных бактерий были сконцентрированы в лейкоцитарной пленке. слой. Среднее количество бактерий на инфицированный лейкоцит составляло 1.3 (IQR, от 0,7 до 2,4) КОЕ / клетку ( n = 81). У детей младше 15 лет ( n = 115) показатели цельной крови были выше, чем у взрослых ( n = 262): в среднем 1,5 (IQR, <0,3 - 6,0; диапазон, <0,3 - 387) по сравнению с медиана 0,6 (IQR, <0,3–2,8; диапазон, <1,3–17,7) КОЕ / мл ( P = 0,008). Количество внеклеточных бактерий также было выше у детей младше 15 лет, чем у взрослых: в среднем 1,5 (диапазон от 0 до 93) против медианы 0,6 (диапазон от 0 до 17.7) ( P = 0,005). Когда в кровь здорового добровольца засевали S. typhi , концентрация организмов, культивируемых из слоя эритроцитов, была такой же, как и в слое лейкоцитарной пленки. Бактерии из плазменного слоя не культивировались. Таким образом, клетки S. typhi не концентрировались в лейкоцитной пленке в результате центрифугирования.
Распределение количества бактерий в крови при остром брюшном тифе.
Устойчивость к антибиотикам и количество бактерий в крови.
Количество QBC было выше у пациентов, инфицированных множественной лекарственной устойчивостью S. typhi ( n = 313), чем у пациентов, инфицированных более чувствительными изолятами ( n = 62): в среднем 1,3 (диапазон, 0 до 387) по сравнению со средним значением 0,5 (диапазон от 0 до 32) КОЕ / мл ( P = 0,006) (рис.). Пациенты, инфицированные штаммами с множественной лекарственной устойчивостью, как правило, были моложе пациентов, инфицированных более чувствительными штаммами: в среднем 10 (IQR, от 6 до 15) по сравнению со средним значением 13 (IQR, от 7 до 24) лет ( P = 0.02). Продолжительность предшествующего заболевания также была немного короче при инфекциях штаммами с множественной лекарственной устойчивостью: в среднем 9 (IQR, от 6 до 12) по сравнению со средним значением в 10 (IQR, от 6 до 15) дней ( P = 0,07). В многофакторном анализе продолжительность предшествующего заболевания, возраст пациента и множественная лекарственная устойчивость изолированного S. typhi были связаны независимо с количеством бактерий в крови ( P = 0,04, P = 0,003 и P = 0,02 соответственно).Связь между количеством бактерий в крови и множественной лекарственной устойчивостью оказалась устойчивой и не могла быть объяснена смешивающими факторами.
Подсчет бактерий в крови пациентов, инфицированных чувствительными к антибиотикам и множественной лекарственной устойчивостью S. typhi . •, медиана; полоски указывают IQR. Каждый кружок представляет одного пациента.
Продолжительность болезни.
С увеличением продолжительности болезни наблюдалось снижение количества бактерий в цельной крови. Средний показатель цельной крови был равен 1.7 (диапазон от <0,2 до 387) КОЕ / мл на первой неделе болезни, 1 (диапазон от 0,2 до 68) КОЕ / мл на второй неделе, 1 (диапазон от <0,2 до 23) КОЕ / мл на третьей неделю и 0,3 (диапазон от <0,2 до 19) КОЕ / мл на четвертой неделе болезни ( P <0,001). Это оставалось статистически значимым, когда и возраст, и местонахождение контролировались в анализе частичной корреляции ( P = 0,002). Аналогичные тенденции наблюдались для внутриклеточного ( P = 0,06) и внеклеточного ( P = 0.03) в счет. Доля внеклеточных организмов также снижалась с увеличением продолжительности заболевания, но при множественном регрессионном анализе, учитывающем возраст и множественную лекарственную устойчивость, эта тенденция не достигла статистической значимости ( P = 0,058).
Каловые культуры.
S. typhi был выделен из 24 из 167 образцов стула пациентов. Среднее количество бактерий в крови у пациентов с положительными культурами стула было значительно выше, чем у пациентов с отрицательными культурами: 3 (IQR, 0.От 7 до 7,3) КОЕ / мл по сравнению с 1 (IQR, <0,3 до 3,0) КОЕ / мл ( P = 0,02). Относительный риск носительства стула у пациентов с инфекциями, вызванными множественной лекарственной устойчивостью S. typhi , по сравнению с таковым для пациентов с инфекциями, вызванными полностью чувствительными S. typhi , составлял 3,0 (95% ДИ от 0,75 до 12,3) ( P = 0,15).
ОБСУЖДЕНИЕ
Кишечная лихорадка – это характерный клинический синдром, который клинически и патологически отличается от других сепсисов, вызываемых грамотрицательными бактериями.Заболевание имеет подострое начало и хроническое течение при отсутствии лечения, но оно редко вызывает эндотоксический шок и несет значительно меньшую смертность, чем другие сепсисы, вызванные грамотрицательными бактериями (6, 12, 15, 16, 23). Несмотря на эти различия, уровни бактериемии у пациентов с неосложненным брюшным тифом (среднее количество 1 КОЕ / мл; смертность <1%) (27) аналогичны уровням бактериемии, вызванной другими энтеробактериями (смертность от 10 до 50%) (6 , 16, 27). Приблизительно у 50% пациентов с брюшным тифом с положительными культурами крови уровень крови составляет менее 1 КОЕ / мл, а у 10% - более 50 КОЕ / мл.Таким образом, патологические различия между сепсисом, вызываемым возбудителями кишечной лихорадки, и сепсисом, вызываемым другими энтеробактериями, нельзя объяснить различиями в количестве микроорганизмов, циркулирующих в крови. В предыдущем исследовании 25 пациентов с брюшным тифом, о котором сообщил Батлер и др., Количество бактерий в крови было выше: у пяти пациентов количество более 100 КОЕ / мл (3). В этой серии небольшой объем (0,1 мл) крови высевали непосредственно на агар, содержащий желчь, который мог высвободить внутриклеточные организмы.Пациенты также были тяжелее (у троих были кишечные кровотечения, двое умерли). Однако перфорация кишечника и кровотечение обычно являются признаками поздней стадии брюшного тифа и связаны с более низкими диагностическими результатами при посеве крови (5, 17). В настоящее исследование не были включены тяжелобольные пациенты, составляющие менее 5% всех случаев в этой области (хотя у 14 из 374 пациентов были признаки кровотечения из верхних отделов желудочно-кишечного тракта). Диапазон количества бактерий в крови в этом большом исследовании брюшного тифа аналогичен таковым в гораздо меньших исследованиях, о которых ранее сообщали Rubin et al., используя, во-первых, метод полуколичественной гибридизации ДНК (19) и, во-вторых, прямые культуры (18).
С точки зрения внутренней токсичности разница между энтеробактериями незначительна. Очищенный эндотоксин S. typhi аналогичен по цитотоксичности и способности индуцировать высвобождение провоспалительных цитокинов с таковым из Escherichia coli (26). Однако сепсис, вызванный грамотрицательными бактериями, часто возникает внезапно, тогда как подострое прогрессирование брюшного тифа может способствовать развитию толерантности к эндотоксинам (11, 14).Сальмонеллы, в том числе S. typhi , развили механизмы подавления воспалительной реакции, предположительно для облегчения устойчивости и передачи (7). Как и при других тяжелых бактериальных инфекциях, более высокие бактериемии чаще обнаруживались у детей с брюшным тифом и были связаны с более высокими пиковыми температурами. Это может отражать более низкий фоновый иммунитет. Принципиальное различие между системной инфекцией сальмонеллами и другими энтеробактериями заключается в том, что две трети бактерий в системе кровообращения находятся внутри фагоцитарных клеток, где они остаются жизнеспособными.Таким образом, количество внеклеточных организмов в кровотоке у пациентов с брюшным тифом обычно ниже, чем у пациентов с другими системными инфекциями.
Концентрация бацилл брюшного тифа в лейкоцитарной пленке (предположительно в моноцитах и полиморфно-ядерных лейкоцитах) означает, что прямое высевание этого клеточного слоя представляет собой альтернативный и более быстрый метод диагностики, чем посев на бульоне из цельной крови. Колонии обычно проявлялись после инкубации в течение ночи. В этом исследовании среднее количество организмов на одну фагоцитарную клетку составляло 1.3, цифра, идентичная приведенной Rubin et al. (18). Лизинг фагоцитарных клеток увеличивал абсолютное количество идентифицированных КОЕ, но не повышал чувствительность процедуры. В целом, культура лейкоцитной пленки была такой же чувствительной, как и культура на бульоне из цельной крови, и позволяла раньше идентифицировать организм и тестировать чувствительность к противомикробным препаратам. Загрязнение в этом исследовании было редким. Культивирование баффи может быть особенно полезно для маленьких детей, которые склонны к более высоким уровням бактериемии, так как это позволяет взять меньший общий объем крови.Плазма одного и того же образца может использоваться как для биохимических, так и для серологических тестов.
В этом исследовании количество бактерий в крови снижалось с увеличением продолжительности болезни. Снижение диагностической чувствительности посева крови с увеличением продолжительности болезни при брюшном тифе было хорошо известно на протяжении всего столетия. В 1907 году обзор литературы показал, что 89% посевов крови были положительными на первой неделе брюшного тифа, 73% были положительными на второй, 60% были положительными на третьей и только 26% были положительными на четвертой и четвертой неделе. последующие недели (5).Современные среды для культивирования крови содержат полианэтолесульфонат натрия (Liquoid) и могут лучше выращивать меньшее количество бактерий, чем те, которые использовались ранее (8, 9), но тенденция в этом большом исследовании была той же. Уменьшение количества бактерий в крови совпадает с увеличением риска язвы и кровотечений в тонкой кишке, поскольку тифоидные бациллы концентрируются в пятнах Пейера, а участки некроза образуются в стенке кишечника.
В других исследованиях, в которых множественная лекарственная устойчивость была связана с тяжестью брюшного тифа, эта связь была приписана неправильному начальному лечению и, следовательно, дальнейшему прогрессированию заболевания и последующему обращению в больницу (2, 25).В этом исследовании у пациентов с брюшным тифом, вызванным штаммами с множественной лекарственной устойчивостью, в крови было больше бактерий S. typhi , чем у пациентов, инфицированных чувствительными к антибиотикам организмами. У них также была немного меньшая продолжительность предшествующего заболевания, поэтому предыдущее лечение неэффективными противомикробными препаратами вряд ли объяснит более высокий уровень бактериемии в этой группе. Хотя нельзя однозначно исключить неэффективное предыдущее лечение, поскольку многие пациенты не уверены в том, какие лекарства они получали, фторхинолоны были антибиотиками, которые с наибольшей вероятностью назначались вне больницы в местах проведения исследования (22a), и они должны были быть столь же эффективными против лекарственно-устойчивые и чувствительные бактерии.Кроме того, фторхинолоны обычно стерилизуют кровь у пациентов с брюшным тифом в течение 2 дней, поэтому маловероятно, что были проведены серьезные курсы лечения антибиотиками. Пациенты с инфекциями, вызываемыми бактериями с множественной лекарственной устойчивостью, как правило, были моложе, но в многофакторном анализе лекарственная устойчивость была независимо связана с более высокими бактериемиями. Это предполагает, что фенотип множественной лекарственной устойчивости может быть связан с вирулентностью у S. typhi . Множественная устойчивость у S.typhi кодируется генами, содержащимися в больших переносимых плазмидах. Неизвестно, несут ли эти плазмиды другие гены вирулентности или сами механизмы устойчивости каким-то образом повышают выживаемость и размножение бактерий in vivo.
Посевы кала при однократном приеме дали положительный результат на S. typhi у 14,3% из 167 пациентов. Носительство S. typhi в стуле было связано со значительно более высоким содержанием бактерий в крови. Поскольку множественная лекарственная устойчивость также была положительно связана с количеством бактерий в крови, пациенты, инфицированные мультирезистентными бактериями, с большей вероятностью выделяли организмы со стулом, хотя эта разница не достигла статистической значимости.Если исследования с участием большего числа пациентов подтвердят это наблюдение, то связь лекарственной устойчивости с увеличением бактериемии, а также повышенным потенциалом передачи может дать правдоподобное объяснение недавнему очень быстрому распространению бацилл брюшного тифа с множественной лекарственной устойчивостью в южной части Вьетнама.
БЛАГОДАРНОСТИ
Мы очень благодарны директорам и персоналу провинциальной больницы Донг Тап и Центра тропических болезней в Хошимине.Мы особенно благодарны отделам микробиологии обоих учреждений за их помощь и Джули Симпсон за советы по статистике.
Это исследование было поддержано британским фондом Wellcome Trust.
СПИСОК ЛИТЕРАТУРЫ
1. Бауэр А. В., Кирби В. М., Шерис Дж. С., Терк М. Определение чувствительности к антибиотикам с помощью стандартизированного метода с одним диском. Am J Clin Pathol. 1978; 45: 493–496. [PubMed] [Google Scholar] 2. Бхутта З. А., Нагви С. Х., Раззак Р. А., Фаруки Б. Дж. Брюшной тиф с множественной лекарственной устойчивостью у детей: презентация и клинические особенности.Rev Infect Dis. 1991; 13: 832–836. [PubMed] [Google Scholar] 3. Батлер Т., Белл В. Р., Левин Дж., Линь Н. Н., Арнольд К. Брюшной тиф; исследования свертывания крови, бактериемии и эндотоксемии. Arch Intern Med. 1978; 138: 407–410. [PubMed] [Google Scholar] 4. Chinh N T, Solomon T, Thong M X, Ly N T, Hoa N T T, Wain J, Diep T. S, Smith M D, Day N P J, Phi L T, Parry C. M, White N J. Короткие курсы офлоксацина для лечения кишечной лихорадки. Trans R Soc Trop Med Hyg. 1997. 91: 347–349. [PubMed] [Google Scholar] 5.Коулман В., Бакстон Б. Х. Бактериология крови при брюшном тифе: анализ 1602 случаев. Am J Med Sci. 1907; 133: 896–903. [Google Scholar] 6. DuPont HL, Spink W. W. Инфекции, вызванные грамотрицательными микроорганизмами: анализ 860 пациентов с бактериемией в медицинском центре Университета Миннесоты, 1958–1966. Медицина. 1969; 48: 307–332. [PubMed] [Google Scholar] 7. Эйзенштейн Т. К., Аль-Рамади Б. К., Хуанг Д. Иммунитет и иммуносупрессия, индуцированные ослабленной Salmonella : роль оксида азота.В: Кабельо Ф, редактор. Биология сальмонеллы. Нью-Йорк, Нью-Йорк: Plenum Press; 1993. С. 265–276. [Google Scholar] 9. Эскамилла Дж., Сантьяго Л. Т., Сангаланг Р. П., Раноа С. П., Кросс Дж. Х. Сравнительное исследование трех систем культивирования крови для выделения кишечной лихорадки Salmonella . Юго-Восточная Азия J Trop Med Public Health. 1984. 15: 161–166. [PubMed] [Google Scholar] 10. Фостер В. Д. Лабораторная диагностика брюшного тифа. Ланцет. 1975; II: 80. [PubMed] [Google Scholar] 11. Грейсман С. Э., Вудворд С. Л.Исследования in vivo роли печени в эндотоксиновой лихорадке и толерантности. J Clin Invest. 1970; 49: 37а – 38а. [Google Scholar] 12. Холл В. Х., Голд Д. Шок, связанный с бактериемией. Arch Intern Med. 1955; 96: 403–412. [PubMed] [Google Scholar] 13. Хоффман С.Л., Пенджаби Н.Х., Рокхилл Р.К., Сутомо А., Риваи А.Р., Пулунгсих С.П. Дуоденальный посев на нити-капсулу в сравнении с культурами костного мозга, крови и ректальных мазков для диагностики брюшного тифа и паратифа. J Infect Dis. 1984. 149: 157–161. [PubMed] [Google Scholar] 14.Хорник Р. Б., Грейсман С. Е., Вудворд Т. Е., Дюпон Н. Л., Докинз А. Т., Снайдер М. Дж. Брюшной тиф: патогенез и иммунологический контроль. N Engl J Med. 1970; 283: 686–691. и 739–746. [PubMed] [Google Scholar] 15. Kluge R M, DuPont H L. Факторы, влияющие на смертность пациентов с бактериемией. Surg Gynecol Obstet. 1973; 137: 137–267. [PubMed] [Google Scholar] 16. Крегер Б. Э., Крейвен Д. Э. Грамотрицательная бактериемия. III. Переоценка этиологии, эпидемиологии и экологии у 612 пациентов. Am J Med. 1980. 68: 332–343.[PubMed] [Google Scholar] 17. Паркер М. Т. Сальмонелла. В: Уилсон Дж., Майлз А., Паркер М. Т., редакторы. Принципы бактериологии, вирусологии и иммунитета Топли и Вильсона. 7-е изд. Лондон, Англия: Эдвард Арнольд; 1983. С. 332–355. [Google Scholar] 18. Rubin FA, McWhirter PD, Burr D, Punjabi NH, Lane E, Kumala S, Sudarmono P, Pulungsih SP, Lesmana M, Tjaniadi P, Sukri N, Hoffman S.L. Быстрая диагностика брюшного тифа путем идентификации Salmonella typhi в 18 часов сбора образцов путем культивирования фракции мононуклеарных клеток и тромбоцитов крови.J Clin Microbiol. 1990; 28: 825–827. [Бесплатная статья PMC] [PubMed] [Google Scholar] 19. Rubin FA, McWhirter PD, Punjabi NH, Lane E, Sudarmono P, Pulungsih SP, Lesmana M, Kumala S, Kopecko DJ, Hoffman S.L. Использование зонда ДНК для обнаружения Salmonella typhi в крови пациентов с брюшным тифом . J Clin Microbiol. 1989; 27: 1112–1114. [Бесплатная статья PMC] [PubMed] [Google Scholar] 21. Стюарт М. Д., Пуллен Р. Л. Брюшной тиф: клинический анализ трехсот шестидесяти случаев. Arch Intern Med. 1946; 78: 629–661.[PubMed] [Google Scholar] 22. Vinh H, Wain J, Hanh V T N, Nga C N, Chinh M T, Bethell D, Hoa N T T, Diep T. S, Dung N M, White N J. Двух или трехдневное лечение офлоксацином неосложненного брюшного тифа с множественной лекарственной устойчивостью у детей. Антимикробные агенты Chemother. 1996; 40: 958–961. [Бесплатная статья PMC] [PubMed] [Google Scholar]22a. Уэйн, Дж. И К. М. Парри. Неопубликованное наблюдение.
23. Уолш А. Л., Смит М. Д., Вутиеканун В., Супуттамонгкол Ю., Чаовагуль В., Дэнс Д. А. Б, Ангус Б., Уайт Н. Дж.Прогностическое значение количественной бактериемии при септическом мелиоидозе. Clin Infect Dis. 1995; 21: 1498–1500. [PubMed] [Google Scholar] 24. Уотсон К. Выделение Salmonella typhi из кровотока. J Lab Clin Med. 1955. 46: 128–134. [PubMed] [Google Scholar] 25. Уайт Н. Дж., Пэрри С. М. Лечение брюшного тифа. Curr Opin Infect Dis. 1996; 9: 298–302. [Google Scholar] 26. Уилсон Б. М., Северн А., Рэпсон Н. Т., Чана Дж., Хопкинс П. Удобная система цельной крови для изучения регуляции высвобождения фактора некроза опухоли бактериальным липополисахаридом.J Immunol Methods. 1991; 139: 233–240. [PubMed] [Google Scholar]Количественное определение бактерий в крови пациентов с брюшным тифом и взаимосвязь между количеством и клиническими характеристиками, трансмиссивностью и устойчивостью к антибиотикам
J Clin Microbiol. 1998 Jun; 36 (6): 1683–1687.
, 1, 2, 3 , 2 , 4 , 1, 3 , 2 , 1, 2, 3 и 1 3, *Джон Уэйн
Отдел клинических исследований Wellcome Trust 1 и Отдел микробиологии, 2 Центр тропических болезней, Больница Чо Куан, Хошимин, и Больница Донг Тап, Цао Лань, Dong Thap, 4 Vietnam, и Центр тропической медицины, Департамент клинической медицины Наффилда, Оксфордский университет, Оксфорд, Соединенное Королевство 3
To Song Diep
Wellcome Trust Clinical Research Unit 1 и Департамент микробиологии, 2 Центр тропических болезней, Больница Чо Куан, Хошимин, и Больница Донг Тхап, Као Лань, Донг Тхап, 4 Вьетнам, и Центр тропической медицины, Департамент клинической медицины Наффилда, О. xford University, Oxford, United Kingdom 3
Vo Anh Ho
Wellcome Trust Clinical Research Unit 1 и Департамент микробиологии, 2 Центр тропических болезней, Больница Чо Куан, Хошимин и Донг Тап Госпиталь, Као Лань, Донг Тхап, 4 Вьетнам, и Центр тропической медицины, Кафедра клинической медицины Наффилда, Оксфордский университет, Оксфорд, Соединенное Королевство 3
Аманда М.Walsh
Wellcome Trust Clinical Research Unit 1 и Департамент микробиологии, 2 Центр тропических болезней, Больница Чо Куан, Хошимин, и Больница Донг Тхап, Као Лань, Донг Тхап, 4 Вьетнам, и Центр тропической медицины, Департамент клинической медицины Наффилда, Оксфордский университет, Оксфорд, Соединенное Королевство 3
Нгуен Тхи Туйет Хоа
Wellcome Trust Отдел клинических исследований 1 и Департамент микробиологии, 2 Центр тропических болезней, Больница Чо Куан, Хошимин, и больница Донг Тхап, Као Лань, Донг Тхап, 4 Вьетнам, и Центр тропической медицины, Кафедра клинической медицины Наффилда, Оксфордский университет, Оксфорд, Соединенное Королевство 3
Кристофер М.Parry
Wellcome Trust Отдел клинических исследований 1 и Департамент микробиологии, 2 Центр тропических болезней, Больница Чо Куан, Хошимин, и Больница Донг Тхап, Као Лань, Донг Тап, 4 Вьетнам, и Центр тропической медицины, Кафедра клинической медицины Наффилда, Оксфордский университет, Оксфорд, Соединенное Королевство 3
Николас Дж. Уайт
Wellcome Trust Отдел клинических исследований 1 и Департамент микробиологии, 2 Центр тропических болезней, Больница Чо Куан, Хошимин, и Больница Донг Тхап, Као Лань, Донг Тхап, 4 Вьетнам, и Центр тропической медицины, Кафедра клинической медицины Наффилда, Оксфордский университет, Оксфорд, Великобритания 3
Wellcome Доверьте отдел клинических исследований 1 и отдел микробиологии, 2 Центр тропических болезней, больница Чо Куан, Хошимин, ан. d Больница Донг Тхап, Као Лань, Донг Тхап, 4 Вьетнам, и Центр тропической медицины, Кафедра клинической медицины Наффилда, Оксфордский университет, Оксфорд, Соединенное Королевство 3
* Автор, отвечающий за переписку.Почтовый адрес: Отдел клинических исследований Wellcome Trust, Центр тропических болезней, Больница Чо Куан, Хошимин, Вьетнам. Телефон: 84 88 353954. Факс: 84 88 353904. Электронная почта: [email protected].Поступило 30 декабря 1997 г .; Изменения запрошены 8 февраля 1998 г .; Принято 3 марта 1998 г.
Copyright © 1998, Американское общество микробиологов. Эта статья цитируется в других статьях в PMC.Abstract
Salmonella typhi была выделена из 369 и Salmonella paratyphi A был выделен у 6 из 515 вьетнамских пациентов с подозрением на кишечную лихорадку.По сравнению с традиционным культивированием крови в бульоне, прямой посев на лейкоцитарную пленку имел диагностическую чувствительность 99,5% (95% доверительный интервал [ДИ] от 97,1 до 100%). Количество бактерий в крови оценивали методом наливной чашки. Среднее количество S. typhi в крови составляло 1 КОЕ / мл (диапазон от <0,3 до 387 КОЕ / мл), из которых в среднем 63% (95% ДИ, от 58 до 67%) были внутриклеточными. Среднее количество бактерий на инфицированный лейкоцит составляло 1,3 (межквартильный размах [IQR], 0,7–2,4) КОЕ / клетку ( n = 81).У детей (<15 лет; n = 115) среднее количество бактерий в крови было выше, чем у взрослых ( n = 262): 1,5 (диапазон от <0,3 до 387) против 0,6 (диапазон от <0,3 до 17,7) КОЕ / мл ( P = 0,008), а пациенты, которые выделяли S. typhi с фекалиями, имели более высокие бактериемии, чем те, кто этого не делал: в среднем 3 (диапазон от <0,3 до 32) против 1 (диапазон от <0,3 до 68 ) КОЕ / мл ( P = 0,02). Количество бактерий в крови снижалось с увеличением продолжительности болезни ( P = 0.002) и были выше при инфекциях, вызванных S. typhi с множественной лекарственной устойчивостью (1,3 [диапазон от <0,3 до 387] КОЕ / мл; n = 313), чем при инфекциях, вызванных чувствительными к антибиотикам S. typhi (0,5 [диапазон от <0,3 до 32] КОЕ / мл; n = 62) ( P = 0,006). В многофакторном анализе это оказалось независимой ассоциацией, предполагающей связь между устойчивостью к антибиотикам и вирулентностью у S. typhi.
Брюшной тиф – это длительное заболевание, характеризующееся бактериемией, вызванной Salmonella typhi , высокоразвитым грамотрицательным бактериальным паразитом, поражающим только людей.Несмотря на бактериологическое сходство между S. typhi и другими энтеробактериями, клиническая картина брюшного тифа обычно отличается и во многих отношениях отличается от таковой при других септицемиях, вызываемых грамотрицательными микроорганизмами. В целом, пациенты с брюшным тифом менее тяжелы, и тяжесть брюшного тифа обычно отражает локализацию инфекции на пятнах Пейера и последующее изъязвление кишечника, а не фульминантную сепсис. Информации о количестве бактерий в крови и их связи с болезненным состоянием мало (17).При стандартном культивировании в бульоне сальмонеллы были обнаружены в крови от 30 до 90% пациентов с клинически подозреваемыми случаями кишечной лихорадки, а доля больных брюшным тифом с положительными культурами крови уменьшается с увеличением продолжительности болезни (3, 5, 20 , 21). Объем взятой крови и лабораторные методы, используемые для выделения, также являются важными факторами, определяющими выход при посеве крови (3–6, 10, 13, 17, 18, 20, 24). S. typhi способен выживать и воспроизводиться внутри моноцитарных фагоцитов, а при брюшном тифе S.typhi , как сообщается, ограничивается фракцией моноцитов-тромбоцитов крови (5, 17, 18, 24). Чтобы исследовать взаимосвязь между количеством бактерий в крови и клиническими и лабораторными признаками брюшного тифа, мы выполнили количественные бактериологические культуры для большой группы пациентов с неосложненной кишечной лихорадкой.
МАТЕРИАЛЫ И МЕТОДЫ
Пациенты.
Взрослые и дети, госпитализированные с подозрением на неосложненный брюшной тиф, изучались в течение 3-летнего периода в двух разных учреждениях во Вьетнаме: Центре тропических болезней, Хошимин, инфекционной больнице и больнице Дружбы, Цао Лань. Город, большая провинциальная больница в провинции Донг Тхап в дельте Меконга.Эти пациенты были набраны для проспективных исследований краткосрочного курса фторхинолоновой терапии на основании клинических подозрений или положительного посева крови. Критериями клинического диагноза брюшного тифа обычно служили лихорадка в течение ≥6 дней без явного очага инфекции, отрицательный мазок крови на малярию и дискомфорт в животе при изменении привычек кишечника. В некоторых случаях замкнутое или апатичное поведение пациентов при лихорадке также было диагностическим признаком.Пациенты с тяжелым или осложненным брюшным тифом (за исключением тех, у кого в анамнезе была только мелена) и те, кто уже получал эффективное лечение антибиотиками (т. Е. Антибиотиками, активными против S. typhi ), не были включены в эти исследования. Перед началом лечения брали кровь для стандартных лабораторных анализов и посева, как описано ниже, и, когда это было возможно, не откладывая начало лечения, культивировали образец кала на Salmonella . Полностью информированное согласие на забор крови было получено от всех пациентов.Это исследование было одобрено научным и этическим комитетами участвующих учреждений.
Лабораторные методы.
В обоих центрах использовались одинаковые лабораторные методы. У каждого пациента в асептических условиях брали от пяти до десяти миллилитров венозной крови и вносили в 50 мл бульона для инфузии мозга и сердца (Oxoid, Basingstoke, Великобритания), содержащего 0,05% полианэтолесульфоната натрия (Sigma, Poole, Великобритания). Поддерживали минимальное соотношение кровь-бульон от 1 до 10.Бульоны для культур крови инкубировали в течение 7 дней, а субкультивирование проводили через 24 часа и через 7 дней. Все флаконы также проверяли ежедневно, и если флакон показывал видимые признаки роста, проводили пересев на агар с овечьей кровью. Культивирование стула проводили после обогащения пробы массой 1 г в 10 мл селенитного бульона в течение 24 ч. Затем пять микролитров из верхней части бульона высевали на агар XLD (Oxoid). Бактериальные изоляты были идентифицированы стандартными биохимическими тестами (глюкоза, ферментация лактозы и образование газа, выработка индола и H 2 S, утилизация цитрата, подвижность и способность расщеплять мочевину) и агглютинация с Salmonella 09- и Vi-специфичными. антисыворотки (Wellcome Diagnostics, Дартфорд, Великобритания).Чувствительность дисков к антибиотикам определяли с использованием модификации метода Bauer et al. (1). Организмы, устойчивые к хлорамфениколу, ампициллину, триметоприму и сульфаметоксазолу, но чувствительные к офлоксацину и цефтриаксону, были описаны как устойчивые к множеству лекарственных препаратов.
Количественные культуры.
Венозная кровь для количественного посева и культивирования в бульоне была взята перед введением противомикробных препаратов от брюшного тифа. Кровь (от 3 до 9 мл у взрослых и от 1,5 до 6 мл у детей) собирали в стерильную гепаринизированную пробирку и немедленно отправляли в лабораторию.Количественные посевы цельной крови (QBC) проводили методом заливки на чашках. Вкратце, три отмеренные аликвоты крови (обычно 1 мл; 0,5 мл для маленьких детей) смешивали с 19 мл расплавленного (50 ° C) колумбийского агара (Unipath, Бейзингсток, Соединенное Королевство) в стерильной чашке Петри и оставляли для застывания. , а затем инкубировали при 37 ° C. Через 2-4 дня колонии подсчитывали и записывали как КОЕ на миллилитр. Для идентификации с поверхности агара собирали до пяти колоний. После повторной инкубации в течение 24 часов были выполнены стандартные биохимические тесты и агглютинация со специфической антисывороткой.Планшеты отбрасывали как отрицательные, если через 4 дня инкубации не было видно колоний.
Для определения количества внутрилейкоцитарных КОЕ в образцах крови были выполнены количественные посевы лейкоцитов периферической крови. Это исследование проводилось на случайно выбранной подгруппе пациентов. Гепаринизированную цельную кровь (2,5 или 5 мл), взятую одновременно с QBC, центрифугировали при 2700 × г в течение 10 мин. Плазму осторожно удаляли стерильной пластиковой пипеткой, и 0.1 мл, включая слой лейкоцитов, аспирировали стерильным шприцем на 1 мл. Количественные культуры были выполнены на этом 0,1-миллилитровом образце путем смешивания его с 19 мл расплавленного колумбийского агара, выливания смеси в виде чашки с агаром и инкубации в течение до 4 дней. Фагоциты периферической крови, содержащие более одной бактерии, будут производить одну колонию в твердой культуральной среде. Таким образом, для образцов цельной крови и лейкоцитов результаты выражались в КОЕ на миллилитр. Чтобы точно определить количество внутриклеточных бактерий на инфицированный фагоцит, секунда 0.Отбирали 1 мл образца лейкоцитов и лейкоциты лизировали путем инкубации с 0,1 мл 0,1% дигитонина (Sigma) в течение 10 мин при 37 ° C. Это должно было высвободить внутриклеточные бактерии. Затем количественные культуры были выполнены на этом образце так же, как и для первого образца, то есть путем смешивания с 19 мл расплавленного агара Колумбия, выливания смеси в виде чашки с агаром и инкубации при 37 ° C в течение до 4 дней. . Чтобы исключить возможность того, что локализация бактерий в лейкоцитарной пленке была артефактом этапа центрифугирования, в 10 мл крови здорового добровольца засевали 10 4 КОЕ из S.typhi и сразу центрифугировали при 2700 × g в течение 10 мин. Объем 0,1 мл лейкоцитарной пленки и 0,1 мл слоя эритроцитов собирали стерильными шприцами объемом 1 мл, смешивали с 19 мл расплавленного агара Columbia и давали возможность застыть, как описано выше. Бактериальные колонии подсчитывали через 4 дня инкубации при 37 ° C.
Расчет количества бактерий.
Число бактерий S. typhi на миллилитр крови (QBC) оценивали по количеству КОЕ на каждой разливочной пластине.Минимальный объем цельной крови, используемой для количественных методов от одного пациента, составлял 1,5 мл для маленьких детей и 3 мл для взрослых и детей старшего возраста. Это дает нижний предел обнаружения 0,7 или 0,3 КОЕ на мл соответственно. При сообщении количества бактерий в образцах лейкоцитарной пленки и лизированной лейкоцитарной пленки знаменателем был объем цельной крови, из которой был взят лейкоцит. У пациентов с положительной культурой в бульоне, но отрицательной по QBC, количественное значение оценивали по общему объему посевной крови: 0.От 7 до 1,0 КОЕ / мл из 1,5 мл крови и от 0,3 до 1,0 КОЕ / мл из 3 мл крови. Жизнеспособные бактерии в образце лейкоцитарной пленки объемом 0,1 мл считались внутрилейкоцитарными, а организмы в оставшейся части крови считались находящимися в плазме. Поэтому количество внеклеточных бактерий рассчитывали по следующей формуле: (КОЕ / мл цельной крови) – (КОЕ / мл лейкоцитарной пленки). Среднее количество жизнеспособных бактерий на инфицированный лейкоцит рассчитывали по следующей формуле: количество лизированных лейкоцитов (в бактериях на миллилитр) / количество нелизированных лейкоцитов (в инфицированных клетках на миллилитр).
Статистический анализ.
SPSS for Windows (SPSS Benelux Inc., Gorinchem, Нидерланды) версии 6 использовался для всех статистических анализов. Коэффициенты частичной корреляции были рассчитаны для связи между непрерывными переменными и количеством бактерий. Различия в количестве бактерий между группами, определяемыми дихотомическими переменными, проверяли с помощью U-критерия Манна-Уитни. Потенциально мешающие переменные (место и / или возраст) контролировались, и все данные с нестандартным распределением ранжировались до того, как были выполнены корреляционные тесты для ранжированных данных.Взаимодействия оценивались с помощью многомерного анализа.
РЕЗУЛЬТАТЫ
Посев крови в бульоне был проведен у 515 взрослых и детей с подозрением на кишечную лихорадку в период с марта 1993 г. по март 1996 г. (таблица). Все пациенты получали лечение офлоксацином перорально (общая доза от 60 до 135 мг / кг массы тела в течение 2–5 дней), как сообщалось в других источниках (4, 22), и все выздоровели. Возбудители кишечной лихорадки выделены от 375 (72,8%) пациентов: S. typhi от 369 пациентов и Salmonella paratyphi A от 6 пациентов.У двух пациентов QBC на чашке для заливки был положительным, но посевы крови в бульоне были отрицательными. Salmonella derby была выделена из крови одного пациента, и этот пациент был признан отрицательным по возбудителям кишечной лихорадки и исключен из анализа. Большинство изолятов S. typhi (313; 80%) обладали множественной лекарственной устойчивостью, то есть устойчивы к хлорамфениколу, триметоприм-сульфаметоксазолу и ампициллину. Подсчет бактерий как в цельной крови, так и в лейкоцитарной пленке был проведен у 187 пациентов.Эти пациенты имели клинические параметры при поступлении, аналогичные таковым у 188 пациентов с кишечной лихорадкой, которым проводился только QBC цельной крови. Одновременно были взяты образцы цельной крови, лейкоцитарной пленки и лизированной лейкоцитарной пленки у подгруппы из 81 пациента. Эти пациенты имели немного более короткую продолжительность болезни перед госпитализацией, т. Е. В среднем составляли 7 (диапазон от 2 до 33) дней по сравнению со средним значением в 9 (диапазон от 2 до 33) дней в целом, но во всех других отношениях их клинические проявления были похожи.
ТАБЛИЦА 1
Клинические и лабораторные параметры для пациентов с подозрением на кишечную лихорадку
| Переменная | Значение для: | |
|---|---|---|
| Все включенные пациенты ( n = 514) | Пациенты с положительным посевом крови ( n = 375) | |
| Возраст (лет) a | 12,9 (9) 14 (9,5) | |
| Продолжительность предшествующей лихорадки (дни) b | 9 (от 7 до 12; от 2 до 33) | 10 (от 7 до 13; от 2 до 33) |
| Температура (° C) а | 39.3 (1.0) | 39.1 (1.0) |
| Гепатомегалия c | 337 из 511 (66) | 237 из 375 (64) |
| Melena c | (4)14 из 374 (4) | |
| Рвота c | 91 из 508 (18) | 69 из 378 (18) |
| Боль в животе c | 32161 | (509)106 из 378 (62) |
| Диарея c | 325 из 506 (64) | 234 из 378 (62) |
| Желтуха a | 5 из 90 5122 9025 460 из 378 (1.1) | |
| Пиковая температура (° C) a | 39,7 (0,9) | 39,7 (0,9) |
| Пятна розы c | 18 из 482 (4) | 17 из 378 ( 5) |
| Количество лейкоцитов / мкл a | 7,300 (3,402) | 7,629 (3,121) |
| Гематокрит (%) a | 33,2 (4,960) 9024 | |
| Число тромбоцитов / мкл a | 180 000 (89 000) | 196 615 (84 795) |
Прямое нанесение на лейкоцитарную пленку.
Прямой посев лейкоцитов был проведен у 192 пациентов со случаями кишечной лихорадки с положительной культурой на бульоне: 190 из 191 S. typhi и 1 из 1 S. paratyphi A культуры были положительными, чувствительность 99,5% ( 95% доверительный интервал [ДИ], от 97,1 до 100%). Хотя точное время образования колоний из культур лейкоцитов не регистрировалось, подсчет обычно был возможен после инкубации в течение ночи. Существенного загрязнения не произошло.
Количественные результаты культивирования.
Среднее количество S. typhi в цельной крови пациентов с неосложненной кишечной лихорадкой ( n = 375) составляло 1 КОЕ / мл (межквартильный диапазон [IQR], <0,3–5; диапазон, <0,3–387) (Инжир. ). В среднем 37,5% (95% ДИ, от 32,9 до 42,1%) КОЕ были получены от организмов, распределенных в слоях эритроцитов и плазмы ( n = 187), а оставшиеся 62,5% жизнеспособных бактерий были сконцентрированы в лейкоцитарной пленке. слой. Среднее количество бактерий на инфицированный лейкоцит составляло 1.3 (IQR, от 0,7 до 2,4) КОЕ / клетку ( n = 81). У детей младше 15 лет ( n = 115) показатели цельной крови были выше, чем у взрослых ( n = 262): в среднем 1,5 (IQR, <0,3 - 6,0; диапазон, <0,3 - 387) по сравнению с медиана 0,6 (IQR, <0,3–2,8; диапазон, <1,3–17,7) КОЕ / мл ( P = 0,008). Количество внеклеточных бактерий также было выше у детей младше 15 лет, чем у взрослых: в среднем 1,5 (диапазон от 0 до 93) против медианы 0,6 (диапазон от 0 до 17.7) ( P = 0,005). Когда в кровь здорового добровольца засевали S. typhi , концентрация организмов, культивируемых из слоя эритроцитов, была такой же, как и в слое лейкоцитарной пленки. Бактерии из плазменного слоя не культивировались. Таким образом, клетки S. typhi не концентрировались в лейкоцитной пленке в результате центрифугирования.
Распределение количества бактерий в крови при остром брюшном тифе.
Устойчивость к антибиотикам и количество бактерий в крови.
Количество QBC было выше у пациентов, инфицированных множественной лекарственной устойчивостью S. typhi ( n = 313), чем у пациентов, инфицированных более чувствительными изолятами ( n = 62): в среднем 1,3 (диапазон, 0 до 387) по сравнению со средним значением 0,5 (диапазон от 0 до 32) КОЕ / мл ( P = 0,006) (рис.). Пациенты, инфицированные штаммами с множественной лекарственной устойчивостью, как правило, были моложе пациентов, инфицированных более чувствительными штаммами: в среднем 10 (IQR, от 6 до 15) по сравнению со средним значением 13 (IQR, от 7 до 24) лет ( P = 0.02). Продолжительность предшествующего заболевания также была немного короче при инфекциях штаммами с множественной лекарственной устойчивостью: в среднем 9 (IQR, от 6 до 12) по сравнению со средним значением в 10 (IQR, от 6 до 15) дней ( P = 0,07). В многофакторном анализе продолжительность предшествующего заболевания, возраст пациента и множественная лекарственная устойчивость изолированного S. typhi были связаны независимо с количеством бактерий в крови ( P = 0,04, P = 0,003 и P = 0,02 соответственно).Связь между количеством бактерий в крови и множественной лекарственной устойчивостью оказалась устойчивой и не могла быть объяснена смешивающими факторами.
Подсчет бактерий в крови пациентов, инфицированных чувствительными к антибиотикам и множественной лекарственной устойчивостью S. typhi . •, медиана; полоски указывают IQR. Каждый кружок представляет одного пациента.
Продолжительность болезни.
С увеличением продолжительности болезни наблюдалось снижение количества бактерий в цельной крови. Средний показатель цельной крови был равен 1.7 (диапазон от <0,2 до 387) КОЕ / мл на первой неделе болезни, 1 (диапазон от 0,2 до 68) КОЕ / мл на второй неделе, 1 (диапазон от <0,2 до 23) КОЕ / мл на третьей неделю и 0,3 (диапазон от <0,2 до 19) КОЕ / мл на четвертой неделе болезни ( P <0,001). Это оставалось статистически значимым, когда и возраст, и местонахождение контролировались в анализе частичной корреляции ( P = 0,002). Аналогичные тенденции наблюдались для внутриклеточного ( P = 0,06) и внеклеточного ( P = 0.03) в счет. Доля внеклеточных организмов также снижалась с увеличением продолжительности заболевания, но при множественном регрессионном анализе, учитывающем возраст и множественную лекарственную устойчивость, эта тенденция не достигла статистической значимости ( P = 0,058).
Каловые культуры.
S. typhi был выделен из 24 из 167 образцов стула пациентов. Среднее количество бактерий в крови у пациентов с положительными культурами стула было значительно выше, чем у пациентов с отрицательными культурами: 3 (IQR, 0.От 7 до 7,3) КОЕ / мл по сравнению с 1 (IQR, <0,3 до 3,0) КОЕ / мл ( P = 0,02). Относительный риск носительства стула у пациентов с инфекциями, вызванными множественной лекарственной устойчивостью S. typhi , по сравнению с таковым для пациентов с инфекциями, вызванными полностью чувствительными S. typhi , составлял 3,0 (95% ДИ от 0,75 до 12,3) ( P = 0,15).
ОБСУЖДЕНИЕ
Кишечная лихорадка – это характерный клинический синдром, который клинически и патологически отличается от других сепсисов, вызываемых грамотрицательными бактериями.Заболевание имеет подострое начало и хроническое течение при отсутствии лечения, но оно редко вызывает эндотоксический шок и несет значительно меньшую смертность, чем другие сепсисы, вызванные грамотрицательными бактериями (6, 12, 15, 16, 23). Несмотря на эти различия, уровни бактериемии у пациентов с неосложненным брюшным тифом (среднее количество 1 КОЕ / мл; смертность <1%) (27) аналогичны уровням бактериемии, вызванной другими энтеробактериями (смертность от 10 до 50%) (6 , 16, 27). Приблизительно у 50% пациентов с брюшным тифом с положительными культурами крови уровень крови составляет менее 1 КОЕ / мл, а у 10% - более 50 КОЕ / мл.Таким образом, патологические различия между сепсисом, вызываемым возбудителями кишечной лихорадки, и сепсисом, вызываемым другими энтеробактериями, нельзя объяснить различиями в количестве микроорганизмов, циркулирующих в крови. В предыдущем исследовании 25 пациентов с брюшным тифом, о котором сообщил Батлер и др., Количество бактерий в крови было выше: у пяти пациентов количество более 100 КОЕ / мл (3). В этой серии небольшой объем (0,1 мл) крови высевали непосредственно на агар, содержащий желчь, который мог высвободить внутриклеточные организмы.Пациенты также были тяжелее (у троих были кишечные кровотечения, двое умерли). Однако перфорация кишечника и кровотечение обычно являются признаками поздней стадии брюшного тифа и связаны с более низкими диагностическими результатами при посеве крови (5, 17). В настоящее исследование не были включены тяжелобольные пациенты, составляющие менее 5% всех случаев в этой области (хотя у 14 из 374 пациентов были признаки кровотечения из верхних отделов желудочно-кишечного тракта). Диапазон количества бактерий в крови в этом большом исследовании брюшного тифа аналогичен таковым в гораздо меньших исследованиях, о которых ранее сообщали Rubin et al., используя, во-первых, метод полуколичественной гибридизации ДНК (19) и, во-вторых, прямые культуры (18).
С точки зрения внутренней токсичности разница между энтеробактериями незначительна. Очищенный эндотоксин S. typhi аналогичен по цитотоксичности и способности индуцировать высвобождение провоспалительных цитокинов с таковым из Escherichia coli (26). Однако сепсис, вызванный грамотрицательными бактериями, часто возникает внезапно, тогда как подострое прогрессирование брюшного тифа может способствовать развитию толерантности к эндотоксинам (11, 14).Сальмонеллы, в том числе S. typhi , развили механизмы подавления воспалительной реакции, предположительно для облегчения устойчивости и передачи (7). Как и при других тяжелых бактериальных инфекциях, более высокие бактериемии чаще обнаруживались у детей с брюшным тифом и были связаны с более высокими пиковыми температурами. Это может отражать более низкий фоновый иммунитет. Принципиальное различие между системной инфекцией сальмонеллами и другими энтеробактериями заключается в том, что две трети бактерий в системе кровообращения находятся внутри фагоцитарных клеток, где они остаются жизнеспособными.Таким образом, количество внеклеточных организмов в кровотоке у пациентов с брюшным тифом обычно ниже, чем у пациентов с другими системными инфекциями.
Концентрация бацилл брюшного тифа в лейкоцитарной пленке (предположительно в моноцитах и полиморфно-ядерных лейкоцитах) означает, что прямое высевание этого клеточного слоя представляет собой альтернативный и более быстрый метод диагностики, чем посев на бульоне из цельной крови. Колонии обычно проявлялись после инкубации в течение ночи. В этом исследовании среднее количество организмов на одну фагоцитарную клетку составляло 1.3, цифра, идентичная приведенной Rubin et al. (18). Лизинг фагоцитарных клеток увеличивал абсолютное количество идентифицированных КОЕ, но не повышал чувствительность процедуры. В целом, культура лейкоцитной пленки была такой же чувствительной, как и культура на бульоне из цельной крови, и позволяла раньше идентифицировать организм и тестировать чувствительность к противомикробным препаратам. Загрязнение в этом исследовании было редким. Культивирование баффи может быть особенно полезно для маленьких детей, которые склонны к более высоким уровням бактериемии, так как это позволяет взять меньший общий объем крови.Плазма одного и того же образца может использоваться как для биохимических, так и для серологических тестов.
В этом исследовании количество бактерий в крови снижалось с увеличением продолжительности болезни. Снижение диагностической чувствительности посева крови с увеличением продолжительности болезни при брюшном тифе было хорошо известно на протяжении всего столетия. В 1907 году обзор литературы показал, что 89% посевов крови были положительными на первой неделе брюшного тифа, 73% были положительными на второй, 60% были положительными на третьей и только 26% были положительными на четвертой и четвертой неделе. последующие недели (5).Современные среды для культивирования крови содержат полианэтолесульфонат натрия (Liquoid) и могут лучше выращивать меньшее количество бактерий, чем те, которые использовались ранее (8, 9), но тенденция в этом большом исследовании была той же. Уменьшение количества бактерий в крови совпадает с увеличением риска язвы и кровотечений в тонкой кишке, поскольку тифоидные бациллы концентрируются в пятнах Пейера, а участки некроза образуются в стенке кишечника.
В других исследованиях, в которых множественная лекарственная устойчивость была связана с тяжестью брюшного тифа, эта связь была приписана неправильному начальному лечению и, следовательно, дальнейшему прогрессированию заболевания и последующему обращению в больницу (2, 25).В этом исследовании у пациентов с брюшным тифом, вызванным штаммами с множественной лекарственной устойчивостью, в крови было больше бактерий S. typhi , чем у пациентов, инфицированных чувствительными к антибиотикам организмами. У них также была немного меньшая продолжительность предшествующего заболевания, поэтому предыдущее лечение неэффективными противомикробными препаратами вряд ли объяснит более высокий уровень бактериемии в этой группе. Хотя нельзя однозначно исключить неэффективное предыдущее лечение, поскольку многие пациенты не уверены в том, какие лекарства они получали, фторхинолоны были антибиотиками, которые с наибольшей вероятностью назначались вне больницы в местах проведения исследования (22a), и они должны были быть столь же эффективными против лекарственно-устойчивые и чувствительные бактерии.Кроме того, фторхинолоны обычно стерилизуют кровь у пациентов с брюшным тифом в течение 2 дней, поэтому маловероятно, что были проведены серьезные курсы лечения антибиотиками. Пациенты с инфекциями, вызываемыми бактериями с множественной лекарственной устойчивостью, как правило, были моложе, но в многофакторном анализе лекарственная устойчивость была независимо связана с более высокими бактериемиями. Это предполагает, что фенотип множественной лекарственной устойчивости может быть связан с вирулентностью у S. typhi . Множественная устойчивость у S.typhi кодируется генами, содержащимися в больших переносимых плазмидах. Неизвестно, несут ли эти плазмиды другие гены вирулентности или сами механизмы устойчивости каким-то образом повышают выживаемость и размножение бактерий in vivo.
Посевы кала при однократном приеме дали положительный результат на S. typhi у 14,3% из 167 пациентов. Носительство S. typhi в стуле было связано со значительно более высоким содержанием бактерий в крови. Поскольку множественная лекарственная устойчивость также была положительно связана с количеством бактерий в крови, пациенты, инфицированные мультирезистентными бактериями, с большей вероятностью выделяли организмы со стулом, хотя эта разница не достигла статистической значимости.Если исследования с участием большего числа пациентов подтвердят это наблюдение, то связь лекарственной устойчивости с увеличением бактериемии, а также повышенным потенциалом передачи может дать правдоподобное объяснение недавнему очень быстрому распространению бацилл брюшного тифа с множественной лекарственной устойчивостью в южной части Вьетнама.
БЛАГОДАРНОСТИ
Мы очень благодарны директорам и персоналу провинциальной больницы Донг Тап и Центра тропических болезней в Хошимине.Мы особенно благодарны отделам микробиологии обоих учреждений за их помощь и Джули Симпсон за советы по статистике.
Это исследование было поддержано британским фондом Wellcome Trust.
СПИСОК ЛИТЕРАТУРЫ
1. Бауэр А. В., Кирби В. М., Шерис Дж. С., Терк М. Определение чувствительности к антибиотикам с помощью стандартизированного метода с одним диском. Am J Clin Pathol. 1978; 45: 493–496. [PubMed] [Google Scholar] 2. Бхутта З. А., Нагви С. Х., Раззак Р. А., Фаруки Б. Дж. Брюшной тиф с множественной лекарственной устойчивостью у детей: презентация и клинические особенности.Rev Infect Dis. 1991; 13: 832–836. [PubMed] [Google Scholar] 3. Батлер Т., Белл В. Р., Левин Дж., Линь Н. Н., Арнольд К. Брюшной тиф; исследования свертывания крови, бактериемии и эндотоксемии. Arch Intern Med. 1978; 138: 407–410. [PubMed] [Google Scholar] 4. Chinh N T, Solomon T, Thong M X, Ly N T, Hoa N T T, Wain J, Diep T. S, Smith M D, Day N P J, Phi L T, Parry C. M, White N J. Короткие курсы офлоксацина для лечения кишечной лихорадки. Trans R Soc Trop Med Hyg. 1997. 91: 347–349. [PubMed] [Google Scholar] 5.Коулман В., Бакстон Б. Х. Бактериология крови при брюшном тифе: анализ 1602 случаев. Am J Med Sci. 1907; 133: 896–903. [Google Scholar] 6. DuPont HL, Spink W. W. Инфекции, вызванные грамотрицательными микроорганизмами: анализ 860 пациентов с бактериемией в медицинском центре Университета Миннесоты, 1958–1966. Медицина. 1969; 48: 307–332. [PubMed] [Google Scholar] 7. Эйзенштейн Т. К., Аль-Рамади Б. К., Хуанг Д. Иммунитет и иммуносупрессия, индуцированные ослабленной Salmonella : роль оксида азота.В: Кабельо Ф, редактор. Биология сальмонеллы. Нью-Йорк, Нью-Йорк: Plenum Press; 1993. С. 265–276. [Google Scholar] 9. Эскамилла Дж., Сантьяго Л. Т., Сангаланг Р. П., Раноа С. П., Кросс Дж. Х. Сравнительное исследование трех систем культивирования крови для выделения кишечной лихорадки Salmonella . Юго-Восточная Азия J Trop Med Public Health. 1984. 15: 161–166. [PubMed] [Google Scholar] 10. Фостер В. Д. Лабораторная диагностика брюшного тифа. Ланцет. 1975; II: 80. [PubMed] [Google Scholar] 11. Грейсман С. Э., Вудворд С. Л.Исследования in vivo роли печени в эндотоксиновой лихорадке и толерантности. J Clin Invest. 1970; 49: 37а – 38а. [Google Scholar] 12. Холл В. Х., Голд Д. Шок, связанный с бактериемией. Arch Intern Med. 1955; 96: 403–412. [PubMed] [Google Scholar] 13. Хоффман С.Л., Пенджаби Н.Х., Рокхилл Р.К., Сутомо А., Риваи А.Р., Пулунгсих С.П. Дуоденальный посев на нити-капсулу в сравнении с культурами костного мозга, крови и ректальных мазков для диагностики брюшного тифа и паратифа. J Infect Dis. 1984. 149: 157–161. [PubMed] [Google Scholar] 14.Хорник Р. Б., Грейсман С. Е., Вудворд Т. Е., Дюпон Н. Л., Докинз А. Т., Снайдер М. Дж. Брюшной тиф: патогенез и иммунологический контроль. N Engl J Med. 1970; 283: 686–691. и 739–746. [PubMed] [Google Scholar] 15. Kluge R M, DuPont H L. Факторы, влияющие на смертность пациентов с бактериемией. Surg Gynecol Obstet. 1973; 137: 137–267. [PubMed] [Google Scholar] 16. Крегер Б. Э., Крейвен Д. Э. Грамотрицательная бактериемия. III. Переоценка этиологии, эпидемиологии и экологии у 612 пациентов. Am J Med. 1980. 68: 332–343.[PubMed] [Google Scholar] 17. Паркер М. Т. Сальмонелла. В: Уилсон Дж., Майлз А., Паркер М. Т., редакторы. Принципы бактериологии, вирусологии и иммунитета Топли и Вильсона. 7-е изд. Лондон, Англия: Эдвард Арнольд; 1983. С. 332–355. [Google Scholar] 18. Rubin FA, McWhirter PD, Burr D, Punjabi NH, Lane E, Kumala S, Sudarmono P, Pulungsih SP, Lesmana M, Tjaniadi P, Sukri N, Hoffman S.L. Быстрая диагностика брюшного тифа путем идентификации Salmonella typhi в 18 часов сбора образцов путем культивирования фракции мононуклеарных клеток и тромбоцитов крови.J Clin Microbiol. 1990; 28: 825–827. [Бесплатная статья PMC] [PubMed] [Google Scholar] 19. Rubin FA, McWhirter PD, Punjabi NH, Lane E, Sudarmono P, Pulungsih SP, Lesmana M, Kumala S, Kopecko DJ, Hoffman S.L. Использование зонда ДНК для обнаружения Salmonella typhi в крови пациентов с брюшным тифом . J Clin Microbiol. 1989; 27: 1112–1114. [Бесплатная статья PMC] [PubMed] [Google Scholar] 21. Стюарт М. Д., Пуллен Р. Л. Брюшной тиф: клинический анализ трехсот шестидесяти случаев. Arch Intern Med. 1946; 78: 629–661.[PubMed] [Google Scholar] 22. Vinh H, Wain J, Hanh V T N, Nga C N, Chinh M T, Bethell D, Hoa N T T, Diep T. S, Dung N M, White N J. Двух или трехдневное лечение офлоксацином неосложненного брюшного тифа с множественной лекарственной устойчивостью у детей. Антимикробные агенты Chemother. 1996; 40: 958–961. [Бесплатная статья PMC] [PubMed] [Google Scholar]22a. Уэйн, Дж. И К. М. Парри. Неопубликованное наблюдение.
23. Уолш А. Л., Смит М. Д., Вутиеканун В., Супуттамонгкол Ю., Чаовагуль В., Дэнс Д. А. Б, Ангус Б., Уайт Н. Дж.Прогностическое значение количественной бактериемии при септическом мелиоидозе. Clin Infect Dis. 1995; 21: 1498–1500. [PubMed] [Google Scholar] 24. Уотсон К. Выделение Salmonella typhi из кровотока. J Lab Clin Med. 1955. 46: 128–134. [PubMed] [Google Scholar] 25. Уайт Н. Дж., Пэрри С. М. Лечение брюшного тифа. Curr Opin Infect Dis. 1996; 9: 298–302. [Google Scholar] 26. Уилсон Б. М., Северн А., Рэпсон Н. Т., Чана Дж., Хопкинс П. Удобная система цельной крови для изучения регуляции высвобождения фактора некроза опухоли бактериальным липополисахаридом.J Immunol Methods. 1991; 139: 233–240. [PubMed] [Google Scholar]Количественное определение бактерий в крови пациентов с брюшным тифом и взаимосвязь между количеством и клиническими характеристиками, трансмиссивностью и устойчивостью к антибиотикам
J Clin Microbiol. 1998 Jun; 36 (6): 1683–1687.
, 1, 2, 3 , 2 , 4 , 1, 3 , 2 , 1, 2, 3 и 1 3, *Джон Уэйн
Отдел клинических исследований Wellcome Trust 1 и Отдел микробиологии, 2 Центр тропических болезней, Больница Чо Куан, Хошимин, и Больница Донг Тап, Цао Лань, Dong Thap, 4 Vietnam, и Центр тропической медицины, Департамент клинической медицины Наффилда, Оксфордский университет, Оксфорд, Соединенное Королевство 3
To Song Diep
Wellcome Trust Clinical Research Unit 1 и Департамент микробиологии, 2 Центр тропических болезней, Больница Чо Куан, Хошимин, и Больница Донг Тхап, Као Лань, Донг Тхап, 4 Вьетнам, и Центр тропической медицины, Департамент клинической медицины Наффилда, О. xford University, Oxford, United Kingdom 3
Vo Anh Ho
Wellcome Trust Clinical Research Unit 1 и Департамент микробиологии, 2 Центр тропических болезней, Больница Чо Куан, Хошимин и Донг Тап Госпиталь, Као Лань, Донг Тхап, 4 Вьетнам, и Центр тропической медицины, Кафедра клинической медицины Наффилда, Оксфордский университет, Оксфорд, Соединенное Королевство 3
Аманда М.Walsh
Wellcome Trust Clinical Research Unit 1 и Департамент микробиологии, 2 Центр тропических болезней, Больница Чо Куан, Хошимин, и Больница Донг Тхап, Као Лань, Донг Тхап, 4 Вьетнам, и Центр тропической медицины, Департамент клинической медицины Наффилда, Оксфордский университет, Оксфорд, Соединенное Королевство 3
Нгуен Тхи Туйет Хоа
Wellcome Trust Отдел клинических исследований 1 и Департамент микробиологии, 2 Центр тропических болезней, Больница Чо Куан, Хошимин, и больница Донг Тхап, Као Лань, Донг Тхап, 4 Вьетнам, и Центр тропической медицины, Кафедра клинической медицины Наффилда, Оксфордский университет, Оксфорд, Соединенное Королевство 3
Кристофер М.Parry
Wellcome Trust Отдел клинических исследований 1 и Департамент микробиологии, 2 Центр тропических болезней, Больница Чо Куан, Хошимин, и Больница Донг Тхап, Као Лань, Донг Тап, 4 Вьетнам, и Центр тропической медицины, Кафедра клинической медицины Наффилда, Оксфордский университет, Оксфорд, Соединенное Королевство 3
Николас Дж. Уайт
Wellcome Trust Отдел клинических исследований 1 и Департамент микробиологии, 2 Центр тропических болезней, Больница Чо Куан, Хошимин, и Больница Донг Тхап, Као Лань, Донг Тхап, 4 Вьетнам, и Центр тропической медицины, Кафедра клинической медицины Наффилда, Оксфордский университет, Оксфорд, Великобритания 3
Wellcome Доверьте отдел клинических исследований 1 и отдел микробиологии, 2 Центр тропических болезней, больница Чо Куан, Хошимин, ан. d Больница Донг Тхап, Као Лань, Донг Тхап, 4 Вьетнам, и Центр тропической медицины, Кафедра клинической медицины Наффилда, Оксфордский университет, Оксфорд, Соединенное Королевство 3
* Автор, отвечающий за переписку.Почтовый адрес: Отдел клинических исследований Wellcome Trust, Центр тропических болезней, Больница Чо Куан, Хошимин, Вьетнам. Телефон: 84 88 353954. Факс: 84 88 353904. Электронная почта: [email protected].Поступило 30 декабря 1997 г .; Изменения запрошены 8 февраля 1998 г .; Принято 3 марта 1998 г.
Copyright © 1998, Американское общество микробиологов. Эта статья цитируется в других статьях в PMC.Abstract
Salmonella typhi была выделена из 369 и Salmonella paratyphi A был выделен у 6 из 515 вьетнамских пациентов с подозрением на кишечную лихорадку.По сравнению с традиционным культивированием крови в бульоне, прямой посев на лейкоцитарную пленку имел диагностическую чувствительность 99,5% (95% доверительный интервал [ДИ] от 97,1 до 100%). Количество бактерий в крови оценивали методом наливной чашки. Среднее количество S. typhi в крови составляло 1 КОЕ / мл (диапазон от <0,3 до 387 КОЕ / мл), из которых в среднем 63% (95% ДИ, от 58 до 67%) были внутриклеточными. Среднее количество бактерий на инфицированный лейкоцит составляло 1,3 (межквартильный размах [IQR], 0,7–2,4) КОЕ / клетку ( n = 81).У детей (<15 лет; n = 115) среднее количество бактерий в крови было выше, чем у взрослых ( n = 262): 1,5 (диапазон от <0,3 до 387) против 0,6 (диапазон от <0,3 до 17,7) КОЕ / мл ( P = 0,008), а пациенты, которые выделяли S. typhi с фекалиями, имели более высокие бактериемии, чем те, кто этого не делал: в среднем 3 (диапазон от <0,3 до 32) против 1 (диапазон от <0,3 до 68 ) КОЕ / мл ( P = 0,02). Количество бактерий в крови снижалось с увеличением продолжительности болезни ( P = 0.002) и были выше при инфекциях, вызванных S. typhi с множественной лекарственной устойчивостью (1,3 [диапазон от <0,3 до 387] КОЕ / мл; n = 313), чем при инфекциях, вызванных чувствительными к антибиотикам S. typhi (0,5 [диапазон от <0,3 до 32] КОЕ / мл; n = 62) ( P = 0,006). В многофакторном анализе это оказалось независимой ассоциацией, предполагающей связь между устойчивостью к антибиотикам и вирулентностью у S. typhi.
Брюшной тиф – это длительное заболевание, характеризующееся бактериемией, вызванной Salmonella typhi , высокоразвитым грамотрицательным бактериальным паразитом, поражающим только людей.Несмотря на бактериологическое сходство между S. typhi и другими энтеробактериями, клиническая картина брюшного тифа обычно отличается и во многих отношениях отличается от таковой при других септицемиях, вызываемых грамотрицательными микроорганизмами. В целом, пациенты с брюшным тифом менее тяжелы, и тяжесть брюшного тифа обычно отражает локализацию инфекции на пятнах Пейера и последующее изъязвление кишечника, а не фульминантную сепсис. Информации о количестве бактерий в крови и их связи с болезненным состоянием мало (17).При стандартном культивировании в бульоне сальмонеллы были обнаружены в крови от 30 до 90% пациентов с клинически подозреваемыми случаями кишечной лихорадки, а доля больных брюшным тифом с положительными культурами крови уменьшается с увеличением продолжительности болезни (3, 5, 20 , 21). Объем взятой крови и лабораторные методы, используемые для выделения, также являются важными факторами, определяющими выход при посеве крови (3–6, 10, 13, 17, 18, 20, 24). S. typhi способен выживать и воспроизводиться внутри моноцитарных фагоцитов, а при брюшном тифе S.typhi , как сообщается, ограничивается фракцией моноцитов-тромбоцитов крови (5, 17, 18, 24). Чтобы исследовать взаимосвязь между количеством бактерий в крови и клиническими и лабораторными признаками брюшного тифа, мы выполнили количественные бактериологические культуры для большой группы пациентов с неосложненной кишечной лихорадкой.
МАТЕРИАЛЫ И МЕТОДЫ
Пациенты.
Взрослые и дети, госпитализированные с подозрением на неосложненный брюшной тиф, изучались в течение 3-летнего периода в двух разных учреждениях во Вьетнаме: Центре тропических болезней, Хошимин, инфекционной больнице и больнице Дружбы, Цао Лань. Город, большая провинциальная больница в провинции Донг Тхап в дельте Меконга.Эти пациенты были набраны для проспективных исследований краткосрочного курса фторхинолоновой терапии на основании клинических подозрений или положительного посева крови. Критериями клинического диагноза брюшного тифа обычно служили лихорадка в течение ≥6 дней без явного очага инфекции, отрицательный мазок крови на малярию и дискомфорт в животе при изменении привычек кишечника. В некоторых случаях замкнутое или апатичное поведение пациентов при лихорадке также было диагностическим признаком.Пациенты с тяжелым или осложненным брюшным тифом (за исключением тех, у кого в анамнезе была только мелена) и те, кто уже получал эффективное лечение антибиотиками (т. Е. Антибиотиками, активными против S. typhi ), не были включены в эти исследования. Перед началом лечения брали кровь для стандартных лабораторных анализов и посева, как описано ниже, и, когда это было возможно, не откладывая начало лечения, культивировали образец кала на Salmonella . Полностью информированное согласие на забор крови было получено от всех пациентов.Это исследование было одобрено научным и этическим комитетами участвующих учреждений.
Лабораторные методы.
В обоих центрах использовались одинаковые лабораторные методы. У каждого пациента в асептических условиях брали от пяти до десяти миллилитров венозной крови и вносили в 50 мл бульона для инфузии мозга и сердца (Oxoid, Basingstoke, Великобритания), содержащего 0,05% полианэтолесульфоната натрия (Sigma, Poole, Великобритания). Поддерживали минимальное соотношение кровь-бульон от 1 до 10.Бульоны для культур крови инкубировали в течение 7 дней, а субкультивирование проводили через 24 часа и через 7 дней. Все флаконы также проверяли ежедневно, и если флакон показывал видимые признаки роста, проводили пересев на агар с овечьей кровью. Культивирование стула проводили после обогащения пробы массой 1 г в 10 мл селенитного бульона в течение 24 ч. Затем пять микролитров из верхней части бульона высевали на агар XLD (Oxoid). Бактериальные изоляты были идентифицированы стандартными биохимическими тестами (глюкоза, ферментация лактозы и образование газа, выработка индола и H 2 S, утилизация цитрата, подвижность и способность расщеплять мочевину) и агглютинация с Salmonella 09- и Vi-специфичными. антисыворотки (Wellcome Diagnostics, Дартфорд, Великобритания).Чувствительность дисков к антибиотикам определяли с использованием модификации метода Bauer et al. (1). Организмы, устойчивые к хлорамфениколу, ампициллину, триметоприму и сульфаметоксазолу, но чувствительные к офлоксацину и цефтриаксону, были описаны как устойчивые к множеству лекарственных препаратов.
Количественные культуры.
Венозная кровь для количественного посева и культивирования в бульоне была взята перед введением противомикробных препаратов от брюшного тифа. Кровь (от 3 до 9 мл у взрослых и от 1,5 до 6 мл у детей) собирали в стерильную гепаринизированную пробирку и немедленно отправляли в лабораторию.Количественные посевы цельной крови (QBC) проводили методом заливки на чашках. Вкратце, три отмеренные аликвоты крови (обычно 1 мл; 0,5 мл для маленьких детей) смешивали с 19 мл расплавленного (50 ° C) колумбийского агара (Unipath, Бейзингсток, Соединенное Королевство) в стерильной чашке Петри и оставляли для застывания. , а затем инкубировали при 37 ° C. Через 2-4 дня колонии подсчитывали и записывали как КОЕ на миллилитр. Для идентификации с поверхности агара собирали до пяти колоний. После повторной инкубации в течение 24 часов были выполнены стандартные биохимические тесты и агглютинация со специфической антисывороткой.Планшеты отбрасывали как отрицательные, если через 4 дня инкубации не было видно колоний.
Для определения количества внутрилейкоцитарных КОЕ в образцах крови были выполнены количественные посевы лейкоцитов периферической крови. Это исследование проводилось на случайно выбранной подгруппе пациентов. Гепаринизированную цельную кровь (2,5 или 5 мл), взятую одновременно с QBC, центрифугировали при 2700 × г в течение 10 мин. Плазму осторожно удаляли стерильной пластиковой пипеткой, и 0.1 мл, включая слой лейкоцитов, аспирировали стерильным шприцем на 1 мл. Количественные культуры были выполнены на этом 0,1-миллилитровом образце путем смешивания его с 19 мл расплавленного колумбийского агара, выливания смеси в виде чашки с агаром и инкубации в течение до 4 дней. Фагоциты периферической крови, содержащие более одной бактерии, будут производить одну колонию в твердой культуральной среде. Таким образом, для образцов цельной крови и лейкоцитов результаты выражались в КОЕ на миллилитр. Чтобы точно определить количество внутриклеточных бактерий на инфицированный фагоцит, секунда 0.Отбирали 1 мл образца лейкоцитов и лейкоциты лизировали путем инкубации с 0,1 мл 0,1% дигитонина (Sigma) в течение 10 мин при 37 ° C. Это должно было высвободить внутриклеточные бактерии. Затем количественные культуры были выполнены на этом образце так же, как и для первого образца, то есть путем смешивания с 19 мл расплавленного агара Колумбия, выливания смеси в виде чашки с агаром и инкубации при 37 ° C в течение до 4 дней. . Чтобы исключить возможность того, что локализация бактерий в лейкоцитарной пленке была артефактом этапа центрифугирования, в 10 мл крови здорового добровольца засевали 10 4 КОЕ из S.typhi и сразу центрифугировали при 2700 × g в течение 10 мин. Объем 0,1 мл лейкоцитарной пленки и 0,1 мл слоя эритроцитов собирали стерильными шприцами объемом 1 мл, смешивали с 19 мл расплавленного агара Columbia и давали возможность застыть, как описано выше. Бактериальные колонии подсчитывали через 4 дня инкубации при 37 ° C.
Расчет количества бактерий.
Число бактерий S. typhi на миллилитр крови (QBC) оценивали по количеству КОЕ на каждой разливочной пластине.Минимальный объем цельной крови, используемой для количественных методов от одного пациента, составлял 1,5 мл для маленьких детей и 3 мл для взрослых и детей старшего возраста. Это дает нижний предел обнаружения 0,7 или 0,3 КОЕ на мл соответственно. При сообщении количества бактерий в образцах лейкоцитарной пленки и лизированной лейкоцитарной пленки знаменателем был объем цельной крови, из которой был взят лейкоцит. У пациентов с положительной культурой в бульоне, но отрицательной по QBC, количественное значение оценивали по общему объему посевной крови: 0.От 7 до 1,0 КОЕ / мл из 1,5 мл крови и от 0,3 до 1,0 КОЕ / мл из 3 мл крови. Жизнеспособные бактерии в образце лейкоцитарной пленки объемом 0,1 мл считались внутрилейкоцитарными, а организмы в оставшейся части крови считались находящимися в плазме. Поэтому количество внеклеточных бактерий рассчитывали по следующей формуле: (КОЕ / мл цельной крови) – (КОЕ / мл лейкоцитарной пленки). Среднее количество жизнеспособных бактерий на инфицированный лейкоцит рассчитывали по следующей формуле: количество лизированных лейкоцитов (в бактериях на миллилитр) / количество нелизированных лейкоцитов (в инфицированных клетках на миллилитр).
Статистический анализ.
SPSS for Windows (SPSS Benelux Inc., Gorinchem, Нидерланды) версии 6 использовался для всех статистических анализов. Коэффициенты частичной корреляции были рассчитаны для связи между непрерывными переменными и количеством бактерий. Различия в количестве бактерий между группами, определяемыми дихотомическими переменными, проверяли с помощью U-критерия Манна-Уитни. Потенциально мешающие переменные (место и / или возраст) контролировались, и все данные с нестандартным распределением ранжировались до того, как были выполнены корреляционные тесты для ранжированных данных.Взаимодействия оценивались с помощью многомерного анализа.
РЕЗУЛЬТАТЫ
Посев крови в бульоне был проведен у 515 взрослых и детей с подозрением на кишечную лихорадку в период с марта 1993 г. по март 1996 г. (таблица). Все пациенты получали лечение офлоксацином перорально (общая доза от 60 до 135 мг / кг массы тела в течение 2–5 дней), как сообщалось в других источниках (4, 22), и все выздоровели. Возбудители кишечной лихорадки выделены от 375 (72,8%) пациентов: S. typhi от 369 пациентов и Salmonella paratyphi A от 6 пациентов.У двух пациентов QBC на чашке для заливки был положительным, но посевы крови в бульоне были отрицательными. Salmonella derby была выделена из крови одного пациента, и этот пациент был признан отрицательным по возбудителям кишечной лихорадки и исключен из анализа. Большинство изолятов S. typhi (313; 80%) обладали множественной лекарственной устойчивостью, то есть устойчивы к хлорамфениколу, триметоприм-сульфаметоксазолу и ампициллину. Подсчет бактерий как в цельной крови, так и в лейкоцитарной пленке был проведен у 187 пациентов.Эти пациенты имели клинические параметры при поступлении, аналогичные таковым у 188 пациентов с кишечной лихорадкой, которым проводился только QBC цельной крови. Одновременно были взяты образцы цельной крови, лейкоцитарной пленки и лизированной лейкоцитарной пленки у подгруппы из 81 пациента. Эти пациенты имели немного более короткую продолжительность болезни перед госпитализацией, т. Е. В среднем составляли 7 (диапазон от 2 до 33) дней по сравнению со средним значением в 9 (диапазон от 2 до 33) дней в целом, но во всех других отношениях их клинические проявления были похожи.
ТАБЛИЦА 1
Клинические и лабораторные параметры для пациентов с подозрением на кишечную лихорадку
| Переменная | Значение для: | |
|---|---|---|
| Все включенные пациенты ( n = 514) | Пациенты с положительным посевом крови ( n = 375) | |
| Возраст (лет) a | 12,9 (9) 14 (9,5) | |
| Продолжительность предшествующей лихорадки (дни) b | 9 (от 7 до 12; от 2 до 33) | 10 (от 7 до 13; от 2 до 33) |
| Температура (° C) а | 39.3 (1.0) | 39.1 (1.0) |
| Гепатомегалия c | 337 из 511 (66) | 237 из 375 (64) |
| Melena c | (4)14 из 374 (4) | |
| Рвота c | 91 из 508 (18) | 69 из 378 (18) |
| Боль в животе c | 32161 | (509)106 из 378 (62) |
| Диарея c | 325 из 506 (64) | 234 из 378 (62) |
| Желтуха a | 5 из 90 5122 9025 460 из 378 (1.1) | |
| Пиковая температура (° C) a | 39,7 (0,9) | 39,7 (0,9) |
| Пятна розы c | 18 из 482 (4) | 17 из 378 ( 5) |
| Количество лейкоцитов / мкл a | 7,300 (3,402) | 7,629 (3,121) |
| Гематокрит (%) a | 33,2 (4,960) 9024 | |
| Число тромбоцитов / мкл a | 180 000 (89 000) | 196 615 (84 795) |
Прямое нанесение на лейкоцитарную пленку.
Прямой посев лейкоцитов был проведен у 192 пациентов со случаями кишечной лихорадки с положительной культурой на бульоне: 190 из 191 S. typhi и 1 из 1 S. paratyphi A культуры были положительными, чувствительность 99,5% ( 95% доверительный интервал [ДИ], от 97,1 до 100%). Хотя точное время образования колоний из культур лейкоцитов не регистрировалось, подсчет обычно был возможен после инкубации в течение ночи. Существенного загрязнения не произошло.
Количественные результаты культивирования.
Среднее количество S. typhi в цельной крови пациентов с неосложненной кишечной лихорадкой ( n = 375) составляло 1 КОЕ / мл (межквартильный диапазон [IQR], <0,3–5; диапазон, <0,3–387) (Инжир. ). В среднем 37,5% (95% ДИ, от 32,9 до 42,1%) КОЕ были получены от организмов, распределенных в слоях эритроцитов и плазмы ( n = 187), а оставшиеся 62,5% жизнеспособных бактерий были сконцентрированы в лейкоцитарной пленке. слой. Среднее количество бактерий на инфицированный лейкоцит составляло 1.3 (IQR, от 0,7 до 2,4) КОЕ / клетку ( n = 81). У детей младше 15 лет ( n = 115) показатели цельной крови были выше, чем у взрослых ( n = 262): в среднем 1,5 (IQR, <0,3 - 6,0; диапазон, <0,3 - 387) по сравнению с медиана 0,6 (IQR, <0,3–2,8; диапазон, <1,3–17,7) КОЕ / мл ( P = 0,008). Количество внеклеточных бактерий также было выше у детей младше 15 лет, чем у взрослых: в среднем 1,5 (диапазон от 0 до 93) против медианы 0,6 (диапазон от 0 до 17.7) ( P = 0,005). Когда в кровь здорового добровольца засевали S. typhi , концентрация организмов, культивируемых из слоя эритроцитов, была такой же, как и в слое лейкоцитарной пленки. Бактерии из плазменного слоя не культивировались. Таким образом, клетки S. typhi не концентрировались в лейкоцитной пленке в результате центрифугирования.
Распределение количества бактерий в крови при остром брюшном тифе.
Устойчивость к антибиотикам и количество бактерий в крови.
Количество QBC было выше у пациентов, инфицированных множественной лекарственной устойчивостью S. typhi ( n = 313), чем у пациентов, инфицированных более чувствительными изолятами ( n = 62): в среднем 1,3 (диапазон, 0 до 387) по сравнению со средним значением 0,5 (диапазон от 0 до 32) КОЕ / мл ( P = 0,006) (рис.). Пациенты, инфицированные штаммами с множественной лекарственной устойчивостью, как правило, были моложе пациентов, инфицированных более чувствительными штаммами: в среднем 10 (IQR, от 6 до 15) по сравнению со средним значением 13 (IQR, от 7 до 24) лет ( P = 0.02). Продолжительность предшествующего заболевания также была немного короче при инфекциях штаммами с множественной лекарственной устойчивостью: в среднем 9 (IQR, от 6 до 12) по сравнению со средним значением в 10 (IQR, от 6 до 15) дней ( P = 0,07). В многофакторном анализе продолжительность предшествующего заболевания, возраст пациента и множественная лекарственная устойчивость изолированного S. typhi были связаны независимо с количеством бактерий в крови ( P = 0,04, P = 0,003 и P = 0,02 соответственно).Связь между количеством бактерий в крови и множественной лекарственной устойчивостью оказалась устойчивой и не могла быть объяснена смешивающими факторами.
Подсчет бактерий в крови пациентов, инфицированных чувствительными к антибиотикам и множественной лекарственной устойчивостью S. typhi . •, медиана; полоски указывают IQR. Каждый кружок представляет одного пациента.
Продолжительность болезни.
С увеличением продолжительности болезни наблюдалось снижение количества бактерий в цельной крови. Средний показатель цельной крови был равен 1.7 (диапазон от <0,2 до 387) КОЕ / мл на первой неделе болезни, 1 (диапазон от 0,2 до 68) КОЕ / мл на второй неделе, 1 (диапазон от <0,2 до 23) КОЕ / мл на третьей неделю и 0,3 (диапазон от <0,2 до 19) КОЕ / мл на четвертой неделе болезни ( P <0,001). Это оставалось статистически значимым, когда и возраст, и местонахождение контролировались в анализе частичной корреляции ( P = 0,002). Аналогичные тенденции наблюдались для внутриклеточного ( P = 0,06) и внеклеточного ( P = 0.03) в счет. Доля внеклеточных организмов также снижалась с увеличением продолжительности заболевания, но при множественном регрессионном анализе, учитывающем возраст и множественную лекарственную устойчивость, эта тенденция не достигла статистической значимости ( P = 0,058).
Каловые культуры.
S. typhi был выделен из 24 из 167 образцов стула пациентов. Среднее количество бактерий в крови у пациентов с положительными культурами стула было значительно выше, чем у пациентов с отрицательными культурами: 3 (IQR, 0.От 7 до 7,3) КОЕ / мл по сравнению с 1 (IQR, <0,3 до 3,0) КОЕ / мл ( P = 0,02). Относительный риск носительства стула у пациентов с инфекциями, вызванными множественной лекарственной устойчивостью S. typhi , по сравнению с таковым для пациентов с инфекциями, вызванными полностью чувствительными S. typhi , составлял 3,0 (95% ДИ от 0,75 до 12,3) ( P = 0,15).
ОБСУЖДЕНИЕ
Кишечная лихорадка – это характерный клинический синдром, который клинически и патологически отличается от других сепсисов, вызываемых грамотрицательными бактериями.Заболевание имеет подострое начало и хроническое течение при отсутствии лечения, но оно редко вызывает эндотоксический шок и несет значительно меньшую смертность, чем другие сепсисы, вызванные грамотрицательными бактериями (6, 12, 15, 16, 23). Несмотря на эти различия, уровни бактериемии у пациентов с неосложненным брюшным тифом (среднее количество 1 КОЕ / мл; смертность <1%) (27) аналогичны уровням бактериемии, вызванной другими энтеробактериями (смертность от 10 до 50%) (6 , 16, 27). Приблизительно у 50% пациентов с брюшным тифом с положительными культурами крови уровень крови составляет менее 1 КОЕ / мл, а у 10% - более 50 КОЕ / мл.Таким образом, патологические различия между сепсисом, вызываемым возбудителями кишечной лихорадки, и сепсисом, вызываемым другими энтеробактериями, нельзя объяснить различиями в количестве микроорганизмов, циркулирующих в крови. В предыдущем исследовании 25 пациентов с брюшным тифом, о котором сообщил Батлер и др., Количество бактерий в крови было выше: у пяти пациентов количество более 100 КОЕ / мл (3). В этой серии небольшой объем (0,1 мл) крови высевали непосредственно на агар, содержащий желчь, который мог высвободить внутриклеточные организмы.Пациенты также были тяжелее (у троих были кишечные кровотечения, двое умерли). Однако перфорация кишечника и кровотечение обычно являются признаками поздней стадии брюшного тифа и связаны с более низкими диагностическими результатами при посеве крови (5, 17). В настоящее исследование не были включены тяжелобольные пациенты, составляющие менее 5% всех случаев в этой области (хотя у 14 из 374 пациентов были признаки кровотечения из верхних отделов желудочно-кишечного тракта). Диапазон количества бактерий в крови в этом большом исследовании брюшного тифа аналогичен таковым в гораздо меньших исследованиях, о которых ранее сообщали Rubin et al., используя, во-первых, метод полуколичественной гибридизации ДНК (19) и, во-вторых, прямые культуры (18).
С точки зрения внутренней токсичности разница между энтеробактериями незначительна. Очищенный эндотоксин S. typhi аналогичен по цитотоксичности и способности индуцировать высвобождение провоспалительных цитокинов с таковым из Escherichia coli (26). Однако сепсис, вызванный грамотрицательными бактериями, часто возникает внезапно, тогда как подострое прогрессирование брюшного тифа может способствовать развитию толерантности к эндотоксинам (11, 14).Сальмонеллы, в том числе S. typhi , развили механизмы подавления воспалительной реакции, предположительно для облегчения устойчивости и передачи (7). Как и при других тяжелых бактериальных инфекциях, более высокие бактериемии чаще обнаруживались у детей с брюшным тифом и были связаны с более высокими пиковыми температурами. Это может отражать более низкий фоновый иммунитет. Принципиальное различие между системной инфекцией сальмонеллами и другими энтеробактериями заключается в том, что две трети бактерий в системе кровообращения находятся внутри фагоцитарных клеток, где они остаются жизнеспособными.Таким образом, количество внеклеточных организмов в кровотоке у пациентов с брюшным тифом обычно ниже, чем у пациентов с другими системными инфекциями.
Концентрация бацилл брюшного тифа в лейкоцитарной пленке (предположительно в моноцитах и полиморфно-ядерных лейкоцитах) означает, что прямое высевание этого клеточного слоя представляет собой альтернативный и более быстрый метод диагностики, чем посев на бульоне из цельной крови. Колонии обычно проявлялись после инкубации в течение ночи. В этом исследовании среднее количество организмов на одну фагоцитарную клетку составляло 1.3, цифра, идентичная приведенной Rubin et al. (18). Лизинг фагоцитарных клеток увеличивал абсолютное количество идентифицированных КОЕ, но не повышал чувствительность процедуры. В целом, культура лейкоцитной пленки была такой же чувствительной, как и культура на бульоне из цельной крови, и позволяла раньше идентифицировать организм и тестировать чувствительность к противомикробным препаратам. Загрязнение в этом исследовании было редким. Культивирование баффи может быть особенно полезно для маленьких детей, которые склонны к более высоким уровням бактериемии, так как это позволяет взять меньший общий объем крови.Плазма одного и того же образца может использоваться как для биохимических, так и для серологических тестов.
В этом исследовании количество бактерий в крови снижалось с увеличением продолжительности болезни. Снижение диагностической чувствительности посева крови с увеличением продолжительности болезни при брюшном тифе было хорошо известно на протяжении всего столетия. В 1907 году обзор литературы показал, что 89% посевов крови были положительными на первой неделе брюшного тифа, 73% были положительными на второй, 60% были положительными на третьей и только 26% были положительными на четвертой и четвертой неделе. последующие недели (5).Современные среды для культивирования крови содержат полианэтолесульфонат натрия (Liquoid) и могут лучше выращивать меньшее количество бактерий, чем те, которые использовались ранее (8, 9), но тенденция в этом большом исследовании была той же. Уменьшение количества бактерий в крови совпадает с увеличением риска язвы и кровотечений в тонкой кишке, поскольку тифоидные бациллы концентрируются в пятнах Пейера, а участки некроза образуются в стенке кишечника.
В других исследованиях, в которых множественная лекарственная устойчивость была связана с тяжестью брюшного тифа, эта связь была приписана неправильному начальному лечению и, следовательно, дальнейшему прогрессированию заболевания и последующему обращению в больницу (2, 25).В этом исследовании у пациентов с брюшным тифом, вызванным штаммами с множественной лекарственной устойчивостью, в крови было больше бактерий S. typhi , чем у пациентов, инфицированных чувствительными к антибиотикам организмами. У них также была немного меньшая продолжительность предшествующего заболевания, поэтому предыдущее лечение неэффективными противомикробными препаратами вряд ли объяснит более высокий уровень бактериемии в этой группе. Хотя нельзя однозначно исключить неэффективное предыдущее лечение, поскольку многие пациенты не уверены в том, какие лекарства они получали, фторхинолоны были антибиотиками, которые с наибольшей вероятностью назначались вне больницы в местах проведения исследования (22a), и они должны были быть столь же эффективными против лекарственно-устойчивые и чувствительные бактерии.Кроме того, фторхинолоны обычно стерилизуют кровь у пациентов с брюшным тифом в течение 2 дней, поэтому маловероятно, что были проведены серьезные курсы лечения антибиотиками. Пациенты с инфекциями, вызываемыми бактериями с множественной лекарственной устойчивостью, как правило, были моложе, но в многофакторном анализе лекарственная устойчивость была независимо связана с более высокими бактериемиями. Это предполагает, что фенотип множественной лекарственной устойчивости может быть связан с вирулентностью у S. typhi . Множественная устойчивость у S.typhi кодируется генами, содержащимися в больших переносимых плазмидах. Неизвестно, несут ли эти плазмиды другие гены вирулентности или сами механизмы устойчивости каким-то образом повышают выживаемость и размножение бактерий in vivo.
Посевы кала при однократном приеме дали положительный результат на S. typhi у 14,3% из 167 пациентов. Носительство S. typhi в стуле было связано со значительно более высоким содержанием бактерий в крови. Поскольку множественная лекарственная устойчивость также была положительно связана с количеством бактерий в крови, пациенты, инфицированные мультирезистентными бактериями, с большей вероятностью выделяли организмы со стулом, хотя эта разница не достигла статистической значимости.Если исследования с участием большего числа пациентов подтвердят это наблюдение, то связь лекарственной устойчивости с увеличением бактериемии, а также повышенным потенциалом передачи может дать правдоподобное объяснение недавнему очень быстрому распространению бацилл брюшного тифа с множественной лекарственной устойчивостью в южной части Вьетнама.
БЛАГОДАРНОСТИ
Мы очень благодарны директорам и персоналу провинциальной больницы Донг Тап и Центра тропических болезней в Хошимине.Мы особенно благодарны отделам микробиологии обоих учреждений за их помощь и Джули Симпсон за советы по статистике.
Это исследование было поддержано британским фондом Wellcome Trust.
СПИСОК ЛИТЕРАТУРЫ
1. Бауэр А. В., Кирби В. М., Шерис Дж. С., Терк М. Определение чувствительности к антибиотикам с помощью стандартизированного метода с одним диском. Am J Clin Pathol. 1978; 45: 493–496. [PubMed] [Google Scholar] 2. Бхутта З. А., Нагви С. Х., Раззак Р. А., Фаруки Б. Дж. Брюшной тиф с множественной лекарственной устойчивостью у детей: презентация и клинические особенности.Rev Infect Dis. 1991; 13: 832–836. [PubMed] [Google Scholar] 3. Батлер Т., Белл В. Р., Левин Дж., Линь Н. Н., Арнольд К. Брюшной тиф; исследования свертывания крови, бактериемии и эндотоксемии. Arch Intern Med. 1978; 138: 407–410. [PubMed] [Google Scholar] 4. Chinh N T, Solomon T, Thong M X, Ly N T, Hoa N T T, Wain J, Diep T. S, Smith M D, Day N P J, Phi L T, Parry C. M, White N J. Короткие курсы офлоксацина для лечения кишечной лихорадки. Trans R Soc Trop Med Hyg. 1997. 91: 347–349. [PubMed] [Google Scholar] 5.Коулман В., Бакстон Б. Х. Бактериология крови при брюшном тифе: анализ 1602 случаев. Am J Med Sci. 1907; 133: 896–903. [Google Scholar] 6. DuPont HL, Spink W. W. Инфекции, вызванные грамотрицательными микроорганизмами: анализ 860 пациентов с бактериемией в медицинском центре Университета Миннесоты, 1958–1966. Медицина. 1969; 48: 307–332. [PubMed] [Google Scholar] 7. Эйзенштейн Т. К., Аль-Рамади Б. К., Хуанг Д. Иммунитет и иммуносупрессия, индуцированные ослабленной Salmonella : роль оксида азота.В: Кабельо Ф, редактор. Биология сальмонеллы. Нью-Йорк, Нью-Йорк: Plenum Press; 1993. С. 265–276. [Google Scholar] 9. Эскамилла Дж., Сантьяго Л. Т., Сангаланг Р. П., Раноа С. П., Кросс Дж. Х. Сравнительное исследование трех систем культивирования крови для выделения кишечной лихорадки Salmonella . Юго-Восточная Азия J Trop Med Public Health. 1984. 15: 161–166. [PubMed] [Google Scholar] 10. Фостер В. Д. Лабораторная диагностика брюшного тифа. Ланцет. 1975; II: 80. [PubMed] [Google Scholar] 11. Грейсман С. Э., Вудворд С. Л.Исследования in vivo роли печени в эндотоксиновой лихорадке и толерантности. J Clin Invest. 1970; 49: 37а – 38а. [Google Scholar] 12. Холл В. Х., Голд Д. Шок, связанный с бактериемией. Arch Intern Med. 1955; 96: 403–412. [PubMed] [Google Scholar] 13. Хоффман С.Л., Пенджаби Н.Х., Рокхилл Р.К., Сутомо А., Риваи А.Р., Пулунгсих С.П. Дуоденальный посев на нити-капсулу в сравнении с культурами костного мозга, крови и ректальных мазков для диагностики брюшного тифа и паратифа. J Infect Dis. 1984. 149: 157–161. [PubMed] [Google Scholar] 14.Хорник Р. Б., Грейсман С. Е., Вудворд Т. Е., Дюпон Н. Л., Докинз А. Т., Снайдер М. Дж. Брюшной тиф: патогенез и иммунологический контроль. N Engl J Med. 1970; 283: 686–691. и 739–746. [PubMed] [Google Scholar] 15. Kluge R M, DuPont H L. Факторы, влияющие на смертность пациентов с бактериемией. Surg Gynecol Obstet. 1973; 137: 137–267. [PubMed] [Google Scholar] 16. Крегер Б. Э., Крейвен Д. Э. Грамотрицательная бактериемия. III. Переоценка этиологии, эпидемиологии и экологии у 612 пациентов. Am J Med. 1980. 68: 332–343.[PubMed] [Google Scholar] 17. Паркер М. Т. Сальмонелла. В: Уилсон Дж., Майлз А., Паркер М. Т., редакторы. Принципы бактериологии, вирусологии и иммунитета Топли и Вильсона. 7-е изд. Лондон, Англия: Эдвард Арнольд; 1983. С. 332–355. [Google Scholar] 18. Rubin FA, McWhirter PD, Burr D, Punjabi NH, Lane E, Kumala S, Sudarmono P, Pulungsih SP, Lesmana M, Tjaniadi P, Sukri N, Hoffman S.L. Быстрая диагностика брюшного тифа путем идентификации Salmonella typhi в 18 часов сбора образцов путем культивирования фракции мононуклеарных клеток и тромбоцитов крови.J Clin Microbiol. 1990; 28: 825–827. [Бесплатная статья PMC] [PubMed] [Google Scholar] 19. Rubin FA, McWhirter PD, Punjabi NH, Lane E, Sudarmono P, Pulungsih SP, Lesmana M, Kumala S, Kopecko DJ, Hoffman S.L. Использование зонда ДНК для обнаружения Salmonella typhi в крови пациентов с брюшным тифом . J Clin Microbiol. 1989; 27: 1112–1114. [Бесплатная статья PMC] [PubMed] [Google Scholar] 21. Стюарт М. Д., Пуллен Р. Л. Брюшной тиф: клинический анализ трехсот шестидесяти случаев. Arch Intern Med. 1946; 78: 629–661.[PubMed] [Google Scholar] 22. Vinh H, Wain J, Hanh V T N, Nga C N, Chinh M T, Bethell D, Hoa N T T, Diep T. S, Dung N M, White N J. Двух или трехдневное лечение офлоксацином неосложненного брюшного тифа с множественной лекарственной устойчивостью у детей. Антимикробные агенты Chemother. 1996; 40: 958–961. [Бесплатная статья PMC] [PubMed] [Google Scholar]22a. Уэйн, Дж. И К. М. Парри. Неопубликованное наблюдение.
23. Уолш А. Л., Смит М. Д., Вутиеканун В., Супуттамонгкол Ю., Чаовагуль В., Дэнс Д. А. Б, Ангус Б., Уайт Н. Дж.Прогностическое значение количественной бактериемии при септическом мелиоидозе. Clin Infect Dis. 1995; 21: 1498–1500. [PubMed] [Google Scholar] 24. Уотсон К. Выделение Salmonella typhi из кровотока. J Lab Clin Med. 1955. 46: 128–134. [PubMed] [Google Scholar] 25. Уайт Н. Дж., Пэрри С. М. Лечение брюшного тифа. Curr Opin Infect Dis. 1996; 9: 298–302. [Google Scholar] 26. Уилсон Б. М., Северн А., Рэпсон Н. Т., Чана Дж., Хопкинс П. Удобная система цельной крови для изучения регуляции высвобождения фактора некроза опухоли бактериальным липополисахаридом.J Immunol Methods. 1991; 139: 233–240. [PubMed] [Google Scholar]Количественное определение бактерий в крови пациентов с брюшным тифом и взаимосвязь между количеством и клиническими характеристиками, трансмиссивностью и устойчивостью к антибиотикам
J Clin Microbiol. 1998 Jun; 36 (6): 1683–1687.
, 1, 2, 3 , 2 , 4 , 1, 3 , 2 , 1, 2, 3 и 1 3, *Джон Уэйн
Отдел клинических исследований Wellcome Trust 1 и Отдел микробиологии, 2 Центр тропических болезней, Больница Чо Куан, Хошимин, и Больница Донг Тап, Цао Лань, Dong Thap, 4 Vietnam, и Центр тропической медицины, Департамент клинической медицины Наффилда, Оксфордский университет, Оксфорд, Соединенное Королевство 3
To Song Diep
Wellcome Trust Clinical Research Unit 1 и Департамент микробиологии, 2 Центр тропических болезней, Больница Чо Куан, Хошимин, и Больница Донг Тхап, Као Лань, Донг Тхап, 4 Вьетнам, и Центр тропической медицины, Департамент клинической медицины Наффилда, О. xford University, Oxford, United Kingdom 3
Vo Anh Ho
Wellcome Trust Clinical Research Unit 1 и Департамент микробиологии, 2 Центр тропических болезней, Больница Чо Куан, Хошимин и Донг Тап Госпиталь, Као Лань, Донг Тхап, 4 Вьетнам, и Центр тропической медицины, Кафедра клинической медицины Наффилда, Оксфордский университет, Оксфорд, Соединенное Королевство 3
Аманда М.Walsh
Wellcome Trust Clinical Research Unit 1 и Департамент микробиологии, 2 Центр тропических болезней, Больница Чо Куан, Хошимин, и Больница Донг Тхап, Као Лань, Донг Тхап, 4 Вьетнам, и Центр тропической медицины, Департамент клинической медицины Наффилда, Оксфордский университет, Оксфорд, Соединенное Королевство 3
Нгуен Тхи Туйет Хоа
Wellcome Trust Отдел клинических исследований 1 и Департамент микробиологии, 2 Центр тропических болезней, Больница Чо Куан, Хошимин, и больница Донг Тхап, Као Лань, Донг Тхап, 4 Вьетнам, и Центр тропической медицины, Кафедра клинической медицины Наффилда, Оксфордский университет, Оксфорд, Соединенное Королевство 3
Кристофер М.Parry
Wellcome Trust Отдел клинических исследований 1 и Департамент микробиологии, 2 Центр тропических болезней, Больница Чо Куан, Хошимин, и Больница Донг Тхап, Као Лань, Донг Тап, 4 Вьетнам, и Центр тропической медицины, Кафедра клинической медицины Наффилда, Оксфордский университет, Оксфорд, Соединенное Королевство 3
Николас Дж. Уайт
Wellcome Trust Отдел клинических исследований 1 и Департамент микробиологии, 2 Центр тропических болезней, Больница Чо Куан, Хошимин, и Больница Донг Тхап, Као Лань, Донг Тхап, 4 Вьетнам, и Центр тропической медицины, Кафедра клинической медицины Наффилда, Оксфордский университет, Оксфорд, Великобритания 3
Wellcome Доверьте отдел клинических исследований 1 и отдел микробиологии, 2 Центр тропических болезней, больница Чо Куан, Хошимин, ан. d Больница Донг Тхап, Као Лань, Донг Тхап, 4 Вьетнам, и Центр тропической медицины, Кафедра клинической медицины Наффилда, Оксфордский университет, Оксфорд, Соединенное Королевство 3
* Автор, отвечающий за переписку.Почтовый адрес: Отдел клинических исследований Wellcome Trust, Центр тропических болезней, Больница Чо Куан, Хошимин, Вьетнам. Телефон: 84 88 353954. Факс: 84 88 353904. Электронная почта: [email protected].Поступило 30 декабря 1997 г .; Изменения запрошены 8 февраля 1998 г .; Принято 3 марта 1998 г.
Copyright © 1998, Американское общество микробиологов. Эта статья цитируется в других статьях в PMC.Abstract
Salmonella typhi была выделена из 369 и Salmonella paratyphi A был выделен у 6 из 515 вьетнамских пациентов с подозрением на кишечную лихорадку.По сравнению с традиционным культивированием крови в бульоне, прямой посев на лейкоцитарную пленку имел диагностическую чувствительность 99,5% (95% доверительный интервал [ДИ] от 97,1 до 100%). Количество бактерий в крови оценивали методом наливной чашки. Среднее количество S. typhi в крови составляло 1 КОЕ / мл (диапазон от <0,3 до 387 КОЕ / мл), из которых в среднем 63% (95% ДИ, от 58 до 67%) были внутриклеточными. Среднее количество бактерий на инфицированный лейкоцит составляло 1,3 (межквартильный размах [IQR], 0,7–2,4) КОЕ / клетку ( n = 81).У детей (<15 лет; n = 115) среднее количество бактерий в крови было выше, чем у взрослых ( n = 262): 1,5 (диапазон от <0,3 до 387) против 0,6 (диапазон от <0,3 до 17,7) КОЕ / мл ( P = 0,008), а пациенты, которые выделяли S. typhi с фекалиями, имели более высокие бактериемии, чем те, кто этого не делал: в среднем 3 (диапазон от <0,3 до 32) против 1 (диапазон от <0,3 до 68 ) КОЕ / мл ( P = 0,02). Количество бактерий в крови снижалось с увеличением продолжительности болезни ( P = 0.002) и были выше при инфекциях, вызванных S. typhi с множественной лекарственной устойчивостью (1,3 [диапазон от <0,3 до 387] КОЕ / мл; n = 313), чем при инфекциях, вызванных чувствительными к антибиотикам S. typhi (0,5 [диапазон от <0,3 до 32] КОЕ / мл; n = 62) ( P = 0,006). В многофакторном анализе это оказалось независимой ассоциацией, предполагающей связь между устойчивостью к антибиотикам и вирулентностью у S. typhi.
Брюшной тиф – это длительное заболевание, характеризующееся бактериемией, вызванной Salmonella typhi , высокоразвитым грамотрицательным бактериальным паразитом, поражающим только людей.Несмотря на бактериологическое сходство между S. typhi и другими энтеробактериями, клиническая картина брюшного тифа обычно отличается и во многих отношениях отличается от таковой при других септицемиях, вызываемых грамотрицательными микроорганизмами. В целом, пациенты с брюшным тифом менее тяжелы, и тяжесть брюшного тифа обычно отражает локализацию инфекции на пятнах Пейера и последующее изъязвление кишечника, а не фульминантную сепсис. Информации о количестве бактерий в крови и их связи с болезненным состоянием мало (17).При стандартном культивировании в бульоне сальмонеллы были обнаружены в крови от 30 до 90% пациентов с клинически подозреваемыми случаями кишечной лихорадки, а доля больных брюшным тифом с положительными культурами крови уменьшается с увеличением продолжительности болезни (3, 5, 20 , 21). Объем взятой крови и лабораторные методы, используемые для выделения, также являются важными факторами, определяющими выход при посеве крови (3–6, 10, 13, 17, 18, 20, 24). S. typhi способен выживать и воспроизводиться внутри моноцитарных фагоцитов, а при брюшном тифе S.typhi , как сообщается, ограничивается фракцией моноцитов-тромбоцитов крови (5, 17, 18, 24). Чтобы исследовать взаимосвязь между количеством бактерий в крови и клиническими и лабораторными признаками брюшного тифа, мы выполнили количественные бактериологические культуры для большой группы пациентов с неосложненной кишечной лихорадкой.
МАТЕРИАЛЫ И МЕТОДЫ
Пациенты.
Взрослые и дети, госпитализированные с подозрением на неосложненный брюшной тиф, изучались в течение 3-летнего периода в двух разных учреждениях во Вьетнаме: Центре тропических болезней, Хошимин, инфекционной больнице и больнице Дружбы, Цао Лань. Город, большая провинциальная больница в провинции Донг Тхап в дельте Меконга.Эти пациенты были набраны для проспективных исследований краткосрочного курса фторхинолоновой терапии на основании клинических подозрений или положительного посева крови. Критериями клинического диагноза брюшного тифа обычно служили лихорадка в течение ≥6 дней без явного очага инфекции, отрицательный мазок крови на малярию и дискомфорт в животе при изменении привычек кишечника. В некоторых случаях замкнутое или апатичное поведение пациентов при лихорадке также было диагностическим признаком.Пациенты с тяжелым или осложненным брюшным тифом (за исключением тех, у кого в анамнезе была только мелена) и те, кто уже получал эффективное лечение антибиотиками (т. Е. Антибиотиками, активными против S. typhi ), не были включены в эти исследования. Перед началом лечения брали кровь для стандартных лабораторных анализов и посева, как описано ниже, и, когда это было возможно, не откладывая начало лечения, культивировали образец кала на Salmonella . Полностью информированное согласие на забор крови было получено от всех пациентов.Это исследование было одобрено научным и этическим комитетами участвующих учреждений.
Лабораторные методы.
В обоих центрах использовались одинаковые лабораторные методы. У каждого пациента в асептических условиях брали от пяти до десяти миллилитров венозной крови и вносили в 50 мл бульона для инфузии мозга и сердца (Oxoid, Basingstoke, Великобритания), содержащего 0,05% полианэтолесульфоната натрия (Sigma, Poole, Великобритания). Поддерживали минимальное соотношение кровь-бульон от 1 до 10.Бульоны для культур крови инкубировали в течение 7 дней, а субкультивирование проводили через 24 часа и через 7 дней. Все флаконы также проверяли ежедневно, и если флакон показывал видимые признаки роста, проводили пересев на агар с овечьей кровью. Культивирование стула проводили после обогащения пробы массой 1 г в 10 мл селенитного бульона в течение 24 ч. Затем пять микролитров из верхней части бульона высевали на агар XLD (Oxoid). Бактериальные изоляты были идентифицированы стандартными биохимическими тестами (глюкоза, ферментация лактозы и образование газа, выработка индола и H 2 S, утилизация цитрата, подвижность и способность расщеплять мочевину) и агглютинация с Salmonella 09- и Vi-специфичными. антисыворотки (Wellcome Diagnostics, Дартфорд, Великобритания).Чувствительность дисков к антибиотикам определяли с использованием модификации метода Bauer et al. (1). Организмы, устойчивые к хлорамфениколу, ампициллину, триметоприму и сульфаметоксазолу, но чувствительные к офлоксацину и цефтриаксону, были описаны как устойчивые к множеству лекарственных препаратов.
Количественные культуры.
Венозная кровь для количественного посева и культивирования в бульоне была взята перед введением противомикробных препаратов от брюшного тифа. Кровь (от 3 до 9 мл у взрослых и от 1,5 до 6 мл у детей) собирали в стерильную гепаринизированную пробирку и немедленно отправляли в лабораторию.Количественные посевы цельной крови (QBC) проводили методом заливки на чашках. Вкратце, три отмеренные аликвоты крови (обычно 1 мл; 0,5 мл для маленьких детей) смешивали с 19 мл расплавленного (50 ° C) колумбийского агара (Unipath, Бейзингсток, Соединенное Королевство) в стерильной чашке Петри и оставляли для застывания. , а затем инкубировали при 37 ° C. Через 2-4 дня колонии подсчитывали и записывали как КОЕ на миллилитр. Для идентификации с поверхности агара собирали до пяти колоний. После повторной инкубации в течение 24 часов были выполнены стандартные биохимические тесты и агглютинация со специфической антисывороткой.Планшеты отбрасывали как отрицательные, если через 4 дня инкубации не было видно колоний.
Для определения количества внутрилейкоцитарных КОЕ в образцах крови были выполнены количественные посевы лейкоцитов периферической крови. Это исследование проводилось на случайно выбранной подгруппе пациентов. Гепаринизированную цельную кровь (2,5 или 5 мл), взятую одновременно с QBC, центрифугировали при 2700 × г в течение 10 мин. Плазму осторожно удаляли стерильной пластиковой пипеткой, и 0.1 мл, включая слой лейкоцитов, аспирировали стерильным шприцем на 1 мл. Количественные культуры были выполнены на этом 0,1-миллилитровом образце путем смешивания его с 19 мл расплавленного колумбийского агара, выливания смеси в виде чашки с агаром и инкубации в течение до 4 дней. Фагоциты периферической крови, содержащие более одной бактерии, будут производить одну колонию в твердой культуральной среде. Таким образом, для образцов цельной крови и лейкоцитов результаты выражались в КОЕ на миллилитр. Чтобы точно определить количество внутриклеточных бактерий на инфицированный фагоцит, секунда 0.Отбирали 1 мл образца лейкоцитов и лейкоциты лизировали путем инкубации с 0,1 мл 0,1% дигитонина (Sigma) в течение 10 мин при 37 ° C. Это должно было высвободить внутриклеточные бактерии. Затем количественные культуры были выполнены на этом образце так же, как и для первого образца, то есть путем смешивания с 19 мл расплавленного агара Колумбия, выливания смеси в виде чашки с агаром и инкубации при 37 ° C в течение до 4 дней. . Чтобы исключить возможность того, что локализация бактерий в лейкоцитарной пленке была артефактом этапа центрифугирования, в 10 мл крови здорового добровольца засевали 10 4 КОЕ из S.typhi и сразу центрифугировали при 2700 × g в течение 10 мин. Объем 0,1 мл лейкоцитарной пленки и 0,1 мл слоя эритроцитов собирали стерильными шприцами объемом 1 мл, смешивали с 19 мл расплавленного агара Columbia и давали возможность застыть, как описано выше. Бактериальные колонии подсчитывали через 4 дня инкубации при 37 ° C.
Расчет количества бактерий.
Число бактерий S. typhi на миллилитр крови (QBC) оценивали по количеству КОЕ на каждой разливочной пластине.Минимальный объем цельной крови, используемой для количественных методов от одного пациента, составлял 1,5 мл для маленьких детей и 3 мл для взрослых и детей старшего возраста. Это дает нижний предел обнаружения 0,7 или 0,3 КОЕ на мл соответственно. При сообщении количества бактерий в образцах лейкоцитарной пленки и лизированной лейкоцитарной пленки знаменателем был объем цельной крови, из которой был взят лейкоцит. У пациентов с положительной культурой в бульоне, но отрицательной по QBC, количественное значение оценивали по общему объему посевной крови: 0.От 7 до 1,0 КОЕ / мл из 1,5 мл крови и от 0,3 до 1,0 КОЕ / мл из 3 мл крови. Жизнеспособные бактерии в образце лейкоцитарной пленки объемом 0,1 мл считались внутрилейкоцитарными, а организмы в оставшейся части крови считались находящимися в плазме. Поэтому количество внеклеточных бактерий рассчитывали по следующей формуле: (КОЕ / мл цельной крови) – (КОЕ / мл лейкоцитарной пленки). Среднее количество жизнеспособных бактерий на инфицированный лейкоцит рассчитывали по следующей формуле: количество лизированных лейкоцитов (в бактериях на миллилитр) / количество нелизированных лейкоцитов (в инфицированных клетках на миллилитр).
Статистический анализ.
SPSS for Windows (SPSS Benelux Inc., Gorinchem, Нидерланды) версии 6 использовался для всех статистических анализов. Коэффициенты частичной корреляции были рассчитаны для связи между непрерывными переменными и количеством бактерий. Различия в количестве бактерий между группами, определяемыми дихотомическими переменными, проверяли с помощью U-критерия Манна-Уитни. Потенциально мешающие переменные (место и / или возраст) контролировались, и все данные с нестандартным распределением ранжировались до того, как были выполнены корреляционные тесты для ранжированных данных.Взаимодействия оценивались с помощью многомерного анализа.
РЕЗУЛЬТАТЫ
Посев крови в бульоне был проведен у 515 взрослых и детей с подозрением на кишечную лихорадку в период с марта 1993 г. по март 1996 г. (таблица). Все пациенты получали лечение офлоксацином перорально (общая доза от 60 до 135 мг / кг массы тела в течение 2–5 дней), как сообщалось в других источниках (4, 22), и все выздоровели. Возбудители кишечной лихорадки выделены от 375 (72,8%) пациентов: S. typhi от 369 пациентов и Salmonella paratyphi A от 6 пациентов.У двух пациентов QBC на чашке для заливки был положительным, но посевы крови в бульоне были отрицательными. Salmonella derby была выделена из крови одного пациента, и этот пациент был признан отрицательным по возбудителям кишечной лихорадки и исключен из анализа. Большинство изолятов S. typhi (313; 80%) обладали множественной лекарственной устойчивостью, то есть устойчивы к хлорамфениколу, триметоприм-сульфаметоксазолу и ампициллину. Подсчет бактерий как в цельной крови, так и в лейкоцитарной пленке был проведен у 187 пациентов.Эти пациенты имели клинические параметры при поступлении, аналогичные таковым у 188 пациентов с кишечной лихорадкой, которым проводился только QBC цельной крови. Одновременно были взяты образцы цельной крови, лейкоцитарной пленки и лизированной лейкоцитарной пленки у подгруппы из 81 пациента. Эти пациенты имели немного более короткую продолжительность болезни перед госпитализацией, т. Е. В среднем составляли 7 (диапазон от 2 до 33) дней по сравнению со средним значением в 9 (диапазон от 2 до 33) дней в целом, но во всех других отношениях их клинические проявления были похожи.
ТАБЛИЦА 1
Клинические и лабораторные параметры для пациентов с подозрением на кишечную лихорадку
| Переменная | Значение для: | |
|---|---|---|
| Все включенные пациенты ( n = 514) | Пациенты с положительным посевом крови ( n = 375) | |
| Возраст (лет) a | 12,9 (9) 14 (9,5) | |
| Продолжительность предшествующей лихорадки (дни) b | 9 (от 7 до 12; от 2 до 33) | 10 (от 7 до 13; от 2 до 33) |
| Температура (° C) а | 39.3 (1.0) | 39.1 (1.0) |
| Гепатомегалия c | 337 из 511 (66) | 237 из 375 (64) |
| Melena c | (4)14 из 374 (4) | |
| Рвота c | 91 из 508 (18) | 69 из 378 (18) |
| Боль в животе c | 32161 | (509)106 из 378 (62) |
| Диарея c | 325 из 506 (64) | 234 из 378 (62) |
| Желтуха a | 5 из 90 5122 9025 460 из 378 (1.1) | |
| Пиковая температура (° C) a | 39,7 (0,9) | 39,7 (0,9) |
| Пятна розы c | 18 из 482 (4) | 17 из 378 ( 5) |
| Количество лейкоцитов / мкл a | 7,300 (3,402) | 7,629 (3,121) |
| Гематокрит (%) a | 33,2 (4,960) 9024 | |
| Число тромбоцитов / мкл a | 180 000 (89 000) | 196 615 (84 795) |
Прямое нанесение на лейкоцитарную пленку.
Прямой посев лейкоцитов был проведен у 192 пациентов со случаями кишечной лихорадки с положительной культурой на бульоне: 190 из 191 S. typhi и 1 из 1 S. paratyphi A культуры были положительными, чувствительность 99,5% ( 95% доверительный интервал [ДИ], от 97,1 до 100%). Хотя точное время образования колоний из культур лейкоцитов не регистрировалось, подсчет обычно был возможен после инкубации в течение ночи. Существенного загрязнения не произошло.
Количественные результаты культивирования.
Среднее количество S. typhi в цельной крови пациентов с неосложненной кишечной лихорадкой ( n = 375) составляло 1 КОЕ / мл (межквартильный диапазон [IQR], <0,3–5; диапазон, <0,3–387) (Инжир. ). В среднем 37,5% (95% ДИ, от 32,9 до 42,1%) КОЕ были получены от организмов, распределенных в слоях эритроцитов и плазмы ( n = 187), а оставшиеся 62,5% жизнеспособных бактерий были сконцентрированы в лейкоцитарной пленке. слой. Среднее количество бактерий на инфицированный лейкоцит составляло 1.3 (IQR, от 0,7 до 2,4) КОЕ / клетку ( n = 81). У детей младше 15 лет ( n = 115) показатели цельной крови были выше, чем у взрослых ( n = 262): в среднем 1,5 (IQR, <0,3 - 6,0; диапазон, <0,3 - 387) по сравнению с медиана 0,6 (IQR, <0,3–2,8; диапазон, <1,3–17,7) КОЕ / мл ( P = 0,008). Количество внеклеточных бактерий также было выше у детей младше 15 лет, чем у взрослых: в среднем 1,5 (диапазон от 0 до 93) против медианы 0,6 (диапазон от 0 до 17.7) ( P = 0,005). Когда в кровь здорового добровольца засевали S. typhi , концентрация организмов, культивируемых из слоя эритроцитов, была такой же, как и в слое лейкоцитарной пленки. Бактерии из плазменного слоя не культивировались. Таким образом, клетки S. typhi не концентрировались в лейкоцитной пленке в результате центрифугирования.
Распределение количества бактерий в крови при остром брюшном тифе.
Устойчивость к антибиотикам и количество бактерий в крови.
Количество QBC было выше у пациентов, инфицированных множественной лекарственной устойчивостью S. typhi ( n = 313), чем у пациентов, инфицированных более чувствительными изолятами ( n = 62): в среднем 1,3 (диапазон, 0 до 387) по сравнению со средним значением 0,5 (диапазон от 0 до 32) КОЕ / мл ( P = 0,006) (рис.). Пациенты, инфицированные штаммами с множественной лекарственной устойчивостью, как правило, были моложе пациентов, инфицированных более чувствительными штаммами: в среднем 10 (IQR, от 6 до 15) по сравнению со средним значением 13 (IQR, от 7 до 24) лет ( P = 0.02). Продолжительность предшествующего заболевания также была немного короче при инфекциях штаммами с множественной лекарственной устойчивостью: в среднем 9 (IQR, от 6 до 12) по сравнению со средним значением в 10 (IQR, от 6 до 15) дней ( P = 0,07). В многофакторном анализе продолжительность предшествующего заболевания, возраст пациента и множественная лекарственная устойчивость изолированного S. typhi были связаны независимо с количеством бактерий в крови ( P = 0,04, P = 0,003 и P = 0,02 соответственно).Связь между количеством бактерий в крови и множественной лекарственной устойчивостью оказалась устойчивой и не могла быть объяснена смешивающими факторами.
Подсчет бактерий в крови пациентов, инфицированных чувствительными к антибиотикам и множественной лекарственной устойчивостью S. typhi . •, медиана; полоски указывают IQR. Каждый кружок представляет одного пациента.
Продолжительность болезни.
С увеличением продолжительности болезни наблюдалось снижение количества бактерий в цельной крови. Средний показатель цельной крови был равен 1.7 (диапазон от <0,2 до 387) КОЕ / мл на первой неделе болезни, 1 (диапазон от 0,2 до 68) КОЕ / мл на второй неделе, 1 (диапазон от <0,2 до 23) КОЕ / мл на третьей неделю и 0,3 (диапазон от <0,2 до 19) КОЕ / мл на четвертой неделе болезни ( P <0,001). Это оставалось статистически значимым, когда и возраст, и местонахождение контролировались в анализе частичной корреляции ( P = 0,002). Аналогичные тенденции наблюдались для внутриклеточного ( P = 0,06) и внеклеточного ( P = 0.03) в счет. Доля внеклеточных организмов также снижалась с увеличением продолжительности заболевания, но при множественном регрессионном анализе, учитывающем возраст и множественную лекарственную устойчивость, эта тенденция не достигла статистической значимости ( P = 0,058).
Каловые культуры.
S. typhi был выделен из 24 из 167 образцов стула пациентов. Среднее количество бактерий в крови у пациентов с положительными культурами стула было значительно выше, чем у пациентов с отрицательными культурами: 3 (IQR, 0.От 7 до 7,3) КОЕ / мл по сравнению с 1 (IQR, <0,3 до 3,0) КОЕ / мл ( P = 0,02). Относительный риск носительства стула у пациентов с инфекциями, вызванными множественной лекарственной устойчивостью S. typhi , по сравнению с таковым для пациентов с инфекциями, вызванными полностью чувствительными S. typhi , составлял 3,0 (95% ДИ от 0,75 до 12,3) ( P = 0,15).
ОБСУЖДЕНИЕ
Кишечная лихорадка – это характерный клинический синдром, который клинически и патологически отличается от других сепсисов, вызываемых грамотрицательными бактериями.Заболевание имеет подострое начало и хроническое течение при отсутствии лечения, но оно редко вызывает эндотоксический шок и несет значительно меньшую смертность, чем другие сепсисы, вызванные грамотрицательными бактериями (6, 12, 15, 16, 23). Несмотря на эти различия, уровни бактериемии у пациентов с неосложненным брюшным тифом (среднее количество 1 КОЕ / мл; смертность <1%) (27) аналогичны уровням бактериемии, вызванной другими энтеробактериями (смертность от 10 до 50%) (6 , 16, 27). Приблизительно у 50% пациентов с брюшным тифом с положительными культурами крови уровень крови составляет менее 1 КОЕ / мл, а у 10% - более 50 КОЕ / мл.Таким образом, патологические различия между сепсисом, вызываемым возбудителями кишечной лихорадки, и сепсисом, вызываемым другими энтеробактериями, нельзя объяснить различиями в количестве микроорганизмов, циркулирующих в крови. В предыдущем исследовании 25 пациентов с брюшным тифом, о котором сообщил Батлер и др., Количество бактерий в крови было выше: у пяти пациентов количество более 100 КОЕ / мл (3). В этой серии небольшой объем (0,1 мл) крови высевали непосредственно на агар, содержащий желчь, который мог высвободить внутриклеточные организмы.Пациенты также были тяжелее (у троих были кишечные кровотечения, двое умерли). Однако перфорация кишечника и кровотечение обычно являются признаками поздней стадии брюшного тифа и связаны с более низкими диагностическими результатами при посеве крови (5, 17). В настоящее исследование не были включены тяжелобольные пациенты, составляющие менее 5% всех случаев в этой области (хотя у 14 из 374 пациентов были признаки кровотечения из верхних отделов желудочно-кишечного тракта). Диапазон количества бактерий в крови в этом большом исследовании брюшного тифа аналогичен таковым в гораздо меньших исследованиях, о которых ранее сообщали Rubin et al., используя, во-первых, метод полуколичественной гибридизации ДНК (19) и, во-вторых, прямые культуры (18).
С точки зрения внутренней токсичности разница между энтеробактериями незначительна. Очищенный эндотоксин S. typhi аналогичен по цитотоксичности и способности индуцировать высвобождение провоспалительных цитокинов с таковым из Escherichia coli (26). Однако сепсис, вызванный грамотрицательными бактериями, часто возникает внезапно, тогда как подострое прогрессирование брюшного тифа может способствовать развитию толерантности к эндотоксинам (11, 14).Сальмонеллы, в том числе S. typhi , развили механизмы подавления воспалительной реакции, предположительно для облегчения устойчивости и передачи (7). Как и при других тяжелых бактериальных инфекциях, более высокие бактериемии чаще обнаруживались у детей с брюшным тифом и были связаны с более высокими пиковыми температурами. Это может отражать более низкий фоновый иммунитет. Принципиальное различие между системной инфекцией сальмонеллами и другими энтеробактериями заключается в том, что две трети бактерий в системе кровообращения находятся внутри фагоцитарных клеток, где они остаются жизнеспособными.Таким образом, количество внеклеточных организмов в кровотоке у пациентов с брюшным тифом обычно ниже, чем у пациентов с другими системными инфекциями.
Концентрация бацилл брюшного тифа в лейкоцитарной пленке (предположительно в моноцитах и полиморфно-ядерных лейкоцитах) означает, что прямое высевание этого клеточного слоя представляет собой альтернативный и более быстрый метод диагностики, чем посев на бульоне из цельной крови. Колонии обычно проявлялись после инкубации в течение ночи. В этом исследовании среднее количество организмов на одну фагоцитарную клетку составляло 1.3, цифра, идентичная приведенной Rubin et al. (18). Лизинг фагоцитарных клеток увеличивал абсолютное количество идентифицированных КОЕ, но не повышал чувствительность процедуры. В целом, культура лейкоцитной пленки была такой же чувствительной, как и культура на бульоне из цельной крови, и позволяла раньше идентифицировать организм и тестировать чувствительность к противомикробным препаратам. Загрязнение в этом исследовании было редким. Культивирование баффи может быть особенно полезно для маленьких детей, которые склонны к более высоким уровням бактериемии, так как это позволяет взять меньший общий объем крови.Плазма одного и того же образца может использоваться как для биохимических, так и для серологических тестов.
В этом исследовании количество бактерий в крови снижалось с увеличением продолжительности болезни. Снижение диагностической чувствительности посева крови с увеличением продолжительности болезни при брюшном тифе было хорошо известно на протяжении всего столетия. В 1907 году обзор литературы показал, что 89% посевов крови были положительными на первой неделе брюшного тифа, 73% были положительными на второй, 60% были положительными на третьей и только 26% были положительными на четвертой и четвертой неделе. последующие недели (5).Современные среды для культивирования крови содержат полианэтолесульфонат натрия (Liquoid) и могут лучше выращивать меньшее количество бактерий, чем те, которые использовались ранее (8, 9), но тенденция в этом большом исследовании была той же. Уменьшение количества бактерий в крови совпадает с увеличением риска язвы и кровотечений в тонкой кишке, поскольку тифоидные бациллы концентрируются в пятнах Пейера, а участки некроза образуются в стенке кишечника.
В других исследованиях, в которых множественная лекарственная устойчивость была связана с тяжестью брюшного тифа, эта связь была приписана неправильному начальному лечению и, следовательно, дальнейшему прогрессированию заболевания и последующему обращению в больницу (2, 25).В этом исследовании у пациентов с брюшным тифом, вызванным штаммами с множественной лекарственной устойчивостью, в крови было больше бактерий S. typhi , чем у пациентов, инфицированных чувствительными к антибиотикам организмами. У них также была немного меньшая продолжительность предшествующего заболевания, поэтому предыдущее лечение неэффективными противомикробными препаратами вряд ли объяснит более высокий уровень бактериемии в этой группе. Хотя нельзя однозначно исключить неэффективное предыдущее лечение, поскольку многие пациенты не уверены в том, какие лекарства они получали, фторхинолоны были антибиотиками, которые с наибольшей вероятностью назначались вне больницы в местах проведения исследования (22a), и они должны были быть столь же эффективными против лекарственно-устойчивые и чувствительные бактерии.Кроме того, фторхинолоны обычно стерилизуют кровь у пациентов с брюшным тифом в течение 2 дней, поэтому маловероятно, что были проведены серьезные курсы лечения антибиотиками. Пациенты с инфекциями, вызываемыми бактериями с множественной лекарственной устойчивостью, как правило, были моложе, но в многофакторном анализе лекарственная устойчивость была независимо связана с более высокими бактериемиями. Это предполагает, что фенотип множественной лекарственной устойчивости может быть связан с вирулентностью у S. typhi . Множественная устойчивость у S.typhi кодируется генами, содержащимися в больших переносимых плазмидах. Неизвестно, несут ли эти плазмиды другие гены вирулентности или сами механизмы устойчивости каким-то образом повышают выживаемость и размножение бактерий in vivo.
Посевы кала при однократном приеме дали положительный результат на S. typhi у 14,3% из 167 пациентов. Носительство S. typhi в стуле было связано со значительно более высоким содержанием бактерий в крови. Поскольку множественная лекарственная устойчивость также была положительно связана с количеством бактерий в крови, пациенты, инфицированные мультирезистентными бактериями, с большей вероятностью выделяли организмы со стулом, хотя эта разница не достигла статистической значимости.Если исследования с участием большего числа пациентов подтвердят это наблюдение, то связь лекарственной устойчивости с увеличением бактериемии, а также повышенным потенциалом передачи может дать правдоподобное объяснение недавнему очень быстрому распространению бацилл брюшного тифа с множественной лекарственной устойчивостью в южной части Вьетнама.
БЛАГОДАРНОСТИ
Мы очень благодарны директорам и персоналу провинциальной больницы Донг Тап и Центра тропических болезней в Хошимине.Мы особенно благодарны отделам микробиологии обоих учреждений за их помощь и Джули Симпсон за советы по статистике.
Это исследование было поддержано британским фондом Wellcome Trust.
СПИСОК ЛИТЕРАТУРЫ
1. Бауэр А. В., Кирби В. М., Шерис Дж. С., Терк М. Определение чувствительности к антибиотикам с помощью стандартизированного метода с одним диском. Am J Clin Pathol. 1978; 45: 493–496. [PubMed] [Google Scholar] 2. Бхутта З. А., Нагви С. Х., Раззак Р. А., Фаруки Б. Дж. Брюшной тиф с множественной лекарственной устойчивостью у детей: презентация и клинические особенности.Rev Infect Dis. 1991; 13: 832–836. [PubMed] [Google Scholar] 3. Батлер Т., Белл В. Р., Левин Дж., Линь Н. Н., Арнольд К. Брюшной тиф; исследования свертывания крови, бактериемии и эндотоксемии. Arch Intern Med. 1978; 138: 407–410. [PubMed] [Google Scholar] 4. Chinh N T, Solomon T, Thong M X, Ly N T, Hoa N T T, Wain J, Diep T. S, Smith M D, Day N P J, Phi L T, Parry C. M, White N J. Короткие курсы офлоксацина для лечения кишечной лихорадки. Trans R Soc Trop Med Hyg. 1997. 91: 347–349. [PubMed] [Google Scholar] 5.Коулман В., Бакстон Б. Х. Бактериология крови при брюшном тифе: анализ 1602 случаев. Am J Med Sci. 1907; 133: 896–903. [Google Scholar] 6. DuPont HL, Spink W. W. Инфекции, вызванные грамотрицательными микроорганизмами: анализ 860 пациентов с бактериемией в медицинском центре Университета Миннесоты, 1958–1966. Медицина. 1969; 48: 307–332. [PubMed] [Google Scholar] 7. Эйзенштейн Т. К., Аль-Рамади Б. К., Хуанг Д. Иммунитет и иммуносупрессия, индуцированные ослабленной Salmonella : роль оксида азота.В: Кабельо Ф, редактор. Биология сальмонеллы. Нью-Йорк, Нью-Йорк: Plenum Press; 1993. С. 265–276. [Google Scholar] 9. Эскамилла Дж., Сантьяго Л. Т., Сангаланг Р. П., Раноа С. П., Кросс Дж. Х. Сравнительное исследование трех систем культивирования крови для выделения кишечной лихорадки Salmonella . Юго-Восточная Азия J Trop Med Public Health. 1984. 15: 161–166. [PubMed] [Google Scholar] 10. Фостер В. Д. Лабораторная диагностика брюшного тифа. Ланцет. 1975; II: 80. [PubMed] [Google Scholar] 11. Грейсман С. Э., Вудворд С. Л.Исследования in vivo роли печени в эндотоксиновой лихорадке и толерантности. J Clin Invest. 1970; 49: 37а – 38а. [Google Scholar] 12. Холл В. Х., Голд Д. Шок, связанный с бактериемией. Arch Intern Med. 1955; 96: 403–412. [PubMed] [Google Scholar] 13. Хоффман С.Л., Пенджаби Н.Х., Рокхилл Р.К., Сутомо А., Риваи А.Р., Пулунгсих С.П. Дуоденальный посев на нити-капсулу в сравнении с культурами костного мозга, крови и ректальных мазков для диагностики брюшного тифа и паратифа. J Infect Dis. 1984. 149: 157–161. [PubMed] [Google Scholar] 14.Хорник Р. Б., Грейсман С. Е., Вудворд Т. Е., Дюпон Н. Л., Докинз А. Т., Снайдер М. Дж. Брюшной тиф: патогенез и иммунологический контроль. N Engl J Med. 1970; 283: 686–691. и 739–746. [PubMed] [Google Scholar] 15. Kluge R M, DuPont H L. Факторы, влияющие на смертность пациентов с бактериемией. Surg Gynecol Obstet. 1973; 137: 137–267. [PubMed] [Google Scholar] 16. Крегер Б. Э., Крейвен Д. Э. Грамотрицательная бактериемия. III. Переоценка этиологии, эпидемиологии и экологии у 612 пациентов. Am J Med. 1980. 68: 332–343.[PubMed] [Google Scholar] 17. Паркер М. Т. Сальмонелла. В: Уилсон Дж., Майлз А., Паркер М. Т., редакторы. Принципы бактериологии, вирусологии и иммунитета Топли и Вильсона. 7-е изд. Лондон, Англия: Эдвард Арнольд; 1983. С. 332–355. [Google Scholar] 18. Rubin FA, McWhirter PD, Burr D, Punjabi NH, Lane E, Kumala S, Sudarmono P, Pulungsih SP, Lesmana M, Tjaniadi P, Sukri N, Hoffman S.L. Быстрая диагностика брюшного тифа путем идентификации Salmonella typhi в 18 часов сбора образцов путем культивирования фракции мононуклеарных клеток и тромбоцитов крови.J Clin Microbiol. 1990; 28: 825–827. [Бесплатная статья PMC] [PubMed] [Google Scholar] 19. Rubin FA, McWhirter PD, Punjabi NH, Lane E, Sudarmono P, Pulungsih SP, Lesmana M, Kumala S, Kopecko DJ, Hoffman S.L. Использование зонда ДНК для обнаружения Salmonella typhi в крови пациентов с брюшным тифом . J Clin Microbiol. 1989; 27: 1112–1114. [Бесплатная статья PMC] [PubMed] [Google Scholar] 21. Стюарт М. Д., Пуллен Р. Л. Брюшной тиф: клинический анализ трехсот шестидесяти случаев. Arch Intern Med. 1946; 78: 629–661.[PubMed] [Google Scholar] 22. Vinh H, Wain J, Hanh V T N, Nga C N, Chinh M T, Bethell D, Hoa N T T, Diep T. S, Dung N M, White N J. Двух или трехдневное лечение офлоксацином неосложненного брюшного тифа с множественной лекарственной устойчивостью у детей. Антимикробные агенты Chemother. 1996; 40: 958–961. [Бесплатная статья PMC] [PubMed] [Google Scholar]22a. Уэйн, Дж. И К. М. Парри. Неопубликованное наблюдение.
23. Уолш А. Л., Смит М. Д., Вутиеканун В., Супуттамонгкол Ю., Чаовагуль В., Дэнс Д. А. Б, Ангус Б., Уайт Н. Дж.Прогностическое значение количественной бактериемии при септическом мелиоидозе. Clin Infect Dis. 1995; 21: 1498–1500. [PubMed] [Google Scholar] 24. Уотсон К. Выделение Salmonella typhi из кровотока. J Lab Clin Med. 1955. 46: 128–134. [PubMed] [Google Scholar] 25. Уайт Н. Дж., Пэрри С. М. Лечение брюшного тифа. Curr Opin Infect Dis. 1996; 9: 298–302. [Google Scholar] 26. Уилсон Б. М., Северн А., Рэпсон Н. Т., Чана Дж., Хопкинс П. Удобная система цельной крови для изучения регуляции высвобождения фактора некроза опухоли бактериальным липополисахаридом.J Immunol Methods. 1991; 139: 233–240. [PubMed] [Google Scholar] Тест Видала| Лабораторные тесты онлайн
Источники, использованные в текущем обзоре
(25 марта 2013 г.) Центры по контролю и профилактике заболеваний. Брюшной тиф. Доступно в Интернете по адресу https://www.cdc.gov/typhoid-fever/index.html. По состоянию на март 2018 г.
(11 июля 2015 г.) Клиника Мэйо. Брюшной тиф. Доступно в Интернете по адресу http://www.mayoclinic.org/diseases-conditions/typhoid-fever/basics/symptoms/con-20028553.По состоянию на март 2018 г.
Adhikari A, et al. Оценка чувствительности и специфичности ELISA против теста Видаля для диагностики брюшного тифа в эндемичной популяции Катманду. BMC Infect Dis . 2015; 15: 523. Доступно в Интернете по адресу https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4647669/. По состоянию на март 2018 г.
Andualem G, et al. Примечания BMC Res . 2014; 7: 653. Сравнительное исследование теста Видаля с посевом крови в диагностике брюшного тифа у пациентов с лихорадкой.Доступно на сайте https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4177418/. По состоянию на март 2018 г.
(13 апреля 2015 г.) Всемирная организация здравоохранения. Брюшной тиф. Доступно в Интернете по адресу http://www.who.int/immunization/diseases/typhoid/en/. По состоянию на март 2018 г.
Источники, использованные в предыдущих обзорах
Willke A, Ergonul O и Bayar B. Widal Test в диагностике брюшного тифа в Турции. Clin Diagn Lab Immunol . 2002 июль; 9 (4): 938–941. Доступно в Интернете по адресу http: // www.ncbi.nlm.nih.gov/pmc/articles/PMC120044/. По состоянию на август 2010 г.
Саудовское общество медицинской микробиологии и инфекционных болезней. Тест Видаля. Доступно в Интернете по адресу http://ssmmid.org/widal-test/. По состоянию на август 2010 г.
Омузе Г., Кохли Р. и Ревати Г. Диагностическая ценность одного теста Видаля для диагностики брюшного тифа в больнице Университета Ага Хана (AKUH), Найроби, Кения. Версия опубликована 1 января 2010 г. Trop Doct 2010; 40: 43-44. © 2010 Royal Society of Medicine Press.Доступно в Интернете по адресу http://td.rsmjournals.com/cgi/content/abstract/40/1/43. По состоянию на август 2010 г.
Ley B et al. Оценка теста агглютинации трубки Видаля для диагностики брюшного тифа среди детей, госпитализированных в сельскую больницу в Танзании, и сравнение с предыдущими исследованиями. BMC Infectious Diseases 2010, 10: 180. Доступно в Интернете по адресу http://www.biomedcentral.com/1471-2334/10/180. По состоянию на август 2010 г.
Медицинская энциклопедия MedlinePlus. Брюшной тиф.Доступно в Интернете по адресу http://www.nlm.nih.gov/medlineplus/ency/article/001332.htm. По состоянию на август 2010 г.
Begum Z et al. Сравнение между DOT EIA IgM и тестом Видаля как ранняя диагностика брюшного тифа. Mymensingh Med J. 2009 Янв; 18 (1): 13-7. Доступно в Интернете по адресу http://www.ncbi.nlm.nih.gov/pubmed/1
42. По состоянию на август 2010 г.
Narayanappa D et al. Сравнительное исследование точечного иммуноферментного анализа (Typhidot-M) и теста Видаля в диагностике брюшного тифа. Индийский педиатр .2010, 7 апреля; 47 (4): 331-3. Epub 2009, 15 апреля. Доступно на сайте http://www.ncbi.nlm.nih.gov/pubmed/19430063. По состоянию на август 2010 г.
Всемирная организация здравоохранения. Руководство по стандартным операционным процедурам для МИКРОБИОЛОГИИ: кишечная лихорадка. Доступно в Интернете по адресу http://www.searo.who.int/EN/Section10/Section17/Section53/Section482_1794.htm. По состоянию на август 2010 г.
Центры по контролю и профилактике заболеваний. Здоровье путешественников, Желтая книга 2010 года: брюшной тиф и паратиф. Доступно в Интернете по адресу http: // wwwnc.cdc.gov/travel/yellowbook/2010/chapter-2/typhoid-paratyphoid-fever.aspx. По состоянию на август 2010 г.
MayoClinic.com. Брюшной тиф. Доступно в Интернете по адресу http://www.mayoclinic.com/health/typhoid-fever/DS00538. По состоянию на август 2010 г.
Центры по контролю и профилактике заболеваний. Здоровье путешественников. Брюшной тиф и паратиф. Глава 3. Желтая книга 2014 года. Доступно в Интернете по адресу http://wwwnc.cdc.gov/travel/yellowbook/2014/chapter-3-infectious-diseases-related-to-travel/typhoid-and-paratyphoid-fever.По состоянию на сентябрь 2013 г.
MayoClinic.com. Брюшной тиф: симптомы Доступны в Интернете по адресу http://www.mayoclinic.com/health/typhoid-fever/DS00538/DSECTION=symptoms. По состоянию на сентябрь 2013 г.
Keddy, KH et al. Чувствительность и специфичность экспресс-тестов на антитела к брюшному тифу для лабораторной диагностики в двух странах Африки к югу от Сахары. Бюллетень Всемирной организации здравоохранения 2011; 89: 640-647. Доступно в Интернете по адресу http://www.who.int/bulletin/volumes/89/9/11-087627/en/.По состоянию на сентябрь 2013 г.
Кришна С., Десаи С., Анджана В. К., Парантаман Р. Г. Тифидот (IgM) как надежный и быстрый диагностический тест на брюшной тиф. Ann Trop Med Public Health 2011; 4: 42-4. Доступно в Интернете по адресу http://www.atmph.org/article.asp?issn=1755-6783;year=2011;volume=4;issue=1;spage=42;epage=44;aulast=Krishna. По состоянию на сентябрь 2013 г.
Диагностика брюшного тифа – победить брюшной тиф
Точная диагностика брюшного тифа имеет решающее значение для того, чтобы больные получали своевременную медицинскую помощь и соответствующее лечение.Современная диагностика брюшного тифа сопряжена со многими проблемами, связанными как с природой заболевания, так и с трудностями, связанными с доступными диагностическими инструментами. Симптомы брюшного тифа похожи на симптомы многих других заболеваний, включая малярию, пневмонию, грипп и другие лихорадочные заболевания. Это приводит к частой постановке неправильного диагноза и свидетельствует о необходимости более точных и быстрых диагностических тестов. Доступные в настоящее время средства диагностики брюшного тифа ограничены как с точки зрения возможности выявления возбудителя, серовара Typhi Salmonella enterica, ( Salmonella, Typhi), так и с точки зрения практичности в условиях ограниченных ресурсов и с высоким бременем болезни.
Текущая диагностика брюшного тифа
По данным Всемирной организации здравоохранения, окончательный диагноз брюшного тифа требует выделения бактерии Salmonella Typhi через кровь или культуру костного мозга. Эти методы считаются золотым стандартом диагностики брюшного тифа, хотя оба все еще имеют серьезные практические ограничения. Посев крови стоит дорого и требует наличия специализированного персонала и лабораторного оборудования.
Пункты посева крови редки во многих странах с ограниченными ресурсами и часто ограничиваются крупными больницами в крупных городах.Когда есть возможность провести посев крови, только от 40 до 60 процентов случаев брюшного тифа выявляются правильно из-за низкого уровня бактерий в крови во время болезни. Лучшее время для тестирования – первые дни заражения, но инкубационный период означает, что наиболее высокий уровень бактерий в крови, вероятно, присутствует до развития клинических симптомов. Предыдущее использование пациентом антибиотиков, а также объем крови, взятой для образца, также влияют на точность посева крови.Кроме того, результаты доступны только через несколько дней после взятия крови, что ограничивает полезность теста в клинических условиях, когда медицинский работник должен быстро принять решение о лечении.
Посев костного мозга, хотя и более точен, чем посев крови, является инвазивной и технически сложной процедурой. Это редко делается в клинических условиях, особенно в странах с низким и средним уровнем доходов.
Из-за этих ограничений диагноз брюшного тифа в большинстве стран с ограниченными ресурсами ставится на основе клинических критериев, что является сложной задачей из-за неспецифичности симптомов брюшного тифа.Дополнительные методы включают посев мочи или кала, которые, несмотря на то, что их проще и дешевле выполнять, не обладают надежной точностью. Тест Видаля, разработанный в конце 1800-х годов, прост и недорог, но его не следует использовать только для диагностики, поскольку он часто неточен из-за перекрестной реактивности с другими инфекционными агентами.
Диагностика в разработке
Несколько диагностических средств брюшного тифа, которые направлены на преодоление недостатков существующих методов, за счет их рентабельности и быстрого получения точных результатов, находятся в стадии разработки.Три серологических быстрых диагностических теста – Typhidot, TUBEX® и Test-It Typhoid (KIT) – показали многообещающие первые результаты. Тем не менее, они все еще нуждаются в оценке в более крупных испытаниях в условиях сообщества. Кроме того, в последние годы появились новые области научных исследований, в том числе транскриптомика и метаболомика, которые могут предложить потенциальное будущее решение для диагностики брюшного тифа, но необходимы дальнейшие инвестиции и исследования в этих областях.


