Кровь на лямблии: Анализ на антитела IgA, IgM, IgG к антигенам лямблий сдать в Москве
Анализ на Антитела к лямблиям (Lamblia intestinalis), суммарные в KDL
Лямблии – простейшие, которые паразитируют в тонкой кишке человека и животных и вызывают лямблиоз. Они могут существовать в форме трофозоитов (активная форма) и в форме цист (покоящаяся форма). Если циста попадает в организм, из нее выходят трофозоиты, которые начинают активно размножаться в кишечнике. Часть трофозоитов вновь образует цисты, которые выделяются вместе с фекалиями.
Заразиться лямблиозом можно при употреблении немытых овощей, фруктов, а также через загрязненные руки, бытовые предметы и при контакте с фекалиями. Инкубационный период болезни составляет от 3 до 42 дней. Симптомы острой инфекции неспецифичны: боль, вздутие и урчание в животе, метеоризм, частый жидкий стул с неприятным запахом, повышенное количество непереваренных жиров в кале, иногда с потерей аппетита и рвотой. Также при лямблиозе наблюдаются аллергические дерматиты, артрит и ринит.
Чаще всего лямблиозом болеют дети. К группе высокого риска также относятся путешественники, люди, не соблюдающие гигиену, пациенты с иммунодефицитами и мальабсорбцией, работники, чья деятельность связана с животными.
Для эффективной диагностики лямблиоза как взрослым, так и детям рекомендован анализ крови на антитела к лямблиям. В ответ на заражение иммунная система вырабатывает специфические антитела разных классов – иммуноглобулины A, M, G. IgM появляются уже на 14-й день после контакта с паразитом, затем начинается синтез IgG, которые остаются в крови до самого конца заболевания; их уровень снижается через 1-2 месяца после выздоровления. Анализ на суммарные антитела к лямблиям позволяет измерить суммарный уровень специфических иммуноглобулинов к лямблиям.
В каких случаях обычно назначают исследование?
- При нарушениях стула
- При хронических заболеваниях желудочно- кишечного тракта
- При признаках кожных заболеваний или аллергической патологшии респираторного тракта
- При обследовании лиц, контактировавших носителем лямблий
Что именно определяется в процессе анализа?
Проводится суммарное определение концентрации антител к лямблиям в крови методом ИФА (иммуноферментный анализ).
Что означают результаты теста?
В норме результат анализа на лямблиоз должен быть отрицательным. Положительный результат говорит о наличии антител к лямблиям, что может быть признаком текущей инфекции, недавно перенесенного заболевания или возможного бессимптомного носительства. Следует помнить, что отрицательные значения могут быть получены при отсутствии иммунного ответа (иммунодефицитные состояния) либо если с момента заражения прошло меньше 14 дней (серонегативный период болезни).
Сроки выполнения теста.
Результат исследования можно получить спустя 3-4 дня после сдачи анализа.
Как подготовиться к анализу?
Следует придерживаться общих правил подготовки к взятию крови из вены. Кровь можно сдавать не ранее, чем через 3 часа после приема пищи в течение дня, или утром натощак. Чистую воду можно пить в обычном режиме.
ВЫЯВЛЕНИЕ ЛЯМБЛИОЗА КИШЕЧНИКА У ДЕТЕЙ
Адреса клиник г. Казань
Адрес: ул. Гаврилова, 1, ост. «Гаврилова» (пр. Ямашева)
Гаврилова, 1, ост. «Гаврилова» (пр. Ямашева)Пн-Пт: 7.00-20.00, Сб: 7.30-16.00, Вс: 8.00-14.00
Автобус: 10, 10а, 18, 33, 35, 35а, 36, 44, 45, 46, 49, 55, 60, 62, 76
Троллейбус: 2, 13
Трамвай: 5, 6
Адрес: ул. Т.Миннуллина, 8а, (Луковского) ост. «Театр кукол»Пн-Пт: 7.00-20.00, Сб: 7.30-16.00, Вс: 8.00-14.00
Автобус: 1, 2, 31, 37, 47, 74
Троллейбус: 6, 8, 12
Метро: Суконная слобода
Адрес: ул. Сыртлановой, 16, ст. метро Проспект Победы, ост. ул. Сыртлановой (проспект Победы)
Пн-Пт: 7. 00-20.00, Сб: 7.30-16.00, Вс: 8.00-14.00
00-20.00, Сб: 7.30-16.00, Вс: 8.00-14.00
Автобус: 5, 34, 37, 62 77
Трамвай: 5
Метро: Проспект Победы
Адрес: ул. Назарбаева, 10, ст. метро «Суконная Слобода», ост. «Метро Суконная Слобода»Автобус: 1, 4, 25, 43, 71
Метро: Суконная слобода
Адрес: ул. Декабристов, 180, ст. метро «Северный вокзал», ост. «Гагарина»
Пн-Пт: 7.00-20.00, Сб: 7.30-16.00, Вс: выходной
Автобус: 6, 18, 29, 33, 37, 40, 43, 53, 62, 76, 78, 89
Троллейбус: 13
Трамвай: 1, 6
Метро: Северный вокзал
Адрес: пр. А.Камалеева, 28/9, (жилой комплекс «XXI век»), ост. «Новый ипподром» Пн-Пт: 7.00-20.00, Сб: 7.30-16.00, Вс: 8.00-14.00
А.Камалеева, 28/9, (жилой комплекс «XXI век»), ост. «Новый ипподром» Пн-Пт: 7.00-20.00, Сб: 7.30-16.00, Вс: 8.00-14.00 Троллейбус: 3
Адрес: Дербышки, ул. Мира, 20, ост. «Магазин Комсомольский», «Гвоздика»
Пн-Пт: 7.00-20.00, Сб: 7.30-16.00, Вс: 8.00-14.00
Автобус: 1, 19, 25, 34, 44, 60, 84
Адрес: ул. Серова, 22/24, ост. «ул. Серова»Пн-Пт: 7.00-20.00, Сб: 7.30-16.00, Вс: 8.00-14.00
Автобус: 10, 10а
Адрес: ул. Беломорская, 6, ст. метро «Авиастроительная», ост. «ул. Ленинградская»
Пн-Пт: 7.
Автобус: 6, 18, 33, 37, 40, 42, 43, 53, 60, 78, 89, 93
Троллейбус: 13
Трамвай: 1
Метро: Авиастроительная
Адрес: ул. Закиева, 41а, ост. «Кабельное телевидение»Пн-Пт: 7.00-20.00, Сб: 7.30-16.00, Вс: 8.00-14.00
Автобус: 5, 18, 30, 31, 34, 45, 46, 62, 63, 77, 89
Троллейбус: 3, 5, 9, 12
Адрес: ул. Кул Гали, 27, ост. «ул. Кул Гали» (ул. Габишева)
Пн-Пт: 7.00-20.00, Сб: 7.30-16.00, Вс: выходной
Автобус: 46, 90 Адрес: ул. Рихарда Зорге, 95, м. «Дубравная», ост. «ул. Юлиуса Фучика»
Рихарда Зорге, 95, м. «Дубравная», ост. «ул. Юлиуса Фучика»Пн-Пт: 7.00-20.00, Сб: 7.30-16.00, Вс: 8.00-14.00
Автобусы: 5, 18, 30, 31, 33, 34, 45, 68, 74, 77
Троллейбусы: 5, 9, 12
Трамвай: 4
Метро: Дубравная
Адрес: ул. Фрунзе, 3а, ост. «Идель»Пн-Пт: 7.00-20.00, Сб: 7.30-16.00, Вс: 8:00-14:00
Автобусы: 10а, 36, 49, 53, 63, 72, 106
Троллейбус:1
Анализ на лямблиоз – сдать анализы на лямблии – цены в Санкт-Петербурге
Лабораторная диагностика лямблиоза и других паразитарных заболеваний, вызванных простейшими
К паразитарным заболеваниям относятся глистные инвазии и болезни, вызванные простейшими. Простейшие обитают в организме животного и человека и передаются в основном фекально-оральным путем, то есть через грязные руки и продукты, зараженные цистами. Возбудители имеют разную патогенность, вызывая как банальный дисбактериоз, так и более серьезную патологию.
Простейшие обитают в организме животного и человека и передаются в основном фекально-оральным путем, то есть через грязные руки и продукты, зараженные цистами. Возбудители имеют разную патогенность, вызывая как банальный дисбактериоз, так и более серьезную патологию.
К простейшим, обитающим в кишечнике человека, относятся амебы, лямблии, Balantidium coli и другие виды паразитов. Простейшие кишечные амебы бывают патогенными и не патогенными (Entamoeba hartmanni, Entamoeba coli, Endolimax папа, Jodamoeba buschlii).
- Патогенная кишечная амеба Entamoeba Histolytica — это возбудитель дизентерии, которая в кишечнике человека встречается в двух формах — тканевая, вызывающая изъязвление кишечника, и просветная форма, характерная для бессимптомных носителей, хронических больных и выздоравливающих пациентов. Исследование кала позволяют обнаружить цисты кишечных амеб.
- Balantidium coli — самый крупный представитель простейших и единственная инфузория, которая паразитирует в кишечнике.
 Заражение может протекать бессимптомно, а может вызывать и вызывает колиты разной степени тяжести от легкой до тяжелой с язвенными поражениями и диареей с кровью.
Заражение может протекать бессимптомно, а может вызывать и вызывает колиты разной степени тяжести от легкой до тяжелой с язвенными поражениями и диареей с кровью. - Лямблии паразитирует в тонком кишечнике, преимущественно в двенадцатиперстной кишке (могут встречаться в желчном пузыре) и вызывают лямблиоз — самое распространенное паразитарное заболевание. Паразиты поражают ворсинки эпителия и провоцируют развитие воспаления с нарушением всасываемости питательных веществ. Характерные симптомы острого лямблиоза — расстройства пищеварения, боль и дискомфорт в животе. Часто заболевание переходит в хроническою форму, приводя к снижению иммунитета и развитию аллергических заболеваний, особенно у детей. Инфицирование лямблиями происходит через воду и продукты, зараженные цистами, а также грязные руки. Диагностируется инфекция по анализу кала на обнаружение цист, тест на антиген Int.lamblia в кале и ИФА крови.
Все виды исследования на простейших паразитов
Для диагностики паразитарных инфекций в Лабстори используется как общеклинический анализ крови, так и специфические исследования. К общеклиническим тестам относится общий анализ крови и лейкоцитарная формула, по результатам которых можно заподозрить заражение глистами или простейшими (анемия, эозинофилия). Еще одним видом общего исследования является копрограмма, позволяющая обнаружить возбудителя в биоматериале. Для уточнения диагноза назначаются специфические исследования.
К общеклиническим тестам относится общий анализ крови и лейкоцитарная формула, по результатам которых можно заподозрить заражение глистами или простейшими (анемия, эозинофилия). Еще одним видом общего исследования является копрограмма, позволяющая обнаружить возбудителя в биоматериале. Для уточнения диагноза назначаются специфические исследования.
Специфические виды исследования:
— ИФА-диагностика на разные виды простейших по крови — определение антител к возбудителю. Положительный результат показывает инфицирование
- определение антигена лямблий в кале;
- ИФА на антитела суммарных классов IgA, IgM, IgG к антигенам лямблий;
- анализ кала на простейшие методом ДНК.
Показания к исследованиям на простейшие:
- дискомфорт и боль в животе, рвота, тошнота, изжога, отрыжка;
- подозрение на паразитарное заболевание по клиническому анализу крови — анемия, лейкоцитоз.
Как правильно подготовиться к исследованию?
Общие правила подготовки к анализу стандартные:
- кровь сдавать натощак, не употребляя пищу в течение 8-10 часов перед процедурой;
- на полчаса следует воздержаться от курения;
- накануне исследования не есть жирной и острой пищи.

- исключить из рациона алкоголь в течение 24 часов до исследования;
- детям в возрасте до 1 года не принимать пищу в течение 30-40 минут до исследования;
- детям в возрасте от 1 до 5 лет не принимать пищу в течение 2-3 часов до исследования.
Учитывая, что поступление яиц гельминтов или цист простейших в кал может носить непостоянный характер, однократное исследование кала малоинформативно — рекомендуется исследование трех образцов кала.
Анализ на лямблии (лямблиоз): как сдавать, результаты и расшифровка | Медицинский центр – МедПросвет | Медицинский центр
Анализ на лямблии ─ метод исследования крови для выявления антител, которые образуются в организме при наличии соответствующих паразитов. Такая диагностика называется серологической, и этот способ намного более надежный, чем исследование кала.
Признаки лямблиоза
Giardia lamblia ─ это простейший паразит, который проникает в кишечник человека, млекопитающих и птиц. Жизни и здоровью взрослых этот жгутиковый паразит угрожает мало. Однако у ребенка вызывает серьезные нарушения пищеварения и обмена веществ. Паразит живет в верхних отделах тонкого кишечника, размножается в присутствии продуктов расщепления углеводистой пищи.
Жизни и здоровью взрослых этот жгутиковый паразит угрожает мало. Однако у ребенка вызывает серьезные нарушения пищеварения и обмена веществ. Паразит живет в верхних отделах тонкого кишечника, размножается в присутствии продуктов расщепления углеводистой пищи.
В группе риска дети с возраста 3 месяцев. Паразиты покрывают поверхность кишечника, нарушают процесс образования кишечных соков, необходимых для переваривания пищи, страдает также процесс всасывания питательных веществ и моторика. В процессе жизнедеятельности паразитов образуются токсины, отравляющие организм.
Анализ крови на лямблии (жиардии) рекомендуется сдавать при наличии практически любых гастроинтестинальных проявлений, поскольку клиническая картина не имеет специфических отличий. Симптомы заражения паразитами следующие:
- постоянная тошнота и неоднократная рвота;
- частый жидкий стул, иногда до 10 раз в сутки;
- чередование запоров и поносов;
- боль и урчание в кишечнике;
- метеоризм;
- головная боль и общая слабость;
- при длительном течении ─ капризность и утомляемость, уменьшение массы тела, расстройства сна, кожная сыпь.

Коварство лямблиоза в том, что от момента заражения до развития первых клинических признаков проходит от 1 до 3-х недель. По окончании этого периода только анализом крови лямблии могут быть обнаружены с высокой достоверностью.
Заражение паразитами легко принять за пищевое расстройство, что откладывает начало этиотропного лечения на очень долгий срок. Взрослый может выздороветь самостоятельно, а ребенок ─ нет, поскольку пищеварительная система в детском возрасте еще незрелая.
Виды анализов
Анализы на лямблиоз используются 2-х видов:
- иммуноферментный или ИФА;
- полимеразная цепная реакция или ПЦР.
Иммуноферментное исследование обнаруживает антитела к лямблиям, которые вырабатываются при проникновении паразитов в ЖКТ. Одно из патологических звеньев формирования болезни — попадание в организм антигена или молекул белкового происхождения. Антиген распознается иммунной системой как «чужак», которого нужно нейтрализовать как можно скорее. В ответ на обнаружение антигена иммунная система вырабатывает антитело к лямблии или клетки особого строения, предназначенные для захвата и уничтожения чужеродных белковых молекул. Весь процесс — обнаружение, синтез и связывание — приводит к образованию комплекса «антиген-антитело».
В ответ на обнаружение антигена иммунная система вырабатывает антитело к лямблии или клетки особого строения, предназначенные для захвата и уничтожения чужеродных белковых молекул. Весь процесс — обнаружение, синтез и связывание — приводит к образованию комплекса «антиген-антитело».
Антитела неоднородны по своему составу, на этом основано подразделение этих веществ на классы. В самом начале, когда антиген только обнаружен, организм синтезирует антитела (иммуноглобулины) класса М, предназначенные для быстрого ответа, связывания максимального количества чужого белка.
Когда подавляющее число антигенов связано, в дело вступают антитела класса G, полностью нейтрализующие все чужеродные молекулы. Эти иммуноглобулины после выздоровления вырабатываются еще долго, обеспечивая иммунитет (невосприимчивость) к конкретному возбудителю.
Одновременно с ними вырабатывается много иммуноглобулинов классов А и Е, которые буквально усеивают слизистые оболочки. Это своеобразные «стражи», не позволяющие прикрепиться чужеродным молекулам.
При анализе крови на лямблиоз учитывается факт наличия комплексов антител, их количество, а также класс.
ПЦР используется крайне редко. Это исследование обнаруживает генетический набор клеток-паразитов.
Расшифровка анализа
Анализ на антитела к лямблиям оценивает 2 типа антител: М и G. Антитела (иммуноглобулины) М появляются в крови уже через неделю после внедрения паразита в тело человека. Антитела G держатся на высоком уровне долго, примерно до полугода от начала болезни.
Последствия лямблиоза
Опасность этой инфекции в том, что паразиты питаются теми же питательными веществами, что и человек. Они буквально обкрадывают его организм, создавая дефицит питания при нормальном количестве еды, которую употребляет пациент.
Раздражение слизистой оболочки кишечника нарушает важнейшую функцию всасывания, оказывается невозможным усвоить то, что уже съедено. Если анализ обнаружил лямблиоз, это значит, что организму приходится еще и обезвреживать токсины, вырабатываемые паразитами. Как результат – ухудшается общее состояние, страдает нервная система, нарушается сон и трудоспособность.
Как результат – ухудшается общее состояние, страдает нервная система, нарушается сон и трудоспособность.
Количество паразитов в теле взрослого человека может достигать нескольких миллионов зрелых особей. Полное избавление от лямблий — длительный и хлопотный процесс, требующий от пациента дисциплины и приверженности к лечению.
Профилактика
Самое главное профилактическое мероприятие — выявление больных, от которых заражаются все остальные. Сдать анализ крови на лямблии нужно всем, у кого неустойчивый стул или неясные кишечные расстройства. Современная диагностика быстро и точно даст ответы на все вопросы.
Если паразиты уже обнаружены, то одновременно с приемом медикаментов нужно ограничить сладкое и мучное, чтобы условия жизни простейших ухудшились, и быстрее наступила их гибель.
Поскольку во внешней среде паразиты принимают форму цист, то все продукты должны быть чистыми. Нужно бороться с мухами и мошками, на лапках которых цисты отлично перемещаются. Фрукты и овощи нужно мыть со щеткой и не есть их с земли, даже если речь идет о собственном огороде. В земле цисты прекрасно сохраняются.
Фрукты и овощи нужно мыть со щеткой и не есть их с земли, даже если речь идет о собственном огороде. В земле цисты прекрасно сохраняются.
Нельзя пить воду из открытых водоемов. Очень важна личная гигиена — мытье рук после каждого посещения туалета может предохранить от повторного заражения. Паразиты активно живут только в тонком кишечнике, а в толстом они уже превратились в цисты, готовы покинуть организм и проникнуть в тело новой жертвы, чтобы повторить там свой жизненный цикл.
Где сдать анализ на лямблии
Венозную кровь для исследования можно сдать в «МедПросвет». Как сдавать анализ на лямблии? Особой подготовки не требуется.
Не рекомендовано:
– употреблять жирную и жаренную пищу с вечера до исследования
– курить за 30 минут до забора.
Сдать анализы крови на вирусы можно без предварительной записи ежедневно:
- пн.-сб.: 08:30—13:00 (первый забор), 13:00—17:00 (второй забор)
- вс.: 09:30—14:00.
Для получения результатов анализов по электронной почте необходимо оставить письменное согласие на отправку у администраторов медицинского центра.
Сдать анализ: Лямблия (Giardia lamblia), антитела суммарные IgG+IgM+IgA
Описание анализа:
Лямблия (Giardia lamblia) суммарные антитела IgG+IgМ+IgA – анализ, позволяющий обнаружить в крови антитела к лямблии – паразиту, обитающему в организме человека. Обычно лямблии заселяют тонкий кишечник человека, но могут паразитировать и в желчном пузыре.
Лямблии относятся к простейшим и могут существовать в двух видах: активной форме (трофозоиты, способные к питанию и размножению) и в качестве цисты (когда клетка окружена защитной оболочкой).
Цисты находятся в окружающей среде вокруг нас: в некипяченой воде, на немытых продуктах и грязных руках. Когда циста заглатывается человеком и попадает в тонкий кишечник, лямблия переходит в активную стадию существования, питаясь и размножаясь. Если клетка паразита попадает в толстую кишку, она снова превращается в цисту, с фекалиями попадает во внешнюю среду и готова к заражению следующего хозяина.
Заражение лямблиями вызывает лямблиоз, инкубационный период которого длится от 3 до 42 дней. После этого появляются проявления болезни: тошнота, рвота, диарея, боли, урчание и вздутие в животе, потеря аппетита. Возможно развитие аллергического дерматита, бронхиальной астмы, ринитов и артрита.
Ярче всего симптомы проявляются у детей в возрасте от года до четырех. Также возможна бессимптомная форма лямблиоза, при которой паразит живет в организме от 1 до 3 месяцев, никак не проявляя себя.
В ответ на инвазию паразита организм вырабатывает антитела, которые присутствуют на разных этапах болезни. Первыми вырабатываются антитела класса М, которые можно выявить уже спустя полторы-две недели после заражения, а антитела класса G циркулируют в организме даже некоторое время после гибели паразитов.
Показания к назначению анализа
Анализ обычно назначают терапевт, педиатр, гастроэнтеролог или инфекционист, в некоторых случаях возможно назначение дерматологом и аллергологом.
Показанием к анализу крови на антитела против лямблий служат:
- симптомы лямблиоза;
- профилактика лямблиоза у пациентов из группы риска (ветеринары, путешественники, зоотехники и пр.).
Обследование на антитела к лямблиям входит в комплекс обследований при подозрении на лямблиоз, однако, основным при этом остается исследование кала человека. Поиск антител – косвенный метод, имеющий меньшую точность, чем анализ кала на антиген лямблий.
Интерпретация результатов
При анализе рассчитывается индекс позитивности и если его значение составляет 1,1 и более – у пациента недавно был или есть лямблиоз в острой или хронической форме. Значение индекса 0.9 и менее говорит об отсутствии антител, а промежуточные значения требуют повторных обследований.
Отсутствие антител возможно в нескольких случаях:
- у пациента нет лямблий;
- заражения произошло недавно и антитела еще не успели синтезироваться;
- некорректная работа иммунитета, который не реагирует на паразита.

Подготовка к обследованию: не нужна.
Материал для исследования: венозная кровь.
Метод исследования: ИФА.
Срок проведения: 2 рабочих дня.
Запись на анализы
Сдать анализ крови на лямблии в Москве: доступные цены.
Микроскопические паразиты лямблии (Giardia Lamblia) вызывают воспаление слизистой кишечника, провоцируя такое заболевание как лямблиоз. Передаются несколькими путями: через загрязненную воду, пищевые продукты, а также контактно-бытовым способом. Чаще всего болеют дети, а также взрослые, имеющие привычку обкусывать ногти или грызть ручку. Лямблии в организме выявить достаточно просто с помощью лабораторных исследований: анализа кала и крови.
Показания к исследованию крови
Доктор назначит этот анализ в том случае, если у него есть подозрения на заболевание. Клинические проявления заболевания следующие:
Клинические проявления заболевания следующие:
- продолжительная по времени диарея,
- боли в животе,
- повышение температуры тела и озноб,
- высыпания на коже,
- рвота.
Видно, что симптомы неспецифичны, поэтому, чтобы назначить адекватное лечение, врачу необходимо доподлинно знать, чем вызваны проблемы с пищеварением.
Выявить лямблий в организме можно с помощью ряда анализов. Это может быть микроскопическое исследование кала, но цисты (споровая форма, которую приобретают микроорганизмы, когда оказываются в прямой кишке) выявляются не всегда, а лишь в 50-70%.
Поэтому обычно вкупе с анализом кала назначается серологическое исследование крови на антитела.
Суть анализа
Исследование крови на лямблии – это серологическое исследование методом иммуноферментного анализа (ИФА). Это означает, что высокоточные приборы клинико-диагностической лаборатории ОН КЛИНИК будут опознавать в сыворотке крови антитела, которые вырабатываются иммунной системой в ответ на поражение организма этим паразитом. Их можно выявить уже спустя 2 недели после заражения.
Их можно выявить уже спустя 2 недели после заражения.
Подготовка к исследованию
Подготовиться диагностике лямблиоза следует заранее. За 10 часов необходимо отказаться от приема пищи, употребления чая, кофе и алкоголя. В клинику приходят на пустой желудок с утра. Разрешено пить воду.
Расшифровка результатов
Специалисты Международного медицинского центра ОН КЛИНИК расшифруют полученные результаты анализов и, если заболевание будет обнаружено, назначат комплекс эффективных терапевтических мероприятий для подавления лямблиоза. Кроме того, доктор обязательно расскажет, что предпринять, чтобы члены семьи не заразилисьвместе с вами.
ОН КЛИНИК: Наша сеть клиник существует вот уже более 20 лет. Наши специалисты – врачи высочайшей квалификации – оказывают эффективную помощь по 60 медицинским направлениям. Обращайтесь!
Анализ на лямблии в Уфе и РБ
Лямблии – это простейшие микроорганизмы, которые могут появляться в желудочно-кишечном тракте организма человека. Эти микроорганизмы вызывают такую болезнь, как лямблиоз, которая проявляется болями в животе, в области правых ребер, неприятным привкусом во рту, жидким стулом, метеоризмом. Однако часто это заболевание протекает практически бессимптомно.
Эти микроорганизмы вызывают такую болезнь, как лямблиоз, которая проявляется болями в животе, в области правых ребер, неприятным привкусом во рту, жидким стулом, метеоризмом. Однако часто это заболевание протекает практически бессимптомно.
Наиболее распространен лямблиоз среди детей, так как они часто не соблюдают правила личной гигиены.
Сдать анализ на лямблии в Уфе можно в одном из 8 филиалов лабораторий «МедиаЛаб».
Диагностика заболевания
Для постановки диагноза основными источниками информации обычно выступают анализы крови и кала на выявление данных микроорганизмов. Эти виды анализов дополняют друг друга и позволяют наиболее точно выявить наличие возбудителя в организме пациента.
В нашей сети лабораторий проводится 3 вида анализов на лямблии в Уфе и РБ:
- Антитела IgM к Giardia lamblia. IgM – это маркеры первичной инфекции, они начинают появляться в течение первых двух недель после заражения организма паразитом и сохраняются в крови около 2-3 месяцев.
 Анализ крови на лямблии нужно сдавать рано с утра натощак, кровь будут забирать из вены, срок выполнения анализа 3 рабочих дня. Но данная диагностика считается недостаточно эффективной, так как антитела к лямблиям полностью исчезают из организма только через 2, а то и 6 месяцев и, кроме того, они могут вырабатываться также при попадании в организм других бактерий или паразитов.
Анализ крови на лямблии нужно сдавать рано с утра натощак, кровь будут забирать из вены, срок выполнения анализа 3 рабочих дня. Но данная диагностика считается недостаточно эффективной, так как антитела к лямблиям полностью исчезают из организма только через 2, а то и 6 месяцев и, кроме того, они могут вырабатываться также при попадании в организм других бактерий или паразитов. - Исследование антигена лямблий (Giardia intestinalis) в кале. Наиболее доступный и эффективный вариант диагностики лямблиоза, обладает высокой чувствительностью. Кал необходимо собрать в стерильный контейнер и доставить в лабораторию в самый короткий срок, так как если кал доставлен на анализ по прошествии 4-х часов после сбора, то результативность исследования резко снижается. Срок выполнения данного анализа около 4-5 рабочих дней.
- Лямблиоз, суммарные антитела. Это исследование проводится для определения острых и хронических форм лямблиоза. Также, как и в случае с IgM антителами, на анализ берется кровь из вены.
 Получить результаты анализа в нашей клинике можно через 3 рабочих дня после сдачи биоматериала.
Получить результаты анализа в нашей клинике можно через 3 рабочих дня после сдачи биоматериала.
Сдавая анализ на лямблии в Уфе в сети клинико-диагностических центров «МедиаЛаб», вы получаете точные результаты и качественное обслуживание! Все вопросы, связанные с нашими лабораториями и ценами на анализы, вы можете задать по телефону нашей горячей линии: 8-800-700-57-22.
Кровавый стул – вызвано лямблиями
Лямблии – это род простейших паразитов, заразных как для людей, так и для домашних животных во всем мире. Лямблии состоят из жгутиков, что означает, что они перемещаются с помощью нескольких хлыстоподобных структур, называемых жгутиками. Они живут в форме, называемой трофозоитом, или для краткости «троф», в кишечнике, где вызывают диарею. В свежих образцах фекалий иногда могут быть обнаружены трофозоиты. Они плавают в движении, описываемом как падающий лист, и выглядят как забавные лица (см. Рисунок ниже – два ядра образуют глаза, а срединные тела образуют рот).
После короткого периода времени за пределами кишечника хозяина трофозоиты собираются и образуют цисты, которые позволяют им выжить в условиях окружающей среды без защиты хозяина. Киста может жить много месяцев с двумя не полностью сформированными трофозоитами внутри, готовыми заразить нового хозяина. Загрязненная вода – классический источник инфекции Giardia .
|
После проглатывания оболочка кисты переваривается, освобождая два трофозоита, которые выходят наружу и прикрепляются к слизистой оболочке кишечника. У трофея есть структура, называемая вентральным диском, которая похожа на присоску и используется для прикрепления тела организма к кишечнику. Если трофей хочет переместиться в другое место, он поднимается и плывет к новому месту через свои жгутики (трофеи, как правило, живут в разных областях кишечника у разных видов хозяев, в зависимости от диеты хозяина).Троф может округлить себя и образовать кисту, находясь в теле хозяина. Если у хозяина диарея, при диарее могут выделяться как трофеи, так и цисты; любую форму можно найти в свежем стуле.
Если трофей хочет переместиться в другое место, он поднимается и плывет к новому месту через свои жгутики (трофеи, как правило, живут в разных областях кишечника у разных видов хозяев, в зависимости от диеты хозяина).Троф может округлить себя и образовать кисту, находясь в теле хозяина. Если у хозяина диарея, при диарее могут выделяться как трофеи, так и цисты; любую форму можно найти в свежем стуле.
После заражения требуется от 5 до 12 дней у собак или от 5 до 16 дней у кошек, чтобы Giardia было обнаружено в стуле хозяина. Диарея может предшествовать выделению Giardia . Заражение чаще встречается в питомниках, где животные содержатся группами.
Как Giardia вызывает диарею?
Никто не уверен полностью, но инфекция, похоже, вызывает проблемы с нормальным кишечным всасыванием витаминов и других питательных веществ.Понос, как правило, не кровавый. Иммуносупрессивные препараты, такие как кортикостероиды, могут повторно активировать старую инфекцию Giardia .
Диагностика
Раньше диагностика была трудной. Исследуемый образец стула должен быть свежим, плюс Giardia редко обнаруживаются при обычных методах анализа фекальной флотации, используемых для выявления других паразитов. Традиционно образец фекалий смешивается с раствором соли или сахара, так что любые присутствующие яйца паразитов всплывают наверх в течение 10-15 минут.Некоторые уловки, которые использовались для облегчения поиска Giardia , включают:
- Обязательно исследовать прямой мазок фекалий в надежде найти плавательные трофеи.
- Плавучие образцы в сульфате цинка, растворе, который, как было обнаружено, лучше всего помогает цистам Giardia плавать.
- Окрашивание образца каким-либо йодом под микроскопом, чтобы облегчить выявление Giardia .
Что значительно упростило тестирование Giardia , так это разработка коммерческого набора для тестов ELISA, который по формату аналогичен домашним тестам на беременность. Образец кала исследуют иммунологически на белков Giardia . Этот метод значительно улучшил способность обнаруживать инфекции Giardia , и тест может быть завершен всего за несколько минут, пока владелец ждет.
Образец кала исследуют иммунологически на белков Giardia . Этот метод значительно улучшил способность обнаруживать инфекции Giardia , и тест может быть завершен всего за несколько минут, пока владелец ждет.
Giardia периодически выделяет организмы, и их может быть трудно обнаружить. Иногда домашних животных необходимо повторно обследовать, чтобы выявить инфекцию.
Лечение
Средство для удаления глистов широкого спектра действия, называемое фенбендазолом (Panacur®), в настоящее время кажется наиболее надежным средством лечения.Метронидазол (Flagyl®) в относительно высоких дозах был классическим средством лечения Giardia , но исследования показывают, что он эффективен только в 67% случаев. Известно, что высокие дозы, необходимые для лечения Giardia , вызывают временные неврологические побочные эффекты или расстройство желудка. В некоторых резистентных случаях оба препарата используются одновременно.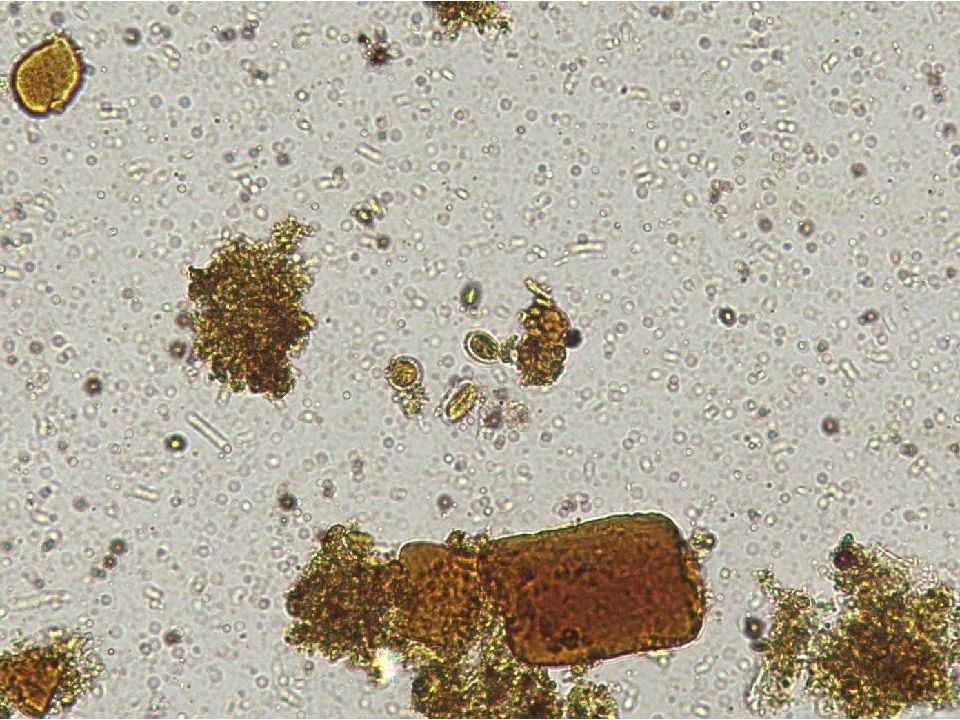 Фебантел также обычно используется для лечения Giardia , поскольку в организме он превращается в фенбендазол.
Фебантел также обычно используется для лечения Giardia , поскольку в организме он превращается в фенбендазол.
Поскольку цисты могут прилипать к шерсти инфицированного пациента и быть источником повторного заражения, положительное животное следует купать хотя бы один раз в процессе лечения.
Не все пациенты с Giardia на самом деле страдают диареей, но поскольку Giardia является наиболее распространенным кишечным паразитом, поражающим людей в Северной Америке, лечение обычно рекомендуется для домашнего животного с положительным результатом теста, даже если никаких симптомов не наблюдается. Идея состоит в том, чтобы уменьшить воздействие на человека.
Обеззараживание окружающей среды
Наиболее доступным эффективным дезинфицирующим средством, вероятно, является отбеливатель, разведенный в соотношении 1:32 с водой. В одном исследовании для уничтожения цист лямблий потребовалось менее одной минуты контакта. Органические вещества, такие как грязь или стул, защищают кисту, поэтому перед дезинфекцией необходимо провести основную очистку бетонной поверхности. Перед повторным помещением в «чистое» место животных следует тщательно вымыть. Правильно хлорированный бассейн не должен подвергаться загрязнению. Что касается участков с газоном или растениями, обеззараживание невозможно без уничтожения растений и высыхания участка под прямыми солнечными лучами.
Органические вещества, такие как грязь или стул, защищают кисту, поэтому перед дезинфекцией необходимо провести основную очистку бетонной поверхности. Перед повторным помещением в «чистое» место животных следует тщательно вымыть. Правильно хлорированный бассейн не должен подвергаться загрязнению. Что касается участков с газоном или растениями, обеззараживание невозможно без уничтожения растений и высыхания участка под прямыми солнечными лучами.
Сноска о вакцинации
Вакцина против Giardia ранее была доступна не для предотвращения инфекции у вакцинированного животного, а для уменьшения выделения цист вакцинированным пациентом.Другими словами, вакцина была разработана для уменьшения заражения питомника, где Giardia , как ожидалось, будет проблемой. Это было бы полезно во время вспышки болезни, в приюте или спасательной ситуации, но не особенно полезно для средней собаки, владелец которой хочет предотвратить заражение. Из-за ограниченной пригодности вакцины ее производство было прекращено в 2009 году.
анализ стула: антиген лямблии | Коннектикут Детский
Содержание
Что это такое
Паразит Giardia lamblia является одной из основных причин диареи в Соединенных Штатах.Он живет в системе желудочно-кишечного тракта (ЖКТ) и выводится из организма с калом (калом).
В тесте на антиген Giardia образец кала проверяется на наличие Giardia .
Почему это сделано
Тест на антиген Giardia используется для диагностики лямблиоза , заболевания пищеварительного тракта, вызываемого Giardia lamblia . Врач может назначить тест, если у вашего ребенка есть такие симптомы, как водянистая диарея, боль в животе, большое количество кишечных газов, потеря аппетита, тошнота или рвота, особенно если в школе или детском саду вашего ребенка произошла вспышка лямблиоза, ваш ребенок недавно пил неочищенную воду, или если ваша семья недавно была в развивающейся стране.Тест также может быть использован для определения эффективности лечения лямблиоза.
Тест можно заказать отдельно или в сочетании с исследованием яиц и паразитов (микроскопическая оценка кала на наличие паразитов). Тест на антиген более чувствителен при обнаружении Giardia lamblia , чем тест на яйца и паразиты (O&P), но он не может выявить какие-либо другие организмы или состояния, вызывающие желудочно-кишечные расстройства.
Препарат
В отличие от большинства других лабораторных тестов, образец стула часто берут родители дома, а не медицинские работники в больнице или клинике.
Если возможно, вашего ребенка могут попросить избегать определенных продуктов питания и лечения в течение 2 недель до обследования, в том числе:
- противодиарейные препараты
- Антибиотики и противопаразитарные препараты
- клизм
Процедура
Врач или больничная лаборатория обычно предоставляют письменные инструкции о том, как собирать образец стула. Если инструкции не предоставлены, вот советы по сбору образца стула у вашего ребенка:
- Обязательно наденьте латексные перчатки, а потом вымойте руки и руки ребенка.

- Многие дети, страдающие диареей, особенно маленькие, не всегда могут заранее сообщить родителям о приближении дефекации. Поэтому для сбора образца стула используется пластиковая крышка в форме шляпы. Это улавливающее устройство можно быстро разместить над унитазом или под попкой ребенка для сбора пробы. Использование улавливающего устройства может предотвратить загрязнение стула водой и грязью. Другой способ собрать образец стула – это накинуть на сиденье унитаза неплотно полиэтиленовую пленку.Затем поместите образец стула в чистый герметичный контейнер, прежде чем отнести его в лабораторию.
- Пластиковую пленку также можно использовать для выстилки подгузника младенца или малыша, который еще не пользуется туалетом. Повязку следует размещать так, чтобы моча попадала в подгузник, а не в подгузник.
- Ваш ребенок не должен мочиться в контейнер и, по возможности, должен опорожнить мочевой пузырь перед дефекацией, чтобы образец кала не разбавлялся мочой.
- Стул следует собрать в чистую сухую пластиковую банку с завинчивающейся крышкой.
 Для достижения наилучших результатов стул следует сразу же доставить в лабораторию. Если это невозможно, стул следует хранить в консерванте, предоставленном лабораторией, а затем сдавать туда как можно скорее.
Для достижения наилучших результатов стул следует сразу же доставить в лабораторию. Если это невозможно, стул следует хранить в консерванте, предоставленном лабораторией, а затем сдавать туда как можно скорее.
Чего ожидать
После того, как образец поступает в лабораторию, технический специалист вводит образец стула в контакт с химическим веществом, которое меняет цвет в присутствии продуктов паразита Giardia lamblia . Важно помнить, что тест на антиген Gardia определяет присутствие только этого конкретного паразита, поэтому врач может назначить дополнительные тесты для постановки окончательного диагноза.
Получение результатов
Как правило, результат теста на антиген Giardia сообщается в течение дня.
Риски
Сбор образцов стула не представляет никакого риска.
Помогая своему ребенку
Взять образец стула безболезненно. Скажите ребенку, что сбор стула не повредит, но это нужно делать осторожно. Достаточно взрослый ребенок может самостоятельно собрать образец, чтобы избежать затруднений. Расскажите ребенку, как это делать правильно.
Достаточно взрослый ребенок может самостоятельно собрать образец, чтобы избежать затруднений. Расскажите ребенку, как это делать правильно.
Если у вас есть вопросы
Если у вас есть вопросы по тесту на антиген Giardia , поговорите со своим врачом.
Лямблии вызывают пролиферацию и выработку интерферона γ лимфоцитами кишечника
Простейшие Лямблии лямблии прикрепляются к слизистой оболочке тощей кишки своим сосательным диском, чьи лектины прикрепляются к олигосахаридам на микроворсинках мембраны эпителиальных клеток1. площадь поверхности микроворсинок, что приводит к нарушению всасывания.При продолжении болезни ворсинки укорачиваются, крипты становятся гиперпластическими, а количество лимфоцитов увеличивается. Тонкая кишка развивает это типичное «уплощение» в ответ на другие воздействия, такие как криптоспоридиоз, избыточный бактериальный рост, чревный спру и болезнь «трансплантат против хозяина», что указывает на то, что аналогичный механизм может иметь место в нескольких ситуациях.
Роль Т-клеток в искоренении лямблии неясна. Доказательством в пользу нацеливания Т-клеток на лямблиоз является демонстрация того, что внутриэпителиальные лимфоциты мыши (IEL) и лимфоциты собственной пластинки (LPL) обладают большей цитотоксической активностью в отношении лямблии, чем лимфоциты селезенки, особенно после инфицирования, предположительно из-за фазы сенсибилизации.2 Мышиные IEL, однако, представляют собой преимущественно TCRγδ +, фенотип, который может обладать большей цитотоксической активностью, чем TCRαβ + Т-клетки, которые составляют большую часть человеческого IEL. Таким образом, эта литическая активность у грызунов не может быть обнаружена у людей. Тот факт, что у мышей с истощением Т-лимфоцитов и голых мышей не выводится организм, указывает на важность Т-лимфоцитов, 3 хотя это может быть связано с сопутствующей потерей иммуноглобулина, требующей помощи Т-лимфоцитов. Напротив, присутствие цитолитических гранул, содержащих гранзим B, в IEL при целиакии, но не при лямблиозе, предполагает, что эти лимфоциты не способны лизировать этот патоген.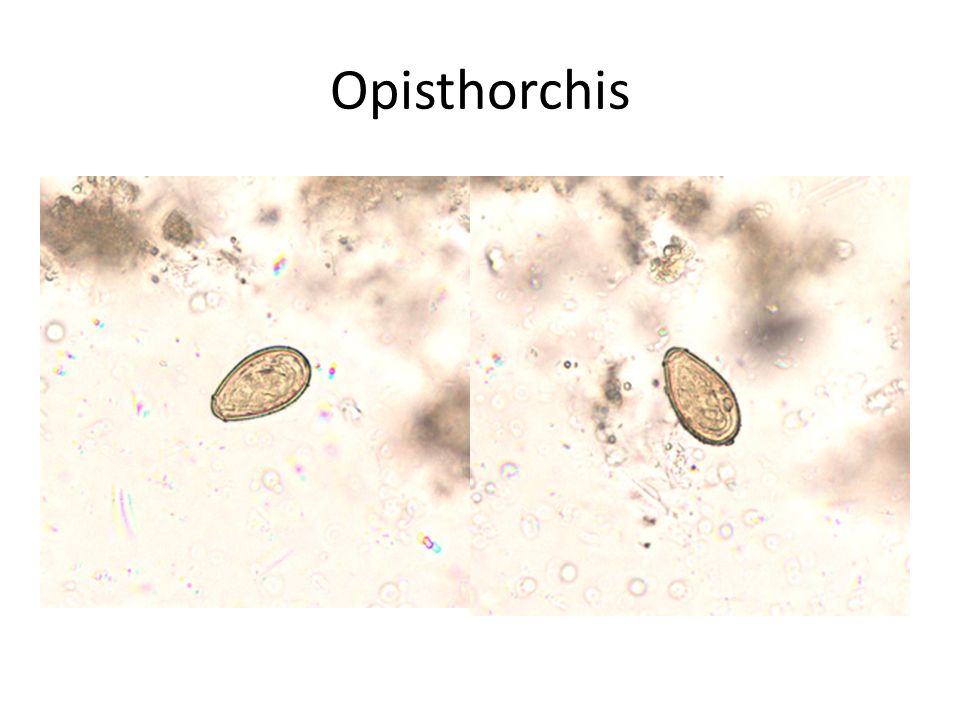 4
4
Мало что известно об опосредованном Т-клетками ответе на лямблиоз, особенно лимфоцитами кишечника человека. В дополнение к прямой цитотоксической активности мышиного IEL против лямблий, антителозависимая клеточная цитотоксичность была показана для мышиного LPL и нейтрофилов человека.5 Однако только 5% IEL и LPL человека экспрессируют рецепторы Fc, и, соответственно, они неспособны к определять антителозависимую клеточную цитотоксичность с использованием других индикаторных систем6.
В настоящем исследовании IEL и LPL, полученные из проксимального отдела тощей кишки здоровых людей, оценивали на реактивность на лямблии.Организм преимущественно прикрепляется к этой же области кишечника. Поскольку фенотип и функция лимфоцитов кишечника меняются в зависимости от местоположения, может быть важно согласование области сбора лимфоцитов с областью, подверженной заболеванию.
Методы
ВЫДЕЛЕНИЕ ЛИМФОЦИТА И КУЛЬТУРА ЛЯМБИНА
ИЭЛ были выделены из слизистой оболочки тощей кишки здоровых людей, перенесших операцию обходного желудочного анастомоза по поводу патологического ожирения. Вкратце, измельченную слизистую оболочку обрабатывали 1 мМ дитиотреитола в течение 30 минут при 37 ° C с последующими тремя 45-минутными инкубациями на водяной бане со встряхиванием с 0.75 мМ ЭДТА и собирали клетки супернатанта. После очистки центрифугированием в градиенте плотности Перколла препараты IEL состояли из более чем 90% лимфоцитов, которые составляли 94 (5)% CD2 + и 89 (2)% CD8 +.
Вкратце, измельченную слизистую оболочку обрабатывали 1 мМ дитиотреитола в течение 30 минут при 37 ° C с последующими тремя 45-минутными инкубациями на водяной бане со встряхиванием с 0.75 мМ ЭДТА и собирали клетки супернатанта. После очистки центрифугированием в градиенте плотности Перколла препараты IEL состояли из более чем 90% лимфоцитов, которые составляли 94 (5)% CD2 + и 89 (2)% CD8 +.
Для выделения LPL обработанную ткань трижды инкубировали с ЭДТА по 45 минут, и высвободившиеся клетки отбрасывали. Оставшуюся ткань переваривали в течение трех часов при 37 ° C в 20 Ед / мл коллагеназы, затем продавливали через сито с проволочной сеткой для диспергирования клеток. LPL, очищенные с использованием градиента плотности Перколла, составляли 55 (10)% CD4 + и 35 (11)% CD8 +.PBL выделяли центрифугированием в градиенте плотности фиколла.
Т-лимфоцитов были разделены на подмножества CD4 + и CD8 + путем отрицательной селекции с использованием антител к CD8 и CD4, соответственно, с последующим добавлением IgG козы антимыши, прикрепленного к магнитным шарикам, как подробно описано в другом месте. 8 После разделения лимфоциты были менее 1% положительными для истощенных. фенотип.
8 После разделения лимфоциты были менее 1% положительными для истощенных. фенотип.
Giardia lamblia (Американская коллекция типовых культур (ATCC), Роквилл, Мэриленд, США) выращивали в среде TYI-S-33 (ATCC) с плотно закрытыми пробирками для поддержания микроаэрофильной среды.Организмы использовались для выращивания бревен, когда более 80% из них двигались. Паразитов, покрытых средой TY, промывали перед помещением в RPMI-1640 с лимфоцитами.
АНАЛИЗ ЦИТОТОКСИЧНОСТИ
Цитотоксические клетки генерировались с лимфоцитами в трех ситуациях: сразу после выделения (спонтанная цитотоксичность, SC), после трехдневного культивирования с интерлейкином 2 (IL-2) или IL-15 (100 нг / мл) ( активность активированного лимфокином киллера (LAK)) или после пятидневного культивирования с лямблией (активность цитотоксических Т-лимфоцитов (CTL)).Затем клетки промывали и инкубировали в течение четырех часов при различных соотношениях с лямблиями, меченными 51 Cr. Альтернативно меченые паразиты инкубировали с фактором некроза опухоли α (TNFα) и / или интерфероном γ (IFNγ) (0,1 мкг / мл). Процент цитотоксичности рассчитывали по отношению к спонтанному и максимальному высвобождению клеток-мишеней в среде и 0,1% Triton X-100, соответственно, как подробно описано ранее.9 Лямблии в качестве мишеней, загруженных 51 Cr-хроматом натрия, высвобожденным 30 % метки через четыре часа со средой (спонтанное высвобождение) и 80% включенной радиоактивности с Triton X-100 (максимальное высвобождение).
СЕРИНЭСТЕРАЗНЫЙ ВЫПУСК
Лимфоциты, полученные, как описано выше, лизировали замораживанием и оттаиванием, а супернатанты тестировали на количество секреции гранул с помощью анализа N-α-бензилоксикарбонил-1-лизинтиобензилового эфира (BLT).
МИГРАЦИЯ
Многолуночная камера для хемотаксиса Бойдена использовалась для измерения миграции лимфоцитов в ответ на различные факторы. Кишечные лимфоциты и PBL были активированы IL-2 в течение 48 часов, поскольку они не мигрируют в хемокины без стимуляции.7 Кондиционированная среда, испытанная на ее способность привлекать лимфоциты, состояла из RPMI-1640 с 10% фетальной телячьей сывороткой (FCS), которую инкубировали в течение 24 часов с лямблиями (1 × 10 5 / мл), а затем фильтровали. Активированные IL-2 IEL, LPL и PBL (1 × 10 5 / 0,05 мл) помещали в верхние лунки камеры Бойдена и лямблий (1 × 10 4 / 0,05 мл) или среды RPMI-1640. (кондиционированный или нет) был помещен в нижние лунки. Через четыре часа при 37 ° C устройство выдерживали при 4 ° C в течение ночи для высвобождения лимфоцитов, связанных с нижней стороной мембраны.После разборки устройства подсчитывали количество лимфоцитов в каждой нижней камере.
ПРОЛИФЕРАЦИЯ И ПРОДУКЦИЯ IFNγ
Лимфоциты (2 × 10 5 / 0,2 мл) культивировали с одним или двумя из следующих: лямблиозом (1 × 10 4 / 0,2 мл), фибробластами KD (ATCC), IL -10, трансформирующий фактор роста β (TGFβ), нейтрализующее антитело к TGFβ (R&D Systems, Миннеаполис, Миннесота, США) и фитогемагглютинин (PHA) (Murex Diagnostics, Norcross, Джорджия, США).Все анализы проводили в среде RPMI-1640 с 10% фетальной бычьей сывороткой, 1% антибиотиком-антимикотиком и 1% глутамином (Sigma). Пролиферацию определяли по включению 3 H-тимидина.
Для измерения продукции IFNγ супернатанты культур лимфоцитов собирали через 72 часа и тестировали иммуноферментным анализом (ELISA) на IFNγ (Immunotech, Westbrook, Maine, USA).
ПРЕДЕЛЬНЫЙ АНАЛИЗ РАЗВЕДЕНИЯ
Частоту респондентов определяли путем культивирования различного количества CD4 + Т-лимфоцитов из собственной пластинки и периферической крови с лямблиями (1 × 10 4 /0.2 мл) и облученный (3000 рад) аутологичный PBL (1 × 10 4 / 0,2 мл) в круглодонных лунках в течение 10 дней. Пролиферацию определяли по включению 3 H-тимидина. Лунки считались отрицательными, если включение 3 H-тимидина не превышало среднего значения контрольных лунок (только среда) более чем на три стандартных отклонения, или положительным, если оно превышало. Процент отрицательных лунок для каждого количества ячеек был нанесен на график в зависимости от количества добавленных ячеек, что привело к линейной регрессии, из которой можно было интерполировать 37% отрицательного количества ячеек.Частоту прекурсоров определяли как обратное число клеток, дающих 37% отрицательных лунок.11
СТАТИСТИЧЕСКИЙ АНАЛИЗ
Для каждого набора данных вычислялось среднее значение (SEM). Пары наборов данных были проанализированы с помощью теста Стьюдента t для парных или независимых переменных.
Результаты
ЦИТОТОКСИЧНОСТЬ
Активность SC, LAK и CTL лимфоцитов тестировали против лямблий в качестве клеток-мишеней. На активность SC IEL, LPL и PBL тестировали сразу после выделения или после 18-часовой инкубации в среде, чтобы обеспечить восстановление после процедуры выделения.Перед анализом LAK IEL, LPL или PBL стимулировали в течение 72 часов с помощью IL-2 или IL-15 (каждый при 100 нг / мл). Для активности CTL IEL, LPL или PBL (2 × 10 5 / 0,2 мл) культивировали с лямблиями (1 × 10 4 / 0,2 мл) в течение пяти дней перед литическим анализом. Чувствительность организмов к TNFα и IFNγ проверяли в четырехчасовом анализе. Паразитов добавляли живыми без облучения во все анализы; большинство из них перестало двигаться примерно через 36 часов на средних оборотах RPM1–1640. Поскольку лямблии постоянно перемещаются и цитотоксичность не возникает без связывания эффекторных клеток-мишеней, клетки помещали в микролунки с V-образным дном и центрифугировали перед четырехчасовой инкубацией.К концу эксперимента осадок клеток оставался практически неповрежденным. Невозможно показать лизис с использованием любого из этих методов при соотношении эффекторных клеток к клеткам-мишеням 50: 1 (n = 4 для каждого типа лизиса). Содержание серинэстеразы в лимфоцитах после четырехчасового совместного культивирования с лямблиями было измерено и оказалось таким же, как и в лимфоцитах только в среде (не показано).
Одной из возможных причин отсутствия лизиса является отсутствие связывания эффектора с клетками-мишенями. После инкубации осадка смешанных клеток в течение 10, 30 и 60 минут и анализа под микроскопом не было связывания лямблий с IEL, LPL или PBL (n = 3, не показано).
МИГРАЦИЯ
Возможность того, что лямблии высвобождают хемокины, которые привлекают IEL, была протестирована с использованием аппарата Бойдена Transwell. Живые лямблии (1 × 10 4 на лунку) или RPMI с 10% FCS, кондиционированные лямблиями в течение 24 часов, помещали в нижние лунки с активированным IL-2 IEL, LPL и PBL (1 × 10 5 / 0,05 мл) в верхние лунки. Подсчитывали количество лимфоцитов, которые мигрировали через поры в мембране, отделяющей верхнюю камеру от нижней. Такое же количество IEL мигрировало в ответ на лямблии или кондиционированную среду, что и в контрольной среде RPMI-1640 с добавлением сыворотки (8 (1) × 10 4 , 7 (2) × 10 4 , 7 (1) × 10 4 , соответственно, n = 3), что указывает на то, что IEL не мигрируют преимущественно в сторону живых лямблий или их секретируемых продуктов.Такие же результаты были получены с LPL и PBL (не показаны).
ПРОЛИФЕРАЦИЯ
LPL, PBL и, в меньшей степени, IEL, размножались при культивировании с живыми лямблиями, отвечая максимально через три дня, как указано в 3 H-тимидин включение: 15 045 (2381) имп / мин с LPL, 13 235 (3220) копий в минуту с PBL и 2133 (233) копий в минуту с IEL. Максимальный бластогенез LPL происходил при концентрации трофозоитов 1 × 10 4 / 0,2 мл. Тестирование пролиферации субпопуляций CD4 + и CD8 + показало, что ответ лямблий полностью обусловлен CD4 + Т-клетками (таблица 1).Несколько модуляторов были протестированы на предмет их действия на пролиферацию, стимулированную лямблиями. Не наблюдалось усиления клеточного деления за счет IEL или LPL в ответ на патоген с использованием облученного (3000 рад) монослоя фибробластов (KD) (n = 5, не показано), который усиливает бластогенез IEL на другие стимулы.12 Тормозящие цитокины, IL-10 и TGFβ, а также блокирующие антитела к CD2 снижали индуцированный лямблиями бластогенез LPL на 87 (5)%, 85 (6)% и 87 (5)% соответственно (n = 3). Это было похоже на блокирующее действие этих агентов на индуцированную PHA пролиферацию LPL: 88 (7)%, 89 (9)% и 83 (6)%, соответственно (n = 3).Нейтрализующие антитела к TGFβ, напротив, увеличивали спонтанную и индуцированную PHA пролиферацию LPL на 188 (22)% и 188 (18)% соответственно (n = 3), но не влияли на пролиферацию, индуцированную лямблиями (98 (25)%). , n = 3), предполагая, что ответная реакция LPL на TGFβ увеличивается с PHA, но не с лямблиями.
Таблица 1Лямблии индуцировали пролиферацию субпопуляций LPL Т-клеток
Чтобы определить, действует ли лямблии как митоген или как антиген, были исследованы характеристики, которые различаются между ними: пиковый ответ на 3-й день для митогенов и 6-й день для антигенов; и гораздо более высокая частота реакции клеток-предшественников на митогены по сравнению с антигенами.Бластогенез IEL, LPL и PBL в лямблии достиг пика на 3-й день, аналогично митогенам (не показаны). Анализ предельного разведения проводился с CD4 + Т-лимфоцитами, полученными из аутологичных LPL и PBL (рис. 1). Частота предшественников, сходная для двух типов лимфоцитов, находилась в диапазоне для митогенов. Таким образом, при использовании обоих критериев стимул лямблиоза имеет характеристики митогена, а не антигена.
Рисунок 1.CD4 + Т-лимфоцитов из LPL и PBL были объединены с лямблиями (1 × 10 4 ) и облучены аутологичными PBL (1 × 10 4 ) в течение 10 дней.Линейный регрессионный анализ позволил интерполировать количество клеток (обратное частоте предшественников), что дало 37% отрицательных лунок.
ПРОИЗВОДСТВО ЦИТОКИНА
Было измерено продуцирование IFNγ стимулированным лямблиями LPL, поскольку этот цитокин секретируется LPL13, и он выполняет множество иммунологических функций, связанных с инфекцией лямблиоза, включая повышенную экспрессию MHC класса II на эпителиальных клетках и снижение барьерной функции эпителий 14 ЛПЛ (2 × 10 5 /0.2 мл) культивировали с живыми лямблиями (1 × 10 4 / 0,2 мл) в течение 72 часов (оптимальное время для продукции IFNγ) .13 Супернатанты собирали и измеряли уровни цитокинов с помощью ELISA. LPL и PBL, но не IEL, продуцировали IFNγ в ответ на лямблии (таблица 2).
Таблица 2Продукция интерферона γ LPL и PBL в ответ на лямблии
Таким образом, лямблии вызывают пролиферацию CD4 + Т-клеток в кишечнике и выработку IFNγ с аналогичной частотой предшественников в LPL и PBL. митогенный, а не антигенный характер, о чем свидетельствует реакция, достигающая пика на 3-й день, а не на 6-й день, и высокая частота предшественников в диапазоне от митогенов.Лямблии не вызывают хемотаксис лимфоцитов и не подвержены лизису лимфоцитами, что, вероятно, сдерживается их непрерывным движением, которое препятствует связыванию лимфоцитов с паразитами.
Обсуждение
Опосредованный человеческими Т-клетками иммунный ответ на лямблиоз кишечными лимфоцитами в значительной степени не изучен. Этот ответ важен не только потому, что лямблии являются распространенным патогеном, но и потому, что подобное повреждение тонкой кишки наблюдается при различных хронических поражениях, таких как глютеновая спру, избыточный бактериальный рост и болезнь трансплантат против хозяина.Неясно, способствуют ли Т-лимфоциты уничтожению паразита и повреждению кишечника.
Точная роль Т-клеток в повреждении слизистой оболочки неизвестна. Подобная морфология может быть индуцирована in vitro при культивировании кишечника плода с TNF, стафилококковым энтеротоксином B или антителом к CD3, в то время как антитело к IFNγ обращает вспять разрушение слизистой оболочки, вызванное глиадином у пациентов с глютеновой болезнью (15-17). Эти исследования предполагают, что Т-клетки опосредуют по крайней мере некоторые структурные повреждения при этих заболеваниях тощей кишки.Дополнительным доказательством опосредованного Т-клетками разрушения является менее серьезная аномалия в архитектуре бестимусных ворсинок по сравнению с эутимическими мышами, инфицированными лямблиями. Кроме того, перенос лимфоцитов от нормальных мышей бестимусным мышам увеличивает повреждение.18 Однако у человека заболевание слизистой оболочки более выражено у хозяев с ослабленным иммунитетом.19
Причина увеличения числа IEL и LPL при этом заболевании неясна. Трофозоиты могут проникать в слизистую оболочку и иногда обнаруживаются в собственной пластинке; это происходит с некоторыми штаммами и высокой нагрузкой патогенов, особенно с недоеданием хозяина, иммунодефицитом и нарушениями барьера эпителиальных клеток.20 Альтернативно, IEL может перемещаться в просвет для контакта с организмом в неподвижном слое воды над эпителием, защищенным от турбулентности. Лямблии также выделяют 70% антигенов клеточной поверхности в течение каждых 24 часов21; эти антигены могут блокировать секреторные антитела или стимулировать иммунные реакции, опосредованные Т-клетками. Воспалительный инфильтрат может образовываться в результате пролиферативных ответов на патоген или в результате миграции к хемокинам, продуцируемым в ответ на лямблии. Например, эпителиальные клетки секретируют различные хемокины, такие как IL-8, в ответ на липополисахарид, TNF и инвазивные патогены.22 IEL и, в меньшей степени, LPL, мигрируют в ответ на хемокины обоих семейств α и β.7
Не удалось показать цитотоксическую активность IEL, LPL или PBL против лямблий, включая SC, активность LAK и активность CTL. В отличие от настоящего исследования, мышиный IEL лизирует лямблиоз. Однако эти лимфоциты представляют собой преимущественно TCRγδ, в отличие от человеческого IEL, которые в основном представляют собой TCRαβ. В IEL человека отсутствуют цитотоксические гранулы при лямблиозе, но не при чревном спруе, что подтверждает низкую литическую активность IEL против этих паразитов.4 Антителозависимая клеточная цитотоксичность была показана с использованием нейтрофилов человека и клеток перитонеального экссудата кролика со специфическими антителами к лямблиям. , 19 Антитела могут быть основной защитой хозяина от этого паразита, поскольку они агглютинируют трофозоиты, возможно, снижая их подвижность и прикрепление к эпителиальным клеткам.
Опосредованное Т-клетками убийство было показано с другими паразитами. Мышиный ИЭЛ (в основном типа TCRαβ) убивает макрофаги и эпителиальные клетки, инфицированные Toxoplasma gondii .23 Сходная генетически ограниченная активность CTL, а также продукция IFNγ была продемонстрирована с мышиным IEL против ротавируса.24 Стимуляция IFNγ линии IEC-6 ингибирует внутриклеточную репликацию T gondii , 25 демонстрируя взаимодействие между цитокинами, полученными от хозяина, и паразитом. .
Повышенное количество кишечных лимфоцитов, особенно IEL, при инфекции лямблиозом может быть связано с усилением миграции или пролиферации. При использовании анализа через лунки не было миграции IEL, LPL или PBL в сторону живых лямблий или среды RPMI, кондиционированных лямблиями.Однако наблюдалась повышенная пролиферация лимфоцитов CD4 + в ответ на живые трофозоиты. Это согласуется с исследованием, показывающим, что инфекция Giardia muris пролонгировалась у мышей, получавших моноклональные антитела, истощающие CD4 + лимфоциты. фенотипа CD4 +. Детальных исследований фенотипов лимфоцитов при лямблиозе нет.
Эксперименты по распространению ограничены условиями роста паразитов, которые являются факультативными анаэробами, которые используют большие молекулы, такие как желчь, казеин и дрожжи.С другой стороны, клетки млекопитающих – это аэробы, которые используют сахара и аминокислоты. Таким образом, совместное культивирование этих двух типов клеток затруднительно, если они найдут среду, удовлетворяющую обоим. Хотя существуют сообщения о таких сокультурах, не все они показывают, что каждый тип клеток сохраняет оптимальный рост и метаболизм. Анализы, использованные в настоящем исследовании, требовали, чтобы лямблии были жизнеспособными только в течение первых нескольких часов культивирования лимфоцитов; Среду RPMI, способствующую росту лимфоцитов, использовали для измерения ответа лимфоцитов.Наилучшие ответы лимфоцитов имели место, когда большинство паразитов были жизнеспособны и двигались; Сама по себе жизнеспособность не является достаточным критерием здоровья паразита.
Положительные результаты этого исследования – пролиферация и продукция IFNγ лимфоцитами кишечника CD4 +, обнаруженными в основном в собственной пластинке кишечника. Антигены лямблий или целые организмы могут связываться с CD4 + IEL или LPL, запуская продукцию IFNγ. Это, в свою очередь, увеличивает проницаемость эпителиальных клеток, позволяя большему количеству компонентов лямблии проникать в слизистую оболочку и дополнительно повышать чувствительность лимфоцитов.
Благодарности
Автор хотел бы поблагодарить Артура И. Робертса за его технические знания и доктора Роберта Е. Бролина за образцы тощей кишки. Работа поддержана грантом NIH (DK42166).
Сокращения
- ЦТЛ
- цитотоксических Т-лимфоцит
- ИЭЛ
- интраэпителиальной лимфоцит
- ИФН
- интерферона
- IL
- интерлейкин
- LAK
- лимфокинов активированного убийцы
- ЛПЛ
- собственной пластинки лимфоцитами
- PBL
- лимфоцит периферической крови
- SC
- спонтанная цитотоксичность
- TGF
- трансформирующий фактор роста
- TNF
- фактор некроза опухоли
- Journ.
Как крупный международный издатель академических и исследовательских журналов Science Alert издает и разрабатывает названия в партнерстве с самыми престижные научные общества и издатели.Наша цель заключается в том, чтобы максимально широко использовать качественные исследования аудитория. Мы прилагаем все усилия, чтобы поддержать исследователей которые публикуют в наших журналах. Есть масса информации здесь, чтобы помочь вам публиковаться вместе с нами, а также ценные услуги для авторов, которые уже публиковались у нас. 2021 цены уже доступны. Ты может получить личную / институциональную подписку перечисленных журналы прямо из Science Alert. В качестве альтернативы вы возможно, пожелает связаться с выбранным вами агентством по подписке. Направляйте заказы, платежи и запросы в службу поддержки. в службу поддержки клиентов журнала Science Alert. Science Alert гордится своей тесные и прозрачные отношения с обществом. В виде некоммерческий издатель, мы стремимся к самым широким возможное распространение публикуемых нами материалов и на предоставление услуг высочайшего качества нашим издательские партнеры. Здесь вы найдете ответы на наиболее часто задаваемые вопросы (FAQ), которые мы получили по электронной почте или через контактную форму в Интернете.В зависимости от характера вопросов мы разделили часто задаваемые вопросы на разные категории. Азиатский индекс научного цитирования (ASCI) стремится предоставить авторитетный, надежный и значимая информация по освещению наиболее важных и влиятельные журналы для удовлетворения потребностей мировых научное сообщество.База данных ASCI также предоставляет ссылку к полнотекстовым статьям до более чем 25000 записей с ссылка на цитированные ссылки. Корреляция между экспрессией группы крови ABO и инфекцией лямблиозом у человека
Настоящее исследование направлено на определение общей частоты инфицирования лямблиозом у людей, включая частоту инфицирования с симптомами или без них.Также учитывалась степень инфицирования по полу. Распределение частот для групп крови ABO и Rh оценивалось для поиска возможных связей с лямблиозом. Настоящее исследование проводилось в лаборатории микробиологии учебной больницы Аль-Ярмук / Багдад / Ирак в период с 1 марта по конец августа 2016 г. В исследовании приняли участие 532 пациента (318 мужчин и 214 женщин) в возрасте 20 лет. -45 лет, чтобы обнаружить наличие образцов стула Giardia lambliain с помощью микроскопического исследования с использованием метода флотации и метода окрашивания (йод Люголя и хромотроп 2R).Образцы крови были собраны у 130 пациентов с целью измерения концентрации антител IgG и IgM в сыворотке с использованием иммуноферментного анализа (ELISA) и для определения группы крови с использованием системы групп крови ABO и Rh. Результаты показали, что общий уровень инфицирования составил 32,89% без существенных различий в зависимости от пола, поскольку более высокий уровень был зарегистрирован для мужчин 18,79% по сравнению с 14,09% женщин. Что касается уровня инфицирования в зависимости от штата, у пациентов с симптомами заболевания зарегистрировано 69.7% (59,8% для мужчин и 40,1% для женщин), в то время как у бессимптомных пациентов было зарегистрировано 30,2% (50,9% для мужчин и 49,05% для женщин), значимой связи p = 0,27 между полом и состоянием не наблюдалось, в то время как значимые различия P Было зарегистрировано <0,0001 для общего количества симптомов и общего количества бессимптомных. Средняя концентрация IgM и IgG показала значительные различия между инфицированными (симптоматическими, бессимптомными) и неинфицированными пациентами для мужчин и женщин. Общие частоты групп крови для симптоматических были A (40%)> B (26%)> O (24%)> AB (10%), а для бессимптомных были O (42%)> A (24%)> B ( 22%)> AB (12%), также более высокий процент наблюдался для положительного резус-фактора 98%, 96% для симптоматического и бессимптомного соответственно, нет значимой связи между ABO P = 0.19, Rh P = 1,04 группа крови и состояние инфекции не выявлено. значимая корреляция (P <0,01) показала между общей частотой инфицирования и распределением в каждой из групп крови (0,77) и резус-теста (0,79). Также была обнаружена значимая корреляция (P <0,01) (0,69) и (0,59) между ABO и каждой из симптоматических и бессимптомных инфекций соответственно. Корреляция резус-фактора с симптоматикой (0,82) и бессимптомом (0,54) была значимой (P <0,01). Общие данные показывают высокую распространенность G.лямблии преимущественно у самцов. Была обнаружена корреляция между человеческой кровью и резус-типом с лямблиозом, поскольку большинство людей с группой крови A имели симптомы, в то время как большинство крови группы O были бессимптомными.
Клеточные иммунные ответы в лимфоцитах периферической крови беличьей обезьяны (Saimiri boliviensis boliviensis), инфицированной Giardia, получавшей фенбендазол
Abstract
Клеточные иммунные ответы были протестированы для определения эффекта фенбендазола на функцию лимфоцитов боливийских беличьих обезьян ( Samiri boliviensis boliviensis ). Giardia -инфицированных беличьих обезьян лечили коммерчески доступным обезьяньим кормом с лекарством фенбендазолом (FBZ). Иммунные ответы сравнивали между историческими контрольными группами ( Giardia, ранее не получавших , не получавших FBZ (контрольные животные)), и Giardia -инфицированных, получавших FBZ беличьих обезьян (исследуемые животные). Лимфоциты периферической крови из исследования обезьян имели значительно более низкие индексы стимуляции по сравнению с контрольными животными при культивировании in vitro с конканавалином A (Con A) (p <0.0001), фитогемагглютинин (PHA) (p <0,0001) и липополисахарид (LPS) (p <0,0001). PBMC также анализировали на наличие клеток, продуцирующих IFN-γ, в ответ на стимуляцию Con A, PHA, PWM и LPS с помощью анализа цитокинов ELISPOT. Значительно более высокие ответы на Con A- (p <0,0001) и PHA- (p <0,001) стимулировали культуры из инфицированных Giardia и обработанных фенбендазолом по сравнению с контролем. Проточный цитометрический анализ экспрессии маркеров клеточной поверхности выявил значительное увеличение B- и NKT-лимфоцитов и значительное снижение моноцитов CD14 + CD16 + после обработки FBZ.Кроме того, циркулирующие цитокины плазмы IFN-γ, TNF-α, IL-12p40, IL-1β, IL-10, IL-13, IL-1ra, IL-6 и IL-4 были значительно снижены после лечения FBZ. Сравнение гематологических параметров между контрольными обезьянами и беличьими обезьянами, получавшими FBZ, выявило значительно меньшее количество общих лейкоцитов, нейтрофилов, моноцитов и эозинофилов по сравнению с контролем. Однако показатели эритроцитов (количество эритроцитов, гемоглобин и гематокрит были значительно выше у обезьян, получавших FBZ. Наши результаты показывают, что лечение фенбендазолом может изменить чувствительные иммунные и молекулярные показатели воспаления.Следует рассмотреть возможность откладывания экспериментального использования беличьих обезьян как минимум на 6 недель после лечения FBZ.
Образец цитирования: Nehete PN, Wilkerson G, Nehete BP, Chitta S, Ruiz JC, Scholtzova H, et al. (2018) Клеточные иммунные ответы в лимфоцитах периферической крови Giardia инфицированных беличьих обезьян ( Saimiri boliviensis boliviensis ), получавших фенбендазол. PLoS ONE 13 (11): e0198497. https://doi.org/10.1371/journal.pone.0198497
Редактор: Изабель Шемин, Центр исследований рака в Лионе, ФРАНЦИЯ
Поступила: 18 мая 2018 г .; Одобрена в печать: 21 октября 2018 г .; Опубликован: 9 ноября 2018 г.
Авторские права: © 2018 Nehete et al. Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Доступность данных: Все соответствующие данные находятся в документе.
Финансирование: Это исследование частично поддержано Cattleman for Cancer Research (PNN) и грантом P40 ODO10938-38 (CRA) по разведению и исследованию беличьих обезьян в Центре сравнительной медицины и исследований Michale E Keeling при MD Онкологический центр Андерсона. Финансирующие организации не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: Авторы заявили об отсутствии конкурирующих интересов.
Сокращения: ФБЗ, г. Фенбендазол; FACS, Сортировка клеток, активируемая флуоресценцией; ЭЛИСПОТ, Enzyme-Linked ImmunoSpot; МТТ, Бромид 3- (4,5-диметилтиазол-2-ил) -2,5-дифенилтетразолия; PHA, Фитогемагглютинин; Con A, Конканавалин А; Иллинойс, Интерлейкин; LPS, липополисахарид; ШИМ, тыкать сорняками митоген
Введение
Род Giardia состоит из простейших паразитов, которые, как известно, инфицируют широкий спектр хозяев – амфибий, рептилий, птиц и млекопитающих.Все Giardia , выделенные у млекопитающих, в настоящее время классифицируются как Giardia lamblia (синонимы: G . duodenalis и G . Кишечник ) [1, 2]. Несмотря на доступность эффективных противопаразитарных препаратов, инфекции Giardia (лямблиоз) в настоящее время считаются вновь возникающим паразитарным заболеванием человека и некоторых животных. У людей заболевание особенно распространено среди детей, живущих в среде с низкими стандартами личной гигиены [1].У животных также отмечается, что распространенность лямблиоза наиболее высока среди молодых животных, содержащихся в неоптимальных условиях, около 10% у взрослых домашних собак, у 50% щенков, содержащихся в качестве домашних животных, и почти у 100% собак, содержащихся в каком-либо разведении. питомники [3, 4].
Фенбендазол (FBZ) – высокоэффективное антигельминтное средство широкого спектра действия, которое используется для лечения многочисленных гельминтов и простейших кишечных паразитов, включая Giardia , домашних и лабораторных животных [5, 6].Его фармакокинетическое поведение, овицидная активность и большой запас прочности у крыс и мышей делают его привлекательным выбором для лечения остриц. [2, 5, 7, 8]. У собак он эффективен против большинства кишечных гельминтов [5]. FBZ также эффективен для лечения Giardia , легочных червей и сосальщиков, но для лечения гельминтов требуются более высокие дозы, а частота неудач достигает 50% [5]. Многие исследовательские центры на животных столкнулись с заражениями острицами, очень заразными паразитами, которые требуют лечения целых колоний и / или групп животных, а также ползучия мурашек во всех исследовательских центрах для искоренения.FBZ обычно вводят лабораторным животным через коммерчески доступные лабораторные диеты, содержащие лекарственные препараты FBZ (600 ppm), для достижения целевой дозы от 8 до 12 ppm в день [6, 9].
Giardia Заражение лабораторных животных является серьезной проблемой для многих исследовательских центров. Хотя FBZ очень эффективен в уничтожении большинства паразитов кишечных гельминтов, опасения по поводу его потенциального воздействия на экспериментальные результаты не исследовались. Считается, что FBZ нарушает синтез ДНК, топоизомеразы и нуклеиновых кислот у бактерий [10–12].Эффект FBZ был описан в исследованиях иммунной системы овец [2], а у мышей [13] и усиленное воспаление, вызванное липополисахаридами, было приписано FBZ у крыс [14]. Хотя не сообщалось о токсических эффектах от использования FBZ на терапевтических уровнях, нецелевое действие FBZ могло изменить или помешать проводимым исследовательским экспериментам [15, 16]. Есть много безответных вопросов о том, влияет ли FBZ на быстро делящиеся клетки и могут ли быть затронуты определенные системы органов, такие как иммунная система.
В биомедицинской литературе не сообщалось об исследованиях влияния FBZ на иммунную систему приматов. В текущем исследовании мы исследуем зараженных Giardia- беличьих обезьян на предмет изменений в обычных иммунологических параметрах и оценках иммунной функции после лечения коммерчески доступной диетой с лекарственными препаратами FBZ (600 ppm). Целью этого исследования было определить, оказывает ли FBZ пагубное влияние на иммунную систему беличьих обезьян. Эти исследования будут способствовать пониманию побочных эффектов лечения FBZ на иммунную систему беличьей обезьяны.Важно отметить, что наше исследование поможет ветеринарам и исследователям оценить, когда экспериментальных животных можно лечить с помощью FBZ, и понять, когда животные, подвергающиеся лечению FBZ, могут быть проанализированы без потенциального отрицательного воздействия на иммунную систему.
Материалы и методы
Обезьяны, уход и жилье
Биологические образцы для этого исследования были получены от некоторых из примерно 400 боливийских беличьих обезьян ( Saimiri boliviensis boliviensis) из Ресурса по разведению беличьих обезьян (SMBRR), расположенного в Онкологическом центре Андерсона Университета Техаса (UTMDACC) Michale E.Центр сравнительной медицины и исследований Килинга (KCCMR) в Бастропе, Техас. Животные в пределах SMBRR содержатся в социально-племенных группах, состоящих из одного взрослого самца и 8–12 взрослых самок с различным количеством молодых особей. Социальные племенные группы размещаются в помещении в двух смежных загонах, каждая из которых имеет размер 4 фута в ширину, 6 футов в высоту и 14 футов в длину. В комнате с загонами поддерживается режим 12: 12 ч свет: темнота, температура от 19,4 до 23,3 ° C и влажность от 30% до 70%. В дополнение к социальному взаимодействию, животным предоставляют разрушаемые манипуляторы обогащения и различные материалы для перемещения / усаживания на ротационной основе, чтобы способствовать типичному для вида поведению.За животными ежедневно наблюдали и клинически оценивал клинический ветеринар в рамках их стандартного протокола поддержания колонии.
В конце 2017 г. Giardia было обнаружено с помощью световой микроскопии в объединенных образцах фекалий всех социальных групп обезьян в пределах SMBRR. Присутствие Giardia было также подтверждено на отдельных беличьих обезьянах с использованием набора для быстрого мембранного иммуноферментного анализа ( Giardia / Cryptosporidium Quick Check, TechLab, Blacksburg, VA, USA).SMBRR был размещен в KCCMR с 2008 года, и Giardia никогда не обнаруживались ни в одной из ежегодных выборок для наблюдения за колониями до этой вспышки. Происхождение инфекции Giardia в этой колонии неизвестно, но могло быть получено либо из зараженной продукции, либо в результате интродукции посторонних животных, которых привезли в колонию для разнообразия генетики племенного поголовья.
Заявление об этике
Это исследование было проведено в KCCMR, аккредитованном AAALAC-I.Все эксперименты на животных проводились в соответствии с положениями Закона о благополучии животных, Политикой защиты животных PHS и принципами Руководства NIH по уходу и использованию лабораторных животных. Все процедуры с животными были одобрены Комитетом по уходу и использованию животных UTMDACC.
Диета
беличьих обезьян, содержащихся в SMBRR, имеют ad libitum доступа к диете приматов Нового Света (Purina # 5040) и фильтрованной воде обратного осмоса. Кроме того, животных ежедневно кормят свежими фруктами или овощами.Специальные продукты, такие как семена, арахис, изюм, йогурт, крупы, чашки для замороженного сока и арахисовое масло, также распространяются ежедневно в качестве дополнительных продуктов. Никогда субъектов этого исследования не лишали пищи или воды. После обнаружения в колонии вспышки Giardia , беличьи обезьяны были помещены на диету с лекарственными препаратами FBZ (лабораторная диета с концентрацией FBZ 600 ppm) в течение 5 дней подряд. Затем животных возвращали к стандартной диете SMBRR в общей сложности на 4 недели.После этого четырехнедельного периода животным второй раз вводили лечебную диету. Во время этой второй схемы лечения животным давали лечебную диету через день в течение периода времени в одну неделю, всего три дополнительных дня лечения FBZ. Лечебная диета FBZ была прекращена, а исследуемые животные были возвращены к стандартной диете SMBRR. После четырехнедельного периода стандартной диеты кровь собирали и анализировали на 2-й, 6-й и 14-й неделе.
Учебные комиссии
Исследование состояло из двух учебных групп.Контрольную группу составили необработанные Giardia -отрицательных животных (группа FBZ (-) Giardia (-)). Вторую группу составили обработанные FBZ Giardia -инфицированные животные (FBZ (+) Giardia (+)). Контрольная группа (FBZ (-) Giardia (-) состояла из 15 самок беличьих обезьян в возрасте 3–5 лет, которые были случайным образом отобраны из колонии для анализа крови в 2015 г. до выявления в колонии лямблиоза. Все субъекты включенные в исследование, были здоровыми и принадлежали к своим нормальным социальным группам на момент отбора.Образцы крови для всех анализов в этом исследовании собирали из периферической вены в пробирки для сбора, покрытые ЭДТА. Все иммунные анализы выполняли с использованием тех же процедур и реагентов на свежевыделенных PBMC от контрольных животных (группа FBZ (-) Giardia (-)), а также животных FBZ (+) Giardia (+).
Общий анализ крови и биохимический анализ крови
Образцы крови были проанализированы на общий анализ крови (гематологический анализатор Siemens Advia 120, Тарритаун, Нью-Йорк).Параметры включали: общие лейкоциты, общие эритроциты, гемоглобин, гематокрит, индексы эритроцитов, дифференциальное количество лейкоцитов и количество тромбоцитов. Были проведены сравнения между каждым из образцов после обработки FBZ и контрольными образцами с использованием теста Даннета для множественных сравнений. Для корректировки использования контрольных данных в множественных сравнениях только различия с вероятностью менее 0,01 считались значимыми.
Сбор крови и подготовка проб
Примерно 2–3 мл каждого образца крови собирали в пробирки для сбора, покрытые ЭДТА, и сразу же плазму отделяли центрифугированием и хранили при -80 ° C до дальнейшего использования.Мононуклеарные клетки периферической крови (PBMC) выделяли с помощью разделения в градиенте плотности фиколл-гипак, как описано ранее [17, 18]. Эритроциты удаляли осмотическим лизисом в лизирующем буфере ACK (Life Technologies, Grand Island, NY), а оставшиеся ядросодержащие клетки дважды промывали RPMI с добавлением 10% фетальной бычьей сыворотки (FBS) и использовали для иммунных анализов.
Проточная цитометрия
Маркеры клеточной поверхности определяли с использованием следующих флуоресцентно меченных моноклональных антител, специфичных к различным субпопуляциям лимфоцитов: T-клетки (CD3 PerCP, клон SP34-2, BD Pharmingen), B-клетки (CD20 APC клон L27, BD Pharmingen, San Jose, CA ), моноциты (CD14 FITC клон M5E2 BioLegend, Сан-Диего, Калифорния) и NK-клетки (CD16 PE клон 3G8, BD Pharmingen, Сан-Хосе, Калифорния).Фенотипический анализ лимфоцитов периферической крови обезьян выполняли путем окрашивания поверхности образцов цельной крови, как описано ранее [18]. Вкратце, 100 мкл цельной крови, консервированной ЭДТА, из каждого образца добавляли в отдельные пробирки из полистирола 12 мм × 75 мм (Falcon, Lincoln Park, NJ, USA), содержащие предварительно добавленные моноклональные антитела против CD3, CD14, CD16 и CD20, и инкубировали в течение 15 мин при комнатной температуре в темноте. После удаления эритроцитов инкубацией с лизирующим раствором FACS (Becton Dickinson, США) мононуклеарные клетки дважды промывали фосфатно-солевым буфером (PBS), содержащим FBS (0.5%) и азид натрия (0,1%) и повторно суспендировали в 1% формальдегиде. Окрашенные клетки получали с помощью FACSCalibur (Becton Dickinson, CA, USA), оборудованного аргоновым ионным лазером 488 нм и красным диодным лазером 635 нм. Т, В, моноциты, NK и NKT-клетки из лимфоцитов регистрировали по точечному графику прямого и бокового рассеяния и анализировали с использованием программного обеспечения FlowJo (Tree Star, Inc., Ashland, OR). Для определения специфичности использовали контроль как компенсации, так и изотипов. Все антитела, использованные в этом исследовании, перекрестно реактивны с Saimiri boliviensis , как сообщается [19], а также в базовом ресурсе NIH Nonhuman Primate Reagent Resource (http: // www.NHPreagents.org).
Стимуляция митогена in vitro
PBMC, свежеприготовленные из цельной крови, были более чем на 90% жизнеспособны, как определено методом исключения трипанового синего, и для каждого иммунного анализа использовали 10 5 клеток / лунку. Пролиферацию PBMC определяли с помощью стандартного анализа восстановления красителя МТТ, как описано ранее [19–22]. Вкратце, аликвоты PBMC (10 5 на лунку) высевали в трехкратные лунки 96-луночных планшетов с плоским дном и индивидуально стимулировали в течение 72 часов митогенами фитогемагглютинином (PHA), конканавалином-A (Con A), липополисахаридом. (LPS) и митоген ландыша (PWM) (Sigma, St Louis, MO), каждый в конечной концентрации 2 мкг / мл.Культуральная среда без добавленных митогенов служила отрицательным контролем. После культивирования в течение 72 часов при 37 ° C в 5% CO 2 150 мкл среды удаляли из каждой лунки и дополнительно инкубировали в течение 4 часов. с 15 мкл свежеприготовленного отфильтрованного красителя МТТ (5 мг / мл в PBS). После инкубации добавляли 175 мкл 0,04 н. Соляной кислоты в изопропаноле (Sigma) и инкубировали в течение 30 мин при комнатной температуре для проявления цвета перед считыванием планшет-ридером для ELISA с использованием фильтра 490 нм (Victor, PerkinElmer, Shelton, CT).Результаты выражаются в виде индекса стимуляции (SI) над контролем среды. Сообщенные значения являются средними для 3-х повторов. Концентрация митогена, количество PBMC и время инкубации были стандартизированы в нашей лаборатории как оптимальные для стимуляции PBMC, выделенных от здоровых животных.
Анализ ELISPOT для обнаружения антиген-специфичных клеток, продуцирующих IFN-γ
Свежевыделенные PBMC, как описано выше, стимулировали митогенами PHA, Con A, LPS и PWM (каждый в конечной концентрации 2 мкг / мл) для определения количества клеток, продуцирующих IFN-γ, с помощью иммуно-связанного с ферментом пятна ( ELISPOT) с использованием методологии, описанной ранее [19, 23, 24].Вкратце, аликвоты PBMC (10 5 на лунку) высевали в дублированные лунки 96-луночных планшетов (планшеты с поливинилидендифторидной подложкой, MAIP S 45, Millipore, Bedford, MA), предварительно покрытые первичным антителом IFN-γ, и лимфоциты стимулировались разными митогенами. После инкубации в течение 18–20 часов. при 37 ° C клетки удаляли, а лунки тщательно промывали PBS и обрабатывали в соответствии с протоколом, предоставленным производителем. Пятна сине-фиолетового цвета, представляющие отдельные клетки, секретирующие IFN-γ, были подсчитаны независимым агентством (Zellnet Consulting, New Jersey, NJ) с использованием автоматической системы KS-ELISPOT (Carl Zeiss, Inc.Thornwood, NY) для количественного анализа количества клеток, образующих пятно IFN-γ (SFC) для 10 5 входных PBMC. Ответы считали положительными, когда количество SFC с тестируемым антигеном было по крайней мере на пять точек выше значений фонового контроля для клеток, культивированных только в среде.
Мультиплексный анализ цитокинов
Цитокинов измеряли в образцах плазмы цельной крови, консервированной ЭДТА, с использованием набора цитокинов приматов, отличных от человека, с IL-4, IL-6, IL-10, IL-12 (p40), IL-1b, MCP-1, IL-13, IL-1ra, IFN-γ и TNF-α от Millipore Corporation (Биллерика, Массачусетс), как описано ранее [19, 23, 25].Существует 91,4% -98,1% гомологии между нуклеотидными последовательностями генов цитокинов беличьей обезьяны и опубликованными последовательностями эквивалентных генов человеческих и нечеловеческих приматов. Концентрации цитокинов в плазме определяли с использованием методологии набора гранул цитокинов (CBA) в соответствии с протоколами производителей. Вкратце, образцы плазмы, консервированной ЭДТА, центрифугировали (1200 × g в течение 10 минут) и аликвоты замораживали при -80 ° C до использования. Перед анализом образцы однократно размороженной плазмы предварительно очищали центрифугированием при 10000 × g в течение 5 минут.96-луночный фильтровальный планшет промывали буфером для анализа в течение 10 мин при комнатной температуре при встряхивании и 25 мкл стандартных или контрольных образцов диспергировали в соответствующих лунках. После добавления 25 мкл шариков в каждую лунку планшет инкубировали на роторном шейкере в течение ночи при 4 ° C. На следующий день после двухкратной промывки промывочным буфером планшеты инкубировали с антителом для обнаружения в течение 1 часа при комнатной температуре, а затем инкубировали с 25 мкл стрептавидин-фикоэритина в течение 30 минут при комнатной температуре.После двухкратной промывки промывочным буфером в каждую лунку добавляли 150 мкл жидкости оболочки и выполняли профилирование нескольких аналитов на системе Bio-Plex 200 (технология Luminex X MAP). Калибровочные микросферы для классификации и считывания репортеров, а также жидкость оболочки, аналитический буфер и промывочный буфер были приобретены у Bio-Rad (Hercules, CA). Полученные данные флуоресценции анализировали с помощью приложения Bio-Plex manager 5.0 (Bio-Rad, Hercules, CA). Все этапы инкубации выполнялись на шейкере. Концентрацию рассчитывали с помощью программного обеспечения для анализа иммуноанализа Multiplex Analyst от Millipore.Минимальные определяемые концентрации в пг / мл для различных цитокинов следующие: IFN-γ (2,2) и TNF-α (2,1), IL-6 (0,3), IL-10 (6,2), IL-12 (P40). ) (1.2), IL-1β (1.2), IL-13 (5.8), IL-1ra (2.4) и MCP-1 (3.1).
Статистический анализ
Для статистического анализа образцы были сгруппированы в соответствии с необработанным контролем и животными, подвергшимися последующей обработке, от которых были взяты образцы. Были проведены сравнения между каждым из образцов после обработки FBZ и контрольными образцами с использованием теста Даннета для множественных сравнений.Для корректировки использования контрольных данных в множественных сравнениях только различия с вероятностью менее 0,01 считались значимыми. Все статистические анализы проводились с использованием GraphPad Prism ® версии 7.01 (GraphPad Software, Сан-Диего, Калифорния, США).
Результаты
Исследование состояло из двух исследовательских групп. Контрольная группа состояла из пятнадцати необработанных Giardia- отрицательных животных (идентифицированных как FBZ (-) Giardia (-)), которые были самками беличьих обезьян в возрасте 3-5 лет, случайно выбранными из колонии для анализа крови в 2015 году перед идентификацией. лямблиоза в колонии.Исследованные животные включали десять самок беличьих обезьян в возрасте 3-5 лет, которые были случайным образом отобраны из социальных групп, инфицированных лямблий (идентифицированных как лямблии (+) FBZ (+) ). Присутствие лямблий было обнаружено с помощью световая микроскопия в объединенных образцах фекалий, а также была подтверждена на отдельных беличьих обезьянах с использованием набора Rapid Membrane Enzyme Immunoassay Kit ( Giardia / Cryptosporidium Quick Check, TechLab, Blapostcksburg, VA, USA). Этот метод является полуколичественным (редко, мало, умеренная, многие), но любая положительная степень указывает на инфекцию и незамедлительно устраняется, чтобы предотвратить увеличение серьезности инфекции.Инфицированная группа Giardia (+) FBZ (+) из животных получала два цикла лечения FBZ, как описано выше в разделе о группах исследования. После четырех недель прекращения диеты, опосредованной FBZ, кровь собирали на 2, 6 и 14 неделях. Все субъекты, включенные в исследование, были здоровы и принадлежали к своим нормальным социальным группам на момент отбора.
Чтобы понять влияние FBZ на иммунные ответы PBMC беличьих обезьян, мы провели подробный анализ клеточно-опосредованных иммунных ответов, включая анализы для 1) фенотипического анализа проточной цитометрией, 2) пролиферации и ИФН-γ ELISPOT в ответ. к стимуляции митогенами (напр.g., Con A, PHA, PWM и LPS), 3) уровни циркулирующих цитокинов в плазме (например, IL-4, IL-6, IL-10, IL-12 (p40), IL-1b, MCP-1 , IL-13, IL-1ra, IFN-γ- и TNF-α), общий анализ крови и химический анализ крови до и после лечения FBZ.
Влияние фенбендазола на основные субпопуляции лимфоцитов периферической крови
Фенотипический анализ моноцитов, Т-клеток, В-клеток, NK-клеток и NKT-клеток из цельной крови был успешно завершен с помощью проточной цитометрии с использованием стратегии стробирования, показанной на рис. 1A.Мы наблюдали значительное увеличение абсолютных количеств NKT (CD3 + CD16 +) у животных, получавших FBZ +, по сравнению с контролем (p <0,01) на 2 неделе (p <0,0001), на 6 неделе (p <0,0001) и на 14 неделе ( p <0,0001) (рис. 1B). Точно так же уровень В-клеток (CD20 +) также был значительно выше после лечения FBZ (p <0,0007) на 2 неделе, 6 неделе (p <0,008) и 14 неделе (p <0,0001) (рис. 1B). Поскольку Giardia -инфекция может стимулировать макрофаги, мы дополнительно определили моноциты как клетки CD14 + CD16 + и CD14 + CD16- и наблюдали значительно меньшее количество популяции CD14 + CD16 + на 2 неделе (p <0.0001), 6 неделе (p <0,0001) и 14 неделе (p <0,0001) по сравнению с контролем. Существенных изменений в популяции CD14 + CD16- не наблюдается. Анализ других субпопуляций лимфоцитов, Т-клеток (CD3 + ), моноцитов (CD14 + ) и NK-клеток (CD16 + ) не выявил значительных различий (рис. 1B).
Рис. 1.
(A) Схема гейтирования для фенотипических анализов различных клеточных маркеров в периферической крови репрезентативного животного. Лимфоциты и моноциты сначала были заблокированы на основе прямого рассеяния (FCS) против бокового рассеяния (SSC), а затем CD3 + (Т-клетки), CD14 + (моноциты), CD3 – CD16 + (NK) клеток, CD3 + CD16 + (NKT) клетки), CD20 + (B-клетки), CD14 + CD16 + и CD14 + CD16- (моноциты) были положительно идентифицированы с помощью специфических маркеров.Специфичность окрашивания для различных маркеров была установлена в соответствии с окрашиванием антител изотипического контроля, используемым для каждой пары комбинированных маркеров, как показано. (B) Эффект фенбендазола различий в лимфоцитах у беличьих обезьян. Аликвоты цельной крови с ЭДТА окрашивали флуоресцентно-меченными антителами для идентификации клеток CD3 + , CD14 + , CD20 + и CD16 + и анализировали на клеточные субпопуляции, такие как CD3 + Т-клетки, CD20 + B. клетки, CD16 + NK-клетки, CD3 + CD16 + NKT-клетки и моноциты CD14 у беличьих обезьян.Моноциты (CD14) далее определялись как моноциты CD14 + CD16 + и CD14 + CD16-. Значения на оси Y – абсолютные лимфоциты. Значения P считались статистически значимыми при p <0,01. FBZ (-) Giardia (-) группа (n = 15), FBZ (+) Giardia группа (+) неделя 2 (n = 10), 6 неделя (n = 8) и неделя 14 (n = 8).
https://doi.org/10.1371/journal.pone.0198497.g001
Влияние фенбендазола на митоген-индуцированные реакции пролиферации
PBMC были проанализированы на предмет пролиферативных ответов на стимуляцию Con A, PHA, PWM и LPS.Анализ пролиферативных ответов показывает, что воздействие FBZ приводит к значительному снижению стимулированных ConA PBMC на 2-й неделе (p <0,0001), 6-й неделе (p <0,0001) и 14-й неделе (p <0,005) пролиферации лимфоцитов после дней. vitro стимуляция с помощью PHA, Con A, PWM и LPS (рис. 2).
Рис. 2. Пролиферативный ответ PBMC на митогены.
PBMC, выделенных из образцов крови из FBZ (-) Giardia (-) группы (n = 15), FBZ (+) Giardia (+) группы 2-й недели (n = 10) и 6-й недели ( n = 8) и на 14-й неделе (n = 8) после обработки обезьян FBZ использовали для определения пролиферативного ответа на различные митогены с использованием стандартного анализа восстановления красителя МТТ.Ответы на пролиферацию выражали как индекс стимуляции (SI) после вычитания холостого опыта (т.е. только среды). Статистически значимыми считались значения P <0,01.
https://doi.org/10.1371/journal.pone.0198497.g002
Влияние фенбендазола на митоген-индуцированные ответы ELISPOT на IFN-γ
РВМС анализировали на клетки, продуцирующие IFN-γ, в ответ на стимуляцию Con A, PHA, PWM и LPS с помощью анализа цитокинов ELISPOT. Значительно большее количество клеток, секретирующих IFN-γ, наблюдалось на 6 неделе в ответ на Con A (p <0.0001) и PHA (p <0,001) стимуляции PBMC от исследуемых животных по сравнению с необработанным контролем. К 14 неделе количество клеток, продуцирующих IFN-γ, не отличалось значимо у исследуемых животных по сравнению с контролем после стимуляции Con A или PHA. (Рис 3). Стимуляция LPS выявила значительное увеличение количества МКПК, продуцирующих IFN-γ, только на 14-й неделе (p <0,0005). Не наблюдалось значительных различий для PBMC, продуцирующих IFN-γ, при стимуляции с помощью PWM (фиг. 3).
Рис. 3. Ответ ELISPOT IFN-γ на митогены.
PBMC, выделенных из образцов крови из FBZ (-) Giardia (-) группы (n = 15), FBZ (+) Giardia (+) группы 2-й недели (n = 10) и 6-й недели ( n = 8) и 14 неделя (n = 8) после обработки обезьян FBZ. В трехкратные лунки 96-луночных микротитровальных планшетов, предварительно покрытых IFN-γ антителом, засевали 10 5 PBMC, стимулировали 1 мкг каждого из митогенов в течение 24 часов при 37ºC, а затем промывали и окрашивали биотинилированным вторичным веществом. IFN-γ антитело.Общее количество клеток, образующих пятна (SFC), в каждой из лунок, стимулированных митогеном, подсчитывали и доводили до контрольной среды в качестве фона. Значения P <0,01 считались статистически значимыми.
https://doi.org/10.1371/journal.pone.0198497.g003
Влияние лечения фенбендазолом на циркулирующие цитокины в плазме
Концентрации цитокинов в плазме определяли с использованием набора для определения мультиплексных цитокинов на основе технологии Luminex.Всесторонний анализ 10 различных цитокинов в образцах плазмы из необработанного контроля после обработки обезьян FBZ показал значительно более низкие уровни в плазме IFNγ, TNFα, IL2-40, IL-1β, IL-10, IL-13, IL- 1ra, ИЛ-6 и ИЛ-4. Только MCP-1 не показал эффекта от обработки FBZ (рис. 4).
Рис. 4. Анализ образцов плазмы с помощью матрицы гранул цитокинов (CBA).
В двойных лунках 96-луночного фильтрующего планшета 25 мкл образца плазмы FBZ (-) Giardia (-) группа (n = 15), FBZ (+) Giardia (+) группа 2 неделя (n = 10), а также на 6-й неделе (n = 8) и 14-й неделе (n = 8), после обработки FBZ обезьян инкубировали с 25 мкл цитокин-связанных шариков в течение ночи при 4ºC с последующей промывкой и окрашиванием биотинилированным детекторным антителом. .Планшеты считывали на BioRad 200 с использованием технологии Luminex, и результаты выражали в концентрации пг / мл. Минимальные определяемые концентрации в пг / мл для IFN-γ (2,2), IL-6 (0,3), IL-10 (6,2), IL-13 (5,8), IL-12 (p40) (1,2), IL-1β. (1.2), IL-ra (2.4), TNF-α (2.1), IL-4 (3.1) и MCP-1 (3.1) были использованы для рассмотрения положительных ответов. Значения P <0,01 считались статистически значимыми.
https://doi.org/10.1371/journal.pone.0198497.g004
Общий анализ крови и биохимический анализ крови
Среднее общее количество лейкоцитов (WBC) в крови, взятой из FBZ (+), было значительно снижено по сравнению со средним, сопоставимым по возрасту, контрольным FBZ (-) Giardia (-).Среднее значение лейкоцитов в крови, собранной через 6 недель после обработки FBZ (нед. 6), было значительно ниже среднего контрольного значения лейкоцитов. Аналогичные изменения в обработанных образцах были выявлены для среднего абсолютного количества моноцитов, нейтрофилов и эозинофилов в том смысле, что все три из этих значений были значительно снижены по сравнению с их соответствующими средними контрольными значениями. Среднее значение на неделе-6 для всех трех из этих параметров было немного выше, чем их соответствующие средние обработанные значения, но все же значительно ниже средних контрольных значений.Абсолютное количество лимфоцитов не демонстрировало аналогичной тенденции, и значения были статистически схожими между всеми тремя когортами. На 14 неделе среднее абсолютное количество лейкоцитов, моноцитов, нейтрофилов и эозинофилов было немного выше, но все же значительно ниже средних контрольных значений.
Что касается параметров эритроцитов, средние обработанные значения HCT, HGB, MCV и MCH были повышены по сравнению с контрольными значениями. Это повышение было статистически значимым для HCT на 6-й неделе. Средние значения HCT, HGB, MCV и MCH на 6-й неделе были выше, чем их соответствующие значения на 2-й неделе, и все четыре значения 6-й недели были значительно выше их соответствующего среднего контроля. значения.MCHC исследуемых животных был снижен по сравнению с контролем на 6 неделе, и этот эффект сохранялся до 14 недели. Значения RBC и RDW исследуемых животных были повышены по сравнению с их соответствующими средними контрольными значениями. Это изменение было статистически значимым для RBC, но не для RDW. Кроме того, средние обработанные значения RBC и RDW были уменьшены по сравнению со средним значением после 6 недель. Здесь RDW, но не RBC, был значительно ниже среднего контрольного значения. Не было выявлено значительных изменений количества тромбоцитов или объемов тромбоцитов у исследуемых животных по сравнению с контролем.Таким образом, данные о параметрах тромбоцитов сюда не включены и не обсуждаются далее в этом отчете. Сравнения были сделаны между каждым из животных, получавших FBZ, и контрольными животными с использованием теста Даннета для множественных сравнительных тестов, которые показаны на рис. 5.
Рис. 5. Общий анализ крови и биохимический анализ крови.
Кровь брали из периферической вены из группы FBZ (-) Giardia (-) (n = 15), FBZ (+) Giardia (+) группы 2 недели (n = 10) и 6 недели (n = 8) и на 14-й неделе (n = 8) анализируют на общий анализ крови (Siemens Advia 120 Hematology Analyzer, Tarrytown, NY) и химический профиль сыворотки (Olympus AU400e® Chemistry Immuno Analyzer, Brea, CA).
https://doi.org/10.1371/journal.pone.0198497.g005
Обсуждение
Беличьи обезьяны были экспериментальными хозяевами для ряда патогенов человека и используются для оценки антигенов-кандидатов в вакцины и стратегий вакцинации. В настоящем сообщении обсуждается влияние FBZ на Т-, В- лимфоциты, моноциты и иммунную эффекторную функцию обезьяны. Это исследование показало, что фенбендазол может обладать иммуномодулирующими свойствами, которые связаны с измененной функцией митоген-специфической пролиферации Т-лимфоцитов и лимфоцитов, продуцирующих IFN-γ.Это наблюдение согласуется с иммуномодулирующим действием левамизола, антигельминтного препарата, используемого в некоторых регионах мира, на клеточную иммунную функцию собак [26–28]. Подобное наблюдение снижения функции Т-лимфоцитов было описано Stankiewicz et al. . (1995) у овец после воздействия ивермектина [7]. Повторное использование группы бензимидазола показало вмешательство в реакцию лимфоцитов на стимуляцию митогенов у ягнят и молодых овец, получавших диету с низким содержанием белка [2, 29, 30].Результаты аналогичного лечения у здоровых мышей неубедительны. Введение FBZ мышам стимулировало пролиферативный ответ Т- и В-клеток на неспецифическую поликлональную активацию [31]. Противоположный эффект наблюдал Reiss, и др. . [13], сообщив, что антигельминтное лечение не влияло на иммунные ответы у мышей, что было исследовано путем индукции специфических цитолитических Т-лимфоцитов (CTL) in vitro , специфичных для гриппа. Т-клетки памяти in vivo , секреция грипп-специфических антител in vivo или гриппоспецифичные Т-клетки-помощники и CTL in vitro [13].Сообщалось, что FBZ блокирует митоз лимфоцитов человека in vitro [32]. Кроме того, обработка овец FBZ снижает реакцию лимфоцитов периферической крови на ConA и PHA [2]; это исследование также показало, что FBZ снижает реакцию in vivo на на антиген в виде частиц. Эти исследования могут отражать видовые различия в чувствительности к FBZ и согласуются с ранее цитированными сообщениями о миелосупрессии, индуцированной FBZ, у видов, не относящихся к грызунам и приматам. Результаты, представленные в настоящем исследовании, продемонстрировали снижение активности лимфоцитов после введения FBZ у беличьих обезьян, инфицированных Giardia .
Иммуносупрессивная активность FBZ, даже в течение короткого периода, нежелательна, поскольку она может подавлять способность животного защищаться от патогенов. Более того, если супрессивная активность FBZ сохраняется в течение более длительных периодов времени, это может повлиять на результаты, полученные от таких обработанных животных, при использовании в экспериментах, особенно тех, которые связаны с иммунными ответами. Хотя использование FBZ не является чем-то необычным в объектах животноводства, настоятельно рекомендуется дальнейшая оценка иммунной функции животных после лечения FBZ перед использованием таких животных в исследовании.
Мы наблюдали увеличение количества B- и NKT-лимфоцитов и уменьшение количества моноцитов, экспрессирующих маркеры CD14 + CD16 + после обработки FBZ. Эти данные согласуются с ранее сообщенным увеличением количества естественных киллеров (NK) и активированных Т-клеток при лечении рака человека левамизолом в качестве адъюванта [33]. Модуляции созревания Т-клеток, а также продукции цитокинов являются потенциальными механизмами, которые могут объяснить этот сдвиг в активности. Это, вместе со сдвигом к продукции цитокинов Th2, является потенциальным ключом к разгадке его механизма действия на FBZ [33–35].Kullberg и др. [36] сообщили об иммунном ответе на паразитарную инфекцию на мышиной модели, приводящей к понижению регуляции ответа Th-1-цитокинов на IL-2 и IFN-g, что может привести к повышенной восприимчивости к инфекции.
Необработанная Giardia -инфекция может регулировать врожденные и адаптивные иммунные ответы, опосредованные Th27 CD4 + Т-клетками и индукцию цитокинов Th2, Th3 и Th27, включая IL-2, IL-5, IL-6, IL-8, IL- 12, IL-13, IL-23, IFN-γ и TNF-α [37, 38]. Напротив, Singer и др. l [39] сообщили, что у мышей, инфицированных Giardia с дефицитом продукции IFN-γ, IL-4 и IL-13 не нуждались в лимфоцитах Th2 или Th3, необходимых для защиты от Giardia. .Singer и др. l [39] пришли к выводу, что Т-клеточный механизм играет важную роль в защите от инфекции Giardia , но не зависит от антител и В-клеток.
В настоящем исследовании мы наблюдали значительное снижение циркулирующих в плазме цитокинов IFN-γ, TNF-α, IL2- (p40), IL-1β, IL-10, IL-13 и IL-ra после обработки FBZ. Подобные наблюдения наблюдались у мышей, экспериментально инфицированных острицами и получавших FBZ [40]. Цитокины Т-хелперов (Th 2) оставались ослабленными после 4 недель лечения FBZ [40].В другом исследовании на мышах наблюдались отчетливые различия в Th2- и Th3-типах и Т-регуляторных ответах во время стадий кишечной миграции, миграции тканей и формирования личинок T . zimbabwensis [41]. Есть несколько отчетов о влиянии остриц на кроветворение хозяина. Бугарски и др. [42] показали значительные гемопоэтические изменения, характеризующиеся усилением миелопоэза и эритропоэза у инбредных мышей CBA, инфицированных S. obvelata .Таким образом, возникающее в результате воспаление вызывает увеличение количества эозинофилов и макрофагов в организме хозяина.
Сообщалось о снижении иммунных ответов, приводящем к длительной инфекции Giardia у необработанного крупного рогатого скота [43]. Babaei и др. [44] показали значительное повышение уровня цитокинов в сыворотке крови человека, инфицированного Giardia , по сравнению с бессимптомным и здоровым человеком. Эти исследования показывают, что как факторы хозяина, так и паразитарные факторы определяют исход инфекции, изменяя иммунные ответы [43, 44].
Данные общего анализа крови из исследования предполагают, что лечение FBZ у беличьих обезьян приводит к легкой или умеренной селективной лейкопении и снижению абсолютного количества моноцитов, нейтрофилов и эозинофилов. Подавляющий эффект лечения, по-видимому, со временем до некоторой степени ослабевает, согласно результатам анализа крови, полученным в группе, получавшей 6-недельную терапию. Интересно и, возможно, противоречит выводам других частей этого исследования, абсолютное количество лимфоцитов в значительной степени не зависит от лечения FBZ.Следовательно, действие FBZ на лимфоциты является функциональным и не зависит от размера популяции.
В совокупности параметры эритроцитов позволяют предположить, что лечение FBZ приводит к умеренному эритропоэзу. Короче говоря, есть доказательства увеличения продукции эритроцитов через 2 и 6 недель после лечения, характеризующиеся увеличением количества крупных незрелых эритроцитов.
Происхождение эффектов на моноциты, нейтрофилы, эозинофилы и эритроциты в этом исследовании неизвестно, но может быть связано с одним из нескольких факторов.Во-первых, возможно, что лекарство само по себе вызывало выявленные здесь селективную лейкопению и эритропоэз. Во-вторых, учитывая тот факт, что функция лимфоцитов, по-видимому, изменяется при лечении FBZ, возможно, что идентифицированные здесь селективная лейкопения и эритропоэз опосредуются изменениями в продукции цитокинов лимфоцитами. Наконец, учитывая, что у нас нет доступа к образцам колоний от необработанных животных, инфицированных Giardia-, остается возможность, что селективная лейкопения и эритропоэз могут быть непосредственно связаны с самой инфекцией Giardia .
Ограничениями в этом исследовании являются отсутствие данных по Giardia инфицированной необработанной группе животных и невозможность измерить уровни FBZ в крови животных после лечения FBZ.
Заключение
На основании информации, представленной в этом отчете, можно сделать вывод, что FBZ оказывает иммуносупрессивное / иммуномодулирующее действие на иммунную систему беличьей обезьяны. Мы предполагаем, что беличьи обезьяны, получавшие FBZ, могли быть не в состоянии инициировать соответствующий клеточно-опосредованный иммунный ответ по сравнению с нелеченными беличьими обезьянами; таким образом создавая потенциально значимую искажающую переменную в исследованиях, требующих нормальных иммунных ответов хозяина.Это имеет важные последствия при использовании животных, получавших FBZ, в исследованиях, где иммунологические переменные используются в качестве измерения эффективности. Критически необходимы дальнейшие исследования влияния FBZ на иммунную функцию приматов.
Благодарности
Мы благодарим Вирджинию Паркс за предоставленные образцы крови для этого исследования.
Список литературы
- 1. Маршалл М.М., Наумовиц Д., Ортега Ю., Стерлинг ЧР. Протозойные патогены, передающиеся через воду. Обзоры клинической микробиологии.1997. 10 (1): 67–85. pmid: 8993859
- 2. Кабай В., Станкевич М., Йонас В.Е., Мур Л.Г. Фенбендазол и его влияние на иммунную систему овец. Новозеландский ветеринарный журнал. 1994. 42 (6): 216–20. Epub 1994/12/01. pmid: 16031786.
- 3. Барр С.К., Боуман Д.Д., Фронгилло М.Ф., Джозеф С.Л. Эффективность комбинации препаратов празиквантела, пирантела памоата и фебантела против лямблиоза у собак. Американский журнал ветеринарных исследований. 1998. 59 (9): 1134–6. pmid: 9736391
- 4.Томпсон Р.А., Палмер С.С., О’Хэндли Р. Общественное здоровье и клиническое значение лямблий и криптоспоридиумов у домашних животных. Ветеринарный журнал. 2008. 177 (1): 18–25. pmid: 18032076
- 5. Папич МГ. Фенбендазол. Справочник Сондерса по ветеринарным препаратам (четвертое издание). Сент-Луис: W.B. Сондерс; 2016. с. 315–6.
- 6. Коглан Л.Г., Ли Д.Р., Псенчик Б., Вайс Д. Практическое и эффективное искоренение остриц (Syphacia muris) у крыс с помощью фенбендазола.Лаборатория зоотехники. 1993. 43 (5): 481–7. Epub 1993/10/01. pmid: 8277731.
- 7. Станкевич М., Кабай В., Пернтанер А., Йонас В., Рабель Б. Сокращенные с помощью лекарств инфекции и развитие иммунитета против Trichostrongylus colubriformis у овец. Международный журнал паразитологии. 1996. 26 (1): 97–103. doi: https://doi.org/https://doi.org/10.1016/0020-7519(95)00088-7. pmid: 9198604
- 8. Варга М. Глава 3 – Терапия. Учебник кроличьей медицины (второе издание): Баттерворт-Хайнеманн; 2014 г.п. 137–77.
- 9.
Райхард М.В., Вольф Р.Ф., Клингенпил Л.К., Доан С.К., Джонс А.Н., Грей К.М. Эффективность фенбендазола, содержащегося в коммерческом рационе приматов, для лечения бабуинов, свободных от конкретных патогенов (Papio cynocephalus anubis), инфицированных Trichuris trichiura. Журнал Американской ассоциации лабораторных животных: JAALAS. 2008. 47 (6): 51–5. Epub 2008/12/04. pmid: 1
54; Идентификатор PubMed Central PMCID: PMCPMC2654603. - 10. Белл Калифорния, Дикстра С.К., Найман Н.А., Кори М., Фэрли Т.А., Тидвелл Р.Р.Исследования структуры и активности дикатионно замещенных бис-бензимидазолов против Giardia lamblia: корреляция антигиардиальной активности с аффинностью связывания ДНК и ингибированием лямблиозной топоизомеразы II. Противомикробные средства и химиотерапия. 1993. 37 (12): 2668–73. pmid: 8109934
- 11. Танкович Дж., Ламарк Д., Дельшер Дж. К., Суси С. Дж., Лабин А., Дженкс П. Дж.. Частая связь между изменением гена therdxA и резистентностью к метронидазолу во французских и североафриканских изолятах Helicobacter pylori.Противомикробные средства и химиотерапия. 2000. 44 (3): 608–13. pmid: 10681326
- 12. Грэм С.П., Трес А.Дж., Коллинз Р.А., Мур Д.М., Гай Ф.М., Тейлор М.Дж. и др. Сниженная регуляция лимфопролиферации совпадает с созреванием паразитов и коллапсом ответов как гамма-интерферона, так и интерлейкина-4 в модели онхоцеркоза у крупного рогатого скота. Инфекция и иммунитет. 2001. 69 (7): 4313–9. pmid: 11401968
- 13. Reiss CS, Herrman JM, Hopkins RE 2nd., Эффект противогельминтного лечения на иммунный ответ мышей.Лаборатория зоотехники. 1987. 37 (6): 773–5. Epub 1987/12/01. pmid: 3501817.
- 14. Хантер Р.Л., Чой Д.Й., Кинсер Дж.Ф., Касс В.А., Бинг Джи, Гаш Д.М. Лечение фенбендазолом может влиять на эффекты липополисахаридов в головном мозге крыс. Сравнительная медицина. 2007. 57 (5): 487–92. Epub 2007/11/03. pmid: 17974132.
- 15. Саджид М.С., Икбал З., Мухаммад Г., Икбал М.Ю. Иммуномодулирующий эффект различных антипаразитарных средств: обзор. Паразитология. 2006. 132 (Pt 3): 301–13. Epub 2005/12/08.pmid: 16332285.
- 16. Вильяр Д., Крэй С., Зайас Дж., Альтман Н.Х. Биологические эффекты фенбендазола у крыс и мышей: обзор. Журнал Американской ассоциации лабораторных животных: JAALAS. 2007. 46 (6): 8–15. Epub 2007/11/13. pmid: 17994667.
- 17. Нехете П.Н., Нехете Б.П., Манури П., Хилл Л., Палмер Дж.Л., Састри К.Дж. Защита с помощью синтетической пептидной коктейльной вакцины против ВИЧ на основе дендритных клеток: доклинические исследования на модели SHIV-резус. Вакцина. 2005. 23 (17–18): 2154–9.pmid: 15755586
- 18. Нехете П.Н., Гамбхира Р., Нехете Б.П., Састри К.Дж. Дендритные клетки усиливают обнаружение антиген-специфических клеточных иммунных ответов лимфоцитами макак-резус, иммунизированных вакциной из пептидного коктейля из конверта ВИЧ. Журнал медицинской приматологии. 2003. 32 (2): 67–73. pmid: 12823628
- 19. Nehete PN, Hanley PW, Nehete BP, Yang G, Ruiz JC, Williams L, et al. Фенотипическая и функциональная характеристика лимфоцитов разных возрастных групп боливийских беличьих обезьян (Saimiri boliviensis boliviensis).ПлоС один. 2013; 8 (11): e79836. Epub 2013/11/28. pmid: 24282512; Идентификатор PubMed Central PMCID: PMCPMC3839916.
- 20. Мосманн Т. Быстрый колориметрический анализ клеточного роста и выживаемости: применение для анализов пролиферации и цитотоксичности. Журнал иммунологических методов. 1983; 65 (1): 55–63. doi: https://doi.org/https://doi.org/10.1016/0022-1759(83)-4.
- 21. Роем Н.В., Роджерс Г.Х., Хэтфилд С.М., Гласбрук А.Л. Улучшенный колориметрический анализ пролиферации и жизнеспособности клеток с использованием соли тетразолия XTT.Журнал иммунологических методов. 1991. 142 (2): 257–65. doi: https://doi.org/https://doi.org/10.1016/0022-1759(91)-U. pmid: 1919029
- 22. Nehete PN, Nehete BP, Chitta S, Williams LE, Abee CR. Фенотипическая и функциональная характеристика лимфоцитов периферической крови из различных возрастных и полозависимых групп обезьян-сов (Aotus nancymaae). Сравнительная медицина. 2017; 67 (1): 67–78. pmid: 28222841
- 23. Nehete PN, Nehete BP, Chitta S, Williams LE, Abee CR.Фенотипическая и функциональная характеристика лимфоцитов периферической крови из различных возрастных и половых групп обезьян-сов (Aotus nancymaae). Сравнительная медицина. 2017; 67 (1): 67–78. Epub 2017/02/23. pmid: 28222841; Идентификатор PubMed Central PMCID: PMCPMC5310627.
- 24. Nehete P, Magden E, Nehete B, Williams L, Abee C, Sastry K. Возрастные и половые различия в фенотипических и функциональных характеристиках лимфоцитов периферической крови у шимпанзе (Pan troglodytes). Журнал Американской ассоциации лабораторных животных: JAALAS.2017. Epub 2017/07/21. pmid: 28726600.
- 25. Heraud JM, Lavergne A, Kazanji M. Молекулярное клонирование, характеристика и количественная оценка цитокинов Th2 и Th3 белки обезьяны (Saimiri sciureus). Иммуногенетика. 2002. 54 (1): 20–9. Epub 2002/04/27. pmid: 11976788.
- 26. McCurdy HD, Герреро Дж. Контролируемая критическая антигельминтная оценка порошка мебендазола у собак. Ветеринария, клиницист по мелким животным: VM, SAC. 1977. 72 (11): 1731–3. Epub 1977/11/01.pmid: 244155.
- 27. Герреро Дж, Панкари Дж, Майкл Б. Сравнительная антигельминтная эффективность двух схем лечения мебендазолом у собак. Американский журнал ветеринарных исследований. 1981. 42 (3): 425–7. Epub 1981/03/01. pmid: 7271006.
- 28. Херси П., Хо К., Веркмайстер Дж., Абеле У. Ингибирование супрессорных Т-клеток в митоген-стимулированных культурах Т- и В-клеток левамизола in vitro и in vivo. Клиническая и экспериментальная иммунология. 1981; 46 (2): 340–9.Epub 1981/11/01. pmid: 6461457; Идентификатор PubMed Central PMCID: PMCPMC1536399.
- 29. Камбара Т., Макфарлейн Р.Г., Абелл Т.Дж., Маканалти Р.В., Сайкс А.Р. Влияние возраста и диетического белка на иммунитет и резистентность ягнят, вакцинированных Trichostrongylus colubriformis. Int J Parasitol. 1993. 23 (4): 471–6. Epub 1993/07/01. pmid: 8354598.
- 30. Parish Sj, McFarlane R.G., Фамильтон A. S. Abell T. J. Влияние фенбендазола на иммунную систему ягнят: Общество животноводства Новой Зеландии; 1996 г.80–3 с.
- 31. Dvorožňáková E, Borošková Z, Dubinsky P, Velebný S, Tomašovičová O, Machnicka B. Изменения клеточного иммунитета у мышей, леченных от личиночного токсокароза фенбендазолом, 1998. 189–95 с.
- 32. Холден HE, Crider PA, Wahrenberg MG. Митотическая остановка аналогов бензимидазола в культурах лимфоцитов человека. Экологический мутагенез. 1980. 2 (1): 67–73. Epub 1980/01/01. pmid: 7327161.
- 33. Холкомб РФ, Ли А., Стюарт Р.М. Левамизол и интерлейкин-2 при запущенных злокачественных новообразованиях.Биотерапия. 1998. 11 (4): 255–8. pmid: 9950101
- 34. Сзето CC, Гиллеспи KM, Мэтисон PW. Левамизол индуцирует интерлейкин-18 и сдвигает баланс цитокинов 1/2 типа. Иммунология. 2000. 100 (2): 217–24. PubMed PMID: PMC2327010. pmid: 10886398
- 35. Kimball ES. Экспериментальная модуляция продукции IL-1 и экспрессии молекул на клеточной поверхности с помощью левамизола. Летопись Нью-Йоркской академии наук. 1993. 685: 259–68. Epub 1993/06/23. pmid: 8103313.
- 36.Куллберг М.К., Берзофски Ю.А., Янкович Д.Л., Барбьери С., Уильямс М.Э., Перлманн П. и др. IL-3, полученный из Т-клеток, индуцирует продукцию IL-4 не-B, не-T-клетками для усиления ответа Th3-цитокинов на непаразитарный антиген у мышей, инфицированных Schistosoma mansoni. Журнал иммунологии (Балтимор, Мэриленд: 1950). 1996. 156 (4): 1482–149. Epub 1996/02/15. pmid: 8568251.
- 37. Лопес-Ромеро Дж., Гарсон Т., Раскон Р., Вальдес А., Кинтеро Дж., Арвизу-Флорес А.А. и др. Характеристика белка BIP G.lamblia в качестве потенциального иммуногена в модели инфекции у мышей. Иммунобиология. 2017; 222 (8): 884–91. doi: https://doi.org/https://doi.org/10.1016/j.imbio.2017.05.008.
- 38. Лопес-Ромеро Дж., Кинтеро Дж., Астиасаран-Гарсия Х., Веласкес С. Защита хозяина от лямблий. Паразитарная иммунология. 2015; 37 (8): 394–406. pmid: 26072999
- 39. Певица С.М., Наш Т.Е. Т-клеточно-зависимый контроль острых инфекций Giardia lamblia у мышей. Инфекция и иммунитет. 2000. 68 (1): 170–5.pmid: 10603384
- 40. Цай Й, Чжоу Дж, Уэбб, округ Колумбия. Лечение мышей фенбендазолом снижает аллергическое воспаление дыхательных путей и продукцию цитокинов Th3 на модели астмы. Иммунология и клеточная биология. 2009. 87 (8): 623–9. Epub 22.07.2009. pmid: 19621025.
- 41. Onkoba N, Chimbari MJ, Kamau JM, Mukaratirwa S. Метаболические и адаптивные иммунные ответы, индуцированные у мышей, инфицированных тканевой нематодой Trichinella zimbabwensis. Open Vet J. 2016; 6 (3): 178–84.pmid: 27882304.
- 42. Бугарски Д., Йовчич Г., Катич-Радивоевич С., Петаков М., Крстич А., Стоянович Н. и др. Изменения кроветворения и измененная реактивность к IL-17 у мышей, инфицированных Syphacia obvelata. Паразитология международная. 2006; 55 (2): 91–7. Epub 2005/12/06. pmid: 16325460.
- 43. Grit GH, Devriendt B, Van Coppernolle S, Geurden T., Hope J, Vercruysse J и др. Giardia duodenalis стимулирует частичное созревание дендритных клеток крупного рогатого скота, связанное с измененной секрецией цитокинов и индукцией пролиферации Т-клеток.Паразитарная иммунология. 2014; 36 (4): 157–69. Epub 2014/01/01. pmid: 24372144.
- 44. Бабаи З., Малихи Н., Зия-Али Н., Шарифи И., Мохаммади М.А., Кагнофф М.Ф. и др. Адаптивный иммунный ответ при симптоматической и бессимптомной кишечной протозойной инфекции: данные об определяющей роли генетической гетерогенности паразитов в иммунитете хозяина к лямблиозу человека. Микробы и инфекции. 2016; 18 (11): 687–95. Epub 2016/10/21. pmid: 27401766; Идентификатор PubMed Central PMCID: PMCPMC5071134.
Лямблии инфекции | UF Health, University of Florida Health
Определение
Лямблии, или лямблиоз, представляют собой паразитарную инфекцию тонкого кишечника.Его вызывает крошечный паразит Giardia lamblia .
Альтернативные названия
Лямблии; G. duodenalis ; G. кишечник ; Диарея путешественников – лямблиоз
Причины
Паразит лямблии обитает в почве, пище и воде. Его также можно найти на поверхностях, которые контактировали с отходами животного или человеческого происхождения.
Вы можете заразиться, если:
- Вы контактируете с членом семьи, больным лямблиозом
- Пейте воду из озер или ручьев, где животные, такие как бобры и ондатры, или домашние животные, такие как овцы, оставили свои отходы
- Есть сырая или недоваренная пища, зараженная паразитом
- Имейте прямой личный контакт в детских садах, домах длительного ухода или домах престарелых с людьми, инфицированными паразитом
- Незащищенный анальный секс
Путешественники подвержены риску заболевания лямблиозом во всем мире.Туристы и туристы подвергаются риску, если пьют неочищенную воду из ручьев и озер.
Симптомы
Время между заражением и появлением симптомов составляет от 7 до 14 дней.
Основной симптом – диарея без крови. Другие симптомы включают:
У некоторых людей, которые болеют лямблиозом в течение длительного времени, симптомы сохраняются даже после того, как инфекция прошла.
Обследования и анализы
К обследованиям, которые можно провести, относятся:
Лечение
Если нет симптомов или есть только легкие симптомы, лечение может не потребоваться.Некоторые инфекции проходят сами по себе в течение нескольких недель.
Лекарства можно использовать для:
- Тяжелых симптомов или симптомов, которые не проходят.
- Люди, работающие в детском саду или доме престарелых, помогают уменьшить распространение болезни
Лечение антибиотиками является успешным для большинства людей. К ним относятся тинидазол, нитазоксанид или метронидазол. Если симптомы не исчезнут, попробуют сменить тип антибиотика. Побочные эффекты от некоторых лекарств, используемых для лечения лямблии:
- Металлический привкус во рту
- Тошнота
- Тяжелая реакция на алкоголь
У большинства беременных женщин лечение не следует начинать до родов.Некоторые лекарства, используемые для лечения инфекции, могут быть опасны для будущего ребенка.
Возможные осложнения
Эти осложнения могут возникнуть:
Когда обращаться к медицинскому работнику
Позвоните своему врачу, если:
- Диарея или другие симптомы длятся более 14 дней
- У вас кровь в стуле
- Вы обезвожены
Профилактика
Перед употреблением очистите всю воду из ручья, пруда, реки, озера или колодца.Используйте такие методы, как кипячение, фильтрация или обработка йодом.
Работники детских дошкольных учреждений или учреждений должны использовать надлежащие методы мытья рук и соблюдения гигиены при переходе от ребенка к ребенку или от человека к человеку.
Более безопасные половые отношения могут снизить риск заражения или распространения лямблиоза. Особенно осторожными должны быть люди, практикующие анальный секс.
Очистите или вымойте свежие фрукты и овощи перед их употреблением.
Изображения
Ссылки
Goering RV, Dockrell HM, Zuckerman M, Chiodini PL.Инфекции желудочно-кишечного тракта. В: Goering RV, Dockrell HM, Zuckerman M, Chiodini PL, ред. Медицинская микробиология и иммунология Мима . 6-е изд. Филадельфия, Пенсильвания: Эльзевьер; 2019: глава 23.
Melia JMP, Sears CL. Инфекционные энтериты и проктоколиты. В: Feldman M, Friedman LS, Brandt LJ, eds. Болезни желудочно-кишечного тракта и печени Слейзенгера и Фордтрана . 11-е изд. Филадельфия, Пенсильвания: Эльзевьер; 2021: глава 110.
Nash TE, Hill DR. Лямблиоз. В: Goldman L, Schafer AI, ред. Гольдман-Сесил Медицина . 26-е изд. Филадельфия, Пенсильвания: Эльзевьер; 2020: глава 330.
Nash TE, Bartelt L.

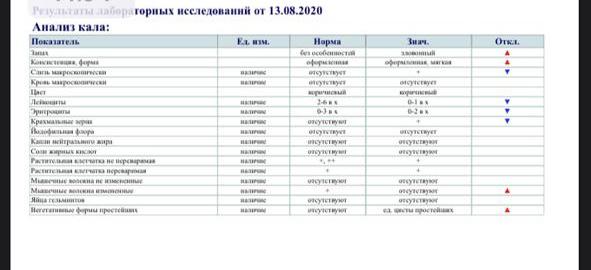 Заражение может протекать бессимптомно, а может вызывать и вызывает колиты разной степени тяжести от легкой до тяжелой с язвенными поражениями и диареей с кровью.
Заражение может протекать бессимптомно, а может вызывать и вызывает колиты разной степени тяжести от легкой до тяжелой с язвенными поражениями и диареей с кровью.

 Анализ крови на лямблии нужно сдавать рано с утра натощак, кровь будут забирать из вены, срок выполнения анализа 3 рабочих дня. Но данная диагностика считается недостаточно эффективной, так как антитела к лямблиям полностью исчезают из организма только через 2, а то и 6 месяцев и, кроме того, они могут вырабатываться также при попадании в организм других бактерий или паразитов.
Анализ крови на лямблии нужно сдавать рано с утра натощак, кровь будут забирать из вены, срок выполнения анализа 3 рабочих дня. Но данная диагностика считается недостаточно эффективной, так как антитела к лямблиям полностью исчезают из организма только через 2, а то и 6 месяцев и, кроме того, они могут вырабатываться также при попадании в организм других бактерий или паразитов. Получить результаты анализа в нашей клинике можно через 3 рабочих дня после сдачи биоматериала.
Получить результаты анализа в нашей клинике можно через 3 рабочих дня после сдачи биоматериала.
 Для достижения наилучших результатов стул следует сразу же доставить в лабораторию. Если это невозможно, стул следует хранить в консерванте, предоставленном лабораторией, а затем сдавать туда как можно скорее.
Для достижения наилучших результатов стул следует сразу же доставить в лабораторию. Если это невозможно, стул следует хранить в консерванте, предоставленном лабораторией, а затем сдавать туда как можно скорее.