Кровоостанавливающие инъекции: Кровоостанавливающие средства купить по низкой цене в Москве в интернет аптеке
инструкция по применению. Дицинон уколы при маточных кровотечениях
В связи с риском падения артериального давления во время парентерального введения у больных с неустойчивым артериальным давлением или гипотензией необходимо соблюдать осторожность (см. раздел «Побочное действие»).
Препарат содержит натрия метабисульфит, который может вызывать аллергические реакции, тошноту и диарею у восприимчивых пациентов.
Аллергические реакции могут иметь выраженный характер, вплоть до анафилактического шока, и способны вызывать опасные для жизни приступы астмы. Распространенность таких аллергических реакций неизвестна, но, по всей вероятности, она невысока. Повышенная чувствительность к сульфитам у больных бронхиальной астмой наблюдается чаще, чем у лиц, не страдающих этим заболеванием (см. раздел «Противопоказания»). В случае развития реакции гиперчувствительности введение препарата необходимо немедленно прекратить.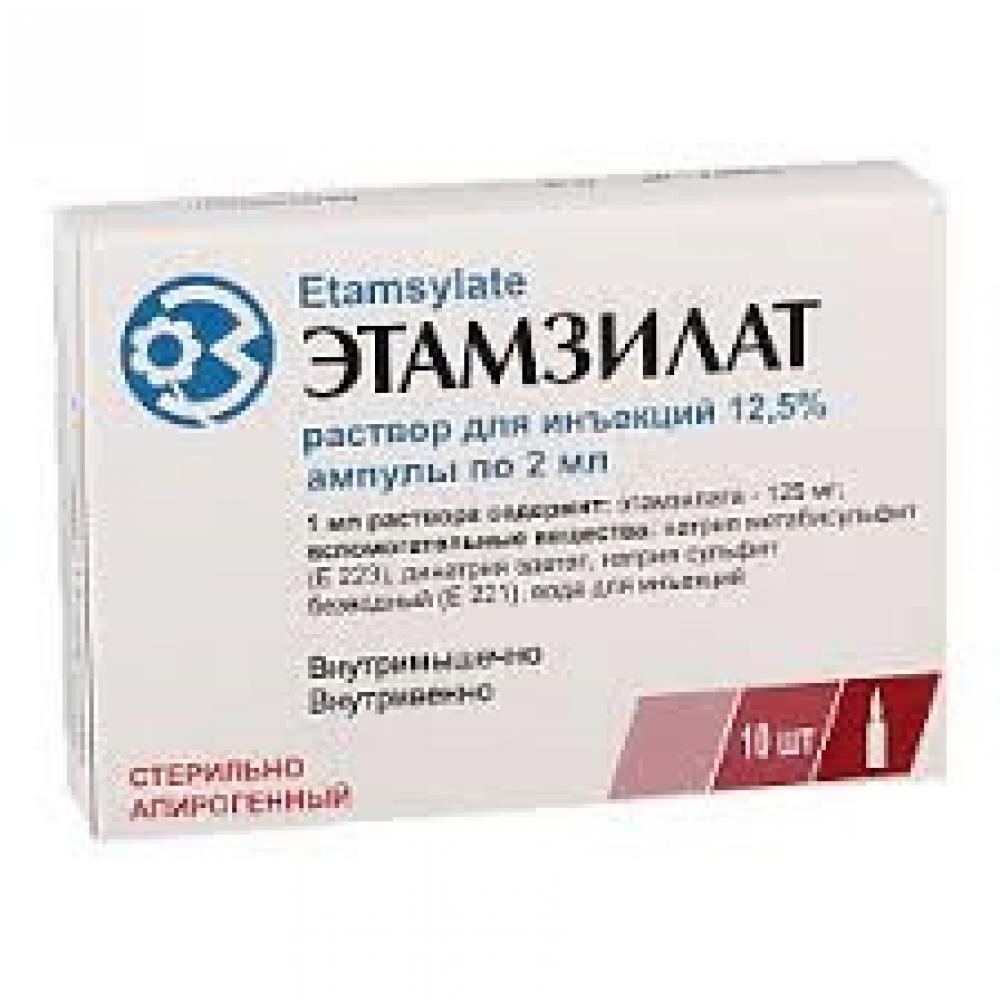
Если препарат назначается для уменьшения обильных и (или) продолжительных менструальных кровотечений, и при этом желаемого эффекта достичь не удается, необходимо исключить наличие другой патологии, способной вызвать такое состояние.
Дети
Препарат подходит для применения у детей в рекомендованных дозах.
Препарат может назначаться для профилактики перивентрикулярных кровоизлияний у недоношенных детей. Рекомендации по дозированию см. в разделе «Способ применения и дозы».
Пациенты с почечной недостаточностью
Безопасность и эффективность лечения этамзилатом у пациентов с почечной недостаточностью не изучалась. Поскольку этамзилат полностью выводится почками, при почечной недостаточности может потребоваться снижение дозы.
Результаты лабораторных анализов
Применяемый в терапевтических дозах этамзилат может повлиять на результаты ферментативного анализа определения креатинина в сторону снижения показателей.
Чтобы исключить любое возможное влияние препарата на лабораторные показатели, до первого применения Дицинона выполняют исходные анализы (напр., крови), которые потребуются в ходе лечения.
Беременность и кормление грудью
Клинические данные об использовании препарата беременными женщинами ограничены.
Эксперименты на животных не выявили какой-либо прямой или косвенной токсичности, влияющей на репродуктивную функцию. В качестве меры предосторожности предпочтительно избегать применения препарата во время беременности.
В связи с отсутствием данных о способности препарата проникать в грудное молоко, кормление грудью во время лечения не рекомендуется. Если же грудное вскармливание продолжается, то применение препарата должно быть прекращено.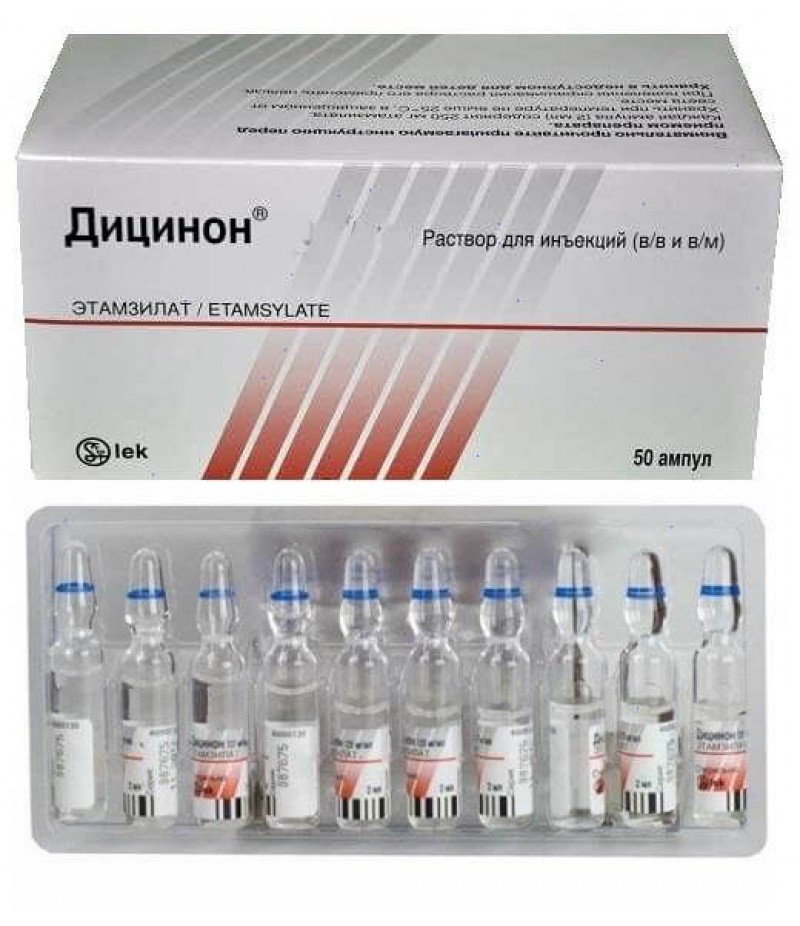
Влияние на способность управлять транспортными средствами и работать с механизмами
Влияния не оказывает.
💊 Состав препарата Дицинон ✅ Применение препарата Дицинон Сохраните у себя Поделиться с друзьями Пожалуйста, заполните поля e-mail адресов и убедитесь в их правильности Описание активных компонентов препарата Дицинон (Dicynone) Приведенная научная информация является обобщающей и не может быть использована для принятия решения о возможности применения конкретного лекарственного препарата.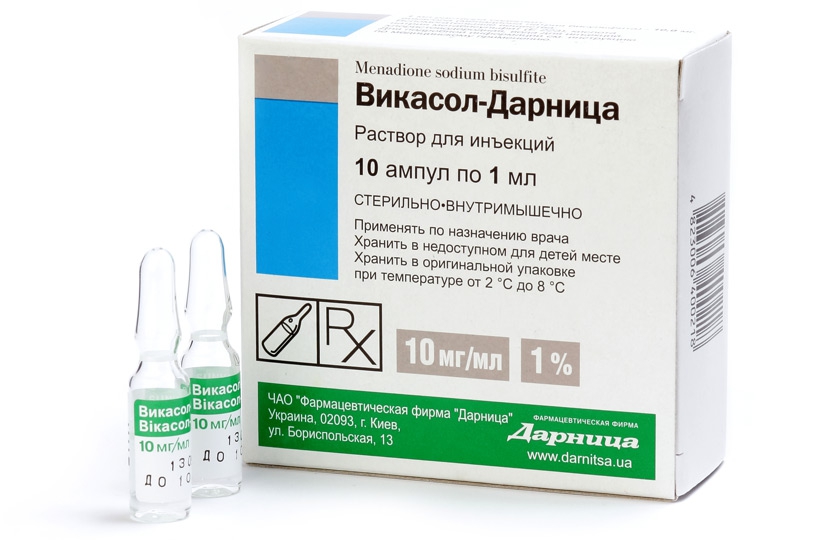 Дата обновления: 2020.07.03 Владелец регистрационного удостоверения:Лекарственная форма
Форма выпуска, упаковка и состав препарата ДицинонРаствор для в/в и в/м введения бесцветный, прозрачный.
Вспомогательные вещества: натрия дисульфит, вода д/и, натрия гидрокарбонат (используется в некоторых случаях для коррекции рН). 2 мл – ампулы бесцветного стекла (10) – блистеры (5) – пачки картонные. Фармакологическое действие Стимулирует образование тромбоцитов и их выход из костного мозга. Гемостатическому действию, обусловленому активацией формирования тромбопластина в месте повреждения мелких сосудов и снижением образования в эндотелии сосудов простациклина PgI2, способствует повышению адгезии и агрегации тромбоцитов, что, в конечном счете, приводит к остановке или уменьшению кровоточивости. Увеличивает скорость образования первичного тромба и усиливает его ретракцию, практически не влияет на концентрацию фибриногена и протромбиновое время. Дозы более 2-10 мг/кг не приводят к большей выраженности эффекта. При повторных введениях тромбообразование усиливается. Обладая антигиалуронидазной активностью и стабилизируя аскорбиновую кислоту, препятствует разрушению и способствует образованию в стенке капилляров мукополисахаридов с большой молекулярной массой, повышает резистентность капилляров, снижает их хрупкость, нормализует проницаемость при патологических процессах. Уменьшает выход жидкости и диапедез форменных элементов крови из сосудистого русла, улучшает микроциркуляцию. Стимулирует образование тромбоцитов и их выход из костного мозга. Гемостатическому действию, обусловленому активацией формирования тромбопластина в месте повреждения мелких сосудов и снижением образования в эндотелии сосудов простациклина PgI2, способствует повышению адгезии и агрегации тромбоцитов, что, в конечном счете, приводит к остановке или уменьшению кровоточивости. Увеличивает скорость образования первичного тромба и усиливает его ретракцию, практически не влияет на концентрацию фибриногена и протромбиновое время. Дозы более 2-10 мг/кг не приводят к большей выраженности эффекта. При повторных введениях тромбообразование усиливается. Обладая антигиалуронидазной активностью и стабилизируя аскорбиновую кислоту, препятствует разрушению и способствует образованию в стенке капилляров мукополисахаридов с большой молекулярной массой, повышает резистентность капилляров, снижает их хрупкость, нормализует проницаемость при патологических процессах. Уменьшает выход жидкости и диапедез форменных элементов крови из сосудистого русла, улучшает микроциркуляцию. Не оказывает сосудосуживающего действия. Восстанавливает патологически измененное время кровотечения. Не оказывает сосудосуживающего действия. Восстанавливает патологически измененное время кровотечения.На нормальные параметры системы гемостаза не влияет. Гемостатический эффект при в/в введении этамзилата наступает через 5-15 мин, максимальный эффект проявляется через 1-2 ч. Действие продолжается в течение 4-6 ч, затем в течение 24 ч постепенно ослабевает; при в/м введении эффект наступает через 30-60 мин. ФармакокинетикаЭтамзилат хорошо абсорбируется при в/м введении, слабо связывается с белками плазмы и форменными элементами крови. Терапевтическая концентрация в крови – 0.05-0.02 мг/мл. Этамзилат равномерно распределяется в различных органах и тканях (зависит от степени их кровоснабжения). После приема внутрь быстро и почти полностью всасывается. Cmax в плазме после приема в дозе 500 мг достигается через 4 ч и составляет 15 мкг/мл. Связывание с белками плазмы составляет около 95%. Практически полностью проникает через плацентарный барьер. Выводится из организма главным образом почками (в неизменном виде), в незначительном количестве с желчью. T1/2 после приема внутрь составляет около 3.7 ч, после в/в введения – 1.9 ч, после в/м введения – 2.1 ч. Выводится из организма главным образом почками (в неизменном виде), в незначительном количестве с желчью: после приема внутрь – 72% в течение 24 ч; через 5 мин после в/в введения – 20-30% дозы, полностью – через 4 ч. Показания активных веществ препарата ДицинонПрофилактика и остановка кровотечений: паренхиматозные и капиллярные кровотечения (в т.ч. травматическое, в хирургии при операциях на сильно васкуляризированных органах и тканях, при оперативных вмешательствах в стоматологической, урологической, офтальмологической, отоларингологической практике, кишечное, почечное, легочное кровотечения, метро- и меноррагии при фибромиоме и другие), вторичные кровотечения на фоне тромбоцитопении и тромбоцитопатии, гипокоагуляция, гематурия, внутричерепное кровоизлияние (в т. Режим дозированияСпособ применения и режим дозирования конкретного препарата зависят от его формы выпуска и других факторов. Оптимальный режим дозирования определяет врач. Следует строго соблюдать соответствие используемой лекарственной формы конкретного препарата показаниям к применению и режиму дозирования. Для приема внутрь суточная доза этамзилата для взрослых и подростков старше 12 лет составляет 10-20 мг/кг в 3-4 приема. В/в или в/м взрослым разовая доза – 250-500 мг. Раствор для инъекций можно применять местно (стерильный тампон пропитывают и накладывают на рану). В офтальмологии вводят субконъюнктивально или ретробульбарно в дозе 125 мг. Детям при необходимости во время операции вводят в/в из расчета 8-10 мг/кг. При наружном применении стерильный тампон, пропитанный этамзилатом (в форме раствора для инъекций), накладывают на рану. Побочное действиеВозможны изжога, чувство тяжести в подложечной области, головная боль, головокружение, гиперемия лица, снижение систолического АД, парестезии нижних конечностей. Возможно: головная боль, головокружение, покраснение лица, аллергическая сыпь, парестезии нижних конечностей, снижение артериального давления. Противопоказания к применениюПовышенная чувствительность к этамзилату, острая порфирия, гемобластоз у детей, тромбоз, тромбоэмболия; детский возраст до 3 лет (для приема внутрь). С осторожностью При кровотечениях на фоне передозировки антикоагулянтов, беременность. Применение при беременности и кормлении грудьюПрименение при беременности возможно только в том случае, если предполагаемая польза для матери превышает потенциальный риск для плода. Отсутствуют данные в отношении выделения этамзилата с грудным молоком. Поэтому, при необходимости применения в период лактации следует решить вопрос о прекращении грудного вскармливания. Применение при нарушениях функции печени Клинических исследований по применению этамзилата у пациентов с нарушением функции печени и/или почек не проводилось. Применение при нарушениях функции почекКлинических исследований по применению этамзилата у пациентов с нарушением функции печени и/или почек не проводилось. Применение у детейПрименение возможно согласно режиму дозирования. У детей до 3 лет противопоказан прием внутрь. Применение у пожилых пациентовС осторожностью применять у пациентов пожилого возраста во избежание риска обострения хронических заболеваний. Особые указанияТребуется соблюдать осторожность у пациентов, у которых когда-либо наблюдался тромбоз или тромбоэмболия. Этамзилат неэффективен у больных со сниженным числом тромбоцитов. При геморрагических осложнениях, связанных с передозировкой антикоагулянтов, рекомендуется использовать специфические антидоты. Использование этамзилата у больных с нарушенными показателями свертывающей системы крови возможно, но оно должно быть дополнено введением препаратов, устраняющих выявленный дефицит или дефект факторов свертывающей системы. Влияние на способность к управлению транспортными средствами и работе с механизмами В период лечения необходимо соблюдать осторожность при управлении транспортными средствами и занятии другими потенциально опасными видами деятельности, требующими повышенной концентрации внимания и быстроты психомоторных реакций. Лекарственное взаимодействиеВведение этамзилаьа в дозе 10 мг/кгза 1 час до введения растворов декстринов со средней молекулярной массой 30000-40000, предотвращает антиагрегационное действие последних; введение этамзилата после растворов декстранов не оказывает гемостатического действия. Сохраните у себя Поделиться с друзьями Пожалуйста, заполните поля e-mail адресов и убедитесь в их правильности |
Транексамовая кислота для лечения кровотечений из носа (эпистаксис)
Актуальность
Кровотечение из носа является очень распространенным состоянием, чаще встречающимся у детей или людей старше 60 лет. Эти кровотечения обычно прекращаются самостоятельно или при простом сжатии носа пальцами, хотя некоторое число кровотечений требует медицинской помощи. Она будет включать либо прижигание (запечатывание) кровоточащего сосуда, если его можно увидеть, или заполнение внутреннего пространства носа материалом для того, чтобы создать повышенное давление и остановить кровотечение («обычная помощь»). В некоторых случаях кровотечение продолжается, несмотря на предпринятые меры, или оно возобновляется после остановки. Это может привести к длительному пребыванию в больнице и возможности проведения дальнейших процедур, таких как повторное заполнение носа другими типами материалов или операция.
В некоторых случаях кровотечение продолжается, несмотря на предпринятые меры, или оно возобновляется после остановки. Это может привести к длительному пребыванию в больнице и возможности проведения дальнейших процедур, таких как повторное заполнение носа другими типами материалов или операция.
Транексамовая кислота – это лекарство, которое, как известно, стимулирует свертывание крови, предотвращая естественный процесс, называемый фибринолизом (растворение сгустка крови). Оно уже применяется в ряде ситуаций, когда кровотечение вызывает серьезное беспокойство, например, после операции на сердце или большой травмы. Транексамовую кислоту можно вводить перорально, непосредственно в место кровотечения (местно) или путем инъекции в вену (внутривенно).
Характеристика исследований
Мы искали рандомизированные контролируемые испытания с участием пациентов любого возраста с кровотечением из носа, требующим вмешательства. Пациентов лечили транексамовой кислотой (в дополнении к обычной помощи) в сравнении с плацебо, отсутствием лечения или любым другим средством, используемым для остановки кровотечения. Мы нашли шесть исследований, которые соответствовали нашим критериям включения, с общим числом участников – 692 человека. В двух исследованиях применялось пероральное введение транексамовой кислоты, в четырех – местное введение. Все участники исследований были взрослыми. Три из шести исследований были проведены более 20 лет назад.
Мы нашли шесть исследований, которые соответствовали нашим критериям включения, с общим числом участников – 692 человека. В двух исследованиях применялось пероральное введение транексамовой кислоты, в четырех – местное введение. Все участники исследований были взрослыми. Три из шести исследований были проведены более 20 лет назад.
Основные результаты
В трех исследованиях оценивали развитие повторного кровотечения в течении 10 дней. Когда мы объединили результаты, мы обнаружили, что у меньшего числа пациентов, которые получали транексамовую кислоту перорально или местно, были эпизоды повторного кровотечения после первоначального кровотечения из носа, по сравнению с теми, кто получал обычную помощь.
Время остановки первоначального кровотечения (контроль кровотечения в течении 30 минут) было измерено в четырех исследованиях. В трех исследованиях доля пациентов, у которых кровотечение остановилось в течении 10 минут, была значимо выше в группе, которая получала транексамовую кислоту местно, по сранению с группой, получавшей другое лекарство (местно адреналин и лидокаин или фенилэфрин). В другом исследовании не было значимых различий через 30 минут, когда транексамовую кислоту (местное применение) сравнивали с плацебо.
В другом исследовании не было значимых различий через 30 минут, когда транексамовую кислоту (местное применение) сравнивали с плацебо.
Ни в одном исследовании не сообщали о доле пациентов, нуждающихся в каком-либо последующем вмешательстве (например, повторной тампонаде, операции).
Только в одном исследовании с пероральным использованием транексамовой кислоты сообщали о доле пациентов, нуждающихся в переливании крови, и доказательств различий между группами не было.
О продолжительности пребывания в больнице сообщали в двух исследованиях. В одном исследовании сообщали о более коротком пребывании в больнице в группе перорального использования транексамовой кислоты, в то время как в другом исследовании не было обнаружено доказательств различий.
В пяти исследованиях отмечали «неблагоприятные эффекты». Не было обнаружено различий между группами в возникновении незначительных неблагоприятных эффектов (например, легкая тошнота и диарея, «неприятный вкус» геля). В одном исследовании у пациента развился тромбофлебит поверхностных вен (воспаление и сгустки крови в венах у поверхности кожи) обеих ног после выписки, но в исследовании не сообщили, в какой группе лечения это произошло. Ни в одном из исследований не было отмечено серьезных неблагоприятных событий.
Ни в одном из исследований не было отмечено серьезных неблагоприятных событий.
Качество доказательств и выводы
В целом, риск смещения в шести исследованиях был низким. Мы оценили качество доказательств в отношении основных исходов (контроль эпистаксиса: повторное кровотечение в течении 10 дней) как среднее, что означает, что дальнейшие исследования, вероятно, окажут значимое влияние на нашу уверенность в оценке эффекта и вероятно изменят эту оценку. В свете этого и учитывая тот факт, что «обычная помощь» изменилась в связи с развитием более современных методов назального прижигания и методов тампонады с тех пор как три из включенных исследований были проведены, остается неопределенность относительно роли транексамовой кислоты в лечении пациентов с носовыми кровотечениями. Более новые исследования эффектов транексамовой кислоты в качестве лечения носовых кровотечений позволили бы информировать решения в лечении этого состояния в будущем.
Доказательства в этом обзоре актуальны на октябрь 2018 года.
Уколы останавливающие кровотечение. Эффективные кровоостанавливающие препараты при маточных кровотечениях
Гемостатические средства при носовом, маточном кровотечении, при порезах и геморрое — обзор препаратов
При обильном кровотечении вследствие повреждения тканей или патологических процессов, протекающих во внутренних органах, необходимо применять кровоостанавливающие препараты для предотвращения значительной кровопотери. Лекарства, способствующие прекращению вытекания крови, бывают местного действия и системного. Каждый отдельный случай требует использование конкретного медикамента, способного ликвидировать проблему в кратчайшие сроки.
Что такое кровоостанавливающие препараты
Процесс свертывания крови в организме человека представлен сложной системой взаимодействий группы веществ (факторов свертывания крови). Большинство из этих веществ — белки. На сегодняшний день установлено наличие 35 факторов свертывания: 13 плазменных и 22 тромбоцитарных. Недостаток одного из этих составляющих приводит к появлению кровотечений разнообразного характера.
Недостаток одного из этих составляющих приводит к появлению кровотечений разнообразного характера.
Гемостатические препараты (от греч. — останавливающие кровь) разработаны с целью устранить причины нарушений в организме и блокировать потерю крови. Принцип действия кровоостанавливающих средств основан на восполнении недостатка собственных ферментов, стимулировании тромбообразования на поверхности поврежденных сосудов и на подавлении фибринолитической активности (растворение сгустков крови).
Как остановить кровотечение при месячных
Обильная кровопотеря у женщин во время менструаций (более суточной нормы 80 мл) может быть вызвана разными причинами. Прежде, чем покупать кровоостанавливающее лекарство в аптеке по совету фармацевта, следует обратиться с этой проблемой к гинекологу. Только профессиональный доктор сможет определить фактор, вызвавший отклонения от нормы, и порекомендовать кровоостанавливающее средство направленного действия.
Применяемые в процессе лечения медикаменты гемостатического действия не являются панацеей от заболеваний, спровоцировавших кровотечение. Они временно препятствуют стремительному оттоку крови, чтобы дать возможность организму восполнить образовавшийся дефицит. Курс лечения назначается врачом и включает медикаментозные средства, воздействующие непосредственно на причину патологии.
Они временно препятствуют стремительному оттоку крови, чтобы дать возможность организму восполнить образовавшийся дефицит. Курс лечения назначается врачом и включает медикаментозные средства, воздействующие непосредственно на причину патологии.
Таблетки
Эффективным средством при обильном кровотечении во время месячных являются кровоостанавливающие таблетки. Правильно подобранные препараты на основе выявленного генеза кровотечения способны восстановить недостаток факторов свертывания. Перед тем как начать принимать препараты-гемостатики, следует узнать о том, что некоторые из них могут иметь побочные эффекты и противопоказания. Описание самых распространенных кровоостанавливающих таблеток представлено в таблице:
Аналог-синтетик витамина К. Предназначен для стимулирования синтеза протромбина
Патологически высокая свертываемость крови, воспалительный тромбоз
Кожные реакции в виде зудящих высыпаний
Сосудосуживающий препарат на основе лекарственных трав с вяжущим действием
Повышенное давление, беременность, лактационный период
Проявление аллергической симптоматики
Сосудоукрепляющее действие наряду со снижением проницаемости капилляров
Урологические заболевания, тромбозы
Стимулирует выработку тромбопластина, что способствует ускоренному образованию первичного тромба
Головная боль, приступы тошноты, нарушение чувствительности конечностей
Подавляет образование белка плазмина, который отвечает за рассасывание тромбов
Кровоизлияния в мозг, инфаркт миокарда
Рвота, проблемы с цветовосприятием, головокружения
Эритростат при месячных
Медикаментозное лечение кровопотери с помощью Эритростата заключается в употреблении двух-трех кровоостанавливающих таблеток каждые 5 часов перед едой. Курс не должен длиться дольше 10 дней, после чего необходимо сделать перерыв не менее 3 месяцев. Если за этот период произошел рецидив, следует обратиться к врачу за консультацией. В такой ситуации может быть назначено лечение другим гемостатическим препаратом.
Курс не должен длиться дольше 10 дней, после чего необходимо сделать перерыв не менее 3 месяцев. Если за этот период произошел рецидив, следует обратиться к врачу за консультацией. В такой ситуации может быть назначено лечение другим гемостатическим препаратом.
Аскорутин при кровотечении маточном
Аскорбиновая кислота, входящая в состав Аскорутина, считается важным компонентом для формирования коллагеновых волокон. Благодаря этому качеству достигается кровоостанавливающий эффект. Периодический прием препарата Аскорутин для профилактики позволяет укрепить стенки сосудов и снизить их ломкость. Пить таблетки следует четыре раза в сутки по 1 пилюле. Действие лекарства накопительное, поэтому положительное влияние с каждым употреблением будет ощутимее. Курс рассчитан на 3 недели.
Дицинон и Транексам одновременно
Некоторые таблетки от кровотечения эффективнее действуют при одновременном пероральном употреблении. Препараты Дицинон и Транексам назначаются специалистами в случаях, требующих экстренной помощи. Задача Транексама — быстро остановить кровопотерю, а Дицинона — защитить организм от возможности образования тромбоза. Принимать эти кровоостанавливающие средства следует по схеме: первый прием — по 2 таблетки каждого, затем — по таблетке каждые 6 часов.
Задача Транексама — быстро остановить кровопотерю, а Дицинона — защитить организм от возможности образования тромбоза. Принимать эти кровоостанавливающие средства следует по схеме: первый прием — по 2 таблетки каждого, затем — по таблетке каждые 6 часов.
Уколы
Экстренной мерой при очень быстрой потере крови являются кровоостанавливающие уколы. Внутривенное введение препарата способствует максимально быстрому образованию сгустков (тромбов), которые блокируют кровотечение. Эффект от инъекционной терапии достигается за 10-15 мин. после введения. Самыми действенными кровоостанавливающими растворами для инфузий при назначении срочного лечения считаются:
- Этамзилат;
- Хлорид кальция;
- Аминокапроновая кислота;
- Контрикал;
- Окситоцин;
- Метилэргометрин;
- Викасол.
Окситоцин при маточных кровотечениях
Действие кровоостанавливающего препарата Окситоцин заключается в усилении сократительной активности гладкой мускулатуры матки. Как следствие этого процесса концентрация кальция внутри клеток увеличивается, и процесс кровотечения останавливается. Рекомендуется вводить раствор препарата внутримышечно для достижения наилучшего эффекта. Доза рассчитывается индивидуально для каждой пациентки на основании имеющихся данных о чувствительности к препарату. Единоразовое введение не может превышать 3 МЕ.
Как следствие этого процесса концентрация кальция внутри клеток увеличивается, и процесс кровотечения останавливается. Рекомендуется вводить раствор препарата внутримышечно для достижения наилучшего эффекта. Доза рассчитывается индивидуально для каждой пациентки на основании имеющихся данных о чувствительности к препарату. Единоразовое введение не может превышать 3 МЕ.
Аминокапроновая кислота при месячных
Сильное гемостатическое действие аминокапроновой кислоты основано на подавлении перехода профибринолизина (неактивной формы плазмина) в фибринолизин (активную форму). Применение этого препарата при обильных месячных предполагает внутривенное введение пятипроцентного раствора каждый час до сокращения количества кровянистых выделений.
Кровоостанавливающие средства при порезах
Для предотвращения потери крови вследствие механического повреждения мягких тканей используются местные медикаментозные кровоостанавливающие средства. Незначительные порезы и раны на коже можно просто обработать перекисью водорода для дезинфекции. Пенообразующий эффект перекиси способен остановить легкое капиллярное кровотечение. Более тяжелый случай требует применения препаратов с усиленным кровоостанавливающим действием.
Пенообразующий эффект перекиси способен остановить легкое капиллярное кровотечение. Более тяжелый случай требует применения препаратов с усиленным кровоостанавливающим действием.
Удобен в использовании кровоостанавливающий порошок с анестетиками. Основное действующее вещество адреналин оказывает сосудосуживающее действие, чем и достигается эффект остановки незначительного кровотечения при поверхностном повреждении. Препараты для наружной обработки ран изготавливаются из обработанной специальным образом крови человека или животных.
Кровоостанавливающие препараты при носовом кровотечении
Чтобы остановить кровотечение из носа различной этиологии следует произвести тампонирование. Для этих целей может применяться марлевая, поролоновая или пневматическая основа. Усилить эффект помогут кровоостанавливающие лекарства, предварительно нанесенные на тампон. Такими препаратами являются:
- Этамзилат;
- Дицинон;
- Эпсилон-аминокапроновая кислота;
- Хлористый кальций;
- Викасол.

Самой часто встречаемой причиной носовых кровотечений является артериальная гипертензия, поэтому важно обеспечить быстрый гипотензивный эффект. Он заключается в снижении артериального давления медикаментозным способом. Препараты, действие которых рассчитано на длительное применение, не подойдут для срочной помощи при кровотечении из носа.
При геморрое
Внезапное кровотечение, вызванное разрывом геморроидального узла можно остановить с помощью кровоостанавливающих средств, применяемых при других видах кровопотери (Дицинон, Викасол, Этамзилат и др.). Помимо этого, действенным препаратом является Релиф, который выпускается в форме свечей и мази. Масла, глицерин и витаминный комплекс, являющиеся основой суппозиториев, обладают ранозаживляющими и кровоостанавливающими свойствами. Использовать свечи для блокировки вытекания крови на постоянной основе противопоказано.
Для местного обезболивания и остановки локального кровотечения из трещин заднего прохода можно воспользоваться гемостатической саморассасывающеся губкой, пропитанной раствором препаратов направленного действия. Введение свечей и губок помогает быстро устранить кровотечение, однако на длительный эффект рассчитывать не стоит.
Введение свечей и губок помогает быстро устранить кровотечение, однако на длительный эффект рассчитывать не стоит.
Противопоказания
Входящие в состав гемостатических препаратов активные вещества могут спровоцировать возникновение аллергических реакций. Чтобы избежать негативных последствий, необходимо предупредить врача о наличии имеющиеся склонности к аллергии. Гиперчувствительность к одному из компонентов препарата является прямым противопоказанием к его приему, поэтому стоит тщательно изучить инструкцию и состав. Игнорирование содержащихся в инструкции к препаратам рекомендаций, в части нарушения дозировки и частоты приема, может привести к развитию тромбогеморрагического синдрома.
После получения рекомендаций врача по поводу применения гемостатического препарата, можно обратиться к услугам электронного каталога медикаментов для ознакомления с выбором имеющихся в наличии средств. Для того чтобы купить в интернет-магазине интересующую позицию по приемлемой цене, следует ознакомиться со средней стоимостью лекарств по региону проживания. Заказать выбранное средство можно, ориентируясь на примерные данные, представленные в таблице:
Заказать выбранное средство можно, ориентируясь на примерные данные, представленные в таблице:
источник
Кровоостанавливающие уколы при маточных кровотечениях
Любое выделение крови из полости матки, не связанное с обычными месячными, называется метроррагией или маточным кровотечением. Это патологическое состояние, связанное с заболеваниями или травмой, может быть опасным для жизни. Каждая женщина должна знать о его возможных причинах, уметь принять срочные и адекватные меры.
Методы остановки маточного кровотечения
При возникновении маточного кровотечения нельзя забывать, что все вопросы его причины и остановки находятся в компетенции врача. Однако необходимо также знать, какие применяются кровоостанавливающие средства, и что можно предпринять для оказания доврачебной помощи.
Первая помощь в домашних условиях
Остановить маточное кровотечение в домашних условиях помогут следующие действия:
- Уложить женщину в постель на ровную поверхность с приподнятым ножным концом.
 Это уменьшит приток крови к органам таза, но улучшит кровообращение мозга, органов грудной клетки.
Это уменьшит приток крови к органам таза, но улучшит кровообращение мозга, органов грудной клетки. - На живот положить холод, лучше всего подойдет пластиковый пакет со льдом или специальный резиновый пузырь, грелка с холодной водой. Холод можно держать до 2 часов, но с 5-минутными перерывами каждые 15 минут.
- Обеспечить женщине питье. Можно давать минеральную воду без газа, не горячий и не крепкий сладкий чай, подслащенную питьевую воду. Хорошо подойдут аптечные глюкозо-солевые растворы (регидрон, глюкосолан и аналоги), они помогут избежать потери жидкости, развития гипоксии мозга и сердечно-сосудистой недостаточности.
Нельзя делать спринцевания, вводить свечи, прикладывать тепло для уменьшения болей. Даже если выделение крови не обильные, женщине нельзя выполнять никакие нагрузки, вступать в половой контакт, принимать душ, ванну.
Кровоостанавливающие средства
Среди кровоостанавливающих препаратов при маточных кровотечениях назначают:
- Дицинон (этамзилат) уколы останавливающее кровотечение из матки по 2 мл (250 мг) для быстрого действия, или в таблетках по 0,25 мг 4 раза в сутки;
- Транексам кровоостанавливающий препарат при маточных кровотечениях — уколы по схеме из расчета на массу тела, или таблетки от 250 мг до 1,5 г 4 раза в день, в зависимости от тяжести;
- Глюконат кальция 10% в растворе или в таблетках по 0,5 г 4 раза в сутки;
- Викасол кровоостанавливающие таблетки при маточных кровотечениях по 15 мг трижды в день или в уколах по 1 мл;
- Аминокапроновую кислоту – внутривенно в капельницах 5% раствор до 100 мл в сутки, или внутрь по 30 мл 3 раза в сутки;
- Эргометрин в инъекциях – препарат из спорыньи, повышающий тонус матки и суживающий ее сосуды;
- Аскорутин – сочетание аскорбиновой кислоты и витамина Р для укрепления сосудов, принимают по 1-2 таблетке трижды в день.

В условиях стационара при обильных маточных кровотечениях применяются также кровоостанавливающие препараты: гемофобин, трасилол, фибриноген и другие в виде внутривенных капельных введений под контролем свертываемости крови.
Кровоостанавливающие средства при маточных кровотечениях местного действия – свечи, аналогичные тем, что назначают при лечении геморроидальных кровотечений. Примером являются фитосвечи ФГС, изготовленные на основе экстрактов кровоостанавливающих трав. Их применяют ректально, а вагинальное использование возможно только по назначению врача.
Гормональный гемостаз
Применение гормональных препаратов для остановки маточного кровотечения назначается в строго индивидуальном порядке, в основном, молодым не рожавшим еще женщинам, которые не входят в группу риска онкологической патологии, и у которых не выявлено никаких органических изменений в матке.
Обычно назначают препараты комбинированного состава типа пероральных контрацептивов – марвелон, мерсилон, риневидон, нон-овлон и другие аналоги. В дальнейшем для профилактики метроррагии, если она имеет гормональную природу, женщине ставят внутриматочную спираль, пропитанную гормонами (типа Мирена), которые постоянно выделяются в определенном количестве и оказывают регулирующее действие.
В дальнейшем для профилактики метроррагии, если она имеет гормональную природу, женщине ставят внутриматочную спираль, пропитанную гормонами (типа Мирена), которые постоянно выделяются в определенном количестве и оказывают регулирующее действие.
Применение народных средств
Популярные травы останавливающие маточное кровотечение не применяются как самостоятельный метод лечения, а лишь в дополнение к назначенным врачом медикаментам.
К кровоостанавливающим травам при маточных кровотечениях и содержащим растительные заменители гормонов, относятся крапива, материнка, тысячелистник, пастушья сумка, полевой хвощ, водяной перец, кровохлебка, другие растения и их сочетание.
Несколько примеров кровоостанавливающих сборов при маточных кровотечениях:
- По 1 столовой ложке листьев крапивы и малины заливают стаканом кипятка, оставляют на слабом огне на 10-15 минут, процеживают. Принимают по столовой ложке 4-5 раз в день.
- Настой душицы – 1 столовую ложку травы заваривают стаканом кипятка, настаивают 10-15 минут, пьют как чай по полстакана 3 раза в день.
 Не рекомендовано употребление беременным, может повысить тонус матки.
Не рекомендовано употребление беременным, может повысить тонус матки.
- Отвар корня кровохлебки – 2 столовые ложки измельченного корня заливают стаканом кипятка, оставляют томиться на водяной бане на полчаса, процеживают. Раствор делят на 6 приемов в течение дня.
Хирургические манипуляции
В тяжелых случаях и при наличии органической патологии единственно эффективным методом остановки кровопотери являются хирургические манипуляции и вмешательства, к ним относятся:
- Кюретаж (выскабливание) полости матки – быстрый способ, применяющийся у женщин детородного возраста и в период климакса;
- Криохирургический метод – воздействие на оболочку матки жидким азотом, когда специальный криоэлектрод вводится через аппарат гистероскоп;
- Радиочастотная абляция (прижигание) – аналогичен предыдущим методам, но эндометрий прижигается воздействием высокой температуры;
- Лазерная абляция – прижигание эндометрия лазерным лучом через световод, введенный в гистероскоп, самый современный метод прижигания с быстрым заживлением раневой поверхности в матке.

В основном, такую операцию делают женщинам в менопаузе и постменопаузе при наличии миомы или других опухолей. Современные лапароскопические технологии позволяют выполнять вмешательства малоинвазивным способом без больших разрезов через несколько небольших надрезов на коже живота.
Симптомы маточного кровотечения
Общим симптомом метроррагии является выделение крови из половых путей в межменструальный период или же обильные и чрезмерно длительные месячные (более 7 дней).
Этот признак может быть выражен в различной степени – от частых «мажущихся» появлений крови до обильного выделения алой крови со сгустками. Характерно усиление кровяных выделений после полового акта, поднятия тяжестей, переутомления, горячего душа.
Сопутствующими симптомами патологического процесса являются:
- Бледность кожи;
- Головная боль, головокружение;
- Учащение пульса и снижение артериального давления;
- Тошнота, рвота;
- Общая слабость, сонливость;
- Боли внизу живота – непостоянный симптом, характерен для выкидыша, внематочной беременности, воспаления, отхождения сгустков крови.

Причины метроррагии
В норме выделение крови из матки у женщины должно быть только в период менструации, в умеренном количестве и не более 7 дней. Все остальные случаи являются патологическими, их причины разделяют на 2 группы: связанные с гинекологическими заболеваниями и связанные с другими факторами.
Причины гинекологических кровотечений:
- Воспалительный процесс в матке;
- Наличие новообразований – полипов, аденомиоза, миомы, злокачественной опухоли;
- Прерывание беременности – самопроизвольное или искусственное;
- Патологические роды – атония или разрывы матки, предлежание плаценты;
- Повреждения матки – при травме, выскабливании.
Причины, не связанные с гинекологической патологией:
- Заболевания крови с понижением свертываемости;
- Длительный прием аспирина, антиаггрегантов, антикоагулянтов;
- Стрессовые ситуации;
- Гормональные нарушения – яичников, щитовидной железы, надпочечников;
Маточное кровотечение со сгустками
Особую тревогу у женщин должно вызывать появление темных сгустков крови в период месячных или независимо от них. Некоторые считают, что отхождение сгустков является признаком очищения матки, но это – заблуждение.
Причиной могут быть и нарушения гормонального фона, чаще всего у девочек-подростков и женщин преклимактерического периода. Подобные негативные процессы также бывают и у тех, кто принимает неадекватно подобранные гормональные контрацептивы, при наличии внутриматочных спиралей. В любом из случаев необходимо обратиться к врачу и пройти обследование.
Когда необходимо обратиться к врачу
Опасность метроррагии состоит в развитии острой анемии, а если они повторяются часто – хронической анемии и гипоксии внутренних органов, дистрофических изменениях во внутренних органах. Частые кровотечения нарушают фертильность женщины – способность забеременеть и выносить ребенка.
Частые кровотечения нарушают фертильность женщины – способность забеременеть и выносить ребенка.
Особую опасность представляют собой кровянистые выделения в период беременности. Такое случается нередко, и бытует ошибочное мнение, что «месячные идут через плаценту». Это ошибочное суждение, никаких месячных во время беременности не бывает, а выделения крови говорят о нарушении имплантации плодного яйца, о проблемах с плацентой.
Все это негативно сказывается на развитии плода. Женщина должна внимательно относиться к своему здоровью, и даже при самых незначительных «нежданных» кровянистых выделениях из половых путей незамедлительно обратиться к гинекологу.
Виды маточных кровотечений
Среди различных вариантов классификации в практике принято понятие аномальных кровотечений из матки (АМК) с разделением на 2 группы по механизму возникновения: органические, дисфункциональные, акушерские – связанные с беременностью и родами.
Органические
Различают различные виды органических кровотечений из матки:
- АМК при полипе;
- Аденомиозе;
- Аденокарциноме;
- Саркоме матки;
- Воспалении;
- Повреждении.

В этих…
Инъекции в Челябинске – Цены и адреса ✓
Ваш возраст Ребенок Взрослый Пенсионер
Ваш пол МужскойЖенский
Клиника ул. 40-летия Победы, 33ул. Труда, 187-Бпр. Ленина, 17ул. 250-летия Челябинска, 73Хариса Юсупова, 103 (в Парковом)ул. Сони Кривой, 32г. Копейск: пр.Славы, 7ул. Барбюса, 61Травмпункт, ул.Труда, 187 «Д»Профосмотры, ул.Труда, 183 «Б»Университетская Набережная, 28
Врач Абрамова Наталья НиколаевнаАвдеева Юлия СергеевнаАгеев Юрий ИвановичАкиншина Ирина ВитальевнаАлександрова Татьяна ГеннадьевнаАнашкина Светлана ЮрьевнаАндреева Юлия ЮрьевнаАниськина Наталья НиколаевнаАнтонова Татьяна ВикторовнаАрхипов Дмитрий АнатольевичАсатрян Карен АртуровичАстапенко Ирина АлександровнаАхмедов Назим РамазановичБавыкина Екатерина ЛеонидовнаБастрон Алексей ЮрьевичБахарев Вадим ВладимировичБахарева Ирина НиколаевнаБахтина Татьяна АнатольевнаБелашкина Елена БорисовнаБеляева Ольга ПавловнаБецков Андрей СергеевичБирюкова Юлия АлександровнаБлагих Андрей ВладимировичБлинов Александр ЮрьевичБогданчикова Елена ВасильевнаБогдашов Григорий ЮрьевичБоженко Яна ЛеонидовнаБондин Игорь ВладимировичБородина Ксения НиколаевнаБочарников Владислав СергеевичБочкарев Михаил ОлеговичБраилко Ирина ВладимировнаБрискер Кира АлександровнаБрыль Игорь ВладимировичБубнов Василий ВладимировичБубнова Валерия СергеевнаБукреева Елена АлександровнаБулавина Марина СергеевнаБуланова Анжелика ВалерьевнаБумагина Светлана ГеннадьевнаБуянова Галина ВикторовнаБыбочкин Дмитрий ВладимировичВасильева Марина ИгоревнаВасилькова Ирина ВадимовнаВасильченко Валентина АлександровнаВильданов Булат ФанилевичВильчинская Диана АртуровнаВинокуров Олег ВладимировичВитьшев Александр АлександровичВласова Мария ЕвгеньевнаВласова Евгения ВячеславовнаВойнова Татьяна ГеннадьевнаВолкова Лариса ИвановнаВыборная Надежда ВладимировнаГаврикова Оксана АнатольевнаГадриян Алиса ДмитриевнаГалеев Ильяс НизиповичГаличанин Иван АрхиповичГамза Валерий НиколаевичГерасимова Наталия ВладимировнаГерасимова Дарья ЕвгеньевнаГиберт Константин ВладимировичГильманшина Диана РалифовнаГирлина Светлана ВасильевнаГирфанов Рустам ТимуровичГлотов Евгений Алексеевич Глущенко Елена СергеевнаГнатюк Яков АнатольевичГнусарева Ольга СергеевнаГолубева Венера НафизовнаГорбунова Дарья СергеевнаГорохова Вера ВалерьевнаГорпиняк Галина ВасильевнаГоршкова Лада ЛьвовнаГренадерова Светлана ВладимировнаГригорьева Татьяна СергеевнаГунашян Сюзанна МушеговнаГурьянова Валерия ПавловнаДаниловских Дмитрий АлександровичДанько Николай Александрович Деева Екатерина ВикторовнаДемченко Алина ЕвгеньевнаДмитриева Ирина СергеевнаДмитриченко Елена ГеннадьевнаДобрынин Илья НиколаевичДолгушин Илья ИльичДолгушина Валентина ФедоровнаДорохова Ирина АлексеевнаДробинина Ольга АлександровнаДудин Александр ВалерьевичДудкина Наталья АлександровнаЕвдокимова Светлана РудольфовнаЕвсеева Валентина БорисовнаЕгина Ирина АлександровнаЕговцева Арина ИгоревнаЕгоршева Ольга ЮрьевнаЕникеева Юлия ШамильевнаЕремина Алла ОлеговнаЖданова Kсения СергеевнаЖукова Наталья ВладимировнаЗабегаева Наталья ВикторовнаЗавадский Семен ЮрьевичЗайко Мария ФедоровнаЗайцева Алла АлександровнаЗамятина Лариса ВладимировнаЗаряда Анна АндреевнаЗахарова Лариса ВалентиновнаЗеликман Ирина ИгоревнаЗимин Федор НиколаевичЗиновенкова Елена АлексеевнаЗлаказова Анна ЮрьевнаЗубрилин Сергей ЭдуардовичЗуйкова Светлана ЭрнстовнаИванов Андрей ВладимировичИванова Ангелина ВасильевнаИванычева (Сабаева) Татьяна ПавловнаКабанова Елена ВитальевнаКамалетдинова Наталия ЛеонидовнаКарасёва Елена ВасильевнаКарманов Вячеслав АнатольевичКарпенко Олег АнатольевичКашко Татьяна НиколаевнаКирпичникова Светлана ИвановнаКобус Алексей ВикторовичКокшарова Ольга ЛеонидовнаКоляда Елена ВалерьевнаКомарова Татьяна МихайловнаКомкова Наталия НиколаевнаКорабельников Артемий ВладимировичКоренев Иван ВикторовичКорнеев Владислав ВладимировичКоролева Марианна БорисовнаКостарев Филипп ИгоревичКотова Ирина ВалерьевнаКочадзе Софио ЕлгуджевнаКочетова Людмила АлексеевнаКрасов Александр НиколаевичКринкер Фаина АлександровнаКрюков Андрей СергеевичКрюковская Ольга ВасильевнаКувайцева Наталья ИгоревнаКудряшова Наталья ВладимировнаКудряшова Юлия ИвановнаКузнецова Ольга ЮрьевнаКузьменко Дмитрий ПетровичКузьмина Елена ЮрьевнаКурбановская Наталия АлександровнаКурченкова Ольга ВалерьевнаЛапицкая Елена ВладимировнаЛапченков Роман ВячеславовичЛарионова Ольга СергеевнаЛенкова Мария МихайловнаЛесунова Любовь ЮрьевнаМазырко Елена ВасильевнаМакодзеба Ольга АлександровнаМаксимовская Алёна ЮрьевнаМалкова Ирина МихайловнаМалыхина Ольга ПавловнаМалышева Светлана СергеевнаМальцева Оксана АлександровнаМальцева Светлана АнатольевнаМамыкин Алексей АлександровичМаркова Татьяна АлександровнаМаркович Анна ВладимировнаМарьина Наталья ВениаминовнаМаслихов Игорь АлександровичМахнанова Марина АлександровнаМаштакова Татьяна ВладимировнаМедведев Антон АлександровичМедведева Анна ВячеславовнаМезенцева Елена АнатольевнаМикуров Александр АлексеевичМиндлина Анна ОлеговнаМиронова Наталья Юрьевна Митькова Ольга ВладимировнаМихалева Ирина ИгоревнаМодебадзе Коба АрчиловичМоисеев Константин ИвановичМоисеева Татьяна НиколаевнаМорозова Юлия ВладимировнаНагорная Анастасия СергеевнаНакарякова Ольга НиколаевнаНасруллаева Галина ТалибовнаНеуймина Татьяна ВалерьевнаНикифоров Евгений ВикторовичНиконова Алёна АлександровнаНисковская Оксана АлександровнаНовокшанова Ольга ВладимировнаНосов Владимир СергеевичНосова Елена ВалерьевнаНужный Виктор ВладимировичОзерова Елена ВикторовнаОлейникова Екатерина ИвановнаОлейникова Виктория ВитальевнаОришич Юлия ПетровнаОрлова Екатерина ГеральдовнаОхотникова Елена СергеевнаПавлов Юрий ВасильевичПавлов Александр БорисовичПанченко Владимир ВладимировичПастьян Евгенья АлександровнаПашкина Наталья ВалентиновнаПашнин Павел ЮрьевичПетрова Евгения БорисовнаПетряева Елена СергеевнаПетухов Юрий Дмитриевич Пивоваров Артем ГеоргиевичПименов Иван ВасильевичПименова Ольга НиколаевнаПинелис Людмила Борисовна Пирогова Ирина ЮрьевнаПлаксин Олег ФедоровичПогосян Виген ШаваршовичПогребная Оксана ЕвгеньевнаПодлубная Людмила ВилиновнаПопов Сергей ВладимировичПопова Ольга СергеевнаПоповкина Майя СергеевнаПостовалова Елена ВениаминовнаПрокопьева Ольга БорисовнаПроценко Светлана ГеннадьевнаПрядко Оксана ЮрьевнаПузрин Евгений ВладимировичПустовая Виктория ВикторовнаПястолов Виктор ВладимировичРечкалова Ольга ПетровнаРодина Елена АнатольевнаРодионова Наталья АлексеевнаРудой Даниил Олегович Русина Кристина ИгоревнаРухлов Антон АлександровичРухлова Евгения ИгоревнаРябухина Светлана ВладимировнаСавочкина Альбина ЮрьевнаСаевец Валерия ВладимировнаСамойлова Ольга БорисовнаСанникова Лариса АлександровнаСауткин Анатолий ГеннадьевичСедов Александр ВячеславовичСергеев Дмитрий ИгоревичСеребренникова Дарья АнатольевнаСидорина Ирина ВладимировнаСкакун Артемий ВикторовичСкиба Маргарита МихайловнаСмагина Екатерина СергеевнаСмирнова Ольга АнатольевнаСорокина Наталья НиколаевнаСтарыгин Алексей АлександровичСтепанова Анастасия ВалентиновнаСтуднева Наталья АлександровнаСтыцин Илья АлександровичСысоева Виктория АлександровнаСычугов Глеб ВячеславовичТарелкина Ольга АлександровнаТележинская Ирина МихайловнаТеше Екатерина СергеевнаТимиркаева Анастасия ГригорьевнаТитова Алевтина ВладимировнаТкачев Александр НиколаевичТомилова Светлана БорисовнаТретьякова (Жизнина) Татьяна НиколаевнаТутанина Лариса АлександровнаТюмбарова Юлия АнатольевнаУфимцева Ирина ВладимировнаУфимцева Яна Анатольевна Ушакова Инна ВячеславовнаУшенин Евгений МихайловичУшпик Анатолий ПетровичФалалеев Сергей ИвановичФанина Эльвира РинатовнаХарлова Татьяна ЭдуардовнаХарькова Анна НиколаевнаХрамцов Алексей ВладимировичХудякова Марина ВладимировнаЧалевич Ольга ВячеславовнаЧернова Татьяна ИвановнаЧимитова Елена НиколаевнаШаимова Ирина СергеевнаШаматава Екатерина РомановнаШахова Елена ВикторовнаШевелева Наталья ВладимировнаШивцов Дмитрий ВитальевичШилова Татьяна ВасильевнаШмакова Наталья СергеевнаШмыгина Олеся СтаниславовнаШорина (Мещерякова) Анастасия ВикторовнаШтырляева Екатерина АлександровнаШумилова Ирина ВалерьевнаЩеткина Ольга ГеннадьевнаЯковлева София ВасильевнаЯпишина Ирина ОлеговнаЯровой Николай Николаевич
Рациональное применение транексамовой кислоты в комплексном лечении при возникновении кровотечения при беременности
Кровотечение и образование ретрохориальных гематом в первом триместре беременности являются клиническими формами невынашивания беременности и в 10-15% случаев осложняют течение беременности у женщин с привычным невынашиванием. В половине этих случаев данные клинические проявления носят рецидивирующий характер и распространяются не только на первый триместр (до 12 недель), но также и на второй (до 16-18 недель). Однако в таких сроках гестации уже сформирована плацента, и гематомы имеют ретроплацентарный характер и являются проявлением преждевременной отслойки плаценты. Именно рецидивирующее течение ретрохориальной гематомы представляет наибольшую сложность в тактике ведения.
В половине этих случаев данные клинические проявления носят рецидивирующий характер и распространяются не только на первый триместр (до 12 недель), но также и на второй (до 16-18 недель). Однако в таких сроках гестации уже сформирована плацента, и гематомы имеют ретроплацентарный характер и являются проявлением преждевременной отслойки плаценты. Именно рецидивирующее течение ретрохориальной гематомы представляет наибольшую сложность в тактике ведения.В третьем гинекологическом отделении КГБУЗ «КМКБ№4» в течение 2015 года проводилось исследование по рациональному применению транексамовой кислоты при возникновении кровотечения при беременности.
Цель исследования – оценить эффективность применения транексама при данной патологии.
Ввиду широкой распространенности вопрос невынашивания беременности сегодня заслуживает особого внимания. В течение многих лет данное осложнение остается актуальной проблемой акушерства, несмотря на прогресс науки в целом. Желанная беременность в 15–20 % случаев заканчивается досрочным спонтанным прерыванием, причем на эмбриональный период приходится до 75 % всех репродуктивных потерь, связанных с невынашиванием. Сложно переоценить медицинскую и социальную актуальность проблемы невынашивания беременности в современных условиях снижения рождаемости и возрастания смертности. Одним из признаков прерывания беременности на ранних сроках является ретрохориальная гематома, вследствие частичного отторжения плодного яйца от хориона — предшественника плаценты.
Сложно переоценить медицинскую и социальную актуальность проблемы невынашивания беременности в современных условиях снижения рождаемости и возрастания смертности. Одним из признаков прерывания беременности на ранних сроках является ретрохориальная гематома, вследствие частичного отторжения плодного яйца от хориона — предшественника плаценты.
Ретрохориальная гематома – это образование, образующееся когда плодное яйцо отторгается от хориона. При этом образуется полость, наполненная свернувшейся кровью, которая и является самой ретрохориальной гематомой.
В зависимости от срока беременности выделяют два вида гематомы:
Ретрохориальная (при отслойке плодного яйца от хориона). Данный вид гематомы может возникать до 16 недель;
Ретроплацентарная(при отслойке плодного яйца от плаценты). Плацента окончательно заканчивает формирование к 16 неделе беременности. При возникновении гематомы говорят о преждевременной отслойке нормально расположенной плаценты.
Классификация по степеням тяжести:
1) Легкая степень. В большинстве случаев гематома легкой степени является случайной находкой на УЗИ, женщина не предъявляет никаких жалоб;
2) Средняя степень. Беременную беспокоят тянущие боли внизу живота, возможно появление кровянистых выделений из половых путей;
3) Тяжелая степень. Появляются сильные схваткообразные боли внизу живота, интенсивное кровотечение, падение артериального давления. Общее состояние женщины значительно ухудшается, возможна потеря сознания.
Существует множество причин, способных вызвать подобное осложнение:
1) Нарушения, связанные с заболеваниями эндокринной системы.
2) Большие физические нагрузки. Именно поэтому беременным женщинам не рекомендуется поднимать тяжести, так как это может привести к осложнениям в течении беременности и порокам развития плода.
3) Инфекционные и воспалительные процессы в мочеполовых органах. Любые признаки инфекционного заболевания должны послужить причиной для незамедлительного лечения.
4) Вредная работа, связанная с постоянным шумом или вибрацией.
5) Аутоиммунные заболевания. Это отклонения, при которых иммунная система вырабатывает антитела, реагирующие не на какие-то инородные элементы и микроорганизмы, а на здоровые клетки собственного организма.
6) Нарушения свертывания крови.
7) Хронический эндометрит.
8) Частые стрессы.
9) Травмы.
10) Опухоли матки.
11) Тяжелая форма токсикоза.
12) Вредные привычки женщины.
13) Пороки развития ребенка
14) Врожденные пороки развития матки.
15) Генитальный инфантилизм. Этот термин обозначает задержку полового развития, при которой у взрослой женщины наблюдается ряд половых признаков, более свойственных ребенку или подростку.
Предупредить появление ретрохориальной гематомы практически невозможно также как и установить точную причину ее образования.
Рис 1. Ретрохориальная гематома
В 3-ем гинекологическом отделении в комплекс лечения входит гестагенотерапия (утрожестан, праджисан, дюфастон, масляный раствор погестерона) в лечебной дозировке, гемостатическая терапия (дицинон, транексамовая кислота). Гемостатические препараты должны назначаться по показаниям. Применение транекамовой кислоты показано при:
1) Угроза прерывания беременности на ранних сроках (отслойки хориона, гематомы)
2) Низкое расположение плаценты и кровотечения в первом и втором триместрах беременности
3) Беременность при пороках развития матки (двойная и двурогая матка, внутриматочная перегородка – кровотечения в первом и втором триместрах беременности)
4) Заоболочечные гематомы во втором триместре беременности
5) Краевая отслойка нормально расположенной плаценты во втором триместре беременности
Транексам – антифибринолитическое средство, специфически ингибирующее активацию профибринолизина (плазминогена) и его превращение в фибринолизин (плазмин). Обладает местным и системным гемостатическим действием при кровотечениях, связанных с повышением фибринолиза (патология тромбоцитов, меноррагии), а также противовоспалительным, противоаллергическим, противоинфекционным и противоопухолевым действиями за счет подавления образования кининов и других активных пептидов, участвующих в аллергических и воспалительных реакциях.
Рис 2. Механизм действия транексамовой кислоты
При анализе исследуемых историй болезни пациенток, накопился отрицательный опыт назначения транексама при скудных темных кровянистых выделениях из половых путей. При наличии острого кровотечения (алых кровянистых выделений) применение препарата носит положительный результат. В случае кровянистых выделений из половых путей, связанных с опорожнением «старой» ретрохориальной гематомы, наблюдалась обратная тенденция в сторону увеличения объема гематомы. В этом случае транексам не показан. При скудных коричневых выделениях из половых путей можно расценить в ранние сроки беременности как нидацию или миграцию плодного яйца в полости матки. В случае назначения препарата дицинон отмечается положительная динамика. Отсюда можно сделать вывод: точка приложения транексамовой кислоты есть остро возникшее кровотечение при беременности, которая по мнению врача, потребует незамедлительных действий для остановки кровотечения.
При кровотечениях во время беременности нами применяется следующая схема назначения препарата транексам — по 250–500 мг 3 раза в сутки до полной остановки кровотечения. При местном фибринолизе терапию начинаем с парентерального (в/в) введения препарата Транексам® с последующим переходом на пероральный прием по 250–500 мг 2–3 раза в сутки. Средняя продолжительность курса лечения — 7 дней. Побочные действия применения препарата транексам в отделении не отмечалось.
Проведен ретроспективный анализ 30 историй болезни пациенток 3-го гинекологического отделения, получавших транексам. В 19 случаях назначение транексама при остром кровотечении, не связанном с объемом ретрохориальной гематомы – положительная динамика. В 11 случаях назначение препарата при скудных кровянистых выделениях из половых путей у больных, поступивших с клиникой ранее возникших ретрохориальных гематом, опорожняющихся на фоне транексама увеличивается объем гематомы в 2-3 раза, через некоторое время при отсутствии каких-либо проявлений продолжающегося маточного кровотечения. В дальнейшем таким пациентам проводится антибактериальная терапия с целью профилактики восходящей инфекции, энзимотерапия на амбулаторном этапе.
Список литературы
1) Торчинов А. М., Умаханова М. М., Доронин Г. Л., Рон М. Г. Беременность малого срока и ретрохориальная гематома: диагностика, лечение и прогнозы на современном этапе развития акушерства (обзор литературы) // Молодой ученый. — 2013. — №4. — С. 659-662.
2) Милованова А.П., Серова О.Ф. 2011. Причины и дифференцированное лечение раннего невынашивания беременности.
3) Сидельникова В.М., Сухих Г.Т. 2010. Невынашивание беременности.
4) Стрижакова А.Н., Давыдова А.И., Игнатко И.В., Белоцерковцева Л.Д. 2011. Невынашивание беременности.
5) Корнеева И.Е., Серова О.Ф. 2013. Угроза прерывания беременности различных сроков гестации. Тактика и стратегия современной терапии.
6) Макацария А.Д. 2015. Беременность высокого риска.
7) Подзлкова Н.М., Скворцова М.Ю. 2010. Невынашивание беременности
Машина И.Н., Елизарьев Е.А., Рустамова Э.Х.
КГБУЗ «КМКБ №4» 3-е гинекологическое отделение
Ветеринарные препараты (лекарства) для животных от производителя NITA FARM
На настоящий момент каталог ветеринарных препаратов NITA-FARM содержит более 85 наименований лекарств для животных в различных фармакологических группах.
Треть ассортимента — это собственные уникальные разработки Компании. А благодаря интенсивной работе научно-исследовательского отдела наш каталог лекарств для животных регулярно пополняется новинками. Описание каждого препарата включает подробную инструкцию по применению и другую полезную информацию.
У нас вы можете приобрести ветеринарные препараты для КРС, свиней, МРС, лошадей, птиц и других животных. При этом наши препараты защищены от подделок — каждая упаковка снабжена специальными отличительными элементами.
Изготовление препаратов в Компании NITA-FARM контролируется на всех этапах. Разработка, производство и продажа ветеринарных препаратов в России сертифицированы в соответствии с общемировыми стандартами DIN EN ISO 9001:2015 и GMP-EU (ГОСТ P 52249-2009). У нас вы покупаете только гарантированно качественную продукцию.
Как найти нужный препарат в каталоге?
Если вам известно название лекарственного препарата для животных, то его можно просто ввести в строку поиска. Также быстро подобрать подходящее лекарство вам позволит система фильтров — используя ее, можно найти препарат по интересующим вас параметрам. А рассчитать его дозировку поможет онлайн-калькулятор.
Как купить препараты для лечения животных от NITA-FARM?
Ветеринарная продукция нашей компании продается во всех регионах России и за рубежом (включая все страны СНГ). Для того чтобы узнать контактную информацию ближайшего к вам торгового представителя NITA-FARM, посетите раздел «Где купить».
Чрескожное введение кровоостанавливающих средств при активном кровоизлиянии в печень
Задний план: Активное кровотечение, вызванное повреждением печени, может быть опасным для жизни и требует немедленного внимания. В настоящее время обычным методом лечения стало безоперационное лечение повреждений твердых органов брюшной полости. Целью этого исследования было определить, может ли только инъекция гемокоагулазы под контролем ультразвукового исследования с контрастным усилением (CEUS) контролировать активное кровотечение в печени кролика.
Методы: Печень 30 кроликов была пунктирована полуавтоматической биопсийной иглой 18 калибра для создания модели активного кровотечения печени, что было подтверждено с помощью CEUS. Животные были случайным образом разделены на две группы: экспериментальную (n = 15) и контрольную (n = 15). В группе лечения гемокоагулаза вводилась в место кровотечения под контролем CEUS. В контрольной группе активное место кровотечения обрабатывали физиологическим раствором.После выполнения этих лечебных процедур обеим группам давали раствор Рингера с лактатом для поддержания среднего артериального давления на уровне 70 мм рт. Ст. В течение 1 часа. В конце исследования анализировали внутрибрюшинную кровопотерю, гематокрит, среднюю частоту сердечных сокращений, а также макро- и микроскопические исследования.
Полученные результаты: CEUS показал гипоэхогенные и анэхогенные дефекты перфузии на моделях печени с активным кровотечением.Макроскопические и микроскопические исследования также подтвердили результаты. После инъекции гемокоагулазы бывший участок кровотечения появился на CEUS как область, лишенная контраста. Кровопотеря была ниже в экспериментальной группе, чем в контрольной (38,0 +/- 16,6 мл против 107,9 +/- 20,8 мл; t = 10,172, P <0,05). Среднее значение гематокрита и частота сердечных сокращений были выше в экспериментальной группе, чем в контрольной группе (гематокрит: 23,9 +/- 3,8% против 18,8 +/- 4,1%; t = 3,541, P <0,05; частота сердечных сокращений: 250 + / -18 против 223 +/- 15; t = 4.551, P <0,01).
Заключение: Инъекция только гемокоагулазы под руководством CEUS – это простой и быстрый метод контроля кровопотери при активном кровотечении в печени.
Портативный инъекционный агент свертывания крови может лечить пострадавших от травм на передовой
Митраготри и его команда разработали полимер-пептидный коагулят, названный HAPPI (гемостатические агенты через соединение полимерных пептидов), который может выборочно связываться с поврежденными кровеносными сосудами и активированными тромбоцитами при кровотечении сайт.Циркулирующие тромбоциты подобны медикаментам неотложной помощи – они постоянно осматривают тело на предмет ран. При повреждении кровеносного сосуда тромбоциты активируются и прикрепляются к поврежденному сосуду, вызывая тромб.
HAPPI связывается с этими активированными тромбоцитами и усиливает их накопление в месте кровотечения. Его можно вводить в любое место тела и при этом добираться до раны.
На моделях мышей HAPPI значительно снизил время кровотечения и объем кровотечения из травм.Исследователи отметили примерно 99-процентное сокращение времени кровотечения и 97-процентное сокращение кровопотери. Исследователи также обнаружили, что при травматических повреждениях инъекция HAPPI увеличивает среднюю выживаемость сверх одного часа, что является важной целью для оказания помощи при травмах.
«Многие смертельные случаи, связанные с травмами, происходят в течение первого часа, когда кровопотеря происходит обильно и при отсутствии вмешательства», – сказал Юншэн Гао, научный сотрудник SEAS и соавтор статьи.«Ключевая задача служб быстрого реагирования – сохранить жизнь пациентам с травмами в этот так называемый золотой час и за это время доставить их в больницу, потому что, как только они попадают в больницу, это совершенно другая игра».
«С помощью HAPPI мы стремились разработать безопасную и эффективную внутреннюю повязку», – сказала Апурва Сароде, бывшая аспирантка SEAS и соавтор исследования. «Мы думаем, что простой дизайн и масштабируемый процесс синтеза HAPPI облегчит его непрерывное масштабирование и перевод на более крупные модели животных, а в конечном итоге и на пациентов.”
Финансирование Гарвардского биомедицинского ускорителя Блаватника позволило лаборатории усовершенствовать и проверить технологию на моделях животных. В дальнейшем команда стремится расширить производство материалов и протестировать их на более крупных моделях животных.
Управление технологического развития Гарварда защитило интеллектуальную собственность, связанную с этим проектом, и изучает возможности коммерциализации.
Соавторами статьи являются Анвей Укидве и Зонгмин Чжао из Harvard SEAS, Шихуэй Го и Роберт Флауменхафт из Медицинского центра Бет Исраэль Дьяконисса, Анирбан Сен Гупта из Университета Кейс Вестерн Резерв и Николаос Кокороскос и Ноэль Сайллан из Массачусетской больницы общего профиля.Исследование было поддержано Национальным институтом здравоохранения в рамках гранта R01HL129179.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie.Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie.Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Список из 12 препаратов для гемостаза по сравнению
Гемостаз – это процесс остановки кровотечения в организме.
Лекарства, применяемые для лечения гемостаза
Следующий список лекарств так или иначе связаны с этим заболеванием или используются для его лечения.
| Название препарата | Рейтинг | Отзывы | Мероприятия & квест; | Rx / OTC | Беременность | CSA | Спирт |
|---|---|---|---|---|---|---|---|
| Посмотреть информацию о фибриновом герметике фибриновый герметик | Показатель | Добавить отзыв | Rx | C | N | ||
Общее название: фибриновый герметик для местного применения Брендовое название: Artiss Класс препарата: модификаторы свертывания разные Потребителям: дозировка, побочные эффекты Для профессионалов: Факты о наркотиках от А до Я | |||||||
| Просмотр информации о тромбине тромбин | Показатель | Добавить отзыв | Rx | C | N | ||
Общее название: актуальный тромбин Бренды: Эвитром, Тромбин-JMI, Рекотром, Тромби-гель, Тромби-Pad …показать все Класс препарата: модификаторы свертывания разные Потребителям: дозировка, побочные эффекты Для профессионалов: Факты о наркотиках от А до Я, Монография AHFS DI, Информация о назначении | |||||||
| Посмотреть информацию о Evithrom Evithrom | Показатель | Добавить отзыв | Rx | C | N | ||
Общее название: актуальный тромбин Класс препарата: модификаторы свертывания разные Потребителям: дозировка, побочные эффекты Для профессионалов: Прописная информация | |||||||
| Посмотреть информацию о Thrombin-JMI Тромбин-JMI | Показатель | Добавить отзыв | Rx | C | N | ||
Общее название: актуальный тромбин Класс препарата: модификаторы свертывания разные Потребителям: дозировка, побочные эффекты Для профессионалов: Прописная информация | |||||||
| Посмотреть информацию о Recothrom Рекотром | Показатель | Добавить отзыв | Rx | C | N | ||
Общее название: актуальный тромбин Класс препарата: модификаторы свертывания разные Потребителям: дозировка, побочные эффекты Для профессионалов: Прописная информация | |||||||
| Посмотреть информацию о Тромби-Геле Тромби-гель | Показатель | Добавить отзыв | Rx | C | N | ||
Общее название: актуальный тромбин Класс препарата: модификаторы свертывания разные Потребителям: дозировка, побочные эффекты | |||||||
| Посмотреть информацию об Artiss Artiss | Показатель | Добавить отзыв | Rx | C | N | ||
Общее название: фибриновый герметик для местного применения Класс препарата: модификаторы свертывания разные Потребителям: дозировка, побочные эффекты | |||||||
| Посмотреть информацию о Thrombi-Pad Тромби-Pad | Показатель | Добавить отзыв | Rx | C | N | ||
Общее название: актуальный тромбин Класс препарата: модификаторы свертывания разные Потребителям: дозировка, побочные эффекты | |||||||
| Посмотреть информацию о ТахоСил ТахоСил | Показатель | Добавить отзыв | Rx | C | N | ||
Общее название: фибриноген / тромбин для местного применения Класс препарата: модификаторы свертывания разные Потребителям: дозировка, Для профессионалов: Прописная информация | |||||||
| Посмотреть информацию о Evicel Evicel | Показатель | Добавить отзыв | Rx | C | N | ||
Общее название: фибриноген / тромбин для местного применения Класс препарата: модификаторы свертывания разные Потребителям: дозировка, Для профессионалов: Прописная информация | |||||||
| Посмотреть информацию о Evarrest Evarrest | Показатель | Добавить отзыв | Rx | C | N | ||
Общее название: фибриноген / тромбин для местного применения Класс препарата: модификаторы свертывания разные Потребителям: дозировка, Для профессионалов: Прописная информация | |||||||
| Посмотреть информацию о VistaSeal VistaSeal | Показатель | Добавить отзыв | Rx | C | N | ||
Общее название: фибриноген / тромбин для местного применения Класс препарата: модификаторы свертывания разные Потребителям: дозировка, Для профессионалов: Прописная информация | |||||||
Легенда
| Рейтинг | Для оценки пользователей спрашивали, насколько эффективным они нашли лекарство с учетом положительных / побочных эффектов и простоты использования (1 = неэффективно, 10 = наиболее эффективно). |
|---|---|
| Деятельность | Активностьоснована на недавней активности посетителей сайта по отношению к другим лекарствам в списке. |
| Rx | Только по рецепту. |
| ОТС | Без рецепта. |
| Rx / OTC | по рецепту или без рецепта. |
| Вне маркировки | Это лекарство не может быть одобрено FDA для лечения этого состояния. |
| EUA | Разрешение на использование в чрезвычайных ситуациях (EUA) позволяет FDA разрешать использование неутвержденных медицинских продуктов или несанкционированного использования одобренных медицинских продуктов в объявленной чрезвычайной ситуации в области общественного здравоохранения, когда нет адекватных, одобренных и доступных альтернатив. |
| Категория беременности | |
|---|---|
| А | Адекватные и хорошо контролируемые исследования не смогли продемонстрировать риск для плода в первом триместре беременности (и нет никаких доказательств риска в более поздних триместрах). |
| B | Исследования репродукции животных не смогли продемонстрировать риск для плода, и нет адекватных и хорошо контролируемых исследований на беременных женщинах. |
| К | Исследования репродукции животных показали неблагоприятное воздействие на плод, и нет адекватных и хорошо контролируемых исследований на людях, но потенциальные преимущества могут потребовать применения у беременных женщин, несмотря на потенциальные риски. |
| Д | Имеются положительные доказательства риска для плода у человека, основанные на данных о побочных реакциях, полученных в результате исследований или маркетингового опыта или исследований на людях, но потенциальные преимущества могут потребовать применения у беременных, несмотря на потенциальные риски. |
| X | Исследования на животных или людях продемонстрировали аномалии плода и / или есть положительные доказательства риска для плода у человека, основанные на данных о побочных реакциях из исследовательского или маркетингового опыта, и риски, связанные с использованием у беременных женщин, явно перевешивают потенциальную пользу. |
| № | FDA не классифицировало препарат. |
| Закон о контролируемых веществах (CSA) Приложение | |
|---|---|
| № | Не подпадает под действие Закона о контролируемых веществах. |
| 1 | Имеет высокий потенциал для злоупотреблений. В настоящее время не применяется в медицинских целях в США. Отсутствуют общепринятые меры безопасности при использовании под медицинским наблюдением. |
| 2 | Имеет высокий потенциал для злоупотреблений. В настоящее время разрешено медицинское использование для лечения в Соединенных Штатах или в настоящее время принятое медицинское использование с серьезными ограничениями. Жестокое обращение может привести к серьезной психологической или физической зависимости. |
| 3 | Имеет меньший потенциал для злоупотребления, чем те, которые указаны в таблицах 1 и 2. В настоящее время разрешено медицинское использование для лечения в Соединенных Штатах. Злоупотребление может привести к умеренной или низкой физической зависимости или высокой психологической зависимости. |
| 4 | Имеет низкий потенциал злоупотребления по сравнению с теми, которые указаны в списке 3. В настоящее время он признан в медицине для лечения в Соединенных Штатах. Злоупотребление может привести к ограниченной физической или психологической зависимости по сравнению с теми, которые указаны в Таблице 3. |
| 5 | Имеет низкий потенциал злоупотребления по сравнению с теми, что указаны в таблице 4. В настоящее время разрешено медицинское использование в лечении в Соединенных Штатах. Жестокое обращение может привести к ограниченной физической или психологической зависимости по сравнению с теми, которые указаны в таблице 4. |
| Спирт | |
|---|---|
| X | взаимодействует с алкоголем. |
Дополнительная информация
Всегда консультируйтесь со своим врачом, чтобы убедиться, что информация, отображаемая на этой странице, применима к вашим личным обстоятельствам.
Заявление об отказе от ответственности
Произошла ошибка при настройке вашего пользовательского файла cookie
Произошла ошибка при настройке вашего пользовательского файла cookieЭтот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie.Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie.Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу.Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта.Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Инъекционные антибактериальные проводящие нанокомпозитные криогели с быстрым восстановлением формы при несжимаемом кровотечении и заживлении ран
Синтез кватернизованного хитозана, функционализированного GMA. хитозан.1 г хитозана (J&K Chemical,
M n = 100 000–300 000 Да) суспендировали в 36 мл деионизированной воды, а затем к суспензии добавляли 180 мкл ледяной уксусной кислоты (Sigma-Aldrich). После перемешивания при 55 ° C в течение 30 минут к смеси хитозан-ледяная уксусная кислота при непрерывном перемешивании соответственно по каплям добавляли различные молярные отношения GTMAC (Sigma-Aldrich). Молярные отношения GTMAC к аминогруппам на остове хитозана варьировали от 1: 1 до 2: 1 и 3: 1, соответственно (дополнительная таблица 1).Реакционные смеси перемешивали при 55 ° C в течение 15 часов. Затем к вышеуказанным реакционным смесям добавляли по каплям GMA (Sigma-Aldrich) при непрерывном перемешивании при 55 ° C соответственно. Отношение GMA к аминогруппам в основной цепи из чистого хитозана было зафиксировано на уровне 0,5: 1,0, и реакцию проводили в течение еще 15 ч при 55 ° C в темноте (дополнительная таблица 1). После реакции нерастворенный полимер удаляли центрифугированием смеси при 5692 × g в течение 20 мин при комнатной температуре.Жидкий супернатант осаждали предварительно охлажденным ацетоном с получением сырого продукта. Для очистки продукта неочищенный продукт растворяли в деионизированной воде, а затем подвергали исчерпывающему диализу (MWCO 3500) против деионизированной воды в течение трех дней в темноте. Чистый продукт получали лиофилизацией. Степени четвертичного аминирования трех сополимеров QCSG определяли титрованием содержания иона хлора 27 . Химическая структура QCSG была подтверждена с помощью ЯМР 1 H (дополнительный рис.15) и ИК-Фурье (дополнительный рис. 2). Параметры синтезированных сополимеров QCSG перечислены в дополнительной таблице 1. Химическая структура QCSG подтверждена спектрами ЯМР 1 H (дополнительный рисунок 15) и FT-IR (дополнительный рисунок 2). Параметры синтезированных сополимеров QCSG приведены в дополнительной таблице 1.Синтез PF127 (PF127-DA), функционализированного диакрилатом
PF127-DA был получен акрилированием PF127 (полиэтиленгликоль) – b -poly (пропиленгликоль) – b -поли (этиленгликоль)) с использованием акрилоилхлорида согласно ссылке 13 .Объем 2,54 г (0,2 ммоль) PF127 (Sigma-Aldrich) и 0,061 г триэтиламина (J&K Chemical) (0,6 ммоль) растворяли в 20 мл безводного дихлорметана на ледяной бане, а затем дегазировали путем вливания азота в течение 20 мин. После этого 0,05 мл акрилоилхлорида (0,6 ммоль) медленно вводили в указанный выше раствор в атмосфере азота. Реакцию проводили при комнатной температуре в течение 24 ч. После реакции растворитель удаляли ротационным испарением, неочищенный продукт растворяли в деионизированной воде и подвергали исчерпывающему диализу (MWCO 3500) против деионизированной воды в течение трех дней.Чистый продукт получали лиофилизацией. Химическая структура PF127-DA была подтверждена спектрами -1 H ЯМР (дополнительный рис. 16) и FT-IR (дополнительный рис. 17).
Приготовление криогелей QCSG / CNT
Криогели были приготовлены путем криополимеризации водного раствора QCSG и водной дисперсии PF127-DA / CNT при -20 ° C с использованием APS / TEMED в качестве окислительно-восстановительной системы инициатора. Во-первых, многослойные УНТ (Nanjing XFNANO Materials Tech Co., диаметр, длина, проводимость и особая площадь поверхности УНТ составляют 10–20 нм, 10–30 мкм, ≥100 См / см и ≥200 м 2 / г соответственно) приготовили дисперсию 13 .Вкратце, равные массы CNT и PF127-DA добавляли в 8 мл деионизированной воды. Затем смесь обрабатывали ультразвуком на ледяной бане в течение 4 ч и еще 1 ч перед использованием. QCSG растворяли в деионизированной воде с образованием 5 мас.% Раствора QCSG. Объем 10 мл раствора QCSG был добавлен к вышеупомянутым растворам дисперсии УНТ или 8 мл деионизированной воды, соответственно, и затем достаточно перемешан. После этого 1 мл раствора APS (Sigma-Aldrich) (100 мг / мл) и 1 мл раствора TEMED (Sigma-Aldrich) (20 мкл / мл) были добавлены в смеси QCSG и QCSG / CNT (предварительно охлажденные в ледяная баня) и последовательно перемешивали на ледяной бане.После этого прекурсор криогеля переносили в цилиндрическую форму (диаметром 10 мм) и помещали в морозильную камеру при -20 ° C. Полимеризации давали возможность продолжаться в течение 18 ч, и полученные криогели оттаивали. Полученные криогели QCSG / CNT очищали погружением в деионизированную воду на семь дней для удаления непрореагировавшего полимера и свободных УНТ, и очищенные криогели QCSG / CNT не показали утечки УНТ (<0,1% УНТ) при дальнейшем погружении в деионизированную воду. В этом исследовании были приготовлены четыре криогеля с постоянной концентрацией QCSG 2,5% масс. И концентрацией УНТ от 0 до 2, 4 и 6 мг / мл, как показано в дополнительной таблице 2.
1 Тест на спектр ЯМР HСпектры QCSG и PF127-DA получали с использованием прибора Bruker Ascend 400 МГц с дейтероксидом и хлороформом-d в качестве растворителей и внутренних стандартов.
FTIR-анализ спектра
Спектры QCSG, PF127, PF127-DA, высушенного криогеля QCSG / CNT0 и высушенного криогеля QCSG / CNT2 были записаны в диапазоне 4000-650 см -1 с использованием Nicolet 6700 FT -ИК-спектрометр (Thermo Scientific Instrument).
Тест УФ-видимого спектра
Спектры супернатантов водной дисперсии УНТ, водной дисперсии PF127-DA / CNT и водной дисперсии PF127-DA / CNT / QCSG после помещения при комнатной температуре в течение 24 часов регистрировали с помощью спектрофотометра ( Lambda 35, PerkinElmer). Водная дисперсия УНТ и водная дисперсия PF127-DA / CNT были приготовлены обработкой ультразвуком смеси УНТ / ДИ-вода и смеси PF127 / УНТ / ДИ-вода на ледяной бане в течение 4 часов соответственно. Водная дисперсия PF127-DA / CNT / QCSG была приготовлена путем тонкого смешивания водной дисперсии PF127-DA / CNT и раствора QCSG.Три водные дисперсии имели одинаковую концентрацию УНТ 2 мг / мл, в то время как QCSG составлял 12,5 мг / мл.
Наблюдение морфологии с помощью растрового электронного микроскопа (SEM)
Морфологии лиофилизированных криогелей (включая состояние без формы, состояние с фиксированной формой и восстановленную форму из состояния с фиксированной формой) наблюдали с помощью сканирующего электронного микроскопа с полевой эмиссией. (FEI Quanta FEG 250). Перед наблюдением поверхность криогелей была покрыта слоем золота.
Тест на коэффициент набухания
Криогели, уравновешенные деионизированной водой при комнатной температуре, сначала взвешивали ( W, E ).Затем их лиофилизировали и снова взвешивали ( W O ). Коэффициент набухания (SR) был рассчитан как:
$$ {\ mathrm {SR =}} \ left ({{{W}} _ {\ mathrm {E}} {{- W}} _ {\ mathrm { O}}} \ right) {{/ W}} _ {\ mathrm {O}} {\ mathrm {\ times 100 \%}} $$
(1)
Кривая проводимости и импеданса криогеля
Сопротивление криогелей как в набухшем, так и в лиофилизированном состоянии измерялось цифровым 4-зондовым тестером Agilent B2900A с током 1 мА и линейной головкой зонда (1.0 мм). Все криогели промывали деионизированной водой для удаления инициатора и непрореагировавшего полимера. Электропроводность криогелей можно рассчитать по формуле:
$$ {\ it {\ sigma}} {\ mathrm {= 1 / \ rho}} $$
(2)
, где ρ – сопротивление, а σ – проводимость. Каждый образец был измерен при небольшой деформации сжатия, и были взяты средние результаты трех значений, измеренных при положительном токе, и трех данных, полученных при отрицательном токе.Кроме того, кривые импеданса высушенного криогеля QCSG / CNT4 и высушенного криогеля QCSG / CNT0 были выполнены с использованием электрохимической рабочей станции (электрохимический анализатор CHI660E) с частотой от 10 2 до 10 6 Гц.
Рентгеновское обнаружение криогеля
Гемостатический нанокомпозитный криогель, определяемый рентгеновскими лучами, был приготовлен путем приклеивания линии, определяемой рентгеновским излучением, к поверхности криогеля. Затем анализ Micro-CT был выполнен на системе трехмерной микрофокусной рентгеновской микрокомпьютерной томографии (Y.CHEETAH *, YXLON) для подтверждения возможности рентгеновского обнаружения линии, определяемой рентгеновскими лучами, содержала гемостатический нанокомпозитный криогель. Нанокомпозитный криогель без линии, определяемой рентгеновскими лучами, использовали в качестве контроля.
Инжекция криогеля
Криогели были приготовлены с диаметром произвольной формы 5 мм. Затем форма криогелей была зафиксирована путем удаления свободной воды из матрицы криогелей. После этого криогели фиксированной формы загружались в инжектор (с внутренним диаметром затупленного сопла 1 мкм).5 мм), а криогели закачивали в воду для восстановления их формы. Процессы инъекции записывались на видео и фотографировались.
Реологические свойства криогеля
Реологические испытания проводили с использованием реометра TA (DHR-2) двумя разными методами. Криогели были нарезаны на диски диаметром 12 мм. Эксперименты с частотой колебаний проводились при постоянной деформации 1% и изменении скорости сдвига от 0,1 до 100 рад / с при 25 ° C.Испытания на изменение амплитуды деформации ( γ = 0,01% -100%) криогелей (диаметром 12 мм) также были выполнены с использованием постоянной частоты 10 рад / с при 25 ° C.
Анализ минимальной ингибирующей концентрации сополимеров
МИК сополимеров для E. coli (ATCC 8739) и S. aureus (ATCC 29213) оценивали в соответствии с нашим предыдущим отчетом 27 . Вкратце, сополимеры растворяли в деионизированной воде, а затем разбавляли бульоном MH, используя метод двукратного разбавления.100 мкл бактериальной суспензии (10 4 –10 5 КОЕ мл -1 ) добавляли в 96-луночный планшет с серией 100 мкл растворов бульона сополимеров MH с двукратным разведением и затем гомогенно перемешивали пипетированием. После этого 96-луночный прозрачный планшет (Costar) помещали в инкубатор при 37 ° C на 18 часов. Бульон MH без инокулята использовали в качестве отрицательного контроля, а бульон MH с инокулятом служил в качестве положительного контроля. По окончании времени оптическую плотность растворов в 96-луночном планшете считывали с помощью считывающего устройства для микропланшетов (Molecular Devices) при 600 нм.МИК сополимеров были определены как минимальные концентрации, которые подавляли рост бактерий более чем на 90%.
Механические свойства криогелей
Механические свойства криогелей оценивали с помощью испытания на сжатие и испытания на циклическое сжатие с использованием реометра TA (DHR-2) при комнатной температуре. Образец криогеля был изготовлен цилиндрической формы высотой 10 мм и диаметром 8 мм. Максимальная деформация сжатия 93% была выбрана для проведения испытания на деформацию сжатия со скоростью деформации 100 мкм / с.Для испытания на циклическое сжатие каплю воды добавляли вокруг образца криогеля на платформе перед испытанием, а также прикладывали деформацию сжатия 40%, 60% и 80% для выполнения испытания на циклическое сжатие. Деформацию сжатия сначала выполняли до заданной деформации, а затем снижали до деформации 0% с постоянной скоростью деформации сжатия и высвобождения 100 мкм / с, которые повторялись 10 раз. Кроме того, было проведено испытание на циклическое сжатие криогеля QCSG / CNT0 и криогеля QCSG / CNT4 в течение 100 циклов с деформацией сжатия до 80% при скорости деформации 100 мкм / с, а затем испытанный QCSG / CNT4 был дополнительно погружен в Деионизированная вода при 37 ° C со скоростью встряхивания 100 об / мин в течение еще 24 часов.Диффузная УНТ была определена с помощью UV-vis 13 .
При инъекции или имплантации криогеля в место кровотечения или рану криогель будет выдерживать постоянную и динамическую силовую нагрузку. Чтобы оценить стабильность УНТ криогеля при непрерывном и динамическом сжатии, мы провели два теста для моделирования ситуаций применения in vivo. Сначала мы пропитали криогель QCSG / CNT4 (высотой 10 мм и диаметром 8 мм) в 3 мл деионизированной воды, а затем провели испытание на динамическое сжатие с деформацией сжатия до 50% при скорости деформации 50 мкм / с. на 6 ч.После испытания высвободившиеся УНТ в деионизированной воде определяли с помощью УФ-видимости 13 . Кроме того, испытанный криогель QCSG / CNT4 также был погружен в 3 мл деионизированной воды при 37 ° C со скоростью встряхивания 100 об / мин еще на 24 часа, а затем высвободившиеся CNT также определялись с помощью УФ-видимой области.
Поведение криогелей с памятью формы
Свойства памяти формы криогелей оценивали в соответствии с ссылкой 13 . Свежеприготовленный криогель (с начальной длиной 10 мм ( L 1 )) прессовали до деформации 80% при скорости деформации 100 мкм / с, а затем выдерживали при этой деформации в течение 1 мин.Затем вода, выдавленная из криогеля, полностью абсорбировалась бумагой, и измеренная длина в сжатом состоянии была установлена как L 2 . После этого образец был свободен от какой-либо нагрузки в течение 5 минут, фиксированная измеренная длина была измерена как L 3 . Затем образец замачивали в воде для регидратации в течение 1 мин, и измеренная длина извлечения составила L 4 . Испытание проводили с использованием реометра ТА. L 2 были измерены прибором автоматически, а L 1 , L 3 и L 4 были точно измерены вручную с помощью программного обеспечения реометра для регулировки расстояния зазора.Тест повторялся пять раз. Коэффициент фиксации памяти формы и коэффициент восстановления были рассчитаны по следующим уравнениям:
$$ {\ mathrm {Maximum}} \; {\ mathrm {compressive}} \; {\ mathrm {stretch:}} \; \ varepsilon _ {\ mathrm {m}} \, {\ mathrm {=}} \, \ left ({{{L}} _ {\ mathrm {1}} {{- L}} _ {\ mathrm {2}}} \ right) {{/ L}} _ {\ mathrm {1}} \ times {\ mathrm {100 \%}} $$
(3)
$$ {\ mathrm {Fixed}} \; {\ mathrm {напряжения:}} \; \ varepsilon _ {\ mathrm {u}} \, {\ mathrm {=}} \, \ left ({{{ L}} _ {\ mathrm {1}} {{- L}} _ {\ mathrm {3}}} \ right) {{/ L}} _ {\ mathrm {1}} \ times {\ mathrm {100 \%}} $$
(4)
$$ {\ mathrm {Recovery}} \; {\ mathrm {напряжения:}} \; \ varepsilon _ {\ mathrm {p}} \, {\ mathrm {=}} \, \ left ({{{ L}} _ {\ mathrm {4}} {{- L}} _ {\ mathrm {3}}} \ right) {{/ L}} _ {\ mathrm {1}} \ times {\ mathrm {100 \%}} $$
(5)
$$ {\ mathrm {Strain}} \; {\ mathrm {fixity}} \; {\ mathrm {ratio:}} \; {{R}} _ {\ mathrm {f}} \, {\ mathrm {=}} \, \ varepsilon _ {\ mathrm {u}} {\ mathrm {/}} \ varepsilon _ {\ mathrm {m}} \ times {\ mathrm {100 \%}} $$
(6)
$$ {\ mathrm {Strain}} \; {\ mathrm {recovery}} \; {\ mathrm {ratio}} \; \, {\ mathrm {=}} \, \ varepsilon _ {\ mathrm {p }} {\ mathrm {/}} \ varepsilon _ {\ mathrm {u}} \ times 100 \% \ = \ (L_4-L_3) {\ mathrm {/}} (L_1-L_3) \ times100 \%.$
(7)
Объемные степени расширения криогелей
Перед фиксацией формы криогеля были протестированы диаметр ( D 1 ) и длина ( L 1 ) столбчатого криогеля. После этого свободную воду из столбчатого криогеля отжимали, чтобы получить криогель фиксированной формы. Затем дополнительно определяли диаметр ( D 2 ) и длину ( L 2 ) криогеля фиксированной формы.2 \ times L2}} $$
(8)
Анализ гемолитической активности криогелей
Для анализа гемолитической активности эритроциты получали центрифугированием (при 116 × g ) мышиной крови в течение 10 минут. DPBS использовали для трехкратной промывки полученных эритроцитов, а затем очищенные эритроциты дополнительно разбавляли до конечной концентрации 5% (об. / Об.). После этого высушенный криогель измельчали до гомогената с помощью измельчителя тканей и четырех жидкостей для диспергирования криогеля (с концентрацией от 5 до 2.5, 1,25 и 0,625 мг / мл). 0,5 мл жидкой дисперсии криогеля и 500 мкл суспензии эритроцитов (5% (об. / Об.)) Добавляли в пробирку объемом 2 мл, а затем осторожно перемешивали пипеткой. После помещения при 37 ° C на 1 час все образцы центрифугировали при 116 × g в течение 10 минут. Объем 500 мкл супернатантов осторожно переносили в новые пробирки, соответственно, а затем супернатанты дополнительно центрифугировали при 11617 × g в течение 10 мин, позволяя полностью удалить частицы криогеля.Полученные супернатанты переносили в новый 96-луночный прозрачный планшет. Оптическую плотность растворов при 540 нм считывали с помощью считывающего устройства для микропланшетов (Molecular Devices). 0,1% Triton X-100 служил положительным контролем, а DPBS служил отрицательным контролем. Процент гемолиза криогелей рассчитывали по формуле:
$$ {\ mathrm {Hemolysis}} \; \ left ({\ mathrm {\%}} \ right) {\ mathrm {=}} \ left [{ \ left ({{\ mathrm {Ap-Ab}}} \ right) {\ mathrm {/}} \ left ({{\ mathrm {At-Ab}}} \ right)} \ right] {\ mathrm {\ умножить на 100 \%}} $$
(9)
, где Ap было значением поглощения супернатанта из групп криогеля, At было значением поглощения положительного контроля Triton X-100 и Ab было значением поглощения DPBS.В каждой группе по три повтора.
Тест на цитотоксичность криогелей
Цитотоксичность криогелей на клетке L929 (ATCC CCL-1, клетка L929 была приобретена в Шанхайском банке клеток Китайской академии наук) оценивалась с использованием двух методов, включая схему выщелачивания и тест прямого контакта между криогелем и клетками. Криогель разрезали на диски диаметром 8 мм и толщиной 5 мм и стерилизовали погружением в 75% спирт. Среда Игла, модифицированная Дульбекко (DMEM) (Gibco) с добавлением 10% фетальной бычьей сыворотки (Gibco), 1.0 × 10 5 Ед / л пенициллина (Hyclone) и 100 мг / л стрептомицина (Hyclone) использовали в качестве полной питательной среды. Клетки L929 высевали в 48-луночный планшет при плотности 25000 клеток / лунку. После культивирования в течение 24 часов диски криогеля, уравновешенные полной средой для выращивания, вводили в лунки, и уровень культуральной среды был немного ниже, чем верхняя поверхность криогеля, за счет удаления избытка среды, чтобы обеспечить тонкий контакт между клеткой и криогелем. Жизнеспособность клеток под криогелем оценивали с помощью анализа alamarBlue ® и анализа LIVE / DEAD ® Viability / Cytotoxicity Kit после культивирования в течение 24 часов.Диски криогеля и среду удаляли и затем в каждую лунку добавляли 20 мкл реагента alamarBlue ® в 200 мкл полной ростовой среды. Планшет инкубировали в течение 4 ч в увлажненном инкубаторе, содержащем 5% CO 2 при 37 ° C. После этого по 100 мкл среды из каждой лунки переносили в 96-луночный черный планшет (Costar). Флуоресценцию считывали с использованием 560 нм в качестве длины волны возбуждения и 600 нм в качестве длины волны излучения с использованием считывающего устройства для микропланшетов (Molecular Devices) в соответствии с инструкциями производителя.Клетки, засеянные на TCP без диска криогеля, служили группой положительного контроля. Тесты повторяли четыре раза для каждой группы. Адгезию и жизнеспособность клеток наблюдали под инвертированным флуоресцентным микроскопом (IX53, Olympus). Жизнеспособность клеток оценивали с помощью анализа alamarBlue ® после культивирования в течение 24 часов.
Для анализа модели выщелачивания стерилизованные растворы экстракта криогеля с массой криогеля варьировали от 20 до 15, 10 и 5 мг / мл в культуральной среде путем погружения высушенных криогелей в среду на 24 часа при 37 ° C. при скорости встряхивания 100 об / мин.Клетки L929 высевали в 96-луночный планшет при плотности 10000 клеток / лунку и предварительно культивировали в течение 24 часов перед заменой культуральной среды свежей средой, содержащей серию различных концентраций растворов экстракта криогеля. После культивирования в течение 24 часов жизнеспособность клеток оценивали с помощью анализа alamarBlue ® . Среду удаляли и затем в каждую лунку добавляли 10 мкл реагента alamarBlue ® в 100 мкл полной ростовой среды. Планшет инкубировали в течение 4 ч в увлажненном инкубаторе, содержащем 5% CO 2 при 37 ° C.После этого по 100 мкл среды из каждой лунки переносили в 96-луночный черный планшет (Costar). Флуоресценцию считывали с использованием 560 нм в качестве длины волны возбуждения и 600 нм в качестве длины волны излучения с использованием считывающего устройства для микропланшетов (Molecular Devices) в соответствии с инструкциями производителя. Клетки, засеянные на TCP без раствора экстракта, служили группой положительного контроля. Тесты повторяли четыре раза для каждой группы.
Свертывание цельной крови криогелей
Свертывание цельной крови криогелей проверяли в соответствии с литературными данными 4,54 .Криогель был разрезан на цилиндрический криогель высотой 5 мм и диаметром 8 мм, а затем цилиндрические криогели были сформированы в положение фиксированной формы. Объем 50 мкл рекальцифицированного раствора цельной крови (0,2 М CaCl 2 , 10 мМ в крови) добавляли в предварительно нагретые криогели (37 ° C) в полипропиленовых пробирках соответственно. Затем пробирку инкубировали при 37 ° C в течение 30 с, 60 с, 90 с, 120 с и 150 с соответственно. Марля и желатиновая гемостатическая губка использовали в качестве контрольных групп.По истечении заданного периода осторожно добавляли 10 мл деионизированной воды для высвобождения несвязанной крови без нарушения сгустка. Оптическую плотность супернатанта регистрировали при 540 нм с использованием считывающего устройства для микропланшетов (Molecular Devices). Было выполнено от трех до пяти повторов. Поглощение 50 мкл рекальцифицированной цельной крови в 10 мл деионизированной воды использовали в качестве контрольного значения (отрицательный контроль). Индекс свертываемости крови (BCI) был рассчитан по формуле:
$$ {\ mathrm {BCI}} \; \ left ({\ mathrm {\%}} \ right) {\ mathrm {=}} \ left [ {\ left ({{{I}} _ {\ mathrm {s}} {{- I}} _ {\ mathrm {o}}} \ right) {\ mathrm {/}} \ left ({{{I }} _ {\ mathrm {r}} {{- I}} _ {\ mathrm {o}}} \ right)} \ right] {\ mathrm {\ times 100 \%}} $$
(10)
, где I s представляет оптическую плотность образца, а I r представляет оптическую плотность контрольного значения.
Адгезия клеток крови и тромбоцитов на криогелях
Анализ адгезии клеток крови и тромбоцитов выполняли в соответствии с ссылкой 52 . Образец криогеля разрезали на диски высотой 5 мм и диаметром 8 мм, которые затем погружали в DPBS на 1 ч при 37 ° C. После этого ACD-цельную кровь по каплям вводили на диски криогеля и помещали при 37 ° C на 5 мин. Богатую тромбоцитами плазму (PRP) получали центрифугированием ACD-цельной крови при 116 × g в течение 10 мин.Затем PRP по каплям вводили на диски криогеля и выдерживали при 37 ° C на 1 час. По окончании времени все тестовые образцы трижды промывали DPBS для удаления физически прикрепленных клеток крови и тромбоцитов. Затем образцы фиксировали 2,5% глутаровым альдегидом еще в течение 2 ч. После этого клетки крови и тромбоциты в образцах постепенно дегидратировали с использованием 50%, 60%, 70%, 80%, 90% и 100% раствора этанола с интервалом времени 10 мин. Высушенные образцы наблюдали с помощью SEM.
Фототермический эффект криогелей
Для выяснения фототермического эффекта криогелей свежеприготовленный криогель разрезали на диски (диаметром 8 мм и высотой 5 мм), а затем подвергали облучению лазером NIR (MDL -III-808нм-1000 мВт, Changchun New Industries Optoelectronics Tech Co., Ltd.) при плотности мощности 1,4 Вт / см 2 в течение 20 мин. Тепловые карты и температурные профили криогелей регистрировались с помощью инфракрасной (ИК) тепловой камеры. Кроме того, были записаны тепловые карты и температурные профили QCSG / CNT4 при плотности мощности от 0.От 6 до 0,9, 1,1 и 1,4 Вт / см 2 соответственно.
Поведение ибупрофена в ответ на стимул в ближнем ИК-диапазоне
Чтобы инкапсулировать ибупрофен в QCSG / CNT0 и QCSG / CNT4, 2 мг ибупрофена добавляли в 0,4 мл DPBS или 0,4 мл DPBS, содержащие 4 мг CNT и 4 мг PF127-DA соответственно. Затем смесь обрабатывали ультразвуком на ледяной бане в течение 4 часов. 0,5 мл 5 мас.% Раствора QCSG добавляли к вышеуказанным 0,4 мл дисперсии PF127-DA / CNT / ибупрофен DPBS или 0,4 мл дисперсии ибупрофена DPBS, соответственно, а затем перемешивали в достаточной степени.После этого в смеси QCSG или QCSG / CNT (предварительно охлажденные на ледяной бане) добавляли 50 мкл персульфата аммония (APS) (100 мг / мл) и 50 мкл тетраметилэтилендиамина (TEMED) (20 мкл / мл) и последовательно перемешивают на ледяной бане. Затем прекурсор криогеля переносили в цилиндрическую форму (диаметром 10 мм) и помещали в морозильную камеру с температурой –20 ° C. После реакции в течение 18 ч полученные криогели QCSG / CNT0 и QCSG / CNT4, нагруженные ибупрофеном, размораживали для испытания с контролируемым высвобождением лекарственного средства. Препарат загружали криогелями (500 мкл) в пробирки по 1.4 мл DPBS (pH = 7,4, 0,01 M) помещали при 37 o ° C со скоростью встряхивания 100 об / мин для получения профилей спонтанного высвобождения лекарственного средства. Для инициируемого NIR высвобождения ибупрофена из QCSG / CNT4 криогели (500 мкл) в пробирках с 1,4 мл DPBS (pH = 7,4, 0,01 M) облучали светом 808 нм NIR (1,4 Вт / см 2 ) в течение период 10 мин. Криогели без ибупрофена использовали в качестве холостого контроля. Через заранее определенные интервалы времени для дальнейшего анализа отбирали 1 мл буфера для высвобождения.Затем в пробирки добавляли 1 мл свежего буфера для поддержания постоянного объема. Концентрации лекарств анализировали с помощью спектрофотометра УФ-видимого диапазона (PerkinElmer Lambda 35). λ max ибупрофена составляло 264 нм.
Антибактериальный тест криогелей с усиленным БИК-излучением
Криогельные диски QCSG / CNT4 (диаметром 8 мм и толщиной около 5 мм) стерилизовали путем погружения образцов в 75% спирт, а затем уравновешивали стерилизованным фосфатом Дульбекко. забуференный физиологический раствор (DPBS).Объем 10 мкл бактериальной суспензии в стерилизованном DPBS (10 8 КОЕ мл -1 ) добавляли на поверхность набухших дисков криогеля (QCSG / CNT0 и QCSG / CNT4). Затем криогель подвергали воздействию лазерного света NIR (808 нм, 1,4 Вт / см 2 ) в течение различных периодов времени от 0 до 1, 3, 5, 10 и 20 минут соответственно. Объем 10 мкл бактериальной суспензии (10 8 КОЕ мл -1 ), суспендированный в 200 мкл DPBS, использовали в качестве отрицательного контроля, который также подвергали воздействию лазерного света NIR (808 нм, 1,1 мкм).4 Вт / см 2 ). После того, как все группы контактировали с бактериями в течение 20 минут, в каждую лунку добавляли 1 мл стерилизованного DPBS для повторного суспендирования любых выживших бактерий. Затем 10 мкл вышеупомянутой ресуспензии выживших бактерий добавляли на чашку с агаром, колониеобразующие единицы на чашке с агаром подсчитывали после инкубирования в течение 18-24 часов при 37 ° C. Тесты были повторены трижды для каждой группы, и результаты были выражены в виде log 10 КОЕ с использованием уравнения:
$$ {\ mathrm {Log}} \; {\ mathrm {Reduction}} = {\ mathrm {Log}} \ ; {\ mathrm {cell}} \; {\ mathrm {count}} \; {\ mathrm {of}} \; {\ mathrm {control}} – {\ mathrm {Log}} \; {\ mathrm {выживший }} \; {\ mathrm {count}} \; {\ mathrm {on}} \; {\ mathrm {cryogel}}.$
(11)
Гемостатическое действие криогелей in vivo
Гемостатическую способность криогелей оценивали как на модели травмы печени мыши 43 , так и на модели ампутации хвоста мыши 54 . Все исследования на животных были одобрены комитетом по исследованиям на животных Сианьского университета Цзяотун. Для модели травмы печени мышей (мыши Kunming, возраст 5-6 недель, вес 32-38 г, самки) случайным образом и поровну делили на семь групп.Животных анестезировали путем инъекции 10 мас.% Хлоралгидрата и фиксировали на хирургической пробковой доске. Печень мыши обнажали разрезом брюшной полости, и серозная жидкость вокруг печени была осторожно удалена для предотвращения неточностей в оценке массы крови, полученной с помощью гемостатических образцов. Предварительно взвешенную фильтровальную бумагу на парафиновой пленке помещали под печень. Кровотечение из печени вызывали с помощью иглы 16 G с наклоном пробковой доски примерно на 30 °. Предварительно взвешенная марля, желатиновая гемостатическая губка и криогели фиксированной формы были немедленно нанесены на место кровотечения соответственно.Никакого лечения после укола печени не использовали в качестве контрольной группы. Данные о времени кровотечения и кровопотере регистрировались во время гемостатического процесса. В каждой группе по десять мышей.
Для модели ампутации хвоста мыши мышей (мышей Kunming, возраст 5-6 недель, вес 32-38 г, самки) случайным образом и поровну делили на семь групп. Животных анестезировали путем инъекции 10 мас.% Хлоралгидрата (0,3 мл на 100 г веса животного) и фиксировали на хирургической пробковой доске. Хвост на пятьдесят процентов отрезали хирургическими ножницами.После разрезания хвост мыши помещали в воздух на 15 с для обеспечения нормальной кровопотери. Затем рану закрывали предварительно утяжеленной марлей, кровоостанавливающей губкой и криогелями фиксированной формы под небольшим давлением. Данные о времени кровотечения и кровопотере регистрировались во время гемостатического процесса. Рану без обработки использовали в качестве контрольной группы. В каждой группе по десять мышей.
In vivo испытание на гемостаз с летальным несжимаемым кровотечением
Дефект объема печени новозеландского белого кролика использовали в качестве модели летального несжимаемого кровотечения для оценки гемостатической способности криогелей.Криогель фиксированной формы вводили в отверстие дефекта печени, чтобы быстро остановить кровотечение и затем вызвать гемостаз. Форма стерилизованных криогелей (диаметром 8 мм и высотой 8 мм) фиксировалась, как описано в разделе 2.6, а диаметр криогелей фиксированной формы составлял 4 мм. Затем криогель фиксированной формы загружали в шприц (с внутренним диаметром 4 мм и внешним диаметром 5 мм) для дальнейшей инъекции in vivo. В качестве контрольных групп использовали два типа желатиновых гемостатических губок (высотой 8 мм и диаметром 4 мм и 6 мм соответственно).Новозеландских белых кроликов (самцы, ~ 2,5 кг) случайным образом делили поровну на пять групп. Животных фиксировали на хирургической пробковой доске, а затем вводили 10% хлоралгидрат в кишечник кроликов для их обезболивания (0,5 мл на 100 г). После этого кролику сделали разрез брюшной полости, чтобы обнажить печень, осторожно удалили серозную жидкость вокруг печени, а затем в правой доле удалили столбчатый дефект объема печени (диаметром 5 мм и высотой 5 мм). игла для биопсии (внутренний диаметр 5 мм) и хирургические ножницы.Оставляли свободное кровотечение в течение 30 с, а затем немедленно вводили криогель в отверстие дефекта или немедленно вставляли желатиновую гемостатическую губку в отверстие дефекта. Во время гемостатического процесса взвешенная марля использовалась для впитывания текущей крови. Соответственно регистрировали время гемостаза, кровопотерю и состояние жизни. Каждую группу повторяли пять раз. Эксперименты на животных были одобрены комитетом по исследованиям на животных Сианьского университета Цзяотун.
Гемостатический тест на стандартизированной модели кровотечения из печени
Форму стерилизованных криогелей (диаметром 12 мм и высотой 8 мм) фиксировали путем сжатия и удаления свободной воды.Диаметр криогелей фиксированной формы составлял около 16 мм. Тридцать два слоя боевой марли диаметром около 8 мм использовались в качестве контрольной группы. Новозеландских белых кроликов (самцы, ~ 2,5 кг) случайным образом делили поровну на четыре группы. Животных фиксировали на хирургической пробковой доске, а затем вводили 10% хлоралгидрат в кишечник кроликов для их обезболивания (0,5 мл на 100 г). После этого кролику сделали разрез брюшной полости, чтобы обнажить печень, и осторожно удалили серозную жидкость вокруг печени.Пластиковый диск (диаметром 12 мм) с биологическим клеем был приклеен к правой доле кролика, а затем в правой доле вырезан круговой поверхностный дефект (диаметром 12 мм) путем разрезания печени по внутренней стороне. диска. Гемостатические средства сразу наносили на дефект с легким давлением в течение 15 мин после создания дефекта поверхности печени. После выступления соответствующим образом фиксировали кровопотерю. Группа без какого-либо лечения использовалась как пустая группа.В каждой группе по шесть кроликов. Эксперименты на животных были одобрены комитетом по исследованиям на животных Сианьского университета Цзяотун.
Тест на заживление ран in vivo
Эксперименты на животных были одобрены комитетом по исследованиям на животных Сианьского университета Цзяотун. Для исследований использовали мышей весом 32–38 г и возрастом 5–6 недель, которые случайным образом и поровну разделили на три группы. Перед операционными группами мышей акклиматизировали в течение одной недели. Что касается хирургической части, все процедуры проводились в асептических условиях.После стандартной процедуры анестезии с внутрибрюшинной инъекцией хлоралгидрата (0,3 мг / кг веса тела) спина мыши выше хвоста, но ниже спины была выбрита для подготовки к операции. По обе стороны от средней линии были созданы две полные раны диаметром 6 мм. Одна группа была одета в прозрачную пленочную повязку в стиле рамы (3 M Health Care, США) и QCSG / CNT0 + Transparent Film Dressing, одна группа была одета в прозрачную пленочную повязку и QCSG / CNT4 + Transparent Film Dressing, а другая группа была одета. by QCSG / CNT0 криогель + прозрачная пленочная повязка и криогель QCSG / CNT4 + прозрачная пленочная повязка.В каждой группе было по пять мышей. Для мониторинга площади раны на 5-й, 10-й и 15-й день мышам выполняли стандартную процедуру анестезии с внутрибрюшинной инъекцией хлоралгидрата, затем измеряли площадь раны, отслеживая границы раны на бумаге для печати.
Регенерация раны (%) рассчитывалась по формуле:
$$ {\ mathrm {Wound}} \; {\ mathrm {contction = (area}} \; {\ mathrm {(0}} \; {\ mathrm {день) – площадь}} \; \ left ({{{n}} \; {\ mathrm {день}}} \ right) {\ mathrm {) / (площадь}} \; {\ mathrm {(0 }} \; {\ mathrm {день)) \ times 100 \%}} $$
(12)
Гистологический анализ
Для оценки регенерации эпидермиса и воспаления в области раны образцы, собранные на 5, 10 и 15 день, фиксировали 4% параформальдегидом в течение 1 часа, затем заливали парафином и делали поперечные срезы на срезы толщиной 40 мкм. , а затем окрашивали гематоксилин-эозином (Beyotime, Китай).Все срезы были проанализированы и сфотографированы под микроскопом (IX53, Olympus, Япония).
Оценка реакции хозяина на криогели in vivo
Оценка реакции хозяина на криогели in vivo была проведена, как мы ранее сообщали 67 . Все процедуры экспериментов на животных выполнялись в соответствии с руководящими принципами, установленными комитетом по исследованиям на животных Сианьского университета Цзяотун. Перед имплантацией все материалы были нарезаны одинаковой формы и размера (диаметр 8 мм и высота 2 мм), стерилизованы 75% этанолом и промыты в фосфатно-солевом буфере (PBS) в течение ночи.Самок крыс Sprague Dawley (вес 200-250 г, 7-8 недель), как правило, анестезировали и делали небольшой разрез на той же области на спине каждой крысы. Предметы для тестирования вводили подкожно в разрез, и кожу закрывали после размещения. Крысы вернулись в свою клетку и получили свободный доступ к пище и воде после того, как оправились от анестезии. После операции в течение 7 дней и 30 дней животных умерщвляли и имплантированные материалы вырезали вместе с прилегающими тканями.После иссечения соединения материал-ткань заливали парафином, делали срезы (3 мкм) и наносили на предметные стекла. Острый воспалительный ответ и хронический воспалительный ответ оценивали как по окрашиванию гематоксилином и эозином (H&E), так и по окрашиванию толуидиновым синим (TB). После окрашивания предметные стекла наблюдали под микроскопом, а изображения анализировали с помощью программного обеспечения Image Pro Plus.
Статистический анализ
Экспериментальные данные были проанализированы с использованием теста Стьюдента t . P Значение <0,05 считалось статистически значимым. Результаты выражены как среднее ± стандартная ошибка (s.e.m) для исследований на животных, тогда как другие результаты выражены как среднее ± стандартное отклонение (s.d.) 62 . Размер выборки для исследований на животных был подтвержден программным обеспечением Gpower3 с использованием апостериорного анализа мощности для двустороннего теста t 68,69 . Индекс величины эффекта рассчитывался по формуле:
$$ d = \ frac {| \ mu 1 – \ mu 2 |}} {{\ sqrt {0.2)}}} $$
(13)
, что сделало мощность (вероятность ошибки 1- β ) ≥ 0,8 для размера выборки 10 в гемостатических экспериментах на мышах, для размера выборки пяти в гемостатических экспериментах на кроликах и для размера выборки пяти в экспериментах по заживлению ран. Для гемостатических экспериментов на мышах средние кровопотери составляли µ 1 и µ 2 из группы мышей, обработанной QCSG / CNT2, и группы мышей, обработанной QCSG / CNT6, и σ 1 и σ 2 были стандартными отклонениями от этих значений. из групп печени мышей, обработанных QCSG / CNT2 и QCSG / CNT6, соответственно.Для гемостатических экспериментов на кроликах средние кровопотери составляли µ 1 и µ 2 в группе кроличьей печени, обработанной желатиновой губкой D2, и в группе кроличьей печени, обработанной QCSG / CNT0, и σ 1 и σ 2 были стандартными отклонениями от этих значений. из групп кроликов, обработанных желатиновой губкой D2 и QCSG / CNT0, соответственно. Для экспериментов по заживлению ран на мышах средний процент сокращения ран составлял µ 1 и µ 2 из группы мышей, обработанных QCSG / CNT0, и группы мышей, обработанных QCSG / CNT4, кожных ран, и σ 1 и σ 2 были стандартные отклонения для групп мышей, обработанных QCSG / CNT0 и QCSG / CNT4, с кожными ранами соответственно.
Доступность данных
Данные, подтверждающие выводы этого исследования, доступны у соответствующего автора по разумному запросу.
Гемостатические и гемодинамические эффекты адреналина во время эндоскопической хирургии носовых пазух: рандомизированное клиническое испытание | Анестезиология | JAMA Отоларингология – хирургия головы и шеи
Цель Оценить гемодинамический и гемостатический эффекты 2-х различных концентраций адреналина в местном анестетике, используемого во время функциональной эндоскопической хирургии носовых пазух (FESS).Введение местного анестетика, содержащего адреналин, во время эндоскопической хирургии носовых пазух, обеспечивая гемостаз, было связано с сердечными побочными эффектами, такими как тахикардия, гипертония, а также аритмии.
Дизайн Двойное слепое рандомизированное клиническое исследование.
Настройка Третичный справочный центр.
Пациенты В общей сложности 140 пациентов, проходящих FESS, случайным образом разделены на 2 группы: группа 1 получала лидокаина гидрохлорид, 2%, с 1: 100 000 адреналина, и группа 2, лидокаин, 2%, с 1: 200 000 адреналина.
Основные показатели результатов Исходные и постинъекционные гемодинамические параметры регистрировались с 1-минутными интервалами в течение 5 минут. Демографические данные пациентов, объем хирургического вмешательства и наличие полипов регистрировались в обеих группах. Сравнивались гемодинамические и гемостатические параметры и интраоперационная кровопотеря.
Результаты Значительные колебания гемодинамики были отмечены после инъекции лидокаина, 2%, с адреналином 1: 100 000 (группа 1).У пациентов 1-й группы отмечалось повышение ЧСС, систолического, диастолического и среднего артериального давления. Было обнаружено, что увеличение было значительным ( P <0,001) в первую и вторую минуты после инъекции и снизилось до исходного уровня к пятой минуте. У пациентов 2-й группы, получавших 2% лидокаин с адреналином 1: 200 000, этого колебания не отмечалось. При использовании стандартизированной шкалы для оценки хирургического кровотечения статистической разницы в 2 группах не наблюдалось ( P >.05).
Заключение Подслизистая инъекция лидокаина, 2%, с адреналином 1: 200 000 во время FESS не приводит к колебаниям гемодинамики или увеличению интраоперационного кровотечения по сравнению с лидокаином, 2%, с адреналином 1: 100 000.
Регистрация пробной версии Clinicaltrials.gov Идентификатор: NCT00852410
С тех пор, как в начале 1970-х годов была разработана функциональная эндоскопическая хирургия носовых пазух (FESS), этот малоинвазивный метод завоевывает все большую популярность среди отоларингологов. 1 , 2 Цель этой операции – очистить воздушные клетки от болезней и улучшить вентиляцию придаточных пазух носа, тем самым уменьшая тяжесть и частоту инфекций. 1 , 2 Основными ограничивающими факторами для эндоскопических доступов к околоносовым пазухам и основанию черепа являются его сложная анатомия и высокая васкуляризация. 1 , 2 Часто легкого кровоизлияния достаточно, чтобы резко ухудшить видимость, создавая плохое операционное поле.Это особенно проблематично у пациентов с тяжелыми инфекциями и обширным полипозом носа. Таким образом, получение адекватного гемостаза имеет первостепенное значение во время операции для улучшения операционного поля и предотвращения осложнений.
Неясен идеальный способ получения сужения сосудов во время FESS. Сужение сосудов обычно достигается путем сочетания местного применения и местной инфильтрации анестетика, содержащего адреналин. 3 -5 Местное сужение сосудов может быть достигнуто с помощью адреналина, оксиметазолина гидрохлорида и, реже, гидрохлорида кокаина. 3 -6 Большинство отоларингологов также рекомендуют использовать подслизистую инфильтрацию местного эстетического средства, содержащего адреналин, для дальнейшего достижения гемостаза и уменьшения послеоперационной боли. 3 -5 Традиционными областями инфильтрации являются область клиновидно-небного отверстия, передние прикрепления средней носовой раковины и крылонебно-небное отверстие. 6 -8
Хотя адреналин во время FESS обеспечивает отличный гемостаз, он также может сопровождаться потенциальными побочными эффектами, такими как артериальная гипертензия, гипотензия, тахикардия и аритмии.Кроме того, эти осложнения могут вызвать серьезные побочные эффекты у восприимчивых пациентов. 9 , 10 В недавнем исследовании Cohen-Kerem et al. 11 сравнили эффективность местного эпинефрина 1: 1000 и местного анестетика, содержащего 1: 100 000 адреналина, во время FESS. В этом исследовании сообщалось, что подслизистая инъекция местного анестетика с адреналином способствовала улучшению хирургического состояния; однако после инфильтрации отмечались повышенные гемодинамические колебания.В последующем исследовании мы разработали двойное слепое рандомизированное контролируемое исследование (РКИ), оценивающее гемодинамические и гемостатические эффекты двух различных концентраций адреналина с местной анестезией во время FESS. Мы предполагаем, что (1) инфильтрация подслизистой оболочки с более низкой концентрацией адреналина, содержащего местный анестетик, уменьшит гемодинамические колебания, отмеченные после инъекции, тем самым создавая более безопасную операционную среду, и (2) использование пониженной концентрации адреналина не приведет к увеличению интраоперационной активности. кровотечение.
Критерии включения и исключения
В исследование были включены 140 пациентов в возрасте от 18 до 70 лет, которым проводилась плановая FESS по поводу рецидивирующего острого синусита, хронического синусита или полипоза носа. Комитет по этике больниц в Центре здоровья Святого Иосифа (Торонто, Онтарио, Канада) одобрил исследование, и до включения в исследование было получено информированное согласие всех пациентов.Наши критерии исключения включали возраст моложе 18 лет, наличие в анамнезе ишемической болезни сердца, нарушений свертываемости крови и прием гипотензивных препаратов. Все включенные пациенты были отнесены к классу I или классу II в соответствии с критериями Американского общества анестезиологов.
Все пациенты, включенные в исследование, были рандомизированы и распределены в 1 из 2 исследуемых групп. Распределение по группам производилось с помощью случайных чисел, сгенерированных компьютером.Процесс рандомизации был выполнен третьей стороной; пациенты, хирурги, анестезиологи и персонал операционной не знали о групповом назначении каждого пациента.
Все хирургические процедуры были выполнены пациенту под стандартной общей анестезией под контролем одного и того же анестезиолога. Премедикация ограничивалась гидрохлоридом мидазолама (0,5-1 мг) и фентанилцитратом (1-2 мкг / кг). Общая анестезия и паралич были получены с использованием пропофола (1-2 мг / кг) и рокурония бромида (1-2 мкг / кг).Поддержание анестезии достигалось севофлураном, закисью азота и при необходимости прерывистыми дозами фентанилцитрата 0,5 мкг / кг.
Те же 2 хирурга (A.M. и I.J.W.) выполнили все процедуры, используя аналогичные методы диссекции. Всем включенным пациентам было выполнено эндоскопическое рассечение верхнечелюстных, решетчатых и клиновидных пазух. Перед инъекцией исследуемого препарата все пациенты получали эпинефрин местно в соотношении 1: 1000 для снятия заложенности слизистой оболочки носа.У всех пациентов регистрировались исходная частота сердечных сокращений (ЧСС) и артериальное давление (АД). Пациенты, рандомизированные в группу 1, получали 2% лидокаина гидрохлорид с адреналином 1: 100 000 (n = 70), а пациенты, рандомизированные в группу 2, получали лидокаин, 2%, с эпинефрином 1: 200 000 (n = 70). С обеих сторон было введено около 4 мл исследуемого раствора. Данные для следующих параметров пациента были собраны во время процедуры с использованием монитора Datex-Ohmeda (GE, Fairfield, Коннектикут): ЧСС, электрокардиограф для аритмий, систолическое и диастолическое АД (САД и ДАД, соответственно) и среднее артериальное давление (САД) измеряется от манжеты для измерения АД.Эти параметры контролировались анестезиологом на протяжении всей процедуры и повторялись с 1-минутными интервалами в течение 5 минут. Демографические данные пациента, объем хирургического вмешательства и наличие полипов носа регистрировались для дальнейшего анализа. В конце каждой процедуры степень кровопотери оценивали с использованием утвержденной шкалы, показанной в таблице 1. 12 , 13 Те же 2 хирурга (AM и I.J.W.) оценивали и оценивали хирургическое поле во время всех процедур. При оценке учитывалась целесообразность проведения процедуры и эффективность гемостаза.
Данные представлены как среднее (стандартное отклонение) для непрерывных переменных и как частота (в процентах) для дискретных переменных. Ковариационный анализ с поправкой на исходные измерения использовался для проверки разницы между группами по ЧСС и АД через 1, 2 и 5 минут. Парный тест t использовался для проверки увеличения по сравнению с исходным уровнем гемодинамических параметров для 2 групп. Точный тест Фишера был использован для проверки различий в пропорциях степени кровотечения между двумя группами.Все тесты двусторонние, и P ≤ 0,05 считалось статистически значимым. Для первых 30 пациентов была определена оценка стандартного отклонения, основанная на разнице изменения ЧСС на 10 ударов в минуту (уд / мин). Чтобы обнаружить эту разницу статистически, с мощностью 80%, потребовалось 64 пациента. Данные были проанализированы с использованием статистического программного обеспечения SAS (версия 9.1; SAS Institute Inc, Кэри, Северная Каролина).
В общей сложности 140 пациентов соответствовали критериям включения в исследование.Демографические данные пациентов, объем хирургического вмешательства, наличие полипов и исходные гемодинамические параметры были схожими (таблица 2). В таблице 3 суммированы гемодинамические изменения, отмеченные после подслизистой инъекции исследуемых препаратов в 2 группах. В группе 1 пациентов, получавших лидокаин, 2%, с адреналином 1: 100 000, мы отметили увеличение ЧСС через 1 и 2 минуты после инъекции, а через 5 минут уровни снизились до исходного уровня. Было обнаружено, что увеличение по сравнению с исходным уровнем на отметках 1 и 2 минуты после инъекции было статистически значимым ( P <.001). У пациентов 2-й группы, получавших 2% лидокаин с адреналином 1: 200 000, этого увеличения не отмечалось. Фактически, минимальные колебания наблюдались после подслизистых инъекций местного анестетика. Аналогичная картина была отмечена в измерениях САД, ДАД и среднего АД в 2 группах (Таблица 3). В группе 1 повышение САД, ДАД и среднего АД отмечалось в первые 2 минуты, а к четвертой и пятой минутам отмечалось постепенное снижение до исходного уровня. Эти измерения оказались статистически значимыми ( P <.001). Минимальные колебания снова были отмечены у пациентов 2-й группы, получавших более низкие дозы адреналина. Статистической значимости показателей гемодинамики у пациентов 2-й группы не отмечено. Во время процедуры ни в одной из групп не было отмечено аритмий.
После инъекции исследуемого препарата увеличение ЧСС на 10,2 и 7,4 ударов в минуту было отмечено через 1 и 2 минуты в группе 1 по сравнению с группой 2 (Таблица 4). Аналогичным образом, САД увеличивалось в среднем на 17,5 мм рт.ст. в группе 1 по сравнению с группой 2 через 1 минуту и увеличивалось на 18.8 мм рт. Ст. Через 2 минуты. Не было различий в средних показателях изменения между двумя группами через 5-минутную отметку после инъекции. Статистическая разница между двумя группами все еще присутствовала в САД, ДАД и САД через 3 минуты после инъекции.
Оценка кровопотери проводилась с использованием стандартизированной валидированной шкалы, представленной в таблице 1. Эта шкала широко использовалась в медицинской литературе для оценки кровопотери у хирургических пациентов. В этом исследовании мы обнаружили, что все пациенты имели кровотечение по шкале от 1 до 4 (таблица 5).Мы не обнаружили статистической разницы ( P = 0,25) между двумя исследуемыми группами по кровотечению.
Эффективность и безопасность адреналина во время FESS – предмет серьезных споров. Чтобы охарактеризовать гемодинамические и гемостатические свойства вводимого адреналина во время FESS и определить оптимальную дозу, обеспечивающую более безопасное рабочее состояние как для хирурга, так и для пациента, мы сравнили 2 различные концентрации вводимого адреналина, используемые с местным анестетиком.В этом исследовании мы показали, что гемодинамические колебания, отмеченные в течение первых нескольких минут после инъекции 2% лидокаина с адреналином 1: 100 000, можно предотвратить с помощью 2% лидокаина с адреналином 1: 200 000. Это может предотвратить дальнейшие сердечные осложнения у восприимчивых пациентов и, следовательно, приведет к более безопасным операционным условиям.
Среди основных ограничивающих факторов FESS – сложность анатомии носа, а также его высокое кровоснабжение. 1 -3 Превосходный гемостаз является обязательным для улучшения эндоскопической визуализации, позволяя идентифицировать анатомические структуры и тем самым предотвращая катастрофические осложнения.Сужение сосудов традиционно выполнялось с помощью комбинации местных и инъекционных деконгестантов. 3 -6 Инъекционные методы обычно включают местный анестетик, содержащий адреналин в различных концентрациях. 5 -8 Эти растворы обычно вводят в переднюю часть средней носовой раковины, в область клиновидно-небного отверстия и в большое небное отверстие, где находится большая часть носовых сосудов. 6 -8
Выбор противоотечных средств для местного применения и инъекций, место инъекции и используемые концентрации весьма различны среди отоларингологов.Многочисленные сообщения показали, что введение адреналина, даже в терапевтических дозах, может привести к увеличению ЧСС и ударного объема, что приводит к аритмии у восприимчивых пациентов. 9 , 10 Было показано, что частота сердечно-сосудистых токсических побочных эффектов увеличивается в зависимости от дозы. 9 , 10
Anderhuber et al. 14 были первой группой, проанализировавшей системное всасывание введенного адреналина во время FESS.После инъекции было отмечено значительное повышение уровня катехоламинов в плазме с соответствующими гемодинамическими колебаниями. 14 В более позднем исследовании Cohen-Kerem et al. 11 исследовали фармакокинетический эффект местного и вводимого адреналина во время FESS. В этом исследовании после введения адреналина были отмечены значительные колебания гемодинамики. Однако инъекция адреналина, содержащего местную анестезию, действительно способствовала улучшению хирургических условий по сравнению с местным адреналином. 11 Гипотензивные эффекты адреналина в субтерапевтических концентрациях были недавно оценены в серии отчетов Yang et al. 15 , 16 Этот механизм приписывают предпочтительной стимуляции рецепторов β2 при более низких концентрациях. 15 , 16 В нашем исследовании эпизодов гипотонии после инъекции исследуемых препаратов не наблюдалось. Мы связываем это с использованием более высокой концентрации адреналина, преимущественно стимулирующего α- и β1-рецепторы, тем самым проявляя сосудосуживающий эффект.
Для оценки интраоперационной кровопотери мы выбрали утвержденную шкалу оценок, предложенную Boezaart et al. 13 (Таблица 1). Этот метод оценки кровопотери подвергался критике за сжатие оценок и его неспособность различать незначительные различия в кровотечениях. 17 Наир и др. 17 предложили дополнительно разделить оценку 3 балла, чтобы учесть эту дифференциацию. В нашем исследовании мы также обнаружили, что в основном баллы были 2 и 3, без баллов на крайних концах шкалы.Тем не менее, мы предпочли этот метод альтернативным методам, таким как измерение кровопотери, поскольку мы считаем, что он обеспечивает объективную меру, которая напрямую отображает операционное поле, видимое хирургом. Используя эту шкалу, мы не обнаружили статистических различий между двумя группами ( P = 0,25).
В заключение, предотвращение гемодинамических колебаний – ключевой фактор в предотвращении сердечных осложнений во время FESS. В этом двойном слепом РКИ мы показали, что инъекция лидокаина, 2%, содержащего 1: 200 000 адреналина, снижает гемодинамические колебания, отмеченные после инъекции, без ухудшения хирургических условий по сравнению с лидокаином, 2%, содержащим 1: 100 000 адреналина.
Для корреспонденции: Али Мошавер, магистр, доктор медицинских наук, FRCSC, отделение хирургии, региональная больница Пентиктона, 550 Carmi Ave, Penticton, BC V2A 7h3, Канада.
Представлено для публикации: 29 декабря 2008 г .; окончательная редакция получена 12 марта 2009 г .; принята к печати 22 апреля 2009 г.
Вклад авторов: Доктора Мошавер, Лин и Виттерик имели полный доступ ко всем данным в исследовании и несли ответственность за целостность данных и точность анализа данных. Концепция и дизайн исследования : Мошавер, Лин и Виттерик. Получение данных : Мошавер и Виттерик. Анализ и интерпретация данных : Мошавер, Пинто и Виттерик. Составление рукописи : Мошавер, Пинто и Виттерик. Критический пересмотр рукописи на предмет важного интеллектуального содержания : Мошавер, Лин, Пинто и Виттерик. Статистический анализ : Пинто и Виттерик. Административная, техническая и материальная поддержка : Мошавер, Лин и Виттерик. Авторский надзор : Виттерик.
Раскрытие финансовой информации: Не сообщалось.
1.Stammberger HKopp W Функциональная эндоскопическая хирургия носовых пазух: Техника Мессерклингера. Филадельфия, Пенсильвания, BC Decker, 1991;
2.Стамбергер HPosawetz W Функциональная эндоскопическая хирургия носовых пазух: концепции, показания и результаты техники Мессерклингера. Eur Arch Оториноларингол 1990; 247 (2) 63-76PubMedGoogle ScholarCrossref 3.Hirshowitz BEliachar I Эффективный гемостаз с местной анестезией в хирургии носа. Br J Plast Surg 1972; 25 (3) 335-341PubMedGoogle ScholarCrossref 4.Lee WCKapur TRRamsden WN Местная и региональная анестезия при функциональной эндоскопической хирургии носовых пазух. Ann Otol Rhinol Laryngol 1997; 106 (9) 767-769PubMedGoogle Scholar5.McClymont LGCrowther JA Местный анестетик с комбинациями сосудосуживающих средств в хирургии перегородки. Дж Ларингол Отол 1988; 102 (9) 793-795PubMedGoogle ScholarCrossref 6. Ляо BSHilsinger RL JrRasgon BMMatsuoka KAdour К.К. Предварительное исследование всасывания кокаина из слизистой оболочки носа. Ларингоскоп 1999; 109 (1) 98-102PubMedGoogle ScholarCrossref 7.Wormald PJAthanasiadis Три GRobinson S Оценка эффекта инъекции в крылонебно-небную ямку с местным анестетиком и адреналином в контроле носового кровотечения во время эндоскопической хирургии придаточных пазух носа. Am J Rhinol 2005; 19 (3) 288–292PubMedGoogle Scholar8.Vanniasegaram I Проспективное исследование использования сосудосуживающих средств и физиологического раствора в хирургии перегородки при инфильтрации. Дж Ларингол Отол 1991; 105 (8) 638-639PubMedGoogle ScholarCrossref 9. Хорриган RWEger EIWilson C Аритмии, вызванные адреналином, во время анфлурановой анестезии у человека: нелинейная доза-реакция и дозозависимая защита от лидокаина. Anesth Analg 1978; 57 (5) 547-550PubMedGoogle ScholarCrossref 10. Мерти HSRao GS Сердечно-сосудистые реакции на инфильтрацию кожи головы с различными концентрациями адреналина с лидокаином или без него во время краниотомии. Anesth Analg 2001; 92 (6) 1516–1519PubMedGoogle ScholarCrossref 11. Коэн-Керем RBrown SVillaseñor LVWitterick I Инъекции адреналина / лидокаина по сравнению с физиологическим раствором во время эндоскопической хирургии носовых пазух. Ларингоскоп 2008; 118 (7) 1275–1281PubMedGoogle ScholarCrossref 12.Jacobi KEBöhm Беррихауэр AJJacobi Чеммерлинг TM Умеренная контролируемая гипотензия с помощью нитропруссида натрия не улучшает хирургических условий и не снижает кровопотерю при эндоскопической хирургии носовых пазух. J Clin Anesth 2002; 12 (3) 202-207PubMedGoogle ScholarCrossref 13.Boezaart APVan der Merwe JCoetzee Сравнение контролируемой гипотензии, вызванной нитропруссидом натрия и эсмололом, при функциональной эндоскопической хирургии носовых пазух. Can J Anaesth 1995; 42 (5, п.1) 373- 376PubMedGoogle ScholarCrossref 14.Андерхубер WWalch CNemeth E и другие. Концентрация адреналина в плазме во время функциональной эндоскопической хирургии носовых пазух. Ларингоскоп 1999; 109 (2, п.1) 204–207PubMedGoogle ScholarCrossref 15. Ян JJWang TYWang J и другие. Выраженная гипотензия, вызванная адреналином, содержащимся в местном анестетике. Ларингоскоп 2005; 115 (2) 348-352PubMedGoogle ScholarCrossref 16.Ян JJLi WYJil Q и другие. Местная анестезия при функциональной эндоскопической хирургии носовых пазух с использованием небольших объемов растворов лидокаина, содержащих адреналин, вызывает сильную гипотенцию. Acta Anaesthesiol Scand 2005; 49 (10) 1471–1476PubMedGoogle ScholarCrossref 17.Наир SCollins MHung PRees GClose DWormald PJ Влияние премедикации β-блокаторами на операционное поле во время эндоскопической хирургии носовых пазух. Ларингоскоп 2004; 114 (6) 1042-1046PubMedGoogle ScholarCrossref .
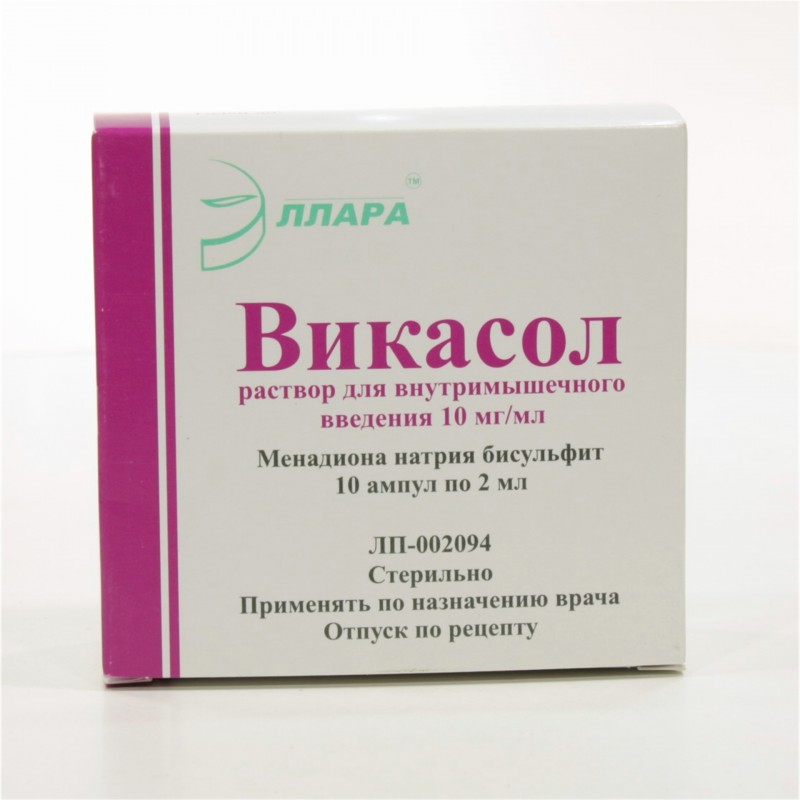
 Неизвестно, выделяется ли этамзилат с грудным молоком.
Неизвестно, выделяется ли этамзилат с грудным молоком. ч. у новорожденных и недоношенных детей), носовые кровотечения на фоне артериальной гипертензии, кровотечения, обусловленные приемом лекарственных средств, геморрагический диатез (в т.ч. болезнь Верльгофа, Виллебранда-Юргенса, тромбоцитопатия), диабетическая микроангиопатия (геморрагическая диабетическая ретинопатия, повторное кровоизлияние в сетчатку, гемофтальм).
ч. у новорожденных и недоношенных детей), носовые кровотечения на фоне артериальной гипертензии, кровотечения, обусловленные приемом лекарственных средств, геморрагический диатез (в т.ч. болезнь Верльгофа, Виллебранда-Юргенса, тромбоцитопатия), диабетическая микроангиопатия (геморрагическая диабетическая ретинопатия, повторное кровоизлияние в сетчатку, гемофтальм). В большинстве случаев разовая доза составляет 250-500 мг, при необходимости разовая доза может быть увеличена до 750 мг, суточная – 1500 мг. У детей применяют половину дозы взрослых.
В большинстве случаев разовая доза составляет 250-500 мг, при необходимости разовая доза может быть увеличена до 750 мг, суточная – 1500 мг. У детей применяют половину дозы взрослых.




 Это уменьшит приток крови к органам таза, но улучшит кровообращение мозга, органов грудной клетки.
Это уменьшит приток крови к органам таза, но улучшит кровообращение мозга, органов грудной клетки.
 Не рекомендовано употребление беременным, может повысить тонус матки.
Не рекомендовано употребление беременным, может повысить тонус матки.

