Неороговевающий рак: Плоскоклеточный рак
Плоскоклеточный рак
Плоскоклеточный рак кожи часто встречающейся злокачественная опухоль поражающая любой участок кожи человеческого тела. Болезнь чаще всего локализуется на открытых для солнца участках кожи. Рак кожи может возникнуть в зонах хронического воспаления, длительно существующих ран и язв, так же на фоне рубцов.
Среди злокачественных новообразований кожи чаще всего встречаются опухоли эпителиального происхождения, из которых около 20% – случаи плоскоклеточного.
Как правило, это одиночное образование в виде эритематозных папул, атрофичных бляшек или узлов. На поверхности может наблюдаться шелушение кожи, иногда кровь. Кожа вокруг опухоли не изменена.
Опухоль чаще всего располагается на открытых участках тела, на лице, конечностях и туловище, а также на наружных половых органах, около заднего прохода и на тыльной стороне кисти. Излюбленная локализация поражения : 55% случаях болезнь поражает кожу головы и лица, 18% – заднюю поверхность кистей, 13% – ног.
Факторы риска
- длительная воздействие УФ (солнце) – длительное, суммарно значительное на протяжении всей жизни, пребывание на солнце, перенесенные солнечные ожоги
- PUVA воздействие
- Ионизирующая радиация – лечение в анамнезе акне, псориаза, злокачественных новообразований
- Возраст старше 65 лет
- различные хронические заболевания и поражения кожи: в том числе предраковые заболевания, рубцы, язвы,
- иммуносупрессия (вирусная инфекция, трансплантация органов, )
- хроническое воспаление кожи
- химические агенты (Арсений, родон, селен и тд)
- генетические нарущения и предпосылки (УФ индуцированное нарушение p53, нарушения в работе киназной пути RAS)
- папилломовирусная инфекция: вирус папилломы человека типов 16, 18, 31, 33, 35 и 45 вызывает плоскоклеточный рак наружных половых органов, заднего прохода.
- Фоновые заболевание – пигментная ксеродерма, буллозный эпидермолиз, альбинизм.
- Некоторые лекарственные препараты – длительное использование вориконазола, некоторых фотосенсибилизирующие препараты
Клинические проявления заболевания
Рак in situ – болезнь Боуэна
Выделяют две формы роста плоскоклеточного рака кожи.
Язвенно инфильтративная (эндофитная) в начале представляет собой пятно, которое за несколько месяцев превращается в плотный малоподвижный узел. Через 4-6 месяцев на поверхности узла в центре образуется неправильной формы язва, иногда с неприятным запахом. Эта форма рака кожи быстро распространяется на окружающие ткани, поражает близлежащие (регионарные) лимфатические узлы, метастазирует в легкие и кости и часто рецидивирует.
Папиллярная или экзофитная форма роста.
Отдельно выделяют редкие формы плоскоклеточного рака
- поражение ротовой полости (болезнь возникает на фоне эритроплакии или лейкоплакии у людей злоупотребляющих табаком и алкоголем.

- Кератоакантома – благоприятный вариант высокодиференцированного рака кожи.
- веррукозная форма роста опухоли. Такое образование чаще всего красно-коричневого цвета, бугристое и покрытое коркой с похожими на бородавки разрастаниями. Для этого вида рака характерен медленный рост и редкое метастазирование. В пожилом возрасте веррукозная форма может походить на так называемый кожный рог. Локализуется в полости рта, вокруг ануса и наружных половых органов и на коже подощвенной поверхности стоп
- рак кожи губ
По результатам исследования ткани опухоли выделяют ороговевающую и неороговевающую формы плоскоклеточного рака кожи.
Для ороговевающей формы характерно более доброкачественное течение, медленный рост. Такие образования почти всегда имеют трудно отделяющиеся чешуйки на поверхности (признаки кератинизации), центральная язва также покрыта коркой. Опухоль красного, желтоватого или цвета обычной кожи; форма – многоугольная, овальная или круглая, чаще всего одиночная.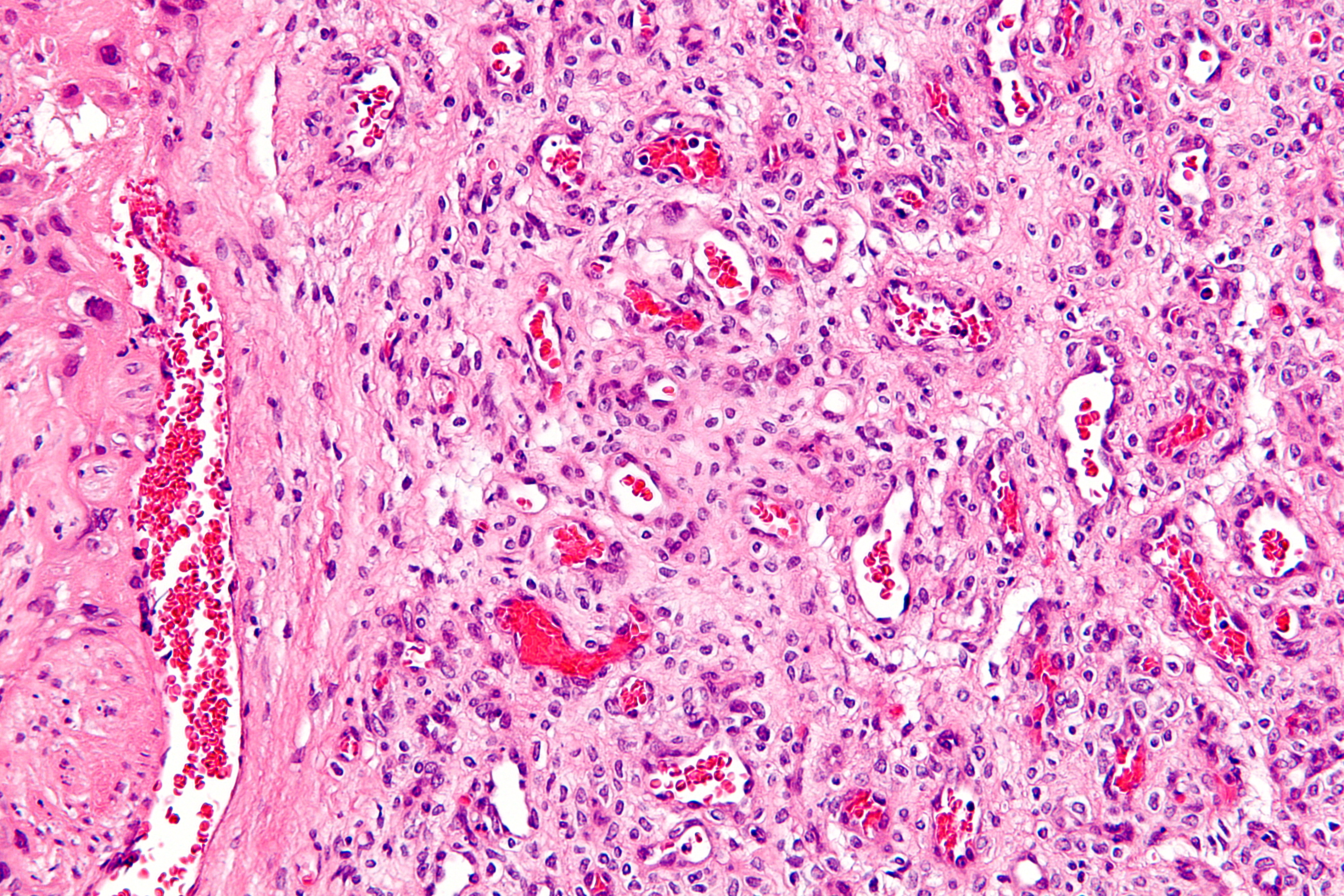 Обнаружение увеличенных регионарных лимфоузлов говорит о вовлечении лимфоузлов и поздней стадии заболевания.
Обнаружение увеличенных регионарных лимфоузлов говорит о вовлечении лимфоузлов и поздней стадии заболевания.
Неороговевающая форма – более злокачественное заболевание, быстро разрастающееся в окружающие ткани, признаки кератинизации отсутствуют. Опухоль – мясистая, мягкая, имеет вид узла или пятна, с покрытой коркой красно-бурой язвой, кровоточащая при контакте. Образование имеет неправильную форму, похожую на цветную капусту. Поражение лимфатических узлов начинается раньше и происходит чаще, чем при ороговевающей форме рака.
МЕТАСТАЗИРОВАНИЕ
Различные формы плоскоклеточного рака кожи метастазируют по-разному, например веррукозная форма метастазирует крайне редко, а неороговевающая – довольно рано поражает регионарные лимфатические узлы. При метастазировании отдаленные метастазы в легкие и кости встречаются в 15% случаев, а в 85% случаев в процесс вовлекаются лимфатические узлы.
Стадии плоскоклеточного рака устанавливают по международной классификации TNM, где Т – характеризует первичную опухоль, N-поражение регионарных лимфатических узлов, M – наличие отдаленных метастазов.
Плоскоклеточный рак кожи | Диагностика и лечение плоскоклеточного рака кожи на любых стадиях
Плоскоклеточный рак кожи возникает при перерождении шиповатых клеток эпидермиса. Встречается довольно часто и отличается высокими рисками метастазирования. Как правило, диагностируется у людей старше 65 лет, однако бывают случаи выявления этого вида неоплазий у более молодых пациентов и детей.
К факторам риска относят высокие дозы ультрафиолета (злоупотребление загаром или нахождение на открытом солнце без защиты), взаимодействие по роду деятельности с канцерогенами, воздействие радиации, иммунные нарушения, наличие ВПЧ, ВИЧ или СПИДа, предраковые состояния, частые механические повреждения кожных покровов в одних и тех же местах, генетическая предрасположенность.
Плоскоклеточный рак кожи: формы и стадии
Выделяют веретеноклеточный, акантолитический, веррукозный и лимфоэпителиальный типы.
Для определения, на какой стадии находится болезнь, используют классификацию TNM — размеры опухоли, вовлечение лимфоузлов, появление метастазов:
I — до 2 см в диаметре, не задеты лимфатические узлы и другие органы;
II — до 4 см, есть прорастание в соседние ткани;
III — поражены регионарные лимфоузлы;
IV — есть метастазирование в отдаленные органы.
Отправьте документы на почту [email protected]. Возможность проведения лечения рассмотрит главный врач клиники Антон Александрович Иванов, онколог-хирург, к.м.н
Симптомы и диагностика
Уплотнение на кожных покровах с покрасневшими краями, язвочка неправильной формы или другие новообразования должны стать поводом незамедлительно обратиться к врачу.
Лечение плоскоклеточного рака кожи
Лечебные мероприятия проводят с учетом особенностей заболевания, его стадии, состояния больного. Пока нет метастазов, опухоль может быть удалена хирургически, альтернативой скальпелю выступает радиохирургия, методы электрокоагуляции и криодеструкции. Химиотерапия перед операцией позволяет уменьшить размеры опухоли, а также используется при неоперабельных формах в комплексе с лучевой терапией.
Опытные специалисты клиники НАКФФ проводят диагностику онкологии, лечение и реабилитацию онкобольных, оказывают паллиативную поддержку. Записаться на консультацию можно по тел. +7 (495) 431-32-35.
Рак легкого | Клиническая больница №122 имени Л.Г.Соколова Федерального Медико-Биологического Агентства
Рак легкого — заболевания при котором происходит бесконтрольное деление клеток ткани легкого.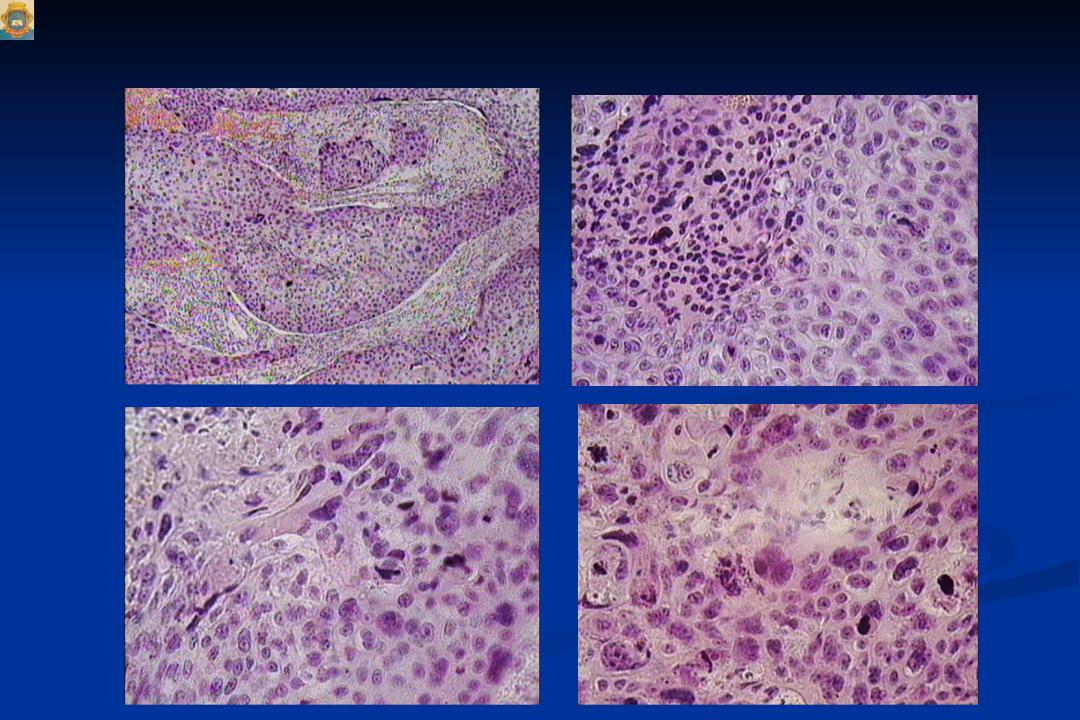
Ткань легкого состоит из нескольких видов клеток. В зависимости от варианта клеток из которых произошла опухоль выделяют две группы патологии:
- Мелкоклеточный рак
- Немелкоклеточный рак
Немелкоклеточный рак может иметь несколько вариантов:
Наиболее распространены:
- Плоскоклеточный (ороговевающий или неороговевающий)
- Аденокарцинома
- Крупноклеточная карцинома (светлоклеточая карцинома, крупноклеточный нейроэндокринный рак, базалойдный рак и т.д.)
- Плеоморфная (саркоматойдная) карцинома (гигантоклеточная, веретеноклеточная и т.д.)
- Атипичный карциноид
- Не классифицируемые карциномы
В обязательный диагностический набор входят:
- Компьютерная томография органов грудной клетки и брюшной полости
- Фибробронхоскопия с гистологическим подтверждением диагноза
- Клинический и биохимический анализ крови
- Компьютерная томография и\или магнитно-резонансная томография головного мозга
- Диагностическая торакоскопия
- Определение онкомаркеров
- Сцинтиграфия костей
- Позитронно-эмиссионная томография (ПЭТ)
Важным звеном при выборе тактики лечения является определение стадии процесса.

Tх — опухоль не выявлена
Tis — опухоль не распространяющаяся в соседние ткани
T1 — опухоль не более 3 см, не распространяющаяся в главный бронх
T2 — опухоль более 3 см, но не более 7 см, не захватывающая все легкое и располагающаяся более 2 см от области разветвления трахеи
T3 — опухоль > 7 см или переходящая на грудную стенку, диафрагму, плевру, перикард (оболочку сердца) или опухоль, не доходящая до области разветвления трахеи менее 2 см, или с ателектазом всего легкого или пневмонией всего легкого
T4 — опухоль, непосредственно переходящая на средостение, сердце, крупные сосуды, трахею, пищевод, тела позвонков, область разветвления трахеи или 2 опухоли в разных долях одного легкого
Лечение немелкоклеточного рака легкого
Выбор тактики лечения зависит от стадии заболевания, состояния пациента, сопутствующей патологии. Часто используются комбинации нескольких методов лечения (хирургический, лекарственный, лучевой).
Часто используются комбинации нескольких методов лечения (хирургический, лекарственный, лучевой).
При ограниченных стадиях опухолевого процесса используют комбинацию хирургического лечения с последующим химиотерапевтическим или химио-лучевым (адъювантным) лечением.
В случае если опухоль слишком большая и выполнение оперативного лечения опасно или невозможно — проводят неоадъюватную терапию для уменьшения размеров опухоли с последующим хирургическим лечением.
При распространенном опухолевом процессе проводят лекарственную терапию (химиотерапия, биотерапия).
Среди наиболее часто используемых химиопрепаратов — цисплатин, доцетаксел, паклитаксел, этопозид, гемцитабин и др.
Наиболее распространенными биопрепаратами (таргетными препаратами) — цетуксимаб (эрбитукс), бевацезумаб (авастин), эрлотиниб (тарцева) и т.д.
Перед принятием решения о дальнейшем лечении, важным моментом является обсуждение выбранной тактики с пациентом и, по его желанию, с родственниками пациента.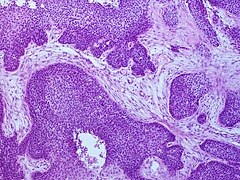
Мелкоклеточный рак легкого
Мелкоклеточный рак также может называться нейроэндокинной опухолью легкого.
Диагностика мелкоклеточного рака легкого
В обязательный диагностический набор входят:
- Компьютерная томография органов грудной клетки и брюшной полости
- Фибробронхоскопия с гистологическим подтверждением диагноза
- Клинический и биохимический анализ крови
- Компьютерная томография и\или магнитно-резонансная томография головного мозга
- Диагностическая торакоскопия
- Определение онкомаркеров
- Сцинтиграфия костей
- Позитронно-эмиссионная томография (ПЭТ)
Общепринятой классификацией мелкоклеточного рака легкого является двухстадийная система:
- Ограниченная стадия (локализованная) — заболевание ограничено одной половиной грудной клетки (гемитораксом)
- Распространенная стадия — заболевание вышло за пределы одной половины грудной клетки
Выбор тактики лечения зависит от стадии заболевания, состояния пациента, сопутствующей патологии.
 Часто используются комбинации нескольких методов лечения (лекарственный, лучевой). Хирургический метод лечения используется редко, т.к. имеет невысокую эффективность при данном виде опухоли.
Часто используются комбинации нескольких методов лечения (лекарственный, лучевой). Хирургический метод лечения используется редко, т.к. имеет невысокую эффективность при данном виде опухоли.При ограниченных стадиях опухолевого процесса используют комбинацию химиолучевого лечения или химиотерапию.
При распространенном опухолевом процессе проводят лекарственную терапию — химиотерапию.
Среди наиболее часто используемых химиопрепаратов — цисплатин, карбоплатин, доцетаксел, иринотекан, паклитаксел, этопозид, гемцитабин и др.
Чаще всего используют комбинации препаратов платины (цисплатин, карбоплатин) с этопозидом, гемцитабином (Гемзар) или иринотеканом.
Перед принятием решения о дальнейшем лечении, важным моментом является обсуждение выбранной тактики с пациентом и, по его желанию, с родственниками пациента.
Вы можете записаться к нам на прием, позвонив нам по телефонам:
Телефон\факс: (812) 559-94-41
Телефон: 8-911-117-82-28
Отделение онкологии
Инвазивный плоскоклеточный рак шейки матки
Плоскоклеточная карцинома рака шейки матки составляет 80–90% всех онкологических заболеваний шейки матки. Эти злокачественные опухоли возникают в клетках на наружной поверхности органа. Также этот тип разделяют на плоскоклеточный рак шейки матки с ороговением (присутствие отмерших или ороговевших клеток) и неороговевающий (клетки имеют более правильную форму, без ороговевших участков, и активно делятся). Если новообразование распространилось за пределы больного органа на соседнюю ткань, ставится диагноз инвазивный плоскоклеточный рак шейки матки.
Эти злокачественные опухоли возникают в клетках на наружной поверхности органа. Также этот тип разделяют на плоскоклеточный рак шейки матки с ороговением (присутствие отмерших или ороговевших клеток) и неороговевающий (клетки имеют более правильную форму, без ороговевших участков, и активно делятся). Если новообразование распространилось за пределы больного органа на соседнюю ткань, ставится диагноз инвазивный плоскоклеточный рак шейки матки.
Диагностика инвазивного плоскоклеточного рака шейки матки
Обследование обычно начинается с взятия мазка Папаниколау. Во время процедуры врач осторожно счищает образец слизи и клеток на шейке матки. Результат мазка помогает обнаружить аномальные изменения ткани, включая наличие вируса ВПЧ.
В случае присутствия атипичных плоскоклеточных клеток пациентка проходит жидкостную цитологию (взятие мазка более высокого качества за счет хранения в особой жидкости). Если в образце присутствуют раковые клетки, врач назначает кольпоскопию.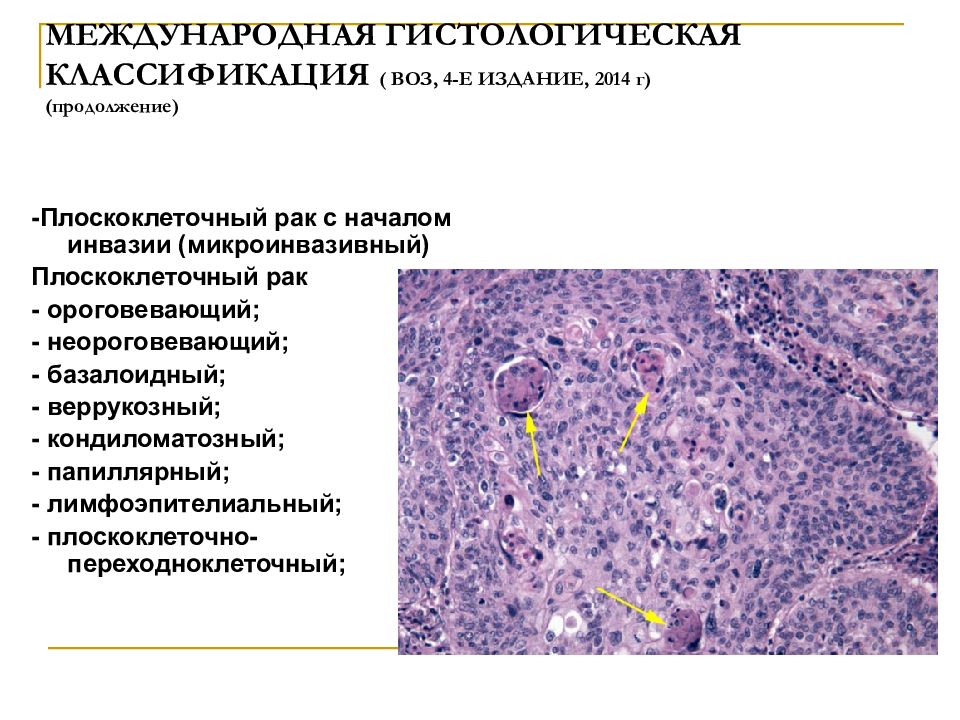 Это обследование шейки матки и взятие образца опухоли увеличительным инструментом с источником света (кольпоскоп).
Это обследование шейки матки и взятие образца опухоли увеличительным инструментом с источником света (кольпоскоп).
Если диагноз остается неясным, проводится коническая биопсия. Это небольшая операция по удалению немного большего количества ткани. При подозрении на инвазивный плоскоклеточный неороговевающий рак шейки матки, врач назначает комплексную визуализацию других органов тела. Тестирование включает в себя рентген грудной клетки, КТ и МРТ брюшной полости и таза, а также сканирование ПЭТ-КТ.
Хирургическое лечение плоскоклеточного рака шейки матки
Инвазивный и микроинвазивный плоскоклеточный рак шейки матки лечат комбинацией хирургии, лучевой терапии или химиотерапии. Современные клиники перед операцией проводят биопсию сторожевого лимфатического узла. Узел, в который раковые клетки могут попасть в первую очередь, сначала выявляется с помощью красителя, а затем удаляется и тестируется на присутствие рака. Эта процедура помогает определить уровень распространения опухоли и правильный план лечения.
Если метастазов не обнаружено, рекомендуется гистерэктомия – полное удаление матки и шейки матки вместе с тазовыми лимфатическими узлами. Сегодня эта операция часто проводится минимально инвазивным методом – с помощью лапароскопа или роботизированной системы «Да Винчи». По сравнению с открытой хирургией новые подходы обеспечивают более короткий период госпитализации, меньший риск заражения и более низкую стоимость.
Нехирургическое лечение инвазивного плоскоклеточного рака шейки матки
Пациенткам, у которых раковые клетки распространились по организму (метастазирование), вместо операции назначают системную химиолучевую терапию. Лучевая терапия часто сочетает в себе внешнее и внутренне облучение. Внешняя лучевая терапия с интенсивной модуляцией луча проводится одновременно с низкой дозой химиотерапии. Препарат «Цисплатин» помогает сделать раковые клетки более чувствительными к излучению. Затем проводится брахитерапия высокой дозы. Это комплексное лечение значительно продлевает жизнь пациенткам с инвазивным плоскоклеточным раком шейки матки.
6242
Плоскоклеточный рак легкого: лечение, стадии, прогноз, химиотерапия.
Почему развивается плоскоклеточный рак легких?
Причины большинства онкологических заболеваний неизвестны, и рак легкого – не исключение. Опухоли дают начало клетки, в которых произошли некоторые мутации, но что именно к этому привело, сказать очень сложно. Известны лишь факторы, которые повышают вероятность развития заболевания. Их так и называют – факторы риска.
Из всех видов немелкоклеточного легких рака именно плоскоклеточный сильнее всего связан с курением. Вредно воздействие табачного дыма в любых формах: в виде сигарет, сигар, кальянов, трубок. Риск напрямую зависит от того, как долго человек является курильщиком, и сколько сигарет выкуривает ежедневно. Пассивное курение тоже опасно.
Другие факторы риска:
- Возраст. Чем старше человек, тем выше вероятность заболеть.

- Семейный анамнез: случаи заболевания у близких родственников.
- Воздействие пыли, асбеста, радона (газ, который образуется в почве при распаде урана и может накапливаться в помещениях) и некоторых других веществ.
Стадии плоскоклеточного рака легких
Стадию определяют в зависимости от размеров первичной опухоли, наличия раковых клеток в регионарных лимфатических узлах, отдаленных метастазов. При плоскоклеточном раке легкого выделяют четыре основные стадии:
- На первой стадии опухоль не больше 4 см в диаметре, не распространяется в регионарные лимфатические узлы, нет отдаленных метастазов.
- При плоскоклеточном раке легкого 2 стадии опухоль крупнее (до 7 см в диаметре), может распространяться на регионарные лимфоузлы.
- На 3 стадии опухоль сильнее прорастает в окружающие ткани, поражает большее количество лимфатических узлов.
- Четвертая стадия рака характеризуется наличием отдаленных метастазов.

Симптомы
На ранних стадиях рак зачастую не проявляется какими-либо симптомами. Позже начинает беспокоить упорный хронический кашель, во время которого может отходить мокрота с примесью крови, боли в грудной клетке, одышка, повышенная утомляемость. По мере прогрессирования рака и образования отдаленных метастазов присоединяются такие симптомы, как желтуха, нарушение пищеварения, тошнота и рвота, потеря веса (при метастазах в печени), боли в костях и патологические переломы (при метастазах в костях), головные боли и неврологические расстройства (при метастазах в головном мозге).
Зачастую из-за отсутствия симптомов рак легких диагностируется на поздних стадиях, когда лечить его уже сложно. В ранней диагностике помогают скрининговые исследования: флюорография, некоторым курильщикам с большим стажем стоит периодически проходить компьютерную томографию (этот вопрос нужно решить с врачом).
Методы диагностики
Обнаружить опухоль в легких помогает рентгенография грудной клетки.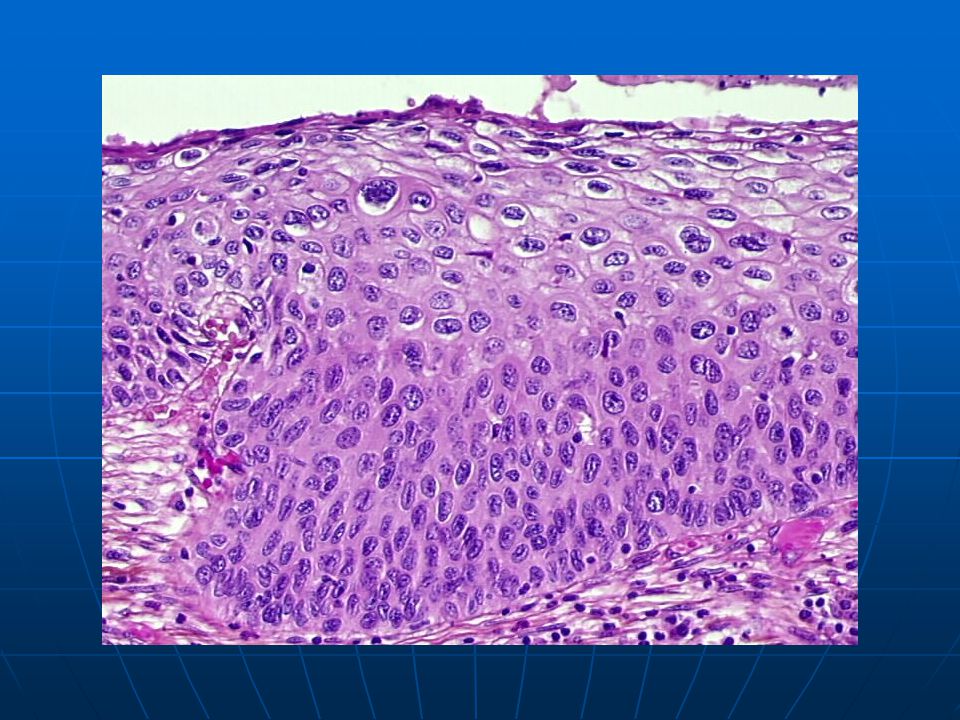 Более детальную картину помогают получить такие методы диагностики, как КТ, МРТ. Для того чтобы осмотреть слизистую оболочку бронхов, прибегают к эндоскопическому исследованию – бронхоскопии. Обнаружить метастазы помогают: ПЭТ-сканирование, рентгенография и радиоизотопное исследование костей, УЗИ органов брюшной полости и другие методы диагностики.
Более детальную картину помогают получить такие методы диагностики, как КТ, МРТ. Для того чтобы осмотреть слизистую оболочку бронхов, прибегают к эндоскопическому исследованию – бронхоскопии. Обнаружить метастазы помогают: ПЭТ-сканирование, рентгенография и радиоизотопное исследование костей, УЗИ органов брюшной полости и другие методы диагностики.
Для того чтобы подтвердить наличие раковых клеток в новообразовании, прибегают к биопсии, цитологическому исследованию мокроты.
Лечение плоскоклеточного рака легких
Выбор лечения зависит от многих факторов, один из самых главных – стадия рака. Чем ниже стадия, тем выше риск ремиссии. К сожалению, поздняя диагностика – весьма актуальная проблема при плоскоклеточном раке легкого. Зачастую, когда человек обращается за медицинской помощью, опухоль уже успевает сильно прорасти за пределы легких, дать метастазы. Но даже если ремиссия невозможна, это еще не означает, что больному нельзя помочь. Зачастую врачи могут существенно продлить жизнь пациента, сделать так, чтобы он не испытывал мучительных симптомов.
Хирургическое лечение
Цель радикальных операций при плоскоклеточном раке легкого – полностью удалить опухоль, так, чтобы в организме не осталось раковых клеток, которые могли бы привести к рецидиву.
Объем вмешательства напрямую зависит от того, насколько сильно успела вырасти опухоль. Но при этом нужно учитывать и состояние функции легких: чем она лучше, тем больше тканей может удалить врач, не боясь серьезных осложнений. Иногда нужно удалить все легкое целиком. В других случаях удаляют его долю, сегмент или небольшую часть – новообразование с некоторым количеством окружающей ткани.
Применяют при раке легкого и миниинвазивные методики. В некоторых случаях можно прибегнуть к видеоассистрированной торакальной хирургии (VATS), если это позволяет техническое оснащение и квалификация врачей клиники.
Лучевая терапия и химиотерапия при плоскоклеточном раке легких
Часто лучевая терапия и химиотерапия по отдельности или в сочетании дополняют хирургическое лечение.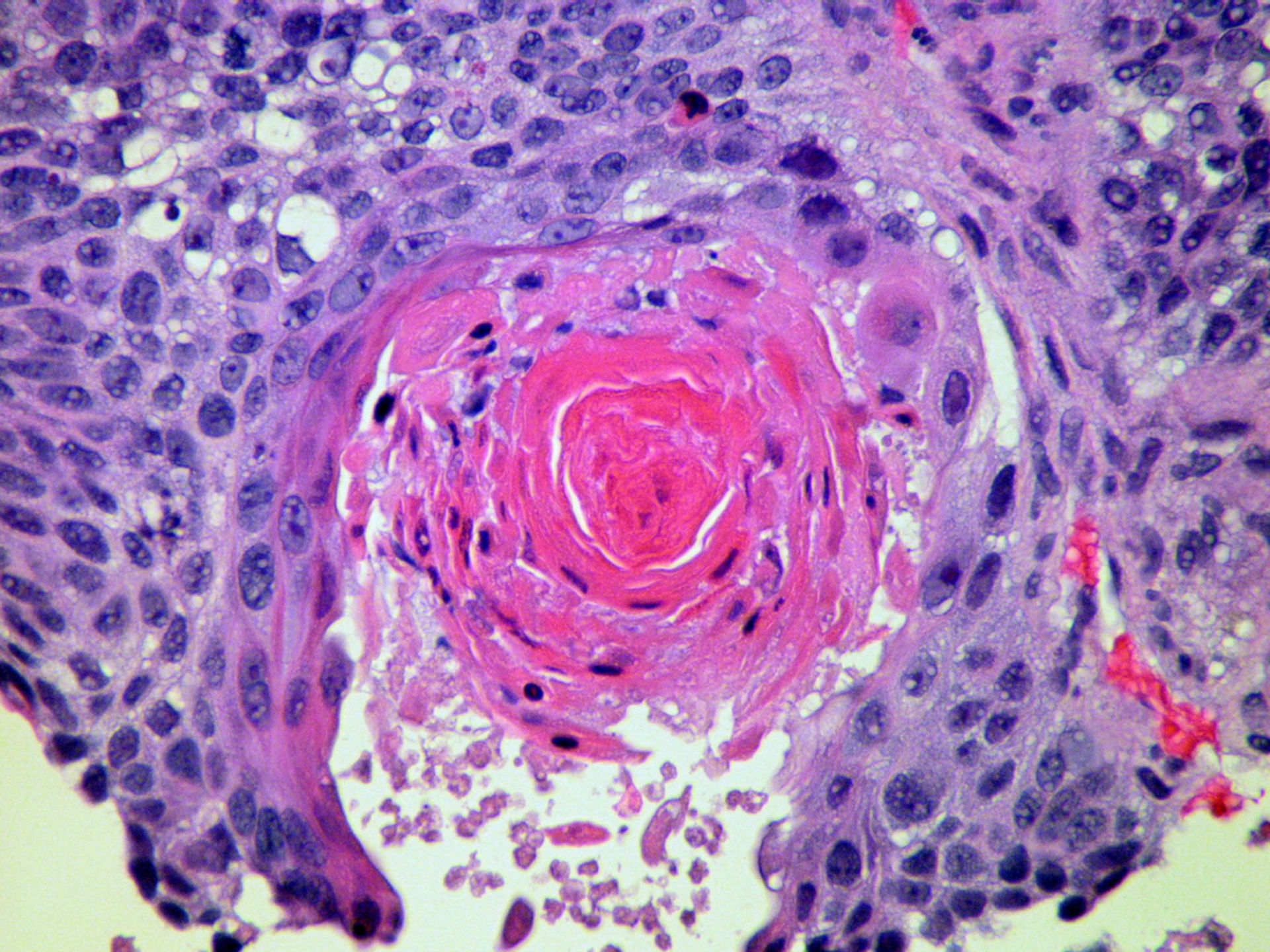 Терапия, которую проводят до операции, называется неоадъювантной. Она помогает уменьшить опухоль, что позволяет сократить объем хирургического вмешательства. Адъювантную терапию назначают после операции, она помогает предотвратить рецидив, так как убивает оставшиеся в организме раковые клетки.
Терапия, которую проводят до операции, называется неоадъювантной. Она помогает уменьшить опухоль, что позволяет сократить объем хирургического вмешательства. Адъювантную терапию назначают после операции, она помогает предотвратить рецидив, так как убивает оставшиеся в организме раковые клетки.
При раке на поздних стадиях химиотерапию и лучевую терапию применяют в паллиативных целях. Они помогают затормозить рост опухоли, улучшить состояние больного, продлить жизнь. С помощью лучевой терапии можно уничтожать единичные метастатические очаги.
Новые методы лечения плоскоклеточного рака легких
Два современных направления в лечении онкологических заболеваний:
- Таргетные препараты. Они блокируют определенные молекулы-мишени, которые нужны для роста и выживания злокачественных опухолей.
- Иммунопрепараты также воздействуют на молекулярные механизмы, помогают снять блок с иммунной системы, который мешает ей атаковать опухолевую ткань.

Оба эти вида лечения применяются при раке легких. В некоторых случаях они помогают на поздних стадиях, когда другие методы лечения неэффективны.
Прогноз при плоскоклеточном раке легких
Основной показатель для оценки прогноза – пятилетняя выживаемость или количество пациентов, которые остаются живы спустя пять лет после того, как установлен диагноз. Пятилетняя выживаемость при плоскоклеточном раке легкого, как и при других онкологических заболеваниях, зависит от стадии:
- Стадия 1 – 68–92%.
- Стадия 2 – 36–60%.
- Прогноз выживаемости при плоскоклеточном раке легкого 3 стадии – 13–36%.
- Прогноз выживаемости при плоскоклеточном раке легкого 4 стадии – 1–10%.
Лечение рака губы в Германии, клиника Вивантес в Берлине
Рак губы — достаточно распространенное злокачественное образование, формирующееся из эпителиальной ткани губ. Занимает 8-9 место в структуре злокачественных поражений. Как правило, поражает нижнюю губу, редко дает метастазы в отдаленные органы и структуры. Злокачественное новообразование в 8-10 раз чаще диагностируют у мужчин, преимущественно в возрасте за 65 лет. Лечение рака губы в Германии является частой причиной обращений иностранных пациентов.
Как правило, поражает нижнюю губу, редко дает метастазы в отдаленные органы и структуры. Злокачественное новообразование в 8-10 раз чаще диагностируют у мужчин, преимущественно в возрасте за 65 лет. Лечение рака губы в Германии является частой причиной обращений иностранных пациентов.
На базе клиники «Вивантес» всесторонней диагностикой и комплексным лечением онкологических процессов с локализацией в области губ занимаются специалисты высшей категории.
Лечение рака губы выполняется с помощью современных методов и направленно на комплексное решение проблемы. Для устранения рака губы немецкими специалистами используются новейшие цитостатические препараты, лучевая и биологическая терапии, хирургическое лечение.
Что такое рак губы?
Рак губы – злокачественное образование, исходящее из эпителия губ. Рак губы возникает в виде уплотнения или язвочки, которая с развитием болезни может инфицироваться. Атипичные клетки прорастают в рядом расположенные структуры, затрудняя процесс приема пищи.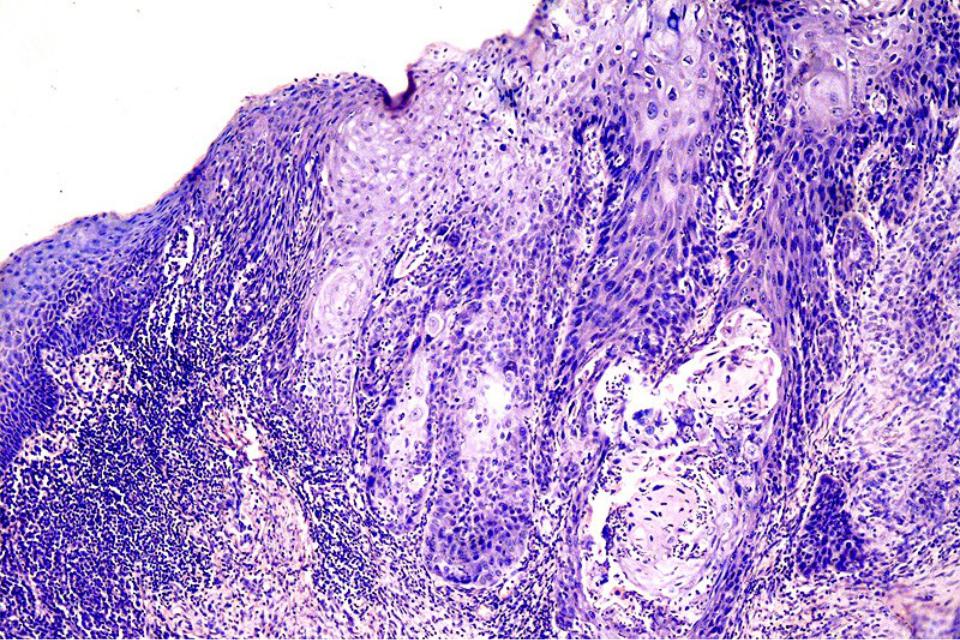
Опухоль редко дает отдаленные метастазы. В большинстве случаев раковые клетки распространяются по сосудам лимфатической системы, поражая лимфатические узлы, реже встречается гематогенное метастазирование (обычно в легкие).
Существует несколько классификаций онкологии. Так, по строению различают:
- плоскоклеточный ороговевающий рак – встречается в 95% случаев, характеризуется медленным ростом, редко дает метастазы;
- неороговевающий – встречается в 5% случаев, отличается быстрым ростом, наличием отдаленных метастазов.
Согласно клиническому течению, выделяют три формы рака – папиллярную, бородавчатую, язвенную.
Онкология возникает в результате воздействия различных факторов, среди которых:
- ультрафиолетовое излучение;
- частое травмирование губ;
- сигареты;
- употребление насваи;
- спиртное;
- химические канцерогены;
- вирусные заболевания и хронические воспалительные процессы.
Также немецкие онкологи выделяют предраковые состояния, к которым относятся доброкачественные образования на губах (папилломы), дискератозы, эритроплакии, хейлит, часто возникающие трещины и язвочки на губах.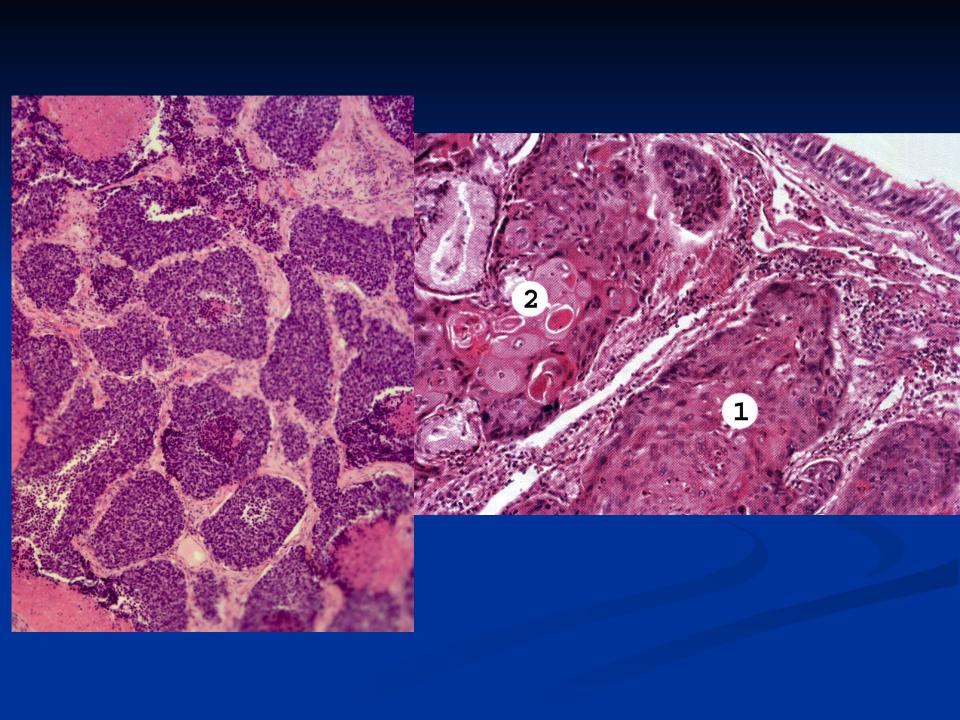
Симптомы и диагностика рака губы
Как правило, рак губы формируется на фоне другой патологии. На ранних этапах возникает небольшое уплотнение или язвочка, преимущественно на нижней губе. В отдельных случаях дефект сопровождается зудом. С развитием патологии могут возникать болезненность, трудности при употреблении пищи, слюнотечение.
По мере прогрессирования онкологического процесса клиническая картина становится более выраженной, боли усиливаются, новообразование увеличивается в размерах, имеет неровные расплывчатые границы.
К общим признакам заболевания можно отнести:
- безболезненное уплотнение, возвышающееся над губой;
- внутри опухоли появляется эрозия или язвочка;
- с прогрессированием опухоли происходит разрушение здоровых окружающих структур, атипичные клетки прорастают на слизистую щек, десен, поражают нижнюю челюсть;
- сверху опухоль покрывается пленкой, под которой виднеются бугристые образования;
- к изъязвлению присоединяется вторичная инфекция.

При метастазах лимфатические узлы увеличиваются в размерах, теряют свою подвижность. Признаками метастазирования рака в легкие становится кашель, затруднение дыхания, болезненность в грудной клетке, откашливание мокроты с кровью.
При отдаленных метастазах отсутствует аппетит, отмечается резкое снижение массы тела, ухудшается общее состояние (слабость, повышение температуры тела).
Диагноз устанавливается с учетом жалоб, результатов внешнего осмотра, а также дополнительных лабораторных и инструментальных исследований. Вначале специалист внимательно осматривает пораженный участок, ротовую полость, пальпирует рядом расположенные лимфатические узлы.
После осмотра назначаются наиболее информативные методы исследования, включающие:
- исследование крови с лейкоцитарной формулой, биохимия;
- ультразвуковое исследование губы, лимфатических узлов, брюшной полости;
- рентгенография нижней челюсти, грудной клетки;
- биопсия с последующим гистологическим исследованием тканей;
- цитологическое исследование материала, взятого с поверхности язвы.

Немецкие специалисты в обязательном порядке проводят дополнительную дифференциальную диагностику для исключения таких патологий, как твердый шанкр, папиллома, лейкоплакия.
Лечение рака губы в Германии
Тактика лечения рака губы в клинике «Вивантес» подбирается в индивидуальном порядке для каждого пациента. Нашими онкологами используются максимально щадящие, безопасные, но в то же время высоко результативные методы лечения, позволяющие на ранних стадиях добиться полного выздоровления.
Консервативное
Лечение рака губы проводится с помощью современных методик консервативной терапии. К числу наиболее востребованных относятся:
- лучевая терапия;
- применение противоопухолевых препаратов последнего поколения;
- гормональная терапия;
- биотерапия.
Хирургическое
Оперативное вмешательство является основным методом терапии и проводится онкохирургами высшей категории с использованием щадящих малоинвазивных техник.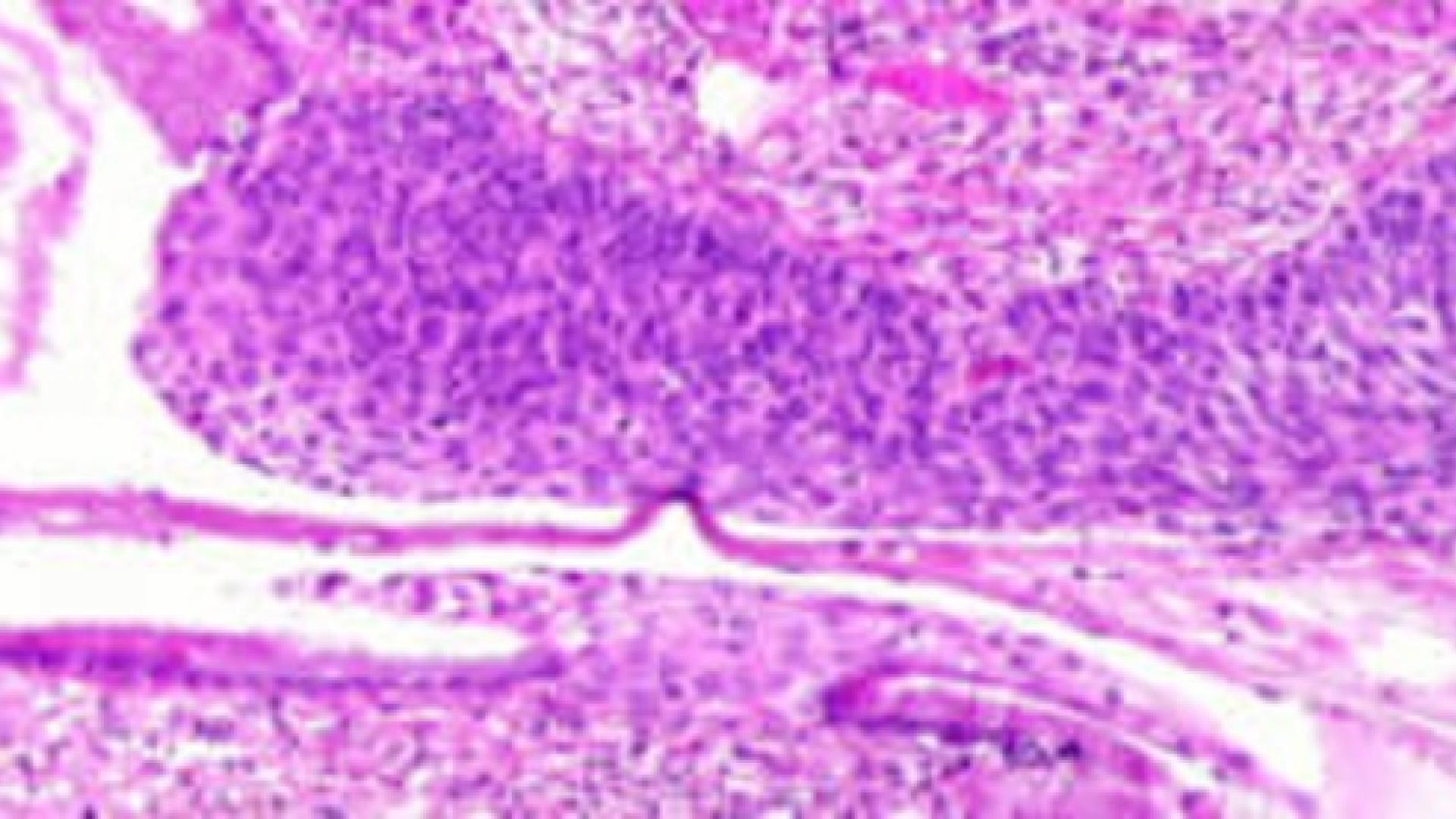 Масштабность хирургического лечения определяется в зависимости от прогрессирования онкологического процесса.
Масштабность хирургического лечения определяется в зависимости от прогрессирования онкологического процесса.
В нашей клинике операции проводятся с помощью инновационных техник, среди которых наиболее актуальны:
- криодеструкция жидким азотом;
- лазерное иссечение;
- кибер-нож.
Благодаря малоинвазивным техникам удается сократить продолжительность восстановительного периода, существенно уменьшить нагрузку на организм. После иссечения опухоли с пациентом работают лучшие челюстно-лицевые хирурги.
Реабилитация
Программа реабилитации разрабатывается отдельно для каждого пациента. С больными работают лучшие психологи и логопеды Германии. Комплексная программа реабилитации позволяет пациенту восстановиться и вернуться к прежнему образу жизни в минимальные сроки.
Доктора
- Определение стадий рака легких, куративная и паллиативная хирургия
- Хирургическое лечение мезотелиомы
- Лазерная хирургия метастазов в легких
- Хирургическое лечение пневмоторакса, плевральной эмпиемы и эмфиземы
- Малоинвазивные операции на органах грудной клетки
- Трахеальная хирургия
- Детская торакальная хирургия
- Интервенционная бронхоскопия, стентирование, лазерная терапия, установка, эндобронхиального клапана
- Видеоконсультация
- Гематология
- Онкология
- Паллиативная медицина
- Гериатрическая онкология
- Видеоконсультация
- Гематология: острый лейкоз, миелодиспластический синдром, лимфомы, миеломная болезнь
- Онкология: рак лёгкого, метастазирующий рак молочной железы, рак желудочно-кишечного тракта (например, злокачественные новообразования толстого кишечника), герминогенные опухоли
- Врач-специалист в области внутренней медицины, гематологии и медицинской онкологии, паллиативной медицины, гемостазиологии
- Видеоконсультация
- Общая травматология
- Лечение политравмы
- Тазовая и вертлужная хирургия
- Травмы позвоночника
- Комплексная травма конечностей
- Лечение перипротезных переломов
- Хирургия опухолей опорно-двигательного аппарата
- Видеоконсультация
- Нервсохраняющая позадилобковая радикальная простатэктомия (микрохирургия)
- Нервсохраняющая цистектомия
- Малоинвазивные методы лечения злокачественных и доброкачественных урологических заболеваний (лапароскопия, ретроперитонеоскопия, лапароскопия единого доступа)
- Восстановительная урохирургия (уретральная хирургия, хирургия простаты)
- Качество жизни онкологических больных, поддерживающая терапия при раке, в частности минимизация побочных эффектов лучевой терапии и химиотерапии
- Оптимизация мультимодальных стратегий лечения онкологических заболеваний, в частности рака молочной железы и легких
- Методы паллиативного радиоонкологического лечения
- Малоинвазивные (лапароскопические) операции при злокачественных и доброкачественных урологических опухолях
- Реконструктивные урологические операции (в особенности на уретре)
- Детская урология (в особенности малоинвазивные операции)
- Центр по лечению злокачественных образований яичника (хирургия и химиотерапия)
- Гинекологическая онкохирургия
- Гинекологическая цитология
- Гинекологическая эндокринология
- Лазерная терапия
- УЗИ DEGUM I
- Акушерство
- Диплом по кольпоскопии (I.
 F.C.P.C.; Europ Fed.Colp) с 2006 года.
F.C.P.C.; Europ Fed.Colp) с 2006 года.
- Применение ПЭТ/КТ при диагностике онкологии, неврологии, инфекций и воспалительных процессов
- ОФЭКТ и ПЭТ при диагностике заболевания Паркинсона и деменеции
- Применение ПЭТ/КТ в нейроонкологии
- Применение ПЭТ/КТ в онкологии
- Диагностика и лечение нейроэндокринных опухолей
- Видеоконсультация
- Маммосонография с высоким разрешением
- Толстоигольная биопсия
- Хирургия рака молочной железы
- Пластическая хирургия груди
- Эстетическая хирургия груди
- Химиотерапия и иммунотерапия
- Комплементарная и естественная медицина
- Акупунктура
- Медицинское питание
- Сертификация роботизированной хирургии Да Винчи
- Квалификация Европейского совета
- Хирургическая онкология
- Лицензия на осуществление хирургии брюшной полости
- Лицензия на осуществление хирургии
- Лицензия на осуществление экстренной медицинской помощи
- Лицензия на осуществление врачебной деятельности
- Внутренние болезни
- Онкология
- Гематология
- Паллиативное лечение
- Хирургия уха
- Функциональные эндоскопические операции пазух носа, хирургия головы и шеи
- Обширный опыт в кохлеарной имплантантации у детей
- Степень магистра медицины в университетской клинике Кигали, Руанда
- Обучение кохлеарному имплантированию в Найроби, Кения и Тарту, Эстония
- Видеоконсультация
- Залобковая нервосберегающая простатэктомия при раке предстательной железы
- Международный эксперт по роботизированной хирургии (хирургический робот Да Винчи)
- Роботизированная лапароскопическая нервосберегающая простатэктомия
- Официальный инспектор компании Intuitive© по повышении квалификации урологов, использующих хирургический робот Да Винчи
- Видеоконсультация
- Дерматология
- Хронические воспалительные заболевания кожи (псориаз, атопический дерматит и др.
 )
) - Аллергология
- Рак кожи
- Эстетическая дерматология
- Детская дерматология
- Надлобковая радикальная простатэктомия с сохранением нервно-сосудистых структур
- Цистэктомия с сохранением нервно-сосудистых структур с формированием мочевого пузыря из петель тонкого кишечника с сохранением функции мочеиспускания или цистэктомии по технологии Mansoura-Pouch
- Хирургическое вмешательство при недержании мочи (искусственный сфинктер мочевого пузыря AMS 800 и AdVanceband)
- Имплантат в кавернозное тело (AMS 700)
- Оперативное лечение недержания мочи (имплантация искусственного сфинктера мочевого пузыря AMS 800 или AdVance Band)
- Оперативное лечение нарушений половой функции у мужчин (установка имплантатов AMS 700 в кавернозные тела полового члена)
- Пневмология / легочная медицина
- Интервенционная пневмология
- Инфекционные заболевания
- Аллергология
- Реаниматология и отлучение от ИВЛ
- Видеоконсультация
- Маммосонография с высоким разрешением
- Толстоигольная биопсия
- Хирургия рака молочной железы
- Пластическая хирургия груди
- Эстетическая хирургия груди
- Химиотерапия и иммунотерапия
- Комплементарная и естественная медицина
- Акупунктура
- Медицинское питание
- Видеоконсультация
- Гинекологическая онкология (яичники, матка, женские наружные половые органы и влагалище):
Хирургическое лечение сложных и прогрессирующих гинекологических онкозаболеваний, в частности первичный и рецидивирующий рак яичников и брюшины
- Хирургия онкологических заболеваний мочеполовой системы
- Радикальная простатэктомия при раке предстательной железы с сохранением нервно-сосудистых структур, отвечающих за поддержание половой функции
- Цистэктомия (удаление мочевого пузыря) с последующим сохранением половой функции, функции удержания мочи и акта мочеиспускания или цистэктомия по методу Mansoura-Pouch
- Малоинвазивная (лапароскопическая) хирургия, включая операции при помощи хирургического робота «Da Vinci»
- Реконструктивная хирургия мочевыводящих путей
- Оперативное лечение опухолей почек (органосохраняющие и малоинвазивные методы лечения)
- Внутренняя медицина
- Гастроэнтерология
- Гепатология
- Инфекционные заболевания
- Интервенционная эндоскопия
- Воспалительные заболевания кишечника
- Вирусный гепатит, хронические заболевания печени, цирроз печени
- Острый и хронический панкреатит
- Диабетология
- Гастроинтестинальная онкология
Методы лечения
Радионуклидная терапия в Германии, лечение лютецием lu177
Узнать большеБеломорская Центральная районная больница.
Статья для общего ознакомления.
Рак (cancer) — злокачественная опухоль, возникающая из клеток эпителия кожи, слизистых оболочек и паренхиматозных органов. Иногда термин «рак» используют для обозначения всех злокачественных новообразований.
Строение опухоли в значительной степени связано со структурно-функциональными особенностями клеток органа или ткани, из которых она развивается. В большинстве случаев в тканях, соприкасающихся с внешней средой (коже, красной кайме губ, слизистой оболочке полости рта, языка, гортани, пищевода, заднего прохода) и покрытых многослойным плоским эпителием, возникает плоскоклеточный (ороговевающий или неороговевающий) рак. Он может также развиваться и в бронхах в результате метаплазии эпителия. Из эпителия желез исходит железистый рак — аденокарцинома. По степени дифференцировки принято выделять высоко-, умеренно, мало и недифференцированные варианты рака.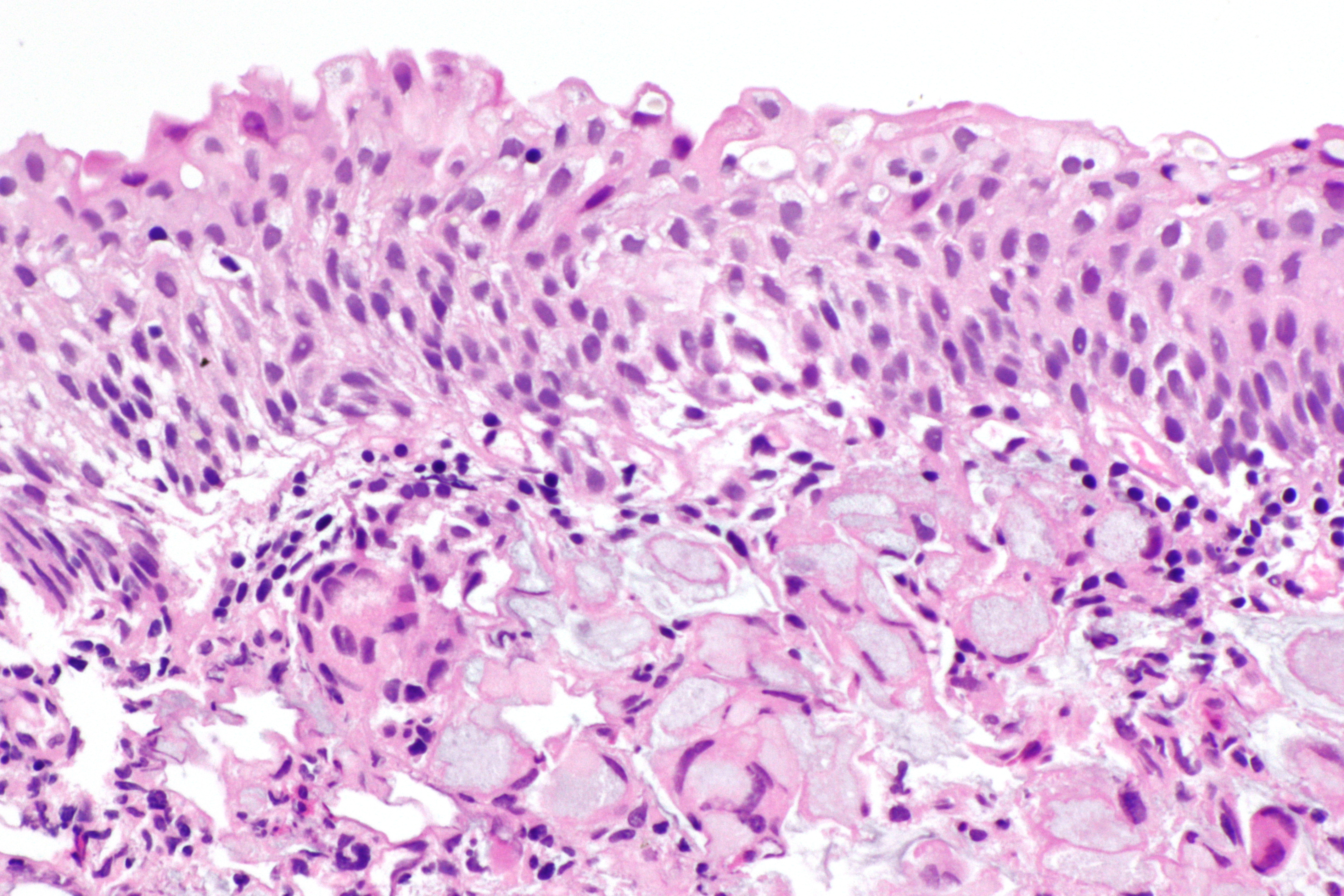
В зависимости от соотношения паренхимы (особенно опухолевых клеток) и стромы, состоящей из соединительной ткани и сосудов, различаютпростой рак, когда паренхима и строма находятся в равном соотношении, медуллярный рак, характеризующийся более развитой паренхимой, и скирр, илифиброзный рак с выраженным преобладанием стромы. Клетки опухоли нередко частично сохраняют функциональные особенности той ткани, из которой они возникли в результате неопластической трансформации, в связи с чем опухоль нередко продуцирует различные вещества (например, слизь), часто в значительном количестве. Некоторыераковые опухоли состоят из клеток, напоминающих клетки органа на различных этапах его развития, в связи с чем возникли такие термины, как «гипернефрома», «гепатоцеллюлярный рак». Сходство некоторых опухолей с эмбриональными тканями явилось причиной появления термина «эмбриональный рак».
Метастазирование в большинстве случаев происходит лимфогенным путем в регионарные или отдаленные лимфатические узлы, однако нередко наблюдается и гематогенное распространение процесса с появлением метастазов в органах и костях.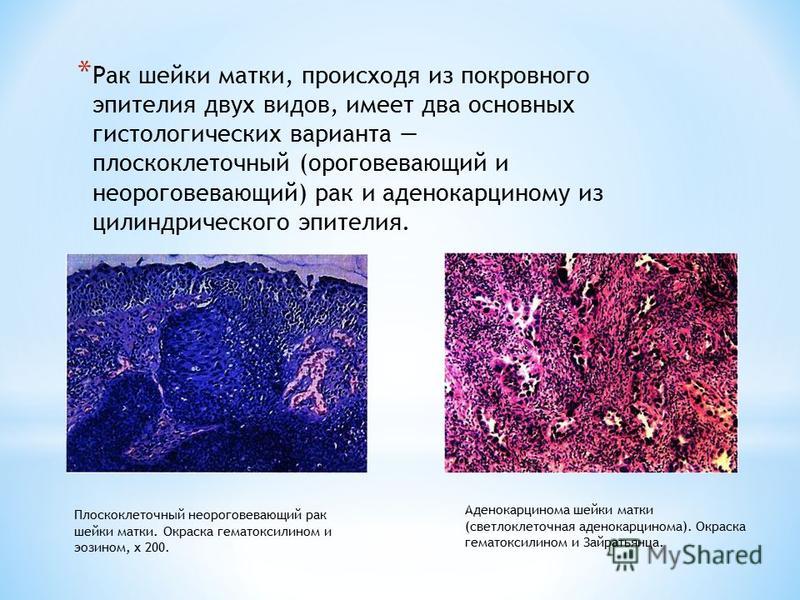 Отмечается своеобразная тропность при метастазировании опухолей некоторых локализаций к определенным органам и тканям. Так, для рака щитовидной, молочной, предстательной железы, а также почки характерны метастазы в кости скелета, рак легкого нередко метастазирует в надпочечники.
Отмечается своеобразная тропность при метастазировании опухолей некоторых локализаций к определенным органам и тканям. Так, для рака щитовидной, молочной, предстательной железы, а также почки характерны метастазы в кости скелета, рак легкого нередко метастазирует в надпочечники.
Симптомы
Клинические проявления рака зависят главным образом от локализации опухоли, ее биологических особенностей (степени дифференцировки, темпов роста), стадии распространения. Симптоматика различна, однако имеется несколько наиболее часто встречающихся и постоянных признаков. К ним можно отнести «беспричинное» похудание, снижение аппетита или изменение его в отношении некоторых пищевых продуктов,немотивированную слабость, нарушение стула, упорный кашель,изменение тембра голоса, постоянные или преходящие боли в груди или животе, «необъяснимые» повышения температуры тела, неприятные ощущения при глотании или прохождении пищи по пищеводу, анемию, появление крови в кале и моче, уплотнений в молочной железе и выделений из соска, выделений из половых путей, в т.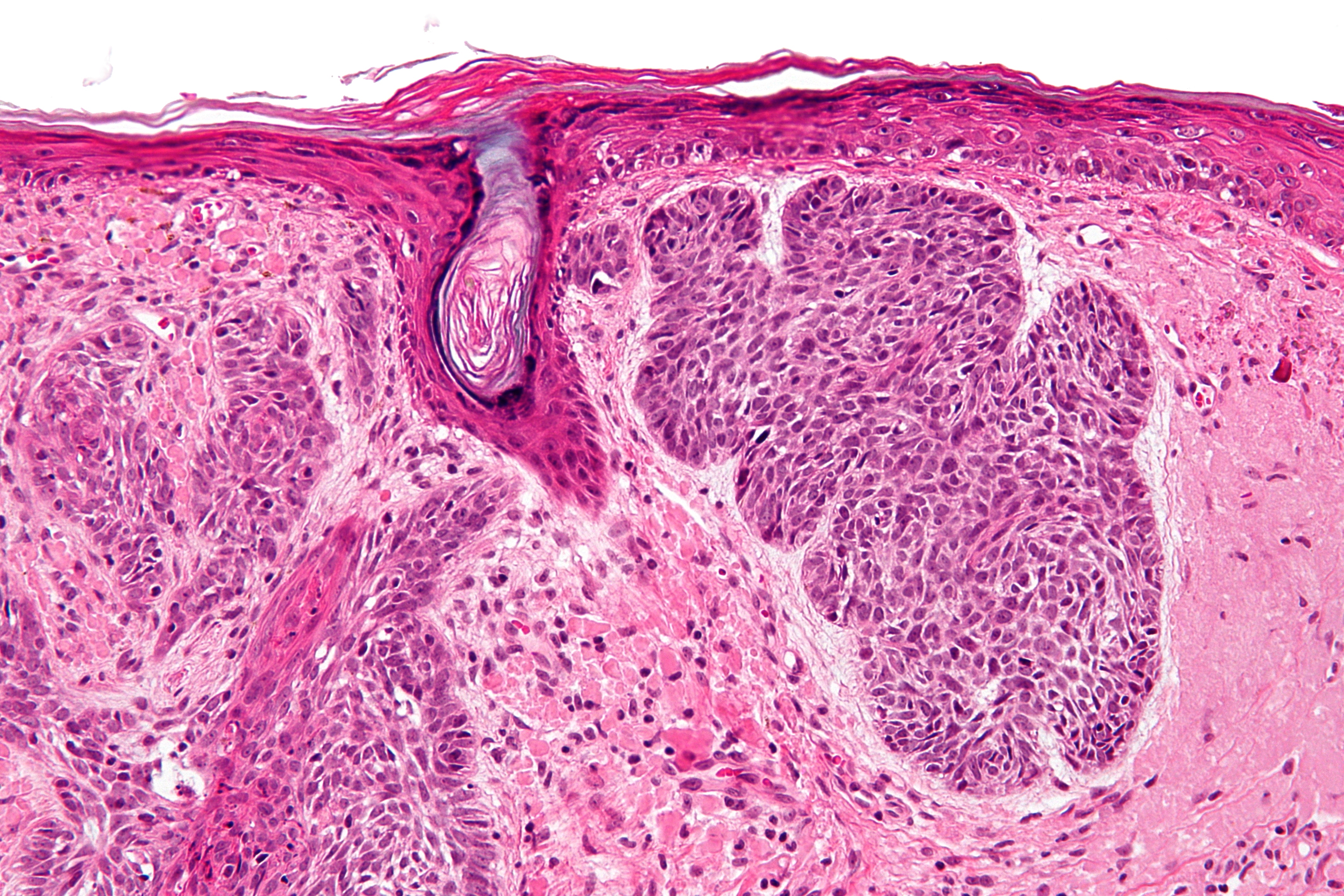 ч. и кровянистых,особенно на фоне менопаузы.
ч. и кровянистых,особенно на фоне менопаузы.
Заподозрить опухоль можно на основании патологических проявлений со стороны других органов и систем (см. Паранеопластические синдромы, Параонкологические дерматозы). При появлении одного или нескольких из этих симптомов (учитывая пол и возраст пациента) необходимо срочно целенаправленно и углубленно обследовать больного. В некоторых случаях первые клинические признаки рака бывают связаны с метастатическим поражением. Например, первичный рак почки может проявиться патологическим переломом длинной трубчатой кости в области метастаза, возникшим в результате умеренной нагрузки или слабой травмы.
Своевременная диагностика рака в значительной мере определяется онкологической настороженностью врача, проводящего первичный прием. Тщательный сбор анамнеза, внимательный осмотр и детальное физикальное обследование позволяют иногда уже и на ранних стадиях заболевания заподозрить наличие рака той или иной локализации и направить пациента на уточняющее диагностическое исследование к соответствующему специалисту или непосредственно вонкологическое учреждение. При этом подтверждающие диагноз цитологическое и гистологическое исследования могут быть произведены амбулаторно.
При этом подтверждающие диагноз цитологическое и гистологическое исследования могут быть произведены амбулаторно.
Диагностика должна быть нацелена на выявление ранних стадий заболевания, так называемых малых раков и преинвазивных форм (carcinoma in situ). Очень важно помнить о существовании группыпредопухолевых заболеваний, при наличии которых наряду с лечением необходимо динамическое наблюдение за больным, что увеличивает возможность раннего выявления рака. Важным моментом в диагностике, особенно для последующего лечения, являетсяопределение стадии процесса в соответствии с принятой классификацией (см. Опухоли).
Лечение
Лечение рака в зависимости от характера опухоли (локализация, строение опухоли, стадия заболевания) предусматривает использование различных методов. Среди хирургических методов кроме радикальных операций в виде иссечения опухоли или ееудаления вместе с пораженным органомширокое распространение получиладеструкция опухоли с помощью низких температур (криодеструкция) илилазерного излучения. Некоторые виды рака чувствительны к действию ионизирующего излучения (см. Лучевая терапия), при других эффективна химиотерапия (см. Противоопухолевые средства).
Некоторые виды рака чувствительны к действию ионизирующего излучения (см. Лучевая терапия), при других эффективна химиотерапия (см. Противоопухолевые средства).
Широкое распространение получило комбинированное лечение с одновременным или последовательным применением различных методов. Так, для закрепления эффекта, а также с целью профилактики метастазов до или после оперативного вмешательства назначают химиотерапию или химиотерапию в сочетании с лучевой терапией. Лечебная тактика определяется индивидуально в зависимости от локализации, форм рака, стадии заболевания и ряда других показателей с учетом наиболее эффективных схем и режимов введения противоопухолевых средств Более подробные сведения о клинических проявлениях, диагностике и лечении рака различной локализации представлены в статьях, посвященных отдельным органам, например Желудок, Кишечник,Легкие, Матка и др.
Прогноз зависит от многих факторов — локализации, стадии, морфологического варианта опухоли, возраста больного. Большое значение для прогноза имеет выявление рака на ранних стадиях его развития, т.к. многие виды рака, например рак кожи, губы, шейки матки, при раннем выявлении и адекватном лечении могут быть полностью излечены.
Большое значение для прогноза имеет выявление рака на ранних стадиях его развития, т.к. многие виды рака, например рак кожи, губы, шейки матки, при раннем выявлении и адекватном лечении могут быть полностью излечены.
Профилактика
Профилактика рака основывается на тех же принципах, что и профилактика всех злокачественных опухолей:
Основные усилия исследователей направлены на разработку критериевранней (в доклинической фазе развития болезни)диагностики опухоли, что может обеспечить максимальный эффект лечебных мероприятий. Одним из путей ранней диагностики опухолей служат массовые профилактические осмотры населения или осуществление массового скрининга среди групп риска (по возрасту, профессиональной вредности) для выявления фоновых заболеваний, предопухолевых состояний и опухолей на ранних стадиях.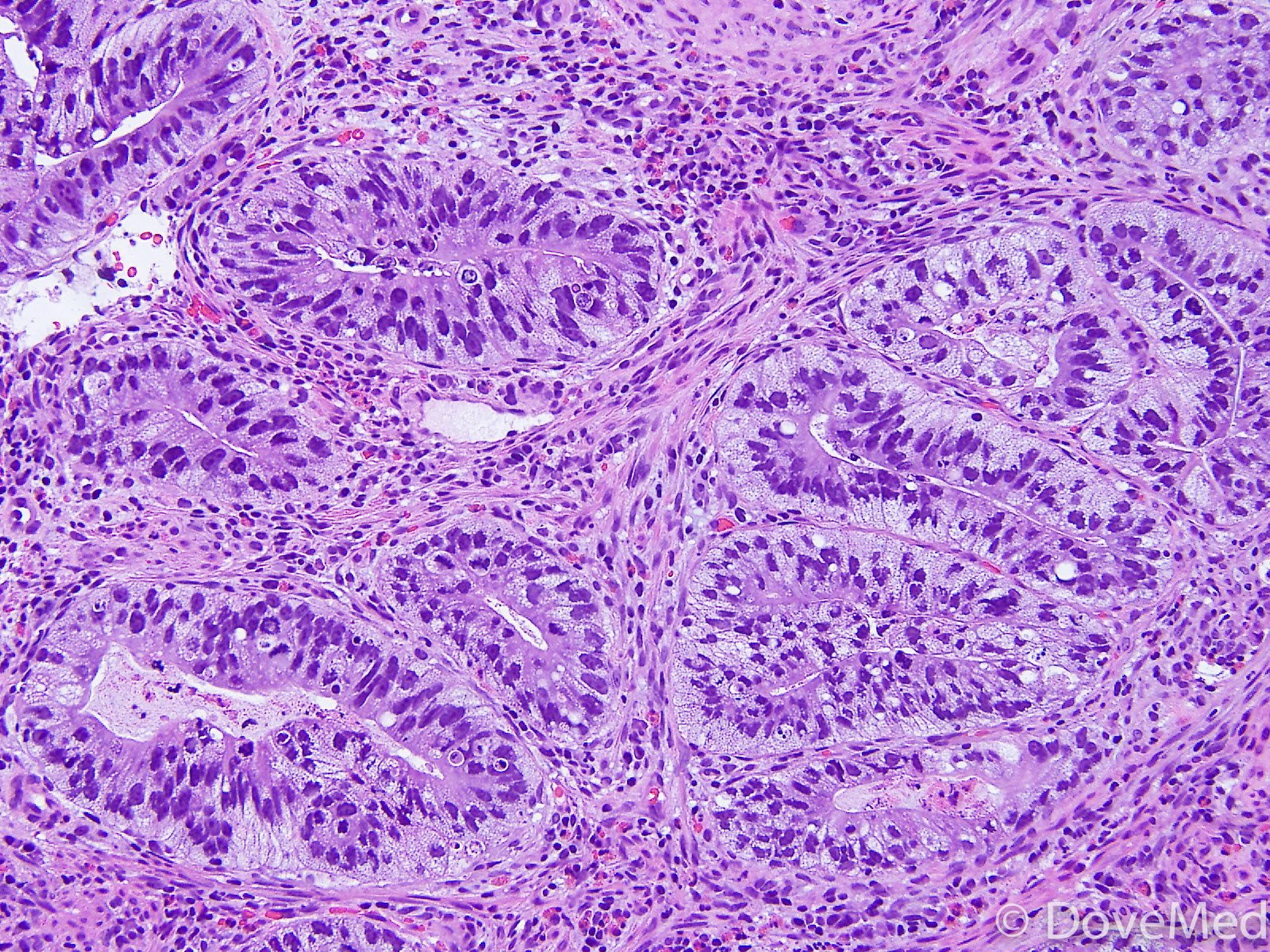 Раннему выявлению наиболее доступны опухоли так называемых визуальных локализаций (т.е. органов видимых и легко пальпируемых): кожи, периферических лимфатических узлов, нижней губы, полости рта, щитовидной железы, молочной железы, шейки матки.
Раннему выявлению наиболее доступны опухоли так называемых визуальных локализаций (т.е. органов видимых и легко пальпируемых): кожи, периферических лимфатических узлов, нижней губы, полости рта, щитовидной железы, молочной железы, шейки матки.
В основе профилактических мероприятий международного и государственного масштаба лежит охрана окружающей среды(воздуха, воды, почвы, продуктов питания, лекарственных средств и др.) от канцерогенных загрязнений. С этой целью заключаются международные договоры и конвенции, издаются специальные законы и регламентирующие акты, внедряются безопасные (чистые) технологии. Индивидуальные меры предусматривают соблюдение здорового образа жизни, включающего главным образом устранение вредных привычек — курения и злоупотребления алкоголем (особенно в отношении опухолей печени, пищевода и желудка), выполнение правил личной, и прежде всего половой, гигиены, имея в виду канцерогенное действие смегмы.
Плоскоклеточный рак миндалин и основания языка без ороговения
Эта статья поможет вам прочитать и понять отчет о патологии некератинизирующейся плоскоклеточной карциномы миндалин и основания языка.
, Джейсон Вассерман, доктор медицинских наук, FRCPC, обновлено 31 декабря 2020 г.
Факты:
- Некератинизирующий плоскоклеточный рак – это тип рака горла, который начинается в миндалинах и у основания языка.
- Миндалины и основание языка являются частью области тела, называемой ротоглоткой.
- Большинство опухолей в этой области вызывается вирусом папилломы человека (ВПЧ).
- Патологоанатомы ищут ВПЧ в раковых клетках, выполняя тест на белок p16.
Миндалины и основание языка
Миндалины и основание языка являются частью области тела, называемой ротоглоткой. Ротоглотка состоит из специальной ткани, которая предназначена для защиты от инфекций, которые могут попытаться проникнуть в наш организм через рот или нос.
Поверхность ротоглотки выстлана плоскими клетками, которые образуют барьер, называемый эпителием.Ткань под эпителием называется стромой. Строма ротоглотки состоит в основном из иммунных клеток, что делает эту ткань очень похожей на лимфатический узел.
Что такое плоскоклеточный рак без ороговения?
Плоскоклеточный рак без ороговения является разновидностью рака горла. Опухоль развивается из плоских клеток эпителия, выстилающего поверхность миндалин и основание языка.
Плоскоклеточный рак без ороговения является наиболее распространенным типом рака миндалин и основания языка.Опухоль называется некератинизацией, потому что опухолевые клетки не подвергаются процессу, называемому ороговением. Этот процесс обычно наблюдается в других опухолях, состоящих из плоских клеток.
Даже если опухоль начинается в горле, раковые клетки обычно распространяются на лимфатические узлы на шее. Перемещение раковых клеток от основной опухоли к лимфатическому узлу или другой области тела называется метастазированием. Когда это произойдет, вы можете заметить аномальную шишку или рост на шее.
Что вызывает плоскоклеточный рак без ороговения?
Большинство случаев некератинизирующего плоскоклеточного рака миндалин и основания языка вызывается вирусом папилломы человека (ВПЧ).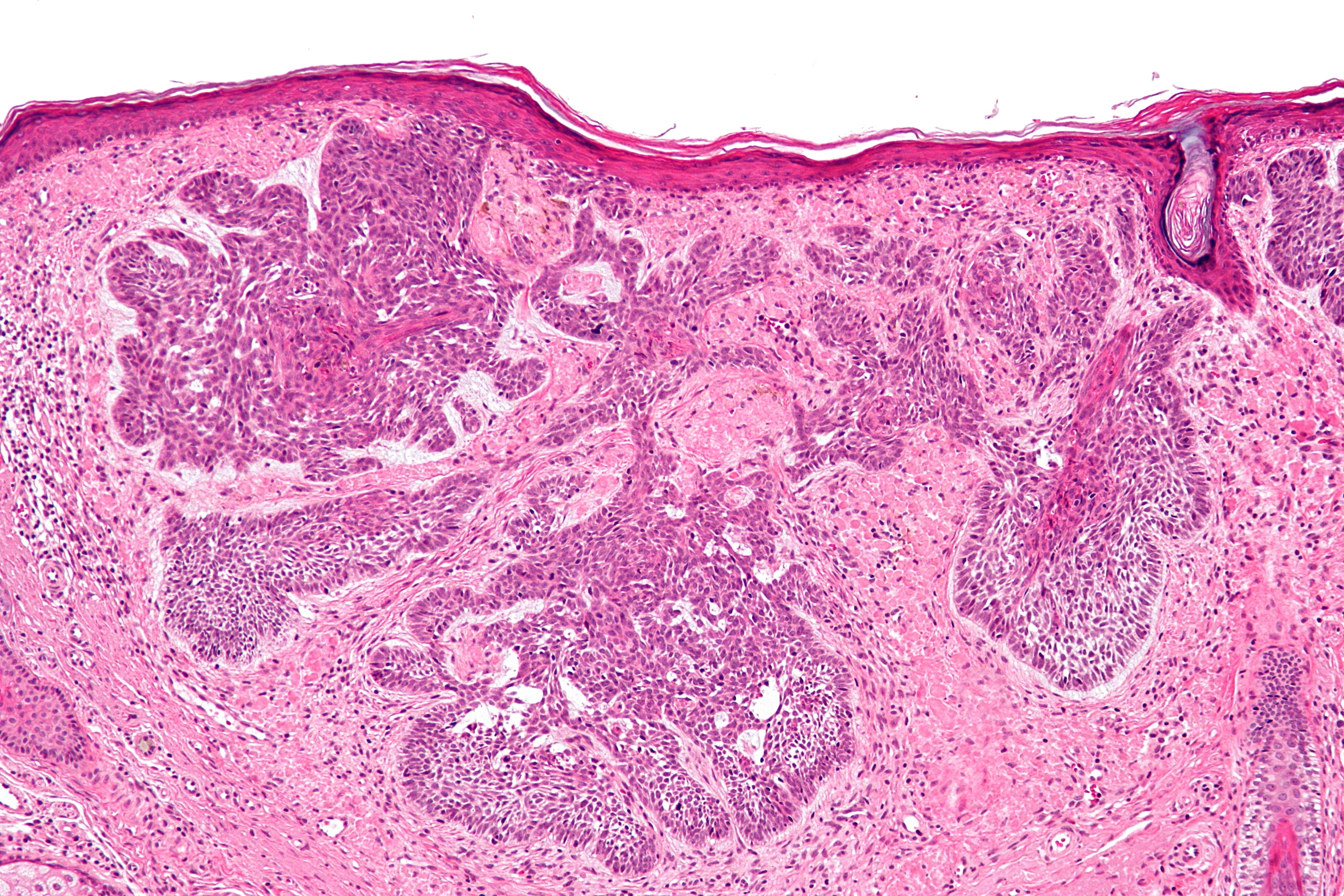 Этот вирус поражает плоскоклеточные клетки и со временем превращает их в раковые.
Этот вирус поражает плоскоклеточные клетки и со временем превращает их в раковые.
Плоскоклеточные клетки, инфицированные ВПЧ, производят большое количество белка, называемого p16, который патологи могут увидеть с помощью теста, называемого иммуногистохимией.
Как патологоанатомы ставят этот диагноз?
Диагноз плоскоклеточного рака без ороговения обычно ставится после удаления небольшого образца ткани в ходе процедуры, называемой биопсией. Биопсия может быть взята с миндалин или основания языка или с шеи.Для подтверждения диагноза и поиска белка p16 внутри опухолевых клеток может быть назначен специальный тест, называемый иммуногистохимией.
Некоторым пациентам может быть проведена операция по удалению всей опухоли. Другие пациенты могут получать лучевую терапию с хирургическим вмешательством по удалению опухоли или без нее. Если опухоль будет удалена, ее отправят патологоанатому, который подготовит новый отчет о патологии.
п16
p16 – это белок, который продуцируется как нормальными, здоровыми клетками, так и опухолевыми клетками. Патологи проводят специальный тест, называемый иммуногистохимией, чтобы увидеть белок p16 внутри клеток.
Патологи проводят специальный тест, называемый иммуногистохимией, чтобы увидеть белок p16 внутри клеток.
Опухоли, состоящие из клеток, которые продуцируют дополнительный p16, описываются как положительные (или реактивные), в то время как опухоли, которые не производят дополнительный p16, считаются отрицательными (нереактивными).
Раковые клетки, инфицированные вирусом папилломы человека (ВПЧ), производят дополнительный p16, который накапливается внутри раковых клеток. По этой причине большинство некератинизирующих плоскоклеточных карцином миндалин и основания языка являются положительными (реактивными) на p16.
Этот результат теста будет использоваться другими вашими врачами для определения вашего лечения, поскольку опухоли с положительным результатом p16 лучше реагируют на облучение по сравнению с опухолями с отрицательным результатом p16.
На что обращать внимание в своем отчете после удаления опухоли
Размер опухоли
Это размер опухоли.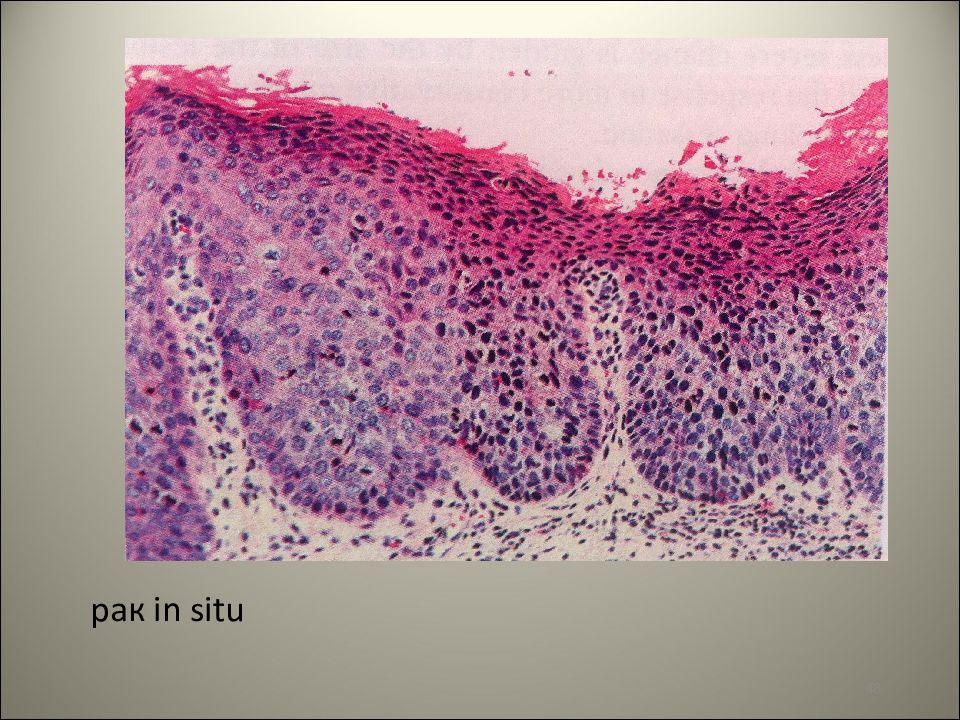 Опухоль обычно измеряется в трех измерениях, но в вашем отчете описывается только самый большой размер. Например, если размер опухоли 4,0 см на 2,0 см на 1.5 см, в вашем отчете будет описана опухоль размером 4,0 см.
Опухоль обычно измеряется в трех измерениях, но в вашем отчете описывается только самый большой размер. Например, если размер опухоли 4,0 см на 2,0 см на 1.5 см, в вашем отчете будет описана опухоль размером 4,0 см.
Размер опухоли используется для определения стадии опухоли (см. «Патологическая стадия» ниже), большие опухоли связаны с худшим прогнозом.
Маржа
Край – это любая ткань, разрезанная хирургом для удаления опухоли из вашего тела. Типы полей, описанные в вашем отчете, будут зависеть от задействованного органа и типа проведенной операции. Поля будут описаны в вашем отчете только после того, как вся опухоль будет удалена.
Предел называется положительным, если опухолевые клетки находятся на самом краю разрезанной ткани. Положительный запас связан с более высоким риском повторения опухоли на том же участке после лечения. Отрицательный край означает, что опухолевые клетки не наблюдались ни на одном из срезанных краев ткани.
Лимфатические узлы
Лимфатические узлы – это небольшие иммунные органы, расположенные по всему телу.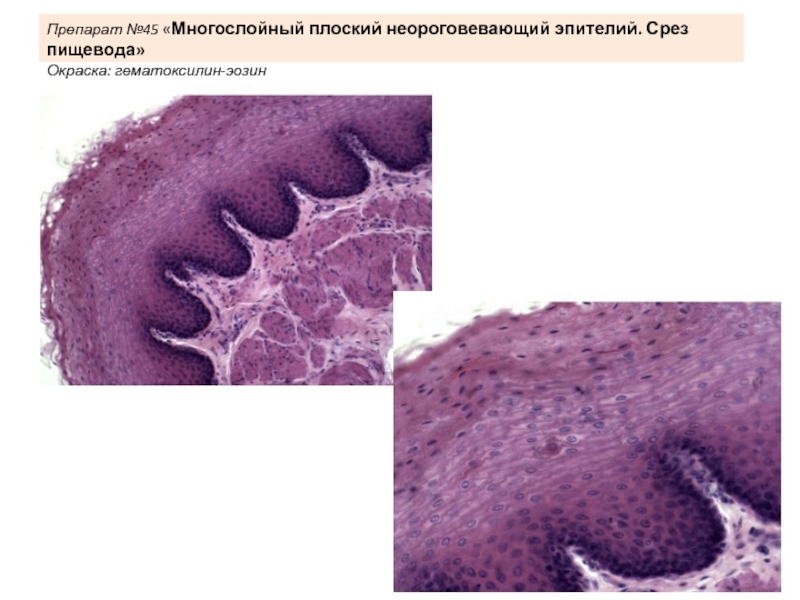 Раковые клетки могут перемещаться из опухоли в лимфатический узел по лимфатическим каналам, расположенным внутри и вокруг опухоли (см. Лимфоваскулярная инвазия выше).Перемещение раковых клеток из опухоли в лимфатический узел называется метастазированием.
Раковые клетки могут перемещаться из опухоли в лимфатический узел по лимфатическим каналам, расположенным внутри и вокруг опухоли (см. Лимфоваскулярная инвазия выше).Перемещение раковых клеток из опухоли в лимфатический узел называется метастазированием.
Лимфатические узлы шеи иногда удаляются одновременно с основной опухолью в ходе процедуры, называемой расслоением шеи. Удаляемые лимфатические узлы обычно берутся из разных областей шеи, и каждая область называется уровнем. Уровни на шее включают 1, 2, 3, 4 и 5. В отчете о патологии часто указывается, сколько лимфатических узлов было обнаружено на каждом уровне, отправленном на обследование.
Лимфатические узлы на той же стороне, что и опухоль, называются ипсилатеральными, а узлы на противоположной стороне опухоли – контралатеральными.
Ваш патолог внимательно исследует каждый лимфатический узел на наличие раковых клеток. Лимфатические узлы, содержащие раковые клетки, часто называют положительными, а те, которые не содержат раковых клеток, – отрицательными. В большинстве отчетов указывается общее количество исследованных лимфатических узлов и количество раковых клеток, если таковые имеются.
В большинстве отчетов указывается общее количество исследованных лимфатических узлов и количество раковых клеток, если таковые имеются.
Количество лимфатических узлов, содержащих раковые клетки, используется для определения узловой стадии (см. «Патологическая стадия» ниже).
Депозит опухоли
Группа раковых клеток внутри лимфатического узла называется отложением опухоли.Если обнаружено отложение опухоли, ваш патолог измерит его, и в вашем отчете будет указано самое крупное обнаруженное отложение опухоли.
Размер самого большого опухолевого отложения важен только для опухолей, не вызванных ВПЧ (p16-отрицательные опухоли). Для этих опухолей более крупные опухолевые отложения связаны с худшим прогнозом. Размер самого большого опухолевого отложения также используется для определения узловой стадии (см. Патологическая стадия ниже).
Экстранодальное расширение (ENE)
Все лимфатические узлы окружены капсулой.Экстранодальное расширение (ENE) означает, что раковые клетки прорвались через капсулу в ткань, окружающую лимфатический узел.
Экстранодальное расширение важно только для опухолей, не вызванных ВПЧ (опухоли с отрицательным p16). Для этих опухолей экстранодальное расширение также связано с более высоким риском развития новых опухолей в области шеи и часто используется вашими врачами для руководства вашим лечением. Экстранодальное расширение также используется для определения узловой стадии (см. Патологическая стадия ниже).
Патологическая стадия (pTNM)
Патологическая стадия плоскоклеточного рака без ороговения основана на системе стадирования TNM, международно признанной системе, первоначально созданной Американским объединенным комитетом по раку.
Эта система использует информацию о первичной опухоли (T), лимфатических узлах (N) и отдаленном метастатическом заболевании (M) для определения полной патологической стадии (pTNM). Ваш патолог исследует представленные ткани и присвоит каждой части номер.В целом, большее число означает более запущенное заболевание и худший прогноз.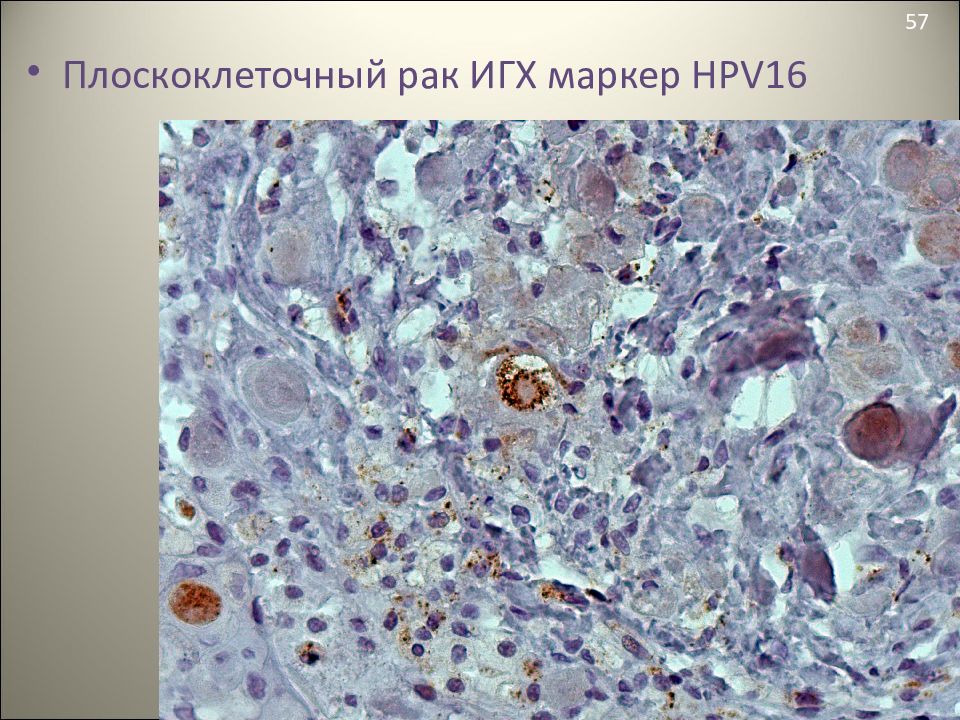
Стадия опухоли (pT) при некератинизирующем плоскоклеточном раке
Некератинизирующий плоскоклеточный рак миндалин и основания языка имеет стадию опухоли от 1 до 4. Стадия опухоли зависит от размера опухоли и от того, разрослась ли опухоль, включив части рта или горла снаружи. ротоглотки.
- T1 – Опухоль 2 см или меньше.
- T2 – Опухоль больше 2 см, но не больше 4 см.
- T3 – Опухоль больше 4 см, но локализуется только в ротоглотке.
- T4 – Опухоль распространилась на ткани за пределами ротоглотки, такие как глубокие мышцы языка, гортани или кость нижней челюсти (нижняя челюсть).
Узловая стадия (pN) плоскоклеточного рака без ороговения
Опухолям, ассоциированным с ВПЧ или положительным по результатам теста на р16, назначается узловая стадия от 0 до 2 в зависимости от количества лимфатических узлов, содержащих раковые клетки.
- N0 – Ни в одном из исследованных лимфатических узлов не обнаружено раковых клеток.

- N1 – Раковые клетки обнаруживаются в 1–4 исследованных лимфатических узлах.
- N2 – Раковые клетки обнаружены более чем в 4 исследованных лимфатических узлах.
Метастатическая стадия (пМ) неороговевающего плоскоклеточного рака
Этим опухолям присваивается метастатическая стадия (пМ), равная 0 или 1, в зависимости от наличия раковых клеток в отдаленных местах тела (например, в легких). Метастатическая стадия может быть назначена только в том случае, если ткань из отдаленного участка отправлена на патологическое исследование.Поскольку эта ткань присутствует редко, стадию метастаза невозможно определить и она указана как pMX.
Некератинизирующая карцинома носоглотки с аденоматозной дифференцировкой
Abstract
Представлен случай некератинизирующей EBV-положительной (EBER-in situ гибридизации) карциномы с аденоматозной дифференцировкой. Пациент – мужчина 40 лет с болезнью T2N2M0, получивший стандартную комбинированную химио- и лучевую терапию с полным исчезновением всей опухоли. Опухолевые клетки были строго положительными по низкомолекулярным цитокератинам (AE1–3), а отдельные клетки экспрессировали цитокератин 20. Не было обнаружено экспрессии цитокератина 5/6, 7, p63, TTF-1, CDX2 или рецептора андрогенов. Не было доказательств рецидива или прогрессирования заболевания при последующем наблюдении через 19 месяцев, которое включало МРТ и ПЭТ-КТ после лечения.
Опухолевые клетки были строго положительными по низкомолекулярным цитокератинам (AE1–3), а отдельные клетки экспрессировали цитокератин 20. Не было обнаружено экспрессии цитокератина 5/6, 7, p63, TTF-1, CDX2 или рецептора андрогенов. Не было доказательств рецидива или прогрессирования заболевания при последующем наблюдении через 19 месяцев, которое включало МРТ и ПЭТ-КТ после лечения.
Ключевые слова: Носоглотка, Карцинома, Аденокарцинома, вирус Эпштейна – Барра
Введение
Большинство (> 90%) некератинизирующих карцином носоглотки (NPC) демонстрируют, помимо ядерного вируса Эпштейна-Барра РНК (EBER), спектр классических гистоморфологических паттернов.Это включает в себя на одном конце опухолевые клетки, расположенные в синцитиальных слоях (модель Regaud), а на другом конце – небольшие гнезда и изолированные злокачественные эпителиальные клетки (схема Шминке), смешанные с различным количеством реактивных лимфоцитов и плазматических клеток. Тем не менее, NPC может демонстрировать множество необычных гистопатологических паттернов, включая веретенообразные клетки, светлые клетки, наличие необычных (типа Рида-Штернберга) опухолевых клеток, неказеозных гранулем, папиллярность, эозинофилию, амилоид и эозинофильные цитоплазматические глобулы [1] . Очень редко NPC могут демонстрировать шнуровидное ретикулярное расположение опухолевых клеток, связанных со значительными миксоидными веществами в строме [2]. Крайне редко NPC могут проявлять аденоматозную дифференцировку [3]. В этом отчете представлен случай NPC с компонентом опухоли, в котором были сформированы аденоматозные структуры. Осведомленность об этом явлении должна помочь в установлении правильного диагноза, когда вы сталкиваетесь с ограниченным биоптатом у NPC с этим необычным паттерном.
Очень редко NPC могут демонстрировать шнуровидное ретикулярное расположение опухолевых клеток, связанных со значительными миксоидными веществами в строме [2]. Крайне редко NPC могут проявлять аденоматозную дифференцировку [3]. В этом отчете представлен случай NPC с компонентом опухоли, в котором были сформированы аденоматозные структуры. Осведомленность об этом явлении должна помочь в установлении правильного диагноза, когда вы сталкиваетесь с ограниченным биоптатом у NPC с этим необычным паттерном.
Анамнез / клинические результаты
Пациент – ранее здоровый мужчина, которому был поставлен диагноз карцинома носоглотки (NPC) стадии T2N2M0 (рис.а, б). Его лечили стандартной комбинацией одновременной химио- и лучевой терапии. Нет никаких доказательств рецидива или прогрессирования заболевания при последующем наблюдении через 19 месяцев, которое включало МРТ и ПЭТ-КТ после лечения.
Исследование с помощью магнитно-резонансной томографии у пациента с некератинизирующей карциномой носоглотки с аденоматозной дифференцировкой, показывающей местнораспространенную опухоль с парафарингеальным расширением ( a ) и двусторонним узловым метастатическим заболеванием ( b )
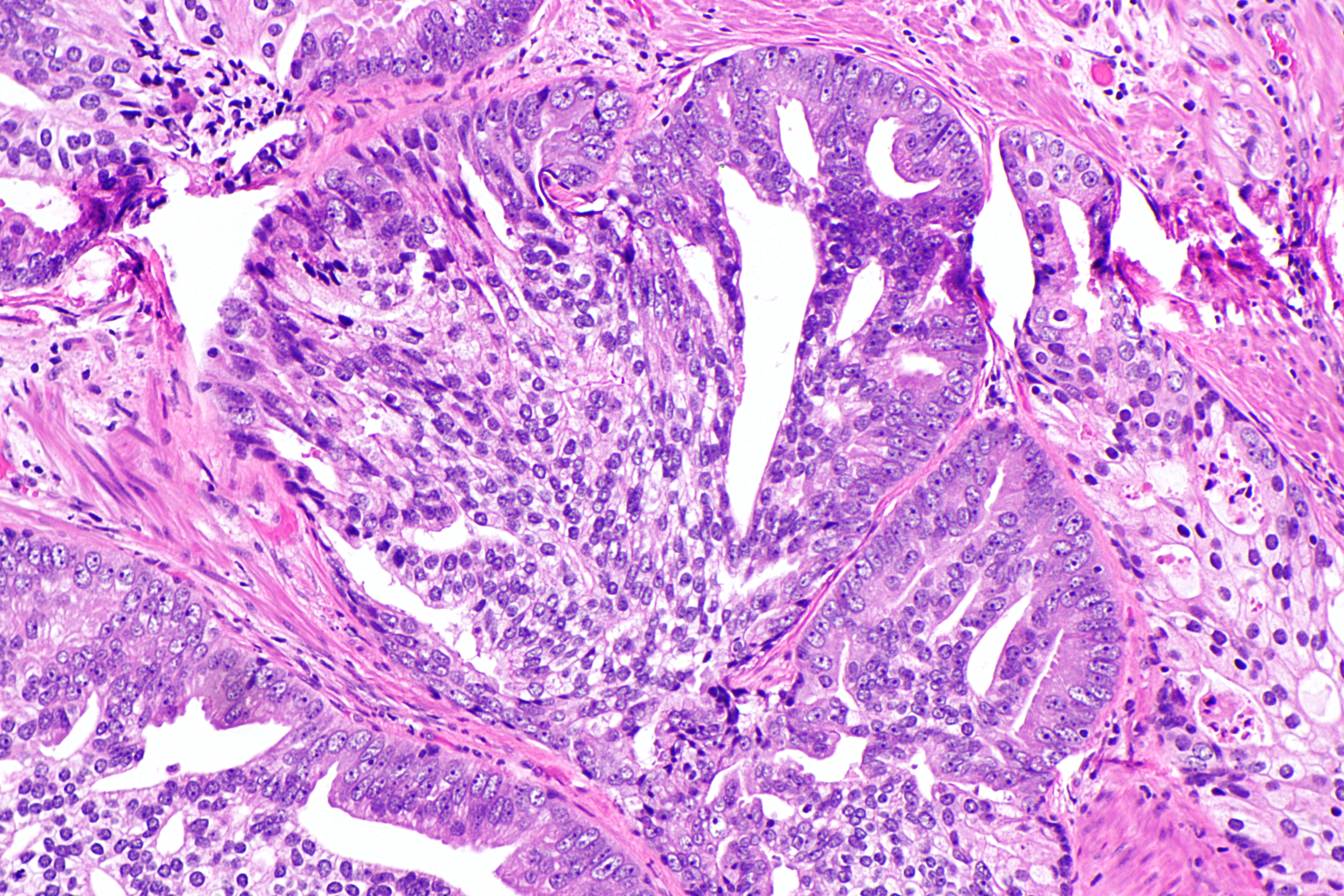
Гистопатология, иммуногистология и иммуногистология Гибридизация
Биопсийный материал состоял из трех фрагментов ткани в диапазоне от 0.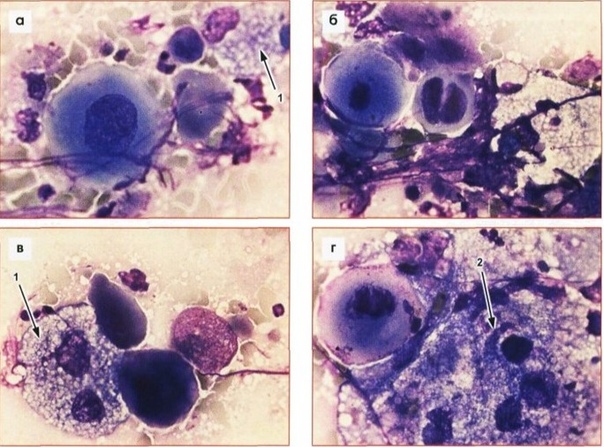 От 2 до 0,4 см. Два из этих фрагментов содержали опухоль, которая состояла из гнезд неопластических клеток различного размера, расположенных в фиброзной строме с тяжелым лимфоцитарным компонентом. При среднем увеличении можно было заметить, что опухоль имела просветные структуры (рис. А). При более высоком увеличении это впечатление подтвердилось, и было также очевидно, что структуры просвета выстланы неопластическими эпителиальными клетками, где ядра поляризованы от структуры просвета, то есть соответствуют критериям истинного образования просвета (рис.б). Опухолевые клетки имели увеличенные, умеренно плеоморфные ядра с выступающими ядрышками. Количество цитоплазмы было ограничено, и митотические фигуры легко определялись. Не было ни некроза, ни дисплазии высокой степени в выстилающем поверхностном эпителии, который был плоскоклеточным.
От 2 до 0,4 см. Два из этих фрагментов содержали опухоль, которая состояла из гнезд неопластических клеток различного размера, расположенных в фиброзной строме с тяжелым лимфоцитарным компонентом. При среднем увеличении можно было заметить, что опухоль имела просветные структуры (рис. А). При более высоком увеличении это впечатление подтвердилось, и было также очевидно, что структуры просвета выстланы неопластическими эпителиальными клетками, где ядра поляризованы от структуры просвета, то есть соответствуют критериям истинного образования просвета (рис.б). Опухолевые клетки имели увеличенные, умеренно плеоморфные ядра с выступающими ядрышками. Количество цитоплазмы было ограничено, и митотические фигуры легко определялись. Не было ни некроза, ни дисплазии высокой степени в выстилающем поверхностном эпителии, который был плоскоклеточным.
Микрофотографии срезов, окрашенных гематоксилином и эозином, выявили уже при увеличении средней мощности наличие просветных структур ( a ). Увеличение с большим увеличением показало истинные структуры просвета с ядрами неопластических клеток, поляризованными от просвета ( b )
Увеличение с большим увеличением показало истинные структуры просвета с ядрами неопластических клеток, поляризованными от просвета ( b )
При иммуногистохимии опухолевые клетки показали сильную маркировку цитокератинов широкого спектра (CK; AE1 / 3).Несколько спорадических опухолевых клеток экспрессировали СК20. Не было экспрессии CK7, CK5 / 6, CDX2, TTF-1, p63 и рецептора андрогенов.
При гибридизации in-situ EBV (EBER) с 3,3′-диаминобензидином (DAB) в качестве хромогена наблюдался диффузный сильный положительный ядерный сигнал, который подчеркивал просветные структуры (рис. A, b).
Опухолевые клетки были диффузно и сильно положительными в отношении EBV при гибридизации in situ для EBER ( a ). При большом увеличении выделено образование истинного просвета ( b )
Диагноз
Некератинизирующая карцинома с аденоматозной дифференцировкой.
Обсуждение
Некератинизирующие NPC могут иметь ряд необычных гистопатологических особенностей. В этом отчете представлен случай NK-NPC с аденоматозной дифференцировкой. ВОЗ классифицирует NPC на ороговевшие (плоскоклеточные), некератинизирующие (включая дифференцированные и недифференцированные варианты) и базалоидные (плоскоклеточные) типы рака. Это не чисто «гистологическая» система классификации, но, помимо морфологии, она также включает эпидемиологические, вирусологические и прогностические / терапевтические аспекты [4].Значительно более высокая заболеваемость NK-NPC среди китайцев, особенно в Южном Китае и Юго-Восточной Азии, в основном приписывается некератинизирующему типу, который почти на 100% связан с ВЭБ и характеризуется заметной чувствительностью к лучевой терапии [1] . NK-NPC обычно содержит заметный реактивный лимфоплазмоцитарный инфильтрат, и до тех пор, пока опухоль ограничена лимфоидным отделом носоглотки, злокачественные клетки обычно не вызывают десмопластического стромального ответа.Когда лимфоплазмоцитарный инфильтрат особенно заметен, а неопластические эпителиальные клетки демонстрируют небольшое распределение вложенных или индивидуальных клеток, это было обозначено как паттерн Рего.
В этом отчете представлен случай NK-NPC с аденоматозной дифференцировкой. ВОЗ классифицирует NPC на ороговевшие (плоскоклеточные), некератинизирующие (включая дифференцированные и недифференцированные варианты) и базалоидные (плоскоклеточные) типы рака. Это не чисто «гистологическая» система классификации, но, помимо морфологии, она также включает эпидемиологические, вирусологические и прогностические / терапевтические аспекты [4].Значительно более высокая заболеваемость NK-NPC среди китайцев, особенно в Южном Китае и Юго-Восточной Азии, в основном приписывается некератинизирующему типу, который почти на 100% связан с ВЭБ и характеризуется заметной чувствительностью к лучевой терапии [1] . NK-NPC обычно содержит заметный реактивный лимфоплазмоцитарный инфильтрат, и до тех пор, пока опухоль ограничена лимфоидным отделом носоглотки, злокачественные клетки обычно не вызывают десмопластического стромального ответа.Когда лимфоплазмоцитарный инфильтрат особенно заметен, а неопластические эпителиальные клетки демонстрируют небольшое распределение вложенных или индивидуальных клеток, это было обозначено как паттерн Рего.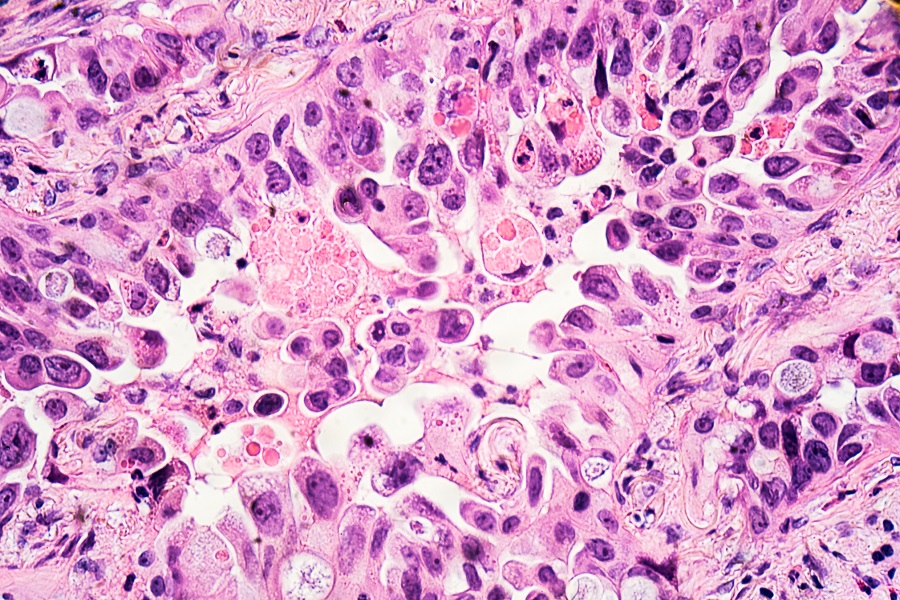 На другом конце классического спектра NK-NPC злокачественные клетки расположены в синцитиальных слоях, и это исторически приписывалось Schminke. Однако NK-NPC может демонстрировать особенности светового микроскопа, которые радикально отличаются от этого стандартного «внешнего вида учебника». Значительное гистологическое разнообразие NK-NPC хорошо известно патологам в Китае и Юго-Восточной Азии.Фактически, до первой (1978 г.) попытки ВОЗ рационализировать и упростить классификацию NPC в Азии существовало множество терминов и несколько систем классификации [5–7]. Нечасто встречающиеся морфологические варианты NK-NPC включают опухоли с веретеновыми клетками, светлые клетки, плеоморфные (подобные Риду – Штернбергу) клетки, десмопластическую строму, гранулематозный компонент, эозинофильные цитоплазматические глобулы, выраженную стромальную эозинофилию, амилоид, а также выраженную папиллярность [1] . Очень редко встречается ретикулярный миксоидный узор [2].Насколько мне известно, было только одно предыдущее сообщение о двух пациентах с NK-NPC, показывающих аденоматозную, «железистую» дифференцировку [3].
На другом конце классического спектра NK-NPC злокачественные клетки расположены в синцитиальных слоях, и это исторически приписывалось Schminke. Однако NK-NPC может демонстрировать особенности светового микроскопа, которые радикально отличаются от этого стандартного «внешнего вида учебника». Значительное гистологическое разнообразие NK-NPC хорошо известно патологам в Китае и Юго-Восточной Азии.Фактически, до первой (1978 г.) попытки ВОЗ рационализировать и упростить классификацию NPC в Азии существовало множество терминов и несколько систем классификации [5–7]. Нечасто встречающиеся морфологические варианты NK-NPC включают опухоли с веретеновыми клетками, светлые клетки, плеоморфные (подобные Риду – Штернбергу) клетки, десмопластическую строму, гранулематозный компонент, эозинофильные цитоплазматические глобулы, выраженную стромальную эозинофилию, амилоид, а также выраженную папиллярность [1] . Очень редко встречается ретикулярный миксоидный узор [2].Насколько мне известно, было только одно предыдущее сообщение о двух пациентах с NK-NPC, показывающих аденоматозную, «железистую» дифференцировку [3]. Это исследование включало двух мужчин европеоидной расы – одному 58 лет, другому 56. У обоих были метастазы в шейных лимфатических узлах. Один из пациентов прошел курс комбинированной лучевой и химиотерапии и был жив без признаков заболевания через 3 года наблюдения. Другой пациент получил только лучевую терапию носоглотки и шеи. У него появились метастазы в легких, и он умер через 2 года после обращения.Ткань опухоли обоих пациентов содержала два разных образца, каждый из которых затрагивал примерно 50% объема опухоли. Эти два разных компонента были (1) компонентом обычной недифференцированной карциномы и (2) компонентом, образующим просвет / железу, с ядрами злокачественных клеток, поляризованными от просвета. Судя по описанию и иллюстрациям, не было выявлено значительных различий в цитоморфологических характеристиках между двумя компонентами. Обе опухоли содержали заметный лимфоцитарный инфильтрат.Оба компонента в обеих опухолях были положительными в отношении EBV (EBER) при гибридизации in situ .
Это исследование включало двух мужчин европеоидной расы – одному 58 лет, другому 56. У обоих были метастазы в шейных лимфатических узлах. Один из пациентов прошел курс комбинированной лучевой и химиотерапии и был жив без признаков заболевания через 3 года наблюдения. Другой пациент получил только лучевую терапию носоглотки и шеи. У него появились метастазы в легких, и он умер через 2 года после обращения.Ткань опухоли обоих пациентов содержала два разных образца, каждый из которых затрагивал примерно 50% объема опухоли. Эти два разных компонента были (1) компонентом обычной недифференцированной карциномы и (2) компонентом, образующим просвет / железу, с ядрами злокачественных клеток, поляризованными от просвета. Судя по описанию и иллюстрациям, не было выявлено значительных различий в цитоморфологических характеристиках между двумя компонентами. Обе опухоли содержали заметный лимфоцитарный инфильтрат.Оба компонента в обеих опухолях были положительными в отношении EBV (EBER) при гибридизации in situ .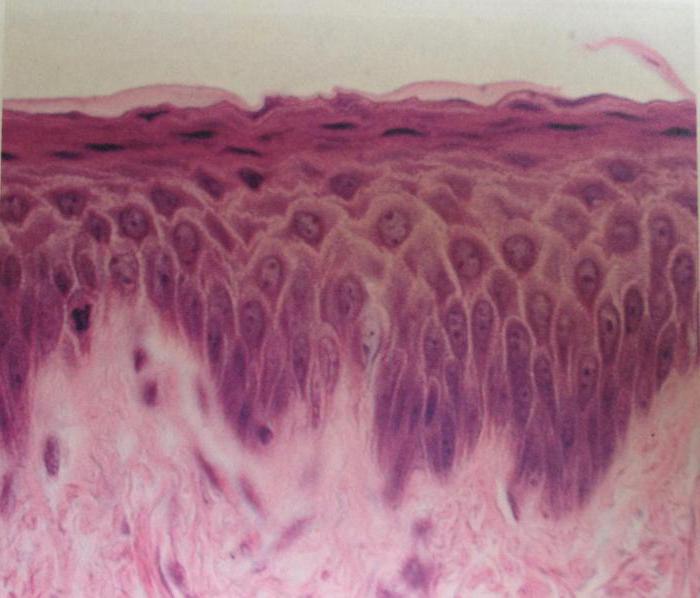 Авторы также предоставили электронную микроскопию для получения светового микроскопа оттиска истинной аденоматозной дифференцировки. Неопластические клетки, выстилающие просвет, имели большую часть цитоплазмы по направлению к просвету, отображали микроворсинки с мелкозернистым гликокаликсом и терминальную сеть микрофиламентов и соединительных комплексов между соседними клетками, которые были идентифицированы в апикальной части цитоплазмы.За исключением того, что аденоматозный компонент составлял более 50% объема опухоли в представленном здесь случае, существует значительное сходство между фактическим случаем и ранее описанными опухолями. Все опухоли были EBV-положительными, содержали значительный лимфоцитарный компонент и при адекватном лечении, то есть при комбинированной химио- и лучевой терапии давали положительный ответ на разрешение всех опухолей, включая узловую болезнь шеи. Такой ответ на лечение также наблюдался у представленного здесь пациента, у которого также было двустороннее и выраженное метастатическое заболевание в шейные узлы.
Авторы также предоставили электронную микроскопию для получения светового микроскопа оттиска истинной аденоматозной дифференцировки. Неопластические клетки, выстилающие просвет, имели большую часть цитоплазмы по направлению к просвету, отображали микроворсинки с мелкозернистым гликокаликсом и терминальную сеть микрофиламентов и соединительных комплексов между соседними клетками, которые были идентифицированы в апикальной части цитоплазмы.За исключением того, что аденоматозный компонент составлял более 50% объема опухоли в представленном здесь случае, существует значительное сходство между фактическим случаем и ранее описанными опухолями. Все опухоли были EBV-положительными, содержали значительный лимфоцитарный компонент и при адекватном лечении, то есть при комбинированной химио- и лучевой терапии давали положительный ответ на разрешение всех опухолей, включая узловую болезнь шеи. Такой ответ на лечение также наблюдался у представленного здесь пациента, у которого также было двустороннее и выраженное метастатическое заболевание в шейные узлы.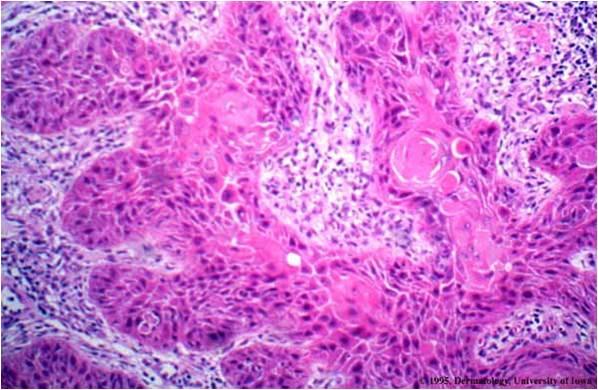 За исключением поляризации от просвета, цитологические особенности в случае, представленном здесь, были в пределах спектра, наблюдаемого в обычных некератинизирующих NK-NPC; высокое ядерно-цитоплазматическое соотношение, увеличенные умеренно плеоморфные ядра и выступающие ядрышки. Кроме того, в случаях, описанных Jain et al. между клетками в аденоматозном и недифференцированном компонентах не было обнаружено значительных световых микроскопических различий.
За исключением поляризации от просвета, цитологические особенности в случае, представленном здесь, были в пределах спектра, наблюдаемого в обычных некератинизирующих NK-NPC; высокое ядерно-цитоплазматическое соотношение, увеличенные умеренно плеоморфные ядра и выступающие ядрышки. Кроме того, в случаях, описанных Jain et al. между клетками в аденоматозном и недифференцированном компонентах не было обнаружено значительных световых микроскопических различий.
По иммуногистохимии большинство NK-NPC проявляют плоскоклеточный фенотип с экспрессией p63 / p40 и CK5 / 6.Эти маркеры не изучались в случаях, описанных Jain et al. Однако в представленном здесь случае не было экспрессии p63 или CK5 / 6. Была очаговая экспрессия CK20, но не CK7. Предположительно, какой бы механизм ни стоял за «фенотипическим дрейфом» в сторону аденоматозной морфологии, это, вероятно, связано с отсутствием экспрессии плоских маркеров. Принимая во внимание ответ на лечение, указанный выше, это, вероятно, не имеет отношения к биологическим свойствам опухоли NK-NPC с аденоматозной дифференцировкой.
Интересно, что в исследовании, проведенном в Тайване, эндемичном регионе для NPC, было исследовано присутствие EBV (EBER-ISH) в том, что авторы назвали карциномой типа носоглотки слюнных желез [8]. Авторы выявили 15 случаев среди 1193 NPC, диагностированных за 5 лет. Из этих случаев 15 были мукоэпидермоидными карциномами (MEC), из которых пять были EBV-положительными, две аденоидно-кистозные карциномы, обе EBV-отрицательные, четыре аденокарциномы, из которых три были EBV-положительными и одна комбинированная опухоль (недифференцированная / аденокарцинома).Составная опухоль поразительно похожа на опухоли, представленные Jain et al. Чистые аденокарциномы подробно не описаны и не проиллюстрированы. Следовательно, возможно, что три EBV-положительных случая могут представлять собой примеры опухоли, представленной в настоящем документе, т.е. что они могут быть некератинизирующими карциномами с аденоматозной дифференцировкой, а не аденокарциномами типа добросовестных слюнных желез. Следует отметить, что аденокарциноматозный случай с отрицательным результатом ВЭБ содержал папиллярные структуры, которые не наблюдались в трех EBV-положительных опухолях и не наблюдались в фактическом случае.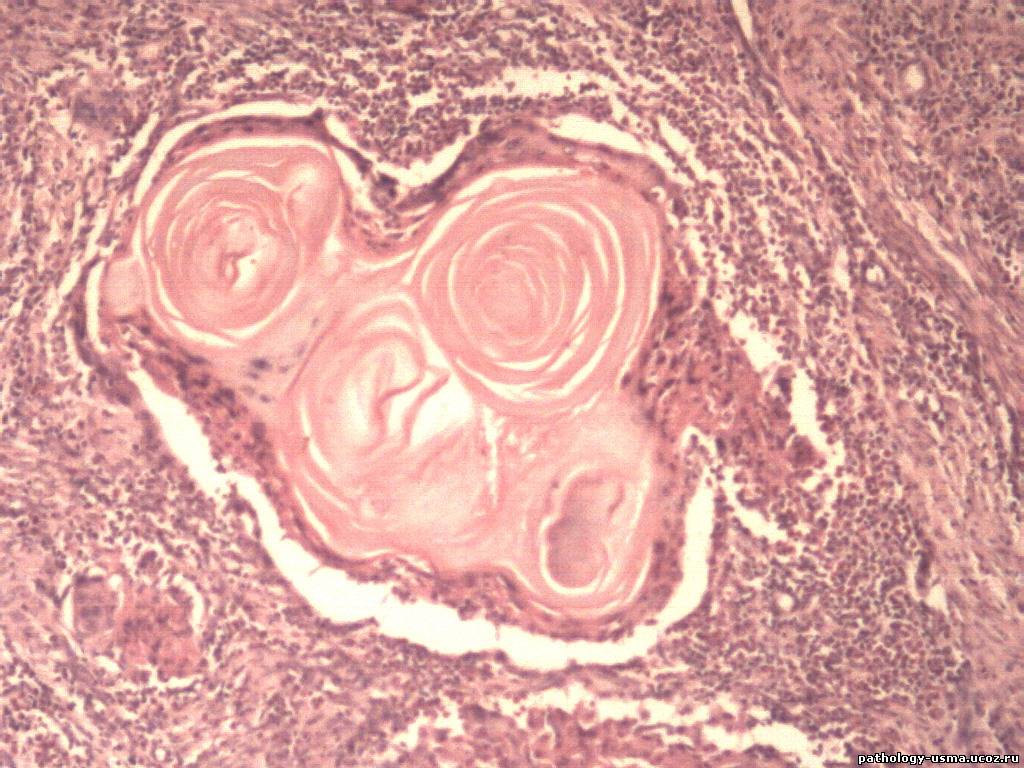 Напротив, основываясь на описании и иллюстрациях, MECs кажутся подлинными примерами этой опухоли, а не NK-NPC с необычным световым микроскопом. Однако нет молекулярно-генетических данных, например Были представлены транслокации CRTC1 / 3 / MAML2. Интересно, что ни у одного из пациентов с последующим наблюдением не было рецидива и / или прогрессирования опухоли.
Напротив, основываясь на описании и иллюстрациях, MECs кажутся подлинными примерами этой опухоли, а не NK-NPC с необычным световым микроскопом. Однако нет молекулярно-генетических данных, например Были представлены транслокации CRTC1 / 3 / MAML2. Интересно, что ни у одного из пациентов с последующим наблюдением не было рецидива и / или прогрессирования опухоли.
В заключение представлен пациент с EBV-положительным некератинизирующим NPC с аденоматозной дифференцировкой. Опухоль показала как рентгенологические, так и клинические признаки, типичные для NPC, включая полное исчезновение всей опухоли с помощью стандартной комбинированной химио- и лучевой терапии, несмотря на локорегионально распространенное заболевание.
Некератинизирующая карцинома носоглотки с аденоматозной дифференцировкой
Abstract
Представлен случай некератинизирующей EBV-положительной (EBER-in situ гибридизации) карциномы с аденоматозной дифференцировкой. Пациент – мужчина 40 лет с болезнью T2N2M0, получивший стандартную комбинированную химио- и лучевую терапию с полным исчезновением всей опухоли.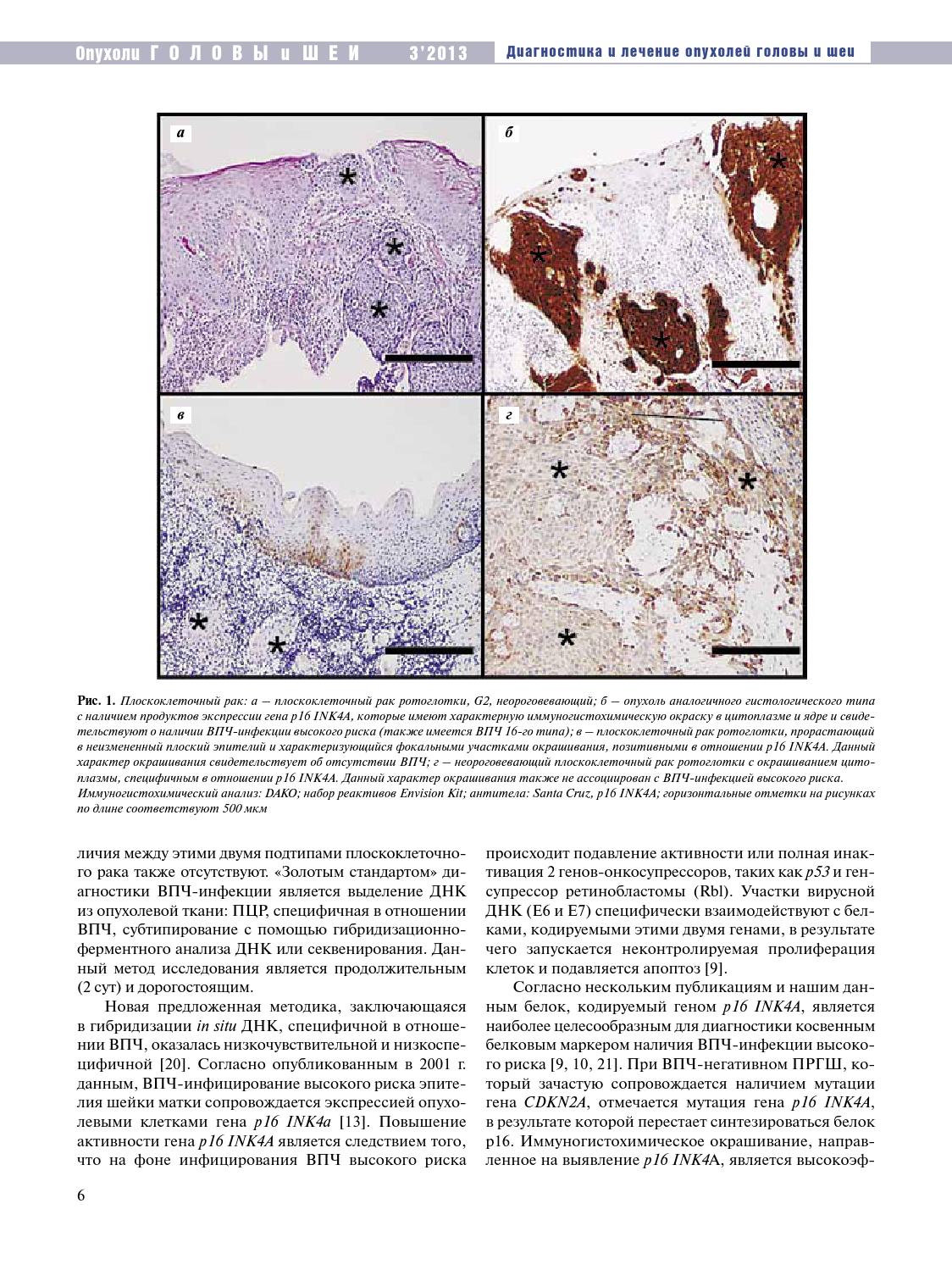 Опухолевые клетки были строго положительными по низкомолекулярным цитокератинам (AE1–3), а отдельные клетки экспрессировали цитокератин 20.Не было обнаружено экспрессии цитокератина 5/6, 7, p63, TTF-1, CDX2 или рецептора андрогенов. Не было доказательств рецидива или прогрессирования заболевания при последующем наблюдении через 19 месяцев, которое включало МРТ и ПЭТ-КТ после лечения.
Опухолевые клетки были строго положительными по низкомолекулярным цитокератинам (AE1–3), а отдельные клетки экспрессировали цитокератин 20.Не было обнаружено экспрессии цитокератина 5/6, 7, p63, TTF-1, CDX2 или рецептора андрогенов. Не было доказательств рецидива или прогрессирования заболевания при последующем наблюдении через 19 месяцев, которое включало МРТ и ПЭТ-КТ после лечения.
Ключевые слова: Носоглотка, Карцинома, Аденокарцинома, вирус Эпштейна – Барра
Введение
Большинство (> 90%) некератинизирующих карцином носоглотки (NPC) демонстрируют, помимо ядерного вируса Эпштейна-Барра РНК (EBER), спектр классических гистоморфологических паттернов.Это включает в себя на одном конце опухолевые клетки, расположенные в синцитиальных слоях (модель Regaud), а на другом конце – небольшие гнезда и изолированные злокачественные эпителиальные клетки (схема Шминке), смешанные с различным количеством реактивных лимфоцитов и плазматических клеток. Тем не менее, NPC может демонстрировать множество необычных гистопатологических паттернов, включая веретенообразные клетки, светлые клетки, наличие необычных (типа Рида-Штернберга) опухолевых клеток, неказеозных гранулем, папиллярность, эозинофилию, амилоид и эозинофильные цитоплазматические глобулы [1] . Очень редко NPC могут демонстрировать шнуровидное ретикулярное расположение опухолевых клеток, связанных со значительными миксоидными веществами в строме [2]. Крайне редко NPC могут проявлять аденоматозную дифференцировку [3]. В этом отчете представлен случай NPC с компонентом опухоли, в котором были сформированы аденоматозные структуры. Осведомленность об этом явлении должна помочь в установлении правильного диагноза, когда вы сталкиваетесь с ограниченным биоптатом у NPC с этим необычным паттерном.
Очень редко NPC могут демонстрировать шнуровидное ретикулярное расположение опухолевых клеток, связанных со значительными миксоидными веществами в строме [2]. Крайне редко NPC могут проявлять аденоматозную дифференцировку [3]. В этом отчете представлен случай NPC с компонентом опухоли, в котором были сформированы аденоматозные структуры. Осведомленность об этом явлении должна помочь в установлении правильного диагноза, когда вы сталкиваетесь с ограниченным биоптатом у NPC с этим необычным паттерном.
Анамнез / клинические результаты
Пациент – ранее здоровый мужчина, которому был поставлен диагноз карцинома носоглотки (NPC) стадии T2N2M0 (рис.а, б). Его лечили стандартной комбинацией одновременной химио- и лучевой терапии. Нет никаких доказательств рецидива или прогрессирования заболевания при последующем наблюдении через 19 месяцев, которое включало МРТ и ПЭТ-КТ после лечения.
Исследование с помощью магнитно-резонансной томографии у пациента с некератинизирующей карциномой носоглотки с аденоматозной дифференцировкой, показывающей местнораспространенную опухоль с парафарингеальным расширением ( a ) и двусторонним узловым метастатическим заболеванием ( b )
Гистопатология, иммуногистология и иммуногистология Гибридизация
Биопсийный материал состоял из трех фрагментов ткани в диапазоне от 0. От 2 до 0,4 см. Два из этих фрагментов содержали опухоль, которая состояла из гнезд неопластических клеток различного размера, расположенных в фиброзной строме с тяжелым лимфоцитарным компонентом. При среднем увеличении можно было заметить, что опухоль имела просветные структуры (рис. А). При более высоком увеличении это впечатление подтвердилось, и было также очевидно, что структуры просвета выстланы неопластическими эпителиальными клетками, где ядра поляризованы от структуры просвета, то есть соответствуют критериям истинного образования просвета (рис.б). Опухолевые клетки имели увеличенные, умеренно плеоморфные ядра с выступающими ядрышками. Количество цитоплазмы было ограничено, и митотические фигуры легко определялись. Не было ни некроза, ни дисплазии высокой степени в выстилающем поверхностном эпителии, который был плоскоклеточным.
От 2 до 0,4 см. Два из этих фрагментов содержали опухоль, которая состояла из гнезд неопластических клеток различного размера, расположенных в фиброзной строме с тяжелым лимфоцитарным компонентом. При среднем увеличении можно было заметить, что опухоль имела просветные структуры (рис. А). При более высоком увеличении это впечатление подтвердилось, и было также очевидно, что структуры просвета выстланы неопластическими эпителиальными клетками, где ядра поляризованы от структуры просвета, то есть соответствуют критериям истинного образования просвета (рис.б). Опухолевые клетки имели увеличенные, умеренно плеоморфные ядра с выступающими ядрышками. Количество цитоплазмы было ограничено, и митотические фигуры легко определялись. Не было ни некроза, ни дисплазии высокой степени в выстилающем поверхностном эпителии, который был плоскоклеточным.
Микрофотографии срезов, окрашенных гематоксилином и эозином, выявили уже при увеличении средней мощности наличие просветных структур ( a ). Увеличение с большим увеличением показало истинные структуры просвета с ядрами неопластических клеток, поляризованными от просвета ( b )
Увеличение с большим увеличением показало истинные структуры просвета с ядрами неопластических клеток, поляризованными от просвета ( b )
При иммуногистохимии опухолевые клетки показали сильную маркировку цитокератинов широкого спектра (CK; AE1 / 3).Несколько спорадических опухолевых клеток экспрессировали СК20. Не было экспрессии CK7, CK5 / 6, CDX2, TTF-1, p63 и рецептора андрогенов.
При гибридизации in-situ EBV (EBER) с 3,3′-диаминобензидином (DAB) в качестве хромогена наблюдался диффузный сильный положительный ядерный сигнал, который подчеркивал просветные структуры (рис. A, b).
Опухолевые клетки были диффузно и сильно положительными в отношении EBV при гибридизации in situ для EBER ( a ). При большом увеличении выделено образование истинного просвета ( b )
Диагноз
Некератинизирующая карцинома с аденоматозной дифференцировкой.
Обсуждение
Некератинизирующие NPC могут иметь ряд необычных гистопатологических особенностей..jpg) В этом отчете представлен случай NK-NPC с аденоматозной дифференцировкой. ВОЗ классифицирует NPC на ороговевшие (плоскоклеточные), некератинизирующие (включая дифференцированные и недифференцированные варианты) и базалоидные (плоскоклеточные) типы рака. Это не чисто «гистологическая» система классификации, но, помимо морфологии, она также включает эпидемиологические, вирусологические и прогностические / терапевтические аспекты [4].Значительно более высокая заболеваемость NK-NPC среди китайцев, особенно в Южном Китае и Юго-Восточной Азии, в основном приписывается некератинизирующему типу, который почти на 100% связан с ВЭБ и характеризуется заметной чувствительностью к лучевой терапии [1] . NK-NPC обычно содержит заметный реактивный лимфоплазмоцитарный инфильтрат, и до тех пор, пока опухоль ограничена лимфоидным отделом носоглотки, злокачественные клетки обычно не вызывают десмопластического стромального ответа.Когда лимфоплазмоцитарный инфильтрат особенно заметен, а неопластические эпителиальные клетки демонстрируют небольшое распределение вложенных или индивидуальных клеток, это было обозначено как паттерн Рего.
В этом отчете представлен случай NK-NPC с аденоматозной дифференцировкой. ВОЗ классифицирует NPC на ороговевшие (плоскоклеточные), некератинизирующие (включая дифференцированные и недифференцированные варианты) и базалоидные (плоскоклеточные) типы рака. Это не чисто «гистологическая» система классификации, но, помимо морфологии, она также включает эпидемиологические, вирусологические и прогностические / терапевтические аспекты [4].Значительно более высокая заболеваемость NK-NPC среди китайцев, особенно в Южном Китае и Юго-Восточной Азии, в основном приписывается некератинизирующему типу, который почти на 100% связан с ВЭБ и характеризуется заметной чувствительностью к лучевой терапии [1] . NK-NPC обычно содержит заметный реактивный лимфоплазмоцитарный инфильтрат, и до тех пор, пока опухоль ограничена лимфоидным отделом носоглотки, злокачественные клетки обычно не вызывают десмопластического стромального ответа.Когда лимфоплазмоцитарный инфильтрат особенно заметен, а неопластические эпителиальные клетки демонстрируют небольшое распределение вложенных или индивидуальных клеток, это было обозначено как паттерн Рего. На другом конце классического спектра NK-NPC злокачественные клетки расположены в синцитиальных слоях, и это исторически приписывалось Schminke. Однако NK-NPC может демонстрировать особенности светового микроскопа, которые радикально отличаются от этого стандартного «внешнего вида учебника». Значительное гистологическое разнообразие NK-NPC хорошо известно патологам в Китае и Юго-Восточной Азии.Фактически, до первой (1978 г.) попытки ВОЗ рационализировать и упростить классификацию NPC в Азии существовало множество терминов и несколько систем классификации [5–7]. Нечасто встречающиеся морфологические варианты NK-NPC включают опухоли с веретеновыми клетками, светлые клетки, плеоморфные (подобные Риду – Штернбергу) клетки, десмопластическую строму, гранулематозный компонент, эозинофильные цитоплазматические глобулы, выраженную стромальную эозинофилию, амилоид, а также выраженную папиллярность [1] . Очень редко встречается ретикулярный миксоидный узор [2].Насколько мне известно, было только одно предыдущее сообщение о двух пациентах с NK-NPC, показывающих аденоматозную, «железистую» дифференцировку [3].
На другом конце классического спектра NK-NPC злокачественные клетки расположены в синцитиальных слоях, и это исторически приписывалось Schminke. Однако NK-NPC может демонстрировать особенности светового микроскопа, которые радикально отличаются от этого стандартного «внешнего вида учебника». Значительное гистологическое разнообразие NK-NPC хорошо известно патологам в Китае и Юго-Восточной Азии.Фактически, до первой (1978 г.) попытки ВОЗ рационализировать и упростить классификацию NPC в Азии существовало множество терминов и несколько систем классификации [5–7]. Нечасто встречающиеся морфологические варианты NK-NPC включают опухоли с веретеновыми клетками, светлые клетки, плеоморфные (подобные Риду – Штернбергу) клетки, десмопластическую строму, гранулематозный компонент, эозинофильные цитоплазматические глобулы, выраженную стромальную эозинофилию, амилоид, а также выраженную папиллярность [1] . Очень редко встречается ретикулярный миксоидный узор [2].Насколько мне известно, было только одно предыдущее сообщение о двух пациентах с NK-NPC, показывающих аденоматозную, «железистую» дифференцировку [3]. Это исследование включало двух мужчин европеоидной расы – одному 58 лет, другому 56. У обоих были метастазы в шейных лимфатических узлах. Один из пациентов прошел курс комбинированной лучевой и химиотерапии и был жив без признаков заболевания через 3 года наблюдения. Другой пациент получил только лучевую терапию носоглотки и шеи. У него появились метастазы в легких, и он умер через 2 года после обращения.Ткань опухоли обоих пациентов содержала два разных образца, каждый из которых затрагивал примерно 50% объема опухоли. Эти два разных компонента были (1) компонентом обычной недифференцированной карциномы и (2) компонентом, образующим просвет / железу, с ядрами злокачественных клеток, поляризованными от просвета. Судя по описанию и иллюстрациям, не было выявлено значительных различий в цитоморфологических характеристиках между двумя компонентами. Обе опухоли содержали заметный лимфоцитарный инфильтрат.Оба компонента в обеих опухолях были положительными в отношении EBV (EBER) при гибридизации in situ . Авторы также предоставили электронную микроскопию для получения светового микроскопа оттиска истинной аденоматозной дифференцировки. Неопластические клетки, выстилающие просвет, имели большую часть цитоплазмы по направлению к просвету, отображали микроворсинки с мелкозернистым гликокаликсом и терминальную сеть микрофиламентов и соединительных комплексов между соседними клетками, которые были идентифицированы в апикальной части цитоплазмы.За исключением того, что аденоматозный компонент составлял более 50% объема опухоли в представленном здесь случае, существует значительное сходство между фактическим случаем и ранее описанными опухолями. Все опухоли были EBV-положительными, содержали значительный лимфоцитарный компонент и при адекватном лечении, то есть при комбинированной химио- и лучевой терапии давали положительный ответ на разрешение всех опухолей, включая узловую болезнь шеи. Такой ответ на лечение также наблюдался у представленного здесь пациента, у которого также было двустороннее и выраженное метастатическое заболевание в шейные узлы.За исключением поляризации от просвета, цитологические особенности в случае, представленном здесь, были в пределах спектра, наблюдаемого в обычных некератинизирующих NK-NPC; высокое ядерно-цитоплазматическое соотношение, увеличенные умеренно плеоморфные ядра и выступающие ядрышки. Кроме того, в случаях, описанных Jain et al. между клетками в аденоматозном и недифференцированном компонентах не было обнаружено значительных световых микроскопических различий.
Это исследование включало двух мужчин европеоидной расы – одному 58 лет, другому 56. У обоих были метастазы в шейных лимфатических узлах. Один из пациентов прошел курс комбинированной лучевой и химиотерапии и был жив без признаков заболевания через 3 года наблюдения. Другой пациент получил только лучевую терапию носоглотки и шеи. У него появились метастазы в легких, и он умер через 2 года после обращения.Ткань опухоли обоих пациентов содержала два разных образца, каждый из которых затрагивал примерно 50% объема опухоли. Эти два разных компонента были (1) компонентом обычной недифференцированной карциномы и (2) компонентом, образующим просвет / железу, с ядрами злокачественных клеток, поляризованными от просвета. Судя по описанию и иллюстрациям, не было выявлено значительных различий в цитоморфологических характеристиках между двумя компонентами. Обе опухоли содержали заметный лимфоцитарный инфильтрат.Оба компонента в обеих опухолях были положительными в отношении EBV (EBER) при гибридизации in situ . Авторы также предоставили электронную микроскопию для получения светового микроскопа оттиска истинной аденоматозной дифференцировки. Неопластические клетки, выстилающие просвет, имели большую часть цитоплазмы по направлению к просвету, отображали микроворсинки с мелкозернистым гликокаликсом и терминальную сеть микрофиламентов и соединительных комплексов между соседними клетками, которые были идентифицированы в апикальной части цитоплазмы.За исключением того, что аденоматозный компонент составлял более 50% объема опухоли в представленном здесь случае, существует значительное сходство между фактическим случаем и ранее описанными опухолями. Все опухоли были EBV-положительными, содержали значительный лимфоцитарный компонент и при адекватном лечении, то есть при комбинированной химио- и лучевой терапии давали положительный ответ на разрешение всех опухолей, включая узловую болезнь шеи. Такой ответ на лечение также наблюдался у представленного здесь пациента, у которого также было двустороннее и выраженное метастатическое заболевание в шейные узлы.За исключением поляризации от просвета, цитологические особенности в случае, представленном здесь, были в пределах спектра, наблюдаемого в обычных некератинизирующих NK-NPC; высокое ядерно-цитоплазматическое соотношение, увеличенные умеренно плеоморфные ядра и выступающие ядрышки. Кроме того, в случаях, описанных Jain et al. между клетками в аденоматозном и недифференцированном компонентах не было обнаружено значительных световых микроскопических различий.
По иммуногистохимии большинство NK-NPC проявляют плоскоклеточный фенотип с экспрессией p63 / p40 и CK5 / 6.Эти маркеры не изучались в случаях, описанных Jain et al. Однако в представленном здесь случае не было экспрессии p63 или CK5 / 6. Была очаговая экспрессия CK20, но не CK7. Предположительно, какой бы механизм ни стоял за «фенотипическим дрейфом» в сторону аденоматозной морфологии, это, вероятно, связано с отсутствием экспрессии плоских маркеров. Принимая во внимание ответ на лечение, указанный выше, это, вероятно, не имеет отношения к биологическим свойствам опухоли NK-NPC с аденоматозной дифференцировкой.
Интересно, что в исследовании, проведенном в Тайване, эндемичном регионе для NPC, было исследовано присутствие EBV (EBER-ISH) в том, что авторы назвали карциномой типа носоглотки слюнных желез [8]. Авторы выявили 15 случаев среди 1193 NPC, диагностированных за 5 лет. Из этих случаев 15 были мукоэпидермоидными карциномами (MEC), из которых пять были EBV-положительными, две аденоидно-кистозные карциномы, обе EBV-отрицательные, четыре аденокарциномы, из которых три были EBV-положительными и одна комбинированная опухоль (недифференцированная / аденокарцинома).Составная опухоль поразительно похожа на опухоли, представленные Jain et al. Чистые аденокарциномы подробно не описаны и не проиллюстрированы. Следовательно, возможно, что три EBV-положительных случая могут представлять собой примеры опухоли, представленной в настоящем документе, т.е. что они могут быть некератинизирующими карциномами с аденоматозной дифференцировкой, а не аденокарциномами типа добросовестных слюнных желез. Следует отметить, что аденокарциноматозный случай с отрицательным результатом ВЭБ содержал папиллярные структуры, которые не наблюдались в трех EBV-положительных опухолях и не наблюдались в фактическом случае.Напротив, основываясь на описании и иллюстрациях, MECs кажутся подлинными примерами этой опухоли, а не NK-NPC с необычным световым микроскопом. Однако нет молекулярно-генетических данных, например Были представлены транслокации CRTC1 / 3 / MAML2. Интересно, что ни у одного из пациентов с последующим наблюдением не было рецидива и / или прогрессирования опухоли.
В заключение представлен пациент с EBV-положительным некератинизирующим NPC с аденоматозной дифференцировкой. Опухоль показала как рентгенологические, так и клинические признаки, типичные для NPC, включая полное исчезновение всей опухоли с помощью стандартной комбинированной химио- и лучевой терапии, несмотря на локорегионально распространенное заболевание.
Некератинизирующая карцинома носоглотки с аденоматозной дифференцировкой
Abstract
Представлен случай некератинизирующей EBV-положительной (EBER-in situ гибридизации) карциномы с аденоматозной дифференцировкой. Пациент – мужчина 40 лет с болезнью T2N2M0, получивший стандартную комбинированную химио- и лучевую терапию с полным исчезновением всей опухоли. Опухолевые клетки были строго положительными по низкомолекулярным цитокератинам (AE1–3), а отдельные клетки экспрессировали цитокератин 20.Не было обнаружено экспрессии цитокератина 5/6, 7, p63, TTF-1, CDX2 или рецептора андрогенов. Не было доказательств рецидива или прогрессирования заболевания при последующем наблюдении через 19 месяцев, которое включало МРТ и ПЭТ-КТ после лечения.
Ключевые слова: Носоглотка, Карцинома, Аденокарцинома, вирус Эпштейна – Барра
Введение
Большинство (> 90%) некератинизирующих карцином носоглотки (NPC) демонстрируют, помимо ядерного вируса Эпштейна-Барра РНК (EBER), спектр классических гистоморфологических паттернов.Это включает в себя на одном конце опухолевые клетки, расположенные в синцитиальных слоях (модель Regaud), а на другом конце – небольшие гнезда и изолированные злокачественные эпителиальные клетки (схема Шминке), смешанные с различным количеством реактивных лимфоцитов и плазматических клеток. Тем не менее, NPC может демонстрировать множество необычных гистопатологических паттернов, включая веретенообразные клетки, светлые клетки, наличие необычных (типа Рида-Штернберга) опухолевых клеток, неказеозных гранулем, папиллярность, эозинофилию, амилоид и эозинофильные цитоплазматические глобулы [1] .Очень редко NPC могут демонстрировать шнуровидное ретикулярное расположение опухолевых клеток, связанных со значительными миксоидными веществами в строме [2]. Крайне редко NPC могут проявлять аденоматозную дифференцировку [3]. В этом отчете представлен случай NPC с компонентом опухоли, в котором были сформированы аденоматозные структуры. Осведомленность об этом явлении должна помочь в установлении правильного диагноза, когда вы сталкиваетесь с ограниченным биоптатом у NPC с этим необычным паттерном.
Анамнез / клинические результаты
Пациент – ранее здоровый мужчина, которому был поставлен диагноз карцинома носоглотки (NPC) стадии T2N2M0 (рис.а, б). Его лечили стандартной комбинацией одновременной химио- и лучевой терапии. Нет никаких доказательств рецидива или прогрессирования заболевания при последующем наблюдении через 19 месяцев, которое включало МРТ и ПЭТ-КТ после лечения.
Исследование с помощью магнитно-резонансной томографии у пациента с некератинизирующей карциномой носоглотки с аденоматозной дифференцировкой, показывающей местнораспространенную опухоль с парафарингеальным расширением ( a ) и двусторонним узловым метастатическим заболеванием ( b )
Гистопатология, иммуногистология и иммуногистология Гибридизация
Биопсийный материал состоял из трех фрагментов ткани в диапазоне от 0.От 2 до 0,4 см. Два из этих фрагментов содержали опухоль, которая состояла из гнезд неопластических клеток различного размера, расположенных в фиброзной строме с тяжелым лимфоцитарным компонентом. При среднем увеличении можно было заметить, что опухоль имела просветные структуры (рис. А). При более высоком увеличении это впечатление подтвердилось, и было также очевидно, что структуры просвета выстланы неопластическими эпителиальными клетками, где ядра поляризованы от структуры просвета, то есть соответствуют критериям истинного образования просвета (рис.б). Опухолевые клетки имели увеличенные, умеренно плеоморфные ядра с выступающими ядрышками. Количество цитоплазмы было ограничено, и митотические фигуры легко определялись. Не было ни некроза, ни дисплазии высокой степени в выстилающем поверхностном эпителии, который был плоскоклеточным.
Микрофотографии срезов, окрашенных гематоксилином и эозином, выявили уже при увеличении средней мощности наличие просветных структур ( a ). Увеличение с большим увеличением показало истинные структуры просвета с ядрами неопластических клеток, поляризованными от просвета ( b )
При иммуногистохимии опухолевые клетки показали сильную маркировку цитокератинов широкого спектра (CK; AE1 / 3).Несколько спорадических опухолевых клеток экспрессировали СК20. Не было экспрессии CK7, CK5 / 6, CDX2, TTF-1, p63 и рецептора андрогенов.
При гибридизации in-situ EBV (EBER) с 3,3′-диаминобензидином (DAB) в качестве хромогена наблюдался диффузный сильный положительный ядерный сигнал, который подчеркивал просветные структуры (рис. A, b).
Опухолевые клетки были диффузно и сильно положительными в отношении EBV при гибридизации in situ для EBER ( a ). При большом увеличении выделено образование истинного просвета ( b )
Диагноз
Некератинизирующая карцинома с аденоматозной дифференцировкой.
Обсуждение
Некератинизирующие NPC могут иметь ряд необычных гистопатологических особенностей. В этом отчете представлен случай NK-NPC с аденоматозной дифференцировкой. ВОЗ классифицирует NPC на ороговевшие (плоскоклеточные), некератинизирующие (включая дифференцированные и недифференцированные варианты) и базалоидные (плоскоклеточные) типы рака. Это не чисто «гистологическая» система классификации, но, помимо морфологии, она также включает эпидемиологические, вирусологические и прогностические / терапевтические аспекты [4].Значительно более высокая заболеваемость NK-NPC среди китайцев, особенно в Южном Китае и Юго-Восточной Азии, в основном приписывается некератинизирующему типу, который почти на 100% связан с ВЭБ и характеризуется заметной чувствительностью к лучевой терапии [1] . NK-NPC обычно содержит заметный реактивный лимфоплазмоцитарный инфильтрат, и до тех пор, пока опухоль ограничена лимфоидным отделом носоглотки, злокачественные клетки обычно не вызывают десмопластического стромального ответа.Когда лимфоплазмоцитарный инфильтрат особенно заметен, а неопластические эпителиальные клетки демонстрируют небольшое распределение вложенных или индивидуальных клеток, это было обозначено как паттерн Рего. На другом конце классического спектра NK-NPC злокачественные клетки расположены в синцитиальных слоях, и это исторически приписывалось Schminke. Однако NK-NPC может демонстрировать особенности светового микроскопа, которые радикально отличаются от этого стандартного «внешнего вида учебника». Значительное гистологическое разнообразие NK-NPC хорошо известно патологам в Китае и Юго-Восточной Азии.Фактически, до первой (1978 г.) попытки ВОЗ рационализировать и упростить классификацию NPC в Азии существовало множество терминов и несколько систем классификации [5–7]. Нечасто встречающиеся морфологические варианты NK-NPC включают опухоли с веретеновыми клетками, светлые клетки, плеоморфные (подобные Риду – Штернбергу) клетки, десмопластическую строму, гранулематозный компонент, эозинофильные цитоплазматические глобулы, выраженную стромальную эозинофилию, амилоид, а также выраженную папиллярность [1] . Очень редко встречается ретикулярный миксоидный узор [2].Насколько мне известно, было только одно предыдущее сообщение о двух пациентах с NK-NPC, показывающих аденоматозную, «железистую» дифференцировку [3]. Это исследование включало двух мужчин европеоидной расы – одному 58 лет, другому 56. У обоих были метастазы в шейных лимфатических узлах. Один из пациентов прошел курс комбинированной лучевой и химиотерапии и был жив без признаков заболевания через 3 года наблюдения. Другой пациент получил только лучевую терапию носоглотки и шеи. У него появились метастазы в легких, и он умер через 2 года после обращения.Ткань опухоли обоих пациентов содержала два разных образца, каждый из которых затрагивал примерно 50% объема опухоли. Эти два разных компонента были (1) компонентом обычной недифференцированной карциномы и (2) компонентом, образующим просвет / железу, с ядрами злокачественных клеток, поляризованными от просвета. Судя по описанию и иллюстрациям, не было выявлено значительных различий в цитоморфологических характеристиках между двумя компонентами. Обе опухоли содержали заметный лимфоцитарный инфильтрат.Оба компонента в обеих опухолях были положительными в отношении EBV (EBER) при гибридизации in situ . Авторы также предоставили электронную микроскопию для получения светового микроскопа оттиска истинной аденоматозной дифференцировки. Неопластические клетки, выстилающие просвет, имели большую часть цитоплазмы по направлению к просвету, отображали микроворсинки с мелкозернистым гликокаликсом и терминальную сеть микрофиламентов и соединительных комплексов между соседними клетками, которые были идентифицированы в апикальной части цитоплазмы.За исключением того, что аденоматозный компонент составлял более 50% объема опухоли в представленном здесь случае, существует значительное сходство между фактическим случаем и ранее описанными опухолями. Все опухоли были EBV-положительными, содержали значительный лимфоцитарный компонент и при адекватном лечении, то есть при комбинированной химио- и лучевой терапии давали положительный ответ на разрешение всех опухолей, включая узловую болезнь шеи. Такой ответ на лечение также наблюдался у представленного здесь пациента, у которого также было двустороннее и выраженное метастатическое заболевание в шейные узлы.За исключением поляризации от просвета, цитологические особенности в случае, представленном здесь, были в пределах спектра, наблюдаемого в обычных некератинизирующих NK-NPC; высокое ядерно-цитоплазматическое соотношение, увеличенные умеренно плеоморфные ядра и выступающие ядрышки. Кроме того, в случаях, описанных Jain et al. между клетками в аденоматозном и недифференцированном компонентах не было обнаружено значительных световых микроскопических различий.
По иммуногистохимии большинство NK-NPC проявляют плоскоклеточный фенотип с экспрессией p63 / p40 и CK5 / 6.Эти маркеры не изучались в случаях, описанных Jain et al. Однако в представленном здесь случае не было экспрессии p63 или CK5 / 6. Была очаговая экспрессия CK20, но не CK7. Предположительно, какой бы механизм ни стоял за «фенотипическим дрейфом» в сторону аденоматозной морфологии, это, вероятно, связано с отсутствием экспрессии плоских маркеров. Принимая во внимание ответ на лечение, указанный выше, это, вероятно, не имеет отношения к биологическим свойствам опухоли NK-NPC с аденоматозной дифференцировкой.
Интересно, что в исследовании, проведенном в Тайване, эндемичном регионе для NPC, было исследовано присутствие EBV (EBER-ISH) в том, что авторы назвали карциномой типа носоглотки слюнных желез [8]. Авторы выявили 15 случаев среди 1193 NPC, диагностированных за 5 лет. Из этих случаев 15 были мукоэпидермоидными карциномами (MEC), из которых пять были EBV-положительными, две аденоидно-кистозные карциномы, обе EBV-отрицательные, четыре аденокарциномы, из которых три были EBV-положительными и одна комбинированная опухоль (недифференцированная / аденокарцинома).Составная опухоль поразительно похожа на опухоли, представленные Jain et al. Чистые аденокарциномы подробно не описаны и не проиллюстрированы. Следовательно, возможно, что три EBV-положительных случая могут представлять собой примеры опухоли, представленной в настоящем документе, т.е. что они могут быть некератинизирующими карциномами с аденоматозной дифференцировкой, а не аденокарциномами типа добросовестных слюнных желез. Следует отметить, что аденокарциноматозный случай с отрицательным результатом ВЭБ содержал папиллярные структуры, которые не наблюдались в трех EBV-положительных опухолях и не наблюдались в фактическом случае.Напротив, основываясь на описании и иллюстрациях, MECs кажутся подлинными примерами этой опухоли, а не NK-NPC с необычным световым микроскопом. Однако нет молекулярно-генетических данных, например Были представлены транслокации CRTC1 / 3 / MAML2. Интересно, что ни у одного из пациентов с последующим наблюдением не было рецидива и / или прогрессирования опухоли.
В заключение представлен пациент с EBV-положительным некератинизирующим NPC с аденоматозной дифференцировкой. Опухоль показала как рентгенологические, так и клинические признаки, типичные для NPC, включая полное исчезновение всей опухоли с помощью стандартной комбинированной химио- и лучевой терапии, несмотря на локорегионально распространенное заболевание.
Некератинизирующая карцинома носоглотки с аденоматозной дифференцировкой
Abstract
Представлен случай некератинизирующей EBV-положительной (EBER-in situ гибридизации) карциномы с аденоматозной дифференцировкой. Пациент – мужчина 40 лет с болезнью T2N2M0, получивший стандартную комбинированную химио- и лучевую терапию с полным исчезновением всей опухоли. Опухолевые клетки были строго положительными по низкомолекулярным цитокератинам (AE1–3), а отдельные клетки экспрессировали цитокератин 20.Не было обнаружено экспрессии цитокератина 5/6, 7, p63, TTF-1, CDX2 или рецептора андрогенов. Не было доказательств рецидива или прогрессирования заболевания при последующем наблюдении через 19 месяцев, которое включало МРТ и ПЭТ-КТ после лечения.
Ключевые слова: Носоглотка, Карцинома, Аденокарцинома, вирус Эпштейна – Барра
Введение
Большинство (> 90%) некератинизирующих карцином носоглотки (NPC) демонстрируют, помимо ядерного вируса Эпштейна-Барра РНК (EBER), спектр классических гистоморфологических паттернов.Это включает в себя на одном конце опухолевые клетки, расположенные в синцитиальных слоях (модель Regaud), а на другом конце – небольшие гнезда и изолированные злокачественные эпителиальные клетки (схема Шминке), смешанные с различным количеством реактивных лимфоцитов и плазматических клеток. Тем не менее, NPC может демонстрировать множество необычных гистопатологических паттернов, включая веретенообразные клетки, светлые клетки, наличие необычных (типа Рида-Штернберга) опухолевых клеток, неказеозных гранулем, папиллярность, эозинофилию, амилоид и эозинофильные цитоплазматические глобулы [1] .Очень редко NPC могут демонстрировать шнуровидное ретикулярное расположение опухолевых клеток, связанных со значительными миксоидными веществами в строме [2]. Крайне редко NPC могут проявлять аденоматозную дифференцировку [3]. В этом отчете представлен случай NPC с компонентом опухоли, в котором были сформированы аденоматозные структуры. Осведомленность об этом явлении должна помочь в установлении правильного диагноза, когда вы сталкиваетесь с ограниченным биоптатом у NPC с этим необычным паттерном.
Анамнез / клинические результаты
Пациент – ранее здоровый мужчина, которому был поставлен диагноз карцинома носоглотки (NPC) стадии T2N2M0 (рис.а, б). Его лечили стандартной комбинацией одновременной химио- и лучевой терапии. Нет никаких доказательств рецидива или прогрессирования заболевания при последующем наблюдении через 19 месяцев, которое включало МРТ и ПЭТ-КТ после лечения.
Исследование с помощью магнитно-резонансной томографии у пациента с некератинизирующей карциномой носоглотки с аденоматозной дифференцировкой, показывающей местнораспространенную опухоль с парафарингеальным расширением ( a ) и двусторонним узловым метастатическим заболеванием ( b )
Гистопатология, иммуногистология и иммуногистология Гибридизация
Биопсийный материал состоял из трех фрагментов ткани в диапазоне от 0.От 2 до 0,4 см. Два из этих фрагментов содержали опухоль, которая состояла из гнезд неопластических клеток различного размера, расположенных в фиброзной строме с тяжелым лимфоцитарным компонентом. При среднем увеличении можно было заметить, что опухоль имела просветные структуры (рис. А). При более высоком увеличении это впечатление подтвердилось, и было также очевидно, что структуры просвета выстланы неопластическими эпителиальными клетками, где ядра поляризованы от структуры просвета, то есть соответствуют критериям истинного образования просвета (рис.б). Опухолевые клетки имели увеличенные, умеренно плеоморфные ядра с выступающими ядрышками. Количество цитоплазмы было ограничено, и митотические фигуры легко определялись. Не было ни некроза, ни дисплазии высокой степени в выстилающем поверхностном эпителии, который был плоскоклеточным.
Микрофотографии срезов, окрашенных гематоксилином и эозином, выявили уже при увеличении средней мощности наличие просветных структур ( a ). Увеличение с большим увеличением показало истинные структуры просвета с ядрами неопластических клеток, поляризованными от просвета ( b )
При иммуногистохимии опухолевые клетки показали сильную маркировку цитокератинов широкого спектра (CK; AE1 / 3).Несколько спорадических опухолевых клеток экспрессировали СК20. Не было экспрессии CK7, CK5 / 6, CDX2, TTF-1, p63 и рецептора андрогенов.
При гибридизации in-situ EBV (EBER) с 3,3′-диаминобензидином (DAB) в качестве хромогена наблюдался диффузный сильный положительный ядерный сигнал, который подчеркивал просветные структуры (рис. A, b).
Опухолевые клетки были диффузно и сильно положительными в отношении EBV при гибридизации in situ для EBER ( a ). При большом увеличении выделено образование истинного просвета ( b )
Диагноз
Некератинизирующая карцинома с аденоматозной дифференцировкой.
Обсуждение
Некератинизирующие NPC могут иметь ряд необычных гистопатологических особенностей. В этом отчете представлен случай NK-NPC с аденоматозной дифференцировкой. ВОЗ классифицирует NPC на ороговевшие (плоскоклеточные), некератинизирующие (включая дифференцированные и недифференцированные варианты) и базалоидные (плоскоклеточные) типы рака. Это не чисто «гистологическая» система классификации, но, помимо морфологии, она также включает эпидемиологические, вирусологические и прогностические / терапевтические аспекты [4].Значительно более высокая заболеваемость NK-NPC среди китайцев, особенно в Южном Китае и Юго-Восточной Азии, в основном приписывается некератинизирующему типу, который почти на 100% связан с ВЭБ и характеризуется заметной чувствительностью к лучевой терапии [1] . NK-NPC обычно содержит заметный реактивный лимфоплазмоцитарный инфильтрат, и до тех пор, пока опухоль ограничена лимфоидным отделом носоглотки, злокачественные клетки обычно не вызывают десмопластического стромального ответа.Когда лимфоплазмоцитарный инфильтрат особенно заметен, а неопластические эпителиальные клетки демонстрируют небольшое распределение вложенных или индивидуальных клеток, это было обозначено как паттерн Рего. На другом конце классического спектра NK-NPC злокачественные клетки расположены в синцитиальных слоях, и это исторически приписывалось Schminke. Однако NK-NPC может демонстрировать особенности светового микроскопа, которые радикально отличаются от этого стандартного «внешнего вида учебника». Значительное гистологическое разнообразие NK-NPC хорошо известно патологам в Китае и Юго-Восточной Азии.Фактически, до первой (1978 г.) попытки ВОЗ рационализировать и упростить классификацию NPC в Азии существовало множество терминов и несколько систем классификации [5–7]. Нечасто встречающиеся морфологические варианты NK-NPC включают опухоли с веретеновыми клетками, светлые клетки, плеоморфные (подобные Риду – Штернбергу) клетки, десмопластическую строму, гранулематозный компонент, эозинофильные цитоплазматические глобулы, выраженную стромальную эозинофилию, амилоид, а также выраженную папиллярность [1] . Очень редко встречается ретикулярный миксоидный узор [2].Насколько мне известно, было только одно предыдущее сообщение о двух пациентах с NK-NPC, показывающих аденоматозную, «железистую» дифференцировку [3]. Это исследование включало двух мужчин европеоидной расы – одному 58 лет, другому 56. У обоих были метастазы в шейных лимфатических узлах. Один из пациентов прошел курс комбинированной лучевой и химиотерапии и был жив без признаков заболевания через 3 года наблюдения. Другой пациент получил только лучевую терапию носоглотки и шеи. У него появились метастазы в легких, и он умер через 2 года после обращения.Ткань опухоли обоих пациентов содержала два разных образца, каждый из которых затрагивал примерно 50% объема опухоли. Эти два разных компонента были (1) компонентом обычной недифференцированной карциномы и (2) компонентом, образующим просвет / железу, с ядрами злокачественных клеток, поляризованными от просвета. Судя по описанию и иллюстрациям, не было выявлено значительных различий в цитоморфологических характеристиках между двумя компонентами. Обе опухоли содержали заметный лимфоцитарный инфильтрат.Оба компонента в обеих опухолях были положительными в отношении EBV (EBER) при гибридизации in situ . Авторы также предоставили электронную микроскопию для получения светового микроскопа оттиска истинной аденоматозной дифференцировки. Неопластические клетки, выстилающие просвет, имели большую часть цитоплазмы по направлению к просвету, отображали микроворсинки с мелкозернистым гликокаликсом и терминальную сеть микрофиламентов и соединительных комплексов между соседними клетками, которые были идентифицированы в апикальной части цитоплазмы.За исключением того, что аденоматозный компонент составлял более 50% объема опухоли в представленном здесь случае, существует значительное сходство между фактическим случаем и ранее описанными опухолями. Все опухоли были EBV-положительными, содержали значительный лимфоцитарный компонент и при адекватном лечении, то есть при комбинированной химио- и лучевой терапии давали положительный ответ на разрешение всех опухолей, включая узловую болезнь шеи. Такой ответ на лечение также наблюдался у представленного здесь пациента, у которого также было двустороннее и выраженное метастатическое заболевание в шейные узлы.За исключением поляризации от просвета, цитологические особенности в случае, представленном здесь, были в пределах спектра, наблюдаемого в обычных некератинизирующих NK-NPC; высокое ядерно-цитоплазматическое соотношение, увеличенные умеренно плеоморфные ядра и выступающие ядрышки. Кроме того, в случаях, описанных Jain et al. между клетками в аденоматозном и недифференцированном компонентах не было обнаружено значительных световых микроскопических различий.
По иммуногистохимии большинство NK-NPC проявляют плоскоклеточный фенотип с экспрессией p63 / p40 и CK5 / 6.Эти маркеры не изучались в случаях, описанных Jain et al. Однако в представленном здесь случае не было экспрессии p63 или CK5 / 6. Была очаговая экспрессия CK20, но не CK7. Предположительно, какой бы механизм ни стоял за «фенотипическим дрейфом» в сторону аденоматозной морфологии, это, вероятно, связано с отсутствием экспрессии плоских маркеров. Принимая во внимание ответ на лечение, указанный выше, это, вероятно, не имеет отношения к биологическим свойствам опухоли NK-NPC с аденоматозной дифференцировкой.
Интересно, что в исследовании, проведенном в Тайване, эндемичном регионе для NPC, было исследовано присутствие EBV (EBER-ISH) в том, что авторы назвали карциномой типа носоглотки слюнных желез [8]. Авторы выявили 15 случаев среди 1193 NPC, диагностированных за 5 лет. Из этих случаев 15 были мукоэпидермоидными карциномами (MEC), из которых пять были EBV-положительными, две аденоидно-кистозные карциномы, обе EBV-отрицательные, четыре аденокарциномы, из которых три были EBV-положительными и одна комбинированная опухоль (недифференцированная / аденокарцинома).Составная опухоль поразительно похожа на опухоли, представленные Jain et al. Чистые аденокарциномы подробно не описаны и не проиллюстрированы. Следовательно, возможно, что три EBV-положительных случая могут представлять собой примеры опухоли, представленной в настоящем документе, т.е. что они могут быть некератинизирующими карциномами с аденоматозной дифференцировкой, а не аденокарциномами типа добросовестных слюнных желез. Следует отметить, что аденокарциноматозный случай с отрицательным результатом ВЭБ содержал папиллярные структуры, которые не наблюдались в трех EBV-положительных опухолях и не наблюдались в фактическом случае.Напротив, основываясь на описании и иллюстрациях, MECs кажутся подлинными примерами этой опухоли, а не NK-NPC с необычным световым микроскопом. Однако нет молекулярно-генетических данных, например Были представлены транслокации CRTC1 / 3 / MAML2. Интересно, что ни у одного из пациентов с последующим наблюдением не было рецидива и / или прогрессирования опухоли.
В заключение представлен пациент с EBV-положительным некератинизирующим NPC с аденоматозной дифференцировкой. Опухоль показала как рентгенологические, так и клинические признаки, типичные для NPC, включая полное исчезновение всей опухоли с помощью стандартной комбинированной химио- и лучевой терапии, несмотря на локорегионально распространенное заболевание.
Связь кератинизации с 5-летней выживаемостью по конкретным заболеваниям при плоскоклеточной карциноме ротоглотки | Биомаркеры рака | JAMA Отоларингология – хирургия головы и шеи
Важность Кератинизация – это гистологический признак окрашивания гематоксилин-эозином, связанный с неблагоприятными исходами при раке головы и шеи, особенно плоскоклеточной карциноме полости рта. Однако прогностическая ценность кератинизации не была продемонстрирована при плоскоклеточном раке ротоглотки (OPSCC) в большой группе пациентов.
Объектив Количественная оценка прогностической ценности кератинизации в большой когорте пациентов с OPSCC с анализом подгрупп, основанным на статусе p16, дифференциации базалоидов и статусе курения.
Дизайн, обстановка и участники Ретроспективное кросс-секционное исследование с использованием проспективно собранной базы данных, которое выявило 208 пациентов с ОПССК, диагностированных и пролеченных в одном третичном онкологическом центре с 2002 по 2009 годы. Микроматрицы тканей (ТМА) были получены из образцов 208 пациентов, окрашенных гематоксилин-эозином и иммуногистохимическими маркерами.Цифровые изображения окрашенных ТМА оценивали на наличие кератинизации и / или дифференцировки базалоидов и на статус p16.
Вмешательства Пациентов лечили с целью лечения с помощью хирургического вмешательства, лучевой терапии и / или химиотерапии.
Основные результаты и мероприятия Первичным критерием оценки была 5-летняя выживаемость при заболевании (DSS) при OPSCC в соответствии с кератинизацией. Для оценки выживаемости в соответствии с гистопатологическим профилем и статусом курения были выполнены одномерные и многомерные анализы выживаемости.
Результаты Из 208 образцов 96 были ороговевшими, а 112 – некератинизирующими. Пациенты с ороговевшими опухолями чаще имели запущенную стадию заболевания и были отрицательными по p16. Кератинизация была независимо связана с неблагоприятными исходами. Пятилетний DSS был значительно выше для некератинизирующих опухолей (63,3%) по сравнению с ороговевшими опухолями (44,8%; P = 0,007). В анализе подгрупп отсутствие ороговения было связано с улучшением DSS у пациентов с небазалоидными и p16-отрицательными опухолями, а также у курильщиков.При стратификации пациентов на основе кератинизации, p16-статуса и статуса курения пациенты с p16-отрицательными кератинизирующими опухолями, которые курили, имели самый низкий 5-летний DSS (26,7%).
Выводы и значимость Пациенты с некератинизированным OPSCC имеют более высокую выживаемость по сравнению с пациентами с ороговевшими опухолями. Информация о кератинизации наиболее полезна с точки зрения прогноза у пациентов с p16-отрицательными и небазалоидными опухолями, а также у курильщиков. Выживаемость может быть стратифицирована с использованием кератинизации, статуса p16 и статуса курения.
Кератинизация – это гистологический признак, наблюдаемый по окрашиванию тканей гематоксилин-эозином (H&E). Об этом обычно сообщают в отчетах гистопатологии, и он может использоваться для дихотомического описания плоскоклеточного рака (ПКР) как ороговевающего или некератинизирующего. 1 Было показано, что у пациентов с плоскоклеточным раком ротоглотки (OPSCC) некератинизирующие опухоли имеют сильную связь с положительной реакцией на вирус папилломы человека (HPV). 2 , 3
Доля OPSCC, ассоциированных с ВПЧ, резко возросла за последние десятилетия. 1 , 4 , 5 p16 Иммуногистохимический анализ обычно используется в качестве суррогатного маркера онкогенной инфекции HPV 1 и, как было показано, является положительным прогностическим фактором при OPSCC. 2 , 6 -8 ВПЧ-положительный ОПССК был описан как некератинизирующий, базалоидный, плохо дифференцированный и чаще проявляющийся у молодых некурящих пациентов. 3 , 9 И наоборот, HPV-отрицательный OPSCC, который связан с традиционными факторами риска рака головы и шеи, связанными с алкоголем и табаком, был связан с кератинизацией. 1 , 10
Несколько авторов 11 -13 изучали значение кератинизации при раке головы и шеи, при этом многие из них уделяли внимание SCC полости рта. Ряд этих исследований показали, что ороговение связано с повышенной смертностью.Эти результаты, в сочетании с ассоциацией ВПЧ с отсутствием ороговения, предполагают, что пациенты с некератинизирующим ОПССК должны иметь улучшенные результаты. На сегодняшний день 2 исследования 2 , 11 изучали прогностическую роль кератинизации при OPSCC и ни в одном из них не было обнаружено статистически значимого влияния на выживаемость. Однако ряд ковариат, которые могут влиять на выживаемость, не были включены в эти отчеты.
Целью этого исследования было количественное определение прогностической ценности H&E признака кератинизации в большой серии пациентов с OPSCC с анализом подгрупп, основанным на статусе p16, дифференциации базалоидов и статусе курения.Для достижения цели нашего исследования мы использовали объективный дизайн исследования, который включал слепую оценку гистологических характеристик микрочипов тканей.
Это ретроспективное перекрестное исследование с использованием данных, собранных проспективным образом в региональном центре лечения рака головы и шеи. До начала исследования было получено одобрение институционального совета по этике. Пациенты были идентифицированы через Реестр рака Альберты с 2002 по 2009 год для включения в исследование.Были собраны демографические данные пациентов, статус курения, стадия, лечение и данные о выживаемости. Пациенты, курящие в анамнезе 10 или более пачко-лет, считались курильщиками. 8
Все пациенты с диагнозом OPSCC и пролеченные в Эдмонтоне, Альберта, Канада, в период с 2002 по 2009 год соответствовали критериям включения. Каждому пациенту требовалось выполнить биопсию ядра или ткани для использования в тканевом микрочипе (ТМА). Включенных пациентов лечили с лечебной целью с использованием любой комбинации методов лечения рака, включая хирургическое вмешательство, химиотерапию и лучевую терапию.Пациенты и связанные с ними ТМА были исключены, если их рак лечили с паллиативным намерением или если была получена неадекватная ткань для оценки особенностей окрашивания H&E при дифференцировке базалоидов и кератинизации.
TMA были сконструированы из фиксированной формалином, залитой парафином (FFPE) опухолевой ткани либо из образцов биопсии перед лечением, либо из первичной хирургической операции, как недавно описано. 14 , 15 Патологоанатом (Л.P.) рассмотрел блоки и исключил случаи с недостаточной тканью для будущего диагноза. Блоки FFPE были отмечены патологом для строительства ТМА. TMA были сконструированы с дублированными или трехкратными ядрами блоков FFPE в соответствии с ранее описанным протоколом TMA. 6 Эти TMA использовались в наших предыдущих исследованиях. 14 -16
Признаки H&E каждой ТМА, включая дифференцировку базалоидов и кератинизацию, были оценены резидентом патологии (B.A.) и подтверждено штатным патологом головы и шеи (L.P.), который не знал результатов иммуногистохимического анализа p16 и личности пациента. И кератинизация, и дифференцировка базалоидов оценивались как присутствующие или отсутствующие в каждом из ТМА. Стандартным определением, используемым для дифференциации базалоидов, было наличие 2 из 3 признаков, используемых для описания дифференциации базалоидов, интерпретируемых на предметном стекле микроматрицы, включая периферический палисадинг, высокое ядерно-цитоплазматическое соотношение и структуру плотного роста.
Иммуногистохимический анализ
Иммуногистохимический анализ на р16 выполняли с использованием метода окрашивания диаминобензидином, как ранее сообщалось Lau et al. 6 Используемое антитело р16 представляло собой клон JC8 (Santa Cruz Biotechnology). В соответствии с ранее установленными стандартами в литературе положительность p16 определялась как высокоинтенсивное окрашивание более чем 70% клеток.
Анализ выживаемости по Каплану-Мейеру был проведен для расчета выживаемости при конкретном заболевании (DSS) с использованием статистических данных логарифмического ранга для статистических сравнений между слоями. 17 Многомерный анализ был выполнен с использованием модели пропорциональных рисков Кокса 18 для переменных возраста, пола, узлового статуса, дифференциации базалоидов, кератинизации, статуса p16 и курения. Сравнение пропорций проводилось с использованием χ 2 и непрерывных данных с использованием теста t .Статистическая значимость была принята как P <0,05 во всех случаях. Все статистические анализы были выполнены с использованием программного обеспечения SPSS (версия 21; SPSS Inc).
Всего в исследование было включено 208 пациентов. Средний возраст составлял 58,4 года (от 32 до 95 лет) при соотношении мужчин и женщин 3,4: 1,0. Сто сорок шесть пациентов были курильщиками, а 59 – некурящими. У трех пациентов не было данных о курении. Большинство пациентов (189) имели клинически продвинутую стадию заболевания (стадии III / IV), и только 19 пациентов имели раннюю стадию заболевания (стадии I / II).Узловая болезнь присутствовала у 172 пациентов при поступлении. Девяносто шесть образцов опухолей (46%) были ороговевшими, а 112 (54%) – некератинизирующими. Из 208 пациентов 111 были положительными по p16 и 97 – с отрицательными. Восемьдесят четыре пациента имели опухоли, дифференцированные на базалоиде, по сравнению с 124 пациентами с опухолями, дифференцированными на основе небазалоидов. Хирургия с последующей химиотерапией и лучевой терапией была наиболее распространенным методом лечения (Таблица 1).
Анализ подгрупп был проведен для сравнения характеристик пациентов с ороговевшим и некератинизирующим SCC (таблица 1).Не было статистически значимых различий в отношении возраста, пола, использования хирургических или нехирургических методов лечения или статуса курения. Хотя большинство пациентов в обеих подгруппах имели запущенную стадию заболевания, у большего числа пациентов с ороговевшими опухолями болезнь была запущена. Из ороговевших SCC 33 также демонстрировали дифференцировку базалоидов, тогда как 63 были дифференцированы небазалоидными. Из 112 образцов OPSCC без ороговения 51 был дифференцирован по базалоидам, тогда как 61 – нет. Статистически значимой разницы в наличии дифференцировки базалоидов при кератинизирующем и некератинизирующем OPSCC не было.Пациенты с некератинизирующим OPSCC с большей вероятностью имели p16-положительный результат. Семьдесят два пациента с опухолями с некератинизирующими гистологическими характеристиками были p16-положительными по сравнению только с 39 пациентами с кератинизацией ( P = 0,001, χ 2 = 11,6).
Регрессия пропорциональных рисков Коксас помощью одномерного анализа показала, что риск смерти значительно зависит от возраста, узлового статуса, статуса курения, положительности p16, дифференцировки базалоидов и кератинизации (таблица 2).Многофакторный анализ, включающий все эти характеристики, показал, что возраст, статус курения, статус p16 и кератинизация были независимыми предикторами риска смерти (таблица 2).
Пятилетний DSS был рассчитан с использованием анализа Каплана-Мейера для пациентов с ороговевшим и некератинизирующим OPSCC, леченных как хирургическим, так и нехирургическим путем (рис. 1). Пациенты с некератинизирующими опухолями имели статистически значимое преимущество в выживаемости с 5-летним DSS на 63,3% по сравнению с 44.8% у пациентов с ороговевшими опухолями ( P = 0,007).
При сравнении DSS, основанного на кератинизации у пациентов с небазалоидными дифференцированными опухолями, это преимущество выживаемости при некератинизирующем раке сохранилось: 5-летний DSS составил 55,8% у пациентов с некератинизирующим заболеванием по сравнению с только 26,6% у пациентов с ороговевшими опухолями ( P = 0,002) (рис. 2А). Однако у пациентов с базалоидно-дифференцированными опухолями не было статистически значимой разницы в DSS (рис. 2А).В этой группе пациенты с ороговевшими опухолями имели 76,5% 5-летнего DSS по сравнению с 71,7% у пациентов с некератинизирующими опухолями ( P = 0,74).
У p16-положительных пациентов не было статистически значимой разницы в 5-летнем DSS у пациентов с ороговевшим OPSCC по сравнению с пациентами с некератинизирующими опухолями (Рисунок 2B). Пятилетние DSS составили 69,0% и 74,9% соответственно ( P = 0,88). Однако у p16-отрицательных пациентов 5-летний DSS составил 47,7% у пациентов с некератинизирующими опухолями по сравнению с 26.8% у пациентов с ороговевшими опухолями ( P = 0,01) (Рисунок 2B).
Для пациентов, курящих в анамнезе 10 или более пачко-лет, наблюдалась статистически значимая разница в 5-летнем DSS у пациентов с некератинизирующим OPSCC (рис. 2C). Пятилетний DSS составил 53,3% у пациентов с некератинизирующим OPSCC по сравнению с 41,1% у пациентов с ороговевшим OPSCC ( P = 0,03). Однако у пациентов, которые были определены как некурящие (в анамнезе <10 упаковок-лет), не было статистически значимой разницы в 5-летнем DSS на основе кератинизации ( P =.24). У некурящих с некератинизирующими опухолями показатель DSS за 5 лет составил 84,4% по сравнению с 57,6% у людей с ороговевшими опухолями.
Добавив кератинизацию к классификационной схеме, использованной Ang et al, 8 , которая использовала статус ВПЧ и историю курения, можно выделить 3 уровня риска. В группу высокого риска входят курильщики с отрицательным p16 и ороговевшими опухолями, курильщики с отрицательным p16 и некератинизирующими опухолями и некурящие с отрицательным p16 и ороговевшими опухолями с DSS 26.7%, 34,7% и 37,4% соответственно. Группа среднего риска будет включать p16-положительных курильщиков с ороговевшими опухолями, p16-положительных курильщиков с некератинизирующими опухолями и p16-положительных некурящих с ороговевшими опухолями. Пятилетние DSS в группе промежуточного риска составили 64,5%, 68,3% и 72,2% соответственно. Группа низкого риска будет включать как p16-положительных пациентов, некурящих, людей с некератинизирующими опухолями, так и p16-отрицательных некурящих с некератинизирующими поражениями с 5-летним DSS 83.2% и 85,7% соответственно (рисунок 3).
Насколько нам известно, это исследование представляет самую большую когорту, описывающую выживаемость на основе кератинизации при OPSCC. Как и предполагалось, у пациентов с некератинизирующим OPSCC наблюдалось значительное преимущество в выживаемости с разницей в DSS 18,5% по сравнению с пациентами с ороговевшим OPSCC. Два предыдущих исследования, посвященных ротоглотке, изучали выживаемость и ороговение. Chernock et al. 2 не обнаружили статистически значимого преимущества в выживаемости у пациентов с некератинизирующим SCC после поправки на возраст и лечение в 118 случаях OPSCC.Crissman et al., , 11, , также изучили кератинизацию и выживаемость OPSCC, снова не обнаружив влияния кератинизации на выживаемость у 77 пациентов. Следует отметить, что это исследование было проведено в начале 1980-х годов, до появления ВПЧ-ассоциированной ОПССК. В более позднем исследовании Crissman et al., 19 было обнаружено статистически значимое преимущество в выживаемости у пациентов с некератинизирующим SCC. Тем не менее, это исследование включало пациентов с раком головы и шеи всех локализаций, подвергшихся химиотерапии и лучевой терапии, при этом пациенты с OPSCC составляли около 40% пациентов.Наше исследование демонстрирует, что статус кератинизации является важным прогностическим фактором при OPSCC.
Ранее было показано, что пациенты с некератинизирующим ПКР полости рта имеют более высокую выживаемость по сравнению с пациентами с ороговевшим раком полости рта. Dissanayaka et al. -13 недавно описали ороговение как прогностический индикатор в серии из 193 пациентов с SCC полости рта в одномерном анализе выживаемости. Аналогичным образом, Fountzilas et al. , 12, обнаружили, что отсутствие ороговения тесно связано с улучшением выживаемости при однофакторном, но не многомерном анализе.
Интересно, что преимущество в выживаемости, наблюдаемое у пациентов с некератинизирующими опухолями, не наблюдалось у пациентов с базалоидно-дифференцированными опухолями. В этой подгруппе нашей серии как ороговевшие, так и некератинизирующие опухоли имели одинаковую выживаемость с 5-летними показателями DSS 76,5% и 71,7%, соответственно, нестатистически значимая разница ( P = 0,74). Однако у пациентов с небазалоидными дифференцированными опухолями пациенты с некератинизирующими опухолями имели значительное преимущество в выживаемости с 29 баллами.На 2% выше DSS по сравнению с ороговевшими небазалоидными опухолями. Наше предыдущее исследование 16 продемонстрировало преимущество в выживаемости, основанное на дифференцировке базалоидов при окрашивании H&E, которое не зависело от статуса p16 и кератинизации. Молекулярная основа дифференцировки базалоидов и их выживаемость при OPSCC в настоящее время неизвестны. Как это связано с ороговением, также неясно. Однако с помощью регрессионного анализа Кокса также было показано, что отсутствие ороговения является независимым предиктором выживаемости.
Подобно дифференцировке базалоидов, наличие или отсутствие кератинизации дало нестатистически значимые различия в DSS у тех пациентов, у которых был p16-положительный OPSCC. Однако у пациентов с p16-отрицательными опухолями наблюдалось улучшение 5-летнего DSS у пациентов с некератинизирующими опухолями на 20,9% по сравнению с пациентами с ороговением. Основываясь на этих данных, прогностическая ценность наличия или отсутствия кератинизации важна для p16-отрицательных пациентов, но не влияет значительно на выживаемость у пациентов с p16-положительными опухолями, у которых уже есть положительный прогноз.
Выживаемость пациентов с OPSCC может быть стратифицирована путем сочетания кератинизации и дифференцировки базалоидов, наблюдаемых при окрашивании H&E. Пациенты с базалоидно-дифференцированными опухолями имеют лучшую выживаемость независимо от ороговения. Пациенты с небазалоидными опухолями имеют меньшую выживаемость, но пациенты с некератинизирующими опухолями имеют улучшенный прогноз по сравнению с пациентами с кератинизацией. Важную прогностическую информацию можно получить только по окрашиванию H&E до иммуногистохимического окрашивания на p16 и любые другие молекулярные маркеры или тестирования на HPV.Благодаря своей простоте и рутинному использованию окрашивания H&E на всех онкологических образцах, отправленных на патологический анализ, эта система стратификации имеет универсальное применение. 16
В целом в этой популяции пациентов было много курильщиков, что наблюдалось как в группах с ороговевшими, так и с некератинизирующими опухолями. Кератинизация была предиктором повышения смертности при анализе подгрупп курильщиков. Однако из-за меньшего числа пациентов разница в 5-летнем DSS у некурящих на основе кератинизации не была статистически значимой ( P =.24).
Кератинизацию можно также комбинировать с классификацией пациентов, использованной Ang et al. 8 для разделения пациентов на категории низкого, среднего и высокого риска. По нашим результатам, пациенты с наименьшим риском были некурящими с некератинизирующими опухолями, независимо от статуса p16. Группу промежуточного риска составили пациенты с p16-положительными опухолями, которые либо курили, либо имели ороговевшие опухоли. Группу высокого риска составили пациенты с p16-отрицательными опухолями, которые либо курили, либо имели ороговевшие опухоли.Наши результаты согласуются с данными Ang et al 8 с наличием или отсутствием кератинизации, изменяющей категоризацию риска для 2 групп пациентов. Некурящие с p16-положительными опухолями были классифицированы как средний риск вместо низкого риска, если у них были ороговевшие опухоли. Кроме того, некурящие с опухолями p16 были отнесены к группе низкого риска вместо промежуточного риска, если у них были опухоли без ороговения.
Предыдущие исследования 19 , 20 также показали, что ороговение OPSCC связано с ухудшением результатов выживания, но молекулярная основа этого неясна.Предполагалось, что ороговевший OPSCC может просто представлять HPV / p16-отрицательные опухоли; однако наше исследование и недавние независимые данные показывают, что это не так, несмотря на некоторую степень корреляции. 20 Недавний протеомный анализ предполагает, что HPV-отрицательный OPSCC имеет повышенную экспрессию белков, что может привести к более дифференцированным ороговевшим опухолям. 21 Необходима дальнейшая работа, чтобы понять молекулярную основу кератинизации, взаимодействие этой дифференциации с инфекцией ВПЧ и то, как это влияет на реакцию на лечение.
Это исследование имело несколько ограничений. Он проводился ретроспективно, и дополнительные переменные, такие как коморбидный статус, в анализ не включались. Все пациенты лечились в одном учреждении. Результаты нашего лечения и методы лечения могут отличаться от результатов лечения в других центрах рака головы и шеи. Некоторые пациенты не могли быть включены в исследование из-за недостаточной доступности тканей для анализа. Гистологический анализ опухолей на предмет ороговения проводился на образцах керна из ТМА, а не на самой опухоли.Это может привести к ошибке выборки из-за вариабельности гистологического вида внутри опухоли. Однако влияние этого ограничения было уменьшено за счет использования повторяющихся и трехкратных образцов керна, взятых из разных областей опухоли.
Подобно ПКР полости рта, отсутствие ороговения является гистологической особенностью, наблюдаемой при окрашивании H&E, что указывает на улучшение прогноза при ОПССК. Это прогностическое преимущество отсутствия ороговения наблюдается у пациентов с небазалоидными дифференцированными и p16-отрицательными опухолями.Однако у пациентов с опухолями, дифференцированными по базалоиду или положительными по p16 и имеющими улучшенный прогноз на основе этих особенностей, кератинизация не оказывает значительного влияния на выживаемость. Существенная прогностическая информация доступна по первоначальному окрашиванию H&E в OPSCC на основе наличия или отсутствия двух ключевых особенностей, кератинизации и дифференциации базалоидов. Стратификация риска пациентов с ОПССК может быть произведена путем объединения статуса p16, кератинизации и статуса курения.
Автор для переписки: Хади Сейкали, MD, FRCSC, Отделение отоларингологии – хирургии головы и шеи, Университет Альберты, 1E4 Центр Уолтера Маккензи, 8440 112 St, Эдмонтон, AB T6G 2B7, Канада ([email protected]).
Отправлено для публикации: 13 июня 2014 г .; окончательная доработка получена 28 сентября 2014 г .; принята 10 ноября 2014 г.
Опубликовано в Интернете: 2 января 2015 г. doi: 10.1001 / jamaoto.2014.3335.
Вклад авторов: Доктор Купер имел полный доступ ко всем данным в исследовании и берет на себя ответственность за целостность данных и точность анализа данных.
Концепция и дизайн кабинета: Купер, Бирон, Климович.
Сбор, анализ или интерпретация данных: Купер, Бирон, Адам, Климович, Путтагунта, Сейкали.
Составление рукописи: Купер, Бирон.
Критический пересмотр рукописи для важного интеллектуального содержания: Бирон, Адам, Климович, Путтагунта, Сейкали.
Статистический анализ: Купер, Адам.
Получено финансирование: Бирон, Сейкалы.
Административная, техническая или материальная поддержка: Бирон, Климович, Путтагунта.
Научное руководство: Бирон, Путтагунта, Сейкали.
Раскрытие информации о конфликте интересов: Доктор Путтагунта ранее работал неоплачиваемым консультантом в AstraZeneca и получал компенсацию командировочных расходов.
Предыдущая презентация: Это исследование было представлено в качестве плаката на многопрофильном симпозиуме по раку головы и шеи; 20-22 февраля 2014 г .; Скоттсдейл, Аризона.
1.Cardesa А, Надаль А.Карцинома головы и шеи в эпоху ВПЧ. Acta Dermatovenerol Alp Pannonica Adriat . 2011; 20 (3): 161-173.PubMedGoogle Scholar2.Chernock РД, Эль-Мофти СК, Торстад WL, Парвин Калифорния, Льюис JS Jr. Неороговевающая плоскоклеточная карцинома ротоглотки, связанная с ВПЧ: полезность микроскопических особенностей в прогнозировании исхода для пациента. Голова Шея Патол . 2009; 3 (3): 186-194.PubMedGoogle ScholarCrossref 3. Чернок RD.Морфологические особенности обычного плоскоклеточного рака ротоглотки: «ороговевающий» и «некератинизирующий» гистологические типы как основа единой системы классификации. Голова Шея Патол . 2012; 6 (приложение 1): S41-S47.PubMedGoogle ScholarCrossref 4. Westra WH. Меняющееся лицо рака головы и шеи в 21 веке: влияние ВПЧ на эпидемиологию и патологию рака полости рта. Голова Шея Патол . 2009; 3 (1): 78-81. PubMedGoogle ScholarCrossref 5.Подкакивание JS, Stein А, Конвей EL, и другие. Рак головы и шеи в Австралии в период с 1982 по 2005 год демонстрирует рост заболеваемости потенциально ассоциированным с ВПЧ раком ротоглотки. Бр.Дж. Рак . 2011; 104 (5): 886-891.PubMedGoogle ScholarCrossref 6.Lau Привет, Брар S, Климович AC, и другие. Прогностическое значение p16 при местнораспространенной плоскоклеточной карциноме головы и шеи, получавшей одновременное лечение цисплатином и лучевой терапией. Голова Шея . 2011; 33 (2): 251-256.PubMedGoogle ScholarCrossref 7. Николс AC, Финкельштейн DM, Faquin ТУАЛЕТ, и другие. Bcl2 и вирус папилломы человека 16 как предикторы исхода после одновременного химиолучевого лечения распространенного рака ротоглотки. Clin Cancer Res . 2010; 16 (7): 2138-2146.PubMedGoogle ScholarCrossref 8.Ang. KK, Харрис Дж., Уиллер Р, и другие. Вирус папилломы человека и выживаемость больных раком ротоглотки. N Engl J Med . 2010; 363 (1): 24-35.PubMedGoogle ScholarCrossref 9. Бирон В.Л., Мохамед А, Хендзель MJ, Алан Андерхилл D, Сейкалы H. Эпигенетические различия между плоскоклеточными карциномами ротоглотки, положительными и отрицательными по вирусу папилломы человека. J Otolaryngol Head Neck Surg . 2012; 41 (приложение 1): S65-S70.PubMedGoogle Scholar10.Wilczynski ИП, Линь BT, Се Y, Paz IB. Обнаружение ДНК вируса папилломы человека и сверхэкспрессия онкопротеина связаны с различными морфологическими паттернами плоскоклеточного рака миндалин. Ам Дж. Патол . 1998; 152 (1): 145-156.PubMedGoogle Scholar 11. Криссман. Джей Ди, Лю WY, Глюкман JL, Каммингс G. Прогностическое значение гистопатологических показателей при плоскоклеточном раке ротоглотки. Рак . 1984; 54 (12): 2995-3001.PubMedGoogle ScholarCrossref 12.Fountzilas G, Космидис P, пиво М, и другие. Факторы, влияющие на полный ответ и выживаемость у пациентов с раком головы и шеи, получавших индукционную химиотерапию на основе платины: исследование Греческой кооперативной онкологической группы. Энн Онкол . 1992; 3 (7): 553-558. PubMedGoogle Scholar13. Диссанаяка. WL, Питияге G, Кумарасири PV, Liyanage Р.Л., Диас KD, Тилакаратне WM. Клинические и гистопатологические параметры выживаемости при плоскоклеточном раке полости рта. Oral Surg Oral Med Oral Pathol Oral Radiol . 2012; 113 (4): 518-525.PubMedGoogle ScholarCrossref 14.Xu CC, Бирон VL, Путтагунта L, Сейкалы Статус H. ВПЧ и вторичные первичные опухоли при плоскоклеточном раке ротоглотки. J Otolaryngol Head Neck Surg . 2013; 42: 36.PubMedGoogle ScholarCrossref 15.Biron VL, Côté DW, Сейкалы H. Плоскоклеточный рак ротоглотки и рак, связанный с вирусом папилломы человека, у женщин: эпидемиологическая оценка связи. J Otolaryngol Head Neck Surg . 2011; 40 (приложение 1): S65-S69.PubMedGoogle Scholar16.Cooper Т, Бирон V, Адам B, Климович AC, Путтагунта L, Сейкалы H. Прогностическая ценность дифференцировки базалоидов при раке ротоглотки. J Otolaryngol Head Neck Surg . 2013; 42: 57.PubMedGoogle ScholarCrossref 17. Кларк Т.Г., Брэдберн MJ, Любовь SB, Альтман DG. Анализ выживания, часть I: основные концепции и первые анализы. Бр.Дж. Рак . 2003; 89 (2): 232-238.PubMedGoogle ScholarCrossref 18.Bradburn MJ, Кларк ТГ, Любовь SB, Альтман DG. Анализ выживаемости, часть II: многомерный анализ данных: введение в концепции и методы. Бр.Дж. Рак .2003; 89 (3): 431-436.PubMedGoogle ScholarCrossref 19. Криссман. JD, Pajak TF, Зарбо RJ, Marcial Вирджиния, Ас-Сарраф M. Улучшенный ответ и выживаемость при комбинированном применении цисплатина и облучения при некератинизирующем плоскоклеточном раке головы и шеи: исследование с помощью RTOG 114 опухолей на поздних стадиях. Рак . 1987; 59 (8): 1391-1397.PubMedGoogle ScholarCrossref 20.Cai C, Чернок RD, Питтман Я, Эль-Мофти СК, Торстад WL, Льюис JS МладшийПлоскоклеточный рак орофаринкса кератинизирующего типа: сверхэкспрессия p16 связана с положительным статусом ВПЧ высокого риска и улучшением выживаемости. Am J Surg Pathol . 2014; 38 (6): 809-815.PubMedGoogle ScholarCrossref 21.Slebos RJC, Jehmlich N, коричневый B, и другие. Протеомный анализ карциномы ротоглотки выявляет новые биологические пути, связанные с ВПЧ. Инт Дж. Рак . 2013; 132 (3): 568-579. PubMedGoogle ScholarCrossrefТипы плоскоклеточного рака
Существует несколько типов плоскоклеточного рака.Некоторые из них распространяются с большей вероятностью, чем другие, но в целом большинство из них обладают схожими характеристиками. Основное различие между каждым подтипом – гистологическое (связано с уникальными характеристиками раковых клеток).
Чтобы определить, какой тип плоскоклеточного рака у пациента, патолог исследует образец ткани под микроскопом. Определяя тип клеток, присутствующих в поражении, онколог может адаптировать план лечения пациента для достижения наилучшего результата и качества жизни.
Первичные типы плоскоклеточного рака:
- Аденоидная / псевдогландулярная плоскоклеточная карцинома
- Внутриэпидермальный плоскоклеточный рак
- Крупноклеточный ороговевающий плоскоклеточный рак
- Крупноклеточный плоскоклеточный рак без ороговения
- Лимфоэпителиальный рак
- Папиллярный плоскоклеточный рак
- Папиллярный рак щитовидной железы
- Мелкоклеточный ороговевающий плоскоклеточный рак
- Веретено-клеточный плоскоклеточный рак
- Веррукозный плоскоклеточный рак
В онкологическом центре Моффитта мы диагностируем и лечим полный спектр видов рака кожи, включая уникальные варианты плоскоклеточного рака.Услуги по скринингу, постановке и долгосрочному наблюдению также доступны в рамках нашей приверженности обеспечению комплексного ухода.
Поскольку хирурги, лучевые терапевты, дерматологи и дерматопатологи в рамках нашей программы кожной онкологии работают исключительно с пациентами с раком кожи, они обладают уникальной квалификацией, чтобы определить, какие методы лечения наиболее перспективны для конкретного диагноза каждого пациента. Наши планы лечения составлены по-разному, при этом особое внимание уделяется не только результатам, но и качеству жизни.
Направления не требуются для поиска диагноза или лечения в Моффитт. Если вам поставили диагноз – или вы обеспокоены тем, что у вас есть признаки – одного из различных типов плоскоклеточного рака, позвоните по телефону 1-888-663-3488 или отправьте онлайн-форму регистрации нового пациента.
.
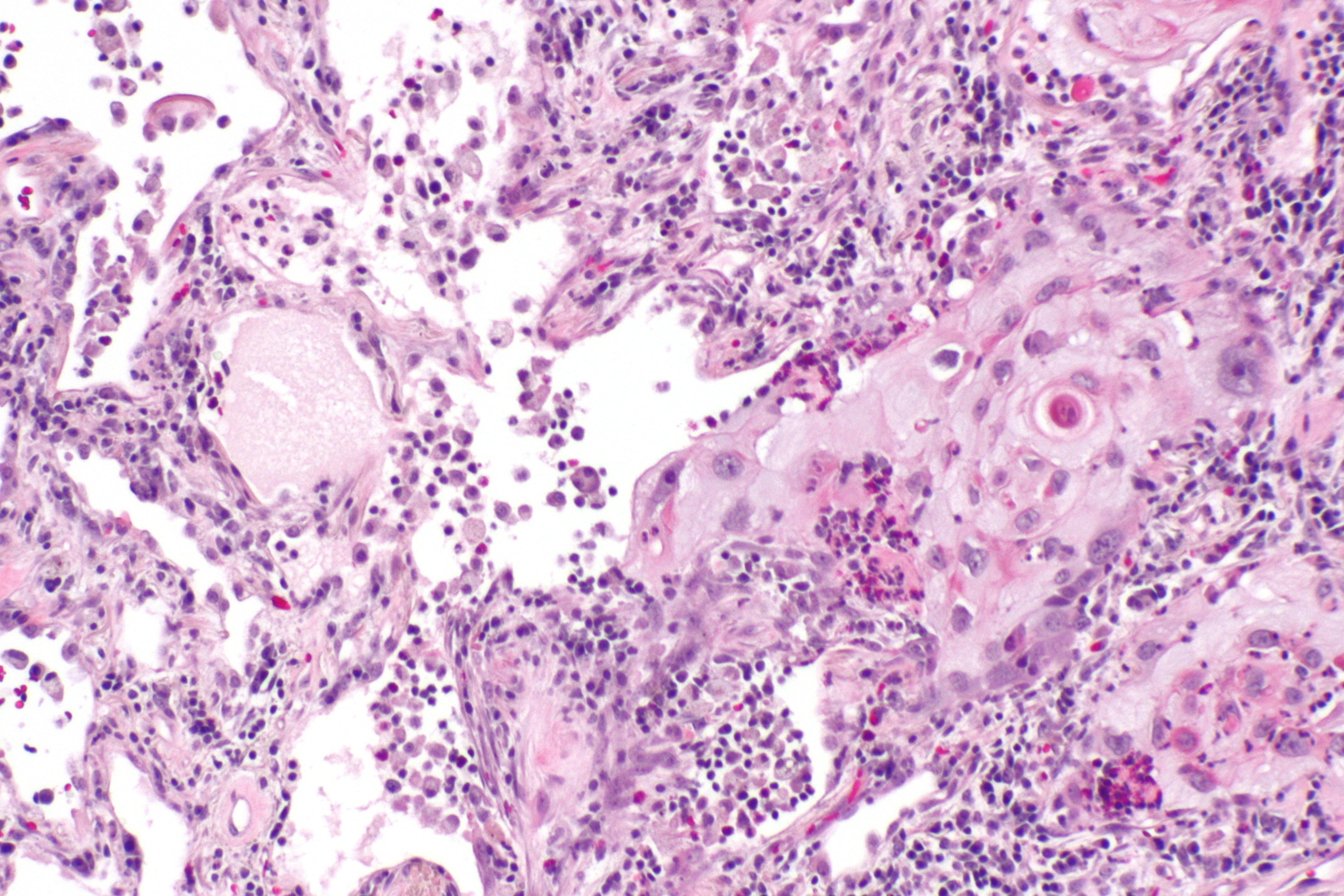
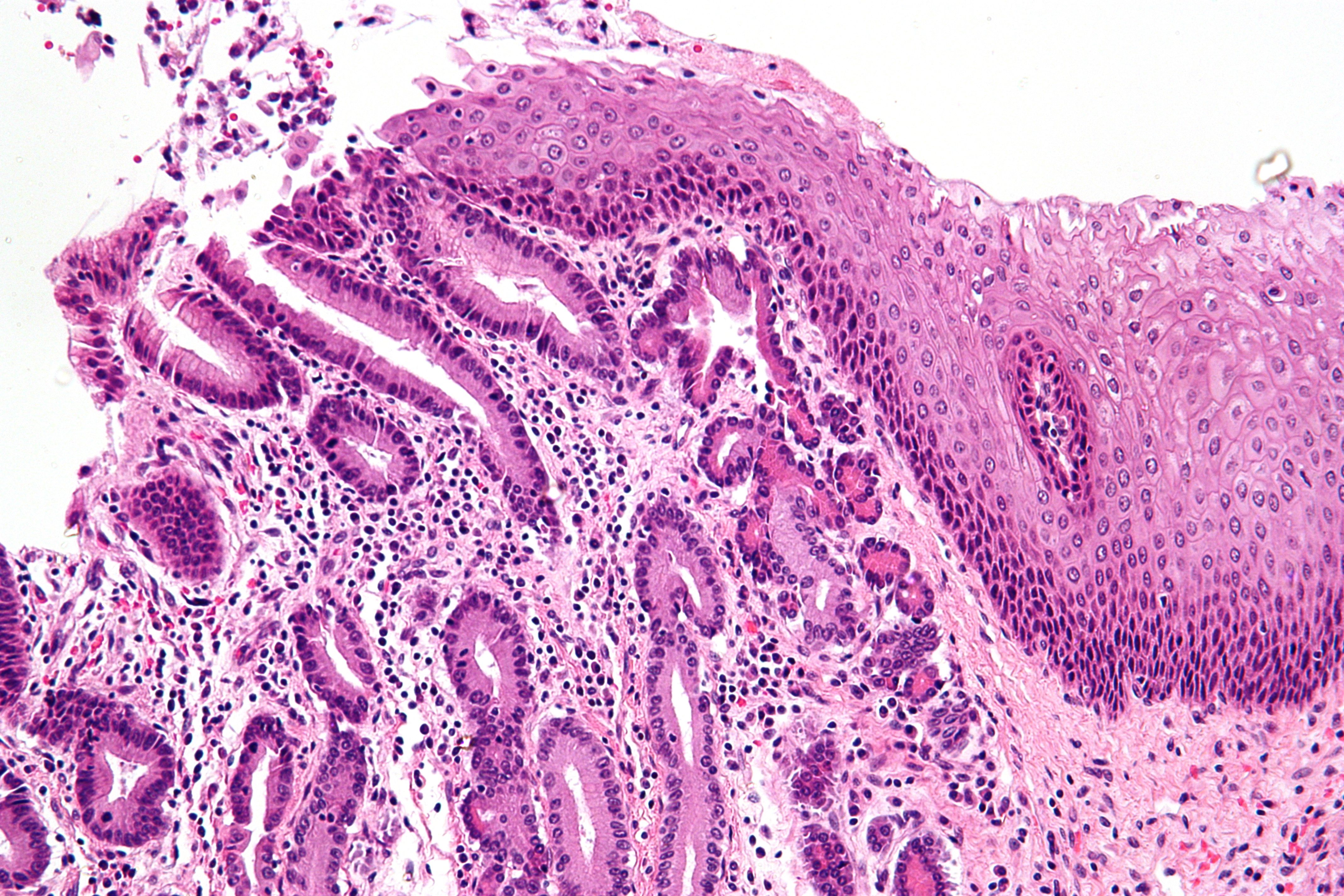

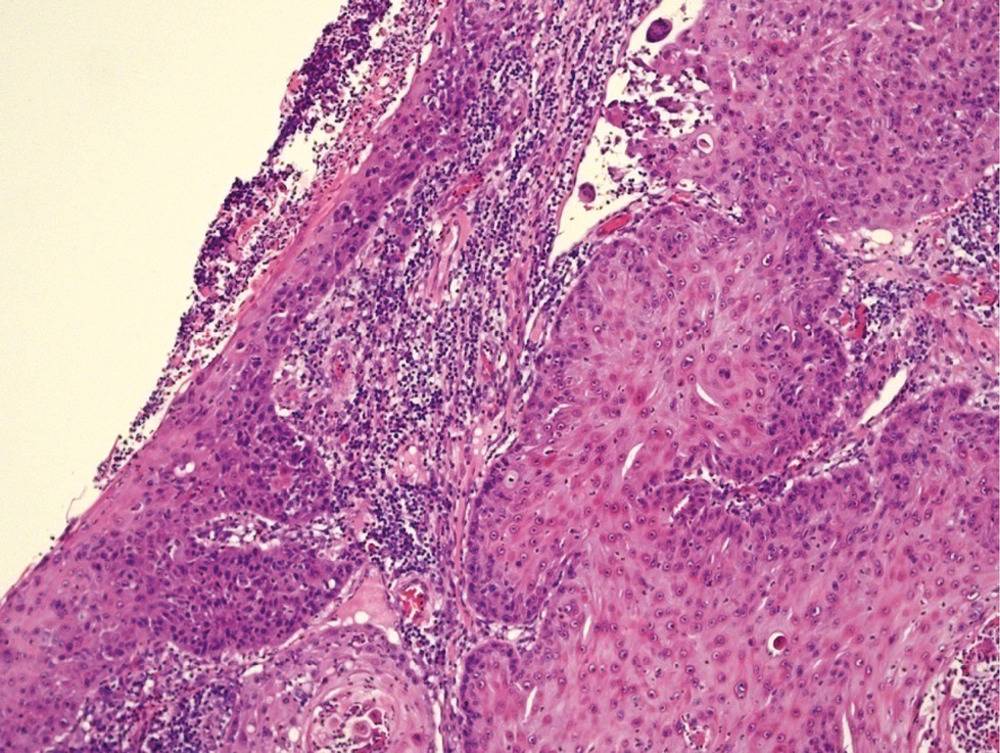

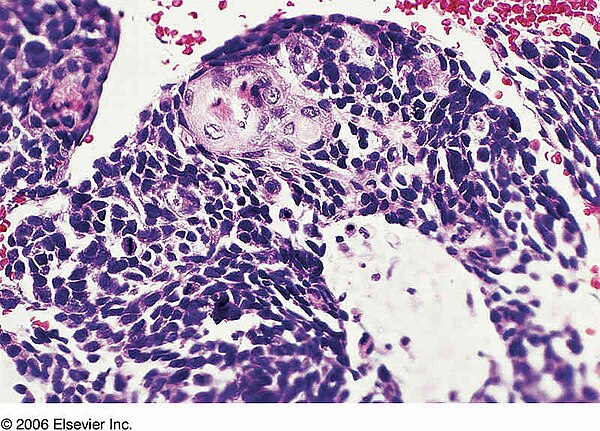
 F.C.P.C.; Europ Fed.Colp) с 2006 года.
F.C.P.C.; Europ Fed.Colp) с 2006 года. )
)