Повышенная или пониженная кислотность как определить: Тест на кислотность желудка. Врач — об опасности отклонения от нормы | Здоровая жизнь | Здоровье
как с этим бороться Как узнать повышенная кислотность или
Как понять, кислотность желудка повышена или понижена? Разберемся.
Для процесса пищеварения очень важно, чтобы желудочный сок обладал нормальным уровнем кислотности. Этот уровень определяется концентрацией соляной кислоты. В нашей статье узнаем, как определить кислотность желудка. Также выясним, какими бывают признаки повышенного или пониженного показателя.
Желудочный сок и его кислотность
Повышенная кислотность является избытком соляной кислоты, она может приводить к ослаблению оболочки, защищающей желудок. Повышенная кислотность крайне отрицательно влияет на его стенки. Такой процесс тесно взаимосвязан с рядом патологий и нежелательной симптоматики, к примеру, это ведет к таким недугам, как язва, кровотечения, гастрит и так далее.
Как определить кислотность желудка в домашних условиях, интересно многим.
Что касается пониженной кислотности, то она представляет собой дефицит соляной кислоты и ведет к неблагоприятным последствиям.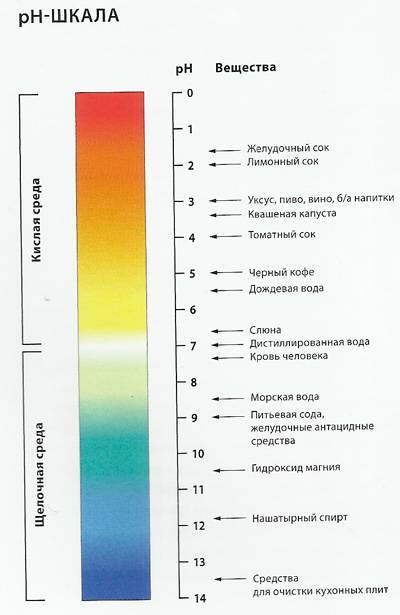 При этой форме отклонения ухудшается антибактериальная деятельность кислоты, из-за чего происходит значительное нарушение кишечной флоры. В желудке находится среда, которая благоприятна для размножения болезнетворных бактерий, а, кроме того, грибов. Поэтому при попадании туда и размножаются бактерии Хеликобактер, из-за чего появляются различные заболевания, такие как эрозия, гастрит, полипоз и, что еще хуже – злокачественные опухоли.
При этой форме отклонения ухудшается антибактериальная деятельность кислоты, из-за чего происходит значительное нарушение кишечной флоры. В желудке находится среда, которая благоприятна для размножения болезнетворных бактерий, а, кроме того, грибов. Поэтому при попадании туда и размножаются бактерии Хеликобактер, из-за чего появляются различные заболевания, такие как эрозия, гастрит, полипоз и, что еще хуже – злокачественные опухоли.
Рассмотрим, как определить кислотность желудка самостоятельно.
Методы самостоятельного диагностирования
Сбои в работе пищеварительной системы при различных типах кислотности можно с легкостью перепутать с другими заболеваниями, если не проводить наблюдение за реакцией организма на те, или иные вкусовые предпочтения. Существуют всем известные тесты для определения кислотности желудка. Необходимо воспользоваться следующими видами продуктов:
- Тест с помощью лимона. Обычно людям, у которых повышенная кислотность, на вкус данный фрукт кажется очень кислым.
 Те, у кого она пониженная, с легкостью употребят мякоть или сок лимона, так как это не вызовет у них неприятных ощущений. Еще как проверить кислотность желудка?
Те, у кого она пониженная, с легкостью употребят мякоть или сок лимона, так как это не вызовет у них неприятных ощущений. Еще как проверить кислотность желудка? - Тест с пищевой содой. Для проверки кислотности с помощью данного метода нужна 0,5 ч. л. соды, которую растворяют в воде и тщательно размешивают. Полученный напиток выпивают на голодный желудок и наблюдают за состоянием своего организма. Отсутствие отрыжки будет указывать на пониженный уровень.
- Тест с использованием пшенной каши с маслом. В том случае, если изжога появится от этого блюда, будет свидетельствовать о повышенном уровне. Как проверить кислотность желудка, знают не все.
- Тест с использованием яблочного сока. Для проверки следует выпить такой сок на голодный желудок. В случае наличия повышенной кислотности, возникнут неприятные, а, кроме того, болезненные ощущения в животе. В том случае, если эти ощущения будут отсутствовать, то это будет означать, что уровень кислотности в норме. Если же имеется желание употребить яблочный сок или другой кислый продукт, значит, она сильно понижена.

Вот как определить кислотность желудка в домашних условиях.
Почему понижена кислотность и каковы для этого причины?
Пониженная кислотность выступает следствием определенных заболеваний, например, гастрита, гастродуоденита или рака желудка. Эти патологии тесно взаимосвязаны с нарушением работы желез, которые отвечают за наличие соляной кислоты. Как таковая пониженная кислотность служит довольно серьезным видом патологии, так как создает среду для распространения инфекций.
Должен знать каждый.
Почему повышается кислотность?
Основной причиной ее увеличения считается неправильный режим питания наряду с несоблюдением графика принятия продуктов. Употребление жирной и острой пищи наряду с копченостями, сладостями, алкоголем и кофе крайне отрицательно отражается на процессе пищеварения.
Помимо этого продолжительный прием некоторого вида медицинских препаратов способен повышать кислотность в желудке. К таким препаратам относят гормональные средства наряду с противовоспалительными нестероидными медикаментами. Курение тоже пагубно влияет на желудок и повышает его кислотность.
Курение тоже пагубно влияет на желудок и повышает его кислотность.
Признаки пониженной кислотности желудка
Наиболее характерными признаками пониженной кислотности являются следующие факторы:
- Наличие отрыжки наряду с неприятным запахом.
- Частое вздутие живота.
- Ощущение тяжести в районе подреберья.
- Присутствие тупой боли после приема пищи.
- Появление расстройства стула.
Вторичными признаками пониженной кислотности желудка, которые появляются спустя некоторое время, в этом случае являются следующие симптомы:
- Наличие сухости кожи на руках, а, кроме того, на лице.
- Присутствие ломкости и расслаивания ногтей.
- Наличие ломкости и сухости волос.
- Возникновение сыпи и расширенной сосудистой сетки на лице.
- Общая слабость организма.
- Наличие быстрой утомляемости организма.
- Снижение гемоглобина даже при сбалансированном питании.
Рассмотрим ниже признаки повышенной кислотности желудка.
Симптоматика избытка кислоты
Это является проблемой с не менее отрицательными последствиями, чем в противоположном случае. У человека происходит раздражение стенки желудка из-за избытка кислотности, что приводит к появлению следующих симптомов:
- Появление изжоги после питания.
- Медный привкус во рту.
- Наличие отрыжки после пищи.
- Боль в желудке, которая имеет ноющий характер.
- Тяжесть со вздутием живота.
- Появление давящих ощущений в брюшной полости.
- Сбой процесса дефекации.
- Появление боли в желудке после лекарственных препаратов.
Вторичными признаками, которые могут возникнуть при отсутствии лечения, служат следующие симптомы:
- Снижение аппетита наряду с апатией.
- Частый дискомфорт в районе желудка.
- Частые приступы тошноты и рвоты.
- Присутствие бело-серого налета на языке.
Как правило, при отсутствии таких признаков кислотность находится в норме (нулевая кислотность желудка).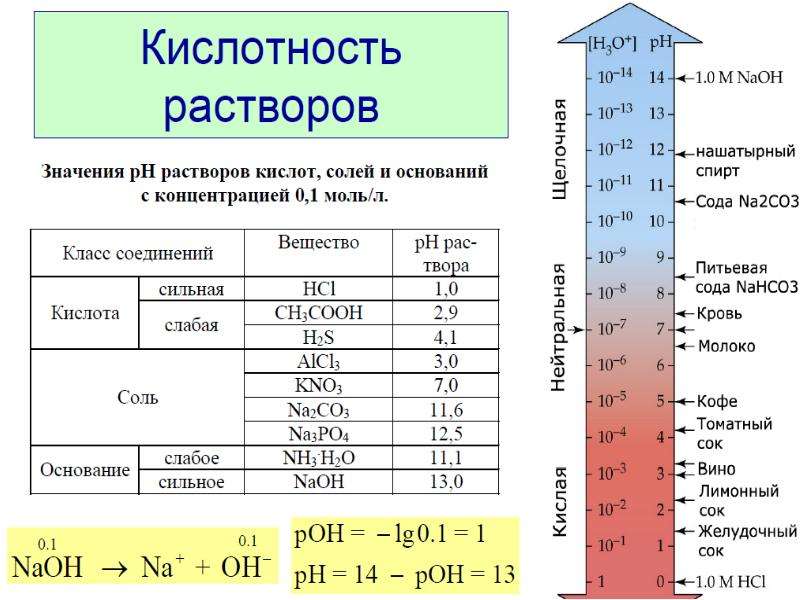 Но, при наличии хотя бы некоторой симптоматики необходимо своевременно обратиться к специалисту в целях выявления вероятных проблем и последующей корректировки. Знать, как определить кислотность желудка, недостаточно. Далее выясним, какой должна быть диета.
Но, при наличии хотя бы некоторой симптоматики необходимо своевременно обратиться к специалисту в целях выявления вероятных проблем и последующей корректировки. Знать, как определить кислотность желудка, недостаточно. Далее выясним, какой должна быть диета.
Выбор диеты при высоком уровне кислоты в желудке
Любая диета при проблемах с кислотностью должна быть направлена на нормализацию уровня соляной кислоты и на создание благоприятных условий для нормального пищеварения. При высоком уровне кислоты необходимо отказываться от наваристых бульонов, а, кроме того, от острых закусок наряду с сырыми овощами и газированной водой. Из овощей разрешено употреблять в пищу отварной картофель, морковь или цветную капусту.
Рекомендуется также ограничить сладости и мучные изделия. Полезным при повышенной кислотности считают употребление каш, а также минеральной воды. Принимать продукты требуется в хорошо измельченном и отварном виде.
Пониженная кислотность и диета
При пониженной кислотности принципы диеты похожи, но стоит исключить жирную, перченую и соленую пищу. При нормализации самочувствия разрешается расширить рацион добавлением мясных бульонов, рыбных блюд и овощных. Оба варианта диеты исключают напитки, содержащие алкоголь. Следует с осторожностью относиться к различным специям, поэтому лучше их полностью убрать, так как они могут оказать сильное раздражающее воздействие на желудок и усилить нежелательные симптомы.
При нормализации самочувствия разрешается расширить рацион добавлением мясных бульонов, рыбных блюд и овощных. Оба варианта диеты исключают напитки, содержащие алкоголь. Следует с осторожностью относиться к различным специям, поэтому лучше их полностью убрать, так как они могут оказать сильное раздражающее воздействие на желудок и усилить нежелательные симптомы.
Способы определения кислотности желудка
Прежде всего, следует знать, что ее нормальный уровень должен составлять от 0 до 9 ммоль. К медицинским мероприятиям, помогающим в определении уровня кислотности, относятся следующие приемы:
Домашние способы понижения повышенной кислотности
Можно попытаться снизить кислотность с помощью диеты. Для этого прекращают употребление продуктов, вызывающих ее повышение, а именно речь идет о кофе, чае, газированных напитках, квашеных овощах, сладостях, бобовых, грибах, кисломолочных жирных продуктах и калорийных блюдах. Следует принимать больше продуктов, способствующих снижению кислотности, к которым относят нежирное молоко наряду с ряженкой, йогуртами, молочными кашами, творожно-фруктовыми запеканками, соками из моркови и свеклы. Также полезно будет употреблять мед и лечебную минеральную воду, но без газа.
Также полезно будет употреблять мед и лечебную минеральную воду, но без газа.
Для понижения кислотности можно пользоваться народными методами. Эффективным народным методом является употребление травяного чая, настоев или отваров, воздействие которых направлено на то, чтобы восстановить нормальную функцию нервной системы. Рекомендуют употреблять чай с мятой, добавляя в него пару капель имбирного сока с ложкой меда. Приготовленный по этому рецепту чай не только успокоит нервы, но и поможет процессу пищеварения.
Можно пить отвар, приготовленный из семечек льна, подойдет и настойка из семян укропа. Действие этих продуктов направлено на восстановление здоровой работы желудка. Число применений в день: два раза. Очень эффективным методом является прием таблеток активированного угля, который способен связывать лишнюю соляную кислоту.
Для устранения кислоты нужен металл. Хорошим для этого средством является кальций. Необходимо растолочь скорлупу от яиц, перемешать полученный порошок с витамином «D» или рыбьим жиром. Употреблять такое средство надо при кислом привкусе во рту.
Употреблять такое средство надо при кислом привкусе во рту.
Мы рассмотрели основные методы определения кислотности желудка.
Профилактика повышения кислотности
Если повышение уровня кислотности возникает лишь время от времени, то подобное состояние крайне редко приводит к серьезным последствиям. Но в том случае, если повышенный уровень наблюдается регулярно, то это может приводить к серьезным заболеваниям. В связи с этим очень важно соблюдать следующие меры профилактики:
- Правильно, а, кроме того, рационально питаться. Употреблять в пищу следует много продуктов, которые содержат клетчатку и белки с витаминами. Пищу рекомендуется принимать небольшими порциями, исключая жирные и острые продукты. Под особым запретом должны быть блюда из категории фаст-фуда.
- Не менее важно отказаться от курения, а, кроме того, употребления алкогольных напитков.
- Следует осуществлять регулярные обследования на присутствие хеликобактерной инфекции.
- Нужно стараться избегать стрессов и нервного перенапряжения.

- Осуществлять своевременное лечение патологий инфекционного генеза, так как они могут привести к развитию осложнений.
Заключение
Как определить кислотность желудка, теперь понятно. Но, несмотря ни на что, следует помнить, что в любом случае требуется обратиться за квалифицированной помощью к доктору. Ведь именно специалист с помощью предназначенной диагностики и клинических обследований поможет поставить верный диагноз, назначив адекватное лечение.
Кислотность желудка – показатель, характеризующий нормальное функционирование этого органа пищеварения. Определить кислотность желудка можно различными способами. Это и диагностические процедуры в лечебном учреждении, и подручные средства в домашних условиях. Выявится повышенная или пониженная кислотность, независимо от этого любое отклонение является патологией и нуждается в коррекции и лечении.
Общие сведения
Желудок является главным органом, участвующим в процессе пищеварения. Внутри него накапливается и расщепляется поступающая в организм пища.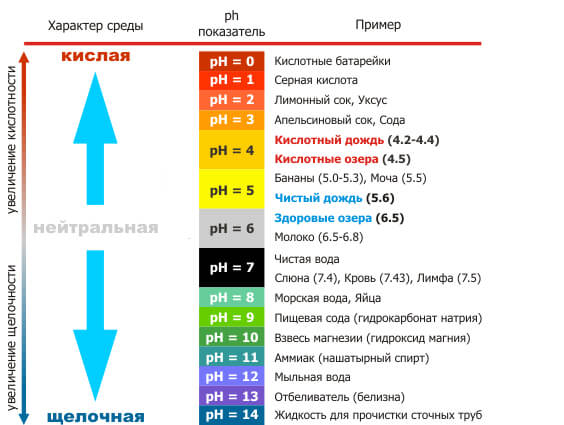 Нормальная ее переработка обеспечивается . Показателем того, что желудок работает в нормальном режиме, является уровень его кислотности. Под этим показателем понимается концентрация соляной кислоты в желудочном соке. Уровень его содержания постоянный и составляет 160 ммоль/л.
Нормальная ее переработка обеспечивается . Показателем того, что желудок работает в нормальном режиме, является уровень его кислотности. Под этим показателем понимается концентрация соляной кислоты в желудочном соке. Уровень его содержания постоянный и составляет 160 ммоль/л.
Если соотношение между щелочным компонентом и кислотой изменяется, то говорят о понижении или повышении кислотности. Когда концентрация завышена, кислотность повышается, и соответственно, снижение концентрации ниже нормы указывает на пониженную кислотность. Любой сдвиг приводит к сбою нормального функционирования ЖКТ и вызывает заболевания органов этой системы.
Инструментальные методы
В современной гастроэнтерологии применяются различные инструментальные методы определения кислотности желудка. Такая диагностика проводится с помощью;
- внутрижелудочной pH-метрии;
- фракционного зондирования;
- окрашивания стенок желудка;
- использования ионообменной смолы.
Внутрижелудочная pH-метрия или интрагастральная метрия считается самым информативным методом.
Фракционное зондирование поможет узнать кислотность желудка. Эта процедура предполагает отсасывание содержимого желудка через резиновую трубку. Полученный материал исследуется в лаборатории. Но необходимо иметь в виду, что результаты такого метода могут иметь погрешность, так как материал забирается из разных участков желудка и перемешивается в процессе отсасывания.
Известно, что исследуемый орган имеет 3 отдела, в каждом из которых кислотность различная. Определение кислотности с помощью окрашивания желудка заключается в эндоскопическом введении красителя в орган пищеварения. Оценка показателя осуществляется посредством визуального исследования стенок желудка по тому, как изменится цвет красителя.
Использование ионообменных смол считается самым простым способом определения кислотности желудочного сока, но вместе с тем и наименее информативным.
Такой способ диагностики применяется, когда у пациента имеются противопоказания к зондированию.
Инструментальные методы отличаются наибольшей точностью
Определение показателя по симптомам
Повышенная выработка желудочной кислоты сопровождается возникновением определенных симптомов. Повышенную кислотность можно выявить по таким признакам, как:
- отрыжка и изжога;
- привкус кислоты во рту;
- тяжесть и боль в желудке;
- вздутие живота и нарушение стула.
Изжога возникает каждый раз после приема пищи. В положении лежа этот симптом усиливается. Подобное проявление обусловлено раздражением стенок желудка вырабатываемой в избытке соляной кислотой. Когда кислотность понижена, наблюдается нарушение процесса пищеварения, поступаемая пища плохо расщепляется, ухудшается усвоение витаминов и микроэлементов.
Снижение концентрации желудочного сока имеет аналогичные проявления, как и при ее повышении, с небольшой разницей. Признаками нехватки желудочного сока является отрыжка с тухлым запахом, постоянное урчание в желудке, снижение уровня гемоглобина. Если говорить об общей реакции организма, то снижается иммунитет, человек становится подверженным заражению различными вирусами и бактериями. Кроме того, пониженная секреция соляной кислоты в желудке может провоцировать рак этого органа.
О снижении кислотность желудка будут свидетельствовать такие дополнительные проявления, как:
- глистная инвазия;
- грибок ногтей;
- ломкость ногтей и волос;
- просвечивание сосудов на лице;
- присутствие в кале непереваренных остатков пищи;
- угревая сыпь на теле и лице.
Какие способы подходят для домашних условий
Несмотря на то что состояние кислотности желудка с достоверной точностью определяется лишь в медицинских условиях, можно самому в домашних условиях проверить этот показатель.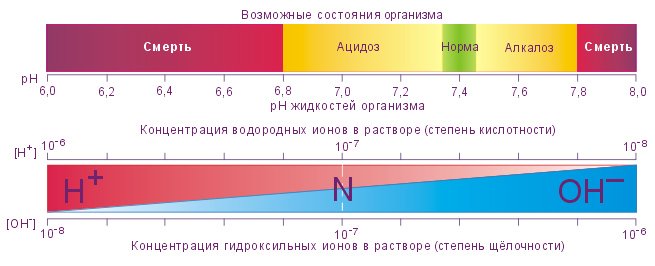 Одним из таких методов является специальная тест-полоска. Ее действие основано на определении уровня PH. На лакмусовую полоску нанесен специальный индикатор, который вступает в химическую реакцию при контакте с кислотой.
Одним из таких методов является специальная тест-полоска. Ее действие основано на определении уровня PH. На лакмусовую полоску нанесен специальный индикатор, который вступает в химическую реакцию при контакте с кислотой.
Повышенная кислотность желудка всегда сопровождается приступами изжоги
Результат определяется по цвету полоски, он меняется. Если кислотность повышена, то индикатор становится красного цвета. При пониженном показателе лакмусовая полоска окрашивается в синий цвет. Рекомендуется проводить проверку натощак утром, между 9 и 11 часами. Для получения наиболее точных данных желательно повторить тест через несколько дней. Сопоставляя эти показатели можно получить более или менее достоверную информацию об интересующем вопросе.
Определить кислотность желудочного сока можно с помощью обычной соды. Для этого нужно выпить раствор соды: половину одной чайной ложки растворяют в стакане прохладной воды. Если после этого появилась отрыжка или обильное срыгивание воздухом, то принято считать, что кислотность повышена. Проверить pH желудка можно с помощью лимона. Достаточно отрезать тонкий ломтик цитрусового фрукта и съесть его.
Если почувствуется сильно кислый привкус, значит у человека повышенная кислотность. Если же показатель на самом деле понижен, то вкус лимона будет воспринят не кислым.
Обычный яблочный сок поможет ответить на вопрос об уровне кислотности желудка. Нужно выпить напиток натощак и проследить за собственной реакцией. При повышенном уровне pH в органе пищеварения, у человека начнутся болевые спазмы в животе, появится изжога и , во рту будет чувствоваться металлический вкус. При пониженной кислотности подобные симптомы отсутствуют.
Кислотно-щелочной баланс организма – важный показатель обмена веществ. При малейших нарушениях этого равновесия человек сталкивается с серьёзными патологиями желудочно-кишечного тракта. Но это вовсе не значит, что при малейшей симптоматике нужно бежать в поликлинику. Определить кислотность желудка самостоятельно можно при помощи простейших опытов или посредством специальных тестовых полосок.
Симптомы повышенной и пониженной кислотности
На 0,5% желудочный сок состоит из соляной кислоты, которая помогает в переваривании пищи, способствуя её постепенному перемещению в полость 12-перстной кишки. Кроме того, она осуществляет ряд прочих функций, не менее значимых для организма человека:
- Содействие процессу расщепления белка.
- Активизация пепсиногенов, которые обращаются в пепсины.
- Формирование субацидной среды.
- Противомикробное действие желудочного сока.
- Развитие панкреатической секреции.
От степени содержания кислоты напрямую зависит субацидность желудка. Она отличается своими определёнными нормами, аномалии которых способствуют появлению дискомфорта в организме.
Узнать кислотность желудка можно самостоятельно. К примеру, повышенный уровень определяют следующие признаки:
- Изжога.
- Острые болевые ощущения, сопровождающиеся жжением в области пищевода.
- Тяжесть в желудке.
- Отрыжка с характерным кисловатым запахом.
- Боль во время еды и между приёмами пищи.
- Красноватый цвет языка с белёсым налётом.
- Болезненное самочувствие.
- Рассеянность.
- Проблемы со сном.
Симптомы пониженной кислотности:
- Гнилостный запах из полости рта даже при отсутствии кариеса зубов или пародонтоза.
- Отрыжка.
- Плохое переваривание еды, сопровождающееся жидким стулом и в некоторых случаях запорами.
- Урчание, вздутие.
- Привкус железа во рту.
- Неважный аппетит или полное его отсутствие.
- Анемия.
- Тошнота.
- Понижение иммунитета.
- Присутствие непереваренных фрагментов пищи в кале.
- Расстройства психики.
Норма кислотности
Субацидность желудка – сосредоточение соляной кислоты, измеряемое рН-метрией. Когда у человека начинаются проблемы с перевариванием пищи, появляется болевой синдром в области желудка, тогда гастроэнтерологи назначают анализ желудочного сока и ФГСД. Всё это помогает определить, в каком состоянии находится слизистая, а также проверить кислотность желудочного секрета.
Для естественного пищеварения в желудке требуются специальные ферменты. Ключевым из них считается пепсин, образующийся лишь в кислой среде. Тем не менее, чтобы всё, что содержится в желудке переместилось в кишечник, нужна обязательная нейтрализация этой кислоты.
В организме всё взаимосвязано, и при малейших нарушениях желудочных процессов, как например при гастрите, происходит сбой всего пищеварительного функционала. А это уже чревато серьёзными осложнениями.
Нормы кислотности здоровой среды желудка выглядят следующим образом (значения указываются в ед. рН):
- Оптимальность – 1,5–2,0.
- Максимум – 0,86.
- Минимум – 8,3.
- Антрум – 1,3–7,4.
- Эпителиальный слой – 7,0.
- Нейтральное число – 7,0.
Если уровень последнего показателя превышает указанную цифру, то в организме доминирует щелочная среда.
Определение кислотности дома
Патологии, связанные с повышенной или пониженной кислотностью, выявляются в домашних условиях с помощью простых методов. Чтобы проверить эти показатели самостоятельно достаточно использовать доступные всем продукты.
Пищевая сода
Потребуется растворить ½ чайной ложечки в 200 мл воды и употребить натощак. Если после приёма появилась отрыжка, то это говорит о повышенной норме. Отсутствие такого симптома указывает на пониженный уровень.
Простейший домашний тест на кислотность, который также поможет понять, что происходит в желудке. В случае повышения нормы вкус цитруса ощущается чрезмерно кислым, а понижения – самым обычным, когда человек даже не сморщится.
Пшённая каша
Когда после употребления этого блюда появляется изжога, то субацидность превышает свои допустимые параметры.
Яблочный сок
Если выпить напиток утром до завтрака, то в случае повышенной концентрации кислоты появится жжение за грудиной посередине (в области пищевода) и металлический вкус во рту. Отсутствие симптоматики говорит о нормальных показателях. Если же после кислого сока хочется попить ещё что-то аналогичное, то это значит, что уровень концентрации низкий.
Лакмусовые полоски
Этот вариант является самым точным показателем проверки кислотной среды желудка. Лакмус – природный краситель, добываемый из лишайника. Кусочек бумаги, пропитанный настоем, играет роль индикатора, который в условиях кислотной среды становится красным, а щелочной – синим.
Стоит отметить, что измерения лучше всего производить натощак с 10 до 12 ч. В этот временной период слюноотделение меньше, чем, например, вечером. За два часа до перекуса лакмусовую бумагу надо положить на поверхность языка и оставить на несколько мгновений. Узнать свои результаты можно при помощи приложенной цветовой шкалы.
Причины отклонения кислотности
Соляная кислота необходима для расщепления белка и переваривания пепсинов, активизации панкреатической секреции и борьбы с болезнетворными бактериями. Поэтому контролировать её концентрацию – занятие необходимое и важное. Только так её можно своевременно нормализовать, а значит избавить свой организм от таких серьёзных заболеваний, как гастрит, язва, и что ещё страшнее – рака желудка, кишечника или других отделов ЖКТ.
Концентрация соляной кислоты изменяется в силу целого ряда причин. В их числе:
- стрессы;
- хеликобактерная инфекция;
- злоупотребление алкоголем;
- курение;
- переедания;
- применение сухой и тяжёлой пищи;
- жирные и острые блюда;
- перенапряжения;
- проблемы со сном;
- продолжительный приём лекарственных препаратов;
- авитаминоз;
- наследственные факторы.
В целом проверить концентрацию кислоты в организме – занятие несложное и сделать это возможно даже дома. Однако не стоит пренебрегать периодическими осмотрами у специалистов. При необходимости будут проведены исследования, включая гастроскопию и зондирование. Это поможет поставить правильный диагноз и назначить своевременное лечение гастроэнтерологической патологии. Не нужно также забывать, что разумное питание, избавление от вредных привычек и стрессов является залогом не только нормальных значений кислотности, но хорошего самочувствия и настроения.
Гастрит − это воспаление слизистых оболочек органов желудочно-кишечного тракта, сопровождаемое нарушением уровня pH в организме. Значительное снижение или повышение кислотности негативно сказывается на работе органов пищеварения и организме, поэтому логичной мерой при появлении гастрита становится диагностика кислотности желудочного сока.
Главная составляющая желудочного сока − соляная кислота. Желудок обладает кислотной реакцией на приём пищи. Кислотная среда считается агрессивной для множества вредоносных бактерий, вирусов, с лёгкостью попадающих в пищу человека, вызывая отравление. Соляная кислота в норме нейтрализует их действие. Необходима для эффективного переваривания пищи.
Между приёмами еды в желудке скапливается некое количество желудочного сока. Когда человек ест, усиливается аппетит, содержание желудочного сока в организме в этот момент достигает полутора литров. Нормальным уровнем кислотности считается водородный показатель (pH) в диапазоне 1,5-2,5 единиц. Среда в органах пищеварения преимущественно кислая. Уровень pH ниже 7 единиц считают кислым, от 7 единиц и выше − щелочным.
Правильный процесс пищеварения обеспечивают ферменты, главным считается пепсин. Указанный фермент вырабатывается и действует, если кислотность желудка в норме. Малейший сбой в кислотности отражается на качестве пищеварения и обуславливает гастрит и прочие заболевания. Правило работает и в обратном направлении − гастрит обуславливает сбои в уровне pH.
Соляная кислота выделяется желудком и нейтрализуется в его антральном отделе для нормального рассасывания пищи в кишечнике. Когда развивается дисбаланс в продукции и нейтрализации соляной кислоты, появляется повышенная кислотность организма. Если излишняя выработка кислоты происходит продолжительное время, возникает её устойчивое повышение в желудке и двенадцатиперстной кишке.
Симптомы снижения кислотности нельзя оставлять без внимания, длительное раздражение слизистой оболочки желудка, особенно при наличии гастрита, чревато многими сопутствующими заболеваниями. Из-за патологии развивается множество расстройств органов пищеварения:
- гастродуоденит;
- гастроэзофагеальная рефлюксная болезнь;
- гастриты различных видов.
Понять, что кислотность повышена, позволяют симптомы:
- изжога − яркий признак заболеваний органов ЖКТ, свидетельствует об этом в комплексе с прочими признаками;
- чувство жжения в районе груди и першение в горле;
- отрыжка с горьким привкусом;
- боль ноющая, приступообразная, свидетельствует о начальной стадии развития язв;
- боль под ребром с правой стороны.
При обнаружении ряда симптомов не откладывайте визит к врачу. Повышение уровня pH − опасная дисфункция органов ЖКТ, при длительном течении последствия необратимы.
Признаки пониженной кислотности желудка
Определить кислотность желудка, если она заметно снижена, возможно самостоятельно. Потом потребуется срочно обратиться к гастроэнтерологу для подтверждения диагноза. Врач диагностирует неполадки в органах ЖКТ и назначит правильное лечение. Пониженная кислотность не менее опасна, чем повышенная, обуславливает ряд характерных явлений.
Основной признак сниженного уровня pH − неприятный запах изо рта, имеющий гнилостный привкус протухшего яйца. Полезные свойства соляной кислоты заключаются в том, что вещество обладает антисептическим, бактерицидным влиянием на патогенные микроорганизмы. Вредные бактерии попадают в организм, желудочный сок обрабатывает заражённую пищу, не допуская отравления продуктами жизнедеятельности. Если соляной кислоты недостаточно, защитные реакции снижаются. Подобным образом в кишечник попадают вирусы и бактерии, уничтожающие полезную микрофлору.
Частый спутник пониженной кислотности − запоры, сменяющиеся частыми поносами. Расстройство кишечника происходит из-за ослабевания защитных механизмов в желудке, важно стараться сохранять правильный баланс кислот в организме. Причина запоров − ухудшение моторной функции кишечника из-за нехватки кислоты. Нарушение нельзя исправить диетой или стимулирующими методами. Проявится лишь временный эффект, поскольку не устранена первопричина.
Брожение в кишечнике вызывает дискомфорт, боль и метеоризм. Белки всасываются в кишечнике, в результате, происходит неполное их усвоение. В желудке собирается избыток продуктов распада, негативно действующих на организм, вызывая интоксикацию. Токсины способствуют снижению сопротивляемости организма к вирусным заболеваниям, падает иммунитет человека. В комплексе с указанными симптомами отмечаются грибковые поражения слизистых оболочек, кожи головы, ладоней и стоп.
Когда замедляется белковый обмен, снижение кислотности приводит к худшему усвоению витаминов и минералов. Авитаминоз чреват ломкостью и сухостью волос, кожи, ломкостью ногтей и другими внешними признаками. От дефицита витаминов страдают органы и системы. Авитаминоз сопровождает железодефицитная анемия. Вместе с атрофическим гастритом анемия считается признаком болезни Аддисон-Бирмера. сопровождает В12-дефицитная анемия.
Среди внешних симптомов пониженной кислотности − неприятности с кожными покровами. У человека на лице и теле наблюдается угревая сыпь, расширение капилляров на лице. В кале заметны непереваренные остатки пищи. После еды человека беспокоят изжога, вздутие и тяжесть в желудке.
Как определяют кислотность желудка
Как определить кислотность при гастрите достоверно, знает врач-гастроэнтеролог. Называют косвенные признаки, по котором делаются выводы о снижении или повышении. Назовём перечень оправданных методов, устанавливающих кислотность с точностью до десятых. Среди упомянутых способов выделяют:
Лечение патологической кислотности
Если пониженная кислотность обнаружена у больного гастритом без наличия эрозивных повреждений слизистой оболочки, назначаются препараты:
- соляная кислота и медикаменты, стимулирующие её выработку;
- для восстановления нормальной ферментативной функции назначают заместительную терапию пепсидилом;
- в зависимости от симптомов обязательно применение лекарств с антацидным действием;
- если имеется заражение бактерией Хеликобактер пилори, применяется антибиотикотерапия.
При низком уровне pH народная медицина предлагает употреблять в пищу растения с горьким привкусом − перечную мяту, полынь или аир. Традиционный метод борьбы с болезнью − соблюдение принципов диетического питания. Больным гастритом рекомендуется отказаться от цельного молока, винограда, абрикосов, свежей выпечки, вызывающих бродильные процессы в кишечнике. Важно воздержание от жареного, острого, жирного, копчёного. Питаться нужно дробно, не допускать больших перерывов между едой.
Всех этих принципов необходимо придерживаться и при высоком уровне pH. Медикаментозно он лечится по такой схеме:
- назначение антисекреторных средств, снижающих выработку желудочного сока;
- применение антацидной терапии при сопутствующих симптомах гастрита;
- ингибиторы протонной помпы, нейтрализующие действие соляной кислоты.
Вовремя принятые меры обеспечат успешную нормализацию секреторной функции желудка, уберут неприятные симптомы. При наличии хронических заболеваний органов ЖКТ важно внимательно относиться к качеству и пользе пищи, своевременно обращаться за медицинской помощью при появлении первых признаков обострения.
Что такое кислотность, как узнать кислотность желудка, и для чего это нужно? Кислотность содержимого желудочно-кишечного тракта может значительно изменяться в зависимости от отдела кишечной трубки. Так, концентрация рН желудка низкая, и это необходимо для активизации желудочных ферментов и осуществления физиологичного пищеварения. Напротив, кислотность содержимого двенадцатиперстной и тощей кишки очень низкая, вплоть до щелочной среды, что также необходимо для активизации панкреатических ферментов и адекватного пищеварения. Однако существует немало заболеваний органов пищеварительной системы, как дисфункционального, так и органического характера, при которых развивается дисбаланс внутренней химической среды. Именно для определения конкретной патологии и дальнейшего эффективного лечения проводится исследование кислотности желудка.
Медицинская справка
Кислотность желудка, а точнее, желудочного сока – показатель, характеризующий концентрацию свободных ионов водорода и соляной кислоты в желудочном соке или в целом желудочного содержимого. Измеряется данный показатель в рН, что является сокращением от латинского pondus Hydrogenii, а в переводе – вес водорода. В независимости от диагностического исследования или метода, главным показателем остаётся исследование уровня рН.
Чтобы не путаться в терминологии, следует запомнить простую схему: чем ниже рН – тем более повышенная кислотность желудка и наоборот, чем выше рН – тем ниже кислотность желудочного сока. Теперь Вы поймете, о чем будет идти речь.
Чтобы понять, как происходит образование соляной кислоты в желудке, и для чего она нужна, необходимо знать элементарные физиологические принципы функционирования данного органа. Всю площадь желудка можно условно разделить на две зоны.
- Верхняя зона, которая состоит из кардиального отдела, дна и тела желудка. Данная зона считается высококислотной, основная секреция соляной кислоты происходит именно в ней.
- Нижняя кислотно-нейтрализующая зона, в которой происходит выработка гидрокарбонатов. Гидрокарбонаты – вещества, понижающие кислотность желудочного содержимого и способствующие нейтрализации соляной кислоты.
Именно эти участки органа необходимо учитывать при проведении исследования кислотности желудка определёнными диагностическими методами. Таким образом, если зонд возьмёт содержимое желудка из антрального или пилорического отдела, то интерпретировать результат можно в качестве пониженной кислотности желудка. Чтобы результат был максимально достоверным, исследование кислотности необходимо проводить в двух отделах желудка.
Как определить кислотность желудка, не прибегая к лабораторным и инструментальным методам исследования? Уже перед началом диагностики специалиста могут насторожить некоторые симптомы и жалобы со стороны пациента, которые говорят в пользу того или иного заболевания.
Симптомы повышенной кислотности
Повышенную кислотность характеризует целый комплекс клинических проявлений. К основным из них можно отнести следующие признаки: изжога, отрыжка, вздутие, тяжесть в верхних отделах живота.
Симптомы пониженной кислотности
Повышение уровня рН может приводить к появлению эрозивного или атрофического гастрита, для которого характерны долгие и упорные боли со слабой интенсивностью.
Важно! Если Вы самостоятельно решили узнать рН желудка, не стоит полагаться на симптомы, лучше купить специальный диагностический препарат, который сможет провести приблизительную оценку кислотности содержимого желудка.
Существует целый ряд кислотозависимых заболеваний желудка. В большинстве своём они связаны с верхними отделами желудочно-кишечного тракта. Нарушение кислотопродукции или её нейтрализация в желудке приводит к повышению кислотности желудочного секрета и развитию дискинезии пищевода, желудка и двенадцатиперстной кишки. Дискинезия приводит к таким заболеваниям, как:
- Гастроэзофагеальная рефлюксная болезнь и эзофагит. Возникает из-за заброса желудочного сока в пищевод, что приводит к воспалению и изъязвлению нижней трети слизистой пищевода.
- Диспепсия верхних отделов ЖКТ. Агрессивная среда желудка с повышенной или, наоборот, пониженной кислотностью приводит к возникновению спазма гладкой мускулатуры органа.
- Гастрит и дуоденит. Повышенная или пониженная кислотность приводит к развитию химического раздражения слизистой верхних отделов пищеварительного тракта и его воспалению.
Методы диагностики
Как проверить кислотность желудка? Исследование секреторной активности и степени концентрации соляной кислоты позволяет не только определить или подтвердить кислотозависимое заболевание желудка и соседних отделов, но и определить степень выраженности дисфункциональных проявлений заболевания. Самые проверенные методы оценки химического состава содержимого желудочно-кишечного тракта представлены ниже.
Как узнать кислотность желудка в домашних условиях? Определить самостоятельно рН желудка можно при помощи специальных препаратов. Ионообменные смолы – самый простой в применении диагностический метод. Человек, у которого проводится исследование, выпивает специальный препарат (Ацидотест или Гастротест) в виде раствора. Данные препараты покупают в аптеке для того, чтобы самостоятельно провести простейшую рН-метрию. Попадая внутрь, раствор взаимодействует с кислотой, после чего высвобождается специальный краситель, который выводится вместе с мочой. По её цвету судят о состоянии кислотности желудка, например, если цвет не изменяется, то кислотность снижена.
Стоит отметить, что данный метод обладает низкой информативностью и редко используется в общей лечебной сети, а вот в качестве самостоятельного мониторинга применяется по желанию пациента.
Определение кислотности желудка эндоскопическим методом лучше всего проводить натощак, чтобы лучше визуализировать слизистую желудка и степень окраски индикатора.
В момент гастроскопии через гибкий эндоскоп в полость желудка вводится небольшое количество красящего вещества – индикатора. В зависимости от концентрации свободных ионов водорода в желудочном соке индикатор окрашивается с той или иной интенсивностью, что регистрирует врач – эндоскопист.
Зондирование относится к аспирационным методам исследования рН желудочного секрета. Такой метод позволяет после взятия желудочного содержимого провести тест с определенными реактивами в лабораторных условиях. Метод позволяет достаточно быстро оценить рН желудочного сока, однако сопряжен с некоторыми трудностями. Диагностическую картину искажают такие факторы, как:
- Усиленная секреция соляной кислоты в момент аспирации.
- Невозможность узнать точную зону взятия материала.
Метод, несомненно, более информативный и точный, в сравнении с применением ионообменных смол, однако для постановки клинического диагноза необходимо проведение дополнительных исследований. Данный анализ или тест часто применяется в амбулаторной практике, перед направлением пациента на стационарное лечение.
В отличие от теста после фракционного зондирования, рН-метрия обладает максимальной точностью и информативностью и позволяет узнать кислотность не только исследуемого органа, но и пищевода и даже дистальных отделов кишечника. Существует три разновидности рН-метрии. Отличаются они по длительности проведения диагностической процедуры:
- Суточная рН-метрия, при таком виде исследования человек целые сутки ходит со специальным зондом, связанным с ацидогастрометром. Внутрижелудочная суточная рН-метрия позволяет определить концентрацию соляной кислоты, а также оценить в динамике его секреторную активность.
- Кратковременная рН-метрия – исследование проводится аналогичным способом, однако длительность процедуры составляет не более 3 часов.
- Экспресс-рН-метрия. Экспресс-тест позволяет за 15-20 минут определить кислотность содержимого желудка, однако не отражает динамики кислотообразования.
Повышенная и пониженная кислотность желудка
17.09.2021
Как определить кислотность желудка? Это можно проверить в медицинском учреждении за сутки. Нормальным считается, если соотношение
кислотности достигает 1,5 -2,5 pH. От величины кислотности в желудке будет зависеть расщепление веществ, переваривание продуктов в организме.
Если существует недостаток желудочного сока, то это пониженная кислотность желудка.
Проявлениями пониженной кислотности обычно являются тошнота, рвота, изжога, тяжесть в желудке, запор или понос. В этом случае слизистая
оболочка обычно воспалена из-за того, что различные бактерии проникают в организм. Кроме этого при такой кислотности очень часто появляются
регулярные грибковые болезни, можно просмотреть кровеносные сосуды на носу и щеках, анемия, пища плохо переваривается, паразиты в пищеварительной
системе, угри, газы. Ещё пониженная кислотность желудка способна изменять процесс пищеварения в кишечнике и желудке.
Если кислотность выше 2,5, то в организме происходит нарушение переваривания белков, появляются аутоиммунные заболевания, а также
размножаются вирусы и грибок.
Симптомы и лечение
Симптомы и лечение пониженной кислотности заключаются в том, чтобы уменьшить внешние проявления с помощью диеты или лекарственных
препаратов. Ещё одним проявлением, которое способствует пониженной кислотности, является наличие глистов в организме. И это надо обязательно
лечить. Профилактика и лечение пониженной кислотности может проводиться и дома.
Повышенная кислотность желудка проявляется также неприятными ощущениями в желудке, как и пониженная.
Симптомы повышенной кислотности следующие. Если вы периодически чувствуете жгучую боль в желудке, тяжесть после еды, у вас бывает
отрыжка, изжога, несварение, запоры, то у вас, скорее всего, есть проблема повышения (КЖС) кислотности желудочного сока. При повышенной КЖС чаще
всего происходит разъедание оболочки желудка при помощи микроба. А это может приводить к гастриту и язве желудка.
В первую очередь помочь при таких неприятных проявлениях этой проблемы вам поможет специальная диета – лечебное питание. Если вы страдаете
повышением КЖС, то вы должны выучить наизусть список продуктов, которые вам нельзя употреблять. Это жирные бульоны. Особенно стоит избегать
грибных бульонов. Также не стоит кушать сырые овощи, маринады, соления, острые закуски, лимонный сок, лук и чеснок (свежие), копчёности,
чёрный хлеб, газированные напитки.
Диета
При повышенной КЖС должна соблюдаться специальная щадящая диета, которая не позволит продуктам раздражать кишечник и пищевод. А это,
в свою очередь, снизит внешние неприятные проявления. Если наступил период обострения болезни, то из первых блюд лучше готовить супы с манной,
перловой, рисовой круп. Понизить кислотность помогут молочно-яичные супы. Их можно готовить из хорошо перемолотых круп или детского питания.
На второе можно кушать паровые суфле из постных сортов рыбы и мяса. Нежирное мясо можно варить или тушить, также можно запечь в духовке. Также
очень полезны каши. Но они должны быть в протёртом виде. Варить их надо из тех же круп, что и супы. Можно добавлять молоко. Не запрещается кушать
паровой омлет или яйца всмятку. Стоит внимательно относиться к хлебу. Его можно есть только в стадии выздоровления. И то лучше ограничивать.
Из напитков лучше отдать предпочтение киселям, щелочной воде, зелёному чаю. Такое питание поможет понизить кислотность или, по крайней мере, не
будет давать ей увеличиваться. А вы, кушая полезную пищу, сможете и чувствовать себя хорошо.
Народная медицина
Первый способ, который поможет избавиться от тошноты и проявлений ленивого желудка, это лечение соком капусты белокочанной. Для этого следует ежедневно
выпивать или полстакана, или целый стакан сока. Второй способ заключается в лечении травами. Но лучше, если вам отвар назначит доктор после того, как вы
пройдёте все обследования, и диагноз будет подтверждён. Можно взять 50 грамм полыни и по 100 грамм ромашки и зверобоя. Все это засыпать в термос и залить
полулитрами кипятка. Настоять в течение 12 часов. Употреблять можно по 150 грамм за полчаса до приёма пищи 3 раза в день.
Навигация по записям
за что отвечает желудочный сок — ЗдоровьеИнфо
Ежедневно организм человека вырабатывает от полутора до двух литров желудочного сока. Рассказываем, зачем он нам нужен и как держать его уровень в норме.
Из чего состоит желудочный сок?Из соляной кислоты, гастромукопротеина, слизи, минеральных веществ, воды и ферментов. Главный из них — пепсин. Он настолько кислый, что запросто может растворить даже капроновые колготки.
Зачем он нужен?Ферменты, которые запускают процесс пищеварения, активизируются только в кислой среде. Правильное количество желудочного сока помогает им убивать бактерии, усваивать витамины, переваривать и расщеплять еду.
Что будет, если его уровень выйдет из нормы?Могут развиться болезни:
- Излишняя выработка соляной кислоты приводит к повышенной кислотности в желудке. Из-за этого появляются изжога, отрыжка, боль и тяжесть в желудке. В перспективе она может привести к гастриту, язве, желудочно-кишечному кровотечению, синдрому неязвенной функциональной диспепсии и гастродуодениту.
- Когда кислоты недостаточно, человек испытывает примерно такие же симптомы, только к ним присоединяются рвота, отрыжка с гнилостным серным привкусом и боли в кишечнике. Это может говорить о более серьёзных болезнях: атрофии слизистой и раке желудка.
Чаще всего такое происходит, если человек переедает, недоедает белок или клетчатку, злоупотребляет алкоголем, антибиотиками или заражается кишечной инфекцией.
Допустим, у меня есть такие симптомы. Как узнать, чем я болен?Обратитесь к врачу. Есть несколько методов исследования кислотности желудочного сока:
- Внутрижелудочная (интрагастральная) pН-метрия — этот самый информативный способ. Он позволяет измерить кислотность одновременно в нескольких зонах желудочно-кишечного тракта. Для этого врачи используют прибор ацидогастрометр, который оснащён зондами с несколькими датчиками рН.
- Метод фракционного зондирования — процедура, при которой врачи отсасывают содержимое желудка с помощью резиновой трубки.
- Метод окрашивания стенки желудка — во время гастроскопии через канал эндоскопа пациенту вводят специальный краситель, который окисляется и определяет уровень кислотности.
- Ионообменные смолы — малоинформативный способ, при котором пациент принимает внутрь реактив с пигментом. Его применяют в случае, если есть противопоказания к зондированию.
Врачи может назначить специальные препараты, ограничить приём некоторых продуктов, а также прописать дробное питание.
Есть ли профилактика подобных проблем?Да, вот что советуют врачи:
- Меньше переживайте — стресс усиливает выработку соляной кислоты.
- Пейте больше воды — её нехватка также может привести к окислению.
- Не голодайте, питайтесь сбалансированно.
- Вовремя посещайте врачей, особенно если вас что-то беспокоит.
- Больше двигайтесь — это стимулирует обменные процессы в организме.
Узнать больше о том, как желудочный сок влияет на процесс пищеварения, можно из сюжета программы «Жить здорово»
Омез при пониженной кислотности
Кислотностью желудка называется концентрация кислоты в просвете органа или желудочном соке. Главную роль в формировании кислотности желудка играет соляная кислота. В норме кислотность в просвете желудка натощак – 1,5-2,0 рН3.
В течение суток и в разных отделах органа кислотность может меняться. Она повышается во время еды, так как кислота активирует ферменты, которые отвечают за переваривание пищи. Кислотность, которая возникает в ответ на прием пищи, называется стимулированной. Постоянная продукция кислоты, не связанная с едой, называется базальной кислотностью3.
Особенности кислотности пищеводаВ механизме развития изжоги важна не только кислотность желудка, но и среда пищевода. В этом органе кислотность значительно ниже, из-за чего его стенки не имеют дополнительной защиты от воздействия кислоты, как стенки желудка. Поэтому при гастроэзофагеальном рефлюксе кислота желудка оказывает раздражающее действие на стенки пищевода, что может приводить к развитию жжения за грудиной2.
Повышенная и пониженная кислотностьСуществует два варианта нарушения кислотности желудка: повышение и понижение. Оба варианта могут провоцировать неприятные симптомы и болезни пищеварительного тракта.
Основные проявления3:
- кислая отрыжка;
- боли за грудиной или в верхней области живота приступообразного или ноющего характера.
Стойкое повышение выработки соляной кислоты может приводить к развитию кислотозависимых болезней. Самой распространенной проблемой, проявления которой – изжога и кислая отрыжка, является гастроэзофагеальная рефлюксная болезнь2,3. Она характеризуется частыми забросами пищи из желудка в пищевод и хроническим ослаблением пищеводного сфинктера2.
Также повышенная кислотность может провоцировать развитие гиперацидного гастрита, чаще всего ассоциированного с бактерией Helicobacter Pylori или язвенной болезни желудка3. Поставить точный диагноз при частом, длительном возникновении симптомов повышенной кислотности может только врач после комплексного обследования.
Понижение кислотности желудка возникает при развитии гастрита со снижением выработки соляной кислоты. При недостатке кислоты могут развиваться инфекционные процессы в пищеварительном тракте. Кроме того, переваривание пищи тоже ухудшается из-за недостатка ферментов, которые активировались соляной кислотой3.
Проявления состояния3:
- повышенное газообразование;
- тяжесть в желудке;
- неприятный запах изо рта;
- снижение моторики кишечника с риском образования запоров.
Точно установить тип кислотности желудка можно только с помощью специального исследования – внутрижелудочной рН-метрии3.
Как Омез® 10 мг влияет на кислотность желудка?Омез® 10 мг с действующим веществом омепразол относится к группе ингибиторов протонной помпы и применяется для лечения изжоги и кислой отрыжки1. Омез® 10 мг понижает кислотность желудка, подавляя выработку соляной кислоты1. Таким образом, он влияет непосредственно на причину развития изжоги, а не только на симптом.
Омез® 10 мг – удобный для применения препарат. Его рекомендуется принимать 1 раз в сутки1. Лекарство выпускается в кишечнорастворимых капсулах, поэтому действующее вещество даже при высокой кислотности дойдет до кишечника, где происходит всасывание в кровь.
Омез® 10 мг при пониженной кислотности желудка еще больше снижает продукцию кислоты. Поэтому при данном расстройстве работы пищеварительного тракта лучше воспользоваться другими препаратами. В частности, при развитии гастритов с пониженной кислотностью может применяться заместительная терапия непосредственно соляной кислотой3.
Список литературы:- Инструкция по применению лекарственного препарата для медицинского применения ОМЕЗ® 10 мг ЛП 00328 от 11.07.17 Дата обращения 01.02.2021.
- Лазебник Л.Б., Бордин Д.С., Машарова А.А. Общество против изжоги // Экспериментальная и клиническая гастроэнтерология. – 2007. – № 4. – С. 5-10.
- Функциональная гастроэнтерология. Справочник. Анатомия и физиология ЖКТ. Кислотность желудка. Доступ от: 02.02.2021.
Kam Electro
Kam Electro Перейти к содержимому- तर्क और तथ्य
- नए साल के लिए दादी को क्या देना है – पोती या पोते से नए साल के उपहारों के 200 विचार, इसे स्वयं ही करें और न केवल
- बोन्साई: बीजों से बढ़ रहा है, उपकरणों की मूल बातें और फोटो के साथ देखभाल
- विंडोज 10 में व्यवस्थापक खाते को कैसे हटाएं
- प्याज चाय: लाभ और हानि, समीक्षा
- अपने हाथों के साथ हीटिंग केबल: स्थापना
- उपचार घावों के लिए पेरूवियन बलसम: यह क्या है, उपयोग, संरचना, अनुरूपता, जहां खरीदना, मूल्य, समीक्षा करने के लिए निर्देश
- Yandex Dzen।
- Yandex Dzen।
- कान को गोली मारता है: क्या करना है?
- डॉ। बोर्नेल
- किंडरगार्टन, स्कूल शिक्षकों और शिक्षकों के शिक्षक – mam.ru
- बच्चे पर कोलिक्स – क्या करना है, सबसे अच्छा उपकरण, कारण और लक्षण
- स्लिमिंग पेट के लिए प्रभावी और उचित अभ्यास
- रिमोट सबक
- मशीन पर रबड़ से बुनाई: अनुभवी स्वामी के लिए शुरुआती और परिसर के लिए सरल प्रकाश योजनाएं
- कहानी को जल्दी से कैसे जानें 🚩 कहानी 🚩 स्कूल को जल्दी से कैसे पढ़ा जाए
- Accordion के बिना एक गीत – विकिपीडिया
- समर्पण क्या है: सफलता के लिए यह इतना महत्वपूर्ण क्यों है और उसे कैसे बढ़ाया जाए
- वेतन से वेतन की गणना कैसे करें
- प्रवेश द्वार पर कंप्यूटर पर एक पासवर्ड कैसे सेट करें
- टैंक ब्लिट्ज की दुनिया – मुफ्त सोने कैसे प्राप्त करें
- Yandex Dzen।
- Yandex Dzen।
- Yandex Dzen।
- साम्यवाद और कबुली के सामने प्रार्थना
- विंडोज 10 डिफेंडर को अक्षम करने के लिए कैसे करें (3 तरीके)
- स्मार्ट मैनेजर सैमसंग: यह क्या है, कार्यों का अवलोकन
- Yandex Dzen।
- एक साथ वर्तनी शब्द
- :: polismed.com।
- युद्ध रणनीति के साथ टी -34-85 पर वीडियो के साथ विस्तृत मार्गदर्शिका, पंपिंग कौशल और स्थापित मॉड्यूल, कंपन जोन और एक वर्ष में कमजोर अंक
- अपने लिए कार्टून बनाएं
- प्रशंसक
- 2020 में क्लिंचराइजेशन, कौन गुजरता है और नया क्या है
- मलम और टेबलेट्स acyclovir – उपयोग के लिए विस्तृत निर्देश, समीक्षा
- एक स्कार्फ-मिट्टी कैसे बांधें (50 फोटो): यह ठीक से कैसे है और खूबसूरती से गर्दन पर स्कार्फ-मिट्टी, गर्दन पर बांधने के तरीके
- अपने हाथों से पैरों पर क्रिसमस का पेड़
- गर्भावस्था के दौरान गर्भाशय का टोनस: क्यों मांसपेशियों को व्यवहार करना पड़ता है इससे भरा हुआ है
- :: polismed.com
- क्लब DNS
- लम्बर कशेरुक – विकिपीडिया
- रूस में आधिकारिक साइट Trx
- Yandex Dzen।
- पिकाबू
- वीडियो के साथ Minecraft पर त्वचा कैसे स्थापित करें
- Mukaltine – आप किस उम्र से बच्चों को दे सकते हैं
- मनोवैज्ञानिक युक्तियाँ – psychbook.ru
- हम क्यों भुगतान करते हैं और आप कैसे पसंद करते हैं?
- नर्स का पीछा कैसे करें: विस्तृत निर्देश
- होम Iconostasis इसे स्वयं करें: फोटो
- इस दिन पुरातनता से नया साल कैसे दिखाई दिया
- केफिर पर बेकिंग – चरण-दर-चरण फोटो चरण के साथ 245 व्यंजनों
- अपने बालों के टिप्स पर कैसे कटौती करें अपने आप को घर: लंबा या छोटा
- नींद मोड से लैपटॉप कैसे निकालें
- अरब पठार: यह क्या है, जहां स्थित है, जलवायु, राहत, पर्यटन की विशेषताएं :: syl.ru
- विंडोज 7 पर वाई-फाई को कैसे सक्षम करें
- Yandex Dzen।
- अपने हाथों से वॉलपेपर की एक तस्वीर कैसे बनाएं: मूल सजावट (+53 तस्वीरें)
- सबसे महंगा लाल कैवियार: विवरण, मूल्य, विचार
- एमटीएस पर “हर जगह घर पर” सेवा को कैसे कनेक्ट करें?
- आप सभी जानना चाहते थे, लेकिन पूछने से डरते थे!
- Remontka.pro।
- गतिशील डिस्क
- सेक्स के लिए लड़की को कैसे छेड़छाड़ करें: सभी प्रभावी पिकैप नियम
- ❶ फ्रांसीसी लीजन को कैसे प्राप्त करें 🚩 विदेशी सेना 🚩 नौकरी खोज में कैसे पहुंचे
- स्लिंगशॉट पर लोचदार गम का उल्लू कैसे प्राप्त करें – अधिकतम विचार
- भाप समुदाय :: गाइड :: खेल यूरो ट्रक सिम्युलेटर 2 पर फैशन कैसे स्थापित करें
- किम।
- Viber स्काइप से अलग है
- चंद्र कैलेंडर – आज
- 10 विचार एक कमरे को अपने हाथों से अधिक आरामदायक बनाने के लिए कैसे करें
- यह निर्धारित करने के लिए कि क्या कोई व्यक्ति आपको इशारे और शब्दों में प्यार करता है?
- उत्सव सलाद की सजावट अपने हाथों से: फोटो के साथ चरण-दर-चरण निर्देश
- Bbf.ru.
- अपने हाथों के साथ डॉटल कॉलम: चित्र और सटीक असेंबली निर्देश
- क्या चाय उपयोगी है: काला या हरा, बेहतर पीना
- सोशल नेटवर्क्स क्या हैं: लोकप्रिय ऑनलाइन (रूस और दुनिया) की एक सूची
- जेल लाह को ठीक से कैसे लागू करें – चरण-दर-चरण निर्देश
- परिसमापन
- नेपोलियन केक घर पर कदम-दर-चरण नुस्खा
- एक पोषण विशेषज्ञ से वजन घटाने के लिए एक सप्ताह के लिए मेनू
- कैलकुलेटर और बिना लाइफहेकर के साथ राशि से ब्याज की गणना करने के 6 तरीके
- प्यार का आकर्षण: 5 सबसे लोकप्रिय और कुशल तरीके
- हेमोग्लोबिन को कैसे कम करें: फल, उत्पाद, पेय, दवाओं को हल करने के तरीके के साथ पुरुषों और महिलाओं में इसे कैसे करें
- ट्रिपेक्स
- आर्टेमन pupd – परी कथाओं “गोल्डन कुंजी” के आधार पर मास्करेड पर सूट
- पीट मॉस ने क्या कहा?
- वयस्कों में ब्रोंकाइटिस के इलाज के लिए अच्छे एंटीबायोटिक्स का चयन कैसे करें?
- 12 के लिए सर्वश्रेष्ठ अभ्यास :: स्वास्थ्य :: आरबीसी शैली
- कैसे सीखें 2, 3, 4, 5 गेंदों को कैसे बढ़ाएं (शुरुआती लोगों के लिए)
- एक गर्म तौलिया रेल कैसे चुनें: चरण-दर-चरण निर्देश, हम मॉडल की विविधता को समझते हैं
- सलाद ओलिवियर क्लासिक – 14 सरल चरण-दर-चरण व्यंजनों
- Yandex Dzen।
- विंडोज़ में डेस्कटॉप पर एक फोटो कैसे डालें
- अपने हाथों के साथ चमड़े से बाहर बैग, सबसे सरल और स्टाइलिश मॉडल
- एक व्यवसाय कैसे खोजें
- Minecraft में त्वचा कैसे स्थापित करें – टाइमवेब सामुदायिक ज्ञान आधार
- हठ योग: व्यायाम
- काम की समझने योग्य योजनाओं के साथ शुरुआती के लिए चरण-दर-चरण मास्टर क्लास
- किस नाक में स्वस्थ कुत्ता होना चाहिए
Что такое повышенная и пониженная кислотность
Наверняка вам знакомы такие термины, как «повышенная кислотность желудка», «пониженная кислотность желудка». Но не все понимают, что это означает и чем грозит такое состояние.
Кислотность желудка – что это?
Желудок – орган, в котором пища переваривается – расщепляется и преобразуется в вещества, способные всасываться в кровь. Для этой цели в нем вырабатывается желудочный сок – секрет содержащий различные вещества, в том числе и соляную кислоту.
С помощью соляной кислоты происходят обработка пищи, размельчение сложных молекул, она способствует работе ферментов, уничтожению патогенных микробов. Кроме того, она поддерживает кислотно-щелочной баланс.
Кислотность желудка определяется тем, какова концентрация соляной кислоты. Выражается она в единицах pH от 1 до 14: максимальная кислотная среда – 1 pH, щелочная – 14 pH, 7 pH соответствует нейтральной среде.
В норме кислотность должна находиться в пределах pH 1,5–2,3.
В чем причины повышенной кислотности
Существуют несколько причин, по которым соляная кислота вырабатывается с избытком.
1. Пища с большим количеством специй, жареные блюда провоцируют образование соляной кислоты в больших объемах. К такому же эффекту приводят беспорядочное питание, еда в спешке, большими кусками, привычка наедаться перед сном.
2. Увлечение спиртным, курение также способствуют чрезмерной продукции соляной кислоты.
3. Повысить образование кислоты могут психоэмоциональные потрясения, сильное продолжительное стрессовое состояние, чрезмерная усталость, нехватка полноценного сна.
4. Бактерии хеликобактер пилари продуцируют фермент уреазу, которая раздражает стенки желудка, способствуя продукции кислоты.
5. Чрезмерная выработка железами гормона гастрина ведет к увеличению кислотности.
6. Кислотность повышается во время полового созревания, беременности, менопаузы.
7. Некоторые медикаменты (гормональные или нестероидные противовоспалительные препараты) раздражающе действуют на слизистую желудка, способствуя повышению кислотности.
8. Кислотность нередко бывает повышенной как сопутствующее состояние при таких болезнях, как гастрит, язва желудка.
Каковы признаки повышенной кислотности
1. Изжога. Ее считают основным признаком повышенной кислотности. Она может быстро пройти или длиться долгое время. Как правило, изжога развивается после еды, особенно усиливающей кислотность.
2. Нарушения функционирования желудка. Проявляются небольшой болью, распиранием под ложечкой. Характерны отрыжка горький или кислый вкус во рту.
3. Если кислотность высока длительное время, она вызывает запоры и усиленный метеоризм.
Чем опасна повышенная кислотность
Состояние это доставляет немало дискомфорта и страданий. Наряду с неприятными симптомами, длительное повышенное содержание кислоты чревато тяжелыми хроническими заболеваниями:
- поражением пищевода – эзофагитом, гастроэзофагально-рефлюксной болезнью;
- воспалением желудка – гастритом;
- развитием воспаления двенадцатиперстной кишки – дуоденита;
- язвенной болезнью;
- плохим всасыванием полезных веществ;
- развитием почечнокаменной болезни.
В чем причины пониженной кислотности
Нехватка соляной кислоты является следствием действия следующих факторов.
Болезни желудка. Нередко понижению кислотности вызывают длительно протекающие воспалительные заболевания: дуоденит, гастрит, гастродуоденит. С течением времени гиперацидный гастрит (с повышенной кислотностью) перерождается в гипоацидный (с пониженной кислотностью). Кислотность понижена и при раке желудка.
Возрастной фактор. Замедление обменных процессов с возрастом приводит к понижению выработки соляной кислоты. Кроме того, у пожилых нередко бывает атрофия клеток слизистой желудка, вызывающая пониженную кислотность.
Нарушения эндокринной системы – в частности нарушение работы щитовидной железы.
Каковы признаки пониженной кислотности
Симптомы похожи на те, что и при высокой кислотности.
1. Изжога вызвана тем, что пища недостаточно переваривается в желудке и может забрасываться в пищевод (кислотный рефлюкс).
2. Очень часто при недостаточной кислотности изо рта пахнет гнилью, мучает отрыжка. Запах усиливается после еды, а также утром, после длительного перерыва в еде.
3. Из-за нехватки кислоты пища плохо переваривается и начинает бродить. Результат – чрезмерное газообразование, урчание, боли и тяжесть в животе, которые возникают, как правило, после еды, особенно если человек ел белковую пищу.
4. При низкой кислотности желудка наблюдается чередование поносов и запоров, меняется запах и цвет каловых масс, в них обнаруживаются непереваренные частицы пищи.
Чем опасна пониженная кислотность
Чаще всего низкая кислотность свидетельствует о заболеваниях ЖКТ, которые требуют обязательного лечения. Она бывает также симптомом рака желудка. Его своевременное выявление и лечение увеличивают шансы на благоприятный исход.
Кроме того, при недостаточном переваривании пищи организм не получает в нужных количествах питательные вещества, микро- и макроэлементы, витамины. Поэтому возможны витаминная недостаточность, железодефицитная анемия. Снижается иммунитет, возникают кожные болезни, простуды, инфекции.
Как нормализовать кислотность
Нередко, люди, страдающие изжогой, мучающиеся болями в желудке, считают, что кислотность у них выше нормы, и глотают таблетки. Благо в аптеках представлен большой ассортимент антацидных (понижающих кислотность) медикаментов. Но проявления как высокой, так и низкой кислотности во многом схожи.
Даже врач по одним лишь симптомам не сможет точно диагностировать, повышенная или пониженная кислотность у больного – необходимы обследования. А самолечение, да еще не от той патологии, может обернуться большими неприятностями.
Многие при изжоге лечатся содой. Делать этого врачи категорически не советуют. Сода при систематическом применении может дать эффект рикошета: сначала кислотность будет нормализована, но затем резко возрастет.
При настораживающих симптомах нарушения пищеварения нужно обратиться к специалисту и пройти обследование. Только врач может назначить нужные препараты и другие меры по нейтрализации кислотности – ведь лечение часто бывает комплексным.
Что можно сделать самостоятельно, это пересмотреть свое питание и образ жизни:
- исключить из рациона жирное, жареное, острое, копченое – эти блюда вредны и для здорового человека;
- отказаться от спиртного;
- бросить курить.
Эти простые меры в любом случае пойдут на пользу и улучшат самочувствие.
Эндоскопическая pH-метрия – клиника СоколМед
Изучение кислотности желудочного сока происходит с давних времен. Учёные установили, что соляная кислота является главным элементом желудочного сока. Чтобы проверить состояние желудочного сока, достаточно пройти некоторые исследования.
При проведении эндоскопической рН-метрии используется рН-метрический зонд, который проводят через инструментальный канал эндоскопа. Аппарат для эндоскопической рН-метрии был разработан в России в 80-х годах. Данное исследование осуществляется в процессе гастроскопии, что делает такую процедуру несколько длиннее. В ходе эндоскопической рН-метриии проверяется кислотность желудка и двенадцатиперстной кишки.
Эндоскопическая рН-метрия позволяет исследовать кислотность слизистой оболочки различных отделов пищеварения (пищевода, желудка, двенадцатиперстной и тощей кишок, толстой и подвздошной кишок).
Главное преимущество эндоскопической рН-метрии – это возможность контроля при измерении рН и точного определения границ кислотопродуцирующей и ощелачивающей зон желудка, также быстрота и простота исследования.
Также возможно использование эндоскопической рН-метрии у больных с язвенным гастродуоденальным кровотечением. рН-метрия осуществляется только после остановки кровотечения и позволяет в экстренной ситуации определить уровень кислотообразования и только потом рекомендовать патогенетическую терапию.
Для проведения исследования в настоящее время используются эндоскопические рН-зонды и ацидогастрометр “АГМ-03”, производимые предприятием “Исток-Система”.
рН-зонды бывают двух видов:
- рН-зонд Г1-Э имеет наружный диаметр 2,4 мм. Подходит ко всем отечественным и импортным эндоскопам с инструментальным каналом 2,8 мм.
- рН-зонд Г1-Д-Э имеет наружный диаметр 1,8 мм. Предназначен для детских эндоскопов с диаметром инструментального канала 2,0 мм.
Повышенная кислотность желудка
Бывают случаи, когда у человека могут случаться приступы повышенной кислотности. Это происходит из-за чрезмерного употребления жареных, кислых, острых, солёных блюд, алкоголя. Также кислотность желудка может повышаться, если в рационе присутствует только ужин, да и то очень плотный. На это необходимо обратить пристальное внимание. Если такие случаи происходят достаточно часто, необходимо пересмотреть режим питания, либо обратиться к врачу.
Когда кислота попадает в пищевод, она поднимается вверх. Это, в свою очередь, вызывает воспаление слизистой оболочки пищевода и, как следствие, неприятные ощущения и жжение.
Основные симптомы повышенной кислотности желудка являются:
- тяжесть и боль в желудке
- потеря аппетита
- изжога
- запоры
Полагаться полностью на проявление симптомов нельзя. Для точного подтверждения диагноза необходимо пройти ряд обследований, одним из которых является эндоскопическая ph-метрия.
При повышенной кислотности обычно назначается специальная диета. Из пищи важно исключить жирные, острые, кислые блюда, копчёности, соленья, кофе, лук, чеснок. Приёмы пищи должны быть небольшими и частыми.
Пониженная кислотность желудка
Пониженная кислотность желудка возникает из-за заболеваний органов пищеварительной системы, таких как гастрит, рак желудка. Причиной становится атрофия обкладочных клеток.
При пониженной кислотности в желудке вырабатывается очень мало кислоты. В связи с этим, он не справляется с перевариванием пищи. Кусочки пищи остаются в желудке, разлагаются и накапливаются. Происходит гниение непереваренной пищи, образуются бактерии, неприятный запах изо рта. Организм человека становится подвержен грибковым заболеваниям. Организм человека плохо усваивает витамины, минералы. К симптомам также относится скопление газов в кишечнике, угревая сыпь, наличие паразитов в организме.
Диета, так же как и при повышенной кислотности, является первостепенным методом лечения. Из рациона рекомендуют исключить продукты, вызывающие брожение, такие как молоко, виноград, изделия из теста, и продукты, требующие активного переваривания, например, молочные продукты.
Если все вышеперечисленные симптомы проявляются очень часто, необходимо обратиться к врачу и пройти исследования. К таким исследованиям также относится эндоскопическая ph- метрия.
Эндоскопическая рН-метрия – это точный и быстрый метод исследования кислотопродуцирующей и ощелачивающей функций желудка. Эндоскопическая рН-метрия позволяет верно и вовремя установить диагноз у гастроэнтерологических больных, на основе которого лечащий врач назначает дальнейшее лечение.
Показания к применению эндоскопической ph-метрии:
- заболевания, при которых нарушена кислотопродуцирующая функция желудка или имеет отрицательное значение и требует дальнейшего лечения и восстановления;
- изменения слизистой оболочки, вызванные нарушением кислотопродукции.
Противопоказаний не выявлено.
При проведении эндоскопической рН-метрии используются специальные приборы для внутрижелудочной рН-метрии. Клинка «СоколМЕД» предлагает пройти своим пациентам процедуру на аппарате ацидогастрометр «АГМ-03» с эндоскопическим рН-зондом. Выполняется во время эндоскопического исследования при помощи прибора «АГМ-03» рН-зонд вводится в желудок через инструментальный канал эндоскопа.
Микропроцессорный прибор для эндоскопической и кратковременной внутрижелудочной рН-метрии у одного пациента
- Проводит измерение кислотности в точке касания стенки того или иного отдела ЖКТ измерительным электродом эндоскопического рН-зонда, вводимого через инструментальный канал эндоскопа.
- Результаты измерений сразу же выводятся на индикатор регистрирующего блока.
- Запоминает результаты не менее 25 измерений.
- Может работать с многоэлектродным (до пяти измерительных электродов) рН-зондом, вводимым в ЖКТ перорально.
- Позволяет исследовать базальную и стимулированную кислотность, провести щелочные, кислотные и другие тесты и лекарственные пробы.
- Позволяет выявлять кислотозависимые патологии ЖКТ и проводить индивидуальный подбор лекарственной терапии.
Шкала pH | Биология для неосновных I
Что вы научитесь делать: продемонстрировать знакомство со шкалой pH
Большинство людей знакомы со словами кислая и кислая – будь то из-за кислотного дождя или кислой пищи, такой как лимонный сок. Однако меньше людей знают о кислоте, противоположной кислоте: основание (также называемое щелочной ). К основным веществам относятся такие вещества, как пищевая сода, мыло и отбеливатель. Дистиллированная вода – нейтральное вещество.Шкала pH, которая измеряется от 0 до 14, показывает, насколько кислым или основным является вещество.
Большинство частей нашего тела (за исключением желудочного сока) имеют величину от 7,2 до 7,6 по шкале pH (7 – нейтральный показатель по шкале). Если посторонние сильные вещества резко изменят этот pH, наш организм больше не сможет нормально функционировать.
В результате мы узнаем о кислотах и основаниях и о том, какое влияние они могут оказать на живые системы.
Результаты обучения
- Определите характеристики кислот
- Определить характеристики базы
- Определите буферы и обсудите роль, которую они играют в биологии человека
Шкала pH от 0 до 14.PH раствора является мерой его кислотности или щелочности (основания). Вы, вероятно, использовали лакмусовую бумагу, бумагу, обработанную натуральным водорастворимым красителем, чтобы ее можно было использовать в качестве индикатора pH, чтобы проверить, сколько кислоты или основания (щелочности) существует в растворе. Возможно, вы даже использовали их, чтобы убедиться, что вода в открытом бассейне очищена должным образом.
Рис. 1. Шкала pH измеряет количество ионов водорода (H + ) в веществе. (кредит: модификация работы Эдварда Стивенса)
Этот тест pH измеряет количество ионов водорода, которое существует в данном растворе.Высокие концентрации ионов водорода приводят к низкому pH (кислые вещества), тогда как низкие уровни ионов водорода приводят к высокому pH (основные вещества). Общая концентрация ионов водорода обратно пропорциональна его pH и может быть измерена по шкале pH (Рисунок 1). Следовательно, чем больше присутствует ионов водорода, тем ниже pH; и наоборот, чем меньше ионов водорода, тем выше pH. Изменение на одну единицу шкалы pH представляет собой изменение концентрации ионов водорода в 10 раз, изменение на две единицы представляет собой изменение концентрации ионов водорода в 100 раз.Таким образом, небольшие изменения pH представляют собой большие изменения концентрации ионов водорода. Чистая вода нейтральна. Он не является ни кислым, ни основным, и его pH составляет 7,0. Все, что ниже 7,0 (от 0,0 до 6,9), является кислотным, а все, что выше 7,0 (от 7,1 до 14,0), является щелочным. Кровь в ваших венах слегка щелочная (pH = 7,4). Среда в желудке очень кислая (pH от 1 до 2). Апельсиновый сок имеет умеренную кислотность (pH = приблизительно 3,5), тогда как пищевая сода является щелочной (pH = 9,0).
Кислоты – это вещества, которые выделяют ионы водорода (H + ) и понижают pH, тогда как основания выделяют ионы гидроксида (OH – ) и повышают pH.Чем сильнее кислота, тем легче она отдает H + . Например, соляная кислота и лимонный сок очень кислые и легко выделяют H + при добавлении в воду. И наоборот, основания – это те вещества, которые легко отдают OH –. Ионы OH – соединяются с H + с образованием воды, которая повышает pH вещества. Гидроксид натрия и многие бытовые чистящие средства очень щелочные и быстро выделяют OH – при помещении в воду, тем самым повышая pH.
Буферы
Большинство клеток нашего тела работают в очень узком диапазоне шкалы pH, обычно в пределах от 7,2 до 7,6. Если pH тела выходит за пределы этого диапазона, дыхательная система не работает, как и другие органы тела. Клетки больше не функционируют должным образом, и белки будут разрушаться. Отклонение от диапазона pH может вызвать кому или даже смерть.
Так как же мы можем проглотить или вдохнуть кислые или основные вещества и не умереть? Буферы – это ключ.Буферы легко поглощают избыток H + или OH –, тщательно поддерживая pH тела в вышеупомянутом узком диапазоне. Двуокись углерода является частью заметной буферной системы в организме человека; он поддерживает pH в нужном диапазоне. Эта буферная система включает угольную кислоту (H 2 CO 3 ) и анион бикарбоната (HCO 3 –). Если слишком много H + попадает в организм, бикарбонат соединяется с H + , образуя угольную кислоту и ограничивая снижение pH.
Аналогичным образом, если в систему вводится слишком много OH – , угольная кислота быстро диссоциирует на бикарбонат и ионы H + . Ионы H + могут объединяться с ионами OH – , ограничивая увеличение pH. Хотя угольная кислота является важным продуктом этой реакции, ее присутствие мимолетно, поскольку углекислота выделяется из организма в виде углекислого газа каждый раз, когда мы дышим. Без этой буферной системы pH в нашем организме будет слишком сильно колебаться, и мы не сможем выжить.
Вкратце: буферы, pH, кислоты и основы
pH раствора является мерой концентрации ионов водорода в растворе. Раствор с большим количеством ионов водорода кислый и имеет низкое значение pH. Раствор с большим количеством гидроксид-ионов является основным и имеет высокое значение pH. Шкала pH находится в диапазоне от 0 до 14, при этом pH 7 является нейтральным. Буферы – это растворы, которые замедляют изменение pH при добавлении кислоты или основания в буферную систему. Буферы важны в биологических системах из-за их способности поддерживать постоянный уровень pH.
Практический вопрос
Используя pH-метр, вы обнаружите, что pH неизвестного раствора равен 8,0. Как бы вы описали это решение?
- слабокислый
- сильнокислый
- слабоосновной
- сильно простой
Это решение слабоосновное. Помните, что pH 7,0 нейтрален. Все, что выше (7–14), является основным, а все, что ниже (0–6), является кислотным.
pH лимонного сока составляет около 2,0, тогда как pH томатного сока составляет около 4.0. Насколько приблизительно увеличивается концентрация водородных ионов между томатным и лимонным соками?
- 2 раза
- 10 раз
- 100 раз
- 1000 раз
Лимонный сок в 100 раз кислотнее томатного. Помните, что каждый шаг шкалы pH представляет изменение концентрации в 10 раз. Поскольку томатный сок имеет pH 4,0, а лимонный сок – 2,0, концентрация изменится в 10 раз.
Проверьте свое пониманиеОтветьте на вопросы ниже, чтобы увидеть, насколько хорошо вы понимаете темы, затронутые в предыдущем разделе. В этой короткой викторине , а не засчитываются в вашу оценку в классе, и вы можете пересдавать ее неограниченное количество раз.
Используйте этот тест, чтобы проверить свое понимание и решить, следует ли (1) изучить предыдущий раздел дальше или (2) перейти к следующему разделу.
Ацидоз и алкалоз | Лабораторные тесты онлайн
Источники, использованные в текущем обзоре
Учебник Титца по клинической химии и молекулярной диагностике, шестое издание, Надер Рифаи Эд, 2018 г., издательство Elsevier, St.Луис, штат Миссури, стр. 1333, 1340-1347
(23 мая 2016 г.) Национальный фонд почек: метаболический ацидоз. Доступно в Интернете по адресу https://www.kidney.org/atoz/content/metabolic-acidosis По состоянию на март 2018 г.
(24 октября 2017 г.) Томас К., Метаболический алкалоз. Ссылка на Medscape. Доступно в Интернете по адресу https://emedicine.medscape.com/article/243160-overview По состоянию на март 2018 г.
(04 апреля 2017 г.) Берд Р. младший, респираторный алкалоз. Ссылка на Medscape. Доступно на сайте https: // emedicine.medscape.com/article/301680-overview По состоянию на март 2018 г.
Источники, использованные в предыдущих обзорах
Куинн А. и Синерт Р. (Обновлено 11 июня 2013 г.). Метаболический ацидоз в неотложной медицине. Справочник по Medscape [Он-лайн информация]. Доступно в Интернете по адресу http://emedicine.medscape.com/article/768268-overview. По состоянию на январь 2014 г.
Thomas, C. и Yaseen, S. (обновлено 3 мая 2013 г.). Метаболический алкалоз. Справочник по Medscape [Он-лайн информация]. Доступно на сайте http: // emedicine.medscape.com/article/243160-overview. По состоянию на январь 2014 г.
Хуанг Л. и Пристли М. (обновлено 12 декабря 2013 г.). Детский метаболический алкалоз. Справочник по Medscape [Он-лайн информация]. Доступно в Интернете по адресу http://emedicine.medscape.com/article/9-overviewm. По состоянию на январь 2014 г.
Хуанг Л. и Пристли М. (Обновлено 17 февраля 2012 г.). Детский метаболический ацидоз. Справочник по Medscape [Он-лайн информация]. Доступно в Интернете по адресу http://emedicine.medscape.com/article/0-overview.По состоянию на январь 2014 г.
Берд-младший, Р. и Рой, Т. (обновлено 4 апреля 2013 г.). Респираторный ацидоз. Справочник по Medscape [Он-лайн информация]. Доступно в Интернете по адресу http://emedicine.medscape.com/article/301574-overview. По состоянию на январь 2014 г.
Couturier, M. et. al. (Обновлено в марте 2013 г.). Метаболический ацидоз. ARUP Consult [Он-лайн информация]. Доступно в Интернете по адресу http://www.arupconsult.com/Topics/MetabolicAcidosis.html?client_ID=LTD. По состоянию на январь 2014 г.
Пагана, К.Д. и Пагана, Т. Дж. (© 2011). Справочник Мосби по диагностическим и лабораторным испытаниям, 10-е издание: Mosby, Inc., Сент-Луис, Миссури. Стр. 119-127.
Кларк, У., редактор (© 2011). Современная практика клинической химии, 2-е издание: AACC Press, Вашингтон, округ Колумбия. С. 371-384.
Томас, Клейтон Л., редактор (1997). Циклопедический медицинский словарь Табера. Компания F.A. Davis, Филадельфия, Пенсильвания [18-е издание].
Пагана, Кэтлин Д. и Пагана, Тимоти Дж. (2001). Справочник Мосби по диагностическим и лабораторным испытаниям, 5-е издание: Mosby, Inc., Сент-Луис, Миссури.
Келлум Дж. И Пуяна Дж. (Январь 2006 г.). Кислотно-основные расстройства, Раздел 8 Глава 8. Хирургия ACS из профессиональной библиотеки WebMD [Он-лайн информация]. Доступно в Интернете по адресу http://www.acssurgery.com/acsonline/Chapters/CH0808.htm через http://www.acssurgery.com.
(© 1995-2006). Кислотно-основной обмен. Руководство Мерк по диагностике и терапии [Он-лайн информация]. Доступно на сайте http://www.merck.com.
(2001). Нельсон Р. Кислотно-основные расстройства.Веб-сайт студентов-медиков Университета штата Юта [Он-лайн информация]. Доступно в Интернете по адресу http://umed.med.utah.edu/ms2/renal/Word%20files/i)%20Acid_Base%20Disorders.htm через http://umed.med.utah.edu.
(1 февраля 2003 г., с изменениями). Кислотно-щелочной баланс. Руководство Merck Home Edition [Электронная информация]. Доступно в Интернете по адресу http://www.merck.com/mmhe/sec12/ch259/ch259a.html
Raghuveer, T. et. al. (1 июня 2006 г.). Врожденные ошибки обмена веществ в младенчестве и раннем детстве: обновление.Американский семейный врач v73 (11) [Электронный журнал]. Доступно в Интернете по адресу http://www.aafp.org/afp/20060601/1981.html
Пагана, К. Д. и Пагана, Т. Дж. (© 2007). Справочник Мосби по диагностике и лабораторным испытаниям, 8-е издание: Mosby, Inc., Сент-Луис, Миссури. С. 117-125.
Кларк В. и Дюфур Д. Р., редакторы (© 2006). Современная практика клинической химии: AACC Press, Вашингтон, округ Колумбия. Стр. 319-329.
(обновлено 12 ноября 2007 г.). Ацидоз. Медицинская энциклопедия MedlinePlus [Он-лайн информация].Доступно в Интернете по адресу http://www.nlm.nih.gov/medlineplus/ency/article/001181.htm. По состоянию на август 2009 г.
(обновлено 12 ноября 2007 г.). Алкалоз. Медицинская энциклопедия MedlinePlus [Он-лайн информация]. Доступно в Интернете по адресу http://www.nlm.nih.gov/medlineplus/ency/article/001183.htm. По состоянию на август 2009 г.
Льюис, Дж. (Пересмотрено в июле 2008 г.) Метаболический ацидоз. Пособие Merck для специалистов здравоохранения [Он-лайн информация]. Доступно в Интернете по адресу http://www.merck.com/mmpe/sec12/ch257/ch257c.html? qt = Acidosis & alt = sh через http://www.merck.com. По состоянию на август 2009 г.
Льюис, Дж. (Отредактировано в июле 2008 г.) Метаболический алкалоз. Пособие Merck для специалистов здравоохранения [Он-лайн информация]. Доступно в Интернете по адресу http://www.merck.com/mmpe/sec12/ch257/ch257d.html через http://www.merck.com. По состоянию на август 2009 г.
Льюис, Дж. (Отредактировано в июле 2008 г.) Респираторный ацидоз. Пособие Merck для специалистов здравоохранения [Он-лайн информация]. Доступно в Интернете по адресу http://www.merck.com/mmpe/sec12/ch257/ch257e.html через http://www.merck.com. По состоянию на август 2009 г.
Льюис, Дж. (Отредактировано в июле 2008 г.) Респираторный алкалоз. Пособие Merck для специалистов здравоохранения [Он-лайн информация]. Доступно в Интернете по адресу http://www.merck.com/mmpe/sec12/ch257/ch257f.html через http://www.merck.com. По состоянию на август 2009 г.
Ганнерсон, К. и Шарма, С. (Обновлено 22 июля 2009 г.) Лактоацидоз. eMedicine [Он-лайн информация]. Доступно в Интернете по адресу http://emedicine.medscape.com/article/167027-overview по адресу http: // emedicine.medscape.com. По состоянию на август 2009 г.
Хипп А. и Синерт Р. (Обновлено 11 сентября 2008 г.) Метаболический ацидоз. eMedicine [Он-лайн информация]. Доступно в Интернете по адресу http://emedicine.medscape.com/article/768268-overview через http://emedicine.medscape.com. По состоянию на август 2009 г.
Ясин С. и Томас К. (Обновлено 18 августа 2009 г.). Метаболический алкалоз. eMedicine [Он-лайн информация]. Доступно в Интернете по адресу http://emedicine.medscape.com/article/243160-overview по адресу http: // emedicine.medscape.com. По состоянию на август 2009 г.
pH воды – Системы измерения окружающей среды
Что такое pH?
pH – это определенное значение на основе определенной шкалы, аналогичное температуре. Это означает, что pH воды не является физическим параметром, который можно измерить как концентрацию или количество. Вместо этого это число от 0 до 14, определяющее, насколько кислым или основным является водоем по логарифмической шкале ¹. Чем меньше число, тем более кислая вода.Чем выше число, тем оно более базовое. PH 7 считается нейтральным. Логарифмическая шкала означает, что каждое число ниже 7 в 10 раз более кислое, чем предыдущее при обратном отсчете. Точно так же, если считать выше 7, каждое число в 10 раз больше основного, чем предыдущее число ².
Логарифмическая шкала pH означает, что по мере увеличения pH концентрация H + будет уменьшаться в 10 раз. Таким образом, при pH 0 концентрация H + составляет 1 M. При pH 7 она снижается до 0,0000001 M.При pH 14 имеется всего 0,00000000000001 M H +.pH означает «мощность водорода» ³. Числовое значение pH определяется молярной концентрацией ионов водорода (H +) ³. Это делается путем отрицательного логарифма концентрации H + (-log (H +)). Например, если в растворе концентрация H + составляет 10 -3 M, pH раствора будет -log (10 -3 ), что равно 3.
Это определение связано с влиянием водорода. ионы (H +) и ионы гидроксила (OH-) от pH.Чем выше концентрация H +, тем ниже pH, и чем выше концентрация OH-, тем выше pH. При нейтральном pH 7 (чистая вода) концентрация как ионов H +, так и ионов OH- составляет 10⁻⁷ M. Таким образом, ионы H + и OH- всегда спарены – по мере увеличения концентрации одного из них концентрация другого будет уменьшаться; независимо от pH сумма ионов всегда будет равна 10⁻¹⁴ M². Из-за этого влияния H + и OH- относятся к основным определениям кислот и оснований.
Кислоты и основания
Пары кислот и оснований могут нейтрализовать друг друга, как Н + и ОН- в этом уравнении. Согласно рабочему определению, кислота – это вещество, которое снижает pH при добавлении в чистую воду. Таким же образом основа – это вещество, которое увеличивает pH воды ⁴. Для дальнейшего определения этих веществ Аррениус определил в 1884 году, что кислота выделяет ион водорода (H +) при растворении в воде, а основание выделяет ион гидроксила (OH-) в воде ⁴. Однако есть некоторые вещества, которые подходят под рабочее определение (изменение pH), но не подходят под определение Аррениуса (высвобождение иона).Чтобы учесть это, Бренстед и Лоури пересмотрели определение кислот и оснований; кислота высвобождает ион водорода или протон (эквивалент H +), а основание принимает ион водорода или протон ⁴. Это означает, что кислоты и основания могут нейтрализовать друг друга, как показано в уравнении воды справа.
Основные или щелочные
Общие примеры щелочей включают молоко магнезии – Mg (OH) 2, едкий калий – KOH, гашеную известь / известковую воду – Ca (OH) 2 и едкий натр (щелок) – NaOH. Термины «щелочной» и «основной» означают примерно одно и то же.Согласно определению Брэнстеда-Лоури, основа описывает любое вещество, которое снижает концентрацию ионов водорода и увеличивает pH воды, или, другими словами, основание. Щелочь происходит от щелочи, которая относится к ионным соединениям (солям), содержащим щелочные или щелочноземельные металлы, которые при растворении в воде образуют гидроксид-ионы ⁵. Щелочные соли очень распространены и легко растворяются. Из-за производимых ими гидроксид-ионов (которые увеличивают pH) все щелочи являются основаниями. Некоторые источники определяют любую растворимую основу как щелочь ⁵.По существу, растворимые основания могут быть описаны как «основные» или «щелочные». Однако нерастворимые основания (такие как оксид меди) следует описывать только как основные, а не щелочные.
Щелочность и pH воды
Щелочность и pH напрямую связаны при 100% -ном насыщении воздухом.Щелочность не относится к щелочам в отличие от щелочей ⁶. Хотя щелочность и pH тесно связаны, между ними есть явные различия. Щелочность воды или раствора – это количественная способность этого раствора буферизовать или нейтрализовать кислоту.Другими словами, щелочность – это показатель способности воды противостоять изменениям pH. Этот термин используется как синоним кислотонейтрализующей способности (ANC) ⁷. Если водоем имеет высокую щелочность, это может ограничить изменения pH из-за кислотных дождей, загрязнения или других факторов ⁸. Щелочность ручья или другого водоема увеличивается за счет богатых карбонатами почв (карбонаты и бикарбонаты), таких как известняк, и уменьшается за счет оттока сточных вод и аэробного дыхания. Из-за присутствия карбонатов щелочность более тесно связана с жесткостью, чем с pH (хотя все же есть явные различия).Однако изменения pH также могут влиять на уровень щелочности (при понижении pH снижается и буферная способность воды) ⁶. pH и щелочность напрямую связаны, когда вода находится на 100% насыщении воздухом ⁹.
Щелочность воды также играет важную роль в ежедневном уровне pH. В процессе фотосинтеза водорослями и растениями используется водород, тем самым повышая уровень pH ¹⁰. Точно так же дыхание и разложение могут снизить уровень pH. Большинство водоемов способны нейтрализовать эти изменения благодаря своей щелочности, поэтому небольшие или локальные колебания быстро видоизменяются, и их может быть трудно обнаружить ¹⁰.
Единицы измерения pH и щелочности
Значения pH определяются по логарифмической шкале.значения pH указываются в виде числа от 0 до 14 в качестве стандартной единицы pH. Эта единица эквивалентна отрицательному логарифму молярной концентрации ионов водорода (-log (H +)) в растворе. В зависимости от точности измерения значение pH может быть указано с точностью до одного или двух десятичных знаков.
Однако, поскольку шкала pH логарифмическая, попытка усреднить два значения pH была бы математически неверной.Если требуется среднее значение, его можно сообщить как медианное значение или диапазон, а не как простой расчет ¹⁰.
Щелочность может быть выражена в мг / л или в микроэквивалентах на литр (мэкв / л). Когда в мг / л, это относится к концентрациям карбоната (CO3 2-), бикарбоната (HCO3 –) или карбоната кальция (CaCO3), хотя карбонат кальция является наиболее распространенным ¹¹.
Щелочность 1 мг / л в пересчете на CaCO3 = 0,01998 мег / л щелочность
Щелочность 1 мг / л в пересчете на CaCO3 = 0,5995 мг / л щелочность в пересчете на CO3 2-
Щелочность 1 мг / л при CaCO3 = 1.2192 мг / л щелочность по HCO3 –
Почему важен pH?
Если pH воды слишком высокий или слишком низкий, водные организмы, живущие в ней, погибнут. pH также может влиять на растворимость и токсичность химических веществ и тяжелых металлов в воде ¹². Большинство водных существ предпочитают диапазон pH 6,5-9,0, хотя некоторые могут жить в воде с уровнем pH за пределами этого диапазона.
Уровни pH в воде. Оптимальный уровень pH для рыб – от 6,5 до 9.0. За пределами оптимальных диапазонов организмы могут подвергнуться стрессу или умереть.По мере того, как уровни pH выходят из этого диапазона (вверх или вниз), это может вызвать стресс у систем животных и снизить показатели вылупления и выживаемости. Чем дальше значение pH выходит за пределы оптимального диапазона, тем выше уровень смертности. Чем более чувствителен вид, тем больше на него влияют изменения pH. Помимо биологических эффектов, экстремальные уровни pH обычно увеличивают растворимость элементов и соединений, делая токсичные химические вещества более «мобильными» и повышая риск поглощения их водными организмами ¹³.
Не только водные виды подвержены влиянию pH. Хотя люди имеют более высокую толерантность к уровням pH (уровни для питья варьируются от 4 до 11 с минимальным раздражением желудочно-кишечного тракта), все еще есть опасения ¹⁴. Значения pH выше 11 могут вызвать раздражение кожи и глаз, равно как и pH ниже 4. Значение pH ниже 2,5 вызовет необратимое повреждение кожи и внутренних органов ¹⁴. Более низкие уровни pH увеличивают риск мобилизации токсичных металлов, которые могут поглощаться даже людьми, и уровни выше 8.0 нельзя эффективно дезинфицировать хлором, что вызывает другие косвенные риски ¹⁴. Кроме того, уровни pH за пределами 6,5-9,5 могут повредить трубы и другие системы и вызвать коррозию, что еще больше повысит токсичность тяжелых металлов.
Незначительное повышение уровня pH может привести к тому, что олиготрофное (богатое растворенным кислородом) озеро станет эвтрофным (без растворенного кислорода). Даже незначительные изменения pH могут иметь долгосрочные последствия. Небольшое изменение pH воды может увеличить растворимость фосфора и других питательных веществ, что сделает их более доступными для роста растений ¹⁰.В олиготрофном озере или озере с низким содержанием питательных веществ для растений и высоким уровнем растворенного кислорода это может вызвать цепную реакцию. Благодаря более доступным питательным веществам, водные растения и водоросли процветают, увеличивая потребность в растворенном кислороде. Это создает эвтрофное озеро, богатое питательными веществами и растениями, но с низким содержанием растворенного кислорода. В эвтрофном озере другие организмы, живущие в воде, подвергаются стрессу, даже если уровень pH остается в оптимальном диапазоне.
Факторы, влияющие на pH воды
Есть много факторов, которые могут повлиять на pH в воде, как естественные, так и искусственные.Большинство естественных изменений происходит из-за взаимодействия с окружающими породами (особенно карбонатными формами) и другими материалами. pH также может колебаться в зависимости от осадков (особенно кислотных дождей), сточных вод или горных стоков ¹³. Кроме того, концентрация CO2 может влиять на уровень pH.
Углекислый газ и pH
Уровни pH могут ежедневно колебаться из-за фотосинтеза и дыхания в воде. Степень изменения зависит от щелочности воды.Двуокись углерода – наиболее частая причина кислотности воды ¹⁵.Фотосинтез, дыхание и разложение – все это способствует колебаниям pH из-за своего влияния на уровень CO2. Крайность этих изменений зависит от щелочности воды, но часто наблюдаются заметные суточные (суточные) колебания ¹⁶. Это влияние более ощутимо в водоемах с высокой скоростью дыхания и разложения.
Хотя углекислый газ существует в воде в растворенном состоянии (например, кислород), он также может реагировать с водой с образованием угольной кислоты:
CO2 + h3O <=> h3CO3
h3CO3 может затем потерять один или оба своих иона водорода. :
h3CO3 <=> HCO3 – + H +….HCO3 – <=> CO3 2- + H +
Высвободившиеся ионы водорода снижают pH воды¹⁵. Однако это уравнение может работать в обоих направлениях в зависимости от текущего уровня pH, работая как собственная буферная система. При более высоком pH эта бикарбонатная система будет сдвигаться влево, и CO3 2- будет улавливать свободный ион водорода.
Эта реакция обычно минимальна, поскольку h3CO3 имеет низкую константу растворимости (закон Генри) ¹⁵. Однако по мере увеличения уровня CO2 во всем мире количество растворенного CO2 также увеличивается, и уравнение будет выполняться слева направо.Это увеличивает h3CO3, что снижает pH. Эффект становится все более очевидным в исследованиях pH океана с течением времени.
Общее изменение годовых уровней pH в океане с 1700-х по 1990-е годы. (данные: Атлас Мирового океана 2009; фото: Plumbago; Wikipedia Commons) Углекислый газ в атмосфере снижает pH осадков.Приведенные выше уравнения также объясняют, почему дождь имеет pH примерно 5,65 ¹⁵. Когда капли дождя падают в воздух, они взаимодействуют с молекулами углекислого газа в атмосфере.В результате в каплях дождя образуется h3CO3, что снижает уровень pH дождя ¹⁷. Уровень pH 5,65, хотя и является кислым, не считается кислотным дождем. Ожидается, что естественный, незагрязненный дождь или снег будет иметь уровень pH около 5,6 при стандартной концентрации CO2 в атмосфере 0,0355% ¹⁵. Кислотный дождь требует pH ниже 5,0 ².
5,65 – это также pH воды, которая уравновешивается с воздухом и не контактирует с карбонатными материалами или известняком.
Естественное влияние pH
Карбонатные материалы и известняк – два элемента, которые могут нейтрализовать изменения pH в воде.Карбонат кальция (CaCO3) и другие бикарбонаты могут объединяться как с ионами водорода, так и с гидроксильными ионами для нейтрализации pH¹⁸. Когда в почве присутствуют карбонатные минералы, буферная способность (щелочность) воды увеличивается, поддерживая pH воды близким к нейтральному даже при добавлении кислот или оснований. Дополнительные карбонатные материалы могут сделать нейтральную воду слегка щелочной.
Известняковые карьеры имеют более высокий уровень pH из-за карбонатных материалов в камне. Молния может снизить pH дождя.Как упоминалось ранее, незагрязненный дождь имеет слабокислый характер (pH 5,6). Уровень pH дождя также может быть понижен из-за вулканического пепла, сульфатредуцирующих бактерий на заболоченных территориях, взвешенных в воздухе твердых частиц от лесных пожаров и даже молний ¹⁹. Если дождь выпадает на источник воды с плохой буферностью, он может снизить pH воды поблизости из-за стока.
Разложение хвои может снизить pH. Хвоя сосны или пихты также может снижать pH почвы и воды, протекающей по ней, поскольку они разлагаются ¹⁸. Интенсивный фотосинтез увеличивает pH воды, поскольку она удаляет CO2, хотя это изменение обычно является суточным ²⁰.
Искусственные факторы воздействия на pH
Загрязнение воздуха, почвы или непосредственно в воде может повлиять на pH.Антропогенные причины колебаний pH обычно связаны с загрязнением. Кислотный дождь – один из самых известных примеров влияния человека на pH воды. Любая форма осадков с уровнем pH менее 5,0 известна как кислотный дождь ²¹. Это осаждение происходит в результате реакции воды с оксидами азота, оксидами серы и другими кислотными соединениями, что снижает и без того слабокислый pH.Эти выбросы обычно происходят в результате горнодобывающих и плавильных работ или сжигания ископаемого топлива (сжигание угля и автомобили) ¹⁸. Чрезвычайно высокий уровень CO2 также может еще больше снизить pH дождя ¹⁷.
Загрязнение из точечных источников – распространенная причина, которая может повышать или понижать pH в зависимости от используемых химикатов ¹⁸. Эти химические вещества могут поступать из сельскохозяйственных стоков, сточных вод или промышленных стоков. Добыча полезных ископаемых (особенно угля) вызывает кислотный сток и просачивание кислых грунтовых вод, если окружающая почва плохо забуферирована ²².Сброс сточных вод, содержащих моющие средства и продукты на основе мыла, может привести к тому, что источник воды станет слишком простым.
Типичные уровни pH
Рекомендуемые минимальные уровни pH для водных организмов.Типичные уровни pH изменяются из-за влияния окружающей среды, особенно щелочности. Щелочность воды зависит от наличия растворенных солей и карбонатов, а также от минерального состава окружающей почвы. Как правило, чем выше щелочность, тем выше pH; чем ниже щелочность, тем ниже pH.Рекомендуемый диапазон pH для большинства рыб составляет от 6,0 до 9,0 с минимальной щелочностью 20 мг / л, с идеальным уровнем CaCO3 от 75 до 200 мг / л²⁰.
Океанические организмы, такие как рыбы-клоуны и кораллы, требуют более высоких уровней pH. Уровень pH ниже 7,6 приведет к разрушению коралловых рифов из-за недостатка карбоната кальция ³⁹. Чувствительные пресноводные виды, такие как лосось, предпочитают уровни pH от 7,0 до 8,0, сильно расстраиваясь и страдая от физиологических повреждений из-за поглощения металлов на уровнях ниже 6.0 ⁴⁰.
Соображения по охране окружающей среды
Естественные осадки, как дождевые, так и снежные, имеют pH около 5,6 из-за контакта с CO2 и других атмосферных воздействий. Большинство злаковых и бобовых культур предпочитают почвы с pH 4,5-7,0, поэтому небольшая кислотность дождя может принести пользу карбонатным почвам ²³.
Кислотность окружающей среды также может влиять на pH воды. Это наиболее очевидно вблизи районов добычи полезных ископаемых, но эффект также может возникать естественным образом. Кислотный сток снижает щелочность воды и снижает pH ниже оптимального уровня.Это может быть терпимо для некоторых водных видов (например, лягушек), но не для большинства рыб. Некоторые лягушки и другие земноводные часто переносят уровень pH ниже 4,0 ²⁴. Кислые почвы в Амазонке приводят к тому, что многие озера и реки естественным образом имеют низкие значения pH ³⁸. Из-за растворенных гуминовых веществ от стока и поглощения источники «черной воды» могут иметь pH до 4,43. Источники «Клируотер» будут иметь немного более высокое, но все же кислое значение pH ³⁸. Вот почему рыбы-ангелы и дискусы из бассейна реки Амазонки могут вполне успешно развиваться в водах с pH всего 5.0 ²⁵.
Морская вода имеет pH около 8,2, хотя он может колебаться от 7,5 до 8,5 в зависимости от ее местной солености. Уровень pH будет увеличиваться с увеличением солености, пока вода не достигнет насыщения карбонатом кальция (CaCO3) ¹⁶. Океаны обычно имеют более высокую щелочность из-за содержания карбонатов и, таким образом, обладают большей способностью буферизовать свободные ионы водорода ²⁷.
Пресноводные озера, пруды и ручьи обычно имеют pH 6-8 в зависимости от окружающей почвы и коренных пород ²¹. В более глубоких озерах, где происходит расслоение (расслоение), pH воды обычно выше (7.5-8,5) у поверхности и ниже (6,5-7,5) на большей глубине ¹⁰. Некоторые штаты, такие как Аляска, пытаются поддерживать стандарт pH для качества воды. Стандарт качества воды Аляски требует уровней pH от 6,5 до 8,5 для защиты многих популяций лосося в штате.
Соображения о стратификации
Стратификация может привести к тому, что уровни pH в водоеме будут различаться выше и ниже границы.Стратификация обычно вызывается разницей температур в водоеме, где каждый слой воды не смешивается со слоями выше или ниже ³⁷.Эти слои разделены клинами, известными как термоклины (температурные разницы) или хемоклины (химические градиенты). Хемоклины могут быть основаны на кислороде, солености или других химических факторах, которые не пересекают границу, таких как углекислый газ. Из-за влияния CO2 на pH воды стратификация может привести к тому, что уровни pH будут различаться в зависимости от климата.
Различия в уровнях pH между слоями воды возникают из-за увеличения CO2 в результате дыхания и разложения ниже термоклина. В кратерных озерах, таких как озеро Ниос или озеро Моноун, pH быстро падает с поверхностного уровня примерно с 7 до 5.5 ниже 60 м (на термоклине и хемоклине) ²⁶. Это значительное снижение происходит из-за насыщенного CO2, который накапливается в нижних слоях озера.
Приспособляемость
Хотя идеальные уровни pH для рыб составляют 7-8 (кровь рыб имеет pH 7,4) ²⁰, большинство рыб могут адаптироваться к уровню pH окружающей среды (6,0-9,0), если нет резких колебаний. . Резкое колебание считается сдвигом pH на 1,4 (вверх или вниз) ²². Для морской рыбы pH воды должен оставаться в пределах 7.5 и 8,5.
Необычный уровень pH и последствия
Каменные кораллы начинают обесцвечиваться и портиться по мере падения уровня карбоната и pH.Вредное воздействие становится заметным, когда pH воды падает ниже 5,0 или поднимается выше 9,6. Болезни из-за подкисления более выражены у морских рыб из-за их адаптации к более высокому pH. Когда pH ниже оптимального, рыба становится восприимчивой к грибковым инфекциям и другим физическим повреждениям ¹⁶. Когда pH воды падает, растворимость карбоната кальция снижается, что препятствует росту раковины у водных организмов ¹⁶.В целом, на воспроизводство рыб влияет уровень pH ниже 5,0, и многие виды (например, морская рыба или чувствительная пресноводная рыба, например, малоротый окунь) покидают этот район ²¹. Рыба начинает умирать, когда pH падает ниже 4,0 ².
Низкий уровень pH может способствовать растворению тяжелых металлов ¹². По мере увеличения уровня ионов водорода катионы металлов, таких как алюминий, свинец, медь и кадмий, попадают в воду, а не поглощаются осадком. По мере увеличения концентрации тяжелых металлов их токсичность также увеличивается.Алюминий может ограничивать рост и размножение, увеличивая уровень смертности при концентрациях всего 0,1-0,3 мг / л²². Кроме того, мобилизованные металлы могут поглощаться организмами во время дыхания, вызывая физиологический ущерб ²². Это особенно пагубно для таких видов, как радужная форель ¹³.
С другой стороны, высокие уровни pH могут повредить жабры и кожу водных организмов и вызвать смерть при уровнях выше 10,0. В то время как некоторые африканские цихлиды хорошо себя чувствуют при высоком уровне pH (до 9.5), большинство рыб их не переносят. Смерть может наступить даже при типичном уровне (9,0), если в воде присутствует аммиак ²¹. При низком и нейтральном уровнях pH аммиак соединяется с водой с образованием иона аммония:
Nh4 + h3O <=> Nh5 + + OH –
Водоросли, устойчивые к низкому pH, могут образовывать цветы, которые могут убить озеро.Аммоний, Nh5⁺, нетоксичен и не влияет на водные организмы. Однако при уровне pH выше 9 уравнение меняется на противоположное, и аммиак попадает в воду ²².Аммиак, Nh4, чрезвычайно токсичен для водных организмов, и по мере увеличения pH уровень смертности увеличивается с увеличением концентрации Nh4.
Что касается экосистемы, то мхи могут начать вторгаться в водоем, когда pH воды падает ниже 5. В эвтрофных озерах могут преобладать водоросли, толерантные к pH, доводя уровни pH до дневных высоких и низких крайних значений, образуя цветение водорослей, которые может убить озеро ¹⁶.
Щелочные и кислотные озера
По всему миру разбросано несколько озер с необычным уровнем pH.Щелочные озера, также известные как содовые озера, обычно имеют уровень pH от 9 до 12. Это часто связано с высоким содержанием соли (хотя не каждое соленое озеро имеет высокий pH). Эти озера имеют высокую концентрацию минералов, особенно растворенных солей: карбонатов и бикарбонатов натрия, кальция, магния ²⁸. В зависимости от озера также могут присутствовать бораты, сульфаты и другие элементы (обычно сильные основные ионы) ²⁹. Щелочные озера образуются, когда единственным выходом для воды является испарение, оставляя минералы для накопления ³⁰.Эти минералы часто образуют колонны минеральных отложений, известные как колонны туфа. Многие щелочные озера являются коммерческим источником кальцинированной соды и поташа, в то время как другие являются популярными туристическими направлениями из-за их «волшебных» целебных свойств (из-за содержания минералов).
Мыльное озеро в Вашингтоне – щелочное озеро, которое, как предполагается, обладает целебными свойствами (Фото предоставлено Стивеном Павловым через Wikipedia Commons) Кальцинированный фламинго, сохранившийся благодаря содовым минералам в озере Натрон. (Фото: © Ник Брандт, 2013 г. Предоставлено галереей Hasted Kraeutler, Нью-Йорк.)Печально известный пример щелочного озера – озеро Натрон в Танзании. Озеро Натрон имеет pH до 10,5 из-за высоких концентраций декагидрата карбоната натрия (кальцинированной соды) и бикарбоната натрия (пищевой соды), которые попадают в воду из окружающей почвы ³¹. В то время как озеро поддерживает процветающую экосистему, включая фламинго, щелочную тилапию и водоросли, устойчивые к pH, фотограф Ник Брант создал множество захватывающих изображений животных, погибших в этом озере ³¹. Тела этих животных сохраняются карбонатом натрия, очень похоже на древнеегипетский процесс мумификации.
Кислотные озера обычно образуются возле вулканов, где серная кислота, сероводород, плавиковая кислота, соляная кислота и диоксид углерода могут попадать в воду ³². В невулканических районах кислотные озера могут также образовываться после кислотных отложений в результате таких явлений, как кислотные дожди, загрязнение или кислотный сток в результате горных работ ³³. Как и их щелочные аналоги, кислотные озера не имеют выхода, кроме испарения, в котором концентрируются сульфаты и кислоты. Кислоты могут попадать в воду в результате атмосферной диффузии в результате сжигания угля, кислотных дождей или после извержения.В вулканических озерах кислоты могут попадать в воду через активную фумаролу или вулканическое отверстие.
Отложения серы и железа на одном из кислых озер Даллола.Кислые озера в Даллоле в Эфиопии являются результатом кислотного выщелачивания из близлежащих вулканов. Сера и железо в воде оставляют желтые и ржавые отложения у кромки воды.
При уровне pH ниже 5,0 некоторые организмы могут жить в кислых озерах. Однако есть одно заметное исключение: ельца Осорезан, или японская ельца.Эта рыба процветает в кислых водах озера Осорезан, комфортно отдыхает при pH 3,5, и плавает в водах с нейтральным pH только для того, чтобы нереститься ³⁴.
Окисление океана
По мере увеличения содержания CO2 в атмосфере растворенный CO2 будет увеличиваться, а pH воды снизится. (данные: NOAA / ESRL и Гавайский университет; кредит: SERC EarthLabs)Закисление океана вызвано притоком растворенного диоксида углерода. Поскольку уровни CO2 в атмосфере увеличиваются из-за антропогенных причин, растворенный CO2 также увеличивается, что, в свою очередь, снижает pH воды.
Когда вода насыщается CO2, это не только снижает pH океана, но и истощает источники карбоната кальция ³⁵. Карбонат кальция, CaCO3, является необходимым ингредиентом для построения кораллов, раковин и экзоскелетов многих водных существ. По мере снижения уровня CO3²⁻ морским существам становится все труднее строить свои раковины.
Как упоминалось в разделе «Двуокись углерода и pH», дополнительный CO2 увеличивает количество ионов водорода в воде, снижая pH:
CO2 + h3O <=> h3CO3… h3CO3 <=> (H +) + HCO3⁻
При уровне pH от 6.4 и 10.33, некоторые из этих ионов водорода присоединяются к карбонатным ионам ²²:
(H +) + CO3 2- <=> HCO3 –
Таким образом, по мере увеличения уровня CO2 доступность карбоната, CO3 2- уменьшается, уменьшая количество ³⁶, доступное для строительства из ракушек и кораллов.
CO2 + h3O + CO3²⁻ <=> 2HCO3⁻
При pH в океане 8,3 уровень карбонатов достаточно высок для строительства кораллов. По мере увеличения CO2 и снижения pH уровень карбонатов быстро падает ниже оптимального уровня.Высокий уровень CO2 также затрудняет поддержание текущих скорлуп из-за более низкого уровня pH и конкуренции за карбонат ³⁵.
Кроме того, воздухонасыщение воды основано на парциальных давлениях из закона Генри. По мере увеличения уровня CO2 в воздухе увеличивается и их парциальное давление. Это снижает парциальное давление кислорода, снижая уровень его насыщения и способствуя гипоксии (низкий уровень O2) ³⁵.
Хотя океаны никогда не станут «кислыми» (с pH менее 7), даже небольшое снижение pH вызывает стресс у морских организмов и увеличивает уровень смертности.pH является логарифмическим, что означает, что уменьшение на 0,1 эквивалентно почти 30% увеличению кислотности ³⁵.
Процитируйте эту работу
Fondriest Environmental, Inc. «pH воды». Основы экологических измерений. 19 ноября 2013 г. Web.
Дополнительная информация
Физиология, кислотно-щелочной баланс – StatPearls
Введение
Для поддержания гомеостаза человеческий организм использует множество физиологических приспособлений.Одно из них – поддержание кислотно-щелочного баланса. При отсутствии патологических состояний pH человеческого тела колеблется от 7,35 до 7,45 при среднем уровне 7,40. Почему именно этот номер? Почему бы не использовать нейтральное число 7,0 вместо слабощелочного 7,40? Такой уровень pH идеален для многих биологических процессов, одним из самых важных является насыщение крови кислородом. Кроме того, многие промежуточные продукты биохимических реакций в организме ионизируются при нейтральном pH, что затрудняет использование этих промежуточных продуктов.
pH ниже 7,35 – это ацидемия, а pH выше 7,45 – алкалиемия. Из-за важности поддержания уровня pH в необходимом узком диапазоне в организме человека есть компенсаторные механизмы. Это обсуждение призвано дать общее представление о кислотно-щелочном балансе в организме, обеспечивая систематический подход к пациентам, которые обращаются с состояниями, вызывающими изменения pH.
Человеческое тело испытывает четыре основных типа кислотных расстройств: метаболический ацидоз, метаболический алкалоз, респираторный ацидоз и респираторный алкалоз.Если возникает одно из этих условий, человеческое тело должно вызвать противовес в виде противоположного состояния. Например, если человек страдает метаболической ацидемией, его организм будет пытаться вызвать респираторный алкалоз для компенсации. Компенсация редко приводит к полностью нормальному значению pH 7,4. При использовании терминов ацидемия или алкалиемия подразумевают, что в целом pH является кислым или щелочным, соответственно. Хотя это и не обязательно, может быть полезно использовать эту терминологию для различения отдельных процессов и общего состояния pH пациента, поскольку одновременно могут возникать множественные дисбалансы.[1] [2]
Cellular
Основное понимание дыхания на клеточном уровне важно для понимания кислотно-щелочного равновесия в организме человека. Аэробное клеточное дыхание необходимо для жизни человека; люди – облигатные аэробы. Хотя отдельные клетки могут выполнять анаэробное дыхание, для поддержания жизни в них должен присутствовать кислород. Одним из побочных продуктов аэробного клеточного дыхания является углекислый газ. Упрощенное химическое уравнение, обозначающее аэробное клеточное дыхание:
Первой стадией клеточного дыхания является гликолиз, который берет шестиуглеродную глюкозу и расщепляет ее на две молекулы пирувата, каждая из которых содержит три атома углерода.Гликолиз использует два АТФ и создает четыре АТФ, что означает, что он генерирует два чистых АТФ. Для этого процесса не нужен кислород. Поскольку пациенты часто испытывают дефицит, стоит отметить, что магний является кофактором двух реакций гликолиза.
В конце концов молекулы пирувата окисляются и вступают в цикл TCA. Цикл TCA генерирует NADH из NAD +, FADh3 из FAD и двух молекул АТФ. Это аэробный процесс, требующий кислорода. Пируват попадает в митохондрии и образует ацетил-КоА с потерей углекислого газа.Этот избыток углекислого газа затем выдыхается во время выдоха.
Последним этапом аэробного клеточного дыхания является цепь переноса электронов (ETC). ETC производит большую часть АТФ, образующегося при клеточном дыхании, при этом создается 34 молекулы АТФ. Чтобы произошла реакция ETC, необходим кислород. Если кислорода недостаточно, продукты гликолиза вступают в реакцию, называемую ферментацией, с образованием АТФ. Побочный продукт брожения – молочная кислота.Во время гликолиза и цикла TCA NAD + восстанавливается до NADH, а FAD – до FADh3. Восстановление характеризуется увеличением количества электронов. Это то, что движет ETC. Для каждой отдельной молекулы глюкозы десять молекул НАД + превращаются в молекулы НАДН, которые производят по три молекулы АТФ в ETC.
Этот процесс аэробного клеточного дыхания характеризует потребность человека в кислороде. Анаэробное дыхание позволяет организму вырабатывать некоторое количество АТФ при недостатке кислорода; однако этот процесс генерирует только два АТФ, в отличие от 38 АТФ, производимых при аэробном дыхании.Двух молекул АТФ на реакцию недостаточно для поддержания жизни.
Как отмечалось выше, диоксид углерода образуется как побочный продукт цикла TCA. Этот углекислый газ играет важную роль в кислотно-щелочном балансе в организме, что демонстрируется следующей реакцией:
Углекислый газ, образующийся во время клеточного дыхания, соединяется с водой с образованием угольной кислоты. Затем угольная кислота диссоциирует на бикарбонат и ион водорода. Эта реакция – одна из многих буферных систем в организме человека; он сопротивляется резким изменениям pH, позволяя человеку оставаться в узком физиологическом диапазоне pH.Эта буферная система находится в равновесии, то есть все компоненты реакции существуют по всему телу и смещены в сторону уравнения, соответствующую окружающей среде. Эта реакция может происходить и происходит без фермента; однако карбоангидраза – это фермент, который помогает в этом процессе. Он катализирует первую реакцию, описанную выше, с образованием угольной кислоты, которая затем может свободно диссоциировать на бикарбонат и ион водорода. Карбоангидраза находится в эритроцитах, почечных канальцах, слизистой оболочке желудка и клетках поджелудочной железы.
Другие буферные системы в организме человека включают фосфатную буферную систему, белки и гемоглобин. Все они содержат основания, которые принимают ионы водорода, что предотвращает резкое падение pH. Фосфатная буферная система, хотя и присутствует во всем мире, важна для регулирования pH мочи. Белки помогают регулировать внутриклеточный pH. Красные кровяные тельца используют описанную выше реакцию, чтобы помочь гемоглобиновому буферу; углекислый газ может диффундировать через красные кровяные тельца и соединяться с водой. Одно только это могло бы вызвать увеличение ионов водорода; однако гемоглобин может связывать ионы водорода.Гемоглобин также может связывать углекислый газ без этой реакции. Это зависит от количества кислорода, связанного с гемоглобином. Это называется эффектом Холдейна и эффектом Бора. Когда гемоглобин насыщен кислородом, он имеет более низкое сродство к CO2 и ионам водорода и способен его высвобождать. [3] [4]
Участвующие системы органов
Каждая система органов человеческого тела зависит от баланса pH; однако почечная система и легочная система являются двумя основными модуляторами. Легочная система регулирует pH с помощью углекислого газа; по истечении срока действия углекислый газ выбрасывается в окружающую среду.Из-за того, что углекислый газ образует угольную кислоту в организме при соединении с водой, количество выдохшего углекислого газа может вызвать повышение или понижение pH. Когда дыхательная система используется для компенсации метаболических нарушений pH, эффект проявляется в течение нескольких минут или часов.
Почечная система влияет на pH, реабсорбируя бикарбонат и выводя фиксированные кислоты. Будь то патология или необходимая компенсация, почки выводят или реабсорбируют эти вещества, влияющие на pH. Нефрон – функциональная единица почки.Кровеносные сосуды, называемые клубочками, транспортируют вещества, обнаруженные в крови, в почечные канальцы, так что некоторые из них могут быть отфильтрованы, а другие реабсорбируются в кровь и рециркулируются. Это верно для ионов водорода и бикарбоната. Если бикарбонат реабсорбируется и / или кислота выделяется с мочой, pH становится более щелочным (увеличивается). Когда бикарбонат не реабсорбируется или кислота не выводится с мочой, pH становится более кислым (снижается). Компенсация метаболизма почечной системой занимает больше времени: дни, а не минуты или часы.
Функция
Физиологический pH человеческого тела важен для многих процессов, необходимых для жизни, включая доставку кислорода к тканям, правильную структуру белка и бесчисленные биохимические реакции, которые зависят от нормального pH, чтобы быть в равновесии и полноте.
Доставка кислорода в ткани
Кривая диссоциации кислорода представляет собой график, изображающий отношение парциального давления кислорода к насыщению гемоглобина. Эта кривая относится к способности гемоглобина доставлять кислород к тканям.Если кривая смещена влево, p50 уменьшается, а это означает, что количество кислорода, необходимое для насыщения гемоглобина на 50%, уменьшается и что сродство гемоглобина к кислороду увеличивается. Этот сдвиг влево вызывает pH в алкалотическом диапазоне. Когда происходит снижение pH, кривая смещается вправо, что указывает на снижение сродства гемоглобина к кислороду.
Структура белка
Трудно переоценить важность белков в организме человека.Они составляют ионные каналы, переносят необходимые липофильные вещества по всему нашему в основном липофобному телу и участвуют в бесчисленных биологических процессах. Чтобы белки выполняли необходимые функции, они должны быть в правильной конфигурации. Заряды белков – это то, что позволяет им существовать в правильной форме. Когда pH изменяется за пределы физиологического диапазона, эти заряды изменяются. Белки денатурируются, что приводит к пагубным изменениям в архитектуре, которые вызывают потерю правильной функции.
Биохимические процессы
В организме человека многие химические реакции находятся в равновесии. Один из наиболее важных ранее упоминался уравнением:
Принцип Ле Шателье гласит, что при изменении переменных концентрации, давления или температуры система, находящаяся в равновесии, соответствующим образом отреагирует, чтобы восстановить новое устойчивое состояние. Для приведенной выше реакции это означает, что если образуется больше ионов водорода, уравнение сместится влево, так что образуется больше реагентов, и система может оставаться в равновесии.Так работают компенсаторные механизмы pH; если имеется метаболический ацидоз, почки не выделяют достаточно ионов водорода и / или не реабсорбируют достаточное количество бикарбонатов. Дыхательная система реагирует увеличением минутной вентиляции (часто путем увеличения частоты дыхания) и выдыханием большего количества CO2 для восстановления равновесия. [5]
Сопутствующее тестирование
Отбор проб газов артериальной крови (ГКК) – это тест, который часто выполняется в условиях стационара для оценки кислотно-щелочного статуса пациента.Для забора крови из артерии, часто лучевой, используется игла, и кровь анализируется для определения таких параметров, как pH, pC02, pO2, HCO3, сатурация кислорода и другие. Это позволяет врачу лучше понять состояние пациента. ГД особенно важны для тяжелобольных. Они являются основным инструментом, который используется для адаптации к потребностям пациента на аппарате ИВЛ. Ниже приведены наиболее важные нормальные значения для ABG:
Способность быстро и эффективно читать ABG, особенно в отношении стационарной медицины, имеет первостепенное значение для качественного ухода за пациентом.
Посмотрите на pH
Определите, является ли он ацидотическим, щелочным или находится в пределах физиологического диапазона
Уровень PaCO2 определяет респираторный вклад; высокий уровень означает, что дыхательная система снижает pH, и наоборот.
Уровень HCO3- указывает на метаболический / почечный эффект. Повышенный уровень HCO3- увеличивает pH и наоборот.
Если pH является ацидотическим, ищите число, которое соответствует более низкому pH.Если это респираторный ацидоз, уровень CO2 должен быть высоким. Если у пациента метаболическая компенсация, уровень HCO3- также должен быть высоким. Метаболический ацидоз будет обозначен низким значением HCO3-.
Если pH является щелочным, снова определите, какое значение вызывает это. Респираторный алкалоз означает низкий уровень CO2; метаболический алкалоз должен давать высокий уровень HCO3. Компенсация в любой системе будет отражена противоположным образом; при респираторном алкалозе метаболический ответ должен быть низким HCO3-, а при метаболическом алкалозе респираторный ответ должен быть высоким.
Если уровень pH находится в физиологическом диапазоне, но PaCO2 и / или бикарбонат не находятся в пределах нормы, вероятно, имеется смешанное заболевание. Кроме того, компенсация происходит не всегда; именно тогда клиническая информация приобретает первостепенное значение.
Иногда бывает трудно установить, есть ли у пациента смешанное заболевание. Об этом позже.
Другие тесты, которые важно выполнять при анализе кислотно-щелочного статуса пациента, включают те, которые измеряют уровни электролитов и функцию почек.Это помогает врачу собрать информацию, которая может быть использована для определения точного механизма кислотно-щелочного дисбаланса, а также факторов, способствующих возникновению расстройств. [6] [3]
Патофизиология
Метаболический ацидоз с увеличением анионной щели
Первичный метаболический ацидоз, то есть первичное кислотно-основное нарушение, имеет множество причин. Они разделяются на те, которые вызывают высокий анионный разрыв, и те, которые не вызывают. Анионный разрыв в плазме помогает врачам определить причину метаболического ацидоза.Когда присутствует метаболический ацидоз, измеряются определенные ионы в крови, которые помогают определить этиологию ацидемии. Анионная щель увеличивается всякий раз, когда бикарбонат теряется из-за его объединения с ионом водорода, который ранее был присоединен к основанию конъюгата. Когда бикарбонат соединяется с ионом водорода, образуется угольная кислота (h3CO3). Основанием конъюгата может быть любой отрицательно заряженный ион, не являющийся бикарбонатом или хлоридом.
Формула для анионной щели:
Люди электрически нейтральны, но все катионы и анионы не измеряются.Нормальный анионный промежуток равен 8 +/- 4. Большая часть этого числа приходится на альбумин; этот анион не учитывается в формуле, что является важной причиной того, что зазор не приближается к нулю. Альбумин обычно составляет 4 мг / дл. Из-за большого влияния альбумина на анионный разрыв, если уровень альбумина у пациента ненормальный, ожидаемый анионный разрыв не будет точным. Это можно исправить с помощью простой математики. Нормальный анионный интервал и уровень альбумина различаются в три раза (нормальный анионный интервал 12, нормальный альбумин 4 мг / дл).Если у пациента анионная щель равна 24, это означает, что присутствует 12 единиц конъюгированного основания, что обычно не связано с комбинацией ионов водорода с бикарбонатом. Если у этого же пациента уровень альбумина 3 мг / дл, их ожидаемый анионный разрыв должен фактически составлять около 9. Это означает, что вместо 12 единиц присутствующего конъюгированного основания на самом деле имеется 15 единиц.
Более сложный метод анализа ионного вклада в изменение pH – это сильная ионная разница / сильная ионная щель.Этот метод подчеркивает влияние других ионов на кислотно-щелочной баланс и полезен для изучения кислотно-щелочного баланса. Однако этот подход более обременительный, чем стандартная анионная щель, и требует дополнительных расчетов. Поэтому многие считают, что его использование в клинической практике ограничено.
Мнемоника МУДПИЛЫ классически использовалась для обучения студентов причинам метаболического ацидоза с высоким анионным разрывом. МУДПИЛЫ означает метанол, уремию, диабетический кетоацидоз, паральдегид, инфекцию, лактоацидоз, этиленгликоль и салицилаты.Было предложено усовершенствовать новую мнемонику GOLDMARK. GOLDMARK – это анаграмма для гликолей (этилена и пропилена), оксопролина, лактата, метанола, аспирина, почечной недостаточности и кетонов. Если у пациента наблюдается анионный разрыв более 12, эти мнемоники помогают запомнить возможные причины расстройства. [7] [8]
Метаболический ацидоз с узкой анионной щелью
Если ацидоз связан с нормальной анионной щелью, происходит потеря бикарбоната, а не повышенное количество ионов водорода с сопутствующим увеличением ионов хлора.Чтобы сохранить физиологически нейтральное состояние, ионы хлора мигрируют из клеток во внеклеточное пространство. Это вызывает повышение уровня хлорида в сыворотке крови пациента и поддерживает нормальный уровень анионной щели. Это означает, что метаболический ацидоз без аномальной анионной щели также является гиперхлоремическим метаболическим ацидозом. Метаболический ацидоз без увеличения анионной щели является результатом многих процессов, включая тяжелую диарею, почечный канальцевый ацидоз (RTA) I типа, длительный прием ингибиторов карбоангидразы и отсасывание содержимого желудка.Когда у пациента гиперхлоремический ацидоз с узкой ионной щелью, врач может рассчитать анионную щель мочи (UAG), чтобы определить этиологию.
Ниже приводится уравнение для анионного разрыва мочи, где Na – натрий, K – калий, а Cl – хлорид:
Почечная система пытается смягчить последствия патологического метаболического ацидоза путем выделения аммония (Nh5 +) с мочой. UAG от 20 до 90 мэкв / л означает низкую или нормальную секрецию Nh5 +. От -20 до -50 мэкв / л предполагает, что основной причиной метаболического ацидоза является длительная тяжелая диарея.
Еще одна важная формула для использования при метаболическом ацидозе – это формула Winter. Это уравнение дает клиницисту ожидаемое значение PCO2. Это важно, потому что может присутствовать другое кислотно-щелочное нарушение.
Формула Винтера:
Если значение PCO2 находится в пределах ожидаемого PCO2, смешанного расстройства нет, только респираторная компенсация. Когда значение ниже или выше ожидаемого, наблюдается смешанный беспорядок; ниже означало бы респираторный алкалоз, а выше – респираторный ацидоз.Сокращение для формулы Winter состоит в том, что последние две цифры pH +/- 2 примерно равны ожидаемому PCO2. [9] [10]
Респираторный ацидоз
Во время выдоха углекислый газ, вырабатываемый клеточным дыханием, выбрасывается в окружающую среду. В организме человека углекислый газ соединяется с водой через карбоангидразу и образует угольную кислоту, которая диссоциирует на ион водорода и бикарбонат. Вот почему снижение частоты дыхания приведет к снижению pH; чем больше углекислого газа выдыхается, тем меньше углекислого газа присутствует в этой реакции.
Респираторный ацидоз как первичное заболевание часто вызывается гиповентиляцией. Это может быть связано с множеством причин, включая хроническую обструктивную болезнь легких, злоупотребление / передозировку опиатами, тяжелое ожирение и травму головного мозга. Когда возникает респираторный ацидоз, метаболический ответ должен заключаться в увеличении количества бикарбоната через почечную систему. Это не всегда происходит, и почечная патология может легко помешать соответствующему физиологическому ответу, что приведет к повышенной опасности для пациента.
Метаболический алкалоз
Метаболический алкалоз также можно разделить на две основные категории, которые помогают установить причину: чувствительный к хлоридам и нечувствительный к хлоридам. При не реагирующем на хлориды метаболическом алкалозе содержание хлоридов в моче составляет <20 мэкв / л. Некоторые причины включают рвоту, гиповолемию и прием мочегонных средств.
Респираторный алкалоз
Любая патология, приводящая к повышенному выделению углекислого газа, может привести к респираторному алкалозу.Когда избыток CO2 выдыхается, pH человеческого тела увеличивается из-за того, что образуется меньше углекислоты. Физиологически подходящей компенсацией является уменьшение количества бикарбоната, вырабатываемого почечной системой. Некоторые причины респираторного алкалоза включают панические атаки с гипервентиляцией, тромбоэмболию легочной артерии, пневмонию и салицилатную интоксикацию. [11]
Клиническая значимость
Кислотно-щелочной баланс в организме человека – один из важнейших физиологических процессов.Клиническое значение кислотно-щелочного баланса трудно отрицать. Некоторые из наиболее частых случаев госпитализации связаны с заболеваниями, которые могут серьезно повлиять на кислотно-щелочной баланс. Вот почему клиницистам важно понимать основные принципы, которые управляют этой частью гомеостаза человека.
Ссылки
- 1.
- Cao Y, Wang M, Yuan Y, Li C, Bai Q, Li M. Газы артериальной крови и кислотно-щелочной баланс у пациентов с синдромом гипертонии, вызванной беременностью.Exp Ther Med. 2019 Янв; 17 (1): 349-353. [Бесплатная статья PMC: PMC6307481] [PubMed: 30651802]
- 2.
- Кастро Д., Патил С.М., Кинаган М. StatPearls [Интернет]. StatPearls Publishing; Остров сокровищ (Флорида): 27 января 2021 г. Газ артериальной крови. [PubMed: 30725604]
- 3.
- Патель С., Шарма С. StatPearls [Интернет]. StatPearls Publishing; Остров сокровищ (Флорида): 24 июня 2021 г. Респираторный ацидоз. [PubMed: 29494037]
- 4.
- Бринкман Дж. Э., Шарма С. StatPearls [Интернет].StatPearls Publishing; Остров сокровищ (Флорида): 26 июля 2020 г. Физиология, метаболический алкалоз. [PubMed: 29493916]
- 5.
- Бринкман Дж. Э., Шарма С. StatPearls [Интернет]. StatPearls Publishing; Остров сокровищ (Флорида): 26 июля 2020 г. Респираторный алкалоз. [PubMed: 29489286]
- 6.
- Rajkumar P, Pluznick JL. Кислотно-щелочная регуляция в проксимальных канальцах почек: использование новых датчиков pH для поддержания гомеостаза. Am J Physiol Renal Physiol. 01 ноября 2018; 315 (5): F1187-F1190.[Бесплатная статья PMC: PMC6293293] [PubMed: 30066586]
- 7.
- Burger MK, Schaller DJ. StatPearls [Интернет]. StatPearls Publishing; Остров сокровищ (Флорида): 20 ноября 2020 г. Метаболический ацидоз. [PubMed: 29489167]
- 8.
- Марано М. [Об использовании формулы Винтерса при хроническом метаболическом ацидозе]. Преподобный Псикиатр Салуд Мент. 2015, январь-март; 8 (1): 45-6. [PubMed: 25434279]
- 9.
- Беренд К. Обзор диагностической оценки метаболического ацидоза с нормальным анионным зазором.Почки Дис (Базель). 2017 декабрь; 3 (4): 149-159. [Бесплатная статья PMC: PMC5757610] [PubMed: 29344509]
- 10.
- Шарма С., Хашми М.Ф., Аггарвал С. StatPearls [Интернет]. StatPearls Publishing; Остров сокровищ (Флорида): 20 мая 2021 г. Гиперхлоремический ацидоз. [PubMed: 29493965]
- 11.
- Raphael KL, Ix JH. Корреляция уровня аммония в моче и осмоляльного разрыва мочи у реципиентов трансплантата почки. Clin J Am Soc Nephrol. 2018 Апрель 06; 13 (4): 638-640. [Бесплатная статья PMC: PMC5969467] [PubMed: 29519951]
pH крови – обзор
3 Изменения pH крови, электролитов и почечная недостаточность
Нарушения pH крови, как ацидоз, так и алкалоз, могут быть связаны с повышением аммиака в крови и головном мозге.Таким образом, ацидоз вызывает повышение уровня аммиака, стимулируя выработку аммиака в почках (где он вырабатывается для устранения H + ) (Richterich and Goldstein, 1958). Алкалоз вместо того, чтобы вызывать повышение уровня аммиака в крови, вместо этого вызывает повышенную диффузию аммиака из крови в мозг за счет преобразования недиффузной ионной формы в гораздо более диффузионный газообразный аммиак (Warren, 1958).
Гипокалиемия, обычно вызываемая применением диуретиков для лечения асцита, обычно связана с ухудшением HE (Sherlock, 1975).Здесь есть несколько механизмов. ( и ) Увеличивается производство аммиака почками (Габузда и Холл, 1966, Шир и Габузда, 1970). ( b ) Гипокалиемия приводит к внеклеточному алкалозу и внутриклеточному ацидозу, создавая градиент pH, который способствует внутриклеточной диффузии и захвату NH 4 + (Warren and Nathan, 1958). ( c ) Может существовать конкуренция K + с NH 4 + для внутриклеточного (глиального) транспорта (Tower et al., 1961; Quastel, 1979). Следовательно, уменьшение K + может позволить большему количеству NH 4 + попасть в ячейки. ( d ) Среда с дефицитом K + приводит к увеличению продукции аммиака в срезах мозга (Рыбова, 1959), тогда как увеличение K + приводит к уменьшению образования аммиака (Vrba et al., 1958). ( e ) Митохондрии печени, суспендированные в среде с дефицитом K + , не превращают аммиак в глутамин с нормальной скоростью (Gumucio et al., 1968). ( f ) Если аминокислотные нейротрансмиттеры участвуют в HE (как обсуждалось выше), аномалии K + могут нарушать поглощение и высвобождение этих аминокислот (Quastel, 1979).
Гипонатриемия также связана с обострением HE (Sherlock et al., 1966; Steigman and Clowdus, 1971), хотя механизм ее действия неизвестен.
Заболевание почек (к сожалению, нередкое осложнение) может усугубить ПЭ за счет собственных энцефалопатических эффектов.Кроме того, ассоциированная азотемия способствует гипераммониемии из-за гидролиза мочевины кишечными бактериями (Webster and Gabuzda, 1959).
Введение в кислотно-щелочной баланс в медицине и болезнях
Нормальный метаболизм клеток зависит от поддержания pH в крови. в очень узких пределах (7,35-7,45).
Даже относительно мягкий экскурсии за пределы этого нормального диапазона pH могут иметь пагубные эффекты, в том числе снижение доставки кислорода к тканям, электролит нарушения и изменения сократимости сердечной мышцы; выживание редко, если pH крови падает ниже 6.8 или выше 7,8.
Проблема для организма в том, что нормальный обмен веществ связан с непрерывное производство ионов водорода (H +) и углекислого газа (CO 2 ), оба из которых имеют тенденцию к снижению pH. Механизм который решает эту проблему и служит для поддержания нормального pH крови (т.е. сохранение кислотно-щелочного гомеостаза) представляет собой сложную синергию действие с участием химических буферов в крови, эритроцитов (эритроциты), которые циркулируют в крови, и функция трех органы: легкие, почки и мозг.
Прежде чем объяснять, как эти пять элементы способствуют общему поддержанию pH крови, это было бы полезно быстро просмотреть некоторые основные концепции.
Что такое кислота, что такое щелочь и что такое pH?
Кислота – это вещество, выделяющее ионы водорода (H + ) при диссоциации в растворе.
Например: соляная кислота (HCl) диссоциирует до водорода. ионы и хлорид-ионы
HCl H + + Cl –
Угольная кислота (H 2 CO 3 ) диссоциирует до ионы водорода и бикарбонат-ионы
H 2 CO 3 H + + HCO 3 –
Мы различаем сильные кислоты, такие как соляная кислота и слабые кислоты, такие как угольная кислота.Разница в том, что сильные кислоты диссоциируют больше, чем слабые кислоты. Следовательно, ион водорода концентрация сильной кислоты намного выше, чем у слабой кислота.
A base – это вещество, которое в растворе принимает ионы водорода.
Например, основной бикарбонат (HCO 3 – ) принимает ионы водорода с образованием угольной кислоты:
HCO 3 – + H + H 2 CO 3
pH – это шкала кислотности и щелочности от 0 до 14.Чистая вода имеет pH 7 и нейтральный (ни кислый, ни щелочной). pH выше 7 является щелочным и ниже 7 кислым. Таким образом, pH крови (7,35-7,45) составляет слабощелочной, хотя в клинической медицине термин алкалоз возможно, что сбивает с толку, зарезервирован для pH крови выше 7,45 а термин ацидоз используется для обозначения pH крови менее 7,35.
pH – это мера концентрации ионов водорода (H + ). Эти двое связаны следующим образом уравнение:
pH = – лог 10 [H + ]
где [H + ] – концентрация ионов водорода в моль на литр (моль / л)
Из этого уравнения
pH 7.4 = H + концентрация 40 нмоль / л
pH 7,0 = H + концентрация 100 нмоль / л
pH 6,0 = H + концентрация 1000 нмоль / л
Понятно, что:
- два параметра изменяются обратно пропорционально; как ион водорода концентрация увеличивается, pH падает
- из-за логарифмической связи большое изменение Концентрация водородных ионов – это на самом деле небольшое изменение pH. Например, удвоение концентрации ионов водорода вызывает pH упасть всего на 0.3
Что такое буфер? – бикарбонатная буферная система
Буферы – это химические вещества в растворе, которые минимизируют изменение pH, которое происходит, когда кислоты добавляются путем «вытирания» ионы водорода. Буфер – это раствор слабой кислоты и ее сопряженное основание. В крови основная буферная система – слабая кислота, угольная кислота (H 2 CO 3 ) и ее конъюгат основа, бикарбонат (HCO 3 – ). Чтобы объяснить, как эта система сводит к минимуму изменения pH, предположим, мы добавляем сильную кислоту, е.грамм. HCl, к бикарбонатному буферу:
Кислота диссоциирует, высвобождая ионы водорода:
HCl H + + Класс –
Затем бикарбонатный буфер «поглощает» ионы водорода, образуя угольная кислота в процессе:
HCO 3 – + H + H 2 CO 3 (угольная кислота)
Важным моментом является то, что, поскольку ионы водорода из HCl были включены в слабую угольную кислоту, которая не диссоциировать так же легко, общее количество ионов водорода в растворе и, следовательно, pH не изменится так сильно, как это могло бы произойти. при отсутствии буфера.
Хотя буфер значительно минимизирует изменение pH, это не устраняет его, потому что даже слабая кислота (например, угольная кислота) до некоторой степени диссоциирует. PH буфера раствор является функцией относительных концентраций слабых кислота и сопряженное с ней основание.
pH = 6,1 + log ([HCO 3 – ] / [H 2 CO 3 ])
Где [HCO 3 – ] = концентрация бикарбонат
[H 2 CO 3 ] = концентрация угольной кислоты
Это соотношение, известное как уравнение Хендерсона-Хассельбаха, показывает, что pH регулируется соотношением оснований (HCO 3 – ) концентрация в кислоте (H 2 CO 3 ) концентрации.
По мере добавления ионов водорода в бикарбонатный буфер:
H + + HCO 3 – H 2 CO 3
бикарбоната (основания) расходуется (концентрация снижается) и образуется угольная кислота (концентрация увеличивается). Если водород ионы продолжают добавляться, весь бикарбонат в конечном итоге будет потребляется (превращается в угольную кислоту), и не будет буферный эффект – pH резко упадет, если будет больше кислоты добавлен.
Однако, если угольная кислота могла быть непрерывно удалена из система и бикарбонат постоянно регенерируются, затем буферная способность и, следовательно, pH может поддерживаться, несмотря на продолжение добавления ионов водорода.
Как станет ясно при более детальном рассмотрении физиологии кислотно-щелочной баланс, то есть, по сути, то, что происходит в организме. В сущность, легкие обеспечивают удаление угольной кислоты (в виде углерода диоксид) и почки обеспечивают постоянную регенерацию бикарбонат.
Эта роль легких зависит от единственного характеристика системы буферизации бикарбоната, и это способность угольной кислоты превращаться в диоксид углерода и воды.
Следующее уравнение описывает взаимосвязь всех элементы системы буферизации бикарбоната, как она работает в кузов
H + + HCO 3 – H 2 CO 3 H 2 O + CO 2
Важно отметить, что реакции обратимы.Направление зависит от относительной концентрации каждого элемент. Так что, например, повышение углекислого газа концентрация сил реакция влево с усилением образования угольной кислоты и в конечном итоге ионов водорода.
Это объясняет кислотный потенциал углекислого газа и подводит нас к важному вклад легких и эритроцитов в общую кислотно-щелочную остаток средств.
Функция легких, перенос CO
2 и кислотно-щелочной балансПостоянное количество CO 2 в крови, необходимое для нормального кислотно-щелочной баланс, отражает баланс между результат метаболизма тканевых клеток и выводится из легких в выдыхаемый воздух.
Путем изменения скорости, с которой углекислый газ выводятся из организма, легкие регулируют содержание углекислого газа в крови. Последовательность событий от производства углекислого газа в удаление тканей в выдыхаемом воздухе показано на рис.1. Углекислый газ диффундирует из клеток ткани в окружающую среду. капиллярная кровь (рис. 1а). Небольшая часть растворяется в крови плазма и в неизмененном виде транспортируется в легкие.
Но чаще всего рассеивается в эритроциты, где он соединяется с водой с образованием угольной кислоты.Кислота диссоциирует с образованием ионов водорода и бикарбонат. Ионы водорода соединяются с деоксигенированным гемоглобином. (гемоглобин здесь действует как буфер), предотвращая опасное падает в клеточном pH, и бикарбонат диффундирует по концентрации градиент от эритроцитов к плазме.
Таким образом, большая часть углекислого газа вырабатывается в тканях, переносится в легкие в виде бикарбоната в плазме крови.
Рис. 1a . CO 2 производится в тканях превращается в бикарбонат для переноса в легкие.
|
Рис. 1b .В легких преобразуется бикарбонат обратно к CO 2 и устраняется легкими.
В альвеолах легких процесс обратный (рис. 1б). Ионы водорода вытесняются из гемоглобина, поскольку он поглощает кислород. из вдыхаемого воздуха. Ионы водорода теперь буферизированы бикарбонат, который диффундирует из плазмы обратно в эритроциты, и образуется угольная кислота. По мере того, как концентрация этого повышается, это превращается в воду и углекислый газ. Наконец, углекислый газ диффундирует вниз по градиенту концентрации от эритроцитов к альвеолам для выделение с выдыхаемым воздухом.
Респираторные хеморецепторы ствола головного мозга реагируют на изменения в концентрации углекислого газа в крови, вызывая повышенное вентиляция (дыхание) при повышении концентрации углекислого газа и снижение вентиляции при падении углекислого газа.
Почки и кислотно-щелочной баланс
Нормальный клеточный метаболизм приводит к постоянному производство ионов водорода. Мы видели это, объединив с эти ионы водорода, бикарбонатный буфер в крови сводит к минимуму их эффект.Однако буферизация полезна только в краткосрочной перспективе, и в конечном итоге ионы водорода должны быть удалены из организма. Кроме того, важно, чтобы бикарбонат, используемый для буферные ионы водорода непрерывно заменяются.
Эти две задачи, устранение ионов водорода и регенерация бикарбоната, являются осуществляется почками. Клетки почечных канальцев богаты фермент карбоангидраза, который способствует образованию углекислого кислота из углекислого газа и воды. Угольная кислота диссоциирует на бикарбонат и ионы водорода.Бикарбонат реабсорбируется в кровь и ионы водорода переходят в просвет канальца и выводятся из организма с мочой.
Это выведение с мочой зависит от наличия в моче буферов, в основном ионы фосфата и аммиака.
НАРУШЕНИЯ КИСЛОТНО-ОСНОВНОГО БАЛАНСА
Большинство кислотно-щелочных нарушений возникает из-за
- Заболевание или повреждение органов (почки, легкие, мозг), чьи нормальное функционирование необходимо для кислотно-щелочного гомеостаза,
- болезнь, которая вызывает аномально повышенное производство метаболические кислоты такие, что гомеостатические механизмы подавлен
- медицинское вмешательство (e.грамм. механическая вентиляция, некоторые наркотики)
Газы артериальной крови – это анализ крови, используемый для определения и следить за кислотно-щелочными нарушениями. Три параметра, измеренные во время анализ газов крови, pH (pH) артериальной крови, парциальное давление углекислый газ в артериальной крови ( p CO 2 (a)) и концентрация бикарбоната (HCO 3 – ) составляет решающее значение (см. Таблицу I для справочного (нормального) диапазона). Результаты этих трех позволяют классифицировать кислотно-основные нарушение одной из четырех этиологических категорий:
- Респираторный ацидоз
- Респираторный алкалоз
- Метаболический ацидоз
- Метаболический алкалоз
Взрослые | Новорожденные | |
pH | 7.35-7.45 | 7.30-7.40 |
p CO 2 (кПа) | 4,7-6,0 | 3,5–5,4 |
Бикарбонат (ммоль / л) | 22-28 | 15-25 |
ТАБЛИЦА I. Примерное эталонное (нормальное) диапазоны
Чтобы понять, как результаты pH, p CO 2 (а) и бикарбонат используются для классификации кислотно-основных нарушений в этом Кстати, мы должны вернуться к уравнению Хендерсона-Хассельбаха
pH = 6,1 + log ([HCO 3 – ] / [H 2 CO 3 ])
Мы измеряем pH и бикарбонат, но не угольную кислоту (H 2 CO 3 ). Однако есть связь между p CO 2 (a) и H 2 CO 3 что позволяет переформулировать уравнение Хендерсона-Хассельбаха в условия трех параметров (pH, p CO 2 (a) и бикарбонат), измеренный во время анализа газов крови:
pH = 6.1 + журнал ([HCO 3 – ] / ( п CO 2 (а) × 0,23))
Удалив все константы из этого уравнения, соотношение между тремя измеряемыми параметрами может быть проще заявлено:
pH ∝ [HCO 3 – ] / p CO 2 (а)
Эти отношения имеют решающее значение для понимания всего этого. следует относительно нарушения кислотно-щелочного баланса, заявляет, что артериальный pH крови пропорционален соотношению концентраций бикарбоната к p CO 2 (a).Это позволяет отчисления:
- pH остается нормальным, пока соотношение [HCO 3 –]: p CO 2 (a) остается нормальным
- pH увеличивается (т.е. возникает алкалоз), если либо [HCO 3 –] увеличивается или p CO 2 (а) уменьшается.
- pH снижается (т.е. возникает ацидоз), если либо [HCO 3 – ] уменьшается или p CO 2 (a) увеличивается
- Если оба p CO 2 (a) и [HCO 3 – ] увеличиваются относительно такое же количество, соотношение и, следовательно, pH в норме
- Если оба p CO 2 (a) и [HCO 3 –] являются уменьшились примерно на такую же величину, соотношение и следовательно, pH в норме.
Кислотно-основные нарушения влияют в первую очередь p CO 2 (a), в этом случае он называется респираторное нарушение, или [HCO 3 –], в этом случае он называется не респираторные или метаболические нарушение:
- Если основная помеха – повышенная p CO 2 (a) (вызывающий ацидоз – см. выше), состояние называется респираторный ацидоз
- Если основное возмущение снижено p CO 2 (a) (вызывающий алкалоз – см. выше), состояние называется респираторный алкалоз
- Если первичное нарушение связано с уменьшенным бикарбонат (который приводит к ацидозу – см. выше), состояние называется метаболическим ацидоз
- Если первичное нарушение связано с повышенным бикарбонат (который приводит к алкалозу – см. выше), состояние называется метаболическим алкалоз
Причины кислотно-щелочных нарушений
Респираторный ацидоз – (повышенный
p CO 2 (a), пониженный pH)Респираторный ацидоз характеризуется повышенным p CO 2 (a) из-за неадекватной альвеолярной вентиляции (гиповентиляция) и, как следствие, снижение выведения CO 2 из крови.Респираторные заболевания, такие как бронхопневмония, эмфизема, астма и хроническая обструкция дыхательных путей болезнь, все может быть связано с гиповентиляцией, достаточной для вызывают респираторный ацидоз.
Некоторые наркотики (например, морфин и барбитураты) могут вызывать респираторный ацидоз, подавляя дыхательный центр в головном мозге. Повреждение или травма грудной клетки и мускулатура, участвующая в механике дыхания, может снизить скорость вентиляции. Это объясняет респираторный ацидоз. которые могут осложнить течение таких заболеваний, как полиомиелит, Синдром Гийена-Барре и восстановление после тяжелой травмы грудной клетки.
Респираторный алкалоз – (сниженный
p CO 2 (а), повышенный pH)Напротив, респираторный алкалоз характеризуется уменьшением p CO 2 (a) из-за чрезмерной альвеолярной вентиляции и, как следствие, чрезмерное удаление CO 2 из крови. Заболевание, при котором из-за пониженного содержания кислорода в крови (гипоксемия) дыхательный центр стимулируется может привести к респираторному алкалоз.
Примеры включают тяжелую анемию, тромбоэмболию легочной артерии. и респираторный синдром взрослых.Гипервентиляции, достаточной для вызывать респираторный алкалоз может быть признаком приступов паники и реакция на сильную боль. Одно из наименее желанных свойств салицилат (аспирин) оказывает стимулирующее действие на дыхательные пути. центр. Этот эффект объясняет респираторный алкалоз, который возникает после передозировки салицилатом. Наконец, чрезмерный энтузиазм искусственная вентиляция легких может вызвать респираторный алкалоз.
Метаболический ацидоз – (уменьшено HCO
3 – , пониженный pH)Сниженный уровень бикарбоната всегда является признаком метаболизма. ацидоз.Это происходит по одной из двух причин: более частое использование бикарбонат для буферизации аномальной кислотной нагрузки или повышенных потерь гидрокарбоната из организма. Диабетический кетоацидоз и молочный ацидоз – это два состояния, характеризующихся перепроизводством метаболические кислоты и последующее истощение бикарбоната.
В первый случай, аномально высокая концентрация кетокислот в крови (b-гидроксимасляная кислота и ацетоуксусная кислота) отражают тяжелые метаболические нарушения, вызванные инсулином дефицит.
Все клетки производят молочную кислоту, если они испытывают недостаток кислорода, так увеличилось производство молочной кислоты и, как следствие, метаболизм ацидоз возникает в любом состоянии, при котором доставка кислорода к ткани серьезно нарушены.
Примеры включают остановку сердца. и любое состояние, связанное с гиповолемическим шоком (например, массивный потеря жидкости). Печень играет важную роль в удалении мелких количество молочной кислоты, которая вырабатывается в нормальных клетках метаболизм, так что лактоацидоз может быть признаком печени отказ.
Аномальная потеря бикарбоната из организма может произойти во время сильный понос. Если этот параметр не отмечен, это может привести к метаболическому ацидозу. Неспособность регенерировать бикарбонат и выводить ионы водорода объясняет метаболический ацидоз, возникающий в почечной отказ.
Метаболический алкалоз – (повышенный HCO
3 – , повышенный pH)Бикарбонат всегда повышен при метаболическом алкалозе. Редко, чрезмерное введение бикарбоната или проглатывание бикарбоната в антацидном препарате может вызвать метаболический алкалоз, но это обычно преходящий.Аномальная потеря ионов водорода из организма может быть главной проблемой. Бикарбонат, который иначе был бы расходуется на буферизацию этих потерянных ионов водорода, следовательно, накапливается в крови. Желудочный сок кислый и желудочный. аспирация или любой болезненный процесс, при котором содержимое желудка потеря из организма представляет собой потерю ионов водорода.
метательная рвота желудочным соком, например, объясняет метаболический алкалоз, который может возникать у пациентов с пилорическим стеноз. Сильное истощение калия может вызвать метаболический алкалоз. из-за взаимного отношения между водородом и калием ионы.
Компенсация – следствие кислотно-щелочного нарушение
Для жизни жизненно важно, чтобы pH не уходил слишком далеко от нормы, и организм всегда будет пытаться вернуть аномальный pH в сторону в норме при нарушении кислотно-щелочного баланса. Компенсация – это название, данное этому процессу сохранения жизни. Понять компенсации, важно помнить, что pH регулируется соотношение [HCO 3 – ]: p CO 2 (а). Пока соотношение нормальное, pH будет нормальным.
Рассмотрим пациента с метаболическим ацидозом с низким pH. потому что уровень бикарбоната [HCO 3 – ] низкий. К компенсировать низкий [HCO 3 – ] и восстановить крайне важное отношение к норме, пациент должен снизить его p CO 2 (а). Хеморецепторы в дыхательных путях центр мозга реагирует на повышение концентрации ионов водорода (низкий pH), вызывая усиление вентиляции (гипервентиляцию) и тем самым повышается выведение углекислого газа; в p CO 2 (а) падает и отношение [HCO 3 –]: p CO 2 (a) возврат в сторону нормального.
Компенсация метаболического алкалоза, при котором [HCO 3 –] высокий, напротив, предполагает угнетение дыхания и, как следствие, задержка углекислого газа так что p CO 2 (a) повышается, чтобы соответствовать увеличению в [HCO 3 – ]. Однако депрессия дыхание имеет нежелательный побочный эффект, угрожающий адекватным оксигенация тканей. По этой причине респираторная компенсация метаболический алкалоз ограничен.
Первичные нарушения p CO 2 (а) (респираторные ацидоз и алкалоз) компенсируются почечной коррекцией экскреция ионов водорода, что приводит к изменению [HCO 3 –], которые надлежащим образом компенсируют первичное изменение p CO 2 (а).Таким образом, почечная компенсация респираторного ацидоза (повышенная p CO 2 (a)) включает повышенную реабсорбцию бикарбонат и почечная компенсация респираторного алкалоза (пониженный p CO 2 (a)) включает восстановленный бикарбонат реабсорбция.
Концепция кислотно-щелочного баланса при компенсации визуально представлена на рис. 2. В таблице II приведены газы крови. результаты, которые характеризуют все четыре кислотно-щелочных нарушения до и после компенсации.
Фиг.2 . «Кислотно-щелочной баланс»: компенсация восстанавливает нормальный pH
Первичный нарушение | ||||
Респираторный ацидоз первичный прибавка дюйм p CO 2 | Репираторный алкалоз первичный уменьшение дюйм p CO 2 | метаболический ацидоз первичный уменьшение из бикарбоната. | метаболический алкалоз первичный прибавка из бикарбоната. | |
Некоторые общий причины | Эмфизема ХОБЛ Пневмония Депрессия репираторных центр | гипер- вентиляция Беспокойство атаки Стимуляция мозга респираторный центр | Почечная недостаточность Диабетик кетоацидоз Циркуляционный отказ – клинический шок (молочная ацидоз) | Бикарбонат адми- стр. Калий истощение |
Компен- сатори механизм | RENAL прибавка бикарбонат | RENAL уменьшение бикарбонат | РЕСПИРА- ТОРИ уменьшение p CO 2 | РЕСПИРА- ТОРИ прибавка p CO 2 но ограничено компенсация sation в метаболическом алкалоз |
Начальная кровь газ результаты (без компенсации насыщенный) | pH уменьшено p CO 2 увеличено Бикарбонат нормальный | pH увеличено p CO 2 уменьшено Бикарбонат нормальный | pH уменьшено p CO 2 нормальный Бикарбонат уменьшено | pH увеличено p CO 2 нормальный Бикарбонат увеличено |
Газ крови результаты после частичное компенсация станция | pH уменьшено но ближе к нормальному p CO 2 увеличено Бикарбонат увеличено | pH увеличено но ближе к нормальному p CO 2 уменьшено Бикарбонат незначительно уменьшено | pH уменьшено но ближе к нормальный p CO 2 незначительно уменьшено Бикарбонат уменьшено | Limited компенсация сация в метаболический алкалоз |
Газ крови результаты после полный компенсация станция | pH нормальный p CO 2 увеличено Бикарбонат увеличено | pH нормальный p CO 2 уменьшено Бикарбонат уменьшено | pH нормальный p CO 2 уменьшено Бикарбонат уменьшено | Limited компенсация сация в метаболический алкалоз |
Печать дружественная версия таблицы, pdf.
ТАБЛИЦА II . Газы крови вызывают нарушения кислотно-щелочной баланс
Респираторная компенсация первичного метаболического нарушения происходит гораздо быстрее, чем метаболическая (почечная) компенсация первичное респираторное нарушение. Во втором случае компенсация происходит в течение нескольких дней, а не часов.
Если компенсация приводит к возвращение pH к норме, тогда пациент считается полностью компенсировано . Но во многих случаях компенсация возвращает pH. к нормальному без реального достижения нормальности; в таких случаях пациент получил частичную компенсацию .
Для по причинам, описанным выше, метаболический алкалоз очень редко полностью компенсируется.
Смешанные кислотно-щелочные возмущения
Из приведенного выше обсуждения можно было бы предположить, что все пациенты с кислотно-щелочным нарушением страдают только одним из четыре категории кислотно-щелочного баланса. Это вполне может быть так, но в определенных обстоятельствах пациенты могут иметь более одно нарушение.
Например, рассмотрим пациента с хроническим заболевание легких, такое как эмфизема, которая имеет давнюю частичную компенсированный респираторный ацидоз.Если бы этот пациент также был диабетик, который не принял нормальную дозу инсулина, и в результате находился в состоянии диабетического кетоацидоза, результаты анализа газов крови отражают комбинированный эффект респираторного ацидоза и Метаболический ацидоз.
Такие смешанные кислотно-щелочные возмущения не являются нечасто и может быть трудно распутать на основании артериального только результаты анализа газов крови.
Сводка
Поддержание нормального pH крови требует участия нескольких систем органов. и зависит от целостности кровообращения.Тогда это не удивительно что нарушение кислотно-щелочного баланса может осложнить течение широко различные заболевания, а также травмы многих частей тело. Организм обладает значительной способностью сохранять pH крови и нарушения обычно подразумевают либо тяжелое хроническое заболевание, либо острое критических заболеваний.
Результаты анализа газов артериальной крови могут выявить кислотно-щелочные нарушения и предоставить ценную информацию в виде к его причине.
Некоторые предлагали дальнейшие чтение
- Томсон WST, Адамс Дж. Ф., Коуэн, РА.Клиническая кислотно-щелочная остаток средств. Оксфорд: Oxford Medical Publications 1997
- Харрисон РА. Кислотно-щелочной баланс. Respir Care Clin, Северная Америка 1995; 1,1: 7-21
- Woodrow P. Анализ газов артериальной крови. Стандарт сестринского дела 2004; 18,21: 45-52
- Sirker AA, Rhodes A, Gounds RM, Bennet ED. Кислотно-основной физиология: «традиционный» и «современный» подход. Анестезия 2002; 57: 348-56
Шкала pH – Chemistry LibreTexts
Цели обучения
- Для определения шкалы pH как меры кислотности раствора
- Расскажите о происхождении и логике использования шкалы pH.
- Примените ту же стратегию для представления других типов величин, таких как p K a , p K b , p K w . {-} (aq)} \ label {1} \]
Это также называется самоионизацией воды.{+}} \). Объединение уравнений \ ref {4a} – \ ref {4c} и \ ref {4e} приводит к следующему важному соотношению:
\ [pK_w = pH + pOH = 14 \ label {5b} \]
Уравнение \ ref {5b} верно только при комнатной температуре, так как изменение температуры изменит \ (K_w \).
Шкала pH является логарифмической, что означает, что увеличение или уменьшение целочисленного значения изменяет концентрацию в десять раз. Например, pH 3 в десять раз более кислый, чем pH 4. Точно так же pH 3 в сто раз более кислый, чем pH 5.+] = 1.0} \), pH = 0. Мы редко говорим, что pH равен 0, и поэтому вы считаете pH = 0 таким странным выражением. PH = -0,30 эквивалентен \ (\ ce {[H +]} \) 2,0 М. Отрицательные значения pH предназначены только для академических упражнений. Прямое использование концентраций дает более четкое представление, чем шкалы pH.
- Шкала pH расширяет деление между нулем и 1 в линейной шкале или компактной шкале в крупную шкалу для целей сравнения. В математике вы узнали, что существует бесконечное количество значений от 0 до 1 или от 0 до 0.1, или от 0 до 0,01, или от 0 до любого небольшого значения. Использование логарифмической шкалы, безусловно, преобразует бесконечно малые количества в бесконечно большие количества.
- Нелинейность шкалы pH с точки зрения \ (\ ce {[H +]} \) легко проиллюстрировать, посмотрев на соответствующие значения pH между 0,1 и 0,9 следующим образом:
| pH | 0 | 0,1 | 0,2 | 0.3 | 0,4 | 0,5 | 0,6 | 0,7 | 0,8 | 0,9 |
|---|---|---|---|---|---|---|---|---|---|---|
| [H + ] | 1 | 0,79 | 0,63 | 0,50 | 0,40 | 0,32 | 0,25 | 0,20 | 0.16 | 0,13 |
- Поскольку отрицательный логарифм \ (\ ce {[H +]} \) используется в шкале pH, шкала pH обычно имеет положительные значения. Кроме того, чем больше pH, тем меньше \ (\ ce {[H +]} \).
Эффективный диапазон шкалы pH
Часто утверждают, что шкала pH находится в диапазоне от 0 до 14 или, возможно, от 1 до 14, но ни то, ни другое не является правильным. Диапазон pH не имеет верхней или нижней границы, поскольку, как определено выше, pH является показателем концентрации H + .Например, при pH, равном нулю, концентрация иона гидроксония составляет один молярный, а при pH 14 концентрация гидроксид-иона составляет один молярный. Обычно концентрации H + в воде в большинстве растворов находятся в диапазоне от 1 M (pH = 0) до 10 -14 M (pH = 14). Следовательно, диапазон от 0 до 14 обеспечивает разумную (но не абсолютную) подставку для шкалы. В воде можно опуститься несколько ниже нуля и несколько выше 14, потому что концентрация ионов гидроксония или гидроксид-ионов может превышать один молярный. + \)?
Решение
Мы можем принять комнатную температуру, поэтому
\ [1.{-8} M \ nonumber \]
Подсказка
Поместите -7,84 в свой калькулятор и возьмите антилогарифм (часто обратный логарифм или 10 x ) = 1,45 x 10 -8 M
Правильное определение pH
Шкала pH была впервые введена датским биохимиком S.P.L. Соренсоном в 1909 году, используя обозначение p H . Буква p происходит от немецкого слова Potenz , означающего степень или показатель степени, в данном случае 10.{+}} \) ion для большинства растворов Международный союз теоретической и прикладной химии (IUPAC) и Национальное бюро стандартов (NBS) определили pH как показания pH-метра, стандартизованные по стандартным буферам. Следующее уравнение используется для расчета pH всех растворов:
\ [\ begin {align} pH & = \ dfrac {F (E-E_ {standard})} {RT \; \ ln 10} + pH_ {standard} \ label {6a} \\ [4pt] & = \ dfrac {5039.879 (E-E_ {стандарт})} {T} + pH_ {стандарт} \ label {6b} \ end {align} \]
с
- \ (R \) – постоянная идеального газа,
- \ (F \) – постоянная Фарадея, а
- \ (T \) – абсолютная температура (в К)
Активность иона H + определяется с максимальной точностью для используемых стандартных растворов.Идентичность этих растворов варьируется от одного органа к другому, но все они дают одинаковые значения pH с точностью до ± 0,005 единицы pH. Историческое определение pH является правильным для тех растворов, которые настолько разбавлены и настолько чисты, что ионы H + не подвержены никакому влиянию, кроме молекул растворителя (обычно воды).
При измерении pH [H + ] выражается в молях H + на литр раствора. Это достаточно точное определение при низких концентрациях (предел разбавления) H + .При очень высоких концентрациях (например, 10 M хлористоводородная кислота или гидроксид натрия) значительная часть ионов будет связана в нейтральные пары, такие как H + Cl –, тем самым снижая концентрацию «доступных» ионов до меньшее значение, которое мы назовем эффективной концентрацией . Эффективная концентрация H + и OH – определяет pH и pOH. Показанная выше шкала pH иногда называется «шкалой концентраций pH» в отличие от «шкалы термодинамических pH».Основное различие между обеими шкалами состоит в том, что в термодинамической шкале pH интересует не концентрация H + , а активность H + . В растворе человек измеряет активность, а не концентрацию. Таким образом, реальные растворы описывает термодинамическая шкала pH, а не концентрационная.
Для растворов, в которых концентрация ионов не превышает 0,1 М, формулы pH = –log [H + ] и pOH = –log [OH – ] обычно надежны, но не ожидайте 10.+] \ label {8} \]
Расчет коэффициента активности требует детальных теорий взаимодействия заряженных частиц в растворе при высоких концентрациях (например, теория Дебая-Хюккеля). В большинстве растворов значение pH отличается от -log [H + ] первой десятичной точкой. В следующей таблице приведены экспериментально определенные значения pH для серии растворов HCl с возрастающей концентрацией при 25 ° C.
| Молярная концентрация \ (HCl \) | pH определяется как концентрация | pH, определенный экспериментально | Относительное отклонение |
|---|---|---|---|
| 0,00050 | 3.30 | 3,31 | 0,3% |
| 0,0100 | 2 | 2,04 | 1,9% |
| 0,100 | 1 | 1,10 | 9% |
| 0,40 | 0,39 | 0,52 | 25% |
| 7,6 | -0.88 | -1,85 | 52% |
В то время как шкала pH формально измеряет активность ионов водорода в веществе или растворе, она обычно приближается к концентрации ионов водорода; это приближение применимо только при низких концентрациях.
Живые системы
Молекулы, которые составляют или производятся живыми организмами, обычно функционируют в узком диапазоне pH (близком к нейтральному) и узком диапазоне температур (температура тела).Многие биологические растворы, например кровь, имеют pH, близкий к нейтральному. pH влияет на структуру и функцию многих ферментов (белковых катализаторов) в живых системах. Многие из этих ферментов имеют узкие диапазоны pH-активности. Клеточный pH настолько важен, что смерть может наступить в течение нескольких часов, если человек становится ацидозом (имеет повышенную кислотность в крови). Как видите, pH имеет решающее значение для жизни, биохимии и важных химических реакций. Ниже приведены общие примеры того, как pH играет очень важную роль в нашей повседневной жизни:
- Вода в бассейне поддерживается путем проверки ее pH.Кислые или основные химические вещества могут быть добавлены, если вода становится слишком кислой или слишком щелочной.
- Каждый раз, когда мы получаем изжогу, в желудке накапливается больше кислоты, что вызывает боль. Нам нужно принимать таблетки-антациды (основу), чтобы нейтрализовать избыток кислоты в желудке.
- pH крови слегка щелочной. Колебание pH крови может нанести серьезный вред жизненно важным органам тела.
- Определенные заболевания диагностируются только путем проверки pH крови и мочи.
- Некоторые культуры лучше развиваются при определенном диапазоне pH.
- Ферменты активируются в нашем организме при определенном pH.
| Отсек | pH |
|---|---|
| Желудочная кислота | 1 |
| Лизосомы | 4,5 |
| Гранулы хромаффинных клеток | 5.5 |
| Кожа человека | 5,5 |
| Моча | 6 |
| Нейтраль H 2 O при 37 ° C | 6,81 |
| Цитозоль | 7,2 |
| Цереброспинальная жидкость | 7,3 |
| Кровь | 7,43-7,45 |
| Митохондриальный матрикс | 7.- \).Решения
Список литературы
Авторы и авторство. |

 Те, у кого она пониженная, с легкостью употребят мякоть или сок лимона, так как это не вызовет у них неприятных ощущений. Еще как проверить кислотность желудка?
Те, у кого она пониженная, с легкостью употребят мякоть или сок лимона, так как это не вызовет у них неприятных ощущений. Еще как проверить кислотность желудка?
