Противовирусные препараты при ротавирусной инфекции у детей: Портал муниципальных образований РТ
Диагностика ротавирусной инфекции у детей
Диагностика ротавирусной инфекции
Для подтверждения ротавирусной инфекции используют молекулярно-генетические, серологические методы. Материалом для исследования служат фекалии. Исследования, направленные на обнаружение антигенов вируса или нуклеиновых кислот вирусов, желательно проводить в первые 4 дня болезни. Наиболее распространенный способ диагностики — обнаружение антигенов ротавируса в фекалиях с помощью иммуноферментного анализа (ИФА), реакции латекс-агглютинации (РЛА). В повседневной практике широко используется ПЦР-диагностика — полимеразная цепная реакция, которая относится к молекулярно-генетическим методам исследования. Существуют экспресс-тесты для выявления антигена ротавируса в фекалиях на основе иммунохроматографического метода (рота-тест).
Как лечить ротавирус у детей
Основа терапии и лечения острых кишечных инфекций — нормализация процессов, к нарушению которых привел возбудитель, микробные или вирусные токсины (воздействие на симптомы общей интоксикации, водно-электролитные нарушения, нарушение процессов пищеварения, изменения микробного пейзажа кишечника).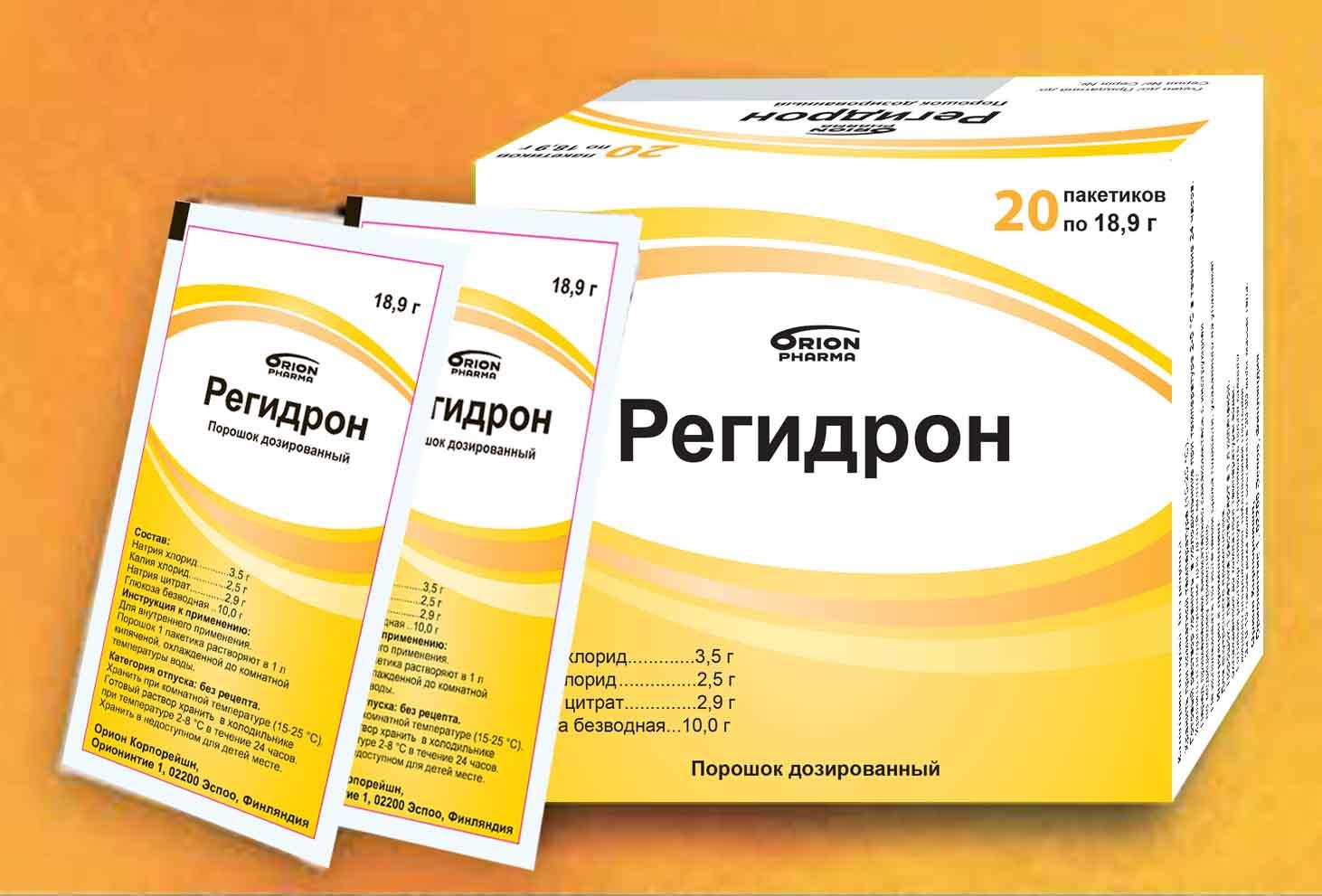
Еще до приезда врача родители могут оказать первую помощь заболевшему ребенку.
Начать ее необходимо со снижения температуры (если она выше 38,5 °С): раздеть ребенка, обтереть прохладной водой, можно поставить жаропонижающую свечу (на основе парацетамола) в прямую кишку (ректально) или, при отсутствии многократных рвот, перорально (через рот) дать средства на основе парацетамола или ибупрофена в виде сиропа или таблетки (растереть в порошок) в возрастной дозе.
Оральная регидратация
После оказания первой помощи необходимо приступить к оральной регидратации (отпаиванию или инфузионной терапии). Для оральной регидратации используются специальные глюкозо-солевые растворы (Хумана Электролит, Гидровит, ОРС-200, Супер-ОРС, Регидрон).
При отпаивании самым важным является дробность введения жидкости. Для этого родители должны набраться терпения и поить ребенка малыми порциями через 10–12 минут.
Для этого родители должны набраться терпения и поить ребенка малыми порциями через 10–12 минут.
Ребенку в возрасте до года за раз можно давать до 5 мл (1 чайная ложка) жидкости, от 1 до 3 лет — до 10 мл (2 чайных или 1 десертная ложка), более старшим детям — до 15 мл (1 столовая ложка). Жидкость ребенку нужно давать из ложки, можно вливать за щеку из шприца (разумеется, без иголки) или отливать необходимый разовый объем жидкости в маленький рожок. Не следует давать ребенку чашку с большим объемом жидкости, т. к. у малыша имеется жажда, самостоятельно он может выпить много жидкости (80–150 мл) и этим спровоцировать рвоту.
Следует знать, что оральную регидратацию проводить нельзя при: неукротимой рвоте, общем тяжелом состоянии ребенка и обезвоживании II–III степени, резком снижении выделения мочи (олигоанурии), что может быть проявлением острой почечной недостаточности. В этих случаях она неэффективна, и драгоценное время на оказание адекватной медицинской помощи будет упущено.
Диетотерапия и питание при ротавирусе
Рациональное питание, или диетотерапия является важнейшей частью лечения детей, переносящих острые кишечные инфекции, т. к. при неадекватном питании возможно формирование длительной диареи, развитие гипотрофии (снижения массы тела), синдрома мальабсорбции (нарушения переваривания и всасывания пищевых веществ) и т. п. Основой диетотерапии является рациональный режим питания и коррекция диеты в зависимости от фазы заболевания. Адекватный подбор питания и специальная диета при ротавирусе способствует повышению сопротивляемости организма и благоприятному исходу ОКИ.
Доказано, что даже при тяжелых формах кишечных инфекций основные функции кишечника сохраняются, а длительное нахождение ребенка без пищи (так называемые водно-чайные паузы, которые раньше широко практиковали в лечении кишечных инфекций за неимением информации о том, чем кормить ребенка при ротавирусе) приводит к задержке восстановительных процессов в слизистой оболочке желудочно-кишечного тракта, способствует развитию белково-калорийной недостаточности и снижению массы тела..gif)
Для детей первого года жизни, переносящих ОКИ, оптимальным видом пищи является грудное молоко, т. к. оно содержит огромное число защитных факторов (иммуноглобулин А, лизоцим, интерферон, лактоферрин, комплемент, бифидо- и лактобактерии и т. д.), чрезвычайно необходимых больному ребенку.
Ребенка необходимо чаще прикладывать к груди. Количество грудного молока, получаемого ребенком за одно кормление, можно контролировать, взвесив ребенка до начала кормления и после его завершения, высчитав разницу в массе тела, которая и будет являться количеством съеденного. В отдельных случаях ребенка можно кормить сцеженным грудным молоком.
№ регистрации | Название |
2747890 | СРЕДСТВО ДЛЯ СНИЖЕНИЯ РИСКА И ОБЛЕГЧЕНИЯ СИМПТОМОВ ЗАРАЖЕНИЯ БЕТА-КОРОНАВИРУСНОЙ ИНФЕКЦИЕЙ |
2747550 | СРЕДСТВО ДЛЯ ПРОФИЛАКТИКИ ИНТЕРСТИЦИАЛЬНОЙ ПНЕВМОНИИ |
2747467 | СПОСОБ ЗАЩИТЫ ОТ КОРОНАВИРУСНОЙ ИНФЕКЦИИ |
2747156 | СПОСОБ ЛЕЧЕНИЯ БОЛЬНЫХ С ХРОНИЧЕСКИМИ ЗАБОЛЕВАНИЯМИ ОРГАНОВ ДЫХАНИЯ |
2747408 | СПОСОБ КОМПЛЕКСНОГО ЛЕЧЕНИЯ НАРУШЕНИЯ ГЕМОДИНАМИКИ БУЛЬБАРНОЙ КОНЪЮНКТИВЫ У ЛИЦ, ПЕРЕНЕСШИХ COVID-19 АССОЦИИРОВАННУЮ ПНЕВМОНИЮ |
2747018 | ИНГИБИТОР РЕПЛИКАЦИИ КОРОНАВИРУСА SARS-COV-2 НА ОСНОВЕ МЕЛАНИНА ИЗ ГРИБА INONOTUS OBLIQUUS |
2746692 | НОВЫЕ СОСТАВЫ 2-(ИМИДАЗОЛ-4-ИЛ)-ЭТАНАМИДА ПЕНТАНДИОВОЙ-1,5 КИСЛОТЫ ДЛЯ ЛЕЧЕНИЯ И ПРОФИЛАКТИКИ ВИРУСНЫХ ЗАБОЛЕВАНИЙ |
2746161 | ФАРМАЦЕВТИЧЕСКИЙ НАБОР ДЛЯ КОМБИНИРОВАННОЙ ТЕРАПИИ COVID19 (SARSCOV2) И СПОСОБ ЕГО ПРИМЕНЕНИ |
2746362 | |
2745774 | СПОСОБ ЛЕЧЕНИЯ ПАЦИЕНТОВ С НОВОЙ КОРОНАВИРУСНОЙ ИНФЕКЦИЕЙ (COVID-19) |
2745986 | ПРОТИВОКОРОНАВИРУСНОЕ СРЕДСТВО ДЛЯ КОМБИНИРОВАННОЙ ТЕРАПИИ COVID-19 (SARS-COV-2) И СПОСОБ ЛЕЧЕНИЯ |
2745985 | АНТИКОРОНАВИРУСНЫЙ ТЕРАПЕВТИЧЕСКИЙ АГЕНТ – ЗАМЕЩЕННЫЙ 7-ГИДРОКСИ-3,4,12,12А-ТЕТРАГИДРО-1H-[1,4]ОКСАЗИНО[3,4-C]ПИРИДО[2,1-F][1,2,4]ТРИАЗИН-6,8-ДИОН ДЛЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ COVID-19 |
2745535 | СПОСОБ ЛЕЧЕНИЯ COVID19 ПНЕВМОНИИ |
2744429 | ПРОТИВО-РНК ВИРУСНОЕ, В ТОМ ЧИСЛЕ ПРОТИВОКОРОНАВИРУСНОЕ СРЕДСТВО – ЗАМЕЩЕННЫЙ ХИНОКСАЛИН, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И ПРИМЕНЕНИЯ |
2744274 | МОНОКЛОНАЛЬНОЕ АНТИТЕЛО К RBD ФРАГМЕНТУ В СОСТАВЕ S БЕЛКА ВИРУСА SARS-COV-2 |
2742505 | АЭРОЗОЛЬ ДЛЯ ИНВАЗИВНОЙ МЕХАНИЧЕСКОЙ ВЕНТИЛЯЦИИ ЛЕГКИХ ПРИ COVID-19 |
2741714 | ИНГИБИТОР РЕПЛИКАЦИИ КОРОНАВИРУСА SARS-COV-2 НА ОСНОВЕ ВОДНОГО ЭКСТРАКТА ГРИБА INONOTUS OBLIQUUS |
2742116 | ПРОТИВОКОРОНАВИРУСНОЕ СРЕДСТВО ДЛЯ КОМБИНИРОВАННОЙ ТЕРАПИИ COVID-19 |
2741502 | СПОСОБ ПОЛУЧЕНИЯ НАТРИЕВОЙ СОЛИ 2МЕТИЛТИО6НИТРО1,24ТРИАЗОЛО[5,1С]1,2,4ТРИАЗИН7ОНА, ДИГИДРАТА, ОБЛАДАЮЩЕЙ ПРОТИВОВИРУСНОЙ АКТИВНОСТЬЮ, И ЕЕ ПРИМЕНЕНИЕ ДЛЯ ЛЕЧЕНИЯ КОРОНАВИРУСНОЙ ИНФЕКЦИИ COVID19 |
2739212 | ПРЕПАРАТ ДЛЯ КОМПЛЕКСНОЙ ТЕРАПИИ ЗАБОЛЕВАНИЙ, ВЫЗВАННЫХ БЕТА-КОРОНАВИРУСАМИ |
2738686 | СПОСОБ СНИЖЕНИЯ ТЯЖЕСТИ ГИПОКСИИ У ПАЦИЕНТОВ С КОРОНАВИРУСОМ, НАХОДЯЩИХСЯ НА ИВЛ |
2738719 | СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ КОРОНАВИРУСНЫХ, РЕТРОВИРУСНЫХ ИНФЕКЦИЙ И ГЕПАТИТА С |
2366411 | ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ |
2654482 | КОМПОЗИЦИИ И СПОСОБЫ ИНГИБИРОВАНИЯ ВИРУСНОЙ ПОЛИМЕРАЗЫ |
2622640 | СЕЛЕКТИВНЫЕ И ОБРАТИМЫЕ ИНГИБИТОРЫ УБИХИТИН-СПЕЦИФИЧЕСКОЙ ПРОТЕАЗЫ 7 |
2718690 | СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ ИНГИБИРОВАНИЯ ПОЛИМЕРАЗЫ |
2505306 | КОМПОЗИЦИЯ ДЛЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ ВИРУСНЫХ ИНФЕКЦИЙ |
2431476 | МАТЕРИАЛЫ И СПОСОБЫ ЛЕЧЕНИЯ ВИРУСНЫХ ИНФЕКЦИЙ С ПОМОЩЬЮ СОЕДИНЕНИЯ ЦИСТЕАМИНА |
2380100 | СРЕДСТВО ДЛЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ ГРИППА А И В |
2301669 | ПРИМЕНЕНИЕ СОЕДИНЕНИЙ АНТИВИРУСНОГО КЛАССА ДЛЯ ПОЛУЧЕНИЯ СРЕДСТВА ДЛЯ ЛЕЧЕНИЯ И ПРОФИЛАКТИКИ ВИРУСНОЙ ИНФЕКЦИИ ДЫХАТЕЛЬНОГО ТРАКТА |
2518314 | СПОСОБ И СРЕДСТВО АКТИВАЦИИ IRF-3 ДЛЯ ЛЕЧЕНИЯ И ПРОФИЛАКТИКИ ЗАБОЛЕВАНИЙ, ВЫЗЫВАЕМЫХ (+) PHK-СОДЕРЖАЩИМИ ВИРУСАМИ |
2580304 | ПРОТИВОВИРУСНОЕ СРЕДСТВО НА ОСНОВЕ СУММЫ ФЛАВОНОИДОВ ИЗ Alchemilla vulgaris L. |
2504397 | ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ФЕРМЕНТ РИБОНУКЛЕАЗУ И ГЛИЦИРРИЗИНОВУЮ КИСЛОТУ ИЛИ ЕЕ СОЛИ: ГЛИЦИРРИЗИНАТ АММОНИЯ, ИЛИ ДИКАЛИЯ, ИЛИ ТРИНАТРИЯ |
2398596 | СПОСОБЫ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ, ВЫЗВАННЫХ ВИРУСОМ ГРИППА ПТИЦ A/H5N1, С ИСПОЛЬЗОВАНИЕМ ИНДУКТОРА ИНТЕРФЕРОНА И ИНГИБИТОРА НЕЙРАМИНИДАЗЫ |
2665848 | ИММУНОГЕННАЯ ЛЕКАРСТВЕННАЯ КОМПОЗИЦИЯ ДЛЯ МЕДИЦИНСКОГО ИСПОЛЬЗОВАНИЯ, СОДЕРЖАЩАЯ РЕКОМБИНАНТ ЖИВОЙ БЦЖ, ВЫДЕЛЯЮЩИЙ АНТИГЕНЫ МЕТАПНЕВМОВИРУСА (HMPV) В СУСПЕНЗИЮ, ПРИГОТОВЛЕННУЮ ИЗ ЛИОФИЛИЗАТА БЕЗ ДОБАВЛЕНИЯ АДЪЮВАНТА |
2501560 | КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ФЕРМЕНТ РИБОНУКЛЕАЗУ И/ИЛИ СТЕАРИЛГЛИЦИРРЕТИНАТ ИЛИ ГЛИЦИРРИЗИНОВУЮ КИСЛОТУ ИЛИ ЕЕ СОЛИ – ГЛИЦИРРИЗИНАТ АММОНИЯ, ИЛИ ДИКАЛИЯ, ИЛИ ТРИНАТРИЯ |
2441647 | ВИРОСОМЫ, ВКЛЮЧАЮЩИЕ ГЕМАГГЛЮТИНИН, ВЫДЕЛЕННЫЙ ИЗ ВИРУСА ГРИППА, ПОЛУЧЕННОГО В ЛИНИИ КЛЕТОК, КОМПОЗИЦИИ, СОДЕРЖАЩИЕ УКАЗАННЫЕ ВИРОСОМЫ, СПОСОБЫ ИЗГОТОВЛЕНИЯ И ПРИМЕНЕНИЕ |
2586283 | ИНЪЕКЦИОННЫЙ ИЛИ ИНФУЗИОННЫЙ РАСТВОР L-АРГИНИНИЕВОЙ СОЛИ 5-МЕТИЛ-6-НИТРО-1,2,4-ТРИАЗОЛО[1,5-а]ПИРИМИДИН-7-ОНА МОНОГИДРАТА ДЛЯ ТЕРАПИИ ГРИППА И ДРУГИХ ВИРУСНЫХ ИНФЕКЦИЙ |
2422444 | ПОЛИЦИКЛИЧЕСКИЕ СРЕДСТВА ДЛЯ ЛЕЧЕНИЯ РЕСПИРАТОРНО-СИНЦИТИАЛЬНЫХ ВИРУСНЫХ ИНФЕКЦИЙ |
2572558 | ПРОТИВОВИРУСНЫЕ ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ |
2566296 | ПРОИЗВОДНОЕ ДИФЕНИЛСУЛЬФИДА И ФАРМАЦЕВТИЧЕСКИЙ ПРОДУКТ, КОТОРЫЙ СОДЕРЖИТ ЕГО В КАЧЕСТВЕ АКТИВНОГО ИНГРЕДИЕНТА |
2505312 | КОМПЛЕКСНОЕ ЛЕКАРСТВЕННОЕ СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ГРИППА РАЗЛИЧНЫХ ТИПОВ |
2234313 | СРЕДСТВО ИНАКТИВАЦИИ КОРОНАВИРУСОВ |
2527688 | СПОСОБ ЛЕЧЕНИЯ ИНФЕКЦИОННЫХ ЗАБОЛЕВАНИЙ, ВЫЗВАННЫХ ВИРУСОМ ГРИППА С ТИПОМ ПОВЕРХНОСТОГО АНТИГЕНА Н1N1 И ЛЕКАРСТВЕННОЕ СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ИНФЕКЦИОННЫХ ЗАБОЛЕВАНИЙ, ВЫЗВАННЫХ ВИРУСОМ ГРИППА С ТИПОМ ПОВЕРХНОСТНОГО АНТИГЕНА Н1N1 |
2488407 | ПОЛИВАЛЕНТНЫЕ ИММУНОГЕННЫЕ КОМПОЗИЦИИ PCV2 И СПОСОБЫ ПОЛУЧЕНИЯ ТАКИХ КОМПОЗИЦИЙ |
2409356 | ПРИМЕНЕНИЕ АМБРОКСОЛА ДЛЯ ЛЕЧЕНИЯ РИНОВИРУСНЫХ ИНФЕКЦИЙ |
2701694 | КОМПОЗИЦИИ И СПОСОБЫ, ОСНОВАННЫЕ НА НЕЙТРАЛИЗУЮЩИХ АНТИТЕЛАХ, ДОСТАВЛЯЕМЫХ ИНТРАНАЗАЛЬНО, ДЛЯ УЛУЧШЕННОЙ ТЕРАПЕВТИЧЕСКОЙ ЭФФЕКТИВНОСТИ |
2288723 | 2288723 ПРОФИЛАКТИЧЕСКОЕ И ТЕРАПЕВТИЧЕСКОЕ ЛЕЧЕНИЕ ИНФЕКЦИОННЫХ И ДРУГИХ ЗАБОЛЕВАНИЙ С ПОМОЩЬЮ ИММУНОЭФФЕКТИВНЫХ СОЕДИНЕНИЙ |
2689788 | ПИРАЗОЛО[1,5-а] ПИРИМИДИНЫ В КАЧЕСТВЕ ПРОТИВОВИРУСНЫХ СОЕДИНЕНИЙ |
2626003 | АМИД 1,2,4-ТРИАЗОЛ-3-ИЛТИОГЛИКОЛЕВОЙ КИСЛОТЫ, ОБЛАДАЮЩИЙ ПРОТИВОВИРУСНОЙ АКТИВНОСТЬЮ, ИЛИ ЕГО ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ, ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ И ИХ ПРИМЕНЕНИЕ ДЛЯ ЛЕЧЕНИЯ И ПРОФИЛАКТИКИ ГРИППА |
2577134 | УЛУЧШЕННЫЕ АМИНОКИСЛОТНЫЕ ПОСЛЕДОВАТЕЛЬНОСТИ, НАПРАВЛЕННЫЕ ПРОТИВ РЕСПИРАТОРНО-СИНЦИТИАЛЬНОГО ВИРУСА ЧЕЛОВЕКА (HRSV), И ПОЛИПЕПТИДЫ, ВКЛЮЧАЮЩИЕ ТАКИЕ ПОСЛЕДОВАТЕЛЬНОСТИ, ДЛЯ ПРОФИЛАКТИКИ И/ИЛИ ЛЕЧЕНИЯ ИНФЕКЦИЙ ДЫХАТЕЛЬНЫХ ПУТЕЙ |
2655616 | ПРИМЕНЕНИЕ КОМПОЗИЦИИ ФИЛЛИРИНА/ФИЛЛИГЕНИНА ПРИ ПРИГОТОВЛЕНИИ МЕДИКАМЕНТА ИЛИ ПРОДУКТА МЕДИЦИНСКОГО НАЗНАЧЕНИЯ ДЛЯ ОБЛЕГЧЕНИЯ И/ИЛИ НАЗНАЧЕНИЯ ДЛЯ ЛЕЧЕНИЯ ВИРУСНЫХ ЗАБОЛЕВАНИЙ, И МЕДИКАМЕНТ ИЛИ ПРОДУКТ МЕДИЦИНСКОГО НАЗНАЧЕНИЯ ДЛЯ ЛЕЧЕНИЯ ВИРУСНЫХ ЗАБОЛЕВАНИЙ |
2530554 | ПРИМЕНЕНИЕ 1,7,7-ТРИМЕТИЛБИЦИКЛО [2. |
2478377 | КОМБИНИРОВАННЫЙ ПРЕПАРАТ ОРВИУМ ДЛЯ УСТРАНЕНИЯ СИМПТОМОВ ПРОСТУДНЫХ ЗАБОЛЕВАНИЙ И ГРИППА |
2568849 | СРЕДСТВО, ПРЕДСТАВЛЯЮЩЕЕ СОБОЙ АМИД ГЛИЦИРРИЗИНОВОЙ КИСЛОТЫ С 5-АМИНОУРАЦИЛОМ, ПРОЯВЛЯЮЩЕЕ ПРОТИВОВИРУСНУЮ АКТИВНОСТЬ В ОТНОШЕНИИ ВИРУСА ГРИППА A/h2N1 |
2624018 | АМИД 5-(ТЕТРАГИДРОФУРАН-2-ИЛ)-1,2,4-ТРИАЗОЛ-3-КАРБОНОВОЙ КИСЛОТЫ, ОБЛАДАЮЩИЙ ПРОТИВОВИРУСНОЙ АКТИВНОСТЬЮ, И СПОСОБ ЕГО ПОЛУЧЕНИЯ |
2521593 | МОНО И ДИФТОРЗАМЕЩЕННЫЕ ЭТИЛ (3R,4R,5S)-5-АЗИДО-4-АЦЕТИЛАМИНО-3-(1-ЭТИЛПРОПОКСИ)-ЦИКЛОГЕКСЕН-1-КАРБОКСИЛАТЫ, СПОСОБ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ |
2502745 | НАНОАНТИТЕЛО “ANTI-FLU”, РЕКОМБИНАНТНЫЕ ВИРУСНЫЕ ВЕКТОРЫ И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ ДЛЯ ПРОФИЛАКТИКИ И ТЕРАПИИ ГРИППА ТИПА А |
2529487 | 5-МЕТИЛ-6-НИТРО-7-ОКСО-4,7-ДИГИДРО-1,2,4-ТРИАЗОЛО[1,5-АЛЬФА]ПИРИМИДИНИД L-АРГИНИНИЯ МОНОГИДРАТ |
2608519 | ПРОЛЕКАРСТВЕННАЯ ФОРМА ЗАМЕЩЕННОГО ПОЛИЦИКЛИЧЕСКОГО ПРОИЗВОДНОГО КАРБАМОИЛПИРИДОНА |
2700415 | ИНГИБИТОРЫ РЕПЛИКАЦИИ ВИРУСОВ ГРИППА |
2542488 | ПРОТИВОВИРУСНОЕ СРЕДСТВО |
2657575 | ПРОТИВОВИРУСНАЯ ЭФФЕКТИВНАЯ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ |
2461544 | ПРОИЗВОДНЫЕ 1-(1-АДАМАНТИЛ)ЭТИЛАМИНА И ИХ ПРОТИВОВИРУСНАЯ АКТИВНОСТЬ |
2685730 | СОСТАВЫ СОЕДИНЕНИЙ АЗАИНДОЛА |
2380366 | ПРОИЗВОДНЫЕ ПИРИДАЗИНИЛАМИНА И ИХ ПРИМЕНЕНИЕ ДЛЯ ПОЛУЧЕНИЯ ИНГИБИТОРОВ ПИКОРНАВИРУСОВ |
2518277 | СПОСОБ ЛЕЧЕНИЯ ГРИППА И ГРИППОПОДОБНЫХ ЗАБОЛЕВАНИЙ, ОСЛОЖНЕННЫХ ПНЕВМОНИЕЙ |
2369401 | КОМПОЗИЦИИ ДЛЯ ЛЕЧЕНИЯ ПОРАЖЕНИЙ ПОЛОСТИ РТА И ВЕРХНИХ ДЫХАТЕЛЬНЫХ ПУТЕЙ |
2234922 | АНТИГРИППОЗНЫЙ КОМПЛЕКСНЫЙ ПРЕПАРАТ |
2683793 | ЗАМЕЩЕННЫЕ АМИНОПИРИМИДИНОВЫЕ СОЕДИНЕНИЯ И СПОСОБЫ ИХ ИСПОЛЬЗОВАНИЯ |
2448711 | КОМПОЗИЦИИ ДЛЯ УХОДА ЗА ПОЛОСТЬЮ РТА, СОДЕРЖАЩИЕ КОМБИНАЦИИ АНТИБАКТЕРИАЛЬНЫХ АГЕНТОВ И АГЕНТОВ, ИЗМЕНЯЮЩИХ РЕАКЦИЮ ОРГАНИЗМА-НОСИТЕЛЯ |
2411042 | КОМПОЗИЦИИ И СПОСОБЫ ДЛЯ ЛЕЧЕНИЯ ОСТРОГО РЕСПИРАТОРНОГО СИНДРОМА (SARS) |
2306137 | СРЕДСТВО ДЛЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ ГРИППА |
2302236 | СРЕДСТВО, ОБЛАДАЮЩЕЕ АНТИГИПОКСИЧЕСКОЙ И ЦИТОПРОТЕКТОРНОЙ АКТИВНОСТЯМИ, ИСПОЛЬЗУЕМОЕ ДЛЯ СНИЖЕНИЯ ТОКСИЧНОСТИ РЕМАНТАДИНА ПРИ ЛЕЧЕНИИ ГРИППОЗНОЙ ИНФЕКЦИИ |
2318499 | СПОСОБ ПРОФИЛАКТИКИ ЗАБОЛЕВАЕМОСТИ ГРИППА И ОСТРЫХ РЕСПИРАТОРНО-ВИРУСНЫХ ИНФЕКЦИЙ У ДЕТЕЙ ПЕРВОГО ДЕТСТВА |
2237470 | КОМБИНИРОВАННЫЙ ПРЕПАРАТ ДЛЯ УСТРАНЕНИЯ СИМПТОМОВ ПРОСТУДНЫХ ЗАБОЛЕВАНИЙ И ГРИППА (ВАРИАНТЫ) |
2401263 | АМИНОПРОИЗВОДНЫЕ АДАМАНТАНА, ОБЛАДАЮЩИЕ ПРОТИВОВИРУСНОЙ АКТИВНОСТЬЮ В ОТНОШЕНИИ ВИРУСА ГРИППА |
2237475 | КОМБИНИРОВАННЫЙ ПРЕПАРАТ ДЛЯ УСТРАНЕНИЯ СИМПТОМОВ ПРОСТУДНЫХ ЗАБОЛЕВАНИЙ И ГРИППА (ВАРИАНТЫ) |
2303441 | ПРЕПАРАТ ДЛЯ ПРОФИЛАКТИКИ РЕСПИРАТОРНЫХ БОЛЕЗНЕЙ ТЕЛЯТ |
2360680 | ПРИМЕНЕНИЕ МЕЛОКСИКАМА ДЛЯ ЛЕЧЕНИЯ РЕСПИРАТОРНЫХ ЗАБОЛЕВАНИЙ У СВИНЕЙ |
2281097 | ЛЕКАРСТВЕННОЕ СРЕДСТВО, ВКЛЮЧАЮЩЕЕ ЦИКЛОФЕРОН, СПОСОБ ЕГО ПРИГОТОВЛЕНИЯ И ПРИМЕНЕНИЯ |
2599013 | СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ ИНГИБИРОВАНИЯ ПОЛИМЕРАЗЫ |
2609857 | ИСПОЛЬЗОВАНИЕ КОМПОЗИЦИИ, СОСТОЯЩЕЙ ИЗ КАТИОННОГО ПЕПТИДА LTP И МОЛЕКУЛ РНК ПРОТИВ РЕСПИРАТОРНЫХ ВИРУСОВ |
2564899 | СПОСОБ ЛЕЧЕНИЯ ДЕТЕЙ С РОТАВИРУСНОЙ ИНФЕКЦИЕЙ |
2502512 | СПОСОБ ЛЕЧЕНИЯ ГРИППА ПТИЦ |
2703535 | КОМБИНАЦИЯ ПРОТИВОВИРУСНЫХ СРЕДСТВ ДЛЯ ЛЕЧЕНИЯ ВИРУСНОЙ ГРИППОЗНОЙ ПНЕВМОНИИ И ЕЕ ПРИМЕНЕНИЕ |
2651754 | ПРИМЕНЕНИЕ АЛИФАТИЧЕСКИХ ИМИНОПРОИЗВОДНЫХ КАМФОРЫ В КАЧЕСТВЕ ЭФФЕКТИВНЫХ ИНГИБИТОРОВ РЕПРОДУКЦИИ ВИРУСА ГРИППА ШТАММ A/CALIFORNIA/07/09 (h2N1) PDM09 И A/PUERTO RICO/8/34 (h2N1) |
2633085 | ПРОТИВОВИРУСНОЕ ЛЕКАРСТВЕННОЕ СРЕДСТВО В ВИДЕ КАПСУЛ И СПОСОБ ЕГО ПОЛУЧЕНИЯ |
2228177 | НАЗАЛЬНАЯ КОМПОЗИЦИЯ И СПОСОБ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ ПРОСТУДЫ И ГРИППА ВИРУСНОГО ПРОИСХОЖДЕНИЯ |
2404182 | НАТРИЕВАЯ СОЛЬ 2-ЭТИЛТИО-6-НИТРО-1,2,4-ТРИАЗОЛО[5,1-c]-1,2,4-ТРИАЗИН-7-ОНА ДИГИДРАТ |
2609661 | АНТИГЕННЫЕ КОМПОЗИЦИИ РЕСПИРАТОРНОГО СИНЦИТИАЛЬНОГО ВИРУСА И СПОСОБЫ |
2489422 | ФТОРЗАМЕЩЕННЫЕ (3R,4R,5S)-5-ГУАНИДИНО-4-АЦИЛАМИНО-3-(ПЕНТАН-3-ИЛОКСИ)ЦИКЛОГЕКСЕН-1-КАРБОНОВЫЕ КИСЛОТЫ, ИХ ЭФИРЫ И СПОСОБ ПРИМЕНЕНИЯ |
2458046 | ГИДРАТИРОВАННЫЕ N-ФУЛЛЕРЕН-АМИНОКИСЛОТЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ НА ИХ ОСНОВЕ |
2537025 | ЛЕКАРСТВЕННОЕ СРЕДСТВО НА ОСНОВЕ ДИИНДОЛИЛМЕТАНА И ЕГО ПРИМЕНЕНИЕ ДЛЯ ЛЕЧЕНИЯ ГРИППА И РЕСПИРАТОРНЫХ ВИРУСНЫХ ИНФЕКЦИЙ |
2670204 | ПРОИЗВОДНЫЕ 2-ТИОУРАЦИЛА, ОБЛАДАЮЩИЕ ПРОТИВОАДЕНОВИРУСНОЙ АКТИВНОСТЬЮ |
2536956 | ПРОТИВОВИРУСНОЕ ОДНОДОМЕННОЕ МИНИ-АНТИТЕЛО, НУКЛЕОТИДНАЯ ПОСЛЕДОВАТЕЛЬНОСТЬ, ЭКСПРЕССИРУЮЩИЙ РЕКОМБИНАНТНЫЙ ВИРУСНЫЙ ВЕКТОР, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ПРОФИЛАКТИКИ ИЛИ ТЕРАПИИ ГРИППА ТИПА А |
2616523 | ИНТРАНАЗАЛЬНАЯ МАЗЬ ДЛЯ ЛЕЧЕНИЯ И ПРОФИЛАКТИКИ РЕСПИРАТОРНОЙ ИНФЕКЦИИ |
2469020 | (3R,4R,5S)-5-АМИНО-4-АЦИЛАМИНО-3-(1-ЭТИЛ-ПРОПОКСИ)-ЦИКЛОГЕКС-1-ЕН-КАРБОНОВЫЕ КИСЛОТЫ, ИХ ЭФИРЫ И СПОСОБ ПРИМЕНЕНИЯ |
2486185 | ПОЛИЦИКЛИЧЕСКИЕ АГЕНТЫ ДЛЯ ЛЕЧЕНИЯ РЕСПИРАТОРНО-СИНЦИТИАЛЬНЫХ ВИРУСНЫХ ИНФЕКЦИЙ |
2518738 | КОМПОЗИЦИИ ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ ВЕРХНИХ ДЫХАТЕЛЬНЫХ ПУТЕЙ И СИМПТОМОКОМПЛЕКСА ГРИППА |
2612530 | ПРОИЗВОДНЫЕ БЕНЗИМИДАЗОЛА, ПОЛЕЗНЫЕ ПРИ ЛЕЧЕНИИ РЕСПИРАТОРНО-СИНЦИТИАЛЬНОЙ ВИРУСНОЙ ИНФЕКЦИИ |
2412718 | СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ И ПРОФИЛАКТИКИ ОСТРЫХ РЕСПИРАТОРНЫХ ВИРУСНЫХ И БАКТЕРИАЛЬНЫХ ЗАБОЛЕВАНИЙ И СПОСОБ ЕГО ПОЛУЧЕНИЯ |
2628800 | АМИДНЫЕ СОЕДИНЕНИЯ, СПОСОБЫ ПОЛУЧЕНИЯ, ПРИМЕНЕНИЕ В КАЧЕСТВЕ СРЕДСТВ ДЛЯ ЛЕЧЕНИЯ И ПРОФИЛАКТИКИ ЗАБОЛЕВАНИЙ, ВЫЗЫВАЕМЫХ РНК-СОДЕРЖАЩИМИ ВИРУСАМИ |
2256451 | ЛЕКАРСТВЕННОЕ СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ АТИПИЧНОЙ ПНЕВМОНИИ |
2523554 | СПОСОБ ЗАЩИТЫ ОРГАНИЗМА ОТ ИНФЕКЦИИ, ВЫЗВАННОЙ ШТАММАМИ СУБТИПА h2N1 ВИРУСА ГРИППА А ПРЕПАРАТОМ НА ОСНОВЕ АЛЬФА-2 ИНТЕРФЕРОНА ЧЕЛОВЕКА |
2720305 | ЗАМЕЩЕННЫЙ 3,4,12,12А-ТЕТРАГИДРО-1Н-[1,4]ОКСАЗИНО[3,4-C]ПИРИДО[2,1-F] [1,2,4]ТРИАЗИН-6,8-ДИОН, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ |
2546006 | ПРОТИВОВИРУСНОЕ СРЕДСТВО |
2229877 | СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ГРИППА |
2330018 | ПРОИЗВОДНЫЕ 4-АМИНОМЕТИЛ-6-БРОМ-5-ГИДРОКСИИНДОЛ-3-КАРБОКСИЛАТОВ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ (ВАРИАНТЫ) И ПРИМЕНЕНИЕ |
2684100 | ПРОИЗВОДНОЕ ФИЛЛИГЕНИНА И ГЛЮКУРОНОВОЙ КИСЛОТЫ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ЕГО ПРИМЕНЕНИЕ |
2650636 | СОСТАВЫ НА ОСНОВЕ ПОЛИИНОЗИНОВОЙ-ПОЛИЦИТИДИЛОВОЙ КИСЛОТЫ (POLY(I:С)) ДЛЯ ЛЕЧЕНИЯ ИНФЕКЦИЙ ВЕРХНИХ ДЫХАТЕЛЬНЫХ ПУТЕЙ |
2520836 | (3R,4R,5S)-4-АМИНО-5-(2,2-ДИФТОРАЦЕТИЛАМИНО)-3-(1-ЭТИЛПРОПОКСИ)-ЦИКЛОГЕКС-1-ЕНКАРБОНОВАЯ КИСЛОТА И ЕЕ ЭФИРЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ |
2436583 | ПРОТИВОВИРУСНОЕ СРЕДСТВО |
2643371 | НОВЫЕ СОЕДИНЕНИЯ |
2695336 | КОМПОЗИЦИЯ НА ОСНОВЕ ПЕПТИДА, ПОДАВЛЯЮЩЕГО РЕПЛИКАЦИЮ ВИРУСА ГРИППА А |
2448692 | ФАРМАЦЕВТИЧЕСКИЕ СОЛИ АМИНОБИЦИКЛО[2. |
2611383 | КОМБИНИРОВАННЫЙ ПРЕПАРАТ ДЛЯ УСТРАНЕНИЯ СИМПТОМОВ И ЛЕЧЕНИЯ ОСТРЫХ РЕСПИРАТОРНЫХ ВИРУСНЫХ ИНФЕКЦИЙ И ГРИППА |
2712275 | ЗАМЕЩЕННЫЕ ПОЛИЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ ПИРИДОНА И ИХ ПРОЛЕКАРСТВА |
2398595 | ФЛАВОНОИДНОЕ СОЕДИНЕНИЕ, ОБЛАДАЮЩЕЕ ПРОТИВОВИРУСНОЙ АКТИВНОСТЬЮ |
2433827 | ПРОФИЛАКТИЧЕСКИЙ ИЛИ ТЕРАПЕВТИЧЕСКИЙ АГЕНТ ПРОТИВ ВИРУСНОГО ЗАБОЛЕВАНИЯ |
2399388 | СРЕДСТВО ДЛЯ ИНАКТИВАЦИИ ВИРУСОВ, ОБЛАДАЮЩЕЕ ОДНОВРЕМЕННОЙ РИБОНУКЛЕАЗНОЙ, МЕМБРАНОЛИТИЧЕСКОЙ И ПРОТИВОВИРУСНОЙ АКТИВНОСТЯМИ |
2403053 | КОМПОЗИЦИЯ ДЛЯ ПРЕДОТВРАЩЕНИЯ И ЛЕЧЕНИЯ ПРОСТУДНЫХ ЗАБОЛЕВАНИЙ |
2564919 | ПРОТИВОВИРУСНОЕ СРЕДСТВО |
2391113 | КОМПОЗИЦИИ, СОДЕРЖАЩИЕ ЭКСТРАКТЫ Sanguinaria ИЛИ Macleaya |
2440123 | ПРИМЕНЕНИЕ LACTOBACILLUS ДЛЯ ЛЕЧЕНИЯ ВИРУСНЫХ ИНФЕКЦИЙ |
2359955 | ПРОИЗВОДНЫЕ БЕНЗОТРОПОЛОНА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБ ИНГИБИРОВАНИЯ РЕПЛИКАЦИИ ВИРУСОВ |
2305547 | ПРИМЕНЕНИЕ АПОПРОТЕИНОВ СЫВОРОТКИ МОЛОКА В ПРОФИЛАКТИКЕ ИЛИ ЛЕЧЕНИИ МИКРОБНОЙ ИЛИ ВИРУСНОЙ ИНФЕКЦИИ |
2622640 | СЕЛЕКТИВНЫЕ И ОБРАТИМЫЕ ИНГИБИТОРЫ УБИХИТИН-СПЕЦИФИЧЕСКОЙ ПРОТЕАЗЫ 7 |
2424234 | НОВЫЕ ИНГИБИТОРЫ ЦИСТЕИНОВЫХ ПРОТЕАЗ И ИХ ТЕРАПЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ |
2311194 | ГОМЕОПАТИЧЕСКОЕ СРЕДСТВО “АНАВИАРИН-ГОМЕОАНТИГРИППИН”, ОБЛАДАЮЩЕЕ ПРОТИВОВИРУСНЫМ ДЕЙСТВИЕМ (ВАРИАНТЫ) |
2491092 | СНИЖЕНИЕ СОПУТСТВУЮЩИХ ИНФЕКЦИЙ У СВИНЕЙ С ПОМОЩЬЮ АНТИГЕНА PCV2 |
2694210 | ПРЕПАРАТ РЕКОМБИНАНТНОГО ИНТЕРФЕРОНА-АЛЬФА СОБАКИ ДЛЯ ПРИМЕНЕНИЯ В ТЕРАПИИ ПРИРОДНЫХ ВИРУСНЫХ ИНФЕКЦИЙ СОБАК |
2678105 | ПРИМЕНЕНИЕ ТАУРИНА ДЛЯ ПРОФИЛАКТИКИ И/ИЛИ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ, ВЫЗВАННЫХ ВИРУСАМИ РОДА КОРОНАВИРУСОВ И/ИЛИ РОДА РОТАВИРУСОВ |
2500422 | КОМПЛЕКСНОЕ ЛЕКАРСТВЕННОЕ СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ВИРУСНЫХ ИНФЕКЦИЙ И СПОСОБ ЛЕЧЕНИЯ ВИРУСНЫХ ИНФЕКЦИЙ |
2672888 | ПРОТИВОВИРУСНОЕ ИММУНОТРОПНОЕ СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ОРВИ |
2665638 | АМИДНОЕ СОЕДИНЕНИЕ И ЕГО ПРИМЕНЕНИЕ В КАЧЕСТВЕ СРЕДСТВА ДЛЯ ЛЕЧЕНИЯ И ПРОФИЛАКТИКИ ЗАБОЛЕВАНИЙ, ВЫЗЫВАЕМЫХ РНК-СОДЕРЖАЩИМИ ВИРУСАМИ |
2590706 | ПЕПТИДЫ И ИХ ПРИМЕНЕНИЕ |
2606947 | БОРСОДЕРЖАЩИЕ МАЛЫЕ МОЛЕКУЛЫ |
2630690 | МОЛЕКУЛЫ АНАЛОГОВ ЦИКЛОСПОРИНА, МОДИФИЦИРОВАННЫЕ ПО 1 и 3 АМИНОКИСЛОТЕ |
2552422 | ПРОИЗВОДНЫЕ ИНДОЛ-3-КАРБОНОВОЙ КИСЛОТЫ, ОБЛАДАЮЩИЕ ПРОТИВОВИРУСНОЙ АКТИВНОСТЬЮ |
2366411 | ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ |
2698902 | ПРОИЗВОДНЫЕ 4-АМИНО-ИМИДАЗОХИНОЛИНА, ПОЛЕЗНЫЕ ПРИ ЛЕЧЕНИИ ЗАБОЛЕВАНИЙ, ОПОСРЕДОВАННЫХ АГОНИСТАМИ TLR7 И/ИЛИ TLR8 |
2453556 | СОЕДИНЕНИЯ ДЛЯ ИНГИБИРОВАНИЯ ФЕРМЕНТА |
2524304 | ПРИМЕНЕНИЕ СОЛИ АЦЕТИЛСАЛИЦИЛОВОЙ КИСЛОТЫ ДЛЯ ЛЕЧЕНИЯ ВИРУСНЫХ ИНФЕКЦИЙ |
2505306 | КОМПОЗИЦИЯ ДЛЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ ВИРУСНЫХ ИНФЕКЦИЙ |
2396273 | ПРОТИВОМИКРОБНЫЕ ПЕПТИДЫ, СОДЕРЖАЩИЕ АРГИНИН – И ЛИЗИНСОДЕРЖАЩИЙ МОТИВ |
2695455 | ПРОТИВОМИКРОБНЫЙ ПЕПТИД |
2639559 | ПЕПТИДЫ, ПОДАВЛЯЮЩИЕ ИНФЕКЦИИ РЕСПИРАТОРНЫХ ВИРУСОВ, ИХ ПРИМЕНЕНИЕ И СПОСОБЫ ПОЛУЧЕНИЯ |
2656160 | АНТИТЕЛО ИЛИ ЕГО АНТИГЕНСВЯЗЫВАЮЩИЙ ФРАГМЕНТ, СПОСОБНЫЙ СВЯЗЫВАТЬСЯ С РЕЦЕПТОРОМ ИНТЕРЛЕЙКИНА-6 ЧЕЛОВЕКА |
2726119 | НОВЫЕ ПРОИЗВОДНЫЕ ПОЛИОЛОВ, ИХ ПРИМЕНЕНИЕ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ |
2725800 | КОМБИНИРОВАННЫЕ ВИДЫ ТЕРАПИИ |
2727772 | ПРОИЗВОДНЫЕ ПИРИМИДИНА ПРОТИВ ВИРУСА ГРИППА |
2728939 | ПРИМЕНЕНИЕ ДАЛАРГИНА ДЛЯ ПРОИЗВОДСТВА СРЕДСТВ ЛЕЧЕНИЯ КОРОНАВИРУСНОЙ ИНФЕКЦИИ COVID-19 |
2728938 | ПРИМЕНЕНИЕ ДАЛАРГИНА ДЛЯ ПРОИЗВОДСТВА ЛЕКАРСТВЕННЫХ СРЕДСТВ ПРОФИЛАКТИКИ ПНЕВМОНИИ |
2728821 | СПОСОБ ЛЕЧЕНИЯ ОСТРОГО РЕСПИРАТОРНОГО ДИСТРЕСС-СИНДРОМА ДАЛАРГИНОМ И ЛЕГОЧНЫМ СУРФАКТАНТОМ |
2731932 | ПРОТИВО-COVID-19 (SARS-COV-2) ВИРУСНАЯ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ |
2732291 | ЛЕКАРСТВЕННЫЙ ПРЕПАРАТ НА ОСНОВЕ ТРАВЫ АЛТЕЯ ЛЕКАРСТВЕННОГО ДЛЯ ЛЕЧЕНИЯ ПРОСТУДНЫХ И ОСТРЫХ РЕСПИРАТОРНЫХ ЗАБОЛЕВАНИЙ |
2733269 | СПОСОБ ПРОИЗВОДСТВА ИНГАЛЯЦИОННОЙ ЛЕКАРСТВЕННОЙ ФОРМЫ ГЕКСАПЕПТИДА |
2733361 | СРЕДСТВО ДЛЯ ИНГИБИРОВАНИЯ РЕПЛИКАЦИИ ВИРУСА SARS-COV-2, ОПОСРЕДОВАННОГО РНК-ИНТЕРФЕРЕНЦИЕЙ |
2735797 | СПОСОБ УЛУЧШЕНИЯ ОКСИГЕНИРУЮЩЕЙ ФУНКЦИИ ЛЕГКИХ У БОЛЬНЫХ НОВОЙ КОРОНАВИРУСНОЙ ИНФЕКЦИЕЙ (COVID-19) С ДЫХАТЕЛЬНОЙ НЕДОСТАТОЧНОСТЬЮ, НАХОДЯЩИХСЯ НА РЕСПИРАТОРНОЙ ПОДДЕРЖКЕ |
2737800 | ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ПРОЛОНГИРОВАННОГО ДЕЙСТВИЯ В ВИДЕ СУППОЗИТОРИЯ, СОДЕРЖАЩАЯ ГЕКСАПЕПТИД |
2737799 | ИНГАЛЯЦИОННЫЙ ГЕКСАПЕПТИД ДЛЯ ЛЕЧЕНИЯ РЕСПИРАТОРНЫХ ЗАБОЛЕВАНИЙ, СВЯЗАННЫХ С ИНТЕРЛЕЙКИНОМ-6 |
2738449 | СПОСОБ ПРОФИЛАКТИКИ ВИРУСНЫХ РЕСПИРАТОРНЫХ ЗАБОЛЕВАНИЙ |
Что нужно знать каждой маме о ротавирусной инфекции
Всем родителям знакома ситуация, когда у малыша по непонятным причинам болит животик, а потом начинается понос и рвота. Причин для возникновения такого состояния много – это бактериальные, вирусные возбудители, простейшие, элементарная пищевая несовместимость. Особое место среди них занимает ротавирусная инфекция.
Причин для возникновения такого состояния много – это бактериальные, вирусные возбудители, простейшие, элементарная пищевая несовместимость. Особое место среди них занимает ротавирусная инфекция.
Пик заболеваемости ее приходится на зимнее-весеннее время. Ежегодно кишечными инфекциями болеет более 475 миллионов детей в мире, на долю ротавирусной инфекции приходится 40%. Ротавирусы очень распространены в природе. Вызывают заболевания не только у людей, но и у животных. Особенности строения вируса объясняют его особую устойчивость во внешней среде, а также нечувствительность ко многим дезинфицирующим средствам. Вирус очень изменчив. Это приводит к тому, что за один сезон ребенок может переболеть несколько раз. Первый раз ребенок может заболеть в возрасте около 6 месяцев, когда истощается иммунитет, который он получил от матери. Иммуноглобулины, которые ребенок получает с грудным молоком, не способны защитить его от заболевания. В некоторой мере они будут уменьшать клинические проявления и способствовать быстрейшему выздоровлению.
Ротавирусная инфекция у детей начинается с ухудшения аппетита, рвоты, жидкого стула, болей в животе, повышение температуры. Многократная рвота и жидкий стул на фоне повышенной температуры приводят к быстрому обезвоживанию. Ребенок становится вялым, капризным, сонливым. Индивидуальные особенности ребенка, такие как дефицит веса, предшествующие тяжелые заболевания, например пневмония, — способствуют более тяжелому течению ротавирусной инфекции. Такие ситуации требуют срочной госпитализации в инфекционное отделение для проведения неотложной терапии. Чаще всего госпитализация необходима детям в возрасте до 2 лет. В этом возрасте из-за физиологических особенностей (быстро наступающие нарушения в водно-солевом обмене организма ребенка), а также несостоятельности иммунной системы, чаще возникают тяжелые осложнения.
Ротавирусная инфекция имеет свои особенности, что отличает ее от других кишечных инфекций – это развитие катарального синдрома. У детей может быть насморк или заложенность носа, першение в горле, сухой кашель. Причем катаральные проявления могут развиваться одновременно с рвотой и диареей или предшествовать им.
Причем катаральные проявления могут развиваться одновременно с рвотой и диареей или предшествовать им.
Доказано, что ротавирусная инфекция как в развитых, так и в развивающихся странах занимает долю примерно 40% от других кишечных инфекций. То есть, несмотря на проводимые санитарно-гигиенические мероприятия, уменьшения заболеваемости не отмечается. Это связано с особенностями вируса. Основной механизм передачи вируса – «руки – рот». Вирус начинает выделяться во внешнюю среду с началом клинических проявлений (в 1 грамме фекалий может находиться до 10 триллионов вирусных частиц), длительность выделения разная, примерно до 20 дней от начала заболевания (вирус все еще продолжает выделяться уже при сформированном стуле). Для заражения ротавирусной инфекцией необходимо, чтобы в организм попало всего лишь 10 – 100 вирусных частиц. Учитывая физиологические особенности детей от 6 месяцев до 2 лет (познание мира через рот, интенсивное прорезывание зубов), уберечь ребенка практически невозможно.
Необходимо отметить, что препаратов, которые бы уничтожали ротавирус, нет. Сорбенты захватывают какую-то часть вирусов и выводят из кишечника, известные противовирусные препараты также в какой-то мере уничтожают вирус, но этиологического лечения нет.
Наиболее разумным способом защитить ребенка от ротавирусной инфекции является вакцинация.
До 2013 года в России не было зарегистрировано ни одной вакцины против ротавируса. Дети могли вакцинироваться только за границей. Прививка против ротавирусной инфекции входит в Национальные Календари 17 стран. С 2013 года вакцина «РотаТек» разрешена для вакцинации в России. Примечательно, что вакцина пероральная. Начинать вакцинацию можно уже на 6-й неделе жизни ребенка, с проведением ревакцинации через 4 недели. Вакцинация имеет ограничение по возрасту – она должна быть закончена до достижения ребенком возраста 24 месяцев. Прививку можно совмещать с другими вакцинами. Даже однократное введение вакцины способствует уменьшению тяжести течения ротавирусной инфекции.
Ротавирусная инфекция
О центре – Учимся быть здоровыми
Обновлено 05.04.2019 05.04.2019
Автор: ManagerРотавирусный гастроэнтерит – острая инфекционная болезнь с фекально–оральным механизмом передачи возбудителя.
Источником инфекции являются инфицированные взрослые и дети – больные или вирусоносители, выделяющие ротавирусы с фекалиями. В течение первых 5–и дней болезни пациенты представляют наибольшую эпидемиологическую опасность для окружающих.
Механизм передачи: фекально-оральный, реализация – вода, пища; контактно-бытовой путь, не исключен и воздушно-пылевой. Наиболее важный фактор передачи – вода.
Наиболее важный фактор передачи – вода.
Из пищевых продуктов опасны молоко и молочные продукты, зараженные при хранении или реализации.
Контактно-бытовая передача происходит чаще в семье, в местах коллективного проживания при несоблюдении правил личной гигиены.
Среди детей и взрослых ротавирусная инфекция может проявляться в виде спорадических случаев, локальных групповых заболеваний, вспышек и имеет повсеместное распространение. Характерна сезонность – зимне-весенний период. Естественная восприимчивость к ротавирусной инфекции высокая, наибольшее число заболевших отмечается среди детей в возрасте от 6 мес. до 2-х лет.
При ротавирусной инфекции отмечается высокая очаговость, особенно в детских дошкольных коллективах. Ротавирусы рассматривают также как один из основных агентов при внутрибольничных вспышках гастроэнтерита в родильных домах и детских стационарах разного профиля. Взрослые и дети старшего возраста инфицируются от больных детей, посещающих детские коллективы.
У переболевших ротавирусной инфекцией формируется строго специфический иммунитет, но продолжительность его неизвестна.
Клиника заболевания
Инкубационный период – от нескольких часов до 1-2 суток.
Периоды болезни:
- Начальная фаза – 12-24 часа;
- Острый период (разгар болезни) – 3-4 дня;
- Период реконвалесценции с 4-7 дня.
Степени тяжести
Первыми признаками болезни являются диарея, рвота, боль в животе. Диарея – постоянный симптом, после дефекации – облегчение.
Испражнения обильные, водянистые, желтого цвета, пенистого вида, с резким кислым запахом.
При легкой степени: температура тела нормальная или повышается до 37,5º, симптомы интоксикации выражены слабо. Рвоты не бывает. Стул густой кашицеобразный, коричневого цвета, до 5 раз в сутки. Больные жалуются на тяжесть в эпигастральной области, снижение аппетита и другие диспепсические явления.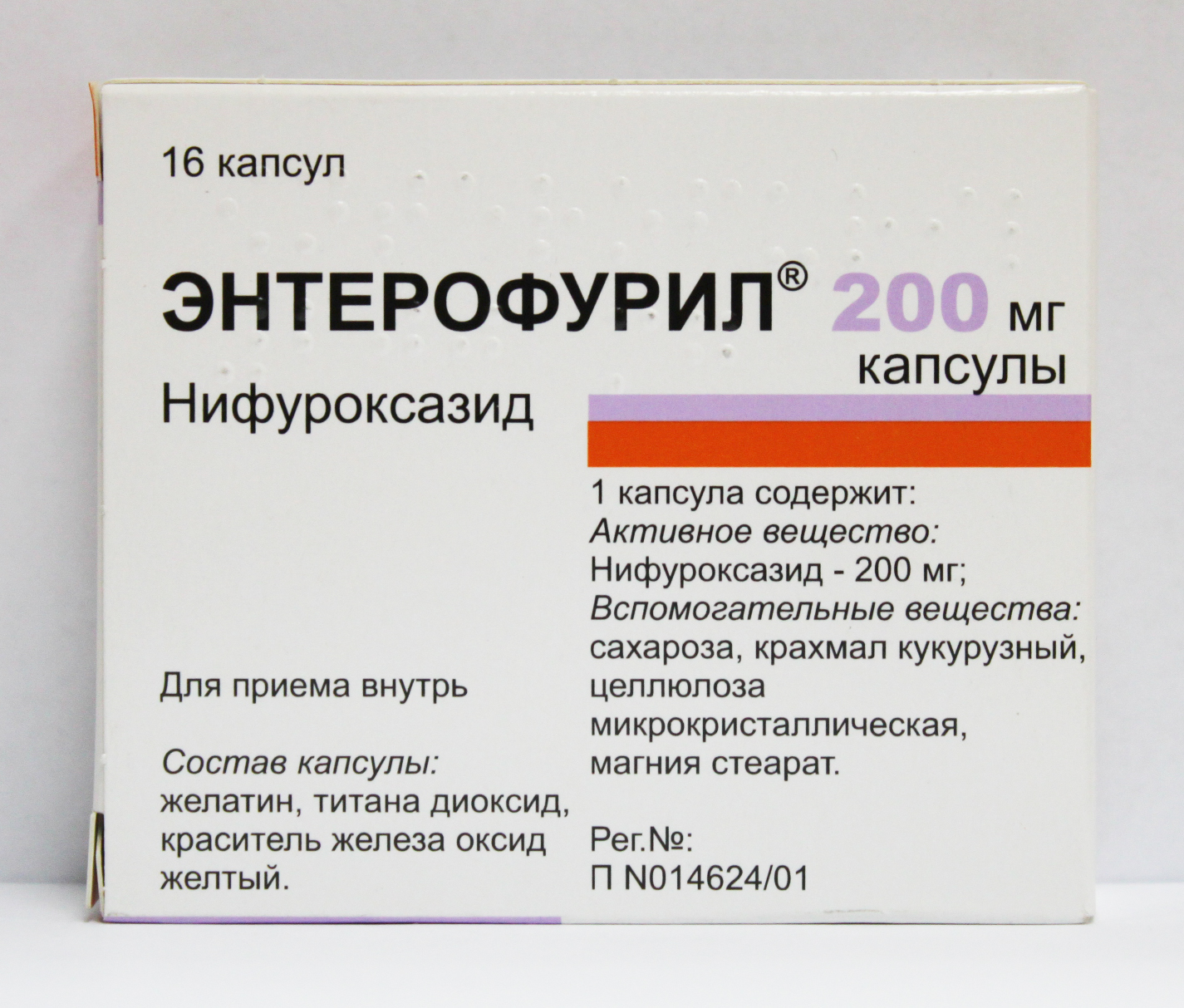
При средней степени тяжести: температура тела 37,5º и выше, умеренно выражены симптомы интоксикации. Рвота возникает у больных одновременно с диареей или раньше, повторяется 3-4 раза и прекращается в течение первых суток. Частота стула 10–15 раз в сутки, имеет мутно-белую окраску , иногда с примесью слизи. Боль в животе локализуется в эпигастральной и пупочной областях или носит диффузный характер.
Тяжелая степень заболевания: температура тела 38,0º и выше, держится 1-3 дня, может быть озноб. Боль в животе может быть очень сильной. Рвота при тяжелом течении болезни возникает после приема пищи или воды. Рвотные массы обильные, содержат примесь пищи и слизи. Испражнения более 15 раз в сутки, обильные, водянистые, желтого цвета, пенистые, с резким запахом. При осмотре больных на слизистой оболочке мягкого неба, небных дужках, языке – гиперемия, зернистость. У детей могут быть признаки ринита, диффузная гиперемия барабанной перепонки. Другие органы и системы также вовлекаются в патологический процесс, но по сравнению с кишечником реже. При тяжелом течении болезни могут развиться острая сердечно – сосудистая недостаточность, обморок.
При тяжелом течении болезни могут развиться острая сердечно – сосудистая недостаточность, обморок.
Лабораторная диагностика: материалом для вирусологического исследования служат фекалии больных. Определяют антиген ротавируса в первые 2-3 дня болезни.
Лечение:
– Диета № 4: исключение овощей, фруктов, молока, молочных продуктов, копченостей, солений, кондитерских изделий, газированных напитков, соков;
– Ограничение сахара;
– Противовирусные препараты: кипферон, арбидол;
– Абсорбенты и вяжущие вещества: смекта, энтеросгель, активированный уголь;
– Полиморфные препараты: мезим форте, фестал, панзинорм.
Профилактика заболевания:
Профилактические меры при ротавирусном гастроэнтерите являются общими, как и для всей группы кишечных инфекций с фекально-оральным механизмом заражения.
Тщательно мойте овощи и фрукты, употребляемые в пищу в сыром виде, мойте руки с мылом перед приготовлением еды и после разделки сырых рыбы, мяса или птицы, после прогулок, игр с животными. Избегайте контакта между сырыми и готовыми пищевыми продуктами. Храните все скоропортящиеся продукты и готовую пищу в холодильнике.
Избегайте контакта между сырыми и готовыми пищевыми продуктами. Храните все скоропортящиеся продукты и готовую пищу в холодильнике.
Показания для госпитализации:
1. Лихорадка выше 38,0º;
2. Рвота более 5 раз за сутки;
3. Диарея более 10 раз за сутки.
Заведующая инфекционным отделением КДЦ № 1 Ольга Ивановна Исакова
Противовирусные препараты при ротавирусной инфекции: нужны ли и какие
Противовирусные препараты при ротавирусной инфекции не имеют этиологического значения, однако все равно назначаются. Для чего это необходимо и какое еще лечение показано в таких случаях?
Что такое ротавирус
Эта инфекция в западных странах носит название желудочного гриппа. Относится она к кишечным инфекциям, вызываемым ротавирусом. Микроорганизм достаточно устойчив во внешней среде и может заражать человека разными путями:
- контактным — через предметы обихода;
- пищевым — через загрязненные фрукты и овощи;
- воздушно-капельным — при чихании и кашле больного человека.

Заразиться могут взрослые и дети. Наиболее часто все же страдают дети младшего возраста, особенно посещающие организованные коллективы. После перенесенной инфекции остается иммунитет, однако заболевание может возникнуть повторно — уже в более легкой форме.
Как проявляется инфекция
Инкубационный период для этой инфекции короткий и составляет всего два дня. Проявления заболевания типичны для любой кишечной инфекции.
- Начинается все с общего недомогания.
- Постепенно поднимается температура.
- Вскоре после начала лихорадки появляется многократная рвота и жидкий частый стул.
- Человек пожалуется на сильные схваткообразные боли в верхней половине живота, которые затем распространяются на весь живот.
Ротавирусная инфекция поражает стенку кишечника и желудка, вследствие чего и развиваются такие симптомы. Характерным признаком является нарушение функции поджелудочной железы.
Лечение
Лечат ротавирусную инфекцию при лихорадке выше 38*С, неудовлетворительном самочувствии пациента. Лучше, если лечение будет комплексным — с назначением лекарственных средств, диеты и немедикаментозных методов.
Пациенту назначают полноценное питание с большим количеством жидкости. Частая рвота и диарея могут привести к обезвоживанию организма. Особенно это касается маленьких детей. Поэтому назначают обильное витаминизированное питье.
При высокой лихорадке показаны жаропонижающие средства. Детям они назначаются в виде сиропов или свечей, взрослым — в таблетках. При появлении признаков обезвоживания назначают препарат для регидратации — Регидрон.
Для чего нужны противовирусные препараты
Этиотропного лечения — воздействующего на причину заболевания — для ротавируса не существует. Однако назначение противовирусных препаратов все же показано. С какой целью это делается? Противовирусные средства обладают комплексным действием.
- Они задерживают размножение вируса и ускоряют процесс выздоровления.
- Практически все препараты обладают иммуномодулирующим действием, за счет чего предупреждают присоединение бактериальной флоры и развитие осложнений.
Какие препараты с противовирусным действием могут быть использованы в лечении? Так как они не обладают специфическим действием, назначаться может любое средство, подходящее по возрасту с учетом предписаний.
Цитовир
Препарат Цитовир является иммуностимулятором с противовирусным действием. Может назначаться взрослым в виде капсул и детям в виде сиропа. В его состав входит аминокислота тимоген и аскорбиновая кислота.
Препарат используется для лечения гриппа и других респираторных вирусных инфекций. В лечении ротавируса он не эффективен и используется только для повышения иммунитета. Противопоказан при сахарном диабете, во время беременности и кормления грудью.
Арбидол
Арбидол — единственный противовирусный препарат, который входит в схему лечения ротавирусной инфекции. Лекарство выпускается в виде суспензии для детей с двух лет, в виде таблеток для детей с трех лет и в виде капсул для взрослых.
Помимо лечения ротавируса, Арбидол применяется при гриппе и респираторных вирусных инфекциях, хронической герпетической инфекции. Противопоказан Арбидол детям младше двух лет и при индивидуальной непереносимости. Для лечения ротавируса Арбидол назначается по схеме.
Ингавирин
Препарат Ингавирин с противовирусной активностью в отношении вирусов гриппа, РС-вирусов, парагриппа. Применяется только у взрослых для лечения заболеваний, вызванных этими микроорганизмами. Детская дозировка назначается с семи лет. Противопоказан беременным и кормящим женщинам. При ротавирусе не назначается, поскольку не воздействует ни на причину заболевания, ни на иммунитет.
Орвирем
Орвирем — препарат на основе римантадина. Выпускается только в форме детского сиропа. Лекарство показано для лечения и профилактики только гриппа. При ротавирусе также не назначается. Противопоказан детям до года.
Таким образом, в лечении ротавирусной инфекции может быть использован только Арбидол в составе комплексной терапии.
Какую цель преследует назначение антибиотиков
Антибактериальные средства в лечении вирусных инфекций с первого дня заболевания не применяются. Их назначение обосновано только в случае присоединения вторичной флоры и развития бактериальных осложнений:
- пневмонии;
- бронхита;
- отита.
Антибиотики при ротавирусной инфекции также не показаны в качестве основного лечения. Обычно используют кишечные антисептики — так как ротавирус снижает иммунные свойства кишечной стенки и может активизироваться патогенная кишечная флора. Это усугубляет течение заболевания. Что относится к кишечным антисептикам?
Нифуроксазид — международное наименование вещества, а торговых названий лекарств с таким действующим компонентом может быть много:
- Энтерофурил;
- Мирофурил;
- Экофурил.
Нифуроксазид назначается детям и взрослым — в виде сиропа и капсул. Нифуроксазид проявляет активность в отношении основных патогенных кишечных бактерий. Препараты, где содержится нифуроксазид, назначаются при диареях любого происхождения — бактериального или вирусного. Противопоказан Нифуроксазид детям до месяца и при индивидуальной непереносимости.
Препарат Бисептол является комбинированным антибиотиком, применяемым в основном для лечения кишечных инфекций. Выпускается в виде детской суспензии и капсул для взрослых. При ротавирусной инфекции может назначаться в составе комплексной терапии, но особого эффекта не выявлено.
Бисептол имеет много противопоказаний и побочных действий, поэтому назначение его нецелесообразно.
Амоксициллин — широко известный антибиотик. Однако применять его для лечения диареи, тем более вызванной ротавирусом не только неэффективно, но и опасно. Это довольно старый препарат с большим количеством противопоказаний и побочных действий. К тому же за годы его использования к нему выработалась резистентность у многих микроорганизмов.
Флемоксин солютаб — это торговое название амоксициллина. Для лечения кишечных инфекций он также не применяется.
Дополнительное лечение
Следует помнить, что ротавирус поражает поджелудочную железу. Поэтому в схему лечения обязательно должны входить ферментные препараты — Креон, Пангрол. Их назначение показано с самого начала заболевания.
Для восстановления стула и профилактики дисбактериоза после антибиотиков используются пробиотические препараты — Максилак, Нормобакт, Линекс. Устранение схваткообразных болей достигается приемом спазмолитиков — Но-шпа, Дюспаталин.
После пройденного лечения необходим курс витаминных препаратов для восстановления защитных сил организма и иммунитета. Хорошими препаратами являются Мультитабс иммунно или Бион 3.
В качестве профилактических мероприятий показаны соблюдение правил личной гигиены, ограничение контакта с больными людьми, тщательное мытье овощей и фруктов. Специфическая профилактика заключается во введении вакцины Ротарикс.
Stomatidine
Лечение ОРВИ у детей и взрослых зависят от двух основных факторов: типа вируса и активности иммунитета. В борьбе с любой болезнью действует принцип: «лучшая битва та, которая не состоялась». Поэтому профилактика всегда лучше, чем лечение ОРВИ.
Диагностика ОРВИ
При установлении диагноза, врачи пользуются двумя инструментами: дифференциальная диагностика и лабораторные исследования. В большинстве случаев второй этап не обязателен, хотя является показательным.
Дифференциальная диагностика включает общий осмотр пациента и анализ симптоматики. Кроме общих проявлений, таких как температура и слабость, при ОРВИ могут увеличиваться селезенка и печень, что тоже учитывается при постановке диагноза.
Лабораторная диагностика определяет наличие антител в крови к тому или иному вирусу. Ее назначают, чтобы подтвердить диагноз или выявить точный вид вируса, когда картина болезни расплывчата.
Профилактика ОРВИ
Наиболее распространенный способ заражения – воздушно-капельный. Частицы живого вируса способны жить сутки в теплом месте без носителя. Поэтому качественный воздухообмен в помещении – залог здоровья. Каждую комнату в доме необходимо проветривать минимум один раз в сутки. Если кто-то из жителей уже заболел, то проветривание проводят чаще. Одной из причин частых ОРВИ у ребенка становится не детский сад, как таковой, а плохая циркуляция воздуха в помещении группы. При этом дети всегда в тесном контакте и всегда есть кто-то с насморком.
Кроме проветривания нужна влажная уборка помещений, желательно с дезинфицирующими растворами.
На улице риск поймать вирус повышается. Марлевые повязки в разгар эпидемий – хороший вариант защиты. Вспышки респираторных заболеваний попадают на осень и зиму, когда погода неустойчива. В эти периоды важно не переохлаждаться.
Ротавирусная инфекция распространяется через тесный контакт с зараженными предметами быта: тарелками, игрушками, канцелярскими принадлежностями. Следующий шаг профилактики очевиден: своевременное мытье рук. Чем чаще, тем лучше.
Быстрое лечение ОРВИ возможно только с помощью противовирусных средств, поэтому чтобы встать на ноги и легко перенести болезнь, нужно укреплять иммунитет. Это самая надежная мера профилактики.
Иммунная система тесно связана со стрессами. Соблюдение правил здорового образа жизни и сон не менее 8 часов в сутки – первое, что необходимо наладить. Систематические прогулки на свежем воздухе полезны и детям, и взрослым. Еще один важный фактор – здоровое питание. Установлена связь между качеством еды и частотой возникновения болезней. Полезная пища легче переваривается, не оставляет лишнего в организме и положительно влияет на работу внутренних органов.
В последние годы популярными стали прививки от вирусных инфекций. Это одно из эффективных средств поддержания иммунитета и защиты от заболеваний.
Внимание, кишечный грипп | БУЗ УР “Малопургинская РБ МЗ УР”
Острые кишечные инфекции (ОКИ) занимают ведущее место в структуре детской заболеваемости и смертности. Ежегодно в мире ОКИ являются причиной смерти более 1 миллиона детей.Сегодня ротавирусы рассматриваются как основной этиологический фактор возникновения ОКИ, особенно у детей раннего возраста. По данным ВОЗ, ежегодно в мире регистрируется около 138 миллионов случаев ротавирусной инфекции. Летальность от ротавирусной инфекции колеблется от 454 до 705 тысяч случаев в год и в среднем составляет 611 тысяч случаев.
Весенне-зимняя пора излюбленное время ротавирусной инфекции, регистрируется наибольшее число случаев заболевания.
Ротавирусная инфекция (синонимы ротавирусный гастроэнтерит, желудочный грипп, кишечный грипп) – одна из форм острой кишечной инфекции, характеризуется симптомами общей интоксикации (повышение температуры, слабость), поражением желудочно-кишечного тракта (тошнота, рвота, диарея, боли в области живота), обезвоживанием.
Возбудителем ротавирусной инфекции является ротавирус человека из рода Rotavirus. Ротавирусы очень устойчивы во внешней среде.
Заболеть ротавирусной инфекцией могут люди в любом возрасте, однако чаще всего болеют дети первых двух лет жизни и лица с пониженной функцией иммунной системы.
Источником инфекции ротавируса может быть не только больной (взрослый и ребенок), но и практически здоровый человек, в организме которого находятся ротавирусы, при этом дети первого года жизни часто заражаются от инфицированных ротавирусами взрослых.
Ротавирусная инфекция регистрируется в течение всего года. Однако чаще в холодное время года. Основные пути передачи – водный, пищевой и контактно-бытовой. При единичных и локальных групповых заболеваниях инфицирование ротавирусами у детей происходит преимущественно бытовым путем, тогда как у взрослых доминирует водный и пищевой пути.
Инкубационный период длится от 15 ч. до 7 дней (чаще 1-2 дня). Заболевание начинается остро. Больные отмечают повышение температуры от 37,9 гр. и выше,боли в эпигастральной области, тошноту, рвоту, жидкий водянистый стул без примеси крови и слизи. При обильном жидком стуле может развиться обезвоживание. С целью подтверждения диагноза «ротавирусная инфекция» необходимо произвести лабораторные исследования.
Сильнее всего страдают от ротавируса дети до 5 лет. А все потому, что им сложнее, чем взрослым, восполнять потерю жидкости. Обезвоживание – самое страшное последствие кишечной инфекции. Малыши, а особенно новорожденные, не могут пить, не могут есть, а тем временем рвота и диарея вместе с высокой температурой лишают малыша необходимой жидкости. Родители не всегда замечают, что подгузник у чада уже много часов подряд совершенно сухой. ЭТО ОПАСНО! Поить ребенка из стакана бесполезно. Нужно давать воду по ложечке, а малышам достаточно просто постоянно смачивать губки. Капать из пипетки или из ложки на губы, пока чадо спит. Вода в маленьких количествах «впитается» и насытит организм.
Идеально давать ребенку не просто воду, а специальный раствор, восполняющий все потерянные организмом витамины и минералы – «Регидрон», «Гидровит» и другие. Некоторые детки любят минеральную воду, кто-то соглашается только на сладкий чай. Тут уж все средства хороши, лишь бы восполнить потерю жидкости.
Многие родители, почуяв симптомы отравления, увидев на градуснике высокую температуру, сразу хватаются за антибиотики. Помните, что антибиотики не смогут побороть вирус! Вирусы убивает только собственный иммунитет заболевшего.
В случае с ротавирусом, лекарства не действуют. Облегчить жизнь могут сорбенты – активированный уголь, «Смекта», «Энтеросгель» и т.д.Но главное – это постоянное восполнение потерянной жидкости.
Профилактика ротавирусной инфекции.
Для предупреждения вспышек ротавирусной инфекции с целью улучшения состояния иммунной системы рекомендуется принимать противовирусные препараты (под контролем лечащего врача), а также необходимо соблюдать правила личной гигиены: перед приготовлением пищи, перед едой, после посещения туалета обязательно мыть руки горячей водой с мылом, овощи и фрукты перед употреблением в пищу тщательно промыть проточной и кипяченной водой.
Покупные мясо и мясные продукты, молоко и молочные продукты, яйца подвергать тщательной термической обработке.
Употреблять только кипяченную воду и свежую продукцию с не просроченным сроком годности. Не покупать продукцию с рук, если есть сомнения по качеству продукта, необходимо попросить у продавца сопроводительные документы на покупаемый продукт (сертификат соответствия, ветеринарное свидетельство и др.).
Если в семье есть грудной ребенок, необходимо соблюдать гигиенические правила, рекомендуемые при уходе и кормлении новорожденного.
И главное если вы все-таки заболели нужно обратиться к врачу!
Врач-инфекционист Степанова Татьяна Леонидовна
границ | Врожденный противовирусный иммунитет кишечника и иммунобиотики: положительные эффекты против ротавирусной инфекции
Введение
Одной из основных причин детской смертности являются предотвратимые инфекционные заболевания (1, 2). Ротавирус (RV), калицивирус, астровирус и аденовирус относятся к вирусным этиологическим агентам гастроэнтерита у человека (3, 4). RV, вирус с голой двухцепочечной РНК (дцРНК), является наиболее частой причиной тяжелой дегидратирующей диареи у детей (5, 6).Основными симптомами гастроэнтерита RV являются тошнота, субфебрильная температура, рвота и острая водянистая диарея. Несмотря на то, что две пероральные вакцины, содержащие ослабленные живые вирусы, используются во всем мире, Rotarix (GlaxoSmithKline) и RotaTeq (Merck), эпидемия в развивающихся странах далека от контроля (6, 7). Эффективность вакцины снижается в развивающихся регионах, и некоторые возможные причины – это дети, инфицированные в раннем возрасте, высокая вирусная нагрузка и отсутствие переданных материнских антител (8, 9).
Некоторые штаммы молочнокислых бактерий (LAB) способны влиять на здоровье человека и животных, модулируя слизистую оболочку и системную иммунную систему. Эти иммунорегулирующие пробиотические LAB, известные как иммунобиотики, обеспечивают защиту от вирусных инфекций, модулируя врожденный и адаптивный противовирусный иммунитет. Таким образом, несколько сообщений показали, что иммунобиотические LAB сокращают продолжительность диареи, уменьшают количество эпизодов, уменьшают выделение RV, нормализуют проницаемость кишечника и увеличивают продукцию антител, специфичных для RV (10–12).
Цель этого обзора – предоставить обновленную информацию о текущем состоянии модуляции кишечного противовирусного врожденного иммунитета иммунобиотиками и их благотворном влиянии на инфекцию RV. Мы также выделяем некоторые результаты нашей группы, которые демонстрируют способность штаммов иммунобиотиков благотворно модулировать иммунный ответ, запускаемый toll-подобным рецептором (TLR) -3, в эпителиальных клетках кишечника (IEC), уменьшать нарушение гомеостаза кишечника, вызванное интраэпителиальными лимфоцитами. (IELs) и повысить устойчивость к инфекции RV.
Кишечный противовирусный врожденный иммунный ответ и ротавирус
После интернализации RV, капсид снимает оболочку, теряя VP4 и VP7, белки внешней поверхности, и дает транскрипционно активную двухслойную частицу. Одиннадцать сегментов вирусного генома дцРНК транскрибируются, управляя синтезом структурных и неструктурных белков и служащих матрицами для комплементарной цепи геномной РНК (13). IEC воспринимает вирусную дцРНК через рецепторы распознавания образов (PRR), такие как TLR3, ген-I, индуцируемый ретиноевой кислотой (RIG-I), и ген-5, связанный с дифференцировкой меланомы (MDA-5), и активируются клеточные сигнальные каскады. реагировать на вирусную инфекцию (14–16) (рис. 1).Один из основных врожденных ответов против вирусов дцРНК основан на активации этих PRR, что приводит к продукции цитокинов и хемокинов IECs и иммунными клетками. Таким образом, дцРНК RV запускает продукцию IL-8, IP-10, IL-6, TNF-α и IL-15 в IEC через TLR3-, RIG-I- и MDA5-активируемые пути, вызывая рекрутирование и активация макрофагов и NK-клеток и стимуляция адаптивного B- и T-клеточного иммунного ответа. В результате активации PRR также продуцируются интерфероны (IFN) и продукты генов, регулируемых IFN, и они играют ключевую роль в установлении антивирусного состояния для удаления вируса и ограничения распространения (рис. 1).IFN типа I и III ограничивают инфицирование RV in vitro , и их уровни повышаются у детей и животных, инфицированных RV (17–19). Оба семейства IFN немедленно продуцируются при инфицировании RV, вызывают ответы на различные типы рецепторов и регулируются во времени и пространстве в желудочно-кишечном тракте (20). Другое свидетельство того, что IFN имеют решающее значение для ограничения инфекции RV, основано на том факте, что этот вирус развил механизмы для манипулирования передачей сигналов IFN, такие как IFN типа I, подавляющие белок NSP1 (21).В то время как TLR3 в основном распознает вирусные компоненты, такие как вирусная нуклеиновая кислота, в эндосомных компартментах, RIG-I и MDA-5 распознают цитоплазматическую дцРНК. Эти пути сходятся на уровне регуляторного фактора ИФН-3 (IRF3) (18, 22, 23). После фосфорилирования IRF3 противовирусные ответы инициируют активацию IFN типа I, который, в свою очередь, вызывает синтез генов, стимулированных интерфероном (ISG), секрецию провоспалительных цитокинов, а также активацию и созревание антигенпрезентирующих клеток (APC) (Рисунок 2). .
Рисунок 1. Врожденный иммунный ответ против ротавируса в эпителиальных клетках кишечника (IEC) . Двухцепочечная геномная РНК ротавируса активирует толл-подобный рецептор 3 (TLR3), ген-I, индуцируемый ретиноевой кислотой (RIG-I), и ген-5, связанный с дифференцировкой меланомы (MDA-5), которые являются рецепторами распознавания образов (PRR). ), выраженные в МЭК. Клеточные сигнальные каскады активируются и сходятся на уровне регуляторного фактора-3 интерферона (IFN) (IRF3), который усиливает экспрессию IFN типа I (IFN-α, IFN-β) и типа III (IFNλ1, IFNλ2 / 3), что, в свою очередь, индуцирует синтез стимулированных IFN генов с противовирусной активностью (MxA, Mx1, RNase L, OAS, PKR).Противовирусные PRR также активируют путь ядерного фактора κB (NF-κB) и индуцируют секрецию провоспалительных цитокинов и хемокинов (IL-6, IL-8, MCP-1, CXCL10). Эти эффекты можно имитировать in vitro и in vivo путем введения синтетического аналога дцРНК поли (I: C).
Рисунок 2. Врожденный иммунный ответ против ротавируса в слизистой оболочке кишечника . Двухцепочечная геномная РНК ротавируса активирует толл-подобный рецептор 3 (TLR3), ген-I, индуцируемый ретиноевой кислотой (RIG-I), и ген-5, связанный с дифференцировкой меланомы (MDA-5), которые являются рецепторами распознавания образов (PRR). ) экспрессируется в эпителиальных клетках кишечника (IEC) и дендритных клетках (DC).Активация противовирусных PRR в слизистой оболочке кишечника увеличивает продукцию IFN типа I (IFN-α, IFN-β), IFN-γ, провоспалительных цитокинов и хемокинов (TNF-α, IL-6, IL-8, IL-12). , MCP-1), который улучшает антивирусное состояние в IEC, вызывает рекрутинг и активацию иммунных клеток и созревание DC. Эти эффекты можно имитировать in vitro и in vivo путем введения синтетического аналога дцРНК поли (I: C).
Poly (I: C), синтетический аналог дцРНК, при внутрибрюшинном введении мышам имитирует местный кишечный иммунный ответ, вызванный кишечной вирусной инфекцией (24, 25).И очищенная дцРНК RV, и поли (I: C) способны вызывать серьезные повреждения слизистой оболочки кишечника посредством активации TLR3 , включая атрофию ворсинок, эрозию слизистой оболочки и ослабление стенки кишечника (24). IELs, которые в основном представляют собой Т-клетки, распределенные в виде отдельных клеток в слое эпителиальных клеток, играют критическую роль в нарушении эпителиального гомеостаза, вызванного аномальной передачей сигналов TLR3 (Рисунок 3) (24). Благодаря своему ключевому расположению на границе между внутренней тканью кишечника и просветом, эти специализированные иммунные клетки важны как первая линия защиты от микробов и в поддержании гомеостаза эпителиального барьера.Большинство IEL – это CD8 + , которые просто классифицируются как CD8αα + или CD8αβ + . IEL CD8αβ + несут отличительные черты клеток адаптивного иммунитета, тогда как IEL CD8αα + считаются клетками врожденного иммунитета (26). Когда TLR3 ненормально активируется поли (I: C) и RV, геномная дцРНК, IL-15 и CD3 + NK1.1 + CD8αα + IELs участвуют в нарушении эпителиального гомеостаза. Кроме того, было продемонстрировано, что активация TLR3 в IECs индуцирует экспрессию ретиноевой кислоты ранней индуцибельной-1 (RAE1), которая опосредует разрушение эпителия и повреждение слизистой оболочки, взаимодействуя с рецептором NKG2D, экспрессируемым на IELs (27) (Рисунок 3).
Фигура 3. Воспалительное повреждение слизистой оболочки кишечника, вызванное ротавирусом в зависимости от toll-подобного рецептора 3-зависимого типа . И очищенная двухцепочечная геномная РНК ротавируса, и поли (I: C) вызывают тяжелое повреждение слизистой оболочки кишечника через активацию TLR3 и взаимодействие эпителиальных клеток кишечника (IEC) и интраэпителиальных лимфоцитов (IEL). Активация TLR3 в IEC увеличивает экспрессию провоспалительных цитокинов и хемокинов (MCP-1, IL-8, IL-15) и ранней индуцибельной-1 ретиноевой кислоты (RAE1).IL-15, продуцируемый IECs, индуцирует рекрутирование IEL CD3 + NK1.1 + CD8αα + , которые опосредуют разрушение эпителия и повреждение слизистой оболочки рецептором NKG2D, экспрессируемым на этих клетках, который способен распознавать RAE1. Это кишечное взаимодействие TLR3-IECs-IELs вызывает атрофию ворсинок, эрозию слизистой оболочки и ослабление стенки кишечника.
Таким образом, углубление нашего понимания того, как PRR, такие как TLR3, активируются и регулируются в иммунных клетках и IEC, может помочь в разработке эффективных методов лечения для профилактики и / или лечения вирусных заболеваний.
Благоприятные эффекты иммунобиотиков при ротавирусной инфекции
Несколько исследований показали, что иммунобиотики могут улучшить исход инфекции RV у людей и сельскохозяйственных животных.
Влияние иммунобиотиков на человека
Lactobacillus rhamnosus GG – вероятно, наиболее изученные пробиотические бактерии в контексте кишечных вирусных инфекций. Isolauri et al. (28) впервые за более чем 20 лет описали защитный эффект L.rhamnosus GG при гастроэнтерите RV у младенцев и детей. В этом исследовании пациенты, которые получали ферментированный молочный продукт L. rhamnosus GG или лиофилизированный порошок L. rhamnosus GG после пероральной регидратации, имели значительно более короткую продолжительность диареи по сравнению с группой плацебо. Позже Majamaa et al. (29) провели исследование, в котором дети в возрасте от 6 до 35 месяцев с гастроэнтеритом РВ получали либо L. rhamnosus GG, Lactobacillus acidophilus , либо комбинацию Streptococcus thermophilus с L.delbrückii subsp. bulgaricus два раза в день в течение 5 дней. Только у детей, получивших L. rhamnosus GG, продолжительность диареи была короче. Защитный эффект был связан с повышенной концентрацией кишечного и сывороточного IgA, а также с большим количеством специфических клеток, секретирующих антитела к RV. Дополнительные исследования показали, что потребление L. rhamnosus GG может сократить диарейную фазу у детей, страдающих инфекцией правых желудочков, эффект, который также был связан с повышенными концентрациями антител IgA (28–33).Кроме того, метаанализ показал, что введение L. rhamnosus GG госпитализированным детям снижает общую заболеваемость диареей, связанной с оказанием медицинской помощи, включая симптоматический гастроэнтерит, вызванный ПЖ (34). Несмотря на эти данные, важно отметить, что сокращение диареи уже на 3-й день после лечения пробиотиками убедительно свидетельствует о том, что основной терапевтический эффект связан с врожденными иммунными ответами, а не с модуляцией адаптивного иммунитета (35).
Другим примером лечения пробиотиками для облегчения гастроэнтерита, вызванного RV, было использование Lactobacillus reuteri , которое ежедневно вводили госпитализированным детям с острой диареей на протяжении госпитализации (до 5 дней). L. reuteri сократил как продолжительность диареи правого желудочка, так и тяжесть заболевания по сравнению с группой плацебо (36). L. sporogenes , ежедневно вводимая новорожденным в течение 1 года, предотвратила заболеваемость, а также уменьшила продолжительность острой диареи правого желудочка (37). Fang et al. (38) продемонстрировали, что минимальная эффективная доза L. rhamnosus значительно снижает концентрацию фекальных выделений RV у педиатрических пациентов. Хотя введение лиофилизированного штамма Lactobacillus paracasei ST11 ежедневно в течение 5 дней имело клинически значимое преимущество в лечении диареи, не вызванной RV, лечение ST11 против тяжелой диареи RV было неэффективным (39).Дети с инфекцией правого желудочка, получавшие молочную смесь с добавлением либо B. animalis Bb12, либо в сочетании с S. thermophilus , имели меньшее количество инфекций, вызванных RV (40).
В Аргентине инфекции слизистых оболочек, такие как бронхит и диарея, являются наиболее распространенными инфекционными заболеваниями у детей (41–43). В рандомизированном контролируемом исследовании, проведенном Villena et al. (44), L. rhamnosus CRL1505 (вводимый в составе йогурта) улучшал иммунитет слизистых оболочек и снижал частоту и тяжесть кишечных и респираторных инфекций у детей.Следовательно, частота инфекционных событий снизилась с 66% в группе плацебо до 34% в группе, получавшей пробиотический йогурт. Кроме того, также наблюдалось значительное снижение показателей тяжести заболевания, таких как лихорадка и необходимость лечения антибиотиками у детей, получавших пробиотический йогурт (44). Таким образом, результаты этого исследования показали, что потребление йогурта, содержащего L. rhamnosus CRL1505, помогло снизить бремя распространенных детских заболеваний, особенно связанных с вирусными инфекциями, включая RV (44).
Влияние иммунобиотиков на домашний скот
Помимо положительного воздействия иммунобиотиков на людей, в некоторых исследованиях оценивалась их противовирусная и противовоспалительная активность на животных. Zhang et al. (45) сообщили, что введение пробиотиков свиньям-гнотобиотам, зараженным RV, не вызывало различий в титрах вирусов по сравнению с группой плацебо. Тем не менее, введение LAB подавляло рекрутирование активированных вирусами моноцитов / макрофагов в кишечном тракте, тем самым ограничивая воспаление, вызванное вирусом (45).
В другом исследовании было показано, что системные ответы моноцитов / макрофагов и APC модулируются иммунобиотиками в контексте инфекции RV (45). Пробиотические LAB индуцировали сильные TLR2-экспрессирующие APC-ответы в крови и селезенке, RV индуцировали TLR3-ответ в селезенке, а TLR9-ответы были индуцированы RV (как измерено в иммунных клетках, выделенных из селезенки) и LAB (как определено в циркулирующих в крови иммунных клетках) . Иммунобиотики и RV оказывали аддитивный эффект на ответы APC, экспрессирующие TLR2 и TLR9, что согласуется с адъювантным эффектом LAB.Иммунобиотики увеличивали уровни IFN-γ и IL-4 в сыворотке, но подавляли TLR3- и TLR9-экспрессирующие APC-ответы в селезенке и сывороточный IFN-α-ответ, индуцированный вирулентными RV (46).
Во время инфекций RV у свиней-отъемышей есть свидетельства нарушения барьерной функции, о чем свидетельствуют уменьшение высоты ворсинок и глубины крипт, более низкие уровни IgA, IL-4 и муцина 1, а также снижение транскрипции ZO-1, окклюдин и Bcl-2 в слизистой оболочке тощей кишки (47). Некоторые из этих эффектов были частично связаны с изменениями продукции трансформирующего фактора роста (TGF) -β (48).Азеведо и др. (48) продемонстрировали, что иммунобиотические LAB дополнительно усиливают ответы цитокинов Th2 и Th3 на инфекцию RV, на что указывают значительно более высокие концентрации IL-12, IFN-γ, IL-4 и IL-10 у свиней-гнотобиотиков, инфицированных RV. LAB также помогает поддерживать иммунологический гомеостаз во время инфекции RV, регулируя продукцию TGF-β. Также было показано, что обработка свиней L. rhamnosus GG модулировала TGF-β и способствовала усилению плотных контактов кишечного эпителия, что может способствовать сохранению и восстановлению гомеостаза кишечника после инфицирования RV (11).О дополнительных доказательствах сообщили Maragkoudakis et al. (12) демонстрируют, что Lactobacillus casei, Shirota и L. rhamnosus GG защищают эпителиальные клетки свиней и коз от RV и других вирусов трансмиссивного гастроэнтерита.
Клеточные и молекулярные механизмы действия иммунобиотиков
Взаимодействие IEC с люминальными антигенами и иммунными клетками играет центральную роль в определении типа иммунного ответа, запускаемого кишечными микроорганизмами (5, 6).Важнейшим и практически универсальным ранним врожденным ответом клеток-хозяев на вирусную инфекцию является секреция факторов, принадлежащих к семейству IFN. Секреция IFN приводит к экспрессии нескольких продуктов ISG с противовирусной активностью.
Мы показали в различных исследованиях, что первоначально созданная линия эпителиальных клеток кишечника свиней (клетки PIE) является полезным инструментом для изучения ответа IFN, запускаемого активацией TLR3, RIG-I и / или MDA-5. Эти клетки являются пермиссивными для свиней RV, а также отвечают на дцРНК и ее синтетический аналог поли (I: C) (49, 50).Кроме того, совместные культуры клеток PIE с иммунными клетками, выделенными из свиных пятен Пейера (PP), обеспечивают систему in vitro для изучения трансдукции сигнала от его обнаружения IEC на воздействие на лежащие под ними иммунные клетки.
Была оценена реакция клеток PIE на заражение поли (I: C), и было обнаружено, что МСР-1, ИЛ-8, TNF-α, ИЛ-6, а также IFN-α и IFN-β были активированы в Клетки PIE после стимуляции (49). Мы также показали, что после стимуляции совместных культур поли (I: C) в иммунных клетках наблюдалась повышенная регуляция IFN-α, IFN-β, IFN-γ, IL-2 и IL-12p40 (49).TLR3 был рецептором, участвующим в распознавании люминального стимула, и ответственным за запуск экспрессии и высвобождения цитокинов, которые, в свою очередь, активировали основные APC и эффекторные лимфоциты.
Ротавирусная инфекция стимулирует экспрессию IFN-β и раннего антивирусного гена с помощью сигнального пути, который требует MAVS, адаптивного белка, который рекрутируется в сигнальные комплексы после активации RIG-I или MDA-5 (51, 52). Кроме того, как RIG-I, так и MDA-5 участвуют в распознавании инфекции RV, что доказано снижением индукции IFN-β при потере этих факторов (51, 52).Принимая во внимание эти факты, мы оценили пригодность клеток PIE и совместных культур в качестве моделей для изучения этого сигнального пути после инфицирования RV. Наши результаты показали, что клетки PIE имеют функциональные рецепторы TLR3, RIG-I и MDA-5, которые передают сигнал через IRF3 и NF-κB, индуцируя IFN-β и повышая регуляцию ISG MxA и РНКазы L (50), которые являются важными противовирусными эффекторами пути IFN.
Мы использовали клетки PIE для скрининга иммунобиотических штаммов LAB с учетом их способности усиливать продукцию IFN-β при стимуляции поли (I: C) (49, 53).Таким образом, был выбран L. casei MEP221106 из-за его способности воздействовать на вирусные кишечные инфекции. L. casei MEP221106 обладал наивысшей способностью улучшать продукцию IFN-β в поли (I: C) -сложных клетках PIE. Более того, эксперименты по совместному культивированию in vitro и показали, что L. casei MEP221106 может улучшать не только продукцию IFN-β, но и уровни других цитокинов, включая IFN-α, TNF-α, MPC-1, и Ил-6. В совместных культурах клеток PIE с иммунными клетками мы продемонстрировали, что L.casei MEP221106 улучшил продукцию воспалительных и противовирусных цитокинов клетками PPs по сравнению с контрольными клетками (49).
Система PIE также использовалась для скрининга штаммов бифидобактерий с эффектом против RV (50). Bifidobacterium infantis MCC12 и Bifidobacterium breve MCC1274 были выбраны при скрининге, поскольку они значительно повышали регуляцию IFN-β в ответ на провокацию поли (I: C). Кроме того, оба штамма MCC12 и MCC1274 значительно повышали устойчивость клеток PIE к инфекции RV (рис. 4), в то время как другие штаммы с умеренным эффектом или отсутствием эффекта на продукцию IFN-β не оказывали никакого влияния на репликацию RV (50).В результате повышенных уровней IFN-β имело место сопутствующее усиление регуляции ISG MxA и РНКазы L. Эти эффекторы противовирусного иммунитета имеют разные механизмы действия: РНКаза L разрушает дцРНК, а полученные фрагменты РНК активируют RLR для усиления продукции IFN. и вызывают апоптоз на инфицированных вирусом клетках (54), в то время как MxA захватывает вновь синтезированные вирусные белки в перинуклеарные комплексы. Тогда повышающая регуляция MxA, РНКазы L и, возможно, других ISG, индуцированная штаммами MCC12 и MCC1274 через IFN-β, будет связана с более низкой репликацией RV, обнаруженной в обработанных бифидобактериями клетках PIE.Это подтверждается тем фактом, что IFN-β является ключевым фактором для улучшения защиты от RV, поскольку репликация вируса ограничивается в пермиссивных клетках, когда они предварительно обрабатываются IFN-β (55). Соответственно, обработка IFN-β новорожденных телят и поросят до инфицирования RV снижает репликацию вируса и тяжесть заболевания (56).
Рис. 4. Благоприятное влияние иммунобиотических бифидобактерий на врожденный иммунный ответ против ротавируса в эпителиальных клетках кишечника (IEC) .Двухцепочечная геномная РНК ротавируса активирует толл-подобный рецептор 3 (TLR3), ген-I, индуцируемый ретиноевой кислотой (RIG-I), и ген-5, связанный с дифференцировкой меланомы (MDA-5), которые являются рецепторами распознавания образов (PRR). ), выраженные в МЭК. Клеточные сигнальные каскады, опосредованные регуляторным фактором-3 интерферона (IFN) (IRF3), повышают экспрессию IFN типа I (IFN-α, IFN-β) и типа III (IFNλ1, IFNλ2 / 3), что, в свою очередь, индуцирует синтез стимулированных IFN генов с противовирусной активностью (MxA, Mx1, RNase L, OAS, PKR).Противовирусные PRR также активируют путь ядерного фактора κB (NF-κB) и индуцируют секрецию провоспалительных цитокинов и хемокинов (IL-6, MCP-1, CXCL10). Профилактическое лечение IEC Bifidobacterium infantis MCC12 или Bifidobacterium breve MCC1274 снижает экспрессию A20, увеличивает активацию IRF3, улучшает продукцию противовирусных факторов IFN-α, IFN-β, MxA и РНКазы L, а также дифференциально регулируют экспрессию IL-6, MCP-1 и CXCL10.
Некоторые цитокины индуцируются посредством передачи сигналов NF-κB в результате инфекции RV, включая IL-8, RANTES, GM-CSF, GRO-α, MIP-1β и IP-10 (57), что наблюдается в обоих случаях. клеточные линии и гистологические образцы кишечника.Секретируемые цитокины инициируют важную первичную линию защиты хозяина, но если этот ответ длится слишком долго или не регулируется, он может привести к повреждению тканей и дисфункции эпителиального барьера. В связи с этим мы сообщали, что эффективная регуляция воспалительного ответа, вызванного иммунобиотическими бактериями, необходима для достижения полной защиты от патогенов (58, 59). В соответствии с этим мы также показали, что штаммы бифидобактерий MCC12 и MCC1274 по-разному модулируют продукцию провоспалительных медиаторов в клетках PIE, инфицированных RV (рис. 4) (50).
Негативные регуляторы Toll-подобных рецепторов играют ключевую роль в поддержании гемостаза в кишечнике, регулируя передачу сигналов TLR. Белок цинкового пальца A20, благодаря своей деубиквитиназной и убиквитиназной лигазной активности E3, способен прекращать передачу сигналов TLR, что приводит к ингибированию активации NF-κB и снижению цитотоксичности, вызванной воспалением (60). Сайто и др. (61) сообщили, что активация IRF3 подавляется A20. Белок A20 способен вызывать подавление IFN-опосредованного иммунного ответа и IFN-промотор-зависимой транскрипции путем физического взаимодействия с IKK-i / IKKϵ и ингибирования димеризации IRF3 после вовлечения TLR3 дцРНК.Более того, нокдаун A20 приводит к усилению IRF3-зависимой транскрипции, запускаемой стимуляцией TLR3 или вирусной инфекции. Дендритные клетки (DC) человека, происходящие из моноцитов, стимулированные поли (I: C), активируют A20. Когда A20 подавляется в DC, они показывают более высокую активацию NF-κB и AP-1, что приводит к увеличению и устойчивой продукции IL-6, IL-10 и IL-12p70. Кроме того, DC усиливали стимулирующую способность Т-лимфоцитов (62). Отрицательные регуляторы, участвующие в передаче сигналов TLR, могут модулироваться иммунобиотическими штаммами в клеточных линиях кишечника человека (63).В связи с этим мы также сообщили, что как B. infantis MCC12, так и B. breve MCC1274 значительно снижали экспрессию A20 в инфицированных RVs PIE-клетках (Рисунок 4) (50), что соответствует способности оба штамма для улучшения активации IRF3 и продукции IFN-β. В соответствии с нашими выводами, MacPherson et al. (64) также изучали влияние пробиотиков на модуляцию вызванного поли (I: C) воспалительного ответа в клетках HT-29. Стимуляция клеток HT29 одним поли (I: C) увеличивала экспрессию A20, но совместная стимуляция поли (I: C) и пробиотиками значительно снижала уровни экспрессии A20.
Мы также использовали эти системы свиней in vitro для получения более глубоких знаний о механизмах, участвующих в иммуномодулирующем эффекте L. rhamnosus CRL1505, и сосредоточили свое внимание на перекрестных помехах между штаммом иммунобиотиков и IECs и APC свиней, чтобы объяснить его способность уменьшать количество эпизодов вирусной диареи у детей (44). Кроме того, мы провели сравнительные исследования с другим штаммом иммунобиотиков, Lactobacillus plantarum CRL1506, который способен стимулировать кишечный иммунитет на животных моделях (65).Исследования, сравнивающие иммунобиотические штаммы L. rhamnosus CRL1505 и L. plantarum CRL1506 в совместных культурах клеток PIE и APC, стимулированных поли (I: C), показали, что оба штамма улучшают продукцию IFN типа I в ответ. на поли (I: C) вызов (66). Кроме того, штаммы CRL1505 и CRL1506 модулировали экспрессию провоспалительных и регуляторных цитокинов и влияли на активацию и созревание APC (рис. 5). Однако L. rhamnosus CRL1505 оказывал более сильное действие как при применении отдельно, так и в сочетании с задним поли (I: C) провокацией.Об улучшении ответа Th2, индуцированного иммунобиотическими лактобациллами, свидетельствует усиленная экспрессия MHC-II, IL-1β, IL-6 и IFN-γ в DC (66, 67). Эти исследования дали научную основу для объяснения защиты от кишечных вирусных инфекций, обеспечиваемой L. rhamnosus CRL1505 у детей.
Рисунок 5. Благоприятное влияние иммунобиотических лактобацилл на врожденный иммунный ответ против ротавируса в слизистой оболочке кишечника . Двухцепочечная геномная РНК ротавируса или поли (I: C) активирует толл-подобный рецептор 3 (TLR3), ген-I, индуцируемый ретиноевой кислотой (RIG-I), и ген-5, связанный с дифференцировкой меланомы (MDA-5), которые представляют собой рецепторы распознавания образов (PRR), экспрессируемые в эпителиальных клетках кишечника (IEC) и дендритных клетках (DC).Активация противовирусных PRR увеличивает продукцию IFN-α, IFN-β, IFN-γ, провоспалительных цитокинов и хемокинов (TNF-α, IL-6, IL-8, IL-12, MCP-1), что улучшает антивирусное состояние в IECs, вызывает набор и активацию иммунных клеток и созревание DC. Кроме того, как очищенная геномная дцРНК ротавируса, так и поли (I: C) активируют TLR3 в IEC, повышая экспрессию IL-15 и ранней индуцибельной-1 ретиноевой кислоты (RAE1). IL-15, продуцируемый IEC, индуцирует рекрутирование CD3 + NK1.1 + CD8αα + интраэпителиальных лимфоцитов (IELs), которые опосредуют разрушение эпителия и повреждение слизистой оболочки рецептором NKG2D, экспрессируемым на этих клетках, который способен распознавать RAE1. Профилактическое лечение с помощью Lactobacillus rhamnosus CRL1505 или Lactobacillus plantarum CRL1506 улучшает выработку IFN типа I и IFN-γ в слизистой оболочке кишечника, усиливая противовирусное состояние и дифференцированно регулируя экспрессию воспалительных цитокинов и хемокинов, особенно уменьшая кишечное повреждение. с взаимодействием TLR3 – IECs – IELs.
Рецепторы, которые активируются штаммами иммунобиотиков с противовирусными свойствами, штаммами MEP221106, MCC12, MCC1274, CRL1505 и CRL1506 в клетках PIE для уменьшения A20, улучшения активации IRF-3 и увеличения продукции IFN-β еще предстоит выяснить. Штаммы бифидобактерий с высокой способностью стимулировать TLR2, такие как B. longum BB536 и B. breve M-16V, были способны увеличивать экспрессию A20 в клетках PIE и снижать TLR4-опосредованный воспалительный ответ (68, 69).Напротив, штаммы с низкой способностью стимулировать TLR2 не изменяли экспрессию убиквитин-редактирующего фермента A20 в клетках PIE, зараженных агонистами TLR4. В наших экспериментах мы не смогли заблокировать увеличение IFN-β, вызванное лактобациллами и бифидобактериями, с помощью антител против TLR2 или против TLR9, что позволяет предположить, что другие рецепторы участвуют в иммунобиотической активности (66). Необходимы дальнейшие исследования, чтобы найти PRR, участвующие в распознавании лактобацилл и бифидобактерий, что приводит к модуляции A20 и IFN-β в клетках PIE.
Недавно мы подтвердили in vivo дифференциальную противовирусную иммуномодулирующую активность, запускаемую L. rhamnosus CRL1505 и L. plantarum CRL1506 (65). Оба штамма увеличивали продукцию IFN, причем обработка CRL1505 была наиболее эффективной для повышения уровней IFN-γ. Затем наши результаты предполагают, что эти два штамма лактобацилл могут быть использованы для улучшения исходов вирусных желудочно-кишечных заболеваний. Это также подтверждается клиническими испытаниями на людях, демонстрирующими емкость л.rhamnosus CRL1505 для улучшения показателей инфекционных заболеваний у детей (70). Недавно Zhang et al. (71) предложили активацию врожденного иммунитета флагеллином в качестве профилактической и терапевтической стратегии против инфекции RV. Они продемонстрировали, что внутрибрюшинная инъекция флагеллина снижает тяжесть и выделение РНК RVs у мышей с острой и хронической инфекцией посредством активации TLR5 / NLRC4, что приводит к секреции IL-22 и IL-18 различными эффекторными клетками. Хотя механизм действия введения флагеллина существенно отличается от механизмов, вызываемых иммунобиотиками, оба подхода основаны на принципе борьбы с вирусной инфекцией путем усиления врожденной иммунной защиты.
Lactobacillus rhamnosus CRL1505 и L. plantarum CRL1506 также снижали TLR3-индуцированное повреждение тонкого кишечника за счет регуляции продукции провоспалительных цитокинов и взаимодействия IECs – IELs (65) (Рисунок 5). IEC и IEL являются первой линией защиты от патогенов, включая вирусы, и их взаимодействие важно для поддержания соответствующего иммунологического гомеостаза. IEC продуцируют множество цитокинов и хемокинов, включая IL-6, IL-7, IL-8, IL-15, TNF-α, TGF-β и GM-CSF.IL-15 действует как медиатор TLR3-индуцированного повреждения тонкого кишечника (24). Аномальная передача сигналов TLR3 приводит к повышенным уровням IL-15, который регулирует апоптоз IEC путем активации перфорин-опосредованного уничтожения CD3 + NK1.1 + IEL (70). Более того, IL-15 способен усиливать цитотоксическую активность IEL человека (72). Блокирование α-рецептора IL-15 частично защищает мышей от вызванного поли (I: C) повреждения тонкого кишечника, включая меньшую атрофию ворсинок и эрозию слизистой оболочки (24).Аутологичные лиганды, высвобождаемые клеточным стрессом и инфекцией, распознаются рецептором NKG2D в NK-клетках. Экспрессия лигандов NKG2D подавляется микробиотой кишечника, как показано на стерильных мышах, у которых была повышена поверхностная экспрессия этих лигандов (73). RAE1, лиганд NKG2D с высоким сродством, который минимально обнаруживается в нормальных клетках, активируется при активации TLR3. Фактически, блокада взаимодействия NKG2D-RAE1 позволяет избежать цитотоксического действия IELs на IECs и предотвращает острое повреждение тонкого кишечника у мышей, зараженных дцРНК (27).Следовательно, передача сигналов TLR3 стимулирует IECs для экспрессии IL-15 и RAE1 и индуцирует IEL CD3 + NK1.1 + CD8αα + для экспрессии NKG2D через IL-15, производный от IEC. В наших руках обработка мышей поли (I: C) увеличивала повреждение кишечника в зависимости от IL-15 и CD8αα + NKG2D + (65). Поли (I: C) индуцировал опосредованное воспалением повреждение кишечной ткани за счет увеличения CD3 + NK1.1 + и CD8αα + NKG2D + клеток, а также провоспалительных медиаторов (TNF-α, IL-1β). , IFN-γ, IL-15, RAE1, IL-8).Мыши, предварительно обработанные иммунобиотическими лактобациллами до активации TLR3, ответили снижением уровней TNF-α, IL-15, RAE1, CD3 + NK1.1 + , CD3 + CD8αα + и CD8αα + NKG2D + ячеек (рисунок 5). Благоприятный эффект этих лактобацилл улучшил здоровье мышей, о чем свидетельствует значительное снижение потери веса тела и повреждения тканей кишечника после провокации поли (I: C) (65).
Хорошо известно, что комменсальные бактерии в кишечнике способны модулировать функцию IELs.Кроме того, IELs значительно снижены у мышей без микробов (74, 75), что определяет важность микробиоты кишечника в поддержании IELs. Эти специализированные лимфоциты играют очень важную роль в защите слизистой оболочки; они, по-видимому, занимают уникальную временную нишу, из которой могут обнаруживать и ограничивать проникновение бактерий уже в первые часы после атаки патогена (76). Исмаил и др. (76) показали, что антибактериальный ответ IEL зависит от бактериальной стимуляции MyD88-зависимой передачи сигналов.Позже Цзян и др. (77) исследовали роль передачи сигналов NOD2 в поддержании IELs и обнаружили, что NOD2 поддерживает IELs посредством распознавания кишечной микробиоты. Они продемонстрировали, что стимуляция IEL требует активации передачи сигналов PRR в соседних IEC (76, 77).
Таким образом, было показано, что комменсальные бактерии создают регуляторную среду в здоровом кишечнике с повышенной экспрессией иммуно-ингибирующих цитокинов, таких как TGF-β и IL-10, которые, в свою очередь, подавляют поверхностную экспрессию лиганда NKG2D (78, 79).Это согласуется с нашими выводами для иммуномодулирующих штаммов L. rhamnosus CRL1505 и L. plantarum CRL1506, которые снижали экспрессию RAE-1 и повышали уровни кишечного IL-10. Вызываются ли иммуномодулирующие эффекты L. rhamnosus CRL1505 и L. plantarum CRL1506 прямым действием на IEC (косвенно на IEL) и / или прямым влиянием на IEL – открытый вопрос, который мы предлагаем рассмотреть в ближайшее будущее.
Заключение
Подробная характеристика клеточных и молекулярных механизмов, лежащих в основе врожденной защиты кишечника от инфекции RV, достигнутая за последние годы, открыла новые пути для разработки стратегий профилактики и лечения этой вирусно-индуцированной диареи.В этом смысле использование иммунобиотических бактерий для благоприятной модуляции IFN и воспалительных сигнальных путей в IEC и иммунных клетках является привлекательной мишенью для профилактического или терапевтического вмешательства против инфекции RV. Кроме того, успехи в изучении молекулярных перекрестных помех между иммунобиотиками и врожденной иммунной системой кишечника пролили свет на сигналы чувствительности к микроорганизмам, которые позволяют этим полезным микроорганизмам улучшать иммунные ответы кишечника. Эта новая молекулярная информация может быть полезна для улучшения разработки функциональных пищевых продуктов и / или фармабиотиков с использованием иммунобиотиков, направленных на снижение смертности и тяжести заболевания RV.
Авторские взносы
JV, MV-P и HK разработали, написали и отредактировали обзорную статью.
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Финансирование
Это исследование было поддержано грантом на научные исследования (B) (2) (№ 16H05019), Challenging Exploratory Research (No.16K15028), а также совместные проекты открытого партнерства двусторонних совместных исследовательских проектов JSPS от Японского общества содействия науке (JSPS) доктору HK. Это исследование было поддержано грантом ANPCyT – FONCyT PICT-2013 (№ 3219) доктору СП.
Список литературы
1. Брайс Дж., Блэк Р. Э., Уокер Н., Бхутта З. А., Лаун Дж. Э., Стекети Р. У. Может ли мир позволить ежегодно спасать жизни 6 миллионов детей? Ланцет (2005) 365 (9478): 2193–200. DOI: 10.1016 / S0140-6736 (05) 66777-3
PubMed Аннотация | CrossRef Полный текст | Google Scholar
2.Брайс Дж., Виктора К.Г. Выживание детей: обратный отсчет до 2015 года. Lancet (2005) 365 (9478): 2153–4. DOI: 10.1016 / S0140-6736 (05) 66752-9
CrossRef Полный текст | Google Scholar
4. Тран А., Талмуд Д., Лежен Б., Джовенен Н., Ренуа Ф., Паян С. и др. Распространенность ротавирусных, аденовирусных, норовирусных и астровирусных инфекций и коинфекций среди госпитализированных детей в северной Франции. J Clin Microbiol (2010) 48 (5): 1943–6. DOI: 10.1128 / JCM.02181-09
PubMed Аннотация | CrossRef Полный текст | Google Scholar
7.Тейт Дж. Э., Патель М. М., Кортезе М. М., Лопман Б. А., Генч Дж. Р., Флеминг Дж. И др. Сохраняющиеся вопросы и проблемы для ротавирусной вакцины в предотвращении глобальной детской диарейной заболеваемости и смертности. Expert Rev Vaccines (2012) 11 (2): 211–20. DOI: 10.1586 / erv.11.184
PubMed Аннотация | CrossRef Полный текст | Google Scholar
10. Басу С., Пол Д. К., Гангули С., Чаттерджи М., Чандра П. К.. Эффективность высоких доз Lactobacillus rhamnosus GG в борьбе с острой водянистой диареей у индийских детей: рандомизированное контролируемое исследование. J Clin Gastroenterol (2009) 43 (3): 208–13. DOI: 10.1097 / MCG.0b013e31815a5780
PubMed Аннотация | CrossRef Полный текст | Google Scholar
11. Лю Ф., Ли Дж., Вэнь К., Буй Т., Цао Д., Чжан И и др. Линия эпителиальных клеток тонкого кишечника свиней (IPEC-J2) ротавирусной инфекции как новая модель для изучения врожденного иммунного ответа на ротавирусы и пробиотики. Viral Immunol (2010) 23 (2): 135–49. DOI: 10.1089 / vim.2009.0088
PubMed Аннотация | CrossRef Полный текст | Google Scholar
12.Maragkoudakis PA, Chingwaru W., Gradisnik L, Tsakalidou E, Cencic A. Молочнокислые бактерии эффективно защищают эпителиальные и иммунные клетки кишечника человека и животных от кишечной вирусной инфекции. Int J Food Microbiol (2010) 141 (Дополнение 1): S91–7. DOI: 10.1016 / j.ijfoodmicro.2009.12.024
PubMed Аннотация | CrossRef Полный текст | Google Scholar
14. Frias AH, Jones RM, Fifadara NH, Vijay-Kumar M, Gewirtz AT. Индуцированный ротавирусом IFN-бета способствует передаче антивирусных сигналов и апоптозу, которые модулируют репликацию вируса в эпителиальных клетках кишечника. Врожденный иммунитет (2012) 18 (2): 294–306. DOI: 10.1177 / 1753425
1930
CrossRef Полный текст | Google Scholar
15. Фриас А.Х., Виджай-Кумар М., Генч Дж. Р., Кроуфорд С.Е., Карвалью Ф.А., Эстес М.К. и др. Кишечный эпителий активирует передачу антивирусных сигналов посредством внутриклеточного восприятия структурных компонентов ротавируса. Иммунол слизистой оболочки (2010) 3 (6): 622–32. DOI: 10,1038 / mi.2010.39
PubMed Аннотация | CrossRef Полный текст | Google Scholar
17.Сен А., Ротенберг М.Э., Мукерджи Г., Фенг Н., Калиски Т., Наир Н. и др. Врожденный иммунный ответ на гомологичную ротавирусную инфекцию в ворсинчатом эпителии тонкой кишки при одноклеточном разрешении. Proc Natl Acad Sci U S. A (2012) 109 (50): 20667–72. DOI: 10.1073 / pnas.1212188109
PubMed Аннотация | CrossRef Полный текст | Google Scholar
20. Lin JD, Feng N, Sen A, Balan M, Tseng HC, McElrath C, et al. Различная роль интерферонов типа I и типа III в кишечном иммунитете к гомологичным и гетерологичным ротавирусным инфекциям. PLoS Pathog (2016) 12 (4): e1005600. DOI: 10.1371 / journal.ppat.1005600
PubMed Аннотация | CrossRef Полный текст | Google Scholar
21. Барро М., Паттон Дж. Т.. Ротавирус NSP1 подавляет экспрессию интерферона I типа, противодействуя функции факторов регуляции интерферона IRF3, IRF5 и IRF7. J Virol (2007) 81 (9): 4473–81. DOI: 10.1128 / JVI.02498-06
PubMed Аннотация | CrossRef Полный текст | Google Scholar
22. Loo YM, Fornek J, Crochet N, Bajwa G, Perwitasari O, Martinez-Sobrido L, et al.Различная передача сигналов RIG-I и MDA5 вирусами РНК при врожденном иммунитете. J Virol (2008) 82 (1): 335–45. DOI: 10.1128 / JVI.01080-07
PubMed Аннотация | CrossRef Полный текст | Google Scholar
24. Zhou R, Wei H, Sun R, Tian Z. Распознавание двухцепочечной РНК с помощью TLR3 вызывает тяжелое повреждение тонкой кишки у мышей. J Immunol (2007) 178 (7): 4548–56. DOI: 10.4049 / jimmunol.178.7.4548
PubMed Аннотация | CrossRef Полный текст | Google Scholar
25.Арая Р.Э., Жюри Дж., Бондарь С., Верду Э. Ф., Чирдо Ф. Г.. Внутрипросветное введение поли I: C вызывает энтеропатию, которая обостряется при пероральном введении диетического антигена. PLoS One (2014) 9 (6): e99236. DOI: 10.1371 / journal.pone.0099236
PubMed Аннотация | CrossRef Полный текст | Google Scholar
26. Шайрс Дж., Теодоридис Э., Хейдей А.С. Биологические данные об интраэпителиальных лимфоцитах TCRgammadelta + и TCRalphabeta + получены с помощью серийного анализа экспрессии генов (SAGE). Иммунитет (2001) 15 (3): 419–34. DOI: 10.1016 / S1074-7613 (01) 00192-3
PubMed Аннотация | CrossRef Полный текст | Google Scholar
27. Zhou R, Wei H, Sun R, Zhang J, Tian Z. Распознавание NKG2D опосредует индуцированное сигналом toll-подобного рецептора 3 нарушение эпителиального гомеостаза в тонком кишечнике мышей. Proc Natl Acad Sci U S. A (2007) 104 (18): 7512–5. DOI: 10.1073 / pnas.0700822104
PubMed Аннотация | CrossRef Полный текст | Google Scholar
28.Isolauri E, Juntunen M, Rautanen T., Sillanaukee P, Koivula T. Человеческий штамм Lactobacillus ( Lactobacillus casei sp штамм GG) способствует выздоровлению от острой диареи у детей. Педиатрия (1991) 88 (1): 90–7.
PubMed Аннотация | Google Scholar
29. Majamaa H, Isolauri E, Saxelin M, Vesikari T. Молочнокислые бактерии в лечении острого ротавирусного гастроэнтерита. J Pediatr Gastroenterol Nutr (1995) 20 (3): 333–8. DOI: 10.1097 / 00005176-199504000-00012
PubMed Аннотация | CrossRef Полный текст | Google Scholar
31. Кайла М., Изолаури Э., Соппи Э., Виртанен Э., Лайне С., Арвиломми Х. Усиление ответа циркулирующих клеток, секретирующих антитела, при диарее человека с помощью штамма Lactobacillus человека. Pediatr Res (1992) 32 (2): 141–4. DOI: 10.1203 / 00006450-199208000-00002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
32. Шорникова А.В., Касас И.А., Микканен Х., Сало Э., Весикари Т.Бактериотерапия Lactobacillus reuteri при ротавирусном гастроэнтерите. Pediatr Infect Dis J (1997) 16 (12): 1103–7. DOI: 10.1097 / 00006454-199712000-00002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
33. Гуарино А., Канани Р. Б., Спаньоло М. И., Альбано Ф., Ди Бенедетто Л. Оральная бактериальная терапия сокращает продолжительность симптомов и сокращает вирусную экскрецию у детей с легкой диареей. J Pediatr Gastroenterol Nutr (1997) 25 (5): 516–9.DOI: 10.1097 / 00005176-199711000-00005
PubMed Аннотация | CrossRef Полный текст | Google Scholar
34. Szajewska H, Wanke M, Patro B. Мета-анализ: эффекты добавки Lactobacillus rhamnosus GG для профилактики диареи, связанной со здоровьем у детей. Aliment Pharmacol Ther (2011) 34 (9): 1079–87. DOI: 10.1111 / j.1365-2036.2011.04837.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
35. Власова А.Н., Кандасами С., Чатта К.С., Раджашекара Г., Саиф Л.Дж.Сравнение эффектов пробиотических лактобацилл и бифидобактерий, иммунных ответов и ротавирусных вакцин и инфекции у разных видов хозяев. Vet Immunol Immunopathol (2016) 172: 72–84. DOI: 10.1016 / j.vetimm.2016.01.003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
36. Шорникова А.В., Касас И.А., Изолаури Э., Микканен Х., Весикари Т. Lactobacillus reuteri как лечебное средство при острой диарее у детей раннего возраста. J Pediatr Gastroenterol Nutr (1997) 24 (4): 399–404.DOI: 10.1097 / 00005176-199704000-00008
PubMed Аннотация | CrossRef Полный текст | Google Scholar
37. Чандра РК. Влияние Lactobacillus на частоту и тяжесть острой ротавирусной диареи у младенцев. Проспективное плацебо-контролируемое двойное слепое исследование. Nutr Res (2002) 22: 65–9. DOI: 10.1016 / S0271-5317 (01) 00367-0
CrossRef Полный текст | Google Scholar
38. Fang SB, Lee HC, Hu JJ, Hou SY, Liu HL, Fang HW. Дозозависимый эффект Lactobacillus rhamnosus на количественное снижение фекального выделения ротавируса у детей. J Trop Pediatr (2009) 55 (5): 297–301. DOI: 10.1093 / tropej / fmp001
PubMed Аннотация | CrossRef Полный текст | Google Scholar
39. Саркер С.А., Султана С., Фукс Г.Дж., Алам Н.Х., Азим Т., Брюссов Х. и др. Lactobacillus paracasei штамм ST11 не влияет на ротавирус, но улучшает исход неротавирусной диареи у детей из Бангладеш. Педиатрия (2005) 116 (2): e221–8. DOI: 10.1542 / педс.2004-2334
PubMed Аннотация | CrossRef Полный текст | Google Scholar
40.Фуапрадит П., Варавитхья В., Ватанофас К., Сангчай Р., Подхипак А., Сутутворавут Ю. и др. Снижение ротавирусной инфекции у детей, получающих смесь с бифидобактериями. J Med Assoc Thai (1999) 82 (Дополнение 1): S43–8.
PubMed Аннотация | Google Scholar
41. Бардах А., Чаппони А., Гарсиа-Марти С., Глюевски Д., Маццони А., Файад А. и др. Эпидемиология острого среднего отита у детей в Латинской Америке и Карибском бассейне: систематический обзор и метаанализ. Int J Pediatr Otorhinolaryngol (2011) 75 (9): 1062–70. DOI: 10.1016 / j.ijporl.2011.05.014
PubMed Аннотация | CrossRef Полный текст | Google Scholar
42. Эдмонд К., Скотт С., Корчак В., Уорд С., Сандерсон С., Теодорату Е. и др. Долгосрочные последствия детской пневмонии; систематический обзор и метаанализ. PLoS One (2012) 7 (2): e31239. DOI: 10.1371 / journal.pone.0031239
PubMed Аннотация | CrossRef Полный текст | Google Scholar
43.Джентиле А., Бардах А., Чаппони А., Гарсия-Марти С., Арудж П., Глузовский Д. и др. Эпидемиология внебольничной пневмонии у детей в Латинской Америке и Карибском бассейне: систематический обзор и метаанализ. Int J Infect Dis (2012) 16 (1): e5–15. DOI: 10.1016 / j.ijid.2011.09.013
PubMed Аннотация | CrossRef Полный текст | Google Scholar
44. Виллена Дж., Сальва С., Нуньес М., Корсо Дж., Толаба Р., Фаедда Дж. И др. Пробиотики для всех! Новый иммунобиотик Lactobacillus rhamnosus CRL1505 и начало социальных пробиотических программ в Аргентине. Int J Biotechnol Wellness Ind (2012) 1: 189–98. DOI: 10.6000 / 1927-3037 / 2012.01.03.05
CrossRef Полный текст | Google Scholar
45. Чжан В., Вэнь К., Азеведо М.С., Гонсалес А., Саиф Л.Дж., Ли Дж. И др. Колонизация молочнокислых бактерий и ротавирусная инфекция человека влияют на распределение и частоту моноцитов / макрофагов и дендритных клеток у новорожденных свиней-гнотобиотиков. Vet Immunol Immunopathol (2008) 121 (3–4): 222–31. DOI: 10.1016 / j.vetimm.2007.10.001
PubMed Аннотация | CrossRef Полный текст | Google Scholar
46.Вен К., Ли Дж., Буй Т., Лю Ф., Ли Ю., Кочер Дж. И др. Высокая и низкая доза Lactobacillus acidophilus оказывала дифференциальное иммуномодулирующее действие на Т-клеточные иммунные ответы, вызванные пероральной ротавирусной вакциной человека у свиней-гнотобиотов. Vaccine (2012) 30 (6): 1198–207. DOI: 10.1016 / j.vaccine.2011.11.107
PubMed Аннотация | CrossRef Полный текст | Google Scholar
47. Мао X, Гу Ц, Ху Х, Тан Дж, Чен Д., Ю Б и др. Dietary Добавка Lactobacillus rhamnosus GG улучшает барьерную функцию слизистой оболочки в кишечнике поросят-отъемышей, зараженных ротавирусом свиней. PLoS One (2016) 11 (1): e0146312. DOI: 10.1371 / journal.pone.0146312
PubMed Аннотация | CrossRef Полный текст | Google Scholar
48. Азеведо М.С., Чжан В., Вен К., Гонсалес А.М., Саиф Л.Дж., Юсеф А.Е. и др. Lactobacillus acidophilus и Lactobacillus reuteri модулируют цитокиновые ответы у свиней-гнотобиотиков, инфицированных ротавирусом человека. Benef Microbes (2012) 3 (1): 33–42. DOI: 10.3920 / BM2011.0041
PubMed Аннотация | CrossRef Полный текст | Google Scholar
49.Хосоя С., Виллена Дж., Симадзу Т., Тоно М., Фуджи Х, Чиба Э и др. Иммунобиотические молочнокислые бактерии благотворно регулируют иммунный ответ, запускаемый поли (I: C) в эпителиальных клетках кишечника свиней. Ветеринарная служба (2011) 42 (1): 111. DOI: 10.1186 / 1297-9716-42-111
PubMed Аннотация | CrossRef Полный текст | Google Scholar
50. Ишизука Т., Канмани П., Кобаяши Х., Миядзаки А., Сома Дж., Суда Й. и др. Штаммы иммунобиотических бифидобактерий модулируют иммунный ответ ротавируса в эпителиоцитах кишечника свиней посредством передачи сигналов рецептора распознавания образов. PLoS One (2016) 11 (3): e0152416. DOI: 10.1371 / journal.pone.0152416
PubMed Аннотация | CrossRef Полный текст | Google Scholar
51. Сен А., Пруйссерс А.Дж., Дермоди Т.С., Гарсия-Састре А., Гринберг HB. Ранний интерфероновый ответ на ротавирус регулируется PKR и зависит от MAVS / IPS-1, RIG-I, MDA-5 и IRF3. J Virol (2011) 85 (8): 3717–32. DOI: 10.1128 / JVI.02634-10
CrossRef Полный текст | Google Scholar
52. Броке А.Х., Хирата Ю., Макаллистер К.С., Кагнофф М.Ф.RIG-I / MDA5 / MAVS необходимы для передачи сигнала о защитном IFN-ответе в инфицированном ротавирусом кишечном эпителии. J Immunol (2011) 186 (3): 1618–26. DOI: 10.4049 / jimmunol.1002862
PubMed Аннотация | CrossRef Полный текст | Google Scholar
53. Хосоя С., Виллена Дж., Чиба Е., Симадзу Т., Суда Й., Асо Х. и др. Расширенное применение эпителиальных клеток кишечника свиней для выбора иммунобиотиков, модулирующих воспаление, опосредованное toll-подобным рецептором 3. J Microbiol Immunol Infect (2013).46: 474–81. DOI: 10.1016 / j.jmii.2012.04.005
CrossRef Полный текст | Google Scholar
55. Папп Х., Ласло Б., Якаб Ф., Ганеш Б., Де Грация С., Маттейнссенс Дж. И др. Обзор штаммов ротавируса группы А, обнаруженных у свиней и крупного рогатого скота. Vet Microbiol (2013) 165 (3–4): 190–9. DOI: 10.1016 / j.vetmic.2013.03.020
PubMed Аннотация | CrossRef Полный текст | Google Scholar
56. Арнольд М.М., Сен А., Гринберг Х. Б., Паттон Дж. Т.. Битва между ротавирусом и его хозяином за контроль над сигнальным путем интерферона. PLoS Pathog (2013) 9 (1): e1003064. DOI: 10.1371 / journal.ppat.1003064
PubMed Аннотация | CrossRef Полный текст | Google Scholar
57. Казола А., Эстес М.К., Кроуфорд С.Е., Огра П.Л., Эрнст П.Б., Гарофало Р.П. и др. Ротавирусная инфекция культивируемых эпителиальных клеток кишечника индуцирует секрецию хемокинов CXC и CC. Гастроэнтерология (1998) 114 (5): 947–55. DOI: 10.1016 / S0016-5085 (98) 70314-2
PubMed Аннотация | CrossRef Полный текст | Google Scholar
58.Чиба Э., Виллена Дж., Хосоя С., Таканаши Н., Симадзу Т., Асо Х. и др. Недавно созданная линия эпителиальных клеток кишечника крупного рогатого скота эффективна для скрининга in vitro потенциальных противовирусных иммунобиотических микроорганизмов для крупного рогатого скота. Res Vet Sci (2012) 93 (2): 688–94. DOI: 10.1016 / j.rvsc.2011.10.002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
59. Селайя Х., Цукида К., Чиба Е., Марранзино Дж., Альварес С., Китадзава Х. и др. Иммунобиотические лактобациллы уменьшают поражение легких, связанное с вирусами, за счет модуляции взаимодействий воспаления и коагуляции. Int Immunopharmacol (2014) 19 (1): 161–73. DOI: 10.1016 / j.intimp.2013.12.020
PubMed Аннотация | CrossRef Полный текст | Google Scholar
61. Сайто Т., Ямамото М., Миягиши М., Тайра К., Наканиси М., Фудзита Т. и др. A20 является негативным регулятором передачи сигналов регулирующего фактора 3 IFN. J Immunol (2005) 174 (3): 1507–12. DOI: 10.4049 / jimmunol.174.3.1507
PubMed Аннотация | CrossRef Полный текст | Google Scholar
62. Breckpot K, Aerts-Toegaert C, Heirman C, Peeters U, Beyaert R, Aerts JL, et al.Ослабленная экспрессия A20 заметно увеличивает эффективность двухцепочечных РНК-активированных дендритных клеток в качестве противораковой вакцины. J Immunol (2009) 182 (2): 860–70. DOI: 10.4049 / jimmunol.182.2.860
PubMed Аннотация | CrossRef Полный текст | Google Scholar
63. Зайферт С., Родригес Гомес М., Ватцл Б., Хольцапфель В.Х., Франц С.М., Визосо Пинто М.Г. Дифференциальный эффект Lactobacillus johnsonii BFE 6128 на экспрессию генов, связанных с путями TLR и врожденным иммунитетом в эпителиальных клетках кишечника. Пробиотики Антимикробные белки (2010) 2: 211–7. DOI: 10.1007 / s12602-010-9055-2
PubMed Аннотация | CrossRef Полный текст | Google Scholar
64. Макферсон С., Оди Дж., Матье О, Томпкинс Т.А. Многопозиционная пробиотическая модуляция иммунного ответа эпителиальных клеток кишечника на двухцепочечный лиганд РНК, поли (i.c). Appl Environ Microbiol (2014) 80 (5): 1692–700. DOI: 10.1128 / AEM.03411-13
CrossRef Полный текст | Google Scholar
65.Тада А., Селайя Х., Клуа П., Сальва С., Альварес С., Китадзава Х. и др. Штаммы Immunobiotic Lactobacillus уменьшают повреждение тонкого кишечника, вызванное интраэпителиальными лимфоцитами после активации толл-подобного рецептора 3. Inflamm Res (2016) 65 (10): 771–83. DOI: 10.1007 / s00011-016-0957-7
PubMed Аннотация | CrossRef Полный текст | Google Scholar
66. Виллена Дж., Чиба Е., Визосо-Пинто М.Г., Томосада Й., Такахаши Т., Исидзука Т. и др. Иммунобиотические штаммы Lactobacillus rhamnosus дифференциально модулируют противовирусный иммунный ответ в эпителиальных и антигенпредставляющих клетках кишечника свиней. BMC Microbiol (2014) 14 (1): 126. DOI: 10.1186 / 1471-2180-14-126
PubMed Аннотация | CrossRef Полный текст | Google Scholar
67. Ивасаки А., Келсалл Б.Л. Уникальные функции дендритных клеток CD11b +, CD8 alpha + и дважды отрицательных пейеровских пятен. J Immunol (2001) 166 (8): 4884–90. DOI: 10.4049 / jimmunol.166.8.4884
PubMed Аннотация | CrossRef Полный текст | Google Scholar
68. Кандасами С., Власова А.Н., Фишер Д., Кумар А., Чатта К.С., Рауф А. и др.Дифференциальные эффекты штамма GG Escherichia coli Nissle и Lactobacillus rhamnosus GG на связывание ротавируса человека, инфекцию и В-клеточный иммунитет. J Immunol (2016) 196 (4): 1780–9. DOI: 10.4049 / jimmunol.1501705
PubMed Аннотация | CrossRef Полный текст | Google Scholar
69. Tomosada Y, Villena J, Murata K, Chiba E, Shimazu T., Aso H, et al. Иммунорегуляторный эффект штаммов бифидобактерий в эпителиальных клетках кишечника свиней посредством модуляции экспрессии фермента А20, редактирующего убиквитин. PLoS One (2013) 8 (3): e59259. DOI: 10.1371 / journal.pone.0059259
PubMed Аннотация | CrossRef Полный текст | Google Scholar
70. Kinoshita N, Hiroi T., Ohta N, Fukuyama S, Park EJ, Kiyono H. Аутокринный IL-15 опосредует гибель кишечных эпителиальных клеток через активацию соседних интраэпителиальных NK-клеток. J Immunol (2002) 169 (11): 6187–92. DOI: 10.4049 / jimmunol.169.11.6187
PubMed Аннотация | CrossRef Полный текст | Google Scholar
71.Чжан Б., Часайн Б., Ши З., Учияма Р., Чжан З., Деннинг Т.Л. и др. Вирусная инфекция. Профилактика и лечение ротавирусной инфекции посредством TLR5 / NLRC4-опосредованной продукции IL-22 и IL-18. Science (2014) 346 (6211): 861–5. DOI: 10.1126 / science.1256999
PubMed Аннотация | CrossRef Полный текст | Google Scholar
73. Hansen CH, Holm TL, Krych L, Andresen L, Nielsen DS, Rune I, et al. Микробиота кишечника регулирует экспрессию лиганда NKG2D на эпителиальных клетках кишечника. Eur J Immunol (2013) 43 (2): 447–57.DOI: 10.1002 / eji.201242462
PubMed Аннотация | CrossRef Полный текст | Google Scholar
74. Кавагути М., Нанно М., Умесаки Ю., Мацумото С., Окада Ю., Цай З. и др. Цитолитическая активность кишечных интраэпителиальных лимфоцитов у стерильных мышей зависит от штамма и определяется Т-клетками, экспрессирующими гамма-дельта-Т-клеточные антигенные рецепторы. Proc Natl Acad Sci U S. A (1993) 90 (18): 8591–4. DOI: 10.1073 / pnas.90.18.8591
PubMed Аннотация | CrossRef Полный текст | Google Scholar
75.Suzuki H, Jeong KI, Itoh K, Doi K. Региональные различия в распределении интраэпителиальных лимфоцитов тонкого кишечника у мышей, свободных от микробов и специфических патогенов. Exp Mol Pathol (2002) 72 (3): 230–5. DOI: 10.1006 / exmp.2002.2433
PubMed Аннотация | CrossRef Полный текст | Google Scholar
76. Исмаил А.С., Северсон К.М., Вайшнава С., Берендт С.Л., Ю. Х, Бенджамин Дж. Л. и др. Интраэпителиальные лимфоциты гаммадельта являются важными медиаторами микробного гомеостаза хозяина на поверхности слизистой оболочки кишечника. Proc Natl Acad Sci U S A (2011) 108 (21): 8743–8. DOI: 10.1073 / pnas.1019574108
PubMed Аннотация | CrossRef Полный текст | Google Scholar
77. Цзян В., Ван Х, Цзэн Б., Лю Л., Тардивел А., Вэй Х и др. Распознавание кишечной микробиоты с помощью NOD2 необходимо для гомеостаза кишечных интраэпителиальных лимфоцитов. J Exp Med (2013) 210 (11): 2465–76. DOI: 10.1084 / jem.20122490
PubMed Аннотация | CrossRef Полный текст | Google Scholar
78.Серрано А.Е., Менарес-Кастильо Е., Гарридо-Тапиа М., Рибейро С.Х., Эрнандес С.Дж., Мендоса-Наранхо А. и др. Интерлейкин 10 снижает экспрессию MICA на поверхности клеток меланомы. Immunol Cell Biol (2011) 89 (3): 447–57. DOI: 10.1038 / icb.2010.100
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Вакцина против ротавирусной болезни – НИПЗ
Вакцина содержит живой ослабленный ротавирус. Вакцинальный вирус не вызывает ротавирусных заболеваний у здоровых детей.Ротавирусная вакцина очень эффективна и дает почти 100% защиту от тяжелой ротавирусной инфекции.
Вакцина против ротавируса вводится перорально и имеет сладкий вкус.
Вакцина, используемая в Программе иммунизации детей, состоит из 2 доз. Первая доза вводится не раньше, чем через 6 недель, но не позднее, чем через 12 недель. Вторая доза назначается, когда ребенку исполняется 3 месяца, но не позднее 16 недель. Защита после вакцинации длится 3–4 года. Этого достаточно, чтобы защитить самых маленьких и самых уязвимых детей.
Сообщите в поликлинику, если ребенок недавно принимал лекарства, у него аллергия или другие проблемы со здоровьем. Их также следует проинформировать, если мать принимала лекарство, влияющее на иммунную систему, во время беременности или грудного вскармливания, поскольку может возникнуть необходимость отложить вакцинацию этой вакциной.
Отложите вакцинацию, если у ребенка острое инфекционное заболевание с температурой выше 38 ºC или острая желудочно-кишечная инфекция с диареей или рвотой.
О ротавирусной болезни
Обычный путь заражения – это когда ребенок засовывает руку в рот после прикосновения к предмету, зараженному ротавирусом. Дети выделяют вирус со стулом до, во время и после появления симптомов. Наличие ротавирусной инфекции дает лишь частичную защиту от повторного заражения, поэтому у многих людей будет несколько эпизодов ротавирусной болезни в детстве. Хорошая гигиена рук снижает распространение вируса, но не останавливает его полностью.
Ротавирусная болезнь часто вызывает более серьезные симптомы, чем другие желудочно-кишечные инфекции. Большинство детей выздоравливают без осложнений, но некоторым потребуется лечение от обезвоживания. Если лечение начнется слишком поздно, болезнь может привести к летальному исходу, но в Норвегии такое случается редко. До включения ротавирусной вакцины в Программу иммунизации детей ротавирусная болезнь была причиной почти двух третей всех госпитализаций маленьких детей с рвотой и диареей.Ежегодно 700–1100 детей с ротавирусной инфекцией госпитализировались на лечение, большинство из них были в возрасте до 2 лет.
Общие побочные эффекты
Наиболее частыми нежелательными эффектами вакцины в Программе иммунизации детей (Rotarix) являются:
- Раздражительность и жидкий стул у 1 из 10 вакцинированных детей.
- Боли в животе, обильное дыхание и кожные реакции возникают примерно у 1 из 100 вакцинированных детей.
Инвагинация – это редкое заболевание у младенцев, при котором часть кишечника втягивается в себя.Ежегодно в Норвегии около 35–40 детей в возрасте до 1 года попадают в больницу с инвагинацией. Исследования показали, что это число может немного увеличиться после введения ротавирусной вакцины (до 1 дополнительного случая на 20 000 вакцинированных), особенно если вакцина вводится старше определенного возраста. Поэтому первую дозу следует ввести к тому времени, когда ребенку исполнится 12 недель, а вторую дозу – к 16-недельному возрасту.
Первая доза вакцины вводится не ранее, чем через 6 недель, но не позднее, чем через 12 недель.
Ротавирус | Здравоохранение и пожилые люди
Ротавирус
Ротавирус – это инфекция, обнаруженная в кал (фекалии) инфицированного человека. Почти все непривитые дети будут иметь по крайней мере одну ротавирусную инфекцию к пятилетнему возрасту. Ротавирус обычно поражает детей в возрасте от 6 месяцев до 2 лет. Дети старшего возраста и взрослые также могут заразиться ротавирусом, но обычно протекает легче.
Поставщик содержимого изображений: Библиотека изображений общественного здравоохранения CDC
Симптомы
Ротавирусная инфекция вызывает жар, боль в животе, рвоту (рвоту), а также диарею, которая может длиться до 7 дней. Лихорадка и рвота обычно являются первыми симптомами, которые появляются через 1-3 дня после контакта человека с вирусом.
Причины
Ротавирус легко распространяется через человека, который контактирует с инфицированным стулом (фекалиями), а затем касается их рта (т.е. фекально-оральный путь передачи). Ротавирус может жить на поверхности зараженных предметов, таких как игрушки и подгузники, и может выжить на немытых руках.
Лечение
Не существует специального лекарства, антибиотика или противовирусного препарата для лечения ротавируса. Текущее лечение направлено на облегчение симптомов, пока ротавирус проходит.
Если ротавирус не лечить, тяжелая и частая диарея и / или рвота могут привести к обезвоживанию детей раннего возраста, что может привести к госпитализации (для внутривенного (внутривенного) введения жидкостей) и, в тяжелых случаях, к смерти.Младенцы и маленькие дети подвержены наибольшему риску обезвоживания.
Симптомы обезвоживания у вашего ребенка могут включать:
- Сухость во рту и горле
- Головокружение
- Уменьшение мочеиспускания (мочеиспускание)
- Плач почти без слез
- Сильная сонливость или суетливость
Важно пить много жидкости, чтобы предотвратить обезвоживание.
Профилактика
Ротавирус среди младенцев можно предотвратить путем иммунизации пероральной вакциной. В Манитобе действует провинциальная программа иммунизации, которая предоставляет бесплатные вакцины, финансируемые государством, тем, кто имеет на нее право.
Можно принять другие меры предосторожности, включая частое мытье рук водой с мылом.
Дети, инфицированные ротавирусной инфекцией, должны оставаться дома, особенно в детских садах, до 48 часов с момента последней рвоты или диареи, чтобы остановить распространение ротавируса.
Ресурсы по здравоохранению и уходу за пожилыми людьми Манитобы
Для общественности
Медицинским работникам
Другие ресурсы
Инфекционные болезни
Контроль (CDC) Ссылки на здоровье – Информация Santé Спросите здоровья |
Ротавирус – Сводка путешественника – TripPrep.com
Сводка путешественника
Ключевые моменты
- Ротавирусная инфекция, вирусная инфекция, встречающаяся во всем мире, передается, в основном, в результате употребления загрязненных фекалиями пищи и воды, контакта с зараженными объектами и вдыхания выделений из дыхательных путей инфицированных людей.
- Во всем мире повышается риск для детей младше 5 лет и взрослых путешественников (с ослабленной иммунной системой), направляющихся в развивающиеся страны с плохими санитарными условиями.
- Симптомы включают внезапную лихорадку, рвоту и взрывную водянистую диарею; однако ротавирусная инфекция также может протекать бессимптомно.
- Последствия инфекции могут включать сильное обезвоживание.
- Профилактика включает соблюдение хорошей респираторной гигиены (этикет кашля и чихания) и гигиены рук (частое и тщательное мытье рук).
- Ротавирусная вакцина обычно вводится детям в возрасте от 6 недель до 8 месяцев сериями из 2 или 3 доз, в зависимости от марки вакцины; вакцины для взрослых и детей старшего возраста нет.
- Побочные эффекты вакцины включают легкую временную диарею, рвоту, кашель, насморк и раздражительность.
- Продолжительность защиты от вакцины неизвестна; бустер не требуется.
Введение
Ротавирус, очень заразная вирусная инфекция, передающаяся в основном фекально-оральным путем, является наиболее частой причиной тяжелых инфекций пищеварительного тракта у младенцев и детей младшего возраста, особенно в развивающихся странах во всем мире.
Зоны риска
Ротавирусная инфекция встречается во всем мире (в том числе в развитых странах) и часто приводит к смерти детей младше 5 лет, особенно в развивающихся странах. Ротавирус – одна из основных причин диареи путешественников как у детей, так и у взрослых в развивающихся странах, особенно в Латинской Америке и Африке. Вспышки диарейных заболеваний, вызванных ротавирусом, также были зарегистрированы среди пожилых людей, проживающих в сообществах пенсионеров.Заражение обычно происходит зимой и весной в умеренном климате (ежегодные эпидемии происходят с января по июнь) и в более прохладные и засушливые месяцы в тропическом климате.
Трансмиссия
Ротавирусы в основном передаются через употребление фекально-загрязненных продуктов питания и воды, тесный контакт между людьми, контакт с зараженными предметами (например, игрушки, книги, одежда и другие поверхности окружающей среды, загрязненные стулом), а также при вдыхании инфицированных респираторных органов. капли, которые люди чихают, кашляют, капают или выдыхают.Ротавирус может оставаться заразным в окружающей среде в течение недель или месяцев.
Факторы риска
Существует риск для детей младше 5 лет и взрослых путешественников (с ослабленной иммунной системой), направляющихся в развивающиеся страны. Заражение может произойти уже в возрасте 2 месяцев, но большинство случаев возникает в возрасте от 6 месяцев до 2 лет.
К другим лицам повышенного риска относятся опекуны и родители детей в детских учреждениях или больницах, пожилые люди, живущие в сообществах пенсионеров, а также дети и взрослые с заболеваниями, которые влияют на способность иммунной системы бороться с инфекцией.
Симптомы
Симптомы чаще всего появляются менее чем через 48 часов после воздействия и включают внезапную лихорадку, рвоту и взрывную водянистую диарею. Симптомы обычно длятся от 3 до 8 дней, но вирус может оставаться в стуле до 3 недель. Ротавирусная инфекция может протекать без симптомов (особенно у взрослых), легкой или тяжелой; Симптомы различаются в зависимости от того, является ли инфекция первой инфекцией или повторной инфекцией.
Дети могут заразиться ротавирусом несколько раз в течение жизни; первая инфекция, если она возникает в возрасте старше 3 месяцев, обычно является наиболее тяжелой.Восстановление после первой инфекции может не привести к постоянному иммунитету, но защищает от последующих тяжелых заболеваний.
Инфекция у взрослых обычно протекает без симптомов, но может вызывать диарейное заболевание.
Последствия инфекции
Это может вызвать сильную диарею и обезвоживание. Может наступить смерть, особенно у детей, которых немедленно не лечат.
Потребность в медицинской помощи
Лица, у которых развиваются симптомы ротавирусной инфекции, должны заниматься самолечением с помощью растворов для пероральной регидратации, разработанных для этой цели, и немедленно обращаться за медицинской помощью.Противовирусных препаратов для лечения ротавирусной инфекции не существует.
Профилактика
Невакцина
Соблюдайте хорошую респираторную гигиену (этикет кашля и чихания) и гигиену рук (частое и тщательное мытье рук), особенно после посещения туалета и смены подгузников (в том числе у младенцев, получивших ротавирусную вакцину).
Вакцина
Ротавирусные вакцины обычно вводятся в качестве детской вакцинации младенцам в возрасте от 6 недель до 8 месяцев, включая младенцев, перенесших ротавирусную инфекцию до получения полной серии вакцин.
Вакцина против ротавируса не рекомендуется детям старшего возраста и взрослым путешественникам.
Побочные эффекты
Побочные эффекты ротавирусных вакцин включают легкую временную диарею или рвоту, кашель или насморк, суетливость или раздражительность.
Редко у детей может возникнуть кишечная непроходимость из-за инвагинации (выдвижение кишечника), обычно в течение 7–21 дней после введения первой дозы вакцины.
Лица, у которых есть дети с сопутствующими заболеваниями или которые обеспокоены вакциной, должны поговорить с лечащим врачом своего ребенка до введения вакцины.
Сроки
Существуют две ротавирусные вакцины (RotaTeq и Rotarix), они представлены следующим образом:
- Порядок (независимо от поездки) для младенцев в возрасте от 6 недель до 8 месяцев:
- RotaTeq: 3 дозы, назначаемые в возрасте 2, 4 и 6 месяцев.
- Ротарикс: 2 дозы, назначаемые в возрасте 2 и 4 месяцев.
Ускоренный график (который может использоваться для путешественников) состоит из 3 доз RotaTeq, вводимых в возрасте 6, 10 и 14 недель, или 2 доз Rotarix, вводимых в возрасте 6 и 10 недель.
Модуляция тяжелого ротавирусного гастроэнтерита комбинацией пробиотиков и пребиотиков
Арнольд М.М., Паттон Дж. Т. (2011) Разнообразие активности антагонистов интерферона, опосредованное белками NSP1 различных штаммов ротавирусов. J Virol 85: 1970–1979
CAS Статья PubMed Google Scholar
Bagchi P et al (2010) Неструктурный белок 1 ротавируса подавляет индуцированный вирусом клеточный апоптоз, способствуя росту вируса, активируя пути выживания клеток на ранних стадиях инфекции.J Virol 84: 6834–6845
CAS Статья PubMed PubMed Central Google Scholar
Ball JM, Tian P, Zeng CQ, Morris AP, Estes MK (1996) Возраст-зависимая диарея, вызванная ротавирусным неструктурным гликопротеином. Наука 272: 101
CAS Статья PubMed Google Scholar
Barro M, Patton JT (2007) Ротавирус NSP1 ингибирует экспрессию интерферона I типа, противодействуя функции факторов регуляции интерферона IRF3, IRF5 и IRF7.J Virol 81: 4473–4481
CAS Статья PubMed PubMed Central Google Scholar
Bhowmick R, Halder UC, Chattopadhyay S, Nayak MK, Chawla-Sarkar M (2013) Неструктурный белок 1, кодируемый ротавирусом, модулирует аппарат клеточного апоптоза, воздействуя на белок-супрессор опухоли p53. J Virol 87: 6840–6850
CAS Статья PubMed PubMed Central Google Scholar
Bines JE, Kirkwood CD (2015) Победить ротавирус: от открытия до глобального внедрения вакцины.J Paediatr Child Health 51: 34–39
Статья PubMed Google Scholar
Blutt SE, Conner ME (2007) Ротавирус: проникает внутрь и не только! Curr Opin Gastroenterol 23: 39–43
Статья PubMed Google Scholar
Boschi-Pinto C, Velebit L, Shibuya K (2008) Оценка детской смертности от диареи в развивающихся странах. Bull World Health Organ 86: 710–717
Статья PubMed PubMed Central Google Scholar
Broquet AH, Hirata Y, McAllister CS, Kagnoff MF (2011) RIG-I / MDA5 / MAVS необходимы для сигнализации защитного ответа IFN в инфицированном ротавирусом кишечном эпителии.J Immunol 186: 1618–1626
CAS Статья PubMed Google Scholar
Chhabra P et al (2013) Этиология вирусного гастроэнтерита у детей младше 5 лет в США, 2008–2009 гг. J Infect Dis 208: 790–800
Статья PubMed Google Scholar
Das S, Gupta PK, Das RR (2016) Эффективность и безопасность Saccharomyces boulardii при острой ротавирусной диарее: двойное слепое рандомизированное контролируемое исследование в развивающейся стране.J Trop Pediatr 62: 464–470
PubMed Google Scholar
Elliott EJ (2007) Острый гастроэнтерит у детей. BMJ Br Med J 334: 35–40
Статья Google Scholar
Estes M, Greenberg H (2013) Ротавирусы. В: Knipe DM, Howley PM (eds) Филдс вирусологии. Lippincott Williams & Wilkins, Филадельфия
Google Scholar
Finkbeiner SR et al (2009) Стул человека содержит ранее неизвестное разнообразие новых астровирусов.Virol J 6: 161
Артикул PubMed PubMed Central Google Scholar
Franco MA, Tin C, Rott LS, VanCott JL, McGhee JR, Greenberg HB (1997) Доказательства Т-клеточного иммунитета CD8 + к ротавирусу мышей в отсутствие перфорина, fas и гамма-интерферона. J Virol 71: 479–486
CAS PubMed PubMed Central Google Scholar
Franco MA, Angel J, Greenberg HB (2006) Иммунитет и корреляты защиты ротавирусных вакцин.Вакцина 24: 2718–2731
CAS Статья PubMed Google Scholar
Gänzle MG, Höltzel A, Walter J, Jung G, Hammes WP (2000) Характеристика реутерициклина, продуцируемого Lactobacillus reuteri LTh3584. Appl Environ Microbiol 66: 4325–4333
Статья PubMed PubMed Central Google Scholar
Gilger M, Matson D, Conner M, Rosenblatt H, Finegold M, Estes M (1992) Внекишечные ротавирусные инфекции у детей с иммунодефицитом.J Pediatr 120: 912–917
CAS Статья PubMed Google Scholar
Guérin-Danan C et al (2001) Пищевая добавка с молоком, ферментированным Lactobacillus casei DN-114 001, защищает сосущих крыс от диареи, связанной с ротавирусом. J Nutr 131: 111–117
PubMed Google Scholar
Hagbom M et al (2011) Ротавирус стимулирует высвобождение серотонина (5-HT) из энтерохромаффинных клеток человека и активирует структуры мозга, участвующие в тошноте и рвоте.PLoS Pathog 7: e1002115
CAS Статья PubMed PubMed Central Google Scholar
Hester SN et al (2013) Олигосахариды грудного молока подавляют инфекционность ротавируса in vitro и у остро инфицированных поросят. Br J Nutr 110: 1233–1242
CAS Статья PubMed Google Scholar
Hostetler MA, Nakanishi AK, Whiteman PJ (2004) Гастроэнтерит: научно обоснованный подход к типичной рвоте, диарее и обезвоживанию.Педиатр Emerg Med Pract 1: 1–19
Google Scholar
Ishizuka T et al (2016) Штаммы иммунобиотических бифидобактерий модулируют иммунный ответ ротавируса в эпителиоцитах кишечника свиней посредством передачи сигналов рецептора распознавания образов. PLoS One 11: e0152416
Артикул PubMed PubMed Central Google Scholar
İşlek A, Sayar E, Yılmaz A, Baysan BÖ, Mutlu D, Artan R (2014) Роль Bifidobacterium lactis B94 plus inulin в лечении острой инфекционной диареи у детей.Turk J Gastroenterol 25: 628–633
PubMed Google Scholar
Jain S, Vashistt J, Changotra H (2014) Ротавирусы: нужен ли надзор за ними? Vaccine 32: 3367–3378
Статья PubMed Google Scholar
Jiang JQ, He X-S, Feng N, Greenberg HB (2008) Качественные и количественные характеристики ротавирус-специфичных Т-клеток CD8 варьируются в зависимости от пути заражения.J Virol 82: 6812–6819
CAS Статья PubMed PubMed Central Google Scholar
Jourdan N, Maurice M, Delautier D, Quero AM, Servin AL, Trugnan G (1997) Ротавирус высвобождается с апикальной поверхности культивируемых кишечных клеток человека посредством нетрадиционного везикулярного транспорта, который обходит аппарат Гольджи. J Virol 71: 8268–8278
CAS PubMed PubMed Central Google Scholar
Kaila M, Isolauri E, Saxelin M, Arvilommi H, Vesikari T (1995) Жизнеспособный по сравнению с инактивированным штаммом лактобацилл GG при острой ротавирусной диарее.Arch Dis Child 72: 51–53
CAS Статья PubMed PubMed Central Google Scholar
Kang JY, Lee DK, Ha NJ, Shin HS (2015) Противовирусные эффекты Lactobacillus ruminis SPM0211 и Bifidobacterium longum SPM1205 и SPM1206 на инфицированных ротавирусом клетках мышей Caco-2 и модели новорожденных. J Microbiol 53: 796–803
CAS Статья PubMed Google Scholar
Koo HL, Ajami N, Atmar RL, DuPont HL (2010) Норовирусы: ведущая причина гастроэнтерита во всем мире.Discov Med 10: 61–70
PubMed PubMed Central Google Scholar
Kuklin NA, Rott L, Feng N, Conner ME, Wagner N, Müller W., Greenberg HB (2001) Защитный кишечный иммунитет против ротавируса В-клеток зависит от экспрессии интегрина α4β7, но не требует продукции антител IgA. J Immunol 166: 1894–1902
CAS Статья PubMed Google Scholar
Lee DK, Park JE, Kim MJ, Seo JG, Lee JH, Ha NJ (2015) Пробиотические бактерии, B.longum и L. acidophilus подавляют инфицирование ротавирусом in vitro и уменьшают продолжительность диареи у педиатрических пациентов. Clin Res Hepatol Gastroenterol 39: 237–244
Статья PubMed Google Scholar
Li M et al (2014) Олигосахариды грудного молока сокращают вызванную ротавирусом диарею и модулируют иммунитет слизистой оболочки поросят и микробиоту толстой кишки. ISME J 8: 1609–1620
CAS Статья PubMed PubMed Central Google Scholar
Liu L et al (2015) Глобальные, региональные и национальные причины детской смертности в 2000–2013 годах с прогнозами для информирования о приоритетах на период после 2015 года: обновленный систематический анализ.Ланцет 385: 430–440
Артикул PubMed Google Scholar
Lundgren O, Svensson L (2001) Патогенез ротавирусной диареи. Микробы заражают 3: 1145–1156
CAS Статья PubMed Google Scholar
Lundgren O, Peregrin AT, Persson K, Kordasti S, Uhnoo I, Svensson L (2000) Роль кишечной нервной системы в секреции жидкости и электролитов при ротавирусной диарее.Наука 287: 491–495
CAS Статья PubMed Google Scholar
Maragkoudakis PA, Chingwaru W., Gradisnik L, Tsakalidou E, Cencic A (2010) Молочнокислые бактерии эффективно защищают эпителиальные и иммунные клетки кишечника человека и животных от кишечной вирусной инфекции. Int J Food Microbiol 141: S91 – S97
Статья PubMed Google Scholar
Matthijnssens J et al (2008) Классификация ротавирусов на основе полного генома выявляет общее происхождение между Wa-подобными штаммами ротавирусов человека и свиней и штаммами человеческих DS-1-подобных и ротавирусов крупного рогатого скота.J Virol 82: 3204–3219
CAS Статья PubMed PubMed Central Google Scholar
Matthijnssens J, Otto PH, Ciarlet M, Desselberger U, Van Ranst M, Johne R (2012) Пороговые значения на основе последовательности VP6 в качестве критерия для демаркации видов ротавирусов. Arch Virol 157: 1177–1182
CAS Статья PubMed Google Scholar
Morelli M, Dennis AF, Patton JT (2015) Предполагаемая убиквитинлигаза E3 ротавируса человека ингибирует активацию NF-κB с помощью молекулярной мимикрии для нацеливания на β-TrCP.MBio 6: e02490 – e02514
CAS Статья PubMed PubMed Central Google Scholar
Olaya Galán NN, Ulloa Rubiano JC, Velez Reyes FA, Duarte F, Karem P, Salas Cárdenas SP, Gutierrez Fernandez MF (2016) In vitro противовирусная активность Lactobacillus casei против инфекции и adorable rotlescentobacter, контролируемой бифидавирусом бифидобактерий, Lactobacillus casei производством белка NSP4. J Appl Microbiol 120: 1041–1051
Статья PubMed Google Scholar
Ousingsawat J, Mirza M, Tian Y, Roussa E, Schreiber R, Cook DI, Kunzelmann K (2011) Ротавирусный токсин NSP4 вызывает диарею путем активации TMEM16A и ингибирования всасывания Na + .Pflugers Arch 461: 579–589
CAS Статья PubMed Google Scholar
Рахман М. и др. (2007) История эволюции и глобальное распространение новых ротавирусов человека G12. J Virol 81: 2382–2390
CAS Статья PubMed Google Scholar
Рамиг РФ (2004) Патогенез кишечной и системной ротавирусной инфекции. J Virol 78: 10213–10220
CAS Статья PubMed PubMed Central Google Scholar
Rezaei M, Sohrabi A, Edalat R, Siadat SD, Gomari H, Rezaei M, Gilani SM (2012) Молекулярная эпидемиология острого гастроэнтерита, вызванного кишечными аденовирусами подрода F (40, 41) у детей, находящихся в стационаре.Lab Med 43: 10–15
Статья Google Scholar
Rigo-Adrover M et al (2016) Комбинация scGOS / lcFOS с Bifidobacterium breve M-16V защищает сосущих крыс от ротавирусного гастроэнтерита. Eur J Nutr 56: 1657–1670
Артикул PubMed Google Scholar
Rigo-Adrover M et al (2017) Концентрат ферментированного молока и комбинация короткоцепочечных галактоолигосахаридов / длинноцепочечных фруктоолигосахаридов / кислых олигосахаридов, полученных из пектина, защищают молочных крыс от ротавирусного гастроэнтерита.Br J Nutr 117: 209–217
CAS Статья PubMed Google Scholar
Santos N, Hoshino Y (2005) Глобальное распространение серотипов / генотипов ротавируса и его значение для разработки и внедрения эффективной ротавирусной вакцины. Rev Med Virol 15: 29–56
Статья PubMed Google Scholar
Saxena K et al (2016) Кишечные энтероиды человека: новая модель для изучения ротавирусной инфекции человека, ограничения хозяина и патофизиологии.J Virol 90: 43–56
CAS Статья Google Scholar
Сдири-Лулизи К. и др. (2011) Молекулярное обнаружение саповируса геногруппы I у тунисских детей, страдающих острым гастроэнтеритом. Гены вирусов 43: 6–12
CAS Статья PubMed Google Scholar
Сервин А.Л. (2004) Антагонистическая активность лактобацилл и бифидобактерий против микробных патогенов.FEMS Microbiol Ред. 28: 405–440
CAS Статья PubMed Google Scholar
Tate JE, Burton AH, Boschi-Pinto C, Steele AD, Duque J, Parashar UD (2012) Оценка смертности детей младше 5 лет, связанной с ротавирусом, во всем мире за 2008 г. до введения всеобщих программ вакцинации против ротавируса: a систематический обзор и метаанализ. Lancet Infect Dis 12: 136–141
Статья PubMed Google Scholar
Варюхина С. и др. (2012) Гликан-модифицирующие бактериальные растворимые факторы из Bacteroides thetaiotaomicron и Lactobacillus casei ингибируют ротавирусную инфекцию в клетках кишечника человека.Микробы заражают 14: 273–278
CAS Статья PubMed Google Scholar
Власова А.Н., Кандасами С., Чатта К.С., Раджашекара Г., Саиф Л.Дж. (2016) Сравнение эффектов пробиотических лактобацилл и бифидобактерий, иммунных ответов и ротавирусных вакцин и инфекции у разных видов хозяев. Vet Immunol Immunopathol 172: 72–84
CAS Статья PubMed PubMed Central Google Scholar
Williams M, Rosé J, Rott L, Franco M, Greenberg H, Butcher E (1998) Подмножество B-клеток памяти, которое отвечает за ответ IgA слизистой оболочки и гуморальный иммунитет к ротавирусу, экспрессирует рецептор самонаведения слизистой оболочки, α 4 β 7.J Immunol 161: 4227–4235
CAS PubMed Google Scholar
Yasui H, Kiyoshima J, Ushijima H (1995) Пассивная защита от индуцированной ротавирусом диареи у детенышей мышей, рожденных и вскармливаемых самками, которых кормили Bifidobacterium breve YIT4064. J Infect Dis 172: 403–409
CAS Статья PubMed Google Scholar
Симптомы, причины, диагностика и лечение
Астровирусы – это тип вируса, вызывающий диарейное заболевание (гастроэнтерит).Младенцы и маленькие дети чаще всего страдают диареей, вызванной астровирусами, но инфекция также встречается у пожилых людей и людей с ослабленной иммунной системой.
Хотя он может вызывать симптомы, сходные с симптомами других распространенных вирусных инфекций, диарейное заболевание, вызванное астровирусной инфекцией, обычно гораздо менее серьезное, чем вызванное ротавирусом и норовирусом. Это также редко требует какого-либо лечения.
Однако исследователи все еще изучают астровирусы человека.Наши знания о том, как они работают, все еще новы по сравнению с другими вирусами, вызывающими аналогичные заболевания.
Веривелл / JR BeeСимптомы
Астровирусы – один из нескольких патогенов, которые могут вызывать гастроэнтерит у человека. Основной симптом, вызываемый астровирусом – диарея. По сравнению с другими микроорганизмами, которые могут вызывать гастроэнтерит, такими как ротавирус и норовирус, диарея, вызванная астровирусом, обычно легкая.
Хотя легкая диарея является основным симптомом, вызываемым астровирусом, у человека, который заболевает, могут быть и другие общие симптомы гастроэнтерита, в том числе:
- Тошнота
- Рвота
- Боль в животе
- Потеря аппетита
- Боли в теле
- Лихорадка
Симптомы астровирусной инфекции обычно легкие и проходят самостоятельно без лечения.Болезнь может длиться всего несколько дней с небольшими рисками для здоровья или осложнениями в долгосрочной перспективе. Госпитализация требуется редко.
Младенцы, очень маленькие дети, пожилые люди и люди с ослабленной иммунной системой (например, получающие лечение от рака или живущие с ВИЧ) более склонны к обезвоживанию.
Здоровые люди с неповрежденной иммунной системой обычно выздоравливают от астровирусной инфекции за несколько дней. В некоторых случаях они могут даже не знать, что были инфицированы астровирусом, потому что в остальном они протекают бессимптомно (без симптомов).
Человек, который инфицирован, но не проявляет симптомов (называемый «носителем»), все еще может передавать вирус другим.
Причины
Астровирусы получили свое название из-за их звездообразного внешнего вида под микроскопом. Есть несколько различных видов астровирусов, некоторые из которых инфицируют людей. Вирус также был обнаружен у других животных, включая собак, птиц, свиней, коров, летучих мышей и даже дельфинов.
Астровирусы, как правило, чаще циркулируют в определенные сезоны.В регионах с умеренным климатом астровирусные инфекции чаще возникают зимой и весной. В тропическом климате астровирус чаще встречается в сезон дождей.
Однако астровирусы присутствуют круглый год и могут вызывать заболевание в любое время, особенно в местах с плохой санитарией или людьми, живущими в людных местах.
Младенцы и дети до двух лет чаще всего страдают диарейными заболеваниями, вызванными астровирусами. Хотя это менее распространено, чем ротавирус и другие вирусы, вызывающие диарею, на астровирусы приходится от 2% до 9% всех случаев педиатрического гастроэнтерита в мире.Взаимодействие с другими людьми
Факторы риска
Астровирус очень мал, и человеку нужно всего несколько вирусных частиц. Как только человек заражен астровирусом, вирусные частицы будут постоянно попадать в фекалии. Даже после того, как человек начинает чувствовать себя лучше, он все еще может выделять частицы, что способствует фекально-оральной передаче вируса.
Факторы риска астровирусной инфекции
- Плохое мытье рук и соблюдение гигиены
- Обработка или приготовление пищи загрязненными руками или на загрязненных поверхностях
- Проживание или тесное сотрудничество с другими людьми в ограниченном пространстве (например, в общежитиях, бараках и детских садах)
У большинства детей иммунитет к астровирусам разовьется к 10 годам.Эта защита – вот почему астровирусы обычно не вызывают болезни у взрослых. Однако считается, что со временем иммунитет ослабевает, поэтому пожилые люди с большей вероятностью заболеют вирусом.
Кроме того, недоедание является значительным фактором риска астровирусной инфекции как у детей, так и у пожилых людей.
Диагностика
Астровирус обычно можно диагностировать с помощью медосмотра, изучения вашей истории болезни и различных анализов крови и стула.На основании анализа ваших симптомов и факторов риска ваш врач может решить лечить вас предположительно, если симптомы легкие.
В других случаях ваш врач может назначить серию тестов для определения конкретной причины диареи, особенно если симптомы тяжелые или имеется локальная вспышка диарейного заболевания. Тесты могут включать:
- Посев кала для визуального и химического теста на астровирус в образце кала
- Иммуноферментный анализ (EIA) , анализ крови, который проверяет наличие иммунных белков, называемых антителами, которые организм вырабатывает в ответ на инфекционные микроорганизмы
- Тесты полимеразной цепной реакции (ПЦР) , способные обнаруживать РНК астровируса в крови
Результаты анализов обычно можно вернуть в течение одного-трех дней.Положительный результат означает, что вы заразились астровирусом. Отрицательный результат означает, что это не так.
Вирусный гастроэнтерит может быть вызван несколькими возбудителями. В некоторых случаях можно заразиться более чем одним вирусом одновременно (это называется коинфекцией).
Лечение
Болезнь, вызванная вирусом, не лечится антибиотиками. Следовательно, любое лечение, назначенное для вирусного гастроэнтерита, будет поддерживающим и направленным на устранение симптомов (например, облегчение тошноты или восполнение жидкости при обезвоживании).
В отличие от некоторых вирусных заболеваний, таких как грипп, противовирусные препараты не назначаются для лечения астровируса и мало что могут изменить течение болезни, если они есть. Также нет вакцин, которые могли бы предотвратить заражение.
С учетом сказанного, ученые добились значительных успехов в разработке нейтрализующих моноклональных антител, которые однажды могут эффективно предотвращать или лечить астровирусные инфекции.
Пока такое вмешательство не будет найдено, единственное, что вы можете сделать, чтобы избежать заражения или распространения астровируса, – это следовать определенным здравым правилам профилактики.К ним относятся:
- Правильное мытье рук, особенно после посещения туалета
- Не пользоваться общей посудой или чашками, если вы или окружающие больны
- Не ходить на работу или учебу, если вы заболели
- Отказ от обработки и приготовления пищи во время болезни или во время выздоровления от болезни
- Использование антисептиков или дезинфицирующих средств для очистки поверхностей, особенно в ванной и на кухне
Слово от Verywell
Астровирусы – один из нескольких вирусов, вызывающих гастроэнтерит.Хотя большинство инфекций протекает в легкой форме, следует проявлять особую осторожность, чтобы избежать заражения у людей, которые подвергаются наибольшему риску осложнений, таких как младенцы, пожилые люди или люди с запущенной ВИЧ-инфекцией. Улучшение гигиены и санитарии, наряду с улучшенным питанием, будет иметь большое значение для предотвращения астровирусной инфекции у этих уязвимых людей.
Тематическая статья: Лекарства и вакцины против COVID-19: что вы должны знать
Многие люди принимают регулярные лекарства, поэтому, готовясь к вакцинации COVID-19, они задаются вопросом, будут ли их лекарства влиять на вакцину или наоборот.В этой статье мы обсудим, почему можно ожидать, что некоторые лекарства изменят реакцию на вакцину, а другие – нет. Однако, учитывая почти 40 различных категорий лекарств и тысячи распространенных лекарственных средств, эта статья не рассматривает эту тему исчерпывающе. Помня об этом, люди всегда должны учитывать три важных момента:
- Никогда не прекращайте принимать лекарства, прописанные врачом, не проверив, безопасно ли это делать.
- Каждое лекарство – рецептурное, безрецептурное, незаконное или так называемое «естественное средство» – оказывает определенное воздействие на ваше тело.
- Если у вас есть вопрос о лекарстве, которое вы принимаете, поговорите со своим врачом, поскольку он знает вашу историю болезни и текущую медицинскую ситуацию, чтобы они могли лучше всего помочь оценить потенциальные риски и преимущества, связанные с самим лекарством или его применением. взаимодействие с чем-то другим, например с вакциной.
В связи с вакцинацией от COVID-19 обычно обсуждаются четыре типа лекарств, поэтому мы начнем с их рассмотрения:
- Жаропонижающие
- Анальгетики
- Антикоагулянты
- Антигистаминные препараты
Жаропонижающие и обезболивающие
Жаропонижающие – это лекарства, снижающие температуру, например салицилаты (например,g., аспирин), ацетаминофен (например, Tylenol ® ) и нестероидные противовоспалительные препараты или НПВП (например, Advil ® или Aleve ® ). Анальгетики – это лекарства, уменьшающие боль. Каждый из типов лекарств, перечисленных как жаропонижающие (салицилаты, ацетаминофен и НПВП), также являются анальгетиками, но более сильные лекарства, такие как опиоиды или комбинированные препараты (например, тайленол с кодеином), также попадают в категорию анальгетиков.
Люди обычно считают лихорадку и боль вызванными патогеном, потому что они возникают одновременно с инфекцией или травмой, но на самом деле они являются следствием наших собственных иммунных реакций.Лихорадка повышает эффективность нашей иммунной системы, а во время инфекции затрудняет эффективное функционирование патогена. Точно так же боль часто возникает в месте травмы, когда кровеносные сосуды расширяются, а иммунные клетки опускаются на травмированную или инфицированную область, часто вызывая отек, который ощущается как боль. Вакцины заставляют нашу иммунную систему реагировать, поэтому они тоже могут вызывать жар или боль. Поскольку жар и боль являются сигналами о том, что наша иммунная система работает, прием лекарств, снижающих температуру или маскирующих боль, может изменить иммунный ответ.
В отношении вакцинации против COVID-19 официальные лица здравоохранения из Центров по контролю и профилактике заболеваний (CDC) рекомендовали людям не принимать эти лекарства до вакцинации в ожидании возникновения побочных эффектов от вакцины COVID-19, потому что мы не знаем, какие будет влияние на иммунный ответ. Однако, если люди чувствуют себя некомфортно после вакцинации, они могут принимать эти лекарства, если это необходимо и с медицинской точки зрения.
Также следует отметить, что если врач назначил регулярный режим приема одного из этих лекарств, например ежедневную терапию аспирином после инсульта или сердечного приступа, пациенты должны продолжать принимать свои обычные дозы.Хотя у этих людей может быть несколько более слабый ответ на вакцину, у них все равно будет развиваться некоторый иммунитет, и риски прекращения приема лекарства могут перевесить преимущества. Тем не менее, с учетом сказанного, люди, которым не был назначен этот тип терапии, но которые ежедневно используют аспирин самостоятельно, чтобы снизить вероятность первого инсульта или сердечного приступа, должны рассмотреть возможность прекращения не только до вакцинации, но и навсегда. Исследования показали, что ежедневная терапия аспирином не снижает риск первого инсульта или сердечного приступа.
Антикоагулянты
Антикоагулянты или разжижители крови – это лекарства, назначаемые для уменьшения вероятности образования тромбов. Некоторые примеры включают, среди прочего, гепарин, кумадин ® , Xarelto ® и Eliquis ® . Поскольку их кровь менее склонна к свертыванию, люди, принимающие антикоагулянты, подвергаются повышенному риску кровотечения.
Вакцины против COVID-19, одобренные в настоящее время для использования в США, вводятся внутримышечно. Иногда, когда игла прокалывает кожу, капилляры под поверхностью нарушаются, вызывая небольшое кровотечение.Пациенту, принимающему препараты для разжижения крови, бывает сложнее остановить кровотечение. Таким образом, хотя эти люди обычно могут получить вакцину COVID-19, лицо, вводящее вакцину, должно быть осведомлено о повышенном риске реципиента, чтобы он мог контролировать длительное кровотечение.
Антигистаминные препараты
Антигистаминные препараты используются для уменьшения аллергических реакций, вызванных чрезмерной выработкой иммунной системой гистамина. Примеры включают Zyrtec ® , Benadryl ® , Allegra ® , Alavert ® и Claritin ® и другие.Поскольку вакцины с мРНК вызывают у некоторых людей тяжелые аллергические реакции, называемые анафилаксией, некоторые задаются вопросом, будет ли полезно принимать антигистаминные препараты перед вакцинацией, чтобы снизить вероятность возникновения анафилаксии. Предварительная обработка антигистаминными препаратами не рекомендуется, поскольку это не снижает вероятность анафилаксии и может замаскировать важные признаки аллергической реакции на вакцину.
С учетом вышесказанного, людям, которые обычно принимают антигистаминные препараты в связи с существующим заболеванием, нет необходимости прекращать прием лекарств до вакцинации.Поскольку их организм привык к обычному уровню, аллергический ответ на вакцину, вероятно, все еще будет заметен, и эти лекарства не работают таким образом, который, как можно было бы ожидать, изменил иммунный ответ на вакцину, поскольку это не гистамин- основанный ответ.
Лекарства прочие
Многие люди обращались в Центр обучения вакцинам (VEC) по поводу других лекарств. Как правило, мы рекомендуем, чтобы они поговорили со своими поставщиками медицинских услуг, которые знают, почему они принимают лекарства, какова доза и любые другие подробности их истории болезни, которые могут иметь значение.Однако здесь мы рассмотрим несколько дополнительных типов лекарств:
- Противовирусные препараты – Эти лекарства лечат вирусные инфекции, поэтому некоторые, естественно, задаются вопросом, можно ли им пройти вакцинацию, принимая противовирусные препараты. Примеры противовирусных препаратов включают, среди прочего, осельтамивир (Тамифлю ® ), пенцикловир, Трувада ® и ацикловир. Поскольку нынешние вакцины, используемые в США, не являются живыми вакцинами, вирус не вырабатывается, и, следовательно, не ожидается, что противовирусный препарат изменит ответ на вакцину.Однако, если человек все еще испытывает симптомы вирусной инфекции, от которой было прописано лекарство, он может рассмотреть возможность отсрочки вакцинации, чтобы было легче определить причину каких-либо симптомов.
- Антибиотики – Эти лекарства лечат бактериальные инфекции. Таким образом, не ожидается, что они повлияют на иммунный ответ на вакцину. Однако, как уже упоминалось в отношении противовирусных препаратов, если человек все еще испытывает симптомы, ему следует рассмотреть возможность отсрочки вакцинации, чтобы можно было отличить эффекты вакцины от последствий инфекции.Примеры антибиотиков включают пенициллин (например, амоксициллин), цефалоспорин (например, цефалексин), тетрациклин (например, доксициклин) и макролид (например, азитромицин), среди многих других.
- Кортикостероиды – Эти препараты, часто называемые стероидами, обычно используются для уменьшения воспаления, вызванного чрезмерной реакцией иммунной системы. Кортикостероиды используются для лечения различных состояний, в том числе ревматоидного артрита, астмы, аллергии, волчанки и васкулита.Их можно вводить перорально, в виде капель или в виде инъекций. Из-за широкого спектра условий, лекарств, режимов дозирования и способов доставки, а также из-за того, что эти лекарства напрямую влияют на иммунную систему, рекомендуется, чтобы люди, у которых есть вопросы, поговорили с лечащим врачом, чтобы оценить, может ли лекарство повлиять на иммунный ответ на COVID. -19 вакцинация. Во многих случаях дозы будут достаточно низкими или достаточно локализованными, чтобы не беспокоить.
- Biologics – Эта группа лекарств нацелена на определенные компоненты иммунной системы, которые при неправильном функционировании приводят к аутоиммунным состояниям, таким как волчанка, ревматоидный артрит, болезнь Крона, язвенный колит, псориаз, диабет и рассеянный склероз, среди других.В результате широкого спектра состояний, которые могут лечить биопрепараты, многие люди их используют. Некоторые из наиболее широко известных биопрепаратов включают Humira ® , Enbrel ® , Remicade ® и Rinvoq ® ; однако часто используются и многие другие. Как и в случае с кортикостероидами, учитывая широкий спектр переменных, связанных с этими лекарствами, и поскольку они напрямую влияют на некоторые аспекты иммунной системы, люди, принимающие их, должны обсудить свою личную ситуацию с лечащим врачом при рассмотрении вопроса о COVID-19 или других вакцинациях.В этом листе вопросов и ответов более подробно рассматриваются вакцины и биопрепараты.
В целом, многие люди принимают лекарства, и некоторые из них могут повлиять на иммунный ответ человека – не только на вакцины, но и на потенциальные инфекции или другие лекарства. Поэтому важно узнать больше о потенциальных эффектах любых лекарств, которые вы принимаете, воздерживаться от использования ненужных лекарств и проконсультироваться с врачом о смене лекарств или по другим вопросам.
Загрузите PDF-версию этой статьи.
.

 2.1] ГЕПТАН-2-ИЛИДЕН-АМИНОЭТАНОЛА В КАЧЕСТВЕ ИНГИБИТОРА РЕПРОДУКЦИИ ВИРУСА ГРИППА
2.1] ГЕПТАН-2-ИЛИДЕН-АМИНОЭТАНОЛА В КАЧЕСТВЕ ИНГИБИТОРА РЕПРОДУКЦИИ ВИРУСА ГРИППА  2.1]ГЕПТАНОВ КАК ИНГИБИТОРЫ ТРАНСКРИПЦИОННОГО ФАКТОРА NF-KB С ПРОТИВОВИРУСНОЙ АКТИВНОСТЬЮ (ВАРИАНТЫ) И ИХ ПРИМЕНЕНИЕ
2.1]ГЕПТАНОВ КАК ИНГИБИТОРЫ ТРАНСКРИПЦИОННОГО ФАКТОРА NF-KB С ПРОТИВОВИРУСНОЙ АКТИВНОСТЬЮ (ВАРИАНТЫ) И ИХ ПРИМЕНЕНИЕ