Противовоспалительные препараты при колите кишечника: Лечение неспецифического язвенного колита – Клиника Здоровье 365 г. Екатеринбург
Способы лечения воспаления кишечника лекарствами на сайте vzk.info
Принципы лечения воспалительных заболеваний кишечника
Лекарственная (консервативная) терапия язвенного колита и болезни Крона проводится не только для того, чтобы устранить симптомы заболевания, с которыми человек обратился к врачу. Цель лечения – сократить частоту и тяжесть обострений, предотвратить развитие осложнений, поскольку они могут потребовать серьезной хирургической операции.
Все лекарства, назначаемые при воспалительных заболеваниях кишечника, условно разделяют на средства для быстрого устранения обострения (индукции ремиссии) и для долгосрочного контроля болезни (поддержания ремиссии). Ремиссией называют период заболевания, во время которого отсутствуют проявления, связанные с активным воспалением. Например, при язвенном колите о ремиссии говорят при частоте стула менее 3 раз в день и полном отсутствии примеси крови в стуле.
В последние годы стало понятно, что самым благоприятным течение воспалительных заболеваний кишечника (ВЗК) становится у людей, у которых удалось не только устранить внешние проявления заболевания (добиться  Поэтому для того, чтобы объективно проверить, эффективно ли лечение, врачи выполняют контрольные эндоскопические исследования, а также используют лабораторные анализы, например, исследование кала на кальпротектин.
Поэтому для того, чтобы объективно проверить, эффективно ли лечение, врачи выполняют контрольные эндоскопические исследования, а также используют лабораторные анализы, например, исследование кала на кальпротектин.
Кроме того, современная терапия ставит целью максимально сократить частоту применения гормонов-глюкокортикостероидов, поскольку их длительный прием не только не позволяет контролировать язвенный колит или болезнь Крона, но и сопровождается побочными эффектами, которые могут остаться и после прекращения их использования. Одна из основных задач современного лечения ВЗК – достижение бесстероидной ремиссии. Быстрое возобновление симптомов заболевания после первоначального улучшения на фоне приема гормонов свидетельствует о гормональной зависимости и всегда требует усиления лекарственной терапии, а иногда и операции.
При лечении ВЗК применяют:
- Противовоспалительные препараты группы аминосалицилатов. Они не имеют ничего общего с ацетилсалициловой кислотой, то есть аспирином.
 Место их действия: преимущественно слизистая оболочка – внутренний слой кишки. По этой причине они успешно применяются при язвенном колите, но редко помогают при болезни Крона, при которой воспаление распространяется за пределы слизистой оболочки.
Место их действия: преимущественно слизистая оболочка – внутренний слой кишки. По этой причине они успешно применяются при язвенном колите, но редко помогают при болезни Крона, при которой воспаление распространяется за пределы слизистой оболочки.
- Местнодействующие (топические) глюкокортикостероиды. Естественный глюкокортикостероид – гормон надпочечников кортизол – ежедневно выделяется в организме любого человека. Эти гормоны подавляют иммунитет, а также оказывают влияние на почти все органы и механизмы регуляции жизнедеятельности организма, контролируя и обмен сахара, жира и белка, и артериальное давление, и выделение жидкости из организма. Топические гормоны почти не попадают в кровь, очень быстро всасываясь в поврежденную слизистую оболочку и оказывая местное противовоспалительное действие.
- Системные глюкокортикостероиды оказывают мощное противовоспалительное действие и назначаются при среднетяжелой и тяжелой формах ВЗК. Если человек не может принимать таблетки, или необходимо как можно быстрее устранить симптомы (например, при тяжелом язвенном колите), эти препараты вводят внутривенно.
 Системные гормоны вызывают множественные побочные эффекты, среди которых перераспределение жира, увеличение массы тела, сахарный диабет, артериальная гипертензия, остеопороз, тромбозы и даже психозы. Системные гормоны всегда применяют коротким курсом и используют только для индукции ремиссии. В качестве постоянной терапии эти препараты не пригодны: эксперты предписывают завершить гормональную терапию за 12 недель.
Системные гормоны вызывают множественные побочные эффекты, среди которых перераспределение жира, увеличение массы тела, сахарный диабет, артериальная гипертензия, остеопороз, тромбозы и даже психозы. Системные гормоны всегда применяют коротким курсом и используют только для индукции ремиссии. В качестве постоянной терапии эти препараты не пригодны: эксперты предписывают завершить гормональную терапию за 12 недель. - Легкие иммуносупрессоры. Эти препараты подавляют деление клеток. Иммуносупрессоры оказывают неизбирательное (неселективное) воздействие на иммунные клетки, тем самым существенно повышая вероятность всевозможных инфекций. Кроме того, препараты несколько увеличивают риск рака кожи и другого злокачественного заболевания – лимфомы. Эти лекарства накапливаются в организме медленно и поэтому используются только для поддержания ремиссии. На время, пока они не “заработали”, пациенту с обострением ВЗК обычно назначают топические или системные гормоны.
- Мощные иммуносупрессоры.
 Эти препараты также подавляют деление клеток, но действуют быстро. При лечении тяжелых форм язвенного колита эти препараты иногда позволяют избежать удаления толстой кишки при неэффективности гормонов.
Эти препараты также подавляют деление клеток, но действуют быстро. При лечении тяжелых форм язвенного колита эти препараты иногда позволяют избежать удаления толстой кишки при неэффективности гормонов.
- Биологические препараты. Это белковые препараты, которые блокируют действие специфичных молекул, участвующих в формировании хронического воспаления. Биологические препараты показаны для пациентов со среднетяжелой и тяжелой активной ВЗК, у которых другая терапия оказалась неэффективной, либо пациентов с высоким риском осложнений. Биологические препараты различаются в зависимости от специфичных белков – мишеней. Они эффективны как для индукции, так и для поддержания ремиссии.
Кроме того, в дополнение к основным препаратам используют вспомогательное лечение, в основном, при осложнениях заболевания или для профилактики осложнений самого лечения.
Зачастую пациентам требуется применение комбинации нескольких препаратов.
При выборе лечения специалист принимает во внимание клинические симптомы, течение и тяжесть заболевания, а также наличие и характер осложнений. ВЗК – хронические заболевания, контроль которых возможен. Важно обсудить с врачом Ваше лечение и неукоснительно соблюдать предписанный режим терапии.
*Не заменяет консультацию врача. Для постановки диагноза и назначения лечения необходимо обратиться к специалисту.
Язвенный колит
Язвенный колит – хроническое воспалительное заболевание кишечника с непрерывным поражением слизистой оболочки толстой кишки.
Как правило, не поражаются другие отделы кишечной трубки. Язвенный колит относится к группе хронических воспалительных заболеваний кишечника, в которую также входит болезнь Крона.
Распространенность
В мире на данное время живет более 5 миллионов человек, страдающих ВЗК (воспалительными заболеваниями кишечника). Распространенность различная в разных странах, при этом в северных регионах она выше, чем в южных.
Причины
На данный момент не установлены точные причины развития этого заболевания. Существуют предположения, что ВЗК развивается в результате имеющейся генетической предрасположенности при нарушении регуляции иммунного ответа на микрофлору кишечника. На развитие воспаления определенное влияние оказывают и факторы внешней среды – вирусы, бактерии, стресс.
Клиника
Как может проявить себя язвенный колит? Существуют так называемые кишечные проявления, внекишечные, а также системные признаки воспаления. К кишечным симптомам относятся боль в животе, диарея, выделение крови из прямой кишки (гематохезия). Системные признаки воспаления – повышение температуры тела, тахикардия, слабость, утомляемость, анемия, повышение уровня тромбоцитов и лейкоцитов, С-реактивного белка.
Формы язвенного колита
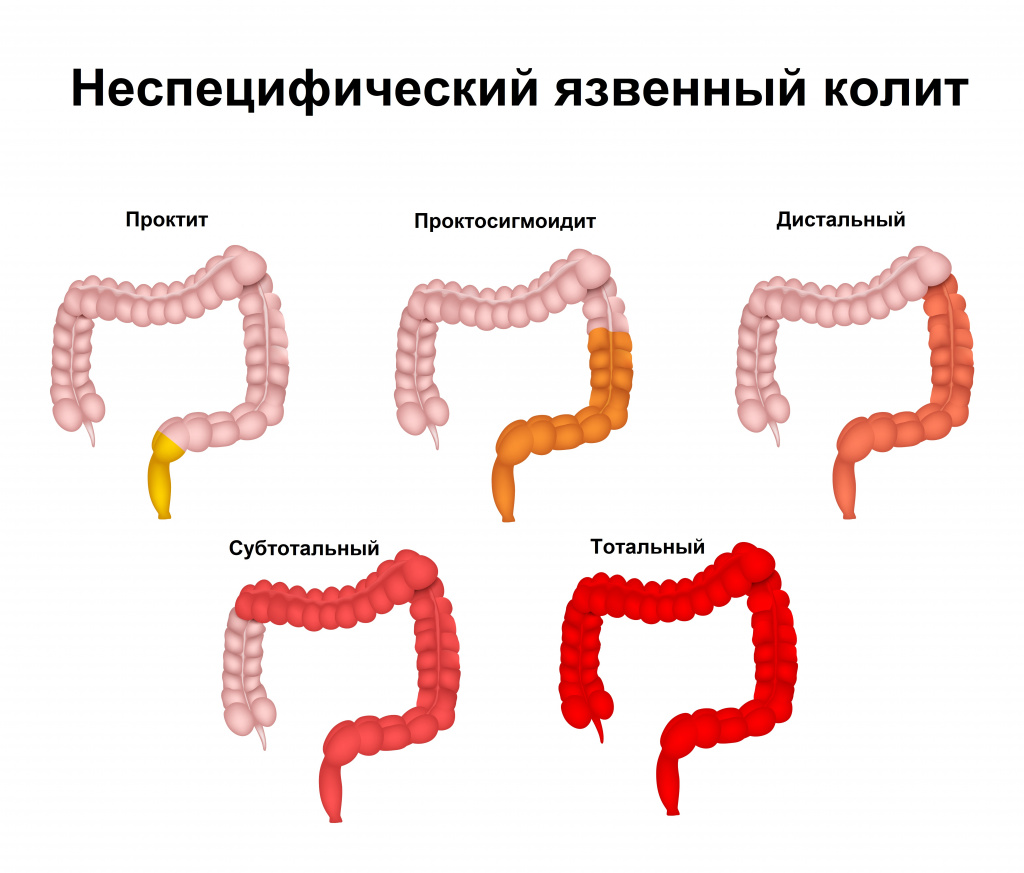
В зависимости от протяженности воспалительного процесса выделяют проктит (поражение только прямой кишки), левосторонний язвенный колит (воспаление в прямой, сигмовидной, нисходящей ободочной кишке), тотальное и субтотальное поражение (воспаление на протяжении всей длины толстой кишки).
Как поставить диагноз?
Диагноз ВЗК устанавливается, исходя из совокупности клинических, эндоскопических, гистологических, рентгенологических и лабораторных данных. Врач-гастроэнтеролог оценивает лабораторные показатели крови (может повышаться С-реактивный белок, зачастую имеет место железодефицитная анемия, повышение уровня лейкоцитов и тромбоцитов, СОЭ), а также маркер кишечного воспаления – фекальный кальпротектин. Основным методом диагностики является колоноскопия – эндоскопическое обследование толстого кишечника. Обязательно при проведении диагностической колоноскопии должен производиться забор биоптатов из разных отделов толстого кишечника.
Основные принципы лечения
Для лечения язвенного колита на сегодняшний день используется несколько групп лекарственных препаратов. При нетяжелых формах наиболее часто назначается противовоспалительная терапия препаратами 5-аминосалициловой кислоты (месакол, салофальк, пентаса). При среднетяжелых и тяжелых формах в лечении используются глюкокортикостероиды (преднизолон, метилпреднизолон) – с целью индукции ремиссии, и иммунодепрессанты (метотрексат, азатиоприн, 6-меркаптопурин, циклоспорин), биологическая терапия (инфликсимаб, адалимумаб, ведолизумаб и др.) – для поддержания ремиссии.
Питание при язвенном колите
Зачастую при постановке диагноза, в дебюте заболевания, назначается достаточно строгая диета, что может негативно сказываться как на психологическом состоянии пациента, так и на его нутритивном статусе (статусе питания).
Стоит запомнить, что не существует диет, которые способны вылечить или предотвратить ХВЗК.
Питание при ХВЗК должно быть в первую очередь сбалансированным, отвечающим принципам здорового питания, с учетом индивидуальной переносимости продуктов.
Если имеется дефицит питания, показано дополнительное энтеральное питание, которое включает в себя как сбалансированные, так и полуэлементные смеси.
В первую очередь, снижается функциональная нагрузка на толстый кишечник, уменьшается дополнительная травматизация воспаленной слизистой и создается режим покоя для дистальных отделов желудочно-кишечного тракта, поскольку всасывание компонентов смесей происходит уже в тонкой кишке.
Во-вторых, из просвета пищеварительного тракта удаляются пищевые антигены, которые могут способствовать поддержанию воспаления. Важно отметить, что в составе смесей для энтерального питания отсутствуют вызывающие диарею лактоза и глютен.
Воспалительные заболевания кишечника
19 мая 2016 года, в Международный день борьбы с воспалительными заболеваниями кишечника, в Совете Федерации РФ состоялось заседание экспертного совета по здравоохранению Комитета Совета Федерации по социальной политике на тему «Совершенствование оказания медицинской помощи больным с воспалительными заболеваниям кишечника»..gif) По результатам заседания были определены шаги по системному решению проблем оказания медицинской помощи данной группе больных.
По результатам заседания были определены шаги по системному решению проблем оказания медицинской помощи данной группе больных.
Воспалительные заболевания кишечника, включающие болезнь Крона и язвенный колит, являются рецидивирующими заболеваниями с периодами ремиссии и характеризующиеся хроническим воспалением различных участков желудочно-кишечного тракта, которые приводят к диарее и абдоминальным болям.
Воспалительные заболевания кишечника поражают людей всех возрастов, но обычно манифестируют в возрасте до 30 лет с пиком заболеваемости от 14 до 24 лет. Язвенный колит может иметь второй, но меньший пик заболеваемости между 50 и 70 годами; однако этот более поздний пик заболеваемости может включать некоторые случаи ишемического колита. Оба пола поражаются одинаково. У родственников первого поколения пациентов с воспалительными заболеваниями кишечника риск заболевания увеличивается в 4-20 раз; абсолютный риск заболевания может составлять выше 7%. Семейный анамнез намного выше при болезни Крона, чем при язвенном колите.
Чем вызываются воспалительные заболевания кишечника у взрослых?
В настоящее время достоверно не установлены причины развития воспалительных заболеваний кишечника. Большое внимание уделяется диете, применению красителей, консервантов в пищевой промышленности, употреблению алкоголя. Была идентифицирована специфическая генная мутация, определяющая высокий риск заболеваемости болезнью Крона (но не язвенного колита). Курение, возможно, вносит свой вклад в развитие или обострение болезни Крона, но уменьшает риск язвенного колита. Нестероидные противовоспалительные препараты (НПВП) могут приводить к обострению воспалительных заболеваний кишечника.
Симптомы воспалительных заболеваний кишечника
Воспалительные заболевания кишечника являются рецидивирующими хроническими заболеваниями, а это значит, что наблюдается чередование эпизодов обострения с яркими проявлениями и периодов относительного благополучия. Характеристика симптомов в целом зависит от поражённой части желудочно-кишечного тракта, симптомы могут быть от относительно лёгких и до тяжёлых. Обычно они сводятся к следующему:
Обычно они сводятся к следующему:
- Жидкий стул
- Примесь крови и слизи в кале
- Спазмы и боль в животе
- Бледно-серый налет на языке
- Затруднения при дефекации
- Лихорадка
- Потеря аппетита
- Потеря веса
- Анемия (в связи с кровопотерей)
При наличии данных симптомов следует незамедлительно обратиться к врачу (терапевту, гастроэнтерологу, проктологу).
Болезнь Крона и язвенный колит поражают, кроме кишечника, и другие органы. Большинство внекишечных проявлений более характерны для язвенного колита и поражения толстой кишки при болезни Крона, чем для болезни Крона, ограниченной тонкой кишкой. Внекишечные симптомы воспалительных заболеваний кишечника подразделяются на три категории:- Нарушения, которые обычно протекают параллельно (т. е. нарастание и убывание) обострениям воспалительных заболеваний кишечника.
 Они включают периферический артрит, эписклерит, афтозный стоматит, узловатую эритему и гангренозную пиодермию. Артрит обычно имеет мигрирующий, транзиторный характер с вовлечением крупных суставов. Один или более таких параллельно протекающих нарушений развивается более чем у 1/3 пациентов, госпитализированных с воспалительными заболеваниями кишечника.
Они включают периферический артрит, эписклерит, афтозный стоматит, узловатую эритему и гангренозную пиодермию. Артрит обычно имеет мигрирующий, транзиторный характер с вовлечением крупных суставов. Один или более таких параллельно протекающих нарушений развивается более чем у 1/3 пациентов, госпитализированных с воспалительными заболеваниями кишечника. - Нарушения, которые, вероятно, являются следствием воспалительных заболеваний кишечника, но появляются независимо от периодов обострений воспалительных заболеваний кишечника. Они включают анкилозирующий спондилит, сакроилеит, увеит и первичный склерозирующий холангит. Анкилозирующий спондилит более характерен для пациентов с воспалительными заболеваниями кишечника и антигеном HLA-B27. У большинства пациентов с поражением позвоночника и подвдошно-крестцовой зоны наблюдаются признаки увеита и наоборот. Первичный склерозирующий холангит является фактором риска развития рака билиарного тракта, который может появиться даже через 20 лет после колэктомии.
 Заболевания печени (напр., стеатоз печени, аутоиммунный гепатит, перихолангит, цирроз) наблюдаются у 3-5 % пациентов, хотя более характерны незначительные изменения функциональных печеночных тестов. Некоторые из этих нарушений (напр., первичный склерозирующий холангит) могут предшествовать воспалительным заболеваниям кишечника, и в случае их диагностики необходимо провести оценку возможности манифестации воспалительных заболеваний кишечника.
Заболевания печени (напр., стеатоз печени, аутоиммунный гепатит, перихолангит, цирроз) наблюдаются у 3-5 % пациентов, хотя более характерны незначительные изменения функциональных печеночных тестов. Некоторые из этих нарушений (напр., первичный склерозирующий холангит) могут предшествовать воспалительным заболеваниям кишечника, и в случае их диагностики необходимо провести оценку возможности манифестации воспалительных заболеваний кишечника. - Нарушения, которые являются следствием деструктивных изменений кишки. Они развиваются главным образом при тяжелом течении болезни Крона тонкой кишки. Мальабсорбция может быть результатом обширной резекции подвздошной кишки и вызывать недостаточность витамина В12 и минералов, приводя к анемии, гипокальциемии, гипомагниемии, нарушению свертывания крови, деминерализации костей, у детей – к задержке роста и развития. Другие нарушения включают образование камней в почках из-за чрезмерной абсорбции оксалатов, гидроуретер и гидронефроз из-за компрессии мочеточника, воспалительные процессы кишечника, желчнокаменную болезнь как следствие нарушенной реабсорбции солей желчных кислот в подвздошной кишке и амилоидоз как следствие длительно протекающего гнойно-воспалительного процесса.

Несколько классов медицинских препаратов эффективны при лечении воспалительных заболеваний кишечника. Детали их выбора и применения обсуждаются в отношении каждого заболевания и определяются лечащим врачом.
Поражение суставов и позвоночника у б ольных с воспалительными заболеваниями кишечника | Кузин
1. Воробьев ГИ, Костенко НВ. Неспецифический язвенный колит. Болезнь Крона. В кн.: Воробьев ГИ, редактор. Основы колопроктологии. Ростов-на-Дону: Феникс; 2001. С. 236-279. [Vorob’ev GI, Kostenko NV. Ulcerative colitis. Crohn’s Disease. In: Vorob’ev GI, editor. Osnovy koloproktologii [Basics of Coloproctology]. Rostov-na-Donu: Feniks; 2001. P. 236-79.]
2. Парфенов АИ. Энтерология. Москва: Триада-Х; 2002. 744 с. [Parfenov AI. Enterologiya [Enterology]. Moscow: Triada-X; 2002. 744 p.]
Moscow: Triada-X; 2002. 744 p.]
3. Халиф ИЛ, Лоранская ИД. Воспалительные заболевания кишечника (неспецифический язвенный колит и болезнь Крона). Клиника, диагностика и лечение. Москва: Миклош; 2004. 88 с. [Khalif IL, Loranskaya ID. Vospalitel’nye zabolevaniya kishechnika (nespetsificheskii yazvennyi kolit i bolezn’ Krona). Klinika, diagnostika i lechenie [Inflammatory bowel disease (ulcerative colitis and Crohn’s disease). Clinic, diagnostics and treatment]. Moscow: Miklosh; 2004. 88 p.]
4. Ardizzone S, Puttini PS, Cassionotti A, Poito GB. Extraintestinal manifestations of inflammatory bowel disease. Dig Liver Dis. 2008 Jul;40 Suppl 2:S253-9. doi: 10.1016/S1590-8658(08)60534-4.
5. Atzeni F, Defendenti C, Ditto MC, et al. Rheumatic manifestations in inflammatory bowel disease. Autoimmun Rev. 2014 Jan; 13(1):20-3. doi: 10.1016/j.autrev.2013.06.006. Epub 2013 Jun 15.
Autoimmun Rev. 2014 Jan; 13(1):20-3. doi: 10.1016/j.autrev.2013.06.006. Epub 2013 Jun 15.
6. Paredes JM, Barrachina MM, Roman J, Moreno-Osset E. Joint disease in inflammatory bowel disease. Gastroenterol Hepatol. 2005 Apr;28(4):240-9.
7. Fantini MC, Pallone F, Monteleone G. Common immunologic mechanisms in inflammatory bowel disease and spondylarthropathies. World J Gastroenterol. 2009 May 28;15(20):2472-8.
8. Salmi M, Andrew DP, Butcher EC, et al. Dual binding capacity of mucosal immunoblasts to mucosal and synovial endothelium in humans: dissection of the molecular mechanisms. J Exp Med. 1995 Jan 1;181(1):137-49.
9. Elewaut D, De Keyser F, Lazarovits A, et al. Inflamed synovial tissue from patients with spondylarthropathy is enriched with activated T-cells carrying beta-7 integrins. Arthritis Rheum. 1996;39:162.
Arthritis Rheum. 1996;39:162.
10. Gheita TA, El Gazzar II, El-Fishawy HS, et al. Involvement of IL-23 in enteropathic arthritis patients with inflammatory bowel disease: preliminary results. Clin Rheumatol. 2014 May;33(5):713-7. doi: 10.1007/s10067-013-2469-y. Epub 2014 Jan 3.
11. Simon EG, Ghosh S, Iacucci M, Moran GW. Ustekinumab for the treatment of Crohn’s disease: can it find its niche? Therap Adv Gastroenterol. 2016 Jan;9(1): 26-36. doi: 10.1177/1756283X15618130.
12. Asquith M, Elewaut D, Lin P, Rosenbaum JT. The role of the gut and microbes in the pathogenesis of spondyloarthritis. Best Pract Res Clin Rheumatol. 2014 Oct;28(5):687-702. doi: 10.1016/j.berh.2014.10.018. Epub 2014 Nov 15.
13. Smith JA, Colbert RA. Review: the interleukin-23/interleukin-17 axis in spondyloarthritis pathogenesis: Th27 and beyond. Arthritis Rheumatol. 2014 Feb;66(2):231-41. doi: 10.1002/art.38291.
Smith JA, Colbert RA. Review: the interleukin-23/interleukin-17 axis in spondyloarthritis pathogenesis: Th27 and beyond. Arthritis Rheumatol. 2014 Feb;66(2):231-41. doi: 10.1002/art.38291.
14. Wright V, Moll JMH. Seronegative polyarthritis. Amsterdam, the Netherlands: North Holland Publishing Company; 1976.
15. Orchard TR, Wordsworth BP, Jewell DP. Peripheral arthropathies in inflammatory bowel disease: their articular distribution and natural history. Gut. 1998 Mar;42(3):387-91.
16. Scarpa R, del Puente A, D’Arienzo A, et al. The arthritis of ulcerative colitis: clinical and genetic aspects. J Rheumatol. 1992 Mar;19(3):373-7.
17. De Vos M. Joint involvement associated with inflammatory bowel disease. Dig Dis. 2009;27(4):511-5. doi: 10.1159/000233290. Epub 2009 Nov 4.
Dig Dis. 2009;27(4):511-5. doi: 10.1159/000233290. Epub 2009 Nov 4.
18. Zochling J, Brandt J, Braun J. The current concept of spondyloarthritis with special emphasis on undifferentiated spondyloarthritis. Rheumatology (Oxford). 2005 Dec;44(12):1483-91. Epub 2005 Aug 9.
19. Souza MH, Troncon LE, Rodrigues CM, et al. Trends in the occurrence (1980-1999) and clinical features of Crohn’s disease and ulcerative colitis in a university hospital in southeastern Brazil. Arq Gastroenterol. 2002 Apr-Jun;39(2):98-105. Epub 2003 Feb 19.
20. Stolwijk C, Pierik M, Landewe R, et al. Prevalence of self-reported spondyloarthritis features in a cohort of patients with inflammatory bowel disease. Can J Gastroenterol. 2013 Apr;27(4):199-205.
21. Protzer U, Duchmann R, Hö hler T, et al. Enteropathic spondylarthritis in chronic inflammatory bowel diseases: prevalence, manifestation pattern and HLA association. Med Klin (Munich). 1996 Jun 15;91(6):330-5.
Protzer U, Duchmann R, Hö hler T, et al. Enteropathic spondylarthritis in chronic inflammatory bowel diseases: prevalence, manifestation pattern and HLA association. Med Klin (Munich). 1996 Jun 15;91(6):330-5.
22. Vavricka SR, Brun L, Ballabeni P, et al. Frequency and Risk Factors for Extraintestinal Manifestations in the Swiss Inflammatory Bowel Disease Cohort. Am J Gastroenterol. 2011 Jan;106(1):110-9. doi: 10.1038/ajg.2010.343. Epub 2010 Aug 31.
23. Dorofeyev AE, Vasilenko IV, Rassokhina OA. Joint extraintestinal manifestations in ulcerative colitis. Dig Dis. 2009;27(4):502-10. doi: 10.1159/000233289. Epub 2009 Nov 4.
24. Veloso FT, Carvalho J, Magro F. Immune-related systemic manifestations of inflammatory bowel disease. A prospective study of 792 patients. J Clin Gastroenterol. 1996 Jul;23(1):29-34.
J Clin Gastroenterol. 1996 Jul;23(1):29-34.
25. Caprilli R, Gassull MA, Escher JC, et al. European evidence based consensus on the diagnosis and management of Crohn’s disease: special situations. Gut. 2006 Mar;55 Suppl 1:i36-58.
26. Urlep D, Mamula P, Baldassano R. Extraintestinal manifestations of inflammatory bowel disease. Minerva Gastroenterol Dietol. 2005 Jun;51(2):147-63.
27. Shivashankar R, Loftus EV, TremaineWJ, et al. Incidence of spondyloarthropathy in patients with Crohn,s disease: a populationbased study. J Rheumatol. 2012 Nov;39(11):2148-52. doi: 10.3899/jrheum.120321. Epub 2012 Sep 15.
28. Bernstein CN, Blanchard JF, Rawsthorne P, Yu N. The prevalence of extraintestinal diseases in inflammatory bowel disease: a population-based study. Am J Gastroenterol. 2001 Apr;96(4):1116-22.
Am J Gastroenterol. 2001 Apr;96(4):1116-22.
29. Wordsworth P. Arthritis and inflammatory bowel disease. Curr Rheumatol Rep. 2000 Apr;2(2):87-8.
30. Van der Horst-Bruinsma IE1, Nurmohamed MT. Management and evaluation of extra-articular manifestations in spondyloarthritis. Ther Adv Musculoskelet Dis. 2012 Dec;4(6):413-22. doi: 10.1177/1759720X12458372.
31. Yü ksel I, Ataseven H, Basьar O, et al. Peripheral Arthritis in the Course of Inflammatory Bowel Diseases. Dig Dis Sci. 2011 Jan;56(1):183-7. doi: 10.1007/s10620-010-1260-z. Epub 2010 May 11.
32. Weisman MH, Reveille JD, Van der Heijde D, editors. Inflammatory bowel disease spondyloarthritis: epidemiology, clinical features and treatment. In: Ankylosing spondylitis and the Spondyloarthropathies. Philadelphia: Mosby; 2006. P. 65-74.
In: Ankylosing spondylitis and the Spondyloarthropathies. Philadelphia: Mosby; 2006. P. 65-74.
33. Palm O, Moum B, Jahnsen J, Gran JT. The prevalence and incidence of peripheral arthritis in patients with inflammatory bowel disease, a prospective population-based study (the IBSEN study). Rheumatology (Oxford). 2001 Nov;40(11):1256-61.
34. Адлер Г. Болезнь Крона и язвенный колит. Пер. с нем. М.: 2001. 527 с.
35. Orchard TR, Thiyagaraja S, Welsh KI, et al. Clinical phenotype is related to HLA genotype in the peripheral arthropathies of inflammatory bowel disease. Gastroenterology. 2000 Feb;118(2):274-8.
36. Suh CH, Lee CH, Lee J, et al. Arthritic manifestations of inflammatory bowel disease. J Korean Med Sci. 1998 Feb;13(1):39-43.
J Korean Med Sci. 1998 Feb;13(1):39-43.
37. Gravallese EM, Kantrowitz FG. Arthritic manifestations of inflammatory bowel disease. Am J Gastroenterol. 1988 Jul;83(7):703-9.
38. Greenstein A, Janowitz H, Sachar D. Extra-intestinal complications of Crohn’s disease and ulcerative colitis. Medicine (Baltimore). 1976 Sep;55(5):401-12.
39. Juillerat P, Mottet C, Froehlich F, et al. Extraintestinal manifestations of Crohn’s disease. Digestion. 2005;71(1):31-6. Epub 2005 Feb 4.
40. Fomberstein B, Yerra N, Pitchumoni CS. Rheumatological complications of GI disorders. Am J Gastroenterol. 1996 Jun;91(6):1090-103.
41. Palm O, Moum B, Ongre A, Gran JT. Prevalence of ankylosing spondylitis and other spondyloarthropathies among patients with inflammatory bowel disease: a population study (the IBSEN study). J Rheumatol. 2002 Mar;29(3):511-5.
Palm O, Moum B, Ongre A, Gran JT. Prevalence of ankylosing spondylitis and other spondyloarthropathies among patients with inflammatory bowel disease: a population study (the IBSEN study). J Rheumatol. 2002 Mar;29(3):511-5.
42. Christodoulou DK, Katsanos KH, Kitsanou M, Stergiopoulou C, Hatzis J, Tsianos EV. Frequency of extraintestinal manifestations in patients with inflammatory bowel disease in Northwest Greece and review of the literature. Dig Liver Dis. 2002 Nov;34(11):781-6.
43. Rodriguez VE, Costas PJ, Vazquez M, et al. Prevalence of spondyloarthropathy in Puerto Rican patients with inflammatory bowel disease. Ethn Dis. 2008 Spring;18 (2 Suppl 2):S2-225-9.
44. De Vlam K, Mielants H, Cuvelier C, et al. Spondylarthropathy is underestimated in inflammatory bowel disease: prevalence and HLA association. J Rheumatol. 2000 Dec;27(12):2860-5.
J Rheumatol. 2000 Dec;27(12):2860-5.
45. Voulgari PV. Rheumatological manifestations in inflammatory bowel disease. Ann Gastroenterol. 2011;24(3):173-180.
46. Acheson ED. An association between ulcerative colitis, regional enteritis, and ankylosing spondylitis. Q J Med. 1960 Oct;29:489-99.
47. Ansell BM, Wigley RA. Arthritic manifestations in regional enteritis. Ann Rheum Dis. 1964 Jan;23:64-72.
48. Haslock I. Arthritis and Crohn’s disease. A family study. Ann Rheum Dis. 1973 Nov;32(6):479-86.
49. Turkcapar N, Toruner M, Soykan I, et al. The prevalence of extraintestinal manifestations and HLA association in patients with inflammatory bowel disease. Rheumatol Int. 2006 May;26(7):663-8. Epub 2005 Sep 1.
Rheumatol Int. 2006 May;26(7):663-8. Epub 2005 Sep 1.
50. McEniff N, Eustace S, McCarthy C, et al. Asymptomatic sacroiliitis in inflammatory bowel disease. Assessment by computed tomography. Clin Imaging. 1995 Oct-Dec;19 (4):258-62.
51. Scott WW Jr, Fishman EK, Kuhlman JE, Caskey CI, O’Brien JJ, Walia GS, Bayless TM. Computed tomography evaluation of the sacroiliac joints in Crohn disease. Radiologic/clinical correlation. Skeletal Radiol. 1990;19(3):207-10.
52. Peeters H, Vander Cruyssen B, Laukens D, et al. Radiological sacroiliitis, a hallmark of spondylitis, is linked with CARD15 gene polymorphisms in patients with Crohn’s disease. Ann Rheum Dis. 2004 Sep;63(9):1131-4.
53. Bandinelli F, Terenzi R, Giovannini L, et al. Occult radiological sacroiliac abnormalities in patients with inflammatory bowel disease who do not present signs or symptoms of axial spondylitis. Clin Exp Rheumatol. 2014 Nov-Dec;32(6):949-52. Epub 2014 Aug 15.
Bandinelli F, Terenzi R, Giovannini L, et al. Occult radiological sacroiliac abnormalities in patients with inflammatory bowel disease who do not present signs or symptoms of axial spondylitis. Clin Exp Rheumatol. 2014 Nov-Dec;32(6):949-52. Epub 2014 Aug 15.
54. Queiro R, Maiz O, Intxausti J, et al. Subclinical sacroiliitis in inflammatory bowel disease: a clinical and follow-up study. Clin Rheumatol. 2000;19(6):445-9.
55. Rodriguez-Reyna TS, Martinez-Reyes C, Yamamoto-Furusho JK. Rheumatic manifestations of inflammatory bowel disease. World J Gastroenterol. 2009 Nov 28;15(44):5517-24.
56. Mendoza JL, Lana R, Taxonera C, et al. Extraintestinal manifestations in inflammatory bowel disease: differences between Crohn’s disease and ulcerative colitis. Med Clin (Barc). 2005 Sep 10;125(8):297-300.
2005 Sep 10;125(8):297-300.
57. Salvarani C, Vlachonikolis IG, van der Heijde DM, et al. Musculoskeletal manifestations in a population-based cohort of inflammatory bowel disease patients. Scand J Gastroenterol. 2001 Dec;36(12):1307-13.
58. Brophy S, Pavy S, Lewis P, et al. Inflammatory eye, skin, and bowel disease in spondyloarthritis: genetic, phenotypic, and environmental factors. J Rheumatol. 2001 Dec;28(12):2667-73.
59. Yuksel I, Basar O, Ataseven H, et al. Mucocutaneous manifestations in inflammatory bowel disease. Inflamm Bowel Dis. 2009 Apr;15(4):546-50. doi: 10.1002/ibd.20807.
60. Rudwaleit M, Baeten D. Ankylosing spondylitis and bowel disease. Best Pract Res Clin Rheumatol. 2006 Jun;20(3):451-71.
2006 Jun;20(3):451-71.
61. Orchard TR. Extraintestinal manifestations: skin, joint and mucocutaneous manifestations. In: Satsangi J, Sutherland LR, et al, editors. Inflammatory bowel disease. Elsevier Limited: Churchill Livingstone; 2003. P. 669-84.
62. De Vos M, Mielants H, Cuvelier C. Arthritis, osteoporosis and rheumatological manifestations: patterns, diagnostic and therapeutic problems. In: Lembcke B, Kruis W, Sartor RB, editors. Systemic manifestations of IBD. Kluwer Academic Publishers; 1998. P. 55-63.
63. Lanna CC, Ferrari Mde L, Rocha SL, et al. A cross-sectional study of 130 Brazilian patients with Crohn’s disease and ulcerative colitis: analysis of articular and ophthalmologic manifestations. Clin Rheumatol. 2008 Apr;27(4):503-9. Epub 2007 Dec 21.
64. Al-Jarallah K, Shehab D, Al-Azmi W, Al-Fadli A. Rheumatic complications of inflammatory bowel disease among Arabs: a hospital-based study in Kuwait. Int J Rheum Dis. 2013 Apr;16(2):134-8. doi: 10.1111/j.1756-185X.2012.01811.x. Epub 2012 Sep 7.
65. Lakatos PL, Lakatos L, Kiss LS, et al. Treatment of extraintestinal manifestations in inflammatory bowel disease. Digestion. 2012; 86 Suppl 1:28-35. doi: 10.1159/000341950. Epub 2012 Oct 5.
66. Armuzzi A, Gionchetti P, Daperno M, et al; GIVI (Gruppo Italiano su Vedolizumab nelle IBD) Group; GIVI Gruppo Italiano su Vedolizumab nelle IBD Group. Expert consensus paper on the use of Vedolizumab for the management of patients with moderateto- severe Inflammatory Bowel Disease. Dig Liver Dis. 2016 Apr;48(4):360-70. doi: 10.1016/j.dld.2015.12.016. Epub 2016 Jan 7.
doi: 10.1016/j.dld.2015.12.016. Epub 2016 Jan 7.
Лечение колита кишечника в Москве
Воспаление толстой кишки (колит) — заболевание, которое может носить хронический или острый характер. Патология проявляется нарушениями в работе кишечника (частые позывы в туалет, диарея, в том числе со слизью, с кровью), сопровождается болью в брюшной области. При хроническом течении болезни наблюдается слабость, ухудшение общего состояния, потеря веса, при этом боли могут отсутствовать.
При отсутствии лечения острого воспаления могут развиться опасные для жизни осложнения: сильное обезвоживание вследствие долгой диареи, критическая потеря веса, перфорация кишечной стенки, перитонит. Если не лечить хронический колит, могут образоваться сужения кишечника, дивертикулы или полипы, а если не лечить долго, то и рак кишечника.
Запишитесь на прием в French Clinic.
Если вы наблюдаете у себя тревожные симптомы, не откладывайте визит к врачу-гастроэнтерологу. В медицинском центре French Clinic грамотные специалисты при помощи новейшего оборудования быстро и эффективно решат проблему и вернут вам хорошее самочувствие.
В медицинском центре French Clinic грамотные специалисты при помощи новейшего оборудования быстро и эффективно решат проблему и вернут вам хорошее самочувствие.
Оставьте свой номер телефона.
Вам перезвонит администратор клиники.
Причины возникновения и факторы риска
Среди возможных причин возникновения патологии можно назвать наследственные факторы, нарушение работы иммунной системы, изменение микрофлоры кишечника. Влияет на вероятность развития заболевания также длительный прием антибиотиков, перенесенные кишечные инфекции, качество питания. Лечение хронического колита должно сопровождаться нормализацией питания — это один из основных факторов, которые влияют на успех терапии.
Развитие острого колита обычно обусловлено повреждением тканей кишечника вследствие проникновения инфекции (например, при дизентерии, сальмонеллезе).
Выделяют несколько основных видов заболевания:
Язвенный
Так называют хроническое воспаление, локализующееся в области ободочной и прямой кишки и сопровождающееся возникновением язв._575.gif) Различают несколько форм: проктит (представляет собой воспаление конечной части кишки), левосторонний колит (патологический процесс ограничивается изгибом кишки с левой стороны), наконец, тотальный (при этой форме страдают все ткани кишки). Основные симптомы, которые должны вас насторожить:
Различают несколько форм: проктит (представляет собой воспаление конечной части кишки), левосторонний колит (патологический процесс ограничивается изгибом кишки с левой стороны), наконец, тотальный (при этой форме страдают все ткани кишки). Основные симптомы, которые должны вас насторожить:
- жидкий стул с кровью;
- частые позывы;
- сильные боли в области прямой кишки.
Лечение язвенного колита должно быть направлено на предотвращение опасных осложнений (кровоизлияний, присоединения инфекции и тд.) и заживление тканей кишечника.
Эрозивный
Этот вид заболевания может затрагивать тонкий и толстый кишечник, сопровождается образованием эрозий на поверхности кишки. Вас могут побеспокоить такие симптомы:
- тяжесть в желудке;
- боль в животе;
- время от времени — неприятный привкус во рту;
- нарушения стула.
Катаральный
Обычно это — первая стадия в развитии хронического колита. Слизистая, выстилающая кишечник, набухает (обычно в нисходящем отделе тонкой кишки). Иногда появляются кровоизлияния. Основные симптомы:
Слизистая, выстилающая кишечник, набухает (обычно в нисходящем отделе тонкой кишки). Иногда появляются кровоизлияния. Основные симптомы:
- общая слабость, плохое самочувствие;
- боль в животе;
- повышенное газообразование;
- частые позывы;
- поносы, чередующиеся запорами.
Диффузный
При этой форме заболевания страдают оба отдела кишечника — и тонкий, и толстый. Это самая тяжелая форма, проявляется она обычно ярко, с характерной симптоматикой:
- резкие боли в брюшине;
- гнилостный привкус во рту, отрыжка;
- нарушения стула: частые ложные позывы, понос и запор.
У некоторых пациентов поднимается температура.
Диагностика
Первое, что будет делать врач на приеме — выслушает жалобы и оценит ваше общее состояние. Обычно для постановки предварительного диагноза этого достаточно. Для того чтобы его подтвердить или опровергнуть, проводят колоноскопию — исследование кишечника эндоскопом — прибор позволяет оценить изменение состояния слизистой, определить наличие язв. В некоторых случаях требуется УЗИ.
В некоторых случаях требуется УЗИ.
Лечение воспаления толстой и тонкой кишки
Обычно в лечении колита кишечника используется комплексный подход. При подборе терапевтической схемы учитываются характер и объем поражения кишечника, длительность болезни, присутствие внекишечных признаков патологии, а также эффективность или неэффективность проведенного ранее лечения. Основные назначения при лечении воспаления толстой кишки:
- диета с исключением острой и раздражающей пищи, частый прием пищи небольшими порциями;
- препараты, угнетающие патогенную флору;
- средства для нормализации микрофлоры кишечника;
- возможно, клизмы;
- при сильном поносе — обволакивающие и вяжущие средства.
Лечение язвенного колита
Включает перечисленные выше мероприятия плюс при опасности присоединения инфекции — прием антибактериальных и противовоспалительных препаратов. Своевременно начатое лечение позволяет снять острые симптомы, предотвратить развитие осложнений.
Лечение хронической формы
Также предполагает нормализацию питания, прием препаратов, нормализующих микрофлору кишечника. В случае, когда заболевание сопровождается образованием множественных язв, осложняется присоединением инфекции, требуется операция.
Для лечения обратитесь в медицинский центр French Clinic по телефону +7(499)110-31-11. Наши врачи имеют опыт более 10 лет, а также регулярно проходят повышение квалификации, в том числе за рубежом. Специалисты нашей клиники помогут вам справиться с заболеванием и вернуться к нормальной жизни в кратчайшие сроки.
Популярные вопросы
Может ли болезнь возникнуть на нервной почве?
Есть данные о связи заболевания с сильными стрессами и переутомлением. Обычно причин несколько: нарушение режима питания, резкое изменение эмоционального фона, сбои в работе иммунитета.
Может ли болезнь переродиться в рак?
Да, наличие язвенного колита, болезни Крона и других патологических изменений тканей толстой кишки повышает риск развития рака. Нужно обязательно встать на учет и регулярно наблюдаться у специалиста.
Нужно обязательно встать на учет и регулярно наблюдаться у специалиста.
Можно ли полностью излечиться от колита?
Сам он не пройдет, народными методами справиться тоже не получится. Обязательно нужно участие грамотного врача. Хорошо поддаются лечению острые формы, связанные с инфекцией: сальмонеллезом, дизентерией. При хронических формах заболевания важнее всего предотвратить развитие опасных для жизни осложнений.
Влияние препаратов висмута на кишечник » Медвестник
На сегодняшний день наиболее широко используют коллоидный субцитрат висмута, или висмута трикалия дицитрат. Несмотря на то, что висмут относится к тяжелым металлам, он и его соединения считаются малотоксичными. Это свойство объясняется преимущественно их нерастворимостью в нейтральных водных растворах и биологических жидкостях и крайне низкой биодоступностью. Висмут практически не всасывается в кровь и именно поэтому проявляет свой максимальный эффект в желудочно-кишечном тракте. Выводится препарат преимущественно с калом, незначительное количество попадает в плазму крови и выводится почками. Наиболее часто встречающимся побочным эффектом является потемнение стула за счет образования сульфида висмута. Это не опасно для здоровья пациента и не требует отмены препарата. Тем не менее, следует предупреждать пациента о таком эффекте во избежание самостоятельной отмены терапии.
Выводится препарат преимущественно с калом, незначительное количество попадает в плазму крови и выводится почками. Наиболее часто встречающимся побочным эффектом является потемнение стула за счет образования сульфида висмута. Это не опасно для здоровья пациента и не требует отмены препарата. Тем не менее, следует предупреждать пациента о таком эффекте во избежание самостоятельной отмены терапии.
По индексу безопасности относится к III классу – малотоксичных, малоопасных препаратов. Фармакодинамика препарата является хорошо изученной. В кислой среде желудка осаждаются нерастворимые висмута оксихлорид и цитрат, образуя хелатные соединения с белковым субстратом в виде защитной пленки на поверхности язв и эрозий (язва, эрозивный гастрит, трофические расстройства). Стимулирует синтез простагландина Е (фактор защиты). Участвует в «накоплении», «осаждении» эпидермального фактора роста в зоне повреждения, стимулируя регенерацию слизистой.
Побочные эффекты при использовании рекомендованных доз препарата проявляются крайне редко и носят временный характер. Это появление тошноты, более частого стула или запоров. На основании имеющихся клинических данных не выявлено случаев кишечной обструкции на фоне приема висмута. Препарат может вызывать более серьезные побочные эффекты исключительно при длительном приеме в больших дозах, что не имеет обоснований для назначения. При таких условиях возможно появление симптомов «висмутовой» энцефалопатии (особенно у больных с нарушением функции почек). На основании анализа 945 клинических случаев было доказано, что побочные эффекты возникают лишь при применении очень высоких доз препаратов на протяжении длительного времени.
Это появление тошноты, более частого стула или запоров. На основании имеющихся клинических данных не выявлено случаев кишечной обструкции на фоне приема висмута. Препарат может вызывать более серьезные побочные эффекты исключительно при длительном приеме в больших дозах, что не имеет обоснований для назначения. При таких условиях возможно появление симптомов «висмутовой» энцефалопатии (особенно у больных с нарушением функции почек). На основании анализа 945 клинических случаев было доказано, что побочные эффекты возникают лишь при применении очень высоких доз препаратов на протяжении длительного времени.
Безопасность введения висмута в схемах эрадикации патогенной бактерии Helicobacter pylori была подтверждена в систематическом обзоре 35 рандомизированных клинических испытаний с общим количеством 4 763 пациентов, 2 435 из которых лечились солями висмута: при этом не было зарегистрировано серьезных побочных эффектов. Также не было статистически значимой разницы в общем количестве неблагоприятных случаев между теми пациентами, которые принимали висмут, и теми, кто использовал схемы лечения без висмута. В группах не наблюдалось отдельных неблагоприятных эффектов, таких как боль в животе, диарея, головокружение, головная боль, металлический привкус, тошнота или рвота. По окончании лечения пациенты отмечали хорошую переносимость и значительный положительный эффект исследуемого препарата на клинические проявления заболевания.
В группах не наблюдалось отдельных неблагоприятных эффектов, таких как боль в животе, диарея, головокружение, головная боль, металлический привкус, тошнота или рвота. По окончании лечения пациенты отмечали хорошую переносимость и значительный положительный эффект исследуемого препарата на клинические проявления заболевания.
Таким образом, препараты висмута не оказывают значимого неблагоприятного воздействия на кишечник. Более того, имеются результаты исследований о положительном влиянии висмута на течение и прогноз некоторых заболеваний кишечника. Механизм его действия заключается в связывании производного сульфатредуцирующими бактериями сероводорода в кишечнике, рост которых происходит при воспалительных заболеваниях кишечника. Висмут, соединяясь с сероводородом, образует нерастворимый безвредный сульфид висмута и оказывает бактериостатическое действие.
В одном из Кокрейновских обзоров на первичные исследования была описана попытка применения висмута в лечении пациентов с установленным диагнозом лимфоцитарного колита. По результатам исследования его преимущества в сравнении с плацебо не было установлено, что, возможно, связано с малым размером выборки пациентов. Тем не менее не наблюдалось и каких-либо побочных эффектов на кишечник и желудочно-кишечный тракт в целом.
По результатам исследования его преимущества в сравнении с плацебо не было установлено, что, возможно, связано с малым размером выборки пациентов. Тем не менее не наблюдалось и каких-либо побочных эффектов на кишечник и желудочно-кишечный тракт в целом.
Другое исследование включало применение висмута в терапии коллагенового колита, при котором зачастую наблюдается хроническая диарея. По результатам исследования разрешение диареи было выявлено в ста процентах случаев за восемь недель применения препарата. Побочных явлений в группе пациентов также не было обнаружено.
В некоторых случаях при тяжелом течении язвенного колита, резистентного к медикаментозной терапии, применяется восстановительная проктоколэктомия с анальным анастомозом подвздошной кишки. Одним из осложнений данного вмешательства является возникновение паучита – воспаления хирургически сформированного резервуара. В одном из рандомизированных плацебо-контролируемых исследований у 40 пациентов с хроническим паучитом применение клизмы с висмутом достоверно вызывало улучшение состояние в 45% случаев в сравнении с группой, получающей плацебо.
Препараты висмута, в особенности субсалицилат висмута, используется в профилактике и лечении диареи у путешественников. Ряд исследований подтвердили эффективность висмута субсалицилата в профилактике и лечении диареи (E. coli энтеротоксигенной) путешественника. Энтеротоксигенная E. coli обнаруживалась реже у тех путешественников, которые получали висмута субсалицилат, чем у тех, кто принимали плацебо; это доказывает, что висмута субсалицилат предотвращает диарею, уменьшая количество энтеротоксигенной E. Coli и подавляя ее размножение.
Кроме того, имеется ряд работ, в которых продемонстрирована роль висмута в лечении синдрома раздраженного кишечника с преобладанием диареи. В нескольких исследованиях применение препарата оказало положительное влияние на клиническую картину этого заболевания – достоверно уменьшился абдоминальный болевой синдром, вздутие и урчание в животе, нормализовались частота и характер стула, улучшилось качество жизни в части общего здоровья, социального и психологического функционирования пациентов. В одном из таких исследований было проведено сравнение комбинации препаратов висмута с мебеверином и плацебо с мебеверином . В результате в группе, которая принимала висмут, наблюдался благоприятный эффект на регрессию симптомов в сравнении с плацебо.
В одном из таких исследований было проведено сравнение комбинации препаратов висмута с мебеверином и плацебо с мебеверином . В результате в группе, которая принимала висмут, наблюдался благоприятный эффект на регрессию симптомов в сравнении с плацебо.
Таким образом, препараты висмута являются важным звеном в терапии многих воспалительных заболеваний пищевода, желудка и двенадцатиперстной кишки. Значимых побочных эффектов при адекватно подобранных дозах при применении препарата не наблюдается. Исследования, на основании которых выявлено благоприятное воздействие висмута на заболевания толстой кишки, требуют дальнейшего изучения.
Литература
- Chande N, Al Yatama N, Bhanji T, Nguyen TM, McDonald JWD, Mac Donald JK. Interventions for treating lymphocytic colitis (Review) Cochrane Systematic Review – Intervention Version published: 13 July 2017.
- Tahir S Kafil, Tran M Nguyen, Petrease H Patton, John K MacDonald, Nilesh Chande, John WD Mc Donald.
 Interventions for treating collagenous colitis. Cochrane Systematic Review – Intervention Version published: 11 November 2017.
Interventions for treating collagenous colitis. Cochrane Systematic Review – Intervention Version published: 11 November 2017. - Ford AC, Malfertheiner P, Giguere M, Santana J, Khan M, Moayyedi P. Adverse events with bismuth salts for Helicobacter pylori eradication: systematic review and meta-analysis. World J Gastroenterol. 2008;14:7361–7370.
- Москалев А.В., Гладких В.С., Огиенко А.Г., Адамова Т.П., Гладких О.Л. Химико-фармакологическое исследование препаратов на основе висмута трикалия дицитрата // Эффективная фармакотерапия. Гастроэнтерология. 2016. № 2 (34). С. 34–47.
- Минушкин О. Н., Топчий Т. Б., Чеботарева А. М. Использование препаратов висмута в лечении гастроэнтерологических больных и эрадикационных схемах с учетом рекомендаций Маастрихт V// Медицинский совет. 2017. № 15 (34). С. 18–19.
- Barton LL, Lyle DA, Ritz NL, Granat AS, Khurshid AN, Kherbik N, Hider R, Lin HC. Bismuth(III) deferiprone effectively inhibits growth of Desulfovibrio desulfuricans ATCC 27774.
 Biometals 2016 Apr;29(2):311-9.
Biometals 2016 Apr;29(2):311-9. - Segal JP, Ding NS, Worley G, Mclaughlin S, Preston S, Faiz OD, Clark SK, Hart AL. Systematic review with meta-analysis: the management of chronic refractory pouchitis with an evidence-based treatment algorithm Aliment Pharmacol Ther. 2017 Mar;45(5):581–592.
- Daghaghzadeh H, Memar A, Mohamadi Y, Rezakhani N, Safazadeh P, Aghaha S, Adibi P. Therapeutic Effects of Low-dose Bismuth Subcitrate on Symptoms and Health-related Quality of Life in Adult Patients with Irritable Bowel Syndrome: A Clinical Trial J Res Pharm Pract. Jan-Mar 2018;7(1):13–21.
Неоперативные методы лечения дивертикулита ободочной кишки (обзор литературы) | Тимербулатов
1. Rezapour M., Ali S., Stollman N. Diverticular disease: an update on pathogenesis and management. Gut Liver. 2018;12:125–32. DOI: 10.5009/gnl16552
2. Peery AF. Recent Advances in Diverticular Disease. Curr Gastroenterol Rep. 2016 Jul;18(7):37. DOI: 10.1007/s11894-016-0513-1
Peery AF. Recent Advances in Diverticular Disease. Curr Gastroenterol Rep. 2016 Jul;18(7):37. DOI: 10.1007/s11894-016-0513-1
3. Kupcinskas J., Strate L.L., Bassotti G., Torti G., Herszènyi L., Malfertheiner P., et al. Pathogenesis of diverticulosis and diverticular disease. J Gastrointestin Liver Dis. 2019;28(suppl. 4):7–10. DOI: 10.15403/jgld-551
4. Peery A.F., Crockett S.D., Murphy C.C., Lund J.L., Dellon E.S., Williams J.L., et al. Burden and cost of gastrointestinal, liver, and pancreatic diseases in the United States: Update 2018. Gastroenterology. 2019;156:254–72.e11. DOI: 10.1053/j.gastro.2018.08.063
5. Wheat C.L., Strate L.L. Trends in hospitalization for diverticulitis and diverticular bleeding in the United States from 2000 to 2010. Clin Gastroenterol Hepatol. 2016;14:96–103.e1. DOI: 10.1016/j.cgh.2015.03.030
Clin Gastroenterol Hepatol. 2016;14:96–103.e1. DOI: 10.1016/j.cgh.2015.03.030
6. Peery A.F., Crockett S.D., Barritt A.S., Dellon E.S., Eluri S., Gangarosa L.M., et al. Burden of gastrointestinal, liver, and pancreatic diseases in the United States. Gastroenterology. 2015;149:1731–41.e3. DOI: 10.1053/j.gastro.2015.08.045
7. Bollom A., Austrie J., Hirsch W., Nee j., Friedlander D., Ellingson K., et al. Emergency department burden of diverticulitis in the USA, 2006–2013. Dig Dis Sci. 2017;62:2694–703. DOI: 10.1007/s10620-017-4525-y
8. Masoomi H., Buchberg B., Nguyen B., Tung V., Stamos M.J., Mills S. Outcomes of laparoscopic versus open colectomy in elective surgery for diverticulitis. World J Surg. 2011;35:2143–8. DOI: 10. 1007/s00268-011-1117-4
1007/s00268-011-1117-4
9. Jeger V., Pop R., Forudastan F., Barras J.P., Zuber M., Piso R.J. Is there a role for procalcitonin in diff erentiating uncomplicated and complicated diverticulitis in order to reduce antibiotic therapy? A prospective diagnostic cohort study. Swiss Med Wkly. 2017;147:w14555. DOI: 10.4414/smw.2017.14555
10. Hogan J., Sehgal R., Murphy D., O’Leary P., Coff ey J.C. Do infl ammatory indices play a role in distinguishing between uncomplicated and complicated diverticulitis? Dig Surg.2017;34:7–11. DOI: 10.1159/000447250
11. Kechagias A., Rautio T., Makela J. Th e early c-reactive protein trend does not have a role in monitoring acute diverticulitis progression. Chirurgia (Bucur). 2016;111(1):43–7. PMID: 26988538
12. Mäkelä J.T., Klintrup K., Takala H., Rautio T. Th e role of C-reactive protein in prediction of the severity of acute diverticulitis in an emergency unit. Scand J Gastroenterol. 2015;50(5):536–41. DOI: 10.3109/00365521.2014.999350
Mäkelä J.T., Klintrup K., Takala H., Rautio T. Th e role of C-reactive protein in prediction of the severity of acute diverticulitis in an emergency unit. Scand J Gastroenterol. 2015;50(5):536–41. DOI: 10.3109/00365521.2014.999350
13. Bolkenstein H.E., van de Wall B.J., Consten E.C., van der Palen J., Broeders I.A, Draaisma W.A. Development and validation of a diagnostic prediction model distinguishing complicated from uncomplicated diverticulitis. Scand J Gastroenterol. 2018;53(10-11):1291–7. DOI: 10.1080/00365521.2018.1517188
14. Alshamari M., Norrman E., Geijer M., Jansson K., Geijer H. Diagnostic accuracy of low-dose CT compared with abdominal radiography in non-traumatic acute abdominal pain: prospective study and systematic review. Eur Radiol. 2016;26:1766–74. DOI: 10.1007/s00330-015-3984-9
15. Wasvary H., Turfah F., Kadro O., Beauregard W. Same hospitalization resection for acute diverticulitis. Am Surg. 1999;65:632–6. PMID: 10399971
Wasvary H., Turfah F., Kadro O., Beauregard W. Same hospitalization resection for acute diverticulitis. Am Surg. 1999;65:632–6. PMID: 10399971
16. Hall J.F., Roberts P.L., Ricciardi R., Read T., Scheirey C., Wald C, et al. Long-term follow-up aft er an initial episode of diverticulitis: what are the predictors of recurrence? Dis Colon Rectum. 2011;54(3):283–8. DOI: 10.1007/DCR.0b013e3182028576
17. Kameda T., Kawai F., Taniguchi N., Kobori Y. Usefulness of transabdominal ultrasonography in excluding adnexal disease. J Med Ultrason (2001). 2016;43(1):63–70. DOI: 10.1007/s10396-015-0666-9
18. Nielsen K., Richir M.C., Stolk T.T., van der Ploeg T., Moormann G.R.H.M., Wiarda B.M., et al. Th e limited role of ultrasound in the diagnostic process of colonic diverticulitis. World J Surg. 2014;38(7):1814–8. DOI: 10.1007/s00268-013-2423-9
World J Surg. 2014;38(7):1814–8. DOI: 10.1007/s00268-013-2423-9
19. Schreyer A.G., Layer G., German Society of Digestive and Metabolic Diseases (DGVS) as well as the German Society of General and Visceral Surgery (DGAV) in collaboration with the German Radiology Society (DRG). S2k guidlines for diverticular disease and diverticulitis: diagnosis, classifi cation, and therapy for the radiologist. Rofo. 2015;187(8):676–84. DOI: 10.1055/s-0034-1399526
20. Dirks K., Calabrese E., Dietrich C.F., Gilja O.H., Hausken T., Higginson A., et al. EFSUMB position paper: recommendations for gastrointestinal ultrasound (GIUS) in acute appendicitis and diverticulitis. Ultraschall Med. 2019;40(2):163–75. DOI: 10.1055/a-0824-6952
21. istä E. , Hjern F., Blomqvist L., Von Heijne A., Abraham-Nordling M. Cancer and diverticulitis of the sigmoid colon. Diff erentiation with computed tomography versus magneticresonance imaging: preliminary experiences. Acta Radiol. 2013;54(3):237–41. DOI: 10.1258/ar.2012.120543
, Hjern F., Blomqvist L., Von Heijne A., Abraham-Nordling M. Cancer and diverticulitis of the sigmoid colon. Diff erentiation with computed tomography versus magneticresonance imaging: preliminary experiences. Acta Radiol. 2013;54(3):237–41. DOI: 10.1258/ar.2012.120543
22. Daniels L., Unlu C., de Korte N., van Dieren S., Stockmann H.B., Vrouenraets B.C., et al. Randomized clinical trial of observational versus antibiotic treatment for a fi rst episode of CT-proven uncomplicated acute diverticulitis. Br J Surg. 2017;104(1):52–61. DOI: 10.1002/bjs.10309
23. Mege D., Yeo H. Meta-analyses of current strategies to treat uncomplicated diverticulitis. Dis Colon Rectum. 2019;62(3):371–8. DOI: 10.1097/DCR.0000000000001295
24. Isacson D. , Smedh K., Nikberg M., Chabok A. Long-term follow-up of the AVOD randomized trial of antibiotic avoidance in uncomplicated diverticulitis. Br J Surg. 2019;106(11):1542–8. DOI: 10.1002/bjs.11239
, Smedh K., Nikberg M., Chabok A. Long-term follow-up of the AVOD randomized trial of antibiotic avoidance in uncomplicated diverticulitis. Br J Surg. 2019;106(11):1542–8. DOI: 10.1002/bjs.11239
25. van Dijk S.T., Daniels L., Unlu C., de Korte N., van Dieren S., Stockmann H.B., et al. Long-term eff ects of omitting antibiotics in uncomplicated acute diverticulitis. Am J Gastroenterol. 2018;113(7):1045–52. DOI: 10.1038/s41395-018-0030-y
26. Shabanzadeh D.M., Wille-Jørgensen P. Antibiotics for uncomplicated diverticulitis. Cochrane Database System Rev. 2012;(11):CD009092. DOI: 10.1002/14651858.CD009092.pub2.
27. Estrada Ferrer O., Ruiz Edo N., Hidalgo Grau L.A., Abadal Prades M., Del Bas Rubia M., Garcia Torralbo E.M., et al. Selective nonantibiotic treatment in sigmoid diverticulitis: is it time to change the traditional approach? Tech Coloproctol. 2016;20(5):309–15. DOI: 10.1007/s10151-016-1464-0
Selective nonantibiotic treatment in sigmoid diverticulitis: is it time to change the traditional approach? Tech Coloproctol. 2016;20(5):309–15. DOI: 10.1007/s10151-016-1464-0
28. Emile S.H., Elfeki H., Sakr A., Shalaby M. Management of acute uncomplicated diverticulitis without antibiotics: a systematic review, meta-analysis, and meta-regression of predictors of treatment failure. Tech Coloproctol. 2018;22(7):499–509. DOI: 10.1007/s10151-018-1817-y
29. Bolkenstein H.E., Draaisma W.A., van de Wall B., Consten E., Broeders I. Treatment of acute uncomplicated diverticulitis without antibiotics: risk factors for treatment failure. Int J ColorectalDis. 2018;33(7):863–9. DOI: 10.1007/s00384-018-3055-1
30. Feingold D., Steele S. R., Lee S., Kaiser A., Boushey R., Buie W.D., et al. Practice parameters for the treatment of sigmoid diverticulitis. Dis Colon Rectum. 2014;57(3):284–94. DOI: 10.1097/DCR.0000000000000075
R., Lee S., Kaiser A., Boushey R., Buie W.D., et al. Practice parameters for the treatment of sigmoid diverticulitis. Dis Colon Rectum. 2014;57(3):284–94. DOI: 10.1097/DCR.0000000000000075
31. Schug-Pass C., Geers P., Hugel O., Lippert H., Kockerling F. Prospective randomized trial comparing short-term antibiotic therapy versus standard therapy for acute uncomplicated sigmoid diverticulitis. Int J Colorectal Dis. 2010;25(6):751–9. DOI: 10.1007/s00384-010-0899-4
32. Biondo S., Golda T., Kreisler E., Espin E., Vallribera F., Oteiza F., et al. Outpatient versus hospitalization management for uncomplicated diverticulitis: a prospective, multicenter randomized clinical trial (DIVER Trial). Ann Surg. 2014;259(1):38–44. DOI: 10.1097/SLA.0b013e3182965a11
33. Gregersen R., Mortensen L.Q., Burcharth J., Pommergaard H.C., Rosenberg J. Treatment of patients with acute colonic diverticulitis complicated by abscess formation: a systematic review. Int J Surg. 2016;35:201–8. DOI: 10.1016/j.ijsu.2016.10.006
Gregersen R., Mortensen L.Q., Burcharth J., Pommergaard H.C., Rosenberg J. Treatment of patients with acute colonic diverticulitis complicated by abscess formation: a systematic review. Int J Surg. 2016;35:201–8. DOI: 10.1016/j.ijsu.2016.10.006
34. Elagili F., Stocchi L., Ozuner G., Kiran R.P. Antibiotics alone instead of percutaneous drainage as initial treatment of large diverticular abscess. Tech Coloproctol. 2015;19(2):97–103. DOI: 10.1007/s10151-014-1250-9
35. Devaraj B., Liu W., Tatum J., Cologne K., Kaiser A.M. Medically treated diverticular abscess associated with high risk of recurrence and disease complications. Dis Colon Rectum. 2016;59(3):208–15. DOI: 10.1097/DCR.0000000000000533
36. Garfi nkle R., Kugler A., Pelsser V. , Vasilevsky C.-A., Morin N., Gordon P., et al. Diverticular abscess managed with long-term defi nitive nonoperative intent is safe. Dis Colon Rectum. 2016;59(7):648–55. DOI: 10.1097/DCR.0000000000000624
, Vasilevsky C.-A., Morin N., Gordon P., et al. Diverticular abscess managed with long-term defi nitive nonoperative intent is safe. Dis Colon Rectum. 2016;59(7):648–55. DOI: 10.1097/DCR.0000000000000624
37. Toorenvliet B.R., Swank H., Schoones J.W., Hamming J.F., Bemelman W.A. Laparoscopic peritoneal lavage for perforated colonic diverticulitis: a systematic review. Colorectal Dis. 2010;12(9):862–7. DOI: 10.1111/j.1463-1318.2009.02052.x
38. Strate L.L., Morris A.M. Epidemiology, pathophysiology, and treatment of diverticulitis. Gastroenterology. 2019;156(5):1282–98.e1. DOI: 10.1053/j.gastro.2018.12.033
39. Schafmayer C., Harrison J.W., Buch S., Lange Ch., Reichert M.C., Hofer Ph., et al. Genome-wide association analysis of diverticular disease points towards neuromuscular, connective tissue and epithelial pathomechanisms. Gut. 2019;68(5):854–65. DOI: 10.1136/gutjnl-2018-317619
Gut. 2019;68(5):854–65. DOI: 10.1136/gutjnl-2018-317619
40. Strate L.L., Keeley B.R., Cao Y., Wu K., Giovannucci E.L., Chan AT. Western dietary pattern increases, and prudent dietary pattern decreases, risk of incident diverticulitis in a prospective cohort study. Gastroenterology. 2017;152(5):1023–30.e2. DOI: 10.1053/j.gastro.2016.12.038
41. Liu P.H., Cao Y., Keeley B.R., Tam I., Wu K., Strate L.L., et al. Adherence to a healthy lifestyle is associated with a lower risk of diverticulitis among men. Am J Gastroenterol. 2017;112(12):1868–76. DOI: 10.1038/ajg.2017.398
42. Aune D., Sen A., Norat T., Riboli E. Dietary fi bre intake and the risk of diverticular disease: a systematic review and meta-analysis of prospective studies. Eur J Nutr. 2020;59(2):421–32. DOI: 10.1007/s00394-019-01967-w
Eur J Nutr. 2020;59(2):421–32. DOI: 10.1007/s00394-019-01967-w
43. Aune D., Sen A., Leitzmann M.F., Tonstad S., Norat T., Vatten LJ. Tobacco smoking and the risk of diverticular disease — a systematic review and meta-analysis of prospective studies. Colorectal Dis. 2017;19(7):621–33. DOI: 10.1111/codi.13748
44. Aune D., Sen A., Leitzmann M.F., Norat T., Tonstad S., Vatten L.J. Body mass index and physical activity and the risk of diverticular disease: a systematic review and meta-analysis of prospective studies. Eur J Nutr. 2017;56(8):2423–38. DOI: 10.1007/s00394-017-1443-x
45. Picchio M., Elisei W., Brandimarte G., Di Mario F., Malfertheiner P., Scarpignato C., et al. Mesalazine for the treatment of symptomatic uncomplicated diverticular disease of the colon and for primary prevention of diverticulitis: a systematic review of randomized clinical trials. J Clin Gastroenterol. 2016;50(suppl 1):S64–9. DOI: 10.1097/MCG.0000000000000669
J Clin Gastroenterol. 2016;50(suppl 1):S64–9. DOI: 10.1097/MCG.0000000000000669
46. Picchio M., Elisei W., Tursi A. Mesalazine to treat symptomatic uncomplicated diverticular disease and to prevent acute diverticulitis occurrence. A systematic review with meta-analysis of randomized, placebo-controlled trials. J Gastrointestin Liver Dis. 2018;27(3):291–7. DOI: 10.15403/jgld.2014.1121.273.pic
47. Carter F., Alsayb M., Marshall J.K., Yuan Y. Mesalamine (5-ASA) for the prevention of recurrent diverticulitis. Cochrane Database Syst Rev. 2017;10:CD009839. DOI: 10.1002/14651858.CD009839.pub2
48. Lanas A., Ponce J., Bignamini A., Mearin F. One year intermittent rifaximin plus fi bre supplementation vs. fi bre supplementation alone to prevent diverticulitis recurrence: a proof-of-concept study. Dig Liver Dis. 2013;45(2):104–9. DOI: 10.1016/j.dld.2012.09.006
49. Moniuszko A., Rydzewska G. Th e eff ect of cyclic rifaximin therapy on symptoms of diverticular disease from the perspective of the gastroenterology outpatient clinic: a “real-life” study. Prz Gastroenterol. 2017;12(2):145–51. DOI: 10.5114/pg.2017.68167
50. Bianchi M., Festa V., Moretti A., Ciaco A., Mangone M., Tornatore V., et al. Meta-analysis: long-term therapy with rifaximin in the management of uncomplicated diverticular disease. Aliment Pharmacol Th er. 2011;33(8):902–10. DOI: 10.1111/j.1365-2036.2011.04606.x
51. Tursi A., Brandimarte G., Elisei W., Picchio M., Forti G., Pianese G., et al. Randomised clinical trial: mesalazine and/or probiotics in maintaining remission of symptomatic uncomplicated diverticular disease–a double- blind, randomised, placebo-controlled study. Aliment Pharmacol Th er. 2013;38(7):741–51. DOI: 10.1111/apt.12463
52. Suhardja T.S., Norhadi S., Seah E.Z., Rodgers-Wilson S. Is early colonoscopy aft er CT-diagnosed diverticulitis still necessary? Int J Colorectal Dis. 2017;32(4):485–9. DOI: 10.1007/s00384-016-2749-5
53. Sallinen V., Mentula P., Leppдniemi A. Risk of colon cancer aft er computed tomography-diagnosed acute diverticulitis: is routine colonoscopy necessary? Surg Endosc. 2014;28(3):961–6. DOI: 10.1007/s00464-013-3257-0
54. Sharma P.V., Eglinton T., Hider P., Frizelle F. Systematic review and meta-analysis of the role of routine colonic evaluation aft er radiologically confi rmed acute diverticulitis. Ann Surg. 2014;259(2):263–72. DOI: 10.1097/SLA.0000000000000294
55. Meyer J., Orci L.A., Combescure C., et al. Risk of colorectal cancer in patients with acute diverticulitis: a systematic review and metaanalysis of observational studies. Clin Gastroenterol Hepatol. 2019;17(8):1448–56.e17. DOI: 10.1016/j.cgh.2018.07.031
56. Lahat A., Yanai H., Menachem Y., Avidan B., Bar-Meir S. Th e feasibility and risk of early colonoscopy in acute diverticulitis: a prospective controlled study. Endoscopy. 2007;39(6):521–4. DOI: 10.1055/s-2007-966399
57. Elmi A., Hedgire S.S., Pargaonkar V., Cao K., McDermott S., Harisinghani M. Is early colonoscopy benefi cial in patients with CT-diagnosed diverticulitis? AJR Am J Roentgenol. 2013;200(6):1269–74. DOI: 10.2214/AJR.12.9539
58. Ramphal W., Schreinemakers J.M., Seerden T.C., Crolla R.M., Rijken A.M., Gobardhan P.D. What is the risk of colorectal cancer aft er an episode of acute diverticulitis in conservatively treated patients? J Clin Gastroenterol. 2016;50(4):e35–9. DOI: 10.1097/MCG.0000000000000373
59. Walker A.S., Bingham J.R., Janssen K.M., et al. Colonoscopy aft er Hinchey I and II left -sided diverticulitis: utility or futility? Am J Surg. 2016;212(5):837–43. DOI: 10.1016/j.amjsurg.2016.02.012
Нестероидные противовоспалительные препараты и противовоспалительные заболевания кишечника
Фармацевтические препараты (Базель). 2010 Apr; 3 (4): 1084–1092.
Отделение гастроэнтерологии, кампус здравоохранения Рамбам, Хайфа, P.O.B. 9602, Хайфа, 31096, Израиль
Получено 13 января 2010 г .; Пересмотрено 1 апреля 2010 г .; Принято 9 апреля 2010 г.
Авторские права © 2010, авторы; лицензиат Molecular Diversity Preservation International, Базель, Швейцария. Эта статья цитировалась в других статьях в PMC.Abstract
Воспалительные заболевания кишечника (ВЗК) – это иммуноопосредованные хронические или рецидивирующие заболевания желудочно-кишечного тракта (ЖКТ).ВЗК характеризуется хроническим воспалительным процессом кишечника с различными компонентами, влияющими на патогенез заболевания, включая факторы окружающей среды, такие как курение или использование нестероидных противовоспалительных препаратов (НПВП). НПВП являются одними из наиболее часто используемых лекарств для лечения различных воспалительных состояний. Основным фактором, ограничивающим использование НПВП, является опасность развития желудочно-кишечной токсичности, включая повреждение слизистой оболочки. Возможная связь между применением НПВП и началом или рецидивом ВЗК неоднократно высказывалась.В этой статье будут рассмотрены современные концепции и доказательства взаимосвязи между ВЗК и НПВП.
Ключевые слова: НПВП, ВЗК, болезнь Крона, язвенный колит
1. Введение
Воспалительные заболевания кишечника (ВЗК) – это иммуноопосредованные хронические или рецидивирующие заболевания желудочно-кишечного тракта, состоящие в основном из болезни Крона (БК). ) и язвенный колит (ЯК). ВЗК характеризуется хроническим воспалительным процессом кишечника с различными компонентами, влияющими на патогенез заболевания, включая факторы окружающей среды (такие как курение или НПВП), генетический фон, кишечную флору хозяина и иммунную систему хозяина [1].
CD – это трансмуральное заболевание, макроскопически характеризующееся пропущенными очагами с афтами, язвами различного типа, а иногда и классическим видом, напоминающим брусчатку. Микроскопически трансмуральное хроническое воспаление присутствует с образованием гранулемы или без него. Хроническое воспаление ЯК ограничивается слизистой оболочкой и носит непрерывный характер. Макроскопически типичен зернистый вид или отечная геморрагическая слизистая оболочка, в более тяжелых случаях. Типичны архитектурные искажения крипт под микроскопом и хроническое воспаление [1].
Поскольку БК может поражать любую часть желудочно-кишечного тракта, клинический спектр заболевания широко варьируется от боли в эпигастрии и гастрита, негативного по Helicobacter pylori из-за поражения верхних отделов желудочно-кишечного тракта, до диареи, потери веса, болей в животе и недостаточности питания у пациентов с заболевание тонкой кишки. Гематохезия, кровавая диарея, тенезмы и иногда лихорадка указывают на поражение толстой кишки при БК или наличие ЯК. Перианальное заболевание встречается только у пациентов с БК.
До трети пациентов с ВЗК страдают внекишечными проявлениями своего заболевания.К ним относятся дерматологические проявления, такие как узловатая эритема, глазные осложнения, такие как конъюнктивит и увеит, гепатобилиарные осложнения, включая холелитиаз, стеатоз и первичный склерозирующий холангит, а также урологические осложнения, в основном нефролитиаз. Наконец, два очень важных и распространенных внекишечных осложнения – это ревматические проявления, такие как артралгии, периферический артрит или анкилозирующий спондилит и остеопороз с повышенным риском переломов, вызванных дефицитом витамина D и кальция и длительным приемом стероидов [2,3].При обоих этих осложнениях, а также при боли, не связанной с ВЗК, пациенты с ВЗК часто обращаются за помощью к НПВП [4,5].
Нестероидные противовоспалительные препараты являются одними из наиболее часто используемых лекарств для лечения различных воспалительных состояний. По оценкам, 60 миллионов американцев регулярно принимают НПВП [6]. Основным фактором, ограничивающим использование НПВП, является опасность развития желудочно-кишечной токсичности, включая повреждение слизистой оболочки в виде эрозий и язв, кровотечение верхних отделов желудочно-кишечного тракта, тонкой кишки или толстой кишки и, в редких случаях, перфорацию и непроходимость из-за образования стриктуры [7].НПВП также могут вызывать неспецифический тип колита и воспаление тонкого кишечника с сопутствующими осложнениями в виде хронической потери крови или белка [8]. Эндоскопические признаки повреждения толстой кишки, вызванного НПВС, включают резко очерченные или периферические язвы, которые обычно обратимы после отмены препарата [9]. Подсчитано, что использование НПВП пациентами с артритом в США вызывает более 100 000 госпитализаций ежегодно по поводу желудочно-кишечных осложнений, одна пятая из которых, по оценкам, связана с осложнениями нижних отделов желудочно-кишечного тракта [10].Обзор литературы о побочных эффектах НПВП со стороны нижнего ЖКТ выявил статистически значимое увеличение частоты побочных эффектов, связанных с применением НПВП, у пациентов с кровотечением из нижних отделов ЖКТ, перфорацией и осложненным дивертикулярным заболеванием [10]. Возможная связь между применением НПВП и началом или рецидивом ВЗК неоднократно высказывалась. Однако отсутствие контролируемых проспективных исследований затрудняет однозначные выводы [4,11].
2.Патогенез желудочно-кишечной токсичности, вызванной НПВП
Было предложено несколько механизмов, ответственных за желудочно-кишечную токсичность, вызванную НПВП, в целом и у пациентов с ВЗК в частности. К ним относятся повышенная проницаемость слизистой оболочки, образование аддуктов лекарственное средство-энтероцит и индуцированный НПВП внутриклеточный дефицит АТФ и усиление энтерогепатической циркуляции. Однако наиболее обсуждаемым механизмом является их влияние на синтез простагландинов [4]. Простагландины играют ключевую роль в защите слизистой оболочки, поддержании микроциркуляции и модуляции иммунной системы в толстой кишке [12].Экспериментальные модели, использующие активную иммунизацию против простагландинов E2, F2A и D2 и ингибирование COX1 и COX2, привели к развитию кишечных язв и обострению колита, вызванного декстрансульфатом натрия (DSS) [13,14]. Снижение продукции простагландинов из-за ингибирования ЦОГ1 и ЦОГ2 было связано с ранними и частыми клиническими рецидивами ВЗК [15].
COX2 – индуцибельный фермент, не обнаруживаемый в нормальном эпителии. Его экспрессия индуцируется в течение нескольких часов после воздействия инвазивных организмов или провоспалительных цитокинов, включая интерлейкин 1 и фактор некроза опухоли альфа, и обычно теряется в течение 24 часов.Многие из этих событий вовлекают сигнальный путь NFK-B [16]. В областях активного воспаления из-за ВЗК фермент COX2 может быть обнаружен в апикальных эпителиальных клетках воспаленной слизистой оболочки [4,17]. Было обнаружено, что экспрессия COX2 в тонкой кишке и слизистой оболочке толстой кишки выше при экспериментальном колите, что коррелирует с воспалительной активностью при ВЗК и оказывает положительное влияние на заживление при экспериментальном колите [18,19]. Точный механизм, с помощью которого ингибиторы ЦОГ2 вызывают рецидив ВЗК, неясен.Было предложено несколько гипотез, включая замедленное заживление ран с повышенной проницаемостью сосудов, поддержание целостности слизистой оболочки кишечника и противовоспалительные свойства кишечной ткани во время воспаления [4,20].
Возможный патогенез вызванной НПВП токсичности желудочно-кишечного тракта [36]. Адаптировано с разрешения издателя.
Таблица 1
Возможные молекулярные механизмы НПВП-индуцированных обострений ВЗК [4]. Адаптировано с любезного разрешения Springer Science + Business Media.
| Механизм действия |
|---|
|
3.Обычные НПВП и ВЗК
НПВП могут инициировать ВЗК или вызывать реактивацию неактивного заболевания и вызывать осложнения со стороны желудочно-кишечного тракта [15,21,22]. Уровень использования НПВП среди пациентов, поступивших в больницу с обострениями ВЗК, выше, чем ожидалось [22]. Несколько ретроспективных и когортных исследований выявили причастность НПВП к началу или обострению ВЗК [23,24,25]. Takeuchi et al. [15], используя клиническую оценку и измерения кальпротектина в кале, продемонстрировали, что неселективные НПВП были связаны с частотой рецидивов 17–28% в течение девяти дней после приема препарата у пациентов с ВЗК.Meyer et al. [24], ретроспективно проанализированы файлы амбулаторных пациентов с ВЗК и показали, что лечение НПВП было связано с рецидивом заболевания. Несколько дополнительных исследований случай-контроль показали, что НПВП повышают риск нового начала ВЗК [26,27], последующих обострений [25,27] и связаны с более высоким индексом активности заболевания [28]. Напротив, два исследования Bonner et al. [27,28] не выявили связи между активной или неподвижной БК или ЯК и применением НПВП в популяции амбулаторных пациентов с ВЗК.
4. Селективные ингибиторы ЦОГ2 и IBD
Селективные ингибиторы ЦОГ2 вызывают меньшую токсичность для ЖКТ по сравнению с обычными НПВП. На сегодняшний день исследования использования селективных ингибиторов ЦОГ2 при ВЗК дали неоднозначные результаты. Махадеван и др. [29] обследовали 27 пациентов с БК, ЯК и поучитом, получавших рофекоксиб или целекоксиб. Было показано, что лечение было полезным и безопасным. Большое двойное слепое плацебо-контролируемое исследование Sandborn et al. [30] из 222 пациентов с ЯК в стадии ремиссии с артритом или артралгиями продемонстрировали, что лечение целекоксибом до двух недель не приводило к более высокой частоте рецидивов, чем плацебо.В другом многоцентровом двойном слепом плацебо-контролируемом исследовании Miedeny et al. [31] включал 146 пациентов с ВЗК, получавших эторикоксиб или плацебо в течение трех месяцев. Лечение было полезным и безопасным и не было связано с обострением болезни. Другое открытое исследование Reinisch [32] продемонстрировало профиль эффективности и безопасности рофекоксиба у аналогичных пациентов.
Напротив, сообщалось о нескольких случаях обострений у пациентов с ВЗК, получавших ингибиторы ЦОГ2 [33,34].Bioncone et al. [16] оценили безопасность и эффективность ингибиторов ЦОГ2 в открытом исследовании. Рофекоксиб контролировал артралгии у двух третей пациентов, однако побочные эффекты, требующие отмены препарата, наблюдались у одной пятой пациентов с ВЗК. К ним относятся боли в животе, диарея, кровавый стул и изжога. Matuk et al. [32] оценили безопасность и токсичность целекоксиба и рофекоксиба у 33 пациентов с ВЗК. Все пациенты испытали обострение болезни в течение 6 недель после начала терапии ЦОГ2, и у 38% из них симптомы исчезли после прекращения лечения.Наконец, недавний метаанализ [35], посвященный применению ингибиторов ЦОГ2 у пациентов с ВЗК, показал, что данных для определения влияния ингибиторов ЦОГ2 на обострения ВЗК недостаточно. Эти смешанные данные предполагают, что требуется дальнейшая оценка использования селективных ингибиторов ЦОГ2 у пациентов с ВЗК. резюмирует исследования по влиянию НПВП на ВЗК.
Таблица 2
Статьи о влиянии НПВП и селективных ингибиторов ЦОГ2 на ВЗК.
| Артикул | Тип исследования | Тип ВЗК | Тип НПВП | Выводы |
|---|---|---|---|---|
| Такеучи, К. et al. [15] | Предполагаемая когорта | ЯК и CD | Неселективный | Прием НПВП связан с частыми и ранними рецидивами ВЗК в покое. |
| Мейер А.М. et al. [24] | Ретроспективная когорта | ЯК и CD | Неселективный | Использование НПВС было связано с рецидивом ВЗК. |
| Felder J.B. et al. [25] | Случай – контроль | ЯК и CD | Неселективный | НПВП вызывают активность заболевания как при ЯК, так и при БК. |
| Evans, J.M. et al. [26] | Контроль случая | UC и CD | Неселективный | НПВП связаны с госпитализацией пациентов с тяжелым колитом с ВЗК. |
| Боннер, Г.Ф. et al. [27] | Ретроспективная когорта | ЯК и CD | Неселективное | Использование НПВП не было связано с более высокой вероятностью активного ВЗК. |
| Боннер, Г.Ф. et al. [28] | Случай – контроль | UC и CD | Неселективный | Высокие дозы НПВП были связаны с более высоким индексом активности заболевания, но значительных обострений заболевания не наблюдалось. |
| Mahadevan, U. et al. [29] | Ретроспективная когорта | ЯК и CD | Селективные ЦОГ2 | Ингибиторы ЦОГ2 оказались безопасными и полезными для пациентов с ВЗК. |
| Sandborn, W.J. et al. [30] | Рандомизированное плацебо-контролируемое исследование | UC | Селективный по COX2 | Лечение целекоксибом не было связано с большей частотой рецидивов по сравнению с плацебо. |
| El Miedany, Y. et al. [31] | Рандомизированное плацебо-контролируемое исследование | ЯК и CD | Селективный по ЦОГ | Лечение эторикоксибом было безопасным и эффективным у пациентов с ВЗК.Это не было связано с обострениями ВЗК. |
| Reinisch, W. et al. [32] | Проспективное открытое исследование | ЯК и CD | Селективный по ЦОГ | Лечение рофекоксибом было безопасным, полезным и не ассоциировалось с обострениями ВЗК. |
| Xin-Pu Miao et al. [35] | Мета-анализ | ЯК и CD | ЦОГ2 селективный | Недостаточно данных для определения влияния ингибиторов ЦОГ2 на обострения ВЗК. |
5. Резюме и выводы
В заключение, на сегодняшний день имеющиеся в литературе данные о влиянии НПВП на активность ВЗК неубедительны. Остается неясным, действительно ли НПВП и селективные ингибиторы ЦОГ2 вызывают обострения ВЗК и являются ли ингибиторы ЦОГ2 более безопасными, чем обычные НПВП. Есть некоторые данные, позволяющие предположить, что краткосрочное использование селективных ингибиторов ЦОГ2 безопасно и полезно у пациентов с ВЗК. Одновременное применение НПВС или ингибиторов ЦОГ2 и стероидов у пациентов с ВЗК требует особого рассмотрения и тщательного наблюдения из-за потенциально повышенной сердечно-сосудистой токсичности и токсичности UGI, особенно у пожилых пациентов.Дальнейшие исследования и будущие контролируемые клинические испытания помогут прояснить некоторые из этих тем.
Список литературы
1. Фордтман С.А. Заболевания желудочно-кишечного тракта и печени. 8-е изд. Сондерс Эльзевир; Филадельфия, Пенсильвания, США: 2006. С. 2459–2549. [Google Scholar] 2. Loftus E.V., Jr. Воспалительное заболевание кишечника, расширяющее его охват. Гастроэнтерология. 2005; 129: 1117–1120. DOI: 10.1053 / j.gastro.2005.07.042. [PubMed] [CrossRef] [Google Scholar] 3. Подольский Д.К. Воспалительное заболевание кишечника. N. Engl. J. Med.2002; 347: 417–429. [PubMed] [Google Scholar] 4. Кефалакес Х., Стилианидес Т.Дж., Аманакис Г. Обострение воспалительных заболеваний кишечника, связанных с применением нестероидных противовоспалительных средств: миф или реальность? Eur J Clin Pharmacol. 2009; 65: 963–970. DOI: 10.1007 / s00228-009-0719-3. [PubMed] [CrossRef] [Google Scholar] 5. Maiden L., Thjodleifsson B., Theodors A., Gonsales J., Bjarnason I. Количественный анализ патологии тонкой кишки, вызванной НПВС, с помощью капсульной энтероскопии. Гастроэнтерология. 2005; 128: 1172–1178.[PubMed] [Google Scholar] 6. Крайер Б. Смертность, связанная с НПВП: рост и снижение смертности от желудочно-кишечного тракта, связанной с НПВП. Являюсь. J. Gastroenterol. 2005; 100: 1694–1695. [PubMed] [Google Scholar] 7. Вулф М.М., Лихтенштейн Д.Р., Сингх Г. Желудочно-кишечная токсичность нестероидных противовоспалительных препаратов. N. Engl. J. Med. 1999; 340: 1888–1899. [PubMed] [Google Scholar] 8. Бьярнасон И., Хайллар Дж., Макферсон А.Дж., Рассел А.С. Побочные эффекты нестероидных противовоспалительных препаратов на тонкий и толстый кишечник человека.Гастроэнтерология. 1993; 104: 1832–1847. [PubMed] [Google Scholar] 9. Курахара К., Мацумото Т., Лида М., Хонда К., Яо Т., Фудзишима М. Клинические и эндоскопические особенности язв толстой кишки, вызванных приемом нестероидных противовоспалительных препаратов. Являюсь. J. Gastroenterol. 2001; 96: 473–480. [PubMed] [Google Scholar] 10. Laine L., Smith R., Min K., Chen C., Dubois R.W. Систематический обзор: нижние желудочно-кишечные побочные эффекты нестероидных противовоспалительных препаратов. Aliment Pharmacol. Ther. 2006. 24: 751–767. [PubMed] [Google Scholar] 11.Гусланди М. Обострение воспалительного заболевания кишечника нестероидными противовоспалительными препаратами и ингибиторами циклооксигеназы-2: факт или вымысел? Мир J. Gastroenterol. 2006; 12: 1509–1510. [Бесплатная статья PMC] [PubMed] [Google Scholar] 12. Уоллес Дж. Л. Биология простагландинов при воспалительном заболевании кишечника. Гастроэнтерол Клин. North Am. 2001; 30: 971–980. [PubMed] [Google Scholar] 13. Редферн Дж. С., Фельдман М. Роль эндогенных простагландинов в предотвращении язв желудочно-кишечного тракта: индукция язв с помощью антител к простагландинам.Гастроэнтерология. 1989; 96 (Дополнение): 596–605. [PubMed] [Google Scholar] 14. Tanaka K., Suemasu S., Ishihara T., Tasaka Y., Arai Y., Mizushima T. Ингибирование как COX-1, так и COX-2 и, как следствие, снижение уровня простагландинов E2, отвечает за нестероидные анти- воспалительный лекарственный (НПВП) -зависимый обострение колита. Евро. J. Pharmacol. 2009; 603: 120–132. [PubMed] [Google Scholar] 15. Такеучи К., Смейл С., Премчанд П., Мэйден Л., Шервуд Р., Тьодлейфссон Б., Бьорнссон Э., Бьярнасон И.Распространенность и механизм клинического рецидива, вызванного приемом нестероидных противовоспалительных препаратов, у пациентов с воспалительным заболеванием кишечника. Clin. Гастроэнтерол Гепатол. 2006; 4: 196–202. [PubMed] [Google Scholar] 16. Biancone L., Tosti C., Geremia A., Fina D., Petruzziello C., Emerenziani S., Pallone F. Рофекоксиб и ранний рецидив воспалительного заболевания кишечника: открытое испытание. Aliment Pharmacol. Ther. 2004. 19: 755–764. [PubMed] [Google Scholar] 17. Singer II, Kawka D.W., Schloemann S., Tessner T., Riehl T., Стенсон В.Ф. Циклооксигеназа 2 индуцируется в эпителиальных клетках толстой кишки при воспалительном заболевании кишечника. Гастроэнтерология. 1998. 115: 297–306. [PubMed] [Google Scholar] 18. Хендель Дж., Нильсен О. Экспрессия мРНК циклооксигеназы-2 при активном воспалительном заболевании кишечника. Являюсь. J. Gastroenterol. 1997; 92: 1170–1173. [PubMed] [Google Scholar] 19. Цубучи Р., Хаяси С., Аой Ю., Нишио Х., Терашима С., Като С., Такеучи К. Исцеляющий эффект ингибиторов циклооксигеназы на колит, индуцированный декстрансульфатом натрия, у крыс.Пищеварение. 2006; 74: 91–100. [PubMed] [Google Scholar] 20. Cipolla G., Crema F., Sacco S., Moro E., De Ponti F., Frigi G. Нестероидные противовоспалительные препараты и воспалительные заболевания кишечника: современные перспективы. Pharmacol. Res. 2002; 46: 1–6. [PubMed] [Google Scholar] 21. Фрайс Дж. Ф., Миллер С. Р., Шпиц П. В., Уильямс К. А., Хуберт Х. Б., Блох Д. А. К эпидемиологии гастропатии, связанной с применением нестероидных противовоспалительных препаратов. Гастроэнтерология. 1989; 96 (Дополнение): 647–655. [PubMed] [Google Scholar] 22.Боннер Г.Ф. Обострение воспалительного заболевания кишечника, связанное с применением целекоксиба. Являюсь. J. Gastroenterol. 2001; 96: 1306–1308. [PubMed] [Google Scholar] 23. Сингх С., Графф Л.А., Бернштейн К.Н. Вызывают ли НПВП, антибиотики, инфекции или стресс обострения ВЗК? Являюсь. J. Gastroenterol. 2009. 104: 1298–1313. DOI: 10.1038 / ajg.2009.15. [PubMed] [CrossRef] [Google Scholar] 24. Мейер А.М., Рамзан Н.Н., Хей Р.И., Лейтон Дж. Рецидив воспалительного заболевания кишечника, связанный с приемом нестероидных противовоспалительных средств.Копать. Дис. Sci. 2006. 51: 168–172. [PubMed] [Google Scholar] 25. Фелдер Дж. Б., Корелиц Б. И., Раджапакс Р., Шварц С., Хоратагис А. П., Глейм Г. Эффекты нестероидных противовоспалительных препаратов на воспалительное заболевание кишечника: исследование случай-контроль. Являюсь. J. Gastroenterol. 2000; 95: 1949–1954. [PubMed] [Google Scholar] 26. Эванс Дж. М., МакМахон А. Д., Мюррей Ф. Э., Макдевитт Д. Г., Макдональд Т. М. Нестероидные противовоспалительные препараты связаны с неотложной госпитализацией по поводу колита из-за воспалительного заболевания кишечника.Кишечник. 1997. 40: 619–622. [Бесплатная статья PMC] [PubMed] [Google Scholar] 27. Боннер Г.Ф., Вальчак М., Китчен Л., Байона М. Переносимость нестероидных противовоспалительных препаратов у пациентов с воспалительным заболеванием кишечника. Являюсь. J. Gastroenterol. 2000; 95: 1946–1948. [PubMed] [Google Scholar] 28. Боннер Г.Ф., Фахри А., Веннаманени С.Р. Долгосрочное когортное исследование использования нестероидных противовоспалительных препаратов и активности заболевания у амбулаторных пациентов с воспалительным заболеванием кишечника. Воспаление. Кишечник. 2004. 10: 751–757. [PubMed] [Google Scholar] 29.Махадеван У., Лофтус Э.В., младший, Тремейн У. Дж., Сэндборн У. Дж. Безопасность селективных ингибиторов циклооксигеназы-2 при воспалительном заболевании кишечника. Являюсь. J. Gastroenterol. 2002; 97: 910–914. [PubMed] [Google Scholar] 30. Сэндборн В.Дж., Стенсон В.Ф., Брынсков Дж., Лоренц Р.Г., Стейдл Г.М., Роббинс Дж.Л., Кент Дж.Д., Блум Б.Дж. Безопасность целекоксиба у пациентов с язвенным колитом в стадии ремиссии: рандомизированное плацебо-контролируемое пилотное исследование. Clin. Гастроэнтерол. Гепатол. 2006; 4: 203–211. [PubMed] [Google Scholar] 31. Эль-Мидани Ю., Юссеф С., Ахмед И., Эль Гаафари М. Безопасность для желудочно-кишечного тракта и влияние на активность эторикоксиба, селективного ингибитора ЦОГ-2 при воспалительных заболеваниях кишечника. Являюсь. J. Gastroenterol. 2006; 101: 311–317. [PubMed] [Google Scholar] 32. Reinisch W., Miehsler W., Dejaco C., Harrer M., Waldhoer T., Lichtenberger C., Vogelsang H. Открытое испытание селективного ингибитора циклооксигеназы-2 рофекоксиба при воспалительных заболеваниях кишечника. периферический артрит и артралгия. Aliment Pharmacol.Ther. 2003. 17: 1371–1380. DOI: 10.1046 / j.1365-2036.2003.01596.x. [PubMed] [CrossRef] [Google Scholar] 33. Уилкокс Г.М., Маттиа А.Р. Рофекоксиб и воспалительные заболевания кишечника: клинико-патологические наблюдения. J. Clin. Гастроэнтерол. 2005; 39: 142–143. [PubMed] [Google Scholar] 34. Горнет Дж. М., Хассани З., Модильяни Р., Леманн М. Обострение колита Крона с тяжелым кровотечением в толстой кишке у пациента, принимающего рофекоксиб. Являюсь. J. Gastroenterol. 2002; 97: 3209–3210. [PubMed] [Google Scholar] 35. Мяо X.P., Оуян К., Ли Х.Ю., Вэнь З.Х., Чжан Д.К., Цуй X.Y. Роль селективных ингибиторов циклооксигеназы-2 в обострении воспалительного заболевания кишечника: систематический обзор и метаанализ. Curr. Терапия. Res. 2008; 69: 181–191. [Бесплатная статья PMC] [PubMed] [Google Scholar] 36. Такеучи А., Танака А., Оно Р., Йокота А. Роль ингибирования ЦОГ в патогенезе повреждения тонкого кишечника, вызванного НПВС. J. Physiol. Pharmacol. 2003. 54 (Приложение): 165–182. [PubMed] [Google Scholar]нестероидных противовоспалительных препаратов и воспалительных заболеваний кишечника
Pharmaceuticals (Базель).2010 Apr; 3 (4): 1084–1092.
Отделение гастроэнтерологии, кампус здравоохранения Рамбам, Хайфа, P.O.B. 9602, Хайфа, 31096, Израиль
Получено 13 января 2010 г .; Пересмотрено 1 апреля 2010 г .; Принято 9 апреля 2010 г.
Авторские права © 2010, авторы; лицензиат Molecular Diversity Preservation International, Базель, Швейцария. Эта статья цитировалась в других статьях в PMC.Abstract
Воспалительные заболевания кишечника (ВЗК) – это иммуноопосредованные хронические или рецидивирующие заболевания желудочно-кишечного тракта (ЖКТ).ВЗК характеризуется хроническим воспалительным процессом кишечника с различными компонентами, влияющими на патогенез заболевания, включая факторы окружающей среды, такие как курение или использование нестероидных противовоспалительных препаратов (НПВП). НПВП являются одними из наиболее часто используемых лекарств для лечения различных воспалительных состояний. Основным фактором, ограничивающим использование НПВП, является опасность развития желудочно-кишечной токсичности, включая повреждение слизистой оболочки. Возможная связь между применением НПВП и началом или рецидивом ВЗК неоднократно высказывалась.В этой статье будут рассмотрены современные концепции и доказательства взаимосвязи между ВЗК и НПВП.
Ключевые слова: НПВП, ВЗК, болезнь Крона, язвенный колит
1. Введение
Воспалительные заболевания кишечника (ВЗК) – это иммуноопосредованные хронические или рецидивирующие заболевания желудочно-кишечного тракта, состоящие в основном из болезни Крона (БК). ) и язвенный колит (ЯК). ВЗК характеризуется хроническим воспалительным процессом кишечника с различными компонентами, влияющими на патогенез заболевания, включая факторы окружающей среды (такие как курение или НПВП), генетический фон, кишечную флору хозяина и иммунную систему хозяина [1].
CD – это трансмуральное заболевание, макроскопически характеризующееся пропущенными очагами с афтами, язвами различного типа, а иногда и классическим видом, напоминающим брусчатку. Микроскопически трансмуральное хроническое воспаление присутствует с образованием гранулемы или без него. Хроническое воспаление ЯК ограничивается слизистой оболочкой и носит непрерывный характер. Макроскопически типичен зернистый вид или отечная геморрагическая слизистая оболочка, в более тяжелых случаях. Типичны архитектурные искажения крипт под микроскопом и хроническое воспаление [1].
Поскольку БК может поражать любую часть желудочно-кишечного тракта, клинический спектр заболевания широко варьируется от боли в эпигастрии и гастрита, негативного по Helicobacter pylori из-за поражения верхних отделов желудочно-кишечного тракта, до диареи, потери веса, болей в животе и недостаточности питания у пациентов с заболевание тонкой кишки. Гематохезия, кровавая диарея, тенезмы и иногда лихорадка указывают на поражение толстой кишки при БК или наличие ЯК. Перианальное заболевание встречается только у пациентов с БК.
До трети пациентов с ВЗК страдают внекишечными проявлениями своего заболевания.К ним относятся дерматологические проявления, такие как узловатая эритема, глазные осложнения, такие как конъюнктивит и увеит, гепатобилиарные осложнения, включая холелитиаз, стеатоз и первичный склерозирующий холангит, а также урологические осложнения, в основном нефролитиаз. Наконец, два очень важных и распространенных внекишечных осложнения – это ревматические проявления, такие как артралгии, периферический артрит или анкилозирующий спондилит и остеопороз с повышенным риском переломов, вызванных дефицитом витамина D и кальция и длительным приемом стероидов [2,3].При обоих этих осложнениях, а также при боли, не связанной с ВЗК, пациенты с ВЗК часто обращаются за помощью к НПВП [4,5].
Нестероидные противовоспалительные препараты являются одними из наиболее часто используемых лекарств для лечения различных воспалительных состояний. По оценкам, 60 миллионов американцев регулярно принимают НПВП [6]. Основным фактором, ограничивающим использование НПВП, является опасность развития желудочно-кишечной токсичности, включая повреждение слизистой оболочки в виде эрозий и язв, кровотечение верхних отделов желудочно-кишечного тракта, тонкой кишки или толстой кишки и, в редких случаях, перфорацию и непроходимость из-за образования стриктуры [7].НПВП также могут вызывать неспецифический тип колита и воспаление тонкого кишечника с сопутствующими осложнениями в виде хронической потери крови или белка [8]. Эндоскопические признаки повреждения толстой кишки, вызванного НПВС, включают резко очерченные или периферические язвы, которые обычно обратимы после отмены препарата [9]. Подсчитано, что использование НПВП пациентами с артритом в США вызывает более 100 000 госпитализаций ежегодно по поводу желудочно-кишечных осложнений, одна пятая из которых, по оценкам, связана с осложнениями нижних отделов желудочно-кишечного тракта [10].Обзор литературы о побочных эффектах НПВП со стороны нижнего ЖКТ выявил статистически значимое увеличение частоты побочных эффектов, связанных с применением НПВП, у пациентов с кровотечением из нижних отделов ЖКТ, перфорацией и осложненным дивертикулярным заболеванием [10]. Возможная связь между применением НПВП и началом или рецидивом ВЗК неоднократно высказывалась. Однако отсутствие контролируемых проспективных исследований затрудняет однозначные выводы [4,11].
2.Патогенез желудочно-кишечной токсичности, вызванной НПВП
Было предложено несколько механизмов, ответственных за желудочно-кишечную токсичность, вызванную НПВП, в целом и у пациентов с ВЗК в частности. К ним относятся повышенная проницаемость слизистой оболочки, образование аддуктов лекарственное средство-энтероцит и индуцированный НПВП внутриклеточный дефицит АТФ и усиление энтерогепатической циркуляции. Однако наиболее обсуждаемым механизмом является их влияние на синтез простагландинов [4]. Простагландины играют ключевую роль в защите слизистой оболочки, поддержании микроциркуляции и модуляции иммунной системы в толстой кишке [12].Экспериментальные модели, использующие активную иммунизацию против простагландинов E2, F2A и D2 и ингибирование COX1 и COX2, привели к развитию кишечных язв и обострению колита, вызванного декстрансульфатом натрия (DSS) [13,14]. Снижение продукции простагландинов из-за ингибирования ЦОГ1 и ЦОГ2 было связано с ранними и частыми клиническими рецидивами ВЗК [15].
COX2 – индуцибельный фермент, не обнаруживаемый в нормальном эпителии. Его экспрессия индуцируется в течение нескольких часов после воздействия инвазивных организмов или провоспалительных цитокинов, включая интерлейкин 1 и фактор некроза опухоли альфа, и обычно теряется в течение 24 часов.Многие из этих событий вовлекают сигнальный путь NFK-B [16]. В областях активного воспаления из-за ВЗК фермент COX2 может быть обнаружен в апикальных эпителиальных клетках воспаленной слизистой оболочки [4,17]. Было обнаружено, что экспрессия COX2 в тонкой кишке и слизистой оболочке толстой кишки выше при экспериментальном колите, что коррелирует с воспалительной активностью при ВЗК и оказывает положительное влияние на заживление при экспериментальном колите [18,19]. Точный механизм, с помощью которого ингибиторы ЦОГ2 вызывают рецидив ВЗК, неясен.Было предложено несколько гипотез, включая замедленное заживление ран с повышенной проницаемостью сосудов, поддержание целостности слизистой оболочки кишечника и противовоспалительные свойства кишечной ткани во время воспаления [4,20].
Возможный патогенез вызванной НПВП токсичности желудочно-кишечного тракта [36]. Адаптировано с разрешения издателя.
Таблица 1
Возможные молекулярные механизмы НПВП-индуцированных обострений ВЗК [4]. Адаптировано с любезного разрешения Springer Science + Business Media.
| Механизм действия |
|---|
|
3.Обычные НПВП и ВЗК
НПВП могут инициировать ВЗК или вызывать реактивацию неактивного заболевания и вызывать осложнения со стороны желудочно-кишечного тракта [15,21,22]. Уровень использования НПВП среди пациентов, поступивших в больницу с обострениями ВЗК, выше, чем ожидалось [22]. Несколько ретроспективных и когортных исследований выявили причастность НПВП к началу или обострению ВЗК [23,24,25]. Takeuchi et al. [15], используя клиническую оценку и измерения кальпротектина в кале, продемонстрировали, что неселективные НПВП были связаны с частотой рецидивов 17–28% в течение девяти дней после приема препарата у пациентов с ВЗК.Meyer et al. [24], ретроспективно проанализированы файлы амбулаторных пациентов с ВЗК и показали, что лечение НПВП было связано с рецидивом заболевания. Несколько дополнительных исследований случай-контроль показали, что НПВП повышают риск нового начала ВЗК [26,27], последующих обострений [25,27] и связаны с более высоким индексом активности заболевания [28]. Напротив, два исследования Bonner et al. [27,28] не выявили связи между активной или неподвижной БК или ЯК и применением НПВП в популяции амбулаторных пациентов с ВЗК.
4. Селективные ингибиторы ЦОГ2 и IBD
Селективные ингибиторы ЦОГ2 вызывают меньшую токсичность для ЖКТ по сравнению с обычными НПВП. На сегодняшний день исследования использования селективных ингибиторов ЦОГ2 при ВЗК дали неоднозначные результаты. Махадеван и др. [29] обследовали 27 пациентов с БК, ЯК и поучитом, получавших рофекоксиб или целекоксиб. Было показано, что лечение было полезным и безопасным. Большое двойное слепое плацебо-контролируемое исследование Sandborn et al. [30] из 222 пациентов с ЯК в стадии ремиссии с артритом или артралгиями продемонстрировали, что лечение целекоксибом до двух недель не приводило к более высокой частоте рецидивов, чем плацебо.В другом многоцентровом двойном слепом плацебо-контролируемом исследовании Miedeny et al. [31] включал 146 пациентов с ВЗК, получавших эторикоксиб или плацебо в течение трех месяцев. Лечение было полезным и безопасным и не было связано с обострением болезни. Другое открытое исследование Reinisch [32] продемонстрировало профиль эффективности и безопасности рофекоксиба у аналогичных пациентов.
Напротив, сообщалось о нескольких случаях обострений у пациентов с ВЗК, получавших ингибиторы ЦОГ2 [33,34].Bioncone et al. [16] оценили безопасность и эффективность ингибиторов ЦОГ2 в открытом исследовании. Рофекоксиб контролировал артралгии у двух третей пациентов, однако побочные эффекты, требующие отмены препарата, наблюдались у одной пятой пациентов с ВЗК. К ним относятся боли в животе, диарея, кровавый стул и изжога. Matuk et al. [32] оценили безопасность и токсичность целекоксиба и рофекоксиба у 33 пациентов с ВЗК. Все пациенты испытали обострение болезни в течение 6 недель после начала терапии ЦОГ2, и у 38% из них симптомы исчезли после прекращения лечения.Наконец, недавний метаанализ [35], посвященный применению ингибиторов ЦОГ2 у пациентов с ВЗК, показал, что данных для определения влияния ингибиторов ЦОГ2 на обострения ВЗК недостаточно. Эти смешанные данные предполагают, что требуется дальнейшая оценка использования селективных ингибиторов ЦОГ2 у пациентов с ВЗК. резюмирует исследования по влиянию НПВП на ВЗК.
Таблица 2
Статьи о влиянии НПВП и селективных ингибиторов ЦОГ2 на ВЗК.
| Артикул | Тип исследования | Тип ВЗК | Тип НПВП | Выводы |
|---|---|---|---|---|
| Такеучи, К. et al. [15] | Предполагаемая когорта | ЯК и CD | Неселективный | Прием НПВП связан с частыми и ранними рецидивами ВЗК в покое. |
| Мейер А.М. et al. [24] | Ретроспективная когорта | ЯК и CD | Неселективный | Использование НПВС было связано с рецидивом ВЗК. |
| Felder J.B. et al. [25] | Случай – контроль | ЯК и CD | Неселективный | НПВП вызывают активность заболевания как при ЯК, так и при БК. |
| Evans, J.M. et al. [26] | Контроль случая | UC и CD | Неселективный | НПВП связаны с госпитализацией пациентов с тяжелым колитом с ВЗК. |
| Боннер, Г.Ф. et al. [27] | Ретроспективная когорта | ЯК и CD | Неселективное | Использование НПВП не было связано с более высокой вероятностью активного ВЗК. |
| Боннер, Г.Ф. et al. [28] | Случай – контроль | UC и CD | Неселективный | Высокие дозы НПВП были связаны с более высоким индексом активности заболевания, но значительных обострений заболевания не наблюдалось. |
| Mahadevan, U. et al. [29] | Ретроспективная когорта | ЯК и CD | Селективные ЦОГ2 | Ингибиторы ЦОГ2 оказались безопасными и полезными для пациентов с ВЗК. |
| Sandborn, W.J. et al. [30] | Рандомизированное плацебо-контролируемое исследование | UC | Селективный по COX2 | Лечение целекоксибом не было связано с большей частотой рецидивов по сравнению с плацебо. |
| El Miedany, Y. et al. [31] | Рандомизированное плацебо-контролируемое исследование | ЯК и CD | Селективный по ЦОГ | Лечение эторикоксибом было безопасным и эффективным у пациентов с ВЗК.Это не было связано с обострениями ВЗК. |
| Reinisch, W. et al. [32] | Проспективное открытое исследование | ЯК и CD | Селективный по ЦОГ | Лечение рофекоксибом было безопасным, полезным и не ассоциировалось с обострениями ВЗК. |
| Xin-Pu Miao et al. [35] | Мета-анализ | ЯК и CD | ЦОГ2 селективный | Недостаточно данных для определения влияния ингибиторов ЦОГ2 на обострения ВЗК. |
5. Резюме и выводы
В заключение, на сегодняшний день имеющиеся в литературе данные о влиянии НПВП на активность ВЗК неубедительны. Остается неясным, действительно ли НПВП и селективные ингибиторы ЦОГ2 вызывают обострения ВЗК и являются ли ингибиторы ЦОГ2 более безопасными, чем обычные НПВП. Есть некоторые данные, позволяющие предположить, что краткосрочное использование селективных ингибиторов ЦОГ2 безопасно и полезно у пациентов с ВЗК. Одновременное применение НПВС или ингибиторов ЦОГ2 и стероидов у пациентов с ВЗК требует особого рассмотрения и тщательного наблюдения из-за потенциально повышенной сердечно-сосудистой токсичности и токсичности UGI, особенно у пожилых пациентов.Дальнейшие исследования и будущие контролируемые клинические испытания помогут прояснить некоторые из этих тем.
Список литературы
1. Фордтман С.А. Заболевания желудочно-кишечного тракта и печени. 8-е изд. Сондерс Эльзевир; Филадельфия, Пенсильвания, США: 2006. С. 2459–2549. [Google Scholar] 2. Loftus E.V., Jr. Воспалительное заболевание кишечника, расширяющее его охват. Гастроэнтерология. 2005; 129: 1117–1120. DOI: 10.1053 / j.gastro.2005.07.042. [PubMed] [CrossRef] [Google Scholar] 3. Подольский Д.К. Воспалительное заболевание кишечника. N. Engl. J. Med.2002; 347: 417–429. [PubMed] [Google Scholar] 4. Кефалакес Х., Стилианидес Т.Дж., Аманакис Г. Обострение воспалительных заболеваний кишечника, связанных с применением нестероидных противовоспалительных средств: миф или реальность? Eur J Clin Pharmacol. 2009; 65: 963–970. DOI: 10.1007 / s00228-009-0719-3. [PubMed] [CrossRef] [Google Scholar] 5. Maiden L., Thjodleifsson B., Theodors A., Gonsales J., Bjarnason I. Количественный анализ патологии тонкой кишки, вызванной НПВС, с помощью капсульной энтероскопии. Гастроэнтерология. 2005; 128: 1172–1178.[PubMed] [Google Scholar] 6. Крайер Б. Смертность, связанная с НПВП: рост и снижение смертности от желудочно-кишечного тракта, связанной с НПВП. Являюсь. J. Gastroenterol. 2005; 100: 1694–1695. [PubMed] [Google Scholar] 7. Вулф М.М., Лихтенштейн Д.Р., Сингх Г. Желудочно-кишечная токсичность нестероидных противовоспалительных препаратов. N. Engl. J. Med. 1999; 340: 1888–1899. [PubMed] [Google Scholar] 8. Бьярнасон И., Хайллар Дж., Макферсон А.Дж., Рассел А.С. Побочные эффекты нестероидных противовоспалительных препаратов на тонкий и толстый кишечник человека.Гастроэнтерология. 1993; 104: 1832–1847. [PubMed] [Google Scholar] 9. Курахара К., Мацумото Т., Лида М., Хонда К., Яо Т., Фудзишима М. Клинические и эндоскопические особенности язв толстой кишки, вызванных приемом нестероидных противовоспалительных препаратов. Являюсь. J. Gastroenterol. 2001; 96: 473–480. [PubMed] [Google Scholar] 10. Laine L., Smith R., Min K., Chen C., Dubois R.W. Систематический обзор: нижние желудочно-кишечные побочные эффекты нестероидных противовоспалительных препаратов. Aliment Pharmacol. Ther. 2006. 24: 751–767. [PubMed] [Google Scholar] 11.Гусланди М. Обострение воспалительного заболевания кишечника нестероидными противовоспалительными препаратами и ингибиторами циклооксигеназы-2: факт или вымысел? Мир J. Gastroenterol. 2006; 12: 1509–1510. [Бесплатная статья PMC] [PubMed] [Google Scholar] 12. Уоллес Дж. Л. Биология простагландинов при воспалительном заболевании кишечника. Гастроэнтерол Клин. North Am. 2001; 30: 971–980. [PubMed] [Google Scholar] 13. Редферн Дж. С., Фельдман М. Роль эндогенных простагландинов в предотвращении язв желудочно-кишечного тракта: индукция язв с помощью антител к простагландинам.Гастроэнтерология. 1989; 96 (Дополнение): 596–605. [PubMed] [Google Scholar] 14. Tanaka K., Suemasu S., Ishihara T., Tasaka Y., Arai Y., Mizushima T. Ингибирование как COX-1, так и COX-2 и, как следствие, снижение уровня простагландинов E2, отвечает за нестероидные анти- воспалительный лекарственный (НПВП) -зависимый обострение колита. Евро. J. Pharmacol. 2009; 603: 120–132. [PubMed] [Google Scholar] 15. Такеучи К., Смейл С., Премчанд П., Мэйден Л., Шервуд Р., Тьодлейфссон Б., Бьорнссон Э., Бьярнасон И.Распространенность и механизм клинического рецидива, вызванного приемом нестероидных противовоспалительных препаратов, у пациентов с воспалительным заболеванием кишечника. Clin. Гастроэнтерол Гепатол. 2006; 4: 196–202. [PubMed] [Google Scholar] 16. Biancone L., Tosti C., Geremia A., Fina D., Petruzziello C., Emerenziani S., Pallone F. Рофекоксиб и ранний рецидив воспалительного заболевания кишечника: открытое испытание. Aliment Pharmacol. Ther. 2004. 19: 755–764. [PubMed] [Google Scholar] 17. Singer II, Kawka D.W., Schloemann S., Tessner T., Riehl T., Стенсон В.Ф. Циклооксигеназа 2 индуцируется в эпителиальных клетках толстой кишки при воспалительном заболевании кишечника. Гастроэнтерология. 1998. 115: 297–306. [PubMed] [Google Scholar] 18. Хендель Дж., Нильсен О. Экспрессия мРНК циклооксигеназы-2 при активном воспалительном заболевании кишечника. Являюсь. J. Gastroenterol. 1997; 92: 1170–1173. [PubMed] [Google Scholar] 19. Цубучи Р., Хаяси С., Аой Ю., Нишио Х., Терашима С., Като С., Такеучи К. Исцеляющий эффект ингибиторов циклооксигеназы на колит, индуцированный декстрансульфатом натрия, у крыс.Пищеварение. 2006; 74: 91–100. [PubMed] [Google Scholar] 20. Cipolla G., Crema F., Sacco S., Moro E., De Ponti F., Frigi G. Нестероидные противовоспалительные препараты и воспалительные заболевания кишечника: современные перспективы. Pharmacol. Res. 2002; 46: 1–6. [PubMed] [Google Scholar] 21. Фрайс Дж. Ф., Миллер С. Р., Шпиц П. В., Уильямс К. А., Хуберт Х. Б., Блох Д. А. К эпидемиологии гастропатии, связанной с применением нестероидных противовоспалительных препаратов. Гастроэнтерология. 1989; 96 (Дополнение): 647–655. [PubMed] [Google Scholar] 22.Боннер Г.Ф. Обострение воспалительного заболевания кишечника, связанное с применением целекоксиба. Являюсь. J. Gastroenterol. 2001; 96: 1306–1308. [PubMed] [Google Scholar] 23. Сингх С., Графф Л.А., Бернштейн К.Н. Вызывают ли НПВП, антибиотики, инфекции или стресс обострения ВЗК? Являюсь. J. Gastroenterol. 2009. 104: 1298–1313. DOI: 10.1038 / ajg.2009.15. [PubMed] [CrossRef] [Google Scholar] 24. Мейер А.М., Рамзан Н.Н., Хей Р.И., Лейтон Дж. Рецидив воспалительного заболевания кишечника, связанный с приемом нестероидных противовоспалительных средств.Копать. Дис. Sci. 2006. 51: 168–172. [PubMed] [Google Scholar] 25. Фелдер Дж. Б., Корелиц Б. И., Раджапакс Р., Шварц С., Хоратагис А. П., Глейм Г. Эффекты нестероидных противовоспалительных препаратов на воспалительное заболевание кишечника: исследование случай-контроль. Являюсь. J. Gastroenterol. 2000; 95: 1949–1954. [PubMed] [Google Scholar] 26. Эванс Дж. М., МакМахон А. Д., Мюррей Ф. Э., Макдевитт Д. Г., Макдональд Т. М. Нестероидные противовоспалительные препараты связаны с неотложной госпитализацией по поводу колита из-за воспалительного заболевания кишечника.Кишечник. 1997. 40: 619–622. [Бесплатная статья PMC] [PubMed] [Google Scholar] 27. Боннер Г.Ф., Вальчак М., Китчен Л., Байона М. Переносимость нестероидных противовоспалительных препаратов у пациентов с воспалительным заболеванием кишечника. Являюсь. J. Gastroenterol. 2000; 95: 1946–1948. [PubMed] [Google Scholar] 28. Боннер Г.Ф., Фахри А., Веннаманени С.Р. Долгосрочное когортное исследование использования нестероидных противовоспалительных препаратов и активности заболевания у амбулаторных пациентов с воспалительным заболеванием кишечника. Воспаление. Кишечник. 2004. 10: 751–757. [PubMed] [Google Scholar] 29.Махадеван У., Лофтус Э.В., младший, Тремейн У. Дж., Сэндборн У. Дж. Безопасность селективных ингибиторов циклооксигеназы-2 при воспалительном заболевании кишечника. Являюсь. J. Gastroenterol. 2002; 97: 910–914. [PubMed] [Google Scholar] 30. Сэндборн В.Дж., Стенсон В.Ф., Брынсков Дж., Лоренц Р.Г., Стейдл Г.М., Роббинс Дж.Л., Кент Дж.Д., Блум Б.Дж. Безопасность целекоксиба у пациентов с язвенным колитом в стадии ремиссии: рандомизированное плацебо-контролируемое пилотное исследование. Clin. Гастроэнтерол. Гепатол. 2006; 4: 203–211. [PubMed] [Google Scholar] 31. Эль-Мидани Ю., Юссеф С., Ахмед И., Эль Гаафари М. Безопасность для желудочно-кишечного тракта и влияние на активность эторикоксиба, селективного ингибитора ЦОГ-2 при воспалительных заболеваниях кишечника. Являюсь. J. Gastroenterol. 2006; 101: 311–317. [PubMed] [Google Scholar] 32. Reinisch W., Miehsler W., Dejaco C., Harrer M., Waldhoer T., Lichtenberger C., Vogelsang H. Открытое испытание селективного ингибитора циклооксигеназы-2 рофекоксиба при воспалительных заболеваниях кишечника. периферический артрит и артралгия. Aliment Pharmacol.Ther. 2003. 17: 1371–1380. DOI: 10.1046 / j.1365-2036.2003.01596.x. [PubMed] [CrossRef] [Google Scholar] 33. Уилкокс Г.М., Маттиа А.Р. Рофекоксиб и воспалительные заболевания кишечника: клинико-патологические наблюдения. J. Clin. Гастроэнтерол. 2005; 39: 142–143. [PubMed] [Google Scholar] 34. Горнет Дж. М., Хассани З., Модильяни Р., Леманн М. Обострение колита Крона с тяжелым кровотечением в толстой кишке у пациента, принимающего рофекоксиб. Являюсь. J. Gastroenterol. 2002; 97: 3209–3210. [PubMed] [Google Scholar] 35. Мяо X.P., Оуян К., Ли Х.Ю., Вэнь З.Х., Чжан Д.К., Цуй X.Y. Роль селективных ингибиторов циклооксигеназы-2 в обострении воспалительного заболевания кишечника: систематический обзор и метаанализ. Curr. Терапия. Res. 2008; 69: 181–191. [Бесплатная статья PMC] [PubMed] [Google Scholar] 36. Такеучи А., Танака А., Оно Р., Йокота А. Роль ингибирования ЦОГ в патогенезе повреждения тонкого кишечника, вызванного НПВС. J. Physiol. Pharmacol. 2003. 54 (Приложение): 165–182. [PubMed] [Google Scholar]нестероидных противовоспалительных препаратов и воспалительных заболеваний кишечника
Pharmaceuticals (Базель).2010 Apr; 3 (4): 1084–1092.
Отделение гастроэнтерологии, кампус здравоохранения Рамбам, Хайфа, P.O.B. 9602, Хайфа, 31096, Израиль
Получено 13 января 2010 г .; Пересмотрено 1 апреля 2010 г .; Принято 9 апреля 2010 г.
Авторские права © 2010, авторы; лицензиат Molecular Diversity Preservation International, Базель, Швейцария. Эта статья цитировалась в других статьях в PMC.Abstract
Воспалительные заболевания кишечника (ВЗК) – это иммуноопосредованные хронические или рецидивирующие заболевания желудочно-кишечного тракта (ЖКТ).ВЗК характеризуется хроническим воспалительным процессом кишечника с различными компонентами, влияющими на патогенез заболевания, включая факторы окружающей среды, такие как курение или использование нестероидных противовоспалительных препаратов (НПВП). НПВП являются одними из наиболее часто используемых лекарств для лечения различных воспалительных состояний. Основным фактором, ограничивающим использование НПВП, является опасность развития желудочно-кишечной токсичности, включая повреждение слизистой оболочки. Возможная связь между применением НПВП и началом или рецидивом ВЗК неоднократно высказывалась.В этой статье будут рассмотрены современные концепции и доказательства взаимосвязи между ВЗК и НПВП.
Ключевые слова: НПВП, ВЗК, болезнь Крона, язвенный колит
1. Введение
Воспалительные заболевания кишечника (ВЗК) – это иммуноопосредованные хронические или рецидивирующие заболевания желудочно-кишечного тракта, состоящие в основном из болезни Крона (БК). ) и язвенный колит (ЯК). ВЗК характеризуется хроническим воспалительным процессом кишечника с различными компонентами, влияющими на патогенез заболевания, включая факторы окружающей среды (такие как курение или НПВП), генетический фон, кишечную флору хозяина и иммунную систему хозяина [1].
CD – это трансмуральное заболевание, макроскопически характеризующееся пропущенными очагами с афтами, язвами различного типа, а иногда и классическим видом, напоминающим брусчатку. Микроскопически трансмуральное хроническое воспаление присутствует с образованием гранулемы или без него. Хроническое воспаление ЯК ограничивается слизистой оболочкой и носит непрерывный характер. Макроскопически типичен зернистый вид или отечная геморрагическая слизистая оболочка, в более тяжелых случаях. Типичны архитектурные искажения крипт под микроскопом и хроническое воспаление [1].
Поскольку БК может поражать любую часть желудочно-кишечного тракта, клинический спектр заболевания широко варьируется от боли в эпигастрии и гастрита, негативного по Helicobacter pylori из-за поражения верхних отделов желудочно-кишечного тракта, до диареи, потери веса, болей в животе и недостаточности питания у пациентов с заболевание тонкой кишки. Гематохезия, кровавая диарея, тенезмы и иногда лихорадка указывают на поражение толстой кишки при БК или наличие ЯК. Перианальное заболевание встречается только у пациентов с БК.
До трети пациентов с ВЗК страдают внекишечными проявлениями своего заболевания.К ним относятся дерматологические проявления, такие как узловатая эритема, глазные осложнения, такие как конъюнктивит и увеит, гепатобилиарные осложнения, включая холелитиаз, стеатоз и первичный склерозирующий холангит, а также урологические осложнения, в основном нефролитиаз. Наконец, два очень важных и распространенных внекишечных осложнения – это ревматические проявления, такие как артралгии, периферический артрит или анкилозирующий спондилит и остеопороз с повышенным риском переломов, вызванных дефицитом витамина D и кальция и длительным приемом стероидов [2,3].При обоих этих осложнениях, а также при боли, не связанной с ВЗК, пациенты с ВЗК часто обращаются за помощью к НПВП [4,5].
Нестероидные противовоспалительные препараты являются одними из наиболее часто используемых лекарств для лечения различных воспалительных состояний. По оценкам, 60 миллионов американцев регулярно принимают НПВП [6]. Основным фактором, ограничивающим использование НПВП, является опасность развития желудочно-кишечной токсичности, включая повреждение слизистой оболочки в виде эрозий и язв, кровотечение верхних отделов желудочно-кишечного тракта, тонкой кишки или толстой кишки и, в редких случаях, перфорацию и непроходимость из-за образования стриктуры [7].НПВП также могут вызывать неспецифический тип колита и воспаление тонкого кишечника с сопутствующими осложнениями в виде хронической потери крови или белка [8]. Эндоскопические признаки повреждения толстой кишки, вызванного НПВС, включают резко очерченные или периферические язвы, которые обычно обратимы после отмены препарата [9]. Подсчитано, что использование НПВП пациентами с артритом в США вызывает более 100 000 госпитализаций ежегодно по поводу желудочно-кишечных осложнений, одна пятая из которых, по оценкам, связана с осложнениями нижних отделов желудочно-кишечного тракта [10].Обзор литературы о побочных эффектах НПВП со стороны нижнего ЖКТ выявил статистически значимое увеличение частоты побочных эффектов, связанных с применением НПВП, у пациентов с кровотечением из нижних отделов ЖКТ, перфорацией и осложненным дивертикулярным заболеванием [10]. Возможная связь между применением НПВП и началом или рецидивом ВЗК неоднократно высказывалась. Однако отсутствие контролируемых проспективных исследований затрудняет однозначные выводы [4,11].
2.Патогенез желудочно-кишечной токсичности, вызванной НПВП
Было предложено несколько механизмов, ответственных за желудочно-кишечную токсичность, вызванную НПВП, в целом и у пациентов с ВЗК в частности. К ним относятся повышенная проницаемость слизистой оболочки, образование аддуктов лекарственное средство-энтероцит и индуцированный НПВП внутриклеточный дефицит АТФ и усиление энтерогепатической циркуляции. Однако наиболее обсуждаемым механизмом является их влияние на синтез простагландинов [4]. Простагландины играют ключевую роль в защите слизистой оболочки, поддержании микроциркуляции и модуляции иммунной системы в толстой кишке [12].Экспериментальные модели, использующие активную иммунизацию против простагландинов E2, F2A и D2 и ингибирование COX1 и COX2, привели к развитию кишечных язв и обострению колита, вызванного декстрансульфатом натрия (DSS) [13,14]. Снижение продукции простагландинов из-за ингибирования ЦОГ1 и ЦОГ2 было связано с ранними и частыми клиническими рецидивами ВЗК [15].
COX2 – индуцибельный фермент, не обнаруживаемый в нормальном эпителии. Его экспрессия индуцируется в течение нескольких часов после воздействия инвазивных организмов или провоспалительных цитокинов, включая интерлейкин 1 и фактор некроза опухоли альфа, и обычно теряется в течение 24 часов.Многие из этих событий вовлекают сигнальный путь NFK-B [16]. В областях активного воспаления из-за ВЗК фермент COX2 может быть обнаружен в апикальных эпителиальных клетках воспаленной слизистой оболочки [4,17]. Было обнаружено, что экспрессия COX2 в тонкой кишке и слизистой оболочке толстой кишки выше при экспериментальном колите, что коррелирует с воспалительной активностью при ВЗК и оказывает положительное влияние на заживление при экспериментальном колите [18,19]. Точный механизм, с помощью которого ингибиторы ЦОГ2 вызывают рецидив ВЗК, неясен.Было предложено несколько гипотез, включая замедленное заживление ран с повышенной проницаемостью сосудов, поддержание целостности слизистой оболочки кишечника и противовоспалительные свойства кишечной ткани во время воспаления [4,20].
Возможный патогенез вызванной НПВП токсичности желудочно-кишечного тракта [36]. Адаптировано с разрешения издателя.
Таблица 1
Возможные молекулярные механизмы НПВП-индуцированных обострений ВЗК [4]. Адаптировано с любезного разрешения Springer Science + Business Media.
| Механизм действия |
|---|
|
3.Обычные НПВП и ВЗК
НПВП могут инициировать ВЗК или вызывать реактивацию неактивного заболевания и вызывать осложнения со стороны желудочно-кишечного тракта [15,21,22]. Уровень использования НПВП среди пациентов, поступивших в больницу с обострениями ВЗК, выше, чем ожидалось [22]. Несколько ретроспективных и когортных исследований выявили причастность НПВП к началу или обострению ВЗК [23,24,25]. Takeuchi et al. [15], используя клиническую оценку и измерения кальпротектина в кале, продемонстрировали, что неселективные НПВП были связаны с частотой рецидивов 17–28% в течение девяти дней после приема препарата у пациентов с ВЗК.Meyer et al. [24], ретроспективно проанализированы файлы амбулаторных пациентов с ВЗК и показали, что лечение НПВП было связано с рецидивом заболевания. Несколько дополнительных исследований случай-контроль показали, что НПВП повышают риск нового начала ВЗК [26,27], последующих обострений [25,27] и связаны с более высоким индексом активности заболевания [28]. Напротив, два исследования Bonner et al. [27,28] не выявили связи между активной или неподвижной БК или ЯК и применением НПВП в популяции амбулаторных пациентов с ВЗК.
4. Селективные ингибиторы ЦОГ2 и IBD
Селективные ингибиторы ЦОГ2 вызывают меньшую токсичность для ЖКТ по сравнению с обычными НПВП. На сегодняшний день исследования использования селективных ингибиторов ЦОГ2 при ВЗК дали неоднозначные результаты. Махадеван и др. [29] обследовали 27 пациентов с БК, ЯК и поучитом, получавших рофекоксиб или целекоксиб. Было показано, что лечение было полезным и безопасным. Большое двойное слепое плацебо-контролируемое исследование Sandborn et al. [30] из 222 пациентов с ЯК в стадии ремиссии с артритом или артралгиями продемонстрировали, что лечение целекоксибом до двух недель не приводило к более высокой частоте рецидивов, чем плацебо.В другом многоцентровом двойном слепом плацебо-контролируемом исследовании Miedeny et al. [31] включал 146 пациентов с ВЗК, получавших эторикоксиб или плацебо в течение трех месяцев. Лечение было полезным и безопасным и не было связано с обострением болезни. Другое открытое исследование Reinisch [32] продемонстрировало профиль эффективности и безопасности рофекоксиба у аналогичных пациентов.
Напротив, сообщалось о нескольких случаях обострений у пациентов с ВЗК, получавших ингибиторы ЦОГ2 [33,34].Bioncone et al. [16] оценили безопасность и эффективность ингибиторов ЦОГ2 в открытом исследовании. Рофекоксиб контролировал артралгии у двух третей пациентов, однако побочные эффекты, требующие отмены препарата, наблюдались у одной пятой пациентов с ВЗК. К ним относятся боли в животе, диарея, кровавый стул и изжога. Matuk et al. [32] оценили безопасность и токсичность целекоксиба и рофекоксиба у 33 пациентов с ВЗК. Все пациенты испытали обострение болезни в течение 6 недель после начала терапии ЦОГ2, и у 38% из них симптомы исчезли после прекращения лечения.Наконец, недавний метаанализ [35], посвященный применению ингибиторов ЦОГ2 у пациентов с ВЗК, показал, что данных для определения влияния ингибиторов ЦОГ2 на обострения ВЗК недостаточно. Эти смешанные данные предполагают, что требуется дальнейшая оценка использования селективных ингибиторов ЦОГ2 у пациентов с ВЗК. резюмирует исследования по влиянию НПВП на ВЗК.
Таблица 2
Статьи о влиянии НПВП и селективных ингибиторов ЦОГ2 на ВЗК.
| Артикул | Тип исследования | Тип ВЗК | Тип НПВП | Выводы |
|---|---|---|---|---|
| Такеучи, К. et al. [15] | Предполагаемая когорта | ЯК и CD | Неселективный | Прием НПВП связан с частыми и ранними рецидивами ВЗК в покое. |
| Мейер А.М. et al. [24] | Ретроспективная когорта | ЯК и CD | Неселективный | Использование НПВС было связано с рецидивом ВЗК. |
| Felder J.B. et al. [25] | Случай – контроль | ЯК и CD | Неселективный | НПВП вызывают активность заболевания как при ЯК, так и при БК. |
| Evans, J.M. et al. [26] | Контроль случая | UC и CD | Неселективный | НПВП связаны с госпитализацией пациентов с тяжелым колитом с ВЗК. |
| Боннер, Г.Ф. et al. [27] | Ретроспективная когорта | ЯК и CD | Неселективное | Использование НПВП не было связано с более высокой вероятностью активного ВЗК. |
| Боннер, Г.Ф. et al. [28] | Случай – контроль | UC и CD | Неселективный | Высокие дозы НПВП были связаны с более высоким индексом активности заболевания, но значительных обострений заболевания не наблюдалось. |
| Mahadevan, U. et al. [29] | Ретроспективная когорта | ЯК и CD | Селективные ЦОГ2 | Ингибиторы ЦОГ2 оказались безопасными и полезными для пациентов с ВЗК. |
| Sandborn, W.J. et al. [30] | Рандомизированное плацебо-контролируемое исследование | UC | Селективный по COX2 | Лечение целекоксибом не было связано с большей частотой рецидивов по сравнению с плацебо. |
| El Miedany, Y. et al. [31] | Рандомизированное плацебо-контролируемое исследование | ЯК и CD | Селективный по ЦОГ | Лечение эторикоксибом было безопасным и эффективным у пациентов с ВЗК.Это не было связано с обострениями ВЗК. |
| Reinisch, W. et al. [32] | Проспективное открытое исследование | ЯК и CD | Селективный по ЦОГ | Лечение рофекоксибом было безопасным, полезным и не ассоциировалось с обострениями ВЗК. |
| Xin-Pu Miao et al. [35] | Мета-анализ | ЯК и CD | ЦОГ2 селективный | Недостаточно данных для определения влияния ингибиторов ЦОГ2 на обострения ВЗК. |
5. Резюме и выводы
В заключение, на сегодняшний день имеющиеся в литературе данные о влиянии НПВП на активность ВЗК неубедительны. Остается неясным, действительно ли НПВП и селективные ингибиторы ЦОГ2 вызывают обострения ВЗК и являются ли ингибиторы ЦОГ2 более безопасными, чем обычные НПВП. Есть некоторые данные, позволяющие предположить, что краткосрочное использование селективных ингибиторов ЦОГ2 безопасно и полезно у пациентов с ВЗК. Одновременное применение НПВС или ингибиторов ЦОГ2 и стероидов у пациентов с ВЗК требует особого рассмотрения и тщательного наблюдения из-за потенциально повышенной сердечно-сосудистой токсичности и токсичности UGI, особенно у пожилых пациентов.Дальнейшие исследования и будущие контролируемые клинические испытания помогут прояснить некоторые из этих тем.
Список литературы
1. Фордтман С.А. Заболевания желудочно-кишечного тракта и печени. 8-е изд. Сондерс Эльзевир; Филадельфия, Пенсильвания, США: 2006. С. 2459–2549. [Google Scholar] 2. Loftus E.V., Jr. Воспалительное заболевание кишечника, расширяющее его охват. Гастроэнтерология. 2005; 129: 1117–1120. DOI: 10.1053 / j.gastro.2005.07.042. [PubMed] [CrossRef] [Google Scholar] 3. Подольский Д.К. Воспалительное заболевание кишечника. N. Engl. J. Med.2002; 347: 417–429. [PubMed] [Google Scholar] 4. Кефалакес Х., Стилианидес Т.Дж., Аманакис Г. Обострение воспалительных заболеваний кишечника, связанных с применением нестероидных противовоспалительных средств: миф или реальность? Eur J Clin Pharmacol. 2009; 65: 963–970. DOI: 10.1007 / s00228-009-0719-3. [PubMed] [CrossRef] [Google Scholar] 5. Maiden L., Thjodleifsson B., Theodors A., Gonsales J., Bjarnason I. Количественный анализ патологии тонкой кишки, вызванной НПВС, с помощью капсульной энтероскопии. Гастроэнтерология. 2005; 128: 1172–1178.[PubMed] [Google Scholar] 6. Крайер Б. Смертность, связанная с НПВП: рост и снижение смертности от желудочно-кишечного тракта, связанной с НПВП. Являюсь. J. Gastroenterol. 2005; 100: 1694–1695. [PubMed] [Google Scholar] 7. Вулф М.М., Лихтенштейн Д.Р., Сингх Г. Желудочно-кишечная токсичность нестероидных противовоспалительных препаратов. N. Engl. J. Med. 1999; 340: 1888–1899. [PubMed] [Google Scholar] 8. Бьярнасон И., Хайллар Дж., Макферсон А.Дж., Рассел А.С. Побочные эффекты нестероидных противовоспалительных препаратов на тонкий и толстый кишечник человека.Гастроэнтерология. 1993; 104: 1832–1847. [PubMed] [Google Scholar] 9. Курахара К., Мацумото Т., Лида М., Хонда К., Яо Т., Фудзишима М. Клинические и эндоскопические особенности язв толстой кишки, вызванных приемом нестероидных противовоспалительных препаратов. Являюсь. J. Gastroenterol. 2001; 96: 473–480. [PubMed] [Google Scholar] 10. Laine L., Smith R., Min K., Chen C., Dubois R.W. Систематический обзор: нижние желудочно-кишечные побочные эффекты нестероидных противовоспалительных препаратов. Aliment Pharmacol. Ther. 2006. 24: 751–767. [PubMed] [Google Scholar] 11.Гусланди М. Обострение воспалительного заболевания кишечника нестероидными противовоспалительными препаратами и ингибиторами циклооксигеназы-2: факт или вымысел? Мир J. Gastroenterol. 2006; 12: 1509–1510. [Бесплатная статья PMC] [PubMed] [Google Scholar] 12. Уоллес Дж. Л. Биология простагландинов при воспалительном заболевании кишечника. Гастроэнтерол Клин. North Am. 2001; 30: 971–980. [PubMed] [Google Scholar] 13. Редферн Дж. С., Фельдман М. Роль эндогенных простагландинов в предотвращении язв желудочно-кишечного тракта: индукция язв с помощью антител к простагландинам.Гастроэнтерология. 1989; 96 (Дополнение): 596–605. [PubMed] [Google Scholar] 14. Tanaka K., Suemasu S., Ishihara T., Tasaka Y., Arai Y., Mizushima T. Ингибирование как COX-1, так и COX-2 и, как следствие, снижение уровня простагландинов E2, отвечает за нестероидные анти- воспалительный лекарственный (НПВП) -зависимый обострение колита. Евро. J. Pharmacol. 2009; 603: 120–132. [PubMed] [Google Scholar] 15. Такеучи К., Смейл С., Премчанд П., Мэйден Л., Шервуд Р., Тьодлейфссон Б., Бьорнссон Э., Бьярнасон И.Распространенность и механизм клинического рецидива, вызванного приемом нестероидных противовоспалительных препаратов, у пациентов с воспалительным заболеванием кишечника. Clin. Гастроэнтерол Гепатол. 2006; 4: 196–202. [PubMed] [Google Scholar] 16. Biancone L., Tosti C., Geremia A., Fina D., Petruzziello C., Emerenziani S., Pallone F. Рофекоксиб и ранний рецидив воспалительного заболевания кишечника: открытое испытание. Aliment Pharmacol. Ther. 2004. 19: 755–764. [PubMed] [Google Scholar] 17. Singer II, Kawka D.W., Schloemann S., Tessner T., Riehl T., Стенсон В.Ф. Циклооксигеназа 2 индуцируется в эпителиальных клетках толстой кишки при воспалительном заболевании кишечника. Гастроэнтерология. 1998. 115: 297–306. [PubMed] [Google Scholar] 18. Хендель Дж., Нильсен О. Экспрессия мРНК циклооксигеназы-2 при активном воспалительном заболевании кишечника. Являюсь. J. Gastroenterol. 1997; 92: 1170–1173. [PubMed] [Google Scholar] 19. Цубучи Р., Хаяси С., Аой Ю., Нишио Х., Терашима С., Като С., Такеучи К. Исцеляющий эффект ингибиторов циклооксигеназы на колит, индуцированный декстрансульфатом натрия, у крыс.Пищеварение. 2006; 74: 91–100. [PubMed] [Google Scholar] 20. Cipolla G., Crema F., Sacco S., Moro E., De Ponti F., Frigi G. Нестероидные противовоспалительные препараты и воспалительные заболевания кишечника: современные перспективы. Pharmacol. Res. 2002; 46: 1–6. [PubMed] [Google Scholar] 21. Фрайс Дж. Ф., Миллер С. Р., Шпиц П. В., Уильямс К. А., Хуберт Х. Б., Блох Д. А. К эпидемиологии гастропатии, связанной с применением нестероидных противовоспалительных препаратов. Гастроэнтерология. 1989; 96 (Дополнение): 647–655. [PubMed] [Google Scholar] 22.Боннер Г.Ф. Обострение воспалительного заболевания кишечника, связанное с применением целекоксиба. Являюсь. J. Gastroenterol. 2001; 96: 1306–1308. [PubMed] [Google Scholar] 23. Сингх С., Графф Л.А., Бернштейн К.Н. Вызывают ли НПВП, антибиотики, инфекции или стресс обострения ВЗК? Являюсь. J. Gastroenterol. 2009. 104: 1298–1313. DOI: 10.1038 / ajg.2009.15. [PubMed] [CrossRef] [Google Scholar] 24. Мейер А.М., Рамзан Н.Н., Хей Р.И., Лейтон Дж. Рецидив воспалительного заболевания кишечника, связанный с приемом нестероидных противовоспалительных средств.Копать. Дис. Sci. 2006. 51: 168–172. [PubMed] [Google Scholar] 25. Фелдер Дж. Б., Корелиц Б. И., Раджапакс Р., Шварц С., Хоратагис А. П., Глейм Г. Эффекты нестероидных противовоспалительных препаратов на воспалительное заболевание кишечника: исследование случай-контроль. Являюсь. J. Gastroenterol. 2000; 95: 1949–1954. [PubMed] [Google Scholar] 26. Эванс Дж. М., МакМахон А. Д., Мюррей Ф. Э., Макдевитт Д. Г., Макдональд Т. М. Нестероидные противовоспалительные препараты связаны с неотложной госпитализацией по поводу колита из-за воспалительного заболевания кишечника.Кишечник. 1997. 40: 619–622. [Бесплатная статья PMC] [PubMed] [Google Scholar] 27. Боннер Г.Ф., Вальчак М., Китчен Л., Байона М. Переносимость нестероидных противовоспалительных препаратов у пациентов с воспалительным заболеванием кишечника. Являюсь. J. Gastroenterol. 2000; 95: 1946–1948. [PubMed] [Google Scholar] 28. Боннер Г.Ф., Фахри А., Веннаманени С.Р. Долгосрочное когортное исследование использования нестероидных противовоспалительных препаратов и активности заболевания у амбулаторных пациентов с воспалительным заболеванием кишечника. Воспаление. Кишечник. 2004. 10: 751–757. [PubMed] [Google Scholar] 29.Махадеван У., Лофтус Э.В., младший, Тремейн У. Дж., Сэндборн У. Дж. Безопасность селективных ингибиторов циклооксигеназы-2 при воспалительном заболевании кишечника. Являюсь. J. Gastroenterol. 2002; 97: 910–914. [PubMed] [Google Scholar] 30. Сэндборн В.Дж., Стенсон В.Ф., Брынсков Дж., Лоренц Р.Г., Стейдл Г.М., Роббинс Дж.Л., Кент Дж.Д., Блум Б.Дж. Безопасность целекоксиба у пациентов с язвенным колитом в стадии ремиссии: рандомизированное плацебо-контролируемое пилотное исследование. Clin. Гастроэнтерол. Гепатол. 2006; 4: 203–211. [PubMed] [Google Scholar] 31. Эль-Мидани Ю., Юссеф С., Ахмед И., Эль Гаафари М. Безопасность для желудочно-кишечного тракта и влияние на активность эторикоксиба, селективного ингибитора ЦОГ-2 при воспалительных заболеваниях кишечника. Являюсь. J. Gastroenterol. 2006; 101: 311–317. [PubMed] [Google Scholar] 32. Reinisch W., Miehsler W., Dejaco C., Harrer M., Waldhoer T., Lichtenberger C., Vogelsang H. Открытое испытание селективного ингибитора циклооксигеназы-2 рофекоксиба при воспалительных заболеваниях кишечника. периферический артрит и артралгия. Aliment Pharmacol.Ther. 2003. 17: 1371–1380. DOI: 10.1046 / j.1365-2036.2003.01596.x. [PubMed] [CrossRef] [Google Scholar] 33. Уилкокс Г.М., Маттиа А.Р. Рофекоксиб и воспалительные заболевания кишечника: клинико-патологические наблюдения. J. Clin. Гастроэнтерол. 2005; 39: 142–143. [PubMed] [Google Scholar] 34. Горнет Дж. М., Хассани З., Модильяни Р., Леманн М. Обострение колита Крона с тяжелым кровотечением в толстой кишке у пациента, принимающего рофекоксиб. Являюсь. J. Gastroenterol. 2002; 97: 3209–3210. [PubMed] [Google Scholar] 35. Мяо X.P., Оуян К., Ли Х.Ю., Вэнь З.Х., Чжан Д.К., Цуй X.Y. Роль селективных ингибиторов циклооксигеназы-2 в обострении воспалительного заболевания кишечника: систематический обзор и метаанализ. Curr. Терапия. Res. 2008; 69: 181–191. [Бесплатная статья PMC] [PubMed] [Google Scholar] 36. Такеучи А., Танака А., Оно Р., Йокота А. Роль ингибирования ЦОГ в патогенезе повреждения тонкого кишечника, вызванного НПВС. J. Physiol. Pharmacol. 2003. 54 (Приложение): 165–182. [PubMed] [Google Scholar]Почему НПВП вредны для лечения болезни Крона и язвенного колита
Загляните практически в любую аптечку, и вы наверняка найдете НПВП (нестероидное противовоспалительное средство).НПВП, которые используются для лечения боли и воспаления, настолько распространены, что зачастую у них есть отдельные полки в аптеках.
Таракорн Арунотай / EyeEm / Getty ImagesФактически, необходимо следить за тем, чтобы люди случайно не приняли слишком много НПВП, особенно потому, что можно легко использовать более одного из этих безрецептурных лекарств для лечения боли и лихорадки от гриппа или других распространенных лекарств. болезни. Другие применения НПВП включают лечение головных болей, мышечных болей, менструальных спазмов, а также облегчение повседневных болей и болей.
Люди с воспалительным заболеванием кишечника (ВЗК) испытывают боли, как и все остальные. Многие также ежедневно испытывают боль из-за внекишечных состояний, таких как артрит, или из-за побочных эффектов лекарств, таких как головные боли. Однако некоторые гастроэнтерологи рекомендуют своим пациентам с ВЗК воздерживаться от НПВП. Причина: НПВП могут отрицательно влиять на болезнь Крона и язвенный колит.
Как действуют НПВП
НПВП работают, блокируя два определенных фермента в организме: циклооксигеназу-1 (ЦОГ-1) и циклооксигеназу-2 (ЦОГ-2).ЦОГ-1 играет роль в пищеварительной системе, а ЦОГ-2 играет роль в воспалительном процессе.
Функция ЦОГ-1 заключается в регулировании веществ, называемых простагландинами, которые защищают слизистую оболочку желудка от кислот, которые помогают переваривать пищу. Простагландины, синтезируемые ЦОГ-2, опосредуют воспалительный процесс и болевой ответ.
Это означает, что, хотя НПВП ослабляют цикл воспаления и боли, они также заставляют пищеварительную систему терять некоторые из своих обычных защитных веществ.Это может создать проблемы для людей, у которых уже есть воспаление или вероятность воспаления в пищеварительном тракте.
НПВП и язвы
Даже у людей без ВЗК НПВП могут способствовать возникновению язв как в желудке, так и в первой части тонкой кишки (называемой двенадцатиперстной кишкой). НПВП могут вызвать воспаление и усугубить кровотечение в тонком кишечнике. Некоторые специалисты по пищеварению обеспокоены тем, что НПВП могут вызвать ремиссию ВЗК.
НПВП и ВБК
Исследования о том, способствуют ли НПВП развитию симптомов ВЗК, противоречивы, вызывая разногласия по поводу их использования среди гастроэнтерологов.Что касается класса препаратов, называемых ингибиторами ЦОГ-2, в настоящее время не так много данных об их влиянии на людей с ВЗК.
Некоторые исследования показывают, что НПВП могут влиять только на определенный процент людей с ВЗК, но невозможно знать, кто пострадает, а кто нет. Было высказано предположение, что использование ингибитора ЦОГ-2, а не лекарства, которое одновременно является ингибитором ЦОГ-1 и ЦОГ-2, можно с осторожностью применять у тех, у кого ВЗК находится в стадии ремиссии.
Людям с ВЗК следует проконсультироваться со своим гастроэнтерологом, прежде чем принимать НПВП, даже те, которые продаются без рецепта.Также чрезвычайно важно, чтобы все члены медицинской бригады пациента знали о влиянии НПВП на их ВЗК.
Что могут сделать те, кто живет с ВБК
Людям с ВЗК, которые ищут безрецептурное обезболивающее, может потребоваться парацетамол. Ацетаминофен, продаваемый под многими торговыми марками, включая Тайленол, не является НПВП и может быть лучшим выбором для людей с ВЗК, которым требуется болеутоляющее. Как парацетамол блокирует боль, до конца не изучено, но считается, что он останавливает выработку простагландинов.
Людям с ВЗК всегда следует сомневаться в добавлении нового рецепта на лекарства, особенно на те, которые используются для снятия боли. Не каждый медицинский работник знает о возможной связи между обезболивающими и ВЗК.
Когда люди с ВЗК собираются перенести операцию или процедуры, не связанные с пищеварительным трактом, важно пригласить гастроэнтеролога для обсуждения об обезболивании, чтобы убедиться, что последняя информация о НПВП и их применении при ВЗК принимается во внимание. .
Ниже представлена таблица НПВП, отпускаемых по рецепту или без рецепта. Это ни в коем случае не исчерпывающий список, поэтому проконсультируйтесь с фармацевтом или врачом по поводу конкретных лекарств.
Нестероидные противовоспалительные препараты (НПВП)
| Фирменное наименование | Общее имя |
| Адвил, Экседрин ИБ, Генприл, Халтран, Ибуприн, Ибупром, Ибу-Таб, Мидрин 200, Медипрен, Мидол ИБ, Мотрин, Нуприн, Памприн-ИБ, Руфен, Трендар | Ибупрофен |
| Алеве, Анапрокс, Напросин | Напроксен натрия |
| Amigesic, Anaflex 750, Marthritic, Mono-Gesic, Salflex, Salsitab, Disalcid | Салсалат |
| Анацин, Байер, Буферин, Экотрин | Холина салицилат |
| Ансаид, Фробен | Флурбипрофен пероральный |
| Апо-Кето, Орудис, Орувайл, Родис | Кетопрофен |
| Апо-Сулин, Клинорил, Ново-Сундак | Сулиндак |
| Aspergum, Genuine Bayer, Bayer Childrens, Bufferin, Easprin, Ecotrin, Empirin, Genprin, Halfprin, Magnaprin, ZORprin | Аспирин |
| Бутазолидин | Фенилбутазон |
| Cataflam, Voltaren | Диклофенак Системный |
| DayPro | Оксапрозин |
| Долобид | Дифлунисал |
| Feldene, Novo-Pirocam, Nu-Pirox | Пироксикам |
| Indocin SR, Indocid, Novo-Methacin | Индометацин |
| Лодин | Этодолак |
| Мекломен | Меклофенамат натрия |
| Mobic | Мелоксикам |
| Nalfon | Фенопрофен Кальций |
| Ponstan, Ponstel | Меклофенамовая кислота |
| Relafen | Nabumetone |
| Толектин | Толметин натрия |
Спасибо за отзыв!
Мы даем советы, как лучше заботиться о кишечнике.
Зарегистрироваться
Ты в!Спасибо, {{form.email}}, за регистрацию.
Произошла ошибка. Пожалуйста, попробуйте еще раз.
Что вас беспокоит?
Другой Неточный Сложно понять Verywell Health использует только высококачественные источники, в том числе рецензируемые исследования, для подтверждения фактов в наших статьях. Прочтите наш редакционный процесс, чтобы узнать больше о том, как мы проверяем факты и обеспечиваем точность, надежность и надежность нашего контента.Kefalakes H, Stylianides TJ, Amanakis G, Kolios G.Обострение воспалительных заболеваний кишечника, связанное с применением нестероидных противовоспалительных препаратов: миф или реальность ?. Eur J Clin Pharmacol . 2009; 65 (10): 963-70. DOI: 10.1007 / s00228-009-0719-3.
Лонг, доктор медицины, Каппельман, доктор медицины, Мартин К.Ф., Чен В., Антон К., Сандлер Р.С. Роль нестероидных противовоспалительных препаратов в обострениях воспалительного заболевания кишечника. Дж Клин Гастроэнтерол . 2016; 50 (2): 152-6. DOI: 10.1097 / MCG.0000000000000421.
Махадеван У., Лофтус Э.В., Тремейн ВД, Сэндборн ВД.Безопасность селективных ингибиторов циклооксигеназы-2 при воспалительном заболевании кишечника. Ам Дж. Гастроэнтерол . 2002; 97 (4): 910-4. DOI: 10.1111 / j.1572-0241.2002.05608.x.
Матук Р., Кроуфорд Дж., Абреу М.Т., Тарган С.Р., Василяускас Е.А., Пападакис К.А. Спектр желудочно-кишечной токсичности и влияние селективных ингибиторов циклооксигеназы-2 на активность заболевания у пациентов с воспалительным заболеванием кишечника. Воспаление кишечника . 2004; 10 (4): 352-6. https://doi.org/10.1097 / 00054725-200407000-00005.
Ribaldone DG, Fagoonee S, Astegiano M, et al. Безопасность коксиба у пациентов с воспалительными заболеваниями кишечника: метаанализ. Врач боли . 2015; 18 (6): 599-607.
Сандборн В.Дж., Стенсон В.Ф., Брынсков Дж. И др. Безопасность целекоксиба у пациентов с язвенным колитом в период ремиссии: рандомизированное плацебо-контролируемое пилотное исследование. Clin Gastroenterol Hepatol Февраль 2006; 4: 203-2011.
Singh S, Graff LA, Bernstein CN.Вызывают ли НПВП, антибиотики, инфекции или стресс обострения ВЗК? Am J Gastroenterol 2009; 104: 1298–1313.
Такеучи К., Смейл С., Премчанд П. и др. «Распространенность и механизм клинического рецидива, вызванного приемом нестероидных противовоспалительных препаратов, у пациентов с воспалительным заболеванием кишечника». Клин Гастроэнтерол Гепатол . 2006 февраль; 4: 196-202.
самых обезболивающих, небезопасных при воспалительном заболевании кишечника
сент.7, 2000 – Сьюзан Джонсон принимала около 400 таблеток ибупрофена в месяц от боли, когда в августе она наконец обратилась к врачу. Она знала, что принимает слишком много, потому что диарея, которая является симптомом воспалительного кишечного заболевания, с которым она боролась в течение двух десятилетий, была хуже, чем в последние годы.
«Никто никогда не говорил мне не принимать ибупрофен, но я знала, что принимать такую дозу – это безумие», – рассказывает WebMD 43-летняя женщина из Уэйнсбурга, штат Пенсильвания. “Но моя боль была настолько сильной, что мне пришлось что-то делать.Когда я сказал своему врачу, сколько я принимаю, его глаза расширились, и он сказал: «Ты, должно быть, шутишь». Затем он сказал мне, что мне вообще не следует принимать ибупрофен, потому что он вызывает диарею ».
Управлять спорадической и длительной болью у людей с воспалительными заболеваниями кишечника, такими как язвенный колит и болезнь Крона, которая есть у Джонсона, – непростая задача. Новое исследование показывает, что это может быть даже более проблематично, чем предполагалось ранее. Исследователи из больницы Ленокс Хилл в Нью-Йорке обнаружили, что пациентам с воспалительным заболеванием кишечника следует избегать не только препаратов ибупрофена, таких как мотрин, адвил и нуприн, но и большинства других антибиотиков. -воспалительные болеутоляющие средства, включая экотрин и все лекарства, содержащие аспирин.
Продолжение
Исследование, опубликованное в августовском выпуске The American Journal of Gastroenterology , предполагает, что пациентам с воспалительным заболеванием кишечника следует избегать приема лекарств, принадлежащих к классу нестероидных противовоспалительных средств (НПВП), поскольку они оба усугубляют симптомы существующего заболевания и могут фактически вызвать начало заболевания у людей, предрасположенных к этому состоянию.
В этом исследовании 60 пациентов с обострениями тяжелого воспалительного заболевания кишечника, требующими госпитализации, были опрошены относительно использования ими НПВП.Авторы обнаружили корреляцию между приемом НПВП и обострением симптомов заболевания кишечника чуть менее чем у одной трети пациентов.
«Использование этих НПВП в целом гораздо более вредно, чем мы предполагали ранее, но, в частности, когда мы говорим о людях с воспалительным заболеванием кишечника, эти препараты не следует использовать, если это вообще возможно», – автор исследования Джозеф Б. Фелдер, доктор медицины, рассказывает WebMD. “Даже самые простые лекарства, отпускаемые без рецепта, могут иметь серьезные последствия для этих пациентов, поэтому им всегда следует проявлять осторожность.”
Продолжение
Из-за мучительной боли в суставах Джонсон принимал ибупрофен горстями – от восьми до 10 таблеток по 200 мг за раз, несколько раз в день, в течение нескольких месяцев, – говорит она. Боль в суставах иногда наблюдается у людей с болезнью Крона. болезнь, но боль была лишь косвенно связана с болезнью Крона – это был побочный продукт постоянного приема стероидного преднизона в течение 24 лет для контроля симптомов болезни.
«Я был в восторге, когда обнаружил ибупрофен, потому что это был единственный это сработало, но мне приходилось принимать все больше и больше, и, наконец, я понял, насколько это безумно », – говорит Джонсон.
По совету врача Джонсон теперь принимает гораздо меньшие количества другого НПВП каждый день, а также другое болеутоляющее и третье лекарство от диареи.
Гастроэнтеролог Скотт Плеви из Медицинской школы Маунт-Синай в Нью-Йорке соглашается с тем, что НПВП могут вызывать ухудшение симптомов у пациентов с заболеваниями кишечника, такими как болезнь Крона и язвенный колит, но добавляет, что нецелесообразно ожидать, что пациенты полностью откажутся от этих лекарств. .Плеви, который занимается исключительно лечением пациентов с воспалительными заболеваниями кишечника, является представителем Американского фонда Крона и колита и подготовил обзор этого исследования для WebMD.
Продолжение
«Я думаю, что врачи, которые регулярно лечат пациентов с болезнью Крона или колитом, понимают, что этим пациентам следует осторожно принимать нестероидные препараты, если вообще принимать их», – говорит он WebMD. «Но врачи, которые не принимают много пациентов с воспалительными заболеваниями кишечника, могут не знать об этом. Если нестероидные препараты можно избежать у пациентов с воспалительными заболеваниями кишечника, им, вероятно, следует знать.Однако есть обстоятельства, при которых эти пациенты не смогут избежать приема этих препаратов. В этих случаях при тщательном рассмотрении их, вероятно, можно безопасно назначать ».
Фельдер говорит, что препараты ацетаминофена, такие как тайленол, которые не попадают в класс НПВП, являются наиболее безопасными вариантами обезболивания для пациентов с воспалительным заболеванием кишечника. Но потому что ацетаминофен не является противовоспалительным, он не может облегчить некоторые виды боли, например, связанной с мышечным напряжением.
Продолжение
«Простое сообщение этого исследования состоит в том, что эти препараты не так безвредны, как кажутся, особенно когда они доходит до воспалительного заболевания кишечника », – говорит он.«В течение долгого времени было известно, что эти препараты имеют побочные эффекты со стороны кишечника, но мы считаем, что они особенно [не рекомендуются] для этих пациентов».
Мало доказательств, что некоторые обезболивающие усугубляют болезнь Крона, язвенный колит
Бостон – Пациентов с болезнью Крона и язвенным колитом часто предупреждают об использовании парацетамола и нестероидных противовоспалительных препаратов (НПВП) из-за опасений, что обезболивающие могут усугубить их состояние. .Однако новый обзор в Alimentary Pharmacology & Therapeutics не выявил четкой связи.
«Вопреки общепринятому мнению, недавний обзор и анализ опубликованных исследований не выявили последовательной связи между употреблением парацетамола и обострением болезни Крона и язвенного колита», – пишут авторы под руководством исследователей больницы общего профиля Массачусетса. «Тем не менее, когда анализ ограничивался исследованиями с низким риском систематической ошибки, была обнаружена связь между применением НПВП и обострением болезни Крона, но не язвенным колитом.
Исследователи провели систематический обзор и метаанализ предыдущих исследований, изучающих связь между ацетаминофеном и НПВП, включая использование ингибиторов циклооксигеназы (ЦОГ-2), и риском обострения болезни Крона (БК) и язвенного колита (ЯК).
Опубликованные рукописи и рефераты до 1 марта 2017 г. были собраны путем систематического поиска в реестрах Medline, Embase, Cochrane и других исследований. Оценка качества проводилась с использованием шкалы Ньюкасла-Оттавы, а метаанализ случайных эффектов с использованием объединенных относительных рисков (ОР) и 95% доверительных интервалов.
Всего за период с 1983 по 2016 год было обнаружено 18 публикаций. Для метаанализа объединенные ОР обострения заболевания при использовании НПВП составили (1,42, 95% ДИ, 0,65–3,09), I 2 = 60,3% для БК и (1,52, 95% ДИ, 0,87–2,63). ), I 2 = 56,1% для UC. Соответствующие значения для использования ацетаминофена были (1,40, 95% ДИ, 0,96? 2,04), I 2 = 45,6% для UC и (1,56, 95% ДИ, 1,22-1,99), I 2 = 0.0% для IBD.
Анализ чувствительности, ограниченный исследованиями с низким риском систематической ошибки, показал значительно повышенный риск обострения БК (1,53, 95% ДИ, 1,08–2,16), но не ЯК (0,94, 95% ДИ, 0,36–2,42) при использовании НПВП.
«Вопреки общепринятому мнению, мы не обнаружили устойчивой связи между применением НПВП и риском обострения БК и ЯК», – заключают авторы исследования. «Не было также убедительных доказательств связи с парацетамолом, хотя необходимы дальнейшие исследования.
«Мы были удивлены, увидев, что в литературе мало данных, подтверждающих нашу общую рекомендацию пациентам с воспалительным заболеванием кишечника избегать всех НПВП», – добавил старший автор Хамед Халили, доктор медицины, магистр здравоохранения, Массачусетской больницы общего профиля.
Мета-анализ: ацетаминофен, НПВП не ухудшают постоянное ухудшение IBD
Систематический обзор и метаанализ не выявили последовательной общей связи между обострением воспалительного заболевания кишечника (ВЗК) и ацетаминофеном, нестероидными противовоспалительными препаратами (НПВП) или ингибиторами циклооксигеназы 2 (ЦОГ-2).
Результаты, опубликованные в Alimentary Pharmacology and Therapeutics , противоречат распространенному мнению о том, что НПВП могут обострять болезнь Крона (БК) и язвенный колит (ЯК). Например, в рекомендациях Американского колледжа гастроэнтерологии по ведению ВЗК НПВП рассматриваются как потенциальные триггеры обострения заболевания.
«Вопреки общему мнению, мы не обнаружили устойчивой связи между использованием НПВП и риском обострений ВЗК», – сказал Хамед Халили, доктор медицины, магистр здравоохранения Массачусетской больницы общего профиля в Бостоне, MedPage Today .«Это было для нас неожиданностью, поскольку обычно клиницисты советуют не использовать НПВП у пациентов с установленной ВЗК. Но мы предостерегаем от любых изменений в текущей практике, поскольку требуется значительно больше работы для изучения безопасности ацетаминофена и НПВП у пациентов с БК и ЯК. ”
Он и его коллеги выявили 18 разнородных англоязычных исследований, опубликованных с 1983 по 2016 год и дающих противоречивые результаты об обострении болезни при приеме НПВП и парацетамола. Исходя из этого, команда рассчитала объединенные коэффициенты относительного риска (ОР).Дизайн исследований варьировался от случая и контроля до ретроспективных и проспективных когорт, а также рандомизированных и нерандомизированных клинических испытаний. Размер выборки также варьировался: от семи пациентов до 1940, а продолжительность воздействия наркотиков составляла от 15 дней до 18 месяцев. Исходы обострения также были разными: от поступления в отделение неотложной помощи до клинического рецидива, активности заболевания и эндоскопических баллов.
Неудивительно, что неоднородность между исследованиями (I 2 ) была значительной, но не показала никаких доказательств предвзятости публикации, заявили авторы.
Для использования НПВП RR обострения в исследованиях составлял 1,42 (95% ДИ 0,65–3,09, I 2 = 60,3%) для БК, а для ЯК – 1,52 (95% ДИ 0,87–2,63, I 2 ). = 56,1%).
Соответствующие значения для ацетаминофена составляли 1,40 (95% ДИ 0,96–2,04, I 2 = 45,6%) для UC и 1,56 (95% ДИ 1,22–1,99, I 2 = 0,0%) для IBD.
«Это исследование отвечает на один из наиболее частых запросов пациентов с ВЗК», – Саймон С.М. Чан, доктор медицинских наук, из Университета Восточной Англии в Норидже, США.К., не имеющий отношения к исследованию, прокомментировал MedPage Today . «Отсутствие связи между НПВП или ингибиторами ЦОГ-2 и риском обострений БК и ЯК в этом метаанализе, несмотря на существование вероятных биологических механизмов, ставит под сомнение веру в то, что эти препараты увеличивают риск обострений воспалительных заболеваний кишечника. Хотя это обнадеживает, многие из них были небольшого размера, и я согласен с авторами в отношении необходимости более крупных, хорошо спланированных испытаний.«
Среди исследований с низким риском систематической ошибки группа Халили обнаружила очевидный связанный с НПВП риск только для БК, при этом анализ чувствительности показал значительный риск обострения БК (1,53, 95% ДИ 1,08-2,16), но не обострения ЯК. (0,94, 95% ДИ 0,36–2,42).
«Хотя хорошо известно, что НПВП могут вызывать de novo повреждение желудочно-кишечного тракта, точный механизм, посредством которого НПВП способствуют обострению ВЗК, остается в значительной степени неизвестным», – писали Халили и его коллеги.
Они объяснили, что ингибирование синтеза простагландинов в кишечнике за счет двойной инактивации ЦОГ-1 и ЦОГ-2 может быть частично причиной ухудшения. «Однако неясно, является ли ингибирование ЦОГ-1 основной причиной повреждения слизистой оболочки и имеют ли пациенты, принимающие ингибиторы ЦОГ-2, аналогичный потенциально повышенный риск обострения по сравнению с теми, кто принимает неселективные НПВП», – написала команда со ссылкой на исследование Хирофуми Мацуи. и коллеги.
Чан назвал открытие связи между приемом парацетамола и обострением БК в двух исследованиях «интересным, особенно потому, что клиницисты склонны отдавать предпочтение этому препарату, а не НПВП или ингибиторам ЦОГ-2 для облегчения боли у пациентов с ВЗК», но добавил осторожная интерпретация, поскольку для ЯК не было обнаружено никакой связи.
«Мы признаем, что ВЗК является гетерогенным заболеванием, и поэтому могут быть подгруппы пациентов, особенно подверженных риску обострения заболевания при применении НПВП», – написали Халили и соавторы. «Следовательно, необходимы будущие исследования, направленные на изучение предикторов обострений / прогрессирования заболевания при использовании НПВП».
Исследователи заявили, что планируют разработать большие проспективные когортные исследования, которые будут систематически изучать связь между ВЗК и использованием парацетамола и НПВП, а также аспирина.
Среди ограничений метаанализа, по словам группы, были неоднородность, особенно разные определения обострения заболевания, и возможность искажения по показаниям, поскольку некоторые исследования не документировали причину использования конкретного лекарства. Кроме того, анализ не обязательно позволял обнаруживать скромные ассоциации. Кроме того, поскольку единственные доступные исследования были на английском языке, результаты не могут быть распространены на более широкие слои населения мира.
Последнее обновление 2 мая 2018 г.
Дайана Свифт – независимый медицинский журналист из Торонто.
Раскрытие информации
Исследование было поддержано Американской гастроэнтерологической ассоциацией, Национальным институтом диабета, болезней органов пищеварения и почек, Abbvie, Samsung Bioepis и Takeda.
Халили сообщил о финансовых отношениях с Abbvie, Samsung Bioepis и Takeda Pharmaceuticals.
.
 Место их действия: преимущественно слизистая оболочка – внутренний слой кишки. По этой причине они успешно применяются при язвенном колите, но редко помогают при болезни Крона, при которой воспаление распространяется за пределы слизистой оболочки.
Место их действия: преимущественно слизистая оболочка – внутренний слой кишки. По этой причине они успешно применяются при язвенном колите, но редко помогают при болезни Крона, при которой воспаление распространяется за пределы слизистой оболочки. Системные гормоны вызывают множественные побочные эффекты, среди которых перераспределение жира, увеличение массы тела, сахарный диабет, артериальная гипертензия, остеопороз, тромбозы и даже психозы. Системные гормоны всегда применяют коротким курсом и используют только для индукции ремиссии. В качестве постоянной терапии эти препараты не пригодны: эксперты предписывают завершить гормональную терапию за 12 недель.
Системные гормоны вызывают множественные побочные эффекты, среди которых перераспределение жира, увеличение массы тела, сахарный диабет, артериальная гипертензия, остеопороз, тромбозы и даже психозы. Системные гормоны всегда применяют коротким курсом и используют только для индукции ремиссии. В качестве постоянной терапии эти препараты не пригодны: эксперты предписывают завершить гормональную терапию за 12 недель. Эти препараты также подавляют деление клеток, но действуют быстро. При лечении тяжелых форм язвенного колита эти препараты иногда позволяют избежать удаления толстой кишки при неэффективности гормонов.
Эти препараты также подавляют деление клеток, но действуют быстро. При лечении тяжелых форм язвенного колита эти препараты иногда позволяют избежать удаления толстой кишки при неэффективности гормонов. Они включают периферический артрит, эписклерит, афтозный стоматит, узловатую эритему и гангренозную пиодермию. Артрит обычно имеет мигрирующий, транзиторный характер с вовлечением крупных суставов. Один или более таких параллельно протекающих нарушений развивается более чем у 1/3 пациентов, госпитализированных с воспалительными заболеваниями кишечника.
Они включают периферический артрит, эписклерит, афтозный стоматит, узловатую эритему и гангренозную пиодермию. Артрит обычно имеет мигрирующий, транзиторный характер с вовлечением крупных суставов. Один или более таких параллельно протекающих нарушений развивается более чем у 1/3 пациентов, госпитализированных с воспалительными заболеваниями кишечника. Заболевания печени (напр., стеатоз печени, аутоиммунный гепатит, перихолангит, цирроз) наблюдаются у 3-5 % пациентов, хотя более характерны незначительные изменения функциональных печеночных тестов. Некоторые из этих нарушений (напр., первичный склерозирующий холангит) могут предшествовать воспалительным заболеваниям кишечника, и в случае их диагностики необходимо провести оценку возможности манифестации воспалительных заболеваний кишечника.
Заболевания печени (напр., стеатоз печени, аутоиммунный гепатит, перихолангит, цирроз) наблюдаются у 3-5 % пациентов, хотя более характерны незначительные изменения функциональных печеночных тестов. Некоторые из этих нарушений (напр., первичный склерозирующий холангит) могут предшествовать воспалительным заболеваниям кишечника, и в случае их диагностики необходимо провести оценку возможности манифестации воспалительных заболеваний кишечника.
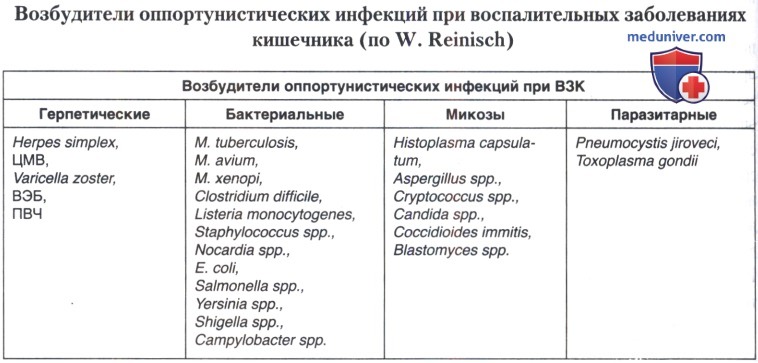 Biometals 2016 Apr;29(2):311-9.
Biometals 2016 Apr;29(2):311-9.