Развитие желудка: развитие, строение, топография, кровоснабжение и иннервация. Рентгенанатомия желудка.
Найден биомаркер рака желудка – РИА Новости, 21.10.2020
https://ria.ru/20201021/rak-1580854662.html
Найден биомаркер рака желудка
Найден биомаркер рака желудка – РИА Новости, 21.10.2020
Найден биомаркер рака желудка
Ученые выявили биомаркер, по которому можно предсказать риск развития рака желудка еще до появления первых симптомов. Результаты исследования опубликованы в… РИА Новости, 21.10.2020
2020-10-21T16:36
2020-10-21T16:36
2020-10-21T16:36
наука
сша
здоровье
рак
биология
/html/head/meta[@name=’og:title’]/@content
/html/head/meta[@name=’og:description’]/@content
https://cdn24.img.ria.ru/images/rsport/113418/41/1134184159_0:160:3076:1890_1920x0_80_0_0_99b9104f9356fa2ad6cde54d932de289.jpg
МОСКВА, 21 окт — РИА Новости. Ученые выявили биомаркер, по которому можно предсказать риск развития рака желудка еще до появления первых симптомов. Результаты исследования опубликованы в журнале Британского общества гастроэнтерологов BMJGut. Рак желудка стоит на третьем месте по количеству смертей среди онкологических больных в мире. Заболевание возникает из-за неправильного питания и неблагоприятных факторов окружающей среды и часто может оставаться незамеченным вплоть до поздних стадий.В настоящее время для диагностики болезни с помощью эндоскопической процедуры биопсии отбирают образец ткани желудка и анализируют на предмет патологии.Биологи из США, Китая и Вьетнама нашли биомаркер, который можно обнаружить с помощью простого анализа крови. К тому же, он появляется в крови пациентов еще до начала развития опухоли. Исследователи уверены, что их открытие поможет раннему выявлению болезни и ее своевременному лечению.Биомаркер MiR130b представляет собой микроРНК, или небольшую некодирующую молекулу РНК, которая играет важную роль в регуляции экспрессии генов, влияя на развитие и прогрессирование заболевания.MiR130b вырабатывается группой иммунных клеток, называемых миелоидными супрессорными клетками, обычно связанными с инфекциями, вызванными Helicobacter pylori — бактериями, провоцирующими язву желудка и рак.
Рак желудка стоит на третьем месте по количеству смертей среди онкологических больных в мире. Заболевание возникает из-за неправильного питания и неблагоприятных факторов окружающей среды и часто может оставаться незамеченным вплоть до поздних стадий.В настоящее время для диагностики болезни с помощью эндоскопической процедуры биопсии отбирают образец ткани желудка и анализируют на предмет патологии.Биологи из США, Китая и Вьетнама нашли биомаркер, который можно обнаружить с помощью простого анализа крови. К тому же, он появляется в крови пациентов еще до начала развития опухоли. Исследователи уверены, что их открытие поможет раннему выявлению болезни и ее своевременному лечению.Биомаркер MiR130b представляет собой микроРНК, или небольшую некодирующую молекулу РНК, которая играет важную роль в регуляции экспрессии генов, влияя на развитие и прогрессирование заболевания.MiR130b вырабатывается группой иммунных клеток, называемых миелоидными супрессорными клетками, обычно связанными с инфекциями, вызванными Helicobacter pylori — бактериями, провоцирующими язву желудка и рак. Известно, что рак желудка может развиваться спустя долгое время после того, как инфекция H. pylori прошла, а эти микроРНК четко коррелируют с предраковыми изменениями, которые впоследствии могут привести к появлению опухоли.”Даже если вы избавились от бактерий, зачастую инфекция уже инициировала каскад событий, которые могут привести к раку. Вот почему так важно раннее обнаружение”, — приводятся в пресс-релизе Аризонского университета слова одного из авторов статьи Яны Заврос (Yana Zavros) из Университета Цинциннати.Началось все с того, что, изучая изменения в желудке мышей, вызванные H. Pylori, исследователи обнаружили у животных маркер MiR130b, а затем ту же микроРНК идентифицировали в человеческой плазме у пациентов с предраковыми изменениями или с диагностированным раком желудка в начальной стадии.”Это было ретроспективное исследование, — отмечает руководитель научной группы доктор Хуанита Мерчант (Juanita Merchant) из Медицинского колледжа Аризонского университета. — Но теперь мы можем начать перспективное изучение этого биомаркера на различных группах пациентов.
Известно, что рак желудка может развиваться спустя долгое время после того, как инфекция H. pylori прошла, а эти микроРНК четко коррелируют с предраковыми изменениями, которые впоследствии могут привести к появлению опухоли.”Даже если вы избавились от бактерий, зачастую инфекция уже инициировала каскад событий, которые могут привести к раку. Вот почему так важно раннее обнаружение”, — приводятся в пресс-релизе Аризонского университета слова одного из авторов статьи Яны Заврос (Yana Zavros) из Университета Цинциннати.Началось все с того, что, изучая изменения в желудке мышей, вызванные H. Pylori, исследователи обнаружили у животных маркер MiR130b, а затем ту же микроРНК идентифицировали в человеческой плазме у пациентов с предраковыми изменениями или с диагностированным раком желудка в начальной стадии.”Это было ретроспективное исследование, — отмечает руководитель научной группы доктор Хуанита Мерчант (Juanita Merchant) из Медицинского колледжа Аризонского университета. — Но теперь мы можем начать перспективное изучение этого биомаркера на различных группах пациентов.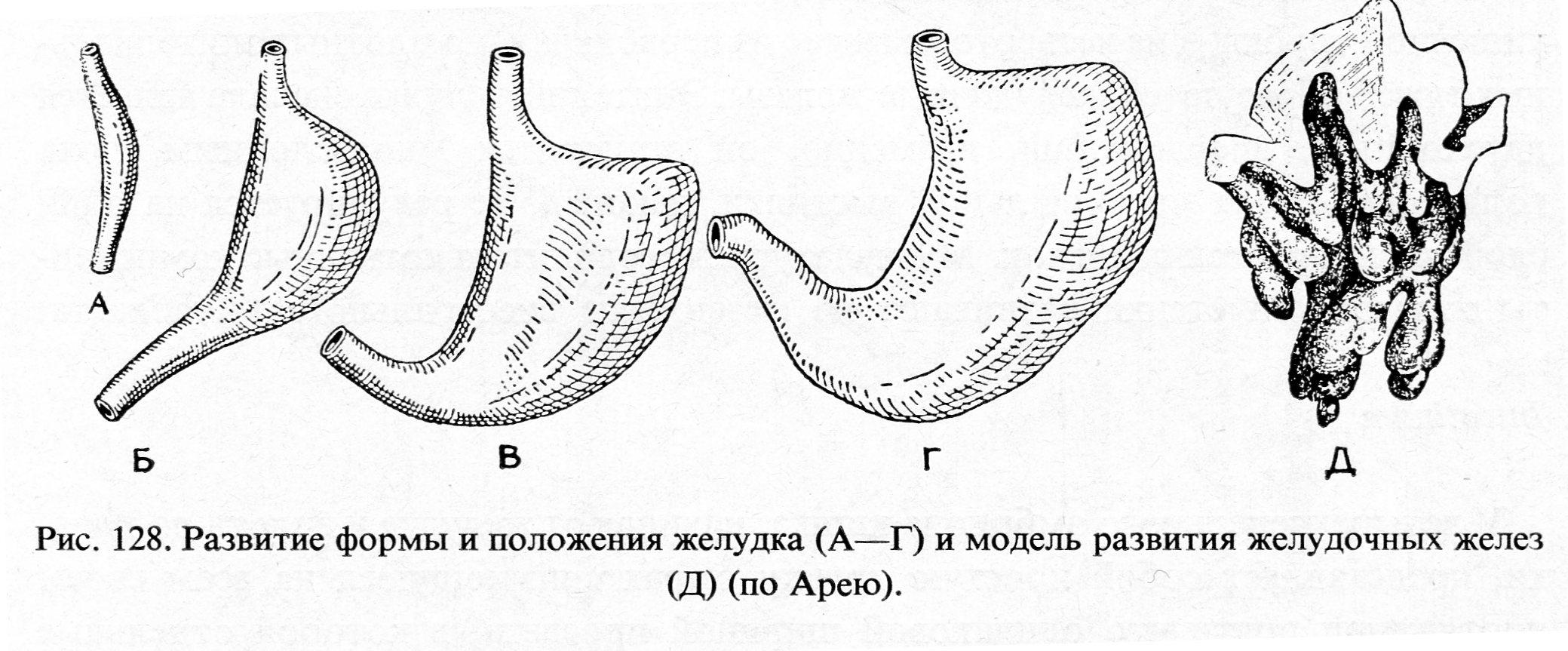 Молекулярная подпись, которую мы обнаружили, поможет нам увидеть, есть ли у пациентов изменения слизистой оболочки, связанные с наличием H. pylori”. Ученые считают, что малоинвазивный анализ крови позволит принимать решение о назначении эндоскопического исследования.Кроме того, авторы надеются, что полученные ими новые данные помогут ответить на вопрос, почему рак желудка так трудно поддается лечению, и разработать новые терапевтические методы.
Молекулярная подпись, которую мы обнаружили, поможет нам увидеть, есть ли у пациентов изменения слизистой оболочки, связанные с наличием H. pylori”. Ученые считают, что малоинвазивный анализ крови позволит принимать решение о назначении эндоскопического исследования.Кроме того, авторы надеются, что полученные ими новые данные помогут ответить на вопрос, почему рак желудка так трудно поддается лечению, и разработать новые терапевтические методы.
https://ria.ru/20201015/telomery-1579966380.html
https://ria.ru/20201016/koronavirus-1580034379.html
сша
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
2020
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
Новости
ru-RU
https://ria.ru/docs/about/copyright.html
https://xn--c1acbl2abdlkab1og. xn--p1ai/
xn--p1ai/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
https://cdn25.img.ria.ru/images/rsport/113418/41/1134184159_173:0:2904:2048_1920x0_80_0_0_da43f23c6c5c2d6608f58f4bcef20645.jpgРИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
сша, здоровье, рак, биология
МОСКВА, 21 окт — РИА Новости. Ученые выявили биомаркер, по которому можно предсказать риск развития рака желудка еще до появления первых симптомов. Результаты исследования опубликованы в журнале Британского общества гастроэнтерологов BMJGut.Рак желудка стоит на третьем месте по количеству смертей среди онкологических больных в мире.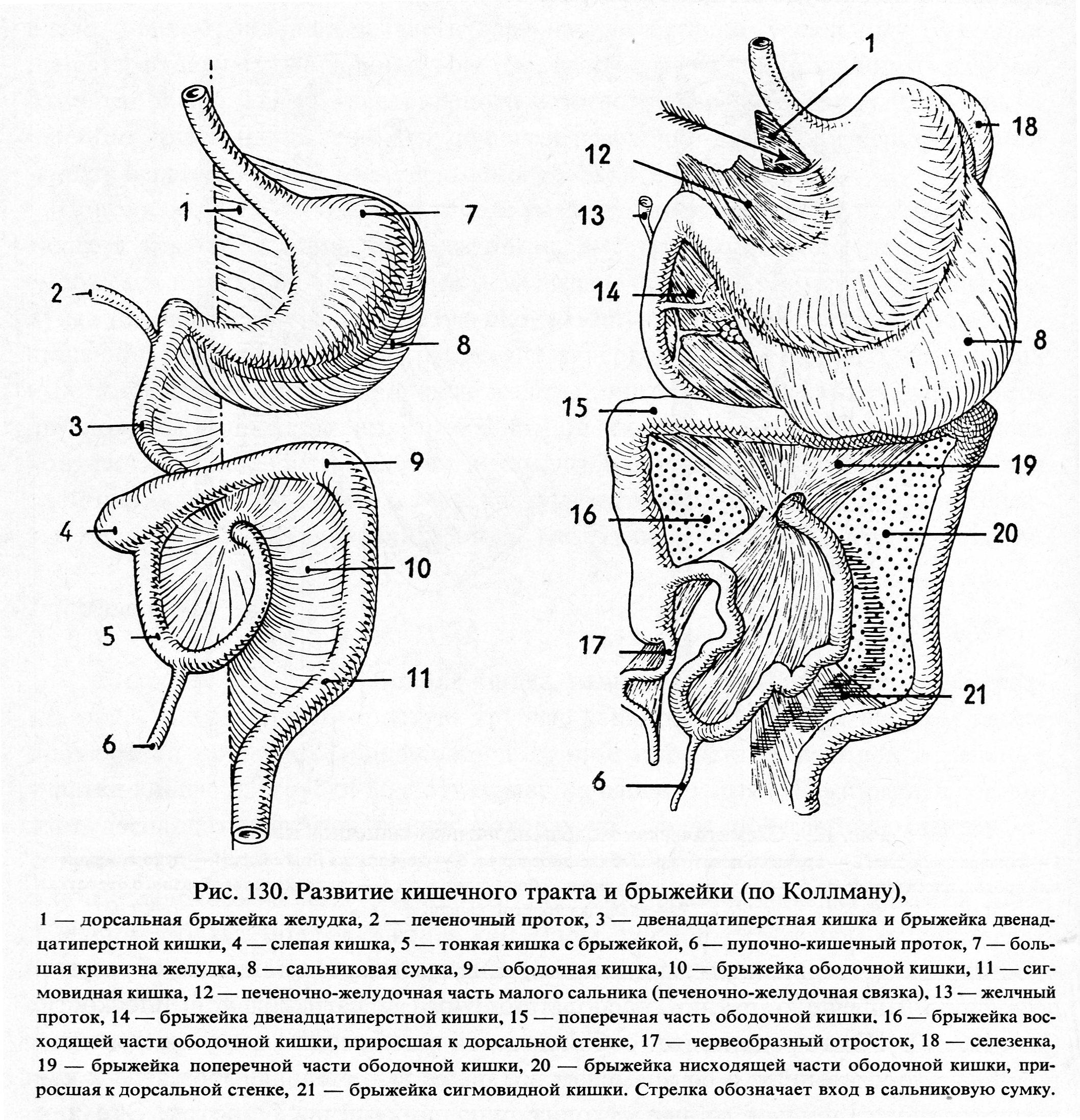 Заболевание возникает из-за неправильного питания и неблагоприятных факторов окружающей среды и часто может оставаться незамеченным вплоть до поздних стадий.
Заболевание возникает из-за неправильного питания и неблагоприятных факторов окружающей среды и часто может оставаться незамеченным вплоть до поздних стадий.
В настоящее время для диагностики болезни с помощью эндоскопической процедуры биопсии отбирают образец ткани желудка и анализируют на предмет патологии.
Биологи из США, Китая и Вьетнама нашли биомаркер, который можно обнаружить с помощью простого анализа крови. К тому же, он появляется в крови пациентов еще до начала развития опухоли. Исследователи уверены, что их открытие поможет раннему выявлению болезни и ее своевременному лечению.Биомаркер MiR130b представляет собой микроРНК, или небольшую некодирующую молекулу РНК, которая играет важную роль в регуляции экспрессии генов, влияя на развитие и прогрессирование заболевания.
MiR130b вырабатывается группой иммунных клеток, называемых миелоидными супрессорными клетками, обычно связанными с инфекциями, вызванными Helicobacter pylori — бактериями, провоцирующими язву желудка и рак.
Известно, что рак желудка может развиваться спустя долгое время после того, как инфекция H. pylori прошла, а эти микроРНК четко коррелируют с предраковыми изменениями, которые впоследствии могут привести к появлению опухоли.
“Даже если вы избавились от бактерий, зачастую инфекция уже инициировала каскад событий, которые могут привести к раку. Вот почему так важно раннее обнаружение”, — приводятся в пресс-релизе Аризонского университета слова одного из авторов статьи Яны Заврос (Yana Zavros) из Университета Цинциннати.Началось все с того, что, изучая изменения в желудке мышей, вызванные H. Pylori, исследователи обнаружили у животных маркер MiR130b, а затем ту же микроРНК идентифицировали в человеческой плазме у пациентов с предраковыми изменениями или с диагностированным раком желудка в начальной стадии.
“Это было ретроспективное исследование, — отмечает руководитель научной группы доктор Хуанита Мерчант (Juanita Merchant) из Медицинского колледжа Аризонского университета. — Но теперь мы можем начать перспективное изучение этого биомаркера на различных группах пациентов. Молекулярная подпись, которую мы обнаружили, поможет нам увидеть, есть ли у пациентов изменения слизистой оболочки, связанные с наличием H. pylori”.
— Но теперь мы можем начать перспективное изучение этого биомаркера на различных группах пациентов. Молекулярная подпись, которую мы обнаружили, поможет нам увидеть, есть ли у пациентов изменения слизистой оболочки, связанные с наличием H. pylori”.
Ученые считают, что малоинвазивный анализ крови позволит принимать решение о назначении эндоскопического исследования.
Кроме того, авторы надеются, что полученные ими новые данные помогут ответить на вопрос, почему рак желудка так трудно поддается лечению, и разработать новые терапевтические методы.
16 октября 2020, 03:00НаукаРазработан тест, предсказывающий тяжелую форму COVID-19Доброкачественные опухоли желудка – Клиника 29
Доброкачественные опухоли желудка – группа новообразований эпителиального и неэпителиального гистогенеза, исходящих из разных слоев желудочной стенки, характеризующихся медленным развитием и относительно благоприятным прогнозом. Опухоли могут проявляться болями в эпигастрии, симптомами желудочного кровотечения, тошнотой, рвотой. Основными методами диагностики доброкачественных опухолей являются рентгенография желудка и фиброгастроскопия, гистологическое исследование опухолевой ткани. Лечение доброкачественных опухолей желудка заключается в их удалении эндоскопическим методом или хирургическим путем.
Основными методами диагностики доброкачественных опухолей являются рентгенография желудка и фиброгастроскопия, гистологическое исследование опухолевой ткани. Лечение доброкачественных опухолей желудка заключается в их удалении эндоскопическим методом или хирургическим путем.
В зависимости от происхождения доброкачественные опухоли желудка разделяются на эпителиальные и неэпителиальные.
Среди эпителиальных опухолей встречаются единичные или множественные аденоматозные и гиперпластические полипы, диффузный полипоз. Полипы представляют собой опухолевидные эпителиальные выросты в просвете желудка с ножкой или широким основанием, шаровидной и овальной формы, с гладкой или грануляционной поверхностью, плотной или мягкой консистенцией. Полипы желудка чаще всего возникают у лиц мужского пола в возрасте 40-60 лет, обычно располагаются в пилороантральном отделе. Ткани полипа представлены разросшимся покровным эпителием желудка, железистыми элементами и соединительной тканью, богатой сосудами.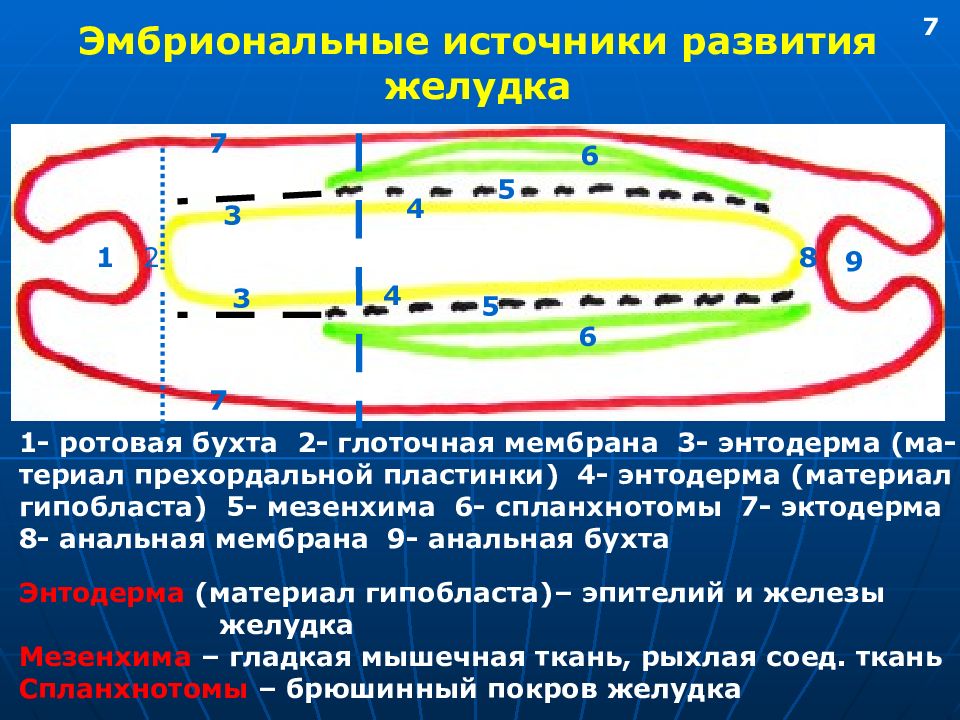
Аденоматозные полипы желудка — истинные доброкачественные опухоли из железистого эпителия состоят из папиллярных и/или тубулярных структур с выраженной клеточной дисплазией и метаплазией. Аденомы опасны в плане малигнизации и часто приводят к развитию рака желудка. До 75% доброкачественных эпителиальных опухолей желудка составляют гиперпластические (опухолеподобные) полипы, возникающие вследствие очаговой гиперплазии покровного эпителия, имеющие относительно низкий риск озлокачествления (около 3%). При диффузном полипозе желудка выявляются и гиперпластические, и аденоматозные полипы.
Редко встречающиеся неэпителиальные доброкачественные опухоли желудка формируются внутри желудочной стенки — в ее подслизистом, мышечном или подсерозном слое из различных элементов (мышечной, жировой, соединительной тканей, нервов и сосудов). К ним относятся миомы, невриномы, фибромы, липомы, лимфангиомы, гемангиомы, эндотелиомы и их смешанные варианты. Также в желудке могут наблюдаться дермоиды, остеомы, хондромы, гамартомы и гетеротопии из тканей поджелудочной железы, дуоденальных желез.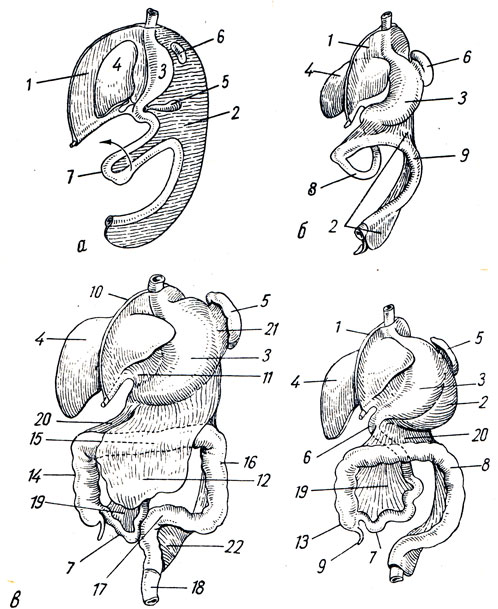 Неэпителиальные доброкачественные опухоли желудка чаще возникают у женщин и иногда могут достигать значительных размеров. Они имеют четкие контуры, обычно округлую форму, гладкую поверхность.
Неэпителиальные доброкачественные опухоли желудка чаще возникают у женщин и иногда могут достигать значительных размеров. Они имеют четкие контуры, обычно округлую форму, гладкую поверхность.
Причины развития доброкачественных опухолей желудка окончательно не выяснены. Развитие полипов может быть связано с нарушением регенерации слизистой оболочки желудка, дискоординацией процессов пролиферации и дифференцировки ее клеток при хроническом гастрите. Аденомы желудка возникают на фоне атрофического гастрита в результате перестройки желез и покровного эпителия, появления кишечной метаплазии. Гиперпластические полипы развиваются при нарушении обновления и увеличения продолжительности жизни клеток, из-за избыточной регенерации покровно-ямочного эпителия.
Источником неэпителиальных доброкачественных опухолей желудка может быть гетеротопированная эмбриональная ткань, сохранившаяся в слизистой оболочке при нарушении внутриутробного развития.
Симптомы доброкачественных опухолей желудка
В половине случаев полипы желудка протекают без клинических проявлений. Симптомы полипов желудка в основном определяются фоновым заболеванием (хроническим гастритом) и осложнениями (изъязвлением верхушки полипа, кровотечением, пролапсом полипа в двенадцатиперстную кишку и непроходимостью привратника).Боли при полипах желудка обусловлены воспалительным процессом в окружающей его слизистой оболочке, локализуются в эпигастральной области и имеют тупой, ноющий характер. Сначала они возникают после приема пищи, затем становятся постоянными. Могут наблюдаться жалобы на горечь во рту, тошноту и отрыжку.
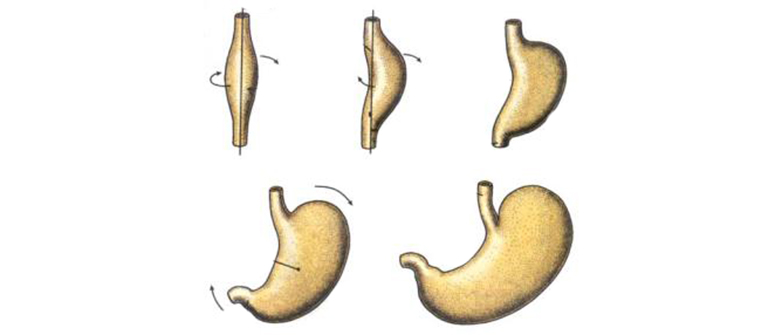
Клинические признаки неэпителиальных доброкачественных опухолей желудка зависят от их локализации, характера и скорости роста, наличия изъязвления поверхности. Чаще всего неэпителиальные опухоли желудка сопровождаются кратковременными и постоянными болями, возникающими натощак, после приема пищи, при изменении положения тела. При невриномах болевой синдром сильный, жгучего характера. Изъязвление опухоли (особенно, гемангиомы) может вызывать скрытые или обильные желудочные кровотечения с угрозой для жизни больного.
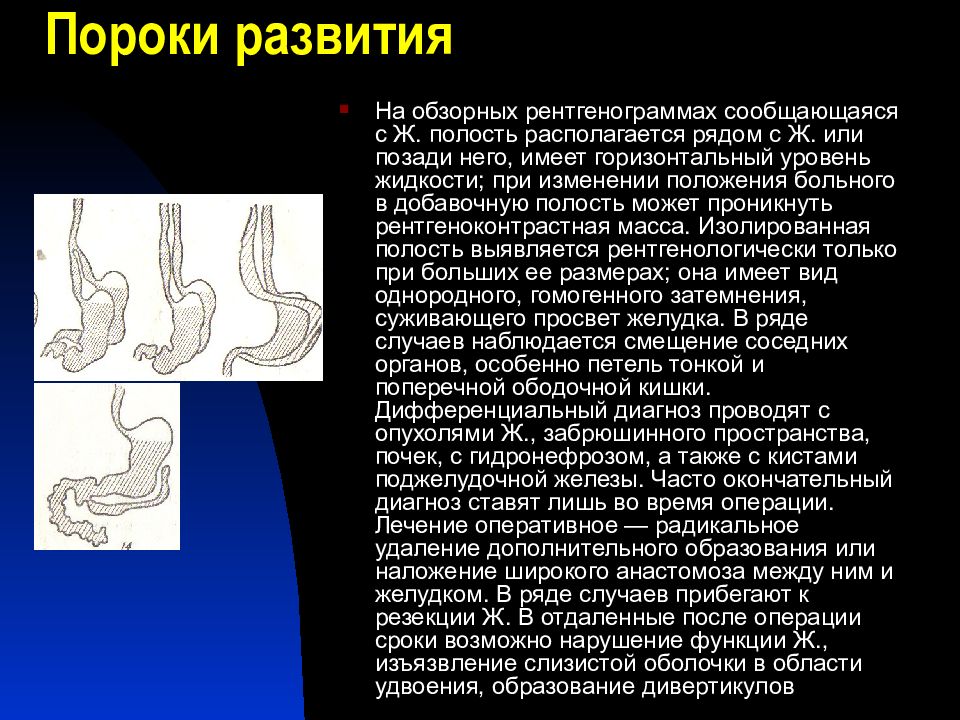
При большом размере опухоли могут пальпироваться через переднюю брюшную стенку. Доброкачественные неэпителиальные опухоли желудка могут осложняться перитонитом при некрозе новообразований; острой или хронической непроходимостью привратника в случае ущемления в нем опухоли и ее злокачественным перерождением.
Диагностика доброкачественных опухолей желудка
Диагностировать опухоли желудка позволяют данные анамнеза, рентгенологического и эндоскопического исследований.На наличие полипов при рентгенографии желудка может указывать дефект наполнения, повторяющий очертания опухоли: четкие, ровные контуры, круглую или овальную форму, его смещаемость при наличии ножки или неподвижность – при полипе с широким основанием.
В случае полипоза желудка выявляют большое число разных по величине дефектов наполнения. Перистальтика стенок желудка при этом сохраняется. Признаки отсутствия перистальтики, увеличение размера, изменение формы, появление нечеткости контуров дефекта наполнения при динамическом наблюдении могут говорить о малигнизации полипа.
Диагноз уточняется при фиброгастродуоденоскопии (ФГДС), которая позволяет провести визуальный осмотр состояния слизистой оболочки желудка, распознавание и дифференциацию полипов от других заболеваний. Визуальная дифференциация доброкачественного полипа от малигнизированного затруднена. Обычно об озлокачествлении могут свидетельствовать наличие полипа размером более 2 см, с бугристой дольчатой поверхностью, неправильными изъеденными контурами. Для точного определения характера полипа во время ФГДС выполняется биопсия подозрительных участков с морфологическим исследованием биоптатов.
Диагноз неэпителиальной доброкачественной опухоли желудка в большинстве случаев можно установить только после операции и морфологического исследования данного новообразования. Наличие клинических проявлений (например, кровотечения) указывает на возможность опухолевого процесса. ФГДС более информативна при эндогастральном росте неэпителиальных опухолей желудка. При интрамурально или экзогастрально расположенных опухолях при эндоскопическом исследовании определяется сдавление желудка извне.
Рентгенография желудка при неэпителиальных доброкачественных опухолях помогает обнаружить округлые или неправильные контуры дефекта наполнения с сохранением перистальтики и складок на подслизистом слое; экзогастральный рост новообразования с оттягиванием стенки желудка; изъязвление с образованием ниши на верхушке опухоли и др. Для обнаружения экзогастральных опухолей желудка могут быть использованы УЗИ и КТ брюшной полости.
Лечение доброкачественных опухолей желудка
Лечение доброкачественных опухолей желудка — только хирургическое; метод оперативного вмешательства зависит от вида, характера опухоли и ее локализации.В отсутствии надежных критериев малигнизации доброкачественных опухолей желудка, необходимо проводить удаление всех выявленных новообразований.
Основными методами удаления доброкачественных опухолей желудка в настоящее время являются малоинвазивная эндоскопическая электроэксцизия (или электрокоагуляция), энуклеация, резекция желудка, редко – гастрэктомия.

Эндоскопическая полипэктомия проводится при небольших одиночных полипах, локализующихся в различных отделах желудка: при размере менее 0,5 см — прижиганием с помощью точечного коагулятора, при размере от 0,5 до 3 см — методом электроэксцизии.
При крупных одиночных полипах желудка на широком основании выполняют хирургическую полипэктомию (иссечение в пределах слизистой оболочки или со всеми слоями стенки желудка) с предварительной гастротомией и ревизией желудка.
Во время удаления неэпителиальных опухолей желудка проводится срочное гистологическое исследование опухолевых тканей. Небольшие доброкачественные новообразования, растущие в направлении просвета желудка, удаляют эндоскопически; инкапсулированные опухоли вылущивают методом энуклеации.
 Большие, труднодоступные эндо- и экзогастральные доброкачественные опухоли желудка удаляют методом клиновидной или парциальной резекции, при подозрении на малигнизацию — резекцию производят с соблюдением онкологических принципов.
Большие, труднодоступные эндо- и экзогастральные доброкачественные опухоли желудка удаляют методом клиновидной или парциальной резекции, при подозрении на малигнизацию — резекцию производят с соблюдением онкологических принципов.Гастроскопия желудка у ребенка – статьи о здоровье
Оглавление
Гастроскопия желудка является востребованным методом диагностики. Обследование заключается в последовательном визуальном осмотре слизистых поверхностей различных структур верхнего отдела ЖКТ (желудочно-кишечного тракта). Для проведения процедуры применяется современная оптоволоконная оптика. Современные гастроскопы представляют собой гибкие трубки, дистальный конец которых поддается простому управлению.
Инновационная техника делает обследование не только максимально точным и эффективным, но и безопасным. Для обеспечения комфорта гастроскопия у ребенка может проводиться в состоянии медикаментозного сна (под наркозом). Этот метод не наносит вреда здоровью даже самых маленьких пациентов, но позволяет обнаружить целый ряд заболеваний на ранних стадиях.
Для обеспечения комфорта гастроскопия у ребенка может проводиться в состоянии медикаментозного сна (под наркозом). Этот метод не наносит вреда здоровью даже самых маленьких пациентов, но позволяет обнаружить целый ряд заболеваний на ранних стадиях.
В клинике МЕДСИ в Перми гастроскопия желудка проводится опытными специалистами с применением оборудования экспертного класса. Благодаря этому врач может диагностировать широкий перечень заболеваний. Мы обеспечиваем комфорт исследования и предотвращаем возможные риски повреждений внутренних органов.
Показания к проведению
Выделяют плановые и экстренные показания к гастроскопии.
Плановые обследования проводятся при наличии симптомов заболеваний для постановки диагноза и с целью наблюдения за развитием патологий, диагностированных ранее.
Гастроскопия назначается при:
- регулярных болях в животе
- пороках развития желудочно-кишечного тракта
- срыгивании пищи или невозможности ее употребления при систематической рвоте
- подозрениях на заболевания поджелудочной железы и желчевыводящих путей
Также обследование назначается при задержке развития, которая обусловлена недостаточной прибавкой в весе или снижением массы тела. Кроме того, диагностику проводят при подозрениях на наличие новообразований в желудке, пищеводе и двенадцатиперстной кишке.
Кроме того, диагностику проводят при подозрениях на наличие новообразований в желудке, пищеводе и двенадцатиперстной кишке.
В экстренном порядке гастроскопия у ребенка проводится при:
- острых желудочных кровотечениях
- пороках развития пищевода
- признаках острой кишечной непроходимости
- наличии посторонних предметов в желудке
Важно! Решение о выполнении обследования принимает врач. При этом он ориентируется на индивидуальные особенности пациента и его текущее состояние, имеющиеся заболевания, симптомы и иные факторы.
Во время гастроскопии можно выявить следующие патологические состояния и заболевания:
- воспалительные процессы в желудке, двенадцатиперстной кишке и пищеводе
- варикоз вен пищевода
- гастроэзофагеальный рефлюкс
- грыжу пищевода
- врожденные аномалии
- пилороспазм
- опухолевые образования и др.

Как подготовиться?
Гастроскопия у ребенка проводится натощак. Поэтому детям запрещено употреблять пищу за 8-12 часов до обследования. Ограничивается и прием жидкостей.
При необходимости могут отменяться некоторые препараты, которые принимаются ребенком. Вопросы, связанные с лекарственной терапией, следует заранее обсудить с гастроэнтерологом.
Если ребенок страдает хроническими заболеваниями, при подготовке к гастроскопии может потребоваться консультация специалистов узкого профиля. Гастроэнтеролог может направить к кардиологу, неврологу, отоларингологу и другим врачам.
Так как процедура является неприятной, важно правильно настроить на нее ребенка. Для этого родителям и врачу важно обсудить с малышом все тонкости выполнения гастроскопии. Даже если обследование будет выполняться в состоянии медикаментозного сна, следует заранее рассказать о том, зачем оно нужно и как будет проходить.
Как проходит обследование?
Во время гастроскопии ребенок располагается на левом боку. Введение гибкого зонда обеспечивается под визуальным контролем. Ребенок делает глотательное движение. Это позволяет раскрыть нижний сфинктер глотки и поместить прибор в пищевод. Для облегчения прохождения гастроскопа под небольшим давлением дополнительно подают воздух. Он раздувает полости пищевода и желудка. Врач поэтапно осматривает внутренние структуры. По окончании процедуры гастроскоп удаляют. Некоторое время ребенок находится под наблюдением специалистов. Особенно важно вести наблюдение за пациентом в том случае, если диагностика выполнялась с применением седативных препаратов и наркоза.
Введение гибкого зонда обеспечивается под визуальным контролем. Ребенок делает глотательное движение. Это позволяет раскрыть нижний сфинктер глотки и поместить прибор в пищевод. Для облегчения прохождения гастроскопа под небольшим давлением дополнительно подают воздух. Он раздувает полости пищевода и желудка. Врач поэтапно осматривает внутренние структуры. По окончании процедуры гастроскоп удаляют. Некоторое время ребенок находится под наблюдением специалистов. Особенно важно вести наблюдение за пациентом в том случае, если диагностика выполнялась с применением седативных препаратов и наркоза.
Как правило, процедура проводится в течение 20-30 минут. При грамотном и аккуратном выполнении она хорошо переносится и не приводит к осложнениям и возникновению побочных эффектов.
Противопоказания
Гастроскопия желудка является серьезным эндоскопическим вмешательством. Специалисты учитывают, что тонкая слизистая поверхность внутренних органов у детей богата сосудами. К особенностям строения верхних отделов ЖКТ у маленьких пациентов относится недостаточно широкий пищевод. Все это повышает риски травмирования и увеличивает вероятность перфорации стенки пищевода и желудка. Даже при небольших повреждениях возможно развитие кровотечения и занесение инфекции.
К особенностям строения верхних отделов ЖКТ у маленьких пациентов относится недостаточно широкий пищевод. Все это повышает риски травмирования и увеличивает вероятность перфорации стенки пищевода и желудка. Даже при небольших повреждениях возможно развитие кровотечения и занесение инфекции.
Поэтому обследование всегда должно проводиться максимально аккуратно и только после исключения всех противопоказаний, к которым относят:
- нарушения свертываемости крови
- патологии сердечно-сосудистой системы
- легочную недостаточность
- бронхиальную астму
- геморрагический диатез
Отложить обследование следует при общем плохом самочувствии ребенка. Также перенести гастроскопию необходимо при воспалительных заболеваниях легких и ЛОР-органов.
Обо всех противопоказаниях расскажет врач. Он же определит целесообразность выполнения процедуры.
Преимущества обращения в МЕДСИ
- Опытные врачи-эндоскописты.
 Наши специалисты регулярно проходят обучение и повышают квалификацию. Врачи владеют методиками и техниками проведения эндоскопических исследований, что позволяет достигать их высокой точности и эффективности. Специалисты выявляют даже скрытые патологии
Наши специалисты регулярно проходят обучение и повышают квалификацию. Врачи владеют методиками и техниками проведения эндоскопических исследований, что позволяет достигать их высокой точности и эффективности. Специалисты выявляют даже скрытые патологии - Современное оборудование. Эндоскопические исследования проводятся на новом видеоэндоскопическом комплексе Olympus EVIS EXERA III с эффектом сканирования тканей. Специалисты могут выявлять любые изменения в состоянии органов на ранних стадиях. Современная техника обеспечивает высокую точность и четкость получаемых изображений
- Возможности проведения биопсии. Для процедуры применяется специальный одноразовый стерильный инструмент
- Возможности проведения исследований в состоянии медикаментозного сна. Нами используются эффективные, но безопасные препараты. Благодаря этому сразу же после выполнения гастроскопии у ребенка можно отправиться домой
- Возможности для обследования большого количества органов и полостей.
 Мы проводим диагностику пищевода, желудка, двенадцатиперстной кишки. При необходимости выполняются и другие обследования. Комплексная диагностика позволяет быстро поставить диагноз и назначить необходимое лечение
Мы проводим диагностику пищевода, желудка, двенадцатиперстной кишки. При необходимости выполняются и другие обследования. Комплексная диагностика позволяет быстро поставить диагноз и назначить необходимое лечение - Быстрое назначение адекватной терапии. Сразу же после прохождения обследования, без длительного ожидания и очередей вы можете записаться на прием к гастроэнтерологу
Если вы планируете пройти гастроскопию желудка, уточнить ее цену в нашей клинике в Перми, позвоните по номеру +7 (342) 215-06-30 Наш специалист ответит на все вопросы и запишет на прием в удобное время.
4 февраля – Всемирный день борьбы со злокачественными заболеваниями
Актуальность проблемы онкозаболеваний становиться более понятной при анализе показателей смертности. Так в РФ ежегодно умирает около 2 млн. человек. На 1-м месте причиной смерти являются сердечно-сосудистые заболевания, а на втором- злокачественные опухоли. Все остальные причины остались далеко позади.
Есть 5 стран-лидеров на которые приходится 40% всех случаев рака желудка в мире. Это Япония, Корея, Китай, Чили и, к сожалению, Россия. У нас ежегодно регистрируется 40 тысяч новых случаев рака желудка (РЖ). Безусловным лидером является Япония, где заболеваемость в 2 раза превышает наши показатели.
Странами с низкой заболеваемостью являются США, Австралия, Новая Зеландия. Так в США ежегодно регистрируется в 2 раза меньше новых больных, чем в России, хотя численность населения в 2.5 раза больше, чем у нас.
В России самый высокий показатель заболеваемости РЖ приходится на наших соседей -Новгородскую область – и Республику Тува, минимальные показатели – в регионах Северного Кавказа, Магаданской области и Чукотке.
В Санкт-Петербурге в настоящее время под наблюдением врачей находится около 125 тысяч онкобольных, причем каждый год регистрируется 25 тысяч новых случаев злокачественных новообразований. Так вот среди мужчин РЖ держит уверенное 3-е место. Надо сказать, что и по мировой статистике мужчины болеют в 2 раза чаще, чем женщины.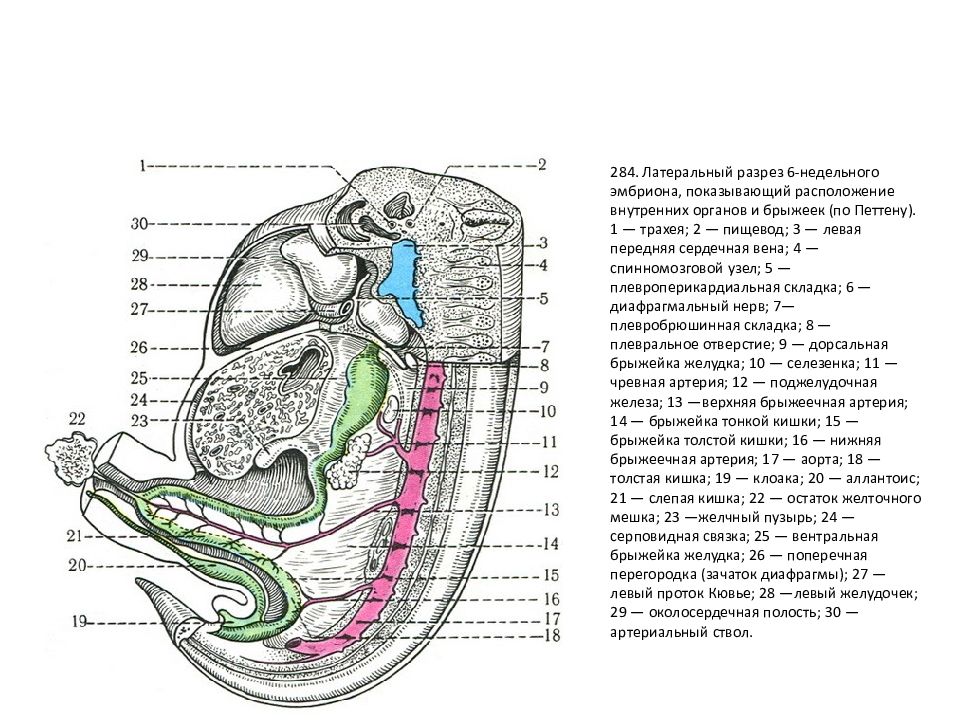
Причина смертности
К сожалению, по уровню смертности от РЖ Россия в ранжированном ряду 45 стран занимает 2 место (у мужчин) и 3 место (у женщин).
Самая высокая выживаемость в мире зарегистрирована в Японии – 53%, в других странах она не выше 15-20%. Это связано с тем, что доля рано выявленного РЖ в Японии наивысшая и составляет половину всех случаев, тогда как в Европе, США и других странах – не более 20%.
Эти факты позволили предположить , что РЖ у японцев является принципиально отличным от РЖ у европейцев, однако дальнейшие исследования в молекулярной биологии показали, что это не так, а успехам в улучшении выживаемости Япония обязана массовому скринингу населения и принятым национальным программам по борьбе с раком.
Особенности питания и факторы окружающей среды
Исследования по сравнению регионов с высокой и низкой заболеваемостью раком желудка выявили взаимосвязь между особенностями питания и РЖ.
Так, преобладание в пище сложных углеводов (картофель, хлеб, мучные продукты что характерно для России), риса (страны Азии, Япония) ассоциировано со сниженным потреблением витамина С и свежих овощей и фруктов, содержащих аскорбиновую кислоту. Повышенное потребление соли, маринованных, пережаренных, копченых продуктов, острой пищи также повышает риск развития РЖ.
Так, национальное корейское блюдо кимчи (разновидность квашеной капусты), содержащее в больших количествах соль и нитраты, было признано одной из причин развития РЖ в Корее.
Потребление большого количества соленого чая в Кашмире (Северный Пакистан) может быть основным фактором развития рака желудка и пищевода в этом регионе.
В 2,5 раза выше риск заболеть РЖ у ежедневно употребляющих животное масло по сравнению с лицами, предпочитающими растительное масло.
Повышенное потребление алкоголя, особенно водки, повышает риск развития РЖ. В исследовании, проведенном в Польше, относительный риск развития рака желудка был значительно повышен у мужчин, которые пили водку натощак.
В июне 2002 года Международное Агентство по изучению рака пришло к выводу, что имеется достаточно данных для подтверждения связи курения и РЖ.
Нитраты и нитриты при продолжительном воздействии также обладают канцерогенным эффектом. Основным источником их поступления в организм человека являются овощи, выращенные с использованием минеральных удобрений, вяленые и копченые продукты, алкоголь, специи.
О влиянии продуктов питания на развитие РЖ убедительно указывает следующий факт. Так, у иммигрантов США японского происхождения, принявших западный образ жизни (и соответственно, питания) заболеваемость РЖ снизилась в 2 раза, особенно во 2-м и последующих поколениях.
Применение замораживания (а не маринование, консервирование, копчение) и использование холодильников для сохранения пищевых продуктов также считается фактором, повлиявшим на снижение заболевания РЖ в развитых странах, в частности, в США, где РЖ в 30-е годы занимал первое место в структуре заболеваемости.
Защитным эффектом обладают фрукты и овощи за счет содержания аскорбиновой кислоты, токоферола, b-каротина.
Имеются сообщения о противоопухолевом эффекте зеленого чая, полифенолы которого содержат вещество, подавляющее выработку интерлейкина-8. Представляет интерес информация о низкой заболеваемости РЖ в некоторых регионах Юго-Восточной Азии и Китая, население которых занимается выращиванием и продажей чеснока.
Примечательно, что в связи с улучшением рациона питания отмечено снижение заболеваемостью раком желудка во всем мире. Так, только в нашем городе за 20 лет отмечено снижение на 42%, однако результаты лечения и цифры выживаемости продолжают удручать.
Инфекционный фактор
Ведущий фактор развития язвенной болезни желудка напрямую связан с появлением онкологии. Имя ему: Хеликобактер Пилори.
В 1983 году был открыт микроорганизм, живущий в слизистой оболочке желудка (Helicobacter pylori (HP), который был признан одним из ведущих факторов в развитии язвенной болезни. Впоследствии Международным Агентством по изучению рака HP признан канцерогеном первого порядка, то есть его связь с развитием РЖ считается доказанной.
Впоследствии Международным Агентством по изучению рака HP признан канцерогеном первого порядка, то есть его связь с развитием РЖ считается доказанной.
Сейчас хорошо разработаны схемы эрадикационной терапии данного микроба, есть эффективные препараты. Остается дело за малым: выполнить гастроскопию и пройти тест на НР, что доступно для каждого пациента.
В последнее время появились сообщения о вакцинации детей против хеликобактерной инфекции, что является эффективной мерой профилактики язвенной болезни и рака желудка.
Генетические факторы
Роль генетического фактора в развитии РЖ была заподозрена в связи с тем, что у лиц с группой крови A(II) заболеваемость выше на 20%, чем у лиц с другой группой крови.
И действительно, был выявлен мутантный ген, наличие которого резко повышает вероятность развития РЖ.
Наглядным примером внедрения генной диагностики в клиническую практику могут служить случаи «профилактических» операций на желудке в семьях у родственников больных РЖ, носителей мутантного гена. Несмотря на отрицательные данные гастроскопий в подавляющем большинстве случаев в удаленных образцах находили перстневидноклеточный рак.
Несмотря на отрицательные данные гастроскопий в подавляющем большинстве случаев в удаленных образцах находили перстневидноклеточный рак.
Поэтому, люди, имеющие заболевших раком желудка родственников 1-й или 2-й линии находятся в группе риска по развитию данного заболевания.
Фоновые и предраковые заболевания желудка
В большинстве случаев РЖ развивается на фоне длительно существующих предопухолевых состояний слизистой. Фоновыми заболеваниями считаются: хронический атрофический гастрит, аденоматозные полипы, гиперпластический гигантоскладочный гастрит.
Наибольшему риску развития РЖ подвержены пациенты, заболевшие атрофическим гастритом в молодом возрасте.
Самой частой и трагической ошибкой, встречающейся в клинической практике, является привыкание как пациента, так и лечащего врача к, казалось бы, безобидному диагнозу «гастрит». Со временем пациенты перестают обращаться к врачу, отказываются от ежегодной гастроскопии, принимают медикаменты «от боли в желудке». Появление новых симптомов или нарастание привычных расценивается пациентами и врачами, как обострение, назначается диета и т.д.
Появление новых симптомов или нарастание привычных расценивается пациентами и врачами, как обострение, назначается диета и т.д.
Полипы желудка также имеют повышенный риск озлокачествления. Считается, что полипы, размеры которых превышают 2 см, малигнизируются в 50% случаев. Необходимо помнить, что наличие полипов в желудке является одним из проявлений фамильного полипоза и в таких случаях требуется толстой кишки (колоноскопия).
Рак желудка – вопросы и ответы
Эта статья дает ответы на наиболее часто встречающиеся вопросы пациентов, страдающих или
страдавших раком желудка, и их близких.
На приеме у врача не всегда есть возможность эти
вопросы задать и, тем более, получить подробный ответ. Надеюсь, что данная публикация
окажется полезной, как для пациентов, так и для врачей.
Европейский кодекс против рака.
«… Если обращать внимание на эти “Десять европейских правил” и руководствоваться ими в
повседневной жизни, то можно уменьшить число смертей от рака в Европе на 15%. »
»
… из “Руководства по борьбе с раком” Европейского сообщества.
Определенных онкологических заболеваний можно избежать, если:
1. Не курить! Курящие должны как можно скорее победить эту вредную привычку и в
дальнейшем избегать находиться в помещениях, где курят.
2. Уменьшите Ваше потребление алкоголя: пиво, вино, крепкие спиртные напитки
3. Избегайте сильного солнечного облучения!
4. Обращайте внимание на меры безопасности на Вашем рабочем месте, если Вы
используете, производите или имеете контакт с вызывающими онкозаболевания веществами
или материалами.
Ваше общее состояние здоровья зависит от следующих двух советов, которые снижают риск
большинства онкозаболеваний:
5. Чаще употребляйте в пищу свежие фрукты и овощи, а также продукты растительного
происхождения с высоким содержанием волокон.
6. Избегайте лишнего веса, ограничивайте себя в приеме продуктов с богатым
содержанием жира.
Все больше онкологических заболеваний можно вылечить, если распознать их на
ранней стадии.
7. Обращайтесь к врачу, если Вы обнаружили у себя необычные припухлости,
изменения родимых пятен на коже или несвойственное Вам кровотечение.
8. Обращайтесь к врачу, если Вы длительное время жалуетесь на хронический кашель,
осиплость голоса, продолжающиеся и обращающие на себя внимание изменения в
пищеварении или непонятная потеря веса.
9. Один раз в год проходите исследование по раннему выявлению онкологических
заболеваний.
Для женщин:
10. Регулярно обследуйте Вашу грудь; если Вы старше 40 лет, проходите маммографическое
исследование в определенные назначенные Вашим врачом промежутки времени.
Вопросы, касающиеся природы и течения заболевания.
1. Сколько пациентов, больных карциномой желудка, имеется в Республике Беларусь?
Карцинома желудка является четвертым (третьим) по частоте встречаемости онкологическим
заболеванием у мужчин после карциномы легкого, карциномы простаты и опухолей кожи. У
женщин рак желудка занимает также четвертую позицию после карциномы молочной железы,
рака толстой кишки и рака кожи. Можно считать, что в Республике Беларусь ежегодно
Можно считать, что в Республике Беларусь ежегодно
выявляется около ………………………… вновь заболевших пациентов.
2. Я слышал, что заболеваемость раком желудка в республике выросла (снизилась). Правда
ли это?
Раньше рак желудка был самым распространенным онкологическим заболеванием во всем
мире. Сегодня можно констатировать снижение заболеваемости повсеместно, особенно в
развитых индустриальных странах. Значительное снижение заболеваемости раком желудка
касается, однако, карциному, расположенную в средней и нижней трети тела желудка. Число
заболевших карциномой, локализующейся в верхней трети желудка, наоборот, скорее
2
увеличилось. В настоящее время насчитывается значительно больше пациентов с раком груди,
раком предстательной железы или раком толстой кишки. Такое положение вещей не связано с
тем, что число злокачественных опухолей других локализаций по сравнению с карциномой
желудка абсолютно выросло. На практике регистрируется действительное снижение
заболеваемости раком желудка. И лишь в некоторых дальневосточных странах карцинома
И лишь в некоторых дальневосточных странах карцинома
желудка является еще наиболее часто встречающейся опухолью.
3. Можно ли назвать некоторые причины, почему раньше риск рака желудка был значительно
выше, а также почему сегодня еще есть регионы, например, дальневосточная Азия, где
люди болеют им значительно чаще?
Существуют лишь предположения, что за это ответственны прежде всего сложившиеся со
временем местные традиции в питании. Если сравнить по привычкам питания регионы с
высоким уровнем заболеваемости раком желудка и регионы с низким уровнем заболеваемости,
то в глаза бросаются некоторые характерные особенности. В регионах с повышенным риском
заболеть раком желудка традиционно употребляют пищу с:
Малым количеством животных жиров и белков
Много комплексных углеводов
Относительно высоким содержанием белка растительного происхождения, в основном
зернового
Мало салатов и свежих овощей в виде листьев
Мало свежих фруктов, особенно цитрусовых
Богатым содержанием соли
Высоким содержанием нитратов
Особенно потребление большого количества соли, а также копченых продуктов называют все
чаще основной причиной такого положения дел. Ведь известно, что богатая солью пища
Ведь известно, что богатая солью пища
благоприятствует развитию хронического воспаления слизистой оболочки желудка –
атрофическому гастриту. Это в свою очередь ведет к усиленному росту в желудке образующих
нитрит бактерий, которые продуцируют нитрозамины. Эти вещества являются – это известно из
опытов над животными – особенно канцерогенными. Так азиаты, особенно японцы, едят все
очень соленое, а потребление нитратов у них почти в четыре раза выше, чем у европейцев.
Эти можно объяснить, что в этих регионах мира карцинома желудка имеет значительно более
высокое распространение.
В западных индустриально развитых странах произошло значительное изменение привычек
питания. Сегодня в этих странах потребляются чаще сахар, жиры и молочные продукты, и в
целом питание стало также более богатым витаминами.
Витамины, в особенности витамин С, должны защищать от карциномы желудка.
В прошлом – до того времени, когда появились холодильники и морозильники и существовали
лишь естественные способы консервирования – имело место подобное более частое
употребление в пищу копченостей, копченой на дыму рыбы или жареного на костре мяса, т.е.
продуктов, содержащих высокие концентрации канцерогенных нитрозаминов. Так как пища,
подвергшаяся копчению, и копченая на дыму рыба, сегодня все еще представлены в
ежедневном рационе восточной Азии, считается, что эти продукты являются одной из причин
большого числа случаев рака желудка в этих регионах.
4. Почему карцинома желудка так редко встречается у детей и подростков?
Преобладают внешние влияния, приводящие к заболеванию раком. Они должны очень долгое
время оказывать свое патологическое влияние. По научным оценкам – минимум 20-40 лет. Если
же рак желудка встречается у молодых людей, то ответственными за его возникновение
считают скорее врожденные, чем приобретенные факторы.
Впрочем, злокачественные опухоли желудка бывают также и у детей. Но тогда речь идет чаще
всего о злокачественном разрастании имеющейся в желудке лимфатической ткани или о
саркоме. Причинами этих злокачественных опухолей желудка являются совсем другие
факторы, чем при карциноме желудка.
5. У моего отца и брата моего дедушки тоже был рак желудка. Передается ли рак желудка по
наследству? Заболеют ли мои дети раком желудка?
3
Рак желудка не передается по наследству, хотя определенная семейная предрасположенность
к этому заболеванию, вероятно, существует. В Европе исходят из того, что риск карциномы
желудка в 3,7 раза выше, если кто-то из Ваших родственников первой степени страдал этим
заболеванием.
Большие эпидемиологические исследования показали, что люди с группой крови А (II)
статистически чаще болеют раком желудка, чем имеющие группу крови В (III) или 0 (I). В
целом исходят из того, что 90 % всех карцином желудка – это следствие влияния факторов
окружающей среды, и лишь максимум 10% приходится на генетическую предрасположенность.
6. Какие существуют другие факторы риска наряду с генетической склонностью к
заболеванию карциномой желудка?
К самым известным факторам риска относят особую форму малокровия (пернициозную
анемию), особый вид хронического воспаления слизистой оболочки желудка (атрофический
гастрит), определенные типы полипов желудка и изменения слизистой оболочки желудка. (см.
таблицу)
Таблица: Эндогенные и экзогенные заболевания и факторы риска для развития в будущем
карциномы желудка
Пернициозная анемия
Болезнь Менетрие (гипертрофический гастрит)
Полипы желудка
Атрофический гастрит
Семейная предрасположенность у людей группы крови А (II) для диффузного типа
карциномы
Синдром Пейтца-Йегерса
Бывшие дети и подростки, лечившиеся ранее по поводу лимфомы
Значительное потребление копченостей, вяленого и повареной соли
Резецированный желудок более чем 15 лет назад
Дисплазия слизистой желудка высокой степени
7. Я слышал утверждение, что снижение заболеваемости раком желудка произошло
одновременно с распространением холодильников. Как это понимать? Может ли
употребление охлажденной пищи защитить от рака желудка?
Это утверждение следует критически прокоментировать. За достоверность этой гипотезы
говорит то, что снижение заболеваемости раком желудка происходило параллельно появлению
в повседневной жизни людей замороженных продуктов питания, уменьшенному потреблению
копченой и инфицированной плесень образующими грибами пищи. Питание сегодня является
более свежим и содержит большее количество «защищающего от рака» витамина С. Так как
копчености сами по себе содержат особенно много нитрозаминов, а плесневые грибки
образуют канцерогенные нитрозамины, благодаря появлению замороженных продуктов
питания, отпадает тем самым очень значительный провоцирующий образование рака фактор.
Но все же замороженные продукты питания ни в коем случае не являются гарантированной
защитой, тем более не от рецидива заболевания.
8. Я слышал, богатая солью питание может увеличить риск рака желудка. Касается это так же
риска повторного заболевания? Должен я теперь есть только несоленую пищу?
Повышенный риск карциномы желудка объясняют тем, что соленая пища благоприятствует
возникновению хронического гастрита (воспаления слизистой оболочки желудка) и в конечном
итоге развитию пониженной или даже нулевой кислотности (атрофический гастрит).
Отсутствие кислоты в желудке приводит к усилению деятельности бактерий, что в свою
очередь ведет к образованию больших концентраций канцерогенных нитрзаминов.
Вам нет необходимости есть пищу вообще без соли. Но и злоупотреблять ею не стоит. Даже
если у Вас резецирован желудок, время экспозиции нитрозаминов, приводящее к
возникновению карциномы, оценивается около 15-20 лет.
9. Верно ли, что из-за недостатка витаминов развивается рак желудка?
Витамин С тормозит образование нитрозаминов. Витамин А и Е (бета-каротин) приводят к
созреванию клеток. Оба витамина тем самым имеют свойство защиты от карциномы желудка.
4
10. Какое влияние имеют нитрозамины при возникновении рака желудка?
Нитрозаминами можно в экспериментах на животных вызвать рак желудка. В научной
литературе есть многочисленные указания на то, что усиленное потребление нитратов – и
вместе с тем нитрозаминов – ведет к повышенному риску карциномы желудка.
Благодаря деятельности бактерий в желудке нитраты редуцируются в нитриты. Потом
последние могут после реакции с другими содержащими азот компонентами образовывать
канцерогенные нитрозамины. Витамин С тормозит эту реакцию в цепи.
При определенных формах хронического воспаления слизистой оболочки желудка
(атрофический гастрит) в нем находятся в большем количестве нитрит образующие бактерии.
Если же имеет место недостаток витаминов А, С и Е, то это приводит к повышенным
концентрациям нитрозаминов и, тем самым, к возможному развитию карциномы.
11. Означают ли операции на желудке в прошлом риск заболеть раком желудка?
Что касается этого вопроса, то среди ученых нет единого мнения. Ранее считалось, что
операция на желудке является одним из важнейших факторов влияющих на развитие
карциномы в резецированном желудке. Сегодня это, будучи ранее догматичным, утверждение,
поддается критическому рассмотрению.
Если оценивать в целом, то риск возникновения рака в области операционного рубца
возникает самое раннее через 15 – 20 лет. Причиной этого повышенного риска рака
рассматривается продукция или недостаточное разрушение в оперированном желудке
канцерогенных веществ. Такая точка зрения объясняла бы также и длительный период
времени в 15-20 лет, необходимый для возникновения карциномы.
12. Меня удивляет, что почти никогда не называют хроническую язвенную болезнь желудка и
12 перстной кишки в качестве фактора риска. Почему?
Злокачественное перерождение язв 12 перстной кишки само по себе очень редкое явление.
Наличие хронической язвы желудка или 12 перстной кишки длительное время не связано с
повышенным риском заболеть карциномой. Хотя как рентгенологически, так и эндоскопически
при гастроскопии карцинома желудка очень похожа на доброкачественную язву и может быть
ошибочно за нее принята. В таком случае за диагнозом «хроническая язва желудка» может
скрываться карцинома.
Исходя из этого, врачи при проведении фиброгастроскопии, принципиально берут пробу ткани
– даже из кажущейся доброкачественной язвы желудка – для микроскопического
исследования. Они настаивают на контрольном исследовании через примерно 6-8 недель, даже
если результат микроскопического исследования ткани был нормальный, а все жалобы и
симптомы исчезли.
13. Существует ли связь, зависимость между душевным состоянием и риском заболевания
раком желудка?
Не существует никаких однозначных научных выводов по этому поводу, хотя в дилетантских
кругах подобное утверждение можно часто слышать. В случаях с доброкачественными язвами
желудка и 12 перстной кишки оно в какой-то мере справедливо.
Наоборот, органические заболевания желудочно-кишечного тракта часто ведут к изменениям
душевного состояния пациента. И даже не редкость, что у пациентов со злокачественными
опухолями желудочно-кишечного тракта, изменения психического состояния могут опережать
клинические их проявления.
14. Можно ли по анализу крови своевременно распознать карциному желудка?
Нет, в настоящее время еще не существует такого рода возможности ранней диагностики этого
заболевания. В случаях т.н. указывающих на заболевание карциномой раковых тестах
(опухолевых маркерах) речь идет об очень неспецифических результатах, которые могут быть
положительны также и у здоровых людей, и при доброкачественных различных заболеваниях.
Врача эндоскопического отделения МКДЦ Дорожко М.В.
Врачи Морозовской больницы помогли новорожденному с редким пороком развития желудочно-кишечного тракта
Мальчика, которому после рождения исполнилось 17 дней, в Морозовскую детскую больницу доставила бригада Скорой медицинской помощи. Состояние ребенка врачи-неонатологи оценили как тяжелое: он срыгивал после каждого кормления, вследствие чего отмечалась патологическая потеря веса (200 грамм от рождения).
После осмотра пациента, с учетом клинических симптомов и возраста, врачи заподозрили пилоростеноз — сужение отверстия, ведущего из желудка к двенадцатиперстной кишке за счет утолщения мышечного слоя. Однако проведенные ультразвуковые исследования диагноз не подтвердили.
Для восстановления водно электролитного баланса ребенку начали внутривенно вводить специальные вещества. Это позволило стабилизировать состояние новорожденного и предотвратить патологические потери организма.
С целью дообследования малышу было проведено рентгенографическое исследование прохождения водорастворимого рентгеноконтрастного препарата по желудочно-кишечному тракту, а также осмотр пищевода, желудка и двенадцатиперстной кишки с помощью микрокамер (эзофагогастродуоденоскопия). Специалисты диагностировали мембрану пилорического отдела желудка. Анатомически она представля¬ет собой перегородку между желудком и двенадцатиперстной кишкой.
«После предоперационной подготовки ребенку выполнили лапароскопию, которая подтвердила локальное сужение, не пропускающее нагнетаемый воздух в желудок, в месте перехода антрального отдела желудка в пилорический. На задне-боковой стенке желудка была обнаружена расположенная полукольцом мембрана. Мы иссекли мембрану, наложили швы на слизистую желудка, в тощую кишку ввели зонд для кормления и ушили желудок в поперечном направлении. Операция длилась около полутора часов», — рассказал детский хирург, обладатель звания «Московский врач» Михаил Рехвиашвили.
Как отметил врач, врожденная мембрана желудка — редкая патология. Сложность диагностики заключается в отсутствии специфических симптомов, характерных для данного заболевания. Трудность хирургического лечения в том, что мембрана состоит из подслизистого и слизистого слоя (без мышц) и сокращается во время иссечения настолько, что ее непросто определить даже при непосредственном осмотре.
В послеоперационном периоде в течение четырех суток ребенок находился в реанимации. Затем врачи удалили зонд. Рентгеноконтрастное исследование подтвердило полное восстановление работы желудка.
Мальчик был переведен в неонатологическое отделение, где находился вместе с мамой. Было возобновлено грудное вскармливание. Объем кормления постепенно увеличился до физиологической нормы. Ребенок полностью усваивал питание и начал прибавлять в весе. На десятый день после хирургического вмешательства с прибавкой в весе 670 грамм (от поступления) малыша в удовлетворительном состоянии выписали домой.
Современные представления о факторах риска развития рака желудка | Хомяков
1. Torre L.A., Bray F., Siegel R.L. et al. Global cancer statistics, 2012. CA Cancer J Clin 2015; 65(2):87-108.
2. GLOBOCAN 2012: Estimated Cancer Incidence, Mortality and Prevalence Worldwide in 2012 v1.0. IARC CancerBase No. 11. Edited by Ferlay J., Soerjomataram I., Ervik M., Dikshit R., Eser S., Mathers C., Rebelo M., Parkin D.M., Forman D., Bray F. Prevalence Worldwide in 2012. IARC, Section of Cancer Surveillance (5/5/2017). http://globocan. iarc.fr/Pages/fact_sheets_population.aspx.
3. GLOBOCAN 2012: Stomach Cancer. Estimated Incidence, Mortality and Prevalence Worldwide in 2012. IARC, Section of Cancer Surveillance (5/5/2017) http://globocan.iarc. fr/Pages/fact_sheets_population.aspx.
4. Злокачественные новообразования в России в 2015 году (заболеваемость и смертность) / Под ред. А.Д. Каприна, В.В. Старинского, Г.В. Петровой. М., 2017.
5. Siewert J.R., Böttcher K., Roder J.D. et al. Prognostic relevance of systematic lymph node dissection in gastric carcinoma. German Gastric Carcinoma Study Group. Br J Surg 1993 Aug;80(8):1015-8.
6. Lauren P. The two histological main types of gastric carcinoma: diffuse and so-called intestinal-type carcinoma. An attempt at a histo-clinical classification. Acta Pathol Microbiol Scand 1965;64:31-49.
7. Correa P., Cuello C., Duque E. Carcinoma and intestinal metaplasia of the stomach in Columbian migrants. J National Cancer Institute 1970; 44: 297.
8. Correa P. Human gastric carcinogenesis: a multistep and multifactorial process – First American Cancer Society Award Lecture on Cancer Epidemiology and Prevention. Cancer Res 1992; 52:6735.
9. Henson D.E., Dittus C., Younes M. et al. Differential trends in the intestinal and diffuse types of gastric carcinoma in the United States, 1973-2000: increase in the signet ring cell type. Arch Pathol Lab Med 2004; 128:765.
10. Blot W.J., Devesa S.S., Kneller R.W. et al. Rising incidence of adenocarcinoma of the esophagus and gastric cardia. JAMA 1991; 265:1287.
11. Yashiro M., Chung Y.S., Nishimura S. et al. Establishment of two new scirrhous gastric cancer cell lines: analysis of factors associated with disseminated metastasis. Br J Cancer 1995; 72:1200.
12. Graziano F., Humar B., Guilford P. The role of the E-cadherin gene (CDh2) in diffuse gastric cancer susceptibility: from the laboratory to clinical practice. Ann Oncol 2003; 14:1705.
13. Humar B., Graziano F., Cascinu S. et al. Association of CDh2 haplotypes with susceptibility to sporadic diffuse gastric cancer. Oncogene 2002; 21:8192.
14. Caldas C., Carneiro F., Lynch H.T. et al. Familial gastric cancer: overview and guidelines for management. J Med Genet 1999; 36:873.
15. Correa P. Gastric cancer: two epidemics? Dig Dis Sci 2011; 56:1585.
16. Oliveira C., Seruca R., Carneiro F. Genetics, pathology, and clinics of familial gastric cancer. Int J Surg Pathol 2006; 14:21.
17. Yashiro M., Chung Y.S., Nishimura S. et al. Establishment of two new scirrhous gastric cancer cell lines: analysis of factors associated with disseminated metastasis. Br J Cancer 1995; 72:1200.
18. Correa P., Haenszel W., Cuello C. et al. Gastric precancerous process in a high risk population: Cross sectional studies. Cancer Res 1990; 50:4731.
19. Nakamura T., Nakano G. Histopathological classification and malignant changes in gastric polyps. J Clin Pathol 1985; 38:754.
20. Genta R.M. Acid suppression and gastric atrophy: sifting fact from fiction. Gut 1998; 43 (Suppl 1):S35.
21. Kolodziejczyk P., Yao T., Oya M. et al. Long-term follow-up study of patients with gastric adenomas with malignant transformation. An immunohistochemical and histochemical analysis. Cancer 1994; 74:2896.
22. Rollag A., Jacobsen C.D. Gastric ulcer and risk of cancer. A five-year follow-up study. Acta Med Scand 1984; 216:105.
23. Japanese Gastric Cancer Association. Japanese classification of gastric carcinoma 2nd English edition. Gastric Cancer 1998; 1(1):10-24.
24. Rugge M., Farinati F., Baffa R. et al. Gastric epithelial dysplasia in the natural history of gastric cancer: a multicenter prospective follow-up study. Interdisciplinary Group on Gastric Epithelial Dysplasia. Gastroenterology 1994; 107:1288.
25. Song H., Ekheden I.G., Zheng Z. et al. Incidence of gastric cancer among patients with gastric precancerous lesions: observational cohort study in a low risk Western population. Br Med J 2015; 351: h4867.
26. Shikata K., Kiyohara Y., Kubo M. et al. A prospective study of dietary salt intake and gastric cancer incidence in a defined Japanese population: the Hisayama study. Int J Cancer 2006; 119:196.
27. Peleteiro B., Lopes C., Figueiredo C., Lunet N. Salt intake and gastric cancer risk according to Helicobacter pylori infection, smoking, tumour site and histological type. Br J Cancer 2011; 104:198.
28. Park B., Shin A., Park S.K. et al. Ecological study for refrigerator use, salt, vegetable, and fruit intakes, and gastric cancer. Cancer Causes Control 2011; 22:1497.
29. González C.A., Jakszyn P., Pera G. et al. Meat intake and risk of stomach and esophageal adenocarcinoma within the European Prospective Investigation Into Cancer and Nutrition (EPIC). J Natl Cancer Inst 2006; 98:345.
30. Zhu H., Yang X., Zhang C. et al. Red and processed meat intake is associated with higher gastric cancer risk: a meta-analysis of epidemiological observational studies. PLoS One 2013 Aug 14;8(8): e70955.
31. Larsson S.C., Orsini N., Wolk A. Processed meat consumption and stomach cancer risk: a meta-analysis. J Natl Cancer Inst 2006; 98:1078.
32. Tsugane S., Sasazuki S. Diet and the risk of gastric cancer: review of epidemiological evidence. Gastric Cancer 2007; 10:75.
33. Zhang Z., Xu G., Ma M. et al. Dietary fiber intake reduces risk for gastric cancer: a meta-analysis. Gastroenterology 2013; 145:113.
34. Wu C.Y., Wu M.S., Kuo K.N. et al. Effective reduction of gastric cancer risk with regular use of nonsteroidal anti-inflammatory drugs in Helicobacter pylori-infected patients. J Clin Oncol 2010; 28:2952.
35. IARC Working Group on the Evaluation of Carcinogenic Risks to Humans, Schistosomes, Liver Flukes and Helicobacter pylori. Vol 61 of IARC monographs on the evaluation of carcinogenic risks to humans. International Agency for Research on Cancer, Lyon, 1994 Prevalence Worldwide in 2012. IARC, Section of Cancer Surveillance (5/5/2017). http://monographs.iarc.fr/ ENG/Monographs/vol61/index.php
36. Correa P. A human model of gastric carcinogenesis. Cancer Res 1988; 48: 3554.
37. Пасечников В.Д., Чуков С.З. Определяют ли факторы вирулентности H. pylori характер гастродуоденальной патологии? Рос журн гастроэнтерол гепатол колопроктол 2001;9(2, Suppl 13):74-81.
38. Rudi J., Rudy A., Maiwald M. et al. Direct determination of Helicobacter pylori vacA genotypes and cagA gene in gastric biopsies and relationship to gastrointestinal diseases. Am J Gastroenterol 1999; 94, 6:1525.
39. Holcombe C. Helicobacter pylori: the African enigma. Gut 1992; 33:429.
40. Boysen T., Mohammadi M., Melbye M. et al. EBVassociated gastric carcinoma in highand low-incidence areas for nasopharyngeal carcinoma. Br J Cancer 2009; 101:530.
41. Kusano M., Toyota M., Suzuki H. et al. Genetic, epigenetic, and clinicopathologic features of gastric carcinomas with the CpG island methylator phenotype and an association with Epstein-Barr virus. Cancer 2006; 106:1467.
42. Yang P., Zhou Y., Chen B. et al. Overweight, obesity and gastric cancer risk: results from a meta-analysis of cohort studies. Eur J Cancer 2009; 45:2867-73.
43. Takeno S., Hashimoto T., Maki K. et al. Gastric cancer arising from the remnant stomach after distal gastrectomy: a review. World J Gastroenterol 2014; 20:13734.
44. Morton L.M., Dores G.M., Curtis R.E. et al. Stomach cancer risk after treatment for Hodgkin lymphoma. J Clin Oncol 2013; 31:3369.
45. Hansford S., Kaurah P., Li-Chang H. et al. Hereditary Diffuse Gastric Cancer Syndrome: CDh2 Mutations and Beyond. JAMA Oncol 2015; 1:23.
46. Van der Post R.S., Vogelaar I.P., Carneiro F. et al. Hereditary diffuse gastric cancer: updated clinical guidelines with an emphasis on germline CDh2 mutation carriers. J Med Genet 2015; 52:361.
47. Worthley D.L., Phillips K.D., Wayte N. et al. Gastric adenocarcinoma and proximal polyposis of the stomach (GAPPS): a new autosomal dominant syndrome. Gut 2012; 61:774.
48. Corso G., Roncalli F., Marrelli D. et al. History, pathogenesis, and management of familial gastric cancer: original study of John XXIII’s family. Biomed Res Int 2013; 2013:385132.
49. Alexander J.R., Andreas J.M., Buchi K. et al. High prevalence of adenomatous polyps of the duodenal papilla in familial adenomatous polyposis. Dig Dis Sci 1989, 34: 167.
50. Vasen H.F., Wijnen J.T., Khan M. et al. Cancer risk in families with hereditary nonpolyposis colorectal cancer diagnosed by mutation analysis. Gastroenterology 1996; 110:1020.
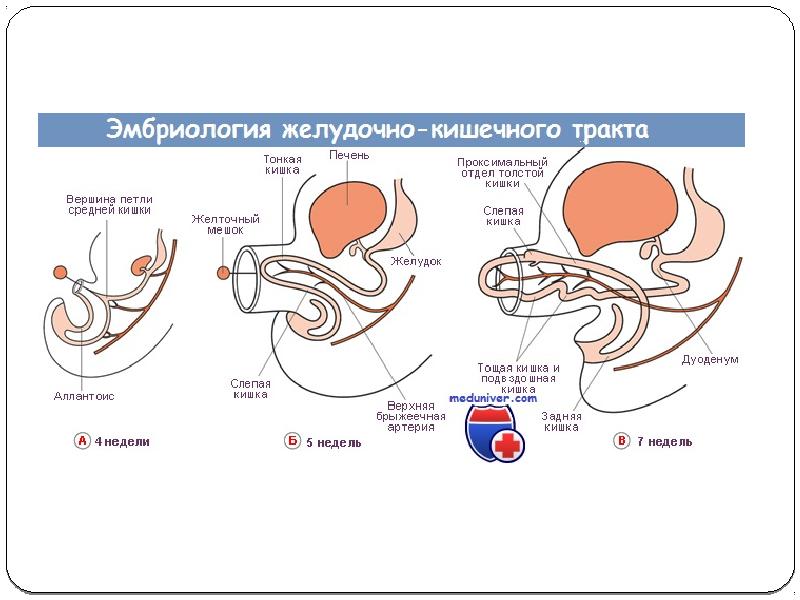
Механизмы развития эмбрионального желудка
Реферат
Желудок – пищеварительный орган, играющий важную роль в физиологии и патофизиологии человека. Источником развития желудка является передняя кишка эмбриона, которая также дает начало ряду других структур. Существует несколько сигнальных путей и факторов транскрипции, которые, как известно, регулируют развитие желудка на разных стадиях, включая формирование паттерна передней кишки, спецификацию желудка и регионализацию желудка.Эти события развития имеют важное значение для более позднего гомеостаза и заболеваний желудка взрослого человека. Здесь мы рассмотрим литературу, которая сформировала наше текущее понимание молекулярных механизмов, которые координируют органогенез желудка. Далее мы обсудим, как парадигмы развития руководят недавними попытками дифференцировать ткань желудка от плюрипотентных стволовых клеток.
Ключевые слова: энтодерма, передняя кишка, желудок, тело, дно, антральный отдел
1. ВВЕДЕНИЕ
Желудок представляет собой эволюционно разнообразную структуру, которая выполняет множество функций, включая переваривание пищи, иммунную защиту и гормональную регуляцию метаболического гомеостаза.В зависимости от своих уникальных диетических потребностей и привычек позвоночные животные адаптировали изменения в своей структурной и гистологической организации желудка [1]. У людей слизистая оболочка желудка полностью состоит из железистого цилиндрического эпителия и разделена на два отдельных отсека, содержащих специализированные типы клеток, которые работают взаимодополняющим образом. Более проксимальная область желудка содержит фундальные железы, которые содержат секретирующие кислоту париетальные клетки, главные клетки, вырабатывающие ферменты, и защитные слизеобразующие клетки, тогда как дистальная область желудка, антральный отдел, состоит в основном из слизистых клеток и эндокринных клеток. включая G-клетки, которые секретируют гастрин.В дополнение к этому, однако, у мышей имеется большой лесной желудок в передней части, который состоит из многослойного плоского эпителия, похожего на эпителий пищевода.
Независимо от его окончательного состава, механизмы, управляющие ранним эмбриональным развитием желудка, по-видимому, сохраняются у всех видов позвоночных. Хотя видоспецифические различия в архитектуре могут иногда препятствовать нашей способности напрямую передавать данные, полученные от животных, людям, мы многое узнали о развитии желудка на модельных организмах, включая мышей, цыплят, лягушек и рыб.Кроме того, недавно было доказано, что энтодерма, полученная из плюрипотентных стволовых клеток человека (hPSC), является ценной модельной системой in vitro для исследования динамических процессов развития передней кишки и желудка. В этом обзоре мы суммируем ранние механизмы развития желудка, сосредотачиваясь на сигнальных путях и регуляторах транскрипции, которые контролируют формирование паттерна энтодермы, спецификацию желудка, регионализацию желудка и морфогенез. Хотя более поздний контроль поведения и гомеостаза желудочных стволовых клеток, вероятно, имеет параллели с процессами раннего развития, эта литература недавно была рассмотрена [1–3] и не будет здесь обсуждаться.
2. СПЕЦИФИКАЦИЯ ЖЕЛУДОЧКА
Эмбриональный желудок происходит из задней части передней кишки и развивается среди ряда соседних тканей, включая пищевод, кишечник, печень, желчный пузырь и поджелудочную железу. Как и в случае развития всех органов энтодермы, за обеспечение судьбы желудка отвечает сложный набор эпителиально-мезенхимальных взаимодействий. И у грызунов, и у эмбрионов кур презумптивная мезодерма желудка необходима для определения судьбы желудка в соседней энтодерме, и она может повторно определять энтодерму, взятую из негастральных областей кишечника [4,5]; однако отвечающая энтодерма компетентна реагировать только на индуцирующие желудок сигналы во время короткого временного окна в раннем развитии [6], указывая тем самым, что спецификация желудка является динамическим во времени и пространстве процессом.Работа нескольких групп привела к выяснению путей передачи сигналов и сетей факторов транскрипции, которые управляют некоторыми из ранних стадий развития желудка.
2.1 Формирование паттерна задней энтодермы передней кишки
После гаструляции ряд инструктивных сигналов формирует паттерн зарождающейся энтодермы, приводящий к трехмерной кишечной трубке, которая грубо разделяется на передний и задний домены (Review in [7]). Задний регион, или задняя кишка, экспрессирует гомеодоменный фактор транскрипции Cdx2 [8,9], и он дает начало тонкому и толстому кишечнику.Передняя энтодерма – это передняя кишка, которая экспрессирует фактор транскрипции HMG box Sox2 [9]. Сигналы, ответственные за это раннее формирование передне-заднего паттерна, были выяснены на многих модельных организмах, и они включают WNT, FGF и BMP [10-13]. Интересно, что все эти пути, как было показано, имеют постериоризирующий эффект на раннюю энтодерму. В формирующейся передней кишке экспрессия Sox2 негативно регулируется с помощью передачи сигналов BMP [14-16]. Более того, репрессия передачи сигналов BMP происходит на ранних стадиях развития пищевода и желудка [17], указывая тем самым, что судьбы этих органов требуют состояния с низким BMP.Хотя WNT, FGF и BMP имеют прямые эффекты на энтодерму [18-20], они обладают активностью формирования паттерна только в присутствии мезодермы, указывая тем самым, что множественные сигналы могут действовать синергетически, чтобы координировать формирование паттерна энтодермы. В самом деле, активность всех трех путей необходима для дифференцировки hPSCs в Cdx2-позитивную ткань задней кишки [16,21].
Вскоре после своего образования Sox2-положительная трубка передней кишки разделяется на ряд примитивных доменов органов. Передняя часть передней кишки в глоточной области эмбриона образует ротоглотку, щитовидную железу, тимус и паращитовидные железы.Более задние части передней кишки дифференцируются в эпителиальную выстилку пищевода и железистого желудка, а также в отрастающие органы, включая легкие, печень, поджелудочную железу и внепеченочную билиарную систему. Способность давать начало такому разнообразию клонов органов подразумевает, что сама передняя кишка может быть разделена на субдомены, которые обладают различными потенциалами развития. Однако этот этап развития краток и труднодоступен экспериментально, поэтому имеется ограниченное количество данных, касающихся этой концепции «формирования паттерна передней кишки».Доказательства в поддержку этой модели приходят через регионализированную экспрессию нескольких факторов транскрипции, которые экспрессируются в задней части передней кишки до спецификации органа, включая Hnf1β , Hnf6 и Prox1 [9,22–24]. В частности, Hnf1β, по-видимому, является главным регулятором развития задней части передней кишки, поскольку его делеция приводит к аберрантной спецификации поджелудочной железы, печени и железистого желудка [24,25].
Ключевым регулятором развития задней части передней кишки является ретиноевая кислота (RA), которая играет многочисленные роли в формировании паттерна в эмбриональном развитии (rev. [26]). Raldh3 , первичный синтетический фермент в пути, экспрессируется в задних мезодермальных тканях, окружающих дистальные отделы передней и задней кишки [27], что указывает на RA как важную молекулу, формирующую паттерн передней кишки. Ранняя активность RA необходима для спецификации нескольких производных задней передней кишки, включая поджелудочную железу [28,29] и легкое [15], и она подавляет развитие передних клонов передней кишки, таких как щитовидная железа [30]. Железистый задний желудок не может формироваться у мышей, лишенных Raldh3 [31], обеспечивая дополнительные доказательства роли RA в развитии задней части передней кишки.В соответствии с этим, применение экзогенного RA является критическим для дифференциации in vitro тканей желудка человека от hPSCs [16]. В этих моделях RA способствует экспрессии HNF1β , указывая тем самым, что регуляторная сеть RA-Hnf1β может контролировать формирование паттерна ранней передней кишки, чтобы создать компетентность для спецификации в клонах задних отделов передней кишки.
Помимо нескольких исследований, описанных выше, известно мало информации о молекулярных путях, которые управляют формированием задней части передней кишки.Снижение передачи сигналов рецептора активина приводит к сходным желудочным фенотипам, наблюдаемым у мутантов Raldh3 [32], но путь TGFβ не был более тщательно исследован на предмет его роли в развитии желудка. Учитывая высокий интерес к созданию полностью функциональных тканей органа передней кишки из hPSCs, важно лучше очертить механизмы, которые разделяют раннюю энтодерму передней кишки на ее производные.
2.2 Определение передней границы желудка
После начального формирования паттерна задняя часть передней кишки делится на отдельные клоны органов.Опять же, молекулярные механизмы, которые точно управляют этими событиями, плохо изучены. Напротив, большая часть наших знаний получена в результате исследований, посвященных установлению границ орган-орган, то есть принятию решения о бинарной судьбе. Предполагаемый желудочный эпителий образуется рядом с пищеводом, тонкой кишкой, поджелудочной железой и печенью; таким образом, спецификация желудка в задней части передней кишки включает процессы, которые исключают или подавляют судьбы каждого из этих других органов.
Процесс установления гастроэзофагеальной границы, вероятно, будет отличаться у мышей, чем у людей, из-за разницы в анатомии между видами млекопитающих.Поскольку у мыши есть лесной желудок, который напоминает пищевод, столбчатый эпителий желудка начинается только на месте схождения межпозвоночного и заднего желудка. Напротив, у людей чешуйчато-столбчатое соединение возникает на границе органов между желудком и пищеводом. На молекулярном уровне кажется, что границы экспрессии генов следуют паттерну плоскостолбчатого соединения скорее у мышей, чем желудочно-пищеводного соединения. Более того, эмбриологические предшественники пищевода и лесного желудка обладают сходным потенциалом развития.Напр., Эктопическая активация β-catenin достаточна для превращения предполагаемых предшественников пищевода в Nkx2-1 -позитивную респираторную линию, и она имеет сходный эффект на передний, но не задний эпителий желудка [33,34]. Следовательно, наиболее вероятно, что граница между лесом и животом у эмбрионов грызунов аналогична границе между желудком и пищеводом в человеческом развитии.
Лиганды пути Hedgehog обычно экспрессируются энтодермальной выстилкой развивающейся кишечной трубки, и они в основном передают сигнал соседней мезодермальной ткани.Большая часть ранней энтодермы у мышей экспрессирует Sonic hedgehog (Shh) , но презумптивный железистый эпителий заднего желудка специфически экспрессирует Indian hedgehog ( Ihh ; [35]). Таким образом, существует граница экспрессии Shh – Ihh на стыке преддверия и заднего желудка. Есть две линии доказательств того, что мезенхима желудка играет важную роль в установлении этого соединения. Во-первых, делеция мезенхимального фактора Hoxa5 нарушает нормальный паттерн экспрессии Shh – Ihh , приводя к дефектной дифференцировке заднего желудка [36].Во-вторых, делеция Shh , которая, как полагают, передает сигналы только непосредственно в мезенхиму [37], также нарушает границу между лесомахом и задним желудком. У обоих мутантов Hoxa5 и Shh [38] задний желудок также принимает некоторые особенности кишечника. Эти данные подтверждают модель, с помощью которой Hoxa5, действуя через неизвестный паракринный фактор, регулирует экспрессию эпителиального лиганда Hh, который, в свою очередь, регулирует мезенхимальные факторы роста, которые дополнительно усиливают соединение между лесом и задним желудком. Т.о., внешние сигнальные механизмы, которые управляют решениями судьбы эпителиальных клеток на передней границе желудка, остаются в значительной степени неизвестными.
Специфический для желудка «главный регулятор» транскрипции еще не был идентифицирован на эмбриональных стадиях. Однако есть несколько широко выраженных факторов, которые способствуют установлению границы пищевода и желудка. Фактор транскрипции цинкового пальца Gata4 устойчиво экспрессируется в заднем желудке и полностью исключен из лесного желудка. Gata4 -null клетки в химерных эмбрионах не вносят вклад в железистый эпителий желудка, а исследования делеций продемонстрировали, что взаимодействия Gata4 с его коактиваторами транскрипции FOG1 / 2 необходимы для нормального развития желудка [39,40].Более того, делеция Gata4 из уже указанного дистального отдела желудка вызывает клеточно-автономную миграцию клеток из заднего желудка в лесной желудок [41]. Родственный фактор, Gata6 , имеет сходный паттерн локализации [42], но его роль в развитии желудка не исследовалась. Таким образом, Gata4 остается одним из очень немногих генов, которые, как известно, необходимы для спецификации желудка. Ранний ген передней кишки Sox2 остается экспрессированным как в пищеводе, так и в желудке на протяжении большей части развития.В то время как это необходимо для правильной дифференцировки плоского эпителия передней кишки [43], железистая дифференцировка желудка не нарушается у гипоморфов Sox2. Хотя было бы важным открытие, что Sox2 незаменим для развития желудка, полный анализ потери функции еще не проводился.
2.3 Определение задней границы желудка
Желудочно-кишечное соединение устанавливается уже на E8.5 у эмбриона мыши, поскольку оно идентифицируется как граница экспрессии Sox2 – Cdx2 .Хотя небольшое количество клеток коэкспрессирует эти факторы в ранней энтодерме [9], граница заостряется и уточняется со временем развития [44]. Эти факторы транскрипции являются важными регуляторами судьбы передней и задней кишок соответственно. Эктопическая активация Sox2 в задней кишке подавляет фенотип кишечника и индуцирует особенности железистого желудка, но не репрессирует сам Cdx2 [45]. Сходным образом принудительная экспрессия Cdx2 в ранее определенном развивающемся эпителии желудка достаточна для индукции кишечной метаплазии [46], но не подавления Sox2 [47].Эти находки, что Sox2 и Cdx2 не являются взаимно репрессивными, интересны, учитывая, что они оказывают доминирующее влияние на дифференцировку желудка и кишечника. Более того, удивительно, что потеря функции Cdx2 имеет разные эффекты в зависимости от времени удаления. Ранняя потеря Cdx2 (через Foxa3 -Cre) ведет к нарушению дифференцировки кишечника, но кишечник принимает пищеводный, а не желудочный фенотип [48]. В этой модели граница желудка не затронута.Напротив, более поздняя делеция Cdx2 с помощью Villin -CreER продуцирует пилорические желудочные железы в кишечнике [49]. Взятые вместе, эти исследования показали, что Sox2 и Cdx2 выполняют ключевые функции в установлении границ желудочно-кишечного тракта и поддержании судьбы органов. Однако результаты также предполагают, что должны быть неустановленные факторы, которые способствуют определению судьбы желудка и кишечника.
Раннее формирование границы желудочно-кишечного тракта организовано мезенхимально-эпителиальной сетью, что было выяснено в ключевой серии статей о факторе транскрипции Barx1 [50,51].Этот фактор специфически экспрессируется в предполагаемой мезенхиме желудка и способствует экспрессии секретируемых антагонистов передачи сигналов WNT (sFRP) в этой области. Это опосредованное Barx1 ингибирование WNT необходимо для подавления кишечной трансформации в презумптивном эпителии желудка. В то время как активация WNT / β-катенина способна стимулировать экспрессию генов задней кишки в нескольких модельных системах, включая энтодерму лягушки, мыши и человека [10,19,21], эктопическая индукция кассеты Barx1-sFRP в мезенхиме задней кишки не влияет на дифференцировку кишечный эпителий [52].Это несоответствие может быть объяснено либо временем репрессии передачи сигналов WNT, либо существованием др. Сигнальных путей, которые регулируют это решение судьбы. Одним из примеров является сигнальный путь BMP, который в моделях энтодермы человека in vitro необходим для спецификации кишечника, и он должен быть неактивным во время раннего развития передней кишки [16]. Аналогичным образом, BMP достаточен для подавления экспрессии Sox2 в передней кишке [14], и активность BMP, соответственно, низкая в эмбриональном желудке и пищеводе.Взятые вместе, эти исследования показывают, что множественные сигнальные пути, включая по крайней мере WNT и BMP, действуют в комбинации, чтобы установить границы органов на стыке передней и задней кишки.
2.4 Границы экспрессии генов между желудком и дополнительными органами
В дополнение к конкурирующим клонам вдоль продольной оси пищеварительного канала, ранние предшественники желудка также должны быть указаны отдельно от отпочковывающихся органов задней части передней кишки – поджелудочной железы и печени.Опять же, существуют границы факторов транскрипции, которые различают эти ранние домены органов. В то время как фактор поджелудочной железы Pdx1 также экспрессируется в эпителии дистального отдела желудка и проксимального отдела кишечника, фактор bHLH Ptf1a очень специфичен для поджелудочной железы на E9.5 [53,54]. Как пример ранней пластичности задней энтодермы передней кишки, эктопическая экспрессия Ptf1a достаточна для индукции судьбы поджелудочной железы у предшественников желудка [55,56]. Делеция Hes1 , др. Фактора bHLH, также ведет к эктопической дифференцировке поджелудочной железы по большей кривизне желудка [57], подтверждая, что Hes1 репрессирует судьбу поджелудочной железы в презумптивном желудке.Хотя Hes1 часто функционирует ниже передачи сигналов Notch, дефекты желудочной спецификации не наблюдаются у др. Мутантов пути Notch [58]. Следовательно, Hes1 может действовать независимо от Notch, но ни его функция, ни функция пути Notch не исследовались в дальнейшем в развивающемся желудке.
Как описано ранее, желудок и печень развиваются рядом друг с другом и экспрессируют ряд общих маркеров, таких как Hnf1β . Несмотря на их близость в передней кишке, мало что известно о механизмах, которые разделяют ранние желудочные и печеночные клоны, за исключением того, что активация BMP и FGF способствует спецификации печени [59,60].Таким образом, отсутствие этих факторов, таким образом, вероятно, способствует развитию желудка, что снова подчеркивает ингибирующую роль BMP в спецификации желудка. Одно интересное наблюдение состоит в том, что в то время как латеральная (предположительно желудочная) энтодерма передней кишки на E9.5 экспрессирует Gata4, почкующийся дивертикул печени является отрицательным Gata4 [61]. Эти данные снова указывают на потенциально важную роль Gata4 в формировании паттерна передней кишки и сегрегации клонов, но ранние специфичные для энтодермы нокауты еще не описаны.
Ключевые сигнальные пути и факторы транскрипции, необходимые для формирования паттерна задней части передней кишки и спецификации желудка, суммированы в.
Схематический обзор механизмов развития, ведущих к спецификации желудкаA. Формирование паттерна задней энтодермы передней кишки. Во время формирования паттерна энтодермы, который происходит около E8.5 у мышей, сигналы WNT, Bmp и Fgf способствуют экспрессии гена задней кишки (Cdx2). BMP подавляет маркер передней кишки Sox2. Активность RA требуется для спецификации задней области передней кишки, где одним из ее генов-мишеней является Hnf1β.B. Сагиттальная и поперечная репрезентации ограничения клонов и спецификации желудка у мышей.
3. ИЗОБРАЖЕНИЕ ЭМБРИОНАЛЬНОГО ЖЕЛУДКА
После уточнения, предшественники желудка делятся далее вдоль ростро-каудальной оси. Проксимальный отдел образует эпителий тела и глазного дна (и, кроме того, лесной желудок у мышей), а дистальный участок переходит в антральный желудок. Во время эмбриональных стадий одно из немногих известных молекулярных различий между этими желудочными доменами – это Pdx1 , который специфически локализуется в презумптивной антральной области на E10.5 [62]. Удивительно, но роль Pdx1 в формировании паттерна желудка не исследована, за исключением его известной потребности в дифференцировке антральных G-клеток на более поздних стадиях [63]. Pdx1 мутантные эмбрионы не обнаруживают грубых или очевидных дефектов морфологии желудка [64], но было бы интересно посмотреть, влияет ли этот фактор транскрипции на дифференцировку желудка в более общем плане. Фактор транскрипции Nkx6.3 также экспрессируется специфическим для антрального отдела образом, но, по-видимому, необходим только для спецификации G-клеток в антральном отделе [65].Для более полного понимания механизмов формирования паттерна желудка необходимо идентифицировать дополнительные гены, которые демонстрируют профили экспрессии, специфичные для региона.
Как и ожидалось, мезенхимно-эпителиальные взаимодействия, по-видимому, играют важную роль в формировании желудочного паттерна. Bapx1 является фактором транскрипции, экспрессирующимся в мезенхиме, окружающей дистальный отдел желудка и проксимальный отдел кишечника [66]. Когда он удаляется, антральный сегмент желудка сокращается, и париетальные клетки обнаруживаются около соединения желудочно-кишечного тракта.Сигнальный механизм, лежащий в основе этого явления, у грызунов не идентифицирован. Однако в желудке птиц Bapx1 репрессирует экспрессию Wnt5a и Bmp4 [67], указывая тем самым, что передача сигналов WNT и / или BMP может играть роль в формировании паттерна желудка. Было замечено, что каноническая активность WNT ограничена ростральным эмбриональным желудком и исключена из предполагаемого антрального отдела [50,68,69]. После этого наблюдения было показано, что делеция канонического эффектора WNT Ctnnb1 в эпителии приводит к эктопической экспрессии Pdx1 и последующей антрализации проксимального отдела желудка.У этих мышей потеря Ctnnb1 привела к нарушению цитодифференцировки фундального типа клеточно-автономным образом. Эти данные подтверждают модель, в которой передача сигналов WNT / β-catenin может переключаться между судьбами клеток в развивающемся железистом желудке. Высокая активность WNT требуется для дифференциации области тела / дна, в то время как подавление пути позволяет специфицировать антральный домен (суммировано в). Делеция у этих животных в основном происходит до формирования желудочного паттерна, поэтому пока неясно, могут ли манипуляции с WNT / β-catenin влиять на судьбу желудка после того, как начальное формирование паттерна уже произошло.Этот принцип в дальнейшем был применен для модуляции клеточной судьбы во время дифференцировки in vitro и PSC в органоиды желудка человека (hGO). В отсутствие передачи сигналов WNT hGO содержат Pdx1 -положительный антральный эпителий, но ранняя стимуляция WNT индуцирует hGO фундального типа, которые содержат париетальные и главные клетки [70].
Сводка WNT-опосредованных механизмов формирования желудочного паттерна in vivo и in vitroA. Передача сигналов WNT / β-catenin способствует спецификации глазного дна из пула клеток-предшественников желудка во время E9-10.B. Активация WNT способствует образованию фундальных органоидов желудка человека (hGO), подавляя антральную спецификацию из сфероидов задней части передней кишки, происходящих от hPSC.
Новые данные, подтверждающие роль передачи сигналов WNT / β-catenin в формировании тела / дна, по-видимому, несовместимы с предыдущими моделями, в которых передача сигналов WNT д. Репрессироваться во время развития желудка. Есть несколько возможных объяснений, которые могут разрешить это несоответствие. Время является важной переменной в эмбриональном развитии, и поэтому возможно, что ранний WNT способствует спецификации кишечника, тогда как более поздний сигнал WNT регулирует формирование желудочного паттерна.Кроме того, эпителиальный ответ на WNT может модулироваться активностью других путей, таких как BMP, как описано выше. Тем не менее, необходима дополнительная работа, чтобы ответить на эти вопросы и определить, как определяется судьба желудка.
4. МОРФОГЕНЕЗ ЖЕЛУДОЧНОГО ЭПИТЕЛИЯ
Ранний эпителий передней кишки представляет собой простую кубовидную выстилку, не имеющую архитектурной сложности. Следуя спецификации желудка и формированию паттерна, слизистая оболочка проходит стадию псевдостратификации до принятия высокой столбчатой морфологии, которая обнаруживается во взрослом органе, подобно событиям, наблюдаемым в кишечнике [71].Сопровождая эти изменения формы клеток, эпителий подвергается складчатости и железистому морфогенезу, который прогрессивно развивается на постнатальных стадиях, что приводит к высокоорганизованной сложной структуре, обнаруживаемой в зрелом желудке. Точные механизмы, которые координируют эти морфогенетические события, полностью не изучены, но известно, что несколько эмбриональных сигнальных молекул играют роль.
Подобно своей роли в регуляции решений клеточной судьбы, мезенхима желудка важна для правильного роста и морфогенеза желудка.Лиганды Hh, происходящие из эпителия, поддерживают выживание и пролиферацию мезенхимальных клеток, и одновременная делеция Shh и Ihh , таким образом, приводит к серьезной задержке роста желудка и кишечника [72]. Несмотря на их аберрантный морфогенез, у этих мутантов сохраняется надлежащая спецификация желудка и формирование паттерна. Ниже эпителиального сигнала Hh транскрипционные факторы FoxF и FoxL опосредуют сложную сигнальную сеть в ассоциированной мезенхиме [73,74].Важным фактором роста, происходящим из мезенхимы, является Fgf10 , который передает сигналы в эпителий через рецептор Fgfr2 на более поздних стадиях развития. Потеря любой молекулы приводит к снижению пролиферации и дефектному морфогенезу желез в эпителии желудка [75,76]. Напротив, избыточная экспрессия Fgf10 ведет к железистой гиперплазии и нарушению цитодифференцировки [77]. Формирование желез в преджелудке птиц также регулируется BMP, WNT5a, Notch и Shh [78–81].У мышей было показано, что Wnt5a активирует путь WNT / PCP, который важен для поддержания полярности эпителиальных клеток, морфогенеза, а также роста и удлинения передней части желудка [69]. Более того, каноническая передача сигналов WNT вносит вклад в рост желудка, поскольку эпителиальная делеция Ctnnb1 ведет к драматическому уменьшению размера желудка [70], хотя и ниже по ходу еще неидентифицированных лигандов WNT. Наконец, EGF является другим важным эпителиальным митогеном, необходимым для нормальной пролиферации и роста слизистой оболочки грызунов [82,83], а эктопический EGF необходим для дифференцировки in vitro эмбриональных структур желудка [16].
5. SUMMARY
В целом, ряд онтогенетических сигнальных путей используется многократно во время развития желудка, чтобы регулировать формирование паттерна энтодермы, спецификацию желудка, регионализацию желудка и морфогенез. В эту группу входят WNT, Bmp, Fgf и RA, и вместе они точно координируют экспрессию факторов транскрипции, которые определяют идентичность клеток. Наше текущее понимание транскрипционных регуляторов развития желудка отсутствует, и для дальнейшей работы необходимо дальнейшее выяснение сигнальных парадигм, лежащих в основе этого процесса.Тем не менее, использование известных эмбриологических механизмов, а также недавно открытых принципов привело к разработке протоколов для дифференциации ткани желудка от PSCs de novo [16,70,84]. Эти системы, в свою очередь, должны оказаться эффективными моделями для изучения развития желудка и заболеваний. Например, в настоящее время нет доступных данных об эпигенетическом контроле развития желудка, а ткани in vitro и хорошо подходят для эпигенетических исследований.
Механизмы развития эмбрионального желудка
Реферат
Желудок – пищеварительный орган, играющий важную роль в физиологии и патофизиологии человека. Источником развития желудка является передняя кишка эмбриона, которая также дает начало ряду других структур. Существует несколько сигнальных путей и факторов транскрипции, которые, как известно, регулируют развитие желудка на разных стадиях, включая формирование паттерна передней кишки, спецификацию желудка и регионализацию желудка.Эти события развития имеют важное значение для более позднего гомеостаза и заболеваний желудка взрослого человека. Здесь мы рассмотрим литературу, которая сформировала наше текущее понимание молекулярных механизмов, которые координируют органогенез желудка. Далее мы обсудим, как парадигмы развития руководят недавними попытками дифференцировать ткань желудка от плюрипотентных стволовых клеток.
Ключевые слова: энтодерма, передняя кишка, желудок, тело, дно, антральный отдел
1. ВВЕДЕНИЕ
Желудок представляет собой эволюционно разнообразную структуру, которая выполняет множество функций, включая переваривание пищи, иммунную защиту и гормональную регуляцию метаболического гомеостаза.В зависимости от своих уникальных диетических потребностей и привычек позвоночные животные адаптировали изменения в своей структурной и гистологической организации желудка [1]. У людей слизистая оболочка желудка полностью состоит из железистого цилиндрического эпителия и разделена на два отдельных отсека, содержащих специализированные типы клеток, которые работают взаимодополняющим образом. Более проксимальная область желудка содержит фундальные железы, которые содержат секретирующие кислоту париетальные клетки, главные клетки, вырабатывающие ферменты, и защитные слизеобразующие клетки, тогда как дистальная область желудка, антральный отдел, состоит в основном из слизистых клеток и эндокринных клеток. включая G-клетки, которые секретируют гастрин.В дополнение к этому, однако, у мышей имеется большой лесной желудок в передней части, который состоит из многослойного плоского эпителия, похожего на эпителий пищевода.
Независимо от его окончательного состава, механизмы, управляющие ранним эмбриональным развитием желудка, по-видимому, сохраняются у всех видов позвоночных. Хотя видоспецифические различия в архитектуре могут иногда препятствовать нашей способности напрямую передавать данные, полученные от животных, людям, мы многое узнали о развитии желудка на модельных организмах, включая мышей, цыплят, лягушек и рыб.Кроме того, недавно было доказано, что энтодерма, полученная из плюрипотентных стволовых клеток человека (hPSC), является ценной модельной системой in vitro для исследования динамических процессов развития передней кишки и желудка. В этом обзоре мы суммируем ранние механизмы развития желудка, сосредотачиваясь на сигнальных путях и регуляторах транскрипции, которые контролируют формирование паттерна энтодермы, спецификацию желудка, регионализацию желудка и морфогенез. Хотя более поздний контроль поведения и гомеостаза желудочных стволовых клеток, вероятно, имеет параллели с процессами раннего развития, эта литература недавно была рассмотрена [1–3] и не будет здесь обсуждаться.
2. СПЕЦИФИКАЦИЯ ЖЕЛУДОЧКА
Эмбриональный желудок происходит из задней части передней кишки и развивается среди ряда соседних тканей, включая пищевод, кишечник, печень, желчный пузырь и поджелудочную железу. Как и в случае развития всех органов энтодермы, за обеспечение судьбы желудка отвечает сложный набор эпителиально-мезенхимальных взаимодействий. И у грызунов, и у эмбрионов кур презумптивная мезодерма желудка необходима для определения судьбы желудка в соседней энтодерме, и она может повторно определять энтодерму, взятую из негастральных областей кишечника [4,5]; однако отвечающая энтодерма компетентна реагировать только на индуцирующие желудок сигналы во время короткого временного окна в раннем развитии [6], указывая тем самым, что спецификация желудка является динамическим во времени и пространстве процессом.Работа нескольких групп привела к выяснению путей передачи сигналов и сетей факторов транскрипции, которые управляют некоторыми из ранних стадий развития желудка.
2.1 Формирование паттерна задней энтодермы передней кишки
После гаструляции ряд инструктивных сигналов формирует паттерн зарождающейся энтодермы, приводящий к трехмерной кишечной трубке, которая грубо разделяется на передний и задний домены (Review in [7]). Задний регион, или задняя кишка, экспрессирует гомеодоменный фактор транскрипции Cdx2 [8,9], и он дает начало тонкому и толстому кишечнику.Передняя энтодерма – это передняя кишка, которая экспрессирует фактор транскрипции HMG box Sox2 [9]. Сигналы, ответственные за это раннее формирование передне-заднего паттерна, были выяснены на многих модельных организмах, и они включают WNT, FGF и BMP [10-13]. Интересно, что все эти пути, как было показано, имеют постериоризирующий эффект на раннюю энтодерму. В формирующейся передней кишке экспрессия Sox2 негативно регулируется с помощью передачи сигналов BMP [14-16]. Более того, репрессия передачи сигналов BMP происходит на ранних стадиях развития пищевода и желудка [17], указывая тем самым, что судьбы этих органов требуют состояния с низким BMP.Хотя WNT, FGF и BMP имеют прямые эффекты на энтодерму [18-20], они обладают активностью формирования паттерна только в присутствии мезодермы, указывая тем самым, что множественные сигналы могут действовать синергетически, чтобы координировать формирование паттерна энтодермы. В самом деле, активность всех трех путей необходима для дифференцировки hPSCs в Cdx2-позитивную ткань задней кишки [16,21].
Вскоре после своего образования Sox2-положительная трубка передней кишки разделяется на ряд примитивных доменов органов. Передняя часть передней кишки в глоточной области эмбриона образует ротоглотку, щитовидную железу, тимус и паращитовидные железы.Более задние части передней кишки дифференцируются в эпителиальную выстилку пищевода и железистого желудка, а также в отрастающие органы, включая легкие, печень, поджелудочную железу и внепеченочную билиарную систему. Способность давать начало такому разнообразию клонов органов подразумевает, что сама передняя кишка может быть разделена на субдомены, которые обладают различными потенциалами развития. Однако этот этап развития краток и труднодоступен экспериментально, поэтому имеется ограниченное количество данных, касающихся этой концепции «формирования паттерна передней кишки».Доказательства в поддержку этой модели приходят через регионализированную экспрессию нескольких факторов транскрипции, которые экспрессируются в задней части передней кишки до спецификации органа, включая Hnf1β , Hnf6 и Prox1 [9,22–24]. В частности, Hnf1β, по-видимому, является главным регулятором развития задней части передней кишки, поскольку его делеция приводит к аберрантной спецификации поджелудочной железы, печени и железистого желудка [24,25].
Ключевым регулятором развития задней части передней кишки является ретиноевая кислота (RA), которая играет многочисленные роли в формировании паттерна в эмбриональном развитии (rev. [26]). Raldh3 , первичный синтетический фермент в пути, экспрессируется в задних мезодермальных тканях, окружающих дистальные отделы передней и задней кишки [27], что указывает на RA как важную молекулу, формирующую паттерн передней кишки. Ранняя активность RA необходима для спецификации нескольких производных задней передней кишки, включая поджелудочную железу [28,29] и легкое [15], и она подавляет развитие передних клонов передней кишки, таких как щитовидная железа [30]. Железистый задний желудок не может формироваться у мышей, лишенных Raldh3 [31], обеспечивая дополнительные доказательства роли RA в развитии задней части передней кишки.В соответствии с этим, применение экзогенного RA является критическим для дифференциации in vitro тканей желудка человека от hPSCs [16]. В этих моделях RA способствует экспрессии HNF1β , указывая тем самым, что регуляторная сеть RA-Hnf1β может контролировать формирование паттерна ранней передней кишки, чтобы создать компетентность для спецификации в клонах задних отделов передней кишки.
Помимо нескольких исследований, описанных выше, известно мало информации о молекулярных путях, которые управляют формированием задней части передней кишки.Снижение передачи сигналов рецептора активина приводит к сходным желудочным фенотипам, наблюдаемым у мутантов Raldh3 [32], но путь TGFβ не был более тщательно исследован на предмет его роли в развитии желудка. Учитывая высокий интерес к созданию полностью функциональных тканей органа передней кишки из hPSCs, важно лучше очертить механизмы, которые разделяют раннюю энтодерму передней кишки на ее производные.
2.2 Определение передней границы желудка
После начального формирования паттерна задняя часть передней кишки делится на отдельные клоны органов.Опять же, молекулярные механизмы, которые точно управляют этими событиями, плохо изучены. Напротив, большая часть наших знаний получена в результате исследований, посвященных установлению границ орган-орган, то есть принятию решения о бинарной судьбе. Предполагаемый желудочный эпителий образуется рядом с пищеводом, тонкой кишкой, поджелудочной железой и печенью; таким образом, спецификация желудка в задней части передней кишки включает процессы, которые исключают или подавляют судьбы каждого из этих других органов.
Процесс установления гастроэзофагеальной границы, вероятно, будет отличаться у мышей, чем у людей, из-за разницы в анатомии между видами млекопитающих.Поскольку у мыши есть лесной желудок, который напоминает пищевод, столбчатый эпителий желудка начинается только на месте схождения межпозвоночного и заднего желудка. Напротив, у людей чешуйчато-столбчатое соединение возникает на границе органов между желудком и пищеводом. На молекулярном уровне кажется, что границы экспрессии генов следуют паттерну плоскостолбчатого соединения скорее у мышей, чем желудочно-пищеводного соединения. Более того, эмбриологические предшественники пищевода и лесного желудка обладают сходным потенциалом развития.Напр., Эктопическая активация β-catenin достаточна для превращения предполагаемых предшественников пищевода в Nkx2-1 -позитивную респираторную линию, и она имеет сходный эффект на передний, но не задний эпителий желудка [33,34]. Следовательно, наиболее вероятно, что граница между лесом и животом у эмбрионов грызунов аналогична границе между желудком и пищеводом в человеческом развитии.
Лиганды пути Hedgehog обычно экспрессируются энтодермальной выстилкой развивающейся кишечной трубки, и они в основном передают сигнал соседней мезодермальной ткани.Большая часть ранней энтодермы у мышей экспрессирует Sonic hedgehog (Shh) , но презумптивный железистый эпителий заднего желудка специфически экспрессирует Indian hedgehog ( Ihh ; [35]). Таким образом, существует граница экспрессии Shh – Ihh на стыке преддверия и заднего желудка. Есть две линии доказательств того, что мезенхима желудка играет важную роль в установлении этого соединения. Во-первых, делеция мезенхимального фактора Hoxa5 нарушает нормальный паттерн экспрессии Shh – Ihh , приводя к дефектной дифференцировке заднего желудка [36].Во-вторых, делеция Shh , которая, как полагают, передает сигналы только непосредственно в мезенхиму [37], также нарушает границу между лесомахом и задним желудком. У обоих мутантов Hoxa5 и Shh [38] задний желудок также принимает некоторые особенности кишечника. Эти данные подтверждают модель, с помощью которой Hoxa5, действуя через неизвестный паракринный фактор, регулирует экспрессию эпителиального лиганда Hh, который, в свою очередь, регулирует мезенхимальные факторы роста, которые дополнительно усиливают соединение между лесом и задним желудком. Т.о., внешние сигнальные механизмы, которые управляют решениями судьбы эпителиальных клеток на передней границе желудка, остаются в значительной степени неизвестными.
Специфический для желудка «главный регулятор» транскрипции еще не был идентифицирован на эмбриональных стадиях. Однако есть несколько широко выраженных факторов, которые способствуют установлению границы пищевода и желудка. Фактор транскрипции цинкового пальца Gata4 устойчиво экспрессируется в заднем желудке и полностью исключен из лесного желудка. Gata4 -null клетки в химерных эмбрионах не вносят вклад в железистый эпителий желудка, а исследования делеций продемонстрировали, что взаимодействия Gata4 с его коактиваторами транскрипции FOG1 / 2 необходимы для нормального развития желудка [39,40].Более того, делеция Gata4 из уже указанного дистального отдела желудка вызывает клеточно-автономную миграцию клеток из заднего желудка в лесной желудок [41]. Родственный фактор, Gata6 , имеет сходный паттерн локализации [42], но его роль в развитии желудка не исследовалась. Таким образом, Gata4 остается одним из очень немногих генов, которые, как известно, необходимы для спецификации желудка. Ранний ген передней кишки Sox2 остается экспрессированным как в пищеводе, так и в желудке на протяжении большей части развития.В то время как это необходимо для правильной дифференцировки плоского эпителия передней кишки [43], железистая дифференцировка желудка не нарушается у гипоморфов Sox2. Хотя было бы важным открытие, что Sox2 незаменим для развития желудка, полный анализ потери функции еще не проводился.
2.3 Определение задней границы желудка
Желудочно-кишечное соединение устанавливается уже на E8.5 у эмбриона мыши, поскольку оно идентифицируется как граница экспрессии Sox2 – Cdx2 .Хотя небольшое количество клеток коэкспрессирует эти факторы в ранней энтодерме [9], граница заостряется и уточняется со временем развития [44]. Эти факторы транскрипции являются важными регуляторами судьбы передней и задней кишок соответственно. Эктопическая активация Sox2 в задней кишке подавляет фенотип кишечника и индуцирует особенности железистого желудка, но не репрессирует сам Cdx2 [45]. Сходным образом принудительная экспрессия Cdx2 в ранее определенном развивающемся эпителии желудка достаточна для индукции кишечной метаплазии [46], но не подавления Sox2 [47].Эти находки, что Sox2 и Cdx2 не являются взаимно репрессивными, интересны, учитывая, что они оказывают доминирующее влияние на дифференцировку желудка и кишечника. Более того, удивительно, что потеря функции Cdx2 имеет разные эффекты в зависимости от времени удаления. Ранняя потеря Cdx2 (через Foxa3 -Cre) ведет к нарушению дифференцировки кишечника, но кишечник принимает пищеводный, а не желудочный фенотип [48]. В этой модели граница желудка не затронута.Напротив, более поздняя делеция Cdx2 с помощью Villin -CreER продуцирует пилорические желудочные железы в кишечнике [49]. Взятые вместе, эти исследования показали, что Sox2 и Cdx2 выполняют ключевые функции в установлении границ желудочно-кишечного тракта и поддержании судьбы органов. Однако результаты также предполагают, что должны быть неустановленные факторы, которые способствуют определению судьбы желудка и кишечника.
Раннее формирование границы желудочно-кишечного тракта организовано мезенхимально-эпителиальной сетью, что было выяснено в ключевой серии статей о факторе транскрипции Barx1 [50,51].Этот фактор специфически экспрессируется в предполагаемой мезенхиме желудка и способствует экспрессии секретируемых антагонистов передачи сигналов WNT (sFRP) в этой области. Это опосредованное Barx1 ингибирование WNT необходимо для подавления кишечной трансформации в презумптивном эпителии желудка. В то время как активация WNT / β-катенина способна стимулировать экспрессию генов задней кишки в нескольких модельных системах, включая энтодерму лягушки, мыши и человека [10,19,21], эктопическая индукция кассеты Barx1-sFRP в мезенхиме задней кишки не влияет на дифференцировку кишечный эпителий [52].Это несоответствие может быть объяснено либо временем репрессии передачи сигналов WNT, либо существованием др. Сигнальных путей, которые регулируют это решение судьбы. Одним из примеров является сигнальный путь BMP, который в моделях энтодермы человека in vitro необходим для спецификации кишечника, и он должен быть неактивным во время раннего развития передней кишки [16]. Аналогичным образом, BMP достаточен для подавления экспрессии Sox2 в передней кишке [14], и активность BMP, соответственно, низкая в эмбриональном желудке и пищеводе.Взятые вместе, эти исследования показывают, что множественные сигнальные пути, включая по крайней мере WNT и BMP, действуют в комбинации, чтобы установить границы органов на стыке передней и задней кишки.
2.4 Границы экспрессии генов между желудком и дополнительными органами
В дополнение к конкурирующим клонам вдоль продольной оси пищеварительного канала, ранние предшественники желудка также должны быть указаны отдельно от отпочковывающихся органов задней части передней кишки – поджелудочной железы и печени.Опять же, существуют границы факторов транскрипции, которые различают эти ранние домены органов. В то время как фактор поджелудочной железы Pdx1 также экспрессируется в эпителии дистального отдела желудка и проксимального отдела кишечника, фактор bHLH Ptf1a очень специфичен для поджелудочной железы на E9.5 [53,54]. Как пример ранней пластичности задней энтодермы передней кишки, эктопическая экспрессия Ptf1a достаточна для индукции судьбы поджелудочной железы у предшественников желудка [55,56]. Делеция Hes1 , др. Фактора bHLH, также ведет к эктопической дифференцировке поджелудочной железы по большей кривизне желудка [57], подтверждая, что Hes1 репрессирует судьбу поджелудочной железы в презумптивном желудке.Хотя Hes1 часто функционирует ниже передачи сигналов Notch, дефекты желудочной спецификации не наблюдаются у др. Мутантов пути Notch [58]. Следовательно, Hes1 может действовать независимо от Notch, но ни его функция, ни функция пути Notch не исследовались в дальнейшем в развивающемся желудке.
Как описано ранее, желудок и печень развиваются рядом друг с другом и экспрессируют ряд общих маркеров, таких как Hnf1β . Несмотря на их близость в передней кишке, мало что известно о механизмах, которые разделяют ранние желудочные и печеночные клоны, за исключением того, что активация BMP и FGF способствует спецификации печени [59,60].Таким образом, отсутствие этих факторов, таким образом, вероятно, способствует развитию желудка, что снова подчеркивает ингибирующую роль BMP в спецификации желудка. Одно интересное наблюдение состоит в том, что в то время как латеральная (предположительно желудочная) энтодерма передней кишки на E9.5 экспрессирует Gata4, почкующийся дивертикул печени является отрицательным Gata4 [61]. Эти данные снова указывают на потенциально важную роль Gata4 в формировании паттерна передней кишки и сегрегации клонов, но ранние специфичные для энтодермы нокауты еще не описаны.
Ключевые сигнальные пути и факторы транскрипции, необходимые для формирования паттерна задней части передней кишки и спецификации желудка, суммированы в.
Схематический обзор механизмов развития, ведущих к спецификации желудкаA. Формирование паттерна задней энтодермы передней кишки. Во время формирования паттерна энтодермы, который происходит около E8.5 у мышей, сигналы WNT, Bmp и Fgf способствуют экспрессии гена задней кишки (Cdx2). BMP подавляет маркер передней кишки Sox2. Активность RA требуется для спецификации задней области передней кишки, где одним из ее генов-мишеней является Hnf1β.B. Сагиттальная и поперечная репрезентации ограничения клонов и спецификации желудка у мышей.
3. ИЗОБРАЖЕНИЕ ЭМБРИОНАЛЬНОГО ЖЕЛУДКА
После уточнения, предшественники желудка делятся далее вдоль ростро-каудальной оси. Проксимальный отдел образует эпителий тела и глазного дна (и, кроме того, лесной желудок у мышей), а дистальный участок переходит в антральный желудок. Во время эмбриональных стадий одно из немногих известных молекулярных различий между этими желудочными доменами – это Pdx1 , который специфически локализуется в презумптивной антральной области на E10.5 [62]. Удивительно, но роль Pdx1 в формировании паттерна желудка не исследована, за исключением его известной потребности в дифференцировке антральных G-клеток на более поздних стадиях [63]. Pdx1 мутантные эмбрионы не обнаруживают грубых или очевидных дефектов морфологии желудка [64], но было бы интересно посмотреть, влияет ли этот фактор транскрипции на дифференцировку желудка в более общем плане. Фактор транскрипции Nkx6.3 также экспрессируется специфическим для антрального отдела образом, но, по-видимому, необходим только для спецификации G-клеток в антральном отделе [65].Для более полного понимания механизмов формирования паттерна желудка необходимо идентифицировать дополнительные гены, которые демонстрируют профили экспрессии, специфичные для региона.
Как и ожидалось, мезенхимно-эпителиальные взаимодействия, по-видимому, играют важную роль в формировании желудочного паттерна. Bapx1 является фактором транскрипции, экспрессирующимся в мезенхиме, окружающей дистальный отдел желудка и проксимальный отдел кишечника [66]. Когда он удаляется, антральный сегмент желудка сокращается, и париетальные клетки обнаруживаются около соединения желудочно-кишечного тракта.Сигнальный механизм, лежащий в основе этого явления, у грызунов не идентифицирован. Однако в желудке птиц Bapx1 репрессирует экспрессию Wnt5a и Bmp4 [67], указывая тем самым, что передача сигналов WNT и / или BMP может играть роль в формировании паттерна желудка. Было замечено, что каноническая активность WNT ограничена ростральным эмбриональным желудком и исключена из предполагаемого антрального отдела [50,68,69]. После этого наблюдения было показано, что делеция канонического эффектора WNT Ctnnb1 в эпителии приводит к эктопической экспрессии Pdx1 и последующей антрализации проксимального отдела желудка.У этих мышей потеря Ctnnb1 привела к нарушению цитодифференцировки фундального типа клеточно-автономным образом. Эти данные подтверждают модель, в которой передача сигналов WNT / β-catenin может переключаться между судьбами клеток в развивающемся железистом желудке. Высокая активность WNT требуется для дифференциации области тела / дна, в то время как подавление пути позволяет специфицировать антральный домен (суммировано в). Делеция у этих животных в основном происходит до формирования желудочного паттерна, поэтому пока неясно, могут ли манипуляции с WNT / β-catenin влиять на судьбу желудка после того, как начальное формирование паттерна уже произошло.Этот принцип в дальнейшем был применен для модуляции клеточной судьбы во время дифференцировки in vitro и PSC в органоиды желудка человека (hGO). В отсутствие передачи сигналов WNT hGO содержат Pdx1 -положительный антральный эпителий, но ранняя стимуляция WNT индуцирует hGO фундального типа, которые содержат париетальные и главные клетки [70].
Сводка WNT-опосредованных механизмов формирования желудочного паттерна in vivo и in vitroA. Передача сигналов WNT / β-catenin способствует спецификации глазного дна из пула клеток-предшественников желудка во время E9-10.B. Активация WNT способствует образованию фундальных органоидов желудка человека (hGO), подавляя антральную спецификацию из сфероидов задней части передней кишки, происходящих от hPSC.
Новые данные, подтверждающие роль передачи сигналов WNT / β-catenin в формировании тела / дна, по-видимому, несовместимы с предыдущими моделями, в которых передача сигналов WNT д. Репрессироваться во время развития желудка. Есть несколько возможных объяснений, которые могут разрешить это несоответствие. Время является важной переменной в эмбриональном развитии, и поэтому возможно, что ранний WNT способствует спецификации кишечника, тогда как более поздний сигнал WNT регулирует формирование желудочного паттерна.Кроме того, эпителиальный ответ на WNT может модулироваться активностью других путей, таких как BMP, как описано выше. Тем не менее, необходима дополнительная работа, чтобы ответить на эти вопросы и определить, как определяется судьба желудка.
4. МОРФОГЕНЕЗ ЖЕЛУДОЧНОГО ЭПИТЕЛИЯ
Ранний эпителий передней кишки представляет собой простую кубовидную выстилку, не имеющую архитектурной сложности. Следуя спецификации желудка и формированию паттерна, слизистая оболочка проходит стадию псевдостратификации до принятия высокой столбчатой морфологии, которая обнаруживается во взрослом органе, подобно событиям, наблюдаемым в кишечнике [71].Сопровождая эти изменения формы клеток, эпителий подвергается складчатости и железистому морфогенезу, который прогрессивно развивается на постнатальных стадиях, что приводит к высокоорганизованной сложной структуре, обнаруживаемой в зрелом желудке. Точные механизмы, которые координируют эти морфогенетические события, полностью не изучены, но известно, что несколько эмбриональных сигнальных молекул играют роль.
Подобно своей роли в регуляции решений клеточной судьбы, мезенхима желудка важна для правильного роста и морфогенеза желудка.Лиганды Hh, происходящие из эпителия, поддерживают выживание и пролиферацию мезенхимальных клеток, и одновременная делеция Shh и Ihh , таким образом, приводит к серьезной задержке роста желудка и кишечника [72]. Несмотря на их аберрантный морфогенез, у этих мутантов сохраняется надлежащая спецификация желудка и формирование паттерна. Ниже эпителиального сигнала Hh транскрипционные факторы FoxF и FoxL опосредуют сложную сигнальную сеть в ассоциированной мезенхиме [73,74].Важным фактором роста, происходящим из мезенхимы, является Fgf10 , который передает сигналы в эпителий через рецептор Fgfr2 на более поздних стадиях развития. Потеря любой молекулы приводит к снижению пролиферации и дефектному морфогенезу желез в эпителии желудка [75,76]. Напротив, избыточная экспрессия Fgf10 ведет к железистой гиперплазии и нарушению цитодифференцировки [77]. Формирование желез в преджелудке птиц также регулируется BMP, WNT5a, Notch и Shh [78–81].У мышей было показано, что Wnt5a активирует путь WNT / PCP, который важен для поддержания полярности эпителиальных клеток, морфогенеза, а также роста и удлинения передней части желудка [69]. Более того, каноническая передача сигналов WNT вносит вклад в рост желудка, поскольку эпителиальная делеция Ctnnb1 ведет к драматическому уменьшению размера желудка [70], хотя и ниже по ходу еще неидентифицированных лигандов WNT. Наконец, EGF является другим важным эпителиальным митогеном, необходимым для нормальной пролиферации и роста слизистой оболочки грызунов [82,83], а эктопический EGF необходим для дифференцировки in vitro эмбриональных структур желудка [16].
5. SUMMARY
В целом, ряд онтогенетических сигнальных путей используется многократно во время развития желудка, чтобы регулировать формирование паттерна энтодермы, спецификацию желудка, регионализацию желудка и морфогенез. В эту группу входят WNT, Bmp, Fgf и RA, и вместе они точно координируют экспрессию факторов транскрипции, которые определяют идентичность клеток. Наше текущее понимание транскрипционных регуляторов развития желудка отсутствует, и для дальнейшей работы необходимо дальнейшее выяснение сигнальных парадигм, лежащих в основе этого процесса.Тем не менее, использование известных эмбриологических механизмов, а также недавно открытых принципов привело к разработке протоколов для дифференциации ткани желудка от PSCs de novo [16,70,84]. Эти системы, в свою очередь, должны оказаться эффективными моделями для изучения развития желудка и заболеваний. Например, в настоящее время нет доступных данных об эпигенетическом контроле развития желудка, а ткани in vitro и хорошо подходят для эпигенетических исследований.
Механизмы развития эмбрионального желудка
Реферат
Желудок – пищеварительный орган, играющий важную роль в физиологии и патофизиологии человека. Источником развития желудка является передняя кишка эмбриона, которая также дает начало ряду других структур. Существует несколько сигнальных путей и факторов транскрипции, которые, как известно, регулируют развитие желудка на разных стадиях, включая формирование паттерна передней кишки, спецификацию желудка и регионализацию желудка.Эти события развития имеют важное значение для более позднего гомеостаза и заболеваний желудка взрослого человека. Здесь мы рассмотрим литературу, которая сформировала наше текущее понимание молекулярных механизмов, которые координируют органогенез желудка. Далее мы обсудим, как парадигмы развития руководят недавними попытками дифференцировать ткань желудка от плюрипотентных стволовых клеток.
Ключевые слова: энтодерма, передняя кишка, желудок, тело, дно, антральный отдел
1. ВВЕДЕНИЕ
Желудок представляет собой эволюционно разнообразную структуру, которая выполняет множество функций, включая переваривание пищи, иммунную защиту и гормональную регуляцию метаболического гомеостаза.В зависимости от своих уникальных диетических потребностей и привычек позвоночные животные адаптировали изменения в своей структурной и гистологической организации желудка [1]. У людей слизистая оболочка желудка полностью состоит из железистого цилиндрического эпителия и разделена на два отдельных отсека, содержащих специализированные типы клеток, которые работают взаимодополняющим образом. Более проксимальная область желудка содержит фундальные железы, которые содержат секретирующие кислоту париетальные клетки, главные клетки, вырабатывающие ферменты, и защитные слизеобразующие клетки, тогда как дистальная область желудка, антральный отдел, состоит в основном из слизистых клеток и эндокринных клеток. включая G-клетки, которые секретируют гастрин.В дополнение к этому, однако, у мышей имеется большой лесной желудок в передней части, который состоит из многослойного плоского эпителия, похожего на эпителий пищевода.
Независимо от его окончательного состава, механизмы, управляющие ранним эмбриональным развитием желудка, по-видимому, сохраняются у всех видов позвоночных. Хотя видоспецифические различия в архитектуре могут иногда препятствовать нашей способности напрямую передавать данные, полученные от животных, людям, мы многое узнали о развитии желудка на модельных организмах, включая мышей, цыплят, лягушек и рыб.Кроме того, недавно было доказано, что энтодерма, полученная из плюрипотентных стволовых клеток человека (hPSC), является ценной модельной системой in vitro для исследования динамических процессов развития передней кишки и желудка. В этом обзоре мы суммируем ранние механизмы развития желудка, сосредотачиваясь на сигнальных путях и регуляторах транскрипции, которые контролируют формирование паттерна энтодермы, спецификацию желудка, регионализацию желудка и морфогенез. Хотя более поздний контроль поведения и гомеостаза желудочных стволовых клеток, вероятно, имеет параллели с процессами раннего развития, эта литература недавно была рассмотрена [1–3] и не будет здесь обсуждаться.
2. СПЕЦИФИКАЦИЯ ЖЕЛУДОЧКА
Эмбриональный желудок происходит из задней части передней кишки и развивается среди ряда соседних тканей, включая пищевод, кишечник, печень, желчный пузырь и поджелудочную железу. Как и в случае развития всех органов энтодермы, за обеспечение судьбы желудка отвечает сложный набор эпителиально-мезенхимальных взаимодействий. И у грызунов, и у эмбрионов кур презумптивная мезодерма желудка необходима для определения судьбы желудка в соседней энтодерме, и она может повторно определять энтодерму, взятую из негастральных областей кишечника [4,5]; однако отвечающая энтодерма компетентна реагировать только на индуцирующие желудок сигналы во время короткого временного окна в раннем развитии [6], указывая тем самым, что спецификация желудка является динамическим во времени и пространстве процессом.Работа нескольких групп привела к выяснению путей передачи сигналов и сетей факторов транскрипции, которые управляют некоторыми из ранних стадий развития желудка.
2.1 Формирование паттерна задней энтодермы передней кишки
После гаструляции ряд инструктивных сигналов формирует паттерн зарождающейся энтодермы, приводящий к трехмерной кишечной трубке, которая грубо разделяется на передний и задний домены (Review in [7]). Задний регион, или задняя кишка, экспрессирует гомеодоменный фактор транскрипции Cdx2 [8,9], и он дает начало тонкому и толстому кишечнику.Передняя энтодерма – это передняя кишка, которая экспрессирует фактор транскрипции HMG box Sox2 [9]. Сигналы, ответственные за это раннее формирование передне-заднего паттерна, были выяснены на многих модельных организмах, и они включают WNT, FGF и BMP [10-13]. Интересно, что все эти пути, как было показано, имеют постериоризирующий эффект на раннюю энтодерму. В формирующейся передней кишке экспрессия Sox2 негативно регулируется с помощью передачи сигналов BMP [14-16]. Более того, репрессия передачи сигналов BMP происходит на ранних стадиях развития пищевода и желудка [17], указывая тем самым, что судьбы этих органов требуют состояния с низким BMP.Хотя WNT, FGF и BMP имеют прямые эффекты на энтодерму [18-20], они обладают активностью формирования паттерна только в присутствии мезодермы, указывая тем самым, что множественные сигналы могут действовать синергетически, чтобы координировать формирование паттерна энтодермы. В самом деле, активность всех трех путей необходима для дифференцировки hPSCs в Cdx2-позитивную ткань задней кишки [16,21].
Вскоре после своего образования Sox2-положительная трубка передней кишки разделяется на ряд примитивных доменов органов. Передняя часть передней кишки в глоточной области эмбриона образует ротоглотку, щитовидную железу, тимус и паращитовидные железы.Более задние части передней кишки дифференцируются в эпителиальную выстилку пищевода и железистого желудка, а также в отрастающие органы, включая легкие, печень, поджелудочную железу и внепеченочную билиарную систему. Способность давать начало такому разнообразию клонов органов подразумевает, что сама передняя кишка может быть разделена на субдомены, которые обладают различными потенциалами развития. Однако этот этап развития краток и труднодоступен экспериментально, поэтому имеется ограниченное количество данных, касающихся этой концепции «формирования паттерна передней кишки».Доказательства в поддержку этой модели приходят через регионализированную экспрессию нескольких факторов транскрипции, которые экспрессируются в задней части передней кишки до спецификации органа, включая Hnf1β , Hnf6 и Prox1 [9,22–24]. В частности, Hnf1β, по-видимому, является главным регулятором развития задней части передней кишки, поскольку его делеция приводит к аберрантной спецификации поджелудочной железы, печени и железистого желудка [24,25].
Ключевым регулятором развития задней части передней кишки является ретиноевая кислота (RA), которая играет многочисленные роли в формировании паттерна в эмбриональном развитии (rev. [26]). Raldh3 , первичный синтетический фермент в пути, экспрессируется в задних мезодермальных тканях, окружающих дистальные отделы передней и задней кишки [27], что указывает на RA как важную молекулу, формирующую паттерн передней кишки. Ранняя активность RA необходима для спецификации нескольких производных задней передней кишки, включая поджелудочную железу [28,29] и легкое [15], и она подавляет развитие передних клонов передней кишки, таких как щитовидная железа [30]. Железистый задний желудок не может формироваться у мышей, лишенных Raldh3 [31], обеспечивая дополнительные доказательства роли RA в развитии задней части передней кишки.В соответствии с этим, применение экзогенного RA является критическим для дифференциации in vitro тканей желудка человека от hPSCs [16]. В этих моделях RA способствует экспрессии HNF1β , указывая тем самым, что регуляторная сеть RA-Hnf1β может контролировать формирование паттерна ранней передней кишки, чтобы создать компетентность для спецификации в клонах задних отделов передней кишки.
Помимо нескольких исследований, описанных выше, известно мало информации о молекулярных путях, которые управляют формированием задней части передней кишки.Снижение передачи сигналов рецептора активина приводит к сходным желудочным фенотипам, наблюдаемым у мутантов Raldh3 [32], но путь TGFβ не был более тщательно исследован на предмет его роли в развитии желудка. Учитывая высокий интерес к созданию полностью функциональных тканей органа передней кишки из hPSCs, важно лучше очертить механизмы, которые разделяют раннюю энтодерму передней кишки на ее производные.
2.2 Определение передней границы желудка
После начального формирования паттерна задняя часть передней кишки делится на отдельные клоны органов.Опять же, молекулярные механизмы, которые точно управляют этими событиями, плохо изучены. Напротив, большая часть наших знаний получена в результате исследований, посвященных установлению границ орган-орган, то есть принятию решения о бинарной судьбе. Предполагаемый желудочный эпителий образуется рядом с пищеводом, тонкой кишкой, поджелудочной железой и печенью; таким образом, спецификация желудка в задней части передней кишки включает процессы, которые исключают или подавляют судьбы каждого из этих других органов.
Процесс установления гастроэзофагеальной границы, вероятно, будет отличаться у мышей, чем у людей, из-за разницы в анатомии между видами млекопитающих.Поскольку у мыши есть лесной желудок, который напоминает пищевод, столбчатый эпителий желудка начинается только на месте схождения межпозвоночного и заднего желудка. Напротив, у людей чешуйчато-столбчатое соединение возникает на границе органов между желудком и пищеводом. На молекулярном уровне кажется, что границы экспрессии генов следуют паттерну плоскостолбчатого соединения скорее у мышей, чем желудочно-пищеводного соединения. Более того, эмбриологические предшественники пищевода и лесного желудка обладают сходным потенциалом развития.Напр., Эктопическая активация β-catenin достаточна для превращения предполагаемых предшественников пищевода в Nkx2-1 -позитивную респираторную линию, и она имеет сходный эффект на передний, но не задний эпителий желудка [33,34]. Следовательно, наиболее вероятно, что граница между лесом и животом у эмбрионов грызунов аналогична границе между желудком и пищеводом в человеческом развитии.
Лиганды пути Hedgehog обычно экспрессируются энтодермальной выстилкой развивающейся кишечной трубки, и они в основном передают сигнал соседней мезодермальной ткани.Большая часть ранней энтодермы у мышей экспрессирует Sonic hedgehog (Shh) , но презумптивный железистый эпителий заднего желудка специфически экспрессирует Indian hedgehog ( Ihh ; [35]). Таким образом, существует граница экспрессии Shh – Ihh на стыке преддверия и заднего желудка. Есть две линии доказательств того, что мезенхима желудка играет важную роль в установлении этого соединения. Во-первых, делеция мезенхимального фактора Hoxa5 нарушает нормальный паттерн экспрессии Shh – Ihh , приводя к дефектной дифференцировке заднего желудка [36].Во-вторых, делеция Shh , которая, как полагают, передает сигналы только непосредственно в мезенхиму [37], также нарушает границу между лесомахом и задним желудком. У обоих мутантов Hoxa5 и Shh [38] задний желудок также принимает некоторые особенности кишечника. Эти данные подтверждают модель, с помощью которой Hoxa5, действуя через неизвестный паракринный фактор, регулирует экспрессию эпителиального лиганда Hh, который, в свою очередь, регулирует мезенхимальные факторы роста, которые дополнительно усиливают соединение между лесом и задним желудком. Т.о., внешние сигнальные механизмы, которые управляют решениями судьбы эпителиальных клеток на передней границе желудка, остаются в значительной степени неизвестными.
Специфический для желудка «главный регулятор» транскрипции еще не был идентифицирован на эмбриональных стадиях. Однако есть несколько широко выраженных факторов, которые способствуют установлению границы пищевода и желудка. Фактор транскрипции цинкового пальца Gata4 устойчиво экспрессируется в заднем желудке и полностью исключен из лесного желудка. Gata4 -null клетки в химерных эмбрионах не вносят вклад в железистый эпителий желудка, а исследования делеций продемонстрировали, что взаимодействия Gata4 с его коактиваторами транскрипции FOG1 / 2 необходимы для нормального развития желудка [39,40].Более того, делеция Gata4 из уже указанного дистального отдела желудка вызывает клеточно-автономную миграцию клеток из заднего желудка в лесной желудок [41]. Родственный фактор, Gata6 , имеет сходный паттерн локализации [42], но его роль в развитии желудка не исследовалась. Таким образом, Gata4 остается одним из очень немногих генов, которые, как известно, необходимы для спецификации желудка. Ранний ген передней кишки Sox2 остается экспрессированным как в пищеводе, так и в желудке на протяжении большей части развития.В то время как это необходимо для правильной дифференцировки плоского эпителия передней кишки [43], железистая дифференцировка желудка не нарушается у гипоморфов Sox2. Хотя было бы важным открытие, что Sox2 незаменим для развития желудка, полный анализ потери функции еще не проводился.
2.3 Определение задней границы желудка
Желудочно-кишечное соединение устанавливается уже на E8.5 у эмбриона мыши, поскольку оно идентифицируется как граница экспрессии Sox2 – Cdx2 .Хотя небольшое количество клеток коэкспрессирует эти факторы в ранней энтодерме [9], граница заостряется и уточняется со временем развития [44]. Эти факторы транскрипции являются важными регуляторами судьбы передней и задней кишок соответственно. Эктопическая активация Sox2 в задней кишке подавляет фенотип кишечника и индуцирует особенности железистого желудка, но не репрессирует сам Cdx2 [45]. Сходным образом принудительная экспрессия Cdx2 в ранее определенном развивающемся эпителии желудка достаточна для индукции кишечной метаплазии [46], но не подавления Sox2 [47].Эти находки, что Sox2 и Cdx2 не являются взаимно репрессивными, интересны, учитывая, что они оказывают доминирующее влияние на дифференцировку желудка и кишечника. Более того, удивительно, что потеря функции Cdx2 имеет разные эффекты в зависимости от времени удаления. Ранняя потеря Cdx2 (через Foxa3 -Cre) ведет к нарушению дифференцировки кишечника, но кишечник принимает пищеводный, а не желудочный фенотип [48]. В этой модели граница желудка не затронута.Напротив, более поздняя делеция Cdx2 с помощью Villin -CreER продуцирует пилорические желудочные железы в кишечнике [49]. Взятые вместе, эти исследования показали, что Sox2 и Cdx2 выполняют ключевые функции в установлении границ желудочно-кишечного тракта и поддержании судьбы органов. Однако результаты также предполагают, что должны быть неустановленные факторы, которые способствуют определению судьбы желудка и кишечника.
Раннее формирование границы желудочно-кишечного тракта организовано мезенхимально-эпителиальной сетью, что было выяснено в ключевой серии статей о факторе транскрипции Barx1 [50,51].Этот фактор специфически экспрессируется в предполагаемой мезенхиме желудка и способствует экспрессии секретируемых антагонистов передачи сигналов WNT (sFRP) в этой области. Это опосредованное Barx1 ингибирование WNT необходимо для подавления кишечной трансформации в презумптивном эпителии желудка. В то время как активация WNT / β-катенина способна стимулировать экспрессию генов задней кишки в нескольких модельных системах, включая энтодерму лягушки, мыши и человека [10,19,21], эктопическая индукция кассеты Barx1-sFRP в мезенхиме задней кишки не влияет на дифференцировку кишечный эпителий [52].Это несоответствие может быть объяснено либо временем репрессии передачи сигналов WNT, либо существованием др. Сигнальных путей, которые регулируют это решение судьбы. Одним из примеров является сигнальный путь BMP, который в моделях энтодермы человека in vitro необходим для спецификации кишечника, и он должен быть неактивным во время раннего развития передней кишки [16]. Аналогичным образом, BMP достаточен для подавления экспрессии Sox2 в передней кишке [14], и активность BMP, соответственно, низкая в эмбриональном желудке и пищеводе.Взятые вместе, эти исследования показывают, что множественные сигнальные пути, включая по крайней мере WNT и BMP, действуют в комбинации, чтобы установить границы органов на стыке передней и задней кишки.
2.4 Границы экспрессии генов между желудком и дополнительными органами
В дополнение к конкурирующим клонам вдоль продольной оси пищеварительного канала, ранние предшественники желудка также должны быть указаны отдельно от отпочковывающихся органов задней части передней кишки – поджелудочной железы и печени.Опять же, существуют границы факторов транскрипции, которые различают эти ранние домены органов. В то время как фактор поджелудочной железы Pdx1 также экспрессируется в эпителии дистального отдела желудка и проксимального отдела кишечника, фактор bHLH Ptf1a очень специфичен для поджелудочной железы на E9.5 [53,54]. Как пример ранней пластичности задней энтодермы передней кишки, эктопическая экспрессия Ptf1a достаточна для индукции судьбы поджелудочной железы у предшественников желудка [55,56]. Делеция Hes1 , др. Фактора bHLH, также ведет к эктопической дифференцировке поджелудочной железы по большей кривизне желудка [57], подтверждая, что Hes1 репрессирует судьбу поджелудочной железы в презумптивном желудке.Хотя Hes1 часто функционирует ниже передачи сигналов Notch, дефекты желудочной спецификации не наблюдаются у др. Мутантов пути Notch [58]. Следовательно, Hes1 может действовать независимо от Notch, но ни его функция, ни функция пути Notch не исследовались в дальнейшем в развивающемся желудке.
Как описано ранее, желудок и печень развиваются рядом друг с другом и экспрессируют ряд общих маркеров, таких как Hnf1β . Несмотря на их близость в передней кишке, мало что известно о механизмах, которые разделяют ранние желудочные и печеночные клоны, за исключением того, что активация BMP и FGF способствует спецификации печени [59,60].Таким образом, отсутствие этих факторов, таким образом, вероятно, способствует развитию желудка, что снова подчеркивает ингибирующую роль BMP в спецификации желудка. Одно интересное наблюдение состоит в том, что в то время как латеральная (предположительно желудочная) энтодерма передней кишки на E9.5 экспрессирует Gata4, почкующийся дивертикул печени является отрицательным Gata4 [61]. Эти данные снова указывают на потенциально важную роль Gata4 в формировании паттерна передней кишки и сегрегации клонов, но ранние специфичные для энтодермы нокауты еще не описаны.
Ключевые сигнальные пути и факторы транскрипции, необходимые для формирования паттерна задней части передней кишки и спецификации желудка, суммированы в.
Схематический обзор механизмов развития, ведущих к спецификации желудкаA. Формирование паттерна задней энтодермы передней кишки. Во время формирования паттерна энтодермы, который происходит около E8.5 у мышей, сигналы WNT, Bmp и Fgf способствуют экспрессии гена задней кишки (Cdx2). BMP подавляет маркер передней кишки Sox2. Активность RA требуется для спецификации задней области передней кишки, где одним из ее генов-мишеней является Hnf1β.B. Сагиттальная и поперечная репрезентации ограничения клонов и спецификации желудка у мышей.
3. ИЗОБРАЖЕНИЕ ЭМБРИОНАЛЬНОГО ЖЕЛУДКА
После уточнения, предшественники желудка делятся далее вдоль ростро-каудальной оси. Проксимальный отдел образует эпителий тела и глазного дна (и, кроме того, лесной желудок у мышей), а дистальный участок переходит в антральный желудок. Во время эмбриональных стадий одно из немногих известных молекулярных различий между этими желудочными доменами – это Pdx1 , который специфически локализуется в презумптивной антральной области на E10.5 [62]. Удивительно, но роль Pdx1 в формировании паттерна желудка не исследована, за исключением его известной потребности в дифференцировке антральных G-клеток на более поздних стадиях [63]. Pdx1 мутантные эмбрионы не обнаруживают грубых или очевидных дефектов морфологии желудка [64], но было бы интересно посмотреть, влияет ли этот фактор транскрипции на дифференцировку желудка в более общем плане. Фактор транскрипции Nkx6.3 также экспрессируется специфическим для антрального отдела образом, но, по-видимому, необходим только для спецификации G-клеток в антральном отделе [65].Для более полного понимания механизмов формирования паттерна желудка необходимо идентифицировать дополнительные гены, которые демонстрируют профили экспрессии, специфичные для региона.
Как и ожидалось, мезенхимно-эпителиальные взаимодействия, по-видимому, играют важную роль в формировании желудочного паттерна. Bapx1 является фактором транскрипции, экспрессирующимся в мезенхиме, окружающей дистальный отдел желудка и проксимальный отдел кишечника [66]. Когда он удаляется, антральный сегмент желудка сокращается, и париетальные клетки обнаруживаются около соединения желудочно-кишечного тракта.Сигнальный механизм, лежащий в основе этого явления, у грызунов не идентифицирован. Однако в желудке птиц Bapx1 репрессирует экспрессию Wnt5a и Bmp4 [67], указывая тем самым, что передача сигналов WNT и / или BMP может играть роль в формировании паттерна желудка. Было замечено, что каноническая активность WNT ограничена ростральным эмбриональным желудком и исключена из предполагаемого антрального отдела [50,68,69]. После этого наблюдения было показано, что делеция канонического эффектора WNT Ctnnb1 в эпителии приводит к эктопической экспрессии Pdx1 и последующей антрализации проксимального отдела желудка.У этих мышей потеря Ctnnb1 привела к нарушению цитодифференцировки фундального типа клеточно-автономным образом. Эти данные подтверждают модель, в которой передача сигналов WNT / β-catenin может переключаться между судьбами клеток в развивающемся железистом желудке. Высокая активность WNT требуется для дифференциации области тела / дна, в то время как подавление пути позволяет специфицировать антральный домен (суммировано в). Делеция у этих животных в основном происходит до формирования желудочного паттерна, поэтому пока неясно, могут ли манипуляции с WNT / β-catenin влиять на судьбу желудка после того, как начальное формирование паттерна уже произошло.Этот принцип в дальнейшем был применен для модуляции клеточной судьбы во время дифференцировки in vitro и PSC в органоиды желудка человека (hGO). В отсутствие передачи сигналов WNT hGO содержат Pdx1 -положительный антральный эпителий, но ранняя стимуляция WNT индуцирует hGO фундального типа, которые содержат париетальные и главные клетки [70].
Сводка WNT-опосредованных механизмов формирования желудочного паттерна in vivo и in vitroA. Передача сигналов WNT / β-catenin способствует спецификации глазного дна из пула клеток-предшественников желудка во время E9-10.B. Активация WNT способствует образованию фундальных органоидов желудка человека (hGO), подавляя антральную спецификацию из сфероидов задней части передней кишки, происходящих от hPSC.
Новые данные, подтверждающие роль передачи сигналов WNT / β-catenin в формировании тела / дна, по-видимому, несовместимы с предыдущими моделями, в которых передача сигналов WNT д. Репрессироваться во время развития желудка. Есть несколько возможных объяснений, которые могут разрешить это несоответствие. Время является важной переменной в эмбриональном развитии, и поэтому возможно, что ранний WNT способствует спецификации кишечника, тогда как более поздний сигнал WNT регулирует формирование желудочного паттерна.Кроме того, эпителиальный ответ на WNT может модулироваться активностью других путей, таких как BMP, как описано выше. Тем не менее, необходима дополнительная работа, чтобы ответить на эти вопросы и определить, как определяется судьба желудка.
4. МОРФОГЕНЕЗ ЖЕЛУДОЧНОГО ЭПИТЕЛИЯ
Ранний эпителий передней кишки представляет собой простую кубовидную выстилку, не имеющую архитектурной сложности. Следуя спецификации желудка и формированию паттерна, слизистая оболочка проходит стадию псевдостратификации до принятия высокой столбчатой морфологии, которая обнаруживается во взрослом органе, подобно событиям, наблюдаемым в кишечнике [71].Сопровождая эти изменения формы клеток, эпителий подвергается складчатости и железистому морфогенезу, который прогрессивно развивается на постнатальных стадиях, что приводит к высокоорганизованной сложной структуре, обнаруживаемой в зрелом желудке. Точные механизмы, которые координируют эти морфогенетические события, полностью не изучены, но известно, что несколько эмбриональных сигнальных молекул играют роль.
Подобно своей роли в регуляции решений клеточной судьбы, мезенхима желудка важна для правильного роста и морфогенеза желудка.Лиганды Hh, происходящие из эпителия, поддерживают выживание и пролиферацию мезенхимальных клеток, и одновременная делеция Shh и Ihh , таким образом, приводит к серьезной задержке роста желудка и кишечника [72]. Несмотря на их аберрантный морфогенез, у этих мутантов сохраняется надлежащая спецификация желудка и формирование паттерна. Ниже эпителиального сигнала Hh транскрипционные факторы FoxF и FoxL опосредуют сложную сигнальную сеть в ассоциированной мезенхиме [73,74].Важным фактором роста, происходящим из мезенхимы, является Fgf10 , который передает сигналы в эпителий через рецептор Fgfr2 на более поздних стадиях развития. Потеря любой молекулы приводит к снижению пролиферации и дефектному морфогенезу желез в эпителии желудка [75,76]. Напротив, избыточная экспрессия Fgf10 ведет к железистой гиперплазии и нарушению цитодифференцировки [77]. Формирование желез в преджелудке птиц также регулируется BMP, WNT5a, Notch и Shh [78–81].У мышей было показано, что Wnt5a активирует путь WNT / PCP, который важен для поддержания полярности эпителиальных клеток, морфогенеза, а также роста и удлинения передней части желудка [69]. Более того, каноническая передача сигналов WNT вносит вклад в рост желудка, поскольку эпителиальная делеция Ctnnb1 ведет к драматическому уменьшению размера желудка [70], хотя и ниже по ходу еще неидентифицированных лигандов WNT. Наконец, EGF является другим важным эпителиальным митогеном, необходимым для нормальной пролиферации и роста слизистой оболочки грызунов [82,83], а эктопический EGF необходим для дифференцировки in vitro эмбриональных структур желудка [16].
5. SUMMARY
В целом, ряд онтогенетических сигнальных путей используется многократно во время развития желудка, чтобы регулировать формирование паттерна энтодермы, спецификацию желудка, регионализацию желудка и морфогенез. В эту группу входят WNT, Bmp, Fgf и RA, и вместе они точно координируют экспрессию факторов транскрипции, которые определяют идентичность клеток. Наше текущее понимание транскрипционных регуляторов развития желудка отсутствует, и для дальнейшей работы необходимо дальнейшее выяснение сигнальных парадигм, лежащих в основе этого процесса.Тем не менее, использование известных эмбриологических механизмов, а также недавно открытых принципов привело к разработке протоколов для дифференциации ткани желудка от PSCs de novo [16,70,84]. Эти системы, в свою очередь, должны оказаться эффективными моделями для изучения развития желудка и заболеваний. Например, в настоящее время нет доступных данных об эпигенетическом контроле развития желудка, а ткани in vitro и хорошо подходят для эпигенетических исследований.
Наука о детском пищеварении
Пищеварение определяется как процесс расщепления пищи организмом на компоненты, которые можно усвоить и использовать там, где они необходимы. Каждый шаг происходит в желудочно-кишечном тракте (ЖКТ), который включает в себя рот, пищевод, желудок, тонкий и толстый кишечник (толстую кишку). Некоторые вспомогательные органы – поджелудочная железа, желчный пузырь и печень – также играют важную роль.
Хотя это может остаться незамеченным, но первый раз, когда новорожденный переваривает грудное молоко или смесь, является поистине знаменательным моментом.В утробе пищеварение не нужно. Питательные вещества из крови матери всасываются через плаценту и пуповину в кровоток ребенка, а продукты жизнедеятельности переносятся обратно в кровь матери тем же путем.
До рождения желудочно-кишечный тракт просто ждет подходящего момента, чтобы начать делать свою работу. Первое кормление дает пищеварительной системе младенца толчок, стимулируя как движение кишечника, так и созревание всего желудочно-кишечного тракта. Рацион вашего ребенка имеет огромное влияние на его рост и развитие в настоящее время, а также на его здоровье в будущем.
Переваривание грудного молока или смеси не только обеспечивает организм энергией, но и способствует созданию здорового кишечного микробиома. Разнообразный и процветающий микробиом имеет решающее значение для иммунной системы и здоровья на протяжении всей жизни.
Что такое микробиом кишечника?
Набор бактерий, вирусов, грибов, простейших и других микроорганизмов в кишечном тракте известен как микробиом кишечника. В основном он находится в толстом кишечнике.
Рацион вашего ребенка имеет огромное влияние на его рост и развитие в настоящее время, а также на его здоровье в будущем.Исследования показали, что состав микрофлоры кишечника в младенчестве влияет на будущее развитие множества аутоиммунных состояний, включая диабет 1 типа и воспалительные заболевания кишечника.
Правильное пищеварение также имеет решающее значение для эффективного усвоения питательных веществ, что влияет практически на все аспекты здоровья вашего ребенка. Например, если пищевые жиры не полностью перевариваются в желудочно-кишечном тракте, жирные кислоты омега-3, жизненно важные для развития глаз и мозга, могут не всасываться в кровь и использоваться для выполнения своих функций.
Анатомия пищеварительного тракта
Как и многие другие части человеческого тела, желудочно-кишечный тракт не полностью сформирован при рождении. Определенные ферменты и различия в анатомии означают, что у новорожденных пищеварение происходит немного по-другому, но их тела, тем не менее, хорошо оборудованы, чтобы расщеплять пищу на компоненты, готовые к усвоению.
Давайте начнем с изучения анатомии пищеварительного тракта и посмотрим, что происходит с момента, когда пища попадает в рот вашего ребенка, пока она не оказывается в его подгузнике.Каждый отдел желудочно-кишечного тракта имеет особую структуру, которая позволяет ему выполнять различные роли в транспортировке и переваривании питательных веществ.
Желудочно-кишечный тракт представляет собой длинную изогнутую трубку, которая тянется от рта к анальному отверстию. У него удивительно большая поверхность, даже больше, чем у кожи.
Эта площадь поверхности в основном связана с ворсинками и микроворсинками (крошечными волоскоподобными структурами), которые покрывают тонкий и толстый кишечник. После завершения пищеварения питательные вещества всасываются в кровоток, печень и другие места назначения через тысячи квадратных сантиметров ткани, обеспечиваемой ворсинками и микроворсинками.
Устье
Рот вашего ребенка играет роль приема грудного молока или смеси. Их челюсти и язык работают, чтобы вытягивать молоко из груди или бутылки. Когда они глотают, язык выталкивает жидкость к задней стенке глотки и в пищевод. Небольшой тканевый лоскут, называемый надгортанником, покрывает трахею (или трахею) во время глотания.
Переваривание углеводов (крахмалов и сахаров) начинается во рту по достижении младенцами трехмесячного возраста благодаря ферменту, называемому амилазой слюны.Поскольку слюнные железы начинают секретировать амилазу, как только человек ожидает приема пищи, это считается первым шагом в пищеварении.
Пищевод
Трубка, соединяющая рот с желудком, называется пищеводом. Его задача двоякая: выталкивать пищу или жидкость изо рта в желудок и предотвращать обратный поток или рефлюкс содержимого желудка.
Как и весь желудочно-кишечный тракт, пищевод состоит из серии мышц, которые сокращаются в волнообразной последовательности (называемой перистальтикой), чтобы пища перемещалась по желудочно-кишечному тракту во время пищеварения.
Рефлюксу препятствует кольцеобразная мышца, называемая нижним сфинктером пищевода. Этот сфинктер находится в нижней части пищевода, чуть выше желудка. Он расслабляется, позволяя пище попасть в желудок, а затем снова сжимается, чтобы предотвратить попадание пищи обратно в пищевод.
Нижний сфинктер пищевода часто бывает слабым до одного года, поэтому у многих младенцев возникает рефлюкс, известный как гастроэзофагеальная рефлюксная болезнь (ГЭРБ), если он вызывает проблемные симптомы.Но к своему первому дню рождения только 10% младенцев все еще испытывают это состояние.
Желудок
Желудок отвечает за хранение пищи, в то время как она сочетается с ферментами и кислотами для пищеварения. Желудочная кислота вырабатывается печенью, накапливается в желчном пузыре и попадает в желудок в ответ на прием пищи.
Желудочная кислота состоит в основном из соляной кислоты. Он чрезвычайно эффективен, поддерживает настолько низкий уровень pH в желудке, что слизистая оболочка желудка будет сожжена, если не будет защищена толстым слоем слизи.
Эта кислая среда активирует пищеварительные ферменты, позволяя им расщеплять пищу в желудке. После того, как пища переварена, желудок регулирует выброс ее содержимого в тонкий кишечник.
Тонкий кишечник
Тонкая кишка представляет собой трубчатый орган, разделенный на три части: двенадцатиперстную кишку, тощую кишку и подвздошную кишку. Двенадцатиперстная кишка – это рабочая лошадка пищеварительного процесса, расщепляющая углеводы, белки и жиры. Всасывание многих витаминов и минералов происходит в тощей и подвздошной кишках.
Частично переваренная пища из желудка объединяется в тонком кишечнике с выделениями поджелудочной железы, которые доставляются через тонкие протоки. Пищеварительные ферменты из этих выделений отвечают за большую часть пищеварительного процесса в тонком кишечнике.
Каждый фермент действует только на макроэлементы, которые он должен переваривать.
- Амилаза и другие углеводные ферменты переваривают углеводы до глюкозы и других простых сахаров
- Липаза расщепляет жиры на их строительные блоки, глицерин и жирные кислоты
- Протеаза расщепляет белки до аминокислот
Большинство этих ферментов вырабатываются поджелудочной железой.
Соли желчных кислот – это тип детергента, который позволяет диетическому жиру смешиваться с водой в тонком кишечнике, чтобы он мог перевариваться липазой.
Конечные продукты пищеварения всасываются в кровоток через ворсинки и микроворсинки. Все, что остается после всасывания питательных веществ и жидкости, попадает в толстую кишку и выводится в виде стула.
Толстая кишка (толстая кишка)
Ободочная кишка изгибается вверх от конца тонкой кишки, через брюшную полость и вниз к прямой кишке.Он в основном отвечает за поглощение воды и электролитов.
По мере того, как отходы (или кал) перемещаются по толстой кишке, вода и электролиты удаляются, поэтому стул становится более твердым. К тому времени, когда он достигает последней части толстой кишки (называемой сигмовидной кишкой), стул в основном состоит из пищевых отходов и бактерий. Тело удерживает стул в сигмовидной кишке до тех пор, пока не накопится достаточно, чтобы выйти в прямую кишку для дефекации.
Прямая кишка
Сфинктер О’Бейрна регулирует поток шлаков из сигмовидной кишки в прямую кишку, которая является местом удержания стула.Внутренний и внешний анальные сфинктеры регулируют отток каловых масс из прямой кишки.
Все части пищеварительной системы работают вместе, чтобы принимать пищу, транспортировать ее через систему желудочно-кишечного тракта, механически и химически расщеплять ее на составные части, а затем удалять лишний материал как отходы.
Добавочные органы пищеварительного тракта
Помимо самого пищеварительного тракта, есть несколько вспомогательных органов, которые играют решающую роль в переваривании пищи.К ним относятся:
Желчный пузырь
Желчный пузырь – это крошечный мешочек, расположенный чуть ниже печени. Здесь собирается и концентрируется желчь из печени, которая попадает в двенадцатиперстную кишку.
И желчный пузырь, и печень необходимы для правильного пищеварения и усвоения жиров и жирорастворимых витаминов, в том числе витаминов A, D, E и K.
Печень
Печень – самый большой орган в организме. Он отвечает за метаболизм белков и углеводов, а также за хранение гликогена и витаминов.Он также способствует образованию, хранению и выведению желчи и играет роль в метаболизме жиров.
Основная пищеварительная функция печени – обрабатывать питательные вещества, всасываемые из тонкого кишечника, и превращать их в химические вещества, которые могут использоваться организмом. В печени также собираются, обрабатываются, хранятся или выводятся токсины, в том числе некоторые лекарства, для защиты остального тела.
Поджелудочная железа
Поджелудочная железа выделяет в тонкий кишечник ферменты для переваривания жиров, белков и углеводов.Хотя пищеварительные ферменты вырабатываются экзокринной железой поджелудочной железы, многие люди более знакомы с гормоном инсулином, который вырабатывается эндокринными железами поджелудочной железы.
Важность грудного молока в пищеварении
Грудное молоко также содержит ферменты, которые помогают пищеварению, такие как амилаза, липаза и протеаза. Это одна из причин, по которой грудное молоко считается идеальной пищей для новорожденных, поскольку большинство пищеварительных ферментов присутствуют в очень низком количестве при рождении. Они неуклонно поднимаются до взрослого уровня после отлучения от груди.
Различия в пищеварении у младенцев и взрослых
Многие аспекты пищеварения младенцев, в том числе то, как развивается желудочно-кишечный тракт, до сих пор остаются загадкой для медицинских экспертов. Причина этого пробела в знаниях заключается в том, что для исследования желудочно-кишечного тракта требуются инвазивные процедуры, которые обычно не выполняются на младенцах без медицинской необходимости.
Однако мы знаем, что пищеварение у младенцев отличается от пищеварения взрослых во многих отношениях. Существует несколько анатомических, а также функциональных различий между пищеварительным трактом младенцев и взрослых.
Устье
У младенцев язык больше по сравнению с ротовой полостью, а лишние жировые подушечки по бокам языка помогают при сосании. Как отмечалось выше, амилаза слюны отсутствует до 3-месячного возраста.
Однако у младенцев (в отличие от взрослых) во рту действительно есть липаза, которая инициирует переваривание жиров. Этот фермент начинает снижаться в младенчестве и отсутствует в детстве.
Пищевод
У новорожденного пищевод составляет около 4 1/2 дюймов в длину (по сравнению с 9 1/2 дюйма в длину у взрослых), а нижний пищеводный сфинктер составляет около 1/2 дюйма в диаметре.В горле надгортанник лежит над мягким небом, чтобы обеспечить дополнительную защиту дыхательных путей во время глотания.
Желудок
Желудок новорожденного может вместить только около 20 мл (чуть больше 1 столовой ложки) жидкости. Это объясняет, почему младенцам нужно есть каждые пару часов.
Сразу после рождения pH желудка ребенка выше, чем у взрослых, около нейтрального уровня 7. Это связано с потреблением плодом околоплодных вод, pH которого также равен 7. Для сравнения, pH желудка взрослого человека составляет между 1 и 2.
Нейтральный рН желудка ребенка позволяет макроэлементам (углеводам, жирам и белкам) из грудного молока или смеси проходить в тонкий кишечник без полного переваривания, где они в большей степени всасываются непосредственно в кровь.
Высокий уровень pH в желудке сохраняется недолго и начинает снижаться в течение 24 часов после рождения. У младенцев в возрасте нескольких дней pH натощак составляет от 3 до 3,5.
Еще одна разница в возрасте заключается в том, что липаза играет гораздо большую роль в переваривании жира в желудке младенца.У взрослых липаза более активна в тонком кишечнике.
Исследования показали, что желудки младенцев опорожняются примерно в два раза быстрее после приема пищи грудным молоком по сравнению с желудками, полученными из смеси. Это объясняет идею о том, что младенцы, находящиеся на искусственном вскармливании, спят дольше и / или лучше, чем младенцы, находящиеся на грудном вскармливании. На самом деле они дольше ощущают сытость, что позволяет им дольше отдыхать между кормлениями.
Тонкий кишечник
Также существуют различия между тонкой кишкой младенца и взрослого.У младенца его длина составляет от 100 до 120 дюймов (8-10 футов), а у взрослого – примерно 264 дюйма (22 фута).
Одной из ключевых характеристик тонкого кишечника сразу после рождения является его повышенная проницаемость. Большие молекулы (например, белки и углеводы) могут легко проходить через стенку тонкой кишки в течение короткого времени после рождения, но это быстро меняется по мере закрытия промежутков в стенке.
Иммуноглобулины – это иммунный белок, который защищает младенцев от болезней.Поскольку у младенцев нет сильной иммунной системы при рождении, они полагаются на иммуноглобулины из материнского грудного молока, чтобы помочь в ее формировании. Одна из причин, по которой стенка тонкой кишки может быть более проницаемой сразу после рождения, – это максимизация переноса иммуноглобулинов из грудного молока в организм ребенка.
Продолжаются исследования, чтобы определить, как долго длится это окно. Мы действительно знаем, что как только желудок и поджелудочная железа начинают вырабатывать пептидазы (тип фермента, переваривающего белки) вскоре после рождения, количество белков, которые в неповрежденном виде достигают тонкой кишки, резко падает.
У младенцев соли желчных кислот играют важную роль не только в переваривании жиров, но и в очищении организма от билирубина (для предотвращения желтухи), созревании желудочно-кишечного тракта и создании полезных бактерий в кишечнике.
Хотя производство солей желчных кислот у младенцев довольно низкое, их тонкий кишечник может реабсорбировать желчь из крови. По сути, это способ новорожденного рециркулировать свои желчные соли для использования до тех пор, пока печень не сможет вырабатывать их в достаточных количествах. Интересно, что грудное молоко содержит соли желчных кислот и липазу, которые способствуют перевариванию жиров.
Еще одно из многих ферментативных различий заключается в том, что младенцы производят больше ферментов, специфичных для углеводов, чем взрослые. Это позволяет их телам переваривать высокий уровень лактозы и других сахаров, содержащихся в грудном молоке и смесях.
После того, как началось употребление твердой пищи и младенцы отлучены от груди, профиль их кишечных и панкреатических ферментов изменится и станет больше похож на профиль взрослого.
Толстая кишка
Толстая кишка играет гораздо большую роль в усвоении питательных веществ у новорожденных, чем у взрослых.Исследователи считают, что это может быть способом организма компенсировать ограниченное всасывание, которое имеет место в тонком кишечнике в неонатальном периоде (после закрытия краткого окна проницаемости).
Табуреты
Первые испражнения называются меконием. Меконий густой, липкий и смолистый. Он имеет черный или темно-зеленый цвет и состоит из слизи, верникса (белого сырного вещества, присутствующего на коже ребенка), лануго (тонких волосков на коже ребенка, особенно у недоношенных), гормонов и углеводов.
Крайне необходимо, чтобы стул у новорожденного ребенка вышел в течение 24 часов после рождения. После выделения мекония родители заметят, что стул у их ребенка мягче, чем у взрослого. Это потому, что младенцы пьют только грудное молоко или смесь в течение первых 6 месяцев жизни.
Мало того, что их диета полностью жидкая, она также содержит незначительное количество клетчатки и не содержит твердых белков (например, в мясе и яйцах). Эти диетические компоненты отвечают за создание большей части стула у детей старшего возраста или взрослых. .
Когда младенцы начинают есть твердую пищу, их стул также становится более твердым.
Здоровые кишечные бактерии
В последние годы исследования значительно расширили наши знания о кишечных бактериях и их важности во всем, от физического здоровья до эмоционального благополучия. Здоровье кишечника ребенка будет влиять не только на его текущий рост, но и на его общее состояние здоровья на долгие годы.
Ранее считалось, что желудочно-кишечный тракт был бесплоден при рождении.Однако исследования в настоящее время установили, что в утробе матери она колонизирована бактериями в результате плаценты и попадания околоплодных вод.
Хотя микробиом кишечника младенцев не так разнообразен, как у взрослых, вскоре после рождения он быстро колонизируется из таких источников, как грудное молоко, пробиотики и другие внешние бактерии и вирусы. Создание здорового микробиома кишечника в первые несколько лет жизни имеет решающее значение для сохранения здоровья в дальнейшей жизни.
Помимо пищеварительных ферментов, здоровые кишечные бактерии важны для правильного пищеварения и усвоения питательных веществ.Жиры и особый тип углеводов, называемые олигосахаридами, служат пищей для кишечных бактерий у младенца, позволяя бактериям размножаться, когда они принимают участие в пищеварительном процессе.
Однако олигосахариды, обнаруженные в большом количестве в грудном молоке, несут ответственность за колонизацию до 90% микробиома кишечника младенца.
Кишечные бактерии также синтезируют витамины группы В и витамин К, который играет жизненно важную роль в свертывании крови. Кроме того, они обеспечивают правильную работу иммунной системы.Младенцы на грудном вскармливании получают натуральные пробиотики и олигосахариды с грудным молоком, которые полезны для микробного сообщества в их кишечнике.
По мере того, как мы узнаем больше о связи микробиома кишечника младенца с грудным вскармливанием, вполне вероятно, что текущие рекомендации по грудному вскармливанию станут еще более строгими. В настоящее время Всемирная организация здравоохранения рекомендует исключительно грудное вскармливание в течение как минимум первых 6 месяцев жизни.
Однако, если вы кормите ребенка смесью, знайте, что смесь обеспечивает здоровую диету и для вашего ребенка.Некоторые формулы обогащены пробиотиками, олигосахаридами и другими полезными ингредиентами, имитирующими те, которые естественным образом содержатся в грудном молоке.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно.Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом.Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу.Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта.Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Какают ли младенцы в утробе матери? Как работает пищеварение плода
То, что попадает внутрь, должно выходить наружу. Хотя их не всегда приятно (или ароматно) убирать, полные подгузники – один из лучших признаков того, что пищеварительная система ребенка выполняет свою работу и усилия по кормлению этого крошечного рта окупаются.
Этот процесс начинается задолго до родов. Вот как все происходит (так сказать).
Когда младенцы начинают усваивать питательные вещества от матери?
Младенцы начинают усваивать питательные вещества от матери примерно через три-пять дней после зачатия. Именно тогда оплодотворенная яйцеклетка удовлетворяет свои энергетические потребности за счет питательных веществ, выделяемых эндометрием матери (тканью, выстилающей матку).
Вскоре после имплантации, что обычно происходит через восемь-девять дней после зачатия, у эмбриона образуется желточный мешок.Желточный мешок обеспечивает жизненно важное питание и газообмен между мамой и ребенком на протяжении большей части первого триместра, пока плацента не начнет замещать ребенка примерно на 10 неделе беременности.
Это означает, что с самого начала ваш ребенок получает все свое питание от вас. Его собственная пищеварительная система не вступит во владение, пока он не родится и не начнет потреблять (и какать) грудное молоко или смесь.
Другими словами, важно то, что вы едите на протяжении всей беременности. Поэтому обязательно принимайте витамины для беременных ежедневно и соблюдайте сбалансированную диету для беременных.Это означает употребление большого количества продуктов, богатых:
- Фолиевая кислота (содержится в бобах, авокадо, листовой зелени, обогащенном цельнозерновом хлебе и других продуктах), чтобы обеспечить развитие новых здоровых клеток и предотвратить некоторые роды. дефекты
- Омега-3 (которые вы можете получить из лосося, сардин, сельди, грецких орехов и яиц DHA), для здорового развития мозга и глаз
- Витамин D (в рыбе, яйцах, витаминизированных апельсиновых соках и хлопьях) для поддержания здоровья костей, зубов, глаз и кожи
- Кальций (в молочных и альтернативных молочных продуктах) для обеспечения прочности костей и зубов, а также здоровья сердца, мышц и нервов
Какают ли младенцы матка?
Младенцы много писают в утробе матери, но обычно не какают до рождения.
Во время беременности в кишечнике ребенка начинает накапливаться липкое зеленовато-черное вещество, известное как меконий. Это первая какашка ребенка. Это не еда, а то, что ваш ребенок накопил в кишечнике во время внутриутробного развития (например, старые клетки желудочно-кишечного тракта и клетки кожи), поэтому он сильно отличается от детских фекалий, которые еще не появились.
Обычно вы видите меконий в первых подгузниках вашего ребенка, но иногда он выходит наружу, пока ребенок еще находится в утробе матери.Если это произойдет, есть риск, что он может вдохнуть околоплодные воды, окрашенные меконием, что может вызвать раздражение его легких или привести к серьезному заболеванию.
Так что сразу же сообщите своему врачу или акушерке, если у вас подтекают зеленые или коричневые околоплодные воды. Ваш практикующий врач может решить ускорить роды и осмотреть ребенка, как только он родится.
Как развивается пищеварительная система вашего ребенка
Пищеварительная система вашего ребенка быстро развивается в течение девяти месяцев беременности – от слоя клеток до полноценной системы питания.Вот основные сведения о том, как пищеварительная система вашего ребенка развивается от триместра к триместру.
Первый триместр
В первые несколько недель беременности у эмбриона развиваются три слоя клеток. Самая внутренняя, называемая энтодермой, в конечном итоге станет пищеварительной системой вашего ребенка (а также другими структурами, такими как его печень, легкие, поджелудочная железа и желчный пузырь). Мезодерма, или средний слой, является источником половых органов, костей, почек и мышц. А эктодерма, или внешний слой, развивается в нервную систему, волосы, кожу и части глаз.
На самом базовом уровне пищеварительная система представляет собой серию трубок (таких как пищевод и кишечник), ведущих от рта (точка входа) к анальному отверстию (выход). К 8 неделе беременности эта трубка начинает формироваться вместе с зоной ожидания (также известной как желудок). На данный момент петли кишечника слишком велики, чтобы поместиться в крохотном животике вашего ребенка, поэтому они выпирают в пуповину. (Это только временно!)
Интересный факт: хотя почки являются частью мочевыделительной системы, они выполняют аналогичную функцию, помогая выводить шлаки из организма.И к тому времени, когда вам исполнится всего 8 недель, у вашего ребенка уже будет два набора временных почек, и будет формироваться постоянный набор.
Примерно к 10-й неделе желудок ребенка и те новые почки, которые остались на всю жизнь, начинают усиленно работать, вырабатывая пищеварительный сок и ферменты в желудке и мочу в почках. Но ваш ребенок по-прежнему будет получать все необходимое ему питание (и выводить все отходы, которых у него нет) через желточный мешок.
Второй триместр
Как только ваша собственная пищеварительная система успокаивается (до свидания, утренняя тошнота!), У вашего ребенка наблюдается рост.В начале второго триместра структуры пищеварительной системы полностью сформированы и находятся в нужных местах. Примерно в то же время плацента полностью захватывает желточный мешок, обеспечивая все потребности вашего ребенка в питании (одновременно избавляясь от шлаков) через пуповину до рождения ребенка.
А пока все сводится к практике: ребенок начинает сосать и глотать околоплодные воды, а мышцы и органы, составляющие пищеварительную систему, учатся сокращаться. Он также регулярно писает.Это все задачи, которые ваш ребенок будет выполнять для пищеварения, когда он выйдет на свет, потребляя грудное молоко, смесь и, в конечном итоге, твердую пищу.
На этом этапе беременности у вашего малыша на крошечном язычке развиваются вкусовые рецепторы. Вкусы продуктов, которые вы едите, присутствуют в амниотической жидкости, которую ваш ребенок глотает каждый день.
Третий триместр
Когда вы выходите на финишную прямую, развитие плода сосредоточено на росте, поскольку ваш ребенок прибавляет в весе и длине.Пищеварительная система продолжает выполнять свои обязанности, но она не будет полностью готова к работе, пока ваш ребенок не родится и не начнет принимать всю пищу через рот (вместо пуповины).
На протяжении всей беременности пищеварительная система вашего ребенка развивается и готовится к важному дню родов, когда он впервые попробует настоящую пищу. А до тех пор ваш ребенок полагается на вас во всем, что касается его питания и обмена шлаков, поэтому обязательно употребляйте много здоровой и свежей пищи.
И, кстати, когда вы начнете менять первые детские подгузники, вы начнете много узнавать о фекалиях новорожденных. Это нормальное поведение молодых родителей! Фактически, вы можете многое узнать о том, как ваш новорожденный поживает и переваривает пищу, по тому, что находится в его подгузнике. ИсследованиеVUMC проливает свет на развитие рака желудка | VUMC Reporter
Билла Снайдера
Исследователи из Медицинского центра Университета Вандербильта создали первую в мире лабораторную модель предраковых изменений слизистой оболочки желудка. Это научный образец силы, который помогает раскрыть тайны развития рака желудка.
Их достижение, недавно описанное в журнале Nature Communications , помогает в поиске потенциальных новых лекарств, которые могут замедлить – и, возможно, даже обратить вспять – предраковые изменения в желудке у людей.
Это особенно важно для пациентов в Азии, России и Южной Америке, где заболеваемость раком желудка значительно выше, чем в других частях мира. Рак желудка является третьей по значимости причиной смерти от рака во всем мире после злокачественных новообразований легких и толстой кишки.
До сих пор было трудно определить, какие клетки участвуют в этапах, ведущих к раку желудка, особенно в развитии предраковых поражений желудка, называемых метаплазией, а позже – дисплазией, появлением аномальных клеток.
Используя свою модель, ученые VUMC определили новую популяцию стволовых клеток, которые возникают во время дисплазии. «Мы думаем, что это критическая точка перехода между предраком и раком», – сказал старший автор статьи, Ынён Чой, доктор философии, доцент хирургии.
Ранее Чой и его коллеги показали, что ингибитор MEK, лекарство, которое блокирует путь передачи сигналов Kras, может обращать вспять метаплазию на животной модели. В настоящее время они пытаются обратить вспять или регрессировать предраковые изменения в лабораторной модели ткани человека, которую они разработали и которую они называют «мини-метапластическим желудком».
Основываясь в основном на этой работе, Чой, соавтор Джеймс Голденринг, доктор медицины, доктор философии, и другие исследователи VUMC были включены в глобальные усилия, которые ранее в этом году получили грант Grand Challenge Grant в размере 26 миллионов долларов от благотворительной организации Cancer Research UK. разработать стратегии профилактики и лечения рака на основе воспаления, включая рак желудка.
Голденринг, профессор экспериментальной хирургии Пола В. Сэнгера и профессор клеточной биологии и биологии развития, сказал, что он и его коллеги надеются запустить в этом году клиническое испытание ингибитора MEK, «чтобы увидеть, сможем ли мы обратить вспять метаплазию» у пациентов с раком желудка. в Корее, Японии и Канаде.
Соавторами статьи были научный сотрудник Вандербильта Чимин Мин, доктор философии, и аспирант Пейдж Вега. Среди других участников были Кен Лау из Вандербильта, доктор философии, адъюнкт-профессор клеточной биологии и биологии развития, и Скотт Мэгнесс, доктор философии, доцент Университета Северной Каролины в Чапел-Хилл.


 Наши специалисты регулярно проходят обучение и повышают квалификацию. Врачи владеют методиками и техниками проведения эндоскопических исследований, что позволяет достигать их высокой точности и эффективности. Специалисты выявляют даже скрытые патологии
Наши специалисты регулярно проходят обучение и повышают квалификацию. Врачи владеют методиками и техниками проведения эндоскопических исследований, что позволяет достигать их высокой точности и эффективности. Специалисты выявляют даже скрытые патологии Мы проводим диагностику пищевода, желудка, двенадцатиперстной кишки. При необходимости выполняются и другие обследования. Комплексная диагностика позволяет быстро поставить диагноз и назначить необходимое лечение
Мы проводим диагностику пищевода, желудка, двенадцатиперстной кишки. При необходимости выполняются и другие обследования. Комплексная диагностика позволяет быстро поставить диагноз и назначить необходимое лечение