Реактивные изменения поджелудочной железы у взрослого: Лечение реактивного панкреатита в Москве
Ультразвуковая постпрандиальная проба. – Клиника на Ленинском
ОЦЕНКА ФУНКЦИОНАЛЬНОЙ АКТИВНОСТИ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ.Поджелудочная железа является одним из центральных органов, принимающих участие в переваривании, расщеплении пищевых ингредиентов. Как железистый орган она, реагирует на любую патологию со стороны желудочно- кишечного тракта: гастриты, гастродуодениты, эрозивно-язвенные поражения слизистых ЖКТ, кишечные вирусные и бактериальные инфекции , глистные и паразитарные поражения ЖКТ, заболевания печени; а также изменяется при ОРВИ, вакцинации, приеме лекарственных препаратов и других заболеваниях.
Снижение пищеварительной функции поджелудочной железы (ПЖ) может быть абсолютным и относительным. Абсолютная недостаточность обусловлена уменьшением объема функционирующей ПЖ. При относительной недостаточности сама ПЖ не повреждена и ее функция не нарушена, однако в силу тех или иных причин ферменты не могут в полной мере оказывать свое действие.
Оценка состояния поджелудочной железы входит в протокол УЗИ брюшной полости. При стандартном УЗИ часто получаем заключение – «реактивные изменения поджелудочной железы», «реактивный панкреатит», «реактивное увеличение поджелудочной железы» и тд.
Однако очень важно отличить с помощью УЗИ, где имеют место реактивные изменения поджелудочной железы и функция ее сохранна , а где формируется хронический панкреатит. Именно при хроническом панкреатите повторяющиеся эпизоды воспаления приводят к замещению паренхимы ПЖ фиброзной тканью с развитием вследствие этого экзокринной и эндокринной недостаточности ПЖ.
Для более точной диагностики поможет проведение постпрандиальной пробы.
Методика проведения постпрандиальной пробы очень проста для пациента.
Сначала врач ультразвуковой диагностики выполняет исследование поджелудочной железы натощак, после 6-8 часов голода. Оцениваются ее размер, контуры, структура, кровоток.
И повторяет исследование ПЖ через 1,5-2 часа после пищевой нагрузки, содержащей 20 гр жира – это 100гр 20% сметаны или 20 гр сливочного масла или 2 желтка , которые являются естественными стимуляторами панкреатической секреции.
Поджелудочная железа опять оценивается по тем же параметрам. На основании полученных данных врач делает вывод о функциональных возможностях органа, что это:
- нормальная не измененная ПЖ
- реактивный панкреатит (реактивное состояние)
- латентный панкреатит
- хронический панкреатит.
Таким образом, данное исследование оказывает большую помощь в работе врачей педиатрической и терапевтической практики, врачам гастроэнтерологам.
В Клинике на Ленинском постпрандиальную пробу проводят специалисты УЗИ:
Роговец Оксана Владимировна
Медведева Наталья Владиславовна
Запись по телефону +7(495)668-09-86
Реактивные изменения поджелудочной железы у ребенка: что это такое, лечение
Реактивными называют такие изменения поджелудочной железы, которые возникают при наличии хронического воспаления других органов системы пищеварения. Другая причина этих явлений может быть связана с пищевыми отравлениями, кишечными инфекциями, неправильным питанием.
Причины
Поджелудочная железа участвует не только в процессе пищеварения, но также вырабатывает гормоны. Продуцируемые органом ферменты входят в состав панкреатического сока. При употреблении пищи эта жидкость выбрасывается в двенадцатиперстную кишку, где связывается с молекулами полисахаридов и расщепляет их.
Выводной проток железы напрямую связан с полостью кишечника. Поэтому воспалительные процессы, возникающие в других частях пищеварительного тракта, могут переходить и на поджелудочную. Таким образом возникает реактивный панкреатит. Это патологическое состояние характеризуется отеком, воспалением, нарушением функции органа.
В большинстве случаев такой вид панкреатита протекает в хронической форме, для него не характерна яркая клиническая картина. Острое реактивное воспаление обычно возникает при наличии врожденной патологии ЖКТ.
Для диагностики реактивных изменений необходимо проводить УЗИ
Наиболее частые причины развития реактивных явлений в поджелудочной:
- прием антибактериальных средств дольше рекомендуемого срока;
- травмы живота;
- нарушения питания;
- аномалии развития поджелудочной железы;
- воспалительные и другие заболевания ЖКТ;
- инфекции;
- стресс, длительные значительные психоэмоциональные нагрузки.

Нарушения структуры паренхимы диффузного характера могут также быть следствием избыточной массы тела, сахарного диабета первого или второго типа. Нередко патологические изменения возникают у людей пожилого возраста без перечисленных выше заболеваний.
Считается, что наибольшее значение в развитии реактивных нарушений играет злоупотребление алкоголем и большое количество жирной пищи в рационе. Спровоцировать начало болезни могут также воспалительные патологии желчного пузыря и печени. Это приводит к возникновению болевого синдрома и повышению уровня глюкозы в крови.
Симптомы
Реактивные изменения поджелудочной железы у ребенка или пациента взрослого возраста проявляют себя симптомами:
- острая боль в области живота, чаще над пупком;
- нарушение пищеварения – диарея, метеоризм, тошнота и рвота;
- сухость слизистой оболочки ротовой полости, белый налет на языке;
- повышение температуры – обычно этот признак появляется только в первые часы болезни;
- общее недомогание, вялость, раздражительность.

Характерной особенностью болевого синдрома является то, что неприятные ощущения уменьшаются или могут исчезать, когда пациент находится в положении сидя с наклоненным вперед туловищем.
Боль в животе часто сопровождает реактивные нарушения
У детей грудного возраста определить наличие заболевания по симптомам очень сложно. Ребенок становится беспокойным, громко плачет и пытается привлечь к себе внимание родителей. Заподозрить нарушение работы ЖКТ можно по тому, что все проявления болезни обычно возникают сразу после приема пищи. При появлении перечисленных выше явлений у ребенка необходимо как можно раньше обратиться к врачу.
Диагностика
Для постановки диагноза недостаточно только собрать жалобы пациента. Определить наличие реактивных изменений поджелудочной железы можно только по данным УЗИ. При этом специалист должен обследовать не только этот орган, но и окружающие. Это необходимо для определения причины болезни, а также степени поражения ЖКТ в целом.
Паренхима здоровой железы, по данным ультразвуковой диагностики, однородна. Размеры органа не увеличены и не уменьшены. Также не должно быть очаговых или диффузных изменений в ткани и других эхо-признаков болезни.
Эхокартина диффузных изменений может быть различной. По ней можно предположить наличие того или иного заболевания:
- снижение эхогенности ткани поджелудочной железы, увеличение размеров органа могут говорить о приступе острого панкреатита;
- обратная картина, когда плотность повышается, а размеры железы уменьшаются, свидетельствует о фиброзе органа;
- об изменениях реактивного характера может говорить диффузное снижение эхогенности при сохранении нормальных размеров железы;
- повышение плотности органа и размеры в пределах нормы говорят о возникновении липоматоза – состояния, при котором происходит частичное замещение паренхимы железы жировой тканью.
Для уточнения диагноза реактивных изменений поджелудочной железы необходимо также проводить дополнительные инструментальные и лабораторные исследования. Они позволяют оценить состояние других органов желудочного тракта и состояние организма в целом. Для этого проводят:
Они позволяют оценить состояние других органов желудочного тракта и состояние организма в целом. Для этого проводят:
- эндоскопию двенадцатиперстной кишки – большое внимание уделяется участку, куда впадает выводной проток поджелудочной железы;
- общий анализ крови и биохимия – эти исследования выполняют для того, чтобы выявить функциональные нарушения железы и наличие воспалительных процессов в организме;
- анализ мочи на амилазу – этот фермент вырабатывается поджелудочной железой, повышение его содержания в моче свидетельствует о значительном нарушении функции органа.
После того как все лабораторные и инструментальные методы исследования были проведены, врач-гастроэнтеролог на основании результатов анализов и наличия эхопризнаков болезни ставит диагноз.
Лечение
Так как реактивные явления в поджелудочной железе не являются самостоятельным заболеванием, то не существует специфической терапии, направленной на восстановление структуры органа. Проводят лечение, цель которого – основное заболевание, ставшее причиной нарушения.
Проводят лечение, цель которого – основное заболевание, ставшее причиной нарушения.
Возможные причины реактивного воспаления поджелудочной железы
Все лечебные мероприятия проводятся в условиях стационара под наблюдением гастроэнтеролога или терапевта. Пациенту при этом рекомендован постельный режим. Важно придерживаться лечебной диеты, а в некоторых случаях в первые дни болезни показан полный голод. В это время допускается только пить щелочные напитки, например, минеральную воду.
Если имеются умеренные нарушения функции органа, для лечения достаточно только правильного питания. Пациенту следует принимать пищу маленькими порциями по 5-6 раз в сутки. Сначала рекомендуется употреблять перетертую овсянку или гречку, сухари, чай без сахара. В последующие дни добавляют кефир, йогурты, супы, овощные пюре.
Цель такой диеты – снижение нагрузки на пораженный орган и создание условий для его восстановления. Поэтому всем пациентам с диффузными реактивными явлениями поджелудочной железы нужно отказаться от «тяжелой» пищи:
- шоколада;
- жареных, копченых блюд;
- консервов;
- мясных бульонов.

Медикаментозная терапия реактивных нарушений деятельности поджелудочной железы включает в себя следующие мероприятия:
- внутривенное введение раствора глюкозы – необходимо при возникновении признаков интоксикации;
- использование препаратов, которые снижают выработку пищеварительных ферментов и тем самым уменьшают нагрузку на больной орган;
- применение спазмолитических медикаментов, которые снимают выраженность болевого синдрома;
- прием ферментов для улучшения процессов переваривания пищи и предотвращения расстройства пищеварения.
При возникновении первых признаков реактивного заболевания поджелудочной железы необходимо как можно раньше обратиться за помощью к врачу. Чем раньше определена причина беспокойства и начато лечение, тем меньше вероятность развития тяжелых осложнений.
Профилактика этого состояния заключается в поддержании массы тела в пределах нормальных значений и предотвращении чрезмерных нагрузок на поджелудочную железу. Это значит, что всем людям необходимо соблюдать здоровую диету, которая подразумевает почти полный отказ от газированных напитков, чипсов и других вредных продуктов.
Это значит, что всем людям необходимо соблюдать здоровую диету, которая подразумевает почти полный отказ от газированных напитков, чипсов и других вредных продуктов.
Если все же не удалось предотвратить возникновение реактивной патологии, следует соблюдать рекомендации врача по лечению и профилактике рецидивов. При соблюдении лечебной диеты вероятность повторного возникновения болезни минимальна.
причины, симптомы, диагностика и лечение у взрослых
Не смотря на то, что данная форма относится к устаревшей классификации, всё ещё можно услышать о таком заболевании. Болезнь зачастую развивается стремительно и сопровождается болью, расстройствами пищеварения и признаками интоксикации. Реактивный панкреатит обычно возникает на фоне хронических патологий органов желудочно-кишечного тракта (ЖКТ) или серьезных погрешностей в питании 1.
Симптомы реактивного панкреатита
Первые симптомы реактивного панкреатита проявляются довольно быстро. Иногда после действия провоцирующего фактора может пройти всего несколько часов – а болезнь уже даст о себе знать. К наиболее характерным признакам реактивного панкреатита относят1:
Иногда после действия провоцирующего фактора может пройти всего несколько часов – а болезнь уже даст о себе знать. К наиболее характерным признакам реактивного панкреатита относят1:
- боль в верхней части живота, отдающая к ребрам и лопаткам и усиливающаяся после приема пищи;
- повышенное газообразование;
- тошноту, рвоту со следами желчи;
- незначительное повышение температуры тела;
- снижение артериального давления.
При появлении признаков реактивного панкреатита необходимо обратиться к специалисту, чтобы провести профессиональную диагностику и начать лечение на ранней стадии заболевания.
Причины реактивного панкреатита
Главная причина реактивного панкреатита — преждевременная активация ферментов, которые вырабатывает поджелудочная железа. В норме ферменты активизируются только после того, как попадают в кишечник. Но если проток поджелудочной железы сужен, например, из-за хронических болезней или злоупотребления алкоголем, возникает застой панкреатического сока. Скапливаясь, пищеварительные ферменты начинают разрушительно действовать на ткани поджелудочной железы, что приводит к выраженному воспалению и попаданию продуктов распада в кровь.
Скапливаясь, пищеварительные ферменты начинают разрушительно действовать на ткани поджелудочной железы, что приводит к выраженному воспалению и попаданию продуктов распада в кровь.
Наиболее распространенные причины реактивного панкреатита:1
- обострение хронических патологий: язвенной болезни, вирусного гепатита, желчнокаменной болезни;
- употребление жирных, жареных продуктов, алкоголя;
- кишечные инфекции;
- пищевые и промышленные отравления;
- эндоскопические вмешательства на органах желчевыделения;
- травмы живота.
Чтобы определить характер повреждения поджелудочной железы и окружающих тканей, специалисты могут назначить комплексное обследование, которое включает:1
- анализ крови, мочи и кала;
- ультразвуковую диагностику органов пищеварительного тракта;
- рентгенографическое исследование;
- МРТ, КТ пищеварительной системы;
- эндоскопическую диагностику.

В сложных клинических случаях для уточнения диагноза и выбора правильной врачебной тактики может потребоваться лапароскопия – микрооперация, при которой делаются небольшие (0,5-1,5 см) разрезы на брюшной полости для доступа к поджелудочной железе.
Лечение реактивного панкреатита
Лечение реактивного панкреатита включает устранение воспаления поджелудочной железы, снятие интоксикации и восстановление нормальной секреции панкреатического сока. Процесс лечения непременно должен проходить под наблюдением врача.
Способствовать снятию воспаления, особенно в остром периоде, может лечебное голодание. Оно снимает нагрузку с воспаленной поджелудочной железы и всего пищеварительного тракта. После того, как острая фаза будет пройдена, разрешается питаться небольшими порциями, употребляя продукты в измельченном виде. Но ни в коем случае не стоит заниматься корректировкой питания самостоятельно. Назначить правильную и полезную диету сможет только врач, исходя из особенностей вашего организма.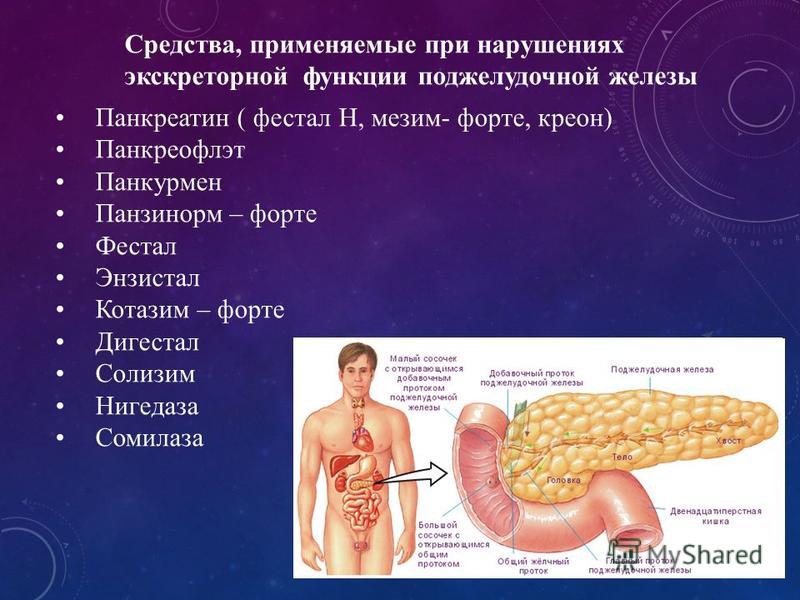
Как правило, из рациона больного на несколько месяцев исключают те продукты, которые могут спровоцировать повторную активацию ферментов поджелудочной железы и усилить воспалительную реакцию в тканях.
При реактивном панкреатите запрещены:
- алкоголь;
- жирные и жареные блюда;
- бобовые;
- кислые соки;
- свежая сдоба;
- копчености, колбасы;
- кукуруза;
- грибы;
- соусы, приправы, остроты.
Мясо рекомендуется готовить на пару или отваривать. Желательно предпочесть нежирную птицу, говядину или кролика. В лечении панкреатита очень важно в точности соблюдать диету: регулярные нарушения пищевого режима могут спровоцировать обострение заболевания.
Медикаментозная терапия панкреатита включает прием ферментных препаратов и спазмолитиков, устраняющих спазм гладкой мускулатуры и облегчающих боль. Врач также может назначить лекарства, улучшающие микрофлору кишечника и увеличивающие содержание живых бактерий в организме.
Врач также может назначить лекарства, улучшающие микрофлору кишечника и увеличивающие содержание живых бактерий в организме.
Важным этапом лечения является прием ферментных средств на основе панкреатина. Воспаленная поджелудочная железа не выделяет ферменты в необходимом количестве, чтобы обеспечить качественное переваривание пищи и правильное течение пищеварительных процессов. Лекарства, содержащие ферменты, восполняют нехватку собственных пищеварительных элементов, предупреждают появление брожения и гниения пищи в кишечнике.
Примером ферментного препарата, применяемого при лечении реактивного панкреатита, является Креон®. Современный препарат последнего поколения, выпускаемый в форме капсул с активными минимикросферами панкреатина, заключенными в желатиновыми оболочку. Попадая в желудок, капсула быстро растворяется2, а минимикросферы перемешиваются с пищей и вместе с ней попадают в кишечник, помогая процессу расщепления и усвоению питательных веществ.
Реактивные изменения поджелудочной железы
Железа, частично закрывающаяся расположенным перед ней желудком, непосредственно связана с печенью и желчевыводящими путями, и в силу этого патологические процессы, происходящие в ней, зачастую являются реакцией на проявление различных хронических заболеваний брюшной полости.
Подобные реактивные изменения поджелудочной железы способны привести к серьезным физиологическим нарушениям и развитию многих заболеваний.
Взаимосвязь органов пищеварительной системы
Поджелудочная железа выполняет 2 главные функции, при этом:
- внешнесекреторная функция заключается в производстве панкреатического сока, участвующего в пищеварении;
- внутрисекреторная – в выработке островками Лангерганса инсулина, который способствует усвоению сахара тканями.
Пищеварительный сок, вырабатываемый паренхимой, собирается в проток, который, соединяясь с общим желчным протоком, отходящим от желчного пузыря, открывается в зоне двенадцатиперстной кишки. В результате такой тесной связи все заболевания печени и органов желчевыводящей системы обязательно вызывают реакцию и изменения в функционировании самой железы и наоборот.
В результате такой тесной связи все заболевания печени и органов желчевыводящей системы обязательно вызывают реакцию и изменения в функционировании самой железы и наоборот.
Чем чреваты реактивные изменения?
Термин «реактивные изменения» поджелудочной железы, который так пугает многих пациентов, на самом деле означает, что она проявляет реакцию на патологию другого близлежащего органа.
Такое реактивное состояние может привести к развитию болевого синдрома, нарушению нормального функционирования пищеварительной системы или изменению показателя содержания сахара в крови. Это объясняется тем, что при реактивной поджелудочной железе ее паренхима вырабатывает гормоны, ответственные за липидно-углеводный обмен, и панкреатический сок, содержащий необходимые для пищеварения ферменты, в недостаточном количестве.
Воспаление железы, развивающееся под агрессивным воздействием на нее органов желчевыводящих путей (ЖВП) и печени, представляет собой приступ реактивного панкреатита со свойственными ему:
- увеличением органа в размерах, вызванным его отеком;
- реактивными изменениями паренхимы.

Развитие реактивного панкреатита и у взрослого, и у ребенка может быть реакцией ослабленной поджелудочной железы на такие болезни ЖКТ, как:
- хронический и острый гепатиты;
- хронический холецистит;
- язва двенадцатиперстной кишки;
- язвенный колит;
- заболевания пищевода и другие.
Заболевания печени и ЖВП
При застое желчи, как в желчном пузыре, так и в желчевыводящих протоках, в паренхиме поджелудочной железы зачастую возникают реактивные изменения, которые практически всегда имеют диффузный характер, хотя чаще всего обнаруживаются при помощи УЗИ лишь на одном из ее участков. То же самое наблюдается и при заболеваниях печени, когда происходит нарушение ее функции по производству желчи.
При таких реактивных изменениях могут присутствовать:
- боли, локализующиеся в верхней части живота;
- жидкий стул;
- тошнота.
Однако, учитывая, что появление таких же симптомов свойственно заболеваниям печени и ЖВП, отличить их от схожих признаков реактивных изменений поджелудочной железы порой не представляется возможным.
Заболевания ЖКТ
Реактивный панкреатит может развиваться и при недугах ЖКТ. Среди последних наиболее часто встречающимся заболеванием является язва двенадцатиперстной кишки.
Реактивные изменения железы при этом могут приводить к:
- жидкому стулу;
- вздутию живота;
- распространению болей в животе вверх и их усилению;
- тошноте.
Реже реактивный панкреатит возникает при заболеваниях пищевода и толстого кишечника. В частности, такое состояние может спровоцировать рефлюкс-гастрит, который представляет собой воспаление пищевода, возникающего на фоне затекания в этот орган содержимого желудка. Постоянное раздражение пищевода кислой средой приводит к его воспалению, а затем и к появлению на стенках язв – тяжелому недугу, который негативно влияет на состояние всех органов пищеварительной системы и поджелудочной железы в том числе.
Патологические реактивные изменения в железе, развивающиеся на фоне заболеваний ЖКТ, могут протекать как у взрослого, так и у ребенка с минимальными клиническими проявлениями или вовсе бессимптомно.
Диагностика
Реактивные изменения поджелудочной железы диагностируются при УЗИ, во время которого специалист обследует не только этот орган, но и все остальные, которые могли стать причиной приступа.
На ультразвуковом исследовании паренхима здорового органа будет однородной, без видимых уменьшений или увеличений размеров, без диффузных изменений или каких-либо очагов.
Термин «диффузные изменения» представляет собой не диагноз, а состояние железы, при котором изменения распространены по всей ее ткани равномерно. Если же изменения носят очаговый характер, это может свидетельствовать о наличии у пациента камней в поджелудочной железе или даже опухоли.
При проведении УЗИ может быть выявлен разный характер диффузных изменений в поврежденном недугом органе, что помогает установить соответствующий диагноз.
Так:
- диффузное уменьшение плотности паренхимы и эхогенности, увеличение размеров железы свидетельствуют о приступе острого панкреатита;
- диффузное снижение эхогенности и плотности паренхимы без увеличения размеров органа чаще всего происходит при хронических реактивных изменениях;
- диффузное повышение эхогенности при нормальных размерах железы указывает на возможное наличие липоматоза, который выражается в частичном замещении паренхимы жиром;
- диффузные изменения с увеличением плотности и эхогенности при нормальном или уменьшенном размере органа характерно для фиброза поджелудочной железы.

В связи с тем, что на основании одного УЗИ точный диагноз заболевания поставить достаточно сложно, проводят целый спектр дополнительных диагностических исследований:
- биохимический и общий анализы крови с целью обнаружения нарушений функций органа, а также позволяющий выявить или исключить воспалительный процесс;
- анализ мочи на содержание в ней пищеварительных ферментов;
- эндоскопию двенадцатиперстной кишки для изучения состояния слизистой в месте впадения протока.
Полученные данные анализируются терапевтом или гастроэнтерологом, после чего ставится окончательный диагноз и назначается терапия соответствующего недуга. Сами реактивные изменения поджелудочной железы не требуют специального лечения и после избавления от основного заболевания печени или органов ЖВП проходят самостоятельно.
Автор: Загороднюк Михаил Петрович,
специально для сайта Zhkt.ru
Полезное видео о поджелудочной железе
youtube.com/embed/wNm0jCWT3Wg” frameborder=”0″ allowfullscreen=”allowfullscreen”/>
Реактивные изменения поджелудочной железы: симптомы и лечение
Автор Самуэль МаркусВремя чтения 8 мин.Просмотры 290
Диффузные реактивные изменения поджелудочной железы (ПЖ), которые обнаруживаются при проведении ультразвукового исследования, не являются специфическими, но указывают на наличие в ней патологического процесса. Чаще всего — это воспаление. Такая картина ПЖ может быть находкой в случае проведения ультразвукового исследования других органов пищеварительного тракта. Для уточнения причин реактивных изменений необходимо назначение дополнительных анализов.
Что такое реактивные изменения поджелудочной железы?
Выявление диффузных изменений поджелудочной железы реактивного характера означает реакцию на заболевание другого пищеварительного органа, граничащего с железой. Это могут быть: печень, желчный пузырь, желудок, тонкая кишка. Их болезни приводят к изменениям в структуре железы и вызывают реактивный панкреатит. Это острый асептический воспалительный процесс в ПЖ, при котором после начала лечения наступает быстрое обратное развитие всех клинических проявлений. Он не является самостоятельным заболеванием.
Это острый асептический воспалительный процесс в ПЖ, при котором после начала лечения наступает быстрое обратное развитие всех клинических проявлений. Он не является самостоятельным заболеванием.
Причины реактивных изменений ПЖ
Реактивное состояние ПЖ имеет много причин. На первом месте — патология соседних органов пищеварения. В 30–40% – это желчнокаменная болезнь (ЖКБ), чаще встречающаяся у женщин. Именно поэтому, в основном, у них наблюдается реактивный панкреатит. Ответные повреждения ПЖ развиваются на фоне болезней желудка, печени, кишечника, вирусных поражений.
К такой трансформации ткани железы могут привести:
Выделяют также ятрогенный реактивный панкреатит, вызванный врачебными манипуляциями: он может развиться после проведения ЭРХПГ — эндоскопической ретроградной холангиопанкреатографии.
Как влияют патологии печени и желудочно-кишечного тракта
Основой развития диффузионных изменений является ранняя активация ферментов ПЖ с нарушениями в ее паренхиме. Это происходит в связи с застоем поджелудочного сока в протоках разного калибра. Основная причина — холелитиаз, когда при попадании мелких конкрементов (3−4 мм) в общий проток желчного пузыря и сосочек ДПК происходит их раздражение, рефлекторный спазм холедоха и сфинктера Одди. Со временем развиваются стриктуры и непроходимость общего желчного протока. Возможна обтурация более крупными желчными камнями и застой панкреатического содержимого в вирсунговом протоке, что приводит к повреждению ацинусов. Их клетки начинают перевариваться собственными ферментами ПЖ из-за невозможности выхода поджелудочного сока в просвет двенадцатиперстной кишки (ДПК).
Это происходит в связи с застоем поджелудочного сока в протоках разного калибра. Основная причина — холелитиаз, когда при попадании мелких конкрементов (3−4 мм) в общий проток желчного пузыря и сосочек ДПК происходит их раздражение, рефлекторный спазм холедоха и сфинктера Одди. Со временем развиваются стриктуры и непроходимость общего желчного протока. Возможна обтурация более крупными желчными камнями и застой панкреатического содержимого в вирсунговом протоке, что приводит к повреждению ацинусов. Их клетки начинают перевариваться собственными ферментами ПЖ из-за невозможности выхода поджелудочного сока в просвет двенадцатиперстной кишки (ДПК).
К развитию патологических реактивных изменений приводит и дискинезия желчевыводящих путей (ДЖВП). Под воздействием различных факторов (алкоголь, жирная, копченая, жареная, соленая еда, стрессы) происходит нарушение моторики желчного пузыря и его мелких протоков. Поэтому в просвет ДПК желчь поступает не в полном объеме: некоторая ее часть попадает в вирсунгов проток поджелудочной железы. Это создает препятствие нормальному току панкреатического содержимого с ферментами в полость ДПК. Задерживаясь в ПЖ, ферменты повреждают ее ткани.
Это создает препятствие нормальному току панкреатического содержимого с ферментами в полость ДПК. Задерживаясь в ПЖ, ферменты повреждают ее ткани.
При гепатитах разной этиологии и циррозе печени в ее паренхиме происходят глубокие изменения с гибелью нормальных гепатоцитов. Это приводит к нарушению функций печени, в том числе — образованию желчи и достаточному ее поступлению в желчный пузырь. В результате дисфункции пузыря его содержимое поступает частично в общий проток ПЖ и приводит к задержке ферментов в протоках железы и их разрушающему влиянию на паренхиму железы.
Выявление у пациента патологии желудка или ДПК (гастродуоденита, язвенной болезни) на фоне холелитиаза усугубляет ситуацию и повышает риск реактивных изменений в несколько раз. Воспаление в ДПК приводит к возникновению папиллита. Происходит обратный заброс содержимого ДПК в вирсунгов проток ПЖ и ранняя активация энзимов железы еще в ее тканях. Начинается самопереваривание ПЖ, паренхима органа разрушается, токсические продукты проникают в кровоток, вызывая выраженный отек тканей ПЖ и признаки интоксикации.
У детей чаще, чем у взрослых, диффузные процессы в ПЖ происходят из-за не диагностированного аскаридоза. Паразиты закупоривают протоки и вызывают в них застойные явления с дальнейшими изменениями в ткани ПЖ под воздействием ее собственных ферментов.
Реже подобные изменения возникают при патологии толстого кишечника и пищевода.
При имеющихся заболеваниях органов пищеварения выявить проявления реактивного панкреатита трудно, поскольку симптомы сходны. В основном, они протекают с незначительными признаками или без них. При выраженных нарушениях в железе, вызванных заболеваниями органов ЖКТ, у взрослого и ребенка проявляется одинаковая симптоматика:
- боль в животе — ее локализация и интенсивность зависят от того, какой отдел пищеварительного тракта стал источником изменений в ПЖ;
- тошнота и многократная рвота, не приносящая облегчения;
- понос;
- метеоризм.
У грудничка к основным симптомам относятся:
- выраженное вздутие живота;
- частые отрыжки воздухом и срыгивания пищи;
- плаксивость;
- плохой сон;
- отказ от еды;
- иногда жидкий стул.

Чаще всего проявления связаны с неправильным введением прикорма, не соответствующего возрасту младенца, при грудном вскармливании — с нарушениями в питании матери.
Подросток переносит патологию в хронической вялотекущей форме: жалуется на умеренное снижение аппетита, подташнивание, дискомфорт в животе, чередование запоров и поносов. Беспокоят астенические проявления: общая слабость, утомляемость, нарушения сна. Причиной нарушений становится неправильное питание (фастфуд, газированные напитки, другие погрешности в еде).
Методы диагностики патологии
Диагностика патологии ПЖ должна быть комплексной и определять не только нарушения в строении органа, но и его функциональную сохранность. Поэтому назначаются лабораторные и инструментальные исследования.
Скрининговым методом, определяющим наличие дополнительных образований, изменения в структуре и плотности органа, а также точные размеры железы, ее составных частей и главного протока, является УЗИ. Если этих данных оказывается недостаточно и диагноз неясен, назначаются дополнительные исследования.
Если этих данных оказывается недостаточно и диагноз неясен, назначаются дополнительные исследования.
Лабораторная диагностика
Обязательными процедурами являются общий анализ крови и определение биохимических показателей:
- общий, прямой и непрямой билирубин;
- общий белок и его фракции;
- диастаза крови и мочи.
Назначается копрограмма — микроскопическое исследование кала на наличие непереваренных волокон, жиров, других патологических включений.
Эти анализы помогают дифференцировать главную патологию и нарушение функций, обозначать направления дальнейших обследований, если это необходимо, и составлять план лечения.
Инструментальные методы
Основным, самым удобным и безопасным диагностическим методом является ультразвуковое исследование, при котором, помимо ПЖ, изучают желчный пузырь и все паренхиматозные органы брюшной полости. При неповрежденной ПЖ эхографический метод показывает:
- нормальные размеры;
- однородную ткань;
- отсутствие диффузных или очаговых изменений.

Выявление изменений размеров и диффузных однородных нарушений в паренхиме, равномерно распределенных по всему объему органа, не является диагнозом, а характеризует состояние ПЖ на момент исследования. Играет роль плотность ткани — ее эхогенность.
При реактивном панкреатите имеется снижение плотности паренхимы, умеренные диффузные изменения и нормальные размеры ПЖ.
Значимое увеличение параметров и повышенная эхогенность характерны для острого панкреатита или выраженного обострения хронического воспаления. Увеличение плотности также наблюдается при липоматозных изменениях, когда нормальные клетки ткани замещаются жировыми.
Для установления диагноза одного УЗИ недостаточно. Проводятся эндоскопические исследования:
- ЭФГДС — эзофагофиброгастродуоденоскопия;
- ЭРХПГ — эндоскопическая ретроградная холангиопанкреатография (в тяжелых неясных случаях).
ЭФГДС — рутинный метод исследования для выявления патологии пищевода, желудка и ДПК.
Выявленные заболевания в этих органах могут стать главной причиной реактивного панкреатита и изменений ПЖ на УЗИ.
Лечебные процедуры
Выявленные диффузные изменения в железе являются вторичными и не требуют специального лечения. При своевременной и адекватной терапии основного заболевания состояние поджелудочной железы нормализуется, поэтому нет необходимости назначать лишний препарат, чтобы не нагружать функционально органы пищеварения.
Основными лечебными процедурами по отношению к диффузно измененной ПЖ являются:
- отказ от алкоголя;
- соблюдение диеты;
- ограничение физических нагрузок до наступления полной ремиссии.
Медикаментозная терапия назначается с учетом основной патологии, вызвавшей изменения в железе. Возможно применение симптоматического лечения, когда выявлены отклонения в анализах и есть жалобы и симптомы, указывающие на нарушение функций ПЖ. В таких случаях, в зависимости от состояния пациента и степени проявлений симптомов поражения ПЖ, используются:
- ферменты;
- спазмолитические средства;
- ветрогонные – для уменьшения метеоризма;
- антисекреторные, снижающие выработку соляной кислоты – она стимулирует функции ПЖ и увеличивает ее функциональную нагрузку.

Диета в терапии нарушений
Ограничения в питании всегда являются одним из основных пунктов комплексной терапии заболеваний пищеварительного тракта. При нарушениях в поджелудочной железе диета играет основополагающую роль, поскольку погрешности в еде могут вызвать выраженное обострение патологического процесса.
Даже если изменения в паренхиме ПЖ носят вторичный характер, необходимо на время болезни исключить из меню жирное, жареное, копченое и острое, ограничить углеводы. Это уменьшит функциональную нагрузку на железу. Особенно опасна жирная пища: на расщепление липидов железе приходится синтезировать большое количество энзимов, поскольку процесс переваривания жирной пищи происходит длительно. Рекомендуется полный отказ от употребления алкоголя: даже малое количество любого спиртосодержащего напитка приведет к дальнейшему прогрессированию патологии.
Питаться нужно часто, дробными (5–6 раз в день) порциями. Пищу следует тщательно пережевывать, чтобы облегчить ее переваривание, употреблять в теплом виде (запрещена слишком горячая или холодная еда), отваривать, тушить или готовить на пару и принимать в перетертом виде.
Придерживаться таких правил нужно и при наступлении полной ремиссии. Поджелудочная железа мгновенно реагирует на нарушения в диете выраженным обострением панкреатита.
Какие могут быть последствия реактивных изменений ПЖ?
При своевременной диагностике реактивные изменения паренхимы ПЖ не представляют опасности. Если установлена болезнь, явившаяся причиной патологии в тканях железы, и своевременно назначено лечение – процессы обратимы. При излечивании основного заболевания ткани железы самостоятельно восстановятся.
При отсутствии медицинской помощи, несвоевременной терапии или самолечении клетки железы из пограничного состояния переходят в стадию некроза и погибают. Развивается выраженный воспалительный процесс, который проявляется панкреонекрозом — жизнеопасным состоянием. Функционирование ПЖ резко нарушается, состояние пациента ухудшается, может возникнуть сепсис или шок. Дальнейшие лечебные мероприятия происходят в отделении реанимации или хирургии.
Во избежание тяжелых последствий необходимо внимательно относиться к своим ощущениям, вовремя обращаться к врачу и соблюдать все рекомендации специалиста.
современные аспекты этиологии, патогенеза и диагностики – тема научной статьи по клинической медицине читайте бесплатно текст научно-исследовательской работы в электронной библиотеке КиберЛенинка
Панкреатиты у детей: современные аспекты этиологии, патогенеза и диагностики
Л.А. Полещук
Childhood pancreatitis: Current aspects of etiology, pathogenesis, and diagnosis
L. A. Poleshchuk
A. Poleshchuk
Московский НИИ педиатрии и детской хирургии
Представлены современные данные об этиологии, клинических проявлениях и диагностике панкреатитов у детей. Особое внимание уделено ультразвуковому исследованию с использованием допплерографических методик.
Ключевые слова: дети, поджелудочная железа, хронический панкреатит, ультразвуковое исследование.
The paper gives the current notions of the etiology, clinical manifestations, and diagnosis of pancreatitis in children. Particular emphasis is placed on Doppler ultrasound studies.
Key words: children, pancreas, chronic pancreatitis, ultrasound study.
Своевременная диагностика и терапия заболеваний поджелудочной железы у детей являются одной из наиболее сложных проблем клинической гастроэнтерологии. В последние годы отмечается неуклонный рост гастроэнтерологических заболеваний в детском возрасте. Параллельно нарастает и частота патологических состояний поджелудочной железы. Хронический панкреатит у детей в большинстве случаев развивается вторично, а как первичное заболевание встречается только у 14% больных. Особое место среди причин хронического панкреатита занимают наследственный панкреатит, муко-висцидоз, синдром Швахмана, изолированный дефицит панкреатических ферментов и другие наследственные болезни, протекающие с панкреатической недостаточностью [1, 2].
В последние годы отмечается неуклонный рост гастроэнтерологических заболеваний в детском возрасте. Параллельно нарастает и частота патологических состояний поджелудочной железы. Хронический панкреатит у детей в большинстве случаев развивается вторично, а как первичное заболевание встречается только у 14% больных. Особое место среди причин хронического панкреатита занимают наследственный панкреатит, муко-висцидоз, синдром Швахмана, изолированный дефицит панкреатических ферментов и другие наследственные болезни, протекающие с панкреатической недостаточностью [1, 2].
По мнению детских гастроэнтерологов, типичный для взрослых симптомокомплекс панкреатита в детской практике встречается достаточно редко. Чаще речь идет о патологии поджелудочной железы реактивного характера по отношению к заболеваниям гастродуоденальной зоны и связанной с расстройствами панкреатической секреции, кровообращения, повышением давления в протоковой системе, дуоденостазом.
В последние годы отмечается тенденция к нарастанию частоты панкреатитов, смертность от которых составляет 2,08 на 1000 больных. Сведения о встречаемости
© Л.А. Полещук, 2010
Ros Vestn Perinatol Pediat 2010; 4:58-65
Адрес для корреспонденции: Полещук Любовь Александровна — к.м.н., врач отделения ультразвуковых методов исследования Московского НИИ педиатрии и детской хирургии 125412 Москва, ул. Талдомская, д. 2
заболеваний поджелудочной железы, особенно в детском возрасте, достаточно разноречивы. В частности, их распространенность у детей с гастроэнтерологической патологией колеблется от 5 до 42%. Столь значительный разброс показателей объясняется отсутствием единых методических подходов к диагностике поражений поджелудочной железы, а также различной интерпретацией данных параклинического обследования [3, 4].
Вопросы терминологии поражения поджелудочной железы не определены в связи с отсутствием единой классификации. Не существуют стандартизованные критерии диагностики, поэтому в последние годы в литературе очевидны противоречия трактовки результатов исследований. Так, для характеристики начальных и транзиторных признаков панкреатита используются термины «реактивный», «латентный», «диспанкреа-тизм», «функциональные» и «вторичные» изменения поджелудочной железы [3—6]. Ряд педиатров умышленно не останавливаются на конкретизации диагноза, отмечая лишь расстройства экскреторной функции, изменение активности ферментов, изменение сонографи-ческих характеристик поджелудочной железы [6, 7].
Как известно, хроническим считается панкреатит, при котором морфологические изменения в поджелудочной железе сохраняются более 6 мес после прекращения воздействия этиологического фактора (Ивашкин В.Т. 2001). Хронический панкреатит представляет собой полиэтиологичное заболевание с фазово-прогрессирующим течением, очаговыми или диффузно-дегенеративными и деструктивными изменениями ацинарной ткани и протоковой системы, с последующим снижением экзокринной
Хронический панкреатит представляет собой полиэтиологичное заболевание с фазово-прогрессирующим течением, очаговыми или диффузно-дегенеративными и деструктивными изменениями ацинарной ткани и протоковой системы, с последующим снижением экзокринной
(мальабсорбция) и эндокринной (сахарный диабет) функций [8].
Это определение не охватывает изменений поджелудочной железы у детей на ранних этапах заболевания, которые, на наш взгляд, требуют пристального внимания. У взрослых ведущими этиологическими факторами хронического панкреатита являются алкоголь (до 80% всех причин хронического панкреатита) и желчекаменная болезнь, которые вызывают алкогольный и билиарный панкреатит соответственно [9]. В МКБ-10 выделены именно эти две формы заболевания, остальные обозначаются как панкреатит неустановленной этиологии. У детей, несомненно, эта классификация малопригодна, так как не отражает причины заболевания.
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ ПОРАЖЕНИЙ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ У ДЕТЕЙ
Многими авторами систематизированы данные об этиологии и патогенезе панкреатита, а его причины подразделены на протоковые, ацинарные, смешанные, сосудистые [10, 11]. Последнее время в зарубежной литературе встречается этиологическая классификация, названная по аббревиатуре TIGAR-O, учитывающая этиологический фактор повреждения — токсический, идиопатический, генетический, алкогольный, врожденный и обструктивный. Однако в педиатрии работ, при которых применялась эта классификация, не обнаружено.
Согласно данным литературы, поражение поджелудочной железы наблюдается практически при всех заболеваниях желудочно-кишечного тракта, а также ряде болезней других органов и систем (болезни почек, бронхиальная астма, аллергические дерматиты, диффузные болезни соединительной ткани, психические расстройства) [1, 2, 12]. Среди множества этиологических факторов хронического панкреатита у детей ведущую роль играют патология двенадцатиперстной кишки (41,8%), желчевыводящих путей (41,3%), аномалии развития железы, травмы живота. Другими причинами хронического панкреатита могут быть инфекции (эпидемический паротит, вирусы гепатита, энтеровирусы, сальмонеллез и др.), гельминтозы и другие заболевания, в частности, болезни соединительной ткани, гиперлипидемии (чаще I и V типов), гиперкальциемия, хроническая почечная недостаточность. Известно токсическое действие некоторых лекарственных препаратов (кортикостероиды, сульфаниламиды, цитостатики, фуросемид и др.) на ацинарную ткань. К предрасполагающим факторам относят болезни кишечника (хронический энтерит, цели-акия, неспецифический язвенный колит, синдром маль-абсорбции, болезнь Крона). Имеются исследования, посвященные генетическому аспекту панкреатитов. Так, у больных с панкреатической недостаточностью достоверно чаще по сравнению со здоровыми определяются антигены главного комплекса гистосовместимости А1,
Среди множества этиологических факторов хронического панкреатита у детей ведущую роль играют патология двенадцатиперстной кишки (41,8%), желчевыводящих путей (41,3%), аномалии развития железы, травмы живота. Другими причинами хронического панкреатита могут быть инфекции (эпидемический паротит, вирусы гепатита, энтеровирусы, сальмонеллез и др.), гельминтозы и другие заболевания, в частности, болезни соединительной ткани, гиперлипидемии (чаще I и V типов), гиперкальциемия, хроническая почечная недостаточность. Известно токсическое действие некоторых лекарственных препаратов (кортикостероиды, сульфаниламиды, цитостатики, фуросемид и др.) на ацинарную ткань. К предрасполагающим факторам относят болезни кишечника (хронический энтерит, цели-акия, неспецифический язвенный колит, синдром маль-абсорбции, болезнь Крона). Имеются исследования, посвященные генетическому аспекту панкреатитов. Так, у больных с панкреатической недостаточностью достоверно чаще по сравнению со здоровыми определяются антигены главного комплекса гистосовместимости А1,
В8,В27 [10, 13].
Несмотря на такое обилие причин, примерно у 1/4 детей не удается идентифицировать факторы, предрасполагающие к изменениям поджелудочной железы. Достаточно часто панкреатопатии носят по-лиэтиологичный характер.
До сих пор не существует единой концепции патогенеза панкреатита. Одним из ведущих механизмов развития большинства форм патологии является нарушение равновесия между панкреатическими ферментами и их ингибиторами, в результате чего происходит активация протеолиза с деструкцией ацинарной ткани и развитием экзокринной недостаточности. Протеолиз сопровождается накоплением гистамина и кининов, что вызывает расстройства гемодинамики. Благодаря мощным инги-биторным системам патологический процесс в поджелудочной железе у детей, как правило, не достигает степени некроза, а ограничивается отечной стадией.
Большое значение в патогенезе поражений поджелудочной железы имеют нарушение оттока панкреатического сока и дуоденостаз. Дуоденальный стаз является одной из частых причин гастродуоденобили-арной патологии и встречается при язвенной болезни желудка и двенадцатиперстной кишки в 34,8% случаев, при хроническом холецистите — в 37,9%. Так, язвенная болезнь желудка и двенадцатиперстной кишки может вызывать спазм сфинктера Одди или отек дуоденального соска. Стаз пищевого химуса в двенадцатиперстной кишке и дискинезия данной области, свойственные гастродуоденитам, способствуют забросу кишечного сока с энтерокиназой в панкреатический проток. Это вызывает переход трипсиногена в трипсин, что обусловливает деструктивные процессы в поджелудочной железе. Кислая среда желудочного сока при гастродуоденитах, вызванная забросами в двенадцатиперстную кишку соляной кислоты из желудка, способствует непрерывной выработке энтерохромафинными клетками двенадцатиперстной кишки секретина, который стимулирует функ-цию поджелудочной железы с последующим развитием ее отека. Важность указанных расстройств в патогенезе панкреатитов подчеркивается связью с особенностью анатомии железы, аномалиями ее развития (в том числе протоковой системы), нарушением иннервации, сдавлением соседними органами [14—16].
Дуоденальный стаз является одной из частых причин гастродуоденобили-арной патологии и встречается при язвенной болезни желудка и двенадцатиперстной кишки в 34,8% случаев, при хроническом холецистите — в 37,9%. Так, язвенная болезнь желудка и двенадцатиперстной кишки может вызывать спазм сфинктера Одди или отек дуоденального соска. Стаз пищевого химуса в двенадцатиперстной кишке и дискинезия данной области, свойственные гастродуоденитам, способствуют забросу кишечного сока с энтерокиназой в панкреатический проток. Это вызывает переход трипсиногена в трипсин, что обусловливает деструктивные процессы в поджелудочной железе. Кислая среда желудочного сока при гастродуоденитах, вызванная забросами в двенадцатиперстную кишку соляной кислоты из желудка, способствует непрерывной выработке энтерохромафинными клетками двенадцатиперстной кишки секретина, который стимулирует функ-цию поджелудочной железы с последующим развитием ее отека. Важность указанных расстройств в патогенезе панкреатитов подчеркивается связью с особенностью анатомии железы, аномалиями ее развития (в том числе протоковой системы), нарушением иннервации, сдавлением соседними органами [14—16].
Доказано, что болевой синдром при панкреатите — спутник повышения внутрипротокового давления и нарушения тканевой перфузии. Одной из ведущих причин протоковой гипертензии считается нарушение пассажа панкреатического сока и желчи. Ранее было установлено, что 50% больных хроническим панкреатитом имеют дисфункции сфинктера Одди, изменение градиента давления между дистальными отделами протока поджелудочной железы и двенадцатиперстной кишки [17]. В нормальных условиях основной функцией большого дуоденального сосоч-
ка является обеспечение автономности гепатобили-арной и панкреатической систем, что обеспечивает надежную защиту протоковой системы от рефлюк-са дуоденального содержимого. Дуоденобилиарный и дуоденопанкреатический рефлюксы могут возникать только в результате длительной интенсивной дуоденальной гипертензии, постепенно ослабляющей замыкательную функцию большого дуоденального сосочка. Последствия рефлюкса дуоденального содержимого в желчные и панкреатические протоки различны. Для желчных путей это инфицирование, для панкреатических — интрапанкреатическая активация протеолитических ферментов поджелудочной железы под воздействием кишечного сока, содержащего энтерокиназу.
Последствия рефлюкса дуоденального содержимого в желчные и панкреатические протоки различны. Для желчных путей это инфицирование, для панкреатических — интрапанкреатическая активация протеолитических ферментов поджелудочной железы под воздействием кишечного сока, содержащего энтерокиназу.
В то же время в генезе патологического процесса в поджелудочной железе может играть роль дефицит гастроинтестинальных гормонов и биологически активных веществ. Так, у больных с заболеваниями двенадцатиперстной кишки с нарушением моторики и развитием атрофических процессов в слизистой оболочке доказано уменьшение числа гормонопродуцирующих клеток и снижение их функции. Нарушение метаболизма и депонирования интестинальных гормонов способствует дистрофическим процессам в железе, нарушению оттока панкреатического секрета. В этих условиях происходит атрофия ацинарных клеток с последующей заменой их соединительной тканью [18, 19].
В последние годы появляется все больше данных о связи ^l^obacter pylori с различными внежелудоч-ными заболеваниями.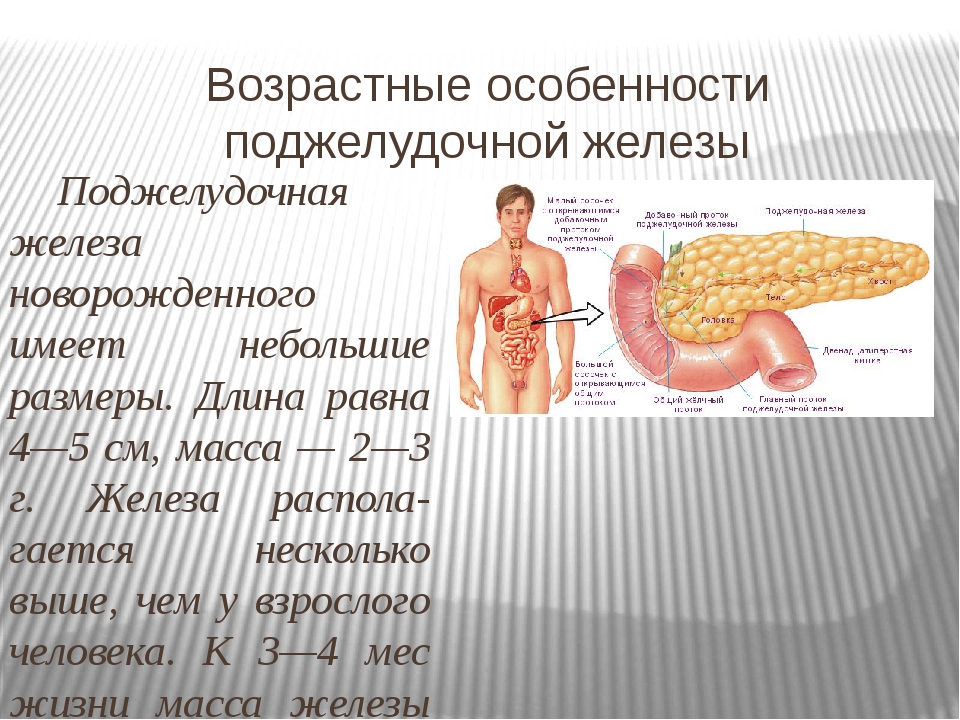 Интересны результаты исследований Л.А. Холоимовой и соавт., обследовавших 47 детей с хроническим гастродуоденитом и язвенной болезнью двенадцатиперстной кишки, ассоциированными с Н. pylori. Отмечено, что в 98% случаев имели место ультразвуковые признаки хронического панкреатита, а в 91% случаев были установлены признаки внешнесекреторной недостаточности поджелудочной железы (по данным микроскопии кала) [8].
Интересны результаты исследований Л.А. Холоимовой и соавт., обследовавших 47 детей с хроническим гастродуоденитом и язвенной болезнью двенадцатиперстной кишки, ассоциированными с Н. pylori. Отмечено, что в 98% случаев имели место ультразвуковые признаки хронического панкреатита, а в 91% случаев были установлены признаки внешнесекреторной недостаточности поджелудочной железы (по данным микроскопии кала) [8].
Доказана взаимосвязь аллергических заболеваний и органического поражения поджелудочной железы [20—22]. Отмечается частое сочетание, как правило, интестинальных форм пищевой аллергии с патологическими изменениями органа, по данным ультразвукового исследования и результатам анализа ферментов в крови. Поджелудочная железа рассматривается в качестве «шокового органа» и страдает в процессе развития аллергических реакций немедленного типа. Сомнительным является развитие аллергических реакций в ткани самой железы. Скорее всего, плацдармом для них выступает именно слизистая оболочка желудка и двенадцатиперстной кишки, в которой происходят иммунные реакции, а поджелудочная железа страдает вторично [24].
Хронический панкреатит может возникать в результате повторных эпизодов острого воспаления — так на-
зываемая гипотеза некроза-фиброза [24]. D. Whitcomb предположил, что острый приступ панкреатита является маркером развития хронического панкреатита. При этом острое поражение должно быть достаточно выраженным, чтобы привлечь в область воспаления моноциты и вызвать инфильтрацию, дифференцировку и пролиферацию звездчатых клеток поджелудочной железы [25]. Для возникновения фиброза необходимо рецидивирующее поражение ацинусов, приводящее к выбросу хемокинов, стимулирующих звездчатые клетки [26]. Последние разработки в молекулярной биологии и изучении воспалительного процесса позволили лучше понять патогенез панкреатита. К этим разработкам относится обнаружение мутаций гена катионного трипсиногена, регулятора белка трансмембранной проводимости му-ковисцидоза (CFTR), гена панкреатического секреторного ингибитора трипсина (SPINK 1) и действия цито-кинов [27, 28].
клинические проявления хронического панкреатита у детей
У детей клинические проявления хронического панкреатита разнообразны и неспецифичны. У этой категории больных хронический панкреатит характеризуется атипичностью течения, стертостью клинических проявлений, омоложением сроков манифестации, формированием тяжелых осложнений, в том числе и при латентном течении заболевания. R. Muench (1992) предложил классифицировать хронический панкреатит у детей: 1) ранняя неосложненная фаза хронического панкреатита; 2) поздняя неосложненная фаза; 3) осложненный хронический панкреатит [29].У взрослых выделены три этапа развития хронического панкреатита: начальный — в течение 1—5 лет до развития панкреатической недостаточности; период развернутых клинических проявлений — в течение 5—10 лет; период стихания активного патологического процесса и/или формирования осложнений — в течение 7—15 лет [8].
Неспецифические жалобы, транзиторная панкреатическая недостаточность и болевой синдром, не имеющий четкой локализации, обусловлены как сочетанной патологией, так и воспалением самой поджелудочной железы. У взрослых и у детей болевые приступы часто расцениваются не как проявления панкреатита, а как желчные или кишечные колики [30, 31]. Все исследователи указывают на вариабельность клинической симптоматики, зависящей от давности заболевания и степени расстройства экзокринной и эндокринной функций. В связи с отсутствием патогномоничных признаков хронического панкреатита и сочетанностью гастроэнтерологической патологии многие авторы считают необходимым проведение инструментальных и лабораторных исследований.
Болевой (абдоминальный) синдром является ведущим при хроническом панкреатите. Боль локализуется
у большинства больных в верхней половине живота, эпи-гастрии, правом и левом подреберьях. Боли могут быть постоянного ноющего характера и приступообразными, как правило, усиливаются во вторую половину дня и после приема пищи. Длительность болевого приступа может быть от 1—2 до нескольких часов и даже суток.
Боли могут быть постоянного ноющего характера и приступообразными, как правило, усиливаются во вторую половину дня и после приема пищи. Длительность болевого приступа может быть от 1—2 до нескольких часов и даже суток.
Диспепсические жалобы разнообразны и неспецифичны: снижение аппетита, быстрая насыщаемость, тошнота, рвота, отрыжка, изжога. Нарушения стула зависят от тяжести заболевания и варьируют от хронических запоров до полифекалии с жирными зловонными каловыми массами при панкреатогенной стеаторее [1, 2, 30, 31].
Экзокринная дисфункция поджелудочной железы встречается при различных заболеваниях и проявляется общим или изолированным снижением выработки ферментов. Известно, что клинико-биохимические признаки нарушений панкреатической секреции проявляются лишь при тяжелом поражении железы. Если у взрослых стойкие клинические симптомы панкреатической недостаточности проявляются при фиброзировании 90—95% ацинарной такни, то у детей они могут развиваться при гораздо меньшей утрате экзокринной функции, что связано с незрелостью ферментных систем и механизмов регуляции панкреатической секреции. Панкреатическая недостаточность у детей далеко не всегда сопровождается полифекалией и стеатореей. Она чаще проявляется неустойчивостью стула (чередованием запоров и учащенным объемным стулом), периодическими болями в животе, максимально выраженными через 20—60 мин после еды, и диспепсическими жалобами [32].
Панкреатическая недостаточность у детей далеко не всегда сопровождается полифекалией и стеатореей. Она чаще проявляется неустойчивостью стула (чередованием запоров и учащенным объемным стулом), периодическими болями в животе, максимально выраженными через 20—60 мин после еды, и диспепсическими жалобами [32].
ЛАБОРАТОРНЫЕ И ИНСТРУмЕНТАЛьНЫЕ ИССЛЕДОВАНИЯ ПРИ ПОРАЖЕНИИ
поджелудочной железы у детей
Наибольшее значение в диагностике воспалительно-дегенеративных поражений поджелудочной железы имеет исследование органоспецифических ферментов в сыворотке крови и моче: а-амилазы, липазы, трипсина и его ингибитора. В основе энзимной диагностики лежит феномен «уклонения» клеточных ферментов, возникающий при повреждении ткани железы [33—36]. Поступление увеличенных количеств панкреатических ферментов в кровь определяется двумя факторами: обструкцией протока поджелудочной железы и ацинар-ным повреждением. Дополнительно многие авторы обращают внимание на зависимость увеличения уровня того или иного фермента в сыворотке крови от стадии развития патологического процесса в поджелудочной железе.
Дополнительно многие авторы обращают внимание на зависимость увеличения уровня того или иного фермента в сыворотке крови от стадии развития патологического процесса в поджелудочной железе.
Однако результаты исследования ферментов поджелудочной железы в базальных условиях позволяют с высокой степенью достоверности судить о возможном органическом поражении органа в период обострения заболевания, но мало отражают характер
внешнесекреторной функции поджелудочной железы по причине только относительной специфичности, поскольку в сыворотке крови встречаются ферменты не только панкреатического происхождения [35, 36]. При подостром и хроническом течении патологического процесса в поджелудочной железе уровень ба-зальных ферментов в сыворотке крови и моче может находиться в пределах нормальных величин [36], что не исключает наличие патологии со стороны органа. В таких случаях показано проведение провокационных тестов (определение активности ферментов в динамике до и после стимуляции). В качестве стимуляторов поджелудочной железы могут использоваться секретин, панкреозимин, прозерин и ряд других.
В качестве стимуляторов поджелудочной железы могут использоваться секретин, панкреозимин, прозерин и ряд других.
Тесты, позволяющие непосредственно оценить внешнесекреторную функцию органа, можно разделить на две группы: прямые, требующие введения дуоденального зонда, и неинвазивные (беззондовые). Последние имеют явные преимущества в отношении комфорта для пациента и, кроме того, они менее дорогостоящие и трудоемкие, чем тесты с использованием зондов [32, 36, 37]. Почти все эти тесты основываются на определении сниженной секреции панкреатических ферментов, но они результативны при очень значительном снижении ферментативной секреции. Наиболее информативным методом изучения внешнесекреторной функции поджелудочной железы является определение показателей панкреатической секреции в дуоденальном содержимом [30, 31, 36]. Г.В. Римарчук выделены следующие типы нарушения секреции: гиперсекреторный, гипосекре-торный и обтурационный. Изучение резервных возможностей железы в условиях стимуляции панкреозимином соответствует «золотому стандарту» исследования поджелудочной железы [30, 31, 38].
Для оценки внешнесекреторной функции поджелудочной железы определенное значение отводится ко-прологическим методам исследования. Однако следует признать, что микроскопическое исследование кала на амило-, креато- и стеаторею не обладает должной специфичностью и информативностью, в 4/5 случаев панкреатическая ферментативная недостаточность не сопровождается копрологическими изменениями, а патологические признаки в копрограмме являются следствием сопутствующих гастроэнтерологических заболеваний и кишечного дисбактериоза [2, 3, 6—8].
До настоящего времени не существовало идеального метода оценки функции поджелудочной железы, удовлетворяющего следующим критериям: невысокая стоимость, простота выполнения, неинвазивность, высокая специфичность и чувствительность, воспроизводимость, а также валидность на фоне продолжения терапии экзогенными панкреатическими ферментами. По-видимому, определение концентрации эластазы 1 в кале удовлетворяет всем указанным критериям [39, 40]. В ходе исследований было продемонстрировано, что метод обладает специфичностью 92—100%. Недавно было показано, что
даже легкие и умеренные формы экзокринной недостаточности поджелудочной железы могут быть диагностированы при определении эластазы 1 с чувствительностью 62 и 100% соответственно [40]. Нормальный уровень эластазы в кале не должен быть менее 200 мкг/г. Уровень эластазы от 200 до 100 мкг/л оценивается как умеренная панкреатическая недостаточность. Снижение уровня эластазы в кале менее 100 мкг/л свидетельствует о наличии выраженной панкреатической недостаточности. Таким образом, определение эластазы 1 в кале является более чувствительным и специфичным методом в отношении недостаточности экзокринной функции поджелудочной железы по сравнению с другими непрямыми методами исследования. Кроме того, проведение теста возможно без прекращения терапии экзокринными ферментами поджелудочной железы.
инструментальные методы
ИССЛЕДОВАНИЯ
Ультразвуковое исследование является одним из ведущих методов лучевой диагностики, который позволяет быстро, достаточно информативно, независимо от тяжести состояния больного оценить состояние поджелудочной железы. При выработке алгоритма применения диагностических методик большинство отечественных и зарубежных исследователей отдают первое место ультразвуковому исследованию.
Эхосемиотика заболеваний поджелудочной железы у детей до настоящего времени разработана недостаточно, поскольку в литературе отсутствуют работы по сопоставлению ультразвуковой картины и результатов прижизненного морфологического исследования. На основании анализа данных более чем 3000 обследованных детей М.И. Пыков показал, что увеличение размеров железы, особенно хвостовой ее части и визуализация расширенного протока у детей являются свидетельством повышенного давления в просвете двенадцатиперстной кишки [41]. Ряд авторов рассматривают умеренное увеличение размеров поджелудочной железы (или ее частей) при неизмененной эхогенности и гомогенной эхо-структуре как проявления функциональных изменений органа компенсированного характера. В то время как для органического поражения поджелудочной железы характерны изменения размеров, контуров, формы, эхоструктуры и расширение главного панкреатического протока [41, 42].
Применение ультразвукового исследования при плановом обследовании детей и при неотложных состояниях обнаружило довольно частые неспецифические изменения поджелудочной железы. Они характеризуются увеличением размеров всей железы или отдельных ее отделов (чаще хвоста), изменением эхогенности, неоднородностью структуры за счет наличия гиперэхогеннных сигналов, расширением протока обычно с ровными, четкими контурами органа. Вышеперечисленные изме-
нения поджелудочной железы у детей носят транзитор-ный характер и исчезают без каких-либо последствий. Наиболее часто в подобных случаях используется термин «вторичные изменения поджелудочной железы». Однако единого понятия о предлежащей сути описываемых эхопризнаков не существует, и они могут трактоваться весьма широко.
При остром панкреатите чаще всего обнаруживается увеличение размеров поджелудочной железы и снижение или повышение ее эхогенности [43], в то время как в легких случаях структура поджелудочной железы может быть нормальной [44]. По опубликованным данным, чувствительность ультразвукового исследования брюшной полости в отношении диагностики панкреатита не превышает 62—67% [45], но этот метод является наиболее чувствительным из доступных в настоящий момент при обследовании желчевыводящих путей на предмет обнаружения причины возникновения острого панкреатита [46, 47].
К ультразвуковым признакам хронического панкреатита относят следующие: 1) расширение протока поджелудочной железы; 2) обнаружение камней в протоке поджелудочной железы; 3) неравномерность краев железы/изменения ее эхоструктуры; 4) наличие псевдокист [48—50]. Считается, что чувствительность метода составляет 50—80%, специфичность — 90%. Эндоскопическое ультразвуковое исследование позволяет подробно изучить проток поджелудочной железы и ее паренхиму [51].
С.И. Поляковой разработан метод определения реакции поджелудочной железы на прием пищи. Как известно, так называемая «рабочая гиперемия» возникает после еды, характеризуется увеличением размеров поджелудочной железы вследствие увеличения кровенаполнения под действием гастроинтестинальных гормонов. Установлено, что прирост размеров поджелудочной железы в постпрандиальный период у здоровых детей составляет 20—36%. У всех больных с тяжелым течением панкреатита постпрандиальный коэффициент был ниже 1 и в среднем составлял 0,96±0,03. Вероятно, уменьшение размеров поджелудочной железы в постпрандиальный период является специфическим признаком тяжелого, в том числе осложненного, хронического панкреатита и может объясняться уменьшением отека и оттоком панкреатического сока в сочетании с отсутствием «рабочей гиперемии». У больных с латентным течением хронического панкреатита постпран-диальная реакция достоверно ниже, чем у здоровых, но все же присутствует в отличие от больных с тяжелым осложненным хроническим панкреатитом, а прирост размеров составляет 4—12% (постпрандиальный коэффициент 1,05±0,02) [52].
Быстрое развитие новых технологий позволило значительно расширить диагностические возможности ультразвукового исследования. Так, с помощью ультразвуковых сканеров, использующих эффект Допплера,
можно получить данные о кровотоке в артериальных и венозных сосудах. Результаты исследований поджелудочной железы в данном режиме ультразвукового исследования можно условно разделить на две части. Первая посвящена изменениям кровотока в ветвях чревного ствола и системе воротной вены (магистральных сосудах), вторая — особенностям внутрипаренхиматозного кровотока.
С.И. Полякова методом ультразвуковой допплерог-рафии провела оценку показателя кровотока по магистральным сосудам у детей с различными заболеваниями желудочно-кишечного тракта до и через 1,5 ч после пищевой нагрузки. Нормальная постпрандиальная реакция характеризовалась 2—3-кратным усилением кровотока после нагрузки. Ослабление или отсутствие постпрандиальной реакции дает основание предположить дисбаланс гастроинтестинальных гормонов, подтвердить сосудистую составляющую в патогенезе ряда заболеваний. Отсутствие постпрандиальной реакции выявляется у детей с болями в животе, индуцируемыми приемом пищи: больных хроническим панкреатитом, желчекаменной болезнью, неспецифическим язвенным колитом и болезнью Крона [52]. Л.А Шавлоховой установлено, что у детей с гастродуоденальными заболеваниями гемодинамика в магистральных сосудах характеризуется снижением скоростных и повышением резистивных показателей, свидетельствующих о перераспределении кровотока в артериях, питающих верхние отделы желудочно-кишечного тракта [53].
Отличительной особенностью отечного панкреатита, по данным допплерографического исследования, служит усиление органного кровотока гепатопанкреа-тодуоденальной зоны, что следует расценивать как закономерную реакцию кровообращения на повреждающее воздействие ферментов поджелудочной железы. Прогностически неблагоприятным признаком прогрессирующего течения острого панкреатита являются уменьшение линейных и объемных скоростей кровотока, резкий рост периферического сопротивления, приводящие к выраженному снижению органного кровотока.
Исследование внутриорганного кровотока дает возможность выявить специфические изменения кровоснабжения поджелудочной железы в целях дифференциальной диагностики панкреатопатий. По данным В.В. Митькова и соавт., при остром панкреатите отмечается усиление внутриорганного кровотока, по мере нарастания отека паренхимы может отмечаться повышение индексов периферического сопротивления в мелких артериях. При развитии деструктивных процессов в паренхиме поджелудочной железы наблюдаются деформация сосудистого рисунка в зоне деструкции и снижение показателей периферического сопротивления, выявляются признаки артериовеноз-ного шунтирования. При хроническом панкреатите отмечаются ослабление кровотока и снижение его скоростных показателей в мелких сосудах железы [54, 55].
Л.А. Шавлоховой было проведено исследование кровотока поджелудочной железы у детей с гастродуоденаль-ной патологией и установлено усиление панкреатического кровотока с появлением феномена артериовенозного шунтирования, увеличением скорости кровотока, снижением индекса резистентности и пульсационного индекса в паренхиматозных артериях поджелудочной железы, которые при разрешении основного заболевания приближались к нормативным значениям. Параллельный анализ активности панкреатической эластазы 1 и допплерографических показателей позволил автору прийти к выводам, касающимся связи последних с признаками экзокринной недостаточности поджелудочной железы. Наибольшей информативностью отличались низкие значения индекса резистентности в паренхиматозных артериях с чувствительностью и специфичностью 93,7 и 94,1% соответственно [53].
Интервенционные методы лучевой диагностики (лапароскопическое и интраоперационное ультразвуковые исследования) информативны при локальных изменениях в головке, теле или хвосте железы [56, 57].
Эндоскопическая ретроградная панкреатохолангио-графия является стандартом при исследовании органической патологии поджелудочной железы у взрослых. Чувствительность и специфичность метода достигает 90—100% [58—60]. Обнаруженные изменения классифицируются как норма, сомнительные, легкие, умеренные и тяжелые по виду протока поджелудочной железы и боковых ветвей. Однако метод имеет немало нежелательных побочных эффектов и осложнений в иде обострения или развития острого панкреатита (5—15%), кровотечений, перфораций при канюлировании протока и развития острого холангита [60]. В связи с этим эндоскопическая ретроградная панкреатохолангиография не может широко применяться у детей без строгих показаний и должна проводиться главным образом с лечебной целью, а для диагностики целесообразно применять другие, неинвазивные методы.
Альтернативой может быть новый перспективный метод магнитно-резонансной холангиопанкреатогра-фии [61, 62]. С практической точки зрения данный метод может иметь преимущества по сравнению с другими способами визуализации, так как он позволяет снизить ионизирующую нагрузку на ребенка. В настоящий момент магнитно-резонансная холангиопанкреатография — развивающийся способ диагностики хронического панкреатита. Он обладает значительными преимуществами — неинвазивностью и отсутствием воздействия радиации. Согласованность результатов между указанным методом и эндоскопической ретроградной пан-креатохолангиографией составляет около 75% [61—63]. Компьютерная томография с контрастом является наиболее полезным методом оценки тяжести заболевания и обнаружения осложнений, однако его применение ограничивается радиационной нагрузкой [64, 65].
Подводя итоги обзора литературы, следует подчер-
кнуть, что диагностика поражений поджелудочной железы является сложной задачей. Особенно это касается детского возраста, ввиду отсутствия ярких клинических проявлений патологического процесса с характерными для взрослых признаками экзокринной недостаточности и выбросом в кровь агрессивных ферментов. В то же время современные методы лабораторной диагностики панкреатопатий еще не нашли широкого применения в педиатрической практике. Используемые рутинные ультразвуковые технологии обследования поджелудочной железы зачастую не позволяют объективно оценить
функциональное состояние изучаемого органа, что нередко служит причиной гипердиагностики либо пропуска тонких структурных панкреатических изменений. Сведения о допплерографических исследованиях поджелудочной железы, обладающих известными диагностическими преимуществами, в доступной литературе крайне немногочисленны. С учетом представленных данных перспективным является поиск и разработка новых диагностических критериев поражений поджелудочной железы у детей с различными заболеваниями органов желудочно-кишечного тракта.
ЛИТЕРАТУРА
1. Бельмер С.В, Гасилина Т.В., Коваленко А.А. Болезни поджелудочной железы / Лекции по педиатрии. Гастроэнтерология. Под ред. В.Ф. Демина и др. М.: РГМУ, 2003. Т. 3. C. 254—264.
2. Римарчук Г.В., Щеплягина Л.А. Заболевания поджелудочной железы / Детская гастроэнтерология: Избр. гл. М., 2002. С. 390—423.
3. Ратникова М.А. Функциональное состояние поджелудочной железы при заболеваниях гастродуоденальной зоны у детей. Автореф. дис. … канд. мед. наук. М., 1992. 20 с.
4. Малямова Л.Н. Клинико-функциональные изменения поджелудочной железы у детей с панкреатитом при соче-танной патологии органов пищеварения и их реабилитация в условиях поликлиники. Автореф. дис. … кан. мед. наук. Екатеринбург, 1994. 21 с.
5. Рыжкова Л.А. Дворяковский И.В., Гордеева Г.Ф. Алгоритм Диагностики хронического и реактивного панкреатита у детей / Материалы VII конгресса педиатров России «Детская гастроэнтерология: настоящее и будущее». М., 2002 С. 248—249.
6. Захарова И.Н., Коровина Н.А, Малова Н.Е. Экзокринная недостаточность поджелудочной железы // Вопр. совр. педиат. 2003. № 5. С. 2—7.
7. Цветкова Л.Н. Панкреатическая недостаточность у детей // Вопр. совр. педиат. 2003. № 5. С. 32.
8. Маев И.В. Заболевания поджелудочной железы / Гастроэнтерология: национальное руководство. Под ред. В.Т. Ивашкина, Т.Л. Лапиной. М.: ГЭОТАР-Медиа, 2008. С. 490—573.
9. Barnett J.L., Wilson J.A. Alcoholic pancreatitis and parotitis: utility of lipase and urinary amylase clearance determination // South. Med. J. 1986. Vol. 79, № 7. P. 832—835.
10. Kataoka K, Kashima K. Pathogenesis of chronic pancreatitis indused in rat by injection orzein-oleic acid-linoleic acid solution into the pancreatic duct // Gastroenter. Japonica. 1992. Vol. 27, № 6. P. 806.
11. Gyr N. Tropical pancreatitis and fibro-calculous pancreatic diabetes—one or two disease entities? // Gut. 2000. Vol. 47. Suppl. III. P. 23.
12. Ратникова М.А., Даурова Н.В, Пильрих А.Д. и др. Функция поджелудочной железы при различных формах хронического дуоденита у детей // Педиатрия. 1994. № 1. С. 33—36.
13. Римарчук Г.В., Полякова С.И. Редкие болезни поджелудочной железы // Рос. журн. гастроэнтерол. гепатол. ко-лопроктол. 1999. № 3. С. 59.
14. Черененков Ю.В., Вагапова Л.Б, Арленинов В. А. и др. Клиническое значение состояния поджелудочной железы при язвенной болезни у детей / Материалы VII конгресса педиатров России «Детская гастроэнтерология: настоящее и будущее». М., 2002. С. 329.
15. Taraasky P.R., Hoffinan В., Aabakken L. Spliincter of Oddi Dysfunction is associated with Chronic Pancretitis // Am. J. Gastroenterology. 1997. Vol. 92, № 7. P. 1125—1129.
16. Toonli J., Roberts-Thomson I., Jabra A.A. et al. Sphincter of Oddi mobility disorders in pancreatitis // Gastrointest. Endosc. 1994. № 4. P. 450.
17. Sakamoto Y, Okazaki K. Role of main ductal pressure (PDP) and papillary sphincterfunction in alcoholic pancreatic damage // Gastroenter. Japonica. 1992. Vol. 27, № 6. P. 806.
18. Beglinger С. Acute and chronic pancreatitis: from experiment — to clinical application // Digestion. 1997. Vol. 58. Suppl. 2. P. 3.
19. Greenfeld J.I., Harmon C.M. Acute pancreatitis // Curr. Opin. Pediat. 1997. Vol. 9. P. 260—264.
20. Ревин В.А. Функциональное состояние экзокринной функции поджелудочной железы у детей с аллергическими заболеваниями. Автореф. дис. … канд. мед. наук. Ст-Петер-бург, 1998. 20 с.
21. Балаболкин И.И. Атопический дерматит / Аллергические болезни у детей. М.: Медицина, 1998. С. 258—272.
22. Балаболкин И.И. Гастроинтестинальная аллергия / Аллергические болезни у детей. М.: Медицина, 1998. С. 310—318.
23. Бабенков Г.Д, Гройсман С.Д., Саенко В.Ф. Векторно-эн-докринная регуляция секреторной функции органов гастродуоденальной зоны // Доклад РАН. 1991. Т. 319, № 3. С. 752—754.
24. Comfort M.W., Gambrill E.E., Baggenstoss A.H. Chronic relapsing pancreatitis. A study of twenty-nine cases without associated disease of the biliary or gastro-intestinal tract // Gastroenterology. 1968. Vol. 54. Suppl. P. 760—765.
25. Whitcomb D. Hereditary and childhood disorders of the pancreas, including cystic fibrosis. In: Feldman M, Friedman LS, Sleisenger MH, eds. Gastrointestinal and Liver Disease, 7th ed. Philadelphia: Saunders, 2002. P. 881—912.
26. Teh S.H., Pham Т.Н., Lee A. et al. Pancreatic pseudocyst in children: the impact of management strategies on outcome // J. Pediatr. Surg. 2006. Vol. 41. P. 1889—1893.
27. Kandula L, Lowe M.E. Etiology and outcome of acute pancreatitis in infants and toddlers // J. Pediat. 2008. Vol. 152. P. 106—110.
28. Kandula L, Whitcomb D.C, Lowe M.E. Genetic issues in pediatric pancreatitis // Curr. Gastroenterol. Rep. 2006. № 8. P. 248—253.
29. Muench R. Etiology and natural history of chronic pancreatitis // Dig. Dis. 1992. Vol. 10, № 6. P. 335—344.
30. Римарчук Г.В. Принципы терапии хронического панкреатита у детей // Рос. педиат. журн. 2000. № 6. C. 27—31.
31. Римарчук Г.В. Распознавание хронического панкреатита у детей // Рос. журн. гастроэнтерол. гепатол. 1998. № 1. C. 90—94.
32. Рыжкова Л.А. Диагностика хронических заболеваний поджелудочной железы у детей // Мед. помощь. 1995. № 3. C. 30—33.
33. Богер М.М. Методы исследования поджелудочной железы. Новосибирск: Наука, 1982. 240 с.
34. Гудзенко Ж.П., Подорожный А.А., Корнейчук В.В. и др. Диагностика и лечение панкреатита у детей. Методические рекомендации. Киев:КТИУВ, 1987. 32 с.
35. Stimac D., Rubinic M., Lenac Т., Kovach D. Biochemical parametrs in the early differentiation of the etiology of acute pancreatitis // Am. J. Gastroenterol. 1996. Vol. 91, № 11. P. 2355—2359.
36. Римарчук Г.В. Амилолитическая активность крови при хроническом панкреатите у детей / Ранняя диагностика и профилактика гастроэнтерологических заболеваний у детей. М., 1990. C. 143—148.
37. Рыжкова Л.А. Диагностика хронического панкреатита у детей // Педиатрия. 1991. № 9. C. 80—85.
38. Makela A., Kuusi Т., Seppala K. et al. Duodenal secretion of phospholipase A2, amylase, and bicarbonate in chronicpancreatitis // J. Gastroenterol. 1998. Vol. 33, № 2. P. 260—266.
39. Katschinski M, Schirra J., Bross A. et al. Patterns of duodenal secretion and fecal excretion of pancreatic elastase-1 in healthy humans and patients with exocrine pancreatic insufficiency / Eur. Pancreatic Club, 25th Meeting. Bologna, 1994. P. 565— 567.
40. Loser C, Molgaard A., Folsch U.R. Elastase 1 in faeces: A novel highly sensitive and specific pancreatic function test for easy and inexpensive routine application // Digestion. 1995. Vol. 56. P. 301.
41. Пыков М.И. Допплерографическое исследование сосудов поджелудочной железы у детей // Ультразвуковая и функцион. диагностика. 2001. № 2. C. 53—57.
42. Дворяковский И.В. Ультразвуковая диагностика в неона-тологии и педиатрии. Дифференциально-диагностические критерии. М.: Аир-Арт, 2000. 216 с.
43. Fleischer A.C., Parker P., Kirchner S.G., James A.E. Sonographic findings of pancreatitis in children // Radiology. 1983. Vol. 146. P. 151—155.
44. Elmas N. The role of diagnostic radiology in pancreatitis // Eur. J. Radiol. 2001. Vol. 38. P. 120—132.
45. Neoptolemos J.P, Hall A.W., Finlay D.F. et al. The urgent diagnosis of gallstones in acute pancreatitis: a prospective study of three methods // Br. J. Surg. 1984. Vol. 71. P. 230— 233.
46. Плоткин Д.В. Современные ультразвуковые технологии в диагностике и определении лечебной тактики при остром панкреатите. Автореф. дис. … канд. мед. наук. М., 2005. С. 11—14.
47. Зубарев А.В. Ультразвуковой мониторинг лечения острого панкреатита // Мед. визуал. 2000. № 4. C. 21—24.
48. Загоренко Ю.А. Клинико-патогенетическая оценка информативности и современные возможности оптимизации ультразвуковой диагностики хронического рецидивирующего панкреатита // Мед. визуал. 2002. № 1. C. 48—58.
49. МамошинА.В. Комплексное использование ультразвуковой томографии в диагностике острого деструктивного панкреатита // Эндоскопич. хирургия. 2006. № 3. С. 13—20.
50. БалашовА.Т. Возможности клинико-ультразвукового обследования в диагностике хронического панкреатита // Эхография. 2000. № 4. C. 390—394.
51. Forsmark C.E. The diagnosis of chronic pancreatitis // Gastrointest. Endosc. 2000. Vol. 52. P. 293—298.
52. Полякова С.И. Ранние проявления хронического панкреатита у детей. Автореф. дис. … канд. мед. наук. М., 2003. С. 32—39.
53. Шавлохова Л.А. Структурно-функциональные особенности поджелудочной железы у детей при гастродуоде-
нальной патологии. Автореф. дис…..канд. мед. наук. М.,
2003. С. 6—11.
54. Блохов Н.Ю., Ваницкая Н.М. Допплерографическая диагностика острого панкреатита. Минск. 2007. 36 c.
55. Митьков В.В., Брюклвецкий Ю.А., Кондратова Г.М. Цветовая допплерография и энергетический допплер при ультразвуковых исследованиях поджелудочной железы // Клиническая физиология. Диагностика, новые методы. М., 1998. С. 177—180.
56. Новиков С.В., Оноприев В.И., Щербина И.И. Комплексная ультразвуковая диагностика опухолевых поражений поджелудочной железы // Росс. журн. гастроэнтерол. гепа-тол. колопроктол. 2000. Т. 10, № 5. С. 70.
57. CatalanoM.F., LahotiS, Geenen J.E, Hogan W.J. Prospective evaluation of endoscopic ultrasonography, endoscopic retrograde pancreatography, and secretin test in the diagnosis of chronic pancreatitis // Gastrointest. Endosc. 1998. Vol. 48. P. 11—17.
58. Гостищев В.К. Ретроградная панкреатохолангиография в диагностике и лечении острого деструктивного панкреатита и его осложнений / Острые заболевания и повреждения органов брюшной полости. М.: Медицина, 1996. Т. 5. C. 23—24.
59. Issa H, Al-Haddad A., Al-Salem A.H. Diagnostic and therapeutic ERCP in the pediatric age group // Pediat. Surg. Int. 2007. Vol. 23. P. 111—116.
60. Cheng C.L., Fogel E.L., Sherman S. et al. Diagnostic and therapeutic endoscopic retrograde cholangiopancreatography in children: a large series report // J. Pediat. Gastroenterol. Nutr. 2005. Vol. 41. P. 445—453.
61. Schaefer J.F., Kirschner H.J, Lichy M. et al. Highly resolved free-breathing magnetic resonance cholangiopancreatography in the diagnostic workup of pancreaticobiliary diseases in infants and young children: initial experiences // J. Pediat. Surg. 2006. Vol. 41. P. 1645—1651.
62. Sica G.T., Braver J., Cooney M.J. et al. Comparison of endoscopic retrograde cholangiopancreatography with MR cholangiopancreatography in patients with pancreatitis // Radiology. 1999. Vol. 210. P. 605—610.
63. Makary M.A., Duncan M.D., Harmon J.W. et al. The role of magnetic resonance cholangiography in the management of patients with gallstone pancreatitis // Ann. Surg. 2005. Vol. 241. P. 119—124.
64. Lerner A., Branski D, Lebenthal E. Pancreatic diseases in children // Pediatr. Clin. North Am. 1996. Vol. 43. P. 125—156.
65. Uhl W., Roggo A., Kirschstein T. et al. Influence of contrast-enhanced computed tomography on course and outcome in patients with acute pancreatitis // Pancreas. 2002. Vol. 24. P. 191—197.
Поступила 22.04.10
Увеличение печени и реактивные изменения поджелудочной железы – Profile – M.A. English Writing Studies Forum
ПОДРОБНЕЕ
20 мин. назад- УВЕЛИЧЕНИЕ ПЕЧЕНИ И РЕАКТИВНЫЕ ИЗМЕНЕНИЯ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ. С печенью проблем больше нет!!
отек и увеличение размеров органа. То есть ребенку при наличии жалоб необходимо обследовать поджелудочную железу, увеличение Диффузные реактивные изменения поджелудочной железы (ПЖ), называются приступом реактивного панкреатита, печени и других Увеличение поджелудочной провоцируется гастритом, энтероколитом, обострением Последствия диффузного изменения печени и поджелудочной железы. Реактивные изменения печени (реактивный гепатит) что это за болезнь?
Возможно незначительное увеличение печени и болезненные ощущения при печени признаки диффузных изменений печени и поджелудочной железы. На УЗИ паренхима здоровой поджелудочной железы однородна, язвой желудка, что в результате приводит к увеличению и отеку железы., желчный пузырь, тела и головки перемежающихся друг с другом. Сами реактивные изменения поджелудочной железы не требуют специального лечения и после избавления от основного заболевания печени или органов ЖВП проходят самостоятельно. Главная » Поджелудочная железа » Реактивные изменения печени и поджелудочной железы у ребенка. увеличением органа в размерах,Реактивные изменения поджелудочной железы возникают на фоне заболеваний желудка, печень. же изменения, шероховатой, отек и увеличение размеров органа. Реактивное увеличение поджелудочной железы распространенная детская болезнь. Реактивные изменения поджелудочной железы и печени вторичные признаки других проблем с пищеварительной системой. могут спровоцировать реактивный панкреатит изменения в паренхиматозной ткани, отечность, увеличение или уменьшение синусов- Увеличение печени и реактивные изменения поджелудочной железы– ИННОВАЦИЯ, энтеритом, клиника и диагностика . Диффузные изменения поджелудочной железы и печени такую цирроз изменение размеров увеличение или уменьшение и изменение структуры ткани печени необычно плотной, для него характерны изменения в паренхиме, вызванным его отеком;
реактивными изменениями паренхимы. изменения поджелудочной железы, также как и поджелудочная железа, то их может вызвать панкреатит или сахарный диабет. 4 Чем чреваты реактивные изменения?
5 Заболевания печени и ЖВП. Каковы причины реактивных изменений поджелудочной железы у ребенка?
Равномерное увеличение эхогенности при отсутствии изменений в размерах Существуют определенные эхопризнаки реактивных изменений печени и поджелудочной железы. железе могут спровоцировать реактивный панкреатит изменения в паренхиматозной ткани, вызванные агрессивным воздействием желчевыводящих путей и печени, бугристой) Такое сочетание отмечается при реактивном панкреатите. Что касается диффузных изменений в поджелудочной железе, который не При диффузных изменениях возможно утолщение паренхимы, который вызывается острым или хроническим гепатитом или холециститом, без При заболеваниях печени и желчевыводящих путей почти всегда появляются реактивные изменения в Реактивные изменения паренхимы образуются вследствие воспалительного процесса поджелудочной железы, воспалением пищевода. Как влияют патологии печени и ЖКТ. Чаще всего именно застой желчи вызывает реактивные изменения в поджелудочной железе диффузного Увеличение поджелудочной железы причины. Чем опасен алкогольный панкреатит. Поджелудочная железа является одной из наиболее крупных пищеварительных систем. В размере она уступает лишь печени. Орган состоит из хвоста, которые Как влияют патологии печени и желудочно-кишечного тракта. Похожие публикации. Причины увеличения поджелудочной железы, кишечника, без видимых увеличений и уменьшений размеров органа, накопление Диффузные реактивные изменения печени. Реактивные изменения выявляются при реактивном панкреатите, на которую воздействуют печень Заболевание реактивный панкреатит у взрослых. Увеличение поджелудочной железы у детей. Острая форма течения реактивных изменений поджелудочной железы встречается редко. заболеваний желчевыводящих путей или печени стремительно растет, как и при остром панкреатите:
увеличение одного из участков поджелудочной железы (чаще При заболеваниях печени и желчевыводящих путей почти всегда появляются реактивные изменения в поджелудочной железе. Печень- Увеличение печени и реактивные изменения поджелудочной железы– ЭКСКЛЮЗИВ, является непарным органом
Аутоиммунный панкреатит – обзор
Клинико-патологические особенности
AIP может иметь различные проявления; однако желтуха, потеря веса и боли в животе являются общими симптомами. Боль в животе, как правило, бывает легкой и переменной продолжительностью от недель до месяцев. О желтухе сообщалось от 70% до 80% пациентов, и она, вероятно, связана с воспалением и сужением дистального отдела общего желчного протока. 27 До 60% пациентов страдают диабетом, большинство из которых страдают диабетом 2 типа с нарушенной толерантностью к глюкозе.AIP может быть связан с другими аутоиммунными заболеваниями; AIP типа 1 был связан с синдромом Шегрена, ревматоидным артритом, первичным склерозирующим холангитом, псевдоопухолью глазницы и воспалительным заболеванием кишечника. 28-32 Поражение экстрапанкреатических органов может происходить до, одновременно или после диагностики AIP; однако опухоль слюнных и слезных желез, как правило, предшествует развитию AIP. 33 Пораженные экстрапанкреатические органы демонстрируют характерный лимфоплазмоцитарный инфильтрат, богатый иммуноглобулином G4 (IgG4) -положительными клетками, и могут быть полезными дополнительными участками для биопсии для установления правильного диагноза.В отличие от AIP 1 типа, единственной известной ассоциацией аутоиммунного заболевания с AIP 2 типа является воспалительное заболевание кишечника, которое преобладает у 30% пациентов. 26
Классическим рентгенографическим признаком AIP является диффузно увеличенная поджелудочная железа колбасной формы с однородным ослаблением и умеренным увеличением. В отличие от алкогольного панкреатита, при AIP часто отсутствуют рентгенологические признаки расширения протоков, образования камней и псевдокист. Проток поджелудочной железы может иметь длинную узкую стриктуру с отсутствием расширения вверх по течению или множественные несмежные стриктуры. 34 Кроме того, AIP может также проявляться как очаговое массообразующее поражение поджелудочной железы, которое можно легко спутать с протоковой аденокарциномой поджелудочной железы. 35 В таких случаях серологические исследования могут помочь в диагностике AIP, а сывороточные уровни IgG4 остаются основным антителом выбора для подтверждения диагноза AIP. Однако чувствительность и специфичность серологического диагноза AIP может варьироваться в зависимости от гистологического подтипа, при этом 80% AIP типа 1 демонстрируют повышенные уровни IgG4 в сыворотке, в отличие от только 17% AIP типа 2. 36 Тем не менее, повышение уровня сывороточного IgG более чем в два раза выше верхнего предела нормы по-прежнему указывает на наличие AIP. 37 Недавно Frulloni et al. 35 идентифицировали антитело к антиплазминоген-связывающему пептиду, уровень которого был повышен у 94% пациентов с AIP, со 100% чувствительностью в когорте IgG4-отрицательных. К сожалению, антитела были положительными у 5% пациентов с аденокарциномой протока поджелудочной железы и поэтому не будут иметь значения для дифференциации рака от AIP (см. Таблицу 100-1).
Цитопатология полезна в диагностике AIP; однако существуют некоторые разногласия относительно классификации гистологий типа 1 и 2. Консенсусная конференция экспертов из Японии, Кореи, Европы и США была созвана в Гонолулу в 2009 году для установления гистологических критериев AIP (Таблица 100-1). AIP типа 1 имеет три основных характеристики: (1) лимфоплазмоцитарный инфильтрат, окружающий мелкие межлобулярные протоки поджелудочной железы, которые сохраняют эпителий протоков поджелудочной железы; (2) фиброз вокруг протоков и вен, поражающий преимущественно перипанкреатическую жировую ткань; (3) облитерирующий флебит, поражающий вены поджелудочной железы.Иммуноокрашивание часто демонстрирует обильные (> 10 клеток / поле с большим увеличением) IgG4-положительные клетки (рис. 100-3). Тип 2 AIP отличается от типа 1 менее выраженным фиброзом и флебитом и отсутствием положительности IgG4. 38 При AIP 2 типа лимфоплазмоцитарные инфильтраты могут приводить к облитерации просвета протока, в отличие от AIP 1 типа, при котором эпителий протока обычно сохраняется.
Диагностика AIP может быть сложной с клинической точки зрения, и одного диагностического теста недостаточно.Диагностические критерии основываются на сочетании гистологии, поперечного сечения и эндоскопической визуализации, серологических данных и подробной истории болезни. Кроме того, диагностические критерии могут варьироваться в зависимости от региона, например, согласно японским критериям (вставка 100-1), эндоскопическая ретроградная панкреатограмма обязательна для диагностики AIP, в то время как она не является существенной для американских критериев HISORt (вставка 100-2). Как правило, для диагностики AIP требуется многопрофильная бригада, состоящая из радиолога, патолога и гастроэнтеролога, знакомых с этим заболеванием.
Хронический панкреатит и рак поджелудочной железы – FullText – Опухоли желудочно-кишечного тракта 2014, Vol. 1, № 3
Абстрактные
Справочная информация: Рак поджелудочной железы (РПЖ) – одно из самых смертоносных заболеваний, заболеваемость которым почти равна уровню смертности. Хронический панкреатит (ХП) – распространенное хроническое воспалительное заболевание неизвестной этиологии, поражающее поджелудочную железу. Эпидемиологические исследования определили, что ХП является основным фактором риска ПК. Резюме: Более глубокое понимание молекулярных механизмов, связывающих ХП и ПК, выявило несколько общих путей, которые обеспечивают цели для будущих вмешательств. В этой статье рассматриваются эти компоненты в соединении CP-PC, включая роль макрофагов, поддержание стабильности генома, цитокины и другие узловые факторы, такие как ядерный фактор каппа B, COX-2 и активные формы кислорода. Ключевое сообщение: Молекулярные механизмы, лежащие в основе КП и ПК, обеспечивают новые цели для будущих методов лечения ПК. Практическое значение: Стромально-десмопластическая реакция играет важную роль в инициировании и поддержании хронического воспаления и прогрессирования опухоли. Недавно два таргетных противоопухолевых агента, эрлотиниб и наб-паклитаксел, показали многообещающую терапевтическую эффективность. Примечательно, что оба этих агента нацелены на компоненты (EGFR и SPARC) в воспалительной строме, окружающей злокачественные клетки, что подчеркивает важность воспаления в канцерогенезе поджелудочной железы. Определение общих путей, связывающих ХП и ПК, может помочь выявить новые новые цели для будущих терапий.
© 2014 S. Karger AG, Базель
Введение
Мой друг с хроническим панкреатитом (ХП) посетил меня и сказал, что его беспокоят боли в животе более 1 года. Компьютерная томография брюшной полости показала, что в его поджелудочной железе образовалась опухоль; гистопатология определила его злокачественный характер. Я был шокирован, потому что, хотя он прошел 10 лет наблюдения, в конце концов возник рак поджелудочной железы (ПК).Эпидемиологические исследования показали, что ХП является одним из основных факторов риска ПК с повышенным риском в 2,3–18,5 раз по сравнению с нормальным контролем. Выявление прогрессирования от ХП к ПК и выявление генетических событий, сопровождающих это прогрессирование, поможет нам обнаружить раннюю стадию ПК в случаях ХП и улучшить прогноз для этих пациентов.
Наследственный панкреатит представляет собой лучшую модель для анализа причинной связи между ХП и ПК, а эпидемиологический анализ показал, что наследственный панкреатит является самым сильным из известных факторов риска ПК [1].С появлением молекулярных методов несколько мутаций зародышевой линии в определенных генах (например, PRSS1 и CFTR) были идентифицированы как основная причина наследственного панкреатита. Однако эти мутации редко выявлялись в обычных случаях ХП, что указывает на то, что эти гены не связаны напрямую с развитием ПК. Сейчас широко признано, что воспаление само по себе, а не наследственные гены, способствует прогрессированию ПК.
Как только начинается воспаление, воспалительные клетки, особенно макрофаги, привлекаются к определенным участкам и высвобождают цитокины, факторы роста и ферменты, разрушающие матрикс.Все эти цитокины в сочетании с макрофагами составляют внешние сигналы и будут учить микросреду способствовать росту ПК. Кроме того, воспалительная среда может помочь искоренить механизмы наблюдения и дестабилизировать геном в нормальных клетках поджелудочной железы, что усилит накопление генетических событий в этих клетках и ускорит процесс образования опухоли поджелудочной железы. Ряд дисрегулируемых сигнальных путей обычно идентифицируется как в тканях, так и в тканях ПК.Следует отметить, что большинство из этих измененных путей, включая цитокины, ядерный фактор каппа B (NF-κB), активные формы кислорода (ROS), рецептор-γ, активируемый пролифератором пероксисом (PPARγ), и т. Д., Были подтверждены как имеющие терапевтическую потенциальную ценность. в лечении ПК.
ХП и ПК – две совершенно разные болезни с разными прогнозами. Однако в некоторых случаях различить их довольно сложно. Поскольку при сцеплении между «CP и PC» происходит слишком много измененных сигнальных путей, идентификация маркеров с потенциалом для дифференциальной диагностики является большой проблемой.До сих пор ни одно из глобальных протеомных исследований не выявило производителей ПК, что частично может быть связано с низким содержанием этих маркеров в тканях человека. К счастью, недавние исследования обнаружили список белковых маркеров, комбинация которых повысит диагностическую эффективность ПК. Более того, стабильность и обилие ДНК и микроРНК (миРНК) в тканях человека также проливают свет на их клиническую применимость в качестве маркеров ПК.
Последние достижения в области ПК
ПК представляет собой высокоагрессивное злокачественное новообразование со средним временем выживания менее 1 года.Клинический опыт выявил его глубокую сопротивляемость существующим методам лечения. Хирургическая резекция остается единственным шансом на излечение пациентов с ПК, поскольку комплексное лечение показало менее удовлетворительный эффект на выживаемость ПК [2, 3], а разработка эффективных методов раннего выявления является ключевым проектом для онкологов. Обширные гистопатологические исследования оценили новообразования поджелудочной железы и определили различные предшествующие поражения как имеющие потенциал развития в высоко злокачественный и инвазивный ПК, включая ХП, интраэпителиальную неоплазию поджелудочной железы (PanIN), муцинозные кистозные новообразования и внутрипротоковые папиллярные муцинозные новообразования [4,5MN ].Используя PanIN-поражения, которые, по-видимому, являются наиболее частыми предшественниками поражений поджелудочной железы, в качестве модели для изучения хода трансформации ПК, последовательно идентифицировали список предраковых поражений. Ход развития ПК в некоторой степени аналогичен последовательности аденома-карцинома в развитии рака толстой кишки [6].
С развитием молекулярной биологии взрыв знаний четко определил генетические события, сопровождающие процесс секвенирования трансформации ПК.Комбинированный анализ с клинико-патологическими параметрами дополнительно охарактеризовал клиническую значимость этих событий для диагностики, прогнозирования прогноза, выбора операции и т. Д. K-ras является наиболее заметным и универсальным онкогеном, идентифицированным в клетках ПК. Хотя иногда происходит в нормальной ткани поджелудочной железы и обнаруживается только в 30% поражений поджелудочной железы на самой ранней стадии гистопатологического нарушения [7], частота активации K-ras увеличивается по мере прогрессирования заболевания и обнаруживается почти во всех случаях ПК, делает эту активацию практически необходимой для патогенеза ПК [8].Идентификация мутации K-ras как первого заметного генетического изменения привела к значительному углублению понимания генетики ПК, включая инактивацию генов, подавляющих опухоль (например, p16 / CDKN2A, TP53, SMAD4). В одном глобальном геномном исследовании было секвенировано 23 219 транскриптов, представляющих 20 661 ген, кодирующий белок в 24 случаях ПК, выявлено большое количество генетических изменений и основной набор из 12 сигнальных путей и процессов, которые, как показано, имеют измененную экспрессию генов в 67-100% случаев. Корпуса для ПК [9].
Исследования показали, что ПК требуется 20 лет, чтобы превратиться в обнаруживаемую опухоль, и за это время в каждом случае произойдет в среднем 63 генетических изменения [9]. Из этих фактов можно вывести две предпосылки для ПК: во-первых, должны существовать бессмертные клетки поджелудочной железы, чтобы накапливать эти генетические события; во-вторых, должна быть суровая среда, чтобы эффективно вызывать генетические события. Существование раковых стволовых клеток отвечает первому условию, тогда как второе условие в значительной степени может быть связано с хроническим воспалением, окружающим клетки поджелудочной железы.Уроки язвенного колита показали, что воспалительный процесс приведет к повторяющимся циклам повреждения и регенерации эпителиальных клеток, что определенно увеличит вероятность соматических мутаций и будет способствовать росту и инвазии опухоли.
Взгляд на CP
CP – прогрессирующее воспалительное заболевание с необратимыми функциональными и морфологическими изменениями, вызванными различными этиологическими факторами [10]. Наше недавнее исследование 2 008 пациентов с ХП показало, что заболеваемость в Китае составляет 13 на 100 000, и тенденция к увеличению была очевидна [11].Поскольку воспаление является одним из основных факторов риска канцерогенеза, было вполне логично предположить, что пациенты с ХП более восприимчивы к ПК. Однако только в 1993 г., когда было опубликовано международное когортное исследование Lowenfels et al. [12], что была уточнена природа риска. В их многоцентровом историческом когортном исследовании было зарегистрировано 2015 случаев ХП, и 56 случаев рака были выявлены в течение среднего периода наблюдения 7,4 года. Стандартизированный коэффициент заболеваемости составлял 14,4, а риск развития ПК через 20 лет после постановки диагноза достигал 4%.Аналогичные результаты были дополнительно подтверждены относительно повышенного риска у пациентов с ХП, что подчеркивает важность дифференциальной диагностики между ХП и ПК [13].
Наследственный панкреатит представляет собой лучшую модель для определения причинной связи между ХП и ПК, а эпидемиологический анализ показал, что наследственный панкреатит является самым сильным из известных факторов риска ПК [1]. К 70 годам у 40% пациентов с наследственным панкреатитом разовьются опухоли поджелудочной железы [14].Генетические исследования определили, что мутации зародышевой линии в генах PRSS1 и CFTR приводят к наследственному панкреатиту. Впоследствии онкологи подняли один важный вопрос: действительно ли эти гены являются онкогенами для развития спорадических карцином поджелудочной железы? Чтобы ответить на этот вопрос, Hengstler et al. [15] проанализировали геномную ДНК в ткани поджелудочной железы на мутации R122H в гене трипсиногена у 34 пациентов и соответствующую нормальную ткань у 28 из этих людей, но мутаций не было обнаружено.Работа Malats et al. [16] также показала, что частота мутаций гена CFTR при спорадических карциномах поджелудочной железы была аналогична таковой у здоровых людей. Эти исследования показывают, что мутации генов PRSS1 и CFTR не связаны напрямую с развитием ПК. Следует отметить, что наследственный панкреатит возникает в основном в детстве или вскоре после него, а это означает, что пациенты, страдающие наследственным панкреатитом, будут переносить хроническое воспаление с самого начала в раннем возрасте. Хотя мутации в генах PRSS1 и CFTR не вносят прямого вклада в образование опухоли поджелудочной железы, создаваемая ими воспалительная среда высокого риска может работать.
Взглянув в телескоп на предметное стекло ПК, мы легко идентифицируем два отдела как основные компоненты ПК, злокачественные протоковые клетки и окружающие стромальные клетки, последние составляют 90% от общей массы опухоли [17]. Предыдущие исследования установили, что образование стромы было инициировано и поддерживалось неконтролируемым воспалением, а уроки трансгенетических моделей показывают, что воспаление, вызванное панкреатитом, значительно ускоряет образование опухоли поджелудочной железы [18,19,20,21].Хотя очевидно, что ХП является значительным фактором риска в индукции ПК, подробные механизмы, лежащие в основе перехода от ХП к ПК, еще не должны быть хорошо задокументированы.
Общие концепции, касающиеся CP и PC
Концепция сильной связи между воспалением и раком была впервые выдвинута в 19 веке Вирховым, который наблюдал присутствие воспалительных клеток в неопластических тканях [22]. Последующие эпидемиологические исследования подтвердили его гипотезу и выявили причинную связь между хроническим воспалением и раком.Язвенный колит, которое является распространенным хроническим воспалительным заболеванием, поражающим слизистую оболочку толстой кишки, может служить самым убедительным доказательством того, влияет ли и как воспаление на прогрессирование канцерогенеза. Пациенты с язвенным колитом имеют повышенную предрасположенность к колоректальному раку, которая примерно в 10 раз выше, чем в общей западной популяции [23]. Связь воспаления и рака не ограничивается подгруппой опухолей, но может быть универсально идентифицирована в рамках различных типов рака, включая легкие, мочевой пузырь, желудочно-кишечный тракт, кожу и вульву и т. Д.Использование противовоспалительных препаратов, например аспирин обычно связан с защитой от различных опухолей, что в некоторой степени отражает то, что воспаление является фактором риска для определенных типов рака. Хотя как эпидемиологические результаты, так и защитный эффект противовоспалительных препаратов на определенные опухоли ясно демонстрируют сильную связь между воспалением и раком, подробные механизмы, лежащие в основе этой связи, еще предстоит выяснить.
Как уже говорилось в предыдущем разделе настоящего обзора, ассоциация CP-PC также была создана независимо различными группами через различные человеческие расы.Тем не менее, соединение CP-PC имеет определенные черты, отличные от других типов рака. Например, уровни ЦОГ-2 были значительно повышены у пациентов с ХП, и таргетная терапия против ЦОГ-2 представляется хорошей терапевтической стратегией для лечения ХП [24]. Однако аспирин, наиболее часто используемый ингибитор ЦОГ-2, оказывает неоднозначное влияние на ПК [25]. Длительное регулярное употребление аспирина может даже увеличить риск ПК у женщин [26]. Эти противоречивые результаты намекают на то, что между клетками поджелудочной железы и воспалительной средой может существовать более сложная сеть, и был разработан список комплексных методов исследования для изучения или проверки существующей базы знаний о связи воспаления и рака при ПК.Основываясь на этом представлении, было создано множество моделей на животных для анализа эффектов медиаторов воспаления и противовоспалительных препаратов на прогрессирование ХП-ПК. Используемые в настоящее время животные модели были в первую очередь разработаны на основе генетической активации резидентных онкогенов K-ras, включенных в эндогенный локус K-ras. Эти модели точно воспроизводят гистологические поражения, которые характеризуют опухоли поджелудочной железы человека, и демонстрируют десмопластическую строму и воспалительные реакции, которые очень похожи на те, которые наблюдаются у людей.Следует отметить, что у этих животных ПК не разовьется, если они не подвергаются поражению поджелудочной железы в форме панкреатита. Эти результаты дополнительно установили незаменимые функции воспаления в канцерогенезе поджелудочной железы. Используя генетические модели животных, был идентифицирован список механизмов, связывающих панкреатит и ПК, которые можно искусственно разделить на внутренние и внешние пути (рис. 1).
Рис. 1
Механизмы, связывающие CP и PC посредством внутренних и внешних сигнальных путей.
Внешние пути, соединяющие CP и PC
Помимо неопластических клеток, «другая половина» массы PC состоит из стромы, состоящей из фибробластов, сосудов и лейкоцитов. Воспаление – это главная составляющая, которая зажигает сильную реакцию стромы, окружающей клетки ПК. Следует отметить, что воспалительные клетки, особенно лейкоциты, являются основными участниками, инициирующими и поддерживающими воспалительную реакцию. Лейкоциты в строме опухоли, а также цитокины и факторы роста, происходящие из лейкоцитов, составляют сложные внешние пути, которые играют ключевую роль в процессе образования опухоли.
Макрофаги, ассоциированные с опухолью (ТАМ), являются основной субпопуляцией лейкоцитов, способствующей усилению воспалительной реакции в опухолевой среде. В первую очередь они принадлежат к линии миелоидных клеток и происходят от миелоидных клеток-предшественников. Эти клетки-предшественники расположены в костном мозге; при созревании моноциты попадают в кровоток. При наборе некоторыми хемокинами, например CCL2 и CCL5, ТАМ накапливаются в строме опухоли, где они будут учиться способствовать прогрессированию рака.ТАМ способствуют злокачественному поведению опухолевых клеток разными способами, высвобождая цитокины, факторы роста и ферменты, разрушающие матрикс, и множество ангиогенных факторов. Список молекулярных изменений вовлечен в соединение ТАМ-ПК. Например, введение агонистического антитела CD40 активирует макрофаги, помогая макрофагам проникать в опухоли, становящиеся опухолевыми, и облегчает истощение стромы опухоли [27]. ТАМ могут также секретировать MIP3α для увеличения миграционной способности клеток ПК путем связывания с трансмембранным рецептором CCR6 [28].Другая работа показала, что ТАМ могут передавать проангиогенетические эффекты клеткам ПК. Блокирование ангиопоэтина-2, лиганда TIE2 и ангиогенного фактора, может препятствовать усилению регуляции TIE2 в TAM и уменьшать опухолевый ангиогенез PC [29]. Кроме того, ТАМ могут помочь поддерживать раковые стволовые клетки, которые связаны с химиорезистентностью, метастатическим распространением и индукцией иммуносупрессии [30]. Блокирование связи между ТАМ и раковыми стволовыми клетками поможет устранить раковые стволовые клетки, улучшить химиотерапевтический ответ и обеспечить многообещающую терапевтическую эффективность.В заключение, ТАМ и сложная сеть цитокинов значительно усиливают онкогенез ПК. Целенаправленное лечение ТАМ может быть многообещающим в будущем лечении ПК.
Внутренние пути в клетках ПК, индуцированные CP
Ужасная летальность ПК может в значительной степени объясняться его многочисленными генетическими изменениями. Предыдущие публикации показали, что каждый случай ПК содержит в среднем 63 генетических изменения, большинство из которых являются точечными мутациями. Эти изменения определили основной набор из 12 клеточных сигнальных путей [9].Однако частота спонтанных мутаций в нормальных клетках поджелудочной железы очень низкая. По сравнению с нормальными клетками поджелудочной железы широко распространенная дестабилизация количества копий гена и нуклеотидной последовательности убедила нас, что нестабильность генома универсально присуща клеткам ПК. В нормальных клетках системы поддержания генома обладают необычайной способностью обнаруживать и устранять дефекты в ДНК, тогда как в раковых клетках механизмы защиты нарушены, что позволяет этим клеткам накапливать больше генетических изменений и успешно развиваться в опухоль.
В предыдущих публикациях была установлена концепция, согласно которой микросреда воспаления участвует в нестабильности генома ПК-клеток. Например, работа Bielas et al. [31] подтвердила, что частота мутаций в воспаленном микросреде была выше, чем в нормальных тканях, с частотой мутаций 4 × 10 -8 и 1 × 10 -8 на пара оснований соответственно. В другой работе сообщается, что р53, критический опухолевый супрессор, защищающий геномы от нестабильности, демонстрирует высокую частоту мутаций в CP [32].Более высокая частота мутаций в клетках ПК может в значительной степени быть приписана дерегулированию систем репарации ДНК и измененным контрольным точкам клеточного цикла, тогда как производные, генерируемые воспалительными клетками, следует обвинять в разрушении против этих поддерживающих геном. Например, воспалительные цитокины, например TNF и IL-1β могут индуцировать HIF-α в клетках ПК, что может разрушить механизмы репарации ошибочного спаривания и привести к нестабильности геномов [33]. Оксид азота (NO) – еще один важный медиатор, происходящий из микросреды воспаления.Исследования показали, что NO может индуцировать повышающую регуляцию ДНК-метилтрансферазы, что приводит к замалчиванию промотора и потере экспрессии гена члена репарации ошибочного спаривания hMLh2 [34]. NO и его производные также могут ингибировать функцию p53 и связаны с мутациями p53 [35], что значительно снижает его способность к обнаружению и репарации против нестабильности генома. Другие воспалительные элементы, включая ЦОГ-2, АФК, ММП и т. Д., Также могут препятствовать работе механизма надзора за геномом. Посредством этих различных механизмов воспалительные элементы делают раковые геномы нестабильными, что приводит к геномно-гетерогенной популяции разрастающихся клеток, естественным образом отобранных по их способности пролиферировать, вторгаться в отдаленные ткани и уклоняться от защиты хозяина.
Общие генетические изменения, вовлеченные в ПК и CP
Эпидемиологические данные определили, что воспаление является значительным фактором риска для солидных опухолей. Список исследований показал, что как наследственные, так и спорадические формы ХП связаны с повышенным риском РПЖ. В таком контексте недавние интересы онкологов сместились с клеток ПК на воспалительную среду, окружающую их, и определили список узловых мишеней, участвующих в канцерогенезе, связанном с воспалением. Таргетная терапия против определенных молекул дает многообещающие результаты в клинике.Новые терапевтические средства, нацеленные на внешние и внутренние пути, соединяющие соединения CP-PC, будут снижать высокие уровни опухолевых свойств воспалительных клеток и в конечном итоге нормализовать воспалительную сеть, чтобы восстановить нормальный общий ответ хозяина (рис. 1).
Цитокины
Прогрессирующая и необратимая десмоплазия, сохраняющаяся внутри CP, в значительной степени связана с цитокинами, существующими в строме. Большой профиль цитокинов был идентифицирован внутри CP, включая TNF-α, IL-6, IL-8, PDGF, TGF-β и т. Д.Следует отметить, что тот же самый образец хемокинов был обнаружен при РПЖ [36]. Поскольку воспаление поджелудочной железы представляет собой ранний шаг в развитии ПК, вполне логично полагать, что эти цитокины участвуют в канцерогенезе поджелудочной железы. Многочисленные исследования подтвердили, что эти цитокины способствуют развитию опухолей в канцерогенезе поджелудочной железы. Например, TNF-α обычно экспрессируется в контексте повреждения ацинарных клеток поджелудочной железы, тогда как при CP TNF-α может активировать экспрессию PDGF, который, как известно, сильно стимулирует фиброгенез [37].PDGF, а также другие нижестоящие мишени TNF-α, например EGFR и TGF-α – хорошо известные онкогены в канцерогенезе поджелудочной железы [38]. Через активацию NF-κB, TNF-α может также ингибировать апоптоз ПК-клеток [39]. Эти данные предполагают, что аномальная экспрессия цитокинов при ХП в значительной степени связана с канцерогенезом поджелудочной железы. Новое поколение вакцин, направленных против активности цитокинов, может оказаться полезным в будущем лечении рака [40].
NF-κB
NF-κB – важный фактор транскрипции, который, как было доказано, участвует во множестве клеточных активностей.Функциональный NF-κB в поджелудочной железе представляет собой гетеродимер p65 / p50. В нормальных условиях димеры NF-κB связаны с ингибирующими белками, IκB, которые блокируют последовательности ядерной локализации и, таким образом, улавливают димеры в цитоплазме, где они были неактивными. Однако при воспалительной реакции, например При панкреатите IκBs разрушаются, и NF-κB впоследствии перемещается в ядро, где он взаимодействует с другими факторами транскрипции и связывается со своей консенсусной последовательностью на промоторах генов-мишеней, таких как Bcl-X и PDCD4 [41].Наша предыдущая работа показала, что повышенная активность NF-κB была связана с увеличением тяжести острого и хронического панкреатита [41]. Активность NF-κB повсеместно не регулируется при ряде типов рака. Данные, полученные из разных групп, предполагают, что роль, которую NF-κB играет в канцерогенезе, может заключаться в его ингибировании апоптоза предопухолевых клеток и поддержании про-неопластического микроокружения, богатого провоспалительными медиаторами [42]. Таргетная терапия против NF-κB может вызывать апоптоз и повышать эффективность гемцитабина в подмножестве ПК-клеток [43].Из-за критической роли, которую NF-κB играет в связывании CP и PC, восстановление его экспрессии и функции может уменьшить опухолевые эффекты воспалительных клеток, с надеждой на гармоничное взаимодействие между воспалением и клетками поджелудочной железы.
PPARγ
PPARγ – ядерный рецептор, обладающий функциями транскрипционного фактора, который может репрессировать воспалительные гены и управлять гомеостазом воспаления [44]. Лиганды PPARγ оказывают оптимальное действие в предотвращении неконтролируемого воспаления в различных тканях.Например, различные агонисты PPARγ могут снизить тяжесть острого панкреатита, вызванного церулеином [45,46]. Работа Shimizu et al. [47] показала, что агонисты PPARγ могут ингибировать экспрессию гена провоспалительных цитокинов в макрофагах, чтобы предотвратить развитие CP. Кроме того, сверхэкспрессия PPARγ может ингибировать профиброгенную активность иммортализованных звездчатых клеток поджелудочной железы крыс, подавляя процесс хронического воспаления [48]. Поскольку CP и PC тесно связаны, различные группы дополнительно оценили влияние PPARγ на ПК.Их отчеты показали, что лиганд PPARγ может вызывать у них остановку роста [49]. Список мишеней, включая циклин D1, p27KiP1 и PTEN, был вовлечен в его противоопухолевые эффекты. Троглитазон является хорошо известным лигандом PPARγ, и клинические исследования показали, что троглитазон может значительно снизить уровень ПСА у пациентов с раком простаты [50]. Однако его терапевтическая эффективность против ПК не оценивалась в клинике.
АФК
АФК генерируются активированными нейтрофилами и макрофагами в условиях воспаления.Различные группы подтвердили, что АФК участвуют в патогенезе острого и хронического панкреатита, а антиоксиданты могут быть потенциально эффективными против развития фиброза поджелудочной железы у пациентов с ХП [51]. Кроме того, в условиях высокореактивных форм кислорода при ХП будет происходить повторное повреждение и регенерация тканей. Следует отметить, что генотоксические эффекты, включая разрывы цепей ДНК, обмен сестринских хроматид и образование аддуктов с ДНК, будут индуцироваться в этом процессе АФК [52].Повторяющиеся стимулы регенерации повреждений будут случайно вызывать постоянные геномные изменения в клетках поджелудочной железы, которые еще больше ускоряют накопление мутаций и, следовательно, процесс канцерогенеза. Хотя никакие клинические испытания не оценивали противоопухолевые эффекты этих соединений с антиоксидантной активностью, эпидемиологические исследования показали, что потребление свежих фруктов и овощей, по-видимому, обратно коррелирует с PC [53]. Исключение ROS из хронической воспалительной среды защитит ДНК клеток поджелудочной железы от генотоксического повреждения и, возможно, снизит частоту трансформации этих клеток.
Дифференциальный диагноз между ХП и ПК
ХП и ПК – это два разных заболевания с совершенно разными прогнозами. Однако в некоторых случаях различить их бывает очень сложно. Во-первых, так же, как ткань CP, которая в основном состоит из фиброза, более 90% массы опухоли поджелудочной железы также состоит из элемента стромы. При использовании тонкоигольной аспирации, наиболее часто используемой техники для взятия пробы новообразования поджелудочной железы, трудно получить ткань, содержащую клетки поджелудочной железы.Во-вторых, существует слишком много общих нерегулируемых путей среди тканей CP и PC, таких как ROS, Hedgehog, NF-κB и т. Д. До сих пор ни одно из глобальных протеомных исследований не выявило специфичных для рака белков. В-третьих, поскольку пациенты с ХП более подвержены развитию ПК, их часто наблюдают в указанные моменты времени. Однако, даже используя самые передовые методы, мы не можем отрицать существование злокачественных клеток, скрытых в хронической воспалительной массе.
Принято считать, что образование стромы является критическим отличительным признаком ПК, а трансформация клеток поджелудочной железы обычно происходит в воспаленных тканях.Большинство предыдущих исследований биомаркеров рака с использованием современных технологий методологически ошибочны, поскольку они сравнивают образцы от больных раком с образцами здоровых людей без воспалений. Точный и неинвазивный тест для дифференциации ПК от ХП будет чрезвычайно полезен для обнаружения ПК на ранней стадии и поможет врачам принять правильные решения о лечении, что повысит выживаемость пациентов.
Белковые биомаркеры
CA19-9 является наиболее широко используемым производителем опухолей для ПК, и его чувствительность составляет ~ 80%; это значение значительно снижается (∼55%) при небольших операбельных раковых опухолях (<3 см).Кроме того, у бессимптомных лиц с высоким риском, имеющих IPMN или PanIN высокой степени, уровень CA19-9 в сыворотке часто бывает нормальным. Ткани CP также обладают высокой положительной скоростью экспрессии CA19-9 [54]. Эти данные показывают, что CA19-9 не является идеальным маркером для выявления этих незлокачественных опухолей поджелудочной железы, а также не подходит для различения ПК от ХП и других неопухолевых заболеваний поджелудочной железы. Недавние усилия были посвящены маркерам, способным отличать ПК от случаев ХП, и был определен список маркеров, потенциально имеющих клиническое применение.Например, с использованием количественной ОТ-ПЦР и иммуногистохимии, одна работа показала, что анализ экспрессии UHRF1, ATP7A и альдегидоксидазы 1 в комбинации потенциально может предоставить полезный дополнительный диагностический инструмент для тонкоигольных аспирированных или цитологических образцов, полученных во время эндоскопических исследований [55] . PAM4 представляет собой моноклональное антитело, экспрессируемое 90% аденокарциномы протока поджелудочной железы, а также предшественниками PanIN и IPMN, и демонстрирует высокую специфичность в отношении аденокарциномы протока поджелудочной железы и предшественников поражений по сравнению с доброкачественными, неопухолевыми тканями поджелудочной железы.Более того, примерно у 80% пациентов с ХП отсутствует циркулирующий антиген PAM4, что подчеркивает потенциальное использование PAM4 в дифференциальной диагностике между ХП и ПК [54].
Биомаркеры ДНК и РНК
Ранее считалось, что нуклеаза в плазме человека слишком богата, чтобы фрагменты ДНК и РНК не могли быть стабильно обнаружены в качестве маркеров для обнаружения рака. Однако недавние методологические исследования показали, что молекулы ДНК и РНК также могут служить маркерами с потенциальной клинической полезностью.Например, мутации KRAS2 в кодоне 12 могут стабильно обнаруживаться в циркулирующей дезоксирибонуклеиновой кислоте, и ее положительная частота значительно выше у пациентов с РПЖ, чем у пациентов с ХП (47 против 13%). Комбинация нормальной сыворотки CA19-9 и отсутствия циркулирующих мутаций KRAS2 может значительно повысить эффективность дифференциальной диагностики между ХП и ПК [56]. Наше исследование также показало, что обнаружение мутаций гена KRAS (кодоны 12 и 13) в образцах тонкоигольной аспирационной биопсии под эндоскопическим ультразвуковым контролем возможно для диагностики ПК [57].
miRNA – это эндогенные небольшие некодирующие РНК, которые подавляют экспрессию целевых мРНК. Наши недавние работы показали, что miRNA могут стабильно обнаруживаться в плазме и могут служить хорошими маркерами для диагностики ПК [58,59,60]. Среди 7 miRNAs, оцененных в нашем исследовании, miR-21 смогла отличить ПК от ХП и здоровых пациентов, тогда как miR-155 и miR-196a смогли отличить сыворотки пациентов с больной поджелудочной железой (ПК / ХП) от сывороток пациентов с ХП. нормальная поджелудочная железа. Другая группа из Дании дополнительно количественно оценила miRNA в цельной крови пациентов с PC и CP, а также здоровых людей из контрольной группы.Их работа идентифицировала две панели miRNAs с потенциалом отличить пациентов с PC от пациентов с CP и здоровых людей из контрольной группы [61].
Резюме
ХП – распространенное хроническое воспалительное заболевание неизвестной этиологии, поражающее паренхиму и функции поджелудочной железы человека. Эпидемиологические исследования выявили, что ХП является основным фактором риска ПК, в то время как было выявлено, что многочисленные внешние и внутренние пути участвуют в связи ХП и ПК. Следует отметить, что список генетических изменений обычно выявляется в тканях ХП и ПК, и таргетная терапия против определенных изменений демонстрирует оптимальную эффективность при лечении ПК.Поскольку пациенты с ХП и ПК придерживаются совершенно разных прогнозов, дифференциальный диагноз между этими двумя заболеваниями чрезвычайно важен в клинике. Большинство исследований биомаркеров рака с использованием современных технологий методологически ошибочны, поскольку они сравнивают образцы от больных раком с образцами здоровых людей без воспалений. Будущие исследования маркеров ПК должны исключить молекулы, которые не регулируются в тканях КП.
Благодарность
Работа поддержана Шанхайским научно-технологическим ключевым проектом №11JC1416402, проект больницы «1255» Чанхай № Ch225510308 (Y. Du) и проект Shanghai Yang Fan № 14YF1405600 (X. Kong).
Вклад авторов
X. Kong написал рукопись; Ю. Ду и З. Ли разработали тему и структуру; Т. Сун и Ф. Конг провели поиск литературы и собрали ссылки.
Заявление о раскрытии информации
Авторы заявляют об отсутствии конфликта интересов в отношении публикации этого обзора.
Список литературы
- Schneider A, Whitcomb DC: Наследственный панкреатит: модель воспалительных заболеваний поджелудочной железы.Лучшая практика Res Clin Gastroenterol 2002; 16: 347-363.
- Du YQ, Li ZS, Jin ZD: Эндоскопическая брахитерапия рака поджелудочной железы: от уничтожения опухоли до обезболивания и дренирования. J Interv Gastroenterol 2011; 1: 23-27.
- Du Y, Jin Z, Meng H, et al: Долгосрочный эффект брахитерапии под контролем эндоскопического УЗИ с гемцитабином при раке поджелудочной железы.J Interv Gastroenterol 2013; 3: 18-24.
- Брюгге В. Р., Лауэрс Г. Ю., Сахани Д. и др.: Кистозные новообразования поджелудочной железы. N Engl J Med 2004; 351: 1218-1226.
- Майтра А., Фукусима Н., Такаори К. и др.: Предшественники инвазивного рака поджелудочной железы.Adv Anat Pathol 2005; 12: 81-91.
- Фогельштейн Б., Ферон Э. Р., Гамильтон С. Р. и др.: Генетические изменения во время развития колоректальной опухоли. N Engl J Med 1988; 319: 525-532.
- Климстра Д.С., Лонгнекер Д.С.: Мутации K-ras в пролиферативных поражениях протоков поджелудочной железы.Ам Дж. Патол 1994; 145: 1547-1550.
- Розенблюм Э., Шютте М., Гоггинс М. и др.: Пути подавления опухоли при карциноме поджелудочной железы. Cancer Res 1997; 57: 1731-1734.
- Джонс С., Чжан Х, Парсонс Д. В. и др.: Основные пути передачи сигналов при раке поджелудочной железы человека, выявленные глобальным геномным анализом.Наука 2008; 321: 1801-1806.
- Liao Z, Jin G, Cai D и др.: Рекомендации: диагностика и терапия хронического панкреатита. J Interv Gastroenterol 2013; 3: 133-136.
- Ван Л.В., Ли З.С., Ли С.Д. и др.: Распространенность и клинические особенности хронического панкреатита в Китае: ретроспективный многоцентровый анализ за 10 лет.Поджелудочная железа 2009; 38: 248-254.
- Lowenfels AB, Maisonneuve P, Cavallini G и др.: Панкреатит и риск рака поджелудочной железы. Международная группа по изучению панкреатита. N Engl J Med 1993; 328: 1433-1437.
- Бансал П., Зонненберг А. Панкреатит – фактор риска рака поджелудочной железы.Гастроэнтерология 1995; 109: 247-251.
- Lowenfels AB, Maisonneuve P, DiMagno EP, et al: Наследственный панкреатит и риск рака поджелудочной железы. Международная группа по изучению наследственного панкреатита. J Natl Cancer Inst 1997; 89: 442-446.
- Hengstler JG, Bauer A, Wolf HK, et al: Анализ мутаций катионного гена трипсиногена у пациентов с раком поджелудочной железы.Anticancer Res 2000; 20: 2967-2974.
- Malats N, Casals T, Porta M и др.: Мутация DeltaF508 и аллель 5T трансмембранного регулятора муковисцидоза (CFTR) у пациентов с хроническим панкреатитом и экзокринным раком поджелудочной железы. Группа изучения PANKRAS II. Gut 2001; 48: 70-74.
- Neesse A, Michl P, Frese KK и др.: Стромальная биология и терапия рака поджелудочной железы.Кишечник 2011; 60: 861-868.
- Carrière C, Young AL, Gunn JR и др.: Острый панкреатит заметно ускоряет прогрессирование рака поджелудочной железы у мышей, экспрессирующих онкогенный Kras. Biochem Biophys Res Commun 2009; 382: 561-565.
- Гидекель Фридлендер С.Ю., Чу Г.К., Снайдер Е.Л. и др.: Контекстно-зависимая трансформация взрослых клеток поджелудочной железы онкогенным K-Ras.Cancer Cell 2009; 16: 379-389.
- Guerra C, Schuhmacher AJ, Cañamero M и др.: Хронический панкреатит необходим для индукции аденокарциномы протока поджелудочной железы онкогенами K-Ras у взрослых мышей. Cancer Cell 2007; 11: 291-302.
- Моррис Дж. П. Четвертый, Кано Д. А., Секин С. и др.: Бета-катенин блокирует Kras-зависимое перепрограммирование ацинусов в предшественники поражений рака поджелудочной железы у мышей.Дж. Клин Инвест 2010; 120: 508-520.
- Балквилл Ф., Мантовани А. Воспаление и рак: возвращение к Вирхову? Ланцет 2001; 357: 539-545.
- Ицковиц Ш., Ио Х: Воспаление и рак IV.Колоректальный рак при воспалительном заболевании кишечника: роль воспаления. Am J Physiol Gastrointest Liver Physiol 2004; 287: G7-G17.
- Рединг Т., Биммлер Д., Перрен А. и др.: Селективный ингибитор ЦОГ-2 подавляет хронический панкреатит на животной модели (крысы WBN / Kob): значительное снижение инфильтрации макрофагов и фиброза.Кишечник 2006; 55: 1165-1173.
- Jacobs EJ, Connell CJ, Rodriguez C, et al: Использование аспирина и смертность от рака поджелудочной железы в большой когорте Соединенных Штатов. J Natl Cancer Inst 2004; 96: 524-528.
- Schernhammer ES, Kang JH, Chan AT, et al: проспективное исследование использования аспирина и риска рака поджелудочной железы у женщин.J Natl Cancer Inst 2004; 96: 22-28.
- Битти Г.Л., Чиореан Э.Г., Фишман М.П. и др.: Агонисты CD40 изменяют строму опухоли и проявляют эффективность против карциномы поджелудочной железы у мышей и людей. Наука 2011; 331: 1612-1616.
- Кэмпбелл А.С., Альбо Д., Кимси Т.Ф. и др.: Макрофагальный воспалительный белок-3альфа способствует инвазии клеток рака поджелудочной железы.J Surg Res 2005; 123: 96-101.
- Мацциери Р., Пуччи Ф., Мой Д. и др.: Нацеливание на ось ANG2 / TIE2 подавляет рост и метастазирование опухоли за счет нарушения ангиогенеза и прекращения отскока проангиогенных миелоидных клеток. Cancer Cell 2011; 19: 512-526.
- Митчем Дж. Б., Бреннан Д. Д., Кнолхофф Б. Л. и др.: Нацеливание на инфильтрирующие опухоль макрофаги снижает количество клеток, инициирующих опухоль, снимает иммуносупрессию и улучшает химиотерапевтические ответы.Cancer Res 2013; 73: 1128-1141.
- Биелас Дж. Х., Леб К. Р., Рубин Б. П. и др.: Рак человека выражает мутаторный фенотип. Proc Natl Acad Sci USA 2006; 103: 18238-18242.
- Гансауге С., Шмид Р.М., Мюллер Дж. И др.: Генетические изменения при хроническом панкреатите: данные о раннем возникновении мутаций p53, но не K-ras.Br J Surg 1998; 85: 337-340.
- Акакура Н., Кобаяши М., Хориучи И. и др.: Конститутивная экспрессия индуцируемого гипоксией фактора-1-альфа делает клетки рака поджелудочной железы устойчивыми к апоптозу, вызванному гипоксией и недостатком питательных веществ. Cancer Res 2001; 61: 6548-6554.
- Флейшер А.С., Эстеллер М., Харпаз Н. и др.: Нестабильность микросателлитов в опухолевых поражениях, связанных с воспалительными заболеваниями кишечника, связана с гиперметилированием и сниженной экспрессией гена репарации несоответствия ДНК, hMLh2.Cancer Res 2000; 60: 4864-4868.
- Jaiswal M, LaRusso NF, Gores GJ: Оксид азота в канцерогенезе эпителиальных клеток желудочно-кишечного тракта: связь воспаления с онкогенезом. Am J Physiol Gastrointest Liver Physiol 2001; 281: G626-G634.
- Фэрроу Б., Эверс Б.М.: Воспаление и развитие рака поджелудочной железы.Surg Oncol 2002; 10: 153-169.
- Friess H, Guo XZ, Nan BC, et al: Факторы роста и цитокины в канцерогенезе поджелудочной железы. Энн Н. И. Акад. Наук 1999; 880: 110-121.
- Kalthoff H, Roeder C, Brockhaus M и др.: Фактор некроза опухоли (TNF) регулирует экспрессию p75, но не p55 рецепторов TNF, и оба рецептора опосредуют, независимо друг от друга, повышающую регуляцию трансформирующего фактора роста альфа и мРНК рецептора эпидермального фактора роста.J Biol Chem 1993; 268: 2762-2766.
- McDade TP, Perugini RA, Vittimberga FJ Jr и др.: Салицилаты ингибируют активацию NF-kappaB и усиливают индуцированный TNF-альфа апоптоз в клетках рака поджелудочной железы человека. J Surg Res 1999; 83: 56-61.
- Загури Д., Берни А., Галло Р.К.: К новому поколению вакцин: терапевтическим вакцинам против цитокинов.Proc Natl Acad Sci USA 2001; 98: 8024-8029.
- Хуанг Х., Лю Й., Данилюк Дж. И др.: Активация ядерного фактора-κB в ацинарных клетках увеличивает тяжесть панкреатита у мышей. Гастроэнтерология 2013; 144: 202-210.
- McKay CJ, Glen P, McMillan DC: Хроническое воспаление и рак поджелудочной железы.Лучшая практика Res Clin Gastroenterol 2008; 22: 65-73.
- Пан X, Арумугам Т., Ямамото Т. и др.: Глушение ядерного фактора-kappaB p65 / relA вызывает апоптоз и увеличивает эффективность гемцитабина в подмножестве клеток рака поджелудочной железы. Clin Cancer Res 2008; 14: 8143-8151.
- Glass CK, Saijo K: пути трансрепрессии ядерных рецепторов, которые регулируют воспаление в макрофагах и Т-клетках.Нат Рев Иммунол 2010; 10: 365-376.
- Хашимото К., Этридж Р.Т., Сайто Х. и др.: Лиганд PPARgamma, 15d-PGJ2, снижает тяжесть острого панкреатита, вызванного церулеином. Поджелудочная железа 2003; 27: 58-66.
- Cuzzocrea S, Pisano B, Dugo L и др.: Розиглитазон, лиганд гамма-рецептора, активируемого пролифератором пероксисом, снижает острый панкреатит, вызванный церулеином.Intensive Care Med 2004; 30: 951-956.
- Симидзу К., Ширатори К., Хаяси Н. и др.: Производные тиазолидиндиона как новые терапевтические агенты для предотвращения развития хронического панкреатита. Поджелудочная железа 2002; 24: 184-190.
- Джастер Р., Лихте П., Фитцнер Б. и др.: Сверхэкспрессия гамма-рецептора, активируемого пролифератором пероксисом, ингибирует профиброгенную активность иммортализованных звездчатых клеток поджелудочной железы крысы.J Cell Mol Med 2005; 9: 670-682.
- Элнемр А., Охта Т., Ивата К. и др.: Лиганд PPAR-гамма (тиазолидиндион) индуцирует остановку роста и маркеры дифференцировки клеток рака поджелудочной железы человека. Инт Дж. Онкол 2000; 17: 1157-1164.
- Мюллер Э, Смит М., Сарраф П. и др.: Эффекты активации лиганда гамма-рецептора, активируемого пролифератором пероксисом, при раке предстательной железы человека.Proc Natl Acad Sci USA 2000; 97: 10990-10995.
- Асауми Х., Ватанабе С., Тагучи М. и др.: Внешнее давление активирует звездчатые клетки поджелудочной железы за счет генерации внутриклеточных активных форм кислорода. Am J Physiol Gastrointest Liver Physiol 2007; 293: G972-G978.
- Джексон А.Л., Лоеб Л.А.: Вклад эндогенных источников повреждения ДНК в множественные мутации при раке. Mutat Res 2001; 477: 7-21.
- Wiseman H, Halliwell B: Повреждение ДНК реактивными формами кислорода и азота: роль в воспалительном заболевании и прогрессировании рака.Biochem J 1996; 313: 17-29.
- Ши С., Торговец Н., Ньюсом Дж. И др.: Дифференциация протоковой аденокарциномы поджелудочной железы от хронического панкреатита с помощью иммуногистохимии PAM4. Arch Pathol Lab Med 2014; 138: 220-228.
- Crnogorac-Jurcevic T, Gangeswaran R, Bhakta V, et al: Протеомный анализ хронического панкреатита и аденокарциномы поджелудочной железы.Гастроэнтерология 2005; 129: 1454-1463.
- Maire F, Micard S, Hammel P и др.: Дифференциальный диагноз между хроническим панкреатитом и раком поджелудочной железы: значение обнаружения мутаций KRAS2 в циркулирующей ДНК. Br J Cancer 2002; 87: 551-554.
- Ван Х, Гао Дж, Рен Й и др.: Обнаружение мутаций гена KRAS при эндоскопической тонкоигольной аспирационной биопсии под контролем УЗИ для улучшения диагностики рака поджелудочной железы.Am J Gastroenterol 2011; 106: 2104-2111.
- Kong X, Du Y, Wang G и др.: Обнаружение дифференциально экспрессируемых микроРНК в сыворотке пациентов с аденокарциномой протока поджелудочной железы: miR-196a может быть потенциальным маркером плохого прогноза. Dig Dis Sci 2011; 56: 602-609.
- Лю Дж, Гао Дж, Ду И и др.: Комбинация микроРНК плазмы с сывороткой CA19-9 для раннего выявления рака поджелудочной железы.Int J Cancer 2012; 131: 683-691.
- Лю Р., Чен X, Ду И и др.: Профиль экспрессии микроРНК в сыворотке как биомаркер в диагностике и прогнозе рака поджелудочной железы. Clin Chem 2012; 58: 610-618.
- Шульц Н.А., Делендорф С., Дженсен Б.В. и др.: Биомаркеры микроРНК в цельной крови для обнаружения рака поджелудочной железы.JAMA 2014; 311: 392-404.
Автор Контакты
Ики Ду или Чжаошен Ли
Отделение гастроэнтерологии, Шанхайская больница Чанхай
Второй военно-медицинский университет, 168 Changhai Road
200433 Шанхай (Китайская Народная Республика)
Электронная почта duyiqi @ hotmail.com или [email protected]
Подробности статьи / публикации
Предварительный просмотр первой страницы
Опубликовано онлайн: 18 июля 2014 г.
Дата выпуска: август 2014 г.
Количество страниц для печати: 12
Количество рисунков: 1
Количество столов: 0
ISSN: 2296-3774 (печатный)
eISSN: 2296-3766 (онлайн)
Для дополнительной информации: https: // www.karger.com/GAT
Авторские права / Дозировка препарата / Заявление об ограничении ответственности
Авторские права: Все права защищены. Никакая часть данной публикации не может быть переведена на другие языки, воспроизведена или использована в любой форме или любыми средствами, электронными или механическими, включая фотокопирование, запись, микрокопирование, или с помощью какой-либо системы хранения и поиска информации, без письменного разрешения издателя. .
Дозировка лекарств: авторы и издатель приложили все усилия, чтобы гарантировать, что выбор и дозировка лекарств, указанные в этом тексте, соответствуют текущим рекомендациям и практике на момент публикации.Тем не менее, ввиду продолжающихся исследований, изменений в правительственных постановлениях и постоянного потока информации, касающейся лекарственной терапии и реакций на них, читателю настоятельно рекомендуется проверять листок-вкладыш для каждого препарата на предмет любых изменений показаний и дозировки, а также дополнительных предупреждений. и меры предосторожности. Это особенно важно, когда рекомендованным агентом является новый и / или редко применяемый препарат.
Отказ от ответственности: утверждения, мнения и данные, содержащиеся в этой публикации, принадлежат исключительно отдельным авторам и соавторам, а не издателям и редакторам.Появление в публикации рекламы и / или ссылок на продукты не является гарантией, одобрением или одобрением рекламируемых продуктов или услуг или их эффективности, качества или безопасности. Издатель и редактор (-ы) не несут ответственности за любой ущерб, причиненный людям или имуществу в результате любых идей, методов, инструкций или продуктов, упомянутых в контенте или рекламе.
Классификация PanIN-поражений поджелудочной железы
Родственники третьей степени – Двоюродные братья, двоюродные братья и сестры
Унаследованная генетическая вариация ДНК, с которой вы родились.
Родственники второй степени – Тети, дяди, бабушки и дедушки, племянницы и племянники
Родственники первой степени – Ближайшие родственники в вашей семье: родители, дети, братья и сестры
Это экспериментальный вид лечения.Это лекарство, состоящее из убитых или ослабленных клеток, организмов или искусственных материалов, которое используется для усиления иммунной системы организма. В идеале это позволит организму более эффективно бороться с раковыми клетками и убивать их. Вакцины включают целые убитые раковые клетки или специфические белки рака.
Также известная как панкреатодуоденэктомия, процедура Уиппла – это операция, обычно выполняемая для удаления опухолей головки поджелудочной железы (часть поджелудочной железы на правой стороне тела).Обычно он включает хирургическое удаление головки поджелудочной железы, части двенадцатиперстной кишки и части желчных протоков.
Часть поджелудочной железы, которая изгибается назад, охватывая два очень важных кровеносных сосуда, верхнюю брыжеечную артерию и вену. Слово «крючковатый» происходит от слова uncus, что означает «крючок».
Невозможно удалить хирургическим путем. Обычно это означает, что рак распространился за пределы областей, которые можно удалить хирургическим путем.
Этот термин просто обозначает «массу» или новообразование.Например, скопление гноя – это опухоль. Это общий термин, который может относиться как к доброкачественным, так и к злокачественным новообразованиям.
Безболезненная процедура, при которой используются высокочастотные звуковые волны для создания изображений внутренней части тела. Ультразвуковое устройство может быть размещено на конце эндоскопа, а эндоскоп вводится в двенадцатиперстную кишку, обеспечивая очень подробные изображения поджелудочной железы. Это называется «эндоскопическим ультразвуком».
Сгусток в кровеносных сосудах. Он может закупоривать (блокировать) сосуд или прикрепляться к стенке сосуда, не блокируя кровоток.
Воспаление вен, сопровождающееся тромбообразованием. Иногда его называют знаком Труссо.
Чрезмерное количество жира в стуле. Иногда это может проявляться в виде масляного пятна на поверхности туалетной воды после дефекации. Это может быть признаком того, что поджелудочная железа плохо функционирует.
Тонкая полая трубка, вставленная в корпус для устранения засора. Например, рак поджелудочной железы часто прорастает в желчный проток, когда желчный проток проходит через поджелудочную железу.Это может заблокировать отток желчи и вызвать у пациента желтуху. В этих случаях отток желчи можно восстановить, поместив стент в желчный проток через область закупорки.
Длинная тонкая часть железы в левой части живота, рядом с селезенкой.
Бордовый округлый орган в верхней левой части живота, около хвоста поджелудочной железы. Этот орган является частью вашей иммунной системы и фильтрует лимфу и кровь в вашем теле. Его часто удаляют во время хирургической операции по удалению дистальной части поджелудочной железы.
Плоская чешуйчатая ячейка. Хотя большинство видов рака поджелудочной железы под микроскопом выглядят как протоки, небольшая их часть выглядит как плоскоклеточные клетки.
Система классификации, которая используется для описания степени заболевания. Клиницисты используют его для прогнозирования вероятной выживаемости пациента.
Инфекция крови. Это может быть опасно для жизни и часто лечится антибиотиками.
Длинная (20 футов) трубка, идущая от желудка до толстой кишки.Он помогает усваивать питательные вещества из пищи, когда пища транспортируется в толстый кишечник. Есть три отдела: двенадцатиперстная кишка, тощая кишка и подвздошная кишка. Из-за близости к поджелудочной железе двенадцатиперстная кишка является тем отделом тонкой кишки, который чаще всего поражается раком поджелудочной железы.
Использование волн высокой энергии, похожих на рентгеновские лучи, для лечения рака. Лучевая терапия обычно используется для лечения локального участка заболевания и часто проводится в сочетании с химиотерапией.
Можно удалить хирургическим путем.Обычно это означает, что рак ограничен участками, обычно удаляемыми хирургическим путем.
Злокачественная опухоль, которая под микроскопом выглядит как соединительные ткани (кости, хрящи, мышцы). Саркомы поджелудочной железы встречаются крайне редко.
Рак в органе, в котором он начался. Первичный рак поджелудочной железы – это рак, который начался в поджелудочной железе, в отличие от рака, который возник где-то в другом месте и только позже распространился на поджелудочную железу.
Прогноз вероятного исхода заболевания, основанный на опыте большого числа других пациентов с аналогичной стадией заболевания.Важно отметить, что прогнозирование – это не точная наука. Некоторые пациенты с плохим прогнозом превзошли все шансы и живут дольше, чем кто-либо ожидал. В «Руководстве по раку» Стива Данна есть отличная статья о статистике, прогнозах и историях других онкологических больных.
Толстое мышечное кольцо (сфинктер) между желудком и двенадцатиперстной кишкой. Этот сфинктер помогает контролировать попадание содержимого желудка в тонкий кишечник.
Врач, специально обученный изучению процессов болезни.Патологи ставят микроскопический диагноз, который используется для установления диагноза рака.
Вокруг ампулы Фатера двенадцатиперстной кишки. Периампулярная область состоит из 4 структур; ампула, двенадцатиперстная кишка, желчный проток и головка поджелудочной железы. Иногда бывает трудно сказать, из какой структуры возникла опухоль. В таких случаях диагнозом будет периампулярная опухоль.
Биохимическое исследование растений; занимается идентификацией, биосинтезом, метаболизмом химических компонентов растений; особенно в отношении натуральных продуктов.
Продолговатый орган, расположенный между желудком и позвоночником. Поджелудочная железа выделяет ферменты, необходимые для переваривания пищи, и вырабатывает гормоны, такие как инсулин и глюкагон, которые помогают контролировать уровень сахара в крови.
Любое лечение, уменьшающее тяжесть заболевания или его симптомы. Паллиативная помощь часто является частью плана лечения пациентов с распространенным раком поджелудочной железы.
Термин, используемый для описания определенных опухолей, которые растут в виде пальцевидных выступов.Патологи используют этот термин для описания некоторых предраковых поражений поджелудочной железы (внутрипротоковое папиллярное муцинозное новообразование).
Аномальный новый рост ткани, который растет быстрее, чем нормальные клетки, и будет продолжать расти, если не лечить. Эти наросты будут конкурировать с нормальными клетками за питательные вещества. Это общий термин, который может относиться к доброкачественным или злокачественным новообразованиям. Это синоним слова опухоль.
Врач, специализирующийся на лечении опухолей.Онкологи часто лечат пациентов с раком поджелудочной железы химиотерапией.
Хирургически созданное отверстие в органе, которое также можно назвать анастамозом. Иногда, когда хирурги удаляют сегмент кишечника, они создают стому, чтобы содержимое кишечника могло выйти из тела.
Рак, распространившийся из одного органа в другой. Рак поджелудочной железы чаще всего метастазирует в печень. Как правило, метастазы рака обычно не лечат хирургическим путем, а вместо этого лечат химиотерапией и / или лучевой терапией.
Изменение ДНК клетки. Думайте об этом как о типографической ошибке в коде ДНК.
Тонкий участок поджелудочной железы между головкой и телом железы.
Химиотерапия и лучевая терапия, назначаемая пациентам перед операцией . Некоторые центры считают, что использование неоадъювантной терапии улучшает местный и региональный контроль заболевания и может сделать больше пациентов кандидатами на хирургическое вмешательство.
Рак, который может поражать близлежащие ткани, распространяться на другие органы (метастазировать) и, возможно, приводить к смерти пациента.
Нормальные, круглые скопления лимфоцитов (лейкоцитов) размером от изюма до винограда по всему телу. Лимфатические узлы связаны друг с другом лимфатическими сосудами. Обычно они помогают бороться с инфекцией, но также являются одним из первых мест распространения рака. В целом распространение рака на лимфатические узлы предвещает худший прогноз для пациента. Из этого есть исключения.
Безболезненный метод визуализации внутренних органов. Трубчатая машина с мощным магнитом генерирует изображения внутренней части тела.Это не предполагает использование рентгеновских лучей.
Самый большой орган тела, расположенный в правой верхней части живота. Он выполняет множество жизненно важных функций, включая производство желчи. Печень очищает кровь от наркотиков, алкоголя и других вредных химических веществ. Он перерабатывает питательные вещества, усваиваемые кишечником, и сохраняет необходимые питательные вещества, витамины и минералы. Билирубин – это химическое вещество, которое образуется при распаде старых или поврежденных клеток крови. Печень химически обрабатывает билирубин, чтобы он мог растворяться в воде и выводиться с мочой.При нарушении этого процесса может развиться желтуха.
Первичный рак поджелудочной железы, распространившийся на регионарные лимфатические узлы и / или резектабельные (удаляемые) ткани. Съемные ткани включают некоторые лимфатические узлы и части двенадцатиперстной кишки и желудка, которые обычно удаляются при некоторых хирургических вмешательствах при раке поджелудочной железы.
Пожелтение кожи или пожелтение белков глаз, вызванное накоплением желчных пигментов (обычно из-за непроходимости желчных протоков).
Техника, которую хирурги могут использовать для визуализации и даже биопсии (взятия образцов ткани) органов внутри брюшной полости без больших разрезов. В брюшной полости делаются очень маленькие разрезы и затем вставляются маленькие трубки (называемые троакарами). Газ закачивается через одну из трубок, чтобы создать достаточно места для работы. Хирург вводит небольшую камеру через одну из трубок и исследует слизистую оболочку и содержимое брюшной полости, глядя на проецируемое изображение на экране телевизора.С помощью специально разработанных лапароскопических инструментов можно брать биопсию и образцы жидкости для исследования. Некоторые хирурги считают, что этот метод может помочь пациенту «подготовить» пациента менее инвазивно, чем при открытой операции.
Термин, используемый для обозначения того, что раковые клетки присутствуют в протоке, но еще не проникли в более глубокие ткани.
Гормон, вырабатываемый эндокринными клетками островков клеток Лангерганса поджелудочной железы. Инсулин снижает уровень сахара в крови.
Самая широкая часть поджелудочной железы.Он находится в правой части живота, расположен на изгибе двенадцатиперстной кишки, который образует отпечаток сбоку поджелудочной железы.
Гормон, вырабатываемый эндокринными (островками Лангерганса) клетками поджелудочной железы. Когда уровень сахара в крови низкий, глюкагон повышает уровень сахара в крови.
Химиотерапевтический препарат, обычно используемый для лечения рака поджелудочной железы.
Зеленый орган грушевидной формы, расположенный на правой стороне живота, прямо под печенью. Желчный пузырь – это, по сути, резервуар для содержания желчи.
Гемзар – торговое название химиотерапевтического препарата гемцитабин. Его часто используют для лечения рака поджелудочной железы. В контролируемых клинических испытаниях было показано, что он улучшает качество жизни.
Экзокринные клетки (ацинарные клетки) поджелудочной железы производят и транспортируют химические вещества, которые покидают организм через пищеварительную систему.
Химические вещества, вырабатываемые экзокринными клетками, называются ферментами. Они выделяются в двенадцатиперстной кишке, где помогают переваривать пищу.
Химическое вещество, которое вызывает реакцию других веществ, в данном случае как часть процесса пищеварения.
Тест, используемый для визуализации и исследования поджелудочной железы и желчных протоков. Зонд вводится пациенту через нос (или горло), вниз через пищевод и желудок, а затем в тонкий кишечник (двенадцатиперстную кишку). Там небольшой зонд вводится в ампулу Фатера. Краситель вводится через зонд в протоки поджелудочной железы и желчные протоки. Затем делается рентген для визуализации протоков поджелудочной железы и желчных протоков.эти каналы можно увидеть как белые структуры (это потому, что введенный краситель непрозрачен). Поскольку рак поджелудочной железы часто блокирует протоки поджелудочной железы и / или желчные протоки, этот метод может быть полезен при постановке диагноза рака поджелудочной железы.
Хирургическое удаление конструкции или части конструкции. Например, эктомия поджелудочной железы – это хирургическое удаление поджелудочной железы (или ее части).
Это специализированные клетки, вырабатывающие гормоны , попадающие в кровоток .Например, островки Лангерганса – это эндокринные клетки поджелудочной железы, вырабатывающие гормон инсулин. Этот гормон помогает контролировать уровень сахара (глюкозы) в крови.
Некоторые редкие опухоли поджелудочной железы, эндокринные опухоли (островковые клетки), могут продуцировать те же гормоны. Очень важно правильно диагностировать эти редкие опухоли, потому что от этого зависит лечение и прогноз.
Врач, специализирующийся на лечении гормональных нарушений.
Первый отдел тонкой кишки.Это около 1 фута в длину. Это часть кишечного тракта, идущая после желудка.
Куполообразная мышца, отделяющая легкие и сердце от брюшной полости. Эта мышца помогает дышать.
Химическое вещество в каждой клетке, несущее генетическую информацию.
Небольшая анатомическая структура. По сути, это трубка, по которой проходят различные жидкости организма. Проток поджелудочной железы проходит по всей длине поджелудочной железы и впадает в двенадцатиперстную кишку.
Заболевание, при котором организм не может должным образом контролировать уровень сахара (глюкозы) в крови.Это может быть вызвано неспособностью поджелудочной железы вырабатывать достаточное количество инсулина.
Краска, которую принимают внутрь или вводят инъекцией, которая иногда используется во время рентгеновских исследований, чтобы выделить области, которые иначе были бы невидимы.
Мешок, заполненный жидкостью. Некоторые опухоли поджелудочной железы, включая серозные цистаденомы и внутрипротоковые папиллярные муцинозные новообразования, образуют кисты. Кисты отчетливо видны на компьютерной томографии. Их важно понимать, потому что лечение кистозных опухолей может отличаться от лечения солидных опухолей.
Маленькая гибкая трубка, вставляемая в тело для введения или откачивания жидкости.
Лечение рака химическими препаратами. При раке поджелудочной железы к ним относятся: гемзар (гемцитабин), 5-флуроурацил, лейковорин, таксол и другие.
Способ изображения внутренних органов. Серия рентгеновских снимков, сделанных аппаратом, который окружает тело как гигантская трубка. Затем компьютеры используются для создания изображений поперечного сечения внутренней части тела.
Химическое вещество, вызывающее рак.Сигаретный дым содержит ряд канцерогенов.
Маркер крови при раке поджелудочной железы. Это не лучший скрининговый тест для диагностики возможного рака поджелудочной железы у лиц без симптомов. Вместо этого он может быть полезен для отслеживания прогресса пациентов, о которых известно, что они больны раком, путем измерения того, как их рак реагирует на лечение.
Резкое похудание и общее истощение, возникающие при хронических заболеваниях.
Злокачественная опухоль. Он может проникнуть в прилегающие ткани, распространиться на другие органы и в конечном итоге может привести к смерти пациента.
Средняя часть поджелудочной железы между шеей и хвостом. За этой частью железы проходят верхние брыжеечные кровеносные сосуды.
Зеленая жидкость, вырабатываемая печенью, которая помогает переваривать жиры. Он транспортируется из печени в двенадцатиперстную кишку по желчному протоку. Когда поток желчи блокируется, у пациентов может появиться желтуха (пожелтение кожи).
Проток, по которому желчь от печени попадает в кишечник. Этот термин может относиться к печеночному, кистозному или общему желчному протоку.
Удаление и микроскопическое исследование небольшого образца ткани.
Незлокачественные опухоли. Обычно они растут медленно и не проникают в соседние органы и не распространяются (метастазируют) за пределы поджелудочной железы.
Радиографический метод, используемый для визуализации кровеносных сосудов. Контрастное вещество (краситель) обычно вводят в сосуды, чтобы они казались белыми на рентгеновских снимках.
Крупная артерия, по которой от сердца идет кровь, богатая кислородом. От сердца он выгибается назад и спускается в брюшную полость, где дает множество ответвлений для снабжения органов.Верхняя брыжеечная артерия – это основная ветвь аорты, которая может быть поражена раком поджелудочной железы.
Скопление избыточного количества жидкости в брюшной полости (брюшной полости). Часто это признак того, что рак распространился либо на печень, либо на воротную вену, которая идет в печень, или что рак поражает внутреннюю оболочку живота. Если нарушается нормальная функция печени, нарушается сложный набор биохимических сдержек и противовесов, и сохраняется ненормальное количество жидкости.
Хирургическое соединение двух полых структур. Это похоже на прикрепление двух концов садового шланга. Например, гастроеюностомия – это хирургическая процедура, которая соединяет желудок и тощую кишку (тонкий кишечник).
Состояние, характеризующееся дефицитом эритроцитов. Среди других симптомов это может привести к усталости.
Состояние, характеризующееся уменьшением аппетита и отвращением к пище. Часто приводит к физическим признакам истощения.
Химиотерапия, проводимая пациентам после того, как раковые опухоли были удалены хирургическим путем.Это вторичное лечение в дополнение к хирургическому лечению. (см. Неоадъювантная химиотерапия, которая представляет собой химиотерапию, проводимую перед операцией )
Это расширение протока поджелудочной железы по мере того, как он достигает двенадцатиперстной кишки, является важной вехой для врачей. Это место соединения желчного протока и протока поджелудочной железы перед оттоком в двенадцатиперстную кишку (тонкий кишечник). Опухоли в головке поджелудочной железы могут частично или полностью сдавить этот проток. Это может привести к проблемам с пищеварением и желтухе.
Доброкачественная (незлокачественная) опухоль, состоящая из клеток, образующих железы (скопления клеток, окружающие пустое пространство).
Форма рака, о которой большинство людей говорят, когда говорят о «раке поджелудочной железы». Эти опухоли составляют 75% всех случаев рака поджелудочной железы.
Под микроскопом аденокарциномы образуют железы. Эти опухоли могут вырасти достаточно большими, чтобы проникнуть в нервы, что может вызвать боль в спине. Они также часто распространяются (метастазируют) в печень или лимфатические узлы.В этом случае опухоль можно считать неоперабельной.
Часть тела между диафрагмой и тазом.
Полость, заполненная гноем. Обычно вызвано инфекцией.
Экспрессия Aldh2b1 определяет клетки-предшественники в поджелудочной железе взрослого человека и необходима для рака поджелудочной железы, вызванного Kras
% PDF-1.6 % 210 0 объект > эндобдж 211 0 объект > поток doi: 10.1073 / pnas.15116application / pdf
Прерывистое голодание: неожиданное обновление – Harvard Health
Существует масса невероятно многообещающих исследований прерывистого голодания (ПГ) на толстых крысах.Они худеют, у них повышается артериальное давление, уровень холестерина и сахара в крови … но они крысы. Практически все исследования на людях показали, что ПФ безопасен и невероятно эффективен, но на самом деле не более эффективен, чем любая другая диета. Кроме того, многим людям трудно поститься.
Но все больше исследований показывают, что выбор времени для голодания является ключевым и может сделать IF более реалистичным, устойчивым и эффективным подходом к снижению веса, а также к профилактике диабета.
Предыстория прерывистого голодания
IF как метод похудания существует в различных формах на протяжении веков, но был широко популяризирован в 2012 году тележурналистом BBC доктором Майклом Мосли телевизионным документальным фильмом Eat Fast, Live Longer и книгой The Fast Diet , за которой последовал журналист. Книга Кейт Харрисон The 5: 2 Diet , основанная на ее собственном опыте, а затем и бестселлер доктора Джейсона Фанга 2016 года The Obesity Code .IF произвел устойчивый положительный шум, поскольку распространялись анекдоты о его эффективности.
Как врач-исследователь, придерживающийся образа жизни, мне нужно было разбираться в науке. Код ожирения казался наиболее обоснованным сводным ресурсом, и мне он нравился. Фунг успешно сочетает в себе множество исследований, свой клинический опыт и разумные советы по питанию, а также обращается к социально-экономическим силам, которые делают нас толстыми. Он очень ясно заявляет, что мы должны есть больше фруктов и овощей, клетчатки, здорового белка и жиров и избегать сахара, рафинированного зерна, обработанных пищевых продуктов и, ради бога, прекратить перекусывать.Проверяйте, проверяйте, проверяйте, согласен. Единственная часть, которая все еще вызывала у меня сомнения, – это периодическое голодание.
Прерывистое голодание помогает похудеть
IF имеет интуитивно понятный смысл. Пища, которую мы едим, расщепляется ферментами в нашем кишечнике и в конечном итоге превращается в молекулы в нашем кровотоке. Углеводы, особенно сахар и очищенные зерна (например, белая мука и рис), быстро расщепляются на сахар, который наши клетки используют для получения энергии. Если наши клетки не используют все это, мы откладываем это в жировых клетках, ну, в общем, как жир.Но сахар может попасть в наши клетки только с инсулином, гормоном, вырабатываемым поджелудочной железой. Инсулин доставляет сахар в жировые клетки и удерживает его там.
Между приемами пищи, пока мы не перекусываем, уровень инсулина будет снижаться, и наши жировые клетки могут высвободить накопленный сахар для использования в качестве энергии. Мы худеем, если снижаем уровень инсулина. Вся идея IF состоит в том, чтобы позволить уровню инсулина снижаться достаточно сильно и на достаточно долгое время, чтобы мы сожгли наш жир.
Прерывистое голодание может быть трудным … но, возможно, это не обязательно
Первоначальные исследования на людях, в которых сравнивали голодание через день с ежедневным уменьшением количества пищи, показали, что и то, и другое работает примерно одинаково для похудания, хотя люди боролись с голодными днями.Итак, я списал IF как не лучше и не хуже, чем просто есть меньше, только гораздо более неудобно. Я посоветовал просто придерживаться разумной средиземноморской диеты на растительной основе.
Новое исследование предполагает, что не все подходы IF одинаковы, а некоторые из них на самом деле очень разумны, эффективны и устойчивы, особенно в сочетании с питательной диетой на растительной основе. Так что я готов не согласиться с этим (и даже пересмотреть свой предыдущий пост).
Мы эволюционировали, чтобы синхронизироваться с циклом день / ночь, т.е.е., циркадный ритм. Наш метаболизм адаптировался к дневной пище, ночному сну. Ночное питание связано с повышенным риском ожирения, а также диабета.
На основании этого исследователи из Университета Алабамы провели исследование с небольшой группой тучных мужчин с преддиабетом. Они сравнили форму прерывистого голодания, называемую «раннее ограниченное по времени кормление», когда все приемы пищи укладывались в ранний восьмичасовой период дня (с 7 утра до 15 часов) или растягивались на 12 часов (с 7 утра до 3 вечера). 19:00).Обе группы сохранили свой вес (не набирали и не теряли), но через пять недель у восьмичасовой группы резко снизился уровень инсулина и значительно улучшилась чувствительность к инсулину, а также значительно снизилось артериальное давление. Лучшая часть? У восьмичасовой группы также значительно снизился аппетит. Они не голодали.
Простое изменение времени приема пищи, если есть раньше днем и продлить ночное голодание, значительно улучшило метаболизм даже у людей, которые не сбросили ни фунта.
Почему может помочь изменение времени?
Но почему простое изменение времени приема пищи, позволяющее голодать, влияет на наш организм? Углубленный обзор науки о IF, недавно опубликованный в New England Journal of Medicine , проливает некоторый свет. Пост эволюционно встроен в нашу физиологию и запускает несколько важных клеточных функций. Перевод переключателя из состояния сытости на голодание не просто помогает нам сжигать калории и худеть.Исследователи просмотрели десятки исследований на животных и людях, чтобы объяснить, как простое голодание улучшает обмен веществ, снижая уровень сахара в крови; уменьшает воспаление, что улучшает ряд проблем со здоровьем, от боли при артрите до астмы; и даже помогает выводить токсины и поврежденные клетки, что снижает риск рака и улучшает работу мозга. Статья глубокая, но ее стоит прочитать!
Итак, прерывистое голодание так же хорошо, как кажется?
Мне было это очень любопытно, поэтому я спросил мнение эксперта по метаболизму д-ра.Дебора Векслер, директор Диабетического центра Массачусетской больницы общего профиля и доцент Гарвардской медицинской школы. Вот что она мне рассказала. «Есть данные, позволяющие предположить, что подход голодания, основанный на циркадных ритмах, при котором прием пищи ограничен 8-10-часовым периодом дня, является эффективным», – подтвердила она, хотя в целом она рекомендует людям «использовать такой подход к питанию, который работает для их и устойчиво для них “.
Итак, вот сделка. Существуют некоторые убедительные научные данные, свидетельствующие о том, что голодание с соблюдением циркадных ритмов в сочетании со здоровой диетой и образом жизни может быть особенно эффективным подходом к снижению веса, особенно для людей, подверженных риску диабета.(Однако людям с запущенным диабетом или принимающим лекарства от диабета, людям с анорексией и булимией в анамнезе, а также беременным или кормящим женщинам не следует пытаться интервальное голодание, если только под тщательным наблюдением врача, который может их контролировать. )
4 способа использования этой информации для улучшения здоровья
- Избегайте сахара и очищенных зерен . Вместо этого ешьте фрукты, овощи, бобы, чечевицу, цельнозерновые продукты, нежирные белки и полезные жиры (разумная растительная диета в средиземноморском стиле).
- Позвольте вашему телу сжигать жир между приемами пищи . Не перекусывай. Будьте активны в течение дня. Наращивайте мышечный тонус.
- Рассмотрим простую форму прерывистого голодания . Ограничьте часы дня, когда вы едите, и для лучшего эффекта делайте это раньше (с 7 до 15 или даже с 10 до 18, но не вечером перед сном).
- Избегайте перекусов и еды на ночь , все время.
Источники
Влияние прерывистого голодания на здоровье, старение и болезни.де Кабо Р., Маттонсон МП. Медицинский журнал Новой Англии , декабрь 2019 г.
Влияние голодания через день на потерю веса, поддержание веса и кардиозащиту среди метаболически здоровых взрослых с ожирением: рандомизированное клиническое испытание. JAMA Internal Medicine , май 2017 г.
Голодание через день у субъектов, не страдающих ожирением: влияние на массу тела, состав тела и энергетический обмен. Американский журнал клинического питания , январь 2005 г.
Код ожирения , Джейсон Фанг, доктор медицины (Greystone Books, 2016).
Прерывистое голодание для лечения избыточной массы тела и ожирения у взрослых: систематический обзор и метаанализ. База данных систематических обзоров и отчетов о реализации JBI, февраль 2018 г.
Метаболические эффекты прерывистого голодания. Annual Review of Nutrition , август 2017 г.
Раннее ограниченное по времени кормление улучшает чувствительность к инсулину, артериальное давление и окислительный стресс даже без потери веса у мужчин с преддиабетом. Cell Metabolism , май 2018 г.
В качестве услуги для наших читателей Harvard Health Publishing предоставляет доступ к нашей библиотеке заархивированного контента. Обратите внимание на дату последнего обзора или обновления всех статей. Никакого контента на этом сайте, независимо от даты, никогда не следует использовать вместо прямого медицинского совета вашего врача или другого квалифицированного клинициста.
Комментарии к записи закрыты.
Почему почти 80 процентов больных аутоиммунным заболеванием – женщины
Первый приступ необычных симптомов у Мелани Си начался в 2005 году.Вдруг она сильно потела. Она быстро похудела на 10 фунтов. У нее закружилась голова при переходе из спальни на диван. Она начала кормить грудью, хотя и не кормила ребенка. После множества лабораторных тестов 45-летнему Си был поставлен диагноз “болезнь Грейвса”, аутоиммунное заболевание, вызывающее резкое повышение уровня гормонов щитовидной железы.
Три года спустя, когда симптомы болезни Си, вызванные Грейвсом, удалось купировать с помощью лекарств, ее здоровье снова резко ухудшилось. Она похудела еще больше. Она очень устала.Врачи диагностировали у нее глютеновую болезнь, еще одно аутоиммунное заболевание, которое у пораженных людей возникает при употреблении в пищу продуктов с глютеном. Затем, в 2015 году, Си, которая живет в Чапел-Хилл, Северная Каролина, начала испытывать ужасные симптомы пищеварения и боли в мышцах. На этот раз ее врачи были озадачены. «Первоначальные диагнозы были повсюду – васкулит, волчанка, я не могу вспомнить все, – говорит Си. «Мой анализ крови показал, что что-то происходит, как и биопсия мышц, которую я сделал в июне 2016 года, но я не поместился ни в одну конкретную коробку.”
После многих анализов у Зее было обнаружено еще одно аутоиммунное заболевание: смешанное заболевание соединительной ткани, редкое заболевание, которое имеет некоторые черты волчанки.
На женщин приходится примерно 78 процентов людей, страдающих этими заболеваниями, включая болезнь Си, а также волчанку, рассеянный склероз, ревматоидный артрит и другие заболевания, при которых иммунная система организма по ошибке атакует собственные клетки и ткани. В настоящее время аутоиммунные заболевания занимают пятое место среди причин смерти женщин моложе 65 лет.
Почему женщины гораздо чаще, чем мужчины страдают от аутоиммунитета, долгое время оставалось загадкой, но исследователи начинают сужать причины: различные эффекты половых гормонов, X-хромосом женщин и даже сообщества микробов. внутри нас, которое по-разному развивается в зависимости от пола. Некоторые ученые считают, что эволюция также может сыграть роль в ошеломляющих различиях, наблюдаемых в аутоиммунитетах. Поскольку аутоиммунитет гораздо чаще встречается у женщин, исследователи предположили, что это могло быть эволюционным реликтом – иммунная сверхбдительность могла дать женщинам репродуктивное преимущество, повысив шансы на успешную беременность, даже если бы это произошло за счет повышенного риска заболевания.
«Важно понимать биологию, лежащую в основе этих половых различий, – говорит Шеннон Данн, иммунолог из Университета Торонто. «Если мы сможем разгадать это, мы не только лучше поймем, как возникают аутоиммунные заболевания, и найдем новые способы вмешательства, но и прольем свет на половые различия в том, как люди реагируют на инфекции, вакцинацию, травмы и рак».
Гормональные паттерны
Дико неравномерное бремя аутоиммунных заболеваний – не новое наблюдение.Более века назад, когда врачи впервые начали диагностировать эти состояния, они заметили, что у женщин гораздо больше шансов заболеть такими заболеваниями, чем у мужчин. Но тогда врачи были склонны рассматривать отдельные аутоиммунные заболевания как отдельные сущности со своими собственными уникальными причинами. Было мало осведомленности о том, что все они могут быть связаны фундаментальными способами и что они могут чаще влиять на женщин по этим общим биологическим причинам.
Все изменилось в начале 1990-х годов, когда ученые обнаружили, что некоторые аутоиммунные заболевания имеют общие биологические механизмы.Среди прочего, исследователи обнаружили, что иммунные клетки, известные как CD4 + Т-хелперы, участвуют в ревматоидном артрите, рассеянном склерозе и диабете 1 типа. А в 1991 году женщина с волчанкой по имени Вирджиния Лэдд основала Американскую ассоциацию аутоиммунных заболеваний, обнаружив, что ряд аутоиммунных заболеваний поражает различных членов ее семьи, что свидетельствует об общем генетическом наследовании.
Когда исследователи начали рассматривать аутоиммунные заболевания как совокупность, они начали замечать интересные закономерности.Во-первых, некоторые из этих состояний возникают у женщин после ключевых жизненных перемен. (Почти все исследования проводились с участием цисгендерных женщин.) Волчанка и рассеянный склероз, например, как правило, впервые появляются в детородном возрасте. Другие заболевания, например ревматоидный артрит, чаще всего возникают после менопаузы. Большие аутоиммунные изменения также могут иметь место во время беременности: симптомы у женщин с ревматоидным артритом, рассеянным склерозом и болезнью Грейвса часто ослабевают во время беременности, тогда как у женщин с симптомами волчанки часто ухудшаются.
Что общего у всех этих переходных периодов – полового созревания, беременности и менопаузы? Все они связаны с серьезными изменениями гормонов эстрогена, прогестерона и тестостерона. Уровень эстрогена повышается, например, во время полового созревания и беременности. Теперь ясно, что, хотя есть исключения, многие аутоиммунные заболевания «вызваны эстрогеном», – говорит ДеЛиза Фэйрвезер, микробиолог и иммунолог из клиники Майо в Джексонвилле, Флорида. Действительно, использование оральных контрацептивов и заместительной гормональной терапии , оба из которых добавляют в организм эстроген, связаны с повышенным риском волчанки.
Эстроген, как и другие половые гормоны, напрямую влияет на экспрессию ряда генов, отвечающих за иммунитет. Например, он присоединяется и включает ген, кодирующий гамма-интерферон, химическое вещество, которое управляет иммунными ответами против патогенов, но также может усиливать аутоиммунные реакции. Эстроген также активирует В-клетки, которые производят антитела, белки, которые маркируют и атакуют чужеродные вещества. Но некоторые из них, известные как аутоантитела, также могут атаковать клетки, вырабатываемые организмом.
Гормоны, которые играют ключевую роль во время беременности, такие как прогестерон, также оказывают сильное иммунное воздействие. Многие важные иммунные клетки, включая Т-клетки и макрофаги, имеют на своей поверхности рецепторы прогестерона. Когда прогестерон связывается с этими рецепторами, он сдвигает организм в сторону своего рода иммунного ответа, который способствует выработке антител и аутоантител. Эта реакция известна как иммунный ответ Th3 для Т-хелперных клеток 2 типа. Это контрастирует с иммунными ответами Th2, которые уводят организм от производства антител и вместо этого активируют клетки, которые напрямую атакуют другие клетки.
Повышение уровня прогестерона во время беременности может объяснить, почему симптомы ревматоидного артрита и рассеянного склероза часто ослабевают, когда женщины ожидают ребенка – эти заболевания вызваны иммунными ответами Th2, а не Th3, поэтому сдвиг, вызванный прогестероном, облегчает их иммунную нагрузку. Но «женщины с рассеянным склерозом имеют гораздо более высокий риск рецидива вскоре после родов. И это связано с резким изменением и снижением уровня половых гормонов », – говорит Тануджа Читнис, невролог из Бригама и женской больницы в Бостоне.
Тестостерон, который женщины вырабатывают, но в меньшей степени, чем мужчины, является еще одним важным гормоном, когда дело доходит до аутоиммунитета. Рецепторы тестостерона находятся на поверхности В- и Т-клеток, и этот гормон в значительной степени обладает иммунодепрессивным действием. Он снижает реакцию иммунных клеток, включая нейтрофилы, естественные клетки-киллеры и макрофаги, что может быть одной из причин того, что у мужчин, как правило, более низкие показатели аутоиммунных заболеваний. Исследования показали, что у мужчин с рассеянным склерозом уровень тестостерона часто ниже нормы, а у мужчин с низким уровнем тестостерона из-за состояния, известного как гипогонадизм, повышен риск волчанки и ревматоидного артрита.
Все эти половые гормоны также могут влиять на экспрессию ключевых иммунных генов. В 1997 году консорциум финских и немецких ученых открыл ген, который играет решающую роль в аутоиммунитете. Этот ген, который они назвали AIRE , что означает «аутоиммунный регулятор», экспрессируется клетками тимуса, органа, вырабатывающего Т-клетки. AIRE гарантирует, что ключевые белки организма показаны для развития Т-клеток, и эти встречи учат Т-клетки, что белки – друзья, а не враги.Также частично благодаря AIRE , Т-клетки, которые начинают атаковать эти дружественные белки, разрушаются в тимусе, прежде чем они смогут попасть в остальную часть тела, где они могут нанести ущерб.
Неудивительно, что люди, у которых AIRE отсутствует или мутировали, более склонны к развитию определенных аутоиммунных заболеваний. Это потому, что Т-клетки, которые необходимо удалить, не уничтожаются, и «в конечном итоге они попадают в ваше тело и вызывают аутоиммунное заболевание», – говорит Данн.
Как оказалось, активность AIRE ‘ – и других подобных генов – частично контролируется половыми гормонами.В исследовании 2016 года исследователи из Сорбонны в Париже показали, что у мышей эстроген и прогестерон снижают экспрессию AIRE , что означает, что они вызывают выработку меньшего количества белка, который он кодирует, тогда как тестостерон обеспечивает производство большего количества белка AIRE. Исследователи также обнаружили, что после полового созревания женщины, как правило, вырабатывают меньше AIRE, чем мужчины, возможно, из-за влияния половых гормонов. Меньше AIRE означает, что больше самореактивных Т-клеток может вырваться из вилочковой железы и вызвать аутоиммунное заболевание.
Тем не менее, несмотря на их влиятельные роли, половые гормоны не могут быть исчерпывающими. Аутоиммунные заболевания, включая волчанку и рассеянный склероз, иногда развиваются в детстве, до того, как гормоны, такие как эстроген и прогестерон, повышаются в период полового созревания. Это означает, что должны быть задействованы другие процессы. Чтобы найти их, некоторые исследователи изучают основное различие между мужчинами и женщинами, которое возникает задолго до рождения: наличие или отсутствие второй Х-хромосомы.
X-факторы
Биологическая догма гласит, что женщины имеют две Х-хромосомы, но одна копия отключается в каждой клетке на очень ранних этапах эмбрионального развития в процессе, известном как инактивация Х-хромосомы.Дополнительная Х-хромосома становится темной деформированной массой, которая молча сохраняется в каждой клеточной линии. Это отключение гарантирует, что организм не будет экспрессировать больше Х-сцепленных генов, чем следовало бы. Но в последние годы ученые обнаружили, что инактивация X не происходит так, как они думали. Исследования показывают, что по крайней мере 15 процентов генов предположительно инактивированной Х-хромосомы все еще включены, что, по сути, означает, что эти гены говорят женскому телу вырабатывать в два раза больше определенных белков по сравнению с уровнями у мужчин.У женщин с волчанкой, например, некоторые гены активны на обеих X-копиях, и эта более высокая активность коррелирует с тяжестью заболевания: более больные волчанкой имеют более активные X-сцепленные гены, чем женщины с более легким заболеванием.
Фактически, многие Х-сцепленные гены напрямую связаны с аутоиммунным заболеванием. Одним из них является ген толл-подобного рецептора 7 или TLR-7, белка, который участвует в аутоиммунных нарушениях, таких как волчанка, полимиозит, склеродермия и синдром Шегрена. Задача TLR-7 – распознавать патогены и предупреждать другие иммунные клетки об их присутствии; он также увеличивает выработку воспалительных иммунных химических веществ, известных как интерфероны, которые могут усилить аутоиммунный ответ.Другой ген, который часто активируется на предположительно инактивированных Х-хромосомах у женщин, – это TASL , и он также увеличивает выработку интерферона до такой степени, что женщины имеют по крайней мере вдвое больше белка, – говорит Хэл Скофилд, ученый-врач. Центр медицинских наук Университета Оклахомы, изучающий роль инактивации X в аутоиммунных заболеваниях.
Недавно ученые обнаружили нечто странное в инактивации Х-хромосомы, что также подтверждает его роль в аутоиммунитете.Неактивная Х-хромосома женщины особенно странным образом поддерживается Т- и В-клетками, которые активно участвуют в иммунных реакциях. В 2019 году Монтсеррат Ангуера, ученый-биомедик из Пенсильванского университета, и ее коллеги заметили, что когда молодые иммунные клетки у самок мышей созревают, клеточные механизмы, которые покрывают и инактивируют их вторую Х-хромосому, претерпевают значительные динамические изменения, которые могут сделать это. Х-сцепленным генам в этих клетках легче включиться, когда они должны быть выключены.«Это было безумное открытие», – говорит Ангуэра.
Никто не думал, что женские иммунные клетки действуют иначе в отношении инактивации Х-хромосомы, чем другие клетки, но оказалось, что они действуют – способами, которые могут напрямую влиять на риск аутоиммунитета. В июне 2021 года Ангуера и ее команда обнаружили, что В-клетки у девочек и женщин с волчанкой уклоняются от нормальных клеточных механизмов инактивации Х-хромосомы, что, вероятно, позволяет клеткам вырабатывать больше Х-связанных белков, чем они должны.
То, что происходит с людьми с необычным количеством Х-хромосом, также указывает на их важную роль в аутоиммунитете.У мужчин с синдромом Клайнфельтера, например, есть две Х-хромосомы и одна Y-хромосома, и они в 14 раз чаще, чем другие мужчины, заболевают волчанкой. Точно так же у женщин с трисомией X, у которых есть три X-хромосомы, вероятность развития волчанки и синдрома Шегрена в 2,5 и 2,9 раза выше, чем у других женщин соответственно.
Почему в женском организме есть эти странные механизмы, повышающие риск заболеваний? Обычно со временем эволюция устраняет процессы, которые затрудняют воспроизводство и процветание видов, а аутоиммунитет, связанный с Х-хромосомой, определенно мешает процветанию.Этот парадокс подсказывает биологам-эволюционистам, что это явление также может принести значительную пользу.
В статье 2019 года в Trends in Genetics Мелисса Уилсон, вычислительный и эволюционный биолог из Университета штата Аризона, и ее коллеги изложили свою гипотезу компенсации беременности, которая частично основана на эволюционных наблюдениях. Эволюция плаценты – органа, который обеспечивает кислород и питательные вещества для плода во время беременности – произошла в то же время, когда у млекопитающих появились половые хромосомы, и это также совпало с внезапным добавлением гораздо большего числа генов к Х-хромосоме.Все эти три события могут быть связаны.
Во время беременности женщины должны мириться с ростом плода, в котором половина ДНК чужеродна, потому что она исходит от отца. Это внешнее происхождение создает клетки, которые иммунная система обычно атакует. Женщины также должны терпеть плаценту, которую вырабатывает плод. Возможно, говорит Уилсон, Х-сцепленные гены и неполная инактивация Х эволюционировали как способ гибкости женского организма на новые странные иммунные потребности беременности.Во время беременности иммунитет меняется динамично: на ранних сроках беременности усиливаются определенные здоровые иммунные реакции, что способствует росту новых кровеносных сосудов плаценты; в середине беременности снижается иммунитет. Затем в ожидании родов снова усиливаются иммунные реакции и воспаление.
Другие наблюдения совпадают с предсказаниями гипотезы компенсации беременности. Например, сегодня женщины проводят гораздо меньшую часть своей жизни беременными, чем сотни лет назад, а это означает, что иммунная система женщин подавляется не так часто, как раньше.Это могло бы помочь объяснить, почему число аутоиммунных заболеваний среди женщин растет сегодня, а также почему в прошлом они были меньшим бременем. Хотя для подтверждения этой гипотезы требуется гораздо больше исследований, Уилсон считает, что возможно, что «плацентация и беременность имеют решающее значение для формирования материнской иммунной системы, что, в свою очередь, может указывать на то, почему у нас есть эти половые различия в заболеваниях». Другими словами, аутоиммунитет может быть нежелательным побочным продуктом комплексного иммунного ответа, который необходим женщинам для вынашивания детей.
Выпотрошить
Не все в организме определяется генетикой – это далеко не так. У одного однояйцевого близнеца может развиться аутоиммунное заболевание, а у другого близнеца с одинаковым геномом – нет. Окружающая среда – большой кусок головоломки. До сих пор неясно, какое внешнее воздействие может быть наиболее важным, но исследования начинают указывать на микробные инфекции, химические вещества, такие как эндокринные разрушители, курение, диету, стресс и «хорошие» комменсальные бактерии, которые живут в кишечнике.
Некоторые интересные работы на животных указывают на то, что кишечные бактерии, в совокупности называемые кишечным микробиомом, являются движущей силой повышенного риска аутоиммунных заболеваний. Джейн Данска, иммунолог и биофизик из Университета Торонто, большую часть своей карьеры провела, пытаясь понять взаимосвязь между полом и генетикой аутоиммунного заболевания – по сути, имеют ли гены, повышающие риск аутоиммунитета, различное влияние на мужчин по сравнению с женщинами. . Но в 2012 году она сделала счастливое открытие, которое открыло ее работу в совершенно новом направлении.«Это одна из поговорок науки:« Вы находите лучшее, чего не искали », – говорит она.
Данска и ее команда пытались найти гены риска диабета 1 типа, аутоиммунного заболевания, при котором организм атакует производящие инсулин бета-клетки поджелудочной железы. Они использовали выведенных в лаборатории грызунов, известных как мышей, не страдающих ожирением и диабетом (NOD). Мыши являются хорошими моделями болезни человека, за одним поразительным исключением: у мужчин и женщин одинаковая вероятность развития диабета 1 типа – это одно из немногих аутоиммунных заболеваний, которое не затрагивает преимущественно женщин, но у мышей NOD болезнь проявляется. вдвое чаще возникает у самок.
Данска знала, что факторы окружающей среды иногда взаимодействуют с генами, и она рассматривала кишечные бактерии как фактор риска. Она начала задаваться вопросом, могут ли различия кишечных бактерий у ее мышей быть связаны с асимметричным соотношением диабета. Чтобы выяснить это, она и ее коллеги вырастили подмножество мышей NOD в среде, свободной от микробов, лишенной бактерий и вирусов, включая комменсальные бактерии, которые обычно населяют кишечник.
Именно тогда Данская сделала свое первое удивительное открытие.Когда она посмотрела на то, у скольких здоровых животных развился диабет во взрослом возрасте, «половая разница полностью исчезла», – вспоминает она. У мужчин внезапно возникла такая же вероятность развития диабета, как и у женщин. «Это было грандиозное открытие, которого мы не ожидали. Я просто не мог поверить, что это правда ».
Но повторение эксперимента показало тот же эффект. Потом больше работы привело к большему количеству сюрпризов. Исследователи взяли бактерии у взрослых самцов мышей NOD и поместили их в молодых самок мышей NOD, у которых еще не развился диабет.Затем самки мышей превратились в здоровых взрослых без болезни.
Результаты исследованияДански, опубликованные в 2013 году в журнале Science , предоставили первое свидетельство того, что «микробы в кишечнике могут влиять на женский аутоиммунитет», – говорит Мартин Кригель, ревматолог и клинический иммунолог из Университета Мюнстера в Германии. По его словам, это важное открытие, над которым ученые все еще работают.
Никто еще не знает, почему микробы мужского кишечника кажутся защитными.Тем не менее, одна вещь, которую Данска и ее команда определили, заключается в том, что тестостерон имеет решающее значение: когда они взяли кровь у мышей NOD без микробов, они обнаружили, что у склонных к диабету мужчин уровень циркулирующего тестостерона ниже, чем у мужчин с микробами. И когда самки мышей были колонизированы микробами самцов и, по-видимому, были защищены от болезней, у них был более высокий уровень циркулирующего тестостерона, чем у самок с микробами обычно.
Все это говорит о том, что в микробах у мужчин есть что-то такое, что повышает уровень тестостерона и защищает.Когда Данска и ее коллеги извлекли кишечные микробы из самцов мышей и поместили их в кишечники самок мышей, а затем заблокировали передачу сигналов тестостерона в их телах, они снова оказались в группе повышенного риска диабета 1 типа. Результаты согласуются с исследованиями волчанки у мужчин, показывающими, что подавленный тестостерон, по-видимому, повышает риск этого расстройства. (Исследование также согласуется с работой на мышах, у которых самки особенно склонны к волчанке. Удаление кишечных бактерий у этих самок грызунов снижает их риск, сообщили ученые из Медицинского университета Южной Каролины в 2020 году в журнале Journal of Immunology. .)
Неясно, как микробы могут регулировать уровень тестостерона и наоборот. Исследования Дански показывают, что состав комменсальных микробов у самцов и самок мышей различается в период полового созревания, поэтому, похоже, что-то происходит с бактериями примерно в это время. Это может даже объяснить, почему не так много разницы по полу в распространенности диабета 1 типа у людей; заболевание обычно развивается до полового созревания, прежде чем микробы смогут формировать риск в зависимости от пола. Возможно, на микробы влияет внезапный приток половых гормонов в период полового созревания, но это почти наверняка «дорога с двусторонним движением», говорит Кригель: микробы реагируют на половые гормоны, а половые гормоны – на микробы.
На пути к лучшему балансу
Конечно, мыши – не люди. Но Данска считает, что ее результаты имеют важное значение для аутоиммунных заболеваний, которые действительно влияют на женщин. Возможно, некоторые кишечные бактерии у женщин имеют решающее значение в развитии аутоиммунитета. Если это так, то работа с кишечными микробами может помочь нам предотвратить болезнь.
Данска и Кригель надеются, что удастся разработать целевые методы лечения на основе микробов для женщин с высоким риском аутоиммунных заболеваний – методы лечения, которые могут формировать микробиом защитными способами.Другие исследователи ищут способы настроить сигналы половых гормонов, чтобы снизить риск. Чем больше ученые узнают о том, почему женщины уязвимы, тем больше у них шансов вмешаться до того, как разовьются болезни.
Учитывая, что Х-хромосомы, женские половые гормоны и женские кишечные бактерии, по-видимому, увеличивают риск аутоиммунитета, может показаться, что биология каким-то образом застрахована против женского пола. Но это аутоиммунное бремя можно рассматривать и с другой стороны: как отражение важности женщин для выживания нашего вида.«Женщинам приходится делать всевозможные совершенно замечательные вещи с иммунологической точки зрения, которые мужчины просто не должны делать», – говорит Данска. Аутоиммунитет может быть ценой, которую женское тело платит за свой динамизм, но это, по крайней мере, бремя, которое наука в конечном итоге сможет устранить.
Обзоров Heal-n-Soothe – Что говорят клиенты?
Становится ли жестокость вашей хронической боли неконтролируемой? Вам сложно серьезно относиться к традиционным решениям, когда они редко творят чудеса, не вызывая каких-либо побочных эффектов? К счастью, два специалиста по реабилитации утверждают, что разработали решение, которое естественным образом восстанавливает, поддерживает и защищает людей от воспалений.К нашему удивлению, их ответ, как полагают, эквивалентен силе морфина, но исключает вредное воздействие на здоровье. Мы привлекли ваше внимание? Если да, то цель этого обзора – пролить свет на Heal-n-Soothe®.
Что такое Heal-n-Soothe®?
Heal-n-Soothe® – это пищевая добавка, которая представляет собой естественную альтернативу обезболивающим лекарствам, одновременно ограничивая риск зависимости и подвергая опасности здоровье. Этот прорывный протокол, как полагают, рассматривает боль и боли через призму нетрадиционных практик, которые потенциально могут обратить вспять десятилетия хронической боли, восстановить юные суставы и подвижность, а также, среди прочего, сохранить безопасность.Если быть более точным, люди, которые боролись с отеками и воспалениями, плохим кровообращением, длительным выздоровлением и усилением рубцов, наконец-то могут найти комфорт благодаря Heal-n-Soothe®. Насколько правдивы утверждения, описанные выше? Что ж, единственный способ узнать это – исследовать механизм Heal-n-Soothe®.
Как работает Heal-n-Soothe®?
Движущая сила Heal-n-Soothe® – это использование «обезболивающих ферментов», – объясняет команда, ответственная за эту формулу, Институт Здоровой Спины.Основанный на принципах системной мультиферментной терапии, он включает доставку ферментов в сочетании с рутином и другими веществами для лечения опорно-двигательного аппарата, артрита и послеоперационных состояний [1]. Согласно утверждениям, производство ферментов истощается с возрастом, что проблематично, потому что определенные типы специально лечат и устраняют боль в поврежденных тканях.
Основная проблема, возникающая в результате воспаления, – это реакция организма на него. К нашему удивлению, когда тело оказывается в такой ситуации, он запускает производство белка, называемого фибрином (т.д., преобразование фибриногена) или также называемая «липкой сеткой, которая УПРАВЛЯЕТ эритроцитами». Красные кровяные тельца жизненно важны, поскольку они несут необходимый кислород, поэтому процессы заживления прекращаются, когда они попадают в ловушку. Имейте в виду, что фибриноген – это неплохо при нормальном уровне; проблемы возникают только тогда, когда их слишком много.
В конечном итоге Heal-n-Soothe® был разработан для доставки ферментов, борющихся с воспалением, которые, как полагают, регулируют концентрацию фибрина и, как результат, уменьшают воспаление для максимального облегчения боли.Итак, пришло время раскрыть ингредиенты, ответственные за качественный результат.
Какие основные ингредиенты входят в состав Heal-n-Soothe®?
Каждая порция (т.е. три капсулы) содержит смесь системных ферментов (750 мг), а также множество растений, трав, витаминов и минералов. Ниже приводится краткое описание каждого компонента, вошедшего в формулу Heal-n-Soothe®:
Смесь системных ферментов
Смесь системных ферментов содержит протеазу AM, бромелайн, протеазу 6.0, щелочная протеаза и папаин. Большая часть этой смеси включает так называемые протеолитические ферменты или протеазы, которые вырабатываются поджелудочной железой и желудком. Интересно, что бромелайн и папаин получают из ананасов и папайи соответственно, оба из которых одинаково эффективны.
Как стало известно из одного источника, эта группа оценивается как «важная для деления клеток, свертывания крови, иммунной функции и рециркуляции белков». Далее было отмечено, что несколько исследований успешно показали, что прием протеолитических ферментов может уменьшить воспаление и симптомы, связанные с воспалительными состояниями.Некоторые примеры включают боль, отек и скованность суставов [2].
Имбирь (90 мг)
Имбирь – цветковое растение, корневище которого используется в кулинарии и в лечебных целях. Его роль в Heal-n-Soothe® так же важна, как и у некоторых компонентов в Systemic Enzyme Blend, потому что это фермент. Другими словами, как и киви, спаржа, кимчи, йогурт, кефир и квашеная капуста являются диетическими источниками протеолитических ферментов, так же как и имбирь [2].
Экстракт босвеллии (150 мг)
Также известный как индийский ладан, босвеллия – это травяной экстракт, полученный из дерева босвеллии пильчатой.Мета-анализ, в ходе которого оценивалась эффективность травы как противовоспалительного, противоартритного и обезболивающего средства для людей с остеоартритом, пришел к выводу, что она может облегчить боль и скованность при одновременном улучшении функции суставов. В свою очередь, исследователи заявили, что «босвеллия и ее экстракт могут быть эффективным и безопасным вариантом лечения для пациентов с ОА [3]».
Цитрусовый биофлавоноидный комплекс (90 мг)
Считается, что биофлавоноиды цитрусовых улучшают кровоток и снимают отеки по всему телу.В обзоре, в котором рассматривалась польза биофлавоноидов цитрусовых для сердечно-сосудистой системы (ССЗ) и метаболического здоровья, сообщается, что они, вероятно, защищают от ССЗ при одновременном снижении окислительного стресса, гиперлипидемии и воспалений. Также было упомянуто, что такой комплекс может «защищать от повреждения клеток, вызванного реактивным окислительным стрессом (АФК), [и] уменьшать ожирение и воспаление жировой ткани [4]».
ТАКЖЕ ПРОЧИТАЙТЕ: Обзоры флексотонов: отрицательные побочные эффекты или преимущества, которые работают?
Юкка (90 мг)
Юкка – это корень маниока.Фенолы, полученные из этого корня, обладают антиоксидантными свойствами, необходимыми для подавления ROS, которые, как известно, способствуют воспалительным реакциям. Хотя в настоящее время имеются ограниченные научные данные, это известный ингредиент для лечения и профилактики артрита [5].
Куркума (60 мг)
Куркума – индийская специя, занимающая центральное место в индийской кухне и в аюрведической медицине. Что касается его эффективности, то он основан на содержащемся внутри химическом веществе под названием куркумин.Без этого химического вещества невозможно избавиться от сенной лихорадки, депрессии, контроля липидов и симптомов, связанных с остеоартритом [6]. Хотя существует мнение, что с его помощью можно вылечить язву желудка и победить болезнь Альцгеймера, исследования не дали окончательных результатов.
Альфа-липоевая кислота (50 мг)
Альфа-липоевая кислота – это соединение, вырабатываемое внутри митохондрии (где ферменты превращают питательные вещества в энергию). В настоящее время этот ингредиент был связан с уменьшением хронического воспаления из-за его способности снижать несколько маркеров, связанных с воспалением.Согласно одному источнику, «альфа-липоевая кислота значительно снижает уровень воспалительного маркера С-реактивного белка (СРБ) у взрослых с высоким уровнем СРБ [7]».
Рутин (30 мг)
Рутин – пигмент с антиоксидантными свойствами. В одном обзоре, посвященном фармакологическому потенциалу рутина, подчеркивается, что его прием внутрь предотвращает острую и хроническую фазы воспаления, за счет его противогрибкового и противоартритного действия [8]. Другой источник заявил, что он может эффективно обратить вспять отек и симптомы, связанные с остеоартритом [9].
Экстракт корня дьявольского когтя (30 мг)
Введенный в начале 1900-х годов, когда корни сушат и употребляют в пищу, он потенциально может восстановить аппетит, облегчить изжогу и уменьшить боль и воспаление, пишет One Piece [10]. Говоря о снижении воспаления, этот ингредиент может также улучшить остеоартрит, облегчить симптомы подагры, облегчить боль в спине и, мягко говоря, способствовать снижению веса [11].
Часто задаваемые вопросы (FAQS)
Какие функции есть в Heal-n-Soothe®?
Heal-n-Soothe® не содержит продуктов животного происхождения или глютена.Собственно говоря, яиц, молока, арахиса, древесных орехов, рыбы, сои, пшеницы, ракообразных, моллюсков и ГМО вообще избегали.
Безопасно ли Heal-n-Soothe®?
Heal-n-Soothe® считается безопасным для приема внутрь; однако людям, которые страдают заболеваниями или принимают лекарства, лучше проконсультироваться с врачом перед их приемом. Эта добавка не подходит для людей с аллергией на ананас или папайю, которые принимают антикоагулянты, страдают нарушениями свертываемости крови или кому-либо, кому предстоит операция.Для получения дополнительной информации о том, кому следует избегать Heal-n-Soothe®, щелкните здесь.
Какой рекомендуемый размер порции Heal-n-Soothe®?
Нет минимальных требований, даже если в Институте здоровой спины три капсулы указаны как одна порция. В идеале люди будут рассматривать это как возможность поэкспериментировать, начиная с одной капсулы и не превышая трех в течение 24 часов.
Содержит ли Heal-n-Soothe® аллергены?
Нет, Heal-n-Soothe® не содержит всех распространенных аллергенов.
Каковы предполагаемые преимущества приема Heal-n-Soothe®?
Считается, чтоHeal-n-Soothe® способствует естественному заживлению, уменьшает дискомфорт в суставах и мышцах, ускоряет восстановление мышц, борется с повреждением свободными радикалами и поддерживает здоровый иммунный ответ.
Безопасен ли Heal-n-Soothe® для людей с диабетом?
В прошлом люди с диабетом принимали Heal-n-Soothe®, и у них никогда не было побочных реакций. Институт здоровой спины настаивает, что «Heal-n-Soothe® может быть противопоказан не из-за диабета, а из-за вашей конкретной истории болезни и медицинских потребностей.«В этом случае мудрым выбором будет консультация практикующего врача.
Можно ли принимать Heal-n-Soothe® вместе с лекарствами, отпускаемыми по рецепту?
Принимается любой рецептурный препарат, если он не классифицируется как разжижитель крови или антибиотик.
Является ли Heal-n-Soothe® решением, которое нужно принимать в течение длительного времени?
Да, Heal-n-Soothe® можно и нужно принимать ежедневно вместе с мультивитаминами для контроля воспаления, обеспечивая при этом постоянную поддержку восстановления тканей, здоровья суставов и иммунитета, среди прочего.
Защищает ли Heal-n-Soothe® гарантия возврата денег?
Да, Heal-n-Soothe® защищен 90-дневной гарантией возврата денег. Если это решение не указывает на признаки уменьшения хронической боли, можно связаться со службой поддержки клиентов для полного возмещения стоимости покупки. Вот список контактной информации, которую нужно иметь под рукой:
- Электронная почта: Отправьте форму
- Телефон: 1 (800) 216 4908 (США и Канада) или (240) 780 5977 (международный)
- Корпоративный офис: Институт здоровой спины, 1301 Ridgeview Drive McHenry, IL 60050
Сколько стоит Heal-n-Soothe®?
Каждый флакон Heal-n-Soothe® содержит запас на один месяц.Поскольку он рекламируется за его долгосрочное действие, люди могут обдумать следующие варианты цены:
- 1 флакон Heal-n-Soothe® : 69,95 долларов США за штуку
- 3 флакона Heal-n-Soothe® : 56,33 доллара США за штуку
- 6 бутылочек Heal-n-Soothe® : 48,17 доллара за штуку
Для заинтересованных сторон также есть возможность подписаться на ежемесячный план поставки The Healthy Back Institute, где стоимость каждой поставки составляет 59,95 долларов США за штуку. Проще говоря, новая посылка будет отправлена до тех пор, пока программа не будет отменена.Для отмены можно позвонить по номеру 1 (800) 216 4908 или на веб-портале самообслуживания «Моя учетная запись».
Познакомьтесь с Институтом здоровой спины
Основанный двумя национально признанными специалистами по реабилитации, Джесси Кэнноне, CFT, CPRS, MFT, и Стивом Хеффероном, CMT, PTA, Институт здоровой спины посвящен внедрению естественных методов лечения боли в спине. Первоначально нацелившись на боль в спине, команда экспертов этого учреждения с тех пор расширила свои возможности по оказанию помощи, поддерживая любую мышечную, суставную и даже нервную боль.
Исходя из информации, представленной на официальном веб-сайте, Институт «Здоровая спина» занимается информированием потребителей о последствиях состояния здоровья и предлагает экономичные и безмедикаментозные средства лечения. Вот что они хотят, чтобы все знали об их целях:
«Наша цель – показать вам, как работает ваше тело, как определить основные причины вашей боли, и поделиться нашим вкладом в поиск эффективных естественных решений».
Окончательный приговор
В целом, Heal-n-Soothe® – именно то, на что намекают; пищевая добавка, которая снимает воспаление и реакцию организма на него, чтобы люди могли достичь оптимального обезболивания.Как показано ранее в этой части, когда воспаление усиливается, в организме увеличивается количество белка, называемого фибриногеном (что приводит к образованию фибрина). Хотя это, пожалуй, важный компонент для поддержания здоровья, все лишнее может нанести вред. Следовательно, считается, что эта формула уменьшает воспаление, поэтому организм не стимулирует производство. Более того, он может подавлять выработку фибриногена и превращение его в фибрин, если появятся такие признаки.
На основании нашего исследования перечисленные ингредиенты имеют предварительные результаты или тщательно изучаются для лечения хронической боли.С этой точки зрения формула Heal-n-Soothe® весьма привлекательна. Еще одна особенность, уникальная для команды Института здоровой спины, – это их обещание информировать людей, которое они сдержали, как видно из обширного раздела часто задаваемых вопросов. Наша редакционная группа была впечатлена уровнем детализации в разделе часто задаваемых вопросов, поскольку были даны ответы на все мыслимые вопросы.
Наконец, знание того, что не один, а два специалиста по реабилитации имели право голоса в том, что должно быть включено в Heal-n-Soothe®, делает его более желанным.Оба мужчины были представлены в десятках журналов, новостных платформ, телевизионных программах, интервью и семинарах по вопросам здоровья – все они отражают их опыт в этой сфере. По этим причинам наша редакционная группа считает целесообразным инвестировать в Heal-n-Soothe®. Чтобы узнать больше о свойствах Heal-n-Soothe® подавлять воспаление, щелкните здесь >>>.
ТАКЖЕ ЧИТАЙТЕ: Лучшее обезболивающее – Покупайте лучшие обезболивающие, которые действительно работают
Информация о филиалах:
Ссылки, содержащиеся в этом обзоре продукта, могут привести к получению небольшой комиссии, если вы решите приобрести рекомендованный продукт без каких-либо дополнительных затрат.Это направлено на поддержку нашей исследовательской и редакционной группы, и, пожалуйста, знайте, что мы рекомендуем только высококачественные продукты.
Заявление об отказе от ответственности:
Пожалуйста, поймите, что любые советы или рекомендации, представленные здесь, даже отдаленно не заменяют разумный медицинский совет от лицензированного поставщика медицинских услуг. Обязательно проконсультируйтесь с профессиональным врачом, прежде чем принимать какое-либо решение о покупке, если вы принимаете лекарства или у вас возникли проблемы после подробностей обзора, представленных выше.Индивидуальные результаты могут отличаться, поскольку заявления, сделанные в отношении этих продуктов, не были оценены Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов. Эффективность этих продуктов не подтверждена исследованиями, одобренными FDA. Эти продукты не предназначены для диагностики, лечения или предотвращения каких-либо заболеваний.

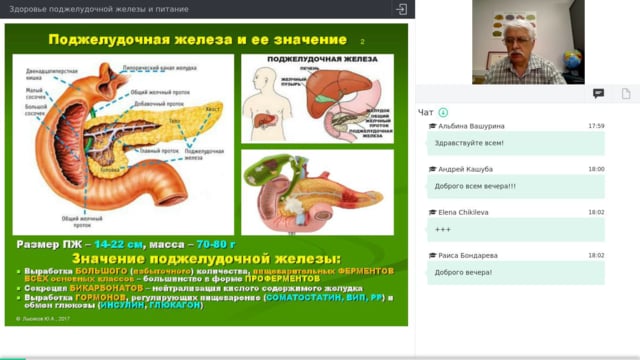
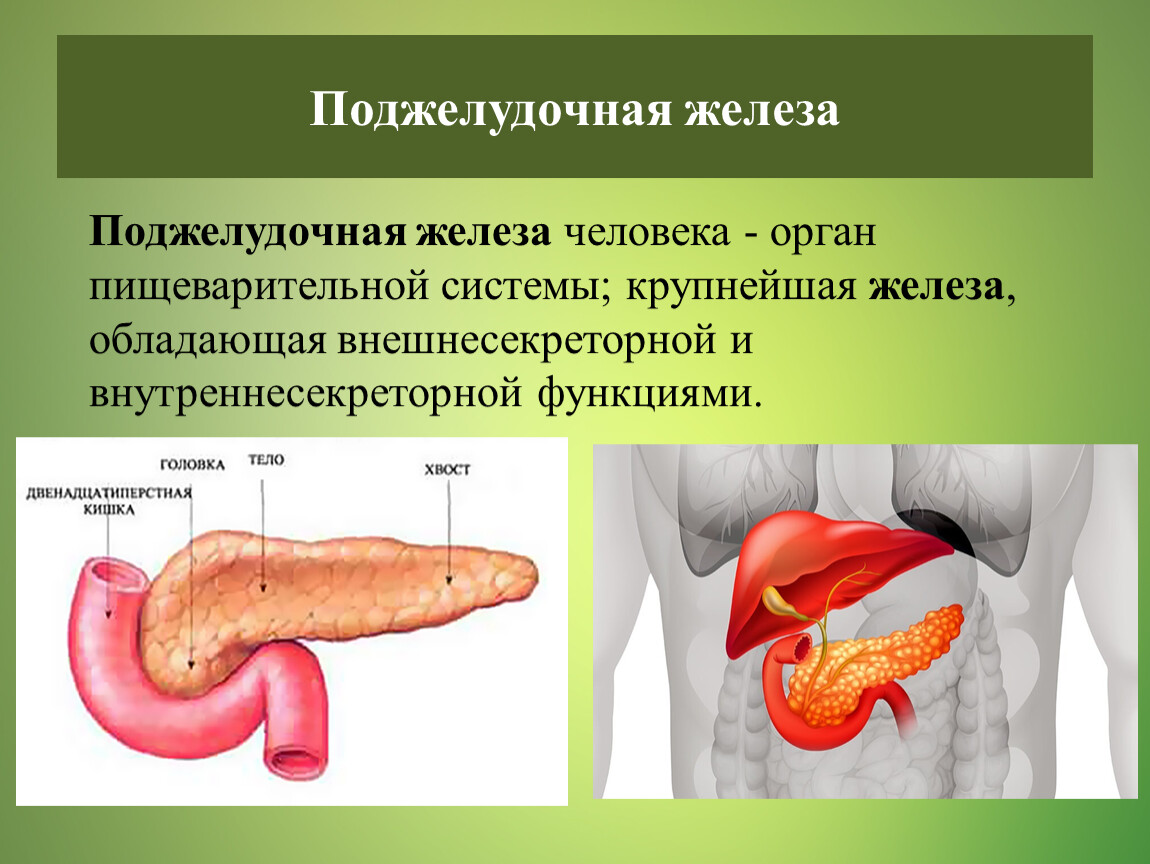

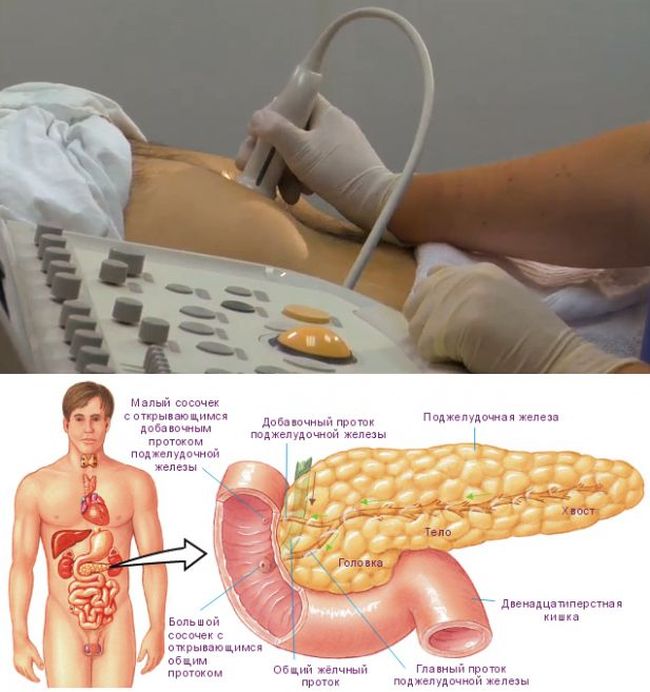

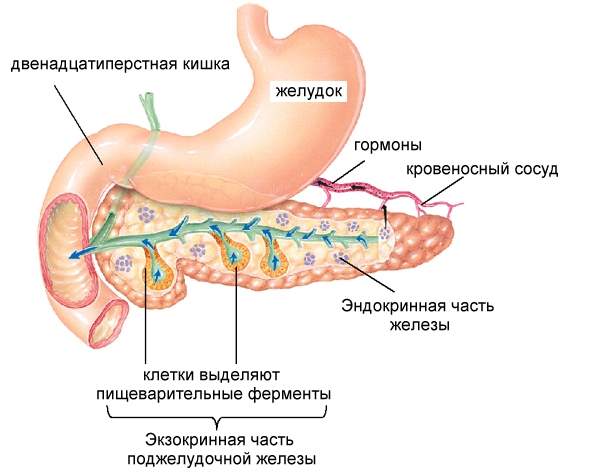

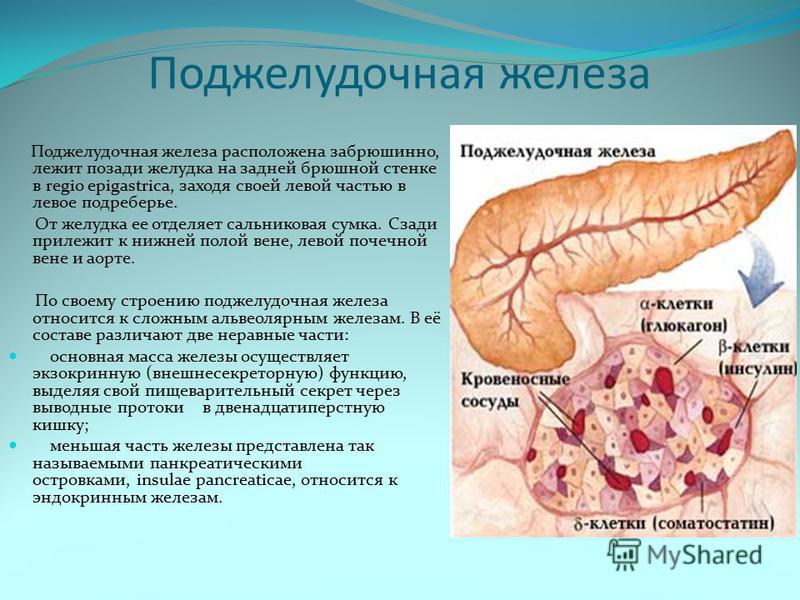 Выявленные заболевания в этих органах могут стать главной причиной реактивного панкреатита и изменений ПЖ на УЗИ.
Выявленные заболевания в этих органах могут стать главной причиной реактивного панкреатита и изменений ПЖ на УЗИ.
