Ротавирусная инфекция классификация: ᐈ Ротавирус: симптомы, лечение ~【Киев】
Классификация ротавирусной инфекции (Колтыпин а.А.)
Тип | Тяжесть | Течение |
1. Типичная 2. Атипичная: – стертая – бессимптомная | 1. Легкая 2. Средней тяжести 3. Тяжелая | 1. Гладкое 2. С осложнениями: токсикоз с эксикозом, дисбактериоз кишечника |
Пример формулировки диагноза: Ротавирусныи гастроэнтерит, среднетяжелая форма. Осложнение: дисбактериоз кишечника, декомпенсированный.
Критерии
тяжести.
1.Легкая форма – стул водянистый, разжиженный до 5 раз в сутки. Рвота однократная, реже повторная или отсутствует. Умеренное снижение аппетита и тошнота. Выздоровление на 4-5 день болезни.
2. Среднетяжелая форма. Умеренно выраженная интоксикация, стул водянистый, обильный, до 10 раз, повторная рвота, боли в животе, температура поднимается до 38С, Умеренно выражены нарушения гемодинамики – мраморность кожи, бледность у детей раннего возраста, снижение артериального давления. Продолжительность болезни 5-7 дней.
3. Тяжелая форма. Интоксикация выраженная, в первые сутки развивается токсикоз с эксикозом. Рвота многократная, обильный водянистый, желтый стул до 20 раз и более, температуры выше 38С. Выздоровление к 8-10-му дню.
Осложнения. Наслоение
бактериальной или вирусно-бактериальной
инфекции. Специфические осложнения не
описаны, но инфекция может вызвать
обострение хронического заболевания
органов пищеварения.
Специфические осложнения не
описаны, но инфекция может вызвать
обострение хронического заболевания
органов пищеварения.
Диагностика.
Клиническая – характерно внезапное появление обильного водянистого, пенистого стула без патологических примесей, сопровождающегося приступообразными болями в верхней половине живота, урчанием, императивными позывами на дефекацию, умеренная кратковременная интоксикация.
Эпидемиологическая – указание в анамнезе на очаг инфекции, преимущественно в зимне-весеннее время года.
Вирусологическая – обнаружение цельных вирионов, вирусного антигена, вирусспецифической РНК в копрофильтратах методом электронной микроскопии, ИФА, РА в первые 24-72 часа заболевания.
Серологическая – нарастание титра антител в 4 раза и более вРСК, РТГА, ИФА в динамике заболевания (через10-14 дней). Для получения сыворотки из вены берут 3-5 мл крови натощак. Сыворотку хранят при температуре 4С, консервант не добавляют.

7. Задания на усвоение темы занятия:
1. Контрольные вопросы:
1. Частота кишечных инфекций, вызванных условно-патогенной флорой и вирусами, в этиологической структуре заболеваний у детей.
2.Особенности эпидемиологии кишечных инфекций, вызванных УПФ, у детей.
3.Особенности патогенеза кишечных инфекций, вызванных УПФ, у детей.
4.Возрастная структура кишечных инфекций, вызванных УПФ.
5.Клиника кишечных инфекций, вызванных отдельными представителями УПФ, у детей (стафилококкозы, протеозы, клебсиеллезы, кампилобактериозы, криптоспоридиозы).
6. Особенности диагностики кишечных инфекций, вызванных УПФ.
7. Лечение кишечных инфекций, вызванных УПФ.
8. Профилактика кишечных инфекций, вызванных УПФ.
9. Особенности эпидемиологии вирусных диарей у детей.
10. Роль ротавирусов в структуре кишечных
инфекций у детей.
Роль ротавирусов в структуре кишечных
инфекций у детей.
11.Особенности патогенеза и иммунитета при рота- вирусных диареях у детей.
13.Особенности течения вирусных диарей у детей.
14.Диагностика вирусных диарей.
15. Профилактика вирусных диарей.
Ротавирусная инфекция | Прививки.уз – Предупредить. Защитить. Привить.
Новые инфо материалы по иммунизации во время пандемии COVID-19
для медицинский работников и родителей
Вакцинация во время пандемии COVID-19
Вопросы и ответы для РОДИТЕЛЕЙ
Вакцинация во время пандемии COVID-19
Вопросы и ответы для МЕДРАБОТНИКОВ
В ВОЗ отмечают 40-летие победы над оспой
и призывают проявить такую же солидарность в борьбе с COVID-19
Может ли БЦЖ вакцина помочь в борьбе с коронавирусом?
Международные исследования анализируют влияние БЦЖ вакцины на коронавирус
Совместное заявление ВОЗ и ЮНИСЕФ
Во время пандемии COVID-19 крайне важно сохранить услуги плановой иммунизации
В условиях пандемии COVID-19 вакцинацию необходимо продолжать, чтобы она сохраняла свою эффективность
Европейская неделя иммунизации – 2020
ГАВИ, ВОЗ, ЮНИСЕФ: успешное сотрудничество и новые планы
22-23 ноября 2019 года в конференц-зале гостиницы Hyatt Regency Tashkent при поддержке ВОЗ Министерство здравоохранения провело ежегодную национальную конференцию по иммунизации
Первый этап вакцинации против ВПЧ прошел успешно и эффективно
Минздрав провел конференцию по итогам первого этапа прививочной кампании против ВПЧ в Узбекистане.
Первые результаты вакцинации от ВПЧ!
Как вы знаете, с 21 октября 2019 года по всей республике проводится вакцинация против ВПЧ.
В Узбекистане дан старт вакцинации против вируса папилломы человека
В столице состоялась пресс-конференция, посвященная началу вакцинации против вируса папилломы человека.Встреча с блогерами о ВПЧ
«Мероприятие полностью меня поглотило».
Профилактика рака шейки матки и внедрение ВПЧ вакцины в Узбекистане
Все о вакцинации от ВПЧ
Встреча с Ассоциацией частных школ Узбекистана по внедрению ВПЧ вакцины
Научно-практическая конференция по профилактике, раннему выявлению и лечению рака шейки матки.
20 августа 2019 года В Ташкенте под слоганом «Будущее без рака шейки матки» прошла научно-практическая конференция по профилактике, раннему выявлению и лечению рака шейки матки.
Техническая поддержка Узбекистану в оценке температурных рисков в системе холодовой цепи для вакцин
В рамках оказания технической поддержки Узбекистану в достижении лучших стандартов качества и безопасности вакцин, с 13 по 24 августа 2019 года проходит миссия в составе консультантов ВОЗ г-жи Claire Frijs-Madsen и г-жи Erida Nelaj.
Рабочий визит делегации Республики Узбекистан по опыту внедрения внедрения вакцинации против ВПЧ в Молдове
«Это наши мамы, наши сестры, наши дочери, которых мы можем защитить от рака шейки матки уже сегодня благодаря вакцине от ВПЧ и программе скрининга», – неоднократно повторяли представители Молдовы.
Прививки: абсолютно исчерпывающая инструкция для взрослых и детей Даже для тех, кто не верит в вакцинацию
Антипрививочное движение продолжает шириться, а вместе с ним растети частота вспышек инфекций
Совсем недавно в рамках Европейской недели иммунизации состоялась очень необычная и интересная встреча
ОСТРЫЕ КИШЕЧНЫЕ ИНФЕКЦИИ ВИРУСНОЙ ЭТИОЛОГИИ У ДЕТЕЙ: ВОЗМОЖНОСТИ ДИАГНОСТИКИ И ТЕРАПИИ | УСЕНКО
 pdf (дата обращения – 17.08.2014).
pdf (дата обращения – 17.08.2014).2. Подколзин A.T., Веселова О.А., Яковенко М.Л. и др. Этиология летальных исходов у детей младшего возраста на фоне острых диарейных заболеваний в Российской Федерации. Инфекционные болезни, 2013, 2: 38-44
3. Веселова О.А., Подколзин А.Т., Шипулин Г.А. Циркуляция различных G типов ротавирусов на территории Российской Федерации в 2012–2013 гг. В книге: Молекулярная диагностика – 2014 VIII Всероссийская научно-практическая конференция с международным участием. Под ред. В.И. Покровского. 2014: 374-375.
4. Манкевич Р.Н., Савич О.Л., Лагир Г.М., Кудин А.П., Завада А.Н. Опыт применения «Линекс форте» у детей с ротавирусной инфекцией. Вопросы детской диетологии, 2016, 14(4): 64-65.
5. Андреева И.В., Стецюк О.У. Эффективность и безопасность комбинации Lactobacillus acidophilus LA-5 и Bifidobacterium lactis ВB-12 в гастроэнтерологии, педиатрии и аллергологии. Клин. микробиол. антимикроб. химиотер., 2006, 18(2): 116-124.
Андреева И.В., Стецюк О.У. Эффективность и безопасность комбинации Lactobacillus acidophilus LA-5 и Bifidobacterium lactis ВB-12 в гастроэнтерологии, педиатрии и аллергологии. Клин. микробиол. антимикроб. химиотер., 2006, 18(2): 116-124.
6. Горелов А.В., Милютина Л.Н., Усенко Д.В. Клинические рекомендации по диагностике и лечению ОКИ у детей. М., 2005, 106 с.
7. Козина Г.А. Клинико-эпидемиологические особенности и вопросы терапии острых кишечных инфекций аденовирусной этиологии (F 40/41) у детей. Дисс. канд. мед наук. М., 2010, 168 с.
8. Дорошина Е.А. Клинико-эпидемиологические особенности и вопросы терапии норовирусной инфекции у детей. Дисс. канд. мед наук. М., 2010, 106 с.
9. Бабик Р.К. Клинико-иммунологические особенности вирусных кишечных инфекций у детей. Дисс. докт. мед. наук. М., 2013, 279 с.
Бабик Р.К. Клинико-иммунологические особенности вирусных кишечных инфекций у детей. Дисс. докт. мед. наук. М., 2013, 279 с.
10. Учайкин В.Ф., Новокшонов А.А., Мазанкова Л.Н. и др. Острые кишечные инфекции у детей (диагностика, классификация, лечение). Пособие для врачей. М., 2004, 136 с.
СОЗДАНИЕ ГИБРИДНЫХ РЕКОМБИНАНТНЫХ БЕЛКОВ НА ОСНОВЕ БЕЛКОВ VP6 И VP8 РОТАВИРУСА ЧЕЛОВЕКА ГРУППЫ А | Духовлинов
1. Balaram P., Kien P.K., Ismail A. Toll-like receptors and cytokines in immune responses to persistent mycobacterial a 1. nd Salmonella infections. Int. J. Med. Microbiol., 2009, vol. 299, no. 3, pp. 177–185.
2. Bishop R.F., Davidson G.P., Holmes I.H., RuckB.J. Virus particles in epithelial cells of duodenal mucosa from children with acute non-bacterial gastroenteritis. Lancet 2, 1973, pp. 1281–1283.
Lancet 2, 1973, pp. 1281–1283.
3. Bruijning-Verhagen P., Mangen J.M.-J., Felderhof M., Hartwig G.N., van Houten M., Winkel L., de Waal J.W., Bonten J.M.M. Targeted rotavirus vaccination of high-risk infants; a low cost and highly cost-effective alternative to universal vaccination. BMC Medicine, 2013, vol. 11, p. 112.
4. Dennehy H.P. Rotavirus Vaccines: an overview. Clin. Microbiol. Rev., 2008, pp. 198–208.
5. Flewett T.H., Bryden A.S., Davies H.A. Virus particles in gastroenteritis. Lancet, 1973, vol. 302, iss. 7844, p. 1497.
6. Invitrogen. Ni-NTA purification system. User manual. Catalog nos. K950-01, K951-01, K952-01, K953-01, K954-01, R901-01, R901-10, R 901-15. Version C. 25-0496, 2006, 32 p.
25-0496, 2006, 32 p.
7. Laemmli U.K. Cleavage of Structural Proteins during the Assembly of the Head of Bacteriophage T4. Nature, 1970, vol. 227, pp. 680–685.
8. Majumder K. Ligation-free gene synthesis by PCR: synthesis and mutagenesis at multiple loci of a chimeric gene encoding OmpA signal peptide and hirudin. Gene, 1992, vol. 110, no. 1, pp. 89–94.
9. Patton J.T. Rotavirus diversity and evolution in the post-vaccine world. Discovery Med., 2012, vol. 13, no. 68, pp. 85–97.
10. Schnagl R.D., Holmes I.H. Characteristics of the genome of human infantile enteritis virus (Rotavirus). J. Virol., 1976, vol. 19, no. 1, pp. 267–270.
11. Studier F.W. Protein production by auto-induction in high density shaking cultures. Protein Expr. Purif., 2005, vol. 41, no. 1, pp. 207–234.
Studier F.W. Protein production by auto-induction in high density shaking cultures. Protein Expr. Purif., 2005, vol. 41, no. 1, pp. 207–234.
Ротавирусная инфекция — признаки и симптомы, причины появления, диагностика и рекомендации для профилактики
Возбудителем ротавирусной инфекции являются болезнетворные вирусы, которые поражают слизистую оболочку ЖКТ. Под воздействием раздражителя желудочно-кишечный тракт воспаляется, что вызывает резкое ухудшение самочувствия. Опасность ротавируса заключается в скорости развития. Если вовремя не оказать медицинскую помощь, пациента ожидает сильное обезвоживание. Также возрастает риск развития осложнений остальных жизненно важных органов и систем.
Инфекция поражает людей независимо от пола и возраста. Однако основную группу риска составляют маленькие дети. Согласно статистике, практически каждый ребенок до 5 лет переносит болезнь. У взрослых проявляется реже, преимущественно у людей пенсионного возраста. Доля обратившихся за медицинской помощью составляет 2-5%.
У взрослых проявляется реже, преимущественно у людей пенсионного возраста. Доля обратившихся за медицинской помощью составляет 2-5%.
Если рассматривать сложность протекания болезни, ротавирус у детей протекает в более острой форме. Сопровождается рвотой и поносом. Эти признаки указывают на присутствие кишечной инфекции.
Симптомы ротавирусной инфекции
В отличие от иных типов заболеваний, ротавирусная инфекция развивается циклично. Инкубационный период продолжается до 5 дней. В случае обострения срок увеличивается до 7 дней. Спустя 3 дня пациент полностью выздоравливает. В запущенном случае реабилитация продолжается в течение пяти суток.
Определить болезнь можно по следующим признакам:
- Резкое ощущение симптомов отравления параллельно с кишечным расстройством.
- Тошнота и рвота. Обильное выделение масс наблюдается в первые сутки с момента заражения.
- Диарея. Сопровождается острой болью в животе (затрагивается верхний и средний участки).
 Пенящийся жидкий стул характерного желто-зеленого цвета.
Пенящийся жидкий стул характерного желто-зеленого цвета. - Дискомфорт в животе. Бульканье, урчание.
- Симптомы интоксикации. Озноб (вплоть до лихорадки), слабость, постоянная головная боль.
- Раздражение и отек слизистой рта. Параллельно появляется насморк и покраснение.
- Повышение температуры. Верхний предел может доходить до 39°.
Из-за обильной рвоты и поноса (даже натощак) организм подвергается сильному обезвоживанию. Проявляется в спутанности сознания (возможны обмороки) и судорогах.
Важно! Сильная дегидратация представляет серьезную угрозу для жизни.
Степени ротавирусной инфекции
Ротавирусная инфекция, или болезнь «грязных рук», возникает спонтанно. Вирус проникает в организм человека через продукты питания, бытовые предметы. Легко распространяется между контактирующими людьми, поэтому нахождение зараженного в коллективе гарантирует распространение ротавируса на всех членов в течение трех дней. В большинстве случаев перенос болезни проходит в первые годы жизни. Инфекция попадает с грудным молоком или сухой смесью.
В большинстве случаев перенос болезни проходит в первые годы жизни. Инфекция попадает с грудным молоком или сухой смесью.
По тяжести протекания болезнь классифицируется на несколько групп.
- Легкая. Симптомы отсутствуют, либо незаметны. Сопровождаются повышением температуры до 38°, которая сохраняется 1-3 дня. Рвота возникает до 5 раз в сутки, сохраняется до 2 дней. Частота диареи до 5 раз/сутки, длится до 3 дней. При оказании медицинской помощи улучшения наступают на второй день.
- Средняя. Также наблюдается высокая температура на период 5 дней. Рвота может достигать 12 раз, диарея – 15. Продолжительность приступов – 3-5 дней. Обезвоживание. Возможны осложнения.
- Тяжелая. Температура поднимается до 39,5°, и не снижается 5 суток. Тошнота и жидкий стул преследуют больше 5 дней. Кратность приступов превышает отметку в 15 раз. Человек испытывает сильную дегидратацию. Усугубляется развитием осложнений.
Независимо от сложности протекания болезни, необходимо вызвать врача.
Патогенез ротавирусной инфекции
Механизм распространения инфекции – орально-фекальный. Передается посредством грязных рук через бытовые предметы и продукты питания. За счет любознательности маленькие дети в бессознательном возрасте чаще становятся объектом заражения. Игрушки, необработанные продукты (особенно молоко и лактозные смеси для кормления), посторонние предметы, которые «тянутся в рот» становятся причиной распространения вирусов. Болезнь протекает стремительно, поэтому моментально отреагировать на изменения в организме сложно.
Кроме этого, основную опасность представляет заболевший человек. Больной бессознательно несет угрозу окружению. Особенно в массовых местах. Это может быть детский сад, игровая площадка, учебные заведения, рабочий коллектив. Если вовремя не изолировать пациента, либо не оградить от прямого контакта с другими людьми, возможна передача ротавирусной инфекции на каждого участника.
Для информации! В большинстве случаев болезнь протекает без патологических осложнений. Однако, есть риск «подхватить» тяжелую форму.
Однако, есть риск «подхватить» тяжелую форму.
Классификация и стадии развития ротавирусной инфекции
Ротавирус разделяется на 3 группы, которые определяются тяжестью заболевания. Это легкая, средняя и тяжелая. Каждый тип характеризуется частотой рвотных позывов и приступов диареи. Чем чаще периодичность, тем сложнее форма.
Клинически подразделяется на атипичную и типичную. Во втором случае наблюдаются стандартные симптомы расстройства желудка и кишечника. Первый действует избирательно. Пациента поражает один из симптомов – диарея или рвота, которые длятся не более двух дней. Лихорадка отсутствует. Однако большинство зараженных пациентов узнают о заражении после сдачи анализов.
Несмотря на отсутствие симптомов, человек также несет угрозу здоровью окружающих. Ощущая себя совершенно здоровым, может стать причиной заражения людям, с которыми непосредственно контактирует.
Обратить внимание! Если у ближайшего окружения появились признаки этого заболевания, рекомендовано держаться от человека на расстоянии, избегать контакта с вещами больного.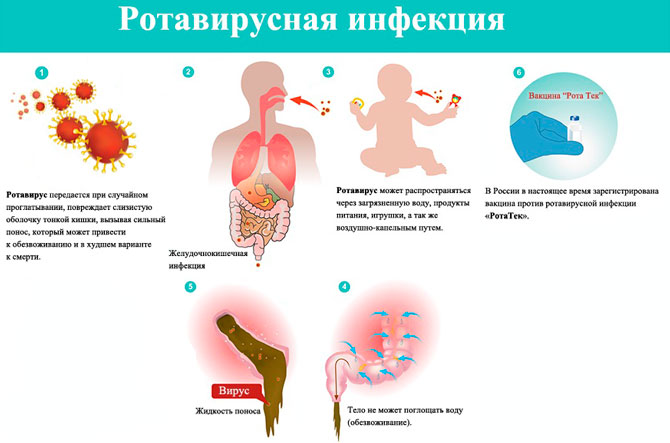
Осложнения ротавирусной инфекции
Одно из самых серьезных последствий ротавирусной инфекции – сильное обезвоживание. Потеря жидкости сопровождается симптомами:
- раздражительность, чувство тревоги;
- жажда;
- сухость слизистых оболочек, кожного покрова.
У младенцев до года частично западает большой родничок. Дети до пяти 5 лет становятся вялыми, снижается активность и восприимчивость, кожа теряет эластичность. Могут отказываться от воды. Походы в туалет становятся реже. Моча ребенка темная, с резким запахом. Объем ниже обычного.
В этом случае необходимо обратиться к врачу. Если не отреагировать на ситуацию, возможно развитие серьезных патологий и необратимых последствий.
В редких случаях встречаются сопутствующие осложнения:
- добавляется бактериальная инфекция;
- развивается почечная недостаточность:
- поражается ЦНС. Пациент теряет ясность сознания, появляются судороги.

Появление нехарактерных признаков сигнализирует о необходимости прохождения медицинского обследования.
Диагностика ротавирусной инфекции
Ротавирус можно обнаружить в кале, поэтому анализ в первую очередь передается на исследование. Если нет времени ждать результата, можно воспользоваться экспресс-тестом. Иммунохроматографический тест на ротавирус Cito Rota Pharmasco N1 выдает информацию буквально в течение 10 минут. Ротавирусная инфекция проявляется не менее 94% в период до 4 суток болезни. Далее, до 8 дней, обнаруживается в 75% случаев.
При обращении в больницу пациент подвергается комплексному обследованию. Помимо анализа кала, проводится забор крови (биохимический и клинический). Это необходимо для проверки состава, уровня ферментов. Присутствие аланинаминотрансферазы указывает на развитие гепатита.
На основании полученных данных врач исключает или подтверждает поражение других внутренних органов, и назначает курс реабилитации.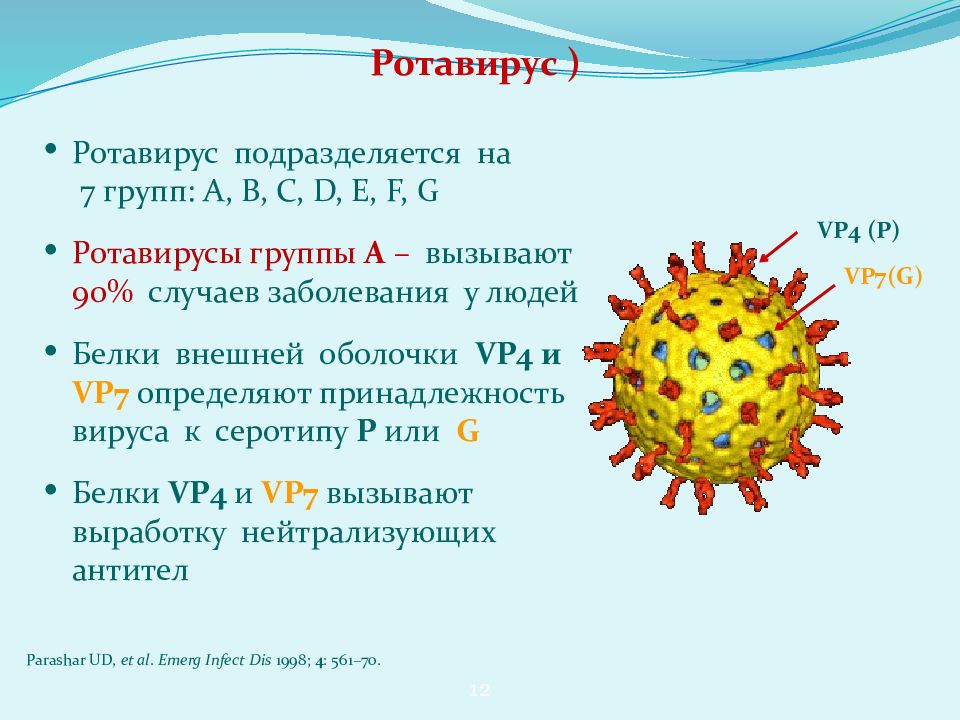 Строгое соблюдение рекомендаций гарантирует эффективное выздоровление.
Строгое соблюдение рекомендаций гарантирует эффективное выздоровление.
Лечение ротавирусной инфекции
Основная задача лечения – восполнение потерянного запаса жидкости в организме. Кроме этого, назначается строгая диета.
Борьба с инфекцией в домашних условиях подразумевает обильное питье и определенный рацион. Для повышения эффективности реабилитации питьевая вода заменяется специальным восстанавливающим раствором, который продается в аптеке. Можно чередовать воду с раствором. Из иных напитков разрешается чай, компот из сухофруктов, раствор глюкозы (5%).
При серьезных потерях жидкости пациента госпитализируют. Для устранения последствий тяжелой формы ротавирусной инфекции требуется внутривенное введение препаратов. Параллельно может назначаться дополнительная терапия для восстановления работы пораженных внутренних органов.
Наряду с питьем, больному назначается диета. Пациент переводится на дробное питание (порядка 5 раз в сутки мелкими порциями). Приготовление продуктов допустимо на пару. Исключаются фрукты, молочные продукты и бобовые. Эта категория является сильным раздражителем кишечника.
Приготовление продуктов допустимо на пару. Исключаются фрукты, молочные продукты и бобовые. Эта категория является сильным раздражителем кишечника.
Для информации! Маленьким детям список разрешенных продуктов назначает педиатр.
Постепенно человек переводится на полноценное питание.
Прогноз. Профилактика
Если симптомы обезвоживания отсутствуют, пациент получает благоприятный прогноз на выздоровление. Подразумевается исключение осложнений. Полное выздоровление наблюдается в течение 5-12 дней.
Ротавирусная инфекция крайне заразна и устойчива к неблагоприятным внешним условиям. Чтобы снизить риск заражения, рекомендовано придерживаться простых правил:
- Соблюдать правила гигиены. Мыть руки после каждого прихода с улицы, похода в туалет и перед едой.
- При контакте с больным человеком проводить дополнительную обработку рук антисептиками.
- Своевременная смена комплекта постельного белья.
- Не пить воду из-под крана.
 Использовать кипяченую или бутилированную жидкость.
Использовать кипяченую или бутилированную жидкость. - Тщательно мыть овощи, фрукты, зелень.
Профилактические меры проводятся при возникновении угрозы заражения, либо при обнаружении заразившегося человека.
Среди нетипичных способов защиты от инфекции выделена вакцинация. Рекомендуется проводить детям в возрасте старше шести недель. Процедура проводится в три этапа.
Важно! На момент третьей инъекции новорожденному должно быть не более 32 недель.
Эта процедура позволяет защитить ребенка от ротавирусной инфекции с возможными осложнениями.
Список используемой литературы
- Учайкин В. Ф. Острые кишечные инфекции у детей (диагностика, классификация, лечение) /В. Ф. Учайкин, Л. Н. Мазанкова // Пособие для врачей. – М., 2003. – 34 с.
- Клинические рекомендации (протокол лечения) оказания медицинской помощи детям больным ротавирусной инфекцией / под ред. Ю. В. Лобзина. – СПб.: НИИДИ, 2013. – 48 с.
- Союз педиатров России.
 Вакцинопрофилактика ротавирусной инфекции у детей. Клинические рекомендации. – 2017. – 24 с.
Вакцинопрофилактика ротавирусной инфекции у детей. Клинические рекомендации. – 2017. – 24 с. - Бирко Н., Горелов А. Ротавирусная инфекция: современный взгляд на проблему // Медицинский вестник. – 2014. – № 14-15. – С. 10-11.
- Таточенко В. К., Озерецковский Н. А. Иммунопрофилактика – 2018: справочник. – 13-е издание, расширенное. – М. Боргес, 2018. – С. 139-146.
- Бехтерева М. К., Раздьяконова И. В., Семенова С. Г., Иванова В. В. Регидратационная терапия – основа лечения острых кишечных инфекций у детей // Медицинский Совет. – 2017. – № 4. – С. 11-15.
- Маянский Н. А., Маянский А. Н., Куличенко Т. В. Ротавирусная инфекция: эпидемиология, патология, вакцинопрофилактика. Вестник РАМН, 2015, 1: 47-55.
- Луцкий А. А., Жирков А. А., Лобзин Д. Ю., Рао М., Алексеева Л. А., Мейрер М. и др. Интерферон-γ: биологическая функция и значение для диагностики клеточного иммунного ответа. Журнал инфектологии, 2015, 7(4): 10-22.
- Павлова Е.
 Б. Эффективная стратегия лечения ОРВИ: противовоспалительное действие нового противовирусного препарата. Internal Medicine. Clinical SleepMedicine (Доктор.Ру), 2014, 9(97): 20-24.
Б. Эффективная стратегия лечения ОРВИ: противовоспалительное действие нового противовирусного препарата. Internal Medicine. Clinical SleepMedicine (Доктор.Ру), 2014, 9(97): 20-24.
Ротавирусная инфекция – это… Что такое Ротавирусная инфекция?
Ротавирусная инфекция (РИ, «кишечный грипп») — инфекционное заболевание, вызванное ротавирусами[1]. Для этого заболевания свойственно острое начало, умеренно выраженные симптомы гастроэнтерита или энтерита, частое сочетание кишечного и респираторного синдромов в начальном периоде болезни.
Ротавирусы
Ротавирусы (лат. Rotavirus) — род вирусов из семейства Reoviridae, сходных по морфологии и антигенной структуре. Как и другие представители этого семейства, ротавирусы обладают двунитевой фрагментированной РНК. В геноме вируса 11 фрагментов, которые окружены чётко выраженной трёхслойной белковой оболочкой (капсидом) с икосаэдрической симметрией. Внешний вид частиц напоминает «колесо с широкой ступицей, короткими спицами и четко очерченным ободком»[2], из-за чего они и получили своё название (лат.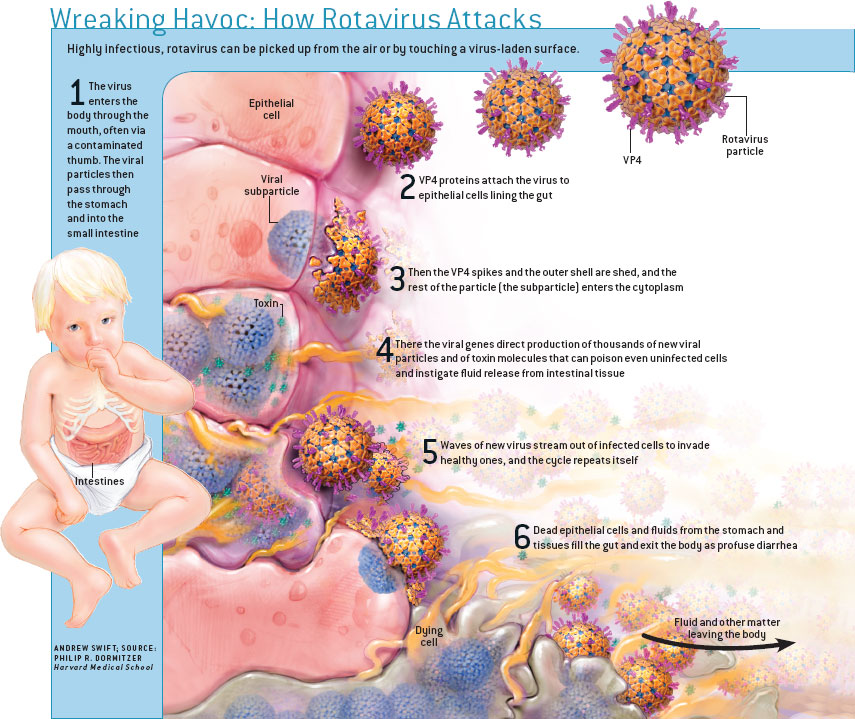 rota — «колесо»). Диаметр вирусных частиц от 65 до 75 нм.
rota — «колесо»). Диаметр вирусных частиц от 65 до 75 нм.
Распространение
Основной механизм передачи ротавирусов — алиментарный, с участием различных путей и множественных факторов передачи.
Заразиться ротавирусной инфекцией можно самыми разными путями. Вирионы ротавирусов хорошо сохраняются при низких температурах. У детей в возрасте от 1 года и старше может появиться из-за посещения яслей, детских садов и школ. Можно отнести эту инфекцию и к «болезням грязных рук».
К пятилетнему возрасту практически все дети в мире переносят ротавирусную инфекцию. С каждым заражением вырабатывается иммунитет к данному типу вируса, и последующие заражения этим типом протекают легче.[3]
Заболевание встречается как спорадически, так и в виде эпидемических вспышек. Характер заболеваемости носит чётко выраженный сезонный характер. В России до 93 %[4] случаев заболевания происходит в холодный период года (с ноября по апрель включительно).
Развитие болезни
Вирус проникает в слизистую оболочку желудочно-кишечного тракта.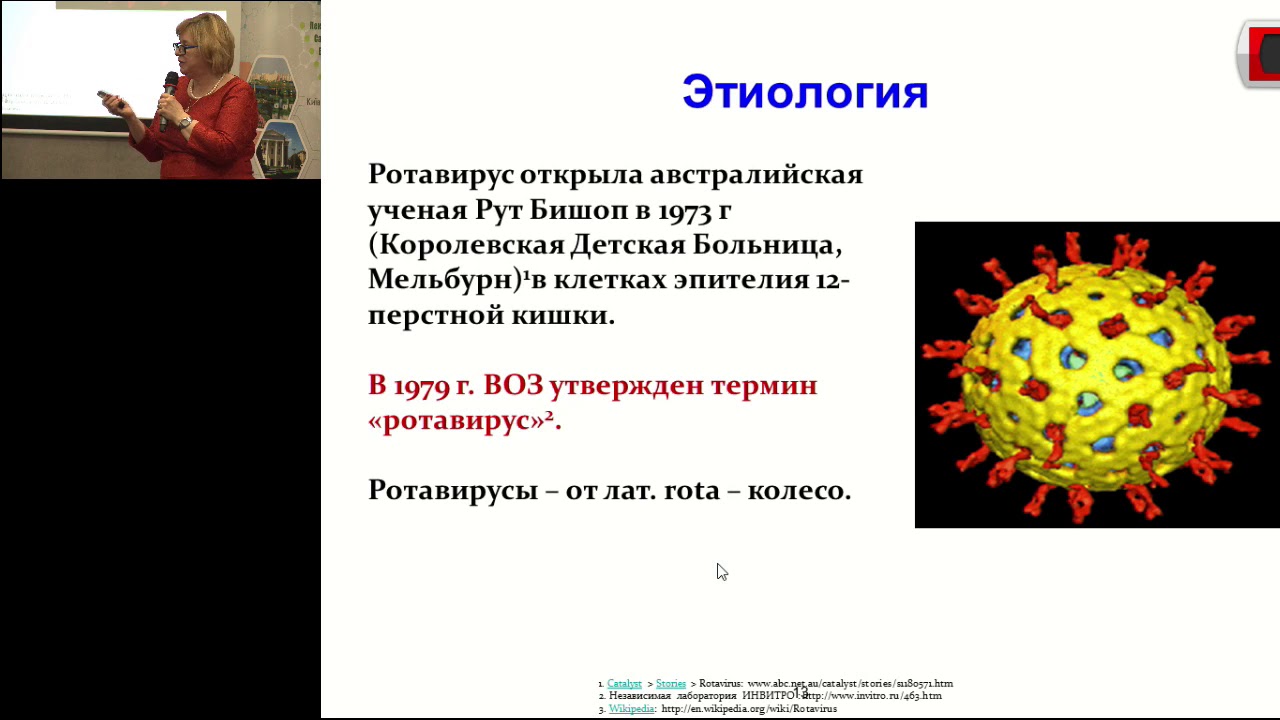 В основном поражается слизистая тонкой кишки.
В основном поражается слизистая тонкой кишки.
Патологическая анатомия
Размножаются в эпителиоцитах двенадцатиперстной кишки, вызывая их гибель. Заболевание протекает с рвотой, болями в животе и диареей в течение 1-2 суток. Частота стула 10-15 раз в сутки.
Клиническая картина
Общий характер болезни носит циклический характер. В одном цикле выделяется инкубационный период (1-5 суток), острый период (3-7 суток, при тяжёлом течении болезни — более 7 суток) и период реконвалесценции — от лат. reconvalescentia — выздоровление (4-5 суток).
Для ротавирусной инфекции характерно острое начало — рвота, резкое повышение температуры, и диарея, зачастую и очень характерный стул — на второй, третий день серо-жёлтый и глинообразный. Кроме того, у большинства заболевших появляются насморк, покраснения в горле, они испытывают боли при глотании. В острый период отсутствует аппетит, наблюдается состояние упадка сил. Многолетние наблюдения показали, что наиболее крупные вспышки заболевания возникают во время или в канун эпидемии гриппа, за что оно получило неофициальное название — «кишечный грипп».
Кал и моча очень сходны по признакам с симптомами гепатита (светлый кал, темная моча, иногда с хлопьями крови).
Болезнь считается детской, потому что организмы взрослых людей более защищены от ротавирусов. У взрослого человека выше кислотность желудочного сока и выше количество вырабатываемого секреторного IgA.
У взрослого РИ может проявляться небольшим кишечным расстройством, поэтому инфицированный человек может не догадываться о том, что он болен. Часто заболевание протекает и вовсе бессимптомно. Обычно если в семье или в коллективе есть инфицированный, то в течение 3-5 суток поочередно начинают заболевать и остальные. Предотвратить заражение от носителя инфекции возможно в случае активной иммунной системы.
Наиболее частым клиническим течением заболевания являются энтерит и гастроэнтерит, вторичная лактазная недостаточность.
Лечение
Основной целью лечения является борьба с результатами воздействия инфекции на организм: дегидратацией, токсикозом и связанными с ними нарушениями сердечно-сосудистой и мочевыделительной систем.
В первую очередь при лечении применяется регидратационная терапия, может назначаться прием сорбентов (активированный уголь, смектит диоктаэдрический, аттапулгит). Эффективных противовирусных препаратов для борьбы с активной ротавирусной инфекцией не существует.
В процессе лечения — строгая диета: каши на воде, яблочный компот. Исключить молочные продукты до полного выздоровления.
В качестве эффективного средства против ротавирусной инфекции ВОЗ рекомендует проведение профилактической вакцинации.
По мнению Американской гастроэнтерологической ассоциации при лечении диареи, вызванной ротавирусной инфекцией, особенно у маленьких детей и младенцев, могут быть полезны такие пробиотики, как Lactobacillus rhamnosus и Lactobacillus casei.[5]
Профилактика
Для специфической профилактики ротавирусной инфекции на настоящий момент существует две вакцины, прошедшие клинические испытания. Обе принимаются орально и содержат ослабленный живой вирус.
Неспецифическая профилактика заключается в соблюдении санитарно-гигиенических норм (мытьё рук, использование для питья только кипячёной воды), очистке и хлорировании водопроводной воды.
Прогноз
Ежегодно регистрируется до 25 млн случаев заболевания, из них 600—900 тысяч (то есть 2,4-3,6 %) — с летальным исходом[4], особенно это касается людей с ослабленным здоровьем[6].
После выздоровления перенесенная болезнь не влечет никаких долговременных последствий. После первого заболевания (как правило, в детском возрасте) в организме появляется относительный иммунитет. У взрослых с низким уровнем антител симптомы заболевания могут повториться.[1]
Примечания
- ↑ 1 2 Bishop RF (1996). «Natural history of human rotavirus infection». Arch. Virol. Suppl. 12: 119–28. PMID 9015109.
- ↑ Грачева Н. М., Аваков А. А., Блохина Т. А., Щербаков И. Т. Клинические аспекты ротавирусной инфекции // Лечащий врач. — 1998. — № 3. — ISSN 1560-5175.
- ↑ Velázquez FR, Matson DO, Calva JJ, Guerrero L, Morrow AL, Carter-Campbell S, Glass RI, Estes MK, Pickering LK, Ruiz-Palacios GM (1996). «Rotavirus infections in infants as protection against subsequent infections». N. Engl. J. Med. 335 (14): 1022–8. DOI:10.1056/NEJM199610033351404. PMID 8793926.
- ↑ 1 2 Ферьева Е. Е. Ротавирусная инфекция // Consilium Provisorum. — 2007. — Т. 5. — № 1.
- ↑ The American Gastroenterological Association. Probiotics: What They Are and What They Can Do for You (англ.). Перевод на русский: Пробиотики. Что это такое и что они могут дать?
- ↑ Тихонов, Виктор Детей-инвалидов убил ротавирус. Газета.ру (1 марта 2010). Архивировано из первоисточника 1 июня 2012. Проверено 19 июля 2011.
См. также
Ссылки
Ротавирусная инфекция – симптомы, лечение, причины болезни, первые признаки
Описание
Ротавирусная инфекция отличается поражением желудочно-кишечного тракта с развитием характерных проявлений гастроэнтерита, включающими в себя диспепсические явления и болевой синдром, а также симптомы обезвоживания и повышение температуры тела.
Причины заболевания
Причина ротавирусной инфекции — вирусы из семейства реовирусов, рода ротавирусов. Данные вирусы особенно устойчивы во внешней среде, могут длительный промежуток времени сохраняться в кале больных людей. В течение нескольких месяцев сохраняют свою жизнеспособность при нахождении в воде, в том числе в водоемах и сточных водах, что делает инфекцию чрезвычайно заразной и склонной к возникновению эпидемических вспышек.
Вирусы устойчивы к воздействию дезинфицирующих средств, но быстро погибают при кипячении и воздействии сильными кислотами или щелочами.
Факторы риска развития ротавирусной инфекции
К факторам, повышающим вероятность возникновения данной кишечной инфекции, относят:
- Ротавирусная инфекция у новорожденных и детей в возрасте от 5 до 40 месяцев возникает наиболее часто, что, в первую очередь, связано с неспособностью собственной иммунной системы эффективно справляться с вирусными частицами.
- Посещение дошкольных образовательных учреждений значительно повышает риск возникновения ротавирусной инфекции в связи с частыми инфекционными заболеваниями в окружении.
- Работающие в детских учреждениях имеют повышенную частоту контактов с потенциально больными детьми, и поэтому сами склоны к заболеванию.
- Весенне-зимнее время года соответствует максимальной частоте заболеваемости ротавирусной инфекцией.
Пути заражения
Многих людей волнует вопрос, заразна или нет ротавирусная инфекция? Ответ однозначный — заразна. Основной механизм передачи ротавирусов — фекально-оральные. Заражение возможно от больного человека в любую из стадий заболевания, или от вирусоносителей, которые не имеют каких-либо симптомов данной патологии.
Как правило, заражение происходит следующими путями:
- Нарушение правил личной гигиены и попадание ротавирусов в организм посредством грязных рук или предметов обихода, с которыми контактировал больной или вирусоноситель;
- Употребление контаминированной (зараженной) воды;
- Через продукты питания, особенно часто через молоко и молочные продукты.
Помимо этого имеются данные о том, что ротавирусная инфекция передается и воздушно-капельным путем.
Классификация заболевания
Согласно данным МКБ, ротавирусная инфекция классифицируется на две больших группы: типичные формы и атипичные, проявляющиеся или стертым течением, или с минимальными симптомами.
Степени тяжести ротавирусной инфекции основываются на характеристиках основных жалоб, а именно стадии развивающегося обезвоживания, и разделяются на три подтипа: легкую степень тяжести, среднетяжелую и тяжелую.
Осложнения заболевания
Осложнения ротавирусной инфекции — состояния, способные привести к смерти больного.
- Обезвоживание организма, развивающееся наиболее быстро при тяжелой степени течения заболевания. Развитие данного осложнения связано с тремя факторами: рвотой, диареей и значительным повышением температуры тела.
- Присоединение бактериальной инфекции. Второе по частоте последствие ротавирусной инфекции связано со значительным снижением иммунитета при попадании вируса в организм.
Прогноз при ротавирусной инфекции благоприятный при своевременном оказании интенсивной и рациональной медицинской помощи.
Информация носит справочный характер и не является руководством к действию. Не занимайтесь самолечением. При первых симптомах заболевания обратитесь к врачу.Структура и классификация ротавирусов
Острый инфекционный гастроэнтерит представляет собой главную причину детской смертности в развивающихся регионах мира и детской заболеваемости в развитых странах. Состояние может быть вызвано множеством различных микроорганизмов, но вирусы все чаще признаются в качестве основных причинных факторов. Среди них ротавирус является ведущей причиной острого гастроэнтерита у младенцев и детей раннего возраста во всем мире.
Название «ротавирус» происходит от характерного для вируса вида колеса при наблюдении с помощью электронной микроскопии, которое происходит от латинского слова «rota», означающего «колесо».Этот патоген был первоначально обнаружен у крупного рогатого скота, мышей и обезьян, страдающих диареей, и, наконец, у младенцев и маленьких детей в 1973 году Бишопом и Флюеттом.
Просвечивающая электронная микрофотография интактных частиц ротавируса с двойной оболочкой. Отчетливый ободок из расходящихся капсомеров.
Структура вируса
Геном ротавируса содержит 11 сегментов двухцепочечной РНК с 18 555 парами оснований. Каждый из этих сегментов представляет собой ген, пронумерованный от 1 до 11 в порядке уменьшения размера.Каждый сегмент генома кодирует один белок, необходимый для жизненного цикла вируса, за исключением сегмента 11 генома, который кодирует два белка.
Такая сегментированная природа генома ротавируса является благодатной почвой для высокой частоты генетической реассортации во время смешанных инфекций – особенности, которая способна генерировать новые, возможно, более опасные штаммы вирусов. Тем не менее, степень реассортации генов, происходящая в природе, полностью не известна, поскольку к настоящему времени секвенировано лишь несколько геномов ротавирусов.
Генетический материал находится внутри сложного 70-нанометрового вирусного нуклеокапсида с тремя концентрическими оболочками: внутренним ядром, внутренним капсидом и внешним капсидом. Шестьдесят шипов длиной от 10 до 12 нм выступают из внешнего капсида.
Вирусные белки VP1, VP2, VP3, VP4, VP6 и VP7 являются структурными белками, которые образуют вирион. Неструктурные белки (продуцируемые клеткой, инфицированной ротавирусом) – это NSP1, NSP2, NSP3, NSP4, NSP5 и NSP6. По крайней мере, шесть из двенадцати вышеупомянутых белков связывают РНК с функциями, важными для репликации ротавируса.
Классификация
Ротавирусы являются частью рода Rotavirus , который является одним из 15 родов семейства Reoviridae , разделенных на подсемейства Sedoreovirinae (с родами Rotavirus, Orbivirus, Phytoreovirus, Cardoreovirus, Mimornavirus) и Seadoreovirus. и Spinareovirinae (с родами Coltivirus, Orthoreovirus, Aquareovirus, Oryzavirus, Dinovernavirus, Cypovirus, Fijivirus, Mycoreovirus и Idnoreovirus).
Согласно Международному комитету по таксономии вирусов (ICTV), ротавирус можно разделить на 7 отдельных групп (от A до G), а также на 4 специфические подгруппы внутри группы A. Группы A – C можно найти у обоих людей. и животные, тогда как ротавирусы групп D – G ограничены исключительно животными.
Поскольку группа A является наиболее важной для инфицирования и заболевания человека, она была дополнительно классифицирована с использованием различных подходов. Два белка внешнего капсида, VP4 (протеазно-расщепленный белок или P-белок) и VP7 (гликопротеин или G-белок) являются детерминантами классификации вирусных серотипов, известных как P-серотипы и G-серотипы.
Кроме того, эта группа также классифицируется в соответствии с паттерном миграции сегментов генома РНК во время электрофореза в полиакриламидном геле, паттернами полногеномной гибридизации РНК (геногруппами), а также анализами нуклеотидных последовательностей или генотипами. В 2008 году для штаммов этой группы была разработана система полной классификации генома на основе нуклеотидных последовательностей.
Дополнительная литература
ротавирусов – обзор | Темы ScienceDirect
Серологическая классификация
Разнообразие ротавирусов, их способность обмениваться сегментами генома, кодирующими антигенные детерминанты, и изменение диагностических технологий привели к развитию систем серологии и классификации.Штаммы ротавирусов серологически классифицируются на серологические группы, подгруппы, серотипы G и серотипы P, а генетически – на электроферотипы, геногруппы, генотипы G и генотипы P. Чтобы организовать растущий объем данных о последовательностях полногеномных ротавирусов, в 2008 году Рабочая группа по классификации ротавирусов (RCWG) разработала основанную на нуклеотидных последовательностях систему полной классификации генома для ротавирусов группы А. 107
Самым широким серологическим обозначением является серогруппа.Семь серогрупп от A до G определяются перекрестным распознаванием частиц сывороточными антителами, полученными от парентерально гипериммунизированных животных. 108 Детерминанты серогрупп преимущественно расположены на VP2 и VP6 (белки внутреннего и среднего слоя). Генетического обмена между представителями разных серогрупп не наблюдалось. Серогруппы A, B и C вызывают заболевания у людей и других животных; группы от D до G были описаны только у нечеловеческих животных. Серогруппа A является наиболее важной с клинической точки зрения, поскольку вирусы группы A вызывают эндемический гастроэнтерит у детей; группы B и C были связаны с эпидемиями гастроэнтерита, поражающими людей всех возрастов.Группа B включает штамм ADRV (ротавирус диареи взрослых), который был связан с крупными вспышками тяжелой диареи у взрослых в Китае. 109 Вирусы группы C были связаны с менее тяжелым гастроэнтеритом как у детей, так и у взрослых. 110,111 Серогруппа A подразделяется на подгруппы I, II, I + II и не-I, не-II на основе распознавания моноклональными антителами антигенных детерминант на VP6. 112
В группе А серотипы ротавирусов определяются на основе реципрокной перекрестной нейтрализации антителом.Первоначально серотипы ротавирусов были обозначены единой системой, которая в первую очередь отражала нейтрализующие антитела, направленные против VP7. Эта система не полностью объясняет схемы перекрестной нейтрализации, поскольку VP4 также содержит детерминанты нейтрализации. 113,114 Ротавирусы группы А теперь классифицируются на серотипы с биномиальной номенклатурой, в которой нейтрализация антителами против VP7 определяет серотип «G» (для гликопротеинового антигена), а нейтрализация антителами против VP4 определяет серотип «P» (для чувствительного к протеазе антигена). ).Еще больше усложняя серологию, VP7 и VP4 являются мишенями как для гомотипических антител, которые нейтрализуют только в пределах серотипа, так и для гетеротипических антител, которые нейтрализуют несколько серотипов. 114,115 Серотип-специфические эпитопы VP4 преимущественно обнаруживаются на вариабельном домене гемагглютинации VP8 * на концах шипов, а гетеротипические эпитопы преимущественно обнаруживаются в более консервативном домене β-бочки, в теле и ножке шипов. (см. рис. 152-2B, слева ). 10,12,29 Иммунодоминантные серотип-специфические и гетеротипические нейтрализующие эпитопы VP7 охватывают кальцийсодержащий интерфейс между субъединицами каждого тримера VP7, а дополнительные нейтрализующие эпитопы обнаруживаются на границе междоменов внутри каждой субъединицы VP7. 26
Ранние попытки генетической классификации сгруппировали ротавирусы в соответствии с электроферотипом генома РНК, при этом штаммы группы А были разделены на «длинные», «короткие» и «сверхкороткие» на основе электрофоретической подвижности сегментов 10 и 11 генома.Анализ полного генома ротавируса показывает, что существует две основные геногруппы ротавирусов человека, каждая из которых содержит вирусы с общим геномным сходством. 116 Геногруппа Wa-подобных ротавирусов человека, по-видимому, имеет общее происхождение с ротавирусами свиней, а геногруппа DS-1, похоже, имеет общее происхождение с ротавирусами крупного рогатого скота. 116 В генетической классификации RCWG каждому из 11 сегментов генома присвоен отдельный генотип. Gx, P [x], Ix, Rx, Cx, Mx, Ax, Nx, Tx, Ex и Hx обозначают гены, которые кодируют VP7, VP4, VP6, VP1, VP2, VP3, NSP1, NSP2, NSP3, NSP4, и NSP5 / 6 соответственно. 107 RCWG предложила соглашение об именах штаммов, в котором штаммы называются «серогруппа RV / вид происхождения / страна идентификации / общее название / год идентификации / G- и P-тип». 117
Поскольку последовательность сегмента генома, кодирующего VP7, точно предсказывает серотип G, генотипирование обеспечивает практический суррогат для определения серотипа G. По состоянию на апрель 2014 г. в сетевой базе данных, поддерживаемой RCWG (http://rotac.regatools.be/), было указано 27 типов G.Из них пять (G1-4 и G9) составляют 88% изолятов ротавируса человека с 1996 по 2007 год. 118 На сегодняшний день не менее 14 серотипов P (с серотипами 1, 2 и 5, каждый из которых разделен на подтипы с буквенными обозначениями). , такие как P1A) были идентифицированы. 107,118 Иммунологические реагенты для определения серотипа P ограничены, а серотипирование P осложняется перекрестной реактивностью между серотипами P. Поэтому для классификации чаще используется генотипирование P. По состоянию на апрель 2014 г. в базе данных RCWG было 37 генотипов P (от P [1] до P [37]).В отличие от серотипов G, которые имеют однозначное соответствие с генотипами G, некоторые серотипы P включают более одного генотипа P. В описании штамма генотип заключен в скобки после обозначения серотипа. Таким образом, G2P1B [4] относится к вирусу G серотипа 2, P серотипа 1B и P генотипа 4. Два генотипа P, P [4] и P [8], вызывают большинство ротавирусных заболеваний человека. Действительно, несмотря на разнообразие комбинаций генотипов ротавирусов, всего пять пар, G1P [8], G2P [4], G3P [8], G4P [8] и G9P [8], содержат примерно 75% изолятов ротавирусов человека с 1996 г. к 2007 г. 117
Существуют значительные географические и временные различия в распределении деформации. Например, штаммы ротавирусов G8 распространены в странах с высокой смертностью от ротавирусов в Африке и, следовательно, имеют большее клиническое значение, чем можно было бы предположить по их глобальной распространенности. 117 Две новые комбинации генотипов, G9P [8] и G9P [6], распространились по всему миру с середины 1990-х годов. 117
Перераспределение между штаммами ротавирусов человека и животных, дрейф антигенов и случайное введение ротавирусов животных в пул вирусов, циркулирующих среди людей, обеспечивают постоянное внедрение генетического разнообразия, что требует постоянного наблюдения, чтобы определить, потребуется ли штамм для ротавирусных вакцин изменения в будущем для продолжения эффективности. 116 Появляются доказательства увеличения распространенности вирусов G2P [4] в регионах с высоким охватом моновалентной ротавирусной вакциной G1P [8], что позволяет предположить, что иммунизация может начать изменять распределение генотипов циркулирующих штаммов. 119
Клиническая информация о ротавирусах | CDC
Клинические характеристики
Ротавирусная болезнь характеризуется рвотой и водянистым поносом в течение трех-восьми дней. Также часто наблюдаются лихорадка и боли в животе. Дополнительные симптомы включают потерю аппетита и обезвоживание.
Симптомы обезвоживания включают
- уменьшение мочеиспускания
- сухость во рту и горле
- головокружение при вставании
- плачет почти без слез и
- необычная сонливость или суетливость.
Инкубационный период ротавирусной болезни составляет примерно два дня.
У детей может развиться ротавирусная болезнь более одного раза, потому что ни вакцина, ни естественная инфекция не обеспечивают полного иммунитета от будущих инфекций.Первое заражение ребенка ротавирусом обычно вызывает самые тяжелые симптомы.
Вирус
Ротавирус имеет характерный вид колеса при просмотре в электронный микроскоп. Смотрите фотографии. Название ротавирус происходит от латинского слова rota, что означает «колесо». Ротавирусы не имеют оболочки, имеют трехслойный капсид и сегментированный геном РНК. Вирус устойчив в окружающей среде.
Эпидемиологические особенности
Первичный путь передачи – фекально-оральный путь, обычно при прямом контакте между людьми.Поскольку вирус устойчив в окружающей среде, передача также может происходить при проглатывании зараженной воды или пищи и при контакте с загрязненными поверхностями или предметами. В Соединенных Штатах и других странах с умеренным климатом болезнь имеет сезонный характер зимой и весной, с ежегодными эпидемиями, происходящими с января по июнь. Самые высокие показатели заболеваемости наблюдаются среди младенцев и детей в возрасте 5 лет и младше. Взрослые могут заразиться ротавирусом, хотя болезнь обычно протекает легче.
Диагностика
Проведение ПЦР-анализов на обнаружение нуклеиновых кислот (только для ротавируса или в панелях с множеством патогенов) или иммуноанализа на антиген в образцах кала для быстрого обнаружения ротавирусной РНК или антигенов и постановки диагноза.Вы можете дополнительно охарактеризовать штаммы путем секвенирования нуклеиновых кислот, но такие тесты обычно проводятся только лабораториями, занимающимися контрольным тестированием или исследованиями.
Лечение
У людей со здоровой иммунной системой ротавирусная болезнь купируется самостоятельно и длится всего несколько дней. Лечение неспецифическое и состоит в основном из пероральной регидратационной терапии для предотвращения обезвоживания.
Вакцинация
Две ротавирусные вакцины, одобренные для использования у младенцев в США, безопасны и эффективны.В течение первого года жизни младенца ротавирусная вакцина обеспечивает от 85% до 98% защиты от тяжелого ротавирусного заболевания и от госпитализации из-за ротавирусного заболевания и от 74% до 87% защиты от ротавирусного заболевания любой степени тяжести.
CDC рекомендует плановую вакцинацию младенцев одной из двух доступных вакцин:
- RotaTeq®, лицензированный в 2006 г., вводится в трех дозах в возрасте 2, 4 и 6 месяцев
- Rotarix®, лицензированный в 2008 г., вводится двумя дозами в возрасте 2 и 4 месяцев
Вакцины различаются по способу изготовления и количеству доз, но обе вакцины вводятся перорально.
Для доп. Информации:
Начало страницы
Классификация ротавирусов серотипов VP4 и VP7
Ротавирусы, члены семейства Reoviridae, являются основными этиологическими агентами острого небактериального гастроэнтерита у молодняка у самых разных видов млекопитающих и птиц, включая человека. Необходимость эффективной иммунопрофилактики против ротавирусного гастроэнтерита стимулировала интерес к биохимическим, молекулярным, генетическим и клиническим аспектам этих агентов с целью разработки безопасных и эффективных вакцин.Поскольку нейтрализующие антитела, по-видимому, играют важную роль в защите от многих вирусных заболеваний, ротавирусные антигены, которые индуцируют нейтрализующие антитела, сыграли центральную роль в исследованиях и разработке ротавирусной вакцины. Было показано, что гликопротеин VP7 и спайковый белок VP4, которые составляют внешний капсид полной частицы ротавируса, являются независимыми антигенами нейтрализации. Поскольку типовая специфичность белков внешнего капсида ротавируса, по-видимому, играет важную роль в защите от болезней в экспериментальных моделях животных, продолжаются усилия по классификации и типированию специфичностей нейтрализации капсидных белков VP7 или VP4.На основании критерия> 20-кратного различия между титрами гомологичных и гетерологичных реципрокных нейтрализующих антител были установлены четырнадцать серотипов VP7 (G). В настоящее время проводятся исследования для характеристики и классификации серотипов VP4 (P) среди штаммов, которые проявляют четырнадцать различных серотипов G. Попытки классифицировать серотипы VP4 на основе того же критерия (т. Е.> 20-кратного различия антител), который применяется для классификации серотипов VP7, продолжаются. Этот стандарт> 20-кратных различий антител может быть применен к гипериммунной сыворотке, полученной реассортантом, обладающим геном, кодирующим VP4 (и неродственным геном, кодирующим VP7).Генотипы могут служить основанием для классификации, но серотип штамма должен основываться на нейтрализации.
границ | Молекулярная эпидемиология и клинические особенности ротавирусной инфекции среди педиатрических пациентов в Восточной Яве, Индонезия, в течение 2015–2018 годов: динамические изменения генотипов ротавирусов от конского G3 к типичному человеческому G1 / G3
Введение
Острый гастроэнтерит – частая и важная причина детской заболеваемости и смертности в развивающихся странах (Elliott, 2007).Диарея, наиболее частый симптом острого гастроэнтерита, остается третьей ведущей причиной общей заболеваемости и ведущей причиной младенческой смертности в Индонезии, а 38–67% детей с диареей, госпитализированных в больницы Индонезии, были инфицированы ротавирусом группы А (RVA). ) (Соенарто и др., 1981; Судармо и др., 2015; Нирвати и др., 2016). RVA, известная как «зимняя диарея», проявляет отчетливую сезонность в регионах с умеренным климатом, тогда как влияние сезона на инфекцию RVA не является экстремальным в тропиках (Levy et al., 2009).
RVA принадлежит к семейству Reoviridae и представляет собой вирус без оболочки, состоящий из 11 сегментов двухцепочечной РНК и кодирующий шесть структурных и шесть неструктурных белков (NSP). RVA подразделяется на 35 G и 50 P типов на основе VP7 (гликопротеин) и VP4 (протеазочувствительный) протеин (Rojas et al., 2017) соответственно. Генотипы RVA G1P [8], G2P [4], G3P [8], G4P [8], G9P [8] и G12P [8] обычно встречаются во всем мире (Santos and Hoshino, 2005; Dóró et al., 2014). Эти генотипы также часто выявлялись в Индонезии в 2010–2015 гг. (Sudarmo et al., 2015; Mulyani et al., 2018). Есть также три группы генотипов RVA человека, называемые Wa-подобными (G1-P [8] -I1-R1-C1-M1-A1-N1-T1-E1-h2), DS-1-подобными (G2-P [4] – I2- R2-C2-M2-A2-N2-T2-E2-h3) и менее распространенные AU-1-подобные (G3-P [9] – I3- R3-C3-M3-A3-N3 -T3-E3-h4) (Matthijnssens et al., 2008). G1, G3, G4, G9 и G12 обычно группируются в созвездие, подобное Wa, а G2 и G8 сгруппированы в созвездие, подобное DS-1.Недавно мы сообщили о штаммах G3P [8] / P [6], подобных лошадям, с позвоночником, подобным DS-1 (G3-P [8] / [6] – I2- R2-C2-M2-A2-N2- T2-E2-h3), возникший в результате редкой перегруппировки людей и лошадей, циркулирующий среди педиатрических стационарных пациентов с острым гастроэнтеритом в частной больнице в пригороде Сурабая, Индонезия (Utsumi et al., 2018). Было установлено, что все протестированные образцы принадлежат к коневодческому генотипу G3, который первоначально был выделен в Австралии и Японии, а затем появился во всем мире (Malasao et al., 2015; Arana et al., 2016; Cowley et al., 2016; Доро и др., 2016; Guerra et al., 2016; Комото и др., 2018; Пич и Либерт, 2018). В отчете из Австралии указано, что конский G3P [8] чаще встречается в районах, где использовался Rotarix ® (Roczo-Farkas et al., 2016), а другое исследование показало, что конский G3P [ 8] был ответственен за большинство эпизодов тяжелого гастроэнтерита (Cowley et al., 2016).
Два вида вакцин против РВА (Rotarix ® и RotaTeq ® ) были лицензированы в 2006 году, и 84 страны внедрили Rotarix ® или RotaTeq ® в свои национальные программы иммунизации (Abou-Nader et al., 2018). Введение вакцин против RVA в человеческое население может оказывать избирательное давление на циркулирующие штаммы RVA, особенно в поствакцинальную эру (Matthijnssens et al., 2010), хотя существующие вакцины против RVA очень эффективны. Исследования поствакцинального надзора в странах, где широко использовалась вакцина Rotarix ® , показали значительное снижение распространенности RVA и пропорциональный сдвиг генотипа со штаммов G1P [8] на G2P [4] (Dóró et al., 2014; Мухопадхья и др., 2017). Индонезия еще не включила вакцину против RVA в свою национальную программу иммунизации, хотя вакцины от RVA коммерчески доступны с 2011 года. Об охвате и воздействии вакцин против RVA в Индонезии известно немного.
Целью настоящего исследования была оценка изменения распространенности и генотипов RVA и тяжести острого гастроэнтерита, связанного с RVA, среди детей, госпитализированных в специализированную больницу в Восточной Яве, Индонезия.
Материалы и методы
Исследуемые популяции и образцы стула
Всего было собрано 432 образца стула у педиатрических пациентов, которые были госпитализированы в государственную больницу с клиническим диагнозом острого гастроэнтерита в период с сентября 2015 года по март 2018 года.Эта больница является специализированной больницей на Восточной Яве, расположенной в Сурабае, втором по величине городе Индонезии. Возраст исследуемой популяции варьировался от 1 месяца до 15 лет и 11 месяцев (средний возраст 12,5 месяцев). Пациенты были разделены на 7 возрастных групп: <6, 6–11, 12–23, 24–35, 36–47, 48–59 и ≥60 месяцев. Критерий острого гастроэнтерита определялся как возникновение водянистого или жидкого стула ≥3 раз в день и продолжительностью менее 14 дней. Чтобы оценить сдвиг генотипов RVA с 2013 на 2018 год в Восточной Яве, случайным образом были включены 4 RVA-положительных образца стула, собранные в 2013 году и 3 в 2014 году у педиатрических пациентов с острым гастроэнтеритом в той же больнице.Ни один из пациентов в этой когорте не был иммунизирован вакциной против RVA. Регистрировались демографические данные (возраст, пол) и клинические особенности (тип стула, рвота, диарея, лихорадка, обезвоживание). Степень обезвоживания определялась с использованием критериев ВОЗ (Всемирная организация здравоохранения [ВОЗ], 2014). Данные о сезонных осадках в регионе Сурабая были получены из программы ClimatView, организованной Японским метеорологическим агентством, поскольку осадки рассматривались как индикатор сезонности в тропических районах.Письменное информированное согласие было получено от родителей или опекунов всех детей. Протокол исследования был рассмотрен и одобрен комитетами по этике государственной больницы (№ 188) и Университета Эйрланга (№ 2054) в Индонезии, а также Университета Кобе (№ 1857) в Японии.
Обнаружение ротавирусов методом иммунохроматографии
Все образцы стула подвергали скринингу на антиген RVA с использованием набора Dipstick «Eiken» Rota (Eiken Chemical, Co., Tokyo, Japan).
Экстракция РНК и генотипирование ОТ-ПЦР
Вирусную РНК экстрагировали из 140 мкл супернатанта с помощью мини-набора QIAamp Viral RNA (Qiagen, Hilden, Германия).Положительные образцы, определенные как положительные с помощью иммунохроматографического теста, подвергали генотипированию в генах VP7 (G-типирование) и VP4 (P-типирование) с помощью мультиплексной ПЦР с обратной транскрипцией (RT-PCR) с недавно разработанными праймерами для лошадиноподобного G3 в Ген VP7 (Fujii et al., 2019b), а также с праймерами для VP4, которые были разработаны и использованы в нашей лаборатории (таблица 1). Конский G3 в VP7 был типирован с праймером G3e-757F (Таблица 1).
Таблица 1. Набор праймеров для генотипирования VP7.
Секвенирование нуклеотидов и филогенетический анализ
Двадцать три (4 отобраны в 2013 г., 3 отобраны в 2014 г. и 16 отобраны в 2015–2018 гг.) RVA-положительных образца, обнаруженных с помощью ОТ-ПЦР, содержали достаточное количество РНК для дальнейшей характеристики полногенома и были проанализированы с помощью секвенирования следующего поколения (NGS ). Подготовка библиотеки кДНК и секвенирование Illumina MiSeq (Illumina, Сан-Диего, Калифорния, США) выполняли, как описано ранее (Doan et al., 2017). Полноразмерную нуклеотидную последовательность каждого сегмента генома RVA получали с использованием CLC Genomics Workbench v7.0.3 (CLC Bio, Орхус, Дания) с собранными контигами в качестве запрашиваемых последовательностей и 11 сегментами генома эталонной RVA в качестве целевых последовательностей. Генотипы 11 сегментов генома 23 индонезийских штаммов были определены с помощью веб-инструмента классификации RotaC v2.0. Последовательности генома были выровнены с эталонными последовательностями с использованием программного обеспечения CLUSTAL X (версия 1.83), а филогенетические деревья были построены методом объединения соседей. Чтобы подтвердить надежность анализа филогенетического дерева, повторная выборка и реконструкция бутстрапа были выполнены 1000 раз.Эти анализы были выполнены с использованием программного обеспечения молекулярно-эволюционного генетического анализа (MEGA4) (Tamura et al., 2007). Последовательности генов, описанные в настоящем исследовании, депонированы в базе данных GenBank под номерами доступа (LC434517 – LC434532, LC434537 – LC434541, LC430883 – LC430888, LC469324 – LC469341 и LC469398 – LC469603).
Статистический анализ
Статистический анализ проводился с помощью критерия хи-квадрат или точного критерия Фишера для категориальных переменных с использованием SPSS Statistics 17.0 (Advanced Analytics, Inc., Токио, Япония). Результаты считались статистически значимыми при P <0,05.
Результаты
Распространенность RVA
RVA было обнаружено в 137 образцах с помощью иммунохроматографического тестирования, и результаты были подтверждены с помощью ПЦР. Таким образом, 31,7% из 432 педиатрических пациентов с острой диареей были инфицированы RVA. Распространенность RVA-инфекции в 2015, 2016 и 2017 годах составила 31,6, 36,3 и 24,2% соответственно. Взаимосвязь между сезонным распределением инфекции RVA и количеством осадков показана на Рисунке 1.Инфекции RVA наблюдались в течение года и достигли пика в ноябре 2017 г., а затем в июне 2016 г. Примерно 88% (121 из 137) RVA-положительных образцов были получены от детей в возрасте до 2 лет. Инфекция RVA была наиболее распространена в возрастной группе от 6 до 11 месяцев ( P <0,05).
Рис. 1. Распределение конских штаммов ротавирусов G3P [8] / P [6] (черные столбцы) и глобальных штаммов ротавирусов G1 / G3P [8] / [6] (серые столбцы), собранных в Восточной Яве, Индонезия, между Сентябрь 2015 г. и март 2018 г.Количество ротавирус-положительных образцов выражается в процентах от общего количества ротавирус-положительных образцов за каждый месяц периода отбора образцов.
Распределение, переход генотипов G и P RVA и полных геномных констелляций штаммов RVA
Из 137 педиатрических пациентов с гастроэнтеритом, ассоциированным с RVA, генотип G был определен во всех случаях, а генотип P – в 130 случаях. Сто тридцать семь образцов были разделены на три генотипа G (типичный человеческий G1, G3 и конский G3), а 130 образцов были разделены на два генотипа P (P [6] и P [8]).Конские штаммы G3 были определены как доминирующий генотип (87,6%), за ними следуют G1 человека (9,5%) и G3 человека (2,9%). Среди идентифицированных здесь генотипов P, P [8] был доминантным генотипом (80,3%), за ним следовал P [6] (14,6%), а 7 штаммов (5,1%) не были типируемыми, поскольку продукты ПЦР не были амплифицированы ОТ-ПЦР с использованием набора праймеров для ПЦР 2 и для генотипирования VP4 (таблицы 1, 2). Наиболее распространенной комбинацией G-P был G3P, подобный лошадям [8], составляющий 80,0%, за которым следовал G3P, подобный лошадям [6] (12.4%), G1P [8] человека (8,8%), G3P [6] (1,5%), G3P [8] (1,5%) и G1P [6] (0,7%) (таблица 2). Комбинации G-P из 7 дополнительных образцов, использованных в качестве контроля в этом исследовании, были классифицированы на G3P [8], подобный лошадям (собранные в 2013 г.) и G1P человека [8] (собранные в 2013 и 2014 гг.). Большинство обнаруженных штаммов RVA были сгруппированы с конским G3 в течение 2015–2017 гг., Тогда как генотип G1 человека стал преобладающим в течение 2017–2018 гг. (Таблица 3). В этом исследовании конские штаммы G3 были обнаружены до мая 2017 года, но в июле 2017 года они были полностью заменены типичными человеческими генотипами G1 и G3 (Рисунок 1).
Таблица 2. Общее распределение генотипов штаммов РНК, выявленных у детей с диареей на Восточной Яве в 2015–2018 гг.
Таблица 3. Годовое распределение генотипов штаммов RVA, выявленных у детей с диареей на Восточной Яве в 2015–2016 годах.
Созвездие генотипов для 11 сегментов генома 23 репрезентативных штаммов с 2013 по 2018 год показано на рисунке 2. Типичный человеческий G1P [8] и лошадиный G3P [8] с DS-1-подобным остовом были представлены в 2013 и 2014 годах, затем эпидемический генотип был полностью заменен конским G3P [8] / [6] с DS-1-подобным остовом в течение 2015–2017 гг. (май).С июля 2017 года эпидемический генотип динамически изменился с конского G3P [8] / [6] на типичный человеческий G1 / G3P [8] / [6], независимо от группировки генотипов, подобных DS-1 или Wa.
Рисунок 2. Сравнение генотипов по периодам исследования. 23 индонезийских штамма RVA в этом исследовании были проанализированы по полногеномным последовательностям. Зеленый и красный указывают на Wa-подобные и DS-1-подобные генные сегменты соответственно. Генотип P [6] VP4 окрашен в желтый цвет, коричневый цвет используется для обозначения генного сегмента лошадиного происхождения, а синий используется для обозначения генного сегмента бычьего происхождения.
Нуклеотидные последовательности и филогенетический анализ конского G3 и других RVA человека
В гене VP7 репрезентативные штаммы были отнесены к линии G3, подобной лошадям, вместе со штаммами, ранее отмечавшимися как G3, подобными лошадям, в другом месте Восточной Явы (Utsumi et al., 2018) и в других странах, таких как Австралия, Таиланд , Испания, Япония и Бразилия (Malasao et al., 2015; Arana et al., 2016; Cowley et al., 2016; Doro et al., 2016; Guerra et al., 2016; Komoto et al., 2016) (рисунок 3). Два контрольных штамма, собранные в 2013 году, также были отнесены к коневодческой линии G3 (Рисунок 3). Остальные репрезентативные штаммы были классифицированы по генотипам G1 и G3 человека вместе со штаммами, собранными в 2013 и 2014 годах (рис. 3). Идентичность нуклеотидной последовательности гена VP7 между конскими штаммами G3 в этом исследовании была чрезвычайно высокой (99,0–100%) независимо от генотипа [P]. Кроме того, его идентичность между конскими штаммами G3 в этом исследовании и штаммами в других странах была высокой (98.7–99,6%), предполагая, что родство конского гена G3P [8] VP7 и конского гена G3P [6] VP7 было генетически близким. В гене VP4 репрезентативные штаммы в этом исследовании были разделены на генотипы P [8] и P [6] (рис. 4). В гене VP4 лошадиные штаммы G3 и человеческие G1 / G3 имели тенденцию иметь свою собственную группу в генотипе P [8] с высокой идентичностью нуклеотидов (≥99,1%), соответственно. Идентичность нуклеотидов между группой лошадиного типа G3 и группой G1 / G3 человека составляла 74,8–75,6%. Однако штаммы RVA показали высокую нуклеотидную идентичность (92.5–99,9%) в пределах генотипа P [6], независимо от того, типичный ли тип G3 у лошади или типичный человеческий тип G1 / G3. Генотипы, определенные филогенетическим анализом, соответствовали генотипам, определенным с помощью ОТ-ПЦР.
Рисунок 3. Филогенетический анализ гена RVA VP7 (генотип G). Дерево было построено с использованием метода объединения соседей. Значения начальной загрузки (> 70) отображаются в узлах ветвления. Названия штаммов RVA, обнаруженных в этом исследовании в 2015, 2016, 2017, 2018 и 2013–2014 годах, выделены синим, красным, коричневым, фиолетовым и зеленым цветом соответственно.
Рисунок 4. Филогенетический анализ нуклеотидных последовательностей VP4 (генотип P) RVA. Дерево было построено с использованием метода объединения соседей. Значения начальной загрузки (> 70) отображаются в узлах ветвления. Штаммы RVA, обнаруженные в этом исследовании, выделены жирным шрифтом.
Филогенетическое дерево, основанное на гене NSP4, показало, что восемь штаммов были классифицированы как штаммы, похожие на бычьи, а остальные 15 были классифицированы как штаммы человека (дополнительный рисунок S8), а один (STM387) не был амплифицирован.Эти коровоподобные штаммы были выявлены в 2012–2014 гг. В Австралии, в 2013 г. в Японии и в Индонезии (Malasao et al., 2015; Cowley et al., 2016; Utsumi et al., 2018). Репрезентативные штаммы RVA в генах VP6, VP1–3, NSP1 – NAP3 и NSP5 сформировали кластер с таковыми из лошадиноподобных DS-1-подобных штаммов из других стран (дополнительные рисунки S1 – S9).
Клинические данные и тяжесть инфекции RVA
Демографические и основные клинические характеристики, связанные с тяжестью заболевания, показаны в таблице 4.Типичные симптомы острого вирусного гастроэнтерита – диарея, рвота, лихорадка и обезвоживание. Распространенность рвоты, водянистого стула и некоторого обезвоживания была значительно выше у RVA-положительных детей, чем у RVA-отрицательных детей (Таблица 4). Увеличение частоты рвоты (≥5 за 24 часа) было тесно связано с RVA-положительными детьми (54,2%), хотя разница с RVA-отрицательными детьми не была статистически значимой (Таблица 4).
Таблица 4. Клинические особенности, наблюдаемые у детей с диареей, положительных на ротавирусную инфекцию.
Мы проанализировали демографические и клинические особенности среди детей, перенесших гастроэнтерит с конскими штаммами G3 или неконскими штаммами G3 (человеческие G1 и G3). Различия в демографических и клинических характеристиках (возраст, пол, продолжительность и частота диареи, рвоты и обезвоживания) не были статистически значимыми между пациентами с RVA-инфекцией, подобной G3, и пациентами с RVA-инфекцией, подобной G3 (данные не показаны).Большинство пациентов, инфицированных RVA, полностью выздоровели или выздоровели, независимо от конского G3 или типичного человеческого G1 / G3. Статистических различий в прогнозе младенцев и детей раннего возраста между лошадиной и типичной человеческой RVA не было, хотя количество выборок было слишком маленьким для сравнения.
Обсуждение
Ранее мы сообщали, что конский штамм G3P [8] / [6] DS-1-подобный RVA был преобладающим (100%) в частной больнице в пригороде Сурабая в 2015–2016 годах (Utsumi et al., 2018). Здесь мы продемонстрировали, что необычный генотип RVA (конский G3P [8] / [6]) также был преобладающим штаммом в этой исследуемой популяции в течение 2015–2018 годов, которые находились в стационаре в национальной специализированной больнице Восточной Явы, расположенной в Сурабае. со сниженной распространенностью (87,6%). Два штамма (D13 и D63), собранные в 2013 г. в том же месте на востоке Явы и включенные в это исследование в качестве контроля, были отнесены к коневодству G3. Наши результаты показывают, что конские штаммы G3, впервые появившиеся в Индонезии в 2013 году одновременно с первым обнаружением в Австралии и Японии, распространились в восточной части острова Ява в Индонезии.Филогенетический анализ гена VP7 показал, что лошадиные штаммы G3P [8] / P [6] очень гомологичны другим штаммам (99,9–97,3%) из Европы, Азии, Южной Америки и Австралии, о чем сообщили несколько исследовательских групп. как лошадиные штаммы RVA.
Лошадиный G3P [8] DS-1-подобный штамм был редким реассортантом у человека / лошади и сгруппирован со штаммами лошадиных G3 на большом генетическом расстоянии согласно филогенетическому анализу в гене VP7 и был назван лошадиноподобным G3P [8] (Коули и др., 2016). Генотип G3, похожий на лошадиный, был обнаружен в Австралии, Азии, Европе и Южной Америке с 2013 года, и он распространяется по всему миру, включая недавно зарегистрированные случаи из Германии (Pietsch and Liebert, 2018) и США (Perkins et al. ., 2017). Конские штаммы G3P [8] / [6] RVA в Индонезии были связаны с большим количеством случаев гастроэнтерита, а также с случаями в Австралии и Испании (Arana et al., 2016; Cowley et al., 2016). Появление во всем мире конских штаммов, подобных G3 DS-1, поставило вопрос о том, вызывают ли вакцины селективное давление на зоонозные штаммы (Luchs et al., 2019). Важно определить, может ли глобальное появление этих новых реассортантов повлиять на эффективность вакцины против RVA.
Типичные человеческие штаммы G1P [8] / [6] и G3P [8] / [6] (12,4%), но не лошадиные G3, были обнаружены с июля 2017 года в настоящем исследовании. Примечательно, что коневодческие штаммы выявлялись исключительно до мая 2017 г., но в июле 2017 г. они были полностью заменены типичной RVA человека (G1 или G3) (Рисунок 1 и Таблица 3). Не типичный Wa-подобный штамм, но необычный G1P [8] DS-1-подобный и конский G3P [8] DS-1-подобный штаммы совместно циркулировали в течение 2013–2014 годов, тогда как конский G3P [8] / [ 6] DS-1-подобные явно циркулировали в течение 2015–2017 гг., А штаммы G1 / G3P [8] / [6] Wa-like / DS-1-подобные были обнаружены в период с июля 2017 г. по март 2018 г. (рис. 2).Теперь генотипы переместились на типичные человеческие G1P [8] и G3P [8], которые ранее были распространены в Индонезии. Сдвиг генотипа от доминантного G1P [8] Wa-подобного к G2P [4] DS-1-подобному наблюдался в первые 2 года после введения Rotarix ® (Gurgel et al., 2007; Zeller et al., 2010 ; Кирквуд и др., 2011; Мухопадхья и др., 2017). Таким образом, возможно, что внедрение вакцины против RVA в 2011 г. в Индонезии привело к сдвигу генотипа в Индонезии. Однако нет убедительного объяснения этому динамическому переходу, который произошел всего за 2 месяца.Насколько нам известно, это первый отчет о динамических изменениях генотипов ротавирусов от конского G3 к типичному человеческому G1 / G3.
Отчет из Японии показал, что G1P [8] DS-1-подобный штамм был наиболее распространенным в 2012–2014 гг. При охвате вакцинацией 39% в 2012–2013 гг. (Fujii et al., 2019a). В других сообщениях из Словении показано, что наиболее распространенный генотип сместился с G1P [8] на G4P [8] и G2P [4] при охвате вакцинацией 27% в 2007–2013 гг. (Steyer et al., 2014). Наши результаты также предполагают, что вакцинация может повлиять на изменение вирусного штамма даже в стране с низким охватом вакцинацией, такой как Индонезия.Дальнейшие исследования могут дать нам представление о направлении глобальной эпидемии RVA в будущем.
Общая распространенность инфекции RVA в этом исследовании составила 31,7%, что ниже, чем ранее сообщенные данные (40%) в Восточной Яве в 2013 году (Sudarmo et al., 2015). В этой когорте подозревалась коинфекция бактериями, поскольку в 2013 году в этой государственной больнице было обнаружено, что примерно 70% педиатрических пациентов с ротавирусом были инфицированы бактериями (Sudarmo et al., 2015).Предыдущий отчет показал, что общая распространенность инфекции RVA на Яве (Центральная и Западная), Бали и Западной Нуса-Тенгара, Индонезия, составляла 48,7% (2010–2015 гг.), 53,7% (2010 г.), 53,3% (2011 г.), 45,1%. % (2012 г.), 41,7% (2013 г.), 38,7% (2014 г.) и 52,5% (2015 г.) (Mulyani et al., 2018). Эти результаты демонстрируют постепенное снижение общей заболеваемости RVA к 2014 году в этих регионах. Кроме того, распространенность инфекции RVA в этом исследовании (Восточная Ява) была аналогична таковой в Центральной Яве в 2006–2010 годах (Nirwati et al., 2016). Взятые вместе, наши результаты показывают, что вакцинация может повлиять на распространенность инфекции RVA даже в районе с низким охватом вакцинацией. Вакцинация против RVA не была включена в национальную программу иммунизации в Индонезии, хотя вакцины против RVA были коммерчески доступны с 2011 года (Mulyani et al., 2018). Ни один из пациентов в этом исследовании не был иммунизирован вакциной RVA. Охват вакцинами от RVA в Индонезии считается довольно низким, поскольку вакцины от RVA слишком дороги для обычных граждан (Sudarmo et al., 2015). По этой причине при оценке эффективности вакцины против RVA следует тщательно учитывать низкий охват вакцинацией.
Введение вакцинации против RVA может быть тесно связано с отбором штаммов генотипов RVA (Roczo-Farkas et al., 2016; Hoque et al., 2018). Кроме того, в Австралии конский штамм RVA был более распространен в районах, где применялась вакцина Rotarix ® (Roczo-Farkas et al., 2016). Новое исследование младенцев с вакцинами против RVA в частных учреждениях Сурабая показало, что примерно 70% младенцев были иммунизированы вакциной Rotarix ® (Gunawan et al., 2019). Эти результаты повышают вероятность того, что вакцина Rotarix ® связана с появлением штаммов, подобных лошадям, и что вакцины против RVA могут вызывать селективное давление, которое благоприятствует определенным генотипам (Roczo-Farkas et al., 2016). Генотип G2P [4], который вновь проявился после внедрения вакцины против RVA в определенных регионах (Roczo-Farkas et al., 2017; Khandoker et al., 2018), не был обнаружен в этот период исследования, но в 2013 году он был преобладающим генотипом. в том же месте на Восточной Яве (Sudarmo et al., 2015).
Младенцы и дети с гастроэнтеритом, связанным с RVA, чаще, чем у детей с не ротавирусным гастроэнтеритом, демонстрировали обезвоживание, рвоту и водянистую диарею, которые указывают на тяжесть инфекции RVA (Subekti et al., 2002; Mulyani et al., 2018 ). Уровень инфицирования среди детей младше 2 лет, особенно в возрасте от 6 до 11 месяцев, был значительно выше. Эти результаты хорошо согласуются с результатами предыдущих исследований (Subekti et al., 2002; Sowmyanarayanan et al., 2012; Гупта и др., 2018). Более низкая распространенность у детей старшего возраста может быть связана с приобретенным иммунитетом в результате предыдущих контактов (Velazquez, 2009).
В настоящем исследовании инфекция RVA выявлялась непрерывно в течение всего года без каких-либо сезонных пиков. Это согласуется с исследованием, проведенным в 2010–2015 годах в Индонезии (Mulyani et al., 2018), но несовместимым с исследованием в том же месте в 2001–2004 годах, показывающим пики в сухой сезон (с июня по август) (Wilopo et al. ., 2009). В других странах с умеренным климатом обычно бывают пики RV зимой (сухие и прохладные условия). Эти результаты показывают, что значительное внимание к местным климатическим условиям может помочь нам понять распространенность инфекции RVA (Levy et al., 2009).
Степень тяжести симптомов у пациентов с RVA с генотипом G3, подобным лошадям, аналогична таковой у пациентов с RVA с типичными G1 и G3 RVA человека в этом исследовании, что не согласуется с исследованиями, проведенными в Австралии и Японии, что указывает на то, что G3P [ 8] штамм был связан с большинством эпизодов тяжелого гастроэнтерита (Cowley et al., 2016; Комото и др., 2018). Поскольку количество глобальных штаммов в этом исследовании было ограниченным, необходимо накопить больше данных о степени тяжести в соответствии с каждым генотипом RVA. Кроме того, все педиатрические пациенты с острым гастроэнтеритом в этом исследовании были госпитализированы, что позволяет предположить, что их симптомы были более серьезными, чем у пациентов, не госпитализированных. Поскольку нам не удалось собрать образцы у детей, не госпитализированных, трудно сделать какие-либо выводы о степени тяжести острого гастроэнтерита, ассоциированного с RVA, у детей в зависимости от генотипа.Необходимы дальнейшие исследования, включающие как госпитализированные, так и не госпитализированные случаи ротавирусного гастроэнтерита.
Разнообразие штаммов происходит с течением времени вместе с временными и генетическими изменениями вирусов (Gupta et al., 2018). Накопление знаний об особенностях вирусных штаммов может дать представление о том, какое влияние внедрение ротавирусной вакцинации оказывает на эпидемиологию вируса и циркулирующие генотипы. Таким образом, постоянный мониторинг генотипов ротавирусов, особенно появления любых необычных штаммов ротавирусов, наряду с данными о распространенности и клинических характеристиках, будет иметь решающее значение для оценки бремени болезни и достижения успеха в будущих программах вакцинации в Индонезии.
Заключение
В этом исследовании наблюдали динамическое изменение генотипа ротавируса от конского G3 к типичному человеческому генотипу (G1 или G3). Поскольку тяжелые случаи инфекции RVA были распространены, особенно у детей в возрасте от 6 до 11 месяцев и, в более общем плане, детей младше 2 лет, вакцинация RVA должна быть включена в национальную программу иммунизации Индонезии. Также необходим тщательный мониторинг появления необычных штаммов RVA.
Заявление об этике
Письменное информированное согласие было получено от родителей или опекунов всех детей.Протокол исследования был рассмотрен и одобрен комитетами по этике государственной больницы и Университета Эйрланга в Индонезии, а также Университета Кобе в Японии.
Авторские взносы
AA были собраны данные пациента. SS, RR, AD и DR собрали образцы. ТУ был ответственным за написание рукописи. RW, ZD и LY провели все эксперименты. Итак, J и ML собрали образцы. CM, LD и TA оказали помощь в проведении исследования. YD, YF, HS, KK и IS оказали помощь в исследовании и анализе.И.С. руководил исследованием и помогал составить рукопись. Все авторы критически отредактировали рукопись, прочитали и одобрили представленную версию.
Финансирование
Это исследование было поддержано Японской инициативой глобальной исследовательской сети по инфекционным заболеваниям (J-GRID) Министерства образования, культуры, спорта, науки и технологий Японии, Японского агентства медицинских исследований и разработок (AMED: 18fm0108004h0004), Синриокукай .
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Благодарности
Мы искренне благодарим профессора Дато Шри Тахира, профессора Тахира, и Министерство исследований, технологий и высшего образования (RISTEKDIKTI) Индонезии за их совет провести это исследование в Индонезии.
Дополнительные материалы
Дополнительные материалы к этой статье можно найти в Интернете по адресу: https://www.frontiersin.org/articles/10.3389/fmicb.2019.00940/full#supplementary-material
Сноски
- www.data.jma.go.jp/gmd/cpd/monitor/climatview/frame.php
- http://rotac.regatools.be/
Список литературы
Абу-Надер, А. Дж., Зауэр, М. А., Стил, А. Д., Тейт, Дж. Э., Атерли, Д., Парашар, У. Д. и др. (2018). Внедрение и охват ротавирусной вакцины в мире: 2006–2016 гг. Hum. Вакцин. Immunother. 14, 2281–2296. DOI: 10.1080 / 21645515.2018.1470725
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Арана, А., Монтес, М., Джер, К. К., Алькорта, М., Итурриза-Гомара, М., и Силла, Г. (2016). Возникновение и распространение ротавирусов G3P [8], обладающих лошадиным VP7 и DS-1-подобной генетической основой, в Стране Басков (север Испании), 2015. Infect. Genet. Evol. 44, 137–144. DOI: 10.1016 / j.meegid.2016.06.048
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Коули Д., Донато К. М., Рочо-Фаркас С. и Кирквуд К. Д. (2016). Появление нового конского реассортантного штамма ротавируса G3P [8], который ассоциируется с гастроэнтеритом у детей Австралии. J. Gen. Virol. 97, 403–410. DOI: 10.1099 / jgv.0.000352
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Доан Ю. Х., Судзуки Ю., Фуджи Ю., Хага К., Фудзимото А., Такай-Тодака Р. и др. (2017). Сложные события перегруппировки необычных штаммов ротавируса G9P [4] в Индии в период с 2011 по 2013 год. Infect. Genet. Evol. 54, 417–428. DOI: 10.1016 / j.meegid.2017.07.025
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Доро, Р., Ласло, Б., Мартелла, В., Лешем, Э., Генч, Дж., Парашар, У. и др. (2014). Обзор глобальных данных о распространенности штаммов ротавируса за шесть лет после лицензирования вакцины: есть ли доказательства отбора штаммов в зависимости от давления вакцины? Заражение. Genet. Evol. 28, 446–461. DOI: 10.1016 / j.meegid.2014.08.017
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Доро Р., Мартон С., Бартокне А. Х., Лендьел Г., Агокс З., Якаб Ф. и др. (2016). Ротавирус G3, подобный лошадям, в Венгрии, 2015 г. – Является ли это новым пандемическим штаммом реассортантной межгеновой группы? Acta Microbiol.Иммунол. Повесили. 63, 243–255. DOI: 10.1556 / 030.63.2016.2.8
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Фудзи Ю., Доан Ю. Х., Судзуки Ю., Накагоми Т., Накагоми О. и Катаяма К. (2019a). Изучение полных последовательностей генома эпидемий и эволюции ротавируса А в Японии в 2012-2014 гг. Фронт. Microbiol. 10:38. DOI: 10.3389 / fmicb.2019.00038
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Fujii, Y., Doan, Y.Х., Вахюни, Р. М., Лусида, М. И., Утсуми, Т., Сёдзи, И. и др. (2019b). Совершенствование метода генотипирования ротавирусов с помощью полугнездовой мультиплексной ПЦР с новым набором праймеров. Фронт. Microbiol. 10: 647. DOI: 10.3389 / fmicb.2019.00647
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Герра, С. Ф., Соарес, Л. С., Лобо, П. С., Пенья, Е. Т., Соуза, Е. К., Безерра, Д. А., и др. (2016). Обнаружение нового конского ротавируса G3, связанного с острым гастроэнтеритом, в Бразилии. J. Gen. Virol. 97, 3131–3138. DOI: 10.1099 / jgv.0.000626
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гунаван, Э., Утсуми, Т., Вахюни, Р. М., Динана, З., Судармо, С. М., Сёдзи, И., и др. (2019). Поствакцинальные бессимптомные ротавирусные инфекции: профильное исследование детей в Сурабае, Индонезия. J. Infect. Общественное здравоохранение [Epub перед печатью].
PubMed Аннотация | Google Scholar
Гупта, С., Кришнан, А., Шарма, С., Кумар, П., Анеха, С., и Рэй, П. (2018). Изменение структуры распространенности, генетического разнообразия и смешанных инфекций вирусов, связанных с острым гастроэнтеритом, у педиатрических пациентов в Нью-Дели, Индия. J. Med. Virol. 90, 469–476. DOI: 10.1002 / jmv.24980
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гургель, Р. К., Куэвас, Л. Э., Виейра, С. К., Баррос, В. К., Фонтес, П. Б., Салустино, Э. Ф. и др. (2007). Преобладание ротавируса P [4] G2 в вакцинированной популяции, Бразилия. Emerg. Заразить. Дис. 13, 1571–1573. DOI: 10.3201 / eid1310.070412
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хоке, С.А., Кобаяши, М., Таканаши, С., Анвар, К.С., Ватанабе, Т., Хамрин, П. и др. (2018). Роль ротавирусной вакцинации в отношении нового штамма ротавируса G8P [8], вызывающего вспышку в центральной Японии. Вакцина 36, 43–49. DOI: 10.1016 / j.vaccine.2017
CrossRef Полный текст | Google Scholar
Хандокер, Н., Thongprachum, A., Takanashi, S., Okitsu, S., Nishimura, S., Kikuta, H., et al. (2018). Молекулярная эпидемиология ротавирусного гастроэнтерита в Японии в 2014-2015 гг .: характеристика вновь появляющегося G2P [4] после внедрения ротавирусной вакцины. J. Med. Virol. 90, 1040–1046. DOI: 10.1002 / jmv.25067
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кирквуд, К. Д., Бонифас, К., Барнс, Г. Л., и Бишоп, Р. Ф. (2011). Распространение генотипов ротавирусов после введения ротавирусных вакцин Rotarix ® и RotaTeq ® в национальную программу иммунизации Австралии. Pediatr. Заразить. Дис. 30, S48 – S53. DOI: 10.1097 / INF.0b013e3181fefd90
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Комото, С., Иде, Т., Негоро, М., Танака, Т., Асада, К., Умемото, М., и др. (2018). Характеристика необычных DS-1-подобных штаммов ротавируса G3P [8] у детей с диареей в Японии. J. Med. Virol. 90, 890–898. DOI: 10.1002 / jmv.25016
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Комото, С., Tacharoenmuang, R., Guntapong, R., Ide, T., Tsuji, T., Yoshikawa, T., et al. (2016). Перегруппировка сегментов генов ротавирусов человека и животных в новых DS-1-подобных штаммах ротавируса G1P [8]. PLoS One 11: e0148416. DOI: 10.1371 / journal.pone.0148416
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Леви К., Хаббард А. Э. и Айзенберг Дж. Н. (2009). Сезонность ротавирусной болезни в тропиках: систематический обзор и метаанализ. Внутр. Дж.Эпидемиол. 38, 1487–1496. DOI: 10.1093 / ije / dyn260
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лучс, А., да Коста, А.С., Чилли, А., Комнинакис, С.С.В., Кармона, Р.С.С., Боэн, Л. и др. (2019). Распространение появляющегося конского штамма ротавируса G3P [8] DS-1-подобного генетического каркаса в Бразилии и идентификация потенциальных генетических вариантов. J. Gen. Virol. 100, 7–25. DOI: 10.1099 / jgv.0.001171
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Маласао, Р., Сайто, М., Судзуки, А., Имагава, Т., Нукива-Сома, Н., Тохма, К. и др. (2015). Человеческий ротавирус G3P [4], полученный в Японии в 2013 году, возможно, возник в результате реассортации ротавирусов человека и лошадей. Гены вируса 50, 129–133. DOI: 10.1007 / s11262-014-1135-z
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Matthijnssens, J., Ciarlet, M., Heiman, E., Arijs, I., Delbeke, T., McDonald S.M., et al. (2008). Классификация ротавирусов на основе полного генома выявляет общее происхождение штаммов ротавирусов Wa-Like и свиней, а также штаммов DS-1-подобных и ротавирусов крупного рогатого скота. J. Virol. 82, 3204–3219. DOI: 10.1128 / JVI.02257-07
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Matthijnssens, J., Heylen, E., Zeller, M., Rahman, M., Lemey, P., and Van Ranst, M. (2010). Филодинамический анализ генотипов ротавирусов G9 и G12 подчеркивает их потенциал для быстрого глобального распространения. Mol. Биол. Evol. 27, 2431–2436. DOI: 10.1093 / molbev / msq137
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мухопадхья, И., Мердок, Х., Берри, С., Хант, А., Итурриза-Гомара, М., Смит-Палмер, А. и др. (2017). Изменение молекулярной эпидемиологии ротавирусной инфекции после введения моновалентной ротавирусной вакцинации в Шотландии. Вакцина 35, 156–163. DOI: 10.1016 / j.vaccine.2016.11.028
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Муляни, Н. С., Прасетьо, Д., Карьяна, И. П. Г., Сукарди, В., Дамаянти, В., Ангграини, Д., и др. (2018). Диарея среди госпитализированных детей в возрасте до пяти лет: призыв к включению ротавирусной вакцины в национальную программу иммунизации в Индонезии. Vaccine 36, 7826–7831. DOI: 10.1016 / j.vaccine.2018.05.031
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Нирвати, Х., Вибава, Т., Аман, А. Т., Вахаб, А., и Соенарто, Ю. (2016). Обнаружение штаммов ротавируса группы А, циркулирующих среди детей с острой диареей в Индонезии. Springerplus 5:97. DOI: 10.1186 / s40064-016-1724-5
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Perkins, C., Mijatovic-Rustempasic, S., Уорд М. Л., Кортезе М. М. и Боуэн М. Д. (2017). Геномная характеристика первого конского штамма ротавируса G3P [8], обнаруженного в США. Genome Announc. 5: e1341-17. DOI: 10.1128 / genomeA.01341-17
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Питч К., Либерт У. Г. (2018). Молекулярная характеристика различных конских штаммов ротавируса G3 из Германии. Заражение. Genet. Evol. 57, 46–50. DOI: 10.1016 / j.meegid.2017
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Рочо-Фаркас, С., Кирквуд, К. Д., Байнс, Дж. Э., Группа кишечных вирусов, Детский научно-исследовательский институт Мердока и Королевская детская больница (2017). Австралийская программа эпиднадзора за ротавирусами: годовой отчет, 2016 г. Commun. Дис. Intell. Q. Rep. 41, E455 – E471.
Google Scholar
Рочо-Фаркас, С., Кирквуд, К. Д., Байнс, Дж. Э., и Австралийская группа по надзору за ротавирусами (2016).Годовой отчет Австралийской программы эпиднадзора за ротавирусами, 2015 г. Дис. Intell. Q. Rep. 40, E527 – E538.
Google Scholar
Рохас, М. А., Гонсалвес, Дж. Л. С., Диас, Х. Г., Манчего, А. и Сантос, Н. (2017). Идентификация двух новых генотипов ротавируса A, G35 и P [50], из фекалий перуанских альпаков. Заражение. Genet. Evol. 55, 71–74. DOI: 10.1016 / j.meegid.2017.08.019
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сантос, Н.и Хосино Ю. (2005). Глобальное распространение серотипов / генотипов ротавируса и его значение для разработки и внедрения эффективной ротавирусной вакцины. Rev. Med. Virol. 15, 29–56. DOI: 10.1002 / RMV.448
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Соенарто, Ю., Себодо, Т., Ридхо, Р., Альрасджид, Х., Роде, Дж. Э., Багг, Х. С. и др. (1981). Острая диарея и ротавирусная инфекция у новорожденных и детей в Джокьякарте, Индонезия, с июня 1978 г. по июнь 1979 г. J. Clin. Microbiol. 14, 123–129.
PubMed Аннотация | Google Scholar
Sowmyanarayanan, T. V., Ramani, S., Sarkar, R., Arumugam, R., Warier, J. P., Moses, P. D., et al. (2012). Тяжесть ротавирусного гастроэнтерита у индийских детей, нуждающихся в госпитализации. Вакцина 30 (Приложение 1), A167 – A172. DOI: 10.1016 / j.vaccine.2011.07.145
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Штайер, А., Сагадин, М., Коленц, М., и Poljšak-Prijatelj, M. (2014). Молекулярная характеристика штаммов ротавирусов в период до и после вакцинации в стране с низким охватом вакцинацией: пример Словении. Заражение. Genet. Evol. 28, 413–425. DOI: 10.1016 / j.meegid.2014.06.021
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Subekti, D., Lesmana, M., Tjaniadi, P., Safari, N., Frazier, E., Simanjuntak, C., et al. (2002). Заболеваемость норволк-подобными вирусами, ротавирусом и аденовирусной инфекцией у пациентов с острым гастроэнтеритом в Джакарте, Индонезия. FEMS Immunol. Med. Microbiol. 33, 27–33. DOI: 10.1111 / j.1574-695X.2002.tb00568.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Судармо, С. М., Шигемура, К., Атия, А. Ф., Осава, К., Вардана, О. П., Дарма, А., и др. (2015). Генотипирование и клинические факторы детской диареи, вызванной ротавирусами: однолетнее наблюдение в Сурабае, Индонезия. Gut Pathog. 7: 3. DOI: 10.1186 / s13099-015-0048-2
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Тамура, К., Дадли, Дж., Ней, М., и Кумар, С. (2007). MEGA4: программа молекулярно-эволюционного генетического анализа (MEGA) версии 4.0. Mol. Биол. Evol. 24, 1596–1599. DOI: 10.1093 / molbev / msm092
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Утсуми Т., Вахюни Р. М., Доан Ю. Х., Динана З., Соэджянто С., Фуджи Ю. и др. (2018). Конские штаммы ротавируса G3 как преобладающие штаммы среди детей в Индонезии в 2015-2016 гг. Заражение. Genet. Evol. 61, 224–228.DOI: 10.1016 / j.meegid.2018.03.027
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Вилопо, С.А., Соенарто, Ю., Брези, Дж. С., Толиб, А., Амина, С., Кахьоно, А., и др. (2009). Эпиднадзор за ротавирусами для определения бремени болезней и эпидемиологии на Яве, Индонезия, с августа 2001 г. по апрель 2004 г. Вакцина 27 (Приложение 5), F61 – F66. DOI: 10.1016 / j.vaccine.2009.09.004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Всемирная организация здравоохранения [ВОЗ] (2014 г.). Курс дистанционного обучения Модуль 4: Диарея. Комплексное ведение детских болезней.
Зеллер М., Рахман М., Хейлен Э., Де Костер С., Де Вос С., Арийс И. и др. (2010). Заболеваемость ротавирусами и распределение генотипов до и после внедрения национальной ротавирусной вакцины в Бельгии. Vaccine 28, 7507–7513. DOI: 10.1016 / j.vaccine.2010.09.004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Классификация ротавирусов, структурный состав и свойства, репликация, способ передачи, патогенез, клинические симптомы, лабораторная диагностика, лечение, профилактика и контроль
Ротавирус- Семейство: Reoviridae
- Род: Rotavirus
- Классифицируется на семь отдельных групп (от A до G) на основе структурного антигена VP6.
- Ротавирусы групп A, B и C обнаруживаются при инфицировании человека, а также при заражении животных
- Ротавирусы группы А являются наиболее частыми патогенами человека
Рисунок: Структура ротавируса
- Характеристики “колесо” как внешний вид (Rota-означает колесо)
- Размер: Диаметр 65-100 нм
- Форма: Сферическая форма
- Симметрия: Икосаэдр
- Геном: 11 сегментов двухцепочечной РНК (дц РНК )
- Белок: 6 структурных белков (VP) и 6 неструктурных белков (NSP)
- Конверт: Отсутствует
- Нуклеиновая кислота окружена двумя слоями: внутренний капсид (VP6), и внешний капсид (VP7)
- VP4 – это спайковый белок, это рецептор клеточной поверхности. Рисунок: 11 сегментов генома ротавируса. .
- Репликация: Встречается в цитоплазме инфицированной клетки.
- Вирус рота содержит РНК-зависимую РНК-полимеразу и другие ферменты, способные продуцировать кэпированные РНК-транскрипты
- Вирусы рота не растут в культуре клеток
Ротавирусы инактивированы –
- Нагрев до 100 ° C
- Обработка кислотой (pH <3),
- Глутаральдегид (3%),
- Фенол,
- Формалин,
- Хлор
- Спирт (70%),
- Присоединение: VP4 к рецептору клеточной поверхности
- Проникновение: рецептор-опосредованный эндоцитоз
- Удаление оболочки в лизосоме
- Транскрипция опосредуется эндогенной вирус-зависимой РНК-полимеразой (транскриптазой)
- Трансляция с образованием вирусного структурного белка
- Синтез полной транскрипции
- Некоторые из полных расшифровок стенограммы инкапсидируются
- Синтез –ve смысловой цепи РНК с капсидом с образованием дц РНК
- Формирование внутреннего капсида
- Морфогенез: почкование вируса с одной оболочкой в RER с приобретением псевдооболочки
- Удаление псевдоконверта и замена внешнего капсида в RER
- Созревание
- Лизис и высвобождение клеток
Рисунок: Цикл репликации ротавируса
- Проглатывание зараженных продуктов питания и воды
- Непосредственно из пальцев, загрязненных фекалиями
- Иногда воздушно-капельным путем
- Чаще всего страдают дети младше 5 лет
- Взрослые инфицированы при контакте с педиатрическими больными
Инкубационный период: 2-3 дня
Патогенез:- Вирус рота реплицируется в энтероцитах около кончика ворсинок, разрушая энтероциты
- Кодируемый вирусами токсин: ранняя обильная секреторная диарея вызывается энтеротоксином NSP4.
- Нарушение эпителия кишечника из-за репликации вируса
- Гистологические изменения энтероцитов, запускающие кишечную нервную систему, кишечную секрецию и иммунный ответ
- Острая инфекция и диарея обычно проходят в течение 7 дней у иммунокомпетентных хозяев.
- Местная инфекция:
- Острый гастроэнтерит, тяжелая форма у младенцев в возрасте 6-24 месяцев.
- Инфицированные младенцы не могут переваривать молоко из-за лактазной недостаточности, вызванной разрушением энтероцитов
- Диарея, тошнота и рвота
- Нарушение всасывания Na +, воды и дисахаридов
- Симптомы обезвоживания: уменьшение мочеиспускания, сухость во рту и горле и чувство головокружения при вставании.
- Высокая температура
- Лимфоцитоз и преходящая нейтропения.
- Фебрильные судороги у маленьких детей
- Тяжелое обезвоживание, гипотония и шок
Лабораторная диагностика:
Образец: фекалий на ранней стадии заражения,
- Обнаружение вирусного антигена: твердофазная агглютинация, ELISA
- Электронная микроскопия
- EIA (иммуноферментный анализ): чувствителен к обнаружению вирусов в стуле
- Индикаторный стержень / экспресс-тест
- ПЦР: для генотипирования ротавируса
- Культура вируса: нет культуры клеток линии
- Пероральная регидратация
- Другая поддерживающая регидратационная терапия для контроля потери воды и электролитов
- Вакцина: две оральные ротавирусные вакцины в настоящее время лицензированы для использования у младенцев.
- RotaTeq® (RV5) вводится в 3 дозах в возрасте 2, 4 и 6 месяцев
- Rotarix® (RV1) вводится в 2 дозах в возрасте 2 и 4 месяцев
- Санитария
- Очистка сточных вод
- Медицинский работник должен мыть руки с мылом до и после контакта с пациентом.
Список литературы
- https://medlineplus.gov/rotavirusinfections.html
- www.immune.org.nz/diseases/rotavirus
- http://www.mayoclinic.org/diseases-conditions/rotavirus/symptoms-causes/dxc-20186931
- http://www.webmd.com/children/vaccines/tc/rotavirus-topic-overview#1
- https://en.wikipedia.org/wiki/Rotavirus
- http://www.medicinenet.com/rotavirus/article.htm
- https://www.cdc.gov/rotavirus/about/treatment.HTML
- https://researchspace.auckland.ac.nz/handle/2292/1286
- https://www.ncbi.nlm.nih.gov/pmc/articles/PMC372748/
- http://www.fbae.org/2009/FBAE/website/special-topics_general_issues_rotaviruses.html
Обзор ротавирусной инфекции – wikidoc
Главный редактор: C. Майкл Гибсон, M.S., M.D. [1] Заместитель главного редактора (ов): Ахмед Эльсай, MBBCH [2]
Обзор
Ротавирусная инфекция – наиболее частая причина тяжелой диареи у детей.Это одна из причин заболевания гастроэнтеритом. Вакцинация детей против ротавируса очень важна для предотвращения любого предстоящего заражения этим вирусом. Были приняты другие меры по профилактике ротавирусной инфекции. Эти меры включают: доступ к чистой безопасной питьевой воде, регулярное мытье рук, а также личную и пищевую гигиену. Инфекция может передаваться фекально-орально и происходит путем множественной вирусной репликации. Ротавирусные инфекции следует дифференцировать от других организмов, вызывающих водянистую диарею, таких как аденовирус, например.coli и taenia spp. Дети подвергаются высокому риску заражения ротавирусом, особенно дети, оставленные в детских учреждениях, и непривитые дети. У пациентов наблюдаются диарея, рвота и субфебрильная температура. Они могут казаться бледными и иметь признаки обезвоживания, такие как запавший глаз, и могут наблюдаться в тяжелых случаях. Профилактика обезвоживания и соблюдение мер по регидратации – это первая линия лечения ротавирусной инфекции.
Историческая перспектива
Открытие ротавируса восходит к прошлому веку после заражения нескольких детей гастроэнтеритом неизвестной причины.Исследования проводились в течение долгого времени с 1940 по 1973 год. В 1973 году д-р Рут Бишоп смогла идентифицировать возбудитель, вызывающий заболевание, как ротавирус.
Классификация
Нет известной классификации ротавирусной инфекции, но ее можно классифицировать по возрасту на ротавирусную инфекцию у взрослых и ротавирусную инфекцию у детей.
Патофизиология
Ротавирус передается фекально-оральным путем. Он передается от инфицированных детей другим людям до и после диареи.Он также может передаваться через инфицированные руки, пищу и такие предметы, как игрушки. Патогенез ротавируса происходит в кишечнике, где происходит репликация вируса и возникает тяжелая водянистая диарея. Белок ротавируса номер 4 играет важную роль в возникновении диареи и клинических проявлений ротавируса. Инфекция разрушает ряд пищеварительных ферментов кишечника, и происходит мальабсорбция, приводящая к диарее. Ротавирусная инфекция не ограничивается только кишечником. Это может повлиять на центральную нервную систему, вызывая менингит.
Причины
Ротавирусы – это род вирусов, принадлежащих к семейству Reoviridae. Было идентифицировано семь основных групп, три из которых (группы A, B и C) инфицируют людей, причем группа A является наиболее распространенной и широко распространенной. Они вызывают рвоту и диарею и являются наиболее частой причиной тяжелой диареи у детей, ежегодно убивая около 600 000 детей в развивающихся странах (по данным на 2005 г.).
Дифференциация ротавирусной инфекции от других болезней
Ротавирус необходимо дифференцировать от других болезней и патогенов, вызывающих водянистую диарею.В приведенной ниже таблице он отличается от других вирусов, которые могут вызывать диарею, таких как аденовирус, бактерий, таких как E. coli, и паразитов, таких как taenia spp.
Эпидемиология и демография
Ротавирусная инфекция – основная причина тяжелой диареи у младенцев и детей. Он поражает примерно 120 миллионов человек ежегодно, вызывая смерть 600 000-650 000 человек во всем мире. Чаще встречается зимой. Больше поражает детей, чем взрослых. Это чаще встречается в развивающихся странах.Нет расовых пристрастий.
Факторы риска
Дети подвержены высокому риску заражения ротавирусом, особенно дети, оставленные в детских учреждениях, и непривитые дети. Однако взрослые также могут подвергаться риску. Пациенты с ослабленным иммунитетом и взрослые, которые контактируют с инфицированными детьми, подвержены риску ротавирусной инфекции. [1] [2]
Естественная история, осложнения и прогноз
Ротавирусная инфекция – заболевание, которое проходит самостоятельно.Иногда это может приводить к обезвоживанию. Обезвоживание – одно из самых серьезных осложнений, которое может возникнуть после заражения. Судороги также являются осложнением ротавирусной инфекции. Прогноз заболевания хороший.
Диагностика
Анамнез и симптомы
Клинические проявления ротавируса обычно начинают развиваться через два дня после заражения. У детей он тяжелее, чем у взрослых. Степень ее тяжести зависит от того, первая ли это инфекция или повторная.Первая инфекция протекает тяжелее. Это может протекать бессимптомно или вызывать водянистую диарею, а в очень тяжелых случаях может вызвать сильное обезвоживание. У детей, инфицированных ротавирусом, наблюдается высокая температура и рвота. [3] [4]
Медицинский осмотр
Пациенты, инфицированные ротавирусной инфекцией, в тяжелых случаях могут казаться вялыми и бледными. У них также низкое кровяное давление и жар из-за инфекции. Признаки обезвоживания более заметны у младенцев, поскольку у них мог быть запавший глаз и вдавленный родничок.В тяжелых случаях также могут наблюдаться судороги.
Лабораторная диагностика
Диагностика ротавирусной инфекции возможна с помощью нескольких диагностических методов. Эти методы включают электронную микроскопию, полимеразную цепную реакцию с обратной транскриптазой и РНК-электрофорез. Исследование кала на вирусы важно для обнаружения извлеченных вирусов. Также для обнаружения антигена можно использовать ELISA и иммунохроматографические анализы.
Рентген
Рентгенологические данные, связанные с ротавирусной инфекцией, отсутствуют.
КТ
Нет данных компьютерной томографии, связанной с ротавирусной инфекцией. Однако его можно использовать для исключения других неврологических заболеваний, если ротавирус поражает нервную систему.
Эхокардиография или УЗИ
Нет данных УЗИ, связанных с ротавирусной инфекцией.
Другие результаты визуализации
Других результатов визуализации, связанных с ротавирусной инфекцией, нет.
Лечение
Лечебная терапия
Самым важным аспектом лечения вирусного гастроэнтерита у детей и взрослых является предотвращение обезвоживания.Это лечение следует начинать дома. Врач может дать конкретные инструкции о том, какие жидкости давать. CDC рекомендует семьям с младенцами и маленькими детьми всегда держать дома запас раствора для пероральной регидратации (ПРС) и использовать раствор, когда у ребенка впервые возникает диарея. Следует избегать приема лекарств, включая антибиотики (которые не действуют на вирусы) и других методов лечения, если это специально не рекомендовано врачом.
Хирургия
Хирургическое вмешательство не рекомендуется для лечения ротавирусной инфекции.
Профилактика
Профилактика ротавирусной инфекции полностью зависит от вакцинации детей от этой инфекции. В 2006 году было показано, что новые вакцины безопасны и эффективны.


 Пенящийся жидкий стул характерного желто-зеленого цвета.
Пенящийся жидкий стул характерного желто-зеленого цвета.
 Использовать кипяченую или бутилированную жидкость.
Использовать кипяченую или бутилированную жидкость. Вакцинопрофилактика ротавирусной инфекции у детей. Клинические рекомендации. – 2017. – 24 с.
Вакцинопрофилактика ротавирусной инфекции у детей. Клинические рекомендации. – 2017. – 24 с. Б. Эффективная стратегия лечения ОРВИ: противовоспалительное действие нового противовирусного препарата. Internal Medicine. Clinical SleepMedicine (Доктор.Ру), 2014, 9(97): 20-24.
Б. Эффективная стратегия лечения ОРВИ: противовоспалительное действие нового противовирусного препарата. Internal Medicine. Clinical SleepMedicine (Доктор.Ру), 2014, 9(97): 20-24.