Ротовирусная инфекция: ᐈ Ротавирус: симптомы, лечение ~【Киев】
Ротавирусная инфекция
Ротавирусная инфекция – антропонозное, высококонтагиозное, острое инфекционное заболевание, характеризующееся преимущественным поражением ЖКТ, общей интоксикацией, дегидратацией, нередко наличием респираторного (катарального) синдрома в начальном периоде болезни.
Ротавирусы (РВ) относительно стабильны в окружающей среде. По устойчивости к хлорсодержащим дезинфектантам, препаратам на основе перекиси водорода и другим средствам, выживаемости во внешней среде:
· не погибают при обычном хлорировании воды в головных водопроводных сооружениях;
· выживают в водопроводной воде до 60 дней;
· на различных объектах внешней среды – от 10 до 30 дней (в зависимости от температуры, влажности воздуха и наличия загрязнений органической природы), их не разрушает многократное замораживание;
· УФ-излучение в дозе 9 вт/м2 инактивирует РВ через 15 минут;
· в фекалиях РВ сохраняются от нескольких недель до 7 месяцев;
· на фруктах – от 5 до 30 дней;
· на тканях из хлопка и шерсти – от 12 до 45 дней;
· на различных поверхностях – до 10 дней, а с органическими загрязнениями – до 16 дней.
Основным резервуаром и источником РВ является человек.
Особенно опасны лица, переносящие стертые формы заболевания. Максимальная концентрация возбудителя в фекалиях наблюдается в первые 3 – 5 дней болезни.
Механизмы передачи возбудителя – контактно-бытовой, водный, пищевой. В настоящее время ведущая роль принадлежит контактно-бытовому пути передачи возбудителя.
Характерен сезонный подъем заболеваемости в холодный период года, с максимальными показателями в зимне-весенние месяцы (с ноября по май).
РВ поражают население разных возрастных групп, однако преимущественно болеют дети в возрасте до 3 лет и пожилые люди старше 60 лет. Наиболее тяжело протекает у детей первичное инфицирование. Повторные заболевания РВИ сопровождаются менее выраженными клиническими проявлениями или переносятся бессимптомно.
При появлении в доме больного ротавирусной инфекцией необходимо обратиться за медицинской помощью и обеспечить выполнение следующих мероприятий в очаге болезни:
1. Влажная уборка помещений горячим мыльно-содовым раствором, тщательное проветривание помещений, для больного выделяется отдельная посуда.
Влажная уборка помещений горячим мыльно-содовым раствором, тщательное проветривание помещений, для больного выделяется отдельная посуда.
2. Для детей 1-го года жизни главные меры профилактики – грудное вскармливание и тщательное соблюдение членами семьи правил личной гигиены, так как эта инфекция причисляется к «болезням грязных рук».
3. Соблюдение правил личной гигиены после посещения туалета (мытье рук с мылом, и т.д.).
4. Стерилизация посуды для детей до полутора лет.
5. Ежедневное мытье игрушек горячим мыльно-содовым раствором.
6. Обработка сосок.
7. Водопроводную воду для питья, особенно детям, кипятить.
8. Грудных детей купать в прокипяченной воде, разбавлять горячую воду до необходимой температуры также охлажденной прокипяченной водой.
9. Употреблять в пищу качественные продукты, особенно молочные (следить за сроком годности и условиями хранения).
10. Тщательное мытье овощей и фруктов с мылом, в том числе бананов, апельсинов, мандаринов и др.
11. Обработка дезинфицирующим средством унитаза и горшка после каждого использования.12. Личный пример родителей – лучший способ обучения ребенка и развития навыков личной гигиены.
Среди мер специфической профилактики наиболее эффективным способом предупреждения ротавирусной инфекции является вакцинация.
В Российской Федерации зарегистрирована единственная вакцина против ротавирусной инфекции – РотаТек. По вопросам иммунизации необходимо проконсультироваться в поликлинике по месту жительства (прикрепления).
Для профилактики ротавирусной инфекции среди населения необходимо выполнение санитарно-эпидемиологических требований в отношении:
· обеспечения населения качественной водой;
· контроля за содержанием открытых водоемов, использующихся для рекреации и хозяйственно-питьевого водопользования;
· обеспечения населения качественным продовольствием;
· содержания объектов общественного питания и пищевой промышленности;
· содержания территории, ее благоустройство, функционирование очистных сооружений;
· обеспечения социально-бытовых условий проживания населения;
· содержания, эксплуатации, соблюдения противоэпидемического режима лечебно-профилактических, детских дошкольных, образовательных и других учреждений;
· создания условий воспитания и обучения;
· проведения плановых лабораторных исследований воды из различных источников по обнаружению микробного загрязнения (или его косвенных признаков), в том числе РВ в окружающей среде с целью определения предпосылок и предвестников эпидемического неблагополучия;
· проведения гигиенического обучения работников отдельных профессий, производств и организаций, связанных непосредственно с процессом производства, приготовления, хранения, транспортирования и реализации пищевых продуктов, водоподготовки, обучением и воспитанием детей и подростков;
· осуществления обследования сотрудников при приеме на работу в детские образовательные и лечебно-профилактические учреждения, объекты питания, в период формирования летних оздоровительных детских коллективов и приема в детские организованные коллективы;
· утренних приемов детей в детское дошкольное учреждение, в том числе после длительного отсутствия, проведение опроса родителей о состоянии здоровья ребенка и проведения лабораторного обследования ребенка по клиническим и эпидемиологическим показаниям.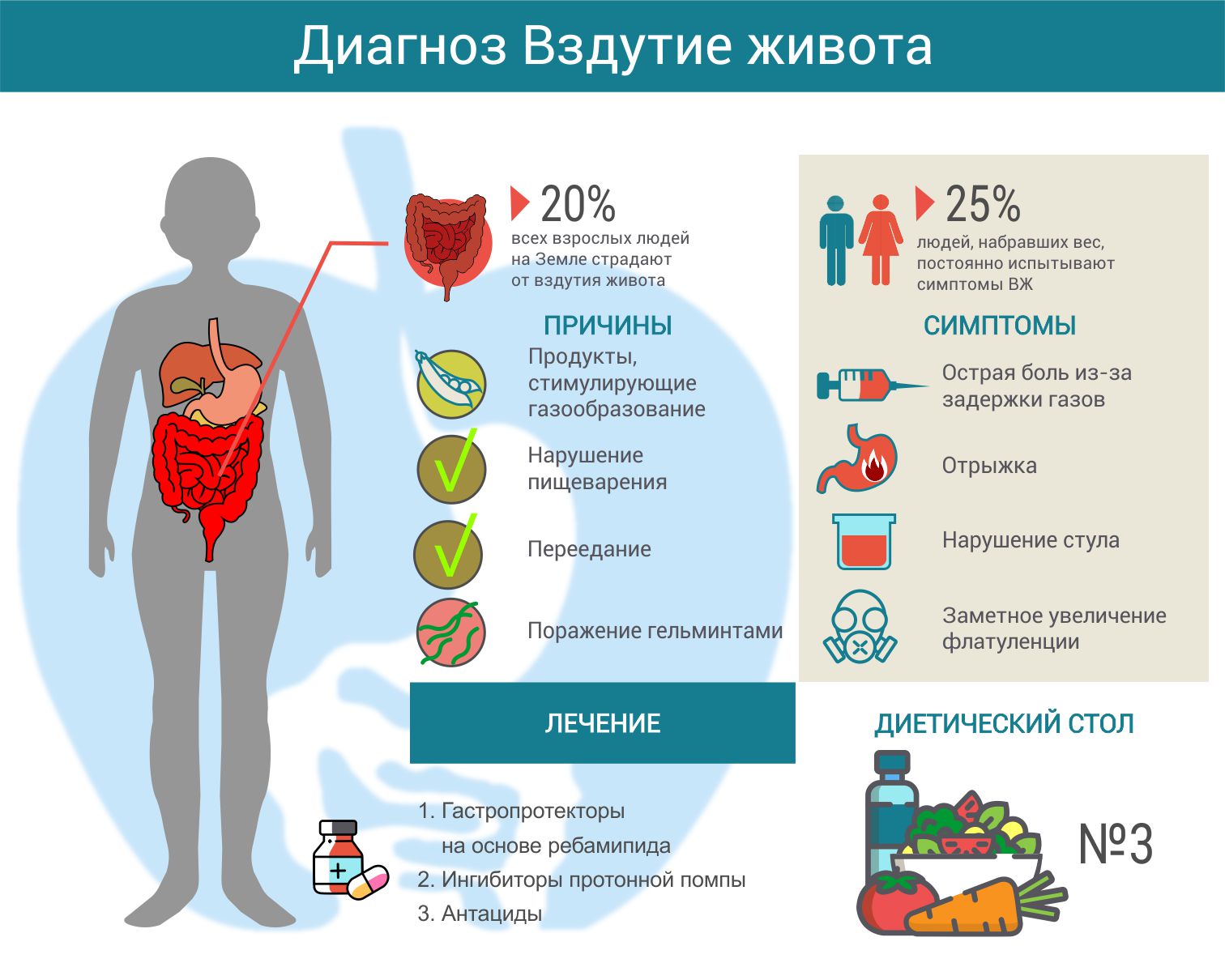
Своевременное выявление больных и лиц с бессимптомной РВИ, качественная клиническая, лабораторная и эпидемиологическая диагностика, изоляция, лечение и диспансерное наблюдение за переболевшими, а также организация и выполнение противоэпидемических мероприятий являются мерами профилактики возникновения новых случаев заболевания и распространения инфекции.
Городская поликлиника №1 г. Ростова-на-Дону
Поликлиника является многопрофильным лечебно-профилактическим учреждением, оснащенным современным медицинским оборудованием. Амбулаторно-поликлиническая помощь оказывается лицам старше 18 лет, в рамках системы обязательного медицинского страхования.
На базе поликлиники работают:
- Городской пульмонологический центр
- Городской флебологический центр
- Круглосуточный травмпункт
- Центр здоровья
- Кабинет мужского здоровья
Своевременное обращение к врачу не даст заболеваниям перейти в запущенную форму, ведь ранняя диагностика и профилактика заболеваний – это самый эффективный способ сохранить здоровье.
На нашем сайте Вы можете узнать об истории, организационной структуре, режиме работы нашей поликлиники, заседаниях школ здоровья. Узнать расписание врачей и при необходимости записаться на прием. Оставить свои отзывы и предложения по работе поликлиники.
Муниципальное бюджетное учреждение здравоохранения «Городская поликлиника№1 города Ростова-на-Дону»
Почтовый и юридический адрес:344029, г.Ростов-на-Дону, ул. Сержантова, 3
Учредитель МБУЗ является муниципальное образование г.Ростова-на-Дону.
Функции и полномочия учредителя осуществляет Управление здравоохранения г.Ростова-на-Дону.
ИНН 6166017539
ОГРН 1026104030094 от 04.01.1995 г. выдан МИ ФНС №23 по РО
АДРЕСА ОКАЗАНИЯ МЕДИЦИНСКОЙ ПОМОЩИ
344029, г.Ростов-на-Дону, ул. Сержантова, 3
Единый телефон call-центра (863) 285-10-35
Телефон травмпункта – 252-04-18
_______________________________________
344029, г.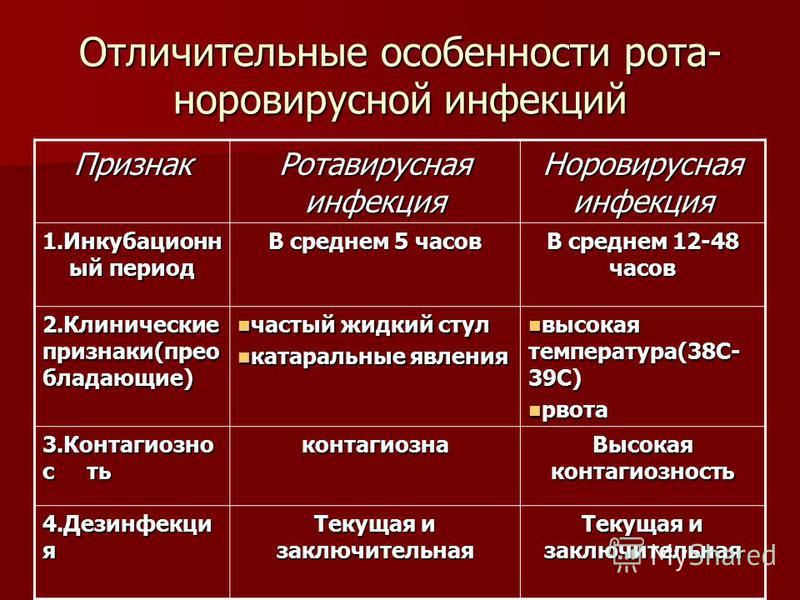 Ростов-на-Дону, ул.В.Пановой, 37
Ростов-на-Дону, ул.В.Пановой, 37
Женская консультация
Телефон регистратуры ( 863 )252-01-13
_______________________________________
344093, г.Ростов-на-Дону, ул. Днепропетровская, 50
Филиал поликлиники, Центр здоровья
Единый телефон call-центра (863) 285-10-35
СХЕМА ПРОЕЗДА:
Главный корпус (травмпункт): 344029, г. Ростов-на-Дону, ул.Сержантова, 3: остановка улица Сержантова»
Троллейбус: №1, №5
Автобус: 3, 3а, 11, 54, 67, 98
Маршрутное такси: 19, 24, 29, 40, 66, 79, 164
Женская консультация: 344029, г. Ростов-на-Дону, ул.В.Пановой, 37: остановка «Веры Пановой»
Троллейбус: №1, №5
Автобус: 3, 3а, 11, 54, 67, 98
Маршрутное такси: 19, 24, 29, 40, 66, 79, 164
Филиал поликлиники, Центр здоровья: 344093, г. Ростов-на-Дону, ул.Днепропетровская, 50: ближайшая остановка «Общежитие»
Ростов-на-Дону, ул.Днепропетровская, 50: ближайшая остановка «Общежитие»
Автобус: № 3, 3а
Маршрутное такси: № 40,42, 50
Ротавирусная инфекция / Администрация Азовского района Ростовской области
Ротавирусная инфекция, которую так же называют ротавирусный гастроэнтерит, или в просторечии – желудочный или кишечный грипп – острая кишечная инфекция, возбудителем которой является Ротавирус человека из рода Rotavirus.
Вероятность заболеть высока у людей любого возраста, однако чаще инфицируются дети раннего возраста от полугода до двух лет.
Источником ротавирусyой инфекции может быть как больной человек, гак и здоровый вирусоноситель. Попадая в тело человека, возбудитель активно размножается в клетках слизистой оболочки желудка и тонкого кишечника, вызывая соответствующую клиническую картину гастроэнтерита, нарушается переваривание пищи, что приводит к развитию обезвоживания вследствие диареи (поноса) и, уже с первого дня заболевания вирус выделяется в окружающую среду с калом.
Главный путь распространения ротавирусной инфекции – фекально-оральный: от человека к человеку, через зараженные предметы, немытые руки, пищу. Возбудитель долго сохраняет жизнеспособность в водной среде, как в открытых водоемах, гак и в хлорированной воде (бассейны). Так же вероятен и воздушно капельный путь передачи – при чихании, кашле.
Инкубационный период – от 1 до 5 дней.
Начало заболевания острое: повышается температура до 39С°, что сопровождается общим недомоганием, слабостью, появляются сильные, схваткообразные боли в животе, рвота. Довольно быстро к этим симптомам присоединяется диарея (стул жидкий, частый, желтоватого цвета, с неприятным резким кислым запахом). Так же характерно покраснение глаз, слизистой задней стенки глотки и небных дужек, мягко выраженные катаральные явления.
Симптомы не являются строго специфичными, они могут сопровождать и другие опасные острые кишечные инфекции (сальмонеллез, пищевое отравление, холера).
Главная опасность ротавирусиой инфекции – в обезвоживании организма, развивающемся вследствие частой рвоты и обильного поноса.
Обычно болезнь заканчивается через 4-7 дней выздоровлением.
Заболевание представляет наибольшую опасность для малышей, обезвоживание у них развивается очень быстро, что может привести даже к смертельному исходу, если потери жидкости постоянно не восполнять. Взрослые же переносят инфекцию в мягкой, стертой форме (послабление стула может быть однократным или кратковременным, на первый план в симптоматике могут выходить катаральные явления в носоглотке), сохраняется достаточная жизненная активность, но в этот период человек высоко заразен.
Специфического (противовирусного) лечения на данный момент не существует. Терапия только симптоматическая (направленная на снижение выраженности основных симптомов: снижение температуры, восполнение потерь воды и восстановление водно-солевого баланса с помощью регидратирующих растворов, щадящая диета и применение мягких ферментных препаратов).
Самодиагностика недопустима, при появлении вышеперечисленных симптомов следует обратиться к врачу, для верификации диагноза.
Профилактика ротавирусной инфекции заключается в соблюдении мер личной гигиены (прежде всего – тщательное и частое мытье рук, фруктов, овощей перед употреблением). Однако следует понимать, что даже неукоснительное соблюдение гигиены не является гарантией отсутствия заражения.
Острые кишечные инфекции. Ротавирусная инфекция.
Острыми кишечными инфекциями называется группа (свыше 30) инфекционных заболеваний с преимущественным поражением кишечника. Возбудителями острых кишечных инфекций могут быть различные вирусы и бактерии. Кишечные инфекции на втором месте после респираторных заболеваний по частоте распространения среди всех человеческих болезней. Лето – особенно «благодатная пора» для этого вида заболеваний.
При первых же симптомах кишечной инфекции необходимо срочно обратиться за медицинской помощью! Свыше половины всех случаев кишечных инфекций приходится на детей. Ежегодно на планете умирает от кишечных инфекций около 1 млн. детей (чаще в возрасте до 2 лет). Основной причиной является сильная диарея с обезвоживанием организма.
Основной причиной является сильная диарея с обезвоживанием организма.
Причины кишечных инфекций
Острые кишечные инфекции могут быть вызваны бактериями (сальмонелла, холера, стафилококк и др.), а также вирусами (напр., энтеровирусная, ротавирусная инфекция).
Заболевание передается через пищу, воду, предметы общего пользования.
Возбудители кишечных инфекций бактериальной природы вырабатывают яд энтеротоксин, который при попадании в кишечник вызывает отравление.
Виды кишечных инфекций
Выделяют следующие основные кишечные инфекции:
- дизентерия;
- холера;
- сальмонеллез;
- пищевое отравление стафилококком;
- энтеровирусная и ротавирусная инфекция у детей и др.
Рассмотрим некоторые из них более подробно.
Пищевые отравления стафилококком
Источником стафилококковой инфекции являются больные ангиной, фарингитом, тонзиллитом, гнойными поражениями кожи. Частой причиной отравления являются такие продукты, как молоко, кефир, рыба, мясо, которые хранились или были приготовлены с нарушением гигиенических норм.
Частой причиной отравления являются такие продукты, как молоко, кефир, рыба, мясо, которые хранились или были приготовлены с нарушением гигиенических норм.
Характерные симптомы данного заболевания – боль в животе, рвота и понос, повышение температуры до 38-39 С – возникают уже через 5-8 часов после употребления некачественного продукта.
Сальмонеллез
Основной источник заражения сальмонеллезом – крупный рогатый скот, лошади, свиньи, кошки, собаки, птицы и другие животные. Основная причина заболевания – употребление в пищу неправильно приготовленных мяса или яиц, зараженных бактерией. Возможно и заражение от больного или носителя сальмонелл.
Инкубационный период заболевания – от 5 часов до 3 суток.
Характерные симптомы – слабость, боль в животе, тошнота и рвота, повышение температуры до 38-39 С, стул до 15 раз в сутки в течение 5-8 дней (испражнения водянистые, с зеленоватым оттенком). Лечение должно проводиться в стационарных условиях.
Ротавирусная инфекция
На ротавирусную инфекцию приходится почти половина всех кишечных расстройств. Заболевание чрезвычайно заразно, передается воздушно-капельно, через грязные руки, сырую воду (хлорка бессильна перед ротавирусом). В народе ротавирусную инфекцию часто называют «кишечным гриппом» или «желудочным гриппом», поскольку среди симптомов есть признаки, свойственные гриппу – кашель, чихание.
Заболевание чрезвычайно заразно, передается воздушно-капельно, через грязные руки, сырую воду (хлорка бессильна перед ротавирусом). В народе ротавирусную инфекцию часто называют «кишечным гриппом» или «желудочным гриппом», поскольку среди симптомов есть признаки, свойственные гриппу – кашель, чихание.
Для ротавирусной инфекции характерно острое начало, причем дети переносят болезнь острее, чем взрослые. Основные симптомы – рвота (возможно со слизью, позывы к рвоте возникают даже при условии пустого желудка), резкий упадок сил, потеря аппетита, повышение температуры иногда выше 39 С (иногда она может держаться до 5 дней, и сбить ее очень трудно). Стул в первые сутки желтый, жидкий, а в последующие дни – глинообразный, серо-желтый. Больные жалуются на боль в горле при глотании и насморк.
У грудных детей, которые в силу возраста не могут описать своё состояние, признаком наличия боли служит плач и урчание в животе, частый жидкий стул. Малыши стремительно теряют вес, становятся раздражительными, сонливыми и плаксивыми.
Лечение кишечных инфекций
1Гастроэнтерология в МедикСити
2Гастроэнтерология в МедикСити
3Дневник здоровья
За редким исключением, лечение кишечных инфекций не зависит от возбудителя заболевания и направлено на борьбу с микробами, поддержание нормального функционирования ЖКТ, устранение диареи и предотвращение обезвоживания.
При лечении ротавирусной и других инфекций требуется соблюдение диеты, обильное питье, назначение антибактериальных препаратов и энтеросорбентов. Также при необходимости принимаются меры для снижения высокой температуры.
Основу диеты при кишечных инфекциях составляют каши на воде, кисломолочные продукты, сухари из белого хлеба и крепкий несладкий чай. Нельзя употреблять цельное молоко, темный хлеб, сахар, сырые фрукты и овощи.
Обращение к врачу – обязательно условие при наличии любых симптомов кишечных инфекций. Некоторые кишечные инфекции требуют стационарного лечения!
Прививку от ротавирусной инфекции сделать в Твери
Ротавирусная инфекция (РВИ) – острое инфекционное заболевание, возбудителем которого является вирус рода Rotavirus.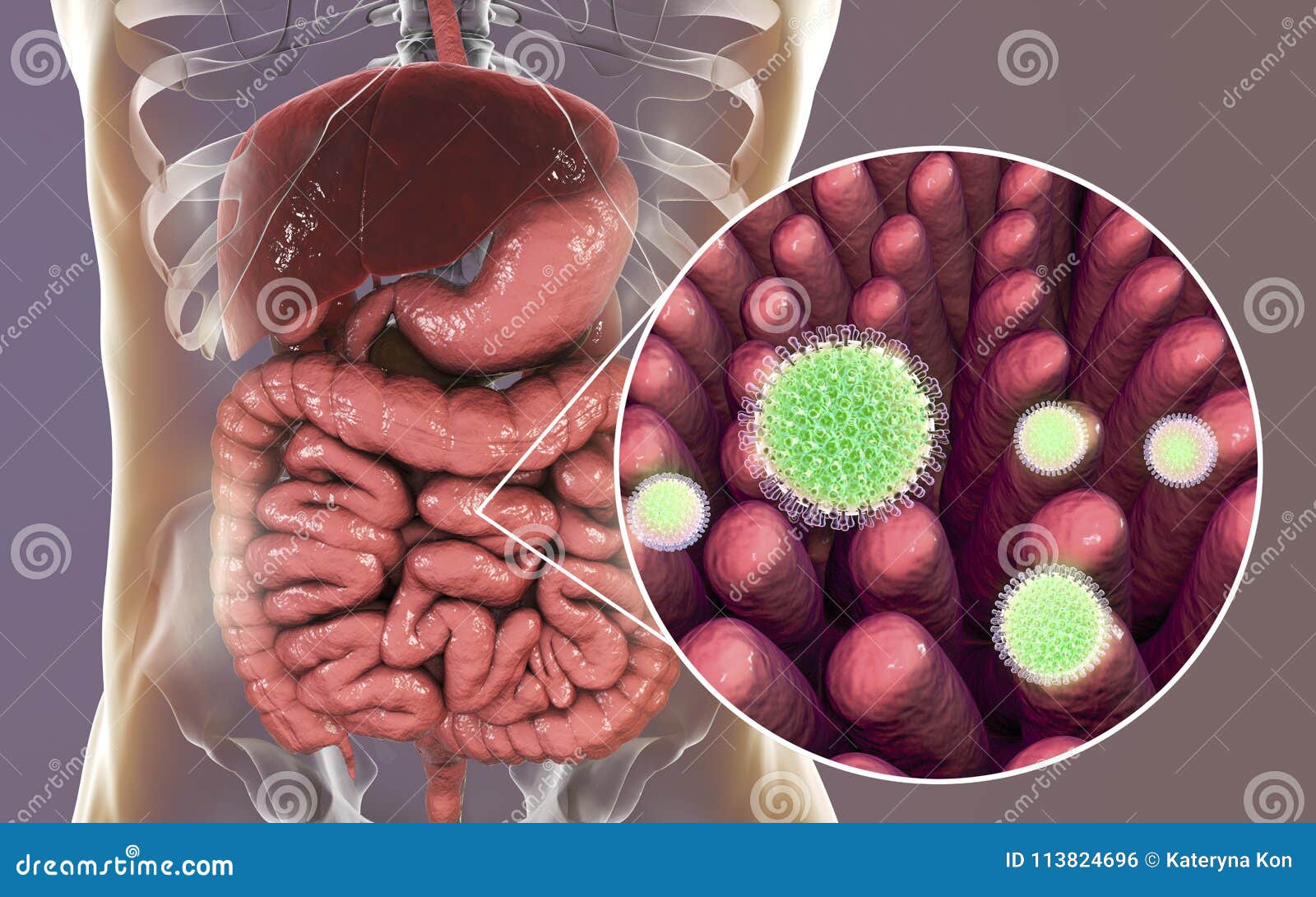 Выражается дисфункцией желудочно-кишечного тракта плюс явными признаками простуды, проявляющейся на ЛОР органах. Проявления ротавируса вполне можно спутать с отравлением, или гриппом тяжёлой формы, однако это – самостоятельное и достаточно серьёзное заболевание.
Выражается дисфункцией желудочно-кишечного тракта плюс явными признаками простуды, проявляющейся на ЛОР органах. Проявления ротавируса вполне можно спутать с отравлением, или гриппом тяжёлой формы, однако это – самостоятельное и достаточно серьёзное заболевание.
Ротавирус передается от человека к человеку через немытые руки и предметы быта или через зараженные пищу и воду.
Больные особенно опасны для окружающих с самого начала заболевания и в течение 3-5 дней. Выделение вируса во внешнюю среду возможно и внешне здоровым ребенком с бессимптомной формой болезни. Взрослый человек часто переносит ротавирус, даже не зная, что заражен. Часто инфекционное заболевание протекает без каких-либо симптомов. Однако, такой человек является опасным рассадником инфекции в семье, в коллективе на работе, в общественном транспорте.
Ротавирус, выделяясь во внешнюю среду с фекалиями, длительно сохраняет свою жизнеспособность и относительно устойчив к распространенным дезинфицирующим средствам. Во внешней среде микроорганизмы рода Rotavirus выживают в самых разных погодных условиях – и в сильнейшие морозы, и в летний зной. В зоне природных водоёмов может быть активным весь летний сезон, на продуктах питания живёт до месяца.
Во внешней среде микроорганизмы рода Rotavirus выживают в самых разных погодных условиях – и в сильнейшие морозы, и в летний зной. В зоне природных водоёмов может быть активным весь летний сезон, на продуктах питания живёт до месяца.
Инкубационный период при ротавирусной инфекции короткий и может длиться от 1 до 3 дней.
Клинические симптомы РВИ
После завершения инкубационного периода развиваются следующие симптомы заболевания:
- Общая интоксикация: слабость, озноб, повышение температуры тела, головная боль.
- Гастроэнтерит: многократная сильная рвота, боль и вздутие в животе, диарея.
- Катаральные симптомы: покраснение слизистой оболочки ротоглотки, боль в горле.
- Болезнь может начинаться как с повышенной температуры, так и с рвоты и жидкого поноса. Температура обычно поднимается до 38-39 C.
При благоприятном течении болезнь длится 5-7 дней. Однако, иногда, особенно у маленьких детей и взрослых с ослабленным здоровьем, могут развиваться различные осложнения. Наиболее частое осложнением РВИ – обезвоживание (дегидратация), особенно распространено у детей первых лет жизни. При отсутствии адекватной терапии возможно развитие жизнеугрожающих осложнений.
Наиболее частое осложнением РВИ – обезвоживание (дегидратация), особенно распространено у детей первых лет жизни. При отсутствии адекватной терапии возможно развитие жизнеугрожающих осложнений.
Другие возможные осложнения ротавирусной инфекции:
- присоединение бактериальной инфекции;
- острая почечная недостаточность;
- поражение ЦНС (нарушение сознания, судороги и т.д.).
Вакцинация против ротавирусной инфекции
В России вакцинация против РВИ рекомендуется детям грудного возраста с целью профилактики заболеваний, вызываемых ротавирусами.
В России зарегистрирована вакцина против РВИ «РотаТек», представляет собой раствор в объеме 2 мл, который вводится ребенку через рот три раза с интервалами 4-10 недель. При этом первая доза вакцины вводится в возрасте от 6 до 12 недель, последняя – до 32 недель.
Вакцинация вакциной «РотаТек» вызывает выработку специфических антител к серотипам ротавируса, циркулирующим в РФ.
РОТАВИРУСНАЯ ИНФЕКЦИЯ
Ротавирусная инфекция – острая кишечная инфекция, вызываемая вирусом, имеющим вид колеса (ротора) под микроскопом. Эта инфекция официально регистрируется Всемирной организацией здравоохранения с 1979 года, распространена во многих странах мира. В Республике Коми в течение 2013 года было зарегистрировано 794 случая ротавирусной инфекции. По мнению ряда эпидемиологов и инфекционистов, в Российской Федерации на долю ротавирусных приходится 70% случаев острых кишечных инфекций, с так называемой неустановленной этиологией (причиной).
В отличие от обычных, давно знакомых летних кишечных инфекций, подъем заболеваемости ротавирусной инфекцией регистрируется с января по март. Источник – только человек (антропоноз). Наибольшую опасность для окружающих представляет «бессимптомный носитель», особенно, когда он ухаживает за детьми, готовит пищу, работает в детских садах и системе водоснабжения.
Помимо классических путей передачи для кишечных инфекций – водного, пищевого, контактно-бытового (через игрушки, посуду, полотенца) – ротавирус освоил и воздушно-капельный путь.
Вирусы распространены повсеместно и очень устойчивы во внешней среде, прекрасно сохраняются в условиях холодильника, беспрепятственно проходят кислотный барьер желудка человека. Подъем заболеваемости приходится на зимнее время года. Как всякая кишечная инфекция, эта болезнь не любит чистоту, кипячение и строгое соблюдение санитарных правил.
Основная группа риска – дети младшего возраста (от 0 до 2 лет), именно они болеют чаще и тяжелее всех.
С момента заражения до проявления болезни проходит от 1 до 5 суток. Основные признаки – расстройство стула (диарея), рвота, боли в животе. Температура повышается не всегда и не выше 38,5 градусов .Среди заболевших до 70% имеют воспаление в носоглотке.
Легкие формы ротавирусной инфекции проходят практически без лечения в течение 3-5 дней. Эти случаи заболевания не требуют госпитализации, но к врачу обратиться необходимо. В тяжелых случаях, когда рвота и жидкий стул регистрируется до 20 раз в сутки, госпитализация жизненно необходима.
Меры профилактики ротавирусной инфекции такие же как при обычных кишечных инфекциях:
Для детей 1-го года жизни главные меры профилактики – грудное вскармливание и тщательное соблюдение членами семьи правил личной гигиены.
В детских дошкольных учреждениях, где чаще всего реализуется контактно-бытовой путь передачи, должны соблюдаться все требования к содержанию помещений.
Родители должны помнить – детям с проявлениями болезни не место в детском коллективе обращение к врачу обязательно!
Работники пищеблоков, продавцы продуктов, хозяйки на кухне, работники, связанные с водоснабжением населения должны четко выполнять правила личной гигиены и все требования санитарных норм и правил. От этого зависит здоровье многих людей!
В домашних условиях желательно использовать бытовые фильтры для дополнительной очистки воды.
При появлении дома больного с ротавирусной инфекцией необходимо строго следовать рекомендациям врача.
Ротавирусная инфекция \ Акты, образцы, формы, договоры \ Консультант Плюс
Подборка наиболее важных документов по запросу Ротавирусная инфекция (нормативно–правовые акты, формы, статьи, консультации экспертов и многое другое).
Статьи, комментарии, ответы на вопросы: Ротавирусная инфекция Открыть документ в вашей системе КонсультантПлюс:Статья: Правовые модели регулирования вакцинопрофилактики в зарубежных странах: конституционно-правовая обоснованность и поиск баланса между частным и публичным интересом
(Чеснокова Е.А., Акулин И.М.)
(“Закон”, 2020, N 7)Однако ввиду неблагоприятной эпидемиологической ситуации в 2017 г. правительством были приняты срочные меры, направленные на ужесточение политики в вопросах вакцинирования. Законодательным декретом от 07.06.2017 N 73 , конвертированным с поправками в Закон от 31.07.2017 N 119 , для несовершеннолетних от рождения до 16 лет, в том числе для всех несовершеннолетних иностранцев, находящихся в стране без сопровождения, была введена обязательная бесплатная вакцинация по возрастным группам в соответствии с национальным календарем для профилактики полиомиелита, дифтерии, столбняка, коклюша, гемофильной инфекции типа b, вирусного гепатита B, кори, краснухи, эпидемического паротита, ветряной оспы, пневмококковой инфекции, ротавирусной инфекции . Предусмотрены и санкции для законных представителей несовершеннолетних в случае уклонения от обязательной вакцинации. Так, согласно ст. 4 названного Декрета при уклонении от вакцинации территориальный орган здравоохранения приглашает законных представителей для собеседования с целью предоставления дополнительной информации о вакцинопрофилактике. Если в установленные компетентным органом сроки после проведения собеседования вакцинация несовершеннолетнего так и не будет осуществлена, данное правонарушение влечет наложение административного штрафа на законного представителя несовершеннолетнего в размере от 100 до 500 евро. Интересно, что согласно циркуляру министерства здравоохранения от 16.08.2017 оплата административного штрафа освобождает от обязанности вакцинации. По мнению некоторых представителей правовой доктрины, учитывая, что наложение административного штрафа за отказ от вакцинации применяется однократно, а не в начале каждого учебного года, данная санкция, по сути, представляет собой плату за освобождение от вакцинации и ставит родителей несовершеннолетних в неравное положение, давая возможности для свободного волеизъявления обеспеченным гражданам . Однако важно то, что в соответствии с этим циркуляром оплата административного штрафа хотя и освобождает от обязанности вакцинации, но не позволяет несовершеннолетнему посещать детские образовательные организации независимо от их формы собственности не только в течение года установления факта невыполнения обязательства, но и в последующие годы, вплоть до выполнения родителем требования по вакцинации. Подобное решение является довольно спорным в свете соблюдения прав детей на получение образования. В данном аспекте следует отметить, что итальянские суды зачастую рассматривают уклонение от обязательной вакцинации детей в соответствии с национальным календарем как ненадлежащее исполнение родителями своих обязанностей, в том числе и ввиду наличия ограничительных мер, препятствующих невакцинированным несовершеннолетним посещать детские образовательные организации и затрудняющих их общение со сверстниками. Конституционно-правовая обоснованность полномочий суда заместить законных представителей в принятии решения о проведении вакцинопрофилактики была подтверждена Конституционным судом Итальянской Республики , который в 1992 г. провел проверку положений Закона от 04.02.1966 N 51 “Обязательность вакцинации против полиомиелита” на предмет их соответствия ст. ст. 32 и 34 Конституции, провозглашающим права несовершеннолетних на медицинскую помощь и на образование. Основанием для проверки стало обращение Апелляционного суда Тренто, по мнению которого положения указанного Закона не были конституционными в части, устанавливающей в качестве единственной санкции для законного представителя, уклоняющегося от обязательной вакцинации несовершеннолетнего, административный штраф и не предусматривающей принудительную вакцинацию в целях защиты прав ребенка на здоровье и образование, а также общественного права на здоровье. По итогам рассмотрения дела Конституционный суд признал оспариваемые положения соответствующими Конституции, указав, что санкцию в виде административного штрафа следует рассматривать в контексте других мер, предусмотренных действующим законодательством в целях защиты общественного здоровья относительно рисков, связанных с неисполнением обязательства по вакцинации, а также принимая во внимание иные юридические инструменты, служащие для защиты прав ребенка в случае, если родители ненадлежащим образом исполняют свои родительские обязанности. В связи с этим Конституционный суд отметил, что введение административной ответственности за нарушение обязательства вакцинировать детей в соответствии с национальным календарем не исключает возможности применения положений Гражданского кодекса , дающих суду право в случае, если поведение родителей представляется вредным для ребенка, принять с учетом обстоятельств дела решения, необходимые как в интересах самого ребенка, так и в общественных интересах.Нормативные акты: Ротавирусная инфекция
Является ли затяжная ротавирусная инфекция частой причиной затяжной диареи?
До того, как в 1973 году Рут Бишоп идентифицировала ротавирус человека в Мельбурне, педиатры могли объяснять только банальности, когда сталкивались с маленькими детьми с острой диареей. С тех пор стало ясно, что ротавирус является наиболее частой причиной гастроэнтерита у детей в возрасте до 2 лет, живущих как в развитых, так и в развивающихся странах1. Его патогенные механизмы в значительной степени выяснены, в основном путем изучения аналогичной инфекции у поросят, вызываемой трансмиссивными инфекциями. возбудитель гастроэнтерита.2 , 3 Ротавирус, вероятно, вызывает диарею, увеличивая круговорот энтероцитов вдоль оси ворсинок, что приводит к заселению притупленных ворсинок незрелыми клетками, которые неспособны к нормальному всасыванию и имеют более криптоподобный и секреторный характер4-6. также снижают экспрессию сахаразы-изомальтазы в энтероцитах человека путем блокирования транспорта сахаразы-изомальтазы к апикальной мембране без видимого разрушения клеток. Снижение активности коррелирует с изменениями цитоскелета энтероцитов, вызванными ротавирусом.7 Имеется также единственный неподтвержденный отчет о выработке ротавирусом средства, усиливающего секрецию: очищенный NSP4 (неструктурный гликопротеин ротавируса) усиливает секрецию хлорида кальций-зависимым сигнальным путем.
У некоторых детей клинический эпизод, неотличимый от острого гастроэнтерита, сопровождается затяжной диареей, так называемым синдромом постгастроэнтерита. Это более вероятно в развивающихся странах, где ранее существовавшее недоедание и энтеропатии могут привести к затяжной диарее у 8–20% детей, изначально страдающих острым гастроэнтеритом.9 В развитых странах это происходит примерно в 5% случаев, и его причины далеко не ясны.10 Может возникнуть вторичная непереносимость лактозы, и у многих детей проявляется непереносимость белка коровьего молока, а часто и некоторых других белков10. , 11 Управление носит прагматичный характер и включает в себя, в основном, поддержку питания. Большинство детей в развитых странах выживают, но смертность в развивающихся странах по-прежнему высока12.
В недавнем отчете группы из Мельбурна предполагается, что стойкая ротавирусная инфекция может играть большую роль в постгастроэнтеритовом синдроме и затяжной диарее, чем считалось ранее.13 До сих пор считалось, что экскреция ротавируса прекращается в течение 10 дней с момента появления симптомов у большинства детей и в течение 20 дней с момента появления всех симптомов14. , 15 Иммуноферментный анализ (ИФА) – это метод, обычно используемый для обнаружения ротавируса в стуле, но обратная транскриптаза-полимеразная цепная реакция (ОТ-ПЦР) до 25 раз более чувствительна, чем ИФА, при обнаружении ротавируса в серийно разведенных фекальных суспензиях. Он имеет как более высокую чувствительность, так и специфичность16. , 17 Используя метод RT – PCR, группа Бишопа изучила продолжительность экскреции ротавируса у 37 детей, госпитализированных с острой ротавирусной инфекцией.13 Выделение прекратилось в течение 10 дней у 17 детей и в течение 20 дней у 26 из 37 детей. Однако длительное выведение в период 25–57 дней наблюдалось у 11 детей. По всей видимости, только один ребенок был повторно инфицирован ротавирусом. В отличие от этого, экскреция ротавируса, оцененная с помощью EIA, варьировала от 4 до 29 дней, и только у 12 детей выявлялась экскреция в период от 10 до 29 дней. Длительное выведение ротавируса было значительно связано с периодическим повышением уровня копроантител IgA к антиротавирусу. Большинство этих повышений были связаны с экскрецией ротавируса.У восьми из 11 детей с продолжительной экскрецией ротавируса в период от 25 до 57 дней развилась легкая диарея и рвота, связанные с экскрецией или повышением уровня копроантител в течение 100 дней наблюдения.
Очевидно, что длительная экскреция ротавируса является не только признаком иммунодефицита18, но также наблюдается примерно у одной трети иммунокомпетентных маленьких детей. Периодическая легкая диарея, наблюдаемая у значительно увеличенного числа детей, выделяющих ротавирус в течение одного-двух месяцев, может объяснить некоторые случаи синдрома постгастроэнтерита.Более того, дети, выделяющие ротавирус в течение длительных периодов времени, могут стать резервуаром ротавируса человека и способствовать его выживанию в период между эпидемиями. Поскольку новые диагностические процедуры показывают, что ротавирусная инфекция может быть причиной затяжной диареи у некоторых детей, у которых инфекция могла быть не обнаружена иным способом, эффективная вакцина против ротавируса становится еще более важной.
Вакцинация против ротавируса и глобальное бремя ротавирусной диареи среди детей младше 5 лет | Гастроэнтерология | JAMA Педиатрия
Ключевые моментыВопросы Каковы масштабы ротавирусной инфекции среди детей младше 5 лет и как вакцина против ротавируса снизила это глобальное бремя?
Выводы Этот отчет о глобальном бремени болезней и несколько расширенных анализов ротавируса и результатов ротавирусной вакцинации показали, что ротавирусная инфекция вызвала 128500 смертей и 258173300 эпизодов диареи среди детей младше 5 лет в 2016 году.По оценкам, вакцина против ротавируса предотвратила примерно 28000 смертей в 2016 году, и еще примерно 83200 детей можно было бы спасти, если бы в этом году был достигнут полный охват вакцинацией.
Значение Для постоянного снижения глобального бремени ротавирусов необходимо уделить первоочередное внимание внедрению ротавирусной вакцины и вмешательствам по снижению заболеваемости и смертности, связанных с диареей.
Важность Ротавирусная инфекция является ведущей мировой причиной заболеваемости и смертности, связанной с диареей, среди детей младше 5 лет.
Объективы Изучить распространенность ротавирусной инфекции среди детей младше 5 лет по странам и количество предотвращенных смертей из-за ротавирусной вакцины.
Дизайн, обстановка и участники Этот отчет основан на результатах исследования «Глобальное бремя болезней» 2016 г., кросс-секционного исследования, в котором измерялись диарейные заболевания и их этиологические факторы. Модели использовались для оценки нагрузки в местах с недостаточным количеством данных.
Воздействие Диарея, вызванная ротавирусной инфекцией.
Основные результаты и мероприятия Смертность и заболеваемость, связанные с ротавирусами, по странам и годам, а также предотвращенные смертельные случаи, связанные с ротавирусной вакциной, по странам.
Результаты Ротавирусная инфекция стала причиной примерно 128500 смертей (интервал неопределенности 95% [UI], 104500-155600) среди детей младше 5 лет во всем мире в 2016 году, при этом 104733 случаев смерти произошли в странах Африки к югу от Сахары (95% UI, 83406-128842).Ротавирусная инфекция стала причиной более 258 миллионов эпизодов диареи среди детей младше 5 лет в 2016 году (95% UI, 193 миллионов – 341 миллион), частота 0,42 случая на ребенка в год (95% UI, 0,30-0,53). . По оценкам, использование вакцины предотвратило более 28000 смертей (95% UI, 14600-46700) среди детей младше 5 лет, а более широкое использование ротавирусной вакцины, особенно в странах Африки к югу от Сахары, могло бы предотвратить примерно 20 % всех смертей, связанных с диареей, среди детей младше 5 лет.
Выводы и актуальность Смертность, связанная с ротавирусами, со временем заметно снизилась, отчасти из-за внедрения ротавирусной вакцины. Это исследование предполагает, что приоритетное внимание к внедрению вакцины и вмешательствам по снижению заболеваемости и смертности, связанных с диареей, необходимо для продолжающегося глобального сокращения ротавирусной инфекции.
Диарейные заболевания были четвертой ведущей причиной смерти среди детей младше 5 лет в 2015 году, вызвав почти 500000 смертей. 1 , 2 Quiz Ref ID Кроме того, ротавирусная инфекция была причиной 29,3% (интервал неопределенности 95% [UI], 24,6–35,9%) всех случаев смерти от диареи среди детей младше 5 лет в 2015 г. (146500 смертей) ; 95% UI, 118000-183500). 2 Смертность от диареи снизилась с 1990 г. почти на 65% отчасти из-за улучшения качества питьевой воды и санитарии, а также сокращения недоедания среди детей младше 5 лет. 2 Устойчивые усилия по масштабированию и внедрению эффективных вмешательств должны оставаться долгосрочной целью облегчения глобального бремени диареи.В ответ на острую необходимость предотвращения предотвратимых эпизодов диареи и связанной с ними смертности Всемирная организация здравоохранения (ВОЗ) рекомендовала включить ротавирусные вакцины в программы иммунизации в Европейском регионе и Америке в 2006 году, и эта рекомендация была распространена на все регионы. во всем мире в 2009 году. 3 Кроме того, Гави, Альянс вакцин, активно поддерживает вакцинацию против ротавирусной инфекции, субсидируя стоимость вакцинации в соответствующих странах. 3
Ротавирус – один из 13 возбудителей диарейной этиологии, измеренных в исследовании Global Burden of Disease Study 2016 (GBD 2016). 1 , 4 , 5 Исследование ГББ 2016 представляет собой систематическую научную работу по получению сопоставимых оценок бремени болезней, включая ротавирусную диарею, для каждого возраста, пола, географического положения и года с 1990 по 2016 год. Это исследование описывает заболеваемость и смертность от ротавирусной инфекции среди детей младше 5 лет и выявляет неотложную потребность в мероприятиях по снижению риска диареи, лечению тяжелых эпизодов диареи и профилактике ротавирусной диареи.
Подробные методы оценки ГББ и диареи в ГББ были ранее опубликованы. 1 , 4 , 5 В этом отчете кратко описываются эти методы с акцентом на этиологическую атрибуцию и изменения по сравнению с предыдущими методами исследования ГББ. Промежуточные модели, входные данные и код доступны на веб-сайте Global Health Data Exchange. 6 Утверждение институционального наблюдательного совета для исследования ГББ 2016 было предоставлено Вашингтонским университетом.
Смертность, связанная с диареей, была смоделирована на платформе модели Cause of Death Ensemble (CODEm).CODEm – это инструмент байесовской, иерархической, пространственно-временной ансамблевой модели. 2 , 7 CODEm производит большое количество подмоделей, предназначенных для включения разнообразного набора ковариат и типов моделей. В таблице 1 Приложения представлен полный список используемых ковариат. Каждая подмодель взвешивается на основе достоверности прогнозов вне выборки и вносит вклад в окончательный набор из 1000 розыгрышей. Эти модели прогнозирующей регрессии позволяют получить оценки смертности от конкретных причин для каждого возраста, пола, географического положения и года на основе данных регистрации актов гражданского состояния, словесного вскрытия и данных системы эпиднадзора.
Заболеваемость диареей моделировалась в DisMod-MR, версия 2.1 (DisMod). DisMod – это байесовский инструмент иерархической метарегрессии. 5 Как и CODEm, DisMod использует пространственно-временную информацию и ковариаты для получения смоделированных оценок для каждого возраста, года, географического положения и пола. DisMod также содержит компартментную модель, которая обеспечивает согласованность между заболеваемостью, распространенностью и смертностью. Исходные данные взяты из научной литературы, репрезентативных обследований населения и записей об использовании медицинских услуг.
Ротавирус был отнесен к числу связанных с диареей смертности и заболеваемости с использованием контрфактического подхода, называемого популяционной фракцией (PAF). 1 Подход этого исследования учитывал кодирование и обнаружение патогенов у здоровых людей и не требует ассоциации 1 патоген с 1 эпизодом. Выявление ротавируса основывалось на молекулярно-диагностическом определении случая. 8 PAF определяется следующим образом: 9 :
PAF = Пропорция × (1 – 1 / ИЛИ)
, где OR – отношение шансов диареи при обнаружении патогена, а пропорция – смоделированная частота обнаружения ротавируса в образцах диареи.OR основаны на результатах Глобального многоцентрового исследования кишечника (GEMS) (таблица 2 в Приложении). 8 , 10 Оценки пропорций взяты из моделей DisMod, в которых входные данные взяты из научной литературы и смоделированы для каждого возраста, пола, года и географического положения. Исходные данные приведены в eTable 3 и eFigure 1 в Приложении. Результаты были скорректированы для соответствия определению случая молекулярной диагностики с использованием чувствительности и специфичности иммуноферментного анализа (ELISA) по сравнению с определением молекулярной диагностики.
В данном исследовании используется систематический повторный анализ образцов GEMS с использованием количественной полимеразной цепной реакции (ПЦР). 8 Стратегия моделирования требует, чтобы непрерывные количественные результаты ПЦР дихотомировали на положительные и отрицательные результаты, чтобы OR отражали силу связи между ротавирусом и диареей. 11 Для этого мы определили самый низкий порог цикла, при котором точность диагностики была максимальной (см. Рисунок 2 в Приложении).Сводка исходных данных для этих моделей представлена в eTable 3 и eFigure 1 в Приложении. Чтобы отнести эпизоды диареи и смерти из-за ротавирусной инфекции, оценки PAF были умножены на количество эпизодов диареи и оценки смертности. Все оценки в ГББ 2016 производятся на уровне выборки с неопределенностью, переносимой на каждом этапе процесса, а значения, представленные в этом исследовании, являются средними значениями из этих распределений с пользовательскими интерфейсами, представленными 2,5-м и 97,5-м процентилями распределения. .
Разветвления ротавирусной вакцины были оценены с использованием анализа смоделированного охвата ротавирусной вакциной. Охват ротавирусной вакциной был смоделирован с использованием пространственно-временной регрессии по Гауссу, в которой входные данные представляли собой отношение оценок охвата ротавирусной вакциной из обследований и программ реализации к охвату 3 дозами дифтерийного и столбнячного токсоидов и коклюшной вакцины (АКДС3). 12 Охват ротавирусной вакциной был смоделирован как отношение к охвату АКДС3, поскольку предполагалось, что охват АКДС3 был верхней границей способности программы плановой иммунизации доставлять вакцину (см. Рисунок 3 в Приложении).Ссылка на опрос Метаанализ IDA эффективности вакцины от тяжелой диареи на основе значений, представленных в систематическом обзоре 2016 г. 13 , был использован для оценки относительного сокращения ротавирусной диареи, связанной с использованием ротавирусной вакцины. Эффективность вакцины и смоделированный охват вакцинацией использовались для оценки контрфактической оценки PAF ротавируса в отсутствие вакцины с разбивкой по полу, году и географическому положению. Разница между наблюдаемой и контрфактической оценкой ожидаемого PAF ротавируса, основанная на охвате вакциной и ее эффективности, использовалась для определения снижения смертности от диареи, связанного с вакциной.
Ротавирусная инфекция стала причиной примерно 128 500 смертей (95% UI, 104 500–155 600) среди детей младше 5 лет в 2016 г .; таким образом, 28,8% (95% UI, 25,0–32,6%) случаев смерти от диареи в этой возрастной группе были связаны с ротавирусом (таблица). Уровень смертности, связанной с ротавирусом, был самым высоким в странах Африки к югу от Сахары, Юго-Восточной Азии и Южной Азии (Рисунок 1). В общей сложности 104733 случаев смерти от ротавирусной инфекции (95% UI, 83406-128842) среди лиц моложе 5 лет произошло в странах Африки к югу от Сахары.Тридцать процентов смертей от диареи среди детей младше 5 лет были связаны с ротавирусной инфекцией во многих географических точках, которые, казалось бы, не зависят от места или социально-демографического индекса (Рисунок 2 и Рисунок 3), при этом относимая доля ротавирусов колеблется от 4,6% (95%). UI, 3,0–6,5%) в Никарагуа до 64,2% (95% UI, 61,0–67,6%) в Демократической Республике Конго (рисунок 2 и электронная таблица 4 в приложении). Более 50% случаев смерти от диареи в странах с высоким уровнем дохода, таких как Дания (51.0%; 95% UI, 44,8-57,0%) и Финляндия (62,6%; 95% UI, 52,2-73,0%) были связаны с ротавирусной инфекцией, что указывает на повсеместную инфекцию среди детей младше 5 лет.
Quiz Ref ID Ротавирусная инфекция стала причиной более 258 миллионов эпизодов диареи среди детей младше 5 лет в 2016 г. (95% UI, 193-341 миллион), частота 0,42 случая на каждый ребенок в год (95% UI, 0,30 -0,53) (таблица и электронная таблица 4 в Приложении). Заболеваемость среди детей младше 5 лет колебалась от 0.024 случая на год ребенка (95% UI, 0,015–0,038) в Южной Корее до 1,63 случая на год ребенка (95% UI, 1,29–2,01) в Демократической Республике Конго (таблица и электронная таблица 4 в приложении) . Ротавирус также был важной причиной заболеваемости диареей в регионах с высоким уровнем дохода, таких как США, на него приходилось 593000 эпизодов среди детей младше 5 лет (95% UI, 375000-875300) (представлены результаты на уровне страны в таблице 4 Приложения). Расчетная частота случаев тяжелой ротавирусной диареи составила 29.4 на 1000 детей лет (95% UI, 22,2–38,0), что составляет 18882800 тяжелых случаев (95% UI, 14263600–2446700). Ротавирусная инфекция стала причиной примерно 1537000 (95% UI, 285000-7750500) госпитализаций во всем мире среди детей младше 5 лет в 2016 году. Кроме того, смертность, связанная с ротавирусом, среди детей младше 5 лет снизилась на 48,2%. (95% UI, 37,3-57,0) в период с 1990 по 2016 год (рисунок 3B).
Внедрение и расширение использования ротавирусной вакцины уже способствовали изменению бремени ротавируса.По оценкам этого исследования, 27,8% детей младше 5 лет были вакцинированы против ротавируса в 2016 году (см. Рисунок 3 в Приложении). Quiz Ref ID Вакцина против ротавируса предотвратила примерно 28800 (95% UI, 14600-46700) смертей в 2016 году, в том числе 24200 (95% UI, 12300-38700) в Африке к югу от Сахары, 1620 (95% UI , 870–2600) в Латинской Америке и 1410 (95% UI, 850–2300) в Юго-Восточной Азии, Восточной Азии и Океании (рисунок 4). Число предотвращенных смертей зависит от доли ротавирусной инфекции и эффективности вакцины.Это исследование показало, что полное использование ротавирусной вакцины могло бы предотвратить еще 83200 смертей (95% UI, 37000–168000) в 2016 году (таблица 5 в Приложении). Таким образом, при текущих уровнях охвата в 2016 г. удалось предотвратить лишь 15,3% потенциально предотвратимых смертей, а в регионах с самым высоким бременем ротавируса не удалось существенно предотвратить смерть от ротавирусной инфекции; полный охват ротавирусной вакциной может предотвратить 23% всех случаев смерти от диареи в странах Африки к югу от Сахары (67200 смертей; 95% UI, 29600-135300) и 10% всех случаев смерти от диареи в Южной Азии (10100 смертей) ; 95% UI, 5200-18100).Результаты на уровне страны приведены в электронной таблице 5 и на электронном рисунке 4 в Приложении. Все результаты доступны для дальнейшего изучения на сайте Института оценки и показателей здоровья. 14
Хотя бремя ротавируса снизилось за последнее десятилетие, ротавирус продолжает оставаться ведущей причиной смертности от диареи среди детей младше 5 лет, вызывая почти 130000 случаев смерти ежегодно.Ротавирус был третьим ведущим патогеном, связанным со смертностью среди лиц моложе 5 лет в 2016 году, после малярии (517000 смертей) и Streptococcus pneumoniae, (359000 смертей). 4 В среднем более 40% детей младше 5 лет имели эпизод ротавирусной диареи в 2016 году. Однако существует большое расхождение между заболеваемостью и смертностью от ротавирусной инфекции в регионах с высоким и низким уровнем доходов.
Число смертей от диареи среди детей младше 5 лет снизилось более чем на 45% с 2005 года. 4 Изменяющаяся смертность от ротавирусной инфекции отражает значительное глобальное снижение смертности от диареи, которое ранее объяснялось улучшением водоснабжения и санитарии и сокращением недоедания среди детей. Тем не менее, по оценкам, ротавирус является причиной 7% эпизодов диареи у детей младше 5 лет в США и 10% в Канаде, что позволяет предположить, что ротавирус может передаваться другими путями, кроме фекально-орального. 15 Высокая трансмиссивность ротавируса и сложность борьбы с ним делают широкое прививочное покрытие приоритетом.
Ротавирусная вакцина и бремя диарейных заболеваний
К концу 2015 года Гави, Альянс вакцин, профинансировал внедрение ротавирусной вакцины в 37 странах, а также в Демократической Республике Конго, Бангладеш и Нигерии, внедрение которых планируется в Пакистане и Индии в ближайшем будущем, 16 тогда как В целом вакцину внедрили 92 страны. 17 Недавно разработанные вакцины, произведенные в Индии 18 или Китае, 19 , вероятно, также будут способствовать более широкому использованию ротавирусной вакцины в этих странах. После этого внедрения ожидается сокращение детской смертности и количества госпитализаций от ротавирусной диареи. В нескольких странах, которые внедрили плановую вакцинацию детей против ротавируса, зарегистрировано меньшее количество случаев тяжелой диареи и ротавирусной болезни, требующей госпитализации 20 и снижение на 22–50% смертности, связанной с диареей. 21 , 22 Настоящее исследование показало, что вакцина уже уменьшила бремя диареи среди лиц моложе 5 лет в нескольких странах, которые внедрили вакцину, включая Финляндию, Руанду и Гану (eTable 5 и eFigure 4 in Приложение). Это исследование предоставит лицам, принимающим решения, ценную информацию для разработки стратегий и достижения международных целей по облегчению значительного бремени диарейных заболеваний.
Сравнение с другими оценками
Исследование ГББ находится в ежегодном цикле публикации, в котором количество смертей от ротавирусной диареи и смертей от всех причин пересчитывается каждый год, что позволяет постепенно улучшать стратегию оценки бремени ротавируса.Сравнение оценок ГББ за 2015 и 2016 гг. Показано на электронном рисунке 5 в Приложении. Число смертей от ротавирусной инфекции среди детей младше 5 лет одинаково между ГББ 2016 (128500; 95% UI, 104500-155600) и GBD 2015 (146000; 95% UI, 118000-183000). 1 , 4
В недавней публикации 23 было проведено всестороннее сравнение оценок ГББ 2013 по смертности, связанной с ротавирусом, и оценок, произведенных Исследовательской группой по эпидемиологии здоровья детей (CHERG), ВОЗ и Центрами по контролю и профилактике заболеваний (CDC).Число смертей от ротавирусной инфекции в исследовании ГББ 2016 ниже, чем оценки других групп. ВОЗ и CDC оценили 215757 смертей в 2013 году, а CHERG – 157398 в 2013 году. 23 -25 Напротив, GBD 2016 оценил 193300 смертей в 2010 году (95% UI, 163800-227500) и 128500 смертей (95% UI, 104500-155600) в 2016 году. Каждый набор оценок использовал разные подходы, исходные данные и допущения модели, чтобы сделать свои выводы. Группы CHERG, а также ВОЗ и CDC использовали одну и ту же оценку смертности от диареи среди лиц моложе 5 лет, которая незначительно превышает оценку ГББ. 23
Данных о заболеваемости диареей и ее причинах мало – проблема, которая часто наиболее распространена в районах с высоким бременем болезни. Впоследствии оценки в этих местах в большей степени полагаются на модели, основанные на прогностической достоверности. Чтобы решить эту проблему недостаточной смертности и этиологических данных, мы распространяли неопределенность на каждом этапе процесса моделирования (см. Рис. 6 в Приложении). Кроме того, в этом исследовании рассматривалась связь между ротавирусной вакциной, госпитализациями и бременем, но его ограничивает тот факт, что во многих странах госпитализация зависит не от тяжести заболевания, а от доступа к медицинской помощи. 26 В таких регионах, где доступ в больницу не ограничен, уровень госпитализаций намного выше. Может произойти сдвиг в использовании диагностики ротавируса с ELISA на молекулярную диагностику, особенно для наблюдения и клинических испытаний. 27 -29 Хотя чувствительность и специфичность диагностики ELISA к частоте обнаружения молекулярной диагностики высоки (> 95%), среди исследований, включенных в этот анализ, может быть ошибка обнаружения, особенно при наличии сильных временных или географических тенденций. в используемых видах диагностики.Использование молекулярной диагностики в качестве стандарта критерия и связь между ИФА и количественной ПЦР, использованные в настоящем исследовании, были подтверждены одним исследованием случай-контроль (GEMS). 8 , 10 Кроме того, поскольку GEMS был исследованием умеренной и тяжелой диареи, это исследование делает предположение, что причина тяжелой диареи сравнима с причиной фатальной диареи.
Эти результаты позволяют предположить, что ротавирус по-прежнему является широко распространенной причиной диареи во всем мире и является причиной значительного несмертельного бремени диареи во всем мире.Эти результаты требуют активизации усилий по профилактике ротавирусной инфекции путем активизации усилий по улучшению охвата вакцинацией, водоснабжения и санитарии, а также доступа к медицинской помощи и ее качества. Правительства, доноры и медицинские работники должны использовать эти результаты для снижения бремени ротавируса на страновом, региональном и глобальном уровнях.
Принята к публикации: 18 апреля 2018 г.
Автор для корреспонденции: Robert C.Райнер-младший, доктор философии, Институт показателей и оценки здоровья, 2301 Fifth Ave, Ste 600, Seattle, WA 98121 ([email protected]).
Опубликовано в Интернете: 13 августа 2018 г. doi: 10.1001 / jamapediatrics.2018.1960
Открытый доступ: Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии CC-BY. © 2018 Troeger C et al. JAMA Педиатрия .
Вклад авторов: Доктора Райнер и Хэй имели полный доступ ко всем данным в исследовании и несли ответственность за целостность данных и точность анализа данных.
Концепция и дизайн: Трегер, Халил, Рао, Ахмед, Брюэр, Мвенда, Парашар, Стил, Мюррей, Хэй, Райнер.
Сбор, анализ или интерпретация данных: Трегер, Халил, Цао, Блэкер, Ахмед, Армах, Бинс, Коломбара, Канг, Киркпатрик, Кирквуд, Петри, Риддл, Стил, Томпсон, Уолсон, Сандерс, Мокдад, Райнер .
Составление рукописи: Трегер, Халил, Рао, Цао, Блэкер, Стил, Уолсон, Райнер.
Критический пересмотр рукописи на предмет важного интеллектуального содержания: Трегер, Блэкер, Ахмед, Армах, Бинс, Брюэр, Коломбара, Канг, Киркпатрик, Кирквуд, Мвенда, Парашар, Петри, Риддл, Стил, Томпсон, Уолсон, Сандерс, Мокдад, Мюррей, Хэй, Райнер.
Статистический анализ: Troeger, Cao, Hay, Reiner.
Получено финансирование: Ахмед, Мюррей.
Административная, техническая или материальная поддержка: Рао, Блэкер, Ахмед, Канг, Мвенда, Риддл, Хэй.
Наблюдение: Халил, Рао, Ахмед, Томпсон, Мокдад, Мюррей, Хэй, Райнер.
Раскрытие информации о конфликте интересов: Не сообщалось.
Финансирование / поддержка: Этот анализ исследования глобального бремени болезней, травм и факторов риска был поддержан грантом OPP1132415 Фонда Билла и Мелинды Гейтс.
Роль спонсора / спонсора: Источник финансирования не участвовал в разработке и проведении исследования; сбор, управление, анализ и интерпретация данных; подготовка, рецензирование или утверждение рукописи; и решение представить рукопись для публикации.
Заявление об ограничении ответственности: Мнения и утверждения, выраженные здесь доктором Риддлом, не обязательно отражают официальную политику или позицию Университета силовых структур или Министерства обороны США.
1. Сотрудники GBD по борьбе с диарейными заболеваниями. Оценки глобальной, региональной и национальной заболеваемости, смертности и этиологии диарейных заболеваний: систематический анализ для исследования глобального бремени болезней 2015 г. Lancet Infect Dis . 2017; 17 (9): 909-948. DOI: 10.1016 / S1473-3099 (17) 30276-1PubMedGoogle ScholarCrossref 2.GBD 2015 Смертность и причины смерти соавторов. Ожидаемая продолжительность жизни на глобальном, региональном и национальном уровнях, смертность от всех причин и смертность от конкретных причин для 249 причин смерти, 1980-2015 гг .: систематический анализ для исследования глобального бремени болезней 2015 г. Ланцет . 2016; 388 (10053): 1459-1544. DOI: 10.1016 / S0140-6736 (16) 31012-1PubMedGoogle ScholarCrossref 3. Всемирная организация здравоохранения. Ротавирусные вакцины: новости. Wkly Epidemiol Rec . 2009; 84 (50): 533-540.PubMedGoogle Scholar4.GBD 2016 Причины смерти соавторов. Глобальная, региональная и национальная возрастная смертность от 264 причин смерти, 1980–2016 гг .: систематический анализ для исследования глобального бремени болезней, 2016 г. Lancet . 2017; 390 (10100): 1151-1210.DOI: 10.1016 / S0140-6736 (17) 32152-9PubMedGoogle ScholarCrossref 5.GBD 2016 Заболеваемость и травматизм, соавторы. Глобальная, региональная и национальная заболеваемость, распространенность и годы, прожитые с инвалидностью для 328 заболеваний и травм в 195 странах, 1990-2016 гг .: систематический анализ для исследования глобального бремени болезней 2016 г. Lancet . 2017; 390 (10100): 1211-1259. DOI: 10.1016 / S0140-6736 (17) 32154-2PubMedGoogle ScholarCrossref 10.Kotloff KL, Натаро JP, Blackwelder ТУАЛЕТ, и другие.Бремя и этиология диарейных заболеваний у детей грудного и раннего возраста в развивающихся странах (Глобальное многоцентровое исследование кишечных заболеваний, GEMS): проспективное исследование случай-контроль. Ланцет . 2013; 382 (9888): 209-222. DOI: 10.1016 / S0140-6736 (13) 60844-2PubMedGoogle ScholarCrossref 12.GBD 2016 Факторы риска Соавторы. Глобальная, региональная и национальная сравнительная оценка 84 поведенческих, экологических, профессиональных и метаболических рисков или групп рисков, 1990-2016 гг .: систематический анализ для исследования глобального бремени болезней 2016 г. Ланцет . 2017; 390 (10100): 1345-1422. DOI: 10.1016 / S0140-6736 (17) 32366-8PubMedGoogle ScholarCrossref 19.Zhen С-С, Ли Y, Ван С-М, и другие. Эффективность живой аттенуированной ротавирусной вакцины, произведенной отечественным производителем в Китае, изучалась с использованием популяционного дизайна «случай-контроль». Эмерджентные микробы заразят . 2015; 4 (10): e64. DOI: 10.1038 / emi.2015.64PubMedGoogle ScholarCrossref 25.Lanata CF, Фишер-Уокер CL, Оласкоага AC, Торрес CX, Арье MJ, черный RE; Справочная группа по эпидемиологии здоровья детей Всемирной организации здравоохранения и ЮНИСЕФ.Глобальные причины смертности от диарейных болезней у детей PLoS One . 2013; 8 (9): e72788. DOI: 10.1371 / journal.pone.0072788PubMedGoogle ScholarCrossref 28.Platts-Mills JA, Бабджи С, Бодхидатта L, и другие; Исследователи сети MAL-ED. Патоген-специфическое бремя общинной диареи в развивающихся странах: многопрофильное когортное исследование (MAL-ED). Ланцетный шар Здоровье . 2015; 3 (9): e564-e575. DOI: 10.1016 / S2214-109X (15) 00151-5PubMedGoogle ScholarCrossref 29.Operario DJ, Platts-Mills JA, Надан S, и другие. Этиология тяжелой острой водянистой диареи у детей в глобальной сети эпиднадзора за ротавирусами с использованием количественной полимеразной цепной реакции. J Заразить Dis . 2017; 216 (2): 220-227. DOI: 10.1093 / infdis / jix294PubMedGoogle ScholarCrossrefРотавирусная инфекция – Knowledge @ AMBOSS
Последнее обновление: 24 марта 2020 г.
Резюме
Ротавирусы являются частой причиной вирусного гастроэнтерита у младенцев и детей раннего возраста и передаются фекально-оральным путем.После короткого инкубационного периода от одного до трех дней у пациентов наблюдаются рвота, водянистая диарея, сильная лихорадка и недомогание. Диагноз устанавливается путем обнаружения антигена в кале. Лечение является поддерживающим и в основном включает замену жидкости, хотя инфекцию можно полностью предотвратить с помощью вакцинации.
Эпидемиология
- Основная причина тяжелой диареи у младенцев и детей в США (особенно зимой) [1]
- Основная причина тяжелой диареи среди младенцев и детей во всем мире, хотя все возрастные группы восприимчивы к инфекции.
- Чаще всего встречается в яслях и детских садах
Ссылки: [2] [3] [4]
Эпидемиологические данные относятся к США, если не указано иное.
Этиология
- Возбудитель: Ротавирус – это реовирус без оболочки, сегментированный, двухцепочечной РНК.
- Передача: фекально-оральный путь (например, при контакте с руками, предметами, пищей, водой, зараженной вирусом)
Каталожные номера: [5] [6]
Патофизиология
Клинические особенности
Ссылки: [3]
Диагностика
Каталожные номера: [7]
Дифференциальный диагноз
Перечисленные здесь дифференциальные диагнозы не являются исчерпывающими.
Лечение
Каталожные номера: [8]
Профилактика
Ссылки: [9] [10] [11]
Список литературы
- Норовирус – бремя болезней и вспышек норовируса. https://www.cdc.gov/norovirus/php/illness-outbreaks.html . Обновлено: 8 июля 2014 г. Доступ: 22 марта 2017 г.
- Здоровый персонал. Легкая, умеренная или тяжелая диарея: обзор темы. Легкая, умеренная или тяжелая диарея: обзор темы . Нью-Йорк, штат Нью-Йорк: WebMD. http://www.webmd.com/a-to-z-guides/tc/mild-moderate-or-severe-diarrhea-topic-overview . Обновлено: 21 августа 2015 г. Дата обращения: 27 марта 2017 г.
- Эпидемиология и профилактика заболеваний, предупреждаемых с помощью вакцин – ротавирус.
- Ле Т, Бхушан В., Сочат М., Чавда Й., Абрамс Дж., Калани М., Каллианос К., Вайдьянатан В. Первая помощь для USMLE Step 1 2019 .McGraw-Hill Medical
- Ротавирус – передача. https://www.cdc.gov/rotavirus/about/transmission.html . Обновлено: 12 августа 2016 г. Доступ: 27 марта 2017 г.
- Хаахайм Л. Р., Паттисон-младший, Уитли Р. Дж. Практическое руководство по клинической вирусологии . Джон Уайли и сыновья ; 2002 г.
- Профилактика ротавирусного гастроэнтерита среди младенцев и детей: рекомендации Консультативного комитета по практике иммунизации (ACIP). https://www.cdc.gov/mmwr/preview/mmwrhtml/rr5802a1.htm . Обновлено: 6 февраля 2009 г. Доступ: 27 марта 2017 г.
- Ротавирус – Лечение. https://www.cdc.gov/rotavirus/about/treatment.html . Обновлено: 12 августа 2016 г. Доступ: 27 марта 2017 г.
- Центры по контролю и профилактике заболеваний. Добавление истории инвагинации как противопоказания к вакцинации против ротавируса. MMWR Morb Mortal Wkly Rep . 2011; 60 (41): с. 1427.
- Информационный бюллетень Наблюдаемая частота реакций на вакцины Ротавирусная вакцина.
- Информационные сообщения о вакцинах (VIS): Rotavirus VIS. https://www.cdc.gov/vaccines/hcp/vis/vis-statements/rotavirus.html . Обновлено: 18 октября 2016 г. Доступ: 27 марта 2017 г.
Защитный иммунитет после естественной ротавирусной инфекции: общинное когортное исследование новорожденных детей в Гвинее-Бисау, Западная Африка | Журнал инфекционных болезней
Абстрактные
Для изучения естественного течения ротавирусной инфекции и определения защиты, которую она обеспечивает от повторного заражения и диареи, в Гвинее-Бисау было проспективно обследовано 200 новорожденных в течение 2 лет.Ротавирус был обнаружен в образцах стула, собираемых еженедельно. К 2 годам частота первичной ротавирусной инфекции составила 74%. В первые 3 месяца жизни 17% инфекций были связаны с диареей по сравнению с 60% через 9–11 месяцев; после 18 месяцев все инфекции протекали бессимптомно. Первичная инфекция обеспечивала 52% (95% доверительный интервал [ДИ], 16–73%) и 70% (95% доверительный интервал, 29–87%) защиту от последующей ротавирусной инфекции и ротавирусной диареи, соответственно. Защита от повторного заражения в рамках той же эпидемии составила 66% (95% ДИ, от 24% до 85%) по сравнению с 34% (95% ДИ, от –29% до 67%) от повторного заражения в любой последующей эпидемии.Высокий уровень защиты от симптоматической ротавирусной инфекции является важным стимулом для разработки ротавирусной вакцины
.Ротавирус является ведущей причиной тяжелой диареи у детей во всем мире, на нее приходится около одной трети всех случаев тяжелой диареи, требующей госпитализации, и ежегодно вызывая 450 000–800 000 из 2,2 миллиона случаев смерти, связанных с диареей [1, 2]. По нашим оценкам, ротавирус вызывает 145 000 смертей ежегодно среди детей младше 5 лет в странах Африки к югу от Сахары [3].Практически все дети инфицированы ротавирусом до достижения ими второго дня рождения как в развивающихся, так и в промышленно развитых странах [2]. Маловероятно, что экологические меры по улучшению гигиенических условий и обеспечению безопасной водой и продуктами питания уменьшат заболеваемость ротавирусной диареей [2]. Поскольку не существует эффективного специфического лечения, вакцинация является основной стратегией борьбы с заболеванием [4]
Иммунизация живыми аттенуированными ротавирусами предназначена для имитации естественной ротавирусной инфекции, обеспечивая защиту от тяжелых заболеваний [5].Разработка ротавирусной вакцины столкнулась с серьезной неудачей, когда было обнаружено, что недавно лицензированная реассортантная ротавирусная вакцина-резус связана с инвагинацией у детей раннего возраста [6] оценка эффективности новых ротавирусных вакцин. Ранние эпидемиологические исследования иммунитета, вызываемого ротавирусной инфекцией, дали разные результаты, от практически полного отсутствия защиты от ротавирусной инфекции и / или заболевания [7, 8] до почти полной [9–11] защиты от ротавирусной диареи.Чтобы описать естественное течение и частоту ротавирусной инфекции, а также оценить защиту, которую естественная инфекция обеспечивает против новой ротавирусной инфекции, мы провели когортное исследование детей, наблюдаемых от рождения до возраста 2 лет
Методы
Дизайн исследования Исследование было проведено в рамках проспективного эпиднадзора за диарейными заболеваниями на уровне общин в пригородных районах Бандим II и Белен в Бисау, столице Гвинеи-Бисау.В общей сложности 603 дома в исследуемой зоне были отобраны случайным образом, и 200 детей, родившихся в этих домах в период с 15 января 1996 г. по 14 января 1997 г., были набраны в течение ~ 3 недель (диапазон, 0–24 дня) после рождения и контролировались с еженедельными посещениями, которые включал забор стула, независимо от того, была ли у ребенка диарея. Из-за военного конфликта весной 1998 года наблюдение за 46 детьми было прекращено. Дата закрытия исследования была ретроспективно определена как 28 апреля 1998 г.
Обнаружение ротавируса Образцы стула были протестированы на ротавирус с помощью набора IDEA ELISA (Dako), как описано производителем
Определения Ребенок был отнесен к категории с диареей или отсутствие диареи в соответствии с информацией, предоставленной лицом, осуществляющим уход, в день взятия пробы.Мы считали, что результаты анализа каждого образца стула представляют до 7 неперекрывающихся дней наблюдения с центром в день сбора образца. Запланированное время наблюдения было определено как период между днем включения и последним днем наблюдения. Ребенок считался инфицированным ротавирусом, когда образец кала был положительным в ELISA на ротавирус. Непрерывная инфекция определялась как серия образцов с положительным результатом на ротавирус, собранных у одного и того же ребенка с разницей в менее 14 дней и без отрицательных образцов.Для таких постоянных инфекций в анализ был включен только первый образец с положительным результатом на ротавирус. Мы считали, что ребенок подвергается риску последующей инфекции после окончания 7-дневного периода после инфицирования
Статистический анализ Заболеваемость рассчитывалась как количество эпизодов на 100 месяцев ребенка в группе риска. Для оценки среднего возраста детей по окончании кормления грудью мы использовали метод Каплана-Мейера. Для определения совокупной заболеваемости первичными ротавирусными инфекциями мы использовали модификацию оценки Каплана-Мейера [12], которая учитывает пробелы в сроках наблюдения.Мы использовали логистическую регрессию для оценки скорректированного по возрасту отношения шансов (OR) для связи между ротавирусной инфекцией и диареей, а также для оценки защитного иммунитета, вызванного ротавирусными инфекциями. Чтобы учесть повторяющиеся записи одного и того же ребенка, мы использовали обобщенные уравнения оценки с составной симметричной (заменяемой) матрицей ковариации и дисперсии [13]. Образцы стула собирали еженедельно на рутинной основе, что отражалось в том, что среднее время риска, связанное с каждым посещением, было одинаковым (6.5 дней), независимо от того, был ли ребенок инфицирован ротавирусом. Следовательно, полученные OR были прямыми измерениями, а не смещенными оценками соответствующих коэффициентов заболеваемости [14]. Процент защиты от последующей инфекции или заболевания рассчитывали как (1-OR) × 100%. Данное воздействие считалось фактором, влияющим на оценку патогенности, если OR изменилось> 10% после добавления переменной, указывающей статус воздействия модели
В Гвинее-Бисау ротавирусные инфекции появляются в ежегодных эпидемиях с января по март. [3].Инфекции у одного и того же ребенка с интервалом> 180 дней были определены как происходящие в разных эпидемиях, тогда как инфекции, произошедшие в течение 180 дней, рассматривались как происходящие в одной и той же эпидемии. Мы использовали вложенные переменные с кодировкой индикаторов [15], чтобы сравнить защиту от повторного заражения ротавирусом и диареи при одной и той же эпидемии по сравнению с любой последующей эпидемией. Кратность разницы в защите рассчитывалась как OR для инфекции или диареи в любой последующей эпидемии, деленное на OR для инфекции или диареи в той же эпидемии.Статистический анализ проводился с помощью системы SAS (версия 8.02; SAS Institute)
Результаты
Когортный мониторинг Из 200 исследуемых детей 104 (52%) были мальчиками. На исследуемой территории проживает большинство основных этнических групп Гвинеи-Бисау [16]. Продолжительное грудное вскармливание является обычным явлением в Гвинее-Бисау [16], и 93,5% детей в нашем исследовании находились на грудном вскармливании во время сбора образцов. В возрасте 1 года 99% детей находились на частичном грудном вскармливании, 83% – в возрасте 1 года.5 лет и 30% в возрасте 2 лет. Наблюдаемый средний возраст прекращения грудного вскармливания составлял 21,5 месяца (межквартильный размах [IQR], 18,5–24,0 месяца). За период наблюдения умерло 18 детей, 10 – на первом году жизни. В общей сложности 38 детей переехали из исследуемой области, а наблюдение еще за 46 детьми было прервано вспышкой военного конфликта в июне 1998 года. Всего 102 ребенка были потеряны для наблюдения в возрасте до 2 лет. Мы наблюдали за детьми в среднем 18,4 месяца (IQR, 13.1–22,3 месяца). За 200 детьми наблюдали 74 791 ребенок-день, что составило 88% (IQR, 74–95%) от общего запланированного времени наблюдения
В целом мы собрали 11 987 образцов, что составляет 88% (IQR, 73%). –95%) запланированных образцов и проанализировали 11 406 из них на ротавирус. Ротавирус выявлен в 132 образцах стула. Шестнадцать изолятов считались частью непрерывных инфекций, в результате чего оставалось 116 различных ротавирусных инфекций, из которых 94 считались первичными инфекциями, 18 – вторыми инфекциями и 4 – третьими инфекциями
Заболеваемость и связь с диареей Общая заболеваемость ротавирусных инфекций, в том числе 22 повторных инфицирования, составило 0.6 инфекций на ребенка в год. По оценкам Каплана-Мейера, 26% детей переживут первичную инфекцию в возрасте 6 месяцев, 46% – в возрасте 1 года и 74% – в возрасте 2 лет (рисунок 1). Из 116 ротавирусных инфекций 46 (40%) были связаны с диареей по сравнению с 10% (1135 из 11 272) ротавирусно-отрицательных образцов. Скорректированный по возрасту OR для связи между ротавирусом и диареей составил 5,9 (95% доверительный интервал [ДИ]: 3,9–8,8). Кормление грудью и секс не влияли на эту оценку патогенности.Симптоматические инфекции были нечастыми в раннем младенчестве, но стали более частыми с увеличением возраста и достигли пика в возрасте 9–11 месяцев (таблица 1). Ротавирусная инфекция не была связана с диареей у детей в возрасте 18–24 месяцев
Диаграмма 1
Кумулятивная заболеваемость первичными ротавирусными инфекциями в когорте новорожденных из 200 детей, наблюдаемых до возраста 2 лет, в Гвинее-Бисау, 1996–1998 гг.
Диаграмма 1
Кумулятивная заболеваемость первичными ротавирусными инфекциями в когорте новорожденных из 200 детей наблюдались до 2 лет в Гвинее-Бисау, 1996–1998
Таблица 1
Возрастная заболеваемость ротавирусными инфекциями в когорте новорожденных из 200 детей, мониторинг которых продолжался до 2 лет в Бисау, Гвинея-Бисау, 1996–1998
Таблица 1
Возрастная заболеваемость ротавирусными инфекциями в когорта новорожденных из 200 детей, мониторинг которых продолжался до 2 лет в Бисау, Гвинея-Бисау, 1996–1998
Сезонность ротавирусных инфекций За некоторыми исключениями, ротавирусные инфекции были ограничены относительно более прохладным и засушливым периодом с января по март ( рисунок 2)
Рисунок 2
Сезонное изменение ротавирусных инфекций у детей младше 2 лет в когорте новорожденных из 200 детей, наблюдаемых до возраста 2 лет, в Гвинее-Бисау, 1996–1998
Рисунок 2
Сезонные колебания ротавирусных инфекций в дети <2 лет в когорте новорожденных из 200 детей, наблюдаемых до возраста 2 лет в Гвинее-Бисау, 1996–1998 гг.
Защита, обеспечиваемая естественной ротавирусной инфекцией Из первичных ротавирусных инфекций 44% имели симптомы.Во время второй и третьей инфекции только 20% детей испытали диарею. Частота первичных ротавирусных инфекций составила 5,37 на 100 месяцев ребенка по сравнению с 3,08 на 100 месяцев ребенка при последующих инфекциях. Соответствующий грубый OR составил 0,57, тогда как OR с поправкой на возраст и повторные записи одного и того же ребенка составил 0,48 (95% ДИ, 0,27–0,84; таблица 2). Точно так же общий OR для ротавирусной диареи при первичных и последующих инфекциях был идентичен таковому для скорректированного OR (0,30 [95% ДИ, 0.13–0.71]). Другими словами, естественная ротавирусная инфекция обеспечивала 52% и 70% защиту от последующей ротавирусной инфекции и диареи, соответственно
Таблица 2
Многомерные отношения шансов (OR) и защита, обеспечиваемая естественными ротавирусными инфекциями против последующей ротавирусной инфекции и ротавирусной диареи в когорте из 200 детей, наблюдаемых на срок до 2 лет в Гвинее-Бисау
Таблица 2
Многомерные коэффициенты соотношения (OR) и защита, обеспечиваемая естественными ротавирусными инфекциями против последующей ротавирусной инфекции и ротавирусной диареи в когорте новорожденных из 200 детей, наблюдаемых на срок до 2 лет в Гвинее-Бисау
OR для симптоматической послеродовой инфекции было 0.30 (95% ДИ, 0,13–0,71), что соответствует 70% защите от ротавирусной диареи. Оценки защиты от повторного заражения в рамках одной и той же эпидемии и в любой последующей эпидемии составили 66% (95% ДИ, 24–85%) и 34% (95% ДИ, –29–67%), соответственно (таблица 3). Таким образом, защита от новой ротавирусной инфекции при той же эпидемии была в 1,9 раза выше (95% ДИ, 0,8–4,6) по сравнению с защитой при любой последующей эпидемии. Защита от ротавирусной диареи составляла 75% (95% ДИ, 10–93%) и 62% (95% ДИ, от –17% до 88%) в той же самой и в любой последующей эпидемии, соответственно, а защита от ротавирусной диареи соответственно было 1.В 5 раз выше (95% ДИ, 0,3–8,2) при той же эпидемии. В дополнительных анализах мы исключили месяцы, когда ротавирусные инфекции были редкими (например, с апреля по декабрь), и обнаружили, что естественная ротавирусная инфекция обеспечивает 54% (95% ДИ, 19–74%) защиту от повторного заражения и 81% (95%). % ДИ, от -44% до 94%) защита от ротавирусной диареи. Защита от повторного заражения при той же эпидемии по сравнению с любой последующей эпидемией составляла 77% (95% ДИ, 41% –91%) и 31% (95% ДИ, от –47% до 67%), соответственно. Таким образом, защита от ротавирусной инфекции составила 3.0 раз выше (95% ДИ, 1,1–8,3) при той же эпидемии, по сравнению с защитой при любой последующей эпидемии
Таблица 3
Многомерные отношения шансов (OR) для постпервичных ротавирусных инфекций и заболевания в когортном исследовании новорожденных с участием 200 детей, наблюдаемых на срок до 2 лет в Гвинее-Бисау
Таблица 3
Многомерные отношения шансов (OR) для постпервичного ротавируса инфекции и болезни в когортном исследовании новорожденных с участием 200 детей, находящихся под наблюдением до 2 лет в Гвинее-Бисау
Обсуждение
В этом продольном когортном исследовании новорожденных в Западной Африке мы подсчитали, что 74% детей заболеют ротавирусной инфекцией до своего второго дня рождения.Вероятно, это консервативная оценка, потому что наш еженедельный отбор проб стула, вероятно, не смог выявить инфекции с выделением ротавируса менее 7 дней, и потому что мы не включали серологические тесты [11]. Более того, дети могли быть потеряны для последующего наблюдения во время эпидемий ротавируса, потому что некоторые из них сопровождали своих матерей за пределами области исследования во время ежегодного сбора кешью к концу эпидемии
Высокая патогенность ротавируса (OR, 5.9) подтверждает предыдущее наблюдение что ротавирус является важной причиной диарейных заболеваний среди детей в Гвинее-Бисау [3].Низкая доля симптоматических инфекций в течение первых 3–6 месяцев жизни, когда почти 98% детей в нашем исследовании находились на грудном вскармливании, подтверждает результаты более ранних лонгитюдных исследований [17, 18] и поддерживает предположения о защитной роли для материнского иммунитета и грудного вскармливания [7, 18, 19]. Пик заболеваемости ротавирусной диареей в возрасте 12–14 месяцев наблюдался примерно в том же возрасте, что и в других исследованиях в Африке [17, 18]. ротавирусные инфекции.Естественная ротавирусная инфекция обеспечивала 52% и 70% защиту от последующей инфекции и ротавирусной диареи, соответственно. Риск внесения систематической ошибки из-за выборочного отказа от последующего наблюдения за детьми более старшего возраста побудил нас провести дополнительный анализ, в котором мы ограничили набор данных, чтобы он включал только детей с ≥85% запланированного времени наблюдения. Затем было обнаружено, что защита от реинфекции, обеспечиваемая естественной ротавирусной инфекцией, составила 64% (95% ДИ, 17–84%) (данные не показаны).Следовательно, включение детей с менее чем 85% запланированного времени наблюдения вряд ли искусственно завышало оценки защиты. включены для выявления инфекций [11]. Однако наше исследование подтверждает главный вывод мексиканского исследования, в котором защита, обеспечиваемая ротавирусной инфекцией против последующей ротавирусной инфекции и ротавирусной диареи, составила 38% и 77% соответственно.Низкая патогенность у детей 18–24 месяцев в настоящем исследовании подтверждает результаты других когортных исследований [17, 18, 20] и, вероятно, отражает высокую степень защиты, обеспечиваемую естественными ротавирусными инфекциями в раннем возрасте
В настоящем исследовании защита от ротавирусной инфекции при любой последующей эпидемии была в 1,9 раза ниже, чем при той же самой эпидемии. Поскольку наши оценки основаны на заболеваемости, не должно быть систематической ошибки, связанной со временем постпервичного события (т.е., произошло ли это в начале или в конце сезона эпидемии). Чтобы выяснить, может ли более высокий уровень защиты во время одной и той же эпидемии быть объясненным смещением, внесенным критериями, которые мы использовали для классификации того, возникла ли постпервичная инфекция в той же самой или в последующей эпидемии, мы ограничили данные, включив только эпидемии ротавируса. Тогда кратность разницы составила 3,0, что указывает на то, что 1,9 может быть консервативной оценкой
Хотя наши оценки неточны и должны интерпретироваться с осторожностью, другие также сообщали о потере защиты от повторного заражения со временем от инфекции [21, 22].Возможное снижение защиты с течением времени может быть связано с ослаблением иммунитета к ротавирусу, ежегодными сдвигами в преобладающих серотипах ротавируса [23] с недостаточной перекрестной защитой или быть связано с динамикой передачи в непосредственном окружении ребенка. Независимо от основных механизмов, наши результаты подчеркивают необходимость включения долгосрочного наблюдения (с минимальной продолжительностью, охватывающей 2 сезона ротавируса), включая профилирование генотипа изолированных ротавирусов в будущих когортных исследованиях иммунитета против ротавируса и в испытаниях ротавирусной вакцины
Мы пришли к выводу, что естественная ротавирусная инфекция обеспечивает высокий уровень защиты от ротавирусной инфекции и ротавирусной диареи.Это важный вывод для стратегии иммунизации маленьких детей и, таким образом, защиты их от ротавирусной диареи в первые критические годы жизни
Благодарности
Мы благодарим Хенрика Йенсена и Пера Краг Андерсена за советы во время статистического анализа
Источники
1,.Анализ политики использования гепатита B, Haemophilus influenzae type B, Streptococcus pneumoniae –конъюгированная и ротавирусная вакцины в национальных календарях иммунизации
,Health Econ
,2000
, vol.9
(стр.19
–35
) 2.Rotavirus
,Emerg Infect Dis
,1998
, vol.4
(стр.561
–70
) 3,,.Оценка смертности от ротавирусных инфекций в странах Африки к югу от Сахары
,Vaccine
,2000
, vol.19
(стр.393
–5
) 4“ и др.Обновленная информация о «Дженнеровском» и модифицированном «Дженнеровском» подходе к вакцинации младенцев и детей раннего возраста от ротавирусной диареи
,Adv Exp Med Biol
,1992
, vol.327
(стр.59
–69
) 5,.Ротавирусные вакцины: обзор
,Clin Microbiol Rev
,1996
, vol.9
(стр.423
–34
) 6“ и др.Популяционное исследование ротавирусной вакцинации и инвагинации
,Pediatr Infect Dis J
,2001
, vol.20
(стр.410
–6
) 7,,,,,.Эпидемиология ротавирусов в когорте из 45 детей гватемальских индейцев майя, наблюдаемых от рождения до трехлетнего возраста
,J Infect Dis
,1983
, vol.148
(стр.452
–61
) 8,,, et al.Наблюдательное исследование естественного иммунитета к ротавирусной диарее в когорте из 363 египетских детей: расчет риска вторых эпизодов с использованием возрастных человеко-лет наблюдения
,Am J Epidemiol
,1989
, vol.130
(стр.981
–8
) 9.Защита, обеспечиваемая ротавирусной инфекцией новорожденных против последующей ротавирусной диареи
,J Infect Dis
,1993
, vol.168
(стр.282
–7
) 10,,,,.Проспективное продольное исследование ротавирусных инфекций у детей от рождения до двух лет в Центральной Африке
,Ann Inst Pasteur Virol
,1988
, vol.139
(стр.421
–8
) 11,,, et al.Ротавирусные инфекции у младенцев как защита от последующих инфекций
,N Engl J Med
,1996
, vol.335
(стр.1022
–8
) 12Андерсен
,PK
“Borgan Ø
“Keiding
,N
.Оценщик Каплана-Мейера: статистические модели, основанные на процессах подсчета
13,,.Энциклопедия биостатистики
14,. ,Меры заболеваемости
,1998
, т.Современная эпидемиология. 2-е изд
Филадельфия
Липпинкотт-Рэйвен
стр.29
15,Хиллз М.Проверка
гипотез
.Статистические модели в эпидемиологии
16,,,,,.Продолжительное грудное вскармливание, диарейные заболевания и выживаемость детей в Гвинее-Бисау
,BMJ
,1994
, vol.308
(стр.1403
–6
) 17“ и др.Эпидемиология ротавирусной диареи у детей Египта и ее значение для борьбы с болезнями
,Am J Epidemiol
,1999
, vol.150
(стр.770
–7
) 18“ и др.Обнаружение энтеропатогенов при острой диарее в семейной когорте населения в сельских районах Египта
,Am J Trop Med Hyg
,1986
, vol.35
(стр.1013
–22
) 19,,,,.Ротавирусные инфекции у маленьких никарагуанских детей
,Pediatr Infect Dis J
,1997
, vol.16
(стр.564
–71
) 20,,,,,.Проспективное исследование внебольничной ротавирусной инфекции
,J Clin Microbiol
,1989
, vol.27
(стр.2083
–90
) 21,,,.Защитная эффективность естественной ротавирусной инфекции в популяции американских индейцев
,J Infect Dis
,1998
, vol.178
(стр.1562
–6
) 22.Корреляты защиты от ротавирусной инфекции и болезней
,Novartis Found Symp
,2001
, vol.238
(стр.106
–13
) 23“ и др.Профили генотипов штаммов ротавирусов, полученных от детей из пригорода в Гвинее-Бисау, Западная Африка
,J Clin Microbiol
,2000
, vol.38
(стр.264
–7
)© 2002 Американским обществом инфекционных болезней
Ротавирусная инфекция у детей в Юго-Восточной Азии, 2008–2018 гг .: бремя болезней, распределение генотипов, сезонность и вакцинация | Журнал биомедицинских наук
Dodet B, Heseltine E, Mary C, Saliou P. Ротавирусы в медицине и ветеринарии. Санте. 1997. 7 (3): 195–9.
CAS PubMed Google Scholar
Adam WR, Kraft LM. Эпизоотическая диарея детенышей мышей: определение этиологического агента. Наука. 1963. 141 (3578): 359–60.
Артикул Google Scholar
Mebus CA, Underdahl NR, Rhodes MB, Twiehaus MJ.Диарея теленка (чистки): воспроизведена вирусом из полевой вспышки. В: Бюллетени исторических исследований опытной сельскохозяйственной станции Небраски, т. 69; 1969. с. 1913–93. http://digitalcommons.unl.edu/ardhistrb/69.
Google Scholar
Malherbe HH, Strickland-Cholmley M. Вирус обезьяны SA11 и родственный агент О. Arch Gesamte Virusforsch. 1967. 22 (1): 235–45.
CAS PubMed Статья Google Scholar
Епископ РФ, Дэвидсон Г.П., Холмс И.Х., Рак Б.Дж. Частицы вируса в эпителиальных клетках слизистой оболочки двенадцатиперстной кишки детей с острым небактериальным гастроэнтеритом. Ланцет. 1973; 2 (7841): 1281–3.
CAS PubMed Статья Google Scholar
Епископ РФ, Дэвидсон Г.П., Холмс И.Х., Рак Б.Дж. Обнаружение нового вируса с помощью электронной микроскопии фекальных экстрактов у детей с острым гастроэнтеритом. Ланцет. 1974; 1 (7849): 149–51.
CAS PubMed Статья Google Scholar
Флюетт Т.Х., Брайден А.С., Дэвис Х. Письмо: вирусные частицы при гастроэнтерите. Ланцет. 1973; 2 (7844): 1497.
CAS PubMed Статья Google Scholar
Flewett TH, Bryden AS, Davies H, Woode GN, Bridger JC, Derrick JM. Связь вирусов острого гастроэнтерита у детей и новорожденных телят.Ланцет. 1974. 304 (7872): 61–3.
Артикул Google Scholar
Estes MK, Greenberg HB. Ротавирусы. В: Fields Virology, 6-е изд., Knipe DM, Howley PM et al. 2013. С. 1347–1401. Wolters Kluwer Health / Lippincott Williams and Wilkins, Филадельфия.
Google Scholar
Chen JZ, Settembre EC, Aoki ST, Zhang X, Bellamy AR, Dormitzer PR, et al. Молекулярные взаимодействия в сборке ротавируса и снятии оболочки, наблюдаемые с помощью крио-ЭМ высокого разрешения.Proc Natl Acad Sci U S. A. 2009; 106 (26): 10644–8.
CAS PubMed PubMed Central Статья Google Scholar
Li Z, Baker ML, Jiang W, Estes MK, Prasad BV. Архитектура ротавируса с субнанометровым разрешением. J Virol. 2009. 83 (4): 1754–66.
CAS PubMed Статья Google Scholar
Settembre EC, Chen JZ, Dormitzer PR, Grigorieff N, Harrison SC.Атомная модель инфекционной частицы ротавируса. EMBO J. 2011; 30 (2): 408–16.
CAS PubMed Статья Google Scholar
Кирквуд CD. Генетическое и антигенное разнообразие ротавирусов человека: потенциальное влияние на программы вакцинации. J Infect Dis. 2010; 202 (Прил.): S43–8.
CAS PubMed Статья Google Scholar
RCWG. Список принятых генотипов.2019; Доступно по ссылке: https://rega.kuleuven.be/cev/viralmetagenomics/virus-classification/rcwg. Цитировано 26 сентября 2019 г.
Google Scholar
Matthijnssens J, Ciarlet M, Heiman E, Arijs I., Delbeke T., McDonald SM, et al. Классификация ротавирусов на основе полного генома выявляет общее происхождение штаммов ротавирусов Wa-подобных и свиней, а также DS-1-подобных штаммов и ротавирусов крупного рогатого скота. J Virol. 2008. 82 (7): 3204–19.
CAS PubMed PubMed Central Статья Google Scholar
Matthijnssens J, Ciarlet M, McDonald SM, Attoui H, Bányai K, Brister JR, et al. Единообразие номенклатуры штаммов ротавирусов, предложенное рабочей группой по классификации ротавирусов (RCWG). Arch Virol. 2011. 156 (8): 1397–413.
CAS PubMed PubMed Central Статья Google Scholar
Matthijnssens J, Van Ranst M. Созвездие генотипов и эволюция ротавирусов группы a, заражающих людей. Curr Opin Virol.2012. 2 (4): 426–33.
CAS PubMed Статья Google Scholar
Matthijnssens J, Otto PH, Ciarlet M, Desselberger U, Van Ranst M, Johne R. Пороговые значения на основе последовательности VP6 в качестве критерия для демаркации видов ротавирусов. Arch Virol. 2012. 157 (6): 1177–82.
CAS PubMed Статья Google Scholar
Михалов-Ковач Э., Геллерт Б, Мартон С., Фаркас С.Л., Фехер Э., Олдал М. и др.Кандидат в новые виды ротавирусов у собак, находящихся в приюте, Венгрия, Emerg Infect Dis. 2015; 21 (4): 660–3.
PubMed PubMed Central Статья CAS Google Scholar
Баньяи К., Кеменези Г., Будински И., Фёльдес Ф., Зана Б., Мартон С. и др. Кандидат в новые виды ротавирусов у летучих мышей Шрайбера, Сербия. Заразить Genet Evol. 2017; 48: 19–26.
PubMed Статья Google Scholar
Phan MVT, Anh PH, Cuong NV, Munnink BBO, van der Hoek L, My PT, et al. Беспристрастное полногеномное глубокое секвенирование образцов стула человека и свиньи показывает циркуляцию нескольких групп ротавирусов и предполагаемую зоонозную инфекцию. Virus Evol. 2016; 2 (2): vew027.
PubMed PubMed Central Статья Google Scholar
Matthijnssens J, Miño S, Papp H, Potgieter C, Novo L, Heylen E, et al. Полный молекулярный анализ генома штаммов ротавируса лошадей с разных континентов выявил несколько новых генотипов и в значительной степени консервативную совокупность генотипов.J Gen Virol. 2012; 93 (Pt 4): 866–75.
CAS PubMed Статья Google Scholar
Schoondermark-van de Ven E, Van Ranst M, de Bruin W, Van den Hurk P, Zeller M, Matthijnssens J, et al. Колония кроликов инфицирована бычьим штаммом ротавируса G6P [11]. Vet Microbiol. 2013. 166 (1–2): 154–64.
CAS PubMed Статья Google Scholar
Рохас М., Гонсалвес Дж. Л., Диас Г. Г., Манчего А., Пезо Д., Сантос Н.Полногеномная характеристика изолята ротавируса перуанской альпаки, экспрессирующего новый генотип VP4. Vet Microbiol. 2016; 196: 27–35.
CAS PubMed Статья Google Scholar
Пикетт Б.Э., Садат Э.Л., Чжан Й., Норонья Д.М., Сквайрс Р.Б., Хант В.и др. ViPR: открытая база данных по биоинформатике и аналитический ресурс для вирусологических исследований. Nucleic Acids Res. 2012; 40 (Выпуск базы данных): D593–8.
CAS PubMed Статья Google Scholar
Pietsch C, Liebert UG. Доказательства предполагаемого происхождения спорадических ротавирусов G6P [9] у людей от кошек. Заразить Genet Evol. 2018; 63: 180–94.
PubMed Статья Google Scholar
O’Shea H, Mulherin E, Matthijnssens J, McCusker MP, Collins PJ, Cashman O, et al. Полный анализ геномной последовательности первой группы ротавирусов жирафов показывает тесную эволюционную связь с ротавирусами, заражающими других представителей парнокопытных.Vet Microbiol. 2014; 170 (1–2): 151–6.
CAS PubMed Статья Google Scholar
Matthijnssens J, Taraporewala ZF, Yang H, Rao S, Yuan L, Cao D, et al. Ротавирусы обезьян обладают дивергентными комбинациями генов, которые возникли в результате межвидовой передачи и реассортации. J Virol. 2010. 84 (4): 2013–26.
CAS PubMed Статья Google Scholar
Марталер Д., Россоу К., Грамер М., Коллинз Дж., Гоял С., Цунэмицу Х. и др. Обнаружение значительного генетического разнообразия ротавирусов группы B свиней в Соединенных Штатах, что привело к изменению предложения по классификации генотипов G. Вирусология. 2012. 433 (1): 85–96.
CAS PubMed PubMed Central Статья Google Scholar
Trovão NS, Shepherd FK, Herzberg K, Jarvis MC, Lam HC, Rovira A, et al. Эволюция ротавируса С у людей и некоторых видов домашних животных.Зоонозы в области общественного здравоохранения. 2019; 66 (5): 546–57.
PubMed Статья CAS Google Scholar
Коллинз П.Дж., Мартелла В., О’Ши Х. Обнаружение и характеристика ротавирусов группы С у бессимптомных поросят в Ирландии. J Clin Microbiol. 2008. 46 (9): 2973–9.
CAS PubMed PubMed Central Статья Google Scholar
Дхама К., Саминатан М., Картик К., Тивари Р., Шаббир М.З., Кумар Н. и др.Птичий ротавирусный энтерит – обновленный обзор. Vet Q.2015; 35 (3): 142–58.
PubMed Статья Google Scholar
Педли С., Бриджер Дж. С., Чейзи Д., МакКрэй, Массачусетс. Определение двух новых групп атипичных ротавирусов. J Gen Virol. 1986. 67 (Pt 1): 131–7.
CAS PubMed Статья Google Scholar
Hull JJ, Marthaler D, Rossow S, Ng TFF, Montmayeur AM, Magana L, et al.Геномная последовательность первого штамма свиного ротавируса группы H в США. Объявление о геноме. 2016; 4 (2): e01763–15 https://doi.org/10.1128/genomeA.01763-15.
PubMed PubMed Central Статья Google Scholar
Yinda CK, Ghogomu SM, Conceição-Neto N, Beller L, Deboutte W., Vanhulle E, et al. Камерунские плодовые летучие мыши являются носителями различных вирусов, включая ротавирус H, бастровирусы и пикобирнавирусы, использующие альтернативный генетический код.Virus Evol. 2018; 4 (1): vey008.
PubMed PubMed Central Статья Google Scholar
Phan TG, Leutenegger CM, Chan R, Delwart E. Ротавирус I в кале кошки с диареей. Гены вирусов. 2017; 53 (3): 487–90.
CAS PubMed PubMed Central Статья Google Scholar
Troeger C, Khalil IA, Rao PC, Cao S, Blacker BF, Ahmed T. и др.Вакцинация против ротавируса и глобальное бремя ротавирусной диареи среди детей младше 5 лет. JAMA Pediatr. 2018; 172 (10): 958–65.
PubMed PubMed Central Статья Google Scholar
Тейт Дж. Э., Бертон А. Х., Боски-Пинто К., Стил А. Д., Дуке Дж., Парашар Ю. Д.. Глобальная сеть эпиднадзора за ротавирусами, координируемая ВОЗ. Оценка смертности от ротавирусной инфекции среди детей младше 5 лет в мире за 2008 год до введения всеобщих программ вакцинации против ротавируса: систематический обзор и метаанализ.Lancet Infect Dis. 2012; 12 (2): 136–41.
PubMed Статья Google Scholar
Parashar UD, Gibson CJ, Bresee JS, Glass RI. Ротавирус и тяжелая диарея у детей. Emerg Infect Dis. 2006. 12 (2): 304–6.
PubMed PubMed Central Статья Google Scholar
Koo HL, Neill FH, Estes MK, Munoz FM, Cameron A, DuPont HL, et al. Норовирусы: наиболее распространенный детский вирусный энтеропатоген в больнице большого университета после введения вакцинации против ротавируса.J Pediatric Infect Dis Soc. 2013; 2 (1): 57–60.
PubMed Статья Google Scholar
Payne DC, Vinjé J, Szilagyi PG, Edwards KM, Staat MA, Weinberg GA, et al. Норовирус и медицинский гастроэнтерит у детей в США. N Engl J Med. 2013. 368 (12): 1121–30.
CAS PubMed PubMed Central Статья Google Scholar
Hemming M, Räsänen S, Huhti L, Paloniemi M, Salminen M, Vesikari T.Значительное сокращение ротавирусного, но не норовирусного гастроэнтерита у детей, находящихся в больнице, после включения вакцины RotaTeq в Национальную программу иммунизации в Финляндии. Eur J Pediatr. 2013. 172 (6): 739–46.
PubMed PubMed Central Статья Google Scholar
Tate JE, Burton AH, Boschi-Pinto C, Parashar UD. Всемирная организация здравоохранения – Глобальная сеть эпиднадзора за ротавирусами. Глобальные, региональные и национальные оценки смертности от ротавирусов у детей младше 5 лет, 2000–2013 гг.Clin Infect Dis. 2016; 62 (Приложение 2): S96 – S105.
PubMed Статья Google Scholar
IHME. GBD Compare. 2019 [10 октября 2019 г.]; Доступно по адресу: http://vizhub.healthdata.org/gbd-compare.
Google Scholar
Troeger C, Blacker B, Khalil IA, Rao PC, Cao J, Zimsen SRM, et al. Оценки глобальной, региональной и национальной заболеваемости, смертности и этиологии диареи в 195 странах: систематический анализ глобального бремени болезней, исследование 2016 г.Lancet Infect Dis. 2018; 18 (11): 1211–28.
Артикул Google Scholar
Карвалью М.Ф., Гилл Д. Эффективность ротавирусной вакцины: текущее состояние и области, требующие улучшения. Hum Vaccin Immunother. 2019; 15 (6): 1237–50.
PubMed Статья Google Scholar
Angkeabos N, Rin E, Vichit O, Chea C, Tech N, Payne DC, et al. Педиатрические госпитализации по поводу ротавирусного гастроэнтерита среди камбоджийских детей: семь лет активного наблюдения, 2010-2016 гг.Вакцина. 2018; 36 (51): 7856–61.
PubMed Статья Google Scholar
Нирвати Х., Вибава Т., Аман А.Т., Вахаб А., Соенарто Ю. Обнаружение штаммов ротавируса группы А, циркулирующих среди детей с острой диареей в Индонезии. Springerplus. 2016; 5: 97.
PubMed PubMed Central Статья Google Scholar
Нирвати Х., Хаким М.С., Амина С., Двиджа ИБНП, Пан К., Аман А.Т.Идентификация штаммов ротавирусов, вызывающих диарею у детей в возрасте до пяти лет в Джокьякарте, Индонезия. Malays J Med Sci. 2017; 24 (2): 68–77.
PubMed PubMed Central Google Scholar
Салим Х., Карьяна И.П., Санджая-Путра И.Г., Будиарса С., Соенарто Ю. Факторы риска ротавирусной диареи у госпитализированных детей в больнице Сангла, Денпасар: проспективное когортное исследование. BMC Gastroenterol. 2014; 14: 54.
PubMed PubMed Central Статья Google Scholar
Prasetyo D, Sabaroedin IM, Ermaya YS, Soenarto Y. Ассоциация между тяжелым обезвоживанием при ротавирусной диарее и исключительно грудным вскармливанием среди младенцев в больнице доктора Хасана Садикина, Бандунг, Индонезия. J Trop Med. 2015; 2015: 862578.
PubMed PubMed Central Статья Google Scholar
Parwata WSS, Wayan S, Abdul W., Yati S. Распространенность и клинические характеристики ротавирусной диареи в Матараме, Ломбок, Индонезия.Педиатр Индонезии. 2016; 56 (2): 118–23 https://paediatricaindonesiana.org/index.php/paediatrica-indonesiana/article/view/120.
Артикул Google Scholar
Судармо С.М., Шигемура К., Атия А.Ф., Осава К., Вардана О.П., Дарма А. и др. Генотипирование и клинические факторы детской диареи, вызванной ротавирусами: однолетнее наблюдение в Сурабае, Индонезия. Gut Pathog. 2015; 7: 3.
PubMed PubMed Central Статья Google Scholar
Джохосугито Ф, Майя С., Деви А., Андани Э. Идентификация генотипов Р ротавируса у детей с острой диареей в Пеканбару, Индонезия. Malays J Microbiol. 2017; 13: 67–72.
CAS Google Scholar
Муляни Н.С., Прасетьо Д., Карьяна ИПГ, Сукарди В., Дамаянти В., Ангграини Д. и др. Диарея среди госпитализированных детей в возрасте до пяти лет: призыв к включению ротавирусной вакцины в национальную программу иммунизации в Индонезии.Вакцина. 2018; 36 (51): 7826–31.
PubMed Статья Google Scholar
Утсуми Т., Вахюни Р.М., Доан Ю.Х., Динана З., Соегиджанто С., Фуджи Ю. и др. Конские штаммы ротавируса G3 как преобладающие штаммы среди детей в Индонезии в 2015-2016 гг. Заразить Genet Evol. 2018; 61: 224–8.
CAS PubMed Статья Google Scholar
Cowley D, Nirwati H, Donato CM, Bogdanovic-Sakran N, Boniface K, Kirkwood CD, et al.Молекулярная характеристика штаммов ротавирусов, выявленных в ходе клинических испытаний вакцины против ротавируса новорожденных человека (RV3-BB) в Индонезии. Вакцина. 2018; 36 (39): 5872–8.
CAS PubMed PubMed Central Статья Google Scholar
Athiyyah AF, Utsumi T., Wahyuni RM, Dinana Z, Yamani LN, Soetjipto, et al. Молекулярная эпидемиология и клинические особенности ротавирусной инфекции среди педиатрических пациентов в Восточной Яве, Индонезия, в течение 2015–2018 гг .: Динамические изменения генотипов ротавирусов от конского G3 к типичному человеческому G1 / G3.Front Microbiol. 2019; 10: 940.
PubMed PubMed Central Статья Google Scholar
SoukAloun D, Douangbouphaa V, Phetsouvanh R, Sibounheuang B, Vongsouvat M, Chanmala K, et al. Ротавирусная диарея у госпитализированных детей в возрасте до 5 лет во Вьентьяне, Лаосская Народно-Демократическая Республика, 2009-2015 гг. Вакцина. 2018; 36 (51): 7878–82.
PubMed Статья Google Scholar
Ли В.С., Лим Б.Т., Чай П.Ф., Кирквуд С.Д., Ли Дж.К. Генотипы ротавирусов в Малайзии и всеобщая ротавирусная вакцинация. Hum Vaccin Immunother. 2012. 8 (10): 1401–6.
CAS PubMed PubMed Central Статья Google Scholar
Theingi WM, Hlaing MT, Ye MK, Khin MA, Mo MW, Htin L, et al. Дозорный эпиднадзор за ротавирусом у детей младше 5 лет, госпитализированных с диарейным заболеванием в Детскую больницу Янгона, Мьянма, 2009–2014 гг.Вакцина. 2018; 36 (51): 7832–5.
Артикул Google Scholar
Ямамото Д., Тандок А 3-й, Меркадо Е, Куичо Ф, Луписан С., Обата-Сайто М. и др. Первое обнаружение DS-1-подобных штаммов ротавируса человека G1P [8] у детей с диареей на Филиппинах. Новые микробы. Новый зараз. 2017; 18: 54–7.
CAS PubMed PubMed Central Статья Google Scholar
Bonifacio J, Lupisan S, Roque V Jr, Ducusin MJ, Grabovac V, Batmunkh N, et al. Молекулярная характеристика ротавирусной диареи у детей в возрасте до пяти лет на Филиппинах, 2013-2015 гг. Вакцина. 2018; 36 (51): 7888–93.
CAS PubMed Статья Google Scholar
Rebato ND, de Los Reyes VCD, Sucaldito MNL, Marin GR. Ваша питьевая вода безопасна? Вспышка ротавируса, связанная с заправочными станциями на Филиппинах, 2016 г.Ответ Western Pac Surveill J. 2019; 10 (1): 1–5.
PubMed PubMed Central Статья Google Scholar
Phua KB, Tee N, Tan N, Ramakrishnan G, Teoh YL, Bock H, et al. Больничное наблюдение за ротавирусным гастроэнтеритом у детей младше 5 лет в Сингапуре. Pediatr Infect Dis J. 2013; 32 (12): e426–31.
PubMed Статья Google Scholar
Phua KB, Lim FS, Lau YL, Nelson EAS, Huang LM, Quak SH и др. Эффективность ротавирусной вакцины RIX4414 сохраняется в течение третьего года жизни: рандомизированное клиническое испытание в азиатской популяции. Вакцина. 2012. 30 (30): 4552–7.
CAS PubMed Статья Google Scholar
Хананурак К., Вутитханачот В., Симакачорн Н., Тембунлерс А., Чонгсрисават В., Поовораван Ю. Распространенность и филогенетический анализ генотипов ротавирусов в Таиланде в период с 2007 по 2009 год.Заразить Genet Evol. 2010. 10 (4): 537–45.
CAS PubMed Статья Google Scholar
Sakpaisal P, Silapong S, Yowang A, Boonyasakyothin G, Yuttayong B., Suksawad U, et al. Распространенность и генотипическое распространение ротавируса в Таиланде: многоцентровое исследование. Am J Trop Med Hyg. 2019; 100 (5): 1258–65.
PubMed PubMed Central Статья Google Scholar
Maiklang O, Vutithanachot V, Vutithanachot C, Hacharoen P, Chieochansin T, Poovorawan Y. Распространенность ротавируса человека генотипа группы A среди детей с дирареей в Таиланде, 2009-2011 гг. Юго-Восточная Азия J Trop Med Public Health. 2012. 43 (4): 904–16.
PubMed Google Scholar
Йодмиклин А., Кхамрин П., Кумтип К., Маласао Р., Укарапол Н., Ушиджима Н. и др. Растущее преобладание ротавирусов G8P [8] a у детей, госпитализированных с острым гастроэнтеритом в Таиланде, 2010-2013 гг.Arch Virol. 2018; 163 (8): 2165–78.
CAS PubMed Статья Google Scholar
Chieochansin T, Vutithanachot V, Phumpholsup T, Posuwan N, Theamboonlers A, Poovorawan Y. Распространенность и разнообразие генотипов ротавируса человека, циркулирующего в Таиланде, 2011-2014 гг. Заразить Genet Evol. 2016; 37: 129–36.
PubMed Статья Google Scholar
Saikruang W, Khamrin P, Malasao R, Kumthip K, Ushijima H, Maneekarn N.Полный анализ генома редкого ротавируса G12P [6], выделенного в Таиланде в 2012 году, выявил прототип штамма DS-1-подобного созвездия. Virus Res. 2016; 224: 38–45.
CAS PubMed Статья Google Scholar
Intamaso U, Poomipak W., Chutoam P, Chotchuang P, Sunkkham W., Srisopha S, et al. Распределение генотипов и филогенетический анализ ротавирусов в Таиланде и появление необычных генотипов. Arch Clin Microbiol.2017; 8 (4): 60 https://doi.org/10.4172/1989-8436.100060.
Google Scholar
Guntapong R, Tacharoenmuang R, Singchai P, Upachai S, Sutthiwarakom K, Komoto S, et al. Преобладающая распространенность ротавирусов человека с генотипами G1P [8] и G8P [8] с коротким профилем РНК в 2013 и 2014 годах в провинциях Сукхотай и Пхетчабун, Таиланд. J Med Virol. 2017; 89 (4): 615–20.
CAS PubMed Статья Google Scholar
Тачароенмуанг Р., Комото С., Гунтапонг Р., Упачаи С., Сингчай П., Иде Т. и др. Высокая распространенность конского ротавируса G3P [8] у детей и взрослых с острым гастроэнтеритом в Таиланде. J Med Virol. 2020; 92 (2): 174–86 https://doi.org/10.1002/jmv.25591.
CAS PubMed Статья Google Scholar
Чан-Ит В., Чанта С. Появление ротавирусов G9P [8] у детей с острым гастроэнтеритом в Таиланде, 2015–2016 гг.J Med Virol. 2018; 90 (3): 477–84.
CAS PubMed Статья Google Scholar
My PV, Rabaa MA, Donato C, Cowley D, Phat VV, Dung TT, et al. Новый свиной ротавирус G26P [19] человека, обнаруженный у госпитализированных педиатрических пациентов с диареей в Хошимине, Вьетнам. J Gen Virol. 2014; 95 (Pt 12): 2727–33.
CAS PubMed PubMed Central Статья Google Scholar
Huyen DTT, Hong DT, Trung NT, Hoa TTN, Oanh NK, Thang HV и др. Эпидемиология острой диареи, вызванной ротавирусом, в пунктах дозорного эпиднадзора во Вьетнаме, 2012-2015 гг. Вакцина. 2018; 36 (51): 7894–900.
PubMed Статья Google Scholar
Всемирный банк. ВВП на душу населения. 2019; Доступно по адресу: https://data.worldbank.org/indicator/ny.gdp.pcap.cd. Цитировано 28 октября 2019 г.
Google Scholar
Джайн С., Вашистт Дж., Чанготра Х. Ротавирусы: нужен ли надзор за ними? Вакцина. 2014. 32 (27): 3367–78.
PubMed Статья Google Scholar
Gentsch JR, Laird AR, Bielfelt B, Griffin DD, Banyai K, Ramachandran M, et al. Разнообразие серотипов и перераспределение между штаммами ротавирусов человека и животных: значение для программ вакцинации против ротавируса. J Infect Dis. 2005; 192 (Приложение 1): S146–59.
PubMed Статья Google Scholar
Лешем Э., Лопман Б., Гласс Р., Генч Дж., Баньяи К., Парашар Ю. и др. Распространение штаммов ротавируса и штаммоспецифическая эффективность ротавирусной вакцины после ее внедрения: систематический обзор и метаанализ. Lancet Infect Dis. 2014. 14 (9): 847–56.
CAS PubMed Статья Google Scholar
Бонифачо Дж., Игой М.А., Тандок А. Повторная сортировка сегментов гена ротавируса человека в штамм ротавируса G9P [8] за четырехлетний период: 2013-2016 гг.Int J Infect Dis. 2018; 73: 195.
Артикул Google Scholar
ВОЗ. Профилактика ротавирусных заболеваний посредством иммунизации в Регионе Западной части Тихого океана, Манила, Филиппины, 11–12 декабря 2018 г .: отчет о заседании. Манила; 2018. с. 36.
Giri S, Priya HR, Arumugam R, Sherchand JB, Thu HM, Galagoda G, et al. Молекулярная эпидемиология ротавирусов в регионе Юго-Восточной Азии с 2009 по 2015 годы. Вакцина.2018; 36 (51): 7851–5.
CAS PubMed Статья Google Scholar
Брандт С.Д., Ким Х.В., Родригес В.Дж., Арробио Дж.О., Джеффрис Б.К., Парротт Р.Х. Ротавирусный гастроэнтерит и погода. J Clin Microbiol. 1982. 16 (3): 478–82.
CAS PubMed PubMed Central Статья Google Scholar
Ли В.С., Раджасекаран Дж., Пи С., Карунакаран Р., Хассан Х. Х., Путучари SD.Ротавирус и другие энтеропатогены при острой диарее у детей: исследование двух центров в Малайзии. J Paediatr Child Health. 2006. 42 (9): 509–14.
PubMed Статья Google Scholar
Алун Д.С., Ньямбат Б., Пхетсуван Р., Дуангбоупа В., Кеонахон П., Ксумпхонфакди Б. и др. Ротавирусная диарея у детей в возрасте до 5 лет в больнице Махосот, Вьентьян, Лаосская Народно-Демократическая Республика. Вакцина. 2009; 27 (Приложение 5): F85–8.
PubMed Статья Google Scholar
Леви К., Хаббард А.Е., Айзенберг Дж. Сезонность ротавирусной болезни в тропиках: систематический обзор и метаанализ. Int J Epidemiol. 2009. 38 (6): 1487–96.
PubMed Статья Google Scholar
Чао Д.Л., Рус А., Ро М., Котлофф К.Л., Проктор Дж.Л. Сезонность возбудителей диарейных болезней: ретроспективное исследование семи сайтов в течение трех лет. PLoS Negl Trop Dis. 2019; 13 (8): e0007211.
PubMed PubMed Central Статья Google Scholar
Джагай Дж.С., Саркар Р., Кастроново Д., Каттула Д., МакЭнти Дж., Уорд Х. и др. Сезонность ротавируса в Южной Азии: подход метаанализа, оценивающий ассоциации с температурой, осадками и вегетационным индексом. PLoS One. 2012; 7 (5): e38168.
CAS PubMed PubMed Central Статья Google Scholar
Ансари С.А., Спрингторп В.С., Саттар С.А. Выживаемость и транспортное распространение ротавирусов человека: возможная связь с сезонностью вспышек.Rev Infect Dis. 1991; 13 (3): 448–61 Обзор.
CAS PubMed Статья Google Scholar
Walker CLF, Rudan I, Liu L, Nair H, Theodoratou E, Bhutta ZA, et al. Глобальное бремя детской пневмонии и диареи. Ланцет. 2013. 381 (9875): 1405–16.
PubMed PubMed Central Статья Google Scholar
ВОЗ. Ротавирусные вакцины: новости.Wkly Epidemiol Rec. 2009. 84 (50): 533–40.
Google Scholar
ВОЗ. Охват ротавирусной иммунизацией. 2019; Доступно по адресу: https://www.who.int/gho/immunization/rotavirus/en/. Цитировано 2 сентября 2019 г.
Google Scholar
Abou-Nader AJ, Sauer MA, Steele AD, Tate JE, Atherly D, Parashar UD, et al. Внедрение и охват ротавирусной вакцины в мире: 2006–2016 гг.Hum Vaccin Immunother. 2018; 14 (9): 2281–96.
PubMed PubMed Central Статья Google Scholar
ГАВИ. Поддержка ротавирусной вакцины. 2019; Доступно по адресу: https://www.gavi.org/library/news/press-releases/2018/gavi-supports-rotavirus-vaccine-introduction-in-uganda/. Цитировано 5 сентября 2019 г.
Google Scholar
Зиссис Г., Ламберт Дж. П., Марбехант П., Мариссенс Д., Лобманн М., Шарлье П. и др.Исследования защиты поросят, лишенных молозива, от кандидатной вакцины против ротавируса крупного рогатого скота с использованием штаммов ротавируса человека для контрольного заражения. J Infect Dis. 1983. 148 (6): 1061–8.
CAS PubMed Статья Google Scholar
Капикян А.З., Хосино Ю., Чанок Р.М., Перес-Шаэль И. Эффективность четырехвалентной ротавирусной вакцины человека на основе резус-ротавируса, направленной на предотвращение тяжелой ротавирусной диареи у младенцев и детей раннего возраста.J Infect Dis. 1996; 174 (Приложение 1): S65–72.
PubMed Статья Google Scholar
Dennehy PH. Ротавирусные вакцины: обзор. Clin Microbiol Rev.2008; 21 (1): 198–208.
CAS PubMed PubMed Central Статья Google Scholar
Murphy TV, Gargiullo PM, Massoudi MS, Nelson DB, Jumaan AO, Okoro CA и др. Группа по расследованию инвагинации ротавируса.Инвагинация у младенцев, получивших пероральную ротавирусную вакцину. N Engl J Med. 2001. 344 (8): 564–72.
CAS PubMed Статья Google Scholar
Колларич Х., Кунди М., Джакинто С., Паульке-Коринек М. Ротавирусные вакцины: история успеха. Clin Microbiol Infect. 2015; 21 (8): 735–43.
CAS PubMed Статья Google Scholar
Phua KB, Lim FS, Quak SH, Lee BW, Teoh YL, Suryakiran PV и др.Эффективность, иммуногенность и безопасность ротавирусной вакцины человека RIX4414 для младенцев из Сингапура. Ann Acad Med Singap. 2016; 45 (2): 44–50.
PubMed Google Scholar
Yung CF, Chan SP, Soh S, Tan A, Thoon KC. Инвагинация и моновалентная вакцинация против ротавируса в Сингапуре: серия самоконтролируемых случаев и исследование риска и пользы. J Pediatr. 2015; 167 (1): 163–168.e161.
PubMed Статья Google Scholar
Ruiz-Palacios GM, Perez-Schael I, Velazquez FR, Abate H, Breuer T, Clemens SC и др. Безопасность и эффективность аттенуированной вакцины против тяжелого ротавирусного гастроэнтерита. N Engl J Med. 2006. 354 (1): 11–22.
CAS PubMed Статья Google Scholar
Tan N, Teoh YL, Phua KB, Quak SH, Lee BW, Teo HJ, et al. Обновленная информация о заболеваемости инвагинацией у детей в Сингапуре: 1997-2007 гг., 11 лет наблюдения за инвагинацией.Ann Acad Med Singap. 2009. 38 (8): 690–2.
PubMed Google Scholar
Весикари Т., Матсон Д.О., Деннехи П., Ван Дамм П., Сантошам М., Родригес З. и др. Безопасность и эффективность пятивалентной вакцины реассортантного ротавируса человека и крупного рогатого скота (WC3). N Engl J Med. 2006. 354 (1): 23–33.
CAS PubMed Статья Google Scholar
ВОЗ. Обновленная информация об инвагинации после введения ротавирусной вакцины: Всемирная организация здравоохранения; 2014 г.Доступно по адресу: http://www.who.int/vaccine_safety/committee/topics/rotavirus/rotarix_and_rotateq/dec_2013/en/.
Debellut F, Clark A, Pecenka C, Tate J, Baral R, Sanderson C, et al. Переоценка потенциального воздействия и рентабельности ротавирусной вакцинации в 73 странах Гави: модельное исследование. Ланцет Glob Health. 2019; 7 (12): e1664–74.
PubMed PubMed Central Статья Google Scholar
Дин Дж., Лопес А.Л., Канунго С., Ван XY, Ань Д.Д., Тапиа М. и др. Повышение охвата ротавирусной вакциной: могут ли помочь вакцины нового поколения и местного производства? Hum Vaccin Immunother. 2018; 14 (2): 495–9.
PubMed Статья Google Scholar
Всемирная организация здравоохранения. Охват ротавирусной иммунизацией. доступно по адресу: https://www.who.int/gho/immunization/rotavirus/en/. Цитировано 3 марта 2020 г.
Бхандари Н., Ронгсен-Чандола Т., Бавдекар А., Джон Дж., Энтони К., Танежа С. и др. Группа вакцины против ротавируса в Индии. Эффективность моновалентной ротавирусной вакцины человека и крупного рогатого скота (116E) у младенцев в Индии: рандомизированное, двойное слепое, плацебо-контролируемое испытание. Ланцет. 2014. 383 (9935): 2136–43.
CAS PubMed PubMed Central Статья Google Scholar
Международный центр доступа к вакцинам. Отчет VIEW-hub: внедрение и внедрение вакцин в мире.2016 www.jhsph.edu/research.
Google Scholar
Кулькарни П.С., Десаи С., Тевари Т., Каваде А., Гоял Н., Гарг Б.С. и др. Рандомизированное клиническое испытание фазы III для оценки эффективности реассортантной пентавалентной ротавирусной вакцины крупного рогатого скота и человека у индийских младенцев. Вакцина. 2017; 35 (45): 6228–37.
CAS PubMed PubMed Central Статья Google Scholar
Исанака С., Гиндо О., Лангендорф С., Матар Сек А., Пликайтис Б.Д., Сайинзога-Макомбе Н. и др. Эффективность недорогой термостойкой оральной ротавирусной вакцины в Нигере. N Engl J Med. 2017; 376 (12): 1121–30.
PubMed Статья Google Scholar
Naik SP, Zade JK, Sabale RN, Pisal SS, Menon R, Bankar SG, et al. Стабильность термостойкой живой аттенуированной ротавирусной вакцины (ROTASIIL®). Вакцина. 2017; 35 (22): 2962–9.
CAS PubMed Статья Google Scholar
Чен Б., Шен С. Выбор и характеристика штамма LLR-85 для пероральной живой вакцины против ротавируса. Chin J Biol. 1994. 7 (2): 49–52.
Google Scholar
Fu C, Dong Z, Shen J, Yang Z, Liao Y, Hu W и др. Инфекция ротавирусного гастроэнтерита среди детей, вакцинированных и невакцинированных ротавирусной вакциной в южном Китае: оценка населения. JAMA Netw Open. 2018; 1 (4): e181382.
PubMed PubMed Central Статья Google Scholar
Zhen SS, Li Y, Wang SM, Zhang XJ, Hao ZY, Chen Y, et al. Эффективность живой аттенуированной ротавирусной вакцины, произведенной отечественным производителем в Китае, изучалась с использованием популяционного дизайна «случай-контроль». Emerg Microbes Infect. 2015; 4 (10): e64.
PubMed PubMed Central Google Scholar
Данг Д.А., Нгуен В.Т., Ву Д.Т., Нгуен Т.Х., Нгуен Д.М., Юхуан В. и др. Группа испытаний вакцины Ротавин-М1. Исследование безопасности и иммуногенности с увеличением дозы новой живой аттенуированной вакцины против ротавируса человека (Ротавин-M1) у вьетнамских детей.Вакцина. 2012; 30 (Приложение 1): A114–21.
PubMed Google Scholar
Bines JE, At Thobari J, Satria CD, Handley A, Watts E, Cowley D, et al. Неонатальная ротавирусная вакцина человека (RV3-BB) для воздействия на ротавирус с рождения. N Engl J Med. 2018; 378 (8): 719–30.
CAS PubMed PubMed Central Статья Google Scholar
Совет Р. Текущая и планируемая вакцина против ротавируса.2019. PDF; доступно по адресу: http://rotacouncil.org/wp-content/uploads/2019/05/ROTA-Brief2-ProductLandscape-SP-1-3.pdf. Цитировано 3 ноября 2019 г.
Google Scholar
Velasquez DE, Parashar U, Jiang B. Снижение эффективности живых аттенуированных пероральных ротавирусных вакцин в странах с низким уровнем дохода: причины и способствующие факторы. Экспертные ревакцины. 2018. 17 (2): 145–61.
CAS PubMed Google Scholar
Кларк Э., Дессельбергер У. Корреляты защиты от ротавирусной болезни человека и факторов, влияющих на защиту в странах с низким уровнем дохода. Mucosal Immunol. 2015; 8 (1): 1–17.
CAS PubMed Статья Google Scholar
Кирквуд С.Д., Ма Л.Ф., Кэри М.Э., Стил А.Д. Процесс разработки ротавирусной вакцины. Вакцина. 2019; 37 (50): 7328–35.
PubMed PubMed Central Статья Google Scholar
Лопман Б.А., Питцер В.Е., Саркар Р., Гладстон Б., Патель М., Глассер Дж. И др. Понимание снижения эффективности ротавирусной вакцины в условиях низкого социально-экономического положения. PLoS One. 2012; 7 (8): e41720.
CAS PubMed PubMed Central Статья Google Scholar
Стил Д., Кирквуд К., Ма Л.Ф. Ротавирусная вакцина нового поколения. В: Консультативный комитет ВОЗ по разработке продуктов для вакцин; 2018. Доступно по адресу: https: //www.who.int /munization / research / sessions_workshops / 23_Steele_Rot_vaccines.pdf? ua = 1.
Google Scholar
Burke RM, Tate JE, Kirkwood CD, Steele AD, Parashar UD. Текущие и новые ротавирусные вакцины. Curr Opin Infect Dis. 2019; 32 (5): 435–44.
CAS PubMed PubMed Central Статья Google Scholar
Blutt SE, Warfield KL, O’Neal CM, Estes MK, Conner ME.Факторы хозяина, вирусы и вакцины, которые определяют защитную эффективность, индуцированную ротавирусом и вирусоподобными частицами (VLP). Вакцина. 2006. 24 (8): 1170–9.
CAS PubMed Статья Google Scholar
Ван И, Азеведо М., Саиф Л. Дж., Генч Дж. Р., Гласс Р. И., Цзян Б. Инактивированная ротавирусная вакцина индуцирует защитный иммунитет у гнотобиотических поросят. Вакцина. 2010. 28 (33): 5432–6.
CAS PubMed Статья Google Scholar
Azevedo MSP, Gonzalez AM, Yuan L, et al. Пероральный и интраназальный режим прайма / бустера с использованием аттенуированного ротавируса человека или вирусоподобных частиц VP2 и VP6 с иммуностимулирующими комплексами влияет на защиту и ответы секретирующих антитела клеток на ротавирус в модели неонатальной гнотобиотической свиньи. Clin Vaccine Immunol. 2010. 17 (3): 420–8.
CAS PubMed PubMed Central Статья Google Scholar
Istrate C, Hinkula J, Charpilienne A, et al.Парентеральное введение ротавирусоподобных частиц RF 8-2 / 6/7 в режиме однократной дозы индуцирует защитный иммунитет у мышей. Вакцина. 2008. 26 (35): 4594–601.
CAS PubMed Статья Google Scholar
Fix AD, Harro C, McNeal M, Dally L, Flores J, Robertson G, et al. Безопасность и иммуногенность парентерально вводимой субъединичной вакцины ротавируса VP8 у здоровых взрослых. Вакцина. 2015; 33 (31): 3766–72.
CAS PubMed Статья Google Scholar
Грум М.Дж., Коэн А., Фикс А., Пейдж N, Хосе Л., Мадхи С.А. и др. Безопасность и иммуногенность парентеральной ротавирусной вакцины субъединицы P2-VP8-P [8] у детей ясельного и младшего возраста в Южной Африке: рандомизированное двойное слепое плацебо-контролируемое исследование. Lancet Infect Dis. 2017; 17 (8): 843–53.
CAS PubMed Статья Google Scholar
Ким С.И., Голди С.Дж., Саломон Дж.А. Экономическая эффективность вакцинации против ротавируса во Вьетнаме. BMC Public Health.2009; 9: 29.
PubMed PubMed Central Статья Google Scholar
Suwantika AA, Tu HA, Postma MJ. Рентабельность иммунизации против ротавируса в Индонезии: учет моделей грудного вскармливания. Вакцина. 2013. 31 (32): 3300–7.
PubMed Статья Google Scholar
Gosselin V, Généreux M, Gagneur A, Petit G. Эффективность ротавирусной вакцины в профилактике тяжелого гастроэнтерита у маленьких детей в зависимости от социально-экономического статуса.Hum Vaccin Immunother. 2016; 12 (10): 2572–9.
PubMed PubMed Central Статья Google Scholar
Бернетт Э., Парашар У., Тейт Дж. Ротавирусные вакцины: эффективность, безопасность и направления на будущее. Педиатрические препараты. 2018; 20 (3): 223–33.
PubMed PubMed Central Статья Google Scholar
Desselberger U. Различия в эффективности ротавирусной вакцины по странам: вероятные причины и способствующие факторы.Возбудители. 2017; 6 (4) https://doi.org/10.3390/pathogens6040065.
PubMed Central Статья CAS Google Scholar
Parker EP, Ramani S, Lopman BA, Church JA, Iturriza-Gómara M, Prendergast AJ, et al. Причины снижения эффективности пероральной вакцины в развивающихся странах. Future Microbiol. 2018; 13: 97–118.
CAS PubMed Статья Google Scholar
Munos MK, Walker CL, черный RE. Влияние ротавирусной вакцины на смертность от диареи. Int J Epidemiol. 2010; 39 (Приложение 1): i56–62.
PubMed PubMed Central Статья Google Scholar
Патель М.М., Стил Д., Генч Дж. Р., Веккер Дж., Гласс Р. И., Парашар Ю. Д.. Влияние ротавирусной вакцинации на реальный мир. Pediatr Infect Dis J. 2011; 30 (1 приложение): S1–5.
PubMed Статья Google Scholar
Premkumar PS, Parashar UD, Gastanaduy PA, McCracken JP, de Oliveira LH, Payne DC, et al. Снижение эффективности ротавирусной вакцины среди детей, рожденных в сезон ротавируса: объединенный анализ 5 исследований случай-контроль, проведенных в Северной и Южной Америке. Clin Infect Dis. 2015; 60 (7): 1075–8.
PubMed Статья Google Scholar
Tharmaphornpilas P, Jiamsiri S, Boonchaiya S, Rochanathimoke O, Thinyounyong W., Tuntiwitayapun S, et al.Оценка первого внедрения ротавирусной вакцины в Таиланде: от фактических данных к политике. Вакцина. 2017; 35 (5): 796–801.
PubMed Статья Google Scholar
Lopman BA, Curns AT, Yen C, Parashar UD. Вакцинация против ротавируса младенцев может обеспечить косвенную защиту детей старшего возраста и взрослых в Соединенных Штатах. J Infect Dis. 2011. 204 (7): 980–6.
PubMed Статья Google Scholar
Поллард С.Л., Мальпика-Льянос Т., Фриберг И.К., Фишер-Уокер С., Ашраф С., Уокер Н. Оценка эффекта ротавирусной вакцины на коллективный иммунитет. Вакцина. 2015; 33 (32): 3795–800.
PubMed Статья Google Scholar
Логанатан Т., Ли В.С., Ли К.Ф., Джит М., Нг CW. Катастрофические расходы домохозяйств на здравоохранение и обнищание из-за ротавирусного гастроэнтерита, требующее госпитализации в Малайзии. PLoS One. 2015; 10 (5): e0125878.
PubMed PubMed Central Статья CAS Google Scholar
Padmawati RS, Heywood A, Sitaresmi MN, Atthobari J, Maclntyre CR, Soenarto Y, et al. Принятие религиозными и общественными лидерами внедрения ротавирусной вакцины в Джокьякарте, Индонезия: качественное исследование. BMC Public Health. 2019; 19 (1): 368.
PubMed PubMed Central Статья Google Scholar
Арумугам Т. Ротавирус: Правительство призвало защитить детей с помощью вакцины. В: New Straits Times. Малайзия; 2017. Доступно по адресу: https://www.nst.com.my/news/2017/02/211628/rotavirus-govt-urged-protect-kids-vaccine. Цитировано 10 октября 2019 г.
ГАВИ. Региональный центр ГАВИ: Мьянма. 2019; Доступно по адресу: https://www.gavi.org/country/myanmar/. Цитировано 1 октября 2019 г.
Google Scholar
PATH, Ротавирусная болезнь и вакцины в Азии.2014; доступно по адресу: https://www.path.org/resources/rotavirus-disease-and-vaccines-in-asia/. Цитировано 1 ноября 2019 г.
Lopez AL, Daag JV, Esparagoza J, Bonifacio J, Fox K, Nyambat B, et al. Эффективность моновалентной ротавирусной вакцины на Филиппинах. Научный доклад 2018; 8 (1): 14291.
PubMed PubMed Central Статья CAS Google Scholar
Tu HA, Розенбаум MH, Coyte PC, Li SC, Woerdenbag HJ, Postma MJ.Экономика здравоохранения иммунизации против ротавируса во Вьетнаме: возможности повышения экономической эффективности в развивающихся странах. Вакцина. 2012; 30 (8): 1521–8.
PubMed Статья Google Scholar
Ngcobo NJ, Cameron NA. Процесс принятия решения о внедрении новых вакцин в ЮАР. Вакцина. 2012; 30 (Дополнение 3): C9–13.
PubMed Статья Google Scholar
Карвалью Н., Джит М., Кокс С., Юн Дж., Хатубесси RCW. Учет соображений воздействия на бюджет в рамках экономических оценок: систематический обзор экономических оценок ротавирусной вакцины в странах с низким и средним уровнем доходов и предлагаемая система оценки. Фармакоэкономика. 2018; 36 (1): 79–90.
PubMed Статья Google Scholar
Ким SY, Sweet S, Slichter D, Goldie SJ. Влияние ротавирусной вакцинации на здоровье и экономику в странах, отвечающих критериям ГАВИ.BMC Public Health. 2010; 10: 253.
PubMed PubMed Central Статья Google Scholar
Портной А., Озава С., Гревал С., Норман Б.А., Раджгопал Дж., Горхэм К.М. и др. Стоимость программ вакцинации в 94 странах с низким и средним уровнем доходов. Вакцина. 2015; 33 (Приложение 1): A99–108.
PubMed Статья Google Scholar
Совет Р. Ротавирус: распространенный, тяжелый, разрушительный, предотвратимый.2016, PDF; доступно по адресу: http://rotacouncil.org/wp-content/uploads/2016/03/White-paper-FINAL-v2.pdf. Цитировано 3 ноября 2019 г.
Google Scholar
Rheingans RD, Antil L, Dreibelbis R, Podewils LJ, Bresee JS, Parashar UD. Экономические издержки ротавирусного гастроэнтерита и экономическая эффективность вакцинации в развивающихся странах. J Infect Dis. 2009; 200 (Приложение 1): S16–27.
PubMed Статья Google Scholar
ВОЗ. Руководство по оценке затрат на внедрение новых вакцин в национальную систему иммунизации. Женева; 2002. Доступно по адресу: https://archives.who.int/vaccines-documents/DocsPDF02/www665.pdf. По состоянию на 3 ноября 2019 г.
Saokaew S, Prasitsuebsai W, Bibera GL, Kengkla K, Zhang XH, Oh KB, et al. Экономическая оценка вакцины против ротавируса человека в Таиланде. Заражение Dis Ther. 2019; 8 (3): 397–415.
PubMed PubMed Central Статья Google Scholar
Ротавирусная инфекция у детей (инструкции по реабилитации)
- CareNotes
- Ротавирусная инфекция у детей
- Инструкции по уходу
Этот материал нельзя использовать в коммерческих целях, в больницах или медицинских учреждениях.Несоблюдение может повлечь за собой судебный иск.
ЧТО НУЖНО ЗНАТЬ:
Ротавирус – это вирус, вызывающий воспаление тонкой кишки. Инфекция может помешать организму вашего ребенка поглощать воду и питательные вещества из пищи. Это может вызвать сильное обезвоживание. Ротавирус может передаваться через кашель, пищу или воду, а также при контакте с испражнениями инфицированного человека. Ротавирус может оставаться на предметах, таких как одежда или игрушки, в течение многих дней. Инфекция может распространяться при прикосновении к зараженному объекту.
ИНСТРУКЦИИ ПО РАЗРЯДУ:
Позвоните на местный номер службы экстренной помощи (911 в США), если:
- Тело вашего ребенка кажется вялым и слабым, или он или она вообще не реагирует на вас.
- У вашего ребенка проблемы с дыханием или его сердцебиение учащается, чем обычно.
Немедленно обратитесь за помощью, если:
- Мягкое пятно на голове вашего ребенка запало.
- Ваш ребенок не может или не будет пить совсем.
- У вашего ребенка сухой липкий рот, он плачет без слез или глаза запавшие.
- Ваш ребенок растерянный или более сонный, чем обычно.
- Ваш ребенок не может остановить рвоту.
- Руки и ноги вашего ребенка внезапно похолодели.
Позвоните своему детскому врачу, если:
- Ваш ребенок пьет меньше жидкости, чем обычно.
- Ваш ребенок мочится меньше обычного или у вашего ребенка меньше 6 мокрых подгузников за 1 день.
- У вашего ребенка жар, который не проходит или становится хуже.
- У вашего ребенка кровь в кишечнике.
- У вашего ребенка боли в животе, чаще диарея.
- Тело вашего ребенка опухшее и опухшее, а лицо красное.
- У вас есть вопросы или опасения по поводу состояния вашего ребенка или ухода за ним.
Давайте ребенку жидкости, как указано:
Вашему ребенку может потребоваться дополнительное количество жидкости, чтобы предотвратить обезвоживание. Спросите, сколько жидкости следует пить ребенку каждый день. Хорошо пить воду или фруктовый сок. Вашему ребенку может потребоваться раствор для пероральной регидратации (ПРС).Это напиток, который содержит необходимое количество соли, сахара и минералов в воде. Если вы кормите грудью, продолжайте кормить ребенка грудью.
Наблюдайте за своим ребенком во время ротавирусной инфекции:
Убедитесь, что вы знаете, сколько и как часто ваш ребенок мочится. Это включает в себя то, как часто ваш ребенок носит мокрый подгузник. У младенцев должно быть не менее 6 мокрых подгузников в день. Проверьте мочу ребенка на темно-желтую или коричневую. Это может быть признаком обезвоживания.
Предотвратить распространение ротавирусной инфекции:
- Часто мойте руки себе и ребенку. Используйте воду и мыло. Если мыло и вода недоступны, используйте дезинфицирующее средство для рук на гелевой основе. Мойте руки после посещения туалета, смены детских подгузников или чихания. Мойте руки перед приготовлением или приемом пищи.
- Узнайте у лечащего врача вашего ребенка о ротавирусной вакцине. Вакцина обычно вводится детям. Ваш ребенок получит дозы в 2 и 4 месяца. Третья доза может потребоваться через 6 месяцев. Окончательную дозу следует вводить не позднее 8-месячного возраста.
- Очистите элементы, которые могут быть заражены. Используйте дезинфицирующие средства на основе хлора для мытья поверхностей, туалетов, игрушек и предметов общего пользования в доме.
- Пусть ваш ребенок останется дома, пока он болеет. Держите ребенка подальше от окружающих до тех пор, пока его или ее лечащий врач предписывает вам это. Не позволяйте ребенку возвращаться в школу или детский сад, пока поставщик не скажет, что это безопасно.
Проконсультируйтесь с врачом вашего ребенка в соответствии с указаниями:
Запишите свои вопросы, чтобы не забывать задавать их во время визитов.
© Copyright IBM Corporation 2021 Информация предназначена только для использования Конечным пользователем и не может быть продана, распространена или иным образом использована в коммерческих целях. Все иллюстрации и изображения, включенные в CareNotes®, являются собственностью A.D.A.M., Inc. или IBM Watson Health
, охраняемой авторским правом.Приведенная выше информация является только учебным пособием. Он не предназначен для использования в качестве медицинского совета по поводу индивидуальных состояний или лечения. Поговорите со своим врачом, медсестрой или фармацевтом, прежде чем следовать какой-либо лечебной схеме, чтобы узнать, безопасно ли она для вас и эффективна.
Подробнее о ротавирусной инфекции у детей (инструкции по реабилитации)
Сопутствующие препараты
IBM Watson Micromedex
Дополнительная информация
Всегда консультируйтесь со своим врачом, чтобы убедиться, что информация, отображаемая на этой странице, применима к вашим личным обстоятельствам.
Заявление об отказе от ответственности за медицинское обслуживание
Ротавирус | Детская больница CS Mott
Обзор темы
Что такое ротавирус и что его вызывает?
Ротавирус – это вирус, поражающий пищеварительный тракт.Вы можете заразиться ротавирусом более одного раза, но обычно самое тяжелое – первая инфекция. Эта инфекция вызывает расстройство желудка и диарею.
Младенцы и дети раннего возраста с ротавирусной инфекцией требуют пристального наблюдения, поскольку они могут очень быстро обезвоживаться. Обезвоживание происходит, когда организм теряет воду быстрее, чем восстанавливается. Когда ваш ребенок обезвоживается, могут возникнуть серьезные проблемы со здоровьем.
Ротавирусные инфекции легко передаются.Вспышки обычно происходят зимой и ранней весной. Ротавирусные инфекции часто распространяются в местах, где много детей находится вместе, например, в детских садах.
Вирус распространяется при контакте со стулом инфицированного ребенка. Вирус может легко распространяться, даже когда люди очень стараются содержать места в чистоте. Например, когда опекун меняет грязный подгузник ребенка, у которого есть ротавирусная инфекция, микробы могут попасть на пеленальный столик, руки опекуна или руки уже инфицированного ребенка.Затем микробы ротавируса могут передаваться другим детям через немытые руки опекуна или ребенка. До раковины может быть всего несколько шагов, но микробы могут попасть на поверхности, к которым ребенок или ребенок прикасается по пути. Например, микробы могут попасть на игрушки, дверные ручки или раковины. Микробы могут жить на предметах и поверхностях в течение нескольких дней, если их не продезинфицировать сразу.
Другие дети, у которых на руках находятся микробы ротавируса, могут заразиться инфекцией, если засовывают руки в рот.Они также могут заразиться ротавирусом, пережевывая игрушку с микробами.
Оставьте ребенка дома, пока он или она болеет, и в течение нескольких дней после того, как он почувствует себя лучше. Именно тогда вирус, скорее всего, может быть передан другим людям. Вирус может оставаться в стуле вашего ребенка в течение нескольких недель после исчезновения симптомов.
Какие симптомы?
У ребенка, подвергшегося воздействию вируса, появляются симптомы от 1 до 3 дней.
Рвота часто является первым признаком. Обычно за этим следует жар и диарея. У большинства детей с ротавирусом наблюдается очень водянистая диарея, которая кажется очень сильной для младенца или маленького ребенка. Самая тяжелая диарея длится от 3 до 8 дней. Но эпизоды диареи могут длиться еще долго после того, как ваш ребенок почувствует себя лучше. У некоторых детей диарея может длиться несколько недель.
Диарея, особенно когда она возникает вместе с рвотой, может быстро привести к обезвоживанию у младенцев и маленьких детей, инфицированных ротавирусом.По этой причине важно продолжать кормить ребенка и внимательно следить за ним на предмет признаков обезвоживания.
Как диагностируется ротавирус?
Ваш врач, вероятно, диагностирует у вашего ребенка ротавирусную инфекцию на основании его или ее симптомов. Время года также является важной подсказкой. Если у вашего ребенка диарея и другие симптомы зимой или ранней весной (примерно с ноября по апрель), ваш врач часто подозревает ротавирус в качестве причины.
Для подтверждения диагноза можно провести анализ стула. Этот вид теста не нужен, если у вашего ребенка нет других заболеваний, из-за которых важно знать точную причину симптомов.
Как лечится?
Очень важно, чтобы ваш ребенок чувствовал себя комфортно и предотвращал обезвоживание.
Держите ребенка столько, сколько он хочет. Держите ребенка в удобной одежде и при необходимости меняйте ему подгузник или трусы.У вашего ребенка может появиться опрелость. Для лечения опрелостей вам может потребоваться использовать теплые мочалки для мытья ягодиц ребенка и кремы, чтобы предотвратить болезненные ощущения. В некоторых случаях вы можете подержать ребенка и ополоснуть его или ее зад в проточной воде, чтобы хорошо очистить область.
Не давайте ребенку лекарства, отпускаемые без рецепта, если вы предварительно не проконсультировались с врачом.
Ваш врач может порекомендовать регидратирующий напиток, например Педиалит. Это может быть особенно полезно, если диарея вашего ребенка длится дольше нескольких дней.Напитки для регидратации помогают восполнить жидкость и электролиты. Обычная вода не обеспечивает необходимых питательных веществ или электролитов и может не усваиваться, когда у вашего ребенка диарея.
Не , а давайте ребенку или маленькому ребенку регидратирующие напитки для взрослых или спортивные напитки, такие как Gatorade. Эти напитки не имеют необходимого для маленьких детей баланса питательных веществ и электролитов.
Ваш врач может порекомендовать вашему ребенку пробиотики. Это бактерии, которые помогают поддерживать естественный баланс организмов (микрофлоры) в кишечнике.Для получения дополнительной информации см. Тему Пробиотики.
Младенца или маленького ребенка необходимо лечить в больнице, если обезвоживание становится серьезным. Позвоните 911 или обратитесь в отделение неотложной помощи, если у вашего ребенка есть признаки сильного обезвоживания, к которым относятся:
- Очень хочется спать, трудно просыпаться.
- Очень сухие во рту и очень сухие глаза.
- Вялость и гибкость, как тряпичная кукла.
- Не использовать мокрые подгузники (сухие подгузники) в течение 12 и более часов.
Можно ли предотвратить заражение вашего ребенка ротавирусом?
Трудно предотвратить заражение ребенка этой инфекцией. Исследования показывают, что грудное вскармливание может помочь предотвратить ротавирус или уменьшить его тяжесть.
Ротавирусная вакцина помогает защитить от ротавирусной болезни.
