Токсокаре: Следы заражения червем токсокарой нашли у каждого пятого человека на планете
Следы заражения червем токсокарой нашли у каждого пятого человека на планете
SuSanA Secretariat / flickr.com
19 процентов людей на Земле хотя бы раз в жизни встречались с паразитическим круглым червем токсокарой, если верить подсчетам ученых, которые проанализировали данные двух с половиной сотен исследований. В зоне риска — жители стран с влажным климатом, мужчины и дети, а также те, кто работает с почвой и держит домашних питомцев. Исследование опубликовано в журнале PLoS Neglected Tropical Diseases.
Токсокары (которых не стоит путать с токсоплазмой) — это круглые паразитические черви, которые могут попасть в организм человека из кошачьих, собачьих и лисьих экскрементов. Сами по себе токсокары внутри человека не размножаются, но проявление болезни зависит от того, в каком органе они оказались. Личинка может жить в кишечнике, вызывая лихорадку, отеки и пневмонию. Или же мигрировать из кишечника и осесть внутри других органов, например, глаз. Обе формы инфекции поддаются лечению, если вовремя их выявить.
Группа ученых под руководством Робина Гэссера (Robin Gasser) из Мельбурнского университета задалась целью подсчитать, насколько на самом деле среди людей распространены токсокары. Несмотря на то, что случаи тяжелой болезни должны быть упомянуты в медицинских отчетах, они не дают полного представления об масштабе проблемы, потому что у некоторых людей заражение токсокарой не вызывает никаких симптомов.
Ученые нашли в базах научных публикаций 250 исследований, авторы которых измеряли титр антител к токсокарам в крови здоровых людей — то есть показатель того, что человек как минимум однажды жил с токсокарой внутри себя. Под здоровыми людьми авторы подразумевали тех, кто не страдает не только токсокарозом, но также аллергией и глазными болезнями, а также не относится к группе повышенного риска, как, например, садовники или ветеринары. Всего в этих исследованиях приняли участие 265327 человек из разных стран мира.
Под здоровыми людьми авторы подразумевали тех, кто не страдает не только токсокарозом, но также аллергией и глазными болезнями, а также не относится к группе повышенного риска, как, например, садовники или ветеринары. Всего в этих исследованиях приняли участие 265327 человек из разных стран мира.Исследователи проанализировали данные всех работ и составили свою карту распространенности токсокар. Чаще всего, как и следовало ожидать, их обнаруживали у африканцев — у 37,7 процентов, а реже всего — около 8 процентов — в восточном средиземноморье. В среднем на планете с токсокарой хотя бы однажды встречалось 19 процентов людей, то есть практически каждый пятый.
Rostami et al. / PLOS Negl Trop Dis, 2019
По подсчетам ученых, токсокарой чаще болели дети, чем взрослые (18 и 12 процентов соответственно). Также количество встреч росло от богатых стран к бедным, от полюсов к экватору и от областей с сухим климатом к областям с повышенной влажностью. Исследователи также составили список факторов, которые повышают риск заражения. В него, в частности, вошли мужской пол (на 27 процентов по сравнению с женским), жизнь в сельской местности (дополнительные 76 процентов), употребление сырого мяса (59 процентов) и некипяченой воды (97 процентов) и работа с почвой (риск растет в два раза).
Также количество встреч росло от богатых стран к бедным, от полюсов к экватору и от областей с сухим климатом к областям с повышенной влажностью. Исследователи также составили список факторов, которые повышают риск заражения. В него, в частности, вошли мужской пол (на 27 процентов по сравнению с женским), жизнь в сельской местности (дополнительные 76 процентов), употребление сырого мяса (59 процентов) и некипяченой воды (97 процентов) и работа с почвой (риск растет в два раза).
Авторы работы отмечают, что некоторые данные могут быть искажены, поскольку при измерении титра антител к токсокаре иногда случайно учитываются антитела к другим гельминтам, например, трихинелле. Тем не менее, им полученные цифры кажутся правдоподобными: несмотря на то, что во многих странах мира гигиена развита хорошо, люди редко едят сырое мясо и тщательно моют руки, частые встречи с токсокарой можно объяснить растущей популярностью домашних питомцев, в особенности — кошек и собак.
Кишечные паразиты преследовали людей всегда — у древних греков их подробно описывал еще Гиппократ, а древних римлян, например, от них не спасали даже бани и гигиена. А недавно найденные окаменелости позволили ученым выяснить, какие паразиты мучили древних британцев и жителей одного из древнейших известных поселений человека в Турции.
А недавно найденные окаменелости позволили ученым выяснить, какие паразиты мучили древних британцев и жителей одного из древнейших известных поселений человека в Турции.
Полина Лосева
Анализ определения антител IgG к токсокаре (anti-Toxocara IgG) в медицинской лаборатории \”Оптимум\” в Сочи.
Анализ выявления антител IgG к токсокаре (anti-Toxocara IgG)
Определение концентрации в крови иммуноглобулина G к антигенам Toxocara canis – серологический маркер наличия токсокароза. Методика основана на специфическом взаимодействии антигена возбудителя и иммунного антитела с помощью меченного фермента. Оценивание полученного иммунного комплекса проводится на специальном аппарате (анализаторе).
Подготовка к исследованию:
- Исследование проводится утром, натощак
- С последнего приема пищи должно пройти не менее 8 часов
- Исключить прием алкоголя не менее чем за 24 часа до взятия биоматериала
- Не рекомендуется сдавать кровь на серологию после флюорографии, рентгена, физиотерапевтических процедур
Тип биоматериала: венозная кровь
Синонимы (rus): Антитела IgG к токсокаре, иммуноглобулины G к экскреторно-секреторному антигену личинок
Синонимы (eng): Anti-Toxocara IgG, Аntibodies IgG
Методы исследования: иммуноферментный анализ
Единицы измерения: КП
Сроки выполнения: 5-7 дней
Общие сведения о токсокарозе и его выявлении
Нематоды Toxocara canis – круглые черви рода Anisakidae, паразитирующие в организме животных рода псов.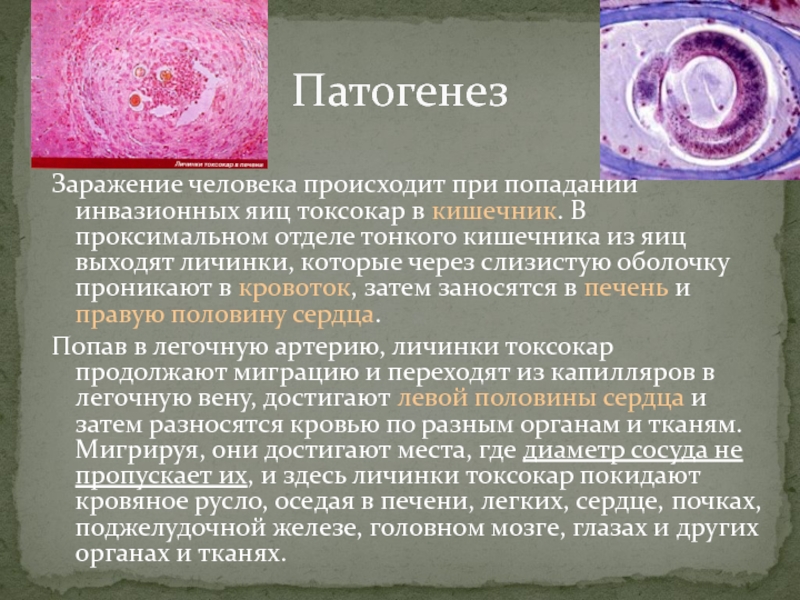 Вызывают паразитарное заболевание, которое поражает глаза и внутренние органы человека. Яйца возбудителя выделяются в окружающую среду с экскрементами инфицированного животного, человек заражается при употреблении плохо обработанных продуктов. В человеческом организме личинки проникают через слизистую тонкой кишки в кровоток, мигрируют по нему и частично оседают в тканях различных органах. Личинки токсокары оказывают воздействие на человеческий организм: поражают печень, почки, скелетные мышцы, легкие, нервную систему, кровеносные сосуды, глаза, вызывают кровотечения и омертвение тканей. Заболевание часто протекает без характерных клинических проявлений, различают:
Вызывают паразитарное заболевание, которое поражает глаза и внутренние органы человека. Яйца возбудителя выделяются в окружающую среду с экскрементами инфицированного животного, человек заражается при употреблении плохо обработанных продуктов. В человеческом организме личинки проникают через слизистую тонкой кишки в кровоток, мигрируют по нему и частично оседают в тканях различных органах. Личинки токсокары оказывают воздействие на человеческий организм: поражают печень, почки, скелетные мышцы, легкие, нервную систему, кровеносные сосуды, глаза, вызывают кровотечения и омертвение тканей. Заболевание часто протекает без характерных клинических проявлений, различают:
- Висцеральную форму (синдром «блуждающей» личинки) – проявляется общим недомоганием, лихорадкой, увеличением селезенки, лимфоузлов и печени, воспалением легких, кожной сыпью.
- Глазную – снижается острота зрения, возможно наличие в стекловидном теле глаза мигрирующих токсокар, вследствие чего развивается острое поражение глаза: эндофтальмит, гранулема сетчатки, кератит, увеит.

Заболевание диагностируют на основании эпидемиологических данных, клинических симптомов, результатов клинических (у пациентов наблюдается большое количество эозинофилов) и серологических анализов.
Кому и когда специалист назначает обследование?
При заражении человека Toxocara canis в организме вырабатываются специфические иммуноглобулины М и G, которые появляются через месяц после инфицирования, уровень содержания их достигает максимума через два месяца и сохраняется в крови длительное время. Степень концентрации антител связана со степенью тяжести состояния пациента.
Квалифицированный офтальмолог, гастроэнтеролог, инфекционист, аллерголог назначает исследование IgG для подтверждения токсокароза при наличии:
- симптомов поражения легких, печени, лихорадки неясной этиологии;
- эозинофилии;
- эпидемиологического очага заражения.
Анализ проводят пациентам, имеющим профессиональный риск инфицирования – кинологам, ветеринарам, фермерам, животноводам.
Расшифровка данных анализа
- Коэффициент позитивности (КП) менее 1,1 – отрицательный результат, токсокароз отсутствует.
- Слабоположительным результатом считают КП от 1,1 до 4,1 – можно предположить вирус-носительство, ранний период инфекционного процесса (анализ нужно повторить через 2 месяца).
- КП выше 4,2 – положительный результат, текущий или недавно перенесенный токсокароз.
У пациентов, страдающих иммунодефицитом или лимфо-пролиферативными патологиями заболеваниями, могут быть ложноположительные результаты анализа. При инвазии, протекающей с поражением глаз, наблюдаются слабоположительные результаты (из-за слабого антигенного воздействия).
Toxocara, IgG, титр
Токсокароз – паразитарное заболевание, вызываемое нематодой семейства Anisakidae рода Тохосаra canis – гельминтом, который паразитирует на собаках и других представителях семейства псовых. Заражение человека происходит при проглатывании яиц токсокар, находящихся в почве, на шерсти животных, в продуктах питания. Заболевание проявляется двумя основными формами: висцеральной – синдромом “блуждающей личинки” – и глазной. Токсокароз характеризуется длительным течением и частыми рецидивами.
Заболевание проявляется двумя основными формами: висцеральной – синдромом “блуждающей личинки” – и глазной. Токсокароз характеризуется длительным течением и частыми рецидивами.
Определение антител класса IgG к возбудителю токсокароза – это основной серологический метод, позволяющий диагностировать инвазию токсокарами.
Синонимы русские
Антитела класса IgG к Toxocara, иммуноглобулины класса G к антигенам токсокар.
Синонимы английские
Anti-Toxocara IgG, Toxocara antibodies, IgG.
Метод исследования
Иммуноферментный анализ (ИФА).
Какой биоматериал можно использовать для исследования?
Венозную кровь.
Как правильно подготовиться к исследованию?
- Не курить в течение 30 минут до исследования.
Общая информация об исследовании
Исследование проводится для выявления инфицирования нематодой семейства Anisakidae рода Тохосаra canis – это круглые черви, которые вызывают токсокароз.
Токсокароз – распространенное во всем мире паразитарное заболевание, поражающее различные органы, включая глаза. Основным хозяином (источником инвазии) являются домашние и дикие животные семейства псовых (собаки, волки, лисы и т. д.), инфицированные T. canis. Инфицированность этих животных у нас в стране составляет до 70 %. В их организме происходит окончательное созревание паразита до взрослых особей, которые локализуются в тонком кишечнике и продуцируют яйца, выделяемые в окружающую среду с калом. При попадании в почву яйца гельминтов длительное время сохраняют жизнеспособность и инвазивность. Человек заражается при проглатывании яиц T. Canis, содержащихся в почве, на шерсти животных, а также употребляя в пищу недостаточно обработанные продукты питания. Попадая внутрь, личинки паразита начинают выходить из яиц в проксимальном отделе тонкой кишки. Затем они мигрируют через слизистую оболочку кишечника в кровеносную систему и через воротную вену попадают в печень, где частично оседают.
Личинки токсокар, прошедшие через легкие, через большой круг кровообращения распространяются по всему организму, оседая в различных органах. Попавшие в ткани органов личинки гельминта не претерпевают дальнейшего нормального развития и в конечном счете там и погибают, инкапсулируясь и образуя гранулемы.
Мигрируя по организму, личинки оказывают на него различное воздействие: травмируют кровеносные сосуды, вызывая кровотечения и некроз. Важное значение имеют экскреторно-секреторные антигены личинок, оказывающие сенсибилизирующее действие на организм.
Тяжесть клинических проявлений заболевания связана не только с численностью паразитов, но и с уровнем аллергической чувствительности организма. При токсокарозе чаще всего поражаются печень, легкие, центральная нервная система, в том числе глаза, почки и скелетные мышцы.
Токсокароз может протекать в различных формах, часто бессимптомно.
Основные симптомы инфицирования T. canis: лихорадка, лимфоаденопатия, общее недомогание, кожная сыпь, желудочно-кишечные расстройства, при массивных инвазиях – боли в правом подреберье, увеличение печени и селезенки, признаки поражения легких. Для глазной формы токсокароза характерно поражение одного глаза в виде снижения остроты зрения, гранулемы сетчатки, увеита, эндофтальмита, неврита зрительного нерва, кератита или наличия мигрирующих личинок в стекловидном теле. Хотя основные проявления заболевания зависят от пораженных органов, наиболее характерным лабораторным показателем является эозинофилия периферической крови.
У пациентов со сниженным иммунитетом при массивной инвазии токсокарами возможны тяжелые осложнения.
Диагноз “токсокароз” ставят на основании клинической картины, эозинофилии, данных эпидемиологического анамнеза и результатов серологического исследования.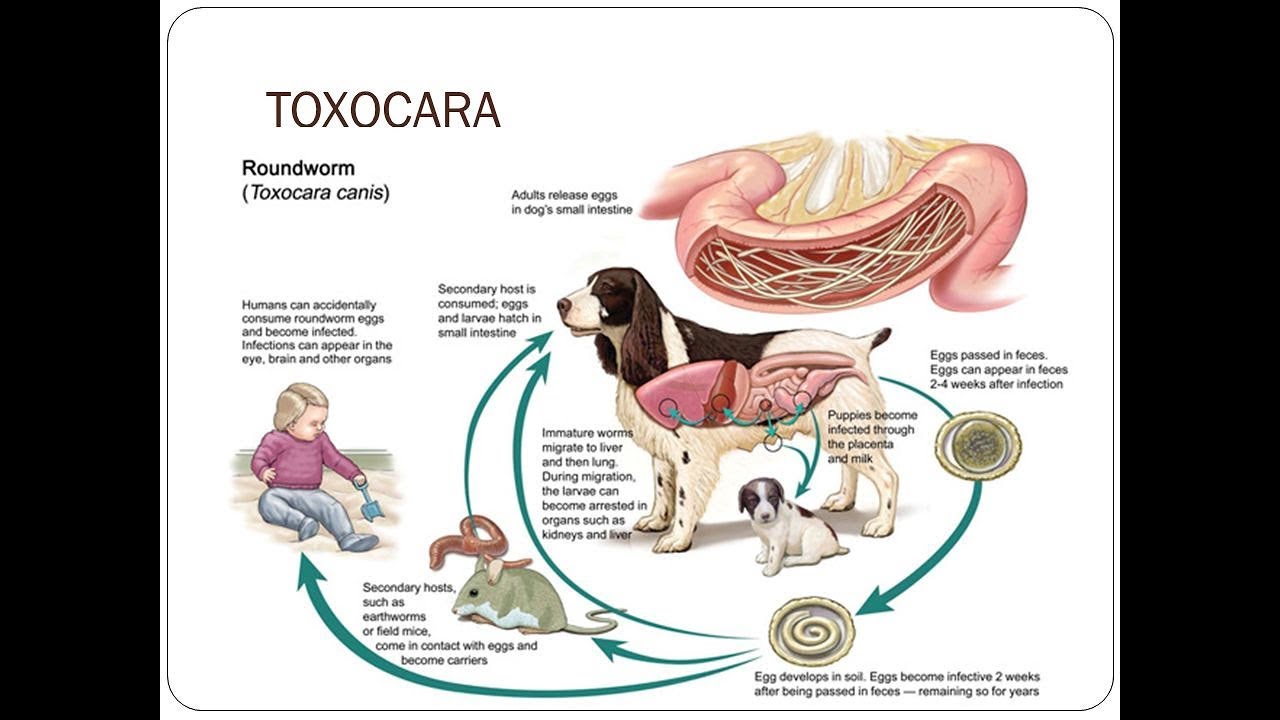
Для чего используется исследование?
Исследование проводится с целью выявления инфицирования нематодой семейства Anisakidae, рода Тохосаra canis, которая вызывает токсокароз. Рекомендуется обследование людей, относящихся к группам риска: ветеринаров, животноводов, кинологов, детей с признаками лихорадки неясного происхождения и с эозинофилией крови.
Существует несколько методов, которые могут быть использованы для проверки на токсокароз. Один из них позволяет определять антитела возбудителя в крови.
Когда происходит контакт человека с Toxocara canis, его иммунная система реагирует, вырабатывая антитела IgM и IgG.
Иммуноглобулины класса G к Toxocara в определяемых количествах появляются в крови через 6-8 недель с момента инфицирования. Концентрация их нарастает и через 2-3 месяца достигает максимума, сохраняясь на определенном уровне в течение продолжительного времени. Степень повышения уровня антител в крови тесно связана с тяжестью заболевания.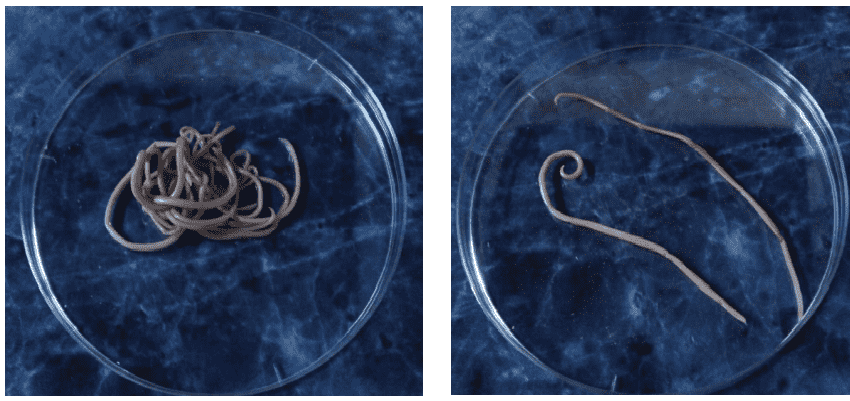
Ложноположительные результаты анализа возможны у лиц с системными лимфопролиферативными заболеваниями и иммунодефицитом. Ложноотрицательные и сомнительные результаты анализа могут наблюдаться у лиц с поражением глаз в результате слабого антигенного воздействия.
Тест на антитела класса IgG к Toxocara является основным методом выявления токсокароза у человека и применяется для подтверждения диагноза.
В каких случаях назначают анализ?
- Если имеются признаки поражения печени, легких и/или лихорадка неясного происхождения на фоне эозинофилии в крови, указывающие на возможную инвазию нематодами.
- При внезапном снижении зрения, затрагивающего один глаз.
- По эпидемиологическим показаниям (контакт с собаками, землей – особенно у детей).
- Если известно, что человек употреблял недостаточно обработанные продукты, которые могли быть заражены T. Canis.
- Когда пациент входит в группу повышенного риска (животноводы, кинологи, фермеры, ветеринары).

Что означают результаты?
Референсные значения
|
КП |
Титр |
Результат |
|
КП |
– |
отрицательный |
|
|
1:100 |
слабоположительный |
|
|
1:200 |
|
|
|
1:400 |
|
|
|
1:800 |
положительный |
|
|
1:1600 |
|
|
|
1:3200 |
|
|
|
1:6400 |
|
|
|
1:12800 |
Для анализов крови на антитела класса IgG к возбудителю токсокароза, которые организм вырабатывает для борьбы с инфекцией, положительный результат указывает на то, что пациент инфицирован Toxocara canis. Вместе с тем отрицательный результат не всегда означает, что у пациента нет токсокароза.
Вместе с тем отрицательный результат не всегда означает, что у пациента нет токсокароза.
Положительный результат теста на антитела IgG к Toxocara canis у ранее серонегативного пациента, а также значительный прирост титров в парных сыворотках, взятых с интервалом, подтверждает первичную инфекцию.
Отрицательный результат данного теста может свидетельствовать об отсутствии инфицирования или слишком раннем его сроке, когда не выработался иммунный ответ.
Повторные исследования уровня антител в крови больного позволяют оценивать проводимое лечение — о его эффективности свидетельствует снижение уровня антител.
Причины отрицательного результата:
- отсутствие инфицирования,
- глазной токсокароз (ввиду слабого иммунного ответа),
- слишком раннее инфицирование, когда не выработался иммунный ответ.
Причины положительного результата:
- текущий или перенесенный в прошлом токсокароз,
- скрытый токсокароз.

Важные замечания
- Диагностика токсокароза сложна. Это обусловлено тем, что в организме человека токсокары не достигают половозрелого состояния, поэтому нельзя выявить взрослых особей или их яйца в образцах кала или дуоденальном содержимом, как при других гельминтозах.
- Обязательно учитывают эпидемиологический анамнез: контакт с собаками, землей, употребление в пищу недостаточно обработанных продуктов.
- Заболевание не передается от человека к человеку.
- Основой профилактики токсокароза является соблюдение правил личной гигиены: мытье рук после контакта с почвой или животными. Нельзя употреблять в пищу плохо обработанные продукты питания, которые могут содержать яйца Toxocara canis.
- Владельцам собак необходимо своевременно обследовать своих питомцев и, если необходимо, проводить их дегельминтизацию.
Также рекомендуется
- Скрининговое обследование на гельминтозы (Opistorchis IgG, Toxocara IgG, Trichinella IgG, Echinococcus IgG)
Кто назначает исследование?
Инфекционист, терапевт, педиатр, гастроэнтеролог, аллерголог, офтальмолог.
Токсокары (антитела класса IgG)(титр)
Токсокароз – паразитарное заболевание, вызываемое личинками аскарид. Характеризуется длительным течением и поражениями нескольких внутренних органов.
Половозрелые формы токсокар – крупные раздельнополые черви длиной 4-18 см локализуются в желудке и тонком кишечнике животных (собак). Интенсивность заражения у собак может быть очень высокой, особенно у молодых животных. Средняя продолжительность жизни половозрелых особей составляет 4 месяца, максимальная – 6 месяцев. Самка паразита за сутки откладывает более 200 тыс. яиц. В 1 г фекалий может содержаться 10000-15000 яиц, так что в почву попадают миллионы яиц, обусловливая тем самым высокий риск заражения токсокарозом.
Цикл развития возбудителя следующий: выделившиеся яйца токсокар попадают в почву, где, в зависимости от влажности и температуры почвы, созревают за 5-36 суток, становясь заразными. Заразность яиц сохраняется в почве длительное время, в компосте – несколько лет.
Заразность яиц сохраняется в почве длительное время, в компосте – несколько лет.
Жизненный цикл токсокары сложный. Выделяют основной цикл и два варианта вспомогательных. Основной цикл происходит по схеме: окончательный хозяин (собаки) – почва – окончательный хозяин (собаки). Вспомогательный цикл (вариант 1) идет трансплацентарно, в этом случае паразит в личиночной стадии переходит от беременной самки к плоду. Зараженный щенок становится функционально полноценным окончательным хозяином, источником заражения.
Вспомогательный цикл (вариант 2) осуществляется по цепи: окончательный хозяин (собаки) – почва – резервуарный хозяин. Резервуарным хозяином могут быть грызуны, свиньи, овцы, птицы, земляные черви. Человек также выступает в роли резервуарного хозяина, но не включается в цикл передачи заражения, являясь для паразита биологическим тупиком. Дальнейшее развитие возбудителя происходит при условии, что резервуарный хозяин будет съеден собакой или другим окончательным хозяином.
У человека цикл развития возбудителя, его миграция осуществляется следующим образом. Из яиц токсокар, попавших в рот, затем в желудок и тонкий кишечник выходят личинки, которые через слизистую оболочку проникают в кровеносные сосуды и через систему воротной вены мигрируют в печень, где часть из них оседает, окружается воспалительной оболочкой. Часть личинок по системе печеночных вен проходит фильтр печени, попадает в правое сердце и через легочную артерию – в легкие. В легких часть личинок также задерживается, а часть, пройдя фильтр легких, по большому кругу кровообращения заносится в различные органы, оседая в них. Личинки токсокар могут локализоваться в различных органах и тканях – почках, мышцах, щитовидной железе, головном мозге и др. В тканях личинки сохраняют жизнеспособность многие годы и периодически, под влиянием различных факторов, возобновляют миграцию, обусловливая рецидивы заболевания.
Токсокароз – широко распространенная болезнь, она регистрируется во многих странах.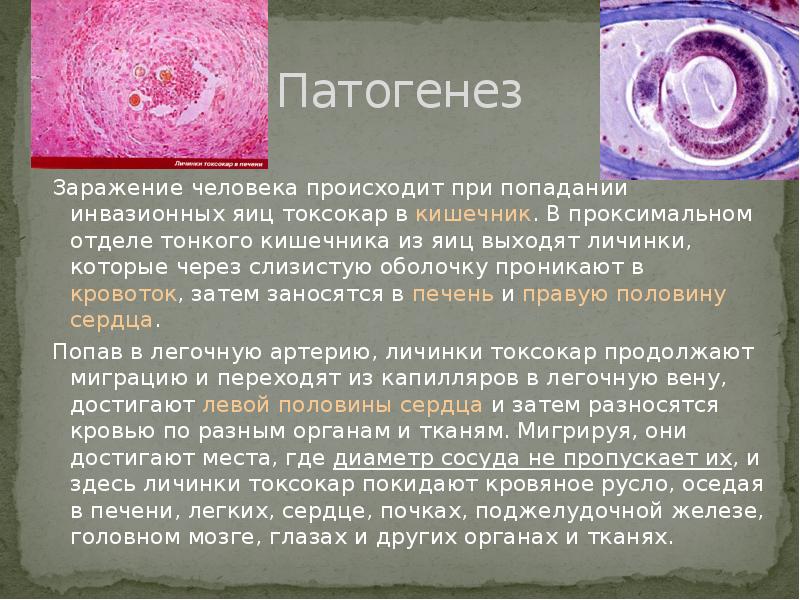
Основным источником заражения для человека являются собаки, особенно щенки. Заражение происходит при непосредственном контакте с зараженным животным, шерсть которого загрязнена яйцами, или при попадании в рот земли, в которой были яйца токсокар. Особенно подвержены заражению дети во время игры в песке или с собакой. Взрослые заражаются при бытовом контакте с заразными животными или в процессе профессиональной деятельности (ветеринары, собаководы, работники коммунальной службы, шоферы, землекопы и др.). У человека возможно заражение также при поедании сырого или плохо обработанного термически мяса. Описаны случаи заражения токсокарозом при употреблении в пищу печени ягненка.
Симптомы токсокароза определяются интенсивностью заражения, распределением личинок в органах и тканях, особенностями иммунного ответа человека. Проявления токсокароза малоспецифичны и имеют сходство с другими гельминтами.
Токсокароз обычно развивается внезапно или после короткой предболезни проявляется в виде легкого недомогания.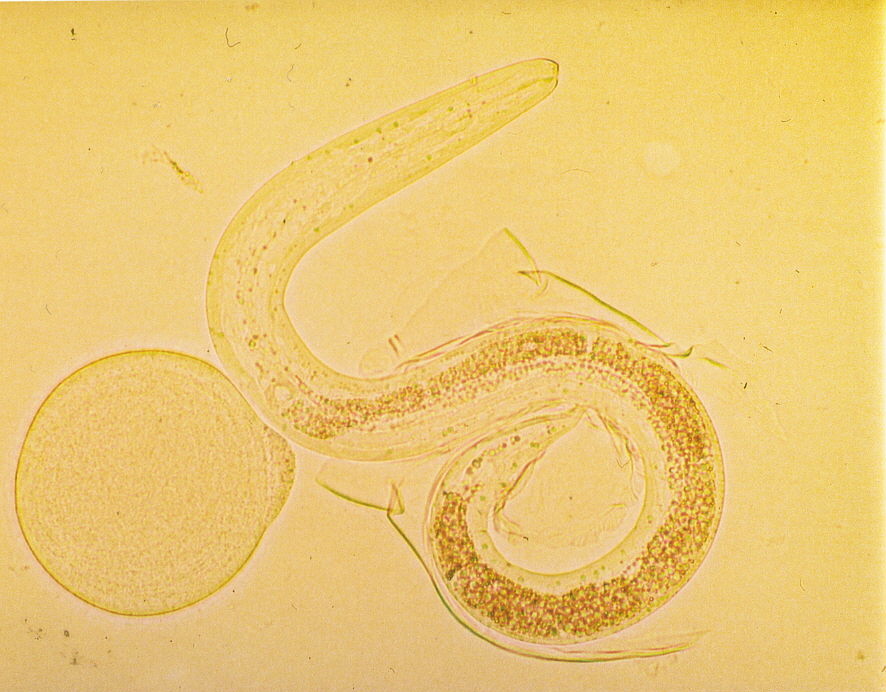 Появляется температура – невысокая в легких случаях и высокая до 39°С и выше, иногда с ознобом. Могут наблюдаться кожные высыпания в виде крапивницы, иногда отеки типа Квинке. В остром периоде наблюдается легочный синдром различной степени тяжести: от легких явлений до острого бронхита, пневмонии, тяжелых приступов удушья. Особенно тяжело легочный синдром протекает у детей раннего возраста. Иногда имеет место приступы болей в животе. Известны случаи поражения щитовидной железы, проявляющиеся симптомами опухоли. При миграции личинок в головной мозг: упорные головные боли, судороги, параличи. У детей заболевание сопровождается слабостью, легкой возбудимостью, нарушением сна.
Появляется температура – невысокая в легких случаях и высокая до 39°С и выше, иногда с ознобом. Могут наблюдаться кожные высыпания в виде крапивницы, иногда отеки типа Квинке. В остром периоде наблюдается легочный синдром различной степени тяжести: от легких явлений до острого бронхита, пневмонии, тяжелых приступов удушья. Особенно тяжело легочный синдром протекает у детей раннего возраста. Иногда имеет место приступы болей в животе. Известны случаи поражения щитовидной железы, проявляющиеся симптомами опухоли. При миграции личинок в головной мозг: упорные головные боли, судороги, параличи. У детей заболевание сопровождается слабостью, легкой возбудимостью, нарушением сна.
Наиболее характерным лабораторным показателем токсокароза является повышенное содержание эозинофилов в периферической крови. Относительный уровень эозинофилии может колебаться в широких пределах, достигая в ряде случаев 70-80% и более. Повышается содержание лейкоцитов. В хронической стадии болезни острые клинические и лабораторные признаки затухают. Наиболее стабильным лабораторным показателем остается повышение эозинофилов.
Наиболее стабильным лабораторным показателем остается повышение эозинофилов.
Паразитологический диагноз устанавливается редко и только по наличию в тканях характерных образований – гранулем и личинок и их идентификации при исследовании биопсийного и секционного материала. Это возможно при пункционной биопсии печени, легких, оперативном вмешательстве. Используют также иммунологические реакции, позволяющие выявлять антитела к антигенам токсокар. Обычно применяют ИФА с секреторно-экскреторным антигеном личинок токсокар второго возраста.
Необходимо воздержаться от приема пищи в течение 2-3 часов.
Антитела IgG к токсокаре | Новая диагностика
Токсокароз (Toxocariasis) — это инфекция, вызванная паразитом рода Toxocara семейства аскарид (как правило, Тохосатcanis и редко — Тохосатcаti). Заболевание возникает через заглатывание почвы, загрязненной яйцами эмбрионов паразита, выделяемыми животными-хозяевами с фекалиями.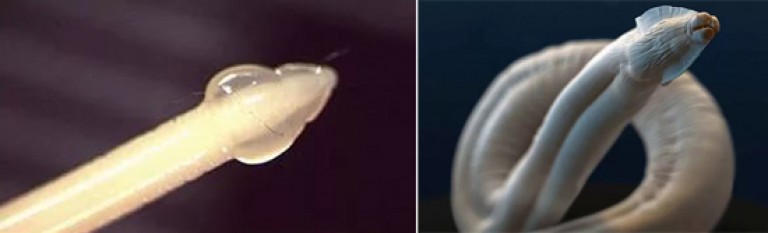 Эмбриогенез происходит в почве (являются геогельминтами) в течение 2–5 недель после элиминации яиц животными. Таким образом, инфицирование людей происходит не в результате контакта свежими фекалиями. Собака является окончательным хозяином Тохосаrcanis. Собака заражается несколькими способами: через заглатывание яиц-эмбрионов, трансплацентарно, или при кормлении молоком детенышей инфицированной самкой. Непосредственным результатом является массовое загрязнение почвы яйцами и тем самым увеличивается риск заражения. Проблема загрязнения окружающей среды яйцами Тохосаr и питание с нарушением правил гигиены способствует распространению инфекции. У детей главным источником инфекции является игровая площадка, куда имеют доступ животные. В таких случаях человек является промежуточным случайным и нетипичным хозяином. В кишечнике личинки выходят из оболочки, проникают в стенку и мигрируют в кровоток, начиная околокишечный цикл. Во время миграции через печень, легкие, почки, мышцы, ЦНС, глаза реакция организма предотвращает развитие личинки, которые достигают так называемый «тупик паразита», инактивируются, а затем разрушаются и подвергаются резорбции.
Эмбриогенез происходит в почве (являются геогельминтами) в течение 2–5 недель после элиминации яиц животными. Таким образом, инфицирование людей происходит не в результате контакта свежими фекалиями. Собака является окончательным хозяином Тохосаrcanis. Собака заражается несколькими способами: через заглатывание яиц-эмбрионов, трансплацентарно, или при кормлении молоком детенышей инфицированной самкой. Непосредственным результатом является массовое загрязнение почвы яйцами и тем самым увеличивается риск заражения. Проблема загрязнения окружающей среды яйцами Тохосаr и питание с нарушением правил гигиены способствует распространению инфекции. У детей главным источником инфекции является игровая площадка, куда имеют доступ животные. В таких случаях человек является промежуточным случайным и нетипичным хозяином. В кишечнике личинки выходят из оболочки, проникают в стенку и мигрируют в кровоток, начиная околокишечный цикл. Во время миграции через печень, легкие, почки, мышцы, ЦНС, глаза реакция организма предотвращает развитие личинки, которые достигают так называемый «тупик паразита», инактивируются, а затем разрушаются и подвергаются резорбции. По этой причине инфицированные лица не могут передавать инфекцию другим. Клинические и патологические проявления, сопровождающиеся местными и общими реакциями организма, при наличии личинок других видов аскарид, иных, чем обычно, паразитируют в организме человека, представляют так называемый синдром висцеральной Ларва Мигранс. Клинические проявления зависят от количественной инфицированности паразитом и возраста хозяина. Многие инфекции протекают бессимптомно, только эозинофилия в общем анализе крови является единственным показателем. Симптомы появляются, в основном, при состояниях, при которых гибнут личинки. Смерть личинок обуславливают реакции гиперчувствительности немедленного типа и позднего типа, с формированием гранулем с участием эозинофилов. В этих случаях периферичнаяэозинофилия может достигать 70–80%. Также могут наблюдаться увеличения уровня сывороточного IgE.
По этой причине инфицированные лица не могут передавать инфекцию другим. Клинические и патологические проявления, сопровождающиеся местными и общими реакциями организма, при наличии личинок других видов аскарид, иных, чем обычно, паразитируют в организме человека, представляют так называемый синдром висцеральной Ларва Мигранс. Клинические проявления зависят от количественной инфицированности паразитом и возраста хозяина. Многие инфекции протекают бессимптомно, только эозинофилия в общем анализе крови является единственным показателем. Симптомы появляются, в основном, при состояниях, при которых гибнут личинки. Смерть личинок обуславливают реакции гиперчувствительности немедленного типа и позднего типа, с формированием гранулем с участием эозинофилов. В этих случаях периферичнаяэозинофилия может достигать 70–80%. Также могут наблюдаться увеличения уровня сывороточного IgE.
Наиболее распространенными клиническими формами являются:
– аллергические проявления;
– легочные поражения: кашель, одышка, субфебрилитет, рентгенограмма с застойными инфильтративными и миграционными процессами;
– печеночные поражения: боли в печеночном ложе, гепатомегалия, ано-рексия, тошнота, лихорадка;
– поражения глаз (самые тяжелые): увеит, нейроретинит, неврит зрительного нерва, –
гранулематозные поражения сетчатки, отслоение сетчатки.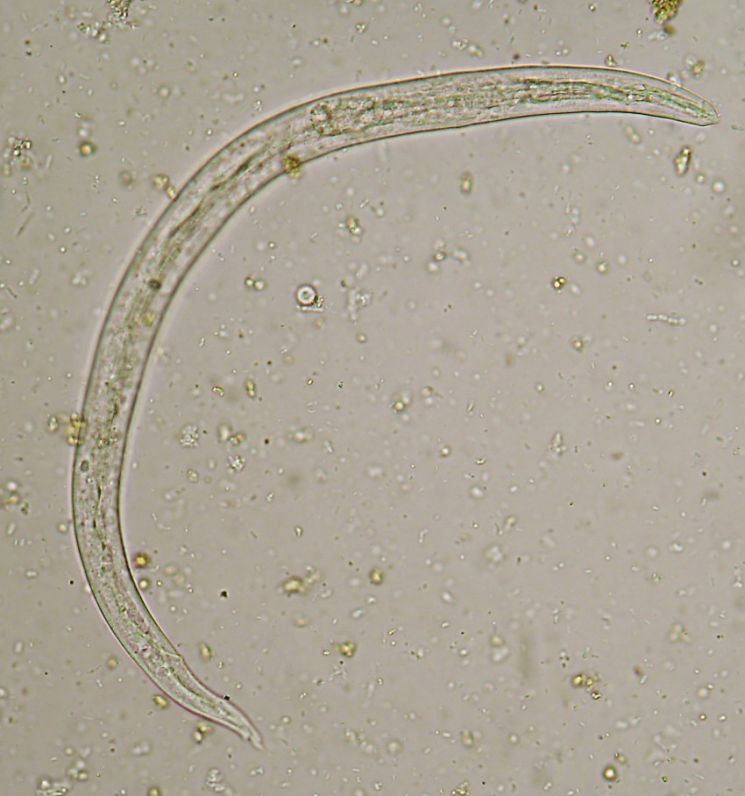
Не существует окончательного метода диагностики инфекций Тохосаrа, а истинная чувствительность и специфичность серологических тестов не могут быть обусловлены точностью. Постановка диагноза осложняется изменчивостью гуморального иммунного ответа, который зависит от инфицированности паразитами и локализации инфекции. Однако многочисленные исследования показывают, что иммуноферментные тесты, которые используют очищенный антиген, выделенный из личиночной стадии, обладают значительно лучшей чувствительностью и специфичностью, по сравнению с другими тестами, использующими необработанные антигены.
Анализ на токсокары ᐈ сдать кровь на (Toxocara canis), антитела IgG
Описание анализа:
Токсокары (Toxocara canis), антитела IgG – анализ, определяющий есть ли в крови антитела к паразиту, круглому червю токсокаре, вызывающему болезнь токсокароз.
Человек не является для токсокары основным хозяином – паразит проходит полный цикл развития в организме собак, лис и волков.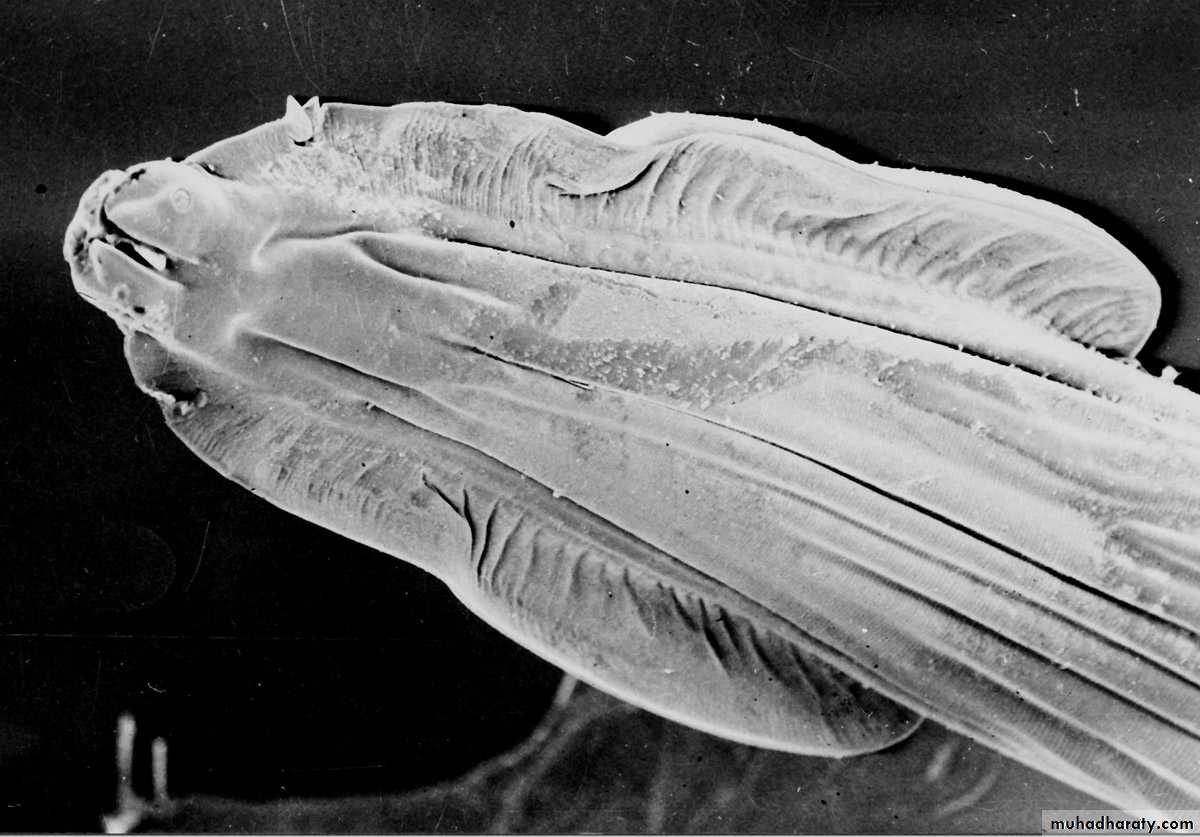 При проглатывании человеком яиц токсокары, содержащихся в почве, на шерсти животных или плохо помытых продуктах, в тонком кишечнике из них вылупляются личинки.
При проглатывании человеком яиц токсокары, содержащихся в почве, на шерсти животных или плохо помытых продуктах, в тонком кишечнике из них вылупляются личинки.
Личинки проникают через стенку кишечника в кровоток, а затем в печень, где часть из них оседает. Остальные личинки токсокары оседают в легких, а их остаток рассеивается по всему организму, поражая головной мозг, глаза, почки, мышцы и другие органы.
В организме человека Toxocara canis не способна пройти полный цикл развития, а потому личинки, рассеявшиеся по нему, в итоге, погибают. Но до того они могут сохранять активность в течение месяцев (в некоторых случаях – нескольких лет), повреждая кровеносные сосуды, провоцируя кровотечения, отмирание тканей и аллергические реакции.
Токсокароз протекает в виде висцерального синдрома («синдром блуждающей личинки») или в форме глазного токсокароза. Также возможно бессимптомное течение заболевания.
Основные симптомы при заражении: повышение температуры, увеличение лимфоузлов, кожная сыпь, расстройства со стороны пищеварительной системы. Если инвазия была массовой (проглочено было большое количество личинок), возможна боль в правом подреберье, увеличение в размерах печени и селезенки, проблемы с легкими.
Если инвазия была массовой (проглочено было большое количество личинок), возможна боль в правом подреберье, увеличение в размерах печени и селезенки, проблемы с легкими.
При глазной форме токсокароза снижается острота зрения, возможен увеит, эндофтальмит, гранулема сетчатки, неврит зрительного нерва или кератит. Все эти проявления обычно наблюдаются только на одном глазу. В некоторых случаях, при офтальмологическом обследовании, в стекловидном теле можно увидеть личинок.
Антитела класса G, вырабатываемые организмом в ответ на инфицирование, возможно определить спустя полтора-два месяца с момента заражения. Спустя 2-4 недели, с момента появления, их концентрация становится максимальной и может оставаться высокой в течение длительного времени.
Показания к назначению анализа на токсокары
Анализ назначается:
- при симптомах токсокароза;
- в случае резкого ухудшения зрения на одном глазу;
- при принадлежности к группе риска (зоотехники, ветеринары, кинологи, сельскохозяйственные работники) в качестве скринингового обследования.

Обследование может назначаться терапевтом или педиатром, инфекционистом, аллергологом, офтальмологом и гастроэнтерологом.
Значение результатов
Если индекс позитивности составляет 0,8 и менее – у пациента нет IgG к токсокаре. Это возможно в том случае, если пациент не заражался гельминтом или же заражение произошло менее 6 недель назад. Также причиной может быть слишком слабая иммунная реакция, такое бывает при иммунодефицитах, а также при глазной форме токсокароза.
Значение индекса позитивности 1,01 и более – признак недавно перенесенного или протекающего токсокароза. Значения в пределах 0,81-1,0 сомнительны и требуют повторного обследования.
Подготовка к обследованию: не требуется.
Материал для исследования: кровь из вены.
Метод исследования: иммуноферментный анализ.
Сроки проведения: 2 рабочих дня.
Запись на анализы
Анализы в KDL.
 Антитела к токсокарам (Toxocara canis), IgG
Антитела к токсокарам (Toxocara canis), IgGТоксокароз – широко распространенное паразитарное заболевание, вызываемое личинками круглых червей Toxocara canis. Окончательный хозяин в цикле развития токсокар – собаки и другие представители семейства псовых (лисы, волки), в их организме гельминт размножается и выделяет яйца, которые попадают в окружающую среду. Человек заражается при проглатывании яиц с водой, почвой, пищей или при контакте с шерстью зараженных животных. Из яиц созревают личинки, которые проникают через стенку кишечника в кровеносное русло и распространяются по сосудам в различные органы и ткани (симптом «блуждающей личинки), что обуславливает разнообразие клинических проявлений. При токсокарозе возможно повышение температуры тела, увеличение лимфоузлов, кожная сыпь по типу крапивницы, приступы бронхиальной астмы, диспепсические расстройства, увеличение печени и селезенки, поражение нервной системы. Отдельно выделяют глазную форму токсокароза.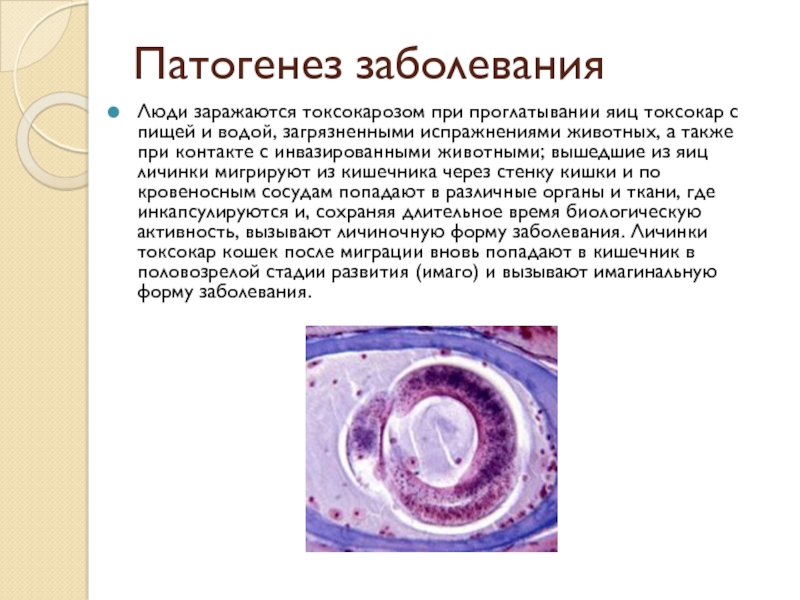 Степень клинических симптомов варьирует от скрытых до тяжелых форм заболевания. Характерный лабораторный признак – высокий уровень эозинофилов в клиническом анализе крови с лейкоцитарной формулой. В кале яйца токсокар при личиночной форме заболевания не определяются, т.к личинки в организме человека не дозревают до стадии размножения.
Степень клинических симптомов варьирует от скрытых до тяжелых форм заболевания. Характерный лабораторный признак – высокий уровень эозинофилов в клиническом анализе крови с лейкоцитарной формулой. В кале яйца токсокар при личиночной форме заболевания не определяются, т.к личинки в организме человека не дозревают до стадии размножения.
Очень редко у человека возникает имагинальная форма токсокароза, когда происходит заражение более зрелыми личинками, способными дозреть до половозрелой особи в организме человека. Клинически проявляется различными кишечными расстройствами. В таком случае можно обнаружить яйца токсокар при исследовании кала.
Антитела к токсокарам (Toxocara canis), IgG вырабатываются через 6-8 недель от момента попадания личинок токсокар в организм человека, являются маркерами хронической или перенесенной инфекции. Определение IgG к токсокарам используют как подтверждающий тест в составе комплексной диагностики личиночной формы заболевания наряду с клиникой, наличием повышенного числа эозинофилов в крови Наличие антител при отсутствии клиники и высоком уровне эозинофилов может расцениваться как токсокароносительство.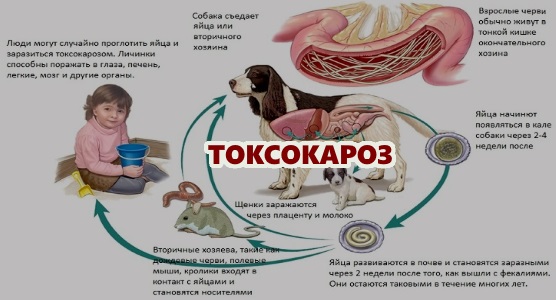
В каких случаях обычно назначают исследование на определение уровня антител к токсокарам IgG?
- при подозрении на токсокароз по клиническим проявлениям – для подтверждения личиночной формы токсокароза
- при выявлении высокого уровня эозинофилов – для дифференциальной диагностики глистных инвазий
- По эпидемиологическим показаниям
Что означают результаты теста?
Референсные значения:
- <1 – результат отрицательный
- 1-4,3 – результат слабоположительный
- >=4,4 – результат положительный
Результат <1 – антитела не обнаружены
- Отсутствие инвазии токсокарами.
- Или сдача анализа в ранний период токсокароза, когда ещё не успели выработаться IgG (при наличии клиники).
Результат >=4,4 – антитела обнаружены
- Текущий токсокароз – при наличии клинических признаков, эпиданамнеза, уровне эозинофилии более 10%.
- Перенесенный токсокароз.

- На основании только определения IgG невозможно достоверно определить давность инфекции.
Результат в интервале от 1 до 4,3 – слабоположительный результат.
- При эозинофилии до 10% вероятно токсокароносительство
Сроки выполнения теста.
3-4 дня
Как подготовиться к анализу?
Можно сдать кровь утром натощак или в течение дня через 3 часа после необильного приёма пищи.
CDC – Токсокароз – Общая информация
Что такое токсокароз?
Токсокароз – это инфекция, передающаяся от животных человеку (зооноз), вызываемая паразитическими круглыми червями, обычно обнаруживаемыми в кишечнике собак ( Toxocara canis ) и кошек ( T. cati ).
Кто подвержен риску токсокароза?
Toxocara может заразиться кто угодно. У маленьких детей и владельцев собак или кошек больше шансов заразиться.
Примерно 5% населения США имеют антитела к Toxocara . Это говорит о том, что десятки миллионов американцев могли подвергнуться воздействию паразита Toxocara .
Это говорит о том, что десятки миллионов американцев могли подвергнуться воздействию паразита Toxocara .
Как можно заразиться токсокарозом?
Собаки и кошки, инфицированные Toxocara , могут выделять Toxocara яиц с фекалиями. Взрослые и дети могут заразиться при случайном проглатывании грязи, содержащей фекалии собак или кошек, содержащие инфекционные яйца Toxocara .Хотя это случается редко, люди также могут заразиться от недоваренного мяса, содержащего личинок Toxocara .
Каковы клинические проявления токсокароза?
Многие люди, инфицированные Toxocara , не имеют симптомов и никогда не болеют. Некоторые люди могут заболеть инфекцией, и у них может развиться следующее:
- Глазной токсокароз: Глазной токсокароз возникает, когда личинок Toxocara мигрируют в глаз.Симптомы и признаки токсокароза глаз включают потерю зрения, воспаление глаз или повреждение сетчатки.
 Обычно поражается только один глаз.
Обычно поражается только один глаз. - Висцеральный токсокароз: Висцеральный токсокароз возникает, когда личинок Toxocara мигрируют в различные органы тела, такие как печень или центральная нервная система. Симптомы висцерального токсокароза включают лихорадку, усталость, кашель, хрипы или боль в животе.
Насколько серьезно заражение
Toxocara ?В большинстве случаев инфекции Toxocara не являются серьезными, и многие люди, особенно взрослые, инфицированные небольшим количеством личинок (незрелых червей), могут не замечать никаких симптомов.Наиболее серьезные случаи встречаются редко, но чаще возникают у маленьких детей, которые часто играют в грязи или едят грязь (pica), загрязненную фекалиями собак или кошек.
Как распространяется токсокароз?
Наиболее распространенным паразитом Toxocara , вызывающим озабоченность у людей, является T. canis , которым щенки обычно заражаются от матери до рождения или от ее молока. Личинки быстро созревают в кишечнике щенка; Когда щенку исполняется 3–4 недели, черви внутри щенка начинают производить большое количество яиц, которые загрязняют окружающую среду через фекалии щенка.После того, как яйца попадают в окружающую среду, инфекционные личинки развиваются в яйцах через 2–4 недели. Если человек проглотит одно из этих инфекционных яиц, он может заразиться токсокарозом.
Личинки быстро созревают в кишечнике щенка; Когда щенку исполняется 3–4 недели, черви внутри щенка начинают производить большое количество яиц, которые загрязняют окружающую среду через фекалии щенка.После того, как яйца попадают в окружающую среду, инфекционные личинки развиваются в яйцах через 2–4 недели. Если человек проглотит одно из этих инфекционных яиц, он может заразиться токсокарозом.
Токсокароз не передается от человека к человеку, как простуда или грипп.
Что мне делать, если я подозреваю, что у меня токсокароз?
Обратитесь к своему врачу, чтобы обсудить возможность заражения и, при необходимости, пройти обследование. Ваш поставщик медицинских услуг может взять образец вашей крови для анализа.
Как лечить токсокароз?
Висцеральный токсокароз лечится противопаразитарными препаратами. Лечение глазного токсокароза сложнее и обычно состоит из мер по предотвращению прогрессирующего повреждения глаза.
Как предотвратить токсокароз?
- Отведите домашних животных к ветеринару, чтобы предотвратить заражение Toxocara .
 Ваш ветеринар может порекомендовать план тестирования и лечения дегельминтизации.
Ваш ветеринар может порекомендовать план тестирования и лечения дегельминтизации. - Мойте руки водой с мылом после игр с домашними или другими животными, после активного отдыха, а также перед тем, как брать пищу или есть.
- Обучите детей тому, как важно мыть руки для предотвращения заражения.
- Не позволяйте детям играть в местах, загрязненных фекалиями домашних или других животных.
- Убирайте жилое пространство вашего питомца не реже одного раза в неделю. Фекалии следует либо закопать, либо собрать в мешки и выбросить в мусорное ведро. Мойте руки после работы с отходами домашних животных.
- Научите детей, что есть грязь или землю опасно.
Подробнее на: Мытье рук
Вернуться к началу
Эта информация не предназначена для использования для самодиагностики или вместо консультации с врачом.Если у вас есть какие-либо вопросы о паразитах, описанных выше, или вы думаете, что у вас паразитарная инфекция, проконсультируйтесь с врачом.
Токсокароз (для родителей) – Nemours Kidshealth
Что такое токсокароз?
Токсокароз (tox-oh-keh-RYE-eh-sis) – это инфекция человека, вызываемая червем, который может жить в кишечнике собак и кошек. Чаще всего встречается у маленьких детей и владельцев домашних животных, но заразиться может любой.
Что вызывает токсокароз?
Яйца собачьего червя Toxocara canis или кошачьего червя Toxocara cati переходят в их фекалии (фекалии). Яйца могут долго храниться в почве дворов, парков и детских площадок. Люди могут проглотить эти яйца, если на их еде или руках есть загрязненная грязь. Это чаще случается с детьми, которые не всегда моют руки хорошо или достаточно часто и которые любят засовывать руки в рот.
В редких случаях люди могут заразиться, употребляя в пищу недоваренное мясо, которое содержит личинок токсокары (детенышей глистов).
Что происходит при токсокарозе?
Проглоченные яйца попадают в кишечник, где из них вылупляются личинки. Личинки проходят через стенку кишечника и попадают в кровоток. Затем они попадают в другие части тела, такие как печень, легкие, сердце, мозг или мышцы.
Личинки проходят через стенку кишечника и попадают в кровоток. Затем они попадают в другие части тела, такие как печень, легкие, сердце, мозг или мышцы.
Личинки не превращаются в кишечных червей у людей, как у собак или кошек. Но они могут жить в человеке месяцами или даже годами и могут повредить любой заразившийся орган.
Каковы признаки и симптомы токсокароза?
Многие люди с токсокарозом не имеют никаких симптомов.Если симптомы действительно появляются, они могут варьироваться от легких до тяжелых.
Симптомы зависят от того, какая часть тела поражена, и могут включать:
- лихорадка
- кашель или хрип
- боль в животе
- увеличенная печень
- потеря аппетита
- Сыпь, иногда напоминающая крапивницу
- увеличенные лимфатические узлы («опухшие железы»)
- проблемы со зрением. Глаз может быть красным и болезненным, глаза могут выглядеть скрещенными, зрение может стать нечетким или затуманенным.
 Если не лечить, это может привести к слепоте на пораженный глаз.
Если не лечить, это может привести к слепоте на пораженный глаз.
Как диагностируется токсокароз?
Поскольку у детей не всегда есть симптомы, во многих случаях токсокароз не диагностируется. При появлении симптомов врачи проведут осмотр и назначат анализы крови, а иногда и другие анализы.
Как лечится токсокароз?
Ребенок с легкими симптомами может не нуждаться в лечении, потому что инфекция исчезнет сама по себе, когда личинки умрут. Детей с симптомами, которые влияют на легкие, глаза или другие важные органы, можно лечить антипаразитарными препаратами, которые убивают личинок.
Врачи иногда также назначают стероиды для облегчения воспаления в поврежденных органах. Они также могут направить ребенка к специалисту (например, к офтальмологу, если поражен глаз).
Можно ли предотвратить токсокароз?
Чтобы защитить ваших детей от контакта с яйцами или личинками, вызывающими токсокароз:
- Отнесите домашних животных к ветеринару для дегельминтизации, особенно щенков младше 6 месяцев.

- Часто очищайте и дезинфицируйте жилое пространство вашего питомца, а после этого хорошо мойте руки.
- Каждый член семьи должен хорошо мыть руки после игры с домашними или другими животными, после игры на улице, а также перед прикосновением к еде или приемом пищи.
- Учите детей младшего возраста не класть грязные руки в рот и не есть грязь или землю.
- Не подпускайте детей к местам с их фекалиями и животными.
- Если у вас есть песочница, не подпускайте к ней домашних животных и накрывайте ее, когда она не используется.
- Вымойте, очистите или приготовьте все фрукты и овощи перед их употреблением.
- Перед употреблением в пищу хорошо готовьте мясо.
Основные аспекты токсокароза человека
Лекарственные препараты
Несмотря на то, что на животных моделях было протестировано множество антигельминтных средств, контролируемые рандомизированные исследования на людях проводились редко, поэтому для лечения человеческого заболевания доступно очень мало лекарств.
Производные бензимидазола включают тиабендазол (TBZ), мебендазол (MBZ) и альбендазол (ABZ) в зависимости от стажа работы.
Когда TBZ вводился перорально каждый день в дозах от 25 мг / кг ч / б (Magnaval and Charlet, 1987) до 50 мг / кг ч / м (Bass et al., 1987; Sturchler et al., 1989) в течение 3-7 дней, улучшение клинических проявлений было обнаружено у 50% (Magnaval and Charlet, 1987) до 53% (Sturchler et al., 1989). Побочные эффекты, включающие головокружение, тошноту и рвоту, наблюдались у 50% (Magnaval and Charlet, 1987) и 60% (Sturchler et al., 1989).
Что касается MBZ, наилучшая схема лечения – 20-25 мг / кг ч / б ежедневно в течение 3 недель, что привело к снижению клинических проявлений на 70%.Побочные эффекты, включающие слабость, головокружение, тошноту, боль в животе и желудке, были незначительными и наблюдались у 17% пациентов (Magnaval, 1995).
При введении ABZ в дозе 10 мг / кг ч / б ежедневно в течение 5 дней клиническое улучшение было обнаружено у 47% пациентов с токсокарозом (Stürchler et al., 1989). Шестьдесят процентов пациентов жаловались на незначительные побочные эффекты. Несмотря на эти неоднозначные результаты, обзор недавней литературы обнаружил многочисленные анекдотические сообщения, свидетельствующие о том, что ABZ стал широко используемым лекарством для лечения токсокароза, возможно, из-за его широкой доступности в большинстве стран.
Как MBZ, так и ABZ плохо абсорбируются из желудочно-кишечного тракта и должны приниматься с жирной пищей.
Диэтилкарбамазин, или ДЭК, был основой химиотерапии филяриатоза с 1949 года. Механизм действия сложен и до сих пор частично неизвестен. При филяриозах он включает усиление как присоединения, так и цитотоксичности нейтрофилов и эозинофилов к микрофиляриям (Piessens and Beldekas, 1979) наряду с активацией тромбоцитов, выделяющих свободные радикалы.Это действие не зависит от антител и запускается филяриальным экскреторным антигеном (Cesbron et al., 1987). Более того, DEC вмешивается в метаболизм арахидоновой кислоты и вызывает продукцию PGE2, PGE12 и тромбоксана как у филяриального паразита, так и у его хозяина (Martin et al., 1997).
В контролируемом рандомизированном исследовании по сравнению с MBZ, DEC давали в дозе 3-4 мг / кг ч / б ежедневно в течение 21 дня. Терапевтический график начинался с 25 мг в день, и доза постепенно увеличивалась в попытке избежать побочных реакций, вызванных лизисом паразитов.Антигистаминные препараты не применялись. Этот режим привел к значительному снижению тяжести клинических признаков на 70%. Двадцать восемь процентов пациентов сообщили о незначительных побочных эффектах, включая повышенную слабость, головокружение, тошноту, рвоту или боль в животе. Эти нарушения были дозозависимыми и уменьшались при уменьшении суточной дозы. У 10% испытуемых наблюдалась реакция, подобная Маззотти (зуд, крапивница и / или отек), что свидетельствует об ускоренном лизисе личинок (Magnaval, 1995).
Было показано, что ивермектин является высокоэффективным и значительно улучшает прогноз для людей с онхоцеркозом, причиной речной слепоты (Boussinesq et al., 1997). Ивермектин был недавно зарегистрирован в Европейском Союзе и США для лечения стронгилоидоза (Marti et al., 1996). Что касается токсокароза, контролируемых исследований его эффективности не проводилось. При испытании на серии из 17 случаев распространенного токсокароза ивермектин оказался только на 40 процентов эффективен в уменьшении клинических проявлений, и не было значительного снижения количества эозинофилов в крови (Magnaval, 1998).Таким образом, ивермектин не следует использовать для лечения токсокароза человека, особенно OLM, до тех пор, пока не будет тщательно изучен вопрос о его эффективности.
Подходит ли человек с токсокарозом для лечения, зависит от типа и тяжести клинических признаков. Острый VLM у детей и взрослых обычно лечится симптоматически или с помощью специфической противогельминтной терапии. Пациенты с обычным токсокарозом (Glickman et al., 1987; Magnaval et al., 1994a) или скрытым токсокарозом (Taylor et al., 1988) наряду с периферической эозинофилией часто лечат консервативно, поскольку эти формы заболевания обычно проходят самостоятельно. Следовательно, противогельминтное лечение не начинается немедленно, но может быть рассмотрено для пациентов, у которых сохраняются симптомы, несмотря на усилия по предотвращению повторного заражения яйцами Toxocara . Бессимптомные пациенты с хронической эозинофилией и пациенты со скрытым токсокарозом в отсутствие эозинофилии обычно не нуждаются в какой-либо специальной терапии.
Что касается OLM, то на сегодняшний день не проводились контролируемые клинические испытания для лечения этой формы заболевания. Однако неофициальные данные и сообщения о случаях заболевания (Dinning et al., 1988; Gillespie et al., 1993; Glickman and Magnaval, 1993; Lobovska and Zackova, 1994; Saint-Blancat et al., 1997; Dietrich et al., 1998) предполагают что использование кортикостероидов для уменьшения воспаления эффективно и может минимизировать необратимое повреждение глаза, вызванное локальным высвобождением TES-Ag в результате миграции личинок в глазу.Обычный режим составляет примерно 1 мг / кг ч / б ежедневно в течение 1 месяца или более, при необходимости дозу уменьшают. Среди физических методов показана лазерная фотокоагуляция, когда личинка может быть идентифицирована путем прямой визуализации в глазу (Gass, Braunstein, 1983; Casella et al., 1998). Глазные гранулемы можно лечить криопексией (El Matri et al., 1990; Zygulska et al., 1993). Витрэктомия Pars plana может использоваться для удаления эпиретинального, а также субретинального компонента гранулемы сетчатки Toxocara (Werner et al., 1999). Если применение пероральных и / или местных кортикостероидов не приводит к полному выздоровлению, следует рассмотреть возможность применения специфических глистогонных препаратов. Не установлено, хорошо ли проникают производные бензимидазола или их активные метаболиты в глаз человека. Дополнительные косвенные доказательства проникновения этого ДЭК в глаз получены из опыта его широкого использования для лечения онхоцеркоза человека (Dadzie et al., 1987). Поэтому DEC может быть лучшим выбором для лечения OLM.Поскольку действие DEC может подавляться кортикостероидами (Maizels and Denham, 1992), оба препарата не следует назначать вместе.
Лечение пациентов с неврологическим токсокарозом состояло из комбинации кортикостероидов и DEC (Komiyama et al., 1995), или MBZ (Duprez et al., 1996), или TBZ (Kumar and Kimm, 1994), или использование только DEC (Ruttinger and Hadidi, 1991) или TBZ (Russegger and Schmutzhard, 1989; Wang et al., 1983). Результаты этих исследований были неоднозначными.
Токсокароз – NHS
Токсокароз – редкая инфекция, вызываемая паразитами аскариды. Люди могут заразиться им при обращении с почвой или песком, загрязненными фекалиями инфицированных животных.
Паразиты аскариды чаще всего встречаются у кошек, собак и лисиц и обычно поражают маленьких детей.
Это связано с тем, что дети с большей вероятностью соприкоснутся с зараженной почвой, когда они играют и засовывают руки в рот.
Однако случаи заболевания зарегистрированы у людей всех возрастов.
Признаки и симптомы
У большинства людей заражение этими личинками круглых червей не вызывает никаких симптомов, и паразиты умирают в течение нескольких месяцев.
Однако у некоторых людей наблюдаются легкие симптомы, например:
В редких случаях личинки аскариды поражают такие органы, как печень, легкие, глаза или мозг, и вызывают серьезные симптомы, например:
- усталость
- потеря аппетита или похудание
- Сыпь на коже
- хрипы или затрудненное дыхание
- изъятия (припадки)
- нечеткое или нечеткое зрение, обычно поражающее только один глаз
- очень красный и болезненный глаз
Когда обращаться к вашему GP
Обратитесь к терапевту как можно скорее, если вы считаете, что у вас или вашего ребенка есть симптомы, которые могут быть вызваны токсокарозом.
Если один из ваших глаз поражен токсокарозом, существует риск необратимой потери зрения. Однако своевременное лечение может снизить вероятность этого.
Анализ крови обычно позволяет выявить токсокароз, хотя при поражении глаз может потребоваться обследование глаз для поиска паразитов.
Почему это происходит
Паразиты аскариды, вызывающие токсокароз (называемые токсокарами), обитают в пищеварительной системе собак, кошек и лисиц.Черви производят яйца, которые выделяются с фекалиями инфицированных животных и загрязняют почву.
Яйца становятся заразными только через 10–21 день, поэтому свежие фекалии животных не представляют непосредственной опасности. Однако, как только яйца попадут в песок или почву, они могут выжить в течение многих месяцев.
Люди могут заразиться, если зараженная почва попадет им в рот. Попав внутрь человеческого тела, яйца попадают в кишечник, прежде чем вылупятся и выпустят личинки (самая ранняя стадия развития).Эти личинки могут путешествовать по большинству частей тела.
Однако, поскольку люди не являются нормальным хозяином для этих личинок, они не могут развиваться дальше этой стадии и производить яйца. Это означает, что инфекция не может передаваться между людьми.
Снижение риска
Лучший способ снизить вероятность развития токсокароза – соблюдать гигиену.
Например, мытье рук теплой водой с мылом после контакта с домашними животными или контакта с песком или почвой.
Если у вас есть домашняя кошка или собака, их следует регулярно очищать от глистов, а их фекалии следует немедленно утилизировать.
Подробнее о профилактике токсокароза.
Как лечится
Если у вас нет симптомов или симптомы легкие, лечение обычно не требуется.
Однако вам понадобятся лекарства, если у вас серьезная инфекция, поражающая ваши органы. Для уничтожения личинок паразита используется лекарство, называемое глистогонным.
Чаще всего используется альбендазол, альтернативой является мебендазол.
Эти лекарства обычно не вызывают побочных эффектов, хотя у некоторых людей могут возникать головные боли или боли в животе.
Помимо глистогонных средств, часто назначают стероидные препараты (кортикостероиды), чтобы уменьшить воспаление, вызванное тяжелой инфекцией.
Если токсокароз поражает глаз, вместо глистогонных средств используются стероидные препараты. Также может потребоваться операция – например, при отслоении сетчатки.
Большинство людей полностью выздоравливают и не испытывают никаких долгосрочных осложнений. Однако существует риск необратимой потери зрения при поражении одного из глаз.
Подробнее о лечении токсокароза.
Насколько распространен токсокароз?
Токсокароз редко встречается в Великобритании, хотя трудно точно определить, сколько случаев происходит ежегодно, поскольку заболевание часто диагностируется неправильно или недиагностируется. Многие люди, вероятно, подверглись воздействию паразитов, даже не подозревая об этом.
В целом токсокароз чаще встречается у детей и молодых людей.
Последняя проверка страницы: 13 июня 2018 г.
Срок следующей проверки: 13 июня 2021 г.
Токсокароз: скрытая угроза с прогрессирующими последствиями для общественного здравоохранения | Инфекционные болезни бедности
Деспомье Д. Токсокароз: клинические аспекты, эпидемиология, медицинская экология и молекулярные аспекты. Clin Microbiol Rev.2003; 16: 265–72.
PubMed PubMed Central Статья Google Scholar
Overgaauw PA, van Knapen F. Ветеринарные аспекты и аспекты общественного здравоохранения Toxocara spp. Vet Parasitol. 2013; 193: 398–403.
PubMed Статья Google Scholar
Голландия CV. Пробелы в знаниях в эпидемиологии Toxocara : загадка остается. Паразитология. 2017; 144: 81–94.
PubMed Статья CAS Google Scholar
Macpherson CN. Эпидемиология и значение токсокароза для общественного здравоохранения: зооноз мирового значения. Int J Parasitol. 2013; 43: 999–1008.
PubMed Статья Google Scholar
Zibaei M. Гельминтные инфекции и сердечно-сосудистые заболевания: Toxocara вид вызывает заболевание. Curr Cardiol Rev.2017; 13: 56–62.
PubMed PubMed Central Статья Google Scholar
Strube C, Heuer L, Janecek E. Toxocara spp. инфекции у паратенических хозяев. Vet Parasitol. 2013; 193: 375–89.
PubMed Статья Google Scholar
Fan CK, Holland CV, Loxton K, Barghouth U. Церебральный токсокароз: немое прогрессирование до нейродегенеративных расстройств? Clin Micobiol Rev.2015; 28: 663–86.
Артикул Google Scholar
Fan CK, Liao CW, Cheng YC. Факторы, влияющие на проявление токсокароза у человека: генетика и окружающая среда. Vet Parasitol. 2013; 193: 342–52.
PubMed Статья CAS Google Scholar
Чен Дж., Чжоу Д.Х., Нисбет А.Дж., Сюй М.Дж., Хуанг С.И., Ли М.В., Ван Ч.Р., Чжу XQ. Достижения в области молекулярной идентификации, таксономии, генетической изменчивости и диагностики Toxocara spp. Заразить Genet Evol. 2012; 12: 1344–8.
PubMed Статья Google Scholar
Nicoletti A. Токсокароз. Handb Clin Neurol. 2013; 114: 217–28.
PubMed Статья Google Scholar
Чен Дж., Сюй М.Дж., Чжоу Д.Х., штаб-квартира Сун, Ван Ч.Р., Чжу XQ. Паразитарные зоонозы собак и кошек в Китае. Векторы паразитов. 2012; 5: 152.
PubMed PubMed Central Статья Google Scholar
Rubinsky-Elefant G, Hirata CE, Yamamoto JH, Ferreira MU. Токсокароз человека: диагностика, распространенность серотипов в мире и клинические проявления системных и глазных форм. Ann Trop Med Parasitol. 2010; 104: 3–23.
PubMed Статья CAS Google Scholar
Hotez PJ, Wilkins PP. Токсокароз: самая распространенная в Америке запущенная инфекция бедности и гельминтоз мирового значения? PLoS Negl Trop Dis. 2009; 3: e400.
PubMed PubMed Central Статья Google Scholar
Fillaux J, Magnaval JF. Лабораторная диагностика токсокароза человека. Vet Parasitol. 2013; 193: 327–36.
PubMed Статья CAS Google Scholar
Морейра GM, TelmoPde L, Mendonça M, Moreira AN, McBride AJ, Scaini CJ, Conceição FR. Токсокароз человека: современные достижения в диагностике, лечении и вмешательстве.Trends Parasitol. 2014; 30: 456–64.
PubMed Статья Google Scholar
Wilder HC. Эндофтальмит нематод. Trans Am Acad Ophthalmol Otolaryngol. 1950; 55: 99–104.
PubMed CAS Google Scholar
Париз М.Э., Хотез П.Дж., Слуцкер Л. Забытые паразитарные инфекции в США: потребности и возможности. Am J Trop Med Hyg. 2014; 90: 783–5.
PubMed PubMed Central Статья Google Scholar
Zhu XQ, Korhonen PK, Cai H, Young ND, Nejsum P, von Samson-Himmelstjerna G, et al. Генетический план зоонозного патогена Toxocara canis . Nat Commun. 2015; 6: 6145.
PubMed PubMed Central Статья CAS Google Scholar
Гассер РБ, Корхонен П.К., Чжу XQ, Янг Н.Д.Использование генома Toxocara для поддержки исследований токсокароза и новых вмешательств. Adv Parasitol. 2016; 91: 87–110.
PubMed Статья Google Scholar
Li MW, Lin RQ, Song HQ, Wu XY, Zhu XQ. Полные митохондриальные геномы трех видов Toxocara , имеющих значение для здоровья человека и животных. BMC Genomics. 2008; 9: 224.
PubMed PubMed Central Статья CAS Google Scholar
Гассер РБ. Идеальное время, чтобы использовать передовые молекулярные технологии для изучения фундаментальной биологии видов Toxocara . Vet Parasitol. 2013; 193: 353–64.
PubMed Статья Google Scholar
Mizgajska-Wiktor H, Jarosz W. Сравнение загрязнения почвы яйцами Toxocara cani s и Toxocara cati в сельских и городских районах Великопольского района в 2000-2005 гг. Wiad Parazytol.2007. 53: 219–25. (на польском языке)
PubMed Google Scholar
Гавор Дж., Борецка А. Загрязнение окружающей среды яиц Toxocara в Мазовецком воеводстве как риск токсокароза у детей. Wiad Parazytol. 2004; 50: 237–41.
PubMed Google Scholar
Борецка А., Гавор Дж., Недворок М., Сордил Б. Встречаемость Toxocara spp.яйца в бытовой среде детей с диагностированным токсокарозом в Лодзинском воеводстве. Wiad Parazytol. 2010; 56: 141–4.
PubMed Google Scholar
Wickramasinghe S, Yatawara L, Rajapakse RP, Agatsuma T. Toxocara canis и Toxocara vitulorum : молекулярная характеристика, дискриминация и филогенетический анализ на основе митохондрий (АТФ-синтаза субъединица 6 и 12S рибосомная субъединица) (ITS-2 и 28S) гены.Parasitol Res. 2009; 104: 1425–30.
PubMed Статья Google Scholar
Wickramasinghe S, Yatawara L, Rajapakse RP, Agatsuma T. Toxocara vitulorum (Ascaridida: Nematoda): содержание, расположение и состав митохондриальных генов по сравнению с другими видами Toxocara . Мол Биохим Паразитол. 2009; 166: 89–92.
PubMed Статья CAS Google Scholar
Le TH, Anh NT, Nguyen KT, Nguyen NT, do TT T, Gasser RB. Toxocara malaysiensis Инфекция домашних кошек во Вьетнаме – новая зоонозная проблема? Заразить Genet Evol. 2016; 37: 94–8.
PubMed Статья Google Scholar
Zhu XQ, Jacobs DE, Chilton NB, Sani RA, Cheng NABY, Gasser RB. Молекулярная характеристика варианта Toxocara от кошек в Куала-Лумпуре, Малайзия. Паразитология. 1998. 117: 155–64.
PubMed Статья CAS Google Scholar
Гиббонс Л.М., Джейкобс Д.Е., Сани РА. Toxocara malaysiensis n. Sp. (Nematoda: Ascaridoidea) от домашней кошки ( Feliscatus Linnaeus , 1758). J Parasitol. 2001; 87: 660–5.
PubMed Статья CAS Google Scholar
Fogt-Wyrwas R, Mizgajska-Wiktor H, Pacoń J, Jarosz W.Внутривидовые вариации между последовательностями ITS Toxocara canis , Toxocara cati и Toxascaris leonine от разных видов хозяев в Юго-Западной Польше. J Helminthol. 2013; 87: 432–42.
PubMed Статья CAS Google Scholar
Zhu XQ, Gasser RB, Jacobs DE, Hung GC, Chilton NB. Взаимоотношения между некоторыми аскаридоидными нематодами на основе данных о последовательности рибосомной ДНК. Parasitol Res.2000; 86: 738–44.
PubMed Статья CAS Google Scholar
Li MW, Lin RQ, Song HQ, Sani RA, Wu XY, Zhu XQ. Электрофоретический анализ изменчивости последовательностей в трех участках митохондриальной ДНК для аскаридоидных паразитов, имеющих значение для здоровья человека и животных. Электрофорез. 2008; 29: 2912–7.
PubMed CAS Google Scholar
Smith H, Holland C, Taylor M, Magnaval JF, Schantz P, Maizels R.Насколько распространен токсокароз у человека? К стандартизации наших знаний. Trends Parasitol. 2009. 25: 182–8.
PubMed Статья Google Scholar
Саид И., Тайра К., Капел СМ. Toxocara canis у экспериментально зараженных серебристых и песцов. Parasitol Res. 2005; 97: 160–6.
PubMed Статья Google Scholar
Guimarães AM, Alves EG, de Rezendede GF, Rodrigues MC. Toxocara sp. яйца и Ancylostoma sp. личинки в общественных парках, Бразилия. Rev Saude Publica. 2005; 39: 293–5. (на португальском языке)
PubMed Статья Google Scholar
Tiyo R, Guedes TA, Falavigna DL, Falavigna-Guilherme AL. Сезонное заражение площадей и газонов паразитами с зоонозным потенциалом в южной части Бразилии. J Helminthol. 2008; 82: 1–6.
PubMed Статья CAS Google Scholar
Дада Б.Дж., Линдквист В.Д. Распространенность Toxocara spp. яйца в некоторых общественных местах и в местах отдыха на шоссе в Канзасе. J Helminthol. 1979; 53: 145–6.
PubMed Статья CAS Google Scholar
Chorazy ML, Ричардсон DJ. Исследование загрязнения окружающей среды яйцеклетками аскарид, Уоллингфорд, Коннектикут. Vector Borne Zoonotic Dis. 2005; 5: 33–9.
PubMed Статья Google Scholar
Düwel D. Распространенность яиц Toxocara яиц в песке детских игровых площадок во Франкфурте / М. Ann Trop Med Parasitol. 1984; 78: 633–6.
PubMed Статья Google Scholar
Рокицкий Ю., Кухарска А.П., Дзидо Дж., Карчевска Д. Заражение детских площадок в городе Гданьск яйцами паразитов. Wiad Parazytol. 2007; 53: 227–30. (на польском языке)
PubMed Google Scholar
Emehelu CO, Fakae BB. Распространенность яиц Toxocara canis на детских площадках детских садов в Нсукке, Нигерия. В J Zoonoses. 1986; 13: 158–61.
CAS Google Scholar
Отейфа Н.М., Мустафа М.А. Потенциальный риск заражения токсокарозом в районе Гелиополис, Каир, Египет. J Egypt Soc Parasitol. 1997. 27: 197–203.
PubMed CAS Google Scholar
Гунасилан Л., Ганесан П.И., Рамадасс П., Башир М.А., Рагхаван Н. Распространенность яиц токсокар в окружающей среде. J Indian Vet. 1992; 69: 308–9.
Google Scholar
Симидзу Т. Распространенность яиц токсокары яиц в песочницах в городе Токусима и его окрестностях. J Vet Med Sci. 1993; 55: 807–11.
PubMed Статья CAS Google Scholar
Киган Дж. Д., Голландия CV. Сравнение эмбрионов Toxocara canis в контролируемых условиях в почве и волосах. J Helminthol. 2013; 87: 78–84.
PubMed Статья Google Scholar
Родди Г., Холланд С., Стаффорд П., Вулф А. Загрязнение шерсти лисицы яйцами Toxocara canis . J Helminthol. 2008. 82: 293–6.
PubMed Статья CAS Google Scholar
Roddie G, Stafford P, Holland CV, Wolfe A. Загрязнение шерсти собак яйцами Toxocara canis . Vet Parasitol. 2008; 152: 85–93.
PubMed Статья Google Scholar
Ли А.С., Шанц П.М., Казакос К.Р., Монтгомери С.П., Боуман Д.Д. Эпидемиологические и зоонозные аспекты аскаридных инфекций у собак и кошек. Trends Parasitol. 2010. 26: 155–61.
PubMed Статья Google Scholar
Дубинский П., Хавасиова-Рейтерова К., Петко Б., Ховорка И., Томасовикова О. Роль мелких млекопитающих в эпидемиологии токсокароза. Паразитология. 1995; 110: 187–93.
PubMed Статья Google Scholar
Антолова Д., Рейтерова К., Митерпакова М., Станко М., Дубинский П. Циркуляция Toxocara spp. в пригородных и сельских экосистемах Словацкой Республики. Vet Parasitol. 2004; 126: 317–24.
PubMed Статья CAS Google Scholar
Reperant LA, Hegglin D, Tanner I., Fischer C, Deplazes P. Грызуны как общие индикаторы зоонозных паразитов хищников в городской среде. Паразитология. 2009. 136: 329–37.
PubMed Статья CAS Google Scholar
Magnaval JF, Glickman LT, Dorchies P, Morassin B. Основные моменты токсокароза человека. Корейский J Parasitol. 2001; 39: 1–11.
PubMed PubMed Central Статья CAS Google Scholar
Акао Н., Охта Н. Токсокароз в Японии. Parasitol Int. 2007; 56: 87–93.
PubMed Статья Google Scholar
Йошикава М., Нишиофуку М., Мория К., Одзи Й., Ишизака С., Касахара К. и др. Семейный случай висцерального токсокароза, вызванного употреблением сырой бычьей печени. Parasitol Int. 2008; 57: 525–9.
PubMed Статья Google Scholar
Stoicescu RM, Mihai CM, Giannakopoulou AD.Выраженная гиперэозинофилия у малыша: отчет о болезни. J Med Life. 2011; 4: 105–8.
PubMed PubMed Central CAS Google Scholar
Musso C, Castelo JS, Tsanaclis AM, Pereira FE. Распространенность индуцированных Toxocara гранулем печени, обнаруженных с помощью иммуногистохимии, в серии аутопсий в Детской клинической больнице в Витории, ES, Бразилия. Арка Вирхова. 2007; 450: 411–47.
PubMed Статья Google Scholar
Хартлеб М., Янушевский К. Тяжелое поражение печени при мигрирующих висцеральных личинках. Eur J Gastroenterol Hepatol. 2001; 13: 1245–9.
PubMed Статья CAS Google Scholar
Kuenzli E, Neumayr A, Chaney M, Blum J. Сердечные заболевания, связанные с токсокарозом – систематический обзор литературы. Acta Trop. 2016; 154: 107–20.
PubMed Статья Google Scholar
Kayes SG, Oaks JA. Развитие гранулематозного ответа при токсокарозе мышей. Начальные события Am J Pathol. 1978; 93: 277–94.
PubMed CAS Google Scholar
Дромер С, Константин А, Амар Дж., Колье М., Билли Т., Шамонтин Б. и др. Ревматологические аспекты токсокароза (мигрирующая висцеральная личинка), по поводу 2 случаев. Преподобный Рум Эд Фр. 1993; 60: 621–4.
PubMed CAS Google Scholar
Шетти AK, Авилес DH. Нефротический синдром, связанный с инфекцией Toxocara canis . Ann Trop Paediatr. 1999; 19: 297–300.
PubMed Статья CAS Google Scholar
Prunier F, Delepine S, Victor J, de Gentile L, Moreau C, Laporte J, et al. Фибробластический эндокардит Лоффлера. Отчет о случае, осложнившем токсокароз. Arch Mal Coeur Vaiss. 2001; 94: 226–30. (на французском языке)
PubMed CAS Google Scholar
Исмаил М.А., Халафаллах О. Toxocara canis и хроническая крапивница у пациентов из Египта. J Egypt Soc Parasitol. 2005; 35: 833–40.
PubMed Google Scholar
Стюарт JM, Cubillan LD, Cunningham ET Jr. Распространенность, клинические особенности и причины потери зрения среди пациентов с глазным токсокарозом. Сетчатка. 2005. 25: 1005–13.
PubMed Статья Google Scholar
Центры по контролю и профилактике заболеваний. Глазной токсокароз – США, 2009–2010 гг. MMWR Morb Mortal Wkly Rep. 2011; 60: 734–6.
Google Scholar
Quinnell RJ. Генетика предрасположенности к гельминтозной инфекции. Int J Parasitol. 2003. 33: 1219–31.
PubMed Статья CAS Google Scholar
Norhaida A, Suharni M, Liza Sharmini AT, Tuda J, Rahmah N.rTES-30USM: клонирование с помощью сборочной ПЦР, экспрессии и оценки полезности при обнаружении токсокароза S228. Ann Trop Med Parasitol. 2008; 102: 151–60.
PubMed Статья CAS Google Scholar
Xinou E, Lefkopoulos A, Gelagoti M, Drevelegas A, Diakou A, Milonas I, Dimitriadis AS. Результаты КТ и МРТ при церебральной токсокаральной болезни. AJNR Am J Neuroradiol. 2003; 24: 714–8.
PubMed CAS Google Scholar
Watthanakulpanich D, Smith HV, Hobbs G, Whalley AJ, Billington D. Применение экскреторно-секреторных антигенов Toxocara canis и антител подкласса IgG (IgG1-4) в серодиагностических анализах токсокароза человека. Acta Trop. 2008; 106: 90–5.
PubMed Статья CAS Google Scholar
Нордин Р., Смит Х.В., Мохамад С., Майзелс Р.М., Фонг М.И. Сравнение IgG-ELISA и IgG4-ELISA для серодиагностики Toxocara .Acta Trop. 2005; 93: 57–62.
PubMed Статья CAS Google Scholar
Jin Y, Shen C, Huh S, Sohn WM, Choi MH, Hong ST. Серодиагностика токсокароза методом ELISA с использованием неочищенного антигена личинок Toxocara canis . Корейский J Parasitol. 2013; 51: 433–9.
PubMed PubMed Central Статья Google Scholar
Jacobs DE, Zhu XQ, Gasser RB, Chilton NB.Методы на основе ПЦР для идентификации потенциально зоонозных аскаридоидных паразитов собак, лисиц и кошек. Acta Trop. 1997; 68: 191–200.
PubMed Статья CAS Google Scholar
Li MW, Lin RQ, Chen HH, Sani RA, Song H, Zhu XQ. Инструменты ПЦР для проверки специфической идентичности аскаридных нематод собак и кошек. Зонды Mol Cell. 2007; 21: 349–54.
PubMed Статья CAS Google Scholar
Рай С.К., Уга С., Ву З., Такахаши Ю., Мацумура Т. Использование полимеразной цепной реакции в диагностике токсокароза: экспериментальное исследование. Юго-Восточная Азия J Trop Med Public Health. 1997; 28: 541–4.
PubMed CAS Google Scholar
Van De N, Trung NV, le Duyet V, Chai JY. Молекулярная диагностика больного глазным токсокарозом во Вьетнаме. Корейский J Parasitol. 2013; 51: 563–7.
PubMed PubMed Central Статья Google Scholar
Lim SJ, Lee SE, Kim SH, Hong SH, You YS, Kwon OW и др. Распространенность Toxoplasma gondii и Toxocara canis среди пациентов с увеитом. Ocul Immunol Inflamm. 2014; 22: 360–6.
PubMed Статья CAS Google Scholar
Macuhova K, Kumagai T., Akao N, Ohta N. Петлевой изотермический анализ амплификации для обнаружения и распознавания яиц Toxocara canis и Toxocara cati непосредственно из образцов песка.J Parasitol. 2010; 96: 1224–7.
PubMed Статья CAS Google Scholar
Томита Н., Мори Ю., Канда Х., Нотоми Т. Петлевая изотермическая амплификация (LAMP) генных последовательностей и простое визуальное обнаружение продуктов. Nat Protoc. 2008; 3: 877–82.
PubMed Статья CAS Google Scholar
Аревало Дж. Ф., СП Эспиноза, Ф. Аревало. Глазной токсокароз.J Pediatr Ophthalmol Strabismus. 2012; 50: 76–86.
PubMed Статья Google Scholar
Campbell JP, Wilkinson CP. Визуализация в диагностике и лечении глазного токсокароза. Int Ophthalmol Clin. 2012; 52: 145–53.
PubMed Статья Google Scholar
Morais FB, MacielAL ATE, Muccioli C, Al-lemann N. Результаты ультразвукового исследования при глазном токсокарозе.Arq Bras Ophthalmol. 2012; 75: 43–7.
Артикул Google Scholar
Hashida N, Nakai K, Nishida K. Диагностическая оценка глазного токсокароза с использованием оптической когерентной томографии с высоким проникновением. Case Rep Ophthalmol. 2014; 5: 16–21.
PubMed PubMed Central Статья Google Scholar
Ахмед А.С., Бисвас Дж. Увейтис: поиск причины.Тайвань J Ophthalmol. 2013; 3: 134–40.
Артикул Google Scholar
Kim YJ, Moon CH, Chang JH. Токсокароз диска зрительного нерва. J Neuroophthalmol. 2013; 33: 151–2.
PubMed Статья Google Scholar
Tran VT, Lumbroso L, LeHoang P, Herbort CP. Ультразвуковая биомикроскопия при периферическом ретиновитреальном токсокарозе. Am J Ophthal. 1999; 127: 607–9.
PubMed Статья CAS Google Scholar
Родман Дж., Пиццименти Дж. Диагностическая визуализация in vivo глазного токсокароза. Clin Exp Optom. 2009. 92: 146–14.
PubMed Статья Google Scholar
Чен К., Гу Дж., Цзян Р., Чжоу М., Чанг К. Роль ультразвуковой биомикроскопии в диагностике глазного токсокароза. Br J Ophthalmol. 2018 Май; 102 (5): 642–6.
PubMed Статья Google Scholar
Sánchez SS, García HH, Nicoletti A. Результаты клинической и магнитно-резонансной томографии нейротоксокароза. Фронт Neurol. 2018; 9: 53.
PubMed PubMed Central Статья Google Scholar
Рохилла С., Джайн Н., Ядав Р., Дхаулаканди Д. Б. Мигрирующая висцеральная личинка печени. BMJ Case Rep.2013; 13: 2013.
Google Scholar
Раджеш С., Патидар Ю., Растоги А., Бихари С. Изображение месяца: мигрирующая висцеральная личинка печени. Am J Gastroenterol. 2015; 110: 497.
PubMed Статья CAS Google Scholar
Ким Ю.К., Ким С.С., Мун В.С., Чо Б.Х., Ли С.И., Ли Дж. Результаты МРТ очаговых эозинофильных заболеваний печени. AJR Am J Roentgenol. 2005; 184: 1541–8.
PubMed Статья Google Scholar
Magnaval JF, Шарле JP. Сравнительная эффективность тиабендазола и мебендазола при лечении токсокароза. Терапия. 1987. 42: 541–4. (на французском языке)
PubMed CAS Google Scholar
Stürchler D, Schubarth P, Gualzata M, Gottstein B, Oettli A. Тиабендазол против альбендазола в лечении токсокароза: клиническое испытание. Ann Trop Med Parasitol. 1989; 83: 473–8.
PubMed Статья Google Scholar
Павловски З. Токсокароз у человека: клиническое проявление и дилемма лечения. J Helminthol. 2001; 75: 299–305.
PubMed Статья CAS Google Scholar
Woodhall DM, Fiore AE. Токсокароз: обзор для педиатров. J Pediatric Infect Dis Soc. 2014; 3: 154–9.
PubMed Статья Google Scholar
Ранасурия Г., Миан А., Бужауд З., Цигрелис К.Легочный токсокароз: клинический случай и обзор литературы. Инфекция. 2014; 42: 575–8.
PubMed Статья CAS Google Scholar
Хрючкова Г. Новые подходы к иммунопрофилактике при токсокарозе. В: Holland CV, Smith HV, редакторы. Toxocara : загадочный паразит. Оксфордшир: CAB International; 2006. с. 174–94.
Google Scholar
Мартинес-Пульгарин Д.Ф., Муньос-Урбано М., Гомес-Сута Л.Д., Дельгадо О.М., Родригес-Моралес AJ. Глазной токсокароз: новые диагностические и терапевтические перспективы. Последние публикации Pat Antiinfect Drug Discov. 2015; 10: 35–41.
PubMed Статья Google Scholar
Frazier M, Anderson ML, Sophocleous S. Лечение глазного токсокароза альбендезолом: описание случая. Оптометрия. 2009. 80: 175–80.
PubMed Статья Google Scholar
Satou T, Horiuchi A, Akao N, Koike K, Fujita K, Nikaido T. Toxocara canis : поиск потенциального лекарства среди алкалоидов бета-карболина – исследования in vitro и на мышах. Exp Parasitol. 2005; 110: 134–9.
PubMed Статья CAS Google Scholar
Осман А.А. Лечебная битва с личиночным токсокарозом: мы все еще далеко позади? Acta Trop. 2012; 124: 171–8.
PubMed Статья Google Scholar
Wiśniewska-Ligier M, Woniakowska-Gęsicka T, Sobolewska-Dryjańska J, Markiewicz-Jówiak A, Wieczorek M. Анализ течения и лечения токсокароза у детей: многолетнее наблюдение. Parasitol Res. 2012; 110: 2363–71.
PubMed Статья Google Scholar
Вудхолл Д., Старр М.К., Монтгомери С.П., Джонс Дж. Л., Лам Ф., Рид Р. У. и др. Глазной токсокароз: эпидемиологические, анатомические и терапевтические варианты на основе опроса узких офтальмологов.Офтальмология. 2012; 119: 1211–7.
PubMed Статья Google Scholar
Choi KD, Choi JH, Choi SY, Jung JH. Токсокарная оптическая нейропатия: клинические особенности и офтальмологические данные. Int J Ophthalmol. 2018; 11: 520–3.
PubMed PubMed Central Google Scholar
Эберхардт О., Биалек Р., Нагеле Т., Дичганс Дж. Эозинофильный менингомиелит при токсокарозе: клинический случай и обзор литературы.Clin Neurol Neurosurg. 2005; 107: 432–8.
PubMed Статья CAS Google Scholar
Graeff-Teixeira C, da Silva AC, Yoshimura K. Обновленная информация об эозинофильном менингоэнцефалите и его клинической значимости. Clin Microbiol Rev.2009; 22: 322–48.
PubMed PubMed Central Статья CAS Google Scholar
Гоффетт С., Жанжан А.П., Дюпре Т.П., Бигайнон Дж., Синдик С.Дж.Эозинофильный плеоцитоз и миелит, связанные с инфекцией Toxocara canis . Eur J Neurol. 2000. 7: 703–6.
PubMed Статья CAS Google Scholar
Хомбу А., Йошида А., Кикучи Т., Нагаясу Е., Куроки М., Маруяма Х. Лечение синдрома мигрирующей личинки с помощью длительного приема альбендазола. J Microbiol Immunol Infect. 2017; S1684-1182 (17): 30142–1.
Google Scholar
Deplazes P, van Knapen F, Schweiger A, Overgaauw PA. Роль домашних собак и кошек в передаче гельминтозов зоонозов в Европе с особым вниманием к эхинококкозу и токсокарозу. Vet Parasitol. 2011; 24: 41–53.
Артикул Google Scholar
Parsons JC. Аскаридные инфекции кошек и собак. Ветеринарная клиника North Am Small Anim Pract. 1987; 17: 1303–7.
Артикул Google Scholar
ВОЗ. Действия по снижению опасности для здоровья человека, исходящей от животных. ВОЗ Хрон. 1978; 32: 307–10.
Google Scholar
Мальейро А., Анибал Ф. Ф., Мартинс-Филью О. А., Тейшейра-Карвалью А., Перини А., Мартинс М. А., Медейруш А. И., Турато В. М., Асенсио М. П., Брандао ИТ, Номизо А., Силва С. Л., Фаччиоли Л. Х. Вакцинация pcDNA-IL-12 блокирует эозинофильное воспаление, но не гиперчувствительность дыхательных путей после инфицирования мыши Toxocara canis .Вакцина. 2008; 26: 305–15.
PubMed Статья CAS Google Scholar
Basualdo J, Sparo M, Chiodo P, Ciarmela M, Minvielle M. Пероральное введение потенциального пробиотика ( Enterococcus faecalis CECT 7121), по-видимому, снижает количество паразитов у мышей, инфицированных Toxocara canis . Ann Trop Med Parasitol. 2007. 101: 559–62.
PubMed Статья CAS Google Scholar
Chiodo PG, Sparo MD, Pezzani BC, Minvielle MC, Basualdo JA. In vitro и in vivo эффекты Enterococcus faecalis CECT7121 на Toxocara canis . Mem Inst Oswaldo Cruz. 2010; 105: 615–20.
PubMed Статья CAS Google Scholar
де Авила Л.Ф., Консейсао, Франция, Telmo Pde L, Dutra GF, de los Santos DG, Martins LH, Berne ME, da Silva PE, Scaini CJ. Saccharomyces boulardii снижает интенсивность заражения мышей токсокарозом.Vet Parasitol. 2012; 187: 337–40.
PubMed Статья Google Scholar
Kudtarkar A, Shinde UP, Bharkad G, Singh K. Твердые липидные наночастицы альбендазола для лечения инфекции Toxocara canis : исследования эффективности in vivo. Nanosci Nanotechnol-Asia. 2017; 7: 80–91.
CAS Google Scholar
Wilkinson CP, Welch RB. Внутриглазный Toxocara .Am J Ophthalmol. 1971; 71: 921–30.
PubMed Статья CAS Google Scholar
Йокои К., Гото Х., Сакаи Дж., Усуи М. Клинические особенности глазного токсокароза в Японии. Ocul Immunol Inflamm. 2003. 11: 269–75.
PubMed Статья Google Scholar
до Лаго А., Андраде Р., Муччиоли С., Белфорт Р. мл. Оптическая когерентная томография предполагаемой субретинальной гранулемы Toxocara : клинический случай.Arq Bras Oftalmol. 2006; 69: 403–5.
PubMed Статья Google Scholar
Gass JD, Gilbert WR, Guerry RK, Scelfo R. Диффузный односторонний подострый нейроретинит. Офтальмология. 1978; 85: 521–45.
PubMed Статья CAS Google Scholar
de Souza EC, Nakashima Y. Диффузный односторонний подострый нейроретинит. Отчет о трансвитреальном хирургическом удалении субретинальной нематоды.Офтальмология. 1995. 102: 1183–6.
PubMed Статья CAS Google Scholar
Коричневый DH. Глаз Toxocara canis . I Экспериментальная иммунология. Энн Офтальмол. 1971; 3: 907–10.
PubMed CAS Google Scholar
Гиллеспи С.Х., Диннинг В.Дж., Воллер А., Кроукрофт Н.С. Спектр глазного токсокароза. Глаз (Лонд). 1993; 7: 415–8.
Артикул Google Scholar
Ahn SJ, Ryoo NK, Woo SJ. Глазной токсокароз: клиника, диагностика, лечение и профилактика. Asia Pac Allergy. 2014; 4: 134–41.
PubMed PubMed Central Статья Google Scholar
Ahn SJ, Woo SJ, Jin Y, Chang YS, Kim TW, Ahn J, et al. Клиника и течение глазного токсокароза у взрослых.PLoS Negl Trop Dis. 2014; 8: e2938.
PubMed PubMed Central Статья CAS Google Scholar
Glickman LT, Magnaval JF, Domanski LM, Shofer FS, Lauria SS, Gottstein B, et al. Висцеральная мигрирующая личинка у взрослых французов: синдром новой болезни? Am J Epidemiol. 1987; 125: 1019–34.
PubMed Статья CAS Google Scholar
Финстерер Дж., Ауэр Х.Нейротоксокароз. Rev Inst Med Trop Сан-Паулу. 2007. 49: 279–87.
PubMed Статья Google Scholar
Richartz E, Buchkremer G. Церебральный токсокароз: редкая причина когнитивных расстройств. Вклад в дифференциальную диагностику деменции. Nervenarzt. 2002. 73: 458–62. (на немецком языке)
PubMed Статья CAS Google Scholar
Bachli H, Minet JC, Gratzl O.Церебральный токсокароз: возможная причина эпилептических припадков у детей. Чайлдс NervSyst. 2004. 20: 468–72.
Google Scholar
Морейра-Силва С.Ф., Родригес М.Г., Пимента Дж.Л., Гомеш С.П., Фрейре Л.Х., Перейра ИП. Токсокароз центральной нервной системы: сообщалось о двух случаях. Rev Soc Bras Med Trop. 2004; 37: 169–74.
PubMed Статья Google Scholar
Фортенберри Дж. Д., Кенни Р. Д., Младший Дж. Мигрирующая висцеральная личинка, вызывающая статическую энцефалопатию у младенца. Pediatr Infect Dis J. 1991; 10: 403–6.
PubMed Статья CAS Google Scholar
Caldera F, Burlone ME, Genchi C, Pirisi M, Bartoli E. Toxocara энцефалит с поражением автономной нервной системы. Инфекция. 2013; 41: 691–4.
PubMed Статья CAS Google Scholar
Gasser RB, Zhu XQ, Jacobs DE, Hu M, Chilton NB. Молекулярно-генетическая характеристика представителей рода Toxocara – таксономические, популяционно-генетические и эпидемиологические соображения. В: Holland CV, Smith HV, редакторы. Toxocara : загадочный паразит. Соединенное Королевство: Уоллингфорд; 2006. с. 18–31.
Google Scholar
Magnaval JF, Faufingue JH, Morassin B, Fabre R. Катионный белок эозинофилов, специфические IgE и IgG4 при токсокарозе человека.J Helminthol. 2006; 80: 417–23.
PubMed Статья CAS Google Scholar
Магнавал Дж. Ф., Берри А., Фабр Р., Морассин Б. Катионный белок эозинофилов как возможный маркер активной инфекции человека Toxocara . Аллергия. 2001; 56: 1096–9.
PubMed Статья CAS Google Scholar
Mohamad S, Azmi NC, Noordin R. Разработка и оценка чувствительного и специфического теста для диагностики токсокароза человека с использованием трех рекомбинантных антигенов (TES-26, TES-30USM и TES-120).J Clin Microbiol. 2009; 47: 1712–7.
PubMed PubMed Central Статья CAS Google Scholar
Peixoto PL, Nascimento E, Cançado GG, Miranda RR, Rocha RL, Araújo RN, et al. Идентификация антигенов-кандидатов от взрослых стадий Toxocara canis для серодиагностики токсокароза человека. Mem Inst Oswaldo Cruz. 2011; 106: 200–6.
PubMed Статья Google Scholar
Magnaval JF, Fabre R, Maurières P, Charlet JP, de Larrard B. Применение процедуры вестерн-блоттинга для иммунодиагностики токсокароза человека. Parasitol Res. 1991; 77: 697–702.
PubMed Статья CAS Google Scholar
Yamasaki H, Araki K, Lim PK, Zasmy N, Mak JW, Taib R, Aoki T. Разработка высокоспецифичного рекомбинантного Toxocara canis второй стадии экскреторно-секреторного антигена личинки для иммунодиагностики токсокароза человека .J Clin Microbiol. 2000; 38: 1409–13.
PubMed PubMed Central CAS Google Scholar
Magnaval JF. Сравнительная эффективность диэтилкарбамазина и мебендазола для лечения токсокароза человека. Паразитология. 1995; 110: 529–33.
PubMed Статья Google Scholar
Баррера М.Г., Леонарди Д., Болмаро Р.Э., Эченике К.Г., Оливьери А.С., Саломон С.Дж. и др.Оценка in vivo микросфер альбендазола для лечения мигрирующих личинок Toxocara canis . Eur J Pharm Biopharm. 2010; 75: 451–4.
PubMed Статья CAS Google Scholar
Леонарди Д., Эченик К., Ламас М.С., Саломон С.Дж. Высокая эффективность альбендазола-ПЭГ 6000 в лечении инфекции, вызванной мигрирующей личинкой Toxocara canis . J Antimicrob Chemother. 2009. 64: 375–8.
PubMed Статья CAS Google Scholar
Хориучи А., Сато Т., Акао Н., Коике К., Фудзита К., Никайдо Т. Влияние свободного альбендазола и альбендазола, заключенного в полиэтиленгликоль-липосомы, на подвижность и количество личинок у мышей, инфицированных Toxocara canis Vet Parasitol. 2005; 129: 83–7.
PubMed Статья CAS Google Scholar
Грцкова Г., Велебный С. Лечение инфекций Toxocara canis у мышей с помощью включенных в липосомы карбаматов бензимидазола и иммуномодулятора глюкана.J Helminthol. 2001; 75: 141–146.
PubMed CAS Google Scholar
Hrckova G, Velebny S, Obwaller A, Auer H, Kogan G. Оценка последующей терапии фенбендазолом, включенным в стабилизированные липосомы, и иммуномодулятор глюкана у мышей, инфицированных личинками Toxocara canis . Acta Trop. 2007. 104: 122–32.
Артикул CAS Google Scholar
Виды токсокар Загрязнение окружающей среды общественных мест в Нью-Йорке
Abstract
Токсокароз человека был идентифицирован как недиагностируемый паразитарный зооноз и диспропорции в отношении здоровья, имеющие большое значение для общественного здравоохранения в Соединенных Штатах из-за его высокой серопозитивности среди социально-экономически неблагополучных групп и возможных связей с задержками когнитивных функций и развития.С помощью микроскопии и количественной ПЦР мы обнаружили, что яиц Toxocara широко распространены в общественных местах Нью-Йорка, что свидетельствует о значительном уровне заражения во всех пяти районах города. В Бронксе был самый высокий уровень загрязнения (66,7%), а в Манхэттене – самый низкий уровень загрязнения (29,6%). Более того, инфекционные яйца были обнаружены только на игровых площадках Бронкса, причем более 70% яиц было извлечено в эмбриональной форме, а количество яиц было самым высоким (p = 0,0365). Во всех остальных районах яйца были в неэмбронизированной доинфекционной форме. Toxocara cati , кошачий аскарид, был преобладающим видом. Эти результаты предполагают, что одичавшие или нелеченные кошки в Нью-Йорке представляют собой значительный источник загрязнения окружающей среды. Эти данные указывают на то, что токсокароз у людей стал серьезным неравенством в отношении здоровья в Нью-Йорке с постоянным риском заражения Toxocara в общественных местах, особенно в более бедных районах. Необходимо уменьшить загрязнение окружающей среды Toxocara .Дополнительные строгие меры общественного здравоохранения должны изучить дальнейшие подходы к прерыванию передачи вируса человеку.
Информация об авторе
Toxocara canis и Toxocara cati – гельминтные черви, заражающие собак и кошек соответственно. Зараженные собаки и кошки испражняют яиц Toxocara в окружающую среду. Люди являются случайными хозяевами и подвергаются воздействию зараженных почв фекально-оральным путем. Покинув желудочно-кишечный тракт, личинки Toxocara попадают в сосудистую сеть и могут мигрировать к любой основной системе органов, включая легкие, глаза и центральную нервную систему.Симптомы могут варьироваться от легких мышечных болей до тяжелой астмы, слепоты и энцефалита. Люди не являются окончательными хозяевами паразита и не могут передавать яиц Toxocara в окружающую среду или другим людям. Существует потребность в исследовании санитарного воздействия Toxocara как на людей, так и на животных, особенно в крупных городах, таких как Нью-Йорк. Бедность также связана с более высокими показателями токсокароза, с более высоким уровнем заражения в более бедных районах, где существует контроль над животными, дегельминтизация домашних животных и менее санитарные условия.Это исследование направлено на более глубокое понимание неравенства между районами с более низким социально-экономическим статусом, имеющими более высокий уровень загрязненных парков и игровых площадок, по сравнению с пятью районами Нью-Йорка.
Образец цитирования: Tyungu DL, McCormick D, Lau CL, Chang M, Murphy JR, Hotez PJ, et al. (2020) Toxocara видов Загрязнение окружающей среды общественных мест в Нью-Йорке. PLoS Negl Trop Dis 14 (5): e0008249. https://doi.org/10.1371/journal.pntd.0008249
Редактор: Селия Холланд, кафедра зоологии, Тринити-колледж, Дублин, Ирландия, ИРЛАНДИЯ
Поступила: 22 сентября 2019 г .; Принята к печати: 24 марта 2020 г .; Опубликовано: 5 мая 2020 г.
Авторские права: © 2020 Tyungu et al.Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Доступность данных: Все соответствующие данные находятся в рукописи и ее файлах с вспомогательной информацией.
Финансирование: Благодарности: это исследование было частично поддержано грантом исследовательского проекта трастового фонда по уходу за пациентами Комитета интернов и ординаторов, финансируемого в 2015-2017 гг.Финансовая поддержка исследований для RM была предоставлена Министерством здравоохранения и социальных служб США, Управлением медицинских ресурсов и услуг для Центра передового опыта в области справедливости, обучения и исследований медицинского колледжа Бейлора (номер гранта: D34HP31024). Финансирование также предоставлено Техасским центром детской больницы по разработке вакцин и Национальной школой тропической медицины Медицинского колледжа Бейлора. Финансирующие организации не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: Авторы заявили, что никаких конкурирующих интересов не существует.
Введение
Toxocara canis и Toxocara cati – это аскаридные нематоды, которые повсеместно заражают собак и кошек и могут привести к загрязнению окружающей среды, если фекалии инфицированных животных попадают в общественные места. Яйца, отложенные в почве, могут проявлять криптобиоз, когда условия окружающей среды не идеальны, и могут сохраняться в течение многих лет.[1] Попадание в организм человека яиц с зародышем через загрязненную почву, несоблюдение правил гигиены или неочищенные овощи может привести к паратеническому зоонозному токсокарозу. [2–4] Поскольку яиц Toxocara развиваются в почве, с помощью микроскопии можно обнаружить прогрессирование гельминта от зародышевых клеток к наличию жизнеспособных инфекционных личинок. Яйца, содержащие полностью развившиеся личинки, заразны для человека, тогда как Toxocara на более ранних стадиях развития являются преинфекционными и не могут привести к токсокарозу.После проглатывания яйца с зародышем личинка третьей стадии попадает в кровоток. Он проникает через ткани организма, где черви могут накапливаться в глазах, головном мозге, печени или коже, что приводит к висцеральной или окулярной мигрирующей личинке, слепоте, субклинической церебральной инфекции или скрытой инфекции, которая может ухудшить неврологические познания или привести к задержке развития. [5–9]
Токсокароз – это заболевание, о котором в Соединенных Штатах не сообщается и мало изучено. И паразитический токсокароз, и токсокароз человека были описаны как «загадочные» из-за многочисленных недостатков в понимании этого организма, включая роль церебрального токсокароза и возможную связь с нейрокогнитивным дефицитом и слепотой у детей.[2, 5] Центры США по контролю и профилактике заболеваний (CDC) идентифицируют токсокароз человека как одну из пяти забытых паразитарных инфекций в США, и, возможно, это самый распространенный гельминтоз в Соединенных Штатах после острицы ( Enterobius vermicularis ). . [8, 10] Токсокароз – это болезнь бедности, которой не уделяют должного внимания, из-за непропорционально высокой серологической распространенности в районах общинной бедности, особенно среди недостаточно представленных меньшинств, проживающих в бедных районах. [10–12]
Одной из самых загадочных особенностей токсокароза является его скрытая форма, которая обычно не связана с висцеральной мигрирующей личинкой.Скрытый токсокароз носит субклинический характер, и только эозинофилия является биомаркером подозрения на инфекцию. [4] Скрытый токсокароз был связан с задержкой когнитивных функций и развития, дисфункцией легких и астмой. Однако исследования все еще находятся на начальной стадии понимания полного клинического спектра заболеваний, вызываемых T . канис и T . кати . [5] В целом, токсокароз может быть серьезно недооценен из-за скрытого характера болезни и пробелов в медицинских знаниях; это заболевание, которое нельзя упускать из виду как причину задержки нейрокогнитивных функций у детей.[2, 4, 5, 7, 13, 14] Исследование 1987 года в Нью-Йорке (NYC) коррелировало T . canis серологическая распространенность к нейрокогнитивному дефициту у детей. [5, 15, 16] Предыдущие исследования также показали, что простая инкубация эмбриона Toxocara позволяет ему стать инфекционным, и после заражения в мозгу мышей были обнаружены живые личинки. [1] Мыши с инфицированным мозгом имеют значительные нарушения, в том числе клеточные, и могут иметь различные области поражения мозга в зависимости от заражающих видов Toxocara .[17, 18] Скрытый токсокароз также может представлять собой важную экологическую причину астмы среди малоимущих американских детей. [19, 20]
На протяжении всей истории Национального исследования здоровья и питания (NHANES) распространенность Toxocara среди населения Соединенных Штатов варьировалась от 5% до 14% во время анализов 1988–1994 и 2011–2014 годов. [11, 21] В обоих исследованиях серопозитивность Toxocara была непропорционально выше у лиц из сообществ с более низким социально-экономическим статусом, особенно в латиноамериканских, неиспаноязычных чернокожих сообществах и лиц с образованием ниже среднего.[11, 21]
В Соединенных Штатах было проведено мало исследований, и большинство из них были опубликованы более двух десятилетий назад. [22–28] В нескольких исследованиях, проведенных в США, уровень загрязнения варьировался от 0,3% до 27,5%, причем уровень заражения определялся как количество яиц, обнаруженных в парке или оцениваемом пространстве. [22–28]
Walsh et al. создали прогнозируемую вероятностную модель для оценки распространенности токсокароза в Нью-Йорке с использованием оценок NHANES III и коррелировали результаты с доступной социально-демографической информацией, которая предполагала более высокие уровни воздействия видов Toxocara в сообществах с низким доходом, меньшинствами и иммигрантами.[29] Это исследование является первым геологическим наблюдением за видами Toxocara во всех пяти районах Нью-Йорка, целью которого является устранение потенциального риска заражения в сообществах Нью-Йорка, сначала исследуя почву по всему городу.
Методы
Сбор проб
Образцы отбирали с 3–5 см ниже поверхности после удаления верхнего слоя почвы. Пять образцов были собраны из каждого места в один и тот же день, и каждый образец был из разных географических областей места отбора пробы, были предприняты попытки равным образом отобрать пробы со всего участка.Они были объединены перед лабораторным анализом в одну более крупную пробу массой 100–150 г. Образцы были отобраны случайным образом в период с октября 2015 года по июль 2016 года. Расчет размера выборки был использован для определения уровня точности с использованием доверительного интервала метанализа (Fakhri et al.) От 16 до 27% загрязнения почвы во всем мире из 42 797 образцов, 79 образцов были необходимо для статистической значимости, и в общей сложности для этого исследования было собрано 91 образец [30]. В период с октября 2015 года по июль 2016 года в Нью-Йорке был обследован 91 участок, и в течение этого периода образцы были собраны с разных участков в разное время.Из них 27 (29,6%) находились на Манхэттене, 15 (16,5%) – в Бронксе, 13 (14,3%) – в Бруклине, 18 (19,8%) – в Квинсе и 18 (19,8%) – на Статен-Айленде. Выборочные участки были выбраны случайным образом для максимального охвата каждого района, из-за ограниченного доступа части Бруклина и Статен-Айленда не тестировались.
Микроскопический анализ.
Образцы были проанализированы с использованием модифицированного метода флотации почвы, основанного на ранее опубликованных методах флотации для извлечения яиц гельминтов из почвы и стула человека.[31, 32] Нитрат натрия был выбран в качестве оптимального раствора для флотации из-за повышенного удельного веса (1,25–1,35), лучших опубликованных результатов извлечения яиц и низкой стоимости лаборатории. Все образцы просеивали для удаления крупных частиц перед трехкратной промывкой в 0,1% твине 20. Затем образцы смешивали примерно с 10–14 мл нитрата натрия с удельным весом 1,30 (Vedco Feca Med, St Joseph, MO), достаточным для образования выпуклого мениска у отверстия пробирки. С закрытым покровным стеклом образцы центрифугировали при 500 g в течение 5 минут и оставляли на 5 минут перед просмотром с использованием стандартного светового микроскопа.Яйца, если они есть, легко визуализировались и подсчитывались с помощью этой техники. Паразитов определяли по структурным характеристикам, а зародышевые формы описывали, если в яйце были обнаружены личинки. Другие случайно обнаруженные паразиты были зарегистрированы и классифицированы с использованием субъективной полуколичественной системы «+» (Таблица 1). Затем покровные стекла промывали в 2 мл пробирках Эппендорфа водой, не содержащей ДНКазы, и сохраняли при -20 градусов Цельсия для последующего тестирования ПЦР в реальном времени.
Таблица 1. Распространенность Toxocara sp.включая присутствие личиночных форм в образцах, собранных на участках в каждом районе Нью-Йорка.
Личинка, инфекционная Toxocara sp. были обнаружены только в Бронксе, районе с наибольшей распространенностью заражения токсокарами.
https://doi.org/10.1371/journal.pntd.0008249.t001
Молекулярные методы.
ДНК паразита экстрагировали из образцов почвы с помощью спин-наборов MP FastDNA для почвы (MP Biomedical, Санта-Ана, Калифорния), используя супернатант покровных стекол с предыдущего этапа центрифугирования.Мы обработали этот супернатант с помощью взбивания шариков в течение пяти минут при 3000 об / мин с последующей десятиминутной стадией нагревания при 90 ° C для ускорения разрушения яиц. Этот же метод был использован для извлечения ДНК из T . канис и T . cati яиц для стандартного контроля. [33] Модель T . канис и T . ДНК cati из этих образцов количественно определяли с использованием протокола многопараллельной количественной полимеразной цепной реакции (кПЦР) в реальном времени.[33] Все образцы прошли количественное ПЦР-тестирование с использованием ранее опубликованных зондов со следующими модификациями [ T . canis (5’-FAM-CCATTACCACACCAGCATAGCTCACCGA-3’-NFQ-MGB) и T . cati (5-FAM-TCTTTCGCAACGTGCATTCGGTGA-3’-NFQ-MGB)] и прямые праймеры [ T . canis (5’-GCGCCAATTTATGGAATGTGAT-3 ’) и T . cati (5’-ACGCGTACGTATGGAATGTGCT-3 ’)] и общий обратный праймер 5’-GAGCAAACGACAGCSATTTCTT-3’) для обоих видов Toxocara .[34] ПЦР выполняли с использованием ABI ViiA 7 (Applied Biosystems, Foster City, CA), как описано ранее [33]. Образец считался положительным, если обнаруживалась ДНК на пороге цикла 38 или раньше. Порог положительности определялся с помощью T . canis / cati разведений геномной ДНК для динамического диапазона. Т . канис и T . кати яиц были выделены и трижды промыты дистиллированной водой. Яйца подсчитывали с использованием предметного стекла для микроскопа McMasters (Advanced Equine Products, Issaquah, WA), и серийные разведения использовали в качестве стандартов.Все образцы были выполнены в двух экземплярах и были повторены для получения противоречивых результатов. Стандартная кривая была построена с использованием серийных разведений 10,000 T . кани и Т . кати яиц. Стандарты использовали в качестве положительных контролей без матрицы для отрицательных контролей. Перед взбиванием гранул ко всем образцам добавляли внутренний контроль плазмиды известной концентрации для подтверждения успешной экстракции ДНК [35].
Демографические данные
Социально-экономические данные были получены с веб-сайтов переписи населения США и Департамента здравоохранения штата Нью-Йорк.[36, 37]. Почтовые индексы были записаны из каждой области выборки, а данные о доходах города Нью-Йорка на один почтовый индекс были получены с веб-сайта текущей статистики доходов бюро переписи для почтовых индексов США. [38]
Статистические методы
Статистический анализ проводился с использованием GraphPad Prism версии 7.0d (GraphPad, La Jolla, CA). Количество яиц Toxocara сравнивалось по почтовому индексу, а яиц Toxocara на участке выборки сравнивалось с отдельными районами с использованием теста Краскала-Уоллиса.Сравнивая распространенность видов Toxocara по почтовому индексу или району, был проведен рейтинг копейщика, в котором сравнивалась распространенность положительных парков на район и средний доход на одного жителя, проживающего в этих почтовых индексах.
Результаты
Результаты экологического обследования (результаты микроскопии)
Из 27 участков отбора проб на Манхэттене яиц Toxocara были обнаружены на 29,6% игровых площадок, при этом по крайней мере одно яйцо было идентифицировано с помощью микроскопии. Из протестированных участков на Статен-Айленде 38.В 9% было обнаружено яиц Toxocara , из 13 протестированных участков в Бруклине на 30,8% были обнаружены яйца, в Квинсе было обнаружено 33,3% участков, а в Бронксе было заражено 66,7% участков (Таблица 1). Общая распространенность 38,5% (35/91) загрязненных игровых площадок в Нью-Йорке.
Инфекционные яйца с зародышем (рис. 1A и 1B, рис. 2) были обнаружены только на игровых площадках Бронкса, причем более 70% выловленных яиц находились в состоянии личинки. Во всех других районах были яйца в доинфекционной, неэмбрионированной (без личинки) форме (Рис. 1C, Рис. 2).
Рис. 2. Геопространственные результаты выборки Toxocara в Нью-Йорке.
Toxocara был обнаружен на участках, представленных синими треугольниками (незаряженное яйцо (яйца)) красными звездами (яйцо (яйца) с зародышем). Toxocara не обнаружен на участках, отмеченных черными кружками. Самая высокая плотность геозагрязнения Toxocara была обнаружена в Бронксе, единственном районе, где были обнаружены инфицированные личинки. Пример ArcMap of NYC, созданный с помощью ArcGIS 10.6.1.
https://doi.org/10.1371/journal.pntd.0008249.g002
Toxocara 9000 Результаты по 8 видам (результаты КПЦР)Из всех положительных образцов в шести было обнаружено T . cati ДНК присутствует (рис. 3, таблица 1). Ни в одном из парков не обнаружено T . canis ДНК присутствует. Более 4 из 6 парков, которые дали положительный результат, были взяты из образцов с наибольшим количеством личинок яиц, что объясняет большее количество копий геномной ДНК, присутствующей во многих образцах (среднее 19.5, от 0 до 102 яиц). (Рис. 3) В шести положительных образцах было рассчитано количество яиц из стандартных разведений с использованием линейной регрессии, которая коррелировала с порогом 40-цикла (Ct) (Spearman r = 0,999, p <0,0001). Один образец (Bk8) был отрицательным при микроскопии, но положительным при кПЦР (13,958, 40-Ct). Одно яйцо T . канис или T . cati в 500 мкл воды последовательно обнаруживали с помощью кПЦР со значениями Ct от 37 до 38.
Рис. 3. Результаты количественной ПЦР, парки, которые были положительными при КПЦР, были заражены T . кати .
Расчетное количество яиц было получено из разведений известного количества яиц Toxocara cati и соотнесено с 40 –Ct (Spearman r = 0,999, p <0,0001).
https://doi.org/10.1371/journal.pntd.0008249.g003
Ассоциация геозагрязнения и социально-экономических данных
Загрязнение было более распространено в районах с более низким социально-экономическим статусом. Манхэттен, район с самым высоким средним доходом (97 255 долларов США) от почтовых индексов, где проводился отбор проб, имел самый низкий уровень загрязнения (29.6%) по сравнению с 66,7% в Бронксе, где средний доход был самым низким (26 131 доллар США) (рис. 4). В Квинсе, Бруклине и Статен-Айленде уровень заражения составлял 30,8–38,9%, а средний доход составлял 57 452–69 998 долларов США, Спирмен r = -0,7, p = 0,233 (рис. 4). В пунктах выборки Бронкса была самая высокая средняя яйценоскость (Бронкс: 16,4, Квинс: 1,8, Бруклин: 1,9, Статен-Айленд: 3,0, Манхэттен: 5,9, p = 0,0365) и распространенность. (Рис. 5) В целом, существует обратная зависимость между средним доходом и вероятностью заражения видами Toxocara (Рис. 5).
Рис. 4. Связь положительных результатов Toxocara со средним доходом жителей, проживающих в почтовых индексах выбранных участков.
Линия представляет собой средний доход семей, живущих в почтовом индексе, где проводилось тестирование Toxocara . Результаты агрегированы по районам. (Спирмен r = -0,7, p = 0,233).
https://doi.org/10.1371/journal.pntd.0008249.g004
Обсуждение
В этом первом экологическом исследовании распространенности Toxocara в Нью-Йорке примерно одна треть участков, отобранных в пяти районах, содержала яиц Toxocara (Таблица 1).Распределение загрязнения по городу было неравномерным. В Бронксе было самое высокое бремя и распространенность Toxocara по сравнению с другими районами (рис. 4 и 5). Во всех районах, кроме Бронкса, были яйца без личинки, доинфекционные формы (рис. 1).
По данным qPCR, T . cati был единственным идентифицированным видом. Это говорит о том, что кошки являются преобладающим резервуаром, вызывающим заражение на игровых площадках Нью-Йорка, хотя собаки могут временно переносить T . cati от кошачьих фекалий, но не являются частью жизненного цикла паразитов. [39] На самом деле обнаружение заражения кошек не является полностью беспрецедентным, поскольку данные NHANES показали высокий уровень сочетанного инфицирования токсокарозом и токсоплазмозом в национальном масштабе, предполагая, что кошки могут представлять собой важный, но часто недооцененный источник яиц Toxocara . [40] Существует несколько причин преобладающего заражения кошек. Ограждение парка состоит из вертикальных металлических решеток, которые эффективно предотвращают вход собак в парки (если владельцы домашних животных не разрешают доступ), но вряд ли ограничат доступ бездомных кошек.Кроме того, люди с большей вероятностью удаляют фекалии своих собак, чем кошек. Кошки могут быть заражены Т . cati на всех этапах жизни, в то время как собаки наиболее серьезно заражаются в младенчестве щенков. [41] Ветеринарные данные в районе Нью-Йорка показывают, что у кошек положительный результат на аскариды как минимум в четыре раза чаще, чем у собак, независимо от района. [42] Кроме того, домашние кошки выделяют токсокар чаще, чем домашние собаки. [43] Хотя образцы не были оптимально обработаны для qPCR и отсутствия T . cani ДНК можно объяснить небольшим размером выборки.
Подобные результаты были недавно получены в нескольких городах Европы [44, 45] и имеют важное значение для определения стратегий по снижению контаминации и риска заражения людей. [39] В недавнем метанализе, проведенном Fakhri et al., Среднее загрязнение почвы Toxocara в США составляло от 4 до 23%. Игровые площадки в Нью-Йорке, вероятно, имеют концентрацию воздействия животных и приводят к более высокому количеству яиц.[30] Существует несколько соображений относительно того, почему КПЦР Toxocara не соответствовала положительным или отрицательным при микроскопии образцам. Это может быть связано с тем, как образцы были сохранены и подготовлены для количественной ПЦР. КПЦР не является прямым сравнением с микроскопией, поскольку образцы сначала обрабатывались для микроскопического анализа, а количественная ПЦР проводилась на супернатанте, полученном из покровных стекол предметных стекол. Конкретный метод переноса после микроскопии может объяснить потерю яиц. Количественная ПЦР проводилась на супернатантах, удаленных с предметного стекла после исследования под микроскопом, а не непосредственно с образца почвы.Учитывая небольшое количество яиц (1-2) во многих образцах, любая потеря может привести к отрицательному результату КПЦР. Образцы с яйцеклеткой с зародышем содержат ДНК Toxocara , часто с очень высокими расчетными геномными эквивалентами, в то время как клетки, не подвергшиеся личинке, имеют только одну копию ДНК. Таким образом, ПЦР может лучше идентифицировать образцы с присутствующими личинками. Образец Bx15 находился за пределами динамического диапазона стандартов, и это, вероятно, связано с тем, что несколько яиц находились на стадии личинки и будут иметь много копий целевой последовательности, что дает завышенное рассчитанное количество яиц (рис. 3).Образец Bk8 был отрицательным при микроскопии, но положительным при кПЦР со значительным значением 40-Ct (13,958), что свидетельствует о том, что микроскопия субъективна и может пропустить визуализацию яиц. Предыдущие литературные исследования [46, 47] предполагают, что эти яйца могут прилипать к пластику и, возможно, были потеряны при промывании покровного стекла и предметного стекла, когда яйца были перенесены в пробирку Эппендорфа при подготовке к замораживанию. Другие ограничения заключаются в том, что образцы собирались в разное время года, когда изменения температуры окружающей среды влияли на яйца с зародышем.Эти температурные изменения могли повлиять на результаты личинки яиц, обнаруженные во всех районах. География также может влиять на распространенность, бремя и стадии зародыша яиц в окружающей среде. Статен-Айленд и Манхэттен не граничат с материком, поэтому количество мигрирующих собак и кошек может уменьшиться, что влияет на результаты.
Распределение зараженных Toxocara парков не было однородным по всему городу, но было более распространено в районах с более низким социально-экономическим статусом.Из пяти районов Бронкс имеет самый низкий средний доход, но самый высокий уровень загрязнения почвы с наибольшим количеством инфекционных личинок паразитов. Если судить по яйцеклеткам с эмбрионами / личинками, риск токсокароза от попадания в организм почвы был самым высоким в Бронксе. Неизвестно, есть ли в этих районах больше домашних животных или бездомных кошек, но, учитывая связь с более низким доходом, вероятно, что более высокий уровень заражения и более высокий инфекционный потенциал могут быть связаны с возможностью оплачивать регулярные ветеринарные осмотры. и дегельминтизация домашних животных.Животные, часто посещающие зараженные районы, могут повторно заразиться даже после дегельминтизации, если соседние животные не прошли дегельминтизацию. В Бруклине, Квинсе и Статен-Айленде медианный доход выше при 30–38% геозагрязнения. Манхэттен имеет самый высокий средний доход, но более низкий процент загрязнения – 29,6%, но все же указывает на то, что более четверти протестированных участков Манхэттена имеют Toxocara . Поскольку вес почвы между игровыми площадками варьировался (от 100 до 150 г), существует вероятность систематической ошибки выборки, поскольку увеличение количества почвы в граммах может означать, что больше яиц будет доступно для микроскопии или обнаружения с помощью количественной ПЦР.Это несоответствие могло увеличить количество яиц в Бронксе (рис. 5). Общий высокий уровень паразитов во всех районах может быть результатом «бума домашних животных»; количество домашних кошек и собак в США увеличилось более чем вдвое за последние четыре десятилетия, что способствует обострению проблемы бездомных кошек в бедных районах. [48]
Несоответствие более высокого уровня загрязнения окружающей среды Toxocara в более бедных районах присутствует и, вероятно, приводит к фактическому неравенству в отношении здоровья, но это еще предстоит оценить, поскольку существуют другие способы передачи Toxocara человеку.Последние окончательные данные о распространенности инфекции Toxocara среди детей и взрослых, проживающих в этих районах, отсутствуют. Однако результаты исследования 1987 года выявили более высокую распространенность серотипа у детей и подростков из бедных районов Нью-Йорка. [15] Кроме того, оба исследования Toxocara NHANES предполагают, что лица из числа меньшинств и лица с более низким социально-экономическим статусом подвергаются большему риску заражения токсокарозом. [11, 21] Таким образом, разумный подход, учитывая потенциально серьезные последствия для здоровья инфекции Toxocara , особенно для маленьких детей и подростков, состоит в том, чтобы предположить, что передача вируса человеку произойдет, и приложить все усилия для снижения загрязнения окружающей среды на . Toxocara как можно больше и в кратчайшие сроки.
Помимо важности неравенства в отношении здоровья человека, Toxocara заражение почвы – это проблема единого здоровья; он влияет на чистоту окружающей среды и может повлиять на здоровье домашних животных и диких животных. Инфекционные яйца представляют собой опасность для окружающей среды и потенциальную опасность для здоровья детей с pica. К другим паратеническим хозяевам этого паразита относятся грызуны, птицы или кролики, которые при заражении продолжают вносить вклад в жизненный цикл паразита. Наконец, другие личинки паразитов были замечены под микроскопом, но не могут быть окончательно идентифицированы в этих образцах, что создает потенциальный инфекционный риск для посещающих животных или детей.
Выводы
Виды Toxocara являются обычными паразитами домашних животных, которые встречаются в песках и почве почти одной трети участков отбора проб в Нью-Йорке, особенно в более бедных районах. Преобладающим видом в Нью-Йорке является T . кати . Следует принять профилактические меры. К ним относятся улучшенное ограждение игровых площадок для предотвращения проникновения диких кошек, дегельминтизация домашних животных в соответствии с национальными ветеринарными рекомендациями, лучший контроль над бездомными кошками и собаками, сбор фекалий домашних животных, отказ от употребления пищи, которая могла быть заражена, ограничение детей с пикой из игровых площадок и частым мытьем рук после посещения игровых площадок перед приемом пищи или закусок.
Благодарности
Авторы благодарят всех нынешних и прошлых соавторов за их вклад в исследование Toxocara и признают невозможность разместить на сайте все рецензируемые публикации. DLT благодарен тем, кто помогал советами и обучением в отношении этого исследования, особенно Сьюзан Литтл, доктор ветеринарной медицины, доктор философии. DACVM, Юнхуа Ли, доктор медицины, Уильям Борковски, доктор медицины, Мона Риго, доктор медицины, Селия Холланд, доктор медицинских наук, и Глория Хереси, доктор медицины. Особая благодарность Дуайту Боумену Ph.D. за предоставление яиц Toxocara cani яиц для проверки количественной ПЦР, и Энн Заяк, доктор медицинских наук, доктор философии. за предоставление образцов кошек, инфицированных яиц Toxocara cati , для проверки количественной ПЦР.
Список литературы
- 1. Борг О.А., Вудрафф А.В. Распространенность инфекционных яйцеклеток видов Toxocara в общественных местах. Британский медицинский журнал. 1973; 4 (5890): 470–2. pmid: 4758452; PubMed Central PMCID: PMC1587590.
- 2. Голландия CV. Пробелы в знаниях в эпидемиологии токсокары: загадка остается.Паразитология. 2015: 1–14. Epub 2015/12/17. pmid: 26670118.
- 3. Strube C, Heuer L, Janecek E. Toxocara spp. инфекции у паратенических хозяев. Ветеринарная паразитология. 2013. 193 (4): 375–89. pmid: 23312872.
- 4. Ма Г., Холланд К.В., Ван Т., Хофманн А., Фан К.К., Майзельс Р.М. и др. Токсокароз человека. Ланцет Инфекционные болезни. 2018; 18 (1): e14 – e24. pmid: 28781085.
- 5. Уолш М.Г., Хасиб М.А. Снижение когнитивной функции у детей с токсокарозом в национальной репрезентативной выборке США.Int J Parasitol. 2012. 42 (13–14): 1159–63. Epub 2012/11/06. pmid: 23123274.
- 6. Fan CK, Holland CV, Loxton K, Barghouth U. Церебральный токсокароз: бесшумное развитие нейродегенеративных заболеваний? Обзоры клинической микробиологии. 2015; 28 (3): 663–86. Epub 2015/06/13. pmid: 26062575; PubMed Central PMCID: PMC4462679.
- 7. Резюме Голландии, Гамильтон СМ. Значение церебрального токсокароза: модельная система для изучения связи между вовлечением мозга, поведением и иммунным ответом.Журнал экспериментальной биологии. 2013; 216 (Pt 1): 78–83. Epub 2012/12/12. pmid: 23225870.
- 8. CDC. Забытые паразитарные инфекции (НПИ) в Соединенных Штатах: Центры по контролю и профилактике заболеваний; 2014 г. [обновлено 10.07.14; процитировано 7 июня 2016 г.]. Доступно по адресу: http://www.cdc.gov/parasites/npi/.
- 9. Брунаска М., Дубинский П., Рейтерова К. Toxocara canis: ультраструктурные аспекты линьки личинок в созревающих яйцах. Int J Parasitol. 1995. 25 (6): 683–90.Epub 1995/06/01. pmid: 7657453.
- 10. Хотез П.Дж., Уилкинс П.П. Токсокароз: самая распространенная в Америке запущенная инфекция бедности и гельминтоз мирового значения? PLoS Negl Trop Dis. 2009; 3 (3): e400. pmid: 19333373; PubMed Central PMCID: PMC2658740.
- 11. Вудхолл DM, Эберхард ML, Parise ME. Забытые паразитарные инфекции в США: токсокароз. Американский журнал тропической медицины и гигиены. 2014; 90 (5): 810–3. pmid: 24808249; PubMed Central PMCID: PMC4015569.
- 12. Hotez PJ. Забытые инфекции бедности в Соединенных Штатах Америки. PLoS Negl Trop Dis. 2008; 2 (6): e256. pmid: 18575621; PubMed Central PMCID: PMC2430531.
- 13. Вон KY, Kruszon-Moran D, Schantz PM, Jones JL. Национальная распространенность и факторы риска зоонозов Toxocara spp. инфекция. Американский журнал тропической медицины и гигиены. 2008. 79 (4): 552–7. pmid: 18840743.
- 14. Смит Х, Холланд К., Тейлор М., Магнавал Дж. Ф., Шанц П., Майзельс Р.Насколько распространен токсокароз у человека? К стандартизации наших знаний. Тенденции паразитологии. 2009. 25 (4): 182–8. pmid: 19269251.
- 15. Мармор М., Гликман Л., Шофер Ф., Файх Л.А., Розенберг С., Корнблатт Б. и др. Инфекция детей Toxocara canis: эпидемиологические и нейропсихологические данные. Американский журнал общественного здравоохранения. 1987. 77 (5): 554–9. pmid: 3565646; PubMed Central PMCID: PMC1647039.
- 16. Эриксон Л.Д., Гейл С.Д., Берретт А., Браун Б.Л., Хеджес Д.В.Связь между токсокарозом и когнитивной функцией у взрослых молодого и среднего возраста. Folia Parasitol (Прага). 2015; 62. Epub 2015/09/17. pmid: 26374832.
- 17. Janecek E, Beineke A, Schnieder T., Strube C. Нейротоксокароз: заметное предпочтение Toxocara canis для головного мозга и T. cati для мозжечка у мыши-хозяина паратенической модели. Паразиты и векторы. 2014; 7: 194. pmid: 24754900; PubMed Central PMCID: PMC4017833.
- 18. Heuer L, Haendel S, Beineke A, Strube C.Влияние личинок Toxocara на выживаемость клеток мозга с помощью оценки модели in vitro. Паразитология. 2015; 142 (10): 1326–34. pmid: 26080924.
- 19. Уолш М.Г., Хасиб М.А. Токсокароз и функция легких: актуальность запущенной инфекции в городской среде. Acta parasitologica / Институт паразитологии Витольда Стефанского, Варшава, Польша. 2014; 59 (1): 126–31. pmid: 24570059.
- 20. Шарги Н., Шанц П.М., Карамико Л., Баллас К., Тиг Б.А., Хотез П.Дж. Воздействие токсокары в окружающей среде как возможный фактор риска астмы: клиническое исследование случай-контроль.Клинические инфекционные болезни: официальное издание Общества инфекционных болезней Америки. 2001; 32 (7): E111–6. pmid: 11264048.
- 21. Фермер А., Белтран Т., Цой Ю.С. Распространенность инфекции видов Toxocara в США: результаты Национального исследования здоровья и питания, 2011–2014 гг. PLoS Negl Trop Dis. 2017; 11 (7): e0005818. pmid: 28759601; PubMed Central PMCID: PMC5552322.
- 22. Дада Б.Дж., Линдквист В.Д. Распространенность Toxocara spp. яйца в некоторых общественных местах и в местах отдыха на шоссе в Канзасе.Журнал гельминтологии. 1979; 53 (2): 145–6. pmid: 479545.
- 23. Surgan MH, Colgan KB, Kennett SI, Paffmann JV. Обследование собачьего токсокароза и токсокарального загрязнения почвы в графстве Эссекс, штат Нью-Джерси. Американский журнал общественного здравоохранения. 1980. 70 (11): 1207–8. pmid: 7425196; PubMed Central PMCID: PMC1619574.
- 24. Chorazy ML, Ричардсон DJ. Исследование загрязнения окружающей среды яйцеклетками аскарид, Уоллингфорд, Коннектикут. Трансмиссивные и зоонозные болезни (Ларчмонт, Нью-Йорк).2005; 5 (1): 33–9. pmid: 15815147.
- 25. Пол AJ, Тодд KS младший, DiPietro JA. Загрязнение окружающей среды яйцами видов Toxocara. Ветеринарная паразитология. 1988. 26 (3–4): 339–42. pmid: 3347993.
- 26. Дубин С., Сегалл С., Мартиндейл Дж. Загрязнение почвы в двух городских парках яйцеклетками собачьих нематод, включая Toxocara canis: предварительное исследование. Американский журнал общественного здравоохранения. 1975. 65 (11): 1242–5. pmid: 1237238; PubMed Central PMCID: PMC1775968.
- 27.Ludlam KE, Platt TR. Связь содержания парка и доступности для собак с присутствием Toxocara spp. яйцеклетки в почве. Американский журнал общественного здравоохранения. 1989. 79 (5): 633–4. pmid: 2705598; PubMed Central PMCID: PMC1349509.
- 28. Чайлдс JE. Распространенность яиц токсокар на задних дворах и в садах Балтимора, штат Мэриленд. Американский журнал общественного здравоохранения. 1985. 75 (9): 1092–4. pmid: 4025663; PubMed Central PMCID: PMC1646325.
- 29.
Уолш М.Г., Хасиб М.А.Оценка вероятности токсокароза в Нью-Йорке на малых территориях на основе социально-демографического состава района. ПлоС один. 2014; 9 (6): e99303. pmid: 24
5; PubMed Central PMCID: PMC4053403.
- 30. Fakhri Y, Gasser RB, Rostami A, Fan CK, Ghasemi SM, Javanian M, et al. Яйца токсокары в общественных местах по всему миру – систематический обзор и метаанализ. Environ Pollut. 2018; 242 (Pt B): 1467–75. Epub 2018/08/25. pmid: 30142562.
- 31. Драйден М.В., Пейн П.А., Ридли Р., Смит В.Сравнение распространенных методов фекальной флотации для извлечения яиц и ооцист паразитов. Ветеринарная терапия: исследования в прикладной ветеринарии. 2005. 6 (1): 15–28. pmid: 157.
- 32. Kazacos KR. Усовершенствованный метод извлечения яиц аскарид и других гельминтов из почвы, связанной с эпизоотиями и во время обзорных исследований. Американский журнал ветеринарных исследований. 1983; 44 (5): 896–900. pmid: 6683477.
- 33. Mejia R, Vicuna Y, Broncano N, Sandoval C, Vaca M, Chico M и др.Новый, многопараллельный подход полимеразной цепной реакции в реальном времени для восьми желудочно-кишечных паразитов обеспечивает улучшенные диагностические возможности для групп риска с ограниченными ресурсами. Американский журнал тропической медицины и гигиены. 2013. 88 (6): 1041–7. pmid: 23509117; PubMed Central PMCID: PMC3752800.
- 34. Durant JF, Irenge LM, Fogt-Wyrwas R, Dumont C, Doucet JP, Mignon B, et al. Дуплексный количественный анализ ПЦР в реальном времени для обнаружения и различения яиц Toxocara canis и Toxocara cati (Nematoda, Ascaridoidea) в образцах почвы и фекалий.Паразиты и векторы. 2012; 5: 288. pmid: 23216873; PubMed Central PMCID: PMC3533947.
- 35. Deer DM, Lampel KA, Gonzalez-Escalona N. Универсальный внутренний контроль для использования в качестве ДНК в ПЦР в реальном времени и в качестве РНК в анализах ПЦР с обратной транскрипцией в реальном времени. Lett Appl Microbiol. 2010. 50 (4): 366–72. pmid: 20149084.
- 36. Гигиена NYCDoHaM. Эпиквери: Интерактивная система данных о здоровье Нью-Йорка – [Данные о населении Нью-Йорка, 2010 г.] 2010 г. Доступно по адресу: https://a816-healthpsi.nyc.гов / эпиквери /.
- 37. Бюро USC. Факты о сообществе – Нью-Йорк, Нью-Йорк, 2016 г. Доступно по адресу: https://factfinder.census.gov/faces/nav/jsf/pages/community_facts.xhtml?src=bkmk.
- 38. Карни К., Моралес, А. Доход по почтовому индексу, 2016 г. [цитируется 10 августа 2016 г.]. Доступно по адресу: https://www.incomebyzipcode.com.
- 39. Overgaauw PA, van Knapen F. Ветеринарные аспекты и аспекты общественного здравоохранения, связанные с Toxocara spp. Ветеринарная паразитология. 2013. 193 (4): 398–403.Epub 2013/01/12. pmid: 23305972.
- 40. Джонс Дж. Л., Крушон-Моран Д., Вон К., Уилсон М., Шанц П. М.. Toxoplasma gondii и Toxocara spp. коинфекция. Американский журнал тропической медицины и гигиены. 2008. 78 (1): 35–9. pmid: 18187782.
- 41. Маленький SE. Toxocara cati (Труды). В: Care UA, редактор. CVC в Вашингтоне, округ Колумбия Слушания; 1 апреля 2010 г .; Вашингтон, округ Колумбия: DVM360.com; 2010. с. Toxocara cati (Proceedings) CVC in Washington, D.C. Proceedings.
- 42.Совет по паразитам животных-компаньонов. Карты распространенности паразитов CAPC Vet за 2017 г. [цитировано 5 июля 2017 г.]. Доступно по адресу: https://www.capcvet.org/maps/#2017/all/roundworm/dog/united-states/.
- 43. Лучио-Форстер А., Мижкири Барбечо Дж. С., Мохаммед Х.О., Корнрайх Б.Г., Боуман Д.Д. Сравнение распространенности выделения яиц токсокары домашними кошками и собаками в США, 2011–2014 гг. Ветеринарная паразитология: региональные исследования и отчеты. 2016; 5: 1–13. https://doi.org/10.1016/j.vprsr.2016.08.002.
- 44. Ванхи М., Далеманс А.С., Виене Дж., Депюйдт Л., Кларебоут Э. Токсокара в песочнице общественных игровых площадок и детских садов во Фландрии (Бельгия). Ветеринарная паразитология: региональные исследования и отчеты. 2015; 1–2: 51–4. https://doi.org/10.1016/j.vprsr.2016.03.002.
- 45. Отеро Д., Алхо А. М., Нийссе Р., Роэльфсема Дж., Овергау П., Мадейра де Карвалью Л. Загрязнение окружающей среды видами Toxocara spp. яйца в общественных парках и песочницах игровых площадок Большого Лиссабона, Португалия.Журнал инфекции и общественного здоровья. 2018; 11 (1): 94–8. pmid: 28545900.
- 46. Кляйне А., Спрингер А., Штрубе С. Сезонные колебания распространенности яиц токсокары на детских игровых площадках в городе Ганновер, Германия. Паразиты и векторы. 2017; 10 (1): 248. pmid: 28526064; PubMed Central PMCID: PMC5437484.
- 47. Kleine A, Janecek E, Waindok P, Strube C. Характеристики флотации и прилипания Toxocara canis и T. cati и надежный метод извлечения яиц Toxocara из почвы.Ветеринарная паразитология. 2016; 227: 35–41. pmid: 27523935.
- 48. Эндрю Н. Роуэн Ph.D. THSotUS. Тенденции защиты животных в США Исторический урок, извлеченный из США и для них. приюты для животных. 2017 21 января 2009 г.
Toxocara cati у кошек и людей
Круглые черви, в частности Toxocara cati , являются наиболее распространенными кишечными паразитами у кошек и встречаются у кошек всех возрастов во всем мире.На протяжении всей жизни кошки рекомендуется регулярный осмотр кала и, при необходимости, лечение от круглых червей. В то время как Toxocara canis (вид круглых червей, встречающийся у собак) был причастен к большинству случаев заражения людей, Toxocara cati также потенциально может передаваться людям и может быть недооцененным источником заболеваний человека.
Toxocara cati – это паразитическая аскарида, поражающая кошек несколькими путями заражения.Хотя существует много общего между круглыми червями собак и кошек, вызываемыми Toxocara canis и Toxocara cati соответственно, эти паразиты имеют разную биологию. Например, Toxocara canis может передаваться собаке через плаценту, а также через молозиво и молоко в течение нескольких недель после рождения. И наоборот, Toxocara cati не заражает животных через плаценту, а скорее передача происходит через молозиво и молоко только в первые дни кормления, когда заражение матки происходит на поздних сроках беременности.Кошки также могут заразиться инфекцией, независимо от их возраста, когда они глотают яйца из окружающей среды (которые выделяются с фекалиями и могут оставаться жизнеспособными в окружающей среде в течение нескольких лет) или промежуточных хозяев (например, беспозвоночные, грызуны, птицы), укрывающих цистин личинки.
Заражение кошек яйцами Toxocara cati происходит, когда проглоченные личинки проникают через стенку желудка и мигрируют через печень, легкие и трахею, пока не достигают тонкой кишки, где развиваются во взрослых особей.Большинство личинок, попавших в организм с молоком (или с промежуточными хозяевами), продолжают свое развитие до взрослых червей в кишечном тракте. Инкубационный период Toxocara cati составляет 8 недель после попадания в организм яиц из окружающей среды или личинок от промежуточных хозяев, а фекальное выделение яиц после передачи через молоко начинается через 6–7 недель. Существует тенденция рассматривать «кишечных червей» как проблему для здоровья котят и что взрослые кошки устойчивы к ним. Однако кошки подвержены инфекциям аскариды на протяжении всей своей жизни – например, взрослые кошки могут проглатывать яйца из окружающей среды, ухаживая за собой.Котята имеют более высокую паразитарную нагрузку, количество яйцеклеток и уровень инфицирования, чем взрослые, но кишечные инфекции встречаются у кошек всех возрастов.
Хотя инфицированные кошки обычно являются носителями Toxocara cati , кошек могут инфицировать и другие круглые черви. Toxocara leonine, аскарида, способная инфицировать как кошек, так и собак, имеет незначительную способность вызывать заболевание у кошек по сравнению с Toxocara cati и не передается людям. Toxocara malaysiensis был описан у кошек из некоторых азиатских регионов.На данный момент мало что известно о его эпидемиологии и клиническом воздействии на Азию или другие регионы, а также отсутствует информация о потенциальной зоонозной (то есть о том, что они могут передаваться и вызывать заболевание у людей).
Клинические аспекты
Многие люди ошибочно полагают, что наличие кишечных глистов у котят является нормальным явлением и что для котенка нет ничего действительно опасного в том, чтобы иметь типичный «животик». Очевидно, что котенок с толстыми, а в некоторых случаях и длиной до 10 см глистами, живущими в тонком кишечнике, является больным животным, независимо от наличия явных клинических признаков.Серьезные инфекции у котят могут привести к:
- Переменный аппетит или анорексия
- Рвота (особенно после кормления)
- Диарея чередовалась с запором
- Нарушения роста
Изгнание массы, обычно живых, червей в рвотных массах также является довольно распространенным явлением. В то время как у взрослых кошек обычно проявляются более легкие клинические признаки, тяжелые инфекции могут вызвать перфорацию желудка, что приведет к опасному для жизни перитониту.
Влияние на здоровье человека
Хорошо известно, что виды круглых червей, встречающиеся у домашних животных, вызывают инфекции человека во всем мире.На сегодняшний день Toxocara canis участвует в большинстве случаев инфицирования людей, но роль Toxocara cati , вероятно, недооценивается. Инфекция у людей обычно возникает при попадании в организм яиц, содержащихся в почве или в зараженной пище. Яйца Toxocara cati не являются инфекционными сразу после выведения с фекалиями, поскольку для полного развития инфекционной личинки необходимо 2–6 недель. Другими источниками заражения человека являются сырое / недоваренное мясо промежуточных хозяев (например,г. куры или крупный рогатый скот). У человека животные видов Toxocara не достигают взрослой стадии, а клинические признаки, если они присутствуют, связаны с мигрирующими личинками. Тяжесть заболевания зависит от:
- Степень повреждения тканей
- Пораженная ткань
- Количество перелетных личинок
- Возраст человека
- Иммунный ответ человека
Наиболее важными клиническими синдромами являются так называемые «мигрирующие висцеральные личинки» (VLM), охватывающие важные органы (в основном печень), и «мигрирующие глазные личинки» (OLM) из-за повреждения глаза.Также описаны другие синдромы, например, скрытый, невральный и атопический токсокароз.
Висцеральные мигранты личинки (VLM)Дети и, в частности, малыши более подвержены риску ВЛМ из-за низкого уровня гигиены и частого контакта с местами (например, песочницами, песочницами, садами, игровыми площадками), потенциально загрязненными яйцами видов Toxocara . ВЛМ у детей характеризуется:
- Лихорадка
- Общее недомогание
- Боль в животе
Инфекция может поражать печень, легкие, сердце и центральную нервную систему с различными признаками, относящимися к каждой из них.Однако экспериментальные модели показали, что Toxocara canis имеет большее сродство к центральной нервной системе по сравнению с Toxocara cati , которая предпочитает органы. Действительно, Toxocara cati может мигрировать в мозг, но чаще локализуется в мозжечке (нижняя часть мозга), тогда как Toxocara canis предпочитает головной мозг (большая часть мозга).
Глазные мигранты личинки (OLM)
ОЛМ встречается в любом возрасте, но чаще встречается у детей в возрасте 5–10 лет.Наиболее важным проявлением является нарушение зрения, вплоть до полной потери зрения, за которым следуют жалобы на «видение света», косоглазие и глаукому.
Скрытый токсокароз (CT) считается более легкой формой заболевания, чем VLM и OLM, и может быть связан с хроническим воздействием. Взрослые с КТ могут иметь:
- Проблемы с дыханием
- Боль в животе
- Слабость
- Сыпь
- Зуд генерализованный
У детей КТ ассоциируется с:
- Рвота
- вялость
- Нарушения поведения и сна
- Кашель и хрипы
- Боль в конечностях
Toxocara видов инфекции могут обострять астму и вызывать кожные заболевания, такие как зуд, экзема и крапивница.Случаи передачи Toxocara cati взрослых особей от детей задокументированы, но они происходят в результате проглатывания червей, выбрасываемых инфицированным животным с рвотой или фекалиями.
Лечение и профилактика
Для лечения и борьбы с кишечными глистами у кошек доступны различные препараты от глистов в различных составах. Существует множество продуктов с узким или широким спектром, которые можно выбрать в соответствии с каждым индивидуальным возможным сценарием и обеспечить соблюдение требований владельцев и животных.Например, составы для точечного нанесения имеют то преимущество, что их легко наносить, в то время как некоторые составы для перорального применения очень приятны на вкус.
Использование продуктов от гельминтов должно соответствовать биологии паразитов и эпидемиологическим особенностям в различных регионах. Следует учитывать географическое распространение паразитов, клиническое значение и возможную высокую устойчивость инфекционных стадий в окружающей среде независимо от времени года или климата. Яйца Toxocara cati устойчивы к агрессивным химическим веществам и широкому диапазону температур.Различные руководящие принципы издаются CAPC в Северной Америке и ESCCAP в Европе (https://capcvet.org; www.esccap.org). Поскольку внутриутробная передача инфекции у кошек отсутствует, котята могут проходить курс лечения каждые две недели с 3-х недель до отъема. Их следует лечить ежемесячно до 6-месячного возраста, а взрослых кошек можно лечить один раз в месяц («круглый год») или раз в месяц подвергать анализу фекалий и лечить соответствующим образом (рекомендации ESSCAP, www.esscap.org). Лечение беременной королевы с помощью выбранных протоколов и выбранных препаратов предотвращает передачу Toxocara cati через молоко.Кормящих маток следует лечить лицензированными препаратами один раз во время лактации одновременно с первой обработкой котят.
Заключение
Регулярные осмотры фекалий и дегельминтизация имеют решающее значение для эффективного контроля над аскаридами на протяжении всей жизни кошки. Такой режим ограничивает риск заражения и способствует охране здоровья как животных, так и человека.
.





 Обычно поражается только один глаз.
Обычно поражается только один глаз. Ваш ветеринар может порекомендовать план тестирования и лечения дегельминтизации.
Ваш ветеринар может порекомендовать план тестирования и лечения дегельминтизации. Если не лечить, это может привести к слепоте на пораженный глаз.
Если не лечить, это может привести к слепоте на пораженный глаз.