Умеренно дифференцированная аденокарцинома желудка: Карцинома желудка – лечение аденокарциномы желудка в Израиле по доступной цене, запись на диагностику и лечение аденокарцинома желудка в Израильских клиниках
Умеренно дифференцированная аденокарцинома желудка: диагностика и прогноз выживаемости
Под умеренно дифференцированной аденокарциномой понимают разновидность рака желудка, которая занимает промежуточное положение между высокодифференцированной и низкодифференцированной. Изменение структуры клеток при этом незначительное, патологические ткани мало отличаются от здоровых.
Причины
Аденокарцинома никогда не возникает у здорового человека. Ей всегда предшествуют те или иные заболевания желудка. Такие состояния называются предраковыми.
К факторам риска также относятся особенности рациона человека. Общие причины развития умеренной дифференцированной аденокарциномы:
- атрофический гастрит;
- наследственная предрасположенность;
- неправильное питание;
- строгие диеты;
- хроническая язва;
- резекция желудка;
- длительное воздействие радиации или токсинов;
- злоупотребление алкоголем, курение.

Симптомы
На каждой стадии развития умеренно дифференцированной аденокарциномы появляются определенные симптомы. Ранний этап чаще протекает практически без каких-либо изменений. В дальнейшем у больного появляются жалобы на те или иные симптомы:
Стадия | Симптомы |
1 | Специфические симптомы еще отсутствуют, поскольку размеры новообразования минимальны. У пациента может отмечаться только ухудшение аппетита. |
2 |
|
3 |
|
4 |
|
Диагностика
При появлении перечисленных выше симптомов стоит как можно раньше обратиться к гастроэнтерологу. Диагностика проводится с целью выявления стадии заболевания. Важным этапом выступает опрос больного для выявления специфических признаков аденокарциномы. Подтвердить диагноз помогают следующие исследования:
- анализ крови;
- гастроскопия с биопсией;
- рентгенологическое исследование желудка с контрастированием;
- УЗИ брюшной полости;
- компьютерная и магнитно-резонансная томографии.
Лечение
Определенная схема лечения подбирается с учетом размеров новообразования и общего состояния пациента.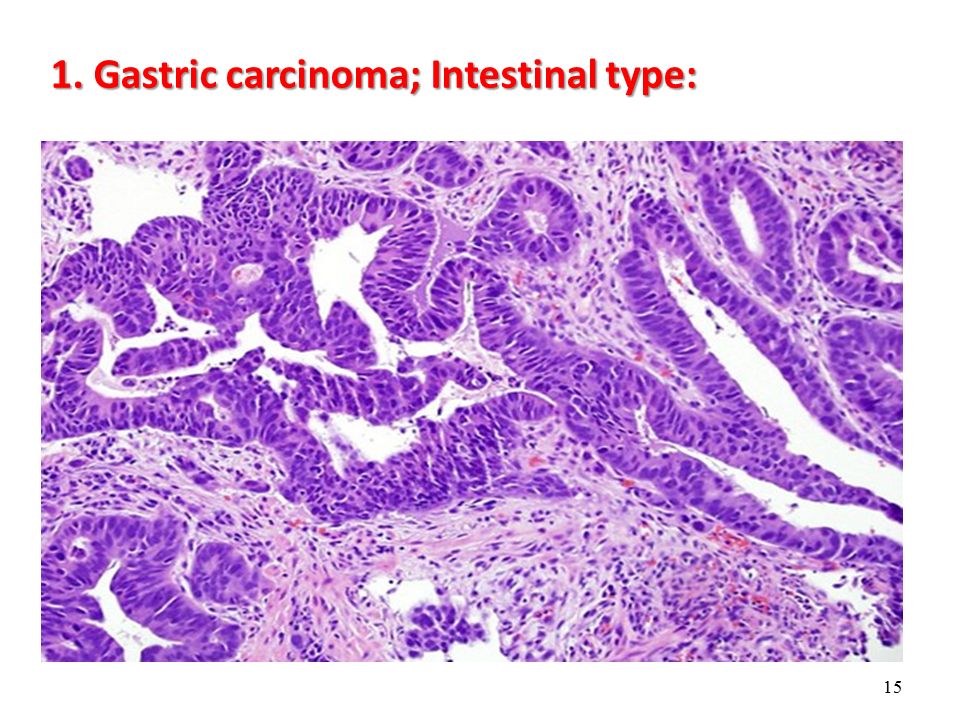 Методы терапии на разных стадиях:
Методы терапии на разных стадиях:
Стадия | Методы лечения |
Первая | До и после операции назначается химио- или лучевая терапия для уменьшения размеров опухоли. Оперативное вмешательство:
|
| Вторая | |
Третья | |
Четвертая | Хирургическое лечение неэффективно, поскольку организм больного ослаблен. Кроме того, на этой стадии опухолевый процесс вызывает множественные метастазы. Применяется только химиотерапия или лучевая терапия. Возможно проведение паллиативного вмешательства:
|
Диета
При умеренно дифференцированной аденокарциноме необходимо соблюдать щадящую для желудка диету. Она предполагает дробное питание. Питаться необходимо только свежеприготовленными блюдами. Принципы питания, которые стоит соблюдать:
- есть только теплые блюда;
- употреблять продукты, приготовленные на пару или отваренные;
- исключить пищу, вызывающую брожение, т. е. молоко, хлеб, бобовые, алкоголь;
- есть медленно, тщательно пережевывая каждый кусочек;
- есть часто, но небольшими порциями.
Народная медицина
Лечить железистый рак желудка народными методами настоятельно не рекомендуется, поскольку это опасное заболевание, которое может быстро прогрессировать. Методы нетрадиционной медицины допустимы только при разрешении врача и исключительно в качестве дополнения к основной терапии. Эффективными считаются следующие средства:
Эффективными считаются следующие средства:
- Взять 100 г корня аконита, промыть и положить в литровую банку. Доверху залить кипятком. Спустя полчаса корни достать и залить тем же количеством 60-градусной водки. Оставить на 21 день, после чего средство будет готово. Разводить 1 каплю настойки в 200 г теплой воды. Пить за полчаса до еды курсом 10 дней. Ежедневно прибавлять по 1 капле.
- Во время цветения собрать цветки картофеля, высушить в темном месте, измельчить. На 1 ст. л. сырья взять 0,5 л кипятка. Настаивать ингредиенты около 3 ч, процедить. Ежедневно пить по 150-170 г 3 раза в сутки за полчаса до приема пищи. Продолжать на протяжении 2 недель.
Возможные осложнения
Основные последствия аденокарциномы связаны с ее лечением и далеко зашедшим патологическим процессом. Среди осложнений этого онкозаболевания выделяются:
- стеноз привратника;
- распространение метастазов на печень, легкие и другие органы;
- асцит из-за сдавливания опухолью кровеносных сосудов;
- кровотечения;
- анемия;
- перфорация желудочных стенок;
- летальный исход.

Прогноз при умеренно дифференцированной аденокарциноме желудка
Существует зависимость прогноза от стадии заболевания и места расположения новообразования. Если аденокарцинома умеренно дифференцированная, то на дальнейшее развитие болезни влияют множество факторов. Варианты прогноза:
Стадия или форма заболевания, другие условия | Выживаемость |
1 | Пятилетняя выживаемость – 80% |
2 | 5-летняя выживаемость – около 50% |
3 | 5-летняя выживаемость – 15-35% |
4 | 5-летняя выживаемость – около 5% |
После лечения аденокарциномы 4 стадии | Продолжительность жизни пациентов редко превышает 1 год. |
Профилактика
Для предотвращения умеренно дифференцированной аденокарциномы желудка необходимо исключить влияние на организм этиологических факторов.
- Отказаться от курения и злоупотребления алкоголем.
- Соблюдать диету, ограничивающую вяленые, копченые, соленые и маринованные блюда.
- Употреблять сезонные фрукты, овощи и ягоды.
- Своевременно лечить хронические заболевания пищеварительного тракта.
Видео
Нашли в тексте ошибку?
Выделите её, нажмите Ctrl + Enter и мы всё исправим!
Внимание! Информация, представленная в статье, носит ознакомительный характер. Материалы статьи не призывают к самостоятельному лечению. Только квалифицированный врач может поставить диагноз и дать рекомендации по лечению, исходя из индивидуальных особенностей конкретного пациента.
Низкодифференцированная аденокарцинома желудка
Онкологические заболевания желудка классифицируются по различным признакам. Дифференцировка – один из них. Специалисты различают:
Дифференцировка – один из них. Специалисты различают:
- Высокодифференцированную форму аденокарциномы. Специфика опухолевых клеток с высоким уровнем дифференцировки имеет много общего со здоровыми тканями. Новообразования медленно увеличиваются в размере. Своевременная диагностика – залог успешного результата лечения. Начальная стадия отличается отсутствием симптоматики, поэтому трудно обнаруживается. Эндоскопическое исследование не всегда выявляет новообразование. Обнаружение опухоли на позднем этапе развития снижает шансы на результативность лечебных процедур;
- Аденокарцинома с умеренной дифференцировкой. Опухолевые очаги практически не поддаются идентификации на тканях, где они расположены. Злокачественность умеренная. Новообразование увеличивается медленно;
- Низкодифференцированное новообразование. Идентификация клеток таких образований с определенными тканями невозможна. Опухоль относится к категориям с высокой злокачественностью. Быстро увеличивается в размерах, метастазы начинают распространяться на ранних стадиях.

Симптоматика низкодифференцированной аденокарциномы
Когда заболевание достигает определенной стадии, ощущается следующая симптоматика:
- Больной теряет аппетит;
- Появляются признаки диспепсии: вздувается живот, человеку тошнит, его мучает отрыжка;
- Большие новообразования перекрывают просветы в желудке, это стимулирует рвотные порывы при потреблении еды. Характерно для последних стадий;
- Падение работоспособности;
- Низкодифференцированная форма сопровождается болями. С течением болезни они становятся постоянными, не зависят от того, ел больной пищу или нет.
Этапы развития низкодифференцированной аденокарциномы
В самом начале развития заболевания эпителиальный слой не поражается злокачественными клетками рака. Болезнь прогрессирует в четыре этапа:
- Прорастание новообразования в эпителиальный слой, распространение по другим слоям желудочных стенок без выхода за их границы.
- Увеличение опухоли, метастазирование на область региональных лимфатических узлов.

- Прорастание в зону соседних органов: поджелудочной железы, печени. Метастазирование на лимфатические узлы.
- Метастазирование по органам, расположенным отдельно от желудка.
Как лечат низкодифференцированную аденокарциному
Хирургическое вмешательство – единственный способ избавить человека от ракового новообразования. В некоторых случаях рекомендуется провести курс химической терапии перед операцией. Лучевая терапия используется для снятия болевых синдромов. Она помогает уничтожить оставшиеся клетки рака.
Лечение онкологии в Tel Aviv Medical Clinic
Лучшие специалисты Израиля в области онкологии и хирургии на протяжении многих лет помогают пациентам клиники Tel Aviv Medical Clinic побороть рак. Тысячи людей избавились от сложнейших заболеваний благодаря высокой квалификации врачей, ультрасовременному оборудованию, инновационным технологиям, используемых в медицинском центре.
Патоморфологическая характеристика рака желудка и его метастазов
Морфологические
и гистологические особенности рака
желудка достаточно разнообразны.
плоскоклеточный рак (не более 1%),
аденоакантому (не более 1%),
клеточно-эндокринный рак (карциноидные опухоли), карциноид – аденокарцинома (не
более 1%),
мезенхимальные опухоли стенки желудка (GIST) – лейомиосаркамы, нейрогенные
опухоли (не болееЗ%),
экстранодулярные лимфосаркомы желудка (лимфосаркомы ЖКТ) – в последнее время отмечается тенденция значительного роста.
С учетом широкого распространения аденокарцином желудка, клиницистам приходиться знать более подробную и достаточно удобную классификацию аденогенного рака, предложенную Японской ассоциацией изучения рака желудка
(1998):
Дифференцированные аденокарциномы:
-папиллярная аденокарцинома (рар),
-высокодифференцированная аденакарцинома (tubl),
-умеренно
дифференцированная аденокарцинома
(tub2).
Низко дифференцированные аденокарциномы:
-солидный тип (porl),
-несолидный тип (рог2),
-перстневидноклеточный рак (sig),
-муцинозная аденокарцинома (тис).
Специальные типы опухолей:
-плоскоклеточный рак,
-железисто-плоскоклеточный рак (диморфный рак),
-карциноидные опухоли,
-прочие типы опухолей (мезенхиомы, лимфосаркомы).
Помимо предложенной выше классификации в клинике принято разделять по характеру роста:
-эндофитные (рост опухоли вдоль желудочной стенки с ее инфильтрацией , и в конечном счете с прорастанием всех ее слоев),
-экзофитные (рост опухоли в основном в просвет желудка),
– смешанные.
Наибольший интерес также представляют собой форма роста опухоли, среди которых принято выделять следующие:
1 .Грибовидный или полиповидный, имеющий экзофитный характер роста в просвет желудка,
2.Экзофитно-язвенный тип – характеризуется наличием изъязвления и приподнятыми омозоленными краями, имеющими четкую границу с окружающими слизистой
желудка,
т.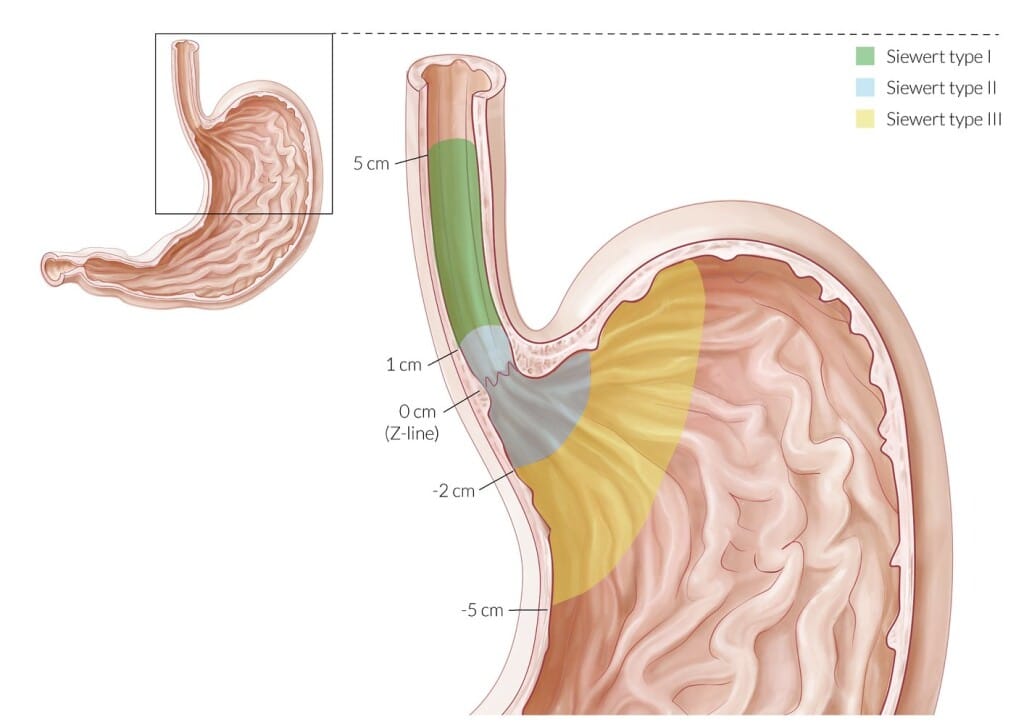 е. блюдцеобразный рак,
е. блюдцеобразный рак,
З.Язвенно-инфильтративный тип – характеризуется изъязвлением , без четких границ с окружающей слизистой оболочкой и интрамуральной инфильтрацией желудочной стенки,
4.Диффузно-инфильтративный тип – характеризуется диффузным поражением стенки желудка, возможно с минимальным изменением его слизистой оболочки и диффузным изменением всех слоев, по типу пластического линита (linitis рlastica).Пластический линит – это инфильтративный диффузный рост аденокарциномы желудка.
Немаловажное
прогностическое значение и закономерности
имеет и локализация
опухоли
в желудке. Наиболее часто встречается
рак антрального отдела и
пилорического
канала (до 40% наблюдений), второй по
частоте локализации рак тела
желудка,
либо антрального отдела с переходом на
тело желудка (до 30% наблюдений ),
и
реже всего, встречается рак проксимального
отдела желудка, зачастую с
инфильтрацией
на абдоменальный отдел пищевода, т.е.
кардио-эзофагеальный рак, (до
20%
наблюдений ). Чаще всего рак возникает
на малой кривизне желудка – 25-23%, реже,
на большой – 2-3%. Относительно часто в
желудке отмечается мультицентричный
рост, что подтверждает теорию опухолевого
роста опухоли. Согласно большим
статистическим данным наиболее высокая
5-тилетняя выживаемость у больных с
раком дистального отдела желудка
(превышает 30%). Промежуточное положение
занимает рак тела желудка, при нем
выживаемость ниже -25-30%, и менее
благоприятный прогноз у пациентов с
кардио-эзофагеальным раком, при котором
5-тилетняя выживаемость составляет
около 15%. Для рака желудка характерно:
Относительно часто в
желудке отмечается мультицентричный
рост, что подтверждает теорию опухолевого
роста опухоли. Согласно большим
статистическим данным наиболее высокая
5-тилетняя выживаемость у больных с
раком дистального отдела желудка
(превышает 30%). Промежуточное положение
занимает рак тела желудка, при нем
выживаемость ниже -25-30%, и менее
благоприятный прогноз у пациентов с
кардио-эзофагеальным раком, при котором
5-тилетняя выживаемость составляет
около 15%. Для рака желудка характерно:
l.рост на протяжении органа с распространением на смежные отделы желудочно-кишечного тракта (пищевод, двенадцатиперстная кишки),
2.прорастание стенки желудка с инвазией в окружающие органы и ткани (поджелудочная железа, печень, диафрагма, поперечно-ободочная кишки, почка),
З.лимфогеннон метастазирование по экстрамуральным лимфатическим сосудам в зоны регионарного метастазирования с возможной перинодальной инвазией клетчатки,
4.отдаленное
гематогенное метастазирование в органы.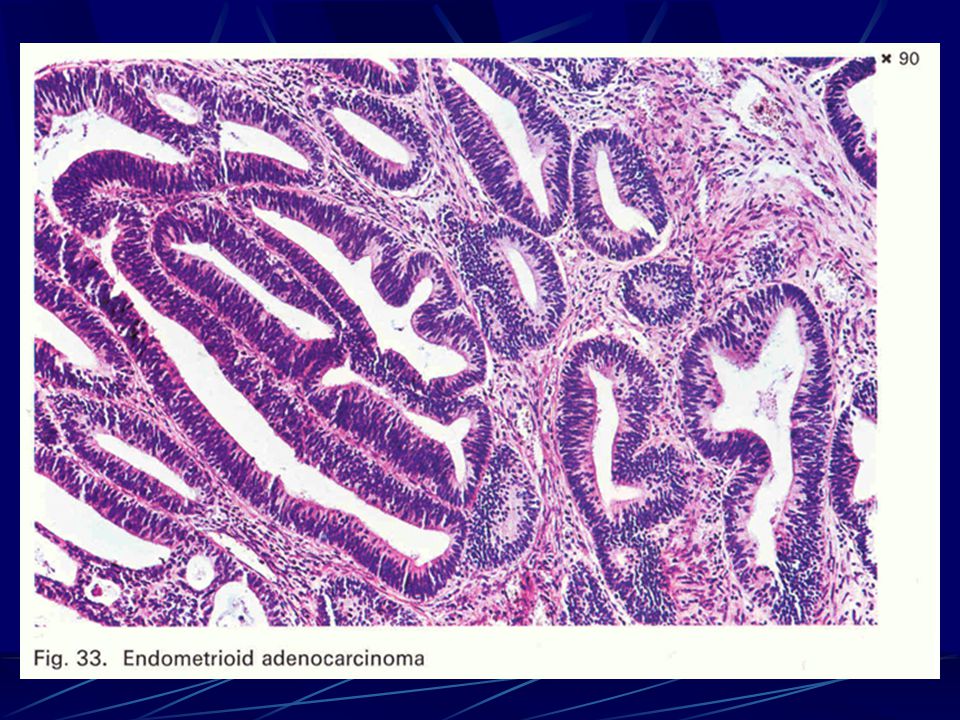
Огромной проблемой является распространение и метастазирование опухолей желудка.
Пути распространения рака желудка
I. Прорастание опухоли:
1. в малый и большой сальники,
2. в печень и диафрагму,
3. в поджелудочную железу,
4. в селезёнку,
5. в желчевыводящие пути,
6. в поперечно-ободочную кишку,
7. в переднюю брюшную стенку.
II. Лимфогенное метастазирование:
1. в регионарные лимфатические узлы,
2. в отдалённые лимфатические узлы (метастаз Вирхова, узел в левой подмышечной области).
III. Гематогенное метастазирование:
1. в печень,
2. в лёгкие,
3. в кости,
4.в мозг.
Имплантационные метастазы:
1. диссеминация, локальная или тотальная,
2. в малом тазу (метастаз Крукенберга, Шницлера).
Процесс
метастазирования это сложный биохимических
процесс, а не банальное, механическое
отделение канцероцитов и их внедрение
в другие органы и ткани. Особое значение
в процессе метастазирования рака желудка
играет его лимфатическая система и
лифатические коллекторы. Многообразие
лимфатической сети желудка и высокой
степени ее организации в различных его
стенках – формирование
лимфатических сплетений, лимфовенозных
анастомозов, и тесная взаимосвязь ее с
лимфатической системой пищевода,
двенадцатиперстной кишки, поджелудочной
железой определяет причину раннего
метастазирования. Как известно первыми
поражаются метастазами перигастральные
лимфатические узлы, в зависимости от
локализации они подразделяются (N1):
Многообразие
лимфатической сети желудка и высокой
степени ее организации в различных его
стенках – формирование
лимфатических сплетений, лимфовенозных
анастомозов, и тесная взаимосвязь ее с
лимфатической системой пищевода,
двенадцатиперстной кишки, поджелудочной
железой определяет причину раннего
метастазирования. Как известно первыми
поражаются метастазами перигастральные
лимфатические узлы, в зависимости от
локализации они подразделяются (N1):
-правые паракардиальные,
-левые паракардиальные,
-Лимфоузлы малой кривизны желудка,
лимфоузлы большой кривизны желудка,
-супрапилорические,
-субпилорические.
K лифатическим узлам второго уровня (порядка) поражения метастазами относят (N2):
-лимфоузлы по ходу левой желудочной артерии,
-лимфоузлы по ходу общей печеночной артерии,
-лимфоузлы, расположенные около чревного ствола,
-лимфоузлы вдоль дуги селезеночной артерии и ворот селезенки,
-лимфоузлы
собственно вдоль селезеночной артерии.
К
третьему этапу (порядку) метастазирования
относят (N3) парааортальные и паракавальные
лимфоузлы. К четвертому уровню
метастазирования рака желудка (N4) относят
поражение отдаленных органов и тканей.
Вовлечение лимфатических коллекторов
N1-N2
рассматривается как регионарное
метастазирование, тогда как вовлечение
лимфоузлов N3 – рассматривается как
распространенность, соответствующая
IV
стадии процесса. Традиционно излюбленная
локализация отдаленных метастазов рака
желудка является _ поражение
параклявикулярных лимфатических узлов
(преимущественно слева) – метастаз
Вирхова, поражение жировой клетчатки
Дугласова пространства – метастаз
Шницлера-Блюма, поражение яичника –
метастаз Крукенберга, поражение
лимфатического узла пупочного кольца
-метастаз сестры Жозеф (при интраперитонеальном
метастазировании). Кроме этого, при
запущенном раке желудка метастазами
поражаются: печень и легкие, реже
надпочечники и кости. Для имплантационного
пути метастазирования характерно
поражение сальника (большого и малого),
а также брюшины (канцероматоз брюшины,
с последующим развитием ракового
асцита).
Изложенные выше позиции метастазирования рака желудка имеет важное значение для проведения расширенного и комбинированного хирургического вмешательства, которое зачастую сводится к операции удаления первичной опухоли желудка и его метастазов, соответственно 1-го, 2-го, реже 3 и 4 порядков. Операции иссечения возможно метастатических лимфатических узлов носит название лимфодиссекция.
Всё что нужно знать об аденокарциноме (железистый рак)
Разбор заболевания мы начнем с самого термина «аденокарцинома». Это, другими словами, железистый рак. Данный тип рака располагается на поверхности многих внешних и внутренних органов. Его развитие ведет к неконтролируемому росту, таким образом и делению, клеток.
Аденокарцинома. Виды и стадии
Медики классифицируют железистый рак по нескольким критериям. Специалисты выделяют три вида аденокарцином:
- Высокодифференцированная аденокарцинома.
 Она очень медленно расходится по организму и отлично лечится. В 3 из 5 случаев данный тип опухоли протекает скрыто, поэтому специалисты выявляют его уже на последних стадиях.
Она очень медленно расходится по организму и отлично лечится. В 3 из 5 случаев данный тип опухоли протекает скрыто, поэтому специалисты выявляют его уже на последних стадиях. -
Умеренно – дифференцированная аденокарцинома. Скорость развития – средняя.
-
Низкодифференцированная аденокарцинома. Самая небезопасная разновидность. Быстрое распространение, довольно плохо поддается какому-либо лечению и рано появляются метастазы.
Типы аденокарциномы онкологи выявляют по органам, в которых заболевание обнаруживается: поджелудочная железа, легкие, матка, желудок, печень и другие.
Стадий аденокарциномы существует пять:
-
Нулевая. Злокачественные клетки не выходят за эпителий, где появились.
-
Первая. Новообразование, размещенное в органе, достигает до 2 см в диаметре.

-
Вторая. Опухоль уже до 4 см. Плюс, от нее могут распространиться метастазы в самые ближайшие к опухоли лимфатические узлы.
-
Третья. Новообразование занимает всю толщину стенок органа, затем переходит на соседние органы, и дает больше метастаз.
-
Четвертая. На этой стадии обильное количество метастаз распространяются в отдаленные органы человека.
Какие причины развития аденокарциномы? Какие симптомы?
Факторы, из-за которых опухоль формируется, ситуационны и специфичны отдельно для каждого органа.
Основные же причины, способствующие развитию опухоли такие:
-
Неправильное питание
-
Стрессы
-
Язвы и полипы
-
Заболевание определенного органа
-
Курение и чрезмерное употребление алкоголя
Основные симптомы, на которые стоит обратить внимание:
-
Боль в одном из органов;
-
Плохое самоощущение;
-
Кровь в выделениях;
-
Потеря аппетита.

Какой прогноз выживаемости при аденокарциноме?
Специалисты отсчитывают его от пятилетней выживаемости (кол-во человек с раком, которые перешли отметку в пять лет после окончания лечения). Существуют следующие данные по стадиям:
0 стадия – 93-100%
Какие есть виды диагностики аденокарциномы?
Пациенту нужно пройти полное обследование:
-
Анализ крови на обнаружение онкомаркеров. Определяет наличие веществ, которые характерны для того или иного типа железистого рака.
-
Исследование крови в лаборатории (биохимический и общий анализ). Способствует выявлению нарушения в работе внутренних органов.
-
Рентген. С его помощью специалисты могут обнаружить метастазы.
-
Анализ мочи.
 Выявляет процессы воспаления.
Выявляет процессы воспаления. -
Биопсия. Сбор тканей опухоли для исследования в лаборатории.
-
УЗИ. С его помощью медики изучают ткани зараженного органа и ближайшие к нему лимфатические узлы. Затем выявляется опухоль и устанавливается её размер.
-
Сцинтиграфия. Врачи используют этот метод визуализации, который заключается в том, что в организм вводят радиоактивные изотопы, а затем получают двумерное изображение. Это помогает находить воспалительные процессы.
Какие есть методы лечения аденокарциномы?
После полного обследования врачи выбирают нужную в конкретном случае методику лечения аденокарциномы.
+ Метод один из самых дешевых
– Остается довольно большой шрам.
-
Лапароскопическое удаление.
 Операция выполняется с помощью пары небольших разрезов (до двух см). Щипцами удаляются ткани, которые поражены. Процесс контролируется прибором с камерой.
Операция выполняется с помощью пары небольших разрезов (до двух см). Щипцами удаляются ткани, которые поражены. Процесс контролируется прибором с камерой.
+ Шрамы почти незаметны. Реабилитация проходит быстрее в полтора раза, чем при открытой операции.
– Стоимость данного метода больше открытой операции.
-
Эндоскопическое удаление. Специалисты удаляют новообразования на начальных стадиях с помощью эндоскопа. При удалении используется трубка с камерой и щипцы. Они вводятся в тело через естественные отверстия.
+ Никаких шрамов.
– Опухоли больших размеров не поддаются удалению.
-
Лучевая терапия (радиотерапия). Злокачественные клетки уничтожают радиацией. При предоперационном облучения главное — это уменьшить опухоль. При послеоперационном главное — это убрать раковые клетки, которые остались.
 Вместо операции лучевую терапию назначают при небольших опухолях.
Вместо операции лучевую терапию назначают при небольших опухолях.
-
Удаление опухоли роботизированной системой Кибер-нож. Проводится радиохирургическая операция. Это означает, что аденокарциному удаляют без разрезов на теле. Точность воздействия — 99,6%.
-
Радиойодтерапия. Используется при нескольких видах аденокарциномы щитовидки. При этом уничтожаются оставшиеся злокачественные клетки. Терапия подразумевает пероральное принятие пациентом капсулы с радиойодом.
-
Фокусированная ультразвуковая абляция. Основное воздействие происходит через ультразвук. Назначают на ранних стадиях стадиях железистого рака простаты, почки, груди, печени и мочевого пузыря.
Какие последствия лечения аденокарциномы? Как проходит реабилитация?
Последствия аденокарциномы довольно ситуационны. Часто после завершения лечения возникает спад в весе, анемия и слабость, а также нарушается работа пищеварения и ранее зараженного органа.
Часто после завершения лечения возникает спад в весе, анемия и слабость, а также нарушается работа пищеварения и ранее зараженного органа.
Для того, чтобы ускорить реабилитацию, постарайтесь не перенапрягаться, уходить от стрессовых ситуаций. Специалисты советуют хорошо отдыхать и придерживаться здоровой диеты, назначенной врачом.
Уменьшение вероятности появления аденокарциномы (железистого рака) поможет следующее:
-
Проходить полное обследование каждый год;
-
Добавлять физические нагрузки;
-
Придерживаться здорового питания;
-
Проходить обследования два раза в год, если аденокарциному обнаружили у родственников;
-
Проходить профилактику заболеваний, которые передаются половым путем.
Таблица 1.
 Международная гистологическая классификация (2010) / КонсультантПлюс
Международная гистологическая классификация (2010) / КонсультантПлюсПлоскоклеточные опухоли | ||
Плоскоклеточная интраэпителиальная неоплазия (дисплазия) (high grade) | ||
Плоскоклеточный рак | ||
Базалоидный плоскоклеточный рак | ||
Аденосквамозный рак | ||
Веретеноклеточный (плоскоклеточный) рак | ||
Веррукозный (плоскоклеточный) рак | ||
Недифференцированный рак с плоскоклеточным компонентом (при наличии любого плоскоклеточного компонента классифицируется и стадируется как плоскоклеточный рак) | ||
Аденокарцинома | ||
Железистая дисплазия (неоплазия) (high grade) | ||
Аденокарцинома | ||
Аденокистозный рак | ||
Мукоэпидермоидный рак | ||
Смешанная аденонейроэндокринная карцинома | ||
Недифференцированный рак с железистым компонентом (при полном отсутствии плоскоклеточного компонента и наличии железистого компонента классифицируется и стадируется как аденокарцинома) | ||
Другие гистологические типы (подлежат стадированию по TNM, но не группируются в прогностические группы) | ||
Нейроэндокринная опухоль (NET) G1, карциноид | ||
Нейроэндокринная опухоль (NET) G2 | ||
Нейроэндокринный рак (NEC) | ||
Крупноклеточный нейроэндокринный рак | ||
Мелкоклеточный нейроэндокринный рак | ||
Степень дифференцировки опухоли, G | Плоскоклеточный рак | Аденокарцинома |
Степень дифференцировки опухоли не может быть оценена | ||
G1 – высоко дифференцированная | Наблюдаются признаки ороговения опухолевых клеток с формированием роговых жемчужин, цитологические признаки атипии минимальные. Митотическая активность низкая | > 95% опухоли представлено хорошо сформированными железами |
G2 – умеренно-дифференцированная | Наиболее частый подтип. Представляет собой промежуточный вариант. Характеризуется большим разнообразием признаков. Обычно роговые “жемчужины” отсутствуют. Четкие критерии не установлены | 50 – 95% опухоли представлено железами и железисто-подобными структурами. Наиболее частый подтип |
G3 – низкодифференцированная | Представляет собой отдельные гнезда базально-подобных клеток, часто с центральным некрозом. Гнезда имеют вид булыжной мостовой с редкими включениями клеток с признаками ороговения. Необходимо избегать необоснованной диагностики недифференцированного рака | Опухоль преимущественно состоит из гнезд и слоев опухолевых клеток. Железисто-подобные структуры составляют менее 50% опухоли |
В настоящее время в развитых странах отмечается снижение заболеваемости плоскоклеточными формами рака пищевода и увеличивается заболеваемость аденокарциномой. По данным Американского канцер регистра, с 1980 по 1990 г. заболеваемость аденокарциномой пищевода удвоилась. Наиболее частой морфологической формой в России является плоскоклеточный рак, реже аденокарцинома (в основном, в дистальной части пищевода и пищеводно-желудочном переходе). Крайне редко встречаются карциносаркома, мелкоклеточный рак и меланома.
По данным Американского канцер регистра, с 1980 по 1990 г. заболеваемость аденокарциномой пищевода удвоилась. Наиболее частой морфологической формой в России является плоскоклеточный рак, реже аденокарцинома (в основном, в дистальной части пищевода и пищеводно-желудочном переходе). Крайне редко встречаются карциносаркома, мелкоклеточный рак и меланома.
Локализация опухоли устанавливается относительно эпицентра роста, однако при планировании лечения необходимо учитывать верхнюю и нижнюю границы опухолевого поражения.
Опухоли пищеводно-желудочного перехода (C16.0) с эпицентром роста выше Z-линии, на уровне Z-линии и до 2,0 см ниже от Z-линии классифицируются и стадируются как рак пищевода (Siewert I – II). Опухоли пищеводно-желудочного перехода (C16.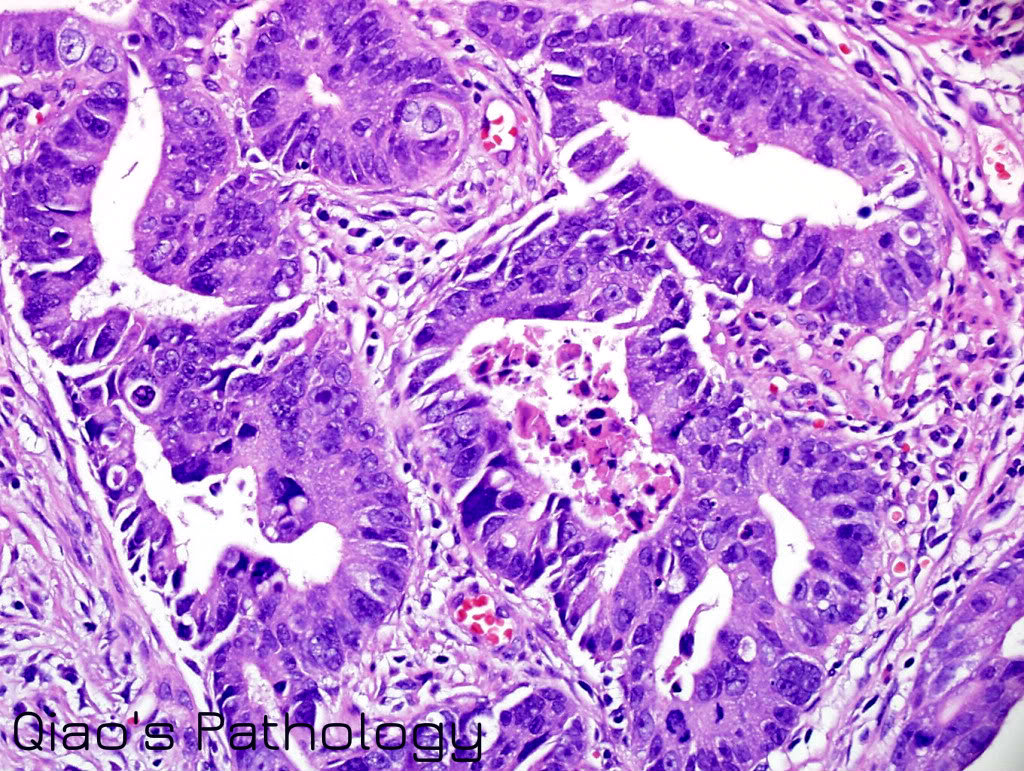 0) с эпицентром роста дистальнее 2 см от Z-линии (Siewert III) классифицируются и стадируются как рак желудка вне зависимости от вовлечения в опухолевый процесс самого пищеводно-желудочного перехода.
0) с эпицентром роста дистальнее 2 см от Z-линии (Siewert III) классифицируются и стадируются как рак желудка вне зависимости от вовлечения в опухолевый процесс самого пищеводно-желудочного перехода.
Открыть полный текст документа
Рак желудка у пациента с хроническим лимфолейкозом | Майер
Введение
Рак желудка — злокачественная опухоль, которая развивается из эпителия слизистой оболочки желудка. Это одна из самых распространенных злокачественных опухолей, уступая лишь раку легких у мужчин и раку молочной железы у женщин. Каждый год в РФ регистрируют около 39 тыс. новых случаев рака желудка и более 34 тыс. больных умирает от этого заболевания [1].
Хронический лимфолейкоз — одно из наиболее распространенных онкогематологических заболеваний. Также это наиболее частый вариант лейкоза среди представителей европеоидной расы. По непонятным причинам редко встречается среди населения стран Восточной Азии.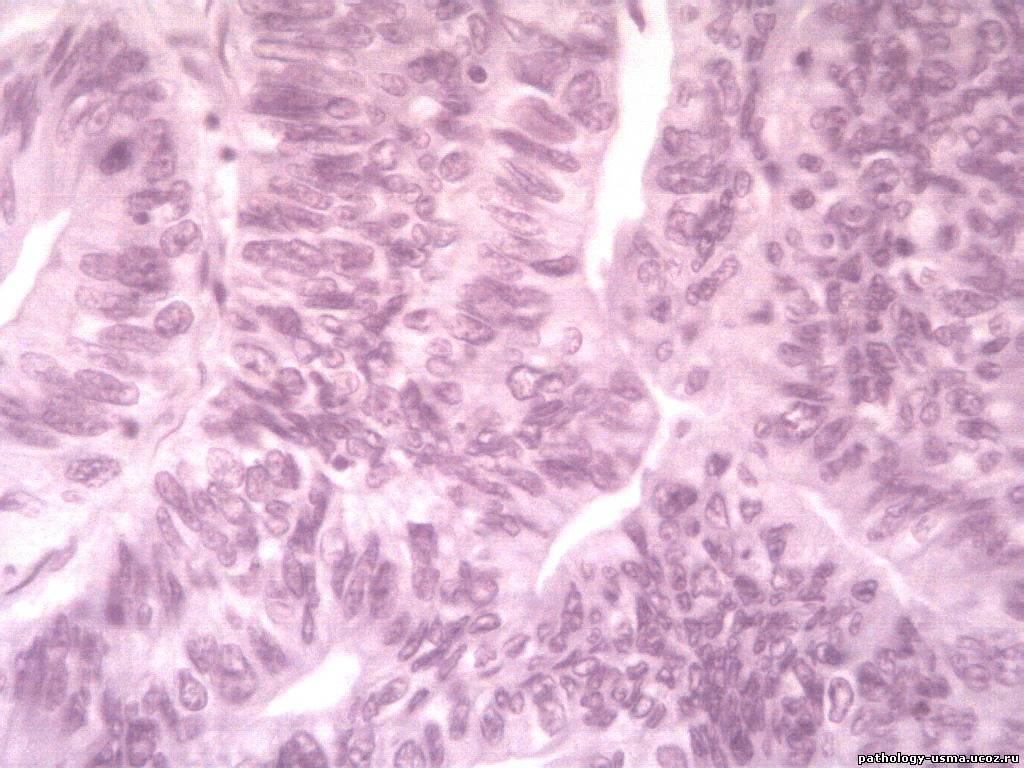 Дебют заболевания происходит в пожилом возрасте — медианный возраст на момент постановки диагноза составляет 70-72 года. Мужчины болеют в 1,5-2 раза чаще, чем женщины [2, 3]. Стандартом терапии являются химиотерапевтические режимы с включением нуклеотидных аналогов, алкилирующих препаратов и моноклональных антител. Один из наиболее эффективных режимов — FCR (англ. fludarabine, cyclophosphamide, rituximab) [4].
Дебют заболевания происходит в пожилом возрасте — медианный возраст на момент постановки диагноза составляет 70-72 года. Мужчины болеют в 1,5-2 раза чаще, чем женщины [2, 3]. Стандартом терапии являются химиотерапевтические режимы с включением нуклеотидных аналогов, алкилирующих препаратов и моноклональных антител. Один из наиболее эффективных режимов — FCR (англ. fludarabine, cyclophosphamide, rituximab) [4].
Рак желудка, который развивается у пациента с ХЛЛ, может быть обусловлен иммунологическими нарушениями, а также быть связан с другими этиологическими факторами, такими как инфекция Helicobacter pylori, курение и другие причины. В свою очередь, снижение иммунокомпетентности при хроническом лимфолейкозе (ХЛЛ) является, скорее всего, причиной более частого развития новых опухолей, чем в соответствующей возрастной популяции, не имеющей ХЛЛ в анамнезе [5, 6]. Актуальность данного клинического случая заключается в том, что существует высокий риск развития злокачественного новообразования у пациентов с хроническим лимфолейкозом.
Материалы и методы
Пациент И., 1955 года рождения, поступает в плановом порядке в Клинику БГМУ 27.08.18 г. на очередной курс химиотерапии с жалобами на выраженную слабость. Из анамнеза известно, что пациент болеет хроническим лимфолейкозом стадии В по Binet в течение двух лет (диагноз установлен в 2016 г.). Пациент наблюдался у врача- гематолога по месту жительства, лечение не получал.
Анализ пунктата костного мозга (29.06.16 г.):
Клетки | Результат | Норма |
|---|---|---|
Кол-во миелокариоцитов | 150 000 | (50,0-150,0)х109/л |
Кол-во мегакариоцитов | 12 | (0,023-0,103)х109/л |
Миелобласты | 2,0 | 0,2-1,7 % |
Нейтр. миелоциты | 5.0 | 7,0-12,2 % |
Нейтр. | 5,0 | 12,8-23,7 % |
Нейтр. сегментоядерные | 9,5 | 13,1-24,1 % |
Лимфоциты | 71,5 | 4,3-13,7 % |
Нормоб. полихроматофильные | 4,5 | 8,9-16,9 % |
Нормоб. оксифильные | 3,5 | 0,8-5,6 % |
Заключение: КМП нормоклеточный, мегакариоцитарный росток деятельный, миелоидный и эритроцитарный ростки сужены. Увеличено количество лимфоцитов.
ОАК с лейкоформулой от 29.06.16 г.:
Клетки | Результат |
|---|---|
WBC | 45,9х109/л |
RBC | 4,95х10,2/л |
HGB | 147 г/л |
HCT | 45,5 % |
PLT | 173х109/л |
NE | 7,9 % |
LY | 90,2 % |
LY | 86х109/л |
NE | 3,6х109/л |
Неоднократно получал курсы химиотерапии (ХТ) согласно клиническим рекомендациям по лечению хронического лимфолейкоза в Клинике БГМУ (09-19. 06.18). Схема терапии FCR: Флударабин 70 мг 2-4-й день ХТ, Эндоксан 500 мг 2-4-й день цикла, Ритуксимаб 700 мг 1-й день ХТ. 23.07-02.08.18, схема терапии: FCR [7, 8]. Объективно на 27.08.18 г.: состояние удовлетворительное, сознание ясное, видимые слизистые бледно-розовые, чистые. Лимфатические узлы не увеличены. Отеков нет. Органы дыхания: аускультативно дыхание везикулярное, хрипов нет. ЧДД 16 в мин. Сердечно-сосудистая система: тоны сердца ритмичные, приглушены, патологические шумы не выслушиваются, АД 110/60 мм рт. ст., пульс 64 в мин., ЧСС 64 в мин. Органы пищеварения: язык чистый, влажный, живот мягкий, безболезненный, печень увеличена на 4 см, желчный пузырь не пальпируется, перистальтика кишечника выслушивается, симптомы раздражения брюшины отрицательные. Кал обычного цвета, обычной консистенции. Диурез адекватный, моча светло-желтого цвета.
06.18). Схема терапии FCR: Флударабин 70 мг 2-4-й день ХТ, Эндоксан 500 мг 2-4-й день цикла, Ритуксимаб 700 мг 1-й день ХТ. 23.07-02.08.18, схема терапии: FCR [7, 8]. Объективно на 27.08.18 г.: состояние удовлетворительное, сознание ясное, видимые слизистые бледно-розовые, чистые. Лимфатические узлы не увеличены. Отеков нет. Органы дыхания: аускультативно дыхание везикулярное, хрипов нет. ЧДД 16 в мин. Сердечно-сосудистая система: тоны сердца ритмичные, приглушены, патологические шумы не выслушиваются, АД 110/60 мм рт. ст., пульс 64 в мин., ЧСС 64 в мин. Органы пищеварения: язык чистый, влажный, живот мягкий, безболезненный, печень увеличена на 4 см, желчный пузырь не пальпируется, перистальтика кишечника выслушивается, симптомы раздражения брюшины отрицательные. Кал обычного цвета, обычной консистенции. Диурез адекватный, моча светло-желтого цвета.
Проведены исследования:
Общий анализ крови (день | поступления) 27.08.18 г.: |
|---|---|
Клетки | Результат |
WBC | 49х109/л |
RBC | 4,05х1012/л |
HGB | 97 г/л |
HCT | 29,7 % |
PLT | 402х109/л |
LYM | 87,7 % |
LYM | 43х109/л |
СОЭ | 7 мм/ч |
На УЗИ органов брюшной полости 28. 08.18 г.: печень +30 мм за счет обеих долей, структура неоднородная, желчный пузырь среднего объема, селезенка 142×66 мм, структура без особенностей, поджелудочная железа обычных размеров, контуры четкие. На ФГС 28.08.18 г.:
08.18 г.: печень +30 мм за счет обеих долей, структура неоднородная, желчный пузырь среднего объема, селезенка 142×66 мм, структура без особенностей, поджелудочная железа обычных размеров, контуры четкие. На ФГС 28.08.18 г.:
Катаральный эзофагит. Дилятация кардии. Субатрофический гастрит. Bl кардиоэзофагеальной зоны? Биопсия. Верификация диагноза по гистологии. Гистологическое заключение от 31.08.18 г.: умеренно дифференцированная аденокарцинома желудка с тенденцией к ослизне- нию, инфильтративный рост, с эрозированием.
Общий анализ крови (день выписки) 03.09.18 г.:
Клетки | Результат |
|---|---|
WBC | 2,6х109/л |
RBC | 3,98х10,2/л |
HGB | 93 г/л |
HCT | 28,2 % |
PLT | 272х109/л |
LYM | 26,4 % |
LYM | 0,7х109/л |
СОЭ | 3 мм/ч |
Проведена химиотерапия по схеме FCR (Флударабин 70 мг 2-4-й день ХТ, Эндоксан 500 мг 2-4-й день цикла, Ритуксимаб 700 мг 1-й день ХТ).
Рекомендована повторная госпитализация 24.09.18 г. в онкологическое отделение Клиники БГМУ для решения вопроса о тактике лечения с учетом выявленной аденокарциномы желудка совместно с хирургами.
25.09.18 г. Пациенту И. проведен курс химиотерапии по схеме FCR (Флударабин 70 мг 2-4-й день ХТ, Эндоксан 500 мг 2-4-й день цикла, Ритуксимаб 700 мг 1-й день ХТ). Консультирован профессором, д.м.н. М. В. Тимербулатовым по поводу Bl тела желудка. Рекомендовано оперативное лечение в плановом порядке, назначен контроль общего анализа крови на 15.10.18 г. с последующим решением вопроса о дате операции (резекция желудка в связи с Bl тела желудка).
ОАК (день поступления) 24.09.18 г.:
Клетки | Результат |
|---|---|
WBC | 4,4х 109/л |
RBC | 3,95х1012/л |
HGB | 94 г/л |
HCT | 27,9 % |
PLT | 244х109/л |
LYM | 20 % |
LYM | 0,8х 109/л |
СОЭ | 7 мм/ч |
Результаты
29. 10.18 г. Пациент И. поступает в плановом порядке в онкологическое отделение Клиники БГМУ на оперативное лечение по поводу Bl тела желудка.
10.18 г. Пациент И. поступает в плановом порядке в онкологическое отделение Клиники БГМУ на оперативное лечение по поводу Bl тела желудка.
ОАК (день поступления) 29.10.18 г.:
Клетки | Результат |
|---|---|
WBC | 3,5х109/л |
RBC | 4,03х1012/л |
HGB | 93 г/л |
HCT | 27,8 % |
PLT | 225х109/л |
LYM | 13,2 % |
LYM | 0,4х109/л |
СОЭ | 7 мм/ч |
Проведена МРТ органов брюшной полости (ОБП) с контрастированием 02.10.18 г. По данным МРТ: Т-r желудка (в кардиальном отделе желудка по малой кривизне на широком основании массивное 65x44x40 мм объемное образование по типу цветной капусты, несколько неоднородной структуры, наружный контур желудка в области основания образования неровный, втянут, в него впадает множество извитых, расширенных артерий), данных за mts не получено.
Проведена диагностическая лапароскопия 30.10.18 г. При ревизии ОБП петли тонкой кишки без патологических изменений. По малой кривизне кардиального отдела желудка с переходом в нижнюю треть пищевода определяется опухоль размерами до 5,0 см. По большой кривизне и по малой кривизне визуализируются увеличенные лимфатические узлы. Произведена резекция соответствующих лимфатических узлов. Материал взят на гистологическое исследование. Решением консилиума врачей рекомендовано провести операцию по результатам гистологического исследования. Было принято решение об изменении объема операции. Проведена КТ ОБП 02.11.18 г. (рис. 1-3). По КТ: объемное образование желудка (не исключается его распространение на область абдоминального отдела пищевода). Оперативное лечение (гастрэктомия) 06.11.18 г.: лапароскопическая гастрэктомия с резекцией пищевода с формированием анастомоза по Ру (рис. 4, 5). Гистологическое заключение: Высокодифференцированная аденокарцинома желудка с ослизнением, прорастанием всех слоев стенки (на фоне хронического лимфопролиферативного заболевания). Элементы опухоли представлены в сальнике.
Элементы опухоли представлены в сальнике.
Рисунок 1. Объемное образование в кардиальном отделе желудка по типу цветной капусты (коронарная плоскость)
Figure 1. Bulky tumour of the cauliflower type in the cardiac section of the stomach (coronal plane)
Рисунок 2. Объемное образование в кардиальном отделе желудка по типу цветной капусты (сагиттальная плоскость)
Figure 2. Bulky tumour of the cauliflower type in the cardiac section of the stomach (sagittal plane)
Рисунок 3. Объемное образование в кардиальном отделе желудка по типу цветной капусты после введения контрастного вещества (аксиальная плоскость)
Figure 3. Bulky tumour of the cauliflower type in the cardiac section of the stomach following the contrast agent injection (axial plane)
Рисунок 4. Резецированный пищевод с формированием анастомоза по Ру (коронарная плоскость)
Figure 4. Resected esophagus with the Roux anastomosis (coronal plane)
Resected esophagus with the Roux anastomosis (coronal plane)
Рисунок 5. Резецированный пищевод с формированием анастомоза по Ру (сагиттальная плоскость)
Figure 5. Resected esophagus with the Roux anastomosis (sagittal plane)
Рентгенография органов грудной клетки (ОГК) 07.11.18 г.: легкие без очагово-инфильтративных изменений.
УЗИ плевральных синусов и брюшной полости 08.11.18 г.: в правом плевральном синусе 400-500 мл свободной жидкости, в левом 200-300 мл свободной жидкости. В брюшной полости и малом тазу свободная жидкость не визуализируется, петли тонкой кишки не растянуты. Перистальтика сохранена.
Рентгенография ОБП 17.11.18 г.: по левому флангу брюшной полости единичные чаши Клойбера. Свободный газ в брюшной полости не определяется.
ОАК (день выписки) 17.11.18 г.:
Клетки | Результат |
|---|---|
WBC | 2х109/л |
RBC | 3,7х10,2/л |
HGB | 84 г/л |
HCT | 24,7 % |
PLT | 280х109/л |
LYM | 16,1 % |
LYM | 0,7х109/л |
СОЭ | 4 мм/ч |
На данный момент пациент проходит курс реабилитации, очередной курс химиотерапии запланирован после стабилизации состояния.
Обсуждение
Была проанализирована история болезни пациента мужчины И. 63 лет, которому с июня 2016 г. установлен диагноз хронический лимфолейкоз. В августе 2018 г. проходил очередной курс химиотерапии, проведена ФГС, по результатам гистологического исследования выявлена аденокарцинома желудка, однако жалоб со стороны желудочно-кишечного тракта не было, беспокоила только слабость, потери массы тела не было. Также была проведена МРТ органов брюшной полости с контрастированием, где обнаружено объемное образование желудка. В октябре 2018 г. проведена диагностическая лапароскопия, выполнена резекция лимфатических узлов, которые в последующем были направлены на гистологическое исследование. Принято решение об оперативном лечении рака желудка. В ноябре 2018 г. проведена лапароскопическая гастрэктомия с резекцией пищевода, были обнаружены метастазы в сальнике. Рак желудка установлен через 26 месяцев после постановки диагноза «хронический лимфолейкоз». Закономерность это или следствие, остается вопросом.
Анализируя данный клинический случай, можно сделать вывод, что ХЛЛ может приводить к различным иммунологическим нарушениям, которые, в свою очередь, повышают риск развития злокачественного новообразования. Необходимо учитывать, что высокий уровень миелосупрессии отмечается и при стандартной внутривенной FCR, а также тот факт, что средний возраст пациентов с ХЛЛ в настоящее время составляет 72 года, также необходимо рассматривать гематологическую токсичность в качестве основной проблемы, и особенно у пожилых пациентов с ХЛЛ [9, 10]. Закономерность локализации раковых поражений при лейкозах отмечается в статистическом материале Mersheimer, Ringel и Eisenberg. Из 57 случаев лейкозов, сочетавшихся с карциномами, последние в 38,7 % располагались в пищеварительной, в 15,8 % — в мужской половой системе, в 14 % — на коже, в 8,8 % — в женской половой системе, в 7,1 % — в дыхательной, в 5,3 % — в мочевой системе, в 3,6 % — в кроветворной и лимфатической ткани, в 3,5 % — в молочной железе и в 3,5 % — в органах других систем. Также имеются данные о времени возникновения рака по отношению к сроку установления диагноза лейкоза: диагноз злокачественной опухоли и лейкоза был установлен одновременно в 43,9 % случаев, с интервалом от 1 до 6 месяцев — в 14 %, от 7 до 12 месяцев — в 1,8 %, от 13 до 18 месяцев — в 5,3 %, от 19 до 24 месяцев — в 3 %, от 25 до 36 месяцев — в 5,3 %, от 37 до 48 месяцев — в 8,8 %, от 49 до 60 месяцев — в 1,8 %, от 61 до 120 месяцев — в 10,5 % и более 120 месяцев — в 5,3 % случаев.
Также имеются данные о времени возникновения рака по отношению к сроку установления диагноза лейкоза: диагноз злокачественной опухоли и лейкоза был установлен одновременно в 43,9 % случаев, с интервалом от 1 до 6 месяцев — в 14 %, от 7 до 12 месяцев — в 1,8 %, от 13 до 18 месяцев — в 5,3 %, от 19 до 24 месяцев — в 3 %, от 25 до 36 месяцев — в 5,3 %, от 37 до 48 месяцев — в 8,8 %, от 49 до 60 месяцев — в 1,8 %, от 61 до 120 месяцев — в 10,5 % и более 120 месяцев — в 5,3 % случаев.
Эти данные интересны тем, что они дают определенное представление о наиболее частых интервалах в сроках диагностирования данных патологических процессов. Более половины синхронных поражений составляют сочетания, диагностированные одновременно (без интервала) и с промежутком 1—6 месяцев. Примерно такое же, но несколько меньшее число сочетаний могут рассматриваться как метахронные, при этом наблюдается некоторое нарастание числа больных по мере увеличения интервала [11, 12]. Это подтверждает и наш клинический случай.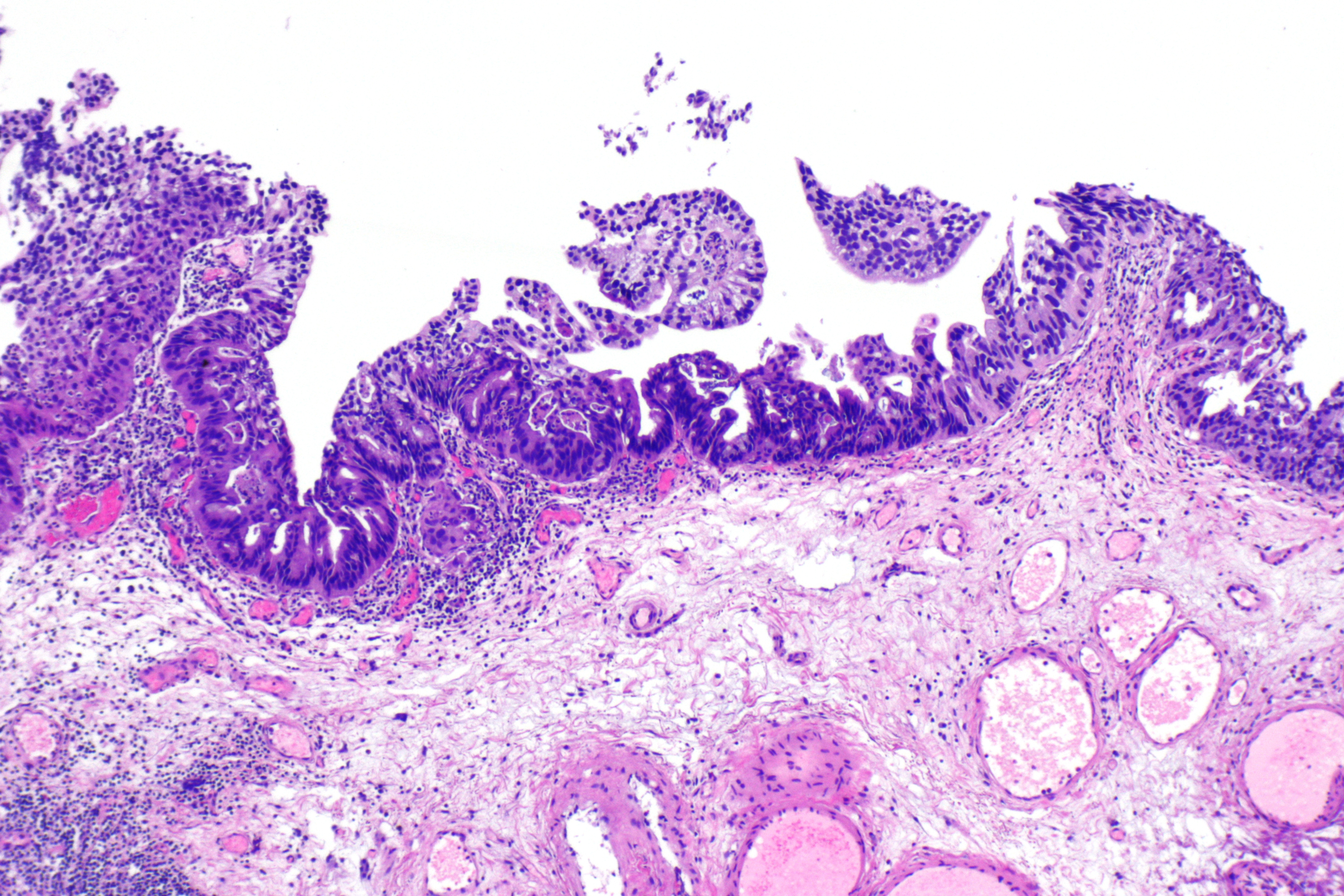 Можно предположить, что ХЛЛ является причинным фактором развития карциномы желудка у пациента И. Также можно предположить, что фактором, предрасполагающим развитие злокачественной опухоли желудка у пациента с ХЛЛ, могло быть иммуносупрессивное состояние. В работе Stacher, Bohnel обсуждался вопрос, является ли одновременное возникновение лейкемии и злокачественных опухолей случайным совладением или проявлением одного и того же патогенетического механизма. Из 285 больных хроническим лимфолейкозом у 11 (3,9 %) одновременно обнаружили злокачественные опухоли. На основании изучения соотношения между временем возникновения хронического лимфолейкоза, опухоли и метастазов этих больных разделили на 3 группы. Первая группа — сначала возникает лимфолейкоз, затем опухоль и метастазы. Вторая группа — сначала возникает лимфолей- коз, затем наступает спонтанная ремиссия к моменту выявления опухоли. Третья группа — устанавливается злокачественная опухоль, которая радикально удаляется, через различные промежутки времени после операции развивается лимфолейкоз, протекающий доброкачественно; отсутствуют метастазы опухоли.
Можно предположить, что ХЛЛ является причинным фактором развития карциномы желудка у пациента И. Также можно предположить, что фактором, предрасполагающим развитие злокачественной опухоли желудка у пациента с ХЛЛ, могло быть иммуносупрессивное состояние. В работе Stacher, Bohnel обсуждался вопрос, является ли одновременное возникновение лейкемии и злокачественных опухолей случайным совладением или проявлением одного и того же патогенетического механизма. Из 285 больных хроническим лимфолейкозом у 11 (3,9 %) одновременно обнаружили злокачественные опухоли. На основании изучения соотношения между временем возникновения хронического лимфолейкоза, опухоли и метастазов этих больных разделили на 3 группы. Первая группа — сначала возникает лимфолейкоз, затем опухоль и метастазы. Вторая группа — сначала возникает лимфолей- коз, затем наступает спонтанная ремиссия к моменту выявления опухоли. Третья группа — устанавливается злокачественная опухоль, которая радикально удаляется, через различные промежутки времени после операции развивается лимфолейкоз, протекающий доброкачественно; отсутствуют метастазы опухоли. Авторы отмечают, что в случаях поражения лимфатической системы (лимфолейкоз) течение злокачественной опухоли стремительное, с более ранним появлением метастазов. Отсюда ясно, что все случаи спонтанных ремиссий при лимфолейкозе заставляют особенно тщательно обследовать больного с целью выявления злокачественной опухоли [13, 14, 15].
Авторы отмечают, что в случаях поражения лимфатической системы (лимфолейкоз) течение злокачественной опухоли стремительное, с более ранним появлением метастазов. Отсюда ясно, что все случаи спонтанных ремиссий при лимфолейкозе заставляют особенно тщательно обследовать больного с целью выявления злокачественной опухоли [13, 14, 15].
Заключение
Таким образом, на примере клинического случая и обзора доступной литературы продемонстрировано, что причинными факторами развития аденокарциномы желудка могли послужить либо ХЛЛ, либо иммуносупрессивное состояние.
Наличие аденокарциномы желудка у пациентов с хроническим лимфолейкозом значительно осложняет течение и исход основного заболевания. Решение относительно тактики ведения пациентов принимается каждый раз индивидуально с учетом тяжести онкологического заболевания и влияет на выбор схемы проводимой терапии. При этом все случаи спонтанных ремиссий при лимфолейкозе должны сопровождаться расширенным скринингом в отношении ранней диагностики злокачественных новообразований.
1. Torre L.A., Bray F., Siegel R.L., Ferlay J., Lortet-Tieulent J., Jemal A. Global cancer statistics, 2012. CA Cancer J Clin. 2015;65(2):87–108. DOI: 10.3322/caac.21262
2. Kipps T.J., Stevenson F.K., Wu C.J., Croce C.M., Packham G., Wierda W.G., et al. Chronic lymphocytic leukaemia. Nat Rev Dis Primers. 2017;(3):16096. DOI: 10.1038/nrdp.2016.96
3. Scarfò L., Ferreri A.J., Ghia P. Chronic lymphocytic leukaemia. Crit Rev Oncol Hematol. 2016;104:169–82. DOI: 10.1016/j.critrevonc.2016.06.003
4. Schinasi L.H., De Roos A.J., Ray R.M., Edlefsen K.L., Parks C.G., Howard B.V., et al. Insecticide exposure and farm history in relation to risk of lymphomas and leukemias in the Women’s Health Initiative observational study cohort.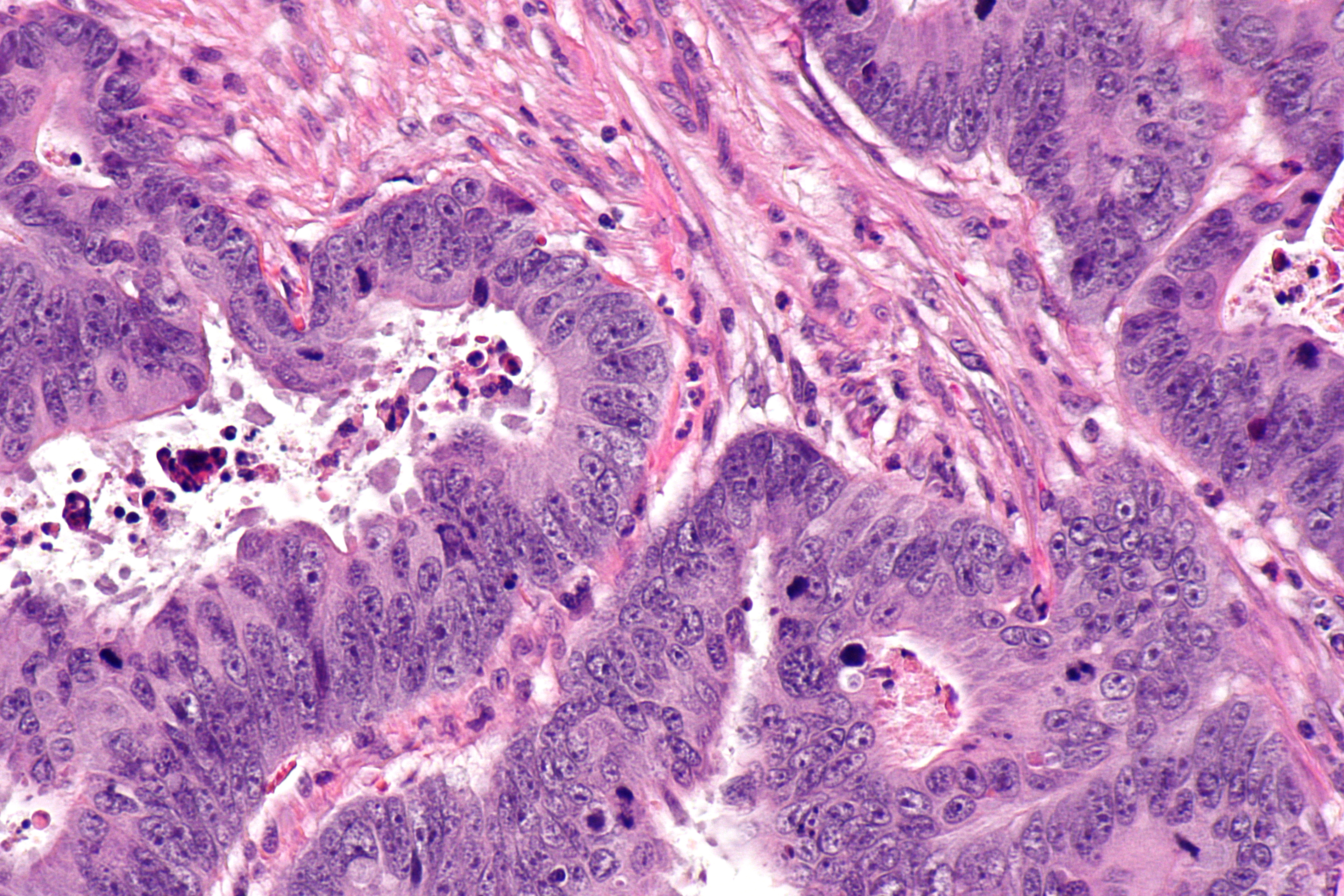 Ann Epidemiol. 2015;25(11):803–10. DOI: 10.1016/j.annepidem.2015.08.002
Ann Epidemiol. 2015;25(11):803–10. DOI: 10.1016/j.annepidem.2015.08.002
5. Абдурахманов Д.Т., Абузарова Г.Р., Агеева Т.А., Алексеев С.М., Аль-Ради Л.С., Асланиди И.П. и др. Российские клинические рекомендации по диагностике и лечению лимфопролиферативных заболеваний. М.; 2018. 356 с.
6. Takizawa J., Rinsho Ketsueki. Chronic lymphocytic leukemia: pathophysiology and current therapy. 2017;58(5):471–79. DOI: 10.11406/ rinketsu.58.471
7. Gozzetti A., Defina M., Fabbri A. Myelosuppression after frontline fludarabine, cyclophosphamide, and rituximab in patients with chronic lymphocytic leukemia: analysis of persistent and new-onset cytopenia. Cancer. 2014;120(3):451–2. DOI: 10.1002/cncr.28443
8. Tees M.T., Flinn I.W. Chronic lymphocytic leukemia and small lymphocytic lymphoma: two faces of the same disease. Expert Rev Hematol. 2017;10(2):137–46. DOI: 10.1080/17474086.2017.1270203
Tees M.T., Flinn I.W. Chronic lymphocytic leukemia and small lymphocytic lymphoma: two faces of the same disease. Expert Rev Hematol. 2017;10(2):137–46. DOI: 10.1080/17474086.2017.1270203
9. Савченко В.Г., Поддубная И.В. (ред.) Клинические рекомендации по обследованию и лечению больных хроническим лимфолейкозом. М.; 2014. 23 с.
10. Alkharabsheh O., Saadeh S.S., Patnaik M.S., Alkhateeb H., Gangat N., Begna K.H., et al. Impact of clone size with a single cytogenetic abnormality on the revised International Prognostic Scoring System in myelodysplastic syndromes. Am J Hematol. 2018;93(12):E398–E401. DOI: 10.1002/ajh.25287
11. Zheng G., Chattopadhyay S., Sud A., Sundquist K., Sundquist J., Försti A., et al. Second primary cancers in patients with acute lymphoblastic, chronic lymphocytic and hairy cell leukaemia. Br J Haematol. 2019;185(2):232–9. DOI: 10.1111/bjh.15777
Br J Haematol. 2019;185(2):232–9. DOI: 10.1111/bjh.15777
12. Chaabouni H., Kacem K., Zriba S., Mansouri R., Ghédira H., Lakhal R.B., et al. Solid tumors after chronic lymphocytic leukemia patients: Report of six cases and review of the literature. Gulf J Oncolog. 2015;1(19):28–32. PMID: 26499827
13. Montoro J., Pomares H., Villacampa G., Merchán B., Molero A., Alonso E., et al. Dichotomization of the new revised international prognostic scoring system for a better clinical stratification of patients with myelodysplastic syndromes. Leuk Lymphoma. 2018;(30):1–6. DOI: 10.1080/10428194.2018.1542151
14. Mangal M., Sudharsanan S., Elamurugan T.P., Jagdish S. Gastric carcinoma in a patient with chronic lymphocytic leukemia: coincidence or consequence? Cureus. 2018;10(4):e2405. DOI: 10.7759/ cureus.2405
2018;10(4):e2405. DOI: 10.7759/ cureus.2405
15. Steensma D.P. Myelodysplastic syndromes current treatment algorithm 2018. Blood Cancer J. 2018;8(5):47. DOI: 10.1038/s41408- 018-0085-4
Умеренно дифференцированная аденокарцинома : причины, симптомы, диагностика, лечение
Симптомы умеренно дифференцированной аденокарциномы
Симптомы умеренно дифференцированной аденокарциномы зависят от локализации опухоли и стадии ее развития. Поражения различных органов и систем имеют характерные и даже схожие симптомы. Рассмотрим основные проявления болезни при поражении таких органов:
- Поджелудочная железа – резкое снижение массы тела, тяжесть после приема пищи, боль в животе (верхние отделы), желтизна кожных покровов, изменение стула.
- Желудок – тошнота, рвота, метеоризм, расстройство стула, снижение массы тела, тяжесть в желудке, отсутствие аппетита.
 Если опухоль увеличивается, то появляются неприятные ощущения после приема пищи, нарушения пищевых привычек, флегмона желудка, малокровие, перитонит.
Если опухоль увеличивается, то появляются неприятные ощущения после приема пищи, нарушения пищевых привычек, флегмона желудка, малокровие, перитонит. - Кишечник – боли ноющего характера в животе, общая слабость, боли при акте дефекации, кровь и слизь в каловых массах, повышенная температура тела, снижение аппетита и массы тела.
- Нос и глотка – онкология схожа с гипертрофией миндалин, поэтому требует дифференциальной диагностики. Пациенты страдают от неприятных ощущений в глотке, болях при глотании, которые отдают в ухо. При росте опухоли увеличиваются лимфатические узлы, и нарушается речь.
Умеренно дифференцированная аденокарцинома прямой кишки
Умеренно дифференцированная аденокарцинома прямой кишки чаще всего встречается у мужчин, как и другие поражения желудочно-кишечного тракта. Рак поражает ампулу прямой кишки выше сфинктера. Если он метастазирует, то поражает простату, мочевой пузырь, мочеиспускательный канал, матку и влагалище. На поздних стадиях распространяется в печень, легкие и кости.
Симптомы:
- Боли (тянущие, ноющие) и затруднения при дефекации.
- Слизь после и до испражнения.
- Примеси гноя и крови в кале.
- Метеоризм.
- Длительные запоры и поносы.
- Отсутствие аппетита.
- Резкая потеря веса.
- Расстройство сна.
На первых порах возникает раздражение стенок кишечника, что приводит к частым и ложным позывам – тенезмам. Дефекация становится затруднительной, вздутие не проходит, появляются постоянные тянущие боли, так как кишечник полностью не опорожняется.
Диагностика затруднена, поскольку ранние стадии недуга схожи с симптомами геморроя. Определяют ее с помощью пальцевой пальпации, копрологического и гистологического исследований. Прогноз полностью зависит от ранней диагностики, так как на поздних стадиях болезнь тяжело поддается лечению.
Умеренно дифференцированная аденокарцинома матки
Умеренно дифференцированная аденокарцинома матки представляет собой опухоль из клеток эндометрия, то есть внутреннего слоя органа, которая распространяется глубоко в ткани. Диагностировать заболевание сложно, так как нередко первые симптомы появляются на поздних стадиях. Женщина начинает терять вес, появляются нетипичные зловонные выделения и постоянные боли внизу живота. Пациентки страдают от ломоты спины и ног, резких болей в момент полового акта. Зачастую онкология дает о себе знать в период менопаузы, поэтому женщины старше 50 лет наиболее подвержены данному недугу. При прогрессировании, рак метастазирует в ближайшие органы, в том числе и кости.
Диагностировать заболевание сложно, так как нередко первые симптомы появляются на поздних стадиях. Женщина начинает терять вес, появляются нетипичные зловонные выделения и постоянные боли внизу живота. Пациентки страдают от ломоты спины и ног, резких болей в момент полового акта. Зачастую онкология дает о себе знать в период менопаузы, поэтому женщины старше 50 лет наиболее подвержены данному недугу. При прогрессировании, рак метастазирует в ближайшие органы, в том числе и кости.
Измененных клеток при данном типе патологии не много. Но наблюдается их увеличение (удлинение и увеличение ядер). Лечение зависит от стадии рака и возраста пациентки. Если опухоль не метастазирует и сосредоточена в полости матки, то пациентке проводят удаление органа и придатков. Если рак поразил мышечный слой, то удаляют и регионарные лимфатические узлы, чтобы предотвратить рецидивы. При поражении метастазами других органов хирургическое вмешательство не проводится. В данном случае пациентке назначают курс радиотерапии в комплексе с химиотерапией.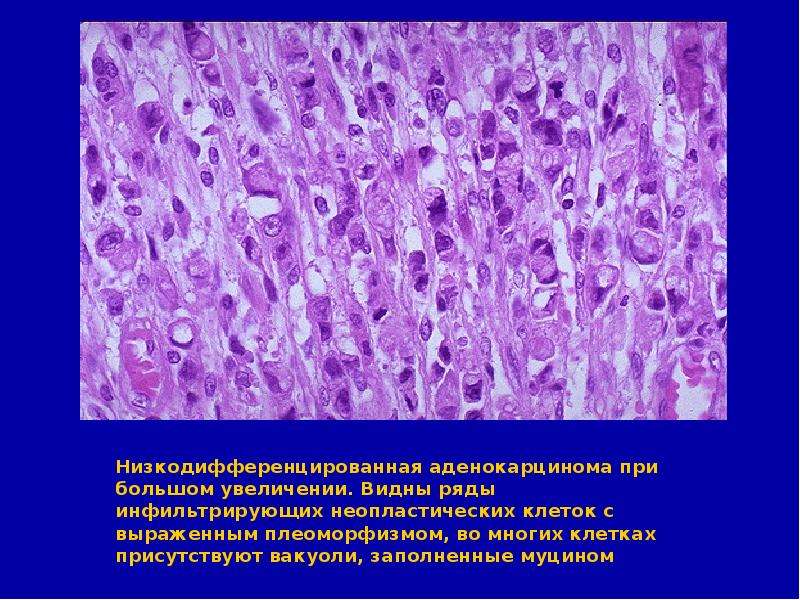 При рецидивах проводят полихимиотерапию.
При рецидивах проводят полихимиотерапию.
Умеренно дифференцированная аденокарцинома желудка
Умеренно дифференцированная аденокарцинома желудка одна из часто диагностированных раковых опухолей. Ранние стадии плохо поддаются диагностике, так как на первых порах недуг протекает практически бессимптомно. Некоторые врачи связывают развитие болезни с наличием в желудке у пациента спиралевидной бактерии (хеликобактер пилори). Рак может появиться на фоне ослабленного иммунитета, гастрита, язвы или из-за неправильного питания. Главная особенность аденокарциномы в том, что она метастазирует в соседние органы и регионарные лимфоузлы еще на ранних стадиях.
Выделяют ряд факторов, которые повышают риск развития болезни. Прежде всего, это возраст пациентов от 40-50 лет, злоупотребление алкоголем и курение, наследственная предрасположенность, питание с обилием соли и консервантов, плохая экология.
Симптомы:
- Изменение вкусовых ощущений.
- Резкая потеря веса и рост объема живота.

- Тошнота и рвота.
- Повышенная слабость.
- Болезненные ощущения в области живота и желудка.
- Кровь в стуле, метеоризм.
Раковое поражение желудка различают по типу строения преобладающего компонента. То есть опухоль бывает высоко, умеренно и низкодифференцированной. Умеренный тип является промежуточным. Основное лечение – это хирургическое удаление желудка и лимфатических узлов. Для предупреждения рецидивов проводят химиотерапию и лучевую терапию. Если такое лечение не приносит положительных результатов, то больному назначают поддерживающие симптоматическое лечение.
Прогноз на выздоровление зависит от степени поражения и стадии. Так, если недуг был обнаружен на первой стадии, то выживаемость на уровне 60-80%. На последней стадии выживаемость пациентов составляет не более 5%. Поскольку болезнь, как правило, обнаруживают на поздних стадиях, средняя жизнь пациентов в возрасте до 50 лет – до 10 лет, а у пациентов старшего возраста – до 5 лет.
Умеренно дифференцированная аденокарцинома эндометрия
Умеренно дифференцированная аденокарцинома эндометрия нередко развивается на фоне гиперплазии или эстрогенной стимуляции. Опухоль состоит из трубчатых желез, выстланных псевдостратифицированным или ратифицированным эпителием. Умеренная дифференциация или вторая гистопатологическая степень вызывает скопление желез волнистого или разветвленного вила и уменьшение их просвета. Клеточные ядра имеют неправильную форму и гиперхромные. В редких случаях опухоль содержит клетки с богатой липидами цитоплазмой.
Прогноз зависит от морфологических особенностей онкологии, то есть гистологической степени опухоли, глубины инвазии, распространения на лимфоузлы, шейку матки, придатки и положительные смывы с брюшины. Если рак развивается на фоне гиперплазии, то имеет благоприятный прогноз, так как в большинстве случаев аденокарцинома высокодифференцированная или умеренного типа. В качестве лечения показано хирургическое удаление пораженного органа.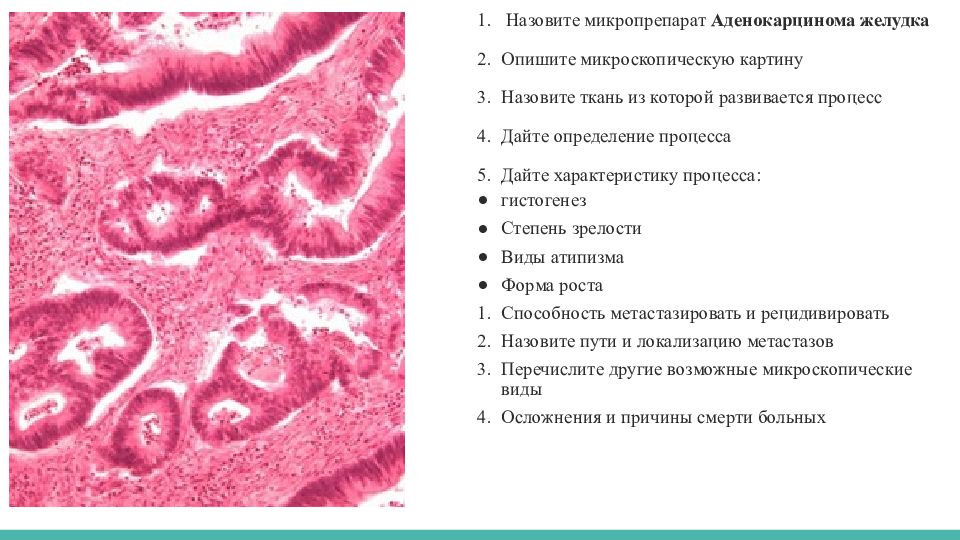 При рецидивах пациентам назначают гормонотерапию и поддерживающее лечение.
При рецидивах пациентам назначают гормонотерапию и поддерживающее лечение.
Умеренно дифференцированная аденокарцинома сигмовидной кишки
Умеренно дифференцированная аденокарцинома сигмовидной кишки является промежуточным этапом между раком высокой и низкой степени дифференцировки. Опухоль состоит из измененных по структуре клеток со средним уровнем патогенности. Если дифференциация высокая, то новообразование растет медленно и редко дает метастазы. В этом случае рак хорошо поддается лечению, имеет положительный прогноз на выздоровление и редко рецидивирует. Если клетки малодифференцированы, то сложно определить начальную точку развития. В этом случае операция может стать причиной метастазирования.
Диагностика основана на жалобах пациента. Врач проводит аппаратное исследование, осмотр и пальпацию. Симптомы размыты и их часто путают с поражениями толстого кишечника. Для более детального исследования используется ректороманоскоп. С помощью данного аппарата удается осмотреть внутренние органы, распознать сомнительные новообразования и взять материал на биопсию. Еще один популярный метод выявления патологий – колоноскопия. С ее помощью можно провести осмотр всей сигмовидной кишки.
Еще один популярный метод выявления патологий – колоноскопия. С ее помощью можно провести осмотр всей сигмовидной кишки.
Независимо от степени и тяжести онкологии, основной метод лечения – хирургическое вмешательство и химиотерапия. Поскольку аденокарцинома растет медленно, то опухоль редко метастазирует. Если недуг обнаружен на ранних стадиях и есть возможность оперативного вмешательства, то это дает высокие шансы на полное излечение.
Умеренно дифференцированная аденокарцинома толстой кишки
Умеренно дифференцированная аденокарцинома толстой кишки находится на четвертом месте среди онкологических поражений организма. Рак развивается из тканей эпителия и метастазирует через лимфу, поэтому высокие шансы на выздоровления есть только на ранних стадиях. Но обнаружить новообразование в начале патологического процесса практически невозможно.
Выделяют ряд предрасполагающих факторов, повышающих риск развития болезни. К ним относится наследственность, пожилой возраст пациентов, неправильное питание, нервные стрессы, работа во вредных условиях, длительные запоры, анальный секс и папилломавирусная инфекция.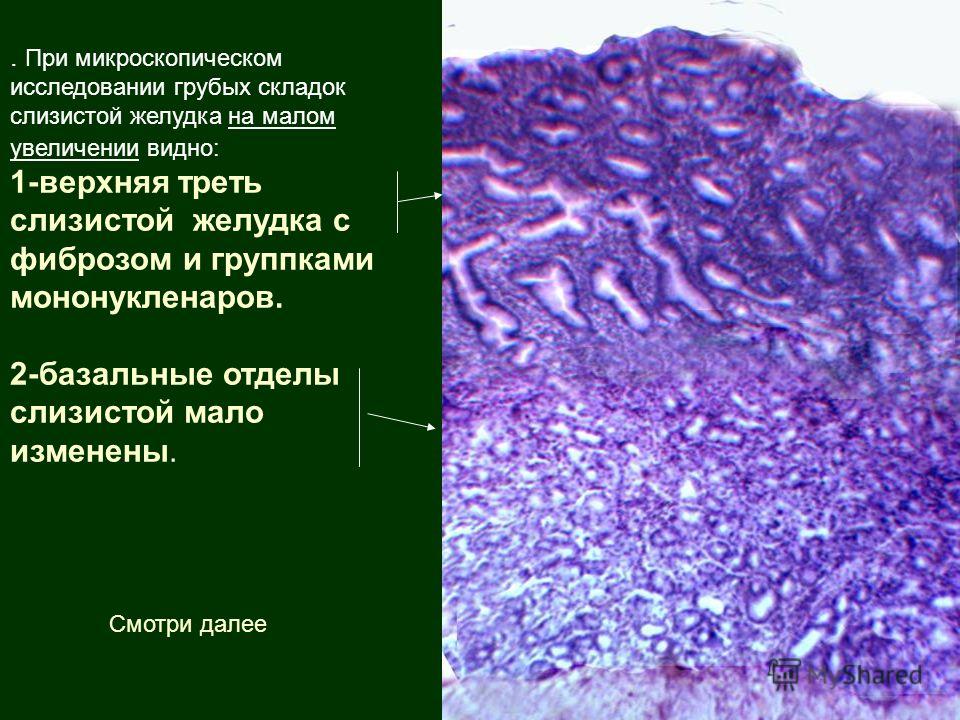 Токсическое воздействие различных химических веществ и препаратов, хронические свищи, полипы, колиты и другие поражения толстой кишки, также могут вызвать рак.
Токсическое воздействие различных химических веществ и препаратов, хронические свищи, полипы, колиты и другие поражения толстой кишки, также могут вызвать рак.
Основная сложность лечения состоит в том, что клетки дифференцируются только на последних стадиях, то есть длительное время продолжают рост в неопределенной форме. Это существенно осложняет диагностику и выбор методики лечения. Умеренный тип ракового поражения толстой кишки плохо поддается лечению, так как нет возможности подобрать эффективный химиопрепарат. Его лечат с помощью оперативного вмешательства и точечного облучения. Если болезнь обнаружили на 1-2 стадии, то прогноз выживаемости хороший. На 3-4 стадии проводится иссечение пораженного участка и установление колостомы.
Умеренно дифференцированная аденокарцинома желудка
Умеренно дифференцированная аденокарцинома желудка встречается часто и в большинстве случаев поражает антральный и пилорический отделы. Чаще всего болезнь вызывает длительное употребление продуктов с высоким содержанием нитритов. В процессе расщепления данные вещества разрушают слизистую оболочку, на фоне чего формируется новообразование. Еще один важный фактор развития опухоли – это наследственная предрасположенность и возраст пациентов после 55 лет.
В процессе расщепления данные вещества разрушают слизистую оболочку, на фоне чего формируется новообразование. Еще один важный фактор развития опухоли – это наследственная предрасположенность и возраст пациентов после 55 лет.
Зачастую новообразование появляется у мужчин, которые перенесли различные заболевания желудочно-кишечного тракта. На начальных стадиях пациенты жалуются на тошноту, резкую потерю веса, расстройства стула, метеоризм, боль в эпигастральной области и пищеварительной системе. Появление таких симптомов указывает на утрату желудком эластичности и требует срочной медицинской помощи. Вторичными симптомами выступают постоянные боли в животе, стул черного цвета и рвота.
Лечение проводят только хирургическим путем. В зависимости от стадии, объем операции может быть разным. На ранних стадиях проводят резекцию, если опухоль пустила отдаленные метастазы и поразила практически весь орган, то проводится паллиативная операция. Главная цель такого лечения – это облегчение состояния пациента и обеспечение возможности питания. Для предупреждения метастазирования проводится курс лучевой терапии и химиотерапии.
Для предупреждения метастазирования проводится курс лучевой терапии и химиотерапии.
Умеренно дифференцированная аденокарцинома предстательной железы
Умеренно дифференцированная аденокарцинома предстательной железы – это злокачественное новообразование, поражающее ткани органа и метастазирующее по всему организму. В большинстве случаев опухоль возникает в периферической зоне, но в 15% случаев поражает центральную и переходную области. Существует группа риска по развитию недуга, в нее входят мужчины старше 60 лет и люди с наследственной предрасположенностью. Но неправильное питание, возрастные гормональные изменения, наличие вируса XMRV и дисбаланс нутриентов, также могут спровоцировать рост опухоли.
Для диагностики используют пальцевое ректальное и трансректальное исследования предстательной железы. Обязательным является определение простатоспецифического антигена, биопсия, магнитно-резонансная томография и остеосцинтиграфия. Своевременное выявление опухоли позволяет провести радикальную терапию, предотвращающую рецидивы и метастазирование.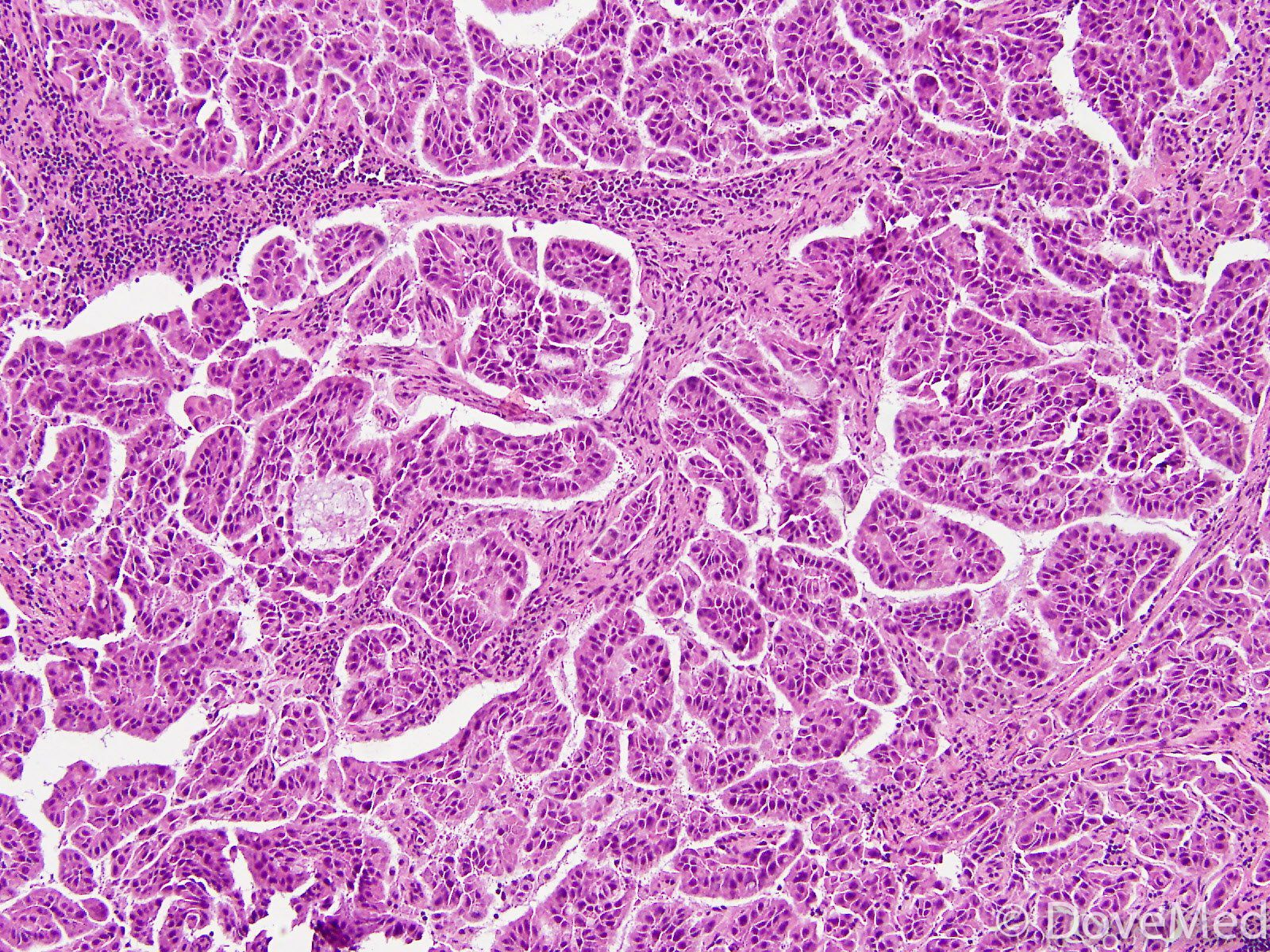 Выбор метода лечения зависит от стадии и места локализации новообразования, возраста пациента и наличия сопутствующих заболеваний. Для этих целей использую гормональную терапию, оперативное вмешательство, лучевую терапию и химиотерапию.
Выбор метода лечения зависит от стадии и места локализации новообразования, возраста пациента и наличия сопутствующих заболеваний. Для этих целей использую гормональную терапию, оперативное вмешательство, лучевую терапию и химиотерапию.
Умеренно дифференцированная аденокарцинома легкого
Умеренно дифференцированная аденокарцинома легкого относится к наиболее распространенному виду немелкоклеточного рака. На данный вид опухоли приходится около 40% случаев поражения легких. Новообразование формируется из бокаловидных крупных бронхов и протекает практически бессимптомно. Первым признаком недуга является обильная мокрота.
Диагностируют болезнь с помощью рентгенограммы. У 65% пациентов выявляют периферическую круглую тень, которая указывает на наличие новообразования. Как правило, опухоль располагается центрально, в редких случаях патологический процесс прорастает в плевральную полость и грудную стенку. Больному необходимо сдать анализы крови, анализ мокроты, а также пройти биопсию легкого и бронхоскопию.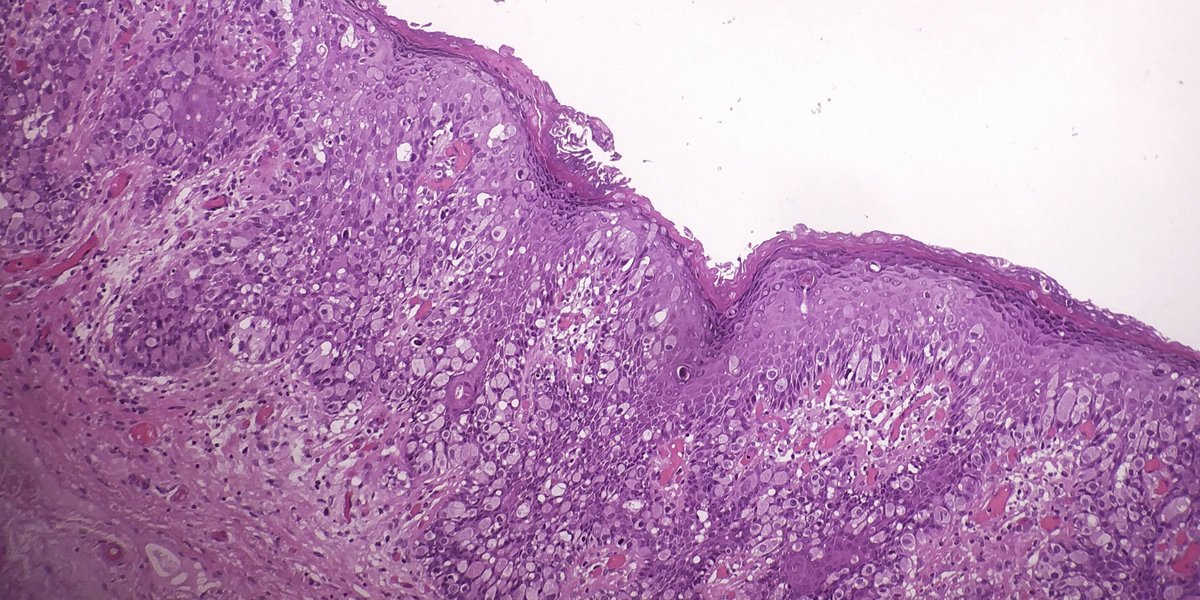 Данные методы помогут установить степень поражения и стадию рака. Основываясь на полученные данные, врач составляет план лечения.
Данные методы помогут установить степень поражения и стадию рака. Основываясь на полученные данные, врач составляет план лечения.
Если болезнь обнаружили на ранней стадии, то для лечения используют радиохирургию (кибернож) или хирургическое вмешательство. В качестве операции показана клиновидная резекция, пневмонэктомия или лобэктомия. Если операция невозможна, то для подавления роста злокачественных клеток применяют лучевую терапию и химиотерапию. При данном заболевании прогноз неблагоприятный, менее 10% больных выживают в течение 10 лет после постановки диагноза.
Умеренно дифференцированная аденокарцинома ободочной кишки
Умеренно дифференцированная аденокарцинома ободочной кишки встречается очень редко. На данное заболевание приходится около 6% всех случаев болезни. В группу риска попадают мужчины в возрасте от 50-60 лет. При этом язвенный колит, аденома или диффузный полипоз рассматриваются как предопухолевые состояния. Симптоматика и клиническая картина на ранних стадиях смазана. Только при тщательном осмотре удается выявить изменения самочувствия и снижение трудоспособности. Данный вид онкологии не вызывает резкую потерю веса, а наоборот пациенты могут поправляться.
Только при тщательном осмотре удается выявить изменения самочувствия и снижение трудоспособности. Данный вид онкологии не вызывает резкую потерю веса, а наоборот пациенты могут поправляться.
Симптомы:
- Сильное урчание кишечника.
- Частые схваткообразные боли в области живота.
- Чередование запоров и поносов.
- Неравномерное вздутие живота из-за сужения просвета ободочной кишки при росте опухоли.
- Кишечная непроходимость и сильные кровотечения.
- Воспалительные осложнения в виде абсцесса, перитонита или флегмоны.
При диагностике используют внешний осмотр и сбор анамнеза. Но при осмотре не всегда удается выявить признаки рака. Только если опухоль достигает больших размеров у очень худых пациентов, ее удается прощупать руками через стенку брюшины. Особое значение имеет рентгенологическое исследование. Для этих целей больному вводят в организм контрастный раствор бария. В некоторых случаях исследуется рельеф слизистой на фоне воздуха в ее просвете. Пациентам необходимо сдать анализ кала для выявления в нем крови и карциноэмбриональных антигенов. Для исключения наличия метастазов проводится ультразвуковая томография печени.
Пациентам необходимо сдать анализ кала для выявления в нем крови и карциноэмбриональных антигенов. Для исключения наличия метастазов проводится ультразвуковая томография печени.
Лечение предполагает комплекс из химиотерапии и радикального хирургического удаления. Существует несколько вариантов операционного вмешательства. Основываясь на анализы, состояние пациента и стадию опухоли, подбирается лучший вариант. Рецидивы наблюдаются очень редко, а если возникают, то из-за некорректно выполненной операции. Онкология дает метастазы по лимфатическим путям, поражая группу узлов по ходу брюшной аорты. Прогноз напрямую зависит от стадии рака, если метастазов нет, то прогноз благоприятный.
Умеренно дифференцированная аденокарцинома слепой кишки
Умеренно дифференцированная аденокарцинома слепой кишки считается самым распространенным опухолевым поражением кишечника. В группу риска входят люди 50-60 лет, но в редких случаях рак появляется в молодом возрасте. Выделяют ряд предраковых поражений слепой кишки: проктосигмоидит, хронические проктиты, ворсинчатые и аденоматозные полипы. При этом полипы имеют самый высокий риск преобразования в злокачественное новообразование.
При этом полипы имеют самый высокий риск преобразования в злокачественное новообразование.
Рак может возникнуть из-за нерационального питания, когда в рационе недостаточно пищи растительного содержания, а преобладает углеводная и богатая жирами еда. Стрессы, хронические запоры, наследственная предрасположенность и вредные условия труда, также относятся к факторам вызывающим недуг. В некоторых случаях возможно сочетание нескольких факторов одновременно.
Симптомы:
- Систематические ноющие боли.
- Плохой аппетит и резкая потеря веса.
- Повышенная температура и слабость.
- Слизь, кровь и гной в каловых массах.
- Чередование поносов и запоров.
- Метеоризм и боли при дефекации.
- Побледнение кожных покровов.
Основной метод лечения – оперативное вмешательство. Как правило, используют лапароскопию, что позволяет удалить новообразование без вскрытия полости. Для защиты здоровых тканей применяют точечное введение химических препаратов и прицельную лучевую терапию. Прогноз напрямую зависит от того на какой стадии недуг был обнаружен и как прошло лечение.
Прогноз напрямую зависит от того на какой стадии недуг был обнаружен и как прошло лечение.
Умеренный тип аденокарциномы по своему течению является сложным заболеванием, которое может повлечь серьезные последствия. Разросшиеся злокачественные клетки могут закрыть просвет в кишке и вызвать непроходимость кишечника. Если опухоль достигает больших размеров, то может прорвать стенку кишечника и вызвать кровотечение. На поздних стадиях рак поражает близлежащие органы, формирует свищи и ухудшает прогноз на выздоровления и жизнь.
Умеренно дифференцированная аденокарцинома поджелудочной железы
Умеренно дифференцированная аденокарцинома поджелудочной железы возникает в 90% случаев ракового поражений органа. Недуг широко распространен среди мужчин 50-60 лет и характеризуется высокой летальностью. Успех выздоровления полностью зависит от ранней диагностики.
Болезнь может формироваться на фоне сахарного диабета, курения, длительного воздействия на организм химических канцерогенов. Наследственная предрасположенность, различного рода генетические мутации, заболевания органов желчевыводящей системы, хронический панкреатит, употребление кофе и пищи с высоким содержанием животных жиров, увеличивают риск развития болезни.
Наследственная предрасположенность, различного рода генетические мутации, заболевания органов желчевыводящей системы, хронический панкреатит, употребление кофе и пищи с высоким содержанием животных жиров, увеличивают риск развития болезни.
Симптомы:
- Болезненные ощущения в эпигастральной области, иррадиирующие в спину.
- Резкое снижение массы тела.
- Желтушность кожных покровов и слизистых оболочек.
- Тошнота, рвота, диарея.
- Общая слабость и повышенная температура.
- Определение новообразования в брюшной полости при пальпации.
Для диагностики используют ультразвуковое исследование, компьютерную томографию, биопсию, различные анализы крови, ангиографию, а также эндоскопическую ретроградную холангиопанкреатографию. Для лечения пациенту проводят радикальное хирургическое вмешательство, а также комплекс из лучевого облучения и химиотерапии.
Умеренно дифференцированная аденокарцинома с изъязвлением
Умеренно дифференцированная аденокарцинома с изъязвлением чаще всего поражает желудок, пищевод и прямую кишку. Подобного рода патологии по праву считаются осложнениями злокачественного новообразования. Многие предраковые заболевания способствуют их появлению. Лечение осложняется, так как перед хирургической операцией требуется несколько курсов химиотерапии или лучевого облучения.
Если изъязвление поражает прямую кишку, то в качестве терапии используют чрезбрюшную резекцию. Операция считается сфинктеросохраняющей, так как удаляют только пораженный аденокарциномой участок, а остальную кишку соединяют аппаратным анастомозом. В любом случае лечение онкологии – это длительный и требующий терпения процесс. Прогноз зависит от своевременной диагностики, выбранного метода лечения и возраста пациента.
Долгосрочное выживание аденокарциномы желудка без терапии: отчет о болезни
Oman Med J. 2010 Oct; 25 (4): 303–305.
От отделения внутренней медицины и онкологии, Больница Короля Фахда Университета, Аль-Хобар, Королевство Саудовская Аравия.
* Адрес для переписки и перепечатки: доктору Али М. Аль-Амри, доктору медицины, отдел внутренней медицины и онкологии, больница Университета имени короля Фахда, Аль-Хобар 31952, а / я 40182, Королевство Саудовская Аравия.Электронная почта: moc.liamtoh@94irmailaПоступила 14 июня 2010 г .; Принято 9 августа 2010 г.
Эта статья цитируется в других статьях в PMC.Abstract
Планирование лечения аденокарциномы желудка у пациента, ранее получавшего частичную гастрэктомию по поводу первичной лимфомы желудка, затруднено. Долгосрочная выживаемость аденокарциномы желудка на поздних стадиях является низкой при лечении и даже хуже без лечения. Единственным потенциально излечивающим методом лечения аденокарциномы желудка является хирургическая резекция с адекватными границами.Паллиативная хирургия улучшает симптомы примерно у 50% пациентов. Химиотерапия может играть меньшую роль. В этом отчете представлен случай аденокарциномы желудка у пациента, перенесшего первичную лимфому желудка, которому была проведена частичная резекция желудка. Через 6 лет после постановки диагноза пациент все еще жив без признаков прогрессирования, несмотря на то, что активного лечения не проводилось.
Введение
Рак желудка остается второй ведущей причиной смерти от рака во всем мире. Прогноз умеренно улучшился за последние годы, но общая выживаемость все еще очень низкая.Единственным потенциально излечивающим подходом для пациентов с раком желудка остается раннее выявление и радикальная хирургическая резекция с лечебной целью. Общая 5-летняя выживаемость колеблется от почти нуля для пациентов с метастатическим заболеванием до почти пятидесятипроцентной выживаемости для пациентов с ранней операбельной аденокарциномой желудка.1 – 6 У пациентов с локализованной аденокарциномой желудка 5-летняя выживаемость составляет примерно только 10%. 1-6 В целом, долгосрочное выживание тесно связано со стадией заболевания и его анатомическим расположением.7 , 8
История болезни
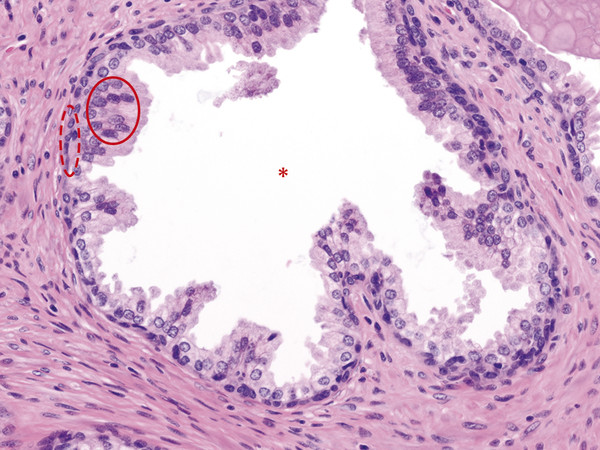
50-летнему мужчине в 1994 году был поставлен диагноз первичной лимфомы желудка I стадии. Затем ему была проведена хирургическая резекция в форме субтотальной резекции желудка и анастомоза Билрота. В мае 2004 г. контрольная эндоскопия показала частичную резекцию желудка с гастритом, вызванным желчной кислотой, и множественные преанастомотические полипы, вероятно, злокачественные. Биопсия желудка и области анастомоза показала результаты, соответствующие хроническому активному гастриту и хорошо дифференцированной аденокарциноме I.()
H&E показывает хорошо дифференцированную аденокарциному слизистой оболочки желудка I степени.
Эндоскопия и биопсия были повторены в марте 2005 г. и ноябре 2005 г. Гистопатологические данные соответствовали хорошо дифференцированной аденокарциноме I степени желудка. Не было обнаружено Helicobacter pylori . Злокачественные клетки были положительными на цитокератин (ЦК). ()
Демонстрирует положительную иммунореактивность (диффузную и гомогенную) опухолевых клеток с ЦК.
В период наблюдения у пациента не было никаких симптомов, и его масса тела поддерживалась на уровне 62 кг. Компьютерная аксиальная томография (CAT) грудной клетки и брюшной полости не выявила признаков метастатического поражения. Маркеры опухолей, включая СЕА, СА125, СА199 и СА153, были нормальными. CBC, RFT и LFT также были нормальными.
В день 1 мая 2004 г. с пациентом были обсуждены варианты лечения, включая наблюдение с наилучшей поддерживающей терапией, хирургическое вмешательство, паллиативную химиотерапию или направление для получения второго медицинского заключения.Пациент отказался от любых операций или химиотерапии. Пациент выбрал наблюдение и регулярное наблюдение.
В марте 2010 года пациент прошел обследование в онкологической клинике, у него не было никаких симптомов. Аппетит нормальный, масса тела 62,5 кг.
Обсуждение
Гистопатологический тип карциномы желудка включает хорошо и плохо дифференцированную аденокарциному, гепатоидную аденокарциному и плоскосквамозную карциному. У указанного пациента гистопатология показала хорошо дифференцированную аденокарциному I степени на момент обращения и умеренно дифференцированную аденокарциному II степени во время последнего посещения через 5 лет после первого посещения.
Единственной возможностью лечебного лечения больных аденокарциномой желудка остается хирургическая резекция со свободными краями. Пациенты пожилого возраста или пациенты, перенесшие ранее операцию на желудке, имеют более высокий уровень послеоперационной смертности. У неопытных пациентов с карциномой желудка только 50% подвергаются резекции желудка из-за запущенного заболевания, а у 60% будет местный или отдаленный рецидив. Кроме того, только 30-50% из тех, кто подвергается обследованию, добиваются хирургической резекции с лечебной целью.6 , 9 В одном исследовании общая выживаемость варьировала от одного месяца до 142,5 месяцев, однако менее 5% пациентов с аденокарциномой желудка IV стадии доживают до 3 лет. химиотерапия улучшает качество жизни (КЖ) с незначительными преимуществами выживаемости по сравнению с лучшим поддерживающим лечением.11 – 13 Среднее время выживания пациентов с запущенной аденокарциномой желудка все еще остается менее одного года.14 Лишь немногие пациенты выжили в течение длительного периода времени, превышающего пять лет (2%), при активном терапевтическом вмешательстве14.
У нашего пациента не проявляются симптомы, у него нормальный аппетит, и его масса тела сохраняется в течение шести лет. В течение этого периода аденокарцинома желудка оставалась локальным заболеванием без признаков метастазирования; однако аденокарцинома прогрессировала с I степени до аденокарциномы II степени. Причины, по которым у этого пациента было местное злокачественное заболевание без прогрессирования в течение пяти лет, могут быть связаны с предыдущими эффектами хирургической резекции на сосудистые и лимфатические пути.Во-вторых, могло случиться так, что злокачественное заболевание затронуло только поверхностную слизистую. Однако причина не ясна. В настоящее время следует знать о столь необычных клинических течениях рака желудка, при которых прогноз может существенно отклоняться от средней нормы по неизвестным причинам.
Заключение
В этом отчете представлен феноменальный случай аденокарциномы желудка у живого пациента без признаков метастазирования через шесть лет после постановки диагноза без какой-либо активной терапии.
Благодарности
Автор сообщил об отсутствии конфликта интересов и финансирования этой работы.
Ссылки
1. Ли В.Дж., Ли В.К., Хунг С.Дж., Шун С.Т., Хоунг Р.Л., Ли П.Х. и др. Выживаемость после резекции рака желудка и прогностическая значимость систематической лимфодиссекции: двадцатилетний опыт работы на Тайване. World J Surg 1995. сентябрь-октябрь; 19 (5): 707-713 10.1007 / BF00295910 [PubMed] [CrossRef] [Google Scholar] 2. Каннингем С.К., Камангар Ф., Ким М.П., Хаммуд С., Хак Р., Майтра А. и др.Выживаемость после резекции аденокарциномы желудка: восемнадцатилетний опыт работы в одном учреждении. J Gastrointest Surg 2005. Май-июнь; 9 (5): 718-725 10.1016 / j.gassur.2004.12.002 [PubMed] [CrossRef] [Google Scholar] 3. Du pont BJ Jr, Cohn I Jr. Аденокарцинома желудка. Curr Probl Cancer 1980; 4: 1-46 [PubMed] [Google Scholar] 4. Faivre J, Forman D, Esteve J, Gatta G. Выживание пациентов с раком пищевода и желудка в Европе. Eur J Cancer 1998; 34: 2167-2175. 10.1016 / S0959-8049 (98) 00329-3 [PubMed] [CrossRef] [Google Scholar] 5.Тойер С.П., Куросаки Т., Зиогас А., Батлер Дж., Антон-Калвер Х. Азиатские пациенты с карциномой желудка в Соединенных Штатах демонстрируют уникальные клинические особенности и превосходные показатели общей и специфической выживаемости при раке. Рак 2000. Ноябрь; 89 (9): 1883-1892 10.1002 / 1097-0142 (20001101) 89: 9 <1883 :: AID-CNCR3> 3.3.CO; 2-8 [PubMed] [CrossRef] [Google Scholar] 6 . Hundahl SA, Phillips JL, Menck HR. Отчет Национальной базы данных по раку о плохой выживаемости пациентов с карциномой желудка в США, получавших гастрэктомию: Пятое издание Американского объединенного комитета по стадированию рака, проксимальному заболеванию и гипотезе «другого заболевания».Рак 2000. Февраль; 88 (4): 921-932 10.1002 / (SICI) 1097-0142 (20000215) 88: 4 <921 :: AID-CNCR24> 3.3.CO; 2-J [PubMed] [CrossRef] [Google Ученый] 7. Бедикян А.Ю., Чен Т.Т., Ханханян Н., Хейлбрун Л.К., МакБрайд С.М., МакМертри М.Дж. и др. Естественная история рака желудка и прогностические факторы, влияющие на выживаемость. J Clin Oncol 1984. Apr; 2 (4): 305-310 [PubMed] [Google Scholar] 8. Рис Л.А., Косари С.Л., Хэнки Б.Ф., Миллер Б.А., Харрас А., Эдвардс Б.К. Обзор статистики рака SEER 1973-1994, Национальный институт рака, публикация NIH No.97-2789. Bethesda: Департамент здравоохранения и социальных служб, 1997. [Google Scholar] 9. Ajani JA. Развивающаяся химиотерапия при распространенном раке желудка. Онколог 2005; 10 (Дополнение 3): 49-58 10.1634 / теонколог.10--49 [PubMed] [CrossRef] [Google Scholar] 10. Heemskerk VH, Lentze F, Hulsewé KW, Hoofwijk TG. Карцинома желудка: обзор результатов лечения в общественной клинической больнице. World J Surg Oncol 2007; 5: 81 10.1186 / 1477-7819-5-81 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 11.Уотерс Дж. С., Норман А., Каннингем Д., Скарф Дж. Х., Уэбб А., Харпер П. и др. Долгосрочная выживаемость при раке желудка после применения эпирубицина, цисплатина и фторурацила: результаты рандомизированного исследования. Br J Cancer 1999. Apr; 80 (1-2): 269-272 10.1038 / sj.bjc.66 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 12. Pyrhönen S, Kuitunen T., Nyandoto P, Kouri M. Рандомизированное сравнение фторурацила, эпидоксорубицина и метотрексата (FEMTX) плюс поддерживающая терапия с поддерживающей терапией только у пациентов с неоперабельным раком желудка.Br J Cancer 1995. Mar; 71 (3): 587-591 [Бесплатная статья PMC] [PubMed] [Google Scholar] 13. Глимелиус Б., Хоффман К., Хаглунд Ю., Нирен О., Сьёден П.О. Начальная или отсроченная химиотерапия с наилучшей поддерживающей терапией при распространенном раке желудка. Энн Онкол 1994. 5 февраля (2): 189-190 [PubMed] [Google Scholar] 14. Ёсида М., Оцу А., Боку Н., Мията Ю., Ширао К., Шимада Ю. и др. Долгосрочная выживаемость и прогностические факторы у пациентов с метастатическим раком желудка, получавших химиотерапию, в исследовании Японской клинической онкологической группы (JCOG).Jpn J Clin Oncol 2004. Ноябрь; 34 (11): 654-659 10,1093 / jjco / hyh220 [PubMed] [CrossRef] [Google Scholar]Долгосрочное выживание аденокарциномы желудка без лечения: отчет о болезни
Oman Med J. Октябрь 2010 г .; 25 (4): 303–305.
От отделения внутренней медицины и онкологии, Больница Короля Фахда Университета, Аль-Хобар, Королевство Саудовская Аравия.
* Адрес для переписки и перепечатки: доктору Али М. Аль-Амри, доктору медицины, отдел внутренней медицины и онкологии, больница Университета имени короля Фахда, Аль-Хобар 31952, а / я 40182, Королевство Саудовская Аравия.Электронная почта: moc.liamtoh@94irmailaПоступила 14 июня 2010 г .; Принято 9 августа 2010 г.
Эта статья цитируется в других статьях в PMC.Abstract
Планирование лечения аденокарциномы желудка у пациента, ранее получавшего частичную гастрэктомию по поводу первичной лимфомы желудка, затруднено. Долгосрочная выживаемость аденокарциномы желудка на поздних стадиях является низкой при лечении и даже хуже без лечения. Единственным потенциально излечивающим методом лечения аденокарциномы желудка является хирургическая резекция с адекватными границами.Паллиативная хирургия улучшает симптомы примерно у 50% пациентов. Химиотерапия может играть меньшую роль. В этом отчете представлен случай аденокарциномы желудка у пациента, перенесшего первичную лимфому желудка, которому была проведена частичная резекция желудка. Через 6 лет после постановки диагноза пациент все еще жив без признаков прогрессирования, несмотря на то, что активного лечения не проводилось.
Введение
Рак желудка остается второй ведущей причиной смерти от рака во всем мире. Прогноз умеренно улучшился за последние годы, но общая выживаемость все еще очень низкая.Единственным потенциально излечивающим подходом для пациентов с раком желудка остается раннее выявление и радикальная хирургическая резекция с лечебной целью. Общая 5-летняя выживаемость колеблется от почти нуля для пациентов с метастатическим заболеванием до почти пятидесятипроцентной выживаемости для пациентов с ранней операбельной аденокарциномой желудка.1 – 6 У пациентов с локализованной аденокарциномой желудка 5-летняя выживаемость составляет примерно только 10%. 1-6 В целом, долгосрочное выживание тесно связано со стадией заболевания и его анатомическим расположением.7 , 8
История болезни
50-летнему мужчине в 1994 году был поставлен диагноз первичной лимфомы желудка I стадии. Затем ему была проведена хирургическая резекция в форме субтотальной резекции желудка и анастомоза Билрота. В мае 2004 г. контрольная эндоскопия показала частичную резекцию желудка с гастритом, вызванным желчной кислотой, и множественные преанастомотические полипы, вероятно, злокачественные. Биопсия желудка и области анастомоза показала результаты, соответствующие хроническому активному гастриту и хорошо дифференцированной аденокарциноме I.()
H&E показывает хорошо дифференцированную аденокарциному слизистой оболочки желудка I степени.
Эндоскопия и биопсия были повторены в марте 2005 г. и ноябре 2005 г. Гистопатологические данные соответствовали хорошо дифференцированной аденокарциноме I степени желудка. Не было обнаружено Helicobacter pylori . Злокачественные клетки были положительными на цитокератин (ЦК). ()
Демонстрирует положительную иммунореактивность (диффузную и гомогенную) опухолевых клеток с ЦК.
В период наблюдения у пациента не было никаких симптомов, и его масса тела поддерживалась на уровне 62 кг. Компьютерная аксиальная томография (CAT) грудной клетки и брюшной полости не выявила признаков метастатического поражения. Маркеры опухолей, включая СЕА, СА125, СА199 и СА153, были нормальными. CBC, RFT и LFT также были нормальными.
В день 1 мая 2004 г. с пациентом были обсуждены варианты лечения, включая наблюдение с наилучшей поддерживающей терапией, хирургическое вмешательство, паллиативную химиотерапию или направление для получения второго медицинского заключения.Пациент отказался от любых операций или химиотерапии. Пациент выбрал наблюдение и регулярное наблюдение.
В марте 2010 года пациент прошел обследование в онкологической клинике, у него не было никаких симптомов. Аппетит нормальный, масса тела 62,5 кг.
Обсуждение
Гистопатологический тип карциномы желудка включает хорошо и плохо дифференцированную аденокарциному, гепатоидную аденокарциному и плоскосквамозную карциному. У указанного пациента гистопатология показала хорошо дифференцированную аденокарциному I степени на момент обращения и умеренно дифференцированную аденокарциному II степени во время последнего посещения через 5 лет после первого посещения.
Единственной возможностью лечебного лечения больных аденокарциномой желудка остается хирургическая резекция со свободными краями. Пациенты пожилого возраста или пациенты, перенесшие ранее операцию на желудке, имеют более высокий уровень послеоперационной смертности. У неопытных пациентов с карциномой желудка только 50% подвергаются резекции желудка из-за запущенного заболевания, а у 60% будет местный или отдаленный рецидив. Кроме того, только 30-50% из тех, кто подвергается обследованию, добиваются хирургической резекции с лечебной целью.6 , 9 В одном исследовании общая выживаемость варьировала от одного месяца до 142,5 месяцев, однако менее 5% пациентов с аденокарциномой желудка IV стадии доживают до 3 лет. химиотерапия улучшает качество жизни (КЖ) с незначительными преимуществами выживаемости по сравнению с лучшим поддерживающим лечением.11 – 13 Среднее время выживания пациентов с запущенной аденокарциномой желудка все еще остается менее одного года.14 Лишь немногие пациенты выжили в течение длительного периода времени, превышающего пять лет (2%), при активном терапевтическом вмешательстве14.
У нашего пациента не проявляются симптомы, у него нормальный аппетит, и его масса тела сохраняется в течение шести лет. В течение этого периода аденокарцинома желудка оставалась локальным заболеванием без признаков метастазирования; однако аденокарцинома прогрессировала с I степени до аденокарциномы II степени. Причины, по которым у этого пациента было местное злокачественное заболевание без прогрессирования в течение пяти лет, могут быть связаны с предыдущими эффектами хирургической резекции на сосудистые и лимфатические пути.Во-вторых, могло случиться так, что злокачественное заболевание затронуло только поверхностную слизистую. Однако причина не ясна. В настоящее время следует знать о столь необычных клинических течениях рака желудка, при которых прогноз может существенно отклоняться от средней нормы по неизвестным причинам.
Заключение
В этом отчете представлен феноменальный случай аденокарциномы желудка у живого пациента без признаков метастазирования через шесть лет после постановки диагноза без какой-либо активной терапии.
Благодарности
Автор сообщил об отсутствии конфликта интересов и финансирования этой работы.
Ссылки
1. Ли В.Дж., Ли В.К., Хунг С.Дж., Шун С.Т., Хоунг Р.Л., Ли П.Х. и др. Выживаемость после резекции рака желудка и прогностическая значимость систематической лимфодиссекции: двадцатилетний опыт работы на Тайване. World J Surg 1995. сентябрь-октябрь; 19 (5): 707-713 10.1007 / BF00295910 [PubMed] [CrossRef] [Google Scholar] 2. Каннингем С.К., Камангар Ф., Ким М.П., Хаммуд С., Хак Р., Майтра А. и др.Выживаемость после резекции аденокарциномы желудка: восемнадцатилетний опыт работы в одном учреждении. J Gastrointest Surg 2005. Май-июнь; 9 (5): 718-725 10.1016 / j.gassur.2004.12.002 [PubMed] [CrossRef] [Google Scholar] 3. Du pont BJ Jr, Cohn I Jr. Аденокарцинома желудка. Curr Probl Cancer 1980; 4: 1-46 [PubMed] [Google Scholar] 4. Faivre J, Forman D, Esteve J, Gatta G. Выживание пациентов с раком пищевода и желудка в Европе. Eur J Cancer 1998; 34: 2167-2175. 10.1016 / S0959-8049 (98) 00329-3 [PubMed] [CrossRef] [Google Scholar] 5.Тойер С.П., Куросаки Т., Зиогас А., Батлер Дж., Антон-Калвер Х. Азиатские пациенты с карциномой желудка в Соединенных Штатах демонстрируют уникальные клинические особенности и превосходные показатели общей и специфической выживаемости при раке. Рак 2000. Ноябрь; 89 (9): 1883-1892 10.1002 / 1097-0142 (20001101) 89: 9 <1883 :: AID-CNCR3> 3.3.CO; 2-8 [PubMed] [CrossRef] [Google Scholar] 6 . Hundahl SA, Phillips JL, Menck HR. Отчет Национальной базы данных по раку о плохой выживаемости пациентов с карциномой желудка в США, получавших гастрэктомию: Пятое издание Американского объединенного комитета по стадированию рака, проксимальному заболеванию и гипотезе «другого заболевания».Рак 2000. Февраль; 88 (4): 921-932 10.1002 / (SICI) 1097-0142 (20000215) 88: 4 <921 :: AID-CNCR24> 3.3.CO; 2-J [PubMed] [CrossRef] [Google Ученый] 7. Бедикян А.Ю., Чен Т.Т., Ханханян Н., Хейлбрун Л.К., МакБрайд С.М., МакМертри М.Дж. и др. Естественная история рака желудка и прогностические факторы, влияющие на выживаемость. J Clin Oncol 1984. Apr; 2 (4): 305-310 [PubMed] [Google Scholar] 8. Рис Л.А., Косари С.Л., Хэнки Б.Ф., Миллер Б.А., Харрас А., Эдвардс Б.К. Обзор статистики рака SEER 1973-1994, Национальный институт рака, публикация NIH No.97-2789. Bethesda: Департамент здравоохранения и социальных служб, 1997. [Google Scholar] 9. Ajani JA. Развивающаяся химиотерапия при распространенном раке желудка. Онколог 2005; 10 (Дополнение 3): 49-58 10.1634 / теонколог.10--49 [PubMed] [CrossRef] [Google Scholar] 10. Heemskerk VH, Lentze F, Hulsewé KW, Hoofwijk TG. Карцинома желудка: обзор результатов лечения в общественной клинической больнице. World J Surg Oncol 2007; 5: 81 10.1186 / 1477-7819-5-81 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 11.Уотерс Дж. С., Норман А., Каннингем Д., Скарф Дж. Х., Уэбб А., Харпер П. и др. Долгосрочная выживаемость при раке желудка после применения эпирубицина, цисплатина и фторурацила: результаты рандомизированного исследования. Br J Cancer 1999. Apr; 80 (1-2): 269-272 10.1038 / sj.bjc.66 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 12. Pyrhönen S, Kuitunen T., Nyandoto P, Kouri M. Рандомизированное сравнение фторурацила, эпидоксорубицина и метотрексата (FEMTX) плюс поддерживающая терапия с поддерживающей терапией только у пациентов с неоперабельным раком желудка.Br J Cancer 1995. Mar; 71 (3): 587-591 [Бесплатная статья PMC] [PubMed] [Google Scholar] 13. Глимелиус Б., Хоффман К., Хаглунд Ю., Нирен О., Сьёден П.О. Начальная или отсроченная химиотерапия с наилучшей поддерживающей терапией при распространенном раке желудка. Энн Онкол 1994. 5 февраля (2): 189-190 [PubMed] [Google Scholar] 14. Ёсида М., Оцу А., Боку Н., Мията Ю., Ширао К., Шимада Ю. и др. Долгосрочная выживаемость и прогностические факторы у пациентов с метастатическим раком желудка, получавших химиотерапию, в исследовании Японской клинической онкологической группы (JCOG).Jpn J Clin Oncol 2004. Ноябрь; 34 (11): 654-659 10.1093 / jjco / hyh220 [PubMed] [CrossRef] [Google Scholar]Очень хорошо дифференцированная карцинома желудка кишечного типа: анализ диагностических критериев
Клиникопатологические особенности
Характеристики 21 случая суммированы в таблице 1. Возраст пациентов варьировался от 53 до 84 лет (средний 67 лет; медиана 68 лет) с соотношением мужчин и женщин 2: 1 (14: 7). . Большинство случаев было выявлено в средней трети желудка (15 из 21, 71%), а остальные шесть были равномерно распределены в верхней и нижней трети желудка.Размер опухоли колебался от 0,3 до 19 см (в среднем 3,2 см; медиана 1,5 см). Эндоскопически все ранние раковые опухоли имели вид преимущественно поверхностного вдавленного поражения ( n = 17), за исключением одного, показывающего поверхностное возвышенное поражение (Рисунок 2). Границы были нечеткими в 9 из 18 случаев (50%), а 4 опухоли (22%) сопровождались подслизистым фиброзом. Из запущенных форм рака два представляли собой поражения типа 4 по Борманну, демонстрируя неровную или плоскую поверхность с заметным утолщением фрески, в то время как одна опухоль образовывала платообразное возвышенное поражение (тип 1).Эндоскопические резекции были выполнены в 12 случаях, а 9 опухолей были удалены хирургическим путем. Кроме того, вторичная хирургическая резекция была выполнена в двух случаях (случаи 11 и 12), когда после эндоскопической резекции границы резекции вернулись к положительным.
Таблица 1 Клинико-патологические данные 21 очень хорошо дифференцированной аденокарциномы кишечного типа Рисунок 2Эндоскопические изображения очень хорошо дифференцированной аденокарциномы кишечного типа (случай 5). Эндоскопическое исследование демонстрирует поверхностное вдавленное эритематозное поражение с плохо очерченным краем с использованием стандартной эндоскопической техники ( a ).Хромоэндоскопия ( b ) и узкополосная визуализация ( c ) лучше определяют поражение.
Гистологически 86% опухолей ( n = 18) были ранними злокачественными опухолями, в том числе 17 злокачественных опухолей внутри слизистой оболочки (pT1a) и 1 с поверхностной инвазией подслизистой оболочки (pT1b). Остальные три случая были запущены, и все они затрагивали серозную поверхность (pT4a). Ни в одном из 18 ранних видов рака не наблюдалось лимфоваскулярной инвазии, тогда как оно присутствовало во всех трех запущенных формах рака. Узловые метастазы были отмечены только в одном из запущенных случаев рака (случай 21).
Информация о последующем наблюдении была доступна в 17 случаях (81%) в диапазоне от 1 до 60 месяцев (в среднем 19 месяцев). Один пациент (случай 21), у которого была опухоль pT4 с узловыми метастазами, умер от болезни через 27 месяцев после операции. Остальные были живы без болезни при последнем контакте ( n = 15) или живы без информации о статусе болезни ( n = 1).
Оценка ряда гистологических признаков
Внутримукозные очень хорошо дифференцированные аденокарциномы
В таблице 2 показаны гистологические особенности, наблюдаемые в 17 внутрислизистых случаях.Извилистые, ветвящиеся и анастомозирующие железы были преобладающими архитектурными образцами и наблюдались в разной степени во всех случаях. В большинстве случаев также были выявлены увеличенные железы (15 из 17, 88%), абортивные железы (15 из 17, 88%), железистый отросток (13 из 17, 76%) и колючие железы (12 из 17, 71%). Дискогезивные неопластические клетки локально присутствовали в четырех (24%) случаях.
Таблица 2 Цитоархитектурные и стромальные находки в 17 внутрислизистых очень хорошо дифференцированных аденокарциномах кишечного типаДеформированные неопластические железы состояли из абсорбирующих клеток со смесью рассеянных нормальных и дистрофических бокаловидных клеток, тогда как в некоторых случаях также были клетки Панета (9 17, 53%) и фовеолярный эпителий (4 из 17, 24%).Ядерная атипия была минимальной. Увеличение ядер наблюдалось во всех случаях, но было умеренным по степени тяжести. Ядерная гиперхромазия (10 из 17, 59%), выступающие ядрышки (9 из 17, 53%) и очищение хроматина (7 из 17, 41%) также наблюдались в различной степени. Подсчет митоза составлял 1–5 на 10 мощных полей (HPF) в восьми (47%), 6–10 на 10 HPF в шести (35%) и> 10 (до 12) на 10 HPF в трех (18 %) случаи. Атипичные митозы отсутствовали. Большинство случаев (16 из 17, 94%) сопровождалось лимфоплазмоцитарным воспалением стромы, по крайней мере, в части поражения.Другие особенности стромы включали эктазию сосудов (10 из 17, 59%), отек (4 из 17, 24%) и нормальную собственную пластинку (2 из 17, 12%). Только в одном случае очаговая десмопластическая реакция была легкой.
Что касается модели роста, то в 6 из 17 (35%) случаев была выявлена периферическая модель «ползания», то есть латеральное опухолевое распространение в средней или нижней половине собственной пластинки, проходящей под неопухолевой эпителиальной поверхностью (рис. 3). В четырех из 17 случаев были обнаружены скопления дискогезивных неопластических клеток, указывающие на очаговую трансформацию в плохо связную карциному.
Рисунок 3Низкое ( a ) и высокое ( b , квадратная рамка в a ) примеры очень хорошо дифференцированной аденокарциномы с «ползучим» рисунком внутрислизистого распространения. Злокачественные железы инфильтрируют нижнюю половину собственной пластинки (ниже пунктирной линии), распространяясь латерально под неопухолевым поверхностным эпителием (выше пунктирной линии).
Подслизистые или глубоко инвазивные очень хорошо дифференцированные аденокарциномы желудка
Компоненты слизистой оболочки в четырех случаях с подслизистым или более глубоким поражением были относительно сохранены во всех случаях, их особенности по существу аналогичны тем случаям, которые ограничиваются слизистой оболочкой.Фактически степень архитектурной атипии в двух случаях была менее серьезной, чем в случаях, ограниченных слизистой оболочкой. Ядерная атипия всегда была легкой, хотя в разной степени наблюдались увеличение ядер, гиперхромазия, очищение хроматина и выступающие ядрышки. Количество митозов составляло 2–8 (в среднем 4,8) на 10 HPF без существенной разницы по сравнению с раком внутри слизистой оболочки. Картина «ползания» компонентов слизистой оболочки отсутствовала во всех случаях. Дискогезивные неопластические клетки локально присутствовали в одном из этих случаев (случай 21).
Морфология подслизистого или более глубоко инвазивного компонента отличалась от морфологии слизистого компонента в трех новообразованиях pT4a (случаи 19, 20 и 21), тогда как в случае, ограниченном инвазией подслизистой оболочки (случай 18), наблюдались минимальные различия. . Две опухоли pT4 (случаи 19 и 20) сохранили очень хорошо дифференцированную морфологию, но большинство подслизистых неопластических желез были больше, чем наблюдаемые на слизистой оболочке, и часто демонстрировали кистозную дилатацию и содержали эозинофильный дебрис и нейтрофильное воспаление (Рисунок 4).Кроме того, хотя бы очагово наблюдалась десмопластическая реакция и плотное воспаление. В одном случае (случай 21), в котором были обнаружены дискогезивные неопластические клетки, локально расположенные в слизистой оболочке, была представлена аналогичная картина инфильтрации диффузного типа (плохо связанная карцинома) с десмопластической реакцией, затрагивающей всю толщину желудка, включая серозную поверхность (Рисунок 5).
Рисунок 4Случай 20: вид с низким увеличением ( a ) и большее увеличение слизистой оболочки ( b , верхняя пунктирная рамка в a ) и глубоко инвазивной области ( c , нижняя пунктирная рамка в ) ).Этот случай сохраняет очень хорошо дифференцированную морфологию в глубоко инвазивной области, хотя железистые структуры больше и более расширены по сравнению с внутрислизистым компонентом.
Рисунок 5Случай 21: вид с низким увеличением ( a ) и большее увеличение слизистой оболочки ( b , верхняя пунктирная рамка в a ) и глубоко инвазивной области ( c , нижняя пунктирная рамка в ) ). В отличие от случая 20 (рис. 4), этот случай демонстрирует трансформацию из очень хорошо дифференцированной аденокарциномы ( b ) в слабо когезионную аденокарциному с десмопластической реакцией ( c ), затрагивающей всю толщу желудка.
Минимальное количество архитектурных особенностей в очень хорошо дифференцированной аденокарциноме
Во всех 21 случае были обнаружены как минимум три из следующих шести архитектурных аномалий: анастомозирующие железы, колючие железы, расширенные железы, дискогезивные клетки, абортивные железы и железистый отросток. Из этих шести признаков три присутствовали в 3 случаях, четыре присутствовали в 5 случаях, пять присутствовали в 10 случаях и все шесть присутствовали в 3 случаях. Короче говоря, в 86% случаев (18 из 21) было четыре или более таких архитектурных элемента.
Иммунофенотип и его связь с клинико-патологическими особенностями
Все 21 новообразование были положительными по кишечным маркерам, включая MUC2 (21 из 21), CDX-2 (19 из 21, 90%) и CD10 (18 из 21, 86%) . Кроме того, в 10 из 21 (48%) случаев были положительны маркеры желудка, при этом MUC5AC экспрессировался во всех случаях, а MUC6 – в 9 из 10 случаев. На основании этого 11 (52%) случаев были отнесены к кишечному типу (Рисунок 6) и 10 (48%) случаев как смешанному типу (Рисунок 7). В случаях подслизистой или более глубокой инвазии иммунофенотип сохранялся на всех уровнях опухолей, кроме случая 21, для которого глубоко инвазивный компонент имел нулевой фенотип.
Рисунок 6Очень хорошо дифференцированная аденокарцинома кишечного иммунофенотипа ( a , H&E). Опухолевые клетки положительны на MUC2 ( b ) и CDX-2 ( c ), но отрицательны на MUC5AC ( d ).
Рисунок 7Очень хорошо дифференцированная аденокарцинома смешанного иммунофенотипа ( a , H&E). Опухолевые клетки показывают положительное окрашивание на MUC2 ( b ), MUC5AC ( c ) и MUC6 ( d ).
Ни в одном случае кишечного фенотипа не было дискогезивных неопластических клеток, указывающих на слабосвязанный компонент, тогда как 5 из 10 (50%) случаев смешанного фенотипа сопровождались по крайней мере очаговой плохо связной карциномой.Не было значительных различий между двумя иммунофенотипами по другим гистологическим признакам, таким как возраст пациента, пол, расположение опухоли, макроскопический тип и узловой статус.
Обзор эндоскопических биопсий перед лечением
От одного до восьми до терапевтических эндоскопических исследований было выполнено 18 пациентам (медиана 2; среднее 2,5). Всего было доступно 196 биопсий тканей. Ретроспективный обзор показал, что 84 из этих исходных биопсий уже были диагностическими для очень хорошо дифференцированной аденокарциномы.Тем не менее, исходные диагнозы были «аденокарцинома» или «подозрение на аденокарциному» только в 30 и 12 биопсиях (36% и 14%) соответственно, тогда как исходные диагнозы в остальных были «неопределенными для неоплазии» или «реактивной кишечной метаплазией». в 22 и 20 биопсиях (26% и 24%) соответственно. Из ранее обсуждавшихся цитоархитектурных особенностей дискогезивные неопластические клетки и остроконечные железы наблюдались в 24% и 62% случаев, соответственно, и были в значительной степени связаны с диагнозом «аденокарцинома» или «подозрение на аденокарциному» по сравнению с другими диагнозами: «неопределенные для неоплазии» или «реактивная кишечная метаплазия», при которых они наблюдались только в 4% для дискогезивных неопластических клеток и 33% для колючих желез, соответственно.Однако не было значительных различий в других гистологических характеристиках между двумя группами.
Задержка в диагностике обычно составляла менее нескольких месяцев: <1 месяца в 13 случаях (72%), 1,5 месяца в 1 случае (6%) и 3 месяца в 1 случае (6%). Однако в трех случаях (17%) прошло больше года: 23, 50 и 84 месяца. Эндоскопически эти три очага были плохо очерченными и небольшого размера, от 1,2 до 1,5 см в наибольшем измерении (рис. 8a и b). Примечательно, что во всех трех случаях между первым осмотром и резекцией были минимальные изменения в размере.Кроме того, гистологическая оценка образца резекции показала, что во всех трех случаях рак оставался внутрислизистым, и ни в одном из них не было плохо связанного компонента карциномы (рис. 8c и d). Таблица 3 суммирует исходный патологический диагноз и эндоскопические данные при резекции этих трех случаев. При ретроспективном обзоре каждый набор биопсий из трех случаев, представленных в таблице 3, действительно содержал ткань, которая была диагностической для очень хорошо дифференцированной аденокарциномы.
Рисунок 8Случай с длительным наблюдением перед резекцией (случай 4).Эндоскопическое изображение непосредственно перед резекцией демонстрирует нечеткое поверхностное вдавленное поражение ( a ). Узкополосная визуализация выделяет поражение ( b ). Первичная биопсия выполнена за 23 месяца до резекции ( c ). Хотя первоначальным диагнозом была кишечная метаплазия с реактивными изменениями, ретроспективный обзор показал, что эта биопсия уже была диагностической для очень хорошо дифференцированной аденокарциномы, основанной на аберрантном ветвлении, анастомозировании, абортивных железах и железистом разрастании ( d ).
Таблица 3 Эндоскопические данные и исходный диагноз биопсии трех случаев с длительным наблюдением до резекцииСолидная низкодифференцированная аденокарцинома желудка: клинико-патологические и молекулярные характеристики, гистогенез
Пациенты
Мы выбрали 54 пациента с низкодифференцированные карциномы желудка (31 КПК твердого типа и 23 КПК нетвердого типа) в случаях хирургического лечения в Токийской столичной гериатрической больнице в период с 2000 по 2007 год без неоадъювантной терапии.В их число входили 31 мужчина и 23 женщины, средний возраст которых составлял 77 лет, от 56 до 99 лет. Пациенты с синдромом Линча были исключены.
Гистопатологическая оценка
Все образцы тканей после резекции фиксировали в 15% формалине, а затем заливали парафином с использованием стандартных процедур. Из каждого образца готовили серийные срезы толщиной 3 и 10 мкм. Срезы толщиной 3 мкм использовали для окрашивания гематоксилином-эозином и эластика по ван Гизону, иммуноокрашивания и гибридизации in situ, тогда как срезы толщиной 10 мкм использовали для экстракции ДНК.
Пятьдесят четыре случая ОАП были диагностированы патологически в соответствии с Японской классификацией карциномы желудка как КПК твердого типа и КПК нетвердого типа [2]. Вкратце, КПК твердого типа включает раковые клетки, которые сформировали твердую или пластинчатую структуру и демонстрируют интенсивный рост. PDA нетвердого типа состоит из раковых клеток с небольшими железами, небольшими кластерами или трабекулярной структурой или состоит из изолированных раковых клеток и часто демонстрирует инфильтративный рост. Характер роста, глубина инвазии, локализация, конкордантный железистый компонент, лимфоидная реакция типа Крона и инфильтрирующие опухоль лимфоциты оценивались, как описано ранее [15, 16].Из-за гистологического сходства с КПК солидного типа нейроэндокринно-клеточная карцинома, злокачественная лимфома и злокачественная меланома были исключены гистопатологически. Венозную и лимфатическую проницаемость оценивали гистологически с использованием препаратов, окрашенных гематоксилином, эозином и эластикой по ван Гизону.
Иммуногистохимический анализ p53 и репарации ошибочного спаривания и основных белков муцина
Экспрессию p53, белков репарации ошибочного спаривания и гликопротеинов ядра муцина оценивали с помощью иммуногистохимии.Эндогенную пероксидазу блокировали обработкой 0,3% H 2 O 2 в метаноле в течение 15 мин. Срезы для p53 и белков репарации ошибочного спаривания нагревали при 100 ° C в течение 10 мин для поиска антигена. Срезы иммуноокрашивали методом стрептавидин-биотин с использованием антитела против p53 (MO-7, разведение 1: 100, Nichirei, Токио, Япония) и антитела против MLh2 человека (клон G168-15, разведение 1: 100, BD Pharmingen , Токио, Япония), MSh3 (клон FE11, разведение 1: 100, Calbiochem, Billerica, MA, США), MSH6 (клон EP49, разведение 1:50, Dako, Glostrup, Дания) и PMS2 (клон A16-4, разведение 1:50, BD Pharmingen) моноклональных антител и проявлено с диаминобензидиновым субстратом.Гематоксилин использовали для контрастного окрашивания. Для белков восстановления несоответствия в качестве внутреннего контроля использовали соседние нормальные ткани. Интенсивность окрашивания ядер во всей опухоли классифицировалась как отрицательная, слабая или положительная. Регистрировали очаговые или неоднородные картины окрашивания. Для статистического анализа слабое окрашивание считалось отрицательным для белков репарации ошибочного спаривания, а экспрессия p53 классифицировалась на основании наличия или отсутствия сверхэкспрессии.
Для определения фенотипа муцина предметные стекла окрашивали гликопротеином против Muc-2 (клон Ccp58, разведение 1:50, Novocastra Laboratories, Ньюкасл-апон-Тайн, Великобритания), Muc-5AC (клон CLh3, разведение 1: 500, Leica Biosystems, Ньюкасл-апон-Тайн, Великобритания), Muc-6 (клин NCL-MUC6, разведение 1:20, Novocastra Laboratories) и CD10 (клон 56C6, готовый к использованию, Ничирей, Токио) с последующим контрастным окрашиванием гематоксилином.Фенотипы муцина были разделены на четыре группы: желудочный тип, кишечный тип, смешанный тип и неклассифицированный тип на основе положительности каждого фенотипа муцина, как описано ранее другими исследователями [17].
Гибридизация in situ малой РНК, кодируемой вирусом Эпштейна-Барра (EBER)
Для выявления инфекции вируса Эпштейна-Барра (EBV) срезы толщиной 3 мкм окрашивали с использованием гибридизации in situ (Дако, Токио, Япония) согласно к инструкции производителя.
Экстракция ДНК
Один срез 10 мкм на предметных стеклах был использован для экстракции ДНК.После депарафинизации ткани опухоли соскребали с полусухого среза лезвием под стереомикроскопом. ДНК выделяли отдельно из опухоли и нормальных участков. Образцы инкубировали в течение ночи при 56 ° C в буфере для лизиса, и ДНК экстрагировали из всех образцов с использованием фенол-хлороформной процедуры, описанной ранее [7].
Обнаружение мутаций
KRAS и BRAFМутации в кодоне 12 и 13 KRAS и BRAF (V600E) были исследованы с использованием полиморфизма длины рестрикционного фрагмента полимеразной цепной реакции (ПЦР – ПДРФ).Последовательности праймеров и условия ПЦР были описаны другими исследователями [18, 19].
Микросателлитный анализ
Статус микросателлита исследовали с использованием пяти маркеров, состоящих из двух мононуклеотидных маркеров ( BAT25 и BAT26 ) и трех динуклеотидных маркеров ( D3S1067, D5S346 и D18S). Последовательности праймеров и условия ПЦР опубликованы в другом месте [20]. Продукты ПЦР смешивали с равным объемом загрузочного буфера (95% формамид, 0.05% бромфенолового синего и 0,5 моль / л ЭДТА), электрофорез на денатурирующих 6% полиакриламидных гелях при 50 ° C и окрашивание с помощью набора для окрашивания серебром (Atto, Токио, Япония) в соответствии с инструкциями производителя. Дополнительные пики в микросателлитном локусе в опухолевой ДНК по сравнению с нормальной ДНК того же пациента были интерпретированы как MSI. Случаи с MSI в 2 или более локусах интерпретировались как демонстрирующие высокий MSI (MSI-H), случаи с MSI только в одном локусе назывались низким MSI (MSI-L), а случаи, которые не показывали MSI ни по одному из пяти маркеров. Панели микроспутников получили название микросателлитных стабильных (MSS).
Статистический анализ
Все данные были подвергнуты статистическому анализу с использованием SPSS версии 22 (IBM). Сравнение непрерывных и категориальных переменных производилось с использованием критерия Манна – Уитни, критерия хи-квадрат или точного вероятностного критерия Фишера. P значения менее 0,05 (двусторонние) указывают на значимость.
Варианты лечения рака желудка по типу и стадии
Лечение рака желудка (также известного как рак желудка) во многом зависит от того, где находится рак в желудке и насколько далеко он распространился.Но другие факторы, такие как возраст человека, общее состояние здоровья и предпочтения, также могут иметь значение.
Рак желудка обычно начинается на внутренней оболочке желудка. Оттуда он может расти и распространяться по-разному. Он может прорасти через стенку желудка в близлежащие органы. Он также может распространяться на близлежащие лимфатические узлы (структуры размером с боб, которые помогают бороться с инфекциями). По мере того, как рак прогрессирует, он может перемещаться по кровотоку или лимфатической системе и распространяться (метастазировать) в такие органы, как печень, легкие и кости, что может затруднить лечение.
Операция по удалению рака обычно является частью лечения, если это возможно, так как она дает наилучшие шансы на долгосрочное выживание. Но операция может быть не лучшим вариантом, если рак распространился широко или если человек недостаточно здоров для этого. Другие методы лечения, такие как химиотерапия и лучевая терапия, также часто являются частью лечения, либо вместе с операцией, либо вместо нее. В некоторых ситуациях также могут быть полезны новые методы лечения, такие как таргетные препараты и иммунотерапия.
Поскольку большинство людей будут получать различные виды лечения рака, важно, чтобы группа врачей рассмотрела и обсудила лучшие варианты лечения. Рак желудка не распространен в Соединенных Штатах, и его может быть сложно лечить, поэтому важно, чтобы ваша бригада по лечению рака имела опыт лечения рака желудка.
Хотя стадия рака AJCC TNM может быть важной при выборе лечения, врачи часто разделяют рак желудка на более крупные группы при выборе наилучших вариантов лечения.К ним относятся:
- Рак очень ранней стадии. Эти виды рака не проникли глубоко в стенку желудка и не распространились за пределы желудка. Эти виды рака составляют лишь небольшую часть случаев рака желудка в Соединенных Штатах.
- Опухоли, потенциально операбельные. Эти виды рака проникли глубже в стенку желудка и могли прорасти в близлежащие области или лимфатические узлы. Но не предполагается, что эти виды рака распространились на отдаленные части тела, поэтому хирургическое вмешательство все же может быть вариантом попыток их полного удаления (резекции).
- Неоперабельные местные или региональные опухоли. Эти виды рака также проникли глубже в стенку желудка и могли прорасти в близлежащие области или лимфатические узлы. Хотя рак еще не распространился на отдаленные части тела, маловероятно, что все это можно удалить хирургическим путем. Например, рак может находиться слишком близко к жизненно важным областям, или человек может быть недостаточно здоров для серьезной операции.
- Метастатический рак. Эти виды рака распространились на отдаленные части тела.
Рак очень ранней стадии
Эти раковые образования все еще находятся только во внутреннем слое оболочки желудка и не проникли в более глубокие слои стенки желудка.
Рак на очень ранней стадии обычно лечится хирургическим путем: либо субтотальной гастрэктомией (удаление части желудка), либо тотальной гастрэктомией (удалением всего желудка). Также удаляются близлежащие лимфатические узлы.
Некоторые малые раковые образования нулевой стадии можно лечить эндоскопической резекцией.В этой процедуре рак и некоторые слои стенки желудка удаляются с помощью эндоскопа, проведенного через глотку. Эта процедура чаще проводится в таких странах, как Япония, где рак желудка часто выявляется на ранней стадии во время скрининга. В Соединенных Штатах редко можно обнаружить рак желудка на столь ранней стадии, поэтому здесь не так часто применяют это лечение. Если это делается, то это должно происходить в онкологическом центре, у которого есть опыт работы с этой техникой.
Если результаты хирургического вмешательства (или эндоскопической резекции) показывают, что вся опухоль удалена, за человеком обычно можно внимательно наблюдать, не нуждаясь в дальнейшем лечении.Если неясно, полностью ли удален рак, скорее всего, будут рекомендованы химиотерапия и лучевая терапия. Другим вариантом может быть более обширная операция по удалению рака.
Потенциально операбельные раковые опухоли
Эти раковые образования прорастали глубже в стенку желудка и, возможно, разрослись в близлежащие области, но нет никаких признаков того, что они распространились на другие части тела, поэтому хирургическое вмешательство может быть вариантом их удаления (резекции).
Очень важно, чтобы все необходимые тесты были выполнены для точной стадии рака до того, как будет предпринята операция, чтобы врачи знали истинную степень распространения рака в организме.Попытка удалить рак вряд ли поможет, если он распространился слишком далеко, а операция может иметь серьезные побочные эффекты, поэтому точное определение стадии рака помогает гарантировать, что потенциальные преимущества операции перевешивают потенциальные недостатки. Наряду с визуализационными тестами, такими как компьютерная томография и ПЭТ, перед попыткой удаления рака могут быть выполнены другие тесты, такие как эндоскопическое ультразвуковое исследование (EUS) или этапная лапароскопия. (Подробнее об этих тестах см. В разделе «Тесты на рак желудка».)
В зависимости от локализации и степени рака некоторым людям в качестве первого лечения может быть проведена операция: либо субтотальная гастрэктомия (удаление части желудка), либо полная гастрэктомия (удаление всего желудка).Также удаляются близлежащие лимфатические узлы (и, возможно, части близлежащих органов). Другие люди могут сначала пройти только химиотерапию или химиотерапию с лучевой терапией (известную как химиолучевое лечение), чтобы попытаться уменьшить рак и облегчить операцию.
После операции можно провести химиотерапию (или химиолучевую терапию, если она не использовалась до операции), чтобы попытаться убить оставшиеся раковые клетки. Это особенно верно, если неясно, был ли удален весь рак, или если во время операции было удалено слишком мало лимфатических узлов.Другой вариант, если не весь рак был удален, может быть более обширная операция.
Неоперабельные местные или региональные опухоли
Эти виды рака не распространились на отдаленные части тела, но их нельзя удалить (удалить) полностью хирургическим путем.
Варианты первой линии лечения этих видов рака могут включать только химиотерапию, химиотерапию плюс иммунотерапию, химиотерапию плюс иммунотерапию плюс таргетный препарат трастузумаб (если рак HER2-положительный) или химиотерапию плюс лучевую терапию (химиолучевую терапию).Затем после лечения повторно оценивается стадия (степень) рака. Очень важно, чтобы врачи знали истинную степень рака на данном этапе. Наряду с визуализирующими исследованиями, такими как компьютерная томография и ПЭТ, могут быть выполнены другие тесты, такие как эндоскопическое ультразвуковое исследование (EUS) или этапная лапароскопия. (Подробнее об этих тестах см. В разделе «Тесты на рак желудка».)
- Если рак достаточно уменьшился в результате этого лечения, на этом этапе может быть вариантом хирургического вмешательства по его удалению. Это может быть субтотальная гастрэктомия (удаление части желудка) или полная гастрэктомия (удаление всего желудка).Также удаляются близлежащие лимфатические узлы (и, возможно, части близлежащих органов).
- Если после первоначального лечения рак все еще неоперабельн, дальнейшее лечение направлено на сдерживание роста рака как можно дольше и предотвращение или облегчение любых проблем, которые он вызывает. Это похоже на лечение метастатического рака (описано далее).
Иногда, даже если рак потенциально операбельн, человек может быть недостаточно здоров для серьезной операции или может отказаться от нее.Лечение этих видов рака обычно направлено на сдерживание роста рака как можно дольше и предотвращение или облегчение любых проблем, которые он вызывает. Это похоже на лечение метастатического рака (описано далее).
Метастатический рак
Эти виды рака распространились на отдаленные части тела, и их очень трудно вылечить. Но лечение часто может помочь держать рак под контролем и помочь предотвратить или облегчить проблемы, которые он может вызвать.
Лечение, направленное на контроль роста рака, может включать только химиотерапию, химиотерапию плюс иммунотерапию или химиотерапию вместе с лучевой терапией, если человек достаточно здоров.Для людей, у которых рак является HER2-положительным, к химиотерапии можно добавить целевой препарат трастузумаб, который может помочь ему лучше подействовать. Другой вариант для людей с метастатическим HER2-положительным раком желудка – назначить трастузумаб с химиотерапией и иммунотерапевтическим препаратом пембролизумаб в качестве первого лечения.
Если один тип химиотерапии не работает (или перестает работать), можно попробовать другой тип химиотерапии. Другие варианты могут включать лекарство для таргетной терапии или лекарство для иммунотерапии.
Некоторые виды паллиативной хирургии, такие как обходное желудочное анастомозирование (или, реже, субтотальная резекция желудка), могут быть полезны в некоторых ситуациях для предотвращения закупорки (закупорки) желудка и / или кишечника или для остановки кровотечения.
Эндоскопические процедуры также могут использоваться для предотвращения или облегчения симптомов, особенно у людей, которые не могут (или не хотят) хирургического вмешательства. Например, лазерный луч, направленный через эндоскоп (длинная гибкая трубка, проходящая через горло), может разрушить части опухоли, не давая ей блокировать прохождение пищи через желудок. При необходимости можно использовать эндоскоп для установки стента (полой металлической трубки) в месте соединения пищевода и желудка, чтобы он оставался открытым и позволял пище проходить.Это также можно сделать на стыке желудка и тонкой кишки.
Рак желудка (и его лечение) часто может приводить к проблемам с питанием, и получение адекватного питания часто вызывает беспокойство. Некоторым людям может помочь установка зонда для кормления. Если это необходимо только на короткое время, можно провести тонкую трубку через нос и горло в желудок или кишечник. Если трубка для кормления требуется в течение более длительного времени, можно выполнить небольшую хирургическую процедуру, чтобы ввести трубку через кожу живота в нижнюю часть желудка (гастростомическая трубка или трубка G ) или тонкий кишечник (трубка для еюностомии или трубка J ).Затем жидкое питание можно вводить прямо в пробирку.
Поскольку эти виды рака трудно поддаются лечению, новые методы лечения, проходящие клинические испытания, могут принести пользу некоторым пациентам.
Даже если лечение не уничтожает или не уменьшает рак, часто есть способы облегчить боль, проблемы с приемом пищи и другие симптомы. Очень важно сразу же сообщать вашей онкологической бригаде о любых симптомах, которые у вас есть, чтобы с ними можно было эффективно справиться.
Рецидив рака
Рак, который возвращается после начального лечения, известен как рецидивирующий рак.Варианты лечения рецидивирующего рака зависят от места рецидива рака, от того, какое лечение человек уже прошел, и от общего состояния здоровья человека.
Если рак возвращается только в одном месте, рядом с тем местом, где был исходный рак, хирургическое вмешательство может быть вариантом, чтобы попытаться удалить его, если у человека достаточно здоровья для операции.
Если рецидив рака более распространен или находится в отдаленной части тела, или если человек недостаточно здоров для операции, лечение аналогично лечению метастатического рака (описанному выше), при котором основные цели заключаются в том, чтобы как можно дольше контролировать рост рака и предотвращать или устранять любые проблемы, которые он может вызвать.
Для заинтересованных людей могут быть вариантом и рассмотрены клинические испытания новых методов лечения.
Метастаз опухоли в опухоль плохо дифференцированной карциномы желудка в липолеомиому матки
Редкое явление метастазирования опухоль в опухоль было впервые описано в 1930 году. Донорское новообразование чаще всего представляет собой карциному легкого или молочной железы, тогда как внутричерепные менингиомы, как сообщается, являются самое распространенное новообразование реципиента. Здесь мы сообщаем о случае метастазирования первичного рака желудка в липолейомиому матки.65-летняя женщина обратилась с диагнозом местнораспространенный рак желудка с данными компьютерной томографии (КТ), свидетельствующими о распространении перитонеального кровотока и образованием в тазовой области 9 см. Она прошла 16 курсов химиотерапии TS-1 / цисплатин, в результате которых удалось добиться значительного уменьшения опухоли. Однако повторная компьютерная томография и магнитно-резонансная томография выявили образование в малом тазу диаметром 9 см, прилегающее к матке. Масса была неоднородно гиперинтенсивной на T1- и T2-взвешенных изображениях с некоторыми слабыми сигнальными пятнами на T1-взвешенных изображениях с подавленным жиром, что указывает на доброкачественную опухоль яичников, такую как зрелая кистозная тератома.Через 3 месяца КТ тазовых органов выявила мультилокулярную кистозную массу 10 см, которая демонстрировала гетерогенное усиление после внутривенного введения контрастного вещества. Диагностическая лапаротомия выявила субсерозную опухоль матки, распространяющуюся на правую широкую связку; Выполнена тотальная абдоминальная гистерэктомия и двусторонняя сальпингоофорэктомия. Опухоль матки показала гистологические особенности липолейомиомы, инфильтрированной хорошо или умеренно дифференцированными клетками карциномы, которые были аналогичны таковым при биопсии желудка, что подтверждает диагноз метастатической аденокарциномы желудка.
1. Введение
За исключением прямой инвазии из соседних органов малого таза, метастазы экстрагенитального рака в матку встречаются редко. Кроме того, крайне редко встречаются метастазы в липолейомиому матки, редкий вариант лейомиомы. Редкий феномен метастазирования в гистологически различные опухоли был впервые описан в 1930 году [1] и известен как метастазирование опухоль в опухоль [2]. Что касается опухоли реципиента, то внутричерепные менингиомы, как сообщается, являются наиболее распространенными [2], тогда как рак груди является наиболее распространенной донорской опухолью [2].Здесь мы представляем случай рака желудка с метастазами в липолейомиому матки.
2. История болезни
62-летняя женщина, беременность 2 абз. 2, обратилась с жалобами на боли в животе. Эндоскопия желудочно-кишечного тракта показала поверхностные эрозии желудка, а гистопатологическое исследование образцов эндоскопической биопсии выявило низкодифференцированную аденокарциному. Компьютерная томография (КТ) показала утолщение стенки пазухи желудка, перитонеальную диссеминацию и твердое образование в тазу диаметром 9 см.На основании этих результатов у пациента был диагностирован рак желудка на поздней стадии (стадия IV), и его лечили химиотерапией TS-1 / цисплатин (CDDP). После 16 курсов химиотерапии TS-1 / CDDP гастроскопия показала полное исчезновение язвенного поражения, а КТ продемонстрировала значительное уменьшение перитонеальной диссеминации. Однако опухоль малого таза не изменилась в размерах и имела кистозный компонент. Пациент был направлен в нашу больницу для оценки опухоли таза.
При первом посещении нашей больницы общее состояние пациентки было хорошим, а ее медицинский и семейный анамнез ничем не примечателен.При гинекологическом осмотре в правой нижней части живота пальпировалось твердое, безболезненное образование диаметром около 10 см. Трансвагинальное ультразвуковое исследование и компьютерная томография (КТ) выявили образование в тазу диаметром 10 см (рисунки 1 (a) и 1 (b)). Магнитно-резонансная томография (МРТ) продемонстрировала опухоль со смешанной интенсивностью сигнала низкой и высокой интенсивности на изображениях, взвешенных как по Т1, так и по Т2 (рисунки 2 (а) и 2 (б)). Более того, жировые элементы были идентифицированы в опухоли на насыщенных жиром Т1-взвешенных изображениях (рис. 2 (c)).Цитология мазка эндометрия отрицательная. Лабораторные данные, включая сывороточные концентрации раковых антигенов 125 и 19-9, карциноэмбрионального антигена и антигена плоскоклеточной карциномы, были в пределах нормы. Поэтому мы заподозрили доброкачественную опухоль правого яичника, такую как зрелая кистозная тератома, и решили внимательно наблюдать за пациентом без дальнейшего лечения. Три месяца спустя трансвагинальное ультразвуковое исследование показало многокомпонентную кистозную массу, которая заметно отличалась от той, которая наблюдалась при обращении в нашу больницу.КТ с контрастированием выявила многоячеистую кистозную массу размером 10 см с неоднородным усилением (рисунки 1 (c) и 1 (d)). Однако диссеминация брюшины была стабильной, и новых метастатических очагов обнаружено не было. Поскольку злокачественные новообразования, включая первичную или метастатическую опухоль яичников, не могли быть исключены с помощью визуализационных исследований, была выполнена диагностическая лапаротомия. При обследовании полости малого таза выявлена субсерозная опухоль матки, распространяющаяся на правую широкую связку, выполнена тотальная абдоминальная гистерэктомия и двусторонняя сальпингоофорэктомия.
Подсерозная опухоль матки размером 10 см в диаметре с желто-белой поверхностью среза; кисты содержали желтую серозную жидкость (рис. 3). Не было обнаружено участков некроза или кровоизлияния (рис. 3). Эндометрий атрофичен. И яичники, и маточные трубы были макроскопически нормальными. При гистологическом исследовании опухоль матки показала признаки липолейомиомы со смесью зрелого жира и пучков мышечных волокон (рисунки 4 (а) и 4 (б)). Он был инфильтрирован хорошо или умеренно дифференцированными клетками карциномы (рисунки 4 (a) -4 (c)), которые при иммуногистохимическом окрашивании оказались положительными на цитокератин (CK) 7, CK20 и CDX2, но отрицательными на эстроген и рецепторы прогестерона (Рисунки 4 (e) и 4 (f)).Эти особенности совместимы с метастатической аденокарциномой предыдущего рака желудка, но не с раком эндометрия, инфильтрирующим миометрий матки (рис. 4 (d)). Кроме того, в теле матки была обнаружена лимфатическая проницаемость. Цитологический анализ перитонеальной промывки не выявил злокачественных клеток.
Послеоперационное течение пациентки протекало без осложнений, выписана на седьмой день. Химиотерапия TS-1 / CDDP была возобновлена, и она осталась жива с диссеминированными метастазами через 14 месяцев после операции.
3. Обсуждение
Липолейомиома матки – редкий вариант лейомиомы матки, частота встречаемости составляет от 0,03% до 0,2% всех опухолей матки [3]. Гистологически эти опухоли состоят из доброкачественных гладкомышечных клеток и зрелой жировой ткани. Липолейомиома матки часто встречается у женщин с ожирением в менопаузе и обычно протекает бессимптомно. Их патогенез остается неясным, потому что жировая ткань не является естественной для миометрия. Двумя основными возможностями являются жировая метаплазия гладкомышечных клеток и мультипотенциальное происхождение клеток Мюллера [4].На сонографии они выглядят как гиперэхогенные образования, частично заключенные в гипоэхогенную корку. КТ показывает инкапсулированные, гетерогенные, преимущественно жировые опухоли [3, 4]. МРТ подтверждает расположение опухоли в матке и ее липоматозную природу [4]. Дифференциальный диагноз включает зрелую тератому яичника, доброкачественную липому таза, липосаркому, экстраадреналовую миелолипому, липобластную лимфаденопатию и кистозную гамартому забрюшинного пространства. Однако липолиомиомы матки часто диагностируются до операции как лейомиомы матки или зрелые тератомы яичников.
За исключением прямой инвазии из соседних органов малого таза, метастазы экстрагенитального рака в матку встречаются редко [5]. Более того, метастазы в лейомиому матки крайне редки; пока зарегистрировано только 19 случаев [2, 5–11]. В этих 19 случаях первичные опухоли возникли в груди (12), желудке (три), поджелудочной железе (два), легких и мочевом пузыре (по одному случаю). В шести из этих случаев метастазы были ограничены лейомиомами. Раковые клетки метастазируют в тело матки, в том числе в лейомиомы, лимфатическими или гематогенными путями.Большинство метастазов в матке являются вторичными по отношению к локальному лимфатическому распространению из предшествующих метастазов в яичниках; однако, когда яичники не поражены, как в данном случае, метастазы являются гематогенными [5].
Феномен метастазирования опухоль в опухоль был впервые описан в 1930 году [1]. На сегодняшний день зарегистрировано 104 случая [2, 5–11]. Донорские новообразования возникли в груди (65 случаев), легких (12), почках (семь), простате (пять), желудке (четыре), толстой кишке (три), коже и поджелудочной железе (по два случая) и шейке матки, яичник, мочевой пузырь и слюнная железа (по одному случаю).Реципиентом может быть любая доброкачественная или злокачественная опухоль; однако менингиомы считаются наиболее частым новообразованием, содержащим метастазы. Вторым по частоте новообразованием у реципиентов является лейомиома матки; Сообщалось о 19 случаях, в том числе 18 случаев лейомиомы и 1 липолеомиомы [5, 7–11]. Предпочтение раковых клеток различным участкам метастазирования зависит от взаимодействия между раковыми клетками («семенами») и окружающей средой конкретных органов («почвой») [12]. Некоторые клинические и биологические характеристики опухолей-реципиентов, такие как медленная скорость роста, гиперваскуляризация и высокое содержание коллагена и липидов, могут играть важную роль в посеве метастазов.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов в отношении публикации данной статьи.
Благодарности
Авторы благодарны доктору Х. Кенджо, доктору М. Ясунага, доктору Т Огами, доктору И Онояме, доктору А. Ичиноэ и профессору Т. Каку за полезные обсуждения и г-же Э Хори за технические служба поддержки. Это исследование было частично поддержано грантом для молодых ученых (B) Министерства образования, культуры, спорта, науки и технологий Японии (№26861332).
Произошла ошибка при настройке вашего пользовательского файла cookie
Произошла ошибка при настройке вашего пользовательского файла cookieЭтот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера на прием файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie.Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie.Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу.Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта.Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.

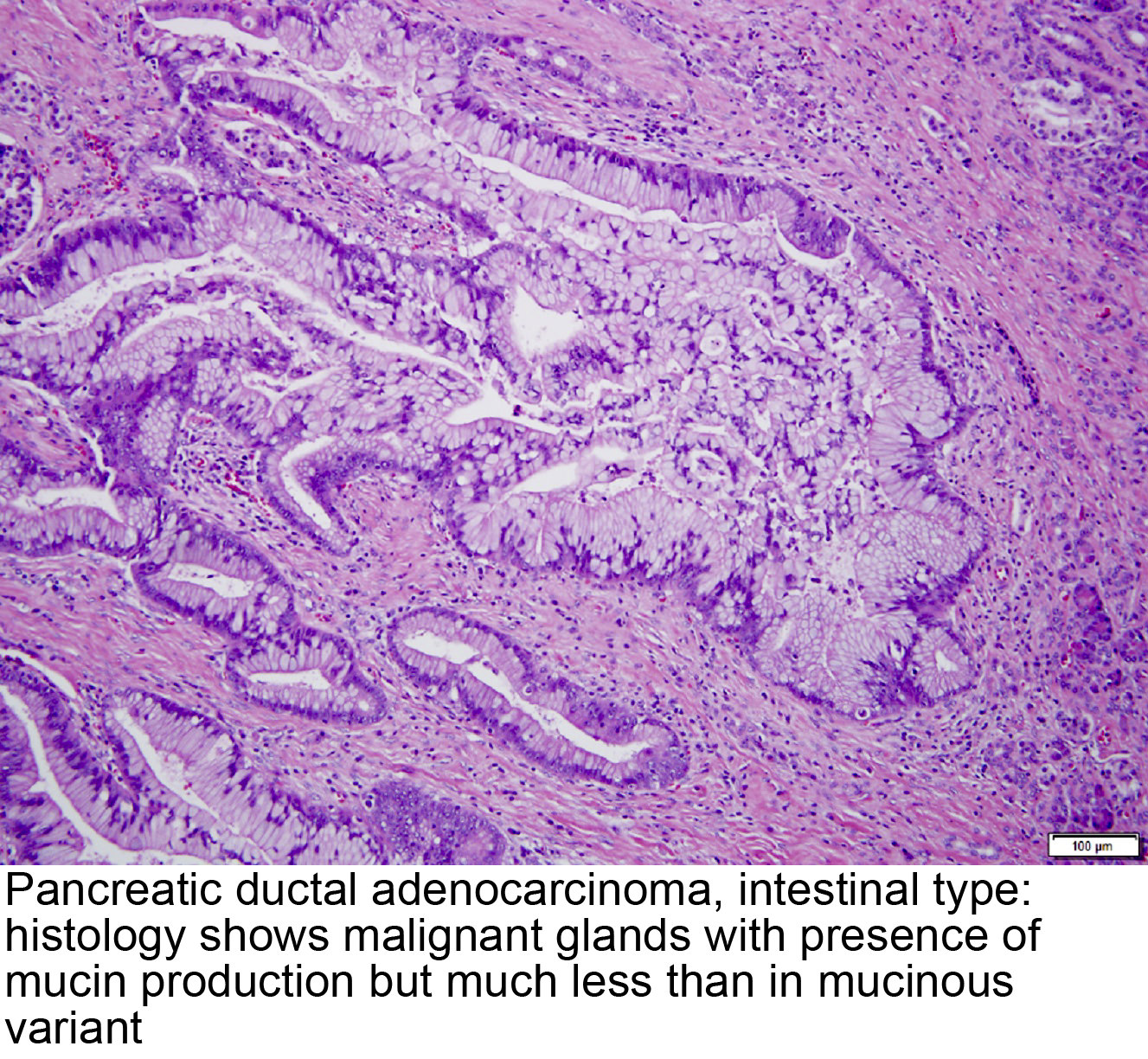
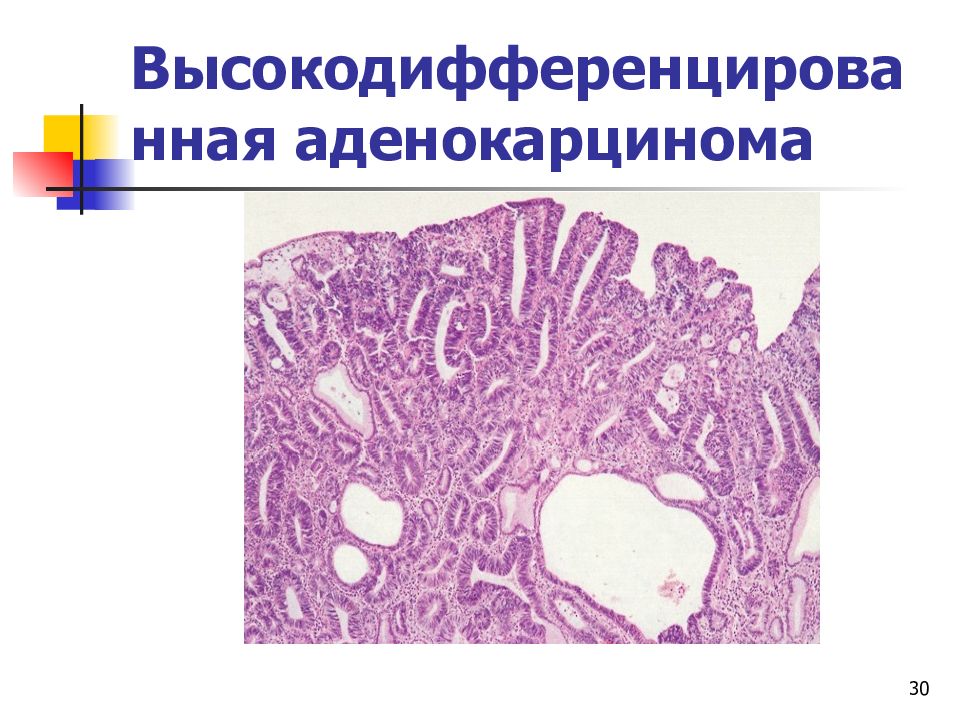


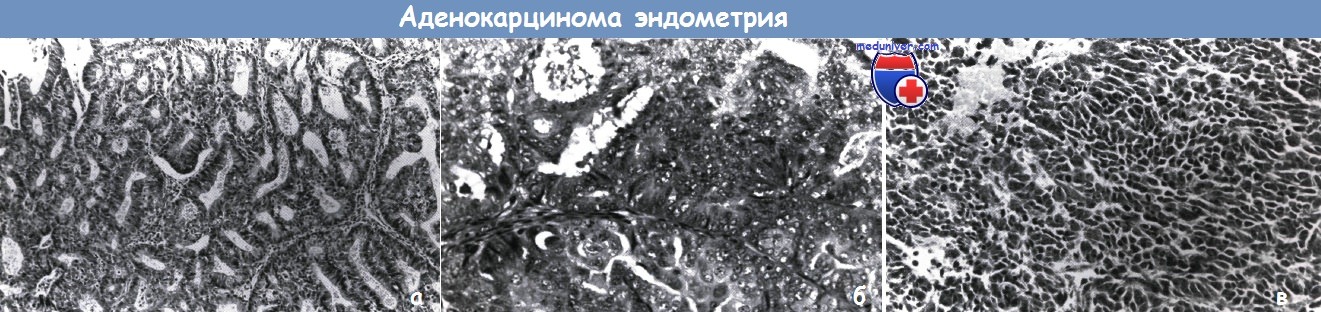
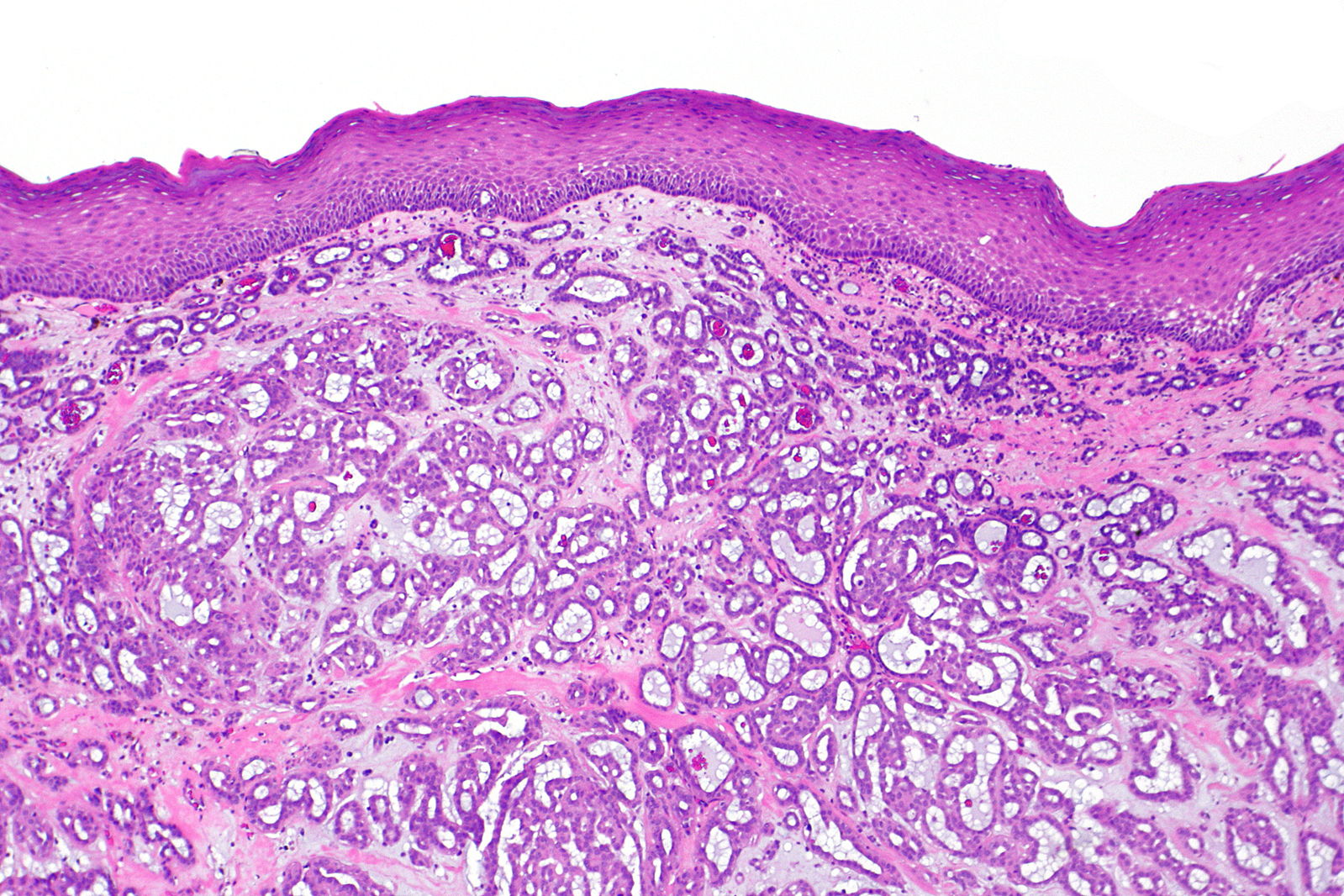
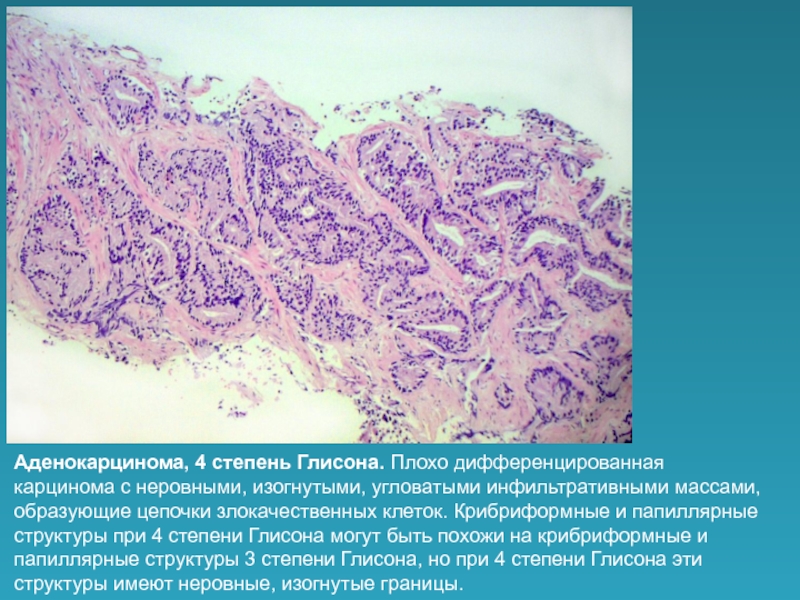 Она очень медленно расходится по организму и отлично лечится. В 3 из 5 случаев данный тип опухоли протекает скрыто, поэтому специалисты выявляют его уже на последних стадиях.
Она очень медленно расходится по организму и отлично лечится. В 3 из 5 случаев данный тип опухоли протекает скрыто, поэтому специалисты выявляют его уже на последних стадиях.
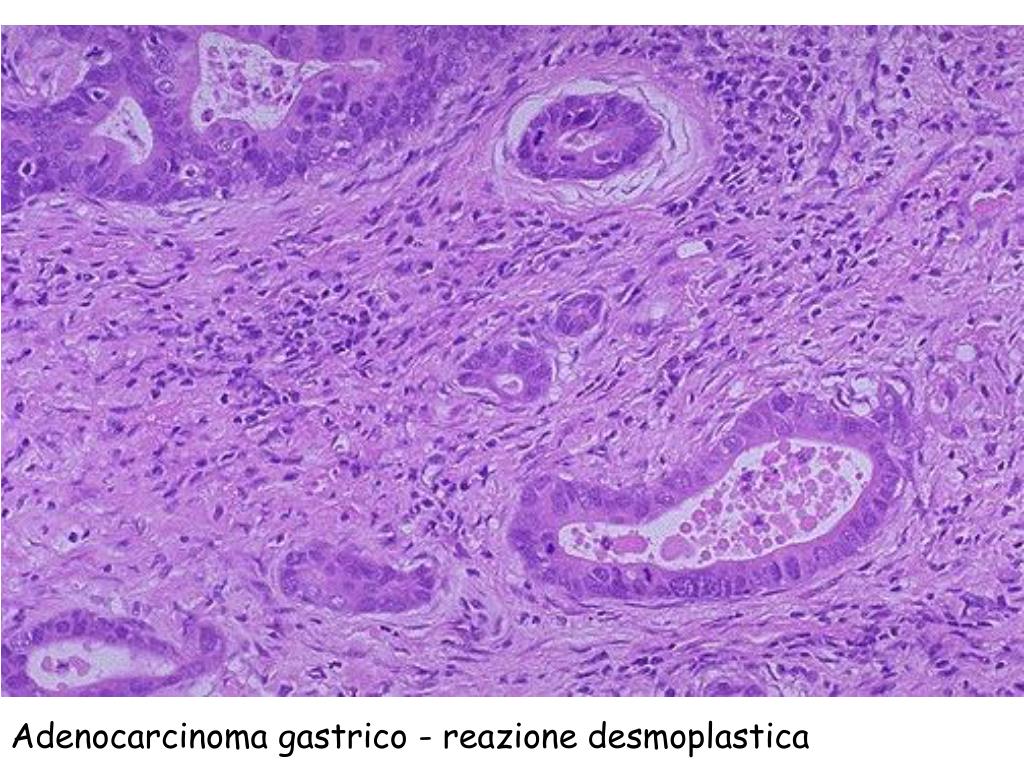
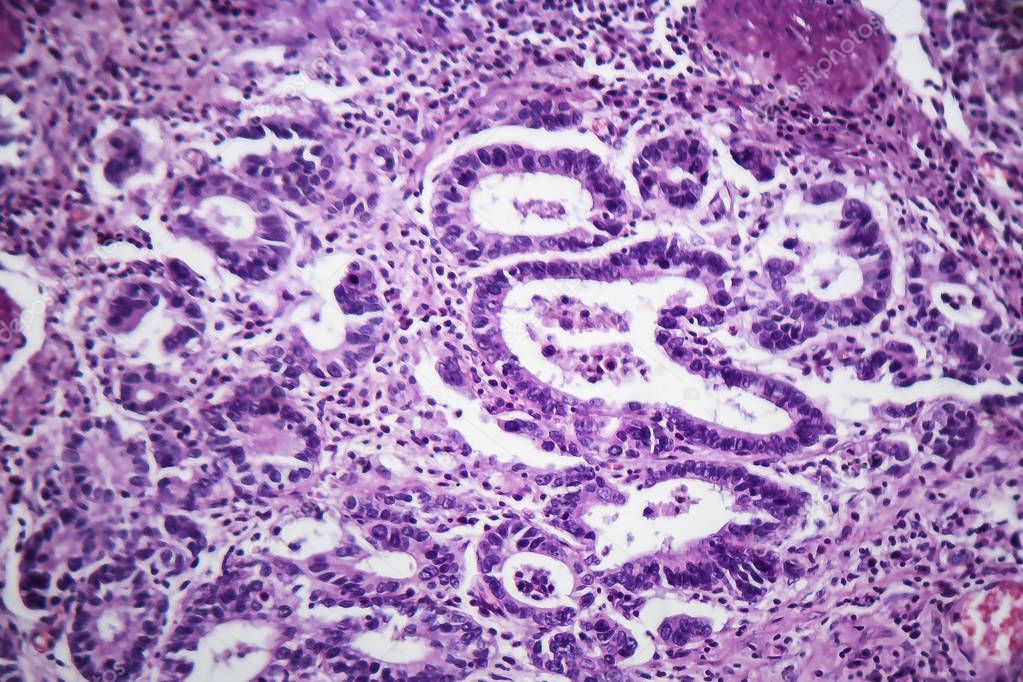 Выявляет процессы воспаления.
Выявляет процессы воспаления. Операция выполняется с помощью пары небольших разрезов (до двух см). Щипцами удаляются ткани, которые поражены. Процесс контролируется прибором с камерой.
Операция выполняется с помощью пары небольших разрезов (до двух см). Щипцами удаляются ткани, которые поражены. Процесс контролируется прибором с камерой.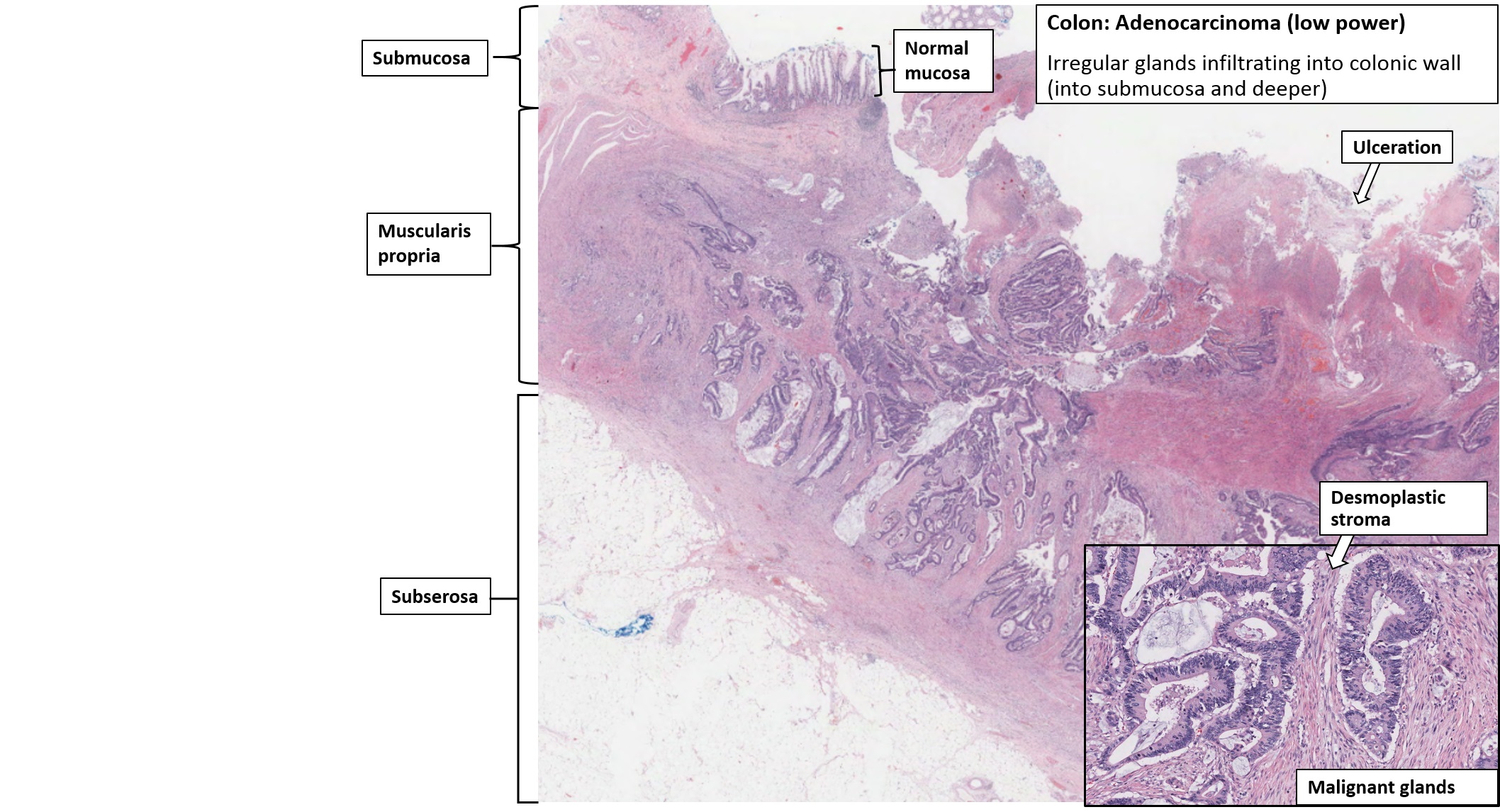 Вместо операции лучевую терапию назначают при небольших опухолях.
Вместо операции лучевую терапию назначают при небольших опухолях.
 палочкоядерные
палочкоядерные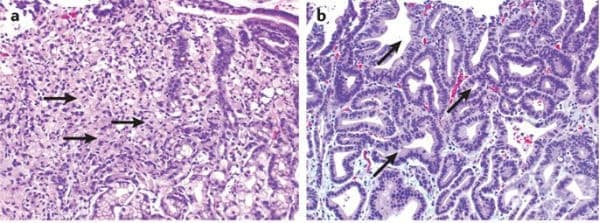 Если опухоль увеличивается, то появляются неприятные ощущения после приема пищи, нарушения пищевых привычек, флегмона желудка, малокровие, перитонит.
Если опухоль увеличивается, то появляются неприятные ощущения после приема пищи, нарушения пищевых привычек, флегмона желудка, малокровие, перитонит.