Умеренные диффузные изменения поджелудочной железы: Лечение диффузных изменений поджелудочной железы в Москве
Диффузные изменения поджелудочной железы у детей
Результаты поиска по запросу:
Вопрос 2010-06-27 19:31:28 какой тип дискинезии желчного пузыря чаще у детей при перегибе желчного пузыря.На УЗИ перегиб желчного пузыря и умеренные диффузные изменения поджелудочной железы, Есть гастрит. Таким образом, поджелудочная железа тесно связана с печенью и желчевыводящей системой, и все заболевания печени обязательно отражаются на поджелудочной железе и наоборот. Что такое «диффузные изменения поджелудочной железы». Главная › Медицинские консультации › Гастроэнтеролог › Диффузные изменения поджелудочной железы.
В 3 недели мы сдавали анализ на дисбактериоз, в результате которого выяснилось, что у
 Coli Verte! и. Своевременная диагностика и терапия заболеваний поджелудочной железы у детей
Coli Verte! и. Своевременная диагностика и терапия заболеваний поджелудочной железы у детейМорфологические изменения ткани поджелудочной железы носят стойкий характер
отделе поджелудочной железы, по мере развития заболевания диффузно поражается вся железа. Все зависит от возраста ребенка. Обычно диффузные изменения поджелудочной железы у детей встречаются в подростковом возрасте. Связано это с резким скачком гормонов в связи с началом полового созревания. Лечение при обнаружении признаков диффузных изменений паренхимы печени и поджелудочной железы у детей или взрослых людей должен назначать специалист при очном приеме.
 При наличии соответствующих жалоб, данных осмотра и результатов исследований гастроэнтеролог поставит диагноз и, при необходимости, назначит лечение. (умеренно выраженные диффузные изменения поджелудочной железы). 21 Responses to “Заболевания поджелудочной железы у детей”. : Апрель 26, 2012 в 3:16 пп.
При наличии соответствующих жалоб, данных осмотра и результатов исследований гастроэнтеролог поставит диагноз и, при необходимости, назначит лечение. (умеренно выраженные диффузные изменения поджелудочной железы). 21 Responses to “Заболевания поджелудочной железы у детей”. : Апрель 26, 2012 в 3:16 пп.Лет в 12 у него появились боли в желудке ,повела его к гастроэнтерологу, ему поставили диагноз «диффузные изменения поджелудочной железы»,врач выписала таблетки»Креон», посидел. .
г лида, знакомства лида, где купить таблетки лида, капсулы лида lida, поздравления лиде
для похудения +в красноярске, дыхательные упражнения +для похудения окси, средства +для.
 .бы мы не получали с пищей, его все равно мало, купила обычные таблетки кальция глюконата 0,5, а
.бы мы не получали с пищей, его все равно мало, купила обычные таблетки кальция глюконата 0,5, аДа потому что, все настолько хорошо , что невозможно оторваться: столько полезного. .также показали, что ежедневное употребление лигнанов в семенах льна снижает уровень сахара в крови у больных сахарным диабетом 2 типа. Льняное семя против воспаления. Два компонента семян льна, альфа-линоленовая кислота и лигнаны, могут снижать воспаление.
Ультразвуковое исследование (УЗИ) органов брюшной полости в Санкт-Петербурге
В нашем центре вы можете пройти ультразвуковое исследование (УЗИ) органов брюшной полости с помощью аппарата ультразвуковой диагностики премиум класса Philips EPIQ 5, который обеспечивает быструю и точную диагностику и высокий уровень надежности результатов даже для пациентов, обследование которых затруднено. УЗИ органов брюшной полости проводят врачи УЗД с опытом более 8 лет.
УЗИ органов брюшной полости проводят врачи УЗД с опытом более 8 лет.
УЗИ органов брюшной полости – это современное неинвазивное и безболезненное обследование органов брюшной полости с помощью ультразвуковых волн, которое является одним из самых точных обследований этих органов и забрюшинного пространства, позволяет получить данные о патологических изменениях на самых ранних сроках и применяется для постановки диагноза при различных заболеваниях желудочно-кишечного тракта.
В УЗИ брюшной полости входит
- обследование внутренних органов – печени, желчного пузыря, поджелудочной железы и селезенки для оценки их формы, внутренней структуры и плотности, а также расположения в брюшной полости;
- обследование желчевыводящих путей, системы воротной вены, сосудов и лимфоузлов брюшной полости.
При необходимости вместе с УЗИ органов брюшной полости можно пройти УЗИ почек.
Как проводится исследование?
Исследование проводится в утреннее время натощак с исключением приема любых жидкостей; или через 6 часов после приема пищи и любых жидкостей. Длительность исследования 15-30 минут.
Длительность исследования 15-30 минут.
Во время исследования пациент находится в основном в положении лежа, иногда может потребоваться сесть или встать.
Подготовка к исследованию подробнее
Какую информацию можно получить с помощью УЗИ органов брюшной полости?
Ультразвуковая диагностика помогает обнаружить:
- опухоли и кисты печени, поджелудочной железы и селезенки;
- конкременты (камни) и полипы в желчном пузыре, а также его аномалии его строения;
- наличие свободной жидкости в брюшной полости и малом тазу, являющееся признаком ряда заболеваний;
- тромбоз артерий или вен, кровоснабжающих печень и селезенку.
УЗИ печени дает возможность определить размеры, форму и структуру печени, ее однородность и неоднородность, состояние и размеры печеночных вен. Чувствительность УЗИ в диагностике цирроза печени равна 85% и дает такую же информацию, как и компьютерная томография. С помощью УЗИ можно обнаружить опухоли в печени до 10 мм.
УЗИ поджелудочной железы используется для качественной визуализации всех ее отделов, тканей и протоков может определить ее расположение, форму, размеры, структуру, контуры, наличие новообразований.
УЗИ селезенки отображает размеры и строение селезенки, ее расположение в брюшной полости, а также наличие или отсутствие патологических включений.
УЗИ желчного пузыря и желчных протоков дает полную информацию о состоянии стенок желчного пузыря, наличии в нем густой желчи, хлопьев, песка, конкрементов, и его сократительной способности. Данное обследование используется в нашем центре для диагностики желчнокаменной болезни, хронического холецистита, холестероза, полипоза, рака и аномалий развития желчного пузыря. Чтобы сделать УЗИ диагностику желчнокаменной болезни более точной, мы рекомендуем пациенту во время исследования повернуться на бок, сделать несколько наклонов, чтобы «взболтать» содержимое желчного пузыря. Эти приемы повышают точность диагностики до 80%.
УЗИ системы воротной вены и сосудов брюшной полости оценивает портальный кровоток, выявляет признаки портальной гипертензии даже при нормальных диаметрах сосудов. Выявляет нарушения кровообращения брюшной полости.
УЗИ и лимфатических узлов брюшной полости определяет размеры лимфатических узлов, их структуру и плотность, изменение которых относительно нормы может свидетельствовать о развитии в организме различных патологических процессов.
УЗИ почек позволяет определить функциональное состояние почек, их размер, строение, положение, наличие или отсутствие новообразований.
Кому и зачем назначается?
УЗИ органов брюшной полости назначается пациентам
- с жалобами на периодические или постоянные боли в животе, горечь во рту, тяжесть в правом подреберье;
- с хроническими заболеваниями печени и желчного пузыря;
- постоянно принимающим лекарства;
- имеющим близких родственников с заболеваниями печени и желчного пузыря;
- употребляющим алкоголь свыше допустимой нормы;
- при ожирении и метаболическом синдроме;
- у которых зафиксировано отклонение от нормы биохимических анализов крови;
- после лечения при заболеваниях печени, желчного пузыря и желчных протоков для оценки результата.

Пациент в результате обследования получит
Заключение врача с описанием размеров, формы и расположения органов в брюшной полости, а также оценку их внутренней структуры и плотности. Кроме того оценивается состояние сосудов, размеры и форма внутренних включений и очаговых образований при их наличии.
Данное заключение совместно с лабораторными анализами поможет вашему лечащему врачу поставить или уточнить диагноз, назначить лечение или дополнительные обследования при необходимости.
Реактивные изменения поджелудочной железы у ребенка
Количество детей, у которых врач диагностирует проблемы с поджелудочной железой, в последнее время заметно увеличилось. О том, что собой представляют реактивные изменения, почему они развиваются и как их лечить мы расскажем в этой статье.
О том, что собой представляют реактивные изменения, почему они развиваются и как их лечить мы расскажем в этой статье.
Что это такое?
Реактивные изменения поджелудочной железы, несмотря на грозное название, не происходят сами по себе и отдельным недугом не считаются. Они являются ответной реакцией этого органа на некие иные недуги органов желудочно-кишечного тракта, а также на неблагоприятные воздействия, которые претерпевает детский организм.
Сама по себе поджелудочная железа – вторая во величине в области живота после печени, обеспечивает выполнение двух важнейших процессов – она вырабатывает необходимый для усвоения сахара инсулин и продуцирует панкреатическую жидкость, без которой пищеварительный процесс не может быть нормальным.
По протокам эта жидкость стекает в двенадцатиперстную кишку.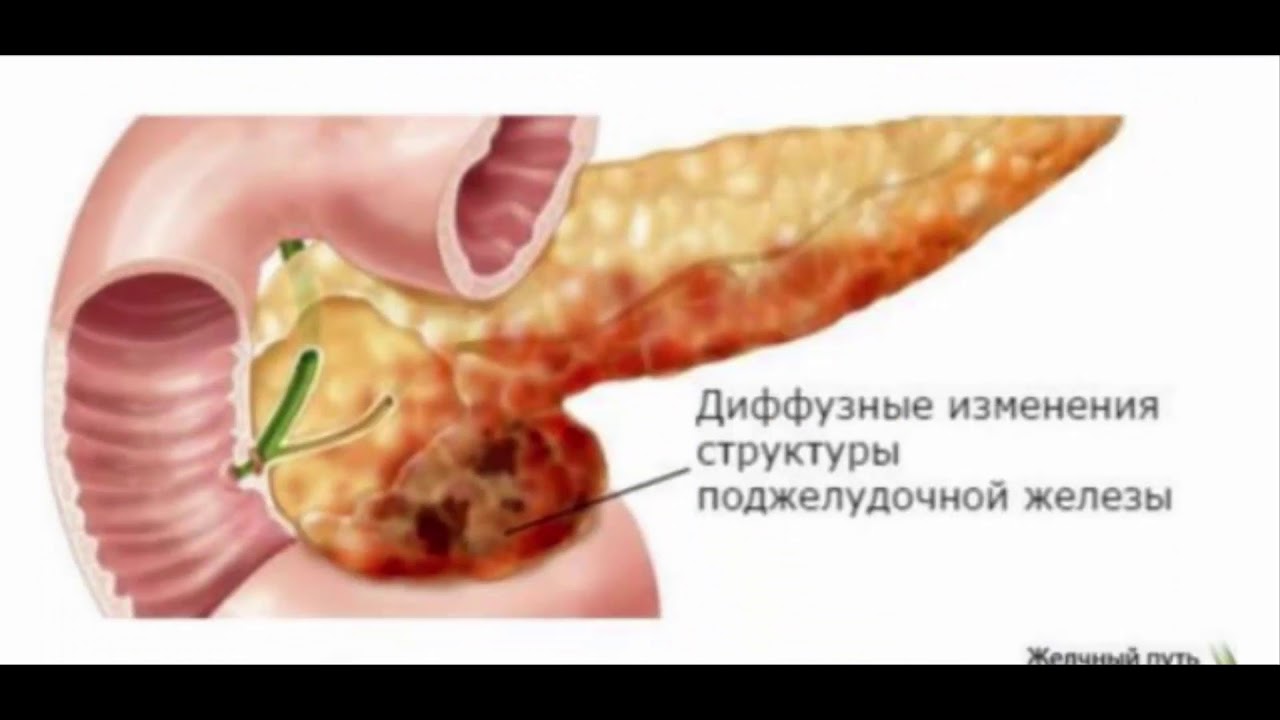 Состояние этих протоков имеет огромное значение для работы поджелудочной железы. Поскольку все органы ЖКТ сообщаются посредством сети протоков, то любой недуг одного из них незамедлительно сказывается на работе поджелудочной, вызывая реактивные изменения.
Состояние этих протоков имеет огромное значение для работы поджелудочной железы. Поскольку все органы ЖКТ сообщаются посредством сети протоков, то любой недуг одного из них незамедлительно сказывается на работе поджелудочной, вызывая реактивные изменения.
Число детей, у которых врачи находят такие изменения, растет. Ученые полагают, что есть в этом определенная толика влияния ухудшающейся экологии, обилия консервантов и красителей даже в детском питании.
Причины возникновения
Ферменты, которые вырабатывает поджелудочная железа, становятся активными только тогда, когда соединяются с жидкостной средой кишечника. Однако при заболеваниях органов пищеварения возможен вброс жидкости из двенадцатиперстной кишки.
Однако при заболеваниях органов пищеварения возможен вброс жидкости из двенадцатиперстной кишки.
Соприкосновение с ней активизирует ферменты раньше времени, до их попадания в кишечник. Начинается активный процесс пищеварения не там, где нужно, и поджелудочная по сути начинает переваривать сама себя. Это в медицине называется реактивным панкреатитом, и такое изменение считается самым распространенным
Спровоцировать реактивные изменения могут самые разнообразные заболевания, такие, как гастрит, гепатит, проблемы с желчным пузырем, гастродуоденит. Причинами развития реактивных изменений в поджелудочной могут стать нарушения питания – малыш недостаточно хорошо кушает или, наоборот, объедается, ему разрешается злоупотреблять фаст-фудом, чипсами, сухариками и сомнительными сладостями с массой красителей и ароматизаторов.
Поджелудочная железа может увеличиться, в ней могут начаться патологические процессы в ответ на некоторые инфекционные заболевания вроде кори или скарлатины, на отравление токсинами, прием медикаментов, особенно на длительное употребление антибиотиков. Иногда «стартовым» механизмом, запускающим реактивные изменения выступают аутоиммунные патологические процессы в организме.
В детском и подростковом возрасте не исключается и психогенный фактор – поджелудочная может претерпевать функциональные нарушения, как говорится, на нервной почве, после пережитого сильного стресса.
Опасность
Реактивные изменения в поджелудочной железе лишь отражают факт наличия другой болезни, но и сами по себе способны доставлять неприятные ощущения. У детей может развиться достаточно выраженный болевой синдром, нарушиться пищеварение, а также увеличиться уровень сахара в крови.
У детей может развиться достаточно выраженный болевой синдром, нарушиться пищеварение, а также увеличиться уровень сахара в крови.
Поджелудочная железа, подверженная таким деструктивным процессам увеличивается в размерах, может отекать. У ребенка может развиваться рвота, диарея, несварение, его могут беспокоить тянущие боли в верхней части живота. Однако в подавляющем большинстве случаев реактивные изменения протекают без симптомов вообще и становятся «находкой» на УЗИ органов ЖКТ.
Симптомы
О проблемах с поджелудочной железой могут свидетельствовать следующие признаки:
Боли в верхней части живота, в районе желудка, которые несколько стихают, если ребенок принимает сидячее положение с небольшим наклоном туловища вперед.
Рвотные массы с непереваренными кусочками пищи.
 Облегчения такая рвота не приносит.
Облегчения такая рвота не приносит.Возможно повышение температуры тела.
Частый понос. Каловые массы имеют водянистую консистенцию, неприятный резкий запах. Если реактивные изменения присутствуют уже давно, то стул ребенка хронически нестабилен – диарея сменяется запорами и наоборот.
Сухость во рту, при осмотре ротовой полости обнаруживается молочный налет на языке.
Изменение аппетита. Ребенок начинает мало и нерегулярно есть, отказывается даже от тех блюд, которые раньше ему нравились.

Регулярная отрыжка, повышенное газообразование, метеоризм, вздутие живота.
Повышенная утомляемость, снижение общего тонуса организма.
Диагностика
Признаки вторичных диффузных изменений могут обнаружиться на ультразвуковом исследовании органов брюшной полости. Норму размеров органа по УЗИ можно оценить только по специальным врачебным таблицам, которые составлены с учетом возраста, пола и веса ребенка. У новорожденного и грудничка в среднем размеры железы по УЗИ в норме – 4-5 сантиметров. К 10-летнему возрасту размеры поджелудочной увеличиваются до 15 сантиметров.
Аномалии паренхимы выражаются не только в превышении верхней границы возрастной нормы по размеру, но и в очертаниях, контурах органа. Если диагност указывает в заключении, что у ребенка диффузные изменения, это означает, что реактивное состояние равномерно распространено по всему органу. Отдельных очагов патологии не наблюдается.
Если диагност указывает в заключении, что у ребенка диффузные изменения, это означает, что реактивное состояние равномерно распространено по всему органу. Отдельных очагов патологии не наблюдается.
Впрочем, ультразвуковое исследование не дает точной картины происходящего. Поэтому при возникновении сомнений у врача назначаются уточняющие анализы:
клинический анализ крови на биохимию позволяет установить признаки возможного воспаления;
анализ мочи показывает, нет ли в образце выделительной жидкости несвойственных этой среде ферментов пищеварения;
эндоскопическое исследование двенадцатиперстной кишки позволяет судить о равномерности и структуре слизистой оболочки в районе стыка протоков.
Лечение
Умеренные реактивные изменения обычно не нуждаются в отдельной специальной терапии. Обычно все приходит в норму следом за тем, как будет завершено лечение основного недуга желудочно-кишечного тракта, который и повлек за собой нарушения работы поджелудочной.
Обычно все приходит в норму следом за тем, как будет завершено лечение основного недуга желудочно-кишечного тракта, который и повлек за собой нарушения работы поджелудочной.
Тяжелые диффузные изменения паренхимы железы лечат в стационарных условиях под постоянным наблюдением врача. Терапия включает в себя спазмолитики («Но-шпу», «Папаверин») для уменьшения болевых ощущений, ферментные препараты («Панкреатин» и другие), а также витамины и минералы. Ребенку также могут быть назначены антигистаминные средства для снятия симптомов аллергии, которая, если присутствует, ухудшает его состояние.
Обязательное условие выздоровления – строгая диета. При выраженной боли и рвоте ребенку устраивают 1-2 дня лечебного голодания, а потом вводят пищу постепенно.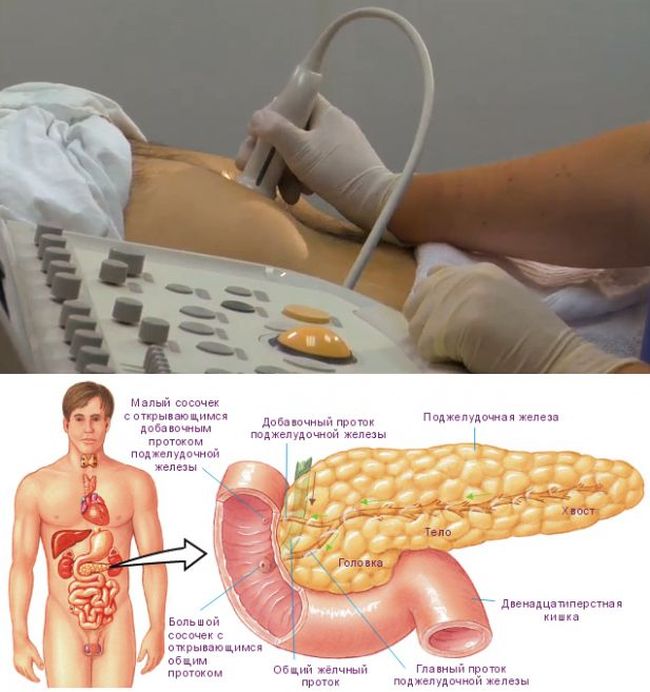 Диета исключает жареные и жирные продукты и блюда, газированные напитки, какао и шоколад, копчености и консервы, маринованные продукты. Полезны овощные супы, каши, кисель, компоты с небольшим содержанием сахара, свежие овощи и фрукты.
Диета исключает жареные и жирные продукты и блюда, газированные напитки, какао и шоколад, копчености и консервы, маринованные продукты. Полезны овощные супы, каши, кисель, компоты с небольшим содержанием сахара, свежие овощи и фрукты.
В дни лечебного голодания ребенку разрешены только теплые негазированные минеральные воды с повышенным содержанием солей – «Боржоми», «Ессентуки» и т. д.
Профилактика
Избежать проблем с поджелудочной железой довольно просто, чего нельзя сказать о лечении реактивных изменений. Родители должны следить за тем, сколько и чего ест ребенок. Питание должно быть регулярным, достаточным, сбалансированным. Нельзя перекармливать малыша.
Нельзя перекармливать малыша.
При возникновении любых симптомов несварения, болей в животе, желательно показать ребенка врачу, чтобы исключить заболевания желудочно-кишечного тракта или обнаружить их и пролечить вовремя, пока поджелудочная не успела отреагировать на них реактивными изменениями паренхимы.
Все о проблемах поджелудочной железы у ребенка и не только смотрите в следующем выпуске программы доктора Комаровского.
Диффузные изменения поджелудочной железы – норма или патология?
Ультразвуковое обследование органов – стандартный метод диагностирования, применяемый в каждой поликлинике. Его рекомендуется проходить не только больным, но и здоровым людям в качестве профилактической меры при медицинском осмотре. Зачастую в заключении врача-диагноста мы видим такую фразу: диффузные изменения паренхимы печени и поджелудочной железы. Но что это за диагноз и представляет ли это угрозу для здоровья? Давайте разберёмся.
Его рекомендуется проходить не только больным, но и здоровым людям в качестве профилактической меры при медицинском осмотре. Зачастую в заключении врача-диагноста мы видим такую фразу: диффузные изменения паренхимы печени и поджелудочной железы. Но что это за диагноз и представляет ли это угрозу для здоровья? Давайте разберёмся.
Что это означает
Метод ультразвуковой диагностики основан на отражающей способности тканей нашего организма. Звуковые волны, достигнув того или иного образования, встречают на своём пути препятствие. Чем плотнее это препятствие, тем больше звуковых волн будет отражено, тем меньше волн пройдёт через всё тело, и наоборот.
Таким образом, основа всей ультразвуковой диагностики – различная плотность тканей человеческого организма. В норме каждый орган имеет одну и ту же плотность во всех участках. В этом случае говорят о гомогенной плотности паренхимы без диффузных изменений ткани.
Если в нём возникает какой-то патологический процесс – воспаление, нарушения реологических свойств жидкости, обменные нарушения — то датчик воспринимает эти очаги как участки различных плотностей в пределах одного органа. Это и называют диффузными изменениями.
Это и называют диффузными изменениями.
Признак помогающий определить участок поражения
Вернёмся к поджелудочной железе. Так же как и другие органы, железа в норме имеет однородную структуру ткани. Если она воспаляется, подвергается жировому перерождению, если в ней образуются участки петрификатов и кальцификатов, то в заключении УЗИ врач напишет фразу «диффузные изменения паренхимы поджелудочной железы». Так как поджелудочная железа находится в непосредственной близости от печени и билиарной системы, то наиболее часто в заключении пишется «диффузные изменения печени и поджелудочной железы».
Так как перестройки наблюдаются при многих патологических процессах, это заключение не может быть диагнозом. Это лишь признак, указывающий, что в органах имеется патология и больной нуждается в дальнейшем обследовании.
Важно! Диффузные изменения органа – это не диагноз, и даже не симптом. Это лишь признак, помогающий врачу определить участок поражения железы, поставить предварительный диагноз и назначить дополнительные лабораторные анализы и инструментальные методы обследования.
Формы диффузных изменений в печени и поджелудочной железе
- Жировое перерождение — липоматоз. Эта патология распространена среди всех людей преклонного возраста. При этом происходит замещение нормальной паренхимы поджелудочной железы на жировую ткань. Панкреатоциты замещаются адипоцитами. Проблема состоит в том, что адипоциты не способны выполнять те же внутрисекреторные и внешнесекреторные функции, присущие поджелудочной железе. Данный симптом встречается и у молодых или зрелых людей, страдающих сахарным диабетом. Сама поджелудочная железа при этом становится более плотная, у больного наблюдаются незначительные симптомы ферментной недостаточности. В заключении врач указывает: диффузные изменения поджелудочной железы по типу липоматоза.
- Диффузное замещение паренхимы поджелудочной железы и печени соединительной тканью. Данный процесс получил название «фиброзирование». Перерождение паренхимы обусловлено воспалительным процессом или нарушениями общего обмена веществ.
 При этом воспалённые или ишемизированные участки замещаются соединительной тканью, которая также не способна выполнять функции поджелудочной железы.
При этом воспалённые или ишемизированные участки замещаются соединительной тканью, которая также не способна выполнять функции поджелудочной железы.
Таким образом, причинами возникновения диффузных изменений могут быть:
- Панкреатит любой формы и этиологии.
- Сахарный диабет как первого, так и второго типов.
- Нарушения обмена веществ и системные заболевания, которые протекают с нарушениями общего обмена.
- Вторичные воспалительные процессы, переходящие с других органов.
- Хронические интоксикации – бесконтрольное потребление лекарственных препаратов, хронические заболевания пищеварительной системы, злоупотребление спиртных напитков, курение.
Предрасполагает к перерождению паренхимы пожилой и старческий возраст, неправильное питание и нарушение диеты, наследственная предрасположенность, частые стрессовые ситуации.
Важно! При тяжёлых состояниях – раковое перерождение, кисты и конкременты выводных протоков – заключение о наличии диффузных изменений не правомерно.
Они могут быть только при хронических обменных, токсических или воспалительных заболеваниях, затрагивающих весь орган полностью, а не только его определённый участок.
Виды диффузных изменений
Диффузные перестройки могут быть двух видов: умеренные и выраженные.
Умеренные диффузные изменения поджелудочной железы наблюдаются при начальных стадиях фиброза и липоматоза. Перерождение ткани ещё не выражено, симптомов ферментной недостаточности не наблюдается. Наиболее частая причина умеренных изменений – лёгкая форма панкреатита и отёк поджелудочной железы. Выявляются они редко, в подавляющем большинстве случаев случайно на профилактическом медицинском осмотре. Специального лечения не требуется. Для предотвращения дальнейшего прогрессирования процесса достаточно консервативной терапии.
Выраженные изменения имеются при запущенных состояниях и хронических заболеваниях с длительным анамнезом. Они, как правило, уже не обратимы. У больного имеются симптомы ферментной недостаточности. Для лечения помимо консервативной терапии врачом назначается заместительная ферментная терапия и терапия лекарственными препаратами. Данные методы являются симптоматическим лечением. В дополнение проводится этиотропное лечение – терапия основного заболевания.
Для лечения помимо консервативной терапии врачом назначается заместительная ферментная терапия и терапия лекарственными препаратами. Данные методы являются симптоматическим лечением. В дополнение проводится этиотропное лечение – терапия основного заболевания.
Изменения при панкреонекрозе и панкреатите на УЗИ
Острый панкреатит
При остром воспалении нарушается нормальный отток секрета. При этом он забрасывается обратно в протоки, откуда попадает в паренхиму. Этот рефлюкс приводит к тому, что ткань железы переваривается под действием собственных ферментов, сам орган отекает. На УЗИ это отражается понижением плотности ткани, увеличением размеров поджелудочной железы. Протоки при этом могут быть без патологии, в некоторых случаях в них обнаруживаются конкременты или стриктуры, мешающие оттоку ферментов.
Хронический панкреатит
При хроническом воспалительном процессе в стадии ремиссии и при панкреонекрозе плотность ткани повышается, паренхима становится более рыхлая из-за разрастающейся соединительной ткани. Размеры самого органа при этом не изменяются, отёк капсулы и паренхимы не наблюдается. Выводные протоки также без патологии.
Размеры самого органа при этом не изменяются, отёк капсулы и паренхимы не наблюдается. Выводные протоки также без патологии.
Изменения при сахарном диабете на УЗИ
При диабете нормальная железистая ткань замещается жировой. Это же наблюдается у здоровых людей в преклонном и пожилом возрасте. Жировая ткань обладает более высокими звукоотталкивающими способностями, чем соединительная ткань и ткань поджелудочной железы. Поэтому, если в заключении врач написал о диффузных изменениях поджелудочной железы с повышенной эхогенностью, то предполагают наличие липоматоза.
Что делать?
Если по заключению УЗИ вам было диагностировано наличие диффузных изменений, не нужно паниковать. Это не диагноз, зачастую они диагностируются у здоровых людей. В подавляющем большинстве случаев наличие диффузных перестроек – хорошая новость, так как они не возникают при серьёзных патологиях: рак, киста, абсцесс.
Если у вас не беспокоят боли в животе, понос, метеоризм и вздутие живота, то достаточно выяснить первопричину и скорректировать рацион питания. Если вышеуказанные симптомы вас беспокоят, то проводят полный спектр исследований для выявления заболевания, назначения соответствующего лечения.
Если вышеуказанные симптомы вас беспокоят, то проводят полный спектр исследований для выявления заболевания, назначения соответствующего лечения.
Принципы лечения
Лечения непосредственно самих диффузных изменений не существует. Не устраняются они и при оперативном вмешательстве, так как тотальное удаление поджелудочной железы проводят в крайних ситуациях.
Если диффузные изменения возникли на фоне полного здоровья, и обследование не показало наличия каких-либо нозологических заболеваний, то для лечения вам достаточно соблюдения диеты.
Диета и основы питания:
- Частые приёмы пищи — до 5-6 раз в день небольшими порциями.
- Тёплая температура подаваемых блюд.
- Исключение из рациона жирного, жареного. Не рекомендуется включать раздражающую пищу: острое, маринованное, солёное, пряное, сладкое.
- Блюда готовятся на пару или отвариваются.
- Основной упор при выборе продуктов нужно делать на овощи, мясо нежирных сортов, зерновые культуры.

- Отказ от приёма спиртных напитков, курения.
Если пациент предъявляет жалобы на нарушения пищеварения, боли в животе, то ему проводят полный спектр диагностических исследований. После выявления основного заболевания, установления диагноза назначается лечение, в ходе которого лечатся и диффузные изменения.
Помимо диеты, отказа от курения и алкоголя, больному прописывают симптоматические и средства и препараты для устранения патологии.
Симптоматические лекарственные средства:
- Заместительная ферментная терапия препаратами пищеварительных ферментов: Фестал, Панкреатин. Они устраняют диспепсические расстройства: тяжесть в животе, понос, вздутие живота.
- Анальгетики ряда нестероидных противовоспалительных препаратов: Найз, Кетонов, Диклофенак, Ибупрофен. Их пьют в период ощущения острых боле в животе.
- Препараты для усиления перистальтики: Метоклопрамид, Домперидон, Церукал.
Патогенетическая терапия для устранения основного заболевания подбирается индивидуально, в зависимости от нозологической группы патологии.
Полезное видео: Диффузные изменения поджелудочной железы, выявленные при ультразвуковом исследовании
Способ верификации диагноза заболеваний поджелудочной железы
Изобретение относится к медицине и может быть использовано в клинике внутренних болезней, в гепатологии и отделениях лучевой диагностики как референтный метод верификации диагноза вместо биопсии.
В настоящее время для верификации диагноза заболеваний поджелудочной железы используют аппаратные методы исследования, а именно: трансабдоминальный ультразвук (Борсуков А.В., Иванов Ю.В., Мамошин А.В. Патент на изобретение №2280408 «Способ выявления некроза при остром деструктивном панкреатите»), эндосонографию (Дж. Шайман, Парта С. Нанди. «Эндоскопическая ультрасонография поджелудочной железы» // Ультразвуковая диагностика в хирургии: основные сведения и клиническое применение. – М.: БИНОМ. Лаборатория знаний, 2012. – с. 404-409; «Кистозные опухоли поджелудочной железы: диагностика и лечение / В.А. Кубышкин, Г.Г. Кармазановский, С.А. Гришанков. – М.: Издательский дом Видар – М. 2013. – с.101-104, с.126, с.145).
– М.: БИНОМ. Лаборатория знаний, 2012. – с. 404-409; «Кистозные опухоли поджелудочной железы: диагностика и лечение / В.А. Кубышкин, Г.Г. Кармазановский, С.А. Гришанков. – М.: Издательский дом Видар – М. 2013. – с.101-104, с.126, с.145).
Но для верификации диагноза псевдотуморозного панкреатита и злокачественных новообразований необходимо дополнительно проводить пункционную биопсию поджелудочной железы («Малоинвазивные технологии под ультразвуковой навигацией в современной клинической практике» под редакцией А.В. Борсукова и В.Н. Шолохова, Смоленск 2009 г. – с. 87-88).
Однако пункционная биопсия обладает рядом недостатков. Это инвазивность, плохая переносимость пациентами, противопоказания к проведению данной манипуляции.
Техническим результатом использования изобретения является упрощение верификации диагноза за счет проведения компрессионной эластографии одновременно с эндосонографией.
Сущность предлагаемого способа верификации диагноза заболеваний поджелудочной железы, включающего трансабдоминальное ультразвуковое исследование и эндосонографию, состоит в том, что одновременно с эндосонографией проводят компрессионную эластографию поджелудочной железы, последовательно устанавливая конвексный датчик при диффузном характере изменений в месте проекции головки поджелудочной железы, а именно: в нисходящей части, верхушке луковицы и в луковице 12-перстной кишки, в месте проекции тела поджелудочной железы в антральном отделе и теле желудка, в месте проекции хвоста поджелудочной железы в дне желудка, при очаговом характере изменений датчик поочередно устанавливают в месте проекции головки и тела поджелудочной железы в очаговой, перифокальной и внеперифокальных зонах, рассчитываются коэффициенты разницы компрессионной эластографии SR, и при коэффициенте разницы меньше 10 у. е. подтверждают диагноз хронического панкреатита, при коэффициенте разницы в пределах 11-25 у.е. – диагноз псевдотуморозного панкреатита, при коэффициенте разницы более 25 у.е. – злокачественное новообразование поджелудочной железы.
е. подтверждают диагноз хронического панкреатита, при коэффициенте разницы в пределах 11-25 у.е. – диагноз псевдотуморозного панкреатита, при коэффициенте разницы более 25 у.е. – злокачественное новообразование поджелудочной железы.
Способ осуществляют с помощью ультразвукового аппарата «HITACHI Prerius» и эндоскопа с конвексным датчиком «PENTAX EG 387OUTK».
После установки предварительного клинического диагноза проводят трансабдоминальное ультразвуковое исследование и эндосонографию поджелудочной железы, где уточняют диффузный или очаговый характер изменений в паренхиме.
При диффузном характере изменений (хроническом панкреатите и псевдотуморозном панкреатите) проводят компрессионную эластографию при эндосонографии по программе №1: в месте проекции головки поджелудочной железы, а именно: в нисходящей части, верхушке луковицы и в луковице 12-перстной кишки, в месте проекции тела поджелудочной железы в антральном отделе и теле желудка, в месте проекции хвоста поджелудочной железы – в дне желудка.
При очаговом характере изменений в паренхиме проводят компрессионную эластографию при эндосонографии по программе №2 в 3-х зонах: 1-ая зона – очаг, 2-ая – перифокальная зона, 3-я – внеперифокальная зона (зона неизмененной паренхимы органа), устанавливая конвексный датчик эндоскопа в зависимости от топографии очагового образования в область проекции головки, тела, хвоста поджелудочной железы.
По мере движения датчика от зоны к зоне рассчитываются коэффициенты разницы компрессионной эластографии SR, выдаваемые дисплеем аппарата. При коэффициенте разницы меньше 10 у.е. верифицируют диагноз хронического панкреатита, в пределах 11-25 у.е. – диагноз псевдотуморозного панкреатита, более 25 у.е. – злокачественное новообразование поджелудочной железы.
Пример №1: Больной Ф., 37 лет, история болезни № 4178
Госпитализирован в гастроэнтерологическое отделение ОГБУЗ «Клиническая больница №1» 27 сентября 2011 года с предварительным диагнозом: Обострение хроническго панкреатита. Эрозивный гастрит. В анамнезе сезонные обострения хронического гастрита, периодическое злоупотребление алкоголем.
Эрозивный гастрит. В анамнезе сезонные обострения хронического гастрита, периодическое злоупотребление алкоголем.
Жалобы: на снижение аппетита, боли ноющего характера в эпигастральной области, тошноту, слабость.
Объективно: кожные покровы телесного цвета, язык обложен белым налетом, в легких дыхание везикулярное, хрипов нет. Тоны сердца ритмичные. Живот мягкий, при пальпации болезненный в эпигастральной области. Печень по краю реберной дуги.
Общий анализ крови: умеренный лейкоцитоз.
Общий анализ мочи: без патологии.
Инфицирования гепатотропными вирусами не установлено: (HBsAg, antiHCV Ag отр.).
Биохимический анализ крови: общий белок 79 г/л, билирубин 15 мкм/л, АЛТ 44 ЕД/л, ACT 52 ЕД/л, ЩФ 98 ЕД/л, ГГТ 101 ЕД/л, α – амилаза 450 мкмоль/л, p – амилаза 155 мкмоль/л
Ультразвуковое трансабдоминальное исследование поджелудочной железы
Заключение. Размеры поджелудочной железы: головка 23 мм, тело 23 мм, хвост 19 мм. Контуры нечеткие, неровные. Выраженные диффузные изменения паренхимы поджелудочной железы. УЗ – признаки обострения хронического панкреатита? Псевдотуморозный панкреатит?
Контуры нечеткие, неровные. Выраженные диффузные изменения паренхимы поджелудочной железы. УЗ – признаки обострения хронического панкреатита? Псевдотуморозный панкреатит?
Эндосонография поджелудочной железы проводилась по стандартной методике с позиционированием конвексного датчика эндоскопа в проекции головки, тела и хвоста поджелудочной железы.
Заключение. Эндосонографические признаки выраженных диффузных изменений паренхимы поджелудочной железы. Вирсунгов проток – 5 мм (расширен) в головке и теле. Локальный панкреатостаз. Нельзя исключить формирование псевдотуморозного панкреатита.
При проведении компрессионной эластографии при эндосонографии поджелудочной железы конвексный датчик последовательно устанавливали по программе №1, а именно: в месте проекции головки поджелудочной железы, а именно в нисходящей части, верхушке луковицы и в луковице 12-перстной кишки, в месте проекции тела поджелудочной железы: в антральном отделе и теле желудка, в месте проекции хвоста поджелудочной железы – в дне желудка. При этом были получены следующие коэффициенты разницы SR: в головке поджелудочной железы 9,8 у.е., в теле – 8,2 у.е., в хвосте – 9,6 у.е., что подтвердило наличие хронического панкреатита.
При этом были получены следующие коэффициенты разницы SR: в головке поджелудочной железы 9,8 у.е., в теле – 8,2 у.е., в хвосте – 9,6 у.е., что подтвердило наличие хронического панкреатита.
Референтным методом для проверки полученных данных по эластографии поджелудочной железы явился метод пункционной биопсии поджелудочной железы с последующим гистологическим исследованием полученного биоптата.
Гистологическое исследование биоптата.
Заключение. В присланном материале из ткани поджелудочной железы (пункционная биопсия) морфологическая картина хронического панкреатита (стекло №23478). Данные морфологического исследования подтверждают диагноз хронического панкреатита.
Пример №2: Больной К., 49 лет, история болезни № 2450
Госпитализирован в хирургическое отделение ОГБУЗ «Клиническая больница №1» 18 мая 2012 года с предварительным диагнозом: Хронический панкреатит. В анамнезе имело место постоянное злоупотребление алкоголем.
Жалобы: на умеренную диспепсию, опоясывающие боли в эпигастральной области, тяжесть и ноющие боли в правом подреберье, сухость и горечь во рту, тошноту, выраженную общую слабость.
Объективно: кожные покровы бледные, в легких дыхание везикулярное, хрипов нет. Тоны сердца ритмичные, приглушены. Живот вздут, при пальпации болезненный в эпигастральной области. Печень выступает из-под края реберной дуги на 3,5 см.
Общий анализ крови: сдвиг лейкоцитарной формулы влево, умеренный лейкоцитоз.
Общий анализ мочи: без патологии.
Инфицирования гепатотропными вирусами не установлено: (HBsAg, antiHCV Ag отр.).
Биохимический анализ крови: общий белок 79 г/л, билирубин 15 мкм/л, АЛТ 58 ЕД/л, ACT 62 ЕД/л, ЩФ 100 ЕД/л, ГТТ 199 ЕД/л, α – амилаза 850 мкмоль/л, p – амилаза 190 мкмоль/л
Ультразвуковое трансабдоминальное исследование поджелудочной железы
Заключение. Размеры поджелудочной железы: головка 23 мм, тело 21 мм, хвост 22 мм. Диффузные изменения паренхимы поджелудочной железы, локальное уплотнение паренхимы поджелудочной железы. УЗ – признаки хронического панкреатита.
Диффузные изменения паренхимы поджелудочной железы, локальное уплотнение паренхимы поджелудочной железы. УЗ – признаки хронического панкреатита.
Эндосонография поджелудочной железы проводилась по стандартной методике с позиционированием конвексного датчика эндоскопа в проекции головки, тела и хвоста поджелудочной железы.
Заключение. Эндосонографические признаки диффузных изменений паренхимы поджелудочной железы, локального уплотнения головки и тела поджелудочной железы. Вероятнее, больше данных за хронический панкреатит.
При проведении компрессионной эластографии при эндосонографии поджелудочной железы конвексный датчик последовательно устанавливали по программе №1, а именно: в месте проекции головки поджелудочной железы, а именно в нисходящей части, верхушке луковицы и в луковице 12-перстной кишки, в месте проекции тела поджелудочной железы: в антральном отделе и теле желудка, в месте проекции хвоста поджелудочной железы – в дне желудка. При этом были получены следующие коэффициенты разницы SR: в головке поджелудочной железы 20 у. е., в теле – 19 у.е., в хвосте – 22 у.е. Коэффициент разницы верифицировал диагноз псевдотуморозного панкреатита.
е., в теле – 19 у.е., в хвосте – 22 у.е. Коэффициент разницы верифицировал диагноз псевдотуморозного панкреатита.
Референтным методом для проверки полученных данных по эластографии поджелудочной железы явился метод пункционной биопсии поджелудочной железы с последующим гистологическим исследованием полученного биоптата.
Гистологическое исследование биоптата.
Заключение. В присланном материале из ткани поджелудочной железы (пункционная биопсия) морфологическая картина псевдотуморозного панкреатита (стекло №295701). Данные морфологического исследования подтверждают диагноз псевдотуморозного панкреатита.
Пример №3: Больной И., 62 года, история болезни № 3642
Госпитализирован в хирургическое отделение ОГБУЗ «Клиническая больница №1» 10 августа 2013 года с предварительным диагнозом: Хронический панкреатит в стадии обострения. В анамнезе – злоупотребление алкоголем отрицает.
Жалобы: на слабость, недомогание, умеренную диспепсию, тяжесть и боли в эпигастральной области в течение дня, не связывает с приемом пищи. Аппетит снижен, тошнота.
Аппетит снижен, тошнота.
Объективно: в легких дыхание везикулярное, хрипов нет. Сердце – без особенностей. Живот мягкий, при пальпации болезненный в эпигастральной области. Печень не увеличена.
Общий анализ крови: повышено СОЭ, лейкопения.
Общий анализ мочи: без видимой патологии.
Биохимический анализ крови: общий белок 79 г/л, билирубин 15 мкм/л, АЛТ 38 ЕД/л, ACT 40 ЕД/л, ЩФ 78 ЕД/л, ГГТ 182 ЕД/л
Ультразвуковое трансабдоминальное исследование поджелудочной железы
Заключение. Размеры поджелудочной железы: головка 31 мм, тело 24 мм, хвост 20 мм. Размеры Вирсунгова протока – 4 мм. УЗ – признаки увеличения размеров головки поджелудочной железы, панкреатостаз. Выраженные диффузные изменения паренхимы поджелудочной железы, неоднородность структуры паренхимы. Панкреатостаз. Подозрение на псевдотуморозный панкреатит.
Эндосонография поджелудочной железы проводилась по стандартной методике с позиционированием конвексного датчика эндоскопа в проекции головки, тела и хвоста поджелудочной железы.
Заключение. В месте проекции головки поджелудочной железы очаговое образование до 10 мм, в теле до 11 мм эндосонографические признаки очагового образования головки поджелудочной железы, нельзя исключить очаговые образования тела. Выраженные диффузные изменения паренхимы поджелудочной железы, деформация главного панкреатического протока. Псевдотуморозный панкреатит? Злокачественное новообразование поджелудочной железы?
При проведении компрессионной эластографии при эндосонографии поджелудочной железы исследовали зону очага, перифокальную зону и внеперифокальную зону. Конвексный датчик эндоскопа в указанных зонах устанавливали в месте проекции головки и тела.
Были получены результаты: в головке поджелудочной железы 102 у.е., в теле – 98 у.е., в хвосте – 26 у.е. Коэффициент разницы подтвердил диагноз рака головки и тела поджелудочной железы.
Референтным методом для проверки полученных данных по эластографии поджелудочной железы явился метод пункционной биопсии поджелудочной железы с последующим гистологическим исследованием полученного биоптата.
Гистологическое исследование биоптата. Заключение. В присланном материале из ткани поджелудочной железы (пункционная биопсия) морфологическая картина аденокарциномы поджелудочной железы (стекло №156240). Данные морфологического исследования подтверждают диагноз рака поджелудочной железы (аденокарцинома).
В городском отделении диагностических исследований и малоинвазивных вмешательств при ОГБУЗ «Клиническая больница №1» предложенный способ верификации заболеваний поджелудочной железы применен у 27 больных.
Данные представлены в таблице.
Полученные данные проверялись референтным методом в гастроэнтерологии и хирургии: пункциями поджелудочной железы под ультразвуковым контролем у 19 пациентов. Данные имели статистически достоверную корреляционную связь между гистологическим заключением и данными компрессионной эластографии при эндосонографии выявленных изменений в поджелудочной железе.
Таким образом, проведение компрессионной эластографии одновременно с эндосонографией поджелудочной железы позволяет верифицировать злокачественные новообразования поджелудочной железы, своевременно и достоверно дифференцировать хронический и псевдотуморозный панкреатит. Способ отличается простотой, является малоинвазивным и достоверным, не требует дополнительных манипуляций, хорошо переносится больными и может найти широкое применение в клинической практике.
Способ отличается простотой, является малоинвазивным и достоверным, не требует дополнительных манипуляций, хорошо переносится больными и может найти широкое применение в клинической практике.
умеренные, признаки и эхопризнаки, структура
Диффузные изменения паренхимы поджелудочной железы могут указывать на сбой в работе внутренних органов. Пациент обращается к врачу, если ухудшается общее самочувствие, возникает рвота, боль в животе под ребрами. Диффузные изменения в паренхиме поджелудочной железы указывают на дегенеративно-дистрофические процессы, происходящие в этом органе. Неоднородность структуры поджелудочной — признак недуга, при котором нарушается кровообращение или отток желчи.
Причины патологических реакций
При развитии болезни печени или органов ЖКТ здоровая ткань поджелудочной замещается недееспособной. Могут наблюдаться диффузные изменения железы на фоне повышенной эхогенности. Если орган становится меньше по размеру, значит происходят дегенеративно-дистрофические реакции хронического характера, еще одна причина уменьшения — естественное старение. Эхопризнаки диффузных изменений паренхимы поджелудки указывают на панкреатит, патологии печени или ЖКТ. Железа также поражается, если наблюдается неправильный отток желчи. Причины диффузионных реакций:
- плохое питание;
- регулярные психоэмоциональные нагрузки;
- переутомление;
- поднятие тяжестей;
- вредные привычки;
- сопутствующие патологии ЖКТ;
- бесконтрольный прием лекарств.
Диффузные изменения паренхимы поджелудочной указывают на патологию или сбой в функционировании внутренних органов. При развитии недуга на снимке можно увидеть, что данный орган имеет уплотненную структуру. Такая картина свидетельствует о воспалительных патологиях.
Симптомы заболевнаия
У человека может отсутствовать аппетит, часто возникают проблемы со стулом. Диффузные изменения поджелудочной нередко вызваны панкреатитом. При прогрессировании этой болезни в тканях создается давление. Неправильный выход ферментов влечет за собой отравление.
Патология провоцирует боли в животе, появляется тошнота, рвота.
Одним из основных признаков будет одышка, патология также приводит к повышению артериального давления. В зависимости от характера клинических проявлений пациенту назначается интенсивная терапия или операция. Если развивается хронический панкреатит, паренхима поджелудочной железы повреждается и отекает. В дальнейшем она уменьшается, нарушается выработка пищеварительных ферментов. Прогрессирование хронического панкреатита сопровождается сильными болями вверху живота.
Фиброз и липоматоз
В результате диффузных изменений паренхимы поджелудочной железы патология развивается под воздействием фиброза. Вначале недуг протекает скрыто, затем главным признаком является воспаление, при котором нормальная ткань замещается соединительной. Поджелудочная железа начинает вырабатывать меньше гормонов, которые нужны для осуществления обмена веществ. Эту патологию можно спутать с панкреатитом. Если она прогрессирует, возникает боль в подреберье. Нехватка ферментов провоцирует тошноту, рвоту. Если истощаются белковые запасы, нарушается производство инсулина, развивается диабет.
Изменения паренхимы поджелудочной могут случиться вследствие липоматоза — патологической реакции, при которой здоровые ткани поджелудочной замещаются на патологические, которые не способны выполнять жизненно важные функции, организм теряет вещества, которые нужны для слаженной работы всех систем. Симптомы зависят от того, насколько выражены диффузные изменения. Недуг может протекать скрыто. В дальнейшем при его прогрессировании паренхима сдавливается патологической тканью, появляются боли в верхней части живота.
В процессе УЗИ-диагностики врач может определить неоднородность структур или повышенную эхогенность органа. Если в результате УЗИ была выявлена повышенная или пониженная эхогенность, требуется сдать анализы крови. В дальнейшем подозреваемая патология подтверждается или опровергается.
Что еще можно увидеть на снимке
Эхопризнаки позволяют выявить плотность и структуру поджелудочной. Если орган функционирует хорошо, эхогенность в норме. Она повышается при патологических реакциях, связанных с тканью поджелудочной. Эхопризнаки диффузных изменений часто указывают на фиброз — недуг при котором происходит рубцевание. На снимке видно, что структура ткани неоднородная. Распространенная причина патологии — нарушение обмена веществ.
Панкреатит изменяет плотность паренхимы, в результате чего повышается эхогенность. Поджелудочная железа взаимодействует с печенью. Если в печени случаются какие-либо изменения, это отражается на работе поджелудочной. Повышенная эхогенность имеется при болезнях, связанных с обменом веществ, или патологиях, при которых нормальная ткань заменяется на недееспособную.
Причиной могут стать сердечно-сосудистые заболевания, патологии, связанные с нарушением кровообращения. Структура паренхимы поджелудочной железы изменяется, если прогрессирует инфекционная болезнь или недуг, связанный с нарушением обмена веществ.
Диффузные изменения наблюдаются у пациентов, которые перенесли острый панкреатит, у них даже после излечения могут возникать боли в подреберье.
Внутренние органы и системы взаимосвязаны, реактивные изменения могут указывать на патологию печени или желудка. Такие болезни возникают у людей, которые переедают или употребляют много жирного, острого. Патологические процессы также наблюдаются при передозировке лекарственных средств.
Диагностические мероприятия и стадии
Чтобы установить точную причину диффузных изменений, нужно провести обследование. Врач осматривает пациента, собирает анамнез.
Диффузные изменения паренхимы подразделяется на 4 стадии:
- Уменьшена плотность ткани, эхогенность снижена, орган по строению увеличен. Такая картина наблюдается при панкреатите.
- Снижена эхогенность.
- Орган имеет нормальные размеры. Причина — липоматоз. Заболевание может развиться на фоне сахарного диабета.
- Усиливается эхогенность и увеличивается плотность, структура неоднородная. Поджелудочная большая или имеет нормальные размеры, это связано с фиброзом, при котором здоровая ткань замещается недееспособной.
Умеренные диффузные изменения паренхимы поджелудочной железы проявляются при развитии болезни ЖКТ. Поджелудочная железа отекает, если появляются предпосылки к панкреатиту. При прогрессировании болезни на снимке можно увидеть уплотнения. Если человек употребляет много жирной пищи, нормальная ткань поджелудочной замещается патологической.
Проведение терапии
Лечебные мероприятия зависят от характера недуга. Если подозревается хронический панкреатит, пациент сдает анализы. При постановке диагноза учитывается клиническая картина. Если человек резко теряет в весе, возникают боли в подреберье, проявляется тошнота, рвота, ставится диагноз панкреатит. Дальнейшее лечение зависит от формы патологии.
При сахарном диабете необходимо принимать лекарства, которые помогут поддерживать уровень сахара в крови. Нужно лечить болезнь, придерживаясь диеты. Народные средства, в том числе и травы, используются после консультации врача. Лечение не требуется, если изменения обусловлены возрастом. Необходимо вести активный образ жизни, правильно питаться, высыпаться и меньше подвергаться стрессам.
причины неоднородной структуры, методы лечения и профилактики диффузных изменений
Печень и поджелудочная железа неразрывно соединены между собой, так как пронизаны общими протоками, через которые выводятся панкреатический сок и желчь. Эти органы называют паренхиматозными, ведь их внутренняя структура имеет вид особой ткани – паренхимы.
Диффузные изменения паренхимы поджелудочной железы, ее внутренней ткани, не являются самостоятельным заболеваниям, а лишь указывают на то, что ткань органа подверглась видоизменению.
Что это такое – паренхима такого органа, как поджелудочная железа?
Последняя является плотным органом с однородной структурой, которую и называют паренхимой. Если ее строение меняется, то это можно диагностировать при ультразвуковом обследовании, потому как ультразвук отражает ткани по-разному. В зависимости от изменений, определяются различные структурные нарушения.
Виды структурных нарушений паренхимы
Изменение структуры ткани может иметь две вариации:
- Локальные изменения. В этом случае эхопризнаки будут заключаться в повышении или понижении эхогенности, что вызывают различные опухоли, камни и кисты. Для получения более ясной картины больному рекомендуют дополнительно пройти МРТ;
- Диффузные изменения. Эхопризнаки в этом случае связаны с уплотнением тканей и повышением эхогенности. Плотность ткани повышается из-за отеков, воспаления, образования псевдокист. Такие изменения нельзя считать отдельным заболеванием. Они всегда являются симптомом, например, гепатита, гастрита, гастродуоденита и др.
Причины структурных нарушений паренхимы
Умеренные и ярко проявляемые диффузные изменения в слое паренхимы поджелудочной железы свидетельствуют о замещении железистого слоя жировыми отложениями или рубцами. Их структура неоднородная и плотность выше, и чем больше жира и рубцов будет вместо здоровой ткани, тем ярче будут признаки диффузных изменений паренхимы такого органа, как поджелудочная на УЗИ, то есть выше эхогенность.
Причины возникновения диффузных изменений:
- хронический панкреатит и перенесенное ранее это же заболевание в острой форме;
- болезни желчного пузыря, печени;
- жировой гепатоз;
- нарушение обмена веществ;
- гастрит и гастродуоденит;
- вредные привычки;
- длительный прием токсичных лекарственных средств;
- неправильное питание;
- сахарный диабет;
- инфекции;
- пожилой возраст;
- гормональный дисбаланс и др.
Терапия структурных нарушений паренхимы
Диффузные изменения в тканях поджелудочной железы коррекции не подлежат. Этот процесс необратимый, но остановить замещение здоровой ткани жиром или рубцами можно.
Для этого необходимо определить, что стало толчком к развитию этого неприятного явления и устранить его. Небольшие изменения паренхимы, выделяющей сок поджелудочной железы, которые протекают без симптомов, лечить не принято. Подобные умеренные перерождения могут быть следствием стресса, нарушений в питании и воспаления.
При стрессе наблюдается усиление сокоотделения, а при депрессивных состояниях угнетение его выработки. Очень часто диффузное перерождение наблюдается у лиц пожилого возраста, а у детей возможны проблемы с выделением ферментов.
В последнем случае для компенсации неспособности органа продуцировать достаточное их количество, врач может назначить прием таких препаратов, как «Креон», «Мезим», «Панкреатин». При панкреатите лечение преследует цель купировать болевой синдром. При этом назначаются анальгетики, спазмолитики, нестероидные противовоспалительные средства.
Признаки диффузных изменений в тканях поджелудочной железы, наблюдаемые на УЗИ при сахарном диабете, побуждают врача назначить препараты для поддержания концентрации глюкозы в крови. В любом случае больного обследуют дополнительно, что дает возможность поставить истинный диагноз и назначить соответствующую терапию.
Диета при структурных нарушениях паренхимы
Теперь понятно, что такое паренхима поджелудочной железы и что влияет на метаморфозы в ее структуре, но тут стоит заметить, что многое зависит от питания больного. Если он ест всухомятку, питается два-три раза в день, переедая и налегая на острую, жареную и соленую пищу, то диффузные изменения ему обеспечены.
Чаще всего в образовании рубцов и жира виновен панкреатит. А он является следствием регулярного возлияния, то есть употребления спиртных напитков. Вот почему около половины больных, страдающих хроническим панкреатитом – это лица, зависимые от алкоголя.
Поджелудочная железа испытывает невероятные перегрузки из-за обилия жирной еды и продуктов с добавлением химических компонентов. Если совместить их прием с большими дозами алкоголя, то редко удается избежать приступов панкреатита, вот почему новогодние и другие массово отмечаемые праздники становятся горячей порой для работников гастроэнтерологического и хирургического отделений в больницах.
Чтобы не попасть на больничную койку, необходимо соблюдать следующие правила:
- Питаться дробно – 5–6 раз в день небольшими порциями;
- Готовить пищу из натуральных и свежих продуктов – мяса, рыбы и др. Не покупать полуфабрикаты, продукты в вакуумных упаковках с большим сроком годности и т.п.;
- Пища должна быть механически и термически щадящей;
- Жирное, жареное, острое, соленое, копченое и кислое – все то, что может раздражать слизистую, исключается, как и алкоголь;
- Способы приготовления предпочтительны пар, варка и запекание;
- Не использовать специи и приправы.
Лечение нарушений в структуре паренхимы фитотерапией
Как известно, лекарственные травы помогают при многих заболеваниях. Способны они облегчить состояние и при заболеваниях, которые вызывают изменение тканей в поджелудочной железе.
Вот наиболее популярные рецепты приготовления отваров, настоев и других средств:
- Спазмолитическое, противовоспалительное и восстанавливающее действие на поджелудочную железу оказывает сбор из мяты, подорожника, ромашки, зверобоя, сушеницы и тысячелистника, взятых в равных долях. Смесь в объеме 1 ст. л. всыпать в стакан кипящей воды, накрыть крышкой и не трогать в течение 30 минут. После профильтровать и пить по трети стакана три раза в день;
- Предупредит развитие кист и опухолей состав из чистотела, календулы и тысячелистника, взятых в равных частях. Способ приготовления тот же, что и в вышеописанном рецепте. Принимать по 2 ст. л. перед трапезой;
- При любых проблемах с поджелудочной, которые включают и диффузные изменения паренхимы, поможет состав из календулы, шалфея и железняка в пропорции 3:2:1. Вместо этих трав, можно использовать бессмертник, ромашку и полынь в соотношении 4:3:2. Три десертные ложки смеси всыпать в 1,5 литра кипящей воды, через полчаса профильтровать и пить по одной трети стакана два раза в день;
- Восстановить функцию поджелудочной железы, оказать регенерирующий эффект на ткани и унять боль поможет японская софора. На 1 ст. л. травы требуется 1 стакан кипящей воды. Заваривать сырье следует в термосе и лучше это делать на ночь. Пить по 1 дес. л. перед трапезой в течение 10 дней. После прерваться на неделю и повторить курс.
Как предупредить диффузные изменения в паренхиме
Неоднородную структуру паренхимы, выделяющей сок поджелудочной железы, выявляют не всегда. Нередко человек живет обычной жизнью и не знает о существующей проблеме, а случайно, например, при диспансеризации обнаруживает наличие такой патологии.
Однако если увеличение плотности этого органа является следствием какого-либо недуга, то не обратить на это внимание не получится. Человек начинает замечать, что после употребления определенных продуктов или обильных возлияний появляются боль в животе, спазмы, метеоризм, тошнота, а в тяжелых случаях понос и рвота.
Следует обратить на это пристальное внимание и при малейших подозрениях на расстройство пищеварения, связанное с нарушением структуры поджелудочной железы, отказаться от вредных продуктов.
Многие думают, что при таких запретах есть вообще будет нечего, но это не так. Существует очень много вкусных и полезных блюд, которые могут составить основу рациона.
Это мясо и рыба, молочные продукты, каши. Не запрещены овощи и фрукты, но первые лучше употреблять в тушеном виде, а ягоды и плоды есть понемногу и только некислые.
Вместе с этим профилактикой данной патологии будет употребление чаев на основе трав, ведение разумного образа жизни, повышение двигательной активности.
Материалы, размещённые на данной странице, носят информационный характер и предназначены для образовательных целей. Посетители сайта не должны использовать их в качестве медицинских рекомендаций. Определение диагноза и выбор методики лечения остаётся исключительной прерогативой вашего лечащего врача.
Различия между диффузным и очаговым аутоиммунным панкреатитом
World J Gastroenterol. 2012 7 мая; 18 (17): 2099–2104.
Таку Табата, Теруми Камисава, Кенсуке Такума, Сэйити Хара, Савако Курума, Ёсихико Инаба, отделение внутренней медицины, Токийская столичная больница Комагоме, 3-18-22 Хонкомагоме, Бункё-ку, Токио 113-8677, Япония
Авторский вклад : Табата Т. и Камисава Т. внесли равный вклад в эту работу, проанализировали данные и написали рукопись; Данные собирали Такума К., Хара С., Курума С. и Инаба Ю.Для корреспонденции: Теруми Камисава, доктор медицинских наук, отделение внутренней медицины, Токийская столичная больница Комагоме, 3-18-22 Хонкомагоме, Бункё-ку, Токио 113-8677, Япония. pj.kcic@awasimak
Телефон: + 81-3-38232101 Факс: + 81-3-38241552
Получено 31 мая 2011 г .; Пересмотрено 19 августа 2011 г .; Принято 27 августа 2011 г.
Copyright © 2012 Baishideng Publishing Group Co., Limited. Все права защищены.Эта статья цитировалась в других статьях в PMC.Abstract
ЦЕЛЬ: изучить различия в клинических характеристиках диффузного и очагового аутоиммунного панкреатита (AIP).
МЕТОДЫ. На основании радиологических данных, полученных с помощью компьютерной томографии и / или магнитно-резонансной томографии, мы разделили 67 пациентов с ОИП на диффузный тип (D-тип) и очаговый тип (F-тип). Далее мы разделили тип F на тип головы (тип H) и тип тела и / или хвоста (тип B / T) в зависимости от места увеличения. Наконец, мы разделили 67 пациентов с ОИП на три группы: тип D, тип H и тип B / T. Мы сравнили три типа AIP с точки зрения клинических, лабораторных, радиологических, функциональных и гистологических данных и клинического течения.
РЕЗУЛЬТАТЫ: 34 пациента с D-типом, 19 с H-типом и 14 с B / T-типом AIP. Хотя механическая желтуха часто выявлялась у пациентов D-типа (88%) и пациентов H-типа (68%), ни у одного из пациентов типа B / T не было желтухи в качестве начального симптома ( P <0,001). Не было различий в частоте боли в животе, но острый панкреатит чаще ассоциировался у пациентов типа B / T (36%), чем у пациентов типа D (3%) ( P = 0,017). Уровни сывороточного иммуноглобулина G (IgG) 4 были значительно выше у пациентов D-типа (медиана 309 мг / дл), чем у пациентов B / T-типа (133.5 мг / дл) ( P = 0,042). Уровни амилазы в сыворотке у пациентов B / T-типа (медиана: 114 МЕ / л) были значительно выше, чем у пациентов H-типа (72 МЕ / л) ( P = 0,049). Лимфоплазмоцитарный склерозирующий панкреатит (LPSP) был гистологически подтвержден у 6 пациентов D-типа, 7 H-типа и 4 B / T-типов; идиопатический протоковоцентрический панкреатит не наблюдался ни у одного пациента. Выраженный фиброз и обильная инфильтрация CD20-положительных B-лимфоцитов небольшим количеством IgG4-положительных плазматических клеток были обнаружены у 2 пациентов B / T-типа.Стероидная терапия была эффективной у всех 50 пациентов (31 тип D, 13 тип H и 6 тип B / T). Хотя AIP рецидивировал во время постепенного снижения дозы или после прекращения приема стероидов у 3 пациентов D-типа и 3 H-типа, ни у одного пациента не было рецидивов типа B / T. В ходе последующего наблюдения рентгенологические характеристики 6 пациентов с типом B / T не изменились, а у 1 пациента с типом B / T улучшилось естественное улучшение.
ЗАКЛЮЧЕНИЕ: Клинические признаки AIP H-типа были аналогичны таковым для D-типа, но B / T-тип отличался от D и H. B / T-тип может включать другие заболевания, кроме LPSP.
Ключевые слова: Аутоиммунный панкреатит, иммуноглобулин G 4, лимфоплазмацитарный склерозирующий панкреатит
ВВЕДЕНИЕ
Аутоиммунный панкреатит (AIP) – это тип панкреатита, который, как считается, имеет аутоиммунную этиологию. AIP резко реагирует на стероидную терапию, поэтому дифференцировать AIP от рака поджелудочной железы важно, чтобы избежать ненужной резекции поджелудочной железы [1-3]. Согласно Азиатским диагностическим критериям AIP [4], AIP диагностируется по следующим признакам: диффузное или очаговое увеличение поджелудочной железы и сужение главного протока поджелудочной железы; повышенный уровень сывороточного иммуноглобулина G (IgG) или IgG4 или присутствие аутоантител в сыворотке; гистологические данные о лимфоплазмоцитарной инфильтрации и фиброзе поджелудочной железы [лимфоплазмоцитарный склерозирующий панкреатит (LPSP) [5]]; и отзывчивость на стероиды.АИП часто встречается у пожилых мужчин. Первичный начальный симптом – механическая желтуха, а сахарный диабет встречается у половины пациентов. AIP редко ассоциируется с острым панкреатитом или язвенным колитом. AIP связан с несколькими склерозирующими экстрапанкреатическими поражениями, такими как склерозирующий холангит, склерозирующий сиаладенит и забрюшинный фиброз, и в настоящее время считается поражением поджелудочной железы системного заболевания, связанного с IgG4. AIP хорошо поддается стероидной терапии, но иногда имеет рецидивы [1,2].
Недавно был обнаружен другой гистологический паттерн AIP, характеризующийся протоковой эпителиальной гранулоцитарной инфильтрацией [6,7]. Этот паттерн называется идиопатическим протоковоцентрическим панкреатитом (IDCP) [6]. Клинические особенности пациентов с IDCP отличаются от пациентов с LPSP. Термины AIP типа 1 и типа 2 предлагаются для описания клинических особенностей, связанных с LPSP и IDCP, соответственно [8-11].
Радиологически AIP подразделяется на диффузный тип (тип D) и очаговый тип (тип F) [1-3,12-14].Хотя диффузное увеличение поджелудочной железы довольно специфично для AIP, AIP F-типа следует строго дифференцировать от рака поджелудочной железы. Однако лишь в нескольких исследованиях [13,14] изучались различия между AIP D- и F-типа, и неизвестно, является ли AIP F-типа начальной стадией AIP D-типа или другим типом AIP. Это исследование было направлено на выяснение различий в клинических характеристиках AIP D- и F-типа.
МАТЕРИАЛЫ И МЕТОДЫ
Пациенты, изучаемые
С 1988 по 2010 год, 67 пациентов с ОИП (47 мужчин и 20 женщин; средний возраст: 60 лет.3 года; диапазон: 27-83 года) были диагностированы в соответствии с Азиатскими диагностическими критериями AIP [4] в токийской столичной больнице Комагоме. На основании рентгенологических данных, полученных с помощью компьютерной томографии и / или магнитно-резонансной томографии, мы разделили пациентов с ОИП на D-тип и F. Далее мы разделили тип F на тип головы (тип H) и тип тела и / или хвоста (тип B / T) в зависимости от места увеличения. Наконец, мы разделили 67 пациентов с ОИП на три группы: тип D, тип H и тип B / T. Пациенты с AIP D-типа показали диффузное увеличение поджелудочной железы (Рисунок -), пациенты H-типа показали очаговое увеличение только головки поджелудочной железы (Рисунок -), а пациенты B / T-типа показали увеличение только тела поджелудочной железы и / или хвост (рисунок а).Мы сравнили клинические, лабораторные, радиологические, функциональные и гистологические данные и клиническое течение трех типов AIP.
Компьютерная томография, показывающая аутоиммунный панкреатит диффузного типа. Был замечен отек головы (A), тела (B) и хвоста (C) поджелудочной железы.
Компьютерная томография, показывающая аутоиммунный панкреатит головного типа. Отек только головки поджелудочной железы (A), но тело поджелудочной железы (B) и хвост (C) были нормального размера.
Компьютерная томография, показывающая аутоиммунный панкреатит по типу тела и / или хвоста.Тело и хвост поджелудочной железы опухли (A), но головка поджелудочной железы была в пределах нормального размера (B).
Клинические, радиологические и лабораторные анализы
Клинические оценки включали: возраст на момент постановки диагноза; секс; привычки к употреблению алкоголя и курения; наличие и / или наличие аллергических заболеваний в анамнезе; начальные симптомы, такие как механическая желтуха и боль в животе; и сопутствующие заболевания, такие как сахарный диабет, острый панкреатит и язвенный колит. Привычка к употреблению алкоголя была определена как употребление алкоголя> 80 г / день в течение> 7 лет.Привычка к курению была определена как курение> 20 пач-лет. Сахарный диабет диагностировали, если уровни глюкозы в сыворотке натощак и / или уровни гемоглобина A1c были выше нормального уровня (126 мг / дл и 6,1% соответственно) [15]. Острый панкреатит был диагностирован, когда наблюдались как сильная боль в животе, так и повышение уровня амилазы в сыворотке крови (более чем в 3 раза; норма: 115 МЕ / л).
Стеноз нижнего желчного протока оценивали с помощью эндоскопической ретроградной холангиопанкреатографии и / или магнитно-резонансной холангиопанкреатографии.Радиологически были оценены три экстрапанкреатических поражения, которые часто связаны с ОИП (склерозирующий холангит прикорневых или внутрипеченочных желчных протоков, отек слюнных желез и забрюшинный фиброз).
Лабораторные данные были оценены, включая уровни сывороточного IgG ( n = 67), IgG4 ( n = 65) и иммуноглобулина E (IgE) ( n = 43), количество периферических эозинофилов ( n = 56) уровни амилазы в сыворотке ( n = 66) и аутоантитела, включая антинуклеарный антиген ( n = 60) и ревматоидный фактор ( n = 58).Уровни IgG4 в сыворотке измеряли нефелометрией с использованием наборов подкласса IgG (BS-NIA). Было использовано общепринятое пороговое значение 135 мг / дл.
Гистологические и иммуногистологические исследования
Поджелудочная железа оценивалась с помощью хирургической резекции ( n = 7), хирургической биопсии или биопсии под контролем УЗИ ( n = 6) и тонкоигольной аспирации под контролем эндоскопического ультразвукового исследования (EUS-FNA , n = 10) и исследовали гистологически и иммуногистохимически с использованием антител анти-CD3, анти-CD20 и анти-IgG4.
Клинический курс
Десяти пациентам первоначально было проведено хирургическое вмешательство при подозрении на рак поджелудочной железы (панкреатодуоденэктомия, n = 6; дистальная панкреатэктомия, n = 1; холедоходуоденостомия с биопсией поджелудочной железы, n = 3). Пятьдесят пациентов, в том числе один хирург, пролеченный пероральными стероидами. Преднизолон в начальной дозе 30-40 мг / сут назначался в течение 2-3 недель. Затем его снижали на 5 мг каждые 1-3 недели до 5 мг / сут. Поддерживающая терапия (2.5-5 мг / сут, 1-3 года) применялась у всех пациентов. Рецидив AIP был определен как повторное появление симптомов с развитием или повторным появлением патологий поджелудочной железы и / или экстрапанкреатических патологий при визуализирующих исследованиях. Восемь пациентов наблюдались консервативно без стероидной терапии.
Статистический анализ
Различия между группами анализировали с использованием точного вероятностного критерия Фишера и критерия Манна-Уитни U . Значения P были скорректированы методом Бонферрони, а значения P <0.05 считали статистически значимым.
РЕЗУЛЬТАТЫ
Клинические, радиологические и лабораторные различия
Шестьдесят семь пациентов с ОИП были классифицированы на D-тип ( n = 34), H-тип ( n = 19) и B / T-тип ( n = 14) AIP. Существенных различий по возрасту, полу, алкоголю, курению и аллергическим заболеваниям между группами не было. Хотя механическая желтуха часто выявлялась у пациентов с D-типом (88%) и H-типом (68%), ни у одного пациента с типом B / T не проявлялась желтуха в качестве начального симптома ( P <0.001). Хотя не было различий в частоте боли в животе, острый панкреатит чаще встречался у пациентов типа B / T (36%), чем у пациентов типа D (3%) ( P = 0,017). Хотя стеноз нижнего желчного протока часто наблюдался у пациентов D-типа (94%) и H-типа (95%), ни у одного пациента типа B / T не было стеноза нижнего желчного протока ( P <0,001). Не было различий между группами по ассоциированным экстрапанкреатическим поражениям (таблица).
Таблица 1
Клинические и рентгенологические данные трех типов аутоиммунного панкреатита
| Тип D, n = 34 | H тип, n = 19 | B / Тип T, n = 14 | Значение P , D против H | P значение, D против B / T | P значение, H против B / T | |
| Средний возраст (лет) (квартильный диапазон) | 67.5 (59-71,5) | 64,0 (56-71) | 61,5 (50,3-72,5) | > 0,99 | > 0,99 | > 0,99 |
| Мужской / женский | 24/10 | 15 / 4 | 8/6 | > 0,99 | > 0,99 | > 0,99 |
| Привычка к употреблению алкоголя +/- (%) | 4/27 (15) | 4/15 (21) | 2 / 12 (14) | > 0,99 | > 0,99 | > 0,99 |
| Привычка к курению +/- (%) | 16/27 (59) | 12/16 (75) | 5/13 ( 39) | > 0.99 | > 0,99 | 0,198 |
| Аллергия +/- (%) | 8/25 (32) | 6/18 (33) | 7/13 (54) | > 0,99 | 0,885 | 0,879 |
| Желтуха +/- (%) | 30/4 (88) | 13/6 (68) | 0/14 (0) | 0,420 | <0,001 | <0,001 |
| Боль в животе +/- (%) | 6/28 (18) | 7/13 (37) | 5/9 (36) | 0.546 | 0,771 | > 0,999 |
| Диабет +/- (%) | 10/24 (29) | 11/8 (58) | 4/10 (29) | 0,231 | > 0,999 | > 0,999 |
| Острый панкреатит +/- (%) | 1/33 (3) | 1/18 (5) | 5/9 (36) | > 0,999 | 0,017 | 0,183 |
| Язвенный колит +/- (%) | 1/33 (3) | 0/19 (0) | 1/13 (7) | > 0.999 | > 0,999 | > 0,999 |
| Стеноз нижнего мерзкого протока +/- (%) | 32/34 (94) | 18/19 (95) | 0/14 (0) | > 0,999 | <0,001 | <0,001 |
| Экстрапанкреатические поражения +/- (%) | 13/21 (38) | 6/13 (32) | 5/9 (36) | > 0,999 | > 0,999 | > 0,999 |
Уровни сывороточного IgG4 были значительно выше у пациентов D-типа (медиана: 309 мг / дл), чем у пациентов B / T-типа (133.5 мг / дл) пациентов ( P = 0,042). Уровни сывороточного IgG4 чаще повышались у пациентов с D-типом (88%), чем у пациентов с B / T-типом (50%) ( P = 0,030). Не было значительных различий в уровнях сывороточного IgE и количестве периферических эозинофилов между группами. Уровни амилазы в сыворотке у пациентов B / T-типа (медиана: 114 МЕ / л) были значительно выше, чем у пациентов H-типа (72 МЕ / л) ( P = 0,049). По соотношению антинуклеарного антигена и ревматоидного фактора различий между группами не было (таблица).
Таблица 2
Лабораторные данные трех типов аутоиммунного панкреатита
| тип D, n = 34 | тип H, n = 19 | тип B / T , n = 14 | P значение, D vs H | P значение, D vs B / T | P значение, H vs B / T | |
| Медиана IgG, мг / дл | 2163.5 (1637,5-2682,8) | 1920 (1398,5-2300) | 1619 (1369,5-2364,5) | 0,642 | > 0,999 | > 0,999 |
| (квартильный диапазон) | ||||||
| 309 (181-1015) | 351 (228-780) | 133,5 (60,8-326,5) | > 0,999 | 0,042 | 0,057 | |
| (квартильный диапазон) | 28/32 (88) | 16/19 (84) | 7/14 (50) | > 0.999 | 0,030 | 0,168 |
| Медиана IgE, МЕ / л | 406,9 (265,5-877) | 249,0 (74,75-589,75) | 264,0 (134,1-856) | 4 0,447> | 4 0,447 > 0,999 | |
| (квартильный диапазон) | ||||||
| IgE> 580, (МЕ / л) (%) | 8/20 (40,0) | 3/12 (25,0) | 4/11 (36,4) | > 0,999 | > 0,999 | > 0,999 |
| Медиана эозинофилов, мкл | 180 (72-440) | 238.5 (152,5-447,75) | 473 (114,5-621,5) | > 0,999 | 0,354 | > 0,999 |
| (квартильный диапазон) | ||||||
| Эозинофилы> 600 / мкл 13 (%) 3/3 | 32 90 (11) | 2/16 (13) | 3/13 (23) | > 0,999 | > 0,999 | > 0,999 |
| Медиана амилазы (МЕ / л) | 86 (49,5-119,5) | 72 (43-100) | 114 (73,3-589,3) | > 0.999 | > 0,999 | 0,049 |
| (квартильный диапазон) | ||||||
| Амилаза> 115 (МЕ / л) (%) | 8/33 (24) | 4/19 (21) | 7 / 14 (50) | > 0,999 | 0,300 | 0,408 |
| Положительный антинуклеарный антиген (%) | 14/29 (48) | 4/18 (22) | 6/13 (46) | 0,366 | > 0,999 | 0,738 |
| Положительный ревматоидный фактор (%) | 10/28 (36) | 2/17 (12) | 1/13 (7) | 0.288 | 0,378 | > 0,999 |
Гистологические и иммуногистохимические исследования
ЛПСП был гистологически подтвержден с обильной инфильтрацией CD3-положительных Т-лимфоцитов и IgG4-положительных плазматических клеток в 6 D-типе, 7 H-типе и 4 Пациенты типа B / T. В поджелудочной железе 2 пациентов B / T-типа (1 образец хирургической биопсии и 1 образец EUS-FNA) были обнаружены выраженный фиброз и обильная инфильтрация CD20-положительных В-лимфоцитов, а не Т-лимфоцитов, но мало IgG4-положительных плазматических клеток или нейтрофилов не обнаружено.IDCP не наблюдался ни у одного пациента. EUS-FNA у 4 пациентов с ОИП не смог подтвердить гистологический диагноз из-за недостаточного количества образцов (таблица).
Таблица 3
Гистологические данные поджелудочной железы при трех типах аутоиммунного панкреатита
| D тип | H тип | B / T тип | LPSP ( n = 3) | LPSP ( n = 3) | LPSP ( n = 1) |
| Биопсия | LPSP ( n = 2) | LPSP ( n = 3) | Фиброз с обильной инфильтрацией В-лимфоцитов ( n = 1) |
| EUS-FNA | LPSP ( n = 1) | LPSP ( n = 1) | ( n = 3) |
| Несоответствующий материал ( n = 1) | Несоответствующий материал ( n = 2) | Фиброз с обильной инфильтрацией B-лимфоцитов ( n = 1) | 9 0175|
| Несоответствующий материал ( n = 1) |
Клинический курс
Стероидная терапия была эффективной у всех 50 пациентов (31 тип D, 13 H тип и 6 B / T тип).Рецидив АИП произошел во время постепенного снижения дозы или после прекращения приема стероидов у 3 пациентов D-типа и 3-х пациентов H-типа. У 8 пациентов, находящихся под консервативным наблюдением (1 тип H и 7 тип B / T), рентгенологические характеристики не изменились у семи пациентов, но увеличение хвоста поджелудочной железы улучшилось естественным образом у 1 пациента с типом B / T. В течение курса, предшествовавшего нашей госпитализации, очаговое увеличение головки поджелудочной железы развилось до диффузного увеличения в трех случаях, а очаговое увеличение хвоста поджелудочной железы развилось до диффузного увеличения в одном случае.
ОБСУЖДЕНИЕ
Радиологически AIP подразделяется на диффузные и очаговые формы. Диффузное увеличение поджелудочной железы, называемое колбасоподобным увеличением, является типичным признаком AIP. Однако AIP F-типа, иногда образующий массу, часто трудно отличить от рака поджелудочной железы [1-3,12-14]. Возможные различия в клинических проявлениях между типами D и F AIP неясны.
В настоящем исследовании мы классифицировали 67 пациентов с ОИП на тип D ( n = 34), тип H ( n = 19) и тип B / T ( n = 14).Типы D и H показали сходные клинические особенности. Однако тип B / T отличался от типов D и H в нескольких аспектах. Механическая желтуха и стеноз нижнего желчного протока часто выявлялись у пациентов с типом D и H, но ни у одного пациента с типом B / T эти особенности не наблюдались. По данным Ghazale et al [16], стеноз нижнего желчного протока присутствовал у 70% из 53 пациентов с ОИП. Хирано и др. [17] заявили, что как отек поджелудочной железы из-за воспаления головки поджелудочной железы, так и утолщение стенки желчных протоков влияют на стеноз нижнего желчного протока при AIP, основываясь на данных EUS и на том факте, что 93% случаев AIP с положительным поражением головки поджелудочной железы у пациентов был стеноз нижнего желчного протока, по сравнению только с 17% пациентов с отрицательным поражением.
В этом исследовании уровень сывороточного IgG4 был значительно ниже у пациентов B / T-типа, чем у пациентов с D-типом, а повышение уровня сывороточного IgG4 было меньше у пациентов с B / T-типом, чем у пациентов с D-типом. Острый панкреатит чаще наблюдался у пациентов B / T-типа, чем у пациентов с D-типом, а уровни амилазы в сыворотке крови были значительно выше у пациентов с B / T-типом, чем у пациентов с H-типом. Что касается диагноза и частоты острого панкреатита, высокий процент пациентов с типом B / T, по-видимому, в основном зависит от более высоких уровней амилазы.Острый панкреатит или некоторые острые воспалительные приступы в случаях хронического панкреатита могут не быть связаны с высокими уровнями амилазы из-за атрофической ацинарной ткани. Не было разницы в частоте болей в животе, поэтому некоторые случаи D-типа и H-типа могли быть упущены из виду.
Ни у одного пациента типа B / T не рецидив после стероидной терапии, по сравнению с 10% пациентов D-типа и 23% пациентов H-типа. Стало ясно, что существует два гистологических подтипа (LPSP и IDCP) в AIP [6-11].Большинство пациентов с AIP в Азии имеют LPSP, а половина пациентов с AIP в Европе имеют IDCP [8,10]. Клинические признаки этих двух подтипов существенно различаются. Обычно сообщается, что пациенты с IDCP моложе на момент постановки диагноза, а у пациентов с IDCP реже повышенный уровень IgG4 в сыворотке крови. IDCP чаще ассоциируется с острым панкреатитом и воспалительным заболеванием кишечника. Согласно сравнительному исследованию пациентов с LPSP и IDCP, проведенным Sah et al [9], пациенты с IDCP, как правило, имели больше очаговых особенностей, чем LPSP (84% против 60%), и рецидивов IDCP не наблюдалось ни у одного пациента, тогда как LPSP рецидивировал у 47% пациентов.Для диагностики IDCP необходимо гистологическое исследование адекватного образца поджелудочной железы, а необходимость гистологического исследования для диагностики IDCP в настоящее время затрудняет клиническую диагностику.
При гистологическом исследовании данных случаев LPSP был подтвержден у 17, но IDCP не был обнаружен. Клинические файлы AIP D-типа и H-типа были совместимы с файлами пациентов с LPSP. Однако, учитывая низкие уровни IgG4 в сыворотке и частую связь с острым панкреатитом, существует вероятность того, что некоторые случаи IDCP могут быть вовлечены в случаи B / T-типа.Например, 32-летний мужчина с AIP B / T-типа показал нормальные уровни IgG4 в сыворотке, связь с язвенным колитом и хорошую чувствительность к стероидной терапии, но гистологический диагноз с помощью EUS-FNA не мог быть подтвержден из-за недостаточного образец биопсии. Интересно, что гистология двух пациентов с B / T-типом включала обильную инфильтрацию B-клеток с небольшой инфильтрацией IgG4-положительных клеток или нейтрофилов, которые могли быть другим типом AIP, отличным от LPSP и IDCP. AIP B / T-типа может включать заболевание, отличное от LPSP.
Три пациента с типом H и один пациент с типом B / T прогрессировали до типа D в течение естественного течения. Также сообщалось, что AIP H-типа переходит в D-тип [18,19], а AIP B / T-типа – в D-тип [20]. Также были сообщения о рецидивах в остаточной поджелудочной железе после резекции, таких как рецидив в остаточной головке поджелудочной железы через 1 год после дистальной панкреатэктомии [21] и рецидив в остаточной части поджелудочной железы через 4 месяца после панкреатодуоденэктомии [22]. Стероидная терапия была эффективной для тех поражений, которые прогрессировали или рецидивировали.Эти данные показывают, что очаговое воспаление может прогрессировать до последующих диффузных изменений по всей поджелудочной железе или развиваться повторно в разных местах и в разное время у некоторых пациентов с ОИП. Диффузное изменение поджелудочной железы может быть окончательным проявлением AIP, и то, влияет ли этот воспалительный процесс на железу диффузно или очагово, может просто отражать стадию заболевания. Из семи консервативно наблюдаемых пациентов типа B / T у шести не было никаких изменений, а у одного улучшилось естественным образом. Kubota et al [23] сообщили, что у всех восьми пациентов с ОИП, у которых спонтанно улучшилось состояние, наблюдалось очаговое увеличение поджелудочной железы.AIP B / T-типа может включать заболевание, отличное от AIP D-типа и H.
В заключение, хотя клинические признаки AIP H-типа аналогичны клиническим характеристикам AIP D-типа, AIP B / T-типа в некоторых аспектах отличается от типов D и H. AIP B / T-типа может включать заболевание, отличное от LPSP.
КОММЕНТАРИИ
Предпосылки
Аутоиммунный панкреатит (АИП) – это особый тип панкреатита, который, как считается, имеет аутоиммунную этиологию. Недавно AIP был радиологически классифицирован на диффузный тип (тип D) и очаговый тип (тип F).Однако различия между AIP D- и F-типа малоизвестны.
Границы исследований
Были исследованы различия в клинических, радиологических, лабораторных и гистологических данных между AIP D- и F-типа.
Инновации и прорывы
Пациенты с ОИП были разделены на тип D и тип F. Кроме того, тип F был разделен на тип головы (тип H) и тип корпуса и / или хвоста (тип B / T). Ни у одного пациента типа B / T не была желтуха как начальный симптом, но острый панкреатит чаще ассоциировался с типом B / T, чем с типом D.Уровни амилазы в сыворотке крови у пациентов B / T-типа были значительно выше, чем у пациентов с H-типом. Уровни сывороточного иммуноглобулина G (IgG) 4 были значительно выше у пациентов D-типа, чем у пациентов B / T-типа. Ни у одного из пациентов типа B / T после стероидной терапии не наблюдалось рецидива, по сравнению с 10% пациентов D-типа и 23% пациентов H-типа. У двух пациентов B / T-типа наблюдалась обильная инфильтрация B-клеток с небольшой инфильтрацией IgG4-положительных клеток или нейтрофилов.
Приложения
AIP B / T-типа отличается по нескольким аспектам от типов D и H, и некоторые AIP B / T-типа могут быть связаны с заболеванием, отличным от лимфоплазмоцитарного склерозирующего панкреатита.
Рецензирование
Само исследование кажется разумным, а результаты интересны и имеют этиологическое значение.
Сноски
При поддержке Исследовательского комитета по трудноизлечимым заболеваниям поджелудочной железы (главный исследователь; Тору Симосегава), предоставлены Министерством здравоохранения, труда и социального обеспечения Японии
Рецензенты: Сёитиро Суми, доктор медицины, доктор философии, младший профессор, Отделение реконструкции органов, Институт пограничных медицинских наук, Университет Киото, Сакё-ку, Киото 606-8507, Япония; Ацуши Масамунэ, доктор медицины, доктор философии, отделение гастроэнтерологии, Высшая школа медицины Университета Тохоку, 1-1 Сейрё-мати, Аоба-ку, Сендай 980-8574, Япония
S- редактор Lv S L- редактор Kerr C. E- редактор Li JY
Ссылки
1.Окадзаки К., Кава С., Камисава Т., Ито Т., Инуи К., Ирие Х, Ирисава А., Кубо К., Нотохара К., Хасебе О. и др. Японские клинические рекомендации по аутоиммунному панкреатиту. Поджелудочная железа. 2009; 38: 849–866. [PubMed] [Google Scholar] 2. Чари С.Т., Такахаши Н., Леви М.Дж., Смирк Т.К., Клейн Дж.Э., Пирсон Р.К., Петерсен Б.Т., Топазиан М.А., Веге С.С. Диагностическая стратегия, позволяющая отличить аутоиммунный панкреатит от рака поджелудочной железы. Clin Gastroenterol Hepatol. 2009; 7: 1097–1103. [PubMed] [Google Scholar] 3. Камисава Т., Такума К., Эгава Н., Цурута К., Сасаки Т.Аутоиммунный панкреатит и склерозирующая болезнь, связанная с IgG4. Нат Рев Гастроэнтерол Гепатол. 2010; 7: 401–409. [PubMed] [Google Scholar] 4. Otsuki M, Chung JB, Okazaki K, Kim MH, Kamisawa T., Kawa S., Park SW, Shimosegawa T., Lee K, Ito T. и др. Азиатские диагностические критерии аутоиммунного панкреатита: консенсус Японско-корейского симпозиума по аутоиммунному панкреатиту. J Gastroenterol. 2008; 43: 403–408. [PubMed] [Google Scholar] 5. Кавагути К., Койке М., Цурута К., Окамото А., Табата И., Фудзита Н. Лимфоплазмоцитарный склерозирующий панкреатит с холангитом: вариант первичного склерозирующего холангита с обширным поражением поджелудочной железы.Hum Pathol. 1991; 22: 387–395. [PubMed] [Google Scholar] 6. Нотохара К., Бургарт Л.Дж., Ядав Д., Чари С., Смирк ТЦ. Идиопатический хронический панкреатит с перидуктальной лимфоплазмоцитарной инфильтрацией: клинико-патологические особенности 35 случаев. Am J Surg Pathol. 2003. 27: 1119–1127. [PubMed] [Google Scholar] 7. Zamboni G, Lüttges J, Capelli P, Frulloni L, Cavallini G, Pederzoli P, Leins A, Longnecker D, Klöppel G. Гистопатологические особенности диагностической и клинической значимости аутоиммунного панкреатита: исследование на 53 образцах резекции и 9 образцах биопсии.Арка Вирхова. 2004. 445: 552–563. [PubMed] [Google Scholar] 8. Park DH, Kim MH, Chari ST. Последние достижения в области аутоиммунного панкреатита. Кишечник. 2009. 58: 1680–1689. [PubMed] [Google Scholar] 9. Сах Р.П., Чари С.Т., Паннала Р., Сугумар А., Клэйн Дж.Э., Леви М.Дж., Пирсон Р.К., Смирк Т.С., Петерсен Б.Т., Топазиан М.Д. и др. Различия в клиническом профиле и частоте рецидивов аутоиммунного панкреатита 1 типа и 2 типа. Гастроэнтерология. 2010; 139: 140–148; викторина 140-148. [PubMed] [Google Scholar] 10. Камисава Т., Нотохара К., Симосегава Т.Два клинико-патологических подтипа аутоиммунного панкреатита: LPSP и IDCP. Гастроэнтерология. 2010; 139: 22–25. [PubMed] [Google Scholar] 11. Chari ST, Kloeppel G, Zhang L, Notohara K, Lerch MM, Shimosegawa T. Гистопатологические и клинические подтипы аутоиммунного панкреатита: консенсусный документ гонолулу. Панкреатология. 2010. 10: 664–672. [PubMed] [Google Scholar] 12. Ирие Х, Хонда Х, Баба С., Куроива Т., Йошимицу К., Тадзима Т., Джими М., Суми Т., Масуда К. Аутоиммунный панкреатит: характеристики КТ и МРТ.AJR Am J Roentgenol. 1998; 170: 1323–1327. [PubMed] [Google Scholar] 13. Wakabayashi T, Kawaura Y, Satomura Y, Fujii T., Motoo Y, Okai T., Sawabu N. Клиническое исследование хронического панкреатита с очаговым нерегулярным сужением главного протока поджелудочной железы и образованием массы: сравнение с хроническим панкреатитом, показывающим диффузное нерегулярное сужение основного протока. проток поджелудочной железы. Поджелудочная железа. 2002. 25: 283–289. [PubMed] [Google Scholar] 14. Фруллони Л., Скаттолини С., Фалькони М., Замбони Дж., Капелли П., Манфреди Р., Грациани Р., Д’Онофрио М., Кацотурчи А.М., Амодио А. и др.Аутоиммунный панкреатит: различия очаговой и диффузной форм у 87 больных. Am J Gastroenterol. 2009. 104: 2288–2294. [PubMed] [Google Scholar] 16. Ghazale A, Chari ST, Zhang L, Smyrk TC, Takahashi N, Levy MJ, Topazian MD, Clain JE, Pearson RK, Petersen BT и др. Иммуноглобулин G4-ассоциированный холангит: клинический профиль и ответ на терапию. Гастроэнтерология. 2008. 134: 706–715. [PubMed] [Google Scholar] 17. Хирано К., Тада М., Исаяма Х, Ямамото К., Мизуно С., Ягиока Х, Яшима Й, Сасаки Т, Когуре Х, Тогава О и др.Эндоскопическая оценка факторов, способствующих возникновению стриктуры внутрипанкреатических желчевыводящих путей при аутоиммунном панкреатите. Gastrointest Endosc. 2010; 71: 85–90. [PubMed] [Google Scholar] 18. Horiuchi A, Kawa S, Akamatsu T., Aoki Y, Mukawa K, Furuya N, Ochi Y, Kiyosawa K. Характерный внешний вид протока поджелудочной железы при аутоиммунном хроническом панкреатите: отчет о болезни и обзор японской литературы. Am J Gastroenterol. 1998. 93: 260–263. [PubMed] [Google Scholar] 19. Кога Й, Ямагути К., Сугитани А., Чидзива К., Танака М.Аутоиммунный панкреатит, начинающийся как локализованная форма. J Gastroenterol. 2002. 37: 133–137. [PubMed] [Google Scholar] 20. Wakabayashi T, Kawaura Y, Satomura Y, Watanabe H, Motoo Y, Sawabu N. Долгосрочный прогноз хронического панкреатита с сужением протока: стратегия лечения стероидами. Поджелудочная железа. 2005; 30: 31–39. [PubMed] [Google Scholar] 21. Motoo Y, Minamoto T., Watanabe H, Sakai J, Okai T., Sawabu N. Склерозирующий панкреатит, демонстрирующий быстро прогрессирующие изменения с периодическим формированием массы. Int J Pancreatol.1997; 21: 85–90. [PubMed] [Google Scholar] 22. Бланк A, Maybody M, Isom-Batz G, Roslin M, Dillon EH. Острый некротический панкреатит, вызванный Salmonella typhimurium. Dig Dis Sci. 2003. 48: 1472–1474. [PubMed] [Google Scholar] 23. Kubota K, Iida H, Fujisawa T., Ogawa M, Inamori M, Saito S, Kakuta Y, Oshiro H, Nakajima A. Клиническое значение опухшего дуоденального сосочка при аутоиммунном панкреатите. Поджелудочная железа. 2007; 35: e51 – e60. [PubMed] [Google Scholar]Различия между диффузным и очаговым аутоиммунным панкреатитом
World J Gastroenterol.2012 7 мая; 18 (17): 2099–2104.
Таку Табата, Теруми Камисава, Кенсуке Такума, Сэйити Хара, Савако Курума, Ёсихико Инаба, отделение внутренней медицины, Токийская столичная больница Комагоме, 3-18-22 Хонкомагоме, Бункё-ку, Токио 113-8677, Япония
Авторский вклад : Табата Т. и Камисава Т. внесли равный вклад в эту работу, проанализировали данные и написали рукопись; Данные собирали Такума К., Хара С., Курума С. и Инаба Ю.Для корреспонденции: Теруми Камисава, доктор медицинских наук, отделение внутренней медицины, Токийская столичная больница Комагоме, 3-18-22 Хонкомагоме, Бункё-ку, Токио 113-8677, Япония.pj.kcic@awasimak
Телефон: + 81-3-38232101 Факс: + 81-3-38241552
Получено 31 мая 2011 г .; Пересмотрено 19 августа 2011 г .; Принято 27 августа 2011 г.
Copyright © 2012 Baishideng Publishing Group Co., Limited. Все права защищены.Эта статья цитировалась в других статьях в PMC.Abstract
ЦЕЛЬ: изучить различия в клинических характеристиках диффузного и очагового аутоиммунного панкреатита (AIP).
МЕТОДЫ. На основании радиологических данных, полученных с помощью компьютерной томографии и / или магнитно-резонансной томографии, мы разделили 67 пациентов с ОИП на диффузный тип (D-тип) и очаговый тип (F-тип).Далее мы разделили тип F на тип головы (тип H) и тип тела и / или хвоста (тип B / T) в зависимости от места увеличения. Наконец, мы разделили 67 пациентов с ОИП на три группы: тип D, тип H и тип B / T. Мы сравнили три типа AIP с точки зрения клинических, лабораторных, радиологических, функциональных и гистологических данных и клинического течения.
РЕЗУЛЬТАТЫ: 34 пациента с D-типом, 19 с H-типом и 14 с B / T-типом AIP. Хотя механическая желтуха часто выявлялась у пациентов D-типа (88%) и пациентов H-типа (68%), ни у одного из пациентов типа B / T не было желтухи в качестве начального симптома ( P <0.001). Не было различий в частоте боли в животе, но острый панкреатит чаще ассоциировался у пациентов типа B / T (36%), чем у пациентов типа D (3%) ( P = 0,017). Уровни сывороточного иммуноглобулина G (IgG) 4 были значительно выше у пациентов D-типа (медиана 309 мг / дл), чем у пациентов B / T-типа (133,5 мг / дл) ( P = 0,042). Уровни амилазы в сыворотке у пациентов с B / T-типом (медиана: 114 МЕ / л) были значительно выше, чем у пациентов с H-типом (72 МЕ / л) ( P = 0.049). Лимфоплазмоцитарный склерозирующий панкреатит (LPSP) был гистологически подтвержден у 6 пациентов D-типа, 7 H-типа и 4 B / T-типов; идиопатический протоковоцентрический панкреатит не наблюдался ни у одного пациента. Выраженный фиброз и обильная инфильтрация CD20-положительных B-лимфоцитов небольшим количеством IgG4-положительных плазматических клеток были обнаружены у 2 пациентов B / T-типа. Стероидная терапия была эффективной у всех 50 пациентов (31 тип D, 13 тип H и 6 тип B / T). Хотя AIP рецидивировал во время постепенного снижения дозы или после прекращения приема стероидов у 3 пациентов D-типа и 3 H-типа, ни у одного пациента не было рецидивов типа B / T.В ходе последующего наблюдения рентгенологические характеристики 6 пациентов с типом B / T не изменились, а у 1 пациента с типом B / T улучшилось естественное улучшение.
ЗАКЛЮЧЕНИЕ: Клинические признаки AIP H-типа были аналогичны таковым для D-типа, но B / T-тип отличался от D и H. B / T-тип может включать другие заболевания, кроме LPSP.
Ключевые слова: Аутоиммунный панкреатит, иммуноглобулин G 4, лимфоплазмацитарный склерозирующий панкреатит
ВВЕДЕНИЕ
Аутоиммунный панкреатит (AIP) – это тип панкреатита, который, как считается, имеет аутоиммунную этиологию.AIP резко реагирует на стероидную терапию, поэтому дифференцировать AIP от рака поджелудочной железы важно, чтобы избежать ненужной резекции поджелудочной железы [1-3]. Согласно Азиатским диагностическим критериям AIP [4], AIP диагностируется по следующим признакам: диффузное или очаговое увеличение поджелудочной железы и сужение главного протока поджелудочной железы; повышенный уровень сывороточного иммуноглобулина G (IgG) или IgG4 или присутствие аутоантител в сыворотке; гистологические данные о лимфоплазмоцитарной инфильтрации и фиброзе поджелудочной железы [лимфоплазмоцитарный склерозирующий панкреатит (LPSP) [5]]; и отзывчивость на стероиды.АИП часто встречается у пожилых мужчин. Первичный начальный симптом – механическая желтуха, а сахарный диабет встречается у половины пациентов. AIP редко ассоциируется с острым панкреатитом или язвенным колитом. AIP связан с несколькими склерозирующими экстрапанкреатическими поражениями, такими как склерозирующий холангит, склерозирующий сиаладенит и забрюшинный фиброз, и в настоящее время считается поражением поджелудочной железы системного заболевания, связанного с IgG4. AIP хорошо поддается стероидной терапии, но иногда имеет рецидивы [1,2].
Недавно был обнаружен другой гистологический паттерн AIP, характеризующийся протоковой эпителиальной гранулоцитарной инфильтрацией [6,7]. Этот паттерн называется идиопатическим протоковоцентрическим панкреатитом (IDCP) [6]. Клинические особенности пациентов с IDCP отличаются от пациентов с LPSP. Термины AIP типа 1 и типа 2 предлагаются для описания клинических особенностей, связанных с LPSP и IDCP, соответственно [8-11].
Радиологически AIP подразделяется на диффузный тип (тип D) и очаговый тип (тип F) [1-3,12-14].Хотя диффузное увеличение поджелудочной железы довольно специфично для AIP, AIP F-типа следует строго дифференцировать от рака поджелудочной железы. Однако лишь в нескольких исследованиях [13,14] изучались различия между AIP D- и F-типа, и неизвестно, является ли AIP F-типа начальной стадией AIP D-типа или другим типом AIP. Это исследование было направлено на выяснение различий в клинических характеристиках AIP D- и F-типа.
МАТЕРИАЛЫ И МЕТОДЫ
Пациенты, изучаемые
С 1988 по 2010 год, 67 пациентов с ОИП (47 мужчин и 20 женщин; средний возраст: 60 лет.3 года; диапазон: 27-83 года) были диагностированы в соответствии с Азиатскими диагностическими критериями AIP [4] в токийской столичной больнице Комагоме. На основании рентгенологических данных, полученных с помощью компьютерной томографии и / или магнитно-резонансной томографии, мы разделили пациентов с ОИП на D-тип и F. Далее мы разделили тип F на тип головы (тип H) и тип тела и / или хвоста (тип B / T) в зависимости от места увеличения. Наконец, мы разделили 67 пациентов с ОИП на три группы: тип D, тип H и тип B / T. Пациенты с AIP D-типа показали диффузное увеличение поджелудочной железы (Рисунок -), пациенты H-типа показали очаговое увеличение только головки поджелудочной железы (Рисунок -), а пациенты B / T-типа показали увеличение только тела поджелудочной железы и / или хвост (рисунок а).Мы сравнили клинические, лабораторные, радиологические, функциональные и гистологические данные и клиническое течение трех типов AIP.
Компьютерная томография, показывающая аутоиммунный панкреатит диффузного типа. Был замечен отек головы (A), тела (B) и хвоста (C) поджелудочной железы.
Компьютерная томография, показывающая аутоиммунный панкреатит головного типа. Отек только головки поджелудочной железы (A), но тело поджелудочной железы (B) и хвост (C) были нормального размера.
Компьютерная томография, показывающая аутоиммунный панкреатит по типу тела и / или хвоста.Тело и хвост поджелудочной железы опухли (A), но головка поджелудочной железы была в пределах нормального размера (B).
Клинические, радиологические и лабораторные анализы
Клинические оценки включали: возраст на момент постановки диагноза; секс; привычки к употреблению алкоголя и курения; наличие и / или наличие аллергических заболеваний в анамнезе; начальные симптомы, такие как механическая желтуха и боль в животе; и сопутствующие заболевания, такие как сахарный диабет, острый панкреатит и язвенный колит. Привычка к употреблению алкоголя была определена как употребление алкоголя> 80 г / день в течение> 7 лет.Привычка к курению была определена как курение> 20 пач-лет. Сахарный диабет диагностировали, если уровни глюкозы в сыворотке натощак и / или уровни гемоглобина A1c были выше нормального уровня (126 мг / дл и 6,1% соответственно) [15]. Острый панкреатит был диагностирован, когда наблюдались как сильная боль в животе, так и повышение уровня амилазы в сыворотке крови (более чем в 3 раза; норма: 115 МЕ / л).
Стеноз нижнего желчного протока оценивали с помощью эндоскопической ретроградной холангиопанкреатографии и / или магнитно-резонансной холангиопанкреатографии.Радиологически были оценены три экстрапанкреатических поражения, которые часто связаны с ОИП (склерозирующий холангит прикорневых или внутрипеченочных желчных протоков, отек слюнных желез и забрюшинный фиброз).
Лабораторные данные были оценены, включая уровни сывороточного IgG ( n = 67), IgG4 ( n = 65) и иммуноглобулина E (IgE) ( n = 43), количество периферических эозинофилов ( n = 56) уровни амилазы в сыворотке ( n = 66) и аутоантитела, включая антинуклеарный антиген ( n = 60) и ревматоидный фактор ( n = 58).Уровни IgG4 в сыворотке измеряли нефелометрией с использованием наборов подкласса IgG (BS-NIA). Было использовано общепринятое пороговое значение 135 мг / дл.
Гистологические и иммуногистологические исследования
Поджелудочная железа оценивалась с помощью хирургической резекции ( n = 7), хирургической биопсии или биопсии под контролем УЗИ ( n = 6) и тонкоигольной аспирации под контролем эндоскопического ультразвукового исследования (EUS-FNA , n = 10) и исследовали гистологически и иммуногистохимически с использованием антител анти-CD3, анти-CD20 и анти-IgG4.
Клинический курс
Десяти пациентам первоначально было проведено хирургическое вмешательство при подозрении на рак поджелудочной железы (панкреатодуоденэктомия, n = 6; дистальная панкреатэктомия, n = 1; холедоходуоденостомия с биопсией поджелудочной железы, n = 3). Пятьдесят пациентов, в том числе один хирург, пролеченный пероральными стероидами. Преднизолон в начальной дозе 30-40 мг / сут назначался в течение 2-3 недель. Затем его снижали на 5 мг каждые 1-3 недели до 5 мг / сут. Поддерживающая терапия (2.5-5 мг / сут, 1-3 года) применялась у всех пациентов. Рецидив AIP был определен как повторное появление симптомов с развитием или повторным появлением патологий поджелудочной железы и / или экстрапанкреатических патологий при визуализирующих исследованиях. Восемь пациентов наблюдались консервативно без стероидной терапии.
Статистический анализ
Различия между группами анализировали с использованием точного вероятностного критерия Фишера и критерия Манна-Уитни U . Значения P были скорректированы методом Бонферрони, а значения P <0.05 считали статистически значимым.
РЕЗУЛЬТАТЫ
Клинические, радиологические и лабораторные различия
Шестьдесят семь пациентов с ОИП были классифицированы на D-тип ( n = 34), H-тип ( n = 19) и B / T-тип ( n = 14) AIP. Существенных различий по возрасту, полу, алкоголю, курению и аллергическим заболеваниям между группами не было. Хотя механическая желтуха часто выявлялась у пациентов с D-типом (88%) и H-типом (68%), ни у одного пациента с типом B / T не проявлялась желтуха в качестве начального симптома ( P <0.001). Хотя не было различий в частоте боли в животе, острый панкреатит чаще встречался у пациентов типа B / T (36%), чем у пациентов типа D (3%) ( P = 0,017). Хотя стеноз нижнего желчного протока часто наблюдался у пациентов D-типа (94%) и H-типа (95%), ни у одного пациента типа B / T не было стеноза нижнего желчного протока ( P <0,001). Не было различий между группами по ассоциированным экстрапанкреатическим поражениям (таблица).
Таблица 1
Клинические и рентгенологические данные трех типов аутоиммунного панкреатита
| Тип D, n = 34 | H тип, n = 19 | B / Тип T, n = 14 | Значение P , D против H | P значение, D против B / T | P значение, H против B / T | |
| Средний возраст (лет) (квартильный диапазон) | 67.5 (59-71,5) | 64,0 (56-71) | 61,5 (50,3-72,5) | > 0,99 | > 0,99 | > 0,99 |
| Мужской / женский | 24/10 | 15 / 4 | 8/6 | > 0,99 | > 0,99 | > 0,99 |
| Привычка к употреблению алкоголя +/- (%) | 4/27 (15) | 4/15 (21) | 2 / 12 (14) | > 0,99 | > 0,99 | > 0,99 |
| Привычка к курению +/- (%) | 16/27 (59) | 12/16 (75) | 5/13 ( 39) | > 0.99 | > 0,99 | 0,198 |
| Аллергия +/- (%) | 8/25 (32) | 6/18 (33) | 7/13 (54) | > 0,99 | 0,885 | 0,879 |
| Желтуха +/- (%) | 30/4 (88) | 13/6 (68) | 0/14 (0) | 0,420 | <0,001 | <0,001 |
| Боль в животе +/- (%) | 6/28 (18) | 7/13 (37) | 5/9 (36) | 0.546 | 0,771 | > 0,999 |
| Диабет +/- (%) | 10/24 (29) | 11/8 (58) | 4/10 (29) | 0,231 | > 0,999 | > 0,999 |
| Острый панкреатит +/- (%) | 1/33 (3) | 1/18 (5) | 5/9 (36) | > 0,999 | 0,017 | 0,183 |
| Язвенный колит +/- (%) | 1/33 (3) | 0/19 (0) | 1/13 (7) | > 0.999 | > 0,999 | > 0,999 |
| Стеноз нижнего мерзкого протока +/- (%) | 32/34 (94) | 18/19 (95) | 0/14 (0) | > 0,999 | <0,001 | <0,001 |
| Экстрапанкреатические поражения +/- (%) | 13/21 (38) | 6/13 (32) | 5/9 (36) | > 0,999 | > 0,999 | > 0,999 |
Уровни сывороточного IgG4 были значительно выше у пациентов D-типа (медиана: 309 мг / дл), чем у пациентов B / T-типа (133.5 мг / дл) пациентов ( P = 0,042). Уровни сывороточного IgG4 чаще повышались у пациентов с D-типом (88%), чем у пациентов с B / T-типом (50%) ( P = 0,030). Не было значительных различий в уровнях сывороточного IgE и количестве периферических эозинофилов между группами. Уровни амилазы в сыворотке у пациентов B / T-типа (медиана: 114 МЕ / л) были значительно выше, чем у пациентов H-типа (72 МЕ / л) ( P = 0,049). По соотношению антинуклеарного антигена и ревматоидного фактора различий между группами не было (таблица).
Таблица 2
Лабораторные данные трех типов аутоиммунного панкреатита
| тип D, n = 34 | тип H, n = 19 | тип B / T , n = 14 | P значение, D vs H | P значение, D vs B / T | P значение, H vs B / T | |
| Медиана IgG, мг / дл | 2163.5 (1637,5-2682,8) | 1920 (1398,5-2300) | 1619 (1369,5-2364,5) | 0,642 | > 0,999 | > 0,999 |
| (квартильный диапазон) | ||||||
| 309 (181-1015) | 351 (228-780) | 133,5 (60,8-326,5) | > 0,999 | 0,042 | 0,057 | |
| (квартильный диапазон) | 28/32 (88) | 16/19 (84) | 7/14 (50) | > 0.999 | 0,030 | 0,168 |
| Медиана IgE, МЕ / л | 406,9 (265,5-877) | 249,0 (74,75-589,75) | 264,0 (134,1-856) | 4 0,447> | 4 0,447 > 0,999 | |
| (квартильный диапазон) | ||||||
| IgE> 580, (МЕ / л) (%) | 8/20 (40,0) | 3/12 (25,0) | 4/11 (36,4) | > 0,999 | > 0,999 | > 0,999 |
| Медиана эозинофилов, мкл | 180 (72-440) | 238.5 (152,5-447,75) | 473 (114,5-621,5) | > 0,999 | 0,354 | > 0,999 |
| (квартильный диапазон) | ||||||
| Эозинофилы> 600 / мкл 13 (%) 3/3 | 32 90 (11) | 2/16 (13) | 3/13 (23) | > 0,999 | > 0,999 | > 0,999 |
| Медиана амилазы (МЕ / л) | 86 (49,5-119,5) | 72 (43-100) | 114 (73,3-589,3) | > 0.999 | > 0,999 | 0,049 |
| (квартильный диапазон) | ||||||
| Амилаза> 115 (МЕ / л) (%) | 8/33 (24) | 4/19 (21) | 7 / 14 (50) | > 0,999 | 0,300 | 0,408 |
| Положительный антинуклеарный антиген (%) | 14/29 (48) | 4/18 (22) | 6/13 (46) | 0,366 | > 0,999 | 0,738 |
| Положительный ревматоидный фактор (%) | 10/28 (36) | 2/17 (12) | 1/13 (7) | 0.288 | 0,378 | > 0,999 |
Гистологические и иммуногистохимические исследования
ЛПСП был гистологически подтвержден с обильной инфильтрацией CD3-положительных Т-лимфоцитов и IgG4-положительных плазматических клеток в 6 D-типе, 7 H-типе и 4 Пациенты типа B / T. В поджелудочной железе 2 пациентов B / T-типа (1 образец хирургической биопсии и 1 образец EUS-FNA) были обнаружены выраженный фиброз и обильная инфильтрация CD20-положительных В-лимфоцитов, а не Т-лимфоцитов, но мало IgG4-положительных плазматических клеток или нейтрофилов не обнаружено.IDCP не наблюдался ни у одного пациента. EUS-FNA у 4 пациентов с ОИП не смог подтвердить гистологический диагноз из-за недостаточного количества образцов (таблица).
Таблица 3
Гистологические данные поджелудочной железы при трех типах аутоиммунного панкреатита
| D тип | H тип | B / T тип | LPSP ( n = 3) | LPSP ( n = 3) | LPSP ( n = 1) |
| Биопсия | LPSP ( n = 2) | LPSP ( n = 3) | Фиброз с обильной инфильтрацией В-лимфоцитов ( n = 1) |
| EUS-FNA | LPSP ( n = 1) | LPSP ( n = 1) | ( n = 3) |
| Несоответствующий материал ( n = 1) | Несоответствующий материал ( n = 2) | Фиброз с обильной инфильтрацией B-лимфоцитов ( n = 1) | 9 0175|
| Несоответствующий материал ( n = 1) |
Клинический курс
Стероидная терапия была эффективной у всех 50 пациентов (31 тип D, 13 H тип и 6 B / T тип).Рецидив АИП произошел во время постепенного снижения дозы или после прекращения приема стероидов у 3 пациентов D-типа и 3-х пациентов H-типа. У 8 пациентов, находящихся под консервативным наблюдением (1 тип H и 7 тип B / T), рентгенологические характеристики не изменились у семи пациентов, но увеличение хвоста поджелудочной железы улучшилось естественным образом у 1 пациента с типом B / T. В течение курса, предшествовавшего нашей госпитализации, очаговое увеличение головки поджелудочной железы развилось до диффузного увеличения в трех случаях, а очаговое увеличение хвоста поджелудочной железы развилось до диффузного увеличения в одном случае.
ОБСУЖДЕНИЕ
Радиологически AIP подразделяется на диффузные и очаговые формы. Диффузное увеличение поджелудочной железы, называемое колбасоподобным увеличением, является типичным признаком AIP. Однако AIP F-типа, иногда образующий массу, часто трудно отличить от рака поджелудочной железы [1-3,12-14]. Возможные различия в клинических проявлениях между типами D и F AIP неясны.
В настоящем исследовании мы классифицировали 67 пациентов с ОИП на тип D ( n = 34), тип H ( n = 19) и тип B / T ( n = 14).Типы D и H показали сходные клинические особенности. Однако тип B / T отличался от типов D и H в нескольких аспектах. Механическая желтуха и стеноз нижнего желчного протока часто выявлялись у пациентов с типом D и H, но ни у одного пациента с типом B / T эти особенности не наблюдались. По данным Ghazale et al [16], стеноз нижнего желчного протока присутствовал у 70% из 53 пациентов с ОИП. Хирано и др. [17] заявили, что как отек поджелудочной железы из-за воспаления головки поджелудочной железы, так и утолщение стенки желчных протоков влияют на стеноз нижнего желчного протока при AIP, основываясь на данных EUS и на том факте, что 93% случаев AIP с положительным поражением головки поджелудочной железы у пациентов был стеноз нижнего желчного протока, по сравнению только с 17% пациентов с отрицательным поражением.
В этом исследовании уровень сывороточного IgG4 был значительно ниже у пациентов B / T-типа, чем у пациентов с D-типом, а повышение уровня сывороточного IgG4 было меньше у пациентов с B / T-типом, чем у пациентов с D-типом. Острый панкреатит чаще наблюдался у пациентов B / T-типа, чем у пациентов с D-типом, а уровни амилазы в сыворотке крови были значительно выше у пациентов с B / T-типом, чем у пациентов с H-типом. Что касается диагноза и частоты острого панкреатита, высокий процент пациентов с типом B / T, по-видимому, в основном зависит от более высоких уровней амилазы.Острый панкреатит или некоторые острые воспалительные приступы в случаях хронического панкреатита могут не быть связаны с высокими уровнями амилазы из-за атрофической ацинарной ткани. Не было разницы в частоте болей в животе, поэтому некоторые случаи D-типа и H-типа могли быть упущены из виду.
Ни у одного пациента типа B / T не рецидив после стероидной терапии, по сравнению с 10% пациентов D-типа и 23% пациентов H-типа. Стало ясно, что существует два гистологических подтипа (LPSP и IDCP) в AIP [6-11].Большинство пациентов с AIP в Азии имеют LPSP, а половина пациентов с AIP в Европе имеют IDCP [8,10]. Клинические признаки этих двух подтипов существенно различаются. Обычно сообщается, что пациенты с IDCP моложе на момент постановки диагноза, а у пациентов с IDCP реже повышенный уровень IgG4 в сыворотке крови. IDCP чаще ассоциируется с острым панкреатитом и воспалительным заболеванием кишечника. Согласно сравнительному исследованию пациентов с LPSP и IDCP, проведенным Sah et al [9], пациенты с IDCP, как правило, имели больше очаговых особенностей, чем LPSP (84% против 60%), и рецидивов IDCP не наблюдалось ни у одного пациента, тогда как LPSP рецидивировал у 47% пациентов.Для диагностики IDCP необходимо гистологическое исследование адекватного образца поджелудочной железы, а необходимость гистологического исследования для диагностики IDCP в настоящее время затрудняет клиническую диагностику.
При гистологическом исследовании данных случаев LPSP был подтвержден у 17, но IDCP не был обнаружен. Клинические файлы AIP D-типа и H-типа были совместимы с файлами пациентов с LPSP. Однако, учитывая низкие уровни IgG4 в сыворотке и частую связь с острым панкреатитом, существует вероятность того, что некоторые случаи IDCP могут быть вовлечены в случаи B / T-типа.Например, 32-летний мужчина с AIP B / T-типа показал нормальные уровни IgG4 в сыворотке, связь с язвенным колитом и хорошую чувствительность к стероидной терапии, но гистологический диагноз с помощью EUS-FNA не мог быть подтвержден из-за недостаточного образец биопсии. Интересно, что гистология двух пациентов с B / T-типом включала обильную инфильтрацию B-клеток с небольшой инфильтрацией IgG4-положительных клеток или нейтрофилов, которые могли быть другим типом AIP, отличным от LPSP и IDCP. AIP B / T-типа может включать заболевание, отличное от LPSP.
Три пациента с типом H и один пациент с типом B / T прогрессировали до типа D в течение естественного течения. Также сообщалось, что AIP H-типа переходит в D-тип [18,19], а AIP B / T-типа – в D-тип [20]. Также были сообщения о рецидивах в остаточной поджелудочной железе после резекции, таких как рецидив в остаточной головке поджелудочной железы через 1 год после дистальной панкреатэктомии [21] и рецидив в остаточной части поджелудочной железы через 4 месяца после панкреатодуоденэктомии [22]. Стероидная терапия была эффективной для тех поражений, которые прогрессировали или рецидивировали.Эти данные показывают, что очаговое воспаление может прогрессировать до последующих диффузных изменений по всей поджелудочной железе или развиваться повторно в разных местах и в разное время у некоторых пациентов с ОИП. Диффузное изменение поджелудочной железы может быть окончательным проявлением AIP, и то, влияет ли этот воспалительный процесс на железу диффузно или очагово, может просто отражать стадию заболевания. Из семи консервативно наблюдаемых пациентов типа B / T у шести не было никаких изменений, а у одного улучшилось естественным образом. Kubota et al [23] сообщили, что у всех восьми пациентов с ОИП, у которых спонтанно улучшилось состояние, наблюдалось очаговое увеличение поджелудочной железы.AIP B / T-типа может включать заболевание, отличное от AIP D-типа и H.
В заключение, хотя клинические признаки AIP H-типа аналогичны клиническим характеристикам AIP D-типа, AIP B / T-типа в некоторых аспектах отличается от типов D и H. AIP B / T-типа может включать заболевание, отличное от LPSP.
КОММЕНТАРИИ
Предпосылки
Аутоиммунный панкреатит (АИП) – это особый тип панкреатита, который, как считается, имеет аутоиммунную этиологию. Недавно AIP был радиологически классифицирован на диффузный тип (тип D) и очаговый тип (тип F).Однако различия между AIP D- и F-типа малоизвестны.
Границы исследований
Были исследованы различия в клинических, радиологических, лабораторных и гистологических данных между AIP D- и F-типа.
Инновации и прорывы
Пациенты с ОИП были разделены на тип D и тип F. Кроме того, тип F был разделен на тип головы (тип H) и тип корпуса и / или хвоста (тип B / T). Ни у одного пациента типа B / T не была желтуха как начальный симптом, но острый панкреатит чаще ассоциировался с типом B / T, чем с типом D.Уровни амилазы в сыворотке крови у пациентов B / T-типа были значительно выше, чем у пациентов с H-типом. Уровни сывороточного иммуноглобулина G (IgG) 4 были значительно выше у пациентов D-типа, чем у пациентов B / T-типа. Ни у одного из пациентов типа B / T после стероидной терапии не наблюдалось рецидива, по сравнению с 10% пациентов D-типа и 23% пациентов H-типа. У двух пациентов B / T-типа наблюдалась обильная инфильтрация B-клеток с небольшой инфильтрацией IgG4-положительных клеток или нейтрофилов.
Приложения
AIP B / T-типа отличается по нескольким аспектам от типов D и H, и некоторые AIP B / T-типа могут быть связаны с заболеванием, отличным от лимфоплазмоцитарного склерозирующего панкреатита.
Рецензирование
Само исследование кажется разумным, а результаты интересны и имеют этиологическое значение.
Сноски
При поддержке Исследовательского комитета по трудноизлечимым заболеваниям поджелудочной железы (главный исследователь; Тору Симосегава), предоставлены Министерством здравоохранения, труда и социального обеспечения Японии
Рецензенты: Сёитиро Суми, доктор медицины, доктор философии, младший профессор, Отделение реконструкции органов, Институт пограничных медицинских наук, Университет Киото, Сакё-ку, Киото 606-8507, Япония; Ацуши Масамунэ, доктор медицины, доктор философии, отделение гастроэнтерологии, Высшая школа медицины Университета Тохоку, 1-1 Сейрё-мати, Аоба-ку, Сендай 980-8574, Япония
S- редактор Lv S L- редактор Kerr C. E- редактор Li JY
Ссылки
1.Окадзаки К., Кава С., Камисава Т., Ито Т., Инуи К., Ирие Х, Ирисава А., Кубо К., Нотохара К., Хасебе О. и др. Японские клинические рекомендации по аутоиммунному панкреатиту. Поджелудочная железа. 2009; 38: 849–866. [PubMed] [Google Scholar] 2. Чари С.Т., Такахаши Н., Леви М.Дж., Смирк Т.К., Клейн Дж.Э., Пирсон Р.К., Петерсен Б.Т., Топазиан М.А., Веге С.С. Диагностическая стратегия, позволяющая отличить аутоиммунный панкреатит от рака поджелудочной железы. Clin Gastroenterol Hepatol. 2009; 7: 1097–1103. [PubMed] [Google Scholar] 3. Камисава Т., Такума К., Эгава Н., Цурута К., Сасаки Т.Аутоиммунный панкреатит и склерозирующая болезнь, связанная с IgG4. Нат Рев Гастроэнтерол Гепатол. 2010; 7: 401–409. [PubMed] [Google Scholar] 4. Otsuki M, Chung JB, Okazaki K, Kim MH, Kamisawa T., Kawa S., Park SW, Shimosegawa T., Lee K, Ito T. и др. Азиатские диагностические критерии аутоиммунного панкреатита: консенсус Японско-корейского симпозиума по аутоиммунному панкреатиту. J Gastroenterol. 2008; 43: 403–408. [PubMed] [Google Scholar] 5. Кавагути К., Койке М., Цурута К., Окамото А., Табата И., Фудзита Н. Лимфоплазмоцитарный склерозирующий панкреатит с холангитом: вариант первичного склерозирующего холангита с обширным поражением поджелудочной железы.Hum Pathol. 1991; 22: 387–395. [PubMed] [Google Scholar] 6. Нотохара К., Бургарт Л.Дж., Ядав Д., Чари С., Смирк ТЦ. Идиопатический хронический панкреатит с перидуктальной лимфоплазмоцитарной инфильтрацией: клинико-патологические особенности 35 случаев. Am J Surg Pathol. 2003. 27: 1119–1127. [PubMed] [Google Scholar] 7. Zamboni G, Lüttges J, Capelli P, Frulloni L, Cavallini G, Pederzoli P, Leins A, Longnecker D, Klöppel G. Гистопатологические особенности диагностической и клинической значимости аутоиммунного панкреатита: исследование на 53 образцах резекции и 9 образцах биопсии.Арка Вирхова. 2004. 445: 552–563. [PubMed] [Google Scholar] 8. Park DH, Kim MH, Chari ST. Последние достижения в области аутоиммунного панкреатита. Кишечник. 2009. 58: 1680–1689. [PubMed] [Google Scholar] 9. Сах Р.П., Чари С.Т., Паннала Р., Сугумар А., Клэйн Дж.Э., Леви М.Дж., Пирсон Р.К., Смирк Т.С., Петерсен Б.Т., Топазиан М.Д. и др. Различия в клиническом профиле и частоте рецидивов аутоиммунного панкреатита 1 типа и 2 типа. Гастроэнтерология. 2010; 139: 140–148; викторина 140-148. [PubMed] [Google Scholar] 10. Камисава Т., Нотохара К., Симосегава Т.Два клинико-патологических подтипа аутоиммунного панкреатита: LPSP и IDCP. Гастроэнтерология. 2010; 139: 22–25. [PubMed] [Google Scholar] 11. Chari ST, Kloeppel G, Zhang L, Notohara K, Lerch MM, Shimosegawa T. Гистопатологические и клинические подтипы аутоиммунного панкреатита: консенсусный документ гонолулу. Панкреатология. 2010. 10: 664–672. [PubMed] [Google Scholar] 12. Ирие Х, Хонда Х, Баба С., Куроива Т., Йошимицу К., Тадзима Т., Джими М., Суми Т., Масуда К. Аутоиммунный панкреатит: характеристики КТ и МРТ.AJR Am J Roentgenol. 1998; 170: 1323–1327. [PubMed] [Google Scholar] 13. Wakabayashi T, Kawaura Y, Satomura Y, Fujii T., Motoo Y, Okai T., Sawabu N. Клиническое исследование хронического панкреатита с очаговым нерегулярным сужением главного протока поджелудочной железы и образованием массы: сравнение с хроническим панкреатитом, показывающим диффузное нерегулярное сужение основного протока. проток поджелудочной железы. Поджелудочная железа. 2002. 25: 283–289. [PubMed] [Google Scholar] 14. Фруллони Л., Скаттолини С., Фалькони М., Замбони Дж., Капелли П., Манфреди Р., Грациани Р., Д’Онофрио М., Кацотурчи А.М., Амодио А. и др.Аутоиммунный панкреатит: различия очаговой и диффузной форм у 87 больных. Am J Gastroenterol. 2009. 104: 2288–2294. [PubMed] [Google Scholar] 16. Ghazale A, Chari ST, Zhang L, Smyrk TC, Takahashi N, Levy MJ, Topazian MD, Clain JE, Pearson RK, Petersen BT и др. Иммуноглобулин G4-ассоциированный холангит: клинический профиль и ответ на терапию. Гастроэнтерология. 2008. 134: 706–715. [PubMed] [Google Scholar] 17. Хирано К., Тада М., Исаяма Х, Ямамото К., Мизуно С., Ягиока Х, Яшима Й, Сасаки Т, Когуре Х, Тогава О и др.Эндоскопическая оценка факторов, способствующих возникновению стриктуры внутрипанкреатических желчевыводящих путей при аутоиммунном панкреатите. Gastrointest Endosc. 2010; 71: 85–90. [PubMed] [Google Scholar] 18. Horiuchi A, Kawa S, Akamatsu T., Aoki Y, Mukawa K, Furuya N, Ochi Y, Kiyosawa K. Характерный внешний вид протока поджелудочной железы при аутоиммунном хроническом панкреатите: отчет о болезни и обзор японской литературы. Am J Gastroenterol. 1998. 93: 260–263. [PubMed] [Google Scholar] 19. Кога Й, Ямагути К., Сугитани А., Чидзива К., Танака М.Аутоиммунный панкреатит, начинающийся как локализованная форма. J Gastroenterol. 2002. 37: 133–137. [PubMed] [Google Scholar] 20. Wakabayashi T, Kawaura Y, Satomura Y, Watanabe H, Motoo Y, Sawabu N. Долгосрочный прогноз хронического панкреатита с сужением протока: стратегия лечения стероидами. Поджелудочная железа. 2005; 30: 31–39. [PubMed] [Google Scholar] 21. Motoo Y, Minamoto T., Watanabe H, Sakai J, Okai T., Sawabu N. Склерозирующий панкреатит, демонстрирующий быстро прогрессирующие изменения с периодическим формированием массы. Int J Pancreatol.1997; 21: 85–90. [PubMed] [Google Scholar] 22. Бланк A, Maybody M, Isom-Batz G, Roslin M, Dillon EH. Острый некротический панкреатит, вызванный Salmonella typhimurium. Dig Dis Sci. 2003. 48: 1472–1474. [PubMed] [Google Scholar] 23. Kubota K, Iida H, Fujisawa T., Ogawa M, Inamori M, Saito S, Kakuta Y, Oshiro H, Nakajima A. Клиническое значение опухшего дуоденального сосочка при аутоиммунном панкреатите. Поджелудочная железа. 2007; 35: e51 – e60. [PubMed] [Google Scholar]Различия между диффузным и очаговым аутоиммунным панкреатитом
World J Gastroenterol.2012 7 мая; 18 (17): 2099–2104.
Таку Табата, Теруми Камисава, Кенсуке Такума, Сэйити Хара, Савако Курума, Ёсихико Инаба, отделение внутренней медицины, Токийская столичная больница Комагоме, 3-18-22 Хонкомагоме, Бункё-ку, Токио 113-8677, Япония
Авторский вклад : Табата Т. и Камисава Т. внесли равный вклад в эту работу, проанализировали данные и написали рукопись; Данные собирали Такума К., Хара С., Курума С. и Инаба Ю.Для корреспонденции: Теруми Камисава, доктор медицинских наук, отделение внутренней медицины, Токийская столичная больница Комагоме, 3-18-22 Хонкомагоме, Бункё-ку, Токио 113-8677, Япония.pj.kcic@awasimak
Телефон: + 81-3-38232101 Факс: + 81-3-38241552
Получено 31 мая 2011 г .; Пересмотрено 19 августа 2011 г .; Принято 27 августа 2011 г.
Copyright © 2012 Baishideng Publishing Group Co., Limited. Все права защищены.Эта статья цитировалась в других статьях в PMC.Abstract
ЦЕЛЬ: изучить различия в клинических характеристиках диффузного и очагового аутоиммунного панкреатита (AIP).
МЕТОДЫ. На основании радиологических данных, полученных с помощью компьютерной томографии и / или магнитно-резонансной томографии, мы разделили 67 пациентов с ОИП на диффузный тип (D-тип) и очаговый тип (F-тип).Далее мы разделили тип F на тип головы (тип H) и тип тела и / или хвоста (тип B / T) в зависимости от места увеличения. Наконец, мы разделили 67 пациентов с ОИП на три группы: тип D, тип H и тип B / T. Мы сравнили три типа AIP с точки зрения клинических, лабораторных, радиологических, функциональных и гистологических данных и клинического течения.
РЕЗУЛЬТАТЫ: 34 пациента с D-типом, 19 с H-типом и 14 с B / T-типом AIP. Хотя механическая желтуха часто выявлялась у пациентов D-типа (88%) и пациентов H-типа (68%), ни у одного из пациентов типа B / T не было желтухи в качестве начального симптома ( P <0.001). Не было различий в частоте боли в животе, но острый панкреатит чаще ассоциировался у пациентов типа B / T (36%), чем у пациентов типа D (3%) ( P = 0,017). Уровни сывороточного иммуноглобулина G (IgG) 4 были значительно выше у пациентов D-типа (медиана 309 мг / дл), чем у пациентов B / T-типа (133,5 мг / дл) ( P = 0,042). Уровни амилазы в сыворотке у пациентов с B / T-типом (медиана: 114 МЕ / л) были значительно выше, чем у пациентов с H-типом (72 МЕ / л) ( P = 0.049). Лимфоплазмоцитарный склерозирующий панкреатит (LPSP) был гистологически подтвержден у 6 пациентов D-типа, 7 H-типа и 4 B / T-типов; идиопатический протоковоцентрический панкреатит не наблюдался ни у одного пациента. Выраженный фиброз и обильная инфильтрация CD20-положительных B-лимфоцитов небольшим количеством IgG4-положительных плазматических клеток были обнаружены у 2 пациентов B / T-типа. Стероидная терапия была эффективной у всех 50 пациентов (31 тип D, 13 тип H и 6 тип B / T). Хотя AIP рецидивировал во время постепенного снижения дозы или после прекращения приема стероидов у 3 пациентов D-типа и 3 H-типа, ни у одного пациента не было рецидивов типа B / T.В ходе последующего наблюдения рентгенологические характеристики 6 пациентов с типом B / T не изменились, а у 1 пациента с типом B / T улучшилось естественное улучшение.
ЗАКЛЮЧЕНИЕ: Клинические признаки AIP H-типа были аналогичны таковым для D-типа, но B / T-тип отличался от D и H. B / T-тип может включать другие заболевания, кроме LPSP.
Ключевые слова: Аутоиммунный панкреатит, иммуноглобулин G 4, лимфоплазмацитарный склерозирующий панкреатит
ВВЕДЕНИЕ
Аутоиммунный панкреатит (AIP) – это тип панкреатита, который, как считается, имеет аутоиммунную этиологию.AIP резко реагирует на стероидную терапию, поэтому дифференцировать AIP от рака поджелудочной железы важно, чтобы избежать ненужной резекции поджелудочной железы [1-3]. Согласно Азиатским диагностическим критериям AIP [4], AIP диагностируется по следующим признакам: диффузное или очаговое увеличение поджелудочной железы и сужение главного протока поджелудочной железы; повышенный уровень сывороточного иммуноглобулина G (IgG) или IgG4 или присутствие аутоантител в сыворотке; гистологические данные о лимфоплазмоцитарной инфильтрации и фиброзе поджелудочной железы [лимфоплазмоцитарный склерозирующий панкреатит (LPSP) [5]]; и отзывчивость на стероиды.АИП часто встречается у пожилых мужчин. Первичный начальный симптом – механическая желтуха, а сахарный диабет встречается у половины пациентов. AIP редко ассоциируется с острым панкреатитом или язвенным колитом. AIP связан с несколькими склерозирующими экстрапанкреатическими поражениями, такими как склерозирующий холангит, склерозирующий сиаладенит и забрюшинный фиброз, и в настоящее время считается поражением поджелудочной железы системного заболевания, связанного с IgG4. AIP хорошо поддается стероидной терапии, но иногда имеет рецидивы [1,2].
Недавно был обнаружен другой гистологический паттерн AIP, характеризующийся протоковой эпителиальной гранулоцитарной инфильтрацией [6,7]. Этот паттерн называется идиопатическим протоковоцентрическим панкреатитом (IDCP) [6]. Клинические особенности пациентов с IDCP отличаются от пациентов с LPSP. Термины AIP типа 1 и типа 2 предлагаются для описания клинических особенностей, связанных с LPSP и IDCP, соответственно [8-11].
Радиологически AIP подразделяется на диффузный тип (тип D) и очаговый тип (тип F) [1-3,12-14].Хотя диффузное увеличение поджелудочной железы довольно специфично для AIP, AIP F-типа следует строго дифференцировать от рака поджелудочной железы. Однако лишь в нескольких исследованиях [13,14] изучались различия между AIP D- и F-типа, и неизвестно, является ли AIP F-типа начальной стадией AIP D-типа или другим типом AIP. Это исследование было направлено на выяснение различий в клинических характеристиках AIP D- и F-типа.
МАТЕРИАЛЫ И МЕТОДЫ
Пациенты, изучаемые
С 1988 по 2010 год, 67 пациентов с ОИП (47 мужчин и 20 женщин; средний возраст: 60 лет.3 года; диапазон: 27-83 года) были диагностированы в соответствии с Азиатскими диагностическими критериями AIP [4] в токийской столичной больнице Комагоме. На основании рентгенологических данных, полученных с помощью компьютерной томографии и / или магнитно-резонансной томографии, мы разделили пациентов с ОИП на D-тип и F. Далее мы разделили тип F на тип головы (тип H) и тип тела и / или хвоста (тип B / T) в зависимости от места увеличения. Наконец, мы разделили 67 пациентов с ОИП на три группы: тип D, тип H и тип B / T. Пациенты с AIP D-типа показали диффузное увеличение поджелудочной железы (Рисунок -), пациенты H-типа показали очаговое увеличение только головки поджелудочной железы (Рисунок -), а пациенты B / T-типа показали увеличение только тела поджелудочной железы и / или хвост (рисунок а).Мы сравнили клинические, лабораторные, радиологические, функциональные и гистологические данные и клиническое течение трех типов AIP.
Компьютерная томография, показывающая аутоиммунный панкреатит диффузного типа. Был замечен отек головы (A), тела (B) и хвоста (C) поджелудочной железы.
Компьютерная томография, показывающая аутоиммунный панкреатит головного типа. Отек только головки поджелудочной железы (A), но тело поджелудочной железы (B) и хвост (C) были нормального размера.
Компьютерная томография, показывающая аутоиммунный панкреатит по типу тела и / или хвоста.Тело и хвост поджелудочной железы опухли (A), но головка поджелудочной железы была в пределах нормального размера (B).
Клинические, радиологические и лабораторные анализы
Клинические оценки включали: возраст на момент постановки диагноза; секс; привычки к употреблению алкоголя и курения; наличие и / или наличие аллергических заболеваний в анамнезе; начальные симптомы, такие как механическая желтуха и боль в животе; и сопутствующие заболевания, такие как сахарный диабет, острый панкреатит и язвенный колит. Привычка к употреблению алкоголя была определена как употребление алкоголя> 80 г / день в течение> 7 лет.Привычка к курению была определена как курение> 20 пач-лет. Сахарный диабет диагностировали, если уровни глюкозы в сыворотке натощак и / или уровни гемоглобина A1c были выше нормального уровня (126 мг / дл и 6,1% соответственно) [15]. Острый панкреатит был диагностирован, когда наблюдались как сильная боль в животе, так и повышение уровня амилазы в сыворотке крови (более чем в 3 раза; норма: 115 МЕ / л).
Стеноз нижнего желчного протока оценивали с помощью эндоскопической ретроградной холангиопанкреатографии и / или магнитно-резонансной холангиопанкреатографии.Радиологически были оценены три экстрапанкреатических поражения, которые часто связаны с ОИП (склерозирующий холангит прикорневых или внутрипеченочных желчных протоков, отек слюнных желез и забрюшинный фиброз).
Лабораторные данные были оценены, включая уровни сывороточного IgG ( n = 67), IgG4 ( n = 65) и иммуноглобулина E (IgE) ( n = 43), количество периферических эозинофилов ( n = 56) уровни амилазы в сыворотке ( n = 66) и аутоантитела, включая антинуклеарный антиген ( n = 60) и ревматоидный фактор ( n = 58).Уровни IgG4 в сыворотке измеряли нефелометрией с использованием наборов подкласса IgG (BS-NIA). Было использовано общепринятое пороговое значение 135 мг / дл.
Гистологические и иммуногистологические исследования
Поджелудочная железа оценивалась с помощью хирургической резекции ( n = 7), хирургической биопсии или биопсии под контролем УЗИ ( n = 6) и тонкоигольной аспирации под контролем эндоскопического ультразвукового исследования (EUS-FNA , n = 10) и исследовали гистологически и иммуногистохимически с использованием антител анти-CD3, анти-CD20 и анти-IgG4.
Клинический курс
Десяти пациентам первоначально было проведено хирургическое вмешательство при подозрении на рак поджелудочной железы (панкреатодуоденэктомия, n = 6; дистальная панкреатэктомия, n = 1; холедоходуоденостомия с биопсией поджелудочной железы, n = 3). Пятьдесят пациентов, в том числе один хирург, пролеченный пероральными стероидами. Преднизолон в начальной дозе 30-40 мг / сут назначался в течение 2-3 недель. Затем его снижали на 5 мг каждые 1-3 недели до 5 мг / сут. Поддерживающая терапия (2.5-5 мг / сут, 1-3 года) применялась у всех пациентов. Рецидив AIP был определен как повторное появление симптомов с развитием или повторным появлением патологий поджелудочной железы и / или экстрапанкреатических патологий при визуализирующих исследованиях. Восемь пациентов наблюдались консервативно без стероидной терапии.
Статистический анализ
Различия между группами анализировали с использованием точного вероятностного критерия Фишера и критерия Манна-Уитни U . Значения P были скорректированы методом Бонферрони, а значения P <0.05 считали статистически значимым.
РЕЗУЛЬТАТЫ
Клинические, радиологические и лабораторные различия
Шестьдесят семь пациентов с ОИП были классифицированы на D-тип ( n = 34), H-тип ( n = 19) и B / T-тип ( n = 14) AIP. Существенных различий по возрасту, полу, алкоголю, курению и аллергическим заболеваниям между группами не было. Хотя механическая желтуха часто выявлялась у пациентов с D-типом (88%) и H-типом (68%), ни у одного пациента с типом B / T не проявлялась желтуха в качестве начального симптома ( P <0.001). Хотя не было различий в частоте боли в животе, острый панкреатит чаще встречался у пациентов типа B / T (36%), чем у пациентов типа D (3%) ( P = 0,017). Хотя стеноз нижнего желчного протока часто наблюдался у пациентов D-типа (94%) и H-типа (95%), ни у одного пациента типа B / T не было стеноза нижнего желчного протока ( P <0,001). Не было различий между группами по ассоциированным экстрапанкреатическим поражениям (таблица).
Таблица 1
Клинические и рентгенологические данные трех типов аутоиммунного панкреатита
| Тип D, n = 34 | H тип, n = 19 | B / Тип T, n = 14 | Значение P , D против H | P значение, D против B / T | P значение, H против B / T | |
| Средний возраст (лет) (квартильный диапазон) | 67.5 (59-71,5) | 64,0 (56-71) | 61,5 (50,3-72,5) | > 0,99 | > 0,99 | > 0,99 |
| Мужской / женский | 24/10 | 15 / 4 | 8/6 | > 0,99 | > 0,99 | > 0,99 |
| Привычка к употреблению алкоголя +/- (%) | 4/27 (15) | 4/15 (21) | 2 / 12 (14) | > 0,99 | > 0,99 | > 0,99 |
| Привычка к курению +/- (%) | 16/27 (59) | 12/16 (75) | 5/13 ( 39) | > 0.99 | > 0,99 | 0,198 |
| Аллергия +/- (%) | 8/25 (32) | 6/18 (33) | 7/13 (54) | > 0,99 | 0,885 | 0,879 |
| Желтуха +/- (%) | 30/4 (88) | 13/6 (68) | 0/14 (0) | 0,420 | <0,001 | <0,001 |
| Боль в животе +/- (%) | 6/28 (18) | 7/13 (37) | 5/9 (36) | 0.546 | 0,771 | > 0,999 |
| Диабет +/- (%) | 10/24 (29) | 11/8 (58) | 4/10 (29) | 0,231 | > 0,999 | > 0,999 |
| Острый панкреатит +/- (%) | 1/33 (3) | 1/18 (5) | 5/9 (36) | > 0,999 | 0,017 | 0,183 |
| Язвенный колит +/- (%) | 1/33 (3) | 0/19 (0) | 1/13 (7) | > 0.999 | > 0,999 | > 0,999 |
| Стеноз нижнего мерзкого протока +/- (%) | 32/34 (94) | 18/19 (95) | 0/14 (0) | > 0,999 | <0,001 | <0,001 |
| Экстрапанкреатические поражения +/- (%) | 13/21 (38) | 6/13 (32) | 5/9 (36) | > 0,999 | > 0,999 | > 0,999 |
Уровни сывороточного IgG4 были значительно выше у пациентов D-типа (медиана: 309 мг / дл), чем у пациентов B / T-типа (133.5 мг / дл) пациентов ( P = 0,042). Уровни сывороточного IgG4 чаще повышались у пациентов с D-типом (88%), чем у пациентов с B / T-типом (50%) ( P = 0,030). Не было значительных различий в уровнях сывороточного IgE и количестве периферических эозинофилов между группами. Уровни амилазы в сыворотке у пациентов B / T-типа (медиана: 114 МЕ / л) были значительно выше, чем у пациентов H-типа (72 МЕ / л) ( P = 0,049). По соотношению антинуклеарного антигена и ревматоидного фактора различий между группами не было (таблица).
Таблица 2
Лабораторные данные трех типов аутоиммунного панкреатита
| тип D, n = 34 | тип H, n = 19 | тип B / T , n = 14 | P значение, D vs H | P значение, D vs B / T | P значение, H vs B / T | |
| Медиана IgG, мг / дл | 2163.5 (1637,5-2682,8) | 1920 (1398,5-2300) | 1619 (1369,5-2364,5) | 0,642 | > 0,999 | > 0,999 |
| (квартильный диапазон) | ||||||
| 309 (181-1015) | 351 (228-780) | 133,5 (60,8-326,5) | > 0,999 | 0,042 | 0,057 | |
| (квартильный диапазон) | 28/32 (88) | 16/19 (84) | 7/14 (50) | > 0.999 | 0,030 | 0,168 |
| Медиана IgE, МЕ / л | 406,9 (265,5-877) | 249,0 (74,75-589,75) | 264,0 (134,1-856) | 4 0,447> | 4 0,447 > 0,999 | |
| (квартильный диапазон) | ||||||
| IgE> 580, (МЕ / л) (%) | 8/20 (40,0) | 3/12 (25,0) | 4/11 (36,4) | > 0,999 | > 0,999 | > 0,999 |
| Медиана эозинофилов, мкл | 180 (72-440) | 238.5 (152,5-447,75) | 473 (114,5-621,5) | > 0,999 | 0,354 | > 0,999 |
| (квартильный диапазон) | ||||||
| Эозинофилы> 600 / мкл 13 (%) 3/3 | 32 90 (11) | 2/16 (13) | 3/13 (23) | > 0,999 | > 0,999 | > 0,999 |
| Медиана амилазы (МЕ / л) | 86 (49,5-119,5) | 72 (43-100) | 114 (73,3-589,3) | > 0.999 | > 0,999 | 0,049 |
| (квартильный диапазон) | ||||||
| Амилаза> 115 (МЕ / л) (%) | 8/33 (24) | 4/19 (21) | 7 / 14 (50) | > 0,999 | 0,300 | 0,408 |
| Положительный антинуклеарный антиген (%) | 14/29 (48) | 4/18 (22) | 6/13 (46) | 0,366 | > 0,999 | 0,738 |
| Положительный ревматоидный фактор (%) | 10/28 (36) | 2/17 (12) | 1/13 (7) | 0.288 | 0,378 | > 0,999 |
Гистологические и иммуногистохимические исследования
ЛПСП был гистологически подтвержден с обильной инфильтрацией CD3-положительных Т-лимфоцитов и IgG4-положительных плазматических клеток в 6 D-типе, 7 H-типе и 4 Пациенты типа B / T. В поджелудочной железе 2 пациентов B / T-типа (1 образец хирургической биопсии и 1 образец EUS-FNA) были обнаружены выраженный фиброз и обильная инфильтрация CD20-положительных В-лимфоцитов, а не Т-лимфоцитов, но мало IgG4-положительных плазматических клеток или нейтрофилов не обнаружено.IDCP не наблюдался ни у одного пациента. EUS-FNA у 4 пациентов с ОИП не смог подтвердить гистологический диагноз из-за недостаточного количества образцов (таблица).
Таблица 3
Гистологические данные поджелудочной железы при трех типах аутоиммунного панкреатита
| D тип | H тип | B / T тип | LPSP ( n = 3) | LPSP ( n = 3) | LPSP ( n = 1) |
| Биопсия | LPSP ( n = 2) | LPSP ( n = 3) | Фиброз с обильной инфильтрацией В-лимфоцитов ( n = 1) |
| EUS-FNA | LPSP ( n = 1) | LPSP ( n = 1) | ( n = 3) |
| Несоответствующий материал ( n = 1) | Несоответствующий материал ( n = 2) | Фиброз с обильной инфильтрацией B-лимфоцитов ( n = 1) | 9 0175|
| Несоответствующий материал ( n = 1) |
Клинический курс
Стероидная терапия была эффективной у всех 50 пациентов (31 тип D, 13 H тип и 6 B / T тип).Рецидив АИП произошел во время постепенного снижения дозы или после прекращения приема стероидов у 3 пациентов D-типа и 3-х пациентов H-типа. У 8 пациентов, находящихся под консервативным наблюдением (1 тип H и 7 тип B / T), рентгенологические характеристики не изменились у семи пациентов, но увеличение хвоста поджелудочной железы улучшилось естественным образом у 1 пациента с типом B / T. В течение курса, предшествовавшего нашей госпитализации, очаговое увеличение головки поджелудочной железы развилось до диффузного увеличения в трех случаях, а очаговое увеличение хвоста поджелудочной железы развилось до диффузного увеличения в одном случае.
ОБСУЖДЕНИЕ
Радиологически AIP подразделяется на диффузные и очаговые формы. Диффузное увеличение поджелудочной железы, называемое колбасоподобным увеличением, является типичным признаком AIP. Однако AIP F-типа, иногда образующий массу, часто трудно отличить от рака поджелудочной железы [1-3,12-14]. Возможные различия в клинических проявлениях между типами D и F AIP неясны.
В настоящем исследовании мы классифицировали 67 пациентов с ОИП на тип D ( n = 34), тип H ( n = 19) и тип B / T ( n = 14).Типы D и H показали сходные клинические особенности. Однако тип B / T отличался от типов D и H в нескольких аспектах. Механическая желтуха и стеноз нижнего желчного протока часто выявлялись у пациентов с типом D и H, но ни у одного пациента с типом B / T эти особенности не наблюдались. По данным Ghazale et al [16], стеноз нижнего желчного протока присутствовал у 70% из 53 пациентов с ОИП. Хирано и др. [17] заявили, что как отек поджелудочной железы из-за воспаления головки поджелудочной железы, так и утолщение стенки желчных протоков влияют на стеноз нижнего желчного протока при AIP, основываясь на данных EUS и на том факте, что 93% случаев AIP с положительным поражением головки поджелудочной железы у пациентов был стеноз нижнего желчного протока, по сравнению только с 17% пациентов с отрицательным поражением.
В этом исследовании уровень сывороточного IgG4 был значительно ниже у пациентов B / T-типа, чем у пациентов с D-типом, а повышение уровня сывороточного IgG4 было меньше у пациентов с B / T-типом, чем у пациентов с D-типом. Острый панкреатит чаще наблюдался у пациентов B / T-типа, чем у пациентов с D-типом, а уровни амилазы в сыворотке крови были значительно выше у пациентов с B / T-типом, чем у пациентов с H-типом. Что касается диагноза и частоты острого панкреатита, высокий процент пациентов с типом B / T, по-видимому, в основном зависит от более высоких уровней амилазы.Острый панкреатит или некоторые острые воспалительные приступы в случаях хронического панкреатита могут не быть связаны с высокими уровнями амилазы из-за атрофической ацинарной ткани. Не было разницы в частоте болей в животе, поэтому некоторые случаи D-типа и H-типа могли быть упущены из виду.
Ни у одного пациента типа B / T не рецидив после стероидной терапии, по сравнению с 10% пациентов D-типа и 23% пациентов H-типа. Стало ясно, что существует два гистологических подтипа (LPSP и IDCP) в AIP [6-11].Большинство пациентов с AIP в Азии имеют LPSP, а половина пациентов с AIP в Европе имеют IDCP [8,10]. Клинические признаки этих двух подтипов существенно различаются. Обычно сообщается, что пациенты с IDCP моложе на момент постановки диагноза, а у пациентов с IDCP реже повышенный уровень IgG4 в сыворотке крови. IDCP чаще ассоциируется с острым панкреатитом и воспалительным заболеванием кишечника. Согласно сравнительному исследованию пациентов с LPSP и IDCP, проведенным Sah et al [9], пациенты с IDCP, как правило, имели больше очаговых особенностей, чем LPSP (84% против 60%), и рецидивов IDCP не наблюдалось ни у одного пациента, тогда как LPSP рецидивировал у 47% пациентов.Для диагностики IDCP необходимо гистологическое исследование адекватного образца поджелудочной железы, а необходимость гистологического исследования для диагностики IDCP в настоящее время затрудняет клиническую диагностику.
При гистологическом исследовании данных случаев LPSP был подтвержден у 17, но IDCP не был обнаружен. Клинические файлы AIP D-типа и H-типа были совместимы с файлами пациентов с LPSP. Однако, учитывая низкие уровни IgG4 в сыворотке и частую связь с острым панкреатитом, существует вероятность того, что некоторые случаи IDCP могут быть вовлечены в случаи B / T-типа.Например, 32-летний мужчина с AIP B / T-типа показал нормальные уровни IgG4 в сыворотке, связь с язвенным колитом и хорошую чувствительность к стероидной терапии, но гистологический диагноз с помощью EUS-FNA не мог быть подтвержден из-за недостаточного образец биопсии. Интересно, что гистология двух пациентов с B / T-типом включала обильную инфильтрацию B-клеток с небольшой инфильтрацией IgG4-положительных клеток или нейтрофилов, которые могли быть другим типом AIP, отличным от LPSP и IDCP. AIP B / T-типа может включать заболевание, отличное от LPSP.
Три пациента с типом H и один пациент с типом B / T прогрессировали до типа D в течение естественного течения. Также сообщалось, что AIP H-типа переходит в D-тип [18,19], а AIP B / T-типа – в D-тип [20]. Также были сообщения о рецидивах в остаточной поджелудочной железе после резекции, таких как рецидив в остаточной головке поджелудочной железы через 1 год после дистальной панкреатэктомии [21] и рецидив в остаточной части поджелудочной железы через 4 месяца после панкреатодуоденэктомии [22]. Стероидная терапия была эффективной для тех поражений, которые прогрессировали или рецидивировали.Эти данные показывают, что очаговое воспаление может прогрессировать до последующих диффузных изменений по всей поджелудочной железе или развиваться повторно в разных местах и в разное время у некоторых пациентов с ОИП. Диффузное изменение поджелудочной железы может быть окончательным проявлением AIP, и то, влияет ли этот воспалительный процесс на железу диффузно или очагово, может просто отражать стадию заболевания. Из семи консервативно наблюдаемых пациентов типа B / T у шести не было никаких изменений, а у одного улучшилось естественным образом. Kubota et al [23] сообщили, что у всех восьми пациентов с ОИП, у которых спонтанно улучшилось состояние, наблюдалось очаговое увеличение поджелудочной железы.AIP B / T-типа может включать заболевание, отличное от AIP D-типа и H.
В заключение, хотя клинические признаки AIP H-типа аналогичны клиническим характеристикам AIP D-типа, AIP B / T-типа в некоторых аспектах отличается от типов D и H. AIP B / T-типа может включать заболевание, отличное от LPSP.
КОММЕНТАРИИ
Предпосылки
Аутоиммунный панкреатит (АИП) – это особый тип панкреатита, который, как считается, имеет аутоиммунную этиологию. Недавно AIP был радиологически классифицирован на диффузный тип (тип D) и очаговый тип (тип F).Однако различия между AIP D- и F-типа малоизвестны.
Границы исследований
Были исследованы различия в клинических, радиологических, лабораторных и гистологических данных между AIP D- и F-типа.
Инновации и прорывы
Пациенты с ОИП были разделены на тип D и тип F. Кроме того, тип F был разделен на тип головы (тип H) и тип корпуса и / или хвоста (тип B / T). Ни у одного пациента типа B / T не была желтуха как начальный симптом, но острый панкреатит чаще ассоциировался с типом B / T, чем с типом D.Уровни амилазы в сыворотке крови у пациентов B / T-типа были значительно выше, чем у пациентов с H-типом. Уровни сывороточного иммуноглобулина G (IgG) 4 были значительно выше у пациентов D-типа, чем у пациентов B / T-типа. Ни у одного из пациентов типа B / T после стероидной терапии не наблюдалось рецидива, по сравнению с 10% пациентов D-типа и 23% пациентов H-типа. У двух пациентов B / T-типа наблюдалась обильная инфильтрация B-клеток с небольшой инфильтрацией IgG4-положительных клеток или нейтрофилов.
Приложения
AIP B / T-типа отличается по нескольким аспектам от типов D и H, и некоторые AIP B / T-типа могут быть связаны с заболеванием, отличным от лимфоплазмоцитарного склерозирующего панкреатита.
Рецензирование
Само исследование кажется разумным, а результаты интересны и имеют этиологическое значение.
Сноски
При поддержке Исследовательского комитета по трудноизлечимым заболеваниям поджелудочной железы (главный исследователь; Тору Симосегава), предоставлены Министерством здравоохранения, труда и социального обеспечения Японии
Рецензенты: Сёитиро Суми, доктор медицины, доктор философии, младший профессор, Отделение реконструкции органов, Институт пограничных медицинских наук, Университет Киото, Сакё-ку, Киото 606-8507, Япония; Ацуши Масамунэ, доктор медицины, доктор философии, отделение гастроэнтерологии, Высшая школа медицины Университета Тохоку, 1-1 Сейрё-мати, Аоба-ку, Сендай 980-8574, Япония
S- редактор Lv S L- редактор Kerr C. E- редактор Li JY
Ссылки
1.Окадзаки К., Кава С., Камисава Т., Ито Т., Инуи К., Ирие Х, Ирисава А., Кубо К., Нотохара К., Хасебе О. и др. Японские клинические рекомендации по аутоиммунному панкреатиту. Поджелудочная железа. 2009; 38: 849–866. [PubMed] [Google Scholar] 2. Чари С.Т., Такахаши Н., Леви М.Дж., Смирк Т.К., Клейн Дж.Э., Пирсон Р.К., Петерсен Б.Т., Топазиан М.А., Веге С.С. Диагностическая стратегия, позволяющая отличить аутоиммунный панкреатит от рака поджелудочной железы. Clin Gastroenterol Hepatol. 2009; 7: 1097–1103. [PubMed] [Google Scholar] 3. Камисава Т., Такума К., Эгава Н., Цурута К., Сасаки Т.Аутоиммунный панкреатит и склерозирующая болезнь, связанная с IgG4. Нат Рев Гастроэнтерол Гепатол. 2010; 7: 401–409. [PubMed] [Google Scholar] 4. Otsuki M, Chung JB, Okazaki K, Kim MH, Kamisawa T., Kawa S., Park SW, Shimosegawa T., Lee K, Ito T. и др. Азиатские диагностические критерии аутоиммунного панкреатита: консенсус Японско-корейского симпозиума по аутоиммунному панкреатиту. J Gastroenterol. 2008; 43: 403–408. [PubMed] [Google Scholar] 5. Кавагути К., Койке М., Цурута К., Окамото А., Табата И., Фудзита Н. Лимфоплазмоцитарный склерозирующий панкреатит с холангитом: вариант первичного склерозирующего холангита с обширным поражением поджелудочной железы.Hum Pathol. 1991; 22: 387–395. [PubMed] [Google Scholar] 6. Нотохара К., Бургарт Л.Дж., Ядав Д., Чари С., Смирк ТЦ. Идиопатический хронический панкреатит с перидуктальной лимфоплазмоцитарной инфильтрацией: клинико-патологические особенности 35 случаев. Am J Surg Pathol. 2003. 27: 1119–1127. [PubMed] [Google Scholar] 7. Zamboni G, Lüttges J, Capelli P, Frulloni L, Cavallini G, Pederzoli P, Leins A, Longnecker D, Klöppel G. Гистопатологические особенности диагностической и клинической значимости аутоиммунного панкреатита: исследование на 53 образцах резекции и 9 образцах биопсии.Арка Вирхова. 2004. 445: 552–563. [PubMed] [Google Scholar] 8. Park DH, Kim MH, Chari ST. Последние достижения в области аутоиммунного панкреатита. Кишечник. 2009. 58: 1680–1689. [PubMed] [Google Scholar] 9. Сах Р.П., Чари С.Т., Паннала Р., Сугумар А., Клэйн Дж.Э., Леви М.Дж., Пирсон Р.К., Смирк Т.С., Петерсен Б.Т., Топазиан М.Д. и др. Различия в клиническом профиле и частоте рецидивов аутоиммунного панкреатита 1 типа и 2 типа. Гастроэнтерология. 2010; 139: 140–148; викторина 140-148. [PubMed] [Google Scholar] 10. Камисава Т., Нотохара К., Симосегава Т.Два клинико-патологических подтипа аутоиммунного панкреатита: LPSP и IDCP. Гастроэнтерология. 2010; 139: 22–25. [PubMed] [Google Scholar] 11. Chari ST, Kloeppel G, Zhang L, Notohara K, Lerch MM, Shimosegawa T. Гистопатологические и клинические подтипы аутоиммунного панкреатита: консенсусный документ гонолулу. Панкреатология. 2010. 10: 664–672. [PubMed] [Google Scholar] 12. Ирие Х, Хонда Х, Баба С., Куроива Т., Йошимицу К., Тадзима Т., Джими М., Суми Т., Масуда К. Аутоиммунный панкреатит: характеристики КТ и МРТ.AJR Am J Roentgenol. 1998; 170: 1323–1327. [PubMed] [Google Scholar] 13. Wakabayashi T, Kawaura Y, Satomura Y, Fujii T., Motoo Y, Okai T., Sawabu N. Клиническое исследование хронического панкреатита с очаговым нерегулярным сужением главного протока поджелудочной железы и образованием массы: сравнение с хроническим панкреатитом, показывающим диффузное нерегулярное сужение основного протока. проток поджелудочной железы. Поджелудочная железа. 2002. 25: 283–289. [PubMed] [Google Scholar] 14. Фруллони Л., Скаттолини С., Фалькони М., Замбони Дж., Капелли П., Манфреди Р., Грациани Р., Д’Онофрио М., Кацотурчи А.М., Амодио А. и др.Аутоиммунный панкреатит: различия очаговой и диффузной форм у 87 больных. Am J Gastroenterol. 2009. 104: 2288–2294. [PubMed] [Google Scholar] 16. Ghazale A, Chari ST, Zhang L, Smyrk TC, Takahashi N, Levy MJ, Topazian MD, Clain JE, Pearson RK, Petersen BT и др. Иммуноглобулин G4-ассоциированный холангит: клинический профиль и ответ на терапию. Гастроэнтерология. 2008. 134: 706–715. [PubMed] [Google Scholar] 17. Хирано К., Тада М., Исаяма Х, Ямамото К., Мизуно С., Ягиока Х, Яшима Й, Сасаки Т, Когуре Х, Тогава О и др.Эндоскопическая оценка факторов, способствующих возникновению стриктуры внутрипанкреатических желчевыводящих путей при аутоиммунном панкреатите. Gastrointest Endosc. 2010; 71: 85–90. [PubMed] [Google Scholar] 18. Horiuchi A, Kawa S, Akamatsu T., Aoki Y, Mukawa K, Furuya N, Ochi Y, Kiyosawa K. Характерный внешний вид протока поджелудочной железы при аутоиммунном хроническом панкреатите: отчет о болезни и обзор японской литературы. Am J Gastroenterol. 1998. 93: 260–263. [PubMed] [Google Scholar] 19. Кога Й, Ямагути К., Сугитани А., Чидзива К., Танака М.Аутоиммунный панкреатит, начинающийся как локализованная форма. J Gastroenterol. 2002. 37: 133–137. [PubMed] [Google Scholar] 20. Wakabayashi T, Kawaura Y, Satomura Y, Watanabe H, Motoo Y, Sawabu N. Долгосрочный прогноз хронического панкреатита с сужением протока: стратегия лечения стероидами. Поджелудочная железа. 2005; 30: 31–39. [PubMed] [Google Scholar] 21. Motoo Y, Minamoto T., Watanabe H, Sakai J, Okai T., Sawabu N. Склерозирующий панкреатит, демонстрирующий быстро прогрессирующие изменения с периодическим формированием массы. Int J Pancreatol.1997; 21: 85–90. [PubMed] [Google Scholar] 22. Бланк A, Maybody M, Isom-Batz G, Roslin M, Dillon EH. Острый некротический панкреатит, вызванный Salmonella typhimurium. Dig Dis Sci. 2003. 48: 1472–1474. [PubMed] [Google Scholar] 23. Kubota K, Iida H, Fujisawa T., Ogawa M, Inamori M, Saito S, Kakuta Y, Oshiro H, Nakajima A. Клиническое значение опухшего дуоденального сосочка при аутоиммунном панкреатите. Поджелудочная железа. 2007; 35: e51 – e60. [PubMed] [Google Scholar]Липоматоз поджелудочной железы: подробный обзор изображений
Определения и история вопроса
Поджелудочная железа – это и эндокринная, и экзокринная железа.Экзокринный компонент составляет около 80 процентов от общего объема желез и в основном состоит из двух разных типов клеток: ацинарных клеток (в основном секретирующих пищеварительные ферменты) и протоковых клеток (в основном секретирующих жидкости и электролиты). Эндокринный компонент состоит из типичных островков Лангерганса, которые содержат несколько типов клеток, разбросанных по экзокринной ткани [ 1 ].
Липоматоз и замещение жира поджелудочной железы являются наиболее частыми доброкачественными патологическими состояниями поджелудочной железы взрослых [ 1 , 2 , 3 ].Классически это явление вызывает повышенную гипоплотность поджелудочной железы на КТ и типичную гиперэхогенность при ультразвуковом (УЗИ) исследовании.
Накопление жира в поджелудочной железе (липоматоз) и замена различных частей поджелудочной железы жиром (замещение жира) имеют разные синонимы: липоматоз поджелудочной железы, замещение жировой ткани, жировая инфильтрация, жировая прослойка поджелудочной железы, липоматозная псевдогипертрофия, безалкогольный жировая болезнь поджелудочной железы и стеатоз поджелудочной железы [ 4 ].Эти синонимы вызывают путаницу.
На основе различных результатов визуализации можно было бы склониться к использованию термина «липоматозная инфильтрация», когда островки поджелудочной железы кажутся диссоциированными от жировой ткани или когда плотность (КТ), эхогенность (ультразвук) или сигнал (МРТ) ) диффузно модифицированы. Когда кажется, что панкреатические островки исчезли или были сильно замещены жиром, можно было бы более склонно предпочесть словесное «замещение жира».
Точно так же можно склониться к использованию термина «липоматозная инфильтрация», когда процесс кажется обратимым, и оставить термин «замещение жира» для случаев, показывающих вероятное необратимое исчезновение островков желез [ 4 , 5 ].
Тем не менее, значительных гистопатологических исследований, чтобы доказать или опровергнуть, что липоматоз и жировое замещение поджелудочной железы являются (i) отдельными образованиями, (ii) ассоциированными образованиями в различных пропорциях в определенном случае, или (iii) выражениями та же болезнь. Поэтому, чтобы упростить лекцию этого иллюстрированного обзора, термины замещение жира, и липоматоз, поджелудочной железы были заменены упрощенным термином жировая инфильтрация , или «FI», повсюду.Это подчеркивает, что FI поджелудочной железы может быть однородным, неравномерно распределенным или ограничиваться одной областью поджелудочной железы (очаговый FI) [, 1, , , 6, ].
Этиология
FI – доброкачественное заболевание, не имеющее единой этиологии [ 1 , 2 , 7 , 8 , 9 ]. Сущность была связана со многими заболеваниями и состояниями. Возраст и ожирение значительно коррелируют со степенью FI [ 9 , 10 ].Как следствие, FI обычно напрямую коррелирует с индексом массы тела пациента (ИМТ). Точнее, корреляция лучше между FI и индексом висцерального жира , который, тем не менее, сложнее оценить, чем ИМТ или вес пациента. Другими словами, количество ткани висцерального жира является лучшим индикатором и предиктором FI поджелудочной железы, чем только BMI (Рисунок 1) [ 1 ].
Рисунок 1Большой диффузный ФИ (тип 2b) был обнаружен у 75-летней женщины с патологическим ожирением и хроническим сахарным диабетом (a и c).Значительный регресс глобального FI был обнаружен после 4-летнего периода (b и d). И диссоциация долек поджелудочной железы жиром, и общий объем органа уменьшились, и пациент потерял более 25 кг. Резко регрессировал стеатоз печени.
FI также коррелирует с наличием сахарного диабета, приобретенного или наследственного панкреатита [ 3 ]. Хотя ФИ ассоциируется с наличием сахарного диабета; это не связано конкретно с самой болезнью.Типичные островки Лангерганса парадоксальным образом примечательны своей устойчивостью к FI.
FI тесно связан с метаболическим синдромом [ 4 ], возникающим синдромом, состоящим из ассоциации по крайней мере трех из следующих признаков: гиперинсулинемия; гипертония; гиперхолестеринемия; ожирение; и гипергликемия. ФИ поджелудочной железы также наблюдалась у пациентов с алкогольным гепатитом или принимающих стероиды [ 1 ].
Большой ФИ поджелудочной железы также является наиболее частой картиной КТ у подростков и взрослых с муковисцидозом [ 11 , 12 , 13 ].
Было обнаружено множество случаев ФИ, связанных с патологиями, связанными с проницаемостью протоков поджелудочной железы или на которые она влияет. Столь выраженный FI, с атрофией желез или без нее, обычно наблюдается у взрослых пациентов, вторично по отношению к обструкции протоков поджелудочной железы внутрипротоковыми камнями или опухолями поджелудочной железы (Рисунки 2, 3 и 4) [ 7 ]. Врожденный стеноз протока поджелудочной железы также во многих случаях может приводить к FI паренхимы [ 14 ]. Предыдущие эксперименты на животных уже продемонстрировали, что перевязка протока поджелудочной железы может привести к атрофии и лизису ацинусов поджелудочной железы, тогда как островки Лангерганса относительно сохранились.Число протоковых клеток медленно уменьшалось, и они становились редкими из-за гибели клеток. Однако поджелудочная железа постепенно увеличивалась за счет замещения внутрилобулярной жировой ткани до 16 недель [ 15 ].
Рисунок 2Криволинейный (a), сагиттальный (b) и коронарный (c) переформатированные виды (MPR) в случае полного FI поджелудочной железы (тип 2b). Псевдогипертрофия не связана. Пациент, мужчина 50 лет, имел лишь легкую биологическую экзокринную недостаточность поджелудочной железы. Лишь небольшое количество железистых ацинусов сохраняется вдоль основной и вторичной сети протоков.Пациенту ранее была проведена хирургическая резекция нейроэндокринной опухоли двенадцатиперстной кишки, расположенной частично на сосочке, и массивный FI уже был замечен до операции (не показано). Гипотеза о хроническом препятствии оттока желчного протока или главного протока поджелудочной железы как основного причинного фактора («протоковая гипотеза») массивного диффузного ФИ подтверждается этим случаем.
Рисунок 3Старение может вызвать FI (белые стрелки на a и b), а также атрофию поджелудочной железы (черные стрелки), как показано на примере этой 100-летней женщины.Большая атрофия тела или хвоста поджелудочной железы (белые стрелки на c) более распространена, чем липоматоз в случае хронической обструкции Вирсунга опухолью, как показано на примере этого 88-летнего мужчины с небольшой аденокарциномой тела (черная звезда). В случае истинной атрофии поджелудочной железы окружающие органы сходятся, чтобы занять ложе поджелудочной железы (белые стрелки на c).
Рис. 4Глобальные и массивные ФИ (тип 2b) обнаружены у 60-летней женщины в результате кальцифицирующего хронического панкреатита с хронической обструкцией главного протока большой кальцификацией (звездочка).Показаны криволинейная реконструкция (a) и осевые виды (b и c). Примитивное ложе (или объем) поджелудочной железы сохраняется (белые стрелки). Чрезвычайно похожий случай кальцифицирующего хронического панкреатита (d и e) превратился в массивную атрофию поджелудочной железы (черная стрелка) вместо FI. Причина такого различия в эволюции неизвестна.
Неравномерная жировая инфильтрация
Неравномерный ФИ поджелудочной железы является очень частым – и в действительности наиболее частым – представлением ФИ, и сообщалось о многих случаях [ 2 , 6 , 7 , 16 ].Хотя неравномерный FI поджелудочной железы может повлиять на любую часть железы, он обычно более частый и заметный в передней головке поджелудочной железы (APH). Задняя головка поджелудочной железы (PPH) поджелудочной железы и крючковидный отросток (UP) обычно щадят или, по крайней мере, более невосприимчивы к FI [ 2 , 7 ]. Область, наиболее резистентная к FI, – это очень маленькая фокальная область вокруг общего желчного протока [ 16 ].
Это анатомическое различие между APH и PPH и UP имеет первостепенное значение с точки зрения эмбриологии.Поджелудочная железа человека развивается в результате слияния дорсальной и вентральной зачатков поджелудочной железы (рис. 5). Брюшной зачаток является общим с желчным протоком. На шестой неделе беременности он поворачивается на 270 ° по часовой стрелке и заканчивается на задней нижней стороне спинного зачатка. Таким образом, он становится анатомически кзади [ 17 , 18 ]. Дорсальный зачаток поджелудочной железы дает начало передней части головки (APH) поджелудочной железы, помимо тела и хвоста, в то время как вращающийся вентральный зачаток поджелудочной железы развивается в заднюю часть головы (PPH) и крючковидный отросток (UP ).Это слияние зачатков поджелудочной железы связано с анастомозом их соответствующих протоков (рис. 5 и 6), за исключением примерно 4–10% пациентов, у которых будет обнаруживаться деление поджелудочной железы. Главный проток брюшного зачатка входит в преимущественное сообщение с основным протоком спинного зачатка. Точка слияния образуется между перешейком и головкой, что приводит к созданию доминирующего и более постоянного протока Вирсунга и объясняет его байонетный вид [ 19 ] (рис. 6).Следовательно, проток Вирсунга дренирует части поджелудочной железы различного эмбриологического происхождения: ПРК (происходящие из брюшной зачатка), а также тело и хвост (происходящие из дорсальной зачатка). Проксимальная часть главного дорсального протока поджелудочной железы частично регрессирует с образованием дополнительного протока поджелудочной железы или протока Санторини, который открывается в малый сосочек двенадцатиперстной кишки.
Рисунок 5Поджелудочная железа развивается в результате слияния дорсального (DP) и вентрального (VP) зачатков поджелудочной железы (a). ВП часто встречается с желчным протоком (выделено зеленым цветом).На шестой неделе беременности VP поворачивается по часовой стрелке на 270 ° (b), чтобы закончить на задне-нижней стороне DP (c). Таким образом, он становится анатомически задним. DP дает начало APH поджелудочной железы, в дополнение к телу и хвосту, в то время как вращающийся VP развивается в PPH и UP. Сращение зачатков поджелудочной железы сопровождается анастомозом протоков (г). Главный канал VP сливается с основным каналом DP и становится доминирующим и более постоянным каналом Вирсунга.Таким образом, проток Вирсунга дренирует части поджелудочной железы различного эмбриологического происхождения. Дистальная часть основного протока DP частично регрессирует с образованием добавочного протока Санторини, который открывается в малый дуоденальный сосочек.
Рисунок 6Анатомия протока поджелудочной железы. Во время развития канал телесной каудальной поджелудочной железы (дорсальный зачаток) сливается с каналом PPH (b) (вентральный зачаток), образуя главный канал Вирсунга (черная стрелка). Этот сплав выражает свою типичную байонетную форму (маленькая белая стрелка).Проток вентральной головки (а) (берущий начало от дистального дорсального зачатка) становится добавочным каналом Санторини (белая стрелка). Классическое пространственное расположение этих протоков хорошо проиллюстрировано на сагиттальной реконструкции головы (b), трехмерной объемной визуализации (d) и толстой проекции минимальной интенсивности (MIN) поджелудочной железы (c).
Неравномерный ФИ поджелудочной железы был классифицирован Мацумото в 1995 г. (рис. 7) на два типа, и каждый из них был вторично разделен на две подгруппы [ 16 ].При типе 1 (71% случаев) PPH и UP не зависят от FI. При типе 1а (35% случаев) ФИ ограничивается APH. А у типа 1б (36% случаев) ФИ АПГ связаны с ФИ тела и хвоста.
Рис. 7Схематическая классификация ФИ, предложенная Мацумото. ФИ обозначен серыми зонами. В типе 1 (71% случаев) PPH и UP не зависят от FI. При типе 1а (35% случаев) ФИ ограничивается APH. А у типа 1б (36% случаев) ФИ АПГ связаны с ФИ тела и хвоста.При типе 2 (29% случаев) FI затрагивает всю голову, за исключением очень маленькой рефрактерной очаговой области вокруг общего желчного протока. При типе 2а (11% случаев) ФИ ограничивается всей головой. А при типе 2б (18% случаев) ФИ головы ассоциируется с ФИ тела и хвоста. Таким образом, FI типа 2b представляет собой FI почти всей поджелудочной железы (за исключением очень маленькой фокальной области вокруг общего желчного протока).
При типе 2 (29% случаев) FI затрагивает всю голову, за исключением очень маленькой рефрактерной фокальной области вокруг общего желчного протока.При типе 2а (11% случаев) ФИ ограничивается всей головой. А при типе 2б (18% случаев) ФИ головы ассоциируется с ФИ тела и хвоста. Таким образом, тип 2b представляет собой FI почти всей поджелудочной железы (за исключением очень маленькой очаговой области вокруг общего желчного протока). Таким образом, неравномерные FI обнаруживаются примерно в 82% случаев FI (типы 1a, 1b и 2a).
Неравномерный FI двух разных эмбриологических частей (APH и PPH) головки головы (типы 1a и 2a), таким образом, обнаруживается в 46% случаев неравномерного FI поджелудочной железы.Причина этой разницы в возможностях FI двух наложенных друг на друга и эмбриологически различных частей головки поджелудочной железы остается неясной, но может быть частично объяснена их конституциональными гистологическими различиями в связи с их различным эмбриологическим происхождением [ 6 ]. Было доказано, что эмбриологическая вентральная поджелудочная железа, которая становится PPH и UP, имеет меньшие, плотно упакованные ацинусы, меньшие экзокринные клетки, скудные или отсутствующие внутрипаренхиматозные жировые клетки и больше межлобулярной фиброзной ткани, чем эмбриологическая дорсальная часть поджелудочной железы [ 6 , 16 ].
По нашему мнению, эта «гистологическая эмбриологическая гипотеза» не может сама по себе объяснить частые неравномерные FI поджелудочной железы. Действительно, эта гипотеза не принимает во внимание, что тело и хвост поджелудочной железы, которые часто учитываются FI в случаях изолированного FI APH (тип 1a) или глобального головного FI (тип 1b) – фактически, в 71% случаев при кумуляции типов 1а и 1b – имеют одинаковое эмбриологическое происхождение. Таким образом, для этих случаев должна быть найдена другая гипотеза, чем эмбриологическая гипотеза.
После слияния двух эмбриологических зачатков поджелудочной железы проксимальная часть главного дорсального протока поджелудочной железы частично регрессирует с образованием добавочного протока поджелудочной железы Санторини, который открывается в малый сосочек двенадцатиперстной кишки [ 19 ]. Этот малый сосочек значительно меньше большого сосочка и может тогда подвергаться возможной перегрузке секреторной способности [ 19 ]. Исследования недавно обнаружили значительную корреляцию между проходимостью добавочного протока поджелудочной железы и острым панкреатитом, при этом проходимость добавочного протока значительно ниже у пациентов с панкреатитом (17%), чем в контрольных случаях (43%) [ 19 ].Таким образом, проходимость добавочного протока чрезвычайно вариабельна и у многих пациентов кажется уменьшенной или отсутствует.
Более того, у пациентов с делением поджелудочной железы (от 4% до 14% населения) большая часть главного дорсального протока остается отделенной от вентральной поджелудочной железы и, следовательно, дренируется исключительно через малый сосочек [ 18 ]. Считается, что несоответствие между малым размером малого сосочка и большим количеством секрета из дорсальной части железы может привести к относительной обструкции оттока из дорсальной части поджелудочной железы, что приведет к боли или панкреатиту.Существуют противоречия, но была показана положительная корреляция между делением поджелудочной железы и панкреатитом [ 18 , 19 , 20 ].
Дополнительный проток Санторини дренирует весь APH, а именно ту часть железы, которая более склонна к FI. Частое преобладание изолированного массивного липоматоза APH породило гипотезу о том, что FI, вероятно, также вызван плохим качеством дренажа из вспомогательного канала Санторини. Эта «гипотеза протоков», вероятно, сосуществует и противоречит «эмбриологической гипотезе» в случаях неравномерного липоматоза.
Визуализация жировой инфильтрации поджелудочной железы
Неравномерный ФИ головной поджелудочной железы обычно обнаруживается не только при использовании современных методов визуализации, но и при УЗИ поджелудочной железы [ 17 , 20 ]. Вентральная эмбриологическая поджелудочная железа, которая имеет тенденцию оставаться свободной от FI, часто оказывается более гипоэхогенной, чем дорсальная часть (Рисунок 8). Во время УЗИ всегда необходимо постоянно осознавать этот классический образец, потому что многие патологические процессы поджелудочной железы также часто являются спонтанно гипоэхогенными, включая карциному, метастазы, лимфому и карциноидные опухоли, а также очаговые и сегментарные острые и хронические панкреатиты [ 17 ] .
Рис. 8Неравномерный ФИ головной поджелудочной железы (тип 1а) обычно обнаруживается во время УЗИ брюшной полости, особенно у женщин среднего возраста. Показаны классические поперечные виды (a, c и d) и сагиттальные виды (b и e). Желчный проток и дистальный участок Вирсунга (белая стрелка) обычно проходят в ПРК (эмбриологический вентральный зачаток), который чаще выглядит гипоэхогенным (звездочка), потому что он меньше подвержен влиянию FI.
Считается, что причиной более высокой чувствительности УЗИ для обнаружения неравномерного ФИ в головном мозге в целом является более высокая чувствительность УЗИ для обнаружения тонких различий в содержании жира в различных тканях.Это также обычное наблюдение в печени, при котором УЗИ легче обнаруживает гиперэхогенную область ограниченного стеатоза и гипоэхогенную область ткани, подверженную стеатозу, чем КТ [ 21 ].
Во время УЗИ FI поджелудочной железы оказывается гиперэхогенным, а не гипоэхогенным, как это обычно наблюдается при липоме. Причина в том, что не сам жир определяет эхогенность, а архитектурная модификация из-за развития адипоцитов внутри межлобулярных перегородок.Чередование железистых и жировых поверхностей раздела отвечает за гиперэхогенность [ 17 ].
Эхогенность поджелудочной железы постепенно увеличивается с возрастом и ожирением. Неравномерный ФИ головки поджелудочной железы редко бывает в возрасте до 25 лет и чаще всего обнаруживается у женщин среднего возраста с умеренно эхогенной поджелудочной железой [ 17 ]. Когда поджелудочная железа становится очень липоматозной и, следовательно, чрезвычайно гиперэхогенной, эффективность УЗИ для диагностики неравномерного ФИ головной головки, тем не менее, резко снижается из-за явления насыщения, а также из-за того, что передача УЗИ через гиперэхогенную переднюю головку резко снижается.Такая же ситуация наблюдается при массивном стеатозе печени.
Напротив, чем больше поджелудочная железа инфильтрирована или замещена жиром, тем лучше компьютерная томография может легко диагностировать это заболевание. Таким образом, КТ становится методом выбора при массивном ФИ поджелудочной железы.
В клинической практике ФИ поджелудочной железы обычно однозначно диагностируется с помощью КТ, когда ФИ достаточно резкий, чтобы показать типичные значения Хаунсфилда с отрицательным затуханием. Тем не менее, если степень очагового FI остается умеренной, ослабление может быть недостаточным и может имитировать кистозный или гиподенсный опухолевый процесс [, 2, , , 7, ].Более того, на постконтрастных изображениях нормальная паренхима поджелудочной железы, заключенная между областями FI, может показывать значительное усиление контраста (Рисунок 9), что может имитировать опухолевую массу [ 2 , 7 ].
Рисунок 9Типичный случай неравномерного FI (a и b), ограниченного APH (тип 1a) (черная стрелка). Однако типичная «отрицательная» плотность жира не так очевидна, потому что измерения плотности неизменно включают остаточные железистые ацинусы. Эти ацинусы также усиливаются при внутривенном контрастировании остальной части железы.Тем не менее, общее усиление контраста липоматозной области (с 7 UH (c) до 28 UH (d)) остается ниже, чем у остальной части железы (с 23-25 UH (e) до 70-90 UH (f )). Эта ситуация может имитировать рак поджелудочной железы, особенно когда отношение сигнал / шум изображения плохое или если толщина среза не соответствует требованиям. В сложных или неоднозначных случаях в дифференциальной диагностике может помочь УЗИ или МРТ.
Классически различные модели неравномерного ФИ, описанные Мацумото, обычно обнаруживаются во время клинической КТ:
Рис. 10PPH и UP исключены из FI в типе 1
Тип 1a (35% случаев), в котором FI ограничивается APH, показан на рисунках 10 и 11.
Тип 1b (36% случаев), в котором FI APH связан с FI тела и хвоста, показан на рисунке 12.
FI включает всю голову, за исключением очень маленькой рефрактерной очаговой области вокруг общего желчного протока у типа 2.
Тип 2а (11% случаев), при котором FI ограничивается всей головой, является самым редким типом.
Тип 2b (18% случаев) представляет собой ФИ почти всей поджелудочной железы (за исключением очень маленькой очаговой области вокруг общего желчного протока) (рисунки 1, 2, 4 и 121314).
На рисунках a – e показаны осевые (a и b), коронарные (c и d) и сагиттальные (e) виды поджелудочной железы 70-летней женщины с патологическим ожирением и сахарным диабетом 2 типа. FI только выборочно включает APH (черная звезда) (тип 1a). Гипоплотность липоматозной APH резко контрастирует с нормальной плотностью PPH, UP и телесной каудальной поджелудочной железы (белые стрелки).
Рисунок 11Быстрое прогрессирование диффузного FI, преимущественно поражающего APH (тип 1a), у 70-летней женщины.Пациенту сделали снимки 3 раза в течение 6 лет в связи с рецидивирующими эпизодами ишемического колита. На аксиальных срезах FI прогрессивно увеличивается во всех частях ткани (a – c), но резко преобладает на APH (c – e), где он связан с прогрессирующим увеличением головы и очаговой «псевдогипертрофией» (белые стрелки).
Рис. 12Типичные аспекты головки поджелудочной железы при ФИ типа 2b (a и b). И APH, и значительная часть PPH и UP инфильтрируются жиром.Только очень небольшая ограниченная овоидная область ткани поджелудочной железы вокруг желчного протока остается нетронутой (черная стрелка). Тонкий, но типичный случай FI типа 1b (рисунки c и d). APH и телесные каудальные части железы (белые звездочки) кажутся более гиподенсированными из-за липоматоза. Они контрастируют с более высокой плотностью PPH (черная звезда). Резкое изменение плотности обнаруживается как раз на уровне цефалоистмического соединения (белый кружок), хотя эти две области дренируются одним и тем же нормальным каналом Вирсунга (черные стрелки).Этот случай подтверждает эмбриологическое гистологическое объяснение неравномерного липоматоза.
Рис.13Криволинейная реконструкция (а), сагиттальная цефальная (b), а также передняя (в) и задняя (г) коронарные виды (d) коронковой части головы почти полного обширного и однородного FI (тип 2b), обнаруженного у довольно молодого пациента (60 лет) с нормальным ИМТ, без диабета и без клинических или биологических признаков внешнесекреторной недостаточности поджелудочной железы. Также присутствует дискретное увеличение органа. FI довольно однороден, за исключением дискретно меньшей инволюции задней части головы (черные стрелки) и конца хвоста (звездочка).
Рис. 14Корональная цефальная (a) и осевая косая каудальная проекции (b) демонстрируют едва различимые признаки острого каудального панкреатита, накладывающиеся на диффузный FI 75-летнего пациента (тип 2b), страдающего карциномой толстой кишки. Дискретный отек обнаруживается между долями железы (белая звездочка), а небольшой линейный выпот (черная стрелка) обнаруживается в передней околопочечной фасции. Последующие исследования – КТ без усиления на 5 день (b) и КТ с контрастным усилением на 30 день (e) – показывают воспалительную агглютинацию долек, имитирующих псевдоопухолевые узелки (белые стрелки).К счастью, интеркуррентная ПЭТ / КТ 18F-FDG, выполненная при последующем наблюдении карциномы толстой кишки на 15-й день, показала отрицательное поглощение FDG (d). Медленный регресс некротических псевдотуморальных узелков отчетливо виден через 10 месяцев (f).
Как показано в этом иллюстрированном обзоре, также могут быть обнаружены другие нетипичные и неклассифицированные проявления неравномерного FI (Рисунки 151617).
Рисунок 15Атипичные и неклассифицируемые случаи неравномерного FI. Косая коронковая (а) и криволинейная (б) реформации у 81-летнего пациента с массивным ФИ только хвоста (белая стрелка).Осевые косые (в) и криволинейные (г) реформации у другого 88-летнего пациента с массивным ФИ головы и тела, контрастирующим с относительной стороной хвоста (черная стрелка).
Рисунок 16Атипичный периферический неровный ФИ. Железа (a и b) окружена гиподонтической полосой, имитирующей перипанкреатический отек или тонкий выпот на изображениях КТ с контрастным усилением (белые стрелки на a и b). Эта гиподенсированная полоса отсутствовала 2 года назад, а хвост поджелудочной железы был тоньше (в).Периферическая полоса гипоинтенсивна на Т2-взвешенном изображении (d), что исключает отечный выпот (белые стрелки на d). Осевые синфазные изображения (e) показывают нормальную интенсивность сигнала в теле поджелудочной железы, более высокий сигнал в периферической железе, заметно на передней стороне (белая стрелка на e), с падением интенсивности сигнала на изображениях в противофазе ( белые стрелки на f) выявляют атипичные периферические неровные перикаудальные FI.
Рисунок 17Рисунки a – e иллюстрируют необычный случай FI, поражающего исключительно дистальный конец поджелудочной железы (черный кружок).Этот атипичный ФИ ассоциируется с элективной псевдогипертрофией. Связана изолированная небольшая липома хвоста (черные стрелки на b и d). Остальная железа выглядит нормально. Этот редкий тип каудального FI был очень стабильным в течение 5-летнего периода.
В нетипичных или неоднозначных случаях МРТ с химическим сдвигом может быть полезной для проведения дифференциального диагноза [ 2 , 7 ]. МРТ с химическим сдвигом имеет преимущество перед КТ в подтверждении наличия очагового ФИ поджелудочной железы. Характерная потеря интенсивности сигнала на Т1-взвешенном градиентном эхо-изображении в противофазе по сравнению с соответствующим синфазным изображением подтверждает присутствие микроскопического липида в очаге панкреатической массы [ 7 ].Это гистологическое состояние, как правило, отсутствует при раке поджелудочной железы [ 2 ]. Последовательности МРТ с подавлением жира также полезны для диагностики FI (рисунки 16, 18 и 19).
Рисунок 18МРТ поджелудочной железы, выполненная для исключения холедохолитиаза у пациента, перенесшего острый панкреатит два месяца назад. Поперечные МРТ-изображения в фазе и противофазе соответственно показывают типичную глобальную гипер- (a) и гипоинтенсивность (b) поджелудочной железы. Т1-взвешенное изображение с подавлением жира (c) подтверждает пониженную интенсивность поджелудочной железы из-за массивного FI.Т1-взвешенное изображение с подавлением жира после усиления гадолиния (d) показывает однородное усиление всей поджелудочной железы.
Рис. 19Типичные аспекты МРТ в случае диффузного ФИ поджелудочной железы. FI преобладает на APH (тип 1a) с увеличением железы (белые стрелки). На T1-взвешенных изображениях (a и b) липоматозный APH имеет типичный высокий сигнал. Резкое исчезновение сигнала обнаруживается на изображениях, взвешенных по T1, с подавлением жира (c и d).
Из-за доброкачественности и редкости тяжелой ФИ поджелудочной железы результаты эндоскопической ретроградной холангиопанкреатографии (ЭРХПГ) недостаточно документированы.При минимальном ФИ панкреатограмма в норме [ 9 ]. При тяжелой ФИ, ЭРХПГ может проявляться стенозом или резкой обструкцией в части тела и хвоста. Стенозированный главный проток поджелудочной железы обычно гладкий и имеет удлиненную форму. Обструкцию следует отличать от патологической обструкции, вызванной агенезией, хроническим панкреатитом или раком. Сегодня эти редкие находки можно предпочтительно описать с помощью магнитно-резонансной холангиопанкреатографии (MRCP).
FI поджелудочной железы также может быть осложнен острым панкреатитом (рис. 20).Другими словами, ФИ поджелудочной железы не защищает орган от эпизода панкреатита. Тем не менее, в этих случаях классические особенности визуализации воспаления могут быть изменены фоном FI, что может привести к диагностической путанице. Очаговый острый или подострый панкреатит может имитировать опухолевое образование из-за очагового увеличения плотности ранее липоматозной части (рис. 14). В этих случаях необходимо наблюдение. Точно так же диффузный панкреатит может имитировать почти нормальную поджелудочную железу в случае массивной предсуществующей ФИ, особенно если для сравнения недоступны предыдущие изображения поджелудочной железы (Рисунок 21).
Рисунок 20Global FI (тип 2b) у 45-летнего пациента (a и b), не страдающего ожирением, гиперметаболическим состоянием или сахарным диабетом. FI затрагивает всю поджелудочную железу, за исключением небольшой части ПРК (черная звездочка на a). Через три года у больной диффузный отечный панкреатит (c и d) неустановленного происхождения. Железа опухшая с нечеткими контурами, плотность увеличилась из-за отека (белая звездочка на c и d). Особенно поражается головная часть (c).Через четыре месяца после эпизода панкреатита морфология липоматозной поджелудочной железы вернулась к исходному состоянию (e и f).
Рисунок 2160-летняя женщина поступила с клиническим и биологическим острым эпизодом панкреатита. КТ брюшной полости без усиления показала умеренно липоматозную, но почти нормальную головную (b) и каудальную (d) части поджелудочной железы. Однако на предыдущей компьютерной томографии, найденной в базе данных, поджелудочная железа выглядела чрезвычайно липоматозной (тип 2b) (a и c).Из-за отека острый панкреатит стал причиной очень необычного «повторного появления» железы. Острый панкреатит на очень липоматозной поджелудочной железе может имитировать нормальную поджелудочную железу.
В нашей практике мы сталкивались с редкими ситуациями массивного LI поджелудочной железы – особенно у пожилых людей – при которых плотность жира была чрезвычайно низкой по сравнению с остальной частью внутрибрюшного жира (рис. 22). У этих пациентов было пониженное количество внутрибрюшного жира, вероятно, из-за хронической потери веса.Тем не менее объем ложа поджелудочной железы оставался нормальным. Причина такой очень низкой плотности неизвестна, но мы предполагаем, что этот аспект представляет собой реальное гистологическое замещение жировой ткани, а не жировую инфильтрацию. Сохранение объема железы также можно объяснить тем фактом, что этот жировой заменитель более устойчив к потере веса.
Рисунок 22Два случая (a и b, случай 1; c и d, случай 2) массивного диффузного (тип 2b) панкреатического FI у пожилых пациентов. Эти пациенты были очень стройными, с очень низким количеством внутрибрюшного жира, что резко контрастировало с сохранением нормального объема липоматозного ложа поджелудочной железы.Средняя плотность жирового ложа поджелудочной железы также оказалась значительно ниже, чем у внутрибрюшного жира. Расхождение составило от 25 до 35 грн. Этот аспект, вероятно, был связан с реальным гистологическим жировым отростком (а не с жировой инфильтрацией). Сохранение объема ложа поджелудочной железы также можно объяснить тем фактом, что этот жировой заменитель более устойчив к потере веса.
Оценка острого панкреатита у пожилых пациентов
До 30% острого панкреатита возникает у пациентов старше 65 лет. 1 У меньшинства тяжелые заболевания с местными осложнениями и органной недостаточностью с морфологическими изменениями на компьютерной томографии (КТ) или без них, указывающими на некроз поджелудочной железы. 2 Тяжелый острый панкреатит связан со смертностью 8–10%; у пожилых пациентов летальность достигает 20-25%. 3 Большая предрасположенность к молниеносным заболеваниям в пожилом возрасте объясняется снижением резерва функции органов, сопутствующими заболеваниями, снижением способности переносить сдвиги жидкости и восприимчивостью к ишемии и инфекции. 4 Возрастные изменения поджелудочной железы и желчевыводящей системы перечислены в Table I . Мы рассматриваем этиологию, оценку и лечение воспаления поджелудочной железы у пожилых людей, чтобы обратить внимание врачей на уникальные особенности острого панкреатита в этой возрастной группе.
Возрастные структурные изменения поджелудочной железы
Диагноз может быть осложнен изменениями структуры органа при нормальном старении. Сообщается, что протоки поджелудочной железы расширяются с возрастом в среднем на 8% за десятилетие после 40 лет. 5 Hastier и соавторы6 сообщили, что только 31,4% (33 из 105) пациентов старше 70 лет без патологии поджелудочной железы имели диаметр протока в определенных пределах нормы. Главный проток поджелудочной железы у некоторых пожилых пациентов может достигать 1 см в диаметре без признаков обструкции или клинического хронического панкреатита. Расширение обычно коварное и равномерное по всей поджелудочной железе, в отличие от подострого, нерегулярного расширения, обычно наблюдаемого при хроническом панкреатите. У некоторых пожилых пациентов эктазия протоков может быть кистозной, имитируя псевдокисту поджелудочной железы или кистозное новообразование.Могут образовываться протоковые или паренхиматозные камни, не связанные с хроническим панкреатитом. 7 В японском обзоре 130 000 ультразвуковых исследований брюшной полости бессимптомных пациентов, 84% дилатаций главного протока поджелудочной железы, 87% кистозных областей и половина всех кальцификатов были признаны исключительно возрастными и не связанными с какой-либо патологией. 8
При аутопсии панкреатограмм у 60 пожилых пациентов без истории болезни или гистологических свидетельств заболевания поджелудочной железы ложноположительные изменения протока, соответствующие таковым при хроническом панкреатите, были обнаружены в 81% случаев. 9 Следует проявлять осторожность при интерпретации панкреатограмм, поскольку нормальные изменения старения могут имитировать изменения при хроническом панкреатите или карциноме поджелудочной железы ( Таблица I ). Также сообщалось об увеличении диаметра общего желчного протока до 10 мм при старении с нормальным уровнем после холецистэктомии до 14 мм. 10 На общем уровне старая поджелудочная железа также атрофируется. 5 Атрофическая железа, резко обрывающаяся при эндоскопической или магнитно-резонансной панкреатографии, может быть ошибочно диагностирована как обструкция в этой точке.
Этиология
Панкреатит у пожилых пациентов, по сравнению с более молодой группой, гораздо более вероятно вызван желчнокаменным панкреатитом (, таблица II, ). У пожилых пациентов причиной 75% эпизодов острого панкреатита является заболевание желчевыводящих путей. Факторы, способствующие этому, могут включать повышенную литогенность желчи, повышенную вероятность инфицирования желчи и повышенную склонность к образованию камней в желчном пузыре. 11
Хотя чрезмерное употребление алкоголя является частой причиной воспаления поджелудочной железы у молодых пациентов, только 5% эпизодов у пожилых пациентов связаны со злоупотреблением алкоголем.Однако злоупотребление алкоголем является наиболее частой причиной хронического панкреатита , который может проявляться как эпизод острого панкреатита без внешнесекреторной или эндокринной недостаточности. Поскольку скрытое употребление алкоголя является обычным явлением, рутинная оценка каждого пожилого пациента должна включать вопросы скрининга на алкоголь с поправкой на возраст. 12
Также необходимо оценить метаболическую и лекарственную этиологию. Пожилые женщины, принимающие заместительную гормональную терапию, подвержены риску гипертриглицеридемического панкреатита , что, как полагают, связано с высвобождением свободных жирных кислот из триглицеридов сыворотки под действием липазы поджелудочной железы.Воспаление поджелудочной железы обычно не возникает, пока уровень триглицеридов в сыворотке не превышает 1000 мг / дл. Заметное повышение также может быть связано с гипотиреозом и сахарным диабетом. Гиперкальциемия также может редко вызывать панкреатит, возможно, из-за индуцированной кальцием активации трипсиногена до его активной формы, трипсина. Диагностика панкреатита, вызванного лекарствами, является сложной задачей, особенно у пожилых людей, принимающих многие лекарства. Потенциально замешано до 100 лекарств, которые обычно используются пожилыми людьми.Важен подробный анамнез пациента и / или лица, осуществляющего уход.
Хотя является редкой причиной панкреатита, аденокарцинома поджелудочной железы также должна рассматриваться. Рак поджелудочной железы, протоковая аденокарцинома, закупоривает главный проток поджелудочной железы, вызывая протоковую гипертензию с последующей утечкой ферментов в паренхиму. При панкреатите, связанном со злокачественными новообразованиями, эффект очаговой массы опухоли может быть скрыт на компьютерной томографии диффузными воспалительными изменениями. 13
Инфекции являются необычной этиологией панкреатита и включают вирусы (эпидемический паротит, Коксаки, ВИЧ, простой герпес, гепатит), бактерии (микобактерии, микоплазма, бруцеллез, сальмонелла), грибы (аспергиллы, кандида) и паразиты.Пожилых пациентов следует расспросить о поездках за границу, поскольку могут возникнуть экзотические инфекции. СПИД связан с повышенным риском панкреатита из-за побочных эффектов лекарств и повышенной восприимчивости к инфекции. Гиперамилаземия или гиперлипаземия, не связанные с признаками воспаления поджелудочной железы, были описаны у 8-10% бессимптомных пациентов со СПИДом. 14 Повышенная частота и тяжесть панкреатита существует у пациентов с шоком или гипотонией.Острый панкреатит более тяжелый при неадекватном восполнении жидкости, лекарственной гипотензии или уже существующей брыжеечной ишемии, которые часто встречаются у пожилых людей.
Несмотря на полное обследование, 10-30% пациентов страдают необъяснимым или идиопатическим заболеванием. В некоторых случаях замешана генетическая мутация. В одном исследовании 18 пациентов с мутацией трансмембранного регулятора муковисцидоза (CFTR), вызывающей панкреатит, у одного субъекта был возраст начала 64 года, а у другого – 75 лет. 15 Такие генные мутации могут играть вспомогательную роль в возникновении воспаления поджелудочной железы при предполагаемом алкогольном панкреатите. Неизвестный процент недиагностированных случаев может представлять собой скрытое заболевание желчевыводящих путей (в том числе ил или микролитиаз), незарегистрированное злоупотребление алкоголем или неисследованную генетическую или аутоиммунную этиологию.
Клиническая презентация
Боль в животе, главный симптом острого панкреатита, варьируется от легкого дискомфорта в эпигастрии до диффузной, неослабевающей мучительной боли.Колики или периодическая боль наводит на мысль о другом диагнозе. У пожилых пациентов может быть слабая боль или ее отсутствие, возможно, из-за невропатии (например, диабета), большей переносимости боли или увеличения фиброза периневрия из-за нормального старения. 16 В одном отчете о девяти пожилых пациентах с острым интерстициальным панкреатитом, обнаруженным только при вскрытии, было отмечено несколько клинических признаков, за исключением быстро развивающегося шока. 17 Преходящие изменения внешнесекреторной и эндокринной функции, возникающие во время острого панкреатита, делают оценку толерантности к глюкозе и стеатореи неточными до тех пор, пока воспаление не стихнет.Результаты физикального обследования помогают определить степень тяжести. Часто наблюдаются субфебрильная температура и тахикардия. Фульминантные эпизоды могут быть связаны с спутанностью сознания, делирием, шоком, гипотонией, гипотермией или тахипноэ. Желтуха склеры предполагает холедохолитиаз, хроническое заболевание печени или непрерывное воспаление поджелудочной железы, охватывающее дистальную, внутрипанкреатическую часть общего желчного протока. Болезненность живота варьируется. Врач должен внимательно следить за признаками органной недостаточности. 18
Диагностические тесты
При остром панкреатите пищеварительные ферменты проникают из ацинарных клеток в интерстиций, а затем в кровоток.Повышение уровня амилазы и липазы в сыворотке неспецифично, однако встречается при широком спектре непанкреатических расстройств с частично совпадающими клиническими признаками (, таблица III, ). 19 Небольшое повышение (менее чем в 2 раза выше верхнего предела нормы) иногда сообщалось при нормальном старении, открытие еще не подтверждено в большой когорте. 20 Панкреатит может быть клинически неотличим от других внутрибрюшных состояний с аналогичными характеристиками и повышением уровня ферментов, включая мезентериальную ишемию с утечкой люминальной амилазы и липазы из кишечника, острое заболевание желчевыводящих путей и перфорированную язву.Повышенные уровни амилазы и липазы в сыворотке крови наблюдаются при почечной недостаточности (в 3-4 раза превышающей верхний предел нормы), метаболическом ацидозе, гипотонии, гипоперфузии и травмах. 21,22 Несмотря на отсутствие специфичности, повышение уровня амилазы и липазы в сыворотке крови составляет основу диагностики панкреатита в соответствующем клиническом контексте. Степень повышения уровня ферментов не коррелирует с тяжестью заболевания; Пациенты со скромным (менее чем в 2 раза превышающим верхний предел нормы) повышением уровня ферментов сыворотки могут иметь или развиваться в тяжелом остром панкреатите. 23
Нормальные уровни амилазы и липазы в сыворотке не исключают острый панкреатит. В одной последовательной серии нормальная сывороточная амилаза была зарегистрирована в 67 из 352 (19%) подтвержденных с помощью КТ случаев острого панкреатита с контрастированием. 24 Повышение уровня ферментов преходяще, обычно возвращаясь к норме в течение двух или трех дней после начала приступа. Ошибочный диагноз может возникнуть, если тестирование проводится после нормализации уровня ферментов. У одной трети пациентов с алкогольным панкреатитом во время обострения сывороточные ферменты будут нормальными, поскольку поджелудочная железа больше не может вырабатывать амилазу или липазу. 25 Фульминантный панкреатит, чаще встречающийся у пожилых пациентов, может быть связан с обширным разрушением железы, что делает ее неспособной секретировать ферменты.
Визуальные исследования
Ультрасонография обычно показана пожилым людям для выявления желчных камней. Однако ультразвуковая диагностика нечувствительна к оценке камней в общих желчных протоках или воспаления поджелудочной железы. Любое острое воспалительное заболевание брюшной полости может быть связано с кишечной непроходимостью или избыточным газом в кишечнике, потенциально закрывая как поджелудочную железу, так и желчевыводящие пути, что ограничивает визуализацию с помощью сонографии.У пожилых людей высокая частота желчнокаменного панкреатита и низкая чувствительность КТ для желчных камней делают УЗИ полезным после клинического разрешения или в качестве первичного визуального исследования в легких, неосложненных случаях.
КТ брюшной полости и таза с внутривенным контрастированием является золотым стандартом неинвазивной диагностики острого панкреатита, но выполняется не во всех случаях. КТ показана в следующих случаях: (1) для подтверждения клинического впечатления при тяжелом заболевании; (2) исключить другие серьезные заболевания брюшной полости; (3) когда диагноз неясен; (4) для оценки осложнений или панкреонекроза при молниеносных эпизодах; (5) когда улучшение не наступает в течение первых 48 часов; или (6) исследовать острое ухудшение. 26 Снижение клиренса креатинина с возрастом и маргинальный почечный резерв у пожилых людей всегда необходимо оценивать из-за риска контрастно-индуцированной нефропатии.
Эндоскопическая ретроградная холангиопанкреатография (ЭРХПГ) должна рассматриваться при клиническом подозрении на холангит или при наличии биохимических признаков обструкции общего желчного протока, дилатации желчного протока или холедохолитиаза при визуализирующих исследованиях. Магнитно-резонансная холангиопанкреатография (MRCP) – это новый неинвазивный метод визуализации панкреатических и желчных протоков. 27 Точность MRCP аналогична ERCP, но первая не имеет терапевтического потенциала ERCP для удаления камней общего желчного протока у пациентов с панкреатитом или билиарным сепсисом. MRCP, менее инвазивный тест, предпочтителен у ослабленных пациентов и у пациентов с низкой клинической вероятностью камней общего желчного протока, которым клинически показана визуализация протока. Пациентам с высокой вероятностью образования камней следует рассмотреть возможность проведения ЭРХПГ. При интерпретации результатов диагностической визуализации следует оценивать вклад нормальных старческих изменений поджелудочной железы и желчевыводящей системы, включая расширение общего желчного протока.
Оценка серьезности
В большинстве случаев острый панкреатит протекает легко и проходит самостоятельно. От 10 до 20% являются тяжелыми, обычно связанными с полиорганной недостаточностью с некротическим панкреатитом или без него. Примерно половина всех случаев смерти происходит в первые 10 дней, что характеризуется синдромом системной воспалительной реакции и стойкой органной недостаточностью. 28 Выявление неблагоприятных прогностических факторов при поступлении может привести к ранней КТ брюшной полости с контрастным усилением, профилактическому назначению антибиотиков для предотвращения вторичной инфекции поджелудочной железы или эндоскопической сфинктеротомии при прогнозируемом тяжелом панкреатите, вызванном желчнокаменной болезнью.Сывороточные уровни амилазы и липазы, хотя и полезны с диагностической точки зрения, не имеют прогностической роли в оценке клинической тяжести.
Увеличение возраста, позволяющее прогнозировать тяжелый эпизод, является основным критерием в двух широко признанных клинических системах оценки тяжести панкреатита: оценке острой физиологии и хронического здоровья (APACHE II) и критериях Рэнсона. Последние данные подтверждают, что пожилой возраст является независимым предиктором плохого прогноза. 29 Гипотония, шок, почечная дисфункция и дыхательная недостаточность коррелируют с некротическим панкреатитом.К сожалению, эти особенности обычно нечасто проявляются в начале тяжелого эпизода. Фан и его коллеги 30 сообщили о 21% смертности среди пациентов старше 75 лет. Их данные свидетельствуют о том, что сопутствующие заболевания у пожилых людей, а не более тяжелые воспалительные заболевания, являются причиной повышенной смертности. Недоедание при поступлении коррелирует с неблагоприятным исходом во время госпитализации и после выписки. 31 Гемоконцентрация при поступлении (гематокрит> 47%) с невозможностью нормализации в течение первых 24 часов может отражать тяжелое воспаление и неадекватную реанимацию жидкости с относительным уменьшением внутрисосудистого объема.В результате снижается перфузия поджелудочной железы, ишемия и повышается риск некроза. 32
КТ с внутривенным контрастированием позволяет оценить степень тяжести, демонстрируя некротическую ткань без усиления, отек поджелудочной железы и скопления жидкости. Система оценки КТ Бальтазара (, таблица IV, ), использующая КТ с контрастным усилением, имеет высокую чувствительность и специфичность для определения стадии; рекомендуется его использование для стратификации риска пожилых пациентов. 26 CT – текущий золотой стандарт для дифференциации интерстициального панкреатита от некротического путем демонстрации некротической ткани, которая не усиливается при введении контрастного вещества.Пациентам с панкреатитом от A до E присваиваются от 0 до 4 баллов на основании увеличения аномалий CT (, таблица V, ). Эпизоды со степенью D или E имеют зарегистрированный уровень смертности 14%, в то время как для эпизодов с уровнями A, B или C уровень смертности составляет всего 4%. В дополнительной модификации проценту некроза паренхимы поджелудочной железы присваивается дополнительное числовое значение: 2 балла для некроза до 30% поджелудочной железы, 4 балла для некроза 30-50% и 6 баллов для некроза более 50%.Balthazar и его коллеги 26 сообщили, что оценка 7-10 баллов связана с заболеваемостью 92% и смертностью 17%. В качестве примера индекса тяжести КТ пациенту с панкреатитом степени D будет присвоено 3 балла. Если бы у этого человека был документально подтвержденный КТ некроз 30-50% паренхимы поджелудочной железы, необходимо было бы оценить дополнительные 4 балла, что дало бы общий балл 7. Тем не менее, клиницистам следует посоветовать, что нормальное КТ у пожилого пациента подозрение на панкреатит может также отражать непанкреатическую причину боли, такую как мезентериальная ишемия с утечкой люминальной амилазы или липазы в сыворотку.
Менеджмент
Планы лечения пожилого пациента должны начинаться с оценки целей лечения пациента, включая приказы о запрете реанимации, сохранение физических функций и надлежащее информированное согласие. Проблемы с питанием особенно важны при остром панкреатите, гиперметаболическом расстройстве, характеризующемся повышенным расходом энергии, протеолизом, глюконеогенезом и инсулинорезистентностью. 33 Большинству пациентов требуется поддерживающая терапия с госпитализацией по поводу внутривенных вливаний и отказа от приема внутрь.Большинство пациентов с прогнозируемой легкой формой заболевания могут начать повторное кормление по мере исчезновения клинических и лабораторных маркеров воспаления. Кормление может быть непереносимым из-за постпрандиальной боли, тошноты или рвоты. Раннее обезболивание имеет решающее значение для предотвращения ненужных страданий. Хотя пожилые пациенты могут быть менее способны переносить сдвиги жидкости, отсутствие адекватной гидратации может увеличить повреждение поджелудочной железы, связанное с ишемией. Однако клиницисты должны знать, что у пожилых людей олигурия может быть результатом развития острого некроза канальцев, а не продолжающегося истощения объема.В этом контексте агрессивная регидратация может привести к легочному и периферическому отеку без улучшения функции почек или диуреза. 34
Пациенты с неблагоприятными прогностическими показателями (см. Выше) должны лечиться в отделении интенсивной терапии на основе ранней стратификации степени тяжести. Инфекция поджелудочной железы коррелирует с некротическим панкреатитом, лихорадкой, лейкоцитозом или органной недостаточностью после первой недели болезни. Инфицированный некроз необходимо также обследовать у пациентов, у которых развивается лихорадка, лейкоцитоз или органная недостаточность через семь-десять дней после начала острого панкреатита.Текущие рекомендации включают использование профилактических антибиотиков при фульминантном панкреатите с некрозом, по крайней мере, до тех пор, пока пункционная пункционная аспирация панкреатического некроза под контролем КТ и дополнительные исследования на непанкреатическую инфекцию не дадут отрицательных результатов. 35 Объединенные данные четырех недавних рандомизированных контролируемых исследований показывают, что внутривенные антибиотики, особенно имипенем, уменьшают панкреатический сепсис (отношение шансов [OR] = 0,51; P = 0,04) и оказывают положительное влияние на смертность (OR = 0.32; P = 0,02). 36 Доказательств использования возрастных критериев для определения показаний для антибиотикопрофилактики недостаточно.
Последние данные свидетельствуют о том, что энтеральное питание (ЭП) предпочтительнее полного парентерального питания (ПП) у пациентов без кишечной непроходимости, которые, как ожидается, не будут переносить пероральное питание в течение длительного периода. 33 Доставка питательных веществ непосредственно в дистальный отдел тощей кишки минимально влияет на секрецию поджелудочной железы по сравнению с более проксимальным кормлением. Кормление через нос и тощую кишку может улучшить нарушенную функцию кишечника, усилить кровоток, усилить иммунную функцию и синтез белка.По сравнению с ППП тощее питание может укрепить целостность слизистой оболочки кишечника как барьер для бактериальной транслокации и последующей инфекции поджелудочной железы, избегая катетерных осложнений ПП. 33 EN может снижать проницаемость кишечника для цитокинов и эндотоксинов, притупляя системную воспалительную реакцию, сопровождающую тяжелый панкреатит. Недавний Кокрановский обзор указывает на тенденцию к снижению заболеваемости при кормлении с высоким содержанием белка и низким содержанием жира через назо-ееюнальное, радиологическое или эндоскопическое размещение питательных зондов тощей кишки. 37 При желчнокаменном панкреатите большинство специалистов рекомендуют профилактическую холецистэктомию во время той же госпитализации из-за возможности повторных приступов. При тяжелом билиарном панкреатите холецистэктомию можно отложить до разрешения острого воспалительного процесса. 38 Ранняя сфинктеротомия ERCP может быть показана при сопутствующем холангите, стойких камнях в общем желчном протоке, желтухе или в эпизодах, которые могут быть тяжелыми. 39 ERCP должна сопровождаться плановой холецистэктомией у пациентов с камнями желчного пузыря, пригодных для хирургического вмешательства.Неотложная холецистэктомия в три раза увеличивает риск заболеваемости и смертности у пожилых пациентов по сравнению с плановым хирургическим вмешательством. 40
Заключение
По мере старения населения пожилые люди будут чаще болеть острым панкреатитом. Структурные и функциональные изменения нормального старения необходимо дифференцировать от патологических состояний. Повышенные уровни ферментов поджелудочной железы в сыворотке крови и боль в животе неспецифичны и должны отличаться от целого ряда других распространенных абдоминальных заболеваний с частично совпадающими характеристиками.И наоборот, отсутствие типичных признаков, симптомов или серологических результатов не исключает острого панкреатита. Чтобы избежать ошибочного диагноза и снизить заболеваемость и смертность, клиницисты должны знать о разнообразном спектре острого панкреатита у пожилых людей.
Доктор Нанда работал в бюро докладчиков Forest Pharmaceuticals и получил исследовательский грант от Amgen. Другие авторы сообщают об отсутствии соответствующих финансовых отношений.
Произошла ошибка при настройке вашего пользовательского файла cookie
Произошла ошибка при настройке вашего пользовательского файла cookieЭтот сайт использует файлы cookie для повышения производительности.Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки вашего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Хронический деструктивный панкреатит безалкогольных протоков
В западных странах наиболее частой причиной хронического панкреатита является злоупотребление алкоголем, на которое приходится примерно 70% случаев.1 Следующим по частоте типом является так называемый идиопатический хронический панкреатит ( ВЧД), который составляет 10-40% всех случаев и не имеет известной причины.2 В редких случаях могут иметь значение такие факторы, как наследственность, гиперкальциемия или аутоиммунный фон.2 Кроме того, в некоторых частях Индии и Африки есть особый тип хронического панкреатита, не связанный ни с одним из факторов, известных в западных странах.2 Этот тип хронического панкреатита встречается у детей и подростков и считается, что он вызван недоеданием.
Обычно считается, что патология хронического панкреатита одинакова для всех этиологических типов. Тем не менее, большинство описаний относятся к хроническому алкогольному панкреатиту (ACP) или принимают во внимание только конечную стадию заболевания, когда все типы хронического панкреатита могут выглядеть одинаково.3-5 Таким образом, мы хорошо знаем эволюцию морфологического изменения, происходящие у пациентов с ACP.Однако морфологические особенности ранней стадии хронического панкреатита и развивающегося хронического панкреатита наследственного, метаболического, идиопатического или тропического типов неизвестны.
Особый тип хронического панкреатита, о котором все чаще сообщается в последние годы, связан с аутоиммунными и родственными заболеваниями, такими как первичный склерозирующий холангит, первичный билиарный цирроз, хроническое идиопатическое воспалительное заболевание кишечника (язвенный колит и болезнь Крона), синдром Шегрена, системная красная волчанка и различные комбинации этих состояний.6-20 В клинических условиях этих заболеваний в поджелудочной железе могут наблюдаться изменения, получившие название склерозирующего панкреатита. , 16 Однако похоже, что аналогичные изменения могут происходить и в поджелудочной железе у пациентов без проявлений аутоиммунных заболеваний.
За последние несколько лет мы собрали серию случаев хронического панкреатита, которые соответствовали строгому определению идиопатического типа или были клинически связаны с аутоиммунными или родственными заболеваниями. У многих из них была желтуха, и их лечили хирургическим путем, так как подозревалась карцинома головки поджелудочной железы.Мы проанализировали гистологические и иммуногистохимические данные резецированных образцов поджелудочной железы от 12 пациентов. В частности, мы сравнили изменения поджелудочной железы у этих пациентов с изменениями, описанными в литературе у пациентов с аутоиммунными заболеваниями, и исследовали, явно ли эти изменения отличаются от изменений, наблюдаемых у пациентов с ACP.
Материалы и методы
Мы изучили истории болезни и гистопатологию поджелудочной железы у 12 пациентов с неалкогольным хроническим панкреатитом (NACP) (пять женщин и семь мужчин; средний возраст 41 год; диапазон 17–77), которые лечились. хирургическим путем и сравнил результаты с образцами панкреатэктомии от 12 пациентов с ACP (две женщины и 10 мужчин; средний возраст 43 года; диапазон 31–51).Четверо пациентов с NACP (все мужчины; средний возраст 49 лет; диапазон 29–77) также имели аутоиммунное или аутоиммунное заболевание: по одному случаю каждый был связан с синдромом Шегрена, первичным склерозирующим холангитом, язвенным колитом и болезнью Крона.
Тканевые блоки 14 хирургических образцов от 12 пациентов с NACP были получены из файлов и консультационных архивов кафедр патологии Католического университета Левена, Бельгия (пациенты 1–4, 9 и 10), Университета Дюссельдорфа, Германия (пациенты 6 и 11), Муниципальная больница Байройт, Германия (пациент 5), Муниципальная больница Люнебурга, Германия (пациент 7), Академическая больница Йетте, Свободный университет Брюсселя, Бельгия (пациент 12), и Кильский университет , Германия (пациент 8).Тканевые блоки хирургических образцов от 12 пациентов с ACP были получены из архива консультаций одного из авторов (GK). Все образцы тканей обычно фиксировали формалином или фиксатором Буэна и заливали парафином. Дополнительные образцы биопсии от одного пациента (пациент 9) были частично зафиксированы в B5 (фиксатор на основе ртути), залиты парафином, а частично свежезаморожены в изопентане, охлажденном жидким азотом, и хранились при -70 ° C до использования.
Срезы (толщиной 3 мкм) окрашивали гематоксилином и эозином, периодной кислотой Шиффа как с предварительной обработкой амилазой, трихромом Массона и Гимза, так и без нее.Антитела, используемые для иммуногистохимических красителей, перечислены в таблице 1 вместе с источником и ссылкой на их специфичность, если применимо. Подмножество Т-хелперов / индукторов идентифицировали путем одновременного применения OKT4 и Leu3a.22 Иммуногистохимическое окрашивание проводили на фиксированном формалине, препарате Буэна или B5 с использованием метода пероксидаза-антипероксидаза (PAP ).23 Метод непрямой иммунопероксидазы применялся на 5 пациентах. Срезы криостата толщиной мкм, зафиксированные в холодном ацетоне и высушенные при комнатной температуре в течение 18 часов.24
Таблица 1Моноклональные антитела, используемые для исследования воспалительного инфильтрата в поджелудочной железе у пациентов с неалкогольным и алкогольным хроническим панкреатитом
Регистрировали степень фиброза и воспаления. Перилобулярный фиброз определялся как наличие соединительной ткани в междольковых пространствах, тогда как внутрилобулярный фиброз определялся как распространение перилобулярного фиброза на ацинарную ткань. Число иммуногистохимически идентифицированных T (UCHL1-положительных) или B (L26-положительных) лимфоцитов подсчитывали вокруг пораженных протоков в последовательных срезах и выражали в виде числа на поле высокого увеличения (hpf) (× 63-6.15 мм 2 ). В каждом случае были проанализированы четыре поля, в том числе по одному пораженному протоку.
Результаты
КЛИНИЧЕСКИЕ И РАДИОЛОГИЧЕСКИЕ ДАННЫЕ
В таблице 2 приведены основные клинические и рентгенологические характеристики 12 пациентов с NACP. Половина пациентов была в возрасте 30 лет или моложе при первичном обращении, тогда как остальным пациентам было 40–77 лет. У четырех пациентов было аутоиммунное или аутоиммунное заболевание (таблица 2). Их средний возраст составлял 49 лет (от 29 до 77 лет).У пяти пациентов (42%) возникла боль в животе и заметно увеличились сывороточные концентрации липазы и / или амилазы. У других пяти пациентов симптомом была механическая желтуха. У двух пациентов NACP был случайным обнаружением при диагностике язвы желудка (пациент 4) и во время наблюдения по поводу язвенного колита (пациент 10). Стромальная опухоль желудочно-кишечного тракта (GIST), происходящая из нисходящей части двенадцатиперстной кишки и распространяющаяся в забрюшинное пространство, была включена в дуодено-панкреатэктомическую резекцию пациента 8.Опухоль показала положительную реакцию на α-актин гладких мышц и в ограниченной степени на белок S100, но без гистологических признаков злокачественности. Не было рентгенологических, хирургических или гистопатологических доказательств того, что опухоль вызвала панкреатит. Ни у одного из пациентов не было холелитиаза в анамнезе.
Таблица 2Основные клинические данные у 12 пациентов с неалкогольным хроническим панкреатитом
ЭРХПГ или сонография, или то и другое вместе, и компьютерная томография выявили сегментарный стеноз главного протока поджелудочной железы у девяти пациентов и терминального сегмента дистального желчного протока в Семь.У четырех пациентов был стеноз как дистального желчного протока, так и протока Вирсунга. Десять пациентов (все, кроме пациентов 1 и 6) были прооперированы по поводу клинического или радиологического, или того и другого, подозрения на злокачественное новообразование. Это подозрение сохранялось даже при макроскопическом исследовании образца резекции, как показано на рис. 1.
Рисунок 1: Общий вид неалкогольного хронического панкреатита, имитирующего карциному поджелудочной железы (образец дуодено-гемипанкреатэктомии от пациента 8). На разрезе головка поджелудочной железы выглядит затвердевшей и бледной.Сужен интрапанкреатический сегмент дистального желчного протока (стрелки).
Все пациенты чувствовали себя хорошо после операции, за исключением пациента 1, которому была проведена повторная операция по поводу рецидивирующих симптомов. Через три года после клиновидной биопсии была сделана панкреатикоеюностомия. Через девять месяцев после этого была проведена вторая панкреатикоеюностомия.
Скрининг на аутоантитела и антитела к гепатиту С (антинуклеарные антитела, антимитохондриальные антитела, антитела островковых клеток, антитела цитоплазмы тироидных клеток, антитела к коллоидным мышцам, антитела гладких мышц, антитела слюнной железы, антитела эпителия толстой кишки, перинуклеарные антинейтрофильные цитоплазматические антитела (pANCA), цитоплазматические антитела к цитоплазме (pANCA) цитоплазматическое Ab, гепатит C) 25-27 выполнено большинству пациентов.Единственным положительным результатом была реакция на pANCA в сыворотке пациента 12. Четыре пациента страдали аутоиммунными или аутоиммунными заболеваниями (таблица 2).
ГИСТОЛОГИЧЕСКИЕ И ИММУНОГИСТОХИМИЧЕСКИЕ РЕЗУЛЬТАТЫ
В таблице 3 приведены наиболее важные изменения поджелудочной железы у пациентов с NACP. Пациенты с аутоиммунными заболеваниями и без них имели гистологически и иммуногистохимически сопоставимые изменения. Наиболее заметными у пациентов с NACP были плотные лимфоцитарные воспалительные инфильтраты вокруг междольковых протоков, особенно протоков среднего и большого размера (рис. 2).Степень перидуктального воспаления различалась от протока к протоку, но в среднем у девяти пациентов она была умеренной, а у трех – тяжелой. У семи пациентов было поражено более 80% межлобулярных протоков, включая главный проток поджелудочной железы. У остальных пациентов было поражено меньшее количество межлобулярных протоков, и пораженные протоки были неравномерно распределены по ткани поджелудочной железы.
Таблица 3Основные гистологические данные при неалкогольном хроническом панкреатите (NACP) по сравнению с алкогольным хроническим панкреатитом (ACP)
Рисунок 2: Деструктивный хронический панкреатит безалкогольного протока: большой междольковый проток, окруженный плотным воспалительным инфильтратом, состоящим из мононуклеарных клеток .Гематоксилин и эозин; оригинальное увеличение × 60.
Перидуктальное воспаление очагово разрушило эпителий протока (рис. 3 и 4) и привело к перидуктальному фиброзу (рис. 5). Эти изменения вызвали облитерацию протока и фиброз ацинарной ткани перед поражением протока (рис. 5). В областях с тяжелой непроходимостью протока ацинарная паренхима была почти полностью замещена фиброзной тканью. Во всех случаях степень перилобулярного фиброза была оценена как более обширная, чем (n = 8) или равная (n = 4) степени внутрилобулярного фиброза.Более чем в половине образцов поджелудочной железы прогрессирующий фиброз чередовался с участками, в которых было обнаружено только перидуктальное воспаление. У четырех пациентов фиброз поджелудочной железы сузил общий желчный проток.
Рисунок 3: Хронический панкреатит с деструкцией неалкогольных протоков: воспалительный процесс, разрушающий эпителий (стрелки) некоторых межлобулярных протоков. Гематоксилин и эозин; оригинальное увеличение × 120.
Рисунок 4: Деструктивный хронический панкреатит безалкогольного протока: небольшой межлобулярный проток, внедренный в плотный воспалительный инфильтрат.Эпителий поражен лимфоцитами и гранулоцитами. Гематоксилин и эозин; исходное увеличение × 240.
Рисунок 5: Деструктивный хронический панкреатит неалкогольного протока: выраженные изменения поджелудочной железы, характеризующиеся фиброзным замещением ацинарной ткани и тяжелой облитерацией протока. Гематоксилин и эозин; оригинальное увеличение × 120.
Выраженный облитерирующий флебит вен малого и среднего размера наблюдался только у одного пациента (пациент 9). Дискретные поражения вен наблюдались у пациентов 3, 6 и 11.Белковые пробки, кальцификаты и / или псевдоцисты не были обнаружены ни в одном из образцов.
Перидуктальные инфильтраты (некоторые с лимфоидными фолликулами) состояли из лимфоцитов (общий лейкоцитарный антиген положительный), плазматических клеток, макрофагов (положительный Kp1) с некоторыми примесью дендритных клеток (положительный S100), эозинофилов и нейтрофилов. B-лимфоциты (положительные по L26) были явно менее многочисленны, чем Т-лимфоциты (положительные по UCHL1). Среднее соотношение B-лимфоцитов к T-лимфоцитам у наших пациентов составляло 3,60: 58,28 (диапазон B-лимфоцитов 0–5.50 ячеек на HPF; Диапазон Т-лимфоцитов 14,35–121,75). У одного пациента (пациент 10) B-лимфоциты были многочисленными и составляли от 65 до 67 клеток на HPF. Поэтому последние значения не были включены в расчет средних значений или диапазонов. Т-лимфоциты перидуктального инфильтрата были CD4 (положительные по ОКТ4 и Leu3a) и CD8 (положительные по ОКТ8). Т-лимфоциты иногда обнаруживались в самом эпителии протоков. Эпителий протоков малого и среднего размера локально экспрессирует антигены MHC класса I (HLA-ABC-положительный) и II (HLA-DR и HLA-DQ-положительный).
Образцы ACP показали диффузный перилобулярный фиброз (12/12) и очаговый внутрилобулярный фиброз (11/12). Обычными были классические признаки ACP, такие как кальцификаты (75%), псевдокисты (50%) и аутопищеварительный некроз (34%). И картина распределения, и состав воспалительного инфильтрата отличались от таковых при NACP (таблица 3).
Обсуждение
Наши морфологические данные позволяют предположить, что все 12 пациентов с NACP (восемь пациентов с хроническим панкреатитом неизвестного происхождения и четыре пациента с ассоциированными аутоиммунными и родственными заболеваниями) имели форму панкреатита, которая явно отличается от ACP и, вероятно, представляет собой особую и особую форму панкреатита. пока еще редко описываемый тип панкреатита.
Основным морфологическим признаком этого типа NACP было заметное перидуктальное воспаление, которое, по-видимому, вызывало обструкцию протока, а иногда и деструкцию протока. Это воспаление, связанное с протоком, часто неравномерно распределялось в ткани поджелудочной железы, прогрессирующие поражения чередовались с довольно свежими изменениями или даже в основном не вовлеченными областями. Перидуктальный инфильтрат состоял в основном из Т-лимфоцитов, но всегда содержал группы В-лимфоцитов и разбросанные плазматические клетки и макрофаги.Полиморфноядерные лейкоциты, некоторые из них эозинофильные, были отмечены в местах разрыва эпителия протока и очевидного разрушения протока. Воспалительный процесс, очевидно, вызвал фиброз, который охватил протоки и распространился на межлобулярные перегородки. Там, где ацинарная ткань была заменена фиброзом, соседние межлобулярные протоки, по-видимому, были сильно разрушены или даже исчезли, что позволяет предположить, что дольчатый фиброз был вызван обструкцией протоков. Пока нет готового объяснения сосудистым изменениям.Однако они были поразительной особенностью только одного пациента.
Когда мы сравнили изменения поджелудочной железы у пациентов с NACP с таковыми в группе ACP, были выявлены четкие различия, которые предполагали различные патогенетические механизмы. При ACP протоки были деформированы и часто содержали кальцификаты. Иногда наблюдались псевдокисты и аутопищеварительный некроз. Ни одна из этих особенностей ACP3-5 не присутствовала в NACP. Напротив, перидуктальное воспаление и изменения протоков, наблюдаемые при NACP, не наблюдались при ACP.Более того, были различия в составе воспалительного инфильтрата. При ACP лимфоцитарный инфильтрат почти полностью состоит из Т-лимфоцитов 28. , 29 тогда как в NACP они также содержали разбросанные агрегаты В-лимфоцитов. Особенностью, которая не способствовала различию между NACP и ACP, была экспрессия MHC класса II, которая в одинаковой степени проявлялась при обоих заболеваниях и, по-видимому, часто встречается при хроническом панкреатите независимо от его типа.29
Литература содержит ряд отчетов, описывающих тип панкреатита, который кажется сопоставимым или даже идентичным тому, что мы наблюдали в нашей серии пациентов с NACP.В 1950 году Болл и др. 11 сообщили об изменениях поджелудочной железы у пациентов с язвенным колитом и назвали этот воспалительный процесс хроническим интерстициальным панкреатитом. Было обнаружено, что интерстициальный лимфоплазмоцитарный инфильтрат, вовлекающий протоки, связан с фибробластической реакцией. Очень похожие, хотя и более обширные, изменения поджелудочной железы были описаны у нескольких пациентов с первичным склерозирующим холангитом.7-9 Помимо хронического интерстициального воспаления, облитерирующего межлобулярные протоки, в некоторых из этих случаев также наблюдался облитерирующий флебит мелких вен.Недавно были описаны изменения хронического протокового деструктивного панкреатита в сочетании с синдромом Шегрена, но также без сопутствующих аутоиммунных или родственных заболеваний. , 21
Причина специфического перидуктального и деструктивного воспаления протоков в поджелудочной железе у наших пациентов с NACP и тех, о которых сообщалось в литературе, неясна. Более того, похоже, что нет значительных различий в изменениях поджелудочной железы между пациентами с аутоиммунным фоном и пациентами без него.В нашей серии пациентов с NACP мы не смогли различить аутоиммунные и неаутоиммунные изменения. Таким образом, кажется, что хроническое деструктивное воспаление перидуктов и протоков не ограничивается клинически очевидным аутоиммунным фоном, но может также возникать у пациентов, принадлежащих к категории ВЧД.
Тесная связь между хроническим воспалением и протоками, наблюдаемая в нашей серии пациентов с NACP, предполагает, что клетки протоков или их содержимое являются мишенью воспалительного процесса.С чисто морфологической точки зрения изменения протока поджелудочной железы очень напоминают изменения желчных протоков, наблюдаемые при первичном билиарном циррозе или, тем более, при первичном склерозирующем холангите. Это поразительное сходство с первичным склерозирующим холангитом имеет особое значение, поскольку, как мы уже упоминали, ряд случаев, описанных в литературе, был связан с этим заболеванием. В нашей серии исследований был один такой случай, тогда как у второго пациента поражение интрапанкреатической части желчного протока очень указывало на внепеченочный первичный склерозирующий холангит.Однако у этого последнего пациента не было ни признаков внутрипеченочного первичного склерозирующего холангита по оценке ERCP, ни антител, таких как pANCA, которые могут быть обнаружены почти у 70% пациентов с первичным склерозирующим холангитом.30 Аутоантитела были протестированы в количество наших пациентов, чтобы найти признаки возможного аутоиммунного фона. За исключением антинейтрофильных цитоплазматических антител, обнаруженных у пациента с ассоциированным первичным склерозирующим холангитом, не было обнаружено ни одного. Однако антитела против карбоангидразы II не тестировались.Это может представлять интерес с учетом недавней демонстрации таких антител у пациентов с идиопатическим хроническим панкреатитом и синдромом Шегрена.31 , 32
Таким образом, изменения поджелудочной железы у наших пациентов с неалкогольным хроническим панкреатитом явно отличаются от таковых с алкогольным хроническим панкреатитом. Поскольку описанные поражения сосредоточены вокруг протоков и кажутся деструктивными по своей природе, мы предлагаем термин «хронический протоковый деструктивный панкреатит» для этого типа заболевания поджелудочной железы.


 Облегчения такая рвота не приносит.
Облегчения такая рвота не приносит.
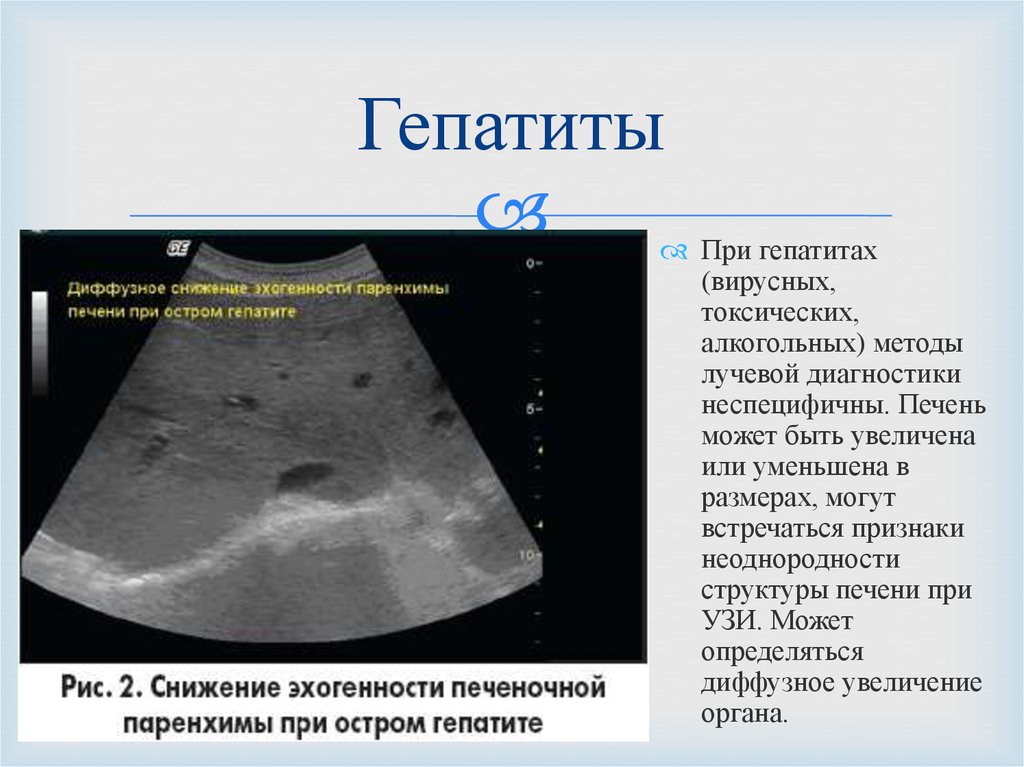
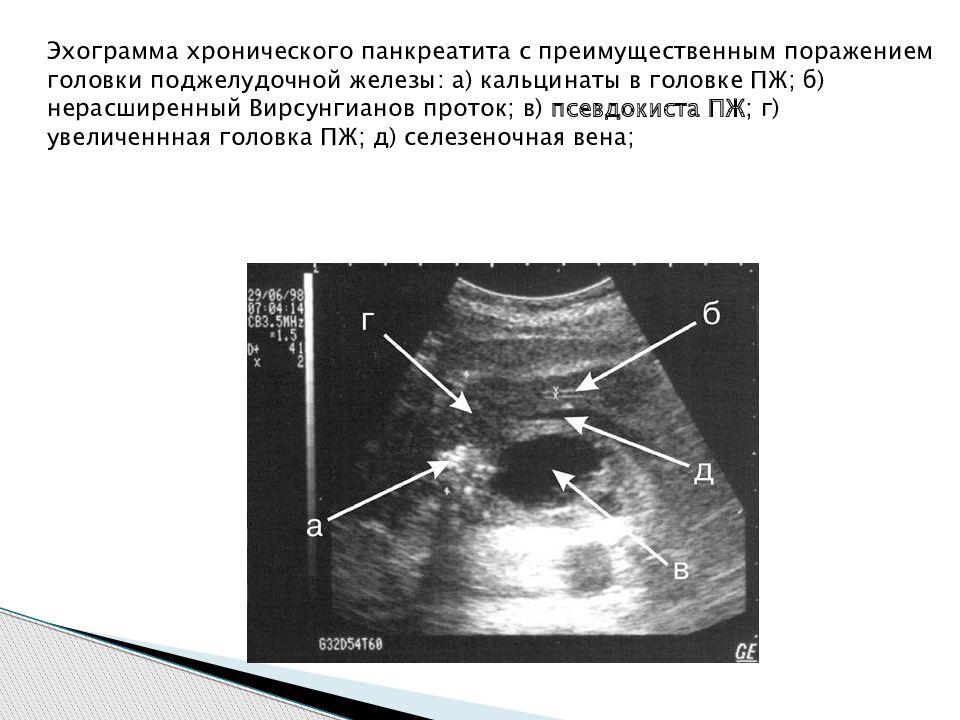 При этом воспалённые или ишемизированные участки замещаются соединительной тканью, которая также не способна выполнять функции поджелудочной железы.
При этом воспалённые или ишемизированные участки замещаются соединительной тканью, которая также не способна выполнять функции поджелудочной железы. Они могут быть только при хронических обменных, токсических или воспалительных заболеваниях, затрагивающих весь орган полностью, а не только его определённый участок.
Они могут быть только при хронических обменных, токсических или воспалительных заболеваниях, затрагивающих весь орган полностью, а не только его определённый участок.