Воспаление слизистой кишечника: Страница не найдена – ГАУЗ АО “Городская поликлиника №1”
Заболевания двенадцатиперстной кишки – Услуги
Нормальное состояние двенадцатиперстной кишки является залогом нормального функционирования организма в целом. Процесс пищеварения в желудочно-кишечном тракте происходит в основном в двух отделах — желудке и двенадцатиперстной кишке. Остальные отделы отвечают за всасывание питательных веществ.
Дуоденит
Наиболее распространенное заболевание двенадцатиперстной кишки — дуоденит — воспаление слизистой оболочки этого отдела тонкого кишечника. Заболевание имеет два вида течения: острое и хроническое. Острый дуоденит практически не встречается, это заболевание чаще всего выявляется на стадии хронического течения. Дуоденит может развиваться как самостоятельно (первичный дуоденит), так и быть следствием воспаления любого другого отдела ЖКТ (вторичный дуоденит), так же он может быть диффузным и локальным.
Причины дуоденита
Основной причиной развития первичного дуоденита является неправильное питание.
Причинами развития вторичного дуоденита являются гастриты, хеликобактерная инфекция, язвенная болезнь т.д.
Симптомы дуоденита
Основным симптомом дуоденита является болевой синдром. Боль возникает в подложечной или пупочной областях натощак или спустя час после еды. Снять боль можно антацидными препаратами или приемом пищи. Очень редко пациентов может беспокоить рвота, изжога, неприятная отрыжка.
Для постановки диагноза используют рентгеноскопию, фиброгастродуоденоскопию, дуоденальное зондирование.
Лечение дуоденита
- Основу лечения дуоденита составляет диетотерапия
- Для снятия болевого синдрома назначаются антацидные препараты
- Для защиты слизистой оболочки кишки необходим прием препаратов, снижающих секрецию соляной кислоты, регулирующих работу ЖКТ и усиливающих восстановление клеток слизистой оболочки
- Обязательным является физиотерапия и санаторно-курортное лечение
Язвенная болезнь двенадцатиперстной кишки
Язвенная болезнь двенадцатиперстной кишки — еще одно широко распространенное заболевание. Это хроническое, часто рецидивирующее заболевание, которое проявляется в виде дефекта стенки двенадцатиперстной кишки.
Это хроническое, часто рецидивирующее заболевание, которое проявляется в виде дефекта стенки двенадцатиперстной кишки.
Язва этого отдела кишечника довольно часто прогрессирует, при этом в патологический процесс могут вовлекаться желудок и другие отделы ЖКТ. Иногда язва может осложняться кровотечениями, разрывами стенки, а эти осложнения очень часто приводят к летальному исходу.
Причины язвенной болезни двенадцатиперстной кишки
Основной причиной по которой двенадцатиперстная кишка поражается язвой, является инфекция Helicobacter pylori. Эта бактерия вырабатывает токсины, которые непосредственно поражают слизистую оболочку, а также способствуют выработке кислого желудочного сока, который усиливает повреждение стенки. Кроме этого язва может возникнуть на фоне предшествующего дуоденита, гастрита и др.
Симптомы язвенной болезни двенадцатиперстной кишки
Поскольку язва процесс хронический, то начальные этапы ее развития ничем себя не проявляют. На ранних стадиях беспокоит чувство тяжести в области желудка или подложечной области, сопровождаемые тошнотой, рвотой, снижением аппетита, потерей массы тела. На более поздних стадиях нередко возникает резкая, ноющая, продолжительная боль в подложечной области.
На ранних стадиях беспокоит чувство тяжести в области желудка или подложечной области, сопровождаемые тошнотой, рвотой, снижением аппетита, потерей массы тела. На более поздних стадиях нередко возникает резкая, ноющая, продолжительная боль в подложечной области.
Лечение язвенной болезни двенадцатиперстной кишки
Лечение болезни связанной с язвой включает несколько этапов.
Первый этап — уничтожение первопричины — Helicobacter pylori. При этом проводится адекватная антибиотикотерапия. На втором этапе для защиты слизистой оболочки кишки врачи назначают прием препаратов, нейтрализующих соляную кислоту омепразол, ранитидин и др. Также необходим прием лекарств, которые защищают здоровую слизистую оболочку, например, де-нол.
Курс лечения язвы двенадцатиперстной кишки занимает примерно 2 недели, после чего больному необходимо строго придерживаться диеты и регулярно сдавать необходимые анализы, дабы не допустить рецидива или угрожающих жизни осложнений.
|
Первичный прием врача гастроэнтеролога ЦЕНА: 1500 |
|
Повторный осмотр врача гастроэнтеролога (постановка диагноза, назначение необходимого курса лечения) ЦЕНА: 1500 |
Язвенный колит кишечника у взрослых: лечение в клинике НЕОМЕД
Гастроэнтерологи клиники НЕОМЕД имеют успешный опыт в диагностике и лечении колитов. Для постановки диагноза максимально информативным методом оценки состояния толстой кишки является колоноскопия. Подробно об этом методе можно ознакомится в разделе «Методы диагностике» на этой странице.
После точной диагностики и в зависимости от результатов, подбирается индивидуальная схема лечения медикаментозными препаратами, а также лечебная диета.
Это группа заболеваний, с воспалением слизистой толстой кишки, иногда её изъязвлением, проявляющиеся болью в животе, расстройством стула, метеоризмом. Боль в животе, как правило, локализуется в нижних отделах живота, но могут беспокоить и разлитые боли по всему животу.
Расстройство стула характеризуется чередованием запоров и поносов, часто стул с примесью слизи и крови. Еще один неприятный симптом – ложные позывы к дефекации (тенезмы), часто беспокоят пациента по ночам, мучительные и болезненные.
Колит может протекать в острой форме, тогда к вышеперечисленным жалобам присоединяется ухудшение общего самочувствия, повышение температуры, тошнота и снижение массы тела. При отсутствии лечения острая форма колита переходит в хроническую, что чревато осложнениями. Как правило, это регулярные обострения заболевания, стойкое нарушение функции и структуры самой толстой кишки.
Также хроническое воспаление слизистой может приводить к образованию язв (язвенный колит), тогда заболевание приобретает опасное течение, кардинально меняющее качество жизни пациента.
Наиболее подвержены данному заболеванию женщины 20-60 лет и мужчины 40-60 лет. Часто колит сочетается и с другими заболеваниями желудочно-кишечного тракта. Поэтому не терпите боль в животе, не занимайтесь самолечением до первых признаков облегчения. Важно вовремя предотвратить развитие такого грозного заболевании как колит, обратившись к гастроэнтерологу.
Симптомы колита зависят от формы, течения, причины заболевания, а также от локализации воспаления.
Общие характерные симптомы для острой формы колитов:
- боль в животе, чаще в нижних отделах живота, но может беспокоить и разлитая боль по всему животу;
- метеоризм;
- нарушение стула в виде поносов и запоров. Стул, как правило, с обильной слизью, может быть с кровью. Акт дефекации болезненный;
- ложные позывы к дефекации (тенезмы), длительные и мучительные, часто беспокоят по ночам.
 Могут заканчиваться выделением слизи.
Могут заканчиваться выделением слизи.
Из-за воспалительного процесса и нарушения пищеварения может возникнуть тошнота, отрыжка, зловонный запах кала, исчезновение аппетита, жажда, слабость, снижение массы тела, анемия. При тяжелых формах температура тела повышается до 38 °С.
Часто причиной развития колита становится инфекция – бактерии и паразиты.
Также причинами колита могут быть:
- химические и токсические вещества – некоторые лекарства, токсины, образующиеся в результате хронических заболеваний;
- механическое повреждение слизистой – частые запоры, клизмы;
- нарушение кровообращения артерий, питающих кишечник.
Предрасполагающие факторы для развития колита: хронические стрессы, болезни органов пищеварения, в том числе дисбактериоз, аллергия, недостаток растительной клетчатки в пище.
Причины неспецифического язвенного колита (НЯК) в настоящее время до конца не известны. Предполагается, что это генетическая предрасположенность и несостоятельность иммунной системы.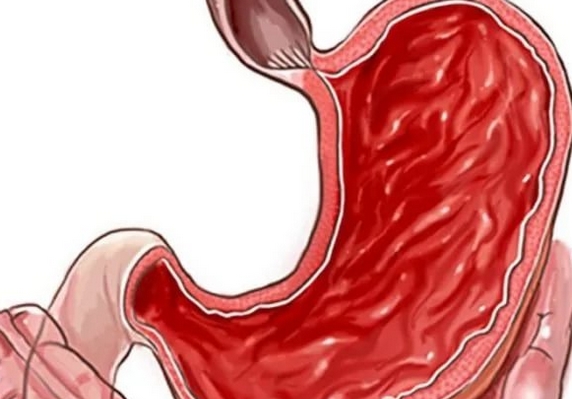
× Текст скрыт. Выберите пункт меню для чтения дополнительной информации.
Ученые выяснили, почему сахар вызывает воспаление кишечника
https://ria.ru/20201028/kishechnik-1581987243.html
Ученые выяснили, почему сахар вызывает воспаление кишечника
Ученые выяснили, почему сахар вызывает воспаление кишечника – РИА Новости, 28.10.2020
Ученые выяснили, почему сахар вызывает воспаление кишечника
Американские ученые в опытах на мышах доказали, что пища с высоким содержанием сахара вызывает нарушение микробиома кишечника. Это объясняет, почему так… РИА Новости, 28.10.2020
2020-10-28T21:00
2020-10-28T21:00
2020-10-28T21:00
наука
питание
диета
сша
здоровье
сахар
/html/head/meta[@name=’og:title’]/@content
/html/head/meta[@name=’og:description’]/@content
https://cdn23.img.ria.ru/images/07e4/08/17/1576204790_0:0:3076:1730_1920x0_80_0_0_4ce2986add468300eab7fa4953304783. jpg
jpg
МОСКВА, 28 окт — РИА Новости. Американские ученые в опытах на мышах доказали, что пища с высоким содержанием сахара вызывает нарушение микробиома кишечника. Это объясняет, почему так называемая западная диета повышает риск воспалительных заболеваний кишечника. Результаты опубликованы в журнале Science Translational Medicine.Воспалительными заболеваниями кишечника (ВЗК), такими как болезнь Крона и язвенный колит, страдают более 3,5 миллионов человек в мире. ВЗК проявляются в виде тяжелой диареи, болей в животе и других изнурительных симптомов. Особенно ВЗК распространены в западных странах, и исследования показывают, что частота их у детей неуклонно растет, начиная с 1980-х годов.Многие ученые предполагают, что главная причина распространения воспалительных заболеваний кишечника в развитых странах — западная диета, включающая в себя калорийную пищу с высоким содержанием сахара. Известно, что сладкие продукты глубокой переработки повышают риск развития ожирения и диабета, однако роль сахара в развитии ВЗК до сих пор оставалась спорной. Американские биологи под руководством Шаханшах Хана (Shahanshah Khan) из Юго-западного медицинского центра Техасского университета в Далласе провели лабораторные эксперименты на мышах и обнаружили, что грызуны, которым давали продукты с высоким содержанием сахара оказались более восприимчивы к индуцированному воспалению толстой кишки, чем мыши, получавшие обычную диету.Воспалительные процессы в кишечнике мышей начались уже через три дня, после того, как они начали получать пищу с высоким содержанием сахара.Авторы выяснили, что сахара изменили состав микробиома кишечника, в первую очередь за счет поддержки бактерий Akkermansia muciniphila, которые разлагают муницы — высокомолекулярные гликопротеины, главный компонент слизи, продуцируемой эпителиальными клетками кишечника.Ранее считалось, что эти бактерии обладают противовоспалительным действием, и их даже планировали использовать для борьбы с ожирением и диабетом 2 типа. Но результаты исследования показали, что увеличение количества Akkermansia muciniphila привело к разрушению защитного слоя слизи, выстилающего внутренние стенки кишечника, что позволило другим бактериям проникнуть в слизистую оболочку.
Американские биологи под руководством Шаханшах Хана (Shahanshah Khan) из Юго-западного медицинского центра Техасского университета в Далласе провели лабораторные эксперименты на мышах и обнаружили, что грызуны, которым давали продукты с высоким содержанием сахара оказались более восприимчивы к индуцированному воспалению толстой кишки, чем мыши, получавшие обычную диету.Воспалительные процессы в кишечнике мышей начались уже через три дня, после того, как они начали получать пищу с высоким содержанием сахара.Авторы выяснили, что сахара изменили состав микробиома кишечника, в первую очередь за счет поддержки бактерий Akkermansia muciniphila, которые разлагают муницы — высокомолекулярные гликопротеины, главный компонент слизи, продуцируемой эпителиальными клетками кишечника.Ранее считалось, что эти бактерии обладают противовоспалительным действием, и их даже планировали использовать для борьбы с ожирением и диабетом 2 типа. Но результаты исследования показали, что увеличение количества Akkermansia muciniphila привело к разрушению защитного слоя слизи, выстилающего внутренние стенки кишечника, что позволило другим бактериям проникнуть в слизистую оболочку. Это вызвало воспаление толстой кишки.В подтверждение своих выводов ученые ссылаются на тот факт, что в кишечнике пациентов с язвенным колитом, как правило, всегда обнаруживают активные ферменты, разлагающие слизь.
Это вызвало воспаление толстой кишки.В подтверждение своих выводов ученые ссылаются на тот факт, что в кишечнике пациентов с язвенным колитом, как правило, всегда обнаруживают активные ферменты, разлагающие слизь.
https://ria.ru/20201027/serdtse-1581767193.html
сша
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
2020
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
Новости
ru-RU
https://ria.ru/docs/about/copyright.html
https://xn--c1acbl2abdlkab1og.xn--p1ai/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
https://cdn23.img.ria.ru/images/07e4/08/17/1576204790_0:0:2729:2047_1920x0_80_0_0_f8027eff596a922ac3c54aae8e8aa328.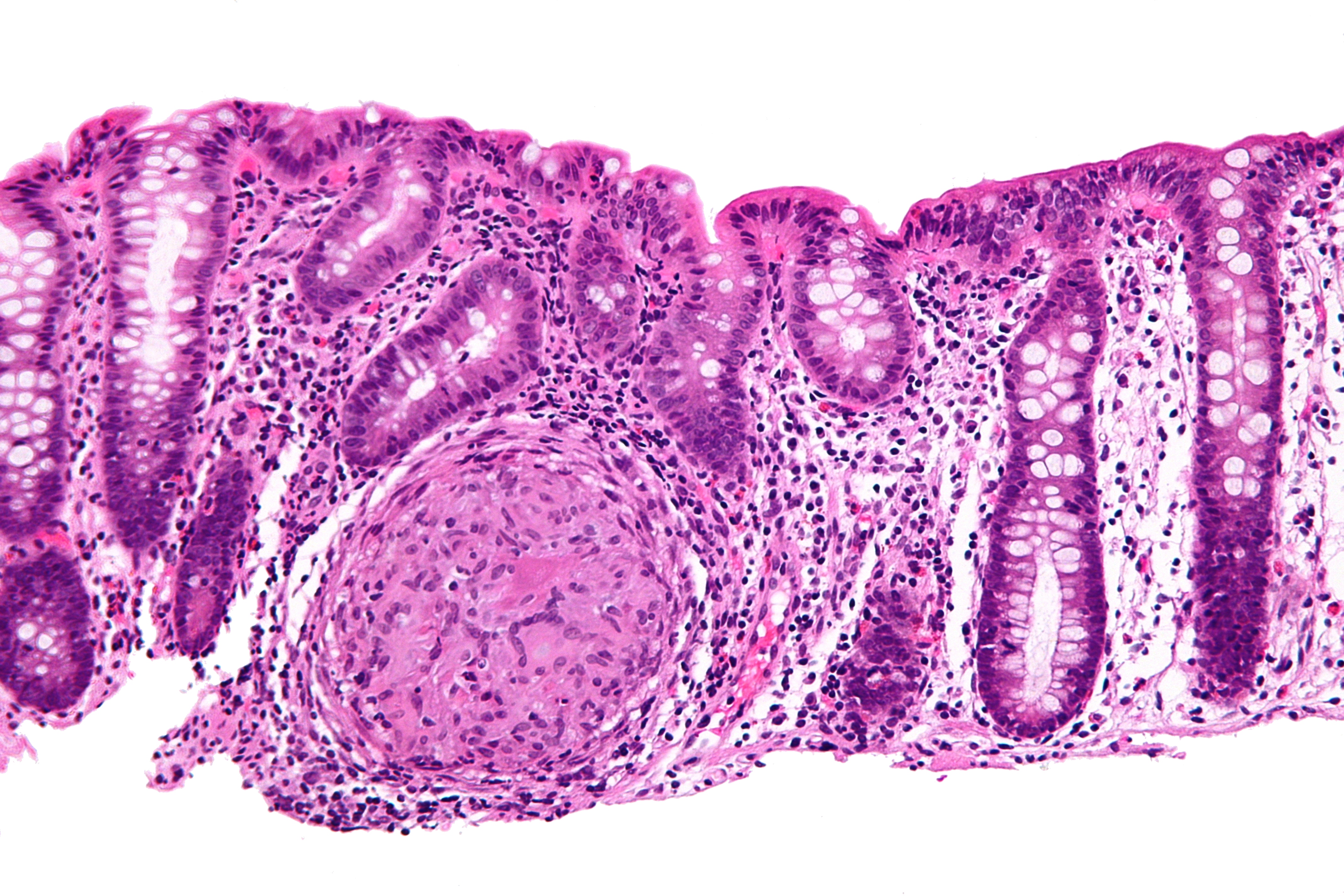 jpg
jpgРИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
питание, диета, сша, здоровье, сахар
МОСКВА, 28 окт — РИА Новости. Американские ученые в опытах на мышах доказали, что пища с высоким содержанием сахара вызывает нарушение микробиома кишечника. Это объясняет, почему так называемая западная диета повышает риск воспалительных заболеваний кишечника. Результаты опубликованы в журнале Science Translational Medicine.Воспалительными заболеваниями кишечника (ВЗК), такими как болезнь Крона и язвенный колит, страдают более 3,5 миллионов человек в мире. ВЗК проявляются в виде тяжелой диареи, болей в животе и других изнурительных симптомов. Особенно ВЗК распространены в западных странах, и исследования показывают, что частота их у детей неуклонно растет, начиная с 1980-х годов.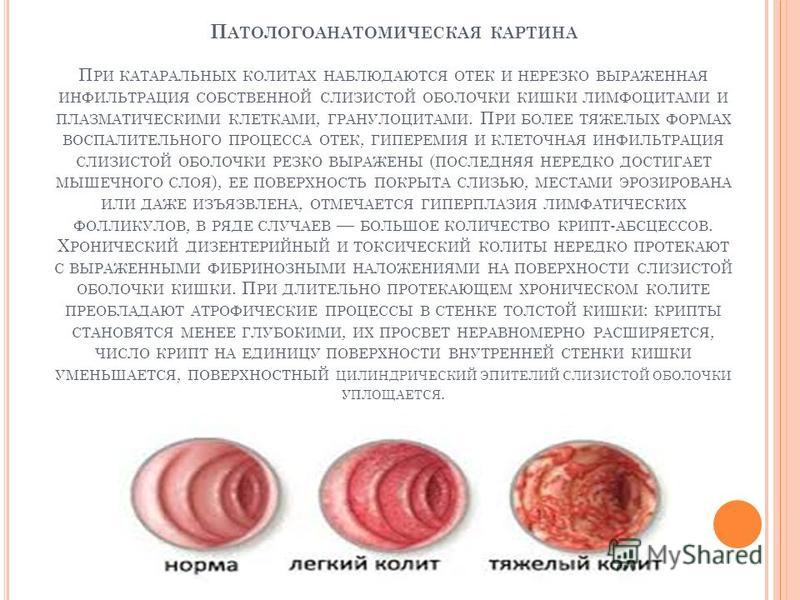
Многие ученые предполагают, что главная причина распространения воспалительных заболеваний кишечника в развитых странах — западная диета, включающая в себя калорийную пищу с высоким содержанием сахара. Известно, что сладкие продукты глубокой переработки повышают риск развития ожирения и диабета, однако роль сахара в развитии ВЗК до сих пор оставалась спорной.
Американские биологи под руководством Шаханшах Хана (Shahanshah Khan) из Юго-западного медицинского центра Техасского университета в Далласе провели лабораторные эксперименты на мышах и обнаружили, что грызуны, которым давали продукты с высоким содержанием сахара оказались более восприимчивы к индуцированному воспалению толстой кишки, чем мыши, получавшие обычную диету.Воспалительные процессы в кишечнике мышей начались уже через три дня, после того, как они начали получать пищу с высоким содержанием сахара.
Авторы выяснили, что сахара изменили состав микробиома кишечника, в первую очередь за счет поддержки бактерий Akkermansia muciniphila, которые разлагают муницы — высокомолекулярные гликопротеины, главный компонент слизи, продуцируемой эпителиальными клетками кишечника.
Ранее считалось, что эти бактерии обладают противовоспалительным действием, и их даже планировали использовать для борьбы с ожирением и диабетом 2 типа. Но результаты исследования показали, что увеличение количества Akkermansia muciniphila привело к разрушению защитного слоя слизи, выстилающего внутренние стенки кишечника, что позволило другим бактериям проникнуть в слизистую оболочку. Это вызвало воспаление толстой кишки.
В подтверждение своих выводов ученые ссылаются на тот факт, что в кишечнике пациентов с язвенным колитом, как правило, всегда обнаруживают активные ферменты, разлагающие слизь.
27 октября 2020, 15:06НаукаУченые доказали пользу кетогенной диеты для сердцаВоспалительные заболевания кишечника | ГАСТРОЦЕНТР
Воспалительные заболевания кишечника (ВЗК) – группа заболеваний, при которых регулярно возникает воспаление органов желудочно-кишечного тракта.
ВЗК постоянно прогрессируют, болезни характеризуются тяжелым течением, повторяющиеся обострения существенно снижают качество жизни пациента, а если болезнь не лечить, последствия могут быть самыми неприятными — риск развития рака толстого кишечника при ВЗК выше в 2-2,5 раза по сравнению со средними показателями, а риск рака тонкого кишечника — почти в 30 раз! Степень инвалидности при ВЗК выше, чем при диабете 1 типа или эпилепсии. Специалисты приравнивают влияние ВЗК на здоровье человека с последствиями астмы, перелома грудины или ампутации руки. Воспалительные заболевания кишечника лидируют среди болезней пищеварительной системы по уровню смертности среди пациентов.
Специалисты приравнивают влияние ВЗК на здоровье человека с последствиями астмы, перелома грудины или ампутации руки. Воспалительные заболевания кишечника лидируют среди болезней пищеварительной системы по уровню смертности среди пациентов.
Основные заболевания группы ВЗК
- Язвенный колит — воспаление слизистой оболочки толстой кишки (часто – прямой кишки), вызывающее появление кровоточащих язв на стенках кишечника
- Болезнь Крона — воспаление слизистой любого органа желудочно-кишечного тракта от полости рта до анального отверстия
Причинами этих заболеваний считаются наследственность и реакция иммунитета на инфекцию, потрясение и другие стрессовые ситуации. Часто на первом этапе болезнь протекает практически без симптомов, поэтому выявить момент начала заболевания очень сложно. Обе эти болезни на сегодняшний день считаются неизлечимыми и требуют пожизненного лечения.
ВЗК – хронические заболевания, начавшись, они продолжаются на протяжении всей жизни. Периоды отсутствия проявлений болезни (ремиссия) чередуются со вспышками обострения и усиления симптомов. Частоту обострений предсказать очень трудно, у каждого человека болезнь протекает по индивидуальному сценарию.
Периоды отсутствия проявлений болезни (ремиссия) чередуются со вспышками обострения и усиления симптомов. Частоту обострений предсказать очень трудно, у каждого человека болезнь протекает по индивидуальному сценарию.
Признаки ВЗК
Так же к группе ВЗК относят:
- Неклассифицированный тип ВЗК — имеет признаки и язвенного колита, и болезни Крона
- Инфекционный ВЗК — воспаление толстой кишки, вызванное инфекцией
- Лекарственный ВЗК — воспаление вызванное приемом лекарств
- Ишемический ВЗК — воспаление толстой кишки, вызванное нарушением кровоснабжения
Успех в лечении ВЗК (достижение стойкой ремиссии) зависит от своевременной постановки диагноза и определения точного места воспаления. Основной метод диагностики ВЗК — колоноскопия с биопсией поврежденных болезнью тканей. От того, что врач-эндоскопист увидит при осмотре кишечника, и от результатов гистологического исследования тканей зависит выбор метода лечения — лекарственно-терапевтического или хирургического.
Диагностика ВЗК в Гастроцентре
Павел Кельсиевич Санников — врач высшей категории, стаж работы в эндоскопии более 30 лет. Специализируется на проведении колоноскопических исследований (толстый кишечник). За годы работы им проведено более 25000 успешных диагностических исследований толстого кишечника. На сегодняшний день Павел Кельсиевич Санников владеет практически всеми современными эндоскопическими технологиями, в том числе современными хирургическими…
Подробнее…
Лечение ВЗК в Гастроцентре
Врач — гастроэнтеролог, кандидат медицинских наук, член Российской гастроэнтерологической ассоциации. Стаж работы — более 8 лет Образование и научная деятельность: Пермский государственный мединститут, Лечебный факультет. (2005-2011 г.) Интернатура по специальности «Терапия», ПГМА,. (2011-2012 г.) Ординатура по специальности «Гастроэнтерология», ПГМА, (2012-2014 г.) Кандидат медицинских наук (2017) Автор 50 публикаций, 1 монографии….
Подробнее…
Колит и энтероколит у собак
Лечение колита у собак (воспаление слизистой поверхности толстой кишки) связано с определением первичного заболевания, приведшего к патологии. Только устранение основной причины воспалительного процесса может быть гарантией его прекращения. Следует также учитывать возможность расширения зоны воспаления на тонкий отдел (энтероколит).
Колит у собаки: симптомы и причины
Воспаление в толстой кишке часто начинается с бактериальной или паразитарной инфекции.
К другим причинам возникновения колита следует отнести:
- различные травмы;
- аллергию;
- нарушенное кормление;
- слабую именную защиту.
Примечание. Возбудимые и слишком агрессивные животные более склонны к заболеваниям кишечника, чем тихие и спокойные. Они требуют в плане своевременной диагностики особого внимания.
К основным симптомам заболевания относятся:
- частый понос;
- спазмы в кишечнике;
- приступы тошноты;
- общее болезненное состояние.
Больные животные часто и безуспешно пытаются опорожниться. В кале – высокая концентрация слизи, иногда с кровью.
Энтероколит – всего лишь проявление другого, основного заболевания, поэтому его разделяют по ряду причин возникновения.
Узнайте, от какого вида патологии необходимо лечить вашу собаку:
- лимфоцитарно-плазматического;
- эозинофильного;
- гранулематозного;
- нейтрофильного;
- или язвенного колита?
Последний тип считается наиболее сложным для определения и проведения лечения. Домашние питомцы могут заболеть по причине проникновения в кишечный тракт инфекционных агентов и паразитов, нанесения травм, попадания инородных тел, перекорма, раздражения, отравления, онкологического фактора.
Лечение колита у собаки
Для определения патологии применяется пальпация, берутся пробы кала, исследуется кровь и моча собаки, назначается прохождение рентгена и УЗИ. Иногда необходимо также проведение колоноскопии – введение зонда с камерой в кишечник для исследования участков воспаления и проведения биопсии – взятия образца из пораженной ткани.
В стандартный набор общепринятой терапии входит голодание на протяжении одного дня или нескольких суток. После этого животному дают небольшие порции пищи с высокой концентрацией волокон (при диагностировании синдрома раздраженного кишечника – это обязательный пункт лечения).
Примечание. Растительная клетчатка увеличивает плотность пищевой массы в кишечнике, хорошо связывает воду, увеличивает сокращение мышц кишечного отдела. На протяжении двух недель животное необходимо подкармливать птичьим вареным мясом и рыбой (вместе с вяжущими средствами и назначенными ветеринаром препаратами).
Энтероколит у собак в некоторых случаях лечат при помощи антибиотиков, особенно если патология была спровоцирована болезнетворными бактериями. Возможно также назначение противовоспалительных и иммуносупрессивных лекарственных средств (например, нестероидные препараты и кортикостероиды).
При значительно повреждении кишки сильно проводится хирургическое удаление пораженного участка (анастомоз).
Профилактические меры
Для предотвращения воспалительных процессов в толстом отделе кишечника домашним питомцам необходимо качественное, сбалансированное питание и грамотный уход. Не отнимайте преждевременно щенков от матери. Дайте им возможность сформировать защитные функции организма. Большинство заболеваний не развивается у собак лишь благодаря иммунитету. Следите за тем, чтобы домашние питомцы не пили грязную воду, не глотали на улице предметы и не поедали фекалий уличных животных. Держите средства бытовой химии в недоступном месте.
Смотрите также:
Лечение язвенного колита в Москве
Стоимость
Прием (осмотр, консультация) врача-колопроктолога (первичный)
RRS – Ректороманоскопия (ректосокпия)- с биопсией слизистой прямой кишки
Аноскопия (осмотр прямой кишки на 10 см.)
Биопсия 1-й категории сложности, без дополнительных методов исследования
Лабораторная диагностика
Анализ кала на скрытую кровь
до 9:00 следующего дня
Общий анализ кала (копрограмма)
Кальпротектин в кале
до 6 суток
Содержание углеводов в кале
Colitis ulcerosa, или язвенный колит кишечника, представляет собой диффузное неспецифическое воспаление слизистой оболочки прямой или ободочной кишки. В запущенных случаях данное заболевание приводит к образованию язвы.
Самые распространенные симптомы язвенного колита:
- Диарея (до 20 опорожнений за сутки)
- Следы крови в кале (даже при отсутствии диареи)
- Общая слабость
- Потеря веса
- Обезвоживание
- Тахикардия
- Лихорадка
- Болезненные ощущения в области живота
Если воспаление коснулось только слизистой оболочки прямой кишки, частота стула может оставаться нормальной (при этом не исключен запор), но будет сопровождаться кровотечениями.
Клинические формы язвенного колитаНеспецифический язвенный колит может сопровождаться изменениями только в прямой кишке, либо заболевание может затрагивать часть (либо всю) ободочную кишку, в редких случаях охватывая и дистальный отдел подвздошной кишки. Заболевание обычно протекает в хронической форме, с короткими ремиссиями и обострениями. Обострения могут вызываться стрессом, изменениями в режиме питания или смене привычной пищи, приеме обезболивающих средств, развитием инфекционных заболеваний толстой кишки и других органов, а также приемом антибиотиков.
Лечение назначается в зависимости от разновидности наблюдаемой клинической формы, определить которую позволяет своевременная диагностика с использованием современных методик и технологий. Различают проктит, дистальную и распространенную формы протекания болезни. Для определения типа и стадии заболевания существуют различные диагностические исследования.
- УЗИ брюшной полости
Данное исследование позволяет выявить косвенные признаки заболевания, такие как утолщения стенок кишки или ее расширение
Исследование можно провести безболезненно, при погружении в медикаментозный сон. Даная методика является основным способом исследования, благодаря которой можно максимально точно изучить протяженность и стадию поражения слизистой оболочки, обнаружить сужения и полипы, а также получить материал для проведения морфологической оценки
- Гистологический анализ ткани
Проводится при колоноскопии, позволяет обнаружить микроскопические признаки, характерные для язвенного колита. Результаты исследования дают возможность исключить наличие раковых изменений в структуре тканей
- Коагулограмма (анализ крови), анализ кала и другие исследования
Данные анализы позволяют обнаружить воспалительные процессы в ЖКТ и организме
- Бактериологический посев
Исследование проводится, чтобы исключить дизентерию, псевдотуберкулез и другие инфекционные заболевания, вирусные и паразитарные поражения
По итогам проведенных исследований лечащий врач принимает решение о назначении курса терапии. Чаще всего современное лечение язвенного колита проводится амбулаторно.
Опасность язвенного колита в том, что часто больные на ранней стадии заболевания игнорируют необходимость обращения к врачу, применяют ничем не обоснованные методы лечения. Не имея необходимой подготовки и опыта, отдельные симптомы ЯК могут быть расценены как признаки геморроя. Это приводит к ошибкам в терапии, а заболевание переходит в более острую форму, что может привести к необходимости экстренной госпитализации.
Лечение язвенного колитаЧаще всего лечение язвенного колита у взрослых, при условии своевременного диагностирования, проводится амбулаторно, поскольку необходимости в госпитализации нет. Для эффективной терапии назначается ряд препаратов, а также даются рекомендации по изменениям в образе жизни. Кроме назначенной медикаментозной терапии, больной всегда получает рекомендации и по нефармакологическим действиям.
Среди рекомендаций, которые вы получите, будут такие:
- Исключение стрессовых ситуаций
- Минимизация риска инфекционных заболеваний ЖКТ
Кроме этого гастроэнтерологом будет разработана индивидуальная диета, которая необходима для эффективной терапии и предупреждения рецидивов заболевания.
Столичная медицинская клиника находится в Москве по улице Сретенка, дом 9. Записаться на прием к специалисту в удобное вам время и получить ответы на появившиеся вопросы можно, позвонив +7 (495) 642-88-62.
Поделиться в соц. сетях:
ВРАЧИ ОТДЕЛЕНИЯ Язвенный колит
ЧерноваАнастасия Геннадьевна
Врач – терапевт – гастроэнтеролог
Колит — симптомы, лечение, диагностика и виды колита кишечника — Клиника «Доктор рядом»
Если у вас совпадает больше 80% перечисленных симптомов, то настоятельно рекомендуем вам обратиться к врачу за консультацией.
Колит кишечника — патологическое состояние слизистой толстой кишки, характеризующееся её воспалительными процессами вследствие инфекционного, медикаментозного или других видов воздействия. Название заболевания говорит само за себя, будучи образованным от двух греческих слов: «kolon» («толстая кишка») и «itis» («воспаление»). Чаще всего от колита страдают мужчины в возрасте от 40-ка до 60-ти лет и женщины в возрасте от 20-ти до 60-ти лет.
Общие сведения и классификация колита
Вы тоже задаётесь вопросом о том, как лечить колит кишечника? Тогда наш материал — для Вас. Заболевание поражает слизистую оболочку толстой кишки, провоцируя её воспалительные процессы. Специалисты считают, что клинические проявления заболевания имеются у половины больных, страдающих от заболеваний органов пищеварительного тракта. Они как никто другой предрасположены к снижению сопротивляемости организма к воздействию различных факторов, что является одной из причин колита. Последний сопровождается болевой симптоматикой, расстройствами пищеварения и метеоризмом.
Нередко колит сочетается с такими болезнями, как энтерит и гастрит, т. е. воспалительными процессами тонкой кишки и желудка, но может проявиться и без них. От него страдают не только взрослые, но и дети, у которых наблюдается дефицит защитного барьера слизистой толстого кишечника. Из-за схожести симптомов колита кишечника его нередко принимают за синдром раздражённого кишечника, однако в последнем случае отсутствует связь с толстой кишкой.
Классификация заболевания осуществляется с учётом различных параметров. Ознакомиться с ними, видами колита и их различиями можно в нашей таблице ниже:
| Вид | Чем характеризуется? |
| По течению | |
| Острый колит | Характеризуется ярко проявленными симптомами в виде специфических болевых ощущений в области живота, вздутия, наличия кровяной примеси в кале, тошноты и позывов к опорожнению кишечника. Нередко переходит во хронический колит, язву кишечника, может открыться кровотечение. Сопровождается воспалительными процессами тонкой кишки и желудка. |
| Хронический колит кишечника | Характеризуется аномальными изменениями в структуре слизистой из-за длительного воспаления: происходит дистрофия поражённых тканей, провоцирующие нарушения функций толстой кишки. Симптоматика острого колита на этой стадии угасает, но периодически проявляется обострениями. В 30% случаев развивается вследствие таких кишечных инфекций, как дизентерия или сальмонеллёз. Нередко появляется на фоне дисбактериоза после длительного приёма антибиотиков. |
| По распространённости патологического процесса | |
| Диффузный колит |
Охватывает два и более отделов органа и сопровождается яркой симптоматикой:
|
| Сегментарный |
Охватывает только один отдел кишечника:
|
| По изменениям, происходящим в слизистой | |
| Язвенный колит кишечника | Проявляется отёками слизистой и появлением на ней язв. |
| Геморрагический | Появляются очаги кровоизлияний. |
| Атрофический | Становится причиной атрофических процессов всего органа или его части. |
| Спастический колит кишечника | Отличается спазмами и снижением перистальтики кишечника. |
| Эрозивный | На слизистой появляются эрозии, но в целом изменения несущественны. |
Этиология колита
Перед тем, как приступить к лечению колита кишечника у взрослых и детей, нужно правильно установить причину заболевания. Она может быть разной: начиная с неправильного режима питания или потребления некачественных продуктов — и заканчивая кишечными инфекциями или осложнений болезней ЖКТ. Негативную роль может сыграть и приём антибиотиков в течение длительного времени. Исходя из этиологии, выделяют разные виды колита.
| Вид колита | Инициирующий фактор развития |
| Инфекционный | Проникновение патогенной микрофлоры в кишечник: бактерии рода Shigella, стрепотококки, кишечная палочка, прочие. |
| Механический | Раздражение стенок кишечника за счёт воздействий механического характера. |
| Аллергический | Индивидуальная непереносимость тех или иных продуктов питания. |
| Медикаментозный | Развивается после неконтролируемого приёма медикаментов, в частности — антибиотиков или НПВС. |
| Ишемический | Причина — закупорка ветвей брюшной аорты, обеспечивающих кровью толстый кишечник. |
| Атонический | Появляется на фоне процессов старения организма исключительно у людей пожилого возраста. |
| Язвенный | Этиология не выяснена. |
Симптомы колита кишечника
| Острый колит: | Хронический колит: |
|
|
Диагностика колита
Диагностика колита предусматривает сбор анамнеза, физикальные, инструментальные и лабораторные исследования. Анализы при колите предусматривают следующее:
- Общий анализ крови и урины для выявления признаков воспаления;
- Биохимический анализ крови;
- Проверка кала на дисбактериоз, бело-кальпротектин и наличие яиц гельминтов.
Что касается физикального обследования, то оно предусматривает:
- пальпацию области живота;
- пальцевое исследование;
- аноскопию.
Использование инструментальных методик направлено на визуальное исследование состояния слизистой оболочки кишечника и дифференцирование обычного колита от язвенного. В процессе проводят:
- Ирригоскопию — рентгенография с применением контрастирования бариевой взвесью для изучения состояния слизистой толстой кишки;
- Колоноскопию — осуществляется забор материала из кишечника для проведения гистологического обследования и исключения наличия новообразований злокачественной природы;
- Фиброилеоколоноскопию — изучают состояние кишечника изнутри при помощи специального оборудования с целью точно определить локализацию воспалительных процессов и стадию их развития;
- УЗИ органов брюшной полости — позволяет определить наличие патологических процессов и изменения, к которым они привели;
- Ангиографию — проводится при подозрениях на то, что колит возник из-за нарушений кровообращения в области кишечника для визуализации сосудов, питающих его.
Если своевременно не провести диагностику и не приступить к адекватному лечению колита, он может стать причиной развития перитонита, характеризующегося прободением стенки толстого кишечника или кровотечением. Последнее приведёт к формированию спаек и сужения кишечника и, как следствие — его непроходимости.
Лечение колита
Подбор тактики лечения осуществляется индивидуально, с учётом причины заболевания, а также запущенности процесса, вовлечённости в него других органов ЖКТ.
| Методика лечения колита | В чём заключается? Какие цели преследует? |
| Медикаментозная |
Направлена на купирование воспалительных процессов и их проявлений. Предусматривает приём следующих фармакологических препаратов:
|
| Лечебная диета | Индивидуально разработанная диета — неотъемлемая составляющая лечения колита. Она позволяет минимизировать нагрузку на органы желудочно-кишечного тракта, стимулирует процессы заживления слизистой и нормализует перистальтику. В первый день рекомендуется голодание с частым потреблением чистой воды, после этого приём пищи происходит по шесть раз в день небольшими порциями. Из рациона исключают жаренную пищу, острые, кислые, сладкие и газообразующие продукты. Конкретный список согласовывается с врачом. |
| Местная терапия | Практикуется при проктосигмоидите в виде микроклизм с отварами календулы или ромашки. |
| Хирургическая | Применяется крайне редко при наличии особых показаний: переход обычного колита в язвенный или при быстром прогрессировании ишемического колита. Если имеются проявления тромбоза или эмболия веток брюшной аорты, удаляют участок кишки или проводят эндоскопическую тромбоэмболэктомию. |
Профилактика колита
Профилактические мероприятия достаточно просты, но их проведение сведёт к минимуму риск заболеть таким неприятным недугом, как колит. Они предусматривают:
- правильное сбалансированное питание;
- своевременное определение и лечение болезней органов ЖКТ;
- соблюдение гигиены;
- регулярное посещение гастроэнтеролога (при имеющихся заболеваниях ЖКТ).
Курс лечения колита кишечника в Москве приглашает пройти сеть клиник «Доктор рядом». Мы располагаем современным диагностическим оборудованием, позволяющим точно поставить диагноз, установив причину развития патологического состояния. У нас работают специалисты высокой квалификации с многолетним опытом практической работы, которые индивидуально разработают тактику устранения проблемы и добьются наилучших результатов. Звоните и записывайтесь к нам на приём не откладывая: +7 (495) 154-92-31!
Заживление слизистой оболочки при воспалительном заболевании кишечника
17 ноября 2017 г.
Воспалительное заболевание кишечника (ВЗК) – хроническое воспалительное заболевание, которое может вызывать прогрессирующие функциональные и структурные повреждения желудочно-кишечного тракта. Лечебные методы лечения ВЗК традиционно сосредоточены на контроле симптомов. Хотя использование пероральных аминосалицилатов и кортикостероидов может быть эффективным для подавления воспалительного процесса и индукции симптоматической ремиссии, не было показано, что этот подход изменяет естественную историю ВЗК, снижает частоту долгосрочных осложнений или улучшает долгосрочные исходы для пациентов.Этот факт в сочетании с доступностью других терапевтических подходов, которые могут вызвать заживление слизистой оболочки, заставил врачей и исследователей усомниться в том, является ли контроль симптомов наиболее подходящей терапевтической целью при лечении ВЗК.
Смена парадигмы
По словам Эдварда В. Лофтуса-младшего, доктора медицины, гастроэнтеролога, специализирующегося на ВЗК в кампусе клиники Мэйо в Рочестере, штат Миннесота, многие эксперты теперь выступают за смену парадигмы, которая делает упор на заживление слизистой оболочки, а не на клиническую ремиссию. в качестве основной цели лечения.«Лечение, направленное на заживление слизистых оболочек, которое может благоприятно изменить естественное течение ВЗК при использовании подхода« лечение к цели », получает признание», – говорит д-р Лофтус.
Инструменты оценки серьезности заболевания
Доктор Лофтус отмечает, что важно понимать, что точная оценка активности и тяжести заболевания при ВЗК по-прежнему является сложной задачей. Два широко используемых инструмента, основанный на симптомах индекс активности болезни Крона (CDAI) и эндоскопический индекс тяжести болезни Крона (CDEIS), часто рисуют очень разные картины активности болезни.
«У пациентов с болезнью Крона, проходящих лечение преднизолоном, данные исследований показывают полное отсутствие корреляции между CDAI и CDEIS», – поясняет д-р Лофтус. «Это говорит о том, что сосредоточение внимания только на тяжести симптомов может быть неподходящим критерием терапевтической эффективности, потому что симптомы болезни Крона нечувствительны и неспецифичны для воспаления кишечника».
Наличие как воспаления, так и структурного повреждения кишечника у бессимптомных пациентов также подчеркивает полезность получения эндоскопических данных о заживлении слизистой оболочки или других объективных маркеров воспаления для принятия терапевтических решений и оценки их эффективности в исследованиях лечения ВЗК.
«Сосредоточение внимания на заживлении слизистой оболочки снижает потребность в стероидах, риск госпитализации и хирургического вмешательства, – говорит доктор Лофтус, – поэтому алгоритмы лечения, учитывающие результаты эндоскопии при принятии решений, могут лучше справиться с достижением долгосрочной ремиссии и сокращением осложнения “.
Первоначальные результаты исследований
Идея использования заживления слизистой оболочки в качестве конечной точки для оценки активности заболевания и ремиссии у пациентов с ВЗК впервые привлекла внимание, когда исследователи показали, что лечение азатиоприном и инфликсимабом вызывает как симптоматическое улучшение, так и эндоскопическую ремиссию у пациентов с болезнью Крона ( CD).С тех пор многочисленные исследования показали, что признаки заживления слизистой оболочки после первоначального лечения связаны со снижением риска колэктомии и риска колоректального рака у пациентов с язвенным колитом (ЯК), а также с уменьшением потребности в стероидах и хирургическом вмешательстве у пациентов с CD.
Исследователи, изучающие различные схемы лечения до достижения цели, показали, что скорость заживления слизистых оболочек достигает 70-80 процентов у пациентов с БК и 80-90 процентов у пациентов с ЯК. Испытание REACT представляло собой кластерное рандомизированное испытание, в котором методы рандомизировались либо по алгоритмическому подходу к БК, где лечение увеличивалось каждые четыре недели в зависимости от симптомов, либо к традиционному подходу.Результаты, опубликованные в The Lancet в 2015 году, REACT показали, что алгоритмический подход со временем снижает количество осложнений по сравнению с традиционным лечением.
Исследование CALM, представленное в аннотации на Неделе болезней пищеварения 2017, показало, что алгоритмический подход, основанный на снижении уровня С-реактивного белка в сыворотке и кальпротектина в фекалиях, привел к гораздо более высокому уровню заживления слизистой оболочки, чем традиционный подход. «Мы увидим больше данных последующего наблюдения за этими пациентами с точки зрения госпитализаций, потребности в хирургических операциях и хирургических осложнений», – отмечает д-р.Лофтус.
Ключевые элементы программы «лечение до цели»
- Отсутствие изъязвлений слизистой оболочки является основной терапевтической целью.
- Желаемый целевой уровень должен быть установлен после базовой оценки активности заболевания и поддерживаться неопределенно долго, и он может корректироваться по мере необходимости для устранения сопутствующих заболеваний и рисков, связанных с лекарствами.
- Симптомы и объективные измерения воспаления (эндоскопические или рентгенологические) должны определять лечение.
- Клиницисты могут увеличивать дозу и комбинировать терапию для повышения эффективности.
- Клиницисты должны оценивать заживление слизистой оболочки каждые шесть месяцев, пока цель не будет достигнута, а затем каждые один-два года, корректируя график в соответствии со степенью обнаруженного воспаления.
Дополнительные вопросы и проблемы
Доктор Лофтус отмечает, что еще предстоит ответить на несколько вопросов, чтобы оптимизировать этот алгоритм лечения для пациентов с ВЗК.
«На данный момент нам все еще нужно определить, сколько исцеления действительно требуется для достижения положительных результатов», – объясняет он. «Мы также должны работать, чтобы прояснить степень постепенного исцеления, которого можно достичь путем увеличения дозы или смены терапии. И требуется дополнительная работа, чтобы помочь нам точно определить подходящий временной интервал между изменениями в терапии и последующей переоценкой».
Для получения дополнительной информации
Khanna, R. Ранняя комбинированная иммуносупрессия для лечения болезни Крона (REACT): кластерное рандомизированное контролируемое исследование.Ланцет. 2015; 386: 1825.
границ | Визуализация воспаления слизистой оболочки: текущие технологические разработки, клиническое значение и перспективы на будущее
Введение
Воспалительные заболевания кишечника (ВЗК), в том числе болезнь Крона (БК) и язвенный колит (ЯК), поражают примерно 3,1 миллиона человек в Соединенных Штатах и около 2,5 миллиона человек в Европе. Они приводят к хроническому инвалидизирующему воспалению слизистой оболочки желудочно-кишечного тракта (1–3).Пострадавшие пациенты страдают от болей в животе, диареи, гематохезии, потери веса, тошноты и т. Д. И подвергаются повышенному риску таких осложнений, как образование абсцесса, перфорация или развитие колоректального рака (CRC).
В последние годы для клинической диагностики и ведения пациентов с ВЗК эндоскопические и неинвазивные методы визуализации приобрели все большее значение для оценки воспаления слизистой оболочки. Хотя первоначальный диагноз ВЗК основывается на нескольких параметрах, включая клинические, лабораторные, эндоскопические, радиологические и гистологические особенности, особенно эндоскопические результаты часто предоставляют важную информацию для окончательного диагноза ВЗК и дифференциации между БК и ЯК.Кроме того, эндоскопическая оценка воспаления слизистой оболочки по сравнению с заживлением слизистой оболочки считается золотым стандартом для оценки активности заболевания и, следовательно, терапевтического лечения ВЗК (3).
Помимо жалоб, связанных с воспалением, повышенный риск развития CRC представляет собой серьезное лечение для пациентов с IBD. Риск CRC был связан с продолжительностью, серьезностью и распространенностью воспаления толстой кишки. Независимые факторы риска включают наличие первичного склерозирующего холангита (ПСХ) или семейный анамнез КРР.Сообщается, что для ЯК совокупный риск составляет 1,6% через 10 лет, 8,3% через 20 лет и до 18,4% через 30 лет (4). Хотя в недавних исследованиях сообщается о более низких показателях риска, например, Jess et al. описали увеличение риска КРР в 2,4 раза после 14 лет у пациентов с ЯК (5), до сих пор широко признано, что длительный колит представляет собой фактор риска развития КРР. Фактически, большинство национальных и международных руководств по ведению ЯК рекомендуют повторную эндоскопию для наблюдения за КРР.Сообщается о повышенном риске у пациентов с БК у пациентов с колитом Крона (6). Хотя данные более ограничены по сравнению с ЯК, эндоскопия также рекомендуется пациентам с БК с длительным воспалением толстой кишки.
Последние технологические разработки существенно повысили точность диагностики и открыли новые возможности для применения эндоскопии при различных типах заболеваний и органов. Эти технологии включают эндоскопы с широким полем зрения с оптическим разрешением высокой четкости, красочную или виртуальную хромоэндоскопию или автофлуоресцентную эндоскопию, а также эндомикроскопические методы, такие как эндоцитоскопия или конфокальная лазерная эндомикроскопия (CLE), которые предоставляют in vivo микроскопическую информацию о поверхность слизистой оболочки при эндоскопии.Помимо методов эндоскопической визуализации, также неинвазивная визуализация, такая как компьютерная томография (КТ), магнитно-резонансная томография (МРТ), сцинтиграфия и ультразвук (УЗИ), предоставляют ценную информацию об активности заболевания, которая дополняет методы эндоскопической визуализации. В этой статье мы обсудим текущие данные, подтверждающие использование этих технологий для оценки воспаления слизистой оболочки, и дадим представление о будущих разработках, которые могут улучшить диагностику и лечение ВЗК.
Современные эндоскопические методы диагностики и наблюдения за воспалением слизистой оболочки
Видеоэндоскопия высокой четкости технически развита, широко признана и доступна и поэтому считается золотым стандартом для обнаружения и характеристики воспаления слизистой оболочки во время первоначальной диагностики и для оценки активности заболевания у пациентов с установленной БК или ЯК. В то время как обычной эндоскопии в белом свете было достаточно для начальных и краткосрочных последующих процедур, более продвинутые методы, такие как красочная и виртуальная хромоэндоскопия или эндоскопия с увеличением, полезны для оценки заживления слизистой оболочки и в долгосрочной перспективе. вверх во время наблюдения за ВЗК.
Диагностика и оценка активности заболевания
В качестве первого диагностического шага у пациентов с подозрением на ВЗК илеоколоноскопия играет решающую роль в дифференциации ЯК и БК. В качестве дополнительных обследований эндоскопия верхних отделов ЖКТ, магнитно-резонансная томография, эндоскопия капсулы тонкой кишки (7) или энтероскопия (8) могут дать дополнительную информацию о степени заболевания. Пациентам с подозрением, известным или рецидивом БК рекомендуется капсульная эндоскопия при отрицательных результатах илеоколоноскопии или гастроскопии (9).Однако роль капсульной эндоскопии толстой кишки как метода наблюдения далека от повседневной клинической практики и, следовательно, в ближайшем будущем не заменит регулярную колоноскопию у пациентов с хронической ВЗК. За исключением перианальной БК, эндосонография верхних или нижних отделов желудочно-кишечного тракта не может влиять на степень заболевания ни для первоначального диагноза, ни для дальнейшей оценки у пациентов с установленным диагнозом ВЗК. Индекс-колоноскопия должна включать сегментарный осмотр и биопсию любого видимого поражения или воспаления в сочетании с получением биопсии невоспаленных участков слизистой оболочки (10, 11).Морфологический аспект и размер воспаленной слизистой оболочки имеют решающее значение для определения основного заболевания и для распознавания других воспалительных причин.
Для оптимального терапевтического лечения ВЗК обязательна регулярная оценка активности заболевания. Было показано, что эндоскопическая оценка заживления слизистой оболочки обеспечивает хорошую корреляцию с клиническим течением заболевания и поэтому в настоящее время считается золотым стандартом для оценки активности заболевания (рис. 1).В этом отношении показатели активности эндоскопического заболевания полезны для прогнозирования прогрессирования заболевания или для оценки успеха лечения с помощью последующих процедур после начала иммуносупрессивной терапии. Эндоскопический индекс тяжести ЯК (12), упрощенная оценка эндоскопии для CD (13) и Rutgeerts-Score (14) для послеоперационной ситуации являются наиболее часто используемыми баллами для документирования активности заболевания у пациентов с ВЗК. Снижение более чем на 50% показателя простой эндоскопической оценки при болезни Крона (SES-CD) или балла Рутгиртса i0-i1 является определением эндоскопического ответа (15).Однако ни одна из этих оценок до сих пор не была общепринятой в качестве стандарта для эндоскопической оценки активности заболевания.
Рисунок 1 . Видеоэндоскопия высокого разрешения, используемая для начальной диагностики воспалительного заболевания кишечника (ВЗК) (a – f) и в сочетании с хромоэндоскопией (разбавленный раствор индигокармина 0,1%) во время контрольной колоноскопии (г – л). (a) Острая болезнь Крона (БК) в подвздошной кишке, (b) Стеноз Крона в двенадцатиперстной кишке, (c) сегментарные фиссуральные язвы в левой ободочной кишке SES-CD 32, (d) легкая активность UC UCEIS 3, (e) умеренно активный UC UCEIS 5, (f) тяжелый UC UCEIS 8, (g) нормальная хромоэндоскопия с равномерно распределенным контрастным красителем, (h) идентификация небольшого плоского поражения ( гиперпластический полип) с хромоэндоскопией, (i, j) хромоэндоскопическая оценка псевдополипов во время наблюдательной колоноскопии, (k, l) идентификация негомогенной плоской полиповидной области и (l) с неоднородностями слизистой оболочки вблизи фокуса. видимый признак интраэпителиальной неоплазии высокой степени.SES-CD, упрощенная эндоскопическая оценка болезни Крона; UCEIS, эндоскопический индекс степени тяжести язвенного колита.
Помимо эндоскопии в белом свете, определение активности заболевания оценивалось в проспективном исследовании с использованием виртуальной хромоэндоскопии с узкополосной визуализацией (NBI) по сравнению с эндоскопией в белом свете, а с помощью NBI был замечен особый сосудистый рисунок слизистой оболочки. Сосудистый паттерн показал хорошую корреляцию с гистологией, что указывает на более точную градацию во время текущей эндоскопии с NBI (16).Другое исследование показало аналогичные результаты при сравнении эндоскопии в белом свете высокой четкости с виртуальной хомоэндоскопией i-scan у пациентов с ВЗК (17). В недавнем исследовании оптическое улучшение с помощью i-scan было объединено с эндоскопией с увеличением, и была обнаружена хорошая корреляция с гистологическими оценками острого и хронического воспаления, что указывает на то, что этот метод может адекватно оценить заживление слизистой оболочки (18).
Однако необходимы дополнительные данные, чтобы четко оценить полезность этих методов для рутинной клинической эндоскопии для диагностики ВЗК и мониторинга активности заболевания.
Контроль CRC
Хотя риск КРР при ВЗК в настоящее время считается ниже, чем предполагалось ранее (19), общий риск КРР у пациентов с ВЗК остается выше по сравнению с общей популяцией (20). Поэтому были приложены большие усилия для выявления ранних изменений слизистых оболочек между периодами активного заболевания. Передовые методы эндоскопии, особенно эндоскопия на основе красителей, рекомендуются для выявления интраэпителиальной неоплазии (ВЭН), которая имеет высокий риск прогрессирования до ассоциированного с ВЗК CRC.Это актуально не только для ИЭН высокой степени, но и для ИЭН низкой степени, которая, как было обнаружено, нечасто перерастает в более позднюю неоплазию (21), но имеет значительный риск прогрессирования в распространенный рак (22).
Для скрининга рака толстой кишки среди населения в целом виртуальная хромоэндоскопия (NBI, i-scan, FICE) не рекомендуется в качестве стандартной методики, поскольку сравнительные исследования с видеоэндоскопией высокого разрешения показали противоречивые результаты (23–25). Никаких различий не было замечено при сравнении обычной эндоскопии в белом свете и эндоскопии высокого разрешения для выявления полипов в общей популяции (26).Однако классическая панхромоэндоскопия на основе красителей, которая в основном используется с разбавленным раствором индигокармина (0,1–0,5%), превосходит эндоскопию в белом свете и значительно увеличивает частоту выявления аденом в популяции среднего риска (27). К сожалению, хромоэндоскопия на основе красителей не используется для скрининговой колоноскопии в большинстве западных стран, потому что этот метод требует много времени, не возмещается и поэтому не используется в общей практике. Предыдущие исследования также показали кривую обучения с использованием методов виртуальной хромоэндоскопии для обнаружения колоректальной неоплазии (23), а дальнейшие технические усовершенствования, такие как получение изображений с помощью синего лазера (28) или связанных цветов (29), принесут новые данные относительно скрининга CRC с помощью виртуальных хомоэндоскопия в общей популяции.
Хотя у значительного числа (17–28%) пациентов с ВЗК развивается КРР до начала программы структурированного эпиднадзора (30), последующие колоноскопии рекомендуются после 8–10 лет обширного колита или 15–20 лет оставшейся болезни. -сторонний колит (10). Стратификация риска должна быть сделана для пациентов с тяжелым воспалением, ПСХ, ассоциированным с колитом, или для пациентов с КРР в анамнезе (10). При наблюдении за ВЗК хромоэндоскопия с использованием красителей с получением целевых биопсий рекомендуется в соответствии с несколькими руководящими принципами (10, 11, 31) и в значительной степени заменила классические протоколы случайной биопсии в большинстве стран.Экономическая эффективность и действенность этой стратегии эпиднадзора были продемонстрированы в нескольких исследованиях (32–34). Комбинация хромоэндоскопии с эндоскопией с увеличением была изучена в очень небольшом количестве исследований и показала лучший прогноз степени заболевания при ЯК (35). В большинстве западных стран эндоскопия с увеличением не используется для рутинной эндоскопии наблюдения, которая более широко используется в восточной части мира. В целом, существует очевидная тенденция к более сложным улучшениям, которые могут способствовать лучшей идентификации и дифференциации колоректальных поражений.Например, были опубликованы первые данные по эндоскопии полного спектра, технологии, обеспечивающей поле зрения 330 °, и влиянию на колоноскопию наблюдения у пациентов с ВЗК. Авторы сообщили о высокой частоте обнаружения предшественников рака и обнаружили высокую частоту промахов при использовании эндоскопов прямого обзора (36). Тем не менее, необходимы дополнительные исследования, чтобы полностью оценить потенциал этих технологий для эпиднадзора за ВЗК.
Хотя 10–20 лет назад обнаружение ИЭН, связанного с ВЗК, во многих случаях напрямую приводило к проктоколэктомии, опубликованные за последнее десятилетие данные вызвали сдвиг парадигмы в сторону эндоскопических методов резекции, если это технически возможно (37).После обнаружения дисплазии поражения следует полностью удалить эндоскопически в соответствии с рекомендациями консенсусной конференции SCENIC (38, 39). Развитие методов эндоскопической резекции и новые данные об их безопасности и эффективности оправдывают эту стратегию.
Эндомикроскопия желудочно-кишечного тракта:
In vivo Гистология воспалительных заболеванийПринципы и техническая база CLE
Конфокальная лазерная эндомикроскопия была внедрена в 2003 году и с тех пор возникла как метод поперечного сечения с высоким разрешением, позволяющий точно визуализировать и охарактеризовать патологию желудочно-кишечного тракта in vivo (40–44) на (суб) клеточном уровне (45) .Технически, CLE использует маломощный синий лазер с длиной волны 488 нм, который направляется через точечное отверстие в определенную точку слизистой оболочки кишечника. Достигнув ткани, генерируется сигнал автофлуоресценции, который отражается и повторно фокусируется на системе обнаружения. Важно отметить, что этот отраженный свет снова проходит через точечное отверстие, в то время как рассеянный свет за пределами интересующей плоскости не обнаруживается. Это приводит к увеличению пространственного разрешения получаемых изображений. Интересующая область сканируется как в горизонтальной, так и в вертикальной плоскостях и, таким образом, предоставляет данные об интенсивности сигнала для каждой отдельной интересующей точки внутри ткани.Затем сигнал флуоресценции каждой точки преобразуется в двухмерное или трехмерное изображение с использованием компьютерного алгоритма, позволяющего получать гистологические изображения с 1000-кратным увеличением in vivo в реальном времени.
Поскольку CLE зависит от сигнала флуоресценции ткани, требуется применение контрастных веществ внутривенно или местно. Среди внутривенных контрастных агентов наиболее часто используется флуоресцеин, который обычно вводят непосредственно перед визуализацией. Оптимальный контраст изображения достигается с помощью 2.От 5 до 5 мл флуоресцеина и изображения можно получить в течение от 30 секунд до 60 минут после инъекции (46). Введение флуоресцеина приводит к микроскопической визуализации сосудистой сети, собственной пластинки и внутриклеточных пространств ткани, в то время как ядра клеток не окрашиваются флуоресцеином. Для окрашивания ядер обычно требуются местные контрастные вещества, такие как акрифлавин и крезил фиолетовый, которые можно наносить через распылительный катетер (47, 48). Однако растет беспокойство по поводу мутагенного потенциала, создаваемого местными контрастными веществами из-за их свойств интеркалирования ДНК.
На сегодняшний день доступны две разные системы CLE, которые используются в повседневной клинической практике, обе из которых одобрены FDA и сертифицированы CE (49) (Таблица 1): (i) система CLE на основе зонда, которая может использоваться практически с любым существующий эндоскоп с рабочим каналом диаметром ≥2,8 мм (pCLE, Cellvizio, Mauna Kea Technologies, Париж, Франция) и (ii) CLE на основе эндоскопа, интегрированная в эндоскоп высокого разрешения (eCLE; Pentax, Токио, Япония) ( 50–52). Однако система eCLE больше не продается.Как общая черта, и eCLE, и pCLE излучают синий лазерный свет с длиной волны возбуждения 488 нм и обнаруживают отраженный свет между 205 и 585 нм. С помощью eCLE изображения получаются со скоростью сканирования 1,6 кадра / с и разрешением 1024 × 512 пикселей или со скоростью 0,8 кадра / с при разрешении 1024 × 1024 пикселей. В eCLE мощность лазера и глубина сканирования регулируются вручную (глубина: 0–250 мкм, мощность: 0–1000 мкВт). Полученные изображения имеют конфокальное поле зрения 475 мкм × 475 мкм с латеральным и осевым разрешением 0.7 и 7 мкм соответственно.
Таблица 1 . Технические характеристики устройств CLE на основе зондов и эндоскопов.
В системе pCLE используются автономные конфокальные мини-зонды, совместимые с любым эндоскопом с диаметром рабочего канала ≥2,8 мм. Как правило, один зонд можно использовать для 20 различных применений, и для различных органов желудочно-кишечного тракта доступны специальные зонды. С помощью pCLE мощность лазера и глубина плоскости изображения фиксируются.В зависимости от используемого мини-зонда поперечное разрешение может составлять от 1 до 3,5 мкм, а поле обзора – от 240 до 600 мкм. Все датчики имеют скорость сканирования изображения 12 кадров / с с полем сканирования 30 000 пикселей, что позволяет снимать видео слизистой оболочки кишечника в реальном времени.
Основываясь на этих технических характеристиках, обе системы CLE имеют определенные преимущества, которые для eCLE заключаются в более высоком разрешении, возможности регулировки глубины плоскости визуализации и возможности одновременного получения биопсий для стандартной гистопатологии, тогда как систему pCLE можно легко использовать с виртуальным доступом. любой эндоскоп по всему желудочно-кишечному тракту, а также позволяет получать видео слизистой оболочки кишечника в реальном времени.
CLE для оценки воспаления кишечника
Техническое приложение CLE, а также оценка и интерпретация изображений CLE для оценки воспаления слизистой оболочки могут быть быстро изучены. Исследования показали, что эффективность отдельных исследователей со временем постоянно увеличивается и приводит к сокращению времени сбора данных и повышению диагностической точности после первых трех исследований pCLE (53). В недавнем исследовании Chang et al. Оценивалась диагностическая точность и кривая обучения для определения барьерной функции слизистой оболочки и целостности слизистой оболочки (54).С этой целью в общей сложности 180 эндоскопических изображений CLE терминального отдела подвздошной кишки были оценены на предмет повышенной кишечной проницаемости (IP), которая оценивалась по усилению межклеточного соединения, утечке флуоресцеина (FL) и выпадению клеток (CDO) опытными и неопытными аналитиками. а также патологоанатомы после 30-минутной обучающей сессии (54). Как показано в этом отчете, идентификация IP требует лишь короткой кривой обучения, после которой достигается высокая точность диагностики.
Различные исследования продемонстрировали, что повышенная IP и барьерная дисфункция хорошо визуализируются с помощью CLE.Как первоначально описано Kiesslich et al. (55), эпителиальные щели являются морфологическим эквивалентом отошедших эпителиальных клеток, и было показано, что эти эпителиальные щели имеют первостепенное значение для оценки воспалительной активности при ХКВ у пациентов с ВЗК.
Эндомикроскопические характеристики нарушения барьерной функции слизистой оболочки кишечника были описаны следующим образом: (i) FL, при котором флуоресцеин разливается в просвет между двумя или более выпавшими или разрушенными энтероцитами, (ii) усиление межклеточного соединения, которое, как апикальное скопление флуоресцеина между двумя эпителиальными клетками, морфологически представляет собой нарушение белков плотного соединения и, следовательно, может рассматриваться как предшественник окончательного разрыва базального плотного соединения (приводящего к FL), и (iii) CDO, как определено как отхождение апоптотических клеток в просветное пространство, где они часто могут быть обнаружены в виде клеточного детрита (рис. 2).Следует отметить, что все функции являются функциональными, и их можно наблюдать только при динамической визуализации с помощью CLE. Следовательно, у них нет гистопатологического эквивалента.
Рисунок 2 . ПКЛЕ терминального отдела подвздошной кишки и толстой кишки. (A) Одиночные ворсинки в терминальном отделе подвздошной кишки, визуализированные с помощью pCLE. В энтероцитах нет просветов или утечки, а просвет кишечника не контрастируется, что соответствует неповрежденному эпителиальному барьеру. Белая линия: граница энтероцитов с просветом кишечника.Белые звездочки: просвет кишечника. Белые стрелки: эритроциты внутри капилляров, содержащих флуоресцеин. (B) Воспаление слизистой оболочки толстой кишки пациента с болезнью Крона (БК). Темные круглые структуры представляют одиночные крипты (белая линия) с утечкой флуоресцеина в просвет (белые стрелки).
В проспективном пилотном исследовании с участием 58 пациентов с ВЗК в стадии клинической ремиссии Kiesslich et al. смогли показать, что усиление клеточного выделения при ФЛ может предсказать последующий рецидив заболевания в течение 12 месяцев после эндомикроскопии (56).В частности, чувствительность, специфичность и точность эндомикроскопической системы классификации, оценивающей выделение клеток и дисфункцию местного барьера (так называемая оценка Уотсона) для прогнозирования обострения, составляли 62,5, 91,2 и 79% соответственно (56).
Аналогичным образом, как показано Liu et al., Плотность эпителиальных щелей значительно выше у пациентов с БК по сравнению с контролем (57), и было показано, что пациенты с ЯК и БК с повышенной плотностью щелей имеют значительно более высокий риск госпитализации или госпитализации. хирургия (58).В недавнем исследовании Lim et al. оценили CLE-изображения двенадцатиперстной кишки у 35 пациентов (15 CD, 10 UC и 10 контрольных) на предмет количества эпителиальных щелей, отшелушивания клеток и степени FL в просвет (59). У всех пациентов двенадцатиперстная кишка была макроскопически нормальной, а гистопатология выявила легкий и неспецифический дуоденит у 7 из 15 пациентов с БК, в то время как все пациенты с ЯК имели гистологически нормальную слизистую двенадцатиперстной кишки. Важно отметить, что у пациентов как с ЯК, так и с БК наблюдалось повышенное количество эпителиальных щелей, отшелушивание эпителиальных клеток и просвет просвета по сравнению с контрольной группой, что позволяет предположить, что активность заболевания иначе не выявляется при обычной эндоскопии или гистопатологии (59).В совокупности эти данные убедительно иллюстрируют, что повышенная IP и локальная дисфункция барьера могут быть визуализированы с помощью CLE, и что появление последних напрямую связано с исходом заболевания.
Конфокальная лазерная эндомикроскопия также доказала свою способность точно оценивать степень воспаления слизистой оболочки in vivo в режиме реального времени при ВЗК и различать активное заболевание. Как показано для UC, крипты толстой кишки кажутся маленькими и круглыми с неправильным расположением в период ремиссии при CLE.Напротив, активное заболевание приводит к образованию больших крипт неправильной формы с хаотичным расположением и повышенным количеством капилляров собственной пластинки (60).
При классификации воспалительной активности, наблюдаемой во время CLE, с помощью четырехуровневой системы классификации, которая объединяет изменения крипт и микрососудистой архитектуры с FL у пациентов с UC, Li et al. смогли показать, что эти параметры коррелировали с гистологией (61). Интересно, что более 50 процентов пациентов с эндоскопической ремиссией имели активную болезнь при гистологическом исследовании.Напротив, ремиссия на основе CLE не была связана с активным заболеванием по гистологическим данным. Таким образом, CLE, по-видимому, предоставляет более надежную информацию об активности UC, чем эндоскопия в белом свете при UC (61). Аналогичные наблюдения могут быть сделаны в отношении CD: результаты нашей группы в Эрлангене показывают, что активный CD характеризуется повышенной извилистостью крипт толстой кишки, увеличением просвета крипт, повышенной васкуляризацией, микроэрозиями и инфильтратами более высоких клеток собственной пластинки на CLE, тогда как CD в стадии ремиссии. ассоциируется с большим количеством крипт и бокаловидных клеток по сравнению с контролем (62).Когда эти критерии систематически оценивались с использованием системы баллов [Оценка эндомикроскопической активности болезни Крона (CDEAS)], эндомикроскопическое различение пациентов с нездоровым и активным заболеванием стало возможным со средним баллом CDEAS 2 при покоящейся БК и 5 при активной БК (62). . В совокупности эти данные демонстрируют, что CLE позволяет точно оценить степень воспаления слизистой оболочки у пациентов с ВЗК.
Помимо этого и очень согласуется с известными гистоморфологическими различиями между UC и CE, CLE также может использоваться для дифференциации in vivo и между этими двумя заболеваниями.В частности, CD характеризуется значительным исчезновением воспалительных признаков, таких как криптит и извилистость крипт на CLE и UC. UC, напротив, проявляется с серьезной и распространенной деформацией крипт, уменьшенным количеством или плотностью крипт и неровной поверхностью во время CLE (44).
Другой центральной областью интереса является обнаружение дисплазии при ВЗК и особенно при ЯК. В нескольких исследованиях изучалась ценность CLE во время контрольной колоноскопии.В знаменательном исследовании, опубликованном в 2007 году Kiesslich et al., 161 пациент с длительным ЯК в клинической ремиссии был рандомизирован для проведения либо традиционной колоноскопии в белом свете, либо хромоэндоскопии с эндомикроскопией (63). Для выявления дисплазии в качестве основного результата в группе WLE были получены случайные, а также прицельные биопсии, тогда как в группе эндомикроскопии ограниченные поражения слизистой оболочки впервые были идентифицированы с помощью хромоэндоскопии, а образцы биопсии были взяты только в присутствии in vivo неровности слизистой оболочки при CLE (63).Поразительно, что при использовании хромоэндоскопии с эндомикроскопией можно было обнаружить в 4,75 раза больше новообразований, чем при традиционной колоноскопии, и в то же время потребовалось на 50% меньше биопсий (63).
Вскоре после этого исследование 36 пациентов с недавним диагнозом полиповидных или неполиповидных поражений показало общую точность (97%) и отличное согласие с гистологией (значение каппа = 0,91) при использовании CLE для различения полиповидных поражений, ассоциированных с колитом, от полиповидных поражений. спорадическая аденома. Эти данные предполагают, что CLE вполне может быть использована для стратификации пациентов на тех, кто подходит для эндолюминальной резекции, по сравнению с теми, которые потребуют немедленного направления для проктоколэктомии (64).
Важно отметить, что вышеупомянутые исследования были выполнены с помощью eCLE. В пилотном исследовании с участием 22 пациентов с ЯК 48 очагов поражения сравнивали с 87 случайными точками с помощью WLE, NBI и pCLE высокого разрешения. Как показано в отчете о 22 пациентах с ЯК с 48 видимыми поражениями, pCLE выполнима с разумной диагностической точностью для наблюдения за дисплазией при ЯК (65).
Хотя систематический анализ не проводился, типичный вид полиповидных поражений, связанных с колитом, был описан как темные клетки с истощением муцина, бокаловидными клетками и пониженной плотностью крипт, зубчатым нерегулярным эпителиальным слоем, искажением и расширением микрососудов и повышенной проницаемостью сосудов. (45, 66).
В то же время недавнее проспективное когортное исследование с участием 61 пациента с БК из пяти центров показало лишь постепенное увеличение диагностической точности при выполнении eCLE после хромоэндоскопии по сравнению с одной только хромоэндоскопией, в то время как частота дисплазии в этом исследовании была в целом низкой (67 ).
В целом, эти вышеупомянутые исследования надежно показывают, что CLE позволяет оценить микроскопическую степень воспаления у пациентов с ВЗК и, таким образом, дает возможность проводить гистологию in vivo в реальном времени.Важно отметить, что микроскопическая оценка воспаления слизистой оболочки является центральным аспектом оценки заживления слизистой оболочки, который служит важным прогностическим и терапевтическим параметром у пациентов с ВЗК (3). Следовательно, чтобы облегчить и оптимизировать как медикаментозное лечение, так и наблюдение за дисплазией и раком у пациентов с ВЗК, в ближайшем будущем они станут широко используемым методом диагностики. Кроме того, накопление доказательств того, что оценка кишечного барьера с помощью CLE может быть использована для проспективного выявления пациентов, которые находятся в группе риска возникновения обострения болезни, и, следовательно, позволяет осуществлять уход за пациентами с учетом риска.
Молекулярная визуализация воспаления кишечника и прогноз терапевтического ответа
Как обсуждалось выше, в области эндоскопии желудочно-кишечного тракта в последние годы произошло быстрое технологическое развитие, что привело к появлению передовых методов визуализации, которые улучшают видимость структур слизистой оболочки и воспаление слизистой оболочки. Тем не менее, все еще существует неудовлетворенная клиническая потребность в лучшей визуализации конкретных поражений слизистой оболочки. Эта необходимость особенно очевидна при обнаружении предраковых поражений при наблюдении за раком.Чувствительность вышеупомянутых эндоскопических методов ограничена тем, что они полагаются исключительно на обнаружение структурных изменений, которые часто могут быть незначительными, что делает невозможным их обнаружение на анатомическом уровне. Идентификация поражений слизистой оболочки может быть значительно улучшена за счет визуализации и характеристики биологических процессов, происходящих на клеточном уровне, что добавит большое новое измерение к нашим текущим диагностическим возможностям. Визуализация определенных биологических свойств может позволить обнаружить другие поражения, которые невозможно идентифицировать (68–72).
Эндоскопическая молекулярная визуализация основана на in vivo и визуализации специфических для заболевания нарушений на молекулярном уровне. Этот подход направлен не только на расширение наших диагностических возможностей, но и на новое понимание патогенеза различных заболеваний пищеварительного тракта.
Требования к эндоскопической молекулярной визуализации
Предпосылкой для успешного применения процедур молекулярной визуализации является идентификация молекулярных мишеней, которые представляют ответ на поставленный клинический вопрос.Эти мишени часто являются результатом фундаментальных научных исследований, которые приводят к успешной идентификации конкретных клеточных белков, критически участвующих в иммунопатогенезе заболеваний. Эпитопы, которые до сих пор рассматривались в исследованиях молекулярной визуализации, включают катепсин B, рецептор эпидермального фактора роста (EGFR), рецептор эпидермального фактора роста 2 человека (HER2), Claudin-1 и тирозин-протеинкиназу Met (c-Met) для улучшенное обнаружение аденомы толстой кишки, EGFR и фактора роста эндотелия сосудов (VEGF) для CRC.В желудке MG7 был идентифицирован как маркер рака желудка, а периостин – плоскоклеточного рака пищевода. Кроме того, HER2, некоторые гликаны и циклофилин A (CypA) были использованы для лучшего обнаружения неоплазии Барретта в пищеводе (70). Эти результаты исследований молекулярных мишеней, специфичных для заболеваний, создают основу для трансляционного переноса в доклиническую и клиническую практику. Другим важным требованием являются молекулярные зонды, которые вызывают специфические взаимодействия с выбранной структурой-мишенью.Идеальный молекулярный зонд должен обладать высокой аффинностью к мишени, быстрой кинетикой связывания, глубоким проникновением в ткани, низкой иммуногенностью, безопасным профилем токсичности, стабильностью in vivo , низкой стоимостью и быстрым выведением из нецелевой ткани, что гарантирует максимальную специфичность для сигнал (73). До сих пор в доклинических и даже клинических применениях использовались различные зонды. Наиболее распространены лектины, пептиды, антитела или аффитела. Эти красители часто маркируются яркими флуоресцентными красителями как оптические репортеры (68, 74).Наиболее распространенными красителями, используемыми в области молекулярной визуализации, являются высокоаффинные флуорофоры, такие как Cyanine 5.5, флуоресцеинизотиоцианат (FITC) или Alexa Fluor 488, которые обеспечивают отчетливый спектр излучения флуоресценции от 422 до 900 нм, который можно обнаружить с помощью специальной флуоресценции. эндоскопы в реальном времени. Активируемые ферменты представляют собой еще один очень привлекательный класс зондов, который до сих пор использовался только в доклинических моделях мышей. Они оптически бездействуют в отсутствие болезни и генерируют яркий флуоресцентный сигнал в присутствии протеолитических ферментов, которые сверхэкспрессируются только в опухолевых поражениях (75, 76).Зонды можно применять системно, что позволяет распределять их по всему телу и проникать в глубокие ткани за счет повышенной вероятности токсических реакций и необходимости заблаговременно до обследования. Другой альтернативой является местное введение зонда через распылительный катетер в пищеварительную ткань, что позволяет применять более высокие дозы для достижения улучшенного контраста изображения, при этом заметно снижая риск системной токсичности. Ограничение этого способа введения заключается в том, что он ограничивается выявлением только очаговых заболеваний (77).
Наиболее подходящая эндоскопическая система для молекулярной визуализации включает эндоскоп с широким полем поля, который позволяет точно различать изменения архитектуры слизистой оболочки и обнаруживать флуоресцентные молекулярные зонды для дальнейшей характеристики на месте. Было разработано несколько устройств, которые использовались в различных исследованиях молекулярной визуализации. К ним относятся нестандартные волоконно-оптические эндоскопы с узкополосными фильтрами или источники синего света для возбуждения (78, 79). Кроме того, CLE недавно стал одним из наиболее широко используемых эндоскопических устройств для микроскопических исследований молекулярной визуализации (45).В настоящее время он доступен в виде гибкого волоконно-оптического жгута, который может проходить через инструментальный канал эндоскопа. Он обеспечивает получение изображений в реальном времени с разрешением in vivo и даже субклеточным разрешением . Этот метод был подробно описан в этой рукописи ранее и использует лазерный свет с длиной волны 488 нм, которая соответствует пику поглощения FITC, или 660 нм для возбуждения. Фокус лазерного света направлен на тонкую плоскость изображения внутри ткани. Затем измеряется интенсивность света, отраженного от данной точки, которая будет флуоресцентным зондом в настройке молекулярной визуализации, чтобы вычислить виртуальное изображение на основе этих данных.
Доклинические исследования кишечной эндоскопической молекулярной визуализации
Визуализация молекулярных мишеней в толстой кишке была предметом многочисленных доклинических исследований, направленных на решение множества клинически значимых проблем.
Доклинические исследования толстой кишки in vivo в первую очередь были сосредоточены на обнаружении неопластических поражений. Впечатляющие результаты могли быть получены Mitsunaga et al., Которые местно вводили ферментативно активируемый флуоресцентный зонд для обнаружения гамма-глутамилтранспептидазы, которая избирательно экспрессируется при неоплазии толстой кишки.С помощью модифицированного широкопольного флуоресцентного эндоскопа можно было показать, что зонд обнаруживал наиболее выраженные дисплазии и рак у мышей, получавших аксоксиметан и декстран (80). Этот подход к визуализации опухолеспецифической ферментативной активности также применялся у мышей с ксенотрансплантатом, у которых лизин-лизин-расщепляющие протеазы были обнаружены в неопластической ткани с высоким соотношением опухоль / фон (81). В другом исследовании местно применялся октапептид ближнего инфракрасного диапазона, специфичный для дисплазии толстой кишки, на модели аденомы у мышей, и здесь снова была достигнута успешная идентификация неопластических поражений (82).
В других исследованиях использовались флуоресцентно меченые антитела для доклинического обнаружения злокачественных опухолей. Сначала флуоресцентное антитело, нацеленное на антитело к EGFR, было протестировано против опухолей ксенотрансплантата человека на мышах. CLE смог точно идентифицировать экспрессию EGFR в этой экспериментальной обстановке. Возможное применение у пациентов было предложено путем местного нанесения этого зонда на образец толстой кишки человека ex vivo , где также было доказано различие между злокачественной и неопухолевой тканью (83).Та же группа также применила меченное Alexa Fluor 488 антитело против VEGF в моделях ксенотрансплантатов опухоли мышей и хирургических образцах CRC человека. Ручной конфокальный инструмент позволил успешно идентифицировать опухолевую ткань (84). В последующем подходе тестировали терапевтическое антитело против EGFR цетуксимаб, меченное флуоресцентной меткой. Прогнозирование ответа на лечение цетуксимабом моноклональным антителом против EGFR было показано на модели ксенотрансплантата человеческих клеток CRC с высокой или низкой экспрессией EGFR, введенных мышам nude.По оценке интенсивности флуоресценции после инъекции меченой тестовой дозы цетуксимаба можно было предсказать ответ на последующую таргетную терапию этим моноклональным антителом против EGFR (85).
Клинические исследования кишечной эндоскопической молекулярной визуализации
Эндоскопическая молекулярная визуализация уже перешла в клинические исследования, и доказательства осуществимости этого подхода постоянно растут. Первое экспериментальное исследование по обнаружению опухолей кишечника было проведено с использованием оптического зонда, созданного из моноклонального антитела против карциноэмбионального антигена, конъюгированного с флуоресцеином.Флуоресцентное антитело применялось местно во время колоноскопии пациентам с колоректальными полипами или опухолями. Пациенты были обследованы с помощью широкопольного эндоскопа с увеличенным оптическим диапазоном за счет использования узкополосных фильтров. Группа смогла идентифицировать 19 из 25 опухолей, и, что важно, никаких побочных эффектов или иммунологических побочных эффектов не наблюдалось (78). Другое ключевое испытание с использованием CLE для визуализации неопластических клеток было выполнено путем местного применения короткой пептидной последовательности, выделенной из фаговой пептидной библиотеки, полученной из аденом человека, которая была конъюгирована с флуоресцеином.Пептид, конъюгированный с флуоресцеином, для местного применения показал повышенное связывание с неопластическими клетками с чувствительностью и специфичностью более 80% (86).
Недавно опубликованное исследование Burggraaf et al. элегантно исследовали способность внутривенно введенного Cy5-меченного пептида GE-37 обнаруживать диспластические поражения у 15 пациентов с высоким риском CRC. Пептид был способен специфически связываться с c-Met, который сверхэкспрессируется в диспластических криптах. Обследование проводилось с помощью модифицированного оптоволоконного колоноскопа, который давал изображения флуоресценции через 3 часа после инъекции пептида.Было увеличено поглощение зонда полипами толстой кишки. Окончательный анализ показал, что все 47 обнаруженных канальцевых аденом показали повышенную интенсивность флуоресценции, как и 33/42 гиперпластических очага и 8/41 нормальной слизистой оболочки, взятых в ходе исследования. С помощью этого диагностического метода было обнаружено в общей сложности девять дополнительных аденом, которые не были обнаружены с помощью оптоволоконного исследования в белом свете. Важно отметить, что не было видимых системных побочных эффектов (87).
Другое недавно опубликованное исследование показало впечатляющие результаты по обнаружению зубчатых аденом на сидячей части (SSA).SSA имеют плоские тонкие черты, поэтому их трудно обнаружить с помощью традиционной колоноскопии. Используя фаговый дисплей, группа Joshi et al. идентифицировали пептид, который предпочтительно связывается с SSA. Выполняя флуоресцентную эндоскопию in vivo у пациентов, авторы сообщили, что средняя интенсивность флуоресценции SSA в 2,43 раза выше, чем у здоровой слизистой оболочки толстой кишки. Флуоресцентная маркировка позволяет отличить SSA от нормальной слизистой оболочки толстой кишки с чувствительностью 89% и специфичностью 92%.Пептид не проявил токсических эффектов в исследовании (88). Эта же группа также продемонстрировала способность мультимодального видеоколоноскопа собирать in vivo широкопольных изображений неполипоидных аденом толстой кишки в реальном времени с использованием флуоресцентно меченных пептидов (89).
Помимо раннего обнаружения CRC, недавно были использованы процедуры молекулярной визуализации для прогнозирования терапевтической эффективности биологических методов лечения пациентов с ВЗК. Надежное прогнозирование терапевтического ответа имеет важное значение в клинической практике, чтобы избежать воздействия неэффективной биологической терапии на не отвечающих на лечение лиц и связанных с этим потенциальных побочных эффектов этого лечения.Кроме того, это позволило бы лечащему врачу напрямую познакомить пациента с наиболее подходящим биологическим терапевтическим вариантом, который обеспечил бы улучшенный и эффективный по времени контроль болезни для пациента. Недавно версия антитела против TNF, соответствующая требованиям надлежащей производственной практики (GMP), была местно применена в инициированном исследователем исследовании с участием 25 пациентов с БК для прогнозирования ответа на последующую терапию анти-TNF (90). Поскольку антитела против TNF, по-видимому, вызывают свой противовоспалительный эффект в первую очередь за счет связывания с мембраносвязанным TNF (mTNF) на клетках-мишенях слизистой оболочки (91), идентификация таких mTNF-экспрессирующих клеток в слизистой оболочке была использована для идентификации пациентов, отвечающих на последующие анти-TNF терапия.Количество mTNF-положительных клеток в воспаленной слизистой оболочке было определено количественно in vivo с использованием CLE. В этом исследовании пациенты с повышенным количеством mTNF-положительных клеток слизистой оболочки имели лучший клинический ответ через 12 недель (11/12 пациентов) по сравнению с пациентами с меньшим количеством mTNF слизистых клеток (2/13 пациентов). Клиническая эффективность поддерживалась в течение наблюдаемого периода наблюдения в 12 месяцев и была связана с индукцией заживления слизистой оболочки (90). В области терапии антиадгезионными молекулами аналогичный подход был протестирован ex vivo на пациентах с CD.Здесь CLE использовали в сочетании с местно применяемым флуоресцеин-меченым антителом к молекуле антиадгезии для визуализации экспрессии интегрина слизистой оболочки ex vivo в слизистой ткани пациентов с CD, чтобы предсказать ответ на последующую терапию антиадгезионными молекулами. Этот подход снова был основан на предположении о связи между уровнями экспрессии и ответом на биологическую терапию, направленную против молекулы-мишени. В исследовании были взяты биопсии слизистой оболочки пяти пациентов с CD с резистентным к TNF заболеванием для молекулярной визуализации ex vivo с флуоресцентной молекулой антиадгезии антителом ведолизумабом, чтобы визуализировать экспрессию слизистой оболочки его молекулы-мишени, интегрина α4β7.Пациенты с БК, которые ответили устойчивой клинической и эндоскопической ремиссией на терапию ведолизумабом, показали заметно более высокую экспрессию интегрина α4β7, чем пациенты, не ответившие на лечение (92). Эти результаты могут открыть новые возможности для персонализированной медицины в лечении пациентов с CD и могут служить в качестве возможного модельного подхода для других воспалительных заболеваний, которые лечатся с помощью биопрепаратов.
Хотя процедуры эндоскопической молекулярной визуализации в настоящее время находятся на ранней стадии развития в клинических процедурах, возможность применения этого метода была убедительно доказана различными клиническими исследованиями.Возможные применения включают расширенное обнаружение опухолевых поражений слизистой оболочки, выявление дисплазии воспаленной слизистой оболочки и прогнозирование терапевтических ответов на молекулярно-направленное лечение. Основной проблемой для дальнейшего применения этих исследований является одобрение регулирующих органов, поскольку флуоресцентные зонды рассматриваются властями как новые исследуемые препараты и, следовательно, требуют обширных доклинических данных по эффективности и безопасности. Кроме того, для синтеза флуоресцентных зондов необходимы средства, обеспечивающие среду, соответствующую требованиям GMP.Тем не менее, имеющиеся захватывающие данные первых исследований молекулярной визуализации ясно подчеркивают потенциал этого метода, который может оказать впечатляющее влияние на улучшенные будущие диагностические и терапевтические алгоритмы.
Неинвазивная визуализация воспаления кишечника
Из-за инвазивности эндоскопии и связанного с ней риска осложнений существует постоянная потребность в неинвазивных методах оценки воспаления слизистой оболочки. Соответственно, стандартные методы визуализации, включая КТ, МРТ, сцинтиграфию и УЗИ, использовались не только для обнаружения стеноза и проникающих поражений, таких как свищи и абсцессы, но и для оценки активности заболевания у пациентов с ВЗК (93).КТ обычно выполняется как КТ энтерография с пероральным и внутривенным введением. контраст для обнаружения патологии стенки кишечника и аномального усиления контраста (94, 95). Параметры, используемые для оценки активности заболевания, включают утолщение стенки, усиление слизистой или кишечной стенки, наслоение фрески, признак гребешка и увеличение регионарных лимфатических узлов (95). Точно так же МРТ выполняется после введения перорального контраста в виде МР-энтерографии (МРЭ) и оценивается толщина стенки, повышенное поглощение контраста, отек и язвы (96).Количественный индекс, индекс активности магнитного резонанса, был разработан, который включает основанные на МРТ характеристики активности заболевания, основанные на логистической регрессии, и показывает хорошую корреляцию с эндоскопической активностью заболевания. Сцинтиграфия в основном выполняется с использованием 99mTc-HMPAO или 111In-оксин-меченных лейкоцитов, которые накапливаются в участках активного заболевания (97). Что касается трансабдоминального УЗИ, утолщение кишечной стенки, оценка васкуляризации на основе цветного допплера, снижение стратификации и перистальтики кишечника или сжимаемость используются в качестве параметров для оценки активности заболевания (95).Поскольку все эти методы визуализации предлагают ограниченное пространственное разрешение, оценка воспаления, ограниченного слизистой оболочкой, практически невозможна.
Фактически, большинство данных клинических испытаний доступно для оценки активности CD, которую легче обнаружить из-за трансмурального воспаления. Что касается оценки активности заболеваний верхних отделов желудочно-кишечного тракта и тонкой кишки у пациентов с БК, все методы показали сопоставимые результаты для оценки терминального илеита.По сравнению с КТ, МРТ и сцинтиграфией, УЗИ ограничивает покрытие всей длины тонкой кишки (97). Для оценки колита Крона МРТ и КТ обеспечивают высокую точность, хотя данные по КТ ограничены. Диагностическая точность УЗИ при колите Крона зависит от опыта исследователя и места поражения. Сообщается, что он сопоставим с МРТ и КТ для оценки сигмовидной / нисходящей ободочной кишки, тогда как точность наименьшей в прямой кишке (98).
В целом, данные по оценке активности заболевания при ЯК с помощью неинвазивных методов визуализации ограничены.Несмотря на низкое пространственное разрешение, текущие данные многообещающие для MRE. Например, Oussalah et al. оценили активность заболевания у 96 пациентов с ВЗК (UC = 35, CD = 61) с помощью МРТ с диффузионно-взвешенной визуализацией (DWI-MRI) (99). В этом исследовании диагностическая точность DWI-MRI для выявления эндоскопического воспаления была даже выше у пациентов с UC (чувствительность = 89,47%; специфичность = 86,67%; AUROC = 0,920) по сравнению с CD (чувствительность = 58,33%; специфичность: 84,48%). ; AUROC = 0,779). Дальнейшие исследования также показывают ценные результаты для УЗИ, тогда как данные КТ показывают лишь умеренную корреляцию с тяжестью заболевания (97).Поэтому срочно необходимы дальнейшие исследования, чтобы полностью оценить ценность неинвазивной визуализации при ЯК.
В дополнение к традиционным методам получения томографических изображений в клинические исследования недавно вошли новые технологические разработки. Перспективным методом оценки активности заболевания у пациентов с ВЗК является мультиспектральная оптоакустическая томография (МСОТ) (100). MSOT позволяет точно локализовать определенные молекулы в тканях на глубину до нескольких сантиметров за счет фотоакустического эффекта.Фотоакустический эффект описывает наблюдение, что свет, поглощаемый молекулами, вызывает термопластическое расширение, которое может быть обнаружено как ультразвуковые волны с очень высоким пространственным разрешением. Последовательно возбуждая ткань несколькими длинами волн, можно использовать методы спектрального разделения для расчета относительного вклада конкретных молекул в общий сигнал с помощью MSOT. Таким образом, на основе характеристик абсорбции, оксигенированный и деоксигенированный гемоглобин легко обнаруживается с помощью MSOT.В недавнем исследовании Knieling et al. оценили использование неинвазивного трансабдоминального MSOT для оценки активности CD (101). Выполняя MSOT у 108 пациентов с активной CD и ремиссией, авторы смогли показать, что измерения общего гемоглобина в стенке кишечника на основе MSOT показывают отличную корреляцию с эндоскопической степенью воспаления, оцененной с помощью SES-CD. По сравнению с УЗИ, MSOT превосходил по дифференциации ремиссии и низкой степени активности заболевания. Хотя эти данные обнадеживают, необходимы дальнейшие исследования, чтобы оценить весь потенциал этого нового метода у пациентов с ВЗК.
Будущие направления эндоскопической оценки воспаления слизистой оболочки
В последние годы ряд новых оптических технологий был оценен на предмет их диагностической ценности при эндоскопической оценке органов и тканей. Во-первых, существуют различные методы визуализации для определения морфологической структуры тканей, а также для получения функциональной информации о клеточных процессах в некоторых случаях. Во-вторых, существует ряд методов спектроскопии, которые разрешают спектральный состав обнаруженных световых сигналов с чувствительностью к молекулярному составу образца.Каждая из технологий основана на специфическом взаимодействии света с веществом: упругом и неупругом рассеянии, поглощении и флуоресценции.
Методы визуализации включают оптическую когерентную томографию (ОКТ), многофотонную микроскопию (MPM), микроскопию когерентного антистоксового комбинационного рассеяния (CARS) и визуализацию времени жизни флуоресценции; Основными методами спектроскопии являются спектроскопия комбинационного рассеяния и инфракрасная спектроскопия с преобразованием Фурье.
Оптическая когерентная томография может использоваться для визуализации структурных особенностей тканей.Контраст основан на поглощении и отражении света в тканях на границах раздела с изменениями показателя преломления. Принцип обнаружения – это интерференция света от эталонного пути со светом, отраженным от ткани. Изменение длины опорного пути с помощью подвижного зеркала настраивает положение фокуса в образце и кодирует осевое положение сигнала в так называемой технике ОКТ во временной области. Дополнительное сканирование светового луча в боковой плоскости позволяет получить трехмерное изображение ткани.В качестве альтернативы, интерференционные картины могут быть обнаружены на спектрометре и преобразованы в пространственные положения с помощью преобразования Фурье в спектральной области ОКТ, которая стала текущим стандартом для большинства коммерческих систем. Как правило, можно достичь разрешения в диапазоне 10 мкм и глубины изображения в диапазоне 2 мм.
Первые результаты по оценке желудочно-кишечных заболеваний с помощью ОКТ были получены еще 20 лет назад (102). В 2004 году Шен и др. подвергали образцы тканей 48 пациентов с ВЗК до OCT ex vivo (103).Согласно этому исследованию, ОКТ позволила идентифицировать трансмуральное воспаление и, таким образом, позволило дифференцировать БК и ЯК с отличной корреляцией с гистопатологией. Впоследствии это исследование было подтверждено данными эндоскопической ОКТ in vivo у 40 пациентов с БК и 30 пациентов с ЯК, что снова предполагает, что ОКТ может помочь в различении БК и ЯК на основе обнаружения трансмурального воспаления (104). Хотя эти данные обнадеживают, последующее подтверждение в последующих исследованиях пока отсутствует.Поскольку ведутся постоянные исследования по дальнейшему совершенствованию эндоскопической ОКТ и разрабатываются более совершенные устройства (105), можно ожидать большего количества данных об использовании ОКТ для оценки воспаления слизистой оболочки.
В MPM флуоресцентная молекула возбуждается взаимодействием с двумя или более фотонами одновременно. Длины волн возбуждения обычно находятся в ближнем инфракрасном диапазоне для флуоресцентного излучения в видимом спектре. Инфракрасный свет меньше рассеивается в ткани, чем свет с более короткими длинами волн, поэтому для визуализации может быть достигнута большая глубина проникновения.Многофотонные эффекты наблюдаются только в небольшой области фокуса объектива, где плотность энергии наиболее высока. Таким образом, сигналы флуоресценции могут быть собраны вблизи задней апертуры объектива без необходимости в конфокальном отверстии, которое блокирует свет от плоскостей, находящихся вне фокуса. Этот способ обнаружения обычно обеспечивает лучшее соотношение сигнал / шум и улучшенную контрастность изображения при визуализации ткани, особенно в более глубоких слоях ткани. Глубина проникновения обычно ограничивается 150 или 200 мкм в плотных тканях, таких как слизистая оболочка толстой кишки, но также может достигать более 500 мкм при визуализации головного мозга.MPM хорошо подходит для визуализации ткани без меток, основанной на аутофлуоресценции [автофлуоресценции с двухфотонным возбуждением (TPEF)] эндогенных молекул, таких как NADH или FAD, которые присутствуют во всех клетках в разных количествах. Кроме того, внеклеточный матрикс можно визуализировать посредством генерации второй гармоники (ГВГ) из коллагена-I, что является еще одним специфическим двухфотонным эффектом, который можно наблюдать только в нескольких очень регулярных и нецентросимметричных структурах филаментов. Комбинируя обнаружение сигналов TPEF и SHG, MPM предоставляет подробную информацию о биологических тканях без необходимости маркировки.
Что касается кишечной ткани, то многофотонная визуализация без меток может обеспечить субклеточное разрешение поверхности слизистой оболочки, что позволяет идентифицировать ядра эпителиальных клеток, бокаловидные клетки, интерстициальный коллаген и т. Д. (106). Safdarian et al. может показать, что MPM без метки можно использовать для обнаружения и количественной оценки инфильтрации эозинофилов при эозинофильном эзофагите ex vivo (107). Кроме того, мы ранее показали, что MPM без метки также может использоваться для отображения воспаления слизистой оболочки в образцах тканей пациентов с ВЗК ex vivo (рис. 3) (108).Недавний технический прогресс позволил непрерывно миниатюризировать устройства MPM, что привело к разработке первых эндоскопических систем MPM, которые были продемонстрированы в доклинических исследованиях (109, 110). Когда станут доступны клинические устройства MPM, будет интересно посмотреть, сможет ли эта технология принести дополнительную пользу для клинической диагностики воспаления слизистой оболочки.
Рисунок 3 . Многофотонная микроскопия болезни Крона в биоптатах толстой кишки человека без маркировки. (a) Эпителиальный слой на глубине 10 мкм. (б) Собственная верхняя пластинка на глубине 40 мкм. (в) Слабое воспаление. (d) Сильное активное воспаление. Масштабные линейки: 100 мкм.
Рамановская спектроскопия – это метод, позволяющий проводить точечные измерения в биологических тканях, предоставляя подробную информацию о молекулярном составе посредством обнаружения неупругого рассеяния. Неупругое рассеяние основано на эффекте комбинационного рассеяния, который может возникать из-за изменений колебательной, вращательной или электронной энергии молекулы после возбуждения (111).Поскольку отдельные молекулы имеют характерные рамановские сигналы, спектроскопическая оценка этих сигналов дает информацию об отдельных молекулярных компонентах в образце ткани, аналогичную молекулярному «отпечатку пальца». Эта информация уже использовалась для диагностики IBD ex vivo (112, 113). В недавнем исследовании Addis et al. использовали рамановскую спектроскопию для оценки активности заболевания в сравнении с заживлением слизистой в биоптатах тканей пациентов с UC ex vivo (114). Поскольку рамановскую спектроскопию можно выполнять с помощью оптоволоконного зонда, ее можно легко интегрировать в установку для эндоскопии.В качестве доказательства принципа Пенс и др. использовали связанную с колоноскопией рамановскую систему в пилотном исследовании у пациентов с ВЗК in vivo (115). Данные этого исследования обнадеживают для будущего использования рамановской спектроскопии в диагностике и мониторинге ВЗК.
В дополнение к одноточечным измерениям, эффект комбинационного рассеяния может также использоваться для визуализации тканей с помощью микроскопии CARS или стимулированного комбинационного рассеяния (SRS) (116). Эти технологии исследуют колебательные молекулярные переходы, например связи C-H.Когерентное возбуждение этих колебательных переходов достигается комбинированным возбуждением двумя лазерами (называемыми лазером накачки и стоксовым лазером) на двух разных длинах волн. Разность энергий этих двух длин волн выбирается так, чтобы точно соответствовать энергии колебательной связи, которую необходимо исследовать в ткани. Нелинейное взаимодействие фотонов от лазерного источника с молекулярными осцилляторами в образце приводит к генерации более коротковолновых фотонов, обнаруживаемых в КАРС-микроскопии, и к вынужденным рамановским потерям или усилению интенсивности рассеянного света на исходных длинах волн лазера, которые могут быть обнаружены синхронно. в усилителях в SRS микроскопии.По сравнению со стандартной рамановской спектроскопией, CARS использует только одну рамановскую частоту для возбуждения за раз, но с гораздо более высоким выходом детектируемых фотонов, что позволяет визуализировать ткани с помощью лазерного сканирующего микроскопа. В недавнем исследовании Чернавская и соавт. использовали безметку нелинейную мультимодальную комбинированную визуализацию TPEF, SHG и CARS для оценки активности заболевания в образцах тканей пациентов с IBD ex vivo (117). Сравнивая результаты этих нелинейных методов визуализации с гистопатологическими результатами, авторы смогли определить набор функций для автоматического прогнозирования активности заболевания с высокой диагностической точностью.Хотя эти данные являются предварительными, они предполагают, что нелинейные мультимодальные методы визуализации без меток могут быть ценными инструментами для оценки воспаления слизистой оболочки.
Заключение
Эндоскопическая оценка воспаления слизистой оболочки за последние годы достигла значительных успехов. Новые широкопрофильные подходы, такие как эндоскопия высокого разрешения, хромоэндоскопия на основе красителей или увеличивающая эндоскопия, не только улучшили диагностику и мониторинг активности заболевания, но и улучшили наблюдение за раком у пациентов с ВЗК.Впервые CLE позволил провести in vivo, гистологию слизистых оболочек, предоставив информацию о микроскопическом состоянии заболевания в режиме реального времени. Несмотря на эти улучшения, все еще остаются неудовлетворенные потребности в клиническом ведении пациентов с ВЗК. Первые данные для подходов к молекулярной визуализации или новых оптических технологий обещают удовлетворить эти потребности. Однако, поскольку эти методы только находятся на пути к клиническому применению, будущие исследования должны будут показать их преимущества для оценки воспаления слизистой оболочки.
Авторские взносы
MW, TR, SS, CB и RA вместе подготовили концепцию, написали и рецензировали рукопись.
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Управляющий редактор заявил о совместной принадлежности, но не о каком-либо другом сотрудничестве, с одним из авторов CB.
Финансирование
MW с благодарностью отмечает финансирование Высшей школы в Эрлангене по передовым оптическим технологиям (SAOT) Немецким исследовательским фондом (DFG) в рамках инициативы German Excellence и финансирование Немецким исследовательским фондом (DFG) в рамках Klinische Forschergruppe 257 (KFO 257) и Forschergruppe 2438 (FOR 2438).РА получил финансирование от Немецкого исследовательского фонда через Klinische Forschergruppe 257 (KFO 257) и Инициативу развивающихся областей Университета Эрланген-Нюрнберг.
Список литературы
2. Дальхамер Дж. М., Заммитти Е. П., Уорд Б. В., Уитон АГ, Крофт Дж. Б.. Распространенность воспалительных заболеваний кишечника среди взрослых в возрасте> / = 18 лет – США, 2015 г. MMWR Morb Mortal Wkly Rep (2016) 65: 1166–9. DOI: 10.15585 / mmwr.mm6542a3
CrossRef Полный текст | Google Scholar
5.Джесс Т., Рунго С., Пейрин-Бируле Л. Риск колоректального рака у пациентов с язвенным колитом: метаанализ популяционных когортных исследований. Clin Gastroenterol Hepatol (2012) 10: 639–45. DOI: 10.1016 / j.cgh.2012.01.010
PubMed Аннотация | CrossRef Полный текст | Google Scholar
6. Canavan C, Abrams KR, Mayberry J. Мета-анализ: риск рака толстой кишки и тонкой кишки у пациентов с болезнью Крона. Aliment Pharmacol Ther (2006) 23: 1097–104.DOI: 10.1111 / j.1365-2036.2006.02854.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
7. Niv Y. Оценка заживления слизистой оболочки тонкой кишки с помощью капсульной эндоскопии как предиктор долгосрочной клинической ремиссии у пациентов с болезнью Крона: систематический обзор и метаанализ. Eur J Gastroenterol Hepatol (2017) 29: 844–8. DOI: 10.1097 / MEG.0000000000000881
PubMed Аннотация | CrossRef Полный текст | Google Scholar
9. Эннс Р.А., Хуки Л., Армстронг Д., Бернштейн С.Н., Хейтман С.Дж., Тешима С. и др.Руководство по клинической практике использования видеокапсульной эндоскопии. Гастроэнтерология (2017) 152: 497–514. DOI: 10.1053 / j.gastro.2016.12.032
CrossRef Полный текст | Google Scholar
10. Аннезе В., Даперно М., Раттер М.Д., Амиот А., Боссайт П., Ист Дж. И др. Европейский консенсус в отношении эндоскопии при воспалительном заболевании кишечника, основанный на фактических данных. J Crohns Colitis (2013) 7: 982–1018. DOI: 10.1016 / j.crohns.2013.09.016
CrossRef Полный текст | Google Scholar
11.C. Стандарты практики Американского общества гастроинтестинальной эндоскопииShergill AK, Lightdale JR, Bruining DH, Acosta RD, Chandrasekhara V, et al. Роль эндоскопии при воспалительном заболевании кишечника. Gastrointest Endosc (2015) 81 (1101–21): e1–13. DOI: 10.1016 / j.gie.2014.10.030
CrossRef Полный текст | Google Scholar
12. Трэвис С.П., Шнелл Д., Кшески П., Абреу М.Т., Альтман Д.Г., Коломбел Дж.Ф. и др. Разработка инструмента для оценки эндоскопической тяжести язвенного колита: эндоскопического индекса тяжести язвенного колита (UCEIS). Кишечник (2012) 61: 535–42. DOI: 10.1136 / gutjnl-2011-300486
PubMed Аннотация | CrossRef Полный текст | Google Scholar
13. Даперно М., Д’Хаэнс Дж., Ван Ассше Дж., Барт Ф., Булуа П., Маунори В. и др. Разработка и проверка новой упрощенной оценки эндоскопической активности болезни Крона: SES-CD. Gastrointest Endosc (2004) 60: 505–12. DOI: 10.1016 / S0016-5107 (04) 01878-4
PubMed Аннотация | CrossRef Полный текст | Google Scholar
14.Rutgeerts P, Geboes K, Vantrappen G, Beyls J, Kerremans R, Hiele M. Предсказуемость послеоперационного течения болезни Крона. Гастроэнтерология (1990) 99: 956–63. DOI: 10.1016 / 0016-5085 (90)
-6PubMed Аннотация | CrossRef Полный текст | Google Scholar
15. Виттон Л., Марто П., Сандборн В. Дж., Левеск Б. Г., Фиган Б., Вермейр С. и др. Технический обзор IOIBD по эндоскопическим индексам для клинических испытаний болезни Крона. Кишечник (2016) 65: 1447–55. DOI: 10.1136 / gutjnl-2015-309903
PubMed Аннотация | CrossRef Полный текст | Google Scholar
16. Кудо Т., Мацумото Т., Эсаки М., Яо Т., Иида М. Сосудистый паттерн слизистой оболочки при язвенном колите: наблюдения с использованием узкополосной визуализирующей колоноскопии с особым упором на гистологическое воспаление. Int J Colorectal Dis (2009) 24: 495–501. DOI: 10.1007 / s00384-008-0631-9
PubMed Аннотация | CrossRef Полный текст | Google Scholar
17. Neumann H, Vieth M, Gunther C, Neufert C, Kiesslich R, Grauer M, et al.Виртуальная хромоэндоскопия для прогнозирования тяжести и степени заболевания у пациентов с воспалительным заболеванием кишечника: рандомизированное контролируемое исследование. Воспаление кишечника (2013) 19: 1935–42. DOI: 10.1097 / MIB.0b013e3182
e
PubMed Аннотация | CrossRef Полный текст | Google Scholar
18. Якуччи М., Кисслих Р., Ги Х, Паначчоне Р., Хезерингтон Дж., Акинола О. и др. Помимо белого света: оптическое усиление в сочетании с колоноскопией с увеличением для оценки заживления слизистой оболочки при язвенном колите. Эндоскопия (2017) 49: 553–9. DOI: 10.1055 / с-0042-124363
PubMed Аннотация | CrossRef Полный текст | Google Scholar
19. Джесс Т., Симонсен Дж., Йоргенсен К.Т., Педерсен Б.В., Нильсен Н.М., Фриш М. Снижение риска колоректального рака у пациентов с воспалительным заболеванием кишечника старше 30 лет. Гастроэнтерология (2012) 143: e13–4. DOI: 10.1053 / j.gastro.2012.04.016
PubMed Аннотация | CrossRef Полный текст | Google Scholar
20. Херринтон Л.Дж., Лю Л., Левин Т.Р., Эллисон Дж.Э., Льюис Д.Д., Велайос Ф.Заболеваемость и смертность от колоректальной аденокарциномы у лиц с воспалительными заболеваниями кишечника с 1998 по 2010 год. Гастроэнтерология (2012) 143: 382–9. DOI: 10.1053 / j.gastro.2012.04.054
PubMed Аннотация | CrossRef Полный текст | Google Scholar
21. Тен Хов Дж. Р., Муивеер Э., ван дер Мейлен де Йонг А. Э., Деккер Э., Понсиоен С. Ю., Сирсема П. Д. и др. Клинические последствия дисплазии низкой степени, обнаруженные во время наблюдения за воспалительными заболеваниями кишечника: ретроспективное исследование, сравнивающее хромоэндоскопию и эндоскопию в белом свете. Эндоскопия (2017) 49: 161–8. DOI: 10.1055 / с-0042-119394
PubMed Аннотация | CrossRef Полный текст | Google Scholar
22. van Schaik FD, ten Kate FJ, Offerhaus GJ, Schipper ME, Vleggaar FP, van der Woude CJ, et al. Ошибочная классификация дисплазии у пациентов с воспалительным заболеванием кишечника: последствия для скорости прогрессирования до прогрессирующей неоплазии. Воспаление кишечника (2011) 17: 1108–16. DOI: 10.1002 / ibd.21467
PubMed Аннотация | CrossRef Полный текст | Google Scholar
23.Адлер А., Ашенбек Дж., Йенерим Т., Майр М., Аминалай А., Дроссель Р. и др. Узкополосная телевизионная эндоскопическая визуализация высокой четкости в сравнении с использованием белого света для скрининг-колоноскопии: проспективное рандомизированное исследование. Гастроэнтерология (2009) 136: 410.e1; quiz 715. doi: 10.1053 / j.gastro.2008.10.022
PubMed Аннотация | CrossRef Полный текст | Google Scholar
24. Иноуэ Т., Мурано М, Мурано Н., Курамото Т., Каваками К., Абе Й и др. Сравнительное исследование традиционной колоноскопии и системы узкополосной визуализации всей толстой кишки при обнаружении неопластических полипов толстой кишки: рандомизированное контролируемое исследование. J Гастроэнтерол (2008) 43: 45–50. DOI: 10.1007 / s00535-007-2125-x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
25. Хоффман А., Сар Ф., Гетц М., Треш А., Мудтер Дж., Бистерфельд С. и др. Колоноскопия высокого разрешения в сочетании с i-Scan превосходит диагностику колоректальных новообразований по сравнению со стандартной видеоколоноскопией: проспективное рандомизированное контролируемое исследование. Эндоскопия (2010) 42: 827–33. DOI: 10.1055 / с-0030-1255713
PubMed Аннотация | CrossRef Полный текст | Google Scholar
26.Subramanian V, Mannath J, Hawkey CJ, Ragunath K. Колоноскопия высокого разрешения по сравнению со стандартной видеоэндоскопией для обнаружения полипов толстой кишки: метаанализ. Эндоскопия (2011) 43: 499–505. DOI: 10.1055 / с-0030-1256207
PubMed Аннотация | CrossRef Полный текст | Google Scholar
27. Pohl J, Schneider A, Vogell H, Mayer G, Kaiser G, Ell C. Панколоническая хромоэндоскопия с индигокармином по сравнению со стандартной колоноскопией для обнаружения неопластических поражений: рандомизированное двухцентровое исследование. Кишечник (2011) 60: 485–90. DOI: 10.1136 / gut.2010.229534
PubMed Аннотация | CrossRef Полный текст | Google Scholar
28. Тогаши К., Немото Д., Утано К., Исохата Н., Кумамото К., Эндо С. и др. Эндоскопическая система с синим лазером для раннего обнаружения и характеристики колоректальных поражений: руководство для эндоскописта. Therap Adv Gastroenterol (2016) 9: 50–6. DOI: 10.1177 / 1756283X15603614
PubMed Аннотация | CrossRef Полный текст | Google Scholar
29.Судзуки Т., Хара Т., Китагава Ю., Такаширо Х., Нанкинзан Р., Сугита О. и др. Связанные цвета изображения улучшают эндоскопическую видимость колоректальных негранулярных плоских поражений. Gastrointest Endosc (2017) 86: 692–7. DOI: 10.1016 / j.gie.2017.01.044
PubMed Аннотация | CrossRef Полный текст | Google Scholar
30. Lutgens MW, Vleggaar FP, Schipper ME, Stokkers PC, van der Woude CJ, Hommes DW, et al. Высокая частота раннего колоректального рака при воспалительном заболевании кишечника. Кишечник (2008) 57: 1246–51.DOI: 10.1136 / gut.2007.143453
PubMed Аннотация | CrossRef Полный текст | Google Scholar
31. Камински М.Ф., Хассан К., Бишопс Р., Поль Дж., Пеллиз М., Деккер Е. и др. Расширенная визуализация для обнаружения и дифференциации колоректальной неоплазии: Руководство Европейского общества гастроинтестинальной эндоскопии (ESGE). Эндоскопия (2014) 46: 435–49. DOI: 10.1055 / с-0034-1365348
PubMed Аннотация | CrossRef Полный текст | Google Scholar
32. Кониджети Г.Г., Шриме М.Г., Анантакришнан А.Н., Чан А.Т.Анализ экономической эффективности хромоэндоскопии для наблюдения за колоректальным раком у пациентов с язвенным колитом. Gastrointest Endosc (2014) 79: 455–65. DOI: 10.1016 / j.gie.2013.10.026
PubMed Аннотация | CrossRef Полный текст | Google Scholar
33. Гасиа М.Ф., Гош С., Паначчоне Р., Ферраз Дж. Г., Каплан Г. Г., Леунг И. и др. Прицельная биопсия позволяет выявлять большую долю пациентов с неоплазией толстой кишки, которым проводится колоноскопия высокого разрешения, хромоэндоскопия с использованием красителя или электронная виртуальная хромоэндоскопия. Clin Gastroenterol Hepatol (2016) 14: 704–12.e4. DOI: 10.1016 / j.cgh.2015.12.047
PubMed Аннотация | CrossRef Полный текст | Google Scholar
34. Омидвари А.Х., Мистер Р.Г., Лансдорп-Фогелаар И. Экономическая эффективность эпиднадзора за раком желудочно-кишечного тракта. Best Practices Clin Gastroenterol (2016) 30: 879–91. DOI: 10.1016 / j.bpg.2016.09.001
PubMed Аннотация | CrossRef Полный текст | Google Scholar
35. Херлстон Д.П., Сандерс Д.С., Макалиндон М.Э., Томсон М., Кросс СС.Хромоскопическая колоноскопия с большим увеличением при язвенном колите: действенный инструмент для оптической биопсии in vivo и оценки степени заболевания. Эндоскопия (2006) 38: 1213–7. DOI: 10.1055 / с-2006-944732
PubMed Аннотация | CrossRef Полный текст | Google Scholar
36. Леонг Р.В., Оои М., Корте С., Яу И., Кермин М., Кателарис П.Х. и др. Эндоскопия полного спектра улучшает наблюдение за дисплазией у пациентов с воспалительными заболеваниями кишечника. Гастроэнтерология (2017) 152: 1337–44.e3. DOI: 10.1053 / j.gastro.2017.01.008
PubMed Аннотация | CrossRef Полный текст | Google Scholar
37. Велайос Ф, Катпалия П., Финлейсон Э. Изменение парадигм в выявлении дисплазии и ведении пациентов с воспалительным заболеванием кишечника: все еще необходима колэктомия? Гастроэнтерология (2017) 152: 440–50.e1. DOI: 10.1053 / j.gastro.2016.10.006
CrossRef Полный текст | Google Scholar
38. Soetikno R, Kaltenbach T, McQuaid KR, Subramanian V, Kumar R, Barkun AN, et al.Смена парадигмы в наблюдении и лечении дисплазии при воспалительном заболевании кишечника (запад). Dig Endosc (2016) 28: 266–73. DOI: 10.1111 / den.12634
PubMed Аннотация | CrossRef Полный текст | Google Scholar
39. Марион Дж. Ф., Сэндс БЭ. Консенсусное заявление SCENIC о наблюдении и лечении дисплазии при воспалительном заболевании кишечника: похвала и слова предостережения. Гастроэнтерология (2015) 148: 462–7. DOI: 10.1053 / j.gastro.2015.01.029
CrossRef Полный текст | Google Scholar
40.Гетц М., Малек Н.П., Кисслих Р. Микроскопическая визуализация в эндоскопии: эндомикроскопия и эндоцитоскопия. Nat Rev Gastroenterol Hepatol (2014) 11: 11–8. DOI: 10.1038 / nrgastro.2013.134
PubMed Аннотация | CrossRef Полный текст | Google Scholar
42. Neumann H, Kiesslich R, Wallace MB, Neurath MF. Конфокальная лазерная эндомикроскопия: технические достижения и клиническое применение. Гастроэнтерология (2010) 139: 388–92, 392.e1–2. DOI: 10.1053 / j.gastro.2010.06.029
CrossRef Полный текст | Google Scholar
43.Нойманн Х., Виет М., Райтель М., Мудтер Дж., Кисслих Р., Нейрат М.Ф. Конфокальная лазерная эндомикроскопия для обнаружения in vivo интраэпителиальной неоплазии в полипах Пейтца-Йегерса. Эндоскопия (2010) 42 (Приложение 2): E139–40. DOI: 10.1055 / с-0029-1244052
CrossRef Полный текст | Google Scholar
44. Tontini GE, Mudter J, Vieth M, Atreya R, Gunther C., Zopf Y, et al. Конфокальная лазерная эндомикроскопия для дифференциальной диагностики язвенного колита и болезни Крона: пилотное исследование. Эндоскопия (2015) 47: 437–43. DOI: 10.1055 / с-0034-13
CrossRef Полный текст | Google Scholar
45. Кисслих Р., Бург Дж., Вьет М., Гнендигер Дж., Эндерс М., Делани П. и др. Конфокальная лазерная эндоскопия для диагностики интраэпителиальных новообразований и колоректального рака in vivo. Гастроэнтерология (2004) 127: 706–13. DOI: 10.1053 / j.gastro.2004.06.050
PubMed Аннотация | CrossRef Полный текст | Google Scholar
46. Беккер В., фон Делиус С., Байбуж М., Карагианни А., Шмид Р.М., Майнинг А.Внутривенное применение флуоресцеина для конфокальной лазерной сканирующей микроскопии: оценка динамики контраста и качества изображения при увеличении времени от инъекции до визуализации. Gastrointest Endosc (2008) 68: 319–23. DOI: 10.1016 / j.gie.2008.01.033
PubMed Аннотация | CrossRef Полный текст | Google Scholar
48. Уоллес М.Б., Фоккенс П. Конфокальная лазерная эндомикроскопия с использованием зондов. Гастроэнтерология (2009) 136: 1509–13. DOI: 10.1053 / j.gastro.2009.03.034
CrossRef Полный текст | Google Scholar
49.Лю Дж, Длугош А., Нойман Х. Помимо эндоскопии в белом свете: роль оптической биопсии при воспалительном заболевании кишечника. World J Gastroenterol (2013) 19: 7544–51. DOI: 10.3748 / wjg.v19.i43.7544
PubMed Аннотация | CrossRef Полный текст | Google Scholar
50. Технологический комитет ASGE. Конфокальная лазерная эндомикроскопия. Gastrointest Endosc (2014) 80: 928–38.
Google Scholar
51. Бюхнер AM, Уоллес МБ. Эндомикроскопия и молекулярные инструменты для оценки воспалительного заболевания кишечника. Gastrointest Endosc Clin N Am (2016) 26: 657–68. DOI: 10.1016 / j.giec.2016.06.002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
52. Рат Т., Тонтини Г. Е., Нейрат М. Ф., Нойман Х. От поверхности к отдельной клетке: новые эндоскопические подходы при воспалительном заболевании кишечника. World J Gastroenterol (2015) 21: 11260–72. DOI: 10.3748 / wjg.v21.i40.11260
PubMed Аннотация | CrossRef Полный текст | Google Scholar
53. Neumann H, Vieth M, Atreya R, Neurath MF, Mudter J.Проспективная оценка кривой обучения конфокальной лазерной эндомикроскопии у пациентов с ВЗК. Histol Histopathol (2011) 26: 867–72. DOI: 10.14670 / HH-26.867
PubMed Аннотация | CrossRef Полный текст | Google Scholar
54. Чанг Дж., Ип М., Ян М., Вонг Б., Пауэр Т, Лин Л. и др. Кривая обучения, согласие между наблюдателями и внутри наблюдателя при эндоскопической конфокальной лазерной эндомикроскопии при оценке дефектов слизистого барьера. Gastrointest Endosc (2016) 83: 785–91.e1. DOI: 10.1016 / j.gie.2015.08.045
PubMed Аннотация | CrossRef Полный текст | Google Scholar
55. Kiesslich R, Goetz M, Angus EM, Hu Q, Guan Y, Potten C, et al. Выявление эпителиальных разрывов в тонком и толстом кишечнике человека с помощью конфокальной эндомикроскопии. Гастроэнтерология (2007) 133: 1769–78. DOI: 10.1053 / j.gastro.2007.09.011
PubMed Аннотация | CrossRef Полный текст | Google Scholar
56. Kiesslich R, Duckworth CA, Moussata D, Gloeckner A, Lim LG, Goetz M, et al.Дисфункция местного барьера, выявленная с помощью конфокальной лазерной эндомикроскопии, позволяет прогнозировать рецидив воспалительного заболевания кишечника. Кишечник (2012) 61: 1146–53. DOI: 10.1136 / gutjnl-2011-300695
PubMed Аннотация | CrossRef Полный текст | Google Scholar
57. Лю Дж. Дж., Мадсен К. Л., Буланже П., Дилеман Л. А., Меддингс Дж., Федорак Р. Н.. Обратите внимание на пробелы: конфокальная эндомикроскопия показала повышенную плотность эпителиальных щелей тонкой кишки при воспалительном заболевании кишечника. J Clin Gastroenterol (2011) 45: 240–5.DOI: 10.1097 / MCG.0b013e3181fbdb8a
PubMed Аннотация | CrossRef Полный текст | Google Scholar
58. Turcotte JF, Wong K, Mah SJ, Dieleman LA, Kao D, Kroeker K, et al. Увеличение эпителиальных щелей в тонкой кишке является предиктором госпитализации и хирургического вмешательства у пациентов с воспалительным заболеванием кишечника. Clin Transl Gastroenterol (2012) 3: e19. DOI: 10.1038 / ctg.2012.13
PubMed Аннотация | CrossRef Полный текст | Google Scholar
59. Лим Л.Г., Нойман Дж., Хансен Т., Гетц М., Хоффман А., Нейрат М.Ф. и др.Конфокальная эндомикроскопия выявляет потерю локальной барьерной функции в двенадцатиперстной кишке у пациентов с болезнью Крона и язвенным колитом. Воспаление кишечника (2014) 20: 892–900. DOI: 10.1097 / MIB.0000000000000027
PubMed Аннотация | CrossRef Полный текст | Google Scholar
60. Ватанабэ О, Андо Т., Маэда О, Хасэгава М., Исикава Д., Исигуро К. и др. Конфокальная эндомикроскопия у больных язвенным колитом. J Гастроэнтерол Hepatol (2008) 23 (Дополнение 2): S286–90.DOI: 10.1111 / j.1440-1746.2008.05559.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
61. Li CQ, Xie XJ, Yu T, Gu XM, Zuo XL, Zhou CJ, et al. Классификация активности воспаления при язвенном колите методом конфокальной лазерной эндомикроскопии. Am J Gastroenterol (2010) 105: 1391–6. DOI: 10.1038 / ajg.2009.664
PubMed Аннотация | CrossRef Полный текст | Google Scholar
62. Нойманн Х., Вьет М., Атрея Р., Грауэр М., Зиблер Дж., Бернатик Т. и др.Оценка активности болезни Крона с помощью конфокальной лазерной эндомикроскопии. Воспаление кишечника (2012) 18: 2261–9. DOI: 10.1002 / ibd.22907
PubMed Аннотация | CrossRef Полный текст | Google Scholar
63. Кисслих Р., Гетц М., Ламмерсдорф К., Шнайдер С., Бург Дж., Штольте М. и др. Эндомикроскопия под контролем хромоскопии увеличивает диагностическую ценность интраэпителиальной неоплазии при язвенном колите. Гастроэнтерология (2007) 132: 874–82. DOI: 10.1053 / j.gastro.2007.01.048
PubMed Аннотация | CrossRef Полный текст | Google Scholar
64. Херлстон Д.П., Томсон М., Браун С., Тиффин Н., Кросс С.С., Хантер М.Д. Конфокальная эндомикроскопия при язвенном колите: дифференциация опухолевого образования, связанного с дисплазией, и аденомоподобного образования. Clin Gastroenterol Hepatol (2007) 5: 1235–41. DOI: 10.1016 / j.cgh.2007.06.003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
65. van den Broek FJ, van Es JA, van Eeden S, Stokkers PC, Ponsioen CY, Reitsma JB, et al.Экспериментальное исследование конфокальной лазерной эндомикроскопии на основе зондов при колоноскопическом наблюдении за пациентами с давним язвенным колитом. Эндоскопия (2011) 43: 116–22. DOI: 10.1055 / с-0030-1255954
PubMed Аннотация | CrossRef Полный текст | Google Scholar
66. Де Пальма Г.Д., Стайбано С., Сицилиано С., Майоне Ф., Сиано М., Эспозито Д. и др. In-vivo характеристика DALM при язвенном колите с помощью конфокальной лазерной эндомикроскопии с высоким разрешением. World J Gastroenterol (2011) 17: 677–80.DOI: 10.3748 / wjg.v17.i5.677
PubMed Аннотация | CrossRef Полный текст | Google Scholar
67. Wanders LK, Kuiper T., Kiesslich R, Karstensen JG, Leong RW, Dekker E, et al. Ограниченная применимость конфокальной лазерной эндомикроскопии под контролем хромоэндоскопии в качестве стратегии повседневного наблюдения при болезни Крона. Gastrointest Endosc (2016) 83: 966–71. DOI: 10.1016 / j.gie.2015.09.001
PubMed Аннотация | CrossRef Полный текст | Google Scholar
69. Махмуд У.Подходы к оптической молекулярной визуализации при колоректальном раке. Гастроэнтерология (2010) 138: 419–22. DOI: 10.1053 / j.gastro.2009.12.014
CrossRef Полный текст | Google Scholar
74. Гетц М., Ван Т.Д. Молекулярная визуализация в эндоскопии желудочно-кишечного тракта. Гастроэнтерология (2010) 138: 828–33.e1. DOI: 10.1053 / j.gastro.2010.01.009
CrossRef Полный текст | Google Scholar
75. Мартен К., Бремер К., Хазайе К., Самени М., Слоан Б., Тунг Ч. и др.Обнаружение диспластических аденом кишечника с помощью чувствительных к ферментам молекулярных маяков у мышей. Гастроэнтерология (2002) 122: 406–14. DOI: 10.1053 / gast.2002.30990
PubMed Аннотация | CrossRef Полный текст | Google Scholar
76. Урано Й, Асанума Д., Хама Й, Кояма Й, Барретт Т., Камия М. и др. Селективная молекулярная визуализация жизнеспособных раковых клеток с помощью pH-активируемых флуоресцентных зондов. Nat Med (2009) 15: 104–9. DOI: 10,1038 / нм 1854
PubMed Аннотация | CrossRef Полный текст | Google Scholar
77.Атрея Р., Вальднер М.Дж., Нейрат М.Ф. Молекулярная визуализация: взаимодействие фундаментальной и клинической науки. Gastroenterol Clin North Am (2010) 39: 911–22. DOI: 10.1016 / j.gtc.2010.08.025
PubMed Аннотация | CrossRef Полный текст | Google Scholar
78. Keller R, Winde G, Terpe HJ, Foerster EC, Domschke W. Флуоресцентная эндоскопия с использованием меченного флуоресцеином моноклонального антитела против карциноэмбрионального антигена у пациентов с колоректальной карциномой и аденомой. Эндоскопия (2002) 34: 801–7.DOI: 10,1055 / с-2002-34254
PubMed Аннотация | CrossRef Полный текст | Google Scholar
79. Messmann H, Endlicher E, Freunek G, Rummele P, Scholmerich J, Knuchel R. Флуоресцентная эндоскопия для обнаружения дисплазии низкой и высокой степени при язвенном колите с использованием системной или локальной сенсибилизации 5-аминолаэвулиновой кислотой. Кишечник (2003) 52: 1003–7. DOI: 10.1136 / gut.52.7.1003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
80. Мицунага М., Косака Н., Чойк П.Л., Янг М.Р., Декстрас С.Р., Сауд С.М. и др.Флуоресцентное эндоскопическое обнаружение рака толстой кишки, связанного с колитом у мышей, с помощью местного применения ферментативно быстро активируемого зонда. Кишечник (2013) 62: 1179–86. DOI: 10.1136 / gutjnl-2011-301795
PubMed Аннотация | CrossRef Полный текст | Google Scholar
81. Аленкар Х., Фуновикс М.А., Фигейредо Дж., Савая Х., Вайследер Р., Махмуд У. Аденокарциномы толстой кишки: микрокатетерная визуализация в ближнем инфракрасном диапазоне с помощью интеллектуальных зондов для раннего обнаружения – исследование на мышах. Радиология (2007) 244: 232–8.DOI: 10.1148 / radiol.2441052114
CrossRef Полный текст | Google Scholar
82. Лю З., Миллер С.Дж., Джоши Б.П., Ван Т.Д. In vivo нацеливание на дисплазию толстой кишки с помощью флуоресцентной эндоскопии с октапептидом ближнего инфракрасного диапазона. Кишечник (2013) 62: 395–403. DOI: 10.1136 / gutjnl-2011-301913
PubMed Аннотация | CrossRef Полный текст | Google Scholar
83. Goetz M, Ziebart A, Foersch S, Vieth M, Waldner MJ, Delaney P, et al. Молекулярная визуализация in vivo колоректального рака с конфокальной эндомикроскопией путем нацеливания на рецептор эпидермального фактора роста. Гастроэнтерология (2010) 138: 435–46. DOI: 10.1053 / j.gastro.2009.10.032
PubMed Аннотация | CrossRef Полный текст | Google Scholar
84. Foersch S, Kiesslich R, Waldner MJ, Delaney P, Galle PR, Neurath MF, et al. Молекулярная визуализация VEGF при раке желудочно-кишечного тракта in vivo с использованием конфокальной лазерной эндомикроскопии. Кишечник (2010) 59: 1046–55. DOI: 10.1136 / gut.2009.202986
PubMed Аннотация | CrossRef Полный текст | Google Scholar
85. Goetz M, Hoetker MS, Diken M, Galle PR, Kiesslich R.Молекулярная визуализация in vivo с использованием цетуксимаба, антитела против EGFR, для прогнозирования ответа в моделях ксенотрансплантата колоректального рака человека. Эндоскопия (2013) 45: 469–77. DOI: 10.1055 / с-0032-1326361
PubMed Аннотация | CrossRef Полный текст | Google Scholar
86. Hsiung P-L, Hardy J, Friedland S, Soetikno R, Du CB, Wu AP, et al. Выявление дисплазии толстой кишки in vivo с использованием целевого гептапептида и конфокальной микроэндоскопии. Nat Med (2008) 14: 454–8. DOI: 10.1038 / нм 1692
PubMed Аннотация | CrossRef Полный текст | Google Scholar
87. Burggraaf J, Kamerling IM, Gordon PB, Schrier L, de Kam ML, Kales AJ, et al. Обнаружение колоректальных полипов у людей с использованием внутривенно вводимого флуоресцентного пептида, направленного против c-Met. Nat Med (2015) 21: 955–61. DOI: 10,1038 / нм.3641
PubMed Аннотация | CrossRef Полный текст | Google Scholar
88. Джоши Б.П., Дай З., Гао З., Ли Дж. Х., Гимире Н., Чен Дж. И др.Обнаружение сидячих зубчатых аденом в проксимальном отделе толстой кишки с помощью флуоресцентной эндоскопии с широким полем зрения. Гастроэнтерология (2017) 152: 1002–13.e9. DOI: 10.1053 / j.gastro.2016.12.009
PubMed Аннотация | CrossRef Полный текст | Google Scholar
89. Джоши Б.П., Пант А., Дуан Х, Прабху А., Вамстекер Э.Дж., Квон Р.С. и др. Мультимодальный видеоколоноскоп для целенаправленного широкоугольного обнаружения неполипоидной колоректальной неоплазии. Гастроэнтерология (2016) 150: 1084–6. DOI: 10.1053 / j.гастро.2016.02.075
CrossRef Полный текст | Google Scholar
90. Атрейя Р., Нойманн Х., Нойферт С., Вальднер М.Дж., Бильмейер Ю., Цопф Ю. и др. Визуализация in vivo с использованием флуоресцентных антител к фактору некроза опухоли позволяет прогнозировать терапевтический ответ при болезни Крона. Nat Med (2014) 20: 313–8. DOI: 10,1038 / нм 3462
PubMed Аннотация | CrossRef Полный текст | Google Scholar
91. Атрея Р., Циммер М., Бартч Б., Вальднер М.Дж., Атрея И., Нойманн Х. и др. Антитела против фактора некроза опухоли (TNF) вызывают апоптоз Т-клеток у пациентов с воспалительными заболеваниями кишечника через рецептор 2 TNF и кишечные макрофаги CD14 + . Гастроэнтерология (2011) 141: 2026–38. DOI: 10.1053 / j.gastro.2011.08.032
PubMed Аннотация | CrossRef Полный текст | Google Scholar
92. Рат Т., Боярски С., Нейрат М.Ф., Атрея Р. Молекулярная визуализация экспрессии интегрина альфа4бета7 слизистой оболочки с флуоресцентным антиадгезионным антителом ведолизумабом при болезни Крона. Gastrointest Endosc (2017) 86: 406–8. DOI: 10.1016 / j.gie.2017.01.012
CrossRef Полный текст | Google Scholar
93. Хорстхуис К., Бипат С., Беннинк Р. Дж., Стокер Дж.Воспалительное заболевание кишечника, диагностированное с помощью УЗИ, МРТ, сцинтиграфии и КТ: метаанализ проспективных исследований. Радиология (2008) 247: 64–79. DOI: 10.1148 / radiol.2471070611
PubMed Аннотация | CrossRef Полный текст | Google Scholar
94. Анупинди С.А., Гроссман А.Б., Нимкин К., Мамула П., Джи М.С. Визуализация при обследовании молодого пациента с воспалительным заболеванием кишечника: что нужно знать гастроэнтерологу. J Pediatr Gastroenterol Nutr (2014) 59: 429–39.DOI: 10.1097 / MPG.0000000000000475
PubMed Аннотация | CrossRef Полный текст | Google Scholar
96. Римола Дж., Ордас И., Родригес С., Гарсия-Бош О., Асейтуно М., Ллах Дж. И др. Магнитно-резонансная томография для оценки болезни Крона: проверка параметров тяжести и количественного показателя активности. Воспаление кишечника (2011) 17: 1759–68. DOI: 10.1002 / ibd.21551
PubMed Аннотация | CrossRef Полный текст | Google Scholar
97. Панес Дж., Бухник Й., Рейниш В., Стокер Дж., Тейлор С.А., Баумгарт Д.К. и др.Методы визуализации для оценки воспалительного заболевания кишечника: совместные согласованные рекомендации ECCO и ESGAR, основанные на фактических данных. J Crohns Colitis (2013) 7: 556–85. DOI: 10.1016 / j.crohns.2013.02.020
PubMed Аннотация | CrossRef Полный текст | Google Scholar
98. Паренте Ф, Греко С., Молтени М., Кучино С., Макони Дж., Сампьетро Г.М. и др. Роль раннего ультразвука в выявлении воспалительных заболеваний кишечника и определении их анатомического расположения в кишечнике. Aliment Pharmacol Ther (2003) 18: 1009–16.DOI: 10.1046 / j.1365-2036.2003.01796.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
99. Усала А., Лоран В., Брюот О., Брессенот А., Бигард М.А., Регент Д. и др. Диффузионно-взвешенный магнитный резонанс без подготовки кишечника для выявления воспаления толстой кишки при воспалительном заболевании кишечника. Кишечник (2010) 59: 1056–65. DOI: 10.1136 / gut.2009.197665
PubMed Аннотация | CrossRef Полный текст | Google Scholar
100. Waldner MJ, Knieling F, Egger C, Morscher S, Claussen J, Vetter M, et al.Мультиспектральная оптоакустическая томография при болезни Крона: неинвазивная визуализация активности болезни. Гастроэнтерология (2016) 151: 238–40. DOI: 10.1053 / j.gastro.2016.05.047
CrossRef Полный текст | Google Scholar
101. Книлинг Ф., Нойферт С., Хартманн А., Клауссен Дж., Урих А., Эггер С. и др. Мультиспектральная оптоакустическая томография для оценки активности болезни Крона. N Engl J Med (2017) 376: 1292–4. DOI: 10.1056 / NEJMc1612455
CrossRef Полный текст | Google Scholar
102.Тирни Г.Дж., Брезински М.Э., Саузерн Дж.Ф., Баума Б.Е., Боппарт С.А., Фудзимото Дж.Г. Оптическая биопсия желудочно-кишечной ткани человека с использованием оптической когерентной томографии. Am J Gastroenterol (1997) 92: 1800–4.
PubMed Аннотация | Google Scholar
103. Шен Б., Цуккаро Г., Грамлих Т.Л., Гладкова Н., Лашнер Б.А., Делани С.П. и др. Ex vivo коррелированная с гистологией оптическая когерентная томография в обнаружении трансмурального воспаления при болезни Крона. Clin Gastroenterol Hepatol (2004) 2: 754–60.DOI: 10.1016 / S1542-3565 (04) 00346-5
PubMed Аннотация | CrossRef Полный текст | Google Scholar
104. Шен Б., Зуккаро Дж. Мл., Грамлих Т.Л., Гладкова Н., Тролли П., Карета М. и др. Колоноскопическая оптическая когерентная томография in vivo для трансмурального воспаления при воспалительном заболевании кишечника. Clin Gastroenterol Hepatol (2004) 2: 1080–7. DOI: 10.1016 / S1542-3565 (04) 00346-5
PubMed Аннотация | CrossRef Полный текст | Google Scholar
106. Rogart JN, Nagata J, Loeser CS, Roorda RD, Aslanian H, Robert ME, et al.Мультифотонная визуализация может использоваться для микроскопического исследования интактной слизистой оболочки желудочно-кишечного тракта человека ex vivo. Clin Gastroenterol Hepatol (2008) 6: 95–101. DOI: 10.1016 / j.cgh.2007.10.008
PubMed Аннотация | CrossRef Полный текст | Google Scholar
107. Safdarian N, Liu Z, Zhou X, Appelman H, Nostrant TT, Wang TD, et al. Количественное определение эозинофилов человека с использованием трехмерных объемных изображений, полученных с помощью многофотонной флуоресцентной микроскопии. Гастроэнтерология (2012) 142: 15–20.e1. DOI: 10.1016 / S0016-5085 (12) 60411-9
CrossRef Полный текст | Google Scholar
108. Schurmann S, Foersch S, Atreya R, Neumann H, Friedrich O, Neurath MF, et al. Визуализация воспалительного заболевания кишечника без маркировки с помощью многофотонной микроскопии. Гастроэнтерология (2013) 145: 514–6. DOI: 10.1053 / j.gastro.2013.06.054
CrossRef Полный текст | Google Scholar
109. Ривера Д. Р., Браун С. М., Узунов Д. Г., Павлова И., Кобат Д., Уэбб В. В. и др. Компактный и гибкий многофотонный эндоскоп с растровым сканированием, позволяющий визуализировать неокрашенные ткани. Proc Natl Acad Sci U S. A (2011) 108: 17598–603. DOI: 10.1073 / pnas.1114746108
PubMed Аннотация | CrossRef Полный текст | Google Scholar
110. Дуан Х, Ли Х, Цю З., Джоши Б.П., Пант А, Смит А. и др. Многофотонный эндомикроскоп на основе МЭМС для повторной визуализации толстой кишки мышей. Biomed Opt Express (2015) 6: 3074–83. DOI: 10.1364 / BOE.6.003074
PubMed Аннотация | CrossRef Полный текст | Google Scholar
111. Петри Р., Шмитт М., Попп Дж.Рамановская спектроскопия – перспективный инструмент в науках о жизни. Chemphyschem (2003) 4: 14–30. DOI: 10.1002 / cphc.2003
CrossRef Полный текст | Google Scholar
112. Би Х, Уолш А., Махадеван-Янсен А., Херлин А. Разработка спектральных маркеров для распознавания язвенного колита и болезни Крона с использованием рамановской спектроскопии. Dis Colon Rectum (2011) 54: 48–53. DOI: 10.1007 / DCR.0b013e3181fcf68d
PubMed Аннотация | CrossRef Полный текст | Google Scholar
113.Белецкий С., Боклитц Т.В., Шмитт М., Краффт С., Марквардт С., Гарби А. и др. Классификация воспалительных заболеваний кишечника с помощью спектроскопии комбинационного рассеяния света клеток эпителия. Дж. Биомед Опт (2012) 17: 076030. DOI: 10.1117 / 1.JBO.17.7.076030
PubMed Аннотация | CrossRef Полный текст | Google Scholar
114. Аддис Дж., Мохаммед Н., Ротими О., Маги Д., Джа А., Субраманиан В. Рамановская спектроскопия эндоскопической биопсии толстой кишки у пациентов с язвенным колитом для выявления воспаления слизистой оболочки и заживления. Biomed Opt Express (2016) 7: 2022–35. DOI: 10.1364 / BOE.7.002022
PubMed Аннотация | CrossRef Полный текст | Google Scholar
115. Пенс И.Дж., Болье Д.Б., Хорст С.Н., Би X, Херлин А.Дж., Шварц Д.А. и др. Клиническая характеристика воспалительного заболевания кишечника in vivo с помощью рамановской спектроскопии. Biomed Opt Express (2017) 8: 524–35. DOI: 10.1364 / BOE.8.000524
PubMed Аннотация | CrossRef Полный текст | Google Scholar
116. Краффт С., Шмитт М., Ши И.В., Сиалла-Май Д., Маттаус С., Боклитц Т. и др.Молекулярная визуализация биологических клеток и тканей без меток методами линейной и нелинейной спектроскопии комбинационного рассеяния. Angew Chem Int Ed Engl (2017) 56: 4392–430. DOI: 10.1002 / anie.201607604
PubMed Аннотация | CrossRef Полный текст | Google Scholar
117. Чернавская О., Хеуке С., Вьет М., Фридрих О., Шурманн С., Атрея Р. и др. Помимо эндоскопической оценки воспалительного заболевания кишечника: гистология активности заболевания в режиме реального времени с помощью нелинейной мультимодальной визуализации. Sci Rep (2016) 6: 29239.DOI: 10.1038 / srep29239
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Аутофагия: роль в гомеостазе и воспалении слизистой оболочки кишечника | Журнал биомедицинских наук
Каур Дж, Дебнат Дж. Аутофагия на перекрестке катаболизма и анаболизма. Nat Rev Mol Cell Biol. 2015; 16 (8): 461–72.
CAS PubMed Статья Google ученый
Boya P, Reggiori F, Codogno P.Возникающая регуляция и функции аутофагии. Nat Cell Biol. 2013; 15 (7): 713–20.
CAS PubMed Статья Google ученый
Эльшаер Д., Бегун Дж. Роль барьерной функции, аутофагии и цитокинов в поддержании гомеостаза кишечника. Semin Cell Dev Biol. 2017; 61: 51–9.
CAS PubMed Статья Google ученый
Кларк С.Г., Грейбил Л.Л., Бхаттачарджи С., Томас С., Бхаттачарья С., Кокс Д.Н.Базальная аутофагия необходима для стимуляции ветвления терминального дендрита в сенсорных нейронах дрозофилы. PLoS One. 2018; 13 (11): e0206743.
PubMed PubMed Central Статья Google ученый
Randall-Demllo S, Chieppa M, Eri R. Кишечный эпителий и аутофагия: партнеры в гомеостазе кишечника. Фронт Иммунол. 2013; 4: 301.
PubMed PubMed Central Статья CAS Google ученый
Айзенберг-Лернер А., Бялик С., Саймон Х.Ю., Кимчи А. Партнеры по жизни и смерти: апоптоз, аутофагия и перекрестный разговор между ними. Смерть клетки отличается. 2009. 16 (7): 966–75.
CAS PubMed Статья Google ученый
Xavier RJ, Подольский ДК. Раскрытие патогенеза воспалительного заболевания кишечника. Природа. 2007. 448 (7152): 427–34.
CAS PubMed Статья Google ученый
Кухарзик Т., Маазер С., Люгеринг А., Кагнофф М., Майер Л., Тарган С. и др. Недавнее понимание патогенеза ВЗК: значение для будущих методов лечения. Воспаление кишечника. 2006. 12 (11): 1068–83.
PubMed Статья Google ученый
Hampe J, Franke A., Rosenstiel P, Till A, Teuber M, Huse K, et al. Полногеномное сканирование ассоциации несинонимичных SNP идентифицирует вариант восприимчивости к болезни Крона в ATG16L1.Нат Жене. 2007. 39 (2): 207–11.
CAS PubMed PubMed Central Статья Google ученый
Li WW, Li J, Bao JK. Микроаутофагия: малоизвестное самопоедание. Cell Mol Life Sci. 2012. 69 (7): 1125–36.
CAS PubMed Статья Google ученый
Ке П., Шао Б.З., Сюй З.К., Чен С.В., Лю С. Кишечная аутофагия и ее фармакологический контроль при воспалительном заболевании кишечника.Фронт Иммунол. 2016; 7: 695.
PubMed Google ученый
Ян З., Клионский DJ. Аутофагия млекопитающих: основной молекулярный механизм и регуляция сигналов. Curr Opin Cell Biol. 2010. 22 (2): 124–31.
CAS PubMed Статья Google ученый
Ким Дж., Кунду М., Виоллет Б., Гуан К.Л. AMPK и mTOR регулируют аутофагию посредством прямого фосфорилирования Ulk1.Nat Cell Biol. 2011; 13 (2): 132–41.
CAS PubMed PubMed Central Статья Google ученый
Бенто С.Ф., Ренна М., Гислат Дж., Пури С., Ашкенази А., Вичинанза М. и др. Аутофагия млекопитающих: как это работает? Анну Рев Биохим. 2016; 85: 685–713.
CAS PubMed Статья Google ученый
Рассел Р.К., Тиан Й., Юань Х., Пак Х.В., Чанг Й.Й., Ким Дж. И др.ULK1 вызывает аутофагию, фосфорилируя Beclin-1 и активируя липидкиназу VPS34. Nat Cell Biol. 2013; 15 (7): 741–50.
CAS PubMed PubMed Central Статья Google ученый
Сако-Накатогава М., Матоба К., Асаи Э., Кирисако Х., Исии Дж., Нода Н.Н. и др. Конъюгат Atg12-Atg5 усиливает активность E2 Atg3 путем перестройки его каталитического сайта. Nat Struct Mol Biol. 2013; 20 (4): 433–9.
CAS PubMed Статья Google ученый
Glick D, Barth S, Macleod KF. Аутофагия: клеточные и молекулярные механизмы. J Pathol. 2010. 221 (1): 3–12.
CAS PubMed PubMed Central Статья Google ученый
Ламарк Т., Свеннинг С., Йохансен Т. Регулирование избирательной аутофагии: парадигма p62 / SQSTM1. Очерки Биохимии. 2017; 61 (6): 609–24.
PubMed Статья Google ученый
Нисида Ю., Аракава С., Фудзитани К., Ямагути Х., Мизута Т., Канасеки Т. и др. Открытие Atg5 / Atg7-независимой альтернативной макроаутофагии. Природа. 2009. 461 (7264): 654–8.
CAS PubMed Статья Google ученый
Лассен К.Г., Ксавье Р.Дж. Механизмы и функция аутофагии при кишечных заболеваниях. Аутофагия. 2018; 14 (2): 216–20.
CAS PubMed PubMed Central Статья Google ученый
Verschuere S, Allais L, Bracke KR, Lippens S, De Smet R, Vandenabeele P и др. Сигаретный дым и подвздошная кишка: усиление аутофагии в эпителии, ассоциированном с фолликулами мыши, и пейеровых бляшках. Histochem Cell Biol. 2012. 137 (3): 293–301.
CAS PubMed Статья Google ученый
Levine B, Mizushima N, Virgin HW. Аутофагия при иммунитете и воспалении. Природа. 2011. 469 (7330): 323–35.
CAS PubMed PubMed Central Статья Google ученый
Бенджамин Дж. Л., Самптер Р. Младший, Левин Б., Хупер Л. В.. Кишечная эпителиальная аутофагия необходима для защиты хозяина от инвазивных бактерий. Клеточный микроб-хозяин. 2013. 13 (6): 723–34.
CAS PubMed PubMed Central Статья Google ученый
Ливи О. Иммунология слизистой оболочки: аутофагия помогает преодолеть барьеры. Nat Rev Immunol. 2013; 13 (7): 470.
PubMed Статья CAS Google ученый
Чанг СИ, Ли С.Н., Ян Дж.Й., Ким Д.В., Юн Дж.Х., Ко Х.Дж. и др. Аутофагия контролирует внутреннюю защиту хозяина от бактерий, способствуя выживанию эпителиальных клеток: модель на мышах. PLoS One. 2013; 8 (11): e81095.
PubMed PubMed Central Статья CAS Google ученый
Li YY, Ishihara S, Aziz MM, Oka A, Kusunoki R, Tada Y, et al. Аутофагия необходима для продукции интерлейкина-8, опосредованной толл-подобными рецепторами, в эпителиальных клетках кишечника.Int J Mol Med. 2011. 27 (3): 337–44.
PubMed Google ученый
Fujishima Y, Nishiumi S, Masuda A, Inoue J, Nguyen NM, Irino Y, et al. Аутофагия в кишечном эпителии снижает вызванные эндотоксинами воспалительные реакции, ингибируя активацию NF-kappaB. Arch Biochem Biophys. 2011. 506 (2): 223–35.
CAS PubMed Статья Google ученый
Nighot PK, Hu CA, Ma TY. Аутофагия усиливает барьерную функцию плотных контактов кишечного эпителия, нацеливаясь на деградацию белка клаудина-2. J Biol Chem. 2015; 290 (11): 7234–46.
CAS PubMed PubMed Central Статья Google ученый
Yang Y, Li W, Sun Y, Han F, Hu CA, Wu Z. Аминокислотная депривация нарушает барьерную функцию и вызывает защитную аутофагию в эпителиальных клетках кишечника свиней. Аминокислоты.2015; 47 (10): 2177–84.
CAS PubMed Статья Google ученый
Фен И, Ван И, Ван П., Хуанг И, Ван Ф. Короткоцепочечные жирные кислоты проявляют стимулирующее и защитное действие на функцию кишечного барьера за счет ингибирования инфламмасомы NLRP3 и аутофагии. Cell Physiol Biochem. 2018; 49 (1): 190–205.
CAS PubMed Статья Google ученый
Каллен Т.В., Скофилд В.Б., Барри Н.А., Патнэм Е.Е., Рунделл Е.А., Трент М.С. и др. Микробиота кишечника. Устойчивость к антимикробным пептидам опосредует устойчивость заметных кишечных комменсалов во время воспаления. Наука. 2015; 347 (6218): 170–5.
CAS PubMed PubMed Central Статья Google ученый
Cadwell K, Liu JY, Brown SL, Miyoshi H, Loh J, Lennerz JK, et al. Ключевая роль аутофагии и гена аутофагии Atg16l1 в кишечных клетках Панета мыши и человека.Природа. 2008. 456 (7219): 259–63.
CAS PubMed PubMed Central Статья Google ученый
Wittkopf N, Gunther C, Martini E, Waldner M, Amann KU, Neurath MF, et al. Отсутствие кишечного эпителия atg7 влияет на образование гранул панетических клеток, но не ставит под угрозу иммунный гомеостаз в кишечнике. Clin Dev Immunol. 2012; 2012: 278059.
PubMed PubMed Central Статья Google ученый
Cabrera S, Fernandez AF, Marino G, Aguirre A, Suarez MF, Espanol Y, et al. ATG4B / аутофагин-1 регулирует гомеостаз кишечника и защищает мышей от экспериментального колита. Аутофагия. 2013; 9 (8): 1188–200.
CAS PubMed PubMed Central Статья Google ученый
Лассен К.Г., Кубалла П., Конвей К.Л., Патель К.К., Беккер С.Е., Пелокин Дж.М. и др. Вариант Atg16L1 T300A снижает избирательную аутофагию, что приводит к изменению передачи сигналов цитокинов и снижению антибактериальной защиты.Proc Natl Acad Sci U S. A. 2014; 111 (21): 7741–6.
CAS PubMed PubMed Central Статья Google ученый
Bel S, Pendse M, Wang Y, Li Y, Ruhn KA, Hassell B и др. Клетки Панета секретируют лизоцим посредством секреторной аутофагии во время бактериальной инфекции кишечника. Наука. 2017; 357 (6355): 1047–52.
CAS PubMed PubMed Central Статья Google ученый
Hodin CM, Lenaerts K, Grootjans J, de Haan JJ, Hadfoune M, Verheyen FK, et al. Голод ставит под угрозу клетки Панета. Am J Pathol. 2011. 179 (6): 2885–93.
CAS PubMed PubMed Central Статья Google ученый
Baxt LA, Xavier RJ. Роль аутофагии в поддержании гомеостаза кишечника. Гастроэнтерология. 2015. 149 (3): 553–62.
PubMed PubMed Central Статья Google ученый
Дхармани П., Шривастава В., Киссун-Сингх В., Чейди К. Роль кишечных муцинов во врожденных механизмах защиты хозяина от патогенов. J. Врожденный иммунитет. 2009. 1 (2): 123–35.
CAS PubMed Статья Google ученый
Tytgat KM, Buller HA, Opdam FJ, Kim YS, Einerhand AW, Dekker J. Биосинтез муцина толстой кишки человека: Muc2 является известным секреторным муцином. Гастроэнтерология. 1994. 107 (5): 1352–63.
CAS PubMed Статья Google ученый
Van der Sluis M, De Koning BA, De Bruijn AC, Velcich A, Meijerink JP, Van Goudoever JB, et al. У мышей с дефицитом Muc2 спонтанно развивается колит, что указывает на то, что MUC2 имеет решающее значение для защиты толстой кишки. Гастроэнтерология. 2006. 131 (1): 117–29.
PubMed Статья CAS Google ученый
Hasnain SZ, Wang H, Ghia JE, Haq N, Deng Y, Velcich A, et al. Дефицит гена муцина у мышей снижает устойчивость хозяина к кишечной паразитарной инфекции.Гастроэнтерология. 2010. 138 (5): 1763–71.
CAS PubMed PubMed Central Статья Google ученый
Бергстром К.С., Киссун-Сингх В., Гибсон Д.Л., Ма К., Монтеро М., Шам ХП и др. Muc2 защищает от смертельного инфекционного колита, отделяя патогенные и комменсальные бактерии от слизистой оболочки толстой кишки. PLoS Pathog. 2010; 6 (5): e1000902.
PubMed PubMed Central Статья CAS Google ученый
Патель К.К., Миёси Х., Битти В.Л., руководитель отдела исследований, Малвин Н.П., Кэдвелл К. и др. Белки аутофагии контролируют функцию бокаловидных клеток, усиливая производство активных форм кислорода. EMBO J. 2013; 32 (24): 3130–44.
CAS PubMed PubMed Central Статья Google ученый
Wlodarska M, Thaiss CA, Nowarski R, Henao-Mejia J, Zhang JP, Brown EM, et al. Инфламмасома NLRP6 управляет интерфейсом кишечника хозяин-микроб, регулируя секрецию слизи бокаловидными клетками.Клетка. 2014. 156 (5): 1045–59.
CAS PubMed PubMed Central Статья Google ученый
Gunawardene AR, Corfe BM, Staton CA. Классификация и функции энтероэндокринных клеток нижнего отдела желудочно-кишечного тракта. Int J Exp Pathol. 2011. 92 (4): 219–31.
CAS PubMed PubMed Central Статья Google ученый
Эль-Салхи М., Гундерсен Д., Хатлебак Дж. Г., Хаускен Т.Хромогранин а клеточная плотность как диагностический маркер лимфоцитарного колита. Dig Dis Sci. 2012; 57 (12): 3154–9.
CAS PubMed PubMed Central Статья Google ученый
Worthington JJ. Кишечная иммуноэндокринная ось: новый перекрестный диалог между энтероэндокринными клетками и иммунной системой во время инфекции и воспалительного заболевания. Biochem Soc Trans. 2015; 43 (4): 727–33.
CAS PubMed PubMed Central Статья Google ученый
Эрнандес-Трехо Дж. А., Суарес-Перес Д., Гутьеррес-Мартинес И. З., Фернандес-Варгас О. Е., Серрано С., Канделарио-Мартинес А. А. и др. Провоспалительные цитокины IFNgamma / TNFalpha увеличивают хромогранин A-положительные нейроэндокринные клетки в эпителии толстой кишки. Биохим Дж. 2016; 473 (21): 3805–18.
CAS PubMed Статья Google ученый
Nagy P, Szatmari Z, Sandor GO, Lippai M, Hegedus K, Juhasz G. Drosophila Atg16 способствует дифференцировке энтероэндокринных клеток посредством регуляции передачи сигналов кишечной щели / Робо.Разработка. 2017; 144 (21): 3990–4001.
CAS PubMed Статья Google ученый
Ghia JE, Li N, Wang H, Collins M, Deng Y, El-Sharkawy RT, et al. Серотонин играет ключевую роль в патогенезе экспериментального колита. Гастроэнтерология. 2009. 137 (5): 1649–60.
CAS PubMed Статья Google ученый
Bischoff SC, Mailer R, Pabst O, Weier G, Sedlik W., Li Z, et al.Роль серотонина в воспалении кишечника: нокаут переносчика обратного захвата серотонина усугубляет колит 2,4,6-тринитробензолсульфоновой кислоты у мышей. Am J Physiol Gastrointest Liver Physiol. 2009; 296 (3): G685–95.
CAS PubMed Статья Google ученый
Soll C, Jang JH, Riener MO, Moritz W, Wild PJ, Graf R, et al. Серотонин способствует росту опухоли при гепатоцеллюлярном раке человека. Гепатология. 2010. 51 (4): 1244–54.
CAS PubMed Статья Google ученый
Имада Т., Накамура С., Хисамура Р., Изута Ю., Джин К., Ито М. и др. Серотонин гормонально регулирует секреторную функцию слезной железы через рецептор серотонина типа 3a. Научный доклад 2017; 7 (1): 6965.
PubMed PubMed Central Статья CAS Google ученый
Wu ZM, Zheng CH, Zhu ZH, Wu FT, Ni GL, Liang Y.SiRNA-опосредованный нокдаун переносчика серотонина в дорсальном ядре шва спасает одиночную длительную индуцированную стрессом аутофагию гиппокампа у крыс. J Neurol Sci. 2016; 360: 133–40.
CAS PubMed Статья Google ученый
Ли Дж., Келер Дж., Юста Б., Бахрами Дж., Мэтьюз Д., Рафии М. и др. Глюкагоноподобный пептид-2, полученный из энтероэндокрина, контролирует транспорт аминокислот в кишечнике. Mol Metab. 2017; 6 (3): 245–55.
CAS PubMed PubMed Central Статья Google ученый
Кабат А.М., Потт Дж., Малой К.Дж. Иммунная система слизистых оболочек и ее регуляция посредством аутофагии. Фронт Иммунол. 2016; 7: 240.
PubMed PubMed Central Статья CAS Google ученый
Zhao Z, Fux B, Goodwin M, Dunay IR, Strong D, Miller BC, et al. Независимая от аутофагосом важная функция белка аутофагии Atg5 в клеточном иммунитете к внутриклеточным патогенам. Клеточный микроб-хозяин. 2008. 4 (5): 458–69.
CAS PubMed PubMed Central Статья Google ученый
Li X, Ye Y, Zhou X, Huang C, Wu M. Atg7 усиливает защиту хозяина от инфекции за счет подавления супероксида, но усиления оксида азота. J Immunol. 2015; 194 (3): 1112–21.
CAS PubMed Статья Google ученый
Санджуан М.А., Диллон С.П., Тейт С.В., Мошиах С., Дорси Ф., Коннелл С. и др. Передача сигналов Toll-подобного рецептора в макрофагах связывает путь аутофагии с фагоцитозом. Природа. 2007. 450 (7173): 1253–7.
CAS PubMed Статья Google ученый
Марчиандо А.М., Раманан Д., Динг Й., Гомес Л.Е., Хаббард-Люси В.М., Маурер К. и др. Дефицит гена аутофагии Atg16L1 повышает устойчивость к кишечной бактериальной инфекции. Клеточный микроб-хозяин. 2013. 14 (2): 216–24.
CAS PubMed Статья Google ученый
Мартин П.К., Марчиандо А., Сюй Р., Руденски Е., Юнг Ф.Schuster SL, et al. Nat Microbiol: белки аутофагии подавляют передачу защитных сигналов интерферона I типа в ответ на микробиоту кишечника мышей; 2018.
Google ученый
Сайто Т., Фудзита Н., Джанг М.Х., Уэмацу С., Ян Б.Г., Сато Т. и др. Потеря белка аутофагии Atg16L1 увеличивает индуцированную эндотоксином продукцию IL-1beta. Природа. 2008. 456 (7219): 264–8.
CAS Статья Google ученый
Zhang H, Zheng L, McGovern DP, Hamill AM, Ichikawa R, Kanazawa Y, et al. Миелоид ATG16L1 способствует взаимодействию бактерий-хозяин в поддержании гомеостаза кишечника. J Immunol. 2017; 198 (5): 2133–46.
CAS PubMed PubMed Central Статья Google ученый
Zhang H, Zheng L, Chen J, Fukata M, Ichikawa R, Shih DQ, et al. Роль защиты Atg16l1 в дендритных клетках CD11c (+) при колите мышей. Иммунобиология.2017; 222 (7): 831–41.
CAS PubMed PubMed Central Статья Google ученый
Сами М., Лим Дж., Вершуерен Э., Боуман Дж. М., Пэн И., Вонг А. и др. Селективная аутофагия адаптера TRIF регулирует передачу сигналов врожденного воспаления. Nat Immunol. 2018; 19 (3): 246–54.
CAS PubMed Статья Google ученый
Strisciuglio C, Duijvestein M, Verhaar AP, Vos AC, van den Brink GR, Hommes DW, et al.Нарушение аутофагии приводит к аномальному взаимодействию дендритных клеток и эпителиальных клеток. Колит Дж. Крона. 2013; 7 (7): 534–41.
PubMed Статья Google ученый
Куни Р., Бейкер Дж., Брейн О, Данис Б., Пичулик Т., Аллан П. и др. Стимуляция NOD2 вызывает аутофагию в дендритных клетках, влияя на обработку бактерий и презентацию антигена. Nat Med. 2010. 16 (1): 90–7.
CAS PubMed Статья Google ученый
Ли Х.К., Маттей Л.М., Стейнберг Б.Е., Альбертс П., Ли Ю.Х., Червонский А. и др. Потребность in vivo в Atg5 при презентации антигена дендритными клетками. Иммунитет. 2010. 32 (2): 227–39.
CAS PubMed PubMed Central Статья Google ученый
Nimmerjahn F, Milosevic S, Behrends U, Jaffee EM, Pardoll DM, Bornkamm GW, et al. Главный комплекс гистосовместимости – ограниченная классом II презентация цитозольного антигена посредством аутофагии.Eur J Immunol. 2003. 33 (5): 1250–9.
CAS PubMed Статья Google ученый
Пуа Х.Х., Гуо Дж., Комацу М., Хе Ю.В. Аутофагия необходима для очистки митохондрий в зрелых Т-лимфоцитах. J Immunol. 2009. 182 (7): 4046–55.
CAS PubMed Статья Google ученый
Ковач Дж. Р., Ли К., Ян К., Ли Дж., Гарсия И. Г., Джу С. и др. Аутофагия способствует выживанию Т-клеток за счет деградации белков механизма гибели клеток.Смерть клетки отличается. 2012. 19 (1): 144–52.
CAS PubMed Статья Google ученый
Пулстон Д.Д., Чжан Х., Пауэлл Т.Дж., Липина Э., Симс С., Пансе I и др. Аутофагия является важным регулятором образования CD8 (+) Т-клеток памяти. Элиф. 2014; 3.
Кабат А.М., Харрисон О.Дж., Риффельмахер Т., Могхаддам А.Е., Пирсон К.Ф., Лейнг А. и др. Ген аутофагии Atg16l1 по-разному регулирует клетки Treg и Th3, чтобы контролировать воспаление кишечника.Элиф. 2016; 5: e12444.
PubMed PubMed Central Статья CAS Google ученый
Парех В.В., Ву Л., Бойд К.Л., Уильямс Дж. А., Гэдди Дж. А., Оливарес-Виллагомес Д. и др. Нарушение аутофагии, дефектный гомеостаз Т-клеток и синдром истощения у мышей с Т-клеточной делецией Vps34. J Immunol. 2013; 190 (10): 5086–101.
CAS PubMed PubMed Central Статья Google ученый
Пуа Х. Х., Джагалов И., Чак М., Мидзусима Н., Хе Ю. Критическая роль гена аутофагии Atg5 в выживании и пролиферации Т-клеток. J Exp Med. 2007. 204 (1): 25–31.
CAS PubMed PubMed Central Статья Google ученый
Conway KL, Kuballa P, Khor B, Zhang M, Shi HN, Virgin HW, et al. ATG5 регулирует дифференцировку плазматических клеток. Аутофагия. 2013. 9 (4): 528–37.
CAS PubMed PubMed Central Статья Google ученый
Chen M, Hong MJ, Sun H, Wang L, Shi X, Gilbert BE и др. Важная роль аутофагии в поддержании иммунологической памяти против инфекции гриппа. Nat Med. 2014; 20 (5): 503–10.
CAS PubMed PubMed Central Статья Google ученый
Pengo N, Scolari M, Oliva L, Milan E, Mainoldi F, Raimondi A, et al. Плазматическим клеткам требуется аутофагия для устойчивого производства иммуноглобулинов. Nat Immunol. 2013. 14 (3): 298–305.
CAS PubMed Статья Google ученый
Чен М., Кодали С., Джанг А., Куай Л., Ван Дж. Потребность в аутофагии при длительном сохранении, но не начальном формировании В-клеток памяти. J Immunol. 2015; 194 (6): 2607–15.
CAS PubMed PubMed Central Статья Google ученый
Xu X, Araki K, Li S, Han JH, Ye L, Tan WG и др.Аутофагия необходима для выживания эффекторных CD8 (+) Т-клеток и формирования памяти. Nat Immunol. 2014. 15 (12): 1152–61.
CAS PubMed PubMed Central Статья Google ученый
Noureldein MH, Eid AA. Микробиота кишечника и передача сигналов mTOR: понимание нового патофизиологического взаимодействия. Microb Pathog. 2018; 118: 98–104.
CAS PubMed Статья Google ученый
Round JL, Мазманян СК. Микробиота кишечника формирует иммунные реакции кишечника во время здоровья и болезни. Nat Rev Immunol. 2009. 9 (5): 313–23.
CAS PubMed PubMed Central Статья Google ученый
Кампиери М., Джиончетти П. Бактерии как причина язвенного колита. Кишечник. 2001. 48 (1): 132–5.
CAS PubMed PubMed Central Статья Google ученый
Kwon YH, Denou E, Ghia JE, Rossi L, Fontes ME, Bernier SP, Shajib M, Banskota S, Collins SM, Surette MG, Khan WI. Модуляция состава кишечной микробиоты с помощью передачи сигналов серотонина влияет на иммунный ответ кишечника и предрасположенность к колиту. Клеточный Мол Гастроэнтерол Гепатол. 2019; pii: S2352-345X (19) 30005-0. https://doi.org/10.1016/j.jcmgh.2019.01.004. [Epub перед печатью].
Ян Л., Лю Ц., Чжао В., Хе Ц, Дин Дж., Дай Р. и др. Нарушение аутофагии в эпителиальных клетках кишечника изменяет микробиоту кишечника и иммунные ответы хозяина.Appl Environ Microbiol. 2018.
Кларк А., Мах Н. Роль витамина D в гипотезе гигиены: взаимодействие между витамином D, рецепторами витамина D, кишечной микробиотой и иммунным ответом. Фронт Иммунол. 2016; 7: 627.
PubMed PubMed Central Статья CAS Google ученый
Wu S, Zhang YG, Lu R, Xia Y, Zhou D, Petrof EO, et al. Удаление рецептора витамина D кишечного эпителия приводит к нарушению аутофагии при колите.Кишечник. 2015; 64 (7): 1082–94.
CAS PubMed Статья Google ученый
Юэ Ц., Ян Х, Ли Дж, Чен Х, Чжао Х, Чен Й и др. N-оксид триметиламина запускает инфламмасому NLRP3 посредством ингибирования индуцированной ATG16L1 аутофагии в эпителиальных клетках толстой кишки. Biochem Biophys Res Commun. 2017; 490 (2): 541–51.
CAS PubMed Статья Google ученый
Лин Р, Цзян Ю., Чжао XY, Гуань Y, Цянь В., Фу XC и др.Четыре типа бифидобактерий вызывают реакцию аутофагии в эпителиальных клетках кишечника. J Dig Dis. 2014. 15 (11): 597–605.
CAS PubMed Статья Google ученый
Мурти А., Ли И, Пэн И., Райхельт М., Катакам А.К., Нубад Р. и др. Вариант болезни Крона в Atg16l1 усиливает его деградацию каспазой 3. Природа. 2014. 506 (7489): 456–62.
CAS PubMed Статья Google ученый
Massey DC, Parkes M. Сканирование ассоциаций по всему геному показывает, что два гена аутофагии, ATG16L1 и IRGM, в значительной степени связаны с болезнью Крона. Аутофагия. 2007. 3 (6): 649–51.
CAS PubMed Статья Google ученый
Brest P, Lapaquette P, Souidi M, Lebrigand K, Cesaro A, Vouret-Craviari V, et al. Синонимичный вариант IRGM изменяет сайт связывания для miR-196 и вызывает нарушение регуляции IRGM-зависимой ксенофагии при болезни Крона.Нат Жене. 2011; 43 (3): 242–5.
CAS PubMed Статья Google ученый
Lees CW, Barrett JC, Parkes M, Satsangi J. Новая генетика ВЗК: общие пути с другими заболеваниями. Кишечник. 2011; 60 (12): 1739–53.
CAS PubMed Статья Google ученый
Travassos LH, Carneiro LA, Ramjeet M, Hussey S, Kim YG, Magalhaes JG, et al. Nod1 и Nod2 направляют аутофагию, рекрутируя ATG16L1 на плазматическую мембрану в месте проникновения бактерий.Nat Immunol. 2010. 11 (1): 55–62.
CAS PubMed Статья Google ученый
Плантинга Т.С., Крисан Т.О., Оостинг М., ван де Веердонк, Флорида, де Йонг Д.Д., Филпотт Д.Д. и др. Связанный с болезнью Крона полиморфизм ATG16L1 избирательно модулирует провоспалительные цитокиновые ответы при активации NOD2. Кишечник. 2011. 60 (9): 1229–35.
CAS PubMed Статья Google ученый
Лю Т.К., Наито Т., Лю З., ВанДуссен К.Л., Харитунианс Т., Ли Д. и др. LRRK2, но не ATG16L1, ассоциирован с дефектом клеток Панета у пациентов с японской болезнью Крона. JCI Insight. 2017; 2 (6): e
.PubMed PubMed Central Статья Google ученый
Роша Д.Д., Шлоссмахер М.Г., Филпотт Д.Д. LRRK2 и Nod2 способствуют сортировке лизоцима в клетках Панета. Nat Immunol. 2015; 16 (9): 898–900.
CAS PubMed Статья Google ученый
Равиндран Р., Лебберманн Дж., Накая Х.И., Хан Н., Ма Х., Гама Л. и др. Аминокислотный сенсор GCN2 контролирует воспаление кишечника, ингибируя активацию инфламмасом. Природа. 2016; 531 (7595): 523–7.
CAS PubMed PubMed Central Статья Google ученый
Пател К.К., Стаппенбек Т.С. Аутофагия и гомеостаз кишечника. Annu Rev Physiol. 2013; 75: 241–62.
CAS PubMed Статья Google ученый
Gardet A, Xavier RJ. Общие аллели, влияющие на аутофагию и риск воспалительного заболевания кишечника. Curr Opin Immunol. 2012; 24 (5): 522–9.
CAS PubMed Статья Google ученый
Сибони М., Абдулла М., Гринфилд Л., Раджу Д., Ву Т., Родригес Д.М. и др. Нарушение аутофагии микробами изменяет экспрессию RISC-компонента AGO2, критического регулятора пути сайленсинга miRNA. Воспаление кишечника.2015; 21 (12): 2778–86.
PubMed PubMed Central Статья Google ученый
Цубои К., Нишитани М., Такакура А., Имаи Ю., Комацу М., Кавашима Х. Аутофагия защищает от колита, поддерживая нормальную микрофлору кишечника и выделяя слизь. J Biol Chem. 2015. 290 (33): 20511–26.
CAS PubMed PubMed Central Статья Google ученый
Adolph TE, Tomczak MF, Niederreiter L, Ko HJ, Bock J, Martinez-Naves E, et al. Клетки Панета как источник воспаления кишечника. Природа. 2013. 503 (7475): 272–6.
CAS PubMed PubMed Central Статья Google ученый
Zhao J, Dong JN, Wang HG, Zhao M, Sun J, Zhu WM, et al. Докозагексаеновая кислота ослабляла экспериментальный хронический колит у мышей с дефицитом интерлейкина 10 за счет усиления аутофагии за счет ингибирования пути mTOR.JPEN J Parenter Enteral Nutr. 2017; 41 (5): 824–9.
CAS PubMed Статья Google ученый
Чжао Дж., Сунь Й., Ши П, Дун Дж. Н., Цзо Л.Г., Ван Х.Г. и др. Целастрол облегчает экспериментальный колит у мышей с дефицитом ИЛ-10 за счет активации аутофагии. Int Immunopharmacol. 2015; 26 (1): 221–8.
CAS PubMed Статья Google ученый
Macias-Ceja DC, Cosin-Roger J, Ortiz-Masia D, Salvador P, Hernandez C, Esplugues JV, et al. Стимуляция аутофагии предотвращает воспаление слизистой оболочки кишечника и облегчает мышечный колит. Br J Pharmacol. 2017; 174 (15): 2501–11.
CAS PubMed PubMed Central Статья Google ученый
Ху С., Чен М., Ван И, Ван З, Пей И, Фан Р. и др. Ингибирование mTOR ослабляет колит, вызванный декстрансульфатом натрия, подавляя пролиферацию Т-клеток и балансируя профиль Th2 / Th27 / Treg.PLoS One. 2016; 11 (4): e0154564.
PubMed PubMed Central Статья CAS Google ученый
Massey DC, Bredin F, Parkes M. Использование сиролимуса (рапамицина) для лечения рефрактерной болезни Крона. Кишечник. 2008. 57 (9): 1294–6.
CAS PubMed Статья Google ученый
Гризотт-Лейк М., Вайшнава С. Аутофагия: горячая линия по предотвращению самоубийств для эпителия кишечника.Клеточный микроб-хозяин. 2018; 23 (2): 147–8.
CAS PubMed Статья Google ученый
Burger E, Araujo A, Lopez-Yglesias A, Rajala MW, Geng L, Levine B, et al. Потеря аутофагии клеток Панета вызывает острую восприимчивость к воспалению, опосредованному токсоплазмой gondii. Клеточный микроб-хозяин. 2018; 23 (2): 177–90 e4.
CAS PubMed Статья Google ученый
Мацудзава-Ишимото И, Шоно И, Гомес Л.Э, Хаббард-Люси В.М., Каммер М., Нил Дж. И др. Белок аутофагии ATG16L1 предотвращает некроптоз кишечного эпителия. J Exp Med. 2017; 214 (12): 3687–705.
CAS PubMed PubMed Central Статья Google ученый
Pott J, Kabat AM, Maloy KJ. Аутофагия кишечных эпителиальных клеток необходима для защиты от апоптоза, индуцированного TNF, во время хронического колита у мышей.Клеточный микроб-хозяин. 2018; 23 (2): 191–202 e4.
CAS PubMed Статья Google ученый
Yuan Y, Ding D, Zhang N, Xia Z, Wang J, Yang H, et al. TNF-альфа индуцирует аутофагию через путь ERK1 / 2 для регулирования апоптоза в клетках модели некротического энтероколита новорожденных IEC-6. Клеточный цикл. 2018; 17 (11): 1390–402.
CAS PubMed Статья Google ученый
Справочник непрофессионала по воспалительному процессу в желудочно-кишечном тракте
Обзор
Иммунная система желудочно-кишечного тракта представляет собой самую большую массу лимфоидной ткани в организме, состоящую из 10 6 лимфоцитов / г ткани.1 Все подходящие и неподходящие воспаления в кишечнике инициируются этой лимфоидной тканью, ассоциированной с кишечником (GALT). Несколько медиаторов воспаления, в том числе цитокины, хемокины и эйкозаноиды, помогают стимулировать и регулировать эти функции, но, если их не регулировать, они могут способствовать повреждению слизистой оболочки, как это наблюдается при воспалительных заболеваниях кишечника (ВЗК). Хотя инициаторы воспаления при желудочно-кишечных заболеваниях различны, пути иммунологически опосредованного повреждения слизистой оболочки являются общими. Баланс между провоспалительными цитокинами и производством противовоспалительных молекул будет определять тяжесть, степень и исход воспаления слизистой оболочки.
Во время нормальных вагинальных родов иммунная система желудочно-кишечного тракта подвергается воздействию кишечных бактерий матери, которые быстро колонизируют кишечник ребенка, достигая концентрации 10 11 / г стула.2 Непрерывное взаимодействие между комменсальными бактериями, присутствующими в желудочно-кишечном тракте, и иммунологической системой создают устойчивое состояние «физиологического воспаления» в слизистой оболочке желудочно-кишечного тракта. В случае сальмонеллы, шигеллы и Campylobacter enteritides физиологическое воспаление может стать чрезмерным, хотя и уместным, как часть ответа на вторжение патогена, или чрезмерным и неуместным, как в случае с ВЗК.Степень этого аномального иммунного ответа, вероятно, будет зависеть как от генетики, так и от окружающей среды. В ткани ВЗК повышается уровень медиаторов воспаления, и терапевтическое вмешательство на этом уровне является основой лечения.
Измененные популяции бактерий в толстой кишке могут быть причиной рецидивов ВЗК – например, язвенного колита и болезни Крона. Это повысило возможность применения «пробиотической» бактериальной флоры в качестве формы лечения микробным вмешательством, чтобы нарушить активность исходного бактериального инсульта.Бактериальные препараты, состоящие из лактобацилл и бифидобактерий, недавно показали свою эффективность при чрезмерном воспалении, присутствующем при илеоанальном поухите.3 Ранние признаки также показывают, что пероральный препарат непатогенной Escherichia coli выгодно отличается от медикаментозного лечения, вызывая аналогичный рецидив. частота и почти одинаковые безрецидивные интервалы.4
Анатомия
Структурно GALT (состоящий из миндалин, аденоидов, аппендикса и пейеровских бляшек) разделен на разные отделы.Агрегированные фолликулы и пейеровы бляшки распределяются внутри слизистой оболочки в виде диффузных популяций лимфоцитов (см. Рис. 1). Лимфоциты также присутствуют в эпителиальном слое кишечника, который расположен в складках, состоящих из ворсинок и крипт, служащих для увеличения площади абсорбирующей поверхности. Эпителий состоит из одного слоя абсорбирующих столбчатых эпителиальных клеток, бокаловидных клеток и интраэпителиальных лимфоцитов, отделенных от подлежащей собственной пластинки базальной пластинкой, создавая четко определенный функциональный отсек, который играет важную роль в интерпретации внутрипросветных событий.5 Эпителий постоянно подвергается атаке антигенов из пищевых и инфекционных источников и обеспечивает первую линию взаимодействия с иммунной системой. Большинство интраэпителиальных Т-клеток, обнаруженных в слое эпителиальных клеток, имеют супрессорный / цитотоксический фенотип, в то время как клетки собственной пластинки, расположенные ниже, состоят из хелперных / индукторных Т-клеток и В-клеток. 6
Рисунок 1Схематическое изображение основных компонентов воспаления желудочно-кишечного тракта и иммунологии (NK = естественный убийца).
Собственная пластинка содержит полный набор мононуклеарных клеток, включая В-клетки, Т-клетки и клетки моноцитарно-макрофагального происхождения.7 Присутствующие Т-клетки в основном используют рецептор αβT-клеток и являются либо CD4 (хелперы), либо CD8 ( супрессор / цитотоксический) с соотношением, очень похожим на соотношение периферической крови. Большинство Т-лимфоцитов CD4 собственной пластинки обладают дополнительным фенотипом, связанным с клетками-индукторами-помощниками, способствующими продукции иммуноглобулина В-клетками.8 Пейеровы пятна, обнаруженные внутри собственной пластинки, более доступны для микроорганизмов, чем другие эпителиальные поверхности кишечника, содержащие специализированные транспортные клетки, называемые М-клетками, 9 которые не имеют микроворсинок и способны фагоцитировать как растворимые антигены, так и микроорганизмы. Лимфоциты в пейеровых бляшках активируются и распространяются через брыжеечные лимфатические узлы, грудной проток и кровоток обратно в собственную пластинку 10.
Типы ячеек
Иммунные ответы опосредуются лейкоцитами, которые происходят из предшественников в костном мозге.Лейкоциты включают полиморфноядерные лейкоциты и макрофаги врожденной иммунной системы и два основных типа лимфоцитов адаптивной иммунной системы. В-лимфоциты созревают в костном мозге, а Т-лимфоциты созревают в тимусе. Зрелые макрофаги мигрируют в собственную пластинку, в то время как лимфоциты постоянно рециркулируют из кровотока через GALT кишечника, где антиген улавливается и представлен в пейеровских бляшках.
GALT включает различные типы клеток, в том числе лейкоциты или лейкоциты, и подразделяется на подкатегорию:
(1) Фагоциты, которые включают нейтрофилы, моноциты и макрофаги, которые составляют часть врожденной иммунной системы и обеспечивают неспецифический иммунитет.
(2) Лимфоциты, обеспечивающие адаптивный или специфический иммунитет.
Макрофаги играют роль в естественном врожденном иммунитете, фагоцитируя и разрушая покрытые антителами и комплементарные опсонизированные инородные частицы, такие как микробы и антигены, убивая микробы за счет секреции ферментов, реактивных кислородных радикалов и медиаторов липидного происхождения (рис. 2). Макрофаги также являются основными эффекторными клетками опосредованного клетками иммунитета, секретирующими хозяина цитокинов и факторов роста.11 Как участники определенного иммунного процесса, макрофаги имеют на своей поверхности рецепторы для различных микробных компонентов, позволяющих отображать чужеродные антигены на поверхности клетки, которые являются распознается антигенспецифическими Т-лимфоцитами.12 Макрофаги также способствуют активации Т-клеток за счет продукции цитокинов.13
фигура 2Роль макрофагов в поглощении чужеродного белка и представлении антигена (MHC = главный комплекс гистосовместимости).
Т-клетки дифференцируются в тимусе на разные субпопуляции, Т-хелперные или Т-цитотоксические / супрессорные клетки, с разными маркерами для их идентификации; CD4 + для Т-хелперов и CD8 + для Т-цитотоксических или супрессорных клеток. Т-хелперные клетки имеют три подтипа, Th2, Th3 и Th0, с различными функциями, которые различаются продуктом их секреции.14
В-клетки дифференцируются в костном мозге и состоят из двух популяций. Первый, характеризуемый маркером CD5 +, обнаруживается в брюшной полости и составляет 15% от общей популяции В-клеток. Второй тип составляет 85% В-клеток и обнаруживается в крови и во всех органах иммунной системы (см. Рис. 3).
Рисунок 3Клеточное развитие иммунного ответа (Th = T-хелпер).
Существует третья популяция не-B, не-T-клеток, дифференцировка которых не определена.
Эта популяция также включает клетки-киллеры (K) и естественные киллеры (NK), которые выполняют важные функции в защите хозяина от опухолей15.
Секреторные компоненты
Первой линией защиты от патогенных бактерий является иммунное исключение с участием антител IgA. Секреция IgA обычно индуцируется в пейеровских бляшках при стимуляции В-клеток.16 Коммитированные В-клетки затем мигрируют в системный кровоток и в собственную пластинку оболочки для производства IgA.17 IgA действует в сотрудничестве с неиммунологическими защитными механизмами, опосредуя иммунное исключение чужеродных веществ. антигены, предотвращая адгезию эпителия и проникновение инвазивных патогенных микроорганизмов, нейтрализуя токсины и размножаясь вирусами.
Вторая линия защиты включает антитела IgG и большое количество медиаторов, включая провоспалительные цитокины.
Недавние исследования также подтвердили наличие новой формы врожденного иммунитета, которая может опосредоваться в просвете и на поверхности слизистой оболочки в форме антимикробных пептидов.18 Члены трех семейств антимикробных пептидов – дефенсинов, магаининов, и цекропины – выделены из желудочно-кишечного тракта животных.19
Цитокины
За представлением антигена в воспалительном процессе следует генерация цитокинов, которые обеспечивают сигналы для коммуникации между различными популяциями клеток, определяющих направление последующего иммунного и воспалительного ответа. Цитокины представляют собой небольшие молекулы гликопротеинового пептида от 5 до 50 кДа с аутокринной, паракринной и эндокринной активностью. 20 Каждый из них может иметь несколько действий, но в широком смысле может быть классифицирован как провоспалительный или противовоспалительный по своей природе.Провоспалительные цитокины включают интерлейкин (ИЛ) -1, ИЛ-6, ИЛ-8 и фактор некроза опухоли альфа (ФНО-альфа), хотя ИЛ-1 также играет роль в заживлении тканей, а ИЛ-6 в индукции высвобождения антибиотиков. белки острой фазы воспаления.21 22 IL-4, IL-10 и трансформирующий фактор роста-бета (TGF-β) считаются противовоспалительными цитокинами (см. Рис. 3). Макрофаги являются основными источниками цитокинов, причем эпителиальные клетки также способны продуцировать ряд этих пептидных факторов.23 Т-хелперные (Th) клетки являются еще одним важным источником цитокинов.Клетки Th2, которые связаны с клеточно-опосредованным иммунным ответом, продуцируют IL-2, интерферон гамма (IFN-γ) и TNF-α. Клетки Th3 усиливают синтез антител В-клетками и продуцируют IL-4, IL-5, IL-6 и IL-10. Имеются данные о преобладании ответа Th2 или Th3 при некоторых заболеваниях человека.24 TNF-α играет важную и широкую роль в воспалительном ответе и устойчивости хозяина, с его способностью индуцировать или подавлять экспрессию ряда генов. 0,25
Эпителиальная клетка является первой клеткой-хозяином, которая взаимодействует с патогенными микроорганизмами просвета и инициирует заболевание слизистой оболочки, секретируя провоспалительные цитокины в ответ на патогены или их продукты.26 После повреждения эпителия повышенная проницаемость приводит к активации открытых макрофагов собственной пластинки и лимфоцитов. Таким образом, цитокины, продуцируемые всеми тремя типами клеток, важны для управления воспалительным процессом.
Деструктивные ферменты, кислородные радикалы и азотные метаболиты
Кишечные макрофаги также выделяют протеазы, такие как эластаза, катепсин G, коллагеназа и другие деструктивные лизосомальные ферменты, после стимуляции фагоцитозом, липополисахаридом или цитокинами.Фагоцитарные лейкоциты также являются основным источником кислородных радикалов и азотных метаболитов, таких как NO 2 – .27 28 Фагоцитарные клетки использовали активные кислородные радикалы в сочетании с протеазами для уничтожения проглоченных микроорганизмов. Кислородные радикалы потенциально вредны, если их не контролировать, вызывая перекисное окисление липидов и дестабилизацию мембран, увеличивая проницаемость слизистой оболочки воспаленного кишечника (29).
Эйкозаноиды
Эйкозаноиды представляют собой группу из 20 углеродных жирных кислот и пептидожирных кислот, полученных из мембранных фосфолипидов.30 В основном, эйкозаноиды считаются провоспалительными медиаторами, однако некоторые простагландины могут оказывать сильное противовоспалительное действие при определенных условиях.31
Простагландины действуют на гладкие мышцы сосудов (PGE 2 и PGI 2 расслабляют: PGF 2 -α сокращаются), агрегацию тромбоцитов (ингибируют PGI 2 и PGD 2 ), секрецию нейтрофилов, адгезию и подвижность (ингибируют PGE 2 и PGI 2 ) и секрецию желудочной кислоты (ингибируют PGI 2 и PGE 2 ).32 Также было показано, что простагландины оказывают защитное действие на желудок, тонкий кишечник и толстую кишку, хотя механизм действия остается неясным.
Тромбоксан представляет собой вещество, полученное из тромбоцитов, с сосудосуживающим действием во многих сосудистых руслах и обладающее сильной активностью в качестве агрегатора тромбоцитов. 34 Лейкотриены можно разделить на две подгруппы. LTB 4 является мощным стимулом секреции, агрегации, адгезии и миграции нейтрофилов.35 Пептидолейкотриены (LTC 4 , LTD 4 и LTE 4 ) оказывают сильное сужающее действие на сосудистую и несосудистую гладкость. мышца.Эти лейкотриены также способны увеличивать проницаемость сосудов и стимулировать адгезию лейкоцитов к эндотелию сосудов.36 Эйкозаноиды также обладают иммуномодулирующим действием с PGE 2 , подавляя продукцию IL-1 и TNF-α моноцитами и подавляя различные функции Т-лимфоцитов. .37 LTB 4 может также изменять пролиферацию В-лимфоцитов и стимулировать выработку TNF-α, IFN-γ, IL-2 мононуклеарными клетками.38 Эти провоспалительные медиаторы важны, поскольку в настоящее время они являются мишенью для различных терапевтических вмешательств. (см. рис. 4).
Рисунок 4Баланс провоспалительных компонентов и защитных сил хозяина в желудочно-кишечном тракте (сокращения см. В тексте).
Воспалительная реакция
ИНИЦИАЦИЯ
Воспалительная реакция возникает против антигена из просвета кишечника, когда он транспортируется специализированными эпителиальными М-клетками в лимфоидные фолликулы. Макрофаги, дендритные клетки и В-клетки имеют поверхностные рецепторы, которые распознают и связывают общие компоненты многих бактериальных поверхностей.39 Дендритные клетки играют решающую роль в иммунитете к вирусам, в то время как макрофаги специализируются на интернализации и представлении антигенов в виде частиц. 40 Существует захват, поглощение и разрушение патогена тканевыми макрофагами, обеспечивая немедленный врожденный клеточный иммунный ответ.
УСИЛЕНИЕ
Этот врожденный иммунный ответ привлекает больше фагоцитарных клеток и эффекторных молекул к месту инфекции за счет высвобождения цитокинов. Цитокины, продуцируемые макрофагами, называются монокинами (IL-1, IL-6, IL-8, IL-12 и TNF-α).Другие высвобождаемые медиаторы включают простагландины, оксид азота, лейкотриены и фактор активации тромбоцитов. В дополнение к этому эффект комплемента также способствует воспалению. 42 Всего этого процесса может быть достаточно, чтобы предотвратить распространение инфекции даже после того, как микроб пересек эпителиальный барьер.
Адаптивный ответ
Презентация антигена также запускает адаптивный ответ, который начинается с презентации процессированных антигенов в контексте главного комплекса гистосовместимости (MHC).Этот процесс приводит к активации Т-клеток.43 Презентация антигенов в ассоциации с молекулами MHC класса I приводит к активации CD8-положительных Т-клеток, тогда как презентация в ассоциации с молекулами группы MHC класса II индуцирует активацию CD4 T-клеток. 44 Молекулы HLA класса I. обычно присутствуют цитоплазматические антигены (эндогенные антигены), которые в первую очередь синтезируются инфицированными клетками, например вирусные белки. В нормальных физиологических условиях презентация антигена эпителиальными клетками кишечника приводит к стимуляции CD8-положительных клеток с супрессорной функцией.Эти примированные лимфоциты покидают слизистую оболочку, попадают в кровоток и мигрируют обратно на поверхности слизистой оболочки; процесс, известный как «самонаведение» 45. Защитные системы врожденного иммунитета эффективны в борьбе с бактериальными патогенами, но ограничиваются бактериями, несущими общие поверхностные молекулы. Чтобы преодолеть это, каждый наивный лимфоцит, попадающий в кровоток, несет рецепторы только одной специфичности. Специфика каждого лимфоцита порождает миллионы различных специфичностей. Эти лимфоциты постоянно подвергаются естественному отбору в течение жизни человека, и только те, которые сталкиваются с антигеном, с которым связывается их рецептор, активируются и дифференцируются в эффекторные клетки.46
Разрешение
Результат иммунного ответа определяется типом эффекторных клеток, которые стимулируются первоначально активированными Т-клетками. Результатом этого специфического ответа является активация иммунных, мезенхимальных, эпителиальных клеток, привлечение циркулирующих эффекторных клеток, повреждение тканей и / или заживление. Эти медиаторы, определяющие разрешение, включают цитокины, метаболиты архидоновой кислоты, активные кислородные промежуточные соединения и факторы роста. Считается, что хроническое воспаление кишечника, обнаруживаемое при ВЗК, является результатом отказа этих регуляторных механизмов, которые обычно служат для ограничения иммунного ответа и устранения патогена.47
Постановление
Чистые эффекты цитокинов играют большую роль в регуляции воспалительной реакции. Путь развития Т-клеток зависит от цитокинов, присутствующих в их микроокружении. Воздействие IFN-γ приводит к образованию клеток Th2, которые продуцируют IL-2 и IFN-γ. IL-4 стимулирует развитие клеток Th3 и, наоборот, IFN-γ подавляет выработку цитокинов клетками Th3. Дифференцировка Т-клеток в Th2- или Th3-подобные цитокины – это процесс, который сам зависит от цитокинов, присутствующих в микроокружении.47 48
Нейроэндокринные гормоны, например, вещество P, также были обнаружены в повышенной концентрации в слизистой оболочке воспаленного кишечника, что указывает на дополнительный механизм усиления воспалительной реакции слизистой оболочки (49).
Дифференцировка В-клеток, продуцирующих IgA, также зависит от факторов, продуцируемых лимфоидными клетками. TGF-β увеличивает продукцию IgA IgA-отрицательными, стимулированными липополисахаридом В-клетками. 50 Человеческий IFN-γ и IL-4 усиливают экспрессию секреторного компонента в линии эпителиальных клеток HT-29, что позволяет предположить, что местная продукция цитокинов может изменять транспорт IgA.51
Пероральное воздействие на иммунную систему слизистой оболочки кишечника часто приводит к иммунной невосприимчивости системы к введенному антигену. Эта невосприимчивость или толерантность частично опосредована антиген-специфическими супрессорными Т-клетками, которые развиваются в лимфоидных фолликулах слизистой оболочки и мигрируют в другие лимфоидные ткани. 53 Действующие дополнительные механизмы подавления включают клональную делецию и анергию.
Влияние на функцию кишечника
Хронически воспаленный кишечник вызывает искажение структуры в виде изъязвления слизистой оболочки, наложение фиброзной ткани, эффект заполнения пространства инфильтратами воспалительных клеток и изменения в росте и созревании клеток в эпителии и мышечных слоях, приводящие к утолщение мышц и притупление ворсинок
Непрерывное воспаление – например, при ВЗК, связано с изменениями транспорта воды и ионов эпителиальными клетками, способствующими диарее.В просвете кишечника происходит чистое скопление жидкости, что приводит к частому и количеству стула. Воспаление также приводит к потере нормальной площади поверхности, что связано с потерей пищеварительных ферментов, уменьшением расщепления и всасывания пищевых продуктов, потерей нормального всасывания белков и жиров, потерей веса и недоеданием. Целостность и проницаемость кишечного эпителиального слоя нарушается во время воспаления, как при ВЗК, что приводит к повышению уровня сывороточных антител к пище и белкам молока.55 Практически каждый аспект функции кишечника регулируется иммунной системой. Функция клеток в любом месте стенки кишечника может быть нарушена наличием воспаления. Структурные и физиологические ткани могут вносить вклад в воспалительный процесс, продуцируя цитокины, которые хемоаттрактируют и способствуют выживанию иммунологических клеток в локальной среде, а также поддерживают состояние дисфункции органов благодаря своему влиянию на физиологические системы как внутри, так и за пределами кишечника.Эти процессы влияют на многие симптомы, включая боль, диарею и потерю веса, которые неизменно сопровождают ВЗК.
Терапевтическое вмешательство: контроль чрезмерного несоответствующего воспаления
Снижение воспаления при ВЗК основано на иммуномодулирующих схемах. Два прочно установленных пути – это использование кортикостероидов и аминосалицилатов (5-ASA). Терапевтические эффекты стероидов опосредуются ингибированием нескольких воспалительных путей, включая прямое подавление опосредованного 5-липоксигеназой метаболизма арахидоновой кислоты, модулированную транскрипцию белков, чувствительных к глюкокортикоидам, и подавление мРНК для большинства интерлейкинов.56 Механизм действия 5-ASA в снижении воспаления кишечника при ВЗК включает ингибирование метаболизма 5-липоксигеназы и выработку интерлейкинов и воспалительных лейкотриенов; подавление фактора активации тромбоцитов, нормализация кишечной проницаемости, хемотаксис нейтрофилов и моноцитов, снижение эпителиальной экспрессии HLA-DR; стимуляция цитопротекторных простагландинов; и удаление свободных радикалов.57
Азатиоприн, циклоспорин и метотрексат – стероидсберегающие иммунодепрессанты, используемые для контроля воспаления кишечника.Азатиоприн представляет собой аналог пурина, который конкурентно ингибирует биосинтез пуриновых нуклеотидов, что приводит к селективному супрессивному действию на Т-клетки. Циклоспорин действует в первую очередь на функцию и пролиферацию Т-клеток, главным образом за счет ингибирования транскрипции гена IL-2. Метотрексат подавляет функцию Т-клеток, снижая активность фолат-зависимых ферментов в лимфоцитах.
Новые лекарственные препараты со специфическими противовоспалительными мишенями
Присутствие повышенных провоспалительных медиаторов при ВЗК привело к разработке методов лечения, нацеленных на ключевые участки для стимулирования или вмешательства в процессы, участвующие в регуляции воспалительного каскада.
Вопросы
(ответы в конце статьи)
- (1)
- Каковы основные провоспалительные инициаторы в желудочно-кишечном тракте?
- (2)
- Какие факторы ответственны за регуляцию и подавление воспаления желудочно-кишечного тракта?
- (3)
- Какую роль играет IgA в воспалении кишечника?
- (4)
- Что такое цитокины и как они работают?
- (5)
- Какие генетические факторы и факторы окружающей среды могут влиять на воспаление желудочно-кишечного тракта?
Антитела против TNF-α были получены у мышей и были генетически модифицированы, чтобы сделать их менее иммуногенными.Два антитела против TNF-α в настоящее время проходят оценку при болезни Крона.58 Регуляторные противовоспалительные цитокины, например, IL-10 и IL-11, также проходят исследования на пациентах с болезнью Крона.59 Антагонисты липидных медиаторов, включая лейкотриен. B4 и тромбоксан также эффективны для уменьшения воспаления. Поглотители активных кислородных метаболитов, такие как супероксиддисмутаза, также использовались с различной эффективностью при ВЗК, но в настоящее время ни один из них не появился на практике.60
Сводка
В этом обзоре описаны основные пути воспаления в желудочно-кишечном тракте. Понимание механизмов этих путей привело к идентификации многих потенциальных участков-мишеней для новых методов лечения воспалительного каскада. Как только станут понятны ключевые процессы воспаления, дальнейшая модификация существующих методов лечения наряду с новыми методами лечения приведет к более безопасному и эффективному контролю воспалительного процесса в желудочно-кишечном тракте.
ответы
(1) Инициаторами воспаления желудочно-кишечного тракта является содержимое просвета кишечника. Они содержат нормальные комменсальные бактерии, патогенные бактерии, например, сальмонеллы, шигеллы, кампилобактеры и энтеропатогенные бактерии E coli . Компоненты этих патогенных бактерий – например, липополисахарид и экзотоксин, эндотоксин и формилметионин, лейцилфилаланин, могут еще больше усугубить воспаление. Другие компоненты просвета, которые могут играть определенную роль, включают желчные кислоты, пищеварительные ферменты и пищевые антигены.
(2) В настоящее время известно, что компоненты комменсальной флоры, известные как пробиотические бактерии, могут защищать от чрезмерного воспаления желудочно-кишечного тракта. Защита просвета также осуществляется в виде секреторного IgA. В собственной пластинке оболочки основные регуляторные и иммунодепрессивные цитокины включают IL-10, TGF-β, антагонист рецептора IL-1 и IL-4. Внекишечные регуляторные компоненты могут принимать форму гормонов, например, вазоактивного кишечного пептида.
(3) IgA действует вместе с другими неиммунологическими защитными механизмами на поверхности эпителия – например, со слизью, опосредуя иммунное исключение чужеродных антигенов, предотвращая их прилипание и проникновение.Он также нейтрализует токсины и снижает размножение вирусов.
(4) Цитокины представляют собой небольшие молекулы гликопротеинового пептида, экспрессируемые рядом клеточных линий иммунной системы. Эти молекулы обладают регуляторными свойствами, позволяющими им контролировать инициирование, амплификацию, сохранение, подавление и разрешение воспалительной реакции. На основании этих возможностей в настоящее время используются различные фармакотерапевтические цитокиновые препараты (например, антитело против TNF-α) для контроля воспаления желудочно-кишечного тракта.Дальнейшие приготовления также находятся в стадии разработки.
(5) Генетические факторы, участвующие в воспалении желудочно-кишечного тракта, включают иммунорегуляцию и барьерную функцию. Генетические нарушения в этих двух областях приводят к ВЗК, то есть к язвенному колиту и болезни Крона. Известные факторы окружающей среды, которые могут влиять на воспаление желудочно-кишечного тракта, включают использование антибиотиков, диету, курение, стресс, лекарства, например нестероидные противовоспалительные препараты, и желудочно-кишечные инфекции.Как генетические факторы, так и факторы окружающей среды являются ключом к раскрытию механизмов ВЗК, а также дают ключи к новым терапевтическим препаратам.
Воспаление слизистой оболочки кишечника приводит к системной генотоксичности у мышей
Реферат
Воспалительное заболевание кишечника, включая язвенный колит и болезнь Крона, существенно увеличивает риск колоректального рака. Однако механизмы, связывающие воспаление слизистой оболочки с последовательностью дисплазии, до конца не изучены.В то время как исследования показали окислительное повреждение толстой кишки, это исследование проверяет, вызывается ли генотоксичность системно острым и хроническим воспалением кишечника. В этом исследовании генотоксические конечные точки оценивались в периферических лейкоцитах (одно- и двухцепочечные разрывы ДНК и окислительное повреждение ДНК) и нормохроматических эритроцитах (микроядрах) во время химического или иммуноопосредованного колита. В течение трех последовательных циклов воспаления кишечника, вызванного введением декстрансульфата натрия, генотоксичность по отношению к периферическим лейкоцитам и эритробластам была обнаружена как в острой, так и в хронической фазах воспаления, индуцированного декстрансульфатом натрия.Окислительный стресс, опосредованный реактивными формами кислорода, и повреждение ДНК были подтверждены положительным окрашиванием 8-оксогуанином и нитротирозином в периферических лейкоцитах. Уровни повреждения ДНК обычно снижаются во время ремиссии и повышаются во время лечения, что коррелирует с клиническими симптомами и уровнями системных воспалительных цитокинов. У трансгенных мышей Gαi2 – / – и интерлейкина-10 – / – , восприимчивых к иммуноопосредованному колиту и аденокарциноме, ассоциированной с воспалением, также наблюдались аналогичные уровни генотоксичности периферических лейкоцитов и эритробластов.Более того, эта системная генотоксичность наблюдалась у мышей с субклиническим воспалением, которое дополнительно усиливалось у мышей с тяжелым воспалением слизистой оболочки. Мы предполагаем, что воспаление слизистой оболочки, вызывая существенное и продолжающееся системное повреждение ДНК, на ранних этапах способствует генетической нестабильности, необходимой для прогрессирования дисплазии, связанной с воспалительными заболеваниями кишечника, и развития рака. [Cancer Res 2009; 69 (11): 4827–34]
- Язвенный колит
- Болезнь Крона
- декстрансульфат натрия
- Повреждение ДНК
- IL-10
- Gαi2
Введение
Целых 1.4 миллиона человек в Соединенных Штатах и 2,2 миллиона человек в Европе в настоящее время страдают воспалительными заболеваниями кишечника (ВЗК), такими как язвенный колит и болезнь Крона, и заболеваемость постоянно растет в модернизирующемся мире ( 1). Пациенты, страдающие этими заболеваниями, также несут повышенный риск развития колоректального рака, в первую очередь из-за кумулятивных эффектов хронического воспаления толстой кишки ( 2). Помимо колоректального рака, у некоторых пациентов с длительным язвенным колитом наблюдаются гепатобилиарная карцинома и рак кроветворения, например лимфома толстой кишки ( 3).
Разнообразные мышиные модели хронического колита были разработаны для изучения генетических особенностей хозяина и факторов окружающей среды (резидентная кишечная микробиота или метаболические стрессоры слизистых оболочек), многие из которых демонстрируют связь хронического воспаления кишечника с аденокарциномой толстой кишки, как при ВЗК человека. Возможно, наиболее изученными являются генетические особенности, которые усиливают воспаление за счет нарушения механизмов метаболического стресса ( 4, 5) муциновый барьер ( 6), сигнализация врожденного иммунитета ( 7) или иммунной регуляции ( 8– 11).Эти вышеупомянутые исследования отражают взаимодействие таких факторов-хозяев с ролью резидентных кишечных бактерий в развитии рака, и это взаимодействие было подтверждено интервенционными исследованиями ( 12– 15). Однако механизмы, связывающие метаболический стресс, воспаление и рак, остаются до конца не изученными.
Помимо генетических моделей хронического колита, важной экспериментальной моделью колита и неоплазии, связанной с колитом, является введение декстрансульфата натрия (DSS), негенотоксичного сульфатированного полисахарида ( 16, 17).Может быть индуцировано острое и хроническое воспаление толстой кишки, что в конечном итоге приводит к дисплазии с последующим колоректальным раком. Пенетрантность коррелирует с продолжительностью воспаления, вызванного либо однократным повторным введением ( 17, 18) или кратковременным воздействием на мышей с генетическими признаками, усиливающими и сохраняющими колит ( 6, 7, 11). Колит, вызванный DSS, был приписан прямой метаболической эпителиальной токсичности, усиленной проникновением в слизистые оболочки кишечной микробиоты и ее продуктов, в результате чего воспаление, в основном, вызвано врожденными, а не адаптивными иммунными типами клеток ( 6, 12, 16, 19).
В нескольких исследованиях изучались потенциальные механизмы, способствующие канцерогенезу при колите, включая восстановление и регенерацию эпителиального барьера, врожденный иммунный ответ, роль цитокинов и окислительное повреждение ДНК в локальных участках воспаления в толстой кишке ( 19– 22). Однако нам неизвестны исследования, в которых определялось, влияет ли воспаление кишечника на уровень системной генотоксичности, например, в периферической крови. Соответственно, это исследование было разработано для характеристики и количественной оценки ассоциации системного повреждения ДНК при остром и хроническом колите как при введении DSS, так и на моделях спонтанного хронического иммунного колита.
Материалы и методы
Животные. C57BL / 6Jp un / p un (3-4 месяца), Gαi2 – / – (фон B6 / 129Sv; 3 месяца; исх. 9) и интерлейкин (IL) -10 – / – (фон C3H / HeJBir; 3 или 6 месяцев) были размещены в Калифорнийском университете в Департаменте лабораторной и животноводческой медицины Лос-Анджелеса в определенных условиях, свободных от патогенов, автоклавированы. подстилка и еда, стандартная диета для грызунов, подкисленная питьевая вода и цикл свет / темнота 12:12 ч.Все мыши были выведены в Калифорнийском университете в Лос-Анджелесе, за исключением IL-10 – / – и C3H / HeJ, которые были приобретены в лаборатории Джексона.
Индукция химического колита. Экспериментальный колит индуцировали 3% (мас. / Об.) DSS (Fisher Scientific; молекулярная масса 40 000), растворенным в подкисленной питьевой воде (менять ежедневно) ad libitum в течение трех циклов. Один цикл состоял из 7 дней обработки обработанной воды и 14 дней обычной питьевой воды. Острый колит был определен как 7-дневное лечение, а хронический колит – как любое дальнейшее лечение, включая периоды ремиссии.Контрольные животные получали только стерильную подкисленную воду. Симптомы (потеря веса, консистенция стула и сильное кровотечение) регистрировались ежедневно для расчета индекса активности заболевания ( 23).
Сбор крови. Периферическую кровь собирали у экспериментальных мышей через лицевую / нижнечелюстную вену с помощью 5-миллиметрового ланцета (Braintree Scientific) в пробирки для сбора, покрытые EDTA (Braintree Scientific). Для анализа на кометах кровь немедленно разбавляли 1: 1 в PBS / 10% DMSO и замораживали при -80 ° C до дальнейшего анализа.Свежесобранная кровь немедленно обрабатывалась для всех других анализов. Идентичные образцы крови использовали для определения конечных точек генотоксичности, а также для экспрессии цитокинов.
Анализ щелочных комет. Для обнаружения одно- и двухцепочечных разрывов, а также щелочно-лабильных участков в ДНК, был проведен щелочной анализ комет, как описано ранее ( 24). Перед дальнейшей подготовкой замороженную кровь разбавляли 1:15 в PBS. После лизиса и электрофореза гели окрашивали SYBR Gold (Molecular Probes) и визуализировали под флуоресцентным микроскопом (Olympus Ax70) при увеличении × 10.Изображения комет анализировали с помощью программы анализа изображений CASP. 4 Момент оливкового хвоста, который представляет как длину хвоста, так и долю ДНК в хвосте, был использован для сбора и анализа данных, в котором апоптотические клетки были исключены согласно ранее предложенным критериям ( 24).
Определение окислительного повреждения ДНК. Ферментный анализ комет, модифицированный hOgg1, использовали для определения окислительного повреждения ДНК ( 25). После лизиса образцы промывали ферментным промывочным буфером [40 ммоль / л HEPES, 0.1 моль / л KCl, 0,5 ммоль / л ЭДТА, 0,2 мг / мл бычьего сывороточного альбумина (pH 8,0)], а затем инкубировали при 37 ° C в течение 10 мин либо в контроле (буфер без hOGG1), либо в обработанном ферментом (буфер с hOGG1) согласно рекомендациям производителя (New England Biolabs). И контрольный, и обработанный ферментом гели затем помещали в буфер для электрофореза и обрабатывали так же, как при щелочном анализе комет.
Иммунофлуоресценция. Периферическую кровь инкубировали в буфере EL (Qiagen) на льду для удаления эритроцитов.Затем образцы обрабатывали на покровных стеклах, как описано в другом месте ( 26). Вкратце, после фиксации, пермеабилизации и блокирования клетки инкубировали с мышиным анти-фосфо-γ-h3AX S139 (P) в соотношении 1: 400, мышиным анти-8-оксогуаниновым клоном 413.5 в соотношении 1: 250 или кроличьими антителами против нитротирозина в соотношении 1: 400. 1: 200 (все от Upstate) с последующим FITC-конъюгированным антимышиным IgG или родамином конъюгированным против кроличьего IgG (Jackson ImmunoResearch) в соотношении 1: 200. Покровные стекла устанавливали с помощью Vectashield с 4 ‘, 6-диамидино-2-фенилиндолом (Vector Laboratories).Изображения были получены с помощью CytoVision (Applied Imaging), подключенного к микроскопу Zeiss Axioplan 2. Было подсчитано не менее 125 клеток, и клетки с более чем четырьмя отдельными очагами в ядре считались положительными по γ-h3AX ( 26). Клетки апоптоза, которые различимы благодаря наличию в поврежденных клетках 10-кратного количества ядерных очагов ( 27), не вошли в анализ.
Парафиновые срезы (5 мкм) толстой кишки из IL-10 – / – и контрольных образцов дикого типа подвергали микроволновке в 10 ммоль / л цитратном буфере (pH 6) в течение 10 минут для извлечения антигена, блокировали и затем инкубировали с антигеном. -8-оксогуанин или анти-нитротирозин с последующими вторичными антителами, идентично процедурам, описанным выше.
Анализ микроядер in vivo . Для оценки хромосомной нестабильности в эритроцитах периферической крови определяли образование микроядер. Аналогично ранее предложенному методу ( 28), 3 мкл цельной крови наносили на предметное стекло микроскопа и окрашивали в модифицированном растворе Райта-Гимзы (Sigma-Aldrich). Микронуклеары подсчитывали и оценивали с помощью Olympus Ax70 при × 100 в соответствии с ранее предложенными критериями ( 29). Подсчитывали не менее 4000 зрелых эритроцитов на мышь, а частоту образования микроядер рассчитывали как количество микроядерных эритроцитов на 1000 нормохроматических эритроцитов.
Выделение РНК и количественная ПЦР в реальном времени. Тотальную РНК выделяли с использованием мини-набора QIAmp RNA Blood Mini (Qiagen) в соответствии с инструкциями производителя. Тотальную РНК (25 нг / мкл) использовали для обратной транскрипции с использованием олиго (dT) (Invitrogen) и обратной транскриптазы SuperScript III (Invitrogen). кДНК (10 нг / мкл) была использована для количественной ПЦР в реальном времени с использованием Taqman Gene Expression Assays (Applied Biosystems) для TATA-связывающего белка, фактора некроза опухоли-α (TNF-α), моноцитарного хемоаттрактантного белка-1 (MCP-1). ; также известный как CC-хемокиновый лиганд 2), IFN-γ, трансформирующий фактор роста-β и смесь Taqman Gene Expression Master Mix в соответствии с инструкциями производителя по системе обнаружения последовательности ABI Prism 7500 (Applied Biosystems).ТАТА-связывающий белок был выбран в качестве эндогенного контроля из-за его низкой вариабельности и относительного содержания от низкого до среднего с точки зрения экспрессии в крови ( 30). Каждое измерение проводилось в трех экземплярах, а результаты анализировались с использованием программного обеспечения SDS 2.2.1 (Applied Biosystems). Экспрессию генов определяли с использованием метода относительных стандартных кривых, нормализованных к экспрессии ТАТА-связывающего белка.
Статистический анализ. Результаты выражены как среднее ± стандартная ошибка. Статистическая значимость определялась непараметрическим односторонним дисперсионным анализом ANOVA с пост-тестом множественного сравнения Данна или парными тестами Стьюдента t с логарифмически преобразованными данными для сравнений временных точек и определялась как P <0.05. При необходимости использовались ANOVA моделей линейной регрессии. Расчеты выполнялись с помощью программного обеспечения для статистического анализа GraphPad Instat версии 3.00 (GraphPad Software) или R: языка и среды для статистических вычислений ( 31).
Результаты
Оценка экспериментального колита. Индекс активности заболевания – это средний комбинированный балл потери веса (0-4), консистенции стула (0-4) и кровотечения (0-4), используемый для оценки клинических симптомов ( 23).У мышей, получавших DSS, на 4-й день цикла 1 наблюдалось ректальное кровотечение, представленное увеличением индекса активности заболевания по сравнению с нелеченными животными ( рисунок 1 ). Однако появление тяжелых симптомов наступило раньше во втором и третьем циклах лечения из-за хронического воспаления даже после 14-дневных периодов ремиссии. Кровотечение и диарея прекратились, как только лечение было остановлено во время ремиссии, и летальных исходов после трех циклов лечения не наблюдалось. Потребление пищи также не изменилось на протяжении всего исследования, а значительная потеря веса наблюдалась только в конце второго и третьего цикла.
Рисунок 1.Индекс активности заболевания ( DAI ) мышей, получавших DSS, и мышей, не получавших лечения. Мыши, получавшие DSS ( n = 10), демонстрировали значительно более высокие индексы активности заболевания каждый день после 4-го дня цикла 1, 3-го дня цикла 2 и 2-го дня цикла 3 по сравнению с нелеченными мышами ( n = 10). Среднее ± SE. †, точки забора крови. **, P <0,001.
Обработка DSS вызывает разрывы одно- и двухцепочечных ДНК в периферических лейкоцитах. Одно- и двухцепочечные разрывы, а также щелочно-лабильные сайты в ДНК периферических лейкоцитов были измерены в терминах среднего момента оливкового хвоста с помощью щелочного анализа комет ( Рис. 2 ). В то время как средние моменты оливкового хвоста у мышей, не получавших лечения, оставались низкими на протяжении каждого цикла лечения, мыши, получавшие DSS, демонстрировали значительно более высокие моменты оливкового хвоста в конце каждого цикла ( P <0,01). После каждого 14-дневного периода ремиссии уровни повреждения ДНК снижались, скорее всего, из-за репарации ДНК.Анализ щелочных комет, модифицированных hOgg1, также использовался для обнаружения окислительного повреждения основания. Ogg1 в первую очередь распознает и удаляет 8-оксогуанин через основной путь эксцизионного восстановления, а также 8-оксоаденин, фапи-гуанин и метил-фапи-гуанин ( 32). Средние моменты оливкового хвоста были выше при инкубации с hOgg1 после циклов обработки у обработанных мышей по сравнению с необработанными мышами, инкубированными с hOgg1 ( P <0,05), что указывает на наличие повреждения окисленным основанием. По сравнению с уровнями до цикла 1, hOgg1-инкубированная ДНК от DSS-обработанных мышей была значительно выше в каждую последующую временную точку ( P <0.01; данные не показаны). Уровни повреждения ДНК увеличиваются с каждым циклом лечения, особенно с учетом окислительного повреждения основания, что указывает на повреждающие эффекты острого и, что более важно, хронического воспаления. Небольшое количество апоптотических клеток с обширной фрагментацией ДНК было очевидно после циклов обработки, но не было включено в расчет средних моментов оливкового хвоста.
Рисунок 2.Средние моменты оливкового хвоста. По крайней мере, 150 «комет» оценивали на мышь в группе, получавшей DSS ( n, = 10) и группе, не получавшей лечения ( n = 10).Перед применением статистических тестов данные были преобразованы в журнал. Среднее ± SE. *, P <0,05; **, P <0,01.
Наличие одних двухцепочечных разрывов ДНК было подтверждено иммунофлуоресценцией γ-h3AX ( Рис. 3A ). В ответ на двухцепочечные разрывы h3AX фосфорилируется (γ-h3AX) в области размером 2 Мбар, фланкирующей двухцепочечный разрыв, в течение 15 мин ( 27). Процент клеток, положительных по ядерным очагам, резко увеличился в группе, получавшей DSS, после первого 7-дневного острого лечения ( P <0.01) по сравнению с нелеченными животными. Хотя это и не столь впечатляюще, процент положительных клеток оставался повышенным по сравнению с нелеченными животными до конца лечения ( P <0,05). Эффективная репарация двухцепочечных разрывов ДНК может быть активирована, уменьшая присутствие очагов при хроническом воспалении из-за сильно повреждающего характера двухцепочечных разрывов по сравнению с окислительным повреждением оснований или одноцепочечными разрывами.
Рисунок 3.очаги γ-h3AX и индукция микроядер. A, процентов положительных клеток по очагам γ-h3AX в периферических лейкоцитах.Наличие двухцепочечных разрывов подтверждали иммунофлуоресценцией γ-h3AX. Положительные клетки содержали более 4 различных ядерных фокусов. Увеличение, × 100. На образец было проанализировано не менее 125 клеток. Среднее значение ± стандартная ошибка ( n = 10 на группу лечения). **, P <0,01; *, P <0,05. B, индукция микроядер в периферических нормохроматических эритроцитах. Подсчитывали не менее 4000 нормохроматических эритроцитов и оценивали наличие микроядер. Среднее значение ± SE микроядерных нормохроматических эритроцитов ( MN-NCE ) на 1000 нормохроматических эритроцитов ( NCE ).Увеличение, × 100. **, P <0,01; *, P <0,05, непараметрический односторонний дисперсионный анализ с тестом множественного сравнения Данна. ANOVA нормальной линейной регрессии показал, что эффект лечения, цикл лечения и взаимодействие эффекта лечения и цикла лечения являются значимыми ( P <0,01).
DSS-индуцированное воспаление кластогенно по отношению к эритробластам. Анализ микроядер in vivo проводили на зрелых нормохроматических эритроцитах, циркулирующих в периферической крови, для определения хромосомных повреждений эритробластов ( Инжир.3Б). Частота появления микроядер обычно используется как показатель цитогенетического повреждения, включая разрывы хромосом, аномалии веретена или структурные аномалии хромосом, чаще всего в эритробластах / эритроцитах периферической крови или костного мозга ( 29). Зрелые микроядерные нормохроматические эритроциты представляют собой заключительную стадию развития эритробластов, содержащих микроядра, лежащие в основе костного мозга, и, таким образом, позволяют изучать как образование, так и элиминацию микроядерных эритроцитов ( 33).
Образование микроядер значимо индуцировалось после первого цикла лечения у животных, получавших DSS ( P <0,01), по сравнению с нелеченными животными и дополнительно индуцировалось после второго и третьего циклов по сравнению как с нелеченными животными, так и с уровнями до цикла 1 ( P <0,01). Подобно картинам, наблюдаемым в результатах щелочного анализа комет, образование микроядер уменьшалось после периодов ремиссии и увеличивалось после каждого цикла лечения.Это указывает на клиренс микроядерных эритроцитов селезенкой с последующей индукцией во время периодов лечения. Начиная с момента времени цикла 3, уровни микроядерных эритроцитов были немного повышены даже у нелеченных животных, скорее всего, из-за эффектов повторных заборов крови и, как следствие, высокой скорости эритропоэза.
Лечение DSS модулирует экспрессию мРНК цитокинов в периферической крови. Системное воспаление, вызванное лечением DSS, было показано по экспрессии генов цитокинов в периферической крови обработанных животных.Лейкоциты, циркулирующие на периферии, вызывают сильный ответ Th2, характеризующийся повышением регуляции TNF-α, MCP-1 и IFN-γ, особенно после первого цикла лечения ( Рис. 4 ). Уровни транскрипта TNF-α соответствовали паттернам повреждения ДНК, увеличиваясь после каждого 7-дневного цикла лечения и затем снижаясь после каждого 14-дневного периода ремиссии. Уровни транскриптов MCP-1 и IFN-γ увеличивались после первого цикла, а затем снижались после периода ремиссии, где они оставались низкими до следующего повышения в третьем цикле, показывая замедленную вторичную индукцию по сравнению с TNF-α.Трансформирующий фактор роста-β, противовоспалительный цитокин, также модулировался аналогично МСР-1 и IFN-γ. Лечение DSS вызывает как ответ Th2, так и противовоспалительный ответ в острой и хронической фазах лечения в периферической крови.
Рисунок 4.Количественная ПЦР цитокинов периферической крови в реальном времени. Уровни экспрессии цитокинов определяли только у мышей, получавших DSS ( n = 10). Среднее значение ± SE экспрессии гена, деленное на экспрессию ТАТА-связывающего белка ( Tbp ). A, уровней транскрипта TNF-α, разделенных на TATA-связывающий белок. B, уровней транскрипта MCP-1, разделенных на TATA-связывающий белок. C, уровней транскрипта IFN-γ, разделенных на TATA-связывающий белок. D, уровней транскрипта трансформирующего фактора роста β, деленных на TATA-связывающий белок. Статистическая значимость определялась непараметрическим односторонним дисперсионным анализом ANOVA с тестом множественного сравнения Данна. *, P <0,05; **, P <0,01.
Повреждение ДНК наблюдается в генетических моделях воспаления слизистой оболочки. Чтобы дополнительно определить, является ли системная генотоксичность общим следствием колита, мы измерили повреждение ДНК на двух генетических моделях воспаления слизистой оболочки без использования DSS. Мы исследовали Gαi2 – / – мышей в возрасте 3 месяцев (хроническое активное воспаление с неопластическими изменениями в толстой кишке) и IL-10 – / – в возрасте 3 и 6 месяцев (у мышей наблюдается субклиническое заболевание с минимальным гистологическим воспалением и активное заболевание и воспаление с легкой гиперплазией эпителия соответственно; Инжир.5А ). Одно- и двухцепочечные разрывы ДНК были значительно выше ( P <0,01) как у мышей Gαi2 – / – по сравнению с мышами соответствующего возраста Gαi2 +/- без клинических симптомов, так и у мышей IL-10 – / – мышей с субклиническим воспалением по сравнению с мышами соответствующего возраста IL-10 + / + с использованием кометного анализа ( Рис. 5Б). Затем мы предположили, что мыши IL-10 – / – с тяжелым воспалением слизистой оболочки будут иметь большее повреждение ДНК, чем мыши с субклиническим воспалением.Эти мыши действительно показали более высокие уровни разрывов цепей, чем мыши IL-10 – / – с субклиническим воспалением ( P <0,01) по сравнению с таковыми у мышей Gαi2 – / – . Окислительное повреждение оснований, однако, казалось очевидным только у мышей Gαi2, как измерено с помощью инкубации hOgg1. Двухцепочечные разрывы ДНК, измеренные с помощью иммунофлуоресценции γ-h3AX ( 5C) также были повышены у мышей Gαi2 – / – и IL-10 – / – и Gαi2 +/- и IL-10 + / + соответственно, хотя статистически значимо только у Gαi2. – / – мышей ( P <0.05) и IL-10 – / – мышей с тяжелым воспалением слизистой оболочки ( P <0,05). Наконец, индукция микроядер в эритробластах также была значительно повышена у мышей Gαi2 – / – по сравнению с мышами Gαi2 +/- ( P <0,01) и повышена, но не статистически значимо повышена для IL-10 – / – . по сравнению с IL-10 + / + мышей ( Рис. 5D). Таким образом, системная генотоксичность может быть вызвана несколькими способами воспаления, независимо от введения DSS.
Рисунок 5.Системная генотоксичность на мышиных моделях воспаления слизистой оболочки. Кровь брали у мышей Gai2 – / – , IL-10 – / – и контрольных мышей IL-10 + / + для анализа генотоксичности в возрасте 3 месяцев; кроме того, были взяты образцы мышей IL-10 – / – в возрасте 6 месяцев, когда колит на этом генетическом фоне прогрессировал в более высокую клиническую активность. A, репрезентативная гистология толстой кишки (окрашивание H&E при указанном увеличении) мышей Gai2 и IL-10 в возрасте 3 месяцев.Анализ щелочных комет B, с инкубацией hOgg1 и без нее проводили в периферических лейкоцитах. стержней, SE ( n = 6 на группу). **, P <0,01, непарный тест Стьюдента t . C, процентов положительных клеток по очагам γ-h3AX в периферических лейкоцитах. Барс, SE. *, P <0,05, непарный тест Стьюдента t . D, микроядерных нормохроматических эритроцитов на 1000 нормохроматических эритроцитов в периферической крови. Барс, SE. **, P <0,01, непарный тест Стьюдента t .
Воспаление кишечника вызывает окислительный стресс, опосредованный реактивными формами кислорода, и повреждение ДНК. Для определения потенциально причинных видов окислительного стресса, вызванного воспалением кишечника, были выделены периферические лейкоциты от мышей, получавших DSS (7 дней, 3% мас. / Об.), И мышей IL-10 – / – (6 месяцев) и окрашены на 8-оксогуанин или нитротирозин ( Рис. 6A и B ).8-Оксогуанин представляет собой окислительное повреждение ДНК, образованное реакцией гидроксильных радикалов, гидропероксидов металлов или пероксинитрита с ДНК, вызывая трансверсии G: C в T: A во время репликации ( 34). Нитротирозин является биохимическим маркером NO-индуцированного образования пероксинитрита, включающего реакции с активными формами кислорода и азота, приводящие к нитративному повреждению белков ( 35). Воспаление, вызванное DSS, вызвало значительное увеличение как 8-оксогуанина, так и нитротирозина ( P <0,01) в периферических лейкоцитах, как и лейкоциты, выделенные из мышей IL-10 – / – ( P <0.05). Срезы толстой кишки мышей IL-10 – / – также показали остатки 8-оксогуанина в основном в ядрах поверхностных эпителиальных клеток, а также в инфильтрирующих воспалительных клетках внутри или около собственной пластинки в виде «очагового» или пан-ядерного окрашивания. ( Рис. 6C). Остатки нитротирозина также присутствовали в цитоплазме эпителиальных клеток и воспалительных клеток, тогда как иммунореактивность не наблюдалась у мышей дикого типа.
Рисунок 6.Образование 8-оксогуанина и нитротирозина в периферических лейкоцитах и толстой кишке. A, репрезентативных изображений положительного окрашивания на 8-оксогуанин ( зеленый ; слева ) и нитротирозин ( красный ; справа ) в лейкоцитах DSS-обработанного дикого типа (7 дней) и IL-10 – / – мышей (6 мес.) Соответственно. B, % положительных клеток для окрашивания 8-оксогуанином и нитротирозином до и после у мышей, получавших DSS (7 дней; n = 6 на группу; слева ) и IL-10 – / – мышей (6 месяцев; n = 4 на группу; справа ).*, P <0,05; **, P <0,01, непарный тест Стьюдента t . C, репрезентативных изображений 8-оксогуанина ( зеленый ) и нитротирозина ( красный ) в срезах толстой кишки мышей IL-10 – / – (6 месяцев) и мышей дикого типа.
Обсуждение
Предыдущие исследования установили роль вызванного воспалением окислительного повреждения ДНК воспалительных и окружающих эпителиальных клеток только в локализованных участках воспаления в толстой кишке.Наше исследование впервые показывает, что это повреждение распространяется за пределы очага воспаления на циркулирующие лейкоциты и эритробласты в костном мозге, проявляя системный эффект и коррелируя с окислительным повреждением, обнаруженным в воспалительной ткани. Генотоксичность по отношению к периферическим лейкоцитам была очевидна с точки зрения как одно-, так и двухцепочечных разрывов ДНК, сопровождаемых окислительным повреждением оснований, в то время как хромосомные аберрации имели место в эритробластах. Такие результаты наблюдались как при острой, так и при хронической фазах химического колита, вызванного введением DSS, и нелеченных мышей Gαi2 – / – и IL-10 – / – , перенесших спонтанный иммунный колит.Более того, у мышей IL-10 – / – , которые отличаются отсроченным началом колита, генотоксичность была дополнительно повышена у мышей, которые перешли в состояние клинически активного колита, по сравнению с мышами с субклиническим воспалением. Маркеры окислительного стресса, вызванного реактивными формами кислорода, показали присутствие 8-оксогуанина и нитротирозина в периферических лейкоцитах мышей, получавших DSS, и мышей IL-10 – / – , что представляет возможные механизмы генотоксичности и коррелирует с окислительным повреждением, наблюдаемым в толстой кишке. .Соответственно, настоящее исследование показывает, что системная генотоксичность является преобладающим признаком субклинических, острых и хронических колитов.
У мышей, получавших DSS, репарация повреждений ДНК наблюдалась в периоды ремиссии, что выражалось в снижении маркеров повреждений. Однако степень восстановления в последней ремиссии оказалась несколько меньшей из-за нарастания тяжести хронического воспаления. Несмотря на увеличивающуюся тяжесть воспаления, количество двухцепочечных разрывов оставалось лишь незначительно повышенным по сравнению с нелеченными животными, что может означать эффективное восстановление по сравнению с одноцепочечными разрывами и окислительным повреждением.Введение DSS также индуцировало системное распределение цитокинов, о чем свидетельствует модуляция уровней транскриптов в периферической крови. Интересно, что TNF-α был повышен во время лечения и понижен во время ремиссии, что отражает паттерны генотоксичности для лейкоцитов. Подобно предыдущим исследованиям цитокинов в толстой кишке мышей, получавших DSS ( 20), особенности активности как Th2, так и Th3 наблюдались системно в периферической крови, что приводило к хронической активации иммунных клеток. Снижение экспрессии MCP-1 и IFN-γ после первого цикла лечения можно объяснить сдвигом в сторону более высокой экспрессии цитокинов Th3 и снижением селективных цитокинов Th2, как недавно было документально подтверждено ( 36) у мышей, получавших DSS.Хроническое лечение DSS имитирует ВЗК с аналогичными профилями цитокинов, демонстрируя дисрегулируемые и несбалансированные иммунологические ответы на комменсальные бактериальные антигены. Дисрегулируемая и поляризованная продукция цитокинов играет ключевую роль в усилении хронического воспаления и туморогенеза за счет передачи сигналов высвобождения медиаторов опухоли ( 37).
Настоящее исследование показывает, что как химические, так и генетические / иммунные модели канцерогенеза, опосредованного воспалением, не только параллельны воспалению, дисплазии и раку ВЗК человека, но также проявляют связанный с воспалением окислительный стресс в толстой кишке, как это наблюдается при язвенном колите и болезни Крона. .В отличие от других моделей неоплазии, связанных с колитом, использующих генотоксические канцерогены толстой кишки в качестве инициаторов неоплазии (азоксиметан или 1,2-диметилгидразин), DSS сам по себе не является мутагеном и не генотоксичен ( 38). Однако было показано, что он как прямо, так и косвенно активирует макрофаги и другие воспалительные клетки ( 16, 39), центральная особенность генетических моделей иммунного колита ( 8– 11). Таким образом, канцерогенез, возникающий в этих условиях, является исключительно проявлением хронического воспаления. Выраженная слизистая и системная активация макрофагов, нейтрофилов, эозинофилов и других эффекторов при DSS-индуцированном колите, генетическом иммунном колите (и при активной болезни пациентов с ВЗК) является потенциальным источником окислительного стресса.Это может вызвать окислительное и нитративное повреждение локально за счет окислительного взрыва и высвобождения цитокинов, которые индуцируют опосредованное рецептором производство активных форм кислорода клетками-мишенями. Нестабильность микросателлитов была идентифицирована в опухолях толстой кишки мышей дикого типа, получавших DSS, и, в большей степени, у Msh3 – / – мышей ( 40). Обработка DSS также индуцировала остатки 8-оксогуанина в слизистой оболочке толстой кишки мышей ( 22), что указывает на окислительное повреждение непосредственно в месте воспаления. Примечательно, что наблюдаемая системная генотоксичность является вторичным эффектом лечения DSS, то есть следствием системного воспаления и окислительного стресса, связанного с воспалением.В соответствии с этими результатами, мы показали образование 8-оксогуанина и нитротирозина в поверхностном эпителии и воспалительном инфильтрате IL-10 – / – толстой кишки, а также в периферической крови IL-10 – / – и DSS- обработанных мышей дикого типа, что указывает на системное присутствие пероксинитрита и активных форм кислорода и азота.
Мы предполагаем два неисключительных процесса, связывающих местное воспаление и системную генотоксичность. Во-первых, локально активированные клетки врожденного иммунитета могут высвобождать реактивные виды, вызывающие образование других реактивных видов, таких как гидроксильные радикалы и пероксинитрит, производный от NO, повреждая эмигрирующие резидентные лейкоциты, которые затем циркулируют на периферии.В качестве альтернативы воспалительные цитокины достигают биологически значимых системных уровней, на которых они индуцируют автономную, опосредованную цитокин-рецепторами продукцию свободных радикалов (и генотоксическое повреждение) в отдаленных популяциях лейкоцитов. Возможны оба сценария, поскольку мы наблюдали провоспалительные цитокины на протяжении всего курса лечения DSS в периферической крови, а также окислительное повреждение ДНК и образование нитротирозина в циркулирующих лейкоцитах. Точно так же образование микроядер в эритробластах костного мозга в нашем исследовании могло быть результатом активированных Т-клеток, которые являются частью нормального пула рециркулирующих лимфоцитов, циркулирующих в костном мозге и приводящих к окислительному повреждению.Накопление одно- и двухцепочечных разрывов может последовательно приводить к хромосомным разрывам и образованию микроядер ( 41).
Кроме того, биологические процессы, затронутые воспалением, также могут определять судьбу клеток, несущих генотоксические повреждения. Поскольку медиаторы воспаления вызывают как пролиферацию эпителиальных клеток, так и антиапоптотические сигналы, эпителиальные клетки при хроническом воспалении подвергаются особому риску повреждения ДНК, что приводит к фиксации мутаций, которые не могут быть должным образом восстановлены и удалены ( 22).При колите DSS окислительное повреждение ДНК положительно коррелировало с апоптозом в тонком кишечнике, но не в толстом кишечнике ( 42). Это биологическое различие может способствовать относительной предрасположенности к прогрессированию рака толстой кишки. Хотя механизм этой дифференциальной индукции апоптоза неясен, генотоксический стресс индуцирует экспрессию лигандов рецептора NKG2D ( 43). Этот рецептор дифференциально экспрессируется на резидентных CD8 + Т-клетках и естественных клетках-киллерах тонкого и толстого кишечника и является мощным индуктором противоэпителиальной цитотоксичности в этой области кишечника ( 44).Наконец, новая область исследований – возможность реципрокной регуляции воспаления и элементов пути репарации ДНК ( 45).
Таким образом, воспаление кишечника связано с системной генотоксичностью через разрывы одинарных и двойных цепей ДНК, окислительное повреждение ДНК, нитрование белка и образование микроядер. Мы предполагаем, что элементы воспалительного ответа, включая окислительный стресс, вызванный реактивными формами кислорода, ответственны за наблюдаемую системную генотоксичность, хотя точные типы клеток и продукты воспаления еще предстоит определить.Предыдущие исследования наблюдали повреждение окислительного основания, микросателлитную нестабильность и генные мутации непосредственно в слизистой оболочке толстой кишки как при ВЗК человека, так и при экспериментальном колите у мышей. Здесь мы подчеркиваем, что системное повреждение ДНК, сопровождающееся системным воспалением, является ранним событием, участвующим в продвижении генетической нестабильности. Такая системная генотоксичность может быть биологически значимым и чувствительным биомаркером одного процесса, способствующего канцерогенезу, связанному с воспалением.
Раскрытие информации о потенциальных конфликтах интересов
О потенциальных конфликтах интересов не сообщалось.
Благодарности
Грантовая поддержка: NIH гранты ES09519 (Р. Х. Шистл), DK46763 (Дж. Браун) и CA016042 (Комплексный онкологический центр Йонссона), Фонд комплексного онкологического центра Йонссона (Р. Х. Шистл и Дж. Браун) и Фонд Крона и колита Америка (Дж. Браун).
Расходы на публикацию этой статьи были частично покрыты за счет оплаты страницы. Таким образом, данная статья должна быть помечена как реклама в соответствии с 18 U.S.C. Раздел 1734 исключительно для указания этого факта.
Мы благодарим Нагеша Рао за техническую помощь с анализом микроядер.
Сноски
- Получено 24 ноября 2008 г.
- Исправление получено 23 марта 2009 г.
- Принято 6 апреля 2009 г.
- © 2009 Американская ассоциация исследований рака.
Каталожные номера
- ↵
Loftus EV. Клиническая эпидемиология воспалительного заболевания кишечника: заболеваемость, распространенность и влияние окружающей среды.Гастроэнтерология 2004; 126: 1504–17.
- ↵
Экбом А, Хелмик С., Зак М., Адами Х.О. Язвенный колит и колоректальный рак. Популяционное исследование. N Engl J Med 1990; 323: 1228–33.
- ↵
Xie J, Itzkowitz SH. Рак при воспалительном заболевании кишечника. Мир Дж Гастроэнтерол 2008; 14: 378–89.
- ↵
Чу Ф.Ф., Эсуорси Р.С., Чу П.Г. и др.Бактериальный рак кишечника у мышей с нарушенными генами Gpx1 и Gpx2. Рак Res 2004; 64: 962–8.
- ↵
Maggio-Price L, Bielefeldt-Ohmann H, Treuting P, et al. Двойное инфицирование Helicobacter bilis и Helicobacter hepaticus у мышей mdr1a – / – с дефицитом P-гликопротеина приводит к колиту, который прогрессирует до дисплазии. Am J Pathol 2005; 166: 1793–806.
- ↵
An G, Wei B, Xia B, et al.Повышенная восприимчивость к колиту и колоректальным опухолям у мышей, лишенных О-гликанов, производных ядра 3. J Exp Med 2007; 204: 1417–29.
- ↵
Greten FR, Eckmann L, Greten TF и др. IKKβ связывает воспаление и онкогенез на мышиной модели рака, ассоциированного с колитом. Клетка 2004; 118: 285–96.
- ↵
Beatty PL, Plevy SE, Sepulveda AR, Finn OJ. Передний край: трансгенная экспрессия человеческого MUC1 в мышах IL-10 – / – ускоряет воспалительное заболевание кишечника и прогрессирование до рака толстой кишки.J Immunol 2007; 179: 735–9.
- ↵
Rudolph U, Finegold MJ, Rich SS и др. Язвенный колит и аденокарцинома толстой кишки у Gαi2-дефицитных мышей. Нат Жене 1995; 10: 143–50.
Макферсон М., Вей Б., Туровская О., Фудзивара Д., Брюер С., Браун Дж. Иммунорегуляция колита с помощью CD8 + Т-клеток требует цитотоксичности Т-клеток и презентации антигена пептида В-клеток. Am J Physiol Gastrointest Liver Physiol 2008; 295: G485–92.
- ↵
Nemetz N, Abad C, Lawson G, et al. Индукция колита и быстрое развитие колоректальных опухолей у мышей с дефицитом нейропептида PACAP. Int J Рак 2008; 122: 1803–9.
- ↵
Попиванова Б.К., Китамура К., Ву Й и др. Блокирование TNF-α у мышей снижает колоректальный канцерогенез, связанный с хроническим колитом. J Clin Invest 2008; 118: 560–70.
О’Махони Л., Фини М., О’Халлоран С. и др.Влияние пробиотиков на микробную флору, воспаление и развитие опухолей у мышей с нокаутом IL-10. Алимент Фармакол Тер 2001; 15: 1219–25.
Erdman SE, Poutahidis T, Tomczak M, et al. CD4 + CD25 + регуляторные Т-лимфоциты ингибируют микробно-индуцированный рак толстой кишки у мышей с дефицитом Rag2. Am J Pathol 2003; 162: 691–702.
- ↵
Takedatsu H, Michelsen KS, Wei B и др. TL1A (TNFSF15) регулирует развитие хронического колита, модулируя активацию как Т-хелперов 1, так и Т-хелперов 17.Гастроэнтерология 2008; 135: 552–67.
- ↵
Окаясу И., Хатакеяма С., Ямада М., Окуса Т., Инагаки Ю., Накая Р. Новый метод индукции надежного экспериментального острого и хронического язвенного колита у мышей. Гастроэнтерология 1990; 98: 694–702.
- ↵
Cooper HS, Murthy S, Kido K, Yoshitake H, Flanigan A. Дисплазия и рак на модели мышиного колита с сульфатом натрия и декстраном.Актуальность для неоплазии, связанной с колитом, у человека: исследование гистопатологии, экспрессии β-катенина и p53 и роли воспаления. Канцерогенез 2000; 21: 757–68.
- ↵
Lennard-Jones JE, Melville DM, Morson BC, Ritchie JK, Williams CB. Предраковые заболевания и рак при обширном язвенном колите: данные среди 401 пациента старше 22 лет. Кишечник 1990; 31: 800–6.
- ↵
Dieleman LA, Ridwan BU, Tennyson GS, Beagley KW, Bucy RP, Elson CO.Колит, вызванный декстрансульфатом натрия, встречается у мышей с тяжелым комбинированным иммунодефицитом. Гастроэнтерология 1994; 107: 1643–52.
- ↵
Dieleman LA, Akol H, Bloemena E, PeÑA AS, Meuwissen SGM, Van Rees EP. Хронический экспериментальный колит, вызванный декстрансульфатом натрия (DSS), характеризуется цитокинами Th2 и Th3. Клин Эксп Иммунол 1998; 114: 385.
Ohkusa T, Okayasu I, Tokoi S, Araki A, Ozaki Y.Изменения бактериального фагоцитоза макрофагов при экспериментальном язвенном колите. Пищеварение 1995; 56: 159–64.
- ↵
Meira LB, Bugni JM, Green SL и др. Повреждение ДНК, вызванное хроническим воспалением, способствует канцерогенезу толстой кишки у мышей. J Clin Invest 2008; 118: 2516.
- ↵
Murthy SN, Cooper HS, Shim H, Shah RS, Ibrahim SA, Sedergran DJ. Лечение мышиного колита, вызванного декстрансульфатом натрия, циклоспорином внутри толстой кишки.Dig Dis Sci 1993; 38: 1722–34.
- ↵
Olive PL, Банат JP. Кометный анализ: метод измерения повреждений ДНК в отдельных клетках. Протоколы Nat 2006; 1: 23–9.
- ↵
Смит СС, О’Донован М.Р., Мартин Э.А. hOGG1 распознает окислительное повреждение с помощью кометного анализа с большей специфичностью, чем FPG или ENDOIII. Мутагенез 2006; 21: 185–90.
- ↵
Голдстайн СП, Нахас С., Гамо К. и др.Конститутивное фосфорилирование ATM в линиях лимфобластоидных клеток от пациентов с синдромом ICF без нижестоящей киназной активности. Ремонт ДНК 2006; 5: 432–43.
- ↵
Муслимович А., Исмаил И., Гао Ю., Хаммарстен О. Оптимизированный метод измерения γ-h3AX в мононуклеарных и культивируемых клетках крови. Протоколы Nat 2008; 3: 1187.
- ↵
Шмид В. Микроядерный тест для цитогенетического анализа.Химические мутагены Принципы и методы их обнаружения. Нью-Йорк: Пленум; 1976. с. 31–53.
- ↵
Hayashi M, Tice RR, MacGregor JT, et al. Анализ микроядер эритроцитов грызунов in vivo . Mutat Res 1994; 312: 293–304.
- ↵
Лоссос И.С., Червински Д.К., Вексер М.А., Леви Р. Оптимизация количественных параметров ОТ-ПЦР в реальном времени для исследования лимфоидных злокачественных новообразований. Лейкемия 17: 789–95.
- ↵
- ↵
Бьорас М., Луна Л., Йонсен Б. и др. Противоположные основно-зависимые реакции фермента эксцизионной репарации оснований человека на ДНК, содержащей 7,8-дигидро-8-оксогуанин и абазические сайты. EMBO J 1997; 16: 6314–22.
- ↵
Steinheider G, Neth R, Marquardt H. Оценка негенотоксических и генотоксических факторов, модулирующих частоту микроядерных эритроцитов в периферической крови мышей.Cell Biol Toxicol 1986; 2: 197–211.
- ↵
Pinlaor S, Ma N, Hiraku Y и др. Повторное заражение Opisthorchis viverrini вызывает накопление 8-нитрогуанина и 8-оксо-7,8-дигидро-2′-дезоксигуанина в желчных протоках хомяков через индуцибельную синтазу оксида азота. Канцерогенез 2004; 25: 1535–42.
- ↵
Лю Дж.С., Чжао М.Л., Броснан К.Ф., Ли СК. Экспрессия индуцибельной синтазы оксида азота и нитротирозина в очагах рассеянного склероза.Am J Pathol 2001; 158: 2057.
- ↵
Алекс П., Закос NC, Нгуен Т. и др. Отчетливые цитокиновые паттерны, идентифицированные из множественных профилей мышиного DSS и TNBS-индуцированного колита. Воспаление кишечника 2009; 15: 341–52.
- ↵
Johansson M, Denardo DG, Coussens LM. Поляризованные иммунные ответы по-разному регулируют развитие рака. Иммунол Рев 2008; 222: 145–54.
- ↵
Мори Х, Охбаяси Ф, Хироно И, Шимада Т, Уильямс ГМ.Отсутствие генотоксичности канцерогенных сульфатированных полисахаридов каррагинан и сульфат декстрана в анализах репарации ДНК млекопитающих и бактериальной мутагенности. Nutr Cancer 1984; 6: 92–7.
- ↵
Шинтани Н., Накадзима Т., Сугиура М. и др. Пролиферативный эффект макрофагов, индуцированных декстрансульфатом натрия (DSS), на Т-клетки мышей с DSS-индуцированным колитом и ингибирование эффекта IgG. Сканд Дж Иммунол 1997; 46: 581–6.
- ↵
Kohonen-Corish MRJ, Daniel JJ, te Riele H, Buffinton GD, Dahlstrom JE.Восприимчивость мышей с дефицитом Msh3 к колоректальным опухолям, связанным с воспалением. Рак Res 2002; 62: 2092–7.
- ↵
Obe G, Pfeiffer P, Savage JRK и др. Хромосомные аберрации: формирование, идентификация и распространение. Mutat Res 2002; 504: 17–36.
- ↵
Hong MY, Turner ND, Carroll RJ, Chapkin RS, Lupton JR. Различная реакция на повреждение ДНК может объяснить различную восприимчивость к раку тонкого и толстого кишечника.Эксп Биол Мед 2005; 230: 464–71.
- ↵
Gasser S, Orsulic S, Brown EJ, Raulet DH. Путь повреждения ДНК регулирует лиганды врожденной иммунной системы рецептора NKG2D. Природа 2005; 436: 1186–90.
- ↵
Meresse B, Curran SA, Ciszewski C, et al. Перепрограммирование CTL в естественные клетки-киллеры при глютеновой болезни. J Exp Med 2006; 203: 1343.
- ↵
Coscoy L, Raulet DH.Неправильное использование ДНК ведет к надзору со стороны иммунной системы. Клетка 2007; 131: 836–8.
Воспаление кишечника: причины, симптомы, лечение, диета
Боль в животе и расстройство желудка являются наиболее частыми симптомами воспаления кишечника. Приблизительно 1 из 10 человек регулярно страдает ими, и во многих случаях причиной является воспаление кишечника.
Что такое воспаление кишечника?
Воспаление – это реакция организма на вредные раздражители.Стимулируется кровообращение и высвобождаются вещества-мессенджеры, которые затем привлекают иммунные клетки. Так организм готовится отразить и исправить повреждение.
Когда воспаление возникает в кишечнике, оно обычно поражает слизистую оболочку (это слой, выстилающий внутреннюю стенку кишечника). Клетки слизистой оболочки постоянно подвергаются воздействию внешних раздражителей, например, от компонентов пищи, бактерий, вирусов, грибов или других вторжений. Хотя сама слизистая оболочка очень прочная, такие раздражители могут спровоцировать воспаление.Поскольку кишечник имеет собственную иммунную защиту, это часто приводит к выраженной реакции.
Где может возникнуть воспаление в кишечнике?
Теоретически весь кишечник (то есть тонкий и толстый кишечник) может быть поражен воспалением. Но редко бывает, чтобы поражалась вся длина кишечника. В зависимости от причины воспаления чаще всего поражаются определенные участки кишечника.
Воспалительное заболевание кишечника, например, язвенный колит, развивается только в толстом кишечнике.Он почти всегда начинается с последнего отдела кишечника (прямой кишки), но также может повлиять на всю толстую кишку. Воспаление кишечника, вызванное вирусами, в основном поражает тонкий кишечник и желудок; это называется гастроэнтеритом.
Что вызывает воспаление кишечника?
Воспаление кишечника может быть вызвано множеством причин. Патогены, такие как вирусы, бактерии и грибки, могут проникать в кишечник извне и вызывать воспаление. Определенные пищевые привычки могут повлиять на естественную кишечную флору, способствуя воспалению.Когда иммунная система атакует кишечник, это называется аутоиммунным заболеванием. Воспалительные заболевания кишечника, болезнь Крона и язвенный колит, имеют такую аутоиммунную причину.
Вирусы, бактерии и грибки
Вирусы – наиболее частая причина воспаления кишечника. Считается, что они ответственны за воспаление желудочно-кишечного тракта (гастроэнтерит) до 70 процентов случаев. В зависимости от вируса воспаление кишечника может сопровождаться тяжелыми симптомами, часто также рвотой и лихорадкой.Вирусы обычно излечиваются без лекарств. В случае гастроэнтерита важно обеспечить адекватную гидратацию.
Бактериальное воспаление встречается реже, чем вирусное воспаление. Обычно он сопровождается более серьезными и продолжительными жалобами и во многих случаях требует стационарного лечения. Антибиотики можно использовать для лечения бактериального воспаления.
Дрожжи Candida albicans играют важную роль в воспалении кишечника, вызванном грибками.Хотя он также встречается у здоровых людей на слизистой оболочке кишечника (колонизация), он также может резко размножаться и нарушать слизистый барьер. Затем возникает инфекция. Однако это случается редко и обычно возникает у людей с ослабленной иммунной системой.
Хроническое воспалительное заболевание кишечника
Болезнь Крона и язвенный колит – хронические воспалительные заболевания кишечника. Это заболевания, при которых собственная иммунная система нацелена на части кишечника. Точные причины этой реакции иммунной системы еще недостаточно изучены.Однако известно, что воспалительные заболевания кишечника различаются по тому, где они возникают в желудочно-кишечном тракте.
Теоретически болезнь Крона может поражать весь пищеварительный тракт от рта до заднего прохода, не затрагивая отдельные участки. С другой стороны, язвенный колит возникает только в толстой кишке и только непрерывно, то есть без исключения частей кишечника.
Может ли неправильное питание привести к воспалению кишечника?
В кишечнике человека обитает около 40 триллионов бактерий.Это соответствует весу около 200 г (7 унций). Эта кишечная флора создана для того, чтобы жить с нами. Он обрабатывает компоненты нашей пищи и помогает нам получать важные питательные вещества, такие как короткоцепочечные жирные кислоты и витамины.
Наша диета и кишечная флора влияют друг на друга. В зависимости от того, что мы едим, мы также используем его для привлечения других видов бактерий. Сладкая пища привлекает бактерии и грибки, перерабатывающие сахар. Пища, богатая клетчаткой, питает бактерии, перерабатывающие клетчатку.
Чтобы предотвратить появление вредных бактерий, важно поддерживать баланс кишечной флоры.Бактерии, входящие в состав здоровой и естественной кишечной флоры, предотвращают распространение и размножение вредных бактерий. Здоровая кишечная флора предотвращает воспаление в кишечнике.
CARA CARE помогает решить проблемы с пищеварениемСкачать приложение
Каковы симптомы воспаления кишечника?
Симптомы воспаления кишечника разнообразны и могут варьироваться от пациента к пациенту. Одним из распространенных симптомов, возникающих у многих пациентов с воспалением кишечника, является диарея.Повреждение приводит к тому, что слизистая оболочка теряет способность извлекать воду из пищи. В результате содержимое кишечника остается жидким и покидает кишечник быстрее, чем у здоровых людей.
Диарея часто сопровождается сильной болью в животе и спазмами. В зависимости от причины воспаления кишечника боль возникает в разных местах живота. При классическом гастроэнтерите обычно болит весь желудок. Язвенный колит в основном поражает прямую кишку и часто сопровождается болями в левой нижней части живота.
Воспаление кишечника часто приводит к тошноте и рвоте. С одной стороны, это затрудняет прием пищи, а с другой – рвота (часто в сочетании с диареей) приводит к обезвоживанию. Вот почему важно пить достаточное количество жидкости в случае воспаления кишечника.
Часто возникают общие симптомы, такие как усталость, жар, головная боль и ломота в теле, особенно при вирусном и бактериальном воспалении.
Наиболее частыми симптомами воспаления кишечника являются:
- Диарея
- Тошнота и рвота
- Сильная боль и спазмы в животе
- Усталость, головная боль и ломота в теле.
Возможно ли воспаление кишечника без диареи?
Диарея – частый симптом воспаления кишечника, но не каждый случай воспаления кишечника сопровождается диареей. Диарея возникает, когда поврежденная слизистая оболочка больше не может должным образом абсорбировать жидкость в кишечнике. Некоторые вещества, выделяемые, например, бактериями, также могут препятствовать абсорбции жидкости.
Но хотя диарея возникает при многих кишечных инфекциях, есть случаи, когда это не так.Легкое воспаление желудочно-кишечного тракта часто приводит к незначительным изменениям частоты и консистенции стула или вообще без них.
Хронические воспалительные заболевания кишечника Болезнь Крона и язвенный колит обычно сопровождаются диареей. Но и здесь могут быть фазы, в которых возникает боль, но диарея отсутствует.
Знаете ли вы?
Диарея – распространенный симптом воспаления кишечника, но диарея не обязательно возникает во всех случаях воспаления кишечника.
Как диагностируется воспаление в кишечнике?
Существует несколько диагностических инструментов для диагностики воспаления кишечника. Вирусный гастроэнтерит, на который приходится большая часть воспаления кишечника, уже можно распознать по описанию пациента. При распространенном вирусном гастроэнтерите исследование кала не требуется.
В более сложных случаях или если предполагается, что причиной являются бактерии, может быть полезным анализ образца стула.Анализы крови также могут помочь определить степень воспаления.
Если с помощью этих средств невозможно поставить диагноз, можно сделать колоноскопию. С помощью этого метода можно диагностировать большинство воспалений кишечника.
Помогает ли УЗИ диагностировать воспаление кишечника?
Ультразвуковое исследование позволяет выявить структуры внутри тела без облучения. В области желудочно-кишечного тракта ультразвуковое исследование используется, например, для диагностики аппендицита.Однако ультразвуковые исследования имеют ограниченное применение для диагностики воспаления кишечника. Причина в том, что они могут выявить грубые признаки воспаления, но трудно определить точную степень воспаления и его причину.
Кроме того, УЗИ – это процедура, которая в значительной степени зависит от соответствующего экзаменатора: чем больше экзаменатор специализируется на УЗИ кишечных заболеваний, тем скорее он сможет диагностировать воспаление кишечника с помощью этого метода.
Как вылечить воспаление кишечника?
Самый распространенный тип воспаления кишечника, вирусный гастроэнтерит, обычно проходит без лечения. Наиболее важными мерами здесь являются постельный режим и адекватное потребление жидкости. Лучшие жидкости – вода, чай и прозрачные бульоны, например овощные или куриные. Эти отвары также содержат важные минералы, которых в организме может не хватать из-за воспаления кишечника.
В случае тяжелой диареи или особых групп пациентов, таких как пожилые люди или маленькие дети, важен так называемый раствор для пероральной регидратации из аптеки для обеспечения минералами (электролитами).То, как выглядит правильная диета, варьируется от человека к человеку.
Прием антибиотиков не имеет смысла при воспалении кишечника, вызванном вирусами, поскольку антибиотики действуют только против бактерий. Бактериальное воспаление кишечника в некоторых случаях проходит спонтанно, и в этом случае лечение такое же, как и при вирусном воспалении кишечника. В некоторых случаях также могут помочь антибиотики.
В случае воспаления кишечника, вызванного дисбалансом кишечной флоры (дисбактериоз), питание является важной частью терапии.Это потому, что пациенты могут активно способствовать росту «хороших» бактерий с помощью здоровой диеты с высоким содержанием клетчатки. Наличие достаточного количества этих «вспомогательных средств» также предотвращает рост вредных бактерий.
Воспалительные заболевания кишечника лечатся поэтапно. Для этого в первую очередь используются лекарства, которые подавляют иммунную систему и, таким образом, сдерживают реакцию организма. Эти препараты включают, например, кортизон, который используется для лечения обострений.
Воспаление кишечника является обычным явлением.Чтобы справиться с симптомами оптимальным образом, важно понимать триггеры и типичные симптомы воспаления кишечника, поскольку существует множество различных методов лечения в зависимости от причины.
ИсточникиForbes A, Escher J, Hebuterne X и др. Руководство ESPEN: Клиническое питание при воспалительном заболевании кишечника. _Clin Nutr. _2017; 36 (2): 321-347.
Hagel S, Epple HJ, Feurle GE и др. [S2k-руководство по инфекционным заболеваниям желудочно-кишечного тракта и болезни Уиппла]._Z Гастроэнтерол. _2015; 53 (5): 418-459
Джеймсон Дж. Л., Фаучи А. С., Каспер Д. Л., Хаузер С. Л., Лонго Д. Л., Лоскальцо Дж., Ред. Принципы внутренней медицины Харрисона . 20-е изд. Нью-Йорк, Нью-Йорк: McGraw-Hill Education, 2018.
Posovszky C, Backendorf V, Buderus S, et al. _Z Гастроэнтерол. _2019; 57 (9): 1077-1118
Отправитель Р., Фукс С., Майло Р. Пересмотренные оценки количества клеток человека и бактерий в организме. _PLoS Biol. _2016; 14 (8): e1002533.
Что такое заживление слизистой оболочки при ВЗК?
Воспалительные заболевания кишечника (ВЗК) являются хроническими состояниями, что означает, что они проходят через периоды активного заболевания (обострения) и ремиссии (в общих чертах определяемых как периоды незначительной активности заболевания или ее отсутствия).Болезнь Крона и язвенный колит – два ВЗК, которые могут вызывать язвы в пищеварительном тракте.
Эти язвы могут поражать несколько слоев стенок тонкой и толстой кишки, особенно при болезни Крона. Самый внутренний слой кишечника называется слизистой оболочкой. Одним из последних критериев лечения ВЗК является заживление язв на слизистой оболочке, что называется заживлением слизистой оболочки.
Colin Anderson Productions Pty Ltd / Getty ImagesРемиссия при ВБК
Чтобы понять, почему заживление слизистой оболочки важно, необходимо рассмотреть типы ремиссии, их определение и почему ремиссия не всегда означает, что заболевание лечится эффективно.Идея ремиссии была трудной для определения как для гастроэнтерологов, так и для людей, живущих с болезнью Крона и язвенным колитом.
Для многих людей, живущих с ВЗК, ремиссия означает отсутствие или отсутствие симптомов, но это не всегда означает, что болезнь не вызывает воспаления. Возможно отсутствие симптомов, но активность заболевания (например, воспаление) или наличие результатов лабораторных исследований, указывающих на то, что болезнь все еще активна. По этой причине в настоящее время определены несколько различных форм ремиссии, в том числе:
- Биохимическая ремиссия. Это когда анализы крови и кала не показывают каких-либо маркеров, которые обычно присутствуют при активном ВЗК.
- Клиническая ремиссия. Это то, о чем большинство людей думают, когда думают о ремиссии – это когда симптомы болезни немногочисленны или отсутствуют.
- Эндоскопическая ремиссия. Во время эндоскопической процедуры (например, колоноскопии) гастроэнтеролог не видит активности заболевания, и любые взятые биопсии также не показывают заболевания.
- Гистологическая ремиссия. При незначительных симптомах или их отсутствии (клиническая ремиссия) и отсутствии активности заболевания во время эндоскопии или биопсии.
- Хирургическая ремиссия. После хирургической процедуры (такой как илеостомия, хирургия кармана или резекция) симптомы практически отсутствуют, а активность заболевания практически отсутствует.
Важность заживления слизистой оболочки
Эксперты по IBD в настоящее время рассматривают заживление слизистой оболочки как самый большой фактор, который является наиболее важным для достижения лучшего долгосрочного результата.
Заживление слизистой оболочки означает, что активность заболевания не наблюдается во время колоноскопии или другой процедуры, которая исследует слизистую оболочку пищеварительного тракта – это означает, что также присутствует гистологическая ремиссия.
В тонком и толстом кишечнике все еще может быть рубцовая ткань, из-за которой язвы зажили, но воспаление прошло. Пока нет единого определения, но гастроэнтерологи продолжают использовать свои знания и опыт, чтобы принимать решения о заживлении слизистой оболочки и о том, что это означает.
Различные лекарства, используемые для лечения ВЗК, связаны с разной скоростью заживления слизистой оболочки. Хотя были исследования, которые показывают, насколько эффективно лекарство для группы, участвующей в клиническом испытании, заживление слизистой оболочки по-прежнему является индивидуальным процессом.
Одним из препятствий при лечении ВЗК является сложность этих заболеваний. Хотя заживление слизистых оболочек особенно важно при ВЗК, их также трудно предсказать. Гастроэнтеролог – лучший ресурс, который поможет определить, какое лекарство лучше всего подойдет конкретному пациенту.
Несмотря на то, что по-прежнему учитывается сложный и индивидуальный характер лечения ВЗК, заживление слизистой оболочки становится все более понятным и достижимым. Фактически, Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) включает заживление слизистой оболочки в качестве цели лечения для новых лекарств, которые изучаются в качестве лечения язвенного колита. FDA признает, что это сложно определить, потому что инструменты, используемые в клинических испытаниях, которые оценивают реакцию участника на лечение, несовершенны.
Тем не менее, по-прежнему рекомендуется продолжать использовать рейтинговые системы, которые используются сейчас, до тех пор, пока не будет разработана новая. Более того, некоторые исследователи задаются вопросом, насколько хорошо рейтинговые системы, используемые в клинических испытаниях, действительно могут быть адаптированы к реальной жизни.
Курс лечения и лечения слизистых оболочек
Некоторые исследования показали, что при заживлении слизистой оболочки определенные риски, связанные с ВЗК, снижаются. Для язвенного колита это может означать снижение риска колэктомии или развития рака толстой кишки.При болезни Крона заживление слизистой оболочки может означать снижение риска хирургического вмешательства и необходимости приема стероидов для лечения.
В кабинете для осмотра это означает, что цели лечения должны включать не только уменьшение симптомов, но и фактическое заживление слизистой оболочки кишечника. Это называется «лечение до цели». Насколько необходимо лечить слизистую оболочку, чтобы получить определенные преимущества, и как долго, все еще изучается.
На данном этапе определяются более тонкие моменты, но в целом принято считать, что заживление слизистой оболочки является критерием для лечения и может привести к менее агрессивному течению заболевания.
Недостатки
Заживление слизистой оболочки может изменить течение болезни и в конечном итоге принести пользу пациентам. Однако добраться до этого момента – непросто. В клинических испытаниях, проведенных до сих пор, лечение до достижения цели включает довольно интенсивный режим, который включает в себя более частое эндоскопическое исследование (например, колоноскопию) и усиление лечения. Это не только означает, что пациенты должны чаще посещать своих врачей и чаще корректировать лечение, но также означает, что это требует дополнительных затрат.
Что-то, что работает в клинических испытаниях, обычно труднее достичь пациентами и гастроэнтерологами с помощью более ограниченных средств. Проводятся исследования для поиска неинвазивных способов оценки заживления слизистой оболочки, но даже эти методы (например, анализ стула) имеют свои собственные препятствия для более частого использования.
Слово от Verywell
Традиционно лечение ВЗК означает уменьшение симптомов.

 Могут заканчиваться выделением слизи.
Могут заканчиваться выделением слизи.