Болезнь випла – Болезнь Уиппла – причины, симптомы, диагностика и лечение
Болезнь Уиппла – причины, симптомы, диагностика и лечение
Болезнь Уиппла – это редко встречающееся инфекционное заболевание, протекающее с преимущественным поражением лимфатической системы тонкого кишечника и синовиальных оболочек суставов. Основные клинические признаки: диарея, повышение температуры тела, полиартриты и суставные боли, множественное увеличение лимфатических узлов, поражение легких, сердца и ЦНС. Постановка диагноза осуществляется путем проведения визуализирующих диагностических тестов (ЭГДС, УЗИ, рентген), биопсии тканей тонкой кишки, анализов крови и ПЦР-диагностики. Пациентам показана длительная терапия антибиотиками, назначение глюкокортикостероидов, ферментов и поливитаминных комплексов.
Общие сведения
Болезнь Уиппла (липофагический кишечный гранулематоз, интестинальная липодистрофия) — патология, получившая название в честь открывшего ее в 1907 году американского патологоанатома Джорджа Х. Уиппла. В ходе процедуры аутопсии ученый обнаружил у скончавшегося пациента мезентериальную лимфаденопатию и отложение липидов в кишечной стенке. Это позволило предположить, что основу болезни составляет кишечная липодистрофия ‒ нарушение выработки и расщепления жиров. Позднее была доказана инфекционная природа болезни, а в 1992 г. благодаря методу ПЦР идентифицирован возбудитель. Частота встречаемости заболевания – 0,5–1 случай на 1 млн. населения. Согласно данным статистики, патология чаще поражает людей 40-50 лет, в 80% случаев пациентами оказываются представители мужского пола.
Болезнь Уиппла
Причины
Возбудителем инфекции при болезни Уиппла выступают грамположительные патогены Tropheryma whippelii ‒ представители актиномицетов, обладающие трехслойной клеточной стенкой. Заражение осуществляется фекально-оральным путем в детском возрасте и проявляется кратковременным гастроэнтеритом. Зарегистрированы семейные случаи заболеваемости, но ни одного факта передачи бактерии от человека к человеку достоверно не зафиксировано. Некоторые ученые считают, что лишь отдельные патогенные штаммы вызывают патологические изменения.
Троферимы Уиппла обнаруживаются в слизистой кишечника, других органах в активной фазе болезни. Однако ДНК возбудителя может выявляться и в слюне пациентов, не имеющих клинических признаков патологии. Имеются предположения, что манифестация заболевания напрямую связана с нарушением реакции «носителя на инвазию». Патология распространена среди лиц с нарушениями гуморального или клеточного иммунитета. Вероятность развития заболевания повышается при дисфункции желез внутренней секреции, особенно надпочечников.
Патогенез
Интестинальная липодистрофия характеризуется скоплением инфильтратов, состоящих из макрофагов, содержащих Tropheryma whippelii, в различных органах. Присутствие бактерии в фагоцитах говорит о том, что эти клетки способны к захвату микроорганизмов, но не могут осуществить их лизис. Это обусловлено расстройствами иммунного ответа (уменьшением выработки противовоспалительного цитокина IL-12 и гамма-интерферона, снижением лимфоцитарной реакции на антигены, а также продуцирования Т-лимфоцитов). В результате макрофаги с патогенами оседают в слизистой тонкой кишки и лимфоузлах брыжейки, обусловливая мальабсорбционную диарею и нарушение лимфооттока.
Скопление инфильтрата в синовиальных оболочках способствует манифестации артритов. Дальнейшее распространение процесса происходит лимфогенно, что объясняет генерализацию инфекции и поражение серозных оболочек сердца, глазного яблока, легких, головного мозга. Возникают множественные патологические очаги, обусловливающие прогрессирование заболевания и его осложнения.
Симптомы болезни Уиппла
Факт мультисистемного поражения делает клиническую картину интестинальной липодистрофии очень вариабельной. У двух третей пациентов заболевание заявляет о себе поражением суставов задолго до развития развернутой гастроэнтерологической картины. Имеют место блуждающие полиартриты либо полиартралгии крупных сочленений (лучезапястных, коленных, крестцово-подвздошных, голеностопных). Длительность приступов — от нескольких часов до 3-4 дней. В период между приступами наблюдается полная ремиссия. Изменение формы суставов или их разрушение не наблюдается. На стадии внекишечных проявлений примерно у половины больных отмечается лихорадка.
На второй стадии в 85% случаев появляется боль в животе, диарея, метеоризм, тошнота, рвота, потеря веса и лихорадка. Частота испражнений достигает 10 раз в сутки. Развиваются признаки истощения, в тяжелых случаях ‒ кахексия. Боль с локализацией в области пупка имеет приступообразный характер. Отличительный признак перехода болезни во вторую стадию — генерализованное увеличение лимфатических узлов, при пальпации они подвижны, но безболезненны. В отдельных случаях наблюдается воспаление различных частей сосудистой оболочки глаза (радужки, цилиарного тела, хориоидеи).
Третья стадия – системных поражений – характеризуется развитием неврологической симптоматики. Страдает центральная и периферическая нервная система, развивается атаксия, полинейропатия, снижается слух и острота зрения. Вовлечение в патологический процесс сердца проявляется эндокардитом и перикардитом (часто патология обнаруживается только в ходе эхокардиографического исследования). У 30-50% пациентов развиваются бронхолегочные патологии (бронхиты или экссудативные плевриты). Вследствие увеличения лимфоузлов средостения и сдавливания трахеи возникает одышка, сухой кашель и чувство удушья.
Осложнения
Болезнь Уиппла — патология с хроническим течением, которой присущи периоды ремиссий и рецидивов. Согласно наблюдениям, осложнения манифестируют в моменты рецидивов, которые имеют место при отсутствии профилактического лечения. Основными из них выступают неврологические патологии, в числе которых прогрессирование слабоумия, нарушение координации движений, гидроцефалия, супрануклеарная офтальмоплегия и миоклония. В последнем случае происходит поражение спинного мозга или коры головного мозга. Это приводит к непроизвольным мышечным судорогам, тремору, а также ухудшению физического и психического состояния человека.
Диагностика
Поскольку болезнь Уиппла на ранних стадиях трудно поддается диагностике, большинству пациентов правильный диагноз устанавливают лишь по истечении нескольких лет. Для подтверждения инфекционного генеза заболевания и типичных патоморфологических изменений проводятся следующие инструментальные и лабораторные тесты:
- Эндоскопическое исследование. При проведении ЭГДС выявляется отечность, гиперемия, растянутость и утолщение складок двенадцатиперстной кишки. Слизистая оболочка становится зернистой, ее ворсинки утолщаются и укорачиваются. Гистологическое изучение биоптата выявляет макрофаги с непереваренными патогенными микроорганизмами, исследование методом ПЦР позволяет обнаружить Tropheryma whippelii и подтвердить болезнь Уиппла, даже если в пробе присутствуют только следы ДНК возбудителя.
- Лучевые исследования. Имеют вспомогательное значение. Рентген тонкого кишечника с контрастным усилением позволяет выявить утолщение слизистой, расширение кишки и дуоденального изгиба. УЗИ средостения и брюшной полости обнаруживает увеличение медиастинальных, брыжеечных и забрюшинных лимфатических узлов.
- Анализы крови. Для интестинальной липодистрофии характерно развитие гипохромной анемии, увеличение СОЭ, гиперлейкоцитоз, тромбоцитоз. В сыворотке крови обнаруживается дефицит белка, кальция, железа и холестерина. Нарушается синтез альбуминов.
Вариабельность клинических проявлений системной инфекции предполагает обязательную дифференциацию интестинальной липодистрофии с энтеритом, болезнью Крона, целиакией, лимфосаркомой тонкого кишечника, болезнью Ходжкина, инфекционным эндокардитом, а также патологиями соединительной ткани. В процессе постановки диагноза принимают участие врачи-гастроэнтерологи, инфекционисты, онкологи, кардиологи и ревматологи.
Лечение болезни Уиппла
В доантибиотическую эру терапевтическое лечение интестинальной липодистрофии считалось практически невозможным. Сегодня для лечения болезни показана этиотропная терапия антибиотиками в течение 1-2-х лет. Выбор конкретных препаратов (цефалоспоринов, тетрациклинов, пенициллинов, сульфаниламидов, фторхинолонов) определяется результатами диагностических тестов и текущими данными по резистентности Tropheryma whippelii к определенным видам антибиотиков.
В процессе терапии через равные промежутки времени проводится ПЦР-анализ и морфологическое исследование биоптатов. При отсутствии следов возбудителя лечение прекращается. Обнаружение патогенов в результатах анализов после отмены терапии может указывать на рецидив болезни (возникает в 40% случаев) и требует продолжения лечения на протяжении двух лет. В состав комплексной терапии входит назначение глюкокортикоидов, цитостатиков и ингибиторов ФНО (при наличии артритов), ферментов, поливитаминных комплексов. При наличии патологий ЦНС, в частности, судорог, показан прием противоэпилептических препаратов. В случаях выявления гидроцефалии проводятся шунтирующие операции.
Прогноз и профилактика
При назначении свое временной и адекватной терапии исход болезни Уиппла условно благоприятный. Улучшение состояния пациентов отмечается спустя 1-2 недели после начала лечения, но регресс морфологических изменений более длительный и не всегда полноценный. При наличии рецидивирующего течения показано повторное лечение. Специфическая иммунопрофилактика интестинальной липодистрофии не разработана. Предупредительные меры сводятся к предотвращению возможных рецидивов. Пациенты, перенесшие болезнь Уиппла, должны проходить диспансерное наблюдение у гастроэнтеролога каждые 3 месяца и посещать инфекциониста каждые полгода.
www.krasotaimedicina.ru
симптомы и признаки, диагностика, лечение
Ранее неизвестная болезнь описана американским врачом патологоанатомом Д. Уипплом в 1907 г. Находки оказались настолько редкими, что только к 1988 г. накопили данные о 1000 пациентах.
Болезнь Уиппла 100 лет назад диагностировалась только при секционном исследовании. И сейчас остаются сложности, связанные с разнообразной симптоматикой и течением. Чаще патология сопровождается кишечной диспепсией, поносами, значительной потерей веса, анемией.
До настоящего времени выявить причину заболевания не удалось. Первый автор исследований предложил название «интестинальная липодистрофия», поскольку во всех случаях обнаруживали типичную гистологическую картину: увеличенные лимфоузлы кишечника, отложение жиров, воспалительный процесс в серозных оболочках внутренних органов.
Современные ученые установили связь с изменением клеточного иммунитета. Имеется факт, что к болезни Уиппла склонны белокожие люди в возрасте 30–60 лет, но описаны случаи заболевания трехлетних детей. Некоторые авторы считают, что мужчины болеют чаще.
Что известно о причинах болезни?
Изучение единичных случаев болезни позволило сделать вывод об основной роли инфекции. Вероятно, происходит заражение бактерией, близкой по типу к актиномицетам (назвали Tropheryma whippelii).
Первоначальное предположение строилось на основании находок в биоптатах лимфоузлов макрофагов с остатками бактерий. Затем подтверждение получено с помощью полимеразной цепной реакции. Удалось выделить и культивировать бактерию на среде из клеток-фагоцитов человека.
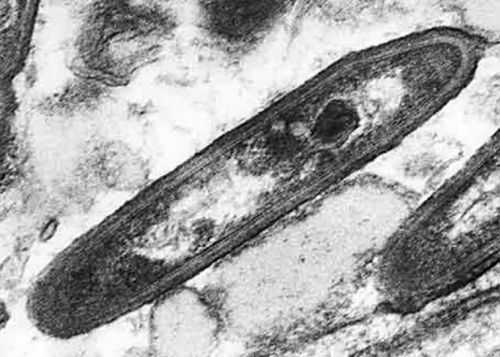
Tropheryma whippelii покрыта тремя слоями оболочки, содержит единственную хромосому, может образовывать патогенные и непатогенные штаммы
Каким образом микроорганизм попадает к человеку неясно. Передачи близким контактам не происходит. Поэтому возникло подозрение, что для заражения нужны дополнительные факторы. Единого мнения об участии клеточного иммунитета в болезни Уиппла нет, проблему продолжают изучать. Исследователи обращают внимание на изменение в соотношении типов Т-лимфоцитов, неясную потерю способности макрофагов кишечника уничтожать бактерии.
На соучастии аутоиммунного механизма указывает на связь заболевания с антигеном гистосовместимости HLA B27.
Что показывает гистология?
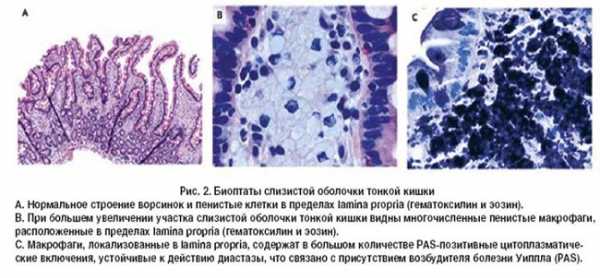
Гистологическое исследование позволяет установить характерное повреждение слизистой оболочки кишечника в собственном слое. Оно заключается в укорочении и утолщении ворсинок в тонкой кишке, изменении их формы, инфильтрации слизистой оболочки макрофагами крупных размеров.
В цитоплазме макрофагов при болезни обнаружено значительное количество гранул из гликопротеинов, имеющих родство к определенной окраске (названы PAS-пoзитивными). Вид клеток описывают как «пенистый». Этот признак считается главным (патогномоничным) в диагностике.
Другие клеточные элементы кишечника по виду неизменены, но значительно уменьшены в количестве, поскольку их замещают макрофаги. Стенка кишки наполнена широкими капиллярами и лимфатическими протоками с жировыми включениями.
С внешней стороны клеток также наблюдаются скопления жиров. Поверхностный слой эпителия кишечника может иметь участки с неспецифическими изменениями, но практически не поражается.
Электронная микроскопия позволила выявить при болезни Уиппла в собственном слое кишечника бациллоподобные тела. Они наиболее сконцентрированы в зонах вокруг сосудов. Также их находят в макрофагах, редко — в лейкоцитах, плазматических и эндотелиальных клетках.
Механизм развития
О системном характере патологии говорит выявление пенистых макрофагов не только в кишечнике, но и в печени, головном мозге, легочной ткани, лимфоузлах, сердце, надпочечниках, суставах. Видимо, при болезни происходит распространение инфекции по организму.
Путь внедрения возбудителя остается неясным. Учитывая максимальные изменения в кишечнике, можно предположить, что здесь начинается специфическая реакция. После инфильтрации собственного слоя затрудняется всасывание необходимых веществ через энтероциты. Кровеносные капилляры и лимфатические пути находятся в сдавленном состоянии.
Значительно увеличиваются лимфоузлы мезентериальной зоны (брыжейки), реже поражается группа в воротах печени, в забрюшинном слое. Тонкая кишка уплотняется, складки отекают, на оболочке выступают желтые узелковые высыпания. Возможно вовлечение толстого кишечника с развитием аналогичных изменений.
Однако замечено, что макрофаги с включениями в слизистой толстого кишечника обнаруживают в прямой и ободочной кишке не только при болезни Уиппла, но и у здоровых людей, при меланозе и гистиоцитозе. Воспаление листков брюшины (перитонит) — одна из тяжелых форм ответной реакции на инфицирование.
Боли носят спастический характер, в нетипичных случаях возникает запор
Симптомы болезни Уиппла
В течение болезни различают 3 стадии, имеющие свои признаки. I — начинается с внекишечной симптоматики, в 65% случаев первыми появляются непостоянные боли в мелких и крупных суставах. При этом признаков воспаления (опухоли, покраснения) нет.
Полиартрит носит мигрирующий характер, боли возникают то в одних, то в других суставах. В отличие от ревматоидного артрита нет стойкой деформации. Одновременно у пациента повышается температура, возможен затяжной трахеобронхит с кашлем. Болезнь Уиппла в этой форме протекает от трех до восьми лет.
II (развернутая) — стадия выраженного поражения кишечника. Для нее типичны:
- Диарея носит хронический мучительный характер, стул обильный до 10 раз в сутки, каловые массы содержат много жира, возможны кровотечения с типичной «меленой» (черный жидкий кал). Живот вздут.
- Кровотечения связаны со сниженной свертываемостью крови, вызванной потерей витамина К, прекращением его всасывания из пищи.
- Пациенты жалуются на постоянные боли вокруг пупка, чувство распирания в животе, они уменьшаются после отхождения газов и стула. С острым приступом больного доставляют в хирургическое отделение. При осмотре врач обращается внимание на увеличенные лимфоузлы на периферии и в брыжейке кишечника. Их удается пропальпировать в животе. Узлы безболезненны, подвижны, не спаяны с кожей.
- Постепенно нарастают признаки белковой недостаточности, гиповитаминоза: снижается аппетит, пациент сильно худеет, возникает слабость и атрофия мышц, появляются отеки на ногах, непереносимость молока. Из-за нарушенного всасывания необходимых веществ страдают все виды метаболизма.
Читайте также:
III (стадия системных проявлений болезни) — характеризуется развитием внекишечных проявлений. Их можно разделить в зависимости от конкретного поражения органов. К признакам надпочечниковой недостаточности относятся: гипотензия, отказ от пищи (анорексия), появление пигментации кожи на лице, шее, кистях, тошнота, рвота. В анализах крови при этом выявляют гипогликемию, снижение уровня натрия.
Признаки поражения кожи: возможно развитие эритематозных высыпаний в виде узелков. Офтальмологические симптомы: воспаление глазных оболочек (увеит, кератит, ретинит). Нарушение деятельности сердца и сосудов проявляется: фиброзным эндокардитом, перикардитом, миокардитом, полисерозитом. Коронариит дает типичную картину стенокардии.
Поражается периферическая и центральная нервная система. У больных возникает потеря зрения, слуха, парез лицевого нерва с характерной асимметрией лица, нарушение чувствительности, подвижности, болевые ощущения в руках и ногах по типу полинейропатии.
Диагностика
Клинически болезнь Уиппла можно подозревать у пациента с болями в суставах и диареей. Это особенно важно, если человек быстро худеет, сохраняется температура неясного происхождения, пальпируются увеличенные лимфоузлы, тип поражения суставов установить не удается.

Проверка показывает в крови пациента при суставных болях отрицательный или слабо положительный тест на ревматоидный фактор и нормальную концентрацию мочевой кислоты
Лабораторные признаки болезни
Лабораторным путем удается подтвердить косвенные признаки поражения внутренних органов.
- В общем анализе крови наблюдается: гипохромная анемия, лейкоцитоз, высокая СОЭ, повышенный уровень тромбоцитов и эозинофилов.
- В анализе мочи: возможна умеренная протеинурия.
- Копрология показывает: массивное выделение кала, значительное количество жиров (стеаторея), наличие непереваренных мышечных волокон, возможна положительная реакция Грегерсена на скрытую кровь.
Биохимические тесты подтверждают нарушение всех видов метаболизма: значительно снижено количество общего белка за счет фракции альбуминов, повышаются трансаминазы, билирубин, падает концентрация в крови железа, кальция, натрия, калия. Определяется падение уровня глюкозы (гипогликемия), протромбина.
При тяжелом состоянии больного в крови определяют содержание гормонов. Характерно снижение уровня кортизола, половых гормонов, тироксина, трийодтиронина.
Что выявляют с помощью инструментальных методов?
Ультразвуковое исследование при болезни Уиппла мало информативно, поскольку оно нацелено на выявление изменений в плотных тканях. Помогает обнаружить увеличенные группы лимфоузлов кишечника в брюшной полости (мезентериальных, забрюшинных, околопеченочных).
Рентгенологическим способом проверяют тонкий кишечник с помощью приема пациентом бариевой взвеси. Тонкий кишечник выглядит расширенным, контуры образуют крупнозубчатый рисунок, иногда увеличенные лимфоузлы дают картину дефекта наполнения.
Складки на слизистой оболочке утолщены и расширены инфильтрацией. Снижена эластичность. На увеличение ретроперитонеальных лимфоузлов указывает расширенный дуоденальный изгиб.
Лимфография — метод связан с введением контрастного вещества в общий лимфатический проток с последующим контролем рентгеновскими снимками. Позволяет обнаружить явления воспаления, застоя в лимфатических протоках. На фиброэзофагогастродуоденоскопии можно выявить сопутствующий гастрит.
Метод исследования биоптата
Биопсия участка слизистой оболочки тонкой кишки — пока единственный способ уточнить диагноз болезни Уиппла и провести дифференциальную диагностику с другими похожими поражениями.
Забор материала проводится при осмотре эндоскопом двенадцатиперстной кишки. Считается, что эта зона содержит максимум гистологических доказательств уже в начальной стадии заболевания.
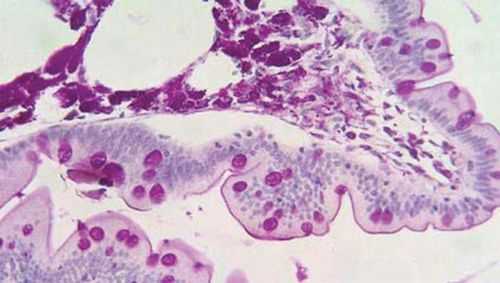
Макрофаги при болезни Уиппла обнаруживаются при биопсии не только в кишечнике, но и в других органах (селезенка, печень), лимфоузлы
Наиболее ценными являются следующие признаки:
- выявление «пенистых» макрофагов в собственном слое слизистой оболочки;
- подтверждение наличия в макрофагах PAS-позитивных гранул с помощью окраски бриллиантовым фуксином;
- обнаружение в ходе электронной микроскопии «телец Уиппла», палочкообразных образований внутри макрофагов и во внеклеточном пространстве;
- накопление жировых включений в слизистой оболочке, лимфатических узлах;
- расширение просвета и застой в лимфатических сосудах.
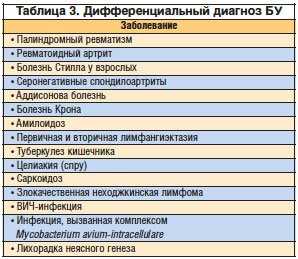
С какими заболеваниями проводится дифференциальная диагностика?
Такие мало специфические симптомы, как потеря веса, диарея, слабость, увеличение лимфоузлов вызывает необходимость дифференциальной диагностики болезни Уиппла со следующими заболеваниями:
- лимфоаденопатиями разной этиологии;
- раковой опухолью;
- болезнью Крона;
- неспецифическим язвенным колитом;
- синдромом Золлингера-Эллисона;
- хроническим энтероколитом;
- спру;
- болезнью Аддисона.
Лечение
Пациент с нарушенным всасыванием питательных веществ из кишечника нуждается в диетическом питании. Для коррекции диета должна содержать животные белки до 150 г/сут, но ограниченное количество жиров (30 г/сут.). Больному назначаются специальные смеси из питательных компонентов для еды и дополнительно внутривенно вводят раствор Альбумина, аминокислот.
Поддержка пищеварения нуждается в применении ферментных препаратов с липазой — Пангрола, Мезима. В лечении болезни Уиппла применяются антибактериальные средства.
Главную задачу по уничтожению инфекционного возбудителя выполняют антибиотики. Важно использовать лекарственные препараты, обладающие способностью проникать сквозь гематоэнцефалический барьер, для терапии клеток головного мозга.
Используются антибиотики: Тетрациклин, Доксициклин, Тайгециклин, Метациклин, производные пенициллина, Ампициллин, Стрептомицин, препараты цефалоспоринового ряда. При поражении головного мозга применяют Рифампицин и Хлорамфеникол.
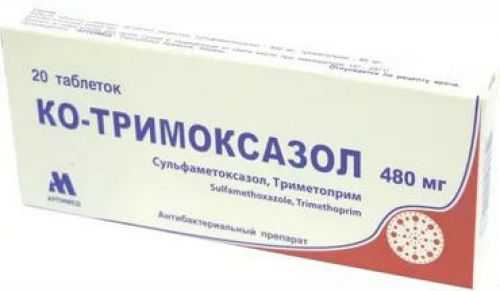
Наиболее эффективны комбинации антибиотиков с триметоприм-сульфаметоксазолом (аналоги Бисептол, Ко-тримоксазол)
Лечение проводят длительно от 2 до 5 месяцев. Антибиотики меняют, чтобы не вызвать привыкания. Затем 9 месяцев пациенту предлагается интермиттирующая терапия (3 дня принимать препараты, 4 дня перерыв и повтор). Ко-тримоксазол назначается на 1–2 года в качестве поддерживающего лечения.
Все препараты вводятся внутривенно и внутримышечно, учитывая нарушенную всасывающую способность кишечника. При болях в животе показаны спазмолитики, они также способны замедлить кишечную перистальтику. С целью снижения поступления в кишечник воды и электролитов назначают Имодиум, Лоперамид.
Для выведения шлаковых веществ применяются энтеросорбенты и препараты висмута. Устранить иммунные нарушения при болезни помогают курсы кортикостероидов. Пациентам необходима симптоматическая терапия: витамины (группы В, С, К), препараты железа, коррекция электролитного баланса.
Критерии эффективности
Без необходимой терапии болезнь Уиппла быстро прогрессирует, итог — летальный исход. Применение антибактериальных средств позволяет через месяц добиться устранения болей в суставах, лихорадки. Восстановление нарушений кишечника происходит медленно.
Результативность терапии оценивают не только по клиническим наблюдениям, но и с помощью повторных исследований биоптата слизистой оболочки кишки. Основной признак эффективности — исчезновение макрофагов.
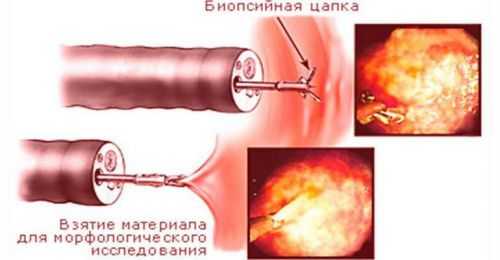
Обычно повторную биопсию проводят спустя годичный срок лечения
Некоторые ученые против повторной биопсии. Они аргументируют свое мнение возможностью присутствия макрофагов в течении нескольких лет.
Под влиянием лечения восстанавливается структура ворсинок слизистой оболочки кишечника, из межклеточного пространства исчезают бациллы. В некоторых случаях остаются очаги макрофагов с расширенными сосудами и скоплениями жировых включений.
О полном выздоровлении и победе над болезнью пока речи не идет. Рецидивы могут возникнуть спустя многие годы. Врачи считают, что пациенты с подозрением на болезнь Уиппла должны направляться для лечения и обследования в специализированные центры. Это позволяет быстрее поставить диагноз и добиться максимально возможных результатов терапии.
vrbiz.ru
Болезнь Уиппла | Белов Б.С.
Введение Болезнь Уиппла (БУ) – редкое хроническое системное заболевание инфекционной этиологии. Оно было описано в 1907 г. американским патологом Дж. Х. Уипплом (George Hoit Whipple) при секционном наблюдении 36-летнего больного, врача по профессии, страдавшего в течение 5 лет лихорадкой, артритом, стойким и упорным кашлем, диареей и прогрессирующим похудением. При вскрытии выявлены выраженное увеличение мезентеральных лимфатических узлов и полисерозит. В кишечнике и лимфоузлах обращали на себя внимание множественные отложения липидов и большое число макрофагов с аргирофильными палочкообразными структурами. Дж. Уиппл рассматривал нарушение метаболизма липидов как наиболее вероятную причину болезни и предложил термин «интестинальная липодистрофия», между тем не исключая и инфекционную этиологию заболевания [1].
Болезнь Уиппла (БУ) – редкое хроническое системное заболевание инфекционной этиологии. Оно было описано в 1907 г. американским патологом Дж. Х. Уипплом (George Hoit Whipple) при секционном наблюдении 36-летнего больного, врача по профессии, страдавшего в течение 5 лет лихорадкой, артритом, стойким и упорным кашлем, диареей и прогрессирующим похудением. При вскрытии выявлены выраженное увеличение мезентеральных лимфатических узлов и полисерозит. В кишечнике и лимфоузлах обращали на себя внимание множественные отложения липидов и большое число макрофагов с аргирофильными палочкообразными структурами. Дж. Уиппл рассматривал нарушение метаболизма липидов как наиболее вероятную причину болезни и предложил термин «интестинальная липодистрофия», между тем не исключая и инфекционную этиологию заболевания [1].Этиология и патогенез
В 1949 г. B. Black-Schaffer показал, что в биоптатах лимфоузлов и тонкого кишечника у пациентов с БУ содержатся PAS (periodic acid Schiff)-позитивные макрофаги, содержащие гликопротеин или мукополисахариды [2]. Через 3 года появилось первое описание успешного применения хлорамфеникола у больного БУ с быстрым обратным развитием клинической симптоматики и патоморфологических признаков. В 1961 г. J. Gardley, T. Hendrix выявили палочкообразные тельца в цитоплазме макрофагов при электронной микроскопии, тем самым подтвердив бактериальную природу заболевания [3]. Но только в работах последних 20 лет [4–6] с помощью метода полимеразной цепной реакции (ПЦР) из инфицированных тканей пациентов была выделена грамположительная бацилла, получившая название Tropheryma whipplei (TW, от греч. trophe – питание, eryma – барьер). По своим филогенетическим данным TW принадлежит к актиномицетам, имеет размеры 0,2х2,0 mм, 3-слойную клеточную стенку, единственную круговую хромосому и небольшой размер генома (925 кД). Предполагается, что патогенными могут быть не все, а строго определенные штаммы возбудителя.
TW относится к убиквитарным (повсеместно распространенным) бактериям-комменсалам. Ее выделяют из фекалий здоровых носителей в 1,5–7% случаев, а среди персонала городских очистных сооружений – в 12–25% [7–9]. По данным популяционного исследования, выполненного в Сенегале, этот показатель составил 31,2% [10]. Частота выявления IgG-антител к TW, определенных методом Western blot, среди взрослых здоровых лиц колеблется от 50 до 70% в зависимости от географического региона [10–12].
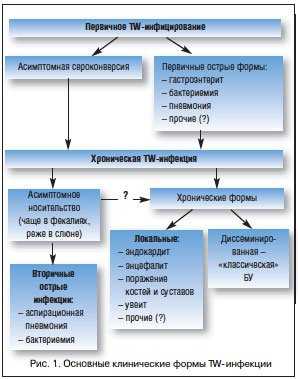
Первичное инфицирование происходит фекально-оральным путем в раннем детстве и протекает асимптомно или в виде одной из острых форм (рис. 1). При наличии определенного иммунологического дефекта после длительного периода (иногда несколько десятилетий) TW-персистенции развиваются локальные хронические формы или происходит генерализация процесса с классической симптоматикой БУ [14]. Наряду с генерализацией инфекции в патогенезе заболевания большую роль играют иммунологические нарушения, в частности снижение Т-клеточного соотношения СD4/CD8 и экспрессии CD11, уменьшение продукции интерлейкина (ИЛ) -12 и γ-интерферона. Параметры гуморального иммунитета изменяются мало. Предполагаемый иммунологический дефект имеет высокую специфичность по отношению к TW, т. к. у больных с БУ другие инфекции развиваются не чаще, чем в популяции. Накопление и размножение TW в макрофагах индуцирует апоптоз клеток макроорганизма, что ведет к диссеминации бактерий. Кроме того, процессу репликации способствует повышение содержания ИЛ-16, который вырабатывается макрофагами в ответ на инфекцию и подавляет лизис возбудителя в фагосомах. Выявлена прямая корреляция сывороточного содержания ИЛ-16 с активностью болезни. Блокирование указанного цитокина способствует бактериальному клиренсу [15].
Таким образом, при сохранной функции фагоцитоза макрофаги теряют способность к лизису TW, а также не отвечают на присутствие микробных антигенов выработкой специфических антител либо данный ответ выражен очень слабо [7]. Последнее, вероятно, связано с гликолизацией антигенных структур возбудителя [16].
Накапливаются данные, свидетельствующие об определенном значении иммуносупрессии в патогенезе БУ. В частности, описано развитие БУ (включая эндокардит) у пациентов, получавших ингибиторы фактора некроза опухоли-α (ФНО-α) по поводу спондилоартропатий и атипично протекавшего ревматоидного артрита [17–21].
Эпидемиология
БУ относится к редким заболеваниям с предполагаемой частотой 0,5–1 случай на 1 млн населения. Мужчины поражаются почти в 8 раз чаще женщин, преимущественно в возрасте 40–49 лет [15]. Наиболее часто заболевают представители белой расы – жители Центральной Европы (55%) и Северной Америки (38%). Единичные случаи болезни описаны среди испанцев, негров, индусов и представителей монголоидной расы. Среди заболевших преобладают жители сельской местности, чаще – фермеры. Имеются сообщения о семейных случаях БУ [11].
Клиническая картина
Мультисистемность поражения при БУ обусловливает чрезвычайную вариабельность клинической симптоматики.
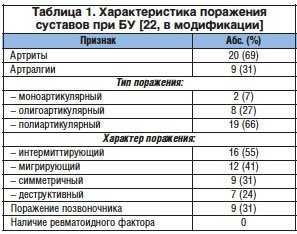
Суставной синдром при БУ – наиболее ранний и очень часто (75%) единственный признак, предшествующий развернутой клинической картине болезни в течение в среднем 6,7 года. Типичный случай поражения суставов был описан Уипплом как «приступообразный артрит, захватывающий различные суставы и вовлекающий почти все суставы, пораженные к этому моменту времени. Эти приступы были преходящими, первый длился около 8 ч. Они рецидивировали вновь и вновь до 3–4 р./нед., в сырую погоду, продолжались от 6 до 24 ч, реже они были выраженными и не позволяли больному работать. Иногда суставы были припухшими и болезненными, реже – только болезненными» [1]. Действительно, у большинства больных отмечается приступообразный мигрирующий олиго- или полиартрит (реже – моноартрит), длящийся от нескольких часов до нескольких дней и отличающийся различной частотой обострений и полной ремиссией между приступами. Чаще поражаются коленные (50–62%), лучезапястные и голеностопные (40–45%) суставы. Как правило, артрит неэрозивный, протекает без развития деформаций, ревматоидный фактор не выявляется (табл. 1). Возможно развитие подкожных узелков, сходных с ревматоидными, однако при гистологическом исследовании в них выявлялись PAS-позитивные макрофаги, что подтверждало диагноз БУ. У отдельных больных отмечаются деструктивные изменения суставов. Описаны случаи формирования анкилоза лучезапястных и голеностопных суставов, а также гипертрофической остеоартропатии. Спондилоартропатии, как правило, сочетаются с периферическим артритом. Возможно развитие одно- или двустороннего сакроилеита с дальнейшим анкилозированием крестцово-подвздошных сочленений. Имеются описания развития дерматомиозита и иных миопатий.
В развернутой стадии заболевания примерно в 50% случаев наблюдаются лихорадочный синдром, сопровождающийся ознобом с последующим профузным потоотделением, а также генерализованная лимфаденопатия. Отмечаются сухость кожи и ее диффузная гиперпигментация, преимущественно на открытых участках тела (но не на слизистых!), хейлит, глоссит, ломкость ногтей, алопеция, отеки. Описано развитие пурпуры (без тромбоцитопении).
Желудочно-кишечные расстройства являются классическими признаками заболевания. У 60–85% больных наблюдаются диарея (чаще – стеаторея), сопровождающаяся болью в животе (60–81%), синдром мальабсорбции и прогрессирующая потеря массы тела (79–93%). Это приводит к полигиповитаминозу и разнообразным нарушениям водно-электролитного обмена.
Поражение органов дыхания (плевральный выпот, пневмонит, гранулематозная медиастинальная лимфаденопатия) отмечается в 30–40% случаев.
У 30–55% больных наблюдаются клинические симптомы поражения сердечно-сосудистой системы. Поражается любая из оболочек сердца, однако наиболее часто развивается эндокардит. По данным германских исследователей, TW как причина эндокардита по частоте (6,3%) занимала 4-е место после наиболее широко распространенных возбудителей этой болезни: стрептококков, стафилококков и энтерококков (36,5, 36,5 и 11,8% соответственно) [23]. Выявлен ряд особенностей, присущих TW-эндокардиту, по сравнению с таковыми, вызванными другими возбудителями: отсутствие предшествовавшей клапанной патологии сердца (69%), нормальная температура тела (61–75%), отрицательная гемокультура (100%), позитивные данные Эхо-КГ отмечаются только в 75–79% случаев [24–26]. Описано более 20 случаев эндокардита при БУ без гастроэнтерологической симптоматики [25, 27–29]. Нередко развиваются гипотензия, артериальные эмболии различной локализации и прогрессирующая застойная сердечная недостаточность.
Поражение ЦНС встречается в 10–50% случаев. Неврологическая симптоматика может быть как первым проявлением заболевания, так и развиваться спустя несколько лет на фоне манифестной клинической картины БУ. Наиболее частые симптомы: деменция, супрануклеарная офтальмоплегия и миоклония, которые встречаются в 25–50% случаев среди больных с патологией ЦНС при БУ. Также описаны эпилептические припадки, церебральная атаксия, инсомния. Сочетание медленного плавного конвергентно-дивергентного маятникообразного нистагма с синхронным сокращением жевательных мышц (oculomasticatory myorhytmia) или лицевых мышц (oculofaciosceletal myorhytmia) наблюдается у 20% больных с вовлечением ЦНС и, несмотря на относительную редкость, рассматривается как патогномоничное для БУ [30].
Имеется ряд сообщений об изолированном поражении ЦНС без каких-либо экстракраниальных или системных проявлений БУ. В подобных случаях с целью получения образца для последующей ПЦР и, соответственно, верификации диагноза и выработки тактики лечения приходится прибегать к стереотаксической биопсии головного мозга [31].
Наиболее распространенными формами поражения глаз при БУ являются увеит и офтальмоплегия. Встречаются диффузный хориоретинит, глаукома, кератит.
В 10–15% случаев выявляют гепатомегалию, спленомегалию, асцит. Патология со стороны мочевыделительной и эндокринной систем встречается крайне редко.
Принимая во внимание возможность изолированного поражения органов или систем (артрит, эндокардит, патология ЦНС и т. д.) без «классических» проявлений БУ, предлагается рассматривать указанные клинические ситуации как отдельные формы хронической TW-инфекции, как упоминалось выше (рис. 1) [13, 32].
Диагностика
С учетом полиморфизма клинических проявлений диагностика БУ весьма часто вызывает существенные трудности. Наибольшие диагностические проблемы возникают у больных с внекишечными формами болезни. По данным отечественных авторов, диагноз БУ устанавливается в среднем спустя 6 лет после первых клинических проявлений [33].
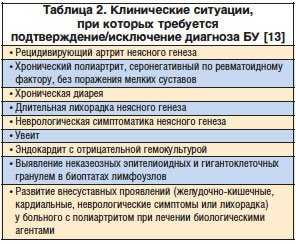
В таблице 2 представлен перечень клинических ситуаций, при которых показано дополнительное обследование для верификации (или исключения) диагноза БУ [15].
Какие-либо специфические изменения лабораторных показателей не наблюдаются. У больных значительно повышены СОЭ, число лейкоцитов и тромбоцитов, уровень СРБ, снижен уровень гемоглобина, железа, кальция, калия, белка, альбуминов, холестерина (как следствие мальабсорбции). Отмечаются положительные результаты функциональных проб с ксилозой, нагрузкой глюкозой и др.
Важная роль в диагностике БУ отводится морфологическому исследованию слизистой оболочки тонкой кишки. При эндоскопии выявляют отек, гиперемию и резкое утолщение складок кишки по причине лимфостаза, а также неровность рельефа слизистой из-за многочисленных желтовато-белых бляшек. При световой микроскопии биоптатов, полученных из тощей и двенадцатиперстной (ДПК) кишок нелеченных больных с БУ, наблюдаются булавовидные ворсинки, содержащие большое количество лимфы. Часто отмечают внутри- и внеклеточное накопление жира в слизистой оболочке тонкой кишки. В собственной пластинке слизистой оболочки наблюдается большое количество пенистых макрофагов, содержащих крупнозернистые цитоплазматические включения с PAS-позитивной реакцией. PAS-позитивные макрофаги могут также обнаруживаться в периферических или брыжеечных лимфоузлах, печени, селезенке, сердечных клапанах, мозговой ткани, стекловидном теле и синовиальной оболочке.
Считают, что PAS-позитивное вещество – это продукты распада фагоцитированных бактерий. Выявление PAS-позитивных включений в цитоплазме макрофагов не является патогномоничным для БУ (как полагали ранее), а может иметь место при других инфекциях, вызванных комплексом Mycobacterium avium-intracellulare (у ВИЧ-инфицированных больных), коринебактериозе, гистоплазмозе, микозах, саркоидозе. В то же время PAS-реакция имеет чрезвычайно важное дифференциально-диагностическое значение, в частности, при разграничении БУ с первичной (болезнь Вальдмана) и приобретенными лимфангиэктазиями.
Электронная микроскопия позволяет выявить в пораженных тканях палочковидные бактерии, локализующиеся как внутриклеточно, так и в межклеточном пространстве.
Несоблюдение правил проведения биопсии (взятие материала из верхней, а не из нижней части ДПК) и предшествовавшая антимикробная терапия могут повлечь за собой отрицательные результаты патоморфологического исследования даже при характерной для БУ клинической картине. В подобных ситуациях особенно необходимой представляется ПЦР-диагностика. Использование праймеров, комплементарных консервативным участкам рибосомных генов (16S- и 23S-РНК), и дальнейшее определение полной нуклеотидной последовательности (секвенирование) амплифицированной ДНК позволяют с высокой степенью вероятности идентифицировать TW. Для выполнения ПЦР могут быть использованы биоптаты слизистой ДПК, лимфоузлов, сердечных клапанов (удаленных во время кардиохирургической операции), а также пунктаты синовиальной жидкости или ликвора. Несмотря на высокую чувствительность и специфичность ПЦР, существует определенная вероятность получения как ложноположительных, так и ложноотрицательных результатов. Поэтому залогом успешной диагностики БУ (как и любого другого заболевания) является комплексная оценка клинической картины и данных дополнительных исследований.
Весьма перспективным представляется использование в диагностике БУ метода флуоресцентной гибридизации in situ, позволяющего дифференцировать активную инфекцию от TW-носительства. Однако в настоящее время выполнение данного исследования доступно только в высокоспециализированных лабораториях [14].
Дифференциальную диагностику БУ проводят с заболеваниями, имеющими сходную клиническую симптоматику (табл. 3). Необходимо заметить, что БУ обязательно должна быть включена в алгоритм диагностического поиска при лихорадке неясного генеза.
Лечение
В доантибиотическую эру БУ заканчивалась летально в 100% наблюдений. Поиски оптимальных схем антибактериальной терапии продолжаются до сегодняшнего дня. К сожалению, редкая встречаемость БУ, а также проблемы, связанные с культурированием TW, служат труднопреодолимым препятствием для проведения рандомизированных клинических исследований.
До 1980-х гг. весьма популярной была комбинация пенициллина и стрептомицина, назначавшаяся в течение 2 нед., с последующим длительным приемом тетрациклина. В дальнейшем было установлено, что основной причиной смерти пациентов, принимавших тетрациклин, были неврологические осложнения, развивавшиеся во время рецидивов. Данное обстоятельство побудило клиницистов к применению ко-тримоксазола – комбинированного препарата, 1 таблетка которого содержит 80 мг триметоприма и 400 мг сульфаметоксазола. Препарат хорошо проникает через гематоэнцефалический барьер и достигает терапевтических концентраций в ликворе даже при неизмененных мозговых оболочках. По сводным данным, объединившим результаты 4-х небольших исследований, минимальная частота рецидивов (4,35%) была среди больных, пролеченных ко-тримоксазолом. В группах пациентов, получавших пенициллин со стрептомицином или тетрациклин, эти показатели составляли 11,8 и 32,2% соответственно [34].
По мнению ряда авторов, лечение следует начинать с 2-недельного парентерального введения бактерицидных антибиотиков, обладающих хорошей пенетрацией в спинномозговую жидкость, с последующим длительным (1–2 года) поддерживающим лечением ко-тримоксазолом. Однако в работах последних лет отмечается нарастание резистентности TW к ко-тримоксазолу. Последнее объясняют мутациями бактериального гена, кодирующего выработку синтетазы, являющейся основной мишенью для сульфаметоксазола [35]. В связи с этим в качестве альтернативы рекомендуется комбинация доксициклина с гидроксихлорохином. Показано, что добавление последнего повышает активность доксициклина in vitro путем увеличения pH в фаголизосомах макрофагов [36]. При наличии неврологической симптоматики к указанной схеме целесообразно добавить сульфадиазин в высоких дозах. Схема лечения БУ представлена в таблице 4.
Многие авторы отмечают выраженную положительную динамику при своевременно начатой и активной терапии. Так, лихорадка и диарея купируются к концу 1 нед. лечения, суставной синдром полностью регрессирует в течение 1 мес. В эти сроки отмечаются явное улучшение общего самочувствия, прибавка в весе. Обратное развитие неврологической симптоматики происходит значительно медленнее.
Вспомогательное значение имеет применение глюкокортикоидов (преднизолон 30–40 мг/сут с постепенным снижением дозы вплоть до полной отмены).
При необходимости в план лечения включают мероприятия, направленные на ликвидацию последствий синдрома мальабсорбции (коррекция метаболических нарушений, водно-электролитного обмена, восполнение дефицита железа и витаминов и т. д.).
Длительность антибактериальной терапии должна составлять не менее 1 года. Контроль за лечением осуществляют с помощью повторных морфологических исследований биоптатов тонкого кишечника либо ПЦР-методик. При отсутствии ответа на антибактериальную терапию представляется перспективным применение γ-интерферона.
На фоне проводимой (и первоначально эффективной) антибактериальной терапии в 10% случаев наблюдается развитие синдрома иммунной реконституции. Он более характерен для больных, у которых в качестве первоначальных диагнозов фигурировали анкилозирующий спондилит или ревматоидный артрит, в связи с чем этим пациентам назначали активное иммуносупрессивное лечение, в т. ч. глюкокортикоиды, цитостатики и ингибиторы ФНО-α. Основные проявления данного синдрома включают лихорадку, артрит, плеврит, нодозную эритему, воспалительную орбитопатию, перфорацию кишечника и гипоталамический синдром. В подобных ситуациях после исключения других системных инфекций рекомендуют назначение преднизолона в суточной дозе 1,5 мг/кг массы тела [37].
Прогноз БУ в большинстве случаев благоприятный. При возникновении рецидивов (8–35%) терапия аналогична вышеуказанной.
Наиболее неблагоприятными в прогностическом плане считают неврологические осложнения, возникающие во время рецидивов, как следствие первично нераспознанной локализации инфекции или неадекватной терапии. Вероятность развития рецидивов существует даже при верифицированной эрадикации возбудителя, достигнутой в результате адекватной терапии первого эпизода болезни, что свидетельствует о стойко высокой восприимчивости этих пациентов к системной TW-инфекции. Данное обстоятельство поднимает вопросы пожизненной профилактики БУ с применением доксициклина [13, 38].
Таким образом, БУ представляет собой мультисистемное заболевание с верифицированным инфекционным этиологическим агентом. Обладая широким спектром клинических проявлений, БУ может встретиться в практике врача любой специальности, в т. ч. ревматолога. Дальнейшие исследования должны быть направлены на совершенствование диагностических подходов и разработку тактики лечения этого коварного заболевания.

Литература
1. Whipple G.H. A hitherto undescribed disease characterized anatomically by deposits of fat and fatty acids in the intestinal mesenteric lymphatic issues // John Hopkins Hospital Bulletin. 1907. Vol. 18. Р. 382–391.
2. Black-Schaffer B. The tinctorial demonstration of a glycoprotein in Whipple’s disease // Proc. Soc. Exp. Biol. Med. 1949. Vol. 72. Р. 225–227.
3. Gardley J., Hendrix T.R. Combined electron and light microscopy in Whipple’s disease: demonstration of “bacillary bones” in the intestine. Bull // Johns Hopkins Hosp. 1961. Vol. 10. Р. 80–98.
4. Wilson K.H., Blitchington R., Frothingham R., Wilson J.A. Phylogeny of the Whipple’s disease – associated bacterium // Lancet. 1991. Vol. 338. Р. 474–475.
5. Relman D.A., Schmidt T.M., Mac Dermott R.P., Falkow S. Identification of the uncultured bacillus of the Whipple’s disease // N. Engl. J. Med. 1992. Vol. 327. Р. 293–301.
6. Raoult D., Birg M.L., La Scola B., Fournier P.E., Enea M., Lepidi H., Roux V., Piette J.C., Vandenesch F., Vital-Durand D., Marrie T.J. Cultivation of the bacillus of Whipple’s disease // N. Engl. J. Med. 2000. Vol. 342. Р. 620–625.
7. Fenollar F., Puéchal X., Raoult D. Whipple’s disease // N Engl J Med. 2007. Vol. 356 (1). Р. 55–66.
8. Schöniger-Hekele M., Petermann D., Weber B., Müller C. Tropheryma whipplei in the environment: survey of sewage plant influxes and sewage plant workers // Appl Environ Microbiol. 2007. Vol. 73 (6). Р. 2033–2035.
9. Fenollar F., Trani M., Davoust B., Salle B., Birg M.L., Rolain J.M., Raoult D. Prevalence of asymptomatic Tropheryma whipplei carriage among humans and nonhuman primates // J Infect Dis. 2008. Vol. 197 (6). Р. 880–887.
10. Keita A.K., Bassene H., Tall A., Sokhna C., Ratmanov P., Trape J.F., Raoult D., Fenollar F. Tropheryma whipplei: a common bacterium in rural Senegal // PLoS Negl Trop Dis. 2011. Vol. 5 (12). Р. 1403.
11. Fenollar F., Keita A.K., Buffet S., Raoult D. Intrafamilial circulation of Tropheryma whipplei, France // Emerg Infect Dis. 2012. Vol. 18 (6). Р. 949–955.
12. Fenollar F., Amphoux B., Raoult D. A paradoxical Tropheryma whipplei western blot differentiates patients with whipple disease from asymptomatic carriers // Clin Infect Dis. Vol. 49 (5). Р. 717–723.
13. Fenollar F., Lagier J.C., Raoult D. Tropheryma whipplei and Whipple’s disease // J Infect. 2014. Vol. 69 (2). Р. 103–112.
14. Moos V., Schneider T. Changing paradigms in Whipple’s disease and infection with Tropheryma whipplei // Eur J Clin Microbiol Infect Dis. 2011. Vol. 30 (10). Р. 1151–1158.
15. Puéchal X. Whipple’s disease // Ann Rheum Dis. 2013. Vol. 72 (6). Р. 797–803.
16. Bonhomme C.J., Renesto P., Desnues B., Ghigo E., Lepidi H., Fourquet P., Fenollar F., Henrissat B., Mege J.L., Raoult D. Tropheryma whipplei glycosylation in the pathophysiologic profile of Whipple’s disease // J Infect Dis. 2009. Vol. 199 (7). Р. 1043–1052.
17. Sparsa L., Fenollar F., Gossec L., Leone J., Pennaforte J.L., Dougados M., Roux C. [Whipple disease revealed by anti-TNFα therapy] // Rev Med Interne. 2013. Vol. 34 (2). Р. 105–109.
18. Gaddy J.R., Khan Z.Z., Chaser B., Scofield R.H. Whipple’s disease diagnosis following the use of TNF-α blockade // Rheumatology (Oxford). 2012. Vol. 51 (5). Р. 946.
19. Ansemant T., Celard M., Tavernier C., Maillefert J.F., Delahaye F., Ornetti P. Whipple’s disease endocarditis following anti-TNF therapy for atypical rheumatoid arthritis // Joint Bone Spine. 2010. Vol. 77 (6). Р. 622–623.
20. Hoppé E., Masson C., Audran M., Drillon M., Andreu M., Saraux A., Berthelot J.M., Maugars Y., Hmamouchi I., Morel J. Whipple’s disease diagnosed during biological treatment for joint disease // Joint Bone Spine. 2010. Vol. 77 (4). Р. 335–339.
21. Daïen C.I., Cohen J.D., Makinson A., Battistella P., Bilak E.J., Jorgensen C., Reynes J., Raoult D. Whipple’s endocarditis as a complication of tumour necrosis factor-alpha antagonist treatment in a man with ankylosing spondylitis // Rheumatology (Oxford). 2010. Vol. 49 (8). Р. 1600–1602.
22. Meunier M., Puechal X., Hoppé E., Soubrier M., Dieudé P., Berthelot J.M., Caramaschi P., Gottenberg J.E., Gossec L., Morel J., Maury E., Wipff J., Kahan A., Allanore Y. Rheumatic and musculoskeletal features of Whipple disease: a report of 29 cases // J Rheumatol. 2013. Vol. 40 (12). Р. 2061–2066.
23. Geissdörfer W., Moos V., Moter A., Loddenkemper C., Jansen A., Tandler R., Morguet A.J., Fenollar F., Raoult D., Bogdan C., Schneider T. High frequency of Tropheryma whipplei in culture-negative endocarditis // J Clin Microbiol. 2012. Vol. 50 (2). Р. 216–222.
24. Fenollar F., Lepidi H., Raoult D. Whipple’s endocarditis: review of the literature and comparisons with Q fever, bartonella infection, and blood culture-positive endocarditis // Clin Infect Dis. 2001. Vol. 33 (8). Р. 1309–1316.
25. Lagier J.C., Lepidi H., Raoult D., Fenollar F. Systemic Tropheryma whipplei: clinical presentation of 142 patients with infections diagnosed or confirmed in a reference center // Medicine (Baltimore). 2010. Vol. 89 (5). Р. 337–345.
26. Fenollar F, Célard M, Lagier JC, Lepidi H, Fournier PE, Raoult D. Tropheryma whipplei endocarditis // Emerg Infect Dis. 2013. Vol. 19 (11). Р. 1721–1730.
27. Gubler J.G., Kuster M., Dutly F., Bannwart F., Krause M., Vogelin H.P., Garzoli G., Altwegg M. Whipple endocarditis without overt gastrointestinal disease: report of four cases // Ann. Intern. Med. 1999. Vol. 131 (2). Р. 112–116.
28. Richardson D.C., Burrows L.L., Korithoski B. et al. Tropheryma whippelii as a cause of afebrile culture-negative endocarditis: the evolving spectrum of Whipple’s disease // J. Infect. 2003. Vol. 47 (2). Р. 170–173.
29. Chan V., Wang B., Veinot J.P., Suh K.N., Rose G., Desjardins M., Mesana T.G. Tropheryma whipplei aortic valve endocarditis without systemic Whipple’s disease // Int J Infect Dis. 2011. Vol. 15 (11). Р. 804–806.
30. Ratnaike R.W. Whipple’s disease. Postgrad // Med. J. 2000. Vol. 76. Р. 760–766.
31. Mohamed W., Neil E., Kupsky W.J., Juhász C., Mittal S., Santhakumar S. Isolated intracranial Whipple’s disease–report of a rare case and review of the literature // J Neurol Sci. 2011. Vol. 308 (1-2). Р. 1–8.
32. Moos V, Loddenkemper C, Schneider T. [Tropheryma whipplei infection. Colonization, self-limiting infection and Whipple’s disease] // Pathologe. 2011. Vol. 32 (5). Р. 362–370.
33. Логинов А.С., Парфенов А.И., Полева Н.И. Болезнь Уиппла: результаты длительного наблюдения // Тер. арх. 1998. № 9. С. 35–41.
34. Misbah S.A., Mapstone N.P. Whipple’s disease revisited // J. Clin. Pathol. 2000. Vol. 53. Р. 750–755.
35. Bakkali N., Fenollar F., Biswas S., Rolain J.M., Raoult D. Acquired resistance to trimethoprim-sulfamethoxazole during Whipple disease and expression of the causative target gene // J Infect Dis. 2008 Jul 1. Vol. 198 (1). Р. 101–108.
36. Van La M., Barbry P., Raoult D., Renesto P. Molecular basis of Tropheryma whipplei doxycycline susceptibility examined by transcriptional profiling // J Antimicrob Chemother. 2007. Vol. 59 (3). Р. 370–377.
37. Feurle G.E., Moos V., Schinnerling K., Geelhaar A., Allers K., Biagi F., Bläker H., Moter A., Loddenkemper C., Jansen A., Schneider T. The immune reconstitution inflammatory syndrome in whipple disease: a cohort study // Ann Intern Med. 2010. Vol. 153 (11). Р. 710–717.
38. Lagier J.C., Fenollar F., Lepidi H., Raoult D. Evidence of lifetime susceptibility to Tropheryma whipplei in patients with Whipple’s disease // J Antimicrob Chemother. 2011. Vol. 66 (5). Р. 1188–1189.
www.rmj.ru
что такое, причины, симптомы и лечение
Болезнь Уиппла (син. болезнь Уиппля, болезнь Виппла, липогранулематоз брыжейки, липофагический кишечный гранулематоз, кишечная липодистрофия, интестинальная липодистрофия) — довольно редкая системная патология, при котором наиболее часто поражается тонкий кишечник. По мере прогрессирования в патологический процесс могут вовлекаться органы пищеварительной, нервной и сердечно-сосудистой систем.
Возбудителем заболевания служит малоизученная на сегодняшний день бактерия Tropheryma whippelii. Основным провоцирующим болезнь фактором принято считать снижение сопротивляемости иммунной системы.
В клинической картине будут преобладать симптомы со стороны пораженного органа или системы. Часто выражается повышением температуры, расстройством стула, продуктивным кашлем, судорожными припадками и снижением остроты зрения.
Диагностика болезни Уиппла в обязательном порядке должна носить комплексный подход. Лабораторные тесты необходимы для выявления болезнетворного агента, а инструментальные процедуры — для выявления степени повреждения внутренних органов.
Тактика терапии носит консервативный характер и заключается в приеме медикаментов и соблюдении щадящего рациона. Стоит отметить, что лечение занимает длительный промежуток времени, в среднем — 2 года.
Современными исследователями принято считать, что болезнь развивается из-за проникновения в человеческий организм патологических микроорганизмов — Tropheryma whippelii.
После инфицирования бактерии активно увеличивают численность в иммунных клетках, которые носят название макрофаги. У здорового человека они выполняют функцию поглощения и разрушения инфекционных агентов, однако в этой ситуации бациллы остаются невредимыми.
Структурно измененные макрофаги начинают скапливаться в слизистой оболочке тонкого кишечника, что приводит к резкому снижению всасывания питательных веществ. Это обусловлено тем, что их транспорт прерывается на уровне кишечника, а в оболочке формируются отложения жира (липодистрофия).
Еще больше усугубляют проблему изменения во всасывании витаминов, минералов и иных питательных веществ. Затем патологический процесс распространяется на внутрибрюшные лимфатические узлы, миокард и перикард, суставы и брюшную полость, плевру и мозг.
Клиницистами было установлено, что у некоторых здоровых людей, т. е. при отсутствии характерных признаков болезни, бактерия может выделяться со слюной.
Кроме инфекционной причины, в развитии заболевания играет важную роль реакция организма. Главные предрасполагающие факторы:
- снижение иммунитета;
- глистные инвазии;
- хронические проблемы с ЖКТ;
- отсутствие полноценного питания.
Стоит отметить, что основную группу риска составляют лица в возрасте 40–50 лет, однако не исключается вероятность развития болезни у людей другой возрастной категории. Примечательно, что наиболее часто страдают от такой разновидности инфекции мужчины.
По мере протекания болезнь Уиппла проходит несколько стадий, которые постепенно развиваются друг за другом:
- 1 этап — появляются внекишечные симптомы. Часто поражается только одна система, например, суставы или лимфатические узлы. Основным признаком выступает постоянно повышенная температура тела.
- 2 этап — наблюдается развитие нарушения протекания процессов пищеварения и возникновение последствий, связанных с этим, например, расстройство стула и резкое снижение массы тела.
- 3 этап — отмечается вовлечение в патологию разных внутренних органов, среди которых могут быть сердце, легкие, нервная система.
Заболевание имеет только хроническое течение.
Несмотря на то, что болезнь Уиппла имеет инфекционную природу, точных данных касательно длительности инкубационного периода в настоящее время нет.
Первые клинические проявления:
- резкое повышение температурных показателей до 38 градусов и выше;
- мышечные и суставные боли;
- сильный озноб;
- опухание и покраснение кожи над пораженным суставом;
- увеличение лимфатических узлов — их подвижность сохраняется, а при пальпации болей не возникает.
Постепенно начинает развиваться кишечная или интестинальная симптоматика:
- расстройство акта дефекации, что выражается в обильной диарее — частота позывов к опорожнению кишечника может достигать 10 раз в сутки;
- пенистая консистенция фекалий и их светло-коричневый окрас — в некоторых случаях каловые массы приобретают дегтеобразную консистенцию, что указывает на нарушение свертываемости крови или развитие внутренних кровоизлияний;
- прогрессирующее снижение массы тела;
- схваткообразные болевые ощущения, локализующиеся в районе пупка и часто возникающие после потребления пищи;
- тошнота, изредка приводящая к рвотным позывам;
- отвращение к пище;
- отечность и воспалительное поражение языка;
- увеличение размеров живота;
- повышенное газообразование;
- быстрая утомляемость.
Наблюдаются изменения со стороны кожного покрова:
- появление участков гиперпигментации;
- сухость и шелушение кожи;
- подкожные кровоизлияния;
- уплотнение кожных покровов.
На вовлечение в патологический процесс легких указывают:
- сильный кашель с выделением мокроты;
- болезненность в области грудной клетки;
- стойкое понижение значений кровяного тонуса;
- одышка;
- незначительное возрастание температуры.

Симптомы болезни Уиппла
Повреждение нервной системы выражается в следующих нарушениях:
- слабоумие;
- судорожные припадки;
- паралич верхних или нижних конечностей;
- расстройство речевой функции;
- нарушения сна;
- депрессивное состояние;
- снижение памяти.
В некоторых случаях страдают органы зрения:
- ночная или «куриная» слепота;
- воспалительное поражение оболочек глаз;
- потемнение кожи вокруг глаз.
Клинические проявления развиваются как у взрослых, так и у детей. Необходимо помнить, что степень выраженности симптомов у ребенка может быть намного выше, нежели у лиц среднего или старшего возраста.
Поставить диагноз «болезнь Уиппла» может только клиницист на основании результатов широкого спектра лабораторно-инструментальных обследований.
При возникновении характерных симптомов стоит пройти консультацию у терапевта, который в обязательном порядке должен самостоятельно выполнить ряд манипуляций:
- изучение истории болезни и сбор жизненного анамнеза;
- оценка состояния кожных покровов и органов зрения;
- измерение показателей температуры, сердечного ритма и кровяного тонуса;
- прослушивание пациента при помощи фонендоскопа;
- детальный опрос — для выяснения первого времени возникновения и степени выраженности симптоматической картины.
Следующий шаг диагностики — лабораторные исследования:
- общеклинический анализ крови;
- биохимия крови;
- гемограмма;
- копрограмма;
- ПЦР-тесты;
- анализ каловых масс на яйца гельминтов и скрытую кровь;
- гистологическое изучение биоптата.
Самые информативные инструментальные процедуры:
- рентгенография брюшины;
- ФГДС;
- ультрасонография органов брюшной полости;
- ирригоскопия;
- биопсия;
- КТ;
- МРТ;
- ЭКГ;
- ЭхоКГ.
Ирригоскопия
В качестве дополнительных диагностических мероприятий, чтобы поставить диагноз болезнь Уиппла, нужны консультации у таких специалистов:
- невролог;
- кардиолог;
- гастроэнтеролог;
- ревматолог;
- педиатр — при развитии заболевания у ребенка.
Устранение болезни Уиппла занимает довольно продолжительный промежуток времени и предусматривает применение только консервативных терапевтических методов.
Медикаментозное лечение предполагает прием таких средств:
- гормональные противовоспалительные вещества;
- ферменты;
- антибактериальные средства;
- общеукрепляющие препараты;
- лекарства для улучшения всасывания питательных веществ;
- минерально-витаминные комплексы;
- препараты калия, магния, железа и кальция.
Во время терапии пациентам важно соблюдать высококалорийную диету с большим содержанием белков. Это означает, что в рацион в обязательном порядке должны входить такие продукты:
- нежирные сорта мяса и рыбы;
- кисломолочная продукция;
- соя и каши;
- морепродукты;
- овощные супы;
- пшеничный хлеб;
- компоты и некрепкий чай;
- зелень и салат;
- бобовые культуры;
- овощи и фрукты, приготовленные путем запекания или пропаривания.
Перечень категорически запрещенных ингредиентов:
- кондитерские изделия;
- свежая сдоба;
- щавель и шпинат;
- кулинарные жиры;
- жирные и острые блюда;
- полуфабрикаты;
- субпродукты;
- сладости и мороженое;
- острые соусы и пряности;
- кофе и алкоголь.
Рекомендуется частое и дробное потребление пищи. Все правила относительно рациона, примерного меню, перечня запрещенных и разрешенных продуктов предоставляет только лечащий врач.
При полном отсутствии терапии болезнь Уиппла может привести к смертельно опасным осложнениям:
Чтобы снизить вероятность развития заболевания, людям следует соблюдать несколько несложных правил. Профилактические рекомендации включают:
- полный отказ от пагубных пристрастий;
- рациональное питание;
- постоянное укрепление иммунной системы;
- комплексное устранение гастроэнтерологических и любых иных хронических патологий, которые могут спровоцировать развитие болезни Уиппла;
- регулярное прохождение полного обследования в медицинском учреждении.
Симптомы и лечение болезни Уиппла влияют на прогноз, который считается условно благоприятным. Это обусловлено тем, что полностью вылечить заболевание невозможно, однако соблюдение терапевтических правил может помочь достичь длительной ремиссии.
Стоит отметить, что без квалифицированной помощи люди умирают через несколько лет с момента возникновения кишечных клинических проявлений. К летальному исходу могут привести осложнения.
simptomer.ru
симптомы, диагностика, лечение и рекомендации
Болезнь Уиппла, или интестинальная липодистрофия – это редкое инфекционное заболевание кишечника. Кроме желудочно-кишечного тракта, поражает суставы, другие органы и системы организма.
Болезнь получила свое название по фамилии американского патологоанатома Джорджа Уиппла, который первым открыл ее и описал характерные симптомы. Это произошло в 1907 году. Ученый обнаружил у умерших людей одни и те же признаки – увеличение лимфоузлов в сочетании с воспалением серозных оболочек и большим скоплением липидов.
В принятой в мире системе классификации МКБ-10 болезнь Уиппла кодируется под номеров К 90.8.
Общие сведения о болезни Уиппла. Патогенез
Чаще всего заболеванию подвержены мужчины в возрасте от 40 до 50 лет (80% заболевших). Однако известны случаи, когда диагноз «болезнь Уиппла» ставился молодым людям и даже детям, в том числе женского пола. Заболеть может даже ребенок ясельного возраста.
Заболевание носит системный характер, поражая не один орган, а несколько систем организма. Это становится причиной большого разнообразия симптомов. От болезни Уиппла могут пострадать не только органы пищеварения, но и сердечнососудистой, нервной систем, а также кожный покров, опорно-двигательный аппарат, надпочечники, органы зрения. Но больше всего в патологию вовлекаются тонкий кишечник и лимфатические узлы.
Причины развития патологии
Возбудителем заболевания является бактерия Тropherima whippelii. Однако носителями инфекции могут быть вполне здоровые люди. Никаких явных симптомов не наблюдается, но бактерия при этом обнаруживается в слюне. Пагубное влияние на здоровье начинается в случаях, когда падает уровень иммунитета: если организм ослаблен стрессами, перенесенными заболеваниями, неполноценным питанием. Когда ресурсы организма истощаются, его способность сопротивляться инфекциям понижена.
Формы заболевания
Течение болезни характеризуется тремя стадиями, на каждой из которых она протекает в особой форме.
- Особенностью первой стадии являются внекишечные проявления. Характерно повышение температуры тела до 37,5-38,5 градусов, в некоторых случаях до 39 и выше. Симптоматика связана с поражением одной из систем организма. В связи с этим пациента могут беспокоить боли в суставах, набухание лимфоузлов, общее недомогание, боли в области сердца, проблемы с дыхательной системой.
- Кишечная форма. На этой стадии начинаются проблемы с органами пищеварения. Больного беспокоит диарея, боли в животе, несварение. Из-за плохого пищеварения нарушается усвояемость поступающих с пищей питательных веществ. Это приводит к дефициту витаминов, минералов, микроэлементов, других питательных веществ. Без полноценной усвояемости нормальное функционирование организма нарушается. Пациент теряет массу тела, слабеет.
- Распространение заболевания на различные органы и системы. При этой форме болезни поражаются сердце, легкие, нервная система, суставы, надпочечники. Проявления болезни зависят от индивидуальных особенностей организма.
Симптоматика может нарастать на протяжении нескольких лет. Только переход одной формы болезни Уиппла в другую может происходить годами (2-10 лет).

Симптоматика
Первые признаки заболевания – повышение температуры тела и воспаление суставов (артрит). Чаще всего больной жалуется на перемежающиеся суставные боли (затрагивают поочередно различные суставы). Начинаются воспаления суставов с отечностью, припухлостью, болезненностью при движениях. Могут также быть боли в мышцах, уплотнения мышечных тканей.
Увеличение лимфатических узлов (периферическая аденопатия) во всех областях тела.
Изменение работы надпочечников, первым заметным признаком которого становится нарушение пигментации кожи на открытых участках. На лице это области вокруг глаз, на скулах.
Со стороны ЖКТ – вздутие живота, повышенное газообразование, жидкий стул до 15 раз в сутки (понос) с жирным компонентом и очень неприятным запахом. У пациента пропадает аппетит, он испытывает боли в животе, особенно после или во время еды. У него возникает психологический барьер, страх перед самим процессом приема пищи. Нарушение жирового обмена ведет к дисфункции стенок тонкого кишечника. В результате всего этого больной меняется внешне – сильно худеет.
Организм истощается, это приводит к нарушению работы сердечных клапанов, повреждению внутренней оболочки сердца (эндокардиту). Поэтому могут быть боли в области сердца.
 Из-за недостатка витамина А снижается острота зрения в сумерках, ночью, в затенении (в народе явление носит название «куриная слепота»). У некоторых больных наблюдается также воспаление глазных оболочек.
Из-за недостатка витамина А снижается острота зрения в сумерках, ночью, в затенении (в народе явление носит название «куриная слепота»). У некоторых больных наблюдается также воспаление глазных оболочек.
Клиническая картина заболевания дополняется патологиями со стороны центральной и периферической нервной системы, которые являются наиболее тяжелыми и необратимыми симптомами.
Неврологические проявления болезни
Если болезнь Уиппла затронула нервную систему, первыми признаками будут нарушения сна, ухудшение памяти, депрессивные состояния. Эти симптомы характерны для многих других заболеваний, они не являются специфическими. Впоследствии болезнь дает о себе знать периодическими судорогами, параличами конечностей.
Неврологическая картина болезни дополняется нарушениями речи. В наихудших случаях прогрессирование болезни Уиппла приводит к поражению головного мозга и развитию слабоумия.
Методы диагностики
Так как симптоматическая картина многообразна, постепенно прогрессирует и схожа с проявлениями многих болезней, постановка диагноза затруднена. Диагностика должна быть комплексной, дифференциальной, с сопоставлением признаков, учетом целостной картины. Учитываются все жалобы больного, перенесенные ранее заболевания. Особое внимание врач обратит на то, имеются ли патологии органов пищеварительной системы.
Важно также выяснить, не страдают ли кишечными патологиями близкие родственники больного. Медицине известны случаи семейной целиакии – заболевания, при котором стенки тонкого кишечника не способны усваивать белки. Для правильной постановки диагноза следует исключить болезни с симптомами, схожими с признаками болезни Уиппла.
Проводятся лабораторные исследования: общий и биохимический анализы крови, а также анализы мочи и кала. Часто у больных на второй стадии выявляется анемия, вызванная нарушениями усвоения железа. В кале обнаруживаются остатки жировых веществ, грубых волокон пищи, может также оказаться, что организм заражен паразитарной инфекцией (глистами). Паразитарные инвазии приводят к повреждению стенок кишечника и становятся причиной болезни Уиппла.
Пациенту необходимо побывать на приеме ревматолога, невролога, гастроэнтеролога. Проводятся диагностические процедуры: рентген брюшной полости, УЗИ брюшной полости, лимфоузлов и сердца, эхокардиография, компьютерная томография всех упомянутых органов. Возможно эндоскопическое исследование кишечника с биопсией – взятием кусочка ткани из его стенки. Такая манипуляция помогает выявить начавшиеся изменения в тканях кишечника.

Лечение
Терапия заболевания очень длительная. Как минимум, в течение 2 лет больному придется принимать лекарственные препараты. Обязательно находиться под наблюдением врача.
Для лечения применяются бактерицидные антибиотики (тетрациклин, доксициклин, метациклин и другие). Курс приема антибиотиков составляет от 2 до 5 месяцев. Затем схема лечения меняется, лекарство принимается через день еще в течение 5-9 месяцев. Врач может назначить препарат 3 раза в неделю с перерывами на 4 дня.
 В протокол лечения может включаться Бисептол, а также Котримоксазол, который считается эффективным средством профилактики против неврологических осложнений. Кроме антибактериальных и противовоспалительных препаратов, показаны лекарственные средства с содержанием ферментов для восстановления мальабсорбции (всасывания питательных веществ) стенок кишечника.
В протокол лечения может включаться Бисептол, а также Котримоксазол, который считается эффективным средством профилактики против неврологических осложнений. Кроме антибактериальных и противовоспалительных препаратов, показаны лекарственные средства с содержанием ферментов для восстановления мальабсорбции (всасывания питательных веществ) стенок кишечника.
Назначается симптоматическое лечение в зависимости от проявлений недуга. При церебральных поражениях применяют бензилпенициллин, стрептомицин. В случае судорог показаны противоэпилептические средства. Если затронуты нервная система, глаза, легкие, сердце, врач также подберет соответствующую лекарственную терапию.
Медикаментозная терапия дополняется приемом витаминов В12, А, Е, К, D, а также фолиевой кислоты, железа.
Одним из компонентов лечения является диета. Она должна быть щадящей, учитывая повреждение кишечника. Острые, жирные, жареные, кислые продукты следует из рациона исключить. Крайне нежелательны алкоголь и черный кофе, особенно если эти напитки крепкие. Сдобу лучше заменить обычным хлебом. Мясные продукты употреблять в отварном виде, готовить на пару. Нужно исключить свинину, включить в рацион нежирную говядину и курятину. Полезны обезжиренный творог, нежирные сорта рыбы.
Прогноз
Если болезнь Уиппла не лечить, прогноз неутешительный. Запущенная вторая стадия может привести к летальному исходу. Чаще всего причиной смерти становится отказ работы надпочечников на фоне истощения через несколько лет после начала пищеварительных нарушений.
Болезнь можно вылечить, однако в некоторых случаях она грозит человеку потерей трудоспособности. При неправильно подобранных антибактериальных средствах симптомы могут исчезнуть, но впоследствии не исключен рецидив заболевания. В некоторых случаях вторичная заболеваемость возможна и после правильного курса лечения.

Осложнения
Заболевание может быть чревато тяжелыми осложнениями:
- Недостаточность функций надпочечников.
- Анемия.
- Отек головного мозга.
- Крайнее истощение организма.
- Заболевания, связанные с истощением миокарда.
- Легочная, почечная, сердечная недостаточность.
Некоторые осложнения болезни Уиппла лечатся с помощью операции. Например, при гидроцефалии проводится шунтирование.
Чтобы избежать осложнений, нужно внимательно относиться к собственному организму, вовремя обращаться к врачу. Профилактики болезни Уиппла не существует. Но заболевание встречается крайне редко: 1 выявленный случай приходится на более чем 1 миллион населения Земли. Чтобы не попасть в эту статистику, нужно стараться укреплять иммунитет, вести здоровый образ жизни, давать организму время на отдых и восстановление.
onevrologii.ru
Болезнь Уиппла – причины, стадии, симптомы, диагностика, лечение
 Болезнь Уиппла или кишечная липодистрофия – системное заболевание инфекционной природы, характеризующееся поражением тонкого кишечника с типичной инфильтрацией слизистой оболочки кишечника «пенистыми макрофагами», грамположительными бациллоподобными тельцами. Также наблюдается накопление в ней липидов, расширение лимфатических сосудов, развитие синдрома мальабсорбции. Болезнь Уиппла развивается преимущественно у мужчин (30:1) возрастной категории 30 – 50 лет. По данным различных исследований ежегодно регистрируется около 30 случаев заболевания в мире.
Болезнь Уиппла или кишечная липодистрофия – системное заболевание инфекционной природы, характеризующееся поражением тонкого кишечника с типичной инфильтрацией слизистой оболочки кишечника «пенистыми макрофагами», грамположительными бациллоподобными тельцами. Также наблюдается накопление в ней липидов, расширение лимфатических сосудов, развитие синдрома мальабсорбции. Болезнь Уиппла развивается преимущественно у мужчин (30:1) возрастной категории 30 – 50 лет. По данным различных исследований ежегодно регистрируется около 30 случаев заболевания в мире.
Этиология болезни Уиппла
Впервые болезнь Уиппла была описана в 1907 году патологоанатомом Дж.Уипплом, который при вскрытии обнаружил увеличение мезентеральных лимфатических узлов с полисерозитом. Бактериальная природа заболевания была подтверждена лишь в 1992 году. При помощи полимеразной цепной реакции были идентифицированы Tropheryna whipelii – грамположительные актиномицеты. Актиномицеты обнаруживаются в активной стадии заболевания в слизистых оболочках тонкого кишечника. Основной причиной развития заболевания в настоящее время предполагается нарушение функционирования иммунной системы различного происхождения. Для активной стадии заболевания характерна локализация бактерий в микрофагах, что указывает на их утрату способности к лизису микроорганизмов. При развитии Болезни Уиппла наблюдается сниженная выработка антител к возбудителю в организме либо же полное ее отсутствие. Более выраженным становится недостаток клеточного иммунного ответа.
Несмотря на то, что возбудитель заболевания был идентифицирован, причины развития болезни Уиппла до сих пор остаются неясными. Ученые не исключают генетическую предрасположенность. Значительная контаминация возбудителем сточных вод и почвы не приводит к массовому заражению. До настоящего времени не зарегистрировано ни единого случая передачи болезни Уиппла от человека человеку. Исследователи полагают, что не все штаммы возбудителя могут развивать болезнь Уиппла и характерные для нее патологические изменения.
Ответной реакцией организма на внедрение возбудителя болезни Уиппла являются патологические изменения в органах и их системах. Так, при болезни Уиппла в первую очередь происходит поражение тонкого кишечника. Ввиду диссеминации возбудителя Tropheryna whipelii у большинства пациентов наблюдается поражение опорно-двигательного аппарата, центральной нервной системы, сердечно-сосудистой системы, бронхолегочной системы.
Особое значение в развитии болезни Уиппла имеет поражение тонкого кишечника и локальной лимфатической системы. Слизистая оболочка кишечника инфильтрована микрофагами. Наблюдается расширение лимфатических сосудов, скопление жира в межклеточном пространстве слизистой оболочки тонкого кишечника.
Структурные нарушения кишечника приводят к развитию мальабсорбции, что затрудняет транспорт питательных веществ.
Стадии заболевания. Симптомы болезни Уиппла
В течении болезни Уиппла различают три стадии:
- Первая стадия, характеризующаяся проявлением внекишечных симптомов. На данной стадии заболевания основными симптомами являются полиартрит, лихорадка неясного происхождения, боль в мышцах, кашель с выделением мокроты. Первая стадия заболевания может длиться от 3 до 8 лет;
- Вторая стадия заболевания характеризуется проявлением гастроинтестинальных симптомов. Основными симптомами болезни Уиппла второй стадии являются хроническая диарея с обильным стулом до 10 раз в сутки, абдоминальная боль, болезненные ощущения при пальпации (возможно обнаружение увеличенных лимфатических узлов), снижение аппетита, снижение массы тела, атрофия мышц и их слабость. Наиболее серьезными изменениями при болезни Уиппла являются нарушения жирового и углеводного обменов, полигиповитаминоз, гипокальцемия, развитие тяжелого синдрома мальабсорбции;
- Третья стадия болезни Уиппла характеризуется развитием внегастроинтестинальных симптомов, системных проявлений. Для третьей стадии заболевания характерны нарушение функции надпочечников (пониженное АД, тошнота, рвота, анорексия, пигментация кожи), признаки поражения ЦНС (расстройство слуха и зрения, поражение черепно-мозговых нервов), поражение сердечно-сосудистой системы (эндокардиты, перикардиты, миокардиты), кожные изменения.
Диагностика болезни Уиппла
 Разнообразие клинических изменений в пораженном организме затрудняет диагностику болезни Уиппла. Основным методом диагностики является анализ биоптата (иссеченная стенка слизистой оболочки верхних отделов кишечника), наблюдение морфологических изменений кишечника при эндоскопии. Наиболее точным является метод ПЦР-диагностики (полимеразной цепной реакции), позволяющий определить возбудителя болезни Уиппла, как в биоптате, так и в других биологических средах.
Разнообразие клинических изменений в пораженном организме затрудняет диагностику болезни Уиппла. Основным методом диагностики является анализ биоптата (иссеченная стенка слизистой оболочки верхних отделов кишечника), наблюдение морфологических изменений кишечника при эндоскопии. Наиболее точным является метод ПЦР-диагностики (полимеразной цепной реакции), позволяющий определить возбудителя болезни Уиппла, как в биоптате, так и в других биологических средах.
Лечение болезни Уиппла
Долгое время полагалось, что для болезни Уиппла характерен летальный исход. Применение интенсивной антибактериальной терапии делает прогноз более благоприятным. В основе лечения болезни Уиппла применяются различные антибиотики. Наиболее эффективными среди них являются препараты тетрациклинового ряда. Дозировка и сроки терапии определяются на основе гистологических исследований в каждом случае индивидуально.
При тяжелых формах заболевания нередко пациентам требуется дополнительное симптоматическое лечение.
Для устранения симптомов мальабсорбции пациенту назначается особая диета, обогащенная животными белками с ограниченным содержанием жиров (до 30г в сутки). Для устранения симптомов диареи и абдоминального дискомфорта пациентам назначаются спазмолитки, замедляющие кишечную перистальтику.
Эффективность применяемой терапии оценивается путем проведения повторного гистологического исследования биоптата. Основным признаком эффективности лечения служит снижение количества макрофагов в исследуемом образце либо полное их отсутствие. Симптомы болезни Уиппла могут проявляться несколько дольше в силу масштабности поражения органов.
Информация является обобщенной и предоставляется в ознакомительных целях. При первых признаках болезни обратитесь к врачу. Самолечение опасно для здоровья!
Знаете ли вы, что:Средняя продолжительность жизни левшей меньше, чем правшей.
Кроме людей, от простатита страдает всего одно живое существо на планете Земля – собаки. Вот уж действительно наши самые верные друзья.
Упав с осла, вы с большей вероятностью свернете себе шею, чем упав с лошади. Только не пытайтесь опровергнуть это утверждение.
Американские ученые провели опыты на мышах и пришли к выводу, что арбузный сок предотвращает развитие атеросклероза сосудов. Одна группа мышей пила обычную воду, а вторая – арбузный сок. В результате сосуды второй группы были свободны от холестериновых бляшек.
Люди, которые привыкли регулярно завтракать, гораздо реже страдают ожирением.
Каждый человек имеет не только уникальные отпечатки пальцев, но и языка.
В течение жизни среднестатистический человек вырабатывает ни много ни мало два больших бассейна слюны.
Самое редкое заболевание – болезнь Куру. Болеют ей только представители племени фор в Новой Гвинее. Больной умирает от смеха. Считается, что причиной возникновения болезни является поедание человеческого мозга.
Согласно исследованиям, женщины, выпивающие несколько стаканов пива или вина в неделю, имеют повышенный риск заболеть раком груди.
Печень – это самый тяжелый орган в нашем теле. Ее средний вес составляет 1,5 кг.
Согласно исследованиям ВОЗ ежедневный получасовой разговор по мобильному телефону увеличивает вероятность развития опухоли мозга на 40%.
Общеизвестный препарат «Виагра» изначально разрабатывался для лечения артериальной гипертонии.
Человек, принимающий антидепрессанты, в большинстве случаев снова будет страдать депрессией. Если же человек справился с подавленностью своими силами, он имеет все шансы навсегда забыть про это состояние.
Наши почки способны очистить за одну минуту три литра крови.
Если улыбаться всего два раза в день – можно понизить кровяное давление и снизить риск возникновения инфарктов и инсультов.
www.neboleem.net
Болезнь Уиппла | Белов Б.С.
Введение
В 1907 г. американский патологоанатом Джордж Х. Уиппл (George Hoit Whipple), работавший в госпитале Дж. Гопкинса, опубликовал секционное наблюдение ранее неизвестного заболевания у 36–летнего мужчины. В течение 5 лет больной, врач по профессии, страдал лихорадкой, артритом, стойким и упорным кашлем, диареей и прогрессирующей потерей веса. При вскрытии обнаружено выраженное увеличение мезентеральных лимфатических узлов в сочетании с полисерозитом. При гистологическом исследовании кишечника и лимфоузлов выявлены множественные отложения липидов и большое число макрофагов, содержащих аргирофильные палочкообразные структуры. В качестве наиболее вероятной причины болезни Уиппл указал на нарушение метаболизма липидов и предложил назвать заболевание интестинальной липодистрофией. В то же время он не исключал и инфекционную этиологию заболевания [1].
В 1907 г. американский патологоанатом Джордж Х. Уиппл (George Hoit Whipple), работавший в госпитале Дж. Гопкинса, опубликовал секционное наблюдение ранее неизвестного заболевания у 36–летнего мужчины. В течение 5 лет больной, врач по профессии, страдал лихорадкой, артритом, стойким и упорным кашлем, диареей и прогрессирующей потерей веса. При вскрытии обнаружено выраженное увеличение мезентеральных лимфатических узлов в сочетании с полисерозитом. При гистологическом исследовании кишечника и лимфоузлов выявлены множественные отложения липидов и большое число макрофагов, содержащих аргирофильные палочкообразные структуры. В качестве наиболее вероятной причины болезни Уиппл указал на нарушение метаболизма липидов и предложил назвать заболевание интестинальной липодистрофией. В то же время он не исключал и инфекционную этиологию заболевания [1].Следует отметить, что впоследствии Дж. Уиппл опубликовал 270 работ, но больше к данному заболеванию не обращался. В 1934 г. он стал первым в США лауреатом Нобелевской премии в области медицины за разработку проблем лечения и профилактики пернициозной анемии. Несмотря на это, до сих пор его имя тесно ассоциируется с описанным им заболеванием – болезнью Уиппла (БУ).
Этиология и патогенез
В своем оригинальном описании случая Уиппл указывал на сходство палочковидных микробов, найденных им в собственной пластинке 12–перстной кишки, с бледной спирохетой. В то время инфекционная этиология болезни упорно оспаривалась оппонентами по причине ее несоответствия постулатам Коха. Однако, начиная с середины ХХ века, постепенно накапливались факты, свидетельствующие в пользу бактериальной этиологии заболевания. В 1949 г. было установлено, что в биоптатах лимфоузлов и тонкого кишечника содержатся PAS– (periodic acid Schiff) – позитивные макрофаги с включениями, похожими на продукты распада бактерий [2]. Спустя три года был описан первый случай успешного применения антибиотиков у больного БУ с быстрым обратным развитием клинической симптоматики и патоморфологических признаков. В начале 60–х гг. описаны палочкообразные тельца, выявленные в цитоплазме макрофагов при электронной микроскопии [3]. И только в работах последнего десятилетия [4–6] с помощью полимеразной цепной реакции (ПЦР) из инфицированных тканей пациентов была выделена грамположительная бацилла, получившая название Tropheryma whippelii (от греческого trophe – питание, eryma – барьер). По своим филогенетическим данным T. whippelii принадлежит к актиномицетам, имеет размеры 0,2х2,0 mм, трехслойную клеточную стенку, единственную круговую хромосому и небольшой размер генома (925 кД). Полагают, что патогенными могут быть не все, а строго определенные штаммы возбудителя.
В патогенезе заболевания наряду с генерализацией инфекции большое значение придается иммунологическим нарушениям. В пользу этого свидетельствуют наблюдаемые у таких больных снижение Т– клеточного соотношения СD4+/CD8+ и экспрессии CD11, уменьшение продукции интерлейкина–12 и g–интерферона. Параметры гуморального иммунитета изменяются мало. Гипотетический иммунологический дефект выражен достаточно слабо и весьма специфичен по отношению к T. whippelii, поскольку у пациентов с БУ частота возникновения других инфекций не превышает таковую в популяции. Показано, что T. whippelii накапливаются и размножаются в макрофагах. Таким образом, макрофаги, несмотря на сохранную функцию фагоцитоза, теряют способность к лизису возбудителя [7].
Эпидемиология
БУ относится к редким заболеваниям. К 2002 г. в литературе имелось чуть более 2000 наблюдений. Наиболее часто БУ выявляется у представителей белой расы – жителей Центральной Европы (55%) и Северной Америки (38%) . Единичные случаи болезни описаны среди испанцев, негров, индусов и представителей монголоидной расы. Преобладают жители сельской местности, чаще – фермеры. Мужчины поражаются в 8 раз чаще женщин, средний возраст к началу заболевания составляет 50 лет. Имеются отдельные сообщения о семейных случаях БУ. На возможную генетическую компоненту в развитии заболевания указывает повышенная частота обнаружения HLA–B27 (26–40%) у этих пациентов, однако в Италии и Аргентине подобная закономерность не выявлялась [8].
Клиническая картина
БУ является мультисистемным заболеванием, вследствие чего клиническая симптоматика чрезвычайно вариабельна. Заболевание начинается постепенно и в большинстве случаев носит хроническое течение со склонностью к рецидивам.
Наиболее ранним и очень часто (75%) единственным признаком БУ является суставной синдром, который может предшествовать развернутой клинической картине болезни в течение в среднем 6,7 лет. Имеется наблюдение, в котором интервал между поражением суставов и развитием желудочно–кишечных проявлений составил 36 лет [9].
Типичный случай поражения суставов был описан Уипплом, как «приступообразный артрит, захватывающий различные суставы и вовлекающий почти все суставы, пораженные к этому моменту времени. Эти приступы были преходящими, первый длился около 8 часов. Они рецидивировали вновь и вновь до 3–4 раз в неделю, в сырую погоду, продолжались от 6 до 24 часов, реже они были выраженными и не позволяли больному работать. Иногда суставы были припухшими и болезненными, реже – только болезненными» [1]. Действительно, у большинства больных отмечается приступообразный мигрирующий олиго– или полиартрит (реже – моноартрит), длящийся от нескольких часов до нескольких дней и отличающийся различной частотой обострений и полной ремиссией между приступами. Поражаются преимущественно коленные, лучезапястные и голеностопные суставы (рис. 1). В большинстве случаев артрит неэрозивный, протекает без развития деформаций, ревматоидный фактор не выявляется. Возможно развитие подкожных узелков, сходных с ревматоидными, однако при гистологическом исследовании в них выявлялись PAS– позитивные макрофаги, что подтверждало диагноз БУ. У отдельных больных отмечаются деструктивные изменения суставов. Описаны случаи формирования анкилоза лучезапястных и голеностопных суставов, а также гипертрофическая остеоартропатия. В 40% случаев встречаются спондилоартропатии, которые, как правило, сочетаются с периферическим артритом. Одно– или двухсторонний сакроилеит обнаруживают у 14% больных. Имеются описания анкилозирования крестцово–подвздошных сочленений, развития дерматомиозита и иных миопатий.
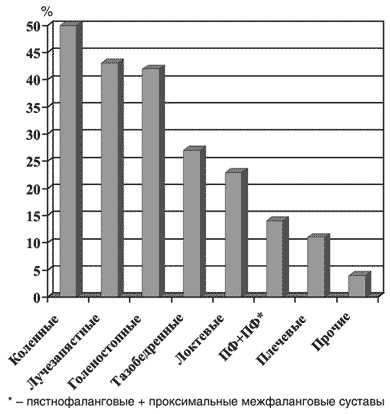
Рис. 1. Поражение суставов при БУ (n=131) [10]
Классическими признаками заболевания являются желудочно–кишечные расстройства. В типичных случаях отмечается диарея (чаще – стеаторея), сопровождающаяся приступообразной болью в животе, синдром нарушенного всасывания и прогрессирующая потеря массы тела. Как следствие, развивается полигиповитаминоз и разнообразные нарушения водно–электролитного обмена.Примерно у половины больных в развернутой стадии заболевания наблюдается лихорадочный синдром, сопровождающийся ознобом с последующим профузным потоотделением, а также генерализованная лимфаденопатия. Отмечается сухость кожи и ее диффузная гиперпигментация, преимущественно, на открытых участках тела (но не на слизистых), хейлит, глоссит, ломкость ногтей, аллопеция, отеки. Описано развитие пурпуры (без тромбоцитопении).
При БУ нередко встречается стойкий кашель, плеврит и пневмонит.
Клинические симптомы поражения сердечно–сосудистой системы наблюдаются в 30–55% случаев. Возможно поражение любой из оболочек сердца, однако наиболее часто развивается эндокардит. Последний по сравнению с инфекционным эндокардитом, вызванным другими возбудителями, имеет ряд особенностей: отсутствие предшествовавшей клапанной патологии сердца, нормальная температура тела, отрицательная гемокультура, позитивные ЭхоКГ– данные отмечаются только в 75% случаев. [11]. Описано несколько случаев эндокардита при БУ без гастроэнтерологической симптоматики [12,13]. Нередко развивается гипотензия и прогрессирующая застойная сердечная недостаточность.
Поражение ЦНС встречается в 10–50% случаев. Неврологическая симптоматика может быть как первым проявлением заболевания, так и развиваться спустя несколько лет на фоне манифестной клинической картины БУ. Наиболее частые симптомы – деменция, супрануклеарная офтальмоплегия и миоклония, которые встречаются в 25–50% случаев среди больных с патологией ЦНС при БУ. Также описаны эпилептические припадки, церебральная атаксия, инсомния. Сочетание медленного плавного конвергентно–дивергентного маятникообразного нистагма с синхронным сокращением жевательных мышц (oculomasticatory myorhytmia) или лицевых мышц (oculofaciosceetal myorhytmia) наблюдаются у 20% больных с вовлечением ЦНС и (несмотря на относительную редкость) рассматриваются как патогномоничные для БУ [14].
Наиболее распространенными формами поражения глаз при БУ являются увеит и офтальмоплегия. Встречается диффузный хориоретинит, глаукома, кератит.
В 10–15% случаев выявляют гепатомегалию, спленомегалию, асцит. Патология желудочно–кишечного тракта и эндокринной системы встречается крайне редко.
В течении БУ выделяют три стадии : I – стадия внекишечных симптомов (полиартрит, лихорадка), II – стадия мальабсорбции с прогрессирующим похуданием и тяжелыми метаболическими расстройствами, III – стадия системных проявлений (кардиальных, неврологических и т.д.).
Диагностика
Учитывая полиморфизм клинических проявлений, диагноз БУ весьма часто вызывает существенные трудности. Наибольшие диагностические проблемы возникают у больных с внекишечными формами болезни. По данным отечественных авторов, диагноз БУ устанавливается в среднем спустя 6 лет после первых клинических проявлений [15].
Какие–либо специфические изменения лабораторных показателей не наблюдаются. У больных значительно повышена СОЭ, а также число лейкоцитов и тромбоцитов, СРБ, снижен уровень гемоглобина, железа, кальция, калия, белка, альбуминов, холестерина (как следствие мальабсорбции). Отмечаются положительные результаты функциональных проб с ксилозой, нагрузкой глюкозой и др.
Важная роль в диагностике БУ отводится морфологическому исследованию слизистой оболочки тонкой кишки. При эндоскопии выявляют отек, гиперемию, и резкое утолщение складок кишки по причине лимфостаза, а также неровность рельефа слизистой из–за многочисленных желтовато–белых бляшек. При световой микроскопии биоптатов, полученных из тощей и 12–перстной кишки нелеченных больных с БУ, выявляют булавовидные ворсинки, содержащие большое количество лимфы. Часто отмечают внутри– и внеклеточное накопление жира в слизистой оболочке тонкой кишки. В собственной пластинке слизистой оболочки наблюдается большое количество пенистых макрофагов, содержащих крупнозернистые цитоплазматические включения с PAS–позитивной реакцией. Эти PAS–позитивные макрофаги могут также обнаруживаться в периферических или брыжеечных лимфоузлах, печени, селезенке, сердечных клапанах, мозговой ткани, стекловидном теле и синовиальной оболочке.
Считают, что PAS–позитивное вещество – это продукты распада фагоцитированных бактерий. Выявление PAS–позитивных включений в цитоплазме макрофагов не является патогномоничным для БУ (как полагали ранее), а может иметь место при других инфекциях, вызванных комплексом M. avium–intracellulare (у ВИЧ–инфицированных больных), коринебактериозе, гистоплазмозе, микозах, саркоидозе. В то же время PAS–реакция имеет чрезвычайно важное дифференциально–диагностическое значение, в частности, при разграничении БУ с первичной (болезнь Вальдмана) и приобретенными лимфангиэктазиями.
Ценным диагностическим подспорьем может служить электронная микроскопия, которая позволяет выявить в пораженных тканях палочковидные бактерии, локализующиеся как внутриклеточно, так и в межклеточном пространстве.
Несоблюдение правил проведения биопсии (взятие материала из верхней, а не из нижней части 12–перстной кишки) и предшествовавшая антимикробная терапия могут повлечь за собой отрицательные результаты патоморфологического исследования даже при характерной для БУ клинической картине. В подобных ситуациях особенно необходимой представляется ПЦР– диагностика. Использование праймеров, комплементарных консервативным участкам рибосомных генов (16S– и 23S–РНК), и дальнейшее определение полной нуклеотидной последовательности амплифицированной ДНК позволяют с высокой степенью вероятности идентифицировать T. whippelii. Для выполнения ПЦР могут быть использованы биоптаты слизистой 12–перстной кишки, лимфоузлов, сердечных клапанов (удаленных во время кардиохирургической операции), а также пунктаты синовиальной жидкости или ликвора. Несмотря на высокую чувствительность и специфичность ПЦР, существует определенная вероятность получения как ложноположительных, так и ложноотрицательных результатов. Поэтому залогом успешной диагностики БУ (как и любого другого заболевания) является комплексная оценка клинической картины и данных дополнительных исследований.
Дифференциальный диагноз БУ проводят с заболеваниями, имеющими сходную клиническую симптоматику (табл. 1). Необходимо заметить, что БУ обязательно должна быть включена в алгоритм диагностического поиска при лихорадке неясного генеза.
Лечение
В доантибиотическую эру БУ заканчивалась летально в 100% наблюдений. Начиная с 1952 г., когда было сообщено об успешном применении антимикробного препарата (хлорамфеникола) для лечения БУ, до сегодняшнего дня продолжаются поиски оптимальных схем антибактериальной терапии. К сожалению, редкая встречаемость БУ, а также проблемы, связанные с культурированием T. whippelii, служат труднопреодолимым препятствием для проведения рандомизированных клинических исследований. Поэтому существующие схемы антимикробной терапии (табл. 2) разработаны на эмпирической основе.
В доантибиотическую эру БУ заканчивалась летально в 100% наблюдений. Начиная с 1952 г., когда было сообщено об успешном применении антимикробного препарата (хлорамфеникола) для лечения БУ, до сегодняшнего дня продолжаются поиски оптимальных схем антибактериальной терапии. К сожалению, редкая встречаемость БУ, а также проблемы, связанные с культурированием , служат труднопреодолимым препятствием для проведения рандомизированных клинических исследований. Поэтому существующие схемы антимикробной терапии (табл. 2) разработаны на эмпирической основе.До 1980–х гг. весьма популярной была комбинация пенициллина и стрептомицина, назначавшаяся в течение 2 недель, с последующим длительным приемом тетрациклина. В дальнейшем было установлено, что основной причиной смерти пациентов, принимавших тетрациклин, были неврологические осложнения, развивавшиеся во время рецидивов. Данное обстоятельство побудило клиницистов к применению ко–тримоксазола – комбинированного препарата, 1 таблетка которого содержит 160 мг триметоприма и 800 мг сульфаметоксазола. Препарат хорошо проникает через гематоэнцефалический барьер и достигает терапевтических концентраций в ликворе даже при неизмененных мозговых оболочках. По сводным данным, объединившим результаты 4 небольших исследований, минимальная частота рецидивов (4,35%) была среди больных, пролеченных ко–тримоксазолом. В группах пациентов, получавших пенициллин со стрептомицином или тетрациклин, эти показатели составляли 11,8 и 32,2% соответственно [16].
По мнению большинства авторов, при БУ, протекающей с неврологической симптоматикой, лечение следует начинать с 2–недельного парентерального введения бактерицидных антибиотиков, обладающих хорошей пенетрацией в спинномозговую жидкость, с последующим длительным (1–2 года) поддерживающим лечением ко– тримоксазолом. В остальных случаях терапия начинается с ко–тримоксазола, что считается более успешным в плане профилактики неврологических осложнений.
Многие авторы отмечают выраженную положительную динамику при своевременно начатой и активной терапии. Так, лихорадка и диарея купируются к концу 1–й недели лечения, суставной синдром полностью регрессирует в течение 1 месяца. В эти же сроки отмечается явное улучшение общего самочувствия, прибавка в весе. Обратное развитие неврологической симптоматики происходит значительно медленнее.
Вспомогательное значение имеет применение глюкокортикостероидов (преднизолон 30–40 мг в сутки с постепенным снижением дозы вплоть до полной отмены).
При необходимости в план лечения включают мероприятия, направленные на ликвидацию последствий синдрома мальабсорбции (коррекция метаболических нарушений, водно–электролитного обмена, восполнение дефицита железа и витаминов и т.д.)
Длительность антибактериальной терапии должна составлять не менее 1 года. Контроль за лечением осуществляют с помощью повторных морфологических исследований биоптатов тонкого кишечника либо ПЦР – методик. При отсутствии ответа на антибактериальную терапию представляется перспективным применение g–интерферона.
Прогноз в большинстве случаев благоприятный. При возникновении рецидивов (8–35%) терапия аналогична вышеуказанной.
Наиболее неблагоприятными в прогностическом плане считают неврологические осложнения, возникающие во время рецидивов, как следствие первично нераспознанной локализации инфекции или неадекватной терапии.
Литература:
1. Whipple G.H. A hitherto undescribed disease characterized anatomically by deposits of fat and fatty acids in the intestinal mesenteric lymphatic issues. //John Hopkins Hospital Bulletin. 1907; 18: 382–391.
2. Black–Schaffer B. The tinctorial demonstration of a glycoprotein in Whipple’s disease. //Proc. Soc. Exp. Biol. Med. 1949; 72: 225 – 227.
3. Gardley J., Hendrix T.R. Combined electron and light microscopy in Whipple’s disease: demonstration of «bacillary bones» in the intestine. Bull. Johns Hopkins Hosp. 1961; 10: 80 –98.
4. Wilson K.H., Blitchington R.,Frothingham R., Wilson J.A.Phylogeny of the Whipple’s disease – associated bacterium.// Lancet. 1991; 338: 474–475.
5. Relman D.A.,Schmidt T.M., Mac Dermott R.P., Falkow S. Identification of the uncultured bacillus of the Whipple’s disease. N. Engl. J. Med. 1992; 327: 293–301.
6. Raoult D., Birq M.C., LaScola B., et al. Cultivation of the bacillus of Whipple’s disease. N. Engl. J. Med. 2000; 342: 620 – 625.
7. Dobbins W.O., Ruffin J.M.A light– and electron – microscopic study of bacterial invasion in Whipple’s disease. Am. J. Pathol. 1967; 51: 225 – 242.
8. Marth T., Raoult D. Whipple’s disease. Lancet. 2003; 361: 239 – 246.
9. Ayoub W.T., Davis D.E., Torreri D., Viozzi F.J. Bone destruction and ankylosis in Whipple’s disease. J. Rheumatol. 1982; 9: 930–931.
10. Puechal X. Whipple’s disease. Joint Bone Spine. 2002; 68: 133 – 140.
11. Fenollar F, Lepidi H, Raoult D. Whipple’s endocarditis: review of the literature and comparisons with Q fever, bartonella infection, and blood culture–positive endocarditis. Clin Infect Dis 2001;33(8):1309–1316.
12. Gubler JG, Kuster M, Dutly F, Bannwart F, Krause M, Vogelin HP, Garzoli G, Altwegg M. Whipple endocarditis without overt gastrointestinal disease: report of four cases. Ann. Intern. Med. 1999; 131(2):112–116.
13. Richardson DC, Burrows LL, Korithoski B, et al. Tropheryma whippelii as a cause of afebrile culture–negative endocarditis: the evolving spectrum of Whipple’s disease. J. Infect. 2003;47(2):170–173.
14. Ratnaike R.W. Whipple’s disease. Postgrad. Med. J. 2000; 76: 760 – 766.
15. Логинов А.С., Парфенов А.И., Полева Н.И. Болезнь Уиппла: результаты длительного наблюдения. Тер. арх. 1998; 9: 35 –41.
16. Misbah S.A., Mapstone N.P. Whipple’s disease revisited. J. Clin. Pathol. 2000; 53: 750 – 755.
17. Singer R. Diagnosis and treatment of Whipple’s disease (review). Drugs. 1998; 55: 699 – 704.
www.rmj.ru
