Степень кислотности – Кислотно-щелочное равновесие. Здоровый показатель pH
Кислотно-щелочное равновесие. Здоровый показатель pH
Кислотно-щелочное равновесие.
Показатель pH и его влияние на качество питьевой воды.
Что такое pH?
pH («potentia hydrogeni» — сила водорода, или «pondus hydrogenii» — вес водорода) — это единица измерения активности ионов водорода в любом веществе, количественно выражающая его кислотность.
Данный термин появился в начале ХХ века в Дании. Показатель pH ввел датский химик Сорен Петр Лауриц Соренсен (1868-1939), хотя утверждения о некой «силе воды» встречаются и у его предшественников.
Активность водорода определяется как отрицательный десятичный логарифм концентрации водородных ионов, выраженной в молях на литр:
pH = -log[H+]
Для простоты и удобства при вычислениях был введен показатель pH. рН определяется количественным соотношением в воде ионов Н+ и ОН-, образующихся при диссоциации воды. Принято измерять уровень pH по 14-цифровой шкале.
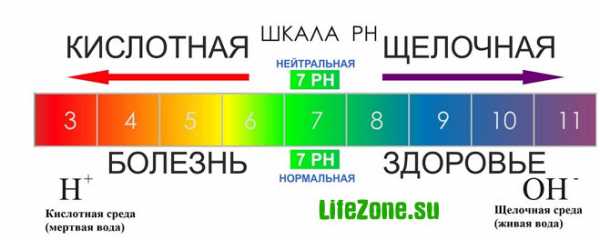
Если в воде пониженное содержание свободных ионов водорода [H+] (рН больше 7) по сравнению с ионами гидроксида [ОН-], то вода будет иметь щелочную реакцию, а при повышенном содержании ионов Н+ (рН меньше 7) — кислую реакцию. В идеально чистой дистиллированной воде эти ионы будут уравновешивать друг друга.
кислая среда: [H+] > [OH-]
нейтральная среда: [H+] = [OH-]
щелочная среда: [OH-] > [H+]
Когда концентрации обоих видов ионов в растворе одинаковы, говорят, что раствор имеет нейтральную реакцию. В нейтральной воде показатель рН равен 7.
При растворении в воде различных химических веществ этот баланс изменяется, что приводит к изменению значения рН. При добавлении к воде кислоты концентрация ионов водорода увеличивается, а концентрация гидроксид-ионов соответственно уменьшается, при добавлении щелочи — наоборот, повышается содержание гидроксид-ионов, а концентрация ионов водорода падает.
рН показатель отражает степень кислотности или щелочности среды, в то время как «кислотность» и «щелочность» характеризуют количественное содержание в воде веществ, способных нейтрализовывать соответственно щелочи и кислоты. В качестве аналогии можно привести пример с температурой, которая характеризует степень нагрева вещества, но не количество тепла. Опустив руку в воду, мы можем сказать какая вода — прохладная или теплая, но при этом не сможем определить сколько в ней тепла (т.е. условно говоря, как долго эта вода будет остывать).
pH считается одним из важнейших показателей качества питьевой воды. Он показывает кислотно-щелочное равновесие и влияет на то, как будут протекать химические и биологические процессы. В зависимости от величины pH может изменяться скорость протекания химических реакций, степень коррозионной агрессивности воды, токсичность загрязняющих веществ и т.д. От кислотно-щелочного равновесия среды нашего организма напрямую зависит наше самочувствие, настроение и здоровье.
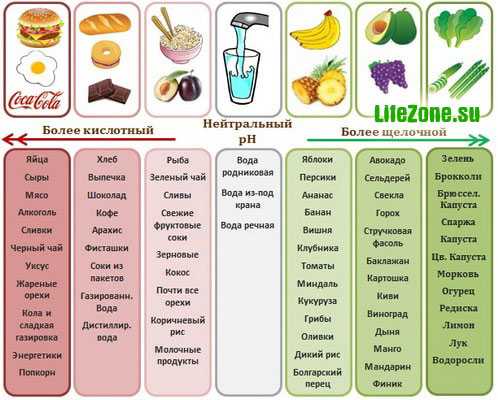
Современный человек живет в загрязненной окружающей среде. Многие приобретают и употребляют пищу, изготовленную из полуфабрикатов. Кроме этого практически каждый человек ежедневно подвергается стрессовому воздействию. Все это оказывает влияние на кислотно-щелочное равновесие среды организма, смещая его в сторону кислот. Чай, кофе, пиво, газированные напитки снижают показатель pH в организме.
Считается, что кислая среда является одной из основных причин разрушения клеток и повреждения тканей, развития заболеваний и процессов старения, росту болезнетворных организмов. В кислой среде до клеток не доходит строительный материал, разрушается мембрана.
Кислая среда провоцирует множество заболеваний, среди которых сердечно-сосудистые заболевания, артрит, остеопороз, онкологические заболевания и др, а так же способствует развитию бактерий, вирусов, грибков, гельминтов и прочих паразитов. Паразиты предпочитают кислую среду обитания, и именно в кислотной среде они проявляют себя наиболее патогенно. Кислую среду в организме создают психические и физические перегрузки, мясо, пища, прошедшая глубокую термическую и иную технологическую обработку, снижающую содержание в ней полезных веществ. Эти же источники закисления наполняют организм свободными радикалами, которые перегружают иммунную систему. Один из признаков закисления организма — некомфортная сухость во рту.
Внешне о состоянии кислотно-щелочного равновесия крови человека можно судить по цвету его конъюнктивы в уголках глаз. При оптимальном кислотно-щелочном балансе цвет конъюнктивы ярко-розовый, если же у человека повышается щелочность крови, конъюнктива приобретает темно-розовый окрас, а при повышении кислотности окрас конъюнктивы становится бледно-розовым. При чем цвет конъюнктивы изменяется уже через 80 секунд после употребления веществ, влияющих на кислотно-щелочное равновесие.
Организм регулирует рН внутренних жидкостей, поддерживая значения на определенном уровне. Кислотно-щелочной баланс организма — это определенное соотношение кислот и щелочей, способствующее его нормальному функционированию. Кислотно-щелочной баланс зависит от сохранения относительно постоянных пропорций между межклеточными и внутриклеточными водами в тканях организма. Если кислотно-щелочное равновесие жидкостей в организме не будет поддерживаться постоянно, нормальное функционирование и сохранение жизни окажутся невозможными. Поэтому важно контролировать то, что вы потребляете.
Кислотно-щелочной баланс – это наш индикатор здоровья. Чем мы «кислее», тем скорее стареем и больше болеем. Для нормальной работы всех внутренних органов уровень рН в организме должен быть щелочным, в интервале от 7 до 9.
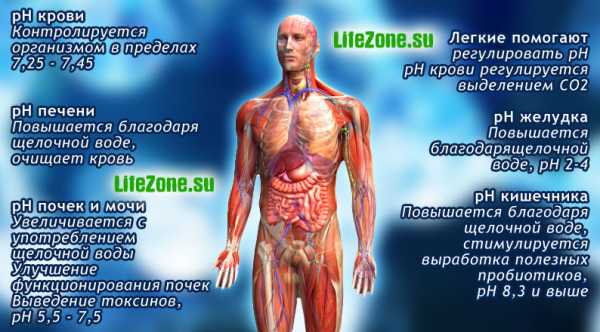
pH внутри нашего тела не всегда одинаков — некоторые его части более щелочные, а некоторые кислотные. Организм регулирует и поддерживает гомеостаз уровня pH лишь в отдельных случаях, например pH крови. На уровень pH почек и других органов, кислотно-щелочное равновесие которых не регулируются организмом, влияют пища и напитки, которые мы употребляем.
pH крови
Уровень pH крови поддерживается организмом в диапазоне 7.35-7.45. Нормальным показателем pH крови человека считается 7,4-7,45. Даже незначительное отклонение этого показателя влияет на способность крови переносить кислород. Если pH крови повышается до 7,5, она переносит на 75% кислорода больше. При снижении показателя pH крови до 7,3 человеку уже сложно подняться с постели. При 7,29 он может впасть в кому, если показатель pH крови снизится ниже 7,1 — человек умирает.
Уровень pH крови должен поддерживаться в здоровом диапазоне, поэтому организм использует органы и ткани для поддержания его постоянства. Вследствие этого, уровень pH крови не меняется из-за употребления щелочной или кислотной воды, но ткани и органы тела, используемые для регулировки pH крови, меняют свой pH.
pH почек
На параметр pH почек оказывает влияние вода, пища, метаболические процессы в организме. Кислотная еда (например мясные продукты, молочные продукты и др.) и напитки (сладкие газированные напитки, алкогольные напитки, кофе и пр.) приводят к низкому уровню pH в почках, потому что организм выводит излишнюю кислотность через мочу. Чем ниже уровень pH мочи, тем тяжелее приходится работать почкам. Поэтому кислотная нагрузка, приходящаяся от такой еды и напитков на почки, называется потенциальной кислотно-почечной нагрузкой.
Употребление щелочной воды приносит почкам пользу — происходит повышение уровня pH мочи, снижается кислотная нагрузка на организм. Увеличение pH мочи повышает pH организма в целом и избавляет почки от кислотных токсинов.
pH желудка
В пустом желудке содержится не больше чайной ложки желудочной кислоты, выработанной в последний прием пищи. Желудок производит кислоту по мере необходимости при употреблении пищи. Желудок не выделяет кислоту, когда человек пьет воду.
Очень полезно — пить воду на пустой желудок. Показатель pH увеличивается при этом до уровня 5-6. Увеличенный pH будет иметь мягкий антацидный эффект и приведет к увеличению количества полезных пробиотиков (благотворных бактерий). Увеличение pH желудка повышает pH организма, что ведет к здоровому пищеварению и освобождает от симптомов расстройства желудка.
pH подкожного жира
Жировые ткани организма имеют кислотный pH, поскольку в них откладываются излишние кислоты. Организму приходится хранить кислоту в жировых тканях, когда она не может быть выведена или нейтрализована иными способами. Поэтому смещение pH организма в кислую сторону — это один из факторов лишнего веса.
Позитивное влияние щелочной воды на массу тела состоит в том, что щелочная вода помогает выводить из тканей излишнюю кислоту, поскольку помогает почкам работать более рационально. Это помогает контролировать вес, поскольку многократно снижается количество кислоты, которое тело должно «хранить». Щелочная вода также улучшает результаты здоровой диеты и упражнений, помогая организму справиться с излишней кислотностью, выделяемой жировыми тканями в процессе потери веса.
Кости
У костей щелочной pH, так как они в основном состоят из кальция. Их pH постоянен, но если кровь нуждается в регулировке pH, кальций забирается из костей.
Польза, приносимая щелочной водой костям, состоит в их защите, путем снижения количества кислоты, с которым организму приходится бороться. Исследования показали, что употребление щелочной воды снижает рассасывание костей — остеопороз.
pH печени
У печени слабощелочной pH, на уровень которого влияет и пища, и напитки. Сахар и алкоголь должны быть расщеплены в печени, а это приводит к излишкам кислоты.
Польза, приносимая щелочной водой печени, состоит в наличии в такой воде антиоксидантов; установлено, что щелочная вода усиливает работу двух антиоксидантов, находящихся в печени, способствующих более эффективному очищению крови.
pH организма и щелочная вода
Щелочная вода позволяет частям тела, сохраняющим pH крови, работать с большей производительностью. Повышение уровня pH в частях тела, отвечающих за поддержание pH крови, поможет этим органам оставаться здоровыми и работать оперативно.
Между приемами пищи Вы можете помочь Вашему организму нормализовать показатель pH, употребляя щелочную воду. Даже небольшое увеличение pH может оказать огромное влияние на состояние здоровья.
По данным исследований японских ученых, показатель pH питьевой воды, находящийся в диапазоне 7-8, повышает продолжительность жизни населения на 20-30%.
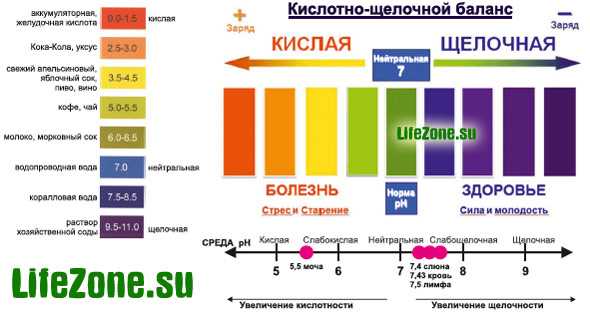
В зависимости от уровня рН воды можно условно разделить на несколько групп:
• сильнокислые воды < 3
• кислые воды 3 — 5
• слабокислые воды 5 — 6.5
• слабощелочные воды 7.5 — 8.5
• щелочные воды 8.5 — 9.5
• сильнощелочные воды > 9.5
Обычно уровень рН питьевой водопроводной воды находится в пределах, при которых он непосредственно не влияет на потребительские качества воды. В речных водах pH обычно находится в пределах 6.5-8.5, в атмосферных осадках 4.6-6.1, в болотах 5.5-6.0, в морских водах 7.9-8.3.
ВОЗ не предлагает какой-либо рекомендуемой по медицинским показателям величины для рН. Известно, что при низком рН вода обладает высокой коррозионной активностью, а при высоких уровнях (рН>11) вода приобретает характерную мылкость, неприятный запах, способна вызывать раздражение глаз и кожи. Именно поэтому для питьевой и хозяйственно-бытовой воды оптимальным считается уровень рН в диапазоне от 6 до 9.
| |||||||||||||||||||||||||||||||||||||||||||||||



Интересно знать: Немецкий биохимик ОТТО ВАРБУРГ, удостоенный в 1931 Нобелевской премии по физиологии и медицине доказал, что недостаток кислорода (кислая среда pH<7.0) в тканях приводит к изменению нормальных клеток в злокачественные.
Ученый обнаружил, что раковые клетки теряют способность к развитию в среде, насыщенной свободным кислородом с показателем pH=7,5 и выше! Это означает, что когда жидкости в организме становятся кислыми, стимулируется развитие рака.
Его последователи в 60-х годах прошлого столетия доказали, что любая патогенная флора теряет способность размножаться при pH=7,5 и выше, и наша иммунная система легко справляется с любыми агрессорами!
Для сохранения и поддержания здоровья нам необходима правильная щелочная вода (рН=7.5 и выше). Это позволит лучше сохранять кислотно-щелочное равновесие жидкостей организма, так как основные жизненные среды имеют слабощелочную реакцию.
Уже при нейтральной биологической среде организм может обладать удивительной способностью к самоисцелению.
Не знаете где можно взять правильную воду? Я подскажу!
Обратите внимание:
Нажатие на кнопку «Узнать» не ведет к каким-либо финансовым тратам и обязательствам.
Вы лишь получите информацию о доступности правильной воды в Вашем регионе,
а так же получите уникальную возможность бесплатно стать членом клуба здоровых людей
и получить скидку 20% на все предложения + накопительный бонус.

Вступи в международный клуб здоровья Coral Club, получи БЕСПЛАТНО дисконтную карту, возможность участия в акциях, накопительный бонус и другие привилегии!
lifezone.su
29.Показатель кислотности – pH. Кислотность почв. Виды почвенной кислотности.
рН – водородный показатель – характеризует кислотность раствора. рН = 7 – нейтральная среда; рН < 7 – кислая; рН> 7 – щелочная. Способность почвы подкислять почвенный раствор обусловлена наличием в почве кислот, гидролитически кислых солей, а также поглощенных ионов водорода и алюминия. Кислотность почвы вызывается ионами водорода. В зависимости от того, в каком состоянии ионы водорода находятся в почве, кислотность может быть активной (актуальной) и потенциальной. Активная кислотность зависит о концентрации свободных ионов водорода в почвенном растворе. Их источником являются органические кислоты, образующиеся при разложении растительных остатков, и угольная кислота, появляющаяся в почве при растворении диоксида углерода в воде. Потенциальная кислотность подразделяется на обменную и гидролитическую. Она обусловлена содержанием ионов водорода и алюминия, находящися в поглощенном состоянии.
30.Классификация почв по степени кислотности. Расчет доз извести. Виды сырья для понижения кислотности почв.
По степени кислотности почвы подразделяются на очень сильнокислые (рН ниже 4,0), сильнокислые (4,1—4,5), кислые (4,6—5,2), слабокислые (5,3—6,4), нейтральные и близкие к нейтральным (6,5—7,4) и щелочные (свыше 7,5). Почвенная кислотность неблагоприятна для жизнедеятельности растений и микроорганизмов, поэтому дя ее устранения применяют известкование почв. При внесении извести в почву поглощенный водород замещается кальцием. Дозы извести: т/га = 1,5Н. Также в качестве сырья вносят мергель,долонит,мел.
Способность почвы подкислять почвенный раствор обусловлена наличием в почве кислот, гидролитически кислых солей, а также поглощенных ионов водорода и алюминия.
Кислотность почвы вызывается ионами водорода. В зависимости от того, в каком состоянии ионы водорода находятся в почве, кислотность может быть активной (актуальной) и потенциальной.
Активная (актуальная) кислотность зависит от концентрации свободных ионов водорода в почвенном растворе. Их источником являются органические кислоты, образующиеся при разложении растительных остатков, и угольная кислота, появляющаяся в почве при растворении диоксида углерода в воде.
Кислую реакцию имеют подзолистые, дерново-подзолистые и болотные почвы, нейтральную – черноземы, щелочную – каштановые почвы, сероземы и солонцы.
Для определения активной кислотности почву заливаю дистиллированной водой, взбалтывают, фильтруют и в полученном растворе с помощью индикатора рН-метра определяют рН.
Потенциальная кислотность подразделяется на обменную и гидролитическую. Она обусловлена содержанием ионов водорода и алюминия, находящихся в поглощенном состоянии.
Обменная кислотность обусловлена содержанием поглощенных ионов водорода, которые могут быть вытеснены из ППК раствором нейтральной соли КСl. Также её создают поглощенные ионы алюминия, которые вытесняются из ППК катионами нейтральной соли и переходят в раствор.
Обменная кислотность сильно выражена в кислых подзолистых и дерново-подзолистых почвах, а в нейтральных и щелочных почвах она не проявляется.
Гидролитическая кислотность зависит от содержания как обменных, так и прочносвязанных ионов водорода. Для определения гидролитической кислотности почву обрабатывают ацетатом натрия.
ДОЗА ИЗВЕСТИ=1.5НГ Hг-гидролитическая кислотность(сумма ионов водорода)
Виды сырья для понижения кислотности -?катионы кальция магния повышают плодородие почв,нейтрализуют кислую реакцию и создают цельную структуру. Катионы водорода разрушают структуру и повышают кислотность почв. Катиона натрия повышают щелочность.
studfiles.net
Определение кислотности
Кислотность водного раствора обусловлена наличие в нем положительных водородных ионов Н+ и оценивается концентрацией в 1 литре раствора C(H+) (моль/л или г/л). В абсолютно чистой воде концентрации ионов Н+ и ОН– равны и раствор нейтрален. В кислых растворах преобладают ионы Н+, в щелочных – ионы ОН–, однако их произведение в любых условиях постоянно. Следовательно, увеличение концентрации одного типа ионов приводит к уменьшению концентрации другого типа в том же количестве. На практике степень кислотности (или щелочности) раствора выражается водородным показателем рН (от латинского «пундус гидрогениум» — вес водорода), представляющим собой отрицательный десятичный логарифм молярной концентрации водородных ионов рН = –lgC(H+). Эта величина может изменяться в небольших пределах – всего от –1 до 15 (а чаще – от 0 до 14). При этом изменению концентрации ионов Н+ в 10 раз соответствует изменение рН на одну единицу. Таким образом, концентрация водородных ионов в среде с рН = 5 в 10, 100 и 1000 раз выше, чем в среде с рН = 6, 7 и 8 соответственно.
Кислыми называют растворы, в которых рН 7, и, чем ближе это значение к 14, тем раствор считается более щелочным. Установленная шкала кислотности идет от рН = 0 (крайне высокая кислотность) до рН = 14 (крайне высокая щелочность). Нейтральная среда имеет показатель ph, равный 7 (при комнатной температуре).
Показатель рН непосредственно влияет на нормальное протекание всех биохимических процессов у живых организмов. Очень важно, чтобы все процессы проходили при строго заданной кислотности. В частности, это необходимо для нормального функционирования биологических катализаторов – ферментов (при выходе за эти пределы их активность может резко снижаться). В клетках организма рН имеет значение около 7, во внеклеточной жидкости – 7,4. Наиболее чувствительны к изменению ph нервные окончания, которые находятся вне клеток. Кроме того, организм использует данное изменение ph в сигнальных целях: при механических или термических повреждениях тканей стенки клеток разрушаются и их содержимое попадает на нервные окончания. Было доказано, что боль вызывают именно катионы водорода, причем с уменьшением рН раствора боль усиливается, – и это лишь частный пример роли ph для живых организмов. Для примера, чистая природная, в частности дождевая, вода в отсутствие загрязнителей тем не менее имеет слабокислую реакцию (рН = 5,6), поскольку в ней легко растворяется углекислый газ с образованием слабой угольной кислоты.
Для определения степени кислотности используют специальные приборы – рН-метры, которые бывают весьма недешевы. Такие приборы измеряют электрический потенциал специального электрода (ЭДС), погруженного в раствор, и этот потенциал зависит от концентрации ионов водорода в растворе, и весьма вероятно измерить его с высокой точностью.
Простым способом определения характера среды является применение индикаторов – химических веществ, окраска которых изменяется в зависимости от рН среды. Наиболее распространенные индикаторы – фенолфталеин, метилоранж, лакмус. Метиловый оранжевый при рН 4,4 – желтый; лакмус при рН 8 – синий и т.д. В домашних условия без наличия этих индикаторов для определения кислотности среды вполне пригодны естественные красители из красной капусты и черной смородины.
Приборы для измерения водородного показателя (рН метры):
www.ecounit.ru
Измерение показателя степени кислотности среды (pH)
pH фактор – это измерение относительной кислотности или щелочности раствора. Значение рН 7 считается нейтральным раствором, кислые растворы имеют значения ниже 7, а щелочные – выше 7. Значение рН может быть измерено pH-метром, переносным pH-метром или с помощью лакмусовой бумажки. Измерение pH фактора обеспечивает числовое обозначение относительной кислотности или щелочности, что является важным параметром в контроле раствора.
Для того, чтобы раствор выполнял свои функции как необходимо, должен быть известен желаемый pH фактор, и раствором тогда можно управлять. Для иллюстрации рассмотрим производство желе. Для превращения фруктов в желе смесь должна быть немного кислой. При pH ниже 2,6 смесь не будет превращаться в желе; при значении 2:6 образуется белый осадок, и желе не имеет рыночного вида; при значении 2,8 происходит отделение капелек воды от смеси; при значении 3,1 смесь образует желе максимальной консистенции; при значении 3,2 образуется желе средней консистенции, а при 3,3 желе будет жидким. При значении рН выше 3,5 желе из смеси вообще не получиться.
Так в пределах нескольких десятых частей pH фактора желе из смеси не образуется, затем получается максимальная консистенция, потом желе опять не получается. Данный пример иллюстрирует важность жесткого контроля pH фактора раствора.
Есть широкий диапазон кислот, от серной кислоты, которая может растворять металл до борной кислоты, которая годится для промывки глаз. Все кислоты образуют в растворе ионы водорода (H+). Степень кислотности – это числовое обозначение концентрации ионов водорода. Выражаясь языком химии, числовые обозначения концентраций ионов водорода представляют собой обычно чрезвычайно малые фракции, например, 1/10 000 000. Масштаб pH фактора был разработан, чтобы избежать использования таких неудобных чисел. Масштаб pH фактора определен математически как отрицательный логарифм концентрации ионов водорода или степени, в которую должна быть возведена 10, чтобы равняться концентрации ионов водорода. Название рН происходит от термина «степень водорода». Математическое выражение предоставляет нам удобный масштаб от 0 для кислого раствора удельной прочности до 7 для нейтрального раствора чистой воды.
Щелочи обязаны своей щелочностью гидроксильным ионам (ОН-), которые они образуют в растворе. Щелочность может быть измерена в том же самом масштабе, как и кислотность, от 7 до 14.
Проще говоря, любое число ниже 7,0 – это кислота и при каждой единице уменьшения этого значения увеличивается интенсивность (ионная концентрация H+) кислоты на фактор 10Х. Любое число выше 7,0 считается щелочью, и на каждую единицу увеличения этого значения увеличивается интенсивность (ионная концентрация ОН-) щелочи на фактор 10Х. В растворе, где присутствует одинаковое количество ионов Н+ и ионов ОН-, pH фактор равняется 7,0.
Водопроводная вода может быть немного щелочной вследствие добавок каустической соды, чтобы сделать воду более приятной для питья. Надлежащее измерение и регулирование воды имеют существенное значение в процессе предварительной обработки. Для обеспечения точности измерений рН-метр должен быть должным образом откалиброван.
Калибровка одноточечным методом описана ниже.
1) Подключите электрод pH к прибору и снимите защитный колпачок с электрода.
2) Промойте электрод pH дистиллированной водой и погрузите его в буферный раствор 7,00.*
3) Включите прибор, установив трехпозиционный переключатель в положение ON (включено).
4) Установите температурный контроль прибора на температуру буферного раствора (используйте термометр Tru GT 100R или другой подходящий термометр, чтобы измерить температуру буферного раствора).
5) Отрегулируйте контроль стандартизации для считывания значения, соответствующего температуре буферного раствора. Буферные значения приводятся в Таблице 1.
6) Достаньте электрод из буферного раствора и промойте дистиллированной водой.
Прибор измерения pH теперь откалиброван и готов к применению.
Кнопка регулирования температуры на приборе должна устанавливаться на температуру раствора, значение рН которого измеряется.
Нельзя допустить высыхание электрода. Если он не используется, электрод должен быть погружен в буферный раствор. Электрод не должен использоваться в растворах с температурой выше 140°Ф (60°C) и должен быть защищен от замораживания. Электрод должен промываться дистиллированной водой до перенесения в буферный раствор из измеряемого раствора. Влагу с электрода необходимо стряхивать, чтобы уменьшить загрязнение раствора при перенесении электрода из одного раствора в другой.
Если на наконечнике электрода образовалась пленочное покрытие, пробуйте удалить его, активно мешая в моющем растворе или опыляя его из баллончика. Если это не сработает, и прибор медленно или неправильно реагирует, можно аккуратно очистить стеклянный сосуд мягкой щеткой. Если и это не даст результата, замените сосуд или прибор.
Значения рН буферных растворов следует периодически проверять, сравнивая их со значениями в свежих буферных растворах. Замените раствор, когда разница значений рН будет достигать 0,1 или больше.
vseokraskah.net
pH чайного гриба или степень кислотности
Помимо полезных свойств, напиток чайного гриба обладает и высокими вкусовыми качествами. Но как определить, что напиток созрел и его уже можно пить?
Можно, конечно, периодически пробовать его на вкус, но лучше отталкиваться от Химико-физических показателей.
В процессе приготовления чайного гриба необходимо контролировать уровень кислотности напитка, по крайней мере, дважды.
В начале, когда вы только приготовили раствор подслащённого чая и, в конце процесса ферментации, когда напиток созрел и готов к употреблению.
Обычно степень кислотности подслащённого чая находится на уровне pH=5, что, на ранних стадиях ферментации, является недостаточным для предотвращения возможного заражения гриба сторонними микроорганизмами, в частности плесенью. Поэтому рекомендуется всегда в новый раствор добавлять до 10% жидкости из предыдущей партии. Это позволит довести pH до необходимого уровня pH=4.5 – 4.6. Если степень кислотности выше, чем 4.6, необходимо ещё добавить жидкости из предыдущей партии до достижения необходимого значения.
Это даст гарантию, что свежий раствор чая достаточно кислый, чтобы бороться с любыми инородными формами. Особенно важна и необходима данная процедура для молодого и тонкого гриба, которому необходимо больше времени для формирования “безопасного” pH раствора.
В конце ферментационного периода, по прошествию от 7 до 14 дней, необходимо во второй раз проверить pH чтобы убедится, что напиток чайного гриба готов к употреблению. Готовый напиток комбуча имеет уровень кислотности близкий до pH=3 (в диапазоне от 3,2 до 2,8 рН).
Если pH будет выше, то гриб необходимо оставить ещё на некоторое время для завершения полного цикла созревания.
| pH=4.5 (вначале приготовления комбучи) |
pH=2.8 – 3.2 (напиток комбуча готов к употреблению) |
Конечно, многое зависит от ваших собственных вкусовых предпочтений. И вы, естественно, можете самостоятельно определить для себя наиболее оптимальную кислотность напитка.
Ниже приведена сравнительная таблица pH на разных стадиях приготовления комбучи.
| Уровень pH |
pH питьевой воды |
Охлаждённый подслащённый чай |
Чай с добавлением “закваски”(10%) | Напиток готовый к употреблению | pH уксусной кислоты |
|
2.0 pH |
* | ||||
|
2.5 pH |
|||||
|
2.8 – 3.2 |
* | ||||
|
3.5 pH |
|||||
|
4.0 pH |
* | ||||
|
4.5 pH |
* | ||||
|
5.0 pH |
* | ||||
|
6.5–8.0 |
* |
Справочно:
pH – водородный показатель, характеризующий концентрацию свободных ионов водорода в воде.
Это определение было введено в 1909 году датским химиком Сёренсеном. Для удобства отображения был введен специальный показатель, названный pH (potentia hydrogeni).
Величина рН определяется количественным соотношением в воде ионов Н+ и ОН-, образующихся при диссоциации воды. Если в воде пониженное содержание свободных ионов водорода (рН>7) по сравнению с ионами ОН-, то вода будет иметь щелочную реакцию, а при повышенном содержании ионов Н+ (рН<7) – кислую. В чистой дистиллированной воде эти ионы будут уравновешивать друг друга. Следовательно вода нейтральна и имеет рН=7.
При растворении в воде различных химических веществ этот баланс может быть нарушен, что приводит к изменению уровня рН.
Часто показатель рН путают с кислотностью и щелочностью жидкости. Разница заключается в том, что рН – это показатель интенсивности, но не количества. То есть, рН отражает степень кислотности или щелочности среды, в то время как определение кислотности и щелочности характеризует количественное содержание в жидкости веществ, способных нейтрализовать соответственно щелочи и кислоты. В качестве аналогии можно привести пример с температурой, которая характеризует степень нагрева вещества, но не количество тепла. Например, опустив руку в воду, мы можем сказать какая вода – холодная или теплая, но при этом не сможем определить сколько в ней тепла.
Конечно, не у каждого дома есть индикаторы pH. И если за рубежом для владельцев чайного гриба продаются специальные pH тест-полоски, то на наших просторах приходится выкручиваться самостоятельно. Хотя в последнее время в продаже стали появляться портативные приборы для измерения PH, так называемые pH-тестеры.
P.S. Соблюдая несложные правила ухода за чайным грибом, вы на долгие годы сможете обеспечить себя настоящим эликсиром здоровья и бодрости.
combucha.ru
норма, признаки повышенной и пониженной кислотности
Существуют определенная норма кислотности желудка для человека. При отклонении этого показателя в большую или меньшую сторону развиваются патологии ЖКТ, которые могут привести к язве и гастриту. При возникновении признаков повышенной или пониженной кислотности больному следует немедленно посетить специалиста для диагностики проблемы и составления схемы лечения.
Что такое кислотность желудка
Показатель определяется концентрацией соляной кислоты в составе желудочного сока и измеряется в рН единицах. Как отклонение показателя от нормативных значений влияет на организм?
Чтобы пища полноценно переваривалась, необходим фермент пепсин, продуцирующийся в кислой среде. Для усваивания еды кишечником нужна дальнейшая нейтрализация соляной кислоты. По этой причине в органах пищеварения имеются несколько зон: одна отвечает за продуцирование кислоты, а другая – за ее нейтрализацию. Любые патологии в функционировании органов ЖКТ приводят к нарушению процесса пищеварения.
Париетальные клетки отвечают за выработку соляной кислоты для желудка. При увеличении количества или отмирании этих структур развивается гастрит с пониженной или пониженной рН средой. В первом случае проблема может повлечь за собой рак желудка, во втором – развитие язвы. По этой причине пациент должен знать о первых симптомах, сопутствующих повышению или понижению кислотности в желудке, чтобы вовремя посетить специалиста.
Признаки пониженной кислотности желудка
Пониженная рH среда в органе пищеварения становится причиной плохого усвоения пищи и брожения в кишечнике. Больной, помимо боли в животе, отмечает у себя следующие признаки:
- гнилостный запах изо рта;
- проблемную дефекацию;
- частую отрыжку;
- сухость кожи и волос;
- ухудшение аппетита;
- слабость;
- метеоризм;
- не переваренные элементы в каловых массах;
- металлический привкус во рту;
- стоматит на языке и язвы в уголках рта;
- выпадение волос;
- снижение веса.
После приема пищи наблюдаются другие симптомы пониженной кислотности:
- тяжесть в животе;
- спазмы в кишечнике;
- чувство распирания в брюшной полости;
- повышенное слюноотделение;
- плохое самочувствие после потребления молока.
Из-за давления не переваренных комков еды на слизистые органов ЖКТ возникает изжога. Пациентам с патологией трудно заставить себя поесть из-за постоянных болей в животе.
Признаки повышенной кислотности желудка
Пациенты, страдающие от патологии, отмечают у себя ряд симптомов:
- одышку;
- головную боль;
- ломоту в суставах;
- постоянную изжогу;
- непрекращающееся чувство голода;
- повышенную возбудимость;
- ноющие боли под ложечкой;
- отрыжку с привкусом кислоты.
Нормы показателя
Показатель кислотности желудка в норме составляет от 0,86-8,3 рН. Нейтральное значение кислотной среды – 7 рН. При превышении этого значения в желудке формируется щелочная среда, при понижении – кислотная.
Значения кислотности меняются в зависимости от отдела желудка. Нормативные значения для каждой зоны представлены в таблице.
Отдел желудка | Нормативные значения (рН) | Усредненные показатели (рН) |
Озерцо | 0,8-2,2 | 1,45-1,47 |
Свод | 0,9-4,5 | 1,5-2,4 |
Передний отдел 12-персной кишки | 5,7-7,9 | 6,3-6,8 |
Задняя стенка | 1,1-1,9 | 1,1-1,3 |
| Передняя стенка | 0,9-1,3 | 1,1-1,2 |
Важно! Эти показатели отмечаются у человека, не страдающего от структурных изменений стенок желудка.
Только врач может определить кислотность желудка. Как проходит обследование? Существуют 2 метода диагностики проблемы:
- Аспирация при помощи зонда. Во время обследования больной глотает зонд, один конец которого попадает в кишечник и желудок, а второй – остается снаружи в ротовой полости. Шприцем отсасывается кислота в различных областях органа пищеварения. Полученные данные отправляют в лабораторию для дальнейшего исследования. У метода имеется только один недостаток – возможные погрешности результатов из-за перемешивания сока в разных функциональных зонах.
- Желудочная рН-метрия – самая точная методика определения кислотности. В органы ЖКТ вводят специальные датчики, которые оценивают показатель внутри человеческого организма. Недостаток методики – невозможность определения количества вырабатываемой соляной кислоты.
Методы восстановления кислотности
Борьба с патологией при повышенной кислотности включает в себя диетотерапию и прием медикаментов. Таблица разрешенных и запрещенных продуктов представлена ниже.
Включить в рацион | Исключить из рациона |
|
|
Среди лекарств, назначаемых при повышенной кислотности, следует выделить:
- Всасывающиеся и не всасывающиеся антациды. Препараты первой группы состоят из магния, кальция и солей натрия. Вещества вступают в реакцию с кислотой и нейтрализуют ее. После лекарств наблюдается снижение болевых симптомов до следующего приема пищи. Не всасывающиеся антациды обладают адсорбирующим эффектом – Фосфалюгель, Рукацид, Алмагель.
- Ингибиторы протонной помпы – Омепрозол, Лансопрозол. Поддерживают кислотный баланс на уровне, при котором происходит восстановление поврежденных стенок органа. При длительном приеме ИПП возрастает риск заражения хеликобактером.
- Гастропротекторы. Образуют клейкую слизь в желудке, которая предотвращает повреждение его структур от соляной кислоты. Терапия длится от 4-8 недель.
Важно! Не следует часто прибегать к соде для снижения кислотности. Продукт может стать причиной нарушения кислотно-щелочного баланса в организме.
Повысить концентрацию соляной кислоты в желудке также возможно при помощи диетического питания и медикаментозной терапии. Диета подразумевает 4-5-разовое питание. В рацион при патологии включают фрукты и овощи, содержащие аскорбиновую кислоту:
- квашеную капусту;
- черный хлеб;
- бобы;
- кисломолочные продукты;
- отварную рыбу и мясо;
- каши: пшеничную, гречневую, рисовую;
- минеральную воду.
Из меню полностью исключаются:
- специи;
- жирные блюда;
- углеводные продукты.
Как восстановить секрецию желудочного сока при помощи препаратов? С этой целью назначают:
- Лекарства, содержащие ферменты желудочного сока, – соляную кислоту, пептины – Панзинорм, Креон, Фестал.
- Витамины группы В.
- Стимуляторы секреции. Активируют выработку соляной кислоты в органе пищеварения – Цитохром, Лимонтар.
- Спазмолитики. Снижают интенсивность болевых симптомов при заболевании – Спазмалгон, Нош-па. Папаверин.
- Антимикробные препараты.
Антисекреторные и антацидные средства назначаются, только если кислотность повышена. Несмотря на то, что признаки повышенной и пониженной кислотности схожи, терапия осуществляется по разным схемам.
Восстанавливать секреторную функцию желудка необходимо с соблюдением профилактических правил:
- отказа от курения;
- минимизации стресса;
- своевременного лечения патологий органов ЖКТ;
- восстановления режима труда и отдыха;
- проведения физиотерапевтических процедур.
Лечение повышенной и пониженной кислотности проходит под контролем гастроэнтеролога. Несмотря на общие симптомы, терапия заболевания проходит разными способами. Неправильно подобранные медикаменты могут усугубить ситуацию и привести к опасным осложнениям – язве, раку желудка и т.д.
gastrodok.com
Определение кислотности
Производство алкоголя
Кислотность (щелочность) растворов выражают в единицах водородного показателя рН или градусах. В основу выражения кислотности (щелочности) растворов в единицах рН положено следующее. При растворении в воде кислот или щелочей их молекулы диссоциируют (распадаются) на ионы, в силу чего химические реакции в таких растворах происходят фактически между ионами. Например, в водном растворе гидроксида натрия или хлороводорода молекулы NaOH и НС1 диссоциируют, что схематически представляется равновесными уравнениями
NaOH = Na+ + ОН-,
Неї = Н+ + С1~.
Однако в водном растворе степень диссоциации (доля распавшихся моЛекул) различных веществ различна. В частности, если молекулы NaOH и НС1 в водном растворе диссоциируют полностью,_то чистая вода лишь незначительно диссоциирует на ионы Н и ОН. Диссоциация молекул воды схематически представляется уравнением
Н2о = Н+ + ОН-,
Из которого следует, что в чистой воде, то есть такой, где нет других веществ и в которой ионы Н и ОН” могут образовываться только в результату диссоциации ее молекул согласно приведенному уравнению, число ионов Н и ОН” должно быть одинаково. Опыт показывает, что при 25 С в 1 л чистой воды содержится 1×10″ моль ионов Н и 1 х 10″ моль ионов ОН” и что произведение их концентрация постоянно и_равно Сн х Сон” = 1 х Ю-1 моль2/л2.
В разбавленных водных растворах кислот и щелочей молярные концентрации ионов Н+ и ОН” не обязательно равны 1 х 1 О”7 моль/л, однако они взаимосвязаны и при 2 5 °С их произведение всегда равно 1 х 10″14 моль2/л2. Поэтому, зная концентрацию одного из них, всегда можно вычислить концентрацию другого.
, в них Сн. моль/л. В |
В кислых растворах преобладают ионы Н+, следовательно, в них Сн, > 1 х 10-7 моль/л и, соответсвенно, Спн_ < 1 х Ю-? моль/л. В
? I X і и ‘ моль/л и, соответсвенно, V-QH____________ ч 1 X 1 и ‘
Щелочных растворах преобладают ионы ОН-, следовательно < 1 х 10″‘ моль/л и, соответственно, СОН > 1 X 10″7 нейтральной среде = Cqh_ = 10″7 моль/л. Поскольку числа со степенями не удобны для записи, вместо них используют водородный показатель рН, равный отрицательному десятичному логарифму чис- лового значения молярной Концентрации ионов водорода, выраженной в моль/л: рН = — Loq(CH+).
Пример. В растворе концентрация Сн+равна 1 х 10″4 моль/л. Тогда рН – — Loq(CH ) Loq(l х 10″4) – 4.
До этого времени мы говорили о чистой воде. Что же произойдет, если к ней прибавить в незначительном количестве кислоту или щелочь? Предположим, что в чистой воде мы растворили NaOH. Тогда его частицы, диссоциируя, добавят в раствор определенное число групп ОН~”. Поскольку произведение концентраций ионов Н+ и ОН~ должно быть постоянно, растворение NaOH приведет к понижению числа ионов
Н+, то есть к понижению кислотности раствора.
Пример. В чистой воде растворили один моль NaOH и получили 1 л раствора с CNaOH – 1 моль/л, что соответствует СОН” – 1 моль/л. (Фактически концентрация ОН” будет большей на величину Сон – – 1 х 10″ моль/л, имевшихся до растворения NaOH в чистой воде, которыми £южно пренебречь). Необходимо определить Сн+ такого раствора. Поскольку Сн х Сон” -1×10″ моль /л, то Сн+ х 1 моль/л – 1 х 10″ моль /л или СН+ – 1х10″14 моль/л, и полученный раствор будет иметь сильно выраженные щелочные свойства.
Предположим, что мы растворили НС1 в чистой воде. Молекулы НС1, диссоциируя, добавят в раствор дополнительное число ионов Н+, что приведет к понижению числа ионов ОН~, то есть к повышению кислотности раствора.
Пример. В чистой воде растворили орин моль НС1 и получили 1 л раствора с Сна – 1 моль/л, что соответствует Сн – 1 моль/л. Числом собственных ионов Н+ в воде можно пренебречь. Определим Сон” такого раствора. Так как CH+ х Сон – 1 X 10 моль /л, то 1 моль/л х Сон” – 1 х 10″ 4 моль /л, или Сон” – 1 х 10″ моль/л и полученный раствор будет иметь сильно выраженные киислотные свойства.
^Зй^Щй: Ії Важнейшие | Кислотно-іцелочньїе индикаторы [411 | |
Индикатор | Интервал рН перехода окраски | Изменение окраски 1 |
Ализариновый желтый | 10,1 — 12,0 | Желтая на красно-оранжевую |
Тимолфталеии | 9,3 — 10,5 | Бесцветная на синюю |
Фенолфталеин | 8,2 — 10,0 | Бесцветная на красную |
Крезоловый красный | 7,2 — 8,8 | Желтая на пурпурную |
Бромтимоловый синий | 6,0 — 7,6 | Желтая на синюю |
Лакмус | 5,0 — 8,0 | Красная на синюю |
Метиловый красный | 4,4 — 6,2 | Красная на желтую |
Метиловый оранжевый | 3,0 — 4,4 | Красная на желтую |
Тропеолин ОО | 1,3 — 3,0 | Красная па желтую |
Тимоловый синий 1-й переход | 2-й переход | 1,2 — 2,8 8,0 — 9,6 | Красная на желтую Желтая на, синюю |
Обычно в водных растворах СН+ и СОН-” меньше или равно 0,1, моль/л и поэтому с учетом их взаимосвязи в таких растворах рН имеет значения от 1 до 13. Величина рН используется как мера кислотности, щелочности или нейтральности раствора: для кислой среды рН меньше 7 (рН < 7), для щелочной среды рН больше 7 (рН > 7), для нейтральной среды рН = 7.
Точно определить значения рН растворов можно только с помощью специальной аппаратуры. Оценку значений рН производят с помощью кислотно-щелочных индикаторов — веществ, которые резко изменяют свою окраску в определенной области значения рН. Некоторые из кислотно-щелочных индикаторов приведены в табл. 1.
На старых русских винокуренных заводах, не использовавших перегретый пар, разваривание картофеля осуществлялось либо обычной варкой его в воде, либо паром с температурой, не превышающей 100°С. При этом в варочных котлах …
Очистка спирта путем дистилляции и ректификации относится к горячим методам очистки. В основе ее лежат физические явления испарения и конденсации. Наряду с этими методами очистки, начиная с XVI — XVII …
Дорош А. К., Лисенко B. C В русском языке до начала XX в. не было слова “самогон” в указанном выше значении. Термин появился в южных и юго-восточных губерниях России, на …
msd.com.ua
