Язва дпк симптомы: Лечение язвы двенадцатиперстной кишки в Екатеринбурге
ABC-медицина
Язва двенадцатиперстной кишки является хроническим заболеванием рецидивирующего характера, которое проявляется в виде ранки, расположенной в стенке пораженного органа. Язва двенадцатиперстной кишки, симптомы которой развиваются преимущественно на фоне заражения бактерией Helicobacter Pylori, обладает склонностью к прогрессированию, что приводит к включению в патологические процессы желудка и иных органов пищеварительной системы.
Причины
Helicobacter Pylori. Язва двенадцатиперстной кишки в большинстве случаев развивается на фоне поражения организма бактерией Helicobacter Pylori. В числе особенностей процессов ее жизнедеятельности можно выделить выработку веществ, повреждающих слизистую желудка и двенадцатиперстной кишки, а также выработку аммиака, приводящего к повышенному выделению соляной кислоты.
Регулярный прием НПВС. Развитие данного заболевания может быть вызвано регулярным употреблением противовоспалительных медпрепаратов нестероидной группы, например диклофенака, ибупрофена, ацетилсалициловой кислоты (аспирина) и пр.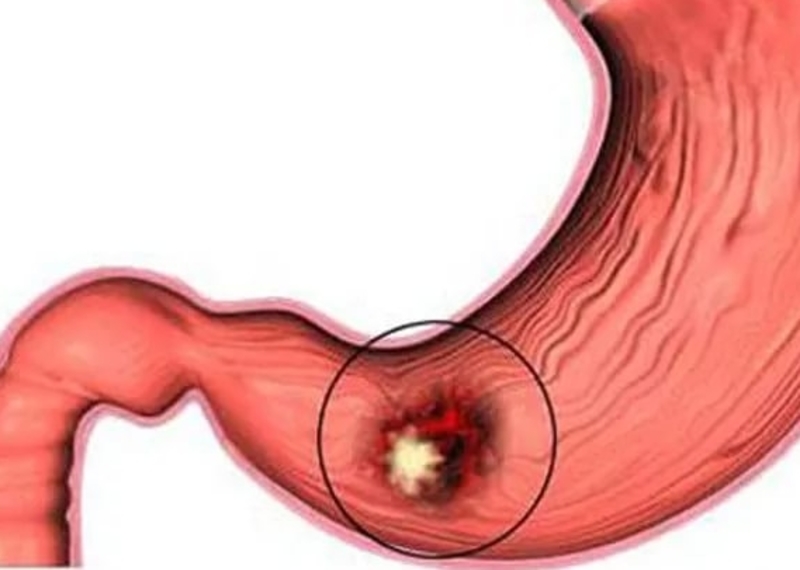
Неправильный образ жизни. В числе факторов, способствующих развитию язвенной болезни двенадцатиперстной кишки, можно выделить злоупотребление алкоголем, курение, неправильное питание.
Наследственность. Одной из возможных причин язвы 12-перстной кишки является наследственность. Статистические данные указывают на то, что наличие у одного из родителей язвы на 40 % определяет ее возникновение у ребенка в будущем.
Виды язв двенадцатиперстной кишки
Язва двенадцатиперстной кишки в острой форме:
- с кровотечением,
- с прободением и кровотечением,
- с прободением,
- без прободения и кровотечения.
Язва двенадцатиперстной кишки в хронической форме:
- неуточненная с прободением,
- неуточненная с кровотечением,
- неуточненная с прободением и кровотечением,
- без прободения и кровотечения.

Симптомы
Болевые ощущения в верхней части живота. Они локализованы немного ниже грудины. Этот симптом встречается практически у всех пациентов. Он, как правило, появляется при голоде и прекращается после еды. Болевой синдром может характеризоваться как сильный, пронзительный или ноющий. Боль нередко иррадиирует в сердце или спину. С ночными болями в животе сталкивается до 80 % больных язвой двенадцатиперстной кишки.
Другие симптомы
- Тошнота.
- Метеоризм.
- Отрыжка.
- Вздутие живота.
- Рвота с кровью (признак запущенной язвы).
Нередко болезнь никак себя не проявляет, что говорит о скрытом ее течении. Это чаще всего встречается у пожилых людей.
Диагностика
Эндоскопия. Наиболее распространенный и достоверный метод установления диагноза – эндоскопия. Процедура достаточно неприятна для пациента, однако именно она позволяет врачу получить полную картину состояния внутренних органов больного.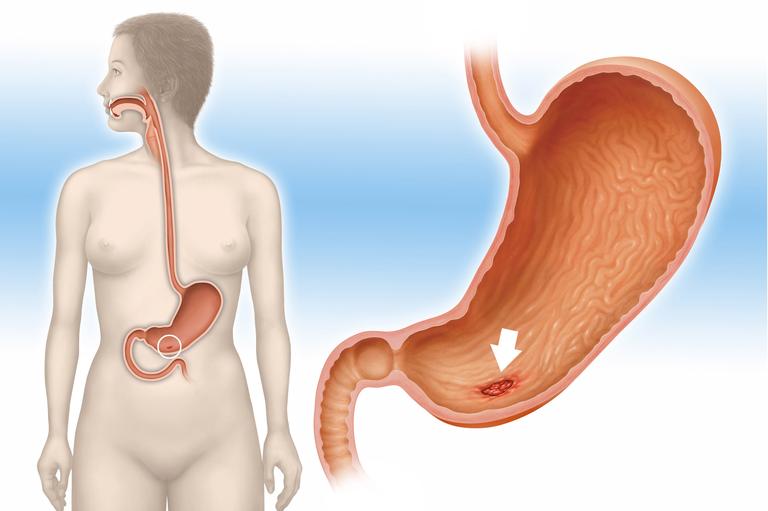
Тесты. Применяются специальные методы тестирования для определения наличия бактерий Helicobacter Pylori. Они предполагают исследование крови, рвотных масс и кала, а также материала, полученного при биопсии.
Рентген. Немаловажную роль в диагностике язвы двенадцатиперстной кишки играет рентгенологическое исследование, которое позволяет дополнить картину заболевания.
Пальпация. Прощупывание соответствующих участков живота является одним из основных методов диагностики язвы.
Лечение
Лечение язвы двенадцатиперстной кишки определяется комплексно в зависимости от общего состояния больного, результатов лабораторных исследований и ряда других условий. Следует отметить, что хирургический метод, который был популярен ранее, на данный момент употребляется реже, только в случае кровотечений или прободных язв. Фармакологическая терапия заключается в уничтожении бактерии Helicobacter Pylori, восстановлении слизистой пораженного органа и недопущении осложнений, вызванных язвой.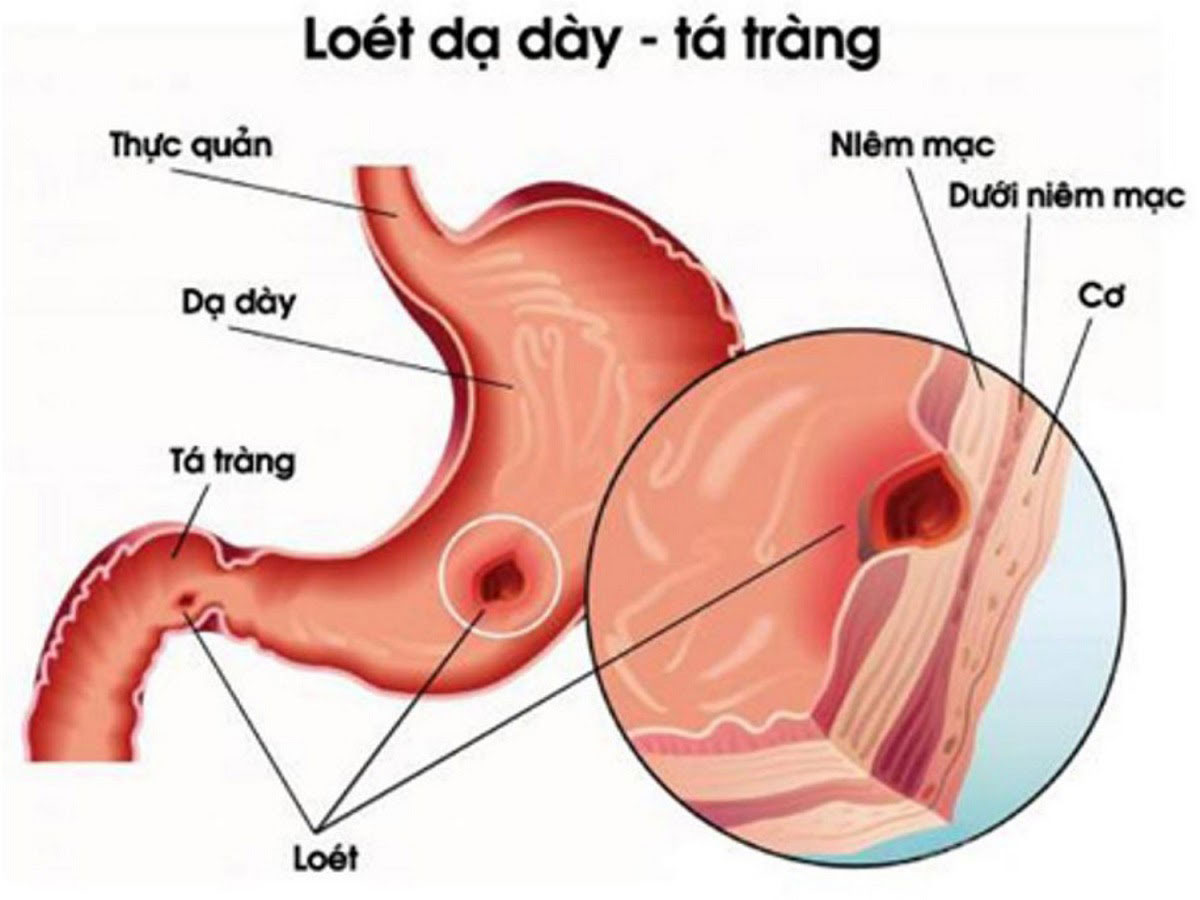
Чтобы записаться в клинику «ABC-Медицина» для диагностики и лечения язвы 12-перстной кишки, позвоните по телефону +7 (495) 223-38-83.
Язва двенадцатиперстной кишки: признаки, симптомы, лечение
Факторы, провоцирующие болезнь
Медицинская статистика свидетельствует, что язва двенадцатиперстной кишки диагностируется у людей среднего и молодого возраста, причем на мужское население приходится больший процент. Связывают это явление с чрезмерным употреблением алкоголя и курением. Также язву двенадцатиперстной кишки провоцирует современный ритм жизни с большим психоэмоциональным напряжением, нервозность, не проходящие стрессовые ситуации. В результате происходит спазмирование сосудов и нарушение нормального питания клеток организма. Под действием кислот и возникают очаги язв в области 12-перстной кишки.
Лидирующее место в списке провоцирующих язву двенадцатиперстной кишки факторов занимают бактерии Хеликобактер. Этот микроорганизм обнаруживается у семи из десяти людей, однако проблемы со здоровьем он вызывает не всегда.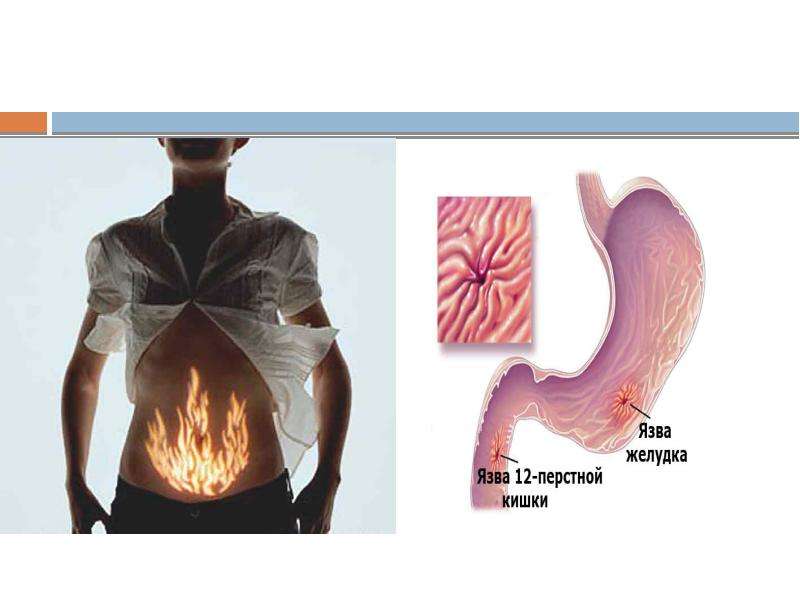 Передается бактерия через общие предметы пользования, медицинский инструмент, слюну и при других тесных контактах. Обзавестись язвой двенадцатиперстной кишки можно и при несоблюдении правил личной гигиены.
Передается бактерия через общие предметы пользования, медицинский инструмент, слюну и при других тесных контактах. Обзавестись язвой двенадцатиперстной кишки можно и при несоблюдении правил личной гигиены.
Язва двенадцатиперстной кишки развивается и на фоне других факторов. К ним относятся:
- генетическая предрасположенность;
- злоупотребление кофе и продуктами с повышенной кислотностью;
- длительные перерывы между приемом пищи;
- применение медикаментов без предписания врача;
- сопутствующие заболевания.
По некоторым данным, ночная работа увеличивает риск возникновения язв в два раза.
Симптоматика заболевания
Главный симптом язвы двенадцатиперстной кишки — болезненность. В периоды ремиссии он может не давать о себе знать, человек чувствует себя комфортно и спокойно. Но во время смены сезонов болезненные симптомы и признаки возвращаются с удвоенной силой. Особенно интенсивно болевые симптомы проявляются после приема пищи и в ночное время. Локализация дискомфортных ощущений наблюдается в области грудины, но может разливаться в верхней части живота. Выраженность зависит от стадии язвы и колеблется от почти не различимой до острой.
Локализация дискомфортных ощущений наблюдается в области грудины, но может разливаться в верхней части живота. Выраженность зависит от стадии язвы и колеблется от почти не различимой до острой.
При язвах двенадцатиперстной кишки у человека наблюдаются следующие симптомы: изжога, отрыжка, вздутие живота, нарушение стула, кал с примесью крови. К признакам язв относятся потеря аппетита и резкое снижение веса. На такие симптомы, как тошнота и рвота, жалуется минимальный процент людей, но они все же имеют место после приема еды. Заметив перечисленные симптомы, стоит записаться к врачу. Не занимайтесь лечением самостоятельно!
Диагностика и лечение болезни
До начала лечения язвы двенадцатиперстной кишки понадобится пройти осмотр и лабораторные исследования. Первичное посещение включает сбор анамнеза и уточнение данных о наследственных заболеваниях. Дальнейшие действия направлены на обнаружение язв в двенадцатиперстной кишке, определение их размеров и локализации.
Диагностика язв двенадцатиперстной кишки будет неполной без определения кислотности желудочных соков, рентгена и других методов установления состояния здоровья.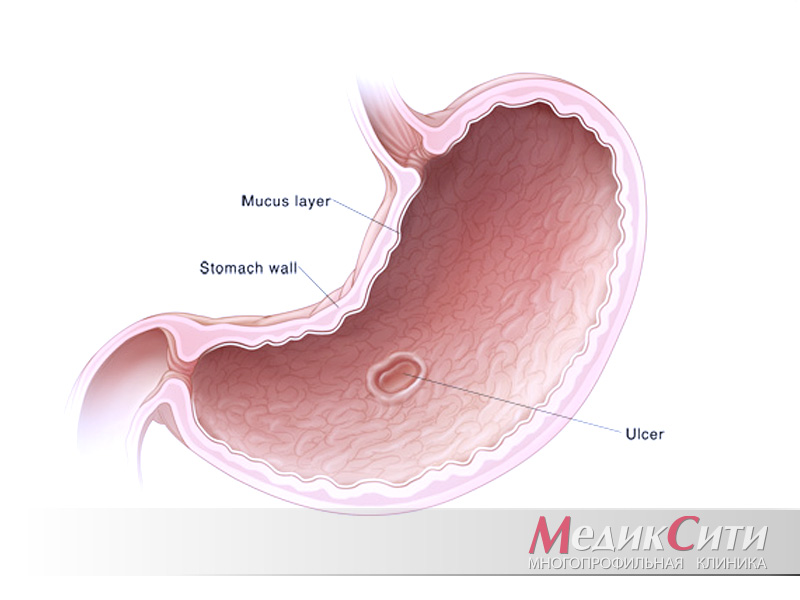
При лечении язв двенадцатиперстной кишки применяется широкий спектр медикаментов. Лечение язв 12-перстной кишки включает:
- антибактериальную терапию;
- прием антибиотиков;
- купирование болевых синдромов;
- снижение кислотности.
При сильном поражении организма лечение язв двенадцатиперстной кишки требует хирургического вмешательства. В этом случае лечение заключается в иссечении части кишок с сильным поражением слизистых.
Осложнения болезни
Лечение язвы двенадцатиперстной кишки сочетает в себе комплекс разных манипуляций и проходит под наблюдением лечащего врача. Самостоятельное лечение и прием медикаментов недопустимо! Подобное лечение язв приводит к затуханию симптомов и переводит болезнь в скрытую вялотекущую форму, грозящую серьезными осложнениями и летальным исходом.
При отсутствии своевременного лечения проблема может прогрессировать, вызывая осложнения. К ним относятся:
К ним относятся:
- кровотечения;
- перфорация кишок;
- сужение кишки;
- стеноз привратника.
Перечисленные осложнения смертельны для человека, поэтому необходимо срочно начинать лечение язв, как только диагноз подтвердился.
Диетический стол и профилактика
Обязательным условием при лечении двенадцатиперстной кишки считается диетический стол. В первую очередь стоит исключить алкоголь и стрессовые ситуации. Убрать из рациона острые, соленые, пряные блюда, заменив их тушеными, отварными или паровыми продуктами, принимать пищу маленькими порциями. В качестве дополнительного метода лечения рекомендуются столовые воды, например, ессентуки.
Разрешенные продукты:
- нежирные молочные продукты;
- каши;
- сухарики и подсушенный хлеб;
- легкие супы;
- растительные масла;
- нежирные сорта рыбы и мяса.
Обязательно в схему лечения включен прием медикаментов, прописанных специалистом. Для скорейшего выздоровления рекомендуется выполнять все предписания врача, не забывать чередовать отдых и работу. Схемы лечения и диетический стол может отличаться в некоторых случаях, поэтому стоит обсудить прием пищи со специалистом.
Для скорейшего выздоровления рекомендуется выполнять все предписания врача, не забывать чередовать отдых и работу. Схемы лечения и диетический стол может отличаться в некоторых случаях, поэтому стоит обсудить прием пищи со специалистом.
Любую болезнь легче предотвратить, чем лечить. Мы рекомендуем всем следить за своим питанием и не есть всухомятку. Вести активных образ жизни, избегать стрессовых ситуаций. Отказаться от алкоголя и сигарет, закаляться и регулярно проходить полный медицинский осмотр.
лечение и диагностика симптомов, причин в Москве
Общее описание
Язвенная болезнь желудка и 12-перстной кишки – это хроническое сезонное рецидивирующее заболевание желудка и двенадцатиперсной кишки, проявляющееся дефектом в слизистой оболочке (язвы). Эти нарушения возникают на фоне дестабилизации нервных и гуморальных механизмов в организме человека, которые регулируют секреторно-репаративные процессы в желудке и двенадцатиперстной кишке. Язвеннной болезни свойственны периоды обострения (весна и осень) и ремиссии.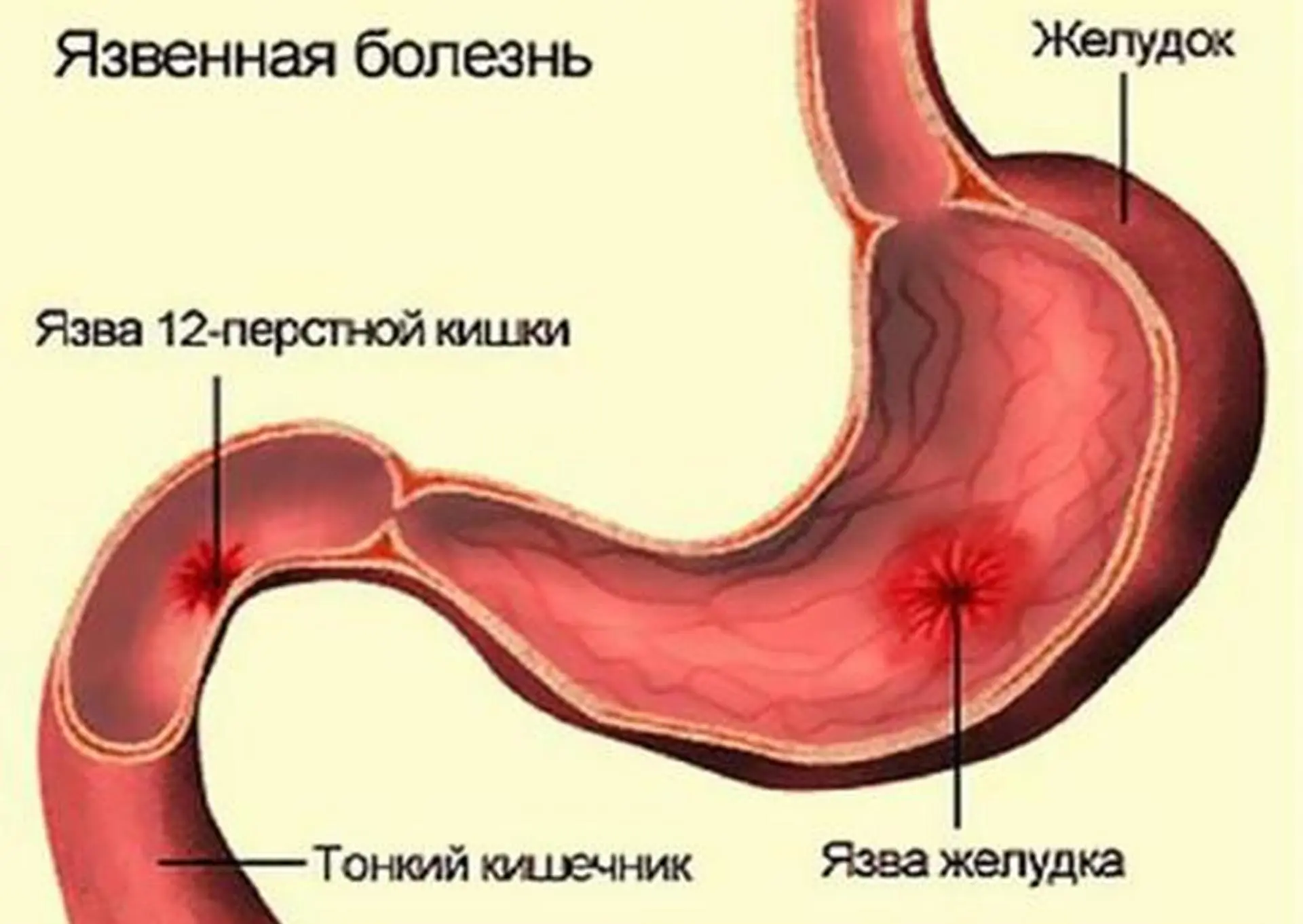 Результат заживления язв – это образование рубца.
Результат заживления язв – это образование рубца.
Распространенность заболевания по всем странам составляет около 4-6% взрослого населения. При полноценном медицинском скрининге пациентов этот процент увеличивается до 20-25%.
Пик заболеваемости приходится на возраст 30-45 лет. Преимущественно у мужчин в возрасте 35-50 лет язвенная болезнь желудка и 12-перстной кишки встречается чаще в 3-4 раза.
Причины возникновения язвенной болезни
- Наличие в желудке и 12-перстной кишки Helicobacter pylori, являющейся основным этиологическим фактором возникновения язв. Влияние других бактерий не доказано
- Нарушение режима питания
- Злоупотребление алкогольными напитками и табакокурением
- Длительный прием препаратов, влияющих на слизистую оболочку желудка, основные: НПВС и глюкокортикостероиды (преднизолон)
- Эмоциональное перенапряжение, стрессы
- Генетическая предрасположенность
- Нарушения обмена веществ
- Гипоавитаминоз
Симптомы язвенной болезни желудка и 12-перстной кишки
- Ноющие или схваткообразные боли, слабоинтенсивные в эпигастральной области, чаще возникают натощак или непосредственно после еды
- Постоянная изжога, особенно в ночные и утренние часы, отрыжка кислым
- Тошнота
- Отрыжка воздухом, кислым или горьким привкусом
- Тяжесть в эпигастральной области после приема пищи, чувство быстрого наполнения желудка
- Снижение аппетита
- При кровотечении из язв появляется рвота “кофейной гущи”, темный стул (мелена)
- При перфорации язв – сильная, кинжальная боль в эпигастральной области, тошнота, рвота, болезненное напряжение мышц живота
Диагностика
- Общий клинический анализ крови, мочи
- Анализ кала на копрограмму
- Анализ кала на скрытую кровь
- Биохимический анализ крови (печеночные пробы, холестерин, щелочная фосфатаза)
- ЭКГ
- Рентгенография органов грудной клетки в 2-х проекциях и рентгенография органов брюшной полости (для исключения перфорации язв)
- Рентгенография пищевода, желудка с бариевой смесью
- УЗИ гепатобилиарной системы
- Суточное мониторирование рН в нижней части пищеводе и желудка
- ЭГДС
- Неинвазивные тесты для определения Helicobacter pylori.
 (дыхательный)
(дыхательный)
Лечение язвенной болезнь желудка и 12-перстной кишки
Основное лечение при хроническом гастрите, состоит из соблюдения здорового образа жизни и правильного рационального питания.
Составляющие здорового образа жизни и правильного рационального питания:
- Отказ от употребления алкогольных, сильногазированных напитков
- Снижение массы тела при ожирении
- Отказ от курения
- Исключение приема пищи в больших количествах и в поздние часы
Если такие методы немедикаментозного лечение не приносят облегчение, применяются лекарственные препараты.
Рекомендуется начинать лечение уже при первых признаков воспаления в желудке.
Применятся следующие препараты:- Прокенетики (способствуют ускорению продвижения пищевого комка от пищевода в желудок, в дальнейшем в двенадцатиперстную кишку, повышение тонуса нижнего пищеводного сфинктера): домперидон (мотилак, мотилиум), итоприд (ганатон)
- Антисекреторные препараты (способствуют подавлению секреции соляной кислоты): ингибиторы протонной помпы (омепразол, пантопразол, эзомепразол, рабепразол)
- Антациды (фосфолюгель, альмагель, гевискон)
При обнаруженной контаминации слизистой оболочки желудка H. pylory применяется схема лечения с антибактериальными препаратами.
pylory применяется схема лечения с антибактериальными препаратами.
Схема лечения подбирается индивидуально в соответствии с состоянием пациента и сопутствующими заболеваниями.
Существует несколько стандартных схем лечения:
- Антибиотики (пенициллиного ряда: амоксицилин, макролиды- кларитромицин)
- Ингибиторы протонной помпы (омепразол, рабепразол, эзомепразол, пантопразол)
- Препараты висмута (новобисмол, де-нол)
Хирургическое лечение проводится по показаниям: осложнения язвенной болезни желудка (кровотечение, пенетрация, перфорация), при частых обострениях, при грубых деформациях желудка и 12-перстной кишки в результате рубцовых изменений со стенозированием просвета.
Перфоративная гастродуоденальная язва – симптомы, современные методы диагностики и лечения
Перфорация, или прободение, язвы желудка и 12-перстной кишки – это прорыв язвы в свободную брюшную полость с поступлением в нее желудочно-дуоденального содержимого. В 75% случаев перфоративная язва располагается в двенадцатиперстной кишке, чаще наблюдается у мужчин в возрасте 20 – 40 лет с кратким язвенным анамнезом (до 3 лет). Иногда перфорация язвы может произойти у людей, которые никогда ранее жалоб на боли в эпигастрии не предъявляли и о наличии у них язвы не знали. В молодом возрасте преобладает перфорация язв двенадцатиперстной кишки, а в среднем и пожилом – язв желудочной локализации. Перфорация язв чаще отмечается осенью и весной.
В 75% случаев перфоративная язва располагается в двенадцатиперстной кишке, чаще наблюдается у мужчин в возрасте 20 – 40 лет с кратким язвенным анамнезом (до 3 лет). Иногда перфорация язвы может произойти у людей, которые никогда ранее жалоб на боли в эпигастрии не предъявляли и о наличии у них язвы не знали. В молодом возрасте преобладает перфорация язв двенадцатиперстной кишки, а в среднем и пожилом – язв желудочной локализации. Перфорация язв чаще отмечается осенью и весной.
Записаться на консультацию перед операцией
Первая консультация бесплатно!
Симптомы перфорации язвы
Основная жалоба при перфорации язвы – боль в верхней половине живота. У большинства больных прободение язв желудка и двенадцатиперстной кишки начинается внезапно, сопровождается резкими болями в животе. Боли бывают настолько сильными, что больные сравнивают их с “ударом кинжала”. Они носят постоянный характер, локализуются вначале в эпигастральной области или в правом подреберье, а затем сравнительно быстро распространяются по всему животу, чаще по правому боковому каналу. У 30-40% больных боли иррадиируют в плечо, лопатку или надключичную область: справа – при перфорации пилородуоденальных язв, слева – язв желудка. При перфорации язвы наблюдаются и общие симптомы: сухость во рту, жажда, тошнота. У 30-40% больных бывает рвота рефлекторного характера, учащающаяся при прогрессировании перитонита.
У 30-40% больных боли иррадиируют в плечо, лопатку или надключичную область: справа – при перфорации пилородуоденальных язв, слева – язв желудка. При перфорации язвы наблюдаются и общие симптомы: сухость во рту, жажда, тошнота. У 30-40% больных бывает рвота рефлекторного характера, учащающаяся при прогрессировании перитонита.
Диагностика
В общем анализе крови наблюдается лейкоцитоз, нейтрофильный сдвиг лейкоцитарной формулы влево.
Обзорная рентгенография живота обнаруживает свободный газ в брюшной полости (пневмоперитонеум). При отсутствии пневмоперитонеума на обзорной рентгенограмме живота в желудок после его опорожнения с помощью зонда вводят 500 – 700 мл воздуха, который частично проходит через перфоративное отверстие в свободную брюшную полость и обнаруживается под диафрагмой.
Также перфорированная язва выявляется с помощью гастроскопии.
Лечение
Больные с перфоративной язвой желудка или двенадцатиперстной кишки подлежат немедленной госпитализации в хирургическое отделение и экстренной операции.
Операции
Возможные варианты операций:
- ушивание язвы однорядным швом в поперечном направлении с аппликацией большим сальником;
- ушивание язвы по Опелю – Поликарпову (с тампонадой перфоративного отверстия прядью большого сальника).
Есть вопросы?
Оставьте телефон –
и мы Вам перезвоним
Наши ведущие специалисты
Преимущества Госпитального центра
Индивидуальная схема лечения для каждого пациента
Для каждого пациента в обязательном порядке, ещё на догоспитальном этапе, разрабатывается индивидуальная схема лечения, с учетом всех особенностей организма: возраста, состояния здоровья, анамнеза заболевания и т.д. – данный подход позволяет минимизировать риски как во время операции, так и в послеоперационном периоде, и как следствие, обеспечить максимально быструю реабилитацию при минимальном сроке нахождения в стационаре.
Мультидисциплинарный подход
Медицинский персонал Госпитального центра представляет собой единую команду, составленную из врачей – экспертов разной специализации, что позволяет осуществлять мультидисциплинарный подход. Мы лечим пациента, видя перед собой не список имеющихся у него заболеваний, а человека, проблемы которого взаимосвязаны и взаимообусловлены. Предпринимаемые лечебные меры всегда направлены на общее улучшение здоровья, самочувствия и качества жизни больного, а не исчерпываются устранением симптомов конкретного заболевания.
Оперативное лечение любого уровня сложности
Оперирующие врачи Госпитального центра владеют передовыми и высокотехнологичными способами выполнения операций. Сочетание высокой квалификации врачей и инновационного оборудования позволяет проводить оперативное лечение самого высокого уровня сложности.
Высокотехнологичные, малоинвазивные методы лечения
Основу методологии лечения, проводимого в Госпитальном центре, составляют принципы минимизации рисков для пациента и максимально быстрой реабилитации.
Осуществление подобного подхода возможно только при использовании самых высокотехнологичных методик, современного оборудования и применения последних достижений медицинской науки.
Квалификация врачей в сочетании с современным оборудованием позволяет нам успешно реализовывать данный подход к лечению.
Fast-track хирургия
Fast-track – это комплексная методика, позволяющая свести к минимуму сроки пребывания пациента в стационаре без ущерба качества лечения.
В основе подхода лежит минимизация хирургической травмы, снижение риска послеоперационных осложнений и ускоренное восстановление после хирургических операций, что обеспечивает нашим пациентам минимальное время пребывания в стационаре.
Даже такие сложные операции, как, например, холецистэктомия, благодаря данному подходу требуют пребывания в стационаре не более 3-х дней.
Персональное врачебное наблюдение в послеоперационном периоде
Для полного исключения развития возможных осложнений ранний послеоперационный период все пациенты, независимо от сложности операции, проводят в отделении реанимации под индивидуальным наблюдением врача-реаниматолога.
Перевод пациента в палату осуществляется только при полном отсутствии даже минимально возможных рисков.
Информирование родственников 24/7
Мы максимально открыты и проявляем заботу не только о пациенте, но и его близких. Информация о состоянии здоровья пациентов предоставляется родственникам семь дней в неделю, 24 часа в сутки.
Посещение пациентов так же возможно в любое удобное время.
Высококомфортабельные одно- и двухместные палаты
К услугам пациентов просторные комфортабельные палаты одно- и двухместного размещения, оборудованные всем необходимым для отдыха и восстановления.
В детском отделении наши маленькие пациенты размещаются совместно с родителями.
Налоговый вычет
Согласно налоговому законодательству РФ каждый пациент имеет право на компенсацию до 13% от суммы, потраченной им на свое лечение, а так же лечение близких родственников.
Наши специалисты подготовят для вас пакет документов для налоговой инспекции на возврат 13% от суммы расходов на лечение, а так же дадут рекомендации по различным способам взаимодействия с налоговой инспекцией.
Контакты
+7 (499) 583-86-76 Москва, улица Бакунинская, дом 1-3
Ближайшая станция метро: Бауманская
Прободная язва – причины и симптомы
Прободная язва – это сквозной дефект стенки желудка или двенадцатиперстной кишки с выходом в брюшную полость или за брюшное пространство.
Причины возникновения заболевания
Прободная язва желудка это серьезнейшее осложнение язвенной болезни. Возникает вследствие обострения язвы, особенно часто в период весенне-осеннего обострения, с последующим возникновением перитонита. Основными причинами его появления могут быть:
• Нарушение лечебного процесса в период обострения язвенной болезни;
• Неправильное питание, особенно переедание;
• Употребление алкоголя;
• Эмоциональное и физическое перенапряжение;
• Физические нагрузки;
• зондирования желудка
Симптомы
При прободении язвы возникает резкая сильная боль в верхней области живота или в подложечной области и продолжается в течение нескольких часов. Боль настолько сильная, что не редко становится причиной шока или обморока. Лицо приобретает землисто-серый оттенок, черты лица становятся заостренными, глаза запавшими. Иногда возникает рвота. Температура тела не меняется или понижается.
Через несколько часов боль может стихнуть. Это кратковременный и коварный период облегчения, после которого боли снова усиливаются и распространяются по всему животу. При этом приступе боли повышается температура тела, учащается пульс. В это период начинает развиваться перитонит. Скорость его развития зависит от наполненности желудка в момент прободения и уровня желудочного сока. Возможно, вам понадобится предварительная подготовка к приему проктолога.
Лечение
Прободная язва желудка опасна своим стремительным развитием. Перитонит возникает в течение 6-12 часов от момента прободения и может привести к летальному исходу. Очень важно при первых проявлениях прободной язвы немедленно госпитализировать больного. Лечение проводится в условиях стационара путем хирургического вмешательства. Целью такого вмешательства является санация брюшной полости и устранение перфорации.
Язвенная болезнь / Заболевания / Клиника ЭКСПЕРТ
Язвенная болезнь – это группа хронических заболеваний, которые проявляются сменой периодов обострения и ремиссии. Отмечается воспалительный процесс и образование язвенных дефектов в слизистой оболочке желудка и/или двенадцатиперстной кишки (ДПК). Как правило, язвенная болезнь носит сезонный характер, период обострения заболевания отмечается в весеннее и осеннее времена года.
Язвенная болезнь достаточно распространена в современном мире. В индустриально-развитых странах встречается 8-10% населения, которые страдают данным недугом. В России за последние 10 лет заболеваемость по язвенной болезни выросла на 38%. Важно заметить, что язвенная болезнь желудка отмечается в популяции старше 40 лет, а язва двенадцатиперстной кишки чаще всего выявляется до 40 лет. Что касается половой принадлежности, то чаще болеют мужчины, чем женщины. Соотношение между женщинами и мужчинами при язве желудка составляет 1:2, а при язве двенадцатиперстной кишки 1:4.
Причины язвенной болезни
Причинными факторами, вызывающие образование язв, являются:
- инфицированность Хеликобактер пилори
- термически, механически, химически «грубая пища», нерегулярное, питание всухомятку
- наследственность
- курение, употребление алкоголя, различных наркотиков
- прием ульцерогенных препаратов
- стрессы
В основе возникновения язвенной болезни лежит нарушение баланса защитных и повреждающих факторов в зоне желудка и двенадцатиперстной кишки.
Защитные факторы:
- защитный барьер из слизи
- адекватное кровообращение
- восстановительная способность клеток желудка
- синтез веществ, которые подавляют и тормозят повреждающие факторы
Повреждающие факторы:
- гиперпродукция соляной кислоты и фермента-пепсина
- инфицированность слизистой оболочки Хеликобактер пилори
- воздействие на слизистую желудка и ДПК желчи, панкреатического сока
- табакокурение, алкоголь
- некоторые медикаментозные препараты
- наследственность
Симптомы язвенной болезни
Болевой синдром
- Язва тела желудка – боль появляется через 1/2ч-1ч после употребления пищи, продолжаются 1-2 часа, а затем стихают. Боли возникают в эпигастральной (подложечной) области и слева.
- Язвы антрального отдела, привратника желудка, а также луковицы ДПК – появляются голодные, ночные, поздние боли. Поздние боли появляются через 2-3 часа после приема пищи. «Голодные» боли – возникают натощак, стихают после употребления небольшого количества пищи. Ночные боли возникают в ранние утренние часы (2-4 ч). Чаще боль возникает в эпигастральной (подложечной) области, справа.
- Язвы кардиального отдела желудка – боль возникает через 10-15 минут или сразу после приема пищи и беспокоит непосредственно в подложечной области.
Диспепсия желудка
- При язвах желудка: изжога, отрыжка кислым, тошнота, отказ от приема пищи.
- При язвах двенадцатиперстной кишки (ДПК): отрыжка, изжога, тошнота реже, рвота кислым.
Кишечная диспепсия
- при язвах желудка: склонность к диарее
- при язвах ДПК: склонность к запорам
Астено-вегетативные проявления
- Появляется при любых локализаций язв: снижение работоспособности, слабость, раздражительность, утомляемость.
Тест риска возникновения язвенной болезни
Потратьте несколько минут, чтобы ответить на приведенные ниже вопросы. Постарайтесь быть честными. Отвечайте на вопросы: «да» или «нет».
- Есть ли у Вас и/или у ваших родственников заболевания желудочно-кишечного тракта?
- У кого-то из ваших родственников обнаруживали Хеликобактер пилори?
- Вы курите?
- Вы соблюдаете режим питания?
- Вас беспокоит изжога, отрыжка кислым, отвращение от еды?
- Замечали ли Вы снижение массы тела в последнее время?
- Беспокоит ли вас дискомфорт или боль в желудке?
- Замечали ли Вы, что ночью просыпаетесь от того, что болит желудок?
- У Вас I группа крови?
- Часто ли Вы принимаете обезболивающие препараты?
- Часто ли Вы находитесь в стрессовых ситуациях?
- Часто ли Вы посещаете места общего питания (фаст-фуд, столовая, кафе, ресторан)?
Результаты теста: Если вы ответили «ДА» хотя бы на 2-3 вопроса, вы подвержены риску заболеваемости по язвенной болезни. Если вы хотите предотвратить прогрессирование заболевания и снизить риск осложнений и инвалидизации, следует обратиться к врачу гастроэнтерологу. Помните, что язвенная болезнь может протекать бессимптомно, как у вас, так и у ваших близких. Прислушайтесь к своему организму, попробуйте проанализировать ваш быт, привычки, питание, а также уровень здоровья в семье. На все возникшие вопросы сможет ответить специалист Клиники ЭКСПЕРТ.
Диагностика язвенной болезни
На первом этапе диагностики врач проводит сбор жалоб и тщательный объективный осмотр. Затем, учитывая все риски заболевания, сопутствующую патологию, врач составляет план индивидуальной диагностики, в который входят лабораторные и инструментальные методы обследования. На сегодняшний день существует множество биохимических показателей, которые помогают не только в диагностике заболеваний желудочно-кишечного тракта, но и в своевременном выявлении возможных осложнений.
Начать обследование также можно с базового скрининга на заболевания желудка.
Прогноз
В случае своевременной диагностики и адекваного комплесного лечения и отсутствия осложнений — прогноз благоприятный.
К сожалению, при несвоевременном обращении к эксперту-гастроэнтерологу в некоторых случаях происходит прогрессирование состояния с возникновением тяжелых жизни угрожающих осложнений, приводящих к инвалидизации, а иногда и к летальному исходу.
Если вовремя не обнаружить язвенную болезнь, то могут развиться следующие серьезные осложнения:
- Кровотечение – достаточно часто встречающееся осложнение язвенной болезни (10-15% ). Язвы дуоденального отдела кровоточат чаще, чем желудочные. Яркая симптоматика кровотечения проявляется в период обострения язвенной болезни и является весьма многоликой. Характерные признаки: кровавая рвота, черный – дегтеобразный стул, постоянная слабость, головокружение, снижается артериальное давление, увеличивается частота пульса. Нужно экстренно обратиться к врачу, так как это состояние урожает жизни человека.
- Прободение (перфорация) язвы бывает в 5-20% случаев. У мужчин встречается в 10-20 раз чаще , чем у женщин. Пациент чувствует «кинжальную», острую боль в области желудка, принимает вынужденное положение(на правом боку или спине, колени приведены к животу). Самочувствие постепенно ухудшается, появляется бледность кожи и слизистых, снижение частоты пульса (брадикардия). Важно отметить и то, что у больных старческого возраста перфорация может протекать без видимых симптомов и без выраженной боли.
- Пенетрация – состояние, когда язва распространяется за границы желудка и ДПК. Наблюдается в 15% случаев. При данном состоянии появляется боль в желудке, при приеме пищи. Также боль может отдавать в спину, в правое подреберье, может носить опоясывающий характер. Локализация боли определяется глубиной повреждения и органом, который вовлечен в процесс.
- Стеноз привратника – у 6-15% больных язвенной болезнью. Клиническая картина зависит от степени выраженности сужения привратника. Появляется тяжесть в желудке после еды, рвота, которая приносит облегчение, периодически возникает отрыжка кислым. При ухудшении состояния появляется дискомфорт и чувство распирания в желудке после употребления небольшого количества пищи, отрыжка тухлым яйцом. Улучшить состояние может только правильное противоязвенное лечение.
- Малигнизация – язва желудка может трансформироваться в злокачественную опухоль. Частота малигнизация колеблется 1 – 38%. У людей старше 60 лет, риск перехода язвенной болезни в рак желудка в 1,4-2 раза чаще, чем у молодых. Клинические проявления колеблются от латентного (скрытого) течения до ярких симптомов болезни. Именно поэтому если вы заподозрили у себя даже минимальные признаки заболевания желудка, обратитесь к врачу-эксперту, чтобы своевременно выявить риски осложнений, повысить качество жизни и избежать летальных исходов.
Лечение
Лечение язвенной болезни должно быть комплексным, с учетом этиологического фактора заболевания. В зависимости от области, глубины поражения и сопутствующих осложнений выделяют консервативное (медикаментозное) и хирургическое лечение.
Медикаментозное лечение подбирается индивидуально, основываясь на этиологических факторах и сопутствующей патологии. Врач, приступая к медикаментозному лечению пациента, должен проследить и за тем, какие препараты больной использует в повседневной жизни. Специалисты Клиники ЭКСПЕРТ всегда подбирают эффективную терапию, учитывая индивидуальную чувствительность и особенность каждого пациента, используют препараты нового уровня и поколения.
Профилактика и рекомендации
Необходимо исключить те факторы, которые приводят к развитию язвенной болезни и отслеживать состояние здоровья при наличии наследственной предрасположенности, даже если вас ничего не беспокоит.
Факторы риска развития язвенной болезни:
- инфицированность Хеликобактер пилори
- наследственная предрасположенность
- группа крови I (0)
- вредные привычки (табакокурение, употребление алкоголя и его суррогатов)
- повышенная кислотность желудка
- нарушение условий труда и отдыха, частые стрессы
- прием ульцерогенных лекарственных препаратов (гормоны, ибупрофен, найз, нурофен, диклофенак и другие)
- несоблюдение режима приема пищи
- заболевания желудочно-кишечного тракта (холецистит, панкреатит, гастрит, гастродуоденит)
- хроническая Обструктивная Болезнь Легких, системные заболевания, хроническая почечная недостаточность.
Часто задаваемые вопросы
Может ли язвенная болезнь передаваться по наследству?
Сама язва не может, но факторы риска ее развития — безусловно.
Можно ли заразиться язвенной болезнью?
В случае инфицирования хеликобактером риск развития язвенной болезни преимущественно 12-перстной кишки и антрального отдела желудка существенно выше.
Может ли язва перерасти в рак?
В случае длительно текущего воспалительного процесса может развиться метаплазия — изменение типичной структуры клеток слизистой оболочки желудка и реже — 12-перстной кишки, что существенно повышает риск озлокачествления.
Можно ли вылечить язву?
Неосложненная язва рубцуется сама, а заболевание «язвенная болезнь» и процесс язвообразования вылечивается при установлении причины (хеликобактер, забросы желчи, лекарственно-индуцированные воздействия, эндокринные заболевания и пр.) и ее устранении.
Можно ли лечить язвенную болезнь без антибиотиков?
Если язвенная болезнь не обусловлена бактерией НР — безусловно, в случае НР-ассоциированного заболевания — курс антибактериальной терапии обязателен.
Истории болезни
История №1
При обращении в Клинику ЭКСПЕРТ пациент Е., 32 л., жаловался на ноющие, режущие боли в эпигастральной области через 1,5 ч после еды, часто по ночам, натощак, изжогу, отрыжку кислым, запоры, слабость, утомляемость.
В течение 5 лет, осенью, отмечал появление ноющих болей в эпигастрии, изжогу. Самостоятельно принимает маалокс. 4 года назад проводилась 7-дневная эрадикационная терапия с применением амоксициллина и кларитромицина. Контроля после лечения не проводилось. Из анамнеза жизни: питается нерегулярно, работа связана с частыми командировками, курит.
Пациенту назначено обследование (исследование крови; УЗИ логанов брюшной полости, ФГДС + НР- тест и др.) в результате которого был поставлен диагноз: Язвенная болезнь. Язва 12-перстной кишки, обострение. НР (+). Рубцовая деформация луковицы 12- перстной кишки. Дополнительно был назначен С13-углеродный дахытельный тест на НР, который показал высокую обсемененность НР. Было назначено комплексное лечение, направленное на устранение действующего фактора — НР. При контрольном осмотре и обследовании жалоб пациент не предъявлял, а при эндоксопическом исследовании была выявлена существенная положительная динамика. НР — не обнаружен. В дальнейшем пациент 1 раз в 6 месяцев проходит профилактическое обследование. За последние 2 года после проведенного лечения обострений не наблюдалось.
История №2.
Пациент С., 49л., обратился в Клинику ЭКСПЕРТ с жалобами на на ноющие боли в эпигастральной области (больше слева), через 20 мин. после еды, отрыжку кислым, изжогу, уменьшающиеся после приема альмагеля. Год назад отмечались подобные жалобы после погрешностей в диете, самостоятельно принимал маалокс, фамотидин.
При лабораторно-инструментальном обследовании выявлена язва тела желудка. Пациенту было назначено лечение, включающее диетические рекомендации и лекарственная терапия, направленная на защиту, восстановление и уменьшение воспаления слизистой оболочки желудка. Жалобы купировались. Пациент продолжает лечение и наблюдение в Клинике ЭКСПЕРТ.
Язва желудка и двенадцатиперстной кишки
Язва желудка и двенадцатиперстной кишки (гастродуоденальная язва) – серьезная и достаточно часто встречающаяся патология. Ее выявляют почти у 25% пациентов с болями в животе, и примерно 3–5% людей в течение жизни хотя бы однократно сталкиваются с этим заболеванием. Причем чаще всего речь идет о склонной к рецидивированию патологии, и в большинстве случаев диагностируется язвенная болезнь желудка и двенадцатиперстной кишки.
Неадекватное и несвоевременное лечение гастродуоденальных изъязвлений чревато развитием грозных осложнений и повышает онкологический риск. Поэтому в современной медицине большое значение придается достоверной диагностике патологии желудочно-кишечного тракта, с использованием современных информативных и безопасных методик.
Что такое язва желудка
Гастродуоденальной язвой называют самостоятельно появившийся дефект на внутренней поверхности стенок желудка или двенадцатиперстной кишки. Он нередко развивается на фоне имеющихся воспалительных изменений, хотя не исключено возникновение острых язв без предшествующей патологии желудка. Это зависит от характера основного ульцерогенного (способствующему изъязвлению) фактора.
На начальных стадиях, когда дефект небольшой и не выходит за пределы слизистой оболочки, говорят о наличии эрозии. В последующем, по мере ее углубления и расширения, уже диагностируется язва. Поначалу она имеет гладкий тонкий край, ровное дно и способна зарастать без формирования грубого рубца.
Но длительно существующее изъязвение выглядит уже по-другому. Оно имеет плотные, неравномерно утолщенные и приподнятые края, кратерообразное бугристое дно с наслоениями из фибрина, следы стягивающего рубцевания по периферии. Такая хроническая язва долго заживает с образованием деформирующих рубцов и может стать местом малигнизации (озлокачествления) клеток, превращаясь в язву-рак.
Почему в желудке и кишечнике появляются язвы
Язвенная болезнь развивается, если собственных защитных (протективных) свойств слизистой оболочки желудка и 12-перстной кишки оказывается недостаточно для противостояния ульцерогенным факторам. Это ключевой момент патогенеза.
К этиологическим (ульцерогенным) факторам относят:
- Инфицирование желудка особой бактерией – Helicobacter pylori. Развивающиеся при этом дефекты называют хеликобактер-ассоциированными. Эта бактерия напрямую повреждает слизистую оболочку, нарушает процесс миграции эпителиальных клеток в процессе заживления, провоцирует их ускоренную гибель.
Носителями хеликобактерной инфекции является около 90% населения, она считается основным причинным фактором развития хронического гастрита и гастродуоденальных язв. При этом речь идет о чрезмерной агрессии Helicobacter pylori в сочетании с повышенной уязвимостью слизистой оболочки и снижением ее способности к регенерации. Такому обычно способствуют различные предрасполагающие факторы.
- Прием нестероидных противовоспалительных препаратов (НПВС). В основе их действия лежит блокада синтеза простагландинов, а побочным эффектом этого становится снижение секреции желудочной слизи и угнетение продукции бикарбонатов. В результате происходит ослабление местных защитных механизмов, слизистая оболочка становится чувствительной к действию желудочного сока. Стероидные язвы формируются не менее чем у 3% пациентов, принимающих НПВС, даже при соблюдении ими всех рекомендаций врача.
- Острая стрессовая реакция. При этом резко нарушается вегетативная регуляция внутренних органов, меняется микроциркуляция, ослабляются защитные механизмы.
- Погрешности в питании, курение, алкоголизация.
У ряда пациентов прослеживается также наследственная предрасположенность к язвенной болезни и другим желудочно-кишечным заболеваниям.
Как это проявляется
Основные симптомы язвы желудка:
- Боли в животе. Это самая частая жалоба пациентов, именно она и становится причиной обращения к врачу. Причем болит живот при язве обычно натощак, неприятные ощущения появляются спустя 1–2 часа после еды и снимаются приемом пищи или раствора пищевой соды. Боли бывают ноющего, жгучего, неясного характера, различной интенсивности и продолжительности. А изменение привычной схемы болевого синдрома обычно свидетельствует о развитии осложнений.
- Изжога. Этот симптом может появляться еще до формирования болевого синдрома или одновременно с ним.
- Диспепсия в виде отрыжки, тяжести в животе, тошноты, изменения аппетита. Свидетельствует о функциональной неполноценности пищеварения.
- Психоэмоциональные проявления (раздражительность, сниженная работоспособность и пр.). Являются вторичными и обусловлены реакцией на хронический болевой синдром и диспепсию.
Встречаются и коварные «молчащие» язвенные дефекты, которые не дают ощутимого дискомфорта и долгое время остаются без должного внимания. Поэтому лечение желудка должно учитывать не только жалобы пациента, но и данные обследования.
Почему язвы нужно обязательно выявлять и лечить
Язвенная болезнь – это не просто очень дискомфортная для пациентов патология. Ее относят к одним из самых опасных состояний в гастроэнтерологии, что связано с высоким риском развития тяжелых осложнений. Причем они могут появляться у пациентов с различным «стажем» заболевания, склонны быстро прогрессировать и обычно требуют срочного хирургического вмешательства.
К основным осложнениям относят:
- Кровотечение из краев или дна язвенного дефекта, обусловленное разрушением расположенных здесь сосудов. Может сопровождаться кровавой рвотой (кофейной гущей) или примесью измененной крови в кале.
- Перфорация стенки пораженного органа. При этом формируется сквозной дефект с выходом содержимого желудка (кишечника) в брюшную полость и развитием перитонита. Чаще всего перфорирует язва двенадцатипертной кишки.
- Пенетрация язвы – прорыв в прилегающий орган (в поджелудочную железу, печень, сальник, в другие отделы кишечника).
- Рубцовые деформации, в том числе с развитием стеноза (патологического сужения). Чаще всего при этом страдает привратник желудка и двенадцатиперстная кишка в верхней трети.
Еще одно опасное и нередко поздно диагностируемое осложнение – малигнизация. Причем формирующаяся опухоль поначалу не дает явных симптомов, а небольшие изменение характера боли обычно остаются без должного внимания. Это приводит к позднему выявлению рака желудка и ухудшает прогноз лечения.
Важность грамотной диагностики
Неверно лечить заболевание ЖКТ наобум, опираясь лишь на оценку симптомов. Подбор терапии следует проводить с учетом характера имеющихся изменений, что возможно лишь при использовании современных информативных визуализационных методов диагностики. Оптимальный способ диагностики – ФГДС. Причем при язвенной болезни желудка такое обследование следует проводить регулярно, не только при обострении, но и в период длительной ремиссии.
Регулярная диагностика состояния слизистой оболочки ЖКТ с использованием ФГДС – залог хорошей эффективности лечения и действенная профилактика гастроинтестинального рака.
Периодическая диагностика желудка и двенадцатиперстной кишки позволяет выявлять мельчайшие, только формирующиеся язвенные дефекты, контролировать состояние хронических воспалительных очагов, оценивать динамику на фоне проводимого лечения.
Принципы лечения
Терапия язвенной болезни желудка проводится комплексно и направлена на решение нескольких ключевых задач:
- Соблюдение диеты для устранения раздражающего фактора при обеспечении организма пациента необходимыми веществами.
- Устранение хеликобактерной инфекции (если она была выявлена) с помощью комбинации антибиотиков. Это позволяет справиться с воспалением, улучшает процесс заживления, служит профилактикой развития осложнений и рецидивов.
- Стабилизация уровня кислотности желудочного сока и оптимизация работы протонной помпы, что снижает риск повторного повреждения тканей и ускоряет заживление. А комбинация ингибиторов протонной помпы с антибактериальными (антихеликобактерными) средствами существенно снижает риск рецидивов.
- Уменьшение выраженности диспепсии, изжоги и болевого синдрома.
При развитии осложнений в экстренном порядке решается вопрос о целесообразности хирургического лечения. В настоящее время возможно проведение операций малоинвазивным путем, с использованием эндоскопических методик.
На любой стадии болезни лечить язву желудка должен врач. Не стоит прибегать к самовольной коррекции предписанной терапевтической схемы и бесконтрольному приему народных средств, это чревато дестабилизацией состояния и повышением риска осложнений.
Диагностика и лечение язвенной болезни в ICLINIC – грамотный подход и современные технологии
Язвенное поражение желудка и двенадцатиперстной кишки – серьезное, требующее особого внимания заболевание. Пациентам с такой патологией рекомендуется наблюдаться у врача-гастроэнтеролога и даже при длительной ремиссии регулярно проходить профилактические осмотры. При этом предпочтение следует отдавать современным, достоверным и безопасным лечебно-диагностическим методикам.
Центр профилактики рака органов пищеварения ICLINIC – современная специализированная клиника с высококлассным оборудованием. Мы ориентированы на грамотное своевременное выявление и эффективное лечение болезней желудочно-кишечного тракта.
При первичном обследовании, динамическом контроле состояния и профилактических осмотрах в ICLINIC широко используется эндоскопическое оборудование высоких классов с повышенным уровнем комфорта. Диагностика язвы желудка и других гастроэнтерологических заболеваний включает обязательное проведение ФГДС. При этом мы используем аппараты улучшенных модификаций, что снижает испытываемый пациентом дискомфорт и повышает результативность исследования.
Лечение язвы желудка в нашей клинике проводится опытным гастроэнтерологом, с использованием результативных терапевтических схем и в соответствии с современными клиническими рекомендациями. Такой подход позволяет быстро улучшить состояние пациентов, добиться стойкой ремиссии и предупредить развитие осложнений.
Мы рекомендуем:
Прием врача-гастроэнтеролога
ФГДС
ФГДС с консультацией ведущего специалиста
ФКС
ФКС с консультацией ведущего специалиста
Взятие биопсии при эндоскопических исследованиях
Тест на вероятность рака желудка
Ваш возраст более 45 лет?
Да Нет
У Ваших родственников были онкологические заболевания?
Да Нет
У Вас есть хронические заболеваний желудочно-кишечного тракта:
– хронический гастрит,
– язвенная болезнь,
– хронический колит и другие воспалительные заболевания кишечника,
– болезнь Крона,
– неспецифический язвенный колит,
– выявленные ранее полипы желудка и кишечника,
– выявленные подслизистые эпителиальные образования желудочно-кишечного тракта?
Да Нет
Вы переносили операции на желудке и кишечнике?
Да Нет
У Вас есть рубцово-спаечные изменения желудочно-кишечного тракта?
Да Нет
Вы курите (более 1 сигареты в день)?
Да Нет
Вы допускаете погрешности в диете (низкое потребление овощей и фруктов, высокое потребление мяса и животных жиров)?
Да Нет
У Вас есть хотя-бы один из перечисленных симптомов:
– лишний вес,
– затруднения при глотании,
– раздражительность,
– бледность кожи,
– боли за грудиной,
– немотивированная слабость,
– нарушение сна,
– снижение аппетита,
– неприятный запах изо рта,
– отрыжка,
– тошнота и/или рвота,
– чувство тяжести в животе,
– изменение стула (запоры и/или поносы),
– следы крови в стуле,
– боли в животе.
Да Нет
Запишитесь на прием
В чем преимущества ICLINIC?Высочайший уровень специалистов: среди них доктора медицинских наук и члены мировых врачебных сообществ, а средний стаж врачей клиники – 16 лет безупречной работы.
Современное экспертное оборудование: диагностические аппараты медицинского центра выпущены в 2017 году ведущими мировыми производителями (Pentax и другими того же уровня).
Безупречная точность эндоскопической диагностики благодаря высокому разрешению изображения в 1,25 млн.пикселей.
Уникальные технологии ранней диагностики рака, среди которых i-scan – виртуальная хромоэндоскопия. С помощью данной технологии можно распознать даже самые мелкие, начальные опухолевые изменения.
Все для комфорта пациента: эффективное обезболивание, включая общий наркоз; тонкие эндоскопы менее 10мм в диаметре; быстрое и точное проведение манипуляций.
Безопасность: автоматизированная дезинфекция оборудования с контролем качества, мониторинг жизненно важных функций пациента в процессе исследований.
Узкая специализация: медцентр занимается заболеваниями пищеварительной системы, постоянно совершенствуясь именно в своей отрасли. Наши специалисты постоянно проходят повышение квалификации, участвуют в международных конференциях, тренингах и семинарах в России и Европе.
Удобное расположение: Петроградский район Санкт-Петербурга расположен недалеко от ценра. Сюда удобно добираться как на машине, так и на общественном транспорте. Совсем рядом с клиникой находится станция метро Чкаловская, также недалеко от медицинского центра станции СПб Спортивная, Петроградская и Горьковская.
Наш профессионализм всегда на страже вашего здоровья.
Что такое перфорированные язвы
Язвенная болезнь – это открытая язва в слизистой оболочке желудка или верхней части тонкой кишки (двенадцатиперстной кишки). Язва может пройти через все слои пищеварительного тракта и образовать отверстие (перфорацию). Это называется прободной язвой. Прободная язва позволяет пище и пищеварительным сокам вытекать из пищеварительного тракта. Это серьезная проблема со здоровьем, требующая неотложной медицинской помощи.
Что вызывает прободные язвы?
Если не лечить пептические язвы, образуется отверстие.Чтобы определить причину вашей язвы, ваш лечащий врач проведет осмотр и изучит вашу историю болезни. Он или она также может заказать тесты. Основные причины пептических язв:
Инфекция бактериями H. pylori (Helicobacter pylori). Это повреждает слизистую оболочку желудка. Пищеварительные соки могут нанести вред пищеварительному тракту.
Долгосрочное использование некоторых безрецептурных обезболивающих, таких как НПВП (нестероидные противовоспалительные препараты). К ним относятся ибупрофен, напроксен и аспирин.Это увеличивает вероятность повреждения желудка или кишечника.
Симптомы прободной язвы
Симптомы прободной язвы могут включать:
Внезапная сильная боль в животе (животе), обычно в верхней части живота
Боль распространяется на спину или плечо
Расстройство желудка (тошнота) или рвота
Отсутствие аппетита или чувство сытости
Вздутие живота или ощущение вздутия
Лечение прободной язвы
Лечение прободной язвы начинается с фиксации дыра в пищеварительном тракте.Это можно сделать хирургическим путем.
Другие методы лечения направлены на облегчение боли и устранение причины язвы. Лекарства, отпускаемые по рецепту, могут помочь в следующих случаях:
Ваш поставщик медицинских услуг может также назначить вам другие лекарства, если язва возникла из-за безрецептурных обезболивающих. В некоторых случаях нельзя избежать приема этих лекарств. Посоветуйтесь со своим врачом, чтобы узнать, что лучше для вас.
Возможные осложнения прободной язвы
Прободные язвы могут иметь серьезные осложнения.К ним относятся:
Когда звонить своему врачу
Немедленно позвоните своему врачу, если у вас есть что-либо из этого:
Рвота кровью или рвота, похожая на кофейную гущу
Кровавый, черный или смолистый – внешний вид стула
Температура 100,4 ° F (38 ° C) или выше, или по указанию врача
Озноб
Усиливающаяся боль
Симптомы, которые не проходят с лечением или ухудшение симптомов
Новые симптомы
Бульбит: эрозивный, поверхностный, катаральный, очаговый
Пищеварительная система обеспечивает питанием различные органы и системы человеческого тела.А чтобы система не вышла из строя, необходимо поддерживать здоровье всех ее органов.
Лечение бульбита, как и любых других заболеваний пищеварительного тракта, предполагает комплексный подход к решению проблемы. С самого начала пациенту предлагается отказаться от вредных привычек (в первую очередь от курения, употребления алкоголя, переедания, сухого питания), нормализовать рацион и характер питания (оно должно быть полноценным, регулярным и по возможности дробным), нормализовать психоэмоциональное состояние.Кроме того, можно начать прием противовоспалительных травяных настоев, картофельного сока и рисового отвара, защищающих слизистую желудочно-кишечного тракта от агрессивного воздействия неблагоприятных факторов.
При легких формах заболевания, причиной которых не является бактериальная инфекция, иногда бывает достаточно даже этого. При выраженном бульбите в комплексное лечение обязательно включают прием медикаментов и лечебную физкультуру.
Физиотерапевтическое лечение бульбита включает в себя такие процедуры: магнитотерапия, УВЧ-излучение, воздействие ультрафиолетовых волн, болевой синдром – медикаментозный электрофорез.Также показано санаторно-курортное лечение и питье минеральных вод «Боржоми», «Трускавец» и других.
Оперативное лечение назначают в первую очередь при эрозивном бульбите со склонностью к кровотечениям. Это либо перевязка кровеносного сосуда с кровотечением из него, либо ваготомия с подавлением ножки блуждающего нерва для снижения выработки соляной кислоты.
Медикаментозная терапия
Многие формы бульбита требуют не только изменения образа жизни и диеты, но и медикаментозного лечения.Медикаментозная терапия в этом случае также многогранна, поскольку преследует сразу несколько важных целей.
Поскольку бульбит свидетельствует о воспалении в области ПДК, в обязательном порядке назначают препараты, купирующие воспалительный процесс за счет снижения кислотности внутренней среды и облегчения работы пищеварительной системы. С этой целью могут быть назначены ферментные препараты, такие как Вобэнзим, Серокс, Энзистал и др., А также антацидные средства (Альмагель, Фосфалугель, Гастал, Маалокс и др.)..
Чаще всего среди антацидов врачи предпочитают препараты первым двум препаратам. «Альмагель», как и «Фосфалюгель», часто назначают при любой патологии желудочно-кишечного тракта, в том числе в случае бульбита, когда требуется быстрое снижение кислотности желудка, поскольку кислота является одним из раздражающих факторов, которые провоцируют воспалительные реакции.
Препарат выпускается в форме таблеток, раствора и суспензии. Принимать его нужно за полчаса до еды от 3 до 6 раз в день.В промежутке между приемом пищи и приемом лекарств нежелательно даже пить воду. Разовая доза препарата – от 1 до 3 мерных ложек раствора (1-2 пакетика или таблетки). Курс лечения от 10 до 15 дней.
Препарат не назначают при непереносимости его компонентов, болезни Альцгеймера, тяжелой патологии печени и почек, при подозрении на острый аппендицит, язвенный колит, геморрой, хронический понос и некоторые другие патологии. Нежелательно применять при грудном вскармливании.Детям лекарство назначают только по показаниям врача в ограниченной дозировке (1/3 или ½ взрослой нормы).
Среди побочных эффектов: боль в желудке, нарушение вкуса, запор, тошнота, рвота, состояния, связанные с избытком минералов, входящих в состав лекарства.
Антибиотики при бульбите не являются препаратами принудительного действия, так как их назначение целесообразно только при наличии бактериальной инфекции, т.е. микроорганизма Helicobacter pylori, который является частой причиной воспалительных патологий пищеварительной системы.
Для борьбы с инфекцией Helicobacter pylori используются антибиотики различных групп: амоксициллин, кларитромицин, метронидазол, тетрациклин и др. Однако противомикробные средства редко используются в монотерапии, чаще всего практикуются различные схемы антибиотикотерапии, в которых одновременно используются два антибиотика и регулирующие препараты. кислотность желудочного сока.
Наиболее популярным в этом отношении является препарат «Амоксициллин», который в случае бульбита, ассоциированного с Helicobacter pylori, является одним из основных компонентов схемы лечения заболевания.Чаще всего его применяют совместно с «Кларитромицином», реже – с «Метронидазолом», поскольку совместное применение препаратов чревато развитием дополнительных побочных эффектов.
Разовая доза антибиотика в большинстве схем составляет 250-500 мг.
Запрещается применять препарат при инфекционном мононуклеозе, лимфолейкозе, вирусных инфекциях, сенной лихорадке, а также при аллергическом диатезе и бронхиальной астме. Нет смысла принимать пероральные антибиотики, если у пациента сильная рвота и диарея.Не назначают препарат при гиперчувствительности к препаратам пенициллина и цефалоспоринового ряда.
Для снижения резистентности амоксициллина его иногда комбинируют с клавулановой кислотой. Такое сочетание может ухудшить состояние пациентов с патологиями печени.
Схемы с метронидазолом не используются для лечения пациентов с патологиями нервной системы и нарушениями кроветворения.
Среди побочных эффектов можно выделить: аллергические реакции, в том числе тяжелые, нарушения со стороны желудочно-кишечного тракта и почек (в сочетании с метронидазолом), развитие суперинфекций.
В комплексных схемах лечения бактериального и небактериального бульбита обязательно присутствуют препараты, повышающие pH желудочного сока. Это антациды, гистаминовые рецепторы H , 2 («Ранитидин», «Фамотидин», «гастрозидин» и др.), Ингибиторы протонной помпы («Омез», «Омепразол», «лансопразол», «пантопразол» и др.). Также показан прием препаратов висмута («Новобимол», «Де-Нол» и др.).
«Омез» – один из наиболее назначаемых препаратов при воспалительных патологиях желудочно-кишечного тракта.Замедляет синтез соляной кислоты, в результате чего желудочный сок имеет более низкий уровень кислотности и не раздражает слизистую желудка и двенадцатиперстной кишки.
«Омез» при бульбите можно назначать в дозировке 20-40 мг. Суточную дозу принимают в 1-2 приема за полчаса до еды, запивая таблетки водой.
Противопоказаний к применению препарата немного. Не назначают в детстве, при беременности и в период лактации. Запрещено принимать лекарство даже при его непереносимости к его составляющим.
Побочные эффекты возникают редко. В основном это нарушения стула (запор или диарея) и вкусового восприятия, тошнота, боли в эпигастрии, ощущение пересыхания слизистых оболочек рта, головные боли и головокружение, нарушения сна. Также могут наблюдаться мышечная слабость и мышечные боли, иногда повышающие светочувствительность, остроту зрения, аллергические реакции.
Обезболивающие назначают в основном при эрозивном бульбите, сопровождающемся сильной болью в эпигастрии. Для снятия болевого синдрома используются как анальгетики (например, старый добрый Баралгин), так и спазмолитики (Но-шпа, Спазмалгон, Дротаверин и др.) подходят.
[24], [25], [26], [27], [28], [29], [30], [31], [32], [33], [34]
Альтернативное лечение
Бульбит – одно из воспалительных заболеваний пищеварительного тракта, и поскольку все органы пищеварительной системы взаимосвязаны, их лечение во многом схоже. Что касается народного лечения, то те же рецепты пригодятся при бульбите, которые применяют для лечения гастрита с повышенной кислотностью.
В первую очередь, это свежевыжатый картофельный сок, который рекомендуется принимать натощак 2–3 раза в день.За один прием нужно выпить ½ стакана сока.
Для защиты от агрессивного действия желудочного сока полезно употребление несоленых отваров злаков. Прекрасно подходят рис и овсяные хлопья (хлопья), из которых получаются слизистые отвары.
Прополис очень хорошо действует при желудочно-кишечных заболеваниях. Его настойку на спирту можно купить в аптеке или приготовить самостоятельно (кусок прополиса весом около 60 г настаивают неделю в 350-400 г спирта). Перед употреблением закапайте 20 капель настойки в воду или молоко (чуть больше ½ стакана) и пейте между приемами пищи.Делайте это трижды в день в течение месяца.
Хорошие результаты дает лечение травами. Вместо чая рекомендуется принимать отвар или настой мяты и ромашки, вместо компотов – сироп шиповника (1 кг плодов растения и сахар, 1,5 л воды) трижды в день по 1 столовой ложке.
Хорошие результаты дает также настой плодов софоры японской (1 чайную ложку измельченного сырья залить стаканом кипятка и настоять 15 минут).Пито по стакану настоя 3 раза в день.
[35], [36], [37], [38], [39], [40], [41], [42], [43], [44]
Гомеопатия
Полезное действие при луковицах, не связанных с Helicobacter pylori, также обеспечивается гомеопатией, применение которой считается более безопасным для здоровья, чем традиционная медицина. Однако при условии, что средство назначается правильно и его прием осуществляется в соответствии с указаниями врача.
Одним из препаратов, которые гомеопаты назначают при бульбите, является Kalium bichromicum в 6-ти разведениях.Принимать рекомендуется по 5 гранул утром и вечером или при болях. Не ешьте во время еды.
В гомеопатических аптеках можно купить и препараты висмута, но принимать их нужно только после консультации с врачом.
Для снятия неприятных симптомов полезны Agaricus (неврологические симптомы), Gentian (диспептические явления), Acidum acetylcum (снятие симптомов, связанных с повышенной кислотностью желудка). Последний препарат назначают и при эрозивном бульбите, так как он помогает остановить кровотечение.
Диета с бульбитом
Диетическое питание при заболеваниях желудочно-кишечного тракта, к которым относятся и бульбиты, является разновидностью лечебных процедур. Если игнорировать требования диеты, лечение не даст ожидаемых результатов.
Диету при бульбите жесткой не назовешь. Однако есть некоторые ограничения. Самое главное – исключить из рациона продукты и блюда, которые могут оказывать раздражающее действие на внутреннюю поверхность желудка и двенадцатиперстной кишки или стимулировать повышение секреции соляной кислоты.К запрещенным товарам относятся: консервы, приправы, кофе, крепкий чай, алкоголь, кислые фрукты и ягоды, копчености. Отказаться следует от жареной пищи и острых блюд. Следует минимизировать потребление соли.
Как и при других патологиях ЖКТ, рекомендуется дробное питание. Пищу нужно принимать небольшими порциями 5-6 раз в день.
Предпочтение отдается жидким первым блюдам, киселям, слизистым бульонам (отварам риса, овса, семян льна). Плоды, ягоды и компоты из них с бульбитом помогают насытить организм витаминами, но следить за тем, чтобы они не были слишком кислыми, утомительно.
При обострении болезни в основном можно есть жидкие блюда, постепенно добавляя в меню яйца всмятку, паровой омлет, вязкие каши, печеные фрукты. Среди разрешенных продуктов в бульбите можно выделить: нежирный творог и сметану, вчерашний белый хлеб и сухарики из него, бисквитное печенье, диетическое мясо и рыбу, макаронные изделия. Не добавляйте в пищу и немного масла.
Молоко при бульбите не только не запрещено, но и полезно, так как улучшает работу кишечника.В день можно выпивать до 5 стаканов молока. Однако перед употреблением рекомендуется отваривать.
Пример меню в бульбите:
- 1-й завтрак: паровой омлет с овощами, ромашковый чай
- 2-й завтрак: печеное яблоко, чуть позже зеленый чай с молоком
- Обед: овощной суп с рисом, пюре с паровой отбивной
- Полдник: бисквитный бисквит, компот
- 1-й ужин: рыба на пару, рисовая каша, кисель молочный
- 2-й ужин: грушевое пюре, мягкий чай с мятой
[45], [46]
Инфекции костей и суставов, вызванные мукормицетами: сложный костно-суставной микоз двадцать первого века | Медицинская микология
658″ data-legacy-id=”sec1″> Введение
Грибы, принадлежащие к отряду Mucorales, состоят преимущественно из сапротрофов естественного происхождения, обитающих в почве и разлагающемся веществе. 1 Хотя большинство грибов отряда Mucorales редко участвуют в инфекциях человека, частота опасных для жизни заболеваний, вызываемых несколькими видами, увеличивается у хозяев с тяжелыми иммунными или метаболическими нарушениями, гематологическими злокачественными новообразованиями, трансплантацией гемопоэтических стволовых клеток и неконтролируемый кетоацидоз, сахарный диабет. 2–5 Инфекции часто принимают драматическое течение с неблагоприятным прогнозом и смертностью из-за глубоко инвазивных и диссеминированных заболеваний у пациентов с иммунодефицитами. 6
Костно-суставные микозы – редкие заболевания. В течение последних нескольких лет в нескольких крупных систематических обзорах были выявлены ключевые демографические, диагностические, терапевтические и исходные параметры многих костно-суставных микозов. 7–17 Однако еще предстоит завершить комплексный анализ, сосредоточенный исключительно на костно-суставном мукормикозе. Поэтому мы провели систематический обзор эпидемиологических, клинических, диагностических и терапевтических аспектов этих серьезных инфекций, уделяя особое внимание общему состоянию иммуносупрессии, влиянию возраста, различным путям заражения, анатомическому распределению и исходу.
662″ data-legacy-id=”sec2-1″> Критерии поиска
Для выявления грибкового остеомиелита и артрита, вызванных Mucormycetes, мы использовали поисковую платформу OvidSP в базах данных MEDLINE и EMBASE с 1978 по 2014 год, используя следующие ключевые слова: грибки, Rhizopus , Apophysomyces , Mucor, Cunninghamella , Lichtheimia (ранее Absidia ), Saksenaea , Zygomycetes, зигомикоз, мукормикоз, системный микоз, заболевания костей, инфекция костей, остит, остеомиелит, периостит, спондилит, дискритный и остеохондритический остеохондроз инфекции суставов и реактивный артрит
Мы включили случаи в окончательный анализ за 1978–2014 гг. с данными об остеомиелите и / или артрите, локализации инфекции, основном заболевании, противогрибковой терапии и хирургическом вмешательстве.Среди других параметров, рассмотренных при анализе случая, были диагностические изображения, маркеры воспаления и проявления заболевания. Мы исключили случаи с расширением кости из-за риносинусита, случаи с отсутствием полных текстов и случаи неанглоязычной литературы.
667″ data-legacy-id=”sec2-3″> Терминология и определения
Существуют различные системы классификации остеомиелита. 18 Описательные термины применялись к механизмам костной инфекции, критериям диагностической вероятности, началу заболевания и гистопатологическим характеристикам остеомиелита. Все определения, использованные в этом исследовании, использовались в предыдущих исследованиях костно-суставных микозов: 10–17
Прямая инокуляция: локальная инфекция костей или суставов после нарушения целостности кожных покровов;
Гематогенный: посев костей или суставов путем диссеминации из удаленного места инокуляции и / или инфекции;
Смежный: описывает засеивание кости или сустава из соседнего участка инфекции; Доказанный грибковый остеомиелит: наличие положительного посева и / или гистологического исследования костной ткани, суставной жидкости или металлических изделий;
Вероятный грибковый остеомиелит: совместимые клинические и рентгенологические признаки остеомиелита с положительными гистологическими данными и / или посевом грибка из вне костно-суставного участка;
Полный ответ: разрешение клинических и рентгенологических данных остеомиелита; Частичный ответ: неполное разрешение клинических и / или рентгенологических данных остеомиелита или неполное клиническое улучшение без наличия радиологических данных;
Общий ответ: полный или частичный ответ клинических и рентгенологических данных остеомиелита;
Пациенты педиатрического профиля: пациенты в возрасте ≤15 лет;
Повышенное количество лейкоцитов (WBC):> 10 000 / мкл.
679″ data-legacy-id=”sec3″> Результаты
683″ data-legacy-id=”sec3-2″> Этиология
Наиболее частыми возбудителями Mucorales, вызывающими инфекции костей и суставов, были вида Rhizopus (15 случаев) 19–29 , за которыми следовали Apophysomyces elegans (четыре случая) 30–33 , Mucor вида (три вида). случаев), 34–36 Cunninghamella bertholletiae (два случая), 37,38 и по одному случаю для каждого Lichtheimia (ранее Absidia ) corymbifera 39 и Sakseiforma. 40 Род не был указан в восьми случаях гистологически задокументированного мукормикоза. 41–48 Все пациенты были инфицированы одним видом грибка.
688″ data-legacy-id=”sec3-4″> Клинические проявления и механизмы инфекции
Наиболее частыми клиническими проявлениями были ограничение движений (62%), местная боль, болезненность и / или отек (59%) и целлюлит / абсцесс (24%) (Таблица 3).О лихорадке сообщали редко. Повышенные воспалительные маркеры были обнаружены для СОЭ и лейкоцитов; данные для C-реактивного белка не были доступны.
Таблица 3.Клинические характеристики и анатомическое распределение костно-суставных инфекций, вызванных грибами mucormycetes, о которых сообщалось в литературе с 1978 по 2014 годы.
| Диагностический подход . | Всего N = 34 (%) . | ||
|---|---|---|---|
| Клиническое проявление * | |||
| Боль / болезненность / припухлость | 20 (59) | ||
| Целлюлит / язва / абсцесс | 8 (24) | Неврологический дефицит (12)||
| Движение болезненно ограничено | 21 (62) | ||
| Лихорадка | 8 (24) | ||
| Типы инфекции | Прямая инокуляция6 19336 | ||
| Гематогенный | 8 (24) | ||
| Смежный | 7 (21) | ||
| Первоначальное проявление костно-суставной инфекции | |||
| Две кости инфицированы | 903 инфицированные4 (12) | ||
| ≥3 инфицированных костей | 2 (6) | ||
| Поражение костей | |||
| Череп и лицевые кости | 6 (18) | ||
| Верхняя конечность | 2 (6) | ||
| Лопатка | 6 | 1 (3) | |
| Позвонок | 3 (9) | ||
| Бедренная кость | 4 (12) | ||
| Остеомиелит тазобедренного сустава / множественные участки | 4 (12) | 4 (12) | 4 (12) | (21)
| Артрит коленного сустава | 2 (6) | ||
| Стопа | 4 (12) | ||
| Рентгенологические признаки * | 9033 | Увеличение использования ядерного сканирования | 8 (23) |
| TC 99 m / Ga 67 | |||
| Разрушение / эрозия костей | 3 (9) | ||
| Lucency | 3 (9) | ||
| Некроз | 2 (6) | ||
| Не указано | маркеры 7 (21) | ||
| СОЭ | |||
| Среднее ± стандартное отклонение | 74 ± 27 | ||
| Медиана (диапазон) | 69 (40–107) | ||
| WBC SD | 16,891 ± 8,265 | ||
| Медиана (диапазон) | 16,150 (7,000–29,400) | ||
| Типы биопсии | N = 32 | ||
| Открытая хирургическая рана | 903 28Чрескожная пункционная биопсия | 3 (9) | |
| Артроскопия | 1 (3) | ||
| Задержка диагностики (дни) | 90 335|||
| Среднее ± стандартное отклонение | 73 ± 47 | ||
| Медиана (диапазон) | 60 (10–180) | ||
| Лечение | N = 33 | ||
| (один до лечения ) | |||
| Только амфотерицин B | 4 (12) | ||
| Только хирургия | 1 (3) | ||
| Амфотерицин B + операция | 28 (85) | 45 (5–573) | |
| медиана (диапазон) d | |||
| Тип хирургического вмешательства (n = 29) | |||
| Дебридмент | 11 (38) | ||
| 5 (17) | |||
| Костная пластика / несколько процедур / | 7 (24) | ||
| Аутотрансплантация / фиксация | |||
| Декомпрессивная ламинэктомия | 1 (3.5) | ||
| Иссечение | 5 (17) | ||
| Результат | |||
| Полный ответ | 14 (41) | ||
| Частичный ответ | 6 12 (351) Частичный ответ | 6 12 (351) | 8 (24) |
| Причина смерти | 6 (18) |
| Диагностический подход . | Всего N = 34 (%) . | ||
|---|---|---|---|
| Клиническое проявление * | |||
| Боль / болезненность / припухлость | 20 (59) | ||
| Целлюлит / язва / абсцесс | 8 (24) | Неврологический дефицит (12)||
| Движение болезненно ограничено | 21 (62) | ||
| Лихорадка | 8 (24) | ||
| Типы инфекции | Прямая инокуляция6 19336 | ||
| Гематогенный | 8 (24) | ||
| Смежный | 7 (21) | ||
| Первоначальное проявление костно-суставной инфекции | |||
| Две кости инфицированы | 903 инфицированные4 (12) | ||
| ≥3 инфицированных костей | 2 (6) | ||
| Поражение костей | |||
| Череп и лицевые кости | 6 (18) | ||
| Верхняя конечность | 2 (6) | ||
| Лопатка | 6 | 1 (3) | |
| Позвонок | 3 (9) | ||
| Бедренная кость | 4 (12) | ||
| Остеомиелит тазобедренного сустава / множественные участки | 4 (12) | 4 (12) | 4 (12) | (21)
| Артрит коленного сустава | 2 (6) | ||
| Стопа | 4 (12) | ||
| Рентгенологические признаки * | 9033 | Увеличение использования ядерного сканирования | 8 (23) |
| TC 99 m / Ga 67 | |||
| Разрушение / эрозия костей | 3 (9) | ||
| Lucency | 3 (9) | ||
| Некроз | 2 (6) | ||
| Не указано | маркеры 7 (21) | ||
| СОЭ | |||
| Среднее ± стандартное отклонение | 74 ± 27 | ||
| Медиана (диапазон) | 69 (40–107) | ||
| WBC SD | 16,891 ± 8,265 | ||
| Медиана (диапазон) | 16,150 (7,000–29,400) | ||
| Типы биопсии | N = 32 | ||
| Открытая хирургическая рана | 903 28Чрескожная пункционная биопсия | 3 (9) | |
| Артроскопия | 1 (3) | ||
| Задержка диагностики (дни) | 90 335|||
| Среднее ± стандартное отклонение | 73 ± 47 | ||
| Медиана (диапазон) | 60 (10–180) | ||
| Лечение | N = 33 | ||
| (один до лечения ) | |||
| Только амфотерицин B | 4 (12) | ||
| Только хирургия | 1 (3) | ||
| Амфотерицин B + операция | 28 (85) | 45 (5–573) | |
| медиана (диапазон) d | |||
| Тип хирургического вмешательства (n = 29) | |||
| Дебридмент | 11 (38) | ||
| 5 (17) | |||
| Костная пластика / несколько процедур / | 7 (24) | ||
| Аутотрансплантация / фиксация | |||
| Декомпрессивная ламинэктомия | 1 (3.5) | ||
| Иссечение | 5 (17) | ||
| Результат | |||
| Полный ответ | 14 (41) | ||
| Частичный ответ | 6 12 (351) Частичный ответ | 6 12 (351) | 8 (24) |
| Приписываемая смерть | 6 (18) |
Клинические характеристики и анатомическое распределение костно-суставных инфекций, вызванных грибами mucormycetes, о которых сообщалось в литературе с 1978 по 2014 гг.
| Диагностический подход . | Всего N = 34 (%) . | ||
|---|---|---|---|
| Клиническое проявление * | |||
| Боль / болезненность / припухлость | 20 (59) | ||
| Целлюлит / язва / абсцесс | 8 (24) | Неврологический дефицит (12)||
| Движение болезненно ограничено | 21 (62) | ||
| Лихорадка | 8 (24) | ||
| Типы инфекции | Прямая инокуляция6 19336 | ||
| Гематогенный | 8 (24) | ||
| Смежный | 7 (21) | ||
| Первоначальное проявление костно-суставной инфекции | |||
| Две кости инфицированы | 903 инфицированные4 (12) | ||
| ≥3 инфицированных костей | 2 (6) | ||
| Поражение костей | |||
| Череп и лицевые кости | 6 (18) | ||
| Верхняя конечность | 2 (6) | ||
| Лопатка | 6 | 1 (3) | |
| Позвонок | 3 (9) | ||
| Бедренная кость | 4 (12) | ||
| Остеомиелит тазобедренного сустава / множественные участки | 4 (12) | 4 (12) | 4 (12) | (21)
| Артрит коленного сустава | 2 (6) | ||
| Стопа | 4 (12) | ||
| Рентгенологические признаки * | 9033 | Увеличение использования ядерного сканирования | 8 (23) |
| TC 99 m / Ga 67 | |||
| Разрушение / эрозия костей | 3 (9) | ||
| Lucency | 3 (9) | ||
| Некроз | 2 (6) | ||
| Не указано | маркеры 7 (21) | ||
| СОЭ | |||
| Среднее ± стандартное отклонение | 74 ± 27 | ||
| Медиана (диапазон) | 69 (40–107) | ||
| WBC SD | 16,891 ± 8,265 | ||
| Медиана (диапазон) | 16,150 (7,000–29,400) | ||
| Типы биопсии | N = 32 | ||
| Открытая хирургическая рана | 903 28Чрескожная пункционная биопсия | 3 (9) | |
| Артроскопия | 1 (3) | ||
| Задержка диагностики (дни) | 90 335|||
| Среднее ± стандартное отклонение | 73 ± 47 | ||
| Медиана (диапазон) | 60 (10–180) | ||
| Лечение | N = 33 | ||
| (один до лечения ) | |||
| Только амфотерицин B | 4 (12) | ||
| Только хирургия | 1 (3) | ||
| Амфотерицин B + операция | 28 (85) | 45 (5–573) | |
| медиана (диапазон) d | |||
| Тип хирургического вмешательства (n = 29) | |||
| Дебридмент | 11 (38) | ||
| 5 (17) | |||
| Костная пластика / несколько процедур / | 7 (24) | ||
| Аутотрансплантация / фиксация | |||
| Декомпрессивная ламинэктомия | 1 (3.5) | ||
| Иссечение | 5 (17) | ||
| Результат | |||
| Полный ответ | 14 (41) | ||
| Частичный ответ | 6 12 (351) Частичный ответ | 6 12 (351) | 8 (24) |
| Причина смерти | 6 (18) |
| Диагностический подход . | Всего N = 34 (%) . | |
|---|---|---|
| Клиническое проявление * | ||
| Боль / болезненность / припухлость | 20 (59) | |
| Целлюлит / язва / абсцесс | 8 (24) | Неврологический дефицит (12)|
| Движение болезненно ограничено | 21 (62) | |
| Лихорадка | 8 (24) | |
| Типы инфекции | Прямая инокуляция6 19336 | |
| Гематогенный | 8 (24) | |
| Смежный | 7 (21) | |
| Первоначальное проявление костно-суставной инфекции | ||
| Две кости инфицированы | 903 инфицированные4 (12) | |
| ≥3 инфицированных костей | 2 (6) | |
| Поражение костей | ||
| Череп и лицевые кости | 6 (18) | |
| Верхняя конечность | 2 (6) | |
| Лопатка | 6 | 1 (3) |
| Позвонок | 3 (9) | |
| Бедренная кость | 4 (12) | |
| Остеомиелит тазобедренного сустава / множественные участки | 4 (12) | 4 (12) | 4 (12) | (21)
| Артрит коленного сустава | 2 (6) | |
| Стопа | 4 (12) | |
| Рентгенологические признаки * | 9033 | Увеличение использования ядерного сканирования | 8 (23) |
| TC 99 m / Ga 67 | ||
| Разрушение / эрозия костей | 3 (9) | |
| Lucency | 3 (9) | |
| Некроз | 2 (6) | |
| Не указано | маркеры 7 (21) | |
| СОЭ | ||
| Среднее ± стандартное отклонение | 74 ± 27 | |
| Медиана (диапазон) | 69 (40–107) | |
| WBC SD | 16,891 ± 8,265 | |
| Медиана (диапазон) | 16,150 (7,000–29,400) | |
| Типы биопсии | N = 32 | |
| Открытая хирургическая рана | 903 28Чрескожная пункционная биопсия | 3 (9) |
| Артроскопия | 1 (3) | |
| Задержка диагностики (дни) | 90 335||
| Среднее ± стандартное отклонение | 73 ± 47 | |
| Медиана (диапазон) | 60 (10–180) | |
| Лечение | N = 33 | |
| (один до лечения ) | ||
| Только амфотерицин B | 4 (12) | |
| Только хирургия | 1 (3) | |
| Амфотерицин B + операция | 28 (85) | 45 (5–573) |
| медиана (диапазон) d | ||
| Тип хирургического вмешательства (n = 29) | ||
| Дебридмент | 11 (38) | |
| 5 (17) | ||
| Костная пластика / несколько процедур / | 7 (24) | |
| Аутотрансплантация / фиксация | ||
| Декомпрессивная ламинэктомия | 1 (3.5) | |
| Иссечение | 5 (17) | |
| Результат | ||
| Полный ответ | 14 (41) | |
| Частичный ответ | 6 12 (35) | 8 (24) |
| Приписываемая смерть | 6 (18) |
Прямая прививка была основным механизмом инфекции в 56% случаев, особенно у пациентов, перенесших ранее травму, несчастный случай или предыдущую операцию .Гематогенное распространение произошло в 24% случаев, особенно у пациентов с гематологическими злокачественными новообразованиями и другими иммунными нарушениями. У оставшихся 21% наблюдалось непрерывное распространение.
694″ data-legacy-id=”sec3-6″> Диагностическая визуализация
Костно-суставные аномалии, обнаруженные с помощью различных методов диагностической визуализации, включали остеолитические поражения, деструкцию / эрозию костей, просветление и увеличение поглощения радионуклидов (таблица 3).Магнитно-резонансная томография показала низкую интенсивность сигнала на T1-взвешенных изображениях и участки с высокой интенсивностью сигнала на T2-взвешенных изображениях.
700″ data-legacy-id=”sec4″> Обсуждение
Большинство случаев костно-суставных микозов вызывается видами Aspergillus 11,14,16 и Candida . 8,10,13 Другие костно-суставные микозы вызываются диморфными грибами, которые демонстрируют отличительные клинические проявления, возникают в эндемичных районах, возникают преимущественно у иммунокомпетентных пациентов и развиваются в результате гематогенного распространения. 12 Большинство этих инфекций протекают медленно.
Костно-суставной мукормикоз, для сравнения, неумолимо прогрессирует с поражением мягких тканей и деструкцией костей, что может потребовать ампутации конечности. 19,34 В то время как мукормикоз очень агрессивен и деструктивен для легких, носовых пазух и головного мозга, он более медленный для костей, в среднем время до постановки диагноза составляет 73 дня,
Кроме того, деструктивная природа мукормикозов как возбудителей остеомиелита от конкретных факторов риска и основных состояний, связанных с этими патогенами, представляют собой серьезную проблему для клиницистов из-за ограниченных вариантов лечения и сравнительно высокой напрямую связанной смертности по сравнению с костно-суставными инфекциями, вызванными другими грибами.Важной характеристикой этих полиморфных инфекций является тот факт, что мукормикоз может поражать самые разные кости и суставы без реального предрасположения к очагу инфекции. Локализация зависит от механизма инфекции, поражающей длинные кости после травмы или операции или широкий спектр костей после гематогенного распространения. 56% случаев были вызваны прямой инокуляцией, а не поражением дыхательных путей или диссеминированным заболеванием, вероятно, объясняют более низкую смертность от костно-суставного мукормикоза по сравнению с таковыми при более летальных легочных, синоорбитальных и риноцеребральных формах этих инфекций, которые приближаются к 80%, в зависимости от вида. 6
Как и Aspergillus , 11,14,16 Candida , 10,13 и другие плесени, отличные от Aspergillus , 17 костно-суставные инфекции, преобладают мужские Соотношение мужчин и женщин 2: 1 при мукормикозе костей и суставов. У иммунокомпетентных пациентов наблюдались два основных патогенетических механизма инфицирования. Первая была внебольничной инфекцией путем прямого заражения во время травмы, а вторая – инфекцией, связанной со здоровьем после хирургических вмешательств.Гематогенное распространение особенно наблюдалось у пациентов с гематологическими злокачественными новообразованиями или у пациентов с ослабленным иммунитетом. В отличие от Candida костно-суставных инфекций, о которых сообщалось в результате гематогенного распространения, прямая инокуляция 10 является причиной инфекции для большинства (56%) описанных здесь мукормикозов.
Окончательный диагноз костно-суставного мукормикоза был отложен в среднем на 60 дней с момента появления симптомов и признаков.Этой задержке способствует слабая лихорадка в большинстве случаев, в то время как повышенные маркеры воспаления (СОЭ, лейкоциты) были повышены неспецифически. Локализованная боль, болезненность и припухлость должны побуждать к диагностической визуализации, которая затем приводит к биопсии, если визуализация совместима с костно-суставной инфекцией.
Характеристики диагностической визуализации остеолитического поражения, деструкции / эрозии кости и интенсивности взвешенного сигнала MRI T 2 совместимы с инфекционным процессом, но не характерны для мукормицетов.Таким образом, оценка подозреваемой инфекции мукормицетов костей и суставов должна включать биопсию для культивирования и гистопатологию, а также визуализацию отдельных ленточных гиф в клиническом образце с использованием флуоресцентного красителя.
Костно-суставной мукормикоз представляет собой серьезную диагностическую и терапевтическую проблему. Несмотря на противогрибковое лечение и хирургическое вмешательство, смертность составила 24%, что выше, чем ранее сообщалось, для других грибковых костно-суставных инфекций 12,17 , но меньше процентной смертности для остеомиелита Aspergillus . 11
Как свидетельствуют 85% пациентов в этом отчете, хирургическое вмешательство в сочетании с противогрибковой терапией широко считается важным вариантом лечения остеомиелита мукормицетов и инфекций суставов. Удаление инфицированных тканей и иссечение кости были основными хирургическими стратегиями, применяемыми для местного контроля при остеомиелите мукормицетов. Некоторым пациентам была проведена реконструкция кости с использованием аллотрансплантата. 20 Синовэктомия и протезирование сустава использовались при хирургическом лечении септического артрита.Эти костные реконструкции были выполнены во время второй операции, через несколько недель или месяцев после хирургической обработки раны.
Костная пластика и аутотрансплантация были ведущими интервенционными процедурами, используемыми для реконструкции костно-суставных инфекций mucormycetes. Промежуток между радикальной обработкой раны и реконструкцией составил не менее шести месяцев и 9,6 месяцев при медиане 20 во избежание вторичного инфицирования трансплантата. Это отсроченное восстановление и реконструкция кости может иметь важное значение для контроля рецидива заболевания в трансплантированном материале для реконструкции.
Аналогичным образом, при других костно-суставных инфекциях плесенью большинство пациентов с Aspergillus (67%) и не-Aspergillus (69%) костно-суставных инфекций получали противогрибковую терапию плюс хирургическое вмешательство. 11,17 Для сравнения: 48% пациентов с костно-суставными инфекциями Candida лечили комбинированным противогрибковым и хирургическим вмешательством. 10
Успех лечения костно-суставного мукормикоза зависит от ранней диагностики, этиологического агента, тяжести инфекции, основных факторов хозяина, сопутствующих заболеваний, а также типа и местоположения инфицированной кости.Например, костно-суставная инфекция, вызванная A. elegans с ≥3 типами костей, привела к неблагоприятному прогнозу 30 или ампутации. 33 Среди 34 случаев инфекций костей и суставов, вызванных мукормикозом, медикаментозная терапия во всех случаях включала в себя состав AmB, восемь из которых имели неблагоприятный исход. Амфотерицин B является основным средством для лечения мукромицетозных инфекций костной и суставной ткани. Нет контролируемых исследований, подтверждающих комбинацию противогрибковой терапии костно-суставного мукормикоза.
Рекомендации по лечению костно-суставного мукормикоза требуют противогрибковой терапии амфотерицином B и хирургического вмешательства в большинстве случаев. В совместных руководствах ESCMID и ECCM липосомальный амфотерицин B 49 рекомендован в качестве основного средства первой линии для лечения мукормикоза. Хотя сообщалось о спасительной терапии с использованием позаконазола для лечения мукормикоза, 50,51 она не рекомендуется в качестве первичной терапии. В этом исследовании позаконазол использовался в качестве поддерживающей терапии при лечении четырех пациентов, один из которых умер.Вопрос о том, играет ли изавуконазол, недавно представленный для первичного лечения мукормикоза, 52 роль в лечении костно-суставного мукормикоза, требует дальнейшего изучения. Устранение первичных иммунных нарушений, включая восстановление после нейтропении, отмену кортикостероидов и изменение метаболических нарушений при сахарном диабете, имеет важное значение для успешного лечения костно-суставного мукормикоза.
Таким образом, стандартами текущего лечения этой изнурительной и потенциально смертельной инфекции остаются ранняя диагностика, липосомальный амфотерицин B, хирургическая резекция и устранение дефектов хозяина.
717″ data-legacy-id=”sec5-1″> Декларация интересов
Д. П. К. является консультантом и членом совета директоров и получал оплату за лекции от компаний Schering-Plough, Pfizer и Astellas Pharma US.Д. П. К. также получил грантовую поддержку от Astellas Pharma US и Merck и получил гонорар от Enzon Pharmaceuticals. T. J. W. получил гранты на исследования в области экспериментальных и клинических противомикробных фармакотерапевтических средств от компаний Astellas, Cubist, Novartis, Pfizer и Theravance. Он также был консультантом компаний Astellas, ContraFect, Cubist, Drais, iCo, Novartis, Pfizer, Methylgene, SigmaTau и Trius.
У остальных авторов нет конфликта интересов.
Лечение метастазов в печени у пациентов с нейроэндокринными опухолями в 2012 г.
Нейроэндокринные опухоли (НЭО) представляют собой гетерогенную группу опухолей, которые образуют отдельный объект. Приблизительно у 75–80% пациентов появляются метастазы в печень на момент постановки диагноза, а у 20–25% эти поражения разовьются в ходе болезни.Наличие вторичных отложений в печени значительно увеличивает заболеваемость и смертность у этих пациентов. Единственным потенциально излечивающим методом лечения является хирургическая резекция первичной опухоли и поражения печени. Однако только 10% пациентов поступают в идеальные условия для такого подхода. Было применено несколько методов, направленных на локализованные поражения печени, которые также дали интересные результаты с точки зрения выживаемости и контроля симптомов. То же самое было продемонстрировано с новыми системными методами лечения (таргетной терапией).Однако они все еще изучаются, чтобы определить их истинную роль в ведении таких пациентов. В этой статье в общих чертах рассматриваются различные варианты лечения пациентов с метастазами в печени от нейроэндокринных опухолей.
1. Введение
Нейроэндокринные опухоли (НЭО) представляют собой гетерогенную группу новообразований, обладающих некоторыми биологическими характеристиками, которые рассматриваются как единое целое [1]. В 62–82% случаев НЭО расположены в пищеварительной системе и обозначаются как гастроэнтеропанкреатические нейроэндокринные опухоли (GEP-NET) [2].
Последние данные из Великобритании, Швеции и Швейцарии позволяют предположить, что их заболеваемость составляет 2–3 на 100 000 с более высокой распространенностью среди женщин [1]. Также данные из базы данных программы эпиднадзора, эпидемиологии и конечных результатов (SEER) сообщают об увеличении заболеваемости в период с 1973 по 2004 год с 1,09 до 5,25 / 100000 [3, 4].
NET классически характеризуются своей способностью секретировать гормоны и / или вазоактивные пептиды, что приводит ко многим их клиническим проявлениям, объединяющим определенные гормональные синдромы.Наиболее частым синдромом является карциноидный синдром, который возникает в результате секреции серотонина и включает такие симптомы, как покраснение кожи, тяжелая диарея, спазмы в животе и электролитные нарушения [4, 5]. Их клиническое течение вариабельно, традиционно считалось, что они имеют вялотекущее естественное течение [1, 4]. Однако некоторые НЭО ведут себя агрессивно в отношении быстрого прогрессирования метастатических поражений. Все они обладают потенциалом метастатического распространения и, следовательно, в настоящее время признаны злокачественными новообразованиями [6].Прогноз и подход к НЭО руководствуются в основном гистологической классификацией. Опухоли со степенью 3, митотическим числом более 20/10 мощных полей и / или с индексом пролиферации Ki-67, превышающим 20%, представляют собой агрессивное злокачественное заболевание с быстрым клиническим течением и низкой выживаемостью [4].
Печень – важнейшее место метастазирования [7]. Более 75% пациентов с НЭО тонкой кишки и 30–85% пациентов с НЭО поджелудочной железы имеют метастазы в печень на момент постановки диагноза или в течение болезни.Кроме того, у 5–10% пациентов с НЭО неизвестной первичной локализации на момент постановки диагноза обнаруживаются метастазы в печени [6, 8].
У пациентов с метастазами в печень наблюдается ухудшение заболеваемости и смертности по сравнению с пациентами без этих поражений. Согласно Touzios et al. [9] выживаемость до 5 лет у пациентов с нелеченными метастазами в печень составляет около 13–54%, против 75–99% у пациентов без метастазов в печень [6, 9]. Этот пересмотр направлен на рассмотрение темы GEP-NET с метастазами в печень, их клинического значения, прогноза и текущего терапевтического подхода с особым акцентом на медикаментозное лечение.
2. Клиническая значимость и прогноз метастазов в печени
У пациентов с НЭО часто развиваются метастазы в печень (NLM), что существенно влияет на их заболеваемость и смертность. Около 75–80% пациентов имеют метастазы в печени на момент постановки диагноза (синхронно), в то время как у 20–25% развиваются вторичные поражения в ходе болезни (метахронные) [10]. 5-летняя выживаемость для пациентов с NLM с поддерживающей терапией составляет 0–20% [11].
Наличие метастазов в печени тесно связано с появлением / обострением симптомов.Многие пептиды и гормоны метаболизируются в печени. Наличие метастазов в печени приводит к меньшему метаболизму этих пептидов, что приводит к увеличению их циркулирующих уровней. Иногда только тогда присутствует полный фенотип заболевания. Следовательно, симптоматический контроль является важным аспектом лечения NLM [5].
Поражение печени является важным прогностическим фактором, несмотря на первичную локализацию опухоли. Его распределение, изменяющее терапевтическое лечение, отражает агрессивность опухоли.Метастазы в печени делятся на 3 типа по локализации. Метастазы I типа – это поражения, ограниченные только одной долей печени или двумя соседними сегментами, что соответствует примерно 20–25% случаев. Метастазы типа II включают наличие доминирующего повреждения с небольшими контралатеральными сателлитами (10–15% случаев). Метастазы III типа соответствуют диффузным мультифокальным очагам и являются наиболее распространенными (60–70% случаев). Из-за возможности хирургической резекции тип I ассоциируется с благоприятным исходом.Метастазы III типа имеют худший прогноз в отношении большего поражения печени и отсутствия хирургического доступа. В этой группе пациентов трансплантацию печени можно рассматривать как форму лечения [6].
3. Терапия, нацеленная на печень
Хирургия неизменно доказывала свое превосходство над нехирургической терапией. Однако полное удаление вторичных поражений является вариантом только для небольшого числа пациентов (10–20%) [6].
Терапевтические возможности для пациентов без хирургических показаний в последние годы улучшились [12].Известно, что метастазы в печень обычно представляют собой сильно сосудистые поражения. Васкуляризация возникает в печеночной артерии более чем в 90% случаев. Это отличается от нормальной системы васкуляризации, которая происходит от порта венозной системы [4]. Обработка печеночной артерии предотвращает доставку питательных веществ и кислорода к опухолевым клеткам с их последующим разрушением. По этой причине было разработано несколько методов, использующих двойственность сосудистой сети печени для контроля над болезненным процессом [4].Эти методы включают абляционные методы, эмболизацию печеночной артерии, химиоэмболизацию и радиоэмболизацию (селективную внутреннюю лучевую терапию) [12]. Пациенты с преобладающим метастатическим поражением печени получают наибольшую пользу от этих методов лечения [13].
3.1. Хирургическое лечение
Хирургическая резекция – единственное потенциально излечивающее лечение НЭО. Целесообразность лечения зависит от стадии и проявления заболевания [13, 14]. Даже при поражении печени хирургический подход, когда это возможно, является лучшим вариантом лечения с доказанной пользой с точки зрения общей выживаемости и улучшения качества жизни [1, 6, 12].Пациенты, которым проводилась хирургическая резекция первичной опухоли и метастазов в печень, имели выживаемость в течение 5 лет более 60%, достигая 80% в некоторых исследованиях, с минимальной смертностью (менее 5%) и допустимой заболеваемостью (менее 30%) [ 6, 12]. Пациентам с метастазами в печень, которые не могут быть подвергнуты хирургическому лечению (80–90% случаев), по-прежнему проводится резекция первичной опухоли. Этот подход можно комбинировать с другими видами терапии, направленными на печень, улучшая исход болезни [12, 13, 15]. В этих случаях, когда была резецирована первичная опухоль, лучший симптоматический контроль был достигнут примерно у 90% пациентов.Поэтому купирование симптомов также является критерием хирургического вмешательства [5, 6].
Что касается критериев отбора пациентов с NLM, единого мнения нет, поскольку несколько разработанных исследований включали небольшое количество пациентов и различные хирургические процедуры. Однако, когда возможно полное удаление значительного количества метастазов в печень, всегда следует рассматривать возможность хирургического вмешательства. В недавнем ретроспективном исследовании было проанализировано 74 случая, и 5-летняя выживаемость составила более 60% у всех пациентов, перенесших хирургическую резекцию метастазов в печени.У 65% этих пациентов иссечение было неполным, и ухудшения прогноза не было [6, 12]. Однако необходимо было выявить другие прогностические переменные при отборе пациентов для хирургического вмешательства. Поэтому были проведены клинические исследования, и пациенты были отобраны на основе степени опухоли. Анализ результатов этих исследований показал, что опухоли высокой степени злокачественности имели худший послеоперационный результат по сравнению с опухолями низкой степени злокачественности [12]. NET-опухоли высокой степени злокачественности являются хорошими кандидатами на химиотерапию и, похоже, не получают пользы от хирургического вмешательства.
Внедряя эти результаты в клиническую практику, в 2008 году Европейское общество нейроэндокринных опухолей (ENETS) выпустило общие рекомендации по хирургической резекции, основанные на трех типах поражения печени. Для пациентов с поражением печени I типа хирургическая резекция является первым вариантом лечения, тогда как у пациентов с поражением III типа она полностью исключена [6]. Чтобы обеспечить наилучшее лечение пациентов с опухолями NET, перед операцией следует провести тщательную оценку.Эта оценка должна учитывать следующие аспекты: статус работоспособности, локализация первичной опухоли, степень опухоли, возможность резекции первичной опухоли, наличие и локализация метастазов, возможность полной резекции метастазов, наличие внепеченочного заболевания (необходимо внепеченочное заболевание). исключены на основании адекватных методов изображения), а также наличия или отсутствия карциноидного порока сердца [6, 17]. У пациентов с карциноидным заболеванием сердца необходимо добиться контроля симптомов и клинической стабилизации, прежде чем рассматривать возможность агрессивного хирургического вмешательства.Кроме того, у пациентов с карциноидным синдромом, даже у тех, кто лечится аналогами соматостатина, интра- и послеоперационный карциноидный криз необходимо предотвращать с помощью тех же аналогов соматостатина [6]. Октреотид должен быть доступен во время любой хирургической процедуры. Предоперационное введение октреотида (300 мкг подкожно) может снизить частоту карциноидного криза и рекомендуется пациентам с карциноидным синдромом в анамнезе, которым требуются хирургические вмешательства. Лечение карциноидного криза отличается от лечения других причин острой интраоперационной гипотензии.Симптомы обычно невосприимчивы к одной только жидкостной реанимации. Кальций и катехоламины могут спровоцировать высвобождение медиаторов из опухоли и усугубить, а не облегчить синдром. Во время карциноидного криза артериальное давление следует поддерживать инфузией плазмы и немедленным введением октреотида (300 мкг внутривенно). Может потребоваться непрерывное внутривенное вливание октреотида. У пациентов с высоким риском карциноидного криза капельное введение октреотида может быть начато до операции [1, 18–23].
Наличие поражения брюшных лимфатических узлов, включая местный рецидив, не является абсолютным противопоказанием для хирургического вмешательства, если удаление лимфатических узлов и метастазов в печень и / или рецидивирующих поражений может быть выполнено одновременно или в запланированных поэтапных фазах [6].
Рецидивы после резекции являются обычным явлением, при этом частота рецидивов через 5 лет превышает 97%. Поэтому хирургическая резекция должна быть максимально радикальной. Во время хирургической операции следует проводить обширную лимфаденэктомию и тщательное обследование всей брюшной полости [24].Использование интраоперационной эхографии, по-видимому, имеет дополнительную ценность, поскольку позволяет определить степень известных поражений и обнаружить небольшие дополнительные поражения [6].
Циторедуктивная хирургия может быть полезна для небольшой и ограниченной группы пациентов. Обычно это рекомендуется в случаях, когда можно удалить более 90% опухоли, или у молодых пациентов [6, 12, 20, 25, 26]. Пациентам с симптомами также может помочь циторедуктивная хирургия, поскольку она, по-видимому, повышает эффективность медикаментозной терапии [12].
3.2. Трансплантация печени
Трансплантация печени – это терапевтический подход, направленный на излечение, продление срока выживания или контроль над симптомами карциноида. Трансплантация печени показана только в случае метастатического поражения, если первичная опухоль – NET [12]. В 1998 году Ленерт проанализировал в общей сложности 103 пациента NET с трансплантацией печени. Общая 5-летняя выживаемость составила 47% при выживаемости без болезней 24%. Гистология опухоли и ее первичное расположение не повлияли на выживаемость в этом исследовании, в отличие от объема операции и возраста пациента [12, 27].Однако в более позднем клиническом исследовании первичная локализация в двенадцатиперстной кишке или поджелудочной железе была связана с худшим прогнозом после трансплантации [6, 12, 28]. Однако эти данные не были подтверждены другими исследованиями [12, 29].
Что касается анализа биомаркеров и их корреляции с исходом трансплантации, авторы обнаружили, что пациенты с низким Ki-67 и нормальной экспрессией E-кадгерина имели более благоприятный прогноз. С другой стороны, статус p53 не влиял на прогноз [2].Анализ данных Объединенной сети обмена органами за период с ноября 1988 г. по март 2011 г. показал, что только 185 трансплантаций печени были связаны с NLM. 5-летняя общая выживаемость составила 57,8%, что ниже, чем у пациентов, перенесших трансплантацию по другим причинам / с другими патологиями [12, 14].
У пациентов с диффузным и неоперабельным заболеванием печени с неконтролируемыми симптомами (резистентность к медикаментозной терапии) следует рассмотреть возможность трансплантации печени, которая может быть вариантом у тщательно отобранных пациентов [12].Основными критериями отбора пациентов для трансплантации печени в этих случаях являются отсутствие кандидата на резекцию, диагностику и полную резекцию первичной опухоли по крайней мере за год до этого, отсутствие внепеченочного заболевания, стабильное заболевание как минимум в течение одного года и неудачное завершение операции. лечения [12]. Однако вопрос о трансплантации печени остается спорным.
3.3. Абляционные методы: радиочастотная абляция
Пациенты с сетчатыми опухолями могут быть выбраны для лечения с помощью различных типов абляционных методов, таких как криоабляция, алкогольная абляция (эти две используются реже) и радиочастотная абляция (РЧА).
Криоабляция – наиболее изученный метод термоабляции [30]. Снижение температуры снижает жизнеспособность клеток, и это зависит как от скорости охлаждения, так и от пространственного отношения между образованием льда и зондом для криоабляции [31]. Чем ниже температура (которая должна быть –50 ° C), тем выше вероятность некроза тканей [32].
Алкогольная абляция, также известная как чрескожная инъекция алкоголя (PAI), уже изучалась в различных сериях [33, 34].Этот метод может быть полезен пациентам, у которых метастазы в печени расположены рядом с крупными сосудами или желчными протоками, которые могут быть повреждены теплом, выделяемым во время РЧА [14]. Эти поражения должны быть меньше 5 см [14]. ИАИ следует использовать не как монотерапию, а с другими абляционными техниками, чтобы добиться лучших результатов [35].
РЧА заключается в интенсивном выделении тепла радиочастотными волнами через переменный электрический ток и может выполняться чрескожным или лапароскопическим доступом [12, 13].Такое явление вызывает внутриклеточную ионную вибрацию, приводящую к разрушению клетки [14]. В настоящее время это предпочтительный метод абляции в большинстве крупных центров. Его использование показало пользу для местного контроля заболеваний с быстрым облегчением симптомов [6]. Он в основном используется у пациентов с небольшим количеством поражений печени, которые нельзя удалить, или в качестве «адъюванта» к другим методам лечения [12].
Клиника Кливленда сообщила о крупнейшем клиническом исследовании с участием пациентов с поражениями печени, получавших РЧА.Восемьдесят девять пациентов были обследованы и подверглись в общей сложности 119 лапароскопической РЧА. Результаты показали, что около 90% пациентов испытали немедленное облегчение симптомов после процедуры, а средняя выживаемость без прогрессирования составила 1,3 года. Из этих 89 пациентов у 22% были рецидивы, и из этих 22% рецидивов 63% соответствовали новым поражениям печени и 59% – внепеченочным заболеваниям [36].
Важным ограничением эффективности этого метода является размер опухоли. Кажется, что трудно полностью искоренить поражения размером более 3 см, а поражения более 5 см не подходят для РЧА, как продемонстрировали Mazzagalia et al.[1, 6, 12]. Идеальным количеством для этой терапии считается максимум пять очагов поражения. Наличие большего количества метастатических двулопастных поражений противопоказано к процедуре [17].
РЧА – процедура с низкой заболеваемостью (5–12%) и низкой 30-дневной смертностью (0–1%) [12, 17]. Наиболее частые осложнения включают абсцессы печени, карциноидный криз, билиоплевральный свищ, утечку желчи и плевральный выпот [12].
3.4. Эмболизация печеночной артерии и химиоэмболизация печеночной артерии
Эмболизация печеночной артерии (HAE) и химиоэмболизация печеночной артерии (HACE) – это два различных метода, которые также можно использовать при лечении метастазов в печень.Эмболизация печеночной артерии часто применяется в качестве паллиативной техники у пациентов с преимущественно печеночной метастатической НЭО, которые не являются кандидатами на хирургическую резекцию. Он основан на том принципе, что опухоли в печени получают большую часть кровоснабжения из печеночной артерии, тогда как здоровые гепатоциты получают большую часть своего кровоснабжения из воротной вены.
Используя эту технику, мы можем заблокировать кровоснабжение опухоли питательными веществами и кислородом с последующей ишемией / некрозом [5].Доказано, что этот метод позволяет уменьшить размер поражений и облегчить симптомы [1, 12]. Ретроспективная оценка показала, что высокая частота и длительный регресс заболевания были достигнуты при химиотерапии после HAE. Поэтому к этой методике были добавлены цитостатики, что привело к химиоэмболизации печеночной артерии (HACE). Чаще всего используются доксорубицин, митомицин С, стрептозин и цисплатин [24]. HACE обеспечивает не только блокирование эмболии, но и прямую химиотерапию для этих клеток, увеличивая действие / концентрацию этих агентов (более чем в 20 раз по сравнению с системной химиотерапией) [12].Его преимущества были задокументированы разными авторами, но не было сравнительных исследований между HAE и HACE, демонстрирующих превосходство одного из этих методов [1].
И HAE, и HACE представляют собой паллиативные методы, применяемые у пациентов с неоперабельными поражениями, с диффузным и прогрессирующим заболеванием печени, с симптомами, не контролируемыми медикаментозным лечением, и без нарушения функции печени [13, 24]. Основное преимущество – облегчение симптомов (70–90% пациентов) и контроль роста опухоли (50% пациентов) [1, 24].Средняя продолжительность ответа может быть короткой (вплоть до развития коллатерального кровообращения) и колеблется от 6 до 42 месяцев в неконтролируемой серии пациентов [5, 6].
Эти методы лечения оказались ценным вариантом, особенно для пациентов с более чем 75% поражением печени, тщательно отобранных без дополнительных факторов риска [12].
Так же, как и при других терапевтических процедурах, могут возникнуть сопутствующие осложнения, иногда серьезные. Сепсис, печеночная и почечная недостаточность, карциноидный криз, некротический холецистит и кровотечение из язвенной болезни были зарегистрированы примерно в 7 случаях.От 5 до 23,8% пациентов. Наиболее частым является постэмболизационный синдром (например, лихорадка, боль в животе, лейкоцитоз, повышение уровня трансаминаз и билирубина), который встречается у 90% пациентов, в большинстве случаев самостоятельно купирующийся (продолжительность 24–72 часа) [6, 17 , 24]. Чтобы минимизировать осложнения, рекомендуется разделять обрабатываемую область небольшими порциями в каждом сеансе (одна доля за сеанс) [5, 17]. Обычно требуется несколько сеансов, которые следует проводить с интервалом в 4–6 недель [6, 13].В дальнейшем рекомендуется одновременный прием антибиотиков и аналогов соматостатина, а также агрессивная гидратация для предотвращения абсцессов печени, карциноидного криза и синдрома лизиса опухоли [1, 24]. Использование аналогов соматостатина во время процедуры крайне важно для предотвращения карциноидного криза. Наиболее существенными противопоказаниями являются нарушения свертываемости крови, почечная недостаточность и / или окклюзия печеночной вены [12].
3.5. Селективная внутренняя лучевая микросферная терапия (SIRT)
Внешняя лучевая терапия имеет ограниченное значение при НЭО, она показана только при наличии симптоматических метастазов в головной мозг и кости [37].SIRT – это новый метод, основанный на радиоизотопах малых микросфер, включая иттрий 90 (90Y), которые вводятся непосредственно в печеночную артерию, что приводит к эмболическому блокированию опухолевых клеток, а также подвергает их воздействию радиоактивных агентов.
Saxena et al. [38] исследовали безопасность и эффективность этого лечения у пациентов с NLM. В этом исследовании у 34 пациентов был долгосрочный ответ со средней общей выживаемостью 29,4 месяца с радиологическим улучшением у 50% пациентов.Уровни Cromogranina A снизились до 50% с сохранением ответа в течение примерно 30 месяцев [12, 38]. Kennedy et al. [39] также показали, что основным преимуществом, по-видимому, является стабилизация запущенного заболевания, что позволяет увеличить общую выживаемость, хотя результаты все еще находятся в стадии исследования.
Часто встречаются такие осложнения, как постэмболизационный синдром, с небольшим риском лучевого гастрита и язв [24].
Чтобы понять, как лучше всего использовать это лечение, необходимы дополнительные исследования.
4. Системная терапия
Поскольку НЭО являются редкой патологией, большие рандомизированные исследования у пациентов с НОП трудно проводить. Это ограничение приводит к общей оценке ограниченных системных методов лечения, которые не могут быть преобразованы в согласованный алгоритм лечения. Однако данные, полученные в одном центре исследования, показали, что агрессивное медикаментозное лечение NLM вместо хирургического лечения увеличивает 3-летнюю выживаемость до 76,4% и 5-летнюю выживаемость до 63.9%. Поэтому консервативное лечение, то есть «подожди и смотри», больше не приемлемо [12].
4.1. Аналоги соматостатина (SSA)
Большинство NET экспрессируется на поверхности рецепторов соматостатина их клеток (SSTR 1–5). Их активация подавляет секрецию пептидов и аминов опухолевыми клетками, а также действие факторов роста опухоли, индуцирующих апоптоз [12, 24]. Поскольку природный соматостатин имеет очень короткий период полураспада (2-3 мин), для клинического использования были разработаны аналоги с более длительным периодом полураспада [24].В 1980 году Бауэр и др. [40] синтезировали первый аналог-октреотид.
В основном SSA используется для контроля симптомов. В первоначальном исследовании подкожное введение октреотида в дозе 150 мг 3 раза в сутки улучшило симптомы, особенно карциноидный синдром, у 88% пациентов [39]. Этот препарат широко применялся в последние три десятилетия. Была разработана формула пролонгированного действия, позволяющая принимать один раз в месяц. Однако препараты короткого действия продолжают играть важную роль в стабилизации заболевания, особенно в ситуациях карциноидного криза и его профилактике [24].
В последние годы появились доказательства того, что SSA может обладать противоопухолевой активностью, а также снижать рост опухоли путем прямого воздействия на рецепторы соматостатина. Возможно даже, что специфические рецепторы могут вызывать апоптоз [13]. Первым рандомизированным клиническим исследованием, демонстрирующим возможные противоопухолевые эффекты октреотида длительного действия по сравнению с плацебо, было исследование PROMID [41]. Это исследование показало снижение риска прогрессирования заболевания на 66% и остановку роста опухоли на 69% при среднем значении 14.3 месяца [12]. Стабильное заболевание часто регистрировалось как лучший ответ [41]. Лечение октреотидом LAR кажется более эффективным у пациентов с низкой опухолевой массой печени и удаленной первичной опухолью [4, 41]. Сцинтиграфия с соматостатином позволяет, помимо уровня самооценки, предсказать реакцию пациента на терапию. Используются и другие SSA, такие как ланреотид, и другие, участвовавшие в исследовании, как пасиреотид (он может взаимодействовать с четырьмя рецепторами (ssts1, ssts2, ssts3 и ssts5), в то время как октреотид и ланреотид взаимодействуют только с двумя типами рецепторов) [42].Предварительные данные показывают, что пасиреотид может быть полезен пациентам, которые не реагируют на октреотид, и может контролировать симптомы у 27% пациентов [43].
Тяжелые побочные эффекты при терапии SSA возникают нечасто. Однако тошнота, рвота, диарея, стеаторея, сердечные нарушения, аритмии, гипотиреоз и гипогликемия были зарегистрированы в разных процентах случаев [42, 44, 45]. Холецистит может возникать более чем в 50% случаев из-за его действия как ингибитора сократительной способности желчного пузыря.У пациентов с факторами риска может потребоваться предварительная плановая холецистэктомия [46].
4.2. Интерферон альфа (INF-)
Интерферон представляет собой иммуномодулятор, который подавляет выработку нескольких факторов роста, а также обладает антиангиогенными свойствами. При использовании в лечении NET эти агенты, по-видимому, обладают дополнительной активностью, которая заключается в гиперрегуляции рецепторов соматостатина [13]. Интерферон α может использоваться в функционирующих и нефункционирующих NET, отдельно или в комбинации с SSA ввиду отсутствия ответа при максимальной дозе этих агентов [1].
В некоторых клинических исследованиях лечение INF- α показало симптоматический контроль в 30–70% случаев, со стабильным заболеванием более чем у 70% пациентов [12, 47]. Однако другие исследования не продемонстрировали их эффективности даже в сочетании с SSA. В одном исследовании наблюдалось увеличение 5-летней выживаемости на 37% при использовании одного INF- α до 57% в комбинации с октреотидом [48]. Однако результаты не были статистически значимыми из-за небольшого количества пациентов.Два других небольших рандомизированных исследования показали, что комбинированная терапия увеличивала токсичность без дополнительного увеличения выживаемости [49, 50]. Новые данные свидетельствуют о том, что пегилированный интерферон лучше переносится, а также проявляет некоторую активность. Однако исследования все еще продолжаются [1, 12].
4.3. Радионуклидная терапия с пептидными рецепторами (PRRT)
PRRT – это терапевтический вариант с особыми преимуществами у пациентов с симптоматическим заболеванием и опухолями с положительными рецепторами соматостатина, которые не являются кандидатами на хирургическое вмешательство.В этом методе используется радиоактивный пептид, связанный с SSA, который после взаимодействия с рецептором интернализуется, высвобождая специфическую и локализованную радиоактивность, что позволяет точно уничтожить опухолевые клетки [42, 51, 52]. Он мало влияет на неопухолевые ткани, за исключением почки, мочевого пузыря и костного мозга [52]. Разработано много радионуклидов. Чаще всего используются 177 лютеций и 90 Y, которые отличаются друг от друга по испусканию частиц, энергии частиц и проникновению в ткань [6, 12].PRRT с 177 Lu-DOTA 0 Tyr 3 октреотат кажется более эффективным. Частота ответа опухоли составляет 35%, а стабилизация заболевания – 80–90% [52]. После лечения этими агентами средняя продолжительность ответа составляет 30–36 месяцев [53].
Сцинтиграфия с соматостатином позволяет прогнозировать эффективность PRRT, как и SSA. Низкое поглощение указывает на возможность воздействия на метастазы в печени на 20%, а высокое поглощение указывает на возможность эффективности 60% [53].
4.4. Химиотерапия
Чувствительность NETs к цитотоксической терапии, по-видимому, коррелирует с первичным расположением опухоли и степенью опухоли [13]. Специфичность цитостатика в NLM не очевидна. Клинические исследования показывают их использование в NET в целом, без спецификаций для метастатического поражения печени. Основные исследования появились в НЭО поджелудочной железы [12]. НЭО поджелудочной железы успешно лечили стрептозоцином (СТЗ). Высокая эффективность их использования заключается в комбинации с другими агентами, такими как 5-фторурацил и доксорубицин, но с результатами среднего ответа 9.3 месяца [12, 13].
Дакарбазин – еще одно цитостатическое средство с доказанной эффективностью при НЭО поджелудочной железы, с показателем ответа 34% в исследовании фазы II [54]. Клиническое применение дакарбазина с СТЗ имело ограничения из-за его высокой токсичности [13]. В последнее время использование алкилирующих агентов, таких как темозоломид, кажется многообещающим при этом типе опухолей. В исследовании II фазы эффективность талидомида и темозоламида составила 45% [55]. В ретроспективном исследовании темозоламида и капецитабина частота ответа составила 70%, при этом средняя выживаемость без прогрессирования составила 18 месяцев и 2 года, а общая выживаемость – 92% [56].
Химиотерапия на основе платины может быть полезна пациентам с недифференцированными опухолями высокой степени злокачественности и с метастазами в печени. У этих пациентов химиотерапия является лечением первой линии. Частота ответа составила 42–80% при использовании цисплатина и этопозида и 78% при использовании комбинации оксалиплатина [57–60].
Хотя химиотерапия может использоваться как средство экстренной помощи, она не считается первой линией нехирургического лечения. Кроме того, наличие метастазов в печень связано с плохим ответом по сравнению с НЭО без метастазов в печень [12].
4.5. Таргетная терапия
Обычные химиотерапевтические агенты обладают ограниченной эффективностью при метастазировании НЭО. Несмотря на некоторые положительные результаты в отношении мало дифференцированных карцином и первичных для поджелудочной железы по отношению к другим локализациям, общие показатели ответа низки и влияние на выживаемость невелико [1]. Растущие знания о биологии этих опухолей, а также способность синтезировать новые лекарства, которые мешают терапевтическим целям, дали возможность разработать новые целевые методы лечения, которые могут изменить исход лечения этих пациентов.
NET представляют собой высокососудистые опухоли, которые экспрессируют на своей клеточной поверхности рецепторы фактора роста эндотелия сосудов (VEGF). Прогрессирование опухоли, по-видимому, связано с высоким уровнем циркулирующего VEGF, что делает эту возможную терапевтическую мишень, например, при других новообразованиях [1].
Бевацизумаб (моноклональные антитела), сунитиниб, сорафениб и пазопаниб (ингибиторы тирозинкиназы) были наиболее изученными препаратами для лечения НЭО поджелудочной железы [6].
Бевацизумаб был представлен в рандомизированном клиническом исследовании с участием пациентов, получавших SSA и бевацизумаб, по сравнению с комбинированной терапией Peg INF- α .Превосходство наблюдалось в группе лечения бевацизумабом у 95% пациентов с выживаемостью без прогрессирования 18 месяцев [61].
Сунитиниб был наиболее изученным препаратом. Основываясь на положительных результатах исследований фазы II, сунитиниб был протестирован в двойном слепом исследовании фазы III у пациентов с хорошо дифференцированной и прогрессирующей НЭО поджелудочной железы по сравнению с плацебо. Первичная конечная точка (выживаемость без прогрессирования) была статистически выше среди пациентов, получавших сунитиниб (11,4 месяца по сравнению с 5.5 месяцев в группе плацебо). Также положительным оказался показатель объективного ответа – 9,3% при стабилизации заболевания у 63% пациентов [62]. В этом клиническом исследовании было 95% пациентов с метастазами, включая метастазы в печень, в группе лечения и 94% в группе плацебо (рис. 1). Однако это исследование было преждевременно прекращено из-за большого количества нежелательных явлений и смертей в группе плацебо [1, 12].
Путь mTOR имеет большое значение, поскольку он мешает контролю клеточного роста, апоптоза и синтеза белка.Наличие аномалий пути mTOR признано в NET, и эти аномалии также считаются частично ответственными за развитие этих опухолей. Два ингибитора mTOR были изучены в НЭО поджелудочной железы, Темсиролимус и Эверолимус [12].
Во II фазе клинического исследования Эверолимуса была продемонстрирована частота ответа 9,6% и стабилизация заболевания у 67,8% пациентов [16]. Последующее исследование III фазы (исследование RADIANT) подтвердило его активность у пациентов с хорошо и умеренно дифференцированной прогрессирующей НЭО поджелудочной железы с выживаемостью без прогрессирования 11.1 месяц и 4,6 месяца в группе плацебо [63]. В группе эверолимуса у 94,8% пациентов были метастазы в печень, по сравнению с 93,3% пациентов в группе эверолимуса плюс LAR. Лечение переносилось очень хорошо. Большинство побочных эффектов были 1-2 степени (стоматит, диарея, сыпь, утомляемость и инфекции) [1].
5. Заключение
NET часто метастазируют в печень, а наличие метастазов в печень ухудшает прогноз пациентов, увеличивая заболеваемость и смертность.Для ведения пациентов с NLM были разработаны различные терапевтические варианты. Хирургическая резекция остается золотым стандартом, особенно при хорошо дифференцированных резектабельных поражениях, а также улучшает симптоматический контроль в отдельных случаях.
Другие методы, направленные на печень, также предпочтительны, особенно при наличии преимущественно заболеваний печени. Кроме того, их можно комбинировать друг с другом, а также с хирургией и системной терапией, что позволяет расширить спектр лечения и повысить общую выживаемость и выживаемость без прогрессирования.Эти методы включают РЧА в ситуациях локального поражения печени до 3 см в диаметре и HACE в случае диффузного заболевания печени
Системная терапия важна для контроля симптомов, особенно при карциноидных опухолях, с помощью SSA. Для тех пациентов, которые не являются кандидатами на операцию, SSA также может предложить контроль прогрессирования заболевания при НЭО низкой степени. Эти агенты остаются основой медикаментозной терапии метастатических карциноидных опухолей.
В рНЭО, особенно в НЭО высокой степени злокачественности с метастазами в печень, химиотерапия играет важную роль.
Совсем недавно было показано, что ингибиторы пути mTOR и пути VEGF очень перспективны для контроля прогрессирования заболевания в pNET. Их роль в опухолях высокой степени злокачественности неизвестна, и при необходимости их можно использовать вместе с SSA.
Есть еще несколько вопросов, которые необходимо решить в будущих исследованиях. Например, предотвращение прогрессирования опухоли – одно из основных направлений исследований. В этой области оценивается роль октреотида LAR (в запущенных опухолях, отличных от тонкой кишки), ланреотида (в нефункционирующих NET уже ведутся исследования) и пасиреотида (SOM230 в NET из всех мест происхождения).Использование эверолимуса и сунитиниба на ранних стадиях опухолей – еще один интересный вопрос, и его роль в предотвращении прогрессирования опухоли еще предстоит определить.
Врачи и пациенты NET также ждут руководств, которые признают лучший подход к лечению пациентов с опухолями 3 степени любого происхождения и локализации. Комбинация низкомолекулярных ингибиторов и химиотерапии может быть вариантом.
Комбинация молекулярной таргетной терапии и химиотерапии, а именно SSA плюс химиотерапия, темозоламид и эверолимус или темозоламид, и сунитиниб у пациентов с pNET также должна быть рассмотрена в клинических испытаниях.
Конфликт интересов
Т. Амарал работает медицинским консультантом в INFARMED-Autoridade Nacional do Medicamento e produtos de Saúde., IP, Национальное управление лекарственных средств и товаров медицинского назначения, I.P. Л. Коста получал гонорары и гранты на исследования от компаний Novartis и Amgen, а гонорары докладчиков от компаний Novartis и Amgen. Остальные авторы не раскрывают никакой информации.
Может ли гипербарическая оксигенотерапия (ГБО) уменьшить повреждение почек у диабетиков с сахарным диабетом? От доклинических моделей до метаболомики человека на JSTOR
AbstractДиабетическая болезнь почек (ДБП) – ведущая причина терминальной почечной недостаточности в западном мире.Современное лечение диабетической болезни почек основывается на диетическом менеджменте и медикаментозном лечении для достижения метаболического контроля. Здесь мы обсуждаем потенциальное применение гипербарической оксигенотерапии (ГБО) для лечения диабетической болезни почек (ДБП), лечения, при котором пациенты должны дышать 100% кислородом при повышенном атмосферном давлении. ГБО традиционно применяли для лечения диабетических язв стопы (DFU), резистентных к традиционным методам лечения. Успешные клинические ответы, наблюдаемые в DFU, обеспечивают терапевтическое обоснование для тестирования HBOT в условиях DKD.Как DFU, так и DKD имеют заболевание эндотелия сосудов микрососудов как общий основной патологический признак. Подтверждающие доказательства HBOT при DKD получены из предыдущих исследований на животных и из нашего предварительного проспективного клинического исследования, о котором сообщается здесь. Мы сообщаем метаболомные данные в моче, полученные от пациентов, перенесших HBOT для DFU, до и после воздействия HBOT в течение 6 недель. Предварительные данные подтверждают концепцию, что HBOT может снизить биомаркеры почечного повреждения, оксидантного стресса и митохондриальной дисфункции у пациентов, получающих HBOT для DFU.Необходимы дальнейшие исследования, чтобы подтвердить эти первоначальные данные и сопоставить их с одновременными измерениями функции почек. ГБО является безопасным и эффективным средством лечения DFU, а также может применяться для людей с DKD.
Информация журналаCell Stress & Chaperones публикует фундаментальные и прикладные исследования клеточных реакций на стресс у животных, микроорганизмов и растений. Клеточный стресс в широком смысле включает в себя клеточные реакции на тепловой шок, окислительный стресс, тяжелые металлы и токсичные химические вещества.Молекулярные шапероны включают не только традиционные белки теплового шока, но и другие белки, которые способствуют укладке белков и поддерживают гомеостаз белков. Журнал является форумом для исследовательского сообщества, отражающим творческое напряжение между теми, кто занимается изучением механизмов и новыми феноменологическими исследованиями. Исследования структуры, функции и регуляции шаперонов и их генов дополняются прикладными исследованиями клеточных стрессовых реакций в молекулярной медицине, иммунологии, токсикологии и биологии окружающей среды.
Информация об издателеМиссия Cell Stress Society International заключается в содействии международному сотрудничеству и обмену информацией между учеными и общественностью в отношении как фундаментальных, так и прикладных исследований реакций клеток на стресс, в частности, и биологических взаимодействий между организмом и окружающей средой в целом, и включает публикацию Cell Стресс и шапероны.
Генетическая основа подверженности риску падения в исследовании биобанка Великобритании
Рубинштейн, Л. З. Падения у пожилых людей: эпидемиология, факторы риска и стратегии профилактики. Возраст Старение 35 , ii37 – ii41 https://doi.org/10.1093/ageing/afl084 (2006).
Verma, S. K. et al. Падения и связанные с ними травмы среди взрослых, проживающих в сообществах в США. PLoS ONE 11 , e0150939 (2016).
PubMed PubMed Central Статья CAS Google Scholar
Heinrich, S., Rapp, K., Rissmann, U., Becker, C. & König, H.-H. Цена падений в старости: систематический обзор. Остеопорос. Int. 21 , 891–902 (2010).
CAS PubMed Статья PubMed Central Google Scholar
Hartholt, K. A. et al. Цена падений для стареющего населения: общенациональное исследование, проведенное в Нидерландах (2007–2009 гг.). Травма 43 , 1199–1203 (2012).
PubMed Статья PubMed Central Google Scholar
Тинетти, М. Э., Спичли, М. и Гинтер, С. Ф. Факторы риска падений среди пожилых людей, живущих в сообществе. N. Engl. J. Med. 319 , 1701–1707 (1988).
CAS PubMed Статья PubMed Central Google Scholar
Graafmans, W. C. et al.Падения в пожилом возрасте: проспективное исследование факторов риска и профилей риска. Am. J. Epidemiol. 143 , 1129–1136 (1996).
CAS PubMed Статья PubMed Central Google Scholar
Гейл, К. Р., Купер, К. и Айхи Сэйер, А. Распространенность и факторы риска падений у пожилых мужчин и женщин: Английское лонгитюдное исследование старения. Возраст Старение 45 , 789–794 (2016).
PubMed PubMed Central Статья Google Scholar
Вагнер, Х., Мельхус, Х., Педерсен, Н. Л. и Микаэльссон, К. Наследование нарушенного баланса: общенациональное когортное исследование близнецов. Остеопорос. Int. 20 , 577–583 (2009).
CAS PubMed Статья PubMed Central Google Scholar
Ортега-Алонсо, А.и другие. Двойное исследование наследуемости способности ходить среди женщин старшего возраста. J. Gerontol. A. Biol. Sci. Med. Sci. 61 , 1082–1085 (2006).
PubMed Статья PubMed Central Google Scholar
Рид, Т., Фабсиц, Р. Р., Селби, Дж. В. и Кармелли, Д. Генетические влияния и нормы силы хвата у мужчин в возрасте 59–69 лет, участвовавших в исследовании близнецов NHLBI. Ann. Гм. Биол . 18, , 425–432 (1991).
Just, K. S., Schneider, K. L., Schurig, M., Stingl, J. C. & Brockmöller, J. Falls: неблагоприятная реакция на лекарства у пожилых людей и влияние фармакогенетики. Фармакогеномика 18 , 1281–1297 (2017).
CAS PubMed Статья PubMed Central Google Scholar
Ham, A.C. et al. Генотипы CYP2C9 изменяют риск падений, связанных с бензодиазепинами: оригинальные результаты трех исследований с метаанализом. J. Am. Med. Реж. Доц. 18 , 88.e1–88.e15 (2017).
Артикул Google Scholar
Pajala, S. et al. Генетические факторы и предрасположенность к падениям у пожилых женщин. J. Am. Гериатр. Soc. 54 , 613–618 (2006).
PubMed Статья PubMed Central Google Scholar
Джадсон, Р. Н. и др. Функциональный вариант ACTN3 577X увеличивает риск падения у пожилых женщин: результаты двух крупных независимых когортных исследований. J. Gerontol. Сер. А 66А , 130–135 (2011).
CAS Статья Google Scholar
van Wijngaarden, J. P. et al. Обоснование и дизайн исследования B-PROOF, рандомизированного контролируемого исследования влияния дополнительного приема витамина B12 и фолиевой кислоты на частоту переломов. BMC Geriatr. 11 , 80 (2011).
PubMed PubMed Central Статья CAS Google Scholar
Икрам, М.А. и др. Цели, дизайн и основные выводы Роттердамского исследования до 2020 года. Eur J Epidemiol. 35 , 483–517 (2020).
PubMed PubMed Central Статья Google Scholar
Тимпсон, Н. Дж., Гринвуд, К. М. Т., Соранцо, Н., Лоусон, Д. Дж. И Ричардс, Дж. Б. Генетическая архитектура: форма генетического вклада в человеческие черты и болезни. Нат. Преподобный Жене. 19 , 110–124 (2018).
CAS PubMed Статья PubMed Central Google Scholar
Юсден, Дж., Льюис, К. М. и О’Рейли, П. Ф. PRSice: программное обеспечение для оценки полигенного риска. Биоинформатика 31 , 1466–1468 (2015).
CAS Статья Google Scholar
Bulik-Sullivan, B. et al. Атлас генетических корреляций между болезнями и особенностями человека. Нат. Genet. 47 , 1236–1241 (2015).
CAS PubMed PubMed Central Статья Google Scholar
Wu, Y. et al. Полногеномное ассоциативное исследование употребления лекарств и связанных заболеваний в Биобанке Великобритании. Нат. Commun. 10 , 1891 (2019).
PubMed PubMed Central Статья CAS Google Scholar
de Leeuw, C. A., Mooij, J. M., Heskes, T. & Posthuma, D. MAGMA: обобщенный анализ набора генов данных GWAS. PLoS Comput. Биол. 11 , e1004219 (2015).
PubMed PubMed Central Статья CAS Google Scholar
Liu, M. et al. Ассоциативные исследования с участием до 1,2 миллиона человек позволяют по-новому взглянуть на генетическую этиологию употребления табака и алкоголя. Нат. Genet. 51 , 237–244 (2019).
CAS PubMed PubMed Central Статья Google Scholar
Уолтерс, Р. К. и др. Трансанцестральный GWAS алкогольной зависимости выявляет общие генетические основы психических расстройств. Нат. Neurosci. 21 , 1656–1669 (2018).
CAS PubMed PubMed Central Статья Google Scholar
Локк, А.E. et al. Генетические исследования индекса массы тела позволяют по-новому взглянуть на биологию ожирения. Природа 518 , 197–206 (2015).
CAS PubMed PubMed Central Статья Google Scholar
Tikkanen, E. et al. Биологическое понимание мышечной силы: генетические данные в британском биобанке. Sci. Док. 8 , 6451 (2018).
PubMed PubMed Central Статья CAS Google Scholar
Gill, D. et al. Использование генетических вариантов, связанных с гипотензивными препаратами, для информирования об эффективности и побочных эффектах. Тираж 140 , 270–279 (2019).
CAS PubMed PubMed Central Статья Google Scholar
Bowden, J. et al. Оценка пригодности сводных данных для двухвыборочного менделевского рандомизационного анализа с использованием регрессии MR-Эггера: роль статистики I2. Внутр.J. Epidemiol. 45 , 1961–1974 (2016).
PubMed PubMed Central Статья Google Scholar
Стивс К.Дж., Спектор Т.Д. и Джексон С.Х.Д. Старение, гены, окружающая среда и эпигенетика: что исследования близнецов говорят нам сейчас и в будущем. Возраст Старение 41 , 581–586 (2012).
PubMed Статья PubMed Central Google Scholar
Reynolds, C.A. et al. Количественный генетический анализ моделей скрытых кривых роста когнитивных способностей в зрелом возрасте. Дев. Psychol. 41 , 3–16 (2005).
PubMed Статья PubMed Central Google Scholar
Trajanoska, K. et al. Оценка генетических и клинических детерминант риска перелома: полногеномное исследование ассоциации и менделевской рандомизации. BMJ 362 , k3225 (2018).
PubMed PubMed Central Статья Google Scholar
Stone, K. L. et al. МПК на нескольких участках и риск переломов нескольких типов: отдаленные результаты исследования остеопоротических переломов. J. Bone Miner. Res. 18 , 1947–1954 (2003).
PubMed Статья PubMed Central Google Scholar
Траяноска, К.и другие. Частота переломов и долгосрочные тенденции в период с 1989 по 2013 год в популяционной когорте: Роттердамское исследование. Кость 114 , 116–124 (2018).
PubMed Статья PubMed Central Google Scholar
Масуд Т. и Моррис Р. О. Эпидемиология падений. Возраст Старение 30 , 3–7 (2001).
PubMed Статья PubMed Central Google Scholar
Ярвинен, Т. Л. Н., Сиеванен, Х., Хан, К. М., Хейнонен, А. и Каннус, П. Смещение акцента в профилактике переломов с остеопороза на падения. BMJ 336 , 124–126 (2008).
PubMed PubMed Central Статья Google Scholar
Geusens, P. et al. Связь между падениями, остеопорозом и переломами в анамнезе у женщин в постменопаузе. Arch. Phys. Med. Rehabil. 83 , 903–906 (2002).
PubMed Статья PubMed Central Google Scholar
Medina-Gomez, C. et al. Полногеномное ассоциативное исследование на протяжении всей жизни, метаанализ МПК всего тела и оценка возрастных эффектов. Am. J. Hum. Genet. 102 , 88–102 (2018).
CAS PubMed PubMed Central Статья Google Scholar
Caubit, X.и другие. Делеция TSHZ3 вызывает синдром аутизма и дефекты корковых проекционных нейронов. Нат. Genet. 48 , 1359–1369 (2016).
CAS PubMed PubMed Central Статья Google Scholar
Kang, H.J. et al. Пространственно-временной транскриптом человеческого мозга. Природа 478 , 483–489 (2011).
CAS PubMed PubMed Central Статья Google Scholar
Kajiwara, Y. et al. FE65 связывает Teashirt, подавляя экспрессию специфической для приматов каспазы-4. PLoS ONE 4 , e5071 (2009 г.).
PubMed PubMed Central Статья CAS Google Scholar
Международный консорциум по молекулярно-генетическим исследованиям аутизма. Полный скрининг генома на аутизм с доказательствами сцепления с областью хромосомы 7q. Hum. Мол. Genet. 7 , 571–578 (1998).
CAS Статья Google Scholar
Liu, J. et al. Полногеномный скрининг локусов предрасположенности к аутизму. Am. J. Hum. Genet. 69 , 327–340 (2001).
CAS PubMed PubMed Central Статья Google Scholar
Hussman, J. P. et al. GWAS-анализ снижения шума указывает на изменение регуляции роста нейритов и наставлений при аутизме. Мол. Аутизм 2 , 1 (2011).
PubMed PubMed Central Статья Google Scholar
Yengo, L. et al. Мета-анализ полногеномных ассоциативных исследований роста и индекса массы тела у ~ 700 000 человек европейского происхождения. Hum. Мол. Genet. 27 , 3641–3649 (2018).
CAS PubMed PubMed Central Статья Google Scholar
Моррис, Дж. А. и др. Атлас генетических влияний на остеопороз у людей и мышей. Нат. Genet. 51 , 258–266 (2019).
CAS PubMed Статья PubMed Central Google Scholar
Ганц, Д. А., Хигаши, Т. и Рубенштейн, Л. З. Мониторинг относится к когортным исследованиям пожилых людей, проживающих в общинах: влияние интервала воспоминаний. J. Am. Гериатр. Soc. 53 , 2190–2194 (2005).
PubMed Статья PubMed Central Google Scholar
Чой, С. В., Мак, Т. С. Х. и О’Рейли, П. Ф. Учебное пособие: руководство по проведению анализа полигенных оценок риска. Nat Protoc. 15 , 2759–2772 (2020).
CAS PubMed Статья PubMed Central Google Scholar
Чарльзуорт, К. Дж., Смит, Э., Ли, Д.С. Х., Альрамадхан, Ф. и Одден, М. С. Полифармация среди взрослых в возрасте 65 лет и старше в США: 1988–2010 гг. J. Gerontol. A. Biol. Sci. Med. Sci. 70 , 989–995 (2015).
CAS PubMed PubMed Central Статья Google Scholar
de Vries, M. et al. Препараты, повышающие риск падений: систематический обзор и метаанализ: I. Сердечно-сосудистые препараты. J. Am. Med. Реж. Доц. 19 , 371.e1–371 (2018). e9.
Артикул Google Scholar
Seppala, L.J. et al. Препараты, повышающие риск падений: систематический обзор и метаанализ: II. Психотропики. J. Am. Med. Реж. Доц. 19 , 371.e11–371 (2018). e17.
Артикул Google Scholar
Seppala, L.J. et al. Препараты, повышающие риск падений: систематический обзор и метаанализ: III.Другие. J. Am. Med. Реж. Доц. 19 , 372.e1–372 (2018). e8.
Артикул Google Scholar
Khera, A. V. et al. Полногеномные полигенные оценки распространенных заболеваний выявляют людей с риском, эквивалентным моногенным мутациям. Нат. Genet. 50 , 1219–1224 (2018).
CAS PubMed PubMed Central Статья Google Scholar
Морленд, Дж. Д., Ричардсон, Дж. А., Голдсмит, К. Х. и Клас, К. М. Слабость и падения мышц у пожилых людей: систематический обзор и метаанализ. J. Am. Гериатр. Soc. 52 , 1121–1129 (2004).
PubMed Статья PubMed Central Google Scholar
Fjeldstad, C., Fjeldstad, A. S., Acree, L. S., Nickel, K. J. & Gardner, A. W. Влияние ожирения на падения и качество жизни. Dyn. Med. 7 , 4 (2008).
PubMed PubMed Central Статья Google Scholar
Митчелл, Р. Дж., Лорд, С. Р., Харви, Л. А. и Клоуз, Дж. С. Т. Связь между ожирением и избыточной массой тела и риском падения, состоянием здоровья и качеством жизни пожилых людей. Aust. Н. З. Дж. Общественное здравоохранение 38 , 13–18 (2014).
PubMed Статья PubMed Central Google Scholar
Dutil, M. et al. Влияние ожирения на контроль баланса у пожилых женщин, проживающих в общинах. Возраст 35 , 883–890 (2013).
PubMed Статья PubMed Central Google Scholar
Такакусаки К. Функциональная нейроанатомия для контроля осанки и походки. J. Mov. Disord. 10 , 1–17 (2017).
PubMed PubMed Central Статья Google Scholar
Gangavati, A. et al. Гипертония, ортостатическая гипотензия и риск падений среди пожилых людей, проживающих в сообществе: поддержание баланса, независимого образа жизни, интеллекта и энтузиазма у пожилых людей в Бостоне. J. Am. Гериатр. Soc. 59 , 383–389 (2011).
PubMed PubMed Central Статья Google Scholar
Schlick, C. et al. Падения и страх падения при головокружении и нарушениях равновесия: контролируемое перекрестное исследование. J. Vestib. Res. 25 , 241–251 (2016).
PubMed Статья PubMed Central Google Scholar
Horikoshi, M. et al. Общегеномные ассоциации веса при рождении и корреляции с заболеванием взрослых. Природа 538 , 248–252 (2016).
CAS PubMed PubMed Central Статья Google Scholar
Берри, С. Д. и Миллер, Р. Р. Фолс: эпидемиология, патофизиология и связь с переломом. Curr. Остеопорос. Док. 6 , 149–154 (2008).
PubMed PubMed Central Статья Google Scholar
Sudlow, C. et al. UK Biobank: ресурс открытого доступа для выявления причин широкого спектра сложных заболеваний среднего и пожилого возраста. PLOS Med. 12 , e1001779 (2015).
PubMed PubMed Central Статья Google Scholar
Консорциум, H. R. et al. Контрольная панель из 64 976 гаплотипов для вменения генотипа. Нат. Genet. 48 , 1279–1283 (2016).
Артикул CAS Google Scholar
Уэлш, С., Пикман, Т., Шеард, С. и Алмонд, Р. Сравнение методологии количественной оценки ДНК, использованной в протоколе выделения ДНК для когорты биобанка Великобритании. BMC Genomics 18 , 26 (2017).
PubMed PubMed Central Статья CAS Google Scholar
Loh, P.-R. и другие. Эффективный байесовский анализ смешанной модели увеличивает силу ассоциации в больших когортах. Нат. Genet. 47 , 284–290 (2015).
CAS PubMed PubMed Central Статья Google Scholar
Ватанабе К., Таскесен Э., ван Боховен А. и Постума Д. Функциональное картирование и аннотация генетических ассоциаций с FUMA. Нат. Commun. 8 , 1826 (2017).
PubMed PubMed Central Статья CAS Google Scholar
Lonsdale, J. et al. Проект “Экспрессия генотипа-ткани” (GTEx). Нат. Genet. 45 , 580–585 (2013).
CAS Статья Google Scholar
Bulik-Sullivan, B.K. et al. Регрессия по шкале LD отличает искажение от полигенности в полногеномных ассоциативных исследованиях. Нат. Genet. 47 , 291–295 (2015).
CAS PubMed PubMed Central Статья Google Scholar
Yang, J. et al. Факторы геномной инфляции при полигенном наследовании. Eur. J. Hum. Genet. 19 , 807–812 (2011).
PubMed PubMed Central Статья Google Scholar
Zheng, J. et al. LD Hub: централизованная база данных и веб-интерфейс для выполнения регрессии оценки LD, которая максимизирует потенциал данных GWAS сводного уровня для анализа наследственности SNP и генетической корреляции. Биоинформатика 33 , 272–279 (2017).
CAS PubMed PubMed Central Статья Google Scholar
Kemp, J. P. et al. Идентификация 153 новых локусов, связанных с минеральной плотностью пяточной кости и функциональным участием GPC6 в остеопорозе. Нат. Genet. 49 , 1468–1475 (2017).
CAS PubMed PubMed Central Статья Google Scholar
Finucane, H. K. et al. Обогащение наследуемости специфически экспрессируемых генов позволяет идентифицировать ткани и типы клеток, связанные с заболеванием. Нат. Genet. 50 , 621–629 (2018).
CAS PubMed PubMed Central Статья Google Scholar
Finucane, H. K. et al. Разделение наследуемости по функциональной аннотации с использованием сводной статистики ассоциаций по всему геному. Нат. Genet. 47 , 1228–1235 (2015).
CAS PubMed PubMed Central Статья Google Scholar
Яворска, О. и Берджесс, С. Менделевская рандомизация: пакет R для выполнения менделевского рандомизационного анализа с использованием обобщенных данных. Внутр. J. Epidemiol. 46 , 1734–1739 (2017).
PubMed PubMed Central Статья Google Scholar
Субаксиальный подвывих ревматоидного шейного отдела позвоночника
13 | Цервикальный шип J2 Grauer |
| Клинический случай |
год пациентки, прошедший медицинский осмотр,
год Анамнез, значимый для ревматоидного артрита (РА), по поводу которого она лечилась модифицирующими течение заболевания противоревматическими препаратами, включая преднизон, в течение последних 17 лет был направлен для оценки боли в шее и затылочных головных болей.Эти симптомы постепенно ухудшались за последние 6 месяцев.
Она заявила, что у нее были проблемы с мелкой моторикой рук в течение многих лет из-за деформации кисти, но в последние несколько месяцев она чувствовала себя более «неуклюжей». Она чаще роняла предметы. Она также шаталась на ногах, так как за последние 2 месяца несколько раз падала на землю. Она отрицала какие-либо изменения в контроле мочеиспускания или кишечника.
При физикальном обследовании выявлено болезненное уменьшение объема движений шейки матки.Она отметила ощущение хлопанья, когда ее шея была вытянутой (положительный тест Шарпа-Персера). Неврологическое обследование было отмечено признаком Лермитта с симптомами на правой руке и туловище. Моторную силу было трудно оценить из-за боли и периферических изменений. Сенсорные и черепные нервы практически не пострадали. У нее было 3+ рефлекса на верхних конечностях (включая перевернутый лучевой компонент справа), 2+ рефлекса на нижних конечностях и двусторонние положительные признаки Гофмана и Бабинского, от пяти до шести ударов клонуса и походка с широкой базой ( Рис.13–1 ).
Результаты рентгенологического исследования
Переднезадние и боковые рентгенограммы ( Рис. 13–2 ) демонстрируют обширные дегенеративные изменения, атлантоаксиальный подвывих (AAS), а также многоуровневые субаксиальные подвывихи (SAS) (C2-3, C4-5 и C7 -T1 3,9 мм, 3,6 мм и 3,2 мм соответственно, с пространством для шнура (SAC) 10,8 мм, 9,5 мм и 10,1 мм соответственно). Рис. 13–3. – рентгенограммы бокового сгибания и разгибания, которые показывают сокращение C1-2 и C2-3 с разгибанием и статическим антеролистезом C4-5 и C7-T1. На рис. 13–4 показаны типичные сагиттальные компьютерные томографические (КТ) и магнитно-резонансные (МР) изображения.
Рисунок 13–1 Иллюстрация, показывающая шейные измерения субаксиальных подвывихов (SAS) и пространство, доступное для пуповины (SAC). (Из Grauer JN, Tingstad EM, Rand N, Christie MJ, Hilibrand AS. Предикторы паралича ревматоидного шейного отдела позвоночника у пациентов, перенесших тотальную артропластику сустава. J Bone Joint Surg Am 2004; 86: 1420-1424. Адаптировано с разрешения.)
Рис. 13–2 Переднезадние и боковые рентгенограммы данного случая, показывающие дегенеративные изменения и антеролистезы C1-2, C2-3, C4-5, C7-T1.
Рис. 13–3 (A) Боковое сгибание и (B) рентгенограммы разгибания демонстрируют сокращение C1 -2 и C2-3 с разгибанием и статическим антеролистезом C4-5 и C7-T1.
Рис. 13–4 (A) Сагиттальное компьютерное томографическое и (B) магнитно-резонансное изображение примера случая, демонстрирующее анатомию костных и нервных элементов.
Диагноз
На основании анамнеза, физического осмотра и динамических рентгенограмм был поставлен диагноз субаксиальной нестабильности и миелопатии.
| Предпосылки |
РА – системное аутоиммунное заболевание неизвестной этиологии, в первую очередь поражающее синовиальную оболочку. Локальная среда, созданная воспалительным процессом, приводит к разрушению суставных поверхностей, суставных капсул и прилегающих связок. 1 Хотя наиболее часто поражаются суставы кистей и стоп, 2 поражение шейного отдела позвоночника также часто встречается из-за важной стабилизирующей роли синовиальных суставов, таких как суставы C1-2 и фасеточных суставов по всей субаксиальной части позвоночника. . 3 Фактически, Winfield et al. Показали, что у большинства пациентов наблюдаются рентгенологические изменения шейного отдела позвоночника в течение первых 2 лет после постановки диагноза РА. 4
Эрозивные изменения шейного отдела позвоночника, связанные с РА, могут привести к нестабильности, деформации и неврологическим последствиям. 1 Эти изменения делятся на три категории: AAS, базилярная инвагинация (BI) и SAS. ААС является наиболее распространенным заболеванием, составляющим 66% ревматоидных подвывихов шейки матки. BI наблюдается в 20% и почти всегда предшествует AAS. Наконец, САС наблюдается у 20-25% пациентов с подвывихами шейки матки. 5 – 7 Предыдущая глава посвящена AAS и BI, тогда как в этой главе основное внимание уделяется SAS.
САС является результатом эрозий фасеточных и дисковертебральных суставов 8 и представляет собой относительно позднее проявление ревматоидного заболевания шейного отдела позвоночника. 2 , 7 , 9 Чаще всего это происходит на уровнях C2-3 и C3-4, но часто затрагивает несколько смежных уровней, образуя характерную «ступенчатую» деформацию. 10 , 11 Существует несколько различных определений субаксиальных подвывихов.
При оценке естественного течения шейных изменений при РА, Fujiwara et al наблюдали за 161 пациентом с консервативным лечением в течение минимум 5 лет (от 5 до 20 лет). 12 В начале исследования у четырех пациентов был САС. В течение периода наблюдения у 14 пациентов развился САС. У семнадцати из 18 пациентов с САС в конце исследования также были изменения верхних отделов шейки матки. Они сообщили, что средняя продолжительность РА в начале САС составляла 13,4 года. Как правило, при оценке динамических рентгенограмм SAS прогрессировал от восстанавливаемого поражения до необратимого поражения. Другие авторы аналогичным образом наблюдали, что основным фактором риска развития подвывиха шейки матки является тяжесть и продолжительность основного ревматоидного заболевания 2 , 9 и употребление стероидов. 13
Ямаути и др. Предположили, что по мере уменьшения подвижности верхнего шейного отдела позвоночника возрастающее напряжение передается на нижний шейный отдел позвоночника, что приводит к субаксиальной нестабильности. 14 Kraus et al. Продемонстрировали, что затылочно-шейный спондилодез коррелировал со значительно более высокой частотой послеоперационного САС, чем атлантоаксиальный спондилодез (36% против 5,5%). 16 Matsunaga et al. Продемонстрировали связь между положением затылка и оси (угол O – C2) с послеоперационными SAS затылочно-шейного слияния.Угол O – C2 определялся как угол между линией МакГрегора и нижней поверхностью оси. Углы по часовой стрелке относительно нижней поверхности оси обозначены как плюс (+), а против часовой стрелки – как минус (-). Следовательно, плюс (+) относится к углам, при которых голова была зафиксирована / сращена при разгибании, и минус (-) при сгибании. Частота возникновения САС была значительно выше у пациентов с аномальным углом минус O – C2 (85,7%), чем у пациентов с нормальным (от 0 до 30 градусов) или положительным углом O – C2 (4.1%). 17 Учитывая связь верхнего шейного спондилодеза с SAS, было бы оптимальным иметь критерии, позволяющие предсказать, у каких пациентов с большей вероятностью разовьются изменения среднего и нижнего шейного отдела позвоночника после хирургического спондилодеза верхнего шейного отдела позвоночника. Затем эту информацию можно использовать для определения оптимальной степени сращения шейки матки. Мацунага и др. Использовали компьютерный биомеханический анализ предоперационных и послеоперационных боковых динамических рентгенограмм для определения двухмерного выпучивания шейного отдела позвоночника у 25 ревматоидных пациентов и 15 неревматоидных пациентов с атлантоаксиальным вывихом, перенесших затылочно-шейный спондилодез. 18 Они смогли продемонстрировать, что предоперационное выпучивание шейки матки более 10 × 10 4 представляет собой прогностический фактор риска САС после слияния O – C. 18 Таким образом, биомеханический анализ на основе наличия или отсутствия коробления перед операцией может оказаться полезным для прогнозирования послеоперационного подвывиха и, следовательно, может указать на более обширный спондилодез или предотвратить ненужную профилактическую операцию.
Тщательный анамнез шейки матки и физикальное обследование, безусловно, имеют решающее значение при оценке популяции с РА.Самая частая жалоба ревматоидного пациента с нестабильностью шейки матки – это боль. 2 , 7 Это может быть затылочное, осевое или корешковое и может усугубляться движением шеи. Могут присутствовать дополнительные миелопатические жалобы. Обследование имеет первостепенное значение, но может быть ограничено из-за периферических проявлений РА, таких как смена рук. 19 По сравнению с пациентами с САС, пациенты с САС чаще страдают неврологическим дефицитом. 20
Предложены показания к хирургическому вмешательству.Большинство авторов согласны с тем, что пациенты с миелопатией, прогрессирующим неврологическим дефицитом или нестабильностью с трудноизлечимой болью требуют хирургического вмешательства. 1 , 6 , 16 , 21 – 24 Однако существуют разногласия относительно хирургического вмешательства для бессимптомных пациентов с рентгенологическими аномалиями (класс Ранавата III (класс Ранавата I) или без него). ) пациенты. Ранават и др. Классифицировали ревматоидных пациентов на основании неврального дефицита: класс I означал отсутствие нервного дефицита; класс II означал субъективную слабость с гиперрефлексией и дизестезией; класс IIIA означал амбулаторных пациентов с объективной слабостью и признаками поражения мочевых путей; а класс IIIB означал пациентов с квадрипарезом, не проходящих амбулаторное лечение. 23 Хотя последние пациенты явно страдают миелопатией, некоторые сообщили о плохих результатах хирургических операций с высокими показателями смертности. 20 , 25 Следовательно, при рассмотрении возможного хирургического вмешательства необходимо учитывать сопутствующие заболевания и хирургические риски у пациентов.
Boden et al. Оценили большую когорту пациентов ( n = 73), которые наблюдались в течение 20-летнего периода по поводу нестабильности, связанной с RA. Хотя в их серии операции выполнялись только пациенты с неврологическим дефицитом, они рекомендовали операцию для пациентов с неврологическим дефицитом или без него, если выполнялись определенные рентгенологические критерии.Они обнаружили, что диаметр субаксиального канала, или SAC, более тесно коррелирует с параличом, чем со степенью смещения тела одного позвонка на другой. Из 10 пациентов с САС у восьми был дефицит Ранавата класса III, и у всех восьми был SAC 13 мм или меньше. Двое других пациентов относились к классу Ранавата II и оба имели размер мешка 14 мм. Таким образом, SAC или задний атлантоденсионный интервал (PADI) <14 мм может указывать на паралич и требует хирургического вмешательства.Это исследование также показало, что хирургическое вмешательство до начала значительного паралича привело к лучшим неврологическим результатам. 21
Зная о высокой частоте рентгенологической нестабильности даже у бессимптомных ревматоидных пациентов, Шарп и Персер рекомендуют рентгенограммы бокового сгибания и разгибания всем пациентам с тяжелым РА, которые будут подвергаться общей анестезии. 26 Эти скрининговые рентгенограммы включают динамические изображения сгибания-разгибания, поскольку SAS может не проявляться на нейтральной боковой поверхности.
Для дальнейшей оценки важности предоперационных рентгенограмм шейного сгибания и разгибания у ревматоидных пациентов, Collins et al ретроспективно проанализировали 113 пациентов, перенесших тотальное артропластику бедра или колена. 27 Шестьдесят девять (61%) пациентов имели рентгенологическую нестабильность (24, или 21%, с SAS), из которых 35 (50%) не имели признаков или симптомов нестабильности. Грауэр и др. Ретроспективно обнаружили, что у четырех из 65 (8%) пациентов, перенесших тотальное эндопротезирование тазобедренного или коленного сустава, были рентгенологические признаки, которые прогнозировали паралич, как определено Боденом (PADI или SAC <14 мм) 21 по сравнению с 20 пациентами. (41%) пациенты с традиционными рентгенологическими признаками нестабильности (AADI> 3 мм или SAS> 3 мм). 28 Хотя существует некоторая вариабельность сообщаемых случаев нестабильности шейки матки в этой популяции, эти исследования действительно подчеркивают важность предоперационных скрининговых пленок у ревматоидных пациентов, которым предстоит эндотрахеальная интубация.
КТ может быть полезен при определении костной анатомии субаксиального отдела позвоночника и особенно полезен при определении анатомии затылочно-шейного соединения. Магнитно-резонансная томография (МРТ) важна для определения компрессии нервных элементов и поражения мягких тканей, таких как паннус. 20 Повышенная интенсивность сигнала в спинном мозге на Т2-взвешенных изображениях, которые могут представлять отек, глиоз или миеломаляцию, было связано с плохим неврологическим восстановлением после операции. 29 Тем не менее, МРТ может недооценивать компрессию нервных элементов из-за вытянутого положения шеи при стандартной МРТ лежа. Белл и Стернс рекомендуют динамическую МРТ для определения наиболее каудального уровня, необходимого для декомпрессии / плавления. 30 Хотя КТ-миелограммы стали реже использоваться с появлением МРТ, они также полезны для оценки нервной компрессии, если МРТ противопоказана. 31
| Рекомендуемый авторами метод хирургического лечения |
В предыдущей главе рассказывалось о хирургических вмешательствах. Конечно, любое такое вмешательство должно учитывать потенциальные SAS и, вероятно, включать их в конструкцию слияния. Фактически, многочисленные исследования показали ранее недиагностированные SAS после операций сращения верхних отделов шейки матки. 1 , 16 , 24 , 32 Можно только предположить, являются ли эти субаксиальные поражения естественным течением РА пациента или вторичными по отношению к более высоким силам, создаваемым более длинным плечом рычага. . Таким образом, пациенты, перенесшие верхние шейные артродезы, должны находиться под пристальным наблюдением на предмет развития САС.
SAS сам по себе может также привести к рекомендации к хирургическому вмешательству. Симптоматическая САС или те, у которых SAC ≤ 14 мм, лучше всего подходят для хирургического вмешательства.Чаще всего это достигается сзади с помощью декомпрессии и спондилодеза. 24 Если есть уменьшение деформации при разгибании и сжатие нервных элементов в этой позе уменьшается, можно рассмотреть только слияние. В качестве альтернативы можно рассмотреть переднюю декомпрессию и спондилодез, если имеется очаговый редуцируемый подвывих. Передние процедуры могут также сочетаться с задней декомпрессией и спондилодезом, если более длинные конструкции рассматриваются для пациента, который не может достичь нейтрального или вытянутого положения шейки матки с помощью предоперационного удлинения.
В данном случае у пациента была комбинация восстанавливаемого и фиксированного SAS, а также восстанавливаемого AAS. Поскольку пленка для бокового расширения пациента продемонстрировала общую лордотическую картину, мы рекомендуем заднюю декомпрессию и спондилодез. Учитывая, что было поражение от верхнего шейного отдела до Т1, обычно рекомендуется процедура от С1 до верхнегрудного отдела. Проксимальная фиксация может быть достигнута с помощью винтов боковой массы С1, винтов Магерля или удлинения до затылочного бугра. Срединно-шейная фиксация обычно достигается с помощью фиксации боковой массы.Фиксация нижнего шейного и верхнегрудного отделов может быть достигнута с помощью фиксации транспедикулярными винтами. 33 , 34 В качестве альтернативы можно рассмотреть процедуру C5 с тщательным мониторингом шейно-грудного перехода; тем не менее, пациент должен быть проинформирован о потенциальной необходимости расширения хирургической конструкции.
| Послеоперационный уход |
Все пациенты иммобилизованы в связи с нестабильностью статуса от ~ 6 до 12 недель после операции по поводу РА.Чаще всего это жесткий шейный воротник. Однако, если есть опасения относительно фиксации из-за конструкции или плохого качества кости, можно рассмотреть ореол. Если спондилодез распространяется на грудной отдел позвоночника, можно рассмотреть шейно-грудной ортез.
Большинство хирургов-позвоночников периодически наблюдают за пациентами с помощью периодических переднезадних и боковых рентгенограмм в течение послеоперационного периода с корсетами. После того, как пациента отлучили от ортеза, необходимо рассмотреть рентгенограммы сгибания-разгибания.Несмотря на прочный спондилодез, пациенты должны находиться под пристальным наблюдением на предмет развития отложенной нестабильности над или под хирургической конструкцией.
| Осложнения |
Общая частота осложнений у пациентов с РА значительно выше, чем у населения в целом. 13 Это может быть связано с основным заболеванием или с лекарствами, используемыми для его лечения.Хроническое употребление стероидов и последующая остеопения могут привести к увеличению частоты отказов инструментов: вырезание имплантата, оседание трансплантата, резорбция трансплантата и прогрессирующий коллапс позвоночника. 23 Псевдоартроз также вызывает серьезное беспокойство. 7 , 23 , 35
Пациенты с ревматоидом могут подвергаться большему риску других осложнений, таких как инфекция, если они длительное время принимают кортикостероиды или другие иммунодепрессанты. Пристальное внимание следует уделять целостности их кожи, особенно у лежачих, чтобы предотвратить пролежни на выступах, таких как затылок. 23 , 36 Эта группа населения также подвержена повышенному риску аспирационной пневмонии. Пациенты класса Ранават III, особенно класса IIIB, имеют чрезвычайно высокий уровень смертности. 23 , 25 , 35
Как обсуждалось ранее, может возникнуть рецидивирующая нестабильность в форме САС, вызванная прогрессированием заболевания или увеличением силы на каудальном участке шейного диска в результате предшествующего сращения. 14 – 18 Это может привести либо к нестабильности, либо к потенциальному неврологическому повреждению, или к обоим, и может потребовать повторной операции с расширением слияния, чтобы включить вовлеченные уровни.
| Альтернативные методы лечения |
Нехирургическое лечение
Безусловно, наиболее консервативное лечение при наиболее консервативных состояниях Хотя описанные ранее факторы могут привести к четкой рекомендации к хирургическому вмешательству; это следует рассматривать в свете сопутствующих заболеваний пациента.Пациенты с терминальной стадией ревматоида могут иметь факторы, запрещающие хирургическое вмешательство.
Таким образом, может потребоваться тяга или внешняя иммобилизация, или и то, и другое. Oostveen et al. Сообщили о двух случаях быстро прогрессирующей миелопатии шейки матки, в которых наблюдалось улучшение миелопатических симптомов и стабилизация субаксиальных шейных поражений только с помощью длительного тракции и иммобилизации ореола. 37 Они предположили, что тракция шейки матки и иммобилизация с помощью жилета-ореола могут рассматриваться как независимый вариант лечения для хирургических кандидатов из группы высокого риска.
Ламинопластика
Ламинопластика может рассматриваться при отсутствии предоперационной кифотической деформации шейки матки и легкой САС (≤ 5 мм) и когда основным симптомом является миелопатия, а не боль в шее. 38 , 39 Mukai et al ретроспективно рассмотрели когорту пациентов с САС, леченных с помощью ламинопластики. Они обнаружили улучшение миелопатии у пациентов с РА без мутилирующего типа (менее 40 эрозированных суставов) и SAS ≤ 5 мм. 38 Конечно, есть опасения по поводу ухудшения основного подвывиха, если такое вмешательство будет выполнено.
| Заключение |
SAS обычно возникают при более поздних и более тяжелых формах РА. Тщательное наблюдение за ревматоидными пациентами с признаками нестабильности шейки матки должно привести к более ранней хирургической стабилизации и, следовательно, к лучшим результатам. Многочисленные исследования показали, что долгосрочная смертность увеличивается, уменьшается количество периоперационных осложнений и уменьшается неврологическое восстановление после того, как пациент становится миелопатическим.Boden et al. Показали, что предоперационный SAC <14 мм был связан с более тяжелым предоперационным параличом (дефицит Ranawat класса III) и что предоперационный SAC ≥ 14 мм был положительным предиктором для полного неврологического восстановления. 21 Таким образом, Boden et al предоставили нам рентгенографические данные, на основании которых мы можем принимать хирургические решения. Для этой популяции уместны тщательный мониторинг и соответствующее хирургическое вмешательство.
Ссылки
1. Simpson JM, An HS, Balderston RA.Осложнения хирургии позвоночника при ревматоидном артрите и анкилозирующем спондилите. В: Balderston RA, An HS, eds. Осложнения в хирургии позвоночника. Филадельфия: У. Б. Сондерс; 1991: 169–175
2. Bland JH. Ревматоидный артрит шейного отдела позвоночника. J Rheumatol 1974; 3: 319–342
3. Hughes JT. Поражение спинного мозга подвывихом C4 – C5 позвонков при ревматоидном артрите: описание 2 случаев, исследованных при аутопсии. Энн Нейрол 1977; 1: 575–582
4. Уинфилд Дж., Кук Д., Брук А.С., Корбетт М.Проспективное исследование рентгенологических изменений шейного отдела позвоночника при раннем ревматоидном артрите. Ann Rheum Dis 1981; 40: 109–114
5. Драйер SJ, Боден С. Естественная история ревматоидного артрита шейного отдела позвоночника. Clin Orthop Relat Res 1999; 366: 98–106
6. Lipson SJ. Ревматоидный артрит шейного отдела позвоночника. Clin Orthop Relat Res 1989; 239: 121–127
7. Роулинз Б.А., Жирарди Ф.П., Боачи-Аджей О. Ревматоидный артрит шейного отдела позвоночника. Rheum Dis Clin North Am 1998; 24: 55–65
8.Мартель В. Патогенез деструкции шейного отдела позвоночника при ревматоидном артрите. Arthritis Rheum 1977; 20: 1217–1225
9. Смит PH, Бенн Р.Т., Шарп Дж. Естественная история ревматоидного вывиха шейки матки. Ann Rheum Dis 1972; 31: 431–439
10. Паймела Л., Лаасонен Л., Канкаанпаа Э., Лейрсисало-Репо М. Прогрессирование изменений шейного отдела позвоночника у пациентов с ранним ревматоидным артритом. J Rheumatol 1997; 24: 1280–1284
11. Йонезава Т., Цуджи Х., Мацуи Х., Хирано Н. Субаксиальные поражения при ревматоидном артрите: рентгенологические факторы, указывающие на миелопатию нижней шейки матки.Spine 1995; 20: 208–215
12. Фудзивара К., Оваки Х., Фудзимото М., Ёненобу К., Очи Т.А. Долговременное наблюдение за поражениями шейки матки при ревматоидном артрите. J Spinal Disord 2000; 13: 519–526
13. Писиткун П., Паттаровас С., Сиривонгпайрат П., Тотемчокчаркарн К., Нантируж К., Джанвитянуджит С. Повторная оценка подвывиха шейного отдела позвоночника у тайских пациентов с ревматоидным артритом. Clin Rheumatol 2004; 23: 14–18
14. Yamauchi K, Nekozuka Y, Kasai Y, et al. Естественная история ревматоидного шейного отдела позвоночника.Jpn J Rheum Joint Surg 1987; 6: 481–489
15. Йошида К., Ханью Т., Такахаши Х. Прогрессирование ревматоидного артрита шейного отдела позвоночника: рентгенологическая и клиническая оценка. J. Orthop Sci 1999; 4: 399–406
16. Kraus DR, Peppelman WC, Agarwal AK, et al. Частота субаксиального подвывиха у пациентов с генерализованным ревматоидным артритом, у которых в прошлом были слияния затылочного отдела шейки матки. Spine 1991; 16: S486-S489
17. Мацунага С., Ониши Т., Саку Т. Значение затылочно-аксиального угла в субаксиальном поражении после затылочно-шейного спондилодеза.Spine 2001; 26: 161–165
18. Мацунага С., Саку Т., Сунахара Н., Оониси Т., Маэдо С., Наканиси К. Биомеханический анализ выпучивания шейного отдела позвоночника: прогностическая ценность субаксиального подвывиха после затылочно-шейного слияния. Spine 1997; 22: 765–771
19. Bailey RW. Ревматоидный артрит и другие неинфекционные воспалительные заболевания. В: Общество исследования шейного отдела позвоночника. Шейный отдел позвоночника. Филадельфия: Липпинкотт-Рэйвен; 1983
20. Стиррат А.Н., Файф И.С.Хирургия ревматоидного шейного отдела позвоночника. Clin Orthop Relat Res 1993; 293: 135–143
21. Боден С.Д., Додж Л.Д., Болман Х.Х., Рехтин Г.Р. Ревматоидный артрит шейного отдела позвоночника: долгосрочный анализ с предикторами паралича и выздоровления. J Bone Joint Surg Am 1993; 75: 1282–1297
22. Pellicci PM, Ranawat CS, Tsairis P, Bryan WJ. Проспективное исследование прогрессирования ревматоидного артрита шейного отдела позвоночника. J Bone Joint Surg Am 1981; 63: 342–350
23. Ранават С.С., О’Лири П., Пелличчи П., Цайрис П., Маркизелл П., Дорр Л.Спондилодез шейного отдела позвоночника при ревматоидном артрите. J Bone Joint Surg Am 1979; 61: 1003–1010
24. Сантавирта С., Конттинен Ю.Т., Санделин Дж., Слатис П. Операции по поводу нестабильного шейного отдела позвоночника при ревматоидном артрите. Acta Orthop Scand 1990; 61: 106–110
25. Crockard HA, Grob D. Ревматоидный артрит: поражение верхних отделов шейки матки. В: Clark CR, ed. Шейный отдел позвоночника. Филадельфия: Липпинкотт-Рэйвен; 1995
26. Sharp J, Purser DW. Спонтанный атланто-аксиальный вывих при анкилозирующем спондилите и ревматоидном артрите.Ann Rheum Dis 1961; 20: 47–77
27. Collins DN, Batnes CL, FitzRandolph RL. Нестабильность шейного отдела позвоночника у ревматоидных пациентов, перенесших тотальное эндопротезирование тазобедренного или коленного сустава. Clin Orthop Relat Res 1991; 272: 127–135
28. Grauer JN, Tingstad EM, Rand N, Christie MJ, Hilibrand AS. Предикторы паралича шейного отдела позвоночника при ревматизме у пациентов, перенесших тотальное эндопротезирование суставов. J Bone Joint Surg Am 2004; 86: 1420–1424
29. Takahashi M, Yamashita Y, Sakamoto Y, Kojima R. Хроническая компрессия шейного отдела спинного мозга: клиническое значение повышенной интенсивности сигнала на МР-изображениях.Радиология 1989; 173: 219–224
30. Белл Г.Р., Стернс К.Л. МРТ сгибательно-разгибания верхнего отдела ревматоидного отдела шейного отдела позвоночника. Ортопедия 1991; 14: 969–974
31. Kramer J, Jolesz F, Kleefield J. Ревматоидный артрит шейного отдела позвоночника. Rheum Dis Clin North Am 1991; 17: 757–772
32. Чан Д.П.К., Нгиан К.С., Коэн Л. Задний верхний шейный спондилодез при ревматоидном артрите. Spine 1992; 17: 268–272
33. Гупта С., Гоэль А. Количественная анатомия латеральных масс атланта и осевых позвонков.Neurol India 2000; 48: 120–125
34. Мельчер Р.П., Путлиц С.М., Кейнстек Ф.С., Лотц Дж. К., Хармс Дж., Брэдфорд Д.С. Биомеханическое тестирование техники задней атлантоаксиальной фиксации. Spine 2002; 27: 2435–2440
35. Олеруд С., Ларссон Б., Родригес М. Субаксиальный подвывих шейного отдела позвоночника при ревматоидном артрите. Acta Orthop Scand 1997; 68: 109–115
36. Омура К., Хукуда С., Кацуура А., Сарухаши Ю., Иманака Т., Имаи С. Оценка заднего длинного спондилодеза по сравнению с консервативным лечением прогрессирующего ревматоидного шейного отдела позвоночника.Spine 2002; 27: 1336–1345
37. Oostveen JC, van de Laar M, Geelen J, de Graaff R. Успешное консервативное лечение ревматоидного субаксиального подвывиха, приводящее к улучшению миелопатии, уменьшению подвывиха и стабилизации шейного отдела позвоночника. : Отчет о двух случаях. Ann Rheum Dis 1999; 58: 126–129
38. Mukai Y, Hosono N, Sakaura H, et al. Ламинопластика при шейной миелопатии, вызванной субаксиальными поражениями при ревматоидном артрите.


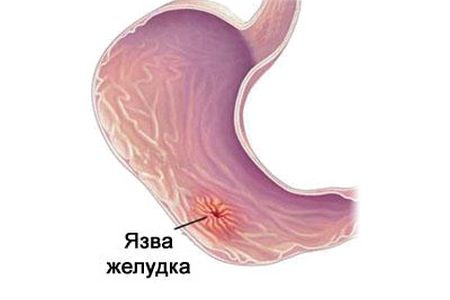 (дыхательный)
(дыхательный)