Мед для жкт: Действие меда на желудочно-кишечный тракт
Действие меда на желудочно-кишечный тракт
За счет содержания большого количества сахара и органических кислот мед обладает некоторым раздражающим действием на Слизистую оболочку желудочно-кишечного тракта и вызывает легкий слабительный эффект. Для этого рекомендуется принять внутрь 50—100 г меда в чистом виде или в смеси с водой. Можно ставить клизму с 10—20 г меда.
Профилактика язвенной болезни желудка и двенадцатиперстной кишки
Ежедневное умеренное употребление в пищу меда действует регулирующим образом на кишечник. Мед входит в состав так называемого «венского питья», назначаемого по сегодняшний день как нежное слабительное. В минувшие времена мед прописывался в составе слабительных кашек. Теперь уже не вызывает сомнения тот факт, что мед снижает повышенную кислотность желудочного сока (из-за наличия щелочеобразующих элементов). Поэтому мед может употребляться как лечебное средство и при гастрите, и при язвенной болезни желудка, сопровождающихся повышенной кислотностью.
При язвенной болезни желудка и двенадцатиперстной кишки мед целесообразнее принимать за полтора—два часа до завтрака и обеда и через 3 часа после ужина. Мед следует растворять в стакане теплой воды, так как в растворенном виде он способствует разжижению слизи в желудке, снимает боль, устраняет тошноту, изжогу. Отмечено также общеукрепляющее действие меда на организм больного. При употреблении меда у больных нарастает вес, увеличивается количество гемоглобина, понижается возбудимость нервной системы, улучшается настроение, сон и т.д. Лечебная доза меда при язвенной болезни, по данным разных авторов, различна. Так Н. П.
Профессор Ф. К. Меньшиков предлагает придерживаться следующего предписания: суточную дозу меда, равную 400—600 г, разделить на три части и каждую часть принимать медленно натощак в разогретом виде (для этого посуду с медом перед употреблением нужно поместить на 5—10 мин в горячую воду температурой 60 градусов). Курс лечения равен примерно 15—20 дням. Нужно отметить, что далеко не каждый больной способен переносить мед в таких больших количествах. К сожалению, подобный способ лечения не всем подходит, так как у пациента невольно развивается отвращение к меду и может возникнуть рвота. Если применять мед непосредственно перед едой, то он, наоборот, способствует выделению желудочного сока, а поэтому не лишним будет использовать его и при лечении больных с низкой кислотностью желудочного сока. При этом рекомендуется применять мед в виде холодного водного раствора (1 столовая ложка на стакан воды).
Как принимать
Таким образом, действие меда на организм зависит от способа и времени его приема. Согласно этим двум условиям мед способен повышать или понижать кислотность желудочного сока. Больные с гиперацидным гастритом (повышенная кислотность желудочного сока) принимают мед (1 ст. ложку) за 1,5—2 часа до еды в растворе теплой воды, а больные с гипоацидным гастритом (пониженная кислотность) — перед едой в растворе холодной воды. Все перечисленные рекомендации для больных гастритом, язвенной болезнью желудка и двенадцатиперстной кишки требуют одного дополнения: медолечение только тогда будет эффективным, когда оно сочетается с другими лечебными препаратами. А комплексное лечение в каждом отдельном случае устанавливает врач.
Народная медицина предлагает следующие рецепты:
- Для лечения желудка применять сок подорожника с медом. Однако он рекомендуется только при пониженной и нормальной секреции желудочного сока. Способ приготовления: 500 г меда смешать с 500 г сока подорожника и варить на очень слабом огне в течение 20 мин.
 Охладить. Принимать перед едой по 1 ст. ложке 3 раза в день.
Охладить. Принимать перед едой по 1 ст. ложке 3 раза в день. - Для лечения язвенной болезни желудка 100 г меда, 100 г сливочного масла, 11 г листьев алоэ, 100 г порошка какао смешать, разогреть на водяной бане и принимать по 1 ст. ложке на стакан горячего молока 2 раза в день в течение месяца.
- Для лечения язвенной болезни желудка и двенадцатиперстной кишки берут 250 г меда, 350 г красного сухого вина, 150 г сока алоэ. Смесь настаивают в течение 7 суток в закрытой посуде из темного стекла. Принимают 3 раза в день за 2 часа до еды: первые 7 дней — по 1 чайной ложке, в последующие дни — по 1 ст. ложке.
- Как противовоспалительное средство при язвенной болезни желудка и двенадцатиперстной кишки применяют настой сушеницы с медом. Способ приготовления: 1 ст. ложку меда, 1 ст. ложку сушеницы болотной залить 250 мл кипятка, настаивать в течение 30 мин. Принимать по 1/3 стакана 2—3 раза в день.
- При язвенной болезни желудка и двенадцатиперстной кишки также рекомендуется следующий рецепт: листья алоэ 3—5-летнего возраста выдержать в темноте при температуре 4—8 градусов в течение 12—14 дней, затем листья промыть в воде, измельчить и залить кипяченой водой в соотношении 1:3.
 Эту смесь оставить настаиваться 1—1,5 часа. Затем сок отжать, 100 г сока алоэ смешать с 500 г измельченных грецких орехов и добавить 300 г меда. Принимать по 1 ст. ложке 3 раза в день за 30 мин до еды.
Эту смесь оставить настаиваться 1—1,5 часа. Затем сок отжать, 100 г сока алоэ смешать с 500 г измельченных грецких орехов и добавить 300 г меда. Принимать по 1 ст. ложке 3 раза в день за 30 мин до еды. - Хорошо устраняет симптомы отрыжки, изжоги, тошноты, снижает кислотность желудка сок картофеля с медом. 5 ст. ложек меда смешать с 1 л картофельного сока. Принимать по 1 стакану 2 раза в день — натощак и на ночь.
- При повышенной кислотности взять 1 ст. ложку меда, 1 стакан сока ромашки, отжатого из всего цветущего растения, смешать и принимать по 1 ст. ложке 3 раза в день до еды.
- При колитах и запорах растворить 80—100 г меда в яблочном соке или в холодной воде. Разделить на 3 части и принимать перед едой.
- При вздутиях живота берут 1 ст. ложку меда, разводят в 1/2 стакана теплой воды. Принимают за 30 мин до еды.
- При болях в животе пьют смесь из 15 г бузины (листья, цветки, плоды), 15 г мяты перечной, 15 г тысячелистника и небольшого количества толченого имбиря, сваренную в 1,5 л воды на медленном огне.
 Процеживают и пьют с медом по 1/2 стакана 6 раз в день.
Процеживают и пьют с медом по 1/2 стакана 6 раз в день. - При болях в животе 1 ст. ложку меда, 1 стакан сока валерианы, отжатого в сентябре—октябре из свежих корней, смешать и принимать по 1 чайной ложке 3 раза в день. (3-й раз обязательно на ночь).
- Тыквенная каша с медом улучшает моторную функцию кишечника, усиливает мочеотделение, выведение солей из организма. Необходимо очистить тыкву от кожи и семян, нарезать мелкими кубиками, припустить ее сливочным маслом, затем подсыпать манную крупу или пшено, предварительно распаренное, добавить мед, соль и варить до готовности. На 500 г тыквы — 1/2 стакана воды, 60 г манной крупы, 2 ст. ложки меда и 50 г сливочного масла.
- В качестве слабительного средства используется смесь из 300 г нагретого (но не до кипения!) меда и 150 г сока алоэ, настаиваемых в течение суток. Полученное средство принимать по 1—2 чайные ложки утром за 1 ч до еды.
Рекомендуем:
Ознакомиться с сортами и купить мёд оптом и мелким оптом можно онлайн в нашем Интернет-магазине.
Помимо мёда в продаже есть прополис, маточное молочко и пчелиный воск. Цена на продукцию обновляется ежедневно, смотрите наш прайс-лист.
Интересные факты:
Если Вы хотите начать использовать мед дома, есть две вещи, о которых вам стоит подумать:
- во-первых, вам следует использовать натуральный мед, не подвергшийся тепловой обработке, потому что он обладает всеми антибактериальными преимуществами;
- во-вторых, вам не стоит использовать тот же самый мед, который вы использовали для лечения своих ран, на ваших хлопьях или тосте. Вы можете заболеть из-за этого.
- Если вы используете натуральный мед, то вам не следует кормить им детей младше одного года. У них еще нет такой развитой иммунной системы. Даже «хорошие бактерии», содержавшиеся в меде, могут навредить ребенку.

Другие статьи
Статьи с полезной информацией о меде
27.09.2015Ахиллес остался бы жив в своем последнем бою у Скейских ворот Трои, если бы послушал Поликсену и налепил на пятку лист подорожника, смазанного медом. Но он не внял увещеваниям принцессы, давшей ему этот совет после приснившегося ей вещего сна перед заключительной битвой эллинов за Илион. Стрела Зевса, посланная рукой Париса, поразила Ахиллеса в единственно уязвимое место на его теле.
Да, мед мог спасти героя, недаром он является признанным универсальным лечебным средством, знакомый людям еще с доисторических времен. Сами врачи отмечают общеукрепляющее его влияние на организм человека: улучшается состав красных телец в крови, возрастает вес, нивелируется кислотность желудочного сока, нормализуется состояние нервной системы.
Особо мед хорош при лечении болезней желудка и пищеварительного тракта. Впрочем, он, в принципе, оказывает благотворное воздействие на протекание пищеварения кишечника. Это объясняется тем, что в меду имеется высокая концентрация железа и марганца, которые улучшают усвоение организмом пищевых продуктов. Кроме того, он пробуждает к деятельности секреторную и моторную деятельность тонкого кишечника и желудка и легко устраняет запоры. Мед считается в своем роде незаменимым лекарством при наличии язвы желудка и двенадцатиперстной кишки. Для сравнения: при лекарственном лечении язвы она заживает лишь у трети больных, а при лечении медовыми растворами – у половины. Ибо он отличается ранозарубцовывающими свойствами и побуждает ткань к естественной эпитализации. И кроме прочего, продукт действует как противомикробное средство на микрофлору кишечника.
Это объясняется тем, что в меду имеется высокая концентрация железа и марганца, которые улучшают усвоение организмом пищевых продуктов. Кроме того, он пробуждает к деятельности секреторную и моторную деятельность тонкого кишечника и желудка и легко устраняет запоры. Мед считается в своем роде незаменимым лекарством при наличии язвы желудка и двенадцатиперстной кишки. Для сравнения: при лекарственном лечении язвы она заживает лишь у трети больных, а при лечении медовыми растворами – у половины. Ибо он отличается ранозарубцовывающими свойствами и побуждает ткань к естественной эпитализации. И кроме прочего, продукт действует как противомикробное средство на микрофлору кишечника.
Какие еще кишечно-желудочные заболевания можно вылечить с помощью меда?
Перечень таких болезней весьма обширен. Поэтому как лечебное средство мед успешно зарекомендовал себя:
- при гастритах;
- как спазмолитическое и противовоспалительное снадобье;
- при наличии у больных посторонних организмов: глистов, солитера и прочих;
- при наличии полипов в пищеводе и желудке;
- для активизации опорожнительных процессов в кишечнике,
как и наоборот:
- для устранения метеоризма, поноса и спазм кишечника.

И еще множества заболеваний, все из которых здесь нет возможности перечислить.
Рецепты
Рецептов на основе меда великое множество, еще больше, чем самих болезней, которые им лечатся. Ниже приводим самый простой и главный из них.
Водный раствор меда: 1 или 2 столовые ложки на стакан кипяченой воды.
И еще запомните: в чистом виде мед, как лекарство, практически, не употребляется
«Мёд — лучший друг желудка» (народная мудрость). Мёд очень благотворно сказывается на процессе пищеварения в кишечнике. Это происходит потому, что находящиеся в меду железо и марганец ускоряют процесс пищеварения, улучшая усвоение организмом пищи. Лечение мёдом было апробировано на многих больных язвенной болезнью желудка.
|
В рамках проекта “Повышение потребления меда жителями Старооскольского городского округа”
В рамках проекта «Повышение потребления меда жителями Старооскольского городского округа» управление здравоохранения администрации доводит информацию о применении меда при болезнях желудочно-кишечного тракта.
Мед является очень ценным натуральным продуктом, который вырабатывается пчелами. Издавна люди применяли мед для разных целей, ибо считали, что он содержит многие полезные вещества, необходимые организму человека. К сожалению, в настоящее время мало внимания уделяется меду.
Мед имеет широкое применение при таких заболеваниях желудочно-кишечного тракта как гиперацидный – повышенная кислотность желудочного сока и гипоацидный -пониженная кислотность желудочного сока – гастрит. Велика роль меда в борьбе с этими заболеваниями.
Велика роль меда в борьбе с этими заболеваниями.
При низкой кислотности желудка мед в виде холодного водного раствора: 1 столовая ложка меда на 1 стакан воды – следует принимать перед едой, так как он способствует выделению желудочного сока, и пища, поступившая после принятия меда, усвоится легко и безболезненно.
При гиперацидном гастрите, а также язвенной болезни желудка и двенадцатиперстной кишки, сопровождающихся повышенной кислотностью, мед нужно принимать, предварительно растворив его в теплой воде. Ведь именно в таком виде мед способствует рассасыванию желудочного сока, устраняет тошноту и изжогу при приеме и после приема пищи. Причем больным гиперацидным гастритом мед рекомендуется употреблять за 1,5–2 часа до еды, заранее смешав 1 столовую ложку лакомства со стаканом теплой воды. Страдающим язвенной болезнью желудка и двенадцатиперстной кишки приготовленный таким же способом мед нужно принимать за 1,5–2 часа до завтрака и обеда и через 2–3 часа после ужина. Видимые улучшения после регулярного приема меда при гастрите и язвенной болезни желудка наступят через 2–2,5 месяца, а потому не следует бросайть лечение, лишь приступив к нему, ибо только усердие и терпение приведут к желаемым результатам.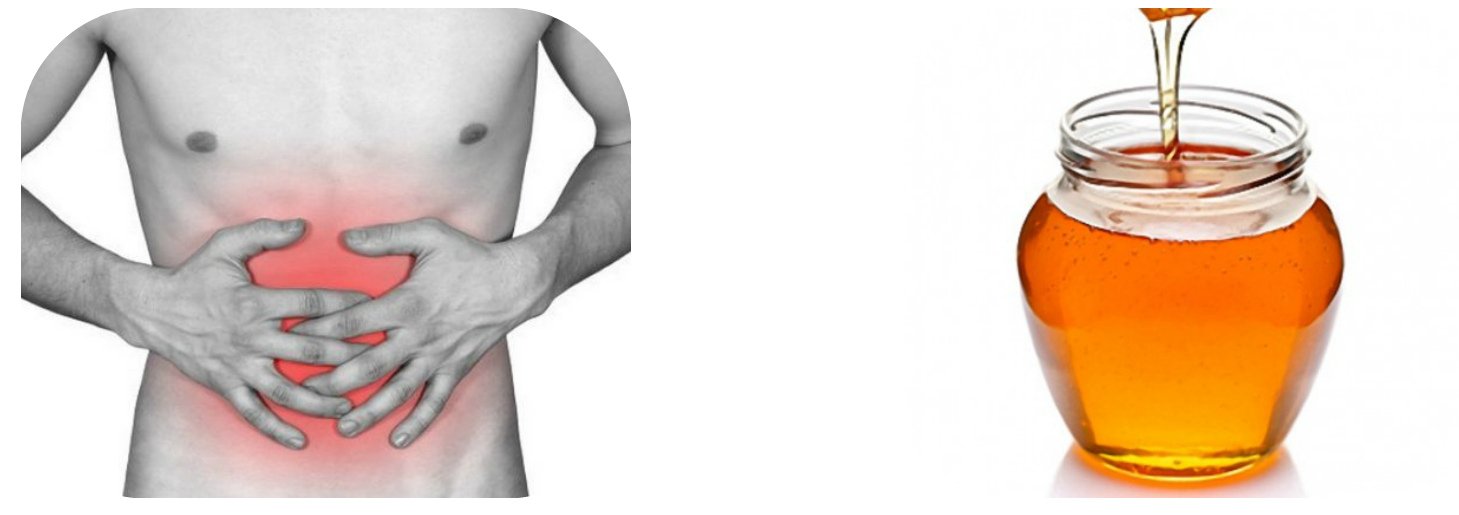
Не нужно забывать и о том, что мед оказывает легкое слабительное действие, а потому является просто необходимым лекарством при запорах, а также метеоризме. В таких случаях, мед рекомендуется употреблять, перед едой в чистом виде или предварительно растворив его в воде. За один прием количество принимаемого меда не должно превышать 100 г.
В Старом Осколе продолжается исследование влияния мёда на организм в рамках проекта «Повышение потребления меда жителями Старооскольского городского округа».
Напомним, что с декабря 2013 года терапевтами в поликлиниках города проводится наблюдение за группой добровольцев из 21 человека, которые в течение длительного времени употребляют мед.
По состоянию на конец июня текущего года, у 10 испытуемых произошло незначительное снижение глюкозы в крови, 11 участников отметили улучшение общего самочувствия и повышение работоспособности. Ни у одного из участников исследования за период наблюдения не отмечалось простудных заболеваний.
29 июня 2015
Мед при гастрите и язве желудка
Болезни желудочно-кишечного тракта – одни из самых коварных. Они подкрадываются незаметно, когда мы уверенны, что полностью здоровы. Но статистика неумолима: каждый третий человек в Украине страдает язвой и гастритом. Ситуация усугубляется тем, у 90% больных наблюдается заболевание переходит в хроническую форму. Продукция пчеловодства поможет избавиться от недугов или минимизировать их проявления.Чтобы разобраться в методах лечения, следует понять природу болезни. Гастрит – это воспаление слизистой оболочки желудка. Подобное происходит, когда желудочный сок начинает разъедать стенки органа. Причины могут быть разнообразными: неправильное или нерегулярное питание, вредные привычки, применение препаратов и т.п.
Язва является следствием запущенного гастрита – на стенках слизистой образуются ранки или язвочки.
Большинство пчелопродуктов обладают противовоспалительными и регенерирующими свойствами. Они как нельзя более кстати пригодятся при лечении вышеупомянутых недугов. Какой продуктов нужно употреблять при язве/гастрите? Как именно это делать и в каком количестве? Читайте советы опытного пасечника.
Они как нельзя более кстати пригодятся при лечении вышеупомянутых недугов. Какой продуктов нужно употреблять при язве/гастрите? Как именно это делать и в каком количестве? Читайте советы опытного пасечника.
Мед
Натуральный мед – самое распространенное средства против язвы и гастрита. Он воздействует на всю систему желудочно-кишечного тракта в комплексе: улучшают моторную и секреторную функции, нормализует процесс пищеварения, ускоряет обмен веществ, улучшает усваиваемость пищи, нейтрализует раздражение и восстанавливает тканевый покров.
Как принимать:
- в чистом виде – съедать по 1 чайной ложке 3-4 раза в день за 30 минут до еды.
- медовая вода – в стакане теплой воды разводить 1 чайную ложку меда. Выпивать 3 раза в день – первый раз натощак, а после за 45 минут до еды.
- мед с алоэ – 100 мл сока алоэ перемешать со 100 г меда. Эту смесь можно принимать в чистом виде, либо добавляя 100 г сливочного масла или 1 стакан кагора. Употреблять 2-3 раза в день за 30-40 минут до еды.

- мед с молоком – в стакане теплого молока разводить 1 чайную ложку меда и кусочек сливочного масла толщиной около 3 см. Выпивать 2 раза в день – утром натощак и вечером за полчаса до ужина.
- мед с отваром ромашки – в 1 л горячей воды заварите 1 столовую ложку сухого соцветия ромашки. Когда отвар остынет, добавьте 100 г меда. Выпивать по ⅔ стакана перед каждым приемом пищи.
Статьи в тему:
Медовая вода – универсальный рецепт здравия
Мед и алоэ: гуру народной медицины
Отвары с медом: рейтинг полезности
Приобрести мед можно напрямую с нашей пасеки “Свій мед”
Забрус
Забрус объединил в своем составе сразу несколько пчелопродуктов: мед, воск, пыльцу и прополис. Соответственно, сила его противовоспалительных и регенеративных свойств приумножается в несколько раз. Он обеспечивает защиту стенок слизистой от воздействия желудочного сока.
Как принимать:
- в чистом виде – жевать по 1 чайной ложке забруса 3 раза в день по 15-20 минут.

Жевать забрус необходимо до тех пор, пока во рту не остается только нерастворимый воск, напоминающий жвачку. Его нужно выплюнуть.
Статья в тему: Что такое забрус пчелиный?
Пчелиная пыльца
Лечение пчелиной пыльцой заболеваний желудочно-кишечного тракта в 80% случаев гарантирует успех. Существует масса рецептов против гастрита и язвы, поговорим о самых популярных из них.
Как принимать:
- в чистом виде – по 1 чайной ложке 3 раза в день за полчаса до еды. Прежде, чем глотать – подержать во рту, смешивая со слюной. Не рекомендуется запивать водой.
- пыльца с медом – смешать в пропорциях 1:1. Смесь перебить блендером или миксером до получения однородной массы. Принимать по 1 чайной ложке 3 раза в день за полчаса до еды.
- пыльца с травяным отваром – перемешать листья подорожника, сушеницу, горец птичий, зверобой, золототысячник, тмин, мяту перечную. Взять 3 столовые ложки готового сбора и залить 0,5 л кипятка. Настаивать в термосе в течение 2 часов, после чего процедить. Принимать по ½ стакана одновременно с пыльцой через час после каждого приема пищи.
Статья в тему: Пчелиная пыльца: эффективная помощь Природы
Приобрести пыльцу можно напрямую с нашей пасеки “Свій мед”
Перга
Перга – это трансформированная пыльца, еще более усовершенствованная природой и пчелиными ферментами. Поэтому ее прием с целью лечения болезней ЖКТ считается эффективнее.
Как принимать:
- в чистом виде – по 1 чайной ложке перги 3 раза в день за 40 минут до еды. Перед тем, как глотать, подержать пару минут во рту, перемешивая со слюной.
- перга с медом – смешать продукты в равных пропорциях, перебить миксером или блендером до однородности. Принимать по 1 чайной ложке 1 раз в день – через 1,5 после еды или за 3 часа до.
- перга с травяным отваром – заварить отвар ромашки, шалфея или подорожника (на 1 л воды 2-3 столовых ложки трав). Настаивать пару часов в термосе. Принимать одновременно в пергой.
Статья в тему: Пчелиная перга – настоящий витаминный «бум»!
Прополис
За счет высокого содержания природных смол и эфирных масел в составе, прополис оказывает мощный противовоспалительный эффект. В том числе, он может воздействовать на Ваш желудок для лечения гастрита и язвы.
Как принимать:
- в виде 20% настойки прополиса – по 40-60 капель на ¼ стакана теплой воды или молока. Принимать 3 раза в день за 1,5 часа до приема пищи.
- в виде прополисного молока – 1,5 молока вскипятить в эмалированной кастрюле. Добавить 100 г измельченного прополиса и помешивать до растворения. Перед употреблением профильтровать. Принимать по ½ стакана 4-5 раз в день.
Статья в тему: Настойка прополиса и все, что Вы хотели о ней знать
Какой из вышеперечисленных народных рецептов эффективнее – покажет только время. Предлагаем Вам перед применением проконсультироваться со своим врачом.
Видео “Алоэ и мед от гастрита”
Источник
Википедия: Гастрит, Язва желудка
6 видов меда, о которых важно знать каждому
Знали ли вы, что
самые ранние упоминания о меде как о лечебном средстве уходят во времена
шумеров? А то, что древние египтяне, римляне, греки и другие народы регулярно
его использовали при лечении кожных и глазных заболеваний? Спустя столько веков
мед не утратил своих уникальных свойств, и практически у каждого в доме имеется
баночка со сладким нектаром. Но вряд ли шумеры могли догадываться, что спустя
тысячелетия разнообразие видов меда достигнет таких масштабов. На сегодняшний
момент известно
более 300 сортов меда. Каждый из них отличается по вкусу, цвету, аромату и,
конечно, по полезным компонентам. Хотите узнать, какой мед помогает бороться с
головными болями, а какой отлично справляется с простудными заболеваниями?
1. ГРЕЧИШНЫЙ МЕД ТОНИЗИРУЕТ ОРГАНИЗМ
· Гречишный мед получается из нектара гречихи. Ему свойственны темный цвет и своеобразный крепкий терпкий вкус. В состав данного меда, как и остальных, входят три главных компонента: фруктоза, глюкоза и вода. Именно поэтому многие стали заменять сахар медом.
· Гречишный мед следует употреблять при простудных заболеваниях и проблемах с желудочно-кишечным трактом, язве желудка, авитаминозе. Мед богат и железом, что играет большую роль для правильной работы крови.
2. ЛИПОВЫЙ МЕД НОРМАЛИЗУЕТ ОБМЕН ВЕЩЕСТВ
· Липа – драгоценное дерево. Из ее листьев можно делать чудесный чай, из соцветий – лечебный отвар. Но также из желтых цветов липы мы получаем по-настоящему целебный мед. Он обладает приятным ароматом, очень сладкий на вкус и гораздо светлее гречишного меда (может быть и совсем белым).
· Липовый мед – один из самых популярных. И не зря. О его ценности знал еще древний ученый, философ и врач Авиценна. В свое время он утверждал, что с помощью липового меда можно избавиться от эпилепсии, головных болей, ревматизма, заболеваний почек и других проблем и болезней. Кроме того, липовый мед включает в себя бесчисленное количество различных микро- и макроэлементов: калий, сера, кальций, медь, цинк, йод, фосфор и другие. Несмотря на то что содержание витаминов в таком меде минимально, их взаимосвязь с элементами дает уникальный эффект.
· Данный мед лучше всех своих собратьев справляется с простудой, кашлем, насморком и даже ангиной. Может применяться как прекрасное профилактическое средство. Регулярное потребление меда из липы поможет нормализовать обмен веществ и улучшить пищеварение. А пыльца, входящая в состав медового продукта, является источником нужных аминокислот и белков.
3. КАШТАНОВЫЙ МЕД УБИВАЕТ МИКРОБЫ
· Не каждый может полюбить каштановый мед за его горьковатый привкус. Но полюбить за его лечебные свойства стоит. Еще один мед в нашей коллекции обладает большим содержанием необходимых элементов, таких как кальций, калий и марганец.
· Мед славится своим антибактериальными и противогрибковыми свойствами. Испанские ученые обнаружили, что каштановый мед обладает высокой антимикробной активностью в отношении золотистого стафилококка и кишечной палочки. Каштановый мед положительно влияет на сосуды, что делает его отличным средством при терапии варикозного расширения вен.
4. АКАЦИЕВЫЙ МЕД РЕГУЛИРУЕТ УРОВЕНЬ САХАРА В КРОВИ
· Акациевый мед можно по праву назвать рекордсменом по количеству благотворных свойств среди всех медовых представителей. Его спектр положительного воздействия на организм небывало широк. Его можно использовать для лечения множества болезней: респираторные заболевания, головные боли, болезни почек, а также он поможет избавиться от бессонницы.
· Многие врачи рекомендуют такой мед и детям, так как он не вызывает аллергии. Кроме того, этот нектар может найти свое применение и в борьбе с кожными и глазными заболеваниями. Акациевый мед обладает в основном желтоватым цветом и приятным сладким вкусом.
5. ДОННИКОВЫЙ МЕД БОРЕТСЯ С ПРОБЛЕМАМИ ПЕЧЕНИ
· Данный вид меда пчелы вырабатывают из растения донник. Многие могли его встречать в лесах или у себя на дачах, так как садоводы его относят больше к сорняку, нежели к культурному растению. Но от этого ценность донникового меда не уменьшается.
· Мед из донника на протяжении многих лет хорошо себя зарекомендовал в лечении гнойно-воспалительных процессов, а также сердечно-сосудистых заболеваний и заболеваний щитовидной железы.
· Входящие в его состав компоненты, а именно железо, калий, медь, витамин С, способны ускорить процесс заживления различных ран. Донниковый мед эффективен даже против устойчивых к антибиотикам бактерий. Вместе с тем, прием хотя бы 1-2 ч. л. такого меда позволит лучше и легче справляться с проблемами печени.
6. МЕД ЧАЙНОГО ДЕРЕВА (МАНУКА) ЗАЖИВЛЯЕТ РАНЫ И ЛЕЧИТ ЯЗВЫ
· К сожалению, манука пока еще не получила широкого распространения. Мед производится исключительно в Новой Зеландии. Имеет темно-коричневый цвет, кремовую консистенцию и умеренно сладкий вкус, отдающий ментолом и лечебными травами.
· О полезных свойствах меда чайного дерева уже чуть ли не слагаются легенды. И простые покупатели, и ученые в один голос подтверждают, что мед из чайного дерева – настоящее чудо природы. Манука обладает сильнейшими антисептическими, антимикробными, противовирусными и противовоспалительными свойствами. Но самое главное, почему мы должны обратить внимание на этот мед, это входящий в его состав компонент «метилглиоксаль». Такой компонент имеется почти во всех видах меда, но в ничтожно малых количествах. В меде чайного дерева концентрация метилглиоксаля невероятно высока. Именно этот компонент и способствует вымиранию бактерий в теле человека.
· Помимо этого, мед чайного дерева имеет и ранозаживляющее свойство. Такая способность меда распространяется не только на простые и мелкие раны, но и на довольно серьезные инфекционно-воспалительные заболевания кожи.
7. ГОРНЫЙ МЕД ИЗБАВЛЯЕТ ОТ СТРЕССА
· Существуют и такие виды меда, названия которых происходят не от растения, из которого пчелы производят мед, а от места, где эти растения росли. Дело в том, что пчелы иногда собирают нектар с разных видов растений.
· Горный мед считается по-настоящему ценным и приносит большую пользу нашему организму. Все потому, что в горах воздух свежий и чистый, растения не подвергаются вредному воздействию ни со стороны автомобилей, ни со стороны фабрик, даже обычная грязь и пыль на них не попадают. Получаемый мед состоит из более 40 видов трав и лекарственных растений.
· Выгода, которую мы можем извлечь из такого меда, очевидна! Горный мед быстро поднимает иммунитет, борется с усталостью, избавляет от депрессий, оказывает спазмолитическое действие, а также выручает при появлении простуды и других заболеваний. Вкус, цвет и запах зависят от конкретного места сбора меда (например, Алтай, Кавказ, Башкирия и т. д.).
· Безусловно, добавление меда в свой рацион пойдет на пользу вашему организму. Но чрезмерное его потребление может принести обратный эффект.
Во-первых, мед – высококалорийный продукт (304 ккал на 100 грамм), поэтому намазывая его на тост, добавляя в кашу и чай по три ложки каждый день, вы запросто сможете увидеть лишние килограммы на весах.
Во-вторых, мед может вызвать кариес, если после его употребления не прополоскать ротовую полость.
И в-третьих, самое опасное, что может вызвать мед – это аллергия. Существуют люди, организм которых отвергает этот продукт, тем самым вызывая аллергические реакции. Особенно осторожно нужно давать мед детям (до 3-х лет добавлять мед в пищу строго не рекомендуется).
Стоит сказать и о суточной норме потребления: для взрослых – не более 10 ч. л. в день, для детей (старше 3-х лет) – не более 4 ч. л.
Какой мёд от каких заболеваний
Какой мёд купить и от какой болезни (при каком недуге) он полезен? Какой мёд самый полезный, а какой, наоборот, принесет наименьшую пользу? Какие бывают разновидности и в чем их особенность?
В этой статье попробуем ответить на все ваши самые главные вопросы о меде…
В ежедневном рационе человека мед должен присутствовать обязательно. Ведь из двадцати четырех микроэлементов, необходимых нашему организму, в этом продукте содержится двадцать два! Употреблять мед нужно за час-полтора до еды и не глотать — минут двадцать держать во рту, пока не рассосется, как конфетка. Не стоит добавлять его в горячий чай, молоко — от высокой температуры продукт теряет свои чудодейственные свойства, превращаясь в обыкновенную сладость. Лучше употребляйте его «вприкуску».
АКАЦИЕВЫЙ – собранный с цветов белой и желтой акации, относится к лучшим сортам. Свежий мед – прозрачен, почти бесцветен, может иметь желтоватый оттенок, при кристаллизации становится белым, мелкозернистым. Имеет слабый, но приятный аромат, очень тонкий нежный вкус, долго сохраняет жидкий вид.
Лечебные свойства: Применяется как общеукрепляющее средство, а также при бессоннице, желудочно-кишечных, почечных заболеваниях, заболеваниях желчного пузыря и желчевыводящих протоков. Не вызывает аллергии.
Рецепты:
1. При язвенной болезни желудка и двенадцатиперстной кишки акациевый мед растворяют в теплой воде, и принимают за 1,5-2 часа до завтрака, обеда и через 3 ч. после ужина, добавив к нему 40-60 капель 5%-ной настойки прополиса в 1/4 стакана теплой воды или молока.
2. При различных заболеваниях глаз мед разводят в теплой воде в соотношении 1:2 и используют в качестве капель и примочек.
БАРБАРИСОВЫЙ – золотисто-желтого цвета, ароматный и нежный на вкус.
Лечебные свойства: Используется как ценное противовоспалительное и кровоостанавливающее средство, легкое мочегонное и желчегонное.
Рецепты:
1. Ранозаживляющая мазь из сушеницы и меда. Взять 1 ст.л. порошка сушеницы болотной и тщательно растереть в ступке с 1/2 стакана сливочного несоленого масла и таким же количеством меда. Использовать мазь при лечении ожогов, ран и язв.
2. Настой сушеницы с медом можно принимать и внутрь – по 1/4 стакана 3 раза в день за 20 мин. до еды как противовоспалительное средство при язвенной болезни желудка и двенадцатиперстной кишки.
БОДЯКОВЫЙ (ЧЕРТОПОЛОХА) – относится к первосортным сортам. Может быть золотистым, зеленоватым или даже бесцветным. Обладает приятным вкусом и ароматом.
Лечебные свойства: Используется в качестве ранозаживляющего, противовоспалительного, мочегонного и желчегонного средства. Улучшает обменные процессы, оказывает благоприятное действие при неврозах и головной боли.
БОЯРЫШНИКОВЫЙ – слегка горьковатый на вкус.
Лечебные свойства: Укрепляет сердечно-сосудистую систему, нормализует повышенное кровяное давление. Полезен после инфаркта миокарда, при лечении щитовидной железы, гастритов. Эффективен при аритмии сердца. Обладает успокаивающим действием.
Рецепты:
1. При миокардите, миокардиосклерозе, сердечной астме, аритмии рекомендуется смесь боярышникового меда с гранатовым соком – 1 ст. ложка на 1 стакан. Курс лечения – 2 месяца, по 100 гр. в сутки.
ВАСИЛЬКОВЫЙ – зеленовато-жёлтого или светло-жёлтого цвета, ароматный, обладает приятным вкусом, с слегка горьковатым привкусом, напоминающим миндаль. Обладает отличными вкусовыми и лечебными качествами.
Лечебные свойства: Используется как мочегонное, желчегонное и противовоспалительное средство.
Рецепты:
1. При ожогах свежий картофель промыть, очистить и натереть на мелкой пластмассовой терке. К 1/2 стакана полученной кашицы добавить 1 ч. ложку василькового меда, тщательно перемешать, нанести слоем в 1 см. на марлевую салфетку, приложить к обожженному участку кожи и слегка прибинтовать. Через 2 ч. повязку сменить. На ночь можно наложить повязку с прополисной мазью, а днем вновь повторить картофельно-медовые аппликации. Это средство дает положительный эффект и при угрях, застарелых язвах, экземе.
ВЕРЕСКОВЫЙ – темный, красно-бурый, имеет слабый аромат, приятный терпкий или горьковатый вкус. Кристаллизуется медленно, приобретая темный цвет с красноватым оттенком.
Лечебные свойства: Хороший антисептик. Хорошо помогает при бронхиальной астме, превосходное кровоочистительное и мочегонное средство. Замечательное лекарство при камнях в мочевом пузыре и почках, ревматизме и подагре. Обладает общеукрепляющим действием
Рецепты:
1. Для выведения песка, камней из почек приготовить сбор: корни стальника, плоды можжевельника, молодые листья березы, чистотел большой, лапчатка гусиная – по 20 гр..; 4 ст. ложки сбора залить 1 л. кипятка, настоять, добавить 2 ст. ложки верескового меда и выпить. Постарайтесь задержать мочеиспускание как можно дольше.
ГОРНЫЙ – обычно темного, темно-желтого и красно-бурого цвета, очень тягучий, медленно кристаллизуется, на вкус терпкий и горьковатый. Сочетает в себе полезные свойства лекарственных и других естественных медоносов растущих в горных и предгорных районах, поэтому рекомендуется как общеукрепляющее средство.
Лечебные свойства: Выводит соли, токсины. Полезен при стрессах, нарушениях эндокринной системы, сердечно-сосудистых заболеваниях. Эффективен при лечении болезней почек, печени, желудка.
ГОРЧИЧНЫЙ – имеет белый или светло-желтый цвет, быстро кристаллизуется в мелкозернистую массу. при кристаллизации приобретает желто-кремовый оттенок.
Лечебные свойства: Используется для борьбы с заболеваниями органов дыхания. К тому же эта разновидность меда способствует выведению из организма токсических веществ, улучшает работу почек, используется как мочегонное средство.
Рецепты:
1. Успокаивающий настой для отвыкающих от курения. Взять по 20 гр. корневища валерианы с корнями, плодов тмина, плодов фенхеля, цветков ромашки и листьев мяты перечной. 2 ст. ложки сухого измельченного сбора залить 0,5 л. кипяченой воды, настоять 2 ч, процедить и пить по 1 стакану с 1 ст. ложкой горчичного меда 2 раза в день.
2. При бронхиальной астме 1 часть горчичного меда растворить в 2 частях дистиллированной воды и применять для ингаляций в объеме 20 мл. на процедуру продолжительностью 20 мин. Курс лечения – до 30 дней, по 2 процедуры в день.
ГРЕЧИШНЫЙ – темный, коричнево-красный. Содержит железо. Специфический вкус и аромат.
Лечебные свойства: Очень полезен при заболеваниях желудочно-кишечного тракта, органов дыхательной системы, незаменим при малокровии. Гречишный мед – прекрасный антисептик, при местном применении эффективно лечит трофические язвы, гнойные раны, фурункулез и другие кожные заболевания. Употребление этого меда положительно воздействует на сердечно-сосудистую систему. С его помощью можно укрепить сердечную мышцу, улучшить кровообращение и нормализовать состав крови.
Рецепты:
1. При малокровии рекомендуется пить чай из цветов липы с гречишным медом с добавлением 2 ст. ложки красного вина на 1 стакан чая. Эффективен и гречишный мед с молоком: поскольку 1 ст. ложка меда содержит 100 калорий и 1 стакан молока – 124 калории, получается высококалорийный лечебный продукт.
ДОННИКОВЫЙ – светло-янтарного или белого цвета, обладает ароматом, напоминающим запах ванили.
Лечебные свойства: Незаменим при гнойно-воспалительных процессах. Он обладает ярко выраженным антисептическим действием. Современные достижения медицины, в частности, широкое внедрение антибиотиков, оттеснили использование меда. Между тем он сочетает в себе разнообразие благоприятных воздействий на рану: противомикробное, противовоспалительное и заживляющее. При наложении меда в ране усиливается кровоток и отток лимфы, создаются лучшие условия для питания клеток.
Рецепты:
1. При геморрое рекомендуются сидячие ванны, введение донникового меда через прямую кишку при помощи клизмы. Для ванны налить в таз 5 л. теплой воды, добавить 50 мл. настоя ромашки, мяты, мать-и-мачехи или зверобоя, 50 гр. донникового меда. Для клизмы используют 30%-ый раствор донникового меда.
2. При варикозном расширении вен 250 гр. очищенного чеснока размять в ступке и смешать с 350 гр. донникового меда, настоять в течение 7 дней и принимать по 1 ст. ложке 3 раза в день за 40 мин. до еды.
ЕЖЕВИЧНЫЙ – прозрачен, как вода. Обладает приятным вкусом, тонким ароматом.
Лечебные свойства: Особенно полезен при респираторных заболеваниях и пневмонии.
ЗОЛОТАРНИКОВЫЙ – темно-желтый или светло-коричневый.
Лечебные свойства: Эффективен при лечении воспаления мочевого пузыря и почек, при болезненном мочеиспускании, при кожных болезнях, а также при заболеваниях печени. Оказывает стимулирующие действие на обмен веществ.
Рецепты:
1. При заболевании почек рекомендуется употреблять 100 гр. меда с соком лимона и настоя шиповника – это снимает интоксикацию. При лечении заболеваний почек мед назначается внутрь с рекомендованной врачом минеральной водой, лучше теплой.
2. При заболевании печени смешать золотарниковый медс черной смородиной 1:1 и употреблять по 1 ч. ложке за 30 мин. до еды.
3. При заболевании мочевого пузыря в 1/2 стакана кипяченой воды растворить чайную ложку золотарникового меда и пить по 1/2 стакана 2 раза в день (перед едой). Средство эффективно при лечении недержания мочи.
ИВОВЫЙ – золотисто-желтого цвета. Приятный аромат цветущей ивы. Иногда качают его в начале мая.
Лечебные свойства: Применяют как сильное жаропонижающее средство, а также при головных болях, ревматизме, радикулите.
КАШТАНОВЫЙ – темного цвета, со слабым ароматом и горьким вкусом. Это мед из Крыма, с Кавказа и из Закавказья. Очень долго (более года) может сохранять жидкий вид.
Лечебные свойства: Каштановый мед обладает самыми ярко выраженными бактерицидными свойствами и поэтому находит свое применение при обработке ран и ангине. Рекомендуется при сердечно-сосудистых заболеваниях и расстройствах пищеварения. Оказывает благоприятное влияние на кровеносную систему и органы желудочно-кишечного тракта. Обладает противоотечным и противовоспалительным действием, способствует выделению желчи и повышает аппетит. Применяется при тромбофлебите, варикозном расширении вен, простате, простудных заболеваниях, оказывает благотворное действие на сосудистую систему. В народной медицине каштановый мед применяется как средство от бронхита, астмы и других заболеваний дыхательных путей. Нормализует давление, эффективен при лечении почек и варикозном расширении вен.
Рецепты:
1. При бронхите, охриплости, кашле смешать сок редьки с каштановым медом в отношении 2:1. Принимать по 1-2 ст. ложке каждый час.
2. При ангине полоскать горло растворенным в воде каштановым медом 3-4 раза в день. 5-6 раз в день в течение 10-15 дней (по одной чайной ложке на процедуру) держать мед во рту до полного растворения.
3. При обработке ран, язв смешивают 80 гр. меда и 20 гр. рыбьего жира; мазь накладывают на рану в виде повязки.
4. При гнойном отите и синусите нужно взять стерильную стеклянную палочку, достать ею мед из сотовой ячейки и закапывать по 2 капли через каждые 3 ч. в одну, а затем в другую ноздрю или в ухо.
КИПРЕЙНЫЙ – имеет прозрачный, немного зеленоватый цвет, Процесс кристаллизации начинается через несколько месяцев после откачки. После кристаллизации становится белым и напоминает по виду сало.
Лечебные свойства: Кипрейный мед полезен при различных заболеваниях, в том числе, болезней слизистой оболочки и кожи. Он богат витаминами и минеральными веществами, поэтому считается хорошим средством при простуде и гриппе. Кроме того, полезно употреблять кипрейный мед людям подверженным нервным расстройствам и неврозам. Кипрейный мёд применяют как успокаивающее, противовос-палительное и обволакивающее средство при гастритах с повышенной кислотностью, язвенной болезни желудка и двенадцатиперстной кишки. Им успешно лечат болезни горла, запоры, хронические заболевания внутренних органов. В тибетской медицине используется при заболеваниях слизистых оболочек и кожи. Этот мед стимулирует кроветворение и повышает защитные свойства организма, а растворенный в теплой воде оказывает благотворное действие при бессоннице и головных болях, нормализует деятельность кишечника, полезен кормящим матерям. Кипрейный мёд очень полезен для мужчин. Он рекомендуется для повышения мужского иммунитета.
КЛЕВЕРНЫЙ – светлый, почти бесцветный, прозрачный, иногда с зеленоватым оттенком, с тонким нежным ароматом и приятным вкусом. Быстро кристаллизуется в твердую мелкокристаллическую белую массу. При кристаллизации образует твердую массу.
Лечебные свойства: Наиболее эффективен при лечении гипертонии. Благодаря дубильным веществам его можно применять при самых разных воспалениях слизистых оболочек. Хорошо помогает от кашля и при заболеваниях печени, используется как потогонное, мочегонное, отхаркивающее средство. Полезен при атеросклерозе. Считается превосходным кровоочистительным средством. Применяется при геморрое, в диетическом питании, при истощении, особенно хорош для восстановления сил после болезни или операции. Если есть проблемы с гинекологией – поможет именно клеверный мед. Женщины также должны знать, что маски для лица на основе этого уникального продукта чудесно смягчают и питают кожу.
Рецепты:
1. Для лечения и профилактики атеросклероза в 100 гр. воды добавить 3 ст. ложки клеверного меда и 1 ст. ложку лимонного сока. Поместить в стеклянную посуду с плотной крышкой и поставить в холодильник. Принимать по 1 ч. ложке с 1/2 стакана теплой воды или чая 3 раза в день перед едой 4 недели.
2. От кашля: сок 1 лимона и 2 ст. ложки глицерина залить медом. Если кашель слабый, принимать по 1 ч. ложке в течение дня, если сильный – по 1 ч. ложке утром, до обеда, на ночь и, если возможно, ночью.
ЛАВАНДОВЫЙ – пчелы вырабатывают из нектара светло-синих или голубовато-фиолетовых цветков лаванды лекарственной. Имеет золотистый цвет, прозрачный. Обладает нежным ароматом и приятным вкусом.
Лечебные свойства: Благотворно влияет на печень, употребляется в качестве желчегонного средства.
Рецепты:
1. При заболевании печени 1 ст. ложку лавандового меда растворить в 1 стакане теплой воды; принимать по 1 стакану 3 раза в день перед едой.
ЛЕСНОЙ – по своей окраске он более темный, чем луговой. У него специфический терпкий аромат и характерный привкус.
Лечебные свойства: Обладает ярко выраженными противовоспалительным, успокоительным действиями. Полезен при простуде, заболеваниях бронхов и легких, желудочно-кишечного тракта, воспалительных процессах различной локализации, кашле, неврозах, бессоннице.
ЛИПОВЫЙ – слабо-желтого или зеленоватого цвета, очень душистый.
Лечебные свойства: Липовый мед применяется при лечении ангины, насморка, ларингита, бронхита, трахеита, бронхиальной астмы, при ослаблении сердечной мышцы, при воспалении желудочно-кишечного тракта, заболеваниях почек, желчевыводящих путей и гинекологических заболеваниях. Оказывает хорошее местное действие при лечении гнойных ран и ожогов. Имеет сильные антибактериальные свойства.
Рецепты:
1. При стоматите 25 гр. сухих цветков аптечной ромашки (6 ст. ложек) залейте в эмалированной посуде 500 мл. кипяченой воды, закройте крышкой и поставьте на 15 мин. на кипящую водяную баню. Затем дайте настою остыть, процедите его, а оставшееся сырье отожмите и доведите объем кипяченой водой до 500 мл., растворите в нем 2 ст. ложки липового меда. Полоскать рот 3 раза в день после еды. Отвар можно также использовать в виде примочек при язвах, экземах, ожогах.
2. При простуде 2 ст. ложки липового меда растворить в 1 стакане теплого молока. Принимать на ночь.
ЛУГОВОЙ – чаще золотистого цвета. Приятный аромат и вкус. Это полифлерный мед, собран пчелами из нектара большого количества луговых трав.
Лечебные свойства: Принимать его рекомендуется тем, кто страдает заболеваниями желудочно-кишечного тракта и различного рода гастритами.
Рецепты:
1. Для лечения ран 1 ст. ложку порошка сушеницы болотной тщательно растереть в ступке с S стакана сливочного несоленого масла и таким же количеством меда. Использовать мазь при лечении ожогов, труднозаживающих ран и язв.
МАЛИНОВЫЙ – обладает тонким ароматом цветков малины и нежным вкусом ягод.
Лечебные свойства: Чрезвычайно полезен при простудных заболеваниях, показан как профилактическое средство против гриппа. При местном применении эффективно лечит стоматиты и воспаления слизистых тканей. Малиновый мед – очень хорошее лечебное средство для детей, у которых нарушена деятельность печени, и при других болезнях.
Рецепты:
1. При гриппе и простуде свежеотжатый сок хрена смешать с медом в соотношении 1:1 и принимать перед сном по 1 ст. ложке, запивая теплой водой.
МЁД ИЗ ДУШИЦЫ – светлый, очень ароматный.
Лечебные свойства: Отменное средство при бессонице, улучшает мозговую деятельность, хорош также при неврозах: успокаивает нервную систему, также применяется в качестве профилактического средства от атеросклероза, улучшает перестальтику кишечника. Кроме этого, обладает мочегонным и потогонным эффектом, полезен тем, у кого имеются заболевания желчного пузыря и печени.
ОДУВАНЧИКОВЫЙ – ранний майский мед. Желтоватого цвета, приятного вкуса и аромата.
Лечебные свойства: Одуванчиковый мед рекомендуют применять при заболеваниях печени, желтухе, гипертонии, бессоннице, геморрое.
Рецепты:
1. При гипертонии смешать 1 стакан сока 1 ст. свеклы, 1 стакан сока хрена, сок 1 лимона и 1 стакан одуванчикового меда. Принимать по 1 ст. ложке 3 раза в день перед сном в течение 2 месяцев.
2. При гепатите смешать по 1 стакану сока хрена, красной моркови, столовой свеклы и одуванчикового меда с добавлением 30 мл. водки и сок 2 лимонов; принимать по 1 ст. ложке 3 раза в день за 20-30 мин. до еды в течение 30 дней; через 2 месяца курс повторить.
ПЛОДОВЫЙ – это самый нежный, тонкого аромата и приятного вкуса мед, окрашенный в светло-янтарные тона.
Лечебные свойства: Просто необходим людям, страдающим ишемической болезнью сердца.
ПОДСОЛНЕЧНЫЙ – золотисто-желтого цвета, обладает слабым ароматом и приятным вкусом. этот сорт меда очень приятен на вкус именно в жидком состоянии, но, к сожалению, он быстро кристаллизуется, иногда даже в сотах, не дожидаясь откачки. Засахаренный подсолнечный мед уступает по вкусовым качествам гречишному и майскому. Подсолнечный мед обычно продается по более низкой цене, чем другие сорта, но по питательным и лечебным свойствам он почти не уступает им.
Лечебные свойства: Рекомендуется он при лечении заболеваний сердца, дыхательных путей и при желудочно-кишечных коликах. Также подсолнечный мед полезен при атеросклерозе, остеохондрозе, различных невралгиях. Он хорошо выводит шлаки из организма и нередко применяется как мочегонное средство.
Рецепты:
1. При простуде и гриппе принимают смесь меда с соком лимона (100 гр. меда и сок 1 лимона).
2. Как отхаркивающее средство: 6 гр. листьев подорожника залить стаканом воды и кипятить в течение 10 мин.; остудить, добавить 30 гр. меда. Принимать по 1 ст. ложке 3 раза в день.
3. При заболеваниях легких взять по стакану сока красной моркови, столовой свеклы, хрена, 30 гр. водки, 1 стакан меда, сок 2 лимонов, тщательно перемешивать и принимать по 1 ст. ложке за 20 мин. до еды.
ПОЛЕВОЙ – светло-желтого цвета, иногда желтовато-коричневатого.
Лечебные свойства: Оказывает успокаивающее действие на нервную систему, рекомендуется при головной боли, бессоннице, учащенном сердцебиении и болях в области солнечного сплетения.
РАПСОВЫЙ – светлый или желтоватый, очень густой. Вкус приторный, горьковатый, с горчичным ароматом. Быстро кристаллизуется.
Лечебные свойства: Эффективен при варикозных язвах; обладает хорошим мочегонным действием. Расширяет сосуды головного мозга, способствует лечению язвенной болезни желудка.
Рецепты:
1. При язвах смазывать поверхность плохо заживающей язвы и раны медом и прикладывать его в повязках.
СИНЯКОВЫЙ – прозрачный, светлый, с зеленовато-желтоватым оттенком, обладает очень тонким ароматом и приятным вкусом. Имеет высокую вязкость, кристаллизуется медленно.
Лечебные свойства: Используются как прекрасное лечебное средство при сердечно-сосудистых заболеваниях и в качестве успокоительного при неврозах. Полезен при ревматизме, остеохондрозе.
СОТОВЫЙ – это продукт 100% природного производства. Мед законсервирован в своей природной таре – сотах, пчелами.
Лечебные свойства: Оказывает на организм общеукрепляющее и омолаживающее действие. Пережевывание восковых сот способствует очистке зубов и дезинфекции полости рта.
ФАЦЕЛИЕВЫЙ – светло-зеленого или белого цвета. Вкус приятный, тонкий, аромат нежный. Кристаллизация салообразная мелкозернистая. При кристаллизации мед становится белым.
Лечебные свойства: Успешно используется в качестве диетического продукта при желудочно-кишечных заболеваниях.
Рецепты:
1. При заболеваниях желудка 100 гр. сока алоэ, 500 гр. хорошо измельченных ядер грецких орехов и 300 гр. меда хорошо смешать; принимать по 1 ст. ложке 3 раза в день за 30 мин. до еды.
ЭСПАРЦЕТОВЫЙ – светло-янтарного цвета, прозрачный, имеет приятный аромат и вкус. Медленно кристаллизуется. В севшем виде представляет собой белую салообразную массу с кремовым или легким зеленоватым оттенком.
Лечебные свойства: Известен как хорошее общеукрепляющее средство. Обладает мочегонным, потогонным действием, укрепляет капиллярные сосуды. Применяется при желудочно-кишечных и гинекологических заболеваниях, маточных кровотечениях, а также как средство, усиливающее половую функцию у мужчин.
Рецепты:
1. При импотенции свежеотжатый сок моркови смешать с эспарцетовым медом 1:1. Принимать по 1/4 стакана 3 раза в день.
При любом состоянии здоровья (за исключением аллергии на мед) этот отменный продукт полезен в качестве быстродействующего восстановительного средства. При физических нагрузках добавит сил, так как мед – очень калориен: в 100 граммах содержится 315 ккал. Но имейте в виду, что при нагревании более сорока градусов чудодейственные свойства меда теряются. Поэтому с горячим чаем его употреблять не рекомендуется.
Будьте здоровы!
http://gorodreceptov.ucoz.ru
| < Предыдущая | Следующая > |
|---|
8 полезных свойств меда для счастливого Нового года – Центр диетологии и питания
Понедельник, 17 сентября 2012 г. – Каждый сентябрь евреи во всем мире отмечают еврейский Новый год множеством традиционных блюд, включая яблоки а также мед и медовый торт, символизирующие сладкий грядущий год. Эта традиция насчитывает сотни (если не тысячи) лет, но это не только добрые пожелания – мед также можно использовать как естественное средство от множества недугов.
Отметьте 5773 год по еврейскому календарю (и конец Национального месяца меда!), Воспользовавшись удивительной пользой меда для здоровья, и попробуйте несколько замечательных сезонных рецептов меда, которые понравятся как евреям, так и неевреям этой осенью.
- Усилитель иммунитета: Антиоксидантные и антибактериальные свойства меда могут помочь вашей иммунной системе защитить вас от болезней, включая простуду.
- Средство для похудания: Мед может помочь людям, сидящим на диете, похудеть, если его использовать в умеренных количествах в качестве замены других подсластителей. Имейте в виду, что в одной столовой ложке меда около 63 калорий, поэтому используйте ее экономно.
- Средство для пищеварения: Мед – популярное домашнее средство (хотя научные данные этого неубедительны) от всех видов проблем с пищеварением, включая запоры и язвы.В качестве домашнего улучшения пищеварения попробуйте чай с медом и лимоном.
- Средство от простуды: Многие люди верят, что мед обладает успокаивающими и успокаивающими свойствами при простуде. Добавьте мед в чай или горячую воду с лимоном, чтобы быстро успокоить горло.
- Противовоспалительное средство: В исследовании 2005 года было обнаружено, что местное применение меда уменьшает мукозит или воспаление пищеварительного тракта у 85 процентов пациентов. Напиток из меда и яблочного уксуса широко используется в качестве домашнего средства от боли при артрите или воспалении суставов.
- Антибактериальная обработка: Мед давно используется в качестве местного антибактериального средства для лечения мелких порезов, ожогов и царапин. Хотя научное сообщество все еще не решило, насколько эффективно это лечение, предварительные данные показывают, что мед, нанесенный на рану в больших количествах, действительно может помочь предотвратить инфекцию.
- Пустышка для кожи: Мед является популярным ингредиентом, наряду с пчелиным воском, в натуральных лосьонах и бальзамах для губ. Считается, что его антимикробные свойства делают его хорошим выбором в качестве домашнего средства от прыщей.Смешайте мед с теплой водой и овсянкой, чтобы получить полностью натуральный скраб для кожи.
- Energy Booster: Мед, как и все сахара, может дать временный прилив энергии и повысить уровень глюкозы в крови, и это более здоровый вариант, чем многие заменители сахара. Исследования показывают, что диабетики также могут есть ограниченное количество меда при условии, что они внимательно следят за уровнем сахара в крови.
Хотите попробовать мед? Вот несколько рецептов, которые можно добавить к регулярной ротации:
- Хала (традиционный еврейский яичный хлеб) с медом
- Яблоки на гриле с сыром и медом
- Печенье с миндалем и медовым маслом
- Медовый миндальный торт без муки
- Свежий инжир С йогуртом и медом
- Медовые бараньи отбивные
СКАЖИТЕ НАМ: Как вы используете мед? Поделитесь в комментариях ниже.
Влияние диетического меда на микрофлору кишечника и токсичность микотоксинов у мышей
BMC Complement Altern Med. 2006; 6: 6.
, 1 , 2 , 3 и 4Али М Эзз Эль-Араб
1 Департамент пищевых наук и питания Национального исследовательского центра, 12644 – Докки, Гиза, Египет
Шенуда М. Гиргис
2 Департамент клеточной биологии, Национальный исследовательский центр, 12644 – Докки, Гиза, Египет
Эман М. Хегази
3 Департамент пищевой токсикологии, Национальный исследовательский центр, 12644 – Докки, Гиза, Египет
Аззат Б. Абд Эль-Халек
4 Департамент молочных продуктов, Национальный исследовательский центр, 12644 – Докки, Гиза, Египет
1 Департамент пищевых наук и питания Национального исследовательского центра, 12644 – Докки, Гиза, Египет
2 Департамент клеточной биологии, Национальный исследовательский центр, 12644 – Докки, Гиза, Египет
3 Департамент пищевой токсикологии, Национальный исследовательский центр, 12644 – Докки, Гиза, Египет
4 Департамент молочной промышленности, Национальный исследовательский центр, 12644 – Докки, Гиза, Египет
Автор, отвечающий за переписку.Поступило 20 февраля 2005 г .; Принято 14 марта 2006 г.
Copyright © 2006 Ezz El-Arab et al; лицензиат BioMed Central Ltd.Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License (http://creativecommons.org/licenses/by/2.0), которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе. при условии правильного цитирования оригинала.
Эта статья цитируется в других статьях в PMC.Abstract
Справочная информация
Пчелиный мед – это функциональный корм, обладающий уникальным составом, антимикробными свойствами и бифидогенным действием.Настоящее исследование было предпринято для того, чтобы оценить, может ли мед подавлять токсическое действие микотоксинов.
Методы
Производство биомассы и токсинов с помощью Aspergillus parasiticus и Aspergillus ochraceus отслеживали в средах без меда и с медом. Хотя афлатоксины и охратоксин А вводили самцам швейцарских мышей-альбиносов в дозах до 1 мкг и 10 нг / кг массы тела / день соответственно. Подопытных животных кормили диетами без нашего 10% меда в течение двух месяцев.Следили за изменениями в пробиотических бактериях толстой кишки, детерминантном ферменте толстой кишки глюкуронидазе и генотоксичности.
Результаты
Добавление 32% в среду увеличивало биомассу A parasiticus , в то время как биомасса A. ochraceus уменьшалась, и охратоксин А. не производился. Когда в среду добавляли мед в соотношении 32 и 48%. Связи между массой мицелия и продукцией микотоксинов не обнаружено. Пероральное введение афлатоксинов (смесь B 1 , B 2 , G 1 и G 2 ) и охратоксина А.вызывали структурные и численные хромосомные аберрации в костном мозге и половых клетках самцов мышей, тогда как лечение медом снижало генотоксичность микотоксинов. Также оба токсина вызывали гистопатологические изменения в печени и почках. Питание на диете с добавлением меда улучшило гистопатологические изменения в случае группы афлатоксинов, но не в случае группы охратоксина А. (за исключением почек в двух случаях). Не было обнаружено значительных различий в активности β-глюкуронидазы толстой кишки между группами, получавшими диету с медом или без него.С другой стороны, количество бифидобактерий толстой кишки и лактобацилл заметно увеличилось в группе, получавшей диету с добавлением меда.
Заключение
Замена сахара на мед в обработанных пищевых продуктах может подавить вредные и генотоксические эффекты микотоксинов и улучшить микрофлору кишечника.
Общие сведения
Пищевые продукты больше не ценятся потребителями только с точки зрения их вкуса и непосредственных потребностей в питании, но также с точки зрения их способности приносить особую пользу для здоровья.Функциональные продукты питания стали важным сектором пищевых продуктов, обеспечивающим пользу для здоровья благодаря функциональным ингредиентам в этих продуктах. Функциональные продукты питания, направленные на улучшение баланса и активности кишечной среды, в настоящее время составляют самый большой сегмент рынка функциональных продуктов питания [1,2].
В течение долгого времени было замечено, что мед можно использовать для лечения заболеваний печени, сердечно-сосудистой системы и желудочно-кишечного тракта [3]. Мед – это натуральный продукт с очень сложным химическим составом. Он состоит в основном из фруктозы и глюкозы, но также содержит от 4 до 5% фруктоолигосахаридов, которые служат пребиотическими агентами [4].Он содержит более 180 веществ, в том числе аминокислоты, витамины, минералы и ферменты [5]. Антимикробные свойства перекиси водорода и неперекисных компонентов меда проверялись в нескольких исследованиях [6].
Распространенность заражения микотоксинами (афлатоксинами и охратоксинами) носит глобальный характер. По оценкам, четверть сельскохозяйственных культур в мире в той или иной степени загрязнены микотоксинами, особенно распространенными в развивающихся странах. Как правило, микотоксины обычно содержатся в пищевых продуктах [7,8].Микотоксины вызывают серьезную озабоченность из-за их пагубного воздействия на здоровье людей и животных. Aspergillus flavus и A. parasiticus продуцируют афлатоксины. Охратоксин А был открыт как метаболит Aspergillus ochraceus . Из токсинов Aspergillus только охратоксин (природный канцероген и нефротоксин) потенциально так же важен, как афлатоксины (природный канцероген). Оба они связаны как с токсичностью, так и с канцерогенностью для здоровья человека.Ведущий деятель в области оценки риска назвал микотоксины наиболее важным хроническим диетическим фактором риска, превосходящим синтетические контаминанты, токсины растений, пищевые добавки или остатки пестицидов [7,9].
Загрязняющие пищевые вещества, попадающие в организм оральным путем, напрямую подвергаются действию кишечной микрофлоры. Микрофлора желудочно-кишечного тракта (ЖКТ) все чаще признается одним из факторов, влияющих на здоровье человека. Эта микрофлора представляет собой динамическое равновесие, которое может быть изменено диетой [10].Нормальная здоровая микрофлора кишечника содержит множество штаммов молочнокислых бактерий (LAB), некоторые из которых были выделены, приписаны несколько полезных эффектов и названы штаммами пробиотиков [11]. Несколько исследований показали, что пробиотические бактерии толстой кишки могут удалять микотоксины посредством физического связывания в качестве механизма удаления мутагена [12-14]. Кроме того, тяжесть отравления микотоксинами может быть усилена такими факторами, как дефицит витаминов, недостаток калорий, злоупотребление алкоголем и статус инфекционного заболевания [7].
Кроме того, есть доказательства того, что пробиотические бактерии толстой кишки могут положительно модулировать определенные микробные ферменты толстой кишки, которые могут играть роль в заболеваниях, связанных с диетой. Изменение этих параметров указывает на защитный эффект от канцерогенов. Пробиотические бактерии связывают мутагены in vitro , а также предотвращают выведение мутагенов из организма человека. Однако необходимы дополнительные исследования, чтобы определить физиологическое значение эндогенных пробиотических бактерий толстой кишки [15].
Полное устранение любых естественных токсинов из пищевых продуктов – недостижимая цель. Наука о питании расширяет знания о том, как продукты питания влияют на потребителей в зависимости от конкретных параметров здоровья.
Следовательно, необходимо провести более глубокие исследования, чтобы выяснить потенциал защитного действия меда за счет его противогрибкового действия и снижения хронических заболеваний, связанных с питанием, таких как рак.
Для достижения этой цели мы изучили in vitro , влияние меда на рост грибов и образование микотоксинов с помощью Aspergillus в пищевых продуктах.Кроме того, мы изучили действие меда in vivo в присутствии микотоксина на эндогенные пробиотические бактерии толстой кишки, микробные ферменты толстой кишки, пролиферацию клеток и генотоксичность.
Методы
Монофлоральный мед (хлопок) был приобретен в Центре исследований пчеловодства Министерства сельского хозяйства, Каир, Египет. Арахис ( Archis hypogalal ) с повреждениями и наблюдаемым загрязнением грибами был получен из источников основного поставщика арахиса в Египте. Бактериальная культура, среда deMann, Rogosa, Sharpe (MRS) (Oxoid, Hampshire, United Kingdom) для Lactobacilli.Триптонно-фитоновые дрожжи (TPY), среда (Oxoid) для бифидобактерий. Стандарт охратоксина А (каталожный № 01877) был приобретен у химической компании Sigma-Aldrich (Сент-Луис, США). Грибы, продуцирующие афлатоксины и охратоксин А, A. parasiticus (FRR 2748) и A. ochraceus (NRRL 3174) были получены от Ассоциации стандартов Австралии (Северный Сидней, Новый Южный Уэльс, Австралия). Природные афлатоксины (B 1 , B 2 , G 1 и G 2 ) были экстрагированы из арахиса [16], и их концентрации были определены методами тонкослойной (ТСХ) и высокоэффективной жидкостной хроматографии (ВЭЖХ). [17].
Концентрация экстрагированных афлатоксинов B 1 , B 2 , G 1 и G 2 из арахиса составила 211,42, 135,53, 368,10 и 99,72 мкг / кг соответственно. Полученный экстракт растворяли в 2-литровом соевом масле и хранили в холодильнике до использования.
Изучение влияния меда на продукцию микотоксинов
A. parasiticus (FRR 2748) и A. ochraceus (NRRL 3174) культивировали на картофельном агаре с декстрозой в течение 10 дней при 25 ° C, пока они не стали хорошо спорулированными.Споры собирали в 10 мл стерильного 1% раствора Твина 80 (об. / Об.) С получением 10 5 спор / мл. Колбы, содержащие 500 мл среды дрожжевой экстракт-сахароза (ДА) с добавлением нулевого, 32 и 48% меда, инокулировали 2,0 мл этой суспензии, инкубировали при 28 ° C в течение 21 дня, а затем анализировали на афлатоксины [18,19].
Изучение влияния меда на прием микотоксинов у мышей
Сорок два самца швейцарских мышей-альбиносов возрастом примерно 7 недель и весом 20 ± 3 г были получены из колонии приюта для животных Национального исследовательского центра, Каир, Египет.Животных содержали индивидуально в клетках из нержавеющей стали с контролируемой температурой (24–26 ° C), влажностью (40–70%) и условиями освещения (12-часовой цикл свет / темнота) и позволяли свободный доступ к дистиллированной воде и основной диете (AIN- 93 М) на 10 дней в качестве адаптивного периода. Порошок AIN-93 M содержал белок (14%), крахмал (62,07%), сахарозу (10%), жир (4%), клетчатку (5%), минеральную смесь (3,5%), смесь витаминов (1%). ), L-цистин (0,18%), битратрат холина (0,25%) и тетрабутилгидрохинон (0,00008%) [20].
Затем мышей случайным образом разделили на шесть групп (по 7 животных в каждой). Группа 1 st получала диету AIN-93 M и вводила охратоксин A (10 нг / кг массы тела / день, группа ОТ). Группу 2 и лечили так же, как группу 1, за исключением того, что она получала мед / диету AIN-93 M (группа HOT). Группе 3 (AT) и H (HAT) скармливали диету AIN-93 M и мед / AIN-93 M, соответственно, и вводили смесь афлатоксинов (1 мкг / кг массы тела / день). Группы 5 (NTC) и 6 (HTC) служили контролем и получали рацион AIN-93 M и медовый AIN-93 M соответственно.Эксперимент проводился в течение 2 месяцев, и животных еженедельно взвешивали для расчета суточной дозы. Животным внутрибрюшинно вводили 0,5 мл 0,05% колхицина за 2 часа до умерщвления, чтобы задержать клетки костного мозга и сперматоциты в стадии метафазы после голодания в течение ночи. Содержимое слепой кишки собирали в чистые пробирки Эппендорфа. Бедро, печень, почки, селезенка, легкие, яички и мозг были удалены.
Активность микробных ферментов толстой кишки
Активность бактериальной β-глюкуронидазы определяли в пищеварении содержимого слепой кишки с помощью P-нитрофенил-β-D-глюкуронида (Fluka, продукт No.73677) [21]. Разведение слепой кишки проводили при 4 ° C. Реакционная смесь содержала 0,3 мл раствора субстрата (5 моль P-нитрофенил-β-D-глюкуронида / л) и 0,2 мл разбавленной слепой кишки (1 часть слепой кишки и 2 части фосфатного буфера pH 6,4, мас. / Об.) И хорошо перемешивалась. , инкубировали при 37 ° C / 48 часов. Концентрацию высвободившегося п-нитрофенола измеряли от до оптического поглощения при 400 нм после добавления 2,5 мл 0,1 н. NaOH для остановки реакции. Активность фермента выражали как образовавшийся молярный продукт / г содержимого слепой кишки.
Исследование хромосомных аберраций
Хромосомы были подготовлены, окрашены 5% красителем Гимза в фосфатном буфере (pH 6,8), и 50 метафазных спредов были проанализированы на каждое животное на предмет хромосомных аберраций в клетках костного мозга [22]. Также были исследованы хромосомные аберрации в половых клетках семенников тех же животных [23].
Гистопатологическое исследование
Биопсии печени, почек, селезенки, легких и мозга фиксировали в 10% забуференном растворе формалина в течение 12 часов и превращали в парафиновые блоки.Срезы ткани толщиной 5 мм вырезали на предметных стеклах с альбумином и окрашивали гематоксилином и эозином (Hx. & E.). Для правильной оценки фиброза ткани и лучшей демонстрации кровеносных сосудов в срезах ткани также использовалось окрашивание трихромом Массона [24].
Исследования пробиотических бактерий толстой кишки
Подсчитывали эндогенные популяции пробиотических бактерий толстой кишки (лактобациллы и бифидобактерии). В конце эксперимента у каждого животного собирали образцы содержимого слепой кишки.Образцы содержимого слепой кишки немедленно (в течение 30 минут) помещали в сосуд для анаэробов и хранили при 4 ° C до анализа (максимум 6 часов). 100-кратные серийные разведения проводили в предварительно восстановленном растворе Рингера, содержащем 0,5% цистеина. Чашки Петри с различными средами инокулировали и инкубировали в течение 72 часов при 37 ° C в анаэробной атмосфере с использованием Gen Kits в сосудах Oxoid. Бактерии были обнаружены на следующих селективных средах: среда deMan, Rogosa, Sharpe (MRS) (Oxoid, Hampshire, United Kingdom) для лактобацилл и среда Tryptone Phytone Yeast (TPY) (Oxoid) для бифидобактерий.После инкубации подсчитывали колонии. Количество бактерий выражается как log 10 колониеобразующих единиц (log 10 КОЕ / г) свежего образца содержимого слепой кишки с пределом обнаружения 3,30 log 10 КОЕ / г.
Статистика
Все данные были выражены как среднее ± стандартная ошибка (SEM) среднего и проанализированы с помощью одностороннего дисперсионного анализа ANOVA с использованием статистической программы SAS (SAS версия 6.11, SAS Institute, Кэри, Северная Каролина). В случае значимости для сравнения различий между средними значениями использовали критерий множественного диапазона Дункана.Уровни значимости были проверены.
Результаты
Влияние меда на продукцию микотоксинов
Исследования in vitro показали, что биомасса A. parasiticus была увеличена в среде, содержащей 32% меда. Однако биомы A. ochraceus были уменьшены в среде, содержащей 32 и 48% меда. Охратоксин А не производился ни при одной концентрации меда. С другой стороны, продукция афлатоксинов B 1 , B 2 , G 1 и G 2 увеличивалась в среде, содержащей 32% меда, но снижалась в среде с высокой концентрацией меда без образования афлатоксина B 2 и G 2 (таблица).Как правило, мы не обнаружили положительной связи между массой мицелия и производством микотоксинов.
Таблица 1
Влияние меда на массу мицелия и концентрацию микотоксинов.
| Мед% | Масса мицелия (г) | Концентрация микотоксинов (мкг / л) | ||||||||||||||||||
| FRR 2748 | FRR | |||||||||||||||||||
| B1 | B2 | G1 | G2 | 71 | 14,69 | 12,69 | 8,99 | 7,70 | 5,00 | 32,03 | ||||||||||
| 32,10 | 40,40 | 13,60 | 15,00 | 15,00 12293 | 30,00 | 10,00 | 5,80 | 00,00 | 1,18 | 00,00 | 00,00 | |||||||||
Влияние меда на активность глюкуронидаз толстой кишки
Влияние пробиотических β-бактерий на активность глюкуронидаз в кишечнике содержимое слепой кишки представлено в таблице.Уровень глюкуронидазы был очень низким, и достоверных различий в его содержании в слепой кишке между всеми группами не наблюдалось (P <0,05).
Таблица 2
Влияние различных обработок микотоксинами и медом на активность бактериальных глюкуронидаз в содержимом слепой кишки мышей.
| β-глюкуронидазы мкмоль / г | Группы | |||||||||||||
| OT | HOT | AT | HAT | HAT | HAT .39 ± 0,11 | 0,40 ± 0,12 | 0,32 ± 0,10 | 0,37 ± 0,10 | 0,38 ± 0,14 | 0,42 ± 0,13 | ||||
Генотоксические эффекты микотоксинов на клетки костного мозга
Настоящее исследование введение афлатоксинов (B 1 , B 2 , G 1 и G 2 ) и охратоксина A самцам мышей индуцировало структурные и числовые хромосомные аберрации (таблица и рисунок).
Таблица 3
Средние значения различных типов хромосомных аберраций в клетках костного мозга мышей-самцов, получавших охратоксин А и афлатоксины (B 1 , B 2 , G 1 и G 2 ).
| Обработанные группы | Числовые аберрации | Структурные аберрации | |||||||
| Перидиплоидия | 9029 Дезинфекция | 9029 Хроматидные зазоры 9029 Хроматидные зазоры 9029 9029 Хроматидные зазоры 9029 9029 Хроматидные зазоры 9029 | |||||||
| OT | 2,50 ± 0,45 a | 0,67 ± 0,17 a | 0.67 ± 0,21 a | 0,83 ± 0,17 b | 2,50 ± 0,00 a | 0,83 ± 0,21 a | 5,50 ± 0,31 b | ||
| HOT | 1,83 ± 0,33 | 0,50 ± 0,00 a | 0,50 ± 0,00 a | 0,50 ± 0,00 b | 0,83 ± 0,21 b | 0,67 ± 0,17 a | 3,00 ± 0,349 c | 3,00 ± 0,349 c | 3,00 ± 0,349 |
| АТ | 2.83 ± 0,67 a | 0,67 ± 0,017 a | 0,67 ± 0,17 a | 4,33 ± 1,31 a | 1,17 ± 0,21 b | 0,83 ± 0,21 a | ± 0,48 a | ||
| HAT | 2,50 ± 0,36 a | 0,50 ± 0,00 a | 0,50 ± 0,00 a | 0,67 ± 0,17 b | 1,00 ± 0,22 | 0.50 ± 0,00 a | 3,17 ± 0,21 c | ||
| NTC | 2,00 ± 0,22 a | 0,50 ± 0,00 a | 0,50 ± 0,0 a | 2 0,50 ± 0,0 b0,83 ± 0,21 b | 0,50 ± 0,00 a | 2,83 ± 0,21 c | |||
| HTC | 2,00 ± 0,34 a | 0,50 ± 0,00 a | 0,50 ± 0,00 b | 0,67 ± 0,17 b | 0,50 ± 0,00 a | 2,67 ± 0,17 c | |||
Метафазные спреды самцов мышей, обработанных охратоксин А и афлатоксины, показывающие: а) ослабление центромеры. б) удаление. В) разрыв хроматиды (маленькая стрелка), фрагмент (большая стрелка) клеток костного мозга и г) полиплоидия. д) аутосомно-однолистный. F) х-у одновалентных клеток сперматоцитов.
Структурные хромосомные аберрации регистрировались в виде хроматидных разрывов, хроматидных разрывов (рисунок), центромерных аттенуаций (рисунок), делеций (рисунок) и фрагментов (рисунок). В таблице представлены средние значения различных структурных хромосомных аберраций, индуцированных микотоксинами в клетках костного мозга мышей-самцов. Результаты показывают низкую частоту хроматидных промежутков, разрывов и фрагментов, тогда как частота центромерного ослабления была значительно высокой между группой AT и группой HAT с одной стороны и между группой AT и контрольными группами (NTC и HTC) с другой стороны.
Значительная разница (P <0,05) была также обнаружена в делециях (рисунок) между группой OT и группой HOT, а также между группой OT и контрольными группами (NTC и HTC), что можно отнести к защитному эффекту меда.
Значительное увеличение (P <0,05) частоты общих структурных хромосомных аберраций было обнаружено между группой OT и группой HOT с одной стороны и между группой OT и контрольными группами (NTC и HTC) с другой стороны. Также была обнаружена значительная разница между группой AT по сравнению с группой HAT и контрольными группами (NTC и HTC), соответственно.
Генотоксическое действие микотоксинов на половые клетки (сперматоциты)
Результаты нашего исследования показали, что пероральное лечение охратоксином А и афлатоксинами (B 1 , B 2 , G 1 и G 2 ) индуцировало численные и структурные хромосомные аберрации в половых клетках мышей-самцов (таблица). Численные аберрации регистрировались как перидиплоидия (n ± 1 или n ± 2) и полиплоидия (рисунок). Перидиплоидия, наблюдаемая в сперматоцитах мышей-самцов, четко различалась (p ≤ 0.5) только в группе, получавшей афлатоксины (AT), по сравнению с контрольными группами (NTC и HTC). Однако полиплоидия, индуцированная группой, обработанной охратоксином А (OT), значительно отличалась (P <0,05) по сравнению с контрольными группами. Между тем, общие числовые аберрации значительно различались (P <0,05) как в группе, получавшей охратоксин A (группа OT), так и в группе, получавшей афлатоксины (AT), по сравнению с контрольными группами (NTC и HTC). Защитный эффект меда проявился только в группе HAT.
Таблица 4
Средние значения различных типов хромосомных аберраций в клетках сперматоцитов мышей-самцов, получавших охратоксин А и афлатоксины (B 1 , B 2 , G 1 и G 2 ).
| Обработанные группы | Числовые аберрации | Структурные аберрации | ||||||
| Перидиплоидия | univalents Univalents||||||||
| OT | 1,75 ± 0,48 ab | 3,75 ± 0,48 a | 5,25 ± 0,48 a | 2.75 ± 0,48 a | 1,00 ± 0,41 a | 3,75 ± 0,86 a | ||
| HOT | 1,50 ± 0,29 abc | 2,75 ± 0,25 a | 4,50 ± | 1,00 ± 0,41 b | 0,75 ± 0,25 a | 1,75 ± 0,63 a | ||
| AT | 2,25 ± 0,25 a | 1,25 ± 0,25 | 0 350 ± 0,29 b | | 2,00 ± 0,92 ab | 0,75 ± 0,75 a | 2,75 ± 0,95 a | ||
| HAT | 1,50 ± 0,29 abc | 0,50 | 2,00 ± 0,0,41 | 1,50 ± 0,29 ab | 0,50 ± 0,29 a | 2,00 ± 0,58 a | ||
| NTC | 0,75 ± 0,48 | 0,75 ± 0,48 | .41 b | 1,50 ± 0,29 c | 1,50 ± 0,29 ab | 1,00 ± 0,41 a | 2,50 ± 0,29 a | | |
| HTC | c 2 0,50 ± 0,29 | 0,25 ± 0,25 b | 1,00 ± 0,41 c | 1,00 ± 0,14 b | 1,00 ± 0,00 a | 2,00 ± 0,00 a | | ||
Лечение с помощью ахратохина высокоиндуцированные структурные хромосомные аберрации, особенно униваленты xy (рисунок), где значительная разница (P <0.05) был обнаружен между группами OT и HOT, а также между группами OT и контрольными группами (HTC).
Влияние меда на пролиферацию клеток
При микроскопическом исследовании контрольной ткани печени были обнаружены гексагональные печеночные дольки, состоящие из центральной вены, из которой были видны печеночные канатики, синусоиды, выстланные излучающими клетками Купфера, а также желчные каналы. Портальный тракт располагался между тремя долями печени и состоял из воротной вены, печеночной артерии и желчного протока (рисунок).
Печень группы НТЦ. Нормальная ткань печени (H x. И E. × 100).
Введение охратоксина А повлияло на ткань печени, так как оно вызвало расширенные и застойные центральные вены с выраженным синусоидальным расширением, застоем и гиперпластическими купферовыми клетками (рисунок). Также был очевиден очаговый некроз печени, преимущественно периваскулярный (рисунок). Введение меда с охратоксином А не выявило положительного эффекта, так как печень в группе АОТ была поражена так же, как и в группе ОТ. С другой стороны, введение афлатоксинов вызвало мутный отек в гепатоцитах, обширные вариабельные боковые некротические области, поражающие паренхиму печени и инфильтрованные нейтрофилами и макрофагами (рисунок).Также были очевидны перегруженность расширенных центральных вен и выраженная синусоидальная дилатация с гиперплазией хупферовских клеток (рисунок). Портальные тракты утолщены мононуклеарными воспалительными клетками, образованными в основном лимфоцитами и телеангиэктатическими, перегруженными сосудистыми каналами (рисунок).
Печень ОТ группы. Расширенные, застойные центральные вены отмечали расширение и гиперемию синусового отдела (Hx. И E. × 200).
Печень ОТ группы. Очаговый некроз печени преимущественно перисосудистый (Hx.И E. × 200).
Печень группы АТ. Некротические участки паренхимы печени, инфильтрованные нейтрофилами (Hx. & E. × 100).
Печень группы АТ. Заложенные расширенные центральные вены и выраженная синусоидальная дилатация (Hx. И E. × 400).
Печень группы АТ. Портальные тракты утолщены за счет заметной дилатации и закупорки сосудистых каналов и умеренного воспалительного инфильтрата мано-ядерной области (Hx. И E. × 400).
Гистопатологическое исследование контрольных тканей почек показало клубочки, проксимальные и дистальные извитые почечные канальцы, мозг содержал собирающие канальцы и части восходящей и нисходящей петли курицы.Введение охратоксина А вызывало мутное набухание проксимальных извитых канальцев, фибриновый тромбин в петлях клубочковых капилляров, увеличение количества и размера клубочков (рисунок), а также интерстициальный фиброз и скопление (рисунок). С другой стороны, совместное введение меда с охратоксином А улучшило действие охратоксина А на почки, где сосудистая полость нормализовалась. Однако они все же были немного увеличены (рисунок). Введение афлатоксинов вызывало мутный отек эпителиальной выстилки почечных канальцев с легким интерстициальным фиброзом и застоем (рисунок).
Почка ОТ группы. Увеличение количества и размера клубочков (Hx. И E. × 100).
Почка ОТ группы. Интерстициальный фиброз и гиперемия (трихром Massons × 100).
Почка группы HOT. Вернитесь к норме, за исключением заложенности сосудов (Hx. И E. × 200).
Почка группы АТ. Мутное набухание эпителия канальцев (Hx. & E. × 100).
Что касается воздействия охратоксина на мозг, гистологическое исследование показало наличие очагов дегенерации (рисунок), в то время как совместное введение меда с охратоксином А улучшило этот эффект.Кроме того, введение афлатоксина не вызывало каких-либо изменений в мозговой ткани.
Мозг. Очаги дегенерации в группе ОТ (Hx. & E. × 100).
Гистопатологическое исследование контрольного легкого показало тонкие альвеолярные стенки, состоящие из эпителиальных клеток с обеих сторон центрально расположенных капилляров без промежуточной стромы соединительной ткани. Введение охратоксина А повлияло на ткани легкого, где в легком наблюдались отек, застой, лимфоидные агрегаты в интерстициальной ткани (рисунок).Результаты показали, что легкое облегчило застойные явления (одновременный прием меда с охратоксином А) (рисунок). Принимая во внимание, что легкие показали интерстициальный фиброз и воспалительный инфильтрат после введения афлатоксина (рисунок).
Легкое группы ОТ. Отек, гиперемия, лимфоидные скопления интерстициальной ткани (Hx. И E. × 100).
Легкое группы HOT. Облегчение отека, но отек и лимфоцитарные агрегаты все еще присутствуют (Hx. И E. × 100).
Легкое группы АТ.Показан интерстициальный фиброз, воспалительное заполнение очаговыми лимфоцитарными агрегатами (трихром Massons × 100).
Контрольная ткань селезенки показала каркас соединительной ткани (который включает капсулу, трабекулы и ретикулярную соединительную ткань) и паренхиму лимфоидной ткани в виде белой (лимфоидные узелки) и красной пульпы (рисунок). На рисунке проиллюстрировано влияние охратоксина А на селезенку, где показано расширение белой пульпы с разрушением нормальной архитектуры, адвентициальное утолщение артериол, адвентициальное утолщение артериол, очаговый фиброз красной пульпы и сжатие синусоидов.
Селезенка группы NTC. Вызваны аналогичные гистопатологические, бело-красные пульпы. (Hx. И E. × 100).
Селезенка группы ОТ. Расширение белой пульпы с облитерацией нормальной архитектуры (Hx. & E. × 100).
С другой стороны, введение афлатоксинов не показало никаких изменений в ткани селезенки. Совместное введение меда с афлатоксинами вызывает улучшение всех гистопатологических изменений, которые произошли во всех исследованных органах, кроме ткани почек.
Влияние меда на пробиотические бактерии толстой кишки
Добавление меда к порошковой диете AIN-93 M (группа HTC) увеличило количество бифидобактерий в среднем на 2,3 ± 0,23 log 10 КОЕ / г (p <0,004) и lactobacilli в среднем на 1,07 ± 0,35 log 10 КОЕ / г (p <0,016) по сравнению с группой NTC (таблица).
Таблица 5
Влияние меда и микотоксинов на рост LAB (log 10 КОЕ / г).
| Штаммы | Группы мышей | ||||||||
| OT | HOT | AT | HAT | ||||||
| NTC | |||||||||
| NTC | 3.26 ± 0,19 | 3,83 ± 0,20 | Нет | Нет | 5,00 ± 0,15 | 6,06 ± 0,22 | |||
| Бифидобактерии | |||||||||
| 3,73 ± 0,19 | 0,373 ± 0,19 | 3,73 ± 0,19 | 3,77 ± 0,22 | 6,26 ± 0,29 | 8,57 ± 0,24 | ||||
Введение охратоксина А в группу, получавшую мед (группа HOT), увеличило количество лактобактерий в среднем на 0,75 ± 0.15 log 10 КОЕ / г (p <0,108) по сравнению с группой ОТ. Лактобациллы не обнаружены при введении афлатоксинов (группы HAT и AT) (таблица).
Введение смеси охратоксина А и афлатоксинов в присутствии меда (группы HOT и HAT) увеличило среднее количество бифидобактерий на 1,03 ± 0,32 log 10 КОЕ / г (p <0,083) и 0,57 ± 0,50 log 10 КОЕ / г (p <0,219) по сравнению с группами ОТ и АТ соответственно.
Обсуждение
Влияние меда на производство микотоксинов
Наши результаты показывают, что влияние меда на биомассу и образование микотоксинов ( in vitro, ) зависело от вида грибов ( A.parasiticus и A. ochraceus ) и концентрации меда. Об антимикробных свойствах перекиси водорода и неперекисных компонентов меда сообщалось в нескольких исследованиях [25]. Таким образом, для этих 2 типов грибов мед нейтрализовал больше патогенов дозозависимым образом, чем контрольный сахарный раствор (80%), состоящий из фруктозы и глюкозы, аналогично чистому меду [25]. Неразбавленный мед полностью подавлял рост обычных грибов поверхностной инфекции и заражения ран ( Aspergillus fumicgatus, A flavus, Penicellum citrinum, Trichophyton rubrum и Candida albicans ), частичное ингибирование с концентрацией меда 50% и отсутствие ингибирования было зарегистрировано концентрация меда 20% [26].
Влияние меда на пробиотические бактерии толстой кишки
Лактобациллы и бифидобактерии имеют сложные пищевые потребности, такие как углеводы, аминокислоты, пептиды, сложные эфиры жирных кислот, соли, производные нуклеиновых кислот и витамины, которые сильно различаются от вида к виду. Мед содержит более 180 веществ, в том числе аминокислоты, витамины, минералы и ферменты [5]. Основными углеводными составляющими меда являются фруктоза (32,56%) и глюкоза (28,54%). Помимо олигосахаридов (1.От 58 до 3,77% мальтозы, 0,78 ± 2,03% туранозы, 1,11 ± 2,81% нигерозы, 0,05 ± 0,15% мели-биозы, 0,03 ± 0,08% панозы, 0,24 ± 1,03% мальтотриозы, 0,21 ± 0,37% мелецитозы и 0,10 ± 0,25%. Мед также содержит от 4 до 5% фруктоолигосахаридов, которые служат пробиотическими агентами [4].
Нормальная слизистая оболочка тонкой кишки человека может не полностью поглощать фруктозу. Несколько исследований показали, что распространенность мальабсорбции фруктозы у здоровых взрослых может достигать 30–50%, эти субъекты могут нарушать всасывание заметного количества дозы 25 г фруктозы [27].Наиболее нормальные субъекты мальабсорбируют около 10% углеводов, содержащихся в меде [28]. Олигосахариды меда с низкой степенью полимеризации считаются благоприятным субстратом для бифидобактерий [10]. Наконец, неперевариваемые и / или неабсорбируемые сахариды перемещаются в толстую кишку, чтобы вызвать селективную ферментацию и селективную стимуляцию роста и активности пробиотических бактерий в толстой кишке, как было обнаружено ранее [29].
Настоящее исследование подтверждает имитирующий эффект меда на пробиотические бактерии толстой кишки.Рост кишечных Bifidobacteria spp. был усилен наличием более чем лактобацилл, что может быть связано с олигосахаридами меда с низкой степенью полимеризации (от 4 до 5%).
Уменьшение количества пробиотических бактерий толстой кишки при введении микотоксина и в отсутствие или в присутствии меда может быть связано с изменениями бактериальной поверхности во время фазы роста в результате связывания микотоксинов [13].
Влияние меда на активность бактериальных ферментов толстой кишки
Уровень глюкуронидаз является важным показателем влияния диеты на состав и активность кишечной микрофлоры.Он участвует в образовании, а также в инактивации канцерогенов в просвете кишечника и может быть положительно изменен присутствием пробиотических бактерий толстой кишки [30].
Антигенотоксические эффекты меда
Было обнаружено, что микотоксины генотоксичны для костного мозга и клеток сперматоцитов мышей, что совпадает с предыдущими сообщениями [31,32], что охратоксин А и афлатоксины вызывали хромосомные аберрации во многих клетках млекопитающих (мыши , крыса, китайский хомяк и даже человек).
Используя смесь охратоксина А и афлатоксинов в качестве токсичных и канцерогенных веществ, мы охарактеризовали потенциальную антигенотоксичность меда. Мед был антигенотоксичным ( in vivo, ), и этот эффект зависел от пробиотических бактерий толстой кишки и других факторов. Предполагается, что пробиотические бактерии толстой кишки обладают несколькими полезными эффектами, включая инактивацию канцерогенов [15]. Помимо открытия, что пробиотические бактерии толстой кишки обладают антигенотоксическими свойствами, непосредственный интерес представляет изучение механизмов, ответственных за их защиту.Было высказано предположение, что белковая структура липополисахаридной мембраны бактерий может быть эффективным компонентом [33]. Кроме того, было несколько сообщений о том, что молочнокислые бактерии (LAB) могут связывать мутагены и, таким образом, могут снижать мутагенность [34].
Пищевые факторы, содержащиеся в меде, можно использовать для предотвращения и устранения мутации, вызванной афлатоксинами [35]. Это соответствовало нашим открытиям, которые показали, что можно предотвратить или уменьшить хромосомные аберрации, вызванные афлатоксинами.Кроме того, вызванное AFB1 повреждение ДНК и хромосомные аберрации в клетках грызунов и человека могут регулироваться множеством факторов, включая питательные вещества и химиопрофилактические агенты [36]. Это согласуется с нашими результатами, согласно которым прием меда может улучшить генетический материал и минимизировать хромосомные аберрации, вызванные микотоксинами.
Влияние меда на пролиферацию клеток
Настоящие результаты гистопатологического исследования показали, что охратоксин А вызывает кровотечение и некроз красной пульпы селезенки.Этот вывод согласуется с работой [30]. Кроме того, некроз белой пульпы затронул корковые и мозговые области лимфоидных фолликулов. Кроме того, охратоксин А связан с нарушением структуры и функции клеточной мембраны мозга [31]. Он может заметно увеличивать активность цитозольных и лизосомальных ферментов.
В настоящем исследовании влияние афлатоксинов на печень согласуется с работой, проделанной ранее [32], которая объяснила это влияние увеличением цитоплазматической легкости и потерей цитоплазматической зернистости гепатоцитов.Также были зарегистрированы периоптальный фиброз с дегенерацией и изъязвлением желчных дуэтов, выстилающих эпителиальные клетки, и пролиферация желчных протоков [33]. Были очевидны мультифокальные, случайно распределенные области некроза печени, инфильтрованные нейтрофилами и макрофагами. Поражения были центральными, более выраженными вокруг портала и аналогичным результатом [34]. Результаты настоящей работы согласуются с ранее опубликованными [35] о том, что у крыс, получавших внутрибрюшинную инъекцию афлатоксина B 1 , наблюдалась выраженная воспалительная реакция в легких, застой, разрушение альвеолярных стенок с амфизематозными изменениями и утолщение стенки кровеносных сосудов, возникающие в пятнистых участках легочной ткани.
На основании гистопатологического исследования можно сделать вывод, что добавление меда к охратоксину А лишь немного улучшило микроскопические изменения почечной ткани. Однако добавление меда афлатоксинов улучшило гистопатологические изменения, вызванные токсином, в различных органах, за исключением ткани почек.
Наши результаты показали, что вредное воздействие микотоксинов может быть уменьшено в присутствии меда, что может быть связано с детоксикацией микотоксинов пробиотическими бактериями.В то же время доступность связанного AFB1 с антителом предполагает, что поверхностные компоненты этих бактерий участвовали в связывании токсина [13]. Изменение температуры (от 4 до 37 ° C) и pH (от 2 до 10) не оказало значительного влияния на количество высвобождаемого AFB1. Связывание AFB1, по-видимому, является преимущественно внеклеточным для жизнеспособных и подвергнутых термической обработке бактерий. Однако обработка кислотой может разрешить внутриклеточное связывание. Во всех случаях связывание обратимо, но стабильность образующихся комплексов зависит от штамма, обработки и условий окружающей среды.Как правило, отделение AFB1 от бактериальной поверхности требует времени. В это время AFB1 выполняет запись вдоль желудочно-кишечного тракта в направлении изгнания. Эта секвестрация AFB1 снижает возможность его реабсорбции или оказания патогенного воздействия на энтероциты или лимфоидную ткань, ассоциированную с кишечником (GALT). Это может быть чистым эффектом детоксикации микотоксинов из организма. Кроме того, наши результаты совместимы с [36], так как охратоксин A демонстрирует мутное набухание проксимальных извитых канальцев в дополнение к канальцевым эозиногильным внутрипросветным цилиндрам, фибриновым тромбам в петлях клубочковых капилляров и выраженному интерстициальному фиброзу и застою.
Афлатоксины являются генотоксическими канцерогенами. Для этого типа канцерогенов обычно считается, что не существует пороговой дозы, ниже которой не могло бы произойти образование опухоли. Другими словами, только нулевой уровень воздействия не приведет к отсутствию риска. Это согласуется с недавней оценкой [37] в отношении генотоксичности афлатоксина [38]. Необходимо провести углубленные исследования, чтобы выяснить влияние фазы роста всех штаммов пробиотических бактерий на связывание AFB 1 и G 1 и других микотоксинов in vitro и in vivo .
Заключение
Настоящие результаты показывают, что мед обладает защитным действием, зависящим от его антимикробных свойств. Также мед усиливает эндогенные пробиотические бактерии толстой кишки (бифидогенные эффекты), что оказывает несколько полезных эффектов (например, детоксикация и антигенотоксичность).
Мы рекомендуем заменять сахар медом в высокой концентрации в обработанных пищевых продуктах, детских смесях, детских закусках, особенно в тех, которые изготовлены из сельскохозяйственных материалов (например,г. молотый горох и кукуруза), чтобы избежать роста грибков и образования микотоксинов. Согласно результатам, полученным в этой статье, доза смеси афлатоксинов, превышающая 1 мкг афлатоксинов на кг веса тела в день, оказывает выраженное вредное воздействие. Это подтверждается недавним обсуждением в Европейском Союзе ограничения максимально допустимого содержания афлатоксинов в пищевых продуктах.
Список сокращений
Группа ОТ – группа 1, порошковая диета AIN-93 M, получавшая и вводившая охратоксин А (10 нг / кг массы тела / день).
HOT группа -группа 2, мед Порошковая диета AIN-93 M, получавшая и вводившая охратоксин А (10 нг / кг массы тела / день).
AT группа -группа 3, порошковая диета AIN-93 M, полученная и вводимая смесью афлатоксинов (1 мкг / кг массы тела / день).
HAT группа -группа 4, мед, порошок AIN-93 M, диета, полученная и вводимая смесью афлатоксинов (1 мкг / кг массы тела / день).
НТК группа -группа 5, АИН-93 М порошковое диетическое скармливание.
HTC группа -группа 6, мед АИН-93 М порошковый диетический скармливаемый.
Конкурирующие интересы
Автор (ы) заявляют, что у них нет конкурирующих интересов.
Вклад авторов
Али Эзз Эль-Араб задумал и спроектировал исследование и выполнил микробные ферменты толстой кишки (он также позаботился об экспериментальном животном в сотрудничестве с Шенудой Гиргисом, который исследовал хромосомные аберрации). Эман Хегази провел гистологическое исследование, а Аззат Абд эль-Халек подсчитал пробиотические бактерии. Все авторы сообщили данные и написали эту рукопись.Благодарности Центр, Докки, Гиза, Египет.
Список литературы
- Саарела М., Латенмаки Л., Криттенден Р., Салминен С., Маттила-Сандхольм Т. Кишечные бактерии и здоровая пища – европейская перспектива. Intern J Food Microbiol.2000. 278: 99–117. [PubMed] [Google Scholar]
- Verschuren PM. Функциональные продукты питания: научные и глобальные перспективы. Br J Nutr. 2002; 88: S125 – S130. DOI: 10,1079 / BJN2002675. [PubMed] [CrossRef] [Google Scholar]
- Bazzarre TL, Wu, SML Yuhas JA. Общие концентрации и ЛПВП после приема йогурта и кальция. Nutr Reports Intern. 1983; 28: 1225–1232. [Google Scholar]
- Чоу Дж. Пробиотики и пребиотики: краткий обзор. J Ren Nutr. 2002; 12: 76–86. [PubMed] [Google Scholar]
- White JW.Состав меда. В: Crane E, редактор. Мед: всеобъемлющий обзор. Лондон, Хайнеманн; 1979. С. 157–192. [Google Scholar]
- Аль-Мамарья М., Аль-Мериб А., Аль-Хабориб М. Антиоксидантная активность и общие фенольные соединения различных видов меда. Nutr Res. 2002; 22: 1041–1047. DOI: 10.1016 / S0271-5317 (02) 00406-2. [CrossRef] [Google Scholar]
- Беннетт Дж. В., Клих М. Микотоксины. Обзор Clin Microb. 2003. 16: 497–516. DOI: 10.1128 / CMR.16.3.497-516.2003. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Генри Ш., Bosch FX, Troxell TC, Bolger PM.Уменьшение рака печени – глобальный контроль афлатоксина. Наука. 1999; 286: 2453–2454. DOI: 10.1126 / science.286.5449.2453. [PubMed] [CrossRef] [Google Scholar]
- Койпер-Гудман Т. Безопасность пищевых продуктов: микотоксины и фикотоксины в перспективе. В: Miraglia M, Van Edmond H, Brera C, Gilbert J, редактор. Микотоксины и фикотоксины – разработки в области химии, токсикологии и безопасности пищевых продуктов. Alaken Inc., Форт-Коллинз, Колорадо; 1998. С. 25–48. [Google Scholar]
- Кадзивара С., Ганди Х., Устунол З. Влияние меда на рост и выработку кислоты кишечными бактериями Bifidobacterium spp.: in vitro, сравнение с коммерческими олигосахаридами и инулином. J food prod. 2002; 65: 214–218. [PubMed] [Google Scholar]
- Salminen S, Bouley MC, Boutron-Rualt MC, Cummings J, Frank A, Gibson E, Isolauri E, Moreau MC, Roberfroid M, Rowland I. Наука о функциональном питании, физиология и функции желудочно-кишечного тракта. Br J Nutr. 1998; 1: 147–171. DOI: 10,1079 / BJN19980108. [PubMed] [CrossRef] [Google Scholar]
- Эль-Незами Х., Микнен Х., Канкаанп П., Салминен С., Ахокас Дж.Способность штаммов Lactobacillus и propionibacterium удалять афлатоксин B1 из двенадцатиперстной кишки цыпленка. J Food Prot. 2000; 63: 549–552. [PubMed] [Google Scholar]
- Haskard CA, El-Nezami HS, Kankaanp PE, Salminen S, Aholmas JT. Поверхностное связывание афлатоксина B1 молочнокислыми бактериями. Appl Environ Microbiol. 2001; 67: 3086–3091. DOI: 10.1128 / AEM.67.7.3086-3091.2001. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Gratz S, Mykkänen H, Ouwehand AC, Juvonen R, Salminen S, El-Nezami H.Кишечная слизь изменяет способность пробиотических бактерий связывать афлатоксин B1 In Vitro . Appl Environ Microbiol. 2004. 70: 6306–6308. DOI: 10.1128 / AEM.70.10.6306-6308.2004. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Pool-Zobel BL, Neidecker C, Domizlaff I, Ji S, Schillinger U, Rumney C, Moretti I, Vilarini I, Scassellati-Sforzolini R, Rowland I. • Антигенотоксичность, опосредованная лактобактериями и бифидобактериями, в толстой кишке крыс. Nutr Cancer. 1996. 26: 365–380. [PubMed] [Google Scholar]
- A.OAC «Официальные методы официальных химиков-аналитиков. Арлингтон, Вирджиния, США. 2000.
- Park D, Neslein S, Trucksess MW, Starck ME, Newel RF. Жидкостный хроматографический метод определения афлатоксинов B-1, B2, G1 и G2 в продукты из кукурузы и арахиса. J Assoc Off Anal Chem. 1990; 73: 260–266. [PubMed] [Google Scholar]
- Haspolat K, Buyukbas S, Cengel H. In vitro антибактериальный и противогрибковый эффект меда. Turk Hijyen – Ve – Денейсел-Бийолоджи-Дергиси.1990; 47: 211–216.[Google Scholar]
- Wahdan HA. Противомикробный эффект меда. Египетская J Lab Med. 1996; 8: 29–44. [Google Scholar]
- Ривз П., Нильсен Ф., Фэи Г. Очищенные диеты AIN-93 для лабораторных грызунов: окончательный отчет специального комитета по написанию Американского института питания о разработке рациона для грызунов AIN-76A. J Nutr. 1993; 123: 1939–1951. [PubMed] [Google Scholar]
- Djouzi Z, Andrieux C. Сравнивали эффекты трех олигосахаридов на метаболизм кишечной микрофлоры у крыс, инокулированных фекальной флорой человека.Br J Nutr. 1997; 78: 313–324. DOI: 10,1079 / BJN19970149. [PubMed] [CrossRef] [Google Scholar]
- Престон Р.Дж., Дин Б.Дж., Галлоуэй С., Холден Х., МакФи А.Ф., Шелби М., Mammalian in vivo, цитогенетический анализ . Mutat Res. 1987. 189: 157–165. DOI: 10.1016 / 0165-1218 (87)
- -8. [PubMed] [CrossRef] [Google Scholar]
- Руссо А. Цитогенетика in vivo : зародышевые клетки млекопитающих. Mutat Res. 2000; 455: 167–189. [PubMed] [Google Scholar]
- A.F.I.P. Институт патологии Вооруженных Сил.Лабораторные методы в гистотехнологии. Вашингтон, округ Колумбия; 1994. [Google Scholar]
- Wahdan HAL. Причины антимикробной активности меда. Заразить. 1998; 26: 26–30. [PubMed] [Google Scholar]
- Efem SEE, Udoh KT, Lwara CI. Антимикробный спектр меда и его клиническое значение. Заразить. 1992. 20: 277–285. [Google Scholar]
- Мишкин Д., Саблаускас Л., Яловский М., Мишкин С. Нарушение всасывания фруктозы и сорбита у амбулаторных пациентов с функциональной диспепсией: сравнение с нарушением переваривания / нарушением всасывания лактозы.Dig Dis Sci. 1997. 42: 2591–2596. DOI: 10.1023 / А: 1018841402133. [PubMed] [CrossRef] [Google Scholar]
- Ladas SD, Raptis SA. Мед, абсорбция фруктозы и слабительное действие. J Nutr. 1999; 15: 591–592. DOI: 10.1016 / S0899-9007 (99) 00092-1. [PubMed] [CrossRef] [Google Scholar]
- Цимер С.Дж., Гибсон Г.Р. Обзор пробиотиков, пребиотиков и синбиотиков в концепции функционального питания: перспективы и будущие стратегии. Int Dairy Journal. 1998. 8: 473–479. DOI: 10.1016 / S0958-6946 (98) 00071-5.[CrossRef] [Google Scholar]
- Налини Н., Манджу В., Менон В.П. Влияние кокосового жмыха на активность бактериального фермента при раке толстой кишки, вызванном 1,2-диметилгидразином. Clin Chim Acta. 2004; 342: 203–210. DOI: 10.1016 / j.cccn.2004.01.001. [PubMed] [CrossRef] [Google Scholar]
- Groose Y, Chekir-Ghedira L, Huc A, Obrecht-Pflumio S, Dirheimer G, Bacha H, Pfohl-Leszkowicz A. Сетчатка, аскорбиновая кислота и альфа-токоферол предотвращают образование аддуктов ДНК у мышей, получавших микотоксины охратоксин А и зеараленон.Раковый латыш. 1997. 114: 255–229. DOI: 10.1016 / S0304-3835 (97) 04676-4. [PubMed] [CrossRef] [Google Scholar]
- Ван Дж. С., Групман Дж. Д. Повреждение ДНК микотоксинами. Mutat Res. 1999; 424: 167–81. [PubMed] [Google Scholar]
- Zhang XB, Ohta Y. Антимутагенность клеточных фракций микроорганизмов в отношении сильнодействующих мутагенных пиролизатов. Mutat Res. 1993; 298: 247–253. DOI: 10.1016 / 0165-1218 (93) -V. [PubMed] [CrossRef] [Google Scholar]
- Эль-Незами Х., Канкаанпаа П., Салминан С., Ахокас Дж. Способность молочных штаммов молочнокислых бактерий связывать общий пищевой канцероген, афлатоксин B1.Food Chem Toxicol. 1998. 36: 321–326. DOI: 10.1016 / S0278-6915 (97) 00160-9. [PubMed] [CrossRef] [Google Scholar]
- Шарманов Т.Ш., Ников П.С., Алдабергенова К.У., Меербекова Б.Т. Влияние типа питания и афлатоксина B1 на структуру хромосом. Вопр Питан. 1986; 5: 56–60. [PubMed] [Google Scholar]
- Munro IC, Scott PM, Moodie CA, Willes RF. охратоксин Возникновение и токсичность. J Am Vet Med Assoc. 1973; 63: 1269–1273. [PubMed] [Google Scholar]
- Monnet-Tschudi F, Sorg O, Honegger P, Zurich M, Hugget AC, Schilter B.Влияние встречающегося в природе пищевого микотоксина хроматоксина А на клетки мозга в культуре. Нейротоксикология. 1997; 18: 831–840. [PubMed] [Google Scholar]
- Кларк Д., Джаир А.В., Хэтч Р. Влияние различных видов лечения на индуцированный хронический афлатоксикоз у кроликов. Am J Vet Res. 1982; 43: 106–110. [PubMed] [Google Scholar]
- Эль-Захан Х., Эль-Ашри М.А., Тарват Е.Е., Саад М.М., Амин С.О. Кролик и афлатоксины: влияние смеси афлатоксинов на кровь, компоненты плазмы природы Новой Зеландии, штамбы белого кролика.Египетский кролик J Sci. 1996; 6: 55–56. [Google Scholar]
- Уэно Ю. Токсикология микотоксинов. CRC Crit Rev Toxicol. 1985. 14: 99–132. [PubMed] [Google Scholar]
- Gopuiath C, Prentic DE, Lewis DJ. Атлас экспериментальной токсикологической патологии. Current, гистопатология, MTP press limited, lan coraster, Boston The Hague-Derdecht. 1987. 30: 43–61. [Google Scholar]
- Albassam MA, Yong SI, Bhatnagar R, Sharma AK, Prior MG. Гистопатологические и электронно-микроскопические исследования острой токсичности охратоксина А у крыс.Vet Pathol. 1987. 24: 427–435. [PubMed] [Google Scholar]
Влияние диетического меда на микрофлору кишечника и токсичность микотоксинов у мышей
BMC Complement Altern Med. 2006; 6: 6.
, 1 , 2 , 3 и 4Али М Эзз Эль-Араб
1 Департамент пищевых наук и питания Национального исследовательского центра, 12644 – Докки, Гиза, Египет
Шенуда М. Гиргис
2 Департамент клеточной биологии, Национальный исследовательский центр, 12644 – Докки, Гиза, Египет
Эман М. Хегази
3 Департамент пищевой токсикологии, Национальный исследовательский центр, 12644 – Докки, Гиза, Египет
Аззат Б. Абд Эль-Халек
4 Департамент молочных продуктов, Национальный исследовательский центр, 12644 – Докки, Гиза, Египет
1 Департамент пищевых наук и питания Национального исследовательского центра, 12644 – Докки, Гиза, Египет
2 Департамент клеточной биологии, Национальный исследовательский центр, 12644 – Докки, Гиза, Египет
3 Департамент пищевой токсикологии, Национальный исследовательский центр, 12644 – Докки, Гиза, Египет
4 Департамент молочной промышленности, Национальный исследовательский центр, 12644 – Докки, Гиза, Египет
Автор, отвечающий за переписку.Поступило 20 февраля 2005 г .; Принято 14 марта 2006 г.
Copyright © 2006 Ezz El-Arab et al; лицензиат BioMed Central Ltd.Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License (http://creativecommons.org/licenses/by/2.0), которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе. при условии правильного цитирования оригинала.
Эта статья цитируется в других статьях в PMC.Abstract
Справочная информация
Пчелиный мед – это функциональный корм, обладающий уникальным составом, антимикробными свойствами и бифидогенным действием.Настоящее исследование было предпринято для того, чтобы оценить, может ли мед подавлять токсическое действие микотоксинов.
Методы
Производство биомассы и токсинов с помощью Aspergillus parasiticus и Aspergillus ochraceus отслеживали в средах без меда и с медом. Хотя афлатоксины и охратоксин А вводили самцам швейцарских мышей-альбиносов в дозах до 1 мкг и 10 нг / кг массы тела / день соответственно. Подопытных животных кормили диетами без нашего 10% меда в течение двух месяцев.Следили за изменениями в пробиотических бактериях толстой кишки, детерминантном ферменте толстой кишки глюкуронидазе и генотоксичности.
Результаты
Добавление 32% в среду увеличивало биомассу A parasiticus , в то время как биомасса A. ochraceus уменьшалась, и охратоксин А. не производился. Когда в среду добавляли мед в соотношении 32 и 48%. Связи между массой мицелия и продукцией микотоксинов не обнаружено. Пероральное введение афлатоксинов (смесь B 1 , B 2 , G 1 и G 2 ) и охратоксина А.вызывали структурные и численные хромосомные аберрации в костном мозге и половых клетках самцов мышей, тогда как лечение медом снижало генотоксичность микотоксинов. Также оба токсина вызывали гистопатологические изменения в печени и почках. Питание на диете с добавлением меда улучшило гистопатологические изменения в случае группы афлатоксинов, но не в случае группы охратоксина А. (за исключением почек в двух случаях). Не было обнаружено значительных различий в активности β-глюкуронидазы толстой кишки между группами, получавшими диету с медом или без него.С другой стороны, количество бифидобактерий толстой кишки и лактобацилл заметно увеличилось в группе, получавшей диету с добавлением меда.
Заключение
Замена сахара на мед в обработанных пищевых продуктах может подавить вредные и генотоксические эффекты микотоксинов и улучшить микрофлору кишечника.
Общие сведения
Пищевые продукты больше не ценятся потребителями только с точки зрения их вкуса и непосредственных потребностей в питании, но также с точки зрения их способности приносить особую пользу для здоровья.Функциональные продукты питания стали важным сектором пищевых продуктов, обеспечивающим пользу для здоровья благодаря функциональным ингредиентам в этих продуктах. Функциональные продукты питания, направленные на улучшение баланса и активности кишечной среды, в настоящее время составляют самый большой сегмент рынка функциональных продуктов питания [1,2].
В течение долгого времени было замечено, что мед можно использовать для лечения заболеваний печени, сердечно-сосудистой системы и желудочно-кишечного тракта [3]. Мед – это натуральный продукт с очень сложным химическим составом. Он состоит в основном из фруктозы и глюкозы, но также содержит от 4 до 5% фруктоолигосахаридов, которые служат пребиотическими агентами [4].Он содержит более 180 веществ, в том числе аминокислоты, витамины, минералы и ферменты [5]. Антимикробные свойства перекиси водорода и неперекисных компонентов меда проверялись в нескольких исследованиях [6].
Распространенность заражения микотоксинами (афлатоксинами и охратоксинами) носит глобальный характер. По оценкам, четверть сельскохозяйственных культур в мире в той или иной степени загрязнены микотоксинами, особенно распространенными в развивающихся странах. Как правило, микотоксины обычно содержатся в пищевых продуктах [7,8].Микотоксины вызывают серьезную озабоченность из-за их пагубного воздействия на здоровье людей и животных. Aspergillus flavus и A. parasiticus продуцируют афлатоксины. Охратоксин А был открыт как метаболит Aspergillus ochraceus . Из токсинов Aspergillus только охратоксин (природный канцероген и нефротоксин) потенциально так же важен, как афлатоксины (природный канцероген). Оба они связаны как с токсичностью, так и с канцерогенностью для здоровья человека.Ведущий деятель в области оценки риска назвал микотоксины наиболее важным хроническим диетическим фактором риска, превосходящим синтетические контаминанты, токсины растений, пищевые добавки или остатки пестицидов [7,9].
Загрязняющие пищевые вещества, попадающие в организм оральным путем, напрямую подвергаются действию кишечной микрофлоры. Микрофлора желудочно-кишечного тракта (ЖКТ) все чаще признается одним из факторов, влияющих на здоровье человека. Эта микрофлора представляет собой динамическое равновесие, которое может быть изменено диетой [10].Нормальная здоровая микрофлора кишечника содержит множество штаммов молочнокислых бактерий (LAB), некоторые из которых были выделены, приписаны несколько полезных эффектов и названы штаммами пробиотиков [11]. Несколько исследований показали, что пробиотические бактерии толстой кишки могут удалять микотоксины посредством физического связывания в качестве механизма удаления мутагена [12-14]. Кроме того, тяжесть отравления микотоксинами может быть усилена такими факторами, как дефицит витаминов, недостаток калорий, злоупотребление алкоголем и статус инфекционного заболевания [7].
Кроме того, есть доказательства того, что пробиотические бактерии толстой кишки могут положительно модулировать определенные микробные ферменты толстой кишки, которые могут играть роль в заболеваниях, связанных с диетой. Изменение этих параметров указывает на защитный эффект от канцерогенов. Пробиотические бактерии связывают мутагены in vitro , а также предотвращают выведение мутагенов из организма человека. Однако необходимы дополнительные исследования, чтобы определить физиологическое значение эндогенных пробиотических бактерий толстой кишки [15].
Полное устранение любых естественных токсинов из пищевых продуктов – недостижимая цель. Наука о питании расширяет знания о том, как продукты питания влияют на потребителей в зависимости от конкретных параметров здоровья.
Следовательно, необходимо провести более глубокие исследования, чтобы выяснить потенциал защитного действия меда за счет его противогрибкового действия и снижения хронических заболеваний, связанных с питанием, таких как рак.
Для достижения этой цели мы изучили in vitro , влияние меда на рост грибов и образование микотоксинов с помощью Aspergillus в пищевых продуктах.Кроме того, мы изучили действие меда in vivo в присутствии микотоксина на эндогенные пробиотические бактерии толстой кишки, микробные ферменты толстой кишки, пролиферацию клеток и генотоксичность.
Методы
Монофлоральный мед (хлопок) был приобретен в Центре исследований пчеловодства Министерства сельского хозяйства, Каир, Египет. Арахис ( Archis hypogalal ) с повреждениями и наблюдаемым загрязнением грибами был получен из источников основного поставщика арахиса в Египте. Бактериальная культура, среда deMann, Rogosa, Sharpe (MRS) (Oxoid, Hampshire, United Kingdom) для Lactobacilli.Триптонно-фитоновые дрожжи (TPY), среда (Oxoid) для бифидобактерий. Стандарт охратоксина А (каталожный № 01877) был приобретен у химической компании Sigma-Aldrich (Сент-Луис, США). Грибы, продуцирующие афлатоксины и охратоксин А, A. parasiticus (FRR 2748) и A. ochraceus (NRRL 3174) были получены от Ассоциации стандартов Австралии (Северный Сидней, Новый Южный Уэльс, Австралия). Природные афлатоксины (B 1 , B 2 , G 1 и G 2 ) были экстрагированы из арахиса [16], и их концентрации были определены методами тонкослойной (ТСХ) и высокоэффективной жидкостной хроматографии (ВЭЖХ). [17].
Концентрация экстрагированных афлатоксинов B 1 , B 2 , G 1 и G 2 из арахиса составила 211,42, 135,53, 368,10 и 99,72 мкг / кг соответственно. Полученный экстракт растворяли в 2-литровом соевом масле и хранили в холодильнике до использования.
Изучение влияния меда на продукцию микотоксинов
A. parasiticus (FRR 2748) и A. ochraceus (NRRL 3174) культивировали на картофельном агаре с декстрозой в течение 10 дней при 25 ° C, пока они не стали хорошо спорулированными.Споры собирали в 10 мл стерильного 1% раствора Твина 80 (об. / Об.) С получением 10 5 спор / мл. Колбы, содержащие 500 мл среды дрожжевой экстракт-сахароза (ДА) с добавлением нулевого, 32 и 48% меда, инокулировали 2,0 мл этой суспензии, инкубировали при 28 ° C в течение 21 дня, а затем анализировали на афлатоксины [18,19].
Изучение влияния меда на прием микотоксинов у мышей
Сорок два самца швейцарских мышей-альбиносов возрастом примерно 7 недель и весом 20 ± 3 г были получены из колонии приюта для животных Национального исследовательского центра, Каир, Египет.Животных содержали индивидуально в клетках из нержавеющей стали с контролируемой температурой (24–26 ° C), влажностью (40–70%) и условиями освещения (12-часовой цикл свет / темнота) и позволяли свободный доступ к дистиллированной воде и основной диете (AIN- 93 М) на 10 дней в качестве адаптивного периода. Порошок AIN-93 M содержал белок (14%), крахмал (62,07%), сахарозу (10%), жир (4%), клетчатку (5%), минеральную смесь (3,5%), смесь витаминов (1%). ), L-цистин (0,18%), битратрат холина (0,25%) и тетрабутилгидрохинон (0,00008%) [20].
Затем мышей случайным образом разделили на шесть групп (по 7 животных в каждой). Группа 1 st получала диету AIN-93 M и вводила охратоксин A (10 нг / кг массы тела / день, группа ОТ). Группу 2 и лечили так же, как группу 1, за исключением того, что она получала мед / диету AIN-93 M (группа HOT). Группе 3 (AT) и H (HAT) скармливали диету AIN-93 M и мед / AIN-93 M, соответственно, и вводили смесь афлатоксинов (1 мкг / кг массы тела / день). Группы 5 (NTC) и 6 (HTC) служили контролем и получали рацион AIN-93 M и медовый AIN-93 M соответственно.Эксперимент проводился в течение 2 месяцев, и животных еженедельно взвешивали для расчета суточной дозы. Животным внутрибрюшинно вводили 0,5 мл 0,05% колхицина за 2 часа до умерщвления, чтобы задержать клетки костного мозга и сперматоциты в стадии метафазы после голодания в течение ночи. Содержимое слепой кишки собирали в чистые пробирки Эппендорфа. Бедро, печень, почки, селезенка, легкие, яички и мозг были удалены.
Активность микробных ферментов толстой кишки
Активность бактериальной β-глюкуронидазы определяли в пищеварении содержимого слепой кишки с помощью P-нитрофенил-β-D-глюкуронида (Fluka, продукт No.73677) [21]. Разведение слепой кишки проводили при 4 ° C. Реакционная смесь содержала 0,3 мл раствора субстрата (5 моль P-нитрофенил-β-D-глюкуронида / л) и 0,2 мл разбавленной слепой кишки (1 часть слепой кишки и 2 части фосфатного буфера pH 6,4, мас. / Об.) И хорошо перемешивалась. , инкубировали при 37 ° C / 48 часов. Концентрацию высвободившегося п-нитрофенола измеряли от до оптического поглощения при 400 нм после добавления 2,5 мл 0,1 н. NaOH для остановки реакции. Активность фермента выражали как образовавшийся молярный продукт / г содержимого слепой кишки.
Исследование хромосомных аберраций
Хромосомы были подготовлены, окрашены 5% красителем Гимза в фосфатном буфере (pH 6,8), и 50 метафазных спредов были проанализированы на каждое животное на предмет хромосомных аберраций в клетках костного мозга [22]. Также были исследованы хромосомные аберрации в половых клетках семенников тех же животных [23].
Гистопатологическое исследование
Биопсии печени, почек, селезенки, легких и мозга фиксировали в 10% забуференном растворе формалина в течение 12 часов и превращали в парафиновые блоки.Срезы ткани толщиной 5 мм вырезали на предметных стеклах с альбумином и окрашивали гематоксилином и эозином (Hx. & E.). Для правильной оценки фиброза ткани и лучшей демонстрации кровеносных сосудов в срезах ткани также использовалось окрашивание трихромом Массона [24].
Исследования пробиотических бактерий толстой кишки
Подсчитывали эндогенные популяции пробиотических бактерий толстой кишки (лактобациллы и бифидобактерии). В конце эксперимента у каждого животного собирали образцы содержимого слепой кишки.Образцы содержимого слепой кишки немедленно (в течение 30 минут) помещали в сосуд для анаэробов и хранили при 4 ° C до анализа (максимум 6 часов). 100-кратные серийные разведения проводили в предварительно восстановленном растворе Рингера, содержащем 0,5% цистеина. Чашки Петри с различными средами инокулировали и инкубировали в течение 72 часов при 37 ° C в анаэробной атмосфере с использованием Gen Kits в сосудах Oxoid. Бактерии были обнаружены на следующих селективных средах: среда deMan, Rogosa, Sharpe (MRS) (Oxoid, Hampshire, United Kingdom) для лактобацилл и среда Tryptone Phytone Yeast (TPY) (Oxoid) для бифидобактерий.После инкубации подсчитывали колонии. Количество бактерий выражается как log 10 колониеобразующих единиц (log 10 КОЕ / г) свежего образца содержимого слепой кишки с пределом обнаружения 3,30 log 10 КОЕ / г.
Статистика
Все данные были выражены как среднее ± стандартная ошибка (SEM) среднего и проанализированы с помощью одностороннего дисперсионного анализа ANOVA с использованием статистической программы SAS (SAS версия 6.11, SAS Institute, Кэри, Северная Каролина). В случае значимости для сравнения различий между средними значениями использовали критерий множественного диапазона Дункана.Уровни значимости были проверены.
Результаты
Влияние меда на продукцию микотоксинов
Исследования in vitro показали, что биомасса A. parasiticus была увеличена в среде, содержащей 32% меда. Однако биомы A. ochraceus были уменьшены в среде, содержащей 32 и 48% меда. Охратоксин А не производился ни при одной концентрации меда. С другой стороны, продукция афлатоксинов B 1 , B 2 , G 1 и G 2 увеличивалась в среде, содержащей 32% меда, но снижалась в среде с высокой концентрацией меда без образования афлатоксина B 2 и G 2 (таблица).Как правило, мы не обнаружили положительной связи между массой мицелия и производством микотоксинов.
Таблица 1
Влияние меда на массу мицелия и концентрацию микотоксинов.
| Мед% | Масса мицелия (г) | Концентрация микотоксинов (мкг / л) | ||||||||||||||||||
| FRR 2748 | FRR | |||||||||||||||||||
| B1 | B2 | G1 | G2 | 71 | 14,69 | 12,69 | 8,99 | 7,70 | 5,00 | 32,03 | ||||||||||
| 32,10 | 40,40 | 13,60 | 15,00 | 15,00 12293 | 30,00 | 10,00 | 5,80 | 00,00 | 1,18 | 00,00 | 00,00 | |||||||||
Влияние меда на активность глюкуронидаз толстой кишки
Влияние пробиотических β-бактерий на активность глюкуронидаз в кишечнике содержимое слепой кишки представлено в таблице.Уровень глюкуронидазы был очень низким, и достоверных различий в его содержании в слепой кишке между всеми группами не наблюдалось (P <0,05).
Таблица 2
Влияние различных обработок микотоксинами и медом на активность бактериальных глюкуронидаз в содержимом слепой кишки мышей.
| β-глюкуронидазы мкмоль / г | Группы | |||||||||||||
| OT | HOT | AT | HAT | HAT | HAT .39 ± 0,11 | 0,40 ± 0,12 | 0,32 ± 0,10 | 0,37 ± 0,10 | 0,38 ± 0,14 | 0,42 ± 0,13 | ||||
Генотоксические эффекты микотоксинов на клетки костного мозга
Настоящее исследование введение афлатоксинов (B 1 , B 2 , G 1 и G 2 ) и охратоксина A самцам мышей индуцировало структурные и числовые хромосомные аберрации (таблица и рисунок).
Таблица 3
Средние значения различных типов хромосомных аберраций в клетках костного мозга мышей-самцов, получавших охратоксин А и афлатоксины (B 1 , B 2 , G 1 и G 2 ).
| Обработанные группы | Числовые аберрации | Структурные аберрации | |||||||
| Перидиплоидия | 9029 Дезинфекция | 9029 Хроматидные зазоры 9029 Хроматидные зазоры 9029 9029 Хроматидные зазоры 9029 9029 Хроматидные зазоры 9029 | |||||||
| OT | 2,50 ± 0,45 a | 0,67 ± 0,17 a | 0.67 ± 0,21 a | 0,83 ± 0,17 b | 2,50 ± 0,00 a | 0,83 ± 0,21 a | 5,50 ± 0,31 b | ||
| HOT | 1,83 ± 0,33 | 0,50 ± 0,00 a | 0,50 ± 0,00 a | 0,50 ± 0,00 b | 0,83 ± 0,21 b | 0,67 ± 0,17 a | 3,00 ± 0,349 c | 3,00 ± 0,349 c | 3,00 ± 0,349 |
| АТ | 2.83 ± 0,67 a | 0,67 ± 0,017 a | 0,67 ± 0,17 a | 4,33 ± 1,31 a | 1,17 ± 0,21 b | 0,83 ± 0,21 a | ± 0,48 a | ||
| HAT | 2,50 ± 0,36 a | 0,50 ± 0,00 a | 0,50 ± 0,00 a | 0,67 ± 0,17 b | 1,00 ± 0,22 | 0.50 ± 0,00 a | 3,17 ± 0,21 c | ||
| NTC | 2,00 ± 0,22 a | 0,50 ± 0,00 a | 0,50 ± 0,0 a | 2 0,50 ± 0,0 b0,83 ± 0,21 b | 0,50 ± 0,00 a | 2,83 ± 0,21 c | |||
| HTC | 2,00 ± 0,34 a | 0,50 ± 0,00 a | 0,50 ± 0,00 b | 0,67 ± 0,17 b | 0,50 ± 0,00 a | 2,67 ± 0,17 c | |||
Метафазные спреды самцов мышей, обработанных охратоксин А и афлатоксины, показывающие: а) ослабление центромеры. б) удаление. В) разрыв хроматиды (маленькая стрелка), фрагмент (большая стрелка) клеток костного мозга и г) полиплоидия. д) аутосомно-однолистный. F) х-у одновалентных клеток сперматоцитов.
Структурные хромосомные аберрации регистрировались в виде хроматидных разрывов, хроматидных разрывов (рисунок), центромерных аттенуаций (рисунок), делеций (рисунок) и фрагментов (рисунок). В таблице представлены средние значения различных структурных хромосомных аберраций, индуцированных микотоксинами в клетках костного мозга мышей-самцов. Результаты показывают низкую частоту хроматидных промежутков, разрывов и фрагментов, тогда как частота центромерного ослабления была значительно высокой между группой AT и группой HAT с одной стороны и между группой AT и контрольными группами (NTC и HTC) с другой стороны.
Значительная разница (P <0,05) была также обнаружена в делециях (рисунок) между группой OT и группой HOT, а также между группой OT и контрольными группами (NTC и HTC), что можно отнести к защитному эффекту меда.
Значительное увеличение (P <0,05) частоты общих структурных хромосомных аберраций было обнаружено между группой OT и группой HOT с одной стороны и между группой OT и контрольными группами (NTC и HTC) с другой стороны. Также была обнаружена значительная разница между группой AT по сравнению с группой HAT и контрольными группами (NTC и HTC), соответственно.
Генотоксическое действие микотоксинов на половые клетки (сперматоциты)
Результаты нашего исследования показали, что пероральное лечение охратоксином А и афлатоксинами (B 1 , B 2 , G 1 и G 2 ) индуцировало численные и структурные хромосомные аберрации в половых клетках мышей-самцов (таблица). Численные аберрации регистрировались как перидиплоидия (n ± 1 или n ± 2) и полиплоидия (рисунок). Перидиплоидия, наблюдаемая в сперматоцитах мышей-самцов, четко различалась (p ≤ 0.5) только в группе, получавшей афлатоксины (AT), по сравнению с контрольными группами (NTC и HTC). Однако полиплоидия, индуцированная группой, обработанной охратоксином А (OT), значительно отличалась (P <0,05) по сравнению с контрольными группами. Между тем, общие числовые аберрации значительно различались (P <0,05) как в группе, получавшей охратоксин A (группа OT), так и в группе, получавшей афлатоксины (AT), по сравнению с контрольными группами (NTC и HTC). Защитный эффект меда проявился только в группе HAT.
Таблица 4
Средние значения различных типов хромосомных аберраций в клетках сперматоцитов мышей-самцов, получавших охратоксин А и афлатоксины (B 1 , B 2 , G 1 и G 2 ).
| Обработанные группы | Числовые аберрации | Структурные аберрации | ||||||
| Перидиплоидия | univalents Univalents||||||||
| OT | 1,75 ± 0,48 ab | 3,75 ± 0,48 a | 5,25 ± 0,48 a | 2.75 ± 0,48 a | 1,00 ± 0,41 a | 3,75 ± 0,86 a | ||
| HOT | 1,50 ± 0,29 abc | 2,75 ± 0,25 a | 4,50 ± | 1,00 ± 0,41 b | 0,75 ± 0,25 a | 1,75 ± 0,63 a | ||
| AT | 2,25 ± 0,25 a | 1,25 ± 0,25 | 0 350 ± 0,29 b | | 2,00 ± 0,92 ab | 0,75 ± 0,75 a | 2,75 ± 0,95 a | ||
| HAT | 1,50 ± 0,29 abc | 0,50 | 2,00 ± 0,0,41 | 1,50 ± 0,29 ab | 0,50 ± 0,29 a | 2,00 ± 0,58 a | ||
| NTC | 0,75 ± 0,48 | 0,75 ± 0,48 | .41 b | 1,50 ± 0,29 c | 1,50 ± 0,29 ab | 1,00 ± 0,41 a | 2,50 ± 0,29 a | | |
| HTC | c 2 0,50 ± 0,29 | 0,25 ± 0,25 b | 1,00 ± 0,41 c | 1,00 ± 0,14 b | 1,00 ± 0,00 a | 2,00 ± 0,00 a | | ||
Лечение с помощью ахратохина высокоиндуцированные структурные хромосомные аберрации, особенно униваленты xy (рисунок), где значительная разница (P <0.05) был обнаружен между группами OT и HOT, а также между группами OT и контрольными группами (HTC).
Влияние меда на пролиферацию клеток
При микроскопическом исследовании контрольной ткани печени были обнаружены гексагональные печеночные дольки, состоящие из центральной вены, из которой были видны печеночные канатики, синусоиды, выстланные излучающими клетками Купфера, а также желчные каналы. Портальный тракт располагался между тремя долями печени и состоял из воротной вены, печеночной артерии и желчного протока (рисунок).
Печень группы НТЦ. Нормальная ткань печени (H x. И E. × 100).
Введение охратоксина А повлияло на ткань печени, так как оно вызвало расширенные и застойные центральные вены с выраженным синусоидальным расширением, застоем и гиперпластическими купферовыми клетками (рисунок). Также был очевиден очаговый некроз печени, преимущественно периваскулярный (рисунок). Введение меда с охратоксином А не выявило положительного эффекта, так как печень в группе АОТ была поражена так же, как и в группе ОТ. С другой стороны, введение афлатоксинов вызвало мутный отек в гепатоцитах, обширные вариабельные боковые некротические области, поражающие паренхиму печени и инфильтрованные нейтрофилами и макрофагами (рисунок).Также были очевидны перегруженность расширенных центральных вен и выраженная синусоидальная дилатация с гиперплазией хупферовских клеток (рисунок). Портальные тракты утолщены мононуклеарными воспалительными клетками, образованными в основном лимфоцитами и телеангиэктатическими, перегруженными сосудистыми каналами (рисунок).
Печень ОТ группы. Расширенные, застойные центральные вены отмечали расширение и гиперемию синусового отдела (Hx. И E. × 200).
Печень ОТ группы. Очаговый некроз печени преимущественно перисосудистый (Hx.И E. × 200).
Печень группы АТ. Некротические участки паренхимы печени, инфильтрованные нейтрофилами (Hx. & E. × 100).
Печень группы АТ. Заложенные расширенные центральные вены и выраженная синусоидальная дилатация (Hx. И E. × 400).
Печень группы АТ. Портальные тракты утолщены за счет заметной дилатации и закупорки сосудистых каналов и умеренного воспалительного инфильтрата мано-ядерной области (Hx. И E. × 400).
Гистопатологическое исследование контрольных тканей почек показало клубочки, проксимальные и дистальные извитые почечные канальцы, мозг содержал собирающие канальцы и части восходящей и нисходящей петли курицы.Введение охратоксина А вызывало мутное набухание проксимальных извитых канальцев, фибриновый тромбин в петлях клубочковых капилляров, увеличение количества и размера клубочков (рисунок), а также интерстициальный фиброз и скопление (рисунок). С другой стороны, совместное введение меда с охратоксином А улучшило действие охратоксина А на почки, где сосудистая полость нормализовалась. Однако они все же были немного увеличены (рисунок). Введение афлатоксинов вызывало мутный отек эпителиальной выстилки почечных канальцев с легким интерстициальным фиброзом и застоем (рисунок).
Почка ОТ группы. Увеличение количества и размера клубочков (Hx. И E. × 100).
Почка ОТ группы. Интерстициальный фиброз и гиперемия (трихром Massons × 100).
Почка группы HOT. Вернитесь к норме, за исключением заложенности сосудов (Hx. И E. × 200).
Почка группы АТ. Мутное набухание эпителия канальцев (Hx. & E. × 100).
Что касается воздействия охратоксина на мозг, гистологическое исследование показало наличие очагов дегенерации (рисунок), в то время как совместное введение меда с охратоксином А улучшило этот эффект.Кроме того, введение афлатоксина не вызывало каких-либо изменений в мозговой ткани.
Мозг. Очаги дегенерации в группе ОТ (Hx. & E. × 100).
Гистопатологическое исследование контрольного легкого показало тонкие альвеолярные стенки, состоящие из эпителиальных клеток с обеих сторон центрально расположенных капилляров без промежуточной стромы соединительной ткани. Введение охратоксина А повлияло на ткани легкого, где в легком наблюдались отек, застой, лимфоидные агрегаты в интерстициальной ткани (рисунок).Результаты показали, что легкое облегчило застойные явления (одновременный прием меда с охратоксином А) (рисунок). Принимая во внимание, что легкие показали интерстициальный фиброз и воспалительный инфильтрат после введения афлатоксина (рисунок).
Легкое группы ОТ. Отек, гиперемия, лимфоидные скопления интерстициальной ткани (Hx. И E. × 100).
Легкое группы HOT. Облегчение отека, но отек и лимфоцитарные агрегаты все еще присутствуют (Hx. И E. × 100).
Легкое группы АТ.Показан интерстициальный фиброз, воспалительное заполнение очаговыми лимфоцитарными агрегатами (трихром Massons × 100).
Контрольная ткань селезенки показала каркас соединительной ткани (который включает капсулу, трабекулы и ретикулярную соединительную ткань) и паренхиму лимфоидной ткани в виде белой (лимфоидные узелки) и красной пульпы (рисунок). На рисунке проиллюстрировано влияние охратоксина А на селезенку, где показано расширение белой пульпы с разрушением нормальной архитектуры, адвентициальное утолщение артериол, адвентициальное утолщение артериол, очаговый фиброз красной пульпы и сжатие синусоидов.
Селезенка группы NTC. Вызваны аналогичные гистопатологические, бело-красные пульпы. (Hx. И E. × 100).
Селезенка группы ОТ. Расширение белой пульпы с облитерацией нормальной архитектуры (Hx. & E. × 100).
С другой стороны, введение афлатоксинов не показало никаких изменений в ткани селезенки. Совместное введение меда с афлатоксинами вызывает улучшение всех гистопатологических изменений, которые произошли во всех исследованных органах, кроме ткани почек.
Влияние меда на пробиотические бактерии толстой кишки
Добавление меда к порошковой диете AIN-93 M (группа HTC) увеличило количество бифидобактерий в среднем на 2,3 ± 0,23 log 10 КОЕ / г (p <0,004) и lactobacilli в среднем на 1,07 ± 0,35 log 10 КОЕ / г (p <0,016) по сравнению с группой NTC (таблица).
Таблица 5
Влияние меда и микотоксинов на рост LAB (log 10 КОЕ / г).
| Штаммы | Группы мышей | ||||||||
| OT | HOT | AT | HAT | ||||||
| NTC | |||||||||
| NTC | 3.26 ± 0,19 | 3,83 ± 0,20 | Нет | Нет | 5,00 ± 0,15 | 6,06 ± 0,22 | |||
| Бифидобактерии | |||||||||
| 3,73 ± 0,19 | 0,373 ± 0,19 | 3,73 ± 0,19 | 3,77 ± 0,22 | 6,26 ± 0,29 | 8,57 ± 0,24 | ||||
Введение охратоксина А в группу, получавшую мед (группа HOT), увеличило количество лактобактерий в среднем на 0,75 ± 0.15 log 10 КОЕ / г (p <0,108) по сравнению с группой ОТ. Лактобациллы не обнаружены при введении афлатоксинов (группы HAT и AT) (таблица).
Введение смеси охратоксина А и афлатоксинов в присутствии меда (группы HOT и HAT) увеличило среднее количество бифидобактерий на 1,03 ± 0,32 log 10 КОЕ / г (p <0,083) и 0,57 ± 0,50 log 10 КОЕ / г (p <0,219) по сравнению с группами ОТ и АТ соответственно.
Обсуждение
Влияние меда на производство микотоксинов
Наши результаты показывают, что влияние меда на биомассу и образование микотоксинов ( in vitro, ) зависело от вида грибов ( A.parasiticus и A. ochraceus ) и концентрации меда. Об антимикробных свойствах перекиси водорода и неперекисных компонентов меда сообщалось в нескольких исследованиях [25]. Таким образом, для этих 2 типов грибов мед нейтрализовал больше патогенов дозозависимым образом, чем контрольный сахарный раствор (80%), состоящий из фруктозы и глюкозы, аналогично чистому меду [25]. Неразбавленный мед полностью подавлял рост обычных грибов поверхностной инфекции и заражения ран ( Aspergillus fumicgatus, A flavus, Penicellum citrinum, Trichophyton rubrum и Candida albicans ), частичное ингибирование с концентрацией меда 50% и отсутствие ингибирования было зарегистрировано концентрация меда 20% [26].
Влияние меда на пробиотические бактерии толстой кишки
Лактобациллы и бифидобактерии имеют сложные пищевые потребности, такие как углеводы, аминокислоты, пептиды, сложные эфиры жирных кислот, соли, производные нуклеиновых кислот и витамины, которые сильно различаются от вида к виду. Мед содержит более 180 веществ, в том числе аминокислоты, витамины, минералы и ферменты [5]. Основными углеводными составляющими меда являются фруктоза (32,56%) и глюкоза (28,54%). Помимо олигосахаридов (1.От 58 до 3,77% мальтозы, 0,78 ± 2,03% туранозы, 1,11 ± 2,81% нигерозы, 0,05 ± 0,15% мели-биозы, 0,03 ± 0,08% панозы, 0,24 ± 1,03% мальтотриозы, 0,21 ± 0,37% мелецитозы и 0,10 ± 0,25%. Мед также содержит от 4 до 5% фруктоолигосахаридов, которые служат пробиотическими агентами [4].
Нормальная слизистая оболочка тонкой кишки человека может не полностью поглощать фруктозу. Несколько исследований показали, что распространенность мальабсорбции фруктозы у здоровых взрослых может достигать 30–50%, эти субъекты могут нарушать всасывание заметного количества дозы 25 г фруктозы [27].Наиболее нормальные субъекты мальабсорбируют около 10% углеводов, содержащихся в меде [28]. Олигосахариды меда с низкой степенью полимеризации считаются благоприятным субстратом для бифидобактерий [10]. Наконец, неперевариваемые и / или неабсорбируемые сахариды перемещаются в толстую кишку, чтобы вызвать селективную ферментацию и селективную стимуляцию роста и активности пробиотических бактерий в толстой кишке, как было обнаружено ранее [29].
Настоящее исследование подтверждает имитирующий эффект меда на пробиотические бактерии толстой кишки.Рост кишечных Bifidobacteria spp. был усилен наличием более чем лактобацилл, что может быть связано с олигосахаридами меда с низкой степенью полимеризации (от 4 до 5%).
Уменьшение количества пробиотических бактерий толстой кишки при введении микотоксина и в отсутствие или в присутствии меда может быть связано с изменениями бактериальной поверхности во время фазы роста в результате связывания микотоксинов [13].
Влияние меда на активность бактериальных ферментов толстой кишки
Уровень глюкуронидаз является важным показателем влияния диеты на состав и активность кишечной микрофлоры.Он участвует в образовании, а также в инактивации канцерогенов в просвете кишечника и может быть положительно изменен присутствием пробиотических бактерий толстой кишки [30].
Антигенотоксические эффекты меда
Было обнаружено, что микотоксины генотоксичны для костного мозга и клеток сперматоцитов мышей, что совпадает с предыдущими сообщениями [31,32], что охратоксин А и афлатоксины вызывали хромосомные аберрации во многих клетках млекопитающих (мыши , крыса, китайский хомяк и даже человек).
Используя смесь охратоксина А и афлатоксинов в качестве токсичных и канцерогенных веществ, мы охарактеризовали потенциальную антигенотоксичность меда. Мед был антигенотоксичным ( in vivo, ), и этот эффект зависел от пробиотических бактерий толстой кишки и других факторов. Предполагается, что пробиотические бактерии толстой кишки обладают несколькими полезными эффектами, включая инактивацию канцерогенов [15]. Помимо открытия, что пробиотические бактерии толстой кишки обладают антигенотоксическими свойствами, непосредственный интерес представляет изучение механизмов, ответственных за их защиту.Было высказано предположение, что белковая структура липополисахаридной мембраны бактерий может быть эффективным компонентом [33]. Кроме того, было несколько сообщений о том, что молочнокислые бактерии (LAB) могут связывать мутагены и, таким образом, могут снижать мутагенность [34].
Пищевые факторы, содержащиеся в меде, можно использовать для предотвращения и устранения мутации, вызванной афлатоксинами [35]. Это соответствовало нашим открытиям, которые показали, что можно предотвратить или уменьшить хромосомные аберрации, вызванные афлатоксинами.Кроме того, вызванное AFB1 повреждение ДНК и хромосомные аберрации в клетках грызунов и человека могут регулироваться множеством факторов, включая питательные вещества и химиопрофилактические агенты [36]. Это согласуется с нашими результатами, согласно которым прием меда может улучшить генетический материал и минимизировать хромосомные аберрации, вызванные микотоксинами.
Влияние меда на пролиферацию клеток
Настоящие результаты гистопатологического исследования показали, что охратоксин А вызывает кровотечение и некроз красной пульпы селезенки.Этот вывод согласуется с работой [30]. Кроме того, некроз белой пульпы затронул корковые и мозговые области лимфоидных фолликулов. Кроме того, охратоксин А связан с нарушением структуры и функции клеточной мембраны мозга [31]. Он может заметно увеличивать активность цитозольных и лизосомальных ферментов.
В настоящем исследовании влияние афлатоксинов на печень согласуется с работой, проделанной ранее [32], которая объяснила это влияние увеличением цитоплазматической легкости и потерей цитоплазматической зернистости гепатоцитов.Также были зарегистрированы периоптальный фиброз с дегенерацией и изъязвлением желчных дуэтов, выстилающих эпителиальные клетки, и пролиферация желчных протоков [33]. Были очевидны мультифокальные, случайно распределенные области некроза печени, инфильтрованные нейтрофилами и макрофагами. Поражения были центральными, более выраженными вокруг портала и аналогичным результатом [34]. Результаты настоящей работы согласуются с ранее опубликованными [35] о том, что у крыс, получавших внутрибрюшинную инъекцию афлатоксина B 1 , наблюдалась выраженная воспалительная реакция в легких, застой, разрушение альвеолярных стенок с амфизематозными изменениями и утолщение стенки кровеносных сосудов, возникающие в пятнистых участках легочной ткани.
На основании гистопатологического исследования можно сделать вывод, что добавление меда к охратоксину А лишь немного улучшило микроскопические изменения почечной ткани. Однако добавление меда афлатоксинов улучшило гистопатологические изменения, вызванные токсином, в различных органах, за исключением ткани почек.
Наши результаты показали, что вредное воздействие микотоксинов может быть уменьшено в присутствии меда, что может быть связано с детоксикацией микотоксинов пробиотическими бактериями.В то же время доступность связанного AFB1 с антителом предполагает, что поверхностные компоненты этих бактерий участвовали в связывании токсина [13]. Изменение температуры (от 4 до 37 ° C) и pH (от 2 до 10) не оказало значительного влияния на количество высвобождаемого AFB1. Связывание AFB1, по-видимому, является преимущественно внеклеточным для жизнеспособных и подвергнутых термической обработке бактерий. Однако обработка кислотой может разрешить внутриклеточное связывание. Во всех случаях связывание обратимо, но стабильность образующихся комплексов зависит от штамма, обработки и условий окружающей среды.Как правило, отделение AFB1 от бактериальной поверхности требует времени. В это время AFB1 выполняет запись вдоль желудочно-кишечного тракта в направлении изгнания. Эта секвестрация AFB1 снижает возможность его реабсорбции или оказания патогенного воздействия на энтероциты или лимфоидную ткань, ассоциированную с кишечником (GALT). Это может быть чистым эффектом детоксикации микотоксинов из организма. Кроме того, наши результаты совместимы с [36], так как охратоксин A демонстрирует мутное набухание проксимальных извитых канальцев в дополнение к канальцевым эозиногильным внутрипросветным цилиндрам, фибриновым тромбам в петлях клубочковых капилляров и выраженному интерстициальному фиброзу и застою.
Афлатоксины являются генотоксическими канцерогенами. Для этого типа канцерогенов обычно считается, что не существует пороговой дозы, ниже которой не могло бы произойти образование опухоли. Другими словами, только нулевой уровень воздействия не приведет к отсутствию риска. Это согласуется с недавней оценкой [37] в отношении генотоксичности афлатоксина [38]. Необходимо провести углубленные исследования, чтобы выяснить влияние фазы роста всех штаммов пробиотических бактерий на связывание AFB 1 и G 1 и других микотоксинов in vitro и in vivo .
Заключение
Настоящие результаты показывают, что мед обладает защитным действием, зависящим от его антимикробных свойств. Также мед усиливает эндогенные пробиотические бактерии толстой кишки (бифидогенные эффекты), что оказывает несколько полезных эффектов (например, детоксикация и антигенотоксичность).
Мы рекомендуем заменять сахар медом в высокой концентрации в обработанных пищевых продуктах, детских смесях, детских закусках, особенно в тех, которые изготовлены из сельскохозяйственных материалов (например,г. молотый горох и кукуруза), чтобы избежать роста грибков и образования микотоксинов. Согласно результатам, полученным в этой статье, доза смеси афлатоксинов, превышающая 1 мкг афлатоксинов на кг веса тела в день, оказывает выраженное вредное воздействие. Это подтверждается недавним обсуждением в Европейском Союзе ограничения максимально допустимого содержания афлатоксинов в пищевых продуктах.
Список сокращений
Группа ОТ – группа 1, порошковая диета AIN-93 M, получавшая и вводившая охратоксин А (10 нг / кг массы тела / день).
HOT группа -группа 2, мед Порошковая диета AIN-93 M, получавшая и вводившая охратоксин А (10 нг / кг массы тела / день).
AT группа -группа 3, порошковая диета AIN-93 M, полученная и вводимая смесью афлатоксинов (1 мкг / кг массы тела / день).
HAT группа -группа 4, мед, порошок AIN-93 M, диета, полученная и вводимая смесью афлатоксинов (1 мкг / кг массы тела / день).
НТК группа -группа 5, АИН-93 М порошковое диетическое скармливание.
HTC группа -группа 6, мед АИН-93 М порошковый диетический скармливаемый.
Конкурирующие интересы
Автор (ы) заявляют, что у них нет конкурирующих интересов.
Вклад авторов
Али Эзз Эль-Араб задумал и спроектировал исследование и выполнил микробные ферменты толстой кишки (он также позаботился об экспериментальном животном в сотрудничестве с Шенудой Гиргисом, который исследовал хромосомные аберрации). Эман Хегази провел гистологическое исследование, а Аззат Абд эль-Халек подсчитал пробиотические бактерии. Все авторы сообщили данные и написали эту рукопись.Благодарности Центр, Докки, Гиза, Египет.
Список литературы
- Саарела М., Латенмаки Л., Криттенден Р., Салминен С., Маттила-Сандхольм Т. Кишечные бактерии и здоровая пища – европейская перспектива. Intern J Food Microbiol.2000. 278: 99–117. [PubMed] [Google Scholar]
- Verschuren PM. Функциональные продукты питания: научные и глобальные перспективы. Br J Nutr. 2002; 88: S125 – S130. DOI: 10,1079 / BJN2002675. [PubMed] [CrossRef] [Google Scholar]
- Bazzarre TL, Wu, SML Yuhas JA. Общие концентрации и ЛПВП после приема йогурта и кальция. Nutr Reports Intern. 1983; 28: 1225–1232. [Google Scholar]
- Чоу Дж. Пробиотики и пребиотики: краткий обзор. J Ren Nutr. 2002; 12: 76–86. [PubMed] [Google Scholar]
- White JW.Состав меда. В: Crane E, редактор. Мед: всеобъемлющий обзор. Лондон, Хайнеманн; 1979. С. 157–192. [Google Scholar]
- Аль-Мамарья М., Аль-Мериб А., Аль-Хабориб М. Антиоксидантная активность и общие фенольные соединения различных видов меда. Nutr Res. 2002; 22: 1041–1047. DOI: 10.1016 / S0271-5317 (02) 00406-2. [CrossRef] [Google Scholar]
- Беннетт Дж. В., Клих М. Микотоксины. Обзор Clin Microb. 2003. 16: 497–516. DOI: 10.1128 / CMR.16.3.497-516.2003. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Генри Ш., Bosch FX, Troxell TC, Bolger PM.Уменьшение рака печени – глобальный контроль афлатоксина. Наука. 1999; 286: 2453–2454. DOI: 10.1126 / science.286.5449.2453. [PubMed] [CrossRef] [Google Scholar]
- Койпер-Гудман Т. Безопасность пищевых продуктов: микотоксины и фикотоксины в перспективе. В: Miraglia M, Van Edmond H, Brera C, Gilbert J, редактор. Микотоксины и фикотоксины – разработки в области химии, токсикологии и безопасности пищевых продуктов. Alaken Inc., Форт-Коллинз, Колорадо; 1998. С. 25–48. [Google Scholar]
- Кадзивара С., Ганди Х., Устунол З. Влияние меда на рост и выработку кислоты кишечными бактериями Bifidobacterium spp.: in vitro, сравнение с коммерческими олигосахаридами и инулином. J food prod. 2002; 65: 214–218. [PubMed] [Google Scholar]
- Salminen S, Bouley MC, Boutron-Rualt MC, Cummings J, Frank A, Gibson E, Isolauri E, Moreau MC, Roberfroid M, Rowland I. Наука о функциональном питании, физиология и функции желудочно-кишечного тракта. Br J Nutr. 1998; 1: 147–171. DOI: 10,1079 / BJN19980108. [PubMed] [CrossRef] [Google Scholar]
- Эль-Незами Х., Микнен Х., Канкаанп П., Салминен С., Ахокас Дж.Способность штаммов Lactobacillus и propionibacterium удалять афлатоксин B1 из двенадцатиперстной кишки цыпленка. J Food Prot. 2000; 63: 549–552. [PubMed] [Google Scholar]
- Haskard CA, El-Nezami HS, Kankaanp PE, Salminen S, Aholmas JT. Поверхностное связывание афлатоксина B1 молочнокислыми бактериями. Appl Environ Microbiol. 2001; 67: 3086–3091. DOI: 10.1128 / AEM.67.7.3086-3091.2001. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Gratz S, Mykkänen H, Ouwehand AC, Juvonen R, Salminen S, El-Nezami H.Кишечная слизь изменяет способность пробиотических бактерий связывать афлатоксин B1 In Vitro . Appl Environ Microbiol. 2004. 70: 6306–6308. DOI: 10.1128 / AEM.70.10.6306-6308.2004. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Pool-Zobel BL, Neidecker C, Domizlaff I, Ji S, Schillinger U, Rumney C, Moretti I, Vilarini I, Scassellati-Sforzolini R, Rowland I. • Антигенотоксичность, опосредованная лактобактериями и бифидобактериями, в толстой кишке крыс. Nutr Cancer. 1996. 26: 365–380. [PubMed] [Google Scholar]
- A.OAC «Официальные методы официальных химиков-аналитиков. Арлингтон, Вирджиния, США. 2000.
- Park D, Neslein S, Trucksess MW, Starck ME, Newel RF. Жидкостный хроматографический метод определения афлатоксинов B-1, B2, G1 и G2 в продукты из кукурузы и арахиса. J Assoc Off Anal Chem. 1990; 73: 260–266. [PubMed] [Google Scholar]
- Haspolat K, Buyukbas S, Cengel H. In vitro антибактериальный и противогрибковый эффект меда. Turk Hijyen – Ve – Денейсел-Бийолоджи-Дергиси.1990; 47: 211–216.[Google Scholar]
- Wahdan HA. Противомикробный эффект меда. Египетская J Lab Med. 1996; 8: 29–44. [Google Scholar]
- Ривз П., Нильсен Ф., Фэи Г. Очищенные диеты AIN-93 для лабораторных грызунов: окончательный отчет специального комитета по написанию Американского института питания о разработке рациона для грызунов AIN-76A. J Nutr. 1993; 123: 1939–1951. [PubMed] [Google Scholar]
- Djouzi Z, Andrieux C. Сравнивали эффекты трех олигосахаридов на метаболизм кишечной микрофлоры у крыс, инокулированных фекальной флорой человека.Br J Nutr. 1997; 78: 313–324. DOI: 10,1079 / BJN19970149. [PubMed] [CrossRef] [Google Scholar]
- Престон Р.Дж., Дин Б.Дж., Галлоуэй С., Холден Х., МакФи А.Ф., Шелби М., Mammalian in vivo, цитогенетический анализ . Mutat Res. 1987. 189: 157–165. DOI: 10.1016 / 0165-1218 (87)
- -8. [PubMed] [CrossRef] [Google Scholar]
- Руссо А. Цитогенетика in vivo : зародышевые клетки млекопитающих. Mutat Res. 2000; 455: 167–189. [PubMed] [Google Scholar]
- A.F.I.P. Институт патологии Вооруженных Сил.Лабораторные методы в гистотехнологии. Вашингтон, округ Колумбия; 1994. [Google Scholar]
- Wahdan HAL. Причины антимикробной активности меда. Заразить. 1998; 26: 26–30. [PubMed] [Google Scholar]
- Efem SEE, Udoh KT, Lwara CI. Антимикробный спектр меда и его клиническое значение. Заразить. 1992. 20: 277–285. [Google Scholar]
- Мишкин Д., Саблаускас Л., Яловский М., Мишкин С. Нарушение всасывания фруктозы и сорбита у амбулаторных пациентов с функциональной диспепсией: сравнение с нарушением переваривания / нарушением всасывания лактозы.Dig Dis Sci. 1997. 42: 2591–2596. DOI: 10.1023 / А: 1018841402133. [PubMed] [CrossRef] [Google Scholar]
- Ladas SD, Raptis SA. Мед, абсорбция фруктозы и слабительное действие. J Nutr. 1999; 15: 591–592. DOI: 10.1016 / S0899-9007 (99) 00092-1. [PubMed] [CrossRef] [Google Scholar]
- Цимер С.Дж., Гибсон Г.Р. Обзор пробиотиков, пребиотиков и синбиотиков в концепции функционального питания: перспективы и будущие стратегии. Int Dairy Journal. 1998. 8: 473–479. DOI: 10.1016 / S0958-6946 (98) 00071-5.[CrossRef] [Google Scholar]
- Налини Н., Манджу В., Менон В.П. Влияние кокосового жмыха на активность бактериального фермента при раке толстой кишки, вызванном 1,2-диметилгидразином. Clin Chim Acta. 2004; 342: 203–210. DOI: 10.1016 / j.cccn.2004.01.001. [PubMed] [CrossRef] [Google Scholar]
- Groose Y, Chekir-Ghedira L, Huc A, Obrecht-Pflumio S, Dirheimer G, Bacha H, Pfohl-Leszkowicz A. Сетчатка, аскорбиновая кислота и альфа-токоферол предотвращают образование аддуктов ДНК у мышей, получавших микотоксины охратоксин А и зеараленон.Раковый латыш. 1997. 114: 255–229. DOI: 10.1016 / S0304-3835 (97) 04676-4. [PubMed] [CrossRef] [Google Scholar]
- Ван Дж. С., Групман Дж. Д. Повреждение ДНК микотоксинами. Mutat Res. 1999; 424: 167–81. [PubMed] [Google Scholar]
- Zhang XB, Ohta Y. Антимутагенность клеточных фракций микроорганизмов в отношении сильнодействующих мутагенных пиролизатов. Mutat Res. 1993; 298: 247–253. DOI: 10.1016 / 0165-1218 (93) -V. [PubMed] [CrossRef] [Google Scholar]
- Эль-Незами Х., Канкаанпаа П., Салминан С., Ахокас Дж. Способность молочных штаммов молочнокислых бактерий связывать общий пищевой канцероген, афлатоксин B1.Food Chem Toxicol. 1998. 36: 321–326. DOI: 10.1016 / S0278-6915 (97) 00160-9. [PubMed] [CrossRef] [Google Scholar]
- Шарманов Т.Ш., Ников П.С., Алдабергенова К.У., Меербекова Б.Т. Влияние типа питания и афлатоксина B1 на структуру хромосом. Вопр Питан. 1986; 5: 56–60. [PubMed] [Google Scholar]
- Munro IC, Scott PM, Moodie CA, Willes RF. охратоксин Возникновение и токсичность. J Am Vet Med Assoc. 1973; 63: 1269–1273. [PubMed] [Google Scholar]
- Monnet-Tschudi F, Sorg O, Honegger P, Zurich M, Hugget AC, Schilter B.Влияние встречающегося в природе пищевого микотоксина хроматоксина А на клетки мозга в культуре. Нейротоксикология. 1997; 18: 831–840. [PubMed] [Google Scholar]
- Кларк Д., Джаир А.В., Хэтч Р. Влияние различных видов лечения на индуцированный хронический афлатоксикоз у кроликов. Am J Vet Res. 1982; 43: 106–110. [PubMed] [Google Scholar]
- Эль-Захан Х., Эль-Ашри М.А., Тарват Е.Е., Саад М.М., Амин С.О. Кролик и афлатоксины: влияние смеси афлатоксинов на кровь, компоненты плазмы природы Новой Зеландии, штамбы белого кролика.Египетский кролик J Sci. 1996; 6: 55–56. [Google Scholar]
- Уэно Ю. Токсикология микотоксинов. CRC Crit Rev Toxicol. 1985. 14: 99–132. [PubMed] [Google Scholar]
- Gopuiath C, Prentic DE, Lewis DJ. Атлас экспериментальной токсикологической патологии. Current, гистопатология, MTP press limited, lan coraster, Boston The Hague-Derdecht. 1987. 30: 43–61. [Google Scholar]
- Albassam MA, Yong SI, Bhatnagar R, Sharma AK, Prior MG. Гистопатологические и электронно-микроскопические исследования острой токсичности охратоксина А у крыс.Vet Pathol. 1987. 24: 427–435. [PubMed] [Google Scholar]
Влияние диетического меда на микрофлору кишечника и токсичность микотоксинов у мышей
BMC Complement Altern Med. 2006; 6: 6.
, 1 , 2 , 3 и 4Али М Эзз Эль-Араб
1 Департамент пищевых наук и питания Национального исследовательского центра, 12644 – Докки, Гиза, Египет
Шенуда М. Гиргис
2 Департамент клеточной биологии, Национальный исследовательский центр, 12644 – Докки, Гиза, Египет
Эман М. Хегази
3 Департамент пищевой токсикологии, Национальный исследовательский центр, 12644 – Докки, Гиза, Египет
Аззат Б. Абд Эль-Халек
4 Департамент молочных продуктов, Национальный исследовательский центр, 12644 – Докки, Гиза, Египет
1 Департамент пищевых наук и питания Национального исследовательского центра, 12644 – Докки, Гиза, Египет
2 Департамент клеточной биологии, Национальный исследовательский центр, 12644 – Докки, Гиза, Египет
3 Департамент пищевой токсикологии, Национальный исследовательский центр, 12644 – Докки, Гиза, Египет
4 Департамент молочной промышленности, Национальный исследовательский центр, 12644 – Докки, Гиза, Египет
Автор, отвечающий за переписку.Поступило 20 февраля 2005 г .; Принято 14 марта 2006 г.
Copyright © 2006 Ezz El-Arab et al; лицензиат BioMed Central Ltd.Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License (http://creativecommons.org/licenses/by/2.0), которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе. при условии правильного цитирования оригинала.
Эта статья цитируется в других статьях в PMC.Abstract
Справочная информация
Пчелиный мед – это функциональный корм, обладающий уникальным составом, антимикробными свойствами и бифидогенным действием.Настоящее исследование было предпринято для того, чтобы оценить, может ли мед подавлять токсическое действие микотоксинов.
Методы
Производство биомассы и токсинов с помощью Aspergillus parasiticus и Aspergillus ochraceus отслеживали в средах без меда и с медом. Хотя афлатоксины и охратоксин А вводили самцам швейцарских мышей-альбиносов в дозах до 1 мкг и 10 нг / кг массы тела / день соответственно. Подопытных животных кормили диетами без нашего 10% меда в течение двух месяцев.Следили за изменениями в пробиотических бактериях толстой кишки, детерминантном ферменте толстой кишки глюкуронидазе и генотоксичности.
Результаты
Добавление 32% в среду увеличивало биомассу A parasiticus , в то время как биомасса A. ochraceus уменьшалась, и охратоксин А. не производился. Когда в среду добавляли мед в соотношении 32 и 48%. Связи между массой мицелия и продукцией микотоксинов не обнаружено. Пероральное введение афлатоксинов (смесь B 1 , B 2 , G 1 и G 2 ) и охратоксина А.вызывали структурные и численные хромосомные аберрации в костном мозге и половых клетках самцов мышей, тогда как лечение медом снижало генотоксичность микотоксинов. Также оба токсина вызывали гистопатологические изменения в печени и почках. Питание на диете с добавлением меда улучшило гистопатологические изменения в случае группы афлатоксинов, но не в случае группы охратоксина А. (за исключением почек в двух случаях). Не было обнаружено значительных различий в активности β-глюкуронидазы толстой кишки между группами, получавшими диету с медом или без него.С другой стороны, количество бифидобактерий толстой кишки и лактобацилл заметно увеличилось в группе, получавшей диету с добавлением меда.
Заключение
Замена сахара на мед в обработанных пищевых продуктах может подавить вредные и генотоксические эффекты микотоксинов и улучшить микрофлору кишечника.
Общие сведения
Пищевые продукты больше не ценятся потребителями только с точки зрения их вкуса и непосредственных потребностей в питании, но также с точки зрения их способности приносить особую пользу для здоровья.Функциональные продукты питания стали важным сектором пищевых продуктов, обеспечивающим пользу для здоровья благодаря функциональным ингредиентам в этих продуктах. Функциональные продукты питания, направленные на улучшение баланса и активности кишечной среды, в настоящее время составляют самый большой сегмент рынка функциональных продуктов питания [1,2].
В течение долгого времени было замечено, что мед можно использовать для лечения заболеваний печени, сердечно-сосудистой системы и желудочно-кишечного тракта [3]. Мед – это натуральный продукт с очень сложным химическим составом. Он состоит в основном из фруктозы и глюкозы, но также содержит от 4 до 5% фруктоолигосахаридов, которые служат пребиотическими агентами [4].Он содержит более 180 веществ, в том числе аминокислоты, витамины, минералы и ферменты [5]. Антимикробные свойства перекиси водорода и неперекисных компонентов меда проверялись в нескольких исследованиях [6].
Распространенность заражения микотоксинами (афлатоксинами и охратоксинами) носит глобальный характер. По оценкам, четверть сельскохозяйственных культур в мире в той или иной степени загрязнены микотоксинами, особенно распространенными в развивающихся странах. Как правило, микотоксины обычно содержатся в пищевых продуктах [7,8].Микотоксины вызывают серьезную озабоченность из-за их пагубного воздействия на здоровье людей и животных. Aspergillus flavus и A. parasiticus продуцируют афлатоксины. Охратоксин А был открыт как метаболит Aspergillus ochraceus . Из токсинов Aspergillus только охратоксин (природный канцероген и нефротоксин) потенциально так же важен, как афлатоксины (природный канцероген). Оба они связаны как с токсичностью, так и с канцерогенностью для здоровья человека.Ведущий деятель в области оценки риска назвал микотоксины наиболее важным хроническим диетическим фактором риска, превосходящим синтетические контаминанты, токсины растений, пищевые добавки или остатки пестицидов [7,9].
Загрязняющие пищевые вещества, попадающие в организм оральным путем, напрямую подвергаются действию кишечной микрофлоры. Микрофлора желудочно-кишечного тракта (ЖКТ) все чаще признается одним из факторов, влияющих на здоровье человека. Эта микрофлора представляет собой динамическое равновесие, которое может быть изменено диетой [10].Нормальная здоровая микрофлора кишечника содержит множество штаммов молочнокислых бактерий (LAB), некоторые из которых были выделены, приписаны несколько полезных эффектов и названы штаммами пробиотиков [11]. Несколько исследований показали, что пробиотические бактерии толстой кишки могут удалять микотоксины посредством физического связывания в качестве механизма удаления мутагена [12-14]. Кроме того, тяжесть отравления микотоксинами может быть усилена такими факторами, как дефицит витаминов, недостаток калорий, злоупотребление алкоголем и статус инфекционного заболевания [7].
Кроме того, есть доказательства того, что пробиотические бактерии толстой кишки могут положительно модулировать определенные микробные ферменты толстой кишки, которые могут играть роль в заболеваниях, связанных с диетой. Изменение этих параметров указывает на защитный эффект от канцерогенов. Пробиотические бактерии связывают мутагены in vitro , а также предотвращают выведение мутагенов из организма человека. Однако необходимы дополнительные исследования, чтобы определить физиологическое значение эндогенных пробиотических бактерий толстой кишки [15].
Полное устранение любых естественных токсинов из пищевых продуктов – недостижимая цель. Наука о питании расширяет знания о том, как продукты питания влияют на потребителей в зависимости от конкретных параметров здоровья.
Следовательно, необходимо провести более глубокие исследования, чтобы выяснить потенциал защитного действия меда за счет его противогрибкового действия и снижения хронических заболеваний, связанных с питанием, таких как рак.
Для достижения этой цели мы изучили in vitro , влияние меда на рост грибов и образование микотоксинов с помощью Aspergillus в пищевых продуктах.Кроме того, мы изучили действие меда in vivo в присутствии микотоксина на эндогенные пробиотические бактерии толстой кишки, микробные ферменты толстой кишки, пролиферацию клеток и генотоксичность.
Методы
Монофлоральный мед (хлопок) был приобретен в Центре исследований пчеловодства Министерства сельского хозяйства, Каир, Египет. Арахис ( Archis hypogalal ) с повреждениями и наблюдаемым загрязнением грибами был получен из источников основного поставщика арахиса в Египте. Бактериальная культура, среда deMann, Rogosa, Sharpe (MRS) (Oxoid, Hampshire, United Kingdom) для Lactobacilli.Триптонно-фитоновые дрожжи (TPY), среда (Oxoid) для бифидобактерий. Стандарт охратоксина А (каталожный № 01877) был приобретен у химической компании Sigma-Aldrich (Сент-Луис, США). Грибы, продуцирующие афлатоксины и охратоксин А, A. parasiticus (FRR 2748) и A. ochraceus (NRRL 3174) были получены от Ассоциации стандартов Австралии (Северный Сидней, Новый Южный Уэльс, Австралия). Природные афлатоксины (B 1 , B 2 , G 1 и G 2 ) были экстрагированы из арахиса [16], и их концентрации были определены методами тонкослойной (ТСХ) и высокоэффективной жидкостной хроматографии (ВЭЖХ). [17].
Концентрация экстрагированных афлатоксинов B 1 , B 2 , G 1 и G 2 из арахиса составила 211,42, 135,53, 368,10 и 99,72 мкг / кг соответственно. Полученный экстракт растворяли в 2-литровом соевом масле и хранили в холодильнике до использования.
Изучение влияния меда на продукцию микотоксинов
A. parasiticus (FRR 2748) и A. ochraceus (NRRL 3174) культивировали на картофельном агаре с декстрозой в течение 10 дней при 25 ° C, пока они не стали хорошо спорулированными.Споры собирали в 10 мл стерильного 1% раствора Твина 80 (об. / Об.) С получением 10 5 спор / мл. Колбы, содержащие 500 мл среды дрожжевой экстракт-сахароза (ДА) с добавлением нулевого, 32 и 48% меда, инокулировали 2,0 мл этой суспензии, инкубировали при 28 ° C в течение 21 дня, а затем анализировали на афлатоксины [18,19].
Изучение влияния меда на прием микотоксинов у мышей
Сорок два самца швейцарских мышей-альбиносов возрастом примерно 7 недель и весом 20 ± 3 г были получены из колонии приюта для животных Национального исследовательского центра, Каир, Египет.Животных содержали индивидуально в клетках из нержавеющей стали с контролируемой температурой (24–26 ° C), влажностью (40–70%) и условиями освещения (12-часовой цикл свет / темнота) и позволяли свободный доступ к дистиллированной воде и основной диете (AIN- 93 М) на 10 дней в качестве адаптивного периода. Порошок AIN-93 M содержал белок (14%), крахмал (62,07%), сахарозу (10%), жир (4%), клетчатку (5%), минеральную смесь (3,5%), смесь витаминов (1%). ), L-цистин (0,18%), битратрат холина (0,25%) и тетрабутилгидрохинон (0,00008%) [20].
Затем мышей случайным образом разделили на шесть групп (по 7 животных в каждой). Группа 1 st получала диету AIN-93 M и вводила охратоксин A (10 нг / кг массы тела / день, группа ОТ). Группу 2 и лечили так же, как группу 1, за исключением того, что она получала мед / диету AIN-93 M (группа HOT). Группе 3 (AT) и H (HAT) скармливали диету AIN-93 M и мед / AIN-93 M, соответственно, и вводили смесь афлатоксинов (1 мкг / кг массы тела / день). Группы 5 (NTC) и 6 (HTC) служили контролем и получали рацион AIN-93 M и медовый AIN-93 M соответственно.Эксперимент проводился в течение 2 месяцев, и животных еженедельно взвешивали для расчета суточной дозы. Животным внутрибрюшинно вводили 0,5 мл 0,05% колхицина за 2 часа до умерщвления, чтобы задержать клетки костного мозга и сперматоциты в стадии метафазы после голодания в течение ночи. Содержимое слепой кишки собирали в чистые пробирки Эппендорфа. Бедро, печень, почки, селезенка, легкие, яички и мозг были удалены.
Активность микробных ферментов толстой кишки
Активность бактериальной β-глюкуронидазы определяли в пищеварении содержимого слепой кишки с помощью P-нитрофенил-β-D-глюкуронида (Fluka, продукт No.73677) [21]. Разведение слепой кишки проводили при 4 ° C. Реакционная смесь содержала 0,3 мл раствора субстрата (5 моль P-нитрофенил-β-D-глюкуронида / л) и 0,2 мл разбавленной слепой кишки (1 часть слепой кишки и 2 части фосфатного буфера pH 6,4, мас. / Об.) И хорошо перемешивалась. , инкубировали при 37 ° C / 48 часов. Концентрацию высвободившегося п-нитрофенола измеряли от до оптического поглощения при 400 нм после добавления 2,5 мл 0,1 н. NaOH для остановки реакции. Активность фермента выражали как образовавшийся молярный продукт / г содержимого слепой кишки.
Исследование хромосомных аберраций
Хромосомы были подготовлены, окрашены 5% красителем Гимза в фосфатном буфере (pH 6,8), и 50 метафазных спредов были проанализированы на каждое животное на предмет хромосомных аберраций в клетках костного мозга [22]. Также были исследованы хромосомные аберрации в половых клетках семенников тех же животных [23].
Гистопатологическое исследование
Биопсии печени, почек, селезенки, легких и мозга фиксировали в 10% забуференном растворе формалина в течение 12 часов и превращали в парафиновые блоки.Срезы ткани толщиной 5 мм вырезали на предметных стеклах с альбумином и окрашивали гематоксилином и эозином (Hx. & E.). Для правильной оценки фиброза ткани и лучшей демонстрации кровеносных сосудов в срезах ткани также использовалось окрашивание трихромом Массона [24].
Исследования пробиотических бактерий толстой кишки
Подсчитывали эндогенные популяции пробиотических бактерий толстой кишки (лактобациллы и бифидобактерии). В конце эксперимента у каждого животного собирали образцы содержимого слепой кишки.Образцы содержимого слепой кишки немедленно (в течение 30 минут) помещали в сосуд для анаэробов и хранили при 4 ° C до анализа (максимум 6 часов). 100-кратные серийные разведения проводили в предварительно восстановленном растворе Рингера, содержащем 0,5% цистеина. Чашки Петри с различными средами инокулировали и инкубировали в течение 72 часов при 37 ° C в анаэробной атмосфере с использованием Gen Kits в сосудах Oxoid. Бактерии были обнаружены на следующих селективных средах: среда deMan, Rogosa, Sharpe (MRS) (Oxoid, Hampshire, United Kingdom) для лактобацилл и среда Tryptone Phytone Yeast (TPY) (Oxoid) для бифидобактерий.После инкубации подсчитывали колонии. Количество бактерий выражается как log 10 колониеобразующих единиц (log 10 КОЕ / г) свежего образца содержимого слепой кишки с пределом обнаружения 3,30 log 10 КОЕ / г.
Статистика
Все данные были выражены как среднее ± стандартная ошибка (SEM) среднего и проанализированы с помощью одностороннего дисперсионного анализа ANOVA с использованием статистической программы SAS (SAS версия 6.11, SAS Institute, Кэри, Северная Каролина). В случае значимости для сравнения различий между средними значениями использовали критерий множественного диапазона Дункана.Уровни значимости были проверены.
Результаты
Влияние меда на продукцию микотоксинов
Исследования in vitro показали, что биомасса A. parasiticus была увеличена в среде, содержащей 32% меда. Однако биомы A. ochraceus были уменьшены в среде, содержащей 32 и 48% меда. Охратоксин А не производился ни при одной концентрации меда. С другой стороны, продукция афлатоксинов B 1 , B 2 , G 1 и G 2 увеличивалась в среде, содержащей 32% меда, но снижалась в среде с высокой концентрацией меда без образования афлатоксина B 2 и G 2 (таблица).Как правило, мы не обнаружили положительной связи между массой мицелия и производством микотоксинов.
Таблица 1
Влияние меда на массу мицелия и концентрацию микотоксинов.
| Мед% | Масса мицелия (г) | Концентрация микотоксинов (мкг / л) | ||||||||||||||||||
| FRR 2748 | FRR | |||||||||||||||||||
| B1 | B2 | G1 | G2 | 71 | 14,69 | 12,69 | 8,99 | 7,70 | 5,00 | 32,03 | ||||||||||
| 32,10 | 40,40 | 13,60 | 15,00 | 15,00 12293 | 30,00 | 10,00 | 5,80 | 00,00 | 1,18 | 00,00 | 00,00 | |||||||||
Влияние меда на активность глюкуронидаз толстой кишки
Влияние пробиотических β-бактерий на активность глюкуронидаз в кишечнике содержимое слепой кишки представлено в таблице.Уровень глюкуронидазы был очень низким, и достоверных различий в его содержании в слепой кишке между всеми группами не наблюдалось (P <0,05).
Таблица 2
Влияние различных обработок микотоксинами и медом на активность бактериальных глюкуронидаз в содержимом слепой кишки мышей.
| β-глюкуронидазы мкмоль / г | Группы | |||||||||||||
| OT | HOT | AT | HAT | HAT | HAT .39 ± 0,11 | 0,40 ± 0,12 | 0,32 ± 0,10 | 0,37 ± 0,10 | 0,38 ± 0,14 | 0,42 ± 0,13 | ||||
Генотоксические эффекты микотоксинов на клетки костного мозга
Настоящее исследование введение афлатоксинов (B 1 , B 2 , G 1 и G 2 ) и охратоксина A самцам мышей индуцировало структурные и числовые хромосомные аберрации (таблица и рисунок).
Таблица 3
Средние значения различных типов хромосомных аберраций в клетках костного мозга мышей-самцов, получавших охратоксин А и афлатоксины (B 1 , B 2 , G 1 и G 2 ).
| Обработанные группы | Числовые аберрации | Структурные аберрации | |||||||
| Перидиплоидия | 9029 Дезинфекция | 9029 Хроматидные зазоры 9029 Хроматидные зазоры 9029 9029 Хроматидные зазоры 9029 9029 Хроматидные зазоры 9029 | |||||||
| OT | 2,50 ± 0,45 a | 0,67 ± 0,17 a | 0.67 ± 0,21 a | 0,83 ± 0,17 b | 2,50 ± 0,00 a | 0,83 ± 0,21 a | 5,50 ± 0,31 b | ||
| HOT | 1,83 ± 0,33 | 0,50 ± 0,00 a | 0,50 ± 0,00 a | 0,50 ± 0,00 b | 0,83 ± 0,21 b | 0,67 ± 0,17 a | 3,00 ± 0,349 c | 3,00 ± 0,349 c | 3,00 ± 0,349 |
| АТ | 2.83 ± 0,67 a | 0,67 ± 0,017 a | 0,67 ± 0,17 a | 4,33 ± 1,31 a | 1,17 ± 0,21 b | 0,83 ± 0,21 a | ± 0,48 a | ||
| HAT | 2,50 ± 0,36 a | 0,50 ± 0,00 a | 0,50 ± 0,00 a | 0,67 ± 0,17 b | 1,00 ± 0,22 | 0.50 ± 0,00 a | 3,17 ± 0,21 c | ||
| NTC | 2,00 ± 0,22 a | 0,50 ± 0,00 a | 0,50 ± 0,0 a | 2 0,50 ± 0,0 b0,83 ± 0,21 b | 0,50 ± 0,00 a | 2,83 ± 0,21 c | |||
| HTC | 2,00 ± 0,34 a | 0,50 ± 0,00 a | 0,50 ± 0,00 b | 0,67 ± 0,17 b | 0,50 ± 0,00 a | 2,67 ± 0,17 c | |||
Метафазные спреды самцов мышей, обработанных охратоксин А и афлатоксины, показывающие: а) ослабление центромеры. б) удаление. В) разрыв хроматиды (маленькая стрелка), фрагмент (большая стрелка) клеток костного мозга и г) полиплоидия. д) аутосомно-однолистный. F) х-у одновалентных клеток сперматоцитов.
Структурные хромосомные аберрации регистрировались в виде хроматидных разрывов, хроматидных разрывов (рисунок), центромерных аттенуаций (рисунок), делеций (рисунок) и фрагментов (рисунок). В таблице представлены средние значения различных структурных хромосомных аберраций, индуцированных микотоксинами в клетках костного мозга мышей-самцов. Результаты показывают низкую частоту хроматидных промежутков, разрывов и фрагментов, тогда как частота центромерного ослабления была значительно высокой между группой AT и группой HAT с одной стороны и между группой AT и контрольными группами (NTC и HTC) с другой стороны.
Значительная разница (P <0,05) была также обнаружена в делециях (рисунок) между группой OT и группой HOT, а также между группой OT и контрольными группами (NTC и HTC), что можно отнести к защитному эффекту меда.
Значительное увеличение (P <0,05) частоты общих структурных хромосомных аберраций было обнаружено между группой OT и группой HOT с одной стороны и между группой OT и контрольными группами (NTC и HTC) с другой стороны. Также была обнаружена значительная разница между группой AT по сравнению с группой HAT и контрольными группами (NTC и HTC), соответственно.
Генотоксическое действие микотоксинов на половые клетки (сперматоциты)
Результаты нашего исследования показали, что пероральное лечение охратоксином А и афлатоксинами (B 1 , B 2 , G 1 и G 2 ) индуцировало численные и структурные хромосомные аберрации в половых клетках мышей-самцов (таблица). Численные аберрации регистрировались как перидиплоидия (n ± 1 или n ± 2) и полиплоидия (рисунок). Перидиплоидия, наблюдаемая в сперматоцитах мышей-самцов, четко различалась (p ≤ 0.5) только в группе, получавшей афлатоксины (AT), по сравнению с контрольными группами (NTC и HTC). Однако полиплоидия, индуцированная группой, обработанной охратоксином А (OT), значительно отличалась (P <0,05) по сравнению с контрольными группами. Между тем, общие числовые аберрации значительно различались (P <0,05) как в группе, получавшей охратоксин A (группа OT), так и в группе, получавшей афлатоксины (AT), по сравнению с контрольными группами (NTC и HTC). Защитный эффект меда проявился только в группе HAT.
Таблица 4
Средние значения различных типов хромосомных аберраций в клетках сперматоцитов мышей-самцов, получавших охратоксин А и афлатоксины (B 1 , B 2 , G 1 и G 2 ).
| Обработанные группы | Числовые аберрации | Структурные аберрации | ||||||
| Перидиплоидия | univalents Univalents||||||||
| OT | 1,75 ± 0,48 ab | 3,75 ± 0,48 a | 5,25 ± 0,48 a | 2.75 ± 0,48 a | 1,00 ± 0,41 a | 3,75 ± 0,86 a | ||
| HOT | 1,50 ± 0,29 abc | 2,75 ± 0,25 a | 4,50 ± | 1,00 ± 0,41 b | 0,75 ± 0,25 a | 1,75 ± 0,63 a | ||
| AT | 2,25 ± 0,25 a | 1,25 ± 0,25 | 0 350 ± 0,29 b | | 2,00 ± 0,92 ab | 0,75 ± 0,75 a | 2,75 ± 0,95 a | ||
| HAT | 1,50 ± 0,29 abc | 0,50 | 2,00 ± 0,0,41 | 1,50 ± 0,29 ab | 0,50 ± 0,29 a | 2,00 ± 0,58 a | ||
| NTC | 0,75 ± 0,48 | 0,75 ± 0,48 | .41 b | 1,50 ± 0,29 c | 1,50 ± 0,29 ab | 1,00 ± 0,41 a | 2,50 ± 0,29 a | | |
| HTC | c 2 0,50 ± 0,29 | 0,25 ± 0,25 b | 1,00 ± 0,41 c | 1,00 ± 0,14 b | 1,00 ± 0,00 a | 2,00 ± 0,00 a | | ||
Лечение с помощью ахратохина высокоиндуцированные структурные хромосомные аберрации, особенно униваленты xy (рисунок), где значительная разница (P <0.05) был обнаружен между группами OT и HOT, а также между группами OT и контрольными группами (HTC).
Влияние меда на пролиферацию клеток
При микроскопическом исследовании контрольной ткани печени были обнаружены гексагональные печеночные дольки, состоящие из центральной вены, из которой были видны печеночные канатики, синусоиды, выстланные излучающими клетками Купфера, а также желчные каналы. Портальный тракт располагался между тремя долями печени и состоял из воротной вены, печеночной артерии и желчного протока (рисунок).
Печень группы НТЦ. Нормальная ткань печени (H x. И E. × 100).
Введение охратоксина А повлияло на ткань печени, так как оно вызвало расширенные и застойные центральные вены с выраженным синусоидальным расширением, застоем и гиперпластическими купферовыми клетками (рисунок). Также был очевиден очаговый некроз печени, преимущественно периваскулярный (рисунок). Введение меда с охратоксином А не выявило положительного эффекта, так как печень в группе АОТ была поражена так же, как и в группе ОТ. С другой стороны, введение афлатоксинов вызвало мутный отек в гепатоцитах, обширные вариабельные боковые некротические области, поражающие паренхиму печени и инфильтрованные нейтрофилами и макрофагами (рисунок).Также были очевидны перегруженность расширенных центральных вен и выраженная синусоидальная дилатация с гиперплазией хупферовских клеток (рисунок). Портальные тракты утолщены мононуклеарными воспалительными клетками, образованными в основном лимфоцитами и телеангиэктатическими, перегруженными сосудистыми каналами (рисунок).
Печень ОТ группы. Расширенные, застойные центральные вены отмечали расширение и гиперемию синусового отдела (Hx. И E. × 200).
Печень ОТ группы. Очаговый некроз печени преимущественно перисосудистый (Hx.И E. × 200).
Печень группы АТ. Некротические участки паренхимы печени, инфильтрованные нейтрофилами (Hx. & E. × 100).
Печень группы АТ. Заложенные расширенные центральные вены и выраженная синусоидальная дилатация (Hx. И E. × 400).
Печень группы АТ. Портальные тракты утолщены за счет заметной дилатации и закупорки сосудистых каналов и умеренного воспалительного инфильтрата мано-ядерной области (Hx. И E. × 400).
Гистопатологическое исследование контрольных тканей почек показало клубочки, проксимальные и дистальные извитые почечные канальцы, мозг содержал собирающие канальцы и части восходящей и нисходящей петли курицы.Введение охратоксина А вызывало мутное набухание проксимальных извитых канальцев, фибриновый тромбин в петлях клубочковых капилляров, увеличение количества и размера клубочков (рисунок), а также интерстициальный фиброз и скопление (рисунок). С другой стороны, совместное введение меда с охратоксином А улучшило действие охратоксина А на почки, где сосудистая полость нормализовалась. Однако они все же были немного увеличены (рисунок). Введение афлатоксинов вызывало мутный отек эпителиальной выстилки почечных канальцев с легким интерстициальным фиброзом и застоем (рисунок).
Почка ОТ группы. Увеличение количества и размера клубочков (Hx. И E. × 100).
Почка ОТ группы. Интерстициальный фиброз и гиперемия (трихром Massons × 100).
Почка группы HOT. Вернитесь к норме, за исключением заложенности сосудов (Hx. И E. × 200).
Почка группы АТ. Мутное набухание эпителия канальцев (Hx. & E. × 100).
Что касается воздействия охратоксина на мозг, гистологическое исследование показало наличие очагов дегенерации (рисунок), в то время как совместное введение меда с охратоксином А улучшило этот эффект.Кроме того, введение афлатоксина не вызывало каких-либо изменений в мозговой ткани.
Мозг. Очаги дегенерации в группе ОТ (Hx. & E. × 100).
Гистопатологическое исследование контрольного легкого показало тонкие альвеолярные стенки, состоящие из эпителиальных клеток с обеих сторон центрально расположенных капилляров без промежуточной стромы соединительной ткани. Введение охратоксина А повлияло на ткани легкого, где в легком наблюдались отек, застой, лимфоидные агрегаты в интерстициальной ткани (рисунок).Результаты показали, что легкое облегчило застойные явления (одновременный прием меда с охратоксином А) (рисунок). Принимая во внимание, что легкие показали интерстициальный фиброз и воспалительный инфильтрат после введения афлатоксина (рисунок).
Легкое группы ОТ. Отек, гиперемия, лимфоидные скопления интерстициальной ткани (Hx. И E. × 100).
Легкое группы HOT. Облегчение отека, но отек и лимфоцитарные агрегаты все еще присутствуют (Hx. И E. × 100).
Легкое группы АТ.Показан интерстициальный фиброз, воспалительное заполнение очаговыми лимфоцитарными агрегатами (трихром Massons × 100).
Контрольная ткань селезенки показала каркас соединительной ткани (который включает капсулу, трабекулы и ретикулярную соединительную ткань) и паренхиму лимфоидной ткани в виде белой (лимфоидные узелки) и красной пульпы (рисунок). На рисунке проиллюстрировано влияние охратоксина А на селезенку, где показано расширение белой пульпы с разрушением нормальной архитектуры, адвентициальное утолщение артериол, адвентициальное утолщение артериол, очаговый фиброз красной пульпы и сжатие синусоидов.
Селезенка группы NTC. Вызваны аналогичные гистопатологические, бело-красные пульпы. (Hx. И E. × 100).
Селезенка группы ОТ. Расширение белой пульпы с облитерацией нормальной архитектуры (Hx. & E. × 100).
С другой стороны, введение афлатоксинов не показало никаких изменений в ткани селезенки. Совместное введение меда с афлатоксинами вызывает улучшение всех гистопатологических изменений, которые произошли во всех исследованных органах, кроме ткани почек.
Влияние меда на пробиотические бактерии толстой кишки
Добавление меда к порошковой диете AIN-93 M (группа HTC) увеличило количество бифидобактерий в среднем на 2,3 ± 0,23 log 10 КОЕ / г (p <0,004) и lactobacilli в среднем на 1,07 ± 0,35 log 10 КОЕ / г (p <0,016) по сравнению с группой NTC (таблица).
Таблица 5
Влияние меда и микотоксинов на рост LAB (log 10 КОЕ / г).
| Штаммы | Группы мышей | ||||||||
| OT | HOT | AT | HAT | ||||||
| NTC | |||||||||
| NTC | 3.26 ± 0,19 | 3,83 ± 0,20 | Нет | Нет | 5,00 ± 0,15 | 6,06 ± 0,22 | |||
| Бифидобактерии | |||||||||
| 3,73 ± 0,19 | 0,373 ± 0,19 | 3,73 ± 0,19 | 3,77 ± 0,22 | 6,26 ± 0,29 | 8,57 ± 0,24 | ||||
Введение охратоксина А в группу, получавшую мед (группа HOT), увеличило количество лактобактерий в среднем на 0,75 ± 0.15 log 10 КОЕ / г (p <0,108) по сравнению с группой ОТ. Лактобациллы не обнаружены при введении афлатоксинов (группы HAT и AT) (таблица).
Введение смеси охратоксина А и афлатоксинов в присутствии меда (группы HOT и HAT) увеличило среднее количество бифидобактерий на 1,03 ± 0,32 log 10 КОЕ / г (p <0,083) и 0,57 ± 0,50 log 10 КОЕ / г (p <0,219) по сравнению с группами ОТ и АТ соответственно.
Обсуждение
Влияние меда на производство микотоксинов
Наши результаты показывают, что влияние меда на биомассу и образование микотоксинов ( in vitro, ) зависело от вида грибов ( A.parasiticus и A. ochraceus ) и концентрации меда. Об антимикробных свойствах перекиси водорода и неперекисных компонентов меда сообщалось в нескольких исследованиях [25]. Таким образом, для этих 2 типов грибов мед нейтрализовал больше патогенов дозозависимым образом, чем контрольный сахарный раствор (80%), состоящий из фруктозы и глюкозы, аналогично чистому меду [25]. Неразбавленный мед полностью подавлял рост обычных грибов поверхностной инфекции и заражения ран ( Aspergillus fumicgatus, A flavus, Penicellum citrinum, Trichophyton rubrum и Candida albicans ), частичное ингибирование с концентрацией меда 50% и отсутствие ингибирования было зарегистрировано концентрация меда 20% [26].
Влияние меда на пробиотические бактерии толстой кишки
Лактобациллы и бифидобактерии имеют сложные пищевые потребности, такие как углеводы, аминокислоты, пептиды, сложные эфиры жирных кислот, соли, производные нуклеиновых кислот и витамины, которые сильно различаются от вида к виду. Мед содержит более 180 веществ, в том числе аминокислоты, витамины, минералы и ферменты [5]. Основными углеводными составляющими меда являются фруктоза (32,56%) и глюкоза (28,54%). Помимо олигосахаридов (1.От 58 до 3,77% мальтозы, 0,78 ± 2,03% туранозы, 1,11 ± 2,81% нигерозы, 0,05 ± 0,15% мели-биозы, 0,03 ± 0,08% панозы, 0,24 ± 1,03% мальтотриозы, 0,21 ± 0,37% мелецитозы и 0,10 ± 0,25%. Мед также содержит от 4 до 5% фруктоолигосахаридов, которые служат пробиотическими агентами [4].
Нормальная слизистая оболочка тонкой кишки человека может не полностью поглощать фруктозу. Несколько исследований показали, что распространенность мальабсорбции фруктозы у здоровых взрослых может достигать 30–50%, эти субъекты могут нарушать всасывание заметного количества дозы 25 г фруктозы [27].Наиболее нормальные субъекты мальабсорбируют около 10% углеводов, содержащихся в меде [28]. Олигосахариды меда с низкой степенью полимеризации считаются благоприятным субстратом для бифидобактерий [10]. Наконец, неперевариваемые и / или неабсорбируемые сахариды перемещаются в толстую кишку, чтобы вызвать селективную ферментацию и селективную стимуляцию роста и активности пробиотических бактерий в толстой кишке, как было обнаружено ранее [29].
Настоящее исследование подтверждает имитирующий эффект меда на пробиотические бактерии толстой кишки.Рост кишечных Bifidobacteria spp. был усилен наличием более чем лактобацилл, что может быть связано с олигосахаридами меда с низкой степенью полимеризации (от 4 до 5%).
Уменьшение количества пробиотических бактерий толстой кишки при введении микотоксина и в отсутствие или в присутствии меда может быть связано с изменениями бактериальной поверхности во время фазы роста в результате связывания микотоксинов [13].
Влияние меда на активность бактериальных ферментов толстой кишки
Уровень глюкуронидаз является важным показателем влияния диеты на состав и активность кишечной микрофлоры.Он участвует в образовании, а также в инактивации канцерогенов в просвете кишечника и может быть положительно изменен присутствием пробиотических бактерий толстой кишки [30].
Антигенотоксические эффекты меда
Было обнаружено, что микотоксины генотоксичны для костного мозга и клеток сперматоцитов мышей, что совпадает с предыдущими сообщениями [31,32], что охратоксин А и афлатоксины вызывали хромосомные аберрации во многих клетках млекопитающих (мыши , крыса, китайский хомяк и даже человек).
Используя смесь охратоксина А и афлатоксинов в качестве токсичных и канцерогенных веществ, мы охарактеризовали потенциальную антигенотоксичность меда. Мед был антигенотоксичным ( in vivo, ), и этот эффект зависел от пробиотических бактерий толстой кишки и других факторов. Предполагается, что пробиотические бактерии толстой кишки обладают несколькими полезными эффектами, включая инактивацию канцерогенов [15]. Помимо открытия, что пробиотические бактерии толстой кишки обладают антигенотоксическими свойствами, непосредственный интерес представляет изучение механизмов, ответственных за их защиту.Было высказано предположение, что белковая структура липополисахаридной мембраны бактерий может быть эффективным компонентом [33]. Кроме того, было несколько сообщений о том, что молочнокислые бактерии (LAB) могут связывать мутагены и, таким образом, могут снижать мутагенность [34].
Пищевые факторы, содержащиеся в меде, можно использовать для предотвращения и устранения мутации, вызванной афлатоксинами [35]. Это соответствовало нашим открытиям, которые показали, что можно предотвратить или уменьшить хромосомные аберрации, вызванные афлатоксинами.Кроме того, вызванное AFB1 повреждение ДНК и хромосомные аберрации в клетках грызунов и человека могут регулироваться множеством факторов, включая питательные вещества и химиопрофилактические агенты [36]. Это согласуется с нашими результатами, согласно которым прием меда может улучшить генетический материал и минимизировать хромосомные аберрации, вызванные микотоксинами.
Влияние меда на пролиферацию клеток
Настоящие результаты гистопатологического исследования показали, что охратоксин А вызывает кровотечение и некроз красной пульпы селезенки.Этот вывод согласуется с работой [30]. Кроме того, некроз белой пульпы затронул корковые и мозговые области лимфоидных фолликулов. Кроме того, охратоксин А связан с нарушением структуры и функции клеточной мембраны мозга [31]. Он может заметно увеличивать активность цитозольных и лизосомальных ферментов.
В настоящем исследовании влияние афлатоксинов на печень согласуется с работой, проделанной ранее [32], которая объяснила это влияние увеличением цитоплазматической легкости и потерей цитоплазматической зернистости гепатоцитов.Также были зарегистрированы периоптальный фиброз с дегенерацией и изъязвлением желчных дуэтов, выстилающих эпителиальные клетки, и пролиферация желчных протоков [33]. Были очевидны мультифокальные, случайно распределенные области некроза печени, инфильтрованные нейтрофилами и макрофагами. Поражения были центральными, более выраженными вокруг портала и аналогичным результатом [34]. Результаты настоящей работы согласуются с ранее опубликованными [35] о том, что у крыс, получавших внутрибрюшинную инъекцию афлатоксина B 1 , наблюдалась выраженная воспалительная реакция в легких, застой, разрушение альвеолярных стенок с амфизематозными изменениями и утолщение стенки кровеносных сосудов, возникающие в пятнистых участках легочной ткани.
На основании гистопатологического исследования можно сделать вывод, что добавление меда к охратоксину А лишь немного улучшило микроскопические изменения почечной ткани. Однако добавление меда афлатоксинов улучшило гистопатологические изменения, вызванные токсином, в различных органах, за исключением ткани почек.
Наши результаты показали, что вредное воздействие микотоксинов может быть уменьшено в присутствии меда, что может быть связано с детоксикацией микотоксинов пробиотическими бактериями.В то же время доступность связанного AFB1 с антителом предполагает, что поверхностные компоненты этих бактерий участвовали в связывании токсина [13]. Изменение температуры (от 4 до 37 ° C) и pH (от 2 до 10) не оказало значительного влияния на количество высвобождаемого AFB1. Связывание AFB1, по-видимому, является преимущественно внеклеточным для жизнеспособных и подвергнутых термической обработке бактерий. Однако обработка кислотой может разрешить внутриклеточное связывание. Во всех случаях связывание обратимо, но стабильность образующихся комплексов зависит от штамма, обработки и условий окружающей среды.Как правило, отделение AFB1 от бактериальной поверхности требует времени. В это время AFB1 выполняет запись вдоль желудочно-кишечного тракта в направлении изгнания. Эта секвестрация AFB1 снижает возможность его реабсорбции или оказания патогенного воздействия на энтероциты или лимфоидную ткань, ассоциированную с кишечником (GALT). Это может быть чистым эффектом детоксикации микотоксинов из организма. Кроме того, наши результаты совместимы с [36], так как охратоксин A демонстрирует мутное набухание проксимальных извитых канальцев в дополнение к канальцевым эозиногильным внутрипросветным цилиндрам, фибриновым тромбам в петлях клубочковых капилляров и выраженному интерстициальному фиброзу и застою.
Афлатоксины являются генотоксическими канцерогенами. Для этого типа канцерогенов обычно считается, что не существует пороговой дозы, ниже которой не могло бы произойти образование опухоли. Другими словами, только нулевой уровень воздействия не приведет к отсутствию риска. Это согласуется с недавней оценкой [37] в отношении генотоксичности афлатоксина [38]. Необходимо провести углубленные исследования, чтобы выяснить влияние фазы роста всех штаммов пробиотических бактерий на связывание AFB 1 и G 1 и других микотоксинов in vitro и in vivo .
Заключение
Настоящие результаты показывают, что мед обладает защитным действием, зависящим от его антимикробных свойств. Также мед усиливает эндогенные пробиотические бактерии толстой кишки (бифидогенные эффекты), что оказывает несколько полезных эффектов (например, детоксикация и антигенотоксичность).
Мы рекомендуем заменять сахар медом в высокой концентрации в обработанных пищевых продуктах, детских смесях, детских закусках, особенно в тех, которые изготовлены из сельскохозяйственных материалов (например,г. молотый горох и кукуруза), чтобы избежать роста грибков и образования микотоксинов. Согласно результатам, полученным в этой статье, доза смеси афлатоксинов, превышающая 1 мкг афлатоксинов на кг веса тела в день, оказывает выраженное вредное воздействие. Это подтверждается недавним обсуждением в Европейском Союзе ограничения максимально допустимого содержания афлатоксинов в пищевых продуктах.
Список сокращений
Группа ОТ – группа 1, порошковая диета AIN-93 M, получавшая и вводившая охратоксин А (10 нг / кг массы тела / день).
HOT группа -группа 2, мед Порошковая диета AIN-93 M, получавшая и вводившая охратоксин А (10 нг / кг массы тела / день).
AT группа -группа 3, порошковая диета AIN-93 M, полученная и вводимая смесью афлатоксинов (1 мкг / кг массы тела / день).
HAT группа -группа 4, мед, порошок AIN-93 M, диета, полученная и вводимая смесью афлатоксинов (1 мкг / кг массы тела / день).
НТК группа -группа 5, АИН-93 М порошковое диетическое скармливание.
HTC группа -группа 6, мед АИН-93 М порошковый диетический скармливаемый.
Конкурирующие интересы
Автор (ы) заявляют, что у них нет конкурирующих интересов.
Вклад авторов
Али Эзз Эль-Араб задумал и спроектировал исследование и выполнил микробные ферменты толстой кишки (он также позаботился об экспериментальном животном в сотрудничестве с Шенудой Гиргисом, который исследовал хромосомные аберрации). Эман Хегази провел гистологическое исследование, а Аззат Абд эль-Халек подсчитал пробиотические бактерии. Все авторы сообщили данные и написали эту рукопись.Благодарности Центр, Докки, Гиза, Египет.
Список литературы
- Саарела М., Латенмаки Л., Криттенден Р., Салминен С., Маттила-Сандхольм Т. Кишечные бактерии и здоровая пища – европейская перспектива. Intern J Food Microbiol.2000. 278: 99–117. [PubMed] [Google Scholar]
- Verschuren PM. Функциональные продукты питания: научные и глобальные перспективы. Br J Nutr. 2002; 88: S125 – S130. DOI: 10,1079 / BJN2002675. [PubMed] [CrossRef] [Google Scholar]
- Bazzarre TL, Wu, SML Yuhas JA. Общие концентрации и ЛПВП после приема йогурта и кальция. Nutr Reports Intern. 1983; 28: 1225–1232. [Google Scholar]
- Чоу Дж. Пробиотики и пребиотики: краткий обзор. J Ren Nutr. 2002; 12: 76–86. [PubMed] [Google Scholar]
- White JW.Состав меда. В: Crane E, редактор. Мед: всеобъемлющий обзор. Лондон, Хайнеманн; 1979. С. 157–192. [Google Scholar]
- Аль-Мамарья М., Аль-Мериб А., Аль-Хабориб М. Антиоксидантная активность и общие фенольные соединения различных видов меда. Nutr Res. 2002; 22: 1041–1047. DOI: 10.1016 / S0271-5317 (02) 00406-2. [CrossRef] [Google Scholar]
- Беннетт Дж. В., Клих М. Микотоксины. Обзор Clin Microb. 2003. 16: 497–516. DOI: 10.1128 / CMR.16.3.497-516.2003. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Генри Ш., Bosch FX, Troxell TC, Bolger PM.Уменьшение рака печени – глобальный контроль афлатоксина. Наука. 1999; 286: 2453–2454. DOI: 10.1126 / science.286.5449.2453. [PubMed] [CrossRef] [Google Scholar]
- Койпер-Гудман Т. Безопасность пищевых продуктов: микотоксины и фикотоксины в перспективе. В: Miraglia M, Van Edmond H, Brera C, Gilbert J, редактор. Микотоксины и фикотоксины – разработки в области химии, токсикологии и безопасности пищевых продуктов. Alaken Inc., Форт-Коллинз, Колорадо; 1998. С. 25–48. [Google Scholar]
- Кадзивара С., Ганди Х., Устунол З. Влияние меда на рост и выработку кислоты кишечными бактериями Bifidobacterium spp.: in vitro, сравнение с коммерческими олигосахаридами и инулином. J food prod. 2002; 65: 214–218. [PubMed] [Google Scholar]
- Salminen S, Bouley MC, Boutron-Rualt MC, Cummings J, Frank A, Gibson E, Isolauri E, Moreau MC, Roberfroid M, Rowland I. Наука о функциональном питании, физиология и функции желудочно-кишечного тракта. Br J Nutr. 1998; 1: 147–171. DOI: 10,1079 / BJN19980108. [PubMed] [CrossRef] [Google Scholar]
- Эль-Незами Х., Микнен Х., Канкаанп П., Салминен С., Ахокас Дж.Способность штаммов Lactobacillus и propionibacterium удалять афлатоксин B1 из двенадцатиперстной кишки цыпленка. J Food Prot. 2000; 63: 549–552. [PubMed] [Google Scholar]
- Haskard CA, El-Nezami HS, Kankaanp PE, Salminen S, Aholmas JT. Поверхностное связывание афлатоксина B1 молочнокислыми бактериями. Appl Environ Microbiol. 2001; 67: 3086–3091. DOI: 10.1128 / AEM.67.7.3086-3091.2001. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Gratz S, Mykkänen H, Ouwehand AC, Juvonen R, Salminen S, El-Nezami H.Кишечная слизь изменяет способность пробиотических бактерий связывать афлатоксин B1 In Vitro . Appl Environ Microbiol. 2004. 70: 6306–6308. DOI: 10.1128 / AEM.70.10.6306-6308.2004. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Pool-Zobel BL, Neidecker C, Domizlaff I, Ji S, Schillinger U, Rumney C, Moretti I, Vilarini I, Scassellati-Sforzolini R, Rowland I. • Антигенотоксичность, опосредованная лактобактериями и бифидобактериями, в толстой кишке крыс. Nutr Cancer. 1996. 26: 365–380. [PubMed] [Google Scholar]
- A.OAC «Официальные методы официальных химиков-аналитиков. Арлингтон, Вирджиния, США. 2000.
- Park D, Neslein S, Trucksess MW, Starck ME, Newel RF. Жидкостный хроматографический метод определения афлатоксинов B-1, B2, G1 и G2 в продукты из кукурузы и арахиса. J Assoc Off Anal Chem. 1990; 73: 260–266. [PubMed] [Google Scholar]
- Haspolat K, Buyukbas S, Cengel H. In vitro антибактериальный и противогрибковый эффект меда. Turk Hijyen – Ve – Денейсел-Бийолоджи-Дергиси.1990; 47: 211–216.[Google Scholar]
- Wahdan HA. Противомикробный эффект меда. Египетская J Lab Med. 1996; 8: 29–44. [Google Scholar]
- Ривз П., Нильсен Ф., Фэи Г. Очищенные диеты AIN-93 для лабораторных грызунов: окончательный отчет специального комитета по написанию Американского института питания о разработке рациона для грызунов AIN-76A. J Nutr. 1993; 123: 1939–1951. [PubMed] [Google Scholar]
- Djouzi Z, Andrieux C. Сравнивали эффекты трех олигосахаридов на метаболизм кишечной микрофлоры у крыс, инокулированных фекальной флорой человека.Br J Nutr. 1997; 78: 313–324. DOI: 10,1079 / BJN19970149. [PubMed] [CrossRef] [Google Scholar]
- Престон Р.Дж., Дин Б.Дж., Галлоуэй С., Холден Х., МакФи А.Ф., Шелби М., Mammalian in vivo, цитогенетический анализ . Mutat Res. 1987. 189: 157–165. DOI: 10.1016 / 0165-1218 (87)
- -8. [PubMed] [CrossRef] [Google Scholar]
- Руссо А. Цитогенетика in vivo : зародышевые клетки млекопитающих. Mutat Res. 2000; 455: 167–189. [PubMed] [Google Scholar]
- A.F.I.P. Институт патологии Вооруженных Сил.Лабораторные методы в гистотехнологии. Вашингтон, округ Колумбия; 1994. [Google Scholar]
- Wahdan HAL. Причины антимикробной активности меда. Заразить. 1998; 26: 26–30. [PubMed] [Google Scholar]
- Efem SEE, Udoh KT, Lwara CI. Антимикробный спектр меда и его клиническое значение. Заразить. 1992. 20: 277–285. [Google Scholar]
- Мишкин Д., Саблаускас Л., Яловский М., Мишкин С. Нарушение всасывания фруктозы и сорбита у амбулаторных пациентов с функциональной диспепсией: сравнение с нарушением переваривания / нарушением всасывания лактозы.Dig Dis Sci. 1997. 42: 2591–2596. DOI: 10.1023 / А: 1018841402133. [PubMed] [CrossRef] [Google Scholar]
- Ladas SD, Raptis SA. Мед, абсорбция фруктозы и слабительное действие. J Nutr. 1999; 15: 591–592. DOI: 10.1016 / S0899-9007 (99) 00092-1. [PubMed] [CrossRef] [Google Scholar]
- Цимер С.Дж., Гибсон Г.Р. Обзор пробиотиков, пребиотиков и синбиотиков в концепции функционального питания: перспективы и будущие стратегии. Int Dairy Journal. 1998. 8: 473–479. DOI: 10.1016 / S0958-6946 (98) 00071-5.[CrossRef] [Google Scholar]
- Налини Н., Манджу В., Менон В.П. Влияние кокосового жмыха на активность бактериального фермента при раке толстой кишки, вызванном 1,2-диметилгидразином. Clin Chim Acta. 2004; 342: 203–210. DOI: 10.1016 / j.cccn.2004.01.001. [PubMed] [CrossRef] [Google Scholar]
- Groose Y, Chekir-Ghedira L, Huc A, Obrecht-Pflumio S, Dirheimer G, Bacha H, Pfohl-Leszkowicz A. Сетчатка, аскорбиновая кислота и альфа-токоферол предотвращают образование аддуктов ДНК у мышей, получавших микотоксины охратоксин А и зеараленон.Раковый латыш. 1997. 114: 255–229. DOI: 10.1016 / S0304-3835 (97) 04676-4. [PubMed] [CrossRef] [Google Scholar]
- Ван Дж. С., Групман Дж. Д. Повреждение ДНК микотоксинами. Mutat Res. 1999; 424: 167–81. [PubMed] [Google Scholar]
- Zhang XB, Ohta Y. Антимутагенность клеточных фракций микроорганизмов в отношении сильнодействующих мутагенных пиролизатов. Mutat Res. 1993; 298: 247–253. DOI: 10.1016 / 0165-1218 (93) -V. [PubMed] [CrossRef] [Google Scholar]
- Эль-Незами Х., Канкаанпаа П., Салминан С., Ахокас Дж. Способность молочных штаммов молочнокислых бактерий связывать общий пищевой канцероген, афлатоксин B1.Food Chem Toxicol. 1998. 36: 321–326. DOI: 10.1016 / S0278-6915 (97) 00160-9. [PubMed] [CrossRef] [Google Scholar]
- Шарманов Т.Ш., Ников П.С., Алдабергенова К.У., Меербекова Б.Т. Влияние типа питания и афлатоксина B1 на структуру хромосом. Вопр Питан. 1986; 5: 56–60. [PubMed] [Google Scholar]
- Munro IC, Scott PM, Moodie CA, Willes RF. охратоксин Возникновение и токсичность. J Am Vet Med Assoc. 1973; 63: 1269–1273. [PubMed] [Google Scholar]
- Monnet-Tschudi F, Sorg O, Honegger P, Zurich M, Hugget AC, Schilter B.Влияние встречающегося в природе пищевого микотоксина хроматоксина А на клетки мозга в культуре. Нейротоксикология. 1997; 18: 831–840. [PubMed] [Google Scholar]
- Кларк Д., Джаир А.В., Хэтч Р. Влияние различных видов лечения на индуцированный хронический афлатоксикоз у кроликов. Am J Vet Res. 1982; 43: 106–110. [PubMed] [Google Scholar]
- Эль-Захан Х., Эль-Ашри М.А., Тарват Е.Е., Саад М.М., Амин С.О. Кролик и афлатоксины: влияние смеси афлатоксинов на кровь, компоненты плазмы природы Новой Зеландии, штамбы белого кролика.Египетский кролик J Sci. 1996; 6: 55–56. [Google Scholar]
- Уэно Ю. Токсикология микотоксинов. CRC Crit Rev Toxicol. 1985. 14: 99–132. [PubMed] [Google Scholar]
- Gopuiath C, Prentic DE, Lewis DJ. Атлас экспериментальной токсикологической патологии. Current, гистопатология, MTP press limited, lan coraster, Boston The Hague-Derdecht. 1987. 30: 43–61. [Google Scholar]
- Albassam MA, Yong SI, Bhatnagar R, Sharma AK, Prior MG. Гистопатологические и электронно-микроскопические исследования острой токсичности охратоксина А у крыс.Vet Pathol. 1987. 24: 427–435. [PubMed] [Google Scholar]
Влияние диетического меда на микрофлору кишечника и токсичность микотоксинов у мышей
BMC Complement Altern Med. 2006; 6: 6.
, 1 , 2 , 3 и 4Али М Эзз Эль-Араб
1 Департамент пищевых наук и питания Национального исследовательского центра, 12644 – Докки, Гиза, Египет
Шенуда М. Гиргис
2 Департамент клеточной биологии, Национальный исследовательский центр, 12644 – Докки, Гиза, Египет
Эман М. Хегази
3 Департамент пищевой токсикологии, Национальный исследовательский центр, 12644 – Докки, Гиза, Египет
Аззат Б. Абд Эль-Халек
4 Департамент молочных продуктов, Национальный исследовательский центр, 12644 – Докки, Гиза, Египет
1 Департамент пищевых наук и питания Национального исследовательского центра, 12644 – Докки, Гиза, Египет
2 Департамент клеточной биологии, Национальный исследовательский центр, 12644 – Докки, Гиза, Египет
3 Департамент пищевой токсикологии, Национальный исследовательский центр, 12644 – Докки, Гиза, Египет
4 Департамент молочной промышленности, Национальный исследовательский центр, 12644 – Докки, Гиза, Египет
Автор, отвечающий за переписку.Поступило 20 февраля 2005 г .; Принято 14 марта 2006 г.
Copyright © 2006 Ezz El-Arab et al; лицензиат BioMed Central Ltd.Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License (http://creativecommons.org/licenses/by/2.0), которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе. при условии правильного цитирования оригинала.
Эта статья цитируется в других статьях в PMC.Abstract
Справочная информация
Пчелиный мед – это функциональный корм, обладающий уникальным составом, антимикробными свойствами и бифидогенным действием.Настоящее исследование было предпринято для того, чтобы оценить, может ли мед подавлять токсическое действие микотоксинов.
Методы
Производство биомассы и токсинов с помощью Aspergillus parasiticus и Aspergillus ochraceus отслеживали в средах без меда и с медом. Хотя афлатоксины и охратоксин А вводили самцам швейцарских мышей-альбиносов в дозах до 1 мкг и 10 нг / кг массы тела / день соответственно. Подопытных животных кормили диетами без нашего 10% меда в течение двух месяцев.Следили за изменениями в пробиотических бактериях толстой кишки, детерминантном ферменте толстой кишки глюкуронидазе и генотоксичности.
Результаты
Добавление 32% в среду увеличивало биомассу A parasiticus , в то время как биомасса A. ochraceus уменьшалась, и охратоксин А. не производился. Когда в среду добавляли мед в соотношении 32 и 48%. Связи между массой мицелия и продукцией микотоксинов не обнаружено. Пероральное введение афлатоксинов (смесь B 1 , B 2 , G 1 и G 2 ) и охратоксина А.вызывали структурные и численные хромосомные аберрации в костном мозге и половых клетках самцов мышей, тогда как лечение медом снижало генотоксичность микотоксинов. Также оба токсина вызывали гистопатологические изменения в печени и почках. Питание на диете с добавлением меда улучшило гистопатологические изменения в случае группы афлатоксинов, но не в случае группы охратоксина А. (за исключением почек в двух случаях). Не было обнаружено значительных различий в активности β-глюкуронидазы толстой кишки между группами, получавшими диету с медом или без него.С другой стороны, количество бифидобактерий толстой кишки и лактобацилл заметно увеличилось в группе, получавшей диету с добавлением меда.
Заключение
Замена сахара на мед в обработанных пищевых продуктах может подавить вредные и генотоксические эффекты микотоксинов и улучшить микрофлору кишечника.
Общие сведения
Пищевые продукты больше не ценятся потребителями только с точки зрения их вкуса и непосредственных потребностей в питании, но также с точки зрения их способности приносить особую пользу для здоровья.Функциональные продукты питания стали важным сектором пищевых продуктов, обеспечивающим пользу для здоровья благодаря функциональным ингредиентам в этих продуктах. Функциональные продукты питания, направленные на улучшение баланса и активности кишечной среды, в настоящее время составляют самый большой сегмент рынка функциональных продуктов питания [1,2].
В течение долгого времени было замечено, что мед можно использовать для лечения заболеваний печени, сердечно-сосудистой системы и желудочно-кишечного тракта [3]. Мед – это натуральный продукт с очень сложным химическим составом. Он состоит в основном из фруктозы и глюкозы, но также содержит от 4 до 5% фруктоолигосахаридов, которые служат пребиотическими агентами [4].Он содержит более 180 веществ, в том числе аминокислоты, витамины, минералы и ферменты [5]. Антимикробные свойства перекиси водорода и неперекисных компонентов меда проверялись в нескольких исследованиях [6].
Распространенность заражения микотоксинами (афлатоксинами и охратоксинами) носит глобальный характер. По оценкам, четверть сельскохозяйственных культур в мире в той или иной степени загрязнены микотоксинами, особенно распространенными в развивающихся странах. Как правило, микотоксины обычно содержатся в пищевых продуктах [7,8].Микотоксины вызывают серьезную озабоченность из-за их пагубного воздействия на здоровье людей и животных. Aspergillus flavus и A. parasiticus продуцируют афлатоксины. Охратоксин А был открыт как метаболит Aspergillus ochraceus . Из токсинов Aspergillus только охратоксин (природный канцероген и нефротоксин) потенциально так же важен, как афлатоксины (природный канцероген). Оба они связаны как с токсичностью, так и с канцерогенностью для здоровья человека.Ведущий деятель в области оценки риска назвал микотоксины наиболее важным хроническим диетическим фактором риска, превосходящим синтетические контаминанты, токсины растений, пищевые добавки или остатки пестицидов [7,9].
Загрязняющие пищевые вещества, попадающие в организм оральным путем, напрямую подвергаются действию кишечной микрофлоры. Микрофлора желудочно-кишечного тракта (ЖКТ) все чаще признается одним из факторов, влияющих на здоровье человека. Эта микрофлора представляет собой динамическое равновесие, которое может быть изменено диетой [10].Нормальная здоровая микрофлора кишечника содержит множество штаммов молочнокислых бактерий (LAB), некоторые из которых были выделены, приписаны несколько полезных эффектов и названы штаммами пробиотиков [11]. Несколько исследований показали, что пробиотические бактерии толстой кишки могут удалять микотоксины посредством физического связывания в качестве механизма удаления мутагена [12-14]. Кроме того, тяжесть отравления микотоксинами может быть усилена такими факторами, как дефицит витаминов, недостаток калорий, злоупотребление алкоголем и статус инфекционного заболевания [7].
Кроме того, есть доказательства того, что пробиотические бактерии толстой кишки могут положительно модулировать определенные микробные ферменты толстой кишки, которые могут играть роль в заболеваниях, связанных с диетой. Изменение этих параметров указывает на защитный эффект от канцерогенов. Пробиотические бактерии связывают мутагены in vitro , а также предотвращают выведение мутагенов из организма человека. Однако необходимы дополнительные исследования, чтобы определить физиологическое значение эндогенных пробиотических бактерий толстой кишки [15].
Полное устранение любых естественных токсинов из пищевых продуктов – недостижимая цель. Наука о питании расширяет знания о том, как продукты питания влияют на потребителей в зависимости от конкретных параметров здоровья.
Следовательно, необходимо провести более глубокие исследования, чтобы выяснить потенциал защитного действия меда за счет его противогрибкового действия и снижения хронических заболеваний, связанных с питанием, таких как рак.
Для достижения этой цели мы изучили in vitro , влияние меда на рост грибов и образование микотоксинов с помощью Aspergillus в пищевых продуктах.Кроме того, мы изучили действие меда in vivo в присутствии микотоксина на эндогенные пробиотические бактерии толстой кишки, микробные ферменты толстой кишки, пролиферацию клеток и генотоксичность.
Методы
Монофлоральный мед (хлопок) был приобретен в Центре исследований пчеловодства Министерства сельского хозяйства, Каир, Египет. Арахис ( Archis hypogalal ) с повреждениями и наблюдаемым загрязнением грибами был получен из источников основного поставщика арахиса в Египте. Бактериальная культура, среда deMann, Rogosa, Sharpe (MRS) (Oxoid, Hampshire, United Kingdom) для Lactobacilli.Триптонно-фитоновые дрожжи (TPY), среда (Oxoid) для бифидобактерий. Стандарт охратоксина А (каталожный № 01877) был приобретен у химической компании Sigma-Aldrich (Сент-Луис, США). Грибы, продуцирующие афлатоксины и охратоксин А, A. parasiticus (FRR 2748) и A. ochraceus (NRRL 3174) были получены от Ассоциации стандартов Австралии (Северный Сидней, Новый Южный Уэльс, Австралия). Природные афлатоксины (B 1 , B 2 , G 1 и G 2 ) были экстрагированы из арахиса [16], и их концентрации были определены методами тонкослойной (ТСХ) и высокоэффективной жидкостной хроматографии (ВЭЖХ). [17].
Концентрация экстрагированных афлатоксинов B 1 , B 2 , G 1 и G 2 из арахиса составила 211,42, 135,53, 368,10 и 99,72 мкг / кг соответственно. Полученный экстракт растворяли в 2-литровом соевом масле и хранили в холодильнике до использования.
Изучение влияния меда на продукцию микотоксинов
A. parasiticus (FRR 2748) и A. ochraceus (NRRL 3174) культивировали на картофельном агаре с декстрозой в течение 10 дней при 25 ° C, пока они не стали хорошо спорулированными.Споры собирали в 10 мл стерильного 1% раствора Твина 80 (об. / Об.) С получением 10 5 спор / мл. Колбы, содержащие 500 мл среды дрожжевой экстракт-сахароза (ДА) с добавлением нулевого, 32 и 48% меда, инокулировали 2,0 мл этой суспензии, инкубировали при 28 ° C в течение 21 дня, а затем анализировали на афлатоксины [18,19].
Изучение влияния меда на прием микотоксинов у мышей
Сорок два самца швейцарских мышей-альбиносов возрастом примерно 7 недель и весом 20 ± 3 г были получены из колонии приюта для животных Национального исследовательского центра, Каир, Египет.Животных содержали индивидуально в клетках из нержавеющей стали с контролируемой температурой (24–26 ° C), влажностью (40–70%) и условиями освещения (12-часовой цикл свет / темнота) и позволяли свободный доступ к дистиллированной воде и основной диете (AIN- 93 М) на 10 дней в качестве адаптивного периода. Порошок AIN-93 M содержал белок (14%), крахмал (62,07%), сахарозу (10%), жир (4%), клетчатку (5%), минеральную смесь (3,5%), смесь витаминов (1%). ), L-цистин (0,18%), битратрат холина (0,25%) и тетрабутилгидрохинон (0,00008%) [20].
Затем мышей случайным образом разделили на шесть групп (по 7 животных в каждой). Группа 1 st получала диету AIN-93 M и вводила охратоксин A (10 нг / кг массы тела / день, группа ОТ). Группу 2 и лечили так же, как группу 1, за исключением того, что она получала мед / диету AIN-93 M (группа HOT). Группе 3 (AT) и H (HAT) скармливали диету AIN-93 M и мед / AIN-93 M, соответственно, и вводили смесь афлатоксинов (1 мкг / кг массы тела / день). Группы 5 (NTC) и 6 (HTC) служили контролем и получали рацион AIN-93 M и медовый AIN-93 M соответственно.Эксперимент проводился в течение 2 месяцев, и животных еженедельно взвешивали для расчета суточной дозы. Животным внутрибрюшинно вводили 0,5 мл 0,05% колхицина за 2 часа до умерщвления, чтобы задержать клетки костного мозга и сперматоциты в стадии метафазы после голодания в течение ночи. Содержимое слепой кишки собирали в чистые пробирки Эппендорфа. Бедро, печень, почки, селезенка, легкие, яички и мозг были удалены.
Активность микробных ферментов толстой кишки
Активность бактериальной β-глюкуронидазы определяли в пищеварении содержимого слепой кишки с помощью P-нитрофенил-β-D-глюкуронида (Fluka, продукт No.73677) [21]. Разведение слепой кишки проводили при 4 ° C. Реакционная смесь содержала 0,3 мл раствора субстрата (5 моль P-нитрофенил-β-D-глюкуронида / л) и 0,2 мл разбавленной слепой кишки (1 часть слепой кишки и 2 части фосфатного буфера pH 6,4, мас. / Об.) И хорошо перемешивалась. , инкубировали при 37 ° C / 48 часов. Концентрацию высвободившегося п-нитрофенола измеряли от до оптического поглощения при 400 нм после добавления 2,5 мл 0,1 н. NaOH для остановки реакции. Активность фермента выражали как образовавшийся молярный продукт / г содержимого слепой кишки.
Исследование хромосомных аберраций
Хромосомы были подготовлены, окрашены 5% красителем Гимза в фосфатном буфере (pH 6,8), и 50 метафазных спредов были проанализированы на каждое животное на предмет хромосомных аберраций в клетках костного мозга [22]. Также были исследованы хромосомные аберрации в половых клетках семенников тех же животных [23].
Гистопатологическое исследование
Биопсии печени, почек, селезенки, легких и мозга фиксировали в 10% забуференном растворе формалина в течение 12 часов и превращали в парафиновые блоки.Срезы ткани толщиной 5 мм вырезали на предметных стеклах с альбумином и окрашивали гематоксилином и эозином (Hx. & E.). Для правильной оценки фиброза ткани и лучшей демонстрации кровеносных сосудов в срезах ткани также использовалось окрашивание трихромом Массона [24].
Исследования пробиотических бактерий толстой кишки
Подсчитывали эндогенные популяции пробиотических бактерий толстой кишки (лактобациллы и бифидобактерии). В конце эксперимента у каждого животного собирали образцы содержимого слепой кишки.Образцы содержимого слепой кишки немедленно (в течение 30 минут) помещали в сосуд для анаэробов и хранили при 4 ° C до анализа (максимум 6 часов). 100-кратные серийные разведения проводили в предварительно восстановленном растворе Рингера, содержащем 0,5% цистеина. Чашки Петри с различными средами инокулировали и инкубировали в течение 72 часов при 37 ° C в анаэробной атмосфере с использованием Gen Kits в сосудах Oxoid. Бактерии были обнаружены на следующих селективных средах: среда deMan, Rogosa, Sharpe (MRS) (Oxoid, Hampshire, United Kingdom) для лактобацилл и среда Tryptone Phytone Yeast (TPY) (Oxoid) для бифидобактерий.После инкубации подсчитывали колонии. Количество бактерий выражается как log 10 колониеобразующих единиц (log 10 КОЕ / г) свежего образца содержимого слепой кишки с пределом обнаружения 3,30 log 10 КОЕ / г.
Статистика
Все данные были выражены как среднее ± стандартная ошибка (SEM) среднего и проанализированы с помощью одностороннего дисперсионного анализа ANOVA с использованием статистической программы SAS (SAS версия 6.11, SAS Institute, Кэри, Северная Каролина). В случае значимости для сравнения различий между средними значениями использовали критерий множественного диапазона Дункана.Уровни значимости были проверены.
Результаты
Влияние меда на продукцию микотоксинов
Исследования in vitro показали, что биомасса A. parasiticus была увеличена в среде, содержащей 32% меда. Однако биомы A. ochraceus были уменьшены в среде, содержащей 32 и 48% меда. Охратоксин А не производился ни при одной концентрации меда. С другой стороны, продукция афлатоксинов B 1 , B 2 , G 1 и G 2 увеличивалась в среде, содержащей 32% меда, но снижалась в среде с высокой концентрацией меда без образования афлатоксина B 2 и G 2 (таблица).Как правило, мы не обнаружили положительной связи между массой мицелия и производством микотоксинов.
Таблица 1
Влияние меда на массу мицелия и концентрацию микотоксинов.
| Мед% | Масса мицелия (г) | Концентрация микотоксинов (мкг / л) | ||||||||||||||||||
| FRR 2748 | FRR | |||||||||||||||||||
| B1 | B2 | G1 | G2 | 71 | 14,69 | 12,69 | 8,99 | 7,70 | 5,00 | 32,03 | ||||||||||
| 32,10 | 40,40 | 13,60 | 15,00 | 15,00 12293 | 30,00 | 10,00 | 5,80 | 00,00 | 1,18 | 00,00 | 00,00 | |||||||||
Влияние меда на активность глюкуронидаз толстой кишки
Влияние пробиотических β-бактерий на активность глюкуронидаз в кишечнике содержимое слепой кишки представлено в таблице.Уровень глюкуронидазы был очень низким, и достоверных различий в его содержании в слепой кишке между всеми группами не наблюдалось (P <0,05).
Таблица 2
Влияние различных обработок микотоксинами и медом на активность бактериальных глюкуронидаз в содержимом слепой кишки мышей.
| β-глюкуронидазы мкмоль / г | Группы | |||||||||||||
| OT | HOT | AT | HAT | HAT | HAT .39 ± 0,11 | 0,40 ± 0,12 | 0,32 ± 0,10 | 0,37 ± 0,10 | 0,38 ± 0,14 | 0,42 ± 0,13 | ||||
Генотоксические эффекты микотоксинов на клетки костного мозга
Настоящее исследование введение афлатоксинов (B 1 , B 2 , G 1 и G 2 ) и охратоксина A самцам мышей индуцировало структурные и числовые хромосомные аберрации (таблица и рисунок).
Таблица 3
Средние значения различных типов хромосомных аберраций в клетках костного мозга мышей-самцов, получавших охратоксин А и афлатоксины (B 1 , B 2 , G 1 и G 2 ).
| Обработанные группы | Числовые аберрации | Структурные аберрации | |||||||
| Перидиплоидия | 9029 Дезинфекция | 9029 Хроматидные зазоры 9029 Хроматидные зазоры 9029 9029 Хроматидные зазоры 9029 9029 Хроматидные зазоры 9029 | |||||||
| OT | 2,50 ± 0,45 a | 0,67 ± 0,17 a | 0.67 ± 0,21 a | 0,83 ± 0,17 b | 2,50 ± 0,00 a | 0,83 ± 0,21 a | 5,50 ± 0,31 b | ||
| HOT | 1,83 ± 0,33 | 0,50 ± 0,00 a | 0,50 ± 0,00 a | 0,50 ± 0,00 b | 0,83 ± 0,21 b | 0,67 ± 0,17 a | 3,00 ± 0,349 c | 3,00 ± 0,349 c | 3,00 ± 0,349 |
| АТ | 2.83 ± 0,67 a | 0,67 ± 0,017 a | 0,67 ± 0,17 a | 4,33 ± 1,31 a | 1,17 ± 0,21 b | 0,83 ± 0,21 a | ± 0,48 a | ||
| HAT | 2,50 ± 0,36 a | 0,50 ± 0,00 a | 0,50 ± 0,00 a | 0,67 ± 0,17 b | 1,00 ± 0,22 | 0.50 ± 0,00 a | 3,17 ± 0,21 c | ||
| NTC | 2,00 ± 0,22 a | 0,50 ± 0,00 a | 0,50 ± 0,0 a | 2 0,50 ± 0,0 b0,83 ± 0,21 b | 0,50 ± 0,00 a | 2,83 ± 0,21 c | |||
| HTC | 2,00 ± 0,34 a | 0,50 ± 0,00 a | 0,50 ± 0,00 b | 0,67 ± 0,17 b | 0,50 ± 0,00 a | 2,67 ± 0,17 c | |||
Метафазные спреды самцов мышей, обработанных охратоксин А и афлатоксины, показывающие: а) ослабление центромеры. б) удаление. В) разрыв хроматиды (маленькая стрелка), фрагмент (большая стрелка) клеток костного мозга и г) полиплоидия. д) аутосомно-однолистный. F) х-у одновалентных клеток сперматоцитов.
Структурные хромосомные аберрации регистрировались в виде хроматидных разрывов, хроматидных разрывов (рисунок), центромерных аттенуаций (рисунок), делеций (рисунок) и фрагментов (рисунок). В таблице представлены средние значения различных структурных хромосомных аберраций, индуцированных микотоксинами в клетках костного мозга мышей-самцов. Результаты показывают низкую частоту хроматидных промежутков, разрывов и фрагментов, тогда как частота центромерного ослабления была значительно высокой между группой AT и группой HAT с одной стороны и между группой AT и контрольными группами (NTC и HTC) с другой стороны.
Значительная разница (P <0,05) была также обнаружена в делециях (рисунок) между группой OT и группой HOT, а также между группой OT и контрольными группами (NTC и HTC), что можно отнести к защитному эффекту меда.
Значительное увеличение (P <0,05) частоты общих структурных хромосомных аберраций было обнаружено между группой OT и группой HOT с одной стороны и между группой OT и контрольными группами (NTC и HTC) с другой стороны. Также была обнаружена значительная разница между группой AT по сравнению с группой HAT и контрольными группами (NTC и HTC), соответственно.
Генотоксическое действие микотоксинов на половые клетки (сперматоциты)
Результаты нашего исследования показали, что пероральное лечение охратоксином А и афлатоксинами (B 1 , B 2 , G 1 и G 2 ) индуцировало численные и структурные хромосомные аберрации в половых клетках мышей-самцов (таблица). Численные аберрации регистрировались как перидиплоидия (n ± 1 или n ± 2) и полиплоидия (рисунок). Перидиплоидия, наблюдаемая в сперматоцитах мышей-самцов, четко различалась (p ≤ 0.5) только в группе, получавшей афлатоксины (AT), по сравнению с контрольными группами (NTC и HTC). Однако полиплоидия, индуцированная группой, обработанной охратоксином А (OT), значительно отличалась (P <0,05) по сравнению с контрольными группами. Между тем, общие числовые аберрации значительно различались (P <0,05) как в группе, получавшей охратоксин A (группа OT), так и в группе, получавшей афлатоксины (AT), по сравнению с контрольными группами (NTC и HTC). Защитный эффект меда проявился только в группе HAT.
Таблица 4
Средние значения различных типов хромосомных аберраций в клетках сперматоцитов мышей-самцов, получавших охратоксин А и афлатоксины (B 1 , B 2 , G 1 и G 2 ).
| Обработанные группы | Числовые аберрации | Структурные аберрации | ||||||
| Перидиплоидия | univalents Univalents||||||||
| OT | 1,75 ± 0,48 ab | 3,75 ± 0,48 a | 5,25 ± 0,48 a | 2.75 ± 0,48 a | 1,00 ± 0,41 a | 3,75 ± 0,86 a | ||
| HOT | 1,50 ± 0,29 abc | 2,75 ± 0,25 a | 4,50 ± | 1,00 ± 0,41 b | 0,75 ± 0,25 a | 1,75 ± 0,63 a | ||
| AT | 2,25 ± 0,25 a | 1,25 ± 0,25 | 0 350 ± 0,29 b | | 2,00 ± 0,92 ab | 0,75 ± 0,75 a | 2,75 ± 0,95 a | ||
| HAT | 1,50 ± 0,29 abc | 0,50 | 2,00 ± 0,0,41 | 1,50 ± 0,29 ab | 0,50 ± 0,29 a | 2,00 ± 0,58 a | ||
| NTC | 0,75 ± 0,48 | 0,75 ± 0,48 | .41 b | 1,50 ± 0,29 c | 1,50 ± 0,29 ab | 1,00 ± 0,41 a | 2,50 ± 0,29 a | | |
| HTC | c 2 0,50 ± 0,29 | 0,25 ± 0,25 b | 1,00 ± 0,41 c | 1,00 ± 0,14 b | 1,00 ± 0,00 a | 2,00 ± 0,00 a | | ||
Лечение с помощью ахратохина высокоиндуцированные структурные хромосомные аберрации, особенно униваленты xy (рисунок), где значительная разница (P <0.05) был обнаружен между группами OT и HOT, а также между группами OT и контрольными группами (HTC).
Влияние меда на пролиферацию клеток
При микроскопическом исследовании контрольной ткани печени были обнаружены гексагональные печеночные дольки, состоящие из центральной вены, из которой были видны печеночные канатики, синусоиды, выстланные излучающими клетками Купфера, а также желчные каналы. Портальный тракт располагался между тремя долями печени и состоял из воротной вены, печеночной артерии и желчного протока (рисунок).
Печень группы НТЦ. Нормальная ткань печени (H x. И E. × 100).
Введение охратоксина А повлияло на ткань печени, так как оно вызвало расширенные и застойные центральные вены с выраженным синусоидальным расширением, застоем и гиперпластическими купферовыми клетками (рисунок). Также был очевиден очаговый некроз печени, преимущественно периваскулярный (рисунок). Введение меда с охратоксином А не выявило положительного эффекта, так как печень в группе АОТ была поражена так же, как и в группе ОТ. С другой стороны, введение афлатоксинов вызвало мутный отек в гепатоцитах, обширные вариабельные боковые некротические области, поражающие паренхиму печени и инфильтрованные нейтрофилами и макрофагами (рисунок).Также были очевидны перегруженность расширенных центральных вен и выраженная синусоидальная дилатация с гиперплазией хупферовских клеток (рисунок). Портальные тракты утолщены мононуклеарными воспалительными клетками, образованными в основном лимфоцитами и телеангиэктатическими, перегруженными сосудистыми каналами (рисунок).
Печень ОТ группы. Расширенные, застойные центральные вены отмечали расширение и гиперемию синусового отдела (Hx. И E. × 200).
Печень ОТ группы. Очаговый некроз печени преимущественно перисосудистый (Hx.И E. × 200).
Печень группы АТ. Некротические участки паренхимы печени, инфильтрованные нейтрофилами (Hx. & E. × 100).
Печень группы АТ. Заложенные расширенные центральные вены и выраженная синусоидальная дилатация (Hx. И E. × 400).
Печень группы АТ. Портальные тракты утолщены за счет заметной дилатации и закупорки сосудистых каналов и умеренного воспалительного инфильтрата мано-ядерной области (Hx. И E. × 400).
Гистопатологическое исследование контрольных тканей почек показало клубочки, проксимальные и дистальные извитые почечные канальцы, мозг содержал собирающие канальцы и части восходящей и нисходящей петли курицы.Введение охратоксина А вызывало мутное набухание проксимальных извитых канальцев, фибриновый тромбин в петлях клубочковых капилляров, увеличение количества и размера клубочков (рисунок), а также интерстициальный фиброз и скопление (рисунок). С другой стороны, совместное введение меда с охратоксином А улучшило действие охратоксина А на почки, где сосудистая полость нормализовалась. Однако они все же были немного увеличены (рисунок). Введение афлатоксинов вызывало мутный отек эпителиальной выстилки почечных канальцев с легким интерстициальным фиброзом и застоем (рисунок).
Почка ОТ группы. Увеличение количества и размера клубочков (Hx. И E. × 100).
Почка ОТ группы. Интерстициальный фиброз и гиперемия (трихром Massons × 100).
Почка группы HOT. Вернитесь к норме, за исключением заложенности сосудов (Hx. И E. × 200).
Почка группы АТ. Мутное набухание эпителия канальцев (Hx. & E. × 100).
Что касается воздействия охратоксина на мозг, гистологическое исследование показало наличие очагов дегенерации (рисунок), в то время как совместное введение меда с охратоксином А улучшило этот эффект.Кроме того, введение афлатоксина не вызывало каких-либо изменений в мозговой ткани.
Мозг. Очаги дегенерации в группе ОТ (Hx. & E. × 100).
Гистопатологическое исследование контрольного легкого показало тонкие альвеолярные стенки, состоящие из эпителиальных клеток с обеих сторон центрально расположенных капилляров без промежуточной стромы соединительной ткани. Введение охратоксина А повлияло на ткани легкого, где в легком наблюдались отек, застой, лимфоидные агрегаты в интерстициальной ткани (рисунок).Результаты показали, что легкое облегчило застойные явления (одновременный прием меда с охратоксином А) (рисунок). Принимая во внимание, что легкие показали интерстициальный фиброз и воспалительный инфильтрат после введения афлатоксина (рисунок).
Легкое группы ОТ. Отек, гиперемия, лимфоидные скопления интерстициальной ткани (Hx. И E. × 100).
Легкое группы HOT. Облегчение отека, но отек и лимфоцитарные агрегаты все еще присутствуют (Hx. И E. × 100).
Легкое группы АТ.Показан интерстициальный фиброз, воспалительное заполнение очаговыми лимфоцитарными агрегатами (трихром Massons × 100).
Контрольная ткань селезенки показала каркас соединительной ткани (который включает капсулу, трабекулы и ретикулярную соединительную ткань) и паренхиму лимфоидной ткани в виде белой (лимфоидные узелки) и красной пульпы (рисунок). На рисунке проиллюстрировано влияние охратоксина А на селезенку, где показано расширение белой пульпы с разрушением нормальной архитектуры, адвентициальное утолщение артериол, адвентициальное утолщение артериол, очаговый фиброз красной пульпы и сжатие синусоидов.
Селезенка группы NTC. Вызваны аналогичные гистопатологические, бело-красные пульпы. (Hx. И E. × 100).
Селезенка группы ОТ. Расширение белой пульпы с облитерацией нормальной архитектуры (Hx. & E. × 100).
С другой стороны, введение афлатоксинов не показало никаких изменений в ткани селезенки. Совместное введение меда с афлатоксинами вызывает улучшение всех гистопатологических изменений, которые произошли во всех исследованных органах, кроме ткани почек.
Влияние меда на пробиотические бактерии толстой кишки
Добавление меда к порошковой диете AIN-93 M (группа HTC) увеличило количество бифидобактерий в среднем на 2,3 ± 0,23 log 10 КОЕ / г (p <0,004) и lactobacilli в среднем на 1,07 ± 0,35 log 10 КОЕ / г (p <0,016) по сравнению с группой NTC (таблица).
Таблица 5
Влияние меда и микотоксинов на рост LAB (log 10 КОЕ / г).
| Штаммы | Группы мышей | ||||||||
| OT | HOT | AT | HAT | ||||||
| NTC | |||||||||
| NTC | 3.26 ± 0,19 | 3,83 ± 0,20 | Нет | Нет | 5,00 ± 0,15 | 6,06 ± 0,22 | |||
| Бифидобактерии | |||||||||
| 3,73 ± 0,19 | 0,373 ± 0,19 | 3,73 ± 0,19 | 3,77 ± 0,22 | 6,26 ± 0,29 | 8,57 ± 0,24 | ||||
Введение охратоксина А в группу, получавшую мед (группа HOT), увеличило количество лактобактерий в среднем на 0,75 ± 0.15 log 10 КОЕ / г (p <0,108) по сравнению с группой ОТ. Лактобациллы не обнаружены при введении афлатоксинов (группы HAT и AT) (таблица).
Введение смеси охратоксина А и афлатоксинов в присутствии меда (группы HOT и HAT) увеличило среднее количество бифидобактерий на 1,03 ± 0,32 log 10 КОЕ / г (p <0,083) и 0,57 ± 0,50 log 10 КОЕ / г (p <0,219) по сравнению с группами ОТ и АТ соответственно.
Обсуждение
Влияние меда на производство микотоксинов
Наши результаты показывают, что влияние меда на биомассу и образование микотоксинов ( in vitro, ) зависело от вида грибов ( A.parasiticus и A. ochraceus ) и концентрации меда. Об антимикробных свойствах перекиси водорода и неперекисных компонентов меда сообщалось в нескольких исследованиях [25]. Таким образом, для этих 2 типов грибов мед нейтрализовал больше патогенов дозозависимым образом, чем контрольный сахарный раствор (80%), состоящий из фруктозы и глюкозы, аналогично чистому меду [25]. Неразбавленный мед полностью подавлял рост обычных грибов поверхностной инфекции и заражения ран ( Aspergillus fumicgatus, A flavus, Penicellum citrinum, Trichophyton rubrum и Candida albicans ), частичное ингибирование с концентрацией меда 50% и отсутствие ингибирования было зарегистрировано концентрация меда 20% [26].
Влияние меда на пробиотические бактерии толстой кишки
Лактобациллы и бифидобактерии имеют сложные пищевые потребности, такие как углеводы, аминокислоты, пептиды, сложные эфиры жирных кислот, соли, производные нуклеиновых кислот и витамины, которые сильно различаются от вида к виду. Мед содержит более 180 веществ, в том числе аминокислоты, витамины, минералы и ферменты [5]. Основными углеводными составляющими меда являются фруктоза (32,56%) и глюкоза (28,54%). Помимо олигосахаридов (1.От 58 до 3,77% мальтозы, 0,78 ± 2,03% туранозы, 1,11 ± 2,81% нигерозы, 0,05 ± 0,15% мели-биозы, 0,03 ± 0,08% панозы, 0,24 ± 1,03% мальтотриозы, 0,21 ± 0,37% мелецитозы и 0,10 ± 0,25%. Мед также содержит от 4 до 5% фруктоолигосахаридов, которые служат пробиотическими агентами [4].
Нормальная слизистая оболочка тонкой кишки человека может не полностью поглощать фруктозу. Несколько исследований показали, что распространенность мальабсорбции фруктозы у здоровых взрослых может достигать 30–50%, эти субъекты могут нарушать всасывание заметного количества дозы 25 г фруктозы [27].Наиболее нормальные субъекты мальабсорбируют около 10% углеводов, содержащихся в меде [28]. Олигосахариды меда с низкой степенью полимеризации считаются благоприятным субстратом для бифидобактерий [10]. Наконец, неперевариваемые и / или неабсорбируемые сахариды перемещаются в толстую кишку, чтобы вызвать селективную ферментацию и селективную стимуляцию роста и активности пробиотических бактерий в толстой кишке, как было обнаружено ранее [29].
Настоящее исследование подтверждает имитирующий эффект меда на пробиотические бактерии толстой кишки.Рост кишечных Bifidobacteria spp. был усилен наличием более чем лактобацилл, что может быть связано с олигосахаридами меда с низкой степенью полимеризации (от 4 до 5%).
Уменьшение количества пробиотических бактерий толстой кишки при введении микотоксина и в отсутствие или в присутствии меда может быть связано с изменениями бактериальной поверхности во время фазы роста в результате связывания микотоксинов [13].
Влияние меда на активность бактериальных ферментов толстой кишки
Уровень глюкуронидаз является важным показателем влияния диеты на состав и активность кишечной микрофлоры.Он участвует в образовании, а также в инактивации канцерогенов в просвете кишечника и может быть положительно изменен присутствием пробиотических бактерий толстой кишки [30].
Антигенотоксические эффекты меда
Было обнаружено, что микотоксины генотоксичны для костного мозга и клеток сперматоцитов мышей, что совпадает с предыдущими сообщениями [31,32], что охратоксин А и афлатоксины вызывали хромосомные аберрации во многих клетках млекопитающих (мыши , крыса, китайский хомяк и даже человек).
Используя смесь охратоксина А и афлатоксинов в качестве токсичных и канцерогенных веществ, мы охарактеризовали потенциальную антигенотоксичность меда. Мед был антигенотоксичным ( in vivo, ), и этот эффект зависел от пробиотических бактерий толстой кишки и других факторов. Предполагается, что пробиотические бактерии толстой кишки обладают несколькими полезными эффектами, включая инактивацию канцерогенов [15]. Помимо открытия, что пробиотические бактерии толстой кишки обладают антигенотоксическими свойствами, непосредственный интерес представляет изучение механизмов, ответственных за их защиту.Было высказано предположение, что белковая структура липополисахаридной мембраны бактерий может быть эффективным компонентом [33]. Кроме того, было несколько сообщений о том, что молочнокислые бактерии (LAB) могут связывать мутагены и, таким образом, могут снижать мутагенность [34].
Пищевые факторы, содержащиеся в меде, можно использовать для предотвращения и устранения мутации, вызванной афлатоксинами [35]. Это соответствовало нашим открытиям, которые показали, что можно предотвратить или уменьшить хромосомные аберрации, вызванные афлатоксинами.Кроме того, вызванное AFB1 повреждение ДНК и хромосомные аберрации в клетках грызунов и человека могут регулироваться множеством факторов, включая питательные вещества и химиопрофилактические агенты [36]. Это согласуется с нашими результатами, согласно которым прием меда может улучшить генетический материал и минимизировать хромосомные аберрации, вызванные микотоксинами.
Влияние меда на пролиферацию клеток
Настоящие результаты гистопатологического исследования показали, что охратоксин А вызывает кровотечение и некроз красной пульпы селезенки.Этот вывод согласуется с работой [30]. Кроме того, некроз белой пульпы затронул корковые и мозговые области лимфоидных фолликулов. Кроме того, охратоксин А связан с нарушением структуры и функции клеточной мембраны мозга [31]. Он может заметно увеличивать активность цитозольных и лизосомальных ферментов.
В настоящем исследовании влияние афлатоксинов на печень согласуется с работой, проделанной ранее [32], которая объяснила это влияние увеличением цитоплазматической легкости и потерей цитоплазматической зернистости гепатоцитов.Также были зарегистрированы периоптальный фиброз с дегенерацией и изъязвлением желчных дуэтов, выстилающих эпителиальные клетки, и пролиферация желчных протоков [33]. Были очевидны мультифокальные, случайно распределенные области некроза печени, инфильтрованные нейтрофилами и макрофагами. Поражения были центральными, более выраженными вокруг портала и аналогичным результатом [34]. Результаты настоящей работы согласуются с ранее опубликованными [35] о том, что у крыс, получавших внутрибрюшинную инъекцию афлатоксина B 1 , наблюдалась выраженная воспалительная реакция в легких, застой, разрушение альвеолярных стенок с амфизематозными изменениями и утолщение стенки кровеносных сосудов, возникающие в пятнистых участках легочной ткани.
На основании гистопатологического исследования можно сделать вывод, что добавление меда к охратоксину А лишь немного улучшило микроскопические изменения почечной ткани. Однако добавление меда афлатоксинов улучшило гистопатологические изменения, вызванные токсином, в различных органах, за исключением ткани почек.
Наши результаты показали, что вредное воздействие микотоксинов может быть уменьшено в присутствии меда, что может быть связано с детоксикацией микотоксинов пробиотическими бактериями.В то же время доступность связанного AFB1 с антителом предполагает, что поверхностные компоненты этих бактерий участвовали в связывании токсина [13]. Изменение температуры (от 4 до 37 ° C) и pH (от 2 до 10) не оказало значительного влияния на количество высвобождаемого AFB1. Связывание AFB1, по-видимому, является преимущественно внеклеточным для жизнеспособных и подвергнутых термической обработке бактерий. Однако обработка кислотой может разрешить внутриклеточное связывание. Во всех случаях связывание обратимо, но стабильность образующихся комплексов зависит от штамма, обработки и условий окружающей среды.Как правило, отделение AFB1 от бактериальной поверхности требует времени. В это время AFB1 выполняет запись вдоль желудочно-кишечного тракта в направлении изгнания. Эта секвестрация AFB1 снижает возможность его реабсорбции или оказания патогенного воздействия на энтероциты или лимфоидную ткань, ассоциированную с кишечником (GALT). Это может быть чистым эффектом детоксикации микотоксинов из организма. Кроме того, наши результаты совместимы с [36], так как охратоксин A демонстрирует мутное набухание проксимальных извитых канальцев в дополнение к канальцевым эозиногильным внутрипросветным цилиндрам, фибриновым тромбам в петлях клубочковых капилляров и выраженному интерстициальному фиброзу и застою.
Афлатоксины являются генотоксическими канцерогенами. Для этого типа канцерогенов обычно считается, что не существует пороговой дозы, ниже которой не могло бы произойти образование опухоли. Другими словами, только нулевой уровень воздействия не приведет к отсутствию риска. Это согласуется с недавней оценкой [37] в отношении генотоксичности афлатоксина [38]. Необходимо провести углубленные исследования, чтобы выяснить влияние фазы роста всех штаммов пробиотических бактерий на связывание AFB 1 и G 1 и других микотоксинов in vitro и in vivo .
Заключение
Настоящие результаты показывают, что мед обладает защитным действием, зависящим от его антимикробных свойств. Также мед усиливает эндогенные пробиотические бактерии толстой кишки (бифидогенные эффекты), что оказывает несколько полезных эффектов (например, детоксикация и антигенотоксичность).
Мы рекомендуем заменять сахар медом в высокой концентрации в обработанных пищевых продуктах, детских смесях, детских закусках, особенно в тех, которые изготовлены из сельскохозяйственных материалов (например,г. молотый горох и кукуруза), чтобы избежать роста грибков и образования микотоксинов. Согласно результатам, полученным в этой статье, доза смеси афлатоксинов, превышающая 1 мкг афлатоксинов на кг веса тела в день, оказывает выраженное вредное воздействие. Это подтверждается недавним обсуждением в Европейском Союзе ограничения максимально допустимого содержания афлатоксинов в пищевых продуктах.
Список сокращений
Группа ОТ – группа 1, порошковая диета AIN-93 M, получавшая и вводившая охратоксин А (10 нг / кг массы тела / день).
HOT группа -группа 2, мед Порошковая диета AIN-93 M, получавшая и вводившая охратоксин А (10 нг / кг массы тела / день).
AT группа -группа 3, порошковая диета AIN-93 M, полученная и вводимая смесью афлатоксинов (1 мкг / кг массы тела / день).
HAT группа -группа 4, мед, порошок AIN-93 M, диета, полученная и вводимая смесью афлатоксинов (1 мкг / кг массы тела / день).
НТК группа -группа 5, АИН-93 М порошковое диетическое скармливание.
HTC группа -группа 6, мед АИН-93 М порошковый диетический скармливаемый.
Конкурирующие интересы
Автор (ы) заявляют, что у них нет конкурирующих интересов.
Вклад авторов
Али Эзз Эль-Араб задумал и спроектировал исследование и выполнил микробные ферменты толстой кишки (он также позаботился об экспериментальном животном в сотрудничестве с Шенудой Гиргисом, который исследовал хромосомные аберрации). Эман Хегази провел гистологическое исследование, а Аззат Абд эль-Халек подсчитал пробиотические бактерии. Все авторы сообщили данные и написали эту рукопись.Благодарности Центр, Докки, Гиза, Египет.
Список литературы
- Саарела М., Латенмаки Л., Криттенден Р., Салминен С., Маттила-Сандхольм Т. Кишечные бактерии и здоровая пища – европейская перспектива. Intern J Food Microbiol.2000. 278: 99–117. [PubMed] [Google Scholar]
- Verschuren PM. Функциональные продукты питания: научные и глобальные перспективы. Br J Nutr. 2002; 88: S125 – S130. DOI: 10,1079 / BJN2002675. [PubMed] [CrossRef] [Google Scholar]
- Bazzarre TL, Wu, SML Yuhas JA. Общие концентрации и ЛПВП после приема йогурта и кальция. Nutr Reports Intern. 1983; 28: 1225–1232. [Google Scholar]
- Чоу Дж. Пробиотики и пребиотики: краткий обзор. J Ren Nutr. 2002; 12: 76–86. [PubMed] [Google Scholar]
- White JW.Состав меда. В: Crane E, редактор. Мед: всеобъемлющий обзор. Лондон, Хайнеманн; 1979. С. 157–192. [Google Scholar]
- Аль-Мамарья М., Аль-Мериб А., Аль-Хабориб М. Антиоксидантная активность и общие фенольные соединения различных видов меда. Nutr Res. 2002; 22: 1041–1047. DOI: 10.1016 / S0271-5317 (02) 00406-2. [CrossRef] [Google Scholar]
- Беннетт Дж. В., Клих М. Микотоксины. Обзор Clin Microb. 2003. 16: 497–516. DOI: 10.1128 / CMR.16.3.497-516.2003. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Генри Ш., Bosch FX, Troxell TC, Bolger PM.Уменьшение рака печени – глобальный контроль афлатоксина. Наука. 1999; 286: 2453–2454. DOI: 10.1126 / science.286.5449.2453. [PubMed] [CrossRef] [Google Scholar]
- Койпер-Гудман Т. Безопасность пищевых продуктов: микотоксины и фикотоксины в перспективе. В: Miraglia M, Van Edmond H, Brera C, Gilbert J, редактор. Микотоксины и фикотоксины – разработки в области химии, токсикологии и безопасности пищевых продуктов. Alaken Inc., Форт-Коллинз, Колорадо; 1998. С. 25–48. [Google Scholar]
- Кадзивара С., Ганди Х., Устунол З. Влияние меда на рост и выработку кислоты кишечными бактериями Bifidobacterium spp.: in vitro, сравнение с коммерческими олигосахаридами и инулином. J food prod. 2002; 65: 214–218. [PubMed] [Google Scholar]
- Salminen S, Bouley MC, Boutron-Rualt MC, Cummings J, Frank A, Gibson E, Isolauri E, Moreau MC, Roberfroid M, Rowland I. Наука о функциональном питании, физиология и функции желудочно-кишечного тракта. Br J Nutr. 1998; 1: 147–171. DOI: 10,1079 / BJN19980108. [PubMed] [CrossRef] [Google Scholar]
- Эль-Незами Х., Микнен Х., Канкаанп П., Салминен С., Ахокас Дж.Способность штаммов Lactobacillus и propionibacterium удалять афлатоксин B1 из двенадцатиперстной кишки цыпленка. J Food Prot. 2000; 63: 549–552. [PubMed] [Google Scholar]
- Haskard CA, El-Nezami HS, Kankaanp PE, Salminen S, Aholmas JT. Поверхностное связывание афлатоксина B1 молочнокислыми бактериями. Appl Environ Microbiol. 2001; 67: 3086–3091. DOI: 10.1128 / AEM.67.7.3086-3091.2001. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Gratz S, Mykkänen H, Ouwehand AC, Juvonen R, Salminen S, El-Nezami H.Кишечная слизь изменяет способность пробиотических бактерий связывать афлатоксин B1 In Vitro . Appl Environ Microbiol. 2004. 70: 6306–6308. DOI: 10.1128 / AEM.70.10.6306-6308.2004. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Pool-Zobel BL, Neidecker C, Domizlaff I, Ji S, Schillinger U, Rumney C, Moretti I, Vilarini I, Scassellati-Sforzolini R, Rowland I. • Антигенотоксичность, опосредованная лактобактериями и бифидобактериями, в толстой кишке крыс. Nutr Cancer. 1996. 26: 365–380. [PubMed] [Google Scholar]
- A.OAC «Официальные методы официальных химиков-аналитиков. Арлингтон, Вирджиния, США. 2000.
- Park D, Neslein S, Trucksess MW, Starck ME, Newel RF. Жидкостный хроматографический метод определения афлатоксинов B-1, B2, G1 и G2 в продукты из кукурузы и арахиса. J Assoc Off Anal Chem. 1990; 73: 260–266. [PubMed] [Google Scholar]
- Haspolat K, Buyukbas S, Cengel H. In vitro антибактериальный и противогрибковый эффект меда. Turk Hijyen – Ve – Денейсел-Бийолоджи-Дергиси.1990; 47: 211–216.[Google Scholar]
- Wahdan HA. Противомикробный эффект меда. Египетская J Lab Med. 1996; 8: 29–44. [Google Scholar]
- Ривз П., Нильсен Ф., Фэи Г. Очищенные диеты AIN-93 для лабораторных грызунов: окончательный отчет специального комитета по написанию Американского института питания о разработке рациона для грызунов AIN-76A. J Nutr. 1993; 123: 1939–1951. [PubMed] [Google Scholar]
- Djouzi Z, Andrieux C. Сравнивали эффекты трех олигосахаридов на метаболизм кишечной микрофлоры у крыс, инокулированных фекальной флорой человека.Br J Nutr. 1997; 78: 313–324. DOI: 10,1079 / BJN19970149. [PubMed] [CrossRef] [Google Scholar]
- Престон Р.Дж., Дин Б.Дж., Галлоуэй С., Холден Х., МакФи А.Ф., Шелби М., Mammalian in vivo, цитогенетический анализ . Mutat Res. 1987. 189: 157–165. DOI: 10.1016 / 0165-1218 (87)
- -8. [PubMed] [CrossRef] [Google Scholar]
- Руссо А. Цитогенетика in vivo : зародышевые клетки млекопитающих. Mutat Res. 2000; 455: 167–189. [PubMed] [Google Scholar]
- A.F.I.P. Институт патологии Вооруженных Сил.Лабораторные методы в гистотехнологии. Вашингтон, округ Колумбия; 1994. [Google Scholar]
- Wahdan HAL. Причины антимикробной активности меда. Заразить. 1998; 26: 26–30. [PubMed] [Google Scholar]
- Efem SEE, Udoh KT, Lwara CI. Антимикробный спектр меда и его клиническое значение. Заразить. 1992. 20: 277–285. [Google Scholar]
- Мишкин Д., Саблаускас Л., Яловский М., Мишкин С. Нарушение всасывания фруктозы и сорбита у амбулаторных пациентов с функциональной диспепсией: сравнение с нарушением переваривания / нарушением всасывания лактозы.Dig Dis Sci. 1997. 42: 2591–2596. DOI: 10.1023 / А: 1018841402133. [PubMed] [CrossRef] [Google Scholar]
- Ladas SD, Raptis SA. Мед, абсорбция фруктозы и слабительное действие. J Nutr. 1999; 15: 591–592. DOI: 10.1016 / S0899-9007 (99) 00092-1. [PubMed] [CrossRef] [Google Scholar]
- Цимер С.Дж., Гибсон Г.Р. Обзор пробиотиков, пребиотиков и синбиотиков в концепции функционального питания: перспективы и будущие стратегии. Int Dairy Journal. 1998. 8: 473–479. DOI: 10.1016 / S0958-6946 (98) 00071-5.[CrossRef] [Google Scholar]
- Налини Н., Манджу В., Менон В.П. Влияние кокосового жмыха на активность бактериального фермента при раке толстой кишки, вызванном 1,2-диметилгидразином. Clin Chim Acta. 2004; 342: 203–210. DOI: 10.1016 / j.cccn.2004.01.001. [PubMed] [CrossRef] [Google Scholar]
- Groose Y, Chekir-Ghedira L, Huc A, Obrecht-Pflumio S, Dirheimer G, Bacha H, Pfohl-Leszkowicz A. Сетчатка, аскорбиновая кислота и альфа-токоферол предотвращают образование аддуктов ДНК у мышей, получавших микотоксины охратоксин А и зеараленон.Раковый латыш. 1997. 114: 255–229. DOI: 10.1016 / S0304-3835 (97) 04676-4. [PubMed] [CrossRef] [Google Scholar]
- Ван Дж. С., Групман Дж. Д. Повреждение ДНК микотоксинами. Mutat Res. 1999; 424: 167–81. [PubMed] [Google Scholar]
- Zhang XB, Ohta Y. Антимутагенность клеточных фракций микроорганизмов в отношении сильнодействующих мутагенных пиролизатов. Mutat Res. 1993; 298: 247–253. DOI: 10.1016 / 0165-1218 (93) -V. [PubMed] [CrossRef] [Google Scholar]
- Эль-Незами Х., Канкаанпаа П., Салминан С., Ахокас Дж. Способность молочных штаммов молочнокислых бактерий связывать общий пищевой канцероген, афлатоксин B1.Food Chem Toxicol. 1998. 36: 321–326. DOI: 10.1016 / S0278-6915 (97) 00160-9. [PubMed] [CrossRef] [Google Scholar]
- Шарманов Т.Ш., Ников П.С., Алдабергенова К.У., Меербекова Б.Т. Влияние типа питания и афлатоксина B1 на структуру хромосом. Вопр Питан. 1986; 5: 56–60. [PubMed] [Google Scholar]
- Munro IC, Scott PM, Moodie CA, Willes RF. охратоксин Возникновение и токсичность. J Am Vet Med Assoc. 1973; 63: 1269–1273. [PubMed] [Google Scholar]
- Monnet-Tschudi F, Sorg O, Honegger P, Zurich M, Hugget AC, Schilter B.Влияние встречающегося в природе пищевого микотоксина хроматоксина А на клетки мозга в культуре. Нейротоксикология. 1997; 18: 831–840. [PubMed] [Google Scholar]
- Кларк Д., Джаир А.В., Хэтч Р. Влияние различных видов лечения на индуцированный хронический афлатоксикоз у кроликов. Am J Vet Res. 1982; 43: 106–110. [PubMed] [Google Scholar]
- Эль-Захан Х., Эль-Ашри М.А., Тарват Е.Е., Саад М.М., Амин С.О. Кролик и афлатоксины: влияние смеси афлатоксинов на кровь, компоненты плазмы природы Новой Зеландии, штамбы белого кролика.Египетский кролик J Sci. 1996; 6: 55–56. [Google Scholar]
- Уэно Ю. Токсикология микотоксинов. CRC Crit Rev Toxicol. 1985. 14: 99–132. [PubMed] [Google Scholar]
- Gopuiath C, Prentic DE, Lewis DJ. Атлас экспериментальной токсикологической патологии. Current, гистопатология, MTP press limited, lan coraster, Boston The Hague-Derdecht. 1987. 30: 43–61. [Google Scholar]
- Albassam MA, Yong SI, Bhatnagar R, Sharma AK, Prior MG. Гистопатологические и электронно-микроскопические исследования острой токсичности охратоксина А у крыс.Vet Pathol. 1987. 24: 427–435. [PubMed] [Google Scholar]
Как сырой мед может улучшить здоровье кишечника
Число хронических заболеваний кишечника растет. В 2016 году британская газета Independent сообщила, что синдром раздраженного кишечника поражает примерно от 10 до 20 процентов населения Великобритании, и наблюдается рост воспалительных заболеваний кишечника, таких как болезнь Крона и язвенный колит. Еще в 2012 году исследование, опубликованное в журнале Gastroenterology, показало, что воспалительные заболевания кишечника (ВЗК) становятся глобальной проблемой.
В эпоху быстрого и быстрого питания, когда стресс и загрязнение окружающей среды влияют на организм, как никогда важно знать, что мы едим, как себя чувствуют и функционируют наши тела. Сбалансированный кишечник улучшает пищеварение, и исследования показали, что, заботясь о здоровье кишечника, мы заботимся и о своем психическом здоровье.
Чтобы понять, как сырой мед может улучшить здоровье кишечника, сначала давайте посмотрим, что происходит внутри нашего тела.
Как работает кишечник
Мы пережевываем пищу, что запускает процесс пищеварения, поскольку слюна расщепляет пищу, а при глотании она продвигается вниз в желудок.Пептическая кислота и ферменты разбавляют и продолжают расщеплять пищу и желудочную кислоту, а ферменты переваривают белки и убивают большинство бактерий в пище. То, что остается, поступает в тонкий кишечник, где основные группы продуктов питания, белки, жиры и углеводы, расщепляются на аминокислоты, сахара и жирные кислоты, которые всасываются в кровоток. Ободочная или толстая кишка забирает неабсорбированные остатки. Он извлекает соль и воду, в то время как триллионы бактерий толстой кишки ферментируют неабсорбированные сахара, крахмалы и белки в короткоцепочечные жирные кислоты, которые затем могут использоваться в качестве источника энергии.Поджелудочная железа выделяет щелочной сок с мощными ферментами, расщепляющими белки, жиры и углеводы. Это также источник гормона инсулина. Печень получает кровь из кишечника, фильтрует ее, выводит токсины, метаболизирует лекарства, накапливает питательные вещества и синтезирует белки. Также он синтезирует желчь. которые желчный пузырь накапливает и концентрирует; после еды он выдавливается в тонкий кишечник, где помогает переваривать жир.
4 причины, по которым сырой мед полезен для кишечника
- Сырой мед поддерживает пищеварительную систему, потому что он не ферментируется в желудке, как большинство рафинированных сахаров, ухудшающих работу пищеварительного тракта.
- Сырой мед образует щелочи, в отличие от обработанного меда, который образует кислоты, поэтому помогает бороться с воспалениями.
- Сырой мед содержит олигосахариды (сахара), которые могут служить источником топлива (пребиотиком) для полезных бактерий в кишечнике.
- Сырой мед содержит небольшое количество полифенолов, которые защищают полезные бактерии и вытесняют вредные.
Сырой мед, пробиотики и пребиотики
Пробиотики – это живые полезные бактерии, которые попадают в наш кишечник через пищевые добавки и пищевые добавки.Пребиотики обеспечивают пищу, которая помогает процветанию полезных микробов в желудке.
Пребиотикибыли впервые идентифицированы и названы французским профессором фармацевтических наук Марселем Роберфроидом в 1995 году. Роберфроид определяет пребиотики как: – избирательно ферментированный ингредиент, который способствует определенным изменениям в микрофлоре желудочно-кишечного тракта, что способствует благополучию и здоровью хозяина. Поскольку пребиотики проходят через желудок, не расщепляясь ни желудочными кислотами, ни пищеварительными ферментами, они вызывают положительные изменения в пищеварительном тракте и органах.Сырой мед содержит компоненты пребиотической клетчатки, необходимые для питания пробиотиков и обеспечения здоровых бактерий в кишечнике.
Как сырой мед помогает при расстройстве желудка
Из-за щелочного действия на пищеварительный тракт сырой мед может помочь или предотвратить расстройство желудка. Может помочь ложка сырого меда перед едой. Кроме того, вы можете пить его в теплой воде или травяном чае сразу после еды или перед сном, чтобы улучшить пищеварение. Также считается, что мед помогает поддерживать плавное пищеварение, потому что он содержит определенные ферменты, которые стимулируют пищеварительную систему.
Сырой мед и кислотный рефлюкс
Гастроэзофагеальный рефлюкс (ГЭРБ) – это когда нижний сфинктер пищевода (НПС) становится слабым, позволяя содержимому желудка вытекать вверх в пищевод. Во время нормального пищеварения LES открывается, позволяя пище пройти в желудок, и закрывается, чтобы пища и кислые желудочные соки не попадали обратно в пищевод. Сырой мед может успокоить это, а также изжогу. Исследования показывают, что сырой мед может помочь уменьшить симптомы, связанные с кислотным рефлюксом, и помочь в заживлении пищевода.Когда вы потребляете мед, он выстилает пищевод, что помогает излечить воспаление или повреждение; в конечном итоге это поможет уменьшить симптомы ГЭРБ, а также избегать употребления алкоголя и сахаров, которые могут вызвать воспаление и ухудшить чувствительность слизистой оболочки пищевода.
Синдром воспалительного кишечника (СРК), язвенный колит (ЯК)
IBS и UC – воспалительные заболевания кишечника. Лечение обычно включает адаптацию к диете, а в тяжелых случаях – противовоспалительные препараты и антибиотики.Их часто назначают на длительный период времени, особенно когда у больного наблюдаются регулярные или тяжелые рецидивы.
В книге Мед в традиционной и современной медицине, под редакцией Лайда Букраэ говорится, что Институт последипломного медицинского образования и исследований Чандигарха обнаружил, что употребление регулярных доз меда мануки может помочь. Они вызвали расстройства пищеварения у экспериментальных крыс, а затем кормили животных медом манука. При обследовании у крыс, получавших мед, было обнаружено значительное снижение уровня воспаления в кишечнике и улучшение показателей клеточных изменений и уровней антиоксидантов.
Анджела Иссельдык, диетолог и дочь пчеловода, делится важным исследованием в своем блоге, опубликованном в июле 2016 года, в котором было обнаружено, что при лечении язвенного колита медом в толстой кишке могут регенерироваться как кишечные клетки, так и нервы. Способность меда восстанавливать здоровые ткани и нервную функцию также соответствовала более низкому уровню гибели клеток, а также окислительным и воспалительным маркерам.
Всегда обращайтесь за медицинской помощью, если у вас проявляются симптомы воспалительного заболевания кишечника, но ложка сырого меда на регулярной основе вместе с другими противовоспалительными продуктами должна помочь облегчить симптомы.
Сырой мед при приеме антибиотиков
Важно защитить свою пищеварительную систему, если вы принимаете антибиотики. Вы можете сделать это, употребляя в пищу достаточное количество продуктов с «хорошими бактериями» или пробиотиками. Организм должен кормить полезные бактерии в нашем кишечнике, чтобы иметь сбалансированную кишечную среду. Сырой мед является хорошим источником пребиотиков, которые помогают питать полезные бактерии, такие как бифидобактерии и лактобациллы. Сырой мед также является натуральным антибиотиком.
Сырой мед – немолочный пробиотик
Сырой мед – это немолочный пробиотический продукт, который полезен тем, что не только имеет прекрасный вкус, но и работает для людей с непереносимостью лактозы или аллергией на молочные продукты.Молочные продукты, такие как натуральный йогурт, обычно используются из-за их пробиотических / пребиотических свойств, сырой мед является отличным альтернативным источником пребиотиков.
Таким образом, сырой мед – это натуральный активный ингредиент. Он изобилует целебными и высоко питательными соединениями, которые дополняют организм и помогают работе кишечника. Добавьте столовую ложку сырого меда в свой распорядок дня с натуральным йогуртом, смузи, травяным чаем или ешьте прямо с ложки, и вы получите естественный заряд пребиотиков / пробиотиков.
Источники включают: Справочник по пребиотикам Гленна Гибсона и Марселя Роберфроида, Пробиотический центр, Oxford Academic Journals, WebMD, NHS UK
Риат
Мед для пищеварения – преимущества меда для пищеварения
Пищеварительная система представляет собой сложную биологическую структуру, которая состоит из группы органов, вместе преобразующих пищу в энергию и другие питательные вещества, которые поступают во все тело для его правильного функционирования. Пищеварительный тракт переносит пищу и в процессе расщепляет ее на молекулы, которые используются в качестве топлива для вашего тела в повседневной жизни.Печень и поджелудочная железа вырабатывают пищеварительные жидкости, которые помогают переваривать пищу, а желчный пузырь используется для хранения. При выходе из строя какой-либо системы биологической единицы может возникнуть ряд заболеваний. Как обеспечить хорошее функционирование пищеварительной системы?
Польза меда для пищеваренияМед – это источник многих минералов, ферментов и аминокислот. Люди знают о пользе меда для здоровья благодаря его антибактериальным и целебным свойствам и используют его для лечения различных состояний, таких как – лечение боли в горле, питание кожи, облегчение кашля, уменьшение воспалений, поддержание уровня холестерина.Теперь есть еще одно дополнение к этому разнообразному списку, это очень хорошо для пищеварения. Исследования показывают, что кислотный рефлюкс может произойти из-за радикалов, которые повреждают клетки, выстилающие пищеварительный тракт. Употребление меда здесь может сыграть важную роль, поскольку он контролирует повреждение, удаляя свободные радикалы.
Преимущества меда для пищеварения:
- Мед содержит определенные ферменты, которые действуют как катализатор в процессе пищеварения, особенно для разложения углеводов и сахаров.
- Мед помогает избавиться от диареи, поскольку он медленно, чем другие обычные сахара, проходит через желудок и кишечник.Исследования показывают, что потребление меда младенцами и младенцами значительно снижает частоту диареи.
- В пищеварительной системе присутствуют некоторые полезные бактерии, известные под общим названием кишечная флора, которые отвечают за хорошее пищеварение.
- Мед содержит соединение под названием метилглиоксаль, которое придает меду антибактериальные свойства. Это помогает вылечить бактериальные инфекции желудка. Основными бактериями, вызывающими нарушения пищеварения, являются Helicobacter pylori.Исследования показали, что мед контролирует рост этих бактерий в желудке.
- Мед помогает укрепить иммунную систему, что помогает предотвратить любые заболевания желудка в будущем.
Различные способы использования меда для пищеварения:
- Ешьте одну-две столовые ложки меда каждый день.
- Также можно пить горячую воду, добавляя немного меда (одну столовую ложку) каждое утро.
- Можно приготовить пасту из меда и порошка корицы.Нанесите эту пасту на хлеб вместо желе или джема. Для эффективного результата ешьте этот хлеб на завтрак каждый день.
- Если вы поклонник йогурта и едите йогурт во время еды, добавьте 1-2 ложки меда, чтобы помочь вам с проблемами кислотного рефлюкса и несварения желудка.
- Смесь уксуса и меда для пищеварения пользуется популярностью уже много лет. Добавьте 2 столовые ложки яблочного уксуса и 1 столовую ложку меда в 8 унций воды и пейте перед каждым приемом пищи.
Нажмите, чтобы узнать, как улучшить пищеварение согласно Аюрведе.

 Охладить. Принимать перед едой по 1 ст. ложке 3 раза в день.
Охладить. Принимать перед едой по 1 ст. ложке 3 раза в день. Эту смесь оставить настаиваться 1—1,5 часа. Затем сок отжать, 100 г сока алоэ смешать с 500 г измельченных грецких орехов и добавить 300 г меда. Принимать по 1 ст. ложке 3 раза в день за 30 мин до еды.
Эту смесь оставить настаиваться 1—1,5 часа. Затем сок отжать, 100 г сока алоэ смешать с 500 г измельченных грецких орехов и добавить 300 г меда. Принимать по 1 ст. ложке 3 раза в день за 30 мин до еды. Процеживают и пьют с медом по 1/2 стакана 6 раз в день.
Процеживают и пьют с медом по 1/2 стакана 6 раз в день.


 Отличный эффект получается при смешивании меда в виде раствора с теплой водой (только не горячей – это особенно противопоказано людям с болезнями сердца).
Отличный эффект получается при смешивании меда в виде раствора с теплой водой (только не горячей – это особенно противопоказано людям с болезнями сердца). Данные исследования показали, что пчелиный мёд нормализует кислотность среды желудка, выделение желудочного сока, производит благотворное воздействие на такие явления субъективного характера, как отрыжка и изжога.
Данные исследования показали, что пчелиный мёд нормализует кислотность среды желудка, выделение желудочного сока, производит благотворное воздействие на такие явления субъективного характера, как отрыжка и изжога. Больные становились спокойными, жизнерадостными, бодрыми.
Больные становились спокойными, жизнерадостными, бодрыми.
